ДВС-синдром в акушерстве
Определение и этиология
Определение 1
Синдром диссеминированного внутрисосудистого свертывания крови, или ДВС-синдром – это изменения в системе свертывания крови вторичного порядка.
Впервые ДВС-синдром описали при преждевременной отслойки нормально расположенной плаценты. ДВС-синдром осложняет некоторые критические состояния и тяжелые заболевания (в частности, тяжелую кровопотерю).
В результате метаболического ацидоза и гипоксии тканей наблюдается активация тканевого и кровяного тромбопластина, что ведет к нарушению гемостаза.
ДВС-синдром можно встретить при:
- тяжелых формах преэклампсии, преждевременной отслойки нормально расположенной плаценты;
- геморрагическом шоке;
- эмболии околоплодными водами;
- тромбоэмболии;
- заболеваниях почек, печени, сердечно-сосудистой системы;
- сепсисе;
- переливании несовместимой группы крови;
- мертвом плоде;
- неразвивающейся беременности и т.
 д.
д.
К развитию ДВС-синдрома приводят:
- поражение эндотелия сосудов, сопровождающееся активацией фактора контакта Хагемана;
- повреждение тканей и попадание в кровяное русло большого количества тканевого тромбопластина;
- повреждение клеток крови и освобождение фосфолипидов в большом количестве;
- гемодинамические нарушения, которые сопровождают шок и ведут к гипоксии.
Патогенез
В развитии ДВС-синдрома выделяют следующие фазы:
- I фаза – образование активного тромбопластина. Самая длительная фаза гемостаза, в которой принимают участие некоторые плазменные и тромбоцитарные факторы.
- II фаза – переход протромбина в тромбин. Осуществляется при действии активного тромбопластина и кальция.
- III фаза – образование фибрин-полимера. Тромбин переводит фибриноген в фибрин-мономер, превращающийся при участии фактора плазмы и тромбоцитарного фактора в нерастворимые нити фибрина-полимера.
На функцию сосудистой системы оказывают влияние биологически активные вещества: катехоламины, кинины, простагландин и др. , выделение которых находится в прямой зависимости от изменения прокоагулянтов в звене гемостаза, ведущего к активации тромбоцитарного звена и агрегации тромбоцитов.
, выделение которых находится в прямой зависимости от изменения прокоагулянтов в звене гемостаза, ведущего к активации тромбоцитарного звена и агрегации тромбоцитов.
Замедленный кровоток способствует расслоению крови на эритроциты и плазму. Эритроциты скапливаются в виде нециркулирующих образований, происходит их агрегация и лизис.
Освобожденный тромбопластин вызывает внутрисосудистое свертывание крови. Нити фибрина образуют комочки – сладжи.
Развивается сладж-феномен. Нарушается кровоснабжение тканей.
Ответной реакцией организма на активацию системы коагуляции является активация защитных механизмов: фибринолитической системы и клеток ретикулоэндотелиальной системы.
Классификация стадий ДВС-синдрома и клинические проявления
В протекании ДВС-синдрома выделяют несколько стадий:
- Стадия гиперкоагуляции. Время свертывания крови уменьшается, снижается антикоагуляционная и фибринолитическая активность. Клинические проявления: гиперемия кожного покрова, которая чередуется с «мраморностью», цианозом кожи конечностей, беспокойство, озноб, тахикардия.

- Стадия гипокоагуляции. Появляются продукты деградации фибрина и фибриногена, число тромбоцитов уменьшается, повышается протромбиновое время, незначительно понижаются время лизиса фибрина и активность антитромбина. Клинические проявления: усиливается кровотечение из раневых поверхностей, родовых путей, носовые кровотечения, кровоизлияния на коже, петехиальные высыпания на грудной клетке (ее боковых поверхностях), верхнем веке, бедрах. Изливающаяся из матки кровь содержит рыхлые, быстро разрушающиеся сгустки.
- Стадия гипокоагуляции с генерализованной активацией фибринолиза. Ослабляются функции тромбоцитов и сокращается их число, снижается активность и концентрация прокоагулянтов, в крови циркулируют продукты деградации фибрина и фибриногена, резко увеличивается фибринолитическая активность, происходит повышение содержания свободного гепарина. Клинические проявления: выделение несвертывающейся крови с единичными мелкими сгустками, кровоточивость из мест инъекций, операционного поля, венесекций, гематурия, в перикарде, грудной и брюшной полости появляются геморрагические выпоты.

- Терминальная стадия – полное несвертывание крови. Гипокоагуляция крайней степени тяжести, антикоагуляционная и фибринолитическая активность. Клинические проявления: генерализованная кровоточивость.
По клиническому течению ДВС-синдром имеет острую и хроническую форму.
Патогенез и лабораторная диагностика ДВС-синдрома в акушерстве
В настоящее время акушерские кровотечения остаются основной причиной материнской смерт-ности в мире [1]. Состояние беременности, которое приводит к кровотечениям с высокой смертностью, называется диссеминированным внутрисосудистым свертыванием крови (ДВС). Впервые ДВС описал в 1901 году Joseph DeLee, который, наблюдая случай смертельного кровотечения при преждевременной отслойке нормально расположенной плаценты, объяснил это состояние как «временная гемофилия» [2]. Непосредственно термин «ДВС-синдром» предложил в 1950 г. американский патолог D. McKay. При вскрытии трупа женщины, погибшей на фоне отслойки плаценты от множественных массивных кровоизлияний, он обнаружил многочисленные тромбы, обтурирующие главным образом мелкие и мельчайшие сосуды.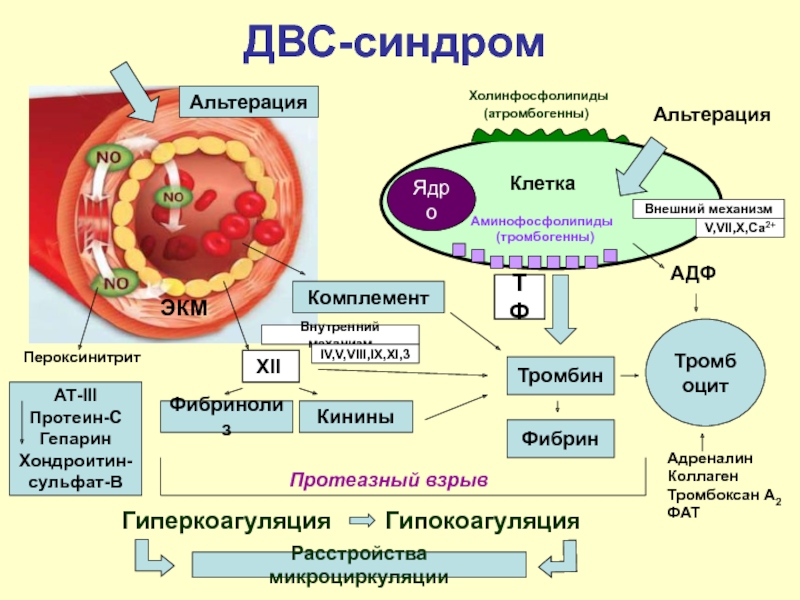 Позже, в 1965 г., D. McKay опубликовал монографию «Синдром диссеминированного внутрисосудистого свертывания как промежуточный механизм патогенеза болезней человека» [3]. Необходимо отметить, что D. McKay принадлежит одно из удачных определений ДВС-синдрома: «Это динамический биологический процесс, который вовлекает множество химических веществ и физиологических активаторов. Возникая в момент проникновения в кровь прокоагулянтного материала, он прогрессирует до стадии агрегации тромбоцитов и формирования фибрина, которые могут приводить к образованию микротромбов в капиллярах, артериолах и венах различных органов. Внутрисосудистое свертывание часто сочетается с активацией фибринолитической системы, расщеплением фибрина и фибриногена, высвобождением продуктов их деградации. Этот процесс сопровождается сильной вазомоторной реакцией и не заканчивается до тех пор, пока коагуляционный механизм и вазомоторный аппарат не нормализуют свою функцию, а продукты деградации фибрина/фибриногена не будут удалены из крови».
Позже, в 1965 г., D. McKay опубликовал монографию «Синдром диссеминированного внутрисосудистого свертывания как промежуточный механизм патогенеза болезней человека» [3]. Необходимо отметить, что D. McKay принадлежит одно из удачных определений ДВС-синдрома: «Это динамический биологический процесс, который вовлекает множество химических веществ и физиологических активаторов. Возникая в момент проникновения в кровь прокоагулянтного материала, он прогрессирует до стадии агрегации тромбоцитов и формирования фибрина, которые могут приводить к образованию микротромбов в капиллярах, артериолах и венах различных органов. Внутрисосудистое свертывание часто сочетается с активацией фибринолитической системы, расщеплением фибрина и фибриногена, высвобождением продуктов их деградации. Этот процесс сопровождается сильной вазомоторной реакцией и не заканчивается до тех пор, пока коагуляционный механизм и вазомоторный аппарат не нормализуют свою функцию, а продукты деградации фибрина/фибриногена не будут удалены из крови». Современные представления о ДВС-синдроме позволяют заключить, что это патологический синдром, в основе которого лежит активация сосудисто-тромбоцитарного и коагуляционного гемостаза, в результате чего кровь сначала сворачивается в микроциркуляторном русле, блокирует его фибрином и клеточными агрегатами, а при истощении потенциала свертывающей и противосвертывающей систем теряет способность к свертыванию, что проявляется кровотечением и развитием синдрома полиорганной недостаточности. ДВС-синдром, соответственно, является ключевым фактором, обусловливающим развитие полиорганной недостаточности и летального исхода по причине смертельного кровотечения. ДВС-синдром неспецифичен и универсален, так как возникает при самых разнообразных заболеваниях.
Современные представления о ДВС-синдроме позволяют заключить, что это патологический синдром, в основе которого лежит активация сосудисто-тромбоцитарного и коагуляционного гемостаза, в результате чего кровь сначала сворачивается в микроциркуляторном русле, блокирует его фибрином и клеточными агрегатами, а при истощении потенциала свертывающей и противосвертывающей систем теряет способность к свертыванию, что проявляется кровотечением и развитием синдрома полиорганной недостаточности. ДВС-синдром, соответственно, является ключевым фактором, обусловливающим развитие полиорганной недостаточности и летального исхода по причине смертельного кровотечения. ДВС-синдром неспецифичен и универсален, так как возникает при самых разнообразных заболеваниях.
Патогенез ДВС-синдрома
Основа патогенеза ДВС-синдрома заключается в глубокой дисфункции всех звеньев системы гемостаза, которая характеризуется последовательной их активацией и истощением. По этой причине происходит смена фаз ДВС-синдрома — от гиперкоагуляции и высокой спонтанной агрегации тромбоцитов в начале до переходного периода и последующей глубокой гипокоагуляции, вплоть до полной несвертываемости крови и тромбоцитопении в конце. Уже на ранних этапах обнаруживается истощение не столько факторов свертывания, сколько важнейших физиологических антикоагулянтов — протеина С (ПрС), протеина S (ПрS), антитромбина III (АТ III). Депрессия физиологических антикоагулянтов тем значительнее, чем тяжелее ДВС. У больных с различными по происхождению вариантами ДВС-синдрома в процессе их формирования и развития отмечается ряд принципиальных закономерностей:
Уже на ранних этапах обнаруживается истощение не столько факторов свертывания, сколько важнейших физиологических антикоагулянтов — протеина С (ПрС), протеина S (ПрS), антитромбина III (АТ III). Депрессия физиологических антикоагулянтов тем значительнее, чем тяжелее ДВС. У больных с различными по происхождению вариантами ДВС-синдрома в процессе их формирования и развития отмечается ряд принципиальных закономерностей:
1) наступление фазы гиперкоагуляции;
2) срыв и прогрессирующее истощение основных антикоагулянтов (ПрС, ПрS, АТ III).
Стадии ДВС-синдрома
I стадия — гиперкоагуляция. При однократном и массивном образовании тромбопластина она кратко-временна, но отчетлива по лабораторным признакам. Данный период характеризуется активацией плазменных систем свертывания крови, внутрисосудистой агрегацией тромбоцитов и других форменных элементов крови, нарушением микроциркуляции в разных органах в результате блокады сосудистого русла массами фибрина и агрегатами клеток.
II стадия — гипокоагуляция. Обусловлена потреблением значительной части имеющихся в организме фибриногена, факторов V, VIII, XIII и других прокоагулянтов, а также тромбоцитов. Одновременно в крови накапливаются патологические ингибиторы свертывания крови, в частности продукты деградации фибрина и фибриногена (ПДФ), обусловливающие увеличение антикоагулянтной активности крови.
III стадия — активация фибринолиза (афибриногенемии с патологическим фибринолизом). Активация фибринолитической системы ведет к растворению кровяных сгустков и создает предпосылки для развития геморрагического синдрома.
IV стадия — восстановительная. Характеризуется возвращением к физиологическим границам коагуляционного потенциала. В этой стадии в той или иной мере происходит восстановление функции органов, которое зависит от степени их поражения. Стадия может закончиться полным выздоровлением. Возможно развитие тяжелых осложнений уже в отсутствие как такового ДВС-синдрома — почечной, печеночной недостаточности, неврологических, кардиальных и других осложнений.
Причины ДВС-синдрома в акушерстве
ДВС-синдром зависит от характера акушерской патологии, вызвавшей кровотечение, сопутствующих соматических заболеваний, особенностей течения беременности и др. При этом наблюдается множество клинических и лабораторных вариантов ДВС-синдрома, протекающего индивидуально у каждой пациентки.
Причины ДВС-синдрома в акушерстве [4, 5]:
1. Отслойка плаценты.
2. Септический аборт и внутриутробная инфекция.
3. Эмболия околоплодными водами.
4. Внутриутробная гибель плода.
5. Внематочная беременность.
6. Преэклампсия/эклампсия.
7. Кесарево сечение (10 %).
8. Трансфузия несовместимой крови.
9. Травматические роды, в том числе энергичный массаж матки (высвобождение тканевого фактора).
10. Синдром массивной гемотрансфузии.
11. HELLP-синдром.
12. Острая жировая дистрофия печени.
Патофизиология ДВС-синдрома при акушерской патологии
В данном вопросе очень важным является понимание процесса свертывания крови в норме и наблюдаемого во время ДВС. Нормальный коагулянтный ответ начинается с воздействия тканевого фактора (TF) вместе с фактором VIIa на фактор Xа для дальнейшего превращения протромбина в тромбин (IIa) [6]. Тромбин является прокоагулянтом при превращении фибриногена в фибрин и контролирует антикоагуляционный процесс путем генерирования активированного протеина С (аПрС), снижая активность факторов Vа и VIIIа. Растворение сгустка и генерирование продуктов деградации фибрина/фибриногена происходят через тромбининдуцированный тканевой активатор плазминогена (tPA) с регуляцией фибринолиза, включающей активацию ингибитора фибринолиза, активируемого тромбином (TAFI) [7, 8]. Таким образом, тромбин играет центральную роль в балансе между про- и антикоагулянтной функцией и про- и антифибринолитической активностью (рис. 1).
Нормальный коагулянтный ответ начинается с воздействия тканевого фактора (TF) вместе с фактором VIIa на фактор Xа для дальнейшего превращения протромбина в тромбин (IIa) [6]. Тромбин является прокоагулянтом при превращении фибриногена в фибрин и контролирует антикоагуляционный процесс путем генерирования активированного протеина С (аПрС), снижая активность факторов Vа и VIIIа. Растворение сгустка и генерирование продуктов деградации фибрина/фибриногена происходят через тромбининдуцированный тканевой активатор плазминогена (tPA) с регуляцией фибринолиза, включающей активацию ингибитора фибринолиза, активируемого тромбином (TAFI) [7, 8]. Таким образом, тромбин играет центральную роль в балансе между про- и антикоагулянтной функцией и про- и антифибринолитической активностью (рис. 1).
Центральное место в развитии ДВС-синдрома принадлежит тромбину, для которого характерна чрезмерная генерация in vivo. Хотя образование тромбина в основном зависит от протромбиназного комплекса на поверхности тромбоцитов, клетки без фосфолипидов также могут поддерживать такие реакции in vivo [9, 10]. Они образуются в результате апоптоза или повреждения клеточных мембран, выпячивая фосфатидилсерин, находящийся на внутренней стороне мембраны. Микрочастицы, которые переносят внутренний фосфатидилсерин, продуцируют прокоагулянт, и их уровни увеличиваются при беременности [11].
Они образуются в результате апоптоза или повреждения клеточных мембран, выпячивая фосфатидилсерин, находящийся на внутренней стороне мембраны. Микрочастицы, которые переносят внутренний фосфатидилсерин, продуцируют прокоагулянт, и их уровни увеличиваются при беременности [11].
Также важное значение имеет обеспечение фосфолипидной поверхности липопротеинами, такими как окисленный липопротеин низкой плотности и липопротеин очень низкой плотности. Последний может увеличиваться при ДВС-синдроме в несколько раз [12]. Кроме того, дисрегуляция липопротеинов влияет на активность тромбина через относительное уменьшение липопротеинов высокой плотности, которые обладают антикоагулянтными свойствами [13]. Было показано, что циркулирующие липопротеины коррелируют с более высокой частотой преэклампсии [14]. У женщин с преэклампсией отмечены 3-кратное увеличение уровня липопротеинов очень низкой плотности и значительно сниженная концентрация липопротеинов высокой плотности. Этот дисбаланс между про- и антикоагулянтными липопротеинами приводит к эндотелиальной дисфункции и служит патогенезом преэклампсии.
Плацента как активатор коагуляционной системы
Плацента обладает повышенным статусом коагуляционной активности за счет увеличения продуцирования тканевого фактора. При этом наблюдаются увеличение степени превращения протромбина (фактор II) в тромбин (фактор IIa) и дальнейшее расщепление фибриногена до фибрина. Происходит увеличение TAFIa, который вместе с повышенными уровнями PAI-1 и -2 снижает фибринолитическую активность. Этот процесс обычно осуществляется через нормальную tPA-индуцированную генерацию плазмина из плазминогена, образуя в конечном итоге продукты деградации фибрина/фибриногена (рис. 2).
В сосудистой оболочке плаценты содержатся эмбриональные трофобластные клетки, обладающие эндотелиальной клеточной способностью регулировать гемостаз. Эти клетки имеют несколько различных гемостатических свойств, которые важны для поддержания гемостаза при нормальной беременности. К ним относятся экспрессия TF, изменение антикоагулянт-ной функции, супрессия фибринолиза и воздействие анионных фосфолипидов.
1. Экспрессия тканевого фактора
Синцитиотрофобласты из нормальной плаценты человека обладают сильно выраженной активностью TF [15]. Нарушение целостности трофобластов, что классически наблюдается при отслойке плаценты, приводит к высвобождению большого количества тканевого фактора в материнском кровообращении. Это способствует активации коагуляционного каскада и распространению воспалительного ответа, который может легко стать системным, что приведет к неконтролируемому высвобождению тромбина и последующему развитию ДВС [16] (рис. 3). Для поддержания гемостаза во время эмбрионального развития необходим соответствующий баланс между TF и TFPI в разных органах [17].
2. Изменение антикоагулянтных функций
Тромбомодулин (ТМ) экспрессируется на трофобластах плаценты таким же образом, как и на поверхности кровеносных сосудов [18]. В работе М. Boffa и др. ([19] показано, что растворимые уровни ТМ на 12-й неделе гестации были одинаковыми при нормальной и патологической беременности. Эндотелиальный рецептор протеина С (EPCR) также экспрессируется на синцитиотрофобластах, что делает возможным аПрС-зависимому протеаза-активированному рецептору-1 блокировать апоптоз клеток плаценты [20]. Высокие уровни антител к EPCR связаны с более высоким риском первого эпизода смерти плода. Аутоантитела (анти-EPCR) могут активировать комплемент и быть причиной провос-палительного разрушения трофобластов и гибели плода. Активность протеина С не зависит от сроков гестации, в то время как прогрессивное уменьшение уровня протеина S наблюдается с увеличением срока гестации. Резистентность активированного протеина С увеличивается в течение беременности у 45 % беременных женщин по сравнению с небеременными женщинами того же возраста [21]. Уровни антитромбина III не изменяются в течение беременности [22]. В целом системная антикоагулянтная активность снижена по сравнению с небеременными женщинами, что подтверждается общим прокоагулянтным сдвигом при нормальной беременности [23]. Отмечено закономерное снижение уровня АТ III в ходе ДВС-синдрома из-за его действия на нейтрализацию тромбина, фактора Хa и других плазменных сериновых протеаз.
Эндотелиальный рецептор протеина С (EPCR) также экспрессируется на синцитиотрофобластах, что делает возможным аПрС-зависимому протеаза-активированному рецептору-1 блокировать апоптоз клеток плаценты [20]. Высокие уровни антител к EPCR связаны с более высоким риском первого эпизода смерти плода. Аутоантитела (анти-EPCR) могут активировать комплемент и быть причиной провос-палительного разрушения трофобластов и гибели плода. Активность протеина С не зависит от сроков гестации, в то время как прогрессивное уменьшение уровня протеина S наблюдается с увеличением срока гестации. Резистентность активированного протеина С увеличивается в течение беременности у 45 % беременных женщин по сравнению с небеременными женщинами того же возраста [21]. Уровни антитромбина III не изменяются в течение беременности [22]. В целом системная антикоагулянтная активность снижена по сравнению с небеременными женщинами, что подтверждается общим прокоагулянтным сдвигом при нормальной беременности [23]. Отмечено закономерное снижение уровня АТ III в ходе ДВС-синдрома из-за его действия на нейтрализацию тромбина, фактора Хa и других плазменных сериновых протеаз.
3. Подавление фибринолиза
При увеличении уровня PAI-1 плацента продуцирует PAI-2. При нормальной беременности показатель PAI-1 постепенно увеличивается, достигая заметного повышения в 3-м триместре. Это значительное увеличение сравнимо с относительно неизменяемыми уровнями tPA, что приводит к уменьшению лизиса сгустка и протромботического смещения у беременных женщин [24]. Эта так называемая повышенная защита против лизиса сгустка действует опосредованно через ингибитор фибринолиза, активируемого тромбином. TAFI представляет собой карбоксипептидазу В-подобного профермента, который синтезируется в печени и активируется тромбин-тромбомодулиновым комплексом. При активации снижается регуляция фибринолиза и значительно увеличивается уровень TAFI у беременных, достигая пика в последнем триместре. При ДВС-синдроме чрезмерная генерация тромбина еще больше увеличивает уровни TAFI как ингибитора фибринолиза.
4. Воздействие анионных фосфолипидов
Было показано, что фосфолипиды играют важную роль в росте поверхности плаценты при дифференциации и внутриклеточном слиянии ворсистого цитотрофобласта в синцитиотрофобласт [25].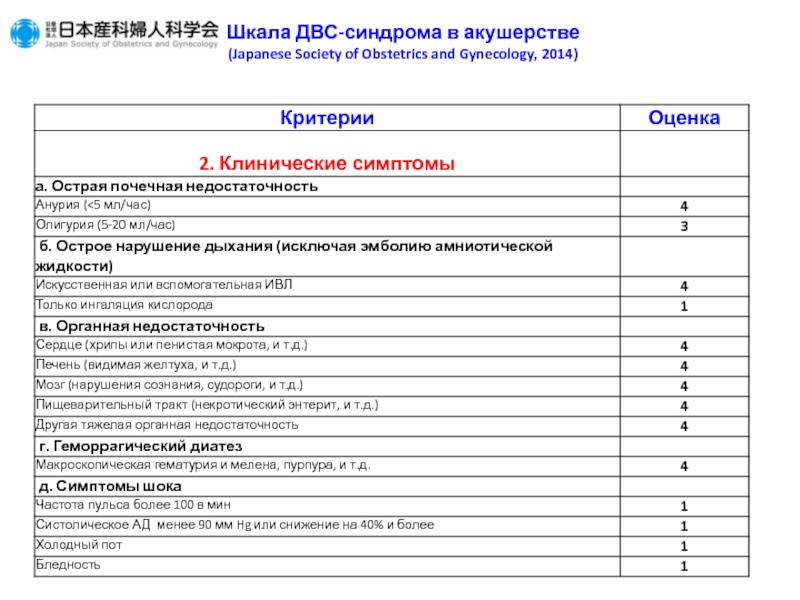 Экстернализация фосфатидилсерина является важным компонентом этого процесса интертрофобластного слияния. Дифференциация цитотрофобластных ворсинок — это результат перераспределения мембранных фосфолипидов с обогащенным фосфатидилсерином на поверх-ности синцитиотрофобласта. При патологических состояниях ДВС в акушерстве наблюдается насыщение фосфатидилсерином трофобластной поверхности.
Экстернализация фосфатидилсерина является важным компонентом этого процесса интертрофобластного слияния. Дифференциация цитотрофобластных ворсинок — это результат перераспределения мембранных фосфолипидов с обогащенным фосфатидилсерином на поверх-ности синцитиотрофобласта. При патологических состояниях ДВС в акушерстве наблюдается насыщение фосфатидилсерином трофобластной поверхности.
Эндотелиальная дисфункция и активация тромбоцитов
Интактные, дисфункциональные или активированные клетки, а также ремнанты клеточных поверхностей, медиаторы воспаления и коагуляционные белки являются частью взаимодействия, в котором неконтролируемая активация коагуляционного каскада приводит к ДВС. Эндотелиальные клетки, тромбоциты и в некоторых случаях лейкоциты могут участвовать в возникновении процесса, который приводит к ДВС при высвобождении провоспалительных цитокинов, распространяющих активацию коагуляции на их поверх-ности или индуцируя экспрессию TF на их мембране [26, 27].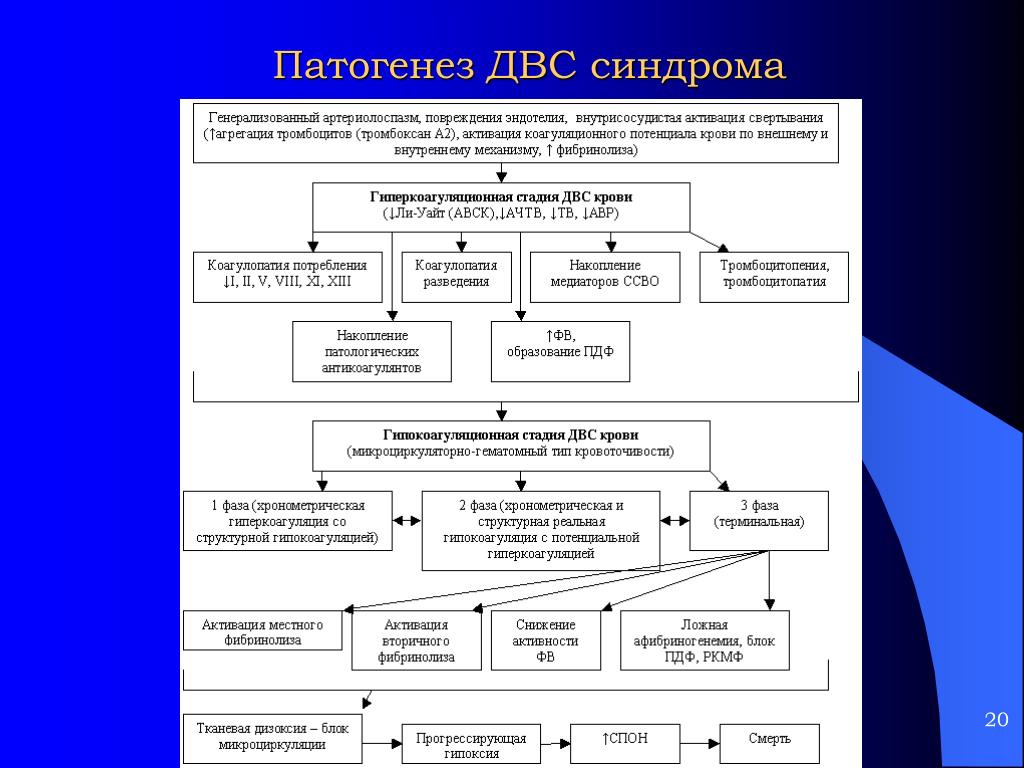 Системный воспалительный ответ, который связан с увеличением циркулирующих провоспалительных цитокинов, таких как фактор некроза опухоли α (TNF-α) и интерлейкин-1 (IL-1), приводит к сверхэкспрессии TF лейкоцитами и эндотелиальными клетками. Результатом этого будет неконтролируемый коагуляционный ответ, который в конечном итоге приведет к ДВС. Тканевой фактор может экспрессироваться не только мононуклеарными клетками, но и сосудистыми эндотелиальными и опухолевыми клетками. Необходимо отметить, что если физиологические антикоагулянты функционируют нормально, то, несмотря на мощное инициирование коагуляции тканевым фактором, активация коагуляции может не возникнуть. Однако при ДВС-синдроме происходит нарушение всех основных природных антикоагулянтов (АТ III, ПрС и ингибитор тканевого фактора — TFPI). Концентрация антитромбина III, самого важного ингибитора тромбина, заметно снижена при ДВС, так как расщепляется эластазой из активированных нейтрофилов. Действие антикоагулянтов связано с эндотелием, поэтому активация эндотелиальных клеток и их дисфункция являются важными компонентами дисбаланса между свертывающей и антисвертывающей системами.
Системный воспалительный ответ, который связан с увеличением циркулирующих провоспалительных цитокинов, таких как фактор некроза опухоли α (TNF-α) и интерлейкин-1 (IL-1), приводит к сверхэкспрессии TF лейкоцитами и эндотелиальными клетками. Результатом этого будет неконтролируемый коагуляционный ответ, который в конечном итоге приведет к ДВС. Тканевой фактор может экспрессироваться не только мононуклеарными клетками, но и сосудистыми эндотелиальными и опухолевыми клетками. Необходимо отметить, что если физиологические антикоагулянты функционируют нормально, то, несмотря на мощное инициирование коагуляции тканевым фактором, активация коагуляции может не возникнуть. Однако при ДВС-синдроме происходит нарушение всех основных природных антикоагулянтов (АТ III, ПрС и ингибитор тканевого фактора — TFPI). Концентрация антитромбина III, самого важного ингибитора тромбина, заметно снижена при ДВС, так как расщепляется эластазой из активированных нейтрофилов. Действие антикоагулянтов связано с эндотелием, поэтому активация эндотелиальных клеток и их дисфункция являются важными компонентами дисбаланса между свертывающей и антисвертывающей системами.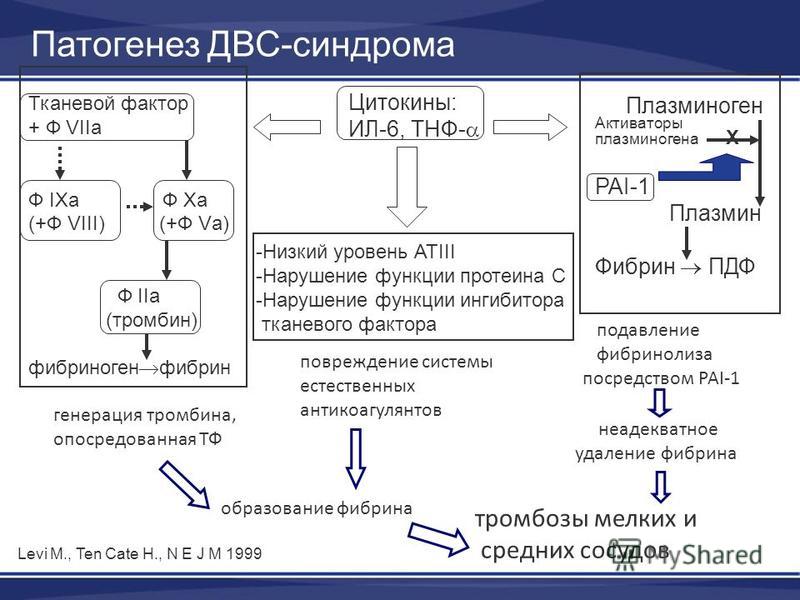
Активация тромбоцитов может ускорить образование фибрина. Экспрессия TF в моноцитах заметно стимулируется при наличии тромбоцитов и гранулоцитов в Р-селектинзависимых реакциях. Этот эффект является результатом индуцированной активации ядерного фактора каппа В при связывании активированных тромбоцитов с нейтрофилами и мононуклеарными клетками. Во время беременности лейкоциты матери имеют высокий активационный статус по сравнению с небеременными женщинами и обладают характеристиками, похожими на сепсис [28]. В случае сепсиса, вызванного инфекционными агентами, септическим абортом или эмболией амниотической жидкостью, это равновесие нарушено, и у матери развивается ДВС-синдром.
Лабораторная диагностика ДВС-синдрома
Лабораторная диагностика ДВС-синдрома должна быть срочной, основанной на четко построенной системе простых и легко выполнимых тестов. Вместе с тем эти тесты должны отражать фазы развития ДВС-синдрома, а также контролировать проводимое лечение. Продолжительность клинических проявлений ДВС-синдрома может достигать 7–9 часов и более. Изменения в системе гемокоагуляции, определяемые с помощью лабораторных методов, сохраняются дольше, чем клинические, поэтому лабораторная диагностика ДВС-синдрома имеет первостепенное значение. Для лабораторной диагностики ДВС-синдрома используют простые и легкодоступные коагуляционные тесты, которые включают анализ количества тромбоцитов, время свертывания, протромбиновое время (ПВ), активированное частичное протромбиновое время (АЧТВ), тромбиновое время (ТВ), фибриноген, продукты деградации фибирина/фибриногена (ПДФ) и D-димер (табл. 1). Одним из ключевых моментов в этом процессе является то, что эти тесты отражают динамические изменения на основе клинических наблюдений.
Продолжительность клинических проявлений ДВС-синдрома может достигать 7–9 часов и более. Изменения в системе гемокоагуляции, определяемые с помощью лабораторных методов, сохраняются дольше, чем клинические, поэтому лабораторная диагностика ДВС-синдрома имеет первостепенное значение. Для лабораторной диагностики ДВС-синдрома используют простые и легкодоступные коагуляционные тесты, которые включают анализ количества тромбоцитов, время свертывания, протромбиновое время (ПВ), активированное частичное протромбиновое время (АЧТВ), тромбиновое время (ТВ), фибриноген, продукты деградации фибирина/фибриногена (ПДФ) и D-димер (табл. 1). Одним из ключевых моментов в этом процессе является то, что эти тесты отражают динамические изменения на основе клинических наблюдений.
Кроме основных лабораторных тестов, для врача-клинициста важно иметь информацию о возможности применения в своей практике более широкого спектра лабораторного тестирования.
1. Дополнительные тесты
Уровни природных антикоагулянтов, такие как антитромбин III и протеин С, снижены у пациентов с ДВС, что отмечено у 90 % пациентов с ДВС. Лабораторные значения этих природных ингибиторов предоставляют ценную информацию для диагностики и мониторинга ДВС-синдрома, однако они не используются в лабораторных исследованиях, так как не добавляют никакой диагностической информации. Низкие уровни антитромбина III и протеина С не являются специфичными для ДВС-синдрома по причине того, что они могут быть связаны с заболеванием печени или с другими патологиями.
Лабораторные значения этих природных ингибиторов предоставляют ценную информацию для диагностики и мониторинга ДВС-синдрома, однако они не используются в лабораторных исследованиях, так как не добавляют никакой диагностической информации. Низкие уровни антитромбина III и протеина С не являются специфичными для ДВС-синдрома по причине того, что они могут быть связаны с заболеванием печени или с другими патологиями.
2. Новые тесты
В дополнение к анализу общего количества тромбоцитов возможно использовать другие параметры тромбоцитов для постановки ДВС-синдрома. Некоторые современные гематологические анализаторы имеют возможность идентифицировать ретикулярные тромбоциты, измеряемые как фракция незрелых тромбоцитов. Недавние исследования показали, что увеличение ретикулярных тромбоцитов коррелирует с диагнозом явного ДВС-синдрома. Наличие ретикулярных тромбоцитов коррелирует с увеличением продуктов деградации фибрина и показывает лучший прогноз ДВС, чем тромбоциты. Поскольку ДВС включает активацию воспалительного процесса, анализ воспалительных маркеров, таких как С-реактивный белок, интерлейкин-6, -8, фактор некроза опухоли альфа, прокальцитонин и липопротеинсвязывающий белок, будет осуществляться в самое ближайшее время.
Поскольку ДВС включает активацию воспалительного процесса, анализ воспалительных маркеров, таких как С-реактивный белок, интерлейкин-6, -8, фактор некроза опухоли альфа, прокальцитонин и липопротеинсвязывающий белок, будет осуществляться в самое ближайшее время.
3. Специализированные тесты
Для установления диагноза ДВС-синдрома могут применяться специализированные лабораторные тесты.
Специализированные тесты для ДВС-синдрома
Избыточная генерация тромбина
— Увеличение комплекса «тромбин — антитромбин».
— Увеличение фибринопептидов.
— Увеличение фрагментов протромбина 1 и 2.
Снижение протеинов С и S, антитромбина III. Повышенный фибринолиз
— Увеличение плазмина.
— Снижение уровня плазминогена.
— Снижение α2-антиплазмина.
— Увеличение комплекса «плазмин — антиплазмин».
— Высокие уровни ингибиторов активатора плазминогена.
Новые маркеры (тромбоз-воспаление)
— Повышенный растворимый тромбомодулин.
— Увеличение количества гистонов и внеклеточной ДНК.
— Повышение групп белков высокой мобильности-1.
— Активация нейтрофилов.
— Снижение ADAMTS-13 (a disintegrin and metalloprotei-nase with a thrombospondin type 1 motif, member 13).
— Маркеры комплемента (С3, комплекс мембранной атаки и маннозосвязывающий лектин).
— Пресепсин (растворимый кластер дифференцировки, субтип 14).
4. Тромбоэластография
Тромбоэластография представляет собой интегральный метод оценки системы гемостаза с использованием анализа вязкоэластических свойств сгустка. Одновременная диагностика коагуляционного каскада, активности фибринолиза и тромбоцитарного звена может обнаружить расстройства системы гемостаза в течение 10–20 мин (рис. 4). Для этих целей широкое применение в мире нашли анализаторы TEG (Haemoscope Corporation, США) и ROTEM (Tem GmbH, Германия).
Шкалы для диагностики ДВС-синдрома
Раннее и точное распознавание ДВС-синдрома является отличительной чертой успеха в лечении этого осложнения. К сожалению, в большинстве случаев диагноз «ДВС-синдром» основывается на клинической оценке пациента. Следует отметить, что не существует ни одного лабораторного или клинического теста, который был бы чувствительным и специфичным для диагностики ДВС. По этим причинам, а также в связи с необходимостью предоставить врачу-клиницисту данные по раннему выявлению ДВС были предприняты усилия для создания скрининг-систем, построенных на идентификации пациентов с высоким риском этого опасного осложнения.
У пациентов с подозрением на ДВС-синдром предлагается использовать для постановки диагноза следующие шкалы: ISTH (International Society on Thrombosis and Hemostasis), JMHW (Japanese Ministry of Health and Welfare), JAAM (Japanese Association for Acute Medicine) (табл. 2) [29–32].
Общепринятые шкалы диагностики ДВС-синдрома по ISTH, JMHW, JAAM не всегда могут учитывать особенности физиологии гемостаза при беременности (увеличение ПДФ, фибриногена) и особенности критических состояний в акушерстве. Для диагностики ДВС-синдрома в акушерстве целесообразно использовать шкалу Japanese Society of Obstetric and Gynecology, 2014 [33] (табл. 3),
Для диагностики ДВС-синдрома в акушерстве целесообразно использовать шкалу Japanese Society of Obstetric and Gynecology, 2014 [33] (табл. 3),
которая учитывает особенности основного заболевания, клинических симптомов, органной недостаточности и лабораторных исследований. Эта шкала объединяет клинические ситуации с пре-обладанием кровотечения и ситуации с преобладанием микротромбоза и органной недостаточности. Несмотря на некоторую ограниченность, характерную для всех шкал, именно подобный комплексный подход должен использоваться врачом акушером-гинекологом и врачом анестезиологом-реаниматологом для диагностики ДВС-синдрома и выбора лечебной тактики: применение заместительной терапии компонентами крови или физиологическими антикоагулянтами.
Заключение
ДВС-синдром связан с акушерской патологией и представляет собой опасную для жизни ситуацию. Понимание механизмов развития и быстрая информативная диагностика этого заболевания, а также своевременное лечение способствуют благоприятному исходу. Лабораторные тесты являются очень важными компонентами диагностического процесса, однако ни один из них, доступный в настоящее время, окончательно не способен диагностировать ДВС. Для диагностики ДВС-синдрома в акушерстве рекомендуется использовать пять основных тестов — на определение количества тромбоцитов, фибриногена, продуктов деградации фибрина/фибриногена, протромбинового времени, D-димера, а также современные тесты — на наличие воспалительных маркеров и метод тромбоэластографии. Для повышения диагностической значимости при установлении диагноза ДВС-синдрома, связанного с акушерской патологией, применяют международные шкалы для подсчета баллов.
Лабораторные тесты являются очень важными компонентами диагностического процесса, однако ни один из них, доступный в настоящее время, окончательно не способен диагностировать ДВС. Для диагностики ДВС-синдрома в акушерстве рекомендуется использовать пять основных тестов — на определение количества тромбоцитов, фибриногена, продуктов деградации фибрина/фибриногена, протромбинового времени, D-димера, а также современные тесты — на наличие воспалительных маркеров и метод тромбоэластографии. Для повышения диагностической значимости при установлении диагноза ДВС-синдрома, связанного с акушерской патологией, применяют международные шкалы для подсчета баллов.
Bibliography
1. Williams J., Mozurkewich E., Chilimigras J., Van De Ven C. Critical care in obstetrics: pregnancy-specific conditions // Best Pract. Res.: Clin. Obstet. Gynaecol. — 2008. — 22(5). — 825-46.
2. DeLee J.B. A case of fatal hemorrhagic diathesis, with premature detachment of the placenta // Am. J. Obstet., Dis. Women, Child. — 1901. — 44. — 785-92.
J. Obstet., Dis. Women, Child. — 1901. — 44. — 785-92.
3. McKay D.G. Disseminated Intravascular Coagulation. An Intermediary Mechanism of Disease. — New York: Harper & Row, 1965.
4. Rattray D.D., O’Connell C.M., Baskett T.F. Acute disseminated intravascular coagulation in obstetrics: a tertiary centre population review (1980 to 2009) // J. Obstet. Gynaecol. Can. — 2012. — 34. — 341-347.
5. Erez O., Novack L., Beer-Weisel R. et al. DIC score in pregnant women — a population based modification of the International Society on Thrombosis and Hemostasis score // PLoS One. — 2014. — 9. — 93240.
6. Hoffman M., Monroe D.M. Coagulation 2006: a modern view of hemostasis // Hematol. Oncol. Clin. North Am. — 2007. — 21. — 1-11.
7. Medved L., Nieuwenhuizen W. Molecular mechanisms of initiation of fibrinolysis by fibrin // Thromb. Haemost. — 2003. — 89. — 409-19.
8. Bajzar L., Morser J. , Nesheim M. TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex // J. Biol. Chem. — 1996. — 271. — 16603-8.
, Nesheim M. TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex // J. Biol. Chem. — 1996. — 271. — 16603-8.
9. Rosing J., van Rijn J.L., Bevers E.M. et al. The role of activated human platelets in prothrombin and factor X activation // Blood. — 1985. — 65. — 319-32.
10. Moyer M.P., Tracy R.P., Tracy P.B. et al. Plasma lipoproteins support prothrombinase and other procoagulant enzymatic complexes // Arterioscler., Thromb., Vasc. Biol. — 1998. — 18. — 458-65.
11. Bretelle F., Sabatier F., Desprez D. et al. Circulating microparticles: a marker of procoagulant state in normal pregnancy and pregnancy complicated by preeclampsia or intrauterine growth restriction // Thromb. Haemost. — 2003. — 89. — 486-92.
12. Dennis M.W., Downey C., Brufatto N. et al. Prothrombinase enhancement through quantitative and qualitative changes affecting very low density lipoprotein in complex with C-reactive protein // Thromb. Haemost. — 2004. — 9. — 522-30.
Haemost. — 2004. — 9. — 522-30.
13. Griffin J.H., Kojima K., Banka C.L. et al. High-density lipoprotein enhancement of anticoagulant activities of plasma protein S and activated protein C // J. Clin. Invest. — 1999. — 103. — 219-27.
14. Sattar N., Bendomir A., Berry C. et al. Lipoprotein subfraction concentrations in preeclampsia: pathogenic parallels to atherosclerosis // Obstet. Gynecol. — 1997. — 89. — 403-8.
15. Aharon A., Brenner B., Katz T. et al. Tissue factor and tissue factor pathway inhibitor levels in trophoblast cells: implications for placental hemostasis // Thromb. Haemost. — 2004. — 92. — 776-86.
16. Oyelese Y., Ananth C.V. Placental abruption // Obstet. Gynecol. — 2006. — 108. — 1005-16.
17. Pedersen B., Holscher T., Sato Y. et al. A balance between tissue factor and tissue factor pathway inhibitor is required for embryonic development and hemostasis in adult mice // Blood. — 2005. — 105. — 2777-82.
— 2005. — 105. — 2777-82.
18. Brenner B. Haemostatic changes in pregnancy // Thromb. Res. — 2004. — 114. — 409-14.
19. Boffa M.C., Valsecchi L., Fausto A. et al. Predictive value of plasma thrombomodulin in preeclampsia and gestational hypertension // Thromb. Haemost. — 1998. — 79. — 1092-5.
20. Isermann B., Sood R., Pawlinski R. et al. The thrombomodulin — protein C system is essential for the maintenance of pregnancy // Nat. Med. — 2003. — 9. — 331-7.
21. Clark P., Brennand J., Conkie J.A. et al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy // Thromb. Haemost. — 1998. — 79. — 1166-70.
22. Bremme K., Ostlund E., Almqvist I. et al. Enhanced thrombin generation and fibrinolytic activity in normal pregnancy and the puerperium // Obstet. Gynecol. — 1992. — 80. — 132-7.
23. Cerneca F., Ricci G., Simeone R. et al. Coagulation and fibrinolysis changes in normal regnancy // Eur. J. Obstet. Gynecol. Reprod Biol. — 1997. — 73. — 31-6.
J. Obstet. Gynecol. Reprod Biol. — 1997. — 73. — 31-6.
24. Robb A.O., Mills N.L., Din J.N. et al. Acute endothelial tissue plasminogen activator release in pregnancy // J. Thromb. Haemost. — 2009. — 7. — 138-42.
25. Das M., Xu B., Lin L. et al. Phosphatidylserine efflux and intercellular fusion in a BeWo model of human villous cytotrophoblast // Placenta. — 2004. — 25. — 96-407.
26. Levi M. Pathogenesis and management of peripartum coagulopathic calamities (disseminated intravascular coagulation and amniotic fluid embolism) // Thromb. Res. — 2013. — 131(Suppl. 1). — 32-4.
27. Levi M., van der Poll T. Inflammation and coagulation // Crit. Care Med. — 2010. — 38. — 26-34.
28. Sacks G.P., Studena K., Sargent K., Redman C.W. Normal pregnancy and preeclampsia both produce inflammatory changes in peripheral blood leukocytes akin to those of sepsis // Am. J. Obstet. Gynecol. — 1998. — 179. — 80-6.
29. Bakhtiari K., Meijers J.C.M., de Jonge E., Levi M. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation // Crit. Care Med. — 2004. — 32. — 2416-21.
30. Yanada M., Matsushita T., Suzuki M., Kiyoi H., Yamamoto K., Kinoshita T. et al. Disseminated intravascular coagulation in acute leukemia: clinical and laboratory features at presentation // Eur. J. Haematol. — 2006. — 77. — 282-7.
31. Gando S., Iba T., Eguchi Y., Ohtomo Y., Okamoto K., Koseki K. et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: Comparing current criteria // Crit. Care Med. — 2006. — 34. — 625-31.
32. Sawamura A., Hayakawa M., Gando S., Kubota N., Sugano M., Wada T. et al. Application of the Japanese Association for Acute Medicine disseminated intravascular coagulation diagnostic criteria for patients at an early phase of trauma // Thromb. Res. — 2009. — 124. — 706-10.
Res. — 2009. — 124. — 706-10.
33. Minakami H., Maeda Т., Fujii T. et al. Guidelines for obstertical practice in Japan: Japan Society of Obstertics and Gynecology (JSOG) and Japan Association of Obstetricians and Gynecologists (JAOG) 2014 edition // J. Obstet. Gynaecol. Res. — 2014 Jun. — 40(6). — 1469-99.
ДВС-синдром в акушерстве — Docsity
Сопоставление различных шкал диагностики явного ДВС-синдрома Шкала диагностики ДВС-синдрома
CDSS
Параметр Критерии
явного ДВС по
ISTH
Критерии ДВС
по JMHLW
Критерии ДВС по
JAAM
Соответствующ
ее заболевание
0 баллов 1 балл 0 баллов
Клинические
проявления
0 баллов
Кровотечение – 1
балл
ПОН -1 балл
SIRS более 3 – 1
балл
Тромбоциты,
тыс в мкл
От 50 до 100 – 1
балл
Менее 50 – 2
балла
От 80 до 120 – 1
балл
От 50 до 80 – 2
балла
Менее 50 -3
балла
От 80 до 120 и
снижение на 30% –
1 балл
От 50 до 80 – и
снижение — 3 балла
ПДФ
Умеренное
повышение – 2
балла
Выраженное
повышение- 3
балла
От 10 до 20
мкг/мл
-1 балл
От 20 до 40
мкг/мл
– 2 балла
Более 40 мкг/мл –
3 балла
От 10 до 25 мкг/мл —
1 балл
Более 25 мкг/мл –
3 балла
Фибриноген г/л
Менее 1,0 – 1
балл
От 1 до 1,5 -1
балл Менее 1,0 –
2 балла
Нет
Протромбиново
е время
От 3 до 6 с – 1
балл
Более 6 с – 2
балла
1,25-1,67 -1
балла Более
1,67 – 2 балла
Более 1,2 – 1 балл
Диагноз Более 5 баллов Более 7 баллов Более 4 баллов
Пункты Баллы
1. Соответствующее заболевание 2
Соответствующее заболевание 2
2. Клинические проявления
Кровотечение (кровоточивость), независимое от
основного заболевания
Любое
значение
Шок, нарушение микроциркуляции, независимое
от основного заболевания 1
Необъясненная органная недостаточность 3. Лабораторные исследования
Количество тромбоцитов (109/л)
Более или равно100 0
80–100 1
Менее 80 2
Уменьшение на 50% в течение 24 часов 1
D-димер (мг/л) Менее 5 0
5–9 2
Более или равно 9 3
Удлинение ПТ и АПТВ Удлинение ПВ менее 3 с и удлинение АПТВ
менее 10 с 0
Удлинение ПВ более или равно 3 c или
удлинение АПТВ более или равно 10 с 1
Удлинение ПВ более или равно 6 с 2
Фибриноген (г/л)
Более или равно 1,0 0
Менее 1.0 1
Диагноз: Семь баллов или больше.
Синдром диссеминированного внутрисосудистого свертывания крови в акушерской практике — Макацария А. Д. — Практическое руководство
Д. — Практическое руководство
Автор: Макацария А.Д., Мищенко А.Л., Бицадзе В.О., Маров С.В.
Описание: В практическом руководстве «Синдром диссеминированного внутрисосудистого свертывания крови в акушерской практике» последовательно рассмотрены история открытия и изучения ДВС-синдрома, физиология функционирования гемостаза, вопросы циркуляторной адаптации сердечно-сосудистой системы и системы гемостаза при физиологически протекающей беременности; молекулярные аспекты патогенеза, варианты течения ДВС-синдрома при основных формах акушерской патологии: преждевременной отслойке нормально расположенной плаценты, эмболии околоплодными водами, гестозах, HELLP-синдроме, длительной задержке мертвого плода в матке.
В книге изложены механизмы ДВС-синдрома и принципы его терапии при шоках и шокоподобных состояниях в акушерстве: геморрагический шок, анафилактический шок, септический шок.
Отдельный раздел книги посвящен принципам лабораторной диагностики ДВС-синдрома.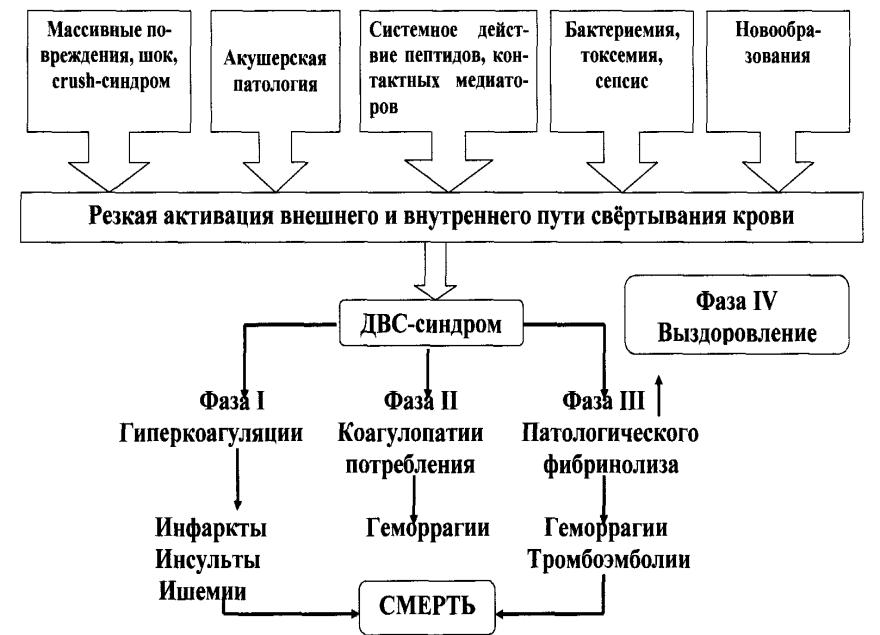
Книга «Синдром диссеминированного внутрисосудистого свертывания крови в акушерской практике» предназначена для врачей акушеров-гинекологов, клиницистов всех специальностей, а также студентов старших курсов медицинских вузов.
Содержание книги
«Синдром диссеминированного внутрисосудистого свертывания крови в акушерской практике»
История развития учения о ДВС-синдроме
Физиология системы гемостаза — краткий очерк
1. Сосудисто-тромбоцитарное звено гемостаза
2. Прокоагулянтное звено гемостаза
3. Звено ингибиторов свертывания крови
4. Фибринолитическая система
Циркуляторная адаптация сердечно-сосудистой системы и системы гемостаза к гестационному процессу
1. Адаптационные изменения в сердечно-сосудистой системе
1.1. Сократимость миокарда
1.2. Структурные изменения в сердце
1.3. Изменение артериального давления и общего периферического сопротивления
1. 4. Изменение объема циркулирующей крови и ее состава во время беременности
4. Изменение объема циркулирующей крови и ее состава во время беременности
1.5. Адаптационные изменения в системе доставки и утилизации кислорода
2. Адаптационные изменения в системе гемостаза
2.1. Тромбоциты
2.2. Сосудистый эндотелий
2.3. Прокоагулянтные факторы
2.4. Антикоагулянтные факторы
2.5. Фибринолитические и антифибринолитические факторы
3. Сосудистая адаптация к беременности
4. Изменения в системе гемостаза в родах и послеродовом периоде
5. Маточно-плацентарный гемостаз при физиологически протекающей беременности
Вопросы патогенеза ДВС-синдрома
1. Клинические состояния, часто осложняющиеся ДВС-синдромом
1.1. Патология в акушерстве и гинекологии
1.2. Заболевания сосудов и системы крови
1.3. Злокачественные опухоли
1.4. Травмы
1.5. Роль инфекционных факторов в генезе ДВС-синдрома
2. Пусковые факторы ДВС-синдрома
2.1. Тканевый тромбопластин как пусковой фактор ДВС-синдрома
2. 2. Нарушения функционального состояния эндотелиальных клеток
2. Нарушения функционального состояния эндотелиальных клеток
2.2.1. Активация эндотелиальных клеток при гестозах
2.2.2. Маркеры активации эндотелиальных клеток in vivo
2.3. Антифосфолипидные антитела как пусковой фактор ДВС-синдрома
3. Прогрессирование ДВС-синдрома
3.1. Роль фибринолитической системы в развитии ДВС-синдрома
3.2. Роль лейкоцитов, воспалительных цитокинов в патогенезе ДВС
Морфологические особенности ДВС-синдрома
1. Морфологические изменения в почках
2. Морфологические изменения в легких
3. Морфологические изменения в надпочечниках
4. Морфологические изменения в селезенке
5. Морфологические изменения в печени
6. Морфологические изменения в коже
7. Морфологические изменения других органов
8. Динамика морфологических изменений на различных стадиях ДВС-синдрома
Клиническая картина ДВС-синдрома
1. Клиническая картина острого и подострого ДВС-синдрома
2. Клиническая картина хронического ДВС-синдрома
Клиническая картина хронического ДВС-синдрома
3. Фазность течения ДВС-синдрома
4. Понятие о локализованном внутрисосудистом свертывании
4.1. Острое локализованное внутрисосудистое свертывание
4.2. Хроническое локализованное внутрисосудистое свертывание
Особенности патогенеза и течения ДВС- синдрома при различных патологических состояниях в акушерской практике
1. Эмболия околоплодными водами
1.1. Патофизиология нарушений гемостаза при эмболии околоплодными водами
1.2. Диагностика и лечение эмболии околоплодными водами
2. Преждевременная отслойка нормально расположенной плаценты
3. Гестоз и ДВС-синдром
3.1. Нарушения инвазии трофобласта и гестоз
3.2. Эндотелиальные повреждения и гестозы
3.3. Циркулирующие липиды и липопротеины
3.4. Принципы профилактики и терапии гестозов
4. HELLP-синдром
4.1. Патогенез HELLP-синдрома
4.2. Патофизиология гемостаза при HELLP-синдроме
4. 3. Принципы лечения HELLP-синдрома
3. Принципы лечения HELLP-синдрома
5. Другие причины ДВС-синдрома в акушерской практике
5.1. Синдром мертвого плода
5.2. Острый жировой гепатоз
5.3. Пузырный занос
6. Заключение
Шок в акушерской практике
1. Классификация шоковых состояний
2. Гиповолемический шок в акушерской практике
2.1. Причины гиповолемических состояний у беременных
2.2. Этиология и патогенез геморрагического шока
2.2.1. Изменение объема циркулирующей крови
2.2.2. Эффекты острой гиповолемии
2.2.3. Снижение оксигенации крови
2.2.4. Снижение функции левого желудочка
2.2.5. Механизмы повреждения клеток при шоке
2.2.6. Динамика патофизиологических изменений при геморрагическом шоке
2.2.7. Дыхательная недостаточность в патогенезе геморрагического шока
2.2.8. Клиническая картина острого респираторного дистресс-синдрома взрослых
2.3. Взаимосвязь ДВС-синдрома и геморрагического шока
2.4. Особенности течения акушерского гиповолемического шока, принципы диагностики и терапии
2. 4.1. Фаза компенсации
4.1. Фаза компенсации
2.4.2. Фаза декомпенсации
2.4.3. Фаза клеточных нарушений (полиорганной недостаточности) и высокого риска смерти
2.5. Основные принципы ведения беременных и рожениц при гиповолемическом шоке
2.5.1. Восстановление ОЦК
2.5.2. Дополнительная терапия лекарственными средствами
2.6. Гиповолемический шок и острая сердечная недостаточность
2.7. Некоторые сложности терапии шока, связанные с беременностью
3. Септический шок в акушерской практике
3.1. Патогенез септического шока
3.2. Синдром системного воспалительного ответа в патогенезе септического шока
3.2.1. Цитокины и система свертывания крови при септическом шоке
3.2.1.1. Фактор некроза опухоли а и интерлейкин-1
3.2.1.2. Интерлейкин-6
3.2.1.3. Интерлейкин-12 и интерферон — у
3.2.1.4. Интерлейкин-10
3.3. Синдром полиорганной недостаточности в патогенезе септического шока
3.4. Клиническая картина септического шока
3. 5. Диагностика септического шока
5. Диагностика септического шока
3.6. Лечение септического шока
4. Анафилактический шок в акушерской практике
4.1. Причины развития анафилактического шока в акушерской практике
4.2. Патофизиология анафилактического шока
4.3. Клиническая картина анафилактического шока
4.4. Дифференциальная диагностика
4.4.1. Стридор
4.4.2. Синкопальное состояние
4.4.3. Наследственный анпюневротическнй отек (НАО)
4.5. Профилактика и лечение анафилактического шока
4.5.1. Профилактика
4.5.2. Лечение анафилактического шока
Принципы лабораторной диагностики ДВС-синдрома
1. Общие положения лабораторной диагностики ДВС-синдрома
2. Лабораторная диагностика ДВС-синдрома
3. Молекулярные маркеры в диагностике ДВС
4. Диагностика коагулопатии потребления
5. Клиническое значение исследований тромбоцитарного звена гемостаза для диагностики ДВС-синдрома
6. Методы исследования системы гемостаза в диагностике ДВС-синдрома
6. 1. Общекоагуляционные методы исследования системы гемостаза
1. Общекоагуляционные методы исследования системы гемостаза
6.1.1. Хронометрические показатели
6.1.2. Тромбоэластография крови, плазмы и проба переноса по Raby(1974)
6.2. Тесты определения патологической активации системы гемостаза
6.2.1. Определение растворимых комплексов мономеров фибрина (РКМФ)
6.2.2. Определение продуктов деградации фибрина и фибриногена (ИДФ)
6.2.3. Определение комплекса тромбин — антитромбин III (ТАТ) и его клиническое значение количественной оценки тромбинемии
6.2.4. Клиническое значение определения начальных этапов тромбиногенеза по количественному содержанию фрагментов протромбина F1+2
6.3. Специальные методы исследования гемостаза
6.3.1. Методы исследования фибринолитического звена системы гемостаза
6.3.2. Выявление антифосфолипидных антител
6.4. Специальные методы оценки эффективности купирования синдрома ДВС
6.4.1. Методы оценки уровня гепаринемии
Система гемостаза у плодов и новорожденных в норме и при критических состояниях
Принципы применения противотромботических препаратов в акушерстве
1. Основные принципы лечения ДВС-синдрома
Основные принципы лечения ДВС-синдрома
2. Купирование коагулопатии потребления при II и III фазах ДВС-синдрома
3. Особенности противотромботической терапии при хронической форме течения ДВС-синдрома у АФА-позитивных и АФА-негативных женщин с гестозом
4. Влияние аспирина и курантила на параметры агрегатограммы у беременных с АФА
5. Влияние реополиглюкина на показатели тромбоцитарного звена системы гемостаза
6. Влияние гепарина и фраксипарина на систему гемостаза у беременных с гестозом
7. Особенности противотромботической терапии при тяжелых формах гестоза
8. Некоторые ограничения применения противотромботических препаратов и профилактика ятрогенных осложнений
Противотромботические и противогеморрагические препараты, применяемые для профилактики и лечения ДВС-синдрома
1. Гепарин
1.1. Фармакологические свойства гепарина
1.2. Осложнения гепариновой терапии
2. Низкомолекулярные гепаричы
2.1. Фармакологические свойства НМГ
3. Синтетический пентасахарид
Синтетический пентасахарид
4. Гепаран-сульфат и дерматан-сульфат
5. Прямые ингибиторы тромбина
6. Антитромбоцитарные средства
6.1. Ингибиторы циклооксигеназы
6.2. Ингибиторы аденилатциклазы, цАМФ, фосфодиэстеразы
6.3. Тиенопирамиды
6.4. Ингибиторы тромбоксанового пути
6.5. Антагонисты ГП IIb/ІІІа
6.6. Другие антитромбоцитарные препараты
7. Эндогенные антикоагулянты и рекомбинантные ингибиторы свертывания
7.1. Активированный протеин С (АРС)
7.2. Рекомбинантный ингибитор внешнего пути тканевого фактора (rTFPI)
7.3. Рекомбинантный фактор Vila свертывания крови
7.4. Препараты антитромбина III
8. Ингибиторы протеиназ в качестве гемостатических средств
9. Свежезамороженная плазма в терапии ДВС-синдрома
9.1. Риск плазменной и компонентной терапии
9.2. Инфузионная терапия при лечении ДВС-синдрома
10. Тромбоцитарная масса в лечении ДВС-синдрома
11. Криопреципитат
12. Декстраны
13. Плазмаферез
Литература
Страница статьи : Анестезиология и реаниматология
Atkins D. , Best D., Briss P.A., Eccles M., Falck-Ytter Y., Flottorp S., et al. Grading quality of evidence and strength of recommendations. BMJ. 2004; 328(7454): 1490.
, Best D., Briss P.A., Eccles M., Falck-Ytter Y., Flottorp S., et al. Grading quality of evidence and strength of recommendations. BMJ. 2004; 328(7454): 1490.
Lavee O., Kidson-Gerber G. Update on inherited disorders of haemostasis and pregnancy. Obstet. Med. 2016; 9(2): 64-72.
Marder V.J., Aird W.C., Bennet J.S., Schulman S., White G.C., eds. Hemostasis and Thrombosis: Basic Principles and Clinical Practice. 6th ed. Philadelphia: Lippincott Williams & Wilkins; 2013.
Cohen H., O’Brien P. Disorders of Thrombosis and Hemostasis in Pregnancy. A Guide to Management. London: Springer Verlag; 2015.
Cunningham F.G., Nelson D.B. Disseminated Intravascular Coagulation Syndromes in Obstetrics. Obstet. Gynecol. 2015; 126(5): 999-1011.
Benes J., Zatloukal J., Kletecka J. Viscoelastic Methods of Blood Clotting Assessment — A Multidisciplinary Review. Front. Med. (Lausanne). 2015; (2): 62.
Gehrie E.A., Baine I., Booth G.S.; Education Committee of the Academy of Clinical Laboratory Physicians and Scientists. Pathology Consultation on Viscoelastic Studies of Coagulopathic Obstetrical Patients. Am. J. Clin. Pathol. 2016; 146(2): 149-55.
Pathology Consultation on Viscoelastic Studies of Coagulopathic Obstetrical Patients. Am. J. Clin. Pathol. 2016; 146(2): 149-55.
Fowler A., Perry D.J. Laboratory monitoring of haemostasis. Anaesthesia. 2015; 70 (Suppl. 1): 68-72.
Levi M. Diagnosis and treatment of disseminated intravascular coagulation. Int. J. Lab. Hematol. 2014; 36(3): 228-36.
Levi M., Hunt B.J. A critical appraisal of point-of-care coagulation testing in critically ill patients. J. Thromb. Haemost. 2015; 13(11): 1960-7.
Mallett S.V., Armstrong M. Point-of-care monitoring of haemostasis. Anaesthesia. 2015; 70 (Suppl. 1): 73-7.
Rossaint R., Bouillon B., Cerny V., Coats T.J., Duranteau J., Fernández-Mondéjar E., et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit. Care. 2016; 20(1): 100.
Whiting P., Al M., Westwood M., Ramos I.C., Ryder S., Armstrong N., et al. Viscoelastic point-of-care testing to assist with the diagnosis, management and monitoring of haemostasis: a systematic review and cost-effectiveness analysis. Health Technol. Assess. 2015; 19(58): 1-228.
Health Technol. Assess. 2015; 19(58): 1-228.
Solomon C., Collis R.E., Collins P.W. Haemostatic monitoring during postpartum haemorrhage and implications for management. Br. J. Anaesth. 2012; 109(6): 851-63.
Boral B.M., Williams D.J., Boral L.I. Disseminated Intravascular Coagulation. Am. J. Clin. Pathol. 2016; 146(6): 670-80.
Taylor F.B., Toh C.H., Hoots W.K., Wada H., Levi M. Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb. Haemost. 2001; 86(5): 1327-30.
Заболотских И.Б., Синьков С.В., Лебединский К.М., Буланов А.Ю. Периоперационное ведение больных с нарушениями системы гемостаза. Вестник интенсивной терапии. 2015; (1): 65-77.
Заболотских И.Б., Синьков С.В., Лебединский К.М., Буланов А.Ю. Периоперационное ведение больных с нарушениями системы гемостаза: Клинические рекомендации ФАР России. Вестник интенсивной терапии. 2015; (2): 68-83.
Вестник интенсивной терапии. 2015; (2): 68-83.
Заболотских И.Б., Пенжоян Г.А., Синьков С.В., Музыченко В.П., Капущенко И.Н. Анализ диагностики и коррекции коагулопатий у беременных и родильниц с гестозами. Анестезиология и реаниматология. 2012; 57(6): 28-33.
Thrombosis and hemostasis study group in hematology branch of the Chinese Medical Association. Chinese experts’ consensus on the diagnosis and treatment of disseminated intravascular coagulation (2012 edition). Chin. J. Hematol. 2012; 33(11): 978-9.
Kobayashi T. Obstetrical disseminated intravascular coagulation score. J. Obstet. Gynaecol. Res. 2014; 40: 1500-6.
Yoshihara M., Uno K., Tano S., Mayama M., Ukai M., Kondo S., et al. The efficacy of recombinant human soluble thrombomodulin for obstetric disseminated intravascular coagulation: a retrospective study. Crit. Care. 2015; 19: 369.
Erez O. Disseminated intravascular coagulation in pregnancy — Clinical phenotypes and diagnostic scores. Thromb. Res. 2017; 151(Suppl. 1): 56-60.
2017; 151(Suppl. 1): 56-60.
Clark S.L., Romero R., Dildy G.A., Callaghan W.M., Smiley R.M., Bracey A.W., et al. Proposed diagnostic criteria for the case definition of amniotic fluid embolism in research studies. Am. J. Obstet. Gynecol. 2016; 215(4): 408-12.
Hunt B.J. Bleeding and coagulopathies in critical care. N. Engl. J. Med. 2014; 370(9): 847-59.
Paterson T.A., Stein D.M. Hemorrhage and coagulopathy in the critically ill. Emerg. Med. Clin. North. Am. 2014; 32(4): 797-810.
Arulkumaran S., Karoshi M., Keith L.G., Lalondé A.B., Lynch C.B., eds. The Global Library of Women’s Medicine. A Comprehensive Textbook of Postpartum Hemorrhage an Essential Clinical Reference for Effective Management. 2nd ed. London: Sapiens Publishing; 2012.
Hart C., Spannagl M. Coagulation disorders in the intensive care station. Internist (Berl). 2014; 55(5): 521-8.
Hook K.M., Abrams C.S. The loss of homeostasis in hemostasis: new approaches in treating and understanding acute disseminated intravascular coagulation in critically ill patients. Clin. Transl. Sci. 2012; 5(1): 85-92.
Clin. Transl. Sci. 2012; 5(1): 85-92.
Kozek-Langenecker S.A., Ahmed A.B., Afshari A., Albaladejo P., Aldecoa C., Barauskas G., et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur. J. Anaesthesiol. 2017; 34(6): 332-95.
Prevention and Management of Postpartum Haemorrhage: Green-top Guideline No. 52. BJOG. 2017; 124(5): e106-49.
Shaylor R., Weiniger C.F., Austin N., Tzabazis A., Shander A., Goodnough L.T., et al. National and International Guidelines for Patient Blood Management in Obstetrics: A Qualitative Review. Anesth. Analg. 2017; 124(1): 216-32.
Vaught A.J. Critical Care for the Obstetrician and Gynecologist: Obstetric Hemorrhage and Disseminated Intravascular Coagulopathy. Obstet. Gynecol. Clin. North. Am. 2016; 43(4): 611-22.
Hunt B.J., Allard S., Keeling D., Norfolk D., Stanworth S.J., Pendry K.; British Committee for Standards in Haematology. A practical guideline for the haematological management of major haemorrhage. Br. J. Haematol. 2015; 170(6): 788-80.
Br. J. Haematol. 2015; 170(6): 788-80.
Royal College of Obstetricians and Gynaecologists. Blood Transfusion in Obstetrics. Green-top Guideline No. 47. London; 2015.
American Society of Anesthesiologists Task Force on Perioperative Blood Management. Practice guidelines for perioperative blood management: an updated report. Anesthesiology. 2015; 122(2): 241-75.
Transfusion. Blood transfusion NICE guideline NG24. London; 2015.
Collins P., Abdul-Kadir R., Thachil J. Subcommittees on Women’ s Health Issues in Thrombosis and Haemostasis and on Disseminated Intravascular Coagulation. Management of coagulopathy associated with postpartum hemorrhage: guidance from the SSC of the ISTH. J. Thromb. Haemost. 2016; 14(1): 205-10.
WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet. 2017; 389(10084): 2105-16.
2017; 389(10084): 2105-16.
Butwick A.J., Goodnough L.T. Transfusion and coagulation management in major obstetric hemorrhage. Curr. Opin. Anaesthesiol. 2015; 28(3): 275-84.
Pacheco L.D., Saade G.R., Costantine M.M., Clark S.L., Hankins G.D. An Update on the use of Massive Transfusion Protocols in Obstetrics. Am. J. Obstet. Gynecol. 2015; 214(3): 340-4.
Jadon A., Bagai R. Blood transfusion practices in obstetric anaesthesia. Indian J. Anaesth. 2014; 58(5): 629-36.
Meier J. Blood transfusion and coagulation management. Best. Pract. Res. Clin. Anaesthesiol. 2016; 30(3): 371-9.
Kaufman R.M., Djulbegovic B., Gernsheimer T., Kleinman S., Tinmouth A.T., Capocelli K.E., et al. AABB. Platelet transfusion: a clinical practice guideline from the AABB. Ann. Intern. Med. 2015; 162(3): 205-13.
Dzik W.H., Blajchman M.A., Fergusson D., Hameed M., Henry B., Kirkpatrick A.W., et al. Clinical review: Canadian National Advisory Committee on Blood and Blood Products — Massive transfusion consensus conference 2011: report of the panel. Crit. Care. 2011; 15(6): 242.
Crit. Care. 2011; 15(6): 242.
Waters J.H. Role of the massive transfusion protocol in the management of haemorrhagic shock. Br. J. Anaesth. 2014; 113(Suppl. 2): ii3-8.
Ahonen J. The role of recombinant activated factor VII in obstetric hemorrhage. Curr. Opin. Anaesthesiol. 2012; 25(3): 309-14.
Franchini M., Franchi M., Bergamini V., Montagnana M., Salvagno G.L., Targher G., et al. The use of recombinant activated FVII in postpartum hemorrhage. Clin. Obstet. Gynecol. 2010; 53(1): 219-27.
Bolliger D., Mauermann E., Tanaka K.A. Thresholds for Perioperative Administration of Hemostatic Blood Components and Coagulation Factor Concentrates: An Unmet Medical Need. J. Cardiothorac. Vasc. Anesth. 2015; 29(3): 768-76.
Neb H., Zacharowski K., Meybohm P. Strategies to reduce blood product utilization in obstetric practice. Curr. Opin. Anaesthesiol. 2017; 30(3): 294-9.
Squizzato A., Hunt B.J., Kinasewitz G.T., Wada H., Ten Cate H., Thachil J., et al. Supportive management strategies for disseminated intravascular coagulation. An international consensus. Thromb. Haemost. 2016; 115(5): 896-904.
An international consensus. Thromb. Haemost. 2016; 115(5): 896-904.
Venugopal A. Disseminated intravascular coagulation. Indian J. Anaesth. 2014; 58(5): 603-8.
Semeraro N., Ammollo C.T., Semeraro F., Colucci M. Coagulopathy of Acute Sepsis. Semin. Thromb. Hemost. 2015; 41(6): 650-8.
Costello R.A., Nehring S.M. Disseminated Intravascular Coagulation (DIC). Treasure Island, FL: StatPearls Publishing; 2017. Available at: http://www.ncbi.nlm.nih.gov/books/NBK441834
Levi M., van der Poll T. Coagulation and sepsis. Thromb. Res. 2017; 149: 38-44.
Wada H., Hasegawa K., Watanabe M. DIC: an update on diagnosis and treatment. Rinsho Ketsueki. 2017; 58(5): 523-9.
Yamakawa K., Umemura Y., Hayakawa M., Kudo D., Sanui M., Takahashi H., et al. Japan Septic Disseminated Intravascular Coagulation (J-Septic DIC) study group. Benefit profile of anticoagulant therapy in sepsis: a nationwide multicentre registry in Japan. Crit. Care. 2016; 20(1): 229.
Rhodes A., Evans L. E., Alhazzani W., Levy M.M., Antonelli M., Ferrer R., et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017; 43(3): 304-77.
E., Alhazzani W., Levy M.M., Antonelli M., Ferrer R., et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017; 43(3): 304-77.
ДВС-синдром: Причины,Симптомы,Лечение | Doc.ua
Данный патологический процесс является не самостоятельной болезнью, а осложнением уже протекающего заболевания, поэтому у патологии «ДВС-синдром» лечение назначается в зависимости от протекания первичного болезненного очага. Кроме этого, данный патологический процесс выражается сильнее, если основное заболевание находится на тяжелой степени протекания.
Классификация
При протекании данной патологии выделены стадии ДВС-синдрома, в характеристике которых есть определенные нарушения гемокоагуляционного процесса, а также имеется конкретная клиническая картина. Так, согласно с данными, которые определили разные авторы при обозначении фаз гипокоагуляции, у ДВС-синдрома количественные показатели стадий колеблются в разных пределах. Итак, при фазе гиперкоагуляции определяется I стадия ДВС-синдрома. Продолжается данная фаза в зависимости от конкретного организма, вследствие личных показателей активности свертывания крови, поэтому для каждого человека продолжительность I стадии ДВС-синдрома своя. Кроме этого, развитие данной фазы происходит быстрыми темпами с сопровождением диссеминированного внутрисосудистого свертывания и тяжелого шока.
Итак, при фазе гиперкоагуляции определяется I стадия ДВС-синдрома. Продолжается данная фаза в зависимости от конкретного организма, вследствие личных показателей активности свертывания крови, поэтому для каждого человека продолжительность I стадии ДВС-синдрома своя. Кроме этого, развитие данной фазы происходит быстрыми темпами с сопровождением диссеминированного внутрисосудистого свертывания и тяжелого шока.
В характеристике периода гиперкоагуляции имеется активация плазменной системы кровяного русла, изменение агрегатного состояния тромбоцитов, эритроцитов и лейкоцитов, а также нарушенная микроциркуляция в тканях разных органов, вследствие возникшей блокировки сосудов фибринами и агрегатами форменных элементов. Кроме этого, при протекании фазы гиперкоагуляции возможно постепенное развитие медленного поступления протромбиназы в малых дозах. При медленном протекании бывают случаи с взрывами и прогрессивно развивающимся ДВС-синдромом в дальнейшем.
На первой стадии диссеминированное внутрисосудистое свертывание может сменяться локально ограниченным протеканием этого процесса и процессом тромбообразования. В 1975 году было установлено, что у патологии «ДВС-синдром» причины становятся видимыми только после серологического анализа не только на количество тромбоцитов, но и на лейкоциты. Первая стадия определяется еще и тем, что вследствие свойств лейкоцитов высвобождать факторы свертывания и способствовать изменению агрегационного состояния, наблюдается вышеопределенный процесс взаимодействия тромбоцитов с поврежденными стенками сосудов и, как следствие, появляются тромбы.
В 1975 году было установлено, что у патологии «ДВС-синдром» причины становятся видимыми только после серологического анализа не только на количество тромбоцитов, но и на лейкоциты. Первая стадия определяется еще и тем, что вследствие свойств лейкоцитов высвобождать факторы свертывания и способствовать изменению агрегационного состояния, наблюдается вышеопределенный процесс взаимодействия тромбоцитов с поврежденными стенками сосудов и, как следствие, появляются тромбы.
II стадия ДВС-синдрома является фазой гипокоагуляции, сменяющей гиперкоагуляцию. На данной фазе происходит потребление уже выбросившихся в кровь фибриногена, XIII, V, VIII факторов и прочих веществ-прокоагулянтов. Во время протекания II стадии ДВС-синдрома происходит накопление патологических ингибиторов свертывания крови, в числе которых явление продуктов распадения фибрина, которое увеличивает антикоагулятивную активность крови.
Хотя в нарушении процесса свертываемости крови важную роль играют комплексно соединяющиеся гепарин с фибрином, в кровяном русле не происходит изменение концентрации гепарина. Кроме этого, несмотря на то, что у патологии «ДВС-синдром» диагностика определила также активирование фибринолитической системы, которая ведет к процессу растворения сгустков крови. Возникновение сопровождающего нарушения, такого как геморрагический синдром, не исключено.
Кроме этого, несмотря на то, что у патологии «ДВС-синдром» диагностика определила также активирование фибринолитической системы, которая ведет к процессу растворения сгустков крови. Возникновение сопровождающего нарушения, такого как геморрагический синдром, не исключено.
III стадия ДВС-синдрома наступает в зависимости протекания процесса в дальнейшем, но при условии, что не наступит летальный исход. Данная стадия является оборотной, поэтому при ее течении восстанавливаются органы и их функции, но этот процесс тесно связан со степенью поражения этих органов. Кроме этого, после III стадии ДВС-синдрома, как правило, наступает полное выздоровление, но с наличием различных осложнений тяжелой степени, не связанных с патологией «синдром диссеминированного внутрисосудистого свертывания». В ряде осложнений наблюдаются явления почечной, печеночной недостаточностях, неврологических, кардиальных и прочих изменений.
Причины
Патогенез ДВС-синдрома в главной роли имеет появляющиеся факторы в крови, которые активируют кровяную свертываемость или меняют ее агрегационное состояние на клеточном уровне. При процессе размножения тканей, хирургических вмешательствах, которые связаны с техникой разминания органов, применяющейся при «вылущивании» аденомы в тканях предстательной железы, а также в послеродовом периоде при маточном массаже в крови возникают вещества, близкие по свойствам к тканевому тромбопластину. Похожее действие имеется и у бактериальных ферментов, активирующих процесс кровяного свертывания и меняющих агрегационное состояние тромбоцитов. Схожее влияние на организм имеют все инфекции, а также васкулит и возникающие стрессовые ситуации. Кроме этого, в кровяное русло выбрасываются катехоламины и кинины, которые обладают такими же функциями.
При процессе размножения тканей, хирургических вмешательствах, которые связаны с техникой разминания органов, применяющейся при «вылущивании» аденомы в тканях предстательной железы, а также в послеродовом периоде при маточном массаже в крови возникают вещества, близкие по свойствам к тканевому тромбопластину. Похожее действие имеется и у бактериальных ферментов, активирующих процесс кровяного свертывания и меняющих агрегационное состояние тромбоцитов. Схожее влияние на организм имеют все инфекции, а также васкулит и возникающие стрессовые ситуации. Кроме этого, в кровяное русло выбрасываются катехоламины и кинины, которые обладают такими же функциями.
Известны три фактора, при которых активируется внутрисосудистая кровяная свертываемость:
- внешний фактор, связанный с действием выброшенных соединений в кровяное русло: тканевый тромблопластин и тромбопластинподобные вещества;
- внутренний фактор, появляющийся после контакта с поврежденными стенками сосудов. Также ДВС-синдром при беременности может активироваться иммунными комплексами;
- клеточная агрегация, появляющаяся вследствие контакта тромбоцитов с поврежденными стенками сосудов, чужеродным телом, а также из-за выброса катехоламинов или возникновения тромбина.

Существует еще один существенный фактор, который приводит к ДВС-синдрому – это сниженные показатели наличия антитромбина III в крови. Данное вещество является основным естественным антикоагулянтом. Здоровые люди имеют колебание уровня данного вещества от 70% до 100%, но при протекании беременности, наличии инфекционного процесса или после хирургического вмешательства уровень антитромбина III может снижаться на 25%, поэтому и возникает риск внутрисосудистого свертывания крови.
Симптомы
Несмотря на то, что гиперкоагуляционный синдром может ликвидироваться самостоятельно, отменять лечение нецелесообразно из-за того, что для больного важной является активная реабилитационная терапия. Именно от наличия реабилитационных манипуляций зависит появление окончательного исхода.
Кроме этого, в характеристике ТГС существует еще один процесс. Когда происходит активирование факторов, свертывающих кровь, в этот же период наблюдается и активация простагландинов из-за выброса в кровь калликреина, кинина, фибрина. Так, тромбогеморрагический синдром и эти факторы в совокупности нарушают систему микроциркуляции крови. Кроме этого, расстройство гемодинамики определяет степень тяжести патологии «ДВС-синдром» у детей.
Так, тромбогеморрагический синдром и эти факторы в совокупности нарушают систему микроциркуляции крови. Кроме этого, расстройство гемодинамики определяет степень тяжести патологии «ДВС-синдром» у детей.
В 1978 году были выделены стадии расстройства гемодинамики (ДВС-синдром), симптомы которых следующие:
- на компенсированной стадии наблюдается гиперемия кожного покрова, артериальная гипертензия, тахикардия. Также присутствуют явления метаболического ацидоза и увеличения уровня гематокрита на 0,6–8%. Как правило, данная стадия протекает во время I фазы диссеминированного внутрисосудистого свертывания. Кроме этого, компенсированная стадия улавливается сложно в случае, если у патологии ДВС-синдром клиника определяет его быстрое развитие;
- субкомпенсированная стадия имеет в характеристике признаки централизованного кровообращения, при этом наблюдается бледность кожи, явление геморрагической сыпи и повышения диастолического давления при артериальной гипертензии. Гематокрит увеличивается на 10%.
 Кроме этого, ДВС-синдром, патогенез которого определяет данную стадию на переходном периоде между первой фазой и фазой гипокоагуляции, может повлечь расстройство нервной системы.
Кроме этого, ДВС-синдром, патогенез которого определяет данную стадию на переходном периоде между первой фазой и фазой гипокоагуляции, может повлечь расстройство нервной системы.
Характеристика декомпенсированной стадии имеет парезы сосудов периферии. Наблюдается серовато-цианотичный цвет кожи, снижение артериального давления, но если возникла патология «ДВС-синдром» в акушерстве, как правило, происходит его значительное повышение. У пациентов на декомпенсированной стадии имеется тахикардия, которая превышает 200/1 минуту, или же брадикардия, а также возможно возникновение анурии и повышенной температуры тела, прогресс неврологических расстройств. Вследствие лабораторных анализов определяется смешанный ацидоз и снижение гематокрита из-за анемии. Стадия декомпенсации, как правило, выявляется уже в протекании фазы гипокоагуляции в глубокой степени.
Диагностика
Синдром диссеминированного внутрисосудистого свертывания – это патология, которая входит в число наиболее сложно диагностируемых дисфункций. Поэтому для его вычисления, после описанных выше медицинских вмешательств или беременности, лечащий врач должен назначить направление в лабораторию на забор крови для определения наличия данной патологии. После этого следует лечение, которое должно проводиться в зависимости от основной причины возникновения ДВС-синдрома.
Поэтому для его вычисления, после описанных выше медицинских вмешательств или беременности, лечащий врач должен назначить направление в лабораторию на забор крови для определения наличия данной патологии. После этого следует лечение, которое должно проводиться в зависимости от основной причины возникновения ДВС-синдрома.
Лечение
ДВС-синдром лечится затруднительно, если заболевание проходит в острой форме, то около 30% случаев имеют летальный исход. Первоочередно лечение направлено на устранение патологических процессов, провоцирующих развитие синдрома. Применяется терапия, направленная на устранение гнойно-септических процессов, которые зачастую лежат в основании этого синдрома. Пациенту необходима ранняя антимикробная терапия, которая основана на клинических показаниях. Важным моментов в лечении этого синдрома является процедура купирования развивающегося состояния шока, быстрое устранение которого может оборвать ДВС-синдром, который начался или же смягчить его течение.
Вопросы патогенеза коагулопатии при септическом шоке » Акушерство и Гинекология
1) Кафедра акушерства и гинекологии Института здоровья детей «Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский Университет) Минздрава России, Москва, Россия;
2) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
3) «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова»,
Санкт-Петербург, Россия;
4) «Городская клиническая больница №67 им. Л.А. Ворохобова» Департамента здравоохранения Москвы, Москва, Россия
Представлены данные по патогенезу нарушений в системе гемостаза на фоне септических состояний, что связано с активацией коагуляции в месте первичного внедрения инфекции и последующего развития коагулопатии. Клиническая картина сепсиса складывается из первичного септического очага и сопутствующих синдромов: диссеминированное внутрисосудистое свертывание (ДВС), острый респираторный дистресс-синдром, шок с поражением соответствующих органов и тканей. Активация гемостаза при септических состояниях происходит при повреждении эндотелия токсинами патогенного микроорганизма, активированными иммунокомпетентными клетками крови, провоспалительными цитокинами, что ведет к синтезу и высвобождению тканевого фактора. При этом снижение уровня ADAMTS13 и последующее повышение уровня фактора Виллебранда также является частью патогенеза сепсиса, что, в свою очередь, может привести к развитию тромботической микроангиопатии. Выраженность ДВС-синдрома и тромботической микроангиопатии при сепсисе является определяющим фактором тяжести состояния и в значительной степени определяет неблагоприятный, в том числе летальный, исход.
Активация гемостаза при септических состояниях происходит при повреждении эндотелия токсинами патогенного микроорганизма, активированными иммунокомпетентными клетками крови, провоспалительными цитокинами, что ведет к синтезу и высвобождению тканевого фактора. При этом снижение уровня ADAMTS13 и последующее повышение уровня фактора Виллебранда также является частью патогенеза сепсиса, что, в свою очередь, может привести к развитию тромботической микроангиопатии. Выраженность ДВС-синдрома и тромботической микроангиопатии при сепсисе является определяющим фактором тяжести состояния и в значительной степени определяет неблагоприятный, в том числе летальный, исход.
сепсис
септический шок
синдром системного воспалительного ответа
коагулопатия
катастрофический антифосфолипидный синдром
тромботическая микроангиопатия
нарушения гемостаза
тромбофилия
- Hotchkiss R.S., Moldawer L.L., Opal S.M., Reinhart K., Turnbull I.R., Vincent J.-L. Sepsis and septic shock.
 Nat. Rev. Dis. Primers. 2016; 2: 16045. doi: 10.1038/nrdp.2016.45.
Nat. Rev. Dis. Primers. 2016; 2: 16045. doi: 10.1038/nrdp.2016.45. - Chebbo A., Tan S., Kassis C., Carlson R.W. Maternal sepsis and septic shock. Crit. Care Clin. 2016; 32(1): 119-35. doi: 10.1016 / jccc.2015.08.010.
- Rimmer E., Doucette S., Houston D.S., Houston B.L., Menard C., Leeies M. et al. White blood cell count trajectory and mortality in septic shock: a retrospective cohort study. Blood. 2018; 132(Suppl. 1): 3691.
- Marik P.E. Dopamine increases mortality in pediatric septic shock. J. Pediatr. 2016; 168: 253-6. doi: 10.1016/j.jpeds.2015.10.073.
- Howell M.D., Davis A.M. Management of sepsis and septic shock. JAMA. 2017; 317(8): 847-8. doi: 10.1001/jama.2017.0131
- Mathias B., Delmas A.L., Ozrazgat-Baslanti T., Vanzant E.L., Szpila B.E., Mohr A.M. et al. Human myeloid-derived suppressor cells are associated with chronic immune suppression after severe sepsis/septic shock. Ann. Surg. 2017; 265(4): 827-34. doi: 10.1097 / SLA.0000000000001783
- Cunningham F.
 G., Nelson D.B. Disseminated intravascular coagulation syndromes in obstetrics. Obstet. Gynecol. 2015; 126(5): 999-1011. doi: 10.1097 / AOG.0000000000001110.
G., Nelson D.B. Disseminated intravascular coagulation syndromes in obstetrics. Obstet. Gynecol. 2015; 126(5): 999-1011. doi: 10.1097 / AOG.0000000000001110. - Куликов А.В., Шифман Е.М., Буланов А.Ю., Заболотских И.Б., Синьков С.В. Интенсивная терапия острых нарушений гемостаза в акушерстве (ДВС-синдром). Клинические рекомендации (протоколы лечения). М.; 2017.
- Вельков В.В. Комплексная лабораторная диагностика системных инфекций и сепсиса: С-реактивный белок, прокальцитонин, пресепсин. М.; 2015. 117 с.
- Gris J.C., Cochery-Nouvellon E., Bouvier S., Jaber S., Albanese J., Constantin J.M. et al. Clinical value of automated fibrin generation markers inpatients with septic shock: a SepsiCoag ancillary study. Br. J. Haematol. 2018; 183(4): 636-47. https://doi.org/10.1111/bjh.15576
- Kell D.B., Pretorius E. To what extent are the terminal stages of sepsis, septic shock, systemic inflammatory response syndrome, and multiple organ dysfunction syndrome actually driven by a prion/amyloid form of fibrin? Semin.
 Thromb. Haemost. 2018; 44(3): 224-38. doi: 10.1055 / s-0037-1604108.
Thromb. Haemost. 2018; 44(3): 224-38. doi: 10.1055 / s-0037-1604108. - Ait-Oufella H., Bakker J. Understanding clinical signs of poor tissue perfusion during septic shock. Intensive Care Med. 2016; 42(12): 2070-2. doi: 10.1007 / s00134-016-4250-6
- Daviaud F., Grimaldi D., Dechartres A., Charpentier J., Geri G., Marin N., et al. Timing and causes of death in septic shock. Ann. Intensive Care. 2015; 5(1): 16. doi: 10.1007 / s00134-016-4250-6
- Соколов Ю.А. Ретроспективный патологоанатомический анализ основных причин смерти у больных с генерализованной интраабдоминальной инфекцией. Медицинский журнал. 2013; 4: 88-91.
- Мишнев О.Д., Гринберг Л.М., Зайратьянц О.В. Актуальные проблемы патологии сепсиса: 25 лет в поисках консенсуса. Архив патологии. 2016; 78(6): 3-8.
- Kellum J.A., Chawla L.S., Keener C., Singbartl K., Palevsky P.M., Pike F.L. et al. The effects of alternative resuscitation strategies on acute kidney injury in patients with septic shock.
 Am. J. Respir. Crit. Care Med. 2016; 193(3): 281-7. doi: 10.1164 / rccm.201505-0995OC.
Am. J. Respir. Crit. Care Med. 2016; 193(3): 281-7. doi: 10.1164 / rccm.201505-0995OC. - Mehta S., Granton J., Gordon A.C., Cook D.J., Lapinsky S., Newton G. et al. Cardiac ischemia in patients with septic shock randomized to vasopressin or norepinephrine. Crit. Care. 2017; 21(1): 98. doi: 10.1186/cc12789
- Макацария А.Д., Акиньшина С.В., Бицадзе В.О., Хизроева Д.Х., Казакова Л.А., Гадаева З.К. Септический шок в акушерстве: новый взгляд на патогенез. Практическая медицина. 2012; 9: 11-23.
- Кошелев Р.В., Ватазин А.В., Зулькарнаев А.Б., Фаенко А.П. Оценка морфофункционального состояния тромбоцитов периферической крови при сепсисе. Альманах клинической медицины. 2018; 46(7): 672-81.
- Лопатин А.Ф., Редкин И.В., Самойленко В.В., Петровская Э.Л., Молчанов И.В. Роль антитромбина в диагностике и лечении сепсиса. Анестезиология и реаниматология. 2018; (3): 19-24.
- Levi M., Schultz M., van der Poll T. Sepsis and thrombosis. Semin. Thromb. Haemost. 2013; 39(5): 559-66.
 doi: 10.1055 / s-0033-1343894
doi: 10.1055 / s-0033-1343894 - Gando S. Role of fibrinolysis in sepsis. Semin. Thromb. Haemost. 2013; 39(4): 392-9. doi: 10.1055 / s-0033-1334140
- Продеус А.П., Устинова М.В., Корсунский А.А., Гончаров А.Г. Новые аспекты патогенеза сепсиса и септического шока у детей. Система комплемента как мишень для эффективной терапии. Инфекция и иммунитет. 2018; 8(1): 19-24.
- Осовских В.В., Васильева М.С., Крайсветная Е.В., Баутин А.Е Скрининг гиперкоагуляционных нарушений при сепсисе. Трансляционная медицина. 2016; 3(5): 34-41.
- Habe K., Wada H., Ito-Habe N., Hatada T., Matsumoto T., Ohishi K. et al. Plasma ADAMTS13, von Willebrand Factor (VWF) and VWF propeptide profilesin patients with DIC and related diseases. Thromb. Res. 2012; 129(5):598-602.
- Chauhan A.K., Walsh M.T., Zhu G., Ginsburg D., Wagner D.D., Motto D.G. The combined roles of ADAMTS-13 and VWF in murine models of TTP, enotoxemia and thrombosis. Blood. 2008; 111(7): 3452-7. doi 10.1182/blood-2007-08-108571
- Kremer Hovinga J.
 A., Zeerleder S., Kessler P., Romani de Wit T., van Mourik J.A., Hack C.E. et al. ADAMTS-13, von Willebrand factor and related parameters in severe sepsis and septic shock. J. Thromb. Haemost. 2007; 5(11): 2284-90. http://dx.doi.org/10.1111/j.1538-7836.2007.02743.x.
A., Zeerleder S., Kessler P., Romani de Wit T., van Mourik J.A., Hack C.E. et al. ADAMTS-13, von Willebrand factor and related parameters in severe sepsis and septic shock. J. Thromb. Haemost. 2007; 5(11): 2284-90. http://dx.doi.org/10.1111/j.1538-7836.2007.02743.x. - Fukushima H., Nishio K., Asai H., Watanabe T., Seki T., Matsui H. et al, Ratio of von Willebrand factor propeptide to ADAMTS13 is associated with severity of sepsis, shock. Shock. 2013; 39(5): 409-14. doi: 10.1097/ SHK.0b013e3182908ea7
- Рогальская Е.А., Климович Л.Г., Самсонова Н.Н. Диагностика нарушений системы гемостаза при системном воспалении, сепсисе и полиорганной недостаточности в кардиохирургии. Бюллетень НЦССХ им. А.Н. Бакулева РАМН Сердечно-сосудистые заболевания. 2016; 17(53): 96.
- Bilgili B., Haliloğlu M., Cinel İ. Sepsis and acute kidney injury. Turk. J. Anaesthesiol. Reanim. 2014; 42(6): 294-301. doi: 10.5152/TJAR.2014.83436.
- Козлов В.К. Сепсис, тяжелый сепсис, септический шок: патогенетическое обоснование диагноза, клиническая интерпретация, принципы и методология диагностики.
 Клинико-лабораторный консилиум. 2014; 2: 20-40.
Клинико-лабораторный консилиум. 2014; 2: 20-40. - Вельков В.В. Использование биомаркера пресепсин для ранней и высокоспецифичной диагностики сепсиса. Раны и раневые инфекции. Журнал имени профессора Б.М. Костючёнка. 2015; 2(1): 54-79.
- Guerci P., Ince C. Endothelial dysfunction of the kidney in sepsis. In: Ronco C., Bellomo R., Kellum J., Ricci Z., eds. Critical care nephrology. 3rd ed. Elsevier; 2019; 518-24. e3. doi: 10.1007 / s00134-017-4755-7
- Воробьева Н.А. Роль антитромбина в диагностике и интенсивной терапии острого ДВС-синдрома. Атеротромбоз. 2017; 2: 53-69.
- Нехаев И.В., Приходченко А.О., Мазурина О.Г., Вяткин П.В., Ломидзе С.В., Сытов А.В. Полиорганная недостаточность, ССВР, ДВС-синдром и антитромбин III. Инфекции в хирургии. 2015; 13(1): 17-26.
- Seymour C.W., Rosengart M.R. Septic shock. Advances in diagnosis and treatment. JAMA. 2015; 314(7): 708-17. doi:10.100 / jama.2015.7885.
- Ishii J., Ohshimo S., Shime N., Lamontagne F.
 , Guyatt L., Pierre P. Target blood pressure for septic and vasodilatory shock: what is optimal? Intensive Care Med. 2018; 44(4): 548-9. doi: 10.1007 / s00134-017-5016-5.
, Guyatt L., Pierre P. Target blood pressure for septic and vasodilatory shock: what is optimal? Intensive Care Med. 2018; 44(4): 548-9. doi: 10.1007 / s00134-017-5016-5. - Leone M., Asfar P., Radermacher P., Vincent J-L., Martin C. Optimizing mean arterial pressure in septic shock: a critical reappraisal of the literature. Crit. Care. 2015; 19: 101. doi: 10.1186 / s13054-015-0794-z.
- Мальцева Л.А., Мосенцев Н.Ф., Базиленко Д.В. Новая шкала для оценки тяжести состояния и прогноза исхода у пациентов с тяжелым сепсисом и септическим шоком — Sepsis Severity Score. Медицина неотложных состояний. 2016; 3(74): 135-8.
- Singer M., Deutschman C.S., Seymour C.W., Shankar-Hari M., Annane D., Bauer M. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016; 315(8): 801-1020. doi: 10.1001 /jama.2016.0287
- Bitsadze V.O., Khizroeva J., Makatsariya A.D. The acquired form of ADAMTS-13 deficiency as the cause of thrombotic microangiopathy in a pregnant woman with recurrent cerebral circulation disorders, venous thromboembolism, preeclampsia and fetal loss syndrome.
 Case Reports In Perinatal Medicine. 2017; 6(2). DOI: https://doi.org/10.1515/crpm-2017-0023
Case Reports In Perinatal Medicine. 2017; 6(2). DOI: https://doi.org/10.1515/crpm-2017-0023 - Акиньшина С.В., Бицадзе В.О., Гадаева З.К., Макацария А.Д. Значение тромботической микроангиопатии в патогенезе акушерских осложнений. Акушерство, гинекология и репродукция. 2015; 9(2): 62-71.
- Rodríguez-Pintó I., Espinosa G., Cervera R. Catastrophic APS in the context of other thrombotic microangiopathies. Curr. Rheumatol. Rep. 2015; 17(1): 482. doi: 10.1007 / s11926-014-0482-z.
- Chang J.C. TTP-like syndrome: novel concept and molecular pathogenesis of endotheliopathy-associated vascular microthrombotic disease. Thromb. J. 2018; 16: 20. https://doi.org/10.1186/s12959-018-0174-4
- Sadick V., Lane S., Fisher E., Sappelt I., Shetty A., McLean A. Post-partum catastrophic antiphospholipid syndrome presenting with shock and digital ischaemia – A diagnostic and management challenge. J. Intensive Care Soc. 2018; 19(4): 357-64. doi: 10.1177 /1751143718762343
- Попугаев К.
 А., Лобанова И.Н., Абудеев С.А., Кругляков Н.М., Белоусова К.А., Багжанов Г.И., Бахарев С.А., Шмарова Д.Г., Удалов Ю.Д., Забелин М.В., Самолов А.С. Катастрофический антифосфолипидный синдром в практике интенсивной терапии. Медицина экстремальных ситуаций. 2017; 62(4): 36-49.
А., Лобанова И.Н., Абудеев С.А., Кругляков Н.М., Белоусова К.А., Багжанов Г.И., Бахарев С.А., Шмарова Д.Г., Удалов Ю.Д., Забелин М.В., Самолов А.С. Катастрофический антифосфолипидный синдром в практике интенсивной терапии. Медицина экстремальных ситуаций. 2017; 62(4): 36-49. - Бицадзе В.О., Хизроева Д.Х., Идрисова Л.Э., Абрамян Р.Р., Андреева М.Д., Макацария А.Д. Катастрофический антифосфолипидный синдром. Вопросы патогенеза. Акушерство, гинекология и репродукция. 2015; 9(2): 32-53.[Bitsadze V.O., Khizroeva D.Kh., Idrisova L.E., Abramyan R.R., Andreeva M.D., Makatsariya A.D. Catastrophic antiphospholipid syndrome. Pathogenesis issues. Akusherstvo, ginekologiya i reproduktsiya/Obstetrics, gynecology and reproduction. 2015; 9(2): 32-53.(In Russian). doi: 10.17749/2070-4968.2015.9.2.032-053.
Поступила 03.09.2019
Принята в печать 04.10.2019
Макацария Александр Давидович, д.м.н., член-корреспондент РАН, профессор, заведующий кафедрой акушерства и гинекологии №2 «Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (903) 728-0897.
И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (903) 728-0897.
Е-mail: [email protected]. Адрес: 109004 Россия, Москва, ул. Земляной Вал, д. 62, стр. 1.
Серов Владимир Николаевич, д.м.н., профессор, академик РАН, г.н.с. ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, президент Российского общества акушеров-гинекологов. Тел.: +7 (495) 438-72-87.
E-mail: [email protected]. Адрес: 117997 Россия, Москва, ул. Академика Опарина, д. 4.
Суконцева Татьяна Александровна, студентка 6 курса лечебного факультета «Первого Санкт-Петербургского государственного медицинского университета
им. академика И.П. Павлова», Санкт-Петербург, Россия.
Тел.: +7 (981) 8581062. E-mail: [email protected]
Бицадзе Виктория Омаровна, д.м.н., профессор РАН, доктор медицинских наук, профессор кафедры акушерства и гинекологии №2 «Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (926) 231-3829.
И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (926) 231-3829.
Е-mail: [email protected]. Адрес: 109004 Россия, Москва, ул. Земляной Вал, д. 62, стр. 1.
Шкода Андрей Сергеевич, д.м.н., профессор, главный врач «Городской клинической больницы №67 имени Л.А.Ворохобова» Департамента здравоохранения Москвы. Тел.: +7 (495) 530-30-71. Е-mail: [email protected].
Адрес: 123423 Россия, Москва, ул. Саляма Адиля, д. 2/44.
Хизроева Джамиля Хизриевна, д.м.н., профессор кафедры акушерства и гинекологии №2 «Первого Московского государственного медицинского университета
им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (915) 361-9073. Е-mail: [email protected].
Адрес: 109004 Россия, Москва, ул. Земляной Вал, д. 62, стр. 1.
Воробьев Александр Викторович, к.м.н., доцент кафедры акушерства и гинекологии №2 «Первого Московского государственного медицинского университета
им. И.М. Сеченова (Сеченовский Университет)» Минздрава России, Москва, Россия. Тел.: +7 (903)105-6365. Е-mail: [email protected].
Адрес: 109004 Россия, Москва, ул. Земляной Вал, д. 62, стр. 1.
Для цитирования: Макацария А.Д., Серов В.Н., Суконцева Т.А., Бицадзе В.О., Шкода А.С., Хизроева Д.Х., Воробьев А.В. Вопросы патогенеза коагулопатии при септическом шоке.
Акушерство и гинекология. 2019; 10:13-21.
https://dx.doi.org/10.18565/aig.2019.10.13-21.
Псевдокапсулорексис у пациента с иридокорнеальным эндотелиальным синдромом | Катаракта и другие заболевания хрусталика | JAMA Офтальмология
Мы описываем пациента с синдромом Чандлера, вариант иридокорнеального эндотелиального синдрома, у которого во время операции была обнаружена эктопическая десцеметовая мембрана на передней поверхности хрусталика. Первоначально мембрану путали с передней капсулой хрусталика во время экстракапсулярной экстракции катаракты, что привело к возникновению псевдокапсулорексиса.Электронная микроскопия показала, что эпилентикулярная мембрана состоит из множества слоев аномальной базальной мембраны, соответствующей иридокорнеальному эндотелиальному синдрому.
Синдром иридокорнеального эндотелия (ICE) включает 3 тесно связанных вида (невус радужки или синдром Когана-Риза, синдром Чандлера и эссенциальная атрофия радужки), которые имеют характерные аномалии эндотелия роговицы, прогрессирующее закрытие угла передней камеры и переменный спектр аномалий радужной оболочки. 1 -3 Эти 3 объекта различаются степенью поражения радужной оболочки и роговицы, а также временной зависимостью развития клинических признаков. Глаукома, связанная либо с обширными периферическими передними синехиями, либо без нее, является частым осложнением синдрома ICE. 4
Было высказано предположение, что это состояние вызвано аномалией задней части роговицы, которая приводит к чрезмерному разрастанию эндотелия роговицы и десцеметовой мембраны над углом передней камеры и передней стороной радужной оболочки.Здесь представлен уникальный случай, характеризующийся расширением эктопической десцеметовой мембраны на хрусталик, что препятствовало удалению катаракты.
У 70-летней белой женщины была диагностирована глаукома левого глаза за 2 года до нашего первоначального обследования. Несколько препаратов местного действия (0,5% левобунолола гидрохлорид два раза в день, 0,1% дипивефрина гидрохлорид два раза в день и 1% пилокарпина гидрохлорид 4 раза в день) не смогли контролировать ее внутриглазное давление (ВГД).Семейный и медицинский анамнез не связаны. При осмотре ее острота зрения с наибольшей коррекцией составила 20/25 OD и 20/40 OS. Правый глаз в норме. Эндотелий роговицы носа ее левого глаза имел серебристый вид, а строма слегка отечна. Передняя камера была глубокой и чистой. Зрачок был минимально реактивным и немного смещен вниз. Отверстий и узелков радужки не было. Внутриглазное давление составляло 17 мм рт. Ст. OD и 37 мм рт. Ст. Гониоскопия ее левого глаза выявила рассеянные широкие периферические передние синехии, закрывающие большую часть угла.Офтальмоскопия выявила выраженную асимметрию диска с соотношением чашек и диска 0,3 OD и 0,7 OS.
Синдром Чандлера диагностирован клинически. Зеркальная микроскопия эндотелия роговицы показала полимегатизм и разграниченные островки аномальных клеток с инверсией темного света, совместимой с синдромом ICE. Добавление перорального ацетазоламида с замедленным высвобождением в дозе 500 мг два раза в день не помогло контролировать ВГД, и была выполнена трабекулэктомия с митомицином. Хотя процедура первоначально контролировала ВГД, через 2 года оно резко увеличилось до 39 мм рт.В это время наблюдался большой приподнятый диффузный ишемический пузырь, и при гониоскопии склеростомия оказалась открытой. Медикаментозное лечение не снизило ВГД. Неодим: внутренняя ревизия склеростомы с помощью YAG-лазера успешно контролировала ВГД в течение 1 года. ВГД снова поднялся, и была проведена вторая внутренняя проверка Nd: YAG, которая контролировала ВГД в течение 6 месяцев. В это время острота зрения составляла 20/300 OS (с точечным отверстием 20/80 OS). Осмотр с щелевой лампой выявил тонкий бессосудистый кистозный пузырь, умеренный отек стромы и клинически значимый (3+) ядерный склероз.ВГД составляло 43 мм рт. Ст., Чашечка диска зрительного нерва увеличилась (соотношение чашечка-диск 0,9).
Пациенту выполнено удаление катаракты путем факоэмульсификации, имплантация интраокулярной линзы в заднюю камеру глаза и трабекулэктомия митомицином. Во время процедуры, которую выполнил один из нас (R.P.W.), по-видимому, выполнялся непрерывный циркулярный капсулорексис. Удивительно, но после этого маневра хирург понял, что передняя капсула хрусталика все еще не повреждена и что он действительно вырезал мембрану, которая покрывала переднюю часть хрусталика.Эта ткань была отправлена на патологическое исследование, и процедура (с истинным капсулорексисом) прошла без осложнений.
Просвечивающая электронная микроскопия, проведенная на депарафинизированной ткани, подтвердила, что мембрана не является передней капсулой хрусталика. Мембрана состояла из нескольких слоев аномального материала базальной мембраны, разного калибра и включавшего очаги пигмента радужной оболочки. Результаты согласуются с синдромом ICE (рис. 1).
Просвечивающая электронная микроскопия мембраны показывает несколько слоев аномального материала базальной мембраны (звездочки), окружающих скопления пигмента радужки.Врезка — часть мембраны при меньшем увеличении. Стрелками показаны 4 отдельных слоя базальной мембраны (основной рисунок, просвечивающая электронная микроскопия, исходное увеличение × 3900; вставка, толудиновый синий, исходное увеличение × 250).
Через четыре месяца после операции острота зрения составила 20/50 OS, а ВГД было у младших подростков без лечения глаукомы.
В этом случае клинический диагноз синдрома Чандлера был основан на выявлении аномального эндотелия роговицы (с помощью биомикроскопии и зеркальной микроскопии) и наличии широких передних синехий у пациента с односторонней закрытоугольной глаукомой и легким отеком роговицы.Нормальный внешний вид контралатерального глаза и отрицательный семейный анамнез исключили заднюю полиморфную эндотелиальную дистрофию. Патологическое исследование перепонки на передней поверхности хрусталика подтвердило диагноз.
Насколько нам известно, это первый случай, когда материал эктопической десцеметовой мембраны был обнаружен интраоперационно на передней капсуле хрусталика у пациента с синдромом ICE. Важно понимать эту возможность, чтобы избежать путаницы и осложнений во время операции по удалению катаракты.
Принята к публикации 19 октября 1998 г.
Отпечатки: Ричард П. Уилсон, Мэриленд, 900 Уолнат-стрит, Филадельфия, Пенсильвания, 19107.
1. орел
RC
JrFont
RLYanoff
М хорошо
Б.С. Пролиферативная эндотелиопатия с аномалиями радужной оболочки: иридокорнеальный эндотелиальный синдром. Arch Ophthalmol. 1979; 972104-2112Google ScholarCrossref 2. Wilson
MCShields
М.Б. Сравнение клинических вариантов иридокорнеального эндотелиального синдрома. Arch Ophthalmol. 1989; 1071465–1468Google ScholarCrossref 3.Hirst
LWQuigley
AStark
WJShields
М.Б. Зеркальная микроскопия иридокорнеального эндотелиального синдрома. Am J Ophthalmol. 1980; 8911-21Google Scholar4.Laganowski
HCMuir
МГК
РА Глаукома и иридокорнеальный эндотелиальный синдром. Arch Ophthalmol. 1992; 110346-350Google ScholarCrossref
Эндотелиальный (ICE) синдром | Ento Key
ОСНОВНАЯ ИНФОРМАЦИЯ
ОПИСАНИЕ
Приобретенное и обычно одностороннее заболевание, поражающее женщин молодого и среднего возраста.Состояние вызывает различные степени аномалий радужной оболочки, отека роговицы и глаукомы у пораженных людей. Этиология неизвестна, но предполагается, что это вирусная инфекция. Это влияет на все расы. Отличительным признаком этого состояния является аномальный эндотелий роговицы, который распространяется на угол передней камеры и радужку.
Педиатрические аспекты
Дети редко поражаются. Сообщалось о случае 11-летней девочки с синдромом ДВС и глаукомой (1).
Гериатрические аспекты
У пожилых пациентов может быть ограничение зрения в пораженном глазу из-за заболевания роговицы и / или глаукомного повреждения зрительного нерва.
Рекомендации по беременности
При лечении глаукомы может потребоваться корректировка лекарств во время беременности и кормления грудью.
ЭПИДЕМИОЛОГИЯ
Синдром ДВС — очень редкое состояние без известных генетических факторов риска.
ОБЩАЯ ПРОФИЛАКТИКА
Профилактика синдрома ДВС не известна.
ЭТИОЛОГИЯ
Предположительно вирусная инфекция. В одном исследовании 5 из 9 образцов роговицы были положительными на ДНК вируса простого герпеса (ВПГ) в эндотелии роговицы. Образцы были отрицательными на вирус опоясывающего герпеса или ДНК вируса Эпштейна-Барра (2).
ОБЩИЕ СВЯЗАННЫЕ УСЛОВИЯ
• Есть 3 варианта, которые имеют несколько разные презентации и курсы. Все 3 варианта связаны с заболеванием роговицы и глаукомой.
• Эссенциальная или прогрессирующая атрофия радужки отличается корэктопией (искаженный зрачок) или псевдополикорией («второй» зрачок).Заметная атрофия радужной оболочки — отличительный признак этого варианта. Тяжелые аномалии переднего сегмента могут включать обширные периферические передние синехии (ПАС). Формирование ПАВ прогрессирует, что приводит к закрытию угла и часто к повышению внутриглазного давления (ВГД). Вторичная закрытоугольная глаукома присутствует как минимум у 50% людей.
• Синдром невуса радужки (Коган Риз) отличается наличием большого невуса, покрывающего большую часть радужки, или множественных узелков радужки. В образцах глаз, удаленных на предмет предполагаемого злокачественного новообразования, в этих невусах была обнаружена ткань радужки.
• Синдром Чендлера отличается наличием эндотелия роговицы с характерным внешним видом «чеканного серебра». Вариант синдрома Чандлера имеет более низкую частоту глаукомы и более высокую частоту отека роговицы из-за нарушения нормальной функции эндотелия.
ДИАГНОСТИКА
ИСТОРИЯ
Признаки и симптомы:
• Почти всегда одностороннее предлежание
• Снижение зрения из-за отека роговицы, которое часто ухудшается утром после пробуждения
• Боль обычно возникает из-за отек роговицы, но может быть вызван повышенным ВГД позже в ходе болезни.
• Нарушения радужной оболочки, замеченные пациентом, семьей и друзьями
• Снижение зрительной функции из-за глаукомы наблюдается при запущенном заболевании.
ФИЗИЧЕСКИЙ ОБСЛУЖИВАНИЕ
При осмотре с помощью щелевой лампы можно выявить отек роговицы и аномальный внешний вид эндотелия роговицы. В другом глазу могут быть видны участки аномального эндотелия роговицы. Атрофия радужной оболочки и нерегулярность или децентрация зрачков являются признаками прогрессирующей атрофии радужки. Гониоскопия может выявить полное закрытие угла, особенно при эссенциальной атрофии радужки.
ДИАГНОСТИЧЕСКИЕ ИСПЫТАНИЯ И ИНТЕРПРЕТАЦИЯ
• Острота зрения в пораженном глазу может снижаться и может колебаться в зависимости от степени отека роговицы.
• Поле зрения может быть ненормальным при сопутствующей глаукомной оптической невропатии.
Визуализация
• Визуализация зрительного нерва может быть полезна при постановке диагноза глаукомы или при обнаружении прогрессирования глаукомы. Устройства визуализации включают фотографию зрительного нерва, оптическую когерентную томографию (ОКТ), конфокальную сканирующую лазерную офтальмоскопию (Heidelberg Retina Tomograph — HRT) и сканирующую лазерную поляриметрию (GDx).
• Заболевание роговицы в основном отслеживается клинически, но зеркальная микроскопия может продемонстрировать характерные аномалии эндотелиальных клеток с вариабельностью размера и формы клеток, а также с потерей нормальных четких шестиугольных границ.
• Пахиметрия может быть полезна для количественной оценки утолщения роговицы.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
• Дистрофия Фуха может иметь схожий вид роговицы, но без аномалий передней камеры.
• PPMD - может показаться похожим, но является семейным и двусторонним.
• Аксенфельд Ригерс врожденный и двусторонний, а также может иметь системные признаки, например, аномалии зубов.
• Меланома радужной оболочки глаза может выглядеть как чистый синдром Когана – Риза.
ЛЕЧЕНИЕ
ДОПОЛНИТЕЛЬНОЕ ЛЕЧЕНИЕ
Общие меры
• Отек роговицы можно лечить гипертоническими каплями или мазью (раствор хлорида натрия или мазь 5%).
• Повышенное ВГД и глаукому можно лечить с помощью капель от глаукомы.
• Лазерная трабекулопластика обычно неэффективна при этом типе хронической закрытоугольной глаукомы.
• Лазерная периферическая иридотомия не останавливает прогрессирующее закрытие угла, которое является отличительной чертой этого состояния.
ХИРУРГИЯ / ДРУГИЕ ПРОЦЕДУРЫ
• Хирургия катаракты может быть осложнена плохим расширением сосочков и наличием ICE-мембраны над передней капсулой.
• Трансплантация роговицы проводится при хроническом отеке и помутнении роговицы. Новые процедуры пересадки роговицы на частичную толщину могут снизить частоту отторжения.Автоматическая эндотелиальная кератопластика с удалением десцемета (DSAEK) включает трансплантацию десцеметовой и эндотелиальной мембран.
• Операцию по восстановлению радужной оболочки глаза для улучшения косметического внешнего вида или уменьшения бликов можно проводить самостоятельно или во время операции по удалению катаракты. Ткань радужки часто бывает рыхлой, и ее трудно ушить. Может быть полезна имплантация искусственной радужки (3).
• Глаукома при синдроме ДВС может быть более тяжелой и не поддается хирургическому лечению. Трабекулэктомия может быть неудачной чаще, и это, как полагают, частично связано с ростом аномального эндотелия роговицы над внутренним устьем склеры.Трабекулэктомия у пациентов с синдромом Чандлера может быть более успешной, чем при других вариантах.
• Трабекулэктомия может быть более успешной, если выполняется с антиметаболитом, таким как митомицин C
• Дренажные имплантаты от глаукомы (трубные шунты) могут быть более успешными, чем трабекулэктомия, поскольку они с меньшей вероятностью будут заблокированы эндотелиальной мембраной (4 ).
НЕПРЕРЫВНЫЙ УХОД
ПОСЛЕДУЮЩИЕ РЕКОМЕНДАЦИИ
Мониторинг пациента
• Пациенты должны периодически наблюдаться для планового ухода за глазами.Легкие случаи без глаукомы можно наблюдать ежегодно.
• Мониторинг развития глаукомы включает оценку внешнего вида зрительного нерва с помощью прямой или непрямой офтальмоскопии. Также может потребоваться проверка поля зрения и визуализация зрительного нерва.
• Людям с глаукомой или заболеванием роговицы может потребоваться более частое наблюдение.
• При декомпенсации роговицы и глаукоме может потребоваться направление к специалистам.
ПРОГНОЗ
• Визуальный прогноз в основном связан с тяжестью глаукомы, но может зависеть от успеха в восстановлении прозрачности роговицы.
• Осложнения после операции по удалению катаракты также могут повлиять на зрительный прогноз.
• Визуальный прогноз обычно хуже для людей, которые отказываются от многократной трансплантации роговицы.
• Нерегулярные аномалии рефракции после операции на роговице могут потребовать использования специальных контактных линз.
СПИСОК ЛИТЕРАТУРЫ
1. Салим С., Шилдс М.Б., Уолтон Д. Иридокорнеальный эндотелиальный синдром у ребенка. J Pediatr Ophthalmol Strabismus 2006; 43: 308–310.
2. Альварадо Дж. А., Андервуд Дж. Л., Грин В. Р. и др. Обнаружение ДНК вируса простого герпеса при иридокорнеальном эндотелиальном синдроме. Arch Ophthalmol 1994; 112: 1601–1609.
3. Khng C, Снайдер ME. Реконструкция радужной оболочки с помощью составного эндокапсулярного протеза при иридокорнеальном эндотелиальном синдроме. J Cataract Refract Surg 2005; 31: 2051–2054.
4. Doe EA, Budenz DL, Gedde SJ, Imami NR. Отдаленные хирургические результаты пациентов с глаукомой, вторичной по отношению к иридокорнеальному эндотелиальному синдрому. Офтальмология 2001; 108: 1789–1795.
Только золотые участники могут продолжить чтение. Войдите или зарегистрируйтесь, чтобы продолжить
Связанные
Какова патофизиология глаукомы, связанной с иридокорнеальным эндотелиальным синдромом (ICE)?
Автор
Ингрид У Скотт, доктор медицины, магистр здравоохранения Джек и Нэнси Тернер, профессор офтальмологии, профессор общественного здравоохранения, Глазной центр Пенсильванского государственного университета, Медицинский колледж
Ингрид У Скотт, доктор медицины, магистр здравоохранения, является членом следующих организаций медицинские общества: Американская академия офтальмологии, Американская медицинская ассоциация, Американское общество катарактальной и рефракционной хирургии, Американское общество специалистов по сетчатке глаза, Ассоциация исследований в области зрения и офтальмологии, Общество макулы, Phi Beta Kappa, Retina Society
Раскрытие: Ничего не раскрывать .
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Получил зарплату от Medscape за работу. для: Medscape.
Мартин Б. Вакс, доктор медицины Профессор кафедры офтальмологии Юго-западной медицинской школы Техасского университета; Вице-президент по исследованиям и разработкам, руководитель отдела офтальмологических исследований и доклинических исследований, Alcon Laboratories, Inc
Мартин Б. Вакс, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Американского общества глаукомы, Общества неврологии
Раскрытие: нечего раскрывать.
Главный редактор
Хэмптон Рой, старший, доктор медицины Доцент кафедры офтальмологии, Медицинский университет Арканзаса
Хэмптон Рой, старший доктор медицины, является членом следующих медицинских обществ: Американская академия офтальмологии, Американский колледж хирургов, Панамериканская ассоциация офтальмологов
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Брэдфорд Шинглтон, доктор медицины Ассистент клинического профессора офтальмологии Гарвардской медицинской школы; Персонал-консультант отделения офтальмологии Массачусетского глазного и ушного госпиталя
Брэдфорд Шинглтон, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия офтальмологии
Раскрытие информации: не раскрывать.
Синдром торакального выхода
Синдром торакального выхода (TOS) — это синдром, включающий сдавление верхнего торакального выхода, включающее сдавление сосудисто-нервного пучка, проходящего между передней лестничной и средней лестницей. Он может поражать плечевое сплетение (нервы, которые переходят в руки от шеи) и / или подключичную артерию или вену (кровеносные сосуды, проходящие между грудной клеткой и верхней конечностью).
Компрессия может быть позиционной (вызванной движением ключицы (ключицы) и плечевого пояса при движении руки) или статической (вызванной аномалиями или увеличением различных мышц, окружающих артерии, вены и плечевое сплетение).
Подробнее:
СИМПТОМЫ
TOS поражает в основном верхние конечности, особенно руки и кисти. Боль в руках и кистях почти всегда присутствует. Боль может быть острой, жгучей или ноющей. Боль может затрагивать только часть руки, например только 4-й и 5-й пальцы, или всю руку. Это может затрагивать внутреннюю часть предплечья и плеча. Боль также может быть в боковой части шеи, в области груди под ключицей, в подмышечной области и в верхней части спины, например в области трапеции и ромбовидной кости.Обесцвечивание рук также является возможным симптомом, и одна рука холоднее, чем другая. Также часто встречается слабость кистей и мышц рук. Также может присутствовать покалывание.
Цереброваскулярная артериальная недостаточность при поражении подключичной артерии. Он также может повлиять на позвоночную артерию, в случае чего может вызвать преходящую слепоту и эмболический церебральный инфаркт. Болезненная, опухшая и посинение руки, обычно возникающая после тяжелых физических нагрузок, может быть признаком венозной компрессии или тромбоза подключичной вены, называемого синдромом Педжета-Шреттера.
ДИАГНОСТИКА
Признак Адсона и реберно-ключичный маневр заведомо неточны и могут быть небольшой частью подробного анамнеза и физического обследования пациента с TOS. В настоящее время не существует единого клинического признака, позволяющего с уверенностью поставить диагноз TOS. Допплеровская артериография очень полезна для оценки синдрома грудной апертуры и может использоваться, если планируется операция по коррекции артериального TOS. Дополнительные маневры, которые могут быть ненормальными, — это «поднятие руки» на срок до 3-5 минут (удерживая обе руки над головой, пораженная рука часто будет бледнее, чем здоровая из-за нарушения кровоснабжения) и «компрессионный тест» (давление между ключицей и медиальной головкой плечевой кости вызывает излучение боли / онемения в пораженную руку).
Вернуться к началу
ВАРИАНТЫ ЛЕЧЕНИЯ
Может быть достаточно продолжительных и активных изменений осанки, наряду с остеопатической или мануальной терапией, иглоукалыванием, физиотерапией или массажем. Однако процесс восстановления длится долго, и несколько дней неправильной осанки часто могут отбросить его назад.
Около 10-15% пациентов подвергаются хирургической декомпрессии после соответствующей пробной консервативной терапии, чаще всего специфической физиотерапии, направленной на лечение синдрома грудной апертуры, и обычно продолжающейся от 6 до 12 месяцев.Хирургическое лечение может включать удаление аномальных мышц, удаление собственных передних и / или средних лестничных мышц, удаление первого ребра или, если имеется, шейного ребра, или невролиз (удаление фиброзной ткани из плечевого сплетения). Хирургическое лечение синдрома торакального выхода действительно связано с серьезным пожизненным риском. Большое количество людей страдают от умеренных и тяжелых послеоперационных осложнений и ухудшения или возвращения симптомов после первой резекции ребра. Эта несчастная часть этой популяции пациентов часто не упоминается в большинстве статей, и медицинское сообщество TOS от нее отказывается.
Неинвазивный
Растяжка
Самостоятельная растяжка предназначена для снятия компрессии в грудной полости, уменьшения сдавливания кровеносных сосудов и нервов и выравнивания костей, мышц, связок и сухожилий, вызывающих проблему.
- Перемещение плеч вперед (сутулость), затем обратно в нейтральное положение, затем их вытягивание назад (выгибание), затем обратно в нейтральное положение, затем подъем плеч и обратно в нейтральное положение.
- Наклонение и разгибание шеи в противоположную сторону от стороны травмы, при этом травмированная рука удерживается опущенной или обхваченной вокруг спины.
Скольжение нервов
Этот синдром вызывает компрессию большого пучка нервов, что приводит к поражению нервов по всей руке. Выполняя упражнения на скольжение нервов, можно растянуть и мобилизовать нервные волокна. Хроническое и прерывистое сдавление нерва изучается на животных моделях и имеет хорошо описанную патофизиологию, как описано Сьюзен Маккиннон, доктором медицины, в настоящее время работающей в Вашингтонском университете в Сент-Луисе. Упражнения на нервное скольжение изучались несколькими авторитетами, в том числе Дэвидом Батлером из Австралии.
Вытяните травмированную руку пальцами прямо в сторону. Наклоните голову в другую сторону и / или поверните голову в другую сторону. Чувство легкого натяжения обычно ощущается на всей травмированной стороне. Вначале только сделайте это и повторите. Когда вы освоите это упражнение и не почувствуете сильной боли, начните разгибать пальцы. Повторите с разными вариациями, наклоняя руку вверх, назад или вниз.
Осанка
Состояние плохого состояния быстро ухудшается из-за неправильной осанки.Активные дыхательные упражнения и эргономичная установка стола могут помочь поддерживать активную осанку. Часто мышцы спины становятся слабыми из-за длительного (годами) сутулости.
Лед / тепло
Лед можно использовать для уменьшения воспаления больных или поврежденных мышц. Тепло также может облегчить боль в мышцах, улучшая кровообращение в них. Хотя обычно ощущается боль во всей руке, некоторое облегчение можно увидеть, если приложить лед / тепло к грудной области (ключица, подмышка или лопатки).
Хиропрактика
Лечение основано на предположении, что поражение нервов может быть вызвано дисфункциональными или смещенными позвоночными сегментами или такими структурами, как малая грудная мышца, противовесная лестница или шейное ребро. Регулируя позвоночные сегменты, шейное ребро и / или выполняя терапию мягких тканей напряженной мускулатуры, можно облегчить ущемление нерва.
Вернуться к началу
Инвазивный
Кортизон
Кортизон, введенный в сустав или мышцу, может помочь облегчить и уменьшить воспаление.
Инъекции ботокса
Сокращенно от ботулинического токсина А, ботокс связывает нервные окончания и предотвращает высвобождение нейротрансмиттеров, которые активируют мышцы. Небольшое количество ботокса, введенное в напряженные или спастические мышцы (обычно в одну или все три лестницы), обнаруживаемое у страдающих TOS, часто приносит облегчение в течение нескольких месяцев, пока мышца временно парализована. К сожалению, это некосметическое лечение не покрывается большинством медицинских планов и стоит более 400 долларов. Облегчение симптомов от инъекции ботокса обычно длится 3-4 месяца, после чего токсин ботокса разрушается пораженными мышцами.Сообщалось о серьезных побочных эффектах, которые столь же продолжительны, поэтому более глубокое понимание механизма «лестничного блока» жизненно важно для определения пользы и риска использования ботокса. Кроме того, многие пациенты сообщают о НУЛЕВОМ облегчении от инъекций ботокса или лестничного пролива с отмеченным обострением после инъекции.
Вернуться к началу
ХИРУРГИЧЕСКИЕ ПОДХОДЫ
Хирургические доступы также использовались. В случаях, когда первое ребро сдавливает вену, артерию или нервный пучок, первое ребро, лестничные мышцы и сдавливающая фиброзная ткань могут быть удалены.Процедура называется резекцией первого ребра и скаленэктомией и включает прохождение через подмышечную область или переднюю лестничную область шеи и удаление первого ребра, лестничных мышц и любой сдавленной фиброзной ткани, чтобы открыть эту область, чтобы позволить кровоток и уменьшить компрессию нерва. Лечебная физкультура используется как до операции, так и после нее для дальнейшего успешного выздоровления пациента. Осложнения включают пневмоторакс, инфекцию, потерю чувствительности, боль и, как и при всех хирургических операциях, очень небольшой риск смерти и очень БОЛЬШОЙ риск необратимой травмы на протяжении всей жизни.
Некоторые врачи рекомендуют инъекцию анестетика короткого действия, такого как ксилокаин или маркаин, в переднюю лестничную, подключичную или малую грудную мышцу в качестве провокационного теста для помощи в диагностике синдрома грудного выхода. Это называется «разносторонним блоком». Однако это не считается «лечением», так как ожидается, что облегчение пройдет максимум в течение часа или двух. Продолжаются активные исследования точности и рисков этого провокационного теста.Следует отметить, что это вышеупомянутое «активное исследование» НЕ относится к каким-либо национально подтвержденным совместным исследованиям NIH в Соединенных Штатах. Как и в случае с текущим канадским испытанием ботокса, у испытуемых НЕ было доказано наличие синдрома торакального выхода с помощью каких-либо проверенных диагностических тестов, что делает канадское испытание ботокса недействительным.
Вернуться к началу
Пика во время беременности: причины, риски и многое другое
Вы, наверное, ожидали, что беременность принесет много странной тяги к еде (сладкие соленья и мюсли?), Но что, если вы жаждете непищевых продуктов как кусочки льда или даже мыло? Это может случиться, и это не редкость среди беременных женщин.
Тяга или употребление в пищу того, что не является едой, называется пика. Это заболевание может случиться с кем угодно, независимо от того, беременны они или нет, но чаще встречается во время беременности.
Итак, почему беременная женщина (или кто-либо другой) хочет есть то, что не является едой?
Подробнее о pica и о том, что делать, если она у вас есть.
Пика — расстройство пищевого поведения. Это может быть диагностировано, если вы постоянно употребляете непищевые продукты не менее 1 месяца.
Это также может быть признаком того, что что-то в вашем теле не сбалансировано.Некоторые исследования показали, что пика может быть связана с анемией, включая железодефицитную анемию. Это может произойти на любом сроке беременности, но часто появляется в первом триместре.
Некоторые из вещей, которые люди с пикой могут есть (или в некоторых случаях сосать), включают:
- лед
- бумагу
- глина
- грязь
- мыло
- мел
- детская присыпка
- пепел
- кукурузный крахмал
- сырой рис
- сырые зерна
- волосы
- нить
- ткань
- крошки краски
- клей
- металл
- обычные камешки
Если у вас все еще есть пика, вы будете есть обычную пищу.Вам просто захочется одного или нескольких непродовольственных товаров. Жажда льда известна как пагофагия. Между тем, тяга к земле, такой как земля или галька, известна как геофагия, а тяга к сырым крахмам, таким как рис, известна как амилофагия.
Разработать pica можно по многим причинам. Некоторые из его причин могут объяснить, почему он чаще встречается у беременных женщин.
Одна из причин, по которой ваше тело может хотеть непродовольственных товаров, заключается в том, что вы не получаете достаточного количества питательных веществ.
Во время беременности пища, которую вы едите, удовлетворяет ваши собственные потребности, а также потребности вашего растущего ребенка.Вашему организму необходимо правильное питание для поддержания беременности.
Иногда повышенная потребность во время беременности может привести к дефициту питательных веществ. Эта проблема может также возникнуть, если тошнота и рвота ограничивают количество питательных веществ, которые вы принимаете.
Дефицит таких важных минералов, как железо и цинк, может вызвать пику. Если вы беременны, у вас более высокий риск развития анемии из-за недостатка железа или витаминов группы B. Это также может вызвать пика.
Одно исследование с участием 286 беременных женщин в Гане показало, что беременные женщины, наиболее подверженные риску развития пика, могут включать тех, кто имеет:
- плохое питание или дефицит питательных веществ
- историческое или культурное воздействие употребления непищевых продуктов, таких как употребление глины как лекарство в некоторых культурах
Исследование также показало, что 47.5 процентов женщин страдали какой-либо формой пика во время беременности. Чаще всего потреблялись белая глина и лед.
Исследователи отметили, что некоторые участники считали, что белая глина и лед имеют питательную ценность. Они также отметили, что многие участники искали непродовольственные товары, потому что они были привлекательными и чувствовали, что запах или вкус помогают облегчить их тошноту.
Пика сама по себе не всегда вредна, но устранение ее основных причин может помочь предотвратить связанные с ней риски.
Если вы просто жаждете льда и наслаждаетесь жеванием ледяной стружки, это не представляет особого риска для вас и вашего ребенка (если вы не выбиваете зуб!). Однако потенциальная первопричина тяги к льду при пике — например, анемия — может быть вредной для вас и вашего ребенка.
Важно отметить, что иногда тяга к пике и непищевым продуктам может нанести прямой вред вашему здоровью, если вы едите непродовольственные товары.
Например, употребление непродовольственных товаров, таких как бумага, глина или грязь, может вызвать у вас заболевание.Они также могут вызвать чувство сытости, что приведет к тому, что вы не будете есть достаточно питательной пищи, необходимой вам и вашему ребенку.
В серьезных случаях пика может привести к другим осложнениям со здоровьем, таким как инфекции, раздражение желудка, закупорка пищеварительного тракта, рвота и потеря веса. Вы также можете есть токсичные продукты.
Если вы думаете, что у вас пика, немедленно сообщите об этом своему акушеру-гинекологу — даже если единственное, что вам не нравится, — это лед. Они могут помочь гарантировать, что вы и ваш ребенок будете получать правильные питательные вещества для здорового роста и развития.
Если вы жаждете других непродовольственных товаров, спросите их, как решить эту проблему.
Ни один тест не может определить, вызвана ли ваша необычная тяга к пикам. Вместо этого ваш акушер-гинеколог изучит вашу историю болезни и, возможно, назначит анализы крови, чтобы определить, есть ли у вас низкий уровень определенных витаминов и минералов.
Ваш акушер может также порекомендовать принимать другие витамины для беременных и придерживаться более сбалансированной диеты. Если вы испытываете тошноту и рвоту, пищевые заменители пищевых напитков могут быть хорошим временным решением, пока ваш аппетит не вернется.
Если у вас все еще есть тяга к вещам, не относящимся к еде, сообщите об этом своему врачу. Также может помочь разговор с диетологом о правильной диете для беременных.
В большинстве случаев Пика беременности проходит сама по себе после устранения недостатков или после рождения малыша.
Пика возникает, когда вы испытываете необычное желание есть что-то, что не является едой, например лед или глину. Это может быть признаком недостаточного питания.
Пика чаще встречается у беременных женщин, потому что во время беременности у вашего организма повышенные потребности в питании.Легче получить дефицит, если вы не едите правильную пищу или у вас тошнота, и вы не можете много есть.
Это условие питания может навредить вашему здоровью в зависимости от того, что вы едите и в каком количестве. Основная причина вашей тяги к непищевым продуктам также может нанести вред вам и вашему ребенку.
В большинстве случаев пика у беременных проходит сама по себе. Может помочь улучшение рациона питания или прием витаминов для беременных. Немедленно сообщите своему акушеру-гинекологу, если вы думаете, что у вас пика.
Иридокорнеальный эндотелиальный синдром и глаукома
Авторы: Сарват Салим, доктор медицины, FACS, и М. Брюс Шилдс, доктор медицины
Отредактировали Ингрид У. Скотт, доктор медицины, магистр здравоохранения, и Шэрон Фекрат, доктор медицины
Эта статья опубликована в октябре 2011 г. и может содержать устаревшие материалы.
Иридокорнеальный эндотелиальный (ICE) синдром включает в себя спектр трех клинических вариаций: синдром Чандлера, прогрессирующая атрофия радужки и синдром Когана-Риза.Хотя первоначально описанные отдельно и с отчетливыми клиническими проявлениями, эти варианты связаны фундаментальным дефектом эндотелия роговицы, как показали гистопатологические и ультраструктурные исследования. Это приобретенное заболевание обычно является односторонним и поражает преимущественно женщин в раннем и среднем возрасте, хотя сообщалось о двусторонних случаях и возникновении у детей 1 .
Потеря зрения, связанная с синдромом ДВС, обычно является вторичной по отношению к декомпенсации роговицы или рефрактерной глаукоме, которая часто требует хирургического вмешательства с переменным успехом.
Клинические особенности
Отличительные клинические признаки синдрома ДВС заключаются в следующем.
Симптомы. Распространенная жалоба — приобретенное отклонение формы или положения одного зрачка. Некоторые пациенты с синдромом ICE сообщают о снижении зрения, которое обычно ухудшается по утрам из-за отека роговицы, который развивается, когда веки закрываются во время сна, и улучшается в течение дня, поскольку роговица обезвоживается на воздухе.
Знаки. Клиническое обследование пациента с синдромом ДВС обычно выявляет аномалии роговицы, угла передней камеры и радужки. Типичная аномалия роговицы при синдроме ICE проявляется при осмотре с помощью щелевой лампы в виде тонкого серебристого цвета задней части роговицы, похожего на дистрофию Фукса, но менее грубого. При зеркальной микроскопии эндотелиальные клетки роговицы уменьшаются в количестве и обнаруживают различную степень плеоморфизма по размеру и форме с потерей гексагональных краев. Эти аномальные клетки также демонстрируют инверсию темного света, при этом границы клеток выглядят яркими, а поверхности клеток темными (рис.1). Эти клетки иногда называют «клетками ICE», а ткань, которую они формируют, — «тканью ICE».
Типичная аномалия угла передней камеры, которая также является общей для всех вариантов синдрома ICE, при гониоскопии определяется как периферические передние синехии, которые могут распространяться кпереди от линии Швальбе (рис. 2). Эти иридотрабекулярные спайки имеют широкую основу и обычно постепенно прогрессируют по окружности угла, что в конечном итоге приводит к закрытию угла и повышению ВГД.
Различия в аномалиях радужной оболочки являются основным средством различения клинических вариантов синдрома ДВС:
- Синдром Чандлера обычно проявляется отеком роговицы и минимальными изменениями радужной оболочки.Хотя это наиболее распространенный вариант ICE, он часто не распознается врачами. Могут также возникать промежуточные вариации, при которых степень иректопии и атрофии стромальной радужки более обширна, чем при типичном синдроме Чандлера, но характерное образование сквозных отверстий прогрессирующей атрофии радужки отсутствует.
- Прогрессирующая атрофия радужной оболочки характеризуется выраженной атрофией радужки, связанной с различной степенью корэктопии и эктропиона сосудистой оболочки глаза.Отличительным признаком прогрессирующей атрофии радужной оболочки является образование отверстий в радужной оболочке, которое бывает двух форм: отверстия растяжения и отверстия плавления. Растягивающиеся отверстия возникают в результате истончения радужной оболочки в квадранте от направления зрачкового искажения (рис. 3 и 4). Дыры плавления развиваются без сопутствующей иректопии или истончения радужной оболочки. Флуоресцентные ангиографические исследования показывают, что эти отверстия связаны с ишемией радужной оболочки.
- Синдром Когана-Риза характеризуется любой степенью атрофии радужки, но преобладающим признаком является наличие множественных пигментированных узелков радужки на ножке (рис.5). Эти узелки состоят из ткани, напоминающей строму радужной оболочки, и часто окружены эндотелиальной тканью. В некоторых случаях другие признаки синдрома ДВС могут присутствовать за много лет до появления узелков.
В их классическом представлении можно легко различить три варианта. Однако, учитывая прогрессирующее течение этого заболевания, иногда трудно четко выделить их среди них, так как клинические проявления могут меняться на разных стадиях заболевания.
Механизм
Основным механизмом, связывающим все три варианта, является аномалия эндотелия роговицы. Как упоминалось ранее, эндотелиальные клетки уменьшаются в количестве, становятся плеоморфными и показывают инверсию темного света. Эндотелиальные клетки приобретают характеристики эпителиальных клеток, такие как наличие десмосом, внутрицитоплазматических нитей и микроворсинок. Затем эти аномальные клетки мигрируют в соседние структуры, включая радужную оболочку и трабекулярную сеть.
Было показано, что эти измененные эндотелиальные клетки секретируют аномальную базальную мембрану, подобную мембране Десцемета. Сокращение этой базальной мембраны приводит к изменениям радужки, иридотрабекулярным синехиям и вторичной закрытоугольной глаукоме. 2
Этиология
Хотя механизм изменений угла передней камеры и радужки хорошо установлен, точная этиология синдрома ICE остается неясной. История иридоциклита в некоторых пораженных глазах и наличие воспалительных клеток в образцах роговицы побудили некоторых исследователей предположить вирусную этиологию.Например, серологические исследования у пациентов с синдромом ДВС предполагают, но не доказали этиологическую роль вируса Эпштейна-Барра.
Более убедительные данные свидетельствуют о том, что вирус простого герпеса (ВПГ) может играть жизненно важную роль в патогенезе синдрома ДВС. Данные, полученные с использованием пар праймеров и методов полимеразной цепной реакции (ПЦР), показали наличие ДНК ВПГ в эндотелии в образцах роговицы пациентов с синдромом ДВС. Этот результат отсутствовал в нормальных роговицах и роговицах пациентов с тремя другими хроническими заболеваниями роговицы (афакическая буллезная кератопатия, интерстициальный кератит и кератоконус). 3
Кроме того, образцы роговицы дали отрицательные результаты на ВПГ после удаления эндотелиального слоя на глазах с синдромом ICE.
Дифференциальная диагностика
Несколько других заболеваний роговицы и радужной оболочки, многие из которых связаны с глаукомой, можно спутать с синдромом ICE. 4
Заболевания роговицы. Двумя основными дифференциальными диагнозами эндотелиальных заболеваний роговицы являются задняя полиморфная дистрофия (PPMD) и эндотелиальная дистрофия Фукса.Пациенты с PPMD могут демонстрировать нерегулярный зрачок, изменения радужной оболочки и изменения угла передней камеры, которые напоминают синдром ICE, но тщательный анализ результатов зеркальной микроскопии, упомянутых выше, помогает дифференцировать эти две сущности. Более того, PPMD - двустороннее заболевание с аутосомно-доминантным наследованием. Изменения эндотелия роговицы при эндотелиальной дистрофии Фукса больше напоминают таковые при синдроме ICE, но у пациентов с синдромом Fuchs не наблюдается угла передней камеры или особенностей радужной оболочки, наблюдаемых при синдроме ICE.
Заболевания радужной оболочки. Заболевания радужной оболочки, которые можно спутать с синдромом ДВС, включают синдром Аксенфельда-Ригера, аниридию и иридошизис. Из них синдром Аксенфельда-Ригера имеет поразительное клиническое и гистопатологическое сходство с синдромом ДВС, но отличается тем, что является двусторонним и врожденным. Клинические проявления синдрома Аксенфельда-Ригера обычно являются стационарными, хотя со временем может наблюдаться некоторое прогрессирование. Кроме того, изменения радужной оболочки и угла при синдроме Аксенфельда-Ригера связаны с удержанием и сокращением первичного эндотелиального слоя, тогда как изменения при синдроме ICE являются вторичными по отношению к миграции и последующему сокращению аномальных эндотелиальных клеток роговицы.Узелковые поражения радужной оболочки, которые можно спутать с синдромом Когана-Риза, включают меланому радужки и узелки Лиша, наблюдаемые при нейрофиброматозе, а также воспалительные узелки при гранулематозных увеитических состояниях, таких как саркоидоз.
Глаукома
Глаукома встречается примерно у половины пациентов с синдромом ДВС. Большинство исследований показывают, что глаукома более серьезна и ее трудно контролировать у пациентов с прогрессирующей атрофией радужной оболочки или вариациями Когана-Риза, чем у пациентов с синдромом Чандлера.Некоторые исследователи коррелировали возникновение глаукомы с зеркальным микроскопическим проявлением и обнаружили более высокую распространенность глаукомы, когда аномальные эндотелиальные клетки поражают всю заднюю поверхность роговицы. 5
Считается, что механизм глаукомы при синдроме ДВС связан с клеточной мембраной. Хотя угол передней камеры кажется нормальным на ранних этапах синдрома ICE из-за наличия этой прозрачной мембраны, прогрессирование заболевания со временем может привести к сокращению аномальной базальной мембраны и образованию периферических передних синехий.Они часто доходят до линии Швальбе, препятствуя оттоку водянистой влаги и заканчиваясь вторичной закрытоугольной глаукомой.
Лечение
Лечение глаукомы часто бывает затруднительным для глаз с синдромом ДВС.
Медицинские доступы. Медикаментозное лечение глаукомы обычно начинается с водных супрессивных средств, но зачастую оно оказывается безуспешным. Миотики обычно неэффективны, и роль гипотензивных липидов в этих глазах полностью не изучена.
Хирургические доступы. Лазерная трабекулопластика неэффективна из-за структурных изменений угловой выемки. Послеоперационная хирургия в конечном итоге требуется большому проценту пациентов. Наиболее часто выполняемая хирургическая процедура — трабекулэктомия, эффективность которой составляет от 60 до 70 процентов и 29 процентов, соответственно, через один и пять лет после операции. 4,5 Эффективность фильтрационной хирургии глаукомы может быть немного выше при использовании антифибротических агентов. 5,6 В целом, более высокая частота неудач после трабекулэктомии связана с более молодой группой пациентов с чрезмерным рубцеванием.(Поскольку ICE поражает людей в раннем и среднем зрелом возрасте, эти пациенты, как правило, моложе типичных пациентов с глаукомой.) Эндотелиализация с накоплением аномальной базальной мембраны в устье фильтрующего пузыря также вызывает поздние отказы.
В одной небольшой серии имплантаты водного дренажа дали благоприятные результаты, но потребовались дополнительные операции для ревизии и изменения положения трубки. 7 Авторы исследования предлагают модификации хирургической техники, чтобы избежать риска окклюзии или миграции трубки вперед из-за продолжающегося сокращения аномальной эндотелиальной мембраны.Предлагаемые модификации включали более длинные дистальные трубки, изогнутый ход трубки на пути к передней камере и размещение трубки в pars plana в псевдофакичных глазах.
Как и в случае других форм глаукомы, когда ВГД невозможно контролировать с помощью более традиционных методов лечения, могут оказаться полезными циклодеструктивные процедуры, особенно трансклеральная циклофотокоагуляция.
___________________________
1 Salim, S. et al. J Pediatr Ophthalmol Strabismus 2006; 43 (5): 308–310.
2 Кэмпбелл, Д. Г. и др. Am J Ophthalmol 1978; 86 (3): 317–324.
3 Alvarado, J. A. et al. Arch Ophthalmol 1994; 112 (12): 1601–1609.
4 Салим С. и М. Б. Шилдс. «Претрабекулярные механизмы повышения внутриглазного давления», в Механизмы глаукомы, изд. J. Tombran-Tink et al. (Тотова, Нью-Джерси: Humana Press, 2008), 83–97.
5 Laganowski, H.C. et al. Arch Ophthalmol 1992; 110 (3): 346–350.
6 Доу, Э.A. et al. Офтальмология 2001; 108 (10): 1789–1795.
7 Kim, D. K. et al. Офтальмология 1999; 106 (5): 1030–1034.
___________________________
Доктор Салим — адъюнкт-профессор офтальмологии и директор службы глаукомы в Университете Теннесси, Мемфис; Доктор Шилдс — профессор и почетный председатель офтальмологии Йельского университета.
Почему так происходит? Подробнее здесь
Беременность влияет на организм по-разному, что может привести к боли в суставах после рождения ребенка.Например, задержка жидкости может вызвать синдром запястного канала, который вызывает боль в суставах пальцев, а вынашивание ребенка может оказывать давление на колени.
Точная причина боли может быть связана с гормональными изменениями и воспалением в суставах. Послеродовые симптомы боли в суставах могут первоначально возникать во время беременности или родов и длиться от нескольких недель до месяцев после рождения.
В этой статье рассказывается, где может возникнуть послеродовая боль в суставах, возможные причины и способы ее лечения.
Некоторые люди могут испытывать боль в суставах во время беременности, которая усиливается и продолжается в послеродовом периоде.
Послеродовая боль может быть результатом гормональных изменений и физических нагрузок во время беременности и родов.
Например, боль в бедре обычна во время беременности и может длиться в течение недель или месяцев после беременности. В редких случаях это могло развиться на всю жизнь. Другие области суставов, которые можно ожидать от боли, включают пальцы и колени.
Послеродовая боль в суставах пальцев может быть вызвана многими причинами, в том числе физическими трудностями и задержкой жидкости.
Физические требования
Продолжительное удерживание руки в определенных положениях во время родов, например, захват за край кровати, может привести к травмам пальцев или суставов рук.
В легких случаях врачи могут предложить лечение на дому. Это может включать в себя отдых пальцев и прикладывание пакета со льдом. Также могут помочь компрессионные повязки.
Задержка жидкости
Беременность может вызвать задержку жидкости, что может увеличить риск синдрома запястного канала. Это состояние возникает, когда срединный нерв руки сдавливается.
Когда в организме содержится больше воды, чем обычно, в запястье может скапливаться жидкость, оказывая давление на нервы рук.
Синдром запястного канала во время беременности может вызывать покалывание и слабость в руках, которые могут сохраняться и в послеродовом периоде. Еще один симптом — резкая боль в пальцах рук.
Узнайте больше о синдроме запястного канала здесь.
Врачи обычно лечат синдром запястного канала, предоставляя поддерживающее приспособление для руки и предлагая период отдыха.Также могут помочь некоторые лекарства, например противовоспалительные. В более тяжелых случаях могут потребоваться инъекции стероидов или операция.
Медицинский термин, обозначающий наиболее распространенный тип боли в бедре во время беременности, — это боль в тазовом поясе (PGP), которая поражает суставы в тазу. Другие состояния, которые могут вызвать боль в бедре в послеродовом периоде, включают синдром грушевидной мышцы и гипертиреоз.
PGP
Исследователи не уверены в точной причине PGP, но обычно это результат нестабильности бедер во время беременности.Гормоны беременности также влияют на то, как люди регулируют боль, поэтому это может объяснить, почему PGP очень болезнен. PGP также может иметь генетическую связь.
Симптомы PGP включают:
- боль в глубине лобковой области
- боль, усиливающуюся при активности
- иррадирующая боль в пояснице
- хлопающий звук при движении бедра
Для лечения PGP врач может порекомендовать физиотерапию. укрепить мышцы таза и уменьшить боль. Также могут помочь обезболивающие.
Синдром грушевидной мышцы
Исследование 2013 года показало, что некоторые люди могут испытывать синдром грушевидной мышцы после беременности. Здесь спазмируется мышца возле ягодиц и вызывает боль в этой области.
Заболевание может повлиять на близлежащий седалищный нерв. Синдром грушевидной мышцы проявляется симптомами радикулита, такими как боль в пояснице, бедрах и ногах.
Врач может порекомендовать нестероидные противовоспалительные препараты для снятия боли. Также помогут физиотерапия и упражнения для ног.
Узнайте больше о синдроме грушевидной мышцы здесь.
Гипертиреоз
У некоторых людей гипертиреоз развивается во время беременности. Гипертиреоз возникает, когда щитовидная железа вырабатывает чрезмерный уровень гормонов.
Болезнь Грейвса может быть основной причиной гипертиреоза и проявляется в 1-4 из каждых 1000 беременностей в Соединенных Штатах. Если у человека впервые развивается болезнь Грейвса во время беременности, симптомы могут ухудшиться в послеродовом периоде.
Гипертиреоз во время беременности и в послеродовом периоде может вызвать тиреотоксическую миопатию. Это состояние может повлиять на тазовый пояс, вызывая боль в этой области.
Врачи порекомендуют антитиреоидные препараты для лечения гипертиреоза или тиреотоксической миопатии. Эти препараты контролируют уровень гормонов щитовидной железы и уменьшают симптомы.
Узнайте больше о гипертиреозе здесь.
Боль в коленях в послеродовом периоде могла быть вызвана тем, что человек носил больший вес во время беременности.Однако боль в суставах также может быть признаком гипертиреоза, поэтому, если после родов боль в коленях не уменьшается, ему следует поговорить со своим врачом.
Для лечения послеродовой боли в коленях человек может захотеть принимать безрецептурные противовоспалительные препараты или обезболивающие. Если человек кормит грудью, ему следует обсудить с врачом безопасное обезболивание.
Человек может облегчить боль с помощью домашнего ухода. Например, человек может лечить поясничную боль в пояснице, прикладывая тепло к этой области, например, с помощью грелки.
Еще одна область, на которой человек может сосредоточиться, — это осанка и походка, чтобы он знал, как двигаться, не оказывая давления на позвоночник. Этот тип управления может также включать упражнения Кегеля.
Поскольку беременность и роды требуют больших физических усилий, предотвращение послеродовой боли в суставах не всегда возможно.
Тем не менее, некоторые общие советы по предотвращению боли в суставах включают:
- поддержание здорового веса
- сохранение физической активности
- укрепление мышц
- употребление большого количества овощей
- сокращение потребления кофеина
- получение достаточного количества витамина D и кальция
- ношение поддерживающей обуви
- упражнения на растяжку и балансировку, такие как йога
Многие состояния вызывают послеродовую боль в суставах, некоторые из которых более серьезны, чем другие.
Если послеродовая боль в суставах является постоянной или усиливается, человеку следует обратиться к врачу. Сильная боль может указывать на основное состояние здоровья, которое требует дальнейшего лечения, например синдром запястного канала или гипертиреоз.

 д.
д.

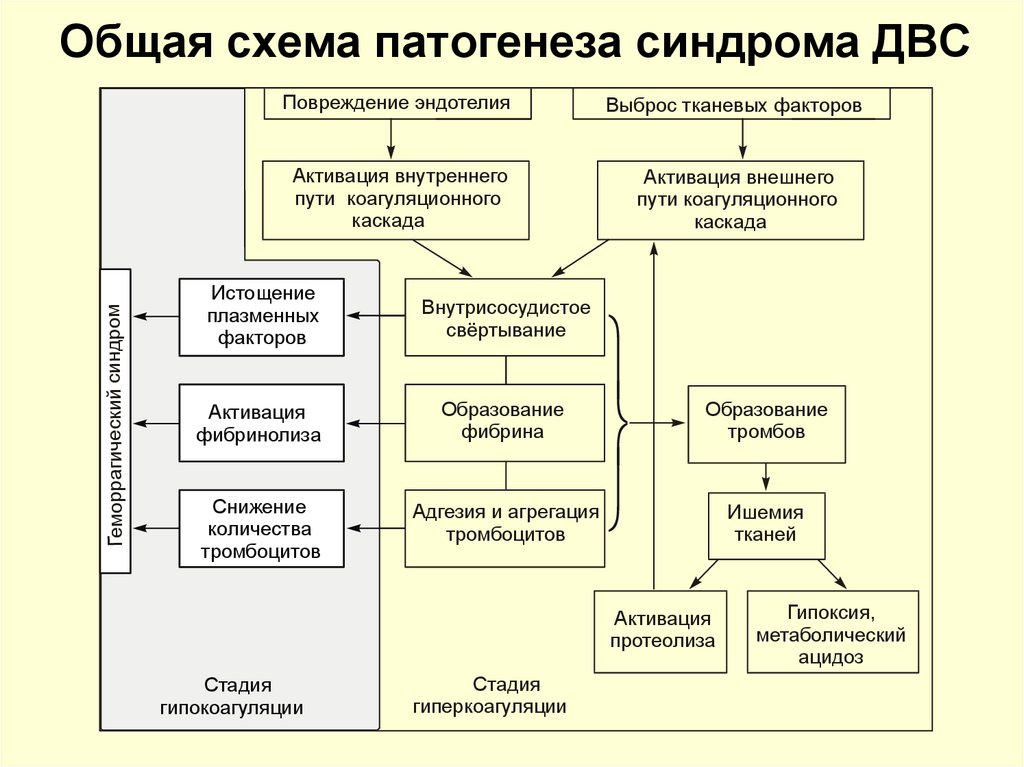 Д. — Практическое руководство
Д. — Практическое руководство
 Кроме этого, ДВС-синдром, патогенез которого определяет данную стадию на переходном периоде между первой фазой и фазой гипокоагуляции, может повлечь расстройство нервной системы.
Кроме этого, ДВС-синдром, патогенез которого определяет данную стадию на переходном периоде между первой фазой и фазой гипокоагуляции, может повлечь расстройство нервной системы. Nat. Rev. Dis. Primers. 2016; 2: 16045. doi: 10.1038/nrdp.2016.45.
Nat. Rev. Dis. Primers. 2016; 2: 16045. doi: 10.1038/nrdp.2016.45. G., Nelson D.B. Disseminated intravascular coagulation syndromes in obstetrics. Obstet. Gynecol. 2015; 126(5): 999-1011. doi: 10.1097 / AOG.0000000000001110.
G., Nelson D.B. Disseminated intravascular coagulation syndromes in obstetrics. Obstet. Gynecol. 2015; 126(5): 999-1011. doi: 10.1097 / AOG.0000000000001110. Thromb. Haemost. 2018; 44(3): 224-38. doi: 10.1055 / s-0037-1604108.
Thromb. Haemost. 2018; 44(3): 224-38. doi: 10.1055 / s-0037-1604108.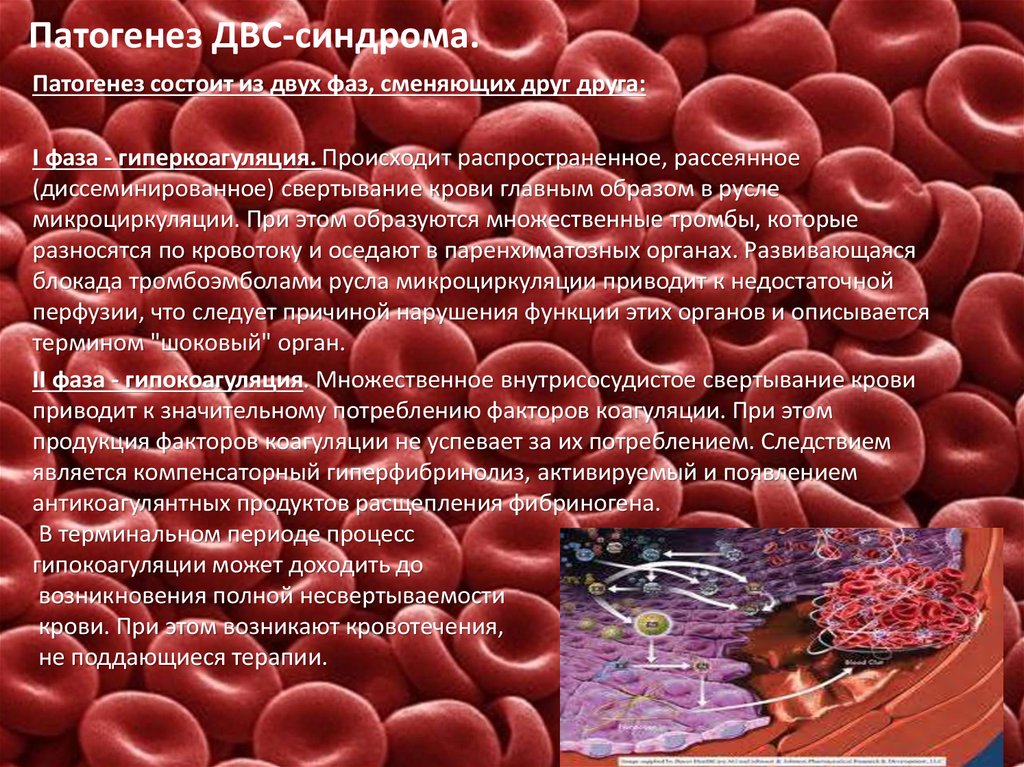 Am. J. Respir. Crit. Care Med. 2016; 193(3): 281-7. doi: 10.1164 / rccm.201505-0995OC.
Am. J. Respir. Crit. Care Med. 2016; 193(3): 281-7. doi: 10.1164 / rccm.201505-0995OC. doi: 10.1055 / s-0033-1343894
doi: 10.1055 / s-0033-1343894 A., Zeerleder S., Kessler P., Romani de Wit T., van Mourik J.A., Hack C.E. et al. ADAMTS-13, von Willebrand factor and related parameters in severe sepsis and septic shock. J. Thromb. Haemost. 2007; 5(11): 2284-90. http://dx.doi.org/10.1111/j.1538-7836.2007.02743.x.
A., Zeerleder S., Kessler P., Romani de Wit T., van Mourik J.A., Hack C.E. et al. ADAMTS-13, von Willebrand factor and related parameters in severe sepsis and septic shock. J. Thromb. Haemost. 2007; 5(11): 2284-90. http://dx.doi.org/10.1111/j.1538-7836.2007.02743.x. Клинико-лабораторный консилиум. 2014; 2: 20-40.
Клинико-лабораторный консилиум. 2014; 2: 20-40. , Guyatt L., Pierre P. Target blood pressure for septic and vasodilatory shock: what is optimal? Intensive Care Med. 2018; 44(4): 548-9. doi: 10.1007 / s00134-017-5016-5.
, Guyatt L., Pierre P. Target blood pressure for septic and vasodilatory shock: what is optimal? Intensive Care Med. 2018; 44(4): 548-9. doi: 10.1007 / s00134-017-5016-5. Case Reports In Perinatal Medicine. 2017; 6(2). DOI: https://doi.org/10.1515/crpm-2017-0023
Case Reports In Perinatal Medicine. 2017; 6(2). DOI: https://doi.org/10.1515/crpm-2017-0023 А., Лобанова И.Н., Абудеев С.А., Кругляков Н.М., Белоусова К.А., Багжанов Г.И., Бахарев С.А., Шмарова Д.Г., Удалов Ю.Д., Забелин М.В., Самолов А.С. Катастрофический антифосфолипидный синдром в практике интенсивной терапии. Медицина экстремальных ситуаций. 2017; 62(4): 36-49.
А., Лобанова И.Н., Абудеев С.А., Кругляков Н.М., Белоусова К.А., Багжанов Г.И., Бахарев С.А., Шмарова Д.Г., Удалов Ю.Д., Забелин М.В., Самолов А.С. Катастрофический антифосфолипидный синдром в практике интенсивной терапии. Медицина экстремальных ситуаций. 2017; 62(4): 36-49.