УЗИ функции желчного пузыря и желчевыводящих путей
Ультразвуковое исследование при дискенезии желчевыводящих путей.
Нарушение моторной функции желчного пузыря у детей является одной из самых давних проблем гастроэнтерологии. Предложено большое количество методик, включающих дуоденальное зондирование, рентгенологическое, радиоизотопное, ультразвуковое исследование.
Следует отметить, что в настоящее время рентгеновские исследования — холецистографию и холангиохолецистографию в различных модификациях в педиатрических клиниках не проводят, поскольку они сопряжены с лучевой нагрузкой и из-за их повреждающего воздействия на организм, и отсутствия контрастных веществ, промышленный выпуск которых прекращен.
К современным неинвазивным методам изучения состояния желчевыводящих путей у детей относится ультразвуковое исследование (УЗИ), которое отличает безвредность, физиологичность и отсутствие противопоказаний.
Динамическое УЗ-исследование функции желчного пузыря — определение наличия его моторных нарушений. С помощью ультразвукового сканирования на экране монитора изучают анатомические особенности желчного пузыря, определяют размеры органа, его первоначальный объем, место расположения, толщину стенок и характер содержимого. Затем пациенту предлагают позавтракать и через 15 — 20 минут после приема желчегонного завтрака измеряют величину пузыря — наибольшую длину и наибольшую ширину. Аналогичные измерения проводят еще через 15 — 20 минут.
В отличие от классического УЗИ желчного пузыря, в данном случае врач снимает показания не только из положения на спине, но и из положения на боку.
Согласно многочисленным литературным источникам по данным УЗИ принято считать сократительную функцию желчного пузыря (СФЖП) нормальной, если объем пузыря к 30-40 минутам уменьшается на 1\2 от первоначального. Если объем пузыря к 30-40 минутам уменьшился менее чем на 50%, СФЖП следует считать сниженной, а при уменьшении его более чем на 75% — повышенной. Исходя из этих показателей следует назначать и коррегирующую терапию.
Исходя из этих показателей следует назначать и коррегирующую терапию.
Задачей обследования является диагностика характера моторно-эвакуаторной функции желчного пузыря у детей, позволяющего точно отдифференцировать норму, гипомоторную и гипермоторную дискинезию. Таким образом, данное обследование помогает установить форму дискинезии, выявляет наличие камней, позволяет определить размеры органа и толщину его стенки, наличие околопузырного инфильтрата и консистенцию содержимого желчного пузыря.
Точная и своевременная диагностика характера нарушений моторно-эвакуаторной функции желчного пузыря с учетом состояния желудка и двенадцатиперстной кишки позволяет выработать адекватную тактику лечения, предотвратить хронизацию патологического процесса и связанные с ним сопутствующие нарушения — необратимые изменения со стороны печени, желчевыводящих протоков, поджелудочной железы, а в отдельных случаях избежать инвалидизации ребенка.
Своевременная диагностика и адекватное лечение улучшают качество жизни, включающее психологический статус, работоспособность и т.д.
Способ является высокоинформативным, объективным и точным, простым и доступным, он может быть широко использован в педиатрических учреждениях разного типа.
Показания:
- Дискинезия желчевыводящих путей.
- Частые боли в правом подреберье, которые не устраняются лекарственными средствами.
- Нарушение переваривания жиров в кишечнике – наличие каловых масс с жирным блеском.
- Рекомендовано пациентам, у которых уже имеются изменения в анализах крови, особенно связанные печеночными ферментами (АсАТ, АлАТ, общий билирубин и пр.).
- Были указания на травму брюшной полости.
- Требуется контроль над эффективностью лечения при заболеваниях печени, желчного пузыря, поджелудочной железы и др.
- Длительный прием медикаментов при хронических патологиях.
- Наличие специфических жалоб (горечь во рту, тяжесть в правом подреберье).
- Злоупотребление острой, жареной, копченой пищей, нерегулярное питание.

- Наличие избыточного веса.
- Низкокалорийные диеты.
- Подозрение на желчнокаменную болезнь.
- Изучение состояния желчевыводящей системы при опухолях.
Противопоказаний нет.
Подготовка:
Проводить УЗИ желчного пузыря нужно строго натощак, также нельзя пить воду (рекомендуется даже не чистить зубы, чтобы не было соблазна сделать, даже случайно, глоток воды).
Во время консультации обсудите с лечащим врачом, с какой целью будет проводиться данное исследование и возможна ли отмена принимаемых лекарств в день выполнения УЗИ.
Для того, чтоб УЗИ было информативным, должны быть соблюдены несколько условий:
- Последний прием пищи должен быть не позднее, чем за 8 часов до исследования, так как в норме в отсутствии еды желчь скапливается в пузыре, и он несколько увеличивается в размерах. Если выпить даже немного воды, то возможно выделение желчи и пузырь сократится. Это также затруднит диагностику.
- Если планируется обследование ребенка: младенцев и детей до 1 года рекомендуется не кормить за 2,5 — 3 часа до процедуры (лучший вариант — записаться на обследование за 20-25 минут перед кормлением по своему графику), детей до 3-х лет – за 4 часа, а детей до 8 лет – за 6 часов. Для ребенка старше 8 лет применяются те же правила, что и для взрослого человека.
- Не должно наблюдаться скопления газов в кишечнике, так как они мешают визуализации.
Допускается отклонение от предложенных рекомендаций при заболеваниях, требующих регулярного приема лекарственных препаратов и строгого соблюдения диеты (сахарный диабет, ишемическая болезнь сердца, гипертоническая болезнь и др.). По поводу приема или отмены лекарственных препаратов проконсультируйтесь у лечащего врача!
В качестве желчегонного завтрака на практике для оценки сократительной функции желчного пузыря используют бутерброд с хлебом и 10 г сливочного масла, или 200 мл 10% сливок, или два яичных желтка, или 50 мл растительного масла, 200 гр йогурта жирностью не менее 8% или молочный шоколад (без добавок).
Что является результатом исследования?
Вы получаете заключение о состоянии функции желчного пузыря.
УЗ-диагностика позволяет определить:
- нарушения в моторике желчного пузыря и определить тип дискенезии.
- консистенцию содержимого и состояние тканей вокруг желчного пузыря — от этого будет зависеть метод лечения.
Page not found | Східноєвропейський журнал внутрішньої та сімейної медицини
Журнал орієнтований на лікаря-практика і його потреби. Журнал грунтується на клінічній доказовій базі, алгоритмах діагностики, лікування та профілактики, призводить максимальну кількість корисного ілюстративного матеріалу, на сайті журналу наводяться відео лекції та тестові завдання, що дають можливість фахівцеві в режимі он-лайн перевірити і підвищити свої знання.
Особливість нашого журналу — практично-орієнтований підхід, а також впровадження дистанційних форм навчання у повсякденну діяльність лікаря.
Статті публікуються українською, російською та англій-
ською мовами. Приймаються в першу чергу оглядові статті з
актуальних проблем внутрішньої та сімейної медицини, які
можуть бути використані для дистанційної освіти лікарів та
підвищення їх післядипломної освіти.
Автор (або колектив авторів) усвідомлює, що несе первісну відповідальність за новизну і достовірність результатів наукового дослідження, що передбачає дотримання таких принципів:
•автори статті повинні надавати достовірні результати проведених досліджень. Завідомо помилкові або сфальсифіковані затвердження неприйнятні.
На сайті журналу постійно оновлюються клінічні протоколи та рекомендації щодо внутрішній медицині. Оформіть передплату на оновлення на сайті заповнивши форму, наведену вище і Ви завжди будете отримувати електронну розсилку з оновленнями.
Ми завжди відкриті для діалогу і співпраці. Ми будемо дуже вдячні за поради та рекомендації, які Ви можете надсилати нам.
Ми дуже сподіваємося, що це видання отримає підтримку як у лікарів, так і у працівників системи післядипломної освіти. Ми вдячні всім, хто співпрацює з нашим виданням, і всім читачам за інтерес до основних проблем сучасної медицини!
Засновником журналу є Харківська обласна організація «Асоціація лікарів загальної практики — сімейної медицини». Харківська медична академія післядипломної освіти:
Кафедра терапії, ревматології та клінічної фармакології.
Харківський національний медичний університет: кафедра внутрішньої медицини №3.
Для кореспонденції: [email protected]
Деформация желчного пузыря лечение
Если при установленной на УЗИ исследовании деформации желчного пузыря вас беспокоят неприятные симптомы, связанные с приемом пищи и наблюдается повышение уровня билирубина необходимы консультация и наблюдение гастроэнтеролога для лечения, чтобы предотвратить возможные осложнения.
Если деформация желчного пузыря обнаружена на УЗИ исследовании, но вас ничего не беспокоит, никакого специфического лечения проводить не надо. Достаточно раз год делать УЗИ для проверки и посещать врача. Может понадобиться два раза в год профилактический прием желчегонных препаратов, которые назначит врач.
В случае врожденной деформации желчного пузыря лечение может потребоваться только в при наличии значительных нарушений, так как многократные загибы, они могут способствовать задержке желчи в желчном пузыре.
Приобретенная по причине холецистита или желчнокаменной болезни деформация желчного пузыря, которая сопровождается нарушением его сократительной функции, изменением качества и количества желчи и нарушением пищеварения нуждается в обязательном лечении.
Пациент в результате лечения получит
- Отсутствие симптомов и улучшение качества жизни.
- Восстановление функций желчного пузыря.
- Профилактику осложнений и удлинение ремиссии.
- Устранение факторов риска.

Советы и рекомендации
Для профилактики и улучшения самочувствия поможет щадящая диета и режим питания. Желательно питаться в одно и тоже время, не переедать и не голодать. Из рациона надо исключить жареные, жирные, острые и копченые блюда, шоколад, грибы.
Справочная информация
Деформация желчного пузыря – это распространенная патология, которая бывает врожденной или приобретается на протяжении жизни человека. Желчный пузырь – это полый орган небольшого размера для хранения желчи. Он представляет собой удлиненный мешочек, по форме в наполненном желчью виде напоминающий грушу. В желчном пузыре выделяют верхнюю суженную часть – шейку, от которой отходит пузырный проток, среднюю – тело, и нижнюю дно. Наиболее частыми деформациями являются перегибы, перекручивание и перетяжки желчного пузыря в области шейки.
Лечение дискинезии желчевыводящих путей в Киржаче, записаться к гастроэнтерологу
Дискинезия желчных путей — это заболевание, связанное с нарушением моторики желчного пузыря и желчных протоков и, как следствие, неправильным поступлением желчи в 12-перстную кишку для пищеварения.
Желчь – жидкость желтовато-коричневого цвета, которая участвует в процессе пищеварения и содержит активные биохимические вещества.
Дискинезия желчевыводящих путей с недостаточным поступлением желчи называется гипокинезией, а с избыточным поступлением желчи – гиперкинезией желчевыводящих путей.
Симптомы дискинезии желчных путей
Дискинезия желчевыводящих путей (ДЖВП) имеет следующие основные симптомы:
тупые, ноющие или острые, приступообразные боли в животе и правом подреберье (отдают в правое плечо и лопатку) и (или) около пупка, горечь во рту, тошнота, рвота.
Причины дискинезии желчных путей
По причинам возникновения дискинезия желчевыводящих путей делится на вторичную и первичную. Первичная форма встречается относительно редко. Как правило, она обусловлена каким-то дефектом развития протоков или желчного пузыря:
Первичная форма встречается относительно редко. Как правило, она обусловлена каким-то дефектом развития протоков или желчного пузыря:
- наличие перегородки внутри пузыря
- слабость стенки пузыря
- удвоенное количество протоков
- перегиб желчного пузыря
- внутрипеченочный, двойной, аномально расположенный или подвижный пузырь
Вторичное нарушение моторики желчевыводящих путей является следствием других заболеваний. Это могут быть заболевания печени – вирусные гепатиты, нейроциркуляторная дисфункция, заболевания желудочно-кишечного тракта – гастриты, язвы, дуоденит, аппендицит, холецистит, желчнокаменная болезнь, пищевые аллергии, воспалительные процессы брюшной полости, патологии женских половых органов, климакс. Также дискинезии желчевыводящих путей могут наблюдаться при инфекциях и глистных инвазиях, лямблиозах, хронических инфекциях (кариес, тонзиллит и т.д.).
Иногда основной причиной нарушения функционирования желчевыводящих путей может являться неправильное и нерегулярное питание – длительное голодание, употребление алкоголя, пряностей, чрезмерно острых жирных и пережаренных блюд, снэков, отказ от употребления растительного масла.
Диагностика дискинезии желчных путей
- Биохимический анализ крови. Во время выраженного обострения в анализе крови обнаруживают повышение уровня печеночных ферментов (щелочная фосфатаза и др.).
- УЗИ печени и желчного пузыря, которое позволяет оценить состояние желчного пузыря и его протоков, выявить камни.
- Дуоденальное зондирование — сбор желчи для анализа с помощью желудочного зонда. Процедуру применяют и с лечебной целью для промывания желчевыводящих путей при застое желчи. Для этого после сбора желчи в зонд вводят подогретую минеральную воду. Процедуру проводят натощак.
- Тесты с применением специальных препаратов. Вводят лекарственное вещество (например, секретин), которое усиливает выработку желчи. Если имеется заболевание, то желчь не успевает выделиться в кишечник, а скапливается в желчном пузыре и протоках.
 Происходит расширение протоков и увеличение объема пузыря, что регистрируют при помощи УЗИ.
Происходит расширение протоков и увеличение объема пузыря, что регистрируют при помощи УЗИ. - Рентгеновские методы – холецистография.
Очень важно не перепутать дискинезию желчных путей с другими серьезными заболеваниями, которые имеют похожие симптомы!
Лечение дискинезии желчных путей
При дискинезии лечение назначается врачом после проведения курса обследования. Если дискинезия является вторичной, то основные усилия должны быть направлены на устранение основного заболевания.
Лечение дискинезии желчных путей должно носить комплексную направленность, включающую нормализацию режима и характера питания, санацию очагов инфекции, десенсибилизирующую, противопаразитарную и противоглистную терапию, ликвидацию дисбактериоза кишечника и гипоавтьаминоза, устранение симптомов дисфункции. Важную роль в лечении дискинезии желчевыводящих путей играет диетотерапия: исключение приема экстрактивных продуктов, тугоплавких жиров, кондитерских изделий, холодных блюд, продуктов, вызывающих газообразование в кишечнике.
Большое внимание при дискинезии желчевыводящих путей уделяется коррекции состояния вегетативной нервной системы.
Восстановление функции желчеообразования и желчеотведения при разных типах дискинезии желчевыводящих путей также проводится дифференцированно.
Методы профилактики ДЖВП в целом совпадают с теми, которые применяются при лечении заболевания. Людям, попадающим в группу риска – подверженным стрессам, ведущим малоподвижный образ жизни, неправильно и нерегулярно питающимся, следует изменить свои привычки, соблюдать диету, нормализовать свои привычки питания, урегулировать режим дня, чередовать труд и отдых, избегать стрессов.
Течение дискинезии желчевыводящих путей хроническое, однако, при соблюдении диеты, здорового образа жизни, своевременном и правильном лечении заболевание может протекать без обострений.
В нашем центре прием ведет опытный врач гастроэнтеролог, специалист высокого класса. Запись на прием по телефону: 8 (49237) 2-95-56.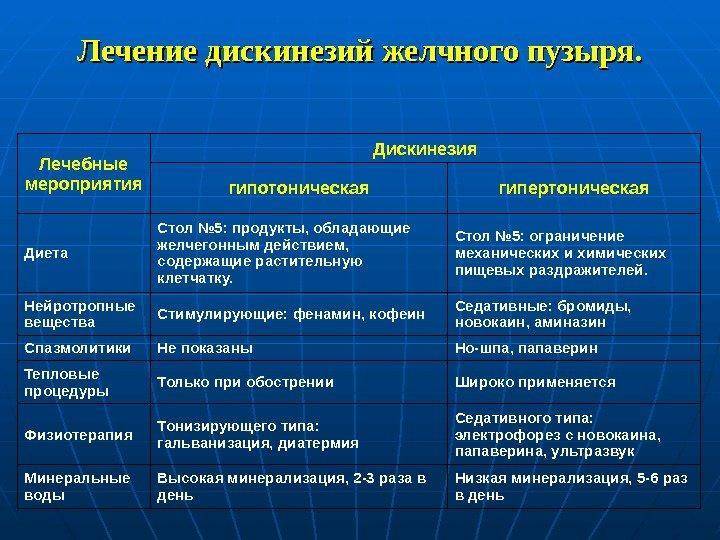
Дискинезии желчевыводящих путей во время беременности (ж-л «9 месяцев», №5)
Шарашкина Н.В.
Терапевт
Центр иммунологии и репродукции
Беременность – прекрасное время ожидания малыша для любой женщины. К сожалению, не каждый день можно чувствовать себя комфортно: тошнота, сонливость, частая смена настроения и прочие «неприятности» зачастую становятся спутниками Вашего «турне» длинною в 9 месяцев.
Одним прекрасным днем Вас начинает мучить неизвестного происхождения боль где-то в правом подреберье. Вы приходите к своему врачу и, оказывается, что у Вас имеет место дискинезия желчного пузыря и желчевыводящих протоков. Что это такое? Опасен ли этот диагноз? Итак, попробуем успокоиться и разобраться.
Немного теории. Дискинезии желчевыводящих путей – заболевание, в основе которого лежит нарушение моторики желчного пузыря и желчевыводящих путей без признаков их органического поражения. Дискинезии – синдром, встречающийся при различных заболеваниях: хроническом холецистите, желчнокаменной болезни, после хирургического удаления желчного пузыря (холецистэктомии), патологии желудка и двенадцатиперстной кишки, печени. При отсутствии сопутствующих заболеваний причиной возникновения дискинезий могут быть врождённые аномалии развития желчного пузыря (перегибы, перетяжки).
Симптомы:
— это боль и диспептические расстройства (тошнота, рвота, горечь во рту, чувство тяжести в брюшной полости, неустойчивый стул).
— тупые, длительные боли в области правого подреберья без четкой иррадиации, так и боли кратковременные, схваткообразные.
Дискинезии желчевыводящих путей являются одним из наиболее распространенных заболеваний, встречающихся у женщин репродуктивного возраста. Беременность и сопутствующие ей изменения гормонального фона являются факторами риска, предрасполагающими развитию заболевания. Например, во второй половине беременности организм женщины вырабатывает большое количество прогестерона. Прогестерон называют гормоном беременности, так как он уменьшает сократительную активность гладкой мускулатуры матки, препятствуя выкидышу и преждевременным родам. Поэтому, по мере прогрессирования беременности, снижается и двигательная активность желчного пузыря, происходит задержка выделения желчи, снижение скорости опорожнения желчного пузыря.
Прогестерон называют гормоном беременности, так как он уменьшает сократительную активность гладкой мускулатуры матки, препятствуя выкидышу и преждевременным родам. Поэтому, по мере прогрессирования беременности, снижается и двигательная активность желчного пузыря, происходит задержка выделения желчи, снижение скорости опорожнения желчного пузыря.
Помните, что диагноз дискинезий устанавливают на основе клинической картины, ультразвукового исследования брюшной полости (УЗИ). Очень часто особенности строения желчных путей или желчного пузыря и являются непосредственной причиной дискинезий.
И всё же, что делать, если диагноз подтвердился? В основе терапии беременных женщин с дискинезиями желчевыводящих путей лежит комплексный подход. Основной целью лечения является восстановление нормального оттока желчи по протокам. Это означает, что проводятся мероприятия по нескольким направлениям: восстановление нормального режима и питания; ликвидация гиповитаминоза и дисбактериоза кишечника, медикаментозная терапия.
«Ты то, что ты ешь»
Лечебное питание должно быть химически, механически и термически щадящим.
Дробим! Беременным женщинам следует принимать еду до 5-6 раз в сутки с относительно равномерным распределением пищи в течение дня для обеспечения ритмичного отделения желчи.
Не обостряем! Из рациона следует исключить экстрактивные вещества: перец, лук, чеснок, редис, копчености, грибы.
Смягчаем! Не следует употреблять тугоплавкие жиры, так как переваривание жиров при дискинезиях затруднено из-за нерегулярного поступления желчи в кишечник и снижения активности ферментов поджелудочной железы.
Умасливаем! Предпочтительнее использовать растительные масла (подсолнечное, оливковое), так как для их переработки не требуется значительное количество желчи и ферментов.
Чем лечим?
Выбор препаратов для восстановления функций желчеообразования и желчевыделения зависит от типа дискинезии.
При сопутствующей патологии желудочно-кишечного тракта терапия базируется на лечении основного заболевания.
- При выраженном болевом синдроме показаны спазмолитические и болеутоляющие средства: но-шпа, папаверина гидрохлорид, мебеверин, баралгин и другие.
- В лечении дискинезий желчевыводящих путей особая роль принадлежит желчегонным средствам. Желчегонные средства растительного происхождения можно принимать в виде желчегонного сбора или чая. В его состав чаще всего входят цветки бессмертника, трава тысячелистника, плоды кориандра, кукурузные рыльца, пижма обыкновенная, шиповник. Назначают по 1/2 стакана 2-3 раза в день в промежутках между приемами пищи.
- Также к желчегонным средствам относятся холеретики, препараты, которые усиливают образование желчи: аллохол, хофитол, холензим, холосас и другие препараты с желчными кислотами, препараты валерианы, минеральная вода (усиление секреции желчи за счет водного компонента).
- Холекинетики способствуют выделению желчи из пузыря в просвет кишечника. К нимотносят: сульфат магния, сорбит, ксилит, спазмолитики, эуфиллин (расслабляют сфинктеры билиарной системы). Они обладают не только желчегонным, но и послабляющим действием, также могут использоваться у беременных в качестве слабительного средства.
Всё же, дискинезия желчевыводящих путей не оказывает отрицательного влияния на развитие беременности и формирование плода. Однако при усилении симптоматики, выраженном болевом синдроме необходимо обратиться к врачу и пройти обследование для исключения более серьезной патологии. После родов желчный пузырь и протоки восстанавливают свой тонус в течение первого месяца. Лёгкой Вам беременности!
Теги:
цир в сми
лечение и диагностика симптомов, причин в Москве
Птицына Наталья николаевна
5 Марта 2021
Хочу выразить огромную благодарность гастроэнтерологу Чуйковой Ольге , это специалист высокого уровня, при назначении мне удаления опухоли в кишечнике,проверила всю информацию по моим обследованиям в клинике,даже за 2020 и 2019, назначила анализы , не только касаемо этой ситуации. ..
..
Подробнее
Антонович Иван
17 Марта 2020
Хочу выразить благодарность Лопатиной Елене Юрьевне за профессионализм.
Очень оперативно вылечила меня от билиарного сланжа ( ранее мучился с ним 4 месяца)
Подробнее
Фейзрахманоа Ильдар Фатехович
15 Ноября 2019
Огромная благодарность Лопатиной Е.Ю. за мое спасение и грамотное лечение ЖКТ, смогла быстро вылечить и избежать резекцию желудка. Операция не понадобилась! Большое спасибо и здоровья всем нам!
Супруги Ильдар Фейзрахманоа и Зулейха Андержанова
Подробнее
Наталья Викторовна
22 Мая 2019
Добрый день! 21.05.2019 была на консультации у врача-гастроэнтеролога, к.м.н. Лопатиной Елены Юрьевны. Хочу выразить слова благодарности за такой высокий профессионализм. Очень грамотный и талантливый врач. Четко расписала схему лечения, все обьяснила. На все мои вопросы ответил…
Подробнее
Васильева Е
15 Мая 2019
Хочу выразить слова благодарности врачу-гастроэнтерологу Алешиной Т.В. за профессиональную работу и преданность профессии.Очень внимательный врач. Профессионал с огромным опытом работы!!
Подробнее
Дискинезия желчевыводящих путей — причины, симптомы, диагностика, лечение, профилактика
Функциональные нарушения моторной активности
Дискинезия желчевыводящих путей и желчного пузыря представляет собой хроническое состояние, при котором происходит нарушение моторики и тонуса стенки желчного пузыря и его протоков.
Такое состояние чаще встречается у женщин, что обусловлено зависимостью от гормонального фона. В половине случаев, заболевание вторично — появляется на фоне других болезней ЖКТ, и самостоятельно проходит после их лечения.
Причины дискинезии
Первичные
Нервный стресс вызывает дисбаланс между отделами вегетативной нервной системы, который ведет к несогласованному сокращению и расслаблению желчного пузыря и сфинктеров. Нарушение режима питания, переедание, употребление некачественных продуктов ведет к нарушению секреции ферментов и гормонов, которые участвуют в регулировке перистальтики. Астенический конституционный тип, малоподвижный образ жизни приводит к снижению тонуса мышечной стенки желченного пузыря, угнетает перистальтику желчных путей. При пищевой аллергии, астме, крапивнице, аллергены раздражающе влияют на систему иннервации, поэтому нарушается процессы расслабления и сокращение мышечной стенки.
Вторичные
На фоне воспалительных заболеваний ЖКТ нарушается выработка ферментов и гормонов, влияющих на моторику желчевыводящих путей. Из-за увеличения кислотности в двенадцатиперстной кишке, повышается тонус сфинктера Одди, который ответственен за выброс желчи. Другие заболевания органов брюшной полости и малого таза (почки, яичники, мочевой пузырь) рефлекторно влияют на перистальтику. Заболевания непосредственно желчного пузыря, печени (холецистит, гепатит), желчнокаменная болезнь вызывают воспаление слизистой протоков, поэтому она острее реагирует на раздражители. Врожденные аномалии (перегибы, перетяжки желчного пузыря) нарушают отток желчи. Некоторые гельминты (описторхии, лямблии) способны проникать в желчевыводящие пути, формируя механическое препятствие к оттоку желчи. Различные эндокринные заболевания и нарушения обмена веществ.
Симптомы дискинезии зависят от её вида
при гипомоторной характерна боль в правом подреберье тупая, разлитая, тошнота, отрыжка после еды, горечь во рту по утрам, ухудшение аппетита, вздутие, метеоризм, запор;
при гипермоторной дискинезии боль острая, приступообразная, сопровождающаяся тошнотой и рвотой, характерно послабление слула;
при смешанной форме наблюдаются признаки, характерные как для гипомоторной, так и для гипермоторной дискинезии.

Диагностика дискинезии желчевыводящих путей включает в себя
Печеночные пробы (АСТ, АЛТ, ГГТП, билирубин).УЗИ органов брюшной полости с функциональной нагрузкой (пробным завтраком).Исследования, направленные на исключение сопутствующих заболеваний.
Лечение
Включает себя соблюдение диеты (стол №5) и медикаментозной поддержки, в зависимости от вида дискинезии
при гиперкинетической форме применяют спазмолитики и желчегонные препараты;
при гипокинетической – прокинетики, желчегонные, препараты урсодезоксихолевой кислоты.
При гипокинетической форме с синдромом холестаза (застоем желчи) назначают беззондовый тюбаж – лечебную процедуру, при которой происходит опорожнение желчного пузыря и желчных путей. Для этого используются желчегонные средства и прогревание области печени грелкой. Такая процедура очень эффективна, хотя противопоказана при желчнокаменной болезни.
Оценка центрального венозного давления на основе ультразвуковой оценки пульса в яремной вене
Аннотация
Цели
Измерение центрального венозного давления (ЦВД), важного клинического параметра, требует инвазивной процедуры, которая представляет риск для пациентов. Целью исследования было разработать неинвазивную методологию определения среднего ЦВД на основе ультразвуковой оценки пульса в яремной вене.
Методы
У тридцати четырех взрослых пациентов (возраст = 60 ± 12 лет; 10 мужчин) ЦВД измеряли с помощью центрального венозного катетера с изменением площади поперечного сечения внутренней яремной вены (ВЯВ) вдоль сердечного сокращения, полученного с помощью ультразвукового исследования. .Результирующие сигналы ЦВД и IJV-CSA были синхронизированы с сигналами электрокардиограммы (ЭКГ), полученными от пациентов. Сигналы автокорреляции были получены из сигналов IJV-CSA с использованием алгоритмов в R (статистическое программное обеспечение с открытым исходным кодом). Значения r корреляции для последовательных интервалов задержки были извлечены и использованы для построения модели линейной регрессии, в которой среднее значение CVP было переменной ответа, а значения r запаздывающей автокорреляции и среднее значение IJV-CSA были переменными-предикторами. Оптимальная модель была определена с использованием минимального значения AIC и подтверждена с помощью 10-кратной перекрестной проверки.
Значения r корреляции для последовательных интервалов задержки были извлечены и использованы для построения модели линейной регрессии, в которой среднее значение CVP было переменной ответа, а значения r запаздывающей автокорреляции и среднее значение IJV-CSA были переменными-предикторами. Оптимальная модель была определена с использованием минимального значения AIC и подтверждена с помощью 10-кратной перекрестной проверки.
Результаты
В то время как сигналы CVP и IJV-CSA плохо коррелировали (среднее r = -0,018, SD = 0,357) из-за отставания сигнала IJV-CSA от сигнала CVP, их автокорреляционные аналоги сильно коррелировали (среднее r = 0,725, SD = 0,215). Используя запаздывающие значения r автокорреляции в качестве предикторов, среднее значение ЦВД было предсказано с разумной точностью (r 2 = 0,612) со средней абсолютной ошибкой 1,455 см вод. Ст. 2 O, которая выросла до 2,436 см вод. Ст. 2 O, когда была проведена перекрестная проверка.
Выводы
Среднее значение ЦВД можно оценить неинвазивно, используя запаздывающие значения r автокорреляции сигнала IJV-CSA. Эта новая методология может иметь значительный потенциал в качестве инструмента клинического мониторинга и диагностики.
Образец цитирования: Zamboni P, Malagoni AM, Menegatti E, Ragazzi R, Tavoni V, Tessari M, et al. (2020) Оценка центрального венозного давления на основе ультразвуковой оценки пульса в яремной вене. PLoS ONE 15 (10):
e0240057.https://doi.org/10.1371/journal.pone.0240057
Редактор: Сюнвен Чен, Темплский университет, США
Поступила: 11 мая 2020 г .; Дата принятия: 17 сентября 2020 г .; Опубликовано: 28 октября 2020 г.
Авторские права: © 2020 Zamboni et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в бумажных и вспомогательных информационных файлах.
Финансирование: Исследование финансировалось Министерством здравоохранения Италии (исх .: RF-2013-02358029). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Яремный венозный пульс (JVP), ключевой параметр эффективной сердечной функции, отражает изменение давления в правом предсердии в течение сердечного цикла [1].Он представлен изменениями площади поперечного сечения (CSA) внутренних яремных вен (IJV), которые можно легко контролировать с помощью сонографии в B-режиме высокого разрешения [2, 3]. IJVs легко реагируют на изменения трансмурального давления, потому что они представляют собой тонкостенные гибкие сосуды, в результате чего CSA этих сосудов колеблется в циклическом движении, на которое влияют как сердечный, так и дыхательный циклы [2]. Однако, несмотря на свою важность, оценкой JVP часто пренебрегают в клинической практике [4], поскольку центральное венозное давление (ЦВД) (i.е. давление в правом предсердии и желудочке в конце диастолы) является наиболее часто оцениваемым параметром. ЦВД — это переменная, указывающая на сердечно-сосудистую функцию, выполняющая двойную роль: расширение диастолического правого желудочка и противодействие венозному возврату [5]. Таким образом, ЦВД является полезным руководством для оценки преднагрузки сердца и состояния сосудистого объема, а также является индикатором, который может помочь лучше понять причины изменений сердечного выброса, учитывая взаимосвязь между сердечной функцией и венозным возвратом [6 ].Его измерение по-прежнему широко используется в отделениях интенсивной терапии и центрах неотложной помощи, главным образом, для управления введением жидкости пациентам с гемодинамической нестабильностью [7]. ЦВД приобретается инвазивным путем, для чего требуется введение катетера через IJV или подключичные вены. Кроме того, у этой процедуры есть недостатки, поскольку она требует высокого уровня навыков и сопряжена со значительным риском осложнений [8]. Следовательно, существует необходимость в разработке неинвазивной методологии для точной оценки ЦВД.
ЦВД приобретается инвазивным путем, для чего требуется введение катетера через IJV или подключичные вены. Кроме того, у этой процедуры есть недостатки, поскольку она требует высокого уровня навыков и сопряжена со значительным риском осложнений [8]. Следовательно, существует необходимость в разработке неинвазивной методологии для точной оценки ЦВД.
Сообщалось о значительной корреляции между CVP и: (i) IJV-CSA [9, 10]; (ii) соотношение ВЯС / ППС общей сонной артерии [9–11]; и (iii) пульс на внешней яремной вене [12]. Это привело нас к гипотезе о возможности прогнозирования ЦВД по JVP [13]. Действительно, было сообщено о нескольких методах неинвазивного мониторинга ЦВД [12, 14–18], хотя ни один, за исключением ближней инфракрасной спектроскопии (NIRS) [12], не продемонстрировал достаточной точности и точности или простоты использования.Недавно был предложен ультразвуковой метод (УЗИ) для получения JVP из последовательностей сонограмм в B-режиме с высоким разрешением (US-JVP), регистрирующий изменения IJV-CSA в течение сердечного цикла (CC) [19], который имеет потенциал в качестве метода оценки ЦВД. Поэтому мы предприняли предварительное исследование, представленное здесь, с целью тестирования эффективности (подтверждения концепции) новой методологии (также представленной здесь) для оценки ЦВД исключительно на основе изменений в IJV-CSA, полученных в результате исследования в США.Эта методология, которая использует сигнал автокорреляции JVP (т. Е. Изменения IJV-CSA по CC) и отражает спектральные характеристики импульса CVP, описана в части Theory раздела Methods ниже, в котором описывается теория, лежащая в основе метода автокорреляции. Важно отметить, что методика носит общий характер и может применяться к отдельным пациентам без каких-либо предварительных знаний об пульсе ЦВД или анатомических особенностях пациента (например,грамм. длина шеи и т. д.).
Методы
Исследование было выполнено проспективно группой, состоящей из клиницистов, техников, физиков и биоинженеров, и включало этап сбора данных, этап постобработки и этап анализа данных. Исследование было частью проекта, предоставленного Министерством здравоохранения Италии (Ricerca Finalizzata 2013, RF-2013-02358029), который был одобрен Комитетом по этике Феррары, Италия (номер ссылки 160499). Исследование проводилось в соответствии с этическими принципами надлежащей клинической практики, изложенными в Европейской директиве и Хельсинкской декларации.Испытание было зарегистрировано NCT03917368 (https://clinicaltrials.gov/ct2/show/NCT03917368).
Исследование было частью проекта, предоставленного Министерством здравоохранения Италии (Ricerca Finalizzata 2013, RF-2013-02358029), который был одобрен Комитетом по этике Феррары, Италия (номер ссылки 160499). Исследование проводилось в соответствии с этическими принципами надлежащей клинической практики, изложенными в Европейской директиве и Хельсинкской декларации.Испытание было зарегистрировано NCT03917368 (https://clinicaltrials.gov/ct2/show/NCT03917368).
Сбор данных
Этап сбора данных, реализованный в Университетской клинике Феррары (Италия), включал прямое инвазивное измерение ЦВД и оценку JVP в США. Обе оценки проводились одновременно.
Субъектов
С сентября 2016 года по июль 2018 года пятьдесят восемь последовательных субъектов (21 мужчина и 37 женщин; средний возраст 61 ± 3 года) были включены в группу выборочного исследования.Участники были отобраны из госпитализированных взрослых пациентов в университетской клинике Феррары (Италия), которым в рамках их обычного лечения требовалась плановая катетеризация центральной вен (ЦВК) и измерение ЦВД. Критерии включения: возраст ≥18 лет, самостоятельное дыхание и способность дать информированное согласие. Пациенты были исключены, если они нуждались в канюляции через внутренний яремный венозный доступ, чтобы не мешать ультразвуковой оценке, или если они были беременны. Кроме того, поскольку для разработки диагностической модели требовались высококачественные изображения США и данные трассировки JVP, любые субъекты, которые давали искаженные или технически несовершенные изображения или сигналы, также были исключены.Ко всем участникам подошли до процедуры CVC и подписали форму письменного информированного согласия.
Прямое инвазивное измерение ЦВД
В операционной после умеренной седации (мидазолам 4 мг внутривенно) и подкожной инфильтрации местных анестетиков (мепивакаин 1% 20 мл) пациенты прошли стандартизированную подключичную туннельную катетеризацию подключичным доступом под рентгеноскопическим контролем. После катетеризации пациентов выводили из операционной в полностью лежачем положении на кровати для измерения ЦВД в соответствии со стандартом [20].Центральный венозный катетер был подключен к внутривенной жидкости внутри мешка высокого давления, наполненного до 300 мм рт. Система измерения давления помещалась на правую или левую руку на уровне пятого ребра (флебостатическая ось), и при необходимости проверялся и калибруется нулевой эталон. На грудь пациентов помещали три электрода для одновременной оценки сигнала электрокардиограммы (ЭКГ). Линия давления и кабели ЭКГ были подключены к стандартному аналоговому монитору (Philips M3046A M4, Philips Medical System, Беблинген, Германия), который, в свою очередь, был подключен к системе видеозахвата, что позволяло захватывать и сохранять изображения экрана на экране. компьютер, поскольку они не были напрямую доступны в их цифровом формате.Один исследователь выполнял все измерения центрального венозного катетера, который служил «золотым стандартом» измерения значения ЦВД и формы волны.
После катетеризации пациентов выводили из операционной в полностью лежачем положении на кровати для измерения ЦВД в соответствии со стандартом [20].Центральный венозный катетер был подключен к внутривенной жидкости внутри мешка высокого давления, наполненного до 300 мм рт. Система измерения давления помещалась на правую или левую руку на уровне пятого ребра (флебостатическая ось), и при необходимости проверялся и калибруется нулевой эталон. На грудь пациентов помещали три электрода для одновременной оценки сигнала электрокардиограммы (ЭКГ). Линия давления и кабели ЭКГ были подключены к стандартному аналоговому монитору (Philips M3046A M4, Philips Medical System, Беблинген, Германия), который, в свою очередь, был подключен к системе видеозахвата, что позволяло захватывать и сохранять изображения экрана на экране. компьютер, поскольку они не были напрямую доступны в их цифровом формате.Один исследователь выполнял все измерения центрального венозного катетера, который служил «золотым стандартом» измерения значения ЦВД и формы волны.
Оценка IJV в США
Наряду с прямым измерением ЦВД была проведена УЗ-оценка IJV (как правого, так и левого), как описано ранее [3, 21]. Использовалась ультразвуковая система Vivid-q (GE Medical Systems, Хортен, Норвегия), оснащенная датчиком с линейной решеткой L12-RS (7,5–11 МГц). Пациентов просили сохранять шею в фиксированном положении на продольной оси, избегая сгибания, гиперэкстензии и вращения, которые могут сдавливать вены и влиять на измерения.Зонд, смазанный обильным количеством геля, помещали на шею пациента в плоскости, поперечной по отношению к длине сосудов, на уровне C5-C6, так называемой плоскости J2 [22]. IJV-CSA был озвучен, пытаясь избежать любого давления на сосуд, и был записан и сохранен видеоклип в B-режиме продолжительностью 10–15 секунд. Этого времени было достаточно, чтобы записать несколько сердечных циклов и два или три дыхательных цикла. Кривая ЭКГ была автоматически записана контекстно с изображениями B-режима IJV-CSA. Все исследования в США проводились одним исследователем.
Все исследования в США проводились одним исследователем.
Постобработка
Сохраненные видеоклипы US IJV и изображения CVP были обработаны в автономном режиме для получения набора числовых данных для последующего анализа и формулирования моделей. Прежде всего, изображения и видеоклипы были разработаны с помощью программного обеспечения ImageJ [23] (например, Рис. 1). Процедура получения набора данных сигналов IJV-CSA с течением времени состояла из нескольких проходов, как ручных, так и автоматических.Эта процедура предоставила значения IJV-CSA в см 2 в зависимости от времени получения сонограммы, полученный результат соответствовал кривой JVP (например, рис. 1) [3, 19, 21], тогда как набор данных сигнала временного ряда CVP был создан цифровым способом. определение положения каждой точки следа CVP, представленного на полученном изображении. Впоследствии кривые JVP и CVP были синхронизированы с использованием сигнала ЭКГ, записанного вместе с измерениями. Наконец, полученные наборы данных были обработаны с помощью Matlab (MathWorks, Inc.) и программное обеспечение R [24] для удаления частот несердечного происхождения, в основном вариаций CSA из-за активации торакального насоса [25]. Это убирало шум со следов, тем самым подчеркивая вклад сердечного сокращения в оба следа [21, 26]. Наконец, постобработка была направлена на согласование длины трасс, что упростило сравнение.
Рис. 1. Пользовательский плагин ImageJ для обнаружения вариаций области: на верхнем рисунке показан пример изображения в B-режиме с прямоугольной областью интереса (ROI) и синхронизированной кривой ЭКГ, вместе со списком областей интереса и собранными измерениями.
На нижнем рисунке показана ориентировочная кривая JVP с пиками a, c, v и впадинами x, y, синхронизированными с кривой ЭКГ. Также показаны фазы систолы и диастолы, а также соответствующее открытие и закрытие трикуспидального клапана и различные временные интервалы (Δt).
https://doi. org/10.1371/journal.pone.0240057.g001
org/10.1371/journal.pone.0240057.g001
Теория
Хотя взаимосвязь между сигналами IJV-CSA и CVP трудно интерпретировать во временной области, было показано, что в частотной области эти два сигнала имеют сходные спектральные характеристики [27].Следовательно, теоретически должно быть возможно многое определить о сигнале CVP, просто исследуя импульс IJV. Однако такие факторы, как дыхание, влияют на импульс IJV, и существует фазовая задержка между импульсом CVP и импульсом IJV, что затрудняет интерпретацию взаимосвязи между двумя сигналами.
Автокорреляция, которая оценивает степень сходства между заданным сигналом временного ряда и отстающей версией самого себя в последовательных временных интервалах, может использоваться для понимания спектральных характеристик сигналов.С помощью теоремы Винера – Хинчина можно показать, что преобразование Фурье (используемое в анализе Фурье) тесно связано с автокорреляционной функцией сигнала [28]. Таким образом, сигнал автокорреляции может использоваться для оценки периодичности любого заданного сигнала временного ряда с использованием уравнения 1.
(1)
Где: f — частота сигнала временного ряда; D — расстояние запаздывания между последовательными пиками на автокоррелограмме; и dt — интервал выборки.
Поскольку функция автокорреляции отражает спектральные характеристики сигналов, если два сигнала временных рядов, такие как импульсы IJV и CVP, имеют сходство в частотной области, то их соответствующие сигналы автокорреляции будут демонстрировать сходство и будут иметь тенденцию выравниваться независимо от любого запаздывания между ними. два сигнала во временной области.Это предполагает, что сигнал автокорреляции может быть полезным инструментом для прогнозирования характеристик импульса CVP с использованием импульса IJV.
Для любого заданного сигнала временного ряда соответствующий сигнал автокорреляции представляет собой просто график изменений корреляционного значения r как функции задержки. Значение r автокорреляции для любого заданного запаздывания во временном ряду можно вычислить с помощью уравнения 2.
Значение r автокорреляции для любого заданного запаздывания во временном ряду можно вычислить с помощью уравнения 2.
(2)
Где: r h — значение r для любого заданного лага; y t — сигнал временного ряда с запаздыванием = 0; y t + h — сигнал временного ряда с запаздыванием = h; и — среднее значение сигнала временного ряда.
Из этого видно, что на сигнал автокорреляции сильно влияет среднее значение измеренного сигнала во временной области. Следовательно, можно предположить, что должна быть возможность оценить среднее значение импульса CVP непосредственно из сигнала автокорреляции импульса IJV, при условии, что они имеют схожие спектральные характеристики.
Анализ данных
Обработка сигналов и статистический анализ проводились с использованием собственных алгоритмов, написанных на R [24].Связь между сигналами временных рядов IJV-CSA и CVP для соответствующих субъектов оценивалась с помощью корреляционного анализа Пирсона, при этом временной лаг между двумя сигналами вычислялся с использованием функции взаимной корреляции ccf в R. Для каждого пациента автокорреляция сигналы были получены из сигналов временных рядов IJV-CSA и CVP с использованием функции ‘acf’ в R. Из них корреляционные r-значения для последовательных лагов 20 временных интервалов от 0 до 360 (т.е. 0, 20, 40, 60 ,… 360 интервалов) были извлечены и использованы для построения модели прогнозирования CVP.Также был проведен анализ Фурье с использованием функции «fft» в R для создания периодограмм для каждого пациента. Из них для каждого пациента были извлечены пять наиболее доминирующих частот (с амплитудами). Затем была построена модель линейной регрессии со средним CVP в качестве ответной (зависимой) переменной и извлеченными r-значениями автокорреляции для последовательных лагов вместе со средним значением IJV-CSA в качестве предиктивных (независимых) переменных. Затем модель была уточнена с использованием внутреннего алгоритма, который оценил все возможные комбинации переменных-предикторов для идентификации модели с минимальным информационным критерием Акаике (AIC). Затем уточненная линейная модель использовалась для прогнозирования среднего CVP для соответствующих субъектов. Наконец, чтобы оценить общую применимость уточненной модели и проверить ее надежность в качестве предиктора среднего CVP, была проведена 10-кратная перекрестная проверка. Это показало, насколько хорошо модель может работать в «реальных» клинических ситуациях. Кроме того, статистический расчет мощности post-hoc был выполнен с использованием модели Коэна f 2 с альфа = 0.05.
Затем уточненная линейная модель использовалась для прогнозирования среднего CVP для соответствующих субъектов. Наконец, чтобы оценить общую применимость уточненной модели и проверить ее надежность в качестве предиктора среднего CVP, была проведена 10-кратная перекрестная проверка. Это показало, насколько хорошо модель может работать в «реальных» клинических ситуациях. Кроме того, статистический расчет мощности post-hoc был выполнен с использованием модели Коэна f 2 с альфа = 0.05.
Чтобы проверить ее клиническую эффективность, регрессионная модель была дополнительно оценена путем разделения результатов на три категории: (i) ЦВД в пределах нормального диапазона, 2–8 мм рт. Ст. (2,72–10,88 см вод. Ст.) [29, 30]; (ii) ЦВД выше нормы; и (iii) ЦВД ниже нормы. Для каждого класса рассчитывалась оценка чувствительности вместе с общей точностью, достигнутой моделью, которая также была статистически оценена с использованием статистики Коэна Каппа для измерения согласия.
Результаты
Клиническая оценка IJV в УЗИ и инвазивное измерение ЦВД были выполнены у всех 58 включенных в исследование пациентов.Фаза постобработки выявила ряд технических недостатков и / или аномалий, связанных с предметом (кривая ЭКГ или изображения ЦВД не записаны, n = 6; края IJV-CSA не четко очерчены, n = 4; изображения ЦВД не читаются, n = 3 ; аномальная ЭКГ, n = 5; аномальный размер IJV-CSA, n = 6), что потенциально может поставить под угрозу разработку модели. Поэтому эти следы были сочтены технически несовершенными, и поэтому видеоклипы из США и изображения CVP от 24 затронутых субъектов были исключены из фазы постобработки, чтобы получить надежный набор данных для анализа.Кроме того, чтобы уменьшить объем данных, в этом исследовании были рассмотрены только подходящие видеоклипы IJV US. Правый IJV был выбран потому, что этот сосуд находится ближе к сердцу, чем левый IJV, и, таким образом, является доминирующей стороной у 80% людей. Клинические характеристики остальных 34 субъектов суммированы в таблице 1. Видеоклипы и изображения остальных 34 субъектов (возраст = 60 ± 12 лет; 10 мужчин / 24 женщины) были окончательно обработаны и проанализированы (рис. 2). Примеры результатов, полученных на этапе постобработки, показаны в таблице S1.
Видеоклипы и изображения остальных 34 субъектов (возраст = 60 ± 12 лет; 10 мужчин / 24 женщины) были окончательно обработаны и проанализированы (рис. 2). Примеры результатов, полученных на этапе постобработки, показаны в таблице S1.
Результаты автокорреляционного анализа представлены в таблице 2 и на рисунке 3, а результаты спектрального анализа представлены в таблицах S2 и S3. В совокупности они показывают, что, хотя сигналы временных рядов CVP и IJV-CSA были плохо коррелированы (среднее r = -0,018, SD = 0,357), их автокорреляционные аналоги сильно коррелировали (среднее r = 0,725, SD = 0,215) (Таблица 3 ). Плохая корреляция между сигналами временных рядов была частично связана с тем, что сигнал IJV-CSA отставал от сигнала CVP в среднем на 0.241 с (SD = 0,175 с) (таблица 3), тогда как в автокорреляционных сигналах обычно совпадали, потому что оба импульса демонстрировали сходные спектральные характеристики (таблицы S2 и S3). Это хорошо проиллюстрировано на рис. 4, на котором показаны: (а) нормализованные сигналы временных рядов; (б) автокорреляционные сигналы; и (c) комбинированная периодограмма, относящаяся к субъекту 19. Из периодограммы на рис. 4 (c) можно видеть, что, хотя оба сигнала имеют сильный пик на 0,95 Гц, импульс CVP демонстрирует сильный второй пик около 1.90–2,14 Гц, что намного слабее в импульсе IJV-CSA. Это различие отражено в соответствующих автокорреляционных сигналах на рис. 4 (b), которые показывают, что, хотя оба сигнала имеют одинаковую общую периодичность (что указывает на преобладание одной частоты в обоих сигналах), сигнал автокорреляции CVP более сложен, указывая на то, что на него в большей степени влияют другие дополнительные частоты.
Результаты уточненной регрессионной модели представлены в таблице 4 и на рисунке 5. Это говорит о том, что простой алгоритм, показанный в уравнении 3, можно использовать для прогнозирования среднего CVP с разумной точностью (r 2 = 0.612), используя только среднее значение IJV-CSA и выбранные r-значения автокорреляции в качестве предикторов. Апостериорный анализ показал, что коэффициент Коэна f 2 равен 1,577 при статистической мощности 0,993.
Апостериорный анализ показал, что коэффициент Коэна f 2 равен 1,577 при статистической мощности 0,993.
(3)
Где: CVP pred — прогнозируемый CVP; CSA среднее значение среднее значение IJV-CSA; и лаг 20–340 — это значения r для указанных лагов, извлеченных из сигнала автокорреляции. Эта линейная модель предсказала среднее значение CVP для соответствующих субъектов (рис. 4) со средней абсолютной ошибкой (mae), равной 1.455 см вод. Ст. 2 O, которая выросла до 2,436 см вод. Ст. 2 O, когда была проведена 10-кратная перекрестная проверка.
Что касается клинической классификации, модель правильно определила 26 из 27 субъектов (чувствительность = 96,3%) как имеющих нормальное ЦВД; 0 из 1 субъекта (чувствительность = 0,0%) имеют высокое ЦВД; и 3 из 6 субъектов (чувствительность = 50,0%) имели низкое ЦВД. Общая точность классификации модели составила 85,3% (Каппа = 0,472).
Обсуждение
Пульс в яремной вене — это физиологический и ключевой параметр для описания сердечно-сосудистой функции, а также преднагрузки сердца.В современной клинической практике от этого параметра со временем отказались из-за сложности создания надежных измерений при физическом обследовании пациентов. Соответствующий инвазивный «золотой стандарт», CVC, и одновременное распространение эхокардиографии, фактически значительно сократили его использование в клинической практике. Однако CVC, будучи инвазивным методом, имеет большой недостаток, связанный с повышенным риском клинических осложнений [8]. Таким образом, создание модели, позволяющей быстро, надежно и неинвазивно обнаруживать ЦВД, представляет собой важную разработку, имеющую отношение к нескольким клиническим приложениям, включая лечение сердечной недостаточности.В частности, это может быть полезно при мониторинге лекарственной терапии с течением времени, что нелегко сделать с помощью эхокардиографии или инвазивного маневра. Таким образом, быстрое ультразвуковое исследование, которое также может выполнить терапевт, может иметь решающее значение в глобальном лечении сердечной недостаточности, заболевания, которое, как считается, поражает примерно 1-2% в западном мире, с высокой степенью заболеваемости. приближается к 5–10 на 1000 человек в год [31], что чаще встречается у пожилых людей и чаще встречается у женщин [32].Кроме того, неинвазивная модель может быть полезна при оценке подозреваемой гиповолемии и венозного возврата мозга или даже в космической медицине [21].
Таким образом, быстрое ультразвуковое исследование, которое также может выполнить терапевт, может иметь решающее значение в глобальном лечении сердечной недостаточности, заболевания, которое, как считается, поражает примерно 1-2% в западном мире, с высокой степенью заболеваемости. приближается к 5–10 на 1000 человек в год [31], что чаще встречается у пожилых людей и чаще встречается у женщин [32].Кроме того, неинвазивная модель может быть полезна при оценке подозреваемой гиповолемии и венозного возврата мозга или даже в космической медицине [21].
Из представленного выше анализа можно увидеть, что, используя график автокорреляции импульса IJV-CSA, можно предсказать среднее значение ЦВД с разумной точностью (r 2 > 0,6) с использованием простой линейной модели. Таким образом, мы смогли показать, что существует четкая взаимосвязь между средним значением импульса CVP и автокорреляционным сигналом импульса IJV, как предполагает уравнение 2.Сказав это, мы были несколько удивлены, что среднее значение CVP можно было оценить с такой точностью, используя простую линейную модель, учитывая, что сам сигнал автокорреляции является нелинейным. Действительно, было возможно использовать только линейную модель, потому что в сигналах автокорреляции CSA преобладала частота сердца чуть ниже 1 Гц, что означало, что сигналы автокорреляции CSA имели тенденцию демонстрировать аналогичную периодичность, как и многие сигналы автокорреляции CVP. (как показано на рис. 4 (b)).Следовательно, между извлеченными значениями r для соответствующих лагов и средними значениями CVP для когорты исследования существовала в целом линейная зависимость, которую мы смогли использовать.
Хотя анализ Фурье часто используется для определения спектральных характеристик кровеносных сосудов, на практике полученные результаты в частотной области могут быть трудно интерпретировать. Для сравнения мы обнаружили, что сигналы автокорреляции намного легче интерпретировать, поскольку они отражают «комбинированный эффект» всех частот, действующих на соответствующие сосуды..jpg) Таким образом, мы смогли быстро оценить сходства и различия между соответствующими сигналами, используя только их автокорреляции, что было бы труднее достичь, используя графики временной или частотной области. Например, из рис. 4 (b) можно увидеть, что, хотя на сигнал автокорреляции ЦВД для субъекта 19 влияет сильная вторичная частота примерно 2 Гц (согласно периодограмме на рис. 4 (с)), это не влияет на общая периодичность сигнала автокорреляции CVP, которая совпадает с периодичностью сигнала автокорреляции CSA — то, что трудно определить с использованием либо соответствующей временной области (рис. 4 (а)), либо частотной области (рис. 4 (с)) сюжеты.Таким образом, это предполагает, что графики автокорреляции имеют значительный потенциал при сравнении венозных гемодинамических сигналов.
Таким образом, мы смогли быстро оценить сходства и различия между соответствующими сигналами, используя только их автокорреляции, что было бы труднее достичь, используя графики временной или частотной области. Например, из рис. 4 (b) можно увидеть, что, хотя на сигнал автокорреляции ЦВД для субъекта 19 влияет сильная вторичная частота примерно 2 Гц (согласно периодограмме на рис. 4 (с)), это не влияет на общая периодичность сигнала автокорреляции CVP, которая совпадает с периодичностью сигнала автокорреляции CSA — то, что трудно определить с использованием либо соответствующей временной области (рис. 4 (а)), либо частотной области (рис. 4 (с)) сюжеты.Таким образом, это предполагает, что графики автокорреляции имеют значительный потенциал при сравнении венозных гемодинамических сигналов.
Хотя в этом первоначальном испытании концепции нам удалось разработать алгоритм, который может приблизительно предсказать среднее значение ЦВД по импульсу IJV-CSA, мы знаем, что, несмотря на достижение общей точности 85%, статистика Каппа составила всего 0,472, что указывает на умеренно хорошие результаты при клинической классификации пациентов. Однако это было достигнуто с помощью простой линейной модели и относительно небольшой когорты, и ожидается, что в будущих исследованиях появится возможность повысить точность прогнозов модели за счет использования сложной стратегии машинного обучения, такой как случайный лес [ 33].Несмотря на это, наши результаты являются многообещающими по сравнению с результатами, достигнутыми с использованием существующих методологий. Например, ЦВД традиционно оценивали путем визуального осмотра изменений объема правого ВЯС, когда верхняя часть тела наклонена, используя угол грудины в качестве ориентира. Однако IJV часто не виден из-за вышележащих тканей шеи, что затрудняет четкую визуальную идентификацию, особенно для менее опытного исследователя [34]. Следовательно, точность метода визуального осмотра оказалась немного лучше, чем примерно 50–60% [35, 36]. Следует также отметить, что наблюдаемые вариации ЦВД могут быть существенными из-за ошибок в размещении датчика при проведении инвазивных измерений катетера [37]. В свете этого представленная здесь методология кажется заслуживающей внимания и потенциально может быть чрезвычайно полезной, особенно в экстренных ситуациях из-за скорости, с которой жизненно важная информация может быть получена неинвазивным способом с помощью простого ультразвукового исследования, которое можно легко провести в больнице. у постели больного. Более того, используя модель в качестве инструмента классификации, разделенного на три категории (нормальное, высокое и низкое ЦВД), можно облегчить ее применение в клинической практике.
Следует также отметить, что наблюдаемые вариации ЦВД могут быть существенными из-за ошибок в размещении датчика при проведении инвазивных измерений катетера [37]. В свете этого представленная здесь методология кажется заслуживающей внимания и потенциально может быть чрезвычайно полезной, особенно в экстренных ситуациях из-за скорости, с которой жизненно важная информация может быть получена неинвазивным способом с помощью простого ультразвукового исследования, которое можно легко провести в больнице. у постели больного. Более того, используя модель в качестве инструмента классификации, разделенного на три категории (нормальное, высокое и низкое ЦВД), можно облегчить ее применение в клинической практике.
Одним из основных ограничений нашего исследования является то, что модель тестировалась только на лицах без признаков или симптомов: хронической или острой сердечной недостаточности; аритмии; или соответствующий стеноз / недостаточность сердечных клапанов. Таким образом, мы рекомендуем в будущих исследованиях изучить применимость модели к пациентам с сопутствующими сердечными заболеваниями, поскольку это может повлиять на поведение алгоритмов, используемых в модели. Кроме того, поскольку модель была создана с использованием относительно небольшой когорты исследователей, мы рекомендуем провести дальнейшие исследования с использованием более широкой когорты, чтобы подтвердить наши выводы и установить чувствительность модели.Кроме того, мы осознаем, что в этом исследовании мы использовали данные только от правильного IJV, и, возможно, использование обоих IJV может дать лучшие результаты. Однако ни у одного из наших пациентов не было трикуспидальной регургитации или легочной гипертензии. Поэтому рекомендуется, чтобы в будущей работе были изучены как JVP, так и их связь с CVP в более сложных клинических условиях. Наконец, в будущих исследованиях следует оценить методологию US-JVP в сравнении с альтернативными стратегиями, такими как NIRS.
В заключение, мы смогли показать, что сигналы автокорреляции соответствующих импульсов ЦВД и IJV-CSA демонстрируют заметное сходство, и что запаздывающие r-значения автокорреляции импульса IJV-CSA можно использовать для оценки среднего ЦВД. с разумной точностью. Этот новый подход, по-видимому, имеет значительный клинический потенциал, поскольку он позволяет неинвазивно измерять ЦВД с помощью ультразвуковой оценки JVP. Таким образом, этот метод может иметь потенциал в качестве инструмента клинического мониторинга и диагностики.
с разумной точностью. Этот новый подход, по-видимому, имеет значительный клинический потенциал, поскольку он позволяет неинвазивно измерять ЦВД с помощью ультразвуковой оценки JVP. Таким образом, этот метод может иметь потенциал в качестве инструмента клинического мониторинга и диагностики.
Ссылки
- 1.
Гарг Н., Гарг Н. Пульс на яремной вене: оценка. Журнал Индийской академии клинической медицины. 2000; 1 (3): 261–9. - 2.
Applefeld MM. Яремное венозное давление и контур пульса. В: Walker HK, Hall WD, Hurst JW, редакторы. Клинические методы: анамнез, физикальное и лабораторное обследование. Бостон: Баттерворт; 1990. - 3.
Сисини Ф., Тессари М., Менегатти Э., Ваннини М.Э., Джанезини С., Тавони В. и др.Клиническая применимость оценки яремного кровотока в индивидуальном сердечном цикле по сравнению с современной методологией ультразвукового исследования. Ультразвук в медицине и биологии. 2016; 42 (8): 1750–63. - 4.
Chiaco JMSC, Парих Н.И., Фергюссон DJ. Повторное обследование яремного венозного давления. Кливлендский медицинский журнал клиники. 2013. 80 (10): 638–44. pmid: 24085809 - 5.
Сондергаард С., Паркин Г., Анеман А. Центральное венозное давление: скоро вопрос, связанный с исходом. Curr Opin Anaesthesiol.2016; 29 (2): 179–85. pmid: 26825283. - 6.
Магдер С. Центральное венозное давление: полезное, но не такое простое измерение. Crit Care Med. 2006. 34 (8): 2224–7. pmid: 16763509. - 7.
Роджер С., Мюллер Л., Риоу Б., Молинари Н., Луар Б., Кербрат Н. и др. Сравнение различных методик измерения центрального венозного давления у тяжелобольных на ИВЛ. BJA: Британский журнал анестезии. 2017; 118 (2): 223–31. pmid: 28100526 - 8.
Гилберт М.Центральное венозное давление и мониторинг давления в легочной артерии. Анестезия и реаниматология. 2018; 19 (4): 189–93. - 9.
Бано С. , Кадир А., Ахтар А. Измерение соотношения диаметров внутренней яремной вены и общей сонной артерии с помощью ультразвука для оценки центрального венозного давления. Cureus. 2018; 10 (3).
, Кадир А., Ахтар А. Измерение соотношения диаметров внутренней яремной вены и общей сонной артерии с помощью ультразвука для оценки центрального венозного давления. Cureus. 2018; 10 (3). - 10.
Хоссейн-Неджад Х., Мохаммадинежад П., Ахмади Ф. Отношение площади поперечного сечения внутренней яремной вены / общей сонной артерии и центральное венозное давление.Журнал клинического ультразвука. 2016; 44 (5): 312–8. pmid: 27028522 - 11.
Бейли Дж. К., МакКолл Дж., Смит С., Каган Р. Дж.. Корреляция отношения внутренней яремной вены / общей сонной артерии к центральному венозному давлению: пилотное исследование на педиатрических ожоговых пациентах. Журнал ожогового ухода и исследований. 2012; 33 (1): 89–92. - 12.
Сатиш Н., Сингх Н.Г., Нагараджа П.С., Сарала Б.М., Прабхушанкар К.Г., Дхананджая М. и др. Сравнение неинвазивного измерения центрального венозного давления с помощью ближней инфракрасной спектроскопии с инвазивным мониторингом центрального венозного давления в кардиохирургическом отделении интенсивной терапии.Анналы сердечной анестезии. 2016; 19 (3): 405. pmid: 27397443 - 13.
Амелард Р., Хьюсон Р.Л., Гривз Д.К., Пфистерер К.Дж., Леунг Дж., Клаузи Д.А. и др. Бесконтактная гемодинамическая визуализация выявляет форму волны пульса в яремной вене. Научные отчеты. 2017; 7: 40150. pmid: 28065933 - 14.
Утхофф Х., Зигемунд М., Ашванден М., Хунцикер Л., Фаббро Т., Бауманн У. и др. Проспективное сравнение неинвазивных прикроватных ультразвуковых методов оценки центрального венозного давления.Ultraschall in der Medizin — Европейский журнал ультразвука. 2012; 33 (07): E256 – E62. - 15.
Ward KR, Tiba MH, Barbee RW, Ivatury RR, Arrowood JA, Spiess BD и др. Новый неинвазивный метод определения центрального венозного давления. Реанимация. 2006. 70 (2): 238–46. pmid: 16820258 - 16.
Келлер А.С., Меламед Р., Малинчок М., Джон Р., Тирни Д.М., Гаджик О. Диагностическая точность простого ультразвукового измерения для оценки центрального венозного давления у спонтанно дышащих пациентов в критическом состоянии.Журнал госпитальной медицины. 2009. 4 (6): 350–5. pmid: 19670356
Диагностическая точность простого ультразвукового измерения для оценки центрального венозного давления у спонтанно дышащих пациентов в критическом состоянии.Журнал госпитальной медицины. 2009. 4 (6): 350–5. pmid: 19670356 - 17.
Деол Г.Р., Коллетт Н., Эшби А., Шмидт Г.А. Ультразвук точно отражает исследование яремных вен, но занижает центральное венозное давление. Грудь. 2011. 139 (1): 95–100. pmid: 20798190 - 18.
Липтон Б. Оценка центрального венозного давления с помощью УЗИ внутренней яремной вены. Американский журнал экстренной медицины. 2000. 18 (4): 432–4. pmid: 10919533 - 19.
Сисини Ф., Тессари М., Гадда Дж., Ди Доменико Дж., Тайби А., Менегатти Е. и др.Ультрасонографический метод оценки пульса в яремной вене: доказательство концепции. Ультразвук в медицине и биологии. 2015; 41 (5): 1334–41. - 20.
Ансари Б.М., Зохиос В., Фальтер Ф., Кляйн А.А. Психологические споры и методы, используемые для определения чувствительности к жидкости: качественный систематический обзор. Анестезия. 2016; 71 (1): 94–105. pmid: 26459299 - 21.
Замбони П., Сисини Ф., Менегатти Э., Тайби А., Гадда Г., Тавони В. и др. Ультразвуковой мониторинг пульса в яремной вене во время космических полетов: подтверждение концепции.Ультразвук в медицине и биологии. 2018; 44 (3): 726–33. - 22.
Николаидес А.Н., Морович С., Менегатти Э., Визельнер Г., Замбони П. Скрининг хронической спинномозговой венозной недостаточности (CCSVI) с использованием ультразвука. Рекомендации по протоколу. Функциональная неврология. 2011; 26 (4): 229. pmid: 22364944 - 23.
Rueden CT, Schindelin J, Hiner MC, DeZonia BE, Walter AE, Arena ET и др. ImageJ2: ImageJ для следующего поколения данных научных изображений. Биоинформатика BMC.2017; 18 (1): 529. pmid: 29187165 - 24.
Команда-R-Core. R: Язык и среда для статистических вычислений. 2013. - 25.
Замбони П. , Менегатти Э., Помидори Л., Морович С., Тайби А., Малагони А. М. и др. Влияет ли торакальный насос на мозговой венозный возврат? J. Appl Physiol (1985). 2012; 112 (5): 904–10. pmid: 22174396.
, Менегатти Э., Помидори Л., Морович С., Тайби А., Малагони А. М. и др. Влияет ли торакальный насос на мозговой венозный возврат? J. Appl Physiol (1985). 2012; 112 (5): 904–10. pmid: 22174396. - 26.
Тавони В. Техническая записка для постобработки пульса в яремной вене, центрального венозного давления и скорости.Вены и лимфатические сосуды. 2020; 9 (1). - 27.
Beggs CB, Malagoni AM, Menegatti E, Tavoni V, Giovanardi L, Ragazzi R и др. Спектральные сигналы пульса в яремной вене как диагностические биомаркеры, связанные с центральным венозным давлением. Диагностика (отправлено). 2020. - 28.
Чатфилд С. Анализ временных рядов: введение. Четвертое изд. Лондон: Чепмен и Холл; 1989. 94–5 с. - 29.
Марьино ПЛ. Книга интенсивной терапии. 4-е изд: Wolters Kluwer Health; 2014 г.157–9 с. - 30.
Киллу К., Сарани Б. Фундаментальная поддержка интенсивной терапии. 6-е изд: Общество интенсивной терапии; 2017. 93–114 с. - 31.
Mosterd A, Hoes AW. Клиническая эпидемиология сердечной недостаточности. Сердце. 2007. 93 (9): 1137–46. pmid: 17699180 - 32.
Редфилд MM, Якобсен SJ, Бернетт JC младший, Махони DW, Бейли KR, Rodeheffer RJ. Бремя систолической и диастолической желудочковой дисфункции в обществе: оценка масштабов эпидемии сердечной недостаточности.Джама. 2003. 289 (2): 194–202. pmid: 12517230 - 33.
Брейман Л. Случайные леса. Машинное обучение. 2001. 45 (1): 5–32. - 34.
Конн РД, О’Киф Дж. Х. Упрощенная оценка яремного венозного давления: значение инспираторного коллапса яремных вен. Медицина Миссури. 2012; 109 (2): 150. pmid: 22675798 - 35.
Бреннан Дж. М., Блэр Дж. Э., Гуневардена С., Ронан А., Шах Д., Васайвала С. и др. Сравнение физикального обследования медицинскими резидентами и ультразвукового исследования для оценки давления в правом предсердии.Американский кардиологический журнал. 2007. 99 (11): 1614–6. pmid: 17531592
2007. 99 (11): 1614–6. pmid: 17531592 - 36.
Демерия Д.Д., МакДугалл А., Спурек М., Рид Дж., Лафрамбуаз К., Тейлор-Жевр Р.М. и др. Сравнение клинического измерения яремного венозного давления с измеренным центральным венозным давлением. Грудь. 2004; 126 (4): 747С. - 37.
Фигг К.К., Немергут ЕС. Ошибка измерения центрального венозного давления. Анестезия и анальгезия. 2009. 108 (4): 1209–11.
Бесконтактная гемодинамическая визуализация выявляет форму пульсовой волны в яремной вене
Протокол исследования
Данные были собраны у 24 участников (возраст ( μ ± σ ) = 28.7 ± 12,4). На рисунке 9 графически показана схема исследования. Демографическая информация (возраст, рост, вес,% жира в организме) была получена в начале исследования. Участников попросили принять положение лежа на спине на время исследования. Чтобы избежать визуальной окклюзии шеи, наземная форма волны пульса крови была собрана с помощью манжеты для фотоплетизмографии (PPG) пальца одновременно с видеоданными. Дополнительная информация включает набор данных формы сигнала, собранный и используемый в этом документе.Техник по УЗИ с 14-летним опытом исследований в области ультразвука поместил ультразвуковой датчик 11 МГц (Vivid i, General Electric Healthcare, Хортен, Норвегия) на шею после видеосъемки. После определения местоположения анатомии сосуда давление, оказываемое на зонд, было сброшено до тех пор, пока зонд не прервал контакт с кожей, а затем снова осторожно приложили к границе раздела геля в том же месте, чтобы обеспечить возможность анализа диаметра сосуда без помех. Ультразвуковые видео были собраны со скоростью 12 кадров в секунду. Были получены видео поперечного сечения в B-режиме, чтобы подтвердить расположение яремной вены относительно сонной артерии и покадрово подтвердить характеристики пульсации сосудов.Яремную вену идентифицировали, вдавливая зонд в кожу и наблюдая, какой из двух сосудов разрушился, через поперечное сечение. Были получены продольные доплеровские измерения яремной вены для подтверждения пульсации яремного кровотока. Сонные и яремные пути были отмечены после видеосъемки для анатомического картирования местоположения наблюдаемого пульса. Информированное согласие было получено от всех участников, а также от тех участников, чьи фотографии были использованы в этой статье. Исследование было одобрено комитетом по этике исследований Университета Ватерлоо и выполнено в соответствии с Хельсинкской декларацией.
Были получены продольные доплеровские измерения яремной вены для подтверждения пульсации яремного кровотока. Сонные и яремные пути были отмечены после видеосъемки для анатомического картирования местоположения наблюдаемого пульса. Информированное согласие было получено от всех участников, а также от тех участников, чьи фотографии были использованы в этой статье. Исследование было одобрено комитетом по этике исследований Университета Ватерлоо и выполнено в соответствии с Хельсинкской декларацией.
Рисунок 9: Настройка исследования.
Участники лежали на спине на протяжении всего исследования. Система биофотонной визуализации была расположена выше и немного правее участника на расстоянии 1,5 м. Освещение осуществлялось пространственно-однородным вольфрамово-галогенным источником освещения мощностью 250 Вт. Данные изображений обрабатывались на блоке цифровой обработки сигналов (DSP). Участник носил манжету для пальца, которая давала основную истинную форму артериальной волны для анализа.
Система визуализации
Для сбора данных использовалась настраиваемая система фотоплетизмографической визуализации (PPGI), состоящая из камеры, чувствительной к ближнему инфракрасному излучению (PointGrey GS3-U3-41C6NIR-C), оптического полосового фильтра 850–1000 нм и вольфрамово-галогенный источник освещения мощностью 250 Вт.Ширина спектральной полосы была выбрана в пределах оптического окна ткани, которое демонстрирует глубокое проникновение фотонов (для достижения основных сосудов) и низкое поглощение меланина (нечувствительность к тону кожи) 21 . Освещение закреплялось на фиксированном расстоянии с помощью световой стойки, чтобы обеспечить стабильное облучение кожи, и оно равномерно проецировалось с помощью переднего диффузора из стеклоткани диаметром 16 дюймов. И источник освещения, и система визуализации были расположены на 1,5 м над участником. Расстояние между пикселями было предварительно откалибровано с использованием целевого разрешения на известном фиксированном расстоянии до изображения. Видео собирались со скоростью 60 кадров в секунду, выдержкой 16 мс и диафрагмой f4.0. Данные обрабатывались с помощью блока цифровой обработки сигналов (DSP). В одном случае шея участника не была видна сверху, поэтому использовался вид у постели больного.
Видео собирались со скоростью 60 кадров в секунду, выдержкой 16 мс и диафрагмой f4.0. Данные обрабатывались с помощью блока цифровой обработки сигналов (DSP). В одном случае шея участника не была видна сверху, поэтому использовался вид у постели больного.
На рисунке 10 показан конвейер обработки сигналов для исследования. Каждый кадр усреднялся по блокам с использованием участков размером 5 × 5 мм. Временные колебания области i дали сигнал отраженного освещения x i ( t ):
Рисунок 10: Конвейер обработки данных.
Каждый кадр анализировался в областях 0,25 × 0,25 мм. Временные колебания каждой области были преобразованы в оптическую плотность с использованием (2). Коэффициент линейной корреляции Пирсона был вычислен для каждой формы сигнала с использованием наземной формы сигнала PPG, что дало карту пространственной корреляции, показывающую местоположения, демонстрирующие сильную прямую и инвертированную пульсацию. Лучше всего смотреться в цвете.
, где R i — это область пикселей 5 × 5 мм, окружающая пиксель i , а v j ( t ) — значение j th пикселя при время т .Отражение было преобразовано в поглощение с использованием закона Бера-Ламберта, моделирующего геометрический путь фотона как путь рассеянного отражения 22 :
, где обозначает теоретическое освещение, падающее на ткань в момент времени t . Метод устранения тренда 23 использовался для устранения вариаций внешнего освещения. Таким образом, считался стабильным во времени (т. Е.), И безразмерный характер формы волны пульса крови привел к окончательной формулировке a i ( t ):
Анализ данных
Использование сигнал PPG пальца в качестве наземной истинной формы пульса артериальной крови, коэффициент линейной корреляции Пирсона был вычислен между сигналом временного поглощения каждой области a i ( t ) и сигналом PPG z (t ) для определения мощность и направленность сигнала:
, где σ z , — это стандартное отклонение сигнала датчика PPG и сигнала области соответственно, а также ковариация двух сигналов. Обратите внимание, что это временная корреляция, а не корреляция данных разброса, где r > 0,5 указывает на сильную пульсацию, соответствующую сигналу артериальной пульсации PPG, а r <−0,5 указывает на сильную пульсацию, которая обратно пропорциональна сигналу PPG. Для визуализации сигналы фильтровались с использованием идеального полосового фильтра в диапазоне 0,5–3,5 Гц (30–210 ударов в минуту), а цветовые карты сглаживались с использованием ядра Гаусса ( σ = 2,5 мм).
Обратите внимание, что это временная корреляция, а не корреляция данных разброса, где r > 0,5 указывает на сильную пульсацию, соответствующую сигналу артериальной пульсации PPG, а r <−0,5 указывает на сильную пульсацию, которая обратно пропорциональна сигналу PPG. Для визуализации сигналы фильтровались с использованием идеального полосового фильтра в диапазоне 0,5–3,5 Гц (30–210 ударов в минуту), а цветовые карты сглаживались с использованием ядра Гаусса ( σ = 2,5 мм).
В некоторых случаях (например,g., холодные пальцы), форма волны сонной артерии существенно отличалась от формы волны PPG пальца. В этих случаях вместо этого использовалась форма сигнала, которая демонстрировала самое сильное спектральное отношение сигнал / шум (SNR) по сравнению с формой сигнала PPG. SNR был рассчитан в частотной области во всех регионах как:
, где Z, A i — нормализованные спектральные амплитуды сигналов PPG и i th , соответственно, и f представляет частоту.Затем шаблон формы волны был выбран следующим образом:
Ультразвуковое измерение для оценки ЦВД
Тяжелый сепсис и септический шок являются причиной более 750000 госпитализаций и 215000 смертей в год.1 Ранняя жидкостная реанимация является краеугольным камнем лечения и ранней целью Было показано, что направленная терапия (ЭГДТ), которая включает целевое центральное венозное давление (ЦВД) от 8 до 12 мм рт.ст., улучшает исходы, включая смертность и продолжительность пребывания в стационаре2. избыточного введения жидкости, что связано с неблагоприятными исходами у пациентов в критическом состоянии.3 Однако неинтенсивные терапевты могут не начинать раннюю агрессивную жидкостную реанимацию из-за неспособности точно оценить внутрисосудистый объем, опасений по поводу непреднамеренной перегрузки объемом или трудности распознавания коварного заболевания. Оценка состояния объема, в первую очередь на основании осмотра внутренней яремной вены для оценки ЦВД, трудно выполнить только клиническим обследованием, особенно если ЦВД очень низкое. 4 Обследование внешней яремной вены, возможно, проще, чем осмотр внутренней яремной вены и по всей видимости, точно оценивает ЦВД, 5 но не позволяет получить степень точности, необходимую для EGDT.Эхокардиография может оценить ЦВД на основе респираторных вариаций или индекса коллапсируемости, но этот метод требует дорогостоящего оборудования и ультразвуковых знаний. Текущий золотой стандарт для измерения ЦВД требует инвазивного центрального венозного катетера, который может отсрочить своевременную реанимацию и связан с осложнениями6. у постели больного, предоставляя результаты измерений в реальном времени.Мы предположили, что ЦВД можно точно оценить с помощью неинвазивной ультразвуковой визуализации внутренней яремной вены, поскольку давление в яремной вене по существу равно ЦВД.7 В частности, в нашем исследовании оценивалась диагностическая точность ультразвукового измерения соотношения сторон (высота / ширина) внутреннюю яремную вену по сравнению с инвазивно измеренным целевым ЦВД для EGDT. Мы ожидали, что более низкое соотношение сторон будет коррелировать с более низким CVP, а более высокое соотношение сторон будет коррелировать с более высоким CVP.
4 Обследование внешней яремной вены, возможно, проще, чем осмотр внутренней яремной вены и по всей видимости, точно оценивает ЦВД, 5 но не позволяет получить степень точности, необходимую для EGDT.Эхокардиография может оценить ЦВД на основе респираторных вариаций или индекса коллапсируемости, но этот метод требует дорогостоящего оборудования и ультразвуковых знаний. Текущий золотой стандарт для измерения ЦВД требует инвазивного центрального венозного катетера, который может отсрочить своевременную реанимацию и связан с осложнениями6. у постели больного, предоставляя результаты измерений в реальном времени.Мы предположили, что ЦВД можно точно оценить с помощью неинвазивной ультразвуковой визуализации внутренней яремной вены, поскольку давление в яремной вене по существу равно ЦВД.7 В частности, в нашем исследовании оценивалась диагностическая точность ультразвукового измерения соотношения сторон (высота / ширина) внутреннюю яремную вену по сравнению с инвазивно измеренным целевым ЦВД для EGDT. Мы ожидали, что более низкое соотношение сторон будет коррелировать с более низким CVP, а более высокое соотношение сторон будет коррелировать с более высоким CVP.
Методы
Добровольцы были набраны в больнице Святой Марии (клиника Майо) в Рочестере, штат Миннесота, с января по март 2006 г., а пациенты были зарегистрированы в больнице Святой Марии и в Северо-западной больнице Эбботт (больницы и клиники Аллина) в Миннеаполисе, штат Миннесота. , с мая 2006 г. по октябрь 2007 г. Исследование было одобрено экспертными советами клиники Mayo и Allina и имело 2 фазы. Первая фаза включала ультразвуковые измерения соотношения сторон внутренней яремной вены и определение согласия между наблюдателями и наблюдателями у здоровых добровольцев.Второй этап включал измерение соотношения сторон внутренней яремной вены и инвазивного ЦВД в удобной выборке из 44 пациентов со спонтанным дыханием, поступивших в отделения интенсивной терапии: 9 пациентов в больнице Сент-Мэрис и 35 пациентов в больнице Эбботт Северо-Западный. Пациенты включались в исследование только тогда, когда участники исследования находились на дежурстве в отделении интенсивной терапии и могли выполнять измерения в рамках исследования. В результате, большая часть пациентов, которые могли иметь право на участие, не были приглашены к участию.
Пациенты включались в исследование только тогда, когда участники исследования находились на дежурстве в отделении интенсивной терапии и могли выполнять измерения в рамках исследования. В результате, большая часть пациентов, которые могли иметь право на участие, не были приглашены к участию.
Каждый доброволец был признан эуволемиком на основании нормальных ортостатических измерений и нормального перорального приема без рвоты или диареи в предыдущие 5 дней. Измерения 19 добровольцев были выполнены одним автором (A.S.K.), с последующими измерениями 15 добровольцев другим автором (O.G.) для определения вариабельности между наблюдателями; 4 участника не прошли второе измерение из-за конфликтов в расписании.
Критерии включения и исключения тяжелобольных пациентов представлены в таблице 1.Набор был основан на представлении симптомов и результатов тестов, которые побудили врачей отделения интенсивной терапии принять решение установить монитор CVP. Всем включенным пациентам было выполнено инвазивное измерение ЦВД примерно через 30-40 минут после ультразвукового измерения внутренней яремной вены; эта задержка была временем, необходимым для размещения центральной линии и получения измерения. Были включены все пациенты, приглашенные для участия в исследовании. Ни один из пациентов не был исключен на основании критериев исключения или из-за невозможности провести центральную линию.Никаких осложнений, связанных с размещением центральной линии, не возникло.
| Критерии включения |
| 1. Возраст 18 лет и старше |
| 2. Поступление в отделение интенсивной терапии |
| 4. Планируемое введение монитора центрального венозного давления для терапии |
| Критерии исключения |
1. Известные травмы или срастание шейного отдела позвоночника Известные травмы или срастание шейного отдела позвоночника |
| 2. Несъемные шейные воротники |
| 3. Хирургические повязки, препятствующие визуализации внутренней яремной вены |
| 4. Невозможность правильного положения пациента |
Мы следовали предписанной методике измерения (таблица 2) для определения соотношения сторон внутренней яремной вены у всех добровольцев и пациентов.Измерения добровольцев проводились с помощью ультразвуковой системы Site-Rite 3 (Bard Access Systems, Inc., Солт-Лейк-Сити, Юта) с использованием датчика 9,0 МГц. Измерения у пациентов в критическом состоянии проводились с помощью ультразвуковой системы SonoSite MicroMaxx (SonoSite, Inc., Ботелл, Вашингтон) с использованием датчика 10,5 МГц. Первоначально врачи исследовательской группы не знали об измеренном ЦВД. Соотношение сторон внутренней яремной вены и ЦВД были измерены в конце дыхательного объема у всех пациентов. Для каждого пациента было проведено одно измерение, причем измерения были выполнены 1 из 4 врачей (2 реаниматолога, 1 реаниматолог и 1 главный врач-ординатор).Без специального обучения ультразвуку и с минимальной практикой врачи могли получить оптимальное соотношение сторон в течение нескольких секунд (рис. 1).
Рисунок 1
Измерение формата изображения. Ультразвуковое изображение в поперечной плоскости в поперечном сечении показывает правую внутреннюю яремную вену и общую сонную артерию. Соотношение сторон внутренней яремной вены (высота / ширина) в этом примере составляет 0,77.
| 1.Положите пациента на спину (0) так, чтобы голова и ноги были плоскими, чтобы обеспечить общий комфорт. Для выравнивания головы, шеи и туловища можно использовать небольшую подушку. |
| 2. Попросите пациента слегка повернуть голову в сторону (<30), чтобы обнажить внутреннюю яремную вену |
3. Поместите датчик на шею пациента поперек предполагаемого расположения внутренней яремной вены. Датчик должен располагаться перпендикулярно шее пациента Поместите датчик на шею пациента поперек предполагаемого расположения внутренней яремной вены. Датчик должен располагаться перпендикулярно шее пациента |
| 4.Слегка надавите на датчик, чтобы найти внутреннюю яремную вену на экране обзора. Используйте минимальное давление, необходимое для получения ультразвукового изображения хорошего качества. |
| 5. После обнаружения внутренней яремной вены отрегулируйте положение датчика над веной для получения наиболее круглого поперечного сечения |
| 6. Попросите пациента нормально дышать, затем попросите его или ее ненадолго прекратить дыхание при нормальном (дыхательном объеме) в конце выдоха |
| 7.Сохраните наилучшее изображение в конце выдоха (на котором внутренняя яремная вена кажется наиболее круглой) и попросите пациента возобновить нормальное дыхание |
| 8. Измерьте высоту и ширину внутренней яремной вены с помощью встроенной функции курсора или ruler |
Это было исследовательское проспективное исследование, и все методы сбора данных были разработаны до включения пациентов. Тем не менее, полученное ультразвуком соотношение сторон 0,83 (которое определяло ЦВД 8 мм рт. кривая для тяжелобольных.
Статистический анализ
Группы сравнивали с использованием теста 2 на различия в пропорциях и критерия суммы рангов Вилкоксона для непрерывных данных. P <0,05 считали статистически значимым. Графики Бланд-Альтмана использовались для описания систематической ошибки и изменчивости соотношения сторон внутри и между наблюдателями.8 Этот метод сравнивает 2 метода измерения для определения согласия и повторяемости путем построения среднего значения разностей (которое должно быть равно нулю) и верхнего предела. и нижние пределы соглашения (1.96 стандартных отклонений [SD] этих различий выше и ниже среднего). Результаты были рассчитаны с использованием имеющихся данных; поправки на недостающие данные не производилось.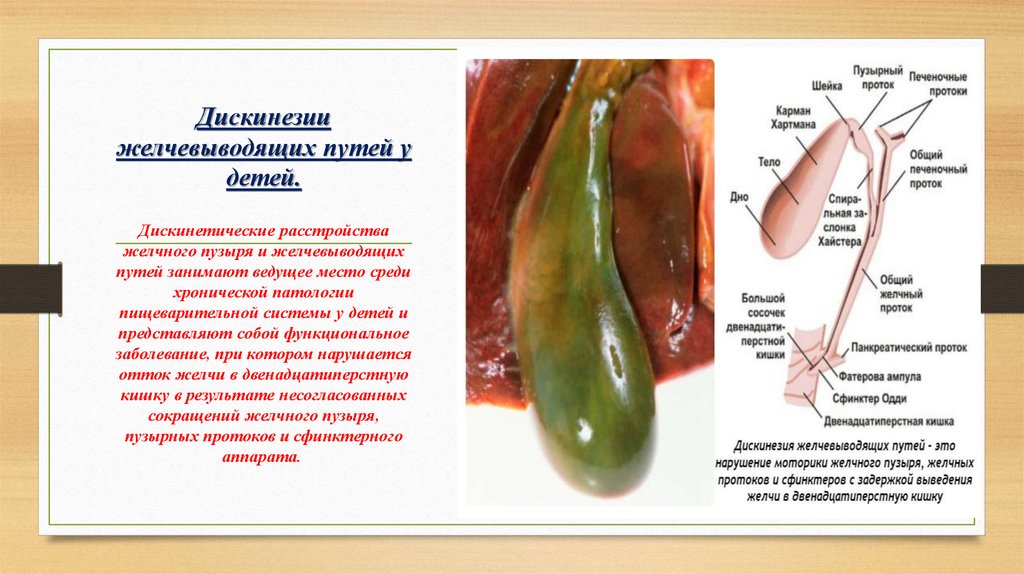 Анализы выполняли с использованием программного обеспечения SPLUS и SAS / STAT (SAS Institute, Inc., Кэри, Северная Каролина).
Анализы выполняли с использованием программного обеспечения SPLUS и SAS / STAT (SAS Institute, Inc., Кэри, Северная Каролина).
Результаты
Сначала мы оценили 19 белых добровольцев: 12 женщин и 7 мужчин. Средний возраст (SD) составлял 42 (11) года, а средний индекс массы тела — 26,6 (4,5) кг / м 2 . Среднее артериальное давление составляло 89 (13) мм рт. Ст., А средняя частота сердечных сокращений — 71 (15) ударов в минуту.Среднее соотношение сторон правой и левой внутренней яремной вены для всех добровольцев составило 0,82 (0,07). Не было разницы в соотношении сторон между правой (0,83 [0,10]) и левой (0,81 [0,13]) веной ( P > 0,10). Кроме того, не было замечено никакой разницы в соотношении сторон между мужчинами (0,81 [0,08]) и женщинами (0,83 [0,07]) ( P = 0,77). Анализ Бланда-Альтмана показал умеренное согласие между наблюдателями и внутри наблюдателя для измерений соотношения сторон (рис. 2).
Рисунок 2 Анализ по Бланду-Альтману
.(A, B) Надежность между наблюдателем для ультразвуковых измерений соотношения сторон правой (A) и (B) левой внутренней яремной вены, выполненных 1 наблюдателем (A.S.K.) на 19 добровольцах. (C, D) Надежность между наблюдателями для измерений (C) правой и (D) левой внутренней яремной вены двумя наблюдателями (A.S.K. и O.G.) у 15 добровольцев. Сплошная линия представляет собой среднее значение разницы в соотношении сторон; пунктирные линии представляют вариабельность разницы. Вертикальная линия на каждом графике указывает соотношение сторон 0.83.
Затем мы сравнили соотношение сторон, измеренное с помощью ультразвука, и ЦВД, измеренное с помощью инвазивного монитора, у 44 спонтанно дышащих пациентов в критическом состоянии (22 женщины и 22 мужчины; 38 были белыми). Средний возраст (SD) составлял 66 (14) лет, а средний индекс массы тела — 28,8 (9,1) кг / м 2 . Среднее артериальное давление (n = 36) составляло 67 (12) мм рт.ст. , а средняя частота сердечных сокращений (n = 34) составляла 92 (22) удара в минуту. Критерии синдрома системного воспалительного ответа (SIRS) присутствовали у 23 из 40 пациентов; по остальным 4 пациентам полные данные отсутствовали.Из этих 40 пациентов у 20 был сепсис, у 15 — тяжелый сепсис и у 5 — септический шок. Наиболее частыми диагнозами были кровотечение из желудочно-кишечного тракта у 6 пациентов и застойная сердечная недостаточность у 4 пациентов. Оценка острой физиологии и хронического здоровья (APACHE III), доступная для 8 из 9 пациентов в больнице Saint Marys, составила 63 (10).
, а средняя частота сердечных сокращений (n = 34) составляла 92 (22) удара в минуту. Критерии синдрома системного воспалительного ответа (SIRS) присутствовали у 23 из 40 пациентов; по остальным 4 пациентам полные данные отсутствовали.Из этих 40 пациентов у 20 был сепсис, у 15 — тяжелый сепсис и у 5 — септический шок. Наиболее частыми диагнозами были кровотечение из желудочно-кишечного тракта у 6 пациентов и застойная сердечная недостаточность у 4 пациентов. Оценка острой физиологии и хронического здоровья (APACHE III), доступная для 8 из 9 пациентов в больнице Saint Marys, составила 63 (10).
На рис. 3 показаны измеренные соотношения сторон по сравнению с инвазивным измерением ЦВД у пациентов в критическом состоянии. Криволинейный результат соответствует характеристикам податливости вен и правого желудочка (объем / давление).Обратите внимание, что точка перегиба (начало увеличенного наклона) кривой соответствует ЦВД около 8 мм рт. Кроме того, соотношение сторон (0,8) в этот момент такое же, как и у добровольцев с эуволемией. Эти данные предполагают, что у пациентов со спонтанным дыханием ЦВД около 8 мм рт.ст. и соотношение сторон около 0,8 каждое определяет начало плато на сердечной кривой Франка-Старлинга.
Рисунок 3
Измерения у пациентов в критическом состоянии со спонтанным дыханием.График соотношения сторон внутренней яремной вены, измеренного с помощью ультразвука (ось x), по сравнению с измеренным инвазивно центральным венозным давлением (ЦВД) в конце выдоха (ось y) для каждого пациента (n = 44). Горизонтальная линия указывает на ЦВД 8 мм рт. Ст., А вертикальная линия указывает на коэффициент сжатия внутренней яремной вены 0,83. Сплошная линия представляет собой лессовое соответствие данным.
Ультразвуковое изображение соотношения сторон внутренней яремной вены точно оценило целевое значение ЦВД в 8 мм рт. Ст. На основе площади под кривой рабочих характеристик приемника, равной 0.84 (95% доверительный интервал [ДИ], 0,72–0,96) (Рисунок 4). Для инвазивно измеренного ЦВД менее 8 мм рт.ст. отношение правдоподобия для положительного результата ультразвукового исследования (соотношение сторон <0,83) составляло 3,5 (95% ДИ, 1,4-8,4), а для отрицательного результата (соотношение сторон 0,83) было 0,30 (95% ДИ, 0,14-0,62). Клинически это означает, что пациенты с измеренным соотношением сторон менее 0,83 нуждаются в дополнительной жидкостной реанимации, тогда как пациенты с измеренным соотношением сторон 0,83 или выше с меньшей вероятностью получат пользу от жидкостной реанимации.
Для инвазивно измеренного ЦВД менее 8 мм рт.ст. отношение правдоподобия для положительного результата ультразвукового исследования (соотношение сторон <0,83) составляло 3,5 (95% ДИ, 1,4-8,4), а для отрицательного результата (соотношение сторон 0,83) было 0,30 (95% ДИ, 0,14-0,62). Клинически это означает, что пациенты с измеренным соотношением сторон менее 0,83 нуждаются в дополнительной жидкостной реанимации, тогда как пациенты с измеренным соотношением сторон 0,83 или выше с меньшей вероятностью получат пользу от жидкостной реанимации.
Рисунок 4 Кривая рабочих характеристик приемника
. Чувствительность (ось Y) отложена в зависимости от специфичности 1 (ось X) для 42 уникальных соотношений сторон внутренней яремной вены среди 44 пациентов. Площадь под кривой 0,84 (95% ДИ 0,72-0,96). «Плечо» указывает точку максимальной чувствительности (0,78) и специфичности (0,77), которая соответствует соотношению сторон 0,83 (*).
Обсуждение
Это исследование продемонстрировало, что целевое значение ЦВД EGDT от 8 до 12 мм рт.Процесс измерения прост для выполнения у постели больного и умеренно надежен при выполнении разными наблюдателями; Кроме того, результаты кажутся одинаковыми для обеих сторон и для мужчин или женщин. Изображения могут храниться в электронном виде для последовательного сравнения и для просмотра другими лицами, осуществляющими уход. Поскольку аспектное отношение практически постоянно по длине внутренней яремной вены, в отличие от диаметра, измерения можно проводить в любом месте вдоль вены. Кроме того, ультразвуковая визуализация позволяет визуализировать внутреннюю яремную вену, несмотря на анатомические вариации.9
Предыдущие попытки неинвазивного гемодинамического мониторинга с использованием плетизмографии, торакального электрического биоимпеданса и внешних допплеровских датчиков показали, что эти методы являются громоздкими или неточными.1013 Другие исследователи использовали эхокардиографию14, 15 и портативное ультразвуковое исследование16 для визуализации диаметра нижней полой вены. чтобы оценить состояние внутрисосудистого объема, но эти методы требуют опыта в ультразвуковой визуализации. Альтернативный метод — измерение периферического венозного давления, которое коррелирует с ЦВД.17 Этот метод, однако, требует технических знаний для обнуления монитора и пока не используется широко для пациентов в критическом состоянии. В результате поиска в литературе было найдено 1 письмо к редактору, в котором предлагалось использовать ультразвуковое изображение внутренней яремной вены в реальном времени для качественного определения давления в яремной вене18 и 3 исследования с использованием ультразвука в сочетании с датчиком давления или манометром для определения давления, необходимого для коллапса. вена (внутренняя яремная или периферическая вена) с последующей корреляцией с ЦВД.1921 г. Эти последние методы кажутся громоздкими и требуют специального оборудования, которое недоступно в большинстве больниц.
чтобы оценить состояние внутрисосудистого объема, но эти методы требуют опыта в ультразвуковой визуализации. Альтернативный метод — измерение периферического венозного давления, которое коррелирует с ЦВД.17 Этот метод, однако, требует технических знаний для обнуления монитора и пока не используется широко для пациентов в критическом состоянии. В результате поиска в литературе было найдено 1 письмо к редактору, в котором предлагалось использовать ультразвуковое изображение внутренней яремной вены в реальном времени для качественного определения давления в яремной вене18 и 3 исследования с использованием ультразвука в сочетании с датчиком давления или манометром для определения давления, необходимого для коллапса. вена (внутренняя яремная или периферическая вена) с последующей корреляцией с ЦВД.1921 г. Эти последние методы кажутся громоздкими и требуют специального оборудования, которое недоступно в большинстве больниц.
Любое измерение ЦВД, включая нашу методику, предполагает корреляцию с реакцией на объем как суррогат для внутрисосудистого объема. Однако ЦВД определяется множеством физиологических и патологических факторов, включая внутрисосудистый объем, эластичность сосудов и желудочков, функцию желудочков, стеноз и регургитацию трикуспидального клапана, тампонаду сердца и атриовентрикулярную диссоциацию.22, 23 Следовательно, одно только ЦВД не может быть точной мерой объемной реакции (внутрисосудистого объема). ЦВД также может иметь спонтанное изменение, подобное давлению заклинивания легочных капилляров, которое может достигать 7 мм рт.ст. у любого конкретного пациента.24 Кроме того, инвазивные мониторы ЦВД также имеют ограничения, и общая точность системы Philips, используемой в больнице Сент-Мэрис. составляет 4% от показания или 4 мм рт. ст., в зависимости от того, что больше.25 Тем не менее, алгоритм EGDT, который включает измерение ЦВД с целевым значением от 8 до 12 мм рт. ст. у спонтанно дышащих пациентов и 12 мм рт. смертности среди пациентов с тяжелым сепсисом и рекомендован Руководством по кампании Surviving Sepsis Campaign26 и Институтом улучшения здравоохранения.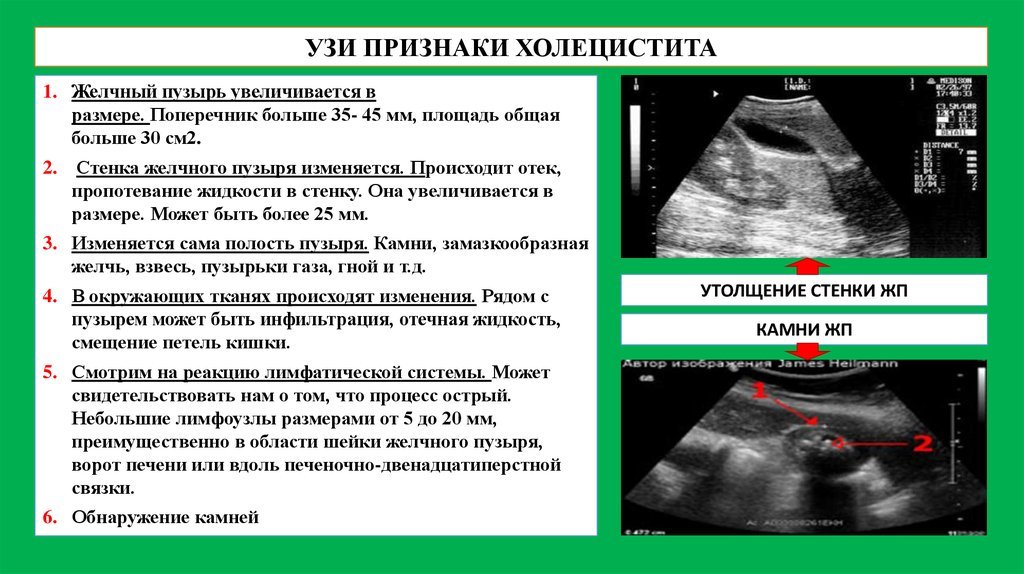 27
27
Эти результаты исследования важны, потому что неинтенсивные терапевты, такие как госпиталисты и врачи отделений неотложной помощи, могут использовать эту технику для обеспечения быстрой инфузионной реанимации на ранних этапах тяжелого сепсиса и септического шока, когда агрессивная жидкостная реанимация наиболее эффективна. Ультразвуковое исследование внутренней яремной вены легко выполнить без формального обучения, а оборудование доступно в большинстве больниц. В будущих исследованиях будут оцениваться результаты у пациентов со спонтанным дыханием и на ИВЛ, чтобы определить точность этого метода измерения в состояниях истощения и перегрузки объема.При валидации у разных групп пациентов ультразвуковое измерение внутренней яремной вены может заменить целевое значение ЦВД EGDT у пациентов в критическом состоянии и позволить раннюю агрессивную жидкостную реанимацию до установки центрального венозного катетера.
Ограничения
В это предварительное исследование была включена небольшая удобная выборка преимущественно белых пациентов. Удобная выборка потенциально подвержена систематической ошибке отбора, поскольку большинство пациентов, которые могли иметь право на участие, никогда не приглашались к участию.Кроме того, не у всех пациентов был синдром сепсиса; Наше намерение состояло в том, чтобы измерить ЦВД и соотношение сторон у имеющихся пациентов в критическом состоянии. Соответственно, результаты могут быть разными в зависимости от тяжести заболевания. Кроме того, некоторые пациенты были переведены из других медицинских центров или из отделений неотложной помощи и поэтому, возможно, уже были частично реанимированы. Другим ограничением является то, что вариабельность внутри наблюдателя и между наблюдателями для здоровых добровольцев показала лишь умеренное согласие, что, возможно, указывает на ограниченную повторяемость, хотя эти результаты могут быть связаны с небольшим размером выборки.Кроме того, мы не определяли вариабельность внутри и между наблюдателями для пациентов в критическом состоянии; результаты могут отличаться от результатов здоровых добровольцев. Кроме того, основные состояния, такие как стеноз трикуспидального клапана или регургитация и тампонада сердца, могут повлиять на результаты измерений, но мы включили всех пациентов без формальной оценки, поскольку лечение проводилось в срочном порядке, как и в реальных клинических условиях.
Кроме того, основные состояния, такие как стеноз трикуспидального клапана или регургитация и тампонада сердца, могут повлиять на результаты измерений, но мы включили всех пациентов без формальной оценки, поскольку лечение проводилось в срочном порядке, как и в реальных клинических условиях.
Благодарности
Авторы посвящают эту работу своим пациентам с тяжелым сепсисом.Они благодарят Лизу Киркланд, доктор медицины, и Мурата Йилмаза, доктора медицины, за их помощь в этом исследовании. Они также выражают благодарность отделениям общей внутренней медицины, легочной медицины и реанимации Mayo Clinic за финансирование.
Ультразвуковой датчик SonoSite для измерения JVP
Ультразвуковой датчик SonoSite для измерения JVP — Health Research Authority
HRA Health Research Authority Защита и продвижение интересов пациентов и общественности в исследованиях в области здравоохранения.
Веб-сайт Управления медицинских исследований использует основные файлы cookie
Этот сайт использует файлы cookie сеанса и постоянные файлы cookie для улучшения содержания и структуры сайта.
Принимать все файлы cookie
См. Политику в отношении файлов cookie
Этот сайт использует файлы cookie. Продолжая просматривать сайт, вы соглашаетесь на использование файлов cookie.
Тип исследования
Исследование
Полное название
Использование зонда SonoSite для измерения яремного венозного давления
IRAS ID
254072
06 Контактный адрес электронной почты
Спонсорская организация
Учебные больницы Шеффилда Доверительный фонд NHS
Clinicaltrials.
 gov Идентификатор
gov ИдентификаторNCT03815188
Продолжительность исследования в Великобритании 905 месяцев, 7 лет в Великобритании 31 день
Резюме исследования
В этом исследовании будет изучен, какой неинвазивный метод измерения яремного венозного давления (JVP) является наиболее точным: физическое обследование JVP или ультразвуковое исследование.JVP — это оценка давления в правом отделе сердца. В современной практике физикальное обследование JVP используется для оценки пациентов с подозрением или известным заболеванием сердца. Недавние исследования показывают, что использование ультразвукового датчика может более точно и надежно измерять JVP. Определение наилучшего метода позволит врачам оценить JVP с помощью наиболее подходящего исследования. Это позволит врачам принять более обоснованное решение о том, какие дополнительные анализы и методы лечения необходимы. Ультразвуковой датчик будет использоваться для записи измерений JVP.Это устройство обычно используется в больницах и коммерчески доступно для измерения JVP. Пациенты, перенесшие операцию на сердце, будут допущены к участию в этом исследовании. У этих пациентов легче определить пульс на яремной вене во время физического обследования, что делает эту подгруппу пациентов наиболее подходящей. Пациентам также необходимо установить центральную линию как часть операции. Центральная линия будет измерять центральное венозное давление и является золотым стандартом для измерения давления в правом отделе сердца.Это позволит сравнить как физическое измерение JVP, так и ультразвуковое измерение с золотым стандартом, определив, какой метод является наиболее точным. Сайт для этого исследования — Фонд NHS учебной больницы Шеффилда. Судебный процесс продлится 8 месяцев. Во время предоперационной оценки пациента будет проведено физикальное обследование JVP и ультразвуковая запись JVP. Центральная линия будет включена для измерения центрального венозного давления. Анестезиолог завершит предоперационную оценку до того, как пациент войдет в операционную.
 Пациент не требует дополнительных посещений. Оба дополнительных исследования неинвазивны и, следовательно, делают исследование с очень низким риском.
Пациент не требует дополнительных посещений. Оба дополнительных исследования неинвазивны и, следовательно, делают исследование с очень низким риском.Название REC
Уэльс REC 7
Ссылка REC
19 / WA / 0039
Дата заключения REC
6 февраля 2019 г.
9 Мнение REC3
77
Будьте в курсе последних новостей, обновлений правил и предстоящих учебных мероприятий
Последовательное УЗИ легких и НПВ в оценке застойной сердечной недостаточности | The Ultrasound Journal
Основная цель настоящего исследования — сравнить серийное ультразвуковое исследование легких и сосудов с клиническими данными после лечения ХСН.Вторичной целью было изучить взаимосвязь между степенью заложенности, измеренной с помощью ультразвукового исследования, и продолжительностью пребывания в больнице, повторной госпитализацией и смертностью.
В текущем исследовании последовательно принимали участие пациенты с клиническим диагнозом левосторонней застойной сердечной недостаточности, которым требуется госпитализация в кардиологическую службу, при этом соответствующая группа кардиологов поставила диагноз. В исследование были включены все госпитализированные взрослые пациенты со спонтанным дыханием в возрасте от 18 до 90 лет с допущенным диагнозом систолической или диастолической левосторонней сердечной недостаточности по мнению кардиолога.Критерии исключения были следующими: пациенты, перенесшие инвазивную вентиляцию легких, пациенты с первичным диагнозом правосторонней сердечной недостаточности, пациенты с активным раком легких, легочным фиброзом, интерстициальным заболеванием легких или пневмонией, пациенты, которым мы не можем провести ультразвуковое исследование в первые 24 часа приема и пациенты, которые не могут подписать форму согласия.
 Пациенты прошли серийное клиническое и ультразвуковое обследование в трех временных точках: в течение 24 часов после поступления (T1), в 1-й день госпитализации (T2) и в течение 24 часов до выписки (T3), в общей сложности было проведено три отдельных клинических и ультразвуковых обследований. (Рисунок.1). Клинические оценки, включая медицинский осмотр, были выполнены старшим ординатором по внутренним болезням и старшим научным сотрудником по интенсивной терапии. Оценщики знали о времени проведения оценки.
Пациенты прошли серийное клиническое и ультразвуковое обследование в трех временных точках: в течение 24 часов после поступления (T1), в 1-й день госпитализации (T2) и в течение 24 часов до выписки (T3), в общей сложности было проведено три отдельных клинических и ультразвуковых обследований. (Рисунок.1). Клинические оценки, включая медицинский осмотр, были выполнены старшим ординатором по внутренним болезням и старшим научным сотрудником по интенсивной терапии. Оценщики знали о времени проведения оценки.Рис.1
Дизайн исследования с тремя отдельными временными точками для УЗИ и клинического обследования
Исходные демографические данные пациентов, включая возраст, вес, пол, сопутствующие соматические заболевания и этиологию сердечной недостаточности, были записаны на основе обзора диаграммы.Лабораторные показатели, включая гемоглобин, функцию почек и тропонин при поступлении, регистрировались с помощью обзора диаграммы. Фракция выброса левого желудочка (ФВЛЖ), диастолическая функция и вальвулопатия были получены на последней эхокардиограмме или во время текущей госпитализации. Рентгенограмма грудной клетки (CXR) при поступлении была рассмотрена и оценена резидентными авторами после того, как они выполнили клиническую и ультразвуковую оценку как наличие интерстициального отека или альвеолярного отека, где альвеолярный отек указывает на более значительную легочную гиперемию.Через три месяца после выписки был проведен обзор карты для оценки продолжительности пребывания в больнице, повторной госпитализации и 90-дневной смертности. Комитет по этике больниц одобрил текущее исследование.
Клиническая оценка
Оценка Киллипа и клиническая оценка заложенности (CCS) были рассчитаны для каждого пациента в трех временных точках. Для оценки степени тяжести сердечной недостаточности рассчитывалась оценка Killip (0–4) [23]: 0 — отсутствие сердечной недостаточности, 4 — кардиогенный шок.
 Хотя эта шкала была разработана специально для случаев острого инфаркта миокарда, она использовалась в этом исследовании, поскольку является широко известным показателем тяжести сердечной недостаточности.
Хотя эта шкала была разработана специально для случаев острого инфаркта миокарда, она использовалась в этом исследовании, поскольку является широко известным показателем тяжести сердечной недостаточности.Клиническая оценка заложенности (CCS) [24] была рассчитана на основе легочных хрипов (оценка 0–4), повышения центрального венозного давления (оценка 0–4), S3 (наличие 1, отсутствие 0) и ортопноэ (оценка 0–4). 4). CCS имеет максимальный балл 13, где более высокие баллы указывают на более тяжелую сердечную недостаточность. CCS был проверен на амбулаторной популяции со стабильной сердечной недостаточностью, и было показано, что он коррелирует с эхокардиографическими данными о повышенном давлении наполнения [19].
В частности, следующие симптомы и результаты физикального обследования оценивались по вышеуказанным баллам следующим образом: наличие одышки и ПНД оценивалось как наличие (1) или отсутствие (0). Ортопноэ оценивалось от 0 до 4, при этом 0 баллов указывал на необходимость использования одной подушки во время сна, а 4 — на хотя бы одну ночь, проведенную во сне в сидячем положении. Повышение центрального венозного давления оценивалось как 0, если гребни ни внутренней, ни внешней яремной вены не видны над ключицей, и 4, если гребни видны на мочке уха при оценке пациента под углом 30–45 °.Печеночно-яремный рефлюкс регистрировался как присутствующий (1) или отсутствующий (0). Хрипы / хрипы оценивались как отсутствующие (0), присутствующие менее чем в 50% поля легкого (1) или более чем на 50% поля легкого (2). Периферический отек оценивался от 0 до 4 в зависимости от глубины вдавления в лодыжке.
Ультразвуковая оценка
Ультразвуковая оценка POCUS была проведена с помощью системы зон Zonare (Zonare Medical Systems Inc, Маунтин-Вью, Калифорния, США). Два автора (RS и MS) собрали данные УЗИ после 3-часовой тренировки и 10 сканирований под наблюдением специалиста по интенсивной терапии с расширенным сердечным эхосигналом и формальным обучением ультразвуку легких до включения пациентов.
 Brennan et al. [25] показали, что врачи-терапевты с минимальной подготовкой, включая 4 часа формального дидактического обучения ультразвуку, и 20 снимков под наблюдением сонографистов, смогли получить адекватные изображения НПВ у 90% пациентов. Во время клинической оценки каждому пациенту проводилось серийное сканирование. Два автора (MS и JL), не видевшие клинической информации, проанализировали сохраненные изображения. Априори было установлено, что данные о сосудистых заболеваниях и LUS не раскрывались лечащей бригаде, если они не обнаружили значительных неожиданных опасных для жизни диагнозов, таких как венозный тромб, сложный плевральный выпот, указывающий на эмпиему, пневмоторакс или тампонаду сердца.В результате на основании результатов УЗИ решения о лечении сердечной недостаточности пациента не принимались.
Brennan et al. [25] показали, что врачи-терапевты с минимальной подготовкой, включая 4 часа формального дидактического обучения ультразвуку, и 20 снимков под наблюдением сонографистов, смогли получить адекватные изображения НПВ у 90% пациентов. Во время клинической оценки каждому пациенту проводилось серийное сканирование. Два автора (MS и JL), не видевшие клинической информации, проанализировали сохраненные изображения. Априори было установлено, что данные о сосудистых заболеваниях и LUS не раскрывались лечащей бригаде, если они не обнаружили значительных неожиданных опасных для жизни диагнозов, таких как венозный тромб, сложный плевральный выпот, указывающий на эмпиему, пневмоторакс или тампонаду сердца.В результате на основании результатов УЗИ решения о лечении сердечной недостаточности пациента не принимались.НПВ анализировали по длинной оси через подреберное окно с помощью ультразвукового преобразователя с фазированной решеткой 4 МГц. Измеряли и записывали диаметр внутрипеченочной НПВ в пределах 1-2 см от правого предсердия и реакцию НПВ на инспираторный маневр. Размер НПВ на выдохе регистрировали, и индекс сжимаемости НПВ рассчитывали как (размер НПВ на выдохе — размер НПВ на вдохе) / размер НПВ на выдохе.
Все УЗИ легких проводились с использованием зонда с изогнутой решеткой на 6 МГц, и в каждом квадранте регистрировался 3-секундный клип. Двустороннее 8-балльное LUS-исследование было выполнено для оценки линий B в соответствии с рекомендациями международного консенсуса [8]. Наклонный межреберный вид был получен, чтобы максимизировать количество B-линий, и фактический подсчет производился в момент визуализации большинства B-линий.
Анализ данных
Клинические и ультразвуковые переменные были проанализированы с использованием парного теста t .Корреляции Пирсона использовались для сравнения клинических и ультразвуковых переменных. Влияние ультразвуковых и клинических оценок на больничную LOS и 90-дневную смертность оценивали с помощью одномерного и многомерного анализов.

Физическое обследование трикуспидальной регургитации — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; {AE}} Вамсикришна Гуннам M.B.B.S [2]
Обзор
При осмотре обычно повышено давление в яремной вене и видны «cv» волны.Печень может быть увеличена и часто пульсирует (последнее обнаружение фактически свидетельствует о недостаточности трикуспидального клапана. Часто обнаруживается периферический отек. В тяжелых случаях может быть асцит и даже цирроз печени (так называемый «сердечный цирроз»). Недостаточность трикуспидального клапана может привести к на наличие пансистолического шума в сердце. Такой шум обычно низкочастотный и лучше всего слышен на левой границе грудины. Он имеет тенденцию усиливаться при вдохе. Однако шум может быть неслышным из-за относительно низкого давления справа сторона сердца.Также может присутствовать третий тон сердца.
Медицинский осмотр
Клинические данные у пациентов с трикуспидальной регургитацией обычно являются результатом правосторонней сердечной недостаточности и регургитации кровотока через трикуспидальный клапан в правое предсердие во время сокращения желудочков. У пациентов с правосторонней сердечной недостаточностью могут наблюдаться периферические отеки, цианоз, гепатоспленомегалия, асцит, кахексия и желтуха. Признаки левосторонней сердечной недостаточности будут преобладать в случае дисфункции левого желудочка.
Шея
Сердце
Пальпация
Аускультация
Тоны сердца
Бормотание
- Присутствует голосистолический шум.
- Лучше всего слышен справа или слева по средней границе грудины или в подксифоидной области.

- При увеличении правого желудочка шум слышен даже на верхушке сердца.
- У пациентов с трикуспидальной регургитацией в некоторых случаях может быть слышен диастолический гул, особенно если существует корреляция со стенозом трикуспидального клапана.
- Диастолический гул также может быть слышен из-за увеличения кровотока через трикуспидальный клапан во время диастолы из-за дефекта межпредсердной перегородки.
Маневры
- Вдохновение, подъем ног, упражнения и сжатие печени увеличивают интенсивность шума за счет увеличения венозного возврата к сердцу.
- Стоя, маневр амилнитрата и валсальвы снижает интенсивность шума за счет уменьшения венозного возврата к сердцу.
- Интенсивность шума изменяется с увеличением или уменьшением давления в легочной артерии, если у пациента гипертензия легочной артерии.
- Признак Риверо-Карвалло может наблюдаться в случаях трикуспидальной регургитации легкой и средней степени тяжести. [1]
Печень
Легкие
- Легочные хрипы могут присутствовать, если дисфункция левого желудочка связана с заболеванием.
Руководство ACC / AHA, 2008 г. и 2006 г., по ведению пациентов с клапанной болезнью сердца (НЕ РЕДАКТИРОВАТЬ)
[2]
Подростки (НЕ РЕДАКТИРОВАТЬ)
[2]
Класс I « 1. Пульсоксиметрия в покое и / или во время физической нагрузки показана для первичной оценки подростков и молодых взрослых пациентов с TR, если имеется предсердная коммуникация, и периодически каждые 1–3 года, в зависимости от степени тяжести. ( Уровень доказательности: C ) » Источники
- Рекомендации ACC / AHA 2008 г., включенные в рекомендации 2006 г.
 по ведению пациентов с пороками клапанов сердца [2]
по ведению пациентов с пороками клапанов сердца [2]
Ссылки
Шаблон: WH
Шаблон: WSМетоды неинвазивной оценки ЦВД
Неинвазивная оценка центрального венозного давления (ЦВД) — это компонент физического обследования, который может быть очень ценным при уходе за пациентом, особенно при оценке состояния объема.Оценка ЦВД может быть достигнута путем оценки яремного венозного давления (JVP), периферического венозного коллапса (PVC) и ультразвуковой визуализации нижней полой вены (IVC). Прикроватная оценка ЦВД началась в 1920-х годах после экспериментов Старлинг по кардиальной гемодинамике, которые связали ее с сердечным выбросом.
Однако относительная точность этих методов по сравнению друг с другом и их применением стажерами с различным опытом остается неопределенной. В недавнем исследовании сравнивалось применение и полезность JVP, PVC и портативного Mini Echo среди слушателей с разным опытом, включая студентов-медиков, ординаторов по внутренним болезням и стажеров-кардиологов.Авторы также представили и утвердили новую технику физического осмотра, знак Anthem, для оценки CVP.
Метод исследования
Это исследование проводилось в эхо-отделении больницы Св. Бонифация в Виннипеге, Манитоба, с официального этического одобрения Университета Манитобы. Когорта стационарных и амбулаторных пациентов, представивших для своих регулярно запланированных эхокардиограмм, предоставила согласие на клиническую оценку ЦВД с использованием этих неинвазивных прикроватных методов: JVP, методы PVC и портативное мини-эхо.Пациенты были исключены, если у них были внутривенные катетеры в правых венах и / или они не могли дать информированное согласие.
Оценка JVP: Оценки ЦВД получены путем определения высоты формы волны внутренней яремной вены относительно угла грудины. ЦВД считается повышенным, если высота венозного столба превышает три сантиметра над грудным углом. Первоначально оценивалась правая внутренняя яремная вена, поскольку она сообщается с правым предсердием относительно прямым ходом.
 Если формы венозных волн правой внутренней яремной вены не были хорошо визуализированы, оценивалась левая внутренняя яремная вена.
Если формы венозных волн правой внутренней яремной вены не были хорошо визуализированы, оценивалась левая внутренняя яремная вена.
Методы ПВХ: В положении лежа на спине с 30-градусным подъемом изголовья кровати руки пациента опираются на бок, а тыльная сторона кисти проверяется на наличие поверхностных вен. Если вены не видны, эту технику нельзя применять, а если они видны, но уже разрушились, ЦВД, вероятно, низкое или нормальное.Если вены остаются расширенными выше угла грудины, вероятно, повышено ЦВД. Поскольку точка наблюдения за ПВХ на тыльной стороне кисти и контрольная точка на грудном углу довольно далеко друг от друга, точное определение уровня ПВХ может быть ошибочным.Пытаясь преодолеть такие ограничения, исследователи модифицировали классическую технику ПВХ и представили и утвердили новый метод физического осмотра, названный знаком Anthem. В этом положении пациент предстает как человек, стоящий во внимании к исполнению государственного гимна.Новая техника начинается так же, как и классический метод ПВХ. Однако, когда рука готова к пассивному подъему, ее просто кладут прямо над грудиной. При таком подходе точка наблюдения ЖЭ на тыльной стороне кисти и контрольная точка на грудины находятся в непосредственной близости, и если вены остаются растянутыми при нахождении на верхней части грудины, считается, что ЦВД повышено.
Прикроватное мини-эхо: Переносное ультразвуковое устройство использовалось для оценки НПВ с целью оценки ЦВД в соответствии с рекомендациями Американского общества эхо-эхо 2010 года.
Исследователи сравнили применение и полезность этих методов среди трех стажеров с разным опытом: студента-медика второго курса с ограниченным клиническим опытом, второго курса медицинского ординатуры с трехлетним клиническим опытом и второго курса кардиолога с шестилетним опытом клинического опыта. Сорок два пациента были обследованы как студентом-медиком, так и ординатором независимо друг от друга для оценки согласия между наблюдателями.

Перед набором пациентов для исследования студент-медик прошел целенаправленное обучение применению методов JVP и PVC, обследовав 44 пациента в течение одной недели, что в общей сложности составило 10 часов обучения.Резидент-терапевт получил только очень краткие инструкции по применению методов физического осмотра, основанные на оценке пациента. Наконец, стажер-кардиолог не нуждался в обучении по применению методов медицинского осмотра у постели больного. Mini Echo использовался студентом-медиком только после 10 часов обучения Echo.
Исследователи не видели результатов эхосигнала, оценок друг друга и истории болезни; их оценки ЦВД сравнивались с оценками золотого стандарта эхокардиографа 3-го уровня по завершении исследования.
Результаты
Всего было обследовано 325 пациентов: 217 студентом-медиком, 58 резидентом, 49 научным сотрудником кардиолога и 43 пациентами, оцененными с помощью мини-эхо. Средний возраст составлял 65 (р.д. 16) лет со средним ИМТ 28 кг / м2 (р.д. 6), 52 процента составляли мужчины.
По сравнению с золотым стандартом CVP эхокардиографом уровня 3, JVP был наиболее чувствительным (86 процентов), улучшаясь с клиническим опытом (p
При применении исследователем с наименьшим клиническим опытом, методы PVC, с знак Anthem, в частности, имел большую чувствительность, чем JVP, на 21% по сравнению с13 процентов. Аналогичные тенденции наблюдались при оценке пациентов с ожирением. После короткой тренировки с эхом результаты мини-эхо, выполненные студентом-медиком, оказались наиболее чувствительными — 100%.
При применении научным сотрудником кардиолога знак Anthem имел более высокую специфичность, чем JVP (85 процентов против 57 процентов, соответственно). Среди всех трех стажеров классическая методика PVC и знак Anthem имели лучшую специфичность по сравнению с JVP, особенно среди пациентов с ожирением.
С точки зрения соглашения между наблюдателями, паттерны чувствительности и специфичности методов клинического осмотра у постели больного были схожими у 42 совместно обследованных пациентов по сравнению с полной подгруппой пациентов, обследованных студентом-медиком и резидентом.


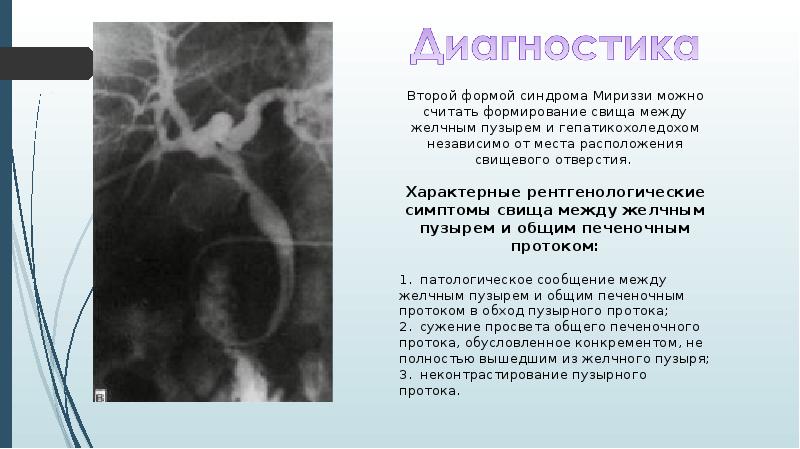

 Происходит расширение протоков и увеличение объема пузыря, что регистрируют при помощи УЗИ.
Происходит расширение протоков и увеличение объема пузыря, что регистрируют при помощи УЗИ.
 , Кадир А., Ахтар А. Измерение соотношения диаметров внутренней яремной вены и общей сонной артерии с помощью ультразвука для оценки центрального венозного давления. Cureus. 2018; 10 (3).
, Кадир А., Ахтар А. Измерение соотношения диаметров внутренней яремной вены и общей сонной артерии с помощью ультразвука для оценки центрального венозного давления. Cureus. 2018; 10 (3). Диагностическая точность простого ультразвукового измерения для оценки центрального венозного давления у спонтанно дышащих пациентов в критическом состоянии.Журнал госпитальной медицины. 2009. 4 (6): 350–5. pmid: 19670356
Диагностическая точность простого ультразвукового измерения для оценки центрального венозного давления у спонтанно дышащих пациентов в критическом состоянии.Журнал госпитальной медицины. 2009. 4 (6): 350–5. pmid: 19670356 , Менегатти Э., Помидори Л., Морович С., Тайби А., Малагони А. М. и др. Влияет ли торакальный насос на мозговой венозный возврат? J. Appl Physiol (1985). 2012; 112 (5): 904–10. pmid: 22174396.
, Менегатти Э., Помидори Л., Морович С., Тайби А., Малагони А. М. и др. Влияет ли торакальный насос на мозговой венозный возврат? J. Appl Physiol (1985). 2012; 112 (5): 904–10. pmid: 22174396. 2007. 99 (11): 1614–6. pmid: 17531592
2007. 99 (11): 1614–6. pmid: 17531592 gov Идентификатор
gov Идентификатор Пациент не требует дополнительных посещений. Оба дополнительных исследования неинвазивны и, следовательно, делают исследование с очень низким риском.
Пациент не требует дополнительных посещений. Оба дополнительных исследования неинвазивны и, следовательно, делают исследование с очень низким риском. Пациенты прошли серийное клиническое и ультразвуковое обследование в трех временных точках: в течение 24 часов после поступления (T1), в 1-й день госпитализации (T2) и в течение 24 часов до выписки (T3), в общей сложности было проведено три отдельных клинических и ультразвуковых обследований. (Рисунок.1). Клинические оценки, включая медицинский осмотр, были выполнены старшим ординатором по внутренним болезням и старшим научным сотрудником по интенсивной терапии. Оценщики знали о времени проведения оценки.
Пациенты прошли серийное клиническое и ультразвуковое обследование в трех временных точках: в течение 24 часов после поступления (T1), в 1-й день госпитализации (T2) и в течение 24 часов до выписки (T3), в общей сложности было проведено три отдельных клинических и ультразвуковых обследований. (Рисунок.1). Клинические оценки, включая медицинский осмотр, были выполнены старшим ординатором по внутренним болезням и старшим научным сотрудником по интенсивной терапии. Оценщики знали о времени проведения оценки. Хотя эта шкала была разработана специально для случаев острого инфаркта миокарда, она использовалась в этом исследовании, поскольку является широко известным показателем тяжести сердечной недостаточности.
Хотя эта шкала была разработана специально для случаев острого инфаркта миокарда, она использовалась в этом исследовании, поскольку является широко известным показателем тяжести сердечной недостаточности. Brennan et al. [25] показали, что врачи-терапевты с минимальной подготовкой, включая 4 часа формального дидактического обучения ультразвуку, и 20 снимков под наблюдением сонографистов, смогли получить адекватные изображения НПВ у 90% пациентов. Во время клинической оценки каждому пациенту проводилось серийное сканирование. Два автора (MS и JL), не видевшие клинической информации, проанализировали сохраненные изображения. Априори было установлено, что данные о сосудистых заболеваниях и LUS не раскрывались лечащей бригаде, если они не обнаружили значительных неожиданных опасных для жизни диагнозов, таких как венозный тромб, сложный плевральный выпот, указывающий на эмпиему, пневмоторакс или тампонаду сердца.В результате на основании результатов УЗИ решения о лечении сердечной недостаточности пациента не принимались.
Brennan et al. [25] показали, что врачи-терапевты с минимальной подготовкой, включая 4 часа формального дидактического обучения ультразвуку, и 20 снимков под наблюдением сонографистов, смогли получить адекватные изображения НПВ у 90% пациентов. Во время клинической оценки каждому пациенту проводилось серийное сканирование. Два автора (MS и JL), не видевшие клинической информации, проанализировали сохраненные изображения. Априори было установлено, что данные о сосудистых заболеваниях и LUS не раскрывались лечащей бригаде, если они не обнаружили значительных неожиданных опасных для жизни диагнозов, таких как венозный тромб, сложный плевральный выпот, указывающий на эмпиему, пневмоторакс или тампонаду сердца.В результате на основании результатов УЗИ решения о лечении сердечной недостаточности пациента не принимались.
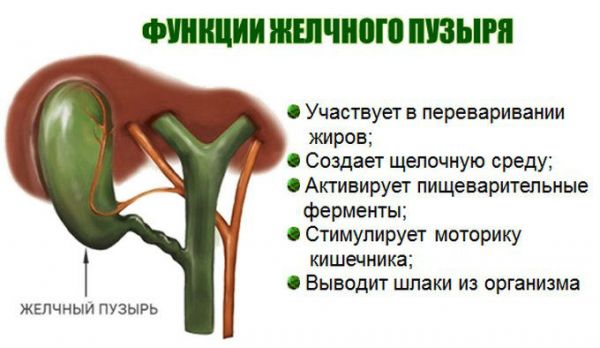
 по ведению пациентов с пороками клапанов сердца [2]
по ведению пациентов с пороками клапанов сердца [2]  Если формы венозных волн правой внутренней яремной вены не были хорошо визуализированы, оценивалась левая внутренняя яремная вена.
Если формы венозных волн правой внутренней яремной вены не были хорошо визуализированы, оценивалась левая внутренняя яремная вена. 
