Автоклавирование. Матчасть и не только . Рецепты. | Fermer.Ru — Фермер.Ру — Главный фермерский портал
! Потихоньку буду перетаскивать наиболее важное и интересное с разных более ранних тем .
Pchelovek пишет:
Не хочу переоценивать, реально есть люди более опытные и знающие, но в Нете информацию систематизированную не выкладывают- кто не хочет принципиально, а кто и просто не знает кому и куда. Рад помочь читателям этого фопума, чем могу, людям- на радость, на экономию сил, времени, денег, а особенно- НА БЕЗОПАСНОСТЬ!!!!
. Ботулизм САМЫЙ сильный яд на земле. Если в пересчете: 1 грамм яда на количество людей, которое он может убить, то с ним не сравнится ни хлор, ни зорин, ни сальмонеллез, ни мышьяк, ни змеиный яд, ни один из любых других известных ядов, которые Вы сможете вспомнить!!!!!!. При этом не имеет НИКАКИХ признаков — ни вкуса, ни запаха, ни цвета (очень редко, иногда, даёт приятный запах голландского твердого сыра) и, как я уже писал ранее, имеет только один, очень четкий признак: косую чёрную полосочку или траурную рамочку на портрете потерпевшего.
Что обидно, что пойди еще те яды найди-одни редкие, другие дорогие, третьи под запретом в обороте. А этот — и искать не надо: берешь своё мясо, или грибочки, или рыбку свежую, делаешь на своей родной Клаве вкуснейшую консервочку, чуток не додерживаешь — по времени, или по температуре, или по спешке, или по экономии, или по безголовости, или по недостатку нужных приборов, или по неточности термометра ( показывает 112град при реальных 108град), или по примитивности рецепта ( называю такие рецепты » циничными», т.е. человек пишет: «нагреваю до 112град и тут же выключаю. И всегда, мол, все нормально, еще никто за 15 лет не отравился». А ничего, что он сам хранит свою тушенку в холодильнике, или зимой на балконе, или в погребе — т.е. при температуре ниже 13град.С, когда ботула не размножается, и сразу из погреба на стол, или в картошку вываливает и, к примеру, еще греет их вместе в казанке (токсины ботулы нестойкие и легко распадаются и безследно обезвреживаются при нагреве 0.5л банки в течении 30минут).
). Прочитал кто-нибудь такой рецепт, и сам сделал, а в погребе не хранит, т.к. живёт в городской квартире, — открыл, съел с удовольствием (какой замечательный и простой рецепт!) и умер через неделю, или в овоща превратился, тяжелого инвалида — слепого, глухого, с мертвым каменным лицом, не помнящим , как его самого зовут и вообще, кто он и откуда?, ещё и какашками бросается. Хорошо ещё, если сам. А если компания на природе, или дети, или близкие, родные люди… или чужой человек, покупатель, умер — и тебя в тюрьму, за непредумышленное убийство. Как перспективка?
ЛЮДИ!!!! Читайте мои посты в этом форуме — я выложил уже всё, достаточное, чтобы всех этих неприятностей избежать. Свою миссию считаю почти выполненной. Кто не спрятался-я не виноват!!! Еще, может, уточню по происхождению ботулы , профилактике и обезвреживанию — системно, когда время будет.
БЕРЕГИТЕ СЕБЯ И СВОИХ БЛИЗКИХ!!!
.
Pchelovek пишет:
Сегодня, на посошок, напишу обещанные мной симптомы ботулизма и что при этом надо делать.
Ботулизм, в зависимости от проглоченной дозы, может привести к смерти за 3час, а может и за 7дней, и все усилия врачей могут увенчаться, а могут и не увенчаться ничем (доза, возраст, алкоголь, наличие антидота ботулинового, уровень медицины, квалификация врачей, своевременность обращения за мед.помощью и т.п.).
Ботулизм поражает центральную нервную систему (далее — ЦНС) сверху вниз: сначала немеет макушка, потом мышцы лба и бровей не слушаются (это всё еще пока потерпевшему непонятно, только тревога может быть, но он на это почти не обращает внимания, т.к. у него уже началась диарея, рвота, ломка, головная боль и т.п.).
Но для Вас всех должно быть понятно уже на ЭТОМ этапе (раз уж Вы читаете этот пост!), что начался Ботулизм!!!
Следующим этапом перестанут открываться глаза — руками веки открыть можно, глаза все видят, мозг всё понимает, но веки отпускаешь- они падают и не открываются. В этот момент, если отказала уже и речь, то можно попросить бумагу, руками открыть веки и написать (как это было у моего знакомого Сереги О.
из Александровки Кировоградской области — отравился копченой речной рыбой с базара) записку: «Вызывай скорую! у меня ботулизм!».
За веками немеют мышцы лица, губ, языка, голосовых связок, челюстей, потом — шеи, плеч, рук, груди. Доходит до центра дыхания — мышцы грудной клетки не работают, воздух не поступает, и человек элементарно тихо умирает от удушья.
Обычно, с учетом того, что с рвотой и поносом часть токсина выбрасывается наружу (защитная реакция организма на яд, которая слабеет, кстати, от алкоголя, и алкоголь ускоряет всасывание яда — т.е. пьяный человек скорее всего заснет и умрет во сне, как это было у шести!!! Серёгиных друзей в ту ночь).
Скорая помощь (если объяснить им по телефону, что мы, мол, люди знающие и знаем признаки Ботулизма) обычно знает что делать и должна приехать с ботулиновым антидотом (сыворотка антиботулиновая или что-то в этом роде), но на Украине ее сейчас у скорой нет — пару ампул хранятся в управлении охраны здоровья обладминистрации в каждом областном центре.
Причем доступ к ним не круглосуточный, и в субботу-воскресенье Вам их никто не даст. В апатеке они не продаются, т.к. потребность в них мизерная.
Серёга траванулся еще в советское время, и жена у него была медсестра — Серегу спасли, единственного из всех, кто в тот вечер ел эту рыбу (с пивом, кстати).
У него на один год выключилась память, он поначалу не помнил себя, свое имя, причем вел себя адекватно — ходил, ел, разговаривал. Забыл, как писать и читать — учился заново. Забыл имя жены, мамы, все свои профессиональные знания, навыки и т.п. Но через год как будто кто-то тумблер включил — все разом вспомнил. Учтите, что он был пьян, но понял — что с ним? — когда перестали открываться веки.
Все его друзяки и подруги, которые вместе в ним ели эту рыбу, как я уже говорил, умерли — кто на скамейке в парке, кто под забором, кто пришел домой , лег в постель и ночью умер.
Серега ничего не мог объяснить в скорой — где он отравился и кто с ним был. Утром врачи просто труповозкой пособирали по вызовам трупы.
Серегу спасло то, что он учился в пищевом, и знал, что такое Ботулизм!!! Сейчас он нормальный человек, последствий никаких, кроме потерянного года жизни.
Рыбу ту всю спалили, продавщицу посадили. Она же эту рыбу и коптила — старая бабка — когда проходила «Комета» (катер на подводных крыльях) по Днепру и глушила винтами и оперением рыбу на мелководье, то рыба сначала всплывала (бабка на лодке быстро сразу за «Кометой» выходила в русло и собирала ее сачком), потом рыба опускалась на дно (вода была теплая — разгар лета, потому и пиво пили) и лежала рыба до следующей «Кометы». «Комета» винтами крутила воду, рыба опять всплывала, бабка ее опять собирала. Потом коптила-вялила-сушила. Там были и свежие рыбки, сразу после винта — ее она продавала, как свежую. Были и с белой головой (уже с ботулой, начавшей размножаться) — она ее и коптила, потому что копчение прячет эту белизну. Дали ей срок очень большой, точно не помню — то ли 10, то ли 15 лет, как за убийство.
Так что, люди, делайте выводы!
Помните симптомы, рассказывайте другим, предупреждайте людей, между делом.
Ботула не дремлет и тоже хочет жить.
То, что для нее жизнь — то для нерадивых Копченистов и Автоклавистов, и для их близких и далеких — смерть.
Ботула в тушенке и в овощных безкислотных консервах — ничем не отличается от ботулы в рыбе, кровяной или копченой колбасе.
Теперь Вы знаете. Я предупредил. А предупрежден — значит вооружен!
Упаси Бог! Но ежели что случится, то все это, что я написал, может пригодиться!
А нашим дорогим «Русским Рулеточникам» (которые стерилизуют в духовке, в воде, в печке и т.п., и считают, что это нормально) любой национальности говорю: «Кто не внял — я не виноват»!.
АМИНЬ.
Pchelovek пишет:
При наличии даже следов воды в мясе и в банке температура кипения внутри банки никогда не будет больше 100град.С — хоть Вы 150град будете поддерживать в духовке, хоть 120, хоть 200. Температура в духовке будет влиять только на интенсивность кипения и скорость выкипания. Только тогда, когда ВСЯ вода испарится, температура в банке начнет расти и будет стараться достичь температуры кипения жиров — обычно это около 180град.
С, если духовка даст такую температуру. Но это будет уже горелый продукт. Когда весь жир выкипит и обуглится, тогда температура будет расти дальше, если духовка это позволит. Но это уже будет уголь.
Экспозиция для гибели ботулы при 100град. С = 6 часов. И это в центре банки!. Плюс то время, чтобы температура 100град достигла центра банки. Итого рекомендуемое время для тушенки в духовке = 7-8 часов! Но это уже не тушенка, а пищевой балласт.
Кроме того, обратите внимание, что резинку из крышки на время тушения в духовке вынимают! А потом, перед закатыванием ее в крышку руками устанавливают!!! В этот момент ботула в банку и может попасть – через грязную резинку или грязные руки (ботула невооруженным взглядом не видна, а руки в кипяток не опустишь).
То, что многие люди так и раньше, и теперь делают тушенку в духовке по 3-6 часов, ничего не значит. Им просто повезло. Ботула в наших продуктах, не касающихся почвы, довольно редка. Мясо — это не корнеплоды типа морковки, свеклы, лука, картошки и т.
п. Даже в этих овощах при аккуратной санитарии споры ботулы попадают в банки примерно 1шт на 2 банки. В мясе же это будет гораздо меньше — в разы, десятки или сотни раз. Кроме того, споры ботулы отличаются устойчивостью на выживание, в зависимости от их возраста и условий взращивания. Молодые споры начинают гибнуть при 92град в течении 30минут, старики могут выживать до 120град и терпеть эту температуру 3 секунды.
Но это не значит, что такими вещами можно пренебрегать и рисковать здоровьем и жизнью окружающих и близких людей. Это «русская рулетка», но не 1 патрон на 6 пулевых каналов, а 1 на сотню, тысячу или миллион банок тушенки. Не думаю, что человеку будет легче умирать, если он будет знать, что только ему одному из миллиона кандидатов не повезло.
Даже на консервных заводах и в НИИ параметры стерилизации просчитывают так, что возможность отравления ботулой будет одна консервная банка на партию в 13 миллиардов (!!!!!) штук.
В СМИ Украины мелькают десятки случаев в год (то, что попадает в прессу) от мясных консервов (в основном, паштеты печеночные, а там лук и морковка, и делают их часто именно в духовке), в Узбекистане — десятки случаев даже от овощных консервов типа огурцов без уксуса и баклажанов (плохо моют, плохая вода, низкий уровень образования и санитарии).
При этом надо знать, что Украина сыворотку противоботулиновую не производит и не закупает уже несколько лет — живем на подарках от ООН — около сотни курсов в год получаем и храним их в областных центрах. Если в далеком селе кто-то заболеет, то обречен на гибель. Если самим покупать в Белоруссии и доставлять самолетом, то обходится что-то около 18000 долларов!!! Плюс потеря памяти и собственного имени на несколько лет, если доза ботулотоксина будет довольно большая, а лекарство прибудет с запозданием.
У Вас в России с этим полегче — государство полностью взяло этот вопрос на себя — сыворотка есть в каждом травмопункте. Но все равно, лечение продлится несколько месяцев постельного режима, проблемы с памятью, выбитый рабочий режим и потухшие семейные отношения.
Поэтому, пожалуйста, не пишите такие посты про такие тушенки в духовке. Не искушайте людей.
И не забывайте, что предыдущие поколения советских людей, которые делали такие тушенки, имели чуть ли не в каждом доме хороший погреб для хранения такой тушенки при температурах не выше 14град.
С, когда ботула не развивается. Или держали в полупустом холодильнике, т.к. в магазинах брать особо чего не было, и полки были полупустые, не то, что сейчас — бери все, что хочешь, только деньги плати. Вопрос качества здесь — за скобками. Т.е. риск умереть от такой тушенки был меньше, чем сейчас, когда все больше людей живут в многоквартирных домах без погреба и держат тушенку , в лучшем случае, на балконе в холодное время года. Да и то, массово переоборудуют балконы в лоджии, еще выводят туда отопление и получается там градусов под 20 С даже в холодное время года.
И неужели даже три часа в духовке лучше, чем 40 мин в автоклаве? Который можно самому заказать у сварщика из газбаллона за сравнительно небольшие деньги, если на заводской автоклав денег не хватает?
Я в Вашей ветке сейчас уже не участвую, хотя и просматриваю раз в пару месяцев. Ну тут не удержался, вот пишу. Простите за поучение…
[
Pchelovek пишет:
Всем добра!
Хочу дополнить про вопрос механического и биологического вздутия.
Это ни для кого не новость, но в наших старых постах про этот вопрос один этот нюанс нигде не упомянут.
Вспомнил о нем по причине маленькой проблемки, возникшей у меня пару дней тому назад при клавировании овощей.
Попались неудачные, слишком мягкие и тонкие крышки (производителя не называю, т.к. это значения не имеет), а закатка у меня — дама жесткая, без сантиментов. Короче, переборщил я с закаткой — слишка задавил края крышки, перестарался, и оттого, что она мягкая, почти как фольга, стала она прокручиваться при тесте качества (вращение от руки вокруг оси банки сразу после снятия закаточного ключа), т.е герметичности нет.
Но, зная, что резинка в крышке сделана из специальной резины, которая разбухает при кипячении, не придал этому значения. Мол, ничего, после клавы герметичность восстановится. Ну и в клаву ее. Таких банок было всего две — обнаружив такой дефект я стал меньше затягивать винт ролика при закатке, до наступления того момента, когда эта фольга начнет развальцовываться на горлышке банки; и проблема исчезла, на остальных банках уже ничего не проворачивалось.
Заложил я клаву, отработал цикл, вытаскиваю банки — а две банки — со вздутыми крышками.
(Если такое случается, то я обычно этому особого значения не придаю — просто пишу маркером: «Вздуто клавой», и — на хранение. При расходе банок я такую банку не боюсь употреблять, т.к. знаю, что это вздутие механическое, а не микробиологическое, т.е возникло и обнаружено при доставании банок из клавы, а не в результате хранения от микробиологического вздутия при размножении болезнетворных бактерий и выделении ими своих «пуков» (как в шампанском).
Определенную осторожность я все же соблюдаю, дабы в одной банке не наложились друг на друга сразу два вздутия — механического и микробиологического: такую банку в чужие руки не отдаю («дабы не смущать начальство»), при открывании нюхаю, обязательно подвергаю тепловой обработке — т.е. только через горячую сковородку под крышкой до кипения не менее 5 минут, и если вдруг появится неприятных запах (такого ни разу еще в моей практике не было, но принцип этот не нарушаю), то такой продукт я в пищу принимать не буду ни сам, ни животным не отдам.
).
Я отвлекся. Вернусь к к своим вздутикам:
— Причину вижу только в одном — из-за нарушенной герметизации при накачивании преддавления воздух из клавы входит в банку. При нагревании и экспозиции резинка разбухает и заполняет все полости, восстанавливая полную герметичность. После остывания клавы и вытаскивания банок мы обнаруживаем туго-вздутые крышки, которые не втягиваются даже после полного остывания и хранения в погребе. Я их сразу помечаю отдельно , и храню отдельно — для употребления в первую очередь.
Конечно, можно их сразу после клавы поставить в холодильник на 3-7 дней и вскрыть их без разогрева при первой же возможности на стол. Но вкус не успеет натянуться — вкуснее будет, если хранится хотя бы месяц.
ТУТ ОСТОРОЖНОСТЬ! Не путать!!! Я не призываю употреблять вздутые по непонятным причинам консервы. Я описал и объяснил еще одну причину возникновения механического вздутия консервов: негерметичность крышки перед укладкой банки в клаву на высокотемпературну.
стерилизацию. И то, как я лично их употребляю.
Pchelovek пишет:
Даю краткий отчет по своим последним клавированиям за последние 2 недели:
баклажанная икра — около 20 литров
помидоры маринованные в литровых, 0,75 и 0,5, 1,5 и 2л банках — около 40литров
томатный сок (когда оставалось пустое место в клаве) — около 4 литров
перцы в медовом маринаде — 1,5 литра
кутчуп 1 литр
соус для пиццы — 2 литра
аджика — 10 литров
салат «Десятка» — 9,5 литров.
На днях добавлю помидоры, перец, соус и кетчуп.
Для обработки объекта паром под давлением используют. Паровой метод стерилизации. Фламбирование, или прокаливание
Преимуществом метода является быстрый и равномерный прогрев всего объема стерилизуемой камеры, так как плотность и теплопроводность пара равна таковым показателям для воды. Поэтому продолжительность и температура стерилизации водяным паром ниже, чем нагретым воздухом
Таблица 3. 8, б.
8, б.
Воздушный метод стерилизации (сухой горячий воздух)
Паровая стерилизация насыщенным паром проводится в 2 режимах:
При избыточном давлении: 0,11 + 0,02 мПа (1,11 + 0,2 кгс/см 2) — температура (120 + 2) грапд.С;
При избыточном давлении: 0,2+0,02 мПа (2,2 + 0,2 кгс/см 2) — температура (132 + 2) град.С.
Стерилизацию паром при температуре (132+2) град.С рекомендуют для растворов термостабильных лекарственных веществ (табл. 3.10).
Таблица 3.9.
Время стерилизационной выдержки в зависимости от объема раствора
Таблица ЗЛО.
Паровой метод (водяной насыщенный пар под давлением)
Контроль температурного режима паровой стерилизации осуществляют максимальным термометром со шкалой на 210 град.С или термопарами. В качестве химического термотеста используют смесь бензойной кислоты с фуксином (10:1), температура плавления — 121 град.С.
Стерилизацию паром под давлением проводят в паровых стерилизаторах различной конструкции (рис. 3.22, 3.23). По форме стерилизаторы паром под давлением делятся на цилиндрические (круговые, буква К в обозначении) и прямоугольные (буква П). Цилиндрические могут располагаться горизонтально и вертикально (буквы ГиВ соответственно). Пример обозначения стерилизаторов:
ВК — вертикальный круговой электрический;
ГП — горизонтальный прямоугольный электрический односторонний;
ГПД — горизонтальный прямоугольный электрический двусторонний.
Цифры обозначают диаметр стерилизационной камеры. Стерилизатор состоит из 3 цилиндров. Первый (наружный) цилиндр называется кожухом. Он предохраняет паровой котел стерилизатора от возможных механических повреждений, а обслуживающий персонал — от ожогов.
Рис. 3.23.
Стерилизатор паровой ВК-75
Рис. 3.22.
Стерилизатор паровой ГП-400
Второй (средний) цилиндр — главная часть стерилизатора, называемая водопаровой камерой. Она изготовляется из высококачественной стали и предназначена для получения пара из воды.
Третий (внутренний) цилиндр называется стерилизационной камерой. Ее назначение — вмещать стерилизуемый материал, ограждая его от воды. В верхней части стерилизационной камеры расположены отверстия для прохождения в нее пара. Кроме того, они служат сепаратором, отделяя пар от капель воды, чтобы стерилизуемый материал не увлажнялся (пар захватывает частички воды). Крышка с резиновой прокладкой и центральным затвором служит для того, чтобы наглухо закрывать водопаровую камеру. Через эту же крышку загружают стерилизуемый материал. Пар в стерилизационную камеру поступает из котелка (или из водопаровой камеры), имеющего внутри электронагревательный элемент. Водопаровая камера заполняется водой очищенной через воронку. За наполнением следят по водомерному стеклу.
Стерилизаторы под давлением снабжены электроконтактным манометром, мановакуумметром, водоструйным эжектором, насо- сом и предохранительным клапаном. Электроконтактный манометр обеспечивает автоматическое поддержание заданного давления.
Мановакуумметр служит для контроля давления в стерилизационной камере. С помощью водоструйного эжектора достигаются быстрый отсос пара после каждой стерилизации, создание вакуума в стерилизационной камере и сушка стерилизуемых материалов, что особенно важно при стерилизации бумаги, ваты и др. Предохранительный клапан служит для предохранения стерилиза- тора от чрезмерного повышения давления пара в нем.
Наиболее удобны настольные паровые стерилизаторы (рис. 3.24), в которых автоматически поддерживаются заданные давление и температура, а также предусмотрена возможность просушивания вспо- могательного материала после стерилизации (вата, фильтровальная бумага, марля и т.п.). Для удаления воздуха из камеры, быстрой сушки материала после стерилизации имеется встроенный вакуум-насос.
Стерилизатор имеет жидкокристаллический дисплей с сенсорной клавиатурой, позволяющий выбирать:
3 стерилизационные программы для запакованного и открытого инструментария при 134 град.С;
Рис. 3.24.
Полуавтоматический стерилизатор паровой
2 стерилизационных программы для запакованного и открытого инструментария при 121 град.С;
Программу с настраиваемыми параметрами;
Быстрый цикл (134 град.С — 4 мин, общее время — 14 мин).
Преимуществом метода является быстрый и равномерный прогрев всего объема стерилизуемой камеры, так как плотность и теплопроводность пара равна таковым показателям для воды. Поэтому продолжительность и температура стерилизации водяным паром ниже, чем нагретым воздухом
Таблица 3.8, б.
Воздушный метод стерилизации (сухой горячий воздух)
Паровая стерилизация насыщенным паром проводится в 2 режимах:
При избыточном давлении: 0,11 + 0,02 мПа (1,11 + 0,2 кгс/см 2) — температура (120 + 2) грапд.С;
При избыточном давлении: 0,2+0,02 мПа (2,2 + 0,2 кгс/см 2) — температура (132 + 2) град.С.
Стерилизацию паром при температуре (132+2) град.С рекомендуют для растворов термостабильных лекарственных веществ (табл. 3.10).
Таблица 3.9.
Время стерилизационной выдержки в зависимости от объема раствора
Таблица ЗЛО.
Паровой метод (водяной насыщенный пар под давлением)
Контроль температурного режима паровой стерилизации осуществляют максимальным термометром со шкалой на 210 град.С или термопарами. В качестве химического термотеста используют смесь бензойной кислоты с фуксином (10:1), температура плавления — 121 град.С.
Стерилизацию паром под давлением проводят в паровых стерилизаторах различной конструкции (рис. 3.22, 3.23). По форме стерилизаторы паром под давлением делятся на цилиндрические (круговые, буква К в обозначении) и прямоугольные (буква П). Цилиндрические могут располагаться горизонтально и вертикально (буквы ГиВ соответственно). Пример обозначения стерилизаторов:
ВК — вертикальный круговой электрический;
ГП — горизонтальный прямоугольный электрический односторонний;
ГПД — горизонтальный прямоугольный электрический двусторонний.
Цифры обозначают диаметр стерилизационной камеры. Стерилизатор состоит из 3 цилиндров. Первый (наружный) цилиндр называется кожухом. Он предохраняет паровой котел стерилизатора от возможных механических повреждений, а обслуживающий персонал — от ожогов.
Рис. 3.23.
Стерилизатор паровой ВК-75
Рис. 3.22.
Стерилизатор паровой ГП-400
Второй (средний) цилиндр — главная часть стерилизатора, называемая водопаровой камерой. Она изготовляется из высококачественной стали и предназначена для получения пара из воды.
Третий (внутренний) цилиндр называется стерилизационной камерой. Ее назначение — вмещать стерилизуемый материал, ограждая его от воды. В верхней части стерилизационной камеры расположены отверстия для прохождения в нее пара. Кроме того, они служат сепаратором, отделяя пар от капель воды, чтобы стерилизуемый материал не увлажнялся (пар захватывает частички воды). Крышка с резиновой прокладкой и центральным затвором служит для того, чтобы наглухо закрывать водопаровую камеру. Через эту же крышку загружают стерилизуемый материал. Пар в стерилизационную камеру поступает из котелка (или из водопаровой камеры), имеющего внутри электронагревательный элемент. Водопаровая камера заполняется водой очищенной через воронку. За наполнением следят по водомерному стеклу.
Стерилизаторы под давлением снабжены электроконтактным манометром, мановакуумметром, водоструйным эжектором, насо- сом и предохранительным клапаном. Электроконтактный манометр обеспечивает автоматическое поддержание заданного давления.
Мановакуумметр служит для контроля давления в стерилизационной камере. С помощью водоструйного эжектора достигаются быстрый отсос пара после каждой стерилизации, создание вакуума в стерилизационной камере и сушка стерилизуемых материалов, что особенно важно при стерилизации бумаги, ваты и др. Предохранительный клапан служит для предохранения стерилиза- тора от чрезмерного повышения давления пара в нем.
Наиболее удобны настольные паровые стерилизаторы (рис. 3.24), в которых автоматически поддерживаются заданные давление и температура, а также предусмотрена возможность просушивания вспо- могательного материала после стерилизации (вата, фильтровальная бумага, марля и т.п.). Для удаления воздуха из камеры, быстрой сушки материала после стерилизации имеется встроенный вакуум-насос.
Стерилизатор имеет жидкокристаллический дисплей с сенсорной клавиатурой, позволяющий выбирать:
3 стерилизационные программы для запакованного и открытого инструментария при 134 град.С;
Рис. 3.24.
Полуавтоматический стерилизатор паровой
2 стерилизационных программы для запакованного и открытого инструментария при 121 град.С;
Программу с настраиваемыми параметрами;
Быстрый цикл (134 град.С — 4 мин, общее время — 14 мин).
Стерилизация проводится в автоклаве под давлением обычно (посуда, физиологический раствор, дистиллированная вода, питательные среды, не содержащие белков и углеводов, различные приборы, изделия из резины) в течение 20-30 минут при температуре 120-121 °С (1 атм.), хотя могут быть и другие соотношения между временем и температурой в зависимости от стерилизуемого объекта.
Любые растворы, содержащие белки и углеводы, стерилизуют в автоклаве при 0,5 атм. (115 °С) в течение 20-30 минут.
Любой инфицированный микроорганизмами (заразный) материал стерилизуют при давлении в 1,5 атм. (127 °С) — 1 час, или при давлении 2,0 атм. (132 о С) – 30 минут.
Когда стерилизуемые растворы находятся в стеклянных сосудах, по окончании цикла стерилизации необходимо контролировать время охлаждения, а также медленно понижать давление, т. к. открывать автоклав можно только после того, как в нем установилось давление окружающей среды.
Стерилизация облучением
Излучение может быть неионизирующим (ультрафиолетовое, инфракрасное, ультразвуковое, радиочастотное) и ионизирующим – корпускулярным (электроны) или электромагнитным (рентгеновские лучи или гамма-лучи).
Эффективность облучения зависит от полученной дозы, а выбор дозы определяется микробным загрязнением, формой и составом материала, подлежащегостерилизации.
Ультрафиолетовое облучение (254 нм) обладает малой проникающей способностью, поэтому требует достаточно длительного воздействия и используется в основном для стерилизации воздуха, открытых поверхностей в помещениях.
Ионизирующее излучение, в первую очередь, гамма-облучение, успешно применяется для стерилизации в промышленных условиях медицинских изделий из термолабильных материалов, поскольку позволяют быстро облучать материалы еще на стадии производства (при любой температуре и герметичной упаковке). В настоящее время широко используется для получения стерильных одноразовых пластмассовых изделий (шприцы, системы для переливания крови, чашки Петри) и хирургических перевязочных и шовных материалов.
Механические методы
Фильтры задерживают микроорганизмы благодаря пористой структуре матрикса, но для пропускания раствора через фильтр требуется вакуум или давление, поскольку сила поверхностного натяжения при таком малом размере пор не дает жидкостям фильтроваться.
Существуют 2 основных типа фильтров — глубинные и фильтрующие.
Глубинные фильтры состоят из волокнистых или гранулированных материалов (асбест, фарфор, глина), которые спрессованы, свиты или связаны в лабиринт проточных каналов, поэтому четкие параметры размера пор отсутствуют.
Частицы задерживаются в них в результате адсорбции и механического захвата в матриксе фильтра, что обеспечивает достаточно большую емкость фильтров, но может приводить к задержке части раствора.
Фильтрующие фильтры имеют непрерывную структуру, и эффективность захвата ими частиц определяется в основном соответствию их размеру пор фильтра. Мембранные фильтры имеют низкую емкость, но эффективность не зависит от скорости протока и перепада давлений, а фильтрат почти или совсем не задерживается.
Мембранная фильтрация в настоящее время широко применяется для стерилизации масел, мазей и растворов, неустойчивых к нагреванию — раствор для внутривенных инъекций, диагностические препараты, растворы витаминов и антибиотиков, сред для культур тканей и т. д. и т. п..
Химические методы
Химические методы стерилизации, связанные с применением химических веществ, обладающих явно выраженной антимикробной активностью, делятся на 2 группы: стерилизация газами и растворами (чаще известна как «дезинфекция»).
Химические методы стерилизации газами используются в лечебно- профилактических учреждениях для обеззараживания медицинских материалов и оборудования, которые нельзя стерилизовать другими способами (оптические приборы, кардиостимуляторы, аппараты искусственного кровообращения, эндоскопы, изделия из полимеров, стекла).
Бактерицидными свойствами обладают многие газы (формальдегид, окись пропилена, озон, надуксусная кислота и метилбромид), но шире всего используется окись этилена, поскольку она хорошо совместима с различными материалами (не вызывает коррозию металла, порчи обрабатываемых изделий из бумаги, резины и всех марок пластмасс). Время экспозиции при использовании газового метода стерилизации варьирует от 6 до 18 часов в зависимости от концентрации газовой смеси и объема специального аппарата (емкости) для этого вида стерилизации. Согласно «Методическим рекомендациям по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов» № 26-613 от 09.02.88 г. для стерилизации газами в качестве газового стерилизационного аппарата возможно применение микроанаэростата, а кроме окиси этилена или смеси окиси этилена с бромистым метилом, — паров 40 % формальдегида в этиловом спирте при температуре 80 °С в стерилизационной камере в течение 60 минут.
Контроль стерильности
производят в специально оборудованных боксах, исключающих возможность вторичного контакта изделий с микрофлорой. Для контроля отбирают не менее 1 % из числа одновременно простерилизированных изделий. Производят посев изделий в питательную среду для контроля. При отсутствии роста бактерий дают заключение о стерильности изделия.
Стерилизация растворами применяется при обработке большинства поверхностей (пространств) или медицинских приборов, которые не могут бытьобеззаражены другими методами.
Согласнотребованиям отраслевого стандарта ОСТ 42-21-2-85 «Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» большинство изделий медицинского назначения из металла, стекла, пластмасс, резины, проходят предстерилизационную обработку, состоящую из нескольких этапов:
Замачивание в моющем растворе при полном погружении изделия в дезинфицирующий раствор в течение 15-ти минут;
Мойка каждого изделия в разобранном виде в моющем растворе в ручном режиме в течение 1-ой минуты;
Ополаскивание под проточной водой хорошо промытых изделий в течение 3-10 минут;
Сушка горячим воздухом в сушильном шкафу.
Контроль качества предстерилизационной очистки изделий медицинского назначения на наличие крови проводят путем постановки амидопириновой пробы. Остаточные количества щелочных компонентов моющего средства определяют с помощью фенолфталеиновой пробы.
Согласно требованиям этого же ОСТа обязательным условием стерилизации растворами изделий медицинского назначения является полное погружение изделий в стерилизационный раствор в разобранном виде, с заполнением каналов и полостей, при температуре раствора не менее 18 °С. Используют только эмалированные емкости (без повреждений) со стеклянными или пластмассовыми крышками. После стерилизации изделия быстро извлекают из раствора с помощью пинцетов или корнцангов, удаляют раствор из каналов и полостей, затем дважды последовательно промывают простерилизованные изделия стерильной водой. Простерилизованные изделия используют сразу по назначению или помещают в стерильную емкость, выложенную стерильной простыней, и хранят не более 3-х суток. В специальном журнале ведут обязательный учет всех циклов химической стерилизации с указанием даты, точного времени стерилизации (закладки, выемки раствора), название используемого препарата и его концентрации.
Препараты, используемые для стерилизации, классифицируются по группам: кислоты или щелочи, перекиси (6 % раствор перекиси водорода), спирты (этиловый, изопропиловый), альдегиды (формальдегид, глутаровый альдегид), галогены (хлор, хлорамин, иодофоры — вескодин), четвертичные аммониевые основания, фенольные соединения (фенол, крезол).
Кроме того, в качестве удобных и экономичных дезинфицирующих растворов могут использоваться универсальные препараты, т.е. позволяющие проводить обеззараживание от всех форм микроорганизмов (бактерий, в том числе микобактерий туберкулеза, вирусов, включая ВИЧ, патогенных грибов) или комбинированные препараты («Дезэффект», «Аламинал», «Септодор», «Виркон»), совмещающие одновременно два процесса — дезинфекцию и предстерилизационную обработку.
Комплекс дезинфекционных мероприятий, ориентированных на удаление или уничтожение возбудителей инфекционных болезней в объектах или на биотических объектах окружающей среды, т. е. при их передаче от источника к восприимчивым людям, делится на 2 вида: очаговая дезинфекция и профилактическая дезинфекция.
Очаговая дезинфекция
осуществляется в эпидемических очагах и в свою очередь подразделяется на текущую, если источник возбудителя присутствует, и заключительную, если источник удален.
Текущая дезинфекция
направлена на постоянное обеззараживание экскрементов, рвотных масс, мокроты, патологического отделяемого, перевязочного материала и др. объектов в окружении больного, которые обсеменены или могли быть обсеменены возбудителями в течение всего периода, пока больной или носитель служат источником возбудителя инфекции.
Заключительная дезинфекция
направлена на уничтожение патогенных микроорганизмов, оставшихся в очаге в жизнеспособном состоянии н различных предметах, хотя источник удален, т. е. после госпитализации, выздоровления или смерти больного. При заключительной дезинфекции обработке подлежат помещения, экскременты, рвотные массы, белье, предметы быта и все другие объекты, которые могли быть контаминированы возбудителями данного заболевания. Этот вид дезинфекции, как правило, осуществляется специализированными службами органов госэпиднадзора.
Профилактическая дезинфекция
проводится в том случае, если источник инфекции не обнаружен, но предполагается возможность его существования. Этот вид дезинфекции чаще всего используют в медицинских учреждениях (профилактика профессионального заражения медицинского персонала внутрибольничных инфекций), на предприятиях общественного питания, предприятиях, изготавливающих, перерабатывающих и реализующих пищевые продукты, а также в местах массовых скоплений людей, где может находиться источник возбудителя инфекционного заболевания среди здорового населения.
При кишечных инфекциях дезинфекционные мероприятия направлены на очистку и обеззараживание источников питьевого водоснабжения, сточных вод, отбросов, пищевых продуктов, материалов от больного, посуды, белья, пищеблоков, санузлов. В очаге проводят и текущую, и заключительную дезинфекцию.
При инфекциях дыхательных путей дезинфекцию проводят с цельюснижения микробного загрязнения воздуха конкретных помещений, что может достигаться путем не только влажной уборки и обеззараживания объектов в окружении больного, но и проветривания или УФ-облучения воздуха в данном помещении.
В очагах трансмиссивных инфекций дезинфекционные мероприятия проводят только при чуме, туляремии, лихорадке Ку, и на объектах, где работают с кровью.
При инфекциях наружных покровов дезинфекции подлежат все вещи, бывшие в употреблении (белье, расчески, ножницы, губки) в банях, душевых, бассейнах, парикмахерских, причем рекомендуется по возможности использовать универсальные препараты, обладающие бактерицидным (в т. ч. спорицидным), вирулицидным, фунгицидным свойствами.
При профилактике внутрибольничных инфекций дезинфекции должны подвергаться все изделия медицинского назначения после каждого пациента, руки персонала, раневая поверхность, операционное поле и т. д. и т. п.
Биологическая стерилизация
—
основана на применении антибиотиков, используется ограниченно — в культурах тканей для культивирования вирусов.
Контроль стерилизации
Требования по контролю за стерилизующим оборудованием изложен в «Методических указаниях по контролю работы парового и воздушного стерилизатора»
15/6 — 5 от 26.02.1991 г.
Плановый контроль работы стерилизатора проводят не реже 2-х раз в год. Самоконтроль работы стерилизатора проводят при каждой загрузке аппарата.
Контроль стерилизации осуществляется физическими, химическими и биологическими методами.
Физические и химические методы контроля являются методами оперативного контроля параметров режимов работы паровых и воздушных стерилизаторов, результаты которого учитывают в процессе стерилизационного цикла или сразу после его окончания.
Физический метод
контроля осуществляют с помощью средств измерений температуры (термометры) и давления (манометры).
Химический метод контроля предназначен для оперативного контроля одного или нескольких в совокупности режимов работы паровых и воздушных стерилизаторов. Осуществляют его с помощью химических тестов и термохимических индикаторов. Химические тесты
— это запаянная с обоих концов стеклянная трубка, заполненная смесью химических соединений с органическими красителями, или только химическим соединением, изменяющим свое агрегатное состояние и цвет при достижении для него определенной температуры плавления. Упакованные химические тесты номеруют и размещают в разных контрольных точках паровых и воздушных стерилизаторов. Термохимические индикаторы
представляют собой полоски бумаги, на одной стороне которых нанесен индикаторный слой, изменяющий свой цвет на цвет эталона при соблюдении температурных параметров режима стерилизации.
Биологические метод
предназначен для контроля эффективности работы стерилизаторов на основании гибели спор тест-культур. Осуществляют его с помощью биотестов.
Биотест — дозированное количество тест-культуры на носителе, например, на диске из фильтровальной бумаги, или помещенное в упаковку (стеклянные флаконы для лекарственных средств или чашечки из фольги). В качестве тест-культуры для контроля работы парового стерилизатора используются споры Bacillus stearothermophilus
ВКМ В-718, а воздушного стерилизатора — споры Bacillus licheniformis.
После стерилизации тесты помещают на питательную среду. Отсутствие роста на питательной среде свидетельствует о гибели спор во время стерилизации.
Биологический контроль
Этот вид контроля проводят 2 раза в год. Для этого используют биотесты, предназначенные для конкретного вида паровой или суховоздушной стерилизации.
Пронумерованные пакеты с биотестами размещают в контрольных точках стерилизатора. После проведенной стерилизации в пробирки с биотестами вносят 0,5 мл цветной питательной среды, начиная со стерильной пробирки для контроля питательной среды и заканчивая контрольным тестом, не подвергавшимся стерилизации (контроль культур).
Далее пробирки инкубируют. После чего проводят учет изменения цвета питательной среды. В контроле (стерильная проба) цвет среды не изменяется. В пробирке с контролем культуры цвет среды должен измениться на цвет, указанный в паспорте, что свидетельствует о наличии жизнеспособных спор.
Работа считается удовлетворительной, если цвет питательной среды во всех биотестах не изменился. Результаты заносят в журнал и регистрируют.
При необходимости контроля за стерильностью медицинских изделий, подвергнутых стерилизации, лаборант бактериологической лаборатории или операционная сестра под руководством сотрудников баклабораторий осуществляют забор проб на стерильность.
Исследование проводят согласно «Методическим рекомендациям по контролю стерильности изделий медицинского назначения». Пробы засевают на питательные среды с соблюдением правил асептики в боксах бактериологической лаборатории. В случаях, когда контролю подвергаются изделия большого размера, пробы забирают путем смыва с них с помощью стерильной салфетки. При отсутствии роста микроорганизмов во всех посевах из проб изделий одной загрузки в стерилизатор они считаются стерильными. При наличии роста хотя бы на одной питательной среде производят повторный контроль удвоенного количества образцов из данной загрузки.
Стерилизация текучим паром
Кипячение
Стерилизация влажным жаром
Стерилизация сухим жаром
Стерелизация (определение, способы, контроль качества стерелизации).
Стерилизация
— полное освобождение какого-либо предмета от всех видов микроорганизмов, включая бактерии и их споры, грибы,вирионы, а также от прионного белка, находящихся на поверхностях, оборудовании, в пищевых продуктах и лекарствах. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
При использовании этого способа стерилизации стерилизуемый объект нагревают в сушильном шкафу при температуре 180 °С в течение 20-40 мин или при 200 °С в течение 10-20 мин. Сухим жаром стерилизуют стеклянную или фарфоровую посуду, жиры, вазелин, глицерин, термоустойчивые порошки (каолин, тальк, кальция сульфат, цинка окись и т.д.). В сушильных шкафах нельзя стерилизовать водные растворы в стеклянной таре, так как вода при высоких температурах превращается в пар, и стекло может быть повреждено.
При использовании этого способа стерилизации комбинируется воздействие высокой температуры и влажности. Если сухой жар вызывает главным образом пирогенетичесое разрушение микроорганизмов, то влажный жар — коагуляцию белка, требующую участия воды. На практике стерилизация влажным паром проводится при температуре 50-150 °С и осуществляется следующими путями.
Этим способом стерилизуются резиновые предметы, хирургический (неодноразовый) инструментарий, стеклянная посуда. Применять кипячение для стерилизации инъекционных растворов не рекомендуется, так как по эффективности оно значительно уступает стерилизации парам и нередко приводит к снижению терапевтического эффекта от применения лекарственного препарата.
Текучим называется насыщенный водяной пар (без примеси воздуха), имеющий давление 760 мм рт. ст. и температуру 100 °С. Стерилизацию текучим паром осуществляют в паровом стерилизаторе или автоклаве в течение 15-60 мин в зависимости от объема раствора. Это самый распространенный метод стерилизации инъекционных растворов в аптеках.
Осуществляется в различной конструкции автоклавах. Автоклав представляет собой герметично закрывающуюся емкость, состоящую из толстостенной стерилизационной камеры и кожуха. На автоклаве имеется предохранительный клапан, обеспечивающий выход пара при избыточном давлении, и манометр. Каждый автоклав должен иметь инструкцию по эксплуатации и уходу.
Стерилизуемый объект помещают внутрь паровой камеры. Паровую камеру подвергают нагреванию. Вначале автоклав нагревают при открытом кране до тех пор, пока пар не пойдет сильной сплошной струей и не вытеснит находящийся в автоклаве воздух, который значительно снижает теплопроводность водяного пара (при содержании в водяном паре 5 % воздуха она уменьшается на 50 %). Во время нагревания автоклава после закрывания крана необходимо следить за давлением, параллельно с возрастанием которого увеличивается температура пара. Зависимость между температурой и давлением пара выражается следующим образом: 1 атм — 100 °С; 1,5 атм — 112,7 °С; 2 атм — 119,6 °С; 3 атм — 132,9 °С; 5 атм — 151,1 °С.
Автоклавирование является наиболее надежным способом стерилизации. Обычно стерилизация в автоклаве производится при 120 °С в течение 5-30 мин в зависимости от объема раствора. Этим гарантируется достаточно полная стерилизация независимо от вида микроорганизма. Таким способом стерилизуют посуду, фильтры, инструменты, водные растворы устойчивых к воздействию высокой температуры лекарственных веществ, перевязочный материал.
Данный способ стерилизации питательных сред является наиболее надежным и чаще всего применяемым. Он основан на нагревании материала насыщенным водяным паром при давлении выше атмосферного. Известно, что температура пара возрастает при повышении его давления (табл. 4.1).
Совместное действие высокой температуры и пара обеспечивает особую эффективность этого процесса. При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при 121 °С. Лишь споры некоторых почвенных бактерий погибают при 1 ати только через 30 мин.
Таблица 4.1 Температура насыщенного пара при разных давлениях
ати* — избыточное атмосферное давление
Рис. 4.1. Схема автоклава:
1 — стерилизационная камера; 2 — кран для выхода воздуха; 3 — манометр; 4- предохранительный клапан; 5- водопаровая камера; 6 — воронка для заполнения автоклава водой; 7 — водомерная трубка; 8 — отверстия для поступления пара в стерили-зационную камеру; 9 — защитный кожух; 10 — крышка автоклава; 11 — подставка для размещения стерилизуемых предметов
Стерилизацию паром под давлением осуществляют в специальных герметически закрывающихся толстостенных аппаратах — автоклавах. Автоклавы разнообразны по форме, размерам, рабочему давлению, конструкции и другим показателям. Они могут быть с ручным управлением, полуавтоматические и автоматические, но, поскольку все автоклавы предназначены для выполнения одной и той же задачи — стерилизации, основной принцип их устройства один и тот же.
На рис. 4.1 показана схема вертикального автоклава с ручным у правлением. Автоклав представляет собой металлический двустенный резервуар, способный выдержать высокое давление. Его внутренняя часть является стерилизационной камерой (7). В нее помещают стерилизуемый материал. Стерилизационная камера снабжена краном (2) для выхода воздуха, манометром (3) для определения давления пара и предохранительным клапаном (4) для выхода пара при повышении давления сверх необходимого и для предотвращения разрыва автоклава. Пространство между стенками, называемое водопаровой камерой (5), заполняется через воронку (6) водой (лучше дистиллированной, чтобы не образовывалась накипь) до определенного уровня, который отмечен на специальной водомерной трубке автоклава (7). Выше этого уровня воду наливать не следует, так как при бурном кипении вода может попасть в трубку, ведущую к манометру и исказить его показания. В верхней части внутренней стенки водопаровой камеры имеются отверстия (8), через которые пар поступает в стерилизационную камеру. Паровой котел сверху покрыт защитным кожухом (9). Он предохраняет котел от механических повреждений, а работающего около автоклава — от ожогов. Для создания герметичности автоклав плотно закрывают массивной крышкой (10) с резиновой прокладкой. Стерилизуемые предметы помещают на специальную подставку (11).
Процесс автоклавирования.
Отдельные операции процесса стерилизации в автоклавах разных типов могут быть несколько различными. Соответственно несколько различается и техника работы с ними, однако общий принцип проведения стерилизации в разных автоклавах одинаковый.
Перед работой осматривают автоклав и контрольно-измерительную аппаратуру. При наличии любой неисправности (смещение стрелки манометра с нуля, трещина на водомерной трубке и др.) работать с прибором нельзя. После осмотра автоклава в водопаровую камеру наливают воду до верхней отметки на водомерной трубке. В стерилизационную камеру на специальную подставку из дерева помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними, иначе они не нагреются до нужной температуры и могут остаться нестерильными. Загрузив стерилизационную камеру, устанавливают и плотно завинчивают крышку (дверь) автоклава. Затем открывают кран, соединяющий стерилизационную камеру с наружным воздухом, и включают нагрев.
После начала парообразования удаляют воздух из стерилизационной камеры. Это необходимое условие стерилизации, так как при одном и том же давлении температура чистого пара выше температуры смеси пара и воздуха. Если в автоклаве останется воздух, материал может не простерилизоваться. Наиболее простой и очень распространенный способ освобождения автоклава от воздуха — вытеснение воздуха паром. Пар и конденсат отводят либо в сосуд с водой, либо в специальное устройство, соединенное с канализацией. В первом случае на кран (2) надевают резиновый шланг, который опускают в воду. Началом продувания считается появление устойчивой непрерывной струи чистого пара. Пока в автоклаве еще имеется воздух, смесь воздуха и пара, проходя через воду, издает сильный треск. Чистый пар выходит с равномерным шипящим звуком. Его пропускают в течение 10 мин. В целом вся операция с момента появления пара с воздухом должна занимать не более 15 — 20 мин, иначе в автоклаве останется мало воды и он может испортиться. Чтобы уменьшить расход пара (воды), кран открывают не полностью. Степень открывания крана устанавливают на практике при эксплуатации автоклава. В наиболее совершенных автоклавах воздух из стерилизационной камеры удаляют с помощью вакуумного насоса.
Когда воздух вытеснен, закрывают пароотводной кран, и давление пара доводят до показания, соответствующего режиму стерилизации. Режим автоклавирования часто выражают в единицах избыточного давления, указывая при этом длительность его поддержания, например стерилизация при 1 ати в течение 20 мин. На манометре автоклава обозначается именно то избыточное давление, которое создается в автоклаве сверх нормального. Нередко режим автоклавирования характеризуется температурой и временем. Как только стрелка манометра дойдет до указателя определенного дополнительного давления и, следовательно, температура пара достигнет соответствующего значения, этот уровень давления пара поддерживают в течение необходимого времени путем ручного или автоматического регулирования подачи пара. В автоматических автоклавах подачу пара регулируют электроконтактным манометром.
По окончании времени стерилизации выключают нагрев автоклава. Давление в автоклаве постепенно падает и сравнивается с атмосферным. Лишь после этого открывают кран, выводящий пар. Преждевременное открывание крана недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает стерильность материала. Когда пар выйдет, открывают крышку (дверь) автоклава, соблюдая при этом осторожность во избежание ожога паром лица и рук. Удаление пара из стерилизационной камеры автоклавов, оснащенных вакуумным насосом, осуществляют с помощью насоса. Одновременно происходит подсушивание стерильного материала.
Поскольку автоклав работает при высоких давлениях и температурах, неправильное обращение с ним может быть причиной несчастных случаев. Установка автоклава и работа с ним производятся при точном и строгом выполнении правил, указанных в прилагаемой к автоклаву инструкции. К работе допускаются только подготовленные лица, имеющие специальное разрешение.
При необходимости проконтролировать температуру в автоклаве пользуются разными веществами, плавящимися при определенной температуре. Эти вещества предварительно смешивают с нейтральными красителями и помещают в автоклав до начала стерилизации. В качестве индикаторов температуры используют фенантрен (температура плавления 98-100°С), бензаурин (115°С), серу (119 °С), бензойную кислоту (121 — 122 °С), мочевину (132°С), глюкозу (146°С), тиомочевину (180°С), аскорбиновую кислоту (187- 192 °С). На 100 г этих веществ берут 0,01 г красителя (фуксин, метиленовый синий), тщательно смешивают, рассыпают в стеклянные трубочки с одинаковым диаметром и толщиной стенок, запаивают и в вертикальном положении раскладывают между стерилизуемым материалом в автоклаве. По достижении в сосуде соответствующей температуры эти вещества расплавляются и окрашиваются в цвет добавленного в них красителя.
Подготовка сред к стерилизации.
При автоклавировании 3 — 5 % жидкости теряется в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5 % дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию.
Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками. Они предохраняют среду от заражения микроорганизмами, находящимися в окружающем воздухе.
Пробки должны быть достаточно плотными, чтобы выполнять эту функцию, но с достаточно равномерным распределением волокон ваты, так как через них происходит газообмен культур с окружающей средой. Слишком плотные пробки затрудняют снабжение культур воздухом.
Для приготовления пробки плоский кусок ваты, взятый вдоль волокна, скатывают валиком. Чтобы придать пробке прочность, ее прокатывают между ладонью и чистым стеклом, лежащим на столе. Длина пробки для обычной пробирки примерно 4 см. Пробка должна входить в пробирку на 1,5 — 2,0 см (рис. 4.2). Для сохранения формы пробку вынимают из горлышка, слегка вращая. Удобно обернуть пробку чистой марлевой салфеткой.
Перед стерилизацией пробки можно прикрыть бумажными колпачками. Нельзя обертывать пробки сосудов, которые будут стерилизоваться в автоклаве, целлофаном, фольгой или другими материалами, не пропускающими пар, так как пар должен проникать через пробку в сосуд, иначе среды не нагреются до нужной температуры и не простерилизуются. При использовании стеклянных, резиновых, корковых и других пробок их завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Пробки в сосуде меняют стерильно около пламени горелки.
Б. Стерилизация водяным паром под давлением
Лабораторную посуду перед стерилизацией
необходимо тщательно вымыть, высушить,
завернуть в бумагу. Чашки
заворачивают в бумагу по одной или
несколько штук. В верхние концы
пипеток вставляют ватные тампоны,
предупреждающие
засасывание материала Градуированные
пипетки заворачивают в длинные
полоски бумаги шириной 5 см. На бумаге
отмечают объем завернутой пипетки.
В пеналах пипетки стерилизуют без
дополнительного завертывания в бумагу.
Острые
концы пастеровских пипеток запаивают
в пламени горелки и заворачивают
в бумагу по 3-5 штук.
Флаконы,
колбы, пробирки закрывают ватно-марлевыми
пробками. Пробка должна
входить в горлышко сосуда на 2/3 длины,
не слишком туго, но и не свободно.
Поверх пробок на сосуд надевают бумажный
колпачок. Пробирки связывают по 5-50
штук и обертывают поверх бумагой.
Режим
работы сухожарового шкафа
Стерилизацию
сухим жаром осуществляют в сухожаровых
шкафах (печь Пастера).
Сухим жаром стерилизуют лабораторную
посуду. Ее неплотно загружают в печь,
чтобы был равномерный прогрев материала.
Дверь шкафа плотно закрывают, включают
электронагревательный прибор и доводят
температуру до 160-165 0 С
и стерилизуют 1
час. По окончании стерилизации выключают
обогрев, но дверцу шкафа не открывают,
пока печь не остынет (иначе холодный
воздух вызовет образование трещин
на посуде). Режим стерилизации: 160°С — 60
мин, 180°С — 15 мин, 200° С — 5 мин.
Жидкости, питательные среды, предметы
из
резины
и синтетических материалов
нельзя стерилизовать сухим жаром.
Стерилизации
паром
под
давлением
подвергают
перевязочный материал, операционное
белье, хирургические инструменты,
питательные среды, лабораторную
посуду, инфицированный материал,
инъекционные растворы. Материал помещают
в емкости (биксы). На дно бикса помещают
прокладки из ткани, впитывающие
влагу после стерилизации. Стерильность
материала сохраняется 3 суток.
Инфицированный материал в чашках и
пробирках стерилизуют в металлических
бачках
с крышкой.
Стерилизацию
паром под давлением производят в
автоклаве. При однократной
обработке погибают как вегетативные,
так и споровые формы бактерий. Паром
под
давлением стерилизуют питательные
среды, кроме сред, содержащих нативные
белки, жидкости, приборы, имеющие
резиновые части. Простые среды (МПА,
МПБ)
стерилизуют 20 мин при 120°С (1 атм). Среды,
содержащие нативные белки и
углеводы, при этой температуре нельзя
стерилизовать, т. к. это легко изменяющиеся
от нагревания вещества. Среды с углеводами
стерилизуют дробно при 100 0 С
или в автоклаве при 112 0 С
(5 атм.) 10-15 мин. Различные жидкости,
приборы, имеющие резиновые шланги,
пробки, бактериальные свечи и фильтры
стерилизуют при 120 0 С
(1 атм.) в течение 20 мин.
Инфицированный
материал (в пробирках, чашках) помещают
в специальные металлические ведра или
баки с отверстиями для проникновения
пара и стерилизуют при 126 0 С
(1,5 атм.) в течение 1 часа. Также стерилизуют
инструменты после работы со споровыми
бактериями.
Существует 2 режима стерилизации:
Текучим паром в автоклаве или в аппарате
Коха при не завинченной крышке и открытом
выпускном клапане, когда антибактериальное
действие пара проявляется в отношении
вегетативных форм. Так стерилизуют
среды с витаминами и углеводами,
мочевиной, молоком, картофелем и
желатином. Для полного обеспложивания
применяют дробную стерилизацию (при
100 0 С) 20-30 мин 3 дня подряд. Это
убивает и споры.
Стерилизация паром под давлением –
наиболее эффективный метод обеспложивания.
Перевязочный материал, белье стерилизуют
при 1 атм. 15-20 мин, инфицированный материал
при 1,5-2 атм в течение 20-25 мин.
Стерилизация паром.
Стерилизация паром.
Насыщенный водяной пар под давлением обладает высокими биоцидными св-вами, не повреждает большинство стерилизуемых материалов, не нуждается в освобождении от стерилизующего агента. Для С.п. характерны надежность, доступность, безопасность для персонала, экономичность, высокая степень автоматизации. Стерилизующий эффект пара связан с прогреванием объекта в процессе конденсации пара в воду на поверхности и внутри предмета. Эффект конденсации оптимален у насыщенного пара, когда в нем находится только 3% жидкой фазы. Перегретый пар,
содержащий менее 2% жидкой фазы, может сжечь объект; влажный пар
(более 3% жидкой фазы) сильно увлажняет предметы. Для получения стерилизующего эффекта также необходимо, чтобы из рабочей камеры был полностью удален воздух, иначе он может помешать контакту пара с поверхностью предмета и оставить его нестерильным.
Выпускают 2 типа паровых стерилизаторов. Первый — стерилизаторы перемещения тяжестью; в них поток пара проникает в верхнюю часть камеры и вытесняет из нее воздух через дренажную трубку. Давление и температура пара возрастают и достигают установленной величины. Включается таймер, к-рый поддерживает постоянную температуру до окончания экспозиции. После этого пар выводится через дренаж из камеры; рубашка камеры остается горячей и ее сухой жар высушивает стерилизуемые объекты. Крышка (дверь) открывается при снижении температуры камеры до 90 °С. В ином случае контейнеры с жидкостью могут взорваться. Второй тип носит название предвакуумный паровой стерилизатор. В нем вакуумная система в 2 цикла вытягивает большинство воздуха из камеры и стерилизуемых объектов через дренаж, после чего камеру и ее рубашку наполняют паром под давлением. Давление и постоянная температура поддерживаются автоматически. После окончания срока стерилизации камера освобождается от пара и объекты высушиваются с помощью вакуумной системы, в камеру впускают фильтрованный воздух. Стерилизатор выгружается. В зависимости от стерилизуемых объектов температуру пара в паровых стерилизаторах устанавливают от 110 до 138°С, давление пара от 0,4 до 2,5 атм, экспозиция — от 15 до 60 мин. Паром стерилизуют почти все изделия из металла, стекла, термостойкой пластмассы, резины, белье, перевязочный и шовный материал, питательные среды, в том числе жидкие, лекарственные препараты. С.п. — предпочтительный способ стерилизации. Исключение составляют термолабильные материалы, крупногабаритные предметы, сложные многокомпонентные приборы типа эндоскопов.
(Источник: «Словарь терминов микробиологии»)
Смотреть что такое «Стерилизация паром.» в других словарях:
автоклавирование/стерилизация паром
— См. также Autoclave (автоклав). [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация EN steam autoclaving … Справочник технического переводчика
стерилизация
— и, ж. stérilisation f. 1. Уничтожение микроорганизмов кипячением, прогреванием, воздействием химических веществ и т. п.; обеззараживание. Стерилизация молока. Лучевая стерилизация. Стерилизация паром. БАС 1. Стерилизация хирургических… … Исторический словарь галлицизмов русского языка
СТЕРИЛИЗАЦИЯ
— СТЕРИЛИЗАЦИЯ. Стерилизация в хирургии. Для обеззараживания хир. инструментов употребляются металлические стерилизаторы ки Ряе. 1. Рисунок 2. пятильники. Наиболее простыми, удобными для применения в походных условиях (экстренная операция, в… … Большая медицинская энциклопедия
I Стерилизация (лат. sterilis бесплодный) полноте уничтожение всех видов микроорганизмов и их спор на поверхности и внутри различных предметов, а также в жидкостях и воздухе. Применяется в медицине, микробиологии, гнотобиологии, пищевой… … Медицинская энциклопедия
И; ж. [от лат. sterilis бесплодный] 1. Уничтожение микроорганизмов различных веществ и предметов действием высоких температур, химических веществ, фильтрацией в пищевых продуктах, на хирургических инструментах, перевязочном материале. С.… … Энциклопедический словарь
СТЕРИЛИЗАЦИЯ
— (от лат. sterilis бесплодный), обеспложивание, уничтожение различных микроорганизмов и их спор в разных объектах с помощью физических и химических факторов. С. важна для клинической ветеринарии при всех хирургических манипуляциях,… … Ветеринарный энциклопедический словарь
— мероприятие для борьбы с вредителями и почвоутомлением. С. п. ч. осуществляется путем обработки почвы различными антисептиками (хлороформом, толуолом, хлорпикрином и др. соединениями, уничтожающими вредителей и фитопатогенные микроорганизмы) и… … Толковый словарь по почвоведению
стерилизация
— и; ж. (от лат. sterilis бесплодный) см. тж. стерилизационный 1) Уничтожение микроорганизмов различных веществ и предметов действием высоких температур, химических веществ, фильтрацией в пищевых продуктах, на хирургических инструментах,… … Словарь многих выражений
Стерилизация проводится в автоклаве под давлением обычно (посуда, физиологический раствор, дистиллированная вода, питательные среды, не содержащие белков и углеводов, различные приборы, изделия из резины) в течение 20-30 минут при температуре 120-121 °С (1 атм.), хотя могут быть и другие соотношения между временем и температурой в зависимости от стерилизуемого объекта.
Любые растворы, содержащие белки и углеводы, стерилизуют в автоклаве при 0,5 атм. (115 °С) в течение 20-30 минут.
Любой инфицированный микроорганизмами (заразный) материал стерилизуют при давлении в 1,5 атм. (127 °С) — 1 час, или при давлении 2,0 атм. (132 о С) – 30 минут.
Когда стерилизуемые растворы находятся в стеклянных сосудах, по окончании цикла стерилизации необходимо контролировать время охлаждения, а также медленно понижать давление, т. к. открывать автоклав можно только после того, как в нем установилось давление окружающей среды.
Стерилизация облучением
Излучение может быть неионизирующим (ультрафиолетовое, инфракрасное, ультразвуковое, радиочастотное) и ионизирующим – корпускулярным (электроны) или электромагнитным (рентгеновские лучи или гамма-лучи).
Эффективность облучения зависит от полученной дозы, а выбор дозы определяется микробным загрязнением, формой и составом материала, подлежащегостерилизации.
Ультрафиолетовое облучение (254 нм) обладает малой проникающей способностью, поэтому требует достаточно длительного воздействия и используется в основном для стерилизации воздуха, открытых поверхностей в помещениях.
Ионизирующее излучение, в первую очередь, гамма-облучение, успешно применяется для стерилизации в промышленных условиях медицинских изделий из термолабильных материалов, поскольку позволяют быстро облучать материалы еще на стадии производства (при любой температуре и герметичной упаковке). В настоящее время широко используется для получения стерильных одноразовых пластмассовых изделий (шприцы, системы для переливания крови, чашки Петри) и хирургических перевязочных и шовных материалов.
Механические методы
Фильтры задерживают микроорганизмы благодаря пористой структуре матрикса, но для пропускания раствора через фильтр требуется вакуум или давление, поскольку сила поверхностного натяжения при таком малом размере пор не дает жидкостям фильтроваться.
Существуют 2 основных типа фильтров — глубинные и фильтрующие.
Глубинные фильтры состоят из волокнистых или гранулированных материалов (асбест, фарфор, глина), которые спрессованы, свиты или связаны в лабиринт проточных каналов, поэтому четкие параметры размера пор отсутствуют.
Частицы задерживаются в них в результате адсорбции и механического захвата в матриксе фильтра, что обеспечивает достаточно большую емкость фильтров, но может приводить к задержке части раствора.
Фильтрующие фильтры имеют непрерывную структуру, и эффективность захвата ими частиц определяется в основном соответствию их размеру пор фильтра. Мембранные фильтры имеют низкую емкость, но эффективность не зависит от скорости протока и перепада давлений, а фильтрат почти или совсем не задерживается.
Мембранная фильтрация в настоящее время широко применяется для стерилизации масел, мазей и растворов, неустойчивых к нагреванию — раствор для внутривенных инъекций, диагностические препараты, растворы витаминов и антибиотиков, сред для культур тканей и т. д. и т. п..
Химические методы
Химические методы стерилизации, связанные с применением химических веществ, обладающих явно выраженной антимикробной активностью, делятся на 2 группы: стерилизация газами и растворами (чаще известна как «дезинфекция»).
Химические методы стерилизации газами используются в лечебно- профилактических учреждениях для обеззараживания медицинских материалов и оборудования, которые нельзя стерилизовать другими способами (оптические приборы, кардиостимуляторы, аппараты искусственного кровообращения, эндоскопы, изделия из полимеров, стекла).
Бактерицидными свойствами обладают многие газы (формальдегид, окись пропилена, озон, надуксусная кислота и метилбромид), но шире всего используется окись этилена, поскольку она хорошо совместима с различными материалами (не вызывает коррозию металла, порчи обрабатываемых изделий из бумаги, резины и всех марок пластмасс). Время экспозиции при использовании газового метода стерилизации варьирует от 6 до 18 часов в зависимости от концентрации газовой смеси и объема специального аппарата (емкости) для этого вида стерилизации. Согласно «Методическим рекомендациям по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов» № 26-613 от 09.02.88 г. для стерилизации газами в качестве газового стерилизационного аппарата возможно применение микроанаэростата, а кроме окиси этилена или смеси окиси этилена с бромистым метилом, — паров 40 % формальдегида в этиловом спирте при температуре 80 °С в стерилизационной камере в течение 60 минут.
Контроль стерильности
производят в специально оборудованных боксах, исключающих возможность вторичного контакта изделий с микрофлорой. Для контроля отбирают не менее 1 % из числа одновременно простерилизированных изделий. Производят посев изделий в питательную среду для контроля. При отсутствии роста бактерий дают заключение о стерильности изделия.
Стерилизация растворами применяется при обработке большинства поверхностей (пространств) или медицинских приборов, которые не могут бытьобеззаражены другими методами.
Согласнотребованиям отраслевого стандарта ОСТ 42-21-2-85 «Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» большинство изделий медицинского назначения из металла, стекла, пластмасс, резины, проходят предстерилизационную обработку, состоящую из нескольких этапов:
Замачивание в моющем растворе при полном погружении изделия в дезинфицирующий раствор в течение 15-ти минут;
Мойка каждого изделия в разобранном виде в моющем растворе в ручном режиме в течение 1-ой минуты;
Ополаскивание под проточной водой хорошо промытых изделий в течение 3-10 минут;
Сушка горячим воздухом в сушильном шкафу.
Контроль качества предстерилизационной очистки изделий медицинского назначения на наличие крови проводят путем постановки амидопириновой пробы. Остаточные количества щелочных компонентов моющего средства определяют с помощью фенолфталеиновой пробы.
Согласно требованиям этого же ОСТа обязательным условием стерилизации растворами изделий медицинского назначения является полное погружение изделий в стерилизационный раствор в разобранном виде, с заполнением каналов и полостей, при температуре раствора не менее 18 °С. Используют только эмалированные емкости (без повреждений) со стеклянными или пластмассовыми крышками. После стерилизации изделия быстро извлекают из раствора с помощью пинцетов или корнцангов, удаляют раствор из каналов и полостей, затем дважды последовательно промывают простерилизованные изделия стерильной водой. Простерилизованные изделия используют сразу по назначению или помещают в стерильную емкость, выложенную стерильной простыней, и хранят не более 3-х суток. В специальном журнале ведут обязательный учет всех циклов химической стерилизации с указанием даты, точного времени стерилизации (закладки, выемки раствора), название используемого препарата и его концентрации.
Препараты, используемые для стерилизации, классифицируются по группам: кислоты или щелочи, перекиси (6 % раствор перекиси водорода), спирты (этиловый, изопропиловый), альдегиды (формальдегид, глутаровый альдегид), галогены (хлор, хлорамин, иодофоры — вескодин), четвертичные аммониевые основания, фенольные соединения (фенол, крезол).
Кроме того, в качестве удобных и экономичных дезинфицирующих растворов могут использоваться универсальные препараты, т.е. позволяющие проводить обеззараживание от всех форм микроорганизмов (бактерий, в том числе микобактерий туберкулеза, вирусов, включая ВИЧ, патогенных грибов) или комбинированные препараты («Дезэффект», «Аламинал», «Септодор», «Виркон»), совмещающие одновременно два процесса — дезинфекцию и предстерилизационную обработку.
Комплекс дезинфекционных мероприятий, ориентированных на удаление или уничтожение возбудителей инфекционных болезней в объектах или на биотических объектах окружающей среды, т. е. при их передаче от источника к восприимчивым людям, делится на 2 вида: очаговая дезинфекция и профилактическая дезинфекция.
Очаговая дезинфекция
осуществляется в эпидемических очагах и в свою очередь подразделяется на текущую, если источник возбудителя присутствует, и заключительную, если источник удален.
Текущая дезинфекция
направлена на постоянное обеззараживание экскрементов, рвотных масс, мокроты, патологического отделяемого, перевязочного материала и др. объектов в окружении больного, которые обсеменены или могли быть обсеменены возбудителями в течение всего периода, пока больной или носитель служат источником возбудителя инфекции.
Заключительная дезинфекция
направлена на уничтожение патогенных микроорганизмов, оставшихся в очаге в жизнеспособном состоянии н различных предметах, хотя источник удален, т. е. после госпитализации, выздоровления или смерти больного. При заключительной дезинфекции обработке подлежат помещения, экскременты, рвотные массы, белье, предметы быта и все другие объекты, которые могли быть контаминированы возбудителями данного заболевания. Этот вид дезинфекции, как правило, осуществляется специализированными службами органов госэпиднадзора.
Профилактическая дезинфекция
проводится в том случае, если источник инфекции не обнаружен, но предполагается возможность его существования. Этот вид дезинфекции чаще всего используют в медицинских учреждениях (профилактика профессионального заражения медицинского персонала внутрибольничных инфекций), на предприятиях общественного питания, предприятиях, изготавливающих, перерабатывающих и реализующих пищевые продукты, а также в местах массовых скоплений людей, где может находиться источник возбудителя инфекционного заболевания среди здорового населения.
При кишечных инфекциях дезинфекционные мероприятия направлены на очистку и обеззараживание источников питьевого водоснабжения, сточных вод, отбросов, пищевых продуктов, материалов от больного, посуды, белья, пищеблоков, санузлов. В очаге проводят и текущую, и заключительную дезинфекцию.
При инфекциях дыхательных путей дезинфекцию проводят с цельюснижения микробного загрязнения воздуха конкретных помещений, что может достигаться путем не только влажной уборки и обеззараживания объектов в окружении больного, но и проветривания или УФ-облучения воздуха в данном помещении.
В очагах трансмиссивных инфекций дезинфекционные мероприятия проводят только при чуме, туляремии, лихорадке Ку, и на объектах, где работают с кровью.
При инфекциях наружных покровов дезинфекции подлежат все вещи, бывшие в употреблении (белье, расчески, ножницы, губки) в банях, душевых, бассейнах, парикмахерских, причем рекомендуется по возможности использовать универсальные препараты, обладающие бактерицидным (в т. ч. спорицидным), вирулицидным, фунгицидным свойствами.
При профилактике внутрибольничных инфекций дезинфекции должны подвергаться все изделия медицинского назначения после каждого пациента, руки персонала, раневая поверхность, операционное поле и т. д. и т. п.
Биологическая стерилизация
—
основана на применении антибиотиков, используется ограниченно — в культурах тканей для культивирования вирусов.
Контроль стерилизации
Требования по контролю за стерилизующим оборудованием изложен в «Методических указаниях по контролю работы парового и воздушного стерилизатора»
15/6 — 5 от 26.02.1991 г.
Плановый контроль работы стерилизатора проводят не реже 2-х раз в год. Самоконтроль работы стерилизатора проводят при каждой загрузке аппарата.
Контроль стерилизации осуществляется физическими, химическими и биологическими методами.
Физические и химические методы контроля являются методами оперативного контроля параметров режимов работы паровых и воздушных стерилизаторов, результаты которого учитывают в процессе стерилизационного цикла или сразу после его окончания.
Физический метод
контроля осуществляют с помощью средств измерений температуры (термометры) и давления (манометры).
Химический метод контроля предназначен для оперативного контроля одного или нескольких в совокупности режимов работы паровых и воздушных стерилизаторов. Осуществляют его с помощью химических тестов и термохимических индикаторов. Химические тесты
— это запаянная с обоих концов стеклянная трубка, заполненная смесью химических соединений с органическими красителями, или только химическим соединением, изменяющим свое агрегатное состояние и цвет при достижении для него определенной температуры плавления. Упакованные химические тесты номеруют и размещают в разных контрольных точках паровых и воздушных стерилизаторов. Термохимические индикаторы
представляют собой полоски бумаги, на одной стороне которых нанесен индикаторный слой, изменяющий свой цвет на цвет эталона при соблюдении температурных параметров режима стерилизации.
Биологические метод
предназначен для контроля эффективности работы стерилизаторов на основании гибели спор тест-культур. Осуществляют его с помощью биотестов.
Биотест — дозированное количество тест-культуры на носителе, например, на диске из фильтровальной бумаги, или помещенное в упаковку (стеклянные флаконы для лекарственных средств или чашечки из фольги). В качестве тест-культуры для контроля работы парового стерилизатора используются споры Bacillus stearothermophilus
ВКМ В-718, а воздушного стерилизатора — споры Bacillus licheniformis.
После стерилизации тесты помещают на питательную среду. Отсутствие роста на питательной среде свидетельствует о гибели спор во время стерилизации.
Биологический контроль
Этот вид контроля проводят 2 раза в год. Для этого используют биотесты, предназначенные для конкретного вида паровой или суховоздушной стерилизации.
Пронумерованные пакеты с биотестами размещают в контрольных точках стерилизатора. После проведенной стерилизации в пробирки с биотестами вносят 0,5 мл цветной питательной среды, начиная со стерильной пробирки для контроля питательной среды и заканчивая контрольным тестом, не подвергавшимся стерилизации (контроль культур).
Далее пробирки инкубируют. После чего проводят учет изменения цвета питательной среды. В контроле (стерильная проба) цвет среды не изменяется. В пробирке с контролем культуры цвет среды должен измениться на цвет, указанный в паспорте, что свидетельствует о наличии жизнеспособных спор.
Работа считается удовлетворительной, если цвет питательной среды во всех биотестах не изменился. Результаты заносят в журнал и регистрируют.
При необходимости контроля за стерильностью медицинских изделий, подвергнутых стерилизации, лаборант бактериологической лаборатории или операционная сестра под руководством сотрудников баклабораторий осуществляют забор проб на стерильность.
Исследование проводят согласно «Методическим рекомендациям по контролю стерильности изделий медицинского назначения». Пробы засевают на питательные среды с соблюдением правил асептики в боксах бактериологической лаборатории. В случаях, когда контролю подвергаются изделия большого размера, пробы забирают путем смыва с них с помощью стерильной салфетки.)
110 °С, бензойная кислота, / пл 120 °С).
Особое внимание следует обратить на стерилизацию питательных сред. Режим автоклавирования, которое в данном случае является наиболее распространенным и эффективным методом, не должен изменять свойства среды (табл. 7).
Таблица 7
Режим стерилизации различных сред автоклавированием
Как правило, принято считать, что при давлении, атм; 0,5; 1,0; 1,5; 2,0 достигается определенная температура, °С; 115, 120, 127, 133 соответственно. До 2 атм давление повышают при сильном засорении материала устойчивыми к температуре формами микроорганизмов. Продолжительность стерилизации зависит от состава стерилизуемого объекта и степени его бактериального загрязнения и колеблется от 30 мин до 1 — 1,5 ч.
Эффективность стерилизации проверяют высевом на питательные среды материала, заведомо зараженного спорами. Материал выдерживают в автоклаве вместе со стерилизуемыми объектами.
Большинство автоклавов относится к гравитационным: пар движется в них сверху вниз под действием разности плотностей воздуха и пара. Весьма важны правильное приготовление стерилизуемых образцов и соответствующая загрузка автоклава.
Наиболее удобны автоматические автоклавы, оснащенные датчиками времени и автоматическими регуляторами температуры. Лабораторные автоклавы должны иметь датчики режима работы на шкалах термометра. Упаковки образцов должны располагаться свободно по отношению друг к другу, чтобы не препятствовать проникновению пара.
В зависимости от объема жидкости и числа емкостей в загрузке меняется продолжительность стерилизации (табл. 8). Она меньше для малых объемов. Таким образом, можно подобрать продолжительность циклов стерилизации по размерам и числу емкостей.
Таблица 8
Влияние объема жидкости и числа емкостей на время, необходимое для достижения температуры 121 °С в автоклаве
По окончании цикла стерилизации необходимо медленно понижать давление, строго соблюдая продолжительность охлаждения стерилизуемой питательной среды. Перед тем как открыть автоклав, необходимо убедиться, что в нем установилось давление окружающей среды, показываемое на манометре. Если открыть крышку автоклава преждевременно (раньше, чем упадет давление), могут произойти заброс воздуха внутрь, загрязнение раствора, закипание жидкости в сосудах или колбах и выталкивание из них пробок. При стерилизации колб и бутылей нужно неплотно закрывать пробки, чтобы обеспечить вентиляцию и предотвратить разбивание стекла.
Питательные среды, содержащие углеводы, стерилизуют в автоклаве при пониженном давлении (0,5 атм) и температуре 110-112 °С в течение 10-15 — 20 мин, отсчитывая время с момента достижения нужного давления.
Среды наливают не выше половины высоты сосуда (табл. 9), пробки из ваты должны быть достаточно плотными, обернутые марлей, но не целлофаном. Поверх пробки горлышко колбы накрывают газетой или пергаментом и фиксируют нитками.
Таблица 9
Уровень наполненности различных типов колб жидкостями
Режим стерилизации.Стерилизация в паровых стерилизаторах (автоклав )
Дезинфекция предметов ухода химическая.
Грелки, пузырь со льдом,–двукратное протирание с интервалом 15 минут ветошью смоченной в 1% р-ре хлорамина, 0,5% гипохлорида кальция, промыть водой горячей с мылом, ополоснуть, высушить,хранить в сухом месте.
Термометр подмышечный— полное погружение в 2%р-р хлорамина, на 15 минут.
3% р-р хлорамина,1,5%р-р гипохлорида кальция на 5 минут, промыть под холодной проточной водой, хранить в сухом месте, 0,5% хлоромин-30 мин..
Ректальный термометр- полное погружение в 3%р-р хлоармина на 60 минут промыть под проточной водой, холодной, затем протереть спиртом 70 %.
Зонды желудочные, катетеры мочевые,газоотводные трубки , грушевидный балон, шпателя 3 этапа Дезинфекция и предстерилизационная очистка 2,5% велтолен-60 минут,аламинол5%-60 минут.
Стерилизация 6% перикись водорода-6часов,кроме шпателей-автоклавирование.или
Полное погружение в 3%хлорамин-60 минут,1,5% гипохлорид кальция -60 минут промыть под проточной водой дезинфекция, Предстерилизационная очистка в 0,5% моющем растворе 45-50 с 15 минут.промыть под проточной водой.
Стерилизация 6% перикись водорода-6 часов.
Судно, мочеприемники, клеенка загрязненная –освободить от содержимого,полное погружение в 1% хлорамин, 0,2% сулфохлорантил, о,5% гипохлорид кальция-60- минут.
Промыть под водой и прсушить. При загрязнении кровью судно погружают в3% хлорамин,1,5% гипохлорид кальция-60 минут.
Перчатки при загрязнении кровью погружают в 3% хлорамин,1,5% гипохлорид каоьция-60 минут.Промыть под проточной водой.Погрузить в моющий раствор 0,5% на 15 минут.Промыть под проточной водой и ополснуть в дестиллированной воде.Не загрязненные ковью перчатки-1% хлорамин,0,5%гипохлорид кальция на30 минут.стерилизация автоклавирование щадящий режим.
Ножницы, бритвенные приборы-.
Кипячение в дистилированной воде-30 минут, добавление соды 2% 15 минут
Мочалки ,, шпателя-кипячение.в дистиллированной воде 30 минут
Ветошь для посуды-кипячение в 2% соде 15 минут, затем погружение в 0,5% р-р хлорной извести на 1 час.для отбелиания, стирка сушка
Посуда
Мойка-обезораживание 2% сода 200 гр соды на 10 л. воды+0,5% моющий р-р.
Мойка обезораживание полное погружение в 0,5% хлорамин – 30 минут или кипячение -30 минут.
Мойка ополаскивание в горячей воде проточной, просушивание.
ВаннаДезинфекция 3% хлорной извести , двукратное протирание(или 1% р-р хлорамина-60 минут)
Сполоснуть под проточной водой Натирать ветошью с моюще- дезинфецирующим или чистяще-дезинфицирующим средством из расчета ½ г на 100кв.см., экспозиция 5 мин, затем ополоснуть под проточной водой
Ополоснуть холодной водой.
Обувь – протирают тампоном смоченным 25%р-р формалином или 40% уксусом до полного увлажнения упаковывют в полиэтиленовый пакет на 3 часа, далее проветривают до полного исчезновения запаха.
Мензурки-1% хлорамин-60 минут, ополаскивание. Или кипячение 30 минут.
Постельное белье нательное— стирка в прачечной с кипячением в2% соде-15 минут, а при загрязнении кровью погружение на 60 минут-3% хлорамин.камерная обработка постельных принадлежностей.
Мешок замачивается в 1% р-р хлорамина 1 час
Влажная уборка не мение 2 раз в день.
Генеральная уборка 1 раз в неделю в оперблоке,в перевязочных,в палатах 1 раз в месяц
Кварцевание поцедурного кабинета, перевязочных -2 часа в палатах через- 30 минут.
Смена маски процедурной перевязочной медсестры каждые 3 часа.
Пипетки глазные кипячение в дистилированной воде-30 мин, стерилизация в щадящем режиме автоклаве в разобранном виде
Кушетка – протирание 1% хлорамина без крови два раза с интервалом 15 мин.
Тема Стерилизация.
Стерилизация-полное уничтожение всех патогенных и непатогенных микроорганизмов в том числе и спорообразующих..
1 способ: Автоклавирование или стерилизация горячим паром. Производится в биксах ( больших, средних и малых) Стерильность материала в закрытых биксах сохраняется в течение 3 суток это простые биксы. В биксах с фильтром 20 суток. В приоткрытых- 1 сутки, в открытых-4-6 часов.
Режим стерилизации.Стерилизация в паровых стерилизаторах (автоклав )
| материал | режим | Давление, атм. | температура | Время мин. |
| Мягкий материал | 2 атм | 132 с | 20 мин | |
| Резиновый материал | 1,1 атм | 120 с | 45 мин |
Стерилизация в воздушных стерилизаторах применяется для стерилизации предметов, котрые не могут быть простерилизованы первым способом (автоклав) из-за коррозии(хирургический, гинекологический, стоматологический инструменатарий).Стерелизуют инструменты без упаковки на решетке-используют сразу, а так же в упаковке( крафт пакете, бязевых салфетках стерильность сохраняется 3 суток) 1 режим – температура 180 с-60 минут для металического инструментария.
2 режим температура -160 с-150 мин для резины в основном силиконовой.
Контроль стерилизации.
Для контроля стерилизации используется сахароза, мочевина,очищенная сера, которые в процессе стерилизации меняют свое агрегатное состояние.Например сера превращалась в слиток, мочевина –испарялась.
В настоящее время для оперативного контроля используют индикаторные ленты, которыезменяют свою окраску до цвета эталона только при воздействии необходимой аппаратуры стерилизации в течение всего времени стерилизации. Результаты контроля стерилизации фиксируются в журналах по форме № 257/у.
Стерилизация перевязочного материала: способы и оборудование
Стерилизация перевязочного материала – это обязательная мера, гарантирующая стопроцентную чистоту и безопасность. Благодаря специальным методам очистки обеспечивается гибель любых патогенных микроорганизмов, способных вызывать бактериальные, вирусные и грибковые заболевания.
Что подразумевается под термином «стерилизация»
На сегодняшний день самыми распространенными методами очищения перевязочного материала и медицинских изделий в клинических условиях являются:
- автоклавирование;
- воздушная стерилизация в сухожаровом шкафу;
- обработка химическими растворами, газом.
В некоторых случаях прибегают к радиационной обработке. Причем каждый из этих методов состоит из трех основных этапов, включая дезинфекцию, очистку предстерилизационную и непосредственно стерилизацию.
Какой материал считается перевязочным
К данной категории относятся разновидности тканей, используемых для обработки ран, в том числе операционного поля (тампонады, повязки, салфетки медицинские и др.). Материал, применяемый для перевязок, обладает высоким уровнем гигроскопичности, поэтому быстро поглощает жидкое отделяемое из открытых ран, мгновенно высыхает, но при этом должен оставаться эластичным и прочным. Кроме того, при подготовке стерильных бинтов, салфеток, турунд и прочих видов марлевых изделий учитывается их гипоаллергенность. Важную роль играет доступность и дешевизна перевязочного материала, поскольку в большинстве случаев требуется его значительный расход. После стерилизации перевязочный материал не должен терять своих свойств.
Преимущественно распространены марля, хлопковая вата, лигнин. Бинты, медицинские салфетки, тампоны, турунды и прочие изделия получают из марли. Перевязочный материал не обходится без использования гигроскопической хлопковой ваты. Она продается в любой аптеке, используется для различных целей, в зависимости от которых приобретают нестерильную или стерильную вату. Оба вида обладает отличными всасывающими способностями, но в медицинской практике чаще используют стерильную вату. Она не допускает попадания в рану пыли, мусора, защищает ее от ударов, воздействия солнечных лучей. При этом вату кладут в рану только поверх стерильного бинта, в противном случае ее пушистые волокна намокнут и прилипнут к эпителию.
Вместо ваты, можно применять лигнин (это тончайшие гофрированные бумажные листы, которые изготавливают из дерева. Чтобы зафиксировать повязки, наложенные на раневую поверхность, используют трубчатые и эластичные бинты – это тоже перевязочный материал, стерилизация которого допускает повторное использование.
Виды обработки медицинских изделий для перевязки
В зависимости от режима стерилизации перевязочного материала, важно придерживаться строго алгоритма действий и осуществлять контроль над ходом процесса обработки. Принципиальное значение в вопросах стерилизации изделий и материала имеет срок сохранения стерильности. Учитывается также период абсолютной чистоты марлевых, ватных изделий и медицинских бикс, указанный производителем. Далее рассмотрим более подробно каждый из видов стерилизации, которые применяются в современных клиниках.
Что такое автоклавирование
Это один из распространенных и доступных способов стерилизации, предполагающий воздействие пара. Метод основан на простых законах физики. Как известно, при кипячении (100 °С) вода образует пар, для этого нет необходимости создавать дополнительное давление. Но если его все же увеличить на 0,5 атмосферы, то пар начнет выделяться при более высокой температуре. Это идеальные условия для гибели всей патогенной микрофлоры, в том числе и тех микроорганизмов, которые устойчивы к высоким температурам.
Продолжительность обработки перевязочного материала зависит от того, при какой температуре она будет происходить:
- при 110 °С экспозиция длится один час;
- при 120-126 °С – порядка 45 минут;
- при 127-133 °С достаточно получаса;
- при температуре 134 °С микробы гибнут за 15 минут.
Стоит отметить, что повторно применять перевязочный материал после стирки можно только в том случае, если он был задействован в негнойной среде.
Прибор для стерилизации
Автоклав представляет собой металлическую емкость, обладающую двойными прочными стенками. Между ними заливают воду, после чего герметично закрывают крышку винтами, а снизу включают ТЭН. Как только вода закипает, начинает образовываться пар, который наполняет внутреннюю часть автоклава с перевязочным материалом.
После укладки бикс закрывают крышкой, за счет чего емкость становится полностью герметичной. Вне прибора для стерилизации биксы могут храниться не более двух дней. Внутри их выстилают тканью. При заполнении автоклава нельзя трамбовать биксы, важно оставить свободное место, чтобы пар мог проникать внутрь. Удобнее заполнять емкости для стерилизации однородными изделиями.
В некоторых случаях автоклавирование подразумевает стерилизацию белья в специальных мешках. Здесь действуют такие же правила, как и при укладке бикса. Единственное, что стоит отметить, это необходимость использовать парные мешки, одетые один на другой. Это позволит сохранить чистоту даже в том случае, если развязывать мешок нестерильными руками. Верхний мешок сдвигают книзу, а внутренний кладут на стерильную поверхность и разбирают его содержимое.
Алгоритм действий при работе с автоклавом
Метод подразумевает применение мощного парового потока, однако для его применения не обойтись без специального аппарата для стерилизации перевязочного материала. Он называется автоклавом. Для того чтобы обработать изделий должным образом и не сомневаться в их стопроцентной чистоте, нужно соблюдать несколько простых правил:
- Перед процедурой обязательно обработать внутреннюю часть бикса медицинским спиртом.
- На дно укладывают чистую простыню, а сверху на нее закладывают емкость постельным бельем, марлевыми и ватными изделиями. Допускается также стерилизация резиновых предметов и медицинских инструментов (их оборачивают полотенцем и отправляют в бикс).
- Затем, после загрузки белья для стерилизации размещают несколько индикаторов. После обработки перевязочного материала они укажут, надлежащим ли образом прошла стерилизация.
Проба на стерильность по Микуличу
Чтобы убедиться в качестве стерилизации перевязочного материала в автоклаве, проводят один из несложных тестов. Самый простой и распространенный – это проба Микулича. Выполняется она следующим образом:
- На полоске бумаге пишут ручкой любое слово, опускают индикатор в жидкость, больше напоминающую клейстер, состоящую из крахмала и воды. После этого бумажке дают высохнуть.
- Сухую полоску снова смачивают, но на этот раз в растворе Люголя, поэтому она темнеет, становится синей и написанное слово на ней пропадает.
- Высушенный индикатор отправляют в автоклав вместе со стерилизуемым перевязочным материалом. Если после экспозиции бумажка снова становится белой, значит обработка прошла успешно.
Бактериологическая проверка
Это прямой способ узнать, осталась ли на перевязочном материале патогенная флора. Чтобы убедиться в стерильности изделий, необходимо вскрыть бикс прямо в операционной и провести по обработанным материалам марлевыми лоскутами, увлажненными изотоническим раствором хлорида натрия. Затем смоченные марлевые тампоны отправляют в пробирку. Бактериологический контроль проводят несколько раз в месяц. Этот метод контроля чистоты и стерильности считается самым надежным.
Воздушная обработка перевязочных материалов
При воздушной обработке стерилизующего эффекта удается достичь за счет мощной подачи сухого и горячего воздуха. Отличительная особенность метода заключается в полном отсутствии влаги на внутренних стенках бикса, в связи с чем срок стерильности увеличивается, а металлической емкости не грозит коррозия металла.
Вместе с тем, воздушный метод обработки перевязочных материалов имеет ряд недостатков. В первую очередь стоит отметить затяжное и неравностепенное прогревание помещенных в бикс изделий. Для того чтобы простерилизовать материалы сухим горячим воздухом потребуется задействовать более высокие температуры. Минимально допустимый температурный порог – 160 °С. При этом продолжительность экспозиции при данном режиме должна составлять не менее 2 часов. Чтобы обработать перевязочный материал за полчаса, понадобится воздушный поток в пределах 200 °С.
Если в автоклаве разрешено обрабатывать резиновые и полимерные детали, то воздушный метод этого не допускает. Кроме того, горячим воздухом невозможно обдуть упаковочные материалы. Эффективность стерилизации перевязочного материала в сухожаровом шкафу зависит от того, насколько равномерно проникнет горячий воздух к изделиям, а для этого крайне важно соблюдать нормы загрузки стерилизатора и скорость принудительной циркуляции воздуха (она должны быть не менее 1 м/с).
Газовая стерилизация
В отличие от остальных методов обработки перевязочного материала, воздушный и паровой являются наиболее безопасными и экологически безвредными. Газовая обработка медицинских изделий подразумевает использование этилена-оксида или формальдегида. Пары этих веществ обладают высоким токсичным действием. К методу газовой стерилизации прибегают, как правило, в том случае, если отсутствует возможность проведения паровой или воздушной.
Чтобы провести газовую обработку перевязочных материалов, потребуется создать все необходимые для этого условия. В газообразной форме химические соединения этилен-оксида не вредят изделиям, не провоцируют коррозийные процессы. Таким образом можно обрабатывать любые ткани: натуральную кожу, шерсть, бумагу, пластмасс, пластик, дерево и т. д. Пары, получаемые в процессе стерилизации, обладают сильным бактерицидным действием и проникают максимально глубоко.
Однако токсичность и взрывоопасность этилен-оксида – его главные недостатки. Для стерилизации изделий и медицинских материалов применяют пары 40 % спиртового формальдегида, испаряющегося из формалина. Для медицинского персонала пары этих веществ небезопасны, к тому же сам процесс газовой стерилизации является весьма продолжительным. Именно поэтому данный метод обработки перевязочного материала используется редко.
Обработка химическими растворами
Еще один вспомогательный метод стерилизации перевязочного материала, который применяется только в том случае, если отсутствует возможность использования других способов. Химическая стерилизация имеет ряд негативных моментов, поскольку обрабатываемые изделия очищают без защитных упаковок. Кроме того, после такой очистительной процедуры потребуется дополнительное полоскание, а это, в свою очередь, может привести к вторичной контаминации. При этом растворы, которые используются для химической стерилизации доступны повсеместно и не требуют дополнительной подготовки перевязочного материала.
Стерилизуемые вещи раскладывают в биксы, не трамбуя. После того как процедура очистки завершится, изделия несколько раз погружают в дистиллированную воду. Если стерилизация осуществлялась перекисью водорода, полоскание проводится дважды, в остальных случаях – не менее трех раз. После каждого погружения стерилизованных вещей воду меняют.
Радиационный метод
В медицинской практике используется крайне редко, в основном тогда, когда есть необходимость стерилизации изделий из термолабильных материалов. В качестве стерилизующих агентов используются ионизирующие гамма- и бета-лучи. Радиационный метод обработки перевязочного материала предполагает обязательное использование бумажных и полиэтиленовых пакетов. Главное достоинство этого способа заключается в продолжительном сроке стерильности.
Радиационный метод применяется в промышленности. К его применению прибегают производственные предприятия, занимающиеся выпуском стерильных изделий однократного использования.
Стерилизация и дезинфекция в косметологическом салоне и медицинской клинике
Как известно, врачи, а тем более врачи-косметологи — одна из самых опасных специальностей в эпидемиологическом отношении. Сегодня косметологические процедуры переживают настоящий бум. Но, к сожалению, после них возможен не только положительный результат эстетической проблемы, но и отрицательный, который проявляет себя через инфицирования как пациента, так и врача, и, в конце концов, может стать причиной тяжелых заболеваний.
Цель этой статьи — улучшить ситуацию в косметологической практике и повысить уровень безопасности врачей-косметологов и другого медицинского персонала, работающего в косметологических клиниках.
Стерилизация или дезинфекция?
Довольно часто от больного к врачу попадает стафилококковая или грибковая инфекция, которая вызывает дерматофитию (микозы) волосистой части головы, ногтей, кистей, ног, туловища. Но, конечно, самая большая опасность, с которой может столкнуться врач-косметолог — это инфицирование гепатитами В, С и ВИЧ / СПИДом. Особенно велик риск таких заболеваний наблюдается при проведении процедур маникюра, педикюра, механической чистки лица и тому подобное.
С целью недопущения инфицирования косметолога во время различных манипуляций рекомендуется проводить профилактические мероприятия. Основные из них — стерилизация и дезинфекция.
Стерилизацией называется полное уничтожение вегетативных и споровых форм всех микроорганизмов.
Под дезинфекцией понимают совместимость физических, химических и механических методов обеззараживания вегетативных и споровых форм патогенных и условно-патогенных микроорганизмов. Цель дезинфекции — предупредить передачу возбудителей болезни от больного к здоровому человеку через различные объекты внешней среды.
Таким образом, понятие «стерилизация» шире понятия «дезинфекция», поскольку при последней уничтожают только патогенные микроорганизмы. Для стерилизации чаще используют воздействие высоких температур, для дезинфекции — химические вещества с широким спектром антимикробного действия.
Дезинфекции и стерилизации должны подвергаться все инструменты — особенно тщательно те, которые будут контактировать с телом человека. А именно: электроды, ножницы, кисточки, насадки для брашинга, дарсонваль и др. Кроме этого, обеззараживания требует посуда, используемая при косметических манипуляциях, поверхности приборов и их провода, поверхности мебели и тому подобное. Также напомним, что дезинфекционные мероприятия должны проводиться во всех помещениях косметических салонов и клиник.
Методы и средства дезинфекции
Различные объекты, подлежащие дезинсекции, обусловливают потребность в использовании различных методов и средств для их обеззараживания.
Основными методами дезинфекции являются:
- протирания
- погружение
- замачивание
Для дезинфекции поверхностей наиболее актуальным методом является протирание дезинфицирующим средством. В свою очередь, для дезинфекции косметологических инструментов наиболее удобным методом является их погружения в раствор дезинфектанта. Инструменты и принадлежности полностью погружают в емкость с раствором средства. Приборы, состоящие из нескольких частей, дезинфицируют в разобранном виде. После окончания дезинфекции разборные части промывают под проточной водой.
Для дезинфекции используют средства, разрешенные к применению Министерством здравоохранения Украины, имеющие сертификаты завода-изготовителя, удостоверяющим соответствие требованиям Государственных отраслевых стандартов или технических условий.
Для проведения дезинфекции применяются различные химические вещества.
Наиболее распространенными активными веществами дезинфектантов являются четвертичные аммониевые соединения (ЧАС), которые отличаются широким спектром антимикробного действия. Среди препаратов, содержащих в своем составе ЧАС, следует отметить: Санифект, Саникон, Санимакс, Дезекон, Максисан, Дезэффект. Они обеспечивают бактерицидное (уничтожающее бактерии в вегетативной форме), фунгицидное (уничтожает плесневые и дрожжеподобные грибы), туберкуляцидное (уничтожает микобактерии туберкулеза), спороцидное (уничтожает бактерии в споровой форме), вируляцидную (уничтожает вирусы, в том числе вирусы гепатитов А, В, С и СПИДа) активнось.
Также положительным свойством дезинфектантов, содержащих ЧАС, является отсутствие токсичности. Препараты на основе гуанидинов имеют сильные бактерицидные свойства, но слабые фунгицидные и туберкуляцидные. Они также отличаются высокой безопасностью. Сами по себе гуанидины редко используются — в основном, их соединяют с другими активнодействующими компонентами.
Препараты на основе глутарового альдегида характеризуются широким спектром антимикробного действия и могут быть использованы как для дезинфекции, так и для химической стерилизации. Дезинфектанты на основе этого вещества называют «золотым стандартом». Но главным недостатком препаратов на основе глутарового альдегида следует отнести их токсичность.
Препараты на основе ортофталевого альдегида обеспечивают антимикробное действие широкого спектра. Ортофталевый альдегид входит в состав многих дезинфицирующих средств и стерилянтов, и является веществом с умеренной токсичностью.
Препараты на основе перекиси водорода отмечаются широким спектром антимикробного действия. Перекись водорода также входит в состав многих дезинфектантов и стерилянтов. Однако к недостаткам препаратов на его основе следует отнести плохую стабильность и способность вызывать коррозию инструментов. У этого препарата высокий показатель безопасности.
Препараты на основе гипохлорита натрия, как и препараты на основе ЧАС, отмечаются бактерицидной, фунгицидной, туберкуляцидной, спороцидной и вируляцидной активностью. Гипохлорит натрия входит в состав многих дезинфектантов и стерилянтов (Новохлор и Новохлор-экстра).
Средства на основе третичных аминов (Дезекон ОМ) обладают широким спектром антимикробного действия, в том числе активные в отношении микобактерий туберкулеза и бактерий в споровой форме.
Дезинфицирующие средства на основе спиртов проявляют обеззараживающие свойства за короткое время, но характеризуются слабой фунгицидной активностью. Они принадлежат к препаратам высокого класса безопасности. К недостаткам дезинфектантов на основе спиртов следует отнести то, что эти средства используются только в больших концентрациях спирта. С экономической точки зрения использование дезинфектантов на основе спиртов является «недешевым удовольствием».
Дезинфицирующие средства на основе изоциануратов имеют широкий спектр антимикробного действия (бактерицидное, фунгицидное, туберкуляцидное, спороцидное, вируляцидная активность). К недостаткам следует отнести запах хлора и умеренную токсичность.
Из приведенного выше можно сделает вывод, что для дезинфекции в косметических салонах и клиниках наиболее подходят дезинфицирующие средства на основе четвертичных аммониевых солей. Причина — широкий спектр антимикробного действия, отсутствие отрицательной воздействия на обрабатываемые материалы, высокий уровень безопасности, отсутствия неприятного запаха.
Методы стерилизации
Инструменты многократного использования (абразии, некоторые виды маникюра и педикюра, системы омоложения), которые связаны с нарушением целостности кожных покровов, кроме дезинфекции, должны обязательно подвергаться стерилизации.
Наиболее распространенными в косметологии являются следующие методы стерилизации:
с помощью суховоздушного шкафа;
Стерилизация с помощью суховоздушного шкафа основывается на обеззараживании микроорганизмов с помощью высокой температуры. Этот прибор для стерилизации внешне напоминает электрическую духовку, в которой размещается инвентарь для стерилизации на необходимую экспозицию. К недостаткам суховоздушного шкафа следует отнести то, что в нем невозможно стерилизовать изделия, которые портятся под действием высокой температуры (предметы из резины, пластмассы и т.д.), а металлические инструменты под действием высокой температуры быстро затупляются. В косметологии наибольшее распространение получили суховоздушные стерилизаторы объемом 1-2,5 литра.
Гласперленовые стерилизаторы представляют собой небольшой стакан, заполненный стеклянными шариками, которые нагреваются до температуры 230 ° С. Стерилизация происходит путем погружения рабочей зоны инструмента в шарики. Этот метод стерилизации является наиболее распространенным в косметологии. Его основным недостатком является невозможность стерилизации нескольких инструментов одновременно. К тому же, на этом мы уже говорили — изделия из металла, которые требуют частого профессионального использования, быстро затупляются под действием высокой температуры.
Сейчас наиболее толерантным методом стерилизации косметологических инструментов, который обеспечивает минимальное механическое повреждение, является автоклавирования. Стерилизация в автоклаве происходит при температуре от 110 ° С и не требует много времени. Изделия при этом методе стерилизации меньше нагреваются и, соответственно, меньше затупляются. Недостатком метода автоклавирования является то, что работа на автоклаве требует специально подготовленного персонала.
Химический метод стерилизации предусматривает использование химических реагентов-стерилянтов (гипохлорит натрия, глутаровый, ортофталевой альдегид, перекись водорода). Недостаток этого метода заключается в том, что большое количество стерилянтов вызывает коррозию изделий из металла, меняет цвет косметологического инвентаря, характеризуется специфическим запахом и требует постоянного контроля активнодействующего вещества. Стерилизацию медицинских инструментов и принадлежностей проводят после достерилизацийного очистки. После окончания очистки изделия тщательно ополаскивают питьевой водой от остатков средства, которое было использовано для достерилизационной очистки, и удаляют воду из внутренних полостей. Стерилизацию инструментария проводят в стерильных стеклянных, полимерных или эмалированных емкостях, закрывающихся крышками.
Все манипуляции выполняют, соблюдая асептические условия. После окончания стерилизации инструменты вынимают из раствора с помощью специально обработанных пинцетов и промывают стерильной водой.
Таким образом, используя высокоэффективные, нетоксичны и доступные дезинфектанты в сочетании с другими факторами антимикробного действия, можно гарантировать безопасность врачей-косметологов и другого медицинского персонала, работающего в косметологических учреждениях.
Уход за руками
Одним из ключевых факторов передачи возбудителей инфекций являются руки. Важность дезинфекции рук работников косметологических заведений даже не подлежит обсуждению: очевидно, что от этого зависит не только здоровье клиентов, но и самого персонала. Необходимо лишь выбрать оптимальное средство, который был бы достаточно эффективным по патогенной или условно-патогенной микрофлоры и одновременно не вредит коже рук.
Частое использование комбинированных антисептиков на основе спиртов уменьшает естественные защитные функции кожи, особенно если ткани травмированы. А сухая, неухоженная, с трещинами кожа является дополнительным интенсивным источником опасных инфекций.
Когда естественный защитный барьер кожи снижен, при контакте со средствами для дезинфекции, кожа может дополнительно получать повреждения от составляющих средства. Частое мытье рук кожи очень горячей или холодной водой, а также ношение перчаток длительное время с образованием влажной камеры между эпидермисом и перчаткой в сочетании с действием химических средств в отдельных случаях может приводить к заболеваниям кожи рук — контактных дерматитов.
Чтобы предотвратить такие проблемы, необходимо использовать средства ухода за кожей рук: лосьоны и кремы для рук (Неософт). Рекомендуется использовать такие препараты преимущественно в перерывах и после окончания работы.
Также для предотвращения нарушения целостности кожи следует выбирать антисептики с добавками, которые смягчают кожу (глицерин, ланолин и т.п.). Наиболее распространенными являются антисептики на спиртовой основе со смягчающими элементами (Неостерил).
При выборе антисептиков для рук предпочтение следует отдавать жидким препаратам, а не средствам в форме геля. Доказано, что при использовании неподобных антисептиков для рук дезинфекция наступает лишь при 60-90 секунд. В то же время при применении жидких спиртовых растворов — через 30 секунд. Риск возникновения аллергических реакций при использовании гелеобразных антисептиков намного выше. Стоит также знать, что наличие красящих компонентов в составе антисептиков при частом использовании окрашивает ногти в цвет соответствующей добавки.
Давайте не будем забывать, что соблюдение правил дезинфекции и стерилизации является обязанностью каждого косметолога, и наша ответственная позиция в этом вопросе является залогом здоровья и благополучия и нас самих, и наших пациентов.
Качан Роман Васильевич
Руководитель химико-микробиологической лаборатории
Кандидат технических наук, доцент кафедры промышленной фармации КНУТД
ул. Нагорная, 27-А
г. Киев, Украина, 04107тел. лаборатории +38 044 337 59 64
моб. тел.: +380 99 603-74-36
e-mail: [email protected]
Использование в автоклаве
Химические индикаторы
Индикаторы ленты
Ленточные индикаторы представляют собой бумажную ленту на липкой основе с термочувствительными химическими индикаторными метками. Индикаторы ленты меняют цвет или отображают диагональные полосы, слова «стерильный» или «автоклавированный» при воздействии температуры 121 ° C. Ленточные индикаторы обычно размещаются на внешней стороне загрузки отходов. Если термочувствительная лента не показывает, что в процессе стерилизации была достигнута температура не менее 121 ° C, загрузка не считается обеззараженной.Если индикаторы ленты выходят из строя при двух последовательных загрузках, сообщите об этом своему начальнику отдела безопасности.
Ленточные индикаторы не предназначены и не предназначены для доказательства того, что организмы действительно были убиты. Они указывают на то, что в автоклаве была достигнута температура 121 ° C. EHS рекомендует НЕ использовать автоклавную ленту как единственный индикатор дезактивации или стерилизации.
Интегрированные химические индикаторные полоски
Встроенные химические индикаторные полоски обеспечивают ограниченную проверку температуры и времени, отображая изменение цвета после воздействия нормальной рабочей температуры автоклава 121 ° C в течение нескольких минут.Индикаторы химического изменения цвета могут быть помещены в загрузку отходов. Если химические индикаторы не работают при двух последовательных загрузках, сообщите об этом своему начальнику отдела безопасности.
Биологические индикаторы
Флаконы с биологическими индикаторами содержат споры B. stearothermophilus , микроорганизма, который инактивируется при воздействии насыщенного пара с 121,1 o C в течение минимум 20 минут. Автоклавы, используемые для обработки биологических отходов, будут оцениваться с помощью биологического индикатора EHS ежеквартально.
Процедура
- EHS будет координировать биологические валидационные испытания с сотрудниками лаборатории.
- Индикаторы будут инкубированы EHS в течение 24 часов при 60 ° C с контролем, который поддерживается при комнатной температуре.
Результаты
- Если автоклавированный индикатор показывает рост, проверка не удалась и будет повторена.
- Если второй индикатор проверки не работает, EHS уведомит начальника отдела безопасности и запросит обслуживание автоклава.Автоклав не следует использовать до тех пор, пока не будет проведено обслуживание и не пройдены проверочные испытания.
- Результаты проверочных испытаний отправляются сотрудниками EHS по электронной почте в соответствующие лаборатории и начальнику отдела безопасности.
- EHS ведет документацию по всем валидационным испытаниям.
Бухгалтерский учет:
Журнал автоклава:
Персонал лаборатории должен вести журнал автоклава, содержащий следующие данные:
- Дата, время и имя оператора
- Контактная информация: Лаборатория, номер кабинета, телефон
- Тип стерилизуемого материала / цикл
- Температура, давление и продолжительность стерилизации загрузки.
Результаты тестирования биологических индикаторов
- EHS поддерживает все результаты испытаний на биологические индикаторы.
Паровая стерилизация | Рекомендации по дезинфекции и стерилизации | Библиотека руководств | Инфекционный контроль
Основной принцип паровой стерилизации, выполняемой в автоклаве, заключается в том, чтобы подвергать каждый предмет прямому контакту с паром при требуемой температуре и давлении в течение определенного времени. Таким образом, существует четыре параметра стерилизации паром: пар, давление, температура и время.Идеальный пар для стерилизации — сухой насыщенный пар и увлеченная вода (доля сухости ≥97%). 813, 819 Давление служит средством достижения высоких температур, необходимых для быстрого уничтожения микроорганизмов. Для обеспечения микробицидной активности необходимо обеспечить определенную температуру. Две распространенные температуры стерилизации паром: 121 ° C (250 ° F) и 132 ° C (270 ° F). Эти температуры (и другие высокие температуры) 830 должны поддерживаться в течение минимального времени, чтобы убить микроорганизмы.Признанные минимальные периоды воздействия для стерилизации упакованных медицинских принадлежностей составляют 30 минут при 121 ° C (250 ° F) в стерилизаторе с гравитационным вытеснением или 4 минуты при 132 ° C (270 ° F) в вакуумном стерилизаторе (таблица 7). При постоянных температурах время стерилизации зависит от типа предмета (например, металл или резина, пластик, предметы с просветом), от того, упакован он или нет, а также от типа стерилизатора.
Два основных типа паровых стерилизаторов (автоклавов) — автоклав с гравитационным вытеснением и высокоскоростной предварительный вакуумный стерилизатор.В первом случае пар поступает в верхнюю или боковые стороны стерилизационной камеры и, поскольку пар легче воздуха, вытесняет воздух из нижней части камеры через дренажное отверстие. Автоклавы с гравитационным вытеснением в основном используются для обработки лабораторных сред, воды, фармацевтических продуктов, регулируемых медицинских отходов и непористых изделий, поверхности которых имеют прямой контакт с паром. Для стерилизаторов с гравитационным вытеснением время проникновения в пористые предметы увеличивается из-за неполного удаления воздуха.Этот момент иллюстрируется обеззараживанием 10 фунтов микробиологических отходов, для чего требуется не менее 45 минут при 121 ° C, потому что захваченный воздух, остающийся в загрузке отходов, значительно замедляет проникновение пара и эффективность нагрева. 831, 832 Высокоскоростные предвакуумные стерилизаторы аналогичны стерилизаторам с гравитационным вытеснением, за исключением того, что они оснащены вакуумным насосом (или эжектором) для обеспечения удаления воздуха из стерилизационной камеры и загрузки до того, как пар будет впущен. Преимущество использования вакуумного насоса заключается в том, что пар почти мгновенно проникает даже в пористые грузы.Тест Боуи-Дика используется для обнаружения утечек и недостаточного удаления воздуха и состоит из сложенных хирургических полотенец из 100% хлопка, которые являются чистыми и предварительно кондиционированными. В центр упаковки следует поместить имеющийся в продаже тестовый лист типа Боуи-Дика. Тестовую упаковку следует поместить горизонтально в переднюю нижнюю часть стойки стерилизатора, рядом с дверцей и над сливом, в пустой камере, и прогреть ее при 134 ° C в течение 3,5 минут. 813, 819 Испытание проводится каждый день использования парового стерилизатора вакуумного типа перед первой обработанной загрузкой.Воздух, который не удален из камеры, будет мешать контакту с паром. Для замены стопки сложенных хирургических полотенец для проверки эффективности вакуумной системы в предвакуумном стерилизаторе были разработаны одноразовые тестовые пакеты меньшего размера (или устройства для испытаний). 833 Эти устройства «предназначены для имитации продукта, подлежащего стерилизации, и представляют определенную проблему для процесса стерилизации». 819, 834 Они должны быть репрезентативными для нагрузки и имитировать наибольшую нагрузку на нее. 835 Вакуумные характеристики стерилизатора являются приемлемыми, если лист внутри тестовой упаковки демонстрирует равномерное изменение цвета. Захваченный воздух приведет к появлению пятна на тестовом листе из-за неспособности пара достичь химического индикатора. Если стерилизатор не прошел тест Боуи-Дика, не используйте стерилизатор до тех пор, пока он не будет проверен персоналом по обслуживанию стерилизатора и не пройдет тест Боуи-Дика. 813, 819, 836
Другой способ стерилизации паром — это процесс с импульсным давлением продувки паром, который быстро удаляет воздух путем многократного чередования продувки паром и импульса давления выше атмосферного.Воздух быстро удаляется из загрузки, как в предвакуумном стерилизаторе, но утечки воздуха не влияют на этот процесс, потому что пар в стерилизационной камере всегда находится выше атмосферного давления. Типичные значения температуры и времени стерилизации составляют от 132 ° C до 135 ° C с временем воздействия от 3 до 4 минут для пористых материалов и инструментов. 827, 837
Как и другие системы стерилизации, паровой цикл контролируется механическими, химическими и биологическими мониторами. Паровые стерилизаторы обычно контролируются с помощью распечатки (или графически) путем измерения температуры, времени при температуре и давления.Обычно химические индикаторы прикрепляются снаружи и включаются в упаковку для контроля температуры или времени и температуры. Эффективность стерилизации паром отслеживается с помощью биологического индикатора, содержащего споры Geobacillus stearothermophilus (ранее Bacillus stearothermophilus ) . Положительные результаты теста на споры являются относительно редким явлением 838 и могут быть связаны с ошибкой оператора, недостаточной подачей пара, 839 или неисправностью оборудования.
Переносные (настольные) паровые стерилизаторы используются в амбулаторных, стоматологических и сельских клиниках. 840 Эти стерилизаторы предназначены для небольших инструментов, таких как шприцы и иглы для подкожных инъекций, а также стоматологические инструменты. Способность стерилизатора достигать физических параметров, необходимых для достижения стерилизации, следует контролировать с помощью механических, химических и биологических индикаторов.
Безопасность в автоклаве | Управление лабораторной безопасности
Автоклавы обеспечивают физический метод дезинфекции и стерилизации.Они работают с сочетанием пара, давления и времени. Автоклавы работают при высокой температуре и давлении, чтобы уничтожить микроорганизмы и споры.
Назначение
Стерилизация означает полное уничтожение всех живых организмов, включая споры.
Общие методы стерилизации включают применение влажного тепла, сухого тепла, химикатов и излучения. Тип материала, контейнер и количество стерилизуемых предметов определяют, какой метод использовать.
Несмотря на встроенные меры безопасности, автоклав представляет возможность серьезного травмирования персонала горячими поверхностями и выбросом пара. Поэтому важно, чтобы персонал лаборатории понимал правильную работу, ограничения и меры безопасности при стерилизации в автоклаве.
Сопутствующие риски
Автоклавы — это стерилизаторы, использующие пар высокого давления и высокой температуры. Потенциальные риски для безопасности операторов:
• Тепловые ожоги от горячих материалов, стенок и дверцы камеры автоклава
• Паровые ожоги от остаточного пара, выходящего из автоклава, и материалов по завершении цикла
• Ошпаривание горячей жидкостью от кипящей жидкости и пролитой в автоклаве.
• Травмы кистей и предплечий при закрытии дверцы автоклава.
• Травма при взрыве
Автоклавы используются в лабораториях для стерилизации оборудования, инструментов и инфекционных отходов. Все операторы должны пройти обучение по безопасной эксплуатации автоклава перед использованием оборудования . Пользователи должны прочитать и понять руководство пользователя для конкретной модели автоклава, который они используют.
Совместимые / несовместимые материалы
Совместимость с автоклавом | Автоклав Несовместим |
Полипропилен Посуда (Pyrex® или боросиликат типа I) Нержавеющая сталь Наконечники для дозаторов Отходы Растворы для сред (заполните до 2/3 емкости и снимите крышки) Колбы для тканевых культур Подстилки и корм для животных | Хлор, гипохлорит, отбеливатель Кислоты, основания и органические растворители Хлориды Сульфаты Морская вода Полистирол Полиэтилен Полиуретан |
Меры предосторожности
• При извлечении стеклянной посуды из автоклавов надевайте теплоизоляционные перчатки.Публикация OSHA по автоклавам и стерилизаторам описывает, что можно и чего нельзя делать при работе с автоклавами и стерилизаторами.
• Убедитесь, что сотрудники, использующие автоклав, были проинформированы о безопасном использовании автоклавов.
• Все операторы должны пройти обучение по безопасной эксплуатации автоклава перед использованием оборудования. Обучение может быть поручено квалифицированному специалисту, но ответственность за обеспечение надлежащего обучения его персонала остается за руководителем.
• Вся стеклянная посуда должна быть проверена перед автоклавированием. Старая посуда может быть менее устойчивой и может разбиться во время процесса.
• Всегда используйте подходящие средства индивидуальной защиты. При работе с автоклавированными материалами необходимо носить обувь с закрытым носком, лабораторные халаты и изолированные перчатки. При опасности разбрызгивания необходимо надевать защитную маску и фартуки.
• При стерилизации жидкостей используйте только жидкостной цикл и не перемешивайте емкости с нагретыми жидкостями, поместите емкости в автоклавируемый лоток.
• Сотрясение контейнеров может вызвать взрыв горячих бутылок. Перед транспортировкой дайте материалам остыть. Ставьте контейнеры на тележки или тележки, выстланные бумагой, чтобы стекло не разбилось.
• Убедитесь, что все крышки имеют свободные вентилируемые крышки для предотвращения повышения давления / вакуума.
• Стерилизаторы, стойки и материалы будут очень горячими после обработки. Отойдите от стерилизатора, открывая дверцу, и дайте материалам остыть перед разгрузкой.
• Немедленно очистите пол от пролитого материала или конденсата, чтобы не поскользнуться и не упасть.
• Не допускает попадания рук в дверной проем при закрытии стерилизатора.
• Сообщайте о любых проблемах с оборудованием, включая неожиданные шумы, вибрацию или запахи, лицу, ответственному за обслуживание.
• Поместите все острые предметы, подлежащие автоклавированию, в специальный контейнер для острых предметов.
• Не пытайтесь открыть дверь во время цикла или в случае тревоги.
Никогда не автоклав:
• Легковоспламеняющиеся, химически активные, коррозионные, токсичные или радиоактивные материалы
• Жидкости в закрытых емкостях.
• Материал, содержащийся таким образом, что он касается внутренних поверхностей автоклава.
• Срезы тканей, залитые парафином.
Циклы автоклава
Чтобы автоклав был эффективным, он должен достигать и поддерживать температуру 121 ° C в течение не менее 30 минут с использованием насыщенного пара под давлением не менее 15 фунтов на квадратный дюйм. В зависимости от состава и объема загрузки может потребоваться увеличенное время цикла.
Скорость выхлопа будет зависеть от характера нагрузки.Сухой материал можно обрабатывать в быстром цикле откачки, в то время как жидкости и биологические отходы требуют медленной откачки, чтобы предотвратить выкипание перегретых жидкостей.
Цикл | Рекомендуется для |
Цикл жидкостей | Используйте стеклянные емкости с вентилируемыми крышками, заполненные только на 2/3. Жидкая среда Негорючие жидкости Жидкие биологические отходы Водные растворы |
Твердый или сухой цикл | Сухие материалы без упаковки или в пористой пленке Металлы Непористые материалы Пустая стеклянная посуда |
Упакованные товары или цикл предварительного вакуумирования | Коробки для наконечников пипеток Биологические отходы в мешках для автоклавов |
Стеклянная посуда, которую необходимо стерилизовать в вертикальном положении | |
Обеззараживание острых предметов |
Процедура в автоклаве
Пользоваться средствами индивидуальной защиты:
Лабораторный халат
Защита глаз / лица
Туфли с закрытым носком
Термостойкие перчатки для снятия предметов, особенно горячей стеклянной посуды
Упаковка и загрузка
Только уполномоченным лицам должно быть разрешено устанавливать и / или изменять параметры автоклавов.
Перед использованием автоклава проверьте внутри, нет ли предметов, оставленных предыдущим пользователем, которые могут представлять опасность.
Очистите сливной фильтр перед загрузкой автоклава.
Всегда кладите предметы во вторичный контейнер.
Не перегружайте и не упаковывайте пакеты слишком плотно. Оставьте достаточно места для циркуляции пара. При необходимости поместите емкость набок, чтобы обеспечить максимальное проникновение пара и избежать захвата воздуха.
Для упаковки отходов используйте только автоклавируемые пакеты.
Не позволяйте пакетам касаться внутренних стенок автоклава, чтобы избежать плавления пластмассы.
Убедитесь, что жидкость заполнена достаточным количеством жидкости, если сухое содержимое мешков автоклава.
Поместите загрязненную стеклянную и лабораторную посуду во вторичные контейнеры и автоклавируйте их в цикле твердых веществ. Не заполняйте емкости жидкостью более чем на 2/3. Ослабьте крышки или используйте вентилируемые крышки.
В случае чистой стеклянной посуды и упакованных инструментов положите их во вторичный контейнер перед автоклавированием в цикле упакованных товаров.
Для вторичной защиты используйте поддоны автоклавов из полипропилена, поликарбоната или нержавеющей стали. Подносы должны иметь твердое дно и стенки, чтобы удерживать содержимое и улавливать пролитую жидкость.
Выберите подходящий цикл для материала. Неправильный выбор цикла может привести к повреждению автоклава, вызвать выкипание жидкости или разрушение бутылок.
Запустите цикл и заполните журнал пользователя автоклава. Полный цикл обычно занимает от 1 до 1,5 часов.
Проверьте манометр камеры / рубашки на предмет минимального давления 20 фунтов на квадратный дюйм (psi).
Закройте и заприте дверь.
Проверяйте температуру 250 ° F (121 ° C) при каждой загрузке.
Не пытайтесь открыть дверцу во время работы автоклава.
Разгрузка
Убедитесь, что цикл завершен, а температура и давление вернулись в безопасный диапазон.
Используйте СИЗ, описанные выше, а также фартук и маску для лица при удалении жидкостей. В качестве меры предосторожности отойдите от двери и осторожно откройте дверь не более чем на 1 дюйм.Это высвободит остаточный пар и позволит нормализовать давление в жидкостях и контейнерах.
Дайте автоклавированной загрузке постоять в камере в течение 10 минут. Это позволит пару очиститься, а захваченному воздуху выйти из горячих жидкостей, что снизит риск для оператора.
Не перемешивайте емкости с перегретыми жидкостями и не снимайте крышки перед разгрузкой.
Поместите жидкости в зону, которая четко указывает на то, что предметы «горячие».
Дайте автоклавированным материалам остыть до комнатной температуры перед транспортировкой.Никогда не перевозите перегретые материалы.
Поместите охлажденный автоклавированный пакет для биологических опасностей в регулируемый контейнер для медицинских отходов. Инфекционные жидкости, обработанные в автоклаве, можно сливать в раковину.
Журнал автоклава
Персонал лаборатории должен вести журнал автоклава. Журнал должен содержать следующие данные:
Дата, время и имя оператора
Контактная информация: Лаборатория, номер кабинета, телефон
Тип стерилизуемого материала / цикл
Температура, давление и продолжительность стерилизации загрузки.
Аттестация автоклава
Химические индикаторы
Ленточные индикаторы
Ленточные индикаторы представляют собой бумажную ленту на липкой основе с термочувствительными химическими индикаторными метками. Индикаторы ленты меняют цвет или отображают диагональные полосы, слова «стерильный» или «автоклавированный» при воздействии температуры 121 ° C. Ленточные индикаторы обычно размещаются на внешней стороне загрузки отходов. Если термочувствительная лента не показывает, что в процессе стерилизации была достигнута температура не менее 121 ° C, загрузка не считается обеззараженной.Если индикаторы ленты выходят из строя при двух последовательных загрузках, сообщите об этом своему начальнику отдела безопасности.
Ленточные индикаторы не предназначены и не предназначены для доказательства того, что организмы действительно были убиты. Они указывают на то, что в автоклаве была достигнута температура 121 ° C. OLS рекомендует НЕ использовать автоклавную ленту как единственный индикатор дезактивации или стерилизации.
Интегрированные химические индикаторные полоски
Встроенные химические индикаторные полоски обеспечивают ограниченную проверку температуры и времени, отображая изменение цвета после воздействия нормальной рабочей температуры автоклава 121 ° C в течение нескольких минут.Индикаторы химического изменения цвета могут быть помещены в загрузку отходов. Если химические индикаторы не работают при двух последовательных загрузках, обратитесь в автоклав на ремонт.
Биологические индикаторы
Флаконы с биологическими индикаторами содержат споры B. stearothermophilus, микроорганизма, который инактивируется при воздействии насыщенного пара при 121 ° C в течение минимум 20 минут. Автоклавы, используемые для обработки биологических отходов, необходимо ежемесячно проверять с помощью биологического индикатора.
Процедура
Индикаторы необходимо инкубировать в течение 24 часов при 60 ° C с контролем, который поддерживается при комнатной температуре.
Результаты
Если автоклавированный индикатор показывает рост, проверка не удалась и ее необходимо повторить.
Если второй индикатор проверки не работает, запросите обслуживание автоклава. Автоклав не следует использовать до тех пор, пока не будет проведено обслуживание и не пройдены проверочные испытания.
Отправьте результаты проверочных тестов по электронной почте в OLS.
Уборка разбитого стекла и разливов
При обнаружении битого стекла необходимо дать автоклаву полностью остыть перед очисткой осколков стекла.
Оператор оборудования несет ответственность за удаление битого стекла и его размещение в специально отведенной таре для битого стекла.
Разливы могут произойти в результате вскипания или поломки контейнеров. Не пытайтесь эксплуатировать автоклав, пока пролитая жидкость не будет удалена.
В случае разлива не допускайте распространения разлива и подождите, пока автоклав и материал внутри не остынут до комнатной температуры. Не пытайтесь убрать разлив, когда он горячий. Очистите пораженный участок и утилизируйте отходы соответствующим образом.
Оператор оборудования несет ответственность за ликвидацию разливов.
Запишите разлив в журнал автоклава.
Щелкните здесь, чтобы просмотреть PDF-версию этого содержания.
Автоклав
: использование, рекомендации и стоимость
Что такое автоклав?
Автоклавы
также известны как паровые стерилизаторы и обычно используются в здравоохранении или в промышленности.Автоклав — это машина, которая использует пар под давлением для уничтожения вредных бактерий, вирусов, грибков и спор на предметах, помещенных в сосуд под давлением. Предметы нагреваются до соответствующей температуры стерилизации в течение определенного времени. Влага пара эффективно передает тепло предметам, разрушая белковую структуру бактерий и спор.
В здравоохранении термин «автоклав» обычно используется в качестве номенклатуры для описания парового стерилизатора.В стандарте ANSI / AAMI 4 , который предоставляет стандарты и рекомендации по обработке медицинских устройств, автоклавы для здравоохранения, в частности, паровые стерилизаторы.
Ознакомьтесь с нашими паровыми стерилизаторами
Кто изобрел автоклав?
Рис. 1 первый паровой стерилизатор, построенный
в 1880 году Чарльзом Чемберлендом
Паровой варочный котел, прототип автоклава, который теперь больше известен как скороварка, был изобретен физиком французского происхождения Дени Папеном в 1679 году. 1 Лишь в 1879 году французский микробиолог Шарль Чемберленд создал новую версию, названную автоклавом, для использования в медицинских целях.
Наука о дезинфекции и стерилизации началась в 1881 году с исследования Роберта Коха дезинфицирующих свойств пара и горячего воздуха. Он продемонстрировал большую проникающую способность влажного тепла (пара) по сравнению с сухим теплом. Наконец, в 1933 году была представлена современная автоклавная технология с первым паровым стерилизатором под давлением, который контролировал производительность путем измерения температуры в дренажной линии камеры (термостатическая ловушка).До этой даты давление было единственным показателем контроля без каких-либо средств для проверки температуры или удаления воздуха.
Со временем была разработана новая технология автоклавов, включая предварительное вакуумирование в 1958 году и импульсное давление с промывкой паром в 1987 году, что позволило науке развиться в автоклавы или паровые стерилизаторы, используемые сегодня в больницах.
Как работает автоклав?
Рис. 2 Пример распечатки ленты цикла
, показывающей три фазы
процесса.
Автоклавы обычно используются в учреждениях здравоохранения для стерилизации медицинских устройств. Предметы, подлежащие стерилизации, помещаются в сосуд высокого давления, обычно называемый камерой. Три фактора имеют решающее значение для обеспечения успешной стерилизации паром в автоклаве: время, температура и качество пара.
Для удовлетворения этих требований процесс автоклавирования состоит из трех этапов:
- Фаза кондиционирования (C): Воздух препятствует стерилизации и должен быть удален из камеры во время первой фазы цикла стерилизации, известной как кондиционирование.В паровых стерилизаторах с динамическим удалением воздуха воздух может быть удален из камеры с помощью вакуумной системы. Его также можно удалить без вакуумной системы, используя серию продувок паром и импульсов давления. Стерилизаторы гравитационного типа используют пар для вытеснения воздуха в камере и вытеснения воздуха через слив стерилизатора.
- Фаза воздействия (S): После удаления воздуха слив стерилизатора закрывается, и в камеру непрерывно поступает пар, быстро повышая давление и температуру внутри до заданного уровня.Цикл переходит в фазу экспонирования, и предметы выдерживаются при температуре стерилизации в течение фиксированного времени, необходимого для их стерилизации.
- Фаза выхлопа (E): Во время заключительной фазы цикла, выхлопа, дренаж стерилизатора открывается и пар удаляется, сбрасывая давление в емкости и позволяя предметам в загрузке высохнуть.
Качественный пар жизненно важен для успешного процесса стерилизации в автоклаве. Пар, используемый для стерилизации, должен состоять на 97% из пара (пар) и 3% влаги (жидкая вода).Это соотношение рекомендуется для наиболее эффективной передачи тепла. Когда влажность пара составляет менее 3%, пар описывается как перегретый (или сухой). Перегретый пар слишком сухой для эффективной передачи тепла и неэффективен для стерилизации паром. 2
Каков диапазон температур автоклава?
Обычно рекомендуемые температуры для стерилизации паром: 250 ° F (121 ° C), 270 ° F (132 ° C) или 275 ° F (135 ° C). Чтобы убить любые присутствующие микроорганизмы, стерилизуемые предметы должны подвергаться воздействию этих температур в течение минимального времени, рекомендованного производителем обрабатываемого устройства.
Каков временной интервал цикла автоклава?
Время воздействия — это время, необходимое для стерилизации устройства, и не включает в себя время всего цикла. Для правильной стерилизации паром существует соотношение времени и температуры, которое было разработано научными испытаниями и используется во всех методах стерилизации для создания так называемой фазы полного воздействия. Периоды воздействия при стерилизации паром зависят, среди прочего, от размера, формы, веса, плотности и состава материала стерилизуемого устройства.
Насколько велик автоклав?
Размер стерилизатора зависит от емкости, необходимой для помещения, где будет использоваться автоклав. Например, в стоматологическом кабинете автоклав может просто стоять на столешнице, где оборудование необходимо только для стерилизации небольших пакетов инструментов. Стерилизатор немедленного использования обычно требуется рядом с операционной, и, возможно, потребуется обрабатывать только 1-3 лотка с инструментами за раз. Однако большинство медицинских учреждений имеют больших автоклавных машин в своем отделении стерильной обработки (SPD), которые могут обрабатывать 15-20 лотков инструментов за цикл или даже до 625 фунтов инструментов за цикл в зависимости от размера.
Автоклавы промышленного размера для производственных процессов могут быть очень большими, некоторые сравнимы с размером грузовика или самолета.
Что такое автоклавирование?
Устройства должны быть совместимы с процессом автоклавирования. Автоклавируемые предметы должны быть совместимы с условиями высокой температуры и влажности и должны обрабатываться в соответствии с письменными инструкциями производителя по применению. Медицинские устройства, контактирующие со стерильными тканями или жидкостями организма, считаются критически важными.Эти предметы могут включать хирургические инструменты, имплантированные медицинские устройства, хирургические простыни и постельное белье. Эти предметы должны быть стерильными при использовании, поскольку любое микробное заражение может привести к передаче инфекции. Пар часто является предпочтительным стерилизующим средством для стерилизации предметов, устойчивых к воздействию тепла и влаги, поскольку он надежен, устойчив и опасен для микроорганизмов, а также безопасен для персонала, обслуживающего автоклав. 2
Сколько стоит автоклав?
Стоимость автоклава может сильно варьироваться из-за различного использования и применения этой технологии.Промышленные и фармацевтические автоклавы настраиваются и изготавливаются для конкретного использования, поэтому их стоимость, вероятно, будет отличаться от стоимости автоклавов, которые вы найдете в больнице или стоматологическом кабинете.
В сфере здравоохранения стоимость автоклава может варьироваться в зависимости от емкости и способа установки. Помимо первоначальной стоимости автоклава, следует учитывать обслуживание и стоимость продуктов для обеспечения стерильности и мониторинга . В зависимости от производителя автоклава затраты на цикл, потребление коммунальных услуг и затраты на техническое обслуживание могут изменяться с течением времени, и их следует оценивать, чтобы сравнить общую стоимость владения с течением времени.
Сравнение промышленных автоклавов и медицинских автоклавов
Автоклавы
могут использоваться в различных промышленных и медицинских целях. Промышленные автоклавы используются в производственных условиях для обработки деталей и материалов с использованием нагретого пара и давления: например, при производстве обработанной под давлением древесины и специальных каучуков, используемых в шинах вашего автомобиля. Автоклавы также используются в научных исследованиях и фармацевтической промышленности — помимо стерилизационного оборудования, используемого в лабораторных исследованиях, большинство автоклавов оснащены жидкостным циклом для стерилизации жидкостей, используемых в лабораторных условиях.
Медицинские паровые стерилизаторы используются в медицинских учреждениях для стерилизации предметов, устойчивых к нагреванию и влаге, таких как хирургические инструменты, имплантированные медицинские устройства, хирургические простыни и постельное белье. Циклы, используемые в медицинских паровых стерилизаторах, разработаны и утверждены в соответствии с признанными отраслевыми стандартами. В США паровые стерилизаторы, используемые в здравоохранении, должны быть разрешены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для использования по назначению производителя стерилизатора.
1 https://www.britannica.com/technology/autoclave
2 https://university.steris.com/course/understanding-steam-sterilization/
3 https://www.cdc.gov/hicpac/ Disinfection_Sterilization / 13_0Sterilization.html
4 (ANSI) Американский национальный институт стандартов Inc./(AAMI) Ассоциация развития медицинского оборудования
Дополнительные ссылки
Ассоциация развития медицинского оборудования. (2017). ANSI / AAMI ST79: 2017 подробное руководство по стерилизации паром и обеспечению стерильности в медицинских учреждениях.
Ассоциация медсестер. (2016). Руководство по периоперационной практике.
Международная ассоциация управления материальными ресурсами центральной службы здравоохранения. (2016). Central Service Technical Manual (8-е изд.). Макдоннелл, Г. (2007). Типы, действие и устойчивость к антисептике, дезинфекции и стерилизации.
Использование физических методов для борьбы с микроорганизмами
Цели обучения
- Понимать и сравнивать различные физические методы контроля роста микробов, включая нагревание, охлаждение, замораживание, обработку под высоким давлением, сушку, лиофилизацию, облучение и фильтрацию
На протяжении тысячелетий люди использовали различные физические методы микробиологического контроля для консервирования пищевых продуктов .Общие методы контроля включают, среди прочего, применение высоких температур, облучение, фильтрацию и осушение (сушку). Многие из этих методов неспецифически убивают клетки путем разрушения мембран, изменения проницаемости мембран или повреждения белков и нуклеиновых кислот путем денатурации, деградации или химической модификации. В этом разделе описаны различные физические методы, используемые для микробиологического контроля.
Тепло
Нагревание — одна из самых распространенных и самых старых форм микробиологического контроля.Используется в простых техниках, таких как приготовление пищи и консервирование . Тепло может убить микробы, изменяя их мембраны и денатурируя белки. Термическая точка смерти (TDP) микроорганизма — это самая низкая температура, при которой все микробы гибнут за 10-минутное воздействие. Различные микроорганизмы по-разному реагируют на высокие температуры, при этом некоторые (например, эндоспорообразователи, такие как C. botulinum ) более терпимы к теплу. Аналогичный параметр, время термической смерти (TDT) , — это время, необходимое для уничтожения всех микроорганизмов в образце при заданной температуре.Эти параметры часто используются для описания процедур стерилизации с использованием сильного нагрева, таких как автоклавирование . Кипячение — один из старейших методов борьбы с микробами влажным теплом, и он, как правило, довольно эффективен при уничтожении вегетативных клеток и некоторых вирусов. Однако кипячение менее эффективно уничтожает эндоспоры; некоторые эндоспоры способны выдержать до 20 часов кипячения. Кроме того, кипение может быть менее эффективным на больших высотах, где точка кипения воды ниже, и поэтому время кипения, необходимое для уничтожения микробов, больше.По этим причинам кипячение не считается полезным методом стерилизации в лабораторных или клинических условиях.
Для стерилизации в лаборатории или клинике можно использовать множество различных протоколов нагрева, и эти протоколы можно разделить на две основные категории: стерилизация сухим жаром и стерилизация влажным теплом . Лабораторная асептическая техника обычно включает в себя некоторые протоколы стерилизации сухим жаром с использованием прямого воздействия высокой температуры, например стерилизацию посевных петель.Сжигание при очень высоких температурах уничтожает все микроорганизмы. Сухой жар также может применяться в течение относительно длительного периода времени (не менее 2 часов) при температуре до 170 ° C с использованием стерилизатора сухого нагрева, такого как духовка. Однако стерилизация влажным теплом обычно является более эффективным протоколом, поскольку она проникает в клетки лучше, чем сухим теплом.
Рис. 1. (a) Стерилизация петли, часто называемая «обжигом петли», является обычным компонентом асептической техники в микробиологической лаборатории и используется для сжигания любых микроорганизмов на петле.(b) В качестве альтернативы можно использовать бактерициератор для уменьшения аэрозолизации микробов и устранения наличия открытого пламени в лаборатории. Это примеры стерилизации сухим жаром путем прямого воздействия высокой температуры, способной к сжиганию. (кредит А: модификация работы Ань-Хюэ Ту; кредит Б: модификация работы Брайана Форстера)
Автоклавы
Автоклавы полагаются на стерилизацию влажным жаром. Они используются для повышения температуры выше точки кипения воды для стерилизации предметов, таких как хирургическое оборудование, от вегетативных клеток, вирусов и особенно эндоспор, которые, как известно, выдерживают температуры кипения, не повреждая предметы.Чарльз Чемберленд (1851–1908) разработал современный автоклав в 1879 году, работая в лаборатории Луи Пастера . Автоклав до сих пор считается самым эффективным методом стерилизации. Вне лабораторий и клинических учреждений большие промышленные автоклавы под названием retort s позволяют проводить стерилизацию влажным теплом в больших масштабах.
Как правило, воздух в камере автоклава удаляется и заменяется увеличивающимся количеством пара, захваченного в замкнутой камере, что приводит к увеличению внутреннего давления и температуры выше точки кипения воды.Два основных типа автоклавов различаются способом удаления воздуха из камеры. В автоклавах самотечного вытеснения пар вводится в камеру сверху или с боков. Воздух, который тяжелее пара, опускается на дно камеры, где вытесняется через вентиляционное отверстие. Полное вытеснение воздуха затруднено, особенно при больших нагрузках, поэтому для таких нагрузок могут потребоваться более длительные циклы. В предвакуумных стерилизаторах воздух полностью удаляется с помощью высокоскоростного вакуума перед подачей пара в камеру.Поскольку воздух удаляется более полно, пар может легче проникать в завернутые предметы. Многие автоклавы могут работать как под действием силы тяжести, так и с предварительным вакуумом, используя первый для обеззараживания отходов и стерилизации сред и неупакованной стеклянной посуды, а второй — для стерилизации упакованных инструментов.
Рис. 2. (a) Автоклав обычно используется для стерилизации в лаборатории и в клинических условиях. Путем вытеснения воздуха в камере увеличивающимся количеством пара может быть достигнуто повышение давления и температура, превышающая 100 ° C, что обеспечивает полную стерилизацию.(b) Исследователь программирует автоклав для стерилизации образца. (кредит а: модификация работы Кортни Харрингтон; кредит б: модификация работы Лакемейер М.Г., Кок-Меркадо Ф.д., Вада Дж., Боллинджер Л., Киндрачук Дж., Валь-Йенсен В., Кун Дж. Х., Джарлинг П.Б.)
Стандартные рабочие температуры автоклавов составляют 121 ° C или, в некоторых случаях, 132 ° C, обычно при давлении от 15 до 20 фунтов на квадратный дюйм (psi). Продолжительность воздействия зависит от объема и природы стерилизуемого материала, но обычно составляет 20 минут или более, при этом для больших объемов требуется более длительное время воздействия для обеспечения достаточной теплопередачи к стерилизуемым материалам.Пар должен напрямую контактировать с стерилизуемыми жидкостями или сухими материалами, поэтому контейнеры оставляют неплотно закрытыми, а инструменты неплотно оборачивают бумагой или фольгой. Ключ к автоклавированию заключается в том, что температура должна быть достаточно высокой, чтобы уничтожить эндоспоры для достижения полной стерилизации.
Рис. 3. Белые полоски на ленте автоклава (левая пробирка) становятся темными во время успешного запуска автоклава (правая пробирка). (кредит: модификация работы Брайана Форстера)
Поскольку стерилизация так важна для безопасных медицинских и лабораторных протоколов, контроль качества имеет важное значение.Автоклавы могут быть оснащены регистраторами для регистрации значений давления и температуры, достигнутых во время каждого цикла. Кроме того, внутренние индикаторы различных типов следует автоклавировать вместе с стерилизуемыми материалами, чтобы гарантировать достижение необходимой температуры стерилизации. Одним из распространенных типов индикаторов является использование термочувствительной ленты для автоклава , которая имеет белые полосы, которые становятся черными при достижении соответствующей температуры во время успешной работы автоклава.Этот тип индикатора относительно недорогой и может использоваться при каждом запуске. Однако автоклавная лента не указывает продолжительность воздействия, поэтому ее нельзя использовать в качестве индикатора стерильности.
Другой тип индикатора, биологический индикаторный тест на споры, использует либо полоску бумаги, либо жидкую суспензию эндоспор Geobacillus stearothermophilus , чтобы определить, уничтожены ли эндоспоры в процессе. Эндоспоры облигатной термофильной бактерии G. stearothermophilus — золотой стандарт, используемый для этой цели из-за их чрезвычайно высокой термостойкости. Биологические индикаторы спор также можно использовать для проверки эффективности других протоколов стерилизации, включая этиленоксид, сухой жар, формальдегид, гамма-излучение и плазменную стерилизацию перекисью водорода с использованием либо G . stearothermophilus , Bacillus atrophaeus, B. subtilis, или Споры B. pumilus .
В случае проверки функции автоклава, эндоспоры инкубируются после автоклавирования, чтобы гарантировать отсутствие жизнеспособных эндоспор.Рост бактерий после прорастания эндоспор можно контролировать с помощью тестов биологических индикаторов спор , которые обнаруживают кислотные метаболиты или флуоресценцию, производимую ферментами, полученными из жизнеспособных G. stearothermophilus . Третий тип автоклавного индикатора — это трубка Diack , стеклянная ампула, содержащая термочувствительный шарик, плавящийся при надлежащей температуре стерилизации. Полоски со спорами или пробирки Диака используются периодически, чтобы гарантировать правильную работу автоклава.
Пастеризация
Хотя полная стерилизация идеальна для многих медицинских применений, она не всегда практична для других применений и может также повлиять на качество продукта. Кипячение и автоклавирование не являются идеальными способами контроля роста микробов во многих пищевых продуктах, поскольку эти методы могут нарушить консистенцию и другие органолептические (сенсорные) качества пищи. Пастеризация — это форма микробиологического контроля пищевых продуктов, при которой используется тепло, но при этом пища не становится стерильной.Традиционная пастеризация убивает болезнетворные микроорганизмы и снижает количество вызывающих порчу микробов, сохраняя при этом качество пищевых продуктов. Процесс пастеризации был впервые разработан Луи Пастером в 1860-х годах как метод предотвращения порчи пива и вина. Сегодня пастеризация чаще всего используется для уничтожения чувствительных к нагреванию патогенов в молоке и других пищевых продуктах (например, яблочном соке и меде). Однако, поскольку пастеризованные пищевые продукты не стерильны, они со временем испортятся.
Методы пастеризации молока уравновешивают температуру и продолжительность обработки. Один метод, высокотемпературная кратковременная пастеризация (HTST) , подвергает молоко воздействию температуры 72 ° C в течение 15 секунд, что снижает количество бактерий при сохранении качества молока. Альтернативой является пастеризация при сверхвысокой температуре (UHT) , при которой молоко подвергается воздействию температуры 138 ° C в течение 2 или более секунд. Пастеризованное молоко UHT можно долго хранить в герметичных емкостях без охлаждения; однако очень высокие температуры изменяют белки в молоке, вызывая легкие изменения вкуса и запаха.Тем не менее, этот метод пастеризации выгоден в регионах, где доступ к охлаждению ограничен.
Рис. 4. Два разных метода пастеризации, HTST и UHT, обычно используются для уничтожения патогенов, связанных с порчей молока. (кредит слева: модификация работы Марка Хиллари; кредит справа: модификация работы Керри Чешика)
Подумай об этом
- В автоклаве, как достигается температура выше кипения?
- Как можно сравнить начало порчи между HTST-пастеризованным и UHT-пастеризованным молоком?
- Почему кипячение не используется в качестве метода стерилизации в клинических условиях?
Холодильное и морозильное оборудование
Так же, как высокие температуры эффективны для контроля роста микробов, воздействие низких температур также может быть простым и эффективным методом микробного контроля, за исключением психрофилов , которые предпочитают низкие температуры (см. Температура и рост микробов).Холодильники, используемые на домашних кухнях или в лаборатории, поддерживают температуру от 0 ° C до 7 ° C. Этот температурный диапазон подавляет микробный метаболизм, значительно замедляя рост микроорганизмов и помогая сохранять охлажденные продукты, такие как продукты питания или медицинские принадлежности. Некоторые типы лабораторных культур могут быть сохранены в холодильнике для дальнейшего использования.
Замораживание ниже –2 ° C может остановить рост микробов и даже убить чувствительные организмы. По данным Министерства сельского хозяйства США (USDA), единственные безопасные способы размораживания замороженных продуктов — это в холодильнике, погружении в холодную воду, сменяемую каждые 30 минут, или в микроволновой печи, поддерживая продукты при температуре, не способствующей росту бактерий. .Кроме того, остановленный рост бактерий может возобновиться в размороженных продуктах, поэтому с размороженными продуктами следует обращаться как со свежими скоропортящимися продуктами.
Бактериальные культуры и медицинские образцы, требующие длительного хранения или транспортировки, часто замораживают при сверхнизких температурах –70 ° C или ниже. Эти сверхнизкие температуры могут быть достигнуты путем хранения образцов на сухом льду в морозильной камере сверхнизкой температуры или в специальных резервуарах с жидким азотом , которые поддерживают температуру ниже −196 ° C.
Рис. 5. Культуры и другие медицинские образцы можно хранить в течение длительного времени при сверхнизких температурах. (а) Морозильник со сверхмалой температурой поддерживает температуру -70 ° C или ниже. (b) Еще более низкие температуры могут быть достигнуты путем замораживания и хранения в жидком азоте. (кредит а: модификация работы «Expert Infantry» / Flickr; кредит b: модификация работы USDA)
Подумай об этом
- Убивает ли еда в холодильнике бактерии?
Давление
Воздействие высокого давления убивает множество микробов.В пищевой промышленности обработка под высоким давлением (также называемая паскализацией ) используется для уничтожения бактерий, дрожжей, плесени, паразитов и вирусов в пищевых продуктах при сохранении качества пищевых продуктов и продлении срока хранения. Применение высокого давления от 100 до 800 МПа (атмосферное давление на уровне моря составляет около 0,1 МПа) достаточно для уничтожения вегетативных клеток путем денатурации белка, но эндоспоры могут выдержать это давление.
В клинических условиях гипербарическая оксигенотерапия иногда используется для лечения инфекций.В этой форме терапии пациент дышит чистым кислородом под давлением, превышающим нормальное атмосферное давление, обычно от 1 до 3 атмосфер (атм). Это достигается помещением пациента в барокамеру или подачей сжатого кислорода через дыхательную трубку. Гипербарическая оксигенотерапия помогает увеличить насыщение кислородом тканей, которые становятся гипоксическими из-за инфекции и воспаления. Эта повышенная концентрация кислорода усиливает иммунный ответ организма за счет увеличения активности нейтрофилов и макрофагов, лейкоцитов, которые борются с инфекциями.Повышенный уровень кислорода также способствует образованию токсичных свободных радикалов, которые подавляют рост чувствительных к кислороду или анаэробных бактерий, таких как Clostridium perfringens , частая причина газовой гангрены . При инфекциях C. perfringens гипербарическая кислородная терапия также может снизить секрецию бактериального токсина, вызывающего разрушение тканей. Гипербарическая кислородная терапия, по-видимому, также повышает эффективность лечения антибиотиками.К сожалению, некоторые редкие риски включают кислородное отравление и воздействие на нежные ткани, такие как глаза, среднее ухо и легкие, которые могут быть повреждены повышенным давлением воздуха.
Обработка под высоким давлением обычно не используется для дезинфекции или стерилизации фомитов. Хотя приложение давления и пара в автоклаве эффективно для уничтожения эндоспор, именно достигнутая высокая температура, а не непосредственно давление, приводит к гибели эндоспор.
Полоса неудачных попыток
Однажды весной 2015 года в понедельник у женщины из Огайо началось нечеткое двоение в глазах; Трудность глотания; и опущенные веки.Ее срочно доставили в отделение неотложной помощи местной больницы. Во время обследования у нее начались спазмы в животе, тошнота, паралич, сухость во рту, слабость лицевых мышц, затрудненная речь и дыхание. На основании этих симптомов был активирован центр управления инцидентами в больнице, и официальные органы здравоохранения штата Огайо были уведомлены о возможном случае ботулизма. Тем временем другие пациенты с подобными симптомами стали появляться в других местных больницах. Из-за подозрения на ботулизм антитоксин был доставлен в эти медицинские учреждения в течение ночи из центра контроля заболеваний для введения пострадавшим пациентам.Первый пациент умер от дыхательной недостаточности в результате паралича, а примерно половине оставшихся жертв потребовалась дополнительная госпитализация после введения антитоксина, при этом, по крайней мере, двум потребовались аппараты ИВЛ для дыхания.
Должностные лица общественного здравоохранения расследовали каждый из случаев и определили, что все пациенты накануне посетили одно и то же церковное угощение. Кроме того, они установили, что источник вспышки — картофельный салат, приготовленный из домашнего консервированного картофеля. Скорее всего, картофель консервировали в кипящей воде — метод, который позволяет эндоспорам Clostridium botulinum выжить. C. botulinum продуцирует ботулинический токсин, нейротоксин, который часто оказывается смертельным после приема внутрь. По данным CDC, случай в Огайо стал крупнейшей вспышкой ботулизма в Соединенных Штатах почти за 40 лет.
Для уничтожения эндоспор C. botulinum требуется минимальная температура 116 ° C (240 ° F), что намного выше точки кипения воды. Эта температура может быть достигнута только в автоклаве, который рекомендуется для домашнего консервирования продуктов с низким содержанием кислоты, таких как мясо, рыба, птица и овощи.Кроме того, CDC рекомендует кипятить домашние консервы примерно за 10 минут перед употреблением. Поскольку ботулотоксин термолабилен (это означает, что он денатурируется под действием тепла), 10 минут кипячения сделают нефункциональным любой ботулотоксин, который может содержаться в пище.
Рис. 6. (a) Clostridium botulinum является возбудителем ботулизма. (b) Для домашнего консервирования рекомендуется использовать автоклав, потому что эндоспоры C. botulinum могут выдерживать температуры выше точки кипения воды.(кредит a: модификация работы Центров по контролю и профилактике заболеваний; кредит b: модификация работы Национального центра консервирования домашней еды)
Чтобы узнать больше о правильных методах консервирования в домашних условиях, посетите веб-сайт CDC.
Высыхание
Сушка, также известная как сушка или обезвоживание, — это метод, который тысячелетиями использовался для консервирования таких продуктов, как изюм, чернослив и вяленое мясо. Это работает, потому что все клетки, включая микробы, нуждаются в воде для своего метаболизма и выживания.Хотя сушка контролирует рост микробов, она может не убить все микробы или их эндоспоры, которые могут начать снова расти, когда условия станут более благоприятными и содержание воды восстановится.
В некоторых случаях продукты сушат на солнце, полагаясь на испарение для достижения высыхания. Сублимационная сушка или лиофилизация — это еще один метод осушения, при котором предмет быстро замораживается («мгновенно замораживается») и помещается под вакуум, чтобы вода терялась при сублимации. Лиофилизация сочетает в себе воздействие низких температур и высыхание, что делает ее весьма эффективной для контроля роста микробов.Кроме того, лиофилизация наносит меньший ущерб предмету, чем обычное высушивание, и лучше сохраняет исходные качества предмета. Лиофилизированные предметы можно хранить при комнатной температуре, если они упакованы соответствующим образом, чтобы предотвратить накопление влаги. Лиофилизация используется для консервирования в пищевой промышленности, а также в лаборатории для длительного хранения и транспортировки микробных культур.
Содержание воды в пищевых продуктах и материалах, называемое активностью воды , можно снизить без физического высушивания путем добавления растворенных веществ, таких как соли или сахара.При очень высоких концентрациях солей или сахаров количество доступной воды в микробных клетках резко снижается, поскольку вода будет поступать из области с низкой концентрацией растворенного вещества (внутри клетки) в область с высокой концентрацией растворенного вещества (вне клетки). Многие микроорганизмы не выживают в условиях высокого осмотического давления. Мед, например, на 80% состоит из сахарозы, среды, в которой очень мало микроорганизмов способно расти, что устраняет необходимость в охлаждении.Соленое мясо и рыба, такие как ветчина и треска, соответственно, были критически важными продуктами питания до возраста охлаждения . Фрукты консервировали, добавляя сахар, делая джемы и желе. Однако некоторые микробы, такие как плесень и дрожжи, обычно более терпимы к высыханию и высокому осмотическому давлению и, таким образом, все еще могут загрязнять эти типы пищевых продуктов.
Рис. 7. (a) Добавление растворенного вещества создает гипертоническую среду, вытягивая воду из клеток. (б) Некоторые продукты можно сушить напрямую, например изюм и вяленое мясо.Остальные продукты сушат с добавлением соли, как в случае соленой рыбы, или сахара, как в случае с вареньем. (кредит а: модификация работы «Брюса Блауса» / Wikimedia Commons; изюминка: модификация работы Кристиана Шнеттелькера; кредитный отрывок: модификация работы Ларри Якобсена; соленая рыба: модификация работы «Фотограф» / Викимедиа Commons; кредитная пробка: модификация работы Кима Беккера)
Подумай об этом
- Как добавление соли или сахара в пищу влияет на ее водную активность?
Радиация
Радиация в различных формах, от излучения высокой энергии до солнечного света, может использоваться для уничтожения микробов или подавления их роста. Ионизирующее излучение включает рентгеновские лучи, гамма-лучи и пучки электронов высокой энергии. Ионизирующее излучение достаточно мощно, чтобы проникнуть в клетку, где оно изменяет молекулярные структуры и повреждает компоненты клетки. Например, ионизирующее излучение вызывает двухцепочечные разрывы в молекулах ДНК. Это может непосредственно вызвать возникновение мутаций ДНК, или могут возникнуть мутации, когда клетка пытается восстановить повреждение ДНК. По мере накопления этих мутаций они в конечном итоге приводят к гибели клеток.
Рентгеновские лучи и гамма-лучи легко проникают в бумагу и пластик и поэтому могут использоваться для стерилизации многих упакованных материалов. В лаборатории ионизирующее излучение обычно используется для стерилизации материалов, которые нельзя автоклавировать, таких как пластиковые чашки Петри и одноразовые пластиковые петли для посева. В клинических условиях ионизирующее излучение используется для стерилизации перчаток, внутривенных трубок и других изделий из латекса и пластика, используемых для ухода за пациентами. Ионизирующее излучение также используется для стерилизации других типов чувствительных к теплу материалов, используемых в клинической практике, включая ткани для трансплантации, фармацевтические препараты и медицинское оборудование.
В Европе широко используется гамма-облучение для консервирования продуктов , хотя в Соединенных Штатах оно медленно приживается. Упакованные сушеные специи также часто подвергаются гамма-облучению. Из-за их способности проникать сквозь бумагу, пластик, тонкие листы дерева и металла, а также ткани, необходимо соблюдать большую осторожность при использовании рентгеновских лучей и гамма-излучения. Эти типы ионизирующего излучения не могут проникать через толстые слои железа или свинца, поэтому эти металлы обычно используются для защиты людей, которые могут быть потенциально подвержены воздействию.
Другой тип излучения, неионизирующее излучение , обычно используется для стерилизации и потребляет меньше энергии, чем ионизирующее излучение. Не проникает в клетки или упаковку. Ультрафиолетовый (УФ) свет является одним из примеров; он вызывает образование димера тимина s между соседними тиминами в одной цепи ДНК. Когда ДНК-полимераза сталкивается с димером тимина, она не всегда включает соответствующие комплементарные нуклеотиды (два аденина), и это приводит к образованию мутаций, которые в конечном итоге могут убить микроорганизмы.
Ультрафиолетовый свет
может эффективно использоваться как потребителями, так и лабораторным персоналом для контроля роста микробов. Ультрафиолетовые лампы в настоящее время обычно включаются в системы очистки воды для использования в домашних условиях. Кроме того, туристы обычно используют небольшие портативные ультрафиолетовые лампы для очистки воды от естественной среды перед употреблением. Бактерицидные лампы также используются в хирургических кабинетах, шкафах биологической безопасности s и переносных колпаках, обычно излучающих ультрафиолетовый свет с длиной волны 260 нм.Поскольку ультрафиолетовый свет не проникает через поверхности и не проходит через пластик или стекло, клетки должны подвергаться прямому воздействию источника света.
Солнечный свет имеет очень широкий спектр, который включает УФ и видимый свет. В некоторых случаях солнечный свет может быть эффективным против определенных бактерий как из-за образования димеров тимина под действием УФ-света, так и из-за образования продуктов реактивного кислорода, индуцированных в небольших количествах под воздействием видимого света.
Рис. 8. (a) УФ-излучение вызывает образование димеров тимина в ДНК, что приводит к летальным мутациям в облученных микробах.(б) Бактерицидные лампы, излучающие УФ-свет, обычно используются в лаборатории для стерилизации оборудования.
Подумай об этом
- Каковы два преимущества ионизирующего излучения как метода стерилизации?
- Как эффективность ионизирующего излучения сравнивается с эффективностью неионизирующего излучения?
Облученная еда: вы бы съели это?
Из всех способов предотвращения порчи пищевых продуктов и болезней пищевого происхождения гамма-облучение может быть самым неаппетитным.Хотя гамма-облучение является проверенным методом устранения потенциально вредных микробов из пищевых продуктов, общественность еще не поверила этому. Однако большая часть их опасений связана с дезинформацией и плохим пониманием основных принципов излучения.
Наиболее распространенный метод облучения заключается в воздействии на пищу кобальта-60 или цезия-137 путем пропускания их через радиационную камеру на конвейерной ленте. Пища не контактирует напрямую с радиоактивным материалом и сама не становится радиоактивной.Таким образом, отсутствует риск облучения радиоактивным материалом при употреблении в пищу продуктов, облученных гамма-излучением. Кроме того, питательные свойства облученных продуктов существенно не меняются, за исключением потери некоторых витаминов, которая также усугубляется длительным хранением. Изменение вкуса или запаха может происходить в облученных пищевых продуктах с высоким содержанием жира, таких как жирное мясо и молочные продукты, но этот эффект можно свести к минимуму, используя более низкие дозы радиации при более низких температурах.
В США CDC, Агентство по охране окружающей среды (EPA) и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) сочли облучение безопасным и эффективным для различных видов мяса, птицы, моллюсков, свежих фруктов и овощей, яиц в скорлупе, и специи и приправы.Гамма-облучение пищевых продуктов также одобрено для использования во многих других странах, включая Францию, Нидерланды, Португалию, Израиль, Россию, Китай, Таиланд, Бельгию, Австралию и Южную Африку. Чтобы облегчить беспокойство потребителей и способствовать усилиям по обучению, облученные продукты теперь четко маркируются и маркируются международным символом облучения, называемым «радура». Принятие со стороны потребителей, похоже, растет, о чем свидетельствуют несколько недавних исследований.
(a) Пищевые продукты подвергаются гамма-излучению при прохождении по конвейерной ленте через камеру излучения.(b) Гамма-облученные продукты должны иметь четкую маркировку и иметь символ облучения, известный как «радура». (кредит a, b: модификация работы Министерства сельского хозяйства США)
Обработка ультразвуком
Использование высокочастотных ультразвуковых волн для разрушения клеточных структур называется обработкой ультразвуком . Применение ультразвуковых волн вызывает быстрые изменения давления внутриклеточной жидкости; это приводит к кавитации , , образованию пузырьков внутри клетки, которые могут разрушить клеточные структуры и, в конечном итоге, вызвать лизис или коллапс клетки.Обработка ультразвуком полезна в лаборатории для эффективного лизирования клеток с целью высвобождения их содержимого для дальнейших исследований; За пределами лаборатории обработка ультразвуком используется для очистки хирургических инструментов, линз и множества других предметов, таких как монеты, инструменты и музыкальные инструменты.
Фильтрация
Фильтрация — это метод физического отделения микробов от образцов. Воздух обычно фильтруется через высокоэффективные воздушные фильтры для твердых частиц (HEPA) . Фильтры HEPA имеют эффективный размер пор 0.3 мкм, достаточно маленький, чтобы улавливать бактериальные клетки, эндоспоры и многие вирусы, когда воздух проходит через эти фильтры, почти стерилизуя воздух с другой стороны фильтра. Фильтры HEPA имеют множество применений и широко используются в клинических условиях, в автомобилях и самолетах и даже в домашних условиях. Например, их можно найти в пылесосах, системах отопления и кондиционирования воздуха, а также в очистителях воздуха.
Рис. 10. (a) HEPA-фильтры, подобные этому, удаляют микробы, эндоспоры и вирусы при прохождении через них воздуха.(б) Схема фильтра HEPA. (кредит а: модификация работы CSIRO; кредит b: модификация работы «LadyofHats» / Мариана Руис Вильярреаль)
Шкафы биологической безопасности
Шкафы биологической безопасности — хороший пример использования НЕРА-фильтров. HEPA-фильтры в шкафу биологической безопасности s (BSC) используются для удаления твердых частиц из воздуха, которые либо попадают в шкаф (воздухозаборник), либо выходят из него (выпуск воздуха), либо обрабатывают как воздухозаборник, так и выхлоп.Использование HEPA-фильтра для забора воздуха предотвращает попадание загрязняющих веществ из окружающей среды в BSC, создавая чистую зону для работы с биологическими материалами. Использование вытяжного HEPA-фильтра предотвращает заражение лаборатории патогенами в лаборатории, тем самым обеспечивая безопасную рабочую зону для персонала лаборатории.
Существует три класса BSC: I, II и III. Каждый класс разработан для обеспечения разного уровня защиты лабораторного персонала и окружающей среды; BSC II и III также предназначены для защиты материалов или устройств в шкафу.В таблице ниже суммирован уровень безопасности, обеспечиваемый каждым классом BSC для каждого BSL.
| Биологические риски и BSC | ||||
|---|---|---|---|---|
| Оценка биологического риска | BSC Класс | Защита персонала | Охрана окружающей среды | Защита продукта |
| BSL-1, BSL-2, BSL-3 | I | Есть | Есть | № |
| BSL-1, BSL-2, BSL-3 | II | Есть | Есть | Есть |
| BSL-4 | III; II при использовании в комнате костюма с костюмом | Есть | Есть | Есть |
BSC класса I защищают лабораторных работников и окружающую среду от низкого или умеренного риска воздействия биологических агентов, используемых в лаборатории.Воздух втягивается в шкаф, а затем фильтруется перед выходом через вытяжную систему здания. BSC класса II используют направленный воздушный поток и частичные барьерные системы для сдерживания инфекционных агентов. BSC класса III предназначены для работы с высокоинфекционными агентами, такими как те, что используются в лабораториях BSL-4 . Они газонепроницаемы, и материалы, входящие в шкаф или выходящие из него, должны проходить через систему с двойными дверцами, позволяющую обеззараживать промежуточное пространство между использованиями. Весь воздух проходит через один или два HEPA-фильтра и систему сжигания воздуха, а затем выходит прямо на улицу (не через вытяжную систему здания).Персонал может работать с материалами внутри шкафа класса III, используя длинные резиновые перчатки, прикрепленные к шкафу.
В этом видео показано, как проектируются BSC, и объясняется, как они защищают персонал, окружающую среду и продукт.
Фильтрация в больницах
Фильтры
HEPA также широко используются в больницах и хирургических кабинетах для предотвращения заражения и распространения переносимых по воздуху микробов через системы вентиляции. Системы фильтрации HEPA могут быть спроектированы как для целых зданий, так и для отдельных помещений.Например, ожоговые отделения, операционные или изоляционные отделения могут потребовать специальных систем фильтрации HEPA для удаления условно-патогенных микроорганизмов из окружающей среды, поскольку пациенты в этих палатах особенно уязвимы для инфекции.
Мембранные фильтры
Фильтрация также может использоваться для удаления микробов из жидких образцов с помощью мембранной фильтрации . Мембранные фильтры для жидкостей работают аналогично фильтрам HEPA для воздуха. Обычно мембранные фильтры, которые используются для удаления бактерий, имеют эффективный размер пор 0.2 мкм, что меньше среднего размера бактерии (1 мкм), но фильтры с меньшими размерами пор доступны для более специфических нужд. Мембранная фильтрация полезна для удаления бактерий из различных типов термочувствительных растворов, используемых в лаборатории, таких как растворы антибиотиков и растворы витаминов. Большие объемы питательной среды также можно стерилизовать фильтрованием, а не автоклавировать, чтобы защитить термочувствительные компоненты. Часто при фильтрации малых объемов используются шприцевые фильтры , но вакуумные фильтры обычно используются для фильтрации больших объемов.
Рис. 11. Мембранные фильтры бывают разных размеров в зависимости от объема фильтруемого раствора. (а) Большие объемы фильтруются в таких единицах. Раствор пропускается через фильтр при подключении устройства к вакууму. (b) Меньшие объемы часто фильтруются с использованием шприцевых фильтров, которые устанавливаются на конце шприца. В этом случае раствор проталкивается нажатием на поршень шприца. (кредит а, б: модификация работы Брайана Форстера)
Подумай об этом
- Будет мембранная фильтрация с 0.Фильтр 2 мкм, скорее всего, удалит вирусы из раствора? Объяснять.
- Назовите хотя бы два распространенных использования HEPA-фильтрации в клинических или лабораторных условиях.
Резюме: Физические методы борьбы с микроорганизмами
В таблицах ниже приведены физические методы управления, обсуждаемые в этом разделе.
| Таблица 1. Методы контроля с использованием тепла | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Кипячение | 100 ° C на уровне моря | Денатурирует белки и изменяет мембраны | Кулинария, личное использование, приготовление некоторых лабораторных сред |
| Сухой жарочный шкаф | 170 ° C в течение 2 часов | Денатурирует белки и изменяет мембраны, обезвоживание, обезвоживание | Стерилизация термостойкого медицинского и лабораторного оборудования и посуды |
| Сжигание | Воздействие пламени | Уничтожить сжиганием | Петля пламенная, микроинсинератор |
| Автоклав | Стандартные настройки: 121 ° C в течение 15–40 минут при 15 фунтах на кв. Дюйм | Денатурирует белки и изменяет мембраны | Стерилизация микробиологических сред, термостойкого медицинского и лабораторного оборудования и других термостойких предметов |
| Пастеризация | 72 ° C в течение 15 секунд (HTST) или 138 ° C в течение ≥ 2 секунд (UHT) | Денатурирует белки и изменяет мембраны | Предотвращает порчу молока, яблочного сока, меда и других жидкостей, пригодных для употребления внутрь |
| Таблица 2.Методы борьбы с холодом | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Холодильное оборудование | от 0 ° C до 7 ° C | Подавляет метаболизм (замедляет или останавливает деление клеток) | Консервация пищевых продуктов или лабораторных материалов (растворов, культур) |
| Замораживание | Ниже −2 ° C | Останавливает метаболизм, может убить микробы | Долгосрочное хранение пищевых продуктов, лабораторных культур или медицинских образцов |
| Таблица 3.Методы управления давлением | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Обработка под высоким давлением | Воздействие давления 100–800 МПа | Денатурирует белки и может вызывать лизис клеток | Консервирование продуктов |
| Гибербарическая оксигенотерапия | Вдыхание чистого кислорода при давлении 1–3 атм. | Подавляет метаболизм и рост анаэробных микробов | Лечение некоторых инфекций (например,г., газовая гангрена) |
| Таблица 4. Методы контроля с использованием Dessication | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Простое обезвоживание | Сушка | Подавляет метаболизм | Сухофрукты вяленое |
| Снижение активности воды | Добавление соли или воды | Подавляет метаболизм и может вызывать лизис | Соленое мясо и рыба, мед, джемы и мармеладки |
| Лиофилизация | Быстрое замораживание под вакуумом | Подавляет метаболизм | Консервация пищевых продуктов, лабораторных культур или реагентов |
| Таблица 5.Методы радиационного контроля | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Ионизирующее излучение | Воздействие рентгеновских или гамма-лучей | Изменяет молекулярные структуры, вводит двухцепочечные разрывы в ДНК | Стерилизация специй и термочувствительных лабораторных и медицинских изделий; используется для стерилизации пищевых продуктов в Европе, но не получил широкого распространения в США |
| Неионизирующее излучение | Воздействие ультрафиолетового света | Вводит димеры тимина, приводя к мутациям | Поверхностная стерилизация лабораторных материалов, очистка воды |
| Таблица 6.Методы контроля с использованием ультразвуковой обработки | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Обработка ультразвуком | Воздействие ультразвуковых волн | Кавитация (образование пустого пространства) разрушает клетки, лизируя их | Лабораторные исследования по лизированию клеток; чистка ювелирных изделий, линз и оборудования |
| Таблица 7. Методы контроля с использованием фильтрации | |||
|---|---|---|---|
| Метод | Условия | Режим действия | Пример использования |
| Фильтрация HEPA | Использование высокоэффективного воздушного фильтра (HEPA) с фильтром 0.Размер пор 3 мкм | Физически удаляет микробы из воздуха | Лабораторные шкафы биологической безопасности, операционные, изоляторы, системы отопления и кондиционирования, пылесосы |
| Мембранная фильтрация | Использование мембранного фильтра с размером пор 0,2 мкм или меньше | Физически удаляет микробы из жидких растворов | Удаление бактерий из термочувствительных растворов, таких как витамины, антибиотики и сред с термочувствительными компонентами |
Ключевые концепции и резюме
- Тепло — широко используемый и высокоэффективный метод контроля роста микробов.
- Стерилизация сухим жаром Протоколы обычно используются в лабораторных асептических методах. Однако стерилизация влажным теплом обычно является более эффективным протоколом, поскольку она проникает в клетки лучше, чем сухим теплом.
- Пастеризация используется для уничтожения патогенов и уменьшения количества микробов, вызывающих порчу пищевых продуктов. Высокотемпературная краткосрочная пастеризация. обычно используется для пастеризации молока, которое будет охлаждено; сверхвысокотемпературная пастеризация можно использовать для пастеризации молока для длительного хранения без охлаждения.
- Охлаждение замедляет рост микробов; замораживание останавливает рост, убивая некоторые организмы. Лабораторные и медицинские образцы можно замораживать на сухом льду или при сверхнизких температурах для хранения и транспортировки.
- Обработка под высоким давлением может использоваться для уничтожения микробов в продуктах питания. Гипербарическая оксигенотерапия для увеличения насыщения кислородом также используется для лечения некоторых инфекций.
- Desiccation давно используется для консервирования пищевых продуктов и ускоряется за счет добавления соли или сахара, которые снижают активность воды в пищевых продуктах.
- Лиофилизация сочетает в себе воздействие холода и сушку для длительного хранения пищевых продуктов и лабораторных материалов, но микробы остаются и могут быть восстановлены.
- Ионизирующее излучение , включая гамма-излучение, является эффективным способом стерилизации термочувствительных и упакованных материалов. Неионизирующее излучение , как и ультрафиолетовое излучение, не может проникать через поверхности, но полезно для стерилизации поверхностей.
- Фильтрация HEPA обычно используется в больничных системах вентиляции и шкафах биологической безопасности в лабораториях для предотвращения передачи переносимых по воздуху микробов. Мембранная фильтрация обычно используется для удаления бактерий из термочувствительных растворов.
Множественный выбор
Какой из следующих методов вызывает лизис клеток из-за кавитации, вызванной быстрыми локальными изменениями давления?
- микроволновая печь
- гамма-облучение
- ультрафиолетовое излучение
- обработка ультразвуком
Показать ответ
г. Обработка ультразвуком вызывает лизис клеток из-за кавитации, вызванной быстрыми локальными изменениями давления.
Какой из следующих терминов используется для описания времени, необходимого для уничтожения всех микробов в образце при данной температуре?
- Значение D
- точка термической смерти
- время термической смерти
- время десятичной редукции
Показать ответ
г. Время термической смерти описывает время, необходимое для уничтожения всех микробов в образце при заданной температуре.
Какой из следующих методов микробного контроля на самом деле не убивает микробы и не подавляет их рост, а вместо этого физически удаляет их из образцов?
- фильтрация
- сушка
- лиофилизация
- неионизирующее излучение
Показать ответ
а.Фильтрация фактически не убивает микробы и не препятствует их росту, а вместо этого физически удаляет их из образцов.
Заполните бланк
В автоклаве давление на ________ увеличивается, чтобы пар достиг температуры выше точки кипения воды.
Покажи ответ
В автоклаве давление пара увеличивается, чтобы дать пару достичь температуры выше точки кипения воды.
Верно / Неверно
Ионизирующее излучение может проникать через поверхности, а неионизирующее излучение — нет.
Протоколы стерилизации влажным жаром требуют использования более высоких температур в течение более длительных периодов времени, чем протоколы стерилизации сухим жаром.
Подумай об этом
- В чем преимущество пастеризации HTST по сравнению со стерилизацией? В чем преимущество УВТ-лечения?
- Как добавление соли или сахара помогает сохранить пищу?
- Что более эффективно при уничтожении микробов: автоклавирование или замораживание? Объяснять.
- В 2001 году эндоспоры Bacillus anthracis , возбудителя сибирской язвы, были отправлены правительственным чиновникам и информационным агентствам по почте.В ответ Почтовая служба США начала облучать почту ультрафиолетовым светом. Была ли это эффективная стратегия? Почему или почему нет?
Что такое автоклавирование?
Что такое автоклавирование?
Автоклавирование — это метод стерилизации с использованием пара под высоким давлением. Процесс автоклавирования основан на концепции, согласно которой точка кипения воды (или пара) увеличивается, когда она находится под давлением.
История автоклава
Название «Автоклав» происходит от греческого «авто», что в конечном итоге означает «я», и латинского «clavis», означающего ключ, то есть самоблокирующееся устройство.
Первый автоклав, по сути, представлял собой скороварку и был первоначально изобретен как метод приготовления пищи французским врачом Дени Папеном около 1681 года. Он назвал свое изобретение «паровым варочным котлом» и описал преимущества использования устройства для обработки пищи для облегчения пищеварения.
Автоклав был повторно изобретен для медицинских и научных целей Чарльзом Чемберлендом в 1879 году. Чемберленд был микробиологом, который работал с Луи Пастером.Случайно он придумал вакцину от куриной холеры. Он уехал в отпуск, забыв ввести болезнь некоторым цыплятам. Когда он вернулся, он увидел, что банка с бактериями все еще там, и решил все равно ввести ее в цыплят. К его изумлению, они не умерли. Когда он сообщил об этом Пастеру, ему сказали вводить свежую форму тем же цыплятам. Эти куры не умерли. Он нашел вакцину. Эта команда также обнаружила, что ослабленная форма болезни может действовать как вакцина.
Как работает автоклав
Предметы, предназначенные для автоклавирования, подвергаются постепенному повышению температуры под высоким давлением до достижения 121 ° C, а затем обрабатываются паром в течение примерно 15–20 минут.
Автоклав позволяет пару обтекать предметы в камере. Продолжительность времени и температура, необходимые для стерилизации, зависят от предметов, которые нужно стерилизовать, и от того, завернуты ли они или оставлены под прямым воздействием пара.Предметы следует разделять, чтобы пар мог равномерно проникать в груз. Пар может проникнуть в небольшие щели и убить все бактерии, вирусы и споры бактерий.
Когда следует использовать автоклав
Автоклавы
могут использоваться для уничтожения микроорганизмов, отверждения композитов, вулканизации резины и для гидротермального синтеза. Автоклавирование — очень надежный метод стерилизации и обеззараживания лабораторной посуды, медицинских инструментов и отходов, реагентов и других сред.Автоклавы могут инактивировать грибки, бактерии, споры, вирусы и другие микроорганизмы на хирургических инструментах, таких как скальпели, щипцы, ножницы и другие металлические предметы.
Почему автоклавирование не вредно для окружающей среды
Поскольку автоклавирование обеспечивает стерилизацию без использования реагентов и позволяет повторно использовать лабораторное оборудование и расходные материалы, оно является экологически чистым. Его можно использовать для стерилизации медицинских отходов перед утилизацией, что устраняет экологические проблемы, связанные с мусоросжигательными заводами.
Какие контейнеры Qorpak можно автоклавировать?
Стеклянные флаконы, как правило, можно обрабатывать в автоклаве, но некоторые крышки могут не подлежать автоклавированию.
Автоклавируемые продукты включают:
· Фенольные колпачки с резиновым покрытием
· Заглушки для отверстий из полипропилена со склеенными перегородками
· Полипропиленовые колпачки без подкладки с или без футеровки диска из ПТФЭ
· Стеклянные бутылки
· Банки полипропиленовые
Меры предосторожности
Укупорочные средства следует стерилизовать в автоклаве отдельно или очень свободно поверх контейнера; в противном случае во время охлаждения создается вакуум.Вкладыши будут втянуты в контейнер или бутылки, а крышки могут треснуть или покоробиться. Расширение паров при нагревании также может привести к растрескиванию или взрыву контейнеров без достаточной вентиляции.
Этот метод стерилизации нельзя использовать, если стерилизуемый материал может быть поврежден под воздействием тепла или влаги. Пластиковые смолы, которые нельзя автоклавировать, включают ПЭТ, ПЭТГ, ПЭНП, а также ПЭВП, ПЭТ, ПЭТГ.
Бумажные изделия, такие как бумага и некоторые пластмассы, нельзя обрабатывать в автоклаве из-за влажного тепла.
Что такое стерилизация в автоклаве? | Служба технической безопасности
Что такое автоклавная стерилизация? Самое простое объяснение состоит в том, что это очень эффективный метод стерилизации и дезинфекции предметов с помощью тепла — в форме пара — плюс давление и время.
В автоклаве предметы или инструменты, подвергшиеся воздействию загрязнителей, таких как микроорганизмы, споры или биологический материал, помещаются в камеру.Затем в машину создается давление и пар заполняется. Это давление повышает температуру пара до необходимого уровня — обычно от 121 ° C до 134 ° C — и гарантирует, что каждая часть инструмента может быть стерилизована путем поддержания давления и температуры в течение заданного времени.
Для чего нужен автоклав?
Автоклавы были разработаны для очистки инструментов, которые нельзя стерилизовать только нагреванием или моющими средствами. Благодаря компоненту процесса создания давления, автоклав может достигать температуры пара выше, чем обычно, что позволяет им работать относительно быстро и обеззараживать все части инструмента.Кроме того, современные автоклавы легко облегчают проверку процедуры с помощью термочувствительной ленты и других индикаторов.
Автоклав чаще всего используется в медицинских центрах и больницах, стоматологических кабинетах, лабораториях и исследовательских центрах. Однако это также полезно в любом случае, когда необходимо стерилизовать многоразовое оборудование. Такие предприятия, как владельцы продуктов питания и напитков, ветеринары и даже парикмахерские или салоны красоты, могут извлечь выгоду из автоклава.
Автоклавный процесс
Здесь мы рассмотрим процесс очистки, в том числе то, как управлять автоклавом для стерилизации. Мы также ответим на некоторые часто задаваемые вопросы о технике.
В автоклавах
обычно выполняются следующие действия:
- Предметы или инструменты (также называемые загрузочными материалами), подлежащие стерилизации, помещаются в мешок, совместимый с автоклавом, а затем во вторичный контейнер. Это поможет предотвратить контакт со стенками автоклава, который может расплавить пластиковые детали.
- После упаковки сосуд помещают в автоклав.
- Оператор закрывает и блокирует автоклав, затем выбирает правильный цикл для типа стерилизуемого материала.
- Автоклав находится под давлением, заполняется паром и начинает приближаться к температуре, указанной для цикла.
- По достижении температуры стерилизации автоклав будет поддерживать камеру при этой температуре в течение всего цикла стерилизации.
- Операторы должны подтвердить, что требуемая температура постоянно поддерживается в течение всего периода стерилизации.
- По завершении цикла автоклав перейдет в режим охлаждения, при котором давление в нем будет медленно сбрасываться, и его температура вернется к комнатной. Многие автоклавы не открываются, пока их внутренняя температура не достигнет безопасного уровня
- Проверьте все меры проверки, например, температурную ленту.
- Снимите инструменты и дайте постоять в обозначенной «горячей зоне», пока они не охладятся до комнатной температуры, затем транспортируйте по мере необходимости.
.
Чтобы ответить на несколько общих вопросов об автоклаве:
- Что составляет цикл стерилизации? С каждым циклом стерилизации связаны различные параметры.Обычно они основаны на конкретной конфигурации нагрузки или типе материала. В автоклаве используются следующие параметры: давление, температура и время.
- Сколько времени нужно автоклаву для стерилизации ? Обычно каждый цикл занимает от 60 до 90 минут. Продолжительность стерилизации варьируется, но обычно составляет около 30 минут, а оставшееся время цикла делится между нагревом и охлаждением камеры.
- На что эффективен автоклав? Процесс стерилизации убивает бактерии, вирусы и споры бактерий.Биологические индикаторы и расчеты летальности могут использоваться для проверки цикла автоклава.
- Может ли процесс завершиться ошибкой? Может по разным причинам. Прочтите, чтобы узнать, почему и что делать в таких обстоятельствах.
Что делать, если автоклав выходит из строя
Автоклав может выйти из строя по ряду причин, чаще всего:
- Неправильная калибровка машины, приводящая к колебаниям температуры или давления
- Неправильный выбор цикла для загружаемых материалов или использование непроверенного цикла
- Низкокачественный пар или пар со слишком высоким содержанием воды или пар, нагретый до температуры, превышающей наиболее эффективную для автоклава (обычно 134 ° C)
- Неправильная упаковка или размещение стерилизуемых материалов
Современные автоклавы включают средства проверки, такие как термочувствительные и / или химические индикаторные ленты, контрольные флаконы, содержащие биологические загрязнители, и многое другое.Подтверждая успешность стерилизации, операторы и оборудование могут легко определить, требуется ли техническое обслуживание, калибровка или другие меры для обслуживания оборудования. Многие автоклавы поставляются с предварительно утвержденными циклами, которые подтверждены производителем для стерилизации определенных типов загрузок. Пользовательские циклы также могут быть проверены конечными пользователями для конкретных материалов и нагрузок.
Калибровка и многое другое с услугами службы технической безопасности
Служба технической безопасности
предлагает помощь лабораториям, медицинским учреждениям и другим контролируемым средам, чтобы гарантировать правильную работу вашего оборудования.Наши услуги включают калибровку, проверку, сертификацию, создание специальной документации и многое другое. Для получения дополнительной информации свяжитесь с нами сегодня.
.

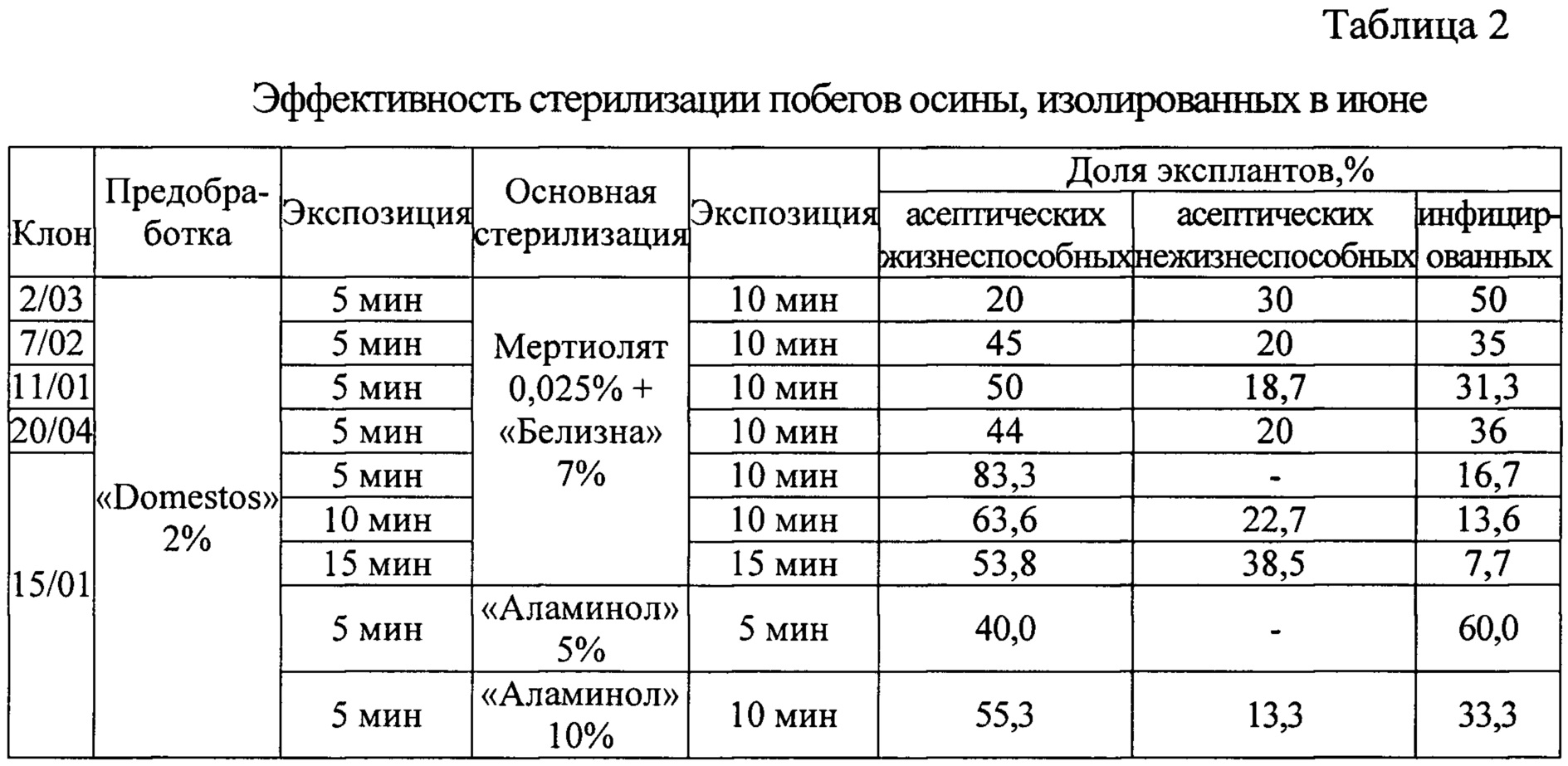 Что обидно, что пойди еще те яды найди-одни редкие, другие дорогие, третьи под запретом в обороте. А этот — и искать не надо: берешь своё мясо, или грибочки, или рыбку свежую, делаешь на своей родной Клаве вкуснейшую консервочку, чуток не додерживаешь — по времени, или по температуре, или по спешке, или по экономии, или по безголовости, или по недостатку нужных приборов, или по неточности термометра ( показывает 112град при реальных 108град), или по примитивности рецепта ( называю такие рецепты » циничными», т.е. человек пишет: «нагреваю до 112град и тут же выключаю. И всегда, мол, все нормально, еще никто за 15 лет не отравился». А ничего, что он сам хранит свою тушенку в холодильнике, или зимой на балконе, или в погребе — т.е. при температуре ниже 13град.С, когда ботула не размножается, и сразу из погреба на стол, или в картошку вываливает и, к примеру, еще греет их вместе в казанке (токсины ботулы нестойкие и легко распадаются и безследно обезвреживаются при нагреве 0.5л банки в течении 30минут).
Что обидно, что пойди еще те яды найди-одни редкие, другие дорогие, третьи под запретом в обороте. А этот — и искать не надо: берешь своё мясо, или грибочки, или рыбку свежую, делаешь на своей родной Клаве вкуснейшую консервочку, чуток не додерживаешь — по времени, или по температуре, или по спешке, или по экономии, или по безголовости, или по недостатку нужных приборов, или по неточности термометра ( показывает 112град при реальных 108град), или по примитивности рецепта ( называю такие рецепты » циничными», т.е. человек пишет: «нагреваю до 112град и тут же выключаю. И всегда, мол, все нормально, еще никто за 15 лет не отравился». А ничего, что он сам хранит свою тушенку в холодильнике, или зимой на балконе, или в погребе — т.е. при температуре ниже 13град.С, когда ботула не размножается, и сразу из погреба на стол, или в картошку вываливает и, к примеру, еще греет их вместе в казанке (токсины ботулы нестойкие и легко распадаются и безследно обезвреживаются при нагреве 0.5л банки в течении 30минут). ). Прочитал кто-нибудь такой рецепт, и сам сделал, а в погребе не хранит, т.к. живёт в городской квартире, — открыл, съел с удовольствием (какой замечательный и простой рецепт!) и умер через неделю, или в овоща превратился, тяжелого инвалида — слепого, глухого, с мертвым каменным лицом, не помнящим , как его самого зовут и вообще, кто он и откуда?, ещё и какашками бросается. Хорошо ещё, если сам. А если компания на природе, или дети, или близкие, родные люди… или чужой человек, покупатель, умер — и тебя в тюрьму, за непредумышленное убийство. Как перспективка?
). Прочитал кто-нибудь такой рецепт, и сам сделал, а в погребе не хранит, т.к. живёт в городской квартире, — открыл, съел с удовольствием (какой замечательный и простой рецепт!) и умер через неделю, или в овоща превратился, тяжелого инвалида — слепого, глухого, с мертвым каменным лицом, не помнящим , как его самого зовут и вообще, кто он и откуда?, ещё и какашками бросается. Хорошо ещё, если сам. А если компания на природе, или дети, или близкие, родные люди… или чужой человек, покупатель, умер — и тебя в тюрьму, за непредумышленное убийство. Как перспективка?
 из Александровки Кировоградской области — отравился копченой речной рыбой с базара) записку: «Вызывай скорую! у меня ботулизм!».
из Александровки Кировоградской области — отравился копченой речной рыбой с базара) записку: «Вызывай скорую! у меня ботулизм!». Причем доступ к ним не круглосуточный, и в субботу-воскресенье Вам их никто не даст. В апатеке они не продаются, т.к. потребность в них мизерная.
Причем доступ к ним не круглосуточный, и в субботу-воскресенье Вам их никто не даст. В апатеке они не продаются, т.к. потребность в них мизерная.

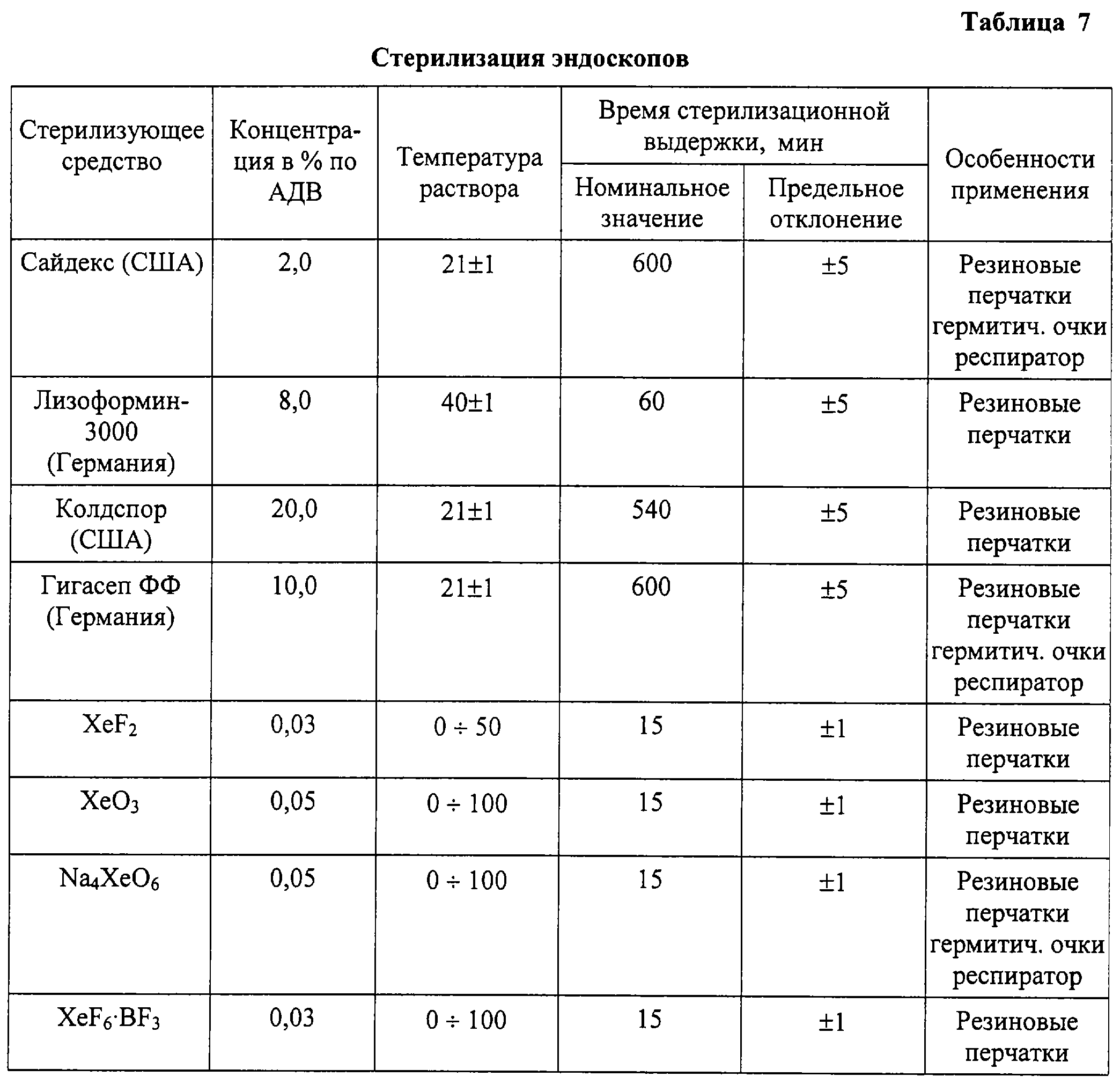 С, если духовка даст такую температуру. Но это будет уже горелый продукт. Когда весь жир выкипит и обуглится, тогда температура будет расти дальше, если духовка это позволит. Но это уже будет уголь.
С, если духовка даст такую температуру. Но это будет уже горелый продукт. Когда весь жир выкипит и обуглится, тогда температура будет расти дальше, если духовка это позволит. Но это уже будет уголь. п. Даже в этих овощах при аккуратной санитарии споры ботулы попадают в банки примерно 1шт на 2 банки. В мясе же это будет гораздо меньше — в разы, десятки или сотни раз. Кроме того, споры ботулы отличаются устойчивостью на выживание, в зависимости от их возраста и условий взращивания. Молодые споры начинают гибнуть при 92град в течении 30минут, старики могут выживать до 120град и терпеть эту температуру 3 секунды.
п. Даже в этих овощах при аккуратной санитарии споры ботулы попадают в банки примерно 1шт на 2 банки. В мясе же это будет гораздо меньше — в разы, десятки или сотни раз. Кроме того, споры ботулы отличаются устойчивостью на выживание, в зависимости от их возраста и условий взращивания. Молодые споры начинают гибнуть при 92град в течении 30минут, старики могут выживать до 120град и терпеть эту температуру 3 секунды.
 С, когда ботула не развивается. Или держали в полупустом холодильнике, т.к. в магазинах брать особо чего не было, и полки были полупустые, не то, что сейчас — бери все, что хочешь, только деньги плати. Вопрос качества здесь — за скобками. Т.е. риск умереть от такой тушенки был меньше, чем сейчас, когда все больше людей живут в многоквартирных домах без погреба и держат тушенку , в лучшем случае, на балконе в холодное время года. Да и то, массово переоборудуют балконы в лоджии, еще выводят туда отопление и получается там градусов под 20 С даже в холодное время года.
С, когда ботула не развивается. Или держали в полупустом холодильнике, т.к. в магазинах брать особо чего не было, и полки были полупустые, не то, что сейчас — бери все, что хочешь, только деньги плати. Вопрос качества здесь — за скобками. Т.е. риск умереть от такой тушенки был меньше, чем сейчас, когда все больше людей живут в многоквартирных домах без погреба и держат тушенку , в лучшем случае, на балконе в холодное время года. Да и то, массово переоборудуют балконы в лоджии, еще выводят туда отопление и получается там градусов под 20 С даже в холодное время года. Это ни для кого не новость, но в наших старых постах про этот вопрос один этот нюанс нигде не упомянут.
Это ни для кого не новость, но в наших старых постах про этот вопрос один этот нюанс нигде не упомянут.
 ).
). стерилизацию. И то, как я лично их употребляю.
стерилизацию. И то, как я лично их употребляю.