показания и противопоказания, польза и вред
Механизм лечебного действия электрофореза
При контакте кожи с разноименными электродами образуются электромагнитные поля, стимулирующие образование новых ионов в лимфе и межклеточном пространстве. Электродные пластины фиксируются на участках кожи, где есть выходы сальных и потовых желез – в этой области осуществляется эффективное всасывание лекарственных средств .
Под катодом и анодом возникает одновременно несколько процессов:
- электродиффузия;
- поляризация;
- электроосмос.
В результате биохимического воздействия на нервные окончания, возникает ответная реакция организма – открываются поры, расширяются капиллярные сосуды, усиливается кровоток, активизируются обменные процессы ( резорбтивный эффект длится от 3 до 20 дней ).
В косметологической практике используются различные электролиты, обладающие оздоровительным, заживляющим, регенерирующим воздействием (на фирменных упаковках отмечен знак электрода, с которого должно вводиться под кожу средство).
По своему назначению препараты для электрофореза могут быть противовоспалительными, омолаживающими (нехирургический лифтинг), питательными, увлажняющими.
В лечебной косметологии активно используются такие препараты как гиалуроновая кислота, коллагеновые гели, маски на основе плацентарного состава, салициловая кислота, никотиновая кислота, антисептические эмульсии, лидаза.
С помощью электрофореза (альтернативное название процедуры – ионофорез) под кожу вводятся растворенные вытяжки из лекарственного растительного сырья, витамины, активные микроэлементы.
Электрофорез хорошо сочетается с талассотерапией , лечебным массажем , грязелечением и безинъекционной мезотерапией. Возможно проведение RF-лифтинга тела (что это такое), а также RF-лифтинга лица (фото до и после тут).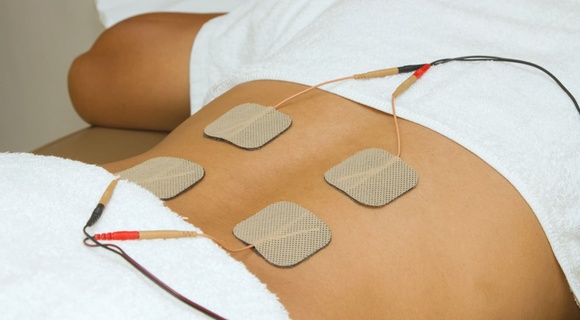 Через день (в один день делать не рекомендуется) после сеанса электрофореза для усиления эффекта можно воспользоваться процедурами ультрафонофореза, гидромассажа с минеральным комплексом и лимфодренажным массажем.
Через день (в один день делать не рекомендуется) после сеанса электрофореза для усиления эффекта можно воспользоваться процедурами ультрафонофореза, гидромассажа с минеральным комплексом и лимфодренажным массажем.
Врач разрабатывает индивидуальную программу ухода за кожей, учитывая состояние кожных покровов, возраст, переносимость лекарственных компонентов, требования к эстетическому эффекту.
Поскольку ионофорез в сочетании с другими косметическими процедурами радикально улучшает кровообращение в периферических сосудах и оказывает противовоспалительное воздействие, уже через несколько сеансов кожа приобретает ровный матовый оттенок, исчезают участки с «жирным блеском» и шелушением.
Лечебные эффекты электрофореза складываются из эффектов гальванизации и фармакологических эффектов раствора лекарственного вещества.
Электрофорез
Определение 1
Электрофорез является движением дисперсных частиц относительно жидкости под действием пространственно-однородного электрического поля.
Электрофорез представляет собой метод, используемый в области молекулярной биологии для отделения частей молекулы ДНК. Это движение частиц в электрическом поле к одному из двух электрических полюсов. Он находит применение в биохимии и медицине для разделения высокомолекулярных соединений на фракции с различной молекулярной массой.
Замечание 1
Впервые этот метод был использован в $1809$ году в Московском государственном университете.
Электрофорез в медицине (физиотерапии)
Лекарственный электрофорез это комбинированное (одновременное) использование постоянного тока, в основном гальванического тока, а также небольшого количества препарата или комбинации препаратов.
Основное значение в терапевтическом механизме этого метода принадлежит току, который, также, повышает чувствительность тканей к действию лекарственных средств.
Характеристики терапевтического действия лекарственных средств электрофореза включают:
Готовые работы на аналогичную тему
- возможность концентрации эффекта на поверхности определенной части тела, например суставе;
- длительность действия процедуры сохраняется в течение нескольких дней;
- исключено негативное влияние препаратов на органы пищеварения;
- введение лекарственного средства в организм в виде ионов, то есть в активной форме.

Замечание 2
Принимая во внимание, что ведущее значение в этом методе принадлежит току, основными показаниями для лекарственного электрофореза, а также гальванизации, являются местные и региональные патологические процессы.
Препараты выбираются по тем же основаниям. Системное действие этих методов, можно ожидать, главным образом во время функциональных нарушений вегетативно-сосудистых заболеваний.
Показания к физиотерапии весьма широки. Они определяются фармакотерапевтическими характеристиками вводимых препаратов. Терапевтичсекий электрофорез применяется при заболеваниях центральной и периферической нервной системы, опорно-двигательного аппарата, гинекологических заболеваний и т.д.
Электрофорез в полиакриламидном геле
Гель-электрофорез (Электрофорез ДНК) это метод разделения и анализа макромолекул (ДНК, РНК и белков), а также их фрагментов, в зависимости от их размера и заряда. Он используется в клинической химии для разделения белков с помощью заряда или размера, а также в области биохимии и молекулярной биологии, чтобы отделить смешанную популяцию ДНК и РНК фрагментов по длине, чтобы оценить размер ДНК и РНК фрагментов или отдельных белков по заряду.
Проще говоря, электрофорез представляет собой процесс, который позволяет проводить сортировку молекул в зависимости от размера.
Термин » гель » в данном случае, относится к матрице, используемой, чтобы сдерживать, а затем отделять молекулы — мишени. В большинстве случаев, гель представляет собой сшитый полимер, состав и пористость выбирается в зависимости от удельного веса и состава мишени для анализа. При разделении белков или небольшие нуклеиновые кислоты (ДНК, РНК) гель обычно состоит из различных концентраций акриламида и поперечно-сшивающего агента.
Электрофорез определяется электродвижущей силой (ЭДС), которая используется для перемещения молекулы через гелиевую матрицу.
Фонофорез
Фонофорез является метод использованиея ультразвука для улучшения доставки применяемых препаратов. Фонофорез используют в целях повышения абсорбции местного применения анальгетиков и противовоспалительных средств, с помощью терапевтического применения ультразвука.
Замечание 3
Была доказана неэффективность этого метода для некоторого вида лечения.
Электрофорез в гинекологии показания и противопоказания
Электрофорез − лечебная и профилактическая методика физиотерапии, в результате которой происходит глубокое проникновение активных ионов раствора в ткани.
Чаще электрофорез в гинекологии назначают, если выявлено воспаление.Название лекарственного вещества подбирает гинеколог с учетом поставленного диагноза.При отсутствии противопоказаний терапия сочетается с другими методиками.
Плюсы и минусы методики
Электрофорез эффективно воздействует на отек, боль, воспаление. Терапия оказывает успокоительное воздействие, улучшая микроциркуляцию, стимулируя выработку витаминов и гормонов, активируя защитную функцию организма. Манипуляция не провоцирует боль. Во время её проведения пациентка может испытывать легкое покалывание в месте введения лекарства.
Плюсы назначения электрофореза при гинекологических патологиях:
- Ввод лекарства в маленьком объеме, что минимизирует риск возникновения отрицательных явлений.

- Препарат концентрируется в области, где накладываются электроды.
- За счет местного применения невозможно прохождение раствора через ЖКТ.
- Проникновение раствора в очаг воспаления.
- Процесс расщепления лекарства на ионы обеспечивает максимально высокий лечебный эффект.
- Возможность применения для беременных.
К показаниям для прохождения электрофореза гинекологи относят операции, нарушенное развитие половых женских органов, гипоплазию матки, патологии молочных желез, воспалительные процессы в матке.
Терапия действует положительно и при отсутствии овуляции, гормональном сбое.
При подозрении на трубное бесплодие проводится комплексное обследование. Если диагноз подтверждается, назначается электрофорез.
Рассматриваемая манипуляция используется и при непроходимости труб. В 39% случаев гинекологи ставят диагноз перитонеальное бесплодие. Его провоцируют спаечные процессы, протекающие в придатках. К причинам развития относят операцию, эндометриоз и воспаление.
Его провоцируют спаечные процессы, протекающие в придатках. К причинам развития относят операцию, эндометриоз и воспаление.
Любое хирургическое вмешательство в гинекологии способно спровоцировать спаечный процесс. Поэтому электрофорез проводят в послеоперационном периоде с целью ускорения регенерации тканей.
Предварительно врач должен исключить наличие следующих противопоказаний к прохождению терапии:
- онкология любой локализации и патогенеза;
- проблемы с сосудами и сердцем;
- острое течение воспаления с высокой температурой тела;
- поражение кожи, включая экземы и дерматиты;
- непереносимость электропроцедуры.
Некоторые гинекологи не советуют проходить физиотерапию электродами при месячных.
Но этот процесс не является противопоказанием с электрофорезом.
Механизм воздействия на болезнь
Гальванизация либо электрофорез заключается в применении электрического заряда в медицине. На фоне манипуляции усиливается кровоток, обеспечивается постоянное поступление питательных веществ в нужном количестве, ускоряется процесс выздоровления.
При лекарственном электрофорезе используют токовые импульсы и медикаменты.
С учетом поставленного диагноза гинекологи назначают гальванизацию с медью, йодом, цинком и прочими лекарственными растворами.
Выбор медикамента зависит от текущего гормонального фона, состояния гормонозависимых органов малого таза, яичников.
Показанием к прохождению электрофореза на низ живота в гинекологии является неполное функционирование желтого тела.
Чрезмерная выработка эстрогенов требует применения йода. Если подтверждена гипофункция яичников, применяется медь.
При необходимости перед физиопроцедурой выполняется ЭКО. Такое комплексное лечение показано при эндометриозе. Отсутствие противопоказаний позволяет совмещать препараты.
Такое комплексное лечение показано при эндометриозе. Отсутствие противопоказаний позволяет совмещать препараты.
Электрофорез с магнезией в гинекологии назначается при воспалении в области малого таза, хроническом процессе, нарушенном цикле, спаечном процессе. Проведение терапии в подостром периоде способствует быстрому выздоровлению пациентки.
Список основных лекарственных средств, используемых для лечения:
- Электрофорез с цинком на низ живота. Процент состава колеблется в пределах 0.5. Лекарство используют при эндоцервиците, эрозии. Медикаменты назначают при частичной дисфункции желтого тела.
- Йодистый калий эффективен против хронического процесса, сопровождающегося болью.
- Магний и кальций, новокаин способствуют устранению болевого синдрома.
- Для размягчения рубцовых и спаечных процессов применяют препараты лидазы и цинк.
 На фоне таких комбинаций обеспечивается нормальное течение беременности.
На фоне таких комбинаций обеспечивается нормальное течение беременности. - Для лечения болезненных месячных применяют обезболивающие медикаменты. Назначают 6−8 манипуляций перед циклом.
Комплексное лечение патологий
Физиотерапия может проводиться с помощью витаминных комплексов, ферментов, антисептиков, седативных и сосудорасширяющих препаратов. Для ввода через кожный покров и слизистую используют такие медикаменты, как Папаверин, Эуфиллин. Комбинирование препаратов зависит от состояния женского организма, выявленной патологии.
Частые схемы физиотерапии при разных недугах:
- Альгоменорея или болезненная менструация, возникающая за несколько дней до начала цикла. Явление проходит через определенный временной период. Боли появляются с разной интенсивностью. Терапия электрофорезом направлена на снятие боли и спазмов. Из медикаментозных растворов применяют Новокаин.
 Электроды накладывают на нижнюю часть живота. Терапия состоит из 6−8 манипуляций. Гинеколог рассчитывает дни так, чтобы терапия завершилась до начала менструации.
Электроды накладывают на нижнюю часть живота. Терапия состоит из 6−8 манипуляций. Гинеколог рассчитывает дни так, чтобы терапия завершилась до начала менструации. - Воспаление, спровоцированное переохлаждением либо проникновением инфекции внутрь. Терапия током показан а после снятия острого воспаления.
- Электрофорез с йодом в гинекологии используют, чтобы закрепить эффект основного лечения. Дополнительно применяют йодистый калий. С помощью раствора снимается воспаление. Манипуляция положительно воздействует на эндокринную систему, уравновешивая работоспособность яичников, щитовидки и гипофиза.
- Для борьбы с эрозией рекомендуется использовать 2,25% раствора цинка.
- Чтобы увеличить циркуляцию крови при разных недугах, назначается электрофорез с лидазой. Доказана эффективность терапии при течении спаечного процесса в трубах детородного органа. Аналогичная схема лечения используется при бесплодии. Но терапия противопоказана, если у пациентки выявлена аллергия на лидазу.
 Лекарство можно разбавить водой, спиртом, Димексидом.
Лекарство можно разбавить водой, спиртом, Димексидом.
Применение цинка и меди для беременных
Разница в проводимых манипуляциях заключается в названии используемого лекарства. Иногда показан полостной электрофорез, при котором во влагалище вводят первый электрод, а второй остается снаружи. Такая терапия проводится цинком, кальцием, магнием, гиалуронидазом, лидазой.
Манипуляция с цинком и медью показана при ЭКО, чтобы уравновесить баланс прогестеронов и эстрогенов.
На фоне применения меди снижается чрезмерная выработка эстрогенов.
Цинк поддерживает лютеиновую фазу.
Терапия корректирует гипофункцию яичников с целью успешного зачатия.
Доказано, что электрофорез с цинком обладает многосторонним влиянием. Он быстро устраняет спайки, оказывая иммуномодулирующее воздействие, нормализуя прогестроновую активность. За счет стимуляции секреции соответствующих гормонов лечится бесплодие. Трудность манипуляции заключается в отсутствии оборудования во всех медицинских учреждениях.
Трудность манипуляции заключается в отсутствии оборудования во всех медицинских учреждениях.
Беременность − период, когда многие медикаменты противопоказаны к приему. Некоторые лекарства провоцируют выкидыш, а другие вызывают отклонения в развитии эмбриона. Электрофорез − один из самых безопасных терапевтических методик в период вынашивания малыша. Отдельно гинекологи выделяют список лекарств, которые не вредят внутриутробному развитию. За счет прямого воздействия только на очаг воспаления обеспечивается быстрое выздоровление. Для достижения терапевтического результата необходимо придерживаться расписанной гинекологом схемой.
Основные показания для прохождения электрофореза беременным:
- гипертонус матки;
- есть вероятность выкидыша;
- гестоз либо отек, спровоцированный гестозом.
Во время терапии электроды накладывают на шейно-воротниковую область либо слизистую носа.
Необходимо избегать наложения электродов на живот. Допускается ввод витаминов и нужных микроэлементов. Беременным назначается электрофорез после 8 недели.
Допускается ввод витаминов и нужных микроэлементов. Беременным назначается электрофорез после 8 недели.
Чаще применяется магнезия, Папаверин, суппозитории с низкой концентрацией эуфиллина.
Противопоказания для прохождения электрофореза в период беременности:
- состояние эмбриона, при котором противопоказано воздействие лекарств, электрического тока;
- плохая свертываемость крови;
- болезни почек и печени;
- поздний гестоз и судороги;
- постоянная рвота;
- тошнота.
Отзывы женщин и гинекологов
Большинство пациенток, прошедших курс лечения электрофорезом, оставляют положительный отзыв о процедуре.
Чаще назначают терапию током с лидазой. Эта схема показана для зачатия. Некоторые женщины прошли такое лечение, чтобы избавиться от токсикоза. Электрофорез, воздействуя на рвотные центры мозга, улучшает самочувствие будущей мамы.
Несмотря на большое количество положительных отзывов, гинекологи советуют относиться к рассматриваемой терапевтической методике серьезно. Медицинскую процедуру может назначить только квалифицированный специалист. Предварительно учитывается состояние и противопоказание к электрофорезу.
Медицинскую процедуру может назначить только квалифицированный специалист. Предварительно учитывается состояние и противопоказание к электрофорезу.
У меня после вторых родов произошел рецидив эрозии шейки матки. Гинеколог предложил после лабораторных анализов пройти лечение электрофорезом. Боль исчезла практически сразу. Уже прошло 3 месяца после лечения. Чувствуя себя хорошо.
Анастаия, 28 лет
Много лет не могла забеременеть. Тесты, бесполезное ЭКО и прочее − вошли в привычную мою жизнь. Но любой метод, преложенный врачом для зачатия, не был эффективным. Решили совместить ЭКО с электрофорезом. Когда через 3 недели после терапии обратилась в гинекологическую консультацию, узнала о беременности.
Екатериана, 32 года
Меня постоянно беспокоили болезненные месячные. Посоветовалась с гинекологом. Назначили электрофорез. Вначале боялась, но физиотерапевт перед процедурой все мне объяснил. Облегчение почувствовала уже на 2−3 сеанс. После курса лечения боли исчезли. Уже первые месячные были в норме.
После курса лечения боли исчезли. Уже первые месячные были в норме.
Елена, 25 лет
Электрофорез в полиакриламидном геле — Polyacrylamide gel electrophoresis
Изображение SDS-PAGE. Молекулярные маркеры (лестница) находятся в левой полосе.
Электрофорез в полиакриламидном геле ( PAGE ) — это метод, широко используемый в биохимии , судебной химии , генетике , молекулярной биологии и биотехнологии для разделения биологических макромолекул , обычно белков или нуклеиновых кислот , в зависимости от их электрофоретической подвижности . Электрофоретическая подвижность зависит от длины, конформации и заряда молекулы. Электрофорез в полиакриламидном геле — мощный инструмент, используемый для анализа образцов РНК. Когда полиакриламидный гель денатурируется после электрофореза, он предоставляет информацию о составе образца РНК.
Гидратация из акрилонитрила приводит к образованию акриламида молекул ( С
3ЧАС
5NO ) нитрилгидратазой . Перед добавлением воды мономер акриламида находится в порошкообразном состоянии. Акриламид токсичен для нервной системы человека, поэтому при работе с ним необходимо соблюдать все меры безопасности. Акриламид растворим в воде и при добавлении воды полимеризуется, что приводит к образованию полиакриламида. Полезно получать полиакриламидный гель путем гидратации акрилмида, поскольку размер пор можно регулировать. Повышенные концентрации акриламида приводят к уменьшению размера пор после полимеризации. Полиакриламидный гель с маленькими порами помогает лучше исследовать более мелкие молекулы, поскольку маленькие молекулы могут проникать в поры и перемещаться через гель, в то время как большие молекулы задерживаются в отверстиях пор.
Перед добавлением воды мономер акриламида находится в порошкообразном состоянии. Акриламид токсичен для нервной системы человека, поэтому при работе с ним необходимо соблюдать все меры безопасности. Акриламид растворим в воде и при добавлении воды полимеризуется, что приводит к образованию полиакриламида. Полезно получать полиакриламидный гель путем гидратации акрилмида, поскольку размер пор можно регулировать. Повышенные концентрации акриламида приводят к уменьшению размера пор после полимеризации. Полиакриламидный гель с маленькими порами помогает лучше исследовать более мелкие молекулы, поскольку маленькие молекулы могут проникать в поры и перемещаться через гель, в то время как большие молекулы задерживаются в отверстиях пор.
Как и во всех формах гель-электрофореза , молекулы могут работать в своем естественном состоянии , сохраняя структуру молекул более высокого порядка. Этот метод называется native-PAGE. В качестве альтернативы может быть добавлен химический денатурант для удаления этой структуры и превращения молекулы в неструктурированную молекулу, подвижность которой зависит только от ее длины (поскольку все комплексы белок-SDS имеют одинаковое соотношение массы к заряду).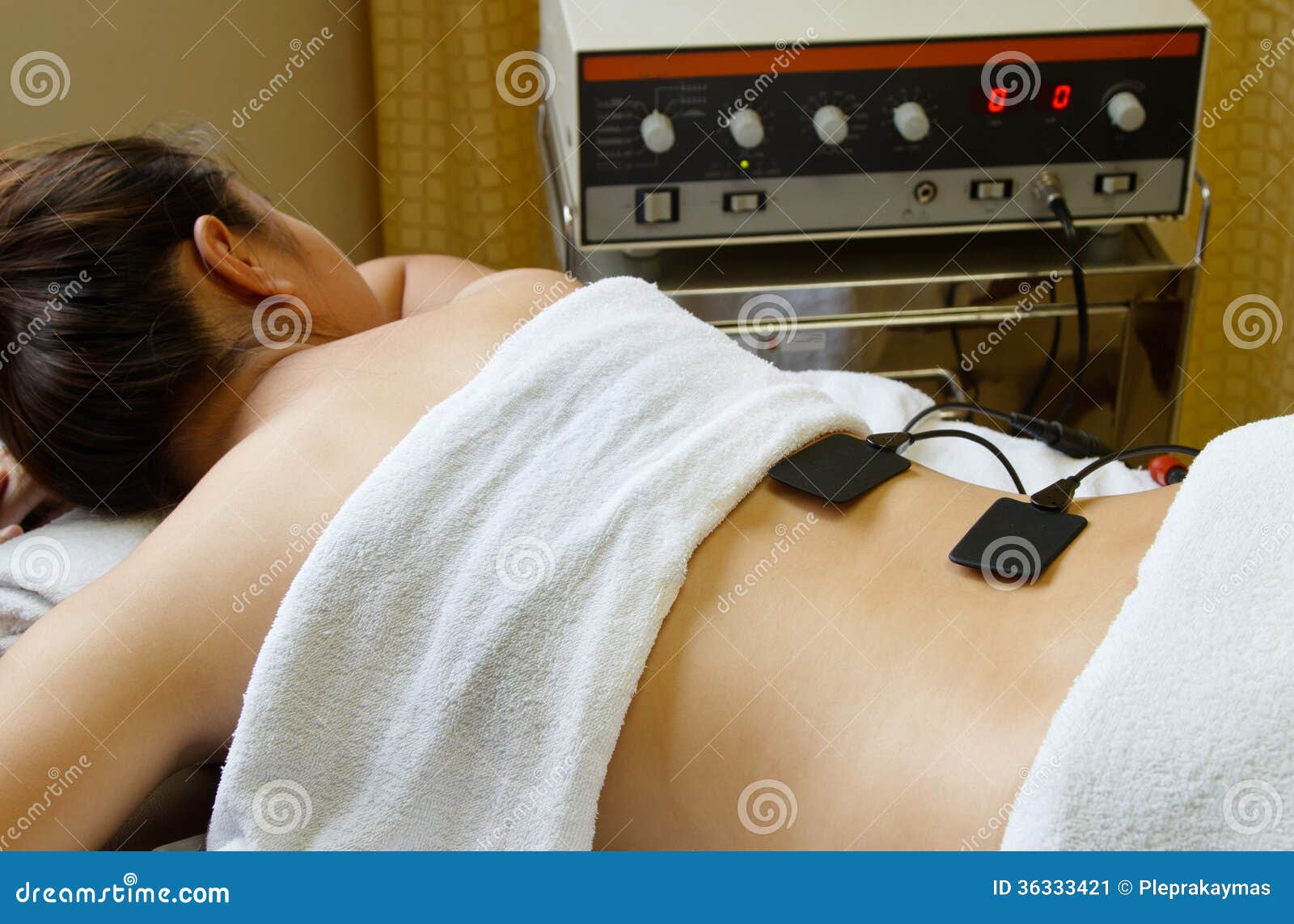 Эта процедура называется SDS-PAGE . Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) — это метод разделения молекул на основе разницы в их молекулярной массе. При pH, при котором проводят гель-электрофорез, молекулы SDS заряжаются отрицательно и связываются с белками в заданном соотношении, примерно одна молекула SDS на каждые 2 аминокислоты. Таким образом, детергент обеспечивает всем белкам однородное соотношение заряда к массе. Связываясь с белками, детергент разрушает их вторичную, третичную и / или четвертичную структуру, денатурируя их и превращая в отрицательно заряженные линейные полипептидные цепи. Под воздействием электрического поля в PAGE отрицательно заряженные полипептидные цепи перемещаются к аноду с различной подвижностью. Их подвижность или расстояние, пройденное молекулами, обратно пропорционально логарифму их молекулярной массы. Сравнивая относительное отношение расстояния, пройденного каждым белком, к длине геля (Rf), можно сделать выводы об относительной молекулярной массе белков, где длина геля определяется расстоянием, пройденным небольшой молекулой.
Эта процедура называется SDS-PAGE . Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) — это метод разделения молекул на основе разницы в их молекулярной массе. При pH, при котором проводят гель-электрофорез, молекулы SDS заряжаются отрицательно и связываются с белками в заданном соотношении, примерно одна молекула SDS на каждые 2 аминокислоты. Таким образом, детергент обеспечивает всем белкам однородное соотношение заряда к массе. Связываясь с белками, детергент разрушает их вторичную, третичную и / или четвертичную структуру, денатурируя их и превращая в отрицательно заряженные линейные полипептидные цепи. Под воздействием электрического поля в PAGE отрицательно заряженные полипептидные цепи перемещаются к аноду с различной подвижностью. Их подвижность или расстояние, пройденное молекулами, обратно пропорционально логарифму их молекулярной массы. Сравнивая относительное отношение расстояния, пройденного каждым белком, к длине геля (Rf), можно сделать выводы об относительной молекулярной массе белков, где длина геля определяется расстоянием, пройденным небольшой молекулой. как следящий краситель.
как следящий краситель.
Для нуклеиновых кислот мочевина является наиболее часто используемым денатурирующим агентом. Для белков додецилсульфат натрия (SDS) представляет собой анионный детергент, применяемый к образцам белка для покрытия белков, чтобы передать два отрицательных заряда (от каждой молекулы SDS) на каждые две аминокислоты денатурированного белка. 2-Меркаптоэтанол также может быть использован для разрыва дисульфидных связей, обнаруженных между белковыми комплексами, что способствует дальнейшей денатурации белка. В большинстве белков связывание SDS с полипептидными цепями обеспечивает равномерное распределение заряда на единицу массы, что приводит к фракционированию по приблизительному размеру во время электрофореза. Белки, которые имеют более высокий гидрофобный состав — например, многие мембранные белки и те, которые взаимодействуют с поверхностно-активными веществами в их естественной среде — по сути сложнее точно обработать с помощью этого метода из-за большей вариабельности соотношения связанных SDS. С процедурной точки зрения, совместное использование как Native, так и SDS-PAGE можно использовать для очистки и разделения различных субъединиц белка. Native-PAGE сохраняет олигомерную форму нетронутой, и на геле будет видна полоса, представляющая уровень активности. SDS-PAGE денатурирует и разделяет олигомерную форму на ее мономеры, показывая полосы, которые представляют их молекулярные массы. Эти полосы можно использовать для идентификации и оценки чистоты белка.
С процедурной точки зрения, совместное использование как Native, так и SDS-PAGE можно использовать для очистки и разделения различных субъединиц белка. Native-PAGE сохраняет олигомерную форму нетронутой, и на геле будет видна полоса, представляющая уровень активности. SDS-PAGE денатурирует и разделяет олигомерную форму на ее мономеры, показывая полосы, которые представляют их молекулярные массы. Эти полосы можно использовать для идентификации и оценки чистоты белка.
Процедура
Базовые приготовления
Образцы могут быть любым материалом, содержащим белки или нуклеиновые кислоты. Они могут быть получены биологическим путем, например, из прокариотических или эукариотических клеток, тканей, вирусов, образцов окружающей среды или очищенных белков. В случае твердых тканей или клеток они часто сначала разрушаются механически с помощью блендера (для больших объемов образцов), с использованием гомогенизатора (меньшие объемы), с помощью ультразвукового устройства или с использованием циклического воздействия высокого давления и комбинации биохимических и механические методы, включая различные типы фильтрации и центрифугирования, могут использоваться для разделения различных клеточных компартментов и органелл перед электрофорезом. Синтетические биомолекулы, такие как олигонуклеотиды, также могут быть использованы в качестве аналитов.
Синтетические биомолекулы, такие как олигонуклеотиды, также могут быть использованы в качестве аналитов.
Образец для анализа при желании может быть смешан с химическим денатурирующим агентом, обычно SDS для белков или мочевиной для нуклеиновых кислот. SDS — это анионный детергент, который денатурирует вторичные и не связанные дисульфидными связями третичные структуры, и дополнительно накладывает отрицательный заряд на каждый белок пропорционально его массе. Мочевина разрывает водородные связи между парами оснований нуклеиновой кислоты, вызывая отжиг составляющих цепей. Нагревание образцов до температуры не менее 60 ° C дополнительно способствует денатурации.
В дополнение к SDS, белки необязательно могут быть кратковременно нагреты почти до кипения в присутствии восстанавливающего агента, такого как дитиотреитол (DTT) или 2-меркаптоэтанол (бета-меркаптоэтанол / BME) , который дополнительно денатурирует белки за счет уменьшения дисульфидных связей, таким образом преодолевая некоторые формы третичного сворачивания белка и разрушая структуру четвертичного белка (олигомерные субъединицы). Это известно как сокращение SDS-PAGE.
Это известно как сокращение SDS-PAGE.
В раствор может быть добавлен следящий краситель. Он обычно имеет более высокую электрофоретическую подвижность, чем аналиты, что позволяет экспериментатору отслеживать продвижение раствора через гель во время электрофоретического анализа.
Приготовление акриламидных гелей
Гели обычно состоят из акриламида , бисакриламида , необязательного денатурирующего агента (SDS или мочевина) и буфера с отрегулированным pH. Раствор можно дегазировать под вакуумом, чтобы предотвратить образование пузырьков воздуха во время полимеризации. В качестве альтернативы, бутанол может быть добавлен в растворяющий гель (для белков) после его заливки, поскольку бутанол удаляет пузырьки и делает поверхность гладкой. Источник свободных радикалов и стабилизатор, такой как персульфат аммония и ТЕМЕД , добавляются для инициирования полимеризации. В результате реакции полимеризации образуется гель из-за добавленного бисакриламида , который может образовывать поперечные связи между двумя молекулами акриламида. Отношение бисакриламида к акриламиду можно варьировать для специальных целей, но обычно составляет примерно 1 часть к 35. Концентрация акриламида в геле также может варьироваться, обычно в диапазоне от 5% до 25%. Гели с более низким процентным содержанием лучше подходят для разделения молекул с очень высокой молекулярной мас
Отношение бисакриламида к акриламиду можно варьировать для специальных целей, но обычно составляет примерно 1 часть к 35. Концентрация акриламида в геле также может варьироваться, обычно в диапазоне от 5% до 25%. Гели с более низким процентным содержанием лучше подходят для разделения молекул с очень высокой молекулярной мас
AES Electrophoresis Society: Microchip Electrophoresis
Виктор М. Угаз
Арти Макферрин Департамент химической инженерии
Техасский университет A&M
Колледж-Стейшн, Техас 77843, США
Воспроизведено частично с разрешения: Глава 10, Микрожидкостные технологии для миниатюрных аналитических систем , Штеффен Хардт и Фридхельм Шенфельд, редакторы. Springer-Verlag, Берлин (2007).
Многие химические и биохимические методы анализа включают выполнение последовательности процессов, которые можно широко классифицировать с точки зрения подготовки проб, реакций и анализа продуктов.Поскольку продукты реакции часто содержат смеси нескольких химических веществ, последующие аналитические этапы должны обеспечивать возможность разделения и идентификации отдельных компонентов. Электрофорез, основанный на обнаружении различий в миграционном поведении между заряженными частицами под действием приложенного электрического поля, оказался очень универсальным аналитическим методом благодаря благоприятной комбинации характеристик, включая относительно простую конструкцию оборудования и совместимость с широким диапазоном. аналитов, включая биологические макромолекулы (например,г., ДНК, белки). В последнее время проявился значительный интерес к адаптации технологии электрофореза к миниатюрным микрофлюидным форматам с целью создания портативных недорогих версий обычных настольных приборов. В конечном итоге предполагается, что эти усилия позволят электрофорезу стать неотъемлемым компонентом автономных устройств « лаборатория на чипе », способных использовать мощность для выполнения множества сложных химических, биологических и биомедицинских анализов непосредственно в руки тех, кому информация нужна больше всего.
Электрофорез, основанный на обнаружении различий в миграционном поведении между заряженными частицами под действием приложенного электрического поля, оказался очень универсальным аналитическим методом благодаря благоприятной комбинации характеристик, включая относительно простую конструкцию оборудования и совместимость с широким диапазоном. аналитов, включая биологические макромолекулы (например,г., ДНК, белки). В последнее время проявился значительный интерес к адаптации технологии электрофореза к миниатюрным микрофлюидным форматам с целью создания портативных недорогих версий обычных настольных приборов. В конечном итоге предполагается, что эти усилия позволят электрофорезу стать неотъемлемым компонентом автономных устройств « лаборатория на чипе », способных использовать мощность для выполнения множества сложных химических, биологических и биомедицинских анализов непосредственно в руки тех, кому информация нужна больше всего.
На макроуровне развитие капиллярного электрофореза (КЭ) ознаменовало прорыв, преодолевший многие ограничения ранних инструментов для пластинчатого геля. Использование ультратонких капилляров (обычно внутренний диаметр 50–100 мкм) обеспечивало более эффективное рассеивание тепла и позволяло применять более сильные электрические поля, минимизируя температурные неоднородности, возникающие из-за эффектов джоулева нагрева. Это помогло добиться более быстрой подвижности аналита и более короткого времени работы без ущерба для эффективности разделения.В дополнение к этим преимуществам капиллярный формат по своей природе требует меньшего количества пробы и реагентов и предлагает большую возможность автоматизации. Поскольку размеры поперечного сечения капилляров находятся в том же масштабе, что и типичные микрофлюидные каналы, неудивительно, что многие усилия по миниатюризации были сосредоточены на прямом уменьшении масштабов проверенных технологий CE. Был исследован ряд различных микромасштабных реализаций этого фундаментального явления, чтобы соответствовать требованиям конкретных аналитов и приложений, включая адаптацию гелевых пластин и капиллярных методов, а также хроматографических методов [16, 30, 59, 61, 91 , 106, 112, 146, 153, 175, 200, 206, 301, 342].
Использование ультратонких капилляров (обычно внутренний диаметр 50–100 мкм) обеспечивало более эффективное рассеивание тепла и позволяло применять более сильные электрические поля, минимизируя температурные неоднородности, возникающие из-за эффектов джоулева нагрева. Это помогло добиться более быстрой подвижности аналита и более короткого времени работы без ущерба для эффективности разделения.В дополнение к этим преимуществам капиллярный формат по своей природе требует меньшего количества пробы и реагентов и предлагает большую возможность автоматизации. Поскольку размеры поперечного сечения капилляров находятся в том же масштабе, что и типичные микрофлюидные каналы, неудивительно, что многие усилия по миниатюризации были сосредоточены на прямом уменьшении масштабов проверенных технологий CE. Был исследован ряд различных микромасштабных реализаций этого фундаментального явления, чтобы соответствовать требованиям конкретных аналитов и приложений, включая адаптацию гелевых пластин и капиллярных методов, а также хроматографических методов [16, 30, 59, 61, 91 , 106, 112, 146, 153, 175, 200, 206, 301, 342]. Некоторые из наиболее распространенных вариаций, о которых сообщалось, включают следующие (рис. 1).
Некоторые из наиболее распространенных вариаций, о которых сообщалось, включают следующие (рис. 1).
| Рис. 1. Режимы электрофореза, используемые в миниатюрных системах, включают (а) электрофорез в свободном растворе, (б) гель-электрофорез, (в) изоэлектрическое фокусирование и (г) мицеллярную электрокинетическую хроматографию (изображены отрицательно заряженные аналиты) |
Это гибридный метод, включающий комбинацию электрофоретических и хроматографических принципов, которые можно применять для разделения как нейтральных, так и заряженных частиц.Здесь отрицательно заряженные мицеллы образуются при добавлении соответствующей концентрации поверхностно-активного вещества в буферный раствор. Поскольку мицеллы образуются путем объединения гидрофобных и гидрофильных групп, содержащих отдельные молекулы поверхностно-активного вещества, гидрофобный или гидрофильный характер аналита определяет степень взаимодействия с мицеллами. Следовательно, подвижность аналита определяется взаимодействием между зарядом, размером и гидрофобностью. Гидрофобные аналиты будут предпочтительно взаимодействовать с гидрофобной внутренней частью мицелл, приводя к чистой скорости миграции, близкой к скорости мицелл, в то время как миграция гидрофильных частиц не будет сильно затронута.Разделение нейтральных частиц может быть достигнуто путем наложения объемного электроосмотического потока.
Следовательно, подвижность аналита определяется взаимодействием между зарядом, размером и гидрофобностью. Гидрофобные аналиты будут предпочтительно взаимодействовать с гидрофобной внутренней частью мицелл, приводя к чистой скорости миграции, близкой к скорости мицелл, в то время как миграция гидрофильных частиц не будет сильно затронута.Разделение нейтральных частиц может быть достигнуто путем наложения объемного электроосмотического потока.
Следует подчеркнуть, что описанные выше методы, охватывая большинство методов, адаптированных к микроструктурным системам, представляют собой подмножество гораздо более широкой области технологии электрофореза. Методы миниатюрной электрохроматографии представляют собой еще один важный класс аналитических методов и рассматриваются отдельно в сопроводительной главе. Здесь мы сосредоточены на разработках, опубликованных в реферируемых журналах, с пониманием того, что дополнительные исследования могут быть задокументированы в таких источниках, как материалы конференций и патентная литература.
Конструкция большинства микроизготовленных систем электрофореза относительно проста и состоит из следующих основных элементов: (1) зона ввода пробы, (2) канал разделения электрофореза и (3) система для обнаружения мигрирующих аналитов (рис. 2). Несмотря на эту лежащую в основе простоту, достижения в технологии микро- и нанообработки позволили внедрить более сложную технологию за счет интеграции с другими процессами на кристалле для повышения производительности и эффективности.
С точки зрения экономики, преимущества миниатюризации включают снижение расхода реагентов и увеличение возможностей автоматизации, так что затраты, связанные с проведением химических и биохимических реакций, могут быть значительно снижены. Что касается аппаратного обеспечения, использование технологии микротехнологии и микромеханической обработки на основе фотолитографии позволяет одновременно производить сотни или тысячи устройств при практически одинаковых затратах на пластину. Следовательно, как неоднократно демонстрировалось в индустрии микроэлектроники, рентабельность микротехнологии становится наиболее очевидной, когда размер устройства становится как можно меньше. Для приложений электрофореза это означает, что возможность создания разделительных колонок достаточной длины для обеспечения требуемого уровня разрешения и чувствительности, в то же время занимая максимально компактную допустимую площадь на кристалле, имеет решающее значение.
Для приложений электрофореза это означает, что возможность создания разделительных колонок достаточной длины для обеспечения требуемого уровня разрешения и чувствительности, в то же время занимая максимально компактную допустимую площадь на кристалле, имеет решающее значение.
| Рис. 2. Типичный цикл электрофореза в микромасштабе начинается с электрокинетического введения образца в устройство, после чего напряжение переключается так, что узкая полоса вводится в канал разделения.Разные виды мигрируют с разной подвижностью и разделяются на отдельные зоны, обнаруживаемые ниже по течению. |
Для эффективного разделения совместно мигрирующих видов разница в их электрофоретической подвижности должна позволять им перемещаться и разделяться на отдельные зоны с большей скоростью, чем зоны расширяются из-за кумулятивных эффектов диффузии и дисперсии во время элюирования. Часто используется режим обнаружения финишной черты, в котором оптический или электронный сигнал генерируется, когда мигрирующие виды проходят мимо фиксированной точки обнаружения ниже по потоку. Затем способность различать соседние зоны или пики можно количественно оценить с помощью параметра, называемого разрешением разделения R, который выражает отношение расстояния между пиками (t 2 — t 1 ) к сумме их половины. -ширины в основании [95] (рис. 3). Если зоны следуют гауссовскому профилю, полуширину каждого пика можно принять равной удвоенному стандартному отклонению σ, что дает следующее выражение.
Затем способность различать соседние зоны или пики можно количественно оценить с помощью параметра, называемого разрешением разделения R, который выражает отношение расстояния между пиками (t 2 — t 1 ) к сумме их половины. -ширины в основании [95] (рис. 3). Если зоны следуют гауссовскому профилю, полуширину каждого пика можно принять равной удвоенному стандартному отклонению σ, что дает следующее выражение.
| (1) |
| Рис.3. В типичном эксперименте электрофореза регистрируется интенсивность флуоресцентно меченных мигрирующих аналитов, когда они проходят через фиксированную точку обнаружения в канале разделения. Способность различать две соседние зоны можно выразить через расстояние между пиками относительно их ширины. |
Ширина пиков также может быть выражена через их полную ширину на полувысоте (FWHM), которая может быть связана со стандартным отклонением согласно FWHM = так, что уравнение. (1) становится
(1) становится
| (2) |
По соглашению, значение R ≥ 0,5 часто используется в качестве критерия, чтобы указать, что два соседних пика четко различимы.
Наблюдаемая ширина мигрирующих зон отражает вклад ряда факторов, включая диффузионное уширение, начальную ширину вводимой пробки образца и конечный объем обнаружения. Учитывая только диффузионный вклад, величины в уравнении.(1) может быть выражено в терминах подвижности (т.е. скорости миграции) и коэффициента диффузии (т.е. скорости расширения полосы во время электрофоретической миграции), давая следующее эквивалентное выражение для разрешения разделения [18, 188].
| (2) |
Здесь член Δμ / μ — это избирательность (т. Е. Относительная подвижность между соседними зонами), μ — средняя подвижность соседних зон, а L — расстояние длина (я.е. расстояние между точками ввода и обнаружения). D — коэффициент, характеризующий скорость уширения продольной зоны, и обычно он больше, чем коэффициент бесполевой диффузии.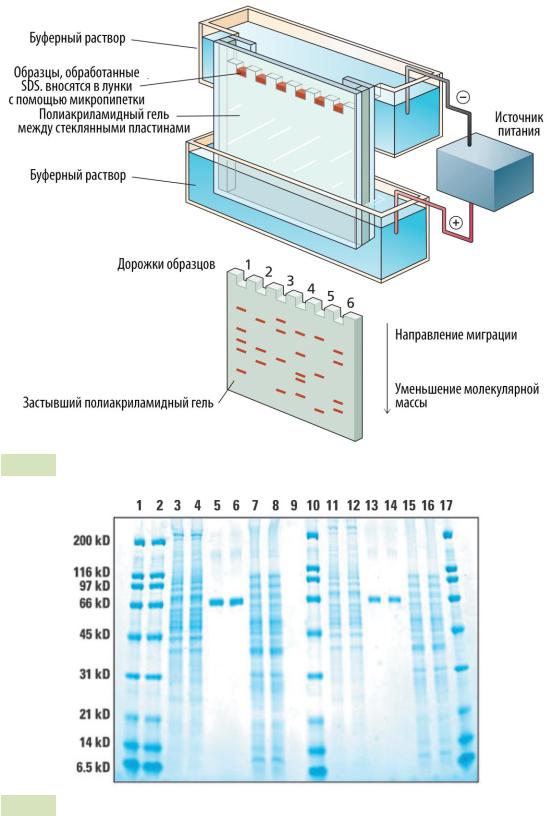 Важный момент, который следует отметить из уравнения. (3) заключается в том, что разрешение зависит от длины разделения, устанавливая предел степени, до которой длина разделительной колонки может быть уменьшена. Длина разделения может широко варьироваться (от миллиметров до десятков сантиметров) в зависимости от конкретного приложения, типа образца и требований к разрешающей способности.В тех случаях, когда L не может быть уменьшено без отрицательного воздействия на производительность, более длинные разделительные колонны могут быть сложены в спиральную или змеевидную геометрию, часто со специально разработанными витками для минимизации дисперсии («эффект беговой дорожки»). Эти конструкции позволяют более компактно расположить на поверхности микросхемы (Таблица 1).
Важный момент, который следует отметить из уравнения. (3) заключается в том, что разрешение зависит от длины разделения, устанавливая предел степени, до которой длина разделительной колонки может быть уменьшена. Длина разделения может широко варьироваться (от миллиметров до десятков сантиметров) в зависимости от конкретного приложения, типа образца и требований к разрешающей способности.В тех случаях, когда L не может быть уменьшено без отрицательного воздействия на производительность, более длинные разделительные колонны могут быть сложены в спиральную или змеевидную геометрию, часто со специально разработанными витками для минимизации дисперсии («эффект беговой дорожки»). Эти конструкции позволяют более компактно расположить на поверхности микросхемы (Таблица 1).
Процесс, с помощью которого пробы вводятся в канал разделения, также важен. Ввод неконцентрированной и несфокусированной зоны образца не только требует большого разделительного расстояния, чтобы различить каждый компонент, но и соответствующий сигнал от каждого вида может падать ниже обнаруживаемого диапазона, поскольку зоны распространяются за счет диффузии. Ввод концентрированной и сфокусированной зоны образца позволяет обнаруживать каждый компонент на значительно более коротком расстоянии. Возможны различные схемы, большинство из которых включает геометрию перпендикулярно пересеченного канала, где аналиты электрокинетически транспортируются через канал разделения, после чего напряжение переключается так, что вводится только объем образца на пересечении [71, 107, 108, 131, 135, 140, 151, 154, 159, 167, 179, 194, 239, 241, 272, 305, 339] (рис.2). Примеры других методов включают объемный поток [123], капиллярный [271], диффузионный [270], управляемый давлением [170], гидродинамический [8], диэлектрофоретический захват [2, 3, 40], межсоединения нанокапиллярных массивов [ 28], комбинированные электрофоретические и электроосмотические процессы на пересечениях микроканалов и наноканалов [49, 56, 318], а также на массивах микроэлектродов на кристалле [19, 65, 177, 178, 262].
Ввод концентрированной и сфокусированной зоны образца позволяет обнаруживать каждый компонент на значительно более коротком расстоянии. Возможны различные схемы, большинство из которых включает геометрию перпендикулярно пересеченного канала, где аналиты электрокинетически транспортируются через канал разделения, после чего напряжение переключается так, что вводится только объем образца на пересечении [71, 107, 108, 131, 135, 140, 151, 154, 159, 167, 179, 194, 239, 241, 272, 305, 339] (рис.2). Примеры других методов включают объемный поток [123], капиллярный [271], диффузионный [270], управляемый давлением [170], гидродинамический [8], диэлектрофоретический захват [2, 3, 40], межсоединения нанокапиллярных массивов [ 28], комбинированные электрофоретические и электроосмотические процессы на пересечениях микроканалов и наноканалов [49, 56, 318], а также на массивах микроэлектродов на кристалле [19, 65, 177, 178, 262].
Таблица 1 . Микрочипы для электрофореза с разделительными каналами, сложенными в компактную форму Микрочипы для электрофореза с разделительными каналами, сложенными в компактную форму | |||
| Метод компактной геометрии | Каталожные номера | ||
| Серпентин | [21, 44, 126, 131, 135, 136, 143, 187, 215, 238, 269, 273, 287] | ||
| Серпентин (геометрия с низкой дисперсией) | [15, 58, 99, 100, 166, 207, 226-228, 236, 268, 297, 337] | ||
| Серпентин (модификация поверхности) | [139, 169] | ||
| Спираль | [45, 98] | ||
В микроустройствах для электрофореза использовались различные составы просеивающей матрицы, в первую очередь в приложениях, включающих разделение ДНК и белков, где подвижность анализируемого вещества в свободном растворе либо не зависит от размера, либо очень слабо [1, 330] (Таблица 2).Полиакриламидные гели (как сшитые, так и несшитые) широко используются благодаря благоприятным свойствам, включая оптическую прозрачность, электронейтральность и общие характеристики разделения. Сшитые гели обычно дают более плотную сетку пор, однако необходимость полимеризации геля внутри разделительного канала означает, что матрица, как правило, не подлежит замене, что ограничивает возможность повторного использования устройства. Методы фотополимеризации использовались для точного позиционирования гелей внутри микроканальных сетей с использованием фотошаблона для выборочного освещения устройства УФ-светом, после чего неполимеризованные реагенты могут быть легко удалены.Несшитые полиакриламидные гели (т.е. линейный полиакриламид; LPA), которые образуют запутанные сети при концентрациях, превышающих критический порог, также полезны для электрофоретического разделения и заменяются. Поскольку образование этой сетки перепутывания сопровождается увеличением вязкости, давление, необходимое для введения гелевой матрицы в канал микросепарации, является одним из факторов, ограничивающих доступный диапазон концентраций полимера. Термообратимые гели, такие как агароза (полисахарид) и плюроник (амфифильный блок-сополимер), также были исследованы как средства, способствующие загрузке и позволяющие заменять просеивающую матрицу.Эти составы претерпевают термически индуцированный переход от гелеобразного к жидкоподобному поведению в определенном температурном диапазоне. Другие изученные просеивающие гели включают гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, полидиметилакриламид и поливинилпирролидон.
| Таблица 2 . Просеивающие матричные материалы, используемые в микрочипах для электрофореза | |||
| Гелевая матрица | Каталожные номера | ||
| Агароза | [119, 120, 155, 300] | ||
| Бактериальные фибриллы целлюлозы | [283] | ||
| Полимер GeneScan | [264, 286, 303] | ||
| Гидроксиэтилцеллюлоза (HEC ) | [77, 118, 125, 142, 144, 163-165, 202, 203, 217, 226, 249, 263, 265, 271, 285, 288-291, 321, 322, 324-326] | ||
| Гидроксипропилцеллюлоза (HPC) | [70, 74, 250, 251] | ||
| Комбинация HPC / HEC | [313] | ||
| Гидроксипропилметилцеллюлоза (HPMC) | [316, 328, 329] | ||
| ГПМЦ / наночастицы латекса | [284] | ||
| Метилцеллюлоза | [52, 235, 274, 294-296, 341] | ||
| Плюроник | [278, 300] | ||
| Полиакриламид ( несшитый; LPA) | [15, 27, 34, 72, 73, 96, 101, 151, 157, 166, 183, 184, 187, 204, 205, 207, 211, 220, 221, 227, 228, 239, 240, 248, 253-256, 271, 273, 287, 309, 310, 323, 332, 337] | ||
| LPA-co- алкилакриламид | [38] | ||
| LPA-со-дигексилакриламид | [39] | ||
| LPA наногель | [58, 261] | ||
| Полиакриламид (сшитый, фотополимеризованный) | [19, 115, 116, 177, 178, 222, 229, 262, 298-300] | ||
| Полиакриламид (сшитый, химически полимеризованный) | [24, 306] | ||
| Полидиметилакриламид (PDMA) | [68, 75 , 152, 190, 192, 252, 292, 319, 320] | ||
| Наносферы полиэтиленгликоля (PEG) / полимолочной кислоты (PLA) | [281] | ||
| Полиэтиленоксид (PEO) | [293, 331] | ||
| ПОП-6 | [6, 7, 85-87] | ||
| Поливинилпирролидон (ПВП) | [12, 154, 217, 235 , 244, 297, 344] | ||
| SDS 14-200 | [260] | ||
| Решение SNAP | [44] | ||
Еще одним важным компонентом микроустройств для электрофореза является способность обнаруживать миграцию разделенных зон (таблица 3).Обычно используется система лазерно-индуцированной флуоресценции (LIF), при которой флуоресцентно меченые частицы освещаются лазером (например, ионом аргона), который возбуждает флуорофоры, конъюгированные с мигрирующими аналитами. Результирующий сигнал флуоресценции фильтруется, чтобы блокировать фоновое освещение от источника возбуждения, и записывается с помощью фотодетектора (например, фотоэлектронного умножителя). В некоторых случаях используются системы оптических микроскопов, при которых чип для электрофореза устанавливается на столик, а мигрирующие зоны с флуоресцентной меткой наблюдаются и регистрируются под увеличением с помощью цифрового (например,г., ПЗС) камера. При достаточно большом увеличении можно даже наблюдать динамику отдельных молекул ДНК, когда они мигрируют через канал разделения [39].
| Таблица 3 . Методы обнаружения, используемые в микрочипах для электрофореза | |||
| Метод обнаружения | Каталожные номера | ||
| Абсорбция | [122, 176, 197] | ||
| Хемилюминесценция | [124] | ||
| Электрохимический | [8, 11, 77, 93, 94, 150, 155, 168, 193, 198 , 199, 279, 326] | ||
| Инфракрасный | [231] | ||
| Лазерно-индуцированная флуоресценция (LIF) | [4, 6, 7, 9, 12, 15, 21, 22, 27, 34- 39, 42-48, 51, 52, 58, 68, 70-75, 78-88, 92, 96-98, 101, 102, 107-109, 113, 116, 118, 125, 126, 130-138, 142, 143, 144, 147, 149, 151, 152, 154, 157, 160–167, 181, 183–187, 190, 192, 194–196, 201, 203–205, 207, 211, 215, 217, 218, 223, 224, 226-228, 230, 235-237, 239, 240, 244-246, 248-258, 260, 261 263-265, 268, 269, 271, 273, 274, 285-293, 303 , 306, 309-313, 315, 316, 319, 320, 322-325, 332, 333, 335-337, 340, 344, 345] | ||
| Микроскоп / цифровая камера | [5, 10, 19, 25, 26, 29, 32, 41, 64, 104, 105, 114, 115, 119-121, 141, 156, 177-179, 202, 208, 21 3, 214, 220, 221, 229, 238, 242, 243, 262, 266, 267, 276, 278, 294-296, 298-300, 317, 327, 334, 338] | ||
| Масс-спектрометрия | [55, 145, 173, 174, 182, 219] | ||
| Встроенный фотодиод | [24, 222, 321] | ||
| Рамановская спектроскопия | [314] | ||
| Визуализация одиночных молекул | [39, 66, 69, 103, 127, 209, 297, 307] | ||
| Двухлучевая флуоресцентная кросс-корреляционная спектроскопия | [20] | ||
Для оптических методов обнаружения обычно требуется источник освещения и компоненты фотодетектирования, которые во многих случаях вносят значительный вклад в общий размер системы.Эти проблемы стимулировали интерес к разработке миниатюрной технологии обнаружения, что было продемонстрировано путем создания микросхем микроэлектрофореза на основе кремния, включающих интеграцию схемы фотодиода на кристалле. Неоптические методы обнаружения также исследовались как средство создания более компактных конструкций устройств. Электрохимическое обнаружение, например, включает мониторинг изменений электрохимического потенциала по мере того, как аналиты проходят мимо рабочего электрода, расположенного в канале разделения [304].
Большинство микрочипов для электрофореза сконструированы с использованием кремниевых или стеклянных подложек (таблица 4). Типичные размеры поперечного сечения микроканалов колеблются от десятков до сотен микрон в ширину и от 5 до 100 мкм в глубину. Затем подложка, содержащая сеть микроканалов, прикрепляется к соответствующему плоскому куску стекла или кремния, чтобы сформировать герметичный корпус. В случае электрофореза, по крайней мере, одна из подложек обычно представляет собой стекло или кварц, чтобы обеспечить оптическую прозрачность для обнаружения аналита.Отверстия для доступа просверливаются для введения в микроканал обработанных поверхностей, просеивающих гелей и образцов. Последующая упаковка может включать добавление соединений к внешнему оборудованию для работы с жидкостью и электронным компонентам контроля напряжения или температуры. Использование кремниевых подложек может быть выгодным, поскольку дает возможность включать электроды на кристалле, нагреватели, датчики температуры и схемы фотодетектирования.
| Таблица 4 . Материалы подложки, используемые для создания микрочипов для электрофореза | |||
| Материал основы | Каталожные номера | ||
| Акрил | [114, 202] | ||
| Фторид кальция | [231] | ||
| Стекло, плавленый кварц | [4, 6, 7, 9, 11, 12, 17, 21, 22 , 27, 34-39, 42-48, 55, 58, 68, 71-73, 75-82, 84-88, 90, 92, 96-98, 101, 102, 107, 108, 115, 116, 118 , 121, 125, 126, 128-133, 136-138, 142, 143] [144, 150-152, 154, 157, 160-169, 173, 174, 176, 181-186, 190, 192-196, 201, 203-205, 207, 211, 215-218, 223, 226-228, 230, 236-240, 242-244, 248-251, 253-258, 263-268, 271, 276, 279, 280, 285, 286, 288-292, 303, 309, 310, 314-316, 319, 320, 322-326, 332, 333, 336, 337, 340, 343, 344] | ||
| Стекло / полиэфирная пленка | [122] | ||
| Полидиметилсилоксан (ПДМС) | [64, 94, 127, 198, 199, 208, 209, 213, 214, 224, 327] | ||
| ПДМС / стекло | [8, 15, 69, 70, 74, 113, 119, 124, 147, 155, 156, 162, 269, 334] | ||
| Полиэтилентерефт алатгликоль (ПЭТГ) | [111] | ||
| Полиметилметакрилат (ПММА) | [50-54, 89, 139, 149, 179, 187, 219-221, 235, 246, 252, 260, 261, 273 , 274, 287, 293, 295, 311-313, 328, 329, 331, 335, 341] | ||
| ПММА / стекло | [20] | ||
| ПММА / ПДМС | [120] | ||
| Встроенный капилляр из поливинилхлорида | [306] | ||
| Кварц | [10, 13, 42, 83, 93, 134, 135, 141, 197, 294, 296, 297, 345] | ||
| Кремний | [26] | ||
| Кремний / стекло | [5, 19, 23-25, 29, 32, 66, 103-105, 109, 177, 178, 222, 225, 229, 262, 298-300, 307, 338] | ||
| Кремний / парилен | [321] | ||
| Кремний / оксид кремния | [41] | ||
| Термопластический эластомер | [278] | ||
| Vivak | |||
| Zeonor | [145] | ||
Пластиковые подложки также были исследованы для использования в электрофорезе.Одной из наиболее широко используемых пластиковых подложек в микрофлюидике является полидиметилсилоксан (PDMS), силиконовый каучук, обладающий превосходной оптической прозрачностью и способностью образовывать прочные связи как со стеклом, так и с поверхностями PDMS. Использование пластиковых подложек может значительно упростить изготовление, позволяя применять процессы формования или мягкой литографии, при которых микроканальные структуры отливаются против жесткой мастер-формы. PDMS — это эластомерный материал, свойство, которое также можно использовать для создания компонентов механического управления текучей средой, таких как встроенные в кристаллы клапаны и насосы.К сожалению, многие пластмассы являются газопроницаемыми, что затрудняет полимеризацию гелей внутри микроканала, поскольку любой кислород, присутствующий в субстрате, ингибирует реакцию.
Хотя стеклянные подложки желательны для использования в электрофорезе из-за их оптической прозрачности, они также обладают характерным отрицательным поверхностным зарядом при значениях pH выше ~ 3 из-за депротонирования поверхностных силанольных (Si-OH) групп с образованием силаноата (Si-O -). Результирующий отрицательный поверхностный заряд притягивает положительно заряженные противоионы, диспергированные в буферном растворе, так что образуется тонкий слой около стенок канала, где их концентрация локально превышает объемную величину.При приложении электрического поля этот положительно заряженный противоионный слой перемещается к отрицательному электроду подобно оболочке, транспортируя с собой объем жидкости (рис. 4). Это явление электроосмотического потока (EOF) может быть выгодным с точки зрения обеспечения средств для перекачивания жидкостей и реагентов в микроканалы, но обычно нежелательно для разделения ДНК, поскольку направление EOF противоположно направлению электрофоретической миграции отрицательно заряженной ДНК.
| Рис.4. Внутренний отрицательный поверхностный заряд вдоль стенок стеклянного микроканала вызывает образование положительно заряженного слоя противоиона, который переносится к катоду при приложении электрического поля. Этот слой действует как оболочка вокруг объема жидкости, создавая электроосмотический поток с характерной скоростью µEOF. Эти эффекты EOF накладываются на электрофоретическую миграцию аналита (µEP) и могут либо усиливать, либо противодействовать ей. |
| Таблица 5 .Методы пассивации поверхности, используемые в микрочипах для электрофореза | |||
| Техника пассивации поверхности | Каталожные номера | ||
| [Акрилоиламино) пропил] триметиламмоний хлорид (BCQ) | [55, 173, 174] | ||
| Рабочий буфер Bio-Rad | [152] | ||
| HCl | [119] | ||
| HCl, NaOH | [92, 113, 264] | ||
| Гидроксиэтилцеллюлоза (HEC) | [249] | ||
| Процесс Хьертена | [15, 27, 34, 58, 68, 75, 77, 96 , 101, 125, 134, 136, 142, 144, 151, 157, 163-166, 183, 184, 197, 203-205, 207, 211, 217, 218, 227, 228, 248, 253-256, 263 , 265, 285, 292, 294, 296, 319, 320, 322, 336, 337] | ||
| HNO3 | [70] | ||
| HNO3 / NaOH | [43] | ||
| Гидроксипропилметилцеллюлоза ( HPMC) | [261] | ||
| LPA (в микроканале PDMS) | [327] | ||
| LPA (фотополимеризованный) | [115, 116] | ||
| Metha № | [224] | ||
| Метилгидроксиэтилцеллюлоза (MHEC) | [260] | ||
| NaOH | [21, 22, 35, 42, 48, 102, 138, 143, 147, 154, 162 , 167, 181, 182, 185, 213, 214, 230, 242, 276, 317, 332, 333, 345] | ||
| O2 плазма | [120] | ||
| Полидиметилакриламид (PDMA) | [44 , 64, 84] | ||
| ПДМА / алкилглицидиловый эфир | [208, 209] | ||
| Полидиметилсилоксан (ПДМС) | [9] | ||
| ПДМС / Плюроник | [201] | ||
| Полиэтиленгликоль (ПЭГ) | [220] | ||
| Полигидроксиэтилакриламид | [38, 39] | ||
| Поливинилпирролидон (ПВП) | [12, 118, 141, 244, 288-290, 344] | ||
| Силан | [323] | ||
Величину и воспроизводимость EOF также может быть сложно точно контролировать, поскольку он очень чувствителен к химическому составу поверхности и pH буфера.Явления электроосмотического потока широко изучались в обычных системах КЭ, где обычно используются капилляры из стекла и кварцевого стекла. Эти усилия привели к разработке надежных способов нанесения покрытия, способных эффективно нейтрализовать поверхностные заряды [14, 57, 60] (Таблица 5). Наиболее широко используемый процесс, первоначально разработанный Hjertén [117], включает ковалентную полимеризацию тонкого слоя полиакриламида или другого пассивирующего полимера вдоль внутренней поверхности капилляра или микроканала.Электроосмотические эффекты не столь проблематичны при гель-электрофорезе, поскольку гелевая матрица часто нейтрализует или экранирует отрицательный поверхностный заряд. Характеристики и контроль EOF менее изучены для других материалов подложек (например, пластмасс), но это активная область текущих исследований.
Микрофабричные системы электрофореза использовались для анализа различных образцов, от небольших молекул до ДНК и белков (таблица 6). Анализ как одноцепочечной, так и двухцепочечной ДНК представляет особый интерес из-за центральной роли, которую он играет во множестве приложений биомедицины и молекулярной биологии.Разделение одноцепочечных фрагментов ДНК, меченных ковалентно присоединенными флуорофорами, обычно проводят в денатурирующих условиях, создаваемых добавлением химических денатурантов и / или при повышенной температуре (~ 50 ° C), чтобы ингибировать образование вторичных структур, которые могут изменить поведение миграции. Размеры фрагментов
| Таблица 6 . Разделение аналитов на микрочипах для электрофореза | |||
| Разделенные аналиты | Ссылки | ||
| ДНК (двухцепочечная) | [5, 7, 10, 12, 19, 24-26, 29, 32, 34, 39, 41, 44, 52, 64, 66, 68-70, 74, 75, 77, 78, 85-88, 101, 103-105, 118-121, 125, 127-129, 136, 141, 142, 144, 148, 151, 152, 154, 155, 163-166, 177- 179, 190, 202, 203, 208, 209, 212, 216, 217, 222, 226, 229, 233, 235, 240, 244, 250-252, 263-265, 271, 274, 278, 281-288, 290, 291, 293, 295, 297, 300, 307, 311, 313, 316, 319-322, 324-326, 328, 329, 331, 338, 341, 343, 344] | ||
| ДНК (одиночная- многожильный) | [6, 15, 58, 71, 72, 76, 78, 96, 157, 183, 184, 187, 192, 204, 205, 207, 211, 227, 228, 239, 248, 253-256 , 261, 271, 273, 289, 292, 294, 296, 298-300, 302, 303, 323, 332, 337] | ||
| Белки | [9, 17, 27, 35, 38, 42, 84 , 90, 97, 98, 114-116, 122, 124, 138, 156, 185, 186, 197, 220, 221, 234, 236, 249, 260, 327, 335] | ||
| Малые молекулы | [ 4, 8, 20-22, 36, 37, 43-48, 50, 51, 53-55, 71, 79-83, 92-94, 1 02, 107-109, 113, 126, 130-135, 137, 143, 145, 147, 149, 150, 155, 160-162, 167, 168, 173, 174, 176, 181, 182, 193-196, 198, 199, 201, 213-215, 218, 219, 223, 224, 230, 231, 237, 238, 242, 243, 246, 257, 258, 266-269, 276, 279, 306, 309, 310, 312, 314, 315, 317, 326, 333, 334, 336, 340, 345] | ||
обычно варьируются от олигонуклеотидов длиной в несколько десятков оснований до примерно одной тысячи оснований.Разделение двухцепочечной ДНК в денатурирующих условиях не проводится, и фрагменты могут быть помечены интеркалирующими красителями, которые не требуют ковалентного присоединения. Размеры фрагментов, которые можно разделить, простираются от 100 до килобаз. Молекулы ДНК в районе 40-50 тысяч оснований и более достаточно велики, чтобы их можно было непосредственно наблюдать с помощью оптического микроскопа, что позволяет регистрировать миграцию отдельных молекул. Разделение белков несколько отличается от ДНК, потому что они обладают переменным соотношением заряда к размеру.Двумерные конфигурации часто используются для решения этого дополнительного уровня сложности, когда частицы сначала разделяются в одном измерении в соответствии с зарядом (например, с использованием изоэлектрического фокусирования в градиенте pH), после чего каждая зона постоянного заряда разделяется в соответствии с размером. Наконец, приложения, включающие разделение нейтральных или слабо заряженных аналитов, могут быть выполнены с использованием методов MEKC.
Последние достижения привели к развитию технологий разделения, предлагающих возможности, превосходящие возможности, которые можно найти в адаптации традиционных методов электрофореза [180] (Таблица 7).Одним из ярких примеров является использование массивов столбиков, изготовленных из микро- и нанотехнологий, в качестве структур разделительной матрицы вместо полимерных гелей. Эти массивы штифтов можно легко производить массово с использованием технологии микрообработки, и они обладают однородной монодисперсной двумерной морфологией пор. Управляя размером, формой и расстоянием между столбиками, можно настроить свойства разделения, чтобы сделать их совместимыми с широким диапазоном образцов и размеров аналитов. Кроме того, поскольку просеивающие структуры изготавливаются заранее внутри микроканала, процесс загрузки геля исключается.Детальная физика, связанная со столкновениями и взаимодействиями, которые происходят между мигрирующими аналитами и массивом препятствий, ответственна за введение подвижностей, зависящих от размера. Размер наноструктурированных столбов ограничен разрешением фотолитографического рисунка, обычно около нескольких сотен нанометров. Следовательно, эти конструкции наиболее эффективны для разделения больших аналитов (например, ДНК размером с килобазу). Другой класс микромашинных просеивающих структур, которые использовались для электрофореза, включает формирование периодически расположенных промежутков нанометрового размера между дном и потолком разделительного канала.В отличие от столбов, промежутки расположены по вертикали и могут быть относительно легко обработаны контролируемым травлением. Физика электрофореза ДНК через эти массивы нанозазоров может быть описана в терминах энтропийного механизма захвата, при котором переходы в нанозазоры производят миграцию, характеризующуюся быстрыми скачками между зазорами, при этом более крупные фрагменты испытывают более высокую вероятность перехода в нанозазоры и, таким образом, элюируют быстрее, чем поменьше.
Новый и совершенно другой класс изготовленных ситовых структур состоит из магнитных микросфер, которые собираются в упакованную матрицу при приложении внешнего магнитного поля.Здесь морфология сети пор зависит от взаимодействия между размером и концентрацией частиц и геометрией разделительного канала. Такая компоновка позволяет формировать просеивающие матрицы с настраиваемыми воспроизводимыми размерами пор на месте, а агрегированную сеть частиц можно мгновенно диспергировать после снятия магнитного поля. Еще одно новое явление разделения, представляющее интерес для миниатюрных систем, — это поверхностный электрофорез ДНК. Здесь подвижность, зависящая от размера, индуцируется посредством взаимодействий между субстратом (обычно кремнием) и цепями ДНК, адсорбированными на его поверхности.Таким образом, поверхностный электрофорез можно использовать для проведения фракционирования по размеру в отсутствие обычных просеивающих гелей.
Наконец, была продемонстрирована интригующая адаптация электрофореза для разделения коротких олигонуклеотидных фрагментов с использованием электрического поля, приложенного параллельно наконечнику атомно-силового микроскопа (АСМ) [302]. Фрагменты ДНК, которые необходимо разделить, сначала собираются электрокинетическим способом у основания кантилевера АСМ, а затем высвобождаются периодически изменяющимся электрическим полем, приложенным между кантилевером и подложкой.Фрагменты ДНК демонстрируют подвижность, зависящую от размера, поскольку они перемещаются по длине наконечника АСМ, а изначально малые размеры позволяют применять очень сильные электрические поля с минимальным джоулевым нагревом. Регулируя частоту, с которой электрическое поле меняет направление на противоположное, фрагменты желаемого размера могут передаваться от наконечника к поверхности подложки, в то время как более медленно движущиеся фрагменты возвращаются в резервуар, прежде чем достигнут наконечника.
| Таблица 7 .Варианты электрофоретического разделения адаптированы к формату микрочипа | |||
| Механизм разделения | Каталожные номера | ||
| Атомно-силовой микроскоп (AFM) | [302] | ||
| Фракционирование потока электрического поля (EFFF) | [33] | ||
| Энтропическая отдача | [26] | ||
| Энтропийное улавливание | [ 31, 62, 103-105, 247, 277] | ||
| Изоэлектрическая фокусировка (IEF) | [114, 122, 124, 197, 249] | ||
| Изотахофорез (ITP) | [314] | ||
| Массив магнитных шариков | [63, 64, 208-210] | ||
| Мицеллярная электрокинетическая хроматография (MEKC) | [45, 160, 215, 236, 238, 243, 260, 279, 310, 315] | ||
| Массив столбов из микроструктурных материалов | [5, 10, 25, 29, 41, 65-67, 121, 127, 141, 225, 232, 307, 308, 334, 338] | ||
| Микроструктурированные периодические полости | [ 69] | ||
| Оптическое фракционирование | [191] | ||
| [88] | |||
| Поверхностный электрофорез | [171, 172, 189, 233, 259] | ||
Значительные успехи были достигнуты с тех пор, как в начале 1990-х годов были впервые разработаны устройства для электрофореза на микроуровне [194].Эти достижения стали возможными благодаря сочетанию улучшений в технологии микромеханической обработки, просеивающих матричных материалах и оборудовании. Несмотря на эти достижения, современное поколение миниатюрных систем, как правило, еще не продемонстрировало преимуществ по стоимости или производительности, которые были бы достаточно убедительными, чтобы сделать их конкурентоспособными по сравнению с традиционной настольной технологией CE. Некоторые из проблем, которые еще предстоит решить, включают уменьшение размера устройства до такой степени, когда может быть полностью реализована огромная экономия средств, связанная с фотолитографическим микроизготовлением, усиление интеграции и улучшение возможностей взаимодействия с внешней средой макроуровня, а также разработка миниатюрной технологии обнаружения.Систематические фундаментальные исследования также важны для обеспечения более полного понимания физики электрофореза в микро- и наноразмерных средах. Дальнейшие разработки в этих областях в течение следующих нескольких лет, вероятно, заложат основу для нового поколения быстрых, чувствительных и недорогих приборов с характеристиками разделения, превышающими характеристики многих традиционных настольных аналитических систем, доступных сегодня.
- 1. Альбаргути М.Н., Баррон А.Е. (2000) Полимерные матрицы для секвенирования ДНК с помощью капиллярного электрофореза.Электрофорез 21: 4096-4111
- 2. Asbury CL, van den Engh G (1998) Захват ДНК в неоднородных осциллирующих электрических полях. Биофизический журнал 74: 1024-1030
- 3. Asbury CL, Diercks AH, van den Engh G (2002) Захват ДНК с помощью диэлектрофореза. Электрофорез 23: 2658-2666
- 4. Аттия С., Джемер А.Б., Тан Т., Фитцпатрик Дж., Зайлер К., Ким Н., Харрисон Д.Д. (2001) Дизайн интерфейса, позволяющий микрожидкостным электрофорезным чипам пить из пожарного шланга внешней среды.Электрофорез 22: 318-327
- 5. Баба М., Сано Т., Игучи Н., Иида К., Сакамото Т., Каваура Х. (2003) Разделение ДНК по размерам с использованием искусственно наноструктурированной матрицы. Письма по прикладной физике 83: 1468-1470
- 6. Backhouse C, Caamano M, Oaks F, Nordman E, Carrillo A, Johnson B, Bay S (2000) Секвенирование ДНК в монолитном микроканальном устройстве. Электрофорез 21: 150-156
- 7. Backhouse CJ, Gajdal A, Pilarski LM, Crabtree HJ (2003) Повышенное разрешение с помощью усиленного электрофореза с инверсией поля на микрочипе.Электрофорез 24: 1777-1786
- 8. Backofen U, Matysik FM, Lunte CE (2002) Система электрофореза на основе чипов с электрохимическим обнаружением и гидродинамической инъекцией. Аналитическая химия 74: 4054-4059
- 9. Badal MY, Wong M, Chiem N, Salimi-Moosavi H, Harrison DJ (2002) Разделение белков и поверхностно-активный контроль электроосмотического потока в капиллярах и микрочипах, покрытых поли (диметилсилоксаном). Журнал хроматографии A 947: 277-286
- 10. Бакаджин О., Дюк ТАДЖ, Тегенфельдт Дж., Чоу К.Ф., Чан С.С., Остин Р.Х., Кокс ЕС (2001) Разделение молекул ДНК длиной 100 килобаз за 10 секунд.Аналитическая химия 73: 6053-6056
- 11. Baldwin RP, Roussel TJ, Crain MM, Bathlagunda V, Jackson DJ, Gullapalli J, Conklin JA, Pai R, Naber JF, Walsh KM, Keynton RS (2002) Полностью интегрированное электрохимическое обнаружение на кристалле для капиллярного электрофореза в микропроцессорное устройство. Аналитическая химия 74: 3690-3697
- 12. Барта С., Ронаи З., Немода З., Секели А., Ковач Е., Сасвари-Секели М., Гутман А. (2001) Анализ полиморфизма гена рецептора дофамина D4 с использованием электрофореза на микрочипе.Журнал хроматографии A 924: 285-290
- 13. Becker H, Lowack K, Manz A (1998) Планарные кварцевые чипы с субмикронными каналами для применения в двумерном капиллярном электрофорезе. Журнал микромеханики и микротехники 8: 24-28
- 14. Белдер Д., Людвиг М. (2003) Модификация поверхности в электрофорезе микрочипов. Электрофорез 24: 3595-3606
- 15. Blazej RG, Kumaresan P, Mathies RA (2006) Микропроцессор для интегрированного секвенирования ДНК Сангера в нанолитровом масштабе.Слушания Национальной академии наук Соединенных Штатов Америки 103: 7240-7245
- 16. Bousse L, Cohen C, Nikiforov T, Chow A, Kopf-Sill AR, Dubrow R, Parce JW (2000) Системы микрожидкостного анализа с электрокинетическим управлением. Ежегодный обзор биофизики и структуры биомолекул 29: 155-181
- 17. Бусс Л., Мурадиан С., Миналла А., Йи Х., Уильямс К., Дуброу Р. (2001) Определение размера белка на микрочипе. Аналитическая химия 73: 1207-1212
- 18. Brahmasandra SN, Burke DT, Mastrangelo CH, Burns MA (2001) Подвижность, диффузия и дисперсия одноцепочечной ДНК в гелях для секвенирования.Электрофорез 22: 1046-1062
- 19. Брахмасандра С.Н., Угаз В.М., Берк Д.Т., Мастранджело С.Х., Бернс М.А. (2001) Электрофорез в микропроцессорных устройствах с использованием фотополимеризованных полиакриламидных гелей и впрыскивания образцов с помощью электродов. Электрофорез 22: 300-311
- 20. Brister PC, Weston KD (2006) Оценка двухлучевой флуоресцентной кросс-корреляционной спектроскопии для электрофоретического анализа перевариваемых белков. Аналитик 131: 303-310
- 21. Bromberg A, Mathies RA (2003) Гомогенный иммуноанализ для обнаружения TNT и его аналогов на микрочипе для капиллярного электрофореза.Аналитическая химия 75: 1188-1195
- 22. Burke BJ, Regnier FE (2001) Электрофоретический микроанализ β-галактозидазы на микрочипах. Электрофорез 22: 3744-3751
- 23. Бернс М.А., Мастранджело С.Х., Саммарко Т.С., Ман Ф.П., Вебстер Дж. Р., Джонсон Б. Н., Фёрстер Б., Джонс Д., Филдс Ю., Кайзер А. Р., Берк Д. Т. (1996) Микрофабричные структуры для интегрированного анализа ДНК. Слушания Национальной академии наук Соединенных Штатов Америки 93: 5556-5561
- 24.Бернс М.А., Джонсон Б.Н., Брахмасандра С.Н., Хандик К., Вебстер Дж. Р., Кришнан М., Саммарко Т.С., Ман П.М., Джонс Д., Хелдсингер Д., Мастранджело С.Х., Берк Д.Т. (1998) Интегрированное устройство для анализа ДНК нанолитров. Наука 282: 484-487
- 25. Кабоди М., Чен Ю.Ф., Тернер С.В.П., Крейгхед Х.Г., Остин Р.Х. (2002) Непрерывное разделение биомолекул с помощью латерально-асимметричной диффузионной матрицы с введением пробы вне плоскости. Электрофорез 23: 3496-3503
- 26. Cabodi M, Turner SWP, Craighead HG (2002) Энтропийное разделение с помощью отдачи длинных молекул ДНК.Аналитическая химия 74: 5169-5174
- 27. Callewaert N, Contreras R, Mitnik-Gankin L, Carey L, Matsudaira P, Ehrlich D (2004) Профилирование N-гликома общего белка сыворотки на платформе капиллярного электрофореза-микрофлюидики. Электрофорез 25: 3128-3131
- 28. Cannon DM, Kuo TC, Bohn PW, Sweedler JV (2003) Межсоединения нанокапиллярных массивов для закрытых инъекций аналитов и электрофоретического разделения в многослойных микрофлюидных архитектурах. Аналитическая химия 75: 2224-2230
- 29.Chan YC, Lee YK, Zohar Y (2006) Высокопроизводительный дизайн и изготовление интегрированной микросистемы с субмикронными столбиками с высоким соотношением сторон для микрокапиллярного электрофореза в свободном растворе. Журнал микромеханики и микротехники 16: 699-707
- 30. Chen G, Lin YH, Wang J (2006) Мониторинг загрязнителей окружающей среды с помощью капиллярного электрофореза микрочипа с электрохимическим обнаружением. Таланта 68: 497-503
- 31. Чен З., Эскобедо Ф.А. (2003) Моделирование разделения по длине цепи в микроканале посредством энтропийного захвата.Молекулярное моделирование 29: 417-425
- 32. Чен З., Бернс М.А. (2005) Влияние буферного потока на разделение ДНК в микропроцессорной системе электрофореза. Электрофорез 26: 4718-4728
- 33. Chen Z, Chauhan A (2005) Разделение ДНК с помощью EFFF в микроканале. Журнал науки о коллоидах и интерфейсах 285: 834-844
- 34. Cheng J, Waters LC, Fortina P, Hvichia G, Jacobson SC, Ramsey JM, Kricka LJ, Wilding P (1998) Полимеразная цепная реакция с вырожденным олигонуклеотидом и анализ капиллярно-электрофоретической ДНК человека на устройствах на основе микрочипов.Аналитическая биохимия 257: 101-106
- 35. Cheng SB, Skinner CD, Taylor J, Attiya S, Lee WE, Picelli G, Harrison DJ (2001) Разработка системы многоканального микрофлюидного анализа, использующей аффинный капиллярный электрофорез для иммуноанализа. Аналитическая химия 73: 1472-1479
- 36. Chiem N, Harrison DJ (1997) Капиллярный электрофорез на основе микрочипов для иммуноанализов: анализ моноклональных антител и теофиллина. Аналитическая химия 69: 373-378
- 37.Chiem NH, Harrison DJ (1998) Системы микрочипов для иммуноанализа: интегрированный иммунореактор с электрофоретическим разделением для определения теофиллина в сыворотке. Клиническая химия 44: 591-598
- 38. Chiesl TN, Shi W, Barron AE (2005) Поли (акриламид-соалкилакриламиды) для электрофоретической очистки ДНК в микроканалах. Аналитическая химия 77: 772-779
- 39. Chiesl TN, Putz KW, Babu M, Mathias P, Shaikh KA, Goluch ED, Liu C, Barron AE (2006) Самоассоциирующиеся блок-сополимерные сети для электрофореза микрочипов обеспечивают улучшенное разделение ДНК за счет динамики цепочки «дюймового червя».Аналитическая химия 78: 4409-4415
- 40. Chou C-F, Тегенфельдт JO, Bakajin O, Chan SS, Cox EC, Darnton N, Duke T., Austin RH (2002) Безэлектродный диэлектрофорез одно- и двухцепочечной ДНК. Биофизический журнал 83: 2170-2179
- 41. Chou CF, Bakajin O, Turner SWP, Duke TAJ, Chan SS, Cox EC, Craighead HG, Austin RH (1999) Сортировка по диффузии: асимметричная полоса препятствий для непрерывного молекулярного разделения. Слушания Национальной академии наук Соединенных Штатов Америки 96: 13762-13765
- 42.Colyer CL, Mangru SD, Harrison DJ (1997) Капиллярный электрофорез белков сыворотки человека на основе микрочипов. Журнал хроматографии A 781: 271-276
- 43. Crabtree HJ, Cheong ECS, Tilroe DA, Backhouse CJ (2001) Аномалии закачки и разделения микрочипа из-за воздействия давления. Аналитическая химия 73: 4079-4086
- 44. Culbertson CT, Jacobson SC, Ramsey JM (1998) Источники дисперсии для компактных геометрических форм на микрочипах. Аналитическая химия 70: 3781-3789
- 45.Culbertson CT, Jacobson SC, Ramsey JM (2000) Микрочиповые устройства для высокоэффективного разделения. Аналитическая химия 72: 5814-5819
- 46. Culbertson CT, Ramsey RS, Ramsey JM (2000) Электроосмотически индуцированная гидравлическая накачка на микрочипах: Дифференциальный перенос ионов. Аналитическая химия 72: 2285-2291
- 47. Culbertson CT, Jacobson SC, Ramsey JM (2002) Измерения коэффициента диффузии в микрофлюидных устройствах. Таланта 56: 365-373
- 48. Калбертсон CT, Tugnawat Y, Meyer AR, Roman GT, Ramsey JM, Gonda SR (2005) Разделение микрочипов в условиях пониженной гравитации и гипергравитации.Аналитическая химия 77: 7933-7940
- 49. Дай Дж. Х., Ито Т., Сан Л., Крукс Р. М. (2003) Электрокинетическое улавливание и обогащение концентрации ДНК в микрофлюидном канале. Журнал Американского химического общества 125: 13026-13027
- 50. Dang F, Zhang L, Hagiwara H, Mishina Y, Baba Y (2003) Сверхбыстрый анализ олигосахаридов на микрочипе с детектированием конфокальной флуоресценции светоизлучающими диодами. Электрофорез 24: 714-721
- 51. Dang FQ, Zhang LH, Jabasini M, Kaji N, Baba Y (2003) Характеристика электрофоретического поведения изомеров сахара с помощью электрофореза на микрочипе в сочетании с видеомикроскопией.Аналитическая химия 75: 2433-2439
- 52. Dang FQ, Tabata O, Kurokawa M, Ewis AA, Zhang LH, Yamaoka Y, Shinohara S, Shinohara Y, Ishikawa M, Baba Y (2005) Высокоэффективный генетический анализ микроизготовленных пластиковых чипов для электрофореза капиллярных матриц, изготовленных путем инъекции литье. Аналитическая химия 77: 2140-2146
- 53. Dang FQ, Kakehi K, Cheng JJ, Tabata O, Kurokawa M, Nakajima K, Ishikawa M, Baba Y (2006) Гибридное динамическое покрытие с н-додецил-β-D-мальтозом и метилцеллюлозой для высокоэффективного анализа углеводов на чипах из поли (метилметакрилата).Аналитическая химия 78: 1452-1458
- 54. Dang FQ, Kakehi K, Nakajima K, Shinohara Y, Ishikawa M, Kaji N, Tokeshi M, Baba Y (2006) Быстрый анализ олигосахаридов, полученных из гликопротеинов, с помощью электрофореза на микрочипах. Журнал хроматографии A 1109: 138-143
- 55. Deng YZ, Henion J, Li JJ, Thibault P, Wang C, Harrison DJ (2001) Капиллярный электрофорез / масс-спектрометрическое определение карнитинов в моче человека на основе чипа. Аналитическая химия 73: 639-646
- 56.Dhopeshwarkar R, Li SA, Crooks RM (2005) Электрокинетическое обогащение концентрации в микрофлюидном устройстве с использованием микровыключателя из гидрогеля. Лаборатория на чипе 5: 1148-1154
- 57. Doherty EAS, Meagher RJ, Albarghouthi MN, Barron AE (2003) Покрытия стенок микроканалов для разделения белков с помощью капиллярного и чип-электрофореза. Электрофорез 24: 34-54
- 58. Doherty EAS, Kan CW, Paegel BM, Yeung SHI, Cao ST, Mathies RA, Barron AE (2004) Редко сшитые наногелевые матрицы в виде жидких, механически стабилизированных полимерных сетей для высокопроизводительного микроканального секвенирования ДНК.Аналитическая химия 76: 5249-5256
- 59. Дольник В., Лю С.Р., Йованович С. (2000) Капиллярный электрофорез на микрочипе. Электрофорез 21: 41-54
- 60. Дольник В. (2004) Покрытие стенок для капиллярного электрофореза на микрочипах. Электрофорез 25: 3589-3601
- 61. Дольник В., Лю С.Р. (2005) Применение капиллярного электрофореза на микрочипе. Журнал науки о разделении 28: 1994-2009
- 62. Дорфман К.Д., Бреннер Х. (2002) Моделирование электрофореза ДНК в устройствах микрофлюидного энтропийного улавливания.Биомедицинские микроустройства 4: 237-244
- 63. Дорфман KD, Viovy JL (2004) Полуфеноменологическая модель дисперсии ДНК во время электрофореза в микрофлюидном массиве штифтов. Физический обзор E 69: 011901
- 64. Doyle PS, Bibette J, Bancaud A, Viovy JL (2002) Самособирающиеся магнитные матрицы для чипов разделения ДНК. Наука 295: 2237-2237
- 65. Duke T, Monnelly G, Austin RH, Cox EC (1997) Секвенирование в наноразмерных массивах: технико-экономическое обоснование. Электрофорез 18: 17-22
- 66.Duke TAJ, Austin RH, Cox EC, Chan SS (1996) Электрофорез в импульсном поле в микролитографических массивах. Электрофорез 17: 1075-1079
- 67. Duke TAJ, Austin RH (1998) Микросито для непрерывной сортировки макромолекул. Письма физического обзора 80: 1552-1555
- 68. Dunn WC, Jacobson SC, Waters LC, Kroutchinina N, Khandurina J, Foote RS, Justice MJ, Stubbs LJ, Ramsey JM (2000) ПЦР-амплификация и анализ полиморфизмов простой длины последовательности в ДНК мыши с использованием одного микрочипа.Аналитическая биохимия 277: 157-160
- 69. Duong TT, Kim G, Ros R, Streek M, Schmid F, Brugger J, Anselmetti D, Ros A (2003) Зависимый от размера электрофорез ДНК свободного раствора в структурированных микрофлюидных системах. Микроэлектронная техника 67-8: 905-912
- 70. Исли CJ, Karlinsey JM, Landers JP (2006) Инъекция давления на чип для интеграции опосредованной инфракрасным излучением амплификации ДНК с электрофоретическим разделением. Лаборатория на чипе 6: 601-610
- 71. Effenhauser CS, Manz A, Widmer HM (1993) Стеклянные чипы для разделения с помощью высокоскоростного капиллярного электрофореза с субмикронной высотой пластин.Аналитическая химия 65: 2637-2642
- 72. Effenhauser CS, Paulus A, Manz A, Widmer HM (1994) Высокоскоростное разделение антисмысловых олигонуклеотидов на микромашинном устройстве для капиллярного электрофореза. Аналитическая химия 66: 2949-2953
- 73. Effenhauser CS, Manz A, Widmer HM (1995) Манипуляции с фракциями образцов на чипе капиллярного электрофореза. Аналитическая химия 67: 2284-2287
- 74. Effenhauser CS, Bruin GJM, Paulus A, Ehrat M (1997) Интегрированный капиллярный электрофорез на гибких силиконовых микроустройствах: анализ рестрикционных фрагментов ДНК и обнаружение одиночных молекул ДНК на микрочипах.Аналитическая химия 69: 3451-3457
- 75. Emrich CA, Tian HJ, Medintz IL, Mathies RA (2002) Микроанализатор для электрофореза с капиллярной матрицей с 384 полосами для сверхвысокопроизводительного генетического анализа. Аналитическая химия 74: 5076-5083
- 76. Endo Y, Zhang L, Katashima R, Itakura M, Doherty EAS, Barron AE, Baba Y (2005) Влияние полимерной матрицы и глицерина на быстрый анализ однонитевого конформационного полиморфизма с помощью капиллярного и микрочипового электрофореза для обнаружения мутаций в K-ras ген.Электрофорез 26: 3380-3386
- 77. Ertl P, Emrich CA, Singhal P, Mathies RA (2004) Чипы для капиллярного электрофореза с электрохимической системой обнаружения с проточной оболочкой. Аналитическая химия 76: 3749-3755
- 78. Fabrizio EF, Nadim A, Sterling JD (2003) Разрешение множественных структур оцДНК при электрофорезе в свободном растворе. Аналитическая химия 75: 5012-5021
- 79. Fan ZH, Harrison DJ (1994) Микрообработка инжекторов и сепараторов для капиллярного электрофореза на стеклянной крошке и оценка потока на пересечении капилляров.Аналитическая химия 66: 177-184
- 80. Fang O, Xu GM, Fang ZL (2002) Высокопроизводительный интерфейс для непрерывного ввода образца для систем капиллярного электрофореза на основе микрофлюидных чипов. Аналитическая химия 74: 1223-1231
- 81. Fister JC, Jacobson SC, Davis LM, Ramsey JM (1998) Подсчет отдельных молекул хромофора для сверхчувствительного анализа и разделения на микрочипах. Аналитическая химия 70: 431-437
- 82. Fister JC, Jacobson SC, Ramsey JM (1999) Сверхчувствительный кросс-корреляционный электрофорез на микрочипах.Аналитическая химия 71: 4460-4464
- 83. Fluri K, Fitzpatrick G, Chiem N, Harrison DJ (1996) Интегрированные устройства для капиллярного электрофореза с эффективным постколоночным реактором в плоских кварцевых и стеклянных крошках. Аналитическая химия 68: 4285-4290
- 84. Foote RS, Khandurina J, Jacobson SC, Ramsey JM (2005) Концентрация белков на микрофлюидных устройствах с использованием мембран из пористого диоксида кремния. Аналитическая химия 77: 57-63
- 85. Footz T, Wunsam S, Kulak S, Crabtree HJ, Glerum DM, Backhouse CJ (2001) Очистка образцов на микрофлюидном устройстве.Электрофорез 22: 3868-3875
- 86. Footz T, Somerville MJ, Tomaszewski R, Sprysak KA, Backhouse CJ (2003) Генотипирование на основе гетеродуплекса с помощью электрофореза микрочипа и DHPLC. Генетическое тестирование 7: 283-293
- 87. Footz T, Somerville MJ, Tomaszewski R, Elyas B, Backhouse CJ (2004) Интеграция комбинированного анализа полиморфизма длины гетеродуплекса / рестрикционного фрагмента на микрочипе для электрофореза для обнаружения наследственного гемохроматоза. Аналитик 129: 25-31
- 88.Foquet M, Korlach J, Zipfel W, Webb WW, Craighead HG (2002) Определение размера фрагмента ДНК путем обнаружения отдельной молекулы в закрытых жидкостных каналах субмикронного размера. Аналитическая химия 74: 1415-1422
- 89. Ford SM, Kar B, McWhorter S, Davies J, Soper SA, Klopf M, Calderon G, Saile V (1998) Устройства для микрокапиллярного электрофореза, изготовленные с использованием полимерных подложек и рентгеновской литографии. Журнал разделения микроколонок 10: 413-422
- 90. Форрер К., Хаммер С., Хелк Б. (2004) Метод гель-электрофореза на основе чипа для количественного определения видов полуантител в IgG4 и их побочных продуктов и продуктов разложения.Аналитическая биохимия 334: 81-88
- 91. Гао QF, Shi YN, Liu SR (2001) Многоканальные микрочипы для высокопроизводительного анализа ДНК с помощью капиллярного электрофореза. Журнал аналитической химии Фрезениус 371: 137-145
- 92. Gao Y, Shen Z, Wang H, Dai ZP, Lin BC (2005) Хиральное разделение на многоканальных микрофлюидных чипах. Электрофорез 26: 4774-4779
- 93. Гэвин П.Ф., Юинг А.Г. (1996) Непрерывное разделение с помощью микровыборочного электрофореза-электрохимического детектирования.Журнал Американского химического общества 118: 8932-8936
- 94. Гаврон А.Дж., Мартин Р.С., Лунте С.М. (2001) Изготовление и оценка двухэлектродного детектора на основе углерода для чипов для электрофореза поли (диметилсилоксана). Электрофорез 22: 242-248
- 95. Giddings JC (1991) Единая наука о разделении. Уайли, Нью-Йорк,
- 96. Goedecke N, McKenna B, El-Difrawy S, Carey L, Matsudaira P, Ehrlich D (2004) Высокопроизводительная многоуровневая микропроцессорная система, разработанная для лаборатории судебной экспертизы ДНК.Электрофорез 25: 1678-1686
- 97. Gottschlich N, Culbertson CT, McKnight TE, Jacobson SC, Ramsey JM (2000) Интегрированное микрочип-устройство для переваривания, разделения и постколоночного мечения белков и пептидов. Журнал хроматографии B 745: 243-249
- 98. Gottschlich N, Jacobson SC, Culbertson CT, Ramsey JM (2001) Двумерная электрохроматография / капиллярный электрофорез на микрочипе. Аналитическая химия 73: 2669-2674
- 99. Гриффитс С.К., Нильсон Р.Х. (2000) Распространение полосы в двумерных микроканальных поворотах для электрокинетического транспорта частиц.Аналитическая химия 72: 5473-5482
- 100. Гриффитс С.К., Нильсон Р.Х. (2001) Повороты и переходы с низкой дисперсией для микроканальных систем. Аналитическая химия 73: 272-278
- 101. Haab BB, Mathies RA (1999) Одномолекулярное обнаружение разделения ДНК в микрочипах для капиллярного электрофореза с использованием сфокусированных молекулярных потоков. Аналитическая химия 71: 5137-5145
- 102. Hadd AG, Jacobson SC, Ramsey JM (1999) Микрожидкостные анализы ингибиторов ацетилхолинэстеразы.Аналитическая химия 71: 5206-5212
- 103. Хан Дж., Тернер С.В., Крейгхед Х.Г. (1999) Энтропийный захват и выход длинных молекул ДНК при сокращении субмикронного размера. Письма физического обзора 83: 1688-1691
- 104. Хан Дж., Крейгхед Х.Г. (2000) Разделение длинных молекул ДНК в микроизготовленном массиве энтропийных ловушек. Наука 288: 1026-1029
- 105. Han JY, Craighead HG (2002) Характеристика и оптимизация энтропийной ловушки для разделения ДНК. Аналитическая химия 74: 394-401
- 106.Handal MI, Ugaz VM (2006) Обнаружение и анализ мутаций ДНК с использованием миниатюрных микрофлюидных систем. Экспертный обзор молекулярной диагностики 6: 29-38
- 107. Harrison DJ, Manz A, Fan ZH, Ludi H, Widmer HM (1992) Капиллярный электрофорез и системы ввода пробы, интегрированные на плоском стеклянном чипе. Аналитическая химия 64: 1926-1932
- 108. Harrison DJ, Fluri K, Seiler K, Fan ZH, Effenhauser CS, Manz A (1993) Микромеханическая обработка миниатюрной системы химического анализа на основе капиллярного электрофореза на чипе.Наука 261: 895-897
- 109. Harrison DJ, Glavina PG, Manz A (1993) На пути к миниатюрным системам электрофореза и химического анализа на кремнии — альтернативе химическим сенсорам. Датчики и исполнительные механизмы B-Chemical 10: 107-116
- 110. Хатаока Ю., Чжан Л.Х., Мори Ю., Томита Н., Нотоми Т., Баба Ю. (2004) Анализ конкретного гена путем интеграции изотермической амплификации и электрофореза на микрочипах из полиметилметакрилата. Аналитическая химия 76: 3689-3693
- 111.Генри AC, Waddell EA, Shreiner R, Locascio LE (2002) Контроль электроосмотического потока в подвергнутых лазерной абляции и химически модифицированных микроканалах из поли (этилентерефталатгликоля) с горячим отпечатком. Электрофорез 23: 791-798
- 112. Генри С.С. (ред.) (2006) Капиллярный электрофорез микрочипов. Методы и протоколы. Humana Press, Totowa, NJ
- 113. Heo YS, Chung S, Cho K, Chung C, Han DC, Chang JK (2003) Влияние аномалий пиков на гидрофильные или гидрофобные свойства резервуаров во время последовательной закачки на микрочипе для капиллярного электрофореза.Журнал хроматографии A 1013: 111-122
- 114. Herr AE, Molho JI, Drouvalakis KA, Mikkelsen JC, Utz PJ, Santiago JG, Kenny TW (2003) Связь на кристалле изоэлектрической фокусировки и электрофореза в свободном растворе для многомерного разделения. Аналитическая химия 75: 1180-1187
- 115. Herr AE, Singh AK (2004) Фотополимеризованные сшитые полиакриламидные гели для определения размера белка на кристалле. Аналитическая химия 76: 4727-4733
- 116. Herr AE, Throckmorton DJ, Davenport AA, Singh AK (2005) Иммуноанализы на основе нативного гель-электрофореза на кристалле на антитела и токсин столбняка.Аналитическая химия 77: 585-590
- 117. Hjerten S (1985) Высокоэффективный электрофорез. Устранение электроэндосмоса и адсорбции растворенных веществ. Журнал хроматографии 347: 191-198
- 118. Hofgartner WT, Huhmer AFR, Landers JP, Kant JA (1999) Быстрая диагностика герпетического энцефалита с использованием микрочип-электрофореза продуктов ПЦР. Клиническая химия 45: 2120-2128
- 119. Hong JW, Fujii T., Seki M, Yamamoto T., Endo I (2001) Интеграция амплификации гена и капиллярного гель-электрофореза на гибридном микрочипе из полидиметилсилоксанового стекла.Электрофорез 22: 328-333
- 120. Хонг Дж. У., Хосокава К., Фуджи Т., Секи М., Эндо I (2001) Микрофабрикация полимерного чипа для капиллярного гелевого электрофореза. Прогресс биотехнологии 17: 958-962
- 121. Хуанг LR, Тегенфельдт JO, Kraeft JJ, Sturm JC, Austin RH, Cox EC (2002) ДНК-призма для высокоскоростного непрерывного фракционирования больших молекул ДНК. Природа Биотехнологии 20: 1048-1051
- 122. Huang TM, Pawliszyn J (2002) Микро-изготовление конического канала для изоэлектрической фокусировки с термически генерируемым градиентом pH.Электрофорез 23: 3504-3510
- 123. Huang XJ, Pu QS, Fang ZL (2001) Система капиллярного электрофореза с вводом пробы в потоке и детектированием хемилюминесценции на платформе чипа. Аналитик 126: 281-284
- 124. Huang XY, Ren JC (2005) Обнаружение хемилюминесценции в режиме онлайн для изоэлектрического фокусирования гемовых белков на микрочипах. Электрофорез 26: 3595-3601
- 125. Huang Z, Munro N, Huhmer AFR, Landers JP (1999) Сканирование лазерного луча на основе акустооптического отклонения для обнаружения флуоресценции на многоканальных электрофоретических микрочипах.Аналитическая химия 71: 5309-5314
- 126. Хатт Л.Д., Главин Д.П., Бада Дж.Л., Матис Р.А. (1999) Микроанализатор аминокислотной хиральности капиллярного электрофореза для внеземных исследований. Аналитическая химия 71: 4000-4006
- 127. Инатоми К., Идзуо С., Ли С.С., Охжи Х., Шионо С. (2003) Электрофорез ДНК в микростолбиках, изготовленных из полидиметилсилоксана. Микроэлектронная инженерия 70: 13-18
- 128. Jabasini M, Zhang LH, Dang FQ, Xu F, Almofli MR, Ewis AA, Lee JW, Nakahori Y, Baba Y (2002) Анализ полиморфизмов ДНК на Y-хромосоме человека с помощью электрофореза микрочипа.Электрофорез 23: 1537-1542
- 129. Jabasini M, Ewis AA, Xu F, Mohamadi MR, Ping GC, Shinka T, Nakahori Y, Baba Y (2005) Мультиплексная ПЦР с многоканальным электрофорезом на микрочипах: сверхбыстрый анализ генетических заболеваний. Журнал хроматографии 43: 221-225
- 130. Jacobson SC, Hergenroder R, Koutny LB, Ramsey JM (1994) Высокоскоростное разделение на микрочипе. Аналитическая химия 66: 1114-1118
- 131. Jacobson SC, Hergenroder R, Koutny LB, Warmack RJ, Ramsey JM (1994) Влияние схем впрыска и геометрии колонки на производительность устройств для электрофореза микрочипов.Аналитическая химия 66: 1107-1113
- 132. Jacobson SC, Hergenroder R, Moore AW, Ramsey JM (1994) Предколоночные реакции с электрофоретическим анализом, интегрированным на микрочип. Аналитическая химия 66: 4127-4132
- 133. Jacobson SC, Koutny LB, Hergenroder R, Moore AW, Ramsey JM (1994) Капиллярный электрофорез на микрочипах со встроенным постколоночным реактором. Аналитическая химия 66: 3472-3476
- 134. Jacobson SC, Moore AW, Ramsey JM (1995) Подложки из плавленого кварца для электрофореза микрочипов.Аналитическая химия 67: 2059-2063
- 135. Jacobson SC, Ramsey JM (1995) Электрофорез на микрочипах с укладкой образцов. Электрофорез 16: 481-486
- 136. Jacobson SC, Ramsey JM (1996) Интегрированное микроустройство для анализа рестрикционных фрагментов ДНК. Аналитическая химия 68: 720-723
- 137. Jacobson SC, Culbertson CT, Daler JE, Ramsey JM (1998) Микрочиповые структуры для субмиллисекундного электрофореза. Аналитическая химия 70: 3476-3480
- 138. Jin LJ, Giordano BC, Landers JP (2001) Динамическое мечение во время капиллярного или микрочип-электрофореза для лазерно-индуцированного флуоресцентного обнаружения комплексов белок-sds без мечения до или после колонки.Аналитическая химия 73: 4994-4999
- 139. Johnson TJ, Ross D, Gaitan M, Locascio LE (2001) Лазерная модификация предварительно сформованных полимерных микроканалов: применение для уменьшения уширения полосы вокруг витков, подверженных электрокинетическому потоку. Аналитическая химия 73: 3656-3661
- 140. Юнг Б., Бхарадвадж Р., Сантьяго Дж. Г. (2003) Тысячкратное увеличение сигнала с использованием суммирования проб с усилением поля для электрофореза на кристалле. Электрофорез 24: 3476-3483
- 141. Кадзи Н., Тезука Ю., Такамура Ю., Уэда М., Нишимото Т., Наканиши Н., Хориике Ю., Баба Ю. (2004) Разделение длинных молекул ДНК кварцевыми наностолбиками под действием электрического поля постоянного тока.Аналитическая химия 76: 15-22
- 142. Камей Т., Пэгель Б.М., Шерер Дж. Р., Скелли А.М., Стрит Р.А., Мэтис Р.А. (2003) Интегрированный гидрогенизированный фотодиодный детектор на аморфном кремнии для микрофлюидных биоаналитических устройств. Аналитическая химия 75: 5300-5305
- 143. Камей Т., Пэгель Б.М., Шерер Дж. Р., Скелли А. М., Стрит Р. А., Мэтис Р. А. (2004) Слияние сенсорной технологии a-Si: H с микрожидкостными биоаналитическими устройствами. Журнал некристаллических твердых тел 338-40: 715-719
- 144. Камей Т., Ториелло Н.М., Лагалли Е.Т., Блейзей Р.Г., Шерер Дж.Р., Стрит Р.А., Мэтис Р.А. (2005) Микрожидкостной генетический анализ со встроенным детектором a-Si: H.Биомедицинские микроустройства 7: 147-152
- 145. Камеока Дж., Крейгхед Х.Г., Чжан Х.В., Хенион Дж. (2001) Полимерный микрофлюидный чип для КЭ / МС определения малых молекул. Аналитическая химия 73: 1935-1941
- 146. Кан CW, Fredlake CP, Doherty EAS, Barron AE (2004) Секвенирование ДНК и генотипирование в миниатюрных системах электрофореза. Электрофорез 25: 3564-3588
- 147. Карлинси Дж. М., Монахан Дж., Марчиарулло Д. Д., Ферранс Дж. П., Ландерс Дж. П. (2005) Ввод давления на микроприбор с клапанами для электрофоретического анализа субмикролитровых образцов.Аналитическая химия 77: 3637-3643
- 148. Kataoka M, Inoue S, Kajimoto K, Sinohara Y, Baba Y (2004) Полезность электрофореза на микрочипах для надежного анализа нестандартных образцов ДНК и последующего ферментативного расщепления на чипе. Европейский журнал биохимии 271: 2241-2247
- 149. Келли Р.Т., Вулли А.Т. (2003) Термическое связывание полимерных микроустройств для капиллярного электрофореза в воде. Аналитическая химия 75: 1941-1945
- 150. Keynton RS, Roussel TJ, Crain MM, Jackson DJ, Franco DB, Naber JF, Walsh KM, Baldwin RP (2004) Дизайн и разработка микроизготовленных устройств для капиллярного электрофореза с электрохимическим обнаружением.Analytica Chimica Acta 507: 95-105
- 151. Khandurina J, Jacobson SC, Waters LC, Foote RS, Ramsey JM (1999) Микрофабрикация пористой мембранной структуры для концентрирования образцов и электрофоретического анализа. Аналитическая химия 71: 1815-1819
- 152. Khandurina J, McKnight TE, Jacobson SC, Waters LC, Foote RS, Ramsey JM (2000) Интегрированная система для быстрого анализа ДНК на основе ПЦР в микрофлюидных устройствах. Аналитическая химия 72: 2995-3000
- 153. Хандурина Дж., Гуттман А. (2003) Микромасштабное разделение и анализ.Текущее мнение в области химической биологии 7: 595-602
- 154. Ким Д.К., Канг С.Х. (2005) Укладка оснований в канале в капиллярном гель-электрофорезе микрочипов для высокочувствительного анализа фрагментов ДНК. Журнал хроматографии A 1064: 121-127
- 155. Kim JH, Kang CJ, Jeon D, Kim YS (2005) Одноразовый микрочип для капиллярного электрофореза с развязывающим устройством из оксида индия и олова / амперометрическим детектором. Микроэлектроника 78-79: 563-570
- 156. Ким С.М., Бернс М.А., Хассельбринк Е.Ф. (2006) Электрокинетическое концентрирование белка с использованием простого микрожидкостного чипа стекло / поли (диметилсилоксан).Аналитическая химия 78: 4779-4785
- 157. Koutny L, Schmalzing D, Salas-Solano O, El-Difrawy S, Adourian A, Buonocore S, Abbey K, McEwan P, Matsudaira P, Ehrlich D (2000) Секвенирование восьмисот оснований в микроизготовленном электрофоретическом устройстве. Аналитическая химия 72: 3388-3391
- 158. Kricka LJ, Wilding P (2003) Microchip PCR. Аналитическая и биоаналитическая химия 377: 820-825
- 159. Kurnik RT, Boone TD, Nguyen U, Ricco AJ, Williams SJ (2003) Использование плавающих электродов в переходном изотахофорезе для повышения чувствительности обнаружения.Лаборатория на чипе 3: 86-92
- 160. Kutter JP, Jacobson SC, Ramsey JM (1997) Интегрированное микрочиповое устройство с электрокинетически контролируемым смешиванием растворителей для изократического и градиентного элюирования в мицеллярной электрокинетической хроматографии. Аналитическая химия 69: 5165-5171
- 161. Kutter JP, Ramsey RS, Jacobson SC, Ramsey JM (1998) Определение катионов металлов в электрофорезе микрочипа с использованием комплексообразования на кристалле и укладки образцов. Журнал разделения микроколонок 10: 313-319
- 162.Lacher NA, de Rooij NF, Verpoorte E, Lunte SM (2003) Сравнение рабочих характеристик устройств для электрофореза на микрочипах из поли (диметилсилоксана) и Pyrex для разделения пептидов. Журнал хроматографии A 1004: 225-235
- 163. Lagally ET, Simpson PC, Mathies RA (2000) Монолитная интегрированная микрофлюидная система для амплификации ДНК и анализа капиллярного электрофореза. Датчики и исполнительные механизмы B-Chemical 63: 138-146
- 164. Lagally ET, Emrich CA, Mathies RA (2001) Полностью интегрированная микросистема ПЦР-капиллярного электрофореза для анализа ДНК.Лаборатория на чипе 1: 102-107
- 165. Lagally ET, Medintz I, Mathies RA (2001) Амплификация и анализ одномолекулярной ДНК в интегрированном микрофлюидном устройстве. Аналитическая химия 73: 565-570
- 166. Lagally ET, Scherer JR, Blazej RG, Toriello NM, Diep BA, Ramchandani M, Sensabaugh GF, Riley LW, Mathies RA (2004) Интегрированная портативная микросистема генетического анализа для обнаружения патогенов / инфекционных заболеваний. Аналитическая химия 76: 3162-3170
- 167. Lapos JA, Ewing AG (2000) Инъекция флуоресцентно меченых аналитов в микрочипы с использованием электрофореза с оптическим стробированием.Аналитическая химия 72: 4598-4602
- 168. Lapos JA, Manica DP, Ewing AG (2002) Двойная флуоресценция и электрохимическое обнаружение на микрочипе для электрофореза. Аналитическая химия 74: 3348-3353
- 169. Lee GB, Fu LM, Lin CH, Lee CY, Yang RJ (2004) Контроль дисперсии в микрожидкостных чипах посредством локализованного изменения дзета-потенциала с использованием эффекта поля. Электрофорез 25: 1879-1887
- 170. Ли Нью-Йорк, Ямада М., Секи М. (2004) Ввод образца под давлением с количественным дозированием жидкости для электрофореза на кристалле.Аналитические науки 20: 483-487
- 171. Li BQ, Fang XH, Luo HB, Petersen E, Seo YS, Samuilov V, Rafailovich M, Sokolov J, Gersappe D, Chu B (2006) Влияние напряженности электрического поля, ионной силы и расстояния миграции на подвижность и диффузия в поверхностном электрофорезе ДНК. Электрофорез 27: 1312-1321
- 172. Li BQ, Fang XH, Luo HB, Seo YS, Petersen E, Ji Y, Rafailovich M, Sokolov J, Gersappe D, Chu B (2006) Разделение ДНК с различными конфигурациями на плоских и наноразмерных поверхностях.Аналитическая химия 78: 4743-4751
- 173. Li JJ, Kelly JF, Chemushevich I, Harrison DJ, Thibault P (2000) Разделение и идентификация пептидов из выделенных из геля мембранных белков с использованием микропроцессорного устройства для комбинированной масс-спектрометрии капиллярного электрофореза / наноэлектрораспыления. Аналитическая химия 72: 599-609
- 174. Li JJ, Tremblay TL, Wang C, Attiya S, Harrison DJ, Thibault P (2001) Интегрированная система для высокопроизводительной идентификации белков с использованием микропроцессорного устройства, связанного с капиллярным электрофорезом / масс-спектрометрией наноэлектроспрея.Протеомика 1: 975-986
- 175. Li SFY, Kricka LJ (2006) Клинический анализ с помощью капиллярного электрофореза микрочипа. Клиническая химия 52: 37-45
- 176. Liang ZH, Chiem N, Ocvirk G, Tang T, Fluri K, Harrison DJ (1996) Микроизготовление плоской ячейки поглощения и флуоресценции для интегрированных устройств капиллярного электрофореза. Аналитическая химия 68: 1040-1046
- 177. Lin RS, Burke DT, Burns MA (2003) Селективная экстракция фракционированных по размеру образцов ДНК в микроизготовленных устройствах для электрофореза.Журнал хроматографии A 1010: 255-268
- 178. Lin RS, Burke DT, Burns MA (2005) Адресные электрические поля для фракционированного по размеру экстракции образцов в микрофлюидных устройствах. Аналитическая химия 77: 4338-4347
- 179. Lin YC, Ho HC, Tseng CK, Hou SQ (2001) Микрочип для электрофореза полиметилметакрилата с предварительным концентратором образцов. Журнал микромеханики и микротехники 11: 189-194
- 180. Lin YW, Huang MF, Chang HT (2005) Наноматериалы и наноструктуры на основе чипов для капиллярного электрофоретического разделения ДНК.Электрофорез 26: 320-330
- 181. Лю Б.Ф., Хисамото Х., Терабе С. (2003) Субсекундное разделение клеточных флавиновых коферментов с помощью капиллярного электрофореза микрочипа с детектированием индуцированной лазером флуоресценции. Журнал хроматографии A 1021: 201-207
- 182. Лю Дж, Ценг К., Гарсия Б., Лебрилла С.Б., Мукерджи Э., Коллинз С., Смит Р. (2001) Разделение электрофорезом в открытых микроканалах. Метод сочетания электрофореза с MALDI-MS. Аналитическая химия 73: 2147-2151
- 183.Лю С.Р., Ши Ю.Н., Джа В.В., Мэтис Р.А. (1999) Оптимизация высокоскоростного секвенирования ДНК на микрофабричных каналах капиллярного электрофореза. Аналитическая химия 71: 566-573
- 184. Лю С.Р., Рен Х.Дж., Гао QF, Роуч Д.Д., Лодер Р.Т., Армстронг TM, Мао QL, Блага И., Баркер Д.Л., Йованович С.Б. (2000) Автоматическое параллельное секвенирование ДНК на многоканальных микрочипах. Слушания Национальной академии наук Соединенных Штатов Америки 97: 5369-5374
- 185. Лю Ю.Дж., Фут Р.С., Калбертсон СТ, Якобсон С.К., Рамси Р.С., Рамси Дж.М. (2000) Электрофоретическое разделение белков на микрочипах.Журнал разделения микроколонок 12: 407-411
- 186. Лю YJ, Foote RS, Jacobson SC, Ramsey RS, Ramsey JM (2000) Электрофоретическое разделение белков на микрочипе с нековалентной постколоночной маркировкой. Аналитическая химия 72: 4608-4613
- 187. Llopis SD, Stryjewski W, Soper SA (2004) Определение времени жизни флуоресценции с временным разрешением в ближнем инфракрасном диапазоне в устройствах для электрофореза на микрочипах из полиметилметакрилата. Электрофорез 25: 3810-3819
- 188. Лаки Дж., Норрис Т., Смит Л. (1993) Анализ разрешения при секвенировании ДНК с помощью капиллярного гель-электрофореза.Журнал физической химии 97: 3067-3075
- 189. Luo HB, Gersappe D (2002) Моделирование динамики электрофореза ДНК на плоской поверхности. Электрофорез 23: 2690-2696
- 190. Ma RB, Crabtree HJ, Backhouse CJ (2005) Метод омоложения стеклянных микрофлюидных чипов с покрытием из поли (N, N-диметилакриламида). Электрофорез 26: 2692-2700
- 191. MacDonald MP, Spalding GC, Dholakia K (2003) Микрожидкостная сортировка в оптической решетке. Природа 426: 421-424
- 192.Manage DP, Zheng Y, Somerville MJ, Backhouse CJ (2005) On-chip HA / SSCP для обнаружения наследственного гемохроматоза. Микрофлюидика и нанофлюидика 1: 364-372
- 193. Manica DP, Mitsumori Y, Ewing AG (2003) Характеристика загрязнения электрода и регенерации поверхности для платинового электрода на микрочипе для электрофореза. Аналитическая химия 75: 4572-4577
- 194. Манц А., Харрисон Д. Д., Верпоорте Э. М. Дж., Феттингер Дж. К., Паулюс А., Луди Х., Видмер Н. М. (1992) Технология планарных чипов для миниатюризации и интеграции методов разделения в системы мониторинга — капиллярный электрофорез на кристалле.Журнал хроматографии 593: 253-258
- 195. Manz A, Verpoorte E, Effenhauser CS, Burggraf N, Raymond DE, Harrison DJ, Widmer HM (1993) Миниатюризация методов разделения с использованием технологии планарных чипов. HRC-Journal of High Resolution Chromatography 16: 433-436
- 196. Манц А., Эффенхаузер К. С., Бургграф Н., Харрисон Д. Д., Зайлер К., Флури К. (1994) Электроосмотическая накачка и электрофоретическое разделение для миниатюрных систем химического анализа. Журнал микромеханики и микротехники 4: 257-265
- 197.Mao QL, Pawliszyn J (1999) Демонстрация изоэлектрической фокусировки на протравленном кварцевом чипе с обнаружением УФ-абсорбционной визуализации. Аналитик 124: 637-641
- 198. Мартин Р.С., Гаврон А.Дж., Фогарти Б.А., Реган Ф.Б., Демпси Е., Люнте С.М. (2001) Электрохимические детекторы на основе углеродной пасты для капиллярного электрофореза микрочипов / электрохимии. Аналитик 126: 277-280
- 199. Martin RS, Ratzlaff KL, Huynh BH, Lunte SM (2002) Внутриканальное электрохимическое обнаружение для капиллярного электрофореза микрочипа с использованием электрически изолированного потенциостата.Аналитическая химия 74: 1136-1143
- 200. Мастранджело Ч., Бернс М.А., Берк Д.Т. (1998) Микрофабрикаты для генетической диагностики. Протоколы IEEE 86: 1769-1787
- 201. McClain MA, Culbertson CT, Jacobson SC, Allbritton NL, Sims CE, Ramsey JM (2003) Микрожидкостные устройства для высокопроизводительного химического анализа клеток. Аналитическая химия 75: 5646-5655
- 202. Маккормик Р.М., Нельсон Р.Дж., АлонсоАмиго М.Г., Бенвегну Дж., Хупер Х.Х. (1997) Микроканальное электрофоретическое разделение ДНК в пластиковых подложках, полученных литьем под давлением.Аналитическая химия 69: 2626-2630
- 203. Medintz I, Wong WW, Sensabaugh G, Mathies RA (2000) Высокоскоростное типирование однонуклеотидного полиморфизма наследственной мутации гемохроматоза с помощью микропланшетов для электрофореза капиллярной матрицы. Электрофорез 21: 2352-2358
- 204. Medintz I, Wong WW, Berti L, Shiow L, Tom J, Scherer J, Sensabaugh G, Mathies RA (2001) Высокоэффективный мультиплексный анализ SNP трех мутаций, связанных с гемохроматозом, с помощью микропланшетов для электрофореза капиллярной матрицы.Геномные исследования 11: 413-421
- 205. Мединц И.Л., Берти Л., Эмрих С.А., Том Дж., Шерер Дж. Р., Мэтис Р.А. (2001) Генотипирование меченных кассетой переноса энергии коротких тандемных повторов ампликонов с микроканальными пластинами для электрофореза капиллярной матрицы. Клиническая химия 47: 1614-1621
- 206. Мединц И.Л., Пегель Б.М., Блейзей Р.Г., Эмрих К.А., Берти Л., Шерер Дж. Р., Матис Р.А. (2001) Высокопроизводительный генетический анализ с использованием микропланшетов для электрофореза с микропланшетами с капиллярной решеткой. Электрофорез 22: 3845-3856
- 207.Мединц И.Л., Пегель Б.М., Матиес Р.А. (2001) Микрофабричные системы анализа ДНК для электрофореза капиллярной матрицы. Журнал хроматографии A 924: 265-270
- 208. Минк Н., Футтерер С., Дорфман К., Банко А., Госсе С., Губо С., Виови Дж. Л. (2004) Количественное микрофлюидное разделение ДНК в самоорганизующихся магнитных матрицах. Аналитическая химия 76: 3770-3776
- 209. Минц Н., Боков П., Зельдович К. Б., Футтерер С., Виовы Дж. Л., Дорфман К. Д. (2005) Движение одиночных длинных молекул ДНК через массивы магнитных колонок.Электрофорез 26: 362-375
- 210. Minc N, Viovy JL, Dorfman KD (2005) Немарковский транспорт ДНК в микрожидкостных постаментах. Письма о физических проверках 94: 198105
- 211. Mitnik L, Carey L, Burger R, Desmarais S, Koutny L, Wernet O, Matsudaira P, Ehrlich D (2002) Высокоскоростной анализ мультиплексированных коротких тандемных повторов с помощью электрофоретического микроустройства. Электрофорез 23: 719-726
- 212. Mohamadi MR, Kataoka M, Mahmoudian L, Jabasini M, Shinohara Y, Baba Y (2005) Анализ источников ошибок в оценке очищенных фрагментов ДНК и неочищенных продуктов ПЦР с помощью электрофореза на микрочипах ДНК.Хроматография 61: 339-344
- 213. Монахан Дж., Фоссер К.А., Гевирт А.А., Нуццо Р.Г. (2002) Конструкция расщепленного микроканала и аналитическая модель для компенсации электроосмотической нестабильности при микросепарации. Лаборатория на чипе 2: 81-87
- 214. Монахан Дж., Гевирт А.А., Нуццо Р.Г. (2002) Непрямое флуоресцентное обнаружение простых сахаров с помощью электрофореза при высоком pH в микрожидкостных чипах из поли (диметилсилоксана). Электрофорез 23: 2347-2354
- 215. Мур А.В., Якобсон С.К., Рэмси Дж. М. (1995) Разделение нейтральных частиц на микрочипах с помощью мицеллярной электрокинетической капиллярной хроматографии.Аналитическая химия 67: 4184-4189
- 216. Mueller O, Hahnenberger K, Dittmann M, Yee H, Dubrow R, Nagle R, Ilsley D (2000) Микрожидкостная система для высокоскоростного воспроизводимого определения размера и количественного определения ДНК. Электрофорез 21: 128-134
- 217. Munro NJ, Snow K, Kant EA, Landers JP (1999) Молекулярная диагностика на микроизготовленных электрофоретических устройствах: от пластинчатого геля до капиллярных и микрочиповых анализов лимфопролиферативных расстройств Т- и В-клеток. Клиническая химия 45: 1906-1917
- 218.Munro NJ, Huang ZL, Finegold DN, Landers JP (2000) Непрямое флуоресцентное обнаружение аминокислот на электрофоретических микрочипах. Аналитическая химия 72: 2765-2773
- 219. Musyimi HK, Guy J, Narcisse DA, Soper SA, Murray KK (2005) Прямое соединение электрофореза микрочипов на полимерной основе с онлайн-MALDI-MS с использованием входного вращающегося шарика. Электрофорез 26: 4703-4710
- 220. Nagata H, Tabuchi M, Hirano K, Baba Y (2005) Высокоскоростное разделение белков с помощью электрофореза на микрочипе с использованием покрытого полиэтиленгликолем пластикового чипа с раствором линейного полиакриламида с додецилсульфатом натрия.Электрофорез 26: 2687-2691
- 221. Nagata H, Tabuchi M, Hirano K, Baba Y (2005) Электрофоретическое разделение белков на микрочипах с использованием электроосмотического потока, индуцированного динамическим покрытием додецилсульфатом натрия непокрытых пластиковых чипов. Электрофорез 26: 2247-2253
- 222. Намасиваям В., Лин Р.С., Джонсон Б., Брахмасандра С., Раззаки З., Берк Д.Т., Бернс М.А. (2004) Достижения в области фотодетекции на кристалле для приложений в миниатюрных системах генетического анализа. Журнал микромеханики и микротехники 14: 81-90
- 223.Ocvirk G, Tang T, Harrison DJ (1998) Оптимизация конфокальной эпифлуоресцентной микроскопии для миниатюрных систем общего анализа на основе микрочипов. Аналитик 123: 1429-1434
- 224. Ocvirk G, Munroe M, Tang T, Oleschuk R, Westra K, Harrison DJ (2000) Электрокинетический контроль потока жидкости в устройствах для капиллярного электрофореза нативного поли (диметилсилоксана). Электрофорез 21: 107-115
- 225. Охжи Х., Идзуо С., Френч П.Дж., Цуцуми К. (2002) Столбовые конструкции с субмикронным пространством, изготовленные с помощью микрообработки на основе макропористых частиц.Датчики и исполнительные механизмы A-Physical 97-8: 744-748
- 226. Пэгель Б.М., Хатт Л.Д., Симпсон П.К., Мэтис Р.А. (2000) Геометрия поворота для минимизации уширения полосы в каналах для микроизготовленного капиллярного электрофореза. Аналитическая химия 72: 3030-3037
- 227. Paegel BM, Emrich CA, Weyemayer GJ, Scherer JR, Mathies RA (2002) Высокопроизводительное секвенирование ДНК с помощью микропроцессора для электрофореза с 96-полосным капиллярным массивом. Слушания Национальной академии наук Соединенных Штатов Америки 99: 574-579
- 228.Paegel BM, Yeung SHI, Mathies RA (2002) Микрочиповый биопроцессор для интегрированной очистки нанообъемных образцов и секвенирования ДНК. Аналитическая химия 74: 5092-5098
- 229. Пал Р., Ян М., Лин Р., Джонсон Б. Н., Шривастава Н., Раззацки С. З., Хомистек К. Дж., Хелдсингер Д. К., Хак Р. М., Угаз В. М., Твар ПК, Чен З., Альфано К., Йим М. Б., Кришнан М., Фуллер А. О. , Larson RG, Burke DT, Burns MA (2005) Интегрированное микрофлюидное устройство для гриппа и других генетических анализов. Лаборатория на чипе 5: 1024-1032
- 230.Палмер Дж., Берги Д.С., Манро Н.Дж., Ландерс Дж. П. (2001) Электрокинетическая инъекция для укладки нейтральных аналитов в капиллярном и микрочиповом электрофорезе. Аналитическая химия 73: 725-731
- 231. Pan T, Kelly RT, Asplund MC, Woolley AT (2004) Изготовление микроустройств для капиллярного электрофореза с фторидом кальция для встроенного инфракрасного обнаружения. Журнал хроматографии A 1027: 231-235
- 232. Patel PD, Shaqfeh ESG (2003) Вычислительное исследование разделения ДНК в редких неупорядоченных и периодических массивах столбиков.Журнал химической физики 118: 2941-2951
- 233. Пернодет Н., Самуилов В., Шин К., Соколов Дж., Рафаилович М.Х., Герсаппе Д., Чу Б. (2000) Электрофорез ДНК на плоской поверхности. Письма о физических проверках 85: 5651-5654
- 234. Ping GC, Zhu BM, Jabasini M, Xu F, Oka H, Sugihara H, Baba Y (2005) Анализ липопротеинов с помощью электрофореза на микрочипе с высокой скоростью и высокой воспроизводимостью. Аналитическая химия 77: 7282-7287
- 235. Qi SZ, Liu XZ, Ford S, Barrows J, Thomas G, Kelly K, McCandless A, Lian K, Goettert J, Soper SA (2002) Микрожидкостные устройства, изготовленные из полиметилметакрилата с использованием горячего тиснения со встроенным капилляр для отбора проб и волоконная оптика для обнаружения флуоресценции.Лаборатория на чипе 2: 88-95
- 236. Ramsey JD, Jacobson SC, Culbertson CT, Ramsey JM (2003) Высокоэффективное двухмерное разделение перевариваемых белков на микрофлюидных устройствах. Аналитическая химия 75: 3758-3764
- 237. Richter T, Shultz-Lockyear LL, Oleschuk RD, Bilitewski U, Harrison DJ (2002) Биферментный и капиллярный электрофоретический анализ нефлуоресцентных соединений в микрофлюидных устройствах — определение ксантина. Датчики и исполнительные механизмы B-Chemical 81: 369-376
- 238.Rocklin RD, Ramsey RS, Ramsey JM (2000) Микрофабричное жидкостное устройство для выполнения двухмерного жидкофазного разделения. Аналитическая химия 72: 5244-5249
- 239. Roddy ES, Lapos JA, Ewing AG (2003) Быстрый серийный анализ множественных образцов олигонуклеотидов на микрочипе с использованием оптически закрытой инъекции. Журнал хроматографии A 1004: 217-224
- 240. Родди Е.С., Прайс М., Юинг А.Г. (2003) Непрерывный мониторинг расщепления ДНК рестрикционными ферментами на микрочипе с автоматическим вводом капиллярных проб.Аналитическая химия 75: 3704-3711
- 241. Roddy ES, Xu HW, Ewing AG (2004) Методы ввода проб для микроизготовленных разделительных устройств. Электрофорез 25: 229-242
- 242. Rodriguez I, Lee HK, Li SFY (1999) Микроканальное электрофоретическое разделение биогенных аминов с помощью мицеллярной электрокинетической хроматографии. Электрофорез 20: 118-126
- 243. Родригес И., Джин Л.Дж., Ли СФИ (2000) Высокоскоростное хиральное разделение на устройствах для электрофореза микрочипов. Электрофорез 21: 211-219
- 244.Ronai Z, Barta C, Sasvari-Szekely M, Guttman A (2001) Анализ ДНК на электрофоретических микрочипах: влияние операционных переменных. Электрофорез 22: 294-299
- 245. Ропер М.Г., Исли С.Дж., Ландерс Дж.П. (2005) Достижения в области полимеразной цепной реакции на микрофлюидных чипах. Аналитическая химия 77: 3887-3894
- 246. Росс Д., Айвори К.Ф., Локацио Л.Е., Ван Котт К.Е. (2004) Пиковое сжатие и разрешение для электрофоретического разделения в расходящихся микроканалах. Электрофорез 25: 3694-3704
- 247.Sakaue T (2006) Электрофорез ДНК в сконструированных каналах. Европейский физический журнал E 19: 477-487
- 248. Salas-Solano O, Schmalzing D, Koutny L, Buonocore S, Adourian A, Matsudaira P, Ehrlich D (2000) Оптимизация высокопроизводительного секвенирования ДНК на коротких микроэлектрофоретических устройствах. Аналитическая химия 72: 3129-3137
- 249. Sanders JC, Huang ZL, Landers JP (2001) Сканирование всего канала на основе акустооптического отклонения для изоэлектрической фокусировки микрочипа с обнаружением индуцированной лазером флуоресценции.Лаборатория на чипе 1: 167-172
- 250. Sanders JC, Breadmore MC, Mitchell PS, Landers JP (2002) Простой электрожидкостной интерфейс на основе PDMS для электрофоретического разделения микрочипов. Аналитик 127: 1558-1563
- 251. Sanders JC, Breadmore MC, Kwok YC, Horsman KM, Landers JP (2003) Гидроксипропилцеллюлоза как просеивающая матрица адсорбционного покрытия для разделения ДНК: Оптимизация искусственной нейронной сети для анализа микрочипов. Аналитическая химия 75: 986-994
- 252. Sassi AP, Paulus A, Cruzado ID, Bjornson T, Hooper HH (2000) Быстрое параллельное разделение аллелей D1S80 в пластиковом микроканальном чипе.Журнал хроматографии A 894: 203-217
- 253. Шмальцинг Д., Коутни Л., Адориан А., Белградер П., Мацудаира П., Эрлих Д. (1997) Типирование ДНК за тридцать секунд с помощью микропроцессорного устройства. Слушания Национальной академии наук Соединенных Штатов Америки 94: 10273-10278
- 254. Schmalzing D, Adourian A, Koutny L, Ziaugra L, Matsudaira P, Ehrlich D (1998) Секвенирование ДНК на микроизготовленных электрофоретических устройствах. Аналитическая химия 70: 2303-2310
- 255.Schmalzing D, Koutny L, Chisholm D, Adourian A, Matsudaira P, Ehrlich D (1999) Двухцветный мультиплексный анализ восьми локусов с короткими тандемными повторами с помощью электрофоретического микроустройства. Аналитическая биохимия 270: 148-152
- 256. Schmalzing D, Tsao N, Koutny L, Chisholm D, Srivastava A, Adourian A, Linton L, McEwan P, Matsudaira P, Ehrlich D (1999) К реальному секвенированию с помощью электрофореза на микроустройствах. Геномные исследования 9: 853-858
- 257. Seiler K, Harrison DJ, Manz A (1993) Планарные стеклянные чипы для капиллярного электрофореза — повторяющееся введение образца, количественный анализ и эффективность разделения
определение электрофореза в The Free Dictionary
e · lec · tro · pho · re · sis
(ĭ-lĕk′trō-fə-rē′sĭs) n.
1. Миграция заряженных коллоидных частиц или молекул через неподвижную среду под действием приложенного электрического поля, обычно создаваемого погруженными электродами. Также называется катафорез .
2. Метод разделения веществ, особенно белков, и анализа молекулярной структуры, основанный на скорости движения каждого компонента в коллоидной суспензии под действием электрического поля.
e · lec′tro · pho · ret′ic (-rĕt′ĭk) прил.
Словарь английского языка American Heritage®, пятое издание. Авторские права © 2016 Издательская компания Houghton Mifflin Harcourt. Опубликовано Houghton Mifflin Harcourt Publishing Company. Все права защищены.
электрофорез
(ɪˌlɛktrəʊfəˈriːsɪs) n
(химия) движение заряженных частиц в коллоиде под действием приложенного электрического поля. Также называется: катафорез
электрофоретический adj
Словарь английского языка Коллинза — полный и полный, 12-е издание, 2014 г. © HarperCollins Publishers 1991, 1994, 1998, 2000, 2003, 2006, 2007, 2009, 2011, 2014
e • lec • tro • pho • re • sis
(ɪˌlɛk troʊ fəˈri sɪs)
n.
движение коллоидных частиц, взвешенных в текучей среде, вызванное влиянием электрического поля на среду.
e • lec`tro • pho • ret′ic (-rɛt ɪk) прил.
Рэндом Хаус Словарь колледжа Кернермана Вебстера © 2010 K Dictionaries Ltd. Авторские права 2005, 1997, 1991, Random House, Inc. Все права защищены.
э · лек · тро · форез
(ĭ-lĕk′trō-fə-rē′sĭs)
Миграция электрически заряженных частиц через жидкость, находящуюся под действием электрического поля.Электрофорез используется специально для разделения коллоидов с целью изучения их компонентов.
Научный словарь для студентов American Heritage®, второе издание. Авторские права © 2014 издательской компании Houghton Mifflin Harcourt. Опубликовано Houghton Mifflin Harcourt Publishing Company. Все права защищены.
электрофорез
Движение заряженных частиц, коллоидных частиц или ионов через жидкость под действием электрического поля.
Словарь незнакомых слов по Diagram Group © 2008, Diagram Visual Information Limited
Гемоглобин — Часть 2 — Электрофорез гемоглобина, (электрофорез Hb) — Labpedia.net
28 октября, 2020HematologyLab Tests
Образец
- Гемолизат получают из крови в ЭДТА, цитрате или гепарине.
- Используйте свежий или охлажденный образец.
- Методы приготовления гемолизатов:
- Метод 1: Возьмите свернувшуюся кровь или эритроциты с равным объемом воды.
- Оставить на ночь в морозильной камере (или заморозить на ночь).
- Супернатант будет готов.
- Метод 2: 1 грамм этилендиаминтетрауксусной кислоты.
- 0,1 грамм сапонина.
- Растворить в 500 мл D.water.
- Возьмите промытые физиологическим раствором эритроциты.
- Смешайте равный объем реагента и промытые эритроциты в течение 5 минут.
- Гемолизат будет готов.
- Метод 1: Возьмите свернувшуюся кровь или эритроциты с равным объемом воды.
Принцип
- Первый гемолизат из крови с ЭДТА получают, а затем его проводят для электрофореза, где Hb разделяется на разные полосы.
- Мы можем обнаружить наличие аномального гемоглобина.
- Электрофорез в ацетате целлюлозы или крахмальном геле проводят с гемолизатом при pH 8,6.
- Затем Hb определяют количественно с помощью элюирования и спектрофотографии.
- Или плотномером.
- HbF является кислотным и устойчивым к щелочам, поэтому его необходимо определять количественно другим методом.
Цель теста (Показания)
- Это позволит выявить аномальные гемоглобинопатии и количественно оценить их.
- Этот электрофорез Hb диагностирует:
- Талассемия.
- Серповидно-клеточная анемия.
- Другие аномальные гемоглобины.
Меры предосторожности
- Переливание крови за последние 12 недель может изменить электрофоретический рисунок.
Электрофорез
- Это миграция заряженных растворенных веществ или частиц в жидкой среде под действием электрического поля.
- Положительные ионы (катионы) движутся к катоду.
- Отрицательные ионы (анионы) движутся к аноду.
Схематическое изображение электрофореза
Патофизиология
- Существуют различные типы гемоглобинов, такие как A1, A2, S, C и F.
- В электромагнитном поле гемоглобин движется с разной скоростью и образует разные полосы.
- Образец пациента сравнивается с нормальной картиной гемоглобина.
- Каждая полоса определяется как процент от общего гемоглобина.
- Hb A1 является основным гемоглобином в нормальных эритроцитах.
- В то время как Hb A2 является второстепенным компонентом (от 2 до 3%).
- Hb F — основной гемоглобин в эритроцитах плода. У нормального взрослого человека минимальное количество.
- Hb F, более 3% в возрасте старше 3 лет, считается ненормальным.
- Hb F может переносить O2, когда его небольшое количество в крови, например, у плода.
- Hb S и C встречаются у чернокожих американцев.
- эритроцитов с Hb C имеют уменьшенную продолжительность жизни и легко лизируются.
Нормальные значения
- Hb A1 => 95% (от 95 до 98%).
- Hb A2 = от 1,5 до 3,7%
- Hb F = <2% (от 0,8 до 2%).
- Hb S = 0%.
- Hb C = 0%.
- Hb F у новорожденных = от 50 до 80%.
- <6 месяцев = <8%.
- > 6 месяцев = 1-2%.
- Картина электрофореза Hb в различных условиях
Hb-электрофорез серповидноклеточной анемии и бета-талассемии
Ацетат целлюлозы нормальный и ненормальный узор
Разделение нормального и аномального Hb на цитратном агаре
Схема электрофореза гемоглобина при талассемии:
| Гемоглобин | Нормальный | Большая талассемия | Малая талассемия |
| Hb F | <1% | от 10 до 98% | переменная |
| Hb A | 97% | Отсутствует | от 80 до 90% |
| ГБ A2 | от 1 до 3% | переменная | от 5 до 10% |
При большой талассемии = Hb F = 98%, HbF = 2%
Схема электрофореза:
| Гемоглобин | Болезнь |
|---|---|
| А> S | Серповидноклеточный признак, серповидноклеточная альфа-талассемия |
| S, F и не A | Серповидноклеточная анемия, Бета-талассемия серпа |
| S> A и F | Серп — бета-талассемия |
| А> С | Hb C признак |
| C, F и не A | Болезнь Hb C, HbC-бета-талассемия |
| С> А | Hb C — бета-талассемия |
Характер гемоглобинопатии в разных условиях:
| Болезнь | Hb A1 | Hb A2 | Hb F | Hb S | Hb C | Hb H |
|---|---|---|---|---|---|---|
| Серповидно-клеточная анемия | 0 | 2–3% | 2% | от 95 до 98% | 0 | 0 |
| Серповидноклеточный признак | от 50 до 60% | от 2 до 3% | 2% | от 35 до 45% | 0 | 0 |
| большая β-талассемия | 0 | от 0 до 15% | от 85 до 100% | 0 | 0 | 0 |
| Малая β-талассемия | от 50 до 85% | от 4 до 8% | от 1 до 5% | 0 | 0 | 0 |
| Болезнь Hb C | 0 | от 2 до 3% | 2% | 0 | от 90 до 100% | 0 |
| Третий.Поколение альфа-талассемия. | от 65 до 90% | 0 | 0 | 0 | 0 | от 5 до 30% |
Электрофорез
— перевод на итальянском языке — esempi inglese
Предложение:
гель-электрофорез
В базе al termine ricercato questi esempi potrebbero context parole volgari.
В base al termine ricercato questi esempi potrebbero context parole colloquiali.
Они поляризованы с помощью процесса, называемого электрофорез .
Я нахожусь в середине электрофореза на трупе.
Стальная скоба вернчата с порошком полиэстера после электрофореза .
Staffa in acciaio vernciata con polveri poliestere previa cataforesi .
Разделение соединений капиллярным электрофорезом зависит от дифференциальной миграции аналитов в приложенном электрическом поле.
La separazione dei composti tramite elettroforesi capillare dipende dalla migrazione different degli analiti in un campo elettrico application.
При электрофорезе липопротеина (тест, который сейчас проводится редко) он проявляется как гиперлипопротеинемия типа IIB.
Sull ‘ elettroforesi delle lipoproteine (un test or raramente eseguito), что представляет собой iperlipoproteinemia di tipo IIB.
Базовая схема системы капиллярного электрофореза показана на рисунке 1.
Схема системы на электрофореза капилляров и больше на рисунке 1.
Вы даете мне знать, что возвращается из… электрофорез гель.
Роль трения: примеры седиментации и электрофореза .
Установка для обнаружения флуоресценции в системе капиллярного электрофореза может быть сложной.
Инструмент для электрофореза capillare con rivelazione a fluorescenza può essere complesso.
Разделение капиллярным электрофорезом может быть обнаружено несколькими устройствами обнаружения.
La separazione tramite Elettroforesi capillare può essere rilevata da diversi Strumenti.
Также можно использовать системы капиллярного электрофореза .
Вы можете использовать различные системы электрофореза capillare.
Электрофорез Технология может сделать поверхность алюминиевого профиля очень красивой.
La tecnologia dell ‘ elettroforesi può rendere la superficie del profilo in alluminio molto bella.
Передовые методы разделения: фракционирование в полевом потоке, капиллярный электрофорез , УВЭЖХ, наноЖХ.Иммунохимия.
Разделительные методы: фраза на открытом воздухе, электрофореза, капилляров, УВЭЖХ, наноЖХ.
Это наиболее совершенный процесс обработки, включающий три последовательных этапа электроосаждения, а также электрофорез прозрачного лака.
Il trattamento pi raffinato con tre elettrodepositi successivi più elettroforesi della vernice trasparente.



 На фоне таких комбинаций обеспечивается нормальное течение беременности.
На фоне таких комбинаций обеспечивается нормальное течение беременности. Электроды накладывают на нижнюю часть живота. Терапия состоит из 6−8 манипуляций. Гинеколог рассчитывает дни так, чтобы терапия завершилась до начала менструации.
Электроды накладывают на нижнюю часть живота. Терапия состоит из 6−8 манипуляций. Гинеколог рассчитывает дни так, чтобы терапия завершилась до начала менструации. Лекарство можно разбавить водой, спиртом, Димексидом.
Лекарство можно разбавить водой, спиртом, Димексидом.