Портосистемная энцефалопатия: причины, симптомы, диагностика, лечение
Лечение портосистемной энцефалопатии
В легких случаях устранение причины обычно приводит к обратному развитию энцефалопатии. Второй задачей терапии является выведение из организма токсичных продуктов пищеварения, оно достигается путем использования ряда методов. Кишечник должен быть очищен с помощью клизмы или, чаще всего, приемом внутрь сиропа лактулозы, который может быть использован для питания через зонд у коматозных больных. Этот синтетический дисахарид является осмотическим очистительным средством. Он также понижает рН в толстой кишке, уменьшая образование аммиака в фекальных массах. Начальная дозировка (30-45 мл перорально 3 раза в сутки) должна быть откорректирована таким образом, чтобы у пациента был два или три раза мягкий стул ежедневно. Также должен быть исключен пищевой белок (разрешено 20-40 г в сутки при умеренных проявлениях), а недостаток калорий возмещается приемом внутрь или внутривенно углеводов.
Седация усугубляет энцефалопатию, и, по возможности, ее следует избегать. При коме, вызванной фульминантным гепатитом, тщательный уход и лечебная диета вместе с профилактикой и лечением осложнений увеличивают шанс на выживание. Глюкортикоиды в высокой дозе, обменное переливание крови и комплекс других сложных мероприятий, направленных на элиминацию циркулирующих в крови токсинов, как правило, не улучшают результат. Клиническое ухудшение наступает из-за быстрого развития печеночной недостаточности, и пациенты могут быть спасены только трансплантацией печени.
Другие методы лечения, включающие леводопу, бромокриптин, флумазенил, бензоат натрия, переливание аминокислот с разветвленной цепью, кетоаналоги основных аминокислот и простагландины, оказались неэффективными. Обнадеживают результаты использования сложных систем фильтрования плазмы крови (искусственная печень), но они требуют дальнейшего изучения.
Портосистемная энцефалопатия: симптомы, лечение
Портосистемная энцефалопатия — это нейропсихиатрический синдром.
.
Часто она связана с высоким содержанием белка в кишечнике или с острым метаболическим стрессом у пациентов с портосистемным шунтированием. Симптомы в основном нейропсихиатрического характера. Лечение обычно направлено на устранение провоцирующей причины, рекомендуется диета, обогащенная растительным белком, пероральный прием лактулозы и невсасывающихся антибиотиков, таких как рифаксимин.
Клинические стадии портосистемной энцефалопатии
| Стадия | Сознание и поведение | Нейромышечная функция |
|---|---|---|
| 0 (субклиническая) | Бессимптомное уменьшение когнитивных способностей | Нет |
| 1 |
Нарушения сна
Нарушение концентрации
Депрессия, тревожность или раздражительность
|
Монотонный голос
Тремор
Плохой почерк
Конструктивная апраксия
|
| 2 |
Сонливость
Дезориентация
Плохая кратковременная память
Несдержанное поведение
|
Атаксия
Дизартрия
Тремор
Автоматизм (зевание, моргание, сосательные движения)
|
| 3 |
Сонливость
Дезориентация
Амнезия
Ярость, паранойя или другое странное поведение
|
Нистагм
Ригидность мышц
Гиперрефлексия или гипорефлекция
|
| 4 | Кома |
Расширенные зрачки
Окулоцефальные или окуловестибулярные рефлексы
Децеребральная поза
|
Причины портосистемной энцефалопатии
Портосистемная энцефалопатия может развиться при фульминантном гепатите вследствие инфицирования вирусами гепатитов, применении лекарств или воздействие токсинов, но чаще она наблюдается при циррозе или других хронических заболеваниях, когда выраженные портосисгемные коллатерали формируются в результате портальной гипертензии. Энцефалопатия также может возникать после наложения портостистемных анастомозов, например при хирургических анастомозах, связывающих портальную и полую вены (портокавальное шунтирование,TIPS).
Провоцирующие факторы. Наиболее часты следующие:
- метаболический стресс,
- патологические состояния, вызывающие повышение содержания белка в кишечнике (например, ЖКК, высокопротеиновая диета),
- неспецифические церебральные депрессанты.
Патофизиология портосистемной энцефалопатии
При портосистемном шунтировании всасывающиеся продукты, которые в ином случае были бы детоксифицированы печенью, попадают в системную циркуляцию и достигают головного мозга, вызывая токсичность, в частности, воздействуя на кору. Вещества, оказывающие токсический эффект на мозг, не полностью изучены. Аммиак -продукт переваривания белка, является важной субстанцией, но другие факторы (изменения в мозговых бензодиазепиновых рецепторах и в нейротрансмиссии за счет у аминомасляной кислоты (GABA) также могут оказывать свое действие).
Симптомы и признаки портосистемной энцефалопатии
Симптомы и признаки энцефалопатии делят на стадии в зависимости от степени их выраженности.
Клинические симптомы обычно появляются при умеренном нарушении функции мозговой деятельности. Могут появиться возбуждение и мания, но это бывает нечасто. Характерный хлопающий тремор проявляется при вытянутом положении рук пациента с тыльным разгибанием кистей. Неврологические нарушения обычно симметричны. Неврологические признаки при коме чаще всего отражают билатеральную диффузную дисфункцию полушарий. Признаки поражения ствола мозга развиваются только при глубокой коме, часто в течение часов или дней перед смертью. Кисло-сладкое дыхание (печеночный запах) может ощущаться вне зависимости от стадии энцефалопатии.
Диагноз портосистемной энцефалопатии
- Клиническая оценка.
- Часто используется специальное психометрическое тестирование с исследованием уровня аммиака, ЭЭГ или их комбинации.
- Исключение других заболеваний.
Диагноз в основном опирается на клиническую картину, но тестирование может оказать помощь.
Психометрическое тестирование может выявить тонкую нейропсихиатрическую патологию, что помогает диагностировать энцефалопатию на ранних стадиях. Обычно измеряется уровень аммиака. При ЭЭГ обычно отмечается диффузная активность медленных волн даже при умеренной степени выраженности энцефалопатии. Метод может быть чувствительным, но неспецифичным на ранних стадиях энцефалопатии.
Исследование спинномозговой жидкости необязательно, единственная характерная аномалия — это умеренное повышение белка
Другие потенциально обратимые нарушения, вызывающие подобные проявления, должны быть исключены. При диагностировании портосистемной энцефалопатии необходимо искать провоцирующие факторы.
Прогноз портосистемной энцефалопатии
При хронических заболеваниях печени элиминация провоцирующего фактора обычно снижает уровень энцефалолопатии без развития стойких неврологических последствий. У некоторых пациентов, особенно с портокавальными шунтами или TIPS,требующих постоянной терапии, необратимые экстрапирамидальные симптомы. Кома, связанная с фульминантным гепатитом, фатальна приблизительно в 80% случаев.
Лечение портосистемной энцефалопатии
- Лечение причины.
- Очистка кишечника с помощью орального приема лактулозы или клизм,
- Овощная диета как источник растительного белка.
Пероральные невсасывающиеся антибиотики, такие как неомицин и рифаксимин. Элиминация токсичных кишечных продуктов — это еще одна цель, которая достигается с использованием нескольких методов.Кишечник необходимо очистить с помощью клизм, или, чаще, пероральным назначением сиропа лактулозы, который может вводиться коматозным пациентам с помощью зонда. Этот синтетический дисахарид — осмотическое слабительное, которое снижает рН в кишечнике и уменьшает фекальную продукцию аммиака. Поступающий с пищей белок должен составлять 1,0 мг/кг/ сут, в основном должен быть растительного происхождения. Оральный прием невсасывающихся антибиотиков, таких как неомицин и рифаксимин, эффективен при печеночной энцефалопатии. Предпочтителен обычно рифаксимин, т. к. неомицин — это аминогликозид, который может вызвать ототоксичность или нефротоксичность
Седативные средства могут усиливать энцефалопатию. При коме на фоне фульминантного гепатита правильное поддерживающее лечение и уход вместе с профилактикой и лечением осложнений повышают шанс выживания. Кортикостероиды в высоких дозах, обменные гемотрансфузии и другие комплексные процедуры, призванные удалять циркулирующие токсины , не улучшают исход. Состояние пациентов ухудшается за счет фульминантной печеночной недостаточности, их может спасти только трансплантация печени.
Другие потенциальные методы лечения, включающие введение разветвленных аминокислот, кетоаналогов эссенциальных аминокислот и простагландинов, не имеют доказанной эффективности. С плазмофильтрующими системами (искусственная печень) связывают определенные ожидания, но они требуют дальнейшего исследования.
Ключевые положения
- Портосистемная энцефалопатия — это нейропсихиатрический синдром, при котором портосистемное шунтирование дает возможность абсорбированным субстанциям, в нормальных условиях обезвреживающихся печенью, достигать головного мозга.
- Клинические проявления включают в себя когнитивную и поведенческую дисфункцию (например, нарушения сознания, оглушение, кому) и нейромышечные расстройства (например, хлопающий тремор, атаксию, гиперрефлексию или гипорефлексию).
- Диагноз портосистемной энцефалопатии преимущественно основывается на клинических признаках, обычно измеряется уровень аммиака в крови. Если клинические признаки минимальны или отсутствуют, проводится нейропсихологическое обследование.
- Исключаются другие, потенциально подлежащие лечению причины (например, субдуральная гематома, гипогликемия, интоксикация), проводится поиск триггеров для развития энцефалопии (например, инфекции, ЖКК. шектролитных изменений). Лечение как непосредственно самой энцефалопатии, так и вызвавшей ее причины исключается в очистке кишечника (с использованием лактулозы или клизм) диетическими ограничениями с рекомендацией принимать в пищу растительный белок, назначением антибиотиков — рифаксимина или неомицина).
Печеночная энцефалопатия: патофизиологические основы терапии | Цодиков Г.В., Богомолов П.О.
Печеночная энцефалопатия (портосистемная энцефалопатия, ПЭ) – это синдром, объединяющий комплекс потенциально обратимых психических и неврологических нарушений, возникающих в результате острой или хронической печеночно–клеточной недостаточности и/или портосистемного шунтирования крови. Расстройства психики проявляются в изменении сознания, поведения, снижении интеллекта, нарушении речи, а неврологические – в патологических нервно–мышечных и нейрофизиологических сдвигах.
Потенциально обратимые нарушения варьируют по интенсивности и могут наблюдаться в разных комбинациях, что позволяет выделить 5 стадий ПЭ – от латентной (0) до комы (IV).
Пристальное внимание к изучению патогенеза, разработке новых методов диагностики и ведению пациентов с ПЭ обусловлено весомой ролью этого нарушения в формировании фатальных исходов больных циррозом печени.
ПЭ регистрируется у 50–80% больных циррозами печени (ЦП), причем большая часть представляет собой латентную ПЭ без выраженных нейропсихических изменений, верифицируемую только специальными психометрическими тестами. Прогрессирующие церебральные нарушения, как правило, развиваются у больных с тяжелыми хроническими заболеваниями печени, особенно у больных с искусственно созданным портокавальным анастомозом (Transjugular intrahepatic portosystemic shunts – «TIPS» или трансъюгулярным внутрипеченочным шунтированием – ТВПШ). Несмотря на возможную обратимость ПЭ на фоне лечения, у ряда больных она быстро прогрессирует вследствие развития органических изменений центральной нервной системы. Это приводит к деменции, церебральной дегенерации, экстрапирамидным нарушениям.
Патофизиология
Традиционно развитие ПЭ тесно связано с изучением нейротоксических метаболитов. Исходя из этого, увеличение их концентраций в системном кровотоке связывают с двумя аспектами – нарастающей печеночно–клеточной недостаточностью и формированием портосистемных шунтов. В этих условиях нейротоксины – азотсодержащие соединения оказывают прямое токсическое действие на ЦНС. Объектом воздействия этих токсичных метаболитов является астроглия ЦНС, играющая принципиальную роль в трофике нейронов и процессах нейротрансмиссии – «гипотеза глии». Необходимо признать, что не существует единственного метаболического нарушения, вызывающего ПЭ, да и патогенез этого состояния до конца не ясен.
В роли токсических метаболитов рассматриваются эндогенные нейротоксины и ложные нейротрансмиттеры, способные проникать через гемато–энцефалический барьер. Среди нейрогенных токсинов наиболее значительную роль отводят аммиаку. Его уровень в крови повышен у 90% больных с ПЭ, содержание его в головном мозге также увеличено.
В головном мозге цикл мочевины не функционирует. Поэтому удаление из него аммиака происходит различными путями. В условиях избытка аммиака запасы глутамата (важного возбуждающего медиатора) истощаются и происходит накопление глутамина. Содержание глутамина и a–кетоглутарата в спинномозговой жидкости коррелирует со степенью ПЭ. Участие других механизмов в патогенезе ПЭ доказывается тем, что у 10% больных вне зависимости от глубины комы в крови сохраняется нормальный уровень аммиака. Производные метионина, особенно меркаптаны, вызывают ПЭ так же, как эндогенные бензодиазепины, ГАМК – подобные молекулы, короткоцепочечные жирные кислоты, фенолы. В астроцитах нарушается экспрессия моноаминоксидазы В, глутаминсинтетазы, синтез нейрональных мессенджеров (моноаминоксидазы А, NO–синтетазы).
Продукция токсических веществ в желудке, кишечнике, нарушения моторики ЖКТ, портосистемное шунтирование, печеночно–клеточная недостаточность, уменьшение нейтрализации аммиака мышцами и другими органами – очевидные патогенетические пути увеличения концентрации нейротоксических метаболитов в системном кровотоке. Развивающееся вследствие этого повреждение ЦНС реализуется через осмотические расстройства астроцитов, нарушение астроцитарно–нейрональных, астроцитарно–эндотелиальных взаимосвязей.
Изменения ЦНС
Внедрение в практику новых прижизненных методов исследования головного мозга (магнитно–резонансной спектроскопии (МРС), позитронно–эмиссионной томографии (ПЭТ), магнитно–резонансной венографии (МРВ)) позволило верифицировать морфологический субстрат повреждения ЦНС при ПЭ. Это феномен отека астроглии, приводящий к серьезным функциональным последствиям. Несмотря на отсутствие клинических признаков повышения внутричерепного давления, четко зафиксированы нарушения системы, поддерживающей осмотическое равновесие системы астроцит–нейрон и проницаемости гемато–энцефалического барьера.
Изменение содержания осмотически активных веществ в астроцитах (истощение запасов миоино–зитола, глицерофосфохолина и таурина, увеличение глутамина – продукта детоксикации аммиака, аквапорина–4 – специфического белка, регулирующего водный обмен астроцитов) приводят к формированию гипергидратации астроцитов, то есть отеку мозга – центральному звену патогенеза ПЭ. Гипергидратации астроцитов также способствуют гипонатриемия, бензодиазепины, ГАМК–подобные молекулы, диуретики, некоторые цитокины (TNF–a).
Действие известных факторов, провоцирующих развитие ПЭ (кровотечение, инфекции, электролитный дисбаланс), также реализуется через отек астроцитов, и именно степень гидратации астроцитов обусловливает клиническую тяжесть, обратимость или необратимость церебральных нарушений.
Развитие и прогрессия ПЭ обусловлены развивающимися вследствие повреждения астроцитарно–нейрональных и астроцитарно–эндотелиальных взаимосвязей у больных атрофией головного мозга, нарушением регионарного кровообращения и нейротрансмиссии.
Нейротоксические метаболиты
Аммиак. Исторически доминирующую роль среди факторов формирования ПЭ занимает аммиак. Газообразный аммиак в астроцитах под действием глутамин–синтетазы способствует увеличению пула глутамина – осмотически активного вещества, изменение концентрации которого приводит к формированию отека глии и, в конечном счете, головного мозга и развитию симптомокомплекса ПЭ. Однако хорошо известны данные о слабой корреляции гипераммониемии и степени ПЭ, нередком развитии церебральной дисфункции на фоне нормального содержания аммиака в крови и наоборот – отсутствие ПЭ при выраженной гипераммониемии. Это привело к изучению других нейротоксичных веществ при ПЭ и поиску способов терапевтического воздействия на это состояние.
Среди большого списка кандидатов на роль нейротоксических метаболитов наибольший интерес в последние годы вызывают ложные нейротрансмиттеры и эндогенные бензодиазепины.
Ложные нейротрансмиттеры. При прогрессирующем поражении печени происходит нарушение переаминирования: изменяется баланс ароматических и разветвленных аминокислот. Принципиальное значение увеличения содержания в ЦНС ароматических аминоксилот (фенилаланин, тирозин, триптофан) заключается в стимуляции продукции ложных нейротрансмиттеров: фенилэтаноламина, октопамина, тирамина, которые замещают собой истинные нейромедиаторы и тем самым препятствуют нормальной нейропередаче. Снижение синтеза физиологичных допамина и норадреналина приводит к неадекватной нейротрансмиссии и развитию ПЭ.
Полагают, что ложные нейротрансмиттеры могут синтезироваться не только в ЦНС. Их источником также является микрофлора кишечника, и при печеночно–клеточной недостаточности или порто–системных анастомозах они могут попадать в ЦНС, становясь причиной ПЭ.
ГАМК–бензодиазепины. g–аминомасляная кислота (ГАМК) представляет собой основной тормозной нейромедиатор в головном мозге. Медиатор связывается со специфическим ГАМК–рецептором на постсинаптической мембране. Рецептор представляет собой часть большого молекулярного комплекса, в котором имеются также места связывания с бензодиазепинами и барбитуратами. Связывание любого из этих лигандов вызывает гиперполяризацию постсинаптической мембраны и торможение нервных импульсов. Эндогенные ГАМК–бензодиазепины играют существенную роль в астроцитарно–нейрональных взаимосвязях. Их источником являются также некоторые продукты питания (грибы, пшеница), микрофлора кишечника. У больных ЦП нарастание концентрации ГАМК–бензодиазепинов в крови и проникновение их через гемато–энцефалический барьер приводит к значительному увеличению экспрессии бензодиазепиновых рецепторов в ЦНС. Их активация, коррелирующая со степенью ПЭ, приводит к усилению синтеза нейростероидов и других нейроактивных веществ, являющихся ингибиторами нейротрансмиссии.
Источники токсичных нейромедиаторов
Итак, изменение содержания аммиака в крови является ключевым звеном в формировании ПЭ. По–видимому, ведущим механизмом гипераммониемии у больных циррозом печени является увеличение его продукции микрофлорой, обладающей уреазной активностью. В связи с этим, помимо кишечной микрофлоры, рассматривается ряд инфекционных состояний, в том числе спонтанный бактериальный перитонит, инфекции мочевыводящих путей, H. рylori–ассоциированный хронический гастрит.
H. pylori–ассоциированный гастрит. Вызывают интерес данные, свидетельствующие о более высокой частоте и выраженности ПЭ у больных циррозом печени с сопутствующим хеликобактерным гастритом. В связи с этим привлекательна возможная позитивная роль антихеликобактерной терапии на течение ПЭ у больных циррозом печени.
Дисмоторика тонкой кишки. Любопытным патогенетическим звеном развития ПЭ является снижение моторики тонкой кишки у больных ПЭ и повышение при этом активности глутаминазы слизистой оболочки. Это, в конечном счете, приводит к увеличению продукции аммиака в кишечнике и возможной прогрессии степени ПЭ. Коррекция нарушений моторики тонкой кишки, в частности, лактулозой (дюфалак, лактусан, лактитол) улучшает течение ПЭ, однако подобные моторные расстройства описаны у больных и без церебральной дистрофии.
Избыточный бактериальный рост в кишечнике. Очевидна роль избыточной бактериальной пролиферации в кишечнике в развитии ПЭ. Это обусловлено интенсивным образованием кишечной микрофлорой помимо аммиака таких нейротоксических метаболитов, как меркаптан, короткоцепочечные жирные кислоты, фенол. Выявляемая у больных циррозом печени избыточная бактериальная пролиферация привела к развитию соответствующих терапевтических подходов: диетических мероприятий (преобладание в рационе белков растительного происхождения, пищевых волокон), применению неабсорбирующегося дисахарида – лактулозы (дюфалак, лактусан, лактитол), попыткам использовать в этих целях антибиотикотерапию.
Порто–системное шунтирование. Эра широкого применения TIPS в борьбе с тяжелой портальной гипертензией предопределила пристальное исследование этого аспекта формирования церебральной дистрофии у больных ЦП. Формирование ПЭ у больных после наложения им TIPS увеличивается на 20%, что обусловлено сбросом в системный кровоток до 60–70% объема крови из системы воротной вены. Применение МР–венографии позволяет верифицировать функционирующие порто–системные анастомозы практически у всех больных ЦП с ПЭ. Использование неинвазивных методов (радиологической) окклюзии крупных порто–системных анастомозов приводит к снижению темпов развития ПЭ, значительному регрессу симптомокомплекса церебральной дистрофии, однако определение четких показаний и противопоказаний для подобного рода манипуляций требует проведения серьезных исследований.
Печеночно–клеточная недостаточность. Нарастающая при диффузных заболеваниях печени печеночная недостаточность ассоциируется с развитием ПЭ. Среди метаболических путей, ответственных за нейтрализацию избыточного количества аммиака, поступающего в печень из системы воротной вены, наибольшую роль играют образование мочевины и цикл Кребса. Наряду с длительно и эффективно используемым орнитин–аспартатом перспективным является изучение терапевтических возможностей цинка и карнитина. Цинк является кофактором всех ферментов цикла образования мочевины. Назначение его при ЦП достоверно увеличивает образование мочевины в эксперименте и, соответственно, приводит к снижению выраженности ПЭ. Аналогичные обнадеживающие данные получены при назначении карнитина.
Угнетение детоксикации аммиака мышцами. Увеличение содержания аммиака в крови связано также с развивающимся на фоне ЦП уменьшением мышечной массы, что коррелирует с развитием ПЭ. Уменьшение синтеза глутамата из аммиака в мышцах корригируется назначением орнитин–аспартата, что сопровождается достоверной редукцией симптомокомплекса ПЭ.
Перспективным является изучение почечного пути метаболизма аммиака в организме человека. Показано увеличение экскреции аммиака на фоне гипераммониемии.
Клинические прявления ПЭ
Клиническая картина ПЭ складывается из изменений психики и двигательных расстройств. Выраженность ПЭ варьирует от латентной и легкой степени (0–I ст) до комы (IV ст). Клинически это определяется по изменениям сознания, поведения, интеллекта, а также нейромышечным изменениям. Стадии ПЭ – это характеристика динамическая, то есть возможны как прогрессия, так и редукция церебральных нарушений.
Изменения психики, иногда обозначаемые как «эпизодический сопор», развиваются внезапно, особенно после приема больших количеств животного белка (мясо или рыба) или применения некоторых препаратов (бензодиазепины, диуретики). Они заключаются в своеобразном изменении сознания, когда больные перестают ориентироваться в окружающей обстановке, совершают немотивированные поступки. Такие состояния обычно длятся от нескольких часов до нескольких дней и иногда прогрессируют до печеночной комы. О случившемся больные не помнят. Постепенно снижается память, развиваются изменения в эмоциональной сфере и деменция.
Двигательные нарушения представлены экстрапирамидными симптомами. Наиболее частым является дрожание, сходное с дрожанием у больных гепатоцеребральной дистрофией. Дрожание распространяется на мышцы рук – астериксис. Отмечаются также брадикинезия, мышечная ригидность. Менее характерные симптомы – повышение сухожильных рефлексов, патологические знаки, мозжечковая атаксия, дизартрия. Эти нарушения прогрессируют медленно.
Классификация ПЭ (Herber, 2000)
Стадия Клинические симптомы
Латентная Субклиническая форма, обнаруживается только при помощи психометрических тестов. Ухудшение умственной деятельности и утрата тонких моторных навыков.
I Легкие изменения личности, нарушения сна, снижено внимание, легкая атаксия и тремор.
II Летаргичность, апатия, нарушение ориентации во времени, гиперактивные рефлексы, монотонная речь.
III Сонливость, спутанность сознания, бессвязная речь, печеночный запах, гипо– или гиперфлексия, «хлопающий» тремор, судороги, ригидность мышц.
IV Кома, выраженный печеночный запах (присутствие меркаптанов), признаки увеличения внутричерепного давления.
Латентная ПЭ верифицируется лишь при помощи специальных психометрических тестов. Это чрезвычайно распространенное состояние – частота ее выявления у больных ЦП достигает 70%. I стадия ПЭ характеризуется в первую очередь развитием диссомнии: сонливость днем и бессонница ночью. Во II стадии сонливость нарастает, прогрессируют нарушения интеллекта, развиваются нарушения «тонкой моторики». III стадия характеризуется присоединением дезориентации во времени и пространстве и дальнейшим прогрессированием нарушения сознания. IV стадия – собственно кома, при которой у пациентов на фоне глубоких нарушений сознания отсутствуют реакции на болевые раздражители.
ПЭ развивается преимущественно на фоне действия так называемых «разрешающих факторов»: диетические погрешности (мясо, рыба), желудочно–кишечное кровотечение, прием психотропных препаратов (особенно бензодиазепинов), назначение салуретиков, развитие инфекционных заболеваний (спонтанный бактериальный перитонит, хронический пиелонефрит и др.), наложение портокавальных анастомозов (TIPS), выполнение лапароцентеза с эвакуацией большого объема асцитической жидкости без адекватного восполнения потерь белка.
Развитие «мясного отравления» при наличии порто–кавальных анастомозов описал еще Экк, что связано с резко развивающейся у больных ЦП гипераммониемией. ПЭ при желудочно–кишечных кровотечениях обусловлена развитием гемодинамических расстройств и увеличением образования токсичных нейрометаболитов в кишечнике при гидролизе уреазо–положительной микрофлорой белковых компонентов крови. Основным источником продукции аммиака являются бактерии энтеробактерии, клостридии, бактероиды, хеликобактер.
Аналогично, при эвакуации большого объема жидкости из брюшной полости без коррекции белковыми растворами или назначении высоких доз салуретиков вследствие гиповолемии развивается тканевая гипоксия с угнетением обезвреживания аммиака в печени.
Нарастание эндотоксемии – основной механизм развития и нарастания ПЭ у больных с инфекционными заболеваниями. Показательно, что нередко основным и единственным симптомом спонтанного бактериального перитонита является нарастание ПЭ. Замедленная биотрансформация психотропных препаратов у больных ЦП обусловливает значительное усиление и пролонгацию их нейротоксического действия, что предопределяет нарастание тяжести церебральных расстройств.
Адекватная терапия этих состояний нередко приводит к значительному регрессу или даже полному купированию симптоматики ПЭ.
Диагностика ПЭ осуществляется на основании соответствующих симптомов и клинико–лабораторных признаков поражения печени. Наиболее простым и распространенным в клинической практике является использование психометрических тестов (тест связи чисел –ТСЧ, тест цифра–символ–ТЦС, тест повторения линий – ТЛ) , позволяющих диагностировать в том числе латентную ПЭ. Применение современных инструментальных методов диагностики, в первую очередь магнитно – резонансная спектроскопия и позитронно–эмиссионная томография позволяют верифицировать и уточнять стадию ПЭ – на сегодняшний день это самые чувствительные методы прижизненной диагностики ПЭ.
Лечение
Лечение ПЭ III–IV стадий характеризуется высокой стоимостью и относительно малой эффективностью. Это предопределяет необходимость ранней профилактики и лечения заболеваний, ассоциированных с развитием ПЭ.
Терапия ПЭ направлена на устранение «разрешающих факторов» в инициации ПЭ, снижение образования, абсорбции и улучшение обезвреживания нейротоксических метаболитов, прежде всего аммиака. Основные положения адекватного ведения больных ПЭ:
1. Диетические мероприятия.
2. Устранение «разрешающих факторов».
3. Снижение образования, абсорбции нейротоксических метаболитов, улучшение их обезвреживания.
4. Воздействие на активность ингибиторных нейротрансмиттеров в ЦНС или на их соотношение.
Большую роль в предупреждении прогрессии ПЭ играет адекватная диетотерапия – преобладание в диете белков растительного происхождения, увеличение потребления пищевых волокон. Рекомендуется ограничить потребление белка до 1 г на 1 кг веса, при развитии ПЭ 3–4 ст. – до 20–30 г/сутки. Адекватное восполнение энергетических затрат осуществляется за счет легкоусвояемых углеводов.
Ведение больных ЦП подразумевает рациональную фармакокоррекцию и профилактику возможных осложнений, инициирующих развитие ПЭ. Подавление протеолитической флоры кишечника проводится с помощью антибиотиков широкого спектра действия. Предпочтение отдается препаратам с минимальным побочным действием – фтор–содержащим хинолонам (норфлоксацин, ципрофлоксацин), назначаемым в течение 5 суток.
Коррекция нарушений моторики тонкой кишки, избыточного бактериального роста (как основных причин в развитии гипераммониемии) осуществляется неадсорбируемым дисахаридом лактулозой. Применение лактулозы не только достоверно улучшает течение ПЭ, но и успешно предотвращает ее развитие.
Применение промежуточных метаболитов цикла мочевины. Назначение L–орнитина–L–аспартата приводит к активизации орнитинового цикла детоксикации аммиака. Внутривенное капельное введение 20–30 г препарата ежедневно в течение 7–15 дней, затем пероральный прием по 9 –18 г в сутки.
Гипотеза нарушения аминокислотного баланса при ЦП нашла отражение в применении разветвленных аминокислот (Гепасол А) у больных с ПЭ. В состав Гепасола А входят L–аргинин и L–аспарагиновая кислота, яблочная кислота, сорбит, рибофлавин. Гепасол А оказывает метаболическое, гепатопротекторное и дезинтоксикационное действие. Эффект препарата основан на влиянии L–аргинина на процессы метаболизма. Он способствует превращению аммиака в мочевину, связывает токсичные ионы аммония, образующиеся при катаболизме белков в печени. Яблочная кислота и сорбит обеспечивают организм энергией.
Гепасол А вводят внутривенно капельно в средней дозе около 500 мл со скоростью 40 капель в минуту 2 раза в сутки. Препарат хорошо переносится пациентами.
Применение селективного антагониста ГАМК–бензодиазепиновых рецепторов флумазенила продемонстрировало эффективность его применения при ПЭ – отмечено достоверное снижение выраженности церебральной дисфункции у больных ЦП. Однако назначение флумазенила не приводит к полному регрессу симптомокомплекса ПЭ, что ограничивает спектр его терапевтического применения.
Итак, очевидное значение токсического воздействия нейрометаболитов, в первую очередь гипераммониемии и эндогенных бензодиазепинов, в развитии ПЭ нашло отражение в существующих патогенетических способах коррекции. Это диетические ограничения (растительный белок, пищевые волокна) и лекарственные препараты: орнитин–аспартат, лактулоза. Продолжается поиск инструментальных (неинвазивная окклюзия порто–системных анастомозов) и фармакологических (флумазенил, цинка ацетат, карнитин) путей лечения и профилактики развития печеночной энцефалопатии.
Литература
1. Ивашкин В.Т. Болезни печени и желчевыводящих путей: Руководство для врачей. М–Вести, 2002. – 416 с.
3. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. Пер. с англ: Под ред. З.Д.Апросиной, Н.А.Мухина.– М.: Геотар Медицина, 1999. – 864 с.
5. Blei A.T. Helicobacter: adverse effects on the brain? Gut 2001; 48:590–1.
6. P.Bogomolov, V. Isakov. Abnormal hydrogen breath test in patients with NASH. AASLD single topic Conference Nonalcoholic steatohepatitis – NASH. P. 131.
7. Lebrec D., Ginily N. Transjugular intrahepatic portosystemic shunts: comparison with paracentesis in patient with cirrhosis and refractory ascites. J. Hepatol. 1996; 25:135–44.
8. Chesta J. Abnormalities in proximal small bowel motility in patients with cirrhosis. Hepatology 1993; 17:828–52.
.
Энцефалопатия
Выделяют атеросклеротическую, гипертоническую, смешанную (атеросклероз и артериальная гипертензия), а также венозную энцефалопатии.
Дисциркуляторная атеросклеротическая энцефалопатия встречается наиболее часто. Выделяют три стадии энцефалопатии.
Стадия I – умеренно выраженная (компенсированная). Проявляется церебрастеническим синдромом (снижение памяти, эмоциональная неустойчивость, раздражительность, головные боли, несистемное головокружение), дистоническими вегетативно-сосудистыми реакциями, различными вариантами психопатологических синдромов: астенодепрессивный, астеноипохондрический, паранойяльный, аффективный. Стойкой очаговой неврологической симптоматики не выявляется, но возможны легкие преходящие, пароксизмальные расстройства. В начальной стадии дисциркуляторной энцефалопатии преобладает гипердинамическая форма церебрастении, проявляющаяся расторможенностью, возбудимостью, несдержанностью, лабильностью настроения, тревожным сном.
Стадия II – выраженная (субкомпенсированная). Возрастают структурные органические изменения, симптоматика становится не только более грубой, но и более стойкой. Головная боль почти постоянная, появляется стойкий шум в голове, углубляются психопатологические синдромы, церебрастения приобретает гиподинамическую форму (вялость, быстрая утомляемость, плаксивость, подавленное настроение, ослабление внимания, снижение памяти, расстройство сна). Диффузная сосудисто-мозговая недостаточность приводит к мелкоочаговым поражениям структур головного мозга, при этом формируется соответствующий клинический неврологический синдром. Чаще всего встречаются псевдобульбарный, амиостатический синдромы, а также пирамидная недостаточность (дизартрия, дисфония, рефлексы орального автоматизма, нарушение иннервации нижней части лица и языка – девиация, замедленность движений, гипомимичность, скованность, ритмичный тремор рук и головы, дискоординация, неловкость движений в пальцах рук, нарушения зрения в виде фотопсий, снижение слуха, эпилептиформные джексоновские припадки, анизорефлексия, патологические рефлексы сгибательного типа).
Стадия III – резко выраженная (декомпенсированная). Характеризуется тяжелыми диффузными морфологическими изменениями мозговой ткани, образуются периваскулярные лакуны, может развиваться гранулярная атрофия коры полушарий головного мозга. На КГ и МРТ определяются участки пониженной плотности белого вещества вокруг боковых желудочков и в субкортикальных отделах мозговых полушарий (лейкоариоз).
Отмечаются углубление и утяжеление уже имевшейся симптоматики, начинают преобладать признаки поражения какой-либо области мозга: мозжечковые расстройства, парезы, нарушения речи, резко страдает память, развивается сосудистый паркинсонизм. Более часто, чем во II стадии, возникают эпилептиформные припадки. Тяжелые изменения психики нередко приводят к глубокой деменции. Наряду с тяжелыми изменениями нервной системы значительно страдает и общесоматическое состояние. В этой стадии могут развиваться острые нарушения мозгового кровообращения.
Гипертоническая дисциркуляторная энцефалопатия, в отличие от атеросклеротической начинается в более молодом возрасте, протекает быстрее, особенно на фоне церебральных гипертонических кризов, новые симптомы часто возникают остро, во время кризов. Среди психических изменений на первый план выступают расторможенность, ажитированность, эмоциональная неустойчивость, эйфория.
Смешанная дисциркуляторная энцефалопатия. Характеризуется сочетанием черт атеросклеротической и гипертонической энцефалопатии.
Венозная энцефалопатия является особым видом дисциркуляторной энцефалопатии и встречается при состояниях, приводящих к хроническому нарушению венозного оттока из полости черепа (первичные расстройства регуляции венозного тонуса – церебральные венозные дистонии, легочно-сердечная недостаточность, краниостеноз, сдавление вне- и внутричерепных вен патологическими процессами). В веществе мозга развивается венозный застой с хроническим отеком. В клинической картине преобладает хронически-ремиттирующий гипертензионный синдром: тупые давящие головные боли, усиливающиеся при кашле, чиханье, натуживании, часто – несистемное головокружение, вялость, апатия, бессонница, нередки симптомы рассеянного мелкоочагового поражения головного мозга, в тяжелых случаях – тошнота и рвота, застой на глазном дне, менингеальные знаки.
Портосистемная энцефалопатия: особенности болезни, причины, симптомы, лечение
Содержание статьи

Портосистемная энцефалопатия – это редко встречающееся заболевание, хотя многие его ассоциируют с печеночной энцефалопатией, от чего услышать такой термин можно значительно чаще, чем это должно быть. Портосистемная энцефалопатия характеризуется целым рядом психоневрологических расстройств и нарушением кровообращения в ЦНС. Но, несмотря на это, заболевание относится к обратимым состояниям и встречается только у тех людей, которым было проведено портосистемное шунтирование.
Причины портосистемной энцефалопатии
Основными причинами возникновения портосистемной энцефалопатии являются выраженные гепатиты, преимущественного вирусного или токсического генеза. При усугублении воспалительного процесса, когда дело доходит до цирроза печени либо других тяжелых заболеваний данного органа, возникают так называемые портальные гипертензии (повышенное давление в печеночных венах). При таких состояниях образуются портосистемные коллатерали, когда возникает необходимость проведения операций по установке анастамозов. В результате этого и появляются симптомы энцефалопатии, которую принято называть портосистемной.
Прямыми причинами возникновения неврологических расстройств и появления непосредственных признаков портосистемной энцефалопатии являются следующие состояния:
– Метаболический стресс – любые изменения баланса (гипокалиемия, алкалоз, обезвоживание, инфекции).
– Состояния, при которых нарушается всасывание белка в кишечнике (белковые диеты, желудочно-кишечные кровотечения).
– Прием средств, угнетающих деятельность ЦНС (медицинские препараты, алкоголь).
При корректировке этих состояний признаки портосистемной энцефалопатии отступают.
Симптомы портосистемной энцефалопатии
Традиционно выделяют три стадии энцефалопатии, что также касается и портосистемной формы. При начальных стадиях в случае не тяжелого поражения могут наблюдаться тревожные состояния, беспокойство, повышенные требования к окружающим, неустойчивое настроение, депрессии, паники.
При второй стадии эти симптомы сохраняются, но отличаются наибольшей стойкостью. К ним могут добавляться двигательные дисфункции и другие признаки нарушенной функциональности со стороны ЦНС, в частности при изменениях церебрального кровообращения.
Третья стадия чаще всего встречается у пациентов, находящихся в коматозном состоянии. В целом, при своевременном оказании медицинской помощи, до тяжелых обострений не должно доходить.
На фоне всех признаков заболевания может появляться слегка сладковатый печеночный запах изо рта.
Лечение портосистемной энцефалопатии
Лечение портосистемной энцефалопатии направлено на устранение факторов, которые поспособствовали развитию данного состояния. С этой целью пациентам, перенесшим портосистемное шунтирование, необходимо строго соблюдать все рекомендации специалистов. Погрешности в диете, злоупотребление и невозможность полного отказа от спиртных напитков может привести к развитию энцефалопатии.
Кроме этого, необходимо регулярно проводить контроль клинически важных показателей крови, чтобы вовремя предотвращать тяжелые состояния. Если внимательно относиться к своему здоровью и своевременно проходить обследования с посещением лечащего врача, стойких нарушений и очаговых поражений в клетках головного мозга не возникнет.
Портосистемная энцефалопатия | Синдромы, отягощающие течение цирроза печени
Под названием «портосистемная энцефалопатия» (portal-systemic encephalopathy) Sherlock с сотрудниками (1954) описали заболевание нервной системы, возникающее у больных диффузными заболеваниями печени, особенно циррозом печени. Развитие этого состояния объясняется тем, что азотсодержащие вещества минуют печень или проходят через нее в неизмененном виде, а затем попадают в общий кровоток и вызывают мозговые расстройства. Содержащие аммиак вещества могут образовываться из белка, поступающего с пищей, крови, излившейся в желудок при кровотечениях из варикозно расширенных вен; известное значение в их образовании принадлежит патологической микрофлоре кишечника. Азотсодержащие токсические продукты могут миновать паренхиму печени по естественным или созданным оперативным путем портокавальным анастомозам или через развитые внутрипеченочные сообщения между разветвлениями воротной и печеночной вен. При тяжелой печеночной недостаточности не требуется даже коллатерального кровообращения для того, чтобы аммиак попал в общий ток кровообращения. Наиболее тонким методом распознавания портосистемной энцефалопатии является электроэнцефалография.
Главным клиническим признаком настоящего синдрома является расстройство сознания, выражающееся в периодически наступающем ступоре и иногда в коматозном состоянии. Перед наступлением аммиачной комы возникают изменения в психике больного: возбуждение, поведение, неадекватное обстановке. Появляется значительный тремор, непроизвольные движения пальцев, атаксическая походка, судороги мимической мускулатуры, часто птоз век, язык иногда свисает изо рта. Рефлексы и мышечный тонус, сначала повышенные, при развитии комы снижаются, иногда наступает полная арефлексия. Реже возникают расстройства сна, галлюцинации, нарушения зрения и речи. Приступы могут заканчиваться внезапно: сознание возвращается, симптомы поражения нервной системы исчезают. Иногда больной погибает в коматозном состоянии вследствие печеночной недостаточности.
В отличие от так называемой истинной печеночной комы, связанной с прогрессирующей гибелью печеночной паренхимы, при описанных состояниях кома наступает не всегда, и если наступает, то она обычно обратима. Kalk (1957) различает еще так называемую ложную печеночную кому с потерей сознания, вызванной в первую очередь гиповолемией. Так как аммиачное отравление и гиповолемия играют значительную роль и в генезе так называемой истинной печеночной комы, отличить таковую от ложной печеночной комы весьма трудно. Leevy, Davidson (1968) указывают, что при коме, являющейся проявлением портосистемной энцефалопатии, не наблюдается нарастания биохимических признаков печеночной недостаточности, иногда последние просто отсутствуют.
что это такое, симптомы, лечение и прогноз жизни
Энцефалопатия головного мозга — это хроническое или острое отклонение работы церебральных структур, как правило, метаболического характера, при котором наблюдается нарушение обмена веществ, падение активности нервных тканей, распад и гибель нейронов. В конечном итоге человек сталкивается со снижением когнитивных функций, утратой части способностей со стороны церебральных структур.
Восстановление представляет определенные сложности, поскольку эффективная коррекция возможна только на первой стадии патологического процесса.
Нарушение имеет собственный код по МКБ-10. G93, с различными постфиксами, указывающими на происхождение изменения.
Прогнозы зависят от множества факторов. Возраста больного, давности расстройства, длительности его течения, общего состояния здоровья страдающего, качества и момента начала помощи. Вопрос сложный и требует тщательной квалифицированной оценки.
Механизм развития
Основу становления патологического процесса определяет несколько основных путей развития. Они могут встречаться как вместе, так и по отдельности.
Если говорить подробнее:
Токсическое поражение головного мозга
Часто причиной энцефалопатии становится злоупотребление спиртными напитками. Продукты распада алкоголя деструктурируют нейроны, а при длительном потреблении этанола они разрушаются в больших количествах.
Восстановление при продолжительном использовании напитков практически невозможно. Есть прямая связь между длительностью применения спиртного и тяжестью патологического процесса. Имеет смысл как можно быстрее отказаться от пагубной привычки.
С другой же стороны, не всегда алкоголь выступает причиной расстройства. Тем же негативным образом сказывается влияние паров, солей различных химических элементов и их соединений. В группе риска — служащие вредных предприятий.
Травматическое расстройство работы церебральных структур
Не всегда повреждения головного мозга сказываются на состоянии нервных волокон сразу. Порой изменения начинаются спустя несколько месяцев или лет.
Происхождение обнаружить крайне непросто, даже при качественной всесторонней диагностике заболевания.
Внимание:
Практически любое повреждение может сказаться на состоянии мозга негативно. Даже простое сотрясение, без осложнений.
Инфекционное поражение
Вовлечение нервных тканей при вирусном или бактериальном процессе сопровождается тяжелыми неврологическими явлениями. Дефицит характеризуется сложными диффузными (разлитыми по всему мозгу) расстройствами.
Возникает целая группа опасных симптомов, нередко пациент становится инвалидом. Если говорить о конкретных диагнозах, особенно часто речь идет о менингите и энцефалите.
Есть и другие варианты. От опухолевого процесса и до системных аутоиммунных нарушений, имеющих воспалительный характер.
Механизмы развития определяют дальнейшее течение, в обязательном порядке выявляются в ходе диагностики. Поскольку от этого зависит качество терапии, самой возможности полного восстановления и избавления от расстройства.
Виды энцефалопатии
Классификация в основном проводится по характеру и происхождению.
Соответственно называют такие формы изменения:
- Дисциркуляторная (синоним ангиоэнцефалопатия). Это хроническое нарушение работы головного мозга, на фоне тяжелого отклонения в местной гемодинамике. Кровоток падает, церебральные ткани недополучают питательных веществ и кислорода, что становится причиной деструкции клеток.
Тяжесть патологии напрямую зависит от того, насколько сильная ишемия присутствует. После инсульта расстройство имеет самый выраженный характер.
Другое название нарушения — сосудистая энцефалопатия мозга и подразделяется на атеросклеротическую, гипертоническую и венозную.
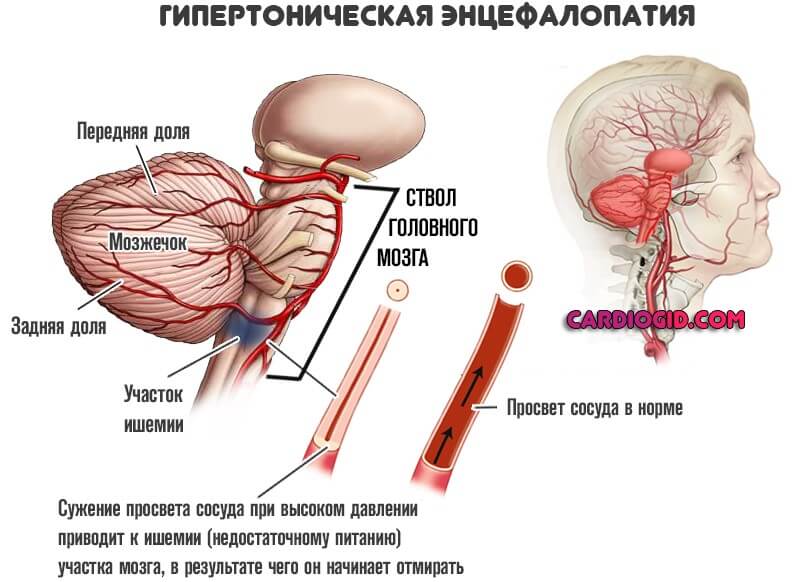
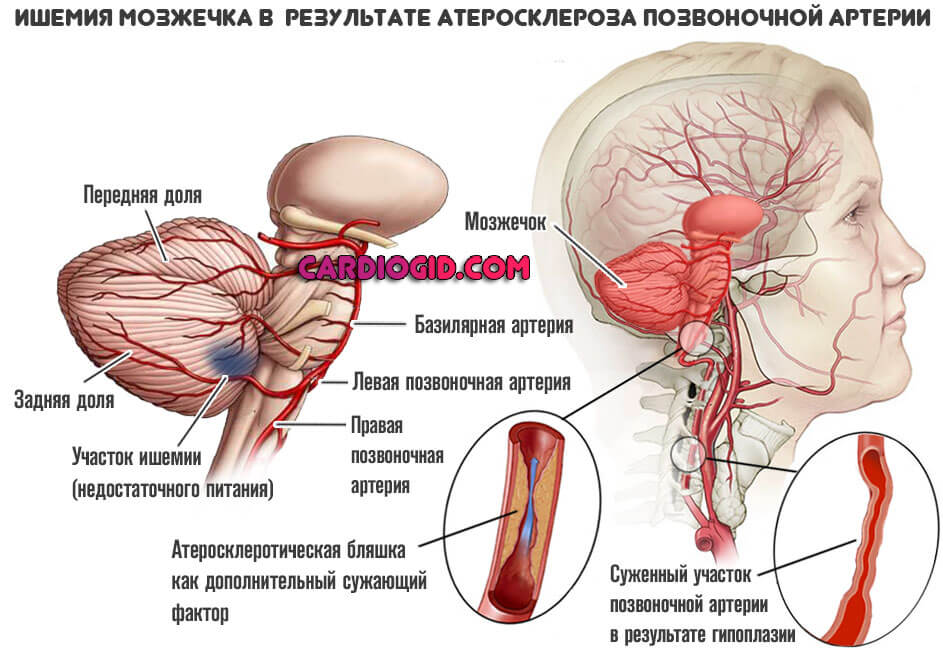
- Травматическая форма. Развивается после перенесенного повреждения тканей церебральных структур. Порой несколько лет спустя, что осложняет диагностику и делает происхождение неочевидным.
Симптоматика обычно стойкая, не сходит к нулю самостоятельно. Прогрессирование медленное, но не всегда. Посттравматический энцефалопатический синдром характеризуется неуклонным развитием, без терапии вероятны необратимые изменения.
- Инфекционная разновидность. Встречается как итог менингита или прочих изменений в организме. Воспалительный процесс приводит к стремительному разрушению тканей, неврологическому дефициту.
Внимание:
Без своевременного лечения шансы на восстановление без последствий ничтожно малы или их нет вообще.
- Токсическая энцефалопатия. Встречается у алкоголиков, лиц, потребляющих наркотики в разных формах, также у работников опасных предприятий. Например, текстильных или химических. Лечение требует устранения факторов-провокаторов, коррекции последствий.
- Метаболическая энцефалопатия. Развивается как итог поражений печени, почек и других органов. Также в ходе длительного течения сахарного диабета.
Сюда входят: печеночная (портосистемная, билирубиновая), уремическая (азотемическая), диабетическая, панкреатическая, гипогликемическая, гипоксическая, аноксическая и синдром Гайе-Вернике. Восстановительные мероприятия сложны, не всегда дают нужный эффект. Подробнее о печеночной форме читайте в этой статье.
- Энцефалопатия смешанного генеза. Сопровождается расстройствами по множеству причин одновременно. Такая полифакторность создает большие проблемы для диагностики и дальнейшего лечения заболевания. Поскольку нужно сразу влиять на группу виновников начала изменений.
Энцефалопатия сложного генеза у взрослых развивается наиболее часто. Сочетания могут быть разными, зависит от конкретной ситуации. Например, в результате перенесенной травмы возникают аномалии в обмене веществ головного мозга, а также отклонения со стороны кровотока. Имеет место сочетанный процесс.
В некоторых случаях определить этиологию расстройство невозможно. По крайней мере, на момент проведения диагностики. Тогда говорят об энцефалопатии неуточненной.
Такие идиопатические формы предполагают только устранение проявлений болезни без влияния на фактор-провокатор.
Стадирование
Другой способ классификации основан на оценке тяжести нарушения. В таком случае выделяют три стадии.
- Первая. Характеризуется практически бессимптомным течением. Обнаруживаются незначительные отклонения со стороны работы головного мозга. Небольшая усталость, болевые ощущения в черепной области, прочие варианты отклонения. Устранение возможно в короткие сроки.
- Вторая. Субкомпенсированная. Организм пока еще справляется с перераспределением функций между здоровыми клетками и тканями нервной системы. Однако уже не полностью, начинаются опасные проявления расстройства.
Например, выраженные головные боли, снижение памяти, интеллекта, проблемы со зрением, слухом, поведенческие изменения. Качественная терапия все еще возможна, но уже потребуется куда более длительный курс с постоянным наблюдением и пересмотром по необходимости.
- Третья. Критическая, декомпенсированная фаза. Пациент утрачивает часть способностей, становится инвалидом. Восстановительные мероприятия не дают стопроцентного результата. А при глубоком укоренении органических изменений эффекта нет вообще.
Внимание:
Классификация по стадиям не считается общепризнанной и имеет массу вариаций. Однако все они примерно сводятся к такому виду.
Симптомы
Клиническая картина определяется точной тяжестью нарушения и его локализацией. Как правило, на первой стадии хронического процесса признаки отсутствуют. Они нарастают постепенно, пока не сложатся в полноценную систему ко второму этапу.
Очаги обычно имеют диффузный (распространенный по всему мозгу)характер, потому и сами проявления определяются многообразием у одного и того же пациента.
Среди симптомов:
- Головная боль. Локализуется везде сразу или отдельных частях: затылке, темени. Интенсивность незначительная, по мере прогрессирования нарушения становится сильнее или чаще возникает (а возможно и то, и другое разом). Применение анальгетиков не дает выраженного результата. Хотя сила дискомфорта и становится меньше.
- Головокружение. Невозможность адекватно ориентироваться, управлять своими телом. Координация движений также нарушена. В наиболее сложных случаях пациент в момент эпизода вертиго вынужден принимать горизонтальное положение и не двигаться, чтобы не усиливать и без того интенсивные ощущения. Продолжительность эпизода — от пары минут до нескольких часов.
- Нарушения мыслительных когнитивных функций — характерный признак энцефалопатии. Сначала проявляется в виде небольшой забывчивости и рассеянности. Затем добавляется тугость мышления. Человеку становится трудно выполнять задачи, которые ранее не вызывали проблем. В то же время, сложно переключаться между разными видами деятельности.
- Поведенческие расстройства. Эмоциональные нарушения. Сюда входят такие признаки, как раздражительность, повышенную агрессивность, плаксивость, депрессивность, проявления апатичности и безволия, нежелания что-либо делать.
Постепенно человек слабее начинает реагировать на внешние раздражители, а затем возможно полное угасание интереса к окружающей реальности.
- Шаткость походки. Мышечная слабость или, напротив, развитие гиперкинезов, судорожных синдромов.
- Рост или падение тонуса мускулатуры.
- Тошнота.
- Рвота.
- Метеочувствительность. Склонность к вегетативным кризам при резких переменах погодных условий, температуры, атмосферного давления.
- Снижение адаптивности организма к окружающей среде. Проявляется при переходе из одного в другие часовые пояса, в иные климатические регионы.
- Проблемы со стороны зрения. Ослабление видения, появление тумана, скотом (слепых участков).
- Снижение слуха.
- Шум в ушах и голове без видимого источника. Ощущается субъективно.
- Невозможность концентрации на определенном предмете.
На финальных стадиях болезни наблюдается критическое изменение работы центральной нервной системы.
Уже на второй степени энцефалопатии превалирует определенный синдром. Например, сопровождающийся интеллектуальным дефицитом или нарушениями работы органов чувств и т.д.
На конечной стадии интенсивность симптомов пиковая, приводит к инвалидности, а то и беспомощности пациента. Типично стремительное развитие энцефалопатии у пожилых с преобладанием когнитивных и мнестических нарушений.
Острая форма встречается реже. Как правило, она становится результатом интоксикации, гепатонекроза (отмирания клеток печени), прочих опасных состояний.
Сопровождается теми же симптомами, но в куда более выраженной форме. Как будто расстройство начинается с третьей стадии.
Лечение необходимо проводить быстро, поскольку в противном случае шансов на выживание практически нет или же пациент останется инвалидом на оставшиеся годы.
Причины
Конкретных виновников достаточно. Если говорить о распространенных провокаторах расстройства:
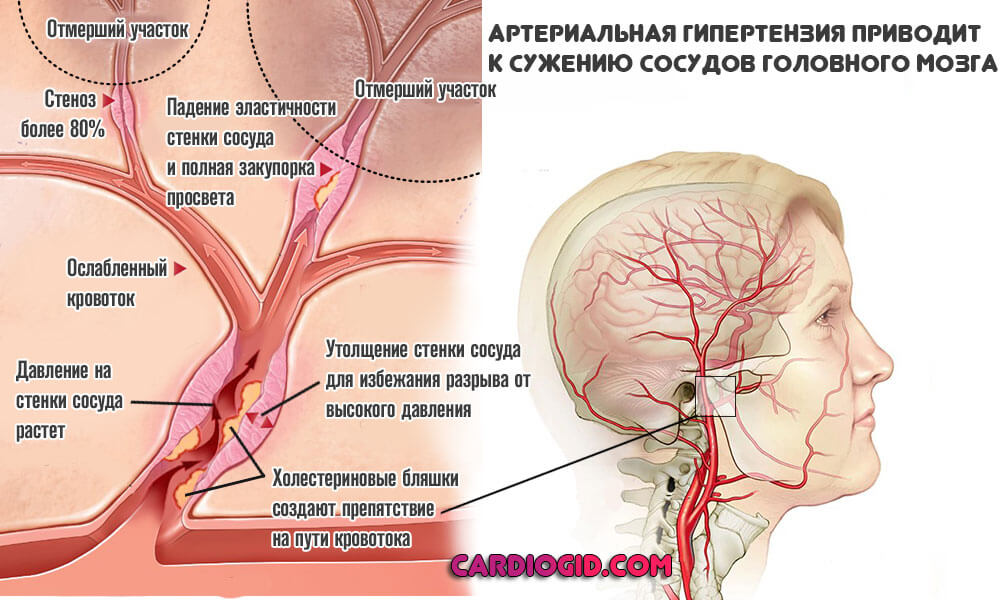
- Гипертоническая болезнь. Стойкое систематическое повышение уровня артериального давления.
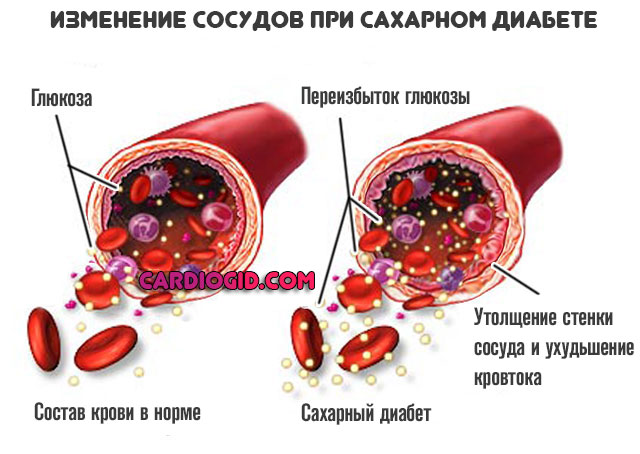
- Сахарный диабет. Нарушение синтеза инсулина или снижение чувствительности тканей организма к нему. Характеризуется сосудистыми проблемами всегда, во всех случаях и независимо от формы процесса.
- Панкреатит. Острое или хроническое воспаление поджелудочной железы, с соответствующим снижением ее функций.
- Патологии печени. В первую очередь, выраженный гепатит или цирроз, некроз тканей органа.
- Расстройства работы эндокринной системы. По типу снижения функциональной активности щитовидной железы, надпочечников и т.д.
- Алкогольная интоксикация. В том числе хроническая, при длительной зависимости от спиртного.
- Прием наркотиков. Некоторые виды стремительно разрушают нервную систему. Как, например, героин или прочие опиоиды. Другие имеют тот же эффект, но нарушают работу ЦНС чуть медленнее (каннабиоиды).
- Травмы головного мозга.
Перечень далеко не полный. Нередко структуры могут повреждаться даже после реанимационных мероприятий, неудачного наркоза, при прочих расстройствах. Вариантов множество.
Диагностика
Обследование проводится под тщательным контролем невролога. По потребности привлекаются прочие специалисты вплоть до профильного хирурга.
Мероприятия стандартные, список расширяется в зависимости от результатов диагностики:
- Опрос больного. Нужно выявить все жалобы. Задача пациента — полностью рассказать о собственном состоянии. Чтобы врач имел возможность составить цельную картину и выдвинуть базовые гипотезы, которые далее будет проверять.
- Сбор анамнеза. Особое значение имеет прием наркотиков, спиртного, перенесенные травмы и заболевания, текущие расстройства и изменения, вредные привычки, образ жизни, повседневная и профессиональная активность, семейная история. Все это учитывается при выявлении вероятного происхождения проблемы.
- Электроэнцефалография. Направлена на оценку характера активности ЦНС.
- Допплерография сосудов шеи и головного мозга. Применяется в рамках комплексной диагностики патологии. Позволяет выявить нарушения церебрального кровотока. Зачастую еще и источник такового.
- По потребности назначаются МРТ. Необходимость возникает не всегда.
- Лабораторные анализы.
Перечень суженный, примерный. Исследований много больше, эти позволяют определить вектор дальнейшей деятельности. Вопрос выбора методик ложится на плечи врача, он же занимается интерпретацией. Один или в тандеме с другими специалистами.
Лечение
Терапия смешанная, поскольку вариантов происхождения заболевания множество. Все зависит от первичного фактора, именно его и нужно устранять.
- Сахарный диабет требует терапии инсулином и диеты. Важно держать уровень глюкозы на стабильных цифрах.
- Гипертензия предполагает назначение специализированных средств. Ингибиторов АПФ, блокаторов кальциевых каналов и прочих медикаментов.
- Эндокринные нарушения корректируются заместительным путем.
- Травмы и сосудистые дисфункции лечатся с помощью препаратов цереброваскулярного ряда.
Если говорить о лечении самой энцефалопатии, назначаются другие группы препаратов:
- Ноотропы. Ускоряют обменные процессы, убирают нарушения метаболизма. Сюда входят такие медикаменты, как Фенибут и Глицин. Также другие.
- Витаминно-минеральные комплексы. В том числе Аевит, Аскорутин. В их задачи входит питание центральной нервной системы.
- Цереброваскулярные для улучшения трофики тканей. Пирацетам, Актовегин.
- По потребности — сосудистые протекторы. Анавенол и прочие. Чтобы защитить артерии, вены и местные капилляры от деструкции.
Препараты для лечения энцефалопатии разнятся (список выше примерный), в основном терапия консервативная. Без радикальных мер.
Но в некоторых случаях не обойтись без хирургического вмешательства. Механического устранения бляшек при их кальцификации или больших размерах, также прочих состояниях.
Прогноз
Благоприятный только на начальной стадии. Возможно полное выздоровление без каких либо последствий. Чем дольше продолжается процесс, тем хуже перспективы.
На второй стадии прогнозы туманные. Излечение уже невозможно.
Все это не приговор. При грамотной комплексной терапии есть шансы перевести заболевание в вялотекущую стадию и компенсировать основные неврологические функции.
Обычно удается отсрочить наступление критической фазы на 5-10 лет. Возможно и неопределенно долгое сохранение нормального положения вещей, в том числе и до конца жизни. Такой прогноз называют условно-благоприятным.
А вот 3-й этап сопряжен с негативным сценарием. Данные приблизительные, слишком много факторов влияет на исход. Подробную информацию лучше получить у своего лечащего врача.
Возможные осложнения
Ключевые последствия энцефалопатии — инсульт, деменция, тотальная инвалидизация пациента с развитием беспомощности. Как итог — смерть от осложнений.
Профилактика
Эффективных мер не существует. Однако можно снизить риски простыми методами, которые применимы ко всем случаям превенции заболеваний церебральных структур:
- Отказ от курения, спиртного, наркотиков.
- Достаточная физическая активность.
- Своевременная борьба со всеми расстройствами.
- Качественный сон.
- Избегание стрессов.
- Правильный витаминизированный рацион.
Энцефалопатия — это сложное заболевание головного мозга, при котором начинается распад и гибель нейронов.
Без следа это не проходит. Чем дольше существует проблема, тем хуже состояние пациента и ниже шансы на восстановление. Коррекция без промедлений — необходимое условие излечения и возвращения к нормальной жизни.
Патогенез печеночной энцефалопатии
Печеночная энцефалопатия может быть серьезным осложнением острой печеночной недостаточности и хронических заболеваний печени, в основном цирроза печени. Гипераммонемия играет важнейшую роль в патогенезе печеночной энцефалопатии. Нарушения гематоэнцефалического барьера, изменения нейротрансмиссии, нейровоспаление, окислительный стресс, нарушения ГАМК-ергических или бензодиазепиновых путей, нейротоксичность марганца, энергетические нарушения мозга и нарушения мозгового кровотока считаются вовлеченными в развитие печеночной энцефалопатии.В последнее время подчеркивается влияние избыточного бактериального роста в тонком кишечнике (СИБР) на индукцию минимальной печеночной энцефалопатии. Цель данной статьи — представить современные взгляды на патогенез печеночной энцефалопатии.
1. Введение
Печеночная энцефалопатия (HE) — это спектр нейропсихиатрических нарушений, наблюдаемых у пациентов с дисфункцией печени после исключения других известных заболеваний головного мозга [1]. Это может быть результатом: острой печеночной недостаточности, портосистемного шунтирования без гепатоцеллюлярной болезни или цирроза печени, портальной гипертензии или портосистемного шунтирования [1].ПЭ проявляется широким спектром нейропсихиатрических нарушений, таких как: нарушения когнитивных, эмоциональных, поведенческих, психомоторных и двигательных функций [2]. Диагноз явной ПЭ ставится на основании клинического обследования. Диагностика минимальной печеночной энцефалопатии (МГЭ) сложна и основана на психометрических тестах [3, 4]. MHE определяется как состояние, при котором у пациента с циррозом печени (независимо от этиологии) количество измеримых нервно-психических расстройств обнаруживается при нормальном психическом и неврологическом статусе к клиническому обследованию [5].MHE ранее назывался ранней, низкой степени, латентной или субклинической печеночной энцефалопатией [6].
2. Эпидемиология печеночной энцефалопатии
Симптомы явной ПЭ наблюдаются примерно у 30–45% пациентов с циррозом печени и у 10–50% пациентов с трансъюгулярными внутрипеченочными портосистемными шунтами (TIPS) [7]. Заболеваемость МГЭ различными авторами оценивается примерно в 30–84% пациентов с циррозом печени в зависимости от применяемых методов диагностики и обследуемой популяции [6, 8, 9].Ромеро-Гомес и др. исследования показали наличие MHE у 53% обследованных пациентов с циррозом печени, у 30% развилась явная энцефалопатия в процессе наблюдения, тогда как у 84% пациентов с явной энцефалопатией в анамнезе заболевания была MHE [10]. Заболеваемость MHE в польской популяции пациентов с циррозом печени оценивается в 17,6–31,3% [11].
Предрасполагающими факторами к развитию HE являются потребление алкоголя, высокий уровень аммиака, цинка и аминокислот с разветвленной цепью, наличие варикозного расширения вен пищевода и MHE [10].Электролитные нарушения, кровотечение из желудочно-кишечного тракта, инфекции, диета с высоким содержанием белка, диуретики и седативные средства могут стимулировать развитие ПЭ [12].
Пациенты с ПЭ могут иметь ряд клинических симптомов, интенсивность которых увеличивается по мере развития ПЭ, таких как: изменения личности, нарушение цикла сна-бодрствования, внимания, концентрации, когнитивных и двигательных функций, таких как замедление психомоторных функций, asterixis [1, 13, 14]. Эти симптомы могут присутствовать хронически, а воздействие факторов, стимулирующих развитие ПЭ, может привести к коме и смерти [15].
3. Патогенез печеночной энцефалопатии
Согласно предыдущим исследованиям, гипераммониемия является основным фактором, ответственным за аномалии головного мозга при ПЭ [16, 17]. Было предложено несколько механизмов, объясняющих влияние аммиака на центральную нервную систему (ЦНС), таких как: специфические взаимодействия между эндотелием головного мозга и астроцитами, модификация транспорта через гематоэнцефалический барьер, изменения в энергетическом обмене, прямое нейротоксическое действие на астроциты и нейрональные мембраны, снижающие синтез свободного глутамата при глутаматергическом нарушении нейротрансмиссии [18–20].
Аммиак является основным субстратом для ряда ферментативных реакций в головном мозге, а также является продуктом некоторых других реакций [17]. Дети с врожденным дефектом фермента цикла мочевины имеют высокую концентрацию аммиака в сыворотке, что, если ее не лечить, приводит к развитию тяжелых неврологических симптомов, судорог и комы, а у выживших — умственная отсталость и паралич головного мозга [17]. . Полный цикл мочевины имеет место в печени, хотя некоторые из этапов могут выполняться в других тканях, включая мозг [17].Было показано, что при циррозе печени активность ферментов цикла мочевины и глутаминсинтетазы в головном мозге снижается [17, 21]. Поскольку мозг не оснащен эффективным циклом мочевины, аммиак удаляется в основном в процессе синтеза глутамина (Gln) из глутамата (Glu) и аммиака с участием глутаминсинтетазы, локализованной почти исключительно в астроцитах [22]. Набухание астроцитов, вторичное по отношению к осмотическим эффектам Gln, в результате приводит к отеку мозга [23]. Поэтому обсуждается концепция терапии ингибитором глутаминсинтетазы мозга [24].
Аммиак влияет также на другие механизмы, приводящие к развитию печеночной энцефалопатии, такие как: нарушение гематоэнцефалического барьера, изменения нейротрансмиссии, провоспалительные цитокины, окислительный стресс, аномалии ГАМК-ергических или бензодиазепиновых путей, нарушение энергетического метаболизма головного мозга и нарушение церебральный кровоток [6, 19, 25–27].
3.1. Аммиак и гематоэнцефалический барьер
Гематоэнцефалический барьер (ГЭБ) образован эндотелиальными клетками, выстилающими микрососуды головного мозга [18, 28].ГЭБ играет важную роль в регуляции гомеостаза микросреды мозга, необходимой для стабильной и скоординированной активности нейронов [29]. Он защищает мозг от вредных факторов, таких как колебания компонентов плазмы крови и нейротрансмиттеров, проникновение ксенобиотиков и токсинов [29, 30]. BBB обеспечивает селективный транспорт веществ из крови в мозг путем диффузии и активного транспорта через эндотелиальные клетки [29, 30]. ГЭБ играет ключевую роль в доставке питательных веществ в мозг и удалении ненужных продуктов, регулирует ионный гомеостаз и позволяет поддерживать отдельный пул нейротрансмиттеров и нейроактивных веществ в CSN, в периферических тканях и в крови [18, 31, 32] .Ряд веществ, таких как аммиак, серотонин, брадикинин, аденозин, пуриновые нуклеотиды, интерлейкины, свободные радикалы, оксид азота и стероиды, могут влиять на функцию эндотелия мозга и плотность ГЭБ [18, 25].
Аммиак — нейротоксин, ответственный за развитие HE за счет прямого воздействия на метаболизм и функции ЦНС и влияющий на прохождение различных молекул через гематоэнцефалический барьер, транспорт аминокислот с разветвленной цепью и ароматических аминокислот (AA) , приток которого увеличивается за счет образования Gln в процессе детоксикации аммиака [25].
Нарушения транспорта АК влияют на синтез катехоламинов головного мозга (серотонин и дофамин) и продукцию «ложных нейротрансмиттеров» (октопамин и фенилэтиламин), что приводит к нарушению ГАМК-ергической, серотонинергической и глутаматергической нейротрансмиссии [15, 25].
3.2. Гипераммонемия и острая печеночная недостаточность
При острой печеночной недостаточности (ОПН), которая может быть результатом гепатотропной вирусной инфекции или токсического поражения, функция детоксикации печени резко снижается из-за массивного некроза гепатоцитов.Это приводит к гипераммониемии и развитию ПЭ, характеризующимся быстрым прогрессированием симптомов от дискретных изменений психического статуса до ступора и комы.
Нейропатологические исследования показали, что основной причиной смерти при ОПН была церебральная грыжа с отеком мозга в результате набухания астроцитов [33–36].
Патогенез набухания астроцитов в ОПН до конца не изучен. Гипераммонемия, застой в головном мозге, воспаление в ткани мозга и системная воспалительная реакция играют важную роль в набухании астроцитов [36].На начальной стадии у пациента нормальное или повышенное внутричерепное давление, которое можно «контролировать» с помощью маннита, но дальнейшее прогрессирование печеночной недостаточности приводит к «неконтролируемой» стадии, требующей трансплантации печени [37].
Был проведен ряд исследований на животных, оценивающих целостность гематоэнцефалического барьера при ОПН. Результаты указывают на многофакторный механизм энцефалопатии и отека головного мозга, в патогенезе которых существенное значение имеет нарушение гематоэнцефалического барьера [38–43].
Исследований на эту тему на людях гораздо меньше.
Тофтенг и Ларсен с помощью техники церебрального микродиализа изучали биохимические изменения в головном мозге пациента с ОПН при трансплантации печени [44]. Они показали увеличение концентрации лактата во внеклеточном пространстве с надлежащим насыщением и повышенными концентрациями глутамата и глицерина, которые снизились после трансплантации. Это указывает на нарушения нейротрансмиссии глутамата и потока лактата через кровь-мозг при ОПН [44].
Като и др. исследовали биопсии головного мозга 9 пациентов, умерших от ОПН, с помощью сканирующей электронной микроскопии и показали наличие изменений, указывающих на то, что цитотоксический механизм с клеточным отеком, по-видимому, является основной причиной отека мозга [45]. Вазогенный механизм с нарушением проницаемости ГЭБ оказывается менее важным в развитии отека мозга при ОПН [45].
Kumar et al. проанализировали влияние артериальной гипераммониемии на осложнения и исходы в группе из 295 пациентов с ОПН [46].Они обнаружили, что стойкая артериальная гипераммониемия увеличивает риск осложнений и смертности у пациентов с ОПЧ [46]. Острая нейротоксичность аммиака, которая может спровоцировать судороги у пациентов с ОПН, является результатом повышенного высвобождения глутамата в нейрональных синапсах с чрезмерной активацией рецепторов глутамата, особенно NMDA (N-метил-D-аспарагиновый рецептор) [47].
3.3. Нейротрансмиссия при печеночной энцефалопатии
Согласно Albrecht et al. при HE, ассоциированном с хроническим заболеванием печени, наблюдается дисбаланс между возбуждающей и тормозной нейротрансмиссией [47].Преобладание торможения связано со снижением экспрессии рецепторов Glu, что приводит к снижению глутаматергического тонуса [47]. Кроме того, инактивация транспортера глутамата GLT-1 у пациентов с гипераммониемией вызывает нарушение обратного захвата Glu в астроциты с последующим чрезмерным внесинаптическим накоплением Glu [47].
γ -аминомасляная кислота (ГАМК) — еще один фактор, увеличивающий тормозную нейротрансмиссию посредством различных механизмов: повышенные уровни эндогенных бензодиазепинов, повышенная доступность ГАМК в рецепторах ГАМК-А из-за повышенного синаптического высвобождения аминокислоты, прямое взаимодействие повышенного уровень аммиака с рецепторным комплексом ГАМК-А-бензодиазепин и индуцированная аммиаком активация астроцитарных периферических бензодиазепиновых рецепторов (PBZR) [47].
Другая гипотеза предполагает, что HE может быть следствием ингибирования комплексного ГАМК-бензодиазепинового рецептора бензодиазепиноподобными лигандами, которые обладают высоким сродством к этим рецепторам [48]. Эта теория подтверждается тем фактом, что применение флумазенила-конкурентного антагониста бензодиазепиновых рецепторов значительно улучшает клинический статус пациентов [49].
3.4. Гипераммонемия и нейростероиды
Гипераммонемия также может быть ответственной за повышение концентрации нейростероидов [15, 50].В экспериментальных исследованиях добавление аммиака к культуре астроцитов увеличивает уровень прегненолона [51, 52].
Ahboucha et al. продемонстрировали повышенную концентрацию аллопрегнанолона, сильно ингибирующего нейростероид, который стимулирует митохондриальные бензодиазепиновые рецепторы периферического типа (PTBR) в головном мозге пациентов с HE [53]. Повышенный уровень нейростероидов, стимулирующих рецепторы ГАМК-А, может быть ответственным за повышенный ГАМК-ергический тонус, наблюдаемый при ПЭ [15, 54]. Этот механизм может объяснять снижение двигательных навыков, проблемы с координацией, замедленную психомоторную гипокинезию и тремор, наблюдаемые при HE [55].Эти нарушения двигательной функции могут нарушать повседневное функционирование пациентов [56].
3.5. Гипераммонемия и окислительный стресс
Гипераммонемия может также оказывать прямое токсическое действие на мембраны нейронов [19]. Исследования у пациентов с портосистемным анастомозом показали непропорционально высокий уровень аммиака в некоторых областях мозга, таких как кора головного мозга, что может нарушать целостность астроцитов [20].
Исследование Sinke et al. на культурах астроцитов доказано участие ядерного фактора κ B (NF κ B), активируемого окислительным стрессом, в индуцированном аммиаком набухании астроцитов.Активация NF κ B была связана с повышенной экспрессией белка индуцибельной синтазы оксида азота (iNOS) и последующим образованием оксида азота (NO) [57].
Согласно Nörenberg et al., Окислительный стресс, вызванный аммиаком, является основным патогенным фактором в патогенезе ALF HE и вызывает целый каскад событий, ведущих к набуханию клеток и отеку мозга [58]. Однако энцефалопатия при хроническом заболевании печени не сопровождается отеком мозга [58, 59]. Возможно, это связано с тем, что вместе с накоплением воды в астроцитах в результате осмотического действия GLN из астроцитов высвобождается миоинозитол (Ins) -органический осмолит, поэтому его концентрация в астроцитах уменьшается, предотвращая изменение объема клеток [ 60].
3.6. Гипераммонемия и нейровоспаление
Нейровоспаление — это новый элемент патогенеза HE, описанный на животных моделях, который, по-видимому, играет важную роль в развитии когнитивных нарушений, которые могут сохраняться после трансплантации печени [61].
Shawcross et al. исследования у пациентов с циррозом печени показали, что воспаление и медиаторы воспаления могут значительно модулировать влияние аммиака на ЦНС (значительное ухудшение психометрического теста и улучшение после исчезновения воспаления) [62].Воспаление является важным фактором, определяющим наличие и тяжесть нейропсихологической дисфункции при МГЭ, вызванной аммиаком, то есть более значимой при более тяжелом воспалении [63].
Отмечено значительное увеличение провоспалительных цитокинов TNF- α и IL-6 в сыворотке крови пациентов с MHE [26].
Альварес и др. исследование культур астроцитов показало, что провоспалительные цитокины, такие как TNF- α , IL-1 β , IL-6 и IF- γ , и аммиак вызывают повышение проницаемости митохондрий и могут быть важным фактором в патогенез ПЭ [64].
Повышенный переход митохондриальной проницаемости приводит к уменьшению ионных градиентов и усилению митохондриальной дисфункции, что приводит к энергетическим расстройствам мозга, которые могут быть потенциальной мишенью для терапии [64–67].
Аммиак оказывает нейротоксическое действие на астроциты головного мозга, кроме того, нарушения энергетического уровня клеток и окислительный стресс усиливают HE. Изменение проницаемости митохондриальной мембраны астроцитов под действием аммиака и Gln может быть важным механизмом формирования церебральных нарушений, связанных с HE [66, 67].Невропатологические нарушения как при остром, так и при хроническом поражении печени затрагивают в основном астроциты [68].
Астроциты, составляющие примерно 1/3 объема коры головного мозга и играющие решающую роль в гематоэнцефалическом барьере, участвуют в поддержании гомеостаза электролитов, удаляют свободные радикалы и отвечают за доставку питательных веществ и предшественников нейротрансмиттеров в организм человека. нейроны [69]. Астроциты играют роль в поддержании как концентрации ионов, так и объема воды и, следовательно, осмолярности внеклеточного пространства мозга, а также благодаря большой емкости и способности регулировать и поддерживать постоянный объем мозга [68].Гипераммонемия вызывает набухание астроцитов, активацию микроглии и развитие астроцитоза типа II по болезни Альцгеймера [70, 71]. В частности, изменение морфологии астроглии характерно для HE: отек и наличие клеток с фенотипом астроцитов типа II Альцгеймера с одновременным изменением экспрессии генов, кодирующих регуляторные белки, контролирующие энергетическое состояние, объем клеток и нейротрансмиссию [71] .
Астроциты болезни Альцгеймера II типа обнаруживаются в сером и белом веществе мозга и подкорковых ядер и могут иметь различные формы, свидетельствующие о гиперплазии [70].Количество астроцитов Альцгеймера II типа коррелирует с интенсивностью энцефалопатии [19, 70].
Исследования с использованием электронного микроскопа на модели портосистемной печеночной энцефалопатии на животных показали, что астроциты до комы характеризуют повышенное количество цитоплазмы, пролиферацию митохондрий и эндоплазматического ретикулума, а также накопление гликогена в цитоплазме клетки, в то время как астроциты типа комы II наблюдалась при наличии дегенеративных изменений митохондрий и наличии крупных бледных ядер с видимыми ядрышками [72].Эти наблюдения могут свидетельствовать о том, что аммиак первоначально вызывает метаболическую активность астроцитов, а затем и развитие глиопатии. Присутствие астроцитов Альцгеймера II типа может быть причиной необратимости изменений [50]. В результате воздействия аммиака в астроцитах происходят некоторые глубокие изменения, касающиеся поглощения нейротрансмиттеров и ионов, которые изменяют свойства астроглия и вызывают его дисфункцию — первичную глиопатию, приводящую к энцефалопатии [33, 50, 70].
3.7. Аммиак и энергетический метаболизм мозга
Другой причиной HE может быть дисфункция нейронов в результате аномальных взаимодействий между нейронами и астроцитами и нарушения энергетического метаболизма мозга [65, 67]. Аммиак изменяет транспорт предшественников оксида азота, аргинина и орнитина (аминокислоты, связывающие аммиак) через гематоэнцефалический барьер и влияет на транспорт энергетического субстрата для мозга, креатина и глюкозы [25].
Церебральный энергетический метаболизм и синтез Gln зависят от поступления глюкозы в мозг, а функциональная активность мозга зависит от степени использования глюкозы [73].Изменения утилизации глюкозы в головном мозге были замечены у пациентов с циррозом печени: уменьшение коры головного мозга и увеличение базальных ганглиев и мозжечка, что могло быть причиной когнитивной дисфункции [74, 75].
Язган и др. сообщили о значительном уменьшении кровотока через таламус и увеличении кровотока через лобные доли пациентов с циррозом печени по сравнению со здоровыми добровольцами [76]. В другом исследовании описывается перераспределение кровотока из коры головного мозга в подкорковые области у пациентов с циррозом печени [75].Исследования с использованием магнитно-резонансной томографии показали увеличение мозгового кровотока и уменьшение среднего времени кровотока в базальных ганглиях и таламусе у пациентов с MHE, что согласуется с концепцией перераспределения крови из коры в базальные ганглии [27] .
Результаты исследования роли местного кровотока в развитии МГЭ неубедительны.
3.8. Нейротоксические эффекты марганца
Также было замечено накопление токсинов в головном мозге, в том числе марганца, отложение которого в базальных ганглиях может быть причиной гиперинтенсивных сигналов на Т1-изображениях при магнитно-резонансной томографии (МРТ) [77–79].У пациентов с циррозом печени, у которых имеется портокавальный анастомоз или TIPS, гиперинтенсивные сигналы в бледном шаре (88% пациентов), а также повышенная концентрация марганца в сыворотке (67% пациентов) и экстрапирамидные симптомы, такие как тремор, ригидность и акинезия ( 89% пациентов) [80]. Нарушения гомеостаза марганца и других минералов могут быть причиной когнитивных нарушений, связанных с циррозом печени [81–83].
Кулисевский и др. На МРТ головного мозга пациентов с циррозом печени помимо усиления сигналов в бледном шаре обнаружена атрофия головного мозга, которая не коррелировала ни с возрастом пациентов, ни с длительностью заболевания, ни с количеством баллов в шкале Чайлд-Пью [84].Отмечена положительная корреляция между степенью атрофии мозга и уровнем аммиака [84]. Описан случай пациентки с 23-летним анамнезом портокавального анастомоза (ПКА), сделанного после второго кровотечения из варикозно расширенных вен пищевода. В течение 12 лет у него были выраженные психоневрологические расстройства и прогрессирующая дегенерация головного мозга в течение 12 лет HE со значительной абстинентностью после трансплантации печени; следовательно, эти состояния не должны быть противопоказанием для трансплантации печени [85].
3.9. Избыточный бактериальный рост тонкого кишечника (SIBO) в развитии печеночной энцефалопатии
Недавно была подчеркнута роль SIBO в развитии MHE [86, 87].
Gupta et al. исследование продемонстрировало высокую распространенность СИБР у пациентов с МПГ (38,6%), что свидетельствует о терапевтическом использовании прокинетиков, невсасывающихся антибиотиков и пробиотиков [86].
Jun et al. обнаружили очень высокую распространенность СИБР (81,3%) у пациентов с циррозом печени и асцитом, что может свидетельствовать о том, что СИБР может быть высоким фактором риска бактериальной транслокации у пациентов с асцитом [87].
4. Заключение
Патогенез HE сложен, и пока ни одна из предложенных гипотез не подчеркивает роль гипераммониемии и воспаления, а также роль провоспалительных цитокинов, нарушения нейротрансмиссии, ложных нейротрансмиттеров, окислительного стресса, изменений мозгового кровотока. , или энергетический метаболизм мозга не полностью объясняет все связанные с ним явления.
Результаты исследований за последние несколько лет показывают ключевую роль гематоэнцефалического барьера в развитии заболеваний, связанных с HE, но большинство из них — исследования на животных.Поэтому необходимо разработать современные методы диагностики, позволяющие оценить метаболизм мозга человека.
Лучшее понимание патогенеза энцефалопатии у пациентов с острой и хронической печеночной недостаточностью, ранняя диагностика MHE и новые методы лечения, основанные на этих знаниях, предотвратят развитие явной энцефалопатии и нейропсихиатрических расстройств.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
.
Портосистемная энцефалопатия | определение портосистемной энцефалопатии по Медицинскому словарю
энцефалопатия
[en-sef ″ ah-lop´ah-the]
любое дегенеративное заболевание головного мозга.
билиарная энцефалопатия ( билирубиновая энцефалопатия ) ядерная желтуха. губчатая энцефалопатия крупного рогатого скота прионная болезнь взрослого крупного рогатого скота на Британских островах с неврологическими симптомами. Он передается с кормом, содержащим белок в виде мясокостной муки, полученной от инфицированных животных.Этиологический агент также является причиной нового варианта болезни Крейтцфельдта-Якоба. Вызывается также коровьим бешенством. боксерская энцефалопатия ( боксерская травматическая энцефалопатия ) синдром, вызванный кумулятивными ударами в голову, поглощенными боксерским рингом, характеризующийся замедлением умственных функций, случайными приступами спутанности сознания и рассеянной потерей памяти. Это может прогрессировать до более серьезного слабоумия боксера. См. Также постконтузионный синдром. диализная энцефалопатия дегенеративное заболевание головного мозга, связанное с длительным использованием гемодиализа, характеризующееся нарушениями речи и постоянными миоклоническими подергиваниями, переходящим в глобальную деменцию.
печеночная энцефалопатия состояние, обычно возникающее на фоне прогрессирующего заболевания печени, отмеченное нарушениями сознания, которые могут прогрессировать до глубокой комы (печеночной комы), психиатрическими изменениями различной степени, хлопающим тремором и плодом печени.
ВИЧ-энцефалопатия ( ВИЧ-ассоциированная энцефалопатия ) прогрессирующая первичная энцефалопатия, вызванная инфицированием вирусом иммунодефицита человека типа I, проявляющаяся различными когнитивными, моторными и поведенческими отклонениями.Вызывается также СПИД-энцефалопатией.
гипернатремическая энцефалопатия тяжелая геморрагическая энцефалопатия, вызванная гиперосмолярностью, сопровождающей гипернатриемию и обезвоживание.
гипертоническая энцефалопатия комплекс церебральных явлений, таких как головная боль, судороги и кома, возникающих при злокачественной гипертензии.
гипоксическая энцефалопатия энцефалопатия, вызванная гипоксией либо из-за снижения скорости кровотока, либо из-за снижения содержания кислорода в артериальной крови; Легкие случаи вызывают временные интеллектуальные, зрительные и двигательные нарушения, а тяжелые могут вызвать необратимое повреждение мозга в течение пяти минут.Вызывается также аноксической энцефалопатией. подострая губчатая энцефалопатия ( трансмиссивная губчатая энцефалопатия ) прионная болезнь. энцефалопатия Вернике неврологическое расстройство, характеризующееся спутанностью сознания, апатией, сонливостью, атаксией походки, нистагмом и офтальмоплегией; это происходит из-за дефицита тиамина, обычно из-за хронического злоупотребления алкоголем. Он почти всегда сопровождается синдромом Корсакова или сопровождается им, а также часто сопровождается другими пищевыми полинейропатиями.См. Также синдром Вернике-Корсакова. .
Портосистемная энцефалопатия — определение — Английский
Пример предложений с «портосистемной энцефалопатией», память переводов

 WikiMatrix Азотные отходы накапливаются в системном кровотоке (отсюда старый термин «портосистемная энцефалопатия»).
WikiMatrix Азотные отходы накапливаются в системном кровотоке (отсюда старый термин «портосистемная энцефалопатия»). 
 springer Заболеваемость портосистемной энцефалопатией после SRS составила 29%.
springer Заболеваемость портосистемной энцефалопатией после SRS составила 29%. 
 springer Восемь пациентов с тяжелой портосистемной энцефалопатией (PSE) лечились с помощью редукционного стента.
springer Восемь пациентов с тяжелой портосистемной энцефалопатией (PSE) лечились с помощью редукционного стента. 
 springer У неоперированных пациентов не развивается портосистемная энцефалопатия (PSE).
springer У неоперированных пациентов не развивается портосистемная энцефалопатия (PSE).
 springer Спленэктомия была хирургической процедурой, показывающей самый высокий уровень повторного кровотечения (54,3%), а портокавальный шунт имел самую высокую частоту PSE (60%). Заболеваемость портосистемной энцефалопатией после SRS составила 29%.
springer Спленэктомия была хирургической процедурой, показывающей самый высокий уровень повторного кровотечения (54,3%), а портокавальный шунт имел самую высокую частоту PSE (60%). Заболеваемость портосистемной энцефалопатией после SRS составила 29%. 
 WikiMatrix Существуют различные объяснения того, почему дисфункция печени или портосистемное шунтирование могут привести к энцефалопатии.
WikiMatrix Существуют различные объяснения того, почему дисфункция печени или портосистемное шунтирование могут привести к энцефалопатии. 
 springer В отличие от классических операций портосистемного шунтирования, этот обходной анастомоз восстанавливает физиологический кровоток в воротной вене, что позволяет избежать возможных последствий длительного портосистемного шунтирования и энцефалопатии низкой степени.
springer В отличие от классических операций портосистемного шунтирования, этот обходной анастомоз восстанавливает физиологический кровоток в воротной вене, что позволяет избежать возможных последствий длительного портосистемного шунтирования и энцефалопатии низкой степени.
 WikiMatrix В 1950-х годах в нескольких отчетах перечислялись многочисленные нарушения, о которых сообщалось ранее, и подтверждалась ранее высказанная теория о том, что метаболические нарушения и портосистемное шунтирование являются основным механизмом печеночной энцефалопатии и что богатые азотом соединения происходят из кишечника.
WikiMatrix В 1950-х годах в нескольких отчетах перечислялись многочисленные нарушения, о которых сообщалось ранее, и подтверждалась ранее высказанная теория о том, что метаболические нарушения и портосистемное шунтирование являются основным механизмом печеночной энцефалопатии и что богатые азотом соединения происходят из кишечника. 
 WikiMatrixГепатическая энцефалопатия может также возникнуть после создания трансъюгулярного внутрипеченочного портосистемного шунта (TIPS).
WikiMatrixГепатическая энцефалопатия может также возникнуть после создания трансъюгулярного внутрипеченочного портосистемного шунта (TIPS). 
 springer Если парацентез большого объема не помогает избавиться от асцита, пациенты могут быть представлены к одному из трех следующих хирургических вариантов: портосистемное шунтирование, перитонеовенозное шунтирование или трансплантация печени Портосистемное шунтирование эффективно при устранении асцита, но оно связано с высокой частотой энцефалопатии и печеночной недостаточности.
springer Если парацентез большого объема не помогает избавиться от асцита, пациенты могут быть представлены к одному из трех следующих хирургических вариантов: портосистемное шунтирование, перитонеовенозное шунтирование или трансплантация печени Портосистемное шунтирование эффективно при устранении асцита, но оно связано с высокой частотой энцефалопатии и печеночной недостаточности.
 WikiMatrix Другие связанные с печенью осложнения (портальная гипертензия, варикозное расширение вен пищевода, асцит, печеночная энцефалопатия) лечат теми же методами, что и при циррозе, хотя лечение трансъюгулярным внутрипеченочным портосистемным шунтом не рекомендуется из-за отсутствия документально подтвержденных преимуществ.
WikiMatrix Другие связанные с печенью осложнения (портальная гипертензия, варикозное расширение вен пищевода, асцит, печеночная энцефалопатия) лечат теми же методами, что и при циррозе, хотя лечение трансъюгулярным внутрипеченочным портосистемным шунтом не рекомендуется из-за отсутствия документально подтвержденных преимуществ. 
 springer Гепатическая энцефалопатия (HE) определяется как неврологические или нейропсихологические проявления, связанные с острой или хронической печеночной недостаточностью и / или с портосистемными шунтами.
springer Гепатическая энцефалопатия (HE) определяется как неврологические или нейропсихологические проявления, связанные с острой или хронической печеночной недостаточностью и / или с портосистемными шунтами.
 springer Печеночная недостаточность, асцит, энцефалопатия, рецидивирующие кровотечения и тромбоз шунта возникают рано; энцефалопатия, прогрессирование цирроза печени, тромбоз шунта, рецидивирующее кровотечение и гастродуоденальная язва также являются поздними синдромами после операции портосистемного шунта.
springer Печеночная недостаточность, асцит, энцефалопатия, рецидивирующие кровотечения и тромбоз шунта возникают рано; энцефалопатия, прогрессирование цирроза печени, тромбоз шунта, рецидивирующее кровотечение и гастродуоденальная язва также являются поздними синдромами после операции портосистемного шунта. 
 Обычное ползание Трансъюгулярные внутрипеченочные портосистемные стент-шунты эффективно снижали риск повторного накопления асцитной жидкости, но были связаны с повышенным риском печеночной энцефалопатии.
Обычное ползание Трансъюгулярные внутрипеченочные портосистемные стент-шунты эффективно снижали риск повторного накопления асцитной жидкости, но были связаны с повышенным риском печеночной энцефалопатии.
 спрингер Всего 28 пациентов с циррозом печени с портосистемным анастомозом сравнивали с 38 пациентами с циррозом без портосистемных шунтов в отношении их психического состояния и биохимических параметров, важных для печеночной энцефалопатии.
спрингер Всего 28 пациентов с циррозом печени с портосистемным анастомозом сравнивали с 38 пациентами с циррозом без портосистемных шунтов в отношении их психического состояния и биохимических параметров, важных для печеночной энцефалопатии. 
 springer Гепатическая энцефалопатия (HE) — это заболевание центральной нервной системы, которое может возникать как осложнение острого или хронического заболевания печени и / или портосистемного коллатерального кровообращения и охватывает широкий спектр когнитивных, умственных и моторных изменений.
springer Гепатическая энцефалопатия (HE) — это заболевание центральной нервной системы, которое может возникать как осложнение острого или хронического заболевания печени и / или портосистемного коллатерального кровообращения и охватывает широкий спектр когнитивных, умственных и моторных изменений.
 springer Если эндоскопическая терапия не контролирует кровотечение из варикозно расширенных вен, портосистемное шунтирование предлагает эффективную терапию, которая позволяет избежать повторных кровотечений и повторных эндоскопий в течение многих лет и улучшает гиперспленизм без ухудшения функции печени или энцефалопатии.
springer Если эндоскопическая терапия не контролирует кровотечение из варикозно расширенных вен, портосистемное шунтирование предлагает эффективную терапию, которая позволяет избежать повторных кровотечений и повторных эндоскопий в течение многих лет и улучшает гиперспленизм без ухудшения функции печени или энцефалопатии.
Показаны страницы 1. Найдено 17 предложения с фразой портосистемная энцефалопатия.Найдено за 4 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Найдено за 0 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Они поступают из многих источников и не проверяются.Имейте в виду.
.
Портосистемная энцефалопатия — определение — Английский
Пример предложений с «портосистемной энцефалопатией», память переводов

 WikiMatrix Азотные отходы накапливаются в системном кровотоке (отсюда старый термин «портосистемная энцефалопатия»).
WikiMatrix Азотные отходы накапливаются в системном кровотоке (отсюда старый термин «портосистемная энцефалопатия»). 
 springer Заболеваемость портосистемной энцефалопатией после SRS составила 29%.
springer Заболеваемость портосистемной энцефалопатией после SRS составила 29%. 
 springer Восемь пациентов с тяжелой портосистемной энцефалопатией (PSE) лечились с помощью редукционного стента.
springer Восемь пациентов с тяжелой портосистемной энцефалопатией (PSE) лечились с помощью редукционного стента. 
 springer У неоперированных пациентов не развивается портосистемная энцефалопатия (PSE).
springer У неоперированных пациентов не развивается портосистемная энцефалопатия (PSE).
 springer Спленэктомия была хирургической процедурой, показывающей самый высокий уровень повторного кровотечения (54,3%), а портокавальный шунт имел самую высокую частоту PSE (60%). Заболеваемость портосистемной энцефалопатией после SRS составила 29%.
springer Спленэктомия была хирургической процедурой, показывающей самый высокий уровень повторного кровотечения (54,3%), а портокавальный шунт имел самую высокую частоту PSE (60%). Заболеваемость портосистемной энцефалопатией после SRS составила 29%. 
 WikiMatrix Существуют различные объяснения того, почему дисфункция печени или портосистемное шунтирование могут привести к энцефалопатии.
WikiMatrix Существуют различные объяснения того, почему дисфункция печени или портосистемное шунтирование могут привести к энцефалопатии. 
 springer В отличие от классических операций портосистемного шунтирования, этот обходной анастомоз восстанавливает физиологический кровоток в воротной вене, что позволяет избежать возможных последствий длительного портосистемного шунтирования и энцефалопатии низкой степени.
springer В отличие от классических операций портосистемного шунтирования, этот обходной анастомоз восстанавливает физиологический кровоток в воротной вене, что позволяет избежать возможных последствий длительного портосистемного шунтирования и энцефалопатии низкой степени.
 WikiMatrix В 1950-х годах в нескольких отчетах перечислялись многочисленные нарушения, о которых сообщалось ранее, и подтверждалась ранее высказанная теория о том, что метаболические нарушения и портосистемное шунтирование являются основным механизмом печеночной энцефалопатии и что богатые азотом соединения происходят из кишечника.
WikiMatrix В 1950-х годах в нескольких отчетах перечислялись многочисленные нарушения, о которых сообщалось ранее, и подтверждалась ранее высказанная теория о том, что метаболические нарушения и портосистемное шунтирование являются основным механизмом печеночной энцефалопатии и что богатые азотом соединения происходят из кишечника. 
 WikiMatrixГепатическая энцефалопатия может также возникнуть после создания трансъюгулярного внутрипеченочного портосистемного шунта (TIPS).
WikiMatrixГепатическая энцефалопатия может также возникнуть после создания трансъюгулярного внутрипеченочного портосистемного шунта (TIPS). 
 springer Если парацентез большого объема не помогает избавиться от асцита, пациенты могут быть представлены к одному из трех следующих хирургических вариантов: портосистемное шунтирование, перитонеовенозное шунтирование или трансплантация печени Портосистемное шунтирование эффективно при устранении асцита, но оно связано с высокой частотой энцефалопатии и печеночной недостаточности.
springer Если парацентез большого объема не помогает избавиться от асцита, пациенты могут быть представлены к одному из трех следующих хирургических вариантов: портосистемное шунтирование, перитонеовенозное шунтирование или трансплантация печени Портосистемное шунтирование эффективно при устранении асцита, но оно связано с высокой частотой энцефалопатии и печеночной недостаточности.
 WikiMatrix Другие связанные с печенью осложнения (портальная гипертензия, варикозное расширение вен пищевода, асцит, печеночная энцефалопатия) лечат теми же методами, что и при циррозе, хотя лечение трансъюгулярным внутрипеченочным портосистемным шунтом не рекомендуется из-за отсутствия документально подтвержденных преимуществ.
WikiMatrix Другие связанные с печенью осложнения (портальная гипертензия, варикозное расширение вен пищевода, асцит, печеночная энцефалопатия) лечат теми же методами, что и при циррозе, хотя лечение трансъюгулярным внутрипеченочным портосистемным шунтом не рекомендуется из-за отсутствия документально подтвержденных преимуществ. 
 springer Гепатическая энцефалопатия (HE) определяется как неврологические или нейропсихологические проявления, связанные с острой или хронической печеночной недостаточностью и / или с портосистемными шунтами.
springer Гепатическая энцефалопатия (HE) определяется как неврологические или нейропсихологические проявления, связанные с острой или хронической печеночной недостаточностью и / или с портосистемными шунтами.
 springer Печеночная недостаточность, асцит, энцефалопатия, рецидивирующие кровотечения и тромбоз шунта возникают рано; энцефалопатия, прогрессирование цирроза печени, тромбоз шунта, рецидивирующее кровотечение и гастродуоденальная язва также являются поздними синдромами после операции портосистемного шунта.
springer Печеночная недостаточность, асцит, энцефалопатия, рецидивирующие кровотечения и тромбоз шунта возникают рано; энцефалопатия, прогрессирование цирроза печени, тромбоз шунта, рецидивирующее кровотечение и гастродуоденальная язва также являются поздними синдромами после операции портосистемного шунта. 
 Обычное ползание Трансъюгулярные внутрипеченочные портосистемные стент-шунты эффективно снижали риск повторного накопления асцитной жидкости, но были связаны с повышенным риском печеночной энцефалопатии.
Обычное ползание Трансъюгулярные внутрипеченочные портосистемные стент-шунты эффективно снижали риск повторного накопления асцитной жидкости, но были связаны с повышенным риском печеночной энцефалопатии.
 спрингер Всего 28 пациентов с циррозом печени с портосистемным анастомозом сравнивали с 38 пациентами с циррозом без портосистемных шунтов в отношении их психического состояния и биохимических параметров, важных для печеночной энцефалопатии.
спрингер Всего 28 пациентов с циррозом печени с портосистемным анастомозом сравнивали с 38 пациентами с циррозом без портосистемных шунтов в отношении их психического состояния и биохимических параметров, важных для печеночной энцефалопатии. 
 springer Гепатическая энцефалопатия (HE) — это заболевание центральной нервной системы, которое может возникать как осложнение острого или хронического заболевания печени и / или портосистемного коллатерального кровообращения и охватывает широкий спектр когнитивных, умственных и моторных изменений.
springer Гепатическая энцефалопатия (HE) — это заболевание центральной нервной системы, которое может возникать как осложнение острого или хронического заболевания печени и / или портосистемного коллатерального кровообращения и охватывает широкий спектр когнитивных, умственных и моторных изменений.
 springer Если эндоскопическая терапия не контролирует кровотечение из варикозно расширенных вен, портосистемное шунтирование предлагает эффективную терапию, которая позволяет избежать повторных кровотечений и повторных эндоскопий в течение многих лет и улучшает гиперспленизм без ухудшения функции печени или энцефалопатии.
springer Если эндоскопическая терапия не контролирует кровотечение из варикозно расширенных вен, портосистемное шунтирование предлагает эффективную терапию, которая позволяет избежать повторных кровотечений и повторных эндоскопий в течение многих лет и улучшает гиперспленизм без ухудшения функции печени или энцефалопатии.
Показаны страницы 1. Найдено 17 предложения с фразой портосистемная энцефалопатия.Найдено за 5 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Найдено за 0 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Они поступают из многих источников и не проверяются.Имейте в виду.
.
