Гормональные исследования во время беременности / Няня.ru
27.02.2012
Нона Овсепян, врач-консультант Независимой лаборатории ИНВИТРО
Зачем необходимо контролировать уровень гормонов?
Гормоны – удивительные биологически активные вещества, которые влияют не только на состояние здоровья, но и на внутренний мир человека. Природой предусмотрено, что в женском организме сразу после зачатия активизируются специальные гормоны беременности, которые не только помогают малышу полноценно развиваться, но также настраивают будущую маму на желанное материнство, учат любить растущего внутри кроху и привыкать заботиться о нем.
В период ожидания малыша происходят серьезные изменения во всем организме женщины — особенно это касается ее гормонального фона. Изменения происходят во всей эндокринной системе. Организм будущей мамы, полностью перестраиваясь, создает условия для вынашивания и нормального развития малыша и уже с первых дней беременности начинает готовиться к родам.
Все гормональные показатели организма будущей мамы играют огромную роль — а именно, являются важнейшими показателями развития плода. Поэтому уровень гормонов в обязательном порядке контролируется лечащим врачом с помощью специальных обследований — пренатальных скринингов, которые женщине необходимо пройти как минимум 2 раза: в первом триместре (11-12 недель) и во втором триместре (16-19 недель). Разберемся, какие показатели входят в это обязательное обследование, о чем говорит повышение или понижение уровня того или иного гормона и в чем состоит их роль.
Гормоны, которые «производит» организм будущего малыша
ХГЧ. Это хорионический гонадотропин человека, гормон, который активно вырабатывается клетками хориона (оболочки плода) сразу после того, как он прикрепляется к стенке матки. «Производство» этого гормона жизненно необходимо для сохранения и поддержания беременности! Именно ХГЧ контролирует выработку основных гормонов беременности — эстрогенов и прогестерона. При серьезном недостатке ХГЧ оплодотворенная яйцеклетка отсоединяется от матки, и снова наступает менструация — иными словами, происходит самопроизвольный выкидыш. В норме концентрация ХГЧ в крови будущей мамы постоянно растет, достигая максимума к 10-11 неделе беременности, затем концентрация ХГЧ постепенно уменьшается, чтобы остаться неизменной уже до самых родов.
При серьезном недостатке ХГЧ оплодотворенная яйцеклетка отсоединяется от матки, и снова наступает менструация — иными словами, происходит самопроизвольный выкидыш. В норме концентрация ХГЧ в крови будущей мамы постоянно растет, достигая максимума к 10-11 неделе беременности, затем концентрация ХГЧ постепенно уменьшается, чтобы остаться неизменной уже до самых родов.
Тест на ХГЧ во время беременности играет огромную роль.
Во-первых, анализ на уровень ХГЧ в крови способен подтвердить, что вы станете мамой, уже на 5-6 день после зачатия. Это намного раньше и, главное, намного надежнее, чем использование обычных экспресс-тестов.
Во-вторых, тест необходим, чтобы определить точный срок беременности. Очень часто будущая мама не может назвать точную дату зачатия или же называет ее, но неправильно. Вместе с тем каждому сроку соответствуют определенные показатели роста и развития, отклонения от нормы могут свидетельствовать о возникновении осложнений.
В-третьих, уровень ХГЧ в крови способен довольно точно «рассказать» о том, правильно ли развивается ваш малыш.
Внеплановое повышение уровня ХГЧ обычно происходит при многоплодии, гестозе, приеме синтетических гестагенов, сахарном диабете у будущей мамы, а также может говорить о некоторых наследственных заболеваниях у малыша (например, о синдроме Дауна) и множественных пороках развития. Ненормально низкий уровень ХГЧ может стать признаком внематочной и неразвивающейся беременности, задержки в развитии плода, угрозы самопроизвольного аборта, хронической плацентарной недостаточности.
Однако не спешите бить тревогу: повышенные или пониженные значения также могут говорить о том, что срок беременности был изначально установлен неправильно. Правильно интерпретировать результаты анализов поможет ваш лечащий врач.
Плацентарный лактоген и свободный эстриол. Контроль уровня этих гормонов крайне важен для оценки риска развития наследственных хромосомных аномалий у будущего малыша (это синдромы Дауна, Эдвардса, Тернера, Патау, дефект нервной трубки и т. д.)
д.)
Свободный эстриол «производится» плацентой. Этот гормон улучшает ток крови по сосудам матки, а также способствует развитию протоков молочных желез, подготавливая организм будущей мамы к кормлению малыша. Уровень свободного эстриола меняется при любых патологических состояниях:
- при фетоплацентарной недостаточности, когда меняется нормальный кровоток и питание в плаценте;
- при задержке развития плода;
- при подозрении на переношенную беременность.
Плацентарный лактоген (ПЛ) также «производится» плацентой, и в крови будущей мамы его можно обнаружить уже начиная с 5-6 недели беременности. Максимального значения он достигает к 37-38 неделе, затем уровень гормона постепенно снижается. Однако уровень ПЛ необходимо отслеживать в течение всего срока беременности — прежде всего это необходимо для оценки состояния плаценты и своевременной диагностики плацентарной недостаточности. Резкое снижение уровня ПЛ более чем в 2 раза (по сравнению со средним уровнем в соответствии со сроком беременности) может говорить о задержке развития плода. В этом случае необходимо принять экстренные меры, чтобы не допустить снижение уровня ПЛ на 80 процентов и более — это может привести к гибели малыша.
Гормоны беременности
Эстрадиол и прогестерон. Гормональные исследования обязательно включают в себя анализы на уровень прогестерона и эстрадиола. Именно они заботятся о вашем будущем малыше, поддерживая нормальное течение беременности, поэтому и называются главными гормонами гестации (беременности).
Эстрадиол вырабатывается яичниками, а во время беременности еще и плацентой. Во время беременности уровень гормона резко возрастает, и неудивительно – эстрадиол «отвечает» за нормальное течение беременности. На ранних сроках по концентрации этого гормона оценивают функционирование плаценты. Снижение уровня эстрадиола говорит о серьезной угрозе прерывания беременности.
Кстати, именно под влиянием этого гормона женщина испытывает естественное желание «свить гнездо», все обустроить и подготовить к рождению малыша. Перед родами концентрация гормона в организме будущей мамы достигает своего «пика», что также объясняется естественными причинами — эстрадиол, действуя, как сильнейшее природное обезболивающее, помогает сделать процесс рождения малыша менее болезненным.
Прогестерон — это также основной «гормон беременности», основная задача которого — сохранить беременность и создать необходимые условия для развития плода. Нормальный уровень прогестерона необходим для того, чтобы произошло само зачатие. Совместно с эстрогенами гормон способствует прикреплению оплодотворенной яйцеклетки к эндометрию и заботливо снижает повышенный тонус матки, предупреждая выкидыш. Во время вынашивания малыша прогестерон стимулирует рост и созревание молочных желез, «готовя» организм будущей мамы к грудному вскармливанию, а в психологическом плане — успокаивает ее и морально поддерживает. К сожалению, у этого гормона есть и «побочные» эффекты, знакомые каждой беременной, — это повышенная сонливость, тошнота, частое мочеиспускание, болезненность и набухание груди.
При недостатке прогестерона беременность может протекать с серьезными осложнениями. Дефицит гормона необходимо срочно восполнить, иначе увеличивается риск неразвивающейся беременности и выкидыша.
Важно! Анализ на уровень эстрадиола и прогестерона проводится как во время беременности, так и при подготовке к рождению ребенка, особенно это необходимо в тех случаях, когда у женщины уже были случаи выкидыша.
Гормоны щитовидной железы
Большую роль для развития малыша играет нормальное функционирование щитовидной железы будущей мамы. О наличии гипо- или гиперфункции железы способны также «рассказать» соответствующие гормоны (ТТГ, Т3 и Т4).
Гормоны материнства
Незаменимую роль во время ожидания малыша играют также гормоны гипофиза (это эндокринная железа, расположенная в гипоталамическом отделе головного мозга). Во время родов гипофиз высвобождает в кровь гормон окситацин, который стимулирует маточные сокращения. А после родов начинается активный синтез гормона пролактина, который «отвечает» за лактацию. При недостатке пролактина женщина просто не смогла бы полноценно кормить своего малыша грудным молоком.
Во время родов гипофиз высвобождает в кровь гормон окситацин, который стимулирует маточные сокращения. А после родов начинается активный синтез гормона пролактина, который «отвечает» за лактацию. При недостатке пролактина женщина просто не смогла бы полноценно кормить своего малыша грудным молоком.
Кроме того, пролактин и окситацин еще называют «гормонами материнства», потому что благодаря им сердце мамы наполняется нежностью, она чувствует удовольствие от кормления и общения с ребенком, что еще больше привязывает ее к малышу. Эти гормоны, по сути, и обеспечивают волшебное «превращение» женщины в маму — под их влиянием приоритеты резко меняются, учеба, работа, карьера и личный успех отходят на второй план, а главное место в сердце женщины занимает маленькое родное существо. Считается, что чем больше у женщины этих самых «гормонов материнства», тем сильнее ее желание постоянно быть рядом с малышом, чувствовать его тепло, заботиться о нем. Однако не стоит ожидать, что это «превращение» произойдет словно по мановению волшебной палочки: в норме уровень гормонов в организме женщины меняется постепенно, так, чтобы ее психика успела без стресса подготовиться к происходящим изменениям. Главное во время беременности — приложить все усилия для того, чтобы выносить крепкого и здорового малыша.
Женское здоровье. Гормоны и беременность.
Течение и сохранение беременности напрямую зависит от гормонального фона. Если при беременности изменяется норма прогестерона, это становится заметно на раннем сроке. Но такое состояние поддается коррекции с учетом правильно проведенного обследования и назначения нужных препаратов.
Влияние прогестерона на женский организм начинается со второй половины менструального цикла. Он увеличивает секрецию слизи в фаллопиевых трубах. Она служит питательной средой для продвигающейся оплодотворенной яйцеклетки.
Под влиянием прогестерона протекают следующие процессы:
1. Происходит секреторная трансформация, увеличивается число кровеносных сосудов, которые будут обеспечивать питание бластоцисты после имплантации. Гормон способен тормозить сократительную активность миометрия. Это необходимо для сохранения беременности и предупреждения отторжения зародыша.
Гормон способен тормозить сократительную активность миометрия. Это необходимо для сохранения беременности и предупреждения отторжения зародыша.
2. Перестраивается эпителий канала шейки матки. Он проиводит большое количество слизи, которая не позволяет проникать внутрь патогенным микроорганизмам.
3. В начале беременности происходит усиленное воздействие долек молочной железы и альвеолярных ходов. Грудная железа подготавливается к секреции молока.
Повышенный прогестерон при беременности проявляется:
- Увеличением отложения подкожного жира.
- Задержкой жидкости в организме, что приводит к появлению отеков
- Повышением сальность и кожи и склонностью к образованию угрей
- Ослабление иммунитета для предотвращения отторжения организмом матери плода.
- Нарушение моторики кишечника
- Торможение психических процессов в коре головного мозга – проявляется нестабильность настроения, плаксивость, снижением памяти.
У беременных уровень прогестерона может измениться как в большую, так и в меньшую сторону. Причины снижения концентрации разнообразны. На ранних сроках его недостаточность может говорить о нарушении функции желтого тела и плаценты.
Пройти необходимые обследования и получить консультацию опытного специалиста Вы можете в клинике Dixion в удобное для Вас время и день. Будьте здоровы!
Беременность и гормоны
Беременность – время наиболее очевидных и интенсивных изменений в организме женщины, поддерживающихся главным образом за счет гормональных изменений, которые начинаются еще до зачатия.
Напомним вкратце, что при овуляции уровень прогестерона начинает увеличиваться, чтобы подготовить матку к беременности. Прогестерон вносит свой вклад в развитие плода прежде его появления. Например, именно этот гормон индуцирует развитие децидуальных клеток эндометрия, которые являются очень важными для питания зародыша на ранних стадиях. Под влиянием прогестерона утолщается слизистая оболочка матки, чтобы облегчить прикрепление к ней яйцеклетки, увеличиваются жировые накопления и молочные железы, а также тормозится лактация до родов и активизируется после них.
Под влиянием прогестерона утолщается слизистая оболочка матки, чтобы облегчить прикрепление к ней яйцеклетки, увеличиваются жировые накопления и молочные железы, а также тормозится лактация до родов и активизируется после них.
Через несколько дней после зачатия начинает повышаться уровень человеческого хорионического гонадотропина (ХГЧ) – гормона, производимого трофобластом. Именно благодаря ХГЧ плодное яйцо подвергается быстрому процессу репликации клеток. Имплантация яйца в матку занимает около восьми дней после зачатия. С этого момента количество хорионического гонадотропина будет иметь тенденцию к непрерывному увеличению до третьего месяца беременности. Затем его уровень уменьшается, и, наконец, стабилизируется (около шестнадцатой недели беременности) до момента рождения ребенка. Следует обратить внимание на то, что снижение ХГЧ в крови матери происходит одновременно с увеличением объемов производства плацентой прогестерона.
Человеческий хорионический гонадотропин играет ключевую роль на ранних стадиях беременности, активизируя желтое тело, образующееся после овуляции. Ведь именно желтое тело производит прогестерон для начального развития децидуальной оболочки. В дальнейшем эта функция будет исчерпана в течение нескольких недель, передав «эстафету» плаценте. Традиционно хорионический гонадотропин используется в качества индекса для диагностики беременности и ее правильной динамики в первые недели.
Следующая целая группа важных женских половых гормонов – это эстрогены. Они секретируются в первую очередь яичниками в ответ на раздражение гипофиза лютеинизирующим гормоном (ЛГ). Небольшие количества эстрогенов производятся также надпочечниками и преобразовываются из других гормонов.
Наиболее чувствительны к эстрогенной активности ткани яичников, матки и груди. Относительно физиологических функций в женском организме эстрогенов следует отметить их регулирующие влияние на половое созревание и участие в развитии половых путей.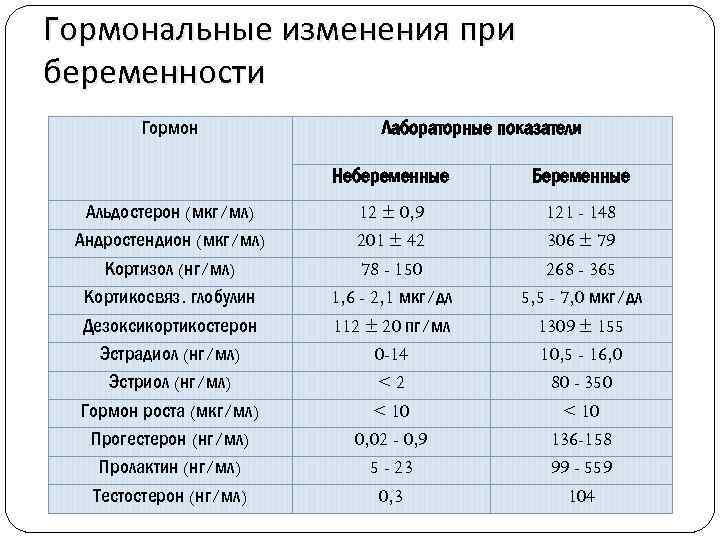 Эстроген поддерживает наличие вторичных половых признаков (рост молочных желез, оволосение, тембр голоса, рост, распределение жира, способствуя его накоплению на бедрах, ягодицах и ниже пупка). Также эстроген стимулирует синтез триглицеридов и повышение липопротеидов высокой плотности (хорошего холестерина), защищая стенки сосудов от атеросклеротических повреждений. Исходя из того, что женщины имеют намного больше эстрогена, чем мужчины, до наступления менопаузы риск развития сердечно-сосудистых заболеваний среди них значительно ниже. (Кстати, в некоторых натуральных продуктах, таких как соевые бобы, содержатся вещества имитирующие действие эстрогена.) Однако, не смотря на все вышеперечисленные полезные свойства, избыток эстрогена опасен, поскольку подвергает женщину более высокому риску развития некоторых форм рака молочной железы, резистентности к инсулину, поликистозу и бесплодию. Женщины должны иметь в виду, что наиболее эффективный способ поддержания нормального уровня эстрогена заключается в контроле веса собственного тела, ведь примерно две трети этого гормона производится в жировой ткани за счет фермента, превращающего андрогены, вырабатываемые надпочечниками, в эстрогены.
Эстроген поддерживает наличие вторичных половых признаков (рост молочных желез, оволосение, тембр голоса, рост, распределение жира, способствуя его накоплению на бедрах, ягодицах и ниже пупка). Также эстроген стимулирует синтез триглицеридов и повышение липопротеидов высокой плотности (хорошего холестерина), защищая стенки сосудов от атеросклеротических повреждений. Исходя из того, что женщины имеют намного больше эстрогена, чем мужчины, до наступления менопаузы риск развития сердечно-сосудистых заболеваний среди них значительно ниже. (Кстати, в некоторых натуральных продуктах, таких как соевые бобы, содержатся вещества имитирующие действие эстрогена.) Однако, не смотря на все вышеперечисленные полезные свойства, избыток эстрогена опасен, поскольку подвергает женщину более высокому риску развития некоторых форм рака молочной железы, резистентности к инсулину, поликистозу и бесплодию. Женщины должны иметь в виду, что наиболее эффективный способ поддержания нормального уровня эстрогена заключается в контроле веса собственного тела, ведь примерно две трети этого гормона производится в жировой ткани за счет фермента, превращающего андрогены, вырабатываемые надпочечниками, в эстрогены.
Самый известный и важный эстроген – эстрадиол. Во время беременности он влияет на состояние сосудов матки, усиливает в них кровоток и способствует повышению свертываемости крови, что играет огромную роль во время родов. Кроме того этот гормон, как и прогестерон, готовит слизистую матки к имплантации плодного яйца. По мере роста эмбриона функция производства эстрадиола переходит к плаценте. В дальнейшем синергия гормона с плацентарным релаксином вызывает расслабление тазовых связок, так что крестцово-повздошные суставы и лобковый симфиз становятся более эластичными во время родов.
Также упоминания заслуживает окситоцин – гормон, который секретируется нейрогипофизом и отвечает за схватки. Секреция окситоцина подвержена механизму обратной связи в женском организме, так как стимулирование и растяжение шейки матки вызывает дальнейшее высвобождение гормона.
После родов, с отхождением плаценты, гормональные концентрации вернутся к исходным значениям, за исключением пролактина. Как следует из названия, этот гормон имеет решающее значение для лактации. Послеродовая секреция молока стимулируется сосанием, что в свою очередь способствует выделению пролактина. Есть еще один гормон, вносящий свой вклад в подготовку молочной железы к лактации во время беременности – это плацентарный лактоген, который эффективно имитирует биологическое действие гормона пролактина.
Знать свой гормональный уровень важно не только во время беременности, но и в процессе подготовки к ней. В любом из пунктов забора лаборатории «Лакмус» Вы можете сдать кровь на гормоны. Стоимость анализов на сегодня составляет: хорионический гонадотропин – 130 грн, эстриол свободный – 130 грн, прогестерон – 115 грн, пролактин – 115 грн.
Половые гормоны
Репродуктивная функция у обоих полов полностью контролируется и регулируется гормонами. Основные половые гормоны разделены на два класса – эстрогены (женские) и андрогены (мужские). И у мужчин, и у женщин присутствуют оба вида гормонов, но в совершенно разных количествах. Так, например, суточная выработка мужского гормона тестостерона у мужчин в 20-30 раз больше чем у большинства женщин. В свою очередь, женский половой гормон эстрадиол, в небольших количествах есть и у мужчин. У женщин, кроме двух основных классов гормонов присутствует ещё один класс: гестагены, главный представитель этого класса – прогестерон. У мужчин половые гормоны образуются в ткани семенников, у женщин они синтезируются яичниками, кроме того, независимо от пола, небольшое количество гормонов вырабатывается в коре надпочечников. Считается, что эстрогены в большей степени отвечают за память, а андрогены – за познавательные функции, настроение, половое влечение. Избыток и, наоборот, дефицит гормонов одинаково неблагоприятно сказываются на здоровье. Так, дефицит и переизбыток тестостерона препятствуют созреванию яйцеклетки.
Прогестерон – основная функция состоит в подготовке организма женщины к беременности. Он необходим для поддержания беременности и тонуса гладкой мускулатуры матки. Предотвращает избыточное разрастание слизистой матки и оказывает влияние на ткань молочных желез (стимулирует рост и развитие железистой ткани молочных желез, способствует подготовке их к лактации).
Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое жёлтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки. Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон. Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником этого гормона во время беременности.
Анализ используется для выявления причин бесплодия, диагностики внематочной или патологической беременности, контроля за состоянием плода и плаценты во время беременности и чтобы определить, была ли у пациентки овуляция.
Тестостерон – основной мужской половой гормон, отвечающий за формирование вторичных половых признаков и половую функцию. Его синтез стимулируется и контролируется лютеинизирующим гормоном (ЛГ), вырабатываемым гипофизом. Уровень тестостерона подвержен значительным колебаниям в течение суток, своего пика он достигает между 4 и 8 часами утра, а минимум приходится на вечерние часы (между 16:00 и 20:00).
Кроме того, его концентрация возрастает после физических нагрузок и уменьшается с возрастом. В особенно большом количестве он вырабатывается у подростков в период полового созревания. У мужчин тестостерон синтезируется яичками и надпочечниками, а у женщин – надпочечниками и в небольшом количестве яичниками.
В особенно большом количестве он вырабатывается у подростков в период полового созревания. У мужчин тестостерон синтезируется яичками и надпочечниками, а у женщин – надпочечниками и в небольшом количестве яичниками.
Тестостерон способствует развитию вторичных половых признаков, таких как увеличение полового члена, рост волос на теле, развитие мышечной массы и низкий голос. У взрослых мужчин он регулирует сексуальные инстинкты и поддержание мышечной массы. Тестостерон также присутствует в организме женщины, хотя и в меньшей концентрации. От него зависят либидо (сексуальное влечение), способность к оргазмам, уровень инсулина, стройная фигура, развитие мышечной массы, костная ткань. Тестостерон отвечает за активность и переносимость эмоциональных нагрузок. В постменопаузу, когда исчезнут эстрогены и гестагены, именно тестостерон будет еще некоторое время поддерживать плотность костной ткани, сердечно-сосудистую систему и поможет легче переносить климактерический синдром.
Анализ назначается при мужском и женском бесплодии или пониженном половом влечении, замедленном либо преждевременном половом созревании у мальчиков и эректильной дисфункции у мужчин, при болезнях гипоталамуса, гипофиза, опухолях яичек.
Лютеинизирующий гормон (ЛГ) – гормон передней доли гипофиза, отвечает за бесперебойную работу всей системы половых желез, равно как и за выработку мужских и женских половых гормонов — прогестерона и тестостерона. У женщин ЛГ воздействует на клетки оболочки яичника и жёлтое тело, стимулирует овуляцию и активирует в клетках яичников синтез эстрогенов и прогестерона, у мужчин — на клетки семенников, активируя в них синтез тестостерона, благодаря чему, в частности, происходит созревание сперматозоидов.
Анализ проводится для диагностики бесплодия и оценки функционального состояния репродуктивной системы.
ФСГ (фолликулостимулирующий гормон) регулирует выработку половых гормонов, но сам не является таковым, поскольку вырабатывается не половыми железами, а гипофизом. В организме ФСГ регулирует деятельность половых желез: способствует образованию и созреванию половых клеток (яйцеклеток и сперматозоидов), влияет на синтез женских половых гормонов (эстрогенов).
В организме ФСГ регулирует деятельность половых желез: способствует образованию и созреванию половых клеток (яйцеклеток и сперматозоидов), влияет на синтез женских половых гормонов (эстрогенов).
У женщин ФСГ влияет на формирование фолликула. Достижение максимального уровня ФСГ приводит к овуляции. У мужчин ФСГ стимулирует рост семявыносящих канальцев, увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо. У мужчин ФСГ стимулирует рост семявыносящих канальцев, увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо.
Определение уровня фолликулостимулирующего гормона (ФСГ) проводится для оценки функции гипофиза, репродуктивной функции (как женщин, так и мужчин), а так же при нарушениях полового созревания у детей и подростков. Анализ назначается для определения причин нарушения менструального цикла различного генеза, диагностика дисфункциональных маточных кровотечений, дифференциальная диагностика центральных и периферических форм заболеваний женской половой системы, контроля эффективности гормонотерапии.
Пролактин – один из гормонов, синтезируемых гипофизом – железой контролирующей метаболизм, а также процессы роста и развития организма. Пролактин необходим для нормального развития молочных желез и обеспечения лактации — он увеличивает выработку молозива, способствует его созреванию и превращению в зрелое молоко. Он также стимулирует рост и развитие молочных желез, увеличение числа долек и протоков в них. Также он контролирует секрецию прогестерона и тормозит выработку фолликулостимулирующего гормона (ФЛГ), обеспечивая нормальный менструальный цикл, тормозя овуляцию и наступление новой беременности. В норме этот физиологический механизм предотвращает беременность следующим ребенком в период кормления грудью предыдущего и может предотвращать менструации в период кормления. В крови мужчин и небеременных женщин пролактин, обычно, присутствует в малых количествах. В повседневной жизни пролактин повышается во время сна, физической нагрузки и полового акта. Но у мужчин чрезмерное повышение его уровня способно нарушать половую функцию угнетая созревание сперматозоидов в яичках и вызывая бесплодие.
В норме этот физиологический механизм предотвращает беременность следующим ребенком в период кормления грудью предыдущего и может предотвращать менструации в период кормления. В крови мужчин и небеременных женщин пролактин, обычно, присутствует в малых количествах. В повседневной жизни пролактин повышается во время сна, физической нагрузки и полового акта. Но у мужчин чрезмерное повышение его уровня способно нарушать половую функцию угнетая созревание сперматозоидов в яичках и вызывая бесплодие.
Анализ используется для диагностики бесплодия и нарушения половой функции, исследования функции гипофиза, выяснения причины галактореи (выделения молока или молозива вне связи с процессом кормления ребёнка), головных болей и ухудшения зрения.
Хорионический гонадотропин человека (ХГЧ) – это гормон, который вырабатывается в плодной оболочке человеческого эмбриона. ХГЧ является важным показателем развития беременности и её отклонений. Его производят клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки (это происходит лишь через несколько дней после оплодотворения). Зародыш на этом этапе беременности представляет собой заполненный жидкостью микроскопический пузырёк, стенки которого состоят из быстро размножающихся клеток. Из одной части этих клеток и развивается будущий ребёнок (эмбриобласт), в то время как из клеток, находящихся снаружи зародыша, образуется трофобласт – та часть плодного яйца, с помощью которого оно прикрепляется к стенке матки. В дальнейшем из трофобласта образуется хорион.
Хорион выполняет функцию питания зародыша, являясь посредником между организмом матери и ребенка. Кроме того, он вырабатывает хорионический гонадотропин, который, с одной стороны, влияет на формирование ребенка, с другой – специфическим образом воздействует на организм матери, обеспечивая благополучное протекание беременности. Появление этого гормона в организме будущей матери на начальной стадии беременности и объясняет важность теста для ранней диагностики беременности.
Появление этого гормона в организме будущей матери на начальной стадии беременности и объясняет важность теста для ранней диагностики беременности.
Хорионический гонадотропин стимулирует секреторную функцию жёлтого тела яичников, которое должно продуцировать гормон прогестерон, поддерживающий нормальное состояние внутренней оболочки стенки матки – эндометрия. Эндометрий обеспечивает надёжное прикрепление плодного яйца к организму матери и его питание всеми необходимыми веществами. Благодаря достаточному количеству хорионического гонадотропина жёлтое тело, в норме существующее лишь около 2 недель в течение каждого менструального цикла, при успешном зачатии не подвергается рассасыванию и остаётся функционально активным в течение всего срока беременности. Причём именно у беременных под влиянием хорионического гонадотропина оно производит очень большие количества прогестерона. Кроме того, ХГЧ стимулирует продукцию эстрогенов и слабых андрогенов клетками яичников и способствует развитию функциональной активности самого хориона, а в дальнейшем и плаценты, которая образуется в результате созревания и разрастания хориональной ткани, улучшая её собственное питание и увеличивая количество ворсин хориона.
Таким образом, роль хорионического гонадотропина заключается в специфическом и многостороннем воздействии на организм женщины и плода в целях успешного протекания беременности.
На основании анализа на хорионический гонадотропин определяется присутствие в организме женщины хорионической ткани, а значит, и беременность. Анализ используется, в том числе, для диагностики многоплодной, внематочной и неразвивающейся беременности, выявления задержек в развитии плода, угрозы самопроизвольного аборта, недостаточности функции плаценты. Может назначаться, как часть комплексного обследования по выявлению пороков развития плода, а также для контроля за эффективностью искусственного аборта.
Свободный В-ХГЧ – Бета-субъединица хорионического гонадотропина человека – одна из составляющих молекулы специфического гормона – хорионического гонадотропина, образующегося в оболочке человеческого эмбриона.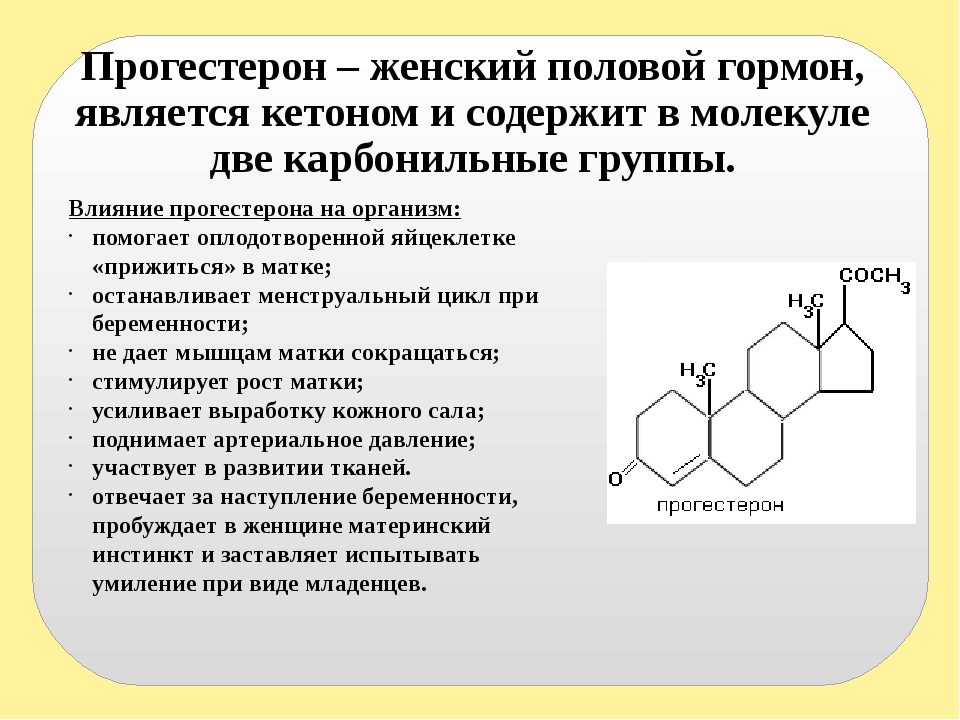 При отсутствии беременности результат теста на бета-ХГЧ будет отрицательным. Обнаружение бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней.
При отсутствии беременности результат теста на бета-ХГЧ будет отрицательным. Обнаружение бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней.
Анализ проводят в целях ранней диагностики беременности (3–5-дневной задержки менструации), выявления её осложнений и диагностики заболеваний, связанных с нарушением секреции ХГЧ.
Эстрадиол — пожалуй, основной и один из наиболее активных женских половых гормонов группы эстрогенов. Относится к типично женским гормонам, поскольку, в женском организме в значительном количестве, вырабатывается яичниками, реализуя большое количество физиологических функций. У мужчин эстрадиол тоже вырабатывается, но в очень малом количестве, и имеет скорее вспомогательные функции.
В женском организме эстрадиол играет исключительно важную роль в регуляции менструального цикла и функционировании всей половой системы. В детском и пубертатном периодах, гормон отвечает за рост и развитие всех органов, относящиеся к репродуктивной сфере. Под его влиянием происходят циклические изменения в тканях половых органов, а также формирование вторичных женских половых признаков (рост молочных желез, оволосение лобка и подмышек и т.д.). У взрослых женщин эстрадиол стимулирует течение первой фазы менструального цикла, вызывает рост и пролиферацию (активное деление клеток) эндометрия, таким образом, подготавливая его к внедрению плодного яйца, и наступлению беременности. Во время беременности эстрадиол усиливает обмен веществ во всех тканях организма. По мере развития беременности он начинает вырабатываться плацентой всё в большем и большем количестве, обеспечивая т.о. повышенные потребности в скорости обмена веществ и кровотоке у женщины. В мужском организме эстрадиол участвует в формировании спермы, т.е. необходим для зачатия. Но, всё же, для мужчин его роль не настолько значительна, как для женщин.
Определение уровня эстрадиола у женщин фертильного возраста проводится при диагностике большого числа заболеваний и состояний, таких как бесплодие, нарушения менструального цикла, отсутствие овуляций, поликистозе и опухолях яичников и т. п, а также для оценка функций плаценты на ранних сроках беременности и мониторинга при экстракорпоральном оплодотворении. Используется при диагностике и лечении остеопороза. У мужчин анализ проводится при низком качестве спермы и бесплодии, заболеваниях надпочечников и печени.
п, а также для оценка функций плаценты на ранних сроках беременности и мониторинга при экстракорпоральном оплодотворении. Используется при диагностике и лечении остеопороза. У мужчин анализ проводится при низком качестве спермы и бесплодии, заболеваниях надпочечников и печени.
Андростендион – основной стероидный гормон, является промежуточным продуктом и основой для образования тестостерона и эстрона. Синтезируется, у мужчин и женщин, корой надпочечников и половыми железами. У обоих полов, уровень андростендиона имеет выраженные колебания, как в течении суток (максимум в утренние часы), так и с возрастом (увеличивается, примерно, с 7-и, и плавно снижается после 30 лет). У женщин показатель также зависит от фазы менструального цикла (максимум в середине) и значительно возрастает при беременности. Определение уровня андростендиона используется для оценки синтеза андрогенов (избытка секреции мужских гормонов) и диагностики различных нарушений функционирования половой и эндокринной систем.
Цены на исследования можно узнать в разделе «Прейскурант» клинической лаборатории. Кровь на исследования принимается ежедневно (кроме воскресенья) с 7 до 11 часов. Строго натощак.
Прочтите так же о Гормонах надпочечников и Гормонах щитовидной железы
их образование и метаболизм при нормальной беременности. Гиперандрогения при беременности. «Мужские» гормоны при беременности.
При беременности уровень тестостерона и других андрогенов изменяется. Изменение этих уровней зависит в том числе и от пола плода.
Краткое содержание статьи
Уровень андрогенов в крови матери
- Концентрация общего тестостерона прогрессивно увеличивается во время беременности.
- Изменения концентрации свободного тестостерона минимально до третьего триместра беременности, в это время она увеличивается примерно в два раза.

- Концентрация андростендиона увеличивается во второй половине беременности.
- Концентрация дегидроэпиандростерон-сульфата (ДГЭА-С) снижается.
- Эстрогены вызывают увеличение концентрации в сыворотке белка, связывающего половые гормоны (SHBG).
Амниотическая жидкость и фетальные андрогены
- Концентрация тестостерона и андростендиона выше у плодов мужского пола.
- Концентрация ДГЭА-С одинаковы у плодов женского и мужского пола.
Гиперандрогения при беременности. Предотвращение вирилизации
Несмотря на рост концентрации общих и свободных андрогенов у беременных женщин, большинство женщин и их младенцев женского пола не вирилизованы. Четырьмя факторами, которые могут защитить от вирилизации, являются: высокие концентрации в сыворотке SHBG, влияние прогестерона на рецепторы к андрогенам, воздействие прогестерона на активацию андрогенов в тканях-мишенях, и плацентарная ароматизация андрогенов. (См. «Защитные механизмы против вирилизации матери и плода»).
Уровень андрогенов в крови беременных женщин
Во время нормальной беременности концентрация в сыворотке крови некоторых, но не всех, андрогенов увеличивается.
Тестостерон при беременности («Мужской» гормон при беременности)
Уровень общего тестостерона постепенно увеличивается во время беременности. Этот эффект объясняется прежде всего постепенным эстроген- индуцированным увеличением концентрации в сыворотке крови белка, связывающего половые гормоны (SHBG). Увеличение концентрации тестостерона при нормальной беременности происходит уже через 15 дней после пика ЛГ, вероятно, за счет его продукции в большей степени яичниками, чем надпочечниками.
Есть несколько исследований посвященных продукции и распаду андрогенов у здоровых беременных женщин. В одном из них при обследовании пяти беременных женщин было выявлено, что темпы продукции тестостерона и дигидротестостерона у беременных и небеременных женщин совпадают. Однако преобразование тестостерона в дигидротестостерон и метаболический клиренс этих гормонов во время беременности были ниже, чего и следовало ожидать при повышенной концентрации в сыворотке SHBG.
Однако преобразование тестостерона в дигидротестостерон и метаболический клиренс этих гормонов во время беременности были ниже, чего и следовало ожидать при повышенной концентрации в сыворотке SHBG.
При другом исследовании, включавшем в себя обследование 1343 женщин с одноплодной беременностью, был выявлен более низкий уровень андрогенов у женщин старше 30 лет, а так же повторнородящих (двое и более родов). В то время как с курением был связан более высокий уровень андрогенов в первой половине беременности по сравнению с более молодыми женщинами, нерожавшими и некурящими женщинами, соответственно.
Во время беременности концентрация тестостерона в сыворотке крови в три-четыре раза выше, чем в сыворотке пуповинной крови. Концентрация тестостерона в крови беременной женщины может колебаться от 100 до 140 нг/дл (от 3,5 до 4,8 нмоль/л), а в пуповинной крови средние значение 33,5 нг/мл (1,2 нмоль/л).
Свободный тестостерон при беременности
Концентрация в сыворотке свободного тестостерона во время беременности изменяется незначительно, вплоть до третьего триместра, когда она увеличивается примерно в два раза. Данное увеличение концентрации свободного тестостерона не может быть объяснено изменением концентрации SHBG и, скорее всего, может быть следствием увеличения продукции тестостерона. Источник повышенного образования тестостерона в данной ситуации не известен. Одной из возможных причин может являться то, что человеческий хорионический гонадотропин (ХГЧ) может стимулировать тека-интерстициальные клетки яичников синтезировать тестостерон, однако, концентрация ХГЧ в сыворотке крови достигает своего пика в конце первого триместра беременности и далее постепенно снижается, а концентрация свободного тестостерона увеличивается. Как показали исследования у человекообразных обезьян, одним из возможных источников тестостерона является желтое тело. Наконец, тестостерон может продуцироваться в коре надпочечников беременных женщин, параллельно с увеличением секреции материнского кортизола в конце беременности.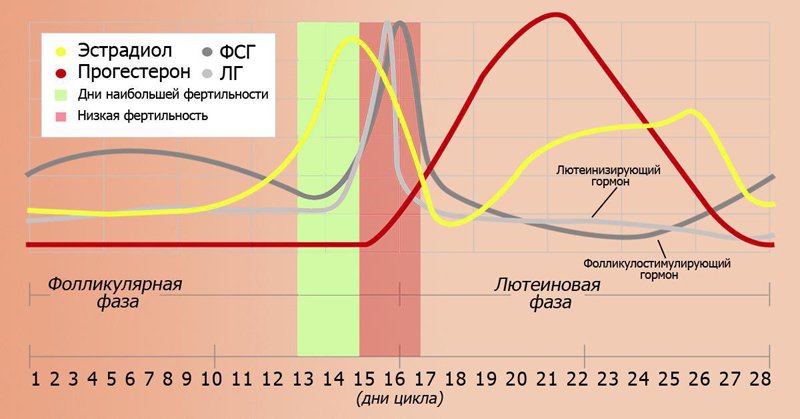
ДЭА-С при беременности
Концентрация дегидроэпиандростерон сульфата (ДГЭА-С) в крови матери во время беременности снижается, несмотря на увеличение его продукции в крови плода. Наибольшее снижение происходит в начале второго триместра, когда метаболический клиренс ДГЭА-С резко возрастает. У беременных женщин ДГЭА-С метаболизируется в печени, путем превращения в 16-альфа-гидрокси-ДЭА, и в плаценте, путем превращения в эстрогены.
Андростендион при беременности
Концентрация андростендиона в крови матери увеличивается во второй половине беременности.
Андростандиол глюкуронид при беременности
Концентрация в сыворотке крови у беременной женщины 3-альфа-17-бета-андростандиол глюкуронида (3а-диол-G), продукта метаболизма дигидротестостерона в волосяных фолликулах кожи, повышается во время беременности. До конца неизвестно, связано ли это с повышением активности 5-альфа-редуктазы и других андроген-метаболизирующих ферментов, или с увеличением доступности субстрата.
Уровень андрогенов в амниотической жидкости
Концентрация в амниотической жидкости тестостерона и андростендиона, в среднем, примерно в два-три раза выше, если плод мужского пола. Медиана вероятного отклонения у мальчиков составляет от 17,3 до 33,7 нг/дл (0,60 до 1,17 нмоль/л) и 5,05 до 12,98 нг/дл (0,175 до 0,45 нмоль/л) у девочек. Эта разница показателей у плодов мужского и женского пола указывает на то, что по крайней мере часть андростендиона и тестостерона в амниотической жидкости продуцируется яичками плода. Концентрация же ДГЭА-С в амниотической жидкости одинакова у плодов женского и мужского пола. Вероятно, это связано с тем, что данный гормон надпочечникового происхождения.
Уровень андрогенов в крови плода
Тестостерон — концентрации тестостерона в сыворотке плодов мужского пола выше, чем у плодов женского пола, в то время как концентрации дигидротестостерона сходны.
У плодов мужского пола концентрации тестостерона достигает своего пика в конце первого триместра беременности — около 150 нг/мл (5,2 нмоль/л; что является половиной от нижней границы нормы у взрослых мужчин), а затем постепенно уменьшается примерно от 60 до 70 процентов.
Мало что известно о регуляции фетального тестостерона, однако предполагается, что он больше зависит от уровня материнского ХГЧ, чем от лютеинизирующего гормона (ЛГ) гипофиза плода. Концентрация ХГЧ в крови матери и плода достигает своего пика в период с 9 до 12 недель беременности, а затем постепенно снижается (концентрация материнского ХГЧ в сыворотке плода значительно ниже, чем в сыворотке самой матери: показатели плода могут варьироваться от едва уловимых до 2,5 мМЕ/мл).
Появление материнского ХГЧ в сыворотки плода совпадает с появлением клеток Лейдига (источник выработки тестостерона в яичках), что происходит на сроке около 8 недель беременности. Предполагается, что материнский ХГЧ играет существенную роль в развитии клеток Лейдига у плода и в продукции тестостерона. Пик формирования клеток Лейдига приходится на сроки от 14 до 18 недель беременности.
Гонадотропины обнаруживаются в гипофизе плода примерно в 10 недель беременности, а в фетальной сыворотке приблизительно еще через неделю. Проведенное исследование на трансгенных мышах мужского пола, а так же позднее начало выработки гонадотропина у плода подтверждает теорию, того что развитие клеток Лейдига и продукция тестостерона инициируется основном материнским ХГЧ. Кроме того, функция клеток Лейдига оказалась нормальной у мышей, лишенных ЛГ или его рецепторов.
У плодов женского полаконцентрация тестостерона в сыворотке крови низкая (около 50 нг/дл [1,7 нмоль/л] ) и на протяжении большей части беременности имеет тенденцию к снижению. Источником тестостерона, вероятнее всего, являются яичники плода, т.к. гонадотропин может стимулировать продукцию андрогенов в яичниках плода, которые в дальнейшем преобразуются в эстрогены.
Уровень андрогенов у новорожденных
У новорожденных мальчиков уровень концентрации тестостерона в пупочной артерии лишь немного выше, чем у девочек. Тем не менее, концентрация тестостерона (и андростендиона) в крови значительно увеличивается в течение первых суток жизни, особенно у мальчиков, а затем снижается в течение следующих шести дней.
Увеличение андрогенов в первый день жизни может быть ответом на выработку свободного ХГЧ.
Во время беременности другие стероиды, вырабатываемые плацентой, могут частично ингибировать действие ХГЧ на клетки плода. Снижение концентрации сывороточных андрогенов в течение первой недели жизни происходит одновременно со снижением концентрации в сыворотке крови ХГЧ.
Уровень андрогенов в плаценте
Исследования показывают, что плацента может самостоятельно синтезировать андрогены, большинство из которых превращается в эстрогены под воздействием плацентарной CYP17. Значение плацентарного синтеза андрогенов неизвестно.
Защитные механизмы против вирилизации матери и плода
Несмотря на увеличение в сыворотке крови беременных женщин концентрации общих и свободных андрогенов, большинство женщин и их детей не вирилизованы. Причинами этого являются:
- Высокие концентрации в сыворотке SHBG. В большинстве случаев повышение уровня концентрации андрогенов в сыворотке крови приходится на SHBG-связанные андрогены. Как отмечалось выше, концентрация свободных андрогенов в сыворотке крови увеличивается незначительно и только на поздних сроках беременности, поэтому большая часть андрогенов не доступна для действия на ткани-мишени.
- Воздействие прогестерона на рецепторы к андрогенам. Концентрация прогестерона увеличивается во время беременности в 10 раз, и может достигать 250 мг/день. В то время как сродство прогестерона с рецепторами к андрогенам низкое, увеличение продукции прогестерона настолько велико, что он может подавлять связывание андрогенов с их рецепторами на тканях-мишенях.
- Воздействие прогестерона на активацию андрогенов в тканях-мишенях. В тканях-мишенях под воздействием 5-альфа-редуктазы тестостерон превращается в биологически более активный дигидротестостерон. Прогестерон имеет слабое сродство к 5-альфа-редуктазе, таким образом, дополнительный прогестерон, производимый во время беременности, может подавлять превращение тестостерона в дигидротестостерон в тканях-мишенях.

- Ароматизация андрогенов в плаценте. Плацента имеет широчайшие возможности для преобразования андрогенов в эстрогены. Поэтому весьма вероятно, что большинство андрогенов матери и плода метаболизируются в плаценте. Этот механизм защищает от вирилизации как самих беременных женщин, так и плодов женского пола. Андростендион и тестостерон являются высокоафинными субстратами для плацентарной системы ферментов ароматаз и преобразуются в эстрон и эстрадиол соответственно. Дигидротестостерон не является субстратом для ароматизации, он метаболизируется под воздействием других плацентарных ферментов (дегидрогеназ оксистероидов) в менее активные метаболиты, такие как 5-альфа-андростан-3бета, 17 бета-диол.
Подтверждение этой теории может быть получено из доклада о беременной женщине, концентрация сывороточного тестостерона у которой достигала 15000 нг/дл (520 нмоль/л), но его концентрация в пуповинной крови была только 252 нг/дл (8,7 нмоль/л), что составило 1,7 процента показателей матери. Это говорит о наличии высокоэффективного барьера, препятствующего переходу тестостерона от матери к плоду. Кроме того, концентрация эстрадиола в крови матери была нормальной, а концентрация эстрадиола в пуповинной крови — значительно выше, что свидетельствует о превращении тестостерона в эстрадиол в плаценте или у плода. Увеличение концентрации эстрогенов в сыворотке крови плода, возможно, ингибирует эффекты андрогенов, так как концентрация сывороточного тестостерона в пуповинной крови значительно превышала нормы (см. выше), но плод не был вирилизован (для сравнения, взрослая женщина с концентрацией сывороточного тестостерона 252 нг/дл [8,7 нмоль/л] будет вирилизована).
Эти результаты показывают, что воздействие андрогенов плода может быть уменьшено плацентарной ароматизацией андрогенов и производством эстрогенов. Также подтверждением этой гипотезы является обнаружение вирилизации у плодов женского пола при недостаточности плацентарной ароматазы. У одного из таких младенцев, концентрация тестостерона, дигидротестостерона и андростендиона в пуповинной крови были в 26, 26 и 207 раз выше нормы, а концентрация эстрона, эстрадиола и эстриола составляли всего 0,6, 0,9 и 0,2 процента от нормы.
У одного из таких младенцев, концентрация тестостерона, дигидротестостерона и андростендиона в пуповинной крови были в 26, 26 и 207 раз выше нормы, а концентрация эстрона, эстрадиола и эстриола составляли всего 0,6, 0,9 и 0,2 процента от нормы.
Тем не менее, ароматизации, как правило, недостаточно, чтобы полностью защитить плод от передачи тестостерона, и это не в полной мере объясняет отсутствие вирилизации плода. Есть доклады о беременных с лютеомами яичников, у которых выявлялись высокие концентрации дигидротестостерона в сыворотки крови, но родились здоровые девочки. Поскольку дигидротестостерон не подвергается ароматизации до эстрогенов, то при физиологически протекающей беременности плоды женского пола должны быть защищены от вирилизации снижением действия андрогенов.
Пренатальное воздействие андрогенов, находящихся в пределах нормы для беременности, скорее всего, не вызывает изменений яичников, ведущих к синдрому поликистозных яичников (СПКЯ) в подростковом возрасте.
Изменения тела во время беременности
31.10.2018
Анна Корнете,
врач – резидент по специальности «гинекология и родовспоможение»
Беременность — это уникальное событие в жизни женщины. В это время в теле будущей мамочки происходит много различных перемен. Во время беременности изменения в теле женщины вызывают гормоны: эстроген, прогестерон, окситоцин. В начале беременности в организме будущей мамы увеличивается уровень прогестерона. В результате влияния прогестерона одними из первых симптомов беременности могут быть изменения чувствительности груди, усталость, перемена настроения, тошнота и рвота.
В случае тошноты и рвоты рекомендуется есть чаще и небольшими порциями, не употреблять в пищу очень калорийные, жирные, соленые или острые блюда. Если тошнота появляется утром, рекомендуется съесть небольшую закуску (например, сэндвич, сухарь, печенье) сразу после пробуждения. В промежутках между приемами пищи нужно пить много воды; желательно пить прохладную воду маленькими глотками. Тошноту помогают уменьшить лимон, мята, имбирь. Позитивный эффект дадут также прогулки на свежем воздухе и полноценный отдых. Если рвота бывает несколько раз в день, обязательно сообщите об этом врачу.
Тошноту помогают уменьшить лимон, мята, имбирь. Позитивный эффект дадут также прогулки на свежем воздухе и полноценный отдых. Если рвота бывает несколько раз в день, обязательно сообщите об этом врачу.
Высокий уровень эстрогена улучшает состояние кожи беременной и способствует росту здоровых волос и ногтей. Во время беременности возможен усиленный рост волос на теле (гирсутизм). Из-за гормональных перемен во время беременности могут увеличиться родинки, усилиться пигментация кожи вокруг сосков, в нижней части живота и вокруг внешних половых органов. На лбу и вокруг глаз могут появиться коричневые пигментные пятна. Из-за увеличения размеров груди и живота возможно образование стрий (растяжек).
На здоровье кожи благоприятно влияют свежий воздух и здоровое питание. Следует помнить, что во время беременности нежелательно посещать солярий. Находясь на солнце обязательно нужно использовать солнцезащитный крем. В случае возникновения стрий помогут специальные кремы. При проблемах с кожей обратитесь за советом к дерматологу.
Во время беременности под воздействием пролактина растут и совершенствуются молочные железы в груди, усиливается кровоснабжение молочных желез и начинается образование молока.
Вес матки во время беременности увеличивается от 30 — 60 г до 700 — 1000 г. По мере увеличения матки, растягиваются связки таза, что может вызвать боли в нижней части живота и спины. Для здоровья спины большое значение имеют физическая активность, лечебная физкультура. Позитивный эффект могут оказать тейпинг и ношение пояса для беременных. Боль в нижней части живота и спины можно снизить, употребляя продукты, богатые магнием (орехи, сушеные фрукты, бананы), а также препараты магния.
В первые месяцы беременности масса тела увеличивается немного, но во второй половине беременности она может увеличиться довольно сильно. Увеличение массы тела будущей мамы происходит вследствие роста плода и плаценты, увеличения плодных вод, увеличения массы матки и грудных желез и накопления жировых тканей. Для женщин с нормальной массой тела до беременности идеальный прирост массы тела во время беременности составляет 10 — 16 кг. Повышенное количество жидкости в теле может приводить к отекам лица, пальцев, бедер, лодыжек. Сбалансированное питание существенно влияет на здоровье мамы и ребенка во время беременности и во время последующей жизни.
Для женщин с нормальной массой тела до беременности идеальный прирост массы тела во время беременности составляет 10 — 16 кг. Повышенное количество жидкости в теле может приводить к отекам лица, пальцев, бедер, лодыжек. Сбалансированное питание существенно влияет на здоровье мамы и ребенка во время беременности и во время последующей жизни.
Повышенный уровень прогестерона ослабляет тонус желудка и приводит к изжоге и ощущению жжения в желудке. Кроме того, опорожнение желудка замедляется, и возможны ощущения тяжести после еды. Ослабляется и действие желудочно-кишечного тракта, поэтому у беременных часто случаются запоры. Желательно есть чаще, маленькими порциями, в пищу включать богатые волокнами продукты (зерновые, бобовые, сушеные и свежие овощи, орехи, семена) и употреблять достаточное количество жидкости (не менее 1,5 литра в день).
Под влиянием прогестерона снижается тонус мочевого пузыря и образуется застой мочи. Наблюдаются изменения и в почках. Важно каждый день выпивать достаточное количество жидкости (по меньшей мере 1,5 литра в день) и использовать в рационе кислые продукты (например, клюкву, лимон).
Во время беременности тело женщины подвержено нескольким факторам (увеличение массы тела, смещение центра тяжести, хрупкие кости, расслабление мышц передней стенки живота, нестабильность тазовых связок), которые влияют на стабильность таза и могут являться причиной болей в спине. Поэтому важно быть физически активной, заниматься лечебной физкультурой, носить пояс для беременных.
Во время беременности снижается тонус гладких мышц в венах. На ногах может появиться венозная сетка и более выраженные вены (варикоз). При расширении вен в прямой кишке увеличивается риск развития геморроя. Кроме того, матка увеличена и может давить на прямую кишку, зачастую провоцируя запоры и образование геморроя. Для здоровья ног рекомендуется носить компрессионные носки. Чтобы избежать появления геморроя, важно принимать меры для профилактики запоров.
С развитием беременности снижается уровень гемоглобина в крови и может развиться анемия. Для анемии характерны бледный цвет кожи, хрупкость волос и ногтей, слабость. Важно включить в пищу богатые железом продукты питания (красное мясо, свекла, шпинат) и дополнительно использовать препараты железа.
Для анемии характерны бледный цвет кожи, хрупкость волос и ногтей, слабость. Важно включить в пищу богатые железом продукты питания (красное мясо, свекла, шпинат) и дополнительно использовать препараты железа.
Иммунная система беременной женщины ослаблена, поэтому повышается риск заболеваний, различные инфекционные заболевания (например грипп) переносятся тяжелее.
Окситоцин оказывает влияние на активность мозга беременной женщины, повышая ее интуитивную чувствительность и способствуя установлению связи с ребенком.
Центр стволовых клеток iVF Riga каждый месяц проводит бесплатные лекции для будущих мам. Лекцию о подготовке к родам и про стволовые клетки читают сертифицированная акушерка и специалист центра стволовых клеток. Узнать о предстоящих лекциях можно на сайте, а также на нашей странице в Facebook.
Эстрадиол
E2 – стероидный гормон, наиболее активный из эстрогенов, преимущественно обуславливает все этапы формирования и нормального функционирования женского организма: обеспечивает формирование половой системы по женскому типу, развитие женских вторичных половых признаков, регуляцию менструальной функции, рост и развитие матки в течение беременности. E2 обладает существенным влиянием на многие процессы функционирования организма: усиливает обмен костной ткани и ускоряет созревание костей скелета, способствует задержке натрия и воды в организме, снижает уровень общего холестерина и увеличивает концентрацию триглицеридов.
У женщин E2 синтезируется преимущественно в яичниках, в меньшей степени в сетчатой зоне коры надпочечников и в ходе периферического преобразования тестостерона. У мужчин E2 образуется в семенниках, в коре надпочечников, но большая часть – в периферических тканях за счет преобразования тестостерона, вследствие чего уровень E2 повышается в пубертатном периоде.
У женщин детородного возраста уровень E2 в сыворотке крови и плазме зависит от фазы менструального цикла, наиболее высокий уровень гормона отмечается в фолликулярной фазе. Во время беременности E2 синтезируется плацентой, концентрация гормона в крови нарастает к моменту родов, возвращается к норме на 4-й день после них. С возрастом у женщин наблюдается снижение концентрации E2. Концентрация Е2 в крови подвержена суточному ритму с максимумом с 15 до 18 часов.
Во время беременности E2 синтезируется плацентой, концентрация гормона в крови нарастает к моменту родов, возвращается к норме на 4-й день после них. С возрастом у женщин наблюдается снижение концентрации E2. Концентрация Е2 в крови подвержена суточному ритму с максимумом с 15 до 18 часов.
Определение уровня E2 – один из основных тестов для оценки репродуктивной функции женщин, включая обследование при бесплодии, олиго-, аменоррее и в менопаузальном периоде, во время подготовки к ЭКО. Снижение уровней E2 в крови молодых женщин часто является проявлением первичного или вторичного гипогонадизма. Высокий уровень Е2 при нарушении менструальной функции отмечают у пациенток с синдромом поликистоза яичников, а также при наличии андрогенили эстроген-продуцирующих опухолей.
Показания к исследованию
- Предменструальный синдром;
- аменорея, олигоменорея, ановуляция;
- ациклические маточные кровотечения;
- нарушение полового созревания, гипогонадизм;
- бесплодие;
- оценка функционирования фетоплацентарного комплекса на ранних сроках беременности;
- при ЭКО: оценка овариального статуса, включая развитие фолликула;
- мониторинг заместительной гормонотерапии, антиэстрогенной терапии;
- остеопороз у женщин;
- гирсутизм;
- бактериальный вагиноз;
- клинические признаки феминизации у мужчин.
Повышенные значения
- Персистенция фолликула;
- эндометриоидные кисты яичников, опухоли, секретирующие эстрогены;
Пониженные значения
- Гипогонадизм гипергонадотропный (первичный), гипогонадотропный (вторичный, третичный)
- гипофизарный нанизм;
- гиперпролактинемия;
- вирильный синдром;
- угроза прерывания беременности эндокринного генеза;
- прием глюкокортикоидов, андрогенов, проведение химиотерапии.

Гормоны во время беременности
Стероидные гормоны, такие как прогестерон, широко изучались в литературе, но при ее использовании на ранних сроках беременности существуют разногласия. Целью обзора была роль в предотвращении абортов, повторного невынашивания беременности и преждевременных родов. Была проанализирована роль добавок эстрогена и прогестерона в вспомогательной репродукции. Факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции
Производство стероидных гормонов и требует использования
Прогестерон
Прогестерон в основном вырабатывается желтым телом примерно до 10 недель беременности. 1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
На ранних сроках беременности у матери повышается уровень 17 α-гидроксипрогестерона, что свидетельствует об активности желтого тела. К десятой неделе беременности это соединение вернулось к исходному уровню, что указывает на то, что плацента имеет небольшую активность 17a-гидроксилазы. Однако, начиная примерно с недели 32, 9, 11, 9, 12, происходит второй, более постепенный рост 17a-гидроксипрогестерона из-за утилизации предшественников плода плацентой.Это важно для понимания профилактики преждевременных родов. Прогестерон также играет важную роль в подавлении материнского иммунологического ответа на фетальные антигены, тем самым предотвращая материнское отторжение трофобласта. И, конечно же, прогестерон подготавливает и поддерживает эндометрий, что позволяет провести имплантацию раньше. Исследования показали, что желтое тело человека вырабатывает значительное количество эстрадиола, но для успешной имплантации требуется прогестерон, а не эстроген. 3
И, конечно же, прогестерон подготавливает и поддерживает эндометрий, что позволяет провести имплантацию раньше. Исследования показали, что желтое тело человека вырабатывает значительное количество эстрадиола, но для успешной имплантации требуется прогестерон, а не эстроген. 3
Эстроген
В плаценте нет всех необходимых ферментов для производства эстрогенов из холестерина или даже прогестерона.В человеческом трофобласте отсутствует 17-гидроксилаза, и поэтому он не может преобразовывать C21-стероиды в C19-стероиды, непосредственные предшественники эстрогена. Чтобы обойти этот дефицит, дегидроизоандростерон сульфат (DHA) из надпочечников плода превращается трофобластами в эстрадиол-17ί. В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
Белковые гормоны
Белковые гормоны: плацентарный лактоген человека (hPL), хорионический гонадотропин человека (hCG), адренокортикотропный агент (ACTH), вариант гормона роста (hGH-V), белок, связанный с паратиреоидным гормоном (PTH-rP) , Кальцитонин, релаксин, ингибины активины, предсердный натрийуретический пептид, гипоталамический рилизинг и ингибирующие гормоны, тиротропин-рилизинг-гормон (TRH), гонадотропин-рилизинг-гормон (GnRH), кортикотропин-рилизинг-гормон (CRH), соматостатин, соматостатин GHRH), альфа-фетопротеин, пролактин, релаксин и другие децидуальные белки.В связи с полнотой вариантов описания гормонов, в этой главе обсуждается клиническая важность ХГЧ для терапии.
Хорионический гонадотропин человека
Наиболее изученным продуктом гормона трофобласта является ХГЧ. Во время беременности этот гликопротеин имеет решающее значение, поскольку он спасает желтое тело от инволюции и поддерживает секрецию прогестерона клетками гранулезы яичника. Его полезность в качестве диагностического маркера беременности связана с тем, что он может быть одним из самых ранних секретируемых продуктов концепта.При беременности плацентарная продукция ХГЧ находится на пике между восьмой и десятой неделями беременности и имеет тенденцию к плато на более низком уровне на протяжении оставшейся части беременности.
Единственная определенно известная функция ХГЧ — это поддержка желтого тела (ХТ), заменяющая ЛГ примерно на восьмой день после овуляции, через 1 день после имплантации, когда b-ХГЧ впервые может быть обнаружен в материнской крови. На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
Имплантация происходит через 5-6 дней после овуляции, а ХГЧ должен появиться к 10 дню овуляции (4 дня после овуляции), чтобы спасти желтое тело.Следовательно, бластоциста должна имплантироваться в узкий промежуток времени. Стимуляция ХГЧ CL приводит к ежедневной секреции 25 мг P и 0,5 мг E2. Экспрессия гена ХГЧ присутствует как в цитотрофобласте, так и в синцитиотрофобласте, но синтезируется в основном в синцитиотрофобласте. Концентрация циркулирующего ХГЧ у матери составляет примерно 100 МЕ / л во время ожидаемой, но пропущенной менструации. Максимальный уровень около 100 000 МЕ / л в кровотоке матери достигается на 8-10 неделе беременности. Есть два клинических состояния, при которых титры ХГЧ в крови особенно полезны: трофобластическая болезнь и внематочная беременность.Трофобластическая болезнь отличается очень высоким уровнем b-ХГЧ (в 3-100 раз выше, чем при нормальной беременности). Внематочная продукция α- и β-ХГЧ нетрофобластическими опухолями встречается редко, но все же происходит.
Человеческий плацентарный лактоген (hPL) секретируется в основном в материнский кровоток, большинство его функций происходит в местах действия в материнских тканях.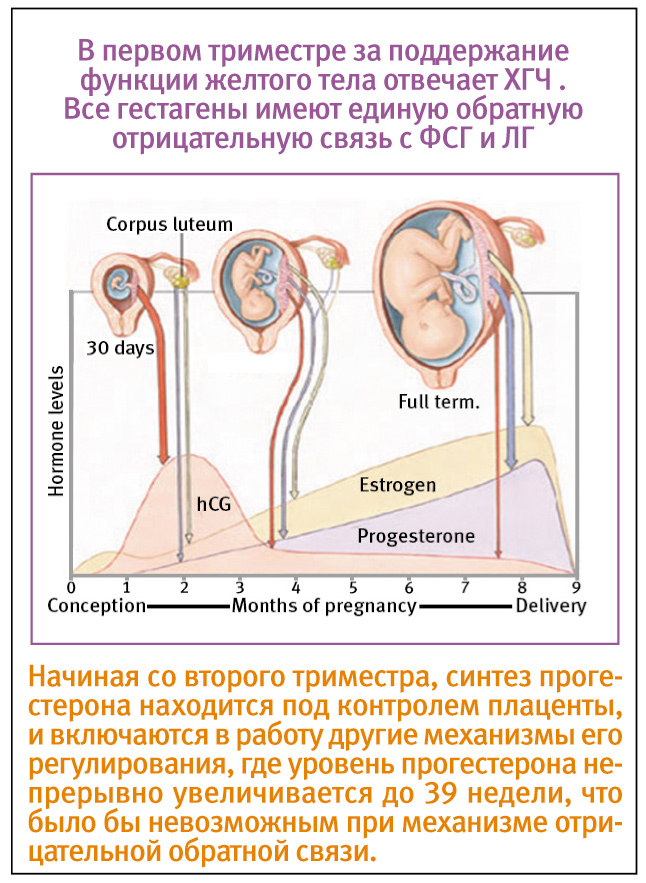 Считается, что плацентарный лактоген человека ответственен за заметное повышение концентрации инсулиноподобного фактора роста-1 (IGF-1) в плазме крови матери по мере приближения срока беременности.Плацентарный лактоген человека оказывает метаболическое действие во время беременности через IGF-I. Он связан с инсулинорезистентностью, увеличивает секрецию инсулина, который стимулирует липолиз, увеличивает количество свободных жирных кислот в крови и ингибирует глюконеогенез; по сути, он противодействует действию инсулина, вызывает непереносимость глюкозы, а также липолиз и протеолиз в материнской системе. Таким образом, в клинической практике подчеркивается роль универсального скрининга аномального уровня сахара в крови в начале третьего триместра.
Считается, что плацентарный лактоген человека ответственен за заметное повышение концентрации инсулиноподобного фактора роста-1 (IGF-1) в плазме крови матери по мере приближения срока беременности.Плацентарный лактоген человека оказывает метаболическое действие во время беременности через IGF-I. Он связан с инсулинорезистентностью, увеличивает секрецию инсулина, который стимулирует липолиз, увеличивает количество свободных жирных кислот в крови и ингибирует глюконеогенез; по сути, он противодействует действию инсулина, вызывает непереносимость глюкозы, а также липолиз и протеолиз в материнской системе. Таким образом, в клинической практике подчеркивается роль универсального скрининга аномального уровня сахара в крови в начале третьего триместра.
Концентрация кальция у плода регулируется перемещением кальция через плаценту из материнского компартмента. Чтобы поддерживать рост костей плода, материнский отсек подвергается корректировкам, которые обеспечивают чистый перенос достаточного количества кальция к плоду. Изменения материнского компартмента, которые способствуют накоплению кальция, включают увеличение потребления с пищей матери, повышение уровня D3 у матери и повышение уровней паратиреоидного гормона.
Добавка прогестерона во время беременности: иммунологическая терапия
Есть несколько исследований, чтобы понять поддержание беременности с помощью прогестерона.Было показано, что прогестерон увеличивает количество цитокинов, продуцируемых клетками Th3, которые преобладают над цитокинами, продуцируемыми клетками Th2, что приводит к поддержанию беременности. Клетки Th3 доминируют в децидуальной оболочке на ранних сроках беременности у людей. Цитокины, производные от Th3, ИЛ-4 и ИЛ-6, индуцируют высвобождение ХГЧ из трофобластов, а ХГЧ стимулирует выработку прогестерона желтым телом во время беременности. Было показано, что прогестерон стимулирует секрецию Th3 и снижает секрецию цитокинов Th2.Таким образом, поддержание беременности приписывается цитокину типа Th3. Эта роль в контроле иммунной и эндокринной системы, которая способствует функционированию трофобластов в месте имплантации, кажется интересной. 4 Использование прогестагена при угрозе прерывания беременности является спорным вопросом. 5
Эта роль в контроле иммунной и эндокринной системы, которая способствует функционированию трофобластов в месте имплантации, кажется интересной. 4 Использование прогестагена при угрозе прерывания беременности является спорным вопросом. 5
Прогестерон при повторном невынашивании беременности
Прогестоген использовался в течение нескольких лет, даже до того, как стали известны иммуномодулирующие свойства прогестерона.С того времени были проведены исследования разного качества, чтобы доказать преимущества приема прогестагенов у больных женщин. Исследование 146 женщин с легким или умеренным вагинальным кровотечением в первом триместре беременности было рандомизировано для приема перорального дидрогестерона (10 мг два раза в день) ( n = 86) или отсутствия лечения ( n = 60). Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
9
Добавки прогестерона после вспомогательных репродуктивных технологий
Использование добавок прогестерона в циклах ВРТ более понятно. 10 Продолжительность приема прогестерона после репродуктивной технологии (ВРТ) изучалась в ретроспективном когортном исследовании. Одна группа получала прогестерон в течение первого триместра беременности (протокол первого триместра) до 12 недель, а вторая группа прекратила прием прогестерона после положительного результата теста на бета-ХГЧ через 2 недели после извлечения (лютеиновый протокол).Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
12
Профилактика повторных преждевременных родов с помощью 17 альфа-гидроксипрогестерона капроата
Следует ожидать и предотвращать преждевременные роды для снижения перинатальной заболеваемости и смертности. Те женщины, у которых ранее были самопроизвольные преждевременные роды, имеют значительно повышенный риск преждевременных родов при последующих беременностях.Результаты нескольких небольших исследований показали, что 17-альфа-гидроксипрогестерона капроат (17P) может снизить риск преждевременных родов. Было проведено двойное слепое плацебо-контролируемое исследование с участием беременных женщин с задокументированной историей самопроизвольных преждевременных родов. 13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме. Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме. Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Исследование восьмидесяти трех женщин с симптомами угрозы преждевременных родов было рандомизировано в исследуемые группы, получавшие токолитическое лечение в сочетании с интравагинальным микронизированным естественным прогестероном (200 мг в день), или в контрольную группу, получающую только токолиз. Обработка микронизированного природного прогестерона привела к увеличению латентного периода 32,1 ± 17,8 дня по сравнению с 21,2 ± 16,3 дня в контрольной группе и увеличению веса при рождении 2 982,8 ± 697,8 г против 2585,3 ± 746,6 г. 19
Обработка микронизированного природного прогестерона привела к увеличению латентного периода 32,1 ± 17,8 дня по сравнению с 21,2 ± 16,3 дня в контрольной группе и увеличению веса при рождении 2 982,8 ± 697,8 г против 2585,3 ± 746,6 г. 19
Добавки эстрадиола во время лютеиновой фазы in vitro циклов оплодотворения
Было проведено проспективное рандомизированное исследование, чтобы найти оптимальную дозу эстрадиола (E2) для поддержки лютеиновой фазы путем добавления различных доз E2 для поддержки лютеиновой фазы прогестероном (P) у пациентов, подвергающихся лечению с использованием длинного агониста ГнРГ in vitro оплодотворения (ЭКО). 20 Двести восемьдесят пять женщин, проходящих лечение ЭКО с использованием длительного протокола агонистов ГнРГ, были проспективно рандомизированы на три группы. Группа 1 ( n = 95) получала P и 2 мг E2, группа 2 ( n = 95) получала P и 4 мг E2, а группа 3 ( n = 95) получала P и 6 мг E2 в качестве лютеиновой фазы. служба поддержки. Первичным результатом была частота клинической беременности (PR). Второстепенными интересующими переменными были частота имплантации (IR), частота выкидышей и множественное PR.Клинический PR составил 31,6%, 40% и 32% соответственно в группах 1, 2 и 3, и различия между группами не были статистически значимыми. Однако частота выкидышей была значительно ниже в группе 2 (2,6%), чем в группе 1 (20%), но не была значительно ниже, чем в группе 3 (9,6%). Исследование пришло к выводу, что добавление 2, 4 или 6 мг перорального E2 к P в лютеиновой фазе не создает статистической разницы в показателях частоты наступления беременности. Однако при использовании 2 мг E2 была обнаружена значительно более высокая частота выкидышей.Следовательно, при поддержке лютеиновой фазы 4 мг перорального эстрадиола в дополнение к прогестерону можно рассматривать как снижение частоты выкидышей. По-прежнему необходимы дополнительные исследования для определения группы риска, оптимального гестационного возраста на момент начала, способа введения, дозы прогестерона и долгосрочной безопасности.
Заболевания щитовидной железы
Это имеет большое влияние на фертильность. Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Контролируемая гиперстимуляция яичников приводит к увеличению эстрадиола, что, в свою очередь, может отрицательно влиять на гормоны щитовидной железы и ТТГ. Гиперстимуляция яичников может стать серьезной при наличии аутоиммунного заболевания щитовидной железы в зависимости от ранее существовавших патологий щитовидной железы. Аутоиммунное заболевание щитовидной железы встречается у 5-20% беременных, не прошедших отбор. Изолированная гипотироксинемия описана примерно в 2% беременностей без повышения уровня ТТГ в сыворотке и аутоантител к щитовидной железе.Существует связь между повышенным риском самопроизвольных абортов, преждевременных родов и / или низкой массой тела при рождении, дистрессом плода в родах и, возможно, гипертензией, вызванной беременностью, и отслойкой плаценты при явном гипотиреозе. Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Заболевания щитовидной железы часто встречаются у женщин во время беременности. Если не лечить, как гипотиреоз, так и гипертиреоз связаны с неблагоприятным воздействием на беременность и исходы плода.Важно правильно идентифицировать эти расстройства и надлежащим образом лечить их, чтобы предотвратить осложнения, связанные с беременностью. Показанным лечением является левотироксин при гипотиреозе, а тиоамиды — средство выбора при гипертиреозе; В отдельных случаях может быть показана тиреоидэктомия. 23 , 24 Кокрановский обзор трех РКИ с участием 314 женщин показал в одном испытании с участием 115 женщин, что терапия левотироксином для лечения беременных эутиреоидных женщин антителами к пероксидазе щитовидной железы не снижает преэклампсию, но значительно снижает преждевременные роды на 72 человека. %.В одном испытании с участием 30 женщин с гипотиреозом сравнивали дозы левотироксина, но сообщали только биохимические результаты. В исследовании с участием 169 женщин сравнивали микроэлемент селенометионин (селен) с плацебо, и не было обнаружено значительных различий ни для преэклампсии, ни для преждевременных родов. Ни в одном из трех испытаний не сообщалось о задержке нервного развития у детей. 25
Гормоны во время беременности
Стероидные гормоны, такие как прогестерон, широко изучались в литературе, что вызывает разногласия по поводу их использования на ранних сроках беременности.Целью обзора была роль в предотвращении абортов, повторного невынашивания беременности и преждевременных родов. Была проанализирована роль добавок эстрогена и прогестерона в вспомогательной репродукции. Факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции
Производство стероидных гормонов и требует использования
Прогестерон
Прогестерон в основном вырабатывается желтым телом примерно до 10 недель беременности. 1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
На ранних сроках беременности у матери повышается уровень 17 α-гидроксипрогестерона, что свидетельствует об активности желтого тела. К десятой неделе беременности это соединение вернулось к исходному уровню, что указывает на то, что плацента имеет небольшую активность 17a-гидроксилазы. Однако, начиная примерно с недели 32, 9, 11, 9, 12, происходит второй, более постепенный рост 17a-гидроксипрогестерона из-за утилизации предшественников плода плацентой.Это важно для понимания профилактики преждевременных родов. Прогестерон также играет важную роль в подавлении материнского иммунологического ответа на фетальные антигены, тем самым предотвращая материнское отторжение трофобласта. И, конечно же, прогестерон подготавливает и поддерживает эндометрий, что позволяет провести имплантацию раньше. Исследования показали, что желтое тело человека вырабатывает значительное количество эстрадиола, но для успешной имплантации требуется прогестерон, а не эстроген. 3
Эстроген
В плаценте нет всех необходимых ферментов для производства эстрогенов из холестерина или даже прогестерона.В человеческом трофобласте отсутствует 17-гидроксилаза, и поэтому он не может преобразовывать C21-стероиды в C19-стероиды, непосредственные предшественники эстрогена. Чтобы обойти этот дефицит, дегидроизоандростерон сульфат (DHA) из надпочечников плода превращается трофобластами в эстрадиол-17ί. В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
Белковые гормоны
Белковые гормоны: плацентарный лактоген человека (hPL), хорионический гонадотропин человека (hCG), адренокортикотропный агент (ACTH), вариант гормона роста (hGH-V), белок, связанный с паратиреоидным гормоном (PTH-rP) , Кальцитонин, релаксин, ингибины активины, предсердный натрийуретический пептид, гипоталамический рилизинг и ингибирующие гормоны, тиротропин-рилизинг-гормон (TRH), гонадотропин-рилизинг-гормон (GnRH), кортикотропин-рилизинг-гормон (CRH), соматостатин, соматостатин GHRH), альфа-фетопротеин, пролактин, релаксин и другие децидуальные белки.В связи с полнотой вариантов описания гормонов, в этой главе обсуждается клиническая важность ХГЧ для терапии.
Хорионический гонадотропин человека
Наиболее изученным продуктом гормона трофобласта является ХГЧ. Во время беременности этот гликопротеин имеет решающее значение, поскольку он спасает желтое тело от инволюции и поддерживает секрецию прогестерона клетками гранулезы яичника. Его полезность в качестве диагностического маркера беременности связана с тем, что он может быть одним из самых ранних секретируемых продуктов концепта.При беременности плацентарная продукция ХГЧ находится на пике между восьмой и десятой неделями беременности и имеет тенденцию к плато на более низком уровне на протяжении оставшейся части беременности.
Единственная определенно известная функция ХГЧ — это поддержка желтого тела (ХТ), заменяющая ЛГ примерно на восьмой день после овуляции, через 1 день после имплантации, когда b-ХГЧ впервые может быть обнаружен в материнской крови. На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
Имплантация происходит через 5-6 дней после овуляции, а ХГЧ должен появиться к 10 дню овуляции (4 дня после овуляции), чтобы спасти желтое тело.Следовательно, бластоциста должна имплантироваться в узкий промежуток времени. Стимуляция ХГЧ CL приводит к ежедневной секреции 25 мг P и 0,5 мг E2. Экспрессия гена ХГЧ присутствует как в цитотрофобласте, так и в синцитиотрофобласте, но синтезируется в основном в синцитиотрофобласте. Концентрация циркулирующего ХГЧ у матери составляет примерно 100 МЕ / л во время ожидаемой, но пропущенной менструации. Максимальный уровень около 100 000 МЕ / л в кровотоке матери достигается на 8-10 неделе беременности. Есть два клинических состояния, при которых титры ХГЧ в крови особенно полезны: трофобластическая болезнь и внематочная беременность.Трофобластическая болезнь отличается очень высоким уровнем b-ХГЧ (в 3-100 раз выше, чем при нормальной беременности). Внематочная продукция α- и β-ХГЧ нетрофобластическими опухолями встречается редко, но все же происходит.
Человеческий плацентарный лактоген (hPL) секретируется в основном в материнский кровоток, большинство его функций происходит в местах действия в материнских тканях. Считается, что плацентарный лактоген человека ответственен за заметное повышение концентрации инсулиноподобного фактора роста-1 (IGF-1) в плазме крови матери по мере приближения срока беременности.Плацентарный лактоген человека оказывает метаболическое действие во время беременности через IGF-I. Он связан с инсулинорезистентностью, увеличивает секрецию инсулина, который стимулирует липолиз, увеличивает количество свободных жирных кислот в крови и ингибирует глюконеогенез; по сути, он противодействует действию инсулина, вызывает непереносимость глюкозы, а также липолиз и протеолиз в материнской системе. Таким образом, в клинической практике подчеркивается роль универсального скрининга аномального уровня сахара в крови в начале третьего триместра.
Концентрация кальция у плода регулируется перемещением кальция через плаценту из материнского компартмента. Чтобы поддерживать рост костей плода, материнский отсек подвергается корректировкам, которые обеспечивают чистый перенос достаточного количества кальция к плоду. Изменения материнского компартмента, которые способствуют накоплению кальция, включают увеличение потребления с пищей матери, повышение уровня D3 у матери и повышение уровней паратиреоидного гормона.
Добавка прогестерона во время беременности: иммунологическая терапия
Есть несколько исследований, чтобы понять поддержание беременности с помощью прогестерона.Было показано, что прогестерон увеличивает количество цитокинов, продуцируемых клетками Th3, которые преобладают над цитокинами, продуцируемыми клетками Th2, что приводит к поддержанию беременности. Клетки Th3 доминируют в децидуальной оболочке на ранних сроках беременности у людей. Цитокины, производные от Th3, ИЛ-4 и ИЛ-6, индуцируют высвобождение ХГЧ из трофобластов, а ХГЧ стимулирует выработку прогестерона желтым телом во время беременности. Было показано, что прогестерон стимулирует секрецию Th3 и снижает секрецию цитокинов Th2.Таким образом, поддержание беременности приписывается цитокину типа Th3. Эта роль в контроле иммунной и эндокринной системы, которая способствует функционированию трофобластов в месте имплантации, кажется интересной. 4 Использование прогестагена при угрозе прерывания беременности является спорным вопросом. 5
Прогестерон при повторном невынашивании беременности
Прогестоген использовался в течение нескольких лет, даже до того, как стали известны иммуномодулирующие свойства прогестерона.С того времени были проведены исследования разного качества, чтобы доказать преимущества приема прогестагенов у больных женщин. Исследование 146 женщин с легким или умеренным вагинальным кровотечением в первом триместре беременности было рандомизировано для приема перорального дидрогестерона (10 мг два раза в день) ( n = 86) или отсутствия лечения ( n = 60). Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Добавки прогестерона после вспомогательных репродуктивных технологий
Использование добавок прогестерона в циклах ВРТ более понятно. 10 Продолжительность приема прогестерона после репродуктивной технологии (ВРТ) изучалась в ретроспективном когортном исследовании. Одна группа получала прогестерон в течение первого триместра беременности (протокол первого триместра) до 12 недель, а вторая группа прекратила прием прогестерона после положительного результата теста на бета-ХГЧ через 2 недели после извлечения (лютеиновый протокол). Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
Профилактика повторных преждевременных родов с помощью 17 альфа-гидроксипрогестерона капроата
Следует ожидать и предотвращать преждевременные роды для снижения перинатальной заболеваемости и смертности. Те женщины, у которых ранее были самопроизвольные преждевременные роды, имеют значительно повышенный риск преждевременных родов при последующих беременностях.Результаты нескольких небольших исследований показали, что 17-альфа-гидроксипрогестерона капроат (17P) может снизить риск преждевременных родов. Было проведено двойное слепое плацебо-контролируемое исследование с участием беременных женщин с задокументированной историей самопроизвольных преждевременных родов. 13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме.
13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме.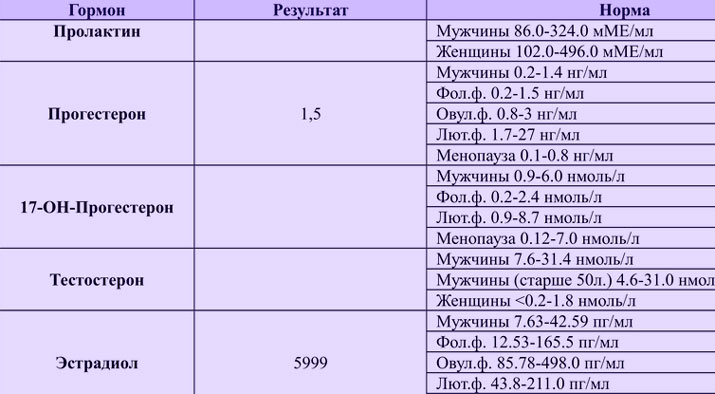 Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Исследование восьмидесяти трех женщин с симптомами угрозы преждевременных родов было рандомизировано в исследуемые группы, получавшие токолитическое лечение в сочетании с интравагинальным микронизированным естественным прогестероном (200 мг в день), или в контрольную группу, получающую только токолиз. Обработка микронизированного природного прогестерона привела к увеличению латентного периода 32,1 ± 17,8 дня по сравнению с 21,2 ± 16,3 дня в контрольной группе и увеличению веса при рождении 2 982,8 ± 697,8 г против 2585,3 ± 746,6 г. 19
19
Добавки эстрадиола во время лютеиновой фазы in vitro циклов оплодотворения
Было проведено проспективное рандомизированное исследование, чтобы найти оптимальную дозу эстрадиола (E2) для поддержки лютеиновой фазы путем добавления различных доз E2 для поддержки лютеиновой фазы прогестероном (P) у пациентов, подвергающихся лечению с использованием длинного агониста ГнРГ in vitro оплодотворения (ЭКО). 20 Двести восемьдесят пять женщин, проходящих лечение ЭКО с использованием длительного протокола агонистов ГнРГ, были проспективно рандомизированы на три группы. Группа 1 ( n = 95) получала P и 2 мг E2, группа 2 ( n = 95) получала P и 4 мг E2, а группа 3 ( n = 95) получала P и 6 мг E2 в качестве лютеиновой фазы. служба поддержки. Первичным результатом была частота клинической беременности (PR). Второстепенными интересующими переменными были частота имплантации (IR), частота выкидышей и множественное PR.Клинический PR составил 31,6%, 40% и 32% соответственно в группах 1, 2 и 3, и различия между группами не были статистически значимыми. Однако частота выкидышей была значительно ниже в группе 2 (2,6%), чем в группе 1 (20%), но не была значительно ниже, чем в группе 3 (9,6%). Исследование пришло к выводу, что добавление 2, 4 или 6 мг перорального E2 к P в лютеиновой фазе не создает статистической разницы в показателях частоты наступления беременности. Однако при использовании 2 мг E2 была обнаружена значительно более высокая частота выкидышей.Следовательно, при поддержке лютеиновой фазы 4 мг перорального эстрадиола в дополнение к прогестерону можно рассматривать как снижение частоты выкидышей. По-прежнему необходимы дополнительные исследования для определения группы риска, оптимального гестационного возраста на момент начала, способа введения, дозы прогестерона и долгосрочной безопасности.
Заболевания щитовидной железы
Это имеет большое влияние на фертильность.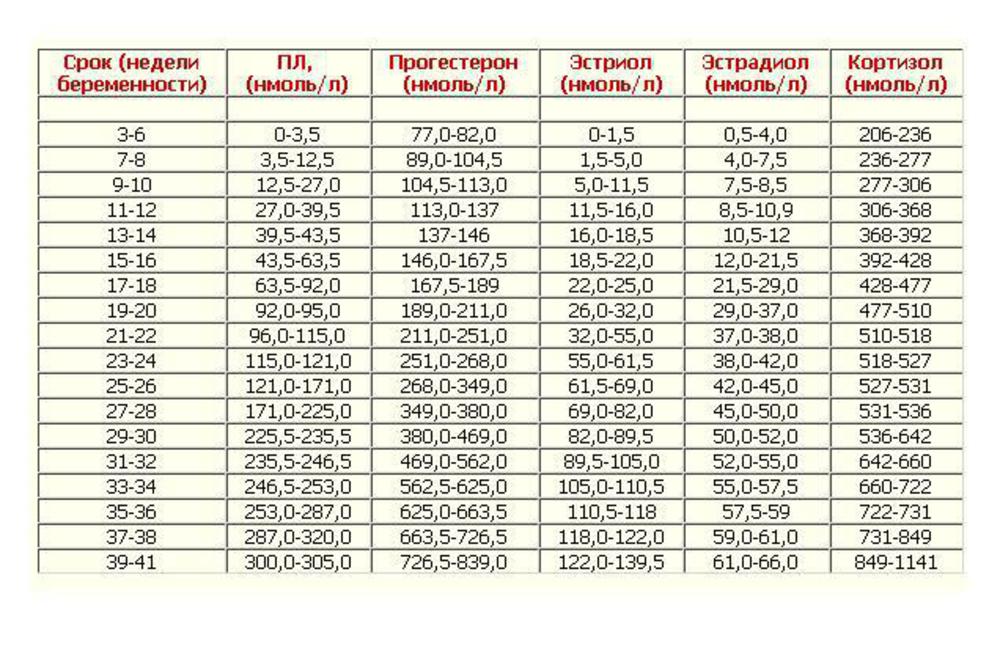 Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Контролируемая гиперстимуляция яичников приводит к увеличению эстрадиола, что, в свою очередь, может отрицательно влиять на гормоны щитовидной железы и ТТГ. Гиперстимуляция яичников может стать серьезной при наличии аутоиммунного заболевания щитовидной железы в зависимости от ранее существовавших патологий щитовидной железы. Аутоиммунное заболевание щитовидной железы встречается у 5-20% беременных, не прошедших отбор. Изолированная гипотироксинемия описана примерно в 2% беременностей без повышения уровня ТТГ в сыворотке и аутоантител к щитовидной железе.Существует связь между повышенным риском самопроизвольных абортов, преждевременных родов и / или низкой массой тела при рождении, дистрессом плода в родах и, возможно, гипертензией, вызванной беременностью, и отслойкой плаценты при явном гипотиреозе. Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Заболевания щитовидной железы часто встречаются у женщин во время беременности. Если не лечить, как гипотиреоз, так и гипертиреоз связаны с неблагоприятным воздействием на беременность и исходы плода.Важно правильно идентифицировать эти расстройства и надлежащим образом лечить их, чтобы предотвратить осложнения, связанные с беременностью. Показанным лечением является левотироксин при гипотиреозе, а тиоамиды — средство выбора при гипертиреозе; В отдельных случаях может быть показана тиреоидэктомия. 23 , 24 Кокрановский обзор трех РКИ с участием 314 женщин показал в одном испытании с участием 115 женщин, что терапия левотироксином для лечения беременных эутиреоидных женщин антителами к пероксидазе щитовидной железы не снижает преэклампсию, но значительно снижает преждевременные роды на 72 человека. %.В одном испытании с участием 30 женщин с гипотиреозом сравнивали дозы левотироксина, но сообщали только биохимические результаты. В исследовании с участием 169 женщин сравнивали микроэлемент селенометионин (селен) с плацебо, и не было обнаружено значительных различий ни для преэклампсии, ни для преждевременных родов. Ни в одном из трех испытаний не сообщалось о задержке нервного развития у детей. 25
Гормоны во время беременности
Стероидные гормоны, такие как прогестерон, широко изучались в литературе, что вызывает разногласия по поводу их использования на ранних сроках беременности.Целью обзора была роль в предотвращении абортов, повторного невынашивания беременности и преждевременных родов. Была проанализирована роль добавок эстрогена и прогестерона в вспомогательной репродукции. Факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции
Производство стероидных гормонов и требует использования
Прогестерон
Прогестерон в основном вырабатывается желтым телом примерно до 10 недель беременности. 1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
На ранних сроках беременности у матери повышается уровень 17 α-гидроксипрогестерона, что свидетельствует об активности желтого тела. К десятой неделе беременности это соединение вернулось к исходному уровню, что указывает на то, что плацента имеет небольшую активность 17a-гидроксилазы. Однако, начиная примерно с недели 32, 9, 11, 9, 12, происходит второй, более постепенный рост 17a-гидроксипрогестерона из-за утилизации предшественников плода плацентой.Это важно для понимания профилактики преждевременных родов. Прогестерон также играет важную роль в подавлении материнского иммунологического ответа на фетальные антигены, тем самым предотвращая материнское отторжение трофобласта. И, конечно же, прогестерон подготавливает и поддерживает эндометрий, что позволяет провести имплантацию раньше. Исследования показали, что желтое тело человека вырабатывает значительное количество эстрадиола, но для успешной имплантации требуется прогестерон, а не эстроген. 3
Эстроген
В плаценте нет всех необходимых ферментов для производства эстрогенов из холестерина или даже прогестерона.В человеческом трофобласте отсутствует 17-гидроксилаза, и поэтому он не может преобразовывать C21-стероиды в C19-стероиды, непосредственные предшественники эстрогена. Чтобы обойти этот дефицит, дегидроизоандростерон сульфат (DHA) из надпочечников плода превращается трофобластами в эстрадиол-17ί. В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
Белковые гормоны
Белковые гормоны: плацентарный лактоген человека (hPL), хорионический гонадотропин человека (hCG), адренокортикотропный агент (ACTH), вариант гормона роста (hGH-V), белок, связанный с паратиреоидным гормоном (PTH-rP) , Кальцитонин, релаксин, ингибины активины, предсердный натрийуретический пептид, гипоталамический рилизинг и ингибирующие гормоны, тиротропин-рилизинг-гормон (TRH), гонадотропин-рилизинг-гормон (GnRH), кортикотропин-рилизинг-гормон (CRH), соматостатин, соматостатин GHRH), альфа-фетопротеин, пролактин, релаксин и другие децидуальные белки.В связи с полнотой вариантов описания гормонов, в этой главе обсуждается клиническая важность ХГЧ для терапии.
Хорионический гонадотропин человека
Наиболее изученным продуктом гормона трофобласта является ХГЧ. Во время беременности этот гликопротеин имеет решающее значение, поскольку он спасает желтое тело от инволюции и поддерживает секрецию прогестерона клетками гранулезы яичника. Его полезность в качестве диагностического маркера беременности связана с тем, что он может быть одним из самых ранних секретируемых продуктов концепта.При беременности плацентарная продукция ХГЧ находится на пике между восьмой и десятой неделями беременности и имеет тенденцию к плато на более низком уровне на протяжении оставшейся части беременности.
Единственная определенно известная функция ХГЧ — это поддержка желтого тела (ХТ), заменяющая ЛГ примерно на восьмой день после овуляции, через 1 день после имплантации, когда b-ХГЧ впервые может быть обнаружен в материнской крови.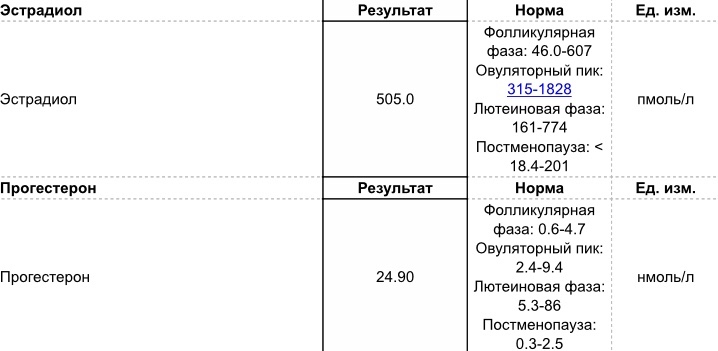 На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
Имплантация происходит через 5-6 дней после овуляции, а ХГЧ должен появиться к 10 дню овуляции (4 дня после овуляции), чтобы спасти желтое тело.Следовательно, бластоциста должна имплантироваться в узкий промежуток времени. Стимуляция ХГЧ CL приводит к ежедневной секреции 25 мг P и 0,5 мг E2. Экспрессия гена ХГЧ присутствует как в цитотрофобласте, так и в синцитиотрофобласте, но синтезируется в основном в синцитиотрофобласте. Концентрация циркулирующего ХГЧ у матери составляет примерно 100 МЕ / л во время ожидаемой, но пропущенной менструации. Максимальный уровень около 100 000 МЕ / л в кровотоке матери достигается на 8-10 неделе беременности. Есть два клинических состояния, при которых титры ХГЧ в крови особенно полезны: трофобластическая болезнь и внематочная беременность.Трофобластическая болезнь отличается очень высоким уровнем b-ХГЧ (в 3-100 раз выше, чем при нормальной беременности). Внематочная продукция α- и β-ХГЧ нетрофобластическими опухолями встречается редко, но все же происходит.
Человеческий плацентарный лактоген (hPL) секретируется в основном в материнский кровоток, большинство его функций происходит в местах действия в материнских тканях. Считается, что плацентарный лактоген человека ответственен за заметное повышение концентрации инсулиноподобного фактора роста-1 (IGF-1) в плазме крови матери по мере приближения срока беременности.Плацентарный лактоген человека оказывает метаболическое действие во время беременности через IGF-I. Он связан с инсулинорезистентностью, увеличивает секрецию инсулина, который стимулирует липолиз, увеличивает количество свободных жирных кислот в крови и ингибирует глюконеогенез; по сути, он противодействует действию инсулина, вызывает непереносимость глюкозы, а также липолиз и протеолиз в материнской системе. Таким образом, в клинической практике подчеркивается роль универсального скрининга аномального уровня сахара в крови в начале третьего триместра.
Концентрация кальция у плода регулируется перемещением кальция через плаценту из материнского компартмента. Чтобы поддерживать рост костей плода, материнский отсек подвергается корректировкам, которые обеспечивают чистый перенос достаточного количества кальция к плоду. Изменения материнского компартмента, которые способствуют накоплению кальция, включают увеличение потребления с пищей матери, повышение уровня D3 у матери и повышение уровней паратиреоидного гормона.
Добавка прогестерона во время беременности: иммунологическая терапия
Есть несколько исследований, чтобы понять поддержание беременности с помощью прогестерона.Было показано, что прогестерон увеличивает количество цитокинов, продуцируемых клетками Th3, которые преобладают над цитокинами, продуцируемыми клетками Th2, что приводит к поддержанию беременности. Клетки Th3 доминируют в децидуальной оболочке на ранних сроках беременности у людей. Цитокины, производные от Th3, ИЛ-4 и ИЛ-6, индуцируют высвобождение ХГЧ из трофобластов, а ХГЧ стимулирует выработку прогестерона желтым телом во время беременности. Было показано, что прогестерон стимулирует секрецию Th3 и снижает секрецию цитокинов Th2.Таким образом, поддержание беременности приписывается цитокину типа Th3. Эта роль в контроле иммунной и эндокринной системы, которая способствует функционированию трофобластов в месте имплантации, кажется интересной. 4 Использование прогестагена при угрозе прерывания беременности является спорным вопросом. 5
Прогестерон при повторном невынашивании беременности
Прогестоген использовался в течение нескольких лет, даже до того, как стали известны иммуномодулирующие свойства прогестерона.С того времени были проведены исследования разного качества, чтобы доказать преимущества приема прогестагенов у больных женщин. Исследование 146 женщин с легким или умеренным вагинальным кровотечением в первом триместре беременности было рандомизировано для приема перорального дидрогестерона (10 мг два раза в день) ( n = 86) или отсутствия лечения ( n = 60). Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Добавки прогестерона после вспомогательных репродуктивных технологий
Использование добавок прогестерона в циклах ВРТ более понятно. 10 Продолжительность приема прогестерона после репродуктивной технологии (ВРТ) изучалась в ретроспективном когортном исследовании. Одна группа получала прогестерон в течение первого триместра беременности (протокол первого триместра) до 12 недель, а вторая группа прекратила прием прогестерона после положительного результата теста на бета-ХГЧ через 2 недели после извлечения (лютеиновый протокол).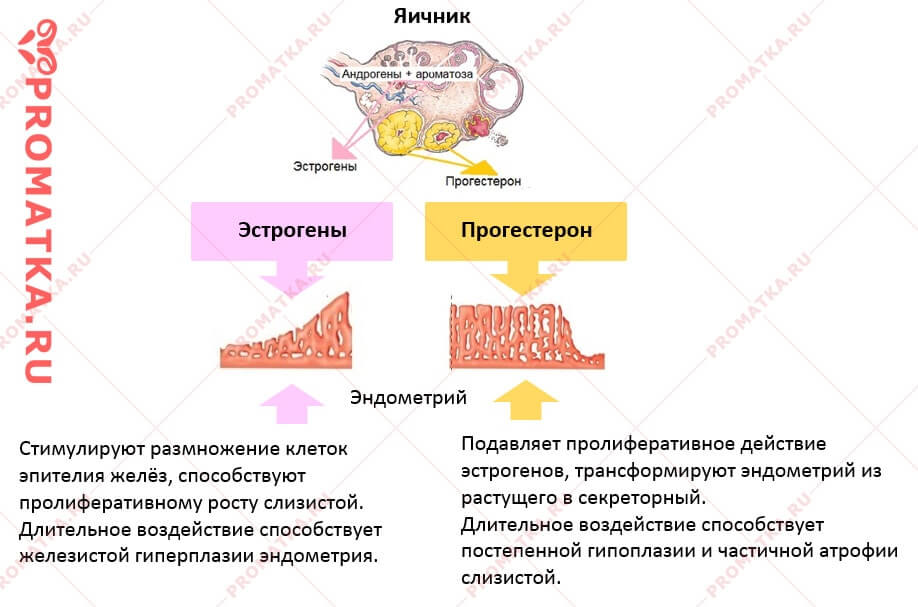 Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
Профилактика повторных преждевременных родов с помощью 17 альфа-гидроксипрогестерона капроата
Следует ожидать и предотвращать преждевременные роды для снижения перинатальной заболеваемости и смертности. Те женщины, у которых ранее были самопроизвольные преждевременные роды, имеют значительно повышенный риск преждевременных родов при последующих беременностях.Результаты нескольких небольших исследований показали, что 17-альфа-гидроксипрогестерона капроат (17P) может снизить риск преждевременных родов. Было проведено двойное слепое плацебо-контролируемое исследование с участием беременных женщин с задокументированной историей самопроизвольных преждевременных родов. 13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме.
13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме. Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Исследование восьмидесяти трех женщин с симптомами угрозы преждевременных родов было рандомизировано в исследуемые группы, получавшие токолитическое лечение в сочетании с интравагинальным микронизированным естественным прогестероном (200 мг в день), или в контрольную группу, получающую только токолиз. Обработка микронизированного природного прогестерона привела к увеличению латентного периода 32,1 ± 17,8 дня по сравнению с 21,2 ± 16,3 дня в контрольной группе и увеличению веса при рождении 2 982,8 ± 697,8 г против 2585,3 ± 746,6 г. 19
19
Добавки эстрадиола во время лютеиновой фазы in vitro циклов оплодотворения
Было проведено проспективное рандомизированное исследование, чтобы найти оптимальную дозу эстрадиола (E2) для поддержки лютеиновой фазы путем добавления различных доз E2 для поддержки лютеиновой фазы прогестероном (P) у пациентов, подвергающихся лечению с использованием длинного агониста ГнРГ in vitro оплодотворения (ЭКО). 20 Двести восемьдесят пять женщин, проходящих лечение ЭКО с использованием длительного протокола агонистов ГнРГ, были проспективно рандомизированы на три группы. Группа 1 ( n = 95) получала P и 2 мг E2, группа 2 ( n = 95) получала P и 4 мг E2, а группа 3 ( n = 95) получала P и 6 мг E2 в качестве лютеиновой фазы. служба поддержки. Первичным результатом была частота клинической беременности (PR). Второстепенными интересующими переменными были частота имплантации (IR), частота выкидышей и множественное PR.Клинический PR составил 31,6%, 40% и 32% соответственно в группах 1, 2 и 3, и различия между группами не были статистически значимыми. Однако частота выкидышей была значительно ниже в группе 2 (2,6%), чем в группе 1 (20%), но не была значительно ниже, чем в группе 3 (9,6%). Исследование пришло к выводу, что добавление 2, 4 или 6 мг перорального E2 к P в лютеиновой фазе не создает статистической разницы в показателях частоты наступления беременности. Однако при использовании 2 мг E2 была обнаружена значительно более высокая частота выкидышей.Следовательно, при поддержке лютеиновой фазы 4 мг перорального эстрадиола в дополнение к прогестерону можно рассматривать как снижение частоты выкидышей. По-прежнему необходимы дополнительные исследования для определения группы риска, оптимального гестационного возраста на момент начала, способа введения, дозы прогестерона и долгосрочной безопасности.
Заболевания щитовидной железы
Это имеет большое влияние на фертильность. Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Контролируемая гиперстимуляция яичников приводит к увеличению эстрадиола, что, в свою очередь, может отрицательно влиять на гормоны щитовидной железы и ТТГ. Гиперстимуляция яичников может стать серьезной при наличии аутоиммунного заболевания щитовидной железы в зависимости от ранее существовавших патологий щитовидной железы. Аутоиммунное заболевание щитовидной железы встречается у 5-20% беременных, не прошедших отбор. Изолированная гипотироксинемия описана примерно в 2% беременностей без повышения уровня ТТГ в сыворотке и аутоантител к щитовидной железе.Существует связь между повышенным риском самопроизвольных абортов, преждевременных родов и / или низкой массой тела при рождении, дистрессом плода в родах и, возможно, гипертензией, вызванной беременностью, и отслойкой плаценты при явном гипотиреозе. Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Заболевания щитовидной железы часто встречаются у женщин во время беременности. Если не лечить, как гипотиреоз, так и гипертиреоз связаны с неблагоприятным воздействием на беременность и исходы плода.Важно правильно идентифицировать эти расстройства и надлежащим образом лечить их, чтобы предотвратить осложнения, связанные с беременностью. Показанным лечением является левотироксин при гипотиреозе, а тиоамиды — средство выбора при гипертиреозе; В отдельных случаях может быть показана тиреоидэктомия. 23 , 24 Кокрановский обзор трех РКИ с участием 314 женщин показал в одном испытании с участием 115 женщин, что терапия левотироксином для лечения беременных эутиреоидных женщин антителами к пероксидазе щитовидной железы не снижает преэклампсию, но значительно снижает преждевременные роды на 72 человека. %.В одном испытании с участием 30 женщин с гипотиреозом сравнивали дозы левотироксина, но сообщали только биохимические результаты. В исследовании с участием 169 женщин сравнивали микроэлемент селенометионин (селен) с плацебо, и не было обнаружено значительных различий ни для преэклампсии, ни для преждевременных родов. Ни в одном из трех испытаний не сообщалось о задержке нервного развития у детей. 25
Гормоны во время беременности
Стероидные гормоны, такие как прогестерон, широко изучались в литературе, что вызывает разногласия по поводу их использования на ранних сроках беременности.Целью обзора была роль в предотвращении абортов, повторного невынашивания беременности и преждевременных родов. Была проанализирована роль добавок эстрогена и прогестерона в вспомогательной репродукции. Факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции
Производство стероидных гормонов и требует использования
Прогестерон
Прогестерон в основном вырабатывается желтым телом примерно до 10 недель беременности. 1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
1 Исследование недостаточности яичников и вспомогательной репродукции показало, что 100 мг фосфора, вероятно, были супрафизиологической дозой для поддержки беременности через 6-8 недель после зачатия. Фетоплацентарное отделение было пригодным на сроке от 10 до 12 недель беременности. 2 Когда беременность достигает срока, уровень прогестерона колеблется от 100 до 200 нг / мл, а плацента вырабатывает около 250 мг / день. Почти весь прогестерон, продуцируемый плацентой, попадает в плаценту, в отличие от эстрогена.Производство прогестерона не зависит от наличия предшественника, состояния плода, включая самочувствие.
На ранних сроках беременности у матери повышается уровень 17 α-гидроксипрогестерона, что свидетельствует об активности желтого тела. К десятой неделе беременности это соединение вернулось к исходному уровню, что указывает на то, что плацента имеет небольшую активность 17a-гидроксилазы. Однако, начиная примерно с недели 32, 9, 11, 9, 12, происходит второй, более постепенный рост 17a-гидроксипрогестерона из-за утилизации предшественников плода плацентой.Это важно для понимания профилактики преждевременных родов. Прогестерон также играет важную роль в подавлении материнского иммунологического ответа на фетальные антигены, тем самым предотвращая материнское отторжение трофобласта. И, конечно же, прогестерон подготавливает и поддерживает эндометрий, что позволяет провести имплантацию раньше. Исследования показали, что желтое тело человека вырабатывает значительное количество эстрадиола, но для успешной имплантации требуется прогестерон, а не эстроген. 3
Эстроген
В плаценте нет всех необходимых ферментов для производства эстрогенов из холестерина или даже прогестерона.В человеческом трофобласте отсутствует 17-гидроксилаза, и поэтому он не может преобразовывать C21-стероиды в C19-стероиды, непосредственные предшественники эстрогена. Чтобы обойти этот дефицит, дегидроизоандростерон сульфат (DHA) из надпочечников плода превращается трофобластами в эстрадиол-17ί.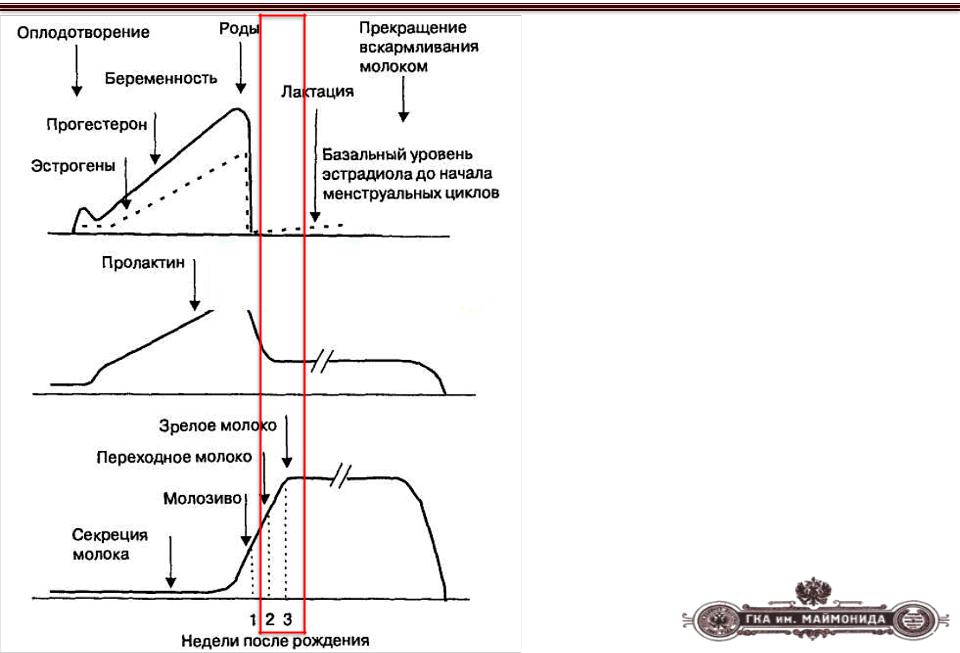 В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
В своем ключевом месте в качестве промежуточной станции между матерью и плодом плацента может использовать прекурсоры от матери или плода, чтобы обойти свой собственный дефицит ферментативной активности. Гормоны действуют как катализаторы химических изменений на клеточном уровне, которые необходимы для роста, развития и получения энергии.У плода отсутствует 3B-гидроксистероиддегидрогеназа, поэтому он не может производить прогестерон, заимствованный из плаценты. Взамен плод дает плаценте то, чего ему не хватает (19 соединений углерода) — предшественника эстрогена.
Белковые гормоны
Белковые гормоны: плацентарный лактоген человека (hPL), хорионический гонадотропин человека (hCG), адренокортикотропный агент (ACTH), вариант гормона роста (hGH-V), белок, связанный с паратиреоидным гормоном (PTH-rP) , Кальцитонин, релаксин, ингибины активины, предсердный натрийуретический пептид, гипоталамический рилизинг и ингибирующие гормоны, тиротропин-рилизинг-гормон (TRH), гонадотропин-рилизинг-гормон (GnRH), кортикотропин-рилизинг-гормон (CRH), соматостатин, соматостатин GHRH), альфа-фетопротеин, пролактин, релаксин и другие децидуальные белки.В связи с полнотой вариантов описания гормонов, в этой главе обсуждается клиническая важность ХГЧ для терапии.
Хорионический гонадотропин человека
Наиболее изученным продуктом гормона трофобласта является ХГЧ. Во время беременности этот гликопротеин имеет решающее значение, поскольку он спасает желтое тело от инволюции и поддерживает секрецию прогестерона клетками гранулезы яичника. Его полезность в качестве диагностического маркера беременности связана с тем, что он может быть одним из самых ранних секретируемых продуктов концепта.При беременности плацентарная продукция ХГЧ находится на пике между восьмой и десятой неделями беременности и имеет тенденцию к плато на более низком уровне на протяжении оставшейся части беременности.
Единственная определенно известная функция ХГЧ — это поддержка желтого тела (ХТ), заменяющая ЛГ примерно на восьмой день после овуляции, через 1 день после имплантации, когда b-ХГЧ впервые может быть обнаружен в материнской крови. На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
На стадии 8 клеток ХГЧ был обнаружен в эмбрионе с помощью методов молекулярной биологии.
Имплантация происходит через 5-6 дней после овуляции, а ХГЧ должен появиться к 10 дню овуляции (4 дня после овуляции), чтобы спасти желтое тело.Следовательно, бластоциста должна имплантироваться в узкий промежуток времени. Стимуляция ХГЧ CL приводит к ежедневной секреции 25 мг P и 0,5 мг E2. Экспрессия гена ХГЧ присутствует как в цитотрофобласте, так и в синцитиотрофобласте, но синтезируется в основном в синцитиотрофобласте. Концентрация циркулирующего ХГЧ у матери составляет примерно 100 МЕ / л во время ожидаемой, но пропущенной менструации. Максимальный уровень около 100 000 МЕ / л в кровотоке матери достигается на 8-10 неделе беременности. Есть два клинических состояния, при которых титры ХГЧ в крови особенно полезны: трофобластическая болезнь и внематочная беременность.Трофобластическая болезнь отличается очень высоким уровнем b-ХГЧ (в 3-100 раз выше, чем при нормальной беременности). Внематочная продукция α- и β-ХГЧ нетрофобластическими опухолями встречается редко, но все же происходит.
Человеческий плацентарный лактоген (hPL) секретируется в основном в материнский кровоток, большинство его функций происходит в местах действия в материнских тканях. Считается, что плацентарный лактоген человека ответственен за заметное повышение концентрации инсулиноподобного фактора роста-1 (IGF-1) в плазме крови матери по мере приближения срока беременности.Плацентарный лактоген человека оказывает метаболическое действие во время беременности через IGF-I. Он связан с инсулинорезистентностью, увеличивает секрецию инсулина, который стимулирует липолиз, увеличивает количество свободных жирных кислот в крови и ингибирует глюконеогенез; по сути, он противодействует действию инсулина, вызывает непереносимость глюкозы, а также липолиз и протеолиз в материнской системе. Таким образом, в клинической практике подчеркивается роль универсального скрининга аномального уровня сахара в крови в начале третьего триместра.
Концентрация кальция у плода регулируется перемещением кальция через плаценту из материнского компартмента. Чтобы поддерживать рост костей плода, материнский отсек подвергается корректировкам, которые обеспечивают чистый перенос достаточного количества кальция к плоду. Изменения материнского компартмента, которые способствуют накоплению кальция, включают увеличение потребления с пищей матери, повышение уровня D3 у матери и повышение уровней паратиреоидного гормона.
Добавка прогестерона во время беременности: иммунологическая терапия
Есть несколько исследований, чтобы понять поддержание беременности с помощью прогестерона.Было показано, что прогестерон увеличивает количество цитокинов, продуцируемых клетками Th3, которые преобладают над цитокинами, продуцируемыми клетками Th2, что приводит к поддержанию беременности. Клетки Th3 доминируют в децидуальной оболочке на ранних сроках беременности у людей. Цитокины, производные от Th3, ИЛ-4 и ИЛ-6, индуцируют высвобождение ХГЧ из трофобластов, а ХГЧ стимулирует выработку прогестерона желтым телом во время беременности. Было показано, что прогестерон стимулирует секрецию Th3 и снижает секрецию цитокинов Th2.Таким образом, поддержание беременности приписывается цитокину типа Th3. Эта роль в контроле иммунной и эндокринной системы, которая способствует функционированию трофобластов в месте имплантации, кажется интересной. 4 Использование прогестагена при угрозе прерывания беременности является спорным вопросом. 5
Прогестерон при повторном невынашивании беременности
Прогестоген использовался в течение нескольких лет, даже до того, как стали известны иммуномодулирующие свойства прогестерона.С того времени были проведены исследования разного качества, чтобы доказать преимущества приема прогестагенов у больных женщин. Исследование 146 женщин с легким или умеренным вагинальным кровотечением в первом триместре беременности было рандомизировано для приема перорального дидрогестерона (10 мг два раза в день) ( n = 86) или отсутствия лечения ( n = 60). Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Дидрогестерон был продолжен до 1 недели после остановки кровотечения. Частота невынашивания беременности была значительно ниже в группе дидрогестерона, чем в группе без лечения (17.5% против . 25%; P <0,05). 6 Большинство процитированных клинических испытаний выявили тенденцию к улучшению показателей беременности и увеличению рождаемости в группе, получавшей прогестагены, но, к сожалению, многие исследования имели плохой дизайн и методические недостатки. 7 Несколько исследований показали, что поддерживающая терапия на ранних сроках беременности связана со значительным положительным влиянием на исход беременности. Женщин с иным необъяснимым повторным невынашиванием беременности следует проконсультировать относительно возможности успешной беременности без какого-либо лечения, кроме поддерживающей терапии, такой как добавка фолиевой кислоты или витаминов. 7 , 8 Прогестаген вводят в различных формах, но обычно рекомендуется исключительное использование прогестагена без какого-либо (анти-) андрогенного или (анти-) эстрогенного действия. Добавки прогестагена доступны в виде вагинальных суппозиториев (0,4 г / день, предпочтительно вечером, потому что естественный прогестерон может вызвать усталость), внутримышечной инъекции (250 мг гидроксипрогестерона в неделю) или перорального приема (например, 10 мг дидрогестерона, стереоизомера природного прогестерона. 9
Добавки прогестерона после вспомогательных репродуктивных технологий
Использование добавок прогестерона в циклах ВРТ более понятно. 10 Продолжительность приема прогестерона после репродуктивной технологии (ВРТ) изучалась в ретроспективном когортном исследовании. Одна группа получала прогестерон в течение первого триместра беременности (протокол первого триместра) до 12 недель, а вторая группа прекратила прием прогестерона после положительного результата теста на бета-ХГЧ через 2 недели после извлечения (лютеиновый протокол).Сходная частота клинических беременностей произошла на сроке 7 недель (81,8% протокол лютеина против 85,8% протокола первого триместра) и по частоте живорождений (76,8% протокол лютеина против 75,0% протокол первого триместра). Наблюдалась тенденция к более высокому уровню выкидышей через 7 недель в группе протокола первого триместра (15,5% против 4,4%), что указывает на то, что добавление прогестерона в первом триместре может поддерживать раннюю беременность в течение 7 недель за счет отсрочки выкидыша, но не улучшает коэффициенты живорождения.Существуют рандомизированные испытания, поддерживающие рутинное использование лютеиновой поддержки в циклах АРТ с использованием агонистов или антагонистов ГнРГ. Пятьдесят девять исследований были включены в обзор для оценки поддержки лютеиновой фазы с помощью ХГЧ по сравнению с плацебо или отсутствием лечения с точки зрения увеличения частоты продолжающихся беременностей. Поддержка лютеиновой фазы с помощью ХГЧ или прогестерона после вспомогательной репродукции приводит к увеличению частоты наступления беременности. ХГЧ не дает лучших результатов, чем прогестерон, и связан с большим риском СГЯ при использовании с ГнРГ.Оптимальный способ введения прогестерона еще не установлен. 11 Обзор показал значительный эффект в пользу прогестерона для поддержки лютеиновой фазы, в пользу синтетического прогестерона перед микронизированным прогестероном. 12
Профилактика повторных преждевременных родов с помощью 17 альфа-гидроксипрогестерона капроата
Следует ожидать и предотвращать преждевременные роды для снижения перинатальной заболеваемости и смертности. Те женщины, у которых ранее были самопроизвольные преждевременные роды, имеют значительно повышенный риск преждевременных родов при последующих беременностях.Результаты нескольких небольших исследований показали, что 17-альфа-гидроксипрогестерона капроат (17P) может снизить риск преждевременных родов. Было проведено двойное слепое плацебо-контролируемое исследование с участием беременных женщин с задокументированной историей самопроизвольных преждевременных родов. 13 Всего для исследования было выбрано 19 клинических центров, в которые были включены беременные женщины на сроке от 16 до 20 недель гестации, которые были случайным образом распределены центральным центром обработки данных в соотношении 2: 1 для получения либо 250 инъекций еженедельно. мг 17P или еженедельные инъекции инертного масляного плацебо; инъекции продолжали до родов или до 36 недель беременности.Лечение 17P значительно снизило риск родов на сроке менее 37 недель гестации, который составил 36,3% в группе прогестерона против . 54,9 процента в группе плацебо; относительный риск при родах на сроке менее 35 недель беременности составил 20,6% против . 30,7 процента; а роды на сроке менее 32 недель беременности составили 11,4 процента против 19,6 процента. Частота некротического энтероколита, внутрижелудочкового кровоизлияния у младенцев у женщин, получавших 17Р, значительно ниже и потребность в дополнительном кислороде.Таким образом, исследование пришло к выводу, что еженедельные инъекции 17P привели к значительному снижению частоты повторных преждевременных родов среди женщин, которые подвергались особенно высокому риску преждевременных родов, и снизили вероятность нескольких осложнений у их младенцев. В одном двойном слепом рандомизированном плацебо-контролируемом исследовании сообщалось о более низкой частоте преждевременных родов при использовании внутримышечного 17-альфа-гидроксипрогестерона капроата (17P) или интравагинальных микронизированных прогестероновых суппозиториев у женщин с риском преждевременных родов. 14 Период полураспада 17P оценивается примерно в 7,8 дня. Путь введения играет важную роль в профиле безопасности и эффективности препарата. Пероральный прогестерон не применялся для предотвращения преждевременных родов из-за его первого прохождения через печеночный метаболизм, а также отсутствуют данные об эффективности, высоком профиле побочных эффектов и из-за крайней изменчивости концентраций в плазме. Вагинальное введение прогестерона позволяет избежать метаболизма через печень при первом прохождении и связано с быстрым всасыванием, высокой биодоступностью и местным воздействием на эндометрий. 15 Вагинальный путь введения не вызывает местной боли и мало побочных эффектов, это связано с различными концентрациями в крови. 16 Для изучения эффективности прогестерона для поддерживающей токолитической терапии после угрозы преждевременных родов было проведено рандомизированное контролируемое исследование. 17 Исследование проводилось на 70 женщинах с симптомами угрозы преждевременных родов, которые после прекращения активности матки были рандомизированы на терапию прогестероном или отсутствие лечения, и цель этого исследования состояла в том, чтобы определить, можно ли вводить вагинальный прогестерон после подавления активности матки. преждевременные роды связаны с увеличенным латентным периодом и уменьшением повторения преждевременных родов.Группа лечения получала суппозиторий с прогестероном (400 мг) ежедневно до родов, а контрольная группа не получала лечения. В исследовании сделан вывод о том, что использование вагинальных суппозиториев с прогестероном после успешного парентерального токолиза связано с более длительным латентным периодом до родов, но не снижает частоту повторных госпитализаций по поводу преждевременных родов. Добавление дидрогестерона женщинам с угрозой преждевременных родов оказало влияние на цитокиновый профиль, гормональный профиль и фактор блокирования, вызванный прогестероном. 18
Исследование восьмидесяти трех женщин с симптомами угрозы преждевременных родов было рандомизировано в исследуемые группы, получавшие токолитическое лечение в сочетании с интравагинальным микронизированным естественным прогестероном (200 мг в день), или в контрольную группу, получающую только токолиз. Обработка микронизированного природного прогестерона привела к увеличению латентного периода 32,1 ± 17,8 дня по сравнению с 21,2 ± 16,3 дня в контрольной группе и увеличению веса при рождении 2 982,8 ± 697,8 г против 2585,3 ± 746,6 г. 19
Добавки эстрадиола во время лютеиновой фазы in vitro циклов оплодотворения
Было проведено проспективное рандомизированное исследование, чтобы найти оптимальную дозу эстрадиола (E2) для поддержки лютеиновой фазы путем добавления различных доз E2 для поддержки лютеиновой фазы прогестероном (P) у пациентов, подвергающихся лечению с использованием длинного агониста ГнРГ in vitro оплодотворения (ЭКО). 20 Двести восемьдесят пять женщин, проходящих лечение ЭКО с использованием длительного протокола агонистов ГнРГ, были проспективно рандомизированы на три группы. Группа 1 ( n = 95) получала P и 2 мг E2, группа 2 ( n = 95) получала P и 4 мг E2, а группа 3 ( n = 95) получала P и 6 мг E2 в качестве лютеиновой фазы. служба поддержки. Первичным результатом была частота клинической беременности (PR). Второстепенными интересующими переменными были частота имплантации (IR), частота выкидышей и множественное PR.Клинический PR составил 31,6%, 40% и 32% соответственно в группах 1, 2 и 3, и различия между группами не были статистически значимыми. Однако частота выкидышей была значительно ниже в группе 2 (2,6%), чем в группе 1 (20%), но не была значительно ниже, чем в группе 3 (9,6%). Исследование пришло к выводу, что добавление 2, 4 или 6 мг перорального E2 к P в лютеиновой фазе не создает статистической разницы в показателях частоты наступления беременности. Однако при использовании 2 мг E2 была обнаружена значительно более высокая частота выкидышей.Следовательно, при поддержке лютеиновой фазы 4 мг перорального эстрадиола в дополнение к прогестерону можно рассматривать как снижение частоты выкидышей. По-прежнему необходимы дополнительные исследования для определения группы риска, оптимального гестационного возраста на момент начала, способа введения, дозы прогестерона и долгосрочной безопасности.
Заболевания щитовидной железы
Это имеет большое влияние на фертильность. Глобулин, связывающий половые гормоны (ГСПГ), изменяется при гипертиреозе и гипотиреозе.Он также изменяет уровень пролактина, гонадотропин-рилизинг-гормона и половых стероидов в сыворотке крови. Он также может иметь прямое воздействие на ооциты, поскольку известно, что специфические сайты связывания тироксина обнаруживаются на ооцитах мыши и человека. Также существует связь между дисфункцией щитовидной железы у женщин и заболеваемостью и исходом беременности. У мужчин гипертиреоз вызывает снижение подвижности сперматозоидов. Количество морфологически аномальных сперматозоидов увеличивается при гипотиреозе. Было обнаружено, что при восстановлении эутиреоза оба нарушения улучшаются или нормализуются.У женщин изменения фертильности, вызванные заболеваниями щитовидной железы, более сложны. Гипер- и гипотиреоз являются основными заболеваниями щитовидной железы, которые отрицательно влияют на репродуктивную функцию женщин и вызывают нарушения менструального цикла, в основном гипоменорею и полименорею при гипертиреозе и олигоменорею при гипотиреозе. Все факторы могут быть связаны с изменениями метаболического пути. Адекватные уровни циркулирующих гормонов щитовидной железы имеют первостепенное значение для нормальной репродуктивной функции. 21
Контролируемая гиперстимуляция яичников приводит к увеличению эстрадиола, что, в свою очередь, может отрицательно влиять на гормоны щитовидной железы и ТТГ. Гиперстимуляция яичников может стать серьезной при наличии аутоиммунного заболевания щитовидной железы в зависимости от ранее существовавших патологий щитовидной железы. Аутоиммунное заболевание щитовидной железы встречается у 5-20% беременных, не прошедших отбор. Изолированная гипотироксинемия описана примерно в 2% беременностей без повышения уровня ТТГ в сыворотке и аутоантител к щитовидной железе.Существует связь между повышенным риском самопроизвольных абортов, преждевременных родов и / или низкой массой тела при рождении, дистрессом плода в родах и, возможно, гипертензией, вызванной беременностью, и отслойкой плаценты при явном гипотиреозе. Все антитиреоидные препараты проникают через плаценту и потенциально могут повлиять на функцию щитовидной железы плода. 22
Заболевания щитовидной железы часто встречаются у женщин во время беременности. Если не лечить, как гипотиреоз, так и гипертиреоз связаны с неблагоприятным воздействием на беременность и исходы плода.Важно правильно идентифицировать эти расстройства и надлежащим образом лечить их, чтобы предотвратить осложнения, связанные с беременностью. Показанным лечением является левотироксин при гипотиреозе, а тиоамиды — средство выбора при гипертиреозе; В отдельных случаях может быть показана тиреоидэктомия. 23 , 24 Кокрановский обзор трех РКИ с участием 314 женщин показал в одном испытании с участием 115 женщин, что терапия левотироксином для лечения беременных эутиреоидных женщин антителами к пероксидазе щитовидной железы не снижает преэклампсию, но значительно снижает преждевременные роды на 72 человека. %.В одном испытании с участием 30 женщин с гипотиреозом сравнивали дозы левотироксина, но сообщали только биохимические результаты. В исследовании с участием 169 женщин сравнивали микроэлемент селенометионин (селен) с плацебо, и не было обнаружено значительных различий ни для преэклампсии, ни для преждевременных родов. Ни в одном из трех испытаний не сообщалось о задержке нервного развития у детей. 25
Концентрация гормонов при неосложненной беременности: продольное исследование | BMC по беременности и родам
Луканова А., Сурсель Х.М., Лундин Э., Каасила М., Лаксо Х.А., Шок Х. и др. Циркулирующие эстрогены и прогестерон во время первородящих беременностей и риск рака груди у матери. Int J Cancer. 2012; 130 (4): 910–20.
CAS
Статья
PubMed
Google Scholar
Whitaker-Azmitia PM, Lobel M, Moyer A. Низкий уровень прогестерона у матери может способствовать как акушерским осложнениям, так и аутизму. Медицинские гипотезы. 2014; 82 (3): 313–8.
CAS
Статья
PubMed
Google Scholar
Braem MG, Онланд-Морет, Северная Каролина, Schouten LJ, Kruitwagen RF, Lukanova A, Allen NE, et al. Множественные выкидыши связаны с риском рака яичников: результаты Европейского проспективного исследования рака и питания. PloS один. 2012; 7 (5), e37141.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Берал В., Булл Д., Долл Р., Пето Р., Ривз Г. Рак груди и аборт: совместный повторный анализ данных 53 эпидемиологических исследований, в том числе 83 000 женщин с раком груди из 16 стран. Ланцет. 2004. 363 (9414): 1007–16.
Артикул
PubMed
Google Scholar
Пуккала Е. Скандинавские когорты банка биологических образцов как основа для исследований причин рака и борьбы с ним: инструменты контроля качества для когорт исследования с более чем двумя миллионами доноров образцов и 130 000 предполагаемыми раками.В: Диллнер Дж., Редактор. Методы в биобанкинге. Том 675, Нью-Йорк: Humana Press; 2011: с. 61-112.
van Eijsden M, Vrijkotte TG, Gemke RJ, van der Wal MF. Профиль когорты: исследование Амстердамских рожденных детей и их развития (ABCD). Int J Epidemiol. 2011; 40 (5): 1176–86.
Артикул
PubMed
Google Scholar
van Gelder MM, Bretveld RW, Roukema J, Steenhoek M, van Drongelen J, Spaanderman ME, et al.Обоснование и дизайн исследования беременности и развития младенцев (PRIDE). Педиатр Перинат Эпидемиол. 2013. 27 (1): 34–43.
Артикул
PubMed
Google Scholar
Moraes TJ, Lefebvre DL, Chooniedass R, Becker AB, Brook JR, Denburg J, et al. Канадское когортное исследование здоровых младенцев при рождении: биологические образцы и биобанкинг. Педиатр Перинат Эпидемиол. 2015; 29 (1): 84–92.
CAS
Статья
PubMed
Google Scholar
Вейхе А.С., Хансен С., Сандангер Т.М., Нибоер Э., Одланд Дж. Когортное исследование загрязнителей матери и ребенка в Северной Норвегии: реализация, характеристики населения и краткое изложение диетических результатов. Int J Циркумполярное здоровье. 2012; 71: 18644.
Артикул
PubMed
Google Scholar
Киши Р., Сасаки С., Йошиока Э., Юаса М., Сата Ф., Сайджо Ю. и др. Профиль когорты: исследование Хоккайдо по окружающей среде и здоровью детей в Японии.Int J Epidemiol. 2011; 40 (3): 611–8.
Артикул
PubMed
Google Scholar
Райт Дж., Смолл Н., Рейнор П., Таффнелл Д., Бхопал Р., Кэмерон Н. и др. Когортный профиль: когортное исследование мультиэтнической семьи Рожденных в Брэдфорде. Int J Epidemiol. 2013; 42 (4): 978–91.
Артикул
PubMed
Google Scholar
Андерсен А.М., Олсен Дж. Датская национальная когорта новорожденных: избранные научные материалы в перинатальной эпидемиологии и перспективах на будущее.Scand J Public Health. 2011; 39 (7 Suppl): 115–20.
Артикул
PubMed
Google Scholar
Tao FB, Hao JH, Huang K, Su PY, Cheng DJ, Xing XY и др. Профиль когорты: когортное исследование Китая и Аньхоя. Int J Epidemiol. 2013. 42 (3): 709–21.
Артикул
PubMed
Google Scholar
Лаппалайнен М., Коскела П., Хедман К., Терамо К., Аммала П., Хилесмаа В. и др.Заболеваемость первичными инфекциями токсоплазмы во время беременности в южной Финляндии: проспективное когортное исследование. Scand J Infect Dis. 1992. 24 (1): 97–104.
CAS
Статья
PubMed
Google Scholar
Коэн Дж., Коэн П., Вест С.Г., Эйкен Л.С. Множественная регрессия / корреляция с двумя или более независимыми переменными. В: Прикладной множественный регрессионный / корреляционный анализ для поведенческих наук, т. 3. Махвах: Лоуренс Эрлбаум Ассошиэйтс; 2003 г.п. 64–100.
Google Scholar
Тейлор Р.Н., Лебович Д.И. Эндокринология беременности. В: Гринспен Ф.С., Гарднер Д.Г., редакторы. Фундаментальная и клиническая эндокринология. Нью-Йорк: Lange Medical Books / McGraw-Hill; 2004. с. 637–57.
Google Scholar
О’Лири П., Бойн П., Флетт П., Бейлби Дж., Джеймс И. Продольная оценка изменений репродуктивных гормонов во время нормальной беременности.Clin Chem. 1991. 37 (5): 667–72.
PubMed
Google Scholar
Керлан В., Наул К., Ле Мартелот М.Т., Берковичи Дж.П. Продольное исследование уровней биодоступного тестостерона и андростандиола в плазме крови матери во время беременности. Клин Эндокринол (Oxf). 1994. 40 (2): 263–7.
CAS
Статья
Google Scholar
Бернштейн Л., Липворт Л., Росс Р.К., Тричопулос Д.Корреляция уровней эстрогенов между последовательными беременностями. Американский журнал эпидемиологии. 1995. 142 (6): 625–8.
CAS
Статья
PubMed
Google Scholar
Арслан А.А., Зеленюх-Жакотт А., Луканова А., Афанасьева Ю., Кац Дж., Левиц М. и др. Влияние паритета на гормональный фон беременности в этнических группах с различной заболеваемостью раком груди. Биомаркеры эпидемиологии рака Пред. 2006. 15 (11): 2123–30.
CAS
Статья
PubMed
Google Scholar
Wuu J, Hellerstein S, Lipworth L, Wide L, Xu B, Yu GP, et al. Корреляты эстрогена беременности, прогестерона и глобулина, связывающего половые гормоны, в США и Китае. Eur J Cancer Пред. 2002. 11 (3): 283–93.
CAS
Статья
PubMed
Google Scholar
Toriola AT, Vaarasmaki M, Lehtinen M, Zeleniuch-Jacquotte A, Lundin E, Rodgers KG и др. Детерминанты материнских половых стероидов в первой половине беременности.Obstet Gynecol. 2011. 118 (5): 1029–36.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ярвела И.Ю., Зачкова Т., Лайтинен П., Рюнянен М., Текай А. Влияние паритета и пола плода на плацентарные и лютеиновые гормоны в начале первого триместра. Prenat Diagn. 2012; 32 (2): 160–7.
Артикул
PubMed
Google Scholar
Troisi R, Hoover RN, Thadhani R, Hsieh CC, Sluss P, Ballard-Barbash R, et al.Материнские, пренатальные и перинатальные характеристики и концентрации гормонов в сыворотке крови матери в первом триместре. Br J Рак. 2008. 99 (7): 1161–4.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Musey VC, Collins DC, Brogan DR, Santos VR, Musey PI, Martino-Saltzman D, et al. Долгосрочное влияние первой беременности на гормональную среду: эстрогены и андрогены. Журнал клинической эндокринологии и метаболизма.1987. 64 (1): 111–8.
CAS
Статья
PubMed
Google Scholar
Kuijper EA, Ket JC, Caanen MR, Lambalk CB. Концентрации репродуктивных гормонов у беременных и новорожденных: систематический обзор. Репродукция Биомед онлайн. 2013. 27 (1): 33–63.
CAS
Статья
PubMed
Google Scholar
Эннинга Е.А., Невала В.К., Кридон Д.Д., Маркович С.Н., Холтан С.Г.Различия материнских гормонов, ангиогенных факторов и иммунных медиаторов в зависимости от пола плода во время беременности и в послеродовом периоде. Американский журнал репродуктивной иммунологии. 2015. 73 (3): 251–62.
CAS
Статья
PubMed
Google Scholar
Фриман М.Э., Каньикска Б., Лерант А., Надь Г. Пролактин: структура, функция и регуляция секреции. Physiol Rev.2000; 80 (4): 1523–631.
CAS
PubMed
Google Scholar
Клецки О.А., Маррс Р.П., Ховард В.Ф., Маккормик В., Мишелл мл. DR. Синтез и высвобождение пролактина во время беременности и послеродового периода. Am J Obstet Gynecol. 1980. 136 (4): 545–50.
CAS
Статья
PubMed
Google Scholar
Xu B, Lipworth L, Wide L, Wuu J, Yu SZ, Lagiou P, et al. Материнские и гестационные корреляты пролактина и гормона роста беременных в США и Китае. Eur J Cancer Пред. 2003. 12 (1): 35–42.
CAS
Статья
PubMed
Google Scholar
Бен-Джонатан Н., Лапензее ЧР, Лапензее Э.В. Что мы можем узнать от грызунов о пролактине у людей? Endocr Rev.2008; 29 (1): 1–41.
CAS
Статья
PubMed
Google Scholar
Капур Д., Джонс TH. Курение и гормоны в здоровье и эндокринные расстройства. Eur J Endocrinol. 2005. 152 (4): 491–9.
CAS
Статья
PubMed
Google Scholar
Гонсалес Ф.А., Хобель С.Дж., Бастер Дж. Э. Влияние пола плода на уровень пролактина в сыворотке матери. J Reprod Med. 1987. 32 (1): 21–4.
CAS
PubMed
Google Scholar
Hercz P, Kazy Z, Siklos P, Ungar L. Количественное сравнение концентраций стероидных и пептидных гормонов в сыворотке крови у плодов мужского и женского пола в материнско-фетоплацентарной системе на 28-40-й неделе беременности. Eur J Obstet Gynecol Reprod Biol. 1989. 30 (3): 201–4.
CAS
Статья
PubMed
Google Scholar
Potischman N, Troisi R, Thadhani R, Hoover RN, Dodd K, Davis WW, et al. Концентрация гормонов беременности в разных этнических группах: последствия для последующего риска рака. Биомаркеры эпидемиологии рака Пред. 2005. 14 (6): 1514–20.
CAS
Статья
PubMed
Google Scholar
Лейси Д.Л., Тиммс Э., Тан Х.Л., Келли М.Дж., Данстан С.Р., Берджесс Т. и др.Лиганд остеопротегерина — это цитокин, регулирующий дифференцировку и активацию остеокластов. Клетка. 1998. 93 (2): 165–76.
CAS
Статья
PubMed
Google Scholar
Уэмура Х., Ясуи Т., Киёкава М., Кувахара А., Икава Х., Мацудзаки Т. и др. Сывороточный фактор, ингибирующий остеопротегерин / остеокластогенез во время беременности и кормления грудью, и взаимосвязь с кальций-регулирующими гормонами и маркерами метаболизма костной ткани. J Endocrinol.2002. 174 (2): 353–9.
CAS
Статья
PubMed
Google Scholar
Naylor KE, Rogers A, Fraser RB, Hall V, Eastell R, Blumsohn A. Сывороточный остеопротегерин как детерминант костного метаболизма в продольном исследовании беременности и кормления грудью человека. Журнал клинической эндокринологии и метаболизма. 2003. 88 (11): 5361–5.
CAS
Статья
PubMed
Google Scholar
Эссли Б., Макнэнли Т., Купер Б., Макинтайр А., Уиттер Ф., Харрис З. и др. Остеопротегерин у беременных подростков различается в зависимости от расы и связан с z-показателем массы тела при рождении. J Dev Orig Health Dis. 2011; 2 (5): 272–9.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Hong JS, Santolaya-Forgas J, Romero R, Espinoza J, Goncalves LF, Kim YM, et al. Концентрация остеопротегерина в плазме крови матери при нормальной беременности.Am J Obstet Gynecol. 2005. 193 (3 Pt 2): 1011–5.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tenta R, Bourgiezi I, Aliferis E, Papadopoulou M, Gounaris A, Skouroliakou M. Костный метаболизм компенсирует задержку роста у маленьких для гестационного возраста новорожденных. Органогенез. 2013; 9 (1): 55–9.
Артикул
PubMed
PubMed Central
Google Scholar
Роджерс А., Истелл Р. Циркулирующий остеопротегерин и активатор рецептора для лиганда ядерного фактора kappaB: клиническое применение при оценке метаболических заболеваний костей. Журнал клинической эндокринологии и метаболизма. 2005. 90 (11): 6323–31.
CAS
Статья
PubMed
Google Scholar
Roza SJ, Verhulst FC, Jaddoe VW, Steegers EA, Mackenbach JP, Hofman A, et al. Курение матери во время беременности и проблемы поведения ребенка: исследование поколения R.Int J Epidemiol. 2009. 38 (3): 680–9.
Артикул
PubMed
Google Scholar
Де Уайлд К.С., Троммельманс Л.С., Лавенс Х.Х., Маес Л.Р., Теммерман М., Будрез Х.Л. Характер курения, депрессия и социально-демографические переменные среди фламандских женщин во время беременности и в послеродовой период. Медсестринское исследование. 2013. 62 (6): 394–404.
Артикул
PubMed
Google Scholar
6 гормонов, которые помогут вам зачать ребенка
Опять же, что такое гормон? Это химический сигнал от пяти желез вашей эндокринной системы к остальному телу.Даже когда вы не беременны, они контролируют ваш аппетит, сон, половое влечение. В основном все. Когда вы забеременеете, гормоны беременности превращают ваше тело в создателя ребенка с некоторыми забавными побочными эффектами.
Каковы основные гормоны при беременности?
Хорионический гонадотропин человека (ХГЧ)
ХГЧ — это гормон, который сообщает остальному телу, что вы беременны. Это также показатель, который используют безрецептурные тесты на беременность.
Что делает ХГЧ? HcG является наиболее вероятным гормоном беременности, вызывающим утреннее недомогание, потому что более высокие уровни коррелируют с более интенсивной рвотой и тошнотой.Еще одна ключевая задача: увеличить выработку эстрогена и прогестерона, чтобы они могли внести свой вклад в рост ребенка.
Когда будет иметь значение ХГЧ? В течение первых двух месяцев беременности уровень ХГЧ будет продолжать очень быстро повышаться, удваиваясь через день, а затем достигая стабильного уровня до конца беременности.
Прогестерон
Прогестерон, как и эстроген, используется в противозачаточных таблетках, чтобы заставить ваше тело думать, что вы беременны, чтобы на самом деле не забеременеть.
Что делает прогестерон? Этот гормон играет ключевую роль в вашей беременности. В течение первого триместра этот гормон беременности делает вашу грудь более чувствительной и помогает ей подготовиться к выработке молока. Он расслабляет матку, поэтому не отторгает плод. Это способствует чувству вздутия живота и усталости.
Когда имеет значение прогестерон? Уровень прогестерона стремительно растет в течение первого триместра, а затем выходит на плато. Плацента вырабатывает прогестерон во время беременности, поэтому после родов, когда плацента выходит вместе с ребенком, уровень прогестерона падает, что способствует перепадам настроения.
Эстроген
Этот гормон беременности является синонимом слова «женщина». Это подтолкнуло вас к половой зрелости и также регулирует ваш месячный цикл.
Что делает эстрогон? Во время беременности эстроген помогает матке расти и ускоряет развитие плода. Он также увеличивает кровоток, что усиливает обоняние и придает «сияние» беременности. Побочные эффекты: сосудистые звездочки и повышенный аппетит.
Когда будет иметь значение эстроген? Уровень эстрогена продолжает расти во время беременности и достигает своего пика в третьем триместре.Поскольку этот гормон беременности также вырабатывается плацентой во время беременности, уровень эстрогена резко падает после родов.
Релаксин
Название говорит само за себя.
Что делает релаксин? Relaxin расслабляет матку в первом триместре и способствует росту плаценты. Это также расслабляет ваши связки. Это может сделать вас более склонным к падению, потому что вы немного шатает, но это открывает ваши бедра и помогает вырваться из воды, чтобы облегчить роды.
Когда релаксин будет иметь значение? Уровень релаксина наиболее высок в первом триместре, когда ваше тело готовится к беременности.
Окситоцин
Это не «Оксиконтин». Это опиоидное обезболивающее. Это версия природы.
Что делает окситоцин? Окситоцин (произносится как окситоцин) — наш любимый гормон. Этот так называемый гормон любви наполняет ваш мозг во время секса, родов и грудного вскармливания и дает вам тепло и пушистость.
Когда будет иметь значение окситоцин? Этот гормон запускает ваши сокращения, продолжает роды и заставляет вашу матку сокращаться после рождения. Затем каждый раз, когда вы кормите грудью, ваш мозг производит ее больше, чтобы помочь вам привязаться к ребенку. Человеческие тела для победы!
Пролактин
Pro = для и lactin = молоко.
Что делает пролактин? Как следует из названия, пролактин помогает вашему организму вырабатывать молоко.
Когда будет иметь значение пролактин? Когда вы беременны, уровень пролактина повышается в 10-20 раз, чтобы подготовить молочные железы к производству молока.Уровни останутся высокими, если вы начнете кормить грудью. Уровень пролактина наиболее высок, когда вы спите и рано утром (возможно, именно поэтому многие женщины в это время демонстрируют самый высокий уровень выработки молока).
Уровни эстрогена (эстрадиола) во время беременности
Что такое эстрадиол?
Эстрадиол более известен как эстроген, женский репродуктивный гормон. Этот гормон содержится как у мужчин, так и у женщин и играет роль в стабилизации настроения, контроле температуры и других функциях организма, хотя наиболее известен как гормон беременности и менопаузы.
Другие функции эстрогена
Эстрогены напрямую связаны с женским воспроизводством, но они также жизненно важны для других систем организма:
- Sexual Performance — Эстроген помогает поддерживать женскую репродуктивную систему в оптимальном состоянии во время зачатия и беременности и усиливает сексуальное удовольствие женщины. Некоторые женщины испытывают сухость влагалища и другие неприятные ощущения, которые мешают сексуальной активности после начала менопаузы.
- Структура скелета — Эстроген усиливает способность женского организма усваивать кальций, витамин D и другие питательные вещества, жизненно важные для прочности костей.Женщины рискуют остеопорозом, истончением костей, когда уровень эстрогена начинает падать во время перименопаузы.
- Сердечно-сосудистая система — У женщин значительно реже, чем у мужчин, развиваются сердечные заболевания в репродуктивном возрасте. Эта связанная с эстрогеном сердечно-сосудистая защита прекращается, когда производство эстрогена снижается во время менопаузы.
- Здоровье мочевыводящих путей — Женщины с низким уровнем эстрогена, как в период менопаузы, часто испытывают истончение уретры, что делает их более предрасположенными к инфекциям мочевыводящих путей и почек.



