P50—P61 Геморрагические и гематологические нарушения у плода и новорождённого
Класс XVI. P00—P96. Отдельные состояния, возникающие в перинатальном периоде
P50 Кровопотеря у плода
- P50.0 Потеря крови плодом из предлежащего сосуда
- P50.1 Потеря крови плодом из разорванной пуповины
- P50.2 Потеря крови плодом из плаценты
- P50.3 Кровотечение у плода другого однояйцового близнеца
- P50.4 Кровотечение у плода в кровеносное русло матери
- P50.5 Потеря крови у плода из перерезанного конца пуповины при однояйцовой двойне
- P50.8 Другая форма кровопотери у плода
- P50.9 Кровопотеря у плода неуточненная
P51 Кровотечение из пуповины у новорожденного
- P51.0 Массивное кровотечение из пуповины у новорожденного
- P51.8 Другое кровотечение из пуповины у новорожденного
- P51.9 Кровотечение из пуповины у новорожденного неуточненное
P52 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного
- P52.0 Внутрижелудочковое кровоизлияние нетравматическое 1-й степени у плода и новорожденного
- P52.1 Внутрижелудочковое нетравматическое кровоизлияние 2-й степени у плода и новорожденного
- P52.2 Внутрижелудочковое нетравматическое кровоизлияние 3-й степени у плода и новорожденного
- P52.3 Неуточненное внутрижелудочковое нетравматическое кровоизлияние у плода и новорожденного
- P52.4 Кровоизлияние в мозг нетравматическое у плода и новорожденного
- P52.5 Субарахноидальное нетравматическое кровоизлияние у плода и новорожденного
- P52.6 Кровоизлияние в мозжечок и заднюю черепную ямку нетравматическое у плода и новорожденного
- P52.8 Другие внутричерепные нетравматические кровоизлияния у плода и новорожденного
- P52.9 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного неуточненное
P53 Геморрагическая болезнь плода и новорожденного
P54 Другие неонатальные кровотечения
- P54.0 Гематемезис новорожденных
- P54.1 Мелена новорожденного
- P54.2 Кровотечение из прямой кишки у новорожденного
- P54.3 Желудочно-кишечное кровотечение у новорожденного
- P54.4 Кровоизлияние в надпочечник у новорожденных
- P54.5 Кровоизлияние в кожу у новорожденного
- P54.6 Кровотечение из влагалища у новорожденного
- P54.8 Другие уточненные кровотечения у новорожденного
- P54.9 Неонатальное кровотечение неуточненное
P55 Гемолитическая болезнь плода и новорожденного
- P55.0 Резус-изоиммунизация плода и новорожденного
- P55.1 АВО-изоиммунизация плода и новорожденного
- P55.8 Другие формы гемолитической болезни плода и новорожденного
- P55.9 Гемолитическая болезнь плода и новорожденного неуточненная
P56 Водянка плода, обусловленная гемолитической болезнью
- P56.0 Водянка плода, обусловленная изоиммунизацией
- P56.9 Водянка плода, обусловленная другой и неуточненной гемолитической болезнью
P57 Ядерная желтуха
- P57.0 Ядерная желтуха, обусловленная изоиммунизацией
- P57.8 Другие уточненные формы ядерной желтухи
- P57.9 Ядерная желтуха неуточненная
P58 Неонатальная желтуха, обусловленная чрезмерным гемолизом
- P58.0 Неонатальная желтуха, обусловленная кровоподтеками
- P58.1 Неонатальная желтуха, обусловленная кровотечением
- P58.2 Неонатальная желтуха, обусловленная инфекцией
- P58.3 Неонатальная желтуха, обусловленная полицитемией
- P58.4 Неонатальная желтуха, обусловленная лекарственными средствами или токсинами, перешедшими из организма матери или введенными новорожденному
- P58.5 Неонатальная желтуха, обусловленная заглатыванием материнской крови
- P58.8 Неонатальная желтуха, обусловленная другими уточненными формами чрезмерного гемолиза
- P58.9 Неонатальная желтуха, обусловленная чрезмерным гемолизом, неуточненная
P59 Неонатальная желтуха, обусловленная другими и неуточненными причинами
- P59.0 Неонатальная желтуха, связанная с преждевременным родоразрешением
- P59.1 Синдром сгущения желчи
- P59.2 Неонатальная желтуха вследствие других и неуточненных повреждений клеток печени
- P59.3 Неонатальная желтуха, обусловленная средствами, ингибирующими лактацию
- P59.8 Неонатальная желтуха, обусловленная другими уточненными причинами
- P59.9 Неонатальная желтуха неуточненная
P60 Диссеминированное внутрисосудистое свертывание крови у плода и новорожденного
P61 Другие перинатальные гематологические нарушения
- P61.0 Преходящая неонатальная тромбоцитопения
- P61.1 Полицитемия новорожденного
- P61.2 Анемия недоношенных
- P61.3 Врожденная анемия вследствие кровопотери у плода
- P61.4 Другие врожденные анемии, не классифицированные в других рубриках
- P61.5 Преходящая неонатальная нейтропения
- P61.6 Другие преходящие неонатальные расстройства коагуляции
- P61.8 Другие уточненные перинатальные гематологические нарушения
- P61.9 Перинатальное гематологическое нарушение неуточненное
Геморрагический синдром по мкб 10
Связанные заболевания и их лечение
Описания заболеваний
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Геморрагический синдром.
Описание
Геморрагический синдром, или склонность к кожной геморрагии и кровоточивости слизистых оболочек, возникает как следствие изменений в одном или нескольких звеньях гемостаза.
Симптомы
Различают 5 типов геморрагического синдрома.
• Гематомный. Типичен для гемофилии А и В, характеризуется возникновением болезненных напряженных кровоизлияний в мягкие ткани и суставы, постепенным развитием нарушений функции опорно-двигательного аппарата.
• Петехиально-пятнистый (синячковый). Возникает при тромбоцитопении, тромбоцитопатии, нарушении свертывающей системы (гипо- и дисфибриногенемия, наследственном дефиците факторов свертывания).
• Смешанный синячково-гематомный. Развивается при тяжелом дефиците факторов протромбинового комплекса и фактора XIII, болезни Виллебранда, ДВС-синдроме, передозировке антикоагулянтов и тромболитиков, появлении в крови иммунных ингибиторов факторов VIII и IX и характеризуется сочетанием петехиально-пятнистых кожных геморрагии с отдельными большими гематомами в забрюшинном пространстве, стенке кишечника. В отличие от гематомного типа, кровоизлияние в полость суставов возникает крайне редко. Синяки могут быть обширными и болезненными.
• Васкулито-пурпурный тип. Наблюдается при инфекционных и иммунных васкулитах, легко трансформируется в ДВС-синдром и характеризуется геморрагией в виде сыпи или эритемы на воспалительной основе, возможным присоединением нефрита и кишечного кровотечения.
• Ангиоматозный тип. Развивается в зонах телеангиэктазий, ангиом, артериовенозных шунтов и характеризуется упорными локальными геморрагиями, связанными с зонами сосудистой патологии.
С определенной долей вероятности предположить патологию сосудисто-тромбоцитарного или коагуляционного звена гемостаза можно по особенностям геморрагических проявлений.
Причины
Геморрагический синдром может бытьобусловлен такой патологией как поражение сосудистой стенки, нарушение структуры, функции и количества тромбоцитов, нарушение коагуляционного гемостаза. При определении причин кровоточивости необходимо учитывать, что одни виды патологии часты, другие — редки, а третьи — крайне редки. Из наследственных нарушений гемостаза наиболее часто в терапевтической практике встречаются тромбоцитопатии, гемофилия A, болезнь Виллебранда, гемофилия В, из сосудистых форм — телеангиэктазия. Причиной приобретенных форм геморрагического синдрома наиболее часто становятся вторичная тромбоцитопения и тромбоцитопатии, ДВС-синдром, дефицит факторов протромбинового комплекса и геморрагический васкулит. Другие формы редки или очень редки. Следует учитывать, что в последние годы все чаще нарушения гемостаза и, как следствие, геморрагический синдром связаны с приемом лекарственных препаратов, нарушающих агрегацию тромбоцитов (антиагреганты) и свертываемость крови (антикоагулянты), а также психогенные формы — невротическая кровоточивость и синдром Мюнхгаузена.
Лечение
При кровотечениях и хирургических вмешательствах- введения криопреципитата и струйно свежезамороженной плазмы. Дозы и частота их введения могут быть в 2-3 раза меньше, чем при гемофилии А. С первого и до последнего дня менструального цикла, а также при носовых и желудочно-кишечных кровотечениях назначают внутрь аминокапроновую кислоту (8-12 г/сут)либо осуществляют гормональный гемостаз. Профилактика. Избегать браков между больными (в том числе между родственниками) в связи с рождением детей с тяжелой гомозиготной формой болезни.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
|
Геморрагический синдром мкб 10 код
Связанные заболевания и их лечение
Описания заболеваний
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Геморрагический синдром.
Описание
Геморрагический синдром, или склонность к кожной геморрагии и кровоточивости слизистых оболочек, возникает как следствие изменений в одном или нескольких звеньях гемостаза.
Симптомы
Различают 5 типов геморрагического синдрома.
• Гематомный. Типичен для гемофилии А и В, характеризуется возникновением болезненных напряженных кровоизлияний в мягкие ткани и суставы, постепенным развитием нарушений функции опорно-двигательного аппарата.
• Петехиально-пятнистый (синячковый). Возникает при тромбоцитопении, тромбоцитопатии, нарушении свертывающей системы (гипо- и дисфибриногенемия, наследственном дефиците факторов свертывания).
• Смешанный синячково-гематомный. Развивается при тяжелом дефиците факторов протромбинового комплекса и фактора XIII, болезни Виллебранда, ДВС-синдроме, передозировке антикоагулянтов и тромболитиков, появлении в крови иммунных ингибиторов факторов VIII и IX и характеризуется сочетанием петехиально-пятнистых кожных геморрагии с отдельными большими гематомами в забрюшинном пространстве, стенке кишечника. В отличие от гематомного типа, кровоизлияние в полость суставов возникает крайне редко. Синяки могут быть обширными и болезненными.
• Васкулито-пурпурный тип. Наблюдается при инфекционных и иммунных васкулитах, легко трансформируется в ДВС-синдром и характеризуется геморрагией в виде сыпи или эритемы на воспалительной основе, возможным присоединением нефрита и кишечного кровотечения.
• Ангиоматозный тип. Развивается в зонах телеангиэктазий, ангиом, артериовенозных шунтов и характеризуется упорными локальными геморрагиями, связанными с зонами сосудистой патологии.
С определенной долей вероятности предположить патологию сосудисто-тромбоцитарного или коагуляционного звена гемостаза можно по особенностям геморрагических проявлений.
Причины
Геморрагический синдром может бытьобусловлен такой патологией как поражение сосудистой стенки, нарушение структуры, функции и количества тромбоцитов, нарушение коагуляционного гемостаза. При определении причин кровоточивости необходимо учитывать, что одни виды патологии часты, другие — редки, а третьи — крайне редки. Из наследственных нарушений гемостаза наиболее часто в терапевтической практике встречаются тромбоцитопатии, гемофилия A, болезнь Виллебранда, гемофилия В, из сосудистых форм — телеангиэктазия. Причиной приобретенных форм геморрагического синдрома наиболее часто становятся вторичная тромбоцитопения и тромбоцитопатии, ДВС-синдром, дефицит факторов протромбинового комплекса и геморрагический васкулит. Другие формы редки или очень редки. Следует учитывать, что в последние годы все чаще нарушения гемостаза и, как следствие, геморрагический синдром связаны с приемом лекарственных препаратов, нарушающих агрегацию тромбоцитов (антиагреганты) и свертываемость крови (антикоагулянты), а также психогенные формы — невротическая кровоточивость и синдром Мюнхгаузена.
Лечение
При кровотечениях и хирургических вмешательствах- введения криопреципитата и струйно свежезамороженной плазмы. Дозы и частота их введения могут быть в 2-3 раза меньше, чем при гемофилии А. С первого и до последнего дня менструального цикла, а также при носовых и желудочно-кишечных кровотечениях назначают внутрь аминокапроновую кислоту (8-12 г/сут)либо осуществляют гормональный гемостаз. Профилактика. Избегать браков между больными (в том числе между родственниками) в связи с рождением детей с тяжелой гомозиготной формой болезни.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
P50 Кровопотеря у плода
- P50.0 Потеря крови плодом из предлежащего сосуда
- P50.1 Потеря крови плодом из разорванной пуповины
- P50.2 Потеря крови плодом из плаценты
- P50.3 Кровотечение у плода другого однояйцового близнеца
- P50.4 Кровотечение у плода в кровеносное русло матери
- P50.5 Потеря крови у плода из перерезанного конца пуповины при однояйцовой двойне
- P50.8 Другая форма кровопотери у плода
- P50.9 Кровопотеря у плода неуточненная
P51 Кровотечение из пуповины у новорожденного
- P51.0 Массивное кровотечение из пуповины у новорожденного
- P51.8 Другое кровотечение из пуповины у новорожденного
- P51.9 Кровотечение из пуповины у новорожденного неуточненное
P52 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного
- P52.0 Внутрижелудочковое кровоизлияние нетравматическое 1-й степени у плода и новорожденного
- P52.1 Внутрижелудочковое нетравматическое кровоизлияние 2-й степени у плода и новорожденного
- P52.2 Внутрижелудочковое нетравматическое кровоизлияние 3-й степени у плода и новорожденного
- P52.3 Неуточненное внутрижелудочковое нетравматическое кровоизлияние у плода и новорожденного
- P52.4 Кровоизлияние в мозг нетравматическое у плода и новорожденного
- P52.5 Субарахноидальное нетравматическое кровоизлияние у плода и новорожденного
- P52.6 Кровоизлияние в мозжечок и заднюю черепную ямку нетравматическое у плода и новорожденного
- P52.8 Другие внутричерепные нетравматические кровоизлияния у плода и новорожденного
- P52.9 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного неуточненное
P53 Геморрагическая болезнь плода и новорожденного
P54 Другие неонатальные кровотечения
- P54.0 Гематемезис новорожденных
- P54.1 Мелена новорожденного
- P54.2 Кровотечение из прямой кишки у новорожденного
- P54.3 Желудочно-кишечное кровотечение у новорожденного
- P54.4 Кровоизлияние в надпочечник у новорожденных
- P54.5 Кровоизлияние в кожу у новорожденного
- P54.6 Кровотечение из влагалища у новорожденного
- P54.8 Другие уточненные кровотечения у новорожденного
- P54.9 Неонатальное кровотечение неуточненное
P55 Гемолитическая болезнь плода и новорожденного
- P55.0 Резус-изоиммунизация плода и новорожденного
- P55.1 АВО-изоиммунизация плода и новорожденного
- P55.8 Другие формы гемолитической болезни плода и новорожденного
- P55.9 Гемолитическая болезнь плода и новорожденного неуточненная
P56 Водянка плода, обусловленная гемолитической болезнью
- P56.0 Водянка плода, обусловленная изоиммунизацией
- P56.9 Водянка плода, обусловленная другой и неуточненной гемолитической болезнью
P57 Ядерная желтуха
- P57.0 Ядерная желтуха, обусловленная изоиммунизацией
- P57.8 Другие уточненные формы ядерной желтухи
- P57.9 Ядерная желтуха неуточненная
P58 Неонатальная желтуха, обусловленная чрезмерным гемолизом
- P58.0 Неонатальная желтуха, обусловленная кровоподтеками
- P58.1 Неонатальная желтуха, обусловленная кровотечением
- P58.2 Неонатальная желтуха, обусловленная инфекцией
- P58.3 Неонатальная желтуха, обусловленная полицитемией
- P58.4 Неонатальная желтуха, обусловленная лекарственными средствами или токсинами, перешедшими из организма матери или введенными новорожденному
- P58.5 Неонатальная желтуха, обусловленная заглатыванием материнской крови
- P58.8 Неонатальная желтуха, обусловленная другими уточненными формами чрезмерного гемолиза
- P58.9 Неонатальная желтуха, обусловленная чрезмерным гемолизом, неуточненная
P59 Неонатальная желтуха, обусловленная другими и неуточненными причинами
- P59.0 Неонатальная желтуха, связанная с преждевременным родоразрешением
- P59.1 Синдром сгущения желчи
- P59.2 Неонатальная желтуха вследствие других и неуточненных повреждений клеток печени
- P59.3 Неонатальная желтуха, обусловленная средствами, ингибирующими лактацию
- P59.8 Неонатальная желтуха, обусловленная другими уточненными причинами
- P59.9 Неонатальная желтуха неуточненная
P60 Диссеминированное внутрисосудистое свертывание крови у плода и новорожденного
P61 Другие перинатальные гематологические нарушения
- P61.0 Преходящая неонатальная тромбоцитопения
- P61.1 Полицитемия новорожденного
- P61.2 Анемия недоношенных
- P61.3 Врожденная анемия вследствие кровопотери у плода
- P61.4 Другие врожденные анемии, не классифицированные в других рубриках
- P61.5 Преходящая неонатальная нейтропения
- P61.6 Другие преходящие неонатальные расстройства коагуляции
- P61.8 Другие уточненные перинатальные гематологические нарушения
- P61.9 Перинатальное гематологическое нарушение неуточненное
Источник
- D65 Диссеминированное внутрисосудистое свертывание [синдром дефибринации]. Афибриногенемия приобретённая . Коагулопатия потребления. Диффузная или диссеминированная внутрисосудистая коагуляция (DJC). Фибринолитическая кровоточивость приобретённая. Пурпура: фибринолитическая, молниеносная.
- Исключен: синдром дефибринации (осложняющий): аборт, внематочную или молярную беременность (O00 — O07, O08.1), у новорождённого (P60), беременность, роды и послеродовой период (O45.0, O46.0, O67.0, O72.3)
- D66 Наследственный дефицит фактора VIII. Дефицит фактора VIII (с функциональным нарушением) Гемофилия: БДУ, А, классическая.
- Исключен: дефицит фактора VIII с сосудистым нарушением (D68.0)
- D67 Наследственный дефицит фактора IX. Болезнь Кристмаса. Дефицит: фактора IX (с функциональным нарушением), тромбопластического компонента плазмы, Гемофилия В
- D68 Другие нарушения свертываемости.
- Исключены осложняющие: аборт, внематочную или молярную беременность (O00-O07, O08.1), беременность, роды и послеродовой период (O45.0, O46.0, O67.0, O72.3)
- D68.0 Болезнь Виллебранда. Ангиогемофилия. Дефицит фактора VIII с сосудистым нарушением. Сосудистая гемофилия.
- Исключены: ломкость капилляров наследственная (D69.8), дефицит фактора VIII: БДУ (D66), с функциональным нарушением (D66)
- D68.1 Наследственный дефицит фактора XI. Гемофилия С. Дефицит предшественника тромбопластина плазмы.
- D68.2 Наследственный дефицит других факторов свертывания. Врожденная афибриногенемия. Дефицит: АС-глобулина, проакцелерина. Дефицит фактора: I (фибриногена), II (протромбина), V (лабильного), VII (стабильного), X (Стюарта-Прауэра), XII (Хагемана), XIII (фибринстабилизирующего). Дисфибриногенемия (врожденная). Гипопроконвертинемия Болезнь Оврена
- D68.3 Геморрагические нарушения, обусловленные циркулирующими в крови антикоагулянтами. Гипергепаринемия Повышение содержания: антитромбина, анти-VIIIa, анти-IXa, анти-Xa, анти-XIa.
- D68.4 Приобретённый дефицит фактора свертывания. Дефицит фактора свертывания вследствие: заболевания печени, недостаточности витамина К.
- Исключена: недостаточность витамина К у новорождённого (P53)
- D68.8 Другие уточнённые нарушения свертываемости. Присутствие ингибитора системной красной волчанки
- D68.9 Нарушение свертываемости неуточнённое
- D69 Пурпура и другие геморрагические состояния.
- Исключены: доброкачественная гипергаммаглобулинемическая пурпура (D89.0), криоглобулинемическая пурпура (D89.1), идиопатическая (геморрагическая) тромбоцитемия (D47.3), молниеносная пурпура (D65), тромботическая тромбоцитопеническая пурпура (M31.1)
- D69.0 Аллергическая пурпура. Пурпура: анафилактоидная, Геноха( — Шенлейна), нетромбоцитопеническая: геморрагическая, идиопатическая, сосудистая. Аллергический васкулит.
- D69.1 Качественные дефекты тромбоцитов. Синдром Бернара-Сулье (гигантских тромбоцитов), Болезнь Гланцманна, Синдром серых тромбоцитов, Тромбастения (геморрагическая) (наследственная). Тромбоцитопатия.
- Исключена: болезнь Виллебранда (D68.0)
- D69.2 Другая нетромбоцитопеническая пурпура. Пурпура: БДУ, сенильная, простая.
- D69.3 Идиопатическая тромбоцитопеническая пурпура. Синдром Эванса
- D69.4 Другие первичные тромбоцитопении.
- Исключены: тромбоцитопения с отсутствием лучевой кости (Q87.2), преходящая неонатальная тромбоцитопения (P61.0), синдром Вискотта — Олдрича (D82.0)
- D69.5 Вторичная тромбоцитопения
- D69.6 Тромбоцитопения неуточнённая
- D69.8 Другие уточнённые геморрагические состояния. Ломкость капилляров (наследственная). Сосудистая псевдогемофилия.
- D69.9 Геморрагическое состояние неуточнённое
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Геморрагическая болезнь новорожденных.
Геморрагическая болезнь новорожденных
Описание
Геморрагическая болезнь новорожденных. Патология, возникающая при дефиците факторов свертывания крови на фоне эндогенной или экзогенной недостаточности витамина К. Проявляется рвотой с примесью крови, кровавым дегтеобразным стулом, кожными геморрагиями, гематомами и внутренними кровоизлияниями. Редко сопровождается геморрагическим шоком, развитием желтухи и образованием эрозий слизистых оболочек ЖКТ. Диагностика базируется на определении количества тромбоцитов, исследовании коагулограммы, проведении УЗД и нейросонографии. Лечение заключается в заместительной терапии синтетическими аналогами витамина К, остановке внутренних кровотечений и коррекции гиповолемии.
Дополнительные факты
Геморрагическая болезнь новорожденных – геморрагический диатез, характеризующийся дефицитом II (протромбина), VII (проконвертина), IX (антигемофильного глобулина В) и X (фактора Стюарта-Пауэра) факторов свертывания при недостаточности витамина К в организме ребенка. Впервые патология описана в 1894 году Товнсендом, однако введенный термин изначально использовался для всех врожденных геморрагических состояний. Распространенность – 0,3-0,5% среди всех новорожденных. После введения обязательный профилактики аналогами витамина К при рождении заболеваемость снизилась до 0,02%. Порядка 3-6% случаев геморрагической болезни новорожденных являются следствием приема матерью фармакотерапевтических средств в период беременности.
Геморрагическая болезнь новорожденных
Причины
Причина геморрагической болезни новорожденных – недостаточность синтеза II, VII, IX и X факторов свертывания крови. Образование этих факторов проходит в тканях печени путем γ-карбоксилирования глутаминовой кислоты под воздействием витамина К. При эндогенной или экзогенной недостаточности витамина К вырабатываются функционально незрелые факторы, имеющие более сильный отрицательный заряд на своей поверхности. Подобные факторы не могут связываться с Ca++, а затем и с фосфатидилхолином. В результате не образуется фибрин, и не формируется красный тромб.
Первичный, или экзогенный, дефицит витамина К обусловлен недостаточностью его поступления в организм при вынашивании ребенка. Провоцирующими факторами геморрагической болезни новорожденных выступают нарушения со стороны матери: употребление антиконвульсивных средств (карбамазепина, конвулекса), антикоагулянтов и антибактериальных препаратов широкого спектра действия (цефалоспоринов, тетрациклинов, сульфаниламидов), преждевременные роды, заболевания печени, энтеропатии, эклампсия, дисбактериоз, нерациональное питание.
Вторичный, или эндогенный, дефицит вызван недостаточным синтезом полипептидных предшественников плазменных факторов свертывания (ПППФ) в тканях печени ребенка. Данная форма заболевания, как правило, провоцируется нарушениями со стороны новорожденного: заболеваниями печени (гепатитом), пороками развития (аномалиями строения желчевыводящих путей), функциональной незрелостью паренхимы печени, синдромом мальабсорбции, антибиотикотерапией, отсутствием профилактического введения викасола (аналога витамина К) после родов, искусственным или продолжительным парентеральным вскармливанием. Первые несколько дней жизни ребенка его ЖКТ находится в стерильном состоянии – микрофлора, способствующая усвоению витамина К, еще не успевает сформироваться, что также усугубляет вторичный эндогенный дефицит данного соединения.
• Классическая. Манифестация симптомов происходит на 2-6 сутки. Наиболее распространенная форма.
• Поздняя. Развивается после 1 недели жизни, редко возникает в возрасте до 4-х месяцев. Как правило, формируется на фоне провоцирующих заболеваний или отсутствия профилактических инъекций витамина К.
Симптомы
Симптомы геморрагической болезни новорожденных зависят от времени развития заболевания. Ранняя форма дает развернутую симптоматику в первые 24 часа жизни ребенка. Первичным проявлением становится рвота с примесью крови по типу «кофейной гущи» (гематемезис). Могут возникать внутренние кровотечения (чаще – в паренхиму печени, надпочечников, селезенки и легких). В отдельных случаях данная патология возникает еще до родов и проявляется кровоизлияниями в ткани головного мозга, петехиями и экхимозами на коже с момента рождения.
Классическая форма чаще всего манифестирует на 4-е сутки. Ее клиническая картина включает гематемезис, мелену, петехии и экхимозы по всему телу. Первым симптомом обычно становится черный дегтеобразный стул. Часто наблюдаются кровотечения из пупочной ранки и кефалогематомы. При использовании акушерских инструментов при родах и тяжелых асфиксиях на фоне дефицита витамина К могут образовываться подкожные гематомы, подапоневротические и внутричерепные кровоизлияния. При выраженном желудочно-кишечном кровотечении выявляется повышение билирубина (преимущественно за счет непрямой фракции) как следствие массивного гемолиза эритроцитов в пищеварительном тракте под воздействием желудочного сока. Это состояние сопровождается длительной желтухой, эрозиями слизистых оболочек двенадцатиперстной кишки и пилоруса. Последние два осложнения могут усугублять кровопотерю и формировать «порочный круг».
Мелена. Рвота. Рвота с кровью.
Диагностика
Диагностика геморрагической болезни новорожденных заключается в выяснении факторов риска, проведении объективного об
Геморрагический синдром код по мкб 10
Связанные заболевания и их лечение
Описания заболеваний
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Геморрагический синдром.
Описание
Геморрагический синдром, или склонность к кожной геморрагии и кровоточивости слизистых оболочек, возникает как следствие изменений в одном или нескольких звеньях гемостаза.
Симптомы
Различают 5 типов геморрагического синдрома.
• Гематомный. Типичен для гемофилии А и В, характеризуется возникновением болезненных напряженных кровоизлияний в мягкие ткани и суставы, постепенным развитием нарушений функции опорно-двигательного аппарата.
• Петехиально-пятнистый (синячковый). Возникает при тромбоцитопении, тромбоцитопатии, нарушении свертывающей системы (гипо- и дисфибриногенемия, наследственном дефиците факторов свертывания).
• Смешанный синячково-гематомный. Развивается при тяжелом дефиците факторов протромбинового комплекса и фактора XIII, болезни Виллебранда, ДВС-синдроме, передозировке антикоагулянтов и тромболитиков, появлении в крови иммунных ингибиторов факторов VIII и IX и характеризуется сочетанием петехиально-пятнистых кожных геморрагии с отдельными большими гематомами в забрюшинном пространстве, стенке кишечника. В отличие от гематомного типа, кровоизлияние в полость суставов возникает крайне редко. Синяки могут быть обширными и болезненными.
• Васкулито-пурпурный тип. Наблюдается при инфекционных и иммунных васкулитах, легко трансформируется в ДВС-синдром и характеризуется геморрагией в виде сыпи или эритемы на воспалительной основе, возможным присоединением нефрита и кишечного кровотечения.
• Ангиоматозный тип. Развивается в зонах телеангиэктазий, ангиом, артериовенозных шунтов и характеризуется упорными локальными геморрагиями, связанными с зонами сосудистой патологии.
С определенной долей вероятности предположить патологию сосудисто-тромбоцитарного или коагуляционного звена гемостаза можно по особенностям геморрагических проявлений.
Причины
Геморрагический синдром может бытьобусловлен такой патологией как поражение сосудистой стенки, нарушение структуры, функции и количества тромбоцитов, нарушение коагуляционного гемостаза. При определении причин кровоточивости необходимо учитывать, что одни виды патологии часты, другие — редки, а третьи — крайне редки. Из наследственных нарушений гемостаза наиболее часто в терапевтической практике встречаются тромбоцитопатии, гемофилия A, болезнь Виллебранда, гемофилия В, из сосудистых форм — телеангиэктазия. Причиной приобретенных форм геморрагического синдрома наиболее часто становятся вторичная тромбоцитопения и тромбоцитопатии, ДВС-синдром, дефицит факторов протромбинового комплекса и геморрагический васкулит. Другие формы редки или очень редки. Следует учитывать, что в последние годы все чаще нарушения гемостаза и, как следствие, геморрагический синдром связаны с приемом лекарственных препаратов, нарушающих агрегацию тромбоцитов (антиагреганты) и свертываемость крови (антикоагулянты), а также психогенные формы — невротическая кровоточивость и синдром Мюнхгаузена.
Лечение
При кровотечениях и хирургических вмешательствах- введения криопреципитата и струйно свежезамороженной плазмы. Дозы и частота их введения могут быть в 2-3 раза меньше, чем при гемофилии А. С первого и до последнего дня менструального цикла, а также при носовых и желудочно-кишечных кровотечениях назначают внутрь аминокапроновую кислоту (8-12 г/сут)либо осуществляют гормональный гемостаз. Профилактика. Избегать браков между больными (в том числе между родственниками) в связи с рождением детей с тяжелой гомозиготной формой болезни.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
P50 Кровопотеря у плода
- P50.0 Потеря крови плодом из предлежащего сосуда
- P50.1 Потеря крови плодом из разорванной пуповины
- P50.2 Потеря крови плодом из плаценты
- P50.3 Кровотечение у плода другого однояйцового близнеца
- P50.4 Кровотечение у плода в кровеносное русло матери
- P50.5 Потеря крови у плода из перерезанного конца пуповины при однояйцовой двойне
- P50.8 Другая форма кровопотери у плода
- P50.9 Кровопотеря у плода неуточненная
P51 Кровотечение из пуповины у новорожденного
- P51.0 Массивное кровотечение из пуповины у новорожденного
- P51.8 Другое кровотечение из пуповины у новорожденного
- P51.9 Кровотечение из пуповины у новорожденного неуточненное
P52 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного
- P52.0 Внутрижелудочковое кровоизлияние нетравматическое 1-й степени у плода и новорожденного
- P52.1 Внутрижелудочковое нетравматическое кровоизлияние 2-й степени у плода и новорожденного
- P52.2 Внутрижелудочковое нетравматическое кровоизлияние 3-й степени у плода и новорожденного
- P52.3 Неуточненное внутрижелудочковое нетравматическое кровоизлияние у плода и новорожденного
- P52.4 Кровоизлияние в мозг нетравматическое у плода и новорожденного
- P52.5 Субарахноидальное нетравматическое кровоизлияние у плода и новорожденного
- P52.6 Кровоизлияние в мозжечок и заднюю черепную ямку нетравматическое у плода и новорожденного
- P52.8 Другие внутричерепные нетравматические кровоизлияния у плода и новорожденного
- P52.9 Внутричерепное нетравматическое кровоизлияние у плода и новорожденного неуточненное
P53 Геморрагическая болезнь плода и новорожденного
P54 Другие неонатальные кровотечения
- P54.0 Гематемезис новорожденных
- P54.1 Мелена новорожденного
- P54.2 Кровотечение из прямой кишки у новорожденного
- P54.3 Желудочно-кишечное кровотечение у новорожденного
- P54.4 Кровоизлияние в надпочечник у новорожденных
- P54.5 Кровоизлияние в кожу у новорожденного
- P54.6 Кровотечение из влагалища у новорожденного
- P54.8 Другие уточненные кровотечения у новорожденного
- P54.9 Неонатальное кровотечение неуточненное
P55 Гемолитическая болезнь плода и новорожденного
- P55.0 Резус-изоиммунизация плода и новорожденного
- P55.1 АВО-изоиммунизация плода и новорожденного
- P55.8 Другие формы гемолитической болезни плода и новорожденного
- P55.9 Гемолитическая болезнь плода и новорожденного неуточненная
P56 Водянка плода, обусловленная гемолитической болезнью
- P56.0 Водянка плода, обусловленная изоиммунизацией
- P56.9 Водянка плода, обусловленная другой и неуточненной гемолитической болезнью
P57 Ядерная желтуха
- P57.0 Ядерная желтуха, обусловленная изоиммунизацией
- P57.8 Другие уточненные формы ядерной желтухи
- P57.9 Ядерная желтуха неуточненная
P58 Неонатальная желтуха, обусловленная чрезмерным гемолизом
- P58.0 Неонатальная желтуха, обусловленная кровоподтеками
- P58.1 Неонатальная желтуха, обусловленная кровотечением
- P58.2 Неонатальная желтуха, обусловленная инфекцией
- P58.3 Неонатальная желтуха, обусловленная полицитемией
- P58.4 Неонатальная желтуха, обусловленная лекарственными средствами или токсинами, перешедшими из организма матери или введенными новорожденному
- P58.5 Неонатальная желтуха, обусловленная заглатыванием материнской крови
- P58.8 Неонатальная желтуха, обусловленная другими уточненными формами чрезмерного гемолиза
- P58.9 Неонатальная желтуха, обусловленная чрезмерным гемолизом, неуточненная
P59 Неонатальная желтуха, обусловленная другими и неуточненными причинами
- P59.0 Неонатальная желтуха, связанная с преждевременным родоразрешением
- P59.1 Синдром сгущения желчи
- P59.2 Неонатальная желтуха вследствие других и неуточненных повреждений клеток печени
- P59.3 Неонатальная желтуха, обусловленная средствами, ингибирующими лактацию
- P59.8 Неонатальная желтуха, обусловленная другими уточненными причинами
- P59.9 Неонатальная желтуха неуточненная
P60 Диссеминированное внутрисосудистое свертывание крови у плода и новорожденного
P61 Другие перинатальные гематологические нарушения
- P61.0 Преходящая неонатальная тромбоцитопения
- P61.1 Полицитемия новорожденного
- P61.2 Анемия недоношенных
- P61.3 Врожденная анемия вследствие кровопотери у плода
- P61.4 Другие врожденные анемии, не классифицированные в других рубриках
- P61.5 Преходящая неонатальная нейтропения
- P61.6 Другие преходящие неонатальные расстройства коагуляции
- P61.8 Другие уточненные перинатальные гематологические нарушения
- P61.9 Перинатальное гематологическое нарушение неуточненное
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Геморрагическая болезнь новорожденных.
Геморрагическая болезнь новорожденных
Описание
Геморрагическая болезнь новорожденных. Патология, возникающая при дефиците факторов свертывания крови на фоне эндогенной или экзогенной недостаточности витамина К. Проявляется рвотой с примесью крови, кровавым дегтеобразным стулом, кожными геморрагиями, гематомами и внутренними кровоизлияниями. Редко сопровождается геморрагическим шоком, развитием желтухи и образованием эрозий слизистых оболочек ЖКТ. Диагностика базируется на определении количества тромбоцитов, исследовании коагулограммы, проведении УЗД и нейросонографии. Лечение заключается в заместительной терапии синтетическими аналогами витамина К, остановке внутренних кровотечений и коррекции гиповолемии.
Дополнительные факты
Геморрагическая болезнь новорожденных – геморрагический диатез, характеризующийся дефицитом II (протромбина), VII (проконвертина), IX (антигемофильного глобулина В) и X (фактора Стюарта-Пауэра) факторов свертывания при недостаточ
Геморрагический синдром код по мкб
Термин «геморрагический васкулит» впервые появился в советской медицинской литературе в 1959 году благодаря ревматологу Насоновой. Само заболевание было изучено немецкими врачами Шенлейном и Генохом в 1837 и 1874 годах, отчего и получило своё название – болезнь Шенлейна – Геноха. Её также называют аллергической или ревматической пурпурой.
Заболевание геморрагический васкулит относится к группе системных болезней и вызывает воспаление капилляров и мелких кровеносных сосудов. В ходе течения их стенки источаются, что приводит к кровоизлияниям под кожей или внутри стенок органов.
В международной классификации болезней оно обозначается кодом D69.0.
Разновидности геморрагического васкулита
Врачи классифицируют эту болезнь по 3 признакам.
Локализация
- Кожа и суставы.
- Тонкий и толстый кишечник (абдоминальный синдром).
- Почки.
Скорость развития
- За несколько дней – молниеносная.
- За 1-3 месяца – острая.
- За полгода – затяжная.
- За 1 год и более – хроническая.
Тяжесть состояния больного
- 1-я степень – легкая,
- 2-я степень – средняя,
- 3-я степень – тяжелая.
Причины и провоцирующие факторы
Основная причина появления васкулита – наличие в крови иммунных комплексов. Они представляют собой «комок» из антигенов и антител. В здоровом организме их количество контролирует фагоцитарная система. Но при избытке чужеродных веществ (антигенов) их становится слишком много и она не успевает их выводить. Это приводит к их оседанию на внутренней стенке сосудов с последующим воспалением этого места.
Главным провоцирующим фактором аллергической пурпуры являются болезни горла, легких: ОРЗ, ОРВИ, ангина и другие.
Другой группой провоцирующих факторов является аллергическая реакция на продукты, медикаменты, прививки, укусы насекомых, бытовую химию.
Симптомы
Проявления геморрагического васкулита можно разделить на 2 группы: общие и специфические. К первой относится повышение температуры до 38-40°C, интоксикация, отсутствие аппетита, слабость.
Вторая группа включает в себя:
- сыпь,
- суставной, абдоминальный, почечный синдромы,
- поражения легких, нервной системы.
Характерные высыпания – главный признак того, что сосуды поражены васкулитом. Сыпь представляет собой множество точек цвета ржавчины. Каждая из них имеет форму круга диаметром 2 миллиметра и возвышается над поверхностью кожи. Они могут объединяться между собой и образовывать пятна больших размеров, вплоть до отсутствия здоровых участков между ними. Появляется она в основном на коже голени (часть ноги ниже колена). При отсутствии лечения постепенно поднимается вверх, покрывая бедра, ягодицы и нижнюю часть спины.
Суставной синдром в 70-90% случаев появляется одновременно с высыпаниями и вызывает боль в коленном, голеностопном и других суставах, а также в прилегающих к ним мышцах.
При абдоминальном синдроме поражаются органы пищеварения и появляются характерные для болезней ЖКТ симптомы: тошнота, рвота, диарея, желудочно-кишечное кровотечение. Также возможно появление отверстий в стенках кишечника или перитонита.
При почечном синдроме нарушается работа почек. Он появляется на третьей неделе развития заболевания, т.е. после остальных проявлений васкулита. Поражение почек проявляется в появлении в моче различных белков.
В очень редких случаях болезнь поражает сосуды легких и головного мозга. В первом случае оно выражается кровотечениями и кровоизлияниями в стенки органа.
Во втором – сильными головными болями и может быть причиной энцефалопатии, полинейропатии, судорог, изменений в поведении и инфаркта.
Лечение
Лечением васкулита занимаются 2 специалиста: терапевт и ревматолог. При появлении абдоминального и почечного синдромов может потребоваться дополнительная консультация гастроэнтеролога и нефролога.
Для того, чтобы вылечить заболевание, врач использует 2 метода: гипоаллергенную диету и медикаменты. В первом случае целью является уменьшение числа попадающих в организм аллергенов. В идеале рекомендуется перейти на диету для больных язвой желудка – стол № 1. Но временный отказ от апельсинов, шоколада, чая, кофе, солёных и острых блюд тоже эффективен.
Во втором случае препараты уменьшают симптомы и замедляют патологические процессы. К ним относятся:
- Тиклопидин, Дипиридамол – предотвращают образование тромбов.
- Никотиновая кислота – стимулирует процесс растворения фибриновых образований и тромбов.
- Гепарин – снижает свертываемость крови.
- Дексаметазон, Преднизолон – регулируют работу иммунной системы.
- Антибиотики – для лечения вторичной бактериальной инфекции.
Длительность лечения составляет от 2 месяцев до года, в зависимости от степени тяжести. Если оно было начато вовремя, то вероятность появлений осложнений очень мала.
Геморрагический васкулит – болезнь, поражающая стенки капилляров и мелких сосудов. Присвоенный ей код по МКБ-10 D69.0. Она возникает из-за избыточной работы иммунной системы. Главный симптом – специфическая сыпь цвета ржавчины, вызванная подкожными кровоизлияниями. Она также проявляется нарушением целостности органов пищеварения и работы почек.
Для того, чтобы не спровоцировать геморрагический васкулит, главное условие – соблюдение рационального питания, своевременное прохождение медицинского обследования и сдача анализов.
Геморрагический синдром код мкб 10
ÐÑледÑÑвие изменений в одном или неÑколÑÐºÐ¸Ñ Ð·Ð²ÐµÐ½ÑÑÑ Ð³ÐµÐ¼Ð¾ÑÑаза Ð²Ð¾Ð·Ð½Ð¸ÐºÐ°ÐµÑ ÑклонноÑÑÑ Ðº кÑовоÑоÑивоÑÑи ÑлизиÑÑÑÑ Ð¾Ð±Ð¾Ð»Ð¾Ñек и к кожной гемоÑÑагии, коÑоÑÑÑ Ð½Ð°Ð·ÑваÑÑ Ð³ÐµÐ¼Ð¾ÑÑагиÑеÑким ÑиндÑомом.
РмедиÑине ÑазлиÑаÑÑ Ð¿ÑÑÑ Ñипов ÑиндÑома, а именно:
- СинÑÑковÑй, или пеÑÐµÑ Ð¸Ð°Ð»Ñно-пÑÑниÑÑÑй â ÑипиÑен Ð´Ð»Ñ ÑÑомбоÑиÑопаÑии, наÑледÑÑвенного деÑиÑиÑа ÑакÑоÑов ÑвеÑÑÑваниÑ, ÑÑомбоÑиÑопении, диÑÑибÑиногенемии и гипоÑибÑиногенемии. ÐÑи гемоÑÑагиÑеÑком ÑиндÑоме ÑÑого Ñипа Ð²Ð¾Ð·Ð½Ð¸ÐºÐ°ÐµÑ Ð´ÐµÑиÑÐ¸Ñ II,V и X ÑакÑоÑов ÑвеÑÑÑÐ²Ð°Ð½Ð¸Ñ ÐºÑови;
- ÐемаÑомнÑй â Ð²Ð¾Ð·Ð½Ð¸ÐºÐ°ÐµÑ Ð½Ð° Ñоне гемоÑилии Ри Ð, Ñ Ð°ÑакÑеÑизÑеÑÑÑ Ð´ÐµÑиÑиÑом VIII, IX и XI ÑакÑоÑов ÑвеÑÑÑÐ²Ð°Ð½Ð¸Ñ ÐºÑови. У болÑного поÑÑепенно ÑазвиваеÑÑÑ Ð½Ð°ÑÑÑение ÑÑнкÑии опоÑно-двигаÑелÑного аппаÑаÑа, возникаÑÑ Ð½Ð°Ð¿ÑÑженнÑе болезненнÑе кÑовоизлиÑÐ½Ð¸Ñ Ð² мÑгкие Ñкани и ÑÑÑÑавÑ. Ðо пÑоÑеÑÑвии неÑколÑÐºÐ¸Ñ ÑаÑов поÑле ÑÑÐ°Ð²Ð¼Ñ Ð½Ð°ÑинаеÑÑÑ Ñ Ð°ÑакÑеÑное Ð´Ð»Ñ ÑÑого Ñипа ÑиндÑома позднее кÑовоÑеÑение;
- ÐикÑоÑиÑкÑлÑÑоÑно-гемаÑомнÑй, или ÑмеÑаннÑй â ÑипиÑен Ð´Ð»Ñ ÐÐС-ÑиндÑома и болезни ÐиллебÑанда, заÑаÑÑÑÑ Ð²Ð¾Ð·Ð½Ð¸ÐºÐ°ÐµÑ Ð¿Ñи пеÑедозиÑовке ÑÑомболиÑиков и анÑикоагÑлÑнÑов, ÑÑжелом деÑиÑиÑе ÑакÑоÑов пÑоÑÑомбинового комплекÑа, поÑвлении иммÑннÑÑ Ð¸Ð½Ð³Ð¸Ð±Ð¸ÑоÑов ÑакÑоÑов VIII и IX в кÑови. ХаÑакÑеÑизÑеÑÑÑ ÑмеÑаннÑй гемоÑÑагиÑеÑкий ÑиндÑом ÑоÑеÑанием в ÑÑенке киÑеÑника и забÑÑÑинном пÑоÑÑÑанÑÑве оÑделÑнÑÑ Ð±Ð¾Ð»ÑÑÐ¸Ñ Ð³ÐµÐ¼Ð°Ñом Ñ Ð¿ÐµÑÐµÑ Ð¸Ð°Ð»Ñно-пÑÑниÑÑÑми кожнÑми гемоÑÑагиÑми;
- ÐаÑкÑлиÑно-пÑÑпÑÑнÑй â ÑазвиваеÑÑÑ Ð½Ð° Ñоне иммÑннÑÑ Ð¸ инÑекÑионнÑÑ Ð²Ð°ÑкÑлиÑов, Ñ Ð°ÑакÑеÑизÑеÑÑÑ ÑазвиÑием на воÑпалиÑелÑной оÑнове гемоÑÑагии в виде ÑÑиÑÐµÐ¼Ñ Ð¸Ð»Ð¸ ÑÑпи, ÐµÐ¼Ñ ÑвойÑÑвенно пÑиÑоединение киÑеÑного кÑовоÑеÑÐµÐ½Ð¸Ñ Ð¸ неÑÑиÑа. ÐÑÐ¾Ñ Ñип ÑиндÑома легко ÑÑанÑÑоÑмиÑÑеÑÑÑ Ð² ÐÐС-ÑиндÑом;
- ÐнгиомаÑознÑй â ÑазвиваеÑÑÑ Ð² Ð·Ð¾Ð½Ð°Ñ Ð°ÑÑеÑиовенознÑÑ ÑÑнÑов, ангиом и ÑелеангиÑкÑазий, ÐµÐ¼Ñ ÑвойÑÑвенно обÑазование ÑвÑзаннÑÑ Ñ Ð·Ð¾Ð½Ð°Ð¼Ð¸ ÑоÑÑдиÑÑой паÑологии ÑпоÑнÑÑ Ð»Ð¾ÐºÐ°Ð»ÑнÑÑ Ð³ÐµÐ¼Ð¾ÑÑагий.
СоглаÑно ÑÑаÑиÑÑиÑеÑким даннÑм, гемоÑÑагиÑеÑкий ÑиндÑом Ñ Ð¶ÐµÐ½Ñин вÑÑÑеÑаеÑÑÑ Ð½ÐµÑколÑко ÑаÑе, нежели Ñ Ð¼ÑжÑин.
ÐемоÑÑагиÑеÑкий ÑиндÑом: пÑиÑÐ¸Ð½Ñ Ð¸ ÑимпÑомÑ
ÐоÑажение ÑоÑÑдиÑÑой ÑÑенки и ее ÑÑÑÑкÑÑÑÑ, колиÑеÑÑва и ÑÑнкÑий ÑÑомбоÑиÑов, а Ñакже наÑÑÑение коагÑлÑÑионного гемоÑÑаза ÑвлÑÑÑÑÑ Ð¿ÑиÑинами ÑазвиÑÐ¸Ñ Ð³ÐµÐ¼Ð¾ÑÑагиÑеÑкого ÑиндÑома. Ð Ð¾Ð´Ð½Ð¸Ñ ÑлÑÑаÑÑ Ð¿Ð°Ñологии вÑÑÑеÑаÑÑÑÑ ÑаÑÑо, в дÑÑÐ³Ð¸Ñ â кÑайне Ñедко, ÑÑо важно ÑÑиÑÑваÑÑ Ð¿Ñи диагноÑÑике заболеваниÑ.
ÐÑиобÑеÑÐµÐ½Ð½Ð°Ñ ÑоÑма ÑиндÑома наиболее ÑаÑÑо ÑазвиваеÑÑÑ Ð½Ð° Ñоне вÑоÑиÑной ÑÑомбоÑиÑопаÑии и ÑÑомбоÑиÑопении, деÑиÑиÑа ÑакÑоÑов пÑоÑÑомбинового комплекÑа, ÐÐС-ÑиндÑома и гемоÑÑагиÑеÑкого ваÑкÑлиÑа.
РпоÑледнее вÑÐµÐ¼Ñ ÑазвиÑие гемоÑÑагиÑеÑкого ÑиндÑома вÑе более ÑаÑÑо ÑвÑзано Ñ Ð¿Ñиемом лекаÑÑÑвеннÑÑ ÑÑедÑÑв, коÑоÑÑе наÑÑÑаÑÑ Ð°Ð³ÑегаÑÐ¸Ñ ÑÑомбоÑиÑов и ÑвеÑÑÑваемоÑÑÑ ÐºÑови. Также, пÑиÑиной ÑазвиÑÐ¸Ñ ÑиндÑома Ð¼Ð¾Ð¶ÐµÑ Ð²Ñ
Геморрагический синдром мкб 10
Исключены:
- доброкачественная гипергаммаглобулинемическая пурпура (D89.0)
- криоглобулинемическая пурпура (D89.1)
- идиопатическая (геморрагическая) тромбоцитемия (D47.3)
- молниеносная пурпура (D65)
- тромботическая тромбоцитопеническая пурпура (M31.1)
При необходимости идентифицировать причину используют дополнительный код внешних причин (класс XX).
Поиск по тексту МКБ-10
Поиск по коду МКБ-10
Поиск по алфавиту
Классы МКБ-10
- I Некоторые инфекционные и паразитарные болезни
(A00-B99)
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2017, 2018, 2022 году.
Краткое описание
Диссеминированное внутрисосудистое свёртывание (синдром дефибринизации) (ДВС) — синдром, возникающий при различных заболеваниях и характеризующийся образованием нерастворимого фибрина в крови и утилизацией прокоагулянтов и тромбоцитов с развитием геморрагического и/или тромботического синдромов, что приводит к нарушению микроциркуляции и тканевой гипоксии. Деление на фазы гипер – и гипокоагуляции не совсем верно, т.к. оба процесса протекают одновременно и наличие клинических проявлений того или иного синдрома зависит от конкретной ситуации.
Классификация • Острое ДВС (генерализованное) — характерен выраженный геморрагический синдром вследствие остро возникающих тромбоцитопении и истощения плазменных факторов свёртывания. Возможно отложение фибрина в микроциркуляторном русле и возникновение геморрагических некрозов • Подострое ДВС — более характерен тромбоэмболический синдром, кровоточивость наблюдают реже.
Причины
Этиология • Выброс тканевых факторов •• Акушерские синдромы ••• Отслойка плаценты ••• Эмболия амниотическими водами ••• Мёртвый плод ••• Аборт во II триместре беременности •• Гемолиз (в т.ч. внутрисосудистый) •• Онкологические заболевания, особенно муцинпродуцирующие аденокарциномы и острый промиелоцитарный лейкоз •• Жировая эмболия •• Повреждение тканей ••• Ожоги ••• Отморожения ••• ЧМТ ••• Огнестрельные ранения • Повреждение эндотелия •• Аневризма аорты •• Гемолитико – уремический синдром •• Острый гломерулонефрит •• Лихорадка скалистых гор • Сосудистые мальформации и сниженная тканевая перфузия • Инфекции.
Факторы риска • Беременность • Хирургические вмешательства на предстательной железе • ЧМТ • Воспалительные состояния • Онкологические заболевания.
Патогенез • Истощение факторов свёртывания и тромбоцитов — тенденция к кровоточивости • Образование депозитов фибрина в микроциркуляторном русле •• Тенденция к кровоточивости •• Ишемическое поражение органов •• Микроангиопатическая гемолитическая анемия.
Симптомы (признаки)
Клиническая картина • Повышенная кровоточивость (наблюдают чаще) • Тромботические нарушения •• Акроцианоз •• Боли в животе • Кашель • Одышка • Локализованные хрипы в лёгких • Тахипноэ • Шум трения плевры • Спутанное сознание, дезориентация • Олигурия, анурия • Иногда при хроническом ДВС (например, при злокачественных новообразованиях) возможно отсутствие повышенной кровоточивости и тромбозов.
Диагностика
Лабораторные исследования • ОАК — тромбоцитопения, анемия, лейкоцитоз, шизоцитоз • Коагулограмма •• Повышенное ЧТВ •• Повышенное ПВ •• Снижение содержания фибриногена •• Повышение содержания продуктов распада фибрина •• Снижение содержания антитромбина III •• Повышение времени кровотечения •• Снижение содержания факторов V, VIII (возможно также его повышение), Х, XIII •• Снижение содержания белка С • Биохимический анализ крови — повышение содержания ЛДГ, мочевины, гемоглобинемия • ОАМ — гематурия • Положительная проба Грегерсена.
Инструментальные исследования — рентгенография органов грудной клетки выявляет двустороннее прикорневое усиление лёгочного рисунка.
Дифференциальная диагностика • Массивный некроз печени • Дефицит витамина К • Тромбоцитопеническая пурпура • Гемолитико – уремический синдром.
Лечение
ЛЕЧЕНИЕ
Цели • Попытка воздействовать на обратимые причины возникновения ДВС •• Антибактериальная терапия при сепсисе •• Родоразрешение, удаление матки при отслойке плаценты • Коррекция возникших нарушений (геморрагических или тромботических) •• При кровоточивости — свежезамороженная плазма, тромбоцитарная масса •• При признаках тромбоза — гепарин в/в •• При субклиническом течении ДВС — гепарин в/в, переливание тромбоцитарной массы и свежезамороженной плазмы (эффективно для профилактики дальнейшего прогрессирования ДВС) • Профилактика повторного возникновения ДВС — длительная терапия гепарином.
Осложнения • ОПН • Шок • Тампонада сердца • Гемоторакс • Внутримозговое кровотечение.
Течение и прогноз. Летальность — 50–80%. Зависит от тяжести основного заболевания, вызвавшего развитие ДВС (при отслойке плаценты, осложнившейся ДВС — менее 1%, при шоке и инфекции — более 90%).
МКБ-10 • D65 ДВС [синдром дефибринации] • P60 ДВС крови у плода и новорождённого
Примечание. Недостаточность антитромбина III (*107300, не менее 45 мутантных аллелей, 1q23–q25, ген AT3, Â). Повышенная свёртываемость крови, венозные тромбозы, тромбофлебит, тромбоз мезентериальных вен. Синонимы: тромбофилия наследуемая, диатез геморрагический.
Вследствие изменений в одном или нескольких звеньях гемостаза возникает склонность к кровоточивости слизистых оболочек и к кожной геморрагии, которую называют геморрагическим синдромом.
В медицине различают пять типов синдрома, а именно:
- Синячковый, или петехиально-пятнистый – типичен для тромбоцитопатии, наследственного дефицита факторов свертывания, тромбоцитопении, дисфибриногенемии и гипофибриногенемии. При геморрагическом синдроме этого типа возникает дефицит II,V и X факторов свертывания крови;
- Гематомный – возникает на фоне гемофилии А и В, характеризуется дефицитом VIII, IX и XI факторов свертывания крови. У больного постепенно развивается нарушение функции опорно-двигательного аппарата, возникают напряженные болезненные кровоизлияния в мягкие ткани и суставы. По прошествии нескольких часов после травмы начинается характерное для этого типа синдрома позднее кровотечение;
- Микроциркуляторно-гематомный, или смешанный – типичен для ДВС-синдрома и болезни Виллебранда, зачастую возникает при передозировке тромболитиков и антикоагулянтов, тяжелом дефиците факторов протромбинового комплекса, появлении иммунных ингибиторов факторов VIII и IX в крови. Характеризуется смешанный геморрагический синдром сочетанием в стенке кишечника и забрюшинном пространстве отдельных больших гематом с петехиально-пятнистыми кожными геморрагиями;
- Васкулитно-пурпурный – развивается на фоне иммунных и инфекционных васкулитов, характеризуется развитием на воспалительной основе геморрагии в виде эритемы или сыпи, ему свойственно присоединение кишечного кровотечения и нефрита. Этот тип синдрома легко трансформируется в ДВС-синдром;
- Ангиоматозный – развивается в зонах артериовенозных шунтов, ангиом и телеангиэктазий, ему свойственно образование связанных с зонами сосудистой патологии упорных локальных геморрагий.
Согласно статистическим данным, геморрагический синдром у женщин встречается несколько чаще, нежели у мужчин.
Геморрагический синдром: причины и симптомы
Поражение сосудистой стенки и ее структуры, количества и функций тромбоцитов, а также нарушение коагуляционного гемостаза являются причинами развития геморрагического синдрома. В одних случаях патологии встречаются часто, в других – крайне редко, что важно учитывать при диагностике заболевания.
Приобретенная форма синдрома наиболее часто развивается на фоне вторичной тромбоцитопатии и тромбоцитопении, дефицита факторов протромбинового комплекса, ДВС-синдрома и геморрагического васкулита.
В последнее время развитие геморрагического синдрома все более часто связано с приемом лекарственных средств, которые нарушают агрегацию тромбоцитов и свертываемость крови. Также, причиной развития синдрома может выступать болезнь Вергольфа, гемофилия и дефицит протромбина.
Признаками синдрома выступают обмороки, кровотечения различного типа и степени сложности, а также кровоточивость (геморрагические диатезы).
Геморрагический синдром у новорожденных
Следствием недостаточного синтеза факторов Тромбинового индекса является геморрагический синдром (болезнь) новорожденных. Из-за дефицита витамина К у детей она протекает в виде врожденной коагулопатии.
Согласно статистическим данным, 20 лет назад геморрагический синдром у новорожденных встречался в 0,25-0,5% случаев, в наши дни повсеместное использование в клинической практике 1 мг дозы витамина К позволило снизить этот показатель до 0,01% и менее.
Развитие синдрома у новорожденных может быть обусловлено несколькими факторами, а именно:
- Приемом беременной женщиной антибиотиков, противосудорожных и противотуберкулезных препаратов, антикоагулянтов непрямого действия, проникающих через плаценту;
- Поздним прикладыванием ребенка к груди, недоношенностью младенца, перинатальной гипоксией и длительным парентеральным питанием;
- Синдромом мальабсорбции, применением антибиотиков широкого спектра действия ребенку и искусственным вскармливанием.
В редких случаях геморрагический синдром у новорожденного проявляется в первый день жизни, более часто он развивается на 5-7 сутки.
Диагностика геморрагического синдрома
Прежде всего, для подтверждения диагноза необходимо провести развернутый анализ крови и мочи, простейшие коагуляционные тесты, осуществить подсчет тромбоцитов периферической крови, по показаниям может потребоваться стернальная пункция.
Врач при постановке диагноза должен учитывать длительность кровотечения и время свертывания крови, проверить ее на содержание фибриногена и протромбина, а также определить толерантность (устойчивость) плазмы к гепарину.
Профилактика и лечение геморрагического синдрома
Для предупреждения развития синдрома у новорожденных детей рекомендуется осуществлять следующие меры профилактики:
- Вводить подкожно витамин К недоношенным младенцам;
- Прикладывать новорожденного ребенка к груди в первые полчаса после рождения.
Лечение геморрагического синдрома у младенцев происходит посредством внутримышечного введения витамина К, а также кормления младенца сцеженным материнским или донорским грудным молоком семь раз в день.
Вне зависимости от возраста пациента, при развитии кровотечения должна быть оказана неотложная медицинская помощь, направленная на его остановку. Для предупреждения развития кровотечения взрослым пациентам могут назначить прием гемостатиков, повышающих свертываемость крови. В индивидуальном порядке, в зависимости от показаний и состояния больного, врач может назначить последующее медикаментозное лечение.
Геморрагический синдром у женщин, мужчин и новорожденных детей проявляется как склонность к кровоточивости слизистых оболочек и кожной геморрагии. Больным необходима экстренная госпитализация и применение адекватного лечения, включающего остановку кровотечения, восстановление уровня витамина К в организме, а также применение лекарственных препаратов, повышающих свертываемость крови.
Геморрагическая лихорадка с почечным синдромом — Диагноз
Эпидемиологический анамнез
Пребывание в эндемическом фокусе, характере профессиональной деятельности.
[13], [14], [15], [16], [17], [18], [19], [20]
Сезонность
Цикличность курса с регулярной сменой инфекционно-токсических симптомов начального периода (повышение температуры тела, головная боль, слабость, гиперемия лица, шеи, верхней трети груди, слизистых оболочек, инъекция склеральных сосудов) признаков нарастания почечная недостаточность олигурического периода (боли в пояснице, животе, рвота, не связанная с приемом пищи, снижение остроты зрения на фоне сильной головной боли, сухость во рту, жажда, тяжелый геморрагический синдром, снижение диуреза до менее 500 мл / сут. .
Неспецифическая лабораторная диагностика геморрагической лихорадки с почечным синдромом
Информативность лабораторных неспецифических (общеклинических, биохимических, коагулопатических, электролитных, иммунологических) и инструментальных (ЭГДС, УЗИ, КТ, ЭКГ, рентгенография НГК и др.) Относительна, так как они отражают выраженность неспецифических патофизиологических синдромов — острых почечная недостаточность, ДВС и другие, их следует оценивать с учетом периода заболевания.
Клинический анализ крови: в начальном периоде — лейкопения, увеличение количества эритроцитов, гемоглобина, снижение СОЭ, тромбоцитопения; в разгар болезни — лейкоцитоз со сдвигом формулы влево, повышение СОЭ до 40 мм / час.
Общий анализ мочи: протеинурия (от 0,3 до 30,0 г / л и выше), микро- и макрогематурия, цилиндрурия, клетки Дунаевского.
Проба Зимницкого: гипоизостенурия.
Биохимический анализ крови: повышение концентрации мочевины, креатинина, гиперкалиемия, гипонатриемия, гипохлоремия.
Коагулограмма: В зависимости от периода заболевания признаки гиперкоагуляции (сокращение тромбинового времени до 10-15 с, время свертывания, повышение концентрации фибриногена до 4.5-8 г / л, протромбиновый индекс до 100-120%) или гипокоагуляция (увеличение тромбинового времени до 25-50 с, удлинение времени свертывания, снижение концентрации фибриногена до 1-2 г / л протромбина индекс до 30-60%).
Специфическая лабораторная диагностика геморрагической лихорадки с почечным синдромом
РНИФ: исследования проводятся на парных сыворотках, взятых с интервалом 5-7 дней. Диагностическим значением считается повышение титра антител в 4 и более раз. Метод высокоэффективен, подтверждение диагноза достигает 96-98%.Для повышения эффективности серодиагностики геморрагической лихорадки с почечным синдромом первую сыворотку рекомендуется принимать до 4-7-го дня заболевания, а вторую — не позднее 15-го дня заболевания. Также используется твердофазный ИФА, позволяющий определять концентрацию IgM-антител. С целью ранней диагностики используется ПЦР для обнаружения фрагментов вирусной РНК в крови.
Инструментальная диагностика геморрагической лихорадки с почечным синдромом
УЗИ почек, ЭКГ, рентген грудной клетки.
.
Код МКБ-10 A98.5 | Геморрагическая лихорадка с почечным синдромом
,00
МКБ-10
МКБ-10 — это 10-я редакция Международной статистической классификации болезней и проблем, связанных со здоровьем (МКБ), списка медицинских классификаций Всемирной организации здравоохранения (ВОЗ).
Он содержит коды заболеваний, признаков и симптомов, отклонений от нормы, жалоб, социальных обстоятельств и внешних причин травм или заболеваний.
УВД
Система классификации анатомо-терапевтических химических веществ (АТХ) используется для классификации активных ингредиентов лекарственных средств в зависимости от органа или системы, на которые они действуют, и их терапевтических, фармакологических и химических свойств.
Он контролируется Центром сотрудничества по методологии статистики лекарственных средств Всемирной организации здравоохранения (WHOCC).
DDD
Установленная суточная доза (DDD) — это статистическая мера потребления лекарств, определенная Всемирной организацией здравоохранения (ВОЗ).
Он используется для стандартизации сравнения употребления наркотиков между разными лекарствами или между различными средами здравоохранения.
.
Синдром острой геморрагической диареи (AHDS) у собак | Vetlexicon Canis от Vetstream
Canis ISSN: 2398-2942
Синоним (ы): Геморрагический гастроэнтерит (HGE)
Автор (и): Джеймс Симпсон, Кен Харкин, Дэниел Бэтчелор
Введение
- Причина : скорее всего, токсин, продуцируемый Clostridium perfringens .
- Признаки : очень острое начало кровавой диареи и рвоты.
- Диагноз : совместимые клинические признаки и исключение других причин.
- Лечение : должно быть агрессивным и в первую очередь симптоматическим / поддерживающим (жидкости, противорвотные средства).
- Прогноз : обычно хороший, если животные получают своевременное лечение.
Патогенез
Этиология
- Доподлинно неизвестно.
- Энтеротоксины — наиболее логичное объяснение разрушения слизистой оболочки.
- Первичная патогенная роль Clostridium perfringens Clostridium perfringens или его токсинов предполагается клостридиальным энтеротоксикозом.
- Сообщалось о большом количестве палочковидных бактерий на некротизированных поверхностях слизистых оболочек собак с AHDS.
- Эти бактерии были идентифицированы как Clostridium perfringens .
- В 2015 году новый преобразующий токсин под названием net F был обнаружен в изоляте C. perfringens от собаки, умершей от AHDS. Затем авторы обнаружили весьма значимую связь между наличием штаммов C. perfringens типа A, несущих ген этого токсина, и случаями AHDS у собак.
- Они также обнаружили аналогичную связь с аналогичным заболеванием у лошадей (некротический энтероколит жеребят).
Предрасполагающие факторы
Общие
- Неизвестно.Заболевание поражает ранее здоровых собак.
- Синдром чаще возникает в зимние месяцы.
Патофизиология
- Быстрая потеря жидкости и белка в желудочно-кишечном тракте.
- Быстрое развитие обезвоживания, коллапса, возможного острого повреждения почек. Почки: острое повреждение почек (ОПП) и ДВС.
Timecourse
- Может прогрессировать в течение нескольких часов.
Эпидемиология
Диагноз
Эта статья полностью доступна зарегистрированным подписчикам.
Зарегистрируйтесь сейчас, чтобы приобрести 30-дневную пробную версию, или
Логин
Лечение
Эта статья полностью доступна зарегистрированным подписчикам.
Зарегистрируйтесь сейчас, чтобы приобрести 30-дневную пробную версию, или
Логин
Профилактика
Эта статья полностью доступна зарегистрированным подписчикам.
Зарегистрируйтесь сейчас, чтобы приобрести 30-дневную пробную версию, или
Логин
Результаты
Эта статья полностью доступна зарегистрированным подписчикам.
Зарегистрируйтесь сейчас, чтобы приобрести 30-дневную пробную версию, или
Логин
Дополнительная литература
Публикации
Реферируемые статьи
- Последние ссылки из PubMed и VetMedResource.
- Mortier F, Strohmeyer K, Hartmann K, Unterer S (2015) Синдром острой геморрагической диареи у собак: 108 случаев. Vet Rec 176 (24), 627 PubMed.
- Busch K, Sucoldolski JS, Kuhner KA, Minamoto Y, Steiner JM, Mueller RS, Hartmann K, Unterer S (2015) Энтеротоксин Clostridium perfringens и токсин Clostridium difficile A / B не играют роли в развитии синдрома острой геморрагической диареи у собак . Vet Rec 176 (10), 253 PubMed.
- Гохари И. М., Паррейра В. Р., Новелл В. Дж., Николсон В. М., Олифант К., Прескотт Дж. Ф. (2015) Новый порообразующий токсин в Clostridium perfringens типа A связан как со смертельным геморрагическим гастроэнтеритом у собак, так и с фатальным некротическим энтерколитом жеребят. PLoS One 10 (4) PubMed.
- Unterer S, Lechner E, Mueller R S, Wolf G, Straubinger R K, Schulz B S, Hartmann K (2015) Проспективное исследование бактериемии при синдроме острой геморрагической диареи у собак. Vet Rec 176 (12), 309 PubMed.
- Маркс С. Л., Ранкин С. С., Брайн Б. А., Виз Дж. С. (2011) Энтеропатогенные бактерии у собак и кошек: диагностика, эпидемиология, лечение и контроль. JVIM 25 (6), 1195-1208 PubMed.
- Unterer S, Strohmeyer K, Kruse B.D, Sauter-Louis C, Hartmann K (2011) Лечение асептических собак с геморрагическим гастроэнтеритом амоксициллином / клавулановой кислотой: проспективное слепое исследование. JVIM 25 (5), 973-979 PubMed.
Другие источники информации
- Mortier F, Yoo T-E, Strohmeyer K, Hartmann K, Unterer S (2013) Синдром идиопатической острой геморрагической диареи у собак: 108 случаев. Abstract, Труды Конгресса ECVIM, Ливерпуль, Великобритания.
.
границ | Профили цитокинов в сыворотке крови, позволяющие дифференцировать геморрагическую лихорадку с почечным синдромом и хантавирусным легочным синдромом
Введение
Хантавирусы — это вирусы с отрицательной цепью РНК, переносимые грызунами, насекомоядными и летучими мышами. Эпидемиология хантавирусов отражает распределение их основных грызунов-хозяев (1) и может быть разделена на две группы в зависимости от клинических проявлений у человека: хантавирусный легочный синдром (HPS) и геморрагическая лихорадка с почечным синдромом (HFRS).ГФС эндемичен для Америки и диагностируется во многих странах, включая Аргентину и США (2, 3). Несколько хантавирусов, включая Andes и Sin Nombre, были связаны с HPS (1). Напротив, ГЛПС диагностируется исключительно в Европе и Азии (1, 4, 5). В Европе клинически различают легкую форму ГЛПС, также называемую эпидемией нефропатии (НЭ) (6, 7). ГЛПС / НЭ диагностируется во многих странах Европы, в том числе в западной части России, где к эндемически активным регионам относится республика Татарцан (8).Вирус Пуумала (PUUV) в первую очередь идентифицируется как возбудитель HFRS / NE в Татарстане (9).
Хантавирусы вызывают бессимптомную инфекцию у грызунов-хозяев, в то время как у человека заражение Andes, Sin Nombre и Puumala может привести к острой, а иногда и смертельной болезни. Считается, что люди заражаются инфекцией при вдыхании аэрозолей, зараженных вирусом (10). Как правило, люди могут заразиться только после прямого контакта с инфицированными грызунами или их экскрементами; тем не менее, были зарегистрированы случаи передачи вируса Анд от человека к человеку (11, 12).
Хантавирусный легочный синдром — острое тяжелое заболевание, характеризующееся пневмонией, сердечно-сосудистой недостаточностью и шоком (13). По мере ухудшения респираторных симптомов заболевание переходит в сердечно-легочную фазу, характеризующуюся респираторной недостаточностью. Через несколько часов у пациентов развивается гипотензия и развивается тахикардия, что может привести к сердечно-сосудистому шоку (13). Кроме того, у некоторых пациентов наблюдаются геморрагические проявления (14, 15). Фаза выздоровления может длиться месяцами, особенно у пациентов, которым требуется искусственная вентиляция легких.Было высказано предположение, что уровень смертности от HPS зависит от штамма хантавируса. Например, Фигейредо и др. сообщили, что штамм хантавируса Araraquara связан с более тяжелым проявлением HPS по сравнению со штаммом Juquitiba (15).
Клинически ГЛПС проявляется нарушениями свертываемости крови и дисфункцией почек (16–18). Позже появляются кровоизлияния, которые варьируются от небольших петехий до сильных внутренних кровотечений (16, 17). В некоторых тяжелых случаях может развиться синдром диссеминированного внутрисосудистого свертывания, который считается одной из основных причин смерти при ГЛПС (19).Патология почек присутствует во всех случаях, прогрессируя через несколько стадий дисфункции почек, включая олигурию, полиурию и выздоровление (18, 20).
Исследования in vitro и патологоанатомические наблюдения показали, что хантавирусы не являются цитопатическими (21–24). Следовательно, патогенез HPS и HFRS нельзя объяснить прямым повреждением тканей из-за вирусной репликации. Реакции организма на хантавирусную инфекцию, особенно контроль экспрессии воспалительных цитокинов, были предложены как ключевой фактор в патогенезе заболевания.Соответственно, повышенная инфильтрация ткани мононуклеарными лейкоцитами является отличительной чертой HPS и HFRS (23-25). Было высказано предположение, что лейкоцитарная инфильтрация, обнаруживаемая в посмертных тканях HPS и HFRS, может быть результатом повышенной экспрессии воспалительных цитокинов (24, 26). Кроме того, как для HPS, так и для HFRS были описаны высокие уровни воспалительных цитокинов в сыворотке крови (27–29). Кроме того, похоже, что тяжесть заболевания связана с экспрессией провоспалительных цитокинов у пациентов с хантавирусной инфекцией.Например, Saksida et al. продемонстрировали, что уровень провоспалительных цитокинов в сыворотке крови был выше у пациентов с HFRS, инфицированных вирусом Добрава, по сравнению с пациентами, инфицированными PUUV (30). Кроме того, в нашем предыдущем отчете указывается на потенциальную роль иммунного ответа Th2-типа в тяжести NE (28). Инфекция PUUV представляет собой более легкую форму заболевания и более низкий уровень смертности по сравнению с инфекциями вируса Добрава. Таким образом, можно предположить, что экспрессия воспалительных цитокинов может определять тяжесть клинических проявлений и потенциально влиять на уровень смертности (6, 31).
В настоящем исследовании наш анализ показал, что разные профили цитокинов связаны с HPS и HFRS. Профиль HPS предполагал серьезные воспалительные реакции по сравнению с профилем HFRS. Кроме того, наши данные демонстрируют, что для HPS характерно усиление иммунного ответа Th2-типа на ранних этапах инфицирования. Выраженная повышающая регуляция цитокинов, которые способствуют врожденному иммунному ответу, особенно функции естественных киллеров (NK), также наблюдалась в случаях HPS по сравнению с HFRS.Более того, активация смешанной популяции иммунных эффекторных клеток, включая мононуклеарные и сегментированные лейкоциты, прогнозируется в случаях HPS на основании цитокинового профиля. Наконец, наблюдаемые профили цитокинов сыворотки HPS и HFRS согласуются с патологией заболевания, характеризующейся повышенной пролиферацией мононуклеарных лейкоцитов, трансэндотелиальной миграцией и деградацией внеклеточного матрикса.
Материалы и методы
Субъекты
Один набор образцов состоял из сывороток, собранных в Аргентине во время вспышек HPS в провинциях Буэнос-Айрес, Санта-Фе, Энтре-Риос и Жужуй.Из 40 образцов сыворотки HPS у 30 субъектов (34 ± 3,5; 26 мужчин, 4 женщины) 7 отдельных образцов были взяты из смертельных случаев, 29 были взяты у выживших, и никакой информации о результатах исследования не было. другие 4. Из 29 образцов выживших образцы сыворотки крови у трех пациентов были собраны один раз на ранней стадии заболевания, а два набора образцов сыворотки были взяты у 13 пациентов, один раз на ранней стадии и один раз на поздней стадии. болезни.
Шестьдесят семь образцов сыворотки HFRS (38 ± 4,6; 52 мужчины, 15 женщин) были собраны у пациентов, поступивших в Республиканскую клиническую инфекционную больницу Республики Татарстан. Сыворотка у 33 пациентов с ГЛПС была собрана дважды (в раннем и в период выздоровления), в то время как один образец сыворотки был получен у одного пациента. Диагнозы HFRS и HPS были основаны на клинических проявлениях и были подтверждены серологически путем обнаружения антител к хантавирусу. В некоторых случаях диагноз подтверждался ПЦР.Образцы сыворотки крови 55 здоровых людей (37 ± 5,1; 32 мужчины, 13 женщин), соответствующих возрасту, полу и региону, были собраны и служили контролем. Образцы, собранные в Российской Федерации, были сделаны в соответствии с протоколом, утвержденным Экспертной комиссией Казанского федерального университета, и информированное согласие было получено от каждого соответствующего субъекта в соответствии с инструкциями, утвержденными в соответствии с этим протоколом (статья 20 Федерального закона «Об охране здоровья» Право граждан Российской Федерации »N323-ФЗ, 11.21.2011). Сбор образцов в Аргентине производился в соответствии с протоколом, утвержденным Советом по надзору за учреждениями Национального института энфермедадес Virales Humanas Argentina.
Мультиплексный анализ
Уровни цитокинов в сыворотке анализировали с использованием наборов для обнаружения антител на основе мультиплексных магнитных шариков, следуя инструкциям производителя (Bio-Rad, Hercules, CA, USA). Для исследования 48 индивидуальных аналитов использовали наборы для иммуноанализа Bio-Plex Pro Human Cytokine 27-plex и 21-plex.Для каждого субъекта 50 мкл сыворотки анализировали на анализаторе Luminex 200 (Luminex, Остин, Техас, США) с использованием контрольного программного обеспечения MasterPlex CT и программного обеспечения для анализа MasterPlex QT (MiraBio, Сан-Бруно, Калифорния, США). Средние интенсивности флуоресценции определяли с использованием минимум 50 шариков на аналит, а концентрации в сыворотке рассчитывали с использованием стандартных кривых для каждого аналита, полученных с помощью стандартов, поставляемых с набором Bio-Plex. Каждый образец сыворотки анализировали в двух экземплярах.
Сеть цитокинов и функциональный анализ
Программное обеспечение
для анализа пути изобретательности (IPA) и DAVID 6.7 пакетов программного обеспечения (32) использовались независимо для изучения обогащения молекулярных путей на основе цитокинов. Был использован список генов, кодирующих значительно измененные цитокины (с порогом ± 2-кратное среднее значение уровня цитокинов, значение P <0,05), и были идентифицированы пути, показывающие обогащение со значимостью P <0,05. и проанализированы. Обе платформы предоставили подтверждающие результаты и одни и те же значительно расширенные списки путей.
Анализ FANTOM5
Уровни сырых цитокинов, измеренные с помощью системы Bio-Plex, сначала были нормализованы относительно среднего уровня 48 цитокинов в каждом образце.Затем была проведена нормализация медианы по группам для двух отдельных групп, Аргентины (Анды) и Татарстана (HFRS). Для каждого цитокина / группы уровень данного цитокина был нормализован до среднего уровня по группе (включая как контроль, так и случаи). В группах Аргентины и Татарстана также были подгруппы, соответствующие сывороткам, взятым при поступлении в больницу, и сывороткам, взятым при выписке. Срединные кратные изменения сравнивали между случаями и контролем для каждой группы или подгруппы.Профили экспрессии цитокинов с повышенной регуляцией были исследованы вручную в наборах данных FANTOM5 (PMID: 24670764, PMID: 25678556), чтобы определить, какими первичными типами клеток они экспрессируются и индуцируются ли они патогенными стимулами.
Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения Statistica и XLSTAT (StatSoft, Талса, Оклахома-сити, США, и Addinsoft, Нью-Йорк, Нью-Йорк, США, соответственно). Статистический анализ был выполнен с использованием теста Стьюдента t для сравнения между отдельными экспериментальными группами.Данные представлены как среднее
Результаты
Образцы сыворотки
Хантавирусный легочный синдром и образцы сыворотки NE были собраны в разные моменты времени во время госпитализации. Из-за характера заболевания двухточечный сбор не всегда был возможен. Например, был взят только один образец сыворотки от каждого из семи смертельных случаев HPS. Большинство образцов HPS (12 образцов) из Аргентины были собраны при поступлении в больницу, в то время как небольшое количество образцов (семь образцов) было также взято перед выпиской.Сыворотки NE и HPS были получены в качестве избыточного клинического материала; поэтому не было доступных идентификаторов пациентов для сопоставления первого и второго образцов. Предоставленная информация ограничивалась диагностикой и штаммом вируса. Сыворотка HPS из Аргентины в основном была штаммом Lechiguanas, за исключением трех образцов, подтвержденных методом ПЦР как штамм Orán. Пробы ГЛПС были собраны в Республике Татарстан, районе, который определен как эндемичный по хантавирусу Пуумала (8). На основе этих данных мы разделили образцы сыворотки на инфекции Andes и PUUV.
Профиль цитокинов сыворотки
Корпуса HPS из Аргентины
Были собраны два набора образцов сыворотки HPS: на раннем этапе госпитализации (7,05 ± 0,98 дня) и в период выздоровления (42,2 ± 6,9 дня). Уровни 41 цитокина в сыворотке крови были повышены на ранней стадии заболевания (таблица 1). Большинство из этих цитокинов, в общей сложности 35, оставались активными на поздней стадии заболевания. Для большинства цитокинов сывороточная концентрация снизилась на поздней стадии, в то время как уровни некоторых цитокинов оставались повышенными (CXCL1, LIF, CXCL9, TNFβ) или еще больше повышались (CXCL10, CCL2, IL-1α, IL-2RA, IL- 3, IL-12p40, CCL27, CCL7, bNGF, SCF, TRAIL).При сравнении уровней сывороточных цитокинов на ранней и поздней стадиях единственные значительные различия обнаружены в концентрациях CXCL10 и MCSF. Интересно, что более высокие уровни CXCL10 и более низкие уровни MCSF были обнаружены в сыворотке на поздней стадии по сравнению с таковыми на ранних временных точках заболевания.
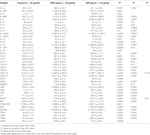
Таблица 1. Уровни цитокинов в сыворотке крови при раннем и позднем хантавирусном легочном синдроме (ГЛС) .
При поступлении в больницу было собрано
образцов сыворотки крови семи смертельных случаев HPS.Средняя дата взятия сыворотки у смертельных случаев составила 6,1 ± 1,18, что близко к дате сбора в ранней фазе нефатальных случаев (7,05 ± 0,98 дня). Таким образом, можно сравнить раннюю фазу нелетальных и летальных случаев (Таблица 2). Уровни 30 цитокинов в сыворотке были повышены в случаях фатального HPS. Хотя большинство этих цитокинов перекрываются с теми, которые имеют повышенную регуляцию в нефатальных случаях, в случаях летального исхода уровень цитокинов однозначно повышен. Например, уровень IL-2, IL-2RA, IL-4, IL-7, IL-17A, CCL4, CCL11, CCL27, bFGF, PDGF-BB, TNFα и VEGF (таблица 1) был повышен в нефатальных случаях. , в то время как уровень IL-6 был значительно повышен только в смертельных случаях по сравнению со здоровым контролем (таблица 2).При сравнении цитокинов, повышенных в смертельных и нефатальных случаях, были выявлены значительные различия в сывороточных уровнях IL-2RA, IL-18, CXCL1, HGF, MCSF, MIF, CXCL9 и SCF (Таблица 2).
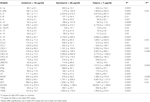
Таблица 2. Уровни цитокинов в сыворотке у выживших и смертельных случаев хантавирусного легочного синдрома (HPS) .
Кейсы HFRS из России
Сывороточные цитокины в случаях HFRS можно разделить на две группы: 22 цитокина имеют повышенную регуляцию, а 12 цитокинов пониженную (таблица 3).Шестнадцать цитокинов были значительно усилены на ранней стадии HFRS, а 11 цитокинов были значительно понижены по сравнению с контролем. На поздней стадии заболевания 18 цитокинов были повышены, а 12 — понижены. Те, у которых была снижена регуляция во время фазы выздоровления, отличались от тех, которые были на ранней стадии. Например, по сравнению с контролем уровень CCL5 значительно изменился только на поздней стадии заболевания, в то время как сывороточный уровень bFGF был значительно снижен только на ранней стадии заболевания.Когда сравнивали повышенную регуляцию цитокинов, девять цитокинов (IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-7, IL-12p75, IFNγ и TNFα) значительно различались между ранней и поздней стадиями. болезни. Интересно, что средние сывороточные концентрации этих цитокинов были выше на поздней стадии по сравнению с ранней стадией заболевания.

Таблица 3. Уровни цитокинов в сыворотке крови при ранней и поздней геморрагической лихорадке с почечным синдромом (HFRS) .
HFRS против HPS цитокиновый профиль
В то время как сывороточные уровни 12 цитокинов были ниже при раннем HFRS по сравнению с контролем, не наблюдалось подавления цитокинов в случаях HPS (таблицы 1 и 3, соответственно).Все 12 цитокинов с пониженной регуляцией на ранней стадии HFRS были активированы в случаях HPS.
Двадцать два цитокина были активированы в сыворотке пациентов с ранней стадией HFRS, в то время как 41 цитокин был активирован в ранних случаях HPS (таблицы 1 и 3, соответственно). Более того, только 14 цитокинов были активированы как в случаях HFRS, так и в случаях HPS на ранней стадии (IL-1RA, IL-2, IL-4, IL-7, IL-12p40, IL-12p75, IL-13, IL-16, CXCL9, CXCL10, CXCL12, MIF, SCGFb и VEGF). По мере прогрессирования заболевания в случаях HFRS повышалась регуляция 17 цитокинов, тогда как в случаях HPS повышалась регуляция гораздо большей группы цитокинов, всего 35 (таблицы 1 и 3, соответственно).Среди этих цитокинов 13 (IL-3, IL-4, IL-7, IL-12p40, IL-13, IL-16, CCL4, CXCL10, CXCL12, GMCSF, IFNγ, MIF и SCGFb) имели повышенную регуляцию в конце стадии HFRS и HPS. Следует отметить, что профили перекрывающихся цитокинов различались на поздних стадиях ГЛПС и ГФС по сравнению с таковыми на ранних стадиях заболевания. Только семь цитокинов (IL-13, CXCL10, IL-12p40, IL-16, MIF, SCGFb и CXCL12) были активированы на ранних и поздних стадиях HFRS и HPS, в то время как уровни IL-12p75 и CXCL9 оставались повышенными только на поздних стадиях. образцы ГНС.
Анализ FANTOM5
Анализ
FANTOM5 выявил CXCL12 как наиболее активный цитокин в сыворотке пациентов с HPS. CXCL12 индуцируется в ответ на сильные провоспалительные стимулы, такие как TNFα и IL-1 (33). CXCL12 продуцируется множеством клеток, включая эндотелиальные клетки, гладкомышечные клетки и макрофаги; однако тромбоциты также являются основным источником этого цитокина в кровотоке (34–38). Было показано, что CXCL12 увеличивает ангиогенез за счет связывания с гепарансульфатными протеогликанами на эндотелиальных клетках (33).Следовательно, можно предположить, что случаи HPS характеризуются повышенным ангиогенезом, возможно, из-за повреждения эндотелия.
Геморрагическая лихорадка с почечным синдромом характеризовалась сильной экспрессией MIF, IL-12p40, IL-3, IL-16, CXCL9, CCL27, CXCL1 и HGF. Напротив, повышающая регуляция MIF, IL-12p40, IL-3 и IL-16 была умеренной при HPS, в то время как активация экспрессии CXCL12 была характерной особенностью HPS. Это наблюдение предполагает, что реакция на хантавирусную инфекцию, вызванная штаммом вируса, вносит свой вклад в профиль.Сильная повышающая регуляция IL-12p40, CXCL9, IL-16 и CCL27, в основном продуцируемых активированными мононуклеарными лейкоцитами, включая лимфоциты, моноциты и дендритные клетки, указывает на роль мононуклеарных лейкоцитов в патогенезе HFRS.
IPA Анализ профиля цитокинов сыворотки при HFRS и HPS
Дифференциально выраженные уровни цитокинов в сыворотке для случаев HFRS и HPS, а также для смертельных и нефатальных случаев HPS были дополнительно исследованы с помощью анализа функциональных путей с использованием двух независимых механизмов анализа обогащения путей.Сначала сравнивали профили цитокинов HFRS и HPS в ранних образцах. Наиболее важные канонические пути, измененные на ранней фазе HFRS, включают передачу сигналов хемокинов при взаимодействии цитокинов и рецепторов цитокинов, передачу сигналов MAPK и пути передачи сигналов нейротропина. Для раннего HPS было изменено большее количество путей, включая взаимодействие цитокин-цитокиновый рецептор, RIG-I-подобную передачу сигналов, передачу сигналов хемокинов, передачу сигналов STAT, цитозольную ДНК-чувствительность, регуляцию аутофагии, передачу сигналов TOLL-подобных рецепторов и NOD-подобных рецепторные сигнальные пути.Кроме того, пути, регулирующие процессинг и презентацию антигена, а также цитотоксичность, опосредованная NK-клетками, были идентифицированы как важные в случаях HPS на ранней стадии.
Анализ сывороточного цитокинового профиля образцов из поздней фазы HFRS не выявил значительно измененных путей по сравнению со здоровым контролем. Анализ образцов сыворотки из поздней фазы HPS выявил меньшее количество путей по сравнению с таковым во время ранней фазы заболевания и включал передачу сигналов NOD-подобного рецептора, взаимодействие цитокин-цитокиновый рецептор и передачу сигналов RIG-I-подобного рецептора.При сравнении летальных и нефатальных случаев ГФС, взаимодействие цитокин-цитокиновый рецептор и сигнальные пути JAK-STAT имели значительные различия. Профили цитокинов в сыворотке позволяют предположить, что сигнальный путь JAK-STAT подавлен в летальных случаях по сравнению с нефатальными случаями HPS.
Обсуждение
Геморрагическая лихорадка с почечным синдромом и ГЛС — острые инфекционные заболевания, вызываемые особой группой хантавирусов, циркулирующих среди мелких грызунов. В Татарстане HFRS ассоциирован с инфицированием хантавирусами, передаваемыми Arvicolinae, а HPS — заболеванием, вызываемым хантавирусами, ассоциированными с Sigmodontinae (39).Хотя клинически HPS и HFRS могут частично совпадать (40–42), пневмония и сердечно-сосудистая недостаточность являются центральными для HPS, в то время как поражение почек и нарушение регуляции свертывания крови являются основными последствиями HFRS. Уровни смертности также различаются, причем HPS имеет более высокий уровень смертности, чем HFRS, 39,3 против 0,4, соответственно (6, 43). Хотя существуют различные клинические проявления, связанные с хантавирусами, рожденными Sigmadontinae и Arvicolinae, эти вирусы не являются цитопатическими in vitro (21, 22).Кроме того, не сообщалось о гибели клеток, связанных с репликацией вируса, в тканях, собранных посмертно из случаев HFRS и HPS (23, 24), что позволяет предположить, что ответ на инфекцию играет важную роль в патогенезе этих заболеваний. Различия в экспрессии цитокинов в сыворотке крови являются одним из наиболее последовательных результатов при HPS и HFRS. Многие исследования документально подтвердили значительную активацию провоспалительных цитокинов, что привело к гипотезе «цитокинового шторма», объясняющей патогенез заболеваний, вызванных хантавирусом.
Наши данные подтверждают роль цитокинов в патогенезе HPS и HFRS. Разительные различия в профилях цитокинов были обнаружены между образцами HPS и HFRS. ГФС, более тяжелая форма хантавирусного зооноза, характеризуется повышенной регуляцией уровня цитокинов в сыворотке без их подавления (таблицы 1 и 3). Напротив, случаи HFRS характеризовались дихотомией в профиле цитокинов сыворотки (таблица 3), причем цитокины были как повышенными, так и пониженными.Кроме того, мы наблюдали большее количество цитокинов, активируемых при HPS, по сравнению с HFRS, 41 против 22, соответственно. Эти данные позволяют предположить, что серьезность заболевания может быть связана с «цитокиновым штормом» как реакцией организма на инфекцию.
Наши данные подтверждают предыдущие наблюдения, что хемокины, способствующие миграции мононуклеарных лейкоцитов, активируются у пациентов, инфицированных хантавирусом (28). В этом исследовании повышающая регуляция CXCL9 и CXCL10 была характерна как для HPS, так и для HFRS на протяжении всего заболевания.Здесь мы расширяем знания об экспрессии хемокинов в HPS и HFRS. Например, повышенный уровень сывороточного IL-16, хемоаттрактанта, действующего на активированные Т-лимфоциты, был обнаружен как при HPS, так и при HFRS (44). Кроме того, мы показали, что CXCL12, мощный хемоаттрактант для мононуклеарных лейкоцитов, активируется у пациентов с хантавирусной инфекцией (45, 46). Кроме того, были выявлены хемокины с уникальной активацией в случаях HPS, включая CCL2, CXCL1 и CCL7. Известно, что эти цитокины способствуют миграции в ткани моноцитов, Т-клеток памяти и дендритных клеток (47, 48).
CXCL1, хемоаттрактант нейтрофилов, продуцируемый активированными макрофагами и эпителиальными клетками (49, 50), был активирован в случаях HPS, но подавлен в образцах HFRS. Это предполагает, что, хотя инфильтрация лейкоцитарной ткани характерна как для HPS, так и для HFRS, в случаях HPS существует смешанный фенотип мигрирующих иммунных эффекторных клеток, включая нейтрофилы и мононуклеарные лейкоциты. Поскольку миграция нейтрофилов часто связана с повреждением тканей и утечкой сосудов, роль миграции нейтрофилов в патогенезе HPS требует дальнейшего изучения.
Ранняя активация лейкоцитов очевидна в сыворотке пациентов с HPS и отличается от HFRS. Например, IL-15 активируется только в HPS, что предполагает активацию и пролиферацию Т-клеток и NK-клеток. IL-15 действует через киназу JAK, STAT3, STAT5 и STAT6, что подтверждается анализом IPA. Кроме того, активация GCSF была обнаружена только в случаях HPS, как на ранних, так и на поздних стадиях заболевания, что свидетельствует об устойчивой пролиферации, дифференцировке и выживании моноцитов и макрофагов при HPS.Повышенные сывороточные уровни IL-3, SCGFb и SCF при HPS указывают на повышенную пролиферацию клеток-предшественников костного мозга, а повышенная регуляция M-CSF и GM-CSF дополнительно предполагает, что пролиферация миелоидных предшественников увеличивается при HPS. Также следует отметить, что уровни IFN-γ оставались устойчиво повышенными в случаях HPS на протяжении всего заболевания, тогда как уровни IFN-γ повышались во время поздней фазы HFRS, что согласуется с нашими предыдущими наблюдениями (28). IFN-γ связан с активацией иммунных ответов Th2-типа и продуцируется активированными Т-хелперами, цитотоксическими Т-лимфоцитами (CTL) и NK-клетками.
Наши данные о том, что уровень IL-18 повышается в сыворотке пациентов с HPS, но снижается в сыворотке по сравнению с пациентами с HFRS, дополнительно подтверждают активацию Th2. IL-18 является сильным активатором иммунитета Th2-типа и сам по себе или вместе с IL-12 усиливает продукцию IFNγ Т-клетками и NK-клетками (51). Эти данные свидетельствуют о том, что ранняя активация NK-клеток и CTL характерна для HPS, но менее выражена для HFRS. Чрезмерная активация NK-клеток и CTL может вызывать повреждение тканей, что, как было показано, играет роль в патогенезе повреждения органов (52, 53).Недавно Прескотт и др. предположили, что адаптивный иммунный ответ не влияет на репликацию хантавируса или патогенез заболевания, основываясь на исследованиях с использованием модели HPS на хомяке (54). Однако клинические исследования указывают на потенциальную роль врожденных и адаптивных иммунных ответов в патогенезе болезней (55–58). Наши данные подтверждают роль адаптивных иммунных ответов в патогенезе хантавирусной инфекции. Также можно предположить, что ранняя сильная активация иммунного ответа Th2-типа может быть связана с тяжелыми клиническими проявлениями.
Сильный воспалительный ответ очевиден на основании профилей цитокинов сыворотки для HFRS и HPS. Например, повышенная регуляция провоспалительных цитокинов, таких как IL-1β, IL-6, TNFα и MIF, была обнаружена в случаях HFRS и HPS. Хотя повышение уровня IL-1β, IL-6 и TNFα в случаях хантавируса хорошо задокументировано, повышение уровня сывороточного MIF не было описано ранее ни для случаев HPS, ни для случаев HFRS. MIF представляет собой многофакторный цитокин с сильной провоспалительной активностью, что предполагает роль MIF в повышении проницаемости сосудов и миграции иммунных эффекторных клеток в ткани.Более того, повышенные уровни VEGF в сыворотке при HFRS и HPS также предполагают, что этой провоспалительной активности может способствовать индуцированная MIF повышающая регуляция металлопротеаз, приводящая к деградации внеклеточного матрикса (59–61). Кроме того, MIF может облегчить трансэндотелиальную миграцию лейкоцитов за счет активации адгезионных молекул VCAM-1 и ICAM-1 на эндотелиальных клетках и моноцитах (62, 63). Хотя HFRS и HPS характеризуются повышенным провоспалительным профилем сыворотки, как описано выше, повышающая регуляция IL-18 была уникальной для HPS.IL-18 был классифицирован как цитокин, вызывающий тяжелые воспалительные реакции (64–66). Таким образом, мы предполагаем, что клиническая картина HPS может быть частично связана с высокими уровнями IL-18 в сыворотке крови. Было продемонстрировано, что активация IL-18 регулируется посредством пути, регулируемого NOD-подобными рецепторами (67, 68). Анализ профилей цитокинов сыворотки с помощью IPA выявил участие NOD-подобного пути только в случаях HPS, что дополнительно указывает на роль этого пути в патогенезе HPS.
Наш анализ профилей цитокинов в сыворотке при HPS и HFRS показывает, что, хотя HPS и HFRS имеют много общих черт, существуют различные профили цитокинов, дифференцирующие эти заболевания.Они включают (1) тяжелую воспалительную реакцию в случаях HPS, где IL-18 может играть центральную роль, (2) надежную и раннюю активацию иммунного ответа Th2-типа в случаях HPS по сравнению с HFRS и (3) сильная активация врожденного иммунного ответа, особенно NK-клеток в случаях HPS. Профили цитокинов указывают на деградацию внеклеточного матрикса, усиление пролиферации мононуклеарных лейкоцитов и трансэндотелиальную миграцию как при HPS, так и при HFRS.
Заявление об этике
Пробы, отобранные в Российской Федерации, были сделаны в соответствии с протоколом, утвержденным Контрольным советом Казанского федерального университета, и информированное согласие было получено от каждого соответствующего субъекта в соответствии с инструкциями, утвержденными в соответствии с этим протоколом (статья 20 Федерального закона «О защите Право на здоровье граждан Российской Федерации »N323-ФЗ, 11.21.2011). Сбор образцов в Аргентине производился в соответствии с протоколом, утвержденным Советом по надзору за учреждениями Национального института энфермедадес Virales Humanas Argentina.
Авторские взносы
SK: сбор данных, анализ данных и написание рукописи. SL: Подготовка образца сыворотки HPS, сайт в Аргентине. SM: Подготовка образца сыворотки HPS, сайт США. ЕМ: Подготовка и сбор данных образцов HFRS, Россия. VA: анализ клинических данных и вклад в обсуждение.О.Г .: Анализ IPA и вклад в обсуждение. SJ: редактор рукописи и координатор исследовательской группы. ВЛ: редактирование рукописи и участие в обсуждении. AR: управление проектами и координация между сайтами Аргентины, США, России и Японии и интеллектуальный вклад в обсуждение.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Редакционный редактор объявил о совместной принадлежности, но не о каком-либо другом сотрудничестве, с одним из авторов (VA) и заявил, что процесс, тем не менее, соответствовал стандартам справедливой и объективной проверки.
Финансирование
Работа поддержана грантом Российского научного фонда 15-14-00016. Работа выполняется в соответствии с Государственной программой повышения конкурентоспособности Казанского федерального университета и субсидией, выделенной Казанскому федеральному университету для государственного задания в сфере научной деятельности.Некоторые эксперименты проводились при поддержке Федерального центра коллективного пользования и Фармацевтического научно-образовательного центра Казанского (Приволжского) федерального университета, Казань, Россия. Мы благодарим доктора Алистера Р. Форреста за помощь в анализе данных.
Список литературы
1. Йонссон С.Б., Фигейредо Л.Т., Вапалахти О. Глобальный взгляд на экологию, эпидемиологию и болезни хантавирусов. Clin Microbiol Rev (2010) 23 (2): 412–41. DOI: 10.1128 / CMR.00062-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Тапперо Дж. У., Хан А. С., Пиннер Р. У., Венгер Дж. Д., Грабер Дж. М., Армстронг Л. Р. и др. Полезность экстренного общенационального телефонного надзора за хантавирусным легочным синдромом. Целевая группа по хантавирусу. JAMA (1996) 275 (5): 398–400. DOI: 10.1001 / jama.275.5.398
CrossRef Полный текст | Google Scholar
3. Кальдерон Дж., Пини Н., Болпе Дж., Левис С., Миллс Дж., Сегура Е. и др. Резервуары-хозяева хантавируса связаны с перидоместическими средами обитания в Аргентине. Emerg Infect Dis (1999) 5 (6): 792–7.DOI: 10.3201 / eid0506.990608
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Хейман П., Вахери А., Члены ENIVD. Ситуация с хантавирусными инфекциями и геморрагической лихорадкой с почечным синдромом в европейских странах по состоянию на декабрь 2006 г. Euro Surveill (2008) 13 (28): 18925.
PubMed Аннотация | Google Scholar
5. Ткаченко Е.А., Бернштейн А.Д., Дзагурова Т.К., Морозов В.Г., Слонова Р.А., Иванов Л.И. и др. Актуальные проблемы геморрагической лихорадки с почечным синдромом. Ж. Микробиол Эпидемиол Иммунобиол (2013) 1: 51–8.
PubMed Аннотация | Google Scholar
6. Hjertqvist M, Klein SL, Ahlm C, Klingstrom J. Характер смертности от геморрагической лихорадки с почечным синдромом, вызванным вирусом Пуумала. Emerg Infect Dis (2010) 16 (10): 1584–6. DOI: 10.3201 / eid1610.100242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Макари П., Канерва М., Оллгрен Дж., Виртанен М.Дж., Вапалахти О., Люйтикяйнен О.Бремя инфекций вируса Пуумала, 1995-2008 гг. Epidemiol Infect (2010) 138 (10): 1484–92. DOI: 10.1017 / S0950268810000087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Гаранина С.Б., Платонов А.Е., Журавлев В.И., Мурашкина А.Н., Якименко В.В., Корнеев А.Г. и др. Генетическое разнообразие и географическое распространение хантавирусов в России. Зоонозы общественного здравоохранения (2009) 56 (6–7): 297–309. DOI: 10.1111 / j.1863-2378.2008.01210.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Кабвэн Э., Давидюк С.Ю., Морзунов П, Шакирова В.Г., АнохинГ А, Исаева Р.С. и др. Генетическая характеристика малосегментного генома штамма вируса Пуумала Казань. BioNanoScience (2016). DOI: 10.1007 / s12668-016-0338-2
CrossRef Полный текст | Google Scholar
11. Мартинес-Вальдебенито С., Кальво М., Флакон С, Мансилла Р., Марко С., Пальма Р. Э. и др. Передача хантавируса Анд от человека к человеку и внутрибольничная передача, Южный Чили, 2011. Emerg Infect Dis (2014) 20 (10): 1629–36.DOI: 10.3201 / eid2010.140353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Падула П.Дж., Эдельштейн А., Мигель С.Д., Лопес Н.М., Росси С.М., Рабинович Р.Д. [Эпидемическая вспышка хантавирусного легочного синдрома в Аргентине. Молекулярные доказательства передачи вируса Анд от человека человеку. Medicina (B Aires) (1998) 58 (Suppl 1): 27–36.
Google Scholar
15. Фигейредо ЛТМ, Морели М.Л., де-Соуза РЛМ, Борхес А.А., де-Фигейредо Г.Г., Мачадо А.М. и др.Хантавирусный легочный синдром, Центральное плато, юго-восток и юг Бразилии. Emerg Infect Dis (2009) 15 (4): 561–7. DOI: 10.3201 / eid1504.080289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Сеттергрен Б., Лещинская Е., Загидуллин И., Фазлыева Р., Хунафина Д., Никлассон Б. Геморрагическая лихорадка с почечным синдромом: сравнение клинического течения в Швеции и на западе Советского Союза. Scand J Infect Dis (1991) 23 (5): 549–52. DOI: 10.3109/00365549109105176
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Пеко-Антич А., Попович-Ролович М., Глигич А., Попович Д., Йованович О., Костич М. Клинические характеристики геморрагической лихорадки с почечным синдромом у детей. Pediatr Nephrol (1992) 6 (4): 335–8. DOI: 10.1007 / BF00869727
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Брен А.Ф., Павловчич С.К., Косель М., Ковач Дж., Кандус А., Кведер Р. Острая почечная недостаточность из-за геморрагической лихорадки с почечным синдромом. Ren Fail (1996) 18 (4): 635–8. DOI: 10.3109 / 08860229609047688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Мякеля С., Ала-Хоухала И., Мустонен Дж., Койвисто А.М., Кури Т., Турьянмаа В. и др. Функция почек и артериальное давление через пять лет после нефропатии, вызванной вирусом Пуумала. Kidney Int (2000) 58 (4): 1711–8. DOI: 10.1046 / j.1523-1755.2000.00332.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Хайбуллина С.Ф., Нетски Д.М., Крумпе П., Сент-Джор, Южная Каролина.Влияние фактора некроза опухоли альфа на инфицирование вирусом синонима in vitro. J Virol (2000) 74 (24): 11966–71. DOI: 10.1128 / JVI.74.24.11966-11971.2000
PubMed Аннотация | CrossRef Полный текст |
.
