Гепатит с при беременности — современные подходы к скринингу, лечению и профилактике осложнений – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
Статья поступила в редакцию 2.07.2019 г.
Мозес К.Б., Мозес В.Г., Захаров И.С., Елгина С.И., Рудаева Е.В.
Кемеровский государственный медицинский университет,
г. Кемерово, Россия
ГЕПАТИТ С ПРИ БЕРЕМЕННОСТИ -СОВРЕМЕННЫЕ ПОДХОДЫ К СКРИНИНГУ, ЛЕЧЕНИЮ И ПРОФИЛАКТИКЕ ОСЛОЖНЕНИЙ
Цель исследования — провести аналитический обзор современных источников научной литературы, освещающих вопросы скрининга, лечения и профилактики осложнений у беременных с гепатитом С.
Материалы и методы. Проведен анализ 56 отечественных и зарубежных источников литературы по данной теме. Результаты. По результатам анализа научных данных обновлено представление о распространенности гепатита С при беременности в Российской Федерации и в мире. В обзоре описаны возможные осложнения беременности и родов, ассоциированные с гепатитом С, проведена оценка риска вертикальной передачи инфекции, освещены вопросы эффективности скрининга данного заболевания и тактика ведения беременности у инфицированных женщин. Заключение. Высокая распространенность гепатита С при беременности делает его актуальной проблемой. Проведенный анализ свидетельствует, что оперативное родоразрешение беременных с гепатитом С не снижает риск вертикальной передачи инфекции, и поэтому не может быть рекомендовано, тогда как запрет ранней амниотомии, профилактика длительного безводного промежутка, снижение частоты использования инвазивного фетального мониторинга и эпизиотомии являются эффективными способами профилактики инфицирования плода и новорожденного. Современная противовирусная терапия препаратами прямого противовирусного действия совершила революцию в лечении гепатита С, однако препараты, позволяющие лечить заболевание во время беременности, находятся в стадии разработки и клинических исследований.
Современная противовирусная терапия препаратами прямого противовирусного действия совершила революцию в лечении гепатита С, однако препараты, позволяющие лечить заболевание во время беременности, находятся в стадии разработки и клинических исследований.
КЛЮЧЕВЫЕ СЛОВА: Вирус гепатита С; гепатит С; беременность; роды; послеродовый период.
Mozes K.B., Mozes V.G., Zaharov I.S., Elgina S.I., Rudaeva E.V.
Kemerovo State Medical University, Kemerovo, Russia
HEPATITIS C IN PREGNANCY — MODERN APPROACHES TO SCREENING,
TREATMENT AND PREVENTION OF COMPLICATIONS
The aim of the research — to carry out an analytical review of modern sources of scientific literature covering the issues of screening, treatment and prevention of complications in pregnant women with hepatitis C. Materials and methods. The analysis of 56 domestic and foreign sources of literature on this topic.
Results. According to the scientific analysis, new data on the prevalence of hepatitis C in pregnancy in the Russian Federation and in the world have been obtained. The review describes possible complications of pregnancy and childbirth associated with hepatitis C, assessed the risk of vertical transmission of infection, highlighted the effectiveness of screening this disease and the tactics of managing pregnancy in infected women.
Conclusion. The high prevalence of hepatitis C in pregnancy makes it an urgent problem. The analysis shows that prompt delivery of pregnant women with hepatitis C does not reduce the risk of vertical transmission, and therefore cannot be recommended, while prohibiting early amniotomy, preventing a prolonged anhydrous period, reducing the frequency of invasive fetal monitoring and episiotomy are effective ways to prevent fetal infection and newborn. Modern antiviral therapy with direct antiviral drugs has revolutionized the treatment of hepatitis C, but drugs that allow to cure the disease during pregnancy are under development and clinical studies.
Modern antiviral therapy with direct antiviral drugs has revolutionized the treatment of hepatitis C, but drugs that allow to cure the disease during pregnancy are under development and clinical studies.
Key words: Hepatitis C virus; hepatitis C; pregnancy; childbirth; the postpartum period.
Гепатит С является ведущей причиной хронической патологии печени. Повреждение печени при этом инфекционном заболевании может варьироваться в широком диапазоне, от минимальных гистологических изменений до распространенного фиброза и цирроза печени с развитием гепато-целлюлярной карциномы печени [1].
Считается, что основным путем передачи вируса гепатита С (ВГС) является черезкожный путь у лиц, использующих зараженные иглы при употреб-
Корреспонденцию адресовать:
МОЗЕС Вадим Гельевич,
650029, г. Кемерово, ул. Ворошилова, д. 22а,
ФГБОУ ВО КемГМУ Минздрава России.
Тел.: 8 (3842) 73-46-00.
E-mail: [email protected]
лении инъекционных наркотиков. Другие пути встречаются реже и включают в себя вертикальный путь от матери к ребенку, нарушение условий при переливании крови, использование недостаточно обработанных инструментов в медицинской практике, при нанесении татуировок, пирсинга и маникюра, совместное использование устройств для неинъекционного употребления наркотиков, и, крайне редко, половой путь [2].
ВГС протекает в виде острой или хронической инфекции. Острая инфекция ВГС в 75 % случаев протекает без симптомов и очень редко ассоциируется с угрожающим жизни состоянием [3]. Без терапии у 15-45 % больных в течение 6 месяцев происходит спонтанное выздоровление, а у остальных заболевание переходит в хроническую форму, при которой ВГС персистирует у человека до конца его
Без терапии у 15-45 % больных в течение 6 месяцев происходит спонтанное выздоровление, а у остальных заболевание переходит в хроническую форму, при которой ВГС персистирует у человека до конца его
ГЕПАТИТ С ПРИ БЕРЕМЕННОСТИ — СОВРЕМЕННЫЕ ПОДХОДЫ К СКРИНИНГУ, ЛЕЧЕНИЮ И ПРОФИЛАКТИКЕ ОСЛОЖНЕНИЙ
жизни, вызывая прогрессирующее повреждение печени с серьезными последствиями для здоровья. Без лечения у 15-30 % пациентов с хронической инфекцией ВГС в течение 20 лет развивается цирроз, в свою очередь у 27 % больных циррозом печени в течение 10 лет развивается гепатоцеллюлярная карцинома [4, 5].
На сегодняшний день в мире насчитывается 71 миллион людей с ВГС, причем многие из них не знают о том, что инфицированы [6]. Официальной статистики по распространенности гепатита С в Российской Федерации нет [7], однако, по мнению Европейской ассоциации по изучению печени (БДБЬ), уровень распространенности заболевания в нашей стране неуклонно растет — с 2,6 % в 2007 году, до 3,3 % в 2017 году, что в масштабах населения страны может быть оценено как 4,8 млн. человек [8]. Таким образом, около 6 % из всего числа лиц инфицированных ВГС в мире, проживают в Российской Федерации.
Популяционные показатели распространенности гепатита С у беременных женщин ни в одной из стран мира точно не установлены, однако, по мнению большинства исследователей, они могут находиться в диапазоне от 8% до 15% [9, 10]. При ведении беременных женщин, инфицированных ВГС, перед врачом встают три основных вопроса: как беременность влияет на течение персистирующей инфекции, как предупредить передачу вируса от матери плоду и как влияет носительство ВГС матери на исход беременности и родов [11].
Накопленный опыт показывает, что у женщин с хронической инфекцией ВГС беременность чаще всего протекает без осложнений, более того, нередко беременность уменьшает ВГС-опосредованное повреждение печени [12]. Этот вывод сделан на основании исследований, показавших, что у беременных с ВГС уровень АЛТ в сыворотке крови, начиная со второго триместра, начинает снижаться, возвращаясь к исходному уровню после родов [13, 14]. Так, например, в исследовании, изучавшем 266 беременных женщин, инфицированных ВГС, повышение АЛТ в первом триместре выявлялось у 56 % женщин, тогда как в третьем триместре лишь у 7 %, однако после родов повышенное АЛТ было зафиксировано у 55 % женщин [15, 16].
Этот вывод сделан на основании исследований, показавших, что у беременных с ВГС уровень АЛТ в сыворотке крови, начиная со второго триместра, начинает снижаться, возвращаясь к исходному уровню после родов [13, 14]. Так, например, в исследовании, изучавшем 266 беременных женщин, инфицированных ВГС, повышение АЛТ в первом триместре выявлялось у 56 % женщин, тогда как в третьем триместре лишь у 7 %, однако после родов повышенное АЛТ было зафиксировано у 55 % женщин [15, 16].
С другой стороны, в отношении уровня РНК ВГС у инфицированных беременных получены противоречивые данные. В некоторых публикациях такая тенденция не выявлена, тогда как в других исследова-
ниях показана корреляция между сроком беременности и увеличением уровня РНК ВГС [17, 18]. Тем не менее, выявленное сочетание снижения АЛТ с ростом РНК ВГС во время беременности позволило предположить, что этот феномен обусловлен гес-тационной иммуносупрессией матери, а поскольку гепатоцеллюлярное повреждение, вызванное хронической инфекцией ВГС, обусловлено не иммунной, а вирусной цитотоксичностью, беременность может снижать степень этого осложнения [19]. Исследования, основанные на гистологическом исследовании печени у больных с ВГС, также подтверждают феномен снижения гепатоцеллюлярного повреждения во время беременности, который выражался в уменьшении прогрессирования фиброза [20]. Лишь в одном исследовании был продемонстрирован негативный результат — худшие показатели фиброза при сравнении биопсии печени до и после беременности у 12 женщин, инфицированных ВГС, и у 12 сопоставимых пациенток, инфицированных ВГС, у которых между биопсиями беременность отсутствовала [17].
Тем не менее, несмотря на то, что беременность уменьшает гепатоцеллюлярное повреждение при хронической инфекции ВГС, имеются данные, показывающие, что заболевание ассоциировано с неблагоприятными исходами беременности и родов [21]. В последнем крупном метаанализе 7 исследований, оценивающих исходы беременности и родов у женщин с ВГС, было показано, что наличие инфекции у матери было связано с недостаточным ростом плода (ОШ = 1,53; 95% ДИ 1,40-1,68) и его низким весом при рождении (ОШ = 1,97; 95% ДИ 1,43-2,71) [22]. В нескольких когортных исследованиях у женщин с ВГС была продемострирована более высокая частота гестационного сахарного диабета, а у их детей чаще выявлялись такие неблагоприятные исходы родов, как кефалогематома, дистоция, повреждение плечевого сплетения, необходимость в вентиляции легких, ВЖК [23]. Тем не менее, остается не ясным, связаны ли эти осложнения с ВГС или они обусловлены диабетической фетопатией [24].
В последнем крупном метаанализе 7 исследований, оценивающих исходы беременности и родов у женщин с ВГС, было показано, что наличие инфекции у матери было связано с недостаточным ростом плода (ОШ = 1,53; 95% ДИ 1,40-1,68) и его низким весом при рождении (ОШ = 1,97; 95% ДИ 1,43-2,71) [22]. В нескольких когортных исследованиях у женщин с ВГС была продемострирована более высокая частота гестационного сахарного диабета, а у их детей чаще выявлялись такие неблагоприятные исходы родов, как кефалогематома, дистоция, повреждение плечевого сплетения, необходимость в вентиляции легких, ВЖК [23]. Тем не менее, остается не ясным, связаны ли эти осложнения с ВГС или они обусловлены диабетической фетопатией [24].
ВГС во время беременности может повышать риск развития внутрипеченочного холестаза, который, по современным представлениям, ассоциирован с высоким риском смерти плода. По данным разных авторов, частота внутрипеченочного холестаза при беременности составляет от 0,2 до 2,5 %, в то время как у женщин с ВГС риск развития этого осложнения возрастает в 20 раз [25].
Сведения об авторах:
МОЗЕС Кира Борисовна, ассистент, кафедра поликлинической терапии и сестринского дела, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия. E-mail: [email protected]
МОЗЕС Вадим Гельевич, доктор мед. наук, профессор кафедры акушерства и гинекологии им. Г.А. Ушаковой, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия. E-mail: [email protected]
ЗАХАРОВ Игорь Сергеевич, доктор мед. наук, профессор кафедры акушерства и гинекологии им. Г.А. Ушаковой, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия. E-mail: [email protected]
ЕЛГИНА Светлана Ивановна, доктор мед. наук, профессор кафедры акушерства и гинекологии им. аше1 в 2017 году было установлено, что передача ВГС происходит преимущественно во втором триместре в промежутке между 24,9 и 36,1 неделями беременности [28]. Этим автор объясняет неэффективность кесарева сечения в качестве меры профилактики инфицирования плода.
аше1 в 2017 году было установлено, что передача ВГС происходит преимущественно во втором триместре в промежутке между 24,9 и 36,1 неделями беременности [28]. Этим автор объясняет неэффективность кесарева сечения в качестве меры профилактики инфицирования плода.
В отношении биологических механизмов внутриутробного инфицирования ВГС существует несколько гипотез: прямое инфицирование трофобласта, которое подтверждается исследованиями последних лет; трансцитоз ВГС клетками трофобласта без инфицирования; инфицирование эндотелиальных клеток плаценты и пуповины [29, 30].
Наличие у матери сочетания ВГС с ВИЧ значительно увеличивает вероятность вертикальной передачи инфекции [31]. В 2014 году был опубликован мета-анализ 25 исследований, изучающих случаи вертикальной передачи ВГС, в том числе у женщин с ВИЧ. По данным 17 исследований беременных женщин с ВГС, которые были ВИЧ-негативными, риск вертикальной передачи составил 5,8 %, тогда как у ВИЧ-позитивных женщин, согласно результатам 8 исследований, этот риск почти удваивался, достигая 10,8 % [32]. Авторами сделан вывод, что повышенный риск вертикальной трансмиссии у ВИЧ позитивных женщин может быть обусловлен более высокой вирусной нагрузкой ВГС в результате ВИЧ-опосредованной им-муносупрессии. Полученные данные согласуются с работами, показавшими более низкий риск вертикальной передачи ВГС у ВИЧ-позитивных беременных в развитых странах, который находился в диапазоне 4-8,5 % и был обусловлен, вероятнее всего, более качественной антиретровирусной терапией [33].
Сегодня считается доказанной корреляция между вирусной нагрузкой ВГС и риском перинатального инфицирования [34]. В литературе описаны нес-
колько случаев вертикальной передачи инфекции у беременных без определяемой РНК ВГС, однако они, по мнению исследователей, были обусловлены изменяющейся вирусной нагрузкой у исследуемых женщин [35].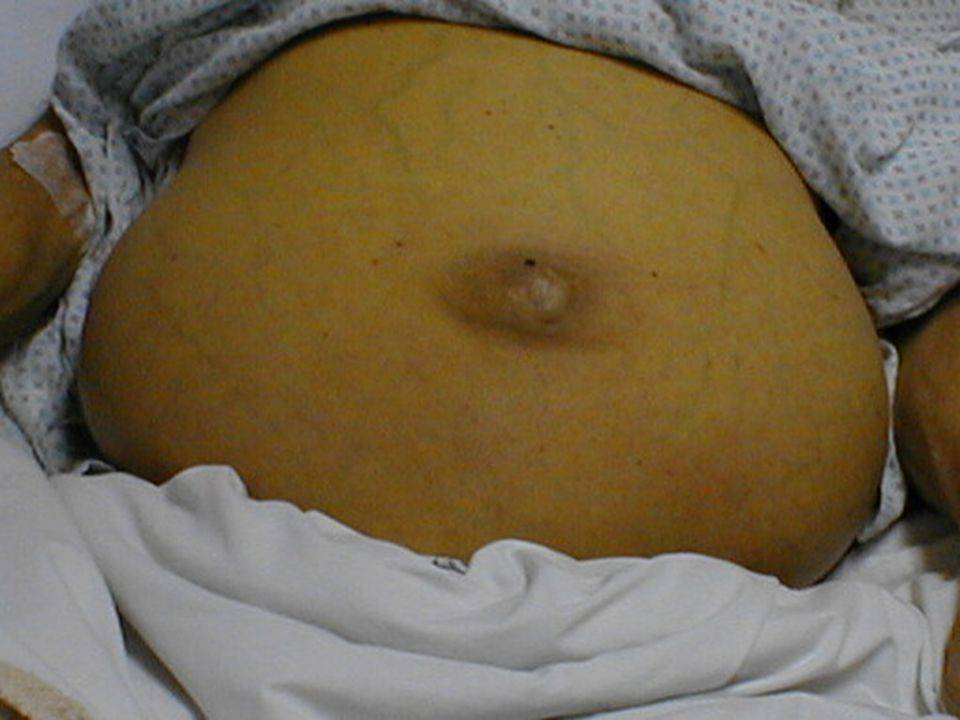 Поэтому сегодня среди всех факторов риска вертикальной передачи ВГС управляемыми считаются те, которые непосредственно увеличивают вероятность контакта инфицированной материнской крови с плодом. Наиболее высокий риск вертикальной передачи в родах был выявлен при длительном (более 6 часов) разрыве амниотических оболочек, при использовании инвазивного фетального мониторинга и эпизиотомии [36, 37]. В нескольких исследованиях показан феномен несогласованной передачи ВГС в родах у близнецов — второй из них имеет более высокий риск инфицирования, вероятнее всего обусловленный отделением плаценты первого близнеца [38, 39].
Поэтому сегодня среди всех факторов риска вертикальной передачи ВГС управляемыми считаются те, которые непосредственно увеличивают вероятность контакта инфицированной материнской крови с плодом. Наиболее высокий риск вертикальной передачи в родах был выявлен при длительном (более 6 часов) разрыве амниотических оболочек, при использовании инвазивного фетального мониторинга и эпизиотомии [36, 37]. В нескольких исследованиях показан феномен несогласованной передачи ВГС в родах у близнецов — второй из них имеет более высокий риск инфицирования, вероятнее всего обусловленный отделением плаценты первого близнеца [38, 39].
Тем не менее, исследования последних лет показывают, что кесарево сечение, которое потенциально снижает вероятность контакта плода с кровью матери, не снижает риск перипартального инфицирования [40, 41]. В метаанализе 8 исследований, оценивающих частоту вертикальной передачи вируса у женщин с ВГС, не выявлено различия в частоте инфицирования при родах через естественные родовые пути и путем операции кесарева сечения [42]. В метаанализе 2013 года была проведена оценка 11 исследований, где изучались исходы вагинальных и оперативных родов у женщин с ВГС, 10 из которых не выявили взаимосвязи между методами родоразреше-ния и вероятностью инфицирования новорожденного [26]. Несмотря на то, что авторами исследований не оценивалась вирусная нагрузка у женщин, большинство современных руководств не считает наличие ВГС показанием для кесарева сечения. Эффективным средством снижения риска вертикальной передачи ВГС на сегодняшний день остаются запрет ранней амниотомии, профилактика длительного безводного периода и снижение частоты эпизиотомии [43].
Несмотря на то, что ВГС обнаруживается в грудном молоке, большинство исследований не показывают высокий риск передачи инфекции при грудном вскармливании. Систематический обзор 14 исследований, в которых оценивался риск передачи ВГС при грудном вскармливании, не выявил ни одного случая инфицирования новорожденных [44]. Этот феномен объясняется уровнем ВГС в грудном молоке, который в 100 раз ниже, чем в плазме крови, и на-
Этот феномен объясняется уровнем ВГС в грудном молоке, который в 100 раз ниже, чем в плазме крови, и на-
Information about authors:
MOZES Kira Borisovna, assistant, department of outpatient therapy and nursing, Kemerovo State Medical University, Kemerovo, Russia. E-mail: [email protected]
MOZES Vadim Gelievich, doctor of medical sciences, professor of the department of obstetrics and gynecology named after G.A. Ushakova, Kemerovo State Medical University, Kemerovo, Russia. E-mail: [email protected]
ZAKHAROV Igor Sergeevich, doctor of medical sciences, professor of the department of obstetrics and gynecology named after G.A. Ushakova, Kemerovo State Medical University, Kemerovo, Russia. E-mail: isza @ .mail.ru
ELGINA Svetlana Ivanovna, doctor of medical sciences, professor of the department of obstetrics and gynecology named after G.A. Ushakova, Kemerovo State Medical University, Kemerovo, Russia. E-mail: [email protected]
RUDAEVA Elena Vladimirova, candidate of medical sciences, docent, docent of the department of obstetrics and gynecology named after G.A. Ushakova, Kemerovo State Medical University, Kemerovo, Russia. E-mail: [email protected]
личием липаз в материнском молоке, которые обладают противовирусной активностью [45]. Поэтому современные клинические руководства не запрещают грудное вскармливание у женщин с ВГС, за исключением случаев, если у женщины имеются трещины сосков [46, 47].
При выполнении инвазивных процедур для пре-натального скрининга риск вертикальной передачи инфекции у женщин с ВГС минимален, однако эти данные получены на ограниченном количестве исследований. В частности, исследование 22 детей, матери которых были инфицированы ВГС и перенесли процедуру амниоцентеза, не выявило у них риска вертикальной передачи вируса [48].
В частности, исследование 22 детей, матери которых были инфицированы ВГС и перенесли процедуру амниоцентеза, не выявило у них риска вертикальной передачи вируса [48].
В отношении скрининга на ВГС во время беременности единого мнения не существует. В одних источниках оспаривается необходимость проведения универсального пренатального скрининга на ВГС, так как в настоящее время препараты противовирусной терапии во время беременности находятся в стадии разработки и поэтому экономическая выгода скрининга не доказана [48]. Так же экономически нецелесообразно в течение беременности контролировать биохимические показатели функции печени. С другой стороны, в действующих руководствах Американского колледжа акушеров и гинекологов (ACOG) и Центров по контролю и профилактике заболеваний (CDC) рекомендуется проводить индивидуальный скрининг на ВГС во время беременности на основе оценки имеющихся или вновь выявленных факторов риска заражения, таких как прием инъекционных наркотических веществ, длительный гемодиализ, нанесение татуировок и т.п. [46, 47]. В некоторых странах, включая Российскую Федерацию, существуют программы бесплатного скрининга на ВГС во время беременности, что позволяет выявлять не диагностированные ранее случаи инфицирования, особенно у лиц высокого риска и мигрантов [49]. Так как у ВГС, хоть и редко, но встречается половой путь передачи инфекции, в литературе имеются рекомендации обследовать таких пациентов на инфекции, передаваемые половым путем, и вирус гепатита В [50]. Некоторыми исследователями подчеркивается, что инфицирование беременных женщин с ВГС гепатитом А и/или гепатитом В может утяжелить гепато-целлюлярное повреждение печени. На основе этих исследований Консультативный комитет по практике иммунизации (ACIP) рекомендует вакцинировать против вирусов гепатита А и гепатита В женщин на этапе преконцепции или, если этого не было сделано, во время беременности [51].
Противовирусная терапия беременных с ВГС является делом отдаленного будущего, так как препараты прямого противовирусного действия, которые можно будет применять во время беременности, находятся в стадии разработки и клинических исследований. Поэтому рекомендации по лечению инфицированных беременных сводятся к ограничению факторов, способствующих дополнительному повреждению печени — отказ от употребления алкоголя, снижение суточной дозы парацетамола до 2 грамм, коррекция
Поэтому рекомендации по лечению инфицированных беременных сводятся к ограничению факторов, способствующих дополнительному повреждению печени — отказ от употребления алкоголя, снижение суточной дозы парацетамола до 2 грамм, коррекция
доз рецептурных и безрецептурных препаратов при нарушении функции печени [52].
Современное лечение ВГС включает в себя б, рибавирин и препараты прямого противовирусного действия.
Пегилированные интерфероны в исследованиях на животных вызывали увеличение числа спонтанных абортов, оказывали тератогенное действие, поэтому их применение при беременности противопоказано. Есть работы, в которых показан потенциальный риск развития послеродовой депрессии у женщин, получающих интерферон, обусловленный его негативным действием на ЦНС [53].
Рибавирин является антиметаболитом нуклеози-дов, препятствует репликации геномов вирусов и в некоторых странах используется не только в лечении ВГС, но и терапии гриппа, геморрагических лихорадок, бешенства. В терапии ВГС рибавирин применяется в сочетании с пегилированными интерферонами. Рибавирин обладает способностью накапливаться в эритроцитах с периодом выведения от 2 до 6 месяцев, обладает тератогенным действием и поэтому абсолютно противопоказан при беременности [54]. Тем не менее, любопытные результаты были получены в США, где в период с 2003 по 2009 год были собраны данные о 118 детях, матери которых получали во время беременности рибавирин (49 случаев прямого и 69 случаев непрямого воздействия). По данным этого исследования, только у 6 детей были выявлены врожденные дефекты, такие как кривошея, ги-поспадия, полидактилия, дефект межжелудочковой перегородки и киста четвертого желудочка головного мозга, однако сами авторы рекомендуют с осторожностью интерпретировать полученные данные [55]. У мужчин рибавирин оказывает клеточную токсичность, мутагенность и снижает количество эпидиди-мальных сперматозоидов, причем эти эффекты сохраняются от 4 до 8 месяцев, поэтому, если партнер женщины получает лечение ВГС, рекомендуется планировать беременность спустя 6 месяцев после окончания терапии.
В 2011 году появились препараты с использованием прямого противовирусного действия первого поколения, а в 2015 году — второго поколения. Ограничением использования препаратов первого поколения является то, что они должны вводиться в сочетании с пегилированными интерферонами и ри-бавирином, как часть схемы тройной терапии [56]. Результаты доклинических исследований препаратов с использованием прямого противовирусного действия второго поколения не обнаружили их прямую или опосредованную репродуктивную токсичность. Тем не менее, их назначение во время беременности и в периоде лактации не рекомендуется.
Информация о финансировании и конфликте интересов
Исследование не имело спонсорской поддержки. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
■ ГЕПАТИТ С ПРИ БЕРЕМЕННОСТИ — СОВРЕМЕННЫЕ ПОДХОДЫ К СКРИНИНГУ, ЛЕЧЕНИЮ И ПРОФИЛАКТИКЕ ОСЛОЖНЕНИЙ
ЛИТЕРАТУРА / REFERENCES:
1. Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol. 2017; 2: 161-176.
2. Joint Panel from the American Association for the Study of Liver Diseases and the Infectious Diseases Society of America. Recommendations for testing, managing, and treating hepatitis C. Available at: http://www.hcvguidelines.org/. Accessed July 02, 2019.
3. Wilkins T, Akhtar M, Gititu E, Jalluri C, Ramirez J. Diagnosis and Management of Hepatitis C. Am Fam Physician. 2015 Jun 15; 91(12): 835-842.
4. World Health Organization. Guidelines for the screening, care, and treatment of persons with chronic hepatitis C infection. Available at: http://www.who.int/hiv/pub/hepatitis/hepatitis-c-guidelines/en. Accessed July 02, 2019.
World Health Organization. Guidelines for the screening, care, and treatment of persons with chronic hepatitis C infection. Available at: http://www.who.int/hiv/pub/hepatitis/hepatitis-c-guidelines/en. Accessed July 02, 2019.
5. European Association for Study of Liver. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol. 2015; 63: 199-236.
6. European Association for Study of Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol. 2018; 69: 461-511.
7. Zayratyants OV, Yushchuk ND, Khripun AI, Znoyko OO, Gudkova SB, Orekhov OO и др. Prevalence of hepatitis B and C viral infection according to the data on fetal outcomes in Moscow in 2015-2017. Arkh Patol. 2019; 81(2): 29-35. (Зайратьянц О.В., Ющук Н.Д., Хрипун А.И., Знойко О.О., Гудкова С.Б., Орехов О.О. и др. Распространенность инфекции, вызванной вирусами гепатита В и С, по материалам летальных исходов в Москве в 2015-2017 гг. //Архив патологии. 2019. Т. 81, № 2. С. 29-35.)
8. HEPAHEALTH project report. Risk Factors and the Burden of Liver Disease in Europe and Selected Central Asian Countries. EASL, 2018. Available at: https://easl.eu/wp-content/uploads/2018/09/EASL-HEPAHEALTH-Report.pdf. Accessed July 02, 2019.
9. Arshad M, El-Kamary SS, Jhaveri R. Hepatitis C virus infection during pregnancy and the newborn period — are they opportunities for treatment? J Viral Hepat. 2011; 18: 229-236.
10. Spera AM, Eldin TK, Tosone G, Orlando R. Antiviral therapy for hepatitis C: has anything changed for pregnant/lactating women? World J Hepatol. 2016; 8: 557-565.
11. Kosih SL, Mozes VG. Experience of using a combined local antibiotic for nonspecific bacterial vulvoaginitis in girls. Russian Bulletin of the obstetrician-gynecologist. 2013; 1: 42-45. Russian (Косых С.Л., Мозес В.Г. Опыт использования комбинированного антибиотика местного действия при неспецифическом бактериальном вульвоагините у девочек //Российский вестник акушера-гинеколога. 2013. Т. 13, № 1. С. 42-45.)
Russian Bulletin of the obstetrician-gynecologist. 2013; 1: 42-45. Russian (Косых С.Л., Мозес В.Г. Опыт использования комбинированного антибиотика местного действия при неспецифическом бактериальном вульвоагините у девочек //Российский вестник акушера-гинеколога. 2013. Т. 13, № 1. С. 42-45.)
12. Ravi Jhaveri, Geeta K Swamy. Hepatitis C Virus in Pregnancy and Early Childhood: Current Understanding and Knowledge Deficits. J Pediatric Infect Dis Soc. 2014 Sep; 3(Suppl 1): S13-S18.
13. Gervais A, Bacq Y, Bernuau J, Martinot M, Auperin A, Boyer N, et al. Decrease in serum ALT and increase in serum HCV RNA during pregnancy in women with chronic hepatitis C. J Hepatol. 2000; 32(2): 293-299.
14. Money D, Boucoiran I, Wagner E, Dobson S, Kennedy A, Lohn Z, et al. Obstetrical and neonatal outcomes among women infected with hepatitis C and their infants. J Obstet Gynaecol Can. 2014; 36(9): 785-794. doi: 10.1016/S1701-2163(15)30480-1.
15. Conte D, Fraquelli M, Prati D, Colucci A, Minola E. Prevalence and clinical course of chronic hepatitis C virus (HCV) infection and rate of HCV vertical transmission in a cohort of 15,250 pregnant women. Hepatology. 2000; 31(3): 751-755.
16. Gervais A, Bacq Y, Bernuau J, Martinot M, Auperin A, Boyer N, et al. Decrease in serum ALT and increase in serum HCV RNA during pregnancy in women with chronic hepatitis C. J Hepatol. 2000; 32(2): 293-299.
17. Fontaine H, Nalpas B, Carnot F, Brechot C, Pol S. Effect of pregnancy on chronic hepatitis C: a case-control study. Lancet. 2000; 356(9238): 1328-1329.
18. Di Martino V, Lebray P, Myers RP, Pannier E, Paradis V, Charlotte F, et al. Progression of liver fibrosis in women infected with hepatitis C: long-term benefit of estrogen exposure. Hepatology. 2004; 40(6): 1426-1433.
Progression of liver fibrosis in women infected with hepatitis C: long-term benefit of estrogen exposure. Hepatology. 2004; 40(6): 1426-1433.
19. Squires JE, Balistreri WF. Hepatitis C virus infection in children and adolescents. HepatolCommun. 2017; 1(2): 87-98.
20. Resti M, Azzari C, Mannelli F, Moriondo M, Novembre E, de Martino M, Vierucci A. Mother to child transmission of hepatitis C virus: prospective study of risk factors and timing of infection in children born to women seronegative for HIV-1. BMJ. 1998; 317(7156): 437-441.
21. Pergam SA, Wang CC, Gardella CM, Sandison TG, Phipps WT, Hawes SE. Pregnancy complications associated with hepatitis C: data from a 2003-2005 Washington state birth cohort. Am J Obstet Gynecol. 2008; 199(1): 38. e1-9. doi: 10.1016/j.ajog.2008.03.052.
22. Huang Q, Hang L, Zhong M, Gao YF, Luo ML, Yu YH. Maternal HCV infection is associated with intrauterine fetal growth disturbance. Medicine (Baltimore). 2016; 95(35): e4777. doi: 10.1097/MD.0 0 0 0 0 0 0 0 0 0 0 0 4777.
23. Salemi JL, Whiteman VE, August EM, Chandler K, Mbah AK, Salihu HM. Maternal hepatitis B and hepatitis C infection and neonatal neurological outcomes. J Viral Hepat. 2014; 21(11): 144-153. doi: 10.1111/jvh.12250.
24. Reddick KL, Jhaveri R, Gandhi M, James AH, Swamy GK. Pregnancy outcomes associated with viral hepatitis. J Viral Hepat. 2011; 18(7): e394-398. doi: 10.1111/j.1365-2893.2011.01436.x.
25. Wijarnpreecha K, Thongprayoon C, Sanguankeo A, Upala S, Ungprasert P, Cheungpasitporn W. Hepatitis C infection and intrahepatic cho-lestasis of pregnancy: a systematic review and meta-analysis. Clin Res Hepatol Gastroenterol. 2017; 41(1): 39-45. doi: 10.1016/j.clin-re.2016.07.004.
2017; 41(1): 39-45. doi: 10.1016/j.clin-re.2016.07.004.
26. Cottrell EB, Chou R, Wasson N, Rahman B, Guise JM. Reducing risk for mother-to-infant transmission of hepatitis C virus: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med. 2013 Jan 15; 158(2): 109-113.
27. Kushner T, Terrault NA. Hepatitis C in Pregnancy: A Unique Opportunity to Improve the Hepatitis C Cascade of Care. Hepatol Commun. 2019 Jan; 3(1): 20-28.
28. Fauteux-Daniel S, Larouche A, Calderon V, Boulais J, Beland C, Ransy DG, et al. Vertical Transmission of Hepatitis C Virus: Variable Transmission Bottleneck and Evidence of Midgestation In Utero Infection. J Virol. 2017; 91(23). pii: e01372-17. doi: 10.1128/JVI.01372-17.
29. Nie QH, Gao LH, Cheng YQ, Huang X?F, Zhang Y?F, Luo X?D, et al. Hepatitis C virus infection of human cytotrophoblasts cultured in vitro. J Med Virol. 2012; 84: 1586-1592. https://doi.org/10.1002/jmv.23380
30. Fletcher NF, Wilson GK, Murray J, Hu K, Lewis A, Reynolds GM, et al. Hepatitis C virus infects the endothelial cells of the blood-brain barrier. Gastroenterology. 2012; 142: 634-643. doi: 10.1053/j.gastro.2011.11.028.
31. Tovo PA, Calitri C, Scolfaro C, Gabiano C, Garazzino S. Vertically acquired hepatitis C virus infection: Correlates of transmission and disease progression. World J Gastroenterol. 2016; 22(4): 1382-1392. doi: 10.3748/wjg.v22.i4.1382.
32. Benova L, Mohamoud YA, Calvert C, Abu-Raddad LJ. Vertical transmission of hepatitis C virus: systematic review and meta-analysis. Clin Infect Dis. 2014; 59: 765-773.
33. бассе
бассе
39. Inui A, Fujisawa T, Sogo T, Komatsu A, Isozaki A, Sekine I. Different outcomes of vertical transmission of hepatitis C virus in a twin pregnancy. J Gastroenterol Hepatol. 2002; 17: 617-619.
40. Parthibana R, Shanmugam S, Velua V, Nandakumara S, Dhevahia E, Thangarajc K, et al. Transmission of hepatitis C virus infection from asymptomatic mother to child in southern India. Int J Infect Dis. 2009; 13(6): 394-400.
41. Floreani A. Hepatitis C and pregnancy. World J Gastroenterol. 2013; 19(40): 6714-6720.
42. Ghamar Chehreh ME, Tabatabaei SV, Khazanehdari S, Alavian SM. Effect of cesarean section on the risk of perinatal transmission of hepatitis Cvirus from HCV-RNAra/HIVe mothers: a meta-analysis. Arch Gynecol Obstet. 2011; 283(2): 255-60. doi: 10.1007/s00404-010-1588-9.
43. European Paediatric Hepatitis C Virus Network. A significant sex—but not elective cesarean section-effect on mother-to-child transmission of hepatitis C virus infection. J Infect Dis.2005; 192(11): 1872-1879.
44. Spencer JD, Latt N, Beeby PJ, Collins E, Saunders JB, McCaughan GW, Cossart YE. Transmission of hepatitis C virus to infants of human immunodeficiency virus-negative intravenous drug-using mothers: rate of infection and assessment of risk factors for transmission. J ViralHe-pat.1997; 4(6): 395-409.
45. Kumar RM, Shahul S. Role of breast-feeding in transmission of hepatitis C virus to infants of HCV-infected mothers. J Hepatol. 1998; 29(2): 191-197.
46. American College of Obstetricians and Gynecologists. Viral hepatitis in pregnancy. Practice bulletin no. 86. Obstet Gynecol. 2007; 110: 941-955.
Obstet Gynecol. 2007; 110: 941-955.
47. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015; 63: 1-137.
48. Gagnon A, Davies G, Wilson RD, GENETICS COMMITTEE. Prenatal invasive procedures in women with hepatitis B, hepatitis C, and/or human immunodeficiency virus infections. J Obstet Gynaecol Can. 2014; 36(7): 648-653. doi: 10.1016/S1701-2163(15)30546-6.
49. Kanninen TT, Dieterich D, Asciutti S. HCV vertical transmission in pregnancy: New horizons in the era of DAAs. Hepatology. 2015; 62(6):1656-1658. doi: 10.1002/hep.28032.
50. Bartholomew ML, Lee MJ. Management of Hepatitis B Infection in Pregnancy. Clin Obstet Gynecol. 2018; 61(1): 137-145.
51. Kim DK, Riley LE, Harriman KH, Hunter P, Bridges CB. Advisory Committee on Immunization Practices Recommended Immunization Schedule for Adults Aged 19 Years or Older — United States, 2017. MMWR MorbMortal Wkly Rep. 2017; 66(5): 136-138. doi: 10.15585/mmwr.mm6605e2.
52. Pessione F, Degos F, Marcellin P, Duchatelle V, Njapoum C, Martinot-Peignoux M, et al. Effect of alcohol consumption on serum hepatitis C virus RNA and histological lesions in chronic hepatitis C. Hepatology. 1998; 27(6): 1717-1722.
53. Arshad M, El-Kamary SS, Jhaveri R. Hepatitis C virus infection during pregnancy and the newborn period — are they opportunities for treatment? J Viral Hepat. 2011; 18: 229-236.
54. Food and Drug Administration. U.S. National Library of Medicine REBETOL-Ribavirin capsule. Available from: http//dailymed.nlm.nih.gov/da-ilymed/lookup.cfm?setid=04d2b6f4-bd9b-4871-9527-92c81aa2d4d0. Accessed July 02, 2019.
Accessed July 02, 2019.
55. Roberts SS, Miller RK, Jones JK, Lindsay KL, Greene MF, Maddrey WC, et al. The Ribavirin Pregnancy Registry: Findings after 5 years of enrollment, 2003-2009. Birth Defects Res A Clin Mol Teratol. 2010; 88(7): 551-559. doi: 10.1002/bdra.20682.
56. Beinhardt S, Zoairy R, Ferenci P, Kozbial K, Freissmuth C, Stern R, et al. DAA-based antiviral treatment of patients with chronic hepatitis C in the pre- and postkidney transplantation setting. Transpl Int. 2016; 29(9): 999-1007. doi: 10.1111/tri.12799.
Вирусный гепатит B и беременность
01.06.2018
Вирусного гепатита B у наших детей быть не должно. Для этого в современном мире есть все средства. Есть эффективные и безопасные рекомбинантные вакцины, а контроль уровня защитных антител прост и дешев. Все, что от нас требуется, – привить ребенка и периодически оценивать уровень антител к HBs-антигену вируса гепатита B (Anti-HBs), при необходимости привить повторно. Как часто осуществлять контроль антител? Не очень часто, раз в несколько лет – более чем достаточно. Все мы периодически сдаем кровь на те или иные анализы, и взять при случае дополнительный образец не составит никакого труда. Естественно, привиты должны быть не только дети, но и все взрослые. Не нужно взвешивать риски подцепить гепатит B, нужно просто быть привитым.
Однако, некоторые из нас уже живут с гепатитом B, в том числе будущие матери. Матери, в крови которых обнаруживается HBsAg и HBeAg – речь тут об определенных вирусных белках, передают вирус своим детям в 70-90% случаев, HBeAg-положительные и HBsAg-отрицательные матери передают вирус ребенку в 10-40% случаев. Если вертикальная передача вируса от матери к ребенку реализовалась, то вероятность хронизации гепатита B у ребенка составляет около 90%, с весьма грустными, хотя и отдаленными перспективами.
Передача вируса внутриутробно составляет очень малый процент случаев, по некоторым оценкам, не более 4%, основная зона риска – роды. Комплекс активной иммунопрофилактики – такой иммуноглобулин, как HBIG, и пассивной – вакцина от гепатита B, буквально в первые часы после родов, позволяет существенно снизить риски вертикальной передачи примерно до 3%. И все случаи вертикальной передачи при адекватной профилактике связаны с высокой вирусной нагрузкой и наличием HBeAg.
И этот неблагоприятный фактор также сегодня можно устранить или предельно минимизировать. Вирусную нагрузку, при наличии показаний, можно эффективно подавить, применяя вполне безопасные антиретровирусные препараты в третьем триместре беременности. Препарат выбора тут – тенофовир, альтернативное решение – телбивудин. Делать это следует, естественно, под наблюдением квалифицированного врача, который очень хорошо ориентируется в вопросе.
Кесарево сечение и тем более применение HBIG во время беременности не рекомендуются, эти мероприятия не показали свою эффективность. Стоит отметить, что в отношении эффективности HBIG даже после родов есть некоторые обоснованные сомнения, но так как это безопасно, а данные об эффективности, пусть и невысокого качества, имеются, то на сегодня данная опция считается актуальной.
Грудное вскармливание при наличии гепатита B не противопоказано, даже для непривитых детей это не несет серьезных рисков, впрочем, повторим – не привитых от гепатита B быть не должно.
-
Dionne-Odom J, Tita AT, Silverman NS. и др. Hepatitis B in pregnancy screening, treatment, and prevention of vertical transmission. Am J Obstet Gynecol. 2016 Jan; 214(1):6-14. PMID: 26454123. -
Gentile I, Borgia G1. Vertical transmission of hepatitis B virus: challenges and solutions. Int J Womens Health. 2014 Jun 10;6:605-11. PMID: 24966696. -
Eke AC, Eleje GU, Eke UA. и др. Hepatitis B immunoglobulin during pregnancy for prevention of mother-to-child transmission of hepatitis B virus. Cochrane Database Syst Rev. 2017 Feb 11;2:CD008545. PMID: 28188612.
Возврат к списку
Хронический вирусный гепатит С: влияние на течение беременности
HEALTH OF WOMAN.2015.3(99):124–127; doi 10.15574/HW.2015.99.124
Хронический вирусный гепатит С: влияние на течение беременности
Бойко В. А., Симачева С. А.
Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
ГУ «Крымский государственный медицинский университет им. С.И. Георгиевского», г. Симферополь
Проведено клинико-лабораторное обследование 48 беременных с хроническим вирусным гепатитом С (ХГС). Выявлена высокая частота хронической патологии пищеварительного тракта (ПТ) у беременных с ХГС. Определены ведущие клинические синдромы заболевания как при латентной фазе, так и при реактивации инфекционного процесса. Установлено негативное влияние ХГС на течение беременности из-за риска развития плацентарной дисфункции и анемии у пациенток. Обоснована необходимость планового, регламентированного обследования беременных на маркеры к вирусному гепатиту С при сочетании следующих состояний: хронические заболевания ПТ, анемия, отягощенный акушерский анамнез (самопроизвольный аборт) для выбора адекватной тактики ведения пациенток.
Ключевые слова: хронический вирусный гепатит С, беременные, сопутствующая патология, клиническое течение, осложнения беременности.
Литература:
1. Шахгильдян ИВ, Ершова ОН, Кистенева ЛБ с соавт. 2012. Активность перинатальной передачи вируса гепатита С. Степень влияния на ее интенсивность отдельных факторов. Материалы Конгресса педиатров России с международным участием. Москва:851–853.
2. Бушуева НВ и др. 2005. Маркеры гепатита С в ткани печени, сыворотке и мононуклеарных клетках периферической крови больных гепатитом С и внепеченочные проявления хронической HCV-инфекции. РЖГГК 2:73–81.
3. Гурская ТЮ. 2006. Беременность и хронический HCV-гепатит: вопросы патогенеза, клиники, диагностики, состояния фето-плацентарной системы. Автореф. дис. д-ра мед. наук: спец. 14.00.01 «Акушерство и гинекология». М:48.
4. Даниленко ЕД, Останко ВЛ. 2008. Клинико-эпидемиологическая характеристика парентеральных вирусных гепатитов и оппортунистических инфекций у женщин с акушерско-гинекологической патологией: Автореф. дис. канд. мед. наук: спец. 14.00.30 «Эпидемиология»; спец. 14.00.01 «Акушерство и гинекология». М:28.
5. Желнова ТИ, Романова ЕЮ, Фомина ВА. 2006, февраля 1–3. Заболевания печени и беременность. Тезисы 6-го съезда научного общества гастроэнтерологов России. М 15:88–89.
6. Игнатова Т.М. 2008. Хронический гепатит С и беременность. Клиническая гепатология 1:3–9.
7. Камінський ВВ, Доан СІ, Музика ОП. 2009. Перебіг вагітності з гепатитом С та ризик ускладнень. Профілактична медицина 2:81–85.
8. Климанська ЛА, Чепілко КІ. 2009. Проблемні аспекти гепатиту С в Україні. Матеріали науково-практичної конференції і пленуму Асоціації інфекціоністів України. Львів:10–12.
9. Останко ВЛ. 2010. Состояние желчевыводящей системы при хроническом вирусном гепатите С: клинико-биохимические и морфо-функциональные аспекты. Автореф. дис. канд. мед. наук: спец. 14.01.04 «Внутренние болезни». Томск:21.
10. Сергеєва ТА, Шагінян ВР, Максименок ОВ. зі співавт. 2009. Поширення гепатитів В, С та ВІЛ-інфекції серед контингентів високого поведінкового ризику. Матеріали науково-практичної конференції і пленуму Асоціації інфекціоністів України. Львів:42–43.
11. Федорченко СВ. 2010. Хроническая HCV-инфекция. К, ВСИ «Медицина»:272.
12. Гураль АЛ, Мариевский ВФ, Сергеева ТА. с соавт. 2011. Характеристика и тенденция развития эпидемического процесса гепатита С в Украине. Профілактична медицина 1(13):9–17.
13. Le Campion A, Larouche A, Fauteux-Daniel S et al. 2012. Pathogenesis of hepatitis C during pregnancy and childhood. Viruses. 4:3531–3550. http://dx.doi.org/10.3390/v4123531; PMid:23223189 PMCid:PMC3528278
14. Prasad MR, Honegger JR. 2013. Hepatitis C virus in pregnancy. Am J Perinatol. 30:149–159. http://dx.doi.org/10.1055/s-0033-1334459; PMid:23389935 PMCid:PMC3862252
15. Reddick KL, Jhaveri R, Gandhi M et al. 2011. Pregnancy outcomes associated with viral hepatitis. J Viral Hepat. 18:394–398. http://dx.doi.org/10.1111/j.1365-2893.2011.01436.x; PMid:21692952
16. Tosone G, Maraolo AE, Mascolo S et al. 2014. Vertical hepatitis C virus transmission: main questions and answers. World J. of Hepatology 27;6(8):538–548.
Гепатит Е у беременных с патологией печени в Республике Беларусь
Цель исследования. Выявить пациенток с маркерами вирусного гепатита Е среди беременных с клиническими симптомами и лабораторными признаками патологии печени, проживающих в Республике Беларусь.
Материал и методы. Обследованы 130 беременных с заболеваниями печени на маркеры вирусного гепатита Е.
Результаты. Беременные с вирусным гепатитом С чаще состояли в незарегистрированных отношениях (OR=3,75, 95% CI: 1,43—9,82, ™2=5,83; р=0,01) по сравнению с беременными без маркеров вирусных инфекций, не имели специального образования (OR=6,8S, 95% CI: 8,78—8,12, F=0,01; р=0,003) и квалифицированной работы (OR=7,21, 95% CI: 6,08—8,55, F=0,01; р=0,01). Гепатит С связан с курением табака (OR=14,22, 95% CI: 11,48— 17,60, F=0,01; р=0,01), потреблением инъекционных наркотиков (F=0,01; р=0,028), высокой долей гинекологической патологии (p=0,001), в том числе патологии шейки матки (OR=2,48, 95% CI: 2,03—3,03, ™2=4,19; р=0,0008). Частота выявления антител класса IgG к вирусу гепатита Е составила 5,3% среди беременных с наличием маркеров гепатита C и 8,3% — среди беременных с симптомами нарушения функции печени без маркеров парентеральных вирусных инфекций. Острый гепатит Е выявлен у 2,1% беременных с гепатитом С и у 8,3% пациенток с внутрипеченочным холестазом. Клинически у всех 5 серопозитивных по анти-ВГЕ IgMGIgG беременных была безжелтушная форма инфекции.
Заключение. Впервые в Беларуси выявлены пациентки с маркерами вирусного гепатита Е среди беременных с заболеваниями печени, что указывает на важность и целесообразность обследования на маркеры вирусного гепатита Е беременных с клиническими симптомами и лабораторными признаками патологии печени. Риск антенатальной гибели плода выше при гепатите Е (RR=32,25, 95% CI: 12,29—84,62, F=0,04; р=0,001). 3начимым клиническим синдромом вероятного инфицирования вирусом гепатита Е является гипертрансаминаземия (OR=7,02, 95% CI: 1,11—44,55, F=0,049; р=0,004). Не увеличивает шанс выявления вирусного гепатита Е у беременных наличие вирусных инфекций с половым и парентеральным механизмом передачи: гепатит C (F=0,6S, p=0,13), ко-инфекция гепатита С и ВИЧ (F=1,0, p=0,28), вирусные гепатиты С и В (F=1,0, p=0,36), гепатиты С, В и ВИЧ-инфекция (F=1,0, p=0,22).
В последнее десятилетие возрос интерес к проблеме вирусного гепатита Е (ВГЕ). Ежегодно в мире регистрируется 3,4 млн случаев инфекции, в результате которой умирают 70 000 больных и происходит 3000 мертворождений [1].
Ранее считалось, что эта инфекция с вовлечением большого количества заболевших характерна только для стран с жарким климатом. Однако в последние годы в европейских странах увеличилось число зарегистрированных случаев гепатита Е (ГЕ), не связанных с выездом в эндемичные регионы. Такие случаи также зарегистрированы в Северной Америке, Японии, России [2]. По результатам проведенного сероэпидемиологического обследования здорового европейского населения, частота обнаружения анти-ВГЕ составила 0,4—5,2% [3]. Так, частота выявления анти-ВГЕ у здорового населения в Англии и Франции составляет 1%, в Италии и Испании, а также в США и Канаде — 2%, в Дании и Швеции — 5% [4, 5], в России колеблется от 0,6 до 4% [6].
Встречаются случаи наложения острого ВГЕ на уже существующие хронические заболевания печени вирусной или невирусной этиологии. Суперинфицирование этим вирусом часто отягощает течение острого гепатита А и В, обостряет течение хронических гепатитов В и С, вызывает тяжелые случаи декомпенсации функции печени, которые осложняются печеночной энцефалопатией и почечной недостаточностью [7].
Наибольшему риску возникновения осложнений гепатита Е подвергаются беременные. Частота тяжелых и фульминантных форм ГЕ с развитием печеночно-почечной недостаточности, ДВС-синдрома и летальностью до 28% увеличивается в III триместре беременности и в раннем послеродовом периоде. Клиническая картина ГЕ во время гестации характеризуется развитием холестаза: у беременных наблюдается интенсивная желтуха, генерализованный зуд кожных покровов, повышение уровня прямого билирубина в 2—5 раз; повышение активности щелочной фосфатазы в 7—10 раз; увеличение протромбинового времени; повышение до 10—100 раз уровня холевой, хенодезоксихолевой и других желчных кислот [8]. С увеличением срока беременности тяжесть течения вирусного гепатита Е обычно нарастает. Беременность чаще заканчивается антенатальной гибелью плода, самопроизвольным выкидышем, преждевременными родами. Из родившихся живыми половина детей погибает в течение месяца [9—11].
Таким образом, выявление ГЕ в европейских странах, особенности течения ВГЕ-инфекции во время беременности, отсутствие до настоящего времени данных о циркуляции вируса ГЕ на территории Республики Беларусь определяют актуальность настоящего исследования.
Цель исследования — выявить пациенток с маркерами вирусного гепатита Е среди беременных с клиническими симптомами и лабораторными признаками патологии печени, проживающих в Республике Беларусь.
Проведенное исследование указывает на важность и целесообразность обследования беременных с клиническими симптомами и лабораторными признаками патологии печени на маркеры вирусного гепатита Е.
Контактная информация:
Зновец Татьяна Владимировна — аспирант кафедры акушерства и гинекологии.
Белорусский государственный медицинский университет. 220116, г. Минск, пр. Дзержинского, 83; e-mail: [email protected]. Участие авторов:
Концепция и дизайн исследования: З. Т. В., Ж. С. В. Сбор и обработка материала: З. Т. В., А. А. А. Статистическая обработка данных: З. Т. В., Б. Е. И. Написание текста: З. Т. В. Редактирование: Ж. С. В., Б. Е. И.
Ключевые слова: беременность, вирусный гепатит C, вирусный гепатит Е, заболевание печени
Автор(ы):
Зновец Т. В., Жаворонок С. В., Барановская Е. И., Арабей А. А.
Медучреждение:
Белорусский государственный медицинский университет
Гепатит Е у беременных – безобидное заболевание или скрытая угроза?
Гепатит E – острая циклическая вирусная инфекция с фекально-оральным механизмом заражения, склонная к эпидемическому распространению в основном в регионах с жарким климатом, протекающая преимущественно доброкачественно, но с большой частотой неблагоприятных исходов у женщин в последнем триместре беременности.
Ежегодно в мире регистрируют 20,1 миллиона случаев HEV-инфекции, в результате которой умирают 70 тысяч больных. На основе географического распределения HEV-инфекция имеет две эпидемиологические модели. Заболевание было первоначально описано как эндемичное в развивающихся странах, где вспышки распространены из-за отсутствия санитарных условий и ассоциированы с инфицированием генотипом 1 вируса гепатита Е. Гепатит Е становится все более распространенным явлением в промышленно развитых странах и связан с возвращением путешественников из эндемичных стран. Однако в последние годы сообщается о спорадических автохтонных случаях заражения генотипами 3 и 4 вируса гепатита Е. Случаи автохтонного гепатита Е среди взрослого населения зарегистрированы в Северной Америке, Японии, РФ.
По результатам проведенного сероэпидемиологического обследования здорового населения частота выявления антител к вирусу гепатита Е в Англии и Франции составляет 1%, в США, Канаде, Испании и Италии — 2%, в Швеции и Дании — 5%, в РФ — от 0,6 до 4%. В Республике Беларусь частота обнаружения Ig G к вирусу гепатита Е в воинском коллективе составила 4%, описан случай острого холестатического автохтонного гепатита Е у 65-летней пациентки в г. Минске.
Основными механизмами инфицирования вирусом гепатита Е являются фекально-оральный путь, передача при переливании продуктов крови, зоонозная и вертикальная трансмиссии. Штаммы вируса гепатита Е обнаружены у домашних свиней, диких кабанов, кроликов, крыс, оленей, мангустов, летучих мышей, хорьков, а также у крупного рогатого скота и овец. Передача вируса гепатита Е связана с употреблением сырого мяса или контактом с животными. В Республике Беларусь циркуляция вируса гепатита Е среди животных доказана по результатам исследования антител к вирусу гепатита Е в сыворотке крови свиней на свиноводческих комплексах. Частота выявления анти-ВГЕ составила 10,7-26,7%. Распространенность антител к вирусу гепатита Е у кроликов из неэндемичных регионов составила 81,5-82,2% в РФ и 12,5% в Республике Беларусь. Частота выявления РНК вируса гепатита Е у кроликов варьировала от 0% до 13,8% в РФ и от 11% до 30% в РБ, все изоляты принадлежали геноварианту, близкому к генотипу 3 вируса гепатита Е.
Эпидемиологические данные о HEV-инфекции у беременных ограничены из-за отсутствия их обследования на вирусный гепатит Е. В Европе первый случай инфицирования генотипом 3 вирусом гепатита Е беременной был зарегистрирован у 41-летней женщины, проживающей в юго-восточной Франции. Аналогичный случай острого гепатита и гипертрансаминаземии был диагностирован у 27-летней беременной в Германии. Результаты исследования во Франции показали, что среди 315 беременных женщин распространенность вируса гепатита Е составила 7,7%.
Инкубационный период HEV-инфекции варьирует от 2 до 8 недель. Клиническая картина заболевания не отличаются у беременных или небеременных женщин. Однако за короткий промежуток времени клинические проявления прогрессируют до острой печеночной недостаточности и, как следствие, у 70% HEV-инфицированных беременных развиваются диссеминированная внутрисосудистая коагуляция, энцефалопатия и отек головного мозга. Коагулопатия приводит к более высокой вероятности послеродового кровотечения. Смертность от печеночной комы происходит в 100% случаев. Данная ситуация отличается в Египте, где инфицирование вирусом гепатита Е в период беременности не коррелирует с увеличением смертности. Некоторые авторы полагают, что это связано с более низкой вирулентностью распространенного на данной территории генотипа вируса гепатита Е. T. Lachish и соавт. сообщили, что у 33% HEV-инфицированных беременных в европейских странах развился молниеносный гепатит, при этом фетальной и материнской смертности не зарегистрировано.
Преждевременные роды, низкий вес при рождении, мертворождение или смерть новорожденного наблюдаются в 25-56% случаев. HEV-инфекция может отвечать за 2400-3000 мертворождений в год, в дополнение к смертельным исходам плода, связанным с дородовой материнской смертностью. Вертикальная трансмиссия представляет особый интерес, поскольку передача вируса гепатита Е от матери ребенку составляет 23,3-50%, ассоциирована с преждевременными родами и антенатальной смертностью.
Профилактика
Заключается преимущественно в соблюдении санитарно-гигиенических норм. Путешественникам не следует употреблять сырую воду в странах, где регистрируется гепатит E. Также разработана рекомбинантная вакцина, показавшая высокую эффективность в клинических испытаниях.
Врач — акушер-гинеколог первой категории
(заведующий) отделением патологии беременности Т. В. Зновец
АУТОИММУННЫЙ ГЕПАТИТ ПРИ БЕРЕМЕННОСТИ | Еремина
1. Рекомендации EASL по лечению аутоиммунного гепатита. J. Hepatol., 2015, vol. 63, pp. 971-1004.
2. Longhi M. S., Ma Y., Mieli-Vergani G., Vergani D. Aetiopathogenesis of autoimmune hepatitis. J Autoimmun., 2009, vol. 17, no. 9, pp.186-189.
3. Schramm C., Wahl I., Weiler-Normann C. et al. Health-related quality of life, depression, and anxiety in patients with autoimmune hepatitis. J. Hepatol., 2014, vol. 60, pp. 618-624.
4. Wolf D. C., Raghuraman U. V. Autoimmune Hepatitis. New York Medical College, St John Medical Center. 2011.[Medline].
5. Czaja A. J. Special clinical challenges in autoimmune hepatitis: the elderly, males, pregnancy, mild disease, fulminant onset, and nonwhite patients. Semin Liver Dis., 2009, vol. 29, no. 3, pp. 315-330.
6. Takahashi H., Zeniya M. Acute presentation of autoimmune hepatitis: Does it exist? A published work review. Hepatol Res., 2011, vol. 41, pp. 498-504.
7. Zachou K., Muratori P., Koukoulis G. K. et al. Review article: autoimmune hepatitis — Current management and challenges. Aliment Pharmacol Ther., 2013, vol. 38, pp. 887-913.
8. Czaja A. J., Lindor K. D. Failure of budesonide in a pilot study of treatment-dependent autoimmune hepatitis. Gastroenterology, 2000, vol. 119, pp. 1312-1316.
9. Czaja A. J. Drug choices in autoimmune hepatitis: part A-Steroids. Expert Rev Gastroenterol Hepatol., 2012, vol. 6, pp. 603-615.
10. Gronbæk L., Vilstrup H., Jepsen P. Autoimmune hepatitis in Denmark: incidence, prevalence, prognosis, and causes of death. A nationwide registry-based cohort study. J Hepatol., 2014, vol. 60, pp. 612-617.
11. Manns M. P., Lohse A. W., Vergani D. «Autoimmune hepatitis — Update 2015». Journal of Hepatology, 2015, vol. 62, no. 1, S 100-S 111.
12. Sex Bias in Experimental Immune-Mediated, Drug-Induced Liver Injury in BALB/c Mice: Suggested Roles for Tregs, Estrogen, and IL-6 — PLoS One, doi:10.1371/journal.pone.0061186, April 2013
13. Obermayer-Straub P., Perheentupa J., Braun S. et al. Hepatic autoantigens in patients with autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy. Gastroenterology, 2001, vol. 121, pp. 668-677.
14. AASLD PRACTICE GUIDELINES Diagnosis and Management of Autoimmune Hepatitis, 2010.
15. Rigopoulou E. I., Dalekos G., Bogdanos D. P. How common are connective tissue disorders in patients with autoimmune hepatitis? Semin Arthritis Rheum., 2007, vol. 36, p.332.
16. Teufel A., Weinmann A., Kahaly G. J. et al. Concurrent autoimmune diseases in patients with autoimmune hepatitis. J Clin Gastroenterol., 2010, vol. 44, pp. 208-213.
17. Ивашкин В. Т., Морозова М. А., Маевская М. В., Буеверов А. О. Современные терапевтические схемы лечения аутоиммунного гепатита. РЖГГК, 2009, № 4, с. 4-12.
18. Heneghan M. A., Norris S. M., O’Grady J.G. et al. Management and outcome of pregnancy in autoimmune hepatitis. Gut, 2001, vol. 48, pp. 97-102.
19. Schramm C., Herkel J., Beuers U. et al. Pregnancy in autoimmune hepatitis: outcome and risk factors. Am J Gastroenterol., 2006, vol. 101, pp. 556-560.
20. Werner M., Bjornsson E., Prytz H. et al. Autoimmune hepatitis among fertile women: strategies during pregnancy and breastfeeding? Scand J Gastroenterol., 2007, vol. 42, pp. 986-991.
21. Westbrook R. H., Yeoman A. D., Kriese S., Heneghan M. A.Outcomes of pregnancy in women with autoimmune hepatitis. J Autoimmun., 2012, vol. 38, J239-244.
22. Varma R. R., Michelsohn N. H., Borkowf H. I., Lewis J. D. Pregnancy in cirrhotic and noncirrhotic portal hypertension. Obstetrics and Gynecology, 1977, vol. 50, no. 2, pp. 217-222.
23. Sandhu B. S., Sanyal A. J. Pregnancy and liver disease. Gastroenterol Clin North Am, 2003, vol. 32, pp. 407-436.
24. Schreyer P., Caspi E., El-Hindi J.M., Eshchar J. Cirrhosis-pregnancy and delivery: a review. Obstet Gynecol Surv., 1982, vol. 37, pp. 304-312.
25. Buchel E., Van Steenbergen W., Nevens F., Fevery J. Improvement of autoimmune hepatitis during pregnancy followed by flare-up after delivery. Am J Gastroenterol., 2002, vol. 97, pp. 3160-3165.
26. Samuel D., Riordan S., Strasser S. et al. Severe autoimmune hepatitis first presenting in the early post partum period. Clin Gastroenterol Hepatol., 2004, vol. 2, pp. 622-624.
27. Muratori P., Loffreda S., Muratori L. et al. Spontaneous remission of autoimmune hepatitis during pregnancy. Dig Liver Dis., 2002, vol. 34, pp. 608-609.
28. Terrabuio D. R., Abrantes-Lemos C.P., Carrilho F. J., Cancado E. L. Follow-up of pregnant women with autoimmune hepatitis: the disease behavior along with maternal and fetal outcomes. J Clin Gastroenterol., 2009, vol. 43, pp. 350-356.
29. Westbrook R. H., Dusheiko G., Williamson A. Болезни печени у беременных. Journal of Hepatology, 2016, vol. 64, pp. 993-945 (Русское издание, Т. 2, № 3)
30. Adamowicz R., Trzeciak-Supel E., Smolarczyk R. et al. Subsequent pregnancy (twin) in woman with autoimmunological hepatitis. Ginekol Pol., 2005, vol. 76, pp. 742-746.
31. Еремина Е. Ю. Лекарственный гепатит у беременных. Врач, 2015, № 8, с. 11-13.
32. Gatselis N. K., Zachou K., Papamichalis P. et al. Comparison of simplified score with the revised original score for the diagnosis of autoimmune hepatitis: a new or a complementary diagnostic score? Dig Liver Dis, 2010, vol. 42, pp. 807-812.
33. Еремина Е. Ю. Лекарственный гепатит у беременных. Проблемы женского здоровья, 2011, № 4, Т. 6, с. 46-55.
34. Еремина Е. Ю. Аутоиммунные заболевания печени и беременность. Практическая медицина, 2011, № 6, Т. 54, с. 12-18.
35. Castiella A., Zapata E., Lucena M. I., Andrade R. J. Drug-induced autoimmune liver disease: a diagnostic dilemma of an increasingly reported disease. World J Hepatol., 2014, vol. 6, pp. 160-168.
36. Weiler-Normann C., Schramm C. Drug induced liver injury and its relationship to autoimmune hepatitis. J Hepatol., 2011, vol. 55, pp. 747-749.
37. Bjornsson E., Talwalkar J., Treeprasertsuk S. et al. Drug-induced autoimmune hepatitis: clinical characteristics and prognosis. Hepatology, 2010, vol. 51, pp. 2040-2048.
38. Ивашкин В. Т., Буеверов А. О., Маевская М. В., Абдулганиева Д. И. Клинические рекомендации по диагностике и лечению аутоиммунного гепатита. М., 2013.
39. Ashima M., Kymberly D., Vaidehi R. Autoimmune Hepatitis: A Review of Current Diagnosis and Treatment Hepatitis Research and Treatment. 2011, Article ID 390916, 11 pages doi:10.1155/2011/390916
40. Candia L., Marquez J., Espinoza L. R. Autoimmune hepatitis and pregnancy: a rheumatologist’s dilemma. Semin Arthritis Rheum., 2005, vol. 35, no. 1, pp. 49-56.
41. Manns M. P., Czaja A. J., Gorham J. D. et al. Diagnosis and management of autoimmune hepatitis. Hepatology, 2010, vol. 51, pp. 2193-2213.
42. Czaja A. J., Freese D. K. AASLD practice guidelines. Diagnosis and treatment of autoimmune hepatitis. Hepatology, 2002, vol. 36, no. 2, pp. 479-497.
43. Murray-Lyon I.M., Stern R. B., Williams R. Controlled trial of prednisone and azathioprine in active chronic hepatitis. Lancet, 1973, vol. 1, pp. 735-737.
44. Summerskill W. H., Korman M. G., Ammon H. V., Baggenstoss A. H. Prednisone for chronic active liver disease: dose titration, standard dose, and combination with azathioprine compared. Gut, 1975, vol. 16, pp. 876-883.
45. De Vries F., Bracke M., Leufkens H. G. et al. Fracture risk with intermittent high-dose oral glucocorticoid therapy. Arthritis Rheum., 2007, vol. 56, pp. 208-214.
46. Czaja A. J. Safety issues in the management of autoimmune hepatitis. Expert Opin Drug Safety, 2008, vol. 7, pp. 319-333.
47. Chambers C. D., Tutuncu Z. N., Johnson D. et al. Human pregnancy safety for agents used to treat rheumatoid arthritis: adequacy of available information and strategies for developing post-marketing data. Arthritis Res Ther., 2006, vol. 8, p. 215.
48. Francella A., Dyan A., Bodian C., et al. The safety of 6-mercaptopurine for childbearing patients with inflammatory bowel disease: a retrospective cohort study. Gastroenterology, 2003, vol. 124, pp. 9-17.
49. Casanova M. J., Chaparro M., Domenech E. et al. Safety of thiopurines and anti-TNF-alpha drugs during pregnancy in patients with inflammatory bowel disease. Am J Gastroenterol., 2013, vol. 108, pp. 433-440.
50. Angelberger S., Reinisch W., Messerschmidt A. et al. Long-term follow-up of babies exposed to azathioprine in utero and via breastfeeding. J Crohns Colitis, 2011, vol. 5, pp. 95-100.
51. Manns M. P., Woynarowski M., Kreisel W. et al. European AIH-BUC Study Group: budesonide induces remission more effectively than prednisone in a controlled trial of patients with autoimmune hepatitis. Gastroenterol., 2010, vol. 139, no. 4, pp. 1198-1206.
52. Woynarowski M., Nemeth A., Baruch Y. et al. European AIH-BUC Study Group. Budesonide versus prednisone with azathioprine for the treatment of autoimmune hepatitis in children and adolescents. J. Pediatr., 2013, vol. 163, no. 5, pp. 1347-1353.
53. Hempfling W., Grunhage F., Dilger K. et al. Pharmacokinetics and pharmacodynamic action of budesonide in early- and late-stage primary biliary cirrhosis. Hepatology, 2003, vol. 38, no. 1, pp. 196-202.
54. Mederacke I., Helfritz F., Puls F. et al. Budd-Chiari syndrome after treatment with budesonide in a cirrhotic patient with autoimmune hepatitis. Ann Hepatol., 2012, vol. 11, no. 1, pp. 143-144.
55. Christopher V., Al-Chalabi T., Richardson P. D. et al. Pregnancy outcome after liver transplantation: a single-center experience of 71 pregnancies in 45 recipients. Liver Transpl., 2006, vol. 12, pp. 1138-1143.
56. Еремина Е. Ю., Машарова А. А. Заболевания органов пищеварительной системы у беременных. Саранск, 2009. 200 с.
57. Еремина Е. Ю. Аутоиммунные заболевания печени и беременность: информация для практического врача. Медицинский альманах, 2011, № 6, Т. 19, c.82-87.
58. Marten W., Einar B., Hanne P. et al. Autoimmune hepatitis among fertile women: strategies during pregnancy and breastfeeding? Scand J Gastroenterol., 2007, vol. 42, no. 8, pp. 986-991.
59. Christensen L. A., Dahlerup J. F., Nielsen M. J. et al. Azathioprine treatment during lactation. Aliment Pharmacol Ther., 2008, vol. 28, pp. 1209-1213.
60. Tripathi D., Neuberger J. Autoimmune hepatitis and liver transplantation: indications, results, and management of recurrent disease. Semin Liver Dis., 2009, vol. 29. No. 3, pp. 286-96.
Лечение гепатита с у беременных
Гепатологи Москвы — последние отзывы
Компетентный, доброжелательный и заинтересованный доктор. Она подошла к моей проблеме с нескольких сторон, посмотрела на нее под разными углами, назначила такие анализы, на которые врачи до этого внимания не заостряли, дала компетентную оценку ситуации и ничего лишнего не навязала. Врач участливо отнеслась к моей проблеме и наметила вектор ее решения.
Анастасия,
31 марта 2021
Очень хороший и профессиональный доктор. Она мне всё объяснила, успокоила и назначила лечение. Я пойду к ней повторно!
Олеся,
30 марта 2021
Специалист внимательный. Вероника Ивановна назначила ребенку лечение.
Ксения,
24 марта 2021
Компетентный, приятный, располагающий к себе, профессиональный и грамотный доктор, который умеет находить общий язык с детьми. Она посмотрела все наши документы и посоветовала другого специалиста. Я тоже к ней запишусь.
На модерации,
05 апреля 2021
Доктор внимательный и компетентный. Она провела консультацию и назначила дополнительные обследования и сдачу анализов. Мы договорились о следующем приёме.
Роман,
04 апреля 2021
Квалифицированный и внимательный доктор. Она уделила мне достаточно времени, четко и грамотно объяснила все вопросы и дала советы.
Ирина,
31 марта 2021
Я получила всё, что хотела. Доктор дала рекомендации и выписала мне справку, за которую я заплатила отдельно. Она меня об этом заранее не предупредила. Она общительный и доброжелательный врач.
Оксана,
30 марта 2021
Врач внимательный. Она меня выслушала, все посмотрела, провела консультацию и назначила анализы.
Александр,
30 марта 2021
Я был не в первый раз у данного специалиста. Она ранее назначила мне лечение, дополнительные исследования. На повторном приёме лечение было скорректировано. Юлия Юрьевна внимательный, чуткий и профессиональный врач, который разбирается в своей сфере.
Игорь,
29 марта 2021
Доктор очень грамотный и внимательный. У меня уже наблюдаются улучшения после назначенного лечения. Она всё объяснила, что нужно мне знать.
Валентина,
29 марта 2021
Показать 10 отзывов из 3044
Универсальный скрининг беременных на гепатит С: время пришло | Клинические инфекционные болезни
Аннотация
Эпидемиология вируса гепатита С (ВГС) значительно изменилась за последнее десятилетие. Когда-то наиболее распространенное среди пожилых людей, нынешнее бремя непропорционально сильно сказалось на молодых людях, включая женщин детородного возраста (WOCA). Общество медицины матери и плода недавно выпустило руководство, в котором не внесены изменения в рекомендации по скринингу беременных женщин на основе факторов риска.Нынешнее бремя среди молодых людей, включая WOCA, способствует изменению стратегии от скрининга на основе риска к всеобщему скринингу на ВГС во время беременности. Универсальный скрининг предлагает несколько преимуществ, которые позволяют нам рассчитывать на будущее, в котором лечение гепатита С во время беременности может проводиться, и предложить нам прогресс в устранении вируса гепатита С.
(См. Раздел IDSA Руководящей группы AASLD-IDSA по ВГС на стр. 1477–92.)
Вирус гепатита С (ВГС) широко признан национальной и глобальной проблемой здравоохранения и является ведущей единственной инфекционной причиной смертности в мире. США [1].Ранее считавшаяся проблемой в основном ветеранов-мужчин и «бэби-бумеров», когорта, родившаяся между 1945 и 1965 годами, эпидемиология ВГС сильно изменилась за последнее десятилетие из-за огромного увеличения числа молодых людей за пределами города, связанных с употреблением инъекционных наркотиков. В Соединенных Штатах. Эта новая волна инфекций ВГС произошла в основном среди молодых людей и подростков обоего пола. Среди молодого взрослого населения есть женщины детородного возраста (WOCA), группа, которая поднимает уникальную проблему передачи вируса от матери ребенку (ПМР).Текущая политика общественного здравоохранения одобряет всеобщий скрининг бэби-бумеров и скрининг с учетом риска для всех других групп, включая беременных женщин. Хотя все беременные женщины проходят всеобщий скрининг на вирус иммунодефицита человека (ВИЧ), вирус гепатита В (ВГВ) и многие другие инфекции, ВГС в этом списке явно отсутствует. Общество медицины матери и плода (SMFM) и Американский колледж акушерства и гинекологии недавно подтвердили позицию скрининга беременных женщин с учетом рисков [2].Другие считают, что настало время внедрить всеобщий скрининг [3–6]. В отличие от документа SMFM, мы утверждаем, что следует принять всеобщий скрининг беременных на основе текущей эпидемиологии ВГС, рекомендаций по изменению акушерской практики для женщин, у которых выявлена инфекция ВГС, и наличия высокоэффективных схем лечения для этих женщин после родов [2]. Эта практика поможет поставщикам лучше понять, что произойдет в ближайшем будущем, и позволит на раннем этапе выявлять младенцев из группы риска.Всеобщий скрининг беременных женщин на ВГС был рекомендован Американской ассоциацией по изучению заболеваний печени / Американским обществом инфекционных заболеваний (AASLD / IDSA) группой рекомендаций по ВГС вместе с каждым обществом [7].
ИЗМЕНЕНИЕ ЭПИДЕМИОЛОГИИ
Информированная политика скрининга на ВГС должна основываться на самой последней эпидемиологии эпидемии. В нескольких недавних публикациях подчеркивается непропорциональное бремя ВГС у молодых людей, связанное с национальной эпидемией опиоидов, особенно в WOCA.В то время как в некоторых населенных пунктах сообщалось о росте заболеваемости ВГС среди молодежи, Центры по контролю и профилактике заболеваний (CDC) в 2014 году описали растущее число случаев ВГС в национальном масштабе и ассоциации с населением за пределами города, белыми людьми, текущим / предыдущим употреблением наркотиков и равное распределение среди мужчин и женщин [8–11]. Последующее исследование CDC описало распространенность ВГС на национальном уровне с использованием данных национальной справочной лаборатории для разработки оценок на уровне населения [12]. Эти данные показали, что национальные оценки распространенности с 2011 по 2014 годы увеличились со 132 до 169/100000 протестированных образцов, а оценки распространенности в Кентукки выросли с 275 до 862/100000 протестированных образцов.В 2017 году авторы CDC использовали те же данные национальных справочных лабораторий для изучения национальных тенденций распространения ВГС среди WOCA [13]. Значительный рост числа выявленных вирусов гепатита С с 2011 по 2014 год был продемонстрирован на всей территории Соединенных Штатов. Текущие оценки показывают, что у 29000 инфицированных ВГС женщин ежегодно рождается 1700 инфицированных младенцев, что намного превышает предыдущие прогнозы [14]. В целом, 1,34% женского населения в возрасте 15–44 лет имели положительные антитела к ВГС с заметной географической согласованностью (1,25% Южный, 1.36% Северо-Восток, 1,37% Запад, 1,63% Средний Запад). Эти тенденции свидетельствуют о растущем риске среди WOCA и были описаны индивидуально в нескольких штатах по всей стране [15, 16]. Эти отчеты не только демонстрируют массовый рост случаев ВГС, но также демонстрируют, что ни один регион страны не затронут изолированно, и что в регионах внутри штатов могут быть резко разные уровни заболеваемости ВГС. Ни одна из этих статей не была упомянута в недавней публикации SMFM.
КОРПУС ДЛЯ УНИВЕРСАЛЬНОГО СКРИНИНГА
Какие факторы, помимо изменений в эпидемиологии, подтверждают необходимость всеобщего скрининга? Во-первых, скрининг, основанный на оценке риска, неоднократно демонстрировал пропуск многих случаев инфекции ВГС [4, 17, 18].Либо поставщики услуг не спрашивают о факторах риска, либо пациенты не предоставляют эту информацию добровольно. При детальном рассмотрении результатов упомянутой выше статьи CDC 2017 года, показатель положительных результатов на антитела к ВГС в тестах, отправленных акушерами, составил 0,37%, что намного ниже, чем в любой другой перечисленной группе поставщиков (педиатрия, 1%; первичная медико-санитарная помощь, 1,62%; инфекционные заболевания). заболевания — 6,57% и гастроэнтерология — 14,69%) [13]. Поверхностный анализ может свидетельствовать о том, что акушеры не наблюдают пациентов, инфицированных ВГС. Однако, учитывая рекомендации скрининга на основе риска и гораздо более низкий уровень, чем в других условиях, более вероятным объяснением является то, что пациенты, инфицированные ВГС, не опрашиваются и, следовательно, не идентифицируются.Единственный опубликованный опрос, касающийся практики скрининга и консультирования среди акушеров-гинекологов, выявил многочисленные пробелы, которые ограничивают эффективность только скрининга на основе факторов риска [19]. Как ни странно, многие акушеры в штатах с высокой распространенностью проводят независимый скрининг всех беременных женщин на ВГС. Скрининг на основе рисков также может создать этические проблемы для поставщиков медицинских услуг, поскольку раскрытие информации об употреблении наркотиков имеет последствия для опеки над детьми и может помешать честному и открытому общению для облегчения ухода за женщинами из группы риска.Следует отметить, что аналогичные аргументы в пользу скрининга, основанного на оценке риска, были выдвинуты много лет назад, когда поднимался вопрос об универсальном скрининге беременных женщин на ВГВ. Была задокументирована такая же неудача этой стратегии, и была принята и принята универсальная политика скрининга, хотя женщины из группы риска редко встречаются в некоторых практиках [20, 21]. Вероятно, что инфекция ВГС будет более распространена в стандартной акушерской практике, чем неустановленная инфекция ВГВ или ВИЧ. Если скрининг на основе факторов риска не будет признан эффективным, что не было продемонстрировано ни в одной популяции, универсальный скрининг с гораздо большей вероятностью позволит выявить полное бремя случаев.Эти проблемы характерны не только для беременности, и недавнее исследование показало, что однократный всеобщий скрининг всех молодых людей (включая WOCA) будет рентабельным [22].
Во-вторых, многие молодые женщины могут постоянно обращаться за медицинской помощью только во время беременности. Как ранее отмечалось в отношении ВИЧ и анекдотично многими экспертами по ВГС, беременные женщины соблюдают правила тестирования и наблюдения выше, поскольку они думают о будущем еще не родившихся детей [23, 24]. Исследования показали, что после родов эта комплаентность ослабевает, и возвращение этих женщин к лечению может быть затруднено [24].
В-третьих, универсальное тестирование можно легко интегрировать в текущую практику пренатального скрининга. Тестирование на антитела к ВГС может быть выполнено с помощью лабораторного тестирования приема, а объединение образцов для серийного тестирования может быть выполнено, чтобы снизить стоимость тестирования и снизить уровень ложноположительных результатов низкого уровня.
В-четвертых, знание статуса ВГС может повлиять на решения поставщика медицинских услуг и поведение пациентов. Поставщики медицинских услуг могли бы принимать более информированные решения о статусе ВГС у женщины и соответствующим образом планировать роды, чтобы избежать инвазивных процедур, которые, как известно, способствуют передаче ВГС (например, мониторинг скальп-электрода).В ранее упомянутом руководстве SMFM рекомендуется изменить акушерскую практику для женщин, инфицированных ВГС. Однако без всеобщего скрининга некоторые инфицированные женщины не смогут воспользоваться этими рекомендациями, что, возможно, подвергнет своих новорожденных ненужному риску передачи инфекции от матери ребенку. Кроме того, женщине, знающей о своем статусе, может быть предложено консультирование по вопросам снижения вреда, она может быть более мотивирована отказаться от рискованного поведения (употребления инъекционных наркотиков) и может привлекать партнеров по инъекциям для прохождения тестирования и ухода за собой.При раннем выявлении ее также можно будет направить на обследование и запланированную терапию гепатита С, когда она еще беременна и, возможно, все еще покрывается государственной страховкой во время беременности. Недавно представленный реферат показал, что раннее выявление ВГС у беременных действительно привело к увеличению числа завершенных обращений к специалистам [25]. В идеале вмешательство такого рода могло бы осуществляться в рамках модели партнерства между общественным здравоохранением и клинической помощью, аналогичной той, которая применяется в отношении ВИЧ и ВГВ.
В-пятых, это знание может также помочь облегчить оценку младенцев, подвергшихся воздействию ВГС, поскольку хорошо известно, что подавляющее большинство этих младенцев никогда не проходят последующего тестирования [26].
Наконец, лечение гепатита С может продлить жизнь. Хроническая инфекция ВГС связана в среднем с 20-летней потерей ожидаемой продолжительности жизни; скрининг во время беременности позволяет выявить и лечить эту потерю. Выявление всех инфекций во время беременности предоставит уникальную возможность улучшить здоровье матери в долгосрочной перспективе.
ОПРОВЕРЖЕНИЕ РАСПРОСТРАНЕННЫХ АРГУМЕНТОВ ПРОТИВ УНИВЕРСАЛЬНОГО СКРИНИНГА
Против всеобщего скрининга беременных женщин на ВГС выдвигалось множество аргументов.Одна из распространенных проблем заключается в том, что у беременной женщины с выявленной ВГС-инфекцией в настоящее время нет никаких вариантов лечения (во время родов). Противовирусные препараты прямого действия (ПППД), которые сейчас используются для лечения ВГС, имеют профили безопасности, аналогичные профилям безопасности других противовирусных препаратов, которые уже широко используются у беременных женщин, включая зидовудин, ламивудин, тенофовир и валацикловир. Рибавирин, обладающий тератогенным потенциалом, больше не является частью схем, используемых для первичного лечения ВГС. Хотя Daas еще не был одобрен для использования во время беременности, бесспорно, что обнаружение HCV-инфицированных женщин во время беременности является необходимым первым шагом.Также очень важно предупредить врачей о том, чтобы они проверили новорожденных на наличие инфекции. Женщина, которая идентифицирована как инфицированная, может получить лечение от ВГС после беременности и излечиться от инфекции. Сила лечения должна быть чрезвычайно убедительной. В нынешнюю эпоху употребления инъекционных наркотиков и увеличения числа случаев ВГС лучшей стратегией общественного здравоохранения по снижению распространенности и заболеваемости ВГС является выявление и лечение как можно большего числа молодых людей, чтобы уменьшить количество людей, способных заразить других.Что касается лечения ВГС во время родов, мы особо подчеркиваем слово «в настоящее время» в этом предложении, поскольку ПППД обладают таким потенциалом при достаточно короткой продолжительности лечения, чтобы вписаться в позднюю беременность. В настоящее время продолжаются клинические испытания ПППД на беременных женщинах, которые в ближайшем будущем станут полезными для этой практики (Clinicaltrials.gov # NCT02683005).
Несмотря на отсутствие в настоящее время вариантов лечения, SMFM рекомендует избегать мониторинга кожи головы плода, длительного разрыва плодных оболочек, эпизиотомии и взятия проб ворсинок хориона у беременных женщин, инфицированных ВГС [2].Также может быть рассмотрен вопрос о тщательном удалении материнской крови и выделений перед введением витамина К новорожденным. Риск, связанный с амниоцентезом у женщин с ВГС, следует учитывать при информированном согласии на эту процедуру. Также важно сообщить об отсутствии доказательств в пользу планового кесарева сечения у женщин, инфицированных ВГС, чтобы избежать ненужного риска и затрат.
Еще одним аргументом против универсального скрининга на ВГС является необходимость обработки или повторного тестирования «ложноположительных» результатов на антитела.В то время как 15–25% женщин, у которых есть антитела к ВГС, могут быть отрицательными на РНК ВГС в сыворотке, а небольшая часть женщин может быть «ложноположительной», все положительные скрининговые тесты на ВГС нуждаются в последующем тестировании на РНК ВГС для выявления хронической инфекции. точно так же, как скрининговые тесты на антитела к ВИЧ и HBV нуждаются в подтверждении вестерн-блоттингом или тестированием на нуклеиновые кислоты [27]. Скрининговые тесты, положительные или ложные, как и любой другой скрининговый тест, требуют подтверждения. Следует отметить, что положительный результат теста на антитела к ВГС может быть суррогатным маркером употребления инъекционных наркотиков в прошлом или в настоящем и должен вести к консультированию по вопросам снижения вреда и доступа к шприцам для снижения риска повторного заражения в будущем.
Третий аргумент заключается в том, что дополнительная стоимость тестирования будет обременительной. Учитывая, что образцы крови уже берутся на ранних сроках беременности для общего анализа крови, определения группы крови, краснухи, гепатита В и тестирования на ВИЧ, дополнительных посещений или флеботомии для добавления тестирования на ВГС не потребуется. В прошлом стратегия объединения образцов для серийного тестирования использовалась как средство для снижения затрат на скрининг и потенциально снижения количества ложноположительных тестов при состояниях с низкой распространенностью [28].Однако стоимость теста на анти-ВГС (иммуноферментный тест) довольно скромна [29], а экономическая эффективность обычного скрининга ожидается даже в популяциях с очень низкой распространенностью [22]. Многие из этих проблем уже решены в отношении ВИЧ, ВГВ и некоторых других инфекций, все из которых гораздо менее распространены, чем ВГС, и все они приводят к меньшему количеству инфекций у младенцев, чем ВГС сейчас.
Наконец, часто высказываются опасения, что всеобщий скрининг может привести к увеличению частоты кесарева сечения из-за опасений по поводу передачи инфекции.Стоит отметить, что никогда не было доказано, что кесарево сечение защищает от ПМР ВГС [30–32]. Кесарево сечение не рекомендуется беременным женщинам, инфицированным ВГС, за исключением случаев, когда это показано на основании других акушерских факторов риска. Эта позиция изложена в документе SMFM, а также в рекомендациях AASLD / IDSA по ведению ВГС во время беременности [2, 7].
СИЛА ПРОТИВОВИРУСНЫХ ТЕРАПИЙ ПРЯМОГО ДЕЙСТВИЯ И ПРОГНОЗ В ВОЗМОЖНОЕ БУДУЩЕЕ
ПППД произвели революцию в терапии ВГС за очень короткое время.Раньше для лечения ВГС использовались сложные длительные методы лечения с серьезными побочными эффектами, которые приводили к успешным результатам только в половине случаев [33]. ПППД — это пероральные, хорошо переносимые препараты, которые можно принимать один раз в день, которые можно принимать всего 8 недель и которые приводят к «излечению» HCV более чем в 95% случаев [34–36]. Несмотря на то, что эти методы лечения все еще высоки, они снижаются. С 2014 по 2018 год ограничения государственной программы Medicaid на терапию ПППД, основанные на оценке фиброза или трезвом состоянии, постепенно отменялись [37].Если доказана безопасность и эффективность во время беременности, эти высокие показатели излечения с быстрым подавлением виремии ВГС в сочетании с короткой продолжительностью 8 недель означают, что лечение может быть легко достигнуто на поздних сроках беременности, но до родов. Поскольку наличие виремии является единственным абсолютным фактором риска передачи вируса от матери ребенку, если бы беременная женщина была излечена от инфекции ВГС, любой риск передачи инфекции младенцу был бы устранен [30, 31]. Такой результат устранит необходимость в обследовании младенцев, подвергшихся облучению.Обсуждение лечения во время беременности немного опережает обсуждение универсального скрининга, поскольку мы сначала должны создать системы для выявления женщин, инфицированных ВГС, и привлечь внимание к необходимости лечения в это время. Фармацевтические компании не будут рассматривать эту группу пациентов для лечения, если мы, как поставщики, не потребуем этого от них и не продемонстрируем, что мы будем использовать эти препараты во время беременности. Подход статус-кво скрининга на основе риска не позволяет нам использовать эту стратегию, в отличие от универсального скрининга.
ПОЧЕМУ СЕЙЧАС?
Почему мы должны начинать всеобщий скрининг сейчас, а не через несколько лет, когда данные показывают, что волна инфекций ВГС намного превысит нынешние показатели 29000 беременных женщин и 1700 инфицированных младенцев [13]? Помимо ранее заявленного факта, что текущая эпидемиология оправдывает изменения, требуется значительное время, чтобы добраться до точки, когда пациенты фактически проходят тестирование в соответствии с рекомендациями. Исследования неоднократно демонстрировали, что, несмотря на то, что скрининг бэби-бумеров является рекомендацией с 2012 года, многие взрослые, родившиеся в 1945–1965 годах, до сих пор не проходят скрининг на ВГС [38].Чем раньше мы начнем, тем быстрее мы достигнем нашей цели по устранению ВГС как проблемы общественного здравоохранения в Соединенных Штатах. Чем дольше мы ждем, тем больше возможностей для выявления вируса гепатита C WOCA упускается [39].
ВЫВОДЫ
Пришло время для всеобщего скрининга беременных женщин на ВГС. Текущая эпидемиология в масштабах страны оправдывает это, и потенциальные ограничения могут быть смягчены с помощью продуманных стратегий реализации. ПППД открывают будущее, в котором беременных женщин можно будет лечить после выявления, и всеобщий скрининг беременных женщин — важный первый шаг к этому будущему.AASLD / IDSA выпустила рекомендацию по универсальному скринингу, и есть надежда, что другие профессиональные организации заинтересованных сторон сделают то же самое. Это возможность для акушеров и других поставщиков медицинских услуг, которые оценивают беременных женщин, сыграть решающую роль в элиминации ВГС в Соединенных Штатах.
Банкноты
Благодарности. Все авторы являются членами совместной группы AASLD / IDSA «Руководство по ВГС: рекомендации по тестированию, ведению и лечению гепатита С.«Мы благодарим наших коллег в группе за их усилия по работе с нами и за их вклад в формирование мнения, выраженного в этой рукописи. Мы благодарим Скотта Холмберга за продуктивные научные обсуждения и редакционную помощь при подготовке этой рукописи.
Возможный конфликт интересов . M. M. J. сообщает о грантах от Gilead Sciences и AbbVie во время проведения исследования и личных гонорарах от Gilead Sciences, о грантах от Bristol Myers-Squibb и Roche / Genentech, а также о нефинансовой поддержке от Echosens помимо представленных работ.A.Y.K. сообщает о грантах от Gilead Sciences помимо представленных работ. M. G. P. сообщает о другом финансировании от Gilead и Merck, выходящем за рамки этой работы, и о супруге, которая работает на Hoffman La Roche. D. B. сообщает о нефинансовой поддержке со стороны AbbVie для предоставления исследуемого препарата в ходе исследования, спонсируемого Национальным институтом здравоохранения. T. B. сообщает о грантах от Gilead Sciences, AbbVie, Merck, Janssen, OraSure Technologies, Abbott, Quest Diagnostics и Walgreens помимо представленных работ. Р. Дж.сообщает о грантах от Gilead, AbbVie и Merck во время проведения исследования. Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1.
Ly
кН
,
Hughes
EM
,
Jiles
RB
,
Holmberg
SD
.
Рост смертности от вируса гепатита С в США, 2003–2013 гг.
.
Clin Infect Dis
2016
;
62
:
1287
—
8
.2.
Хьюз
BL
,
Страница
CM
,
Kuller
JA
.
Гепатит С у беременных: скрининг, лечение и ведение
.
Am J Obstet Gynecol
2017
;
217
:
B2
—
12
.3.
Морзе
А
,
Barritt
A
,
Jhaveri
R
.
Данные по гепатиту С в отдельных штатах поддерживают распространение скрининга за пределы бэби-бумеров на всех взрослых
.
Гастроэнтерология
2018
;
154
:
1850
—
1 e2
.4.
Будова
S
,
Марка
К
,
Эль-Камары
SS
.
Скрининг на гепатит С во время беременности с учетом риска менее надежен, чем универсальный скрининг: обзор ретроспективной карты
.
Открытый форум Infect Dis
2018
;
5
:
ofy043
.5.
Чаппелл
CA
,
Hillier
SL
,
Crowe
D
,
Meyn
LA
,
Bogen
DL
,
Krans
EE
.
Скрининг на вирус гепатита С среди детей, инфицированных во время беременности
.
Педиатрия
2018
;
141
:
e20173273
.6.
Бернштейн
HB
,
Дункельберг
JC
,
Лесли
KK
.
Гепатит С во время беременности в эпоху противовирусного лечения прямого действия: потенциальные преимущества универсального скрининга и дородовой терапии
.
Clin Obstet Gynecol
2018
;
61
:
146
—
56
.8.
Сурьяпрасад
AG
,
Белый
JZ
,
Xu
F
и др.
Возникающая эпидемия вирусных инфекций гепатита С среди молодых людей из других городов, употребляющих инъекционные наркотики, в США, 2006–2012 гг.
.
Clin Infect Dis
2014
;
59
:
1411
—
9
.9.
Инфекция вирусом гепатита С среди подростков и молодых людей: Массачусетс, 2002–2009 гг.
.
MMWR Morb Mortal Wkly Rep
2011
;
60
:
537
—
41
.10.
Использование усиленного эпиднадзора за инфекцией вируса гепатита С для выявления кластера среди молодых потребителей инъекционных наркотиков — Нью-Йорк, ноябрь 2004 г. — апрель 2007 г.
.
MMWR Morb Mortal Wkly Rep
2008
;
57
:
517
—
21
. 11.
Заметки с мест: инфекции вирусом гепатита С среди молодых людей — сельский Висконсин, 2010 г.
.
MMWR Morb Mortal Wkly Rep
2012
;
61
:
358
.12.
Зиббелл
JE
,
Iqbal
K
,
Patel
RC
и др.
Рост инфицирования вирусом гепатита С, связанного с употреблением инъекционных наркотиков, среди лиц в возрасте
.
MMWR Morb Mortal Wkly Rep
2015
;
64
:
453
—
8
. 13.
Ly
кН
,
Jiles
RB
,
Teshale
EH
,
Foster
MA
,
Pesano
RL
,
Holmberg
SD
.
Инфекция вирусом гепатита С среди женщин и детей репродуктивного возраста в США, 2006–2014 гг.
.
Ann Intern Med
2017
;
166
:
775
—
82
. 14.
Джавери
R
,
Grant
W
,
Kauf
TL
,
McHutchison
J
.
Бремя инфицирования вирусом гепатита С у детей: предполагаемые прямые медицинские расходы за 10-летний период
.
J Pediatr
2006
;
148
:
353
—
8
.15.
Патрик
SW
,
Бауэр
AM
,
Уоррен
MD
,
Джонс
TF
,
Вестер
C
.
Инфекция вирусом гепатита С среди рожениц — Теннесси и США, 2009–2014 гг.
.
MMWR Morb Mortal Wkly Rep
2017
;
66
:
470
—
3
.16.
Вт
т
,
Stockman
L
,
Martin
J
,
Guilfoyle
S
,
Vergeront
JM
.
Повышенный риск передачи вируса гепатита С от матери ребенку среди получателей Medicaid — Висконсин, 2011–2015 гг.
.
MMWR Morb Mortal Wkly Rep
2017
;
66
:
1136
—
9
.17.
Эль-Камары
SS
,
Hashem
M
,
Saleh
DA
и др.
Надежность основанного на оценке риска скрининга на вирус гепатита С среди беременных женщин в Египте
.
J Заражение
2015
;
70
:
512
—
9
. 18.
Роблин
DW
,
Smith
BD
,
Weinbaum
CM
,
Sabin
ME
.
Практика скрининга и распространенность ВГС в МСО, 2000–2007 годы
.
Am J Manag Care
2011
;
17
:
548
—
55
. 19.
Боаз
К
,
Fiore
AE
,
Schrag
SJ
,
Gonik
B
,
Schulkin
J
.
Практика скрининга и консультирования пациентов с вирусной инфекцией гепатита С, о которой сообщили акушеры-гинекологи
.
Infect Dis Obstet Gynecol
2003
;
11
:
39
—
44
.20.
Кумар
мл
,
Dawson
NV
,
McCullough
AJ
и др.
Следует ли всем беременным женщинам проходить скрининг на гепатит В
?
Ann Intern Med
1987
;
107
:
273
—
7
.21.
Профилактика перинатальной передачи вируса гепатита В: пренатальный скрининг всех беременных женщин на предмет поверхностного антигена гепатита В
.
MMWR Morb Mortal Wkly Rep
1988
;
37
:
341
—
6
, 51.22.
Ассуму
SA
,
Tasillo
A
,
Leff
JA
и др.
Экономическая эффективность одноразовых стратегий скрининга на гепатит С среди подростков и молодых людей в учреждениях первичной медико-санитарной помощи
.
Clin Infect Dis
2018
;
66
:
376
—
84
. 23.
Меллинс
CA
,
Чу
C
,
Malee
K
и др.
Соблюдение режима антиретровирусной терапии среди беременных и ВИЧ-инфицированных женщин в послеродовом периоде
.
AIDS Care
2008
;
20
:
958
—
68
.24.
Рейд
S
,
День
CA
,
Bowen
DG
и др.
Вертикальная передача гепатита С: тестирование и медицинское обслуживание
.
J Детский педиатр
2018
;
54
:
647
—
52
. 25.
Навате
RS
,
Касс
S
,
Фенкель
J
,
Роман
A
.
Сравнение дородового и послеродового направления в гепатолог по поводу инфекции гепатита С у матери (аннотация № 401)
. В:
37-е ежегодное собрание Общества медицины материнского плода: Встреча по беременности, Vol. 216: Американский журнал акушерства и гинекологии
,
2017
:
S240
. 26.
Кунцио
DE
,
Ньюберн
EC
,
Johnson
CC
,
Viner
KM
.
Неспособность проверить и идентифицировать перинатально инфицированных детей, рожденных от инфицированных вирусом гепатита С женщин
.
Clin Infect Dis
2016
;
62
:
980
—
5
. 27.
Саркар
м
,
Bacchetti
P
,
Tien
P
и др.
Расовые / этнические различия в спонтанном избавлении от ВГС у ВИЧ-инфицированных и неинфицированных женщин
.
Dig Dis Sci
2013
;
58
:
1341
—
8
. 28.
Куруц
JD
,
Cope
AB
,
Sampson
LA
и др.
Десять лет скрининга и тестирования на острую ВИЧ-инфекцию в Северной Каролине
.
J Acquir Immune Defic Syndr
2016
;
71
:
111
—
9
.29.
Рейн
DB
,
Smith
BD
,
Wittenborn
JS
и др.
Экономическая эффективность скрининга новорожденных на антитела к гепатиту С в учреждениях первичной медико-санитарной помощи США
.
Ann Intern Med
2012
;
156
:
263
—
70
.30.
Ceci
O
,
Margiotta
M
,
Marello
F
и др.
Вертикальная передача вируса гепатита С в когорте из 2447 ВИЧ-серонегативных беременных женщин: проспективное исследование, продолжающееся 24 месяца
.
J Педиатр Гастроэнтерол Нутр
2001
;
33
:
570
—
5
. 31.
Мачта
EE
,
Hwang
LY
,
Seto
DS
и др.
Факторы риска перинатальной передачи вируса гепатита С (ВГС) и естественное течение инфекции ВГС, приобретенной в младенчестве
.
J Infect Dis
2005
;
192
:
1880
—
9
. 32.
Джавери
R
,
Hashem
M
,
El-Kamary
SS
и др.
Вертикальная передача вируса гепатита С (ВГС) у 12-месячных младенцев, рожденных от инфицированных ВГС женщин, и оценка факторов риска для матери
.
Открытый форум Infect Dis
2015
;
2
:
ofv089
.33.
МакХатчисон
JG
,
Lawitz
EJ
,
Shiffman
ML
и др. ;
IDEAL Study Team
.
Пегинтерферон альфа-2b или альфа-2а с рибавирином для лечения инфекции гепатита С
.
N Engl J Med
2009
;
361
:
580
—
93
.34.
Каудли
кВ
,
Gordon
SC
,
Reddy
KR
и др. ;
Исследователи ИОН-3
.
Ледипасвир и софосбувир в течение 8 или 12 недель для лечения хронического гепатита С без цирроза печени
.
N Engl J Med
2014
;
370
:
1879
—
88
0,35.
Поле
JJ
,
Kowdley
KV
,
Coakley
E
и др.
Лечение ВГС ABT-450 / r-омбитасвиром и дасабувиром рибавирином
.
N Engl J Med
2014
;
370
:
1594
—
603
. 36.
Кво
г.
,
Poordad
F
,
Asatryan
A
и др.
Глекапревир и пибрентасвир дают высокий уровень ответа у пациентов с генотипом 1-6 ВГС без цирроза печени
.
J Hepatol
2017
;
67
:
263
—
71
0,38.
Джемал
А
,
Fedewa
SA
.
Последние модели тестирования на вирус гепатита С среди бэби-бумеров
.
Am J Prev Med
2017
;
53
:
31
—
3
.39.
Стром
BL
,
Бакли
ГДж.
Национальная стратегия ликвидации гепатитов B и C: отчет о втором этапе
.
Вашингтон, округ Колумбия
,
2017
.
© Автор (ы) 2018. Опубликовано Oxford University Press для Общества инфекционных болезней Америки. Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected].
Универсальный скрининг беременных на гепатит С более рентабелен, чем подход, основанный на оценке риска
Контактное лицо для СМИ: Нола Грунейзен
Телефон: 571-292-3068
Телефон на месте: 415-978-3601
Электронная почта: media @ aasld.org
САН-ФРАНЦИСКО — Предварительные данные нового исследования, представленного на этой неделе на The Liver Meeting®, проводимого Американской ассоциацией по изучению заболеваний печени, показали, что всеобщий скрининг беременных женщин из группы риска на вирус гепатита С (обычно называемый HCV ) инфекция — более эффективный и экономичный диагностический подход, чем скрининг на основе рисков.
За последние годы среди беременных женщин резко возросло
случая инфицирования ВГС (в значительной степени из-за эпидемии опиоидов).CDC и Американский колледж акушеров и гинекологов в настоящее время рекомендуют скрининг на основе риска, а универсальный скрининг рекомендован AASLD и Американским обществом инфекционных заболеваний в их Руководстве по ВГС.
«Примерно 50 процентов инфицированных ВГС не знают, что инфицированы. Диагностика — это первый шаг в увязке с лечением », — говорит Мишель Роуз, MBA, менеджер по инфекционным заболеваниям, Population Health, Norton Healthcare и соавтор исследования. «Исследования показывают, что большинство младенцев заражаются ВГС в процессе родов.Беременные женщины должны знать, что инфекция может быть передана их младенцу ». Роуз продолжает объяснять, что с эффективностью новых противовирусных препаратов прямого действия, излечивающими от 95 до 98 процентов пациентов, не получавших лечения, возможно искоренение инфекции.
При скрининге на ВГС положительный результат теста на антитела к ВГС подтверждается с помощью ПЦР на РНК ВГС. Соавторы этого исследования решили сравнить рентабельность двух методов тестирования в своем учреждении Norton Healthcare в Луисвилле, штат Кентукки.Они провели ретроспективный анализ скрининга, основанного на оценке риска, с 1 мая 2014 г. по 31 декабря 2015 г. и проспективный анализ всеобщего скрининга с 1 мая 2016 г. по 31 декабря 2017 г. Практика тестирования включала долю положительных результатов скрининга, и исследователи провели подтверждающие тесты между двумя периодами. Целью было проанализировать экономическую эффективность универсального скрининга.
Исследователи собрали данные о 19 452 беременных женщинах, которые были пациентами их больницы с 2014 по 2017 год.Они обнаружили, что универсальный скрининг не увеличивал вероятность положительного результата теста на антитела к ВГС, но был связан с повышенной вероятностью получения пациентом подтверждающего результата РНК. Хотя повышенная стоимость универсального скрининга составляет 308 долларов на пациента, это приводит к увеличению коэффициента экономической эффективности в размере 18 139 долларов на выявленную активную инфекцию, или 4662 доллара на каждый год жизни с поправкой на качество. Эта цифра, по мнению исследователей, ниже порога готовности платить с точки зрения экономической эффективности.
Основываясь на этом открытии, исследователи пришли к выводу, что скрининг на ВГС на основе оценки риска может привести к тому, что у значительного числа беременных женщин не будет правильно диагностирована активная инфекция, и это может привести к отсутствию связи с соответствующей помощью. Для сравнения, универсальный скрининг более рентабелен и должен проводиться в этой популяции пациентов, говорят они.
«Основываясь на результатах нашего исследования, мы надеемся, что учреждения, устанавливающие политику для скрининга на ВГС, быстро примут передовую практику авторефлексии всех скринингов на антитела к ВГС на количественный ПЦР-тест», — говорит Роуз.«Это позволит поставщикам услуг быстро выявлять активную хроническую инфекцию ВГС и впоследствии связывать этих пациентов с лечением или лечением».
Роуз отмечает, что и Norton Healthcare, и медицинская школа Университета Луисвилля выявляют около 100 новых хронических активных инфекций ВГС в месяц, и около 80 процентов этих пациентов беременны. Это приводит к следующим этапам исследований исследователя.
«Новый закон, SB250, рекомендует тестирование для детей, рожденных от беременной женщины с положительным результатом теста на гепатит С.Поэтому мы работаем над скринингом и увязкой со стратегиями ухода за младенцами и детьми, подвергшимися ВГС через пренатальную передачу и передачу в домашних условиях, а также над увязкой со стратегиями ухода за женщинами, у которых выявлен вирус гепатита С во время беременности ».
Мишель Роуз, MBA, представит эти результаты на пресс-конференции AASLD в комнате 312-314 конференц-центра Джорджа Р. Москоне в Сан-Франциско в субботу, 10 ноября, с 16:00 до 17:30. Исследование, озаглавленное «На основе риска вируса гепатита С против.Универсальный скрининг среди беременных женщин: внедрение и анализ экономической эффективности) »будет представлена в воскресенье, 11 ноября, в 10:30 в комнате 154/156. Соответствующий реферат (номер 0087) можно найти в журнале ГЕПАТОЛОГИЯ.
Беременность и помощь при гепатите С
Независимо от того, недавно ли у вас диагностировали гепатит C или вы уже некоторое время живете с ним, команда Norton Complex Care Clinics ответит на ваши вопросы и поможет вам в процессе лечения.Наша цель — убедиться, что вы знаете, чего ожидать, и что у вас и вашей семьи есть ответы, которые вам нужны.
Поскольку вирус гепатита С может передаваться ребенку во время беременности или родов, женщинам, у которых до беременности был диагностирован хронический гепатит С, следует обратиться за лечением и завершить его до зачатия.
Norton Healthcare проводит скрининг беременных женщин на гепатит С с 2016 года. В 2018 году наша команда поддержала законодателей в принятии закона, который поможет Кентукки стать первым штатом, внедрившим скрининг на гепатит С у всех беременных матерей во время их первого дородового визита.
Если вы беременны и имеете активную инфекцию гепатита С или недавно диагностированную инфекцию, наша команда в Norton Complex Care Clinics может помочь вам составить план, который лучше всего подходит для вас и вашего ребенка во время и после беременности. Наша команда разработает индивидуальный план лечения, который соответствует вашим непосредственным потребностям здоровья, а также потребностям после рождения ребенка и во время кормления грудью.
Клиники
Norton Complex Care Clinics создают атмосферу сострадания, которая поддерживает вас и отвечает на ваши вопросы на каждом этапе пути, чтобы убедиться, что вы полностью понимаете свой дородовой мониторинг и варианты послеродового лечения.Мы подключаем вас к ресурсам, которые могут вам понадобиться для лечения гепатита C, а также к ресурсам для скрининга вашего ребенка.
Когда обращаться за помощью
Женщины, у которых во время беременности диагностирован гепатит С, или беременные с известной инфекцией гепатита С, должны обратиться к врачу, который специализируется на лечении этой инфекции во втором или третьем триместре. Хотя женщины не могут лечиться во время беременности или кормления грудью, специалист проведет важное дородовое обучение, направленное на поддержание общего состояния здоровья матери и развивающегося ребенка.
Какую помощь я могу получить во время и после беременности при гепатите С?
Клиники
Norton Complex Care Clinics работают с вами, чтобы разработать план мониторинга и лечения для ваших уникальных потребностей. Многие факторы могут повлиять на план лечения гепатита С, включая ваш план кормления грудью, стадию заболевания печени, долгосрочные решения по планированию семьи и другие состояния здоровья, с которыми вы сталкиваетесь. Обычно в план лечения беременных женщин входят следующие этапы:
- Пренатальный визит: Включает в себя обзор вашего анамнеза, сбор анализов крови и обучение для получения рекомендаций по родам, грудному вскармливанию и методам предотвращения передачи вируса вашему ребенку или другим членам вашего домохозяйства
- Послеродовое тестирование : Последующее обследование матери на гепатит С через шесть недель.Исследования показывают, что некоторые женщины спонтанно избавляются от инфекции гепатита С после родов, в то время как у других развивается хронический гепатит С. Единственный способ узнать наверняка — пройти повторное обследование. Вашему ребенку потребуется последующее обследование, чтобы определить, передалась ли инфекция, и ваш врач может порекомендовать лучший возраст для завершения обследования.
- Лечение : Если ваша инфекция не исчезла, наша команда вместе с вами разработает план лечения.
Филиалы
Свяжитесь с одним из отделений клиники Norton Complex Care Clinic, чтобы записаться на прием.
Клиника комплексного ухода Norton — Центр города
Институт рака Нортона — Центр города
676 S. Floyd St., нижний этаж
Луисвилл, KY 40202
Телефон: (502) 629-2500
Клиника комплексного ухода Norton — Коридон
Больница округа Харрисон
Медицинский павильон, офис 110
1263 Hospital Drive NW
Коридон, ИН 47112
Телефон: (812) 734-0912
А ФАЗА 1 ИЗУЧЕНИЕ ЛЕДИПАСВИРА / СОФОСБУВИРА У БЕРЕМЕННЫХ С ВИРУСОМ ГЕПАТИТА C
Инфекция вирусом гепатита C (ВГС) растет среди беременных женщин в Соединенных Штатах, что увеличивает риск перинатальной передачи.Беременность — это окно возможностей для медицинских вмешательств, включая лечение ВГС, которое может улучшить здоровье матери и предотвратить перинатальную передачу ВГС. Нет опубликованных данных о безопасности или эффективности противовирусных препаратов прямого действия при беременности. Таким образом, основной целью этого пилотного исследования было определение безопасности и вирусологического ответа на терапию ледипасвиром 90 мг-софосбувиром 200 мг (LDV / SOF) во время беременности.
В это открытое исследование фазы 1 были включены ВИЧ-отрицательные беременные женщины с хронической инфекцией HCV генотипа 1 между 23-24 неделями беременности и начавшие 12-недельный курс LDV / SOF.Участники должны были получить не менее 73 (87%) запланированных доз, чтобы их можно было оценить. Тестирование вирусной нагрузки проводилось при 7 посещениях: скрининг, набор, 13-21 день и 5-6 недель после начала LDV / SOF, 1-7 дней и 12 недель после завершения LDV / SOF и при родах. Сообщается о нежелательных явлениях у матери, исходах родов и устойчивом вирусологическом ответе через 12 недель после терапии (УВО12), определяемом как неопределяемая вирусная нагрузка ВГС.
Из 28 беременных женщин с хроническим ВГС, прошедших скрининг, 20 были исключены из-за инфекции генотипа 2 или 3 (n = 10), продолжающегося употребления запрещенных наркотиков (n = 4), снижения участия в исследовании (n = 3), намерения родить ребенка -сайта (n = 2) и оценка APRI> 1 (n = 1).В исследование были включены восемь женщин, все из которых были белыми, со средним возрастом 32 (от 25 до 38) лет. Семь женщин были инфицированы ВГС из-за внутривенного употребления наркотиков, 4 из которых получали опиоидную фармакотерапию, а одна была инфицирована перинатально. Из 7 поддающихся оценке пациентов средняя вирусная нагрузка HCV при включении в исследование составила 518 173 (диапазон 103 457-3 757 923) копий / мл. У всех был быстрый ответ на терапию, и у всех был достигнут УВО12 (таблица). Все нежелательные явления, связанные с LDV / SOF, были ≤ степени 2. Все семь участников родили в срок с неопределяемой вирусной нагрузкой HCV на момент родов.Годовое наблюдение за младенцами продолжается.
В этом первом исследовании лечения ВГС у беременных женщин реакция на LDV / SOF была аналогична вирусной реакции, наблюдаемой у небеременных, без каких-либо выявленных проблем безопасности. Прежде чем можно будет рекомендовать эту стратегию, необходимы более масштабные исследования. Значительная часть женщин прошла скрининг из-за инфекции генотипа 2 или 3, что подчеркивает важность дальнейших исследований для расширения возможностей лечения ВГС во время беременности.
Hep C и беременность | Тесты для беременных мам и младенцев
Наличие гепатита С обычно не влияет на вашу беременность. Беременность обычно не влияет на уровень гепатита С.
Могу ли я родить ребенка, если у меня гепатит C?
Hep C обычно не влияет на вашу способность забеременеть. Очень небольшое количество детей может родиться с гепатитом С, но половина из них избавится от гепатита С в первый год жизни.
Но если у вас печени цирроз и вы хотите создать семью, поговорите со своим врачом клиники печени или со своим специалистом, прежде чем забеременеть.
Обследование на гепатит С при беременности
Когда вы беременны, вам, вероятно, сделают много анализов. В рамках программы вы, скорее всего, пройдете тест на гепатит С. Первый тест на гепатит С (тест на антитела) скажет вам, был ли у вас когда-либо гепатит С. Если первый тест окажется положительным, вас попросят принять еще один тест. Второй тест на гепатит С (тест ПЦР) скажет вам, есть ли у вас гепатит С. Затем ваш врач или медсестра будут работать с вами, чтобы сохранить ваше здоровье и здоровье вашего ребенка, насколько это возможно, во время беременности и родов.
Как гепатит С передается младенцам?
Большинство младенцев не подвержены риску заражения вирусом гепатита С у мамы. Из всех мам с гепатитом С менее 6 из 100 детей будут рождены с гепатитом С.
Hep C передается через контакт кровь-кровь . Если ребенок рождается с гепатитом С, он передается либо в утробе матери, либо во время родов.
Hep C не передается вашему ребенку через грудное молоко. Матерям рекомендуется кормить грудью независимо от того, есть ли у них гепатит С.Если ваши соски потрескались и кровоточат, прекратите грудное вскармливание, пока они не заживут. Для получения дополнительной информации позвоните на информационную линию по гепатиту или прочтите информационный бюллетень «Беременность, младенцы и дети» .
Нужно ли мне кесарево сечение, если у меня гепатит C?
Нет, вы все еще можете родить естественным путем, если у вас гепатит С. Кесарево сечение не принесет никакой пользы ни вам, ни вашему ребенку. Врач может порекомендовать кесарево сечение по другим медицинским причинам, но не потому, что у вас гепатит С.
Когда проверять ребенка на гепатит C
Вашему ребенку нужно будет сдать анализ на гепатит C только в том случае, если у вас был гепатит C во время беременности.
Ваш ребенок может пройти ПЦР-тест в возрасте 8 недель, а затем 14 недель. Это покажет, есть ли у вашего ребенка гепатит С на момент обследования. Дети, рожденные с гепатитом С, имеют 50% шанс вылечиться в первый год жизни. В 18 месяцев ваш ребенок может пройти тест на антитела, чтобы проверить, избавился ли он от вируса.
Что произойдет, если мой ребенок родится с гепатитом С?
Если ребенок рождается с гепатитом С, у него будет 50% шанс избавиться от инфекции естественным путем.Это произойдет в течение первых 12 месяцев их жизни.
Детям с хроническим гепатитом С будет полезно обратиться к педиатру (детскому специалисту по здоровью), который сможет контролировать их гепатит С. В детстве гепатит С протекает в легкой форме с очень незначительным воспалением печени.
Нет необходимости рассказывать другим людям о статусе гепатита С у вашего ребенка. Это означает, что вы не обязаны сообщать другим членам семьи, персоналу по уходу за детьми, школам, няням, друзьям ребенка или спортивным группам
За дополнительной информацией обращайтесь к клинической медсестре-специалисту отделения гастроэнтерологии Детской больницы в Вестмиде по телефону 9845 3999 >>
.
Следует ли мне избегать лечения гепатита С во время беременности?
ПППД для беременных и кормящих женщин не рекомендуется.Женщинам рекомендуется подождать 4 недели после лечения, прежде чем пытаться создать семью и забеременеть.
Очень важно поговорить со своим врачом о лечении, беременности и контрацепции.
Хотите узнать больше о гепатите С и беременности?
Если вы хотите узнать больше о том, как гепатит С может повлиять на вашу беременность, ребенка или ребенка, позвоните по телефону Инфолиния по гепатиту сегодня.
Вы также можете посетить нашу подробную страницу по гепатиту C, просмотреть нашу таблицу тестов на гепатит C или прочитать информационный бюллетень «Беременность, младенцы и дети» для получения дополнительной информации.
Инфекция вирусом гепатита C во время беременности и риск передачи от матери ребенку
Alter M: Передача вируса гепатита C — путь, доза и титр. Медицинский журнал Новой Англии 1994, 330: 784–786.
Google Scholar
Polywka S, Laufs R: Антитела к вирусу гепатита C среди различных групп риска и пациентов с подозрением на гепатит не-A, не-B. Инфекция 1991, 19: 81–84.
Google Scholar
Feucht HH, Polywka S, Zöllner B, Laufs R: большее количество РНК HCV в слезах по сравнению с кровью. Микробиология и иммунология 1994, 38: 157–158.
Google Scholar
Огасавара С., Каге М., Косай К.И., Шимамацу К., Кодзиро М.: РНК вируса гепатита С в слюне и грудном молоке матерей-носителей гепатита С. Ланцет 1993, 341: 561.
Google Scholar
Kudesia G, Ball G, Irving WL: Вертикальная передача гепатита C. Lancet 1995, 345: 1122.
Google Scholar
Maggiore G, Ventura A, De Giacomo C, Silini E, Cerino A, Mondelli MU: Вертикальная передача гепатита C. Lancet 1995, 345: 1122.
Google Scholar
Уэхара С., Абэ Ю., Сайто Т., Йошида Ю., Вагацума С., Окамура К., Ядзима А., Мандай М.: Частота вертикальной передачи вируса гепатита С.Журнал экспериментальной медицины Тохоку, 1993, 171: 195–202.
Google Scholar
Мацубара Т., Сумазаки Р., Такита Х: Передача вируса гепатита С от матери ребенку: перспективное исследование. Европейский журнал педиатрии, 1995, 154: 973–978.
Google Scholar
Пипан С., Амичи С., Астори Г., Сечи Г.П., Ботта Г.А.: Вертикальная передача вируса гепатита С у беременных из группы низкого риска.Европейский журнал клинической микробиологии и инфекционных заболеваний, 1996 г., 15: 116–120.
Google Scholar
Zanetti AR, Tanzi E, Paccagnini S, Principi N, Pizzocolo G, Caccamo ML, D’Amico E, Cambiè G, Vecchi L и Ломбардийская исследовательская группа по вертикальной передаче: передача от матери ребенку вируса гепатита С. Ланцет 1995, 345: 289–291.
Google Scholar
Lam JP, McOmish F, Burns SM, Yap PL, Mok JY, Simmonds P: Редкая вертикальная передача вируса гепатита С. Журнал инфекционных болезней 1993, 167: 572–576.
Google Scholar
Feucht HH, Zöllner B, Polywka S, Laufs R: Исследование надежности коммерчески доступных тестов на антитела к вирусу гепатита C. Журнал клинической микробиологии, 1995, 33: 620–624.
Google Scholar
Chomczynski P, Sacchi N: Одностадийный метод выделения РНК кислотной экстракцией тиоцианат-фенол-хлороформ гуанидия. Аналитическая биохимия 1987, 162: 156–159.
Google Scholar
Reuter D, Polywka S, Iske L, Feucht HH, Laufs R: Тесная корреляция между серологией вируса гепатита C и полимеразной цепной реакцией у хронически инфицированных пациентов, Infection 1992, 20: 20–323.
Google Scholar
Мория Т., Сасаки Ф., Мидзуи М., Оно Н., Мори Х., Миширо С., Йошизава Х .: Передача вируса гепатита С от матери младенцу: его частота и факторы риска. Биомедицина и фармакотерапия 1995, 49: 59–64.
Google Scholar
Ohto H, Terazawa S, Sasaki N, Sasaki N, Hino K, Ishiwata C, Kako M, Ujiie N, Endo C, Matsui A, Okamoto H, Mishiro S, и вертикальная передача вируса гепатита C Совместная исследовательская группа: Передача вируса гепатита С от матери младенцу.Медицинский журнал Новой Англии 1994, 330: 744–750.
Google Scholar
Lin HH, Kao JH, Hsu HY, Ni YH, Chang MH, Huang SC, Hwang LH, Chen PJ, Chen DS: Отсутствие инфекции у грудных детей, рожденных от инфицированных вирусом гепатита матерей. Журнал педиатрии 1995, 126: 589–591.
Google Scholar
Lazizi Y, Dubreuil P, Pillot J: Избыток HBcAg у носителей хронического вируса гепатита B, отрицательных по Hbc.Гепатология 1993, 17: 966–970.
Google Scholar
Manzini P, Saracco G, Cerchier A, Riva C, Musso A, Ricotti E, Palomba E, Scolfaro C, Verme G, Bonino F, Tovo PA: Инфекция вируса иммунодефицита человека как фактор риска для Передача вируса гепатита С у детей: устойчивость вируса гепатита С у детей связана с иммуноблоттингом матери против вируса гепатита С. Гепатология 1995, 21: 328–332.
Google Scholar
Серопространственность и эпидемиология вирусов гепатита B и C у беременных женщин в Испании. Факторы риска вертикальной передачи
Аннотация
Предпосылки и цель
Во всем мире принимаются меры по искоренению вирусов гепатита B (HBV) и C (HCV), которые могут передаваться от матери во время родов. Это исследование направлено на определение распространенности ВГВ и ВГС у беременных женщин в Испании, уделяя особое внимание стране происхождения, эпидемиологическим факторам и риску вертикальной передачи (ЖТ).
Методология
Многоцентровое открытое когортное исследование, проведенное в 2015 году. Распространенность ВГВ была определена у 21870 беременных женщин, а распространенность ВГС — у 7659 беременных. Эпидемиологические факторы и факторы риска ЖТ были проанализированы у положительных женщин, а также изучены различия между случаями ВГВ и ВГС.
Результаты
Распространенность ВГВ составила 0,42% (91/21870), а распространенность ВГС — 0,26% (20/7659). Среди женщин с ВГВ 65,7% (44/67) были мигрантами. Путь передачи ВГВ матери в 40 лет был неизвестен.3% случаев (27/67) и ЖТ в 31,3% (21/67). Среди факторов риска ЖТ 67,7% (42/62) женщин имели виремию, а 14,5% (9/62) имели положительный результат на HBeAg. Все новорожденные, рожденные от HBV-положительных матерей, прошли иммунопрофилактику, и ни один из них не заразился ЖТ. У 80% (16/20) женщин с ВГС путь передачи был парентеральным, а девять употребляли наркотики внутривенно. Виремия присутствовала у 40% (8/20) женщин, и у 10% (2/20) была коинфекция ВИЧ. Дети не были инфицированы. Женщины с ВГС реже кормят ребенка грудью, чем женщины с ВГВ (65% vs.86%).
Выводы
Распространенность, полученная в нашем исследовании беременных женщин, ниже, чем ранее задокументированные для населения в целом. Среди женщин с ВГВ большинство были мигрантами и имели семейный анамнез инфекции, в то время как среди женщин с ВГС наиболее распространенным фактором было внутривенное употребление наркотиков. Несмотря на наблюдаемые факторы риска ЖТ, ни один из детей не был инфицирован. Надлежащая иммунопрофилактика необходима для предотвращения ЖТ у детей, рожденных от HBV-положительных женщин.
Образец цитирования: Ruiz-Extremera Á, Díaz-Alcázar MdM, Muñoz-Gámez JA, Cabrera-Lafuente M, Martín E, Arias-Llorente RP, et al. (2020) Распространенность и эпидемиология вирусов гепатита B и C у беременных женщин в Испании. Факторы риска вертикальной передачи. PLoS ONE 15 (5):
e0233528.
https://doi.org/10.1371/journal.pone.0233528
Редактор: Анна Крамвис, Университет Витватерсранда, ЮЖНАЯ АФРИКА
Поступила: 13 января 2020 г .; Дата принятия: 6 мая 2020 г .; Опубликовано: 21 мая 2020 г.
Авторские права: © 2020 Ruiz-Extremera et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Это исследование получило финансовую помощь от следующих организаций: Ciberehd, Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III. ISCIII, Proyecto del Plan Nacional I + D + i 2013-2016 (PI13 / 01925), Confinanciación Fondos FEDER.Программа стипендий Галаад (GLD14-00292 и GLD15-00307).
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
По данным Всемирной организации здравоохранения (ВОЗ) [1], хроническая инфекция вирусом гепатита B (HBV) поражает 257 миллионов человек. Это особенно распространено в Африке к югу от Сахары и в Восточной Азии, поражая 5–10% всего взрослого населения, тогда как в Северной Америке инфицировано менее 1%. По оценкам, распространенность в Восточной Европе составляет менее 5%, 1.5% в Северной Европе, 2% в Южной Европе и 1% в Западной Европе. Однако эти значения, вероятно, занижены, потому что, помимо прочего, данные получены от доноров крови [2]. Более того, на ситуацию в Европе может негативно повлиять изменение моделей миграции [3,4]. Согласно систематическому обзору, проведенному Европейским центром профилактики и контроля заболеваний (ECDC) [5] на основе статей, опубликованных с 2005 по 2015 год, распространенность в Испании составила около 0,8% (0,6–1.1), а согласно последнему доступному отчету [3] — 0,66% (0,34–0,97).
По данным ВОЗ, 71 миллион человек инфицирован вирусом гепатита С (ВГС) [1], и что наиболее сильно пораженными регионами являются Европа и Восточное Средиземноморье (2,3%). В Европе распространенность антител к ВГС (анти-ВГС) оценивается в 1,1% (95% ДИ 0,9–1,4) [5]. В Испании распространенность антител составляет 1,7%, а виремии (положительная РНК ВГС) — 1,2% [6]. В когорте Ethon [7] распространенность положительных анти-HCV (anti-HCV + ve) составляла 1.23% и только 0,32% страдали виремией. Однако на эту распространенность могут повлиять изменения в моделях миграции в Европе, особенно в Испании [8].
В Испании распространенность инфекции HBV (положительный поверхностный антиген) у беременных колеблется от 0,1% до 4,4% [5,9,10]. Вертикальная передача (VT) HBV продолжает оставаться одним из основных путей заражения во всем мире [11], особенно в регионах, где он эндемичен [12]. Высокая вирусная нагрузка (ВН), которая в основном поражает HBeAg-положительных (HBeAg + ve) женщин, является наиболее важным фактором риска, хотя женщины с HBeAg-отрицательными (HBeAg-ve) и с высокой ВН также подвержены риску передачи. [13].В этой популяции сообщалось о 90% хронических инфицированных новорожденных [14].
Распространенность анти-ВГС у беременных женщин в Испании оценивается в 0,5–1,4% [9,15,16], а распространенность виремии — 42–72%. Частота ЖТ среди женщин с ВГС низкая: 1–8% у матерей без коинфекции и около 20% у матерей с коинфекцией ВИЧ. Однако 90% инфицированных детей заражаются вирусом ЖТ. Факторами, связанными с ЖТ при ВГС, являются коинфекция ВН и ВИЧ [17–19]. Никакие другие факторы, связанные с родами, эпидемиологией или грудным вскармливанием, не были связаны с ЖТ.
Скрининг на ВГВ у беременных обычно рекомендуется, поскольку возможна иммунопрофилактика против ЖТ [12,20]. По данным 2015 года, генерализованная иммунопрофилактика при рождении снизила долю хронически инфицированных детей в возрасте до пяти лет с 4,7% до 1,3% [1]. Тем не менее до 10% новорожденных, матери которых имеют высокий ВН, становятся инфицированными [14,21]. Соответственно, у HBV + ve женщин рекомендуется оценивать ВН на 24 неделе беременности и назначать противовирусное лечение, если ВН высока.С другой стороны, определение ВГС во время беременности рекомендуется только для групп риска, таких как потребители инъекционных наркотиков, женщины с сексуальной практикой высокого риска, женщины с коинфекцией ВИЧ и женщины, родившиеся в странах с высокой эндемичностью по ВГС. Следовательно, распространенность, указанная в литературе, может не соответствовать действительности. В настоящее время реализуются профилактические и терапевтические меры по искоренению ВГВ и ВГС. Дети, инфицированные ЖТ, должны быть включены в эту программу, но скрининг на ВГС во время беременности еще не является универсальным, и поэтому у некоторых детей, инфицированных ЖТ, диагноз не будет диагностирован.
Принимая во внимание эти соображения, основной целью данного исследования является определение распространенности ВГВ и ВГС у беременных женщин в Испании с учетом страны их происхождения, эпидемиологических факторов и риска ЖТ.
Материал и метод
Пациенты
Для определения распространенности ВГВ и ВГС в популяции беременных женщин с января по декабрь 2015 г. было проведено многоцентровое проспективное открытое когортное исследование. В нем приняли участие следующие больницы: Hospital Universitario 12 de Octubre Madrid (HU12O), Госпиталь Университет Ла-Пас в Мадриде (HULP), Университетская больница Сан-Сесилио Гранада (HUSC), Университетская больница Вирхен-де-лас-Ньевес Гранада (HUVN), Центральная больница Астурии в Овьедо (HUCA), Больница Universitario Torrecárdenas Almería (HUT), Больница Вирхен-Дели. Росио Севилья (HUVR) и Университетская больница Вирхен-де-ла-Виктория Малага (HUVV).
Население, проанализированное в исследовании распространенности ВГВ, состояло из 21870 беременных женщин, данные которых были предоставлены исследователями в каждой больнице из анонимной базы данных, управляемой ее Службой микробиологии, которая собирает и обрабатывает эти данные в соответствии с обычной клинической практикой во время беременности. После родов матери, у которых был обнаружен вирус гепатита В (HBV + ve), были приглашены для участия в исследовании, заполнив эпидемиологическое обследование, указав свою страну происхождения и предоставив подробную информацию о родах.В каждом случае было получено информированное согласие матери. Кроме того, была запрошена сдача образцов крови от каждой матери и ребенка вместе с согласием на медицинское наблюдение новорожденного в течение 18 месяцев. На рис. 1 показана блок-схема набора этих участников.
В Испании определение ВГС не является частью обычной клинической практики, поэтому информированное согласие в этом отношении запрашивалось и получалось в каждом случае, включенном в это исследование. Соответственно, тесты на ВГС были проведены у 7659 женщин на 12 неделе беременности во время планового посещения больницы для выявления хромосомопатий.После родов матери, у которых был обнаружен вирус гепатита С (HCV + ve), были приглашены для участия в исследовании, заполнив эпидемиологическое обследование, указав свою страну происхождения и предоставив подробную информацию о родах. В каждом случае на этот счет было получено информированное согласие. Кроме того, была запрошена сдача образцов крови матери и ребенка вместе с согласием на медицинское наблюдение новорожденного в течение 18 месяцев. На рис. 1 показана блок-схема набора этих участников.
Критерии включения: положительный поверхностный антиген HBV (HBsAg + ve) или статус анти-HCV + ve, подтвержденный иммуноферментным анализом (ELISA) и предоставление информированного согласия.
Эпидемиологическое исследование
Переменными исследования были возраст участника, страна происхождения и факторы риска заражения. Рассматриваемые факторы риска включали переливание крови, внутривенное употребление наркотиков (IVDA), татуировки, пирсинг, хирургическое вмешательство, стоматологическое лечение, инфицированный партнер, сексуальные практики с высоким риском, история инфекции у матери или братьев и сестер участника и коинфекция ВИЧ, классифицированные как да, нет или неизвестно.В ходе опроса также спрашивали, знала ли женщина об инфекции до беременности. Пути передачи инфекции классифицировались как вертикальный, парентеральный, половой или неизвестный.
Факторы риска вертикальной передачи
Антиген E (HBeAg) и антитело E (анти-HBe) анализировали на HBV, а VL анализировали на HBV и / или HCV.
HBV + ve женщин были классифицированы в соответствии с Руководством по клинической практике EASL [22] как HBeAg-положительная хроническая инфекция (HBeAg + ve и ДНК> 10 7 МЕ / мл), HBeAg-положительный хронический гепатит (HBeAg + ve и ДНК 10 4 −10 7 МЕ / мл), HBeAg-отрицательная хроническая инфекция (HBeAg-ve и ДНК <2000 МЕ / мл) и HBeAg-отрицательный хронический гепатит (HBeAg-ve и ДНК> 2000 МЕ / мл) .
Другая информация, собранная для исследования, включала данные о беременности и родах, включая экстракорпоральное оплодотворение, противовирусное лечение HBV во время беременности, тип родов, срок беременности, время, прошедшее с момента выхода из воды, вес, оценку новорожденного по шкале Апгар. при рождении и типе лактации.
Протокол исследования такой же, как был описан в предыдущих исследованиях этой исследовательской группы (17–19).
Анализ различий между HBV и HCV
Зависимая переменная: HBV + ve по сравнению с HCV + ve.Остальные переменные считались независимыми.
Вирусологические анализы
Серологическое определение HBsAg, анти-ВГС и анти-ВИЧ проводилось с помощью коммерческого ИФА, который обычно используется в лабораториях каждой из участвующих больниц.
ВН ВГВ и / или ВГС определяли с помощью COBAS TaqMan (пороговое значение <12 МЕ / мл, <15 МЕ / мл. Roche Diagnostics, соответственно), делая различие между не обнаруженными, ниже порогового значения, но не поддающимся количественной оценке и большим. чем отсекаемые и поддающиеся количественной оценке.У женщин с HBV + ve также определялись HBeAg и анти-HBe.
Статистический анализ
В нашем статистическом анализе количественные переменные описываются средним значением и стандартным отклонением, или, в случаях ненормального распределения, медианой и межквартильным размахом. Качественные переменные представлены как абсолютные и относительные частоты. Также были рассчитаны соответствующие распространенности и 95% доверительные интервалы. Межгрупповые различия определяли с помощью двумерного анализа с использованием критерия хи-квадрат Пирсона или точного критерия Фишера для качественных переменных и t-критерия Стьюдента или U-критерия Манна-Уитни для непрерывных переменных.Нормальность распределения данных проверялась тестом Колмогорова-Смирнова. Значение p <0,05 считалось значимым. Все анализы данных проводились с использованием статистического программного обеспечения IBM SPSS 19.
Этические соображения
Это исследование было проведено в соответствии с этическими принципами Хельсинкской декларации 1975 года, пересмотренной в 2013 году. Все участники дали письменное и устное информированное согласие. Протокол исследования был сначала одобрен Комитетом по этике провинции Гранада (Комитет по этике больницы главного исследователя), а затем Комитетом по этике в каждой участвующей больнице.Соответствующие положения испанского законодательства о защите данных соблюдались на всех этапах исследования.
Результаты
Распространенность ВГВ и ВГС у беременных
Проспективная когорта для исследования HBV состояла из 21870 беременных женщин, из которых 91 была HBsAg + ve, с распространенностью 0,42% (95% ДИ 0,33–0,50). В таблице 1 показано распределение среди участвующих больниц. Когорта для исследования ВГС включала 7659 женщин, из которых 20 были анти-ВГС + ve, с распространенностью 0.26% (95% ДИ 0,15–0,38). Распространенность HBV значительно различалась среди больниц (p = 0,013), самая низкая в HUCA и самая высокая в HULP, HUT и HUVR. С другой стороны, различия между больницами по распространенности анти-ВГС не были значительными (p = 0,52).
Эпидемиология и факторы риска вертикальной передачи у HBV-положительных женщин
Из 67 женщин, включенных в исследование, 31 (46,3%) знала об инфекции до беременности. Ни один из них не был инфицирован ВГС, и был один случай (1.5%) коинфекции с ВИЧ. По стране рождения 22 человека (32,8%) были испанцами, за ними по частоте следуют выходцы из Китая и Восточной Европы (рис. 2). Факторы риска инфицирования этих беременных женщин показаны в таблице 2. Путь передачи был парентеральным в 14 случаях (20,9%), вертикальным — в 21 (31,3%), половым — в 3 (4,5%) и неизвестным — в 27 (40,3%). %). 13 (61,9%) женщин с ЖТ были иностранками.
Рис. 2. Географическое происхождение беременных с инфекцией HBV или HCV.
На этом рисунке показано географическое происхождение беременных женщин с инфекцией HBV или HCV, которые участвовали в эпидемиологическом исследовании, выраженное в относительной частоте.
https://doi.org/10.1371/journal.pone.0233528.g002
Из 62 HBsAg + ve женщин, предоставивших образцы, 42 (67,7%) страдали виремией. Девять (14,5%) были HBeAg + ve и один (с беременностью двойней) имел хроническую инфекцию с ВН 2070 МЕ / мл на момент родов. Из восьми женщин с хронической инфекцией HBeAg + ve шесть лечились во время беременности: у трех была достигнута неопределяемая ВН до родов, а у трех других максимальная ВН составила 1448 МЕ / мл.Две женщины с HBeAg + ve, которые не получали лечения, имели VL> 10 8 МЕ / мл. Две женщины из HBeAg + ve были испанками, пять — китаянками, одна — из Центральной Америки и одна — из Африки к югу от Сахары. За десятью новорожденными наблюдали после рождения, и ни один из них не заразился. Из 53 (85,5%) женщин с HBeAg-ve у 40 была хроническая инфекция, а у 13 — хронический гепатит.
Ни одна из беременностей не наступила при экстракорпоральном оплодотворении. Роды были самопроизвольными в 47 (72,3%) случаях, кесаревым сечением — в 13 (20%) (два из которых были запланированы) и инструментальными родами — в пяти (7.7%). Данные по 69 новорожденным сведены в Таблицу 3. Только один из детей с низкой массой тела в анамнезе матери проходил противовирусное лечение. Из 30 новорожденных, у которых ВН была проанализирована при рождении, двое были HBV + ve, хотя более поздние тесты были отрицательными. Все новорожденные, рожденные от женщин с HBsAg + ve, получали иммунопрофилактику в течение первых двенадцати часов жизни, в среднем на 3,4 ± 3 часа. Десять детей, рожденных от женщин HBeAg + ve, получили иммунопрофилактику в первые три часа жизни. Ни один из 54 детей, прошедших наблюдение, не заразился.
Эпидемиология и факторы риска вертикальной передачи у женщин с ВГС
Тринадцать женщин (65%) ранее знали о своей инфекции ВГС. Ни один из них не был инфицирован HBV, и было два случая (10%) коинфекции с ВИЧ. По странам происхождения большинство женщин были из Испании (11 случаев, 55%) и Восточной Европы (четыре случая, 20%) (рис. 2). Факторы риска инфекции подробно описаны в таблице 2. Путь передачи был парентеральным у 16 женщин (80%), из которых девять имели в анамнезе IVDA.Путь передачи неизвестен в четырех случаях (20%).
РНК HCV была положительной (HCV-RNA + ve) у восьми (40%) из 20 женщин, со средней ВН 1,9×10 5 МЕ / мл (4,4×10 5 –3,5×10 6 МЕ / мл). Распределение генотипов было 1b (25%), 3 (25%), 4c (12,5%) и неизвестно (37,5%).
Ни одна из беременностей не наступила при экстракорпоральном оплодотворении. Роды были спонтанными в 12 случаях (60%), путем кесарева сечения — в четырех (20%) и инструментальными родами — в четырех (20%).Данные по 20 новорожденным суммированы в таблице 3. Пятеро детей из восьми женщин с виремией завершили наблюдение, и ни один из них не заразился.
Анализ различий между HBV и HCV беременными
Как видно из Таблицы 2, 65,7% (44/67) женщин с ВГВ родились за границей, по сравнению с только 45% (9/20) женщин с ВГС. Тем не менее, разница не была статистически значимой (p = 0,07). Аналогичная картина наблюдалась для неизвестного пути материнской инфекции, которая чаще встречалась среди женщин с ВГВ, чем у женщин с ВГС (40.3% против 20%; р = 0,066). ЖТ как механизм инфицирования чаще встречалась у женщин с HBV + ve (31,3% против 0%; p = 0,001), тогда как IVDA чаще встречалась в группе HCV (45% против 0%; p <0,001). Предыдущее переливание крови также было значительно выше в группе ВГС (15% против 1,5%; p = 0,043).
Не было статистически значимых различий среди новорожденных по любой из проанализированных переменных, за исключением того, что значительно меньшая доля женщин с ВГС кормила своих детей грудью (65% vs.86%; p = 0,044) (таблица 3).
Обсуждение
В нашем исследовании распространенность HBV составляла 0,42% (91/21870), а HCV — 0,26% (20/7659). Женщины, инфицированные вирусом гепатита В, чаще родились за границей, чем женщины с вирусом гепатита С. Наиболее частый путь передачи ВГВ был неизвестного происхождения, в то время как среди путей передачи известного происхождения чаще всего наблюдалась ЖТ. Что касается факторов риска ЖТ, 67,7% женщин с HBV имели виремию, а 14,5% — HBeAg + ve. Иммунопрофилактика проводилась правильно всем новорожденным, рожденным от HBV + ve матерей.Среди матерей, инфицированных вирусом гепатита C, наиболее распространен парентеральный путь передачи, в основном из-за IVDA. В группе ВГС у 40% была виремия, а у 10% была коинфекция ВИЧ. Женщины с вирусом гепатита С реже, чем женщины с вирусом гепатита С, кормили своих детей грудью.
В этом исследовании наблюдаемая распространенность HBsAg + ve значительно различалась среди участвующих больниц. Самый высокий уровень был получен для HUT в Альмерии (0,64%), больницы, обслуживающей большое количество мигрантов из Северной Африки и Африки к югу от Сахары.Напротив, данные о распространенности анти-ВГС были довольно согласованными среди участвующих больниц, за единственным исключением HUVV в Малаге, где распространенность была выше, хотя в этом случае размер выборки был очень небольшим.
В общей популяции Испании распространенность ВГВ составляет 0,66% (0,34–0,97) [3], что выше, чем у беременных женщин. В предыдущем исследовании, проведенном в 1986–89 [23] в HUSC в Гранаде, на основе популяции из 4450 беременных женщин, распространенность HBV составляла 1.53% (95% ДИ 1,14–1,92). Тридцать лет спустя, согласно нашим данным, распространенность в этом городе упала до 0,39%. Для сравнения, исследование Salleras и др. 2009 г. [24] с популяцией беременных женщин в Каталонии, которая была принята ECDC в качестве эталона для Испании [5], зафиксировала очень низкую распространенность — 0,1%.
Наши результаты показывают, что 65,7% участников, инфицированных вирусом гепатита В + ve, были рождены за границей, с особенно сильным присутствием женщин из Китая и Восточной Европы, что подтверждает ранее описанную картину [25,26].В исследовании, проведенном в Мадриде [26], самый высокий уровень серопозитивности был обнаружен среди женщин из Румынии и других стран Восточной Европы (23,7%), за которыми следуют женщины из Китая (20,3%) и стран Африки к югу от Сахары (18,6%). В последние годы распространенность ВГВ в Испании имела тенденцию к снижению, и если бы население считалось исключенным из числа лиц иностранного происхождения, распространенность, вероятно, была бы еще ниже.
В большинстве случаев, проанализированных в нашем исследовании, путь передачи инфекции HBV был неизвестен, в то время как наиболее распространенным из известных путей была инфекция HBV в семейном анамнезе матери (31.3%), хотя у некоторых женщин было несколько факторов риска инфицирования. Подавляющее большинство женщин (67,7%) страдали виремией и, следовательно, являлись потенциальными переносчиками инфекции. 14,5% были HBeAg + ve, что еще больше увеличивало риск передачи. Однако только шесть из этих женщин получали противовирусное лечение во время беременности, что показывает, что не все больницы соблюдают клинические рекомендации в этом отношении [22]. В предыдущем исследовании, проведенном в Гранаде с участием 4169 беременных женщин [25], сообщалось, что HBV присутствовал у 27, из которых только одна (женщина азиатского происхождения) имела HBeAg + ve.
Все 69 новорожденных, рожденных от HBV + ve матерей, получили иммунопрофилактику в течение первых двенадцати часов жизни, а десять детей, рожденных от HBeAg + ve женщин, получили иммунопрофилактику в первые три часа жизни. Ни один из 54 новорожденных, завершивших наблюдение, не заразился. Сюда входят двое детей HBeAg + ve женщин с высоким уровнем ВН, которые не получали лечения, что подчеркивает важность правильного проведения иммунопрофилактики новорожденным на раннем этапе жизни.
В нашем исследовании распространенность ВГС составила 0.26%, и только 40% из этих случаев были HCV-RNA + ve. С другой стороны, предыдущие исследования среди населения в целом показали более высокую распространенность, 1,7% (0,4–2,6), с РНК HCV + ve в 68,6% этих случаев [27]. Тем не менее, исследования показали, что распространенность ВГС среди женщин ниже, чем среди населения в целом. В исследовании, проведенном в США [28], распространенность среди мужчин составила 1,56% по сравнению с 0,75% у женщин. В другом исследовании, также проведенном в США [29], с участием 87924 беременных женщин, распространенность ВГС составляла 1.2%. В Наварре (Испания) исследование 7314 предоперационных пациентов [30] показало распространенность 0,94% с более высокими значениями для мужчин, чем для женщин (1,25% против 0,62%, p = 0,0049). Наконец, исследование, проведенное в 1993–95 гг. С участием 3003 беременных женщин в HUSC в Гранаде [19], показало, что только 19 были HCV + ve (0,63%), в то время как 14 (74%) имели виремию. Таким образом, значение 0,26%, полученное в настоящем исследовании, намного ниже, чем эти предыдущие результаты.
Среди нашего исследуемого населения 55% женщин с ВГС были испанками, за ними по частоте следуют женщины из Восточной Европы (20%), что соответствует предыдущим результатам [31].Согласно более раннему исследованию [27], 80% случаев, зарегистрированных во всем мире с положительной виремией, зарегистрированы в 31 стране, одна из которых — Испания, но более половины инфекций приходится только на шесть стран: Китай, Пакистан, Нигерия, Египет, Индия и Россия. Парентеральная передача — наиболее распространенный путь заражения, и в большинстве случаев в анамнезе используется IVDA, хотя в 20% случаев происхождение инфекции неизвестно. Этот пробел в знаниях может оправдать введение скрининга на ВГС у беременных.Подобные результаты были получены в других исследованиях [29,32,33]. Инфекция значительно чаще встречается у людей в возрасте до 30 лет, у лиц европейского происхождения, особенно у выходцев из Восточной Европы, а также у лиц с историей IVDA. Наиболее частыми генотипами, зарегистрированными в нашем исследовании, были 1b и 3, за которыми следовали 4, что согласуется с результатами предыдущих исследований [33]. Две женщины (10%) имели коинфекцию ВИЧ, что увеличивает вероятность передачи ВГС ребенку [17].
Среди детей женщин с инфекцией ВГС 20% были недоношенными, что выше, чем в общей популяции.Более того, только 65% начали грудное вскармливание, что намного ниже показателя для детей от HBV + ve матерей (86%) и населения в целом. Эти данные могут быть больше подвержены влиянию истории IVDA, чем HCV как такового [34]. Это также может быть причиной того, что не все дети матерей с виремией завершили наблюдение.
Среди специфических характеристик, отличающих женщин от HBV + ve, преобладание инфекции VT и большая доля тех, кто кормил своих детей грудью.Кроме того, больше женщин родились за границей по сравнению с женщинами с ВГС. В группе HCV основными отличительными особенностями были переливание крови и наличие IVDA в анамнезе.
Основное ограничение этого исследования касалось определения ВГС у беременных женщин, поскольку скрининг этого состояния не является универсальным в Испании во время беременности, и поэтому требовалось подписанное информированное согласие. По этой причине размер выборки для нашего анализа распространенности ВГС был меньше, чем для ВГВ.Более того, некоторые из приглашенных испанских больниц отказались от участия. Другое ограничение касалось наблюдения за детьми серопозитивных матерей; многие из этих детей были усыновлены после рождения, и поэтому их место жительства изменилось.
Таким образом, распространенность HBV и HCV, о которой мы сообщаем, ниже, чем задокументированные ранее. Значительное число женщин с ВГВ родились за границей и / или имели в семейном анамнезе инфекцию от матери. Среди пациентов с ВГС у многих в анамнезе была IVDA, что, вероятно, повлияло на то, что эти женщины с меньшей вероятностью завершили последующее наблюдение и с меньшей вероятностью кормили своих детей грудью.Более половины женщин с ВГВ страдали виремией и, следовательно, являлись потенциальными переносчиками инфекции новорожденному. Следовательно, обеспечение соответствующей иммунопрофилактики (включая терапию иммуноглобулином и вакцинацию) важно для новорожденных, рожденных от HBV + ve матерей. Однако среди женщин с ВГС, несмотря на наличие виремии и сочетанной инфекции с ВИЧ, передачи детям не было.
Благодарности
Мы благодарим Педро Лукаса из FIBAO (Общественный фонд биомедицинских исследований в Восточной Андалусии) за разработку базы данных, использованной в этом исследовании.
Этот документ будет представлен Марией дель Мар Диас-Алькасар для получения степени доктора философии. в рамках докторской программы «Клиническая медицина и общественное здравоохранение» Университета Гранады (Испания).
Ссылки
- 1.
Всемирная организация здоровья. Global Hepatitis Report 2017. [Интернет] Женева: Всемирная организация здравоохранения; 2017. Доступно по адресу: http://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/. - 2.
Пимпин Л., Кортез-Пинто Х., Негр Ф., Корбоулд Э., Лазарус СП, Уэббер Л. и др.Бремя болезней печени в Европе: эпидемиология и анализ факторов риска для определения профилактических мер. Журнал гепатологии 2018; 69: 718–35. pmid: 29777749 - 3.
Ахмад А.А., Фалла А.М., Даффелл Э., Нури Т., Бечини А., Рейнтьес Р. и др. Оценка масштабов инфицирования вирусом хронического гепатита B среди мигрантов в странах ЕС / ЕЭЗ. BMC Infect Dis 2018; 18 (1): 34–48. pmid: 29325525 - 4.
Ортис Э., Скэнлон Б., Малленс А., Дарем Дж. Эффективность вмешательств при гепатите В и С: систематический обзор вакцинации, скрининга, укрепления здоровья и связи с медицинской помощью в странах с более высоким уровнем доходов.J Community Health 2019. [Epub перед печатью]. - 5.
Hofstraat SHI, Falla AM, Duffell EF, Hahné SJM, Amato-Gauci AJ, Veldhuijzen IK, et al. Текущая распространенность хронической вирусной инфекции гепатита B и C среди населения в целом, у доноров крови и беременных женщин в ЕС / ЕЭЗ: систематический обзор. Epidemiol Infect 2017; 145 (14): 2873–85. pmid: 288 - 6.
Ministerio de Sanidad, Servicios Sociales e Igualdad. Plan estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud.[Интернет] Мадрид: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2015. Доступно по ссылке: https://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/docs/plan_estrategico_hepatitis_C.pdf. - 7.
Куадрадо А., Перелло С., Ллерена С., Эскудеро-Гарсия Д., Гомес М., Эстебанес А. и др. Разработка и экономическая эффективность стратегии элиминации вируса гепатита С на основе обновленного эпидемиологического исследования (когорта ETHON). Плакат представлен в Европейской ассоциации изучения печени на Международном конгрессе по печени, Париж.Журнал Hepatol 2018; 68 (Приложение 1): S164. - 8.
Фалла А.М., Ахмад А.А., Даффелл Э., Нури Т., Велдхуйзен И.К. Оценка масштабов хронической инфекции вируса гепатита С в ЕС / ЕЭЗ: внимание мигрантов из стран, эндемичных по ВГС. BMC Infect Dis 2018; 18 (1): 42–55. pmid: 29338702 - 9.
Ruiz-Extremera A, López-Garrido MA, Barranco E, Quintero MD, Ocete-Hita E, Muñoz de Rueda P, et al. Активность печеночных ферментов с шестнадцатой недели беременности. Am J Obstet Gynecol 2005; 193 (6): 2010–6.pmid: 16325605 - 10.
Аристеги Фернандес Дж., Дьес-Доминго Дж., Марес Бермудес Дж., Мартинон Торрес Ф. Вакунасьон против гепатита В. Воздействие программ вакуума на 20 дней использования в Испании. ¿Es tiempo de cambios? Enferm Infecc Microbiol Clin 2015; 33 (2): 113–8. - 11.
Дионне-Одом Дж, Тита А.Т., Сильверман Н.С. Гепатит B в обследовании на беременность, лечении и профилактике вертикальной передачи. Общество медицины матери и плода (SMFM).Am J Obstet Gynecol 2016; 214: 6–14. pmid: 26454123 - 12.
Вен WH, Lai MW, Чанг MH. Обзор стратегий предотвращения передачи инфекции вируса гепатита В от матери ребенку. Expert Rev Gastroenterol Hepatol 2016; 10 (3): 317–30. pmid: 26566769 - 13.
Bleich LM, Swenson ES. Профилактика передачи вируса гепатита В у новорожденных. J Clin Gastroenterol 2014; 48 (9): 765–72. pmid: 24667588 - 14.
Йонас ММ. Гепатит В и беременность: недооцененная проблема.Liver Int 2009; 29 (Дополнение 1): 133–9. - 15.
Муньос-Альмагро С., Джункоса Т., Фортуни С., Гильен Дж. Дж., Гонсалес-Куэвас А., Латорре С. Распространенность вируса гепатита С у беременных женщин и вертикальная передача. Med Clin 2002; 118 (12): 452–4. - 16.
Бенова Л., Мохамуд Ю.А., Калверт С., Абу-Раддад Л.Дж. Вертикальная передача вируса гепатита С: систематический обзор и метаанализ. Clin Infect Dis 2014; 59 (6): 765–73. pmid: 24928290 - 17.
Руис-Экстремра А., Муньос-Гамес Х.А., Сальмерон-Руис М.А., де Руэда П.М., Куилес-Перес Р., Хила-Медина А. и др.Генетическая изменчивость интерлейкина 28B в отношении вертикальной передачи вируса гепатита С и спонтанного клиренса у детей, инфицированных ВГС. Гепатология 2011; 53 (6): 1830–18. pmid: 21413051 - 18.
Руис-Экстремра А., Сальмерон Дж., Торрес С., Де Руэда П.М., Хименес Ф., Роблес С. и др. Последующее наблюдение за передачей гепатита С младенцам у женщин с отрицательным вирусом иммунодефицита человека: роль грудного вскармливания в передаче. Pediatr Infect Dis J, 2000; 19 (6): 511–6. pmid: 10877164 - 19.Сальмерон Дж., Хименес Ф., Торрес С., Рос Р., Паласиос А., Кинтеро Д. и др. Эпидемиология и распространенность серопозитивной реакции на вирус гепатита С у беременных женщин в Гранаде. Ред. Эсп Энферм Dig 1998; 90 (12): 841–50. pmid: 9973846
- 20.
И П, Чен Р., Хуан И, Чжоу Р. Р., Фань XG. Управление передачей вируса гепатита В от матери ребенку: предложения и проблемы. J Clin Virol 2016; 77: 32–9. pmid: 26895227 - 21.
Pan CQ, Duan ZP, Bhamidimarri KR, Zou HB, Liang XF, Li J, et al.Алгоритм оценки риска и вмешательства от матери ребенку в передачу вируса гепатита В. Clin Gastroenterol Hepatol 2012; 10 (5): 452–9. pmid: 22079509 - 22.
Европейская ассоциация изучения печени. Руководство EASL 2017 по клинической практике по ведению инфекции вируса гепатита В. Журнал Hepatol 2017; 67 (2): 370–98. pmid: 28427875 - 23.
Дель Кастильо Дж., Руис-Экстремра А., Лопес Ф., Томас Дж., Хименес Ф., Сальмерон Ф. Дж. Prevalencia del VHB en mujeres gestantes.Инмунопрофилаксия. Rev Soc Andal Pat Digest 1989; 12: 447–50. - 24.
Саллерас Л., Домингес А., Бругера М., Планы П., Эспуньес Дж., Коста Дж. И др. Сероэпидемиология вирусной инфекции гепатита В у беременных в Каталонии (Испания). J Clin Virol 2009; 44 (4): 329–32. pmid: 19230752 - 25.
Сампедро А., Мазуэлас П., Родригес-Грейнджер Дж., Торрес Е., Пуэртас А., Наварро Дж. М.. Marcadores serológicos enestantes inmigrantes y autóctonas en Granada. Enferm Infecc Microbiol Clin 2010; 28 (10): 694–97.pmid: 20961669 - 26.
Лопес-Фабаль Ф., Гомес-Гарсес Ж.Л. Marcadores serológicos deestantes españolas e inmigrantes en un área del sur de Madrid durante el periodo 2007–2010. Преподобный Эсп Кимиотер 2013; 26 (2): 108–11. pmid: 23817647 - 27.
Гауэр Э., Эстес С., Блах С., Разави-Ширер К., Разави Х. Глобальная эпидемиология и распределение генотипов инфекции вируса гепатита С. Журнал Hepatol 2014; 61 (S): 45–57. - 28.
Холл EW, Розенберг ES, Салливан PS.Оценка хронической инфекции вируса гепатита С на уровне штата, стратифицированная по расе и полу, США, 2010 г. BMC Infect Dis 2018; 18: 224–38. pmid: 29769036 - 29.
Чаппелл С., Хиллиер С.Л., Кроу Д., Мейн Л.А., Боген Д.Л., Кранс Э. Скрининг на вирус гепатита С среди детей, инфицированных во время беременности. Педиатрия 2018; 141 (6): 1–14. - 30.
Агинага А., Диас Гонсалес Дж., Перес Гарсия А., Баррадо Л., Мартинес Баз I, Касадо И. и др. Распространенность диагностированной и недиагностированной вирусной инфекции гепатита С в Наварре, Испания, 2014–2016 гг.Enferm Infecc Microbiol Clin 2018; 36 (6): 325–31. pmid: 28110858 - 31.
Ramos JM, Masiá M, Padilla S, Escolano C, Bernal E, Gutiérrez F. Enfermedades importadas y no importadas en la población inmigrante. Una década de experiencecia desde unidad de enfermedades infcciosas. Enferm Infecc Microbiol Clin 2011; 29 (3): 185–92. pmid: 21349607 - 32.
Алонсо Лопес С., Агудо Фернандес С., Гарсиа дель Валь А, Мартинес Абад М., Лопес Эрмоса Сесенья П., Искьердо М. Дж. И др.Seroprevalencia de hepatitis C en población con factores de riesgo del suroeste de la Comunidad de Madrid. Гастроэнтерол Hepatol 2016; 39 (10): 656–62. pmid: 27417563 - 33.
Асеро Фернандес Д., Ферри Иглесиас М.Дж., Буксо Пухольрас М., Лопес Нуньес С., Серра Матамала I, Керальт Моле X. Изменения в эпидемиологии и распространении генотипов вируса гепатита С в Северо-Восточной Испании за последние 35 лет. Гастроэнтерол Hepatol 2018; 41 (1): 2–11. pmid: 260
- 34.
Pergam SA, Wang CC, Gardella CM, Sandison TG, Phipps WT, Hawes SE.Осложнения беременности, связанные с гепатитом C: данные когорты родившихся в штате Вашингтон за 2003–2005 гг. Am J Obstet Gynecol 2008; 199 (Приложение 1): 38–51.
.
