Гепатопротекторы в наркологической практике
Злоупотребление психоактивными веществами (ПАВ) относится к числу основных причин поражения печени.
Распространенность различных форм поражения печени у лиц, страдающих алкогольной и наркотической зависимостью, очень высока, а у отдельных категорий наркологических больных приближается к 100% [1].
В основе поражения печени у пациентов наркологической клиники обычно лежат следующие основные причины: 1) гепатотоксическое действие ПАВ; 2) заражение вирусными гепатитами, связанное с нестерильным внутривенным введением ПАВ. Токсическое влияние этанола и каскад патологических биохимических реакций и морфологических процессов, вызванных алкогольной интоксикацией — являются основной причиной алкогольного поражения печени (АПП). Парентеральное введение опиоидов, имеет значение прежде всего для потребителей инъекционных наркотиков (ПИН), являясь причиной вирусных гепатитов (ВГ), главным образом гепатитов С и В.
Различные по клиническим проявлениям и тяжести формы АПП встречаются практически у всех лиц, злоупотребляющих алкоголем.
Распространенность ВГ у ПИН, по оценкам разных авторов [1, 3, 6], находится в пределах 60-95%.
Таким образом, у подавляющего большинства представителей двух основных категорий пациентов наркологической клиники — больных алкоголизмом и лиц, страдающих опиоидной зависимостью, — отмечается та или иная форма поражения печени.
У некоторых наркологических больных в соответствии со сложным характером аддиктивных расстройств развиваются смешанные формы поражения печени. Например, многие ПИН, страдающие ВГ, в периоды прекращения употребления наркотика злоупотребляют алкоголем, и в этих случаях хронический гепатит может осложняться атаками острого алкогольного гепатита (ОАГ). В свою очередь распространенность гепатита С у лиц, страдающих алкогольной зависимостью, составляет более 25%, что значительно превышает общепопуляционные показатели [5].
Сочетание вирусного и алкогольного поражения печени закономерно повышает риск развития цирроза печени.
Проблема своевременного лечения поражения печени у наркологических больных осложняется трудностями в его распознавании.
Алкогольная жировая дистрофия печени и алкогольный цирроз печени могут протекать практически бессимптомно. Клинические проявления ОАГ часто бывают значительно более очевидными, но собственный клинический опыт автора статьи показывает, что у подавляющего большинства больных алкоголизмом, поступающих в наркологическую клинику в плановом или экстренном порядке, отсутствуют жалобы, указывающие на АПП, даже в тех случаях, когда позже у этих пациентов диагностируется ОАГ [1].
Острые ВГ у ПИН часто также протекают стерто, без очевидных симптомов поражения печени, с выраженным преобладанием безжелтушных форм.
Сложность распознавания болезней печени в наркологической практике усугубляется экстренной госпитализацией пациентов, затрудняющей своевременное использование лабораторных и инструментальных методов диагностики.
Таким образом, следует выделить два основных аспекта проблемы поражения печени у пациентов наркологической клиники: 1) высокая распространенность поражения печени различной этиологии у лиц, злоупотребляющих ПАВ; 2) трудности в своевременной диагностике и лечении болезней печени в неотложной наркологической практике.
Важно также принимать во внимание, что риск утяжеления течения острого алкогольного или вирусного гепатита при отсутствии возможности его своевременного выявления существенно повышается при активном назначении поступающим в клинику пациентам психотропных средств, многие из которых обладают гепатотоксическими свойствами.
Все сказанное выше позволяет считать предупреждение и лечение болезней печени необходимым компонентом лечебных программ в наркологии, особенно в условиях неотложной наркологической практики, и основным профилактическим и лечебным средством в данных случаях являются гепатопротекторы, важное место среди которых занимает адеметионин (международное название — S-аденозилметионин).
Адеметионин (гептрал) относится к препаратам метаболического действия, является основным донатором метильных групп, принимает участие во многих биохимических реакциях, обладает гепатотропными и умеренными нейротропными свойствами. Выступая в роли гепатопротектора, адеметионин улучшает течение болезней печени, уменьшает проявления АПП и препятствует развитию цирроза печени [4].
Адеметионин может быть эффективен в предупреждении и лечении умеренного когнитивного нарушения и начальных проявлений деменции [7].
Адеметионин обладает тимоаналептическими (антидепрессивными) свойствами, определяющими его способность усиливать эффекты антидепрессантов, а также выступать в качестве средства монотерапии неглубоких депрессивных состояний [2, 4]. Адеметионин эффективен при соматизированных депрессиях и дистимиях [2].
Антидепрессивные свойства придают адеметионину особое значение для наркологической практики в связи с высокой частотой коморбидных депрессий у лиц, страдающих зависимостью от алкоголя и наркотиков, и в связи с дисфорическими состояниями и другими аффективными расстройствами, осложняющих синдромы отмены ПАВ у многих пациентов.
Введение адеметионина в лечебные схемы при поступлении пациентов в наркологическую клинику позволяет добиться двойного эффекта: уменьшения угрозы здоровью, связанной с болезнями печени (особенно если они не распознаны в связи с бессимптомным течением) и улучшения эмоционального состояния пациентов. Кроме того, благотворное влияние препарата на метаболические процессы позволяет рассчитывать на улучшение мозговых функций при алкогольной и печеночной энцефалопатиях.
Кроме того, благотворное влияние препарата на метаболические процессы позволяет рассчитывать на улучшение мозговых функций при алкогольной и печеночной энцефалопатиях.
Адеметионин (гептрал) выпускается в виде таблеток для приема внутрь и лиофилизата для приготовления раствора с целью внутримышечного или внутривенного введения. Способ употребления и суточные дозы (800-1600 мг — при энтеральном приеме, 400-800 мг — при парентеральном введении) определяются индивидуально.
Лечение адеметионином (гептралом) рекомендуется сопровождать назначением цианокобаламина (витамина В12) и фолиевой кислоты, поскольку недостаток этих веществ может уменьшать плазменную концентрацию препарата и, следовательно, его лечебное действие. Данная превентивная мера имеет особое значение для комплексной терапии алкоголизма в связи с дефицитом многих витаминов, осложняющим злоупотребление алкоголем. Кроме того, благотворное влияние препарата на метаболические процессы позволяет рассчитывать на улучшение мозговых функций при алкогольной и печеночной энцефалопатиях.
Статья подготовлена при поддержке компании «Эбботт».
Пищеварительная система при антипсихотической терапии (обзор литературы). Часть VI: ятрогенная патология печени (эффект атипичных антипсихотиков) | Волков
1. A case report of olanzapine-induced hypersensitivity syndrome / A. Raz, R. Bergman, O. Eilam [et al.] // Am. J. Med. Sci.-2001.- Vol. 321, N2.- P. 156-158. doi: 10.1097/00000441-200102000-00008.
2. A comparison of ziprasidone and risperidone in the long-term treatment of schizophrenia: a 44-week, double-blind, continuation study / D. E. Addington, A. Labelle, J. Kulkarni [et al.] // Can. J. Psychiatry.- 2009.- Vol. 54, N 1.- P. 46-54. doi: 10.1177/070674370905400108.
3. A review of liver function tests during treatment with atypical antipsychotic drugs: a chart review study / N. Atasoy, A. Erdogan, I. Yalug [et al.] // Prog. Neuropsychopharmacol. Biol. Psychiatry.- 2007.- Vol. 31, N6.- P. 1255-1260. doi: 10.1016/j.pnpbp.2007.05.005.
Atasoy, A. Erdogan, I. Yalug [et al.] // Prog. Neuropsychopharmacol. Biol. Psychiatry.- 2007.- Vol. 31, N6.- P. 1255-1260. doi: 10.1016/j.pnpbp.2007.05.005.
4. A 1-year, double-blind, placebo-controlled trial of ziprasidone 40, 80 and 160 mg/day in chronic schizophrenia: the Ziprasidone Extended Use in Schizophrenia (ZEUS) study / M. Arato, R. O’Connor, H. Y. Meltzer[et al] / / Int. Clin. Psychopharmacol. — 2002.- Vol. 17, N5.- P. 207-215.
5. Acute cholestatic hepatitis probably associated with risperidone / F. Llinares Tello, C. Hernandez Prats, N. Bosacoma Ros[et al.] // Int. J. Psychiatry Med.- 2005.- Vol. 35, N2.- P. 199-205. doi: 10.2190/5XRB-D 2XX-X8AH-32KB.
6. Acute drug-induced hepatitis during aripiprazole monotherapy: a case report / J. Kornischka, J. Cordes, C. Engelke [et al.] / / J. Pharmacovigil.- 2016.- Vol. 4, N2.- Art. 201. doi:10.4172/2329-6887.1000201.
Cordes, C. Engelke [et al.] / / J. Pharmacovigil.- 2016.- Vol. 4, N2.- Art. 201. doi:10.4172/2329-6887.1000201.
7. [Acute hepatocellular lesion after successive exposure to clozapine and olanzapine in a patient with chronic hepatitis C infection] / R. Gomez Espn, I. Sanchez Quiles, H. Hallal[et al.] / / Gastroenterol. Hepatol.-2009.- Vol. 33, N2.- P. 150-152. doi: 10.1016/j.gastrohep.2009.08.001
8. Akta$ S, Bakir M. G.T., Kaya B. Toxic hepatitis development due to clozapine treatment for schizophrenia: case presentation // Turk. J. Psychiatry.- 2015.- Vol. 26, Suppl 1.- Р. 47.
9. Al Mutairi F., Dwivedi G., Al Ameel T. Fulminant hepatic failure in association with quetiapine: a case report // J. Med. Case Rep.- 2012.- Vol. 6, N 1.- P. 418. doi: 10.1186/1752-1947-5^18.
10. Antipsychotic Agents. [Электронный ресурс].- URL: http://livertox.nih.gov/AntipsychoticAgents. htm (дата обращения: 15.10.2016).
11. Antipsychotic-induced weight gain in first-ep
БИОХИМИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ КОМПЛЕКСНОЙ ТЕРАПИИ В ОСТРОЙ ФАЗЕ ЭКСПЕРИМЕНТАЛЬНЫХ ГЕЛЬМИНТОЗОВ ЖИВОТНЫХ | Гришина
1. Баркалова, Н.В. Биохимическое обоснование компексной терапии при гельминтозах у жвачных животных / Н.В. Баркалова // Веснік Віцебскага дзяржаўнага універсітэта. – 2011. – Т. 3, № 63. – С. 32–38.
2. Якубовский, М.В. Достижения и проблемы профилактики паразитозов / М.В. Якубовский // Ученые записки УО “ВГАВМ”. – Витебск, 2004. – Т. 40, ч. 1. – С. 331–332.
3. Камышников, В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике /В.С. Камышников. – 3-е изд. – М.: «МЕД пресс-информ», 2009. – 196 с.
4. Меньшиков, В.В. Критерии оценки методик и результатов клинических лабораторных исследований : справочное пособие / В.В. Меньшиков. – М.: Лабора, 2011. – 328 с.
5. Озерецковская, Н.Н. Современные проблемы терапии гельминтозов / Н.Н. Озерецковская // Мед. паразитол. и паразитарн. болезни. – 1975. – № 3. – С. 271–276.
6. Якубовский, М.В. Применение новых технологий и препаратов для диагностики, лечения и профилактики паразитарных болезней животных / М.В. Якубовский // Эпизоотология, иммунобиология, фармакология, санитария. – 2008. – № 1. – С. 45–53.
– 2008. – № 1. – С. 45–53.
7. Иммуно-модулятор-метаболик-детоксикант-адаптогенрадиопротектор. Патент на изобретение N2194502. Приор. 27.12.2000.
8. Никитин, О.А. Терапевтическая эффективность гамавита при лечении мелких домашних животных / О.А. Никитин // Зооиндустрия. – 2003. – № 5. – С. 28.
9. Санин, А.В. Гамавит – антидотная терапия при оксидативном стрессе / А.В. Санин [и др.] // Ветеринарный доктор. – 2008. – № 6. – С. 7–8.
10. Санин, А.В. Парадоксы дегельминтизации, или Третий лик Януса / А.В. Санин, И.К. Васильев // Ветеринарный доктор. – 2007. – № 10. – С. 13–14.
11. Методические указания по биохимическому исследованию крови животных с использованием диагностических наборов : утв. ГУВ МСХиП РБ 27.11.2007 г. / И.Н. Дубина [и др.]. – Витебск: УО «ВГАВМ», 2007. –60 с.
ГУВ МСХиП РБ 27.11.2007 г. / И.Н. Дубина [и др.]. – Витебск: УО «ВГАВМ», 2007. –60 с.
12. Титов, В.Н. Патофизиологические основы лабораторной диагностики заболеваний печени / В.Н. Титов // Клиническая лабораторная диагностика. –1996. –№ 1. –С. 3–.
13. Медицинские лабораторные технологии и диагностика: справочник / под ред. А.И. Карпищенко. –СПб.: Интермедика, 1999. –Т. 2. –656 с.
14. Center S.A. Pathophysiology of liver disease: normal and abnormal function / Strombeck’s small animal gastroenterology. 3 rd. Edition. Philadelphia: W.B. Saunders. 1996. P. 553–32.
15. Nutrition in pancreatic and liver disorders / M.A. Korsten [et al.] // Modern nutrition in health and disease. Philadelphia: Lea & Febiger, 1994. P. 1066–080.
Philadelphia: Lea & Febiger, 1994. P. 1066–080.
16. Wanji S, Eyong EJ, Tendongfor N et al. Ivermectin treatment of Loa loa hyper-microfilaraemic baboons (Papio anubis): Assessment of microfilarial load reduction, haematological and biochemical parameters and histopathological changes follow ing treatment. PLoS Negl Trop Dis. 2017 Jul 7;11(7):e0005576. doi: 10.1371/journal.pntd.0005576. e Collection 2017 Jul.
17. Ricken FJ, Nell J, Gruner B, et al. Albendazole increases the inflammatory response and the amount of Em2-positive small particles of Echinococcus multilocularis (spems) in human hepatic alveolar echinococcosis lesions. PLoS Negl Trop Dis. 2017 May 25;11(5):e0005636. doi: 10.1371/journal. pntd.0005636. eCollection 2017 May.
18. Grosskopf HM, Schwertz CI, Machado G, et al. Cattle naturally infected by Eurytrema coelomaticum: Relation between adenosine deaminase activity and zinc levels. Res Vet Sci. 2017 Feb;110:79-84. doi: 10.1016/j.rvsc.2016.10.016. Epub 2016 Oct 29.
Cattle naturally infected by Eurytrema coelomaticum: Relation between adenosine deaminase activity and zinc levels. Res Vet Sci. 2017 Feb;110:79-84. doi: 10.1016/j.rvsc.2016.10.016. Epub 2016 Oct 29.
19. Liu Q, Huang SY, Yue DM, Wang JL et al. Proteomic analysis of Fasciola hepatica excretory and secretory products (FhESPs) involved in interacting with host PBMCs and cytokines by shotgun LC-MS/MS. Parasitol Res. 2017 Feb;116(2):627-635. doi: 10.1007/s00436-016-5327-4. Epub 2016 Nov 19.
20. Леонард, Р.А. Влияние гамавита, фоспренила и максидина на ряд биохимических показателей крови собак, больных пироплазмозом / Р.А. Леонард // Ветеринарная клиника. –2006. – № 3. – С. 2–5.
21. Обрывин, В.Н. Влияние препаратов гамавит и галавет на токсический иммунодефицит у белых крыс / В. Н. Обрывин, Г.А. Жоров, П.Н. Рубченков // Ветеринарная патология. – 2008. – №3. – С. 119–125.
Н. Обрывин, Г.А. Жоров, П.Н. Рубченков // Ветеринарная патология. – 2008. – №3. – С. 119–125.
22. Санин, А.В. Экспериментальное обоснование применения Гамавита при дегельминтизации животных четырёххлористым углеродом / А.В. Санин [и др.] // Ветеринарная медицина домашних животных : сб. статей. – Казань, 2004. – Вып. 1. – С. 27–30.
Сравнительная оценка биохимических показателей крови и изменений со стороны внутренних органов под влиянием доксорубицина и наноструктурированного доксорубицина в условии перевиваемого канцерогенеза (экспериментальная асцитная гепатома Зайдела) | Чаиркин
1. Алексеев К.В. Наноразмерные системы доставки лекарственных веществ / Алексеев К.В., Аляутдин Р.Н., Блынская Е.В., Квинх Б.Т. // Вестник новых медицинских технологий. — 2009. — Т.16, №2. — с. 17-20.
— Т.16, №2. — с. 17-20.
2. Барышников А.Ю. Наноструктурированные липосомальные системы как средство доставки противоопухолевых препаратов // Вестник РАМН. — 2012. — №3. — С. 23-30.
3. Дубровин Н.А., Бычков Д.В., Гордеев К.С, Жидков А.А. Современные методы лечения рака/ Портал научно-практических публикаций [Электронный ресурс]. URL: http: / portalnp.ru/ 2017, 11, 9896.
4. Пятаев Н.А. Особенности тканевого распределения и противоопухолевой активности доксорубицина при введении в форме конъюгата с ДНК у крыс с трансплантированной карциномой РС-1 / Н.А.Пятаев, С.А. Щукин, Е.Ю. Коровина, Н.Н. Зырняева // Российский биотерапевтический журнал. — 2011. — Т.10, № 2. — С. 55-61.
5. Решетарова Д. А. Анализ онкологической заболеваемости населения ПФО [Электронный ресурс] / Д. А. Решетарова // Современные проблемы территориального развития : электрон. журн. — 2018. — № 2. ID 39 ISSN: 2542-2103.
Решетарова Д. А. Анализ онкологической заболеваемости населения ПФО [Электронный ресурс] / Д. А. Решетарова // Современные проблемы территориального развития : электрон. журн. — 2018. — № 2. ID 39 ISSN: 2542-2103.
6. Allen T.M. and Cullis P.R. Liposomal drag delivery system: From concept to clinical applications. Adv.Drag Deliv. Rev.2013, 65: 36-48.
7. Bawarski W.E., Chidlowsky E., Bharali D.J. et al. Emerging nanopharmaceuticals. Nanomedicine: Nanotechnology, Biology and Medicine. 2008; 4: 273-282.
8. Immordino M.L., Dosio F., Cattel L. Stealth liposomes: review of the basic science, rationale and clinical applications, existing and potential. International Journal of Nanomedicine. 2006; 1 (3): 297-315.
9. Катаева Р.М., Аглетдинов Э.Ф., Иванова Н.А., Галимова Р.А., Булыгин К.В., Катаев В.В. Изучение репродуктивной токсичности перспективного нового лекарственного средства «11-дезоксимизопростол». Современные проблемы науки и образования. 2015; № 1 (57): 1284.
Катаева Р.М., Аглетдинов Э.Ф., Иванова Н.А., Галимова Р.А., Булыгин К.В., Катаев В.В. Изучение репродуктивной токсичности перспективного нового лекарственного средства «11-дезоксимизопростол». Современные проблемы науки и образования. 2015; № 1 (57): 1284.
Гепатотоксичность современных нестероидных противовоспалительных препаратов
Общеизвестно, что в желудочно-кишечном тракте нестероидные противовоспалительные препараты (НПВП) токсичны не только для слизистой пищеварительной трубки, но и для печени. Иллюстрацией социальной значимости проблемы гепатотоксичности НПВП является включение в весьма ограниченный список показаний для трансплантации печени острой печеночной недостаточности, обусловленной приемом НПВП. Проблема гепатотоксического действия некоторых НПВП является настолько острой, что в ряде стран данные препараты законодательно к использованию не допущены. Так, например, НПВП нимесулид в настоящее время запрещен к использованию в Испании, Финляндии, Израиле, Индии, Шри-Ланке. В США, Великобритании, Канаде и Австралии препарат не допущен к регистрации. Удивительно в этой связи, что в России нимесулид используется и в педиатрической практике.
В США, Великобритании, Канаде и Австралии препарат не допущен к регистрации. Удивительно в этой связи, что в России нимесулид используется и в педиатрической практике.
Все современные НПВП качественно обладают гепатотоксичностью, однако количественная степень негативного воздействия на печень у них весьма вариабельна. Наибольшим потенциалом в плане развития НПВП-индуцированной гепатотоксичности обладают сулиндак, нимесулид и индометацин. Наименьшей гепатотоксичностью обладают селективный ингибитор ЦОГ-2 целекоксиб (Целебрекс) и традиционный НПВП напроксен.
Как минимизировать риск токсических эффектов со стороны печени у пациентов, нуждающихся в терапии НПВП? Назначение НПВП с учетом их потенциальной гепатотоксичности может иметь характер алгоритма. На первом этапе, по аналогии с вышеописанным алгоритмом, проводится оценка показаний к назначению НПВП (локальная или системная воспалительная реакция). Затем проводится оценка факторов риска гепатотоксичности НПВП. При этом следует помнить, что гепатотоксическим потенциалом качественно обладают все современные НПВП. С другой стороны, количественный критерий гепатотоксичности позволяет разделить все НПВП на препараты с высоким гепатотоксическим потенциалом (сулиндак, ибупрофен, нимесулид) и препараты с низким гепатотоксическим потенциалом (напроксен, целекоксиб). Четкого временного промежутка между началом терапии НПВП и возникновением повреждения печеночной паренхимы до настоящего времени не установлено. Поэтому разделение терапии НПВП на непродолжительную и длительную с точки зрения реализации их гепатотоксического потенциала является некорректным: развитие цитолитического или холестатического синдрома возможно уже через несколько суток от начала терапии. К факторам риска гепатоксичности НПВП относятся: возраст пациента старше 65 лет, наличие аутоиммунного заболевания, почечной недостаточности, гипоальбуминемия, прием более одного НПВП или прием НПВП в максимальной дозе, одновременное назначение большого числа лекарственных препаратов и, наконец, самое существенное – наличие исходной патологии печени.
С другой стороны, количественный критерий гепатотоксичности позволяет разделить все НПВП на препараты с высоким гепатотоксическим потенциалом (сулиндак, ибупрофен, нимесулид) и препараты с низким гепатотоксическим потенциалом (напроксен, целекоксиб). Четкого временного промежутка между началом терапии НПВП и возникновением повреждения печеночной паренхимы до настоящего времени не установлено. Поэтому разделение терапии НПВП на непродолжительную и длительную с точки зрения реализации их гепатотоксического потенциала является некорректным: развитие цитолитического или холестатического синдрома возможно уже через несколько суток от начала терапии. К факторам риска гепатоксичности НПВП относятся: возраст пациента старше 65 лет, наличие аутоиммунного заболевания, почечной недостаточности, гипоальбуминемия, прием более одного НПВП или прием НПВП в максимальной дозе, одновременное назначение большого числа лекарственных препаратов и, наконец, самое существенное – наличие исходной патологии печени. Следует заметить, что само по себе наличие острой патологии печени с синдромами цитолиза или холестаза, тем более осложненное печеночноклеточной недостаточностью, должно являться противопоказанием к назначению НПВП. Возможности проведения терапии НПВП на фоне хронического диффузного заболевания печени также весьма ограничены. Так, при наличии хронического диффузного заболевания печени перед назначением НПВП обязательным является исследование биохимических маркеров синдромов цитолиза гепатоцитов и холестаза: АлАТ, АсАТ, ГГТП, билирубина, ЩФ. Превышение данных показателей в 2 и более раза относительно верхней границы нормы указывает на невозможность проведение терапии НПВП. В случае наличия хронического диффузного заболевания печени, но незначительного отклонения (не превышающего норму более чем в 2 раза) вышеуказанных биохимических показателей терапия НПВП возможна, но при этом необходимо использовать препараты с минимальным гепатотоксическим потенциалом (напроксен, целекоксиб). При отсутствии у пациента факторов риска гепатоксичности теоретически возможно применение любого официально зарегистрированного НПВП.
Следует заметить, что само по себе наличие острой патологии печени с синдромами цитолиза или холестаза, тем более осложненное печеночноклеточной недостаточностью, должно являться противопоказанием к назначению НПВП. Возможности проведения терапии НПВП на фоне хронического диффузного заболевания печени также весьма ограничены. Так, при наличии хронического диффузного заболевания печени перед назначением НПВП обязательным является исследование биохимических маркеров синдромов цитолиза гепатоцитов и холестаза: АлАТ, АсАТ, ГГТП, билирубина, ЩФ. Превышение данных показателей в 2 и более раза относительно верхней границы нормы указывает на невозможность проведение терапии НПВП. В случае наличия хронического диффузного заболевания печени, но незначительного отклонения (не превышающего норму более чем в 2 раза) вышеуказанных биохимических показателей терапия НПВП возможна, но при этом необходимо использовать препараты с минимальным гепатотоксическим потенциалом (напроксен, целекоксиб). При отсутствии у пациента факторов риска гепатоксичности теоретически возможно применение любого официально зарегистрированного НПВП. Однако на практике следует все же воздержаться от использования НПВП с доказанной гепатоксичностью – сулиндака, ибупрофена и нимесулида. Кроме того, вне зависимости от гепатотоксического потенциала применяемого в каждом конкретном случае НПВП, необходим динамический контроль биохимических маркеров печеночного цитолиза и холестаза, поскольку возникновение лекарственного повреждения печени – весьма труднопрогнозируемая ситуация. При длительной терапии НПВП периодичность такого контроля должна быть не меньше 1 раза в месяц.
Однако на практике следует все же воздержаться от использования НПВП с доказанной гепатоксичностью – сулиндака, ибупрофена и нимесулида. Кроме того, вне зависимости от гепатотоксического потенциала применяемого в каждом конкретном случае НПВП, необходим динамический контроль биохимических маркеров печеночного цитолиза и холестаза, поскольку возникновение лекарственного повреждения печени – весьма труднопрогнозируемая ситуация. При длительной терапии НПВП периодичность такого контроля должна быть не меньше 1 раза в месяц.
Следует подчеркнуть, что в настоящее время, при практически сходной эффективности большинства современных НПВП, на первый план при выборе конкретного варианта терапии должен выходить все-таки критерий ее безопасности. Приоритет именно данного критерия, положенного в основу представленного алгоритма, направленного на предупреждение или минимизацию побочных эффектов НПВП со стороны печени, позволит избежать неуверенного балансирования на виртуальной грани эффективности и безопасности и проводить лечение в условиях максимального комфорта и для пациента, и для врача.
Статья добавлена 13 апреля 2016 г.
Осложнения терапии НПВП | Еженедельник АПТЕКА
|
По данным ВОЗ, около 20% населения земного шара регулярно принимают НПВП [3]. Спектр показаний к их применению достаточно широк: ревматические заболевания, неревматические заболевания опорно-двигательного аппарата, неврологические заболевания воспалительного генеза, болевой синдром и лихорадка различной этиологии, дисменорея, профилактика артериальных тромбозов. Побочные эффекты НПВП, в том числе серьезные, довольно часто отмечаются вследствие широкого, а нередко и бесконтрольного их применения при различных патологических состояниях.
ПР любых ЛС могут быть обусловлены абсолютной и относительной передозировкой, фармакологическими свойствами самих ЛС, нарушениями иммунобиологических свойств организма, аллергическими реакциями, идиосинкразией, синдромом отмены [1]. Большинство ПР вызваны непосредственно фармакологическим воздействием НПВП. Все известные НПВП близки по фармакологическим свойствам и механизмам действия. Ведущий механизм, определяющий эффективность и токсичность НПВП, связан с подавлением активности циклооксигеназы (ЦОГ) — ключевого фермента метаболизма арахидоновой кислоты. В настоящее время хорошо изучены две изоформы ЦОГ. В тканях содержится ЦОГ-1, синтезируемая в физиологических условиях и регулирующая синтез простагландинов (ПГ), защищающих от повреждения слизистую оболочку пищеварительного тракта (ПТ) и почки. В норме концентрация ЦОГ-2 в тканях очень низкая, однако происходит ее резкое повышение при воспалительных процессах под влиянием биологически активных веществ (цитокинов, эндотоксинов, митогенов и др.).
Ведущий механизм, определяющий эффективность и токсичность НПВП, связан с подавлением активности циклооксигеназы (ЦОГ) — ключевого фермента метаболизма арахидоновой кислоты. В настоящее время хорошо изучены две изоформы ЦОГ. В тканях содержится ЦОГ-1, синтезируемая в физиологических условиях и регулирующая синтез простагландинов (ПГ), защищающих от повреждения слизистую оболочку пищеварительного тракта (ПТ) и почки. В норме концентрация ЦОГ-2 в тканях очень низкая, однако происходит ее резкое повышение при воспалительных процессах под влиянием биологически активных веществ (цитокинов, эндотоксинов, митогенов и др.).
ЦОГ-2 играет важную роль в синтезе ПГ, вызывающих и поддерживающих местные и общие воспалительные реакции (повышение температуры тела, формирование отека, генерация боли, нарушение функции и др.) [7].
Таким образом, ингибиция ЦОГ-2 с последующим снижением синтеза провоспалительных ПГ рассматривается как один из важных механизмов противовоспалительной и анальгетической активности НПВП, а ЦОГ-1 — развития побочных реакций [4]. Поэтому селективность НПВП в отношении ЦОГ имеет большое значение и положена в основу их классификации (Frolich J., 1997) на селективные ингибиторы ЦОГ-1 (низкие дозы ацетилсалициловой кислоты), ингибиторы ЦОГ-1 и ЦОГ-2 (большинство известных НПВП), селективные ингибиторы ЦОГ-2 (мелоксикам, этодолак, набуметон, нимесулид), специфичные ингибиторы ЦОГ-2 (рофекоксиб, целекоксиб). Таким образом, чем выше специфичность действия НПВП, тем ниже риск развития ПР. Перспективным направлением профилактики осложнений ПР является широкое внедрение в клиническую практику селективных и тем более специфичных ингибиторов ЦОГ-2.
Поэтому селективность НПВП в отношении ЦОГ имеет большое значение и положена в основу их классификации (Frolich J., 1997) на селективные ингибиторы ЦОГ-1 (низкие дозы ацетилсалициловой кислоты), ингибиторы ЦОГ-1 и ЦОГ-2 (большинство известных НПВП), селективные ингибиторы ЦОГ-2 (мелоксикам, этодолак, набуметон, нимесулид), специфичные ингибиторы ЦОГ-2 (рофекоксиб, целекоксиб). Таким образом, чем выше специфичность действия НПВП, тем ниже риск развития ПР. Перспективным направлением профилактики осложнений ПР является широкое внедрение в клиническую практику селективных и тем более специфичных ингибиторов ЦОГ-2.
ПР НПВП разнообразны и включают осложнения со стороны ПТ, центральной нервной системы (ЦНС), нефротоксичность, гепатотоксичность, ототоксичность, реакции гиперчувствительности и кожные аллергические реакции, а также другие редко возникающие побочные эффекты.
Наиболее частое осложнение при приеме НПВП — так называемая НПВП-гастропатия. Понятие «НПВП-гастропатия» включает гастритоподобные изменения, эрозии и язвы, объединенные общим патогенезом. Основной патогенный механизм действия НПВП для слизистой оболочки желудка заключается в блокаде ЦОГ-1, которая способствует выработке ПГ (прежде всего ПГE2 и ПГI2), обеспечивающих защиту слизистой оболочки желудка. Под влиянием НПВП нарушается баланс между факторами защиты и агрессии в пользу последних. Таким образом, «НПВП-гастропатия» — не местная, а системная реакция организма, возникающая в ответ на подавление синтеза гастропротекторных ПГ, поэтому снижение дозы, переход на парентеральный или ректальный путь введения, использование кишечно-растворимых форм НПВП не могут устранить проблему риска развития НПВП-гастропатии. Примерно у 15–40% пациентов, принимающих НПВП, регистрируются эрозии или язвы желудка [6]. Чаще всего НПВП-гастропатию вызывают кеторолак и пироксикам [8]. Субъективная симптоматика ПР со стороны ПТ включает тошноту, рвоту, диспепсию, диарею, запор, изжогу, боль в эпигастральной области и отмечается у трети больных, чаще всего при длительном приеме НПВП [4].
Понятие «НПВП-гастропатия» включает гастритоподобные изменения, эрозии и язвы, объединенные общим патогенезом. Основной патогенный механизм действия НПВП для слизистой оболочки желудка заключается в блокаде ЦОГ-1, которая способствует выработке ПГ (прежде всего ПГE2 и ПГI2), обеспечивающих защиту слизистой оболочки желудка. Под влиянием НПВП нарушается баланс между факторами защиты и агрессии в пользу последних. Таким образом, «НПВП-гастропатия» — не местная, а системная реакция организма, возникающая в ответ на подавление синтеза гастропротекторных ПГ, поэтому снижение дозы, переход на парентеральный или ректальный путь введения, использование кишечно-растворимых форм НПВП не могут устранить проблему риска развития НПВП-гастропатии. Примерно у 15–40% пациентов, принимающих НПВП, регистрируются эрозии или язвы желудка [6]. Чаще всего НПВП-гастропатию вызывают кеторолак и пироксикам [8]. Субъективная симптоматика ПР со стороны ПТ включает тошноту, рвоту, диспепсию, диарею, запор, изжогу, боль в эпигастральной области и отмечается у трети больных, чаще всего при длительном приеме НПВП [4].
Однако развитие субъективной симптоматики плохо коррелирует с истинной тяжестью поражения ПТ. Около 50% пациентов, у которых возникают большие пептические язвы, а также у госпитализированных по поводу желудочных кровотечений, вызванных приемом НПВП, жалоб, свидетельствующих о поражении пищеварительного тракта, не предъявляют [2, 4]. Несмотря на несомненную ульцерогенную активность НПВП, очевидным является то, что тяжелые осложнения (прободные пептические язвы, кровотечения) — это не закономерное следствие лечения НПВП. Среди факторов риска развития НПВП-индуцированного поражения ПТ выделяют пожилой возраст, пептическую язву желудка и двенадцатиперстной кишки, желудочные кровотечения в анамнезе, сопутствующие заболевания сердечно-сосудистой системы, легких, печени и других внутренних органов, прием диуретиков и ингибиторов АПФ, НПВП в высоких дозах, одноразовый прием нескольких НПВП (кроме ацетилсалициловой кислоты в низких дозах), сочетанный прием НПВП и глюкокортикостероидов, НПВП и антикоагулянтов, первые 3 мес применения НПВП. Следовательно, индивидуальная оценка факторов риска для каждого конкретного пациента, использование альтернативных анальгетиков, применение препарата в максимально низких эффективных дозах, предпочтительное назначение селективных и высокоселективных ингибиторов ЦОГ-2, а также использование при лечении пациентов группы повышенного риска мизопростола (синтетического аналога ПГE2), назначение блокаторов Н2-рецепторов или (предпочтительнее) ингибиторов протонного насоса позволяет существенно снизить риск развития индуцируемых НПВП осложнений со стороны ПТ.
Следовательно, индивидуальная оценка факторов риска для каждого конкретного пациента, использование альтернативных анальгетиков, применение препарата в максимально низких эффективных дозах, предпочтительное назначение селективных и высокоселективных ингибиторов ЦОГ-2, а также использование при лечении пациентов группы повышенного риска мизопростола (синтетического аналога ПГE2), назначение блокаторов Н2-рецепторов или (предпочтительнее) ингибиторов протонного насоса позволяет существенно снизить риск развития индуцируемых НПВП осложнений со стороны ПТ.
Поскольку НПВП — липофильные вещества и проникают через гематоэнцефалический барьер, большинство из них способно вызвать побочные эффекты со стороны ЦНС, которые по частоте занимают второе место после гастропатии. Отмечаются головная боль, головокружение, лабильность настроения, депрессия, бессонница, деперсонализация, тремор, психозы (при лечении индометацином, толметином), сонливость, нарушения зрения, поражение периферической нервной системы (при лечении мелоксикамом), возможны снижение слуха и шум в ушах (при приеме салицилатов), описаны редкие случаи асептического менингита (при приеме ибупрофена, индометацина, сулиндака, толметина преимущественно у больных системной красной волчанкой).
Осложнения со стороны сердечно-сосудистой системы чаще всего развиваются у людей пожилого возраста. У данной категории пациентов существенно повышается риск декомпенсации кровообращения, что обусловлено задержкой натрия и увеличением объема циркулирующей крови. Риск обострения застойной сердечной недостаточности у лиц, принимавших НПВП, в 10 раз выше, чем у не принимавших эти препараты [5]. У больных с артериальной гипертензией лечение НПВП ассоциируется с повышением диастолического АД. При применении НПВП снижается эффективность ингибиторов АПФ, диуретиков, повышается АД, отмечается негативное влияние на общую выживаемость пациентов с застойной сердечной недостаточностью.
Метаболизм НПВП происходит преимущественно в печени с образованием неактивных метаболитов, экскретируемых с мочой. Данным препаратам свойственна гепатотоксичность, чаще всего проявляющаяся в виде повышения уровня печеночных ферментов, особенно аминотрансфераз (АсАТ и АлАТ). Отмечались также случаи холестаза, тяжелого идиосинкразического гепатита при применении индометацина, диклофенака, сулиндака и фенилбутазона. Описано фатальное гепатотоксическое действие индометацина у детей, поэтому препарат не рекомендуется использовать для лечения артритов у детей в возрасте младше 11 лет. Гепатотоксичность НПВП обычно отмечется в первые 6 мес лечения, поэтому необходимо осуществлять контроль функции печени в течение первого месяца приема препарата и в дальнейшем — каждые 3–6 мес.
Отмечались также случаи холестаза, тяжелого идиосинкразического гепатита при применении индометацина, диклофенака, сулиндака и фенилбутазона. Описано фатальное гепатотоксическое действие индометацина у детей, поэтому препарат не рекомендуется использовать для лечения артритов у детей в возрасте младше 11 лет. Гепатотоксичность НПВП обычно отмечется в первые 6 мес лечения, поэтому необходимо осуществлять контроль функции печени в течение первого месяца приема препарата и в дальнейшем — каждые 3–6 мес.
При лечении НПВП возможно поражение почек: обратимая почечная недостаточность с повышением уровня креатинина, канальцевый некроз, острый интерстициальный нефрит, нефротический синдром. К факторам риска индуцированного поражения почек относятся пожилой возраст, сопутствующие заболевания почек, сердечная недостаточность, прием диуретиков.
Отмечаются также реакции гиперчувствительности к НПВП. Наиболее высокий риск их возникновения у пациентов с тяжелой бронхиальной астмой и полипами носа — почти у 78% из них развиваются ПР на ацетилсалициловую кислоту [2]. У пациентов с носовыми полипами, бронхиальной астмой или хронической крапивницей также повышен риск гиперреакции на другие НПВП, обычно в виде бронхоспазма и одышки. Важно отметить, что это именно реакции гиперчувствительности, а не аллергии, поскольку они не опосредованы иммуноглобулином E.
У пациентов с носовыми полипами, бронхиальной астмой или хронической крапивницей также повышен риск гиперреакции на другие НПВП, обычно в виде бронхоспазма и одышки. Важно отметить, что это именно реакции гиперчувствительности, а не аллергии, поскольку они не опосредованы иммуноглобулином E.
К редко возникающим побочным эффектам НПВП относятся: лихорадка, волчаночный синдром, васкулит, перикардит, миокардит, апластическая анемия, изолированная эритроцитарная аплазия, тромбоцитопения, нейтропения, гемолитическая анемия, стоматит, кожные реакции (фоточувствительность, полиморфная эритема, крапивница, токсический эпидермальный некролиз).
Учитывая то, что у многих пациентов отмечается несколько хронических заболеваний и они вынуждены принимать одновременно препараты различных групп, необходимо обратить внимание на особенности взаимодействия НПВП с другими широко применяемыми ЛС. Так, совместное применение с непрямыми антикоагулянтами (в частности, варфарином) повышает риск кровотечения за счет ингибирования тромбоцитарных функций и повреждения слизистой оболочки желудка. Сочетанное использование с блокаторами b-адренорецепторов вызывает снижение выраженности их гипотензивного эффекта, а с ингибиторами АПФ, гидралазином и празозином — его нейтрализацию. Комбинированное применение НПВП с диуретиками приводит к нейтрализации их натрийуретического (фуросемид, спиронолактон) и гипотензивного эффекта (фуросемид, тиазидные диуретики). С другой стороны, концентрация некоторых препаратов (литий, дигоксин, аминогликозиды, метотрексат) в плазме при сочетанном применении с НПВП может значительно повышаться, что неизбежно влечет проявление их токсического действия.
Сочетанное использование с блокаторами b-адренорецепторов вызывает снижение выраженности их гипотензивного эффекта, а с ингибиторами АПФ, гидралазином и празозином — его нейтрализацию. Комбинированное применение НПВП с диуретиками приводит к нейтрализации их натрийуретического (фуросемид, спиронолактон) и гипотензивного эффекта (фуросемид, тиазидные диуретики). С другой стороны, концентрация некоторых препаратов (литий, дигоксин, аминогликозиды, метотрексат) в плазме при сочетанном применении с НПВП может значительно повышаться, что неизбежно влечет проявление их токсического действия.
Итак, на выбор оптимального НПВП для конкретного пациента влияет целый комплекс факторов: эффективность, безопасность, селективность по отношению к ЦОГ-2, наличие токсического действия на хрящ (что особенно важно при остеоартрозе), фармакодинамические свойства, удобство дозировки, форма выпуска, совместимость с другими ЛС, стоимость, индивидуальная чувствительность пациента, его возраст, наличие основного заболевания, сопутствующей патологии. Таким образом, НПВП, с одной стороны, — незаменимые препараты для лечения многих заболеваний, с другой, — имеют значительное количество различных нежелательных эффектов, связанных как с самими лекарствами, так и со взаимодействием их с другими активными химическими соединениями.
Таким образом, НПВП, с одной стороны, — незаменимые препараты для лечения многих заболеваний, с другой, — имеют значительное количество различных нежелательных эффектов, связанных как с самими лекарствами, так и со взаимодействием их с другими активными химическими соединениями.
Елена Барсукова
ЛИТЕРАТУРА | |
|
ФАРМАТЕКА » Лекарства и печень
В статье представлены эпидемиология, патогенез, классификация, алгоритм диагностики и методы лечения лекарственных поражений печени (ЛПП). Большое внимание уделено этиологии и патогенезу этих поражений. Обсуждается система диагностического поиска, рассмотрены этапы диагностики и дифференциальной диагностики, разбираются современные подходы к терапии ЛПП, приводятся оптимальные варианты медикаментозного лечения. Подчеркивается, что наиболее перспективным средством лечения ЛПП является препарат Гептрал (адеметионин).
Обсуждается система диагностического поиска, рассмотрены этапы диагностики и дифференциальной диагностики, разбираются современные подходы к терапии ЛПП, приводятся оптимальные варианты медикаментозного лечения. Подчеркивается, что наиболее перспективным средством лечения ЛПП является препарат Гептрал (адеметионин).
Печень играет основную роль в метаболизме лекарственных средств (ЛС), в связи с этим считается, что не существует лекарств, которые в определенных условиях не вызывали бы повреждения этого органа. Многие исследователи под лекарственными поражениями печени (ЛПП) подразумевают ее повреждения, вызванные прямым или опосредованным воздействием ЛС или их метаболитов [1–4]. Непрерывно возрастающий поток сведений о гепатотоксическом действии (ГТД) многих ЛС свидетельствует о том, что ЛПП в настоящее время являются одной из важнейших проблем гепатологии. Известно более тысячи ЛС, способных вызывать ЛПП.
Эпидемиология ЛПП
По данным американских исследователей, побочные эффекты ЛС выступают в роли причинного фактора желтухи у 2–5 % стационарных больных, обусловливают 40 % гепатитов у пациентов старше 40 лет и 25 % случаев фульминантной (острой) печеночной недостаточности (ОПН) [5–7]. В России опубликован ряд исследований по ЛПП, вызванным противотуберкулезными препаратами [8, 9] и нестероидными противовоспалительными средствами [8, 10]. В нашей стране острые ЛПП выявляются среди 2,7 % госпитализированных больных. Чаще всего ЛПП связаны с противотуберкулезными, антибактериальными препаратами, анальгетиками, гормональными, цитостатическими, гипотензивными и антиаритмическими средствами [11]. Во фтизиатрии частота медикаментозных поражений печени составляет от 15 до 20 % [9].
В России опубликован ряд исследований по ЛПП, вызванным противотуберкулезными препаратами [8, 9] и нестероидными противовоспалительными средствами [8, 10]. В нашей стране острые ЛПП выявляются среди 2,7 % госпитализированных больных. Чаще всего ЛПП связаны с противотуберкулезными, антибактериальными препаратами, анальгетиками, гормональными, цитостатическими, гипотензивными и антиаритмическими средствами [11]. Во фтизиатрии частота медикаментозных поражений печени составляет от 15 до 20 % [9].
В последние годы частота ЛПП существенно увеличилась, что связано с множеством ЛС, отпускаемых в аптечной сети без рецепта, а также с отсутствием достаточной информации об их возможном побочном действии. Доказано, что при одновременном приеме 5 ЛС вероятность развития побочных эффектов составляет около 4 %, 5–10 препаратов – 10 %, 11–16 – 28 %, а 17–20 –54 % [8]. ЛПП является одной из основных причин ОПН в большинстве развитых стран мира. На рис. 1 представлены данные американских исследователей по ЛС, вызвавшим ОПН с дальнейшей трансплантацией печени в период с 1987 по 2006 г.
Рисунок 1.
Патогенез ЛПП
При рассмотрении патогенеза ЛПП выделяют следующие механизмы действия лекарств:
• прямое ГТД на клетки печени;
• непрямое ГТД: токсические эффекты метаболитов ЛС, иммуноаллергические поражения печени.
Прямое гепатотоксическое действие
ЛС, в определенных дозах оказывающие непосредственное повреждающее влияние на печень, называют препаратами с облигатным ГТД. Для прямого ГТД характерны зависимость риска повреждения от дозы и воспроизводимость токсического эффекта [10]. Латентный период между введением препарата и развитием поражения печени относительно короток и имеет известную продолжительность.
Развитие ЛПП при приеме облигатных гепатотоксинов объясняется нарушением процессов их обезвреживания в организме. Это может наблюдаться, в частности, при превышении терапевтической дозы препарата с узким интервалом терапевтического действия, а также при снижении скорости детоксикации или выведения ЛС. К препаратам, обладающим прямым ГТД, относятся, например, изониазид, меркаптоприн, метотрексат, парацетамол, тетрациклин.
К препаратам, обладающим прямым ГТД, относятся, например, изониазид, меркаптоприн, метотрексат, парацетамол, тетрациклин.
Механизмы действия прямых гепатотоксинов включают непосредственное повреждение клеточных структур, денатурацию белков, активацию перекисного окисления липидов (ПОЛ). Для повреждения печени под влиянием прямых гепатотоксинов характерны гистологические изменения в виде некроза гепатоцитов и/или жировой дистрофии печени.
Прямое ГТД ЛС на гепатоциты в настоящее время встречается крайне редко, что обусловлено ужесточением контроля над побочными эффектами лекарств. В качестве примера можно привести препарат галотан, запрещенный к применению из-за токсического действия на печень.
Непрямое гепатотоксическое действие
ЛС, способные оказывать непрямое повреждающее действие на печень, называют препаратами с факультативным ГТД. Для непрямого ГТД характерно отсутствие зависимости риска повреждения печени от дозы и невозможность его воспроизведения в эксперименте. Непрямое ГТД лекарств можно наблюдать лишь среди небольшой части принимающих их пациентов.
Непрямое ГТД лекарств можно наблюдать лишь среди небольшой части принимающих их пациентов.
Латентный период между введением препарата и развитием гепатопатии имеет различную непрогнозируемую продолжительность, обычно составляя от нескольких недель до нескольких месяцев.
Развитие ЛПП при приеме факультативных гепатотоксинов объясняется образованием токсичных метаболитов или реакцией гиперчувствительности к препарату. Подобные реакции индивидуальной непереносимости называют идиосинкразией.
Повреждение печени вследствие реакций идиосинкразии (под действием непрямых гепатотоксинов) может развиваться по иммунологическому или метаболическому типу.
Метаболический тип повреждений связан с вмешательством необычных побочных продуктов метаболизма в клеточный обмен. Под их влиянием может наблюдаться, например, алкилирование или ацетилирование клеточных белков, развиваться дефицит синтеза АТФ, происходить связывание рецепторов и сульфгидрильных групп, взаимодействие с нуклеопротеинами (пример: амиодарон, обладающий большим периодом полувыведения).
Иммунологический тип ЛПП связывают с метаболитами, которые могут оказаться гаптенами для белков клеток печени, вызывая их иммунное повреждение. При наличии генетического дефекта в печени лекарство превращается в токсический метаболит, ковалентно связывается с клеточным белком (глутатионом), приводя к некрозу гепатоцитов, а также стимулирует образование антигена (гаптена) и сенсибилизирует Т-лимфоциты, запускающие механизмы иммунной гепатотоксичности. Повторная экспозиция (назначение лекарственного препарата) приводит к усилению иммунной реакции.
В этом процессе могут участвовать ферменты системы Р450. На мембранах гепатоцитов присутствует несколько изоферментов Р450, индукция которых может приводить к образованию специфических антител при иммунном повреждении печеночных клеток.
Идиосинкразия к диуретикам и тиениловой кислоте сопровождается появлением аутоантител, взаимодействующих с органелами гепатоцита.
Характерным признаком иммунологически опосредованного повреждения печени является наличие сопутствующих проявлений аллергии, таких как экзантема, зуд, артралгия, эозинофилия.
Для повреждения печени под действием непрямых гепатотоксинов характерны гистологические изменения в виде некроза, стеатоза, холестаза или опухолевой трансформации клеток печени, вторичной воспалительной инфильтрации. При иммунологическом типе повреждения нередко выявляются гранулемы и эозинофильная инфильтрация.
В ряде случаев патогенез ЛПП можно рассматривать как комбинированный: например, на фоне уже имеющегося токсического поражения печени образуются побочные “конечные продукты” с высоким повреждающим потенциалом.
Метаболизм ЛС в печени (гепатоците) можно представить следующей последовательностью:
• Фаза 1: гидроксилирование ЛС.
• Фаза 2: биотрансформация лекарственных метаболитов.
• Фаза 3: экскреция продуктов биотрансформации с желчью или мочой.
Фаза 1. Основная система, метаболизирующая ЛС, расположена в микросомальной фракции гепатоцитов (гладкой эндоплазматической сети; рис. 2). К ней относятся монооксигеназы со смешанной функцией, цитохром-С-редуктаза, цитохром Р450. Кофактором служит восстановленный НАДФ в цитозоле. ЛС подвергаются гидроксилированию или окислению, что обеспечивает усиление их поляризации.
Кофактором служит восстановленный НАДФ в цитозоле. ЛС подвергаются гидроксилированию или окислению, что обеспечивает усиление их поляризации.
Рисунок 2.
Система цитохромов Р450, локализованная в эндоплазматической сети гепатоцитов, обеспечивает метаболизм ЛС. При этом образуются токсичные метаболиты. Идентифицировано по меньшей мере 50 изоферментов системы Р450, и нет сомнений, что их еще больше. Человеку метаболизм лекарств обеспечивают цитохромы, относящиеся к трем семействам: P450-I, P450-II и P450-III.
Увеличение содержания ферментов системы цитохрома Р450 в результате индукции приводит к повышению выработки токсичных метаболитов. Когда два активных ЛС конкурируют за один участок связывания на ферменте, метаболизм препарата с меньшей аффинностью замедляется и срок его действия увеличивается. Этанол индуцирует синтез Р450-II-Е1 и тем самым увеличивает токсичность парацетамола. Токсичность парацетамола увеличивается и при лечении изониазидом, который также индуцирует синтез Р450-II-Е1.
Фаза 2. Основными реакциями этой фазы являются нейтрализация, дезактивация, детоксикация гидрофильных и зачастую токсичных продуктов фазы 1 при помощи различных гидролаз и трансфераз. Промежуточные метаболиты с помощью ферментов семейств глутатион-S-трансферазы (GST), уридиндифосфатглукуронозилтрансферазы (UGT), N-ацетилтрансфераз (NAT) превращаются в полярные водорастворимые нетоксические продукты и выводятся из организма. Ферменты фазы 2 функционируют при любых путях поступления лекарств, осуществляя или завершая детоксикацию. Большинство указанных ферментов находится в гиалоплазме, часть из них локализована в мембранах эндоплазматического ретикулума и митохондрий. Наиболее широка и многообразна активность семейства GST (GSTM1, GSTP1), а также NAТ, метаболизирующих тысячи ксенобиотиков [13].
GST важна с точки зрения защиты гепатоцитов от нестабильных электрофильных соединений. Глутатионтрасферазы тесно связаны с цитохромом Р450 и быстро инактивируют активные метаболиты, образующиеся в I фазе метаболизма. Генетически обусловленный дефицит глутатионсинтетазы может повышать восприимчивость к токсическому действию ряда препаратов, включая парацетамол.
Генетически обусловленный дефицит глутатионсинтетазы может повышать восприимчивость к токсическому действию ряда препаратов, включая парацетамол.
На рис. 3 представлены семейства цитохрома P450, которые участвуют в метаболизме ЛС (размер каждой секции диаграммы отображает процентное количество ЛС, метаболизируемых с помощью определенного цитохрома; фаза 1), и процентные количества ферментов, участвующих в процессе биотрансформации ЛС (фаза 2).
Рисунок 3.
Фаза 3. Продукты биотрансформации ЛС могут выделяться с желчью или мочой. Способ выделения определятся многими факторами, некоторые из них еще не изучены. Высокополярные вещества, а также метаболиты, ставшие полярными после конъюгации, выделяются с желчью в неизмененном виде.
Метаболизм ЛС происходит не только в гепатоцитах, но и в синусоидальных эндотелиальных клетках (ряд лекарственных препаратов проявляет селективную токсичность по отношению к ним).
Механизмы ЛПП
Повреждение клеток печени происходит в специфических структурах пораженных внутриклеточных органелл. Нормальный гепатоцит, представленный на рис. 4, может быть поврежден шестью способами (1–6). Нарушение внутриклеточного гомеостаза кальция приводит к разрушению фибрилл актина на поверхности гепатоцита. Это ведет к вздутию мембраны клетки (1), а в дальнейшем – к ее разрушению и лизису. При холестатических заболеваниях разрушение ворсинок актина (2) может происходить рядом с канальцем специфичной части клетки, ответственной за желчную экскрецию. Нарушение передачи в ворсинках актина мультирезистентного белка (MRP3) предотвращает экскрецию с билирубином органических элементов лекарственного препарата.
Нормальный гепатоцит, представленный на рис. 4, может быть поврежден шестью способами (1–6). Нарушение внутриклеточного гомеостаза кальция приводит к разрушению фибрилл актина на поверхности гепатоцита. Это ведет к вздутию мембраны клетки (1), а в дальнейшем – к ее разрушению и лизису. При холестатических заболеваниях разрушение ворсинок актина (2) может происходить рядом с канальцем специфичной части клетки, ответственной за желчную экскрецию. Нарушение передачи в ворсинках актина мультирезистентного белка (MRP3) предотвращает экскрецию с билирубином органических элементов лекарственного препарата.
Рисунок 4.
Многие гепатоцеллюлярные реакции активизируют гемсодержавший цитохром P450 (3), инициируя при этом высокоэнергетические реакции, которые могут приводить к образованию ковалентной связи ЛС с ферментом, таким образом создавая неактивные продукты метаболизма. Эти продукты в виде пузырьков (4) мигрируют к поверхности клетки и могут становиться причиной многогранного иммунного ответа, включающего цитолитические Т-лимфоциты и цитокины.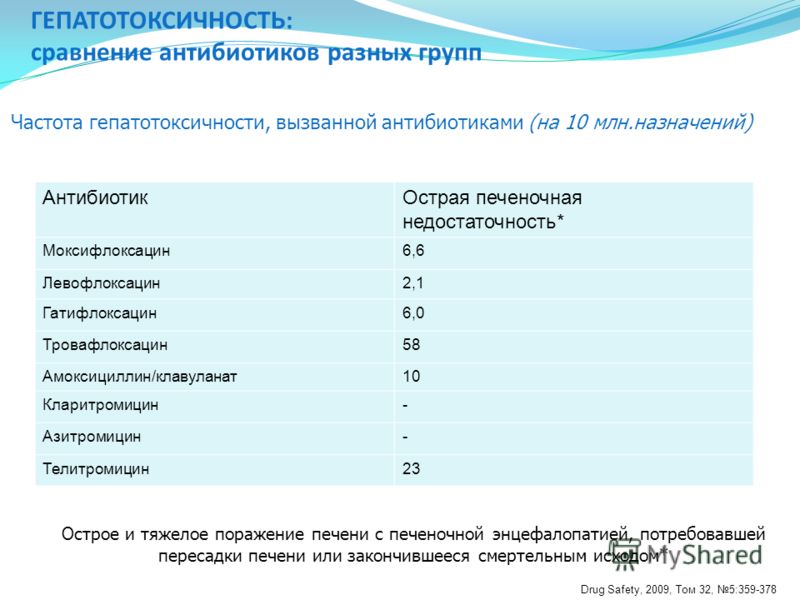 Активация фактора некроза опухоли α является триггерным фактором запуска каскада межклеточных каспаз (5), который заканчивается программированным апоптозом клеток с потерей ядерного хроматина.
Активация фактора некроза опухоли α является триггерным фактором запуска каскада межклеточных каспаз (5), который заканчивается программированным апоптозом клеток с потерей ядерного хроматина.
Некоторые препараты ингибируют функцию митохондрий гепатоцита двойным эффектом, снижая продукцию АТФ и ферментов дыхательной цепи (6). Свободные жирные кислоты не метаболизируются из-за дефицита аэробных механизмов, участвующих в накоплении лактата и реактивных продуктов окисления. Их накопление приводит к повреждению митохондриальной ДНК. Такая структура повреждения характерна для множества ЛС, включая нуклеозидные ингибиторы обратной транскриптазы, вальпроевую кислоту, тетрациклин и аспирин. Все они экскретируются в желчь и могут повреждать эпителий желчного протока.
Проникновение лекарств в гепатоцит зависит от липофильности медикаментов. Жировая растворимость является важнейшим фактором попадания ЛС в системную циркуляцию с диффузным проникновением в энтероцит. Лекарства с незначительной липофильностью плохо абсорбируются и экскретируются с каловыми массами, а в комплексе с протеином, обычно альбумином, обладают высокой способностью проникновения в различные ткани. Практически все ЛС, назначенные перорально, попадают в печень. Степень печеночной экскреции лекарств зависит от печеночного кровотока и активности ферментов, участвующих в их метаболизме.
Основные факторы развития ЛПП
Вероятность развития ЛПП зависит от свойств лекарственного препарата, особенностей больного и прочих факторов. Известно, что она возрастает с увеличением количества одновременно принимаемых лекарств.
Беременность, стресс, бедное белками питание увеличивают риск токсичности медикаментов. ЛС, являющиеся энзиматическими индукторами, могут потенцировать действие других препаратов. В современной клинической практике широко распространено комбинированное применение лекарств, что связано с наличием у пациента нескольких заболеваний или недостаточной эффективностью монотерапии. При комбинированной терапии возможно взаимодействие лекарств. В частности, риск развития гепатита увеличивается для больных, одновременно принимающих рифампицин и изониазид. При этом гепатиты возникают в 5–8 % случаев, тогда как при монотерапии изониазидом и рифампицином их развитие отмечается среди 1,2 и 0,3 % больных соответственно.
Потенциально опасные комбинации лекарств являются серьезной клинической проблемой. Имеются данные, что от 17 до 23 % назначаемых врачами комбинаций ЛС потенциально опасны. Только в США из-за непредусмотренного взаимодействия лекарств ежегодно умирают 48 тыс. больных. FDA сняло с регистрации несколько ЛС (в т. ч. прокинетик цизаприд) по причине их потенциально опасных взаимодействий с другими медикаментами, приводивших в т. ч. и к летальным исходам.
• Основные механизмы взаимодействий лекарств связаны с изменением их фармакокинетики или фармакодинамики. Наиболее существенными, согласно современным представлениям, являются изменения фармакокинетики при метаболизме лекарств с участием цитохромов системы Р450.
• Примером опасного взаимодействия является недавно обнаруженное взаимодействие ингибиторов протонной помпы (ИПП) и клопидогрела, широко применяемого при лечении больных ишемической болезнью сердца. Для уменьшения риска гастроинтестинальных осложнений больным, получающим ацетилсалициловую кислоту в комбинации с клопидогрелом, назначают ИПП. Поскольку биоактивация клопидогрела происходит с участием CYP2C19, прием ИПП, метаболизируемых тем же цитохромом, может снижать антиагрегантный эффект клопидогрела. В мае 2009 г. были представлены данные, свидетельствующие, что одновременное использование клопидогрела и ИПП значительно повышает риск возникновения инфаркта миокарда, инсульта, нестабильной стенокардии, необходимость повторных коронарных вмешательств и коронарной смерти [14]. Примеры взаимодействия ЛС, обусловленного индукцией ферментов печени, представлены на рис. 5.
Рисунок 5.
Список лекарств, вызывающих лекарственные гепатиты, довольно значительный, но такие поражения печени встречаются сравнительно редко.
Гепатотоксические реакции, возникающие при применении салицилатов, тетрациклинов и антиметаболитов, зависят от дозы лекарств. Поражения печени, обусловленные лекарственной идиосинкразией, могут возникать при воздействии любых медикаментов. Так, например, галотан, изониазид и парацетамол способны вызывать массивный некроз печени; метилдофа – острый или хронический гепатит.
ЛПП обычно проявляют себя бессимптомным повышением уровня печеночных ферментов, т. е. протекают субклинически, являясь “биохимической находкой” (безжелтушный вариант течения острого лекарственного гепатита). Дальнейший прием препаратов, вызвавших безжелтушный лекарственный гепатит, может приводить к развитию тяжелых лекарственных гепатитов, сопровождающихся желтухой.
В большинстве случаев осложнения со стороны печени проявляются изолированным повышением уровня аминотрансфераз без отчетливых клинических проявлений или сопровождаются астеническим синдромом. Бессимптомное повышение уровня аминотрансфераз может наблюдаться при использовании таких лекарственных средств, как изониазид, метилдофа и амиодарон. При повторном приеме перечисленных препаратов могут развиваться тяжелые гепатиты со смертельным исходом. Таким образом, на изолированное повышение активности аминотрансфераз необходимо обращать самое пристальное внимание, т. к. оно может свидетельствовать о развитии лекарственной патологии печени. Диапазон клинических проявлений ЛПП разнообразен: от небольшого бессимптомного повышения уровня аминотрансфераз до молниеносно манифестирующего гепатита и развития цирроза. Для человека ЛПП могут напоминать почти все существующие заболевания печени (рис. 6).
Рисунок 6.
Лекарственные гепатиты, сопровождающиеся желтухой, могут протекать по цитолитическому, холестатическому или смешанному варианту. В ряде случаев может развиваться псевдохирургическая симптоматика (боли в животе, лихорадка, желтуха, увеличенный желчный пузырь). К ЛС, обладающим способностью вызывать острую псевдохирургическую симптоматику, относятся цитостатики, антидепрессанты, антиаритмические препараты. Фактором, способствующим переходу гепатита в хроническую стадию, является длительный прием лекарств.
Диагностика ЛПП
Диагностика ЛПП представляет собой сложную проблему.
Предлагается несколько критериев, содействующих уточнению диагноза и подтверждению лекарственного характера хронология возникновения осложнений;
• регресс клинической симптоматики после отмены лечения;
• рецидив осложнения после повторного введения препарата;
• отсутствие другой возможной этиологии;
• результаты лабораторно-инструментальных и морфологических исследований.
Хронологический критерий весьма показателен, хотя время появления осложнений после приема лекарства существенно различается – от несколько дней (иногда часов) до нескольких недель и месяцев. В случае полипрагмазии хронологический фактор очень трудно оценить.
Регресс клинических признаков осложнения после отмены лечения – довольно четкий диагностический критерий. Регресс может быть длительным (более месяца), при этом учитывается нормализация уровня аминотрансфераз. При повторном применении лекарства, ранее уже вызывавшего гепатит, рецидив осложнения рассматривается как результат действия данного лекарства.
В ряде работ указывается на необходимость дифференциальной диагностики между медикаментозными и вирусными гепатитами, гепатомой, первичным билиарным циррозом печени, алкогольным гепатитом. Кроме того, важно исключить поражение печени вследствие тяжелого инфекционного заболевания, шока, сердечно-сосудистой недостаточности, глистных инвазий, заболеваний желчных путей.
К методам, позволяющим проводить дифференциальную диагностику ЛПП с другой возможной патологией печени, относятся биохимические исследования сыворотки крови (спектр печеночных ферментов), иммуноферментный анализ (маркеры вирусных гепатитов и опухолевого процесса) и инструментальные методы (ультразвуковое исследование, компьютерная томография, лапароскопия с биопсией печени, эндоскопическая ретроградная холангиопанкреатография). Большая роль в определении типа ЛПП принадлежит оценке биохимических проб печени с выделением синдромов цитолиза, холестаза, иммунного воспаления и печеночно-клеточной недостаточности [1].
Для синдрома цитолиза при повреждении печени без холестаза и аутоиммунных нарушений характерно повышение в сыворотке крови уровней АЛТ и АСТ при нормальном содержании щелочной фосфатазы (ЩФ), γ-глутамилтранспептидазы (ГГТП) и γ-глобулинов. Для интралобулярного холестаза характерно повышение уровней АЛТ, АСТ, ГГТП, возможно ЩФ, но не более двух норм.
При экстралобулярном (дуктулярном) холестазе происходит повышение уровней АЛТ, АСТ, ГГТП, а также ЩФ в 2 и более раз. В случае аутоиммунного генеза ЛПП повышаются уровни АЛТ, АСТ, γ-глобулинов (в 1,5 и более раз), циркулирующих иммунных комплексов (ЦИК), иммуноглобулинов.
Биохимическим маркером синдрома холестаза является повышение в сыворотке крови уровней ГГТП, ЩФ, в ряде случаев – общего билирубина с преобладанием конъюгированного. При интралобулярном холестазе отмечается или изолированное повышение уровня ГГТП (гепатоцеллюлярный холестаз), или повышение уровня ГГТП в сочетании с увеличением содержания ЩФ, не превышающим двукратный уровень нормы ЩФ (каналикулярный холестаз). Для экстралобулярного (дуктулярного) холестаза характерно увеличение уровня ГГТП и содержания ЩФ, превышающее норму в 2 и более раз.
Для синдрома иммунного воспаления наряду с повышением уровня АЛТ и АСТ типично увеличение содержания γ-глобулинов в 1,5 и более раз, а также ЦИК и иммуноглобулинов.
При наличии синдрома печеночно-клеточной недостаточности отмечается снижение протромбинового индекса или увеличение протромбинового времени, нередко – уровня альбуминов. Классификация поражений печени, основанная на критериях Совета международных научно-медицинских организаций (CIOMS), представлена в табл. 1.
Таблица 1.
Лечение ЛПП
Примерные схемы терапии основных ЛПП, которые, согласно данным [1], оказались достаточно эффективными, представлены в табл. 2.
Таблица 2.
Наиболее перспективным препаратом, воздействующим на основные звенья патогенеза внутрипеченочного холестаза, является Гептрал. Он представляет собой природное вещество S-аденозил-L-метионин, входящее в состав тканей организма и синтезируемое в печени.
Таким образом, диагностика медикаментозных поражений печени осуществляется на стадии, проявляющейся желтухой и гепатомегалией. При этом существует настоятельная необходимость выявления лекарственных препаратов, применяемых в России и обладающих гепатотоксическим эффектом, описания клинических вариантов течения ЛПП, усовершенствования алгоритма дифференциальной диагностики лекарственных гепатитов и схем их лечения.
1. Ковтун А.В., Яковенко А.В., Иванов А.Н. и др. Лекарственно-индуцированные поражения печени. Диагностика и лечение // Лечащий врач 2011. № 2.
2. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. М.,1999. 859 с.
3. Kaplowitz N, DeLeve LD. Drug-induced liver disease. Informa Healthcare 2007:808.
4. Lee W.M. Drug-induced hepatotoxicity. N Engl J Med 2003;349:474–85.
5. Abboud G, Kaplowitz N. Drug-induced liver injury. Drug Saf 2007;30(4):277–94.
6. Andrade RJ, Robles M, Fernandez-Castaner A, et al. Assessment of drug-induced hepatotoxicity in clinical practice: a chal-lenge for gastroenterologists. World J Gastroenterol 2007;13(3):329–40.
7. Mindikoglu AL, Magder LS, Regev A. Outcome of liver transplantation for drug-induced acute liver failure in the United States: analysis of the united network for organ sharing database. LiverTranspl 2009;15:719–29.
8. Белозеров Е.С., Змушко Е.И. Медикаментозные осложнения. Питер, 2001. 448 с.
9. Суханов Д.С., Романцов М.Г. Эффекты гепатопротектора при поражении печени у больных туберкулезом органов дыхания // Успехи современного естествознания 2008. № 10. С. 40–50.
10. Шульпекова Ю.О. Лекарственные поражения печени // Concilium Medicum. Гастроэнтерология 2007. Т. 9. № 1.
11. Полунина Т.Е., Маев И.В. Лекарственный гепатит // Consilium medicum. Гастроэнтерология 2008. № 1. С. 3–10.
12. Rouas C, Gueguen Y. Les enzymes du metabolisme des xenobiotiques : un role essentiel de detoxication. IRSN 2011.
13. Hardman JG, Limbird LE, Goodman GA. The dynamics of drug absorption, distribution and elimination. In: Goodman and Gilman’s The Pharmacological Basis of Therapeutics, 10th ed. New York, McGraw—Hill, 2001.
14. Бордин Д.С. Что следует учитывать при выборе ингибитора протонной помпы больному ГЭРБ? // Медицинский альманах 2010. № 1. С. 127–130.
15. Ramachandran R, Kakar S. Histological patterns in drug-induced liver disease. J Clin Pathol2009;62:481–92.
Физиологические изменения, вызванные гепатотоксичностью и защитной ролью некоторых лекарственных растений
Реферат
Печень — самый крупный, важный орган и место основных биохимических реакций в организме человека. Он имеет функцию детоксикации токсичных веществ и синтеза полезных биомолекул. Поэтому поражение печени приводит к тяжелым последствиям. Этот ущерб возник в результате хронического злоупотребления алкоголем, вирусного гепатита или наследственного метаболического заболевания. Повреждение печени связано с клеточным некрозом, фиброзом, увеличением перекисного окисления липидов в тканях и снижением уровня тканевого глутатиона.Большинство гепатотоксичных химических веществ повреждают клетки печени, в основном, за счет перекисного окисления липидов и других окислительных повреждений печени. Природные антиоксиданты содержатся во многих соединениях, классифицируемых как вторичные метаболиты растений, например полифенолы (фенольные кислоты и флавоноиды) и терпеноиды (каротиноиды), а также потребление продуктов, содержащих эти соединения в больших количествах, по-видимому, играет важную роль в профилактике многих заболеваний. Травяные препараты, полученные из экстрактов растений, все чаще используются для лечения широкого спектра клинических заболеваний.Больше внимания было уделено защитным эффектам природных антиоксидантов от токсичности, вызванной лекарствами, особенно когда речь идет о генерации свободных радикалов. Популярность лечебных трав растет, и по меньшей мере четверть пациентов с заболеваниями печени используют их. По оценкам Всемирной организации здравоохранения (ВОЗ), 80 процентов населения некоторых азиатских и африканских стран в настоящее время используют фитотерапию для некоторых аспектов первичной медико-санитарной помощи. Некоторые лекарственные травы обладают гепатопротекторным потенциалом. Silybum marianum (расторопша пятнистая) используется для лечения заболеваний печени с 16 века. Его основными составляющими являются флавоноиды силибинин, силидианин, силихристин и изосилибинин, из которых силибинин является наиболее биологически активным соединением и используется для стандартизации фармацевтических продуктов.
Ключевые слова
Физиологические изменения
Гепатотоксичность
Некоторые лекарственные растения
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию
© 2016 Beni-Suef University.Производство и размещение компанией Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
(PDF) Гепатотоксические эффекты афлатоксина у рабочих, подвергшихся воздействию пыли пшеничной муки
Египетский журнал экологических исследований EJER; 2014, Т. 2: 51-56
56
Belfield A, Goldberg DM. (1971): пересмотренный анализ активности фенилфосфатазы в сыворотке с использованием 4-амино-
антипирина. Фермент .; 12 (5): 561-73.
Bergmeyer HU, Bowers GN, Hørder JM и Moss DW (1977): Предварительные рекомендации по методам
IFCC для измерения каталитических концентраций ферментов. Clin Chem .; 23: 887 — 899.
Brera C, Caputi R, Miraglia M, Iavicoli I, Salerno A, Carelli, G. (2002): Оценка воздействия
микотоксинов на рабочих местах: A атоксины и охратоксины A в переносимой по воздуху пыли и в пыли человека. сыворотка.
Microchem. J .; 73: 167–173.
Эль-Сайед Ю.С., Халил Р.Х.(2009): Токсичность, биохимические эффекты и остатки афлатоксина B (1) у морского окуня
, разводимого на воде (Dicentrarchus labrax L.). Food Chem Toxicol .; 47 (7): 1606-9.
Fu JC, Chen Q, Du J, Shi BM, Shan AS. (2013): Эффективность майфанита в снижении пагубного воздействия
афлатоксина B1 на гематологию, остатки афлатоксина B1 и активность антиоксидантных ферментов у
поросят-отъемышей. Животноводство .; 157 (1): 218-224.
Hou YJ, Zhao YY, Xiong B, Cui XS, Kim NH, Xu YX, Sun SC.(2013): Микотоксин-
, содержащий диету, вызывает окислительный стресс у мышей. PLoS One .; 8 (3): e60374.
Kramer JW. Клиническая энзимология. JJ Kaneko (Ed.), Клиническая биохимия домашних животных (изд. 4),
Academic Press, Сан-Диего (1989).
Олувафеми, Ф., Одебийи, Т., Колапо, А. (2012): Профессиональное воздействие афлатоксина на
рабочих комбикормового завода в Нигерии. Всемирный журнал микотоксинов; 5 (4): 385-389.
R-Biopharm GmbH, (2004): Иммуноферментный анализ для количественного анализа афлатоксина B1.Изобразительное искусство.
№: R1201. R-Biopharm GmbH, Дармштадт, Германия.
Редди КРН, Фархана Н.И., Салле Б. (2011): Встречаемость Aspergillus spp. и афлатоксин B1 в
малазийских пищевых продуктах, употребляемых в пищу людьми .; Журнал пищевой науки; 76: T99 – T104
Саад-Хусейн, (2010–2013). Заключительный отчет о грибках, вызывающих рак как проблема здоровья окружающей среды
в проекте «Профессии в группе риска», финансируемом Национальным исследовательским центром Египта.
Стрессер Д.М., Бейли Г.С.(1994): Уильямс Д. Индол-3-карбинол и бета-нафтофлавон индуцируют метаболизм
афлатоксина B1 и цитохромов P-450, связанные с биоактивацией и детоксикацией
афлатоксина B1 у крыс. Утилизация наркотиков, 22: 383–391.
Sun CA, Wu DM, Wang LY, Chen CJ, You SL, Santella RM. (2002): Детерминанты образования
аддуктов афлатоксин-альбумин: исследование в семи городах Тайваня.Br J Cancer; 87: 966–970.
Сас Г. (1969): Определение гамма-GT.Clin Chem. 15: 124-136.
Traverso A, Bassoli V, Cioè A, Anselmo S, Ferro M. (2010): Оценка воздействия афлатоксина на
лабораторного работника
во время анализов на загрязнение пищевых продуктов. Оценка процедур, принятых
A.R.P.A.L. лаборатория (Агентство по охране окружающей среды Лигурийского региона). Med Lav .; 101 (5): 375-80.
Viegas S, Veiga L, Malta-Vacas J, Sabino R, Figueredo P, Almeida A, Viegas C, Carolino E.
(2012): Профессиональное воздействие афлатоксина (AFB) в птицеводстве.Журнал токсикологии и
Гигиена окружающей среды, часть A, 75: 1330–1340.
Wang Y, Chai T, Lu G, Quan C, Duan H, Yao M, Zucker BA, Schlenker G. (2008): одновременное обнаружение
переносимых по воздуху афлатоксина, охратоксина и зеараленона в птичнике методом иммуноаффинной очистки —
up и высокоэффективная жидкостная хроматография. Environ Res .; 107 (2): 139-44.
Ян Дж, Донг С., Цзян Кью, Си Кью, Лю Х, Ян Дж. (2013): Характеристика и экспрессия цитоплазматического гена
супероксиддисмутазы меди / цинка (CuZn SOD) при температуре и перекиси водорода (h3O2)
у коловратки Brachionus calyciflorus.Ген. 15; 518 (2): 388-96.
Яссеин С.Н., Згаир Зр. (2012): Исследование токсичности и патогенности афлатоксина B1 и G1 на мышах Al
Anbar J Vet Sci .; 5: 23–31.
Эффекты природных соединений в лечении и профилактике гепатотоксичности и гепатоцеллюлярной карциномы
1. Loguercio C, Federico A. Окислительный стресс при вирусных и алкогольных гепатитах. Free Radic Biol Med 2003; 34: 1-10.
DOI
2. Vitaglione P, Morisco F, Caporaso N, Fogliano V.Диетические антиоксидантные соединения и здоровье печени. Crit Rev Food Sci Nutr 2004; 44: 575-86.
DOIPubMed
3. Джемал А1, Брей Ф., Центр М.М., Ферли Дж., Уорд Э., Форман Д. Глобальная статистика рака. CA Cancer J Clin 2011; 61: 69-90.
PubMed
4. Ko WS, Hsu SL, Chyau CC, Chen KC, Peng RY. Соединение Cordyceps TCM-700C проявляет мощную гепатопротекторную способность на животных моделях. Фитотерапия 2010; 81: 1-7.
DOIPubMed
5. Сомасундарам А., Картикеян Р., Велмуруган В., Дхандапани Б., Раджа М.Оценка гепатопротекторной активности корневищ Kyllinga nemoralis (Hutch & Dalz). J. Этнофармакол 2010; 127: 555-7.
DOIPubMed
6. Хамзави М.А., Эль-Деншари Э.С., Хассан Н.С., Маннаа Ф.А., Абдель-Ваххаб М.А. Пищевая добавка календулы лекарственной противодействует окислительному стрессу и повреждению печени, вызванным афлатоксином. ISRN Nutr 2013; 2013: 538427.
7. Браво Л. Полифенолы: химия, источники питания, метаболизм и значение в питании.Гайка Ред. 1998; 56: 317-33.
DOIPubMed
8. Ямасита Х., Гото М., Мацуи-Юаса И., Кодзима-Юаса А. Полифенол Ecklonia cava оказывает защитное действие против вызванного этанолом повреждения печени циклическим АМФ-зависимым образом. Мар Наркотики 2015; 13: 3877-91.
DOIPubMedPMC
9. Манах С., Скальберт А., Моран С., Ремеси С., Хименес Л. Полифенолы: источники пищи и биодоступность. Am J Clin Nutr 2004; 79: 727-47.
DOIPubMed
10. Вунджунтук К., Кеттаван А, Чароенкиаткул С., Рунгруанг Т.Пропаренный пророщенный коричневый рис защищает крыс от окислительного стресса, вызванного CCl4, и повреждения печени. J Med Food 2015; Epub впереди печати.
PubMed
11. Райс-Эванс К.А., Миллер Н.Дж., Паганга Г. Взаимосвязь между структурой и антиоксидантной активностью флавоноидов и фенольных кислот. Free Rad Biol Med 1996; 20: 933-56.
DOI
12. Сяо З.П., Пэн З.Й., Пэн М.Дж., Ян В.Б., Оуян Ю.З., Чжу Х.Л. Польза флавоноидов для здоровья и их молекулярный механизм. Mini Rev Med Chem 2011; 11: 169-77.
DOIPubMed
13. Донфак Дж. Х., Симо С. К., Нгамени Б., Чана А. Н., Керр П. Г., Финци П. В., Видари Г., Джардина С., Буонокоре Д., Нгаджуи Б. Т.. Антигепатотоксическая и антиоксидантная активность метанольного экстракта и выделенных соединений из Ficus chlamydocarpa. Nat Prod Comm 2010; 5: 1607-12.
PubMed
14. Shaker E, Mahmoud H, Mnaa S. Силимарин, антиоксидантный компонент и экстракты Silybum marianum предотвращают повреждение печени. Food Chem Toxicol 2010; 48: 803-6.
ДОИПубМед
15.Алькарас-Контрерас Y, Мендоса-Лозано Р.П., Мартинес-Алькарас ER, Мартинес-Альфаро M2, Гальегос-Корона М.А., Рамирес-Моралес М.А., Васкес-Гевара М.А. Силимарин и димеркаптоянтарная кислота уменьшают индуцированную свинцом нефротоксичность и генотоксичность у крыс. Hum Exp Toxicol 2015; Epub впереди печати.
PubMed
16. Fiore C, Eisenhut M, Ragazzi E, Zanchin G, Armanini D. История терапевтического использования лакрицы в Европе. Дж. Этнофармакол 2005; 99: 317-24.
ДОИПубМед
17.Накагава К., Хосоэ К., Хидака Т., Набае К., Кавабе М., Китано М. Ингибирование флавоноидным маслом солодки глутатион-S-трансферазы-положительных очагов в среднесрочном биотесте на гепатоканцерогенез у крыс. Nut Res 2010; 30: 74-81.
DOIPubMed
18. Оразизаде М., Фахредини Ф., Мансури Э., Хорсанди Л. Влияние глицирризиновой кислоты на гепатотоксичность у крыс, вызванную наночастицами диоксида титана. Chem Biol Interact 2014; 220: 214-21.
DOIPubMed
19. Абдель-Ваххаб М.А., Хасан Н.С., Эль-Кади А.А., Хадрави Я.А., Эль-Некити А.А., Мохамед С.Р., Шараф А.А., Маннаа Ф.А.Экстракт красного женьшеня защищает от предраковых поражений печени у крыс, вызванных афлатоксином B1 и фумонизинами. Food Chem Toxicol 2010; 48: 733-42.
DOIPubMed
20. Эль Деншари Э.С., Аль-Гахазали М.А., Маннаа Ф.А., Салем Х.А., Хассан Н.С., Абдель-Ваххаб М.А. Диетический мед и женьшень защищают крыс от гепатонефротоксичности, вызванной тетрахлорметаном. Exp Toxicol Pathol 2012; 64: 753-60.
DOIPubMed
21. Хэ SX, Ло JY, Ван Ю.П., Ван ИЛ, Фу Х, Сюй Ж.Л., Чжао Г, Лю Э.Влияние экстракта из гинкго билоба на повреждение печени у крыс, вызванное тетрахлорметаном. Всемирный журнал J Gastroenterol 2006; 12: 3924-8.
DOIPubMedPMC
22. Schiborr C, Eckert P, Weissenberger J, Muller E, Schwamm D., Grune T., Rimbach G, Frank J. Окислительный стресс и воспаление сердца у мышей SAMP8 и SAMR1 сходны и не изменяются куркумином и гинкго biloba. Извлечение впуска. Курр Фармацевтическая Биотехнология 2010; 11: 861-7.
DOI
23. Янь З., Фан Р., Инь С., Чжао Х, Лю Дж., Ли Л., Чжан В., Гэ Л.Защитное действие полисахарида листьев гинкго билоба на неалкогольную жировую болезнь печени и ее механизмы. Int J Biol Macromol 2015; 80: 573-80.
DOIPubMed
24. Koh PO. Экстракт гинкго билоба (EGb 761) предотвращает церебральную ишемию киназы p70S6 и фосфорилирование S6. Ам Дж. Чин Мед 2010; 38: 727.
DOIPubMed
25. Гульфраз М., Ахамд Д., Ахмад М.С., Куреши Р., Махмуд Р.Т., Джабин Н., Аббаси К.С. Влияние экстрактов листьев Taraxacum officinale на CCl4-индуцированную гепатотоксичность у крыс, исследование in vivo.Пак Дж. Фарм. Sci 2014; 27: 825-9.
PubMed
26. Чо СИ, Пак Дж.Й., Пак Э.М., Чой М.С., Ли М.К., Чон С.М., Чан М.К., Ким М.Дж., Пак Й.Б. Изменение активности печеночных антиоксидантных ферментов и липидного профиля у крыс с индуцированным стрептозотоцином диабетом при добавлении водного экстракта одуванчика. Clinica Chimica Acta 2002; 317: 109-17.
DOI
27. Колле Д., Арантес Л.П., Губерт П., да Луз С.К., Атайд М.Л., Тейшейра Роча Дж. Б., Соареш Ф.А. Антиоксидантные свойства экстракта листьев Taraxacum officinale участвуют в защитном эффекте против гепатотоксичности, вызываемой ацетаминофеном у мышей.J Med Food 2012; 15: 549-56.
DOIPubMed
28. Domitrovic R, Jakovac H, Romic Z, Rahelic D, Tadic Z. Антифибротическая активность корня Taraxacum officinale при повреждении печени у мышей, вызванном тетрахлорметаном. Журнал Этнофармакол 2011; 130: 569-77.
DOIPubMed
29. Рана С.В., Пал Р., Вайфей К., Шарма С.К., Ола Р.П. Чеснок в здоровье и болезни. Nutr Res Rev 2011; 24: 60-71.
DOIPubMed
30. Чу Ю.Л., Хо, Т.Т., Чанг Дж.Г., Рагху Р., Ло Ю.К., Шин Л.Й. Аллицин индуцирует клетки против рака печени человека через ген p53, модулирующий апоптоз и аутофагию.J Agric Food Chem 2013; 61: 9839-48.
DOIPubMed
31. Reyes-Gordillo K, Segovia J, Shibayama M, Vergara P, Moreno MG, Muriel P. Куркумин защищает от острого повреждения печени у крыс, ингибируя NF-[каппа] B, выработку провоспалительных цитокинов и окислительную стресс. Biochim Biophysic Acta 2007; 1770: 989-96.
32. Солиман М.М., Байомы А.А., Ясин М.Х. Молекулярное и гистопатологическое исследование улучшающих эффектов куркумина в отношении гепатотоксичности и нефрототоксичности, вызванной ацетатом свинца, у крыс Wistar.Biol Trace Elem Res 2015; 167: 91-102.
DOIPubMed
33. Le Marchand Y, Singh A, Assimacopoulos-Jeannet F, Orci L, Rouiller C, Jeanrenaud B. Роль микротрубочковой системы в высвобождении липопротеинов очень низкой плотности перфузированной печенью мыши. J Biol Chem 1973; 248: 6862-70.
PubMed
34. Ludford RJ. Колхицин в экспериментальной химиотерапии рака. J Natl Cancer Inst 1945; 6: 89.
35. Лу И, Чен Дж, Ван Дж, Ли СМ, Ан С., Барретт СМ, Далтон Дж.Т., Ли В., Миллер Д.Д.Дизайн, синтез и биологическая оценка стабильных ингибиторов тубулина сайта связывания колхицина как потенциальных противораковых агентов. J Med Chem 2014; 57: 7355-66.
DOIPubMedPMC
36. Мунтони С., Ройкинд М. Колхицин снижает проколлаген III и повышает уровень псевдохолинэстеразы при хроническом заболевании печени. Всемирный журнал J Gastroenterol 2010; 16: 2889-94.
DOIPubMedPMC
37. Hamzawy MA, El-Denshary ESM, Hassan NS, Manaa F, Abdel-Wahhab MA. Антиоксидантное и гепаторопротекторное действие экстракта тимьяна обыкновенного у крыс при афлатоксикозе.Global J Pharmacol 2012; 6: 106-17.
38. Чиццола Р., Мичич Х., Франц С. Антиоксидантные свойства листьев тимуса обыкновенного: сравнение различных экстрактов и хемотипов эфирных масел. J Agric Food Chem 2008; 56: 6897-904.
DOIPubMed
39. Re TA, Mooney D, Antignac E, Dufour E, Bark I, Srinivasan V, Nohynek G. Применение подхода, основанного на токсикологической опасности, для оценки безопасности лепестков и экстрактов цветков календулы (Calendula officinalis) используется в косметических продуктах и средствах личной гигиены.Food Chem Toxicol 2009; 47: 1246-54.
DOIPubMed
40. Фонсека Ю.М., Катини С.Д., Вичентини ФТМК, Кардосо Дж. С., Кавальканти де Альбукерке Жуниор Р.Л., Виейра Фонсека М.Дж. Эффективность составов, содержащих экстракт календулы, против окислительного стресса, вызванного УФ-излучением. J Pharm Sci 2011; 100: 2182-93.
DOIPubMed
41. Абдель-Азим С.Х., Хассан А.М., Эль-Деншари ESM, Хамзави М.А., Манаа Ф.А., Абдель-Ваххаб М.А. Благоприятные эффекты экстрактов тимьяна и календулы по отдельности или в комбинации против окислительного стресса, вызванного афлатоксинами, и генотоксичности в печени крыс.Цитотехнология 2014; 66: 457-70.
DOIPubMedPMC
42. Banerjee R, Ragsdale SW. Многоликость витамина B12: катализ кобаламин-зависимыми ферментами 1. Ann Rev Biochem 2003; 72: 209-47.
DOIPubMed
43. Асада К., Котаке Ю., Асада Р., Сондерс Д., Бройлс Р. Х., Таунер Р. А., Фукуи Х., Флойд Р. А.. Гипометилирование LINE-1 при раке печени, вызванном дефицитом холина, у крыс: зависимость от периода кормления. Дж. Биомед Биотехнология 2006; 2006: 17142.
44.Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M. Гепатопротекторный эффект витамина B12 на повреждение печени, вызванное диметилнитрозамином. Биол Фарм Булл 2008; 31: 309-11.
DOIPubMed
45. Соуэлл Дж., Фрей Б., Стивенс Дж. Ф. Конъюгаты витамина С генотоксичных продуктов перекисного окисления липидов: структурная характеристика и обнаружение в плазме человека. Proc Natl Acad Sci U S A 2004; 101: 17964.
ДОИПубМедПМС
46.Majamaa K, Günzler V, Hanauske-Abel HM, Myllyl R, Kivirikko KI. Частичная идентичность сайтов связывания 2-оксоглутарата и аскорбата пролил-4-гидроксилазы. J Biol Chem 1986; 261: 7819.
PubMed
47. Ю С.Дж., Бэ С., Кан Дж. С., Юн Дж. Х., Чо Э. Дж., Ли Дж. Х., Ким Й. Дж., Ли В. Дж., Ким С. Ю., Ли Х. С. Гепатопротекторный эффект витамина С на холестатическое повреждение печени, вызванное литохолевой кислотой, у мышей Gulo (- / -). Eur J Pharmacol 2015; 762: 247-55.
DOIPubMed
48. Трабер М.Г., Стивенс Дж.Ф.Витамины C и E: положительные эффекты с механической точки зрения. Free Rad BiolMed 2011; 51: 1000-13.
DOIPubMedPMC
49. Пакер Л., Ландвик С. Витамин Е в биологических системах. Ad Exp Med Biol 1990; 264: 93.
DOIPubMed
50. Абд Хамид Н.А., Хасрул М.А., Рузанна Р.Дж., Ибрагим И.А., Баруах П.С., Мазлан М., Юсоф Ю.А., Нга В.З. Влияние витамина E (Tri E®) на антиоксидантные ферменты и повреждение ДНК у крыс после восьми недель упражнений. Орех J 2011; 10: 37.
ДОИПубМедПМС
51.Ayed Boussema I, Abassi H, Bouaziz C, Hlima WB, Ayed Y, Bacha H. Антиоксидантный и антигенотоксический эффект витамина E против цитотоксичности и генотоксичности патулина в клетках HepG2. Environ Toxicol 2011; 28: 299-306.
DOIPubMed
52. Палипоч С., Пунсавад С., Кумхин П., Суванналерт П. Гепатопротекторный эффект куркумина и альфа-токоферола против оксидативного стресса, вызванного цисплатином. BMC Complement Altern Med 2014; 14: 111.
DOIPubMedPMC
53. Наката Э., Лью Ф.Ф., Уватоко С., Киёнака С., Мори Ю., Кацуда Ю., Эндо М., Сугияма Х., Мори Т.Белки Zinc-Finger для сайт-специфического позиционирования белков на структурах ДНК-оригами. Angewandte Chemie 2012; 51: 2421-4.
DOIPubMed
54. Формигари А., Ирато П., Сантон А. Цинк, антиоксидантные системы и металлотионеин в опосредованном металлом апоптозе: биохимические и цитохимические аспекты. Comp Biochem Physiol C Toxicol Pharmacol 2007; 146: 443-59.
DOIPubMed
55. Rogalska J, Pilat-Marcinkiewicz B, Brzóska MM. Защитный эффект цинка против гепатотоксичности кадмия зависит от потребления этого биоэлемента и уровня воздействия кадмия: исследование на крысиной модели.Chemi Biol Interact 2011; 193: 191-203.
DOIPubMed
56. Malhotra A, Dhawan DK. Современные представления о цинке как о гепатопротекторном средстве в условиях токсичности, вызванной хлорпирифосом. Pestic Biochem Physiol 2014; 112: 1-6.
DOIPubMed
57. Ромеро Х., Чжан Й., Гладышев В.Н., Салинас Г. Эволюция свойств использования селена. Геном биол 2005; 6: R66.
DOIPubMedPMC
58. Арбогаст С., Феррейро А. Селенопротеины и защита от окислительного стресса: селенопротеин N как новый игрок на перекрестке редокс-сигналов и гомеостаза кальция.Антиоксидный окислительно-восстановительный сигнал 2010; 12: 893-904.
DOIPubMed
59. Абул-Суд М.А., Аль-Осман А.М., Эль-Десоки Г.Э., Аль-Осман З.А., Юсуф К., Ахмад Дж., Аль-Хедхайри А.А. Гепатопротекторные эффекты витамина Е / селена против повреждений, вызванных малатионом, на антиоксидантный статус и экспрессию генов, связанных с апоптозом, у крыс. J. Toxicol Sci 2011; 36: 285-96.
DOIPubMed
60. Zou C, Qiu Q, Chen H, Dou L, Liang J. Гепатопротекторные эффекты селена во время диабета у крыс. Hum Exp Toxico 2015; Epub впереди печати.
61. Ахмед Х. Х., Эль-Азием ША, Абдель-Ваххаб Массачусетс. Возможная роль цистеина и метионина в защите от гормонального дисбаланса и мутагенности, вызванных фуразолидоном у самок крыс. Токсикология 2008; 243: 31-42.
DOIPubMed
62. Парселл С. Сера в питании человека и применении в медицине. Альтернативная медицина Ред. 2002; 7: 22-44.
PubMed
63. Де Врис Н., Де Флора С. Н. ацетил-1 цистеин. J. Cell Biochem. 1993; 53: 270-7.
ДОИ
64.Эль Рахи С., Томпсон-Мур Н., Мехиа П., Де Ойос П. Успешное использование N-ацетилцистеина для лечения тяжелого повреждения печени, вызванного диетической добавкой для фитнеса. Фармакотерапия 2015; 35: e96-101.
DOIPubMed
65. Biewenga GP, Haenen GR, Bast A. Фармакология антиоксидантной липоевой кислоты. Gen Pharmacol 1997; 29: 315-31.
DOI
66. Packer L, Witt EH, Tritschler HJ. Альфа-липоевая кислота как биологический антиоксидант. Free Rad Biol Med 1995; 19: 227-50.
ДОИ
67.Хамзави М.А., Эль-Деншари Э., Бахгат А., Абдель-Ваххаб М.А. Гепатопротекторный эффект эстрадиола и α-липоевой кислоты у крыс. Global J Pharmacol 2014; 8: 694-702.
68. Фу Н.П., Линь Ш., Ли Й.Х., Ву М.Дж., Ван Й.Дж. α-Липоевая кислота подавляет фиброз печени за счет ослабления передачи сигналов, запускаемых ROS в звездчатых клетках печени, активируемых PDGF и TGF-β. Токсикология 2011; 282: 39-46.
DOIPubMed
69. Рамзи Р. Карнитинацилтрансферазы: модуляторы ацил-КоА-зависимых реакций.Biochem Soc Trans 2000; 28: 182-6.
DOIPubMed
70. Olszowy Z, Plewka A, Czech E, Nowicka J, Plewka D, Nowaczyk G, Kaminski M. Влияние добавок l-карнитина на метаболизирующие ксенобиотики печеночные ферменты, подвергшиеся воздействию метанола. Exp Toxicol Pathol 2006; 57: 427-35.
DOIPubMed
71. Mansour HH. Защитная роль эфира карнитина против радиационно-индуцированного окислительного стресса у крыс. Pharmacol Res 2006; 54: 165-71.
DOIPubMed
72. Даянандан А., Кумар П., Паннеерселвам К.Защитная роль L-карнитина в перекисном окислении липидов печени и сердца у атеросклеротических крыс. J Nut Biochem 2001; 12: 254-7.
DOI
73. Hamzawy MA, El-Denshary E, Bahgat A, Abdel-Wahhab MA. Защитный эффект L-карнитина против печени, индуцированной тетрахлорметаном. New Egypt J Med 2009; 40: 139-149.
74. Хачик Ф., Карвалью Л., Бернштейн П.С., Мюир Г.Дж., Чжао Д.Й., Кац Н.Б. Химия, распределение и метаболизм каротиноидов томатов и их влияние на здоровье человека.Exp Biol Med 2002; 227: 845-51.
DOI
75. Saedisomeolia A, Wood LG, Garg ML, Gibson PG, Wark PAB. Обогащение ликопином культивированных эпителиальных клеток дыхательных путей снижает воспаление, вызванное риновирусной инфекцией и липополисахаридом. J Nut Biochem 2009; 20: 577-85.
DOIPubMed
76. Субхаш К., Бозе С., Агравал Б.К. Влияние кратковременного приема томатов на антиоксидантные ферменты и перекисное окисление липидов при диабете 2 типа. Индийский журнал J Clin Biochem 2007; 22: 95-8.
DOIPubMedPMC
77. Мин Дж. Р., Лиан Ф, Ван XD. Биологическая активность метаболитов ликопина: значение для профилактики рака. Гайка Ред. 2008; 66: 667-83.
DOIPubMed
78. ИП BC, Лю С., Лихтенштейн А.Х., фон Линтиг Дж., Ван XD. Ликопин и апо-10′-ликопеновая кислота обладают различными механизмами защиты от стеатоза печени у самцов мышей с нокаутом β-каротин-9 ‘, 10’-оксигеназы. J Nutr 2015; 145: 268-76.
DOIPubMedPMC
79. Lu SC. Регуляция синтеза глутатиона в печени.Semin Liver Dis 1998; 18: 331-44.
DOIPubMed
80. Тернеус М.В., Кинингем К.К., Карпентер А.Б., Салливан С.Б., Валентович М.А. Сравнение защитных эффектов S-аденозил-L-метионина и N-ацетилцистеина на токсичность ацетаминофена для печени. J. Pharmacol Exp Ther 2007; 320: 99-107.
DOIPubMed
81. Song Z, Zhou Z, Chen T., Hill D, Kang J, Barve S, McClain C. S-аденозилметионин (SAMe) защищает от острой вызванной алкоголем гепатотоксичности у мышей. J Nut Biochem 2003; 14: 591-7.
DOI
82. Гуо Т., Чанг Л., Сяо Ю., Лю К. S-аденозил-L-метионин для лечения хронических заболеваний печени: систематический обзор и метаанализ. PLoS One 2015; 10: e0122124.
DOIPubMedPMC
83. Parod PW. Роль молочных белков в профилактике рака. Aust J Dairy Tech 1998; 53: 37-47.
84. Баунус Г. Концентрат сывороточного протеина (WPC) и модуляция глутатиона в лечении рака. Anticancer Res 2000; 20: 4785-92.
ПабМед
85.Yoo YC, Watanabe S, Watanabe R, Hata K, Shimazaki K, Azuma I. Бычий Лактоферрин и лактоферрицин ™ подавляют метастазирование опухоли у мышей. Adv Lacto Res 1998; 443: 285.
DOI
86. Низкий PPL, Rutherfurd KJ, Gill HS, Cross ML. Влияние диетического концентрата сывороточного протеина на первичный и вторичный ответ антител у иммунизированных мышей BALB / c. Int Immunopharmcol 2003; 3: 393-401.
DOI
87. Аджелло М., Греко Р., Джиансанти Ф., Массуччи М. Т., Антонини Дж., Валенти П. Антиинвазивная активность бычьего лактоферрина в отношении стрептококков группы А.Biochem Cell Biol 2002; 80: 119-24.
DOIPubMed
88. Вайнберг Э. Роль железа при раке. Eur J Cancer Prev 1996; 5: 19-36.
PubMed
89. Абдель-Азием С.Х., Хассан А.М., Абдель-Ваххаб М.А. Пищевая добавка с сывороточным протеином и экстрактом женьшеня противодействует окислительному стрессу и повреждению ДНК у крыс, получавших диету, загрязненную афлатоксином. Mutat Res 2011; 723: 65-71.
DOIPubMed
Профилактические эффекты жирной печени и гепатотоксичность высоких доз полифенолов чая — Penn State
ОПИСАНИЕ (предоставлено заявителем): Благоприятное воздействие на здоровье чая (Camellia sinensis) и его основного полифенольного компонента, (-) — эпигаллокатехин-3 -галлат (EGCG) были широко изучены и опубликованы.В последнее время, полифенолы зеленого чая, были использованы в качестве пищевых добавок для снижения веса, однако эффективность таких препаратов остается дискуссионным. Вызывает озабоченность новые сообщения о случаях, когда токсичность для печени связывается с потреблением добавок на основе зеленого чая. Наши предварительные исследования показали, что в то время как высокие дозы EGCG являются гепатотоксичными, умеренные дозы защищают от развития ожирения и метаболического синдрома у мышей с высоким содержанием жиров. Что еще более важно, диетический EGCG также предотвращал развитие связанной с ожирением жировой болезни печени (ORFLD).ORFLD становится серьезной проблемой для здоровья и представляет собой значительный фактор риска развития цирроза печени. Мы предполагаем, что диетическое введение EGCG может предотвратить и обратить вспять развитие ORFLD, но высокие дозы EGCG являются гепатотоксичными, а токсичность усиливается ORFLD. Защитные эффекты опосредованы способностью EGCG изменять всасывание жиров и метаболизм жиров в печени. Токсические эффекты возникают из-за прооксидантной активности высоких доз EGCG. Мы предлагаем проверить эти гипотезы следующим образом: 1.Определить профилактические эффекты низких доз хронического EGCG против развития ORFLD как на диетических, так и на генетических моделях мышей. 2. Определить механизмы, с помощью которых EGCG предотвращает развитие ORFLD в диетических и генетических моделях мышей. 3. Охарактеризовать гепатотоксические эффекты высоких доз EGCG и определить, усиливается ли эта токсичность ORFLD у мышей. Успешное завершение заявки на грант расширит наше понимание эффективности полифенолов зеленого чая в качестве профилактических агентов ОРЖБП и задействованных механизмов.Кроме того, будет определена доза-реакция благоприятного и потенциального токсического воздействия EGCG на печень, что позволит рационально спланировать будущие доклинические и клинические испытания. Учитывая растущую эпидемию ожирения и более широкое использование пищевых добавок на основе зеленого чая для похудания, ожидается, что настоящие исследования окажут значительное влияние на общественное здоровье. ЗНАЧЕНИЕ ДЛЯ ОБЩЕСТВЕННОГО ЗДРАВООХРАНЕНИЯ: частота ожирения и связанных с ним осложнений жировой болезни печени растет быстрыми темпами; диетические вмешательства, такие как полифенолы зеленого чая, могут иметь значительное влияние на общественное здоровье.Однако более широкое использование пищевых добавок на основе зеленого чая, в которых экстракты чая сконцентрированы и / или очищены, представляет собой ситуацию, в которой могут возникать непредвиденные побочные эффекты из-за изменений в дозе, лекарственной форме и фармакокинетике. В этом исследовании мы изучим эффективность и механизмы действия эпигаллокатехин-3-галлата (EGCG), основного полифенола чая, в качестве средства профилактики ожирения печени, а также гепатотоксичность высоких доз EGCG. Успешное завершение этого исследования предоставит важную информацию о профилактических эффектах EGCG для печени, установит верхний предел безопасности для дозы EGCG и определит потенциальные медицинские ситуации (т.е. предшествующее жировое заболевание печени), при котором люди могут быть сенсибилизированы к гепатотоксическим эффектам EGCG.
| Наши журналы | ||||||
| Как крупный международный издатель академических и исследовательских журналов Science Alert издает и разрабатывает названия в сотрудничестве с самыми престижные научные общества и издатели. Наша цель заключается в том, чтобы максимально широко использовать качественные исследования аудитория. | ||||||
| Для авторов | ||||||
| Мы прилагаем все усилия, чтобы поддержать исследователей которые публикуют в наших журналах. Есть масса информации здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные услуги для авторов, которые уже публиковались у нас. | ||||||
| Подписчикам | ||||||
| 2021 цены уже доступны.Ты может получить личную / институциональную подписку на перечисленные журналы прямо из Science Alert. В качестве альтернативы вы возможно, пожелает связаться с выбранным вами агентством по подписке. Направляйте заказы, платежи и запросы в службу поддержки. в службу поддержки клиентов журнала в Science Alert. | ||||||
| Для обществ | ||||||
| Science Alert гордится своей тесные и прозрачные отношения с обществом.В качестве некоммерческий издатель, мы стремимся к самым широким возможное распространение публикуемых нами материалов и на предоставление услуг высочайшего качества нашим издательские партнеры. | ||||||
| Справочный центр | ||||||
| Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете.В зависимости от характера вопросов мы разделили часто задаваемые вопросы на различные категории. | ||||||
| База данных ASCI | ||||||
| Азиатский индекс научного цитирования (ASCI) стремится предоставить авторитетный, надежный и значимая информация по освещению наиболее важных и влиятельные журналы для удовлетворения потребностей мировых научное сообщество.База данных ASCI также предоставляет ссылку к полнотекстовым статьям до более 25000 записей с ссылка на цитированные ссылки. | ||||||
Гепатотоксические эффекты перорального введения низких доз глутамата натрия у самцов крыс-альбиносов
ACC Egbuonu
О Обидоа
CA Ezeokonkwo
PM Ejikeme
Ключевые слова:
Глутамат натрия, щелочная фосфатаза, аспартатаминотрансфераза, аланинаминотрансфераза, малоновый диальдегид, гепатотоксическое действие.
Аннотация
Настоящее исследование направлено на изучение возможностей введения глутамата натрия в низких концентрациях в индукции гепатотоксических эффектов у самцов крыс-альбиносов. Так, глутамат натрия
в дозе 5 мг / кг веса тела вводили взрослым самцам крыс-альбиносов путем пероральной интубации. Лечение проводилось ежедневно в течение 28 дней. Обработка глутаматом натрия значительно (p <0,05)
снизила активность щелочной фосфатазы в сыворотке на 71.97%, но увеличил (p <0,05) активность сывороточного фермента аспартатаминотрансферазы на 66,86% и аланинаминотрансферазы на 9,15%. Лечение также увеличило (p <0,05) концентрацию малонового диальдегида в сыворотке на 287,15% и соотношение аспартатаминотрансферазы к аланинаминотрансферазе в сыворотке на 56,59%. Таким образом, лечение крыс с помощью глутамата натрия
в низкой концентрации (5 мг / кг массы тела) может быть гепатотоксичным без значительного холестаза или патологий костей.
Авторское право на статьи, опубликованные в этом журнале, сохраняется за журналом.
% PDF-1.4
%
1 0 obj
>
endobj
8 0 объект
/Заголовок
/ Автор
/Режиссер
/ Ключевые слова
/ CreationDate (D: 20210129205203-00’00 ‘)
/ ModDate (D: 20100310044522 + 08’00 ‘)
>>
endobj
2 0 obj
>
endobj
3 0 obj
>
endobj
4 0 obj
>
endobj
5 0 obj
>
endobj
6 0 obj
>
endobj
7 0 объект
>
транслировать
Acrobat Distiller 6.0 (Windows) 3B2 Total Publishing System 8.07e / W Unicode 2010-03-10T04: 45: 22 + 08: 002010-03-08T23: 51: 52 + 08: 002010-03-10T04: 45: 22 + 08 : 00uuid: 420e0bbe-3dab-4ae0-9509-8169e646c3c3uuid: 9be3ec21-134c-4eaa-bca7-0d292d18cf1bapplication / pdf
конечный поток
endobj
9 0 объект
>
endobj
10 0 obj
>
endobj
11 0 объект
>
/ ProcSet [/ PDF / Text / ImageC / ImageB / ImageI]
>>
endobj
12 0 объект
>
транслировать
x ڝ XɎ6 + -U \ FAr32 Ѵ; O «= — b-H-_8K% | _ | V 5Kk, s999RO: Bs.


 — 122 с.
— 122 с.