Гиперурикемия: взгляд кардиолога | UroWeb.ru — Урологический информационный портал!
| Я.А. Орлова, д.м.н., заведующая отделом возраст-ассоциированных заболеваний Медицинского научно-образовательного центра ФГБОУ ВО МГУ им. М.В. Ломоносова |
Мочевая кислота была впервые идентифицирована почти двести лет назад, несмотря на это, некоторые патофизиологические аспекты повышения ее уровня в плазме крови до сих пор не совсем понятны. В течение многих лет гиперурикемия ассоциировалась с риском развития подагры и нефролитиаза, теперь же мочевая кислота является предметом пристального изучения как маркер ряда метаболических и гемодинамических нарушений.
По данным эпидемиологических исследований, распространенность гиперурикемии в популяции очень высока – почти 17% взрослого населения России имеют повышенный уровень мочевой кислоты (МК): более 400 мкмоль/л, приблизительно 7 мг/дл – для мужчин, более 360 мкмоль/л, приблизительно 6 мг/дл – для женщин. Люди вообще имеют более высокий уровень МК, чем большинство млекопитающих, из-за дефицита печеночного фермента уриказы и более низкого фракционного выделения МК. Приблизительно две трети общего количества уратов в организме вырабатывается эндогенно, а оставшаяся треть приходится на пурины, поступающие в организм с пищей. Приблизительно 70% вырабатываемых уратов постоянно выводятся почками, а остальные – кишечником. Однако при почечной недостаточности вклад кишечной экскреции уратов увеличивается, чтобы компенсировать снижение их выведения почками. Уровень МК в крови является отражением баланса между расщеплением пуринов и скоростью их выведения из организма. Теоретически, любые изменения в этом балансе могут быть причиной повышения сывороточного уровня МК, но на практике именно нарушение выведения уратов является причиной большинства случаев гиперурикемии.
Люди вообще имеют более высокий уровень МК, чем большинство млекопитающих, из-за дефицита печеночного фермента уриказы и более низкого фракционного выделения МК. Приблизительно две трети общего количества уратов в организме вырабатывается эндогенно, а оставшаяся треть приходится на пурины, поступающие в организм с пищей. Приблизительно 70% вырабатываемых уратов постоянно выводятся почками, а остальные – кишечником. Однако при почечной недостаточности вклад кишечной экскреции уратов увеличивается, чтобы компенсировать снижение их выведения почками. Уровень МК в крови является отражением баланса между расщеплением пуринов и скоростью их выведения из организма. Теоретически, любые изменения в этом балансе могут быть причиной повышения сывороточного уровня МК, но на практике именно нарушение выведения уратов является причиной большинства случаев гиперурикемии.
Увеличение уровня МК в плазме крови прогрессивно повышает риск развития подагры. Однако абсолютный риск не так уж велик. Согласно большим проспективным исследованиям, в течение 15 лет клинически выраженная подагра развилась только у 49% пациентов даже с высоким уровнем гиперурикемии (10 мг/дл и выше). Эти наблюдения указывают на наличие дополнительных факторов в патогенезе подагры; это могут быть ингибиторы или активаторы образования кристаллов уратов в присутствии их повышенных концентраций в тканях, генетические факторы и факторы окружающей среды, которые определяют воспалительный ответ на осажденные уратные кристаллы.
Согласно большим проспективным исследованиям, в течение 15 лет клинически выраженная подагра развилась только у 49% пациентов даже с высоким уровнем гиперурикемии (10 мг/дл и выше). Эти наблюдения указывают на наличие дополнительных факторов в патогенезе подагры; это могут быть ингибиторы или активаторы образования кристаллов уратов в присутствии их повышенных концентраций в тканях, генетические факторы и факторы окружающей среды, которые определяют воспалительный ответ на осажденные уратные кристаллы.
Связь гиперурикемии с риском развития нефролитиаза еще менее линейна. Даже у больных подагрой только в 20–25% случаев имеет место мочекислый уролитиаз. В этом случае очевидно, что на риск развития мочекаменной болезни влияет не только гиперпродукция эндогенной МК и дефект ее почечной экскреции, но и кислотность мочи, а, вероятно, и другие ее характеристики.
Первая публикация о том, что уровень МК в плазме крови может быть связан с сердечно-сосудистыми заболеваниями (ССЗ), появилась в Британском медицинском журнале в 1886 г. К середине XX века было показано, что у пациентов с ишемической болезнью сердца значительно повышен уровень МК по сравнению с группой контроля, сопоставимой по возрасту и полу. Последующие эпидемиологические исследования, включившие в общей сложности около 100 тыс. пациентов, подтвердили роль МК как фактора риска ССЗ. Описано несколько потенциальных механизмов, благодаря которым гиперурикемия может играть роль в патогенезе сердечно-сосудистых событий, но ни один из них пока не имеет надежных доказательств.
К середине XX века было показано, что у пациентов с ишемической болезнью сердца значительно повышен уровень МК по сравнению с группой контроля, сопоставимой по возрасту и полу. Последующие эпидемиологические исследования, включившие в общей сложности около 100 тыс. пациентов, подтвердили роль МК как фактора риска ССЗ. Описано несколько потенциальных механизмов, благодаря которым гиперурикемия может играть роль в патогенезе сердечно-сосудистых событий, но ни один из них пока не имеет надежных доказательств.
Очевидно, что повышенный уровень МК усиливает оксигенацию липопротеидов низкой плотности и связан с увеличенной продукцией свободных кислородных радикалов, что может играть роль в прогрессировании атеросклероза. МК может оказывать влияние на процессы адгезии и агрегации тромбоцитов. Это породило гипотезу о том, что гиперурикемия повышает риск коронарного тромбоза у пациентов с уже имеющимися коронарными заболеваниями. Предполагают, что повышение уровня МК отражает повреждение эндотелия. Эндотелиальная дисфункция, проявляющаяся снижением эндотелийзависимой сосудистой релаксации в результате действия оксида азота, обычна для пациентов с сахарным диабетом и артериальной гипертензией и играет роль в развитии атеросклероза и эректильной дисфункции. Во многих исследованиях обнаружено, что уровень МК связан с гиперлипидемией, в особенности с гипертриглицеридемией. Более сильная связь была выявлена именно с триглицеридами, а не с холестерином, что привело к предположению, о патогенетических механизмах, связывающих гиперурикемию с нарушением углеводного обмена. Гиперинсулинемия, как следствие инсулинорезистентности, может снижать почечную экскрецию МК независимо от клиренса креатинина. Вероятно инсулин, увеличивая канальцевую реабсорбцию натрия, способствует увеличению реабсорбции МК. Длительное время считалось, что гиперурикемия является результатом резистентности к инсулину, а не предшествует ей. В настоящее время на животных моделях показано, что МК сама увеличивает толерантность к инсулину путем ингибирования биодоступности оксида азота, снижая тем самым инсулин-стимулированное усвоение глюкозы.
Эндотелиальная дисфункция, проявляющаяся снижением эндотелийзависимой сосудистой релаксации в результате действия оксида азота, обычна для пациентов с сахарным диабетом и артериальной гипертензией и играет роль в развитии атеросклероза и эректильной дисфункции. Во многих исследованиях обнаружено, что уровень МК связан с гиперлипидемией, в особенности с гипертриглицеридемией. Более сильная связь была выявлена именно с триглицеридами, а не с холестерином, что привело к предположению, о патогенетических механизмах, связывающих гиперурикемию с нарушением углеводного обмена. Гиперинсулинемия, как следствие инсулинорезистентности, может снижать почечную экскрецию МК независимо от клиренса креатинина. Вероятно инсулин, увеличивая канальцевую реабсорбцию натрия, способствует увеличению реабсорбции МК. Длительное время считалось, что гиперурикемия является результатом резистентности к инсулину, а не предшествует ей. В настоящее время на животных моделях показано, что МК сама увеличивает толерантность к инсулину путем ингибирования биодоступности оксида азота, снижая тем самым инсулин-стимулированное усвоение глюкозы. Кроме того, МК может способствовать увеличению риска сахарного диабета прямым цитотоксическим действием на β-клетки поджелудочной железы через аллоксаноподобные производные.
Кроме того, МК может способствовать увеличению риска сахарного диабета прямым цитотоксическим действием на β-клетки поджелудочной железы через аллоксаноподобные производные.
Описывая патогенетические связи гиперурикемии и ССЗ, нельзя обойти почечные механизмы. Повышенный уровень МК, очевидно ассоциирован с почечной сосудистой резистентностью и имеет обратную зависимость от почечного кровотока. Он коррелирует с экскрецией альбуминов с мочой, которые являются предвестниками развития нефросклероза, а нарушение почечной гемодинамики предшествует нарушению метаболизма МК у пациентов с нефропатией.
Таким образом, в настоящее время, несмотря на отсутствие полного понимания причинно-следственных связей, не остается сомнений, что гиперурикемия ассоциирована с повышенными рисками возникновения ССЗ. В Европейских рекомендациях по диагностике и лечению артериальной гипертензии 2018 г. и в Российских рекомендациях, опубликованных на сайте Минздрава в феврале 2020 г.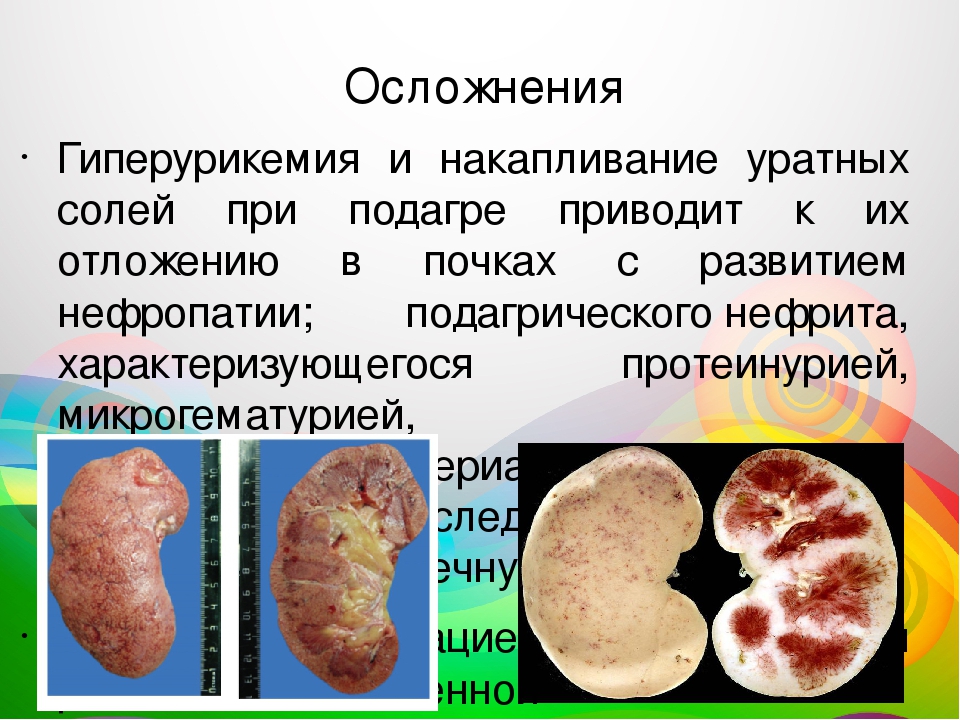 , повышение уровня МК (360 мкмоль/л и более у женщин, 420 мкмоль/л и более у мужчин) официально отнесено к факторам сердечно-сосудистого риска. Однако указаний на необходимость использования специфических препаратов для лечения бессимптомной гиперурикемии в Рекомендациях нет. Это связано с отсутствием рандомизированных клинических исследований, подтверждающих пользу терапии. Такой подход полностью согласуется с актуальной позицией других медицинских сообществ. На основании того, что у большинства пациентов с бессимптомной гиперурикемией никогда не развиваются подагра или мочекаменная болезнь, специфическое фармакологическое лечение бессимптомной гиперурикемии не считается полезным или экономически эффективным и, как правило, не рекомендуется. Кроме того, данные последних лет дают основание предполагать, что некоторые из вполне эффективных препаратов для лечения пациентов с гиперурикемией при подагре несут в себе определенный риск. Результаты проспективного исследования CARES, сравнивающего влияние фебуксостата и аллопуринола на ССЗ и их осложнения, показали отсутствие различий по риску развития новых ССЗ между двумя этими группами пациентов, однако сердечно-сосудистая смертность и смертность от всех причин были достоверно ниже в группе пациентов, получавших лечение аллопуринолом.
, повышение уровня МК (360 мкмоль/л и более у женщин, 420 мкмоль/л и более у мужчин) официально отнесено к факторам сердечно-сосудистого риска. Однако указаний на необходимость использования специфических препаратов для лечения бессимптомной гиперурикемии в Рекомендациях нет. Это связано с отсутствием рандомизированных клинических исследований, подтверждающих пользу терапии. Такой подход полностью согласуется с актуальной позицией других медицинских сообществ. На основании того, что у большинства пациентов с бессимптомной гиперурикемией никогда не развиваются подагра или мочекаменная болезнь, специфическое фармакологическое лечение бессимптомной гиперурикемии не считается полезным или экономически эффективным и, как правило, не рекомендуется. Кроме того, данные последних лет дают основание предполагать, что некоторые из вполне эффективных препаратов для лечения пациентов с гиперурикемией при подагре несут в себе определенный риск. Результаты проспективного исследования CARES, сравнивающего влияние фебуксостата и аллопуринола на ССЗ и их осложнения, показали отсутствие различий по риску развития новых ССЗ между двумя этими группами пациентов, однако сердечно-сосудистая смертность и смертность от всех причин были достоверно ниже в группе пациентов, получавших лечение аллопуринолом. Важно сказать, что исследование имело существенные ограничения, в частности неоднородность при анализе смертности наблюдалась в двух подгруппах у пациентов с сопутствующим приемом аспирина или нестероидных противовоспалительных средств. Кроме того, в отсутствие группы плацебо невозможно с уверенностью определить, представляет ли бóльшая частота сердечно-сосудистой смертности и смертности от всех причин в группе пациентов, получавших фебуксостат, фактическое увеличение подобных событий или, возможно, менее значительное снижение риска их возникновения по сравнению с пациентами, получавшим аллопуринол.
Важно сказать, что исследование имело существенные ограничения, в частности неоднородность при анализе смертности наблюдалась в двух подгруппах у пациентов с сопутствующим приемом аспирина или нестероидных противовоспалительных средств. Кроме того, в отсутствие группы плацебо невозможно с уверенностью определить, представляет ли бóльшая частота сердечно-сосудистой смертности и смертности от всех причин в группе пациентов, получавших фебуксостат, фактическое увеличение подобных событий или, возможно, менее значительное снижение риска их возникновения по сравнению с пациентами, получавшим аллопуринол.
Тем не менее в настоящее время именно аллопуринол считается препаратом выбора для лечения пациентов с ССЗ и гиперурикемией, несмотря на то что результаты исследований с ним достаточно противоречивы. Некоторые из них показывают, что аллопуринол достоверно снижает частоту ССЗ и их осложнений; другие не находят никакой пользы. Неоднородность в дизайне и ограничения, присущие ретроспективным исследованиям, также способствуют этой путанице. Важным прорывом в этом направлении смогут стать результаты продолжающегося проспективного рандомизированного исследования ALL-HEART, в котором изучается влияние аллопуринола на неблагоприятные сердечно-сосудистые исходы у пациентов с установленной ишемической болезнью сердца и бессимптомной гиперурикемией.
Важным прорывом в этом направлении смогут стать результаты продолжающегося проспективного рандомизированного исследования ALL-HEART, в котором изучается влияние аллопуринола на неблагоприятные сердечно-сосудистые исходы у пациентов с установленной ишемической болезнью сердца и бессимптомной гиперурикемией.
Данные о влиянии других препаратов, снижающих уровень МК, на риски возникновения ССЗ и их осложнений крайне ограничены. В одном когортном исследовании Medicare пациенты, принимающие пробенецид, на 20% реже страдали инфарктом миокарда или инсультом, чем пациенты, принимающие аллопуринол. Однако этот результат может отражать базовые различия между группами пациентов – в исследовании отсутствовали важные сравнительные данные, в частности уровни МК до лечения. Кроме того, пациенты, получавшие пробенецид, реже страдали хронической болезнью почек, что также могло повлиять на сердечно-сосудистые исходы.
Однако в настоящее время пациентам с бессимптомной гиперурикемией можно рекомендовать не только изменение образа жизни: коррекцию рациона питания, снижение потребления алкоголя и физические упражнения, которые могут снизить уровень МК. Целый ряд лекарственных препаратов, применяемых в терапевтической практике, показал положительные результаты при гиперурикемии.
Целый ряд лекарственных препаратов, применяемых в терапевтической практике, показал положительные результаты при гиперурикемии.
Наиболее часто в этом контексте обсуждаются свойства лозартана, блокатора ангиотензиновых рецепторов, широко применяемого при лечении больных артериальной гипертензией и сердечной недостаточностью. Этот препарат достаточно уникален, т.к. вместе со своим неактивным предшественником имеет способность блокировать реабсорбцию секретированной МК в проксимальном канальце почки, значительно снижая уровень МК в плазме крови. Он обладает небольшим моделирующим антиатеросклеротическим действием, улучшает когнитивные функции, позитивно влияет на эректильную функцию. Однако эти свойства в отличие от урикозурического эффекта присущи и другим представителям класса сартанов. По данным некоторых авторов, благоприятное влияние на уровень МК могут оказывать блокаторы кальциевых каналов, в частности исрадипин. В январе 2020 г. опубликованы данные, показавшие, что ингибиторы натриево-глюкозного котранспортера-2 (SGLT-2) могут снизить риск развития подагры у взрослых с сахарным диабетом 2 типа. Глюкозурия, вызываемая этими препаратами, приводит к секреции МК в мочу и снижению уровня МКв сыворотке крови, но ранее связь с подагрой не была показана. В этом новом исследовании наблюдалось снижение относительного риска подагры на 36% среди взрослых, которым назначали ингибиторы SGLT-2, по сравнению с теми, кто получал агонисты рецептора глюкагоноподобного пептида-1 (GLP-1), не влияющие на уровень МК. Полученные результаты показывают, что ингибиторы SGLT-2 могут стать эффективным средством для профилактики подагры у пациентов с сахарным диабетом или нарушениями углеводного обмена. Эффекты лекарств этого класса в снижении сердечно-сосудистой заболеваемости и смертности были ранее продемонстрированы в ряде исследований, однако вклад их урикозурического действия отдельно не изучался.
Глюкозурия, вызываемая этими препаратами, приводит к секреции МК в мочу и снижению уровня МКв сыворотке крови, но ранее связь с подагрой не была показана. В этом новом исследовании наблюдалось снижение относительного риска подагры на 36% среди взрослых, которым назначали ингибиторы SGLT-2, по сравнению с теми, кто получал агонисты рецептора глюкагоноподобного пептида-1 (GLP-1), не влияющие на уровень МК. Полученные результаты показывают, что ингибиторы SGLT-2 могут стать эффективным средством для профилактики подагры у пациентов с сахарным диабетом или нарушениями углеводного обмена. Эффекты лекарств этого класса в снижении сердечно-сосудистой заболеваемости и смертности были ранее продемонстрированы в ряде исследований, однако вклад их урикозурического действия отдельно не изучался.
Таким образом, несколько основных аспектов, связанных с гиперурикемией, являются в настоящее время предметом активного изучения. Во-первых, это дальнейшее исследование роли МК в патогенезе развития ССЗ и нарушений углеводного обмена с выявлением направленности биологических связей.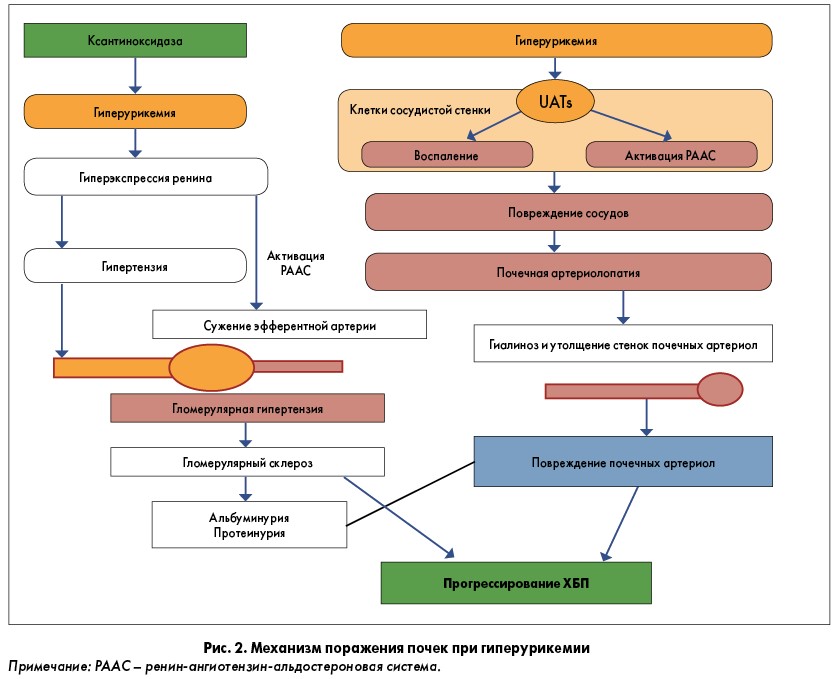 Во-вторых, оценка эффективности и безопасности снижения уровня уратов для модификации рисков ССЗ. Этот вопрос наиболее актуален, когда речь идет о пациентах с бессимптомной гиперурикемией и высоким риском ССЗ. До получения надежных доказательств решение о выборе тактики лекарственного лечения пациентов с ССЗ и гиперурикемией должны приниматься полидисциплинарной врачебной командой.
Во-вторых, оценка эффективности и безопасности снижения уровня уратов для модификации рисков ССЗ. Этот вопрос наиболее актуален, когда речь идет о пациентах с бессимптомной гиперурикемией и высоким риском ССЗ. До получения надежных доказательств решение о выборе тактики лекарственного лечения пациентов с ССЗ и гиперурикемией должны приниматься полидисциплинарной врачебной командой.
Гиперурикемия – эволюция значимости в популяции больных с сердечно-сосудистым риском. Международная конференция «Спорные и нерешенные вопросы кардиологии – 2019». Сателлитный симпозиум компании «Эгис»
В рамках Международной конференции «Спорные и нерешенные вопросы кардиологии – 2019», прошедшей под председательством академика РАН, профессора, президента Российского медицинского общества по артериальной гипертонии, директора Института клинической кардиологии им.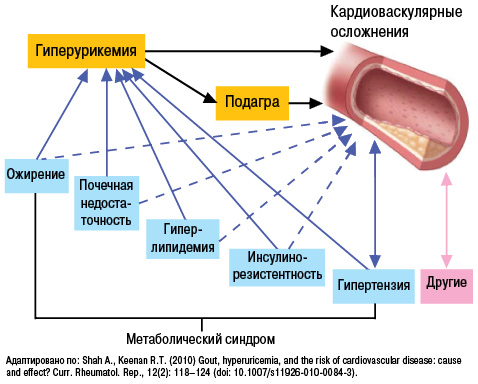 А.Л. Мясникова Ирины Евгеньевны ЧАЗОВОЙ, был организован симпозиум по проблеме гиперурикемии у больных с повышенным сердечно-сосудистым риском. С докладами выступили ведущие российские и зарубежные ученые. Они обсудили основные факторы риска сердечно-сосудистых заболеваний, критерии диагностики и эпидемиологию гиперурикемии, современные международные и национальные рекомендации по ее коррекции.
А.Л. Мясникова Ирины Евгеньевны ЧАЗОВОЙ, был организован симпозиум по проблеме гиперурикемии у больных с повышенным сердечно-сосудистым риском. С докладами выступили ведущие российские и зарубежные ученые. Они обсудили основные факторы риска сердечно-сосудистых заболеваний, критерии диагностики и эпидемиологию гиперурикемии, современные международные и национальные рекомендации по ее коррекции.
Профессор, д.м.н. С.В. Недогода
Профессор, д.м.н. К. Наркевич
Профессор, д.м.н. Ю.В. Жернакова
Насколько безопасны дженерики
Заведующий кафедрой терапии и эндокринологии факультета усовершенствования врачей Волгоградского государственного медицинского университета, д.м.н., профессор Сергей Владимирович НЕДОГОДА отметил, что в рекомендациях по артериальной гипертензии (АГ) 2019 г. гиперурикемия признана фактором сердечно-сосудистого риска. Повышенный уровень мочевой кислоты сопровождается развитием тофусов, подагрой или подагрическим артритом. Однако, по мнению выдающегося советского ученого Е.М. Тареева, распространенность скрытой, химической подагры значительно превосходит таковую для типичной суставной формы подагры, достигая 40% в общей популяции. Речь идет о гиперурикемии, когда суставные проявления и клинические симптомы подагры отсутствуют.
гиперурикемия признана фактором сердечно-сосудистого риска. Повышенный уровень мочевой кислоты сопровождается развитием тофусов, подагрой или подагрическим артритом. Однако, по мнению выдающегося советского ученого Е.М. Тареева, распространенность скрытой, химической подагры значительно превосходит таковую для типичной суставной формы подагры, достигая 40% в общей популяции. Речь идет о гиперурикемии, когда суставные проявления и клинические симптомы подагры отсутствуют.
Особую озабоченность вызывают пациенты с асимптоматической гиперурикемией, поскольку у них усиливается атерогенез, а повышенный уровень мочевой кислоты в плазме служит фактором риска сердечно-сосудистой заболеваемости и смертности.
В норме у человека с нормальной функцией почек за сутки образуется около 600 мг мочевой кислоты. Гиперпродукция мочевой кислоты (более 800 мг/сут) обусловлена дефицитом гипоксантин-гуанинфосфорибозилтрансферазы, контролируемой генами, локализованными в Х-хромосоме. Более чем у 90% пациентов с первичной подагрой нарушено выведение мочевой кислоты через почки. В зависимости от суточного выделения мочевой кислоты больных подразделяют на «гиперпродукторов» и «гипоэкскреторов». Свыше 90% пациентов с подагрой относятся к «гипоэкскреторам».
Более чем у 90% пациентов с первичной подагрой нарушено выведение мочевой кислоты через почки. В зависимости от суточного выделения мочевой кислоты больных подразделяют на «гиперпродукторов» и «гипоэкскреторов». Свыше 90% пациентов с подагрой относятся к «гипоэкскреторам».
Этиологических факторов развития гиперурикемии много: пища, богатая пуринами (мясо, почки, печень, морепродукты, бобовые, сладости и др.), голодание, алкоголь, некоторые лекарственные препараты, инфекции, травмы, сахарный диабет (СД), ожирение, АГ, заболевания щитовидной железы, патология почек, саркоидоз. Обратите внимание: распространенность гиперурикемии увеличивается после 30 лет у мужчин, а также у женщин в период постменопаузы.
Повышенный уровень мочевой кислоты встречается у 40–60% больных АГ1. Высокий уровень мочевой кислоты увеличивает риск возникновения и прогрессирования АГ2, 3. В 12-летнем исследовании PIUMA с участием 1720 пациентов с нелеченой АГ высокий уровень мочевой кислоты в сыворотке крови повышал риск развития сердечно-сосудистых осложнений в 1,73 раза, фатальных событий – в 1,96 раза4.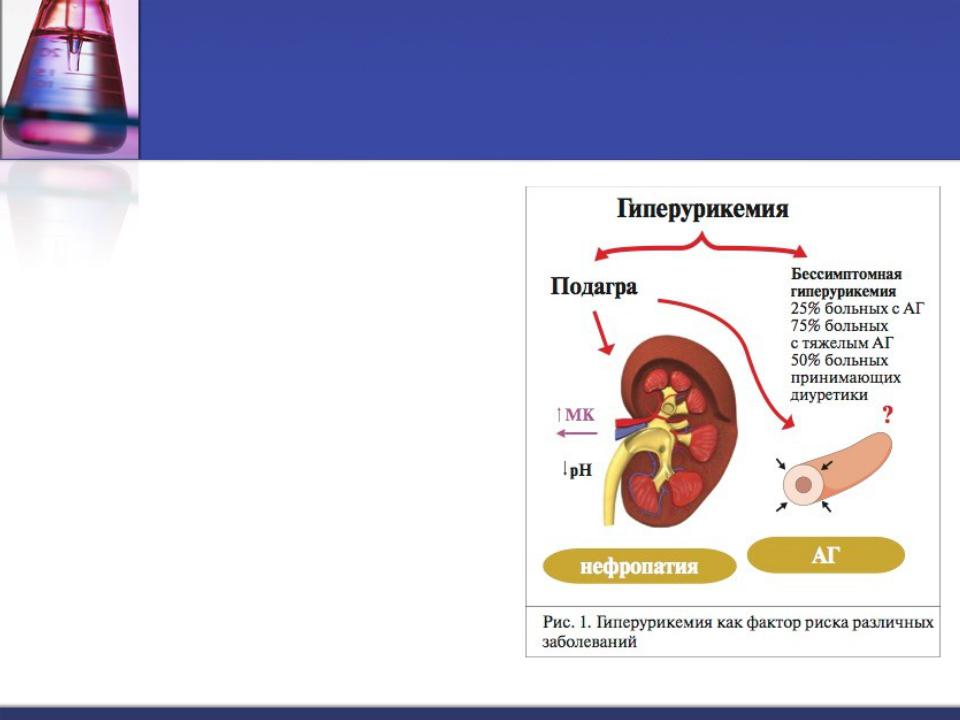
Повышение уровня мочевой кислоты на 1 мг/дл увеличивает риск сердечно-сосудистых осложнений на 32%. Это сопоставимо с увеличением уровня холестерина на 46 мг/дл или систолического артериального давления (АД) на 10 мм рт. ст.5
Накопленные данные показывают, что сочетание АГ и гиперурикемии в пять раз повышает риск сердечно-сосудистых осложнений6, 7.
Связь между высоким уровнем мочевой кислоты и повышенным АД подтверждена в пилотном исследовании с участием 30 подростков в возрасте 11–17 лет с АГ. Пациентов рандомизировали на две группы терапии – аллопуринола и плацебо. Четырехнедельная терапия аллопуринолом способствовала снижению гиперурикемии, что привело к уменьшению уровня АД8.
У больных АГ при гиперурикемии потенцируется поражение всех органов-мишеней. Происходит активация почечной ренин-ангиотензиновой системы (РАС), циклооксигеназы 2. Доказана роль мочевой кислоты в развитии гипертрофии левого желудочка у больных АГ9.
При гиперурикемии усиливается продукция ренина, тромбоксана и фактора пролиферации гладкомышечных клеток сосудов, повышается уровень липопротеинов очень низкой плотности. Высокий уровень мочевой кислоты стимулирует развитие афферентной артериолопатии с почечной гипертонией и последующим гломерулосклерозом и нефроангиосклерозом10.
Как показывают результаты исследований, у больных с повышенным уровнем мочевой кислоты на 75% повышается риск развития гипертрофии миокарда левого желудочка и в два раза – риск развития аномалии каротидных артерий. Эти данные подтверждают роль мочевой кислоты в сыворотке крови как независимого модифицируемого маркера сердечно-сосудистых повреждений11.
Повышение уровня мочевой кислоты способно нивелировать позитивные эффекты сердечно-сосудистых препаратов. В исследовании SHEP у больных пожилого возраста с высоким уровнем мочевой кислоты исчезало кардиопротективное действие диуретиков12.
Основной мишенью при гиперурикемии являются почки. Среди механизмов повреждающего действия мочевой кислоты на почки – увеличение экспрессии провоспалительных хемокинов с активацией резидентных макрофагов и привлечением моноцитов, повышение уровня эндотелина 1 и стойкая тканевая гипоксия, угнетение урокиназы и локально-почечного фибринолиза, снижение продукции оксида азота и вазодилатации, активация пролиферации и трансформации в клетку с признаками макрофага и фибробласта. Особое значение в воздействии на почечную ткань имеет гиперпродукция ангиотензина II с развитием внутриклубочковой гипертензии и профибриногенного эффекта.
У больных быстро развивается подагрическая нефропатия – различные формы поражения почек, вызванные нарушениями пуринового обмена и другими метаболическими и сосудистыми изменениями, свойственными подагре. Поражение почек наблюдается у 30–50% больных подагрой. У каждого четвертого развивается хроническая подагрическая нефропатия (ХПН). При стойком повышении уровня мочевой кислоты в крови (более 476 ммоль/л) риск последующего развития ХПН возрастает в 3–10 раз. От клинической манифестации подагрической нефропатии до появления ХПН в среднем проходит 12 лет. Факторами риска развития ХПН являются стойкая АГ, протеинурия, хронический пиелонефрит, СД, злоупотребление алкоголем, пожилой возраст.
При стойком повышении уровня мочевой кислоты в крови (более 476 ммоль/л) риск последующего развития ХПН возрастает в 3–10 раз. От клинической манифестации подагрической нефропатии до появления ХПН в среднем проходит 12 лет. Факторами риска развития ХПН являются стойкая АГ, протеинурия, хронический пиелонефрит, СД, злоупотребление алкоголем, пожилой возраст.
На фоне гиперурикемии формируется коморбидная патология, в том числе у пациентов с гиперурикемией и подагрой. В исследовании NHANES с участием 5707 пациентов показана частота распространения коморбидной патологии. Отмечалось преобладание таких коморбидных заболеваний, как АГ, хроническая болезнь почек, ожирение, СД, хроническая сердечная недостаточность. Установлена прямая связь между увеличением количества коморбидных состояний и повышением уровня мочевой кислоты в крови13.
В среднем количество сопутствующих заболеваний при гиперурикемии достигает трех-четырех. АГ встречается более чем в 90% случаев, СД и хроническая болезнь почек – в 50%, ишемическая болезнь сердца – более чем в 45% случаев14.
Итак, гиперурикемия приводит к прогрессированию сердечно-сосудистых заболеваний, в частности АГ, что в свою очередь усугубляет нарушение почечной гемодинамики. Гиперурикемия вызывает эндотелиальную дисфункцию, способствует выделению провоспалительных цитокинов, активирует тромбоциты, формирует неинфекционное воспаление15, 16. Чем выше уровень мочевой кислоты, тем ниже выживаемость пациентов, выше риск развития сердечно-сосудистых осложнений, в том числе ишемического инсульта, инфаркта миокарда17. Гиперурикемия повышает риск неконтролируемой АГ, особенно у больных с метаболическим синдромом. Как отмечал академик Е.И. Чазов, метаболический синдром – это комплекс патогенетически взаимосвязанных нарушений углеводного, липидного, пуринового обмена, инсулинорезистентности, ожирения центрального типа и АГ. Сегодня повышение мочевой кислоты рассматривается как новый фактор риска развития СД. В то же время смертность больных СД 2-го типа при повышенном уровне мочевой кислоты выше, чем при неконтролируемом уровне гликированного гемоглобина и ожирении18. Кроме того, гиперурикемия повышает риск развития и прогрессирования хронической сердечной недостаточности на 80%. Соответственно смертность пациентов с хронической сердечной недостаточностью при высоком уровне мочевой кислоты значительно возрастает19.
Кроме того, гиперурикемия повышает риск развития и прогрессирования хронической сердечной недостаточности на 80%. Соответственно смертность пациентов с хронической сердечной недостаточностью при высоком уровне мочевой кислоты значительно возрастает19.
Таким образом, увеличение уровня мочевой кислоты должно быть «красным флагом» повышения риска сердечно-сосудистых осложнений, особенно при наличии сердечно-сосудистых заболеваний.
Из сказанного следует, что лечение больных гиперурикемией и АГ должно начинаться как можно раньше, до развития морфологических изменений со стороны сосудов. При контролируемой гиперурикемии улучшается эластичность сосудов, восстанавливается просвет в афферентных артериолах20.
Европейский консенсус по гиперурикемии. Польские национальные рекомендации по АГ. Перспективы борьбы с гиперурикемией в Европе
Как отметил главный специалист по артериальной гипертензии Польши, экс-президент Европейского общества по гипертензии (2009–2011 гг. ), член экспертного совета европейских ученых по созданию Европейского консенсуса по гиперурикемии, д.м.н., профессор Кшиштоф НАРКЕВИЧ, роль высокого уровня мочевой кислоты в патогенезе АГ доказана. Продолжаются исследования факторов риска развития сердечно-сосудистых заболеваний, поиск новых подходов к ведению пациентов с высоким сердечно-сосудистым риском.
), член экспертного совета европейских ученых по созданию Европейского консенсуса по гиперурикемии, д.м.н., профессор Кшиштоф НАРКЕВИЧ, роль высокого уровня мочевой кислоты в патогенезе АГ доказана. Продолжаются исследования факторов риска развития сердечно-сосудистых заболеваний, поиск новых подходов к ведению пациентов с высоким сердечно-сосудистым риском.
Подагра – одно из наиболее распространенных заболеваний взрослого населения. Она известна с древних времен. Ею страдали многие знаменитые исторические личности. Заболевание передавалось из поколения в поколение (роды Медичи Османы, Карла V, герцогов Лотарингских, Черчиллей и др.). В настоящее время подагра рассматривается как хроническое системное метаболическое заболевание, характеризующееся хроническим воспалением и нарушением обмена пуринов. Среди больных подагрой наблюдается высокая распространенность коморбидной патологии. Таким образом, заболевание не относится исключительно к области ревматологии и должно рассматриваться с междисциплинарной позиции, подразумевающей определенный подход к диагностике и лечению.
Особый интерес современных исследователей вызывает тактика ведения пациентов с высоким сердечно-сосудистым риском, в том числе нарушением синтеза мочевой кислоты. Поскольку гиперурикемия не только фактор риска развития подагры, но и модифицируемый фактор риска развития сердечно-сосудистых осложнений, пациенты нуждаются в своевременном наблюдении и лечении.
В основу консенсуса по диагностике и лечению пациентов с гиперурикемией и высоким сердечно-сосудистым риском, подготовленного ведущими европейскими экспертами в области кардиологии, хирургии, нефрологии, фармакологии из разных стран, легли результаты ряда исследований. Ученые изучили факторы риска осложнений в популяции пациентов с высоким сердечно-сосудистым риском, эпидемиологию и патофизиологию сердечно-сосудистых событий у больных гиперурикемией. По мнению экспертов, один из самых существенных рисков – высокий уровень концентрации мочевой кислоты в крови, обусловленный ее избыточным производством и недостаточным выведением из организма. Избыточное производство мочевой кислоты связано с богатой пуринами диетой, воздействием генетических факторов или факторов окружающей среды. Кроме того, к гиперурикемии приводят нарушения обмена веществ, эндогенное избыточное производство мочевой кислоты. Недостаточное выведение мочевой кислоты из организма вызвано нарушением функции почек (снижением почечного кровотока, увеличением скорости клубочковой фильтрации). Повышенный уровень мочевой кислоты в плазме крови приводит к нарушению окислительного метаболизма и, как следствие, развитию АГ, сердечной недостаточности, метаболического синдрома, хронической почечной недостаточности, атеросклерозу.
Избыточное производство мочевой кислоты связано с богатой пуринами диетой, воздействием генетических факторов или факторов окружающей среды. Кроме того, к гиперурикемии приводят нарушения обмена веществ, эндогенное избыточное производство мочевой кислоты. Недостаточное выведение мочевой кислоты из организма вызвано нарушением функции почек (снижением почечного кровотока, увеличением скорости клубочковой фильтрации). Повышенный уровень мочевой кислоты в плазме крови приводит к нарушению окислительного метаболизма и, как следствие, развитию АГ, сердечной недостаточности, метаболического синдрома, хронической почечной недостаточности, атеросклерозу.
В исследованиях продемонстрировано, что высокий уровень мочевой кислоты служит независимым предиктором смертности у пациентов с ангиографически подтвержденной ишемической болезнью сердца21, а также убедительным независимым маркером неблагоприятного прогноза у пациентов с умеренной и тяжелой хронической сердечной недостаточностью22. Информация о повышенной концентрации уратов в сыворотке крови может использоваться при стратификации риска будущей сердечной смерти после инсульта23.
Информация о повышенной концентрации уратов в сыворотке крови может использоваться при стратификации риска будущей сердечной смерти после инсульта23.
Гиперурикемия в комбинации с другими факторами риска сердечно-сосудистых заболеваний существенно влияет на развитие АГ. В одном из исследований изучали взаимосвязь между уровнем мочевой кислоты и рядом сердечно-сосудистых показателей, в том числе факторами риска, которые не оценивались ранее (нарушение функции органов и АД вне кабинета врача), а также оценивали прогностическую значимость такого уровня для пациентов. Установлена взаимосвязь между высоким уровнем сывороточной мочевой кислоты и частотой впервые возникшей АГ в кабинете врача и за его пределами. Кроме того, увеличение уровня мочевой кислоты коррелирует с показателями отдаленной смертности24.
Профессор К. Наркевич подробно прокомментировал Европейский консенсус по лечению гиперурикемии. Экспертный совет ученых разработал пятиступенчатый подход к терапии гиперурикемии. На первой ступени оценивают уровень мочевой кислоты в сыворотке крови. Высоким считается уровень, превышающий 6 мг/дл (360 мкмоль/л). У пациентов с высоким сердечно-сосудистым риском целевым признается уровень мочевой кислоты в сыворотке крови менее 5 мг/дл (300 мкмоль/л). К высокому сердечно-сосудистому риску относят пациентов при наличии двух и более факторов риска: АГ, диабет, дислипидемия, недавно перенесенный инсульт, инфаркт миокарда, хроническая почечная недостаточность.
На первой ступени оценивают уровень мочевой кислоты в сыворотке крови. Высоким считается уровень, превышающий 6 мг/дл (360 мкмоль/л). У пациентов с высоким сердечно-сосудистым риском целевым признается уровень мочевой кислоты в сыворотке крови менее 5 мг/дл (300 мкмоль/л). К высокому сердечно-сосудистому риску относят пациентов при наличии двух и более факторов риска: АГ, диабет, дислипидемия, недавно перенесенный инсульт, инфаркт миокарда, хроническая почечная недостаточность.
На следующей ступени у таких больных выявляют сопутствующую патологию, а также отменяют препараты, влияющие на уровень мочевой кислоты. Как известно, уровень мочевой кислоты могут повышать диуретики. Поэтому при выраженной гиперурикемии у пациентов с сердечно-сосудистой патологией следует воздерживаться от их применения как можно дольше. На этой ступени у пациентов с гиперурикемией определяют факторы риска (чрезмерное употребление алкоголя, отравление свинцом, нарушение обмена липидов, ожирение, метаболический синдром, СД 2-го типа, мочекаменная болезнь, хроническая почечная недостаточность, АГ). На третьей ступени терапии проводят разъяснительную работу с пациентом о заболевании, образе жизни, необходимости физической активности. Особое внимание врач должен уделять формированию приверженности больного длительному лечению. Модификация диеты при гиперурикемии и подагре предполагает снижение потребления мяса, морепродуктов, отказ от алкоголя, сахаросодержащих безалкогольных напитков, фруктозосодержащих продуктов. Профилактическая диета должна содержать нежирные молочные продукты, продукты с высоким содержанием пищевых волокон, вишню25. На четвертой ступени терапии рассматривают необходимость назначения аллопуринола по 100 мг каждый день. Затем титруют дозу до 300–600 мг/сут до достижения целевого значения мочевой кислоты.
На третьей ступени терапии проводят разъяснительную работу с пациентом о заболевании, образе жизни, необходимости физической активности. Особое внимание врач должен уделять формированию приверженности больного длительному лечению. Модификация диеты при гиперурикемии и подагре предполагает снижение потребления мяса, морепродуктов, отказ от алкоголя, сахаросодержащих безалкогольных напитков, фруктозосодержащих продуктов. Профилактическая диета должна содержать нежирные молочные продукты, продукты с высоким содержанием пищевых волокон, вишню25. На четвертой ступени терапии рассматривают необходимость назначения аллопуринола по 100 мг каждый день. Затем титруют дозу до 300–600 мг/сут до достижения целевого значения мочевой кислоты.
Как показал анализ ряда исследований, аллопуринол нормализует эндотелиальную дисфункцию у пациентов с СД 2-го типа с АГ легкой степени, сердечной недостаточностью26, 27. Терапевтический эффект препарата в отношении сердечно-сосудистых заболеваний основан на ингибировании ксантиноксидазы, снижении окислительного стресса в сосудистой системе28. На фоне терапии аллопуринолом у пожилых пациентов с АГ удается достичь уровня контроля АД29.
На фоне терапии аллопуринолом у пожилых пациентов с АГ удается достичь уровня контроля АД29.
В настоящее время исследования эффективности аллопуринола у больных гиперурикемией продолжаются, обсуждаются результаты завершенных исследований. Достижение цели – последняя, пятая ступень терапии гиперурикемии. Она предполагает продолжение лечения аллопуринолом и мониторинг уровня мочевой кислоты в сыворотке крови два раза в год. В особых случаях рассматривают комбинированную терапию.
Подводя итог, докладчик еще раз подчеркнул важность приверженности терапии, причем не только приему препаратов, но и правильному образу жизни.
Текущее восприятие проблемы гиперурикемии в России. Что поможет врачу преодолеть стереотипы: алгоритм действий и регламентирующие документы
Симпозиум завершила д.м.н., профессор Юлия Валерьевна ЖЕРНАКОВА докладом «Текущее восприятие проблемы гиперурикемии в России. Что поможет врачу преодолеть стереотипы: алгоритм действий и регламентирующие документы».
Юлия Валерьевна отметила, что наряду с европейскими рекомендациями в действующих российских рекомендациях по диагностике и лечению АГ мочевая кислота также внесена в перечень независимых факторов риска сердечно-сосудистых заболеваний (ССЗ) на основании достаточно большого количества накопленных данных. Отрицательные, неблагоприятные эффекты мочевой кислоты, такие как индуцирование провоспалительных и протромботических состояний, подавление выработки оксида азота, могут приводить к развитию метаболического синдрома, сахарного диабета и поражению почек. Существует и обратная зависимость, когда метаболический синдром и ожирение приводят к повышению уровня мочевой кислоты. Поэтому мониторинг уровня мочевой кислоты и его коррекция должны быть неотъемлемой частью терапии не только с ревматологической точки зрения, но и с точки зрения предупреждения ССЗ. В настоящее время в России одним из немногих крупных эпидемиологических исследований, оценивающих распространенность различных факторов риска ССЗ, в том числе гиперурикемии, является исследование ЭССЕ30. Его результаты показали, что 16,8% населения имеют повышенный уровень мочевой кислоты, причем у женщин он регистрируется почти в два раза реже, чем у мужчин. В США повышенный уровень мочевой кислоты в среднем наблюдается у 22% населения, но среди женщин и мужчин распространенность гиперурикемии примерно одинакова. Согласно результатам китайских исследований, показатель соотношения между мужчинами и женщинами совпадает с российским. Если говорить о возрастных различиях, то уровень гиперурикемии существенно не меняется с возрастом, тогда как распространенность гиперурикемии увеличивается, что может косвенно свидетельствовать о повышении распространенности гиперурикемии за счет субклинических форм, которые часто не сопровождаются развитием подагры. Субклинические формы гиперурикемии чаще являются фактором риска сосудистых и метаболических заболеваний и наблюдаются у большинства пациентов с гиперурикемией. Такие пациенты требуют особого внимания со стороны врачей.
Его результаты показали, что 16,8% населения имеют повышенный уровень мочевой кислоты, причем у женщин он регистрируется почти в два раза реже, чем у мужчин. В США повышенный уровень мочевой кислоты в среднем наблюдается у 22% населения, но среди женщин и мужчин распространенность гиперурикемии примерно одинакова. Согласно результатам китайских исследований, показатель соотношения между мужчинами и женщинами совпадает с российским. Если говорить о возрастных различиях, то уровень гиперурикемии существенно не меняется с возрастом, тогда как распространенность гиперурикемии увеличивается, что может косвенно свидетельствовать о повышении распространенности гиперурикемии за счет субклинических форм, которые часто не сопровождаются развитием подагры. Субклинические формы гиперурикемии чаще являются фактором риска сосудистых и метаболических заболеваний и наблюдаются у большинства пациентов с гиперурикемией. Такие пациенты требуют особого внимания со стороны врачей.
Кроме того, установлена связь гиперурикемии с регионом проживания. Наиболее высокий уровень распространенности гиперурикемии наблюдается в г. Иваново, наиболее низкий – в Северной Осетии – Алании и г. Самаре. Распространенность гиперурикемии практически не зависит от образовательного статуса, однако ее небольшое увеличение отмечается среди лиц с неполным средним и средним образованием, что, возможно, связано с образом жизни, низкой физической активностью и потреблением алкоголя. Связь распространенности гиперурикемии с местом жительства свидетельствует не в пользу городских жителей, которые чаще страдают гиперурикемией. Это скорее всего также обусловлено более широкой распространенностью других факторов риска ССЗ: дислипидемии, ожирения и метаболического синдрома. С помощью модели множественной логистической регрессии, взаимосвязи гиперурикемии с кардиометаболическими факторами риска была показана существенная значимость таких факторов, как ожирение, применение диуретиков и нарушение липидного спектра (основной вклад вносят триглицериды).
Наиболее высокий уровень распространенности гиперурикемии наблюдается в г. Иваново, наиболее низкий – в Северной Осетии – Алании и г. Самаре. Распространенность гиперурикемии практически не зависит от образовательного статуса, однако ее небольшое увеличение отмечается среди лиц с неполным средним и средним образованием, что, возможно, связано с образом жизни, низкой физической активностью и потреблением алкоголя. Связь распространенности гиперурикемии с местом жительства свидетельствует не в пользу городских жителей, которые чаще страдают гиперурикемией. Это скорее всего также обусловлено более широкой распространенностью других факторов риска ССЗ: дислипидемии, ожирения и метаболического синдрома. С помощью модели множественной логистической регрессии, взаимосвязи гиперурикемии с кардиометаболическими факторами риска была показана существенная значимость таких факторов, как ожирение, применение диуретиков и нарушение липидного спектра (основной вклад вносят триглицериды).
Профессор Ю. В. Жернакова отметила, что интересные данные были получены в ходе наблюдательной программы по оценке эпидемиологических показателей, касавшихся определения уровня мочевой кислоты у больных АГ в сочетании с метаболическим синдромом, сахарным диабетом и болью в суставах. В исследование были включены свыше 9617 пациентов (56,6% мужчин и 43,4% женщин). Критериями включения в исследование стали возраст 30‒80 лет, уровень холестерина более 4,5 ммоль/л, АГ в сочетании с метаболическим синдромом или сахарным диабетом, артралгии. У 33% участников исследования имело место сочетание АГ и сахарного диабета, у половины пациентов – сочетание АГ и метаболического синдрома, более чем у 70% – АГ и артралгии. Гиперурикемия среди этих пациентов распределилась в общем равномерно, но наиболее часто наблюдалась у пациентов с АГ и диабетом (69,6%), даже чаще, чем у пациентов с АГ и артралгией (64,2%), с АГ и метаболическим синдромом (61%). Эти данные подчеркивают значимость гиперурикемии как кардиометаболического фактора риска.
В. Жернакова отметила, что интересные данные были получены в ходе наблюдательной программы по оценке эпидемиологических показателей, касавшихся определения уровня мочевой кислоты у больных АГ в сочетании с метаболическим синдромом, сахарным диабетом и болью в суставах. В исследование были включены свыше 9617 пациентов (56,6% мужчин и 43,4% женщин). Критериями включения в исследование стали возраст 30‒80 лет, уровень холестерина более 4,5 ммоль/л, АГ в сочетании с метаболическим синдромом или сахарным диабетом, артралгии. У 33% участников исследования имело место сочетание АГ и сахарного диабета, у половины пациентов – сочетание АГ и метаболического синдрома, более чем у 70% – АГ и артралгии. Гиперурикемия среди этих пациентов распределилась в общем равномерно, но наиболее часто наблюдалась у пациентов с АГ и диабетом (69,6%), даже чаще, чем у пациентов с АГ и артралгией (64,2%), с АГ и метаболическим синдромом (61%). Эти данные подчеркивают значимость гиперурикемии как кардиометаболического фактора риска.
Другое исследование было посвящено изучению реальной клинической практики по измерению уровня мочевой кислоты в первичном амбулаторном звене. Целью исследования стало изучение проблемы гиперурикемии как фактора риска ССЗ. Для этого оценили ситуацию на участках: имеется ли у врачей возможность измерять уровень мочевой кислоты и как часто они могут выполнять этот анализ; у каких пациентов чаще определяется уровень мочевой кислоты, какой тактики лечения пациентов придерживаются врачи? В результате было показано, что в реальной клинической практике у достаточно большого количества пациентов определяется уровень мочевой кислоты. В основном это пациенты с коморбидными состояниями: АГ, сахарным диабетом и артралгиями. Пациентам с изолированной АГ или метаболическим синдромом реже определяют уровень мочевой кислоты. Только 60% врачей рекомендуют измерять уровень мочевой кислоты во всех ситуациях. При этом практически во всех случаях, когда, по мнению врачей, необходимо определить уровень мочевой кислоты, этот анализ выполняется (93%). Каждый пятый пациент проводит данный анализ платно. Однако 30% пациентов с потенциально высоким уровнем мочевой кислоты остаются необследованными. Большинство врачей (80%) при необходимости назначают аллопуринол, что совершенно справедливо, отметила профессор Ю.В. Жернакова.
Каждый пятый пациент проводит данный анализ платно. Однако 30% пациентов с потенциально высоким уровнем мочевой кислоты остаются необследованными. Большинство врачей (80%) при необходимости назначают аллопуринол, что совершенно справедливо, отметила профессор Ю.В. Жернакова.
В рекомендациях Российского общества по АГ 2019 г. сказано, что у всех пациентов с АГ необходимо определять уровень мочевой кислоты, поскольку он является независимым фактором риска ССЗ и поражения почек. Еще в 2013 г. экспертами Общества по артериальной гипертензии были подготовлены рекомендации по ведению больных АГ с метаболическими нарушениями. Отдельная глава была посвящена гиперурикемии. Однако в то время отсутствовал конкретный алгоритм действий по снижению сердечно-сосудистого риска. В настоящее время вслед за европейскими коллегами российские эксперты подготовили «Консенсус по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском», который находится в стадии публикации. Данный документ содержит алгоритм ведения пациентов, который достаточно тесно коррелирует с алгоритмом, представленным профессором К. Наркевичем. На первом этапе рекомендуется оценивать уровень мочевой кислоты (высоким считается уровень более 6 мг/дл, или 360 мкмоль/л). Затем необходимо оценить наличие сопутствующих заболеваний с высоким сердечно-сосудистым риском. Пороговый уровень для вмешательств – концентрация мочевой кислоты 5 мг/дл, или 300 мкмоль/л. Сейчас не всем пациентам с таким уровнем мочевой кислоты назначают лекарственные препараты. Третий этап – информирование пациента о фармакологических и эпидемиологических факторах риска гиперурикемии.
Данный документ содержит алгоритм ведения пациентов, который достаточно тесно коррелирует с алгоритмом, представленным профессором К. Наркевичем. На первом этапе рекомендуется оценивать уровень мочевой кислоты (высоким считается уровень более 6 мг/дл, или 360 мкмоль/л). Затем необходимо оценить наличие сопутствующих заболеваний с высоким сердечно-сосудистым риском. Пороговый уровень для вмешательств – концентрация мочевой кислоты 5 мг/дл, или 300 мкмоль/л. Сейчас не всем пациентам с таким уровнем мочевой кислоты назначают лекарственные препараты. Третий этап – информирование пациента о фармакологических и эпидемиологических факторах риска гиперурикемии.
В заключение профессор Ю.В. Жернакова подчеркнула, что важно разъяснять значение диетических факторов, влияющих на уровень мочевой кислоты, значение физической активности, коррекции массы тела и всех модифицируемых факторов риска. Пациентам с высоким и очень высоким сердечно-сосудистым риском и уровнем мочевой кислоты свыше 5 мг/дл должна быть назначена терапия аллопуринолом 100 мг/сут с последующей титрацией до 300‒600 мг/сут.
Заключение
Высокий уровень мочевой кислоты в сыворотке крови является фактором риска развития не только подагры, но и сердечно-сосудистых событий. Ингибитор ксантинокидазы аллопуринол способствует снижению продукции пуринов, уменьшает концентрацию мочевой кислоты как в сыворотке крови, так и в моче. Применение аллопуринола в комплексном лечении больных с коморбидной патологией (АГ, метаболический синдром, хроническая почечная недостаточность, атеросклероз) позволяет достигать целевого уровня мочевой кислоты в сыворотке крови и максимально снижает риск и прогрессирование сердечно-сосудистых осложнений и смертности.
Согласно результатам исследований, терапия аллопуринолом ассоциируется с более низким риском общей смертности и лучшей выживаемостью больных гиперурикемией. Доказана связь между применением аллопуринола и снижением уровня АД у больных АГ и сопутствующей гиперурикемией. Аллопуринол много лет широко используется в клинической практике и считается эффективным средством для коррекции гиперурикемии.
Причины, симптомы и лечение гиперурикемии
Гиперурикемия: причины и симптомы
Гиперурикемия не что иное, как избыток в организме мочевой кислоты. В результате прохождения обменных белковых процессов в печени образуется мочевая кислота, выводится лишнее ее количество почками. Если содержание этой кислоты повышено, то это сигнализирует о болезненном состоянии человека и требует лечения. Больше информации о правильном питании, рецепты вы можете найти здесь .
Способ определения проблемы
Выявить повышение мочевой кислоты помогает биохимический анализ крови. Перед тем, как идти его сдавать, необходимо соблюсти ряд правил.
- За 3 дня до анализа не пить алкоголь и не кушать, богатую белками пищу
- Не есть минимум за 8 часов до сдачи крови
Причины ненормального количества мочевой кислоты в организме
Гиперурикемия является последствием частых алкогольных возлияний, экспериментов с голодовками, чересчур активными физическими нагрузками, злоупотребления жирной пищей и углеводами.
К повышению уровня содержания мочевой кислоты приводят и некоторые заболевания.
- Инфекции: туберкулез, пневмония, скарлатина
- Воспаления: желчных путей, печени, почек
- Кожные поражения: экзема, крапивница, псориаз
- Болезни крови: Лейкоз, лимфома, ацидоз, анемия
- Диабеты
- Отравления алкоголем
Какие болезни провоцирует гиперурикемия?
Наличие повышенного уровня мочевой кислоты является одним из симптомов подагры и артрита. Если кислота плохо выводится из организма, то она взаимодействует с натрием, образуются солевые отложения в суставах и других тканях. Вот откуда артриты и первичная (или уже вторичная) подагра и хронический артрит. Если кристаллы отложились в почках, они перестают четко функционировать и воспаляются. В некоторых случаях развивается мочекаменная болезнь. Здесь http://roman-trusov.ru/tests/test-soderzhanie-mikroelementov-v-produktah.html можно пройти тест за содержание микроэлементов в пищи. Рекомендуем, много интересного откроете для себя.
Рекомендуем, много интересного откроете для себя.
Симптомы гиперурикемии
Самый достоверный симптом – это, безусловно, результат анализа крови, который подтвердил нахождение человека в группе риска. Остальные симптомы нельзя назвать специфичными, но они сигнализируют о том, что проблемы в организме есть.
Среди симптомов:
- Боли в животе и частые запоры
- Избыточная потливость и лишний вес
- Нарушения работы желчевыводящих путей
- Болезненность при мочеиспускании
- Боли и ломота в поясничном отделе
- Проблемы с артериальным давлением
Лечение
Оно должно быть комплексным. К приему медикаментов должна быть добавлена пожизненная диета, с низким содержанием белков подробнее о продуктах, которые рекомендованы и наоборот, можно прочесть здесь http://roman-trusov.ru/blog/mochevaya-kislota.html Придется абсолютно исключить алкоголь, сахар, консервированную и жирную пищу, ограничить употребление мясных продуктов и много пить простой воды без добавок.
Эксперты обсудили диагностику и лечение гиперурикемии у пациентов с высоким сердечно-сосудистым риском
На сегодняшний день, по данным ВОЗ, артериальная гипертензия является одной из наиболее частых причин преждевременной смертности в мире1. Установлено, что в ряде случаев на развитие болезни влияет повышенный уровень мочевой кислоты, а гиперурикемия как фактор риска внесена в европейские (2018 года) и российские (2019 года) рекомендации по артериальной гипертензии2. Более того, увеличение целевого уровня мочевой кислоты (МК) повышает риск развития других микрососудистых и макрососудистых заболеваний: метаболического синдрома, ИБС, диабета, нарушения мозгового кровообращения, хронической болезни почек3,4,5.
«На основе имеющихся данных и рекомендаций, оптимальный целевой уровень мочевой кислоты в сыворотке не должен превышать 5 мг/дл (300 мкмоль/л) у пациентов с высоким риском сердечно-сосудистых заболеваний при наличии не менее двух из следующих факторов: артериальная гипертензия, диабет, дислипидемия, недавно перенесенный инсульт или инфаркт миокарда, хроническая болезнь мочек, и не превышать 6 мг/дл (360 мкмоль/л) для пациентов, у которых не отмечаются вышеуказанные факторы.
Повышенный уровень мочевой кислоты в сыворотке является следствием диеты богатой пуринами/фруктозой, генетических факторов или факторов окружающей среды, а также нарушений обмена веществ. Мы убеждены, что все пациенты должны получать точную информацию о необходимом изменении образа жизни, пересмотре диеты и необходимости снижения веса тела. Если этих мер недостаточно, мы рекоммендуем терпаию аллопуринолом, начиная с дозировки 100 мг в день с постепенным титрованием до 300-600 мг в день для достижения целевых уровней. Пациентам крайне важно следует постоянно соблюдать урат-понижающую терапию и поддерживать целевой уровень мочевой кислоты»,- подчеркнул д.м.н., проф., заведующий кафедрой гипертонии и диабетологии, Медицинского университета Гданьска, Польша, экс-президент Европейского общества по артериальной гипертензии Кшиштоф Наркевич.
Российский взгляд на гиперурикемию озвучила Юлия Жернакова, д.м.н, ученый секретарь Института клинической кардиологии им. А. Л. Мясникова, профессор кафедры кардиологии факультета последипломного образования РНИМУ им. Н.И.Пирогова. Эксперт рассказала о Российском консенсусе по диагностике и лечению пациентов с гиперурикемией и высоким сердечно-сосудистым риском.
А. Л. Мясникова, профессор кафедры кардиологии факультета последипломного образования РНИМУ им. Н.И.Пирогова. Эксперт рассказала о Российском консенсусе по диагностике и лечению пациентов с гиперурикемией и высоким сердечно-сосудистым риском.
«Российский Консенсус по диагностике и лечению пациентов с гиперурикемией и высоким риском ССЗ во многом совпадает с европейским. Кардиологи рекомендуют измерять уровень МК всем пациентам с АГ, даже впервые выявленной. Подробные результаты исследования и алгоритм лечения будут опубликованы в декабре 2019 года в журнале «Системные гипертензии». Мы надеемся, что это станет важным этапом в истории антигиперурикемической терапии», – отметила В. Ю. Жернакова.
Для поддержания целевого уровня мочевой кислоты рекомендуется применять препараты, угнетающие продукцию мочевой кислоты (ингибиторы ксантиноксидазы).
- Journal of Hypertension 2018, 36:1953–2041
- Системные гипертензии.
 2019; 16 (1): 6–31. DOI: 10.26442/2075082X.2019.1.190179
2019; 16 (1): 6–31. DOI: 10.26442/2075082X.2019.1.190179 - Am J Med. 2012; 125(7): 679–687.e1, doi: 10.1016/j.amjmed.2011.09.033, indexed in Pubmed: 22626509.
- Circulation. 2003;107:1991-1997
- European Heart Journal (2002) 23, 788-793 doi:10.1053/euhj.2001.2970
Подагра и гиперурикемия. клиника, диагностика, лечение Текст научной статьи по специальности «Клиническая медицина»
В.С.МОИСЕЕВ, академик РАМН, д.м.н., профессор, РУДН, Москва
Подагра и гиперурикемия
КЛИНИКА, ДИАГНОСТИКА, ЛЕЧЕНИЕ
Термином «подагра» обозначают ряд расстройств, связанных с отложением в тканях кристаллов мочевой кислоты вследствие увеличения ее содержания в крови и организме в целом. Наиболее характерно отложение мочевой кислоты в почках и суставах. Гиперурикемией считают увеличение содержания мочевой кислоты в крови до уровня более 7 мг/дл у мужчин и 6 мг/дл у женщин.
■ эпидемиология
В последние десятилетия отмечается рост заболеваемости подагрой, особенно в высокоразвитых странах. В США бессимптомная гиперурикемия выявляется у 5% людей. Распространенность подагрического артрита составляет 5—50 на 1000 мужчин и 1—9 на 1000 женщин. Соотношение мужчин и женщин составляет 2—7:1. Пик заболеваемости — 40—50 лет у мужчин, 60 лет и старше у женщин. Развитию гиперурикемии способствует длительное применение тиазидных диуретиков, особенно при снижении функции почек.
н этиология и патогенез
Мочевая кислота является конечным продуктом метаболизма пуриновых соединений, растворимость ее мононитрата уменьшается с понижением температуры тела, в т.ч. в дистальных отделах конечностей. Мочевая кислота накапливается в организме здоровых людей в количестве около 1,2 г у мужчин и 0,5 г у женщин.
Существует определенное равновесие между синтезом и поступлением мочевой кислоты и ее выделением из организма. Множество внешних и генетических факторов влияют на процессы ее образования и выделения.
Приблизительно у 20% страдающих подагрой заболевание носит семейный характер.
Усиленное образование мочевой кислоты и нарушенное ее выделение могут быть результатом как отдельного расстройства, так и комбинации нарушений. Лишь у небольшой части больных подагрой болезнь развивается исключительно в результате избыточного образования мочевой кислоты. У большинства больных одновременно имеется и нарушение выделения уратов почками, что может быть связано с уменьшением фильтрации их в результате избыточной гидратации, а также действия различных факторов: органических кислот (кетоацидоз, лактаты), лекарств (диуретики, циклоспорин, низкие дозы аспирина), экзогенных токсинов (свинец) и канальцевых нарушений.
Больные подагрой обычно имеют сопутствующую патологию, предрасполагающую к почечной не-
достаточности (включая артериальную гипертонию), при которой увеличена реабсорбция уратов. Немало больных с гиперурикемией страдают также метаболическим синдромом, при котором решающим обстоятельством является инсулинорезистентность наряду с абдоминальным ожирением, гипергликемией и гиперлипидемией, что способствует прогрессиро-ванию атеросклероза. При этом гиперинсулинемия усиливает реабсорбцию в почках ряда веществ, включая ураты.
Повышение синтеза уратов может быть связано с усилением потребления пуринов, рядом заболеваний (лимфопролиферативные, гемолиз, диабетический кетоацидоз, пернициозная анемия, саркоидоз, гипер-паратиреоз, гипотиреоз, акромегалия, псориаз) с ускоренным метаболизмом нуклеотидов, со злоупотреблением алкоголем, чрезмерным употреблением фруктозы, чрезвычайным мышечным напряжением, голоданием.
Избыток мочевой кислоты может откладываться в организме в виде тофусов (скопления уратов), особенно в области измененных межфаланговых суставов. Кристаллические ураты в области суставов обладают провоспалитель-ным действием, индуцируя освобождение из клеток метаболитов арахидоновой кислоты, включая различные цитокины ФНО, ИЛ-1, ИЛ-8.
Выделяют несколько факторов неблагоприятного влияния мочевой кислоты на сердечно-сосудистую систему. В качестве возможных механизмов, объясняющих взаимосвязь повышенного уровня мочевой кислоты и увеличения сердечно-сосудистого риска, рассматриваются окислительный стресс, неспецифическое воспаление, эндотелиальная дисфункция и инсулинорезистентность [6]. Гиперури-кемия усиливает окисление ЛПНП и способствует перекисному окислению липидов, а также увеличивает продукцию свободных радикалов. Окислительный стресс и повышение окисления ЛПНП в стенке артерий способствует прогрессированию атеросклероза [8].
■ Примерно 1/5 больных имеет генетическую предрасположенность к развитию подагры.
■клиническая картина
Подагра проявляется повторными обострениями острого артрита с отеком и краснотой пораженного сустава, что часто вызывает подозрение на гнойное воспаление. Обычно это моно- или олигоарт-рит с преимущественным поражением первого плюснефаланго-вого сустава. Периодически наблюдается локтевой бурсит.
Как правило, приступ протекает на фоне лихорадки, лейкоцитоза. У пожилых больных чаще встречается полиартрит, причем с постепенной деформацией и нарушением функции суставов, что может напоминать ревматоидное поражение суставов. Однако при рентгенологическом исследовании обнаруживаются четко ограниченные эрозии с нависающими краями, что нехарактерно для ревматоидного артрита.
Подагрические тофусы образуются не только в синовии и хрящах, но также в области ушной раковины. Мочекаменная болезнь с уратными камнями — характерное проявление подагры. Нередко этому сопутствует интерстициальная нефропатия в связи с отложением мочевой кислоты в ткани мозгового вещества почек с постепенным снижением их функции. Наряду с этим при лечении лимфопролифера-тивных заболеваний цитоста-тиками возможно интенсивное выделение пуринов с образованием кристаллов уратов в почечных канальцах и развитием острой почечной недостаточности.
Мочекаменная болезнь с уратными камнями — характерное проявление подагры. Нередко этому сопутствует интерстициальная нефропатия в связи с отложением мочевой кислоты в ткани мозгового вещества почек с постепенным снижением их функции. Наряду с этим при лечении лимфопролифера-тивных заболеваний цитоста-тиками возможно интенсивное выделение пуринов с образованием кристаллов уратов в почечных канальцах и развитием острой почечной недостаточности.
В молодом возрасте развитие подагры связывают с дефицитом фермента гипоксантин-гуанин-фосфорибозилтрансферазы, что приводит к формированию тяжелого поражения нервной системы с нарушением умственного развития.
Вторичная гиперурикемия встречается при различных патологических состояниях: хронической почечной недостаточности, артериальной гипертонии с метаболическими нарушениями, саркоидозе, злоупотреблении алкоголем, микседеме, длительном приеме салицилатов [1].
Поражение сердца у больных подагрой, особенно у пожилых пациентов, страдающих ожирением, чаще всего является следствием атеросклероза коронарных артерий [2]. В лите-
■ Типичный приступ подагрического артри та возникает в одном суставе, наиболее часто в I плюснефаланго-вом суставе большого пальца стопы.
■ Гиперурикемия является одним из факторов риска развития сердечно-сосудистых заболеваний.
ратуре имеется описание случая, когда у больного подагрой тофус локализовался на створке митрального клапана, распространился на миокард и вызвал сдавливание огибающей коронарной артерии и развитие инфаркта миокарда. При морфологическом исследовании миокарда был обнаружен типичный тофус в виде аморфной массы, содержащей мочевую кислоту, ураты и окруженной фиброзной тканью, гигантскими клетками и макрофагами [3].
В последнее время накапливается все больше данных о роли мочевой кислоты в развитии сердечно-сосудистых заболеваний, сопоставимой по значимости с другими метаболическими факторами риска.
У пациентов с артериальной гипертонией, ИБС, сердечной недостаточностью и нарушением почечной функции наблюдается более высокий уровень мочевой кислоты, чем в общей популяции [7]. Мы наблюдали больного тяжелой сердечной недостаточностью на фоне метаболических нарушений с выраженной гиперурикемией и подагрической артропа-тией. Развитие поражения сердца можно было связать с ИБС и злоупотреблением алкоголем.
У некоторых больных, особенно при хорошей экскреции уратов почками, подагра многие годы протекает благоприятно, больные длительно сохраняют трудоспособность. В более тяжелых случаях — при массивных тофусах с разрушением сустава и особенно при развитии подагрической почки, выраженного атеросклероза коронарных или церебральных сосудов — в течение нескольких лет может наступить инвалидизация.
Гиперурикемию как фактор риска сердечнососудистых осложнений стали рассматривать
Рисунок. Причины гиперурикемии (генетические дефекты)
■ I активности ГГФТ (гипоксантин-гуанин-фосфорибозилтрансфераза)
■ Т активности ФРПФ -синтетазы (фосфорибозилпирофосфат)
■ недостаток глюкозо-6-фосфатазы
Т
активности глутатионредуктазы
только в последнее время [6]. В конце ХХ в. клиницисты отмечали повышенную частоту заболеваний сердечно-сосудистой системы у больных подагрой. В середине прошлого века Samuel Levine обнаружил, что у пациентов с коронарной болезнью сердца уровень мочевой кислоты значительно выше, чем у пациентов контрольной группы, сопоставимой по возрастному и половому составу. Эти клинические наблюдения послужили основанием для эпидемиологических исследований, которые проводились во второй половине ХХ в. в общей популяции и в группах пациентов с различными заболеваниями.
Эти клинические наблюдения послужили основанием для эпидемиологических исследований, которые проводились во второй половине ХХ в. в общей популяции и в группах пациентов с различными заболеваниями.
диагностические критерии я подагры (воз, 2000 г.)
I. Наличие характерных кристаллических уратов в суставной жидкости и/или
II. Наличие тофусов (доказанных), содержащих кристаллические ураты, подтвержденные химически или поляризационной микроскопией и/или
III. Наличие 6 из 12 нижепредставленных признаков:
1) более чем одна острая атака артрита в анамнезе;
2) максимум воспаления сустава в первые сутки;
3) моноартикулярный характер артрита;
4) гиперемия кожи над пораженным суставом;
5) припухание или боль в I плюснефаланговом суставе;
6) одностороннее поражение суставов свода стопы;
7) узелки, напоминающие тофусы;
8) гиперурикемия;
9) одностороннее поражение I плюснефалангового сустава;
10) асимметричное припухание пораженного сустава;
11) субкортикальные кисты без эрозий на рентгенограммах;
12) отсутствие флоры в суставной жидкости.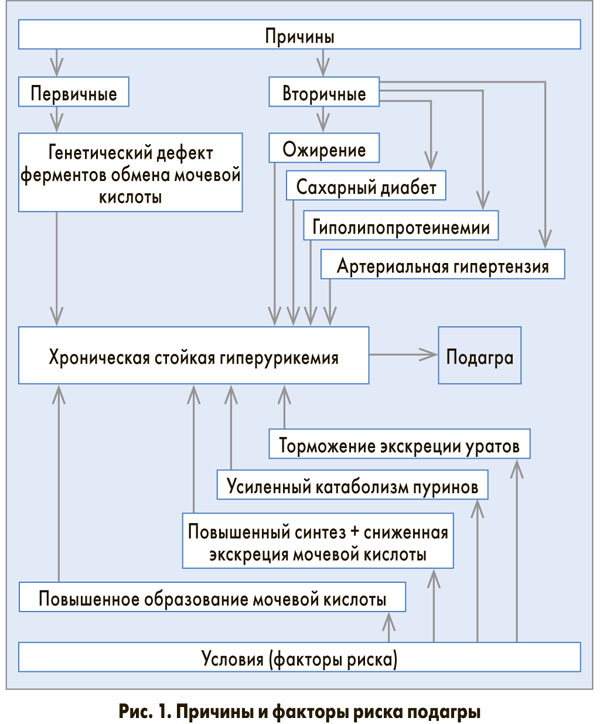
н дифференциальный диагноз
Необходимо дифференцировать заболевание от псевдоподагры, реактивного артрита, ревматоидного артрита, острой ревматической лихорадки, обострения остеоартроза.
Пирофосфатная артропатия (ПФА), как и подагра, относится к группе микрокристаллических артритов и характеризуется обызвествлением, главным образом, суставного хряща из-за отложения в нем кристаллов пирофосфата кальция. Наличие кристаллов может приводить к возникновению острых атак артрита, напоминающего подагрический (псевдоподагры), или к хроническому поражению суставов. Однако часто такие изменения остаются бессимптомными.
Течение болезни вариабельно. У некоторых больных наблюдаются лишь эпизодические острые суставные атаки, у других — прогрессирующие дегенеративные изменения суставов без острых атак. Наиболее важные методы диагностики — рентгенография суставов (отложения пирофосфата кальция в хрящах имеют вид пунктирной линии, параллельной субхонд-ральной кости и расположенной отдельно от нее) и исследование синовиальной жидкости на обнаружение кристаллов.
Наиболее важные методы диагностики — рентгенография суставов (отложения пирофосфата кальция в хрящах имеют вид пунктирной линии, параллельной субхонд-ральной кости и расположенной отдельно от нее) и исследование синовиальной жидкости на обнаружение кристаллов.
ипрогноз
В целом благоприятный, однако в 20—50% случаев развивается уролитиаз. У 18—25% больных причиной смерти является почечная недостаточность. Ги-перурикемия является фактором риска развития сердечно-сосудистых заболеваний (ИБС, артериальная гипертония, сердечная недостаточность).
илечение
Задачей лечения болезни является не только купирование острого приступа артрита, но и выведение избытка уратов и предупреждение накопления их в тканях, а также предотвращение повторных атак заболевания.
Острый подагрический артрит хорошо поддается лечению НПВС. Рекомендуется применение индоме-тацина или напроксена в средних дозах. При противопоказаниях к назначению НПВС (обострение язвенной болезни, почечная или сердечная недостаточность) возможно кратковременное применение кортикостероидов.
Рекомендуется применение индоме-тацина или напроксена в средних дозах. При противопоказаниях к назначению НПВС (обострение язвенной болезни, почечная или сердечная недостаточность) возможно кратковременное применение кортикостероидов.
Полезным дополнением НПВС может быть колхицин в дозе 0,5 мг 2 раза в день. При этом колхицин является эффективным средством профилактики обострений подагрического артрита. Колхицин особенно эффективен при внутривенном введении, однако его не следует вводить при нарушении функции почек или внепеченочной билиарной обструкции. Внутривенно вводят 2—3 мг колхицина.
Лечение артериальной гипертонии в таких случаях нецелесообразно проводить с применением мочегонных.
Для снижения количества уратов в организме целесообразно назначение урикозурических средств пробенецида, сульфинпиразона или бензпромарона.
Пробенецид назначают сначала по 250 мг дважды в день в течение 1—2 нед.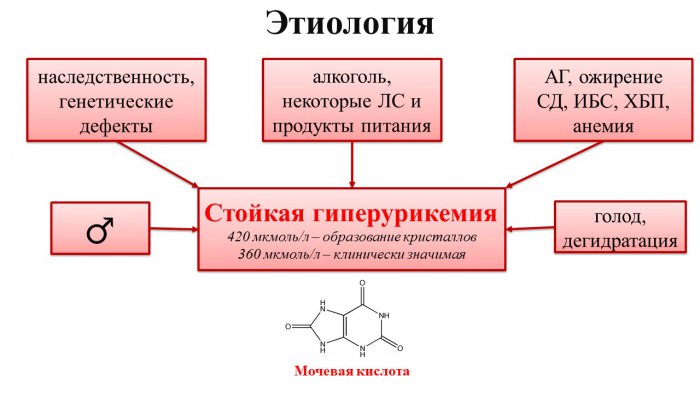 , а затем 500 мг также дважды в день в течение 2 нед. Далее суточная доза увеличивается на 500 мг каждые 2 нед. до максимума — 2 г.
, а затем 500 мг также дважды в день в течение 2 нед. Далее суточная доза увеличивается на 500 мг каждые 2 нед. до максимума — 2 г.
Начальная доза сульфинпиразона — 50 мг дважды в день 3—4 дня с постепенным увеличением суточной дозы до 800 мг в сутки.
Побочные эффекты урикозурических средств выражаются в диспепсических расстройствах, обострении артрита, появлении кожной сыпи.
Для уменьшения образования мочевой кислоты в организме показано применение ингибитора ксан-тиноксидазы аллопуринола. Последний препарат назначается на длительное время для поддерживающего лечения и особенно полезен в случае регулярного избыточного выделения уратов из организма, поскольку уменьшает их образование. Однократная суточная доза препарата составляет чаще 300 мг, но может быть увеличена до 800 мг. Препарат может вызывать кожные сыпи, лейкопению, диспепсические явления. Гиперчувствительность к аллопуринолу может проявляться лихорадкой, васкулитом, нарушением функций почек и печени. Профилактика
Гиперчувствительность к аллопуринолу может проявляться лихорадкой, васкулитом, нарушением функций почек и печени. Профилактика
гиперурикемии требует ограничения приема мясной пищи, углеводов, а также таких продуктов, как томаты, шпинат, шоколад, необходимо резкое ограничение алкоголя.
Несмотря на доказанную эффективность аллопу-ринола в отношении снижения уровня мочевой кислоты в сыворотке крови и улучшения течения подагры, на сегодняшний день остается открытым вопрос о положительном влиянии препарата на сердечно-сосудистую систему и о риске сердечнососудистых осложнений.
t
ЛИТЕРАТУРА
1. Ревматические болезни. /Руководство по внутренним болезням. //Под ред. Насонова В.А., Бунчук Н.В. — М.: Меди-цина,1997. — С. 363—373.
2. Барскова В.Г, Насонова В.А. Дифференциальная диагностика подагрического артрита и методы его купирования. //Тер.Архив. — 2003; 5, С. 60—64.
Барскова В.Г, Насонова В.А. Дифференциальная диагностика подагрического артрита и методы его купирования. //Тер.Архив. — 2003; 5, С. 60—64.
3. Дидковский Н.А. и др. Подагра: современный взгляд на этиопатогенез и новые перспективы в лечении. //Клин. геронтология. — 2005; 4, С. 26—29.
4. Кобалава ЖД. Мочевая кислота-маркер и\или новый фактор риска сердечно-сосудистых осложнений. Клиническая фармакология и терапия. — 2002; 3, с. 9—12.
5. Барскова В.Г, Якунина И.А. Противовоспалительная тера-
пия острого и хронического подагрического артрита. Consilium medicum. — 2005; 2;(7), С. 103—106.
6. Мухин Н.А., Балкаров И.М., Лебедева М.В. Подагра — старые и новые проблемы. //РМЖ. — 1998; 4; С. 18-23.
7. Terkeltaub R. Gout. //N.EnglJ.Med. — 2003; 349; 1647.
Terkeltaub R. Gout. //N.EnglJ.Med. — 2003; 349; 1647.
8. Hawkins D. Gout and hyperuricemia. In Di Piro et al (eds) Pharmacotherapy. //A pathophysiologic approach. McGRAW-HILL. — 2005; 1705.
9. Garsia Puig J., Ruilope L. Uric acid as a cardiovascular risk factor in arterial hypertension. //J. Hyperttens. 1999; 17; 869— 872.
10. Fang J., Alderman M. Serum uric acid and cardiovascular mortality. //The NHANES 1 Epidemiologic follow-up Study. 1971—1992 — JAMA. 2000; 283; 2404—2410.
Лекарственная терапия для лечения повышенного уровня мочевой кислоты у лиц с высоким кровяным давлением
Актуальность
Мочевая кислота является естественным конечным продуктом распада тканей организма и пищи человека, преимущественно белка. Мочевая кислота обычно выводится из крови почками и элиминируется из организма с мочой. Однако, если слишком много мочевой кислоты или почки не могут удалить её из крови как обычно, уровень мочевой кислоты в крови повышается (гиперурикемия). Связь между гиперурикемией и высоким артериальным давлением (ведущая проблема здоровья во всем мире) была признана ещё в 19 веке. В настоящее время существует множество доказательств важности этой связи. Цель настоящего обзора — оценить, может ли снижение уровня мочевой кислоты в крови также снизить артериальное давление. Такой подход может представлять собой новую цель и/или вариант лечения лиц с гипертензией.
Однако, если слишком много мочевой кислоты или почки не могут удалить её из крови как обычно, уровень мочевой кислоты в крови повышается (гиперурикемия). Связь между гиперурикемией и высоким артериальным давлением (ведущая проблема здоровья во всем мире) была признана ещё в 19 веке. В настоящее время существует множество доказательств важности этой связи. Цель настоящего обзора — оценить, может ли снижение уровня мочевой кислоты в крови также снизить артериальное давление. Такой подход может представлять собой новую цель и/или вариант лечения лиц с гипертензией.
Характеристика исследований
В этом обновлении предыдущего обзора мы рассмотрели абстракты из 349 ссылок и отобрали 21 для оценки. Для включения в обзор подходили только три исследования, два из которых не были указаны в предыдущем обзоре по этой теме. Исследования, включённые в настоящий обзор, были из США; в них оценили подростков и взрослых. Целью этих исследований было сравнение лекарственной терапии, применяемой для снижения уровня мочевой кислоты, с плацебо у лиц с диагностированным высоким артериальным давлением.
О чем говорят исследования
Мы обнаружили, что лекарственная терапия для снижения уровня мочевой кислоты не приводила к значительному снижению кровяного давления по сравнению с плацебо у лиц с высоким уровнем мочевой кислоты в крови и с высоким кровяным давлением. Лекарственная терапия превосходила плацебо в снижении уровня мочевой кислоты в крови. Число выбываний пациентов из исследований из-за побочных эффектов не увеличилось при лекарственной терапии; однако в одном исследовании один пациент выбыл из исследования из-за тяжёлой кожной реакции.
Таким образом, нет достаточных доказательств того, что использование лекарств, снижающих уровень мочевой кислоты в крови, также снижает кровяное давление у лиц с гипертензией. Необходимы дополнительные исследования по этому вопросу. Поскольку только три исследования были подходящими для включения в обзор, мы не можем быть уверены, что будущие исследования не изменят эти выводы.
Качество доказательств
В целом, имелись доказательства низкого качества, на основании которых не смогли установить, что лекарственная терапия высокого уровня мочевой кислоты в крови приводит к снижению кровяного давления. Исследования, включенные в настоящий обзор, представили результаты, различающиеся между исследованиями, в отношении этого исхода. Кроме того, мы обнаружили доказательства высокого качества того, что лекарственная терапия, направленная на снижение уровня мочевой кислоты, действительно снижает уровень мочевой кислоты. Наконец, были доказательства очень низкого качества, на основании которых не удалось установить, увеличивает ли лекарственная терапия число выбываний из исследований из-за побочных эффектов. Основными причинами этого были проблемы с дизайном исследований, недостаток данных и отсутствие единообразия результатов разных исследований.
Исследования, включенные в настоящий обзор, представили результаты, различающиеся между исследованиями, в отношении этого исхода. Кроме того, мы обнаружили доказательства высокого качества того, что лекарственная терапия, направленная на снижение уровня мочевой кислоты, действительно снижает уровень мочевой кислоты. Наконец, были доказательства очень низкого качества, на основании которых не удалось установить, увеличивает ли лекарственная терапия число выбываний из исследований из-за побочных эффектов. Основными причинами этого были проблемы с дизайном исследований, недостаток данных и отсутствие единообразия результатов разных исследований.
Концепция аутовоспаления в генезе подагры и гиперурикемии. Клиническая фармакология и терапия
Подагра, проявляющаяся атаками ост рого артрита, – яркий пример воспалительного заболевания, характеризующегося выраженной экссудативной фазой, в развитии которой большое значение имеют нейтрофилы, макрофаги и другие клетки врожденного неспецифического иммунитета.
Воспаление является комплексной реакцией на различные патогены, развивается не только в зоне повреждения, но и сопровождается выраженной системной реакцией с целью максимального восстановления поврежденных тканей [1]. Упрощен ная формула воспалительной реакции включает 5 известных признаков, каждый из которых представляет собой проявление сосудистой реакции в зоне воспаления – гиперемия, припухлость, боль, локальное повышение температуры, нарушение функции. В то же время следует признать, что воспаление нельзя отождествлять с сосудистой реакцией. На это обратили внимание уже классики теории воспаления – И.И. Мечников и П. Эр лих
Поскольку сосудистая воспалительная ре ак ция формировалась у животных па раллельно развитию теплокровности, И.И. Мечников в своих публикациях задает читателю риторический вопрос: разве воспаление не существует у рыб и более низших животных, не обладающих теплокровностью? [2] Далее И.И. Мечников доказывает, что принципиальным и наиболее древним (уже у простейших) процессом, на основе которого развивается воспаление, является фагоцитоз. Мечниковской теории фагоцитоза П. Эрлих, разработавший метод цитологических окрасок, противопоставлял гипотезу о дегрануляции воспалительных клеток, которую он наблюдал в клетках миелоидного ряда. Синтез обеих теорий впоследствии позволил обосновать концепцию врожденного иммунитета, носителями которого являются различные фагоциты (нейтрофилы, макрофаги, дендритные клетки и др.).
Мечниковской теории фагоцитоза П. Эрлих, разработавший метод цитологических окрасок, противопоставлял гипотезу о дегрануляции воспалительных клеток, которую он наблюдал в клетках миелоидного ряда. Синтез обеих теорий впоследствии позволил обосновать концепцию врожденного иммунитета, носителями которого являются различные фагоциты (нейтрофилы, макрофаги, дендритные клетки и др.).
Клетки врожденного иммунитета способны реагировать на групповые лиганды, специфичные для родственных микробов и поврежденных клеток организма. Система врожденного иммунитета в рамках физиологической реакции не реагирует на собственные антигены. Недостаточность врожденного иммунитета проявляется в отсутствии иммунологической памяти и ограниченном наборе генетически закрепленных реакций.
Одновременно с трудами И.И. Мечни кова и П. Эрлиха появились знаменитые пуб ликации Л. Пастера, который продемонстрировал эффективность системы специфического иммунитета, основанного на реакциях В- и Т-лимфоцитов. Демонстрация высокой эффективности вакцинации против различных инфекций произвела глубокое впечатление на современников, после чего все внимание специалистов, занимающихся воспалительными заболеваниями, было переключено на систему специфического иммунитета. Н.Ф. Гама лея под впечатлением работ Л. Пастера писал, что “… дни теории фагоцитоза И.И. Мечникова сочтены …”.
Демонстрация высокой эффективности вакцинации против различных инфекций произвела глубокое впечатление на современников, после чего все внимание специалистов, занимающихся воспалительными заболеваниями, было переключено на систему специфического иммунитета. Н.Ф. Гама лея под впечатлением работ Л. Пастера писал, что “… дни теории фагоцитоза И.И. Мечникова сочтены …”.
является достаточно поздним эволюционным приобретением и возникла только у млекопитающих. Главной новацией этой системы стало появление у лимфоцитов под влиянием антигенной стимуляции способности к реарранжировке генов, а возникшее в результате этого неограниченное число генетических вариаций позволило синтезировать индивидуальные антитела к любому антигену.
Эти открытия перевернули представления врачей о механизмах воспаления. В итоге в течение многих лет авторитетные руководства по патологии среди причин воспаления называли лишь три – инфекции, интоксикации и аутоиммунные процессы [3]. Под последними понимали развитие реакций против собственных антигенов, реализуемых главным образом аутореактивными Т-лимфоцитами и/или синтезом аутоантител В-лимфоцитами. Реакциям врожденного иммунитета придавали вспомогательное значение, считая их необходимыми лишь на этапе инициации воспаления и презентации антигена, в то время как специфическому иммунитету приписывали основное значение в развитии эффекторных реакций.
Под последними понимали развитие реакций против собственных антигенов, реализуемых главным образом аутореактивными Т-лимфоцитами и/или синтезом аутоантител В-лимфоцитами. Реакциям врожденного иммунитета придавали вспомогательное значение, считая их необходимыми лишь на этапе инициации воспаления и презентации антигена, в то время как специфическому иммунитету приписывали основное значение в развитии эффекторных реакций.
В последние два десятилетия отмечается повышение интереса к системе врожденного иммунитета в рамках новой теории аутовоспаления, под которым понимают самостоятельное развитие полноценных воспалительных реакций без участия Т и/или В-лимфоцитов, только за счет активации системы фагоцитов [4]. Чаще всего такие заболевания развиваются вследствие генетических мутаций. Таким образом, был объяснен патогенез ряда редких моногенных семейных периодических лихорадок: периодической болезни (мутации пирина), гипериммуноглобулинемии D (дефицит мевалонаткиназы), криопиринопатии (мутации криопирина у больных семейной холодовой крапивницей, синдромом Макла-Уэллса, NOMID-CINCA), TRAPS (мутации рецептора к фактору некроза опухоли альфа). В настоящее время таких моногенных аутовоспалительных заболеваний описано достаточно много. Несмотря на редкость этих состояний их изучение позволило открыть важнейший механизм аутовоспаления, реализуемый фагоцитами, в первую очередь, нейтрофилами – гиперсекрецию интерлейкина-1 вследствие формирования внутриклеточной макромолекулярной платформы – криопириновой инфламмасомы. Сборка инфламмасомы происходит в результате активации криопирина с последующим соединением с белками ASC, CARDINAL, каспазой-1. Основной функциональной задачей криопириновой инфламмасомы является активация каспазы-1, которая, в свою очередь, приводит к активации интерлейкина-1 [5].
В настоящее время таких моногенных аутовоспалительных заболеваний описано достаточно много. Несмотря на редкость этих состояний их изучение позволило открыть важнейший механизм аутовоспаления, реализуемый фагоцитами, в первую очередь, нейтрофилами – гиперсекрецию интерлейкина-1 вследствие формирования внутриклеточной макромолекулярной платформы – криопириновой инфламмасомы. Сборка инфламмасомы происходит в результате активации криопирина с последующим соединением с белками ASC, CARDINAL, каспазой-1. Основной функциональной задачей криопириновой инфламмасомы является активация каспазы-1, которая, в свою очередь, приводит к активации интерлейкина-1 [5].
Для криопиринопатий характерна спонтанная активация мутантного криопирина. При периодической болезни мутации пирина нарушают его способность контролировать сборку инфламмасомы, дефицит мевалонаткиназы приводит к недостаточной продукции изопреноидов, необходимых для фиксации инфламмасомы, и, вследствие этого, ее несвоевременной активации. Несмотря на то, что существуют и другие механизмы аутовоспаления, криопириновая инфламмасомопатия является одним из наиболее частых механизмов [5].
Несмотря на то, что существуют и другие механизмы аутовоспаления, криопириновая инфламмасомопатия является одним из наиболее частых механизмов [5].
В дальнейшем выяснилось, что при многих ревматологических и, в целом, воспалительных заболеваниях внутренних органов возможно сочетание различных гетерозиготных мутаций, вовлекающих аутовоспалительные механизмы. Такие заболевания относят к группе полигенных аутовоспалительных болезней. Эта ситуация оказалась достаточно частой в практике врачей, что делает по настоящему актуальным выделение аутовоспаления как самостоятельного варианта воспалительных заболеваний. К подобным заболеваниям относятся, в первую очередь, серонегативные спондилоартропатии (анкилозирующий спондилоартрит, псориатическая артропатия, болезнь Крона, хронический язвенный колит, синдром Стилла), интерстициальные болезни легких (саркоидоз, пневмокониоз и др.) и многие другие [5].
Оказалось, что аутовоспаление не всегда развивается вследствие генетической предрасположенности, существуют модели исключительно приобретенного механизма аутовоспалительного заболевания. Примером такой приобретенной инфламмасомопатии является подагра. Сама гиперурикемия как предпосылка подагры может быть генетически обусловленной [6], однако аутовоспалительная подагрическая атака развивается как генетически нормальная реакция на гиперурикемию, не связанная с мутациями. В этом случае активация инфламмасомы связана с тем, что криопирин является внутриклеточным рецептором, который реагирует на различные патогены, в том числе кристаллические структуры (кристаллы мочевой кислоты, холестерина), оказавшиеся в кровотоке или интерстиции [5]. Поскольку растворимость мочевой кислоты при физиологическом рН составляет 6,8 мг/дл, то предел растворимости мочевой кислоты может быть достигнут уже при нормальной ее концентрации и повышении температуры тела. В этом случае возможна трансформация растворенной мочевой кислоты в кристаллическую форму, что запускает активацию инфламмасомы в нейтрофилах и провоцирует атаку подагры [6]. Важным фактором, сдерживающим неконтролируемую кристаллизацию мочевой кислоты, является то, что плазма, обладая свойствами коллоидного раствора, повышает растворимость мочевой кислоты, а некоторые ее компоненты ингибируют образование кристаллов.
Примером такой приобретенной инфламмасомопатии является подагра. Сама гиперурикемия как предпосылка подагры может быть генетически обусловленной [6], однако аутовоспалительная подагрическая атака развивается как генетически нормальная реакция на гиперурикемию, не связанная с мутациями. В этом случае активация инфламмасомы связана с тем, что криопирин является внутриклеточным рецептором, который реагирует на различные патогены, в том числе кристаллические структуры (кристаллы мочевой кислоты, холестерина), оказавшиеся в кровотоке или интерстиции [5]. Поскольку растворимость мочевой кислоты при физиологическом рН составляет 6,8 мг/дл, то предел растворимости мочевой кислоты может быть достигнут уже при нормальной ее концентрации и повышении температуры тела. В этом случае возможна трансформация растворенной мочевой кислоты в кристаллическую форму, что запускает активацию инфламмасомы в нейтрофилах и провоцирует атаку подагры [6]. Важным фактором, сдерживающим неконтролируемую кристаллизацию мочевой кислоты, является то, что плазма, обладая свойствами коллоидного раствора, повышает растворимость мочевой кислоты, а некоторые ее компоненты ингибируют образование кристаллов.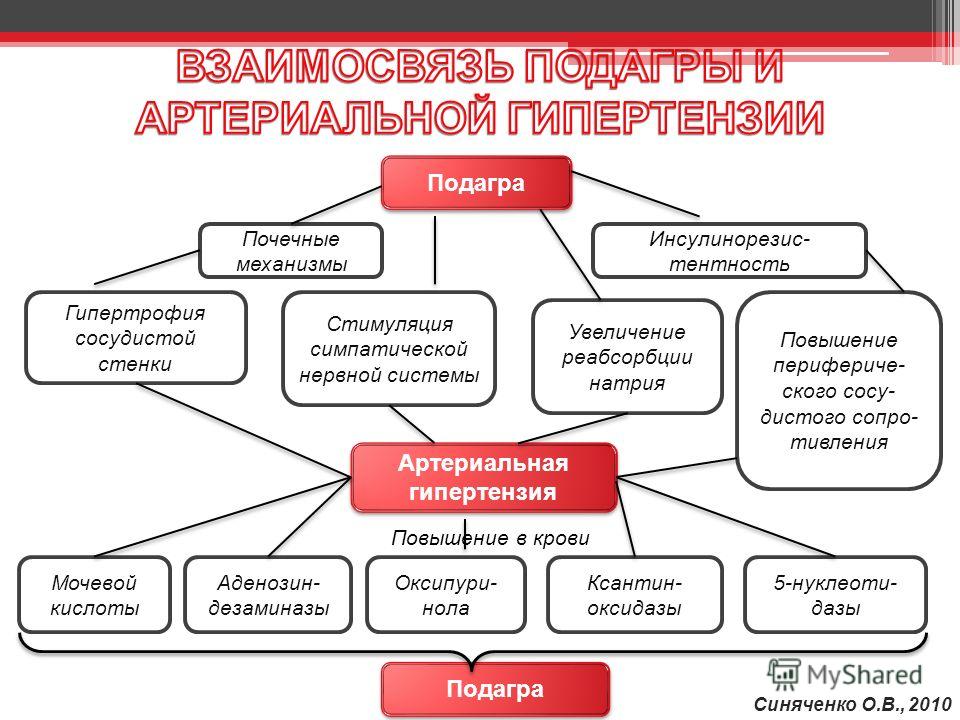 По этой причине даже при повышенном уровне мочевой кислоты в крови у многих пациентов подагра не развивается. Тем не менее, это не исключает возможность активации инфламмасомы фагоцитов у лиц с гиперурикемией даже вне подагрической атаки, что создает предпо сылки для персистирования субклинического аутовоспаления, являющегося важным фактором развития осложнений.
По этой причине даже при повышенном уровне мочевой кислоты в крови у многих пациентов подагра не развивается. Тем не менее, это не исключает возможность активации инфламмасомы фагоцитов у лиц с гиперурикемией даже вне подагрической атаки, что создает предпо сылки для персистирования субклинического аутовоспаления, являющегося важным фактором развития осложнений.
В течение последнего десятилетия было доказано, что гиперурикемия является независимым фактором риска артериальной гипертонии, фибрилляции предсердий и сердечно-сосудистых заболеваний, ассоциирована с сахарным диабетом, ожирением и хронической болезнью почек [7-12]. Это обосновывает правомочность включения гиперурикемии в состав метаболического синдрома и, следовательно, в группу факторов повышенного риска опасных сердечно-сосудистых осложнений [13].
Среди механизмов артериальной гипертонии у больных с гиперурикемией в первую очередь обсуждают блокаду продукции оксида азота [14-24], в результате чего снижается его системное вазодилатирующее действие, уменьшаются контроль пролиферативной активности гладких миоцитов стенок артерий и антитромбогенный эффект.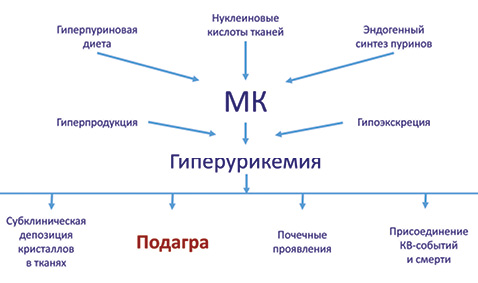 Возникающее под влиянием этого повышение общего периферического сопротивления сосудов является мощным фактором активации ренин-ангиотензиновой системы с развитием артериальной гипертонии. Блокаду синтеза оксида азота у больных с гиперурикемией связывают с гиперпродукцией свободных перекисных радикалов, что, в свою очередь, обусловлено персистирующей субклинической активацией аутовоспалительных механизмов [14-24]. H. Zheng и соавт. в опытах на кроликах показали, что гиперурикемия с высокой достоверностью коррелировала с уровнем ренина и ангиотензина II, а назначение лозартана приводило не только к нормализации активности ренина и ангиотензина II, но также к подавлению пролиферации гладких миоцитов [24]. Важным фактором подавления пролиферативной активности гладких миоцитов сосудов является также снижение концентрации адипонектина, которое коррелирует с гиперурикемией [25,26].
Возникающее под влиянием этого повышение общего периферического сопротивления сосудов является мощным фактором активации ренин-ангиотензиновой системы с развитием артериальной гипертонии. Блокаду синтеза оксида азота у больных с гиперурикемией связывают с гиперпродукцией свободных перекисных радикалов, что, в свою очередь, обусловлено персистирующей субклинической активацией аутовоспалительных механизмов [14-24]. H. Zheng и соавт. в опытах на кроликах показали, что гиперурикемия с высокой достоверностью коррелировала с уровнем ренина и ангиотензина II, а назначение лозартана приводило не только к нормализации активности ренина и ангиотензина II, но также к подавлению пролиферации гладких миоцитов [24]. Важным фактором подавления пролиферативной активности гладких миоцитов сосудов является также снижение концентрации адипонектина, которое коррелирует с гиперурикемией [25,26].
Кристаллы мочевой кислоты способны непосредственно повреждать эндотелий сосудов, что приводит к субэндотелиальной депозиции липидов и развитию атеросклероза. В исследовании случай-контроль (n=4884) уровень мочевой кислоты коррелировал с кальцификацией коронарных артерий, индекс которой позволял четко выявлять пациентов, относящихся к группе высокого риска летального исхода [27]. По данным китайских исследователей, проанализировавших 6347 больных ишемической болезнью сердца, наличие гиперурикемии повышает риск коронарной болезни в 2,76 раза [28]. Этот эффект реализуется через воспалительную индукцию оксидативного стресса и повреждение эндотелия кристаллами мочевой кислоты [28]. С гиперпродукцей воспалительных цитокинов, оксидативным стрессом M. Kuwabara и соавт. связывают и повышенный риск фибрилляции предсердий у больных с гиперурикемией [29,30].
В исследовании случай-контроль (n=4884) уровень мочевой кислоты коррелировал с кальцификацией коронарных артерий, индекс которой позволял четко выявлять пациентов, относящихся к группе высокого риска летального исхода [27]. По данным китайских исследователей, проанализировавших 6347 больных ишемической болезнью сердца, наличие гиперурикемии повышает риск коронарной болезни в 2,76 раза [28]. Этот эффект реализуется через воспалительную индукцию оксидативного стресса и повреждение эндотелия кристаллами мочевой кислоты [28]. С гиперпродукцей воспалительных цитокинов, оксидативным стрессом M. Kuwabara и соавт. связывают и повышенный риск фибрилляции предсердий у больных с гиперурикемией [29,30].
Ассоциация гиперурикемии с инсулинрезистентностью и нарушениями обмена углеводов также может объясняться действием свободных перекисных радикалов, продуктов оксидативного стресса активированных нейтрофилов, блокадой продукции оксида азота, активацией криопириновой инфламмасомы в самих бетаклетках островков Лангерганса с их последующим апоптозом. Сходные процессы наблюдают также в гепатоцитах что приводит к жировой дистрофии печени [31,32].
Сходные процессы наблюдают также в гепатоцитах что приводит к жировой дистрофии печени [31,32].
Таким образом, в настоящее время сопутствующие гиперурикемии состояния хорошо обоснованы. Име ют ся достаточные причины предполагать, что они во многом обусловлены хронической субклинической воспалительной активностью, патогенез которой объясняют аутовоспалительной инфламмасомопатией, сопровождающейся гиперпродукцией интерлейкина-1. В этой связи одним из основных способов предотвращения артериальной гипертонии и атеросклероза у больных с гиперурикемией и подагрой является проведение длительной противовоспалительной терапии с обязательным подавлением активности интерлейкина1.
В лечении инфламмасомопатий, в том числе полигенных, таких как синдром Стилла, высокой эффективностью обладают ингибиторы интерлейкина-1, в особенности канакинумаб, оказывающий пролонгированное действие. При подагре также имеется опыт применения этого препарата. Среди пациентов с противопоказаниями, непереносимостью или резистентностью к традиционным нестероидным противовоспалительным средствам или колхицину проведено два многоцентровых контролируемых рандомизированных исследования, которые показали высокую эффективность канакинумаба в предотвращении приступов подагры [32-34].
Среди пациентов с противопоказаниями, непереносимостью или резистентностью к традиционным нестероидным противовоспалительным средствам или колхицину проведено два многоцентровых контролируемых рандомизированных исследования, которые показали высокую эффективность канакинумаба в предотвращении приступов подагры [32-34].
Рекомендованная доза препарата у взрослых составляет 150 мг, препарат вводят однократно подкожно во время приступа подагрического артрита. Для достижения максимального эффекта канакинумаб необходимо вводить как можно раньше после начала приступа подагрического артрита. У пациентов с положительным ответом на терапию препаратом при необходимости продолжения лечения повторное введение канакинумаба возможно не ранее чем через 12 недель после предыдущей инъекции. Оптимизацию контроля гиперурикемии следует проводить с помощью соответствующих противоподагрических препаратов.
В редких случаях у больных, способных синтезировать амилоидогенный вариант белка острой фазы воспаления SAA, подагра может осложниться вторичным АА-амилоидозом. Такое осложнение может свидетельствовать о том, что у пациента даже вне приступа подагры сохраняется высокая острофазовая субклиническая активность. Однако скорее можно ожидать, что течение подагры у этих пациентов будет характеризоваться тяжелым многосуставным поражением с развитием деформаций и многочисленных тофусов. Един ственным способом остановить прогрессирование амилоидоза у таких пациентов является длительное многолетнее лечение ингибитором интерлейкина-1. Приводим такое наблюдение из собственной практики.
Такое осложнение может свидетельствовать о том, что у пациента даже вне приступа подагры сохраняется высокая острофазовая субклиническая активность. Однако скорее можно ожидать, что течение подагры у этих пациентов будет характеризоваться тяжелым многосуставным поражением с развитием деформаций и многочисленных тофусов. Един ственным способом остановить прогрессирование амилоидоза у таких пациентов является длительное многолетнее лечение ингибитором интерлейкина-1. Приводим такое наблюдение из собственной практики.
Больной Т., 66 лет, в течение многих лет страдает артериальной гипертонией 3 степени, регулярно антигипертензивные средства не принимает. Шесть лет назад впервые развился острый артрит левого голеностопного сустава, диагностирована подагра. В дальнейшем к врачам не обращался, периодически повторялись острые приступы артрита, преимущественно поражались крупные суставы ног, однако неоднократно вовлекались и суставы рук, в том числе мелкие, нередко развивался олигоартрит. Самостоятельно принимал диклофенак. Год назад участились приступы до 2-3 раз в месяц, отметил ограничение подвижности кистей. При рентгенографии кистей и ультразвуковом исследовании выявлены признаки хронической тофусной подагры. В крови сохранялся высокий уровень мочевой кислоты в крови (650-700 мкмоль/л). Назначен колхицин 1 мг/сут.
Самостоятельно принимал диклофенак. Год назад участились приступы до 2-3 раз в месяц, отметил ограничение подвижности кистей. При рентгенографии кистей и ультразвуковом исследовании выявлены признаки хронической тофусной подагры. В крови сохранялся высокий уровень мочевой кислоты в крови (650-700 мкмоль/л). Назначен колхицин 1 мг/сут.
В связи с выявленной протеинурией 8-12 г/сут и снижением фильтрационной функции почек (сывороточный креатинин 129,4 мкмоль/л, скорость клубочковой фильтрации 47,4 мл/мин) проведена биопсия почки. На фоне диффузного глобального гломерулосклероза пре имуществнно по ходу сосудов почек выявлены конгофильные массы, обладающие свойством двойного лучепреломления в поляризованном свете. Диагно сти рован амилоидоз. Отсутствие моноклональной гамма патии по результатам иммунохимического иссле до вания с применением высокочувствительных методов исключало AL-тип амилоидоза. Нефропати ческий вариант амилоидоза, высокие уровни С-реактивного белка (35 мг/л) и наличие хронического подагрического полиартрита позволили диагностировать АА-амилоидоз. Проведено тщательное обследование для исключения паранеопластической природы амилоидоза – эзофагогастродуоденоскопия, колоноскопия, мультиспиральная компьютерная томография органов грудной клетки и брюшной полости.
Проведено тщательное обследование для исключения паранеопластической природы амилоидоза – эзофагогастродуоденоскопия, колоноскопия, мультиспиральная компьютерная томография органов грудной клетки и брюшной полости.
К лечению колхицином 1 мг/сут добавлен канакинумаб 150 мг, возобновлено лечение аллопуринолом 100 мг/сут. Через год после начала лечения канакинумабом купирован нефротический синдром, протеинурия снизилась до 0,67-1,4 г/л, функция почек не ухудшилась. Приступы подагры не повторялись, нормализовался уровень С-реактивного белка, улучшилась подвижность в суставах кистей, заметно уменьшился в размерах тофус в области левого запястья.
Представленное наблюдение демонстрирует современные возможности эффективного лечения АА-амилоидоза. Применение канакинумаба позволило не только купировать нефротический синдром, но и задержать прогрессирующее ухудшение функции почек, которое потребовало бы назначения почечной заместительной терапии. Пожалуй, наиболее приемлемой схемой для длительной терапии следует признать колхицин 1-2 мг/сут, при неэффективности которого следует обсуждать необходимость назначения канакинумаба.
Пожалуй, наиболее приемлемой схемой для длительной терапии следует признать колхицин 1-2 мг/сут, при неэффективности которого следует обсуждать необходимость назначения канакинумаба.
Представленное наблюдение показывает также необ ходимость комплексной терапии у больных подагрой. Только противовоспалительное лечение эффективно снижает риск повторных подагрических атак, однако не дает возможность остановить прогрессирование – у пациентов может усугубиться эрозивная артропатия, продолжиться рост тофусов, что, в итоге, способствует ухудшению функции суставов. Поэтому лечение больного подагрой и гиперурикемией обязательно должно включать мероприятия по снижению уровня мочевой кислоты в крови и тканях [6].
Традиционным способом снижения уровня мочевой кислоты в крови является соблюдение гипопуриновой диеты, так как мочевая кислота является продуктом метаболизма пуриновых оснований. Однако соблюдение низкопуриновой диеты в большинстве случаев не является достаточным для достижения целевого уровня мочевой кислоты, поэтому проведение адекватной лекарственной терапии – основа успеха лечения заболевания [35].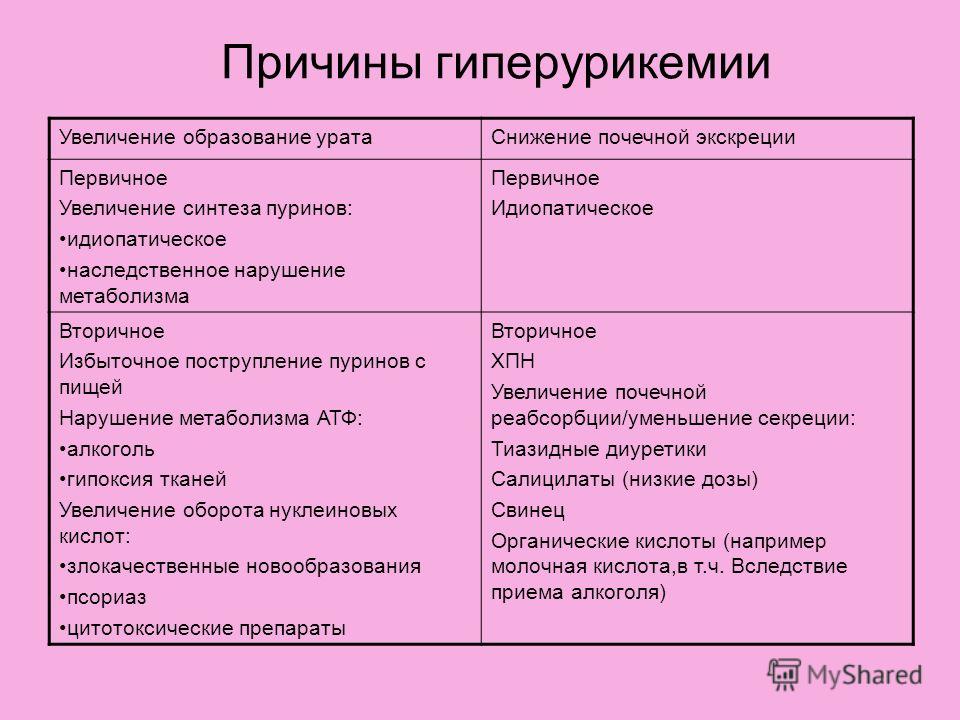 Трудность соблюдения диеты связана со значительным изменением образа жизни – отказом от алкоголя, резким ограничением базовых продуктов питания (мясо), что является неприемлемым для людей с гедонистическим складом личности. Не менее важной причиной недостаточной эффективности диеты является также то, что баланс поступления и выведения мочевой кислоты в первую очередь обусловлен ограничениями в экскреции мочевой кислоты почками (две трети экскретируемой мочевой кислоты выводится почками и одна треть – желудочно-кишечным трактом). Известно, что гиперурикемия развивается после длительного периода повышенной экскреции мочевой кислоты с мочой и является результатом декомпенсации механизмов ее выведения, что многими исследователями рассматривается как проявление почечной недостаточности. Во всяком случае любое выявление гиперурикемии следует рассматривать как возможный признак хронического уратного интерстициального нефрита.
Трудность соблюдения диеты связана со значительным изменением образа жизни – отказом от алкоголя, резким ограничением базовых продуктов питания (мясо), что является неприемлемым для людей с гедонистическим складом личности. Не менее важной причиной недостаточной эффективности диеты является также то, что баланс поступления и выведения мочевой кислоты в первую очередь обусловлен ограничениями в экскреции мочевой кислоты почками (две трети экскретируемой мочевой кислоты выводится почками и одна треть – желудочно-кишечным трактом). Известно, что гиперурикемия развивается после длительного периода повышенной экскреции мочевой кислоты с мочой и является результатом декомпенсации механизмов ее выведения, что многими исследователями рассматривается как проявление почечной недостаточности. Во всяком случае любое выявление гиперурикемии следует рассматривать как возможный признак хронического уратного интерстициального нефрита.
Нормальная урикозурия составляет 620±75 мг/сут (нормальный клиренс 8,7±2,5 мл/мин, нормальная экскретируемая фракция мочевой кислоты 7,25±2,98%, или 6-8%), 91-95% профильтровавшейся мочевой кислоты подвергается реабсорбции в обмен на внутриклеточные анионы, наблюдается также небольшая тубулярная секреция мочевой кислоты.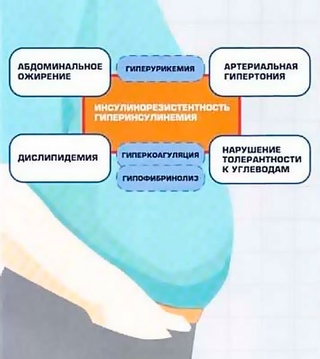 В итоге, в окончательной моче содержится только 3-10% от исходно профильтровавшегося количества мочевой кислоты. Гиперурикозурией считают мочевую экскрецию более 800 мг/сут у мужчин и более 750 мг/сут у женщин и связывают, главным образом, с нарушением реабсорбции мочевой кислоты [6].
В итоге, в окончательной моче содержится только 3-10% от исходно профильтровавшегося количества мочевой кислоты. Гиперурикозурией считают мочевую экскрецию более 800 мг/сут у мужчин и более 750 мг/сут у женщин и связывают, главным образом, с нарушением реабсорбции мочевой кислоты [6].
Среди транспортеров, обеспечивающих реабсорбцию мочевой кислоты (URAT1, GLUT9, OAT4, OAT10), основное значение придают белку URAT1. Мутации, вызывающие полное отсутствие активности этого белка, приводят к практически полному прекращению реабсорбции мочевой кислоты. В этом случае экскретируемая фракция мочевой кислоты составляет 40-100%, а концентрация в крови в среднем снижается до кри тического уровня 0,93 мг/дл. Концентрации мочевой кислоты менее 1 мг/дл считают небезопасными и ассоциированными с риском нефролитиаза и острого почечного повреждения, вероятно, вследствие обструкции почечных канальцев преципитатами мочевой кислоты, спровоцированной физическими нагрузками. Среди причин острого почечного повреждения обсуждают также острую ишемию почек вследствие спазма почечных артерий, вызванного продукцией свободных перекисных радикалов. Наконец, повреждение почек может быть связано с избытком накопленных в цитоплазме тубулярного эпителия анионов, обладающих токсическими свойствами.
Среди причин острого почечного повреждения обсуждают также острую ишемию почек вследствие спазма почечных артерий, вызванного продукцией свободных перекисных радикалов. Наконец, повреждение почек может быть связано с избытком накопленных в цитоплазме тубулярного эпителия анионов, обладающих токсическими свойствами.
Активность URAT1 зависит от градиента натрия, создаваемого Na+K+АТФазой, так как этот градиент определяет количество анионов, которое должно быть обменено на мочевую кислоту. Активность транспортера находится также в прямой зависимости от уровня в крови тестостерона и в обратной зависимости от концентрации эстрогенов. По-видимому, этим механизмом опосредуется более высокий риск гиперурикемии у мужчин и женщин в постменопаузальном периоде. Этот белок рассматривают как основную мишень для разработки урикозурической терапии [6].
GLUT9 является менее значимым транспортером мочевой кислоты, однако он также, наряду с URAT1, ассоциирован с риском гиперурикозурии и уратного нефролитиаза и почечной недостаточностью вследствие физических перегрузок [6]. Важно отметить, что гиперурикозурия, вызванная дисфункцией этого транспортера, нередко сочетается с глюкозурией и возникает при значительном потреблении фруктозы (это может быть одним из объяснений уратного нефролитиаза при злоупотреблении продуктами, содержащими фруктозу).
Важно отметить, что гиперурикозурия, вызванная дисфункцией этого транспортера, нередко сочетается с глюкозурией и возникает при значительном потреблении фруктозы (это может быть одним из объяснений уратного нефролитиаза при злоупотреблении продуктами, содержащими фруктозу).
У больных подагрой экскретируемая фракция мочевой кислоты снижается до 3-5%, что и позволяет рассматривать снижение почечной экскреции как основной фактор развития гиперурикемии. Снижение экскреции мочевой кислоты может быть итогом повреждения тубулярного эпителия вследствие длительной гиперурикозурии или быть вызвано изначальным снижением секреции мочевой кислоты. Основным транспортером, обеспечивающим тубулярную секрецию мочевой кислоты, является ABCG2. Мутации в гене этого белка четко ассоциированы с гиперурикемией и риском подагры [6].
Традиционное медикаментозное лечение подагры и гиперурикемии базируется на применении ингибиторов ксантиноксидазы, которые останавливают деградацию пуринов на этапе ксантина и, тем самым, блокируют образование мочевой кислоты. К таким препаратам относятся аллопуринол и фебуксостат. Основными показаниями к применению этих препаратов являются подагра, уратный нефролитиаз, а также состояния, сопровождающиеся гиперпродукцией мочевой кислоты – синдром Леша-Нихана, хронические миелопролиферативные заболевания (синдром лизиса опухоли). Наиболее широко применяют аллопуринол. Лечение рекомендуется начинать с дозы 100 мг/сут с последующим ее увеличением каждые 2-4 недели вплоть до 800 мг/сут, пока не будет достигнут целевой уровень мочевой кислоты менее 6 мг/сут. При этом следует помнить о необходимости избегать высокой дозы аллопуринола у больных с почечной недостаточностью.
К таким препаратам относятся аллопуринол и фебуксостат. Основными показаниями к применению этих препаратов являются подагра, уратный нефролитиаз, а также состояния, сопровождающиеся гиперпродукцией мочевой кислоты – синдром Леша-Нихана, хронические миелопролиферативные заболевания (синдром лизиса опухоли). Наиболее широко применяют аллопуринол. Лечение рекомендуется начинать с дозы 100 мг/сут с последующим ее увеличением каждые 2-4 недели вплоть до 800 мг/сут, пока не будет достигнут целевой уровень мочевой кислоты менее 6 мг/сут. При этом следует помнить о необходимости избегать высокой дозы аллопуринола у больных с почечной недостаточностью.
Другим ингибитором ксантиноксидазы является фебуксостат, который применяют для лечения подагры (но не бессимптомной гиперурикемии) в дозах 40-80120 мг/сут при неэффективности или непереносимости аллопуринола. Выведение препарата преимущественно печенью позволяет использовать его у больных почечной недостаточностью. Фебуксостат слабо взаимодействует с другими медикаментами. Препарат особенно эффективен у больных с дисфункцией ABCG2-транспортера. В исследовании CARES частота сердечнососудистых событий при лечении фебуксостатом была несколько выше, чем при лечении аллопуринолом, хотя многие авторы указывают на ряд ограничений этого исследования [36-39].
Фебуксостат слабо взаимодействует с другими медикаментами. Препарат особенно эффективен у больных с дисфункцией ABCG2-транспортера. В исследовании CARES частота сердечнососудистых событий при лечении фебуксостатом была несколько выше, чем при лечении аллопуринолом, хотя многие авторы указывают на ряд ограничений этого исследования [36-39].
В качестве второй линии терапии при неэффективности ингибиторов ксантиноксидазы используют урикозурические препараты – лезинурад, пробенецид и бензбромарон, которые блокируют реабсорбцию мочевой кислоты, подавляя активность URAT1. Увеличивая урикозурию, оба препарата могут провоцировать образование камней в системе мочевыделения, что требует эффективного защелачивания мочи.
В настоящее время проводится оценка и других препаратов, снижающих уровень мочевой кислоты, в частности препаратов уриказы и др.
Существенной проблемой в лечении больных подагрой является низкая приверженность больных к длительной терапии, как противовоспалительной, так и направленной на снижение уровня мочевой кислоты в крови. Многие пациенты продолжают нарушать гипопуриновую диету. Правильная организация работы с пациентом и проведение эффективных образовательных тренингов позволяют почти в 5 раз увеличить шансы достижения целевого уровня мочевой кислоты [40]. Способствует этому и проведение противовоспалительной терапии, в том числе применение колхицина и ингибиторов ИЛ-1 [41].
Многие пациенты продолжают нарушать гипопуриновую диету. Правильная организация работы с пациентом и проведение эффективных образовательных тренингов позволяют почти в 5 раз увеличить шансы достижения целевого уровня мочевой кислоты [40]. Способствует этому и проведение противовоспалительной терапии, в том числе применение колхицина и ингибиторов ИЛ-1 [41].
Гиперурикемия (высокое содержание мочевой кислоты) — устранение побочных эффектов
Что такое гиперурикемия?
Гиперурикемия — это избыток мочевой кислоты в крови. Мочевая кислота проходит через
печень и попадает в ваш кровоток. Большая его часть выводится из организма (выводится из вашего тела)
в моче или проходит через кишечник для регулирования «нормального» уровня.
Нормальный уровень мочевой кислоты — 2.4-6,0 мг / дл (женщины) и 3,4-7,0 мг / дл (мужчины).
Нормальные значения будут отличаться от лаборатории к лаборатории.
Также важны пурины для уровня мочевой кислоты в крови. Пурины азотсодержащие
соединения, которые производятся внутри клеток вашего тела (эндогенные) или происходят из
вне вашего тела, из продуктов, содержащих пурин (экзогенный). Пуриновые перерывы
вниз в мочевую кислоту.Повышенный уровень мочевой кислоты из-за избытка пуринов может накапливаться
в ваших тканях и образуют кристаллы. Это может вызвать повышенный уровень мочевой кислоты.
в крови.
Образование мочевой кислоты может происходить, когда уровень мочевой кислоты в крови поднимается выше 7 мг / дл.
Такие проблемы, как камни в почках и подагра (скопление кристаллов мочевой кислоты в
суставов, особенно пальцев ног и ног).
Что вызывает гиперурикемию?
Причинами высокого уровня мочевой кислоты (гиперурикемии) могут быть:
первичный (повышенный уровень мочевой кислоты из-за пурина) и вторичный (повышенный уровень мочевой кислоты
уровни из-за другого заболевания или состояния).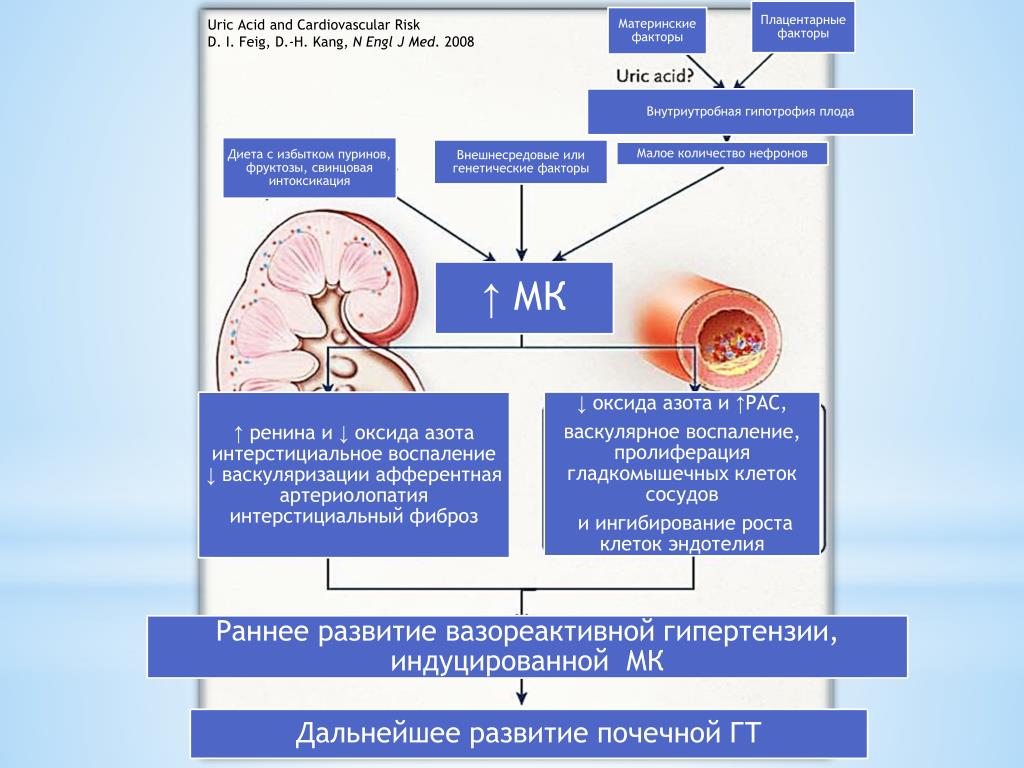 Иногда организм производит больше мочевой кислоты.
Иногда организм производит больше мочевой кислоты.
кислоты, чем она способна выводить из организма.
Причины высокого уровня мочевой кислоты:
- Первичная гиперурикемия
- Увеличение производства мочевой кислоты из пурина
- Почки не могут избавиться от мочевой кислоты в крови, что приводит к
уровни
- Вторичная гиперурикемия
- Некоторые виды рака или химиотерапевтические агенты могут вызывать повышенную скорость оборота
гибель клеток.Обычно это происходит из-за химиотерапии, но может наблюдаться высокий уровень мочевой кислоты.
перед проведением химиотерапии. - После химиотерапии часто наблюдается быстрое разрушение клеток и опухоль.
может возникнуть синдром лизиса. Вы можете подвергаться риску синдрома лизиса опухоли, если получаете
Вы можете подвергаться риску синдрома лизиса опухоли, если получаете
химиотерапия при определенных типах лейкемии, лимфомы или множественной миеломы, если есть
присутствует большое количество болезней. - Заболевание почек — это может привести к тому, что вы не сможете выводить мочевую кислоту из
ваша система, тем самым вызывая гиперурикемию. - Лекарства — могут вызвать повышение уровня мочевой кислоты в крови
- Эндокринные нарушения или нарушения обмена веществ — некоторые формы диабета или ацидоза
может вызвать гиперурикемию - Повышенный уровень мочевой кислоты может вызвать проблемы с почками или вовсе не вызвать их.Люди могут
живут много лет с повышенным уровнем мочевой кислоты, и у них не развивается подагра или
подагрический артрит (артрит означает «воспаление суставов»). Только около 20% людей
Только около 20% людей
с повышенным уровнем мочевой кислоты когда-либо развивается подагра, а у некоторых людей с подагрой нет
имеют значительно повышенный уровень мочевой кислоты в крови.
- Некоторые виды рака или химиотерапевтические агенты могут вызывать повышенную скорость оборота
Симптомы гиперурикемии:
- У вас может не быть никаких симптомов.
- Если уровень мочевой кислоты в крови значительно повышен, и вы проходите
химиотерапия лейкемии или лимфомы, у вас могут быть симптомы проблемы с почками или
подагрический артрит из-за высокого уровня мочевой кислоты в крови. - У вас могут быть жар, озноб, усталость, если у вас есть определенные формы рака, и ваш
уровень мочевой кислоты повышен (вызван синдромом лизиса опухоли) - Вы можете заметить воспаление сустава (так называемое «подагра»), если кристаллы мочевой кислоты
отложите в одном из ваших суставов. (* Примечание — подагра может возникнуть при нормальном уровне мочевой кислоты,
(* Примечание — подагра может возникнуть при нормальном уровне мочевой кислоты,
тоже). - У вас могут быть проблемы с почками (вызванные образованием камней в почках) или проблемы
с мочеиспусканием
Что можно сделать при гиперурикемии:
- Обязательно сообщите своему врачу, а также всем поставщикам медицинских услуг о любых других
лекарства, которые вы принимаете (в том числе безрецептурные, витамины или лечебные травы). - Напомните своему врачу или медицинскому работнику, если у вас в анамнезе диабет, печень,
болезнь почек или сердца. - Следуйте инструкциям врача по снижению уровня крови.
уровень мочевой кислоты и лечение гиперурикемии. Если ваш уровень в крови
сильно повышены, он или она может прописать лекарства для снижения мочевой кислоты
уровни до безопасного диапазона.
Если у вас повышенный уровень мочевой кислоты в крови, и ваш лечащий врач считает, что
что у вас может быть риск подагры, камней в почках, старайтесь придерживаться диеты с низким содержанием пуринов.
Продукты с высоким содержанием пурина включают:
- Все субпродукты (например, печень), мясные экстракты и подливки
- Дрожжи и дрожжевые экстракты (например, пиво и алкогольные напитки)
- Спаржа, шпинат, фасоль, горох, чечевица, овсянка, цветная капуста и грибы
К продуктам с низким содержанием пурина относятся:
- Крупы рафинированные — хлеб, макаронные изделия, мука, тапиока, пирожные
- Молоко и молочные продукты, яйца
- Салат, помидоры, зеленые овощи
- Крем-супы без мясного бульона
- Вода, фруктовые соки, газированные напитки
- Арахисовое масло, фрукты и орехи
- Поддерживайте водный баланс, выпивайте от 2 до 3 литров воды в день, если вам не сказали
иначе.
- Принимайте все лекарства от гиперурикемии в соответствии с указаниями.
- Избегайте кофеина и алкоголя, так как они могут вызвать проблемы с мочевой кислотой.
и гиперурикемия. - Избегайте приема лекарств, таких как тиазидные диуретики (гидрохлоротиазид) и петлевые диуретики.
(например, фуросемид или Lasix ® ). Также такие препараты
как ниацин, и низкие дозы аспирина (менее 3 граммов в день) могут ухудшить мочевой
кислотный уровень.Не принимайте эти лекарства или аспирин, если только врач.
кто знает ваше состояние сказал вам. - Если вы испытываете симптомы или побочные эффекты, особенно тяжелые, обязательно обсудите
их вместе с вашей медицинской бригадой. Они могут прописать лекарства и / или предложить
другие предложения, которые эффективны при решении таких проблем.
Лекарства или методы лечения, которые может назначить ваш врач:
Ваш врач или поставщик медицинских услуг может назначить лекарства, если у вас высокий
уровень мочевой кислоты в крови.Сюда могут входить:
- Нестероидные противовоспалительные средства (НПВП) и тайленол ® —
такие как напроксен натрия и ибупрофен, могут облегчить боль, связанную с подагрой. Подагра
может быть результатом высокого уровня мочевой кислоты. - Если вам следует избегать приема НПВП из-за вашего типа рака или химиотерапии
вы принимаете ацетаминофен (тайленол) до 4000 мг в день (два сверхсильных
таблетки каждые 6 часов) может помочь. - Важно не превышать рекомендуемую суточную дозу тайленола, так как это может вызвать
повреждение печени. Обсудите это со своим врачом.
- Урикозурические препараты: эти препараты действуют, блокируя реабсорбцию уратов, которые
может предотвратить отложение кристаллов мочевой кислоты в тканях. Примеры
из урикозурических препаратов включают пробенецид и сульфинпиразон. - Ингибиторы ксантиноксидазы — такие как аллопуринол, предотвращают подагру. Однако это
может усилить симптомы подагры, если принимать во время эпизода
болезненное воспаление суставов. - Аллопуринол также может быть назначен вам, если у вас определенная форма лейкемии или
лимфома, для предотвращения осложнений от химиотерапии и синдрома лизиса опухоли —
и не обязательно для предотвращения подагры.С высоким уровнем мочевой кислоты в крови,
в результате вашего заболевания мочевая кислота будет собираться и образовывать кристаллы в вашем
почки. Это может произойти во время химиотерапии и вызвать отказ почек.
Это может произойти во время химиотерапии и вызвать отказ почек.
Когда обращаться к врачу или поставщику медицинских услуг:
- Локализованная боль в суставах (особенно в суставах пальцев рук и ног), красная и воспаленная.
- Одышка, боль в груди или дискомфорт; следует немедленно оценить.
- Чувство учащенного сердцебиения (учащенное сердцебиение).
- Кровотечение, которое не прекращается через несколько минут.
- Любые новые высыпания на коже, особенно если вы начали принимать новые лекарства.
Вернуться к списку крови
Отклонения от нормы
Примечание: Мы настоятельно рекомендуем вам поговорить со своим лечащим врачом.
о вашем конкретном заболевании и лечении.Информация, содержащаяся
на этом веб-сайте предназначено быть полезным и образовательным, но не заменять
для медицинской консультации.
Высокий уровень мочевой кислоты: причины, риски, лечение, профилактика
Обзор
Что такое высокий уровень мочевой кислоты?
Мочевая кислота — это отходы жизнедеятельности, обнаруженные в крови.Он образуется, когда организм расщепляет химические вещества, называемые пуринами. Большая часть мочевой кислоты растворяется в крови, проходит через почки и покидает организм с мочой. Еда и напитки с высоким содержанием пуринов также повышают уровень мочевой кислоты. К ним относятся:
- Морепродукты (особенно лосось, креветки, омары и сардины)
- Красное мясо
- Мясные субпродукты, например печень
- Еда и напитки с кукурузным сиропом с высоким содержанием фруктозы и алкоголь (особенно пиво, включая безалкогольное)
Если в организме остается слишком много мочевой кислоты, возникает состояние, называемое гиперурикемией. Гиперурикемия может вызывать образование кристаллов мочевой кислоты (или уратов). Эти кристаллы могут оседать в суставах и вызывать подагру — форму артрита, которая может быть очень болезненной. Они также могут оседать в почках и образовывать камни в почках.
Гиперурикемия может вызывать образование кристаллов мочевой кислоты (или уратов). Эти кристаллы могут оседать в суставах и вызывать подагру — форму артрита, которая может быть очень болезненной. Они также могут оседать в почках и образовывать камни в почках.
При отсутствии лечения высокий уровень мочевой кислоты может со временем привести к необратимому повреждению костей, суставов и тканей, заболеванию почек и сердечно-сосудистых заболеваний. Исследования также показали связь между высоким уровнем мочевой кислоты и диабетом 2 типа, высоким кровяным давлением и жировой болезнью печени.
Как диагностируется повышенная мочевая кислота и подагра?
Берут образец крови и исследуют его для определения уровня мочевой кислоты. Если вы удалите камень в почках или удалили его хирургическим путем, сам камень можно проверить, чтобы определить, является ли он камнем из мочевой кислоты или камнем другого типа. Обнаружение повышенного уровня мочевой кислоты в крови НЕ то же самое, что диагностика подагрического артрита. Чтобы диагностировать подагру, кристаллы мочевой кислоты должны быть обнаружены в жидкости, взятой из опухшего сустава, или обнаружены с помощью специальной визуализации костей и суставов (ультразвук, рентген или компьютерная томография).
Чтобы диагностировать подагру, кристаллы мочевой кислоты должны быть обнаружены в жидкости, взятой из опухшего сустава, или обнаружены с помощью специальной визуализации костей и суставов (ультразвук, рентген или компьютерная томография).
Уход и лечение
Как лечится высокий уровень мочевой кислоты?
Если у вас приступ подагры, можно использовать лекарства, чтобы уменьшить воспаление, боль и отек. Вы должны пить много жидкости, но избегать алкоголя и сладких безалкогольных напитков. Лед и возвышенность полезны.
Камни в почках могут постепенно выходить из организма с мочой. Важно пить больше жидкости. Старайтесь выпивать не менее 64 унций в день (8 стаканов по восемь унций в штуке). Лучше всего вода.
Ваш врач может также прописать лекарства, которые помогают прохождению камней, расслабляя мышцы мочеточника — протока, по которому моча проходит от почки к мочевому пузырю.
Если камень слишком большой для выхода, блокирует отток мочи или вызывает инфекцию, может потребоваться хирургическое удаление камня.
Можно ли контролировать и предотвращать высокий уровень мочевой кислоты?
Высокий уровень мочевой кислоты можно контролировать, а вспышки боли в суставах контролировать и останавливать с помощью долгосрочной программы лечения заболевания. Ваш врач может назначить лекарства, растворяющие отложения кристаллов мочевой кислоты. Может потребоваться пожизненная уратоснижающая терапия с лекарствами, которые предотвращают приступы подагры и в конечном итоге растворяют кристаллы, которые уже находятся в вашем теле.
Другие способы помочь контролировать высокий уровень мочевой кислоты:
- Похудание, при необходимости
- Следите за тем, что вы едите (ограничьте потребление кукурузного сиропа с фруктозой, мясных субпродуктов, красного мяса, рыбы и алкогольных напитков)
Гиперурикемия: основы практики, патофизиология, этиология
Stack A, Manolis AJ, Ritz E. Пагубная роль гиперурикемии на сердечно-рено-сосудистую систему. Curr Med Res Opin . 2015 31 сентября Дополнение 2: 21-6. [Медлайн].
Johnson RJ, Kivlighn SD, Kim YG, Suga S, Fogo AB. Переоценка патогенеза и последствий гиперурикемии при гипертонии, сердечно-сосудистых заболеваниях и заболеваниях почек. Am J Почки почек . 1999 фев.33 (2): 225-34. [Медлайн].
Эномото А., Кимура Х., Чаироунгдуа А., Шигета Й, Джутабха П., Ча Ш. и др. Молекулярная идентификация почечного уратного анионита, регулирующего уровень уратов в крови. Природа . 2002 г. 23 мая. 417 (6887): 447-52. [Медлайн].
Итида К., Хосоямада М.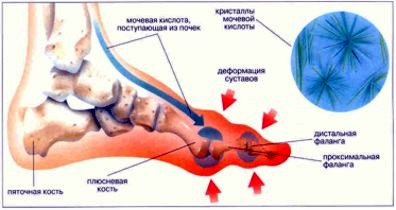 , Кимура Х., Такеда М., Уцуномия Й., Хосоя Т. и др. Транспорт уратов через человеческий транспортер ПАУ hOAT1 и его генная структура. Почки Инт .2003 Январь 63 (1): 143-55. [Медлайн].
, Кимура Х., Такеда М., Уцуномия Й., Хосоя Т. и др. Транспорт уратов через человеческий транспортер ПАУ hOAT1 и его генная структура. Почки Инт .2003 Январь 63 (1): 143-55. [Медлайн].
Лил-Пинто Э., Коэн Б.Е., Липковиц М.С., Абрамсон Р.Г. Функциональный анализ и молекулярная модель переносчика / канала уратов человека, hUAT. Am J Physiol Renal Physiol . 2002 Июль 283 (1): F150-63. [Медлайн].
Сираиси Х., Уне Х. Влияние взаимодействия между ожирением и употреблением алкоголя на гиперурикемию у японских офисных работников мужского пола. J Эпидемиол . 2009. 19 (1): 12-6. [Медлайн].[Полный текст].
Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Кристаллы мочевой кислоты, ассоциированные с подагрой, активируют инфламмасому NALP3. Природа . 2006 9 марта. 440 (7081): 237-41. [Медлайн].
[Медлайн].
Dalbeth N, Merriman T. Взгляд хрустального шара: новые терапевтические мишени при гиперурикемии и подагре. Ревматология (Оксфорд) . 2009 Март 48 (3): 222-6. [Медлайн].
Latourte A, Bardin T, Richette P.Профилактика обострения подагры после начала уратснижающей терапии. Ревматология (Оксфорд) . 2014 ноябрь 53 (11): 1920-6. [Медлайн].
Xie DX, Xiong YL, Zeng C, Wei J, Yang T, Li H и др. Связь между низким содержанием цинка в пище и гиперурикемией у мужчин среднего и старшего возраста в Китае: кросс-секционное исследование. BMJ Открыть . 2015 окт 13.5 (10): e008637. [Медлайн].
Wang YL, Zeng C, Wei J, Yang T, Li H, Deng ZH и др.Связь между диетическим потреблением магния и гиперурикемией. PLoS One . 2015. 10 (11): e0141079. [Медлайн].
2015. 10 (11): e0141079. [Медлайн].
Chen SC, Huang YF, Wang JD. Гиперферритинемия и гиперурикемия могут быть связаны с нарушением функции печени у подростков с ожирением. PLoS One . 2012. 7 (10): e48645. [Медлайн]. [Полный текст].
Ли Ю.М., Бэ С.Г., Ли С.Х., Джейкобс Д.Р. младший, Ли Д.Х. Стойкие органические загрязнители и гиперурикемия в США.С. население в целом. Атеросклероз . 2013 Сентябрь 230 (1): 1-5. [Медлайн].
Rho YH, Zhu Y, Choi HK. Эпидемиология мочевой кислоты и фруктозы. Семин Нефрол . 2011 Сентябрь 31 (5): 410-9. [Медлайн]. [Полный текст].
Bae J, Chun BY, Park PS, Choi BY, Kim MK, Shin MH, et al. Более высокое потребление подслащенных безалкогольных напитков увеличивает риск гиперурикемии у населения Кореи: когортное исследование корейских многонациональных сообществ. Семенной ревматический артрит . 2014 Апрель 43 (5): 654-61. [Медлайн].
Семенной ревматический артрит . 2014 Апрель 43 (5): 654-61. [Медлайн].
Лопес-Молина Р., Парра-Кабрера С., Лопес-Ридаура Р., Гонсалес-Вильяльпандо М.Э., Ферраннини Э., Гонсалес-Вильяльпандо С. Потребление сладких напитков, гиперурикемия и метаболический синдром: исследование диабета в Мехико. Salud Publica Mex . 2013 декабрь 55 (6): 557-63. [Медлайн].
Сикейра Дж. Х., Милл Дж. Г., Веласкес-Мелендес Дж., Морейра А. Д., Баррето С. М., Бенсеньор И. М. и др.Безалкогольные напитки с сахаром и потребление фруктозы связаны с гиперурикемией: перекрестный анализ Бразильского продольного исследования здоровья взрослых (ELSA-Brasil). Питательные вещества . 2018 27 июля, 10 (8): [Medline]. [Полный текст].
Lecoultre V, Egli L, Shetaz F, Despland C, Schneiter P, Tappy L. Гиперурикемия, вызванная фруктозой, связана со снижением почечной экскреции мочевой кислоты у людей. Уход за диабетом . 2013 сентября, 36 (9): e149-50.[Медлайн]. [Полный текст].
Уход за диабетом . 2013 сентября, 36 (9): e149-50.[Медлайн]. [Полный текст].
Chen-Xu M, Yokose C, Rai SK, Pillinger MH, Choi HK. Современная распространенность подагры и гиперурикемии в Соединенных Штатах и десятилетние тенденции: Национальное исследование здоровья и питания, 2007-2016 гг. Ревматический артрит . 2019 июн.71 (6): 991-999. [Медлайн]. [Полный текст].
Desideri G, Puig JG, Richette P. Управление гиперурикемией с отложением уратов. Curr Med Res Opin .2015 Сентябрь 31 Дополнение 2: 27-32. [Медлайн].
Менесес-Леон Дж., Денова-Гутьеррес Е., Кастаньон-Роблес С., Гранадос-Гарсия V, Талавера Дж. О., Ривера-Паредес Б. и др. Потребление подслащенных напитков и риск гиперурикемии у взрослых мексиканцев: кросс-секционное исследование. BMC Общественное здравоохранение . 2014 12 мая. 14: 445. [Медлайн].
2014 12 мая. 14: 445. [Медлайн].
Лю Л., Лу С., Сюй К., Мэн З., Чжан К., Сун К. Взаимосвязь между выбором образа жизни и гиперурикемией у китайских мужчин и женщин. Clin Rheumatol . 7 ноября 2012 г. [Medline].
Иоанну Г. Н., Бойко Э. Я. Влияние менопаузы и заместительной гормональной терапии на ассоциации гиперурикемии со смертностью. Атеросклероз . 22 октября 2012 г. [Medline].
Кубота М. Гиперурикемия у детей и подростков: современные знания и направления будущего. Дж Нутрь Метаб . 2019. 2019: 3480718. [Медлайн]. [Полный текст].
Ким С.И., Де Вера Массачусетс, Чой, Гонконг.Подагра и смертность. Clin Exp Rheumatol . 2008 сен-окт. 26 (5 Прил. 51): S115-9. [Медлайн].
Дин Х, Цзэн Ц., Вэй Дж, Ли Х, Ян Т., Чжан И и др. Связь уровня мочевой кислоты в сыворотке и гиперурикемии с остеоартритом коленного сустава. Ревматол Инт . 2016 7 января [Medline].
Ян Т., Дин Х, Ван ИЛ, Цзэн Ц., Вэй Дж, Ли Х и др. Связь между высокочувствительным С-реактивным белком и гиперурикемией. Ревматол Инт . 2016 г. 10 февраля [Medline].
Li M, Hou W, Zhang X, Hu L, Tang Z. Гиперурикемия и риск инсульта: систематический обзор и метаанализ проспективных исследований. Атеросклероз . 2014 Февраль 232 (2): 265-70. [Медлайн].
Li L, Yang C, Zhao Y, Zeng X, Liu F, Fu P. Является ли гиперурикемия независимым фактором риска нового хронического заболевания почек?: Систематический обзор и метаанализ, основанный на наблюдательных когортных исследованиях. БМК Нефрол . 2014 27 июля, 15:12 [Медлайн]. [Полный текст].
[Рекомендации] Eckel RH, Jakicic JM, Ard JD, de Jesus JM, et al. Руководство AHA / ACC 2013 г. по управлению образом жизни для снижения риска сердечно-сосудистых заболеваний: отчет Рабочей группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Тираж . 2014, 24 июня, 129 (25, приложение 2): S76-99. [Медлайн].
Becker MA, Schumacher HR, Espinoza LR, Wells AF, MacDonald P, Lloyd E, et al. Уратснижающая эффективность и безопасность фебуксостата при лечении гиперурикемии подагры: исследование CONFIRMS. Лечение артрита . 2010. 12 (2): R63. [Медлайн]. [Полный текст].
Frampton JE. Фебуксостат: обзор его использования при лечении гиперурикемии у пациентов с подагрой. Наркотики . 2015 Март 75 (4): 427-38. [Медлайн].
Зурампик (лесинурад) [вкладыш в упаковке]. Уилмингтон, Делавэр: AstraZeneca Pharmaceuticals. Декабрь 2015 г. Доступно в [Полный текст].
Диннел Дж., Мур Б.Л., Скивер Б.М., Бозе П. Расбуриказа в лечении лизиса опухоли: научно обоснованный обзор ее места в терапии. Ядро Эвид . 2015. 10: 23-38. [Медлайн]. [Полный текст].
Mena-Sánchez G, et al; Следователи ПРЕДИМЕД-ПЛЮС.Связь между потреблением молочных продуктов и гиперурикемией у пожилых людей с метаболическим синдромом. Нутр Метаб Кардиоваск Дис . 2020 10 февраля. 30 (2): 214-222. [Медлайн].
Zhang Y, Qiu H. Потребление фолиевой кислоты, витамина B6 и витамина B12 в связи с гиперурикемией. Дж. Клин Мед . 11 августа 2018 г. 7 (8): [Medline]. [Полный текст].
[Рекомендации] Фитцджеральд Дж. Д., Далбет Н., Микулс Т. и др. Руководство Американского колледжа ревматологии по лечению подагры, 2020 г. Центр лечения артрита (Хобокен) . 2020 июн.72 (6): 744-760. [Медлайн]. [Полный текст].
Maesaka JK, Fishbane S. Регулирование почечной экскреции уратов: критический обзор. Am J Почки почек . 1998 Декабрь 32 (6): 917-33. [Медлайн].
Бишт М, Бист СС. Фебуксостат: новое средство для лечения гиперурикемии при подагре. Индийский журнал J Pharm Sci . 2011 ноябрь 73 (6): 597-600. [Медлайн]. [Полный текст].
Schumacher HR Jr, Becker MA, Lloyd E, et al.Фебуксостат в лечении подагры: результаты 5-летнего исследования эффективности и безопасности FOCUS. Ревматология (Оксфорд) . 2009 Февраль 48 (2): 188-94. [Медлайн].
Schumacher HR Jr, Becker MA, Wortmann RL, et al. Эффекты фебуксостата по сравнению с аллопуринолом и плацебо в снижении уровня уратов в сыворотке у субъектов с гиперурикемией и подагрой: 28-недельное рандомизированное двойное слепое исследование в параллельных группах, фаза III. Rheum артрита . 2008 15 ноября. 59 (11): 1540-8. [Медлайн].
Беккер Г. Рекомендации CARI. Камни в почках: камни мочевой кислоты. Нефрология (Карлтон) . 2007, 12 февраля, приложение 1: S21-5. [Медлайн].
Iseki K, Ikemiya Y, Inoue T., Iseki C, Kinjo K, Takishita S. Значение гиперурикемии как фактора риска развития ESRD в когорте, прошедшей скрининг. Am J Почки почек . 2004 Октябрь, 44 (4): 642-50. [Медлайн].
Zhu Y, Pandya BJ, Choi HK. Распространенность подагры и гиперурикемии среди населения США в целом: Национальное обследование здоровья и питания 2007-2008 гг. Rheum артрита . 2011 Октябрь 63 (10): 3136-41. [Медлайн].
Гиперурикемия и болезнь почек
Когда мы мочимся, наши тела удаляют жидкие отходы, состоящие из воды и соли, а также химических веществ мочевины и мочевой кислоты. Большая часть мочевой кислоты вырабатывается в организме естественным путем; остальное превращается из веществ, содержащихся в определенных продуктах, называемых пуринами. Если уровень мочевой кислоты слишком высок, это может вызвать состояние, известное как гиперурикемия, фактор риска как подагры, так и заболевания почек.Взаимодействие с другими людьми
Уровни уратов в сыворотке
Большая часть мочевой кислоты растворяется в крови, затем попадает в почки и выводится с мочой. Обычно женщины поддерживают стабильный уровень уратов в сыворотке крови от 1,5 до 6,0 мг / дл, а у мужчин — от 2,5 до 7,0 мг / дл. Если вы производите слишком много мочевой кислоты или не можете вывести ее в достаточном количестве, вы можете имеют повышенный уровень уратов в сыворотке крови, который известен как гиперурикемия.
Анализ крови — это один из способов проверить уровень мочевой кислоты; его также можно проверить с помощью образца мочи.В идеале уровень мочевой кислоты в сыворотке должен составлять 6,0 мг / дл или ниже. Уровень мочевой кислоты 6,8 мг / дл или выше указывает на гиперурикемию.
Причины и факторы риска
Старение и мужское начало повышают риск развития гиперурикемии. Согласно исследованиям, проведенным в США и Новой Зеландии, люди африканского, маори или филиппинского происхождения подвержены более высокому риску, чем люди европейского происхождения. К другим факторам риска относятся:
- Почечная недостаточность
- Метаболический синдром — заболевание, которое включает ожирение, аномальное кровяное давление, дисгликемию (нарушение уровня сахара в крови), дислипидемию (нарушение липидов).
- Диета с высоким содержанием алкоголя, пуринов, белков и углеводов.
- Лекарства. , включая тиазиды, петлевые диуретики и низкие дозы аспирина
- Ниацин
- Ацидоз
- Химиотерапия
- Диабет
- Гипопаратиреоз
- Псориаз
- Отравление свинцом
- Истинная полицитемия
- Токсемия, связанная с беременностью
- Генетическая предрасположенность
Симптомы и осложнения
Хотя гиперурикемия сама по себе не является заболеванием и в некоторых случаях не вызывает никаких симптомов или проблем, длительное состояние этого состояния может привести к образованию кристаллов мочевой кислоты, что может быть проблематичным.
Двумя наиболее распространенными состояниями, которые могут возникнуть в результате высокого уровня мочевой кислоты, являются подагра и заболевание почек. При подагре кристаллы мочевой кислоты накапливаются в суставах, вызывая воспаление и разрушение суставного хряща. Симптомы включают боль, отек, покраснение, скованность, деформацию, воспаление и ограниченный диапазон движений.
Verywell / Эмили Робертс
Кристаллы мочевой кислоты также могут откладываться в почках, вызывая образование камней в почках и .Эти камни могут быть очень болезненными и, если их не лечить, могут блокировать мочевыводящие пути и вызывать инфекции. Симптомы камней в почках включают:
- Боль или ноющая боль в пояснице, боку, животе или паху
- Тошнота
- Повышенное позывание к мочеиспусканию
- Боль при мочеиспускании
- Затруднение при мочеиспускании
- Кровь в моче
- Зловонная или мутная моча
Камни в почках также могут вызывать инфекции мочевыводящих путей (ИМП), потому что они содержат бактерии.Симптомы ИМП могут включать любые или все из вышеперечисленных, а также потенциально лихорадку или озноб.
Со временем камни в почках и другие формы поражения почек могут привести к хроническому заболеванию почек , что затрудняет избавление от мочевой кислоты. Нелеченное заболевание почек может в конечном итоге привести к почечной недостаточности или потере функции почек.
Лечение
Если у вас нет симптомов, вам не обязательно требуется лечение гиперурикемии.При наличии симптомов диета с низким содержанием некоторых пуринов нерастительного происхождения может помочь регулировать уровень мочевой кислоты.
Повышенная мочевая кислота
Мясные субпродукты, мясные экстракты и подливы
Сардины, анчоусы, моллюски и тунец
Пиво и прочие алкогольные напитки
Сладкие продукты и напитки (например, газированные напитки), содержащие кукурузный сироп с высоким содержанием фруктозы
Снижение мочевой кислоты
Молоко и молочные продукты
Яйца
Салат, помидоры и зеленые овощи
Супы-пюре без мясного бульона
Арахисовое масло и орехи
Цитрусовые
Также важно пить много воды в день, чтобы почки вымывали мочевую кислоту.Некоторые исследования показывают, что регулярное употребление кофе может помочь предотвратить развитие подагры.
Когда изменения в рационе питания недостаточно контролируют гиперурикемию, ваш врач может назначить лекарства, чтобы контролировать уровень мочевой кислоты. Для большинства пациентов с подагрой предпочтение отдается уратоснижающей терапии. Варианты включают:
- Бенемид (пробенецид) — известный как урикозурический препарат, этот препарат увеличивает выведение мочевой кислоты с мочой.
- Зилоприн (аллопуринол), улорик (фебуксостат) — эти ингибиторы ксантиноксидазы (XOI) снижают выработку организмом мочевой кислоты.
- Зурампик (ленисурад) — прописан XOI для усиления его эффектов.
- Krystexxa (пеглотиказа) —Пеглотиказа вводится внутривенно. Он превращает мочевую кислоту в вещество под названием аллантоин, которое легко выводится из организма. Он предназначен для людей, у которых не помогли другие лекарства от подагры.
Слово Verywell
Важно знать свой уровень мочевой кислоты, так же как важно знать уровень холестерина или глюкозы в крови.Поговорите со своим врачом, если вы испытываете боль в суставах или частые инфекции мочевыводящих путей. Если у вас были приступы подагры, вам следует проверять уровень мочевой кислоты каждые шесть месяцев, чтобы убедиться, что он остается ниже 6,0 мг / дл.
Руководство по обсуждению подагрического доктора
Получите наше руководство для печати к следующему визиту к врачу, которое поможет вам задать правильные вопросы.
Отправить руководство по электронной почте
Отправить себе или любимому человеку.
Зарегистрироваться
Это руководство для обсуждения с доктором было отправлено на {{form.электронное письмо}}.
Произошла ошибка. Пожалуйста, попробуйте еще раз.
Диагностика и лечение подагры
ДЖОЕЛ Р. ПИТТМАН, ФАРМ. D., и МАЙКЛ Х. БРОСС, доктор медицины, Медицинский центр Университета Миссисипи, Джексон, Миссисипи
Am Fam Physician. , 1 апреля 1999; 59 (7): 1799-1806.
Доступна более свежая статья о подагре.
См. Соответствующий информационный бюллетень для пациентов по подагре, написанный авторами этой статьи.
Подагра — это заболевание, возникающее в результате отложения кристаллов уратов, вызванного чрезмерной выработкой или недостаточной экскрецией мочевой кислоты. Заболевание часто, но не всегда, связано с повышенным уровнем мочевой кислоты в сыворотке крови. Клинические проявления включают острый и хронический артрит, тофусы, интерстициальную болезнь почек и мочекислый нефролитиаз. Диагноз основывается на обнаружении кристаллов мочевой кислоты в суставах, тканях или биологических жидкостях. Цели лечения включают прекращение острого приступа, предотвращение повторных приступов и предотвращение осложнений, связанных с отложением кристаллов уратов в тканях.Фармакологическое лечение остается основой лечения. Острые приступы можно купировать с помощью нестероидных противовоспалительных средств, колхицина или внутрисуставных инъекций кортикостероидов. Пробенецид, сульфинпиразон и аллопуринол можно использовать для предотвращения повторных приступов. Ожирение, употребление алкоголя, определенные продукты и лекарства могут способствовать гиперурикемии. Эти потенциально усугубляющие факторы следует выявить и изменить.
Подагра — это заболевание, возникающее в результате отложения кристаллов мононатриевой соли урата в синовиальной жидкости и других тканях или образования камней мочевой кислоты в почках.Хотя распространенность подагры у мужчин и женщин одинакова, мужчины в шесть раз чаще имеют концентрацию мочевой кислоты в сыворотке выше 7 мг на дл (420 мкмоль на л). Подагра обычно возникает в среднем возрасте и редко встречается в возрасте до 30 лет. У женщин приступы подагрического артрита до наступления менопаузы редко возникают.1
Патогенез
Гиперурикемия определяется как концентрация мочевой кислоты в сыворотке выше 7 мг на дл (420 мкмоль на л). Эта концентрация также является пределом растворимости мононатрия урата в плазме.При уровнях 8 мг на дл (480 мкмоль на л) или выше мононатрий урат с большей вероятностью выпадет в осадок в тканях. При pH 7 более 90 процентов мочевой кислоты существует в виде урата натрия.
Мочевая кислота, конечный продукт метаболизма пуринов, является отходом, не имеющим физиологической роли. Людям не хватает уриказы — фермента, который расщепляет мочевую кислоту на более водорастворимый продукт (аллантоин), предотвращая накопление мочевой кислоты. Повышенная концентрация мочевой кислоты в сыворотке является результатом перепроизводства или недостаточной экскреции мочевой кислоты.У 90 процентов пациентов подагра вызвана недостаточной экскрецией мочевой кислоты.2
Хотя гиперурикемия является фактором риска развития подагры, точная взаимосвязь между гиперурикемией и острой подагрой неясна. Острый подагрический артрит может возникать при нормальной концентрации мочевой кислоты в сыворотке крови. И наоборот, у многих людей с гиперурикемией никогда не бывает приступа подагрического артрита.3
Гиперурикемия может иметь множество причин. Уровни мочевой кислоты в сыворотке повышаются при любом заболевании, которое приводит к пролиферации клеток или чрезмерному обмену нуклеопротеидов.Гиперурикемия также может возникать при снижении функции почек и при генетических нарушениях, которые увеличивают выработку или ограничивают выведение мочевой кислоты (таблица 1) .4 Некоторые лекарства повышают концентрацию мочевой кислоты в сыворотке за счет изменения отфильтрованной нагрузки мочевой кислоты или одного из трубчатые транспортные процессы.
Просмотреть / распечатать таблицу
ТАБЛИЦА 1
Классификация гиперурикемии
Избыточное производство уратов | ||||
Первичная идиопатическая гиперурикемия | ||||
Гемолитические процессы | ||||
Лимфопролиферативное заболевание | ||||
Миелопролиферативное заболевание 9666 66 9705 9667 96676 9705 9067 9667 Болезнь Педжета | ||||
Рабдомиолиз | ||||
Физические упражнения | ||||
Алкоголь | ||||
Ожирение 90 005 | ||||
Диета, богатая пуринами | ||||
Снижение экскреции мочевой кислоты | ||||
Первичная идиопатическая гиперурикемия | ||||
почечная недостаточность | ||||
Несахарный диабет | ||||
Гипертония | ||||
Ацидоз | ||||
Лактикоацидоз | 6 | Лактикоацидоз | 6 | |
Голодный кетоз | ||||
Бериллиоз | ||||
Саркоидоз | ||||
Свинцовая интоксикация | ||||
Гипотиреоз | ||||
Токсемия беременных | ||||
Синдром Барттера | ||||
70 | ||||
Диуретики | ||||
Спирт | ||||
Леводопа-карбидопа (Синемет) | ||||
Никотиновая кислота (ниацин; Nicolar) | ||||
Циклоспорин (Sandimmune) | ||||
Комбинированный механизм | ||||
Глюкозо-6-фосфатдегидрогеназа Дефицит фосфатдегидрогеназы 96675 | ||||
Алкоголь | ||||
Шок | ||||
ТАБЛИЦА 1
Классификация гиперурикемии
Гиперурикемия | Гиперпродукция гиперпродукции | ||||
Повышенная активность фосфорибозилпирофосфатсинтетазы | |||||
Гемолитические процессы | |||||
05 Лифопролиферативное заболевание 67 Миелопролиферативное заболевание | |||||
Истинная полицитемия | |||||
Псориаз (тяжелый) | |||||
Болезнь Педжета 55 | 5 | ||||
Ожирение | |||||
Пуриновая диета | |||||
Снижение экскреции мочевой кислоты | |||||
Первичная идиопатия | Поликистоз почек | ||||
Несахарный диабет | |||||
Гипертония | |||||
Ацидоз | |||||
Ацидоз | |||||
диабетический кетоацидоз | |||||
синдром Дауна | |||||
Голодание кетоза | |||||
Бериллиоз | |||||
саркоидоз | |||||
свинцовой интоксикации | |||||
Гиперпаратиреоз | |||||
Гипотиреоз | |||||
Токсемия беременных | |||||
Синдром Барттера | |||||
Диуретики | |||||
Спирт | |||||
Леводопа-карбидопа (Синемет670 | 90 | мбутол (миамбутол) | |||
Пиразинамид | |||||
Никотиновая кислота (ниацин; Nicolar) | |||||
Циклоспорин (Sandimmune) | |||||
Комбинированный механизм | |||||
Глюкозо-6-фосфатдегидрогеназа Дефицит фосфатдегидрогеназы 96675 | |||||
Алкоголь | |||||
Шок | |||||
Гиперурикемия связана с гипертриглицеридемией и сахарным диабетом 5, и может быть фактором риска развития коронарной болезни сердца.6 Подагра и ревматоидный артрит, по-видимому, не связаны. 7,8
ПЕРЕПРОИЗВОДСТВО МОЧНОЙ КИСЛОТЫ
Пурины, которые позже метаболизируются до мочевой кислоты, входят в общий метаболический путь, по которому вырабатывается либо нуклеиновая кислота, либо мочевая кислота. Считается, что нормальная выработка мочевой кислоты составляет 600 мг в сутки у мужчин с нормальной функцией почек, соблюдающих диету без пуринов. Избыточное производство мочевой кислоты может происходить из-за нарушения ферментов, регулирующих метаболизм пуринов. Задокументированы два таких отклонения.Повышение активности фосфорибозилпирофосфатсинтетазы приводит к увеличению синтеза мочевой кислоты. Дефицит гипоксантин-гуанинфосфорибозилтрансферазы также увеличивает уровень мочевой кислоты в сыворотке.9
Практический подход заключается в проведении суточного определения мочевой кислоты без ограничений в питании. Пациент, соблюдающий обычную диету, который выделяет более 800 мг мочевой кислоты за 24 часа, считается чрезмерно продуцируемым. 4
НЕДОПУСТИМОСТЬ МОЧЕВОЙ КИСЛОТЫ
Около двух третей-трех четвертей всей мочевой кислоты, производимой ежедневно, выводится почками.Желудочно-кишечный тракт устраняет остальные от одной трети до одной четверти. В нормальных условиях мочевая кислота фильтруется в клубочках почек, реабсорбируется в проксимальных канальцах и секретируется дистально. Тубулярная секреция почти полностью отвечает за выведение мочевой кислоты. Приблизительно у 98% пациентов с первичной гиперурикемией и подагрой почечная терапия мочевой кислотой неэффективна. 4
Клиническая картина
Начальные приступы подагры обычно моноартрические.Однако могут возникать и полиартрические приступы. Более 75 процентов острых приступов подагры поражают сустав нижней конечности, особенно первый плюснефаланговый сустав. Подагра, острый приступ подагры на большом пальце ноги, составляет более 50% всех острых приступов (рис. 1). Приблизительно от 85 до 90 процентов пациентов с подагрой на каком-то этапе болезни испытывают подагру.10
Пациенты с рецидивирующими приступами подагры имеют более длительную продолжительность заболевания и с большей вероятностью страдают полиартритом.Поражение суставов при полиартрических атаках имеет восходящий асимметричный характер. Помимо большого пальца ноги, поражаются и другие области, включая подъемы стопы, пятки, лодыжки, колени, пальцы, запястья и локти.
Просмотр / печать Рисунок
РИСУНОК 1.
Подагра: моноартикулярный артрит первого плюснефалангового сустава.
РИСУНОК 1.
Подагра: моноартикулярный артрит первого плюснефалангового сустава.
ОСТРЫЙ ПОГРИТНЫЙ АРТРИТ
Приступы острого подагрического артрита могут возникать без провокации или они могут быть спровоцированы рядом состояний, повышающих уровень мочевой кислоты (таблица 1) .4 Модифицируемые факторы риска приступов подагры включают потребление алкоголя, ожирение, гипертонию воздействие свинца на рабочем месте и в окружающей среде.11
Любое резкое изменение концентрации мочевой кислоты в сыворотке может спровоцировать острый приступ подагрического артрита. Колебания концентрации кислоты в сыворотке крови могут возникать у людей, соблюдающих голодание, чрезмерно употребляющих алкоголь или принимающих большое количество белков и богатых пуринами продуктов (например,г., бекон, лосось, сладкое, морской гребешок, индейка).
Основная жалоба, связанная с острым приступом подагры, — мучительная боль, сопровождающаяся признаками воспаления, включая опухоль, эритему, тепло и болезненность. Вместе с воспалением может возникнуть субфебрильная температура. Острые приступы обычно достигают пика в течение одного-двух дней после появления симптомов. Приступы без лечения могут длиться от семи до 10 дней.
Приступы обычно начинаются в ночное время, и сначала отмечается умеренная боль в суставе.Боль постоянно усиливается и имеет продолжительный гнойный характер. Суставы большого пальца стопы и других частей нижней конечности, как правило, поражаются в первую очередь. Эти суставы часто подвергаются атакам из-за более низкой температуры тела и пониженной растворимости мононатриевого урата. Травма нижней конечности также может привести к приступу. Травма, вызванная тяжелыми суставами в результате повседневной деятельности, вызывает синовиальный выпот в дневное время. Ночью вода реабсорбируется из суставных щелей, оставляя перенасыщенную концентрацию урата натрия.
Боль и воспаление возникают, когда кристаллы мочевой кислоты активируют гуморальные и клеточные воспалительные процессы.12 Поскольку острый приступ начинается внезапно, опухоль, эритема и болезненность в суставе могут быть ошибочно диагностированы как септический артрит или целлюлит.13
ИНТЕРВАЛЬНАЯ ПОДАГА
Интервальная или интеркритическая подагра — это состояние, которое возникает после того, как острый приступ разрешился и у пациента исчезли симптомы. На этом этапе врач обычно решает, начинать ли профилактическую гиперурикемическую терапию.Как правило, следует лечить пациентов с гиперурикемией и рецидивирующими приступами, хронической подагрой, тофусами, подагрическим артритом или нефролитиазом. Некоторые исследователи утверждают, что первый приступ острого подагрического артрита является основанием для начала лечения гиперурикемии. Другие утверждают, что первый приступ легко поддается лечению, и рекомендуют воздерживаться от профилактической терапии до тех пор, пока не возникнут новые приступы. 14,15
ТОФАЦЕВАЯ ПОГАГА
Tophi представляют собой узелковые массы кристаллов мононатрия урата, откладывающиеся в мягких тканях тела.Они являются поздним осложнением гиперурикемии. В редких случаях тофусы могут развиться без предшествующего острого подагрического артрита.16 Наиболее частыми местами отложения уратов являются основание большого пальца стопы, а также пальцы, запястье, кисть, локтевая сумка и ахиллово сухожилие (рисунки 2 и 3). Тофусы возникают в среднем примерно через 12 лет после первоначального приступа (зарегистрированный диапазон: от трех до 42 лет после начальных симптомов) .2 Осложнения тофусов включают боль, повреждение и деформацию мягких тканей, разрушение суставов и синдромы сдавления нервов, такие как синдром запястного канала .
Просмотреть / распечатать рисунок
РИСУНОК 2.
Хроническая тофагеозная подагра с подкожными тофусами, вызывающими костную деформацию рук пациента на Рисунке 1.
РИСУНОК 2.
Хроническая подагра тофагеозная подагра с подкожными тофусами, вызывающими костную деформацию рук пациента на рисунке 1.
Просмотр / печать Рисунок
РИСУНОК 3.
Хроническая тофусная подагра с подкожными тофами, вызывающими костную деформацию колени.
РИСУНОК 3.
Хроническая тофагеозная подагра с подкожными тофусами, вызывающими костную деформацию колен.
ПОЧЕЧНЫЕ ПРОЯВЛЕНИЯ
Три почечных осложнения подагры — это нефролитиаз, острая и хроническая подагрическая нефропатия. Нефролитиаз встречается примерно у 10-25 процентов пациентов с первичной подагрой.17 Растворимость кристаллов мочевой кислоты увеличивается по мере того, как pH мочи становится более щелочным. Кислая моча, насыщенная кристаллами мочевой кислоты, может вызвать спонтанное камнеобразование.Могут развиваться и другие типы камней, потому что мочевая кислота может выступать в качестве очага для оксалатных или фосфатных камней кальция.
Острая подагрическая нефропатия обычно возникает в результате массового обмена злокачественных клеток, возникающего при лечении миелопролиферативных или лимфопролиферативных заболеваний. Блокировка потока мочи из-за осаждения мочевой кислоты в собирательных протоках и мочеточниках может привести к острой почечной недостаточности.
Длительное отложение кристаллов в паренхиме почек может вызвать хроническую уратную нефропатию.Образование микротофов вызывает гигантоклеточную воспалительную реакцию. Это приводит к протеинурии и неспособности почек концентрировать мочу.2
Диагностическая оценка
Поскольку пациенты с подагрой обычно имеют гипертонию и нарушение функции почек, необходимо обследование почечной и сердечно-сосудистой систем. Базовые лабораторные тесты должны включать в себя полный подсчет клеток крови, анализ мочи, креатинин сыворотки, азот мочевины крови и мочевую кислоту в сыворотке.
Рентгенография не очень полезна при диагностике начальных приступов острого подагрического артрита. Рентгенологические находки обычно неспецифичны и состоят из опухоли мягких тканей вокруг сустава. Костные аномалии указывают на наличие хронической подагры. Как правило, подагру необходимо не лечить или лечить неадекватно в течение примерно 12 лет, прежде чем на рентгенограммах будут видны хронический артрит и эрозии костей. Классические рентгенологические признаки подагры включают тофусы, выступающий край коры и «выбитую» эрозию кости со склеротическими границами18 (Рисунок 4).Минерализация в норме, суставные щели сохранены. Распространение включает ступни, лодыжки, колени, руки и локти.
Просмотр / печать Рисунок
РИСУНОК 4.
Рентгенограмма, показывающая резко «выбитые» костные дефекты дистального отдела лучевой кости и проксимальной фаланги среднего пальца.
РИСУНОК 4.
Рентгенограмма, показывающая резко «выбитые» костные дефекты дистального отдела лучевой кости и проксимального отдела фаланги среднего пальца.
Магнитно-резонансная томография (МРТ) обычно не используется при оценке подагры. В редких случаях подагрический тофус может имитировать инфекционный или неопластический процесс. В этом случае необходима оценка МРТ. Точечная подагра должна рассматриваться, когда новообразование демонстрирует неоднородно низкую или среднюю интенсивность сигнала, особенно если в соседней кости наблюдаются эрозивные изменения или поражены другие суставы.19
Диагноз подагры подтверждается наличием полиморфно-ядерных лейкоцитов и внутриклеточных кристаллов мононатрий урата в синовиальная жидкость аспирирована из воспаленного сустава (рис. 5).Кристаллы мононатрия урата, наблюдаемые с помощью микроскопии в поляризованном свете, имеют игольчатую форму и обладают отрицательным двойным лучепреломлением (рис. 6). Исследование аспирированной суставной жидкости также может исключить другие заболевания, имитирующие подагру, такие как септический артрит и псевдоподагра. Иногда у пациентов с подагрой могут отсутствовать кристаллы мочевой кислоты в аспирате синовиальной жидкости. Однако повторная аспирация через пять часов или один день показывает кристаллы в синовиальной жидкости у большинства этих пациентов.20,21
Просмотр / печать Рисунок
РИСУНОК 5.
Кристаллы мононатрия урата из тофуса, наблюдаемые с помощью микроскопии в поляризованном свете.
РИСУНОК 5.
Кристаллы мононатрия урата из тофуса, наблюдаемые с помощью микроскопии в поляризованном свете.
Просмотр / печать Рисунок
РИСУНОК 6.
Внутриклеточный кристалл мононатрия урата из синовиальной жидкости, наблюдаемый с помощью микроскопии в поляризованном свете.
РИСУНОК 6.
Внутриклеточный кристалл мононатрия урата из синовиальной жидкости, наблюдаемый с помощью микроскопии в поляризованном свете.
Лечение
Концентрация мочевой кислоты в сыворотке крови может быть снижена нефармакологической терапией. Полезные изменения в питании и образе жизни включают снижение веса, уменьшение употребления алкоголя, снижение потребления продуктов с высоким содержанием пуринов и контроль гиперлипидемии и гипертонии. Однако, если они используются сами по себе, эти меры, вероятно, не снизят уровень мочевой кислоты в сыворотке до нормального, что является целью лечения для предотвращения острых приступов подагры. Симптоматическая гиперурикемия обычно требует приема лекарств.
ОСТРЫЙ ПОХОДНЫЙ АРТРИТ
В настоящее время для лечения острого приступа подагрического артрита доступны три метода лечения: нестероидные противовоспалительные препараты (НПВП), колхицин и кортикостероиды.
НПВП. Эти препараты быстрого действия в настоящее время являются наиболее предпочтительным средством лечения острых приступов подагры. Индометацин (индоцин) обычно является препаратом выбора, но можно использовать и другие НПВП (таблица 2). В одном исследовании сообщалось о достижении облегчения боли у пациентов, поступивших в отделение неотложной помощи с острым подагрическим артритом, которые лечились внутримышечной инъекцией 60 мг кеторолака (торадола).22
Просмотр / печать таблицы
ТАБЛИЦА 2
Лечение подагры выбранными нестероидными противовоспалительными препаратами *
| Лекарство | Дозировка | Стоимость в день † |
|---|---|---|
oc Индометацин oc | 50 мг три раза в день | 2,75 доллара (от 0,50 до 1,00) |
Напроксен натрия (Анапрокс) | 825 мг один раз, затем 275 мг каждые 8 часов | |
Сулиндак (клинорил) | 200 мг два раза в день | 2,50 (2,00) |
ТАБЛИЦА 2
Лечение подагреганами Нестероидными препаратами *
| Лекарство | Дозировка | Стоимость в день † |
|---|---|---|
Индометацин (Индоцин) | 50 мг трижды в день | $ 2.75 (от 0,50 до 1,00) |
Напроксен натрия (Анапрокс) | 825 мг один раз, затем 275 мг каждые 8 часов | 4,00 (3,50) в первый день; 2,50 (от 2,00 до 2,50 после этого) |
Сулиндак (клинорил) | 200 мг два раза в день | 2,50 (2,00) |
Все НПВП могут иметь серьезные побочные эффекты со стороны желудочно-кишечного тракта и желудочно-кишечного тракта. изъязвление.Поэтому эти препараты следует применять с осторожностью пациентам с язвенной болезнью в анамнезе, застойной сердечной недостаточностью или хронической почечной недостаточностью. Следует проявлять осторожность при назначении НПВП пациентам с аллергией на аспирин, астмой или полипами носа.
Колхицин. Это средство является эффективной альтернативой НПВП при лечении острого подагрического артрита. Колхицин наиболее эффективен, когда его вводят в первые 12–36 часов после приступа. Он, по-видимому, проявляет свой эффект, подавляя фагоцитоз мочевой кислоты и блокируя высвобождение хемотаксического фактора.Колхицин обладает противовоспалительным действием, но не обладает обезболивающим действием.
Колхицин можно вводить перорально или парентерально. При пероральном приеме сначала принимают две таблетки по 0,5 или 0,6 мг. Затем принимают по одной таблетке каждый час до исчезновения симптомов со стороны суставов, развития побочных эффектов со стороны желудочно-кишечного тракта (тошнота, рвота и диарея) или всего 5-7 мг. Колхицин можно вводить внутривенно в дозах 1 мг (не более 4 мг в день), если пероральный путь недоступен или следует избегать побочных эффектов со стороны желудочно-кишечного тракта.Внутривенное введение было связано с повышенным риском токсических побочных эффектов, включая подавление костного мозга и повреждение клеток почек или печени.
Кортикостероиды. Монартрическая подагра хорошо реагирует на кортикостероиды, вводимые внутрисуставными инъекциями. Системные кортикостероиды (например, преднизон [дельтазон] в дозировке от 20 до 30 мг в день) используются только тогда, когда НПВП и колхицин не эффективны или противопоказаны.
ПРЕДОТВРАЩЕНИЕ РЕАКТИВНЫХ АТАК
Гиперурикемическую терапию следует начинать у пациентов с частыми приступами подагры, тофусами или уратной нефропатией.Низкая дозировка НПВП или колхицина эффективна для предотвращения острых приступов подагры. Гиперурикемическую лекарственную терапию не следует начинать до окончания острого приступа подагрического артрита из-за риска повышенной мобилизации запасов мочевой кислоты. Разумная цель — снизить концентрацию мочевой кислоты в сыворотке до менее 6 мг на дл (360 мкмоль на л).
Урикозурические препараты. Эти агенты снижают уровень мочевой кислоты в сыворотке за счет увеличения почечной экскреции. Пробенецид (Бенемид) и сульфинпиразон (Антуран) используются у пациентов, которые считаются недовыводящими мочевую кислоту.Урикозурические препараты не следует назначать пациентам с диурезом менее 1 мл в минуту, клиренсом креатинина менее 50 мл в минуту (0,84 мл в секунду) или с наличием в анамнезе почечных камней. Физиологическое снижение функции почек, которое происходит с возрастом, часто ограничивает использование урикозурических средств.
Пробенецид в дозировке от 1 до 2 г в день обеспечивает удовлетворительный контроль у 60-85 процентов пациентов.23 Важно отметить, что препарат также блокирует канальцевую секрецию других органических кислот.Это может привести к увеличению плазменной концентрации пенициллинов, цефалоспоринов, сульфаниламидов и индометацина.
Сульфинпиразон — это урикозурический агент, родственный фенилбутазону. Поскольку он может действовать как антитромбоцитарный препарат, его следует с осторожностью применять у пациентов, принимающих антикоагулянты или имеющих проблемы с кровотечением. Сульфинпиразон также может вызывать проблемы с желудочно-кишечным трактом. Таким образом, следует соблюдать осторожность при назначении этого препарата пациентам с язвенной болезнью.
Аллопуринол.Как ингибитор ксантиноксидазы, аллопуринол (зилоприм) ухудшает превращение гипоксантина в ксантин и превращение ксантина в мочевую кислоту. Действие препарата зависит от дозировки. Сообщалось, что аллопуринол в дозировке 300 мг в день снижает концентрацию уратов в сыворотке до менее 7 мг на дл (420 мкмоль на л) у 70 процентов пациентов24. отложений и у пациентов с нарушением функции почек в анамнезе (клиренс креатинина менее 50 мл в минуту [0.84 мл в секунду]), нефропатии мочевой кислоты или нефролитиаза. Препарат также предпочтителен в качестве средства предварительной обработки для защиты от нефропатии мочевой кислоты у пациентов с лимфопролиферативными или миелопролиферативными расстройствами.
Побочные эффекты аллопуринола включают кожную сыпь (например, синдром Стивенса-Джонсона и токсический эпидермальный некролиз), лейкопению и желудочно-кишечные расстройства. Начало терапии аллопуринолом также может спровоцировать острый приступ подагры. Дозировку аллопуринола следует корректировать у пациентов с почечной недостаточностью.
Подагра | Артрит | CDC
Что такое подагра?
Подагра — это распространенная форма воспалительного артрита, которая очень болезненна. Обычно это поражает один сустав (часто сустав большого пальца ноги). Бывают периоды, когда симптомы ухудшаются, известные как обострения, и периоды, когда симптомы отсутствуют, так называемая ремиссия. Повторные приступы подагры могут привести к подагрическому артриту, обостряющейся форме артрита.
От подагры нет лекарства, но вы можете эффективно лечить и контролировать ее с помощью лекарств и стратегий самоконтроля.
Каковы признаки и симптомы подагры?
Обострения подагры начинаются внезапно и могут длиться дни или недели. За этими обострениями следуют длительные периоды ремиссии — недели, месяцы или годы — без симптомов, прежде чем начнется новое обострение. Подагра обычно возникает только в одном суставе за раз. Часто встречается на большом пальце ноги. Наряду с большим пальцем ноги, суставами, которые обычно поражаются, являются суставы малого пальца стопы, голеностопный сустав и колено.
Симптомы пораженного сустава (суставов) могут включать:
- Боль, обычно сильная
- Набухание
- Покраснение
- Тепло
Начало страницы
Что вызывает подагру?
Подагра вызывается состоянием, известным как гиперурикемия, при котором в организме слишком много мочевой кислоты.Организм вырабатывает мочевую кислоту, когда расщепляет пурины, которые содержатся в вашем теле и в продуктах, которые вы едите. Когда в организме слишком много мочевой кислоты, кристаллы мочевой кислоты (мононатрий урат) могут накапливаться в суставах, жидкостях и тканях организма. Гиперурикемия не всегда вызывает подагру, и гиперурикемия без симптомов подагры не требует лечения.
Начало страницы
Что увеличивает ваши шансы на подагру?
Следующие факторы повышают вероятность развития гиперурикемии, которая вызывает подагру:
- Мужчина
- Ожирение
- Имеющие определенные заболевания, в том числе:
- Застойная сердечная недостаточность
- Гипертония (повышенное артериальное давление)
- Инсулинорезистентность
- Метаболический синдром
- Диабет
- Нарушение функции почек
- Принимает определенные лекарства, например диуретики (водяные таблетки).
- Распитие спиртных напитков. Риск подагры возрастает с увеличением потребления алкоголя.
- Прием пищи и напитков с высоким содержанием фруктозы (разновидность сахара).
- Диета с высоким содержанием пуринов, которые в организме расщепляются на мочевую кислоту. Продукты, богатые пуринами, включают красное мясо, субпродукты и некоторые виды морепродуктов, такие как анчоусы, сардины, мидии, гребешки, форель и тунец.
Начало страницы
Как диагностируется подагра?
Врач диагностирует подагру, оценивая ваши симптомы и результаты вашего физического осмотра, рентгеновских снимков и лабораторных тестов.Подагра может быть диагностирована только во время обострения, когда сустав горячий, опухший и болезненный, и когда лабораторный анализ обнаруживает кристаллы мочевой кислоты в пораженном суставе.
Начало страницы
Кому следует диагностировать и лечить подагру?
Заболевание должен диагностировать и лечить врач или группа врачей, специализирующихся на лечении пациентов с подагрой. Это важно, потому что признаки и симптомы подагры неспецифичны и могут выглядеть как признаки и симптомы других воспалительных заболеваний.Врачи, специализирующиеся на подагре и других формах артрита, называются ревматологами. Чтобы найти ближайшего к вам поставщика услуг, посетите базу данных ревматологов на веб-сайте Американского колледжа ревматологии. После того, как ревматолог диагностирует и эффективно вылечит вашу подагру, поставщик первичной медико-санитарной помощи обычно может отследить ваше состояние и помочь вам справиться с подагрой.
Начало страницы
Как лечится подагра?
Подагра можно эффективно лечить и контролировать с помощью медикаментозного лечения и стратегий самолечения.Ваш лечащий врач может порекомендовать план лечения по телефону
.
- Избавьтесь от боли при обострении. Для лечения обострений используются нестероидные противовоспалительные препараты (НПВП), такие как ибупрофен, стероиды и противовоспалительный препарат колхицин.
- Предотвратить будущие вспышки. Внесение изменений в свой рацион и образ жизни, например снижение веса, ограничение употребления алкоголя, употребление менее богатой пуринами пищи (например, красного мяса или субпродуктов), может помочь предотвратить будущие приступы.Также может помочь смена или прекращение приема лекарств, связанных с гиперурикемией (например, диуретиков).
- Предотвращает образование тофусов и камней в почках от образования в результате хронического высокого уровня мочевой кислоты. Тофусы — это твердые отложения мочевой кислоты под кожей. Людям с частыми обострениями или хронической подагрой врачи могут порекомендовать профилактическую терапию для снижения уровня мочевой кислоты в крови с использованием таких препаратов, как аллопуринол, фебуксостат и пеглотиказа.
Помимо лечения, вы можете управлять подагрой с помощью стратегий самоконтроля.Самоуправление — это то, что вы делаете изо дня в день, чтобы управлять своим состоянием и оставаться здоровым, например, при выборе здорового образа жизни. Доказано, что описанные ниже стратегии самоконтроля уменьшают боль и инвалидность, поэтому вы можете заниматься важной для вас деятельностью.
Начало страницы
Как я могу справиться с подагрой и улучшить качество своей жизни?
Подагра влияет на многие аспекты повседневной жизни, включая работу и досуг. К счастью, существует множество недорогих стратегий самоконтроля, которые, как доказано, улучшают качество жизни людей с подагрой.
В частности, при подагре:
- Придерживайтесь здоровой диеты. Избегайте продуктов, которые могут вызвать обострение подагры, включая продукты с высоким содержанием пуринов (например, диета, богатая красным мясом, мясом субпродуктов и морепродуктами), и ограничьте потребление алкоголя (особенно пива и крепких напитков).
Программа лечения артрита CDC рекомендует пять стратегий самоконтроля для лечения артрита и его симптомов. Они также могут помочь при подагре.
- Изучите навыки самоуправления. Присоединяйтесь к учебному классу по самоуправлению, который помогает людям с артритом и другими хроническими заболеваниями, включая подагру, понять, как артрит влияет на их жизнь, и повысить их уверенность в том, что они контролируют свои симптомы и живут хорошо. Узнайте больше об образовательных программах по самоуправлению, рекомендованных CDC.
- Станьте физически активными. Эксперты рекомендуют взрослым уделять хотя бы умеренной физической активности 150 минут в неделю. Каждая минута активности на счету, и любая активность лучше, чем ничего.Рекомендуются умеренные занятия с низким уровнем воздействия, включая ходьбу, плавание или езду на велосипеде. Регулярная физическая активность также может снизить риск развития других хронических заболеваний, таких как сердечные заболевания, инсульт и диабет. Узнайте больше о физической активности при артрите.
- Перейти к эффективным программам физической активности. Для людей, которые беспокоятся о том, что физическая активность может усугубить артрит, или не знают, как безопасно заниматься спортом, участие в программах физической активности может помочь уменьшить боль и инвалидность, связанную с артритом, а также улучшить настроение и способность двигаться.Занятия проходят в местных школах, парках и общественных центрах. Эти занятия могут помочь людям с артритом почувствовать себя лучше. Узнайте больше о программах физической активности, рекомендованных CDC.
- Поговорите со своим врачом. Вы можете играть активную роль в борьбе с артритом, регулярно посещая врача и следуя рекомендованному плану лечения. Это особенно важно, если у вас есть и другие хронические заболевания, например диабет или болезни сердца.
- Похудеть. Для людей с избыточным весом или ожирением потеря веса снижает нагрузку на суставы, особенно на суставы, несущие нагрузку, такие как бедра и колени. Достижение или поддержание здорового веса может облегчить боль, улучшить функции и замедлить прогрессирование артрита.
- Защитите суставы. Травмы суставов могут вызвать или усугубить артрит. Выбирайте занятия, которые не влияют на суставы, например ходьбу, езду на велосипеде и плавание. Эти упражнения с малой ударной нагрузкой имеют низкий риск травм, не перекручивают и не нагружают суставы.Узнайте больше о том, как безопасно тренироваться при артрите.
Подробнее о подагре
Узнать больше об артрите
Настоящие знания и направления на будущее
Последние данные свидетельствуют о том, что гиперурикемия является важным заболеванием у детей и подростков, особенно в связи с неинфекционными заболеваниями. Этот обзор призван обобщить наше текущее понимание этого состояния у педиатрических пациентов. Анализ референсных значений мочевой кислоты в сыворотке крови здорового населения показывает, что они постепенно увеличиваются с возрастом до подросткового возраста, причем различия между полами возникают примерно в 12-летнем возрасте.Эту информацию следует принимать во внимание при определении гиперурикемии в исследованиях. Подагра крайне редко встречается у детей и подростков, и большинство пациентов с подагрой имеют какое-либо основное заболевание. Основными причинами гиперурикемии являются хронические состояния, включая синдром Дауна, метаболические или генетические заболевания и врожденные пороки сердца, а также острые состояния, включая гастроэнтерит, бронхиальную астму (гипоксию), злокачественные заболевания и побочные эффекты лекарств. Обсуждаются механизмы, лежащие в основе ассоциации между этими заболеваниями и гиперурикемией, а также недавняя генетическая информация.Ожирение является основной причиной гиперурикемии у здоровых детей и подростков. Ожирение часто сопровождается метаболическим синдромом; гиперурикемия у детей и подростков с ожирением связана с компонентами метаболического синдрома и неинфекционных заболеваний, включая гипертензию, инсулинорезистентность, дислипидемию и хроническое заболевание почек. Наконец, представлены стратегии лечения гиперурикемии, включая изменение образа жизни и прием лекарств.
1.Введение
Гиперурикемия — это лабораторное отклонение, часто наблюдаемое у детей и подростков. Однако из-за низкой диагностической ценности одной только мочевой кислоты в сыворотке (далее именуемой «мочевая кислота») педиатры не могут адекватно учитывать уровни мочевой кислоты. Больше внимания на гиперурикемию у детей и подростков привлекло несколько недавних исследований, в которых сообщается о ее связи с ожирением и неинфекционными заболеваниями (НИЗ), особенно с сердечно-сосудистыми расстройствами.При поиске в литературе было найдено только два обзора гиперурикемии у детей и подростков [1, 2]. Хотя эти обзоры являются исчерпывающими и хорошо обобщенными, у них есть два основных недостатка. Во-первых, они не рассматривают адекватно связь между гиперурикемией и НИЗ. Во-вторых, недавние результаты генетических исследований гиперурикемии полностью не обсуждаются. Таким образом, данный обзор направлен на освещение этих тем и предлагает будущие направления исследований гиперурикемии у детей и подростков.
2. База данных
Статьи, опубликованные с 2000 по 2018 год, были найдены при поиске в Medline и Web of Science. Методология поиска состояла из контролируемого словаря, как в Национальной медицинской библиотеке MeSH, и ключевых слов мочевая кислота / гиперурикемия и ребенок / подросток. Обзоры и отчеты о случаях, опубликованные до 2000 г., включены, если они считаются особо важными.
3. Контрольные значения мочевой кислоты у детей и подростков
У взрослых мочевая кислота в сыворотке> 7.0 мг / дл широко используется в качестве определения гиперурикемии, учитывая растворимость мочевой кислоты [3, 4]. Однако уровень мочевой кислоты у детей и подростков меняется в процессе развития. Следовательно, для определения гиперурикемии у детей и подростков следует учитывать контрольные значения мочевой кислоты, связанные с возрастом и полом. Обобщая предыдущие отчеты, были идентифицированы следующие изменения уровней мочевой кислоты, хотя абсолютные значения мочевой кислоты незначительно отличаются от отчета к отчету [1, 5-7].Уровень мочевой кислоты постепенно увеличивается от рождения до конца начальной школы. Впоследствии уровни резко повышаются у мужчин и немного у женщин, создавая значительную разницу между полами. Для справки, данные двух исследований [1, 6] представлены в таблице 1.
4. Состояния, вызывающие гиперурикемию4.1. ПодаграМасштабные эпидемиологические исследования подагры у детей и подростков весьма ограничены.В исследовании с использованием данных Исследовательской базы данных общей практики Великобритании (1990–1999) Mikuls et al. сообщают, что заболеваемость подагрой у лиц младше 25 лет составляла 12 на 255 950 мужчин и 1 на 246 346 женщин [8]. В период с 2007 по 2015 год в Корее заболеваемость составляла от 2 до 3 на 100 000 человек в возрасте 0–9 лет и от 9 до 20 на 100 000 человек в возрасте 10–19 лет [9]. Наш общенациональный анкетный опрос педиатрических отделений выявил только семь случаев подагры у более чем 2 300 000 стационарных и амбулаторных пациентов в возрасте до 15 лет [10].Было обнаружено, что все пациенты с подагрой в нашем исследовании имели по крайней мере одно основное заболевание. Предыдущие сообщения о случаях показали, что подагра у детей и подростков была связана с сопутствующими заболеваниями, такими как синдром Дауна [11], болезнь накопления гликогена [12], трансплантация почки [13], лейкемия [14] и метилмалоновая ацидемия [15] (таблица 2).
4.2. Хронические заболевания4.2.1. Метаболические заболеванияБыло показано, что нарушения метаболизма пурина или родственных соединений вызывают гиперурикемию в младенчестве или детстве [16, 17]. Эти отклонения включают полный дефицит гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT) (синдром Леша-Найхана), частичный дефицит HGPRT (синдром Келли-Сигмиллера), дефицит аденинфосфорибозилтрансферазы (APRT), дефицит фосфорибозилпирофосфата и дефицит синтетической фосфорибозилпирофосфата (PRPPPP). .Наиболее частой причиной гиперурикемии является гиперпродукция мочевой кислоты [1, 17]. У некоторых пациентов с синдромом Леша – Найхана, синдромом Келли – Сигмиллера или гиперактивностью PRPP-синтетазы подагра проявляется в раннем детстве или подростковом возрасте [1]. Болезни накопления гликогена, особенно типы I, III, V и VII, также вызывают гиперурикемию. Считается, что напряжение мышц при этих заболеваниях приводит к ускоренной деградации пуриновых нуклеотидов в мышцах [1]. 4.2.2. Синдром ДаунаСиндром Дауна, наблюдаемый примерно в одном случае на 800–1000 живорождений, является наиболее распространенной хромосомной аномалией.Связь между синдромом Дауна и гиперурикемией была описана довольно рано [18]. С тех пор несколько сообщений указали на более высокую распространенность гиперурикемии у пациентов с синдромом Дауна [19, 20]. В частности, Kashima et al. сообщают, что гиперурикемия при синдроме Дауна возникает в раннем младенчестве, согласно их возрастным контрольным значениям [20]. Предполагается, что основной причиной этой связи являются повышенные уровни ферментов, метаболизирующих пурины [21], и факторы, связанные с образом жизни, такие как ожирение или низкая физическая активность [20].Недавно Garlet et al. представили гипотезу о том, что повышенный уровень мочевой кислоты является компенсаторной реакцией на окислительно-восстановительный дисбаланс, сопровождающий синдром Дауна [22]. 4.2.3. Врожденные пороки сердцаВрожденные пороки сердца, особенно цианотические пороки сердца, часто связаны с гиперурикемией [6, 23]. Полицитемия, хроническая гипоксия и, как следствие, повышенный катаболизм пуринов, как предполагается, являются основными патогенетическими механизмами, лежащими в основе этой ассоциации [1].Родригес-Хемандес и др. недавно постулировали, что ИМТ, нарушение функции почек, цианоз и применение диуретиков являются факторами риска гиперурикемии у пациентов с врожденными пороками сердца [24]. 4.2.4. Генетические заболеванияСемейная ювенильная гиперурикемическая нефропатия (FJHN) характеризуется ювенильным началом гиперурикемии, подагры и прогрессирующей нефропатии [25]. Hart et al. впервые определили, что мутация в гене уромодулина ответственна за FJHN [26]. Полногеномное ассоциативное исследование показало, что однонуклеотидные полиморфизмы в генах переносчиков мочевой кислоты (ABCG2 и SLC2A9) вызывают гиперурикемию и подагру, изменяя клиренс мочевой кислоты с мочой [27].Полиморфизм гена аполипопротеина E также связан с первичной гиперурикемией, как было идентифицировано Wu et al. в китайской педиатрической популяции из 770 человек [28]. 4.3. Острые заболевания4.3.1. ГастроэнтеритНаше исследование состояний, связанных с гиперурикемией у более чем 9000 педиатрических стационарных пациентов, показало, что гастроэнтерит является наиболее распространенным заболеванием [6]. Из возбудителей гастроэнтерита ротавирусная инфекция чаще всего вызывает гиперурикемию [29, 30].Обезвоживание — предполагаемая причина гиперурикемии при гастроэнтерите; Уровни мочевой кислоты быстро возвращаются к нормальным уровням после гидратационной терапии без использования антигиперурикемических препаратов. Кроме того, Matsuo et al. предполагают дополнительный возможный механизм, включающий снижение экскреции кишечной мочевой кислоты через ABCG2, вызванное гастроэнтеритом повреждением кишечного эпителия [31]. 4.3.2. Бронхиальная астма (гипоксия)Бронхиальная астма, особенно во время острого приступа, является частой причиной гиперурикемии у педиатрических пациентов [6].Абдулнаби и др. продемонстрировали, что степень повышения уровня мочевой кислоты в сыворотке может служить полезным маркером тяжести бронхиальной астмы [32]. Гипоксия и обезвоживание считаются возможными первопричинами гиперурикемии при бронхиальной астме. При исследовании нарушений дыхания во время сна у детей и подростков с ожирением было обнаружено, что степень насыщения артериальной крови кислородом коррелирует с уровнем мочевой кислоты [33]. 4.3.3. Злокачественные и гематологические заболеванияПациенты педиатрического профиля со злокачественными заболеваниями, особенно с гематологическими заболеваниями, такими как лейкемия и лимфома, подвержены риску гиперурикемии [34, 35].Этот риск может быть частично связан с большой опухолевой массой в начальной стадии злокачественных новообразований у детей [35]. Кроме того, более высокая чувствительность детей к химиотерапевтическим средствам подвергает их большему риску развития синдрома лизиса опухоли (TLS), чем взрослых пациентов [36]. Гемолитическая анемия, такая как гемолитико-уремический синдром [37] и серповидно-клеточная анемия [38], вызывает гиперурикемию. Повышенная деструкция эритроцитов и гиперлактацидемия могут играть роль в возникновении гиперурикемии. Примечательно, что уровень мочевой кислоты иногда превышал 20 мг / дл, что требовало перитонеального диализа у пациентов с гемолитико-уремическим синдромом [37]. 4.3.4. Побочные эффекты лекарствСообщалось, что некоторые лекарственные средства, такие как диуретики (тиазид), противосудорожные средства (вальпроат и фенобарбитал), циклоспорин, теофиллин и пиразинамид, повышают уровень мочевой кислоты у детей и подростков [1, 13, 39–41]. Хотя основные причины до конца не изучены, постулируется реабсорбция мочевой кислоты в почечных канальцах, дегидратация и повышенный катаболизм пуринов [1, 42]. 4.4. Расстройства, связанные с образом жизни4.4.1. ОжирениеОжирение у детей и подростков — глобальная проблема, наблюдаемая как в развитых, так и в развивающихся странах [43, 44]. Результаты крупномасштабных исследований распространенности гиперурикемии среди детей и подростков в целом представлены в таблице 3 [45–49]. Как правило, распространенность гиперурикемии в западных странах выше, чем в странах Азии, и у мужчин, чем у женщин. Ограниченные отчеты среди людей с ожирением продемонстрировали распространенность в несколько раз выше, чем среди населения в целом; однако эти отчеты имели недостатки, в том числе меньшие группы страдающих ожирением, чем население в целом, и неоднородность в определении ожирения [50–53].Кроме того, средний уровень мочевой кислоты оказывается выше в популяции с ожирением [54, 55]. В течение более чем 6-летнего периода наблюдения за детьми в возрасте 6–12 лет на момент начала исследования Kuwahara et al. показали, что чрезмерное увеличение ИМТ в это время было связано со значительным повышением мочевой кислоты в раннем подростковом возрасте [56].
4.4.2. Метаболический синдром (МС)Связь гиперурикемии с рассеянным склерозом хорошо документирована у взрослых [57]. В недавнем обзоре РС у детей и подростков Bussler et al. продемонстрировали распространенность РС от 6 до 39%, в зависимости от применяемых критериев определения [58]. Они также определили гиперурикемию как важную сопутствующую патологию наряду с неалкогольной жировой болезнью печени и ограничением сна. В когорте 1370 подростков в возрасте от 12 до 17 лет, разделенных на четыре квартиля на основе уровня мочевой кислоты, Ford et al.наблюдали последовательно более высокую распространенность РС от самого низкого квартиля (<1%) до самого высокого квартиля (21,1%) [45]. Было обнаружено, что у 2284 тайваньских детей в возрасте 6–12 лет уровень мочевой кислоты является значимым предиктором рассеянного склероза, что свидетельствует о повышении риска рассеянного склероза на 54% при увеличении концентрации мочевой кислоты на 1 мг / дл [46]. Положительная связь уровня мочевой кислоты или гиперурикемии с возникновением РС была зарегистрирована во многих странах, включая Японию [50], Испанию [51] и Бразилию [52].Кроме того, в нескольких исследованиях сообщается, что взаимосвязь между уровнем мочевой кислоты и рассеянным склерозом у подростков зависит от расовых / этнических и половых различий [59, 60]. 4.5. Компоненты МС или НИЗ4.5.1. ГипертонияГипертония в связи с гиперурикемией наиболее широко исследовалась среди компонентов рассеянного склероза или НИЗ. В когорте из 125 детей в возрасте 6–18 лет, обследованных на предмет гипертонии, Фейг и Джонсон отметили, что уровни мочевой кислоты напрямую коррелируют с артериальным давлением у нелеченных детей и что концентрация> 5.5 мг / дл у подростков настоятельно указывают на первичную гипертензию [61]. Впоследствии многочисленные исследования в разных странах подтвердили эту связь между гиперурикемией и гипертонией у детей и подростков [49, 55, 62, 63]. Наблюдая за 449 детьми в возрасте от 3 до 7 лет, Park et al. обнаружили, что у детей с высоким уровнем мочевой кислоты в возрасте 3 и 5 лет было самое высокое систолическое артериальное давление в 7 лет [64]. Кроме того, при среднем периоде наблюдения, составляющем 12 лет, повышенный уровень мочевой кислоты в детстве показал, что он связан с повышением артериального давления вначале у детей и более высокими уровнями артериального давления, которые сохраняются в зрелом возрасте [65].Принимая во внимание эти сообщения, Яник и Фейг предлагают использовать уровень мочевой кислоты в качестве возможного биомаркера для диагностики эссенциальной гипертензии у детей [66]. 4.5.2. ИнсулинорезистентностьВ более раннем исследовании японских детей с ожирением в возрасте 7–15 лет уровни инсулина натощак положительно коррелировали с уровнями мочевой кислоты [67]. После корректировки по возрасту, полу и ИМТ было обнаружено, что уровни мочевой кислоты положительно связаны с инсулинорезистентностью по оценке модели гомеостаза (HOMA-R) и отрицательно связаны с концентрацией адипонектина [54].Исследование греческой молодежи с ожирением указывает на связь между гиперурикемией и HOMA-R [68]. 4.5.3. Дислипидемия и атеросклерозDenzer et al. наблюдали, что триглицериды и соотношение холестерин / ЛПВП положительно коррелировали с уровнями мочевой кислоты в когорте из 269 детей с ожирением, ИМТ которых был> 90 90-103-го процентиля [69]. В исследовании различных этнических групп на Тайване гипертригликемия и гиперхолестеринемия были связаны с гиперурикемией, но тенденция различалась между этническими группами (Aborigines vs.неаборигены) [70]. Гиперлипидемия связана с повышенным риском атеросклероза у детей и подростков [71]. Pacifico et al. показали, что интима-медиальная толщина сонной артерии, индикатор атеросклероза, была повышена у участников из четвертого квартиля мочевой кислоты по сравнению с участниками из первого, второго и третьего квартилей [72]. Кроме того, у японских детей с ожирением было показано, что уровни мочевой кислоты положительно коррелируют с липидами и отрицательно — с опосредованным потоком расширением плечевой артерии [73].В совокупности эти результаты предполагают, что гиперурикемия у детей с ожирением может быть маркером раннего атеросклероза. 4.5.4. Хроническая болезнь почек (ХБП)Недавний обзор предполагает, что мочевая кислота играет роль в патогенезе ХБП у детей [74]. Rodenbach et al. продемонстрировали, что гиперурикемия является независимым фактором риска более быстрого прогрессирования ХБП в когорте из более чем 600 детей и подростков в течение 5-летнего периода [75]. Более того, снижение уровня мочевой кислоты с помощью аллопуринола в течение 4-месячного периода независимо улучшало рСКФ у детей с ХБП 1-3 стадии [76]. 5. Лечение гиперурикемииПомимо причинно-следственной связи, очевидно, что гиперурикемия и эти четыре компонента НИЗ, описанные выше, тесно связаны друг с другом. Гиперурикемия у детей и подростков является целью лечения, учитывая отчет, демонстрирующий, что педиатрические пациенты с гиперурикемией подвергаются повышенному риску смерти, особенно из-за болезней почек и сердечно-сосудистых заболеваний [77]. 5.1. Вмешательство в образ жизниПоскольку ожирение является основной причиной гиперурикемии у здоровых в остальном детей и подростков, важны программы снижения массы тела с помощью изменения образа жизни (диета, физическая активность и изменения поведения) [78].Однако, насколько мне известно, в литературе представлены только два исследования, посвященных этому вопросу. Togashi et al. продемонстрировали, что уровень мочевой кислоты значительно снизился у 33 детей с ожирением после диеты и физических упражнений в течение 3 месяцев [79]. Кроме того, сообщалось, что годичная программа снижения веса в когорте 10-17-летних снизила уровень мочевой кислоты у 86% женщин и 67% мужчин [80]. Хотя влияние программ изменения образа жизни на ожирение является многообещающим, влияние на гиперурикемию требует дальнейшего изучения в течение более длительного периода наблюдения. 5.2. Ингибиторы ксантиноксидазыАллопуринол, ингибитор ксантиноксидазы, является старым препаратом, обычно используемым для лечения различных детских заболеваний [17, 25], включая дефицит HGPRT [81], дефицит APRT [82], болезнь накопления гликогена типа Ia [83] и FJHN [84]. Кроме того, эффективность лечения аллопуринолом самостоятельно [85] или в комбинации с эналаприлом [86] для снижения артериального давления была исследована у детей с гиперурикемической гипертензией. Однако аллопуринол следует использовать с осторожностью, поскольку он может вызвать серьезные побочные эффекты со стороны кожи, включая синдром Стивенса-Джонсона (SJS).Выявлена ассоциация индуцированного аллопуринолом SJS с человеческим лейкоцитарным антигеном (HLA) -B * 5801 [87]. Фебуксостат — это недавно разработанный непуриновый селективный ингибитор ксантиноксидазы [88]. Каку и Нишимура вводили фебуксостат 16 детям с ХБП и наблюдали защитный эффект почек, сопровождающийся снижением уровня мочевой кислоты [89]. При использовании в качестве профилактики TLS при злокачественных гематологических заболеваниях у детей наблюдался эффект, сопоставимый с эффектом аллопуринола [90].Для определения эффективности и безопасности фебуксостата для применения у детей и подростков необходимы дальнейшие исследования. 5.3. Оксидаза мочевой кислоты (расбуриказа)Рекомбинантная оксидаза мочевой кислоты, расбуриказа, широко используется для профилактики гиперурикемии, наблюдаемой при TLS при диагностике или во время лечения различных злокачественных новообразований у детей [91, 92]. Лечение расбуриказой приводило к более значительному и более быстрому снижению уровня мочевой кислоты, чем аллопуринол [91]. Несмотря на эффективность расбуриказы в TLS, вызванном злокачественными новообразованиями, Cheuk et al.вызвали опасения по поводу его серьезных побочных эффектов, включая гиперчувствительность и гемолиз [93]. 6. Заключение и дальнейшие направленияВ этом обзоре поднимаются три момента, которые следует рассмотреть, чтобы улучшить и сформировать направление будущих исследований гиперурикемии у детей и подростков. Во-первых, контрольные значения мочевой кислоты у детей и подростков меняются с возрастом, причем разница между полами возникает примерно в 12-летнем возрасте. Таким образом, определение гиперурикемии, используемое при анализе данных, должно учитывать эти факторы.Во-вторых, в будущих исследованиях следует рассмотреть вопрос о том, как гиперурикемия, возникающая в детском или подростковом возрасте, влияет на здоровье во взрослом возрасте, особенно в отношении НИЗ. Чтобы ответить на этот вопрос, необходимы большие когортные долгосрочные исследования. В-третьих, лечение гиперурикемии у детей и подростков должно быть исследовано с целью стандартизации, включая рекомендации относительно того, когда следует начинать лечение, снижающее уровень мочевой кислоты, и какие препараты являются наиболее подходящими. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

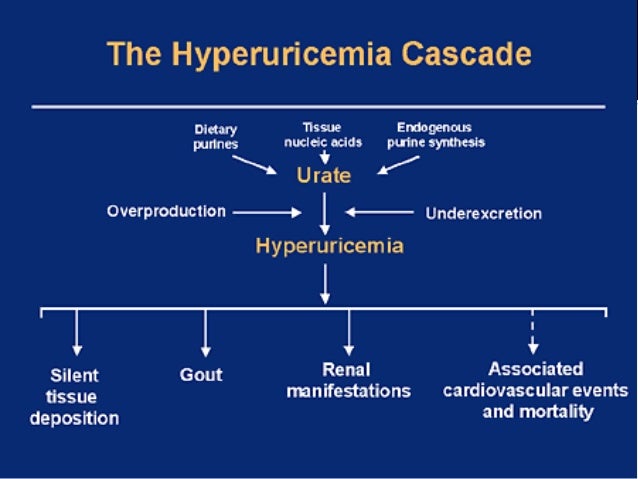 Повышенный уровень мочевой кислоты в сыворотке является следствием диеты богатой пуринами/фруктозой, генетических факторов или факторов окружающей среды, а также нарушений обмена веществ. Мы убеждены, что все пациенты должны получать точную информацию о необходимом изменении образа жизни, пересмотре диеты и необходимости снижения веса тела. Если этих мер недостаточно, мы рекоммендуем терпаию аллопуринолом, начиная с дозировки 100 мг в день с постепенным титрованием до 300-600 мг в день для достижения целевых уровней. Пациентам крайне важно следует постоянно соблюдать урат-понижающую терапию и поддерживать целевой уровень мочевой кислоты»,- подчеркнул д.м.н., проф., заведующий кафедрой гипертонии и диабетологии, Медицинского университета Гданьска, Польша, экс-президент Европейского общества по артериальной гипертензии Кшиштоф Наркевич.
Повышенный уровень мочевой кислоты в сыворотке является следствием диеты богатой пуринами/фруктозой, генетических факторов или факторов окружающей среды, а также нарушений обмена веществ. Мы убеждены, что все пациенты должны получать точную информацию о необходимом изменении образа жизни, пересмотре диеты и необходимости снижения веса тела. Если этих мер недостаточно, мы рекоммендуем терпаию аллопуринолом, начиная с дозировки 100 мг в день с постепенным титрованием до 300-600 мг в день для достижения целевых уровней. Пациентам крайне важно следует постоянно соблюдать урат-понижающую терапию и поддерживать целевой уровень мочевой кислоты»,- подчеркнул д.м.н., проф., заведующий кафедрой гипертонии и диабетологии, Медицинского университета Гданьска, Польша, экс-президент Европейского общества по артериальной гипертензии Кшиштоф Наркевич. 2019; 16 (1): 6–31. DOI: 10.26442/2075082X.2019.1.190179
2019; 16 (1): 6–31. DOI: 10.26442/2075082X.2019.1.190179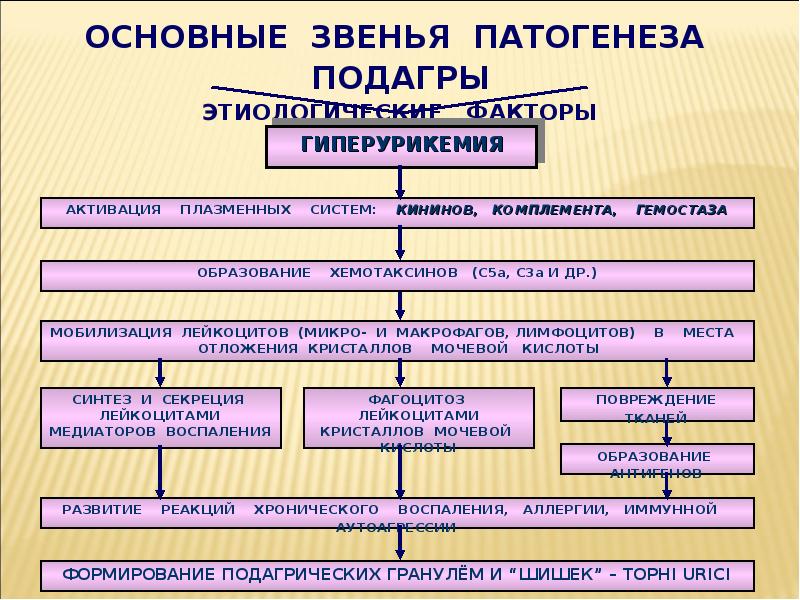 Вы можете подвергаться риску синдрома лизиса опухоли, если получаете
Вы можете подвергаться риску синдрома лизиса опухоли, если получаете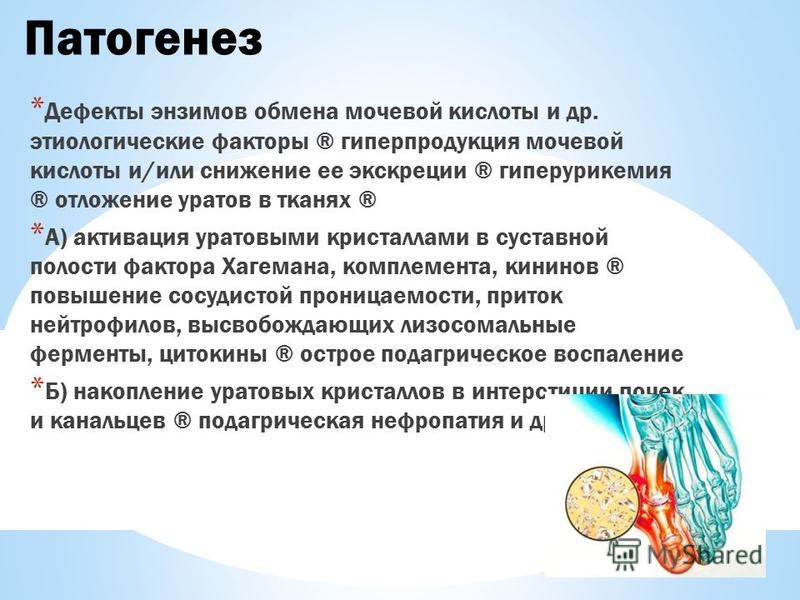 Только около 20% людей
Только около 20% людей (* Примечание — подагра может возникнуть при нормальном уровне мочевой кислоты,
(* Примечание — подагра может возникнуть при нормальном уровне мочевой кислоты,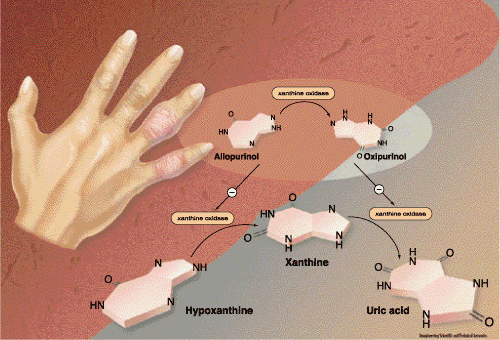



 Это может произойти во время химиотерапии и вызвать отказ почек.
Это может произойти во время химиотерапии и вызвать отказ почек.