Гипогликемия новорожденных
Низкий сахар у малыша после рождения — один из частых поводов для беспокойства будущей мамы с сахарным диабетом.
Что происходит с уровнем глюкозы у детей мам с сахарным диабетом после родов
Новорожденному требуется время, чтобы адаптироваться к самостоятельной жизни и научиться поддерживать сахар крови на нужном уровне. В первые 1–2 часа независимой жизни уровень глюкозы у ребенка снижается, а потом повышается благодаря запасам глюкозы из печени и дополнительным источникам питания в виде жировой ткани.
Детям мам с сахарным диабетом требуется чуть больше времени, чтобы наладить контроль глюкозы в крови. Во время беременности глюкоза вместе с кровью мамы переносится к малышу. Если глюкозы много, поджелудочная железа ребенка выделяет инсулин и нормализует уровень сахара в крови. При недостаточном контроле диабета во время беременности секреция инсулина происходит постоянно, что может привести к выбросу большего чем нужно количества инсулина в кровь ребенка. В результате, после родов у малыша случаются гипогликемии, которые могут сохраняться в течение первых 48 часов жизни.
В результате, после родов у малыша случаются гипогликемии, которые могут сохраняться в течение первых 48 часов жизни.
Какой уровень глюкозы крови считается слишком низким для новорожденных
Если вы будете излишне тревожиться, решите измерить сахар малышу и увидите цифру 3,5 ммоль/л — пугаться не стоит. Во-первых, глюкометр должен быть сертифицирован для использования у новорожденных, иначе доверять его показаниям нельзя. Во-вторых, уровень глюкозы крови у новорожденных может быть чуть ниже нормы. До сих пор ученые и врачи из разных стран не договорились, какой уровень сахара крови считать низким для малышей. В России гипогликемией у новорожденных считается показатель ниже 2,6 ммоль/л и случается она, как правило, в первые 24–48 часов после рождения.
Кто и как определяет глюкозу крови новорожденным
Зная о риске гипогликемии у новорожденных в первые дни жизни, педиатр в роддоме обязательно будет измерять уровень глюкозы крови вашего малыша и искать симптомы снижения сахара, которые появляются нечасто и их трудно заметить даже самой внимательной маме.
Если гипогликемия случилась, что делать
Все зависит от значений глюкозы крови и состояния малыша. Если есть возможность, ребенка стараются покормить. Если еда, будь то грудное молоко или смесь, не повысила уровень сахара достаточно, малышу введут раствор глюкозы или декстрозы внутривенно.
Насколько опасна гипогликемия новорожденных
Глюкоза — источник питания для мозга, поэтому нам страшно, что даже временный ее дефицит повлияет на ребенка, будь то способности к математике, заучиванию стихов или что угодно еще. Однако ученые пока не доказали, что временное снижение сахара у новорожденных влияет на их здоровье и умственные способности в течение жизни. Но это повод не рисковать, а действовать — будущие мамы стараются поддерживать целевые значения глюкозы во время беременности и родов, а врачи следят за уровнем сахара у новорожденных.
Упал сахар в крови у ребенка. При каком уровне сахара показана госпитализация?
20. 04.2020
04.2020
Снижение содержания сахара (глюкозы) в крови называется гипогликемия. Это состояние вызывает нарушение функции многих систем организма.
Особенно чувствителен к гипогликемии головной мозг, так как соединения сахара являются главным источником энергии и питания для клеток мозга. При очень резком падении уровня глюкозы могут нарушаться функции мозга.
Глобально причины возникновения гипогликемии подразделяют на связанные с лекарственными препаратами и не связанные с приемом лекарств.
В основном низкий уровень показателя глюкозы крови бывает при заболеваниях сахарным диабетом и неадекватной терапии заболевания, прежде всего инсулином и другими лекарственными препаратами назначаемыми пациентам с сахарным диабетом для снижения содержания глюкозы в крови.
Также гипогликемии могут быть вызваны и другими причинами: нарушением режима питания (голоданием или исключением из рациона питания продуктов, содержащих углеводы, большими перерывами в еде), чрезмерными физическими, умственными и эмоциональными нагрузками, нарушением метаболизма веществ и др.
Существует разновидность гипогликемии, которая встречается у детей первого года жизни. Она вызывается продуктами содержащими фруктозу, галактозу (молочный сахар) или аминокислоту-лецитин. Результатом этого является снижение сахара в крови через некоторое время после употребления продуктов, содержащих эти вещества.
Симптомы снижения сахара в крови: бледность кожи, потливость, раздражительность,”плаксивость”, беспокойное поведение, слабость, повышенная утомляемость, дрожь, головокружение, головная боль, тошнота, боли в животе, нечеткость зрения, спутанность сознания, чувство тревоги. Дефицит глюкозы может вызвать кому, а длительная гипогликемия вызывает необратимые повреждения мозга. Таким образом, снижение глюкозы крови очень тревожный симптом!
При уровне гликемии 2,2 ммоль/л показана срочная госпитализация и стационарное лечение. При уровне глюкозы 3,0-3,5 ммоль/л, ребенка в сознании необходимо дробно выпаивать сладким чаем, соком, и проводить контроль уровня глюкозы каждые 15 мин, если эффекта нет, ребенок теряет сознание и уровень глюкозы не поднимается — показана срочная госпитализация в стационар.
Не занимайтесь самолечением! Состояние гипогликемии нельзя оставлять без внимания. Ребенка обязательно необходимо показать детскому эндокринологу, при необходимости пройти дообследование, выбрать тактику лечения, разработать принципы правильного питания и режима дня.
В Детском Диагностическом центре ведет прием опытный детский эндокринолог Данилычева Любовь Ивановна!
Будьте здоровы!
Возврат к списку
Гипогликемия новорожденных » Акушерство и Гинекология
ФГБУ Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова, Санкт-Петербург, Россия; ФГБ ВОУ ВПО Военно-медицинская академия им. С.М. Кирова Министерства обороны России, Санкт-Петербург
Обзор посвящен истории изучения, этиологии, патогенезу одного из наиболее часто встречающихся патологических состояний – гипогликемии новорожденных. Актуальность определяется сложностями диагностики данного состояния и влиянием на неврологический исход в неонатальном периоде.
гипогликемия
новорожденные
критерии определения
группы риска
диагностика
лечение
- Бернар К. Лекции по экспериментальной патологии. (Leçons de pathologie expérimentale. 1871) Пер. Д.Е. Жуковского. М.-Л.: Биомедгиз; 1937.
- Карлик Л.Н. Клод Бернар. М.: Наука; 1964.
- Cornblath M., Odell G., Levin E. Symptomatic neonatal hypoglycemia associated with toxemia of pregnancy. J. Pediatr. 1959; 55: 545–62.
- Hay W.W. Jr. Placental-fetal glucose exchange and fetal glucose metabolism. Trans. Am. Clin. Climatol. Assoc. 2006; 117: 321–39.
- Rozance P.J., Hay W.W.Jr. Describing hypoglycemia—definition or operational threshold? Early Hum. Dev. 2010; 86(5): 275–80.
- Hay W.W.Jr. Recent observations on the regulation of fetal metabolism by glucose. J. Physiol. 2006; 572(Pt 1): 17–24.
- Kalhan S.C., Parimi P.S. Metabolic and endocrine disorders, part one: disorders of carbohydrate metabolism. In: Martin R.J., Fanaroff A.
 A., Walsh M.C., eds. Fanaroff and Martin’s Neonatal-Perinatal Medicine. 8th ed. Philadelphia, PA: Mosby Elsevier; 2006: 1467–91.
A., Walsh M.C., eds. Fanaroff and Martin’s Neonatal-Perinatal Medicine. 8th ed. Philadelphia, PA: Mosby Elsevier; 2006: 1467–91. - Kalhan S.C., Savin S.M., Adam P.A.J. Measurement of glucose turnover in the human newborn with glucose-1-13C. J. Clin. Endocrinol. Metab. 1976; 43: 704–7.
- Kalhan S.C., Oliven A., King K.C., Lucero C. Role of glucose in the regulation of endogenous glucose production in the human newborn. Pediatr. Res. 1986; 20: 49–52.
- Rao P.N., Shashidhar A., Ashok C. In utero fuel homeostasis: Lessons for a clinician. Indian J. Endocrinol. Metab. 2013; 17(1): 60–8.
- Pugh S.K., Doherty D.A., Magann E.F., Chauhan S.P., Hill J.B., Morrison J.C. Does hypoglycemia following a glucose challenge test identify a high risk pregnancy? Reprod. Health. 2009; 14: 6–10.
- Girard J. Metabolic adaptations to change of nutrition at birth. Biol. Neonate. 1990; 58(Suppl. 1): 3–15.
- Fowden A.L., Mundy L., Silver M. Developmental regulation of glucogenesis in the sheep fetus during late gestation.
 J. Physiol. 1998; 508: 937–47.
J. Physiol. 1998; 508: 937–47. - Hume R., Burchell A., Williams F.L., Koh D.K. Glucose homeostasis in the newborn. Early Hum. Dev. 2005; 81(1): 95–101.
- Mejri A., Dorval V.G., Nuyt A.M., Carceller A. Hypoglycemia in term newborns with a birth weight below the 10th percentile. Paediatr. Child Health. 2010; 15(5): 271–5.
- Van Kempen A.A., Ackermans M.T., Endert E., Kok J.H., Sauerwein H.P. Glucose production in response to glucagon is comparable in preterm AGA and SGA infants. Clin. Nutr. 2005; 24(5): 727–36.
- Шабалов Н.П., Иванов Д.О. Сепсис новорожденных. Педиатрия. Журнал им. Г.Н. Сперанского. 2003; 5: 46–56.
- Курзина Е.А., Жидкова О.Б., Петренко Ю.В., Иванов Д.О., Шабалов Н.П. Прогнозирование состояния здоровья в катамнезе у детей, перенесших тяжелую перинатальную патологию. Детская медицина Северо-Запада. 2010; 1(1): 22–7.
- Иванов Д.О., Петренко Ю.В., Федосеева Т.А. Современные возможности поддержки грудного вскармливания. Детская медицина Северо-Запада.
 2012; 3(4): 36–43.
2012; 3(4): 36–43. - Иванов Д.О., Петренко Ю.В., Курзина Е.А., Федосеева Т.А. Гипергликемии у новорожденных. Детская медицина Северо-Запада. 2012; 3(3): 3–14.
- Cornblath M., Hawdon J.M., Williams A.F., Aynsley-Green A., Ward-Platt M.P., Schwartz R., Kalhan S.C. Controversies regarding definition of neonatal hypoglycemia: suggested operational thresholds. Pediatrics. 2000; 105(5): 1141–5.
- Davies M.W., Cartwright D. Hypoglycaemia. In: Davies M.W., Cartwright D.W., Ingliss G.D.T., eds. Pocket notes on neonatology. 2nd ed. Churchill Livingstone; 2008: 77–9.
- Alkalay A.L., Sarnat H.B., Flores-Sarnat L., Elashoff J.D., Farber S.J., Simmons C.F.Population meta-analysis of low plasma glucose thresholds in full-term normal newborns. Am. J. Perinatol. 2006; 23(2): 115–9.
- Cornblath M., Reisner S.H. Blood glucose in the neonate and its clinical significance. N. Engl. J. Med. 1965; 273: 378–81.
- Lucas A., Boyes S., Bloom S.R., Aynsley-Green A. Metabolic and endocrine responses to a milk feed in six-day-old term infants: differences between breast and cow’s milk formula feeding.
 Acta Paediatr. Scand. 1981; 70: 195–200.
Acta Paediatr. Scand. 1981; 70: 195–200. - Srinivasan G., Pildes R.S., Cattamanchi G., Voora S., Lilien L.D. Plasma glucose values in normal neonates: A new look. J. Pediatr. 1986; 109: 114–7.
- Heck L.J., Erenburg A. Serum glucose levels in term neonates during the first 48 hours of life. J. Pediatr. 1987; 110: 119–22.
- Lucas A., Morley R., Cole T.J. Adverse neurodevelopmental outcome of moderate neonatal hypoglycaemia. Br. Med. J. 1988; 297: 1304–8.
- Hoseth E., Joergensen A., Ebbesen F., Moeller M. Blo od glucose levels in a population of healthy, breast fed, term infants of appropriate size for gestational age. Arch. Dis. Child Fetal Neonatal Ed. 2000; 83(2): 117–9.
- Overfield C.V., Savory J., Heintges M.A. Gycolysis: a re-evaluation of the effect on blood glucose. Clin. Chim. Acta. 1972; 39: 35–40.
- Aynsley-Green A. Glucose: a fuel for thought! J. Paediatr. Child Health. 1991; 27(1): 21–30.
- Kayıran S.M., Gürakan B. Screening of blood glucose levels in healthy neonates.
 Singapore Med. J. 2010; 51(11): 853–5.
Singapore Med. J. 2010; 51(11): 853–5. - Fox R.E., Redstone D. Sources of error in glucose determinations in neonatal blood by glucose oxidase methods, including dextrostix. Am. J. Clin. Pathol. 1976; 66: 658–66.
- Achoki R., Opiyo N., English M. Mini-review: Management of hypoglycaemia in children aged 0-59 months. J. Trop. Pediatr. 2010; 56(4): 227–34.
- Сурков Д.Н., Иванов Д.О., Оболонский А.И., Капустина О.Г., Волков Д.Г., Петренко Ю.В. Современные стратегии выхаживания недоношенных детей. Детская медицина Северо-Запада. 2012; 3(1): 4–9.
- Мавропуло Т.К., Иванов Д.О., Сурков Д.Н., Фот А.Ю. Особенности оказания неотложной и реанимационной помощи новорожденным, родившимся в 22–27 недель гестации. Детская медицина Северо-Запада. 2012; 3(2): 4–13.
- DePuy A.M., Coassolo K.M., Som D.A., Smulian J.C. Neonatal hypoglycemia in term, nondiabetic pregnancies. Am. J. Obstet. Gynecol. 2009; 200(5): e45–51.
- Deshpande S., Ward Platt M. The investigation and management of neonatal hypo-glycaemia.
 Semin. Fetal Neonatal Med. 2005; 10(4): 351–61.
Semin. Fetal Neonatal Med. 2005; 10(4): 351–61. - Williams A.F. Neonatal hypoglycaemia: Clinical and legal aspects. Semin. Fetal Neonatal Med. 2005; 10(4): 363–8.
- Aziz K., Dancey P.; Canadian Paediatric Society. Screening guidelines for newborns at risk for low blood glucose. Paediatr. Child Health. 2004; 9(10): 723–9.
- Edmund H. Neonatal formulary: drug use in pregnancy and the first year of life. 5th ed. Blackwell Publ.; 2007.
- Murad M.H., Coto-Yglesias F., Wang A., Sheidaee N., Mullan R.J., Elamin M.B. et al. Clinical review: Drug-induced hypoglycemia: a systematic review. J. Clin. Endocrinol. Metab. 2009; 94(3): 741–5.
- Çoban D., Kurtoğlu S., Akın M.A., Akçakuş M., Güneş T. Neonatal episodic hypoglycemia: a finding of valproic acid withdrawal. J. Clin. Res. Pediatr. Endocrinol. 2010; 2(2): 92–4.
- Lubchenco L.O., Bard H. Incidence of hypoglycemia in newborn infants classified by birth weight and gestational age. Pediatrics. 1971; 47: 831–8.

- Anderson D.M., Kliegman R.M. The relationship of neonatal alimentation practices to the occurrence of endemic necrotising enterocolitis. Am. J. Perinatol. 1991; 8: 62–7.
- Koivisto M., Blanco-Sequeiros M., Krause U. Neonatal sympomatic and asymptomatic hypoglycaemia: a follow-up study. Dev. Med. Child Neurol. 1972; 14: 603–14.
- Boluyt N., van Kempen A., Offringa M. Neurodevelopment after neonatal hypoglycemia: a systematic review and design of an optimal future study. Pediatrics. 2006; 117(6): 2231–43.
- Kinnala A., Rikalainen H., Lapinleimu H., Parkkola R., Kormano M., Kero P. Cerebral magnetic resonance imaging and ultrasonography findings after neonatal hypoglycemia. Pediatrics. 1999; 103: 724–9.
Иванов Дмитрий Олегович, д.м.н., директор института перинатологии и педиатрии ФГБУ Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова. Адрес: 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2. Телефон: 8 (812) 702-68-58. E-mail: doivanov@yandex. ru
ru
Шабалов Николай Павлович, д.м.н., профессор, зав. кафедрой детских болезней ФГБВОУ ВПО Военно-медицинская академия им. С.М. Кирова Министерства обороны России. Адрес: Россия, Санкт-Петербург, ул. Боткинская, д. 6. Телефон: 8 (812) 292-33-53. E-mail: [email protected]
Петренко Юрий Валентинович, к.м.н., зав. НИЛ физиологии и патологии новорожденных, ФГБУ Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова. Адрес: 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2. Телефон: 8 (812) 702-68-58. E-mail: [email protected]
Стойкая гипогликемия у новорожденного как редкий вариант проявления врожденного гипотиреоза
117№ 4 (91), 2018 www.mif-ua.com, http://emergency.zaslavsky.com.ua
Клинический случай / Clinical Case
После консультации эндокринолога и получе-
ния данных лабораторного обследования (табл. 1)
выставлен диагноз врожденного гипотиреоза, на-
значен левотироксин натрия.
С началом назначения L-тироксина постепенно,
на протяжении десяти суток, мы снижали дозу ги-
дрокортизона с последующей успешной отменой.
На фоне приема только L-тироксина произошла
стабилизация уровня глюкозы крови.
Показатели общего анализа крови, концентра-
ции электролитов, пигментного обмена печени в
плазме крови — в пределах возрастной нормы.
При ультразвуковом обследовании щитовидной
железы и органов брюшной полости — данные без
особенностей.
При эхокардиографии обнаружена аберрантная
хорда в полости левого желудочка, открытое оваль-
ное окно диаметром 0,4 мм.
При проведении нейросонографии на вторые
сутки жизни выявлены признаки субарахноидаль-
ного кровоизлияния в теменной области слева.
Консультация эндокринологом на 4-е сутки
жизни, рекомендован план диагностического об-
следования.
Кроме того, ребенок осмотрен неврологом, ге-
нетиком, дерматологом, офтальмологом. Данные
без особенностей. Дерматолог — гиперпигментный
невус.
Диагноз при выписке
Основной: врожденный гипотиреоз.
Осложнения: персистирующая гипогликемия.
Сопутствующий: перинатальное поражение
ЦНС, субарахноидальное кровоизлияние в темен-
ной области головного мозга слева, вентрикуло-
дилатация слева; невус волосистой части головы
затылочной области. В анамнезе неонатальная
аспирация мекония.
Ребенок выписан из стационара на 21-е сутки
жизни, оформлена инвалидность (пункт ІІІ раздела
II № 454/471/516 от 08.11.2001 МЗ Украины).
Обсуждение
Описанный клинический случай, с нашей точки
зрения, уникален тем, что у ребенка с первых дней
жизни имела место стойкая гипогликемия, которая
не поддавалась лечению внутривенным введением
растворов глюкозы и длилась более трех первых су-
ток жизни.
Предрасполагающих факторов как со сторо-
ны ребенка (недоношенность, задержка внутри-
утробного развития), так и со стороны матери
(сахарный диабет) не выявлено.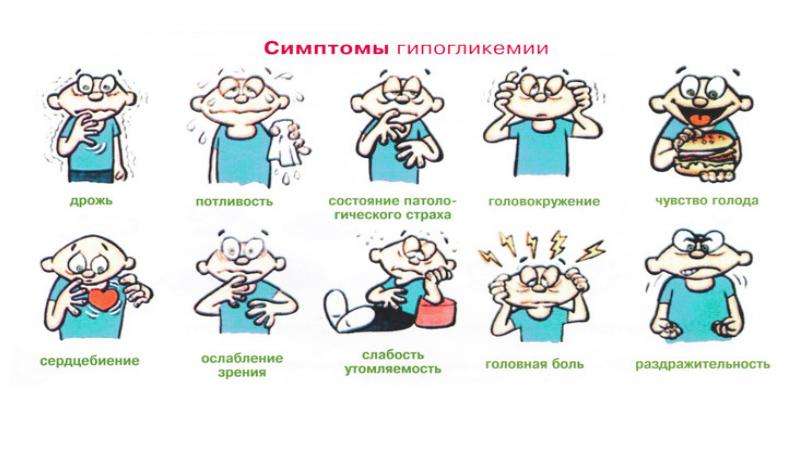 Это послужило
Это послужило
поводом провести широкий диагностический
поиск.
Одним из обязательных обследований на эта-
пах определения причины гипогликемии являет-
ся исследование концентрации гормонов в кро-
ви, влияющих на углеводный обмен [4]. К таким
гормонам относятся инсулин, кортизол, адрено-
кортикотропный гормон (АКТГ), соматотропный
гормон и гормоны щитовидной железы. Сочетание
гипотиреоза с дефицитом соматотропного гормо-
на и АКТГ может приводить к стойкой тяжелой
гипогликемии [5]. Однако литературных данных,
объясняющих феномен гипогликемии при изоли-
рованной дисфункции щитовидной железы у но-
ворожденных, недостаточно [6]. Несмотря на то,
что гормоны щитовидной железы опосредованно
принимают участие в регуляции углеводного обме-
на, некоторые авторы считают, что гипогликемия
является нетипичным проявлением гипотиреоза.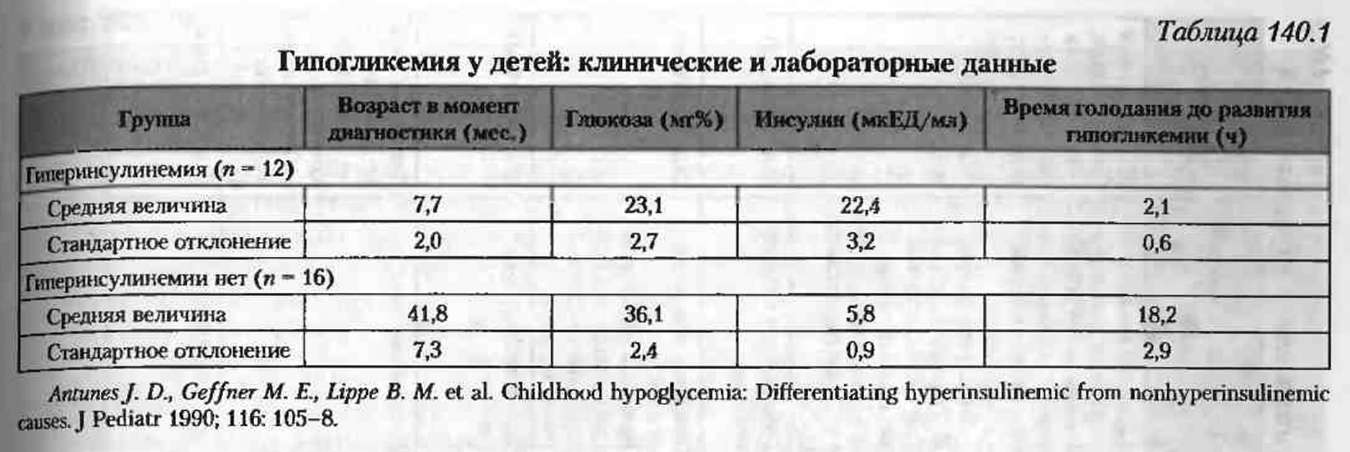
Вместе с тем у новорожденных гипотиреоз может
протекать асимптомно [7–9], описаны единичные
случаи, где гипогликемия была единственным его
проявлением [10]. Возможными причинами гипо-
гликемии при гипотиреозе могут быть замедленное
поглощение глюкозы клеткой, уменьшение скоро-
сти абсорбции глюкозы в кишечнике, сниженный
клиренс инсулина из крови, нарушение глюконео-
генеза [10–12].
В качестве первой линии коррекции гипо-
гликемии рекомендовано болюсное внутривен-
ное введение 10% раствора глюкозы из расчета
2 мл/кг. При неэффективности следует увеличить
суточное поступление глюкозы на 20–50 %. Если
и эти шаги не дают эффекта, то следующим эта-
пом назначается внутривенно гидрокортизон, а
вместе с тем продолжается поиск причины гипо-
гликемии [4, 6].
В описанном случае были получены лаборатор-
ные данные в пользу гипотиреоза, а именно — по-
вышение уровня тиреотропного гормона и сниже-
ние концентрации свободного тироксина. Диагноз
Диагноз
также подтверждает стойкий положительный эф-
фект коррекции гипогликемии, полученный при
назначении заместительной терапии левотирокси-
ном на фоне снижения гидрокортизона с последу-
ющей его отменой.
Выводы
Как гипогликемия, так и гипотиреоз оказыва-
ют негативное влияние на головной мозг младен-
ца с последующим развитием грубого невроло-
гического дефицита и когнитивных дисфункций
вплоть до нарушения умственного развития. По-
этому устранение этих двух состояний необходи-
мо осуществлять в самые ранние сроки от момен-
та рождения.
В заключение мы хотим сделать акцент на не-
обходимости исследования функции щитовидной
железы при обнаружении стойкой гипогликемии у
новорожденного ребенка с целью ранней диагно-
стики и своевременного начала лечения врожден-
ного гипотиреоза.
Ранняя диагностика и, соответственно, ранняя
заместительная терапия левотироксином предот-
вращают негативные последствия гипотиреоза в
развитии головного мозга.
Конфликт интересов. Авторы заявляют об отсут-
ствии какого-либо конфликта интересов при под-
готовке данной статьи.
Клиническое наблюдение: персистирующая транзиторная гипогликемия у новорожденного ребенка.
Клиническое наблюдение: персистирующая транзиторная гипогликемия у новорожденного ребенка
Боровкова Ю.А., Дусанова А.Е
Научный руководитель: к.м.н., доцент Бочкова Л.Г.
ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Кафедра госпитальной педиатрии и неонатологии
Как известно, гипогликемия у новорожденных диагностируется при уровне глюкозы крови менее 2,6 ммоль/л в любые сутки жизни. Под нашим наблюдением находился мальчик Б. доношенный, родившийся при первых срочных родах, путем кесарева сечения по поводу предлежания плаценты, с массой тела 2750 гр, длинной 49 см. Ребёнок родился в состоянии умеренной асфиксии с оценкой по шкале Апгар 7-8 баллов. Состояние новорожденного в детском отделении оценивалось как удовлетворительное. На третьи сутки состояние ухудшилось: отмечались тонические судороги, угнетение двигательной активности и рефлексов. При обследовании обнаружена гипогликемия – 1,1ммоль/л. Проводилось лечение: глюкоза 20% внутривенно, преднизолон 2мг/кг/сутки однократно. Несмотря на проводимое лечение гипогликемия сохранялась. При консультации детским эндокринологом поставлен предварительный диагноз: Врожденный гиперинсулинизм, врожденная дисплазия коры надпочечников. Рекомендовано включить в терапию препарат Кортинефф по 25 мкг 2 раза в день. Инфузии глюкозы были продолжены со скоростью утилизации от 12 до 8 ммоль/час. В рамках данного диагноза на 10 сутки проведено расширенное обследование гормонального статуса. Были получены следующие результаты: кортизол – 3,4 мкг/дл; АКТГ – 18 Пг/мл; инсулин – 3,0 мкМЕ/мл; С-пептид – 1,0 нг/мл, которые были интерпретированы нами как референсные показатели. На второй неделе жизни была проведена голодовая проба, которая показала нормализацию уровня гликемии, в связи с чем, гормонотерапия и инфузии глюкозы были отменены.
На третьи сутки состояние ухудшилось: отмечались тонические судороги, угнетение двигательной активности и рефлексов. При обследовании обнаружена гипогликемия – 1,1ммоль/л. Проводилось лечение: глюкоза 20% внутривенно, преднизолон 2мг/кг/сутки однократно. Несмотря на проводимое лечение гипогликемия сохранялась. При консультации детским эндокринологом поставлен предварительный диагноз: Врожденный гиперинсулинизм, врожденная дисплазия коры надпочечников. Рекомендовано включить в терапию препарат Кортинефф по 25 мкг 2 раза в день. Инфузии глюкозы были продолжены со скоростью утилизации от 12 до 8 ммоль/час. В рамках данного диагноза на 10 сутки проведено расширенное обследование гормонального статуса. Были получены следующие результаты: кортизол – 3,4 мкг/дл; АКТГ – 18 Пг/мл; инсулин – 3,0 мкМЕ/мл; С-пептид – 1,0 нг/мл, которые были интерпретированы нами как референсные показатели. На второй неделе жизни была проведена голодовая проба, которая показала нормализацию уровня гликемии, в связи с чем, гормонотерапия и инфузии глюкозы были отменены. В дальнейшем ребенок был выписан домой под наблюдение эндокринолога. В амбулаторных условиях уровень гликемии контролировался дважды в неделю и оставался в пределах нормы в течение первого месяца жизни. Таким образом, данный клинический случай следует рассматривать, как расстройство неонатальной адаптации в виде персистирующей транзиторной гипогликемии, при которой целесообразным является продолжительная коррекция уровня гликемии внутривенным введением глюкозы.
В дальнейшем ребенок был выписан домой под наблюдение эндокринолога. В амбулаторных условиях уровень гликемии контролировался дважды в неделю и оставался в пределах нормы в течение первого месяца жизни. Таким образом, данный клинический случай следует рассматривать, как расстройство неонатальной адаптации в виде персистирующей транзиторной гипогликемии, при которой целесообразным является продолжительная коррекция уровня гликемии внутривенным введением глюкозы.
Гипогликемия у детей | Официальный сайт Санаторно-курортный комплекс ДиЛУЧ
Главная → Гипогликемия у детей
Глюкоза – это один из самых важных элементов в организме человека. Она необходима для нормального обмена веществ, и с ее помощью питаются ткани и клетки тела. Поэтому от нормального уровня глюкозы в крови прямо зависит функционирование органов. Особенно это важно для детского организма. Гипогликемия у детей представляет собой патологию, при которой уровень глюкозы в крови падает до критических отметок.
Гипогликемия — что это такое, симптомы у детей? По каким признакам можно своевременно заметить и диагностировать гипогликемию? В чем причины гипогликемии у детей, и какие существуют клинические рекомендации по устранению этой патологии?
Как известно, глюкоза играет огромную роль в обмене веществ. Именно благодаря ей ткани нашего тела и клетки головного мозга человека обогащаются кислородом. От того, насколько хорошо сбалансирован уровень сахара в крови сильно зависит правильная работа центральной нервной системы, стабильны процессы, происходящие во внутренних органах и положительно состояние здоровья в целом. Это правило одинаково актуально как для организма взрослого человека, так и для детского. Именно по этой причине сохранение баланса сахара в крови имеет такое большое значение. Снижение уровня глюкозы в плазме крови до минимальной отметки может привести к необратимым последствиям, способным вызвать такие серьезные состояния организма, как кратковременная потеря сознания и даже кома.
Что такое гипогликемия?
При такой патологии, как гипогликемия у детей, уровень глюкозы в крови ребенка падает до отметки менее 4 ммоль/литр. В результате может произойти нарушение работы центральной нервной системы и другие неприятные последствия. Организм ребенка растет, а значит, своевременная реакция взрослых на недуг может помочь избежать проблем в развитии малыша. Что касается новорожденных, гипогликемия может стать даже причиной смерти.
Своевременная диагностика и вовремя начатое лечение болезни чрезвычайно важно в любом возрасте, однако, в детском от времени обращения к специалисту может сильно зависеть результат терапии.
Степени тяжести болезни
Степень тяжести состояния ребенка при гипогликемии можно определить по некоторым внешним признакам. Специалисты медицинского центра «ДиЛУЧ» настоятельно рекомендуют обратиться к врачу, если состояние ребенка вызывает подозрение на нехватку глюкозы.
Врачи различают три степени тяжести болезни:
- Первая (легкая) степень
- Вторая степень, средняя тяжесть
- Третья, тяжелая степень.

В зависимости от степени патологии, врач назначает соответствующее лечение, опираясь на результаты проведенных исследований.
Причины гипогликемии у детей
Самая распространенная причина гипогликемии у новорожденных – сахарный диабет у матери во время беременности. Быстро предотвратить возможные последствия патологии помогают своевременно проведенный анализ крови будущей матери и малыша в первые дни жизни.
В целом, причинами гипогликемии у детей могут стать следующие факторы:
- Сбои в работе нервной или эндокринной систем организма ребенка
- Стресс или повышенная физическая нагрузка
- Патологии, перенесенные во время беременности
- Недоношенность и другие.
Кстати! Особое место среди факторов, вызывающих гипогликемию занимает нарушение правильного режима питания ребенка. Растущий детский организм требует большого количества энергии, для получения которой необходима глюкоза и многие другие вещества. При нарушении режима питания или даже просто пропущенном приеме еды, уровень глюкозы резко падает. Это приводит к сбоям в процессе обмена веществ, и может стать причиной ряда негативных последствий.
Помимо перечисленных факторов, причиной понижения уровня глюкозы могут стать:
- Недостаток питья: вода играет жизненно важную роль в процессах обмена веществ
- Период стресса и эмоционального дискомфорта: негативные состояния повышают активность работы эндокринной системы
- Физическое перенапряжение
- Последствия приема медикаментов.
К самым распространенным причинам недуга можно отнести:
- Онкологические заболевания
- Болезни ЦНС
- Сахарный диабет и заболевания эндокринной системы
- Инфекционные заболевания
- Поражения почек и нарушения метаболизма
- Плохое кровообращение и гиперинсулизм.
Симптомы гипогликемии у детей
Вне зависимости от того, что стало причиной гипогликемии, недуг имеет ряд симптомов, по которым можно заметить его даже на ранних стадиях развития.
- Первое проявление падения уровня глюкозы – раздражительность и беспокойство. Ребенок может стать совершенно неуправляемым, его настроение резко меняется от перевозбуждения и гиперактивности до полной апатии и вялости.
- Изменение цвета кожи – она становится бледнее, чем обычно, пропадает румянец даже при физической активности.
- Ребенок сильно потеет, у него сбивается режим сна. Возможна повышенная ночная активность и апатия к играм в дневное время.
- Прогрессирование гипогликемии сопровождается сбоями в работе нервной системы: могут дрожать конечности, появляются судороги, проблемы с пищеварением – диарея и рвота.
- Сильное снижение уровня глюкозы провоцирует головную боль, понижение температуры тела, сильное падение артериального давления. Может ухудшиться зрение, сбивается сердечный ритм.
- Озноб, тремор и резкое ухудшение внимания, головокружения и потеря сознания.
- Сильный голод или, наоборот, полная потеря аппетита.
Малыши первого года жизни при гипогликемии могут сильно капризничать без видимых на то причин или же, наоборот, не проявлять ни малейшего интереса к окружающему миру, много спать. Часто у них пропадает аппетит, ребенок отказывается даже от сладкой пищи.
Главное, о чем не стоит забывать – серьезная роль ранней диагностики недуга. Чем раньше внимательные родители отведут ребенка к врачу, тем больше вероятность того, что удастся избежать негативных последствий. Поэтому при наблюдении одного или нескольких перечисленных признаков патологии, необходимо обратиться к специалисту.
Гипогликемическое состояние у детей | #12/02
Редкий случай органического гиперинсулинизма у ребенка 3 месяцев
Уровень глюкозы в крови натощак у практически здорового человека колеблется от 3,3 до 5,5 ммоль/л при определении глюкозооксидазным методом. На протяжении суток глюкоза в плазме крови в норме может колебаться от 2,8 до 8,8 ммоль/л. Содержание глюкозы в крови ниже 2,7 ммоль/л принято называть гипогликемией.
Основная причина гипогликемического симптомокомплекса — гиперинсулинизм.
Гиперинсулинизм — патологическое состояние организма, обусловленное абсолютным или относительным избытком инсулина, вызывающим значительное снижение содержания сахара в крови; как следствие возникают дефицит глюкозы и кислородное голодание мозга, что ведет к нарушению в первую очередь высшей нервной деятельности.
Абсолютный гиперинсулинизм — это состояние, связанное с патологией инсулярного аппарата (первичный органический гиперинсулинизм). Наиболее частыми причинами органического гиперинсулинизма являются инсулинома — опухоль b-клеток островков Лангерганса, секретирующая избыточное количество инсулина (у взрослых и детей старшего возраста) и незидиобластоз — гиперплазия островков поджелудочной железы (у детей первого года жизни). Еще одна нередкая причина гиперинсулинизма у детей младшего возраста — функциональный гиперинсулинизм новорожденных от матерей с сахарным диабетом.
Доброкачественную аденому островков Лангерганса впервые обнаружил в 1902 году во время вскрытия Николлс. В 1904 году Л. В. Соболев описал «струму островков Лангерганса». В 1924 году Гаррис и отечественный хирург В. А. Оппель независимо друг от друга описали симптомокомплекс гиперинсулинизма. В этом же году Г. Ф. Ланг наблюдал множественный аденоматоз панкреатических островков. В России успешная операция удаления инсулиномы была выполнена в 1949 году А. Д. Очкиным, а в 1950 году — О. В. Николаевым. Инсулин-секретирующая опухоль описана во всех возрастных группах, от новорожденных до престарелых, однако чаще она поражает людей трудоспособного возраста — от 30 до 55 лет. Среди общего числа больных дети составляют всего около 5%. 90% инсулином — доброкачественные. Около 80% из них — солитарные. В 10% случаев гипогликемия обусловлена множественными опухолями, 5% из них — злокачественные, а 5% составляет незидиобластоз (Антонов А. В. Клиническая эндокринология, 1991).
Термин незидиобластоз введен Г. Лейдло в 1938 году. Незидиобластоз — это тотальная трансформация протокового эпителия поджелудочной железы в b-клетки, продуцирующие инсулин. У детей первого года жизни это наиболее частая причина органического гиперинсулинизма (лишь 30% гиперинсулинизма у детей обусловлено инсулиномой, 70% — незидиобластозом). Это генетически обусловленное заболевание.
Диагноз устанавливается только морфологически после исключения инсулиномы. Клинически он проявляется тяжелыми, трудно поддающимися коррекции гипогликемиями, вследствие чего при отсутствии положительного эффекта от консервативного лечения придется прибегать к уменьшению массы ткани поджелудочной железы. Общепринятый объем операции — 80 — 95% резекции железы.
Инсулиномы у детей встречаются исключительно редко и располагаются либо в хвосте, либо в теле поджелудочной железы. Их диаметр колеблется от 0,5 до 3 см. Малые размеры инсулином создают сложности для диагностики (информативность УЗИ-метода — не более 30%). Для определения локализации инсулиномы применяют селективную ангиографию, КТ и МРТ или сканирование с изотопом октреотида (аналог соматостатина). Наиболее информативной является ангиография с селективным забором крови из вен поджелудочной железы (60 — 90%).
Инсулинома проявляется более или менее резким падением уровня сахара крови, что обусловлено повышенной секрецией инсулина в кровь. Радикальным методом лечения инсулиномы является хирургический (инсулиномэктомия ), прогноз в большинстве случаев благоприятный (88 — 90%) при своевременном оперативном вмешательстве.
Органический гиперинсулинизм (инсулинома, незидиобластоз) является причиной тяжелых панкреатических гипогликемий с падением сахара крови до 1,67 ммоль/л и ниже (во время приступа). Эти гипогликемии всегда некетотические (ацетон в моче отрицательный за счет подавления процессов липолиза).
Наиболее часто в клинической практике встречаются кетотические гипогликемии (с ацетонурией). Кетотические гипогликемии являются внепанкреатическими и могут быть эндокринно- и неэндокриннозависимыми. Они сопровождаются относительным гиперинсулинизмом, то есть не связанным с патологией инсулярного аппарата поджелудочной железы (вторичный, функциональный, симптоматический гиперинсулинизм). Относительный гиперинсулинизм обусловлен повышением чувствительности организма к нормально выделяемому b-клетками панкреатических островков инсулину или нарушением компенсаторных механизмов, участвующих в регуляции углеводного обмена и в инактивации инсулина.
Эндокриннозависимые кетотические гипогликемии (без повышения уровня инсулина в крови) выявляются при недостаточности контринсулиновых гормонов у больных с гипофункцией передней доли гипофиза (церебрально-гипофизарный нанизм, изолированный дефицит СТГ, гипопитуитаризм), щитовидной железы (гипотиреоз), коры надпочечников (болезнь Аддисона).
Без повышения уровня инсулина могут протекать внепанкреатические гипогликемии, встречающиеся при экстрапанкреатических опухолях (грудной клетки, брюшной полости, ретроперитонеальные и т. д.), гипогликемии, сопровождающие диффузные заболевания печени, хроническую почечную недостаточность. У детей первого года жизни причиной кетотических неэндокринозависимых гипогликемий (без гиперинсулинизма) являются врожденные энзимопатии (гликогенозы).
В клинической практике часто встречаются реактивные гипогликемии — функциональный гиперинсулинизм при вегетососудистой дистонии. Они наблюдаются у лиц с ожирением, у детей-невротиков дошкольного возраста на фоне ацетонемических рвот из-за нарушения процессов глюконеогенеза и т. д.
Нередки также гипогликемии экзогенной природы (вызванные введением инсулина, сахароснижающих средств, салицилатов, сульфаниламидов и других лекарственных средств).
При функциональном гиперинсулинизме гипогликемии клинически менее выражены, содержание сахара крови не падает ниже 2,2 ммоль/л.
Обнаружить гипогликемию можно по клиническим признакам, чаще же сниженный уровень сахара в крови является лабораторной находкой. Достоверным считается выявление гипогликемии в ранние утренние часы или натощак перед завтраком в капиллярной крови не менее 2 — 3 раз (при отсутствии четких клинических данных). Показанием для обследования в стационаре является классическая клиника гиперинсулинизма или трижды подтвержденная утренняя гипогликемия (без клинических проявлений) ниже возрастных показателей (снижение гликемии натощак для новорожденных — менее 1,67 ммоль/л, 2 месяца — 18 лет — менее 2,2 ммоль/л, старше 18 лет — менее 2,7 ммоль/л).
Для гипогликемической болезни патогномоничной является триада Уиппла:
- возникновение приступов гипогликемии после длительного голодания или физической нагрузки;
- снижение содержания сахара в крови во время приступа ниже 1,7 ммоль/л у детей до 2 лет, ниже 2,2 ммоль/л — старше 2 лет;
- купирование гипогликемического приступа внутривенным введением глюкозы или пероральным приемом растворов глюкозы.
Большинство симптомов гипогликемии обусловлено недостаточным снабжением центральной нервной системы глюкозой. При снижении уровня глюкозы до гипогликемии включаются механизмы, направленные на гликогенолиз, глюконеогенез, мобилизацию свободных жирных кислот, кетогенез. В этих процессах участвуют в основном 4 гормона: норадреналин, глюкагон, кортизол, гормон роста. Первая группа симптомов связана с повышением в крови содержания катехоламинов, что вызывает слабость, тремор, тахикардию, потливость, беспокойство, чувство голода, побледнение кожных покровов. Симптомы со стороны ЦНС (симптомы нейрогликопении) включают головную боль, двоение в глазах, нарушение поведения (психическое возбуждение, агрессивность, негативизм), в дальнейшем наступает потеря сознания, появляются судороги, может развиться кома с гипорефлексией, поверхностным дыханием, мышечной атонией. Глубокая кома ведет к смерти или необратимым повреждениям ЦНС. Частые приступы гипогликемии приводят к изменению личности у взрослых, снижению интеллекта у детей. Отличие симптомов гипогликемии от настоящих неврологических состояний — положительный эффект приема пищи, обилие симптомов, не укладывающихся в клинику.
Наличие выраженных нервно-психических нарушений и недостаточная осведомленность врачей о гипогликемических состояниях часто приводят к тому, что вследствие диагностических ошибок больные с органическим гиперинсулинизмом длительно и безуспешно лечатся под самыми разными диагнозами. Ошибочные диагнозы ставятся у 3/4 больных с инсулиномой (эпилепсия диагностируется в 34% случаев, опухоль головного мозга — в 15%, вегетососудистая дистония — в 11%, диэнцефальный синдром — в 9%, психозы, неврастения — 3% (Dizon A. М., 1999).
Период острой гипогликемии — это результат срыва контринсулярных факторов и адаптационных свойств ЦНС.
Чаще всего приступ развивается в ранние утренние часы, что связано с продолжительным ночным перерывом в приеме пищи. Обычно больные не могут «проснуться» из-за различного рода расстройств сознания. Может быть вялость, апатия по утрам. Наблюдаемые у этих больных эпилептиформные припадки отличаются от истинных большей продолжительностью, хориоформными судорожными подергиваниями, гиперкинезами, обильной нейровегетативной симптоматикой. Распознавание заболевания требует тщательного изучения анамнеза и внимательного наблюдения за больными. Это особенно важно для диагностики органического гиперинсулинизма как причины гипогликемии у детей.
У детей первого года жизни клинически выявить гипогликемию сложно, так как симптомы нечетки и нетипичны. Это может быть цианоз, бледность кожных покровов, снижение мышечного тонуса, остановка дыхания (апноэ), тремор, судороги, «закатывание» глазных яблок (нистагм), беспокойство. При врожденной форме (незидиобластоз) наблюдается большая масса тела (крупный плод), отечность, круглое лицо.
У детей дошкольного и школьного возраста с органическим гиперинсулинизмом чаще регистрируется доброкачественная инсулинома. Для этих детей характерны утренняя неработоспособность, трудности утреннего пробуждения, нарушение концентрации внимания, выраженные чувство голода, тяга к сладкому, негативизм, сердцебиения. Гиперинсулинизм приводит к повышению аппетита и ожирению. Чем моложе ребенок, тем больше выражена склонность к низкому сахару крови в ответ на более продолжительные перерывы между приемами пищи.
Среди лабораторных показателей при подозрении на органический гиперинсулинизм (инсулиному или незидиобластоз) особое место занимает исследование иммунореактивного инсулина (ИРИ). Но, как показала практика, далеко не всегда при доказанной инсулиноме имеются повышенные его значения. ИРИ принято оценивать одновременно с уровнем гликемии. Важным является индекс отношения инсулина к глюкозе — ИРИ мкед/мл/глюкоза венозная ммоль/л. У здоровых людей и на фоне гипогликемии без гиперинсулинизма этот индекс составляет менее 5,4.
Среди функциональных проб, используемых для диагностики органического гиперинсулинизма, наиболее распространена проба с голоданием.
Проба основана на развитии гипогликемии у людей с гиперфункцией инсулярного аппарата поджелудочной железы при прекращении поступления углеводов с пищей. Во время проведения пробы больному разрешается пить только воду или чай без сахара. Чем младше ребенок и чем чаще приступы гипогликемии, тем проба короче.
Длительность пробы:
дети до 3 лет — 8 ч;
2 — 10 лет — 12-16 ч;
10 — 18 лет — 20 ч;
старше 18 лет — 72 ч.
(рекомендации кафедры детской эндокринологии РМАПО, Москва).
У детей 2 лет и старше последний прием пищи должен быть накануне вечером; детям до 2 лет пробу начинают в ранние утренние часы.
У здорового человека ночное, а также более продолжительное по времени голодание умеренно снижает уровень гликемии и, что характерно, уменьшает содержание инсулина в крови. При наличии опухоли, постоянно продуцирующей избыточное количество инсулина, в условиях голодания создаются предпосылки для развития гипогликемии, поскольку поступления глюкозы из кишечника нет, а печеночный гликогенолиз блокирован опухолевым инсулином.
Перед началом пробы определяют содержание глюкозы в плазме крови. Далее гликемия в капиллярной крови (глюкометром) исследуется у детей до 2 лет 1 раз в час, у детей в возрасте 2 лет и старше — 1 раз в 2 часа. При снижении сахара в крови до 3,3 ммоль/л и меньше интервалы исследования сокращаются в 2 — 3 раза. Порог допустимой гликемии, при котором голодание прекращают и проводят исследования, — 1,7 ммоль/л у ребенка до 2 лет, 2,2 ммоль/л у детей старше 2 лет. После регистрации глюкометром пороговой гипогликемии исследуется сыворотка крови на содержание ИРИ и контринсулиновых гормонов, глюкоза крови исследуется биохимическим методом (поскольку после снижения уровня глюкозы до 3,3 ммоль/л и ниже глюкометр дает неточный результат), исследуется уровень липидов крови.
Купируется приступ гипогликемии введением в/в струйно 40% глюкозы; сразу после введения глюкозы и через 3 часа после окончания пробы исследуется моча на содержание кетоновых тел.
Интерпретация результатов пробы
- Если ацетон в моче не обнаружен, значит, гипогликемия вызвана гиперинсулинизмом (повышенный инсулин подавляет процесс распада жирных кислот — липолиз). Наличие ацетонурии указывает на интенисивное образование кетоновых тел из поступающих из жировых депо жирных кислот. При гипогликемии, не связанной с гиперпродукцией инсулина, включается липолиз как источник энергии, что ведет к образованию кетоновых тел и образованию положительного ацетона в моче.
- При гиперинсулинизме содержание липидов в крови не изменено или снижено, при кетотических гипогликемиях уровень липидов повышен.
- Снижение уровня контринсулиновых гормонов отмечается при эндокринно-зависимых кетотических гипогликемиях; при органическом гиперинсулинизме показатели не изменены.
- Индекс ИРИ/венозная гликемия у здоровых детей и на фоне гипогликемии без гиперинсулинизма составляли менее 5,4, тогда как при органическом гиперинсулинизме этот показатель значительно возрастает.
В случае подтверждения гиперинсулинизма как причины гипогликемии необходимо дообследование и лечение в специализированном эндокринологическом отделении.
Во всех случаях инсулином показано хирургическое лечение. При незидиобластозе терапия может быть консервативной и радикальной. Наибольшее признание в настоящее время получил препарат диазоксид (прогликем, зароксолин). Гипергликемизирующий эффект этого недиуретического бензотиазида основан на торможении секреции инсулина из опухолевых клеток. Рекомендуемая доза для детей — 10 — 12 мг на кг массы тела в сутки в 2 — 3 приема. При отсутствии выраженной положительной динамики показано оперативное лечение — субтотальная или тотальная резекция поджелудочной железы (с возможным переходом в сахарный диабет).
С. А. Столярова, Т. Н. Дубовая, Р. Г. Гарипов
С. А. Мальмберг, доктор медицинских наук
В. И. Широкова, кандидат медицинских наук
ДКБ №38 ФУ «Медбиоэкстрем» при МЗ РФ, Москва
Больной Захар З., 3 мес., поступил в отделение психоневрологии ДКБ № 38 ФУ «Медбиоэкстрем» Москвы 01.11.02 с направляющим диагнозом эпилепсия.
Ребенок с умеренно отягощенным перинатальным анамнезом. Беременность у матери первая, протекала с токсикозом в первой половине, анемией. Роды на 40-й неделе, крупный плод (вес при рождении 4050 г, длина 54 см). Оценка по шкале Апгар — 8/9 баллов. С периода новорожденности до 2 мес. периодически отмечался тремор подбородка, с 2-месячного возраста появились приступообразные состояния в виде остановки взора, снижения двигательной активности, подергивания правой половины лица, правой руки (приступы фокальных судорог) — по несколько секунд 3 — 4 раза в сутки. Лечился амбулаторно у невропатолога, получал противосудорожную терапию без выраженного положительного эффекта. Накануне госпитализации появились хореиформные подергивания в утренние часы на фоне нарушенного сознания. Госпитализирован в отделение психоневрологии с направляющим диагнозом эпилепсия.
При поступлении состояние ребенка средней тяжести. В соматическом статусе — кожные покровы с проявлениями атопического дерматита, зев чистый, в легких хрипов нет, тоны сердца звучные, тахикардия до 140 — 160 уд. в мин. Живот мягкий, печень +2 см, селезенка +1 см. Мочеиспускание не нарушено. В неврологическом статусе — вялый, взгляд фиксирует, голову удерживает плохо. ЧН — интактны, мышечный тонус снижен, больше в руках, симметричный. Сухожильные рефлексы невысокие, Д=С, безусловные рефлексы н/р — по возрасту. Вес — 7 кг, рост — 61 см (отмечается избыток веса на фоне средневозрастного показателя роста).
В стационаре при исследовании биохимического анализа крови натощак впервые выявлено снижение сахара в крови до 1,6 ммоль/л при отсутствии кетоновых тел в моче.
Результаты лабораторного и инструментального обследования:
- Окулист — патологии на глазном дне не выявлено.
- ЭКГ — ЧСС 140, синусовый ритм, вертикальное положение ЭОС.
- Аллерголог — атопический дерматит, распространенная форма, легкое течение.
- УЗИ органов брюшной полости — поджелудочная железа в типичном месте четко не визуализируется. УЗИ надпочечников — без изменений. УЗИ почек — реактивные изменения стенок ЧЛС, синдром Фрейли слева, нельзя исключить пиелоэктазию слева. Селезенка — умеренная спленомегалия.
- Общий анализ крови — Нb 129 г/л, эр — 5,08 млн., л — 8,7 тыс, СОЭ-3 мм/час.
- Общий анализ мочи — белок, сахар, ацетон — отр., Л — 2 — 3 в п/зр., эр — 0 — 1 в п/зр.
- Биохимия крови (при поступлении) — белок общ. — 60,5 г/л, АЛТ — 20,2 г/л, АСТ — 66,9 г/л, билирубин общ. — 3,61 мкмоль/л, глюкоза — 1,6 ммоль/л, креатинин-36,8 мкмоль/л, мочевина — 1,88 ммоль/л, холестерин общ. — 4,44 ммоль/л, железо общ. — 31,92 мкмоль/л, калий — 4,9 ммоль/л, натрий — 140,0 ммоль/л.
Динамический контроль уровня глюкозы позволил выявить стойкую гипогликемию в капиллярной и венозной крови. Натощак и через 2 часа после кормления грудным молоком в течение суток гликемия колебалась от 0,96 до 3,2 ммоль/л. Клинически гипогликемия проявлялась повышенным аппетитом, вялостью, тахикардией, эпизодами «закатывания» правого глазного яблока, генерализованными эпилептиформными судорогами. В межприступный период самочувствие удовлетворительное. Гипогликемические состояния купировались приемом глюкозы внутрь, а также внутривенным введением 10%-ной глюкозы.
С диагностической целью для подтверждения гиперинсулинизма ребенку проведена проба с голоданием: последнее ночное кормление в 6 часов утра, перед кормлением гликемия — 2,8 ммоль/л, через 3,5 часа после кормления глюкометром отмечено снижение уровня гликемии до 1,5 ммоль/л (ниже допустимого порогового значения). На фоне гипогликемии взята сыворотка крови для гормонального исследования (ИРИ, с-пептид. кортизол, СТГ). Сделан забор венозной крови для биохимического исследования уровня глюкозы и липидов. После купирования гипогликемии в/в струйным введением глюкозы собрана трехчасовая порция мочи на содержание кетоновых тел.
Результаты пробы: ацетонурии нет. Уровень контринсулиновых гормонов не снижен (кортизол — 363,6 при норме 171 — 536 нмоль/л, СТГ — 2,2 при норме 2,6 — 24,9 мкЕ/мл). С-пептид — 0,53 при норме — 0,36 — 1,7 пмоль/л. ИРИ — 19,64 при норме — 2,6 — 24,9 ммкЕ/мл. Глюкоза венозная — 0,96 ммоль/л. Уровень липидов крови на нижней границе нормы (триглицериды — 0,4 ммоль/л, холестерин общ. — 2,91 ммоль/л, холестерин липопр. выс. плотн. — 1,06 ммоль/л, холест. липопр. низк. плотн. — 1,67 ммоль/л. Индекс ИРИ/глюкоза (19,64 /0,96) составил 20,45 при норме менее 5,4.
Данные анамнеза, динамического наблюдения, клинико-лабораторного обследования позволили поставить диагноз: некетотическая гипогликемия. Гиперинсулинизм. Незидиобластоз?
Для уточнения генеза заболевания и тактики лечения ребенок переведен в эндокринологическое отделение РДКБ Москвы, где инсулинома у мальчика исключена. Подтвержден диагноз незидиобластоз. Назначено пробное консервативное лечение прогликемом в дозе 10 мг на кг массы тела. Отмечена тенденция к нормализации показателей углеводного обмена. Планируется дальнейшее динамическое наблюдение для коррекции тактики лечения.
Рассмотренный клинический случай диктует необходимость исследования показателей углеводного обмена у всех детей раннего возраста с судорожным синдромом, ввиду стертости клинических симптомов гипогликемии у детей грудного и раннего детского возраста, для исключения диагностических ошибок.
Гипогликемия новорожденных — StatPearls — Книжная полка NCBI
Непрерывное обучение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным. Тем не менее, четкое определение неонатальной гипогликемии отсутствует. Текущие рекомендации по скринингу и алгоритмы лечения основаны на ограниченных доказательствах и больше полагаются на мнение экспертов при составлении рекомендаций.В этом упражнении рассматривается неонатальная гипогликемия и необходимость углубления знаний о ней. Это упражнение подчеркивает роль межпрофессиональной группы в распознавании и лечении неонатальной гипогликемии.
Цели:
Объяснить особенности неонатальной гипогликемии.
Опишите текущие рекомендации по ведению неонатальной гипогликемии.
Просмотрите, как можно уточнить текущие знания о неонатальной гипогликемии.
Объясните роль членов межпрофессиональной группы в оптимизации сотрудничества и коммуникации, чтобы гарантировать раннее распознавание неонатальной гипогликемии и приложить все усилия для оказания оптимальной помощи, которая приведет к улучшенным результатам.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным.Тем не менее, четкое определение неонатальной гипогликемии отсутствует. [1] [2] [3] Текущие рекомендации по скринингу и алгоритмы ведения основаны на ограниченных доказательствах, больше полагаясь на мнение экспертов при составлении рекомендаций. [1] [3] [4]
Несмотря на лучшее понимание раннего гомеостаза глюкозы и переходной гипогликемии в первые 48 часов жизни, пробелы в наших знаниях сохраняются. Наблюдения показали, что у здоровых младенцев преходящая гипогликемия является частью нормальной адаптации к внематочной жизни со снижением концентрации глюкозы в крови до значений от 20 до 25 мг / дл в первые два часа жизни.[1] Однако, поскольку мы обычно не измеряем концентрацию глюкозы в крови у здоровых младенцев без факторов риска гипогликемии, трудно определить «нормальные» уровни глюкозы в крови в первые 48 часов жизни. Как Harding et al. вопрос: «даже если у здоровых младенцев наблюдаются низкие концентрации глюкозы, можем ли мы распространить эти значения на младенцев с риском нарушения метаболической адаптации?» [5] И насколько низкий является слишком низким?
Многоцентровое исследование питания, проведенное в 1988 г. Lucas et al. предложили концентрацию глюкозы в крови <47 мг / дл в качестве критического порога, связанного с неблагоприятными исходами развития нервной системы.[1] [2] [5] [6] В исследовании изучался уровень глюкозы в крови у 661 недоношенного ребенка с массой тела при рождении <1850 граммов, включенных в исследование питания, посвященное стратегиям раннего кормления и когнитивным результатам. [1] [6] Исследователи обнаружили, что количество дней с концентрацией глюкозы в крови <47 мг / дл, связанное с более низкими показателями моторного и умственного развития по шкале Бейли для младенческого развития в 18 месяцев, скорректировано по возрасту [6]. У младенцев, у которых наблюдалась гипогликемия (глюкоза <47 мг / дл) в течение 5 или более дней, риск нарушения развития нервной системы увеличивался в 3-5 раз.[6] Авторы пришли к выводу, что «даже умеренная гипогликемия связана со значительным увеличением неблагоприятных последствий развития нервной системы», и призвали к переоценке нынешних тенденций в практике. В результате это значение «47 мг / дл» стало широко принятым в качестве стандартного числового значения для определения неонатальной гипогликемии для всех младенцев, даже здоровых, доношенных, подходящих для младенцев гестационного возраста [1].
Очевидно, что чрезвычайно низкие концентрации глюкозы в крови у новорожденных могут вызывать апноэ, раздражительность, летаргию, судороги [7] [8] и повреждение головного мозга [9]; и что длительная или симптоматическая гипогликемия может коррелировать с долгосрочными нарушениями развития нервной системы.[1] [10] Однако долгосрочное значение ранних, бессимптомных и временно низких уровней глюкозы до сих пор не установлено. И доказательства, подтверждающие четкое численное значение глюкозы в крови, которое связано с травмой головного мозга или надежно предсказывает неблагоприятные исходы развития нервной системы, отсутствуют. [3] [2] Даже Лукас и др. признал, что «связь между [концентрациями глюкозы в крови <47 мг / дл] и плохими исходами нервного развития не может быть причинной и может отражать неспособность внести поправку на смешивающие факторы.'[6]
Этиология
У здоровых младенцев наблюдается ожидаемое падение концентрации глюкозы в крови сразу после рождения как часть нормального физиологического перехода к внематочной жизни. Резкое пережатие пуповины при рождении нарушает связь младенца с плацентой, от которой он зависел, чтобы поставлять глюкозу и другие метаболиты, необходимые для удовлетворения его энергетических потребностей в утробе матери. Непрерывное поступление экзогенной внутривенной глюкозы из плаценты внезапно прекращается, и концентрация глюкозы в крови ребенка снижается в первые часы жизни.Для большинства здоровых младенцев эта переходная неонатальная гипогликемия является кратковременной, преходящей и чаще всего бессимптомной. [4] [11]
Младенцы подвержены риску более тяжелой или продолжительной гипогликемии из-за одного или комбинации следующих основных механизмов: недостаточное поступление глюкозы, низкие запасы гликогена или жира или слабые механизмы производства глюкозы; повышенное использование глюкозы, вызванное чрезмерным производством инсулина или повышенным метаболическим спросом; или отказ контррегулирующих механизмов (т.е., гипофизарная или надпочечниковая недостаточность). [12] [11] Неонатальная гипогликемия чаще всего поражает следующие группы младенцев [3]:
Ограничение внутриутробного развития или маленькие по сравнению с младенцами гестационного возраста
Младенцы от матерей с диабетом или большие младенцы для гестационного возраста
Поздно недоношенные младенцы (Гестационный возраст от 34 до 36,6 недель)
Недоношенные, ограниченные внутриутробные дети и маленькие для гестационного возраста младенцы подвержены риску гипогликемии, потому что они рождаются с уменьшенными запасами гликогена, уменьшенной жировой тканью и испытывают повышенные метаболические потребности из-за их относительно большого размера. размер мозга.[1] [12] У недоношенных детей с очень низкой массой тела при рождении (<1000 г) ферменты, участвующие в глюконеогенезе, экспрессируются на низком уровне; таким образом, их способность продуцировать эндогенную глюкозу низкая, что увеличивает риск серьезных или продолжительных низких концентраций глюкозы. [12]
Младенцы от матерей с диабетом (IDM) и большие для гестационного возраста младенцы страдают гиперинсулинизмом плода и повышенной утилизацией периферической глюкозы, что подвергает их риску гипогликемии в ближайшем послеродовом периоде.[1] [4] [12] Плацента снабжает плод прямым источником глюкозы посредством облегченной диффузии, так что концентрация глюкозы у плода пропорциональна материнскому уровню. Длительное повышение концентрации глюкозы у матери приводит к гипергликемии плода и чрезмерной стимуляции поджелудочной железы, что приводит к увеличению выработки эндогенного инсулина плода. [12] Эти повышенные уровни инсулина плода сохраняются после рождения и, в отсутствие постоянного источника экзогенной глюкозы, приводят к увеличению утилизации глюкозы и снижение концентрации глюкозы в крови.[12] IDM имеют пониженную способность мобилизовать запасы гликогена после рождения и испытывают относительную надпочечниковую недостаточность с пониженным уровнем катехоламинов, что еще больше увеличивает риск низкого уровня глюкозы в крови.
Младенцы, испытывающие перинатальный стресс (например, дистресс плода, перинатальная ишемия, преэклампсия / эклампсия у матери, сепсис, гипотермия) или дети с врожденными пороками сердца, имеют повышенные потребности в метаболической энергии, что подвергает их риску гипогликемии. [1] [4] [12] Перинатальный стресс вызывает состояние «гипогликемического гиперинсулинизма», которое может сохраняться от нескольких дней до недель, что приводит к устойчиво низким концентрациям глюкозы, требующим постоянного вмешательства для поддержания эугликемии.[1]
Другие ятрогенные причины преходящей неонатальной гипогликемии включают внутриродовое введение материнских лекарств (например, бета-адренергических токолитиков, вальпроевой кислоты, пропранолола и проводниковых анестетиков), отсроченное кормление и введение экзогенного инсулина. [12] [11] ]
Низкие концентрации глюкозы после первых 48 часов жизни вызывают беспокойство по поводу основного заболевания как этиологии гипогликемии. Основные физиологические механизмы, вызывающие патологическую или стойкую гипогликемию, аналогичны описанным выше: гиперинсулинизм (например,g., врожденный гиперинсулинизм, синдром Беквита-Видмана, синдром Сото), недостаточное снабжение энергией (т. е. врожденные нарушения метаболизма, которые приводят к дефициту гликогена, аминокислот или свободных жирных кислот) или дефицит кортизола или гормона роста ( например, синдром Костелло, гипопитуитаризм, врожденная гиперплазия надпочечников). Причины стойкой неонатальной гипогликемии включают [12] [10]:
Врожденный гиперинсулинизм
Врожденные синдромы: синдром Беквита-Видемана, синдром Сото, синдром Костелло
Эндокринные нарушения: врожденная гипопокринная гипоплазия, врожденная гипопокринная болезнь. гипотиреоз
Врожденные нарушения обмена веществ: болезнь мочи кленового сиропа, нарушения накопления гликогена, наследственная непереносимость фруктозы, галактоземия, нарушения окисления жирных кислот
Эпидемиология
Сообщаемая частота неонатальной гипогликемии варьируется в зависимости от нескольких факторов: включали популяцию младенцев, частоту и время тестирования глюкозы, использованный метод тестирования и определение гипогликемии.В исследовании 2006 г., проведенном Harris et al. который стремился определить частоту гипогликемии (уровень глюкозы в крови <47 мг / дл) в первые 48 часов жизни у младенцев старше 35 недель с риском гипогликемии в соответствии с рекомендациями AAP, обнаружил, что 25% всех родов имели риск гипогликемии. ; из этих младенцев из группы риска 51% испытали по крайней мере один эпизод гипогликемии. [1] [13]
Патофизиология
Плод зависит от материнского метаболизма и плацентарного кровообращения, обеспечивая глюкозу, кетоны, свободные жирные кислоты и аминокислоты, необходимые для удовлетворения его энергетических потребностей.[2] Плацента обеспечивает кровообращение плода прямым источником глюкозы. [2] [5] Зажатие пуповины при рождении резко нарушает этот непрерывный источник глюкозы, что приводит к быстрому снижению уровня глюкозы в крови в первые 2–3 часа жизни. [1] [2] [5] Низкие концентрации глюкозы в крови вызывают выброс инсулина и других гормонов (включая катехоламины, глюкагон и кортикостероиды), которые стимулируют выработку глюкозы посредством глюконеогенеза и гликогенолиза и усиливают окисление жирных кислот.Это обеспечивает младенца эндогенным источником глюкозы и других энергетических субстратов, необходимых для поддержания его метаболизма [1]; результатом является постепенное повышение уровня глюкозы в крови в течение следующих нескольких часов или дней. [5] Считается также, что низкий уровень глюкозы стимулирует аппетит новорожденного и помогает ему адаптироваться к прерывистому питанию. [1]
Любой механизм, нарушающий эту последовательность физиологических изменений, подвергает младенца риску более серьезных или продолжительных периодов низкого уровня глюкозы.Риск гипогликемии наиболее высок в первые часы после рождения. [5] [12]
Стойкая гипогликемия возникает в результате чрезмерной секреции инсулина, дефицита кортизола или гормона роста или врожденных нарушений метаболизма. [4] [12]
Анамнез и физические данные
Клинические проявления гипогликемии новорожденных могут быть разными. В остальном здоровый младенец может оставаться бессимптомным, несмотря на чрезвычайно низкий уровень глюкозы в крови в период переходной гипогликемии. Клинические симптомы не коррелируют с уровнем глюкозы в крови.
Симптомы неонатальной гипогликемии включают [2] [11]:
Потливость
Проблемы с кормлением, плохое сосание
Слабый или пронзительный крик
Тремор
Раздражительность
Летаргия / ступор
Гипотония
Судороги
Кома
Апноэ, хрипы или тахипноэ
Симптоматическая гипогликемия
Большой для гестационного возраста
- Перинатальный стресс
Перинатальная гипоксия / ишемия, дистресс плода
Материнская преэклампсия / эклампсия
Синдром аспирации мекония, эритробластоз плода, полицитемия, гипотермия
014
014
Семейный анамнез генетической гипогликемии
Врожденный синдром (e.g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
Симптоматическая гипогликемия или тяжелая гипогликемия, требующая лечения декстрозой внутривенно
Младенцы, неспособные поддерживать концентрацию глюкозы в крови> 50 мг / дл в первые 48 часов жизни и> 60 после 48 часов
Семейный анамнез генетической формы гипогликемии
Врожденный синдром (например,g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
- 1.
- Адамкин Д.Х. Неонатальная гипогликемия. Semin Fetal Neonatal Med. 2017 Февраль; 22 (1): 36-41. [PubMed: 27605513]
- 2.
- Тин В. Определение неонатальной гипогликемии: продолжающиеся дебаты. Semin Fetal Neonatal Med. 2014 Февраль; 19 (1): 27-32. [PubMed: 24148999]
- 3.
- Комитет по плодам и новорожденным. Адамкин Д.Х. Послеродовой гомеостаз глюкозы у недоношенных и доношенных детей.Педиатрия. 2011 Март; 127 (3): 575-9. [PubMed: 21357346]
- 4.
- Thornton PS, Stanley CA, De Leon DD, Harris D, Haymond MW, Hussain K, Levitsky LL, Murad MH, Rozance PJ, Simmons RA, Sperling MA, Weinstein DA, White NH , Wolfsdorf JI., Педиатрическое эндокринное общество. Рекомендации Детского эндокринного общества по оценке и лечению стойкой гипогликемии у новорожденных, младенцев и детей. J Pediatr. 2015 Август; 167 (2): 238-45. [PubMed: 25957977]
- 5.
- Harding JE, Harris DL, Hegarty JE, Alsweiler JM, McKinlay CJ.Новая доказательная база для ведения неонатальной гипогликемии. Early Hum Dev. 2017 Янв; 104: 51-56. [Бесплатная статья PMC: PMC5280577] [PubMed: 27989586]
- 6.
- Лукас А., Морли Р., Коул Т.Дж.. Неблагоприятный исход развития нервной системы при умеренной гипогликемии новорожденных. BMJ. 19 ноября 1988 г .; 297 (6659): 1304-8. [Бесплатная статья PMC: PMC1834933] [PubMed: 2462455]
- 7.
- CORNBLATH M, ODELL GB, LEVIN EY. Симптоматическая неонатальная гипогликемия, связанная с токсемией беременности.J Pediatr. 1959 ноябрь; 55: 545-62. [PubMed: 13811999]
- 8.
- HAWORTH JC, COODIN FJ, FINKEL KC, WEIDMAN ML. Гипогликемия, связанная с симптомами в период новорожденности. Can Med Assoc J. 1963, 5 января; 88: 23-8. [Бесплатная статья PMC: PMC1920909] [PubMed: 13953228]
- 9.
- Андерсон Дж. М., Милнер Р. Д., Стрих С. Дж. Влияние гипогликемии новорожденных на нервную систему: патологическое исследование. J Neurol Neurosurg Psychiatry. 1967 августа; 30 (4): 295-310. [Бесплатная статья PMC: PMC496190] [PubMed: 6055339]
- 10.
- Томпсон-Бранч А., Хавранек Т. Гипогликемия новорожденных. Pediatr Rev.2017 Апрель; 38 (4): 147-157. [PubMed: 28364046]
- 11.
- Пухальский М.Л., Рассел Т.Л., Карлсен К.А. Неонатальная гипогликемия: есть ли сладкое пятно? Crit Care Nurs Clin North Am. 2018 декабрь; 30 (4): 467-480. [PubMed: 30447807]
- 12.
- Шарма А., Дэвис А., Шехават П.С. Гипогликемия у недоношенных новорожденных: этиопатогенез, диагностика, лечение и отдаленные результаты. Перевод Педиатр. 2017 Октябрь; 6 (4): 335-348.[Бесплатная статья PMC: PMC5682372] [PubMed: 29184814]
- 13.
- Харрис Д.Л., Вестон П.Дж., Хардинг Д.Э. Заболеваемость неонатальной гипогликемией у детей, относящихся к группе риска. J Pediatr. 2012 ноябрь; 161 (5): 787-91. [PubMed: 22727868]
- 14.
- Харрис Д.Л., Баттин М.Р., Уэстон П.Дж., Хардинг Дж. Непрерывный мониторинг уровня глюкозы у новорожденных с риском гипогликемии. J Pediatr. 2010 август; 157 (2): 198-202.e1. [PubMed: 20338573]
- 15.
- Tin W, Brunskill G, Kelly T, Fritz S.15-летнее наблюдение рецидивирующей «гипогликемии» у недоношенных детей. Педиатрия. 2012 декабрь; 130 (6): e1497-503. [PubMed: 23129080]
- 16.
- Болайт Н., ван Кемпен А., Оффринга М. Нейроразвитие после неонатальной гипогликемии: систематический обзор и дизайн оптимального будущего исследования. Педиатрия. 2006 июн; 117 (6): 2231-43. [PubMed: 16740869]
- 17.
- Шах Р., Хардинг Дж., Браун Дж., Мак-Кинли С. Неонатальная гликемия и результаты нервного развития: систематический обзор и метаанализ.Неонатология. 2019; 115 (2): 116-126. [PubMed: 30408811]
- 18.
- Hay WW, Raju TN, Higgins RD, Kalhan SC, Devaskar SU. Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья детей и развития человека Юнис Кеннеди Шрайвер. J Pediatr. 2009 ноябрь; 155 (5): 612-7. [Бесплатная статья PMC: PMC3857033] [PubMed: 19840614]
- 19.
- McKinlay CJD, Alsweiler JM, Anstice NS, Burakevych N, Chakraborty A, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Nyan Y, Paudel Jiang Y , Сан-Диего RJ, Томпсон B, Wouldes TA, Harding JE., Группа изучения детей с гипогликемией и их последующим развитием (CHYLD). Связь неонатальной гликемии с исходами нервного развития через 4,5 года. JAMA Pediatr. 2017 г. 01 октября; 171 (10): 972-983. [Бесплатная статья PMC: PMC5710616] [PubMed: 28783802]
Объяснить особенности неонатальной гипогликемии.
Опишите текущие рекомендации по ведению неонатальной гипогликемии.
Просмотрите, как можно уточнить текущие знания о неонатальной гипогликемии.
Объясните роль членов межпрофессиональной группы в оптимизации сотрудничества и коммуникации, чтобы гарантировать раннее распознавание неонатальной гипогликемии и приложить все усилия для оказания оптимальной помощи, которая приведет к улучшенным результатам.
Ограничение внутриутробного развития или маленькие по сравнению с младенцами гестационного возраста
Младенцы от матерей с диабетом или большие младенцы для гестационного возраста
Поздно недоношенные младенцы (Гестационный возраст от 34 до 36,6 недель)
Врожденный гиперинсулинизм
Врожденные синдромы: синдром Беквита-Видемана, синдром Сото, синдром Костелло
Эндокринные нарушения: врожденная гипопокринная гипоплазия, врожденная гипопокринная болезнь. гипотиреоз
Врожденные нарушения обмена веществ: болезнь мочи кленового сиропа, нарушения накопления гликогена, наследственная непереносимость фруктозы, галактоземия, нарушения окисления жирных кислот
Потливость
Проблемы с кормлением, плохое сосание
Слабый или пронзительный крик
Тремор
Раздражительность
Летаргия / ступор
Гипотония
Судороги
Кома
Апноэ, хрипы или тахипноэ
Симптоматическая гипогликемия
Большой для гестационного возраста
- Перинатальный стресс
Перинатальная гипоксия / ишемия, дистресс плода
Материнская преэклампсия / эклампсия
Синдром аспирации мекония, эритробластоз плода, полицитемия, гипотермия
014
014
Семейный анамнез генетической гипогликемии
Врожденный синдром (e.g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
Симптоматическая гипогликемия или тяжелая гипогликемия, требующая лечения декстрозой внутривенно
Младенцы, неспособные поддерживать концентрацию глюкозы в крови> 50 мг / дл в первые 48 часов жизни и> 60 после 48 часов
Семейный анамнез генетической формы гипогликемии
Врожденный синдром (например,g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
- 1.
- Адамкин Д.Х. Неонатальная гипогликемия. Semin Fetal Neonatal Med. 2017 Февраль; 22 (1): 36-41. [PubMed: 27605513]
- 2.
- Тин В. Определение неонатальной гипогликемии: продолжающиеся дебаты. Semin Fetal Neonatal Med. 2014 Февраль; 19 (1): 27-32. [PubMed: 24148999]
- 3.
- Комитет по плодам и новорожденным. Адамкин Д.Х. Послеродовой гомеостаз глюкозы у недоношенных и доношенных детей.Педиатрия. 2011 Март; 127 (3): 575-9. [PubMed: 21357346]
- 4.
- Thornton PS, Stanley CA, De Leon DD, Harris D, Haymond MW, Hussain K, Levitsky LL, Murad MH, Rozance PJ, Simmons RA, Sperling MA, Weinstein DA, White NH , Wolfsdorf JI., Педиатрическое эндокринное общество. Рекомендации Детского эндокринного общества по оценке и лечению стойкой гипогликемии у новорожденных, младенцев и детей. J Pediatr. 2015 Август; 167 (2): 238-45. [PubMed: 25957977]
- 5.
- Harding JE, Harris DL, Hegarty JE, Alsweiler JM, McKinlay CJ.Новая доказательная база для ведения неонатальной гипогликемии. Early Hum Dev. 2017 Янв; 104: 51-56. [Бесплатная статья PMC: PMC5280577] [PubMed: 27989586]
- 6.
- Лукас А., Морли Р., Коул Т.Дж.. Неблагоприятный исход развития нервной системы при умеренной гипогликемии новорожденных. BMJ. 19 ноября 1988 г .; 297 (6659): 1304-8. [Бесплатная статья PMC: PMC1834933] [PubMed: 2462455]
- 7.
- CORNBLATH M, ODELL GB, LEVIN EY. Симптоматическая неонатальная гипогликемия, связанная с токсемией беременности.J Pediatr. 1959 ноябрь; 55: 545-62. [PubMed: 13811999]
- 8.
- HAWORTH JC, COODIN FJ, FINKEL KC, WEIDMAN ML. Гипогликемия, связанная с симптомами в период новорожденности. Can Med Assoc J. 1963, 5 января; 88: 23-8. [Бесплатная статья PMC: PMC1920909] [PubMed: 13953228]
- 9.
- Андерсон Дж. М., Милнер Р. Д., Стрих С. Дж. Влияние гипогликемии новорожденных на нервную систему: патологическое исследование. J Neurol Neurosurg Psychiatry. 1967 августа; 30 (4): 295-310. [Бесплатная статья PMC: PMC496190] [PubMed: 6055339]
- 10.
- Томпсон-Бранч А., Хавранек Т. Гипогликемия новорожденных. Pediatr Rev.2017 Апрель; 38 (4): 147-157. [PubMed: 28364046]
- 11.
- Пухальский М.Л., Рассел Т.Л., Карлсен К.А. Неонатальная гипогликемия: есть ли сладкое пятно? Crit Care Nurs Clin North Am. 2018 декабрь; 30 (4): 467-480. [PubMed: 30447807]
- 12.
- Шарма А., Дэвис А., Шехават П.С. Гипогликемия у недоношенных новорожденных: этиопатогенез, диагностика, лечение и отдаленные результаты. Перевод Педиатр. 2017 Октябрь; 6 (4): 335-348.[Бесплатная статья PMC: PMC5682372] [PubMed: 29184814]
- 13.
- Харрис Д.Л., Вестон П.Дж., Хардинг Д.Э. Заболеваемость неонатальной гипогликемией у детей, относящихся к группе риска. J Pediatr. 2012 ноябрь; 161 (5): 787-91. [PubMed: 22727868]
- 14.
- Харрис Д.Л., Баттин М.Р., Уэстон П.Дж., Хардинг Дж. Непрерывный мониторинг уровня глюкозы у новорожденных с риском гипогликемии. J Pediatr. 2010 август; 157 (2): 198-202.e1. [PubMed: 20338573]
- 15.
- Tin W, Brunskill G, Kelly T, Fritz S.15-летнее наблюдение рецидивирующей «гипогликемии» у недоношенных детей. Педиатрия. 2012 декабрь; 130 (6): e1497-503. [PubMed: 23129080]
- 16.
- Болайт Н., ван Кемпен А., Оффринга М. Нейроразвитие после неонатальной гипогликемии: систематический обзор и дизайн оптимального будущего исследования. Педиатрия. 2006 июн; 117 (6): 2231-43. [PubMed: 16740869]
- 17.
- Шах Р., Хардинг Дж., Браун Дж., Мак-Кинли С. Неонатальная гликемия и результаты нервного развития: систематический обзор и метаанализ.Неонатология. 2019; 115 (2): 116-126. [PubMed: 30408811]
- 18.
- Hay WW, Raju TN, Higgins RD, Kalhan SC, Devaskar SU. Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья детей и развития человека Юнис Кеннеди Шрайвер. J Pediatr. 2009 ноябрь; 155 (5): 612-7. [Бесплатная статья PMC: PMC3857033] [PubMed: 19840614]
- 19.
- McKinlay CJD, Alsweiler JM, Anstice NS, Burakevych N, Chakraborty A, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Nyan Y, Paudel Jiang Y , Сан-Диего RJ, Томпсон B, Wouldes TA, Harding JE., Группа изучения детей с гипогликемией и их последующим развитием (CHYLD). Связь неонатальной гликемии с исходами нервного развития через 4,5 года. JAMA Pediatr. 2017 г. 01 октября; 171 (10): 972-983. [Бесплатная статья PMC: PMC5710616] [PubMed: 28783802]
Объяснить особенности неонатальной гипогликемии.
Опишите текущие рекомендации по ведению неонатальной гипогликемии.
Просмотрите, как можно уточнить текущие знания о неонатальной гипогликемии.
Объясните роль членов межпрофессиональной группы в оптимизации сотрудничества и коммуникации, чтобы гарантировать раннее распознавание неонатальной гипогликемии и приложить все усилия для оказания оптимальной помощи, которая приведет к улучшенным результатам.
Ограничение внутриутробного развития или маленькие по сравнению с младенцами гестационного возраста
Младенцы от матерей с диабетом или большие младенцы для гестационного возраста
Поздно недоношенные младенцы (Гестационный возраст от 34 до 36,6 недель)
Врожденный гиперинсулинизм
Врожденные синдромы: синдром Беквита-Видемана, синдром Сото, синдром Костелло
Эндокринные нарушения: врожденная гипопокринная гипоплазия, врожденная гипопокринная болезнь. гипотиреоз
Врожденные нарушения обмена веществ: болезнь мочи кленового сиропа, нарушения накопления гликогена, наследственная непереносимость фруктозы, галактоземия, нарушения окисления жирных кислот
Потливость
Проблемы с кормлением, плохое сосание
Слабый или пронзительный крик
Тремор
Раздражительность
Летаргия / ступор
Гипотония
Судороги
Кома
Апноэ, хрипы или тахипноэ
Симптоматическая гипогликемия
Большой для гестационного возраста
- Перинатальный стресс
Перинатальная гипоксия / ишемия, дистресс плода
Материнская преэклампсия / эклампсия
Синдром аспирации мекония, эритробластоз плода, полицитемия, гипотермия
014
014
Семейный анамнез генетической гипогликемии
Врожденный синдром (e.g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
Симптоматическая гипогликемия или тяжелая гипогликемия, требующая лечения декстрозой внутривенно
Младенцы, неспособные поддерживать концентрацию глюкозы в крови> 50 мг / дл в первые 48 часов жизни и> 60 после 48 часов
Семейный анамнез генетической формы гипогликемии
Врожденный синдром (например,g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
- 1.
- Адамкин Д.Х. Неонатальная гипогликемия. Semin Fetal Neonatal Med. 2017 Февраль; 22 (1): 36-41. [PubMed: 27605513]
- 2.
- Тин В. Определение неонатальной гипогликемии: продолжающиеся дебаты. Semin Fetal Neonatal Med. 2014 Февраль; 19 (1): 27-32. [PubMed: 24148999]
- 3.
- Комитет по плодам и новорожденным. Адамкин Д.Х. Послеродовой гомеостаз глюкозы у недоношенных и доношенных детей.Педиатрия. 2011 Март; 127 (3): 575-9. [PubMed: 21357346]
- 4.
- Thornton PS, Stanley CA, De Leon DD, Harris D, Haymond MW, Hussain K, Levitsky LL, Murad MH, Rozance PJ, Simmons RA, Sperling MA, Weinstein DA, White NH , Wolfsdorf JI., Педиатрическое эндокринное общество. Рекомендации Детского эндокринного общества по оценке и лечению стойкой гипогликемии у новорожденных, младенцев и детей. J Pediatr. 2015 Август; 167 (2): 238-45. [PubMed: 25957977]
- 5.
- Harding JE, Harris DL, Hegarty JE, Alsweiler JM, McKinlay CJ.Новая доказательная база для ведения неонатальной гипогликемии. Early Hum Dev. 2017 Янв; 104: 51-56. [Бесплатная статья PMC: PMC5280577] [PubMed: 27989586]
- 6.
- Лукас А., Морли Р., Коул Т.Дж.. Неблагоприятный исход развития нервной системы при умеренной гипогликемии новорожденных. BMJ. 19 ноября 1988 г .; 297 (6659): 1304-8. [Бесплатная статья PMC: PMC1834933] [PubMed: 2462455]
- 7.
- CORNBLATH M, ODELL GB, LEVIN EY. Симптоматическая неонатальная гипогликемия, связанная с токсемией беременности.J Pediatr. 1959 ноябрь; 55: 545-62. [PubMed: 13811999]
- 8.
- HAWORTH JC, COODIN FJ, FINKEL KC, WEIDMAN ML. Гипогликемия, связанная с симптомами в период новорожденности. Can Med Assoc J. 1963, 5 января; 88: 23-8. [Бесплатная статья PMC: PMC1920909] [PubMed: 13953228]
- 9.
- Андерсон Дж. М., Милнер Р. Д., Стрих С. Дж. Влияние гипогликемии новорожденных на нервную систему: патологическое исследование. J Neurol Neurosurg Psychiatry. 1967 августа; 30 (4): 295-310. [Бесплатная статья PMC: PMC496190] [PubMed: 6055339]
- 10.
- Томпсон-Бранч А., Хавранек Т. Гипогликемия новорожденных. Pediatr Rev.2017 Апрель; 38 (4): 147-157. [PubMed: 28364046]
- 11.
- Пухальский М.Л., Рассел Т.Л., Карлсен К.А. Неонатальная гипогликемия: есть ли сладкое пятно? Crit Care Nurs Clin North Am. 2018 декабрь; 30 (4): 467-480. [PubMed: 30447807]
- 12.
- Шарма А., Дэвис А., Шехават П.С. Гипогликемия у недоношенных новорожденных: этиопатогенез, диагностика, лечение и отдаленные результаты. Перевод Педиатр. 2017 Октябрь; 6 (4): 335-348.[Бесплатная статья PMC: PMC5682372] [PubMed: 29184814]
- 13.
- Харрис Д.Л., Вестон П.Дж., Хардинг Д.Э. Заболеваемость неонатальной гипогликемией у детей, относящихся к группе риска. J Pediatr. 2012 ноябрь; 161 (5): 787-91. [PubMed: 22727868]
- 14.
- Харрис Д.Л., Баттин М.Р., Уэстон П.Дж., Хардинг Дж. Непрерывный мониторинг уровня глюкозы у новорожденных с риском гипогликемии. J Pediatr. 2010 август; 157 (2): 198-202.e1. [PubMed: 20338573]
- 15.
- Tin W, Brunskill G, Kelly T, Fritz S.15-летнее наблюдение рецидивирующей «гипогликемии» у недоношенных детей. Педиатрия. 2012 декабрь; 130 (6): e1497-503. [PubMed: 23129080]
- 16.
- Болайт Н., ван Кемпен А., Оффринга М. Нейроразвитие после неонатальной гипогликемии: систематический обзор и дизайн оптимального будущего исследования. Педиатрия. 2006 июн; 117 (6): 2231-43. [PubMed: 16740869]
- 17.
- Шах Р., Хардинг Дж., Браун Дж., Мак-Кинли С. Неонатальная гликемия и результаты нервного развития: систематический обзор и метаанализ.Неонатология. 2019; 115 (2): 116-126. [PubMed: 30408811]
- 18.
- Hay WW, Raju TN, Higgins RD, Kalhan SC, Devaskar SU. Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья детей и развития человека Юнис Кеннеди Шрайвер. J Pediatr. 2009 ноябрь; 155 (5): 612-7. [Бесплатная статья PMC: PMC3857033] [PubMed: 19840614]
- 19.
- McKinlay CJD, Alsweiler JM, Anstice NS, Burakevych N, Chakraborty A, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Nyan Y, Paudel Jiang Y , Сан-Диего RJ, Томпсон B, Wouldes TA, Harding JE., Группа изучения детей с гипогликемией и их последующим развитием (CHYLD). Связь неонатальной гликемии с исходами нервного развития через 4,5 года. JAMA Pediatr. 2017 г. 01 октября; 171 (10): 972-983. [Бесплатная статья PMC: PMC5710616] [PubMed: 28783802]
Объяснить особенности неонатальной гипогликемии.
Опишите текущие рекомендации по ведению неонатальной гипогликемии.
Просмотрите, как можно уточнить текущие знания о неонатальной гипогликемии.
Объясните роль членов межпрофессиональной группы в оптимизации сотрудничества и коммуникации, чтобы гарантировать раннее распознавание неонатальной гипогликемии и приложить все усилия для оказания оптимальной помощи, которая приведет к улучшенным результатам.
Ограничение внутриутробного развития или маленькие по сравнению с младенцами гестационного возраста
Младенцы от матерей с диабетом или большие младенцы для гестационного возраста
Поздно недоношенные младенцы (Гестационный возраст от 34 до 36,6 недель)
Врожденный гиперинсулинизм
Врожденные синдромы: синдром Беквита-Видемана, синдром Сото, синдром Костелло
Эндокринные нарушения: врожденная гипопокринная гипоплазия, врожденная гипопокринная болезнь. гипотиреоз
Врожденные нарушения обмена веществ: болезнь мочи кленового сиропа, нарушения накопления гликогена, наследственная непереносимость фруктозы, галактоземия, нарушения окисления жирных кислот
Потливость
Проблемы с кормлением, плохое сосание
Слабый или пронзительный крик
Тремор
Раздражительность
Летаргия / ступор
Гипотония
Судороги
Кома
Апноэ, хрипы или тахипноэ
Симптоматическая гипогликемия
Большой для гестационного возраста
- Перинатальный стресс
Перинатальная гипоксия / ишемия, дистресс плода
Материнская преэклампсия / эклампсия
Синдром аспирации мекония, эритробластоз плода, полицитемия, гипотермия
014
014
Семейный анамнез генетической гипогликемии
Врожденный синдром (e.g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
Симптоматическая гипогликемия или тяжелая гипогликемия, требующая лечения декстрозой внутривенно
Младенцы, неспособные поддерживать концентрацию глюкозы в крови> 50 мг / дл в первые 48 часов жизни и> 60 после 48 часов
Семейный анамнез генетической формы гипогликемии
Врожденный синдром (например,g., Beckwith-Wiedermann), аномальные физические особенности (например, пороки развития средней линии лица)
- 1.
- Адамкин Д.Х. Неонатальная гипогликемия. Semin Fetal Neonatal Med. 2017 Февраль; 22 (1): 36-41. [PubMed: 27605513]
- 2.
- Тин В. Определение неонатальной гипогликемии: продолжающиеся дебаты. Semin Fetal Neonatal Med. 2014 Февраль; 19 (1): 27-32. [PubMed: 24148999]
- 3.
- Комитет по плодам и новорожденным. Адамкин Д.Х. Послеродовой гомеостаз глюкозы у недоношенных и доношенных детей.Педиатрия. 2011 Март; 127 (3): 575-9. [PubMed: 21357346]
- 4.
- Thornton PS, Stanley CA, De Leon DD, Harris D, Haymond MW, Hussain K, Levitsky LL, Murad MH, Rozance PJ, Simmons RA, Sperling MA, Weinstein DA, White NH , Wolfsdorf JI., Педиатрическое эндокринное общество. Рекомендации Детского эндокринного общества по оценке и лечению стойкой гипогликемии у новорожденных, младенцев и детей. J Pediatr. 2015 Август; 167 (2): 238-45. [PubMed: 25957977]
- 5.
- Harding JE, Harris DL, Hegarty JE, Alsweiler JM, McKinlay CJ.Новая доказательная база для ведения неонатальной гипогликемии. Early Hum Dev. 2017 Янв; 104: 51-56. [Бесплатная статья PMC: PMC5280577] [PubMed: 27989586]
- 6.
- Лукас А., Морли Р., Коул Т.Дж.. Неблагоприятный исход развития нервной системы при умеренной гипогликемии новорожденных. BMJ. 19 ноября 1988 г .; 297 (6659): 1304-8. [Бесплатная статья PMC: PMC1834933] [PubMed: 2462455]
- 7.
- CORNBLATH M, ODELL GB, LEVIN EY. Симптоматическая неонатальная гипогликемия, связанная с токсемией беременности.J Pediatr. 1959 ноябрь; 55: 545-62. [PubMed: 13811999]
- 8.
- HAWORTH JC, COODIN FJ, FINKEL KC, WEIDMAN ML. Гипогликемия, связанная с симптомами в период новорожденности. Can Med Assoc J. 1963, 5 января; 88: 23-8. [Бесплатная статья PMC: PMC1920909] [PubMed: 13953228]
- 9.
- Андерсон Дж. М., Милнер Р. Д., Стрих С. Дж. Влияние гипогликемии новорожденных на нервную систему: патологическое исследование. J Neurol Neurosurg Psychiatry. 1967 августа; 30 (4): 295-310. [Бесплатная статья PMC: PMC496190] [PubMed: 6055339]
- 10.
- Томпсон-Бранч А., Хавранек Т. Гипогликемия новорожденных. Pediatr Rev.2017 Апрель; 38 (4): 147-157. [PubMed: 28364046]
- 11.
- Пухальский М.Л., Рассел Т.Л., Карлсен К.А. Неонатальная гипогликемия: есть ли сладкое пятно? Crit Care Nurs Clin North Am. 2018 декабрь; 30 (4): 467-480. [PubMed: 30447807]
- 12.
- Шарма А., Дэвис А., Шехават П.С. Гипогликемия у недоношенных новорожденных: этиопатогенез, диагностика, лечение и отдаленные результаты. Перевод Педиатр. 2017 Октябрь; 6 (4): 335-348.[Бесплатная статья PMC: PMC5682372] [PubMed: 29184814]
- 13.
- Харрис Д.Л., Вестон П.Дж., Хардинг Д.Э. Заболеваемость неонатальной гипогликемией у детей, относящихся к группе риска. J Pediatr. 2012 ноябрь; 161 (5): 787-91. [PubMed: 22727868]
- 14.
- Харрис Д.Л., Баттин М.Р., Уэстон П.Дж., Хардинг Дж. Непрерывный мониторинг уровня глюкозы у новорожденных с риском гипогликемии. J Pediatr. 2010 август; 157 (2): 198-202.e1. [PubMed: 20338573]
- 15.
- Tin W, Brunskill G, Kelly T, Fritz S.15-летнее наблюдение рецидивирующей «гипогликемии» у недоношенных детей. Педиатрия. 2012 декабрь; 130 (6): e1497-503. [PubMed: 23129080]
- 16.
- Болайт Н., ван Кемпен А., Оффринга М. Нейроразвитие после неонатальной гипогликемии: систематический обзор и дизайн оптимального будущего исследования. Педиатрия. 2006 июн; 117 (6): 2231-43. [PubMed: 16740869]
- 17.
- Шах Р., Хардинг Дж., Браун Дж., Мак-Кинли С. Неонатальная гликемия и результаты нервного развития: систематический обзор и метаанализ.Неонатология. 2019; 115 (2): 116-126. [PubMed: 30408811]
- 18.
- Hay WW, Raju TN, Higgins RD, Kalhan SC, Devaskar SU. Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья детей и развития человека Юнис Кеннеди Шрайвер. J Pediatr. 2009 ноябрь; 155 (5): 612-7. [Бесплатная статья PMC: PMC3857033] [PubMed: 19840614]
- 19.
- McKinlay CJD, Alsweiler JM, Anstice NS, Burakevych N, Chakraborty A, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Nyan Y, Paudel Jiang Y , Сан-Диего RJ, Томпсон B, Wouldes TA, Harding JE., Группа изучения детей с гипогликемией и их последующим развитием (CHYLD). Связь неонатальной гликемии с исходами нервного развития через 4,5 года. JAMA Pediatr. 2017 г. 01 октября; 171 (10): 972-983. [Бесплатная статья PMC: PMC5710616] [PubMed: 28783802]
В / в декстроза (для профилактики и лечения)
- Джейн Э. Макгоуэн, доктор медицины *
- * Доцент педиатрии, MCP
Университет Ганемана и больница Святого Христофора
для детей, Филадельфия, Пенсильвания. Описать наиболее частую причину затяжных неонатальных заболеваний.
гипогликемия.Перечислите признаки гипогликемии.
Опишите состояние, которое было задействовано как механизм
гипогликемическое повреждение головного мозга.Какой вероятный диагноз
для гипогликемии этого младенца?Какие диагностические тесты могут
были сделаны в роддоме
определить, есть ли у младенца
временный или постоянный
гипогликемия?Что можно было сделать
до выписки из родов
больница, чтобы предоставить доказательства
способность младенца поддерживать нормальный
концентрация глюкозы в крови с
нормальный график кормления?Что сделала панкреатическая
патологическое обследование, вероятно, покажет
на момент подведения итогов
панкреатэктомия?Как бы вы оценили
клинический результат в отношении
первичный диагноз и его
осложнения по сравнению с менингитом E coli
и шок?Эйнсли-Грин А. Глюкоза, мозг и педиатрия
эндокринолог.
Horm Res. 1996; 46: 8-25Калхан С., Балобан Ф.Метаболические и эндокринные нарушения, часть первая:
нарушения углеводного обмена. В: Fanaroff AA, Martin RJ, eds.
Неонатально-перинатальная медицина: болезни плода и
Новорожденный . 6th 1997 Mosby-Year Book Inc, Сент-Луис, МоСтэнли, Калифорния. Гиперинсулинизм у младенцев и детей.
Pediatr Clin North Am . 1997; 44: 363-374Уильямс AF. Гипогликемия у новорожденных: обзор .Публикации ВОЗ № 5778, 1997 г.
- Авторское право © 1999 Американской академии педиатрии
- Рано родиться
- Инфекция
- Потребность в кислороде после доставки
- Мать с диабетом
- Имеет медленный рост в утробе матери
- Размер меньше или больше обычного
- Голубоватый или бледный цвет кожи
- Апноэ (паузы дыхания) или учащенное дыхание
- Гипотермия (низкая температура тела)
- Дрожь, ворчание и / или раздражительность
- Плохое кормление или рвота
- Вялость (общее плохое самочувствие)
- Тремор или судороги
Американская академия педиатрии (AAP) и Педиатрическое эндокринное общество (PES) представляют противоречащие друг другу рекомендации по скринингу детей из группы риска и ведению неонатальной гипогликемии.В самых последних рекомендациях AAP рекомендуется проводить скрининг недоношенных и доношенных детей с симптомами гипогликемии, а также бессимптомных детей с наивысшим риском гипогликемии в первые 12–24 часа жизни. Младенцы «группы риска» включают недоношенных на поздних сроках (34–36,6 недель беременности), доношенных детей, которые малы для гестационного возраста, детей от матерей с диабетом и крупных детей для гестационного возраста [3]. В рекомендациях говорится, что «у здоровых доношенных новорожденных после нормальной беременности и родов не требуется рутинный скрининг и мониторинг уровня глюкозы в крови.'[3]
Педиатрическое эндокринное общество (PES) рекомендует проводить скрининг всех младенцев с факторами риска продолжительной или патологической гипогликемии, включая [4]:
Младенец от диабетической матери
В соответствии с рекомендациями PES, младенцы, неспособные поддерживать уровень глюкозы в крови перед приемом пищи> 50 мг / дл в первые 48 часов жизни или > 60 мг / дл после этого подвержены риску стойкой гипогликемии и требуют дальнейшего обследования перед выпиской домой. [4] PES рекомендует, чтобы оценка младенцев с риском стойкой гипогликемии по основной этиологии проводилась после первых 48 часов жизни, чтобы исключить тех младенцев, у которых наблюдается кратковременный низкий уровень глюкозы (т.е., переходная неонатальная гипогликемия). [4]
PES рекомендует обследовать следующих младенцев, чтобы исключить стойкие причины гипогликемии [4]:
Тестирование в месте оказания медицинской помощи (POCT) предлагает быстрый и экономичный метод скрининга на гипогликемию. [5] Однако у этих методов есть ограничения. В большинстве стандартных инструментов используются неферментативные методы измерения концентрации глюкозы в крови, которые менее точны при более низких значениях глюкозы, чем лабораторный анализ с использованием методов глюкозооксидазы (золотой стандарт) [5]. Образцы цельной крови (используемые в POCT) имеют на 10–18% более низкие концентрации глюкозы, чем в плазме, в зависимости от гематокрита.[5] Следовательно, аномально низкие значения глюкозы на POCT требуют подтверждения путем измерения концентрации глюкозы в плазме с использованием клинических лабораторных методов. [4] [10]
В последнее время изучается возможность использования непрерывного мониторинга уровня глюкозы (CGM) для выявления и лечения неонатальной гипогликемии. В исследовании, опубликованном в 2010 году Harris et al. изучили полезность непрерывного мониторинга уровня глюкозы у 102 новорожденных> 32 недель беременности с риском гипогликемии в течение первых 7 дней жизни.[14] Младенцы были обследованы на гипогликемию с периодическим измерением уровня глюкозы в крови и начали получать раннее пероральное питание или внутривенное введение раствора декстрозы в соответствии с клиническими рекомендациями. [14] Исследователи обнаружили, что обнаруженная гипогликемия (уровень глюкозы в крови <47 мг / дл) присутствовала у 44% младенцев при непрерывном мониторинге уровня глюкозы по сравнению с 32% младенцев при периодическом измерении уровня глюкозы в крови. [14] И что есть хорошее соответствие между интерстициальными (используемыми при непрерывном мониторинге) измерениями глюкозы в крови.[14] Исследование предполагает, что непрерывный мониторинг уровня глюкозы безопасен, прост в использовании и позволяет выявлять больше эпизодов гипогликемии. [14]
У младенцев со стойкой гипогликемией с подозрением на наличие основного заболевания измерение уровней бикарбоната, молочной кислоты, бета-гидроксибутирата, свободных жирных кислот, инсулина и карнитина во время гипогликемии (уровень глюкозы в крови <50 мг / дл) полезно для дифференциации метаболических причины стойкой гипогликемии и помогает в диагностике гиперинсулинизма и нарушений окисления жирных кислот.[4]
Лечение / ведение
В связи с отсутствием единообразного определения неонатальной гипогликемии рекомендации различаются в отношении приемлемого более низкого уровня глюкозы и необходимости вмешательства. Хотя стратегии сосредоточены на целевых концентрациях глюкозы, конечной целью лечения является снижение риска травм головного мозга и долгосрочных нарушений развития нервной системы, которые могут коррелировать с гипогликемией. [5]
Раннее начало грудного вскармливания имеет решающее значение для всех младенцев.Для бессимптомных младенцев с риском неонатальной гипогликемии AAP рекомендует начинать кормление в течение первых часа жизни и проводить первоначальный скрининг глюкозы через 30 минут после первого кормления [3]. AAP рекомендует целевые уровни глюкозы в крови, равные или превышающие 45 мг / дл перед рутинным кормлением, и вмешательство для уровня глюкозы в крови <40 мг / дл в первые 4 часа жизни и <45 мг / дл в 4-24 часа жизнь. [1] [3] Лучшее вмешательство при бессимптомной гипогликемии - увеличить частоту кормления.[5] Некоторым младенцам сложно увеличить объем грудного вскармливания. Трудности с прикладыванием младенца к груди, плохое кормление и малое количество грудного молока могут помешать успешному установлению грудного вскармливания в первые часы жизни. Чаще всего смесь для младенцев является выбором при бессимптомной неонатальной гипогликемии у недоношенных и доношенных новорожденных. [5] Формула недорогая, легкодоступная, простая в употреблении и имеет высокое содержание углеводов, что приводит к быстрому повышению концентрации глюкозы в крови в течение нескольких минут.[12] Однако использование детской смеси может помешать установлению грудного вскармливания и изменить микробиом новорожденного, потенциально увеличивая риск инфекций и аллергии. [5] Уровень глюкозы в крови следует повторно проверить через час после кормления. Неизвестно, нуждаются ли в коррекции ранние эпизоды низкого уровня глюкозы в первые 48 часов жизни у бессимптомных, здоровых младенцев без факторов риска гипогликемии. [5] [3]
Гель декстрозы, массирующий 200 мг / кг на слизистую оболочку рта, является эффективной альтернативой лечения бессимптомных поздних недоношенных и доношенных детей.[5] [12] Гель с декстрозой относительно недорог, хорошо переносится, и было показано, что его использование снижает количество госпитализаций в отделение интенсивной терапии новорожденных для внутривенного введения декстрозы. [5] Кроме того, использование геля декстрозы может быть более предпочтительным вариантом лечения по сравнению с детской смесью, поскольку он способствует грудному вскармливанию и укреплению связи между матерью и младенцем.
AAP рекомендует госпитализацию в отделение интенсивной терапии новорожденных и вмешательство с внутривенным введением декстрозы в следующих случаях [3]:
Все младенцы с симптомами и уровнем глюкозы менее 40 мг / дл
Младенцы со стойкой гипогликемией, несмотря на частоту кормления
*** Бессимптомные младенцы группы риска с чрезвычайно низкими концентрациями глюкозы в крови <25 мг / дл в первые 4 часа жизни или <35 мг / дл в 4–24 часа жизни.
Внутривенно глюкоза вводится болюсно 200 мг / кг (декстроза 10% при 2 мл / кг) с последующей непрерывной инфузией 10% декстрозы при 5–8 мг / кг в минуту (от 80 до 100 мл / кг в минуту). день) для поддержания уровня глюкозы в крови от 40 до 50 мг / дл. [1] [3] Младенцам, получающим внутривенные инфузии декстрозы, требуется тщательный мониторинг с частыми измерениями уровня глюкозы в крови, каждый час в течение первых 12 часов, затем реже достигается одно целевое значение глюкозы. [12] У младенцев от матерей с диабетом для минимизации стимуляции поджелудочной железы и секреции эндогенного инсулина можно использовать более низкие скорости инфузии глюкозы от 3 до 5 мг / кг / мин.[12] Младенцы, которым требуется более высокая скорость внутривенного введения декстрозы (> 12–16 мг / кг / мин) или более 5 дней, с большей вероятностью имеют постоянную причину гипогликемии. [12]
Терапия второй линии для лечения стойкой гипогликемии включает использование кортикостероидов или глюкагона. [12] Кортикостероиды повышают концентрацию глюкозы в крови за счет снижения периферического использования глюкозы и назначаются в виде гидроксикортизона от 5 до 15 мг / кг в день или преднизона 2. мг / кг в день. [12] Глюкагон — гормон, который стимулирует выработку эндогенной глюкозы посредством гликогенолиза и глюконеогенеза; таким образом, его эффективность зависит от наличия у младенца адекватных запасов гликогена.[12] Это наиболее полезно для доношенных детей и младенцев от матерей с диабетом. [12] Дозировка глюкагона осуществляется в виде болюса 30 мкг / кг или непрерывной инфузии 300 мкг / кг в минуту. [12]
PES рекомендует целевые концентрации глюкозы> 50 мг / дл для младенцев с риском гипогликемии без подозрения на врожденное нарушение в течение первых 48 часов жизни и> 60 мг / дл в дальнейшем. [4] Младенцы, не способные поддерживать эти целевые уровни глюкозы, несмотря на регулярный график кормлений, должны быть обследованы, чтобы исключить постоянную причину гипогликемии перед выпиской домой, чтобы гарантировать раннее распознавание и облегчить лечение.[4]
Для младенцев со стойкой гипогликемией цель лечения младенцев с подозрением на гиперинсулинизм — предотвратить повторяющиеся эпизоды низкого уровня глюкозы в крови, которые подвергают ребенка риску будущих эпизодов гипогликемии. У новорожденных с врожденными нарушениями метаболизма и нарушением выработки эндогенной глюкозы целью лечения является предотвращение метаболического ацидоза и последующего нарушения роста [4]. Педиатрическое эндокринное общество рекомендует давать эндогенную глюкозу для поддержания уровня глюкозы в крови> 70 мг / дл у этих младенцев.Инфузии диазоксида от 10 до 15 мг / кг в день могут использоваться у младенцев с врожденным гиперинсулинизмом для подавления секреции инсулина; эффекты видны в течение 2–4 дней. [12] Рекомендации требуют скорейшей консультации с эндокринологом или генетиком. [4]
Дифференциальный диагноз
Симптомы неонатальной гипогликемии неспецифичны и частично совпадают с симптомами других состояний, включая недоношенность, сепсис, гипоксически-ишемическую энцефалопатию и гипонатриемию. Как обсуждалось выше, хотя редкие, стойкие причины гипогликемии должны быть исключены.
Прогноз
Влияние бессимптомной гипогликемии в первые 48 часов жизни на отдаленные исходы развития нервной системы остается хорошо изученным. В результате влиятельного исследования, опубликованного в 1988 г. Lucas et al. предполагая, что рецидивирующая умеренная неонатальная гипогликемия коррелирует с серьезными моторными и умственными нарушениями в скорректированном возрасте 18 месяцев [6], было признано, что даже ранняя бессимптомная гипогликемия может нанести вред долгосрочному развитию. [2] [15] Несколько других наблюдательных исследований представили аналогичные выводы.Однако трудно доказать причинно-следственную связь наблюдаемых результатов. Внося свой вклад в понимание влияния низких уровней глюкозы, большинство исследований не смогли включить контроль эугликемии и использовать различные определения «гипогликемии». [2] Систематический обзор 2006 г., оценивающий доказательства неонатальной гипогликемии на исходы нервного развития, проведенный Boluyt et al. . обнаружили, что большинство исследований в целом были низкого качества, а результаты двух высококачественных исследований были недействительными из-за неоднородности методов.[2] [16] Авторы пришли к выводу, что ни одно из исследований не предоставило убедительных доказательств влияния неонатальной гипогликемии на развитие нервной системы, по которым можно было бы дать клинические рекомендации, и призвали к хорошо спланированному проспективному исследованию по этой теме. [16]
Несмотря на запросы о дальнейших исследованиях младенцев с риском гипогликемии с долгосрочным наблюдением за развитием нервной системы [17] [18], было проведено только два исследования, которые соответствовали методологическим критериям, рекомендованным Boluyt et al .: 15-летнее наблюдение. плановое исследование рецидивирующей гипогликемии у недоношенных детей, проведенное Tin et al.[15] и исследование «Дети с гипогликемией и их дальнейшее развитие» (CHYLD). [5] [19] Опубликованный в 2012 году журнал Tin et al. исследование было направлено на подтверждение результатов исследования Lucas et al. [6] Это проспективное исследование включало недоношенных новорожденных <32 недель беременности, родившихся между 1990 и 1991 годами, у которых измерения уровня глюкозы в крови проводились в первые 10 дней жизни. [15] Исследователи сопоставили младенцев, у которых наблюдалась рецидивирующая неонатальная гипогликемия (определяемая как уровень глюкозы в крови <47 мг / дл в течение 3 или более дней в первые 10 дней жизни), с контрольной группой с эугликемией и не обнаружили различий в развитии или инвалидности в возрасте 2 лет.[2] [15] При повторной оценке в возрасте 15 лет исследователи снова не обнаружили разницы в развитии или показателях IQ между двумя группами. [15] Авторы пришли к выводу, что «исследование не нашло доказательств, подтверждающих мнение о том, что повторяющиеся низкие уровни глюкозы в крови в первые 10 дней жизни обычно представляют опасность для недоношенных детей» [15].
Исследование CHYLD представляет собой проспективное когортное исследование младенцев, родившихся на сроке беременности более 32 недель с факторами риска неонатальной гипогликемии. [19] Первоначальные результаты показали, что лечение неонатальной гипогликемии для поддержания уровня глюкозы в крови> 47 мг / дл не коррелировало с повышенным риском нейросенсорных нарушений в 4 года.5 лет. [19] У младенцев, у которых были более тяжелые или продолжительные эпизоды низкого уровня глюкозы в крови, не было худших результатов [5] [19]. Исследователи не смогли установить числовой уровень глюкозы, при котором риск увеличивался, но обнаружили, что нестабильность глюкозы (пропорция измерений и продолжительность времени, в течение которого значения глюкозы в крови находились за пределами диапазона 54-72 мг / дл) в течение 48 часов жизни были наиболее значительными. прогнозирование худших результатов развития. [5] [19] Младенцы с наибольшей нестабильностью глюкозы имели в 2–3 раза повышенный риск нейросенсорных нарушений.[5] [19] Интересно, что умеренная «гипергликемия», уровень глюкозы в крови> 72 мг / дл, действительно коррелировала с повышенным риском плохой зрительной моторики и исполнительных функций. [19] Это открытие поднимает вопрос: подвергаются ли младенцы с низким и «высоким» ранним уровнем глюкозы в крови риску худших исходов нервного развития?
Осложнения
Тяжелая длительная гипогликемия в неонатальном периоде может иметь разрушительные последствия, включая длительные нарушения нервного развития, церебральный паралич и смерть.Младенцы с врожденными причинами стойкой гипогликемии имеют значительно более высокие показатели заболеваемости и смертности: от 25 до 50% имеют нарушения развития [4]. Нервная ткань может пережить длительные периоды низкого уровня глюкозы в крови, используя альтернативные энергетические субстраты (кетоны, аминокислоты, лактат) для удовлетворения своих метаболических потребностей. [4] [9] Гипотеза состоит в том, что использование этих альтернативных метаболитов может иметь нейропротекторный эффект на незрелый мозг новорожденного. [11] Однако в конечном итоге необходимо обеспечить запас глюкозы.В 1967 году Андерсон и др. опубликовали серию клинических случаев патологических данных 6 младенцев с тяжелой длительной гипогликемией в первую неделю жизни. [9] Авторы сообщили, что тяжелая длительная гипогликемия вызвала обширное перерождение центральной нервной системы и, если ее не лечить, в конечном итоге привела к смерти. [9] Повреждение мозга было менее серьезным у младенцев, получавших экзогенную глюкозу. [9] Таким образом, раннее распознавание состояний, вызывающих стойкую гипогликемию, имеет решающее значение.
Сдерживание и обучение пациентов
Частые проверки уровня глюкозы в крови и диагностика неонатальной гипогликемии могут быть стрессовыми для молодых матерей.Лучший подход к лечению — это тот, который способствует установлению связи между матерью и младенцем и раннему грудному вскармливанию.
Улучшение результатов команды здравоохранения
Важно, чтобы клиницисты и медперсонал в отделении новорожденных сохраняли клиническое подозрение на неонатальную гипогликемию, поскольку симптомы расплывчаты и неспецифичны. Для младенцев с риском стойкой гипогликемии жизненно важно установить, что младенец может поддерживать уровень глюкозы в крови на целевом уровне перед выпиской домой, поскольку стойкая гипогликемия может проявлять клинические симптомы только после первых 48 часов жизни, к этому времени у многих младенцев уже выписаны домой.
Дополнительное образование / Контрольные вопросы
Список литературы
Неонатальная гипогликемия — StatPearls — Книжная полка NCBI
Непрерывное обучение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным.Тем не менее, четкое определение неонатальной гипогликемии отсутствует. Текущие рекомендации по скринингу и алгоритмы лечения основаны на ограниченных доказательствах и больше полагаются на мнение экспертов при составлении рекомендаций. В этом упражнении рассматривается неонатальная гипогликемия и необходимость углубления знаний о ней. Это упражнение подчеркивает роль межпрофессиональной группы в распознавании и лечении неонатальной гипогликемии.
Цели:
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным. Тем не менее, четкое определение неонатальной гипогликемии отсутствует. [1] [2] [3] Текущие рекомендации по скринингу и алгоритмы ведения основаны на ограниченных доказательствах, больше полагаясь на мнение экспертов при составлении рекомендаций. [1] [3] [4]
Несмотря на лучшее понимание раннего гомеостаза глюкозы и переходной гипогликемии в первые 48 часов жизни, пробелы в наших знаниях сохраняются.Наблюдения показали, что у здоровых младенцев преходящая гипогликемия является частью нормальной адаптации к внематочной жизни со снижением концентрации глюкозы в крови до значений от 20 до 25 мг / дл в первые два часа жизни [1]. Однако, поскольку мы обычно не измеряем концентрацию глюкозы в крови у здоровых младенцев без факторов риска гипогликемии, трудно определить «нормальные» уровни глюкозы в крови в первые 48 часов жизни. Как Harding et al. вопрос: «даже если у здоровых младенцев наблюдаются низкие концентрации глюкозы, можем ли мы распространить эти значения на младенцев с риском нарушения метаболической адаптации?» [5] И насколько низкий является слишком низким?
Многоцентровое исследование питания, проведенное в 1988 г. Lucas et al.предложили концентрацию глюкозы в крови <47 мг / дл в качестве критического порога, связанного с неблагоприятными исходами развития нервной системы. [1] [2] [5] [6] В исследовании изучались уровни глюкозы в крови у 661 недоношенного ребенка с массой тела при рождении <1850 граммов, включенных в исследование питания, посвященное стратегиям раннего кормления и когнитивным результатам. [1] [6] Исследователи обнаружили, что количество дней с концентрацией глюкозы в крови <47 мг / дл, связанное с более низкими показателями моторного и умственного развития по шкале Бейли для младенческого развития в возрасте 18 месяцев, скорректировано.[6] У младенцев, у которых наблюдалась гипогликемия (глюкоза <47 мг / дл) в течение 5 или более дней, риск нарушения развития нервной системы увеличивался в 3-5 раз. [6] Авторы пришли к выводу, что «даже умеренная гипогликемия связана со значительным увеличением неблагоприятных последствий развития нервной системы», и призвали к переоценке нынешних тенденций в практике. В результате это значение «47 мг / дл» стало широко принятым в качестве стандартного числового значения для определения неонатальной гипогликемии для всех младенцев, даже здоровых, доношенных, подходящих для младенцев гестационного возраста.[1]
Очевидно, что чрезвычайно низкие концентрации глюкозы в крови у новорожденных могут вызывать апноэ, раздражительность, летаргию, судороги [7] [8] и повреждение головного мозга [9]; и что длительная или симптоматическая гипогликемия может коррелировать с долгосрочными нарушениями развития нервной системы. [1] [10] Однако долгосрочное значение ранних, бессимптомных и временно низких уровней глюкозы до сих пор не установлено. Доказательства, подтверждающие четкое числовое значение глюкозы в крови, которое связано с травмой головного мозга или надежно предсказывает неблагоприятные исходы развития нервной системы, отсутствуют.[3] [2] Даже Лукас и др. признал, что «связь между [концентрациями глюкозы в крови <47 мг / дл] и плохими исходами развития нервной системы может не быть причинной и может отражать неспособность внести поправку на вмешивающиеся факторы». [6]
Этиология
У здоровых младенцев наблюдается ожидаемое снижение в концентрациях глюкозы в крови сразу после рождения как часть нормального физиологического перехода к внематочной жизни. Резкое пережатие пуповины при рождении нарушает связь младенца с плацентой, от которой он зависел, чтобы поставлять глюкозу и другие метаболиты, необходимые для удовлетворения его энергетических потребностей в утробе матери.Непрерывное поступление экзогенной внутривенной глюкозы из плаценты внезапно прекращается, и концентрация глюкозы в крови ребенка снижается в первые часы жизни. Для большинства здоровых младенцев эта переходная неонатальная гипогликемия является кратковременной, преходящей и чаще всего бессимптомной. [4] [11]
Младенцы подвержены риску более тяжелой или продолжительной гипогликемии из-за одного или комбинации следующих основных механизмов: недостаточное поступление глюкозы, низкие запасы гликогена или жира или слабые механизмы производства глюкозы; повышенное использование глюкозы, вызванное чрезмерным производством инсулина или повышенным метаболическим спросом; или отказ контррегулирующих механизмов (т.е., гипофизарная или надпочечниковая недостаточность). [12] [11] Неонатальная гипогликемия чаще всего поражает следующие группы младенцев [3]:
Недоношенные, ограниченные внутриутробные дети и маленькие для гестационного возраста младенцы подвержены риску гипогликемии, потому что они рождаются с уменьшенными запасами гликогена, уменьшенной жировой тканью и испытывают повышенные метаболические потребности из-за их относительно большого размера. размер мозга.[1] [12] У недоношенных детей с очень низкой массой тела при рождении (<1000 г) ферменты, участвующие в глюконеогенезе, экспрессируются на низком уровне; таким образом, их способность продуцировать эндогенную глюкозу низкая, что увеличивает риск серьезных или продолжительных низких концентраций глюкозы. [12]
Младенцы от матерей с диабетом (IDM) и большие для гестационного возраста младенцы страдают гиперинсулинизмом плода и повышенной утилизацией периферической глюкозы, что подвергает их риску гипогликемии в ближайшем послеродовом периоде.[1] [4] [12] Плацента снабжает плод прямым источником глюкозы посредством облегченной диффузии, так что концентрация глюкозы у плода пропорциональна материнскому уровню. Длительное повышение концентрации глюкозы у матери приводит к гипергликемии плода и чрезмерной стимуляции поджелудочной железы, что приводит к увеличению выработки эндогенного инсулина плода. [12] Эти повышенные уровни инсулина плода сохраняются после рождения и, в отсутствие постоянного источника экзогенной глюкозы, приводят к увеличению утилизации глюкозы и снижение концентрации глюкозы в крови.[12] IDM имеют пониженную способность мобилизовать запасы гликогена после рождения и испытывают относительную надпочечниковую недостаточность с пониженным уровнем катехоламинов, что еще больше увеличивает риск низкого уровня глюкозы в крови.
Младенцы, испытывающие перинатальный стресс (например, дистресс плода, перинатальная ишемия, преэклампсия / эклампсия у матери, сепсис, гипотермия) или дети с врожденными пороками сердца, имеют повышенные потребности в метаболической энергии, что подвергает их риску гипогликемии. [1] [4] [12] Перинатальный стресс вызывает состояние «гипогликемического гиперинсулинизма», которое может сохраняться от нескольких дней до недель, что приводит к устойчиво низким концентрациям глюкозы, требующим постоянного вмешательства для поддержания эугликемии.[1]
Другие ятрогенные причины преходящей неонатальной гипогликемии включают внутриродовое введение материнских лекарств (например, бета-адренергических токолитиков, вальпроевой кислоты, пропранолола и проводниковых анестетиков), отсроченное кормление и введение экзогенного инсулина. [12] [11] ]
Низкие концентрации глюкозы после первых 48 часов жизни вызывают беспокойство по поводу основного заболевания как этиологии гипогликемии. Основные физиологические механизмы, вызывающие патологическую или стойкую гипогликемию, аналогичны описанным выше: гиперинсулинизм (например,g., врожденный гиперинсулинизм, синдром Беквита-Видмана, синдром Сото), недостаточное снабжение энергией (т. е. врожденные нарушения метаболизма, которые приводят к дефициту гликогена, аминокислот или свободных жирных кислот) или дефицит кортизола или гормона роста ( например, синдром Костелло, гипопитуитаризм, врожденная гиперплазия надпочечников). Причины стойкой неонатальной гипогликемии включают [12] [10]:
Эпидемиология
Сообщаемая частота неонатальной гипогликемии варьируется в зависимости от нескольких факторов: включали популяцию младенцев, частоту и время тестирования глюкозы, использованный метод тестирования и определение гипогликемии.В исследовании 2006 г., проведенном Harris et al. который стремился определить частоту гипогликемии (уровень глюкозы в крови <47 мг / дл) в первые 48 часов жизни у младенцев старше 35 недель с риском гипогликемии в соответствии с рекомендациями AAP, обнаружил, что 25% всех родов имели риск гипогликемии. ; из этих младенцев из группы риска 51% испытали по крайней мере один эпизод гипогликемии. [1] [13]
Патофизиология
Плод зависит от материнского метаболизма и плацентарного кровообращения, обеспечивая глюкозу, кетоны, свободные жирные кислоты и аминокислоты, необходимые для удовлетворения его энергетических потребностей.[2] Плацента обеспечивает кровообращение плода прямым источником глюкозы. [2] [5] Зажатие пуповины при рождении резко нарушает этот непрерывный источник глюкозы, что приводит к быстрому снижению уровня глюкозы в крови в первые 2–3 часа жизни. [1] [2] [5] Низкие концентрации глюкозы в крови вызывают выброс инсулина и других гормонов (включая катехоламины, глюкагон и кортикостероиды), которые стимулируют выработку глюкозы посредством глюконеогенеза и гликогенолиза и усиливают окисление жирных кислот.Это обеспечивает младенца эндогенным источником глюкозы и других энергетических субстратов, необходимых для поддержания его метаболизма [1]; результатом является постепенное повышение уровня глюкозы в крови в течение следующих нескольких часов или дней. [5] Считается также, что низкий уровень глюкозы стимулирует аппетит новорожденного и помогает ему адаптироваться к прерывистому питанию. [1]
Любой механизм, нарушающий эту последовательность физиологических изменений, подвергает младенца риску более серьезных или продолжительных периодов низкого уровня глюкозы.Риск гипогликемии наиболее высок в первые часы после рождения. [5] [12]
Стойкая гипогликемия возникает в результате чрезмерной секреции инсулина, дефицита кортизола или гормона роста или врожденных нарушений метаболизма. [4] [12]
Анамнез и физические данные
Клинические проявления гипогликемии новорожденных могут быть разными. В остальном здоровый младенец может оставаться бессимптомным, несмотря на чрезвычайно низкий уровень глюкозы в крови в период переходной гипогликемии. Клинические симптомы не коррелируют с уровнем глюкозы в крови.
Симптомы неонатальной гипогликемии включают [2] [11]:
Американская академия педиатрии (AAP) и Педиатрическое эндокринное общество (PES) представляют противоречащие друг другу рекомендации по скринингу детей из группы риска и ведению неонатальной гипогликемии.В самых последних рекомендациях AAP рекомендуется проводить скрининг недоношенных и доношенных детей с симптомами гипогликемии, а также бессимптомных детей с наивысшим риском гипогликемии в первые 12–24 часа жизни. Младенцы «группы риска» включают недоношенных на поздних сроках (34–36,6 недель беременности), доношенных детей, которые малы для гестационного возраста, детей от матерей с диабетом и крупных детей для гестационного возраста [3]. В рекомендациях говорится, что «у здоровых доношенных новорожденных после нормальной беременности и родов не требуется рутинный скрининг и мониторинг уровня глюкозы в крови.'[3]
Педиатрическое эндокринное общество (PES) рекомендует проводить скрининг всех младенцев с факторами риска продолжительной или патологической гипогликемии, включая [4]:
Младенец от диабетической матери
В соответствии с рекомендациями PES, младенцы, неспособные поддерживать уровень глюкозы в крови перед приемом пищи> 50 мг / дл в первые 48 часов жизни или > 60 мг / дл после этого подвержены риску стойкой гипогликемии и требуют дальнейшего обследования перед выпиской домой. [4] PES рекомендует, чтобы оценка младенцев с риском стойкой гипогликемии по основной этиологии проводилась после первых 48 часов жизни, чтобы исключить тех младенцев, у которых наблюдается кратковременный низкий уровень глюкозы (т.е., переходная неонатальная гипогликемия). [4]
PES рекомендует обследовать следующих младенцев, чтобы исключить стойкие причины гипогликемии [4]:
Тестирование в месте оказания медицинской помощи (POCT) предлагает быстрый и экономичный метод скрининга на гипогликемию. [5] Однако у этих методов есть ограничения. В большинстве стандартных инструментов используются неферментативные методы измерения концентрации глюкозы в крови, которые менее точны при более низких значениях глюкозы, чем лабораторный анализ с использованием методов глюкозооксидазы (золотой стандарт) [5]. Образцы цельной крови (используемые в POCT) имеют на 10–18% более низкие концентрации глюкозы, чем в плазме, в зависимости от гематокрита.[5] Следовательно, аномально низкие значения глюкозы на POCT требуют подтверждения путем измерения концентрации глюкозы в плазме с использованием клинических лабораторных методов. [4] [10]
В последнее время изучается возможность использования непрерывного мониторинга уровня глюкозы (CGM) для выявления и лечения неонатальной гипогликемии. В исследовании, опубликованном в 2010 году Harris et al. изучили полезность непрерывного мониторинга уровня глюкозы у 102 новорожденных> 32 недель беременности с риском гипогликемии в течение первых 7 дней жизни.[14] Младенцы были обследованы на гипогликемию с периодическим измерением уровня глюкозы в крови и начали получать раннее пероральное питание или внутривенное введение раствора декстрозы в соответствии с клиническими рекомендациями. [14] Исследователи обнаружили, что обнаруженная гипогликемия (уровень глюкозы в крови <47 мг / дл) присутствовала у 44% младенцев при непрерывном мониторинге уровня глюкозы по сравнению с 32% младенцев при периодическом измерении уровня глюкозы в крови. [14] И что есть хорошее соответствие между интерстициальными (используемыми при непрерывном мониторинге) измерениями глюкозы в крови.[14] Исследование предполагает, что непрерывный мониторинг уровня глюкозы безопасен, прост в использовании и позволяет выявлять больше эпизодов гипогликемии. [14]
У младенцев со стойкой гипогликемией с подозрением на наличие основного заболевания измерение уровней бикарбоната, молочной кислоты, бета-гидроксибутирата, свободных жирных кислот, инсулина и карнитина во время гипогликемии (уровень глюкозы в крови <50 мг / дл) полезно для дифференциации метаболических причины стойкой гипогликемии и помогает в диагностике гиперинсулинизма и нарушений окисления жирных кислот.[4]
Лечение / ведение
В связи с отсутствием единообразного определения неонатальной гипогликемии рекомендации различаются в отношении приемлемого более низкого уровня глюкозы и необходимости вмешательства. Хотя стратегии сосредоточены на целевых концентрациях глюкозы, конечной целью лечения является снижение риска травм головного мозга и долгосрочных нарушений развития нервной системы, которые могут коррелировать с гипогликемией. [5]
Раннее начало грудного вскармливания имеет решающее значение для всех младенцев.Для бессимптомных младенцев с риском неонатальной гипогликемии AAP рекомендует начинать кормление в течение первых часа жизни и проводить первоначальный скрининг глюкозы через 30 минут после первого кормления [3]. AAP рекомендует целевые уровни глюкозы в крови, равные или превышающие 45 мг / дл перед рутинным кормлением, и вмешательство для уровня глюкозы в крови <40 мг / дл в первые 4 часа жизни и <45 мг / дл в 4-24 часа жизнь. [1] [3] Лучшее вмешательство при бессимптомной гипогликемии - увеличить частоту кормления.[5] Некоторым младенцам сложно увеличить объем грудного вскармливания. Трудности с прикладыванием младенца к груди, плохое кормление и малое количество грудного молока могут помешать успешному установлению грудного вскармливания в первые часы жизни. Чаще всего смесь для младенцев является выбором при бессимптомной неонатальной гипогликемии у недоношенных и доношенных новорожденных. [5] Формула недорогая, легкодоступная, простая в употреблении и имеет высокое содержание углеводов, что приводит к быстрому повышению концентрации глюкозы в крови в течение нескольких минут.[12] Однако использование детской смеси может помешать установлению грудного вскармливания и изменить микробиом новорожденного, потенциально увеличивая риск инфекций и аллергии. [5] Уровень глюкозы в крови следует повторно проверить через час после кормления. Неизвестно, нуждаются ли в коррекции ранние эпизоды низкого уровня глюкозы в первые 48 часов жизни у бессимптомных, здоровых младенцев без факторов риска гипогликемии. [5] [3]
Гель декстрозы, массирующий 200 мг / кг на слизистую оболочку рта, является эффективной альтернативой лечения бессимптомных поздних недоношенных и доношенных детей.[5] [12] Гель с декстрозой относительно недорог, хорошо переносится, и было показано, что его использование снижает количество госпитализаций в отделение интенсивной терапии новорожденных для внутривенного введения декстрозы. [5] Кроме того, использование геля декстрозы может быть более предпочтительным вариантом лечения по сравнению с детской смесью, поскольку он способствует грудному вскармливанию и укреплению связи между матерью и младенцем.
AAP рекомендует госпитализацию в отделение интенсивной терапии новорожденных и вмешательство с внутривенным введением декстрозы в следующих случаях [3]:
Все младенцы с симптомами и уровнем глюкозы менее 40 мг / дл
Младенцы со стойкой гипогликемией, несмотря на частоту кормления
*** Бессимптомные младенцы группы риска с чрезвычайно низкими концентрациями глюкозы в крови <25 мг / дл в первые 4 часа жизни или <35 мг / дл в 4–24 часа жизни.
Внутривенно глюкоза вводится болюсно 200 мг / кг (декстроза 10% при 2 мл / кг) с последующей непрерывной инфузией 10% декстрозы при 5–8 мг / кг в минуту (от 80 до 100 мл / кг в минуту). день) для поддержания уровня глюкозы в крови от 40 до 50 мг / дл. [1] [3] Младенцам, получающим внутривенные инфузии декстрозы, требуется тщательный мониторинг с частыми измерениями уровня глюкозы в крови, каждый час в течение первых 12 часов, затем реже достигается одно целевое значение глюкозы. [12] У младенцев от матерей с диабетом для минимизации стимуляции поджелудочной железы и секреции эндогенного инсулина можно использовать более низкие скорости инфузии глюкозы от 3 до 5 мг / кг / мин.[12] Младенцы, которым требуется более высокая скорость внутривенного введения декстрозы (> 12–16 мг / кг / мин) или более 5 дней, с большей вероятностью имеют постоянную причину гипогликемии. [12]
Терапия второй линии для лечения стойкой гипогликемии включает использование кортикостероидов или глюкагона. [12] Кортикостероиды повышают концентрацию глюкозы в крови за счет снижения периферического использования глюкозы и назначаются в виде гидроксикортизона от 5 до 15 мг / кг в день или преднизона 2. мг / кг в день. [12] Глюкагон — гормон, который стимулирует выработку эндогенной глюкозы посредством гликогенолиза и глюконеогенеза; таким образом, его эффективность зависит от наличия у младенца адекватных запасов гликогена.[12] Это наиболее полезно для доношенных детей и младенцев от матерей с диабетом. [12] Дозировка глюкагона осуществляется в виде болюса 30 мкг / кг или непрерывной инфузии 300 мкг / кг в минуту. [12]
PES рекомендует целевые концентрации глюкозы> 50 мг / дл для младенцев с риском гипогликемии без подозрения на врожденное нарушение в течение первых 48 часов жизни и> 60 мг / дл в дальнейшем. [4] Младенцы, не способные поддерживать эти целевые уровни глюкозы, несмотря на регулярный график кормлений, должны быть обследованы, чтобы исключить постоянную причину гипогликемии перед выпиской домой, чтобы гарантировать раннее распознавание и облегчить лечение.[4]
Для младенцев со стойкой гипогликемией цель лечения младенцев с подозрением на гиперинсулинизм — предотвратить повторяющиеся эпизоды низкого уровня глюкозы в крови, которые подвергают ребенка риску будущих эпизодов гипогликемии. У новорожденных с врожденными нарушениями метаболизма и нарушением выработки эндогенной глюкозы целью лечения является предотвращение метаболического ацидоза и последующего нарушения роста [4]. Педиатрическое эндокринное общество рекомендует давать эндогенную глюкозу для поддержания уровня глюкозы в крови> 70 мг / дл у этих младенцев.Инфузии диазоксида от 10 до 15 мг / кг в день могут использоваться у младенцев с врожденным гиперинсулинизмом для подавления секреции инсулина; эффекты видны в течение 2–4 дней. [12] Рекомендации требуют скорейшей консультации с эндокринологом или генетиком. [4]
Дифференциальный диагноз
Симптомы неонатальной гипогликемии неспецифичны и частично совпадают с симптомами других состояний, включая недоношенность, сепсис, гипоксически-ишемическую энцефалопатию и гипонатриемию. Как обсуждалось выше, хотя редкие, стойкие причины гипогликемии должны быть исключены.
Прогноз
Влияние бессимптомной гипогликемии в первые 48 часов жизни на отдаленные исходы развития нервной системы остается хорошо изученным. В результате влиятельного исследования, опубликованного в 1988 г. Lucas et al. предполагая, что рецидивирующая умеренная неонатальная гипогликемия коррелирует с серьезными моторными и умственными нарушениями в скорректированном возрасте 18 месяцев [6], было признано, что даже ранняя бессимптомная гипогликемия может нанести вред долгосрочному развитию. [2] [15] Несколько других наблюдательных исследований представили аналогичные выводы.Однако трудно доказать причинно-следственную связь наблюдаемых результатов. Внося свой вклад в понимание влияния низких уровней глюкозы, большинство исследований не смогли включить контроль эугликемии и использовать различные определения «гипогликемии». [2] Систематический обзор 2006 г., оценивающий доказательства неонатальной гипогликемии на исходы нервного развития, проведенный Boluyt et al. . обнаружили, что большинство исследований в целом были низкого качества, а результаты двух высококачественных исследований были недействительными из-за неоднородности методов.[2] [16] Авторы пришли к выводу, что ни одно из исследований не предоставило убедительных доказательств влияния неонатальной гипогликемии на развитие нервной системы, по которым можно было бы дать клинические рекомендации, и призвали к хорошо спланированному проспективному исследованию по этой теме. [16]
Несмотря на запросы о дальнейших исследованиях младенцев с риском гипогликемии с долгосрочным наблюдением за развитием нервной системы [17] [18], было проведено только два исследования, которые соответствовали методологическим критериям, рекомендованным Boluyt et al .: 15-летнее наблюдение. плановое исследование рецидивирующей гипогликемии у недоношенных детей, проведенное Tin et al.[15] и исследование «Дети с гипогликемией и их дальнейшее развитие» (CHYLD). [5] [19] Опубликованный в 2012 году журнал Tin et al. исследование было направлено на подтверждение результатов исследования Lucas et al. [6] Это проспективное исследование включало недоношенных новорожденных <32 недель беременности, родившихся между 1990 и 1991 годами, у которых измерения уровня глюкозы в крови проводились в первые 10 дней жизни. [15] Исследователи сопоставили младенцев, у которых наблюдалась рецидивирующая неонатальная гипогликемия (определяемая как уровень глюкозы в крови <47 мг / дл в течение 3 или более дней в первые 10 дней жизни), с контрольной группой с эугликемией и не обнаружили различий в развитии или инвалидности в возрасте 2 лет.[2] [15] При повторной оценке в возрасте 15 лет исследователи снова не обнаружили разницы в развитии или показателях IQ между двумя группами. [15] Авторы пришли к выводу, что «исследование не нашло доказательств, подтверждающих мнение о том, что повторяющиеся низкие уровни глюкозы в крови в первые 10 дней жизни обычно представляют опасность для недоношенных детей» [15].
Исследование CHYLD представляет собой проспективное когортное исследование младенцев, родившихся на сроке беременности более 32 недель с факторами риска неонатальной гипогликемии. [19] Первоначальные результаты показали, что лечение неонатальной гипогликемии для поддержания уровня глюкозы в крови> 47 мг / дл не коррелировало с повышенным риском нейросенсорных нарушений в 4 года.5 лет. [19] У младенцев, у которых были более тяжелые или продолжительные эпизоды низкого уровня глюкозы в крови, не было худших результатов [5] [19]. Исследователи не смогли установить числовой уровень глюкозы, при котором риск увеличивался, но обнаружили, что нестабильность глюкозы (пропорция измерений и продолжительность времени, в течение которого значения глюкозы в крови находились за пределами диапазона 54-72 мг / дл) в течение 48 часов жизни были наиболее значительными. прогнозирование худших результатов развития. [5] [19] Младенцы с наибольшей нестабильностью глюкозы имели в 2–3 раза повышенный риск нейросенсорных нарушений.[5] [19] Интересно, что умеренная «гипергликемия», уровень глюкозы в крови> 72 мг / дл, действительно коррелировала с повышенным риском плохой зрительной моторики и исполнительных функций. [19] Это открытие поднимает вопрос: подвергаются ли младенцы с низким и «высоким» ранним уровнем глюкозы в крови риску худших исходов нервного развития?
Осложнения
Тяжелая длительная гипогликемия в неонатальном периоде может иметь разрушительные последствия, включая длительные нарушения нервного развития, церебральный паралич и смерть.Младенцы с врожденными причинами стойкой гипогликемии имеют значительно более высокие показатели заболеваемости и смертности: от 25 до 50% имеют нарушения развития [4]. Нервная ткань может пережить длительные периоды низкого уровня глюкозы в крови, используя альтернативные энергетические субстраты (кетоны, аминокислоты, лактат) для удовлетворения своих метаболических потребностей. [4] [9] Гипотеза состоит в том, что использование этих альтернативных метаболитов может иметь нейропротекторный эффект на незрелый мозг новорожденного. [11] Однако в конечном итоге необходимо обеспечить запас глюкозы.В 1967 году Андерсон и др. опубликовали серию клинических случаев патологических данных 6 младенцев с тяжелой длительной гипогликемией в первую неделю жизни. [9] Авторы сообщили, что тяжелая длительная гипогликемия вызвала обширное перерождение центральной нервной системы и, если ее не лечить, в конечном итоге привела к смерти. [9] Повреждение мозга было менее серьезным у младенцев, получавших экзогенную глюкозу. [9] Таким образом, раннее распознавание состояний, вызывающих стойкую гипогликемию, имеет решающее значение.
Сдерживание и обучение пациентов
Частые проверки уровня глюкозы в крови и диагностика неонатальной гипогликемии могут быть стрессовыми для молодых матерей.Лучший подход к лечению — это тот, который способствует установлению связи между матерью и младенцем и раннему грудному вскармливанию.
Улучшение результатов команды здравоохранения
Важно, чтобы клиницисты и медперсонал в отделении новорожденных сохраняли клиническое подозрение на неонатальную гипогликемию, поскольку симптомы расплывчаты и неспецифичны. Для младенцев с риском стойкой гипогликемии жизненно важно установить, что младенец может поддерживать уровень глюкозы в крови на целевом уровне перед выпиской домой, поскольку стойкая гипогликемия может проявлять клинические симптомы только после первых 48 часов жизни, к этому времени у многих младенцев уже выписаны домой.
Дополнительное образование / Контрольные вопросы
Список литературы
Неонатальная гипогликемия — StatPearls — Книжная полка NCBI
Непрерывное обучение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным.Тем не менее, четкое определение неонатальной гипогликемии отсутствует. Текущие рекомендации по скринингу и алгоритмы лечения основаны на ограниченных доказательствах и больше полагаются на мнение экспертов при составлении рекомендаций. В этом упражнении рассматривается неонатальная гипогликемия и необходимость углубления знаний о ней. Это упражнение подчеркивает роль межпрофессиональной группы в распознавании и лечении неонатальной гипогликемии.
Цели:
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным. Тем не менее, четкое определение неонатальной гипогликемии отсутствует. [1] [2] [3] Текущие рекомендации по скринингу и алгоритмы ведения основаны на ограниченных доказательствах, больше полагаясь на мнение экспертов при составлении рекомендаций. [1] [3] [4]
Несмотря на лучшее понимание раннего гомеостаза глюкозы и переходной гипогликемии в первые 48 часов жизни, пробелы в наших знаниях сохраняются.Наблюдения показали, что у здоровых младенцев преходящая гипогликемия является частью нормальной адаптации к внематочной жизни со снижением концентрации глюкозы в крови до значений от 20 до 25 мг / дл в первые два часа жизни [1]. Однако, поскольку мы обычно не измеряем концентрацию глюкозы в крови у здоровых младенцев без факторов риска гипогликемии, трудно определить «нормальные» уровни глюкозы в крови в первые 48 часов жизни. Как Harding et al. вопрос: «даже если у здоровых младенцев наблюдаются низкие концентрации глюкозы, можем ли мы распространить эти значения на младенцев с риском нарушения метаболической адаптации?» [5] И насколько низкий является слишком низким?
Многоцентровое исследование питания, проведенное в 1988 г. Lucas et al.предложили концентрацию глюкозы в крови <47 мг / дл в качестве критического порога, связанного с неблагоприятными исходами развития нервной системы. [1] [2] [5] [6] В исследовании изучались уровни глюкозы в крови у 661 недоношенного ребенка с массой тела при рождении <1850 граммов, включенных в исследование питания, посвященное стратегиям раннего кормления и когнитивным результатам. [1] [6] Исследователи обнаружили, что количество дней с концентрацией глюкозы в крови <47 мг / дл, связанное с более низкими показателями моторного и умственного развития по шкале Бейли для младенческого развития в возрасте 18 месяцев, скорректировано.[6] У младенцев, у которых наблюдалась гипогликемия (глюкоза <47 мг / дл) в течение 5 или более дней, риск нарушения развития нервной системы увеличивался в 3-5 раз. [6] Авторы пришли к выводу, что «даже умеренная гипогликемия связана со значительным увеличением неблагоприятных последствий развития нервной системы», и призвали к переоценке нынешних тенденций в практике. В результате это значение «47 мг / дл» стало широко принятым в качестве стандартного числового значения для определения неонатальной гипогликемии для всех младенцев, даже здоровых, доношенных, подходящих для младенцев гестационного возраста.[1]
Очевидно, что чрезвычайно низкие концентрации глюкозы в крови у новорожденных могут вызывать апноэ, раздражительность, летаргию, судороги [7] [8] и повреждение головного мозга [9]; и что длительная или симптоматическая гипогликемия может коррелировать с долгосрочными нарушениями развития нервной системы. [1] [10] Однако долгосрочное значение ранних, бессимптомных и временно низких уровней глюкозы до сих пор не установлено. Доказательства, подтверждающие четкое числовое значение глюкозы в крови, которое связано с травмой головного мозга или надежно предсказывает неблагоприятные исходы развития нервной системы, отсутствуют.[3] [2] Даже Лукас и др. признал, что «связь между [концентрациями глюкозы в крови <47 мг / дл] и плохими исходами развития нервной системы может не быть причинной и может отражать неспособность внести поправку на вмешивающиеся факторы». [6]
Этиология
У здоровых младенцев наблюдается ожидаемое снижение в концентрациях глюкозы в крови сразу после рождения как часть нормального физиологического перехода к внематочной жизни. Резкое пережатие пуповины при рождении нарушает связь младенца с плацентой, от которой он зависел, чтобы поставлять глюкозу и другие метаболиты, необходимые для удовлетворения его энергетических потребностей в утробе матери.Непрерывное поступление экзогенной внутривенной глюкозы из плаценты внезапно прекращается, и концентрация глюкозы в крови ребенка снижается в первые часы жизни. Для большинства здоровых младенцев эта переходная неонатальная гипогликемия является кратковременной, преходящей и чаще всего бессимптомной. [4] [11]
Младенцы подвержены риску более тяжелой или продолжительной гипогликемии из-за одного или комбинации следующих основных механизмов: недостаточное поступление глюкозы, низкие запасы гликогена или жира или слабые механизмы производства глюкозы; повышенное использование глюкозы, вызванное чрезмерным производством инсулина или повышенным метаболическим спросом; или отказ контррегулирующих механизмов (т.е., гипофизарная или надпочечниковая недостаточность). [12] [11] Неонатальная гипогликемия чаще всего поражает следующие группы младенцев [3]:
Недоношенные, ограниченные внутриутробные дети и маленькие для гестационного возраста младенцы подвержены риску гипогликемии, потому что они рождаются с уменьшенными запасами гликогена, уменьшенной жировой тканью и испытывают повышенные метаболические потребности из-за их относительно большого размера. размер мозга.[1] [12] У недоношенных детей с очень низкой массой тела при рождении (<1000 г) ферменты, участвующие в глюконеогенезе, экспрессируются на низком уровне; таким образом, их способность продуцировать эндогенную глюкозу низкая, что увеличивает риск серьезных или продолжительных низких концентраций глюкозы. [12]
Младенцы от матерей с диабетом (IDM) и большие для гестационного возраста младенцы страдают гиперинсулинизмом плода и повышенной утилизацией периферической глюкозы, что подвергает их риску гипогликемии в ближайшем послеродовом периоде.[1] [4] [12] Плацента снабжает плод прямым источником глюкозы посредством облегченной диффузии, так что концентрация глюкозы у плода пропорциональна материнскому уровню. Длительное повышение концентрации глюкозы у матери приводит к гипергликемии плода и чрезмерной стимуляции поджелудочной железы, что приводит к увеличению выработки эндогенного инсулина плода. [12] Эти повышенные уровни инсулина плода сохраняются после рождения и, в отсутствие постоянного источника экзогенной глюкозы, приводят к увеличению утилизации глюкозы и снижение концентрации глюкозы в крови.[12] IDM имеют пониженную способность мобилизовать запасы гликогена после рождения и испытывают относительную надпочечниковую недостаточность с пониженным уровнем катехоламинов, что еще больше увеличивает риск низкого уровня глюкозы в крови.
Младенцы, испытывающие перинатальный стресс (например, дистресс плода, перинатальная ишемия, преэклампсия / эклампсия у матери, сепсис, гипотермия) или дети с врожденными пороками сердца, имеют повышенные потребности в метаболической энергии, что подвергает их риску гипогликемии. [1] [4] [12] Перинатальный стресс вызывает состояние «гипогликемического гиперинсулинизма», которое может сохраняться от нескольких дней до недель, что приводит к устойчиво низким концентрациям глюкозы, требующим постоянного вмешательства для поддержания эугликемии.[1]
Другие ятрогенные причины преходящей неонатальной гипогликемии включают внутриродовое введение материнских лекарств (например, бета-адренергических токолитиков, вальпроевой кислоты, пропранолола и проводниковых анестетиков), отсроченное кормление и введение экзогенного инсулина. [12] [11] ]
Низкие концентрации глюкозы после первых 48 часов жизни вызывают беспокойство по поводу основного заболевания как этиологии гипогликемии. Основные физиологические механизмы, вызывающие патологическую или стойкую гипогликемию, аналогичны описанным выше: гиперинсулинизм (например,g., врожденный гиперинсулинизм, синдром Беквита-Видмана, синдром Сото), недостаточное снабжение энергией (т. е. врожденные нарушения метаболизма, которые приводят к дефициту гликогена, аминокислот или свободных жирных кислот) или дефицит кортизола или гормона роста ( например, синдром Костелло, гипопитуитаризм, врожденная гиперплазия надпочечников). Причины стойкой неонатальной гипогликемии включают [12] [10]:
Эпидемиология
Сообщаемая частота неонатальной гипогликемии варьируется в зависимости от нескольких факторов: включали популяцию младенцев, частоту и время тестирования глюкозы, использованный метод тестирования и определение гипогликемии.В исследовании 2006 г., проведенном Harris et al. который стремился определить частоту гипогликемии (уровень глюкозы в крови <47 мг / дл) в первые 48 часов жизни у младенцев старше 35 недель с риском гипогликемии в соответствии с рекомендациями AAP, обнаружил, что 25% всех родов имели риск гипогликемии. ; из этих младенцев из группы риска 51% испытали по крайней мере один эпизод гипогликемии. [1] [13]
Патофизиология
Плод зависит от материнского метаболизма и плацентарного кровообращения, обеспечивая глюкозу, кетоны, свободные жирные кислоты и аминокислоты, необходимые для удовлетворения его энергетических потребностей.[2] Плацента обеспечивает кровообращение плода прямым источником глюкозы. [2] [5] Зажатие пуповины при рождении резко нарушает этот непрерывный источник глюкозы, что приводит к быстрому снижению уровня глюкозы в крови в первые 2–3 часа жизни. [1] [2] [5] Низкие концентрации глюкозы в крови вызывают выброс инсулина и других гормонов (включая катехоламины, глюкагон и кортикостероиды), которые стимулируют выработку глюкозы посредством глюконеогенеза и гликогенолиза и усиливают окисление жирных кислот.Это обеспечивает младенца эндогенным источником глюкозы и других энергетических субстратов, необходимых для поддержания его метаболизма [1]; результатом является постепенное повышение уровня глюкозы в крови в течение следующих нескольких часов или дней. [5] Считается также, что низкий уровень глюкозы стимулирует аппетит новорожденного и помогает ему адаптироваться к прерывистому питанию. [1]
Любой механизм, нарушающий эту последовательность физиологических изменений, подвергает младенца риску более серьезных или продолжительных периодов низкого уровня глюкозы.Риск гипогликемии наиболее высок в первые часы после рождения. [5] [12]
Стойкая гипогликемия возникает в результате чрезмерной секреции инсулина, дефицита кортизола или гормона роста или врожденных нарушений метаболизма. [4] [12]
Анамнез и физические данные
Клинические проявления гипогликемии новорожденных могут быть разными. В остальном здоровый младенец может оставаться бессимптомным, несмотря на чрезвычайно низкий уровень глюкозы в крови в период переходной гипогликемии. Клинические симптомы не коррелируют с уровнем глюкозы в крови.
Симптомы неонатальной гипогликемии включают [2] [11]:
Американская академия педиатрии (AAP) и Педиатрическое эндокринное общество (PES) представляют противоречащие друг другу рекомендации по скринингу детей из группы риска и ведению неонатальной гипогликемии.В самых последних рекомендациях AAP рекомендуется проводить скрининг недоношенных и доношенных детей с симптомами гипогликемии, а также бессимптомных детей с наивысшим риском гипогликемии в первые 12–24 часа жизни. Младенцы «группы риска» включают недоношенных на поздних сроках (34–36,6 недель беременности), доношенных детей, которые малы для гестационного возраста, детей от матерей с диабетом и крупных детей для гестационного возраста [3]. В рекомендациях говорится, что «у здоровых доношенных новорожденных после нормальной беременности и родов не требуется рутинный скрининг и мониторинг уровня глюкозы в крови.'[3]
Педиатрическое эндокринное общество (PES) рекомендует проводить скрининг всех младенцев с факторами риска продолжительной или патологической гипогликемии, включая [4]:
Младенец от диабетической матери
В соответствии с рекомендациями PES, младенцы, неспособные поддерживать уровень глюкозы в крови перед приемом пищи> 50 мг / дл в первые 48 часов жизни или > 60 мг / дл после этого подвержены риску стойкой гипогликемии и требуют дальнейшего обследования перед выпиской домой. [4] PES рекомендует, чтобы оценка младенцев с риском стойкой гипогликемии по основной этиологии проводилась после первых 48 часов жизни, чтобы исключить тех младенцев, у которых наблюдается кратковременный низкий уровень глюкозы (т.е., переходная неонатальная гипогликемия). [4]
PES рекомендует обследовать следующих младенцев, чтобы исключить стойкие причины гипогликемии [4]:
Тестирование в месте оказания медицинской помощи (POCT) предлагает быстрый и экономичный метод скрининга на гипогликемию. [5] Однако у этих методов есть ограничения. В большинстве стандартных инструментов используются неферментативные методы измерения концентрации глюкозы в крови, которые менее точны при более низких значениях глюкозы, чем лабораторный анализ с использованием методов глюкозооксидазы (золотой стандарт) [5]. Образцы цельной крови (используемые в POCT) имеют на 10–18% более низкие концентрации глюкозы, чем в плазме, в зависимости от гематокрита.[5] Следовательно, аномально низкие значения глюкозы на POCT требуют подтверждения путем измерения концентрации глюкозы в плазме с использованием клинических лабораторных методов. [4] [10]
В последнее время изучается возможность использования непрерывного мониторинга уровня глюкозы (CGM) для выявления и лечения неонатальной гипогликемии. В исследовании, опубликованном в 2010 году Harris et al. изучили полезность непрерывного мониторинга уровня глюкозы у 102 новорожденных> 32 недель беременности с риском гипогликемии в течение первых 7 дней жизни.[14] Младенцы были обследованы на гипогликемию с периодическим измерением уровня глюкозы в крови и начали получать раннее пероральное питание или внутривенное введение раствора декстрозы в соответствии с клиническими рекомендациями. [14] Исследователи обнаружили, что обнаруженная гипогликемия (уровень глюкозы в крови <47 мг / дл) присутствовала у 44% младенцев при непрерывном мониторинге уровня глюкозы по сравнению с 32% младенцев при периодическом измерении уровня глюкозы в крови. [14] И что есть хорошее соответствие между интерстициальными (используемыми при непрерывном мониторинге) измерениями глюкозы в крови.[14] Исследование предполагает, что непрерывный мониторинг уровня глюкозы безопасен, прост в использовании и позволяет выявлять больше эпизодов гипогликемии. [14]
У младенцев со стойкой гипогликемией с подозрением на наличие основного заболевания измерение уровней бикарбоната, молочной кислоты, бета-гидроксибутирата, свободных жирных кислот, инсулина и карнитина во время гипогликемии (уровень глюкозы в крови <50 мг / дл) полезно для дифференциации метаболических причины стойкой гипогликемии и помогает в диагностике гиперинсулинизма и нарушений окисления жирных кислот.[4]
Лечение / ведение
В связи с отсутствием единообразного определения неонатальной гипогликемии рекомендации различаются в отношении приемлемого более низкого уровня глюкозы и необходимости вмешательства. Хотя стратегии сосредоточены на целевых концентрациях глюкозы, конечной целью лечения является снижение риска травм головного мозга и долгосрочных нарушений развития нервной системы, которые могут коррелировать с гипогликемией. [5]
Раннее начало грудного вскармливания имеет решающее значение для всех младенцев.Для бессимптомных младенцев с риском неонатальной гипогликемии AAP рекомендует начинать кормление в течение первых часа жизни и проводить первоначальный скрининг глюкозы через 30 минут после первого кормления [3]. AAP рекомендует целевые уровни глюкозы в крови, равные или превышающие 45 мг / дл перед рутинным кормлением, и вмешательство для уровня глюкозы в крови <40 мг / дл в первые 4 часа жизни и <45 мг / дл в 4-24 часа жизнь. [1] [3] Лучшее вмешательство при бессимптомной гипогликемии - увеличить частоту кормления.[5] Некоторым младенцам сложно увеличить объем грудного вскармливания. Трудности с прикладыванием младенца к груди, плохое кормление и малое количество грудного молока могут помешать успешному установлению грудного вскармливания в первые часы жизни. Чаще всего смесь для младенцев является выбором при бессимптомной неонатальной гипогликемии у недоношенных и доношенных новорожденных. [5] Формула недорогая, легкодоступная, простая в употреблении и имеет высокое содержание углеводов, что приводит к быстрому повышению концентрации глюкозы в крови в течение нескольких минут.[12] Однако использование детской смеси может помешать установлению грудного вскармливания и изменить микробиом новорожденного, потенциально увеличивая риск инфекций и аллергии. [5] Уровень глюкозы в крови следует повторно проверить через час после кормления. Неизвестно, нуждаются ли в коррекции ранние эпизоды низкого уровня глюкозы в первые 48 часов жизни у бессимптомных, здоровых младенцев без факторов риска гипогликемии. [5] [3]
Гель декстрозы, массирующий 200 мг / кг на слизистую оболочку рта, является эффективной альтернативой лечения бессимптомных поздних недоношенных и доношенных детей.[5] [12] Гель с декстрозой относительно недорог, хорошо переносится, и было показано, что его использование снижает количество госпитализаций в отделение интенсивной терапии новорожденных для внутривенного введения декстрозы. [5] Кроме того, использование геля декстрозы может быть более предпочтительным вариантом лечения по сравнению с детской смесью, поскольку он способствует грудному вскармливанию и укреплению связи между матерью и младенцем.
AAP рекомендует госпитализацию в отделение интенсивной терапии новорожденных и вмешательство с внутривенным введением декстрозы в следующих случаях [3]:
Все младенцы с симптомами и уровнем глюкозы менее 40 мг / дл
Младенцы со стойкой гипогликемией, несмотря на частоту кормления
*** Бессимптомные младенцы группы риска с чрезвычайно низкими концентрациями глюкозы в крови <25 мг / дл в первые 4 часа жизни или <35 мг / дл в 4–24 часа жизни.
Внутривенно глюкоза вводится болюсно 200 мг / кг (декстроза 10% при 2 мл / кг) с последующей непрерывной инфузией 10% декстрозы при 5–8 мг / кг в минуту (от 80 до 100 мл / кг в минуту). день) для поддержания уровня глюкозы в крови от 40 до 50 мг / дл. [1] [3] Младенцам, получающим внутривенные инфузии декстрозы, требуется тщательный мониторинг с частыми измерениями уровня глюкозы в крови, каждый час в течение первых 12 часов, затем реже достигается одно целевое значение глюкозы. [12] У младенцев от матерей с диабетом для минимизации стимуляции поджелудочной железы и секреции эндогенного инсулина можно использовать более низкие скорости инфузии глюкозы от 3 до 5 мг / кг / мин.[12] Младенцы, которым требуется более высокая скорость внутривенного введения декстрозы (> 12–16 мг / кг / мин) или более 5 дней, с большей вероятностью имеют постоянную причину гипогликемии. [12]
Терапия второй линии для лечения стойкой гипогликемии включает использование кортикостероидов или глюкагона. [12] Кортикостероиды повышают концентрацию глюкозы в крови за счет снижения периферического использования глюкозы и назначаются в виде гидроксикортизона от 5 до 15 мг / кг в день или преднизона 2. мг / кг в день. [12] Глюкагон — гормон, который стимулирует выработку эндогенной глюкозы посредством гликогенолиза и глюконеогенеза; таким образом, его эффективность зависит от наличия у младенца адекватных запасов гликогена.[12] Это наиболее полезно для доношенных детей и младенцев от матерей с диабетом. [12] Дозировка глюкагона осуществляется в виде болюса 30 мкг / кг или непрерывной инфузии 300 мкг / кг в минуту. [12]
PES рекомендует целевые концентрации глюкозы> 50 мг / дл для младенцев с риском гипогликемии без подозрения на врожденное нарушение в течение первых 48 часов жизни и> 60 мг / дл в дальнейшем. [4] Младенцы, не способные поддерживать эти целевые уровни глюкозы, несмотря на регулярный график кормлений, должны быть обследованы, чтобы исключить постоянную причину гипогликемии перед выпиской домой, чтобы гарантировать раннее распознавание и облегчить лечение.[4]
Для младенцев со стойкой гипогликемией цель лечения младенцев с подозрением на гиперинсулинизм — предотвратить повторяющиеся эпизоды низкого уровня глюкозы в крови, которые подвергают ребенка риску будущих эпизодов гипогликемии. У новорожденных с врожденными нарушениями метаболизма и нарушением выработки эндогенной глюкозы целью лечения является предотвращение метаболического ацидоза и последующего нарушения роста [4]. Педиатрическое эндокринное общество рекомендует давать эндогенную глюкозу для поддержания уровня глюкозы в крови> 70 мг / дл у этих младенцев.Инфузии диазоксида от 10 до 15 мг / кг в день могут использоваться у младенцев с врожденным гиперинсулинизмом для подавления секреции инсулина; эффекты видны в течение 2–4 дней. [12] Рекомендации требуют скорейшей консультации с эндокринологом или генетиком. [4]
Дифференциальный диагноз
Симптомы неонатальной гипогликемии неспецифичны и частично совпадают с симптомами других состояний, включая недоношенность, сепсис, гипоксически-ишемическую энцефалопатию и гипонатриемию. Как обсуждалось выше, хотя редкие, стойкие причины гипогликемии должны быть исключены.
Прогноз
Влияние бессимптомной гипогликемии в первые 48 часов жизни на отдаленные исходы развития нервной системы остается хорошо изученным. В результате влиятельного исследования, опубликованного в 1988 г. Lucas et al. предполагая, что рецидивирующая умеренная неонатальная гипогликемия коррелирует с серьезными моторными и умственными нарушениями в скорректированном возрасте 18 месяцев [6], было признано, что даже ранняя бессимптомная гипогликемия может нанести вред долгосрочному развитию. [2] [15] Несколько других наблюдательных исследований представили аналогичные выводы.Однако трудно доказать причинно-следственную связь наблюдаемых результатов. Внося свой вклад в понимание влияния низких уровней глюкозы, большинство исследований не смогли включить контроль эугликемии и использовать различные определения «гипогликемии». [2] Систематический обзор 2006 г., оценивающий доказательства неонатальной гипогликемии на исходы нервного развития, проведенный Boluyt et al. . обнаружили, что большинство исследований в целом были низкого качества, а результаты двух высококачественных исследований были недействительными из-за неоднородности методов.[2] [16] Авторы пришли к выводу, что ни одно из исследований не предоставило убедительных доказательств влияния неонатальной гипогликемии на развитие нервной системы, по которым можно было бы дать клинические рекомендации, и призвали к хорошо спланированному проспективному исследованию по этой теме. [16]
Несмотря на запросы о дальнейших исследованиях младенцев с риском гипогликемии с долгосрочным наблюдением за развитием нервной системы [17] [18], было проведено только два исследования, которые соответствовали методологическим критериям, рекомендованным Boluyt et al .: 15-летнее наблюдение. плановое исследование рецидивирующей гипогликемии у недоношенных детей, проведенное Tin et al.[15] и исследование «Дети с гипогликемией и их дальнейшее развитие» (CHYLD). [5] [19] Опубликованный в 2012 году журнал Tin et al. исследование было направлено на подтверждение результатов исследования Lucas et al. [6] Это проспективное исследование включало недоношенных новорожденных <32 недель беременности, родившихся между 1990 и 1991 годами, у которых измерения уровня глюкозы в крови проводились в первые 10 дней жизни. [15] Исследователи сопоставили младенцев, у которых наблюдалась рецидивирующая неонатальная гипогликемия (определяемая как уровень глюкозы в крови <47 мг / дл в течение 3 или более дней в первые 10 дней жизни), с контрольной группой с эугликемией и не обнаружили различий в развитии или инвалидности в возрасте 2 лет.[2] [15] При повторной оценке в возрасте 15 лет исследователи снова не обнаружили разницы в развитии или показателях IQ между двумя группами. [15] Авторы пришли к выводу, что «исследование не нашло доказательств, подтверждающих мнение о том, что повторяющиеся низкие уровни глюкозы в крови в первые 10 дней жизни обычно представляют опасность для недоношенных детей» [15].
Исследование CHYLD представляет собой проспективное когортное исследование младенцев, родившихся на сроке беременности более 32 недель с факторами риска неонатальной гипогликемии. [19] Первоначальные результаты показали, что лечение неонатальной гипогликемии для поддержания уровня глюкозы в крови> 47 мг / дл не коррелировало с повышенным риском нейросенсорных нарушений в 4 года.5 лет. [19] У младенцев, у которых были более тяжелые или продолжительные эпизоды низкого уровня глюкозы в крови, не было худших результатов [5] [19]. Исследователи не смогли установить числовой уровень глюкозы, при котором риск увеличивался, но обнаружили, что нестабильность глюкозы (пропорция измерений и продолжительность времени, в течение которого значения глюкозы в крови находились за пределами диапазона 54-72 мг / дл) в течение 48 часов жизни были наиболее значительными. прогнозирование худших результатов развития. [5] [19] Младенцы с наибольшей нестабильностью глюкозы имели в 2–3 раза повышенный риск нейросенсорных нарушений.[5] [19] Интересно, что умеренная «гипергликемия», уровень глюкозы в крови> 72 мг / дл, действительно коррелировала с повышенным риском плохой зрительной моторики и исполнительных функций. [19] Это открытие поднимает вопрос: подвергаются ли младенцы с низким и «высоким» ранним уровнем глюкозы в крови риску худших исходов нервного развития?
Осложнения
Тяжелая длительная гипогликемия в неонатальном периоде может иметь разрушительные последствия, включая длительные нарушения нервного развития, церебральный паралич и смерть.Младенцы с врожденными причинами стойкой гипогликемии имеют значительно более высокие показатели заболеваемости и смертности: от 25 до 50% имеют нарушения развития [4]. Нервная ткань может пережить длительные периоды низкого уровня глюкозы в крови, используя альтернативные энергетические субстраты (кетоны, аминокислоты, лактат) для удовлетворения своих метаболических потребностей. [4] [9] Гипотеза состоит в том, что использование этих альтернативных метаболитов может иметь нейропротекторный эффект на незрелый мозг новорожденного. [11] Однако в конечном итоге необходимо обеспечить запас глюкозы.В 1967 году Андерсон и др. опубликовали серию клинических случаев патологических данных 6 младенцев с тяжелой длительной гипогликемией в первую неделю жизни. [9] Авторы сообщили, что тяжелая длительная гипогликемия вызвала обширное перерождение центральной нервной системы и, если ее не лечить, в конечном итоге привела к смерти. [9] Повреждение мозга было менее серьезным у младенцев, получавших экзогенную глюкозу. [9] Таким образом, раннее распознавание состояний, вызывающих стойкую гипогликемию, имеет решающее значение.
Сдерживание и обучение пациентов
Частые проверки уровня глюкозы в крови и диагностика неонатальной гипогликемии могут быть стрессовыми для молодых матерей.Лучший подход к лечению — это тот, который способствует установлению связи между матерью и младенцем и раннему грудному вскармливанию.
Улучшение результатов команды здравоохранения
Важно, чтобы клиницисты и медперсонал в отделении новорожденных сохраняли клиническое подозрение на неонатальную гипогликемию, поскольку симптомы расплывчаты и неспецифичны. Для младенцев с риском стойкой гипогликемии жизненно важно установить, что младенец может поддерживать уровень глюкозы в крови на целевом уровне перед выпиской домой, поскольку стойкая гипогликемия может проявлять клинические симптомы только после первых 48 часов жизни, к этому времени у многих младенцев уже выписаны домой.
Дополнительное образование / Контрольные вопросы
Список литературы
Неонатальная гипогликемия — StatPearls — Книжная полка NCBI
Непрерывное обучение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным.Тем не менее, четкое определение неонатальной гипогликемии отсутствует. Текущие рекомендации по скринингу и алгоритмы лечения основаны на ограниченных доказательствах и больше полагаются на мнение экспертов при составлении рекомендаций. В этом упражнении рассматривается неонатальная гипогликемия и необходимость углубления знаний о ней. Это упражнение подчеркивает роль межпрофессиональной группы в распознавании и лечении неонатальной гипогликемии.
Цели:
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Гипогликемия — наиболее частое нарушение обмена веществ в неонатальном периоде. Скрининг младенцев из группы риска и контроль низкого уровня глюкозы в крови в первые часы или дни жизни — частая проблема при уходе за новорожденным. Тем не менее, четкое определение неонатальной гипогликемии отсутствует. [1] [2] [3] Текущие рекомендации по скринингу и алгоритмы ведения основаны на ограниченных доказательствах, больше полагаясь на мнение экспертов при составлении рекомендаций. [1] [3] [4]
Несмотря на лучшее понимание раннего гомеостаза глюкозы и переходной гипогликемии в первые 48 часов жизни, пробелы в наших знаниях сохраняются.Наблюдения показали, что у здоровых младенцев преходящая гипогликемия является частью нормальной адаптации к внематочной жизни со снижением концентрации глюкозы в крови до значений от 20 до 25 мг / дл в первые два часа жизни [1]. Однако, поскольку мы обычно не измеряем концентрацию глюкозы в крови у здоровых младенцев без факторов риска гипогликемии, трудно определить «нормальные» уровни глюкозы в крови в первые 48 часов жизни. Как Harding et al. вопрос: «даже если у здоровых младенцев наблюдаются низкие концентрации глюкозы, можем ли мы распространить эти значения на младенцев с риском нарушения метаболической адаптации?» [5] И насколько низкий является слишком низким?
Многоцентровое исследование питания, проведенное в 1988 г. Lucas et al.предложили концентрацию глюкозы в крови <47 мг / дл в качестве критического порога, связанного с неблагоприятными исходами развития нервной системы. [1] [2] [5] [6] В исследовании изучались уровни глюкозы в крови у 661 недоношенного ребенка с массой тела при рождении <1850 граммов, включенных в исследование питания, посвященное стратегиям раннего кормления и когнитивным результатам. [1] [6] Исследователи обнаружили, что количество дней с концентрацией глюкозы в крови <47 мг / дл, связанное с более низкими показателями моторного и умственного развития по шкале Бейли для младенческого развития в возрасте 18 месяцев, скорректировано.[6] У младенцев, у которых наблюдалась гипогликемия (глюкоза <47 мг / дл) в течение 5 или более дней, риск нарушения развития нервной системы увеличивался в 3-5 раз. [6] Авторы пришли к выводу, что «даже умеренная гипогликемия связана со значительным увеличением неблагоприятных последствий развития нервной системы», и призвали к переоценке нынешних тенденций в практике. В результате это значение «47 мг / дл» стало широко принятым в качестве стандартного числового значения для определения неонатальной гипогликемии для всех младенцев, даже здоровых, доношенных, подходящих для младенцев гестационного возраста.[1]
Очевидно, что чрезвычайно низкие концентрации глюкозы в крови у новорожденных могут вызывать апноэ, раздражительность, летаргию, судороги [7] [8] и повреждение головного мозга [9]; и что длительная или симптоматическая гипогликемия может коррелировать с долгосрочными нарушениями развития нервной системы. [1] [10] Однако долгосрочное значение ранних, бессимптомных и временно низких уровней глюкозы до сих пор не установлено. Доказательства, подтверждающие четкое числовое значение глюкозы в крови, которое связано с травмой головного мозга или надежно предсказывает неблагоприятные исходы развития нервной системы, отсутствуют.[3] [2] Даже Лукас и др. признал, что «связь между [концентрациями глюкозы в крови <47 мг / дл] и плохими исходами развития нервной системы может не быть причинной и может отражать неспособность внести поправку на вмешивающиеся факторы». [6]
Этиология
У здоровых младенцев наблюдается ожидаемое снижение в концентрациях глюкозы в крови сразу после рождения как часть нормального физиологического перехода к внематочной жизни. Резкое пережатие пуповины при рождении нарушает связь младенца с плацентой, от которой он зависел, чтобы поставлять глюкозу и другие метаболиты, необходимые для удовлетворения его энергетических потребностей в утробе матери.Непрерывное поступление экзогенной внутривенной глюкозы из плаценты внезапно прекращается, и концентрация глюкозы в крови ребенка снижается в первые часы жизни. Для большинства здоровых младенцев эта переходная неонатальная гипогликемия является кратковременной, преходящей и чаще всего бессимптомной. [4] [11]
Младенцы подвержены риску более тяжелой или продолжительной гипогликемии из-за одного или комбинации следующих основных механизмов: недостаточное поступление глюкозы, низкие запасы гликогена или жира или слабые механизмы производства глюкозы; повышенное использование глюкозы, вызванное чрезмерным производством инсулина или повышенным метаболическим спросом; или отказ контррегулирующих механизмов (т.е., гипофизарная или надпочечниковая недостаточность). [12] [11] Неонатальная гипогликемия чаще всего поражает следующие группы младенцев [3]:
Недоношенные, ограниченные внутриутробные дети и маленькие для гестационного возраста младенцы подвержены риску гипогликемии, потому что они рождаются с уменьшенными запасами гликогена, уменьшенной жировой тканью и испытывают повышенные метаболические потребности из-за их относительно большого размера. размер мозга.[1] [12] У недоношенных детей с очень низкой массой тела при рождении (<1000 г) ферменты, участвующие в глюконеогенезе, экспрессируются на низком уровне; таким образом, их способность продуцировать эндогенную глюкозу низкая, что увеличивает риск серьезных или продолжительных низких концентраций глюкозы. [12]
Младенцы от матерей с диабетом (IDM) и большие для гестационного возраста младенцы страдают гиперинсулинизмом плода и повышенной утилизацией периферической глюкозы, что подвергает их риску гипогликемии в ближайшем послеродовом периоде.[1] [4] [12] Плацента снабжает плод прямым источником глюкозы посредством облегченной диффузии, так что концентрация глюкозы у плода пропорциональна материнскому уровню. Длительное повышение концентрации глюкозы у матери приводит к гипергликемии плода и чрезмерной стимуляции поджелудочной железы, что приводит к увеличению выработки эндогенного инсулина плода. [12] Эти повышенные уровни инсулина плода сохраняются после рождения и, в отсутствие постоянного источника экзогенной глюкозы, приводят к увеличению утилизации глюкозы и снижение концентрации глюкозы в крови.[12] IDM имеют пониженную способность мобилизовать запасы гликогена после рождения и испытывают относительную надпочечниковую недостаточность с пониженным уровнем катехоламинов, что еще больше увеличивает риск низкого уровня глюкозы в крови.
Младенцы, испытывающие перинатальный стресс (например, дистресс плода, перинатальная ишемия, преэклампсия / эклампсия у матери, сепсис, гипотермия) или дети с врожденными пороками сердца, имеют повышенные потребности в метаболической энергии, что подвергает их риску гипогликемии. [1] [4] [12] Перинатальный стресс вызывает состояние «гипогликемического гиперинсулинизма», которое может сохраняться от нескольких дней до недель, что приводит к устойчиво низким концентрациям глюкозы, требующим постоянного вмешательства для поддержания эугликемии.[1]
Другие ятрогенные причины преходящей неонатальной гипогликемии включают внутриродовое введение материнских лекарств (например, бета-адренергических токолитиков, вальпроевой кислоты, пропранолола и проводниковых анестетиков), отсроченное кормление и введение экзогенного инсулина. [12] [11] ]
Низкие концентрации глюкозы после первых 48 часов жизни вызывают беспокойство по поводу основного заболевания как этиологии гипогликемии. Основные физиологические механизмы, вызывающие патологическую или стойкую гипогликемию, аналогичны описанным выше: гиперинсулинизм (например,g., врожденный гиперинсулинизм, синдром Беквита-Видмана, синдром Сото), недостаточное снабжение энергией (т. е. врожденные нарушения метаболизма, которые приводят к дефициту гликогена, аминокислот или свободных жирных кислот) или дефицит кортизола или гормона роста ( например, синдром Костелло, гипопитуитаризм, врожденная гиперплазия надпочечников). Причины стойкой неонатальной гипогликемии включают [12] [10]:
Эпидемиология
Сообщаемая частота неонатальной гипогликемии варьируется в зависимости от нескольких факторов: включали популяцию младенцев, частоту и время тестирования глюкозы, использованный метод тестирования и определение гипогликемии.В исследовании 2006 г., проведенном Harris et al. который стремился определить частоту гипогликемии (уровень глюкозы в крови <47 мг / дл) в первые 48 часов жизни у младенцев старше 35 недель с риском гипогликемии в соответствии с рекомендациями AAP, обнаружил, что 25% всех родов имели риск гипогликемии. ; из этих младенцев из группы риска 51% испытали по крайней мере один эпизод гипогликемии. [1] [13]
Патофизиология
Плод зависит от материнского метаболизма и плацентарного кровообращения, обеспечивая глюкозу, кетоны, свободные жирные кислоты и аминокислоты, необходимые для удовлетворения его энергетических потребностей.[2] Плацента обеспечивает кровообращение плода прямым источником глюкозы. [2] [5] Зажатие пуповины при рождении резко нарушает этот непрерывный источник глюкозы, что приводит к быстрому снижению уровня глюкозы в крови в первые 2–3 часа жизни. [1] [2] [5] Низкие концентрации глюкозы в крови вызывают выброс инсулина и других гормонов (включая катехоламины, глюкагон и кортикостероиды), которые стимулируют выработку глюкозы посредством глюконеогенеза и гликогенолиза и усиливают окисление жирных кислот.Это обеспечивает младенца эндогенным источником глюкозы и других энергетических субстратов, необходимых для поддержания его метаболизма [1]; результатом является постепенное повышение уровня глюкозы в крови в течение следующих нескольких часов или дней. [5] Считается также, что низкий уровень глюкозы стимулирует аппетит новорожденного и помогает ему адаптироваться к прерывистому питанию. [1]
Любой механизм, нарушающий эту последовательность физиологических изменений, подвергает младенца риску более серьезных или продолжительных периодов низкого уровня глюкозы.Риск гипогликемии наиболее высок в первые часы после рождения. [5] [12]
Стойкая гипогликемия возникает в результате чрезмерной секреции инсулина, дефицита кортизола или гормона роста или врожденных нарушений метаболизма. [4] [12]
Анамнез и физические данные
Клинические проявления гипогликемии новорожденных могут быть разными. В остальном здоровый младенец может оставаться бессимптомным, несмотря на чрезвычайно низкий уровень глюкозы в крови в период переходной гипогликемии. Клинические симптомы не коррелируют с уровнем глюкозы в крови.
Симптомы неонатальной гипогликемии включают [2] [11]:
Американская академия педиатрии (AAP) и Педиатрическое эндокринное общество (PES) представляют противоречащие друг другу рекомендации по скринингу детей из группы риска и ведению неонатальной гипогликемии.В самых последних рекомендациях AAP рекомендуется проводить скрининг недоношенных и доношенных детей с симптомами гипогликемии, а также бессимптомных детей с наивысшим риском гипогликемии в первые 12–24 часа жизни. Младенцы «группы риска» включают недоношенных на поздних сроках (34–36,6 недель беременности), доношенных детей, которые малы для гестационного возраста, детей от матерей с диабетом и крупных детей для гестационного возраста [3]. В рекомендациях говорится, что «у здоровых доношенных новорожденных после нормальной беременности и родов не требуется рутинный скрининг и мониторинг уровня глюкозы в крови.'[3]
Педиатрическое эндокринное общество (PES) рекомендует проводить скрининг всех младенцев с факторами риска продолжительной или патологической гипогликемии, включая [4]:
Младенец от диабетической матери
В соответствии с рекомендациями PES, младенцы, неспособные поддерживать уровень глюкозы в крови перед приемом пищи> 50 мг / дл в первые 48 часов жизни или > 60 мг / дл после этого подвержены риску стойкой гипогликемии и требуют дальнейшего обследования перед выпиской домой. [4] PES рекомендует, чтобы оценка младенцев с риском стойкой гипогликемии по основной этиологии проводилась после первых 48 часов жизни, чтобы исключить тех младенцев, у которых наблюдается кратковременный низкий уровень глюкозы (т.е., переходная неонатальная гипогликемия). [4]
PES рекомендует обследовать следующих младенцев, чтобы исключить стойкие причины гипогликемии [4]:
Тестирование в месте оказания медицинской помощи (POCT) предлагает быстрый и экономичный метод скрининга на гипогликемию. [5] Однако у этих методов есть ограничения. В большинстве стандартных инструментов используются неферментативные методы измерения концентрации глюкозы в крови, которые менее точны при более низких значениях глюкозы, чем лабораторный анализ с использованием методов глюкозооксидазы (золотой стандарт) [5]. Образцы цельной крови (используемые в POCT) имеют на 10–18% более низкие концентрации глюкозы, чем в плазме, в зависимости от гематокрита.[5] Следовательно, аномально низкие значения глюкозы на POCT требуют подтверждения путем измерения концентрации глюкозы в плазме с использованием клинических лабораторных методов. [4] [10]
В последнее время изучается возможность использования непрерывного мониторинга уровня глюкозы (CGM) для выявления и лечения неонатальной гипогликемии. В исследовании, опубликованном в 2010 году Harris et al. изучили полезность непрерывного мониторинга уровня глюкозы у 102 новорожденных> 32 недель беременности с риском гипогликемии в течение первых 7 дней жизни.[14] Младенцы были обследованы на гипогликемию с периодическим измерением уровня глюкозы в крови и начали получать раннее пероральное питание или внутривенное введение раствора декстрозы в соответствии с клиническими рекомендациями. [14] Исследователи обнаружили, что обнаруженная гипогликемия (уровень глюкозы в крови <47 мг / дл) присутствовала у 44% младенцев при непрерывном мониторинге уровня глюкозы по сравнению с 32% младенцев при периодическом измерении уровня глюкозы в крови. [14] И что есть хорошее соответствие между интерстициальными (используемыми при непрерывном мониторинге) измерениями глюкозы в крови.[14] Исследование предполагает, что непрерывный мониторинг уровня глюкозы безопасен, прост в использовании и позволяет выявлять больше эпизодов гипогликемии. [14]
У младенцев со стойкой гипогликемией с подозрением на наличие основного заболевания измерение уровней бикарбоната, молочной кислоты, бета-гидроксибутирата, свободных жирных кислот, инсулина и карнитина во время гипогликемии (уровень глюкозы в крови <50 мг / дл) полезно для дифференциации метаболических причины стойкой гипогликемии и помогает в диагностике гиперинсулинизма и нарушений окисления жирных кислот.[4]
Лечение / ведение
В связи с отсутствием единообразного определения неонатальной гипогликемии рекомендации различаются в отношении приемлемого более низкого уровня глюкозы и необходимости вмешательства. Хотя стратегии сосредоточены на целевых концентрациях глюкозы, конечной целью лечения является снижение риска травм головного мозга и долгосрочных нарушений развития нервной системы, которые могут коррелировать с гипогликемией. [5]
Раннее начало грудного вскармливания имеет решающее значение для всех младенцев.Для бессимптомных младенцев с риском неонатальной гипогликемии AAP рекомендует начинать кормление в течение первых часа жизни и проводить первоначальный скрининг глюкозы через 30 минут после первого кормления [3]. AAP рекомендует целевые уровни глюкозы в крови, равные или превышающие 45 мг / дл перед рутинным кормлением, и вмешательство для уровня глюкозы в крови <40 мг / дл в первые 4 часа жизни и <45 мг / дл в 4-24 часа жизнь. [1] [3] Лучшее вмешательство при бессимптомной гипогликемии - увеличить частоту кормления.[5] Некоторым младенцам сложно увеличить объем грудного вскармливания. Трудности с прикладыванием младенца к груди, плохое кормление и малое количество грудного молока могут помешать успешному установлению грудного вскармливания в первые часы жизни. Чаще всего смесь для младенцев является выбором при бессимптомной неонатальной гипогликемии у недоношенных и доношенных новорожденных. [5] Формула недорогая, легкодоступная, простая в употреблении и имеет высокое содержание углеводов, что приводит к быстрому повышению концентрации глюкозы в крови в течение нескольких минут.[12] Однако использование детской смеси может помешать установлению грудного вскармливания и изменить микробиом новорожденного, потенциально увеличивая риск инфекций и аллергии. [5] Уровень глюкозы в крови следует повторно проверить через час после кормления. Неизвестно, нуждаются ли в коррекции ранние эпизоды низкого уровня глюкозы в первые 48 часов жизни у бессимптомных, здоровых младенцев без факторов риска гипогликемии. [5] [3]
Гель декстрозы, массирующий 200 мг / кг на слизистую оболочку рта, является эффективной альтернативой лечения бессимптомных поздних недоношенных и доношенных детей.[5] [12] Гель с декстрозой относительно недорог, хорошо переносится, и было показано, что его использование снижает количество госпитализаций в отделение интенсивной терапии новорожденных для внутривенного введения декстрозы. [5] Кроме того, использование геля декстрозы может быть более предпочтительным вариантом лечения по сравнению с детской смесью, поскольку он способствует грудному вскармливанию и укреплению связи между матерью и младенцем.
AAP рекомендует госпитализацию в отделение интенсивной терапии новорожденных и вмешательство с внутривенным введением декстрозы в следующих случаях [3]:
Все младенцы с симптомами и уровнем глюкозы менее 40 мг / дл
Младенцы со стойкой гипогликемией, несмотря на частоту кормления
*** Бессимптомные младенцы группы риска с чрезвычайно низкими концентрациями глюкозы в крови <25 мг / дл в первые 4 часа жизни или <35 мг / дл в 4–24 часа жизни.
Внутривенно глюкоза вводится болюсно 200 мг / кг (декстроза 10% при 2 мл / кг) с последующей непрерывной инфузией 10% декстрозы при 5–8 мг / кг в минуту (от 80 до 100 мл / кг в минуту). день) для поддержания уровня глюкозы в крови от 40 до 50 мг / дл. [1] [3] Младенцам, получающим внутривенные инфузии декстрозы, требуется тщательный мониторинг с частыми измерениями уровня глюкозы в крови, каждый час в течение первых 12 часов, затем реже достигается одно целевое значение глюкозы. [12] У младенцев от матерей с диабетом для минимизации стимуляции поджелудочной железы и секреции эндогенного инсулина можно использовать более низкие скорости инфузии глюкозы от 3 до 5 мг / кг / мин.[12] Младенцы, которым требуется более высокая скорость внутривенного введения декстрозы (> 12–16 мг / кг / мин) или более 5 дней, с большей вероятностью имеют постоянную причину гипогликемии. [12]
Терапия второй линии для лечения стойкой гипогликемии включает использование кортикостероидов или глюкагона. [12] Кортикостероиды повышают концентрацию глюкозы в крови за счет снижения периферического использования глюкозы и назначаются в виде гидроксикортизона от 5 до 15 мг / кг в день или преднизона 2. мг / кг в день. [12] Глюкагон — гормон, который стимулирует выработку эндогенной глюкозы посредством гликогенолиза и глюконеогенеза; таким образом, его эффективность зависит от наличия у младенца адекватных запасов гликогена.[12] Это наиболее полезно для доношенных детей и младенцев от матерей с диабетом. [12] Дозировка глюкагона осуществляется в виде болюса 30 мкг / кг или непрерывной инфузии 300 мкг / кг в минуту. [12]
PES рекомендует целевые концентрации глюкозы> 50 мг / дл для младенцев с риском гипогликемии без подозрения на врожденное нарушение в течение первых 48 часов жизни и> 60 мг / дл в дальнейшем. [4] Младенцы, не способные поддерживать эти целевые уровни глюкозы, несмотря на регулярный график кормлений, должны быть обследованы, чтобы исключить постоянную причину гипогликемии перед выпиской домой, чтобы гарантировать раннее распознавание и облегчить лечение.[4]
Для младенцев со стойкой гипогликемией цель лечения младенцев с подозрением на гиперинсулинизм — предотвратить повторяющиеся эпизоды низкого уровня глюкозы в крови, которые подвергают ребенка риску будущих эпизодов гипогликемии. У новорожденных с врожденными нарушениями метаболизма и нарушением выработки эндогенной глюкозы целью лечения является предотвращение метаболического ацидоза и последующего нарушения роста [4]. Педиатрическое эндокринное общество рекомендует давать эндогенную глюкозу для поддержания уровня глюкозы в крови> 70 мг / дл у этих младенцев.Инфузии диазоксида от 10 до 15 мг / кг в день могут использоваться у младенцев с врожденным гиперинсулинизмом для подавления секреции инсулина; эффекты видны в течение 2–4 дней. [12] Рекомендации требуют скорейшей консультации с эндокринологом или генетиком. [4]
Дифференциальный диагноз
Симптомы неонатальной гипогликемии неспецифичны и частично совпадают с симптомами других состояний, включая недоношенность, сепсис, гипоксически-ишемическую энцефалопатию и гипонатриемию. Как обсуждалось выше, хотя редкие, стойкие причины гипогликемии должны быть исключены.
Прогноз
Влияние бессимптомной гипогликемии в первые 48 часов жизни на отдаленные исходы развития нервной системы остается хорошо изученным. В результате влиятельного исследования, опубликованного в 1988 г. Lucas et al. предполагая, что рецидивирующая умеренная неонатальная гипогликемия коррелирует с серьезными моторными и умственными нарушениями в скорректированном возрасте 18 месяцев [6], было признано, что даже ранняя бессимптомная гипогликемия может нанести вред долгосрочному развитию. [2] [15] Несколько других наблюдательных исследований представили аналогичные выводы.Однако трудно доказать причинно-следственную связь наблюдаемых результатов. Внося свой вклад в понимание влияния низких уровней глюкозы, большинство исследований не смогли включить контроль эугликемии и использовать различные определения «гипогликемии». [2] Систематический обзор 2006 г., оценивающий доказательства неонатальной гипогликемии на исходы нервного развития, проведенный Boluyt et al. . обнаружили, что большинство исследований в целом были низкого качества, а результаты двух высококачественных исследований были недействительными из-за неоднородности методов.[2] [16] Авторы пришли к выводу, что ни одно из исследований не предоставило убедительных доказательств влияния неонатальной гипогликемии на развитие нервной системы, по которым можно было бы дать клинические рекомендации, и призвали к хорошо спланированному проспективному исследованию по этой теме. [16]
Несмотря на запросы о дальнейших исследованиях младенцев с риском гипогликемии с долгосрочным наблюдением за развитием нервной системы [17] [18], было проведено только два исследования, которые соответствовали методологическим критериям, рекомендованным Boluyt et al .: 15-летнее наблюдение. плановое исследование рецидивирующей гипогликемии у недоношенных детей, проведенное Tin et al.[15] и исследование «Дети с гипогликемией и их дальнейшее развитие» (CHYLD). [5] [19] Опубликованный в 2012 году журнал Tin et al. исследование было направлено на подтверждение результатов исследования Lucas et al. [6] Это проспективное исследование включало недоношенных новорожденных <32 недель беременности, родившихся между 1990 и 1991 годами, у которых измерения уровня глюкозы в крови проводились в первые 10 дней жизни. [15] Исследователи сопоставили младенцев, у которых наблюдалась рецидивирующая неонатальная гипогликемия (определяемая как уровень глюкозы в крови <47 мг / дл в течение 3 или более дней в первые 10 дней жизни), с контрольной группой с эугликемией и не обнаружили различий в развитии или инвалидности в возрасте 2 лет.[2] [15] При повторной оценке в возрасте 15 лет исследователи снова не обнаружили разницы в развитии или показателях IQ между двумя группами. [15] Авторы пришли к выводу, что «исследование не нашло доказательств, подтверждающих мнение о том, что повторяющиеся низкие уровни глюкозы в крови в первые 10 дней жизни обычно представляют опасность для недоношенных детей» [15].
Исследование CHYLD представляет собой проспективное когортное исследование младенцев, родившихся на сроке беременности более 32 недель с факторами риска неонатальной гипогликемии. [19] Первоначальные результаты показали, что лечение неонатальной гипогликемии для поддержания уровня глюкозы в крови> 47 мг / дл не коррелировало с повышенным риском нейросенсорных нарушений в 4 года.5 лет. [19] У младенцев, у которых были более тяжелые или продолжительные эпизоды низкого уровня глюкозы в крови, не было худших результатов [5] [19]. Исследователи не смогли установить числовой уровень глюкозы, при котором риск увеличивался, но обнаружили, что нестабильность глюкозы (пропорция измерений и продолжительность времени, в течение которого значения глюкозы в крови находились за пределами диапазона 54-72 мг / дл) в течение 48 часов жизни были наиболее значительными. прогнозирование худших результатов развития. [5] [19] Младенцы с наибольшей нестабильностью глюкозы имели в 2–3 раза повышенный риск нейросенсорных нарушений.[5] [19] Интересно, что умеренная «гипергликемия», уровень глюкозы в крови> 72 мг / дл, действительно коррелировала с повышенным риском плохой зрительной моторики и исполнительных функций. [19] Это открытие поднимает вопрос: подвергаются ли младенцы с низким и «высоким» ранним уровнем глюкозы в крови риску худших исходов нервного развития?
Осложнения
Тяжелая длительная гипогликемия в неонатальном периоде может иметь разрушительные последствия, включая длительные нарушения нервного развития, церебральный паралич и смерть.Младенцы с врожденными причинами стойкой гипогликемии имеют значительно более высокие показатели заболеваемости и смертности: от 25 до 50% имеют нарушения развития [4]. Нервная ткань может пережить длительные периоды низкого уровня глюкозы в крови, используя альтернативные энергетические субстраты (кетоны, аминокислоты, лактат) для удовлетворения своих метаболических потребностей. [4] [9] Гипотеза состоит в том, что использование этих альтернативных метаболитов может иметь нейропротекторный эффект на незрелый мозг новорожденного. [11] Однако в конечном итоге необходимо обеспечить запас глюкозы.В 1967 году Андерсон и др. опубликовали серию клинических случаев патологических данных 6 младенцев с тяжелой длительной гипогликемией в первую неделю жизни. [9] Авторы сообщили, что тяжелая длительная гипогликемия вызвала обширное перерождение центральной нервной системы и, если ее не лечить, в конечном итоге привела к смерти. [9] Повреждение мозга было менее серьезным у младенцев, получавших экзогенную глюкозу. [9] Таким образом, раннее распознавание состояний, вызывающих стойкую гипогликемию, имеет решающее значение.
Сдерживание и обучение пациентов
Частые проверки уровня глюкозы в крови и диагностика неонатальной гипогликемии могут быть стрессовыми для молодых матерей.Лучший подход к лечению — это тот, который способствует установлению связи между матерью и младенцем и раннему грудному вскармливанию.
Улучшение результатов команды здравоохранения
Важно, чтобы клиницисты и медперсонал в отделении новорожденных сохраняли клиническое подозрение на неонатальную гипогликемию, поскольку симптомы расплывчаты и неспецифичны. Для младенцев с риском стойкой гипогликемии жизненно важно установить, что младенец может поддерживать уровень глюкозы в крови на целевом уровне перед выпиской домой, поскольку стойкая гипогликемия может проявлять клинические симптомы только после первых 48 часов жизни, к этому времени у многих младенцев уже выписаны домой.
Дополнительное образование / Контрольные вопросы
Список литературы
Гипогликемия новорожденных — Педиатрия — Руководства Merck Professional Edition
Новорожденные, относящиеся к большинству групп высокого риска, проходят профилактическое лечение.Например, младенцев от женщин с диабетом, которые принимали инсулин, часто начинают при рождении с вливания 10% D / W внутривенно или перорального приема глюкозы, как и тем, кто болеет, очень недоношен или страдает респираторной недостаточностью. Других новорожденных из группы риска, которые не болеют, следует начинать с раннего и частого кормления смесями, чтобы обеспечить их углеводами.
Любой новорожденный, у которого уровень глюкозы падает до ≤ 50 мг / дл (≤ 2,75 ммоль / л), должен незамедлительно начать лечение с энтерального питания или с внутривенной инфузией до 12.5% D / W, 2 мл / кг за 10 минут; При необходимости можно вводить более высокие концентрации декстрозы через центральный катетер. Затем инфузия должна продолжаться со скоростью, обеспечивающей от 4 до 8 мг / кг / мин глюкозы (т. Е. 10% D / W примерно от 2,5 до 5 мл / кг / час). Для корректировки скорости инфузии необходимо контролировать уровень глюкозы в сыворотке. Как только состояние новорожденного улучшится, энтеральное питание может постепенно заменить внутривенное вливание, в то время как концентрация глюкозы продолжает контролироваться. Внутривенное введение декстрозы всегда должно быть постепенным, поскольку внезапное прекращение приема может вызвать гипогликемию.
Если начало внутривенной инфузии новорожденному с гипогликемией затруднено, глюкагон от 100 до 300 мкг / кг внутримышечно (максимум 1 мг) обычно быстро повышает уровень глюкозы в сыворотке, и этот эффект длится 2-3 часа, за исключением новорожденных с истощенным гликогеном магазины. Гипогликемию, резистентную к высоким дозам инфузии глюкозы, можно лечить гидрокортизоном 12,5 мг / м 2 каждые 6 часов. Если гипогликемия не поддается лечению, следует рассмотреть другие причины (например, сепсис) и, возможно, эндокринное обследование на предмет стойкого гиперинсулинизма и нарушений дефектного глюконеогенеза или гликогенолиза.
Гипогликемия новорожденных | Американская академия педиатрии
ЦЕЛИ
После завершения этой статьи читатели должны иметь возможность:
Пример из практики
Доношенный младенец мужского пола родился после
протекающая без осложнений беременность
28-летняя беременная I женщина, которая
не имел признаков гипергликемии
и никаких хронических заболеваний. Младенец
имел баллы по шкале Апгар 7 и 9 на
1 и 5 минут соответственно. Его
параметры роста были в
нормальный диапазон, при весе на 60-м
процентиль, окружность головы на
50-й процентиль и длина на
50-й процентиль.Ребенка забрали
к колодцу детскую, осмотрели
и купались, а потом отнесли в
мать для кормления около 2 часов
возраста. Он выглядел слегка нервным
в то время и было не очень
заинтересован в уходе или очень осведомлен.
Концентрация глюкозы в крови
1,39 ммоль / л (25 мг / дл) было
получено с помощью One Touch ®
инструмент. Ребенка кормили 25 мл
5% раствор декстрозы в воде. Кровь
полученная концентрация глюкозы
1 час спустя 2,22 ммоль / л.
(40 мг / дл), и ребенок, находившийся на кормлении грудью в течение
около 5 минут на каждую грудь с
очевидное удовлетворение.Дрожь и «
отсутствие интереса ».
Обычный режим работы яслей был
последовал, без комментариев в диаграмме
медперсоналом о
кормление или поведение младенца до
второй день жизни, когда он снова
казался нервным и суетливым. Глюкоза
концентрация в то время была
1,11 ммоль / л (20 мг / дл). Младенец
кормили грудью или из бутылочки (обычное
Домашняя формула 20 ккал / унция)
чередование каждые 2 часа и клинические признаки
улучшен. One Touch ® глюкоза
концентрации, полученные в течение следующих
24 часа были переменными, но в целом
концентрация увеличилась, с
перед выпиской, предрандиальная стоимость
2.78 ммоль / л (50 мг / дл).
Семья не вернулась в
больничная клиника на следующий день, но сделал
обратитесь к своему лечащему врачу на
пятый день жизни в это время
младенец вел себя голодным, был отмечен
быть «очень активным» и взвешенным
На 113,4 г больше веса при рождении. В
2 недели жизни, отметили родители
младенец быть очень суетливым и
нервничать и испытывать приступы пристального взгляда.
В местном отделении неотложной помощи он
было отмечено похудание,
казался сонным, но суетливым, когда
возбудился, и начал
тонико-клонические подергивания всех
конечности.«Глюкоза
концентрация »была менее 0,55 ммоль / л.
(10 мг / дл). Младенец лечился
с внутривенным введением глюкозы, и
очевидный приступ разрешился. Над
следующие несколько недель младенец
вернулся в аварийную ситуацию
отдел несколько раз с похожими
эпизоды.
После окончательного осмотра
врач первичной медико-санитарной помощи, младенец
набрала 283,5 г и появилась «
пухлый ». «Офисная глюкоза»
концентрация »составляла 1,94 ммоль / л (35
мг / дл). Младенец был направлен в
детский эндокринолог, отметивший
что вес младенца был
приближается к 90-му процентилю,
была определенная гепатомегалия,
и младенец выглядел «апатичным».”
В больнице несколько сывороток
концентрации глюкозы были измерены
менее 2,22 ммоль / л (40
мг / дл), с инсулином в плазме
все концентрации более 144 пмоль / л
(20 мкЕд / мл).
Младенец лечился
диазоксид с ограниченным успехом
в течение следующих 3 месяцев.
Разработка продолжалась, но была «медленной». Он
лечился в местной неотложной помощи
отдел трижды для
тонико-клонические судороги, требующие
внутривенное введение глюкозы для коррекции тяжелой
гипогликемия. В 5-месячном возрасте
младенец прошел промежуточный итог
панкреатэктомия.Во время выздоровления у него был
тяжелый, продолжительный приступ и был
был в шоке, требуя двух
туры реанимации. Эшерихия
coli был диагностирован менингит и
лечится успешно.
В возрасте 1 года младенец
показал небольшой прогресс в развитии
с 6-месячного возраста. Через 5 лет
возраст, он выставлялся крайне бедным
рост, был сахарный диабет,
потребовалось лечение инсулином, и
требуемый фермент поджелудочной железы
замена кормлением для лечения
мальабсорбционная диарея.Он был почти
полностью глухой и пометил
отставание в развитии. Его родители
обратился за помощью к адвокату, утверждая, что
лечащие врачи в родах
больнице не удалось диагностировать «
гиперинсулинизм », которое затем привело
к несвоевременной диагностике и лечению,
с последующим тяжелым неврологическим
повреждать.
Вопросы для рассмотрения (не стесняйтесь
отправьте свои ответы на эти
вопросы и любые собственные вопросы
на рассмотрение «экспертов» и
обсудить об этом случае):
Уильям У.Hay, Jr, MD, соредактор
Введение
Глюкоза является основным источником
энергия для работы органов. Хотя
все органы могут использовать глюкозу,
человеческий мозг использует это почти
исключительно как субстрат для энергии
метаболизм. Потому что церебральный
запасы гликогена ограничены, техническое обслуживание
адекватной доставки глюкозы в
мозг является важным физиологическим
функция. Высота
соотношение массы тела и мозга у новорожденного
приводит к пропорционально более высокому
потребность в глюкозе по сравнению с
емкость для производства глюкозы
чем то, что встречается у взрослого,
с учетом использования церебральной глюкозы
на целых 90% общей глюкозы
потребление.Хотя альтернативный
топливо, такое как лактат и кетон
тела, можно использовать как подложку
для производства энергии
противодействие незрелому новорожденному
ответ ограничивает доступность
эти молекулы. Таким образом, новорожденные
чрезвычайно восприимчив к любому
состояние, которое ухудшает положение
нормального гомеостаза глюкозы
при переходе с внутриутробного
к самостоятельной внематочной жизни.
Гомеостаз глюкозы в утробе
Глюкоза является одним из основных
субстраты для метаболизма плода.Под
нормальные условия (т.е. нормальные
материнский уровень глюкозы), практически все
глюкоза, используемая плодом,
поступает из материнского кровообращения
через облегченное распространение через
плацента. Это приводит к зарождению плода.
концентрация глюкозы в крови
примерно 70% материнских
значение. Хотя ферменты
необходим как для глюконеогенеза, так и для
гликогенолиз присутствуют в
человеческий плод к концу первого
триместр, несколько исследований
продемонстрировал отсутствие значительных
производство глюкозы у плода
если не будет устойчивого снижения
в пуповинном поглощении глюкозы.Глюкоза
коэффициент утилизации у плода
оценивается от 4 до 6 мг / кг на
минута. Примерно от 60% до 70%
утилизации глюкозы плода
объясняется окислением
углерод глюкозы к CO 2 , с
остаток доступен для синтеза
гликоген и другие макромолекулы.
В организме плода человека окисление
глюкоза составляет примерно
80% потребления кислорода плодом,
демонстрируя, что глюкоза — это
основной субстрат для окислительного
метаболизм.
Скорость, с которой плод использует
глюкоза в первую очередь является функцией
концентрация глюкозы, хотя
изменения концентрации инсулина
может иметь скромное влияние, поскольку
хорошо.Исследования показали, что
уровни инсулина поджелудочной железы плода
секреция коррелирует с изменениями в
концентрация глюкозы у плода, но
панкреатический ответ притупляется
по сравнению с новорожденным или взрослым.
Секреция инсулина в ответ на развитие плода.
гипергликемия увеличивает глюкозу
скорости утилизации и окисления, но это
мало влияет на метаболизм плода
скорость или скорость кислорода
потребление, предполагая, что окисление
другие субстраты уменьшаются под
эти условия. Уменьшено
окисление субстратов, таких как амино
кислоты и лактат приводят к увеличению
наличие этих субстратов для
срастание тканей и может учитывать
часть для повышенного соматического
рост, связанный с плодом
гиперинсулинемия.
В моделях на животных, введение
глюкагона не имеет
прямое влияние на глюкозу плода
метаболизм. Однако соотношение
инсулин в глюкагон у плода
циркуляция играет решающую роль в
регулирование баланса между глюкозой
потребление и хранение энергии.
Высокое соотношение инсулин: глюкагон у
кровообращение плода приводит к
активация синтеза гликогена и
подавление гликогенолиза за счет
регулирование активности печени
ферменты, используемые для этих процессов.Преобладание инсулина поддерживает
гликогенсинтаза в активной форме
и гликогенфосфорилаза в его
неактивная форма через цАМФ-зависимую
эффекты на специфические протеинкиназы
и фосфорилазы, таким образом усиливая
синтез гликогена и минимизация
гликогенолиз. У большинства видов
включая человека, печеночный гликоген
запасы накапливаются медленно во время
ранние и средние сроки беременности, с быстрым
увеличение содержания гликогена в печени
происходящие в течение последних 30%
жизнь плода. Заметное увеличение
синтез гликогена во время этого
период связан с увеличением
в циркулирующих концентрациях обоих
инсулин и кортизол.Поскольку
повышение уровня кортизола кажется
необходимо для максимальной активации
гликогенсинтаза, надпочечники плода
дисфункция может ограничивать гликоген в печени
накопление на поздних сроках беременности.
В условиях, связанных с
снижение уровня глюкозы у плода
концентрации и повышенный глюкагон
секреция, например, хроническая гипогликемия
или гипоксемия, гликоген
фосфорилаза активируется, а синтаза
преобразован в неактивную форму,
тем самым подавляя гликоген
синтез и стимуляция
гликогенолиз с последующим истощением
запасы гликогена плода.Высота
соотношение инсулин: глюкагон также подавляет
липолиз, что позволяет
энергия, которая должна храниться в виде
подкожно-жировая клетчатка. Таким образом, плод
гормональная и метаболическая среда
налаживает поставку готового субстрата
которые можно использовать во время
метаболический переход от плода к
новорожденный.
Гомеостаз глюкозы у новорожденного
Относительная зависимость плода
на постоянный приток материнских
глюкоза требует значительных
изменения в регуляции глюкозы
метаболизм при рождении после
резкое прерывание пуповины
доставка глюкозы.Хотя точный
триггер неизвестен, количество
физиологические изменения снабжают
новорожденный для поддержания уровня глюкозы
гомеостаз. Выросла
концентрация катехоламинов немедленно
следующие роды стимулируют
секреция глюкагона с последующим
снижение инсулина: глюкагон
соотношение. Гликогенсинтаза — это
инактивирована и гликогенфосфорилаза
активируется, что приводит к стимуляции
гликогенолиз и ингибирование
синтез гликогена. Высвобождение глюкозы
из гликогена обеспечивает быстрое
доступный источник глюкозы для
новорожденный в первые несколько часов
послеродовой.Однако это было
подсчитали, что доношенные младенцы имеют только
достаточное количество печеночного гликогена для поддержания
запас глюкозы примерно на
10 часов. Следовательно, другие
механизмы необходимы для поддержания
гомеостаз глюкозы. Высота
соотношение глюкагон: инсулин также в послеродовом периоде
индуцирует синтез ферментов
необходим для глюконеогенеза. С участием
сочетание выпуска
жирные кислоты, стимулируемые высоким
концентрации катехоламинов, которые
приводит к заметному увеличению
наличие и доступность глицерина
свободных аминокислот в
кровообращение, младенец становится способным к
значительный глюконеогенез от 4 до
6 часов жизни.Однако фермент
занятия не достигают взрослого уровня
до 1–2-недельного возраста.
Показатели использования базальной глюкозы в
новорожденному от 4 до 6 мг / кг
в минуту, почти вдвое больше
удельные веса у взрослых. В течение
первые несколько часов жизни, уровень глюкозы в крови
концентрации падают от плода
ценность, которая отражает материнское
концентрация глюкозы в крови, как
низкий 1,7 ммоль / л (30 мг / дл)
до того, как младенец достигнет
метаболический переход к самостоятельному
производство глюкозы и устанавливает
послеродовой гомеостаз глюкозы.До того как
экзогенная подача субстрата
обеспечивается либо энтеральным кормлением
или введение внутривенного
жидкости, вывод глюкозы в печени служит
самый значительный источник
глюкоза для удовлетворения метаболических потребностей. К
поддерживать нормальный уровень печеночного
производство глюкозы, младенец должен
иметь адекватные запасы гликогена
и глюконеогенные предшественники
(например, жирные кислоты, глицерин, амино
кислоты и лактат), соответствующие
концентрации печеночных ферментов
необходим для глюконеогенеза и
гликогенолиз и в норме
функционирующая эндокринная система.Отсутствие
любого из этих требований приводит
к нарушению гомеостаза глюкозы,
чаще всего приводит к
неонатальная гипогликемия.
Заболеваемость, диагностика и клиническая картина
ЗАБОЛЕВАЕМОСТЬ
Оценки заболеваемости
гипогликемия у новорожденного зависит
как по определению
состояние и методы, с помощью которых
концентрация глюкозы в крови
измеряется. Общая заболеваемость
оценивается от 1 до 5 на 1000
живорождений, но это выше в группе риска
населения.Например, 8%
большие для гестационного возраста младенцы
(в основном младенцы от матерей с диабетом [
IDMs]) и 15% недоношенных детей.
и младенцы с внутриутробным
задержка роста (ЗВУР)
сообщается как имеющий
гипогликемия; заболеваемость в целом
популяция младенцев «высокого риска» может быть
до 30%.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Концентрация глюкозы в крови
при котором диагностируется неонатальный
гипогликемия должна быть
были весьма противоречивыми.
Гипогликемия у доношенных детей наблюдалась.
определяется как значение глюкозы в крови
менее 2.0 ммоль / л (<35 мг / дл)
или как значение глюкозы в плазме
менее 2,2 ммоль / л (<40 мг / дл).
Однако недавний обзор
педиатры в Соединенном Королевстве
не продемонстрировал консенсуса относительно
уровень глюкозы в крови, который они
считается «гипогликемией». Они процитировали
концентрации от
От 1 ммоль / л (20 мг / дл) до 4 ммоль / л
(70 мг / дл) как нижний предел
обычный. Далее, определения
гипогликемия основана прежде всего на
популяционные исследования крови или
концентрация глюкозы в плазме
в течение первых 48-72 часов жизни,
с гипогликемией, определяемой как
уровень глюкозы в крови более чем
2 стандартных отклонения ниже
Средняя численность населения.Такие определения имеют
только ограниченный физиологический
значимость.
Физиологически гипогликемия
присутствует, когда доставка глюкозы
неадекватно для удовлетворения потребности в глюкозе
и может произойти в диапазоне
концентрации глюкозы в зависимости от
статус младенца. Например,
2-часовой здоровый младенец, у которого
уровень глюкозы в крови 1,7 ммоль / л
(30 мг / дл) может не демонстрировать
нарушение функции органа, но
стрессовый младенец может продемонстрировать
физиологическая гипогликемия в крови
концентрация глюкозы 2.8 ммоль / л
(50 мг / дл), если уровень глюкозы
доставка в определенные органы (например,
мозг) меньше, чем скорость
утилизация глюкозы. На сегодняшний день исследований нет
установили абсолютную кровь
концентрация глюкозы, при которой
краткосрочный или долгосрочный орган
неизменно возникает дисфункция, хотя
исследования на животных показывают, что
концентрации менее 1 ммоль / л (<20
мг / дл), если выдерживается в течение нескольких
часов, может быть связано с
неизбежная травма головного мозга. Без конкретных
доказательства в поддержку абсолютного
пороговое значение, без единой крови
значение глюкозы можно использовать для определения
физиологическая гипогликемия.
Определение «нормальной» крови
концентрации глюкозы для данного
популяция новорожденных также
зависит от практики кормления в
это население. Например,
среднее значение для нормальной крови
концентрация глюкозы у доношенных детей
определено на основании исследований 30 лет
назад был значительно ниже, чем
ценности, определенные в прошлом
10 лет. Это не из-за
изменение физиологии новорожденных, но
потому что педиатры больше не
следовать практике удержания
кормления от здоровых новорожденных для
длительный период после родов.Вместо того, чтобы отражать «нормальный»
неонатальный гомеостаз глюкозы, эти
ранние ценности продемонстрировали эффект
вмешательства медицинских
практикующих в нормальном переходе к
послеродовой метаболизм. По аналогии,
ранние данные, которые продемонстрировали более низкие
значения глюкозы в крови у населения
недоношенных детей по сравнению с
доношенные младенцы были интерпретированы
ошибочно означать, что низкий вес при рождении
младенцы лучше переносили гипогликемию
чем новорожденные с нормальным весом. В
Фактически, эти данные отражают отказ
производство глюкозы в печени в
недоношенные дети в ответ на
недостаточное поступление экзогенного субстрата.В то время стандартное кормление
практика не была установлена для
это население, и надежный
внутривенное (в / в) питание не было
имеется в наличии. Наконец, время, когда
концентрация глюкозы в крови
измеряется влияет на рассматриваемое значение »
обычный»; глюкоза в крови
концентрации увеличиваются в течение первых 24 до
48 часов жизни при здоровом сроке
младенцы, вероятно, в результате обоих
увеличивающийся объем энтерального
кормление и начало
глюконеогенез. Таким образом, значение, которое было бы
считается «низко нормальным» через 3 часа
жизни можно было бы назвать «
гипогликемический »в 18 часов.
Проведение точной диагностики
гипогликемия дополнительно осложняется
ограничения методов, используемых для
измерить уровень глюкозы в крови
концентрации быстро. Хотя «золото
стандарт »остается гексокиназой
метод, используемый многими диагностическими
лабораторий, такой подход
непрактичен в качестве инструмента скрининга из-за
время, необходимое для обработки
образец и выполнить анализ.
Кроме того, если образец не
быстро доставлен в лабораторию
и быстро обрабатывается, глюкоза
метаболизируется красной кровью
ячеек, тем самым ложно уменьшая
концентрация глюкозы.Размещение
образец в пробирке, содержащей
гликолитический ингибитор, такой как натрий
фторид может предотвратить эту проблему,
но такие трубки либо нелегко
есть в наличии или просто не используется.
Большинство детских садов используют глюкозу
оксидазный / пероксидазный хромогеновый тест
полоски для скрининга новорожденных из группы высокого риска
при низком уровне глюкозы в крови
концентрации. Капля крови попала на
пропитанная реагентом бумажная полоска для
указанное время вызовет
изменение цвета, которое коррелирует с
концентрация глюкозы в крови. В
фактическая концентрация глюкозы в крови
можно оценить путем сравнения
со стандартной диаграммой или определенным
точнее, «читая»
цвет полосы с коэффициентом отражения
колориметр, который был откалиброван
с помощью стандартного раствора.Хотя
использование колориметра отражательной способности для
читать тест-полоски улучшается
точность, сравнение нескольких исследований
различными методами установлено, что
корреляция между «настоящей» кровью
значения глюкозы и полученные значения
использование тест-полосок остается высоким
Переменная. Это особенно актуально при низких
концентрация глюкозы в крови.
Результаты тест-полоски реагента также
подвержены изменениям в
метод, используемый для получения образца (например,
вариабельность количества крови
нанесенный на полоску или загрязнение
образца по остаточному изопропилу
спирт на коже).Это было
оценил, что скрининг с
полоски с реагентами обнаруживают
примерно 85% случаев
гипогликемия, хотя частота ложноположительных результатов
может достигать 25%. Таким образом, чтобы
обеспечить точное обнаружение низких
концентрация глюкозы в крови, а
подтверждающий образец должен быть отправлен в
центральная лаборатория, если тест-полоска
значение соответствует
гипогликемия или если результат тест-полоски
нормальный диапазон, но клинический
находки вызывают подозрение
гипогликемия.
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
Хотя гипогликемия часто бывает
классифицируется как «симптоматический» или «
бессимптомно », эти термины фактически
отражать наличие или отсутствие
физические признаки, сопровождающие низкий
концентрация глюкозы в крови.А
различные признаки могут быть замечены в случаях
тяжелая или длительная гипогликемия
и у младенцев, у которых
от легкой до умеренной гипогликемии и
иначе физиологически стрессовый.
Большинство результатов неспецифичны и
в результате нарушений в одном или
больше аспектов центральной нервной
системная функция. Это включает
аномальные респираторные паттерны, такие как
тахипноэ, апноэ или респираторный
бедствие; сердечно-сосудистые признаки, такие как
тахикардия или брадикардия; а также
неврологические находки, в том числе
нервозность, вялость, слабое сосание,
нестабильность температуры и судороги.Многие
этих признаков могут быть следствием других
общие неонатальные расстройства,
включая сепсис, гипокальциемию и
внутричерепное кровоизлияние. Гипогликемия
всегда следует учитывать в
младенец с одним или несколькими из
эти признаки из-за отсутствия лечения
гипогликемия может иметь серьезные
последствия, и лечение быстрое,
относительно легко и имеет ограниченную сторону
эффекты. Однако с учетом нынешнего
стандарты ухода за новорожденными, в большинстве случаев
гипогликемии у новорожденных
диагностирован во время планового скрининга
младенцев, находящихся в группе риска
но которые выглядят физиологически
нормально на момент оценки.
Этиология
Недоношенность и ЗВР
Причины неонатального
гипогликемию можно разделить на следующие категории:
связанные нарушения в одном или
больше процессов, необходимых для
нормальное производство глюкозы в печени
что может привести к кратковременному или
длительные эпизоды гипогликемии
(Таблица 1⇓
).
Запасы гликогена в печени
ограничены у обоих недоношенных новорожденных,
кто не пережил период
быстрого накопления гликогена
на поздних сроках беременности и
младенцы с малым к гестационному возрасту (SGA), которые
не имели адекватного субстрата
запас для синтеза гликогена,
что подвергает риску этих новорожденных
при гипогликемии.ЗВУР из-за
плацентарная недостаточность с
сохранение нормального размера головы ставит
добавлен спрос на младенцев
уже низкие запасы гликогена, потому что
увеличения соотношения между мозгом и телом
соотношение. Доношенные младенцы и младенцы
многоплодная беременность также может быть
риск из-за наличия
относительная плацентарная недостаточность. В
дополнение к пониженному гликогену
доступность, исследования недоношенных и ЗВУР
младенцы обнаружили измененные модели
секреции инсулина, субстрата
метаболизм и гормональные реакции на
изменения уровня глюкозы в крови
концентрация по сравнению с
доношенных детей, соответствующих гестационному возрасту (AGA).
Таблица 1.
Этиология неонатальной гипогликемии
Младенцы, перенесшие
перинатальный стресс из-за асфиксии или
переохлаждение или повышенное
работа дыхания за счет дыхательной
бедствие может иметь «нормальный»
запасы гликогена, но количество
доступный гликоген может быть недостаточным для
удовлетворить их повышенные требования из-за
к более высокому, чем обычно, уровню
утилизация глюкозы. Гипогликемия может
возникают у этих младенцев, когда они становятся доступными
гликоген был использован для удовлетворения
начальные послеродовые метаболические потребности,
особенно если был
период гипоксемии с сопутствующими
быстрое потребление глюкозы через
анаэробный метаболизм.
Это необычно для неадекватных
уровни глюконеогенных предшественников
быть ограничивающим фактором в печеночной
выработка глюкозы у новорожденного
потому что появляются даже недоношенные дети
иметь достаточное количество жирных кислот,
глицерин, аминокислоты, лактат и
пируват доступен. Тем не мение,
глюконеогенные ферменты индуцируются больше
медленно у недоношенных детей. Способствовать,
производство кетоновых тел
относительно уменьшился в ответ на
гипогликемия. Доношенные младенцы могут
имеют увеличенное высвобождение кетона
тела, когда глюкоза в крови
уменьшается, но концентрация
кетоны плохо коррелируют с
степень гипогликемии.Как результат,
вклад глюконеогенеза
к производству глюкозы в печени может
быть ограниченным у некоторых новорожденных.
IDMS
Несколько групп младенцев находятся в
повышенный риск гипогликемии из-за
к изменениям печеночного фермента
функции, нарушающие гликогенолиз,
глюконеогенез или и то, и другое. Печеночный
функция может быть затронута
количество эндокринных и метаболических
нарушения, наиболее частое из которых
гиперинсулинизм. IDM могут иметь
повышенная секреция поджелудочной железы
инсулин из-за воздействия
повышенная материнская глюкоза
концентрации в утробе матери.Плацентарная глюкоза
транспорт увеличивается, что приводит к
гипергликемия плода, что, в свою очередь,
стимулирует секрецию инсулина
поджелудочная железа плода. IDM также имеют
повышенный инсулин поджелудочной железы
секреция в ответ на данную глюкозу
нагрузка по сравнению с nonIDM. Другой
индуцированные диабетом изменения в
материнский метаболизм, такой как
изменения аминокислот в сыворотке крови, может
играют роль в метаболизме
изменения, обнаруженные в IDM.
После родов повышенная кровь
концентрации глюкозы больше не
присутствует, но гиперинсулинемия
сохраняется, таким образом поддерживая высокий
Соотношение инсулин: глюкагон постнатально.В результате гликогенолиз и
липолиз подавляются,
глюконеогенные ферменты не индуцируются, и
остается производство глюкозы в печени
на низких уровнях перед лицом
снижение концентрации глюкозы в крови.
Инсулин также увеличивает периферическое
утилизация глюкозы инсулиночувствительными
ткани, такие как скелетные мышцы,
способствуя быстрому истощению
доступная глюкоза. Комбинированные эффекты
повышенного использования глюкозы и
подавленное производство глюкозы в печени
привести к гипогликемии, которая может
сохраняться от 24 до 72 часов до
Нормализуются паттерны секреции инсулина.
ЭРИТРОБЛАСТОЗ ПЛОДА И ТОКОЛИТИЧЕСКИЕ АГЕНТЫ БЕТА-АГОНИСТА
Хотя диабет матери является
наиболее частая причина
гиперинсулинизм у новорожденного, послеродовой инсулин
секреция может быть ненормальной из-за
несколько других расстройств. Младенцы, которые
есть эритробластоз плода
повышенный уровень инсулина и
увеличение количества панкреатических
бета-клетки. Механизм этого
развитие неясно, но один
возможно, что глутатион высвободился
из гемолизированных эритроцитов инактивирует
инсулин в кровообращении, который
вызывает большую секрецию инсулина и
активирует бета-клетки.Обмен
переливание крови может усугубить
проблема из-за переливания крови
обычно сохраняется с
комбинация декстрозы и других агентов.
Во время обмена младенец
получает значительную нагрузку глюкозой,
с последующим завышенным инсулином
ответ от гиперпластического
поджелудочная железа. В конце обмена
скорость введения декстрозы
возвращается к исходному уровню, но уровень инсулина
остаются на возвышении, что ведет к дальнейшим
гипогликемия.
Использование токолитиков бета-агонистов
такие агенты, как тербуталин, также
связаны с гиперинсулинемией в
новорожденный, особенно если возбудитель
использовался более 2 недель и
был прекращен менее чем за 1 неделю
до доставки.Больные младенцы
также, похоже, уменьшили
запасы гликогена, что еще больше усугубляет
гиперинсулинемия и ее последствия
по снижению глюкозы
концентрации.
ГИПЕРИНСУЛИНИЗМ
Гипогликемия, которая сохраняется дольше
более 5-7 дней не является обычным явлением и
чаще всего из-за
гиперинсулинизм. Некоторые младенцы с ЗВУР
или перинатальная асфиксия демонстрируют
гиперинсулинемия, которая может сохраняться
целых 4 недели, но такие
случаи относительно редки, и
лежащий в основе механизм неясен.Несколько видов врожденных
были описаны гиперинсулинизм и
считаются наиболее распространенными
причина сохраняющейся гипогликемии
за пределами первой недели жизни.
Аутосомно-рецессивная форма
врожденный гиперинсулинизм был
связано с дефектом сульфонилмочевины
рецептор или K + -ATP канал. А
одиночная мутация на коротком плече
хромосома 11 была описана
в еврейском населении ашкенази,
но случаи в других этнических группах
были связаны с рядом
других мутаций в том же
область, край.Аутосомно-доминантная форма
гиперинсулинемии также
описано. Мутация (ы)
отвечает за аутосомно-доминантную форму
гиперинсулинизма еще не было
выявлено, но расстройство отличается
от аутосомно-рецессивной формы
в том, что это, похоже, не приводит
от аномального рецептора сульфонилмочевины
функция. Синдром врожденного
гиперинсулинемия и бессимптомное течение
гипераммониемия, связанная с
мутации в глутамате
также был описан ген дегидрогеназы.
Синдром Беквита-Вейдемана
связанные с гиперплазией
несколько органов, включая поджелудочную железу,
с последующим повышением инсулина
секреция.Редко гиперинсулинемия.
может возникнуть в результате локализации островковой клетки
аденомы в ином
нормальная поджелудочная железа.
ВНУТРЕННИЕ ОШИБКИ МЕТАБОЛИЗМА
Врожденные нарушения обмена веществ могут
повлиять на доступность
глюконеогенные предшественники или
функция ферментов, необходимых для
производство печеночной глюкозы.
Метаболические нарушения, которые могут проявляться
гипогликемия включает некоторые формы
болезни накопления гликогена,
галактоземия, дефекты окисления жирных кислот,
дефицит карнитина, некоторые из
аминоацидемии, наследственная фруктоза
непереносимость (дефицит фруктозо-1,6-дифос-фатазы) и дефекты
другие глюконеогенные ферменты.Наконец, эндокринные расстройства, такие как
гипопитуитаризм и надпочечниковая недостаточность
также может привести к гипогликемии
из-за отсутствия
соответствующий гормональный ответ на
гипогликемия и последующая неспособность
активировать выработку глюкозы в печени.
Однако эти условия очень
редко и следует рассматривать после
исключение более распространенной этиологии.
ОПРЕДЕЛЕНИЕ ЭТИОЛОГИИ
Получение тщательного перинатального анамнеза
это первый шаг в определении
этиология гипогликемии в
новорожденный.Наличие риска
факторов, таких как ненормальные результаты на
материнский тест на толерантность к глюкозе,
материнский прием лекарств
связанные с неонатальным
гипогликемия или недоношенность вызывает
диагностика относительно проста. Рост
параметры должны быть нанесены на
установить, является ли ребенок SGA, AGA,
или LGA. Следует заподозрить сепсис
сильно у доношенного ребенка, у которого
гипогликемия, но без других явных признаков
факторы риска. Если гипогликемия сохраняется
более 1 недели
возможности гиперинсулинемии, другие
эндокринные нарушения и врожденные ошибки
метаболизм следует исследовать,
особенно если гипогликемия
устойчив к стандартному лечению.
К сожалению, часто бывает сложно
документировать гиперинсулинемию
потому что уровень инсулина должен быть
нарисованный во время эпизодов
гипогликемия, чтобы продемонстрировать наличие
несоответствующей секреции инсулина.
Уровни связывающего белка для
инсулиноподобный фактор роста 1
(IGFBP-1) уменьшаются в присутствии
гиперинсулинемия, вызывающая
измерение сывороточного уровня IGFBP-1
полезно для подтверждения диагноза
гиперинсулинемия. Сыворотка и моча
тесты на специфические метаболические и
эндокринные нарушения, такие как сыворотка
аминокислотные профили и
измерение кортизола и роста
уровни гормонов, также могут быть необходимы
для выяснения этиологии неонатальных
гипогликемия.
Менеджмент
Цели лечения младенца, который
гипогликемия должна нормализоваться
концентрации глюкозы в крови как
как можно быстрее и избегать
дальнейшие эпизоды гипогликемии
обеспечение адекватного субстрата до тех пор, пока
нормальный гомеостаз глюкозы может быть
учредил. Метод, выбранный для
достижение этой цели является функцией
как клинический статус младенца
и предполагаемую этиологию
гипогликемия.
ЭНТЕРАЛЬНОЕ КОРМЛЕНИЕ
Доношенные дети, у которых есть
бессимптомная легкая гипогликемия, начальная
попытка энтерального питания может быть
успешно в достижении целевой крови
значения глюкозы.Хотя подсказка
повышение уровня глюкозы в крови
концентрации могут быть достигнуты после
кормление 5% декстрозой и
водный раствор, декстроза
метаболизируется быстро, и
гипогликемия может повториться раньше нормы
кормления могут быть установлены. Использование
стандартная детская смесь обеспечит
не только углеводы в виде
лактоза, а также белок и жир,
которые метаболизируются медленнее
и, следовательно, обеспечит
постоянная подача субстрата. Потребление жиров
также снижает клеточную глюкозу
усваивает и стимулирует
глюконеогенез, дополнительно способствуя
восстановление нормального гомеостаза глюкозы.Подсчитано, что уровень глюкозы в крови
концентрации должны увеличиваться на
примерно 1,67 ммоль / л (30
мг / дл) в течение первого часа после
подача от 30 до 60 мл стандарта
детская смесь.
Внутривенная терапия
Младенцы с уровнем глюкозы в крови
концентрации нормализуются после
энтеральное питание следует продолжать
иметь концентрацию глюкозы в крови
проверяется перед каждым кормлением на предмет
От 12 до 24 часов. Если после приема пищи
концентрация в норме, но
значение до следующего кормления
снова в гипогликемическом диапазоне,
следует рассмотреть возможность энтерального питания
неудача, а младенец —
кандидат на внутривенную терапию.Подсказка
обеспечение IV глюкозы в этих
обстоятельства позволят избежать повторных эпизодов
препрандиальной гипогликемии. Этот
может быть важным, потому что последующее наблюдение
исследования младенцев, у которых есть
рецидивирующая гипогликемия указывает на то, что
множественные эпизоды низкого уровня глюкозы в крови
концентрации с большей вероятностью будут
связанные с неблагоприятными
результаты развития нервной системы, чем один
эпизод.
Внутривенная терапия должна быть первой
метод лечения, используемый в
симптоматические младенцы, младенцы, неспособные
переносят энтеральное питание, а те
у кого нарушение глюкозы
гомеостаз тяжелый или ожидаемый
длиться более нескольких часов.В
последняя категория включает недоношенных
младенцы, младенцы с ЗВУР,
младенцы женщин, у которых плохо
контролируемый диабет и младенцы, которые
имеют основную этиологию
гипогликемия, такая как сепсис, известная или
подозреваемые врожденные ошибки
метаболизм или эндокринные дефекты, или
эритробластоз.
Введение начального болюса
200 мг / кг 10% декстрозы и
вода (2 мл / кг D 10 W) должна быть
с последующим непрерывным вливанием
декстроза рассчитана на доставку от 5 до
8 мг / кг глюкозы в минуту (т. Е.
скорость, эквивалентная глюкозе
коэффициент использования здорового младенца).Значок «
мини-болюс ».
показано, что возвращает глюкозу в крови
концентрация в норме быстрее
чем постоянный настой в одиночку. Значок «
мини-болюс »также рассчитана
чтобы избежать превышения желаемого
концентрация глюкозы. Ограничивая
количество глюкозы в виде
болюс, можно избежать
вызывая ятрогенную гипергликемию, которая
может стимулировать избыток инсулина
секреция и вызвать отскок
гипогликемия. Уровень глюкозы в крови
следует проверить концентрацию
примерно через 30 минут после
болюс, затем каждые 1-2 часа до
стабильно и в пределах нормы.Если
последующее значение попадает в
гипогликемический диапазон, болюс должен быть
повторяется и скорость инфузии
увеличился с 10% до 15%. Нет
необычно для младенцев, у которых есть
кратковременный или продолжительный
гиперинсулинемия требует от 12 до
15 мг / кг глюкозы в минуту внутривенно
для поддержания нормогликемии. В таком
случаях может потребоваться разместить
катетер пупочной вены или
периферический центральный венозный катетер
(так называемая линия PIC), чтобы
введение растворов IV с
концентрация декстрозы выше, чем
12.5%.
Если нет опасений по поводу
перегрузка жидкостью или способность
переносят энтеральное питание, младенцы
требуется внутривенная терапия гипогликемии
должно быть разрешено продолжить
кормления. Есть несколько преимуществ
к этой практике. Во-первых, это позволит
более легкий переход от парентерального
к энтеральному источнику углеводов
однократно концентрация глюкозы в крови
стабилизировались. Во-вторых, предоставление
немного углеводов в виде галактозы (один
сахаров, входящих в состав лактозы)
может быть полезен в IDM и других
младенцы, страдающие гиперинсулинемией;
исследования показали, что
инсулиновый ответ поджелудочной железы на галактозу
меньше, чем ответ на
эквивалентное количество глюкозы.Когда
нормальная концентрация глюкозы в крови
было установлено, и требование
для внутривенного введения глюкоза стабильна в течение
От 12 до 24 часов, младенец может быть
отлучен от этой терапии
измерение уровня глюкозы в крови на препрандиальном уровне
концентрации и уменьшение
скорость инфузии от 10% до 20% каждый
время глюкозы в крови больше
от 2,8 до 3,4 ммоль / л (от> 50 до
60 мг / дл). Неспособность терпеть
отлучение от внутривенного введения глюкозы указывает на
наличие распространенного расстройства,
например, метаболический дефект или
идиопатическая гиперинсулинемия, и следует
подскажите дальнейшую оценку.
ДРУГИЕ АГЕНТЫ
Было использовано несколько других агентов
для лечения рефрактерной гипогликемии,
чаще всего встречается в одном из
гиперинсулинемические состояния (Таблица 2⇓
).
Кортикостероиды (гидрокортизон, от 5 до
15 мг / кг в день через два-три человека
разделенные дозы или преднизон,
2 мг / кг в день) связаны
со снижением периферической глюкозы
утилизация и увеличение крови
концентрации глюкозы, но у них есть
множество других метаболических эффектов
это необходимо учитывать.
Прием кортикостероидов в качестве дополнения
к глюкозе внутривенно может быть полезно, когда
потребность в глюкозе больше
чем 15 мг / кг в минуту.
Таблица 2.
Дополнительные методы лечения гипогликемии
Глюкагон вызывает быстрое
повышение уровня глюкозы в крови у младенцев, которые
имеют адекватные запасы гликогена, но
это всего лишь временный эффект, и
опекуны должны быть готовы к
справиться с гипогликемией, когда она повторяется.
Недоношенные и младенцы, которые
есть ЗВУР имеют ограниченный гликоген
магазины и вряд ли испытают
повышение уровня глюкозы в крови
концентрация после введения
глюкагон. Начальная доза
30 мкг / кг может вызвать реакцию
у некоторых младенцев, но у тех, у кого
гиперинсулинемия может потребовать
В 10 раз более высокая доза для преодоления
эффекты инсулина с высоким уровнем циркуляции
уровни и стимулируют гликогенолиз.Введение глюкагона наиболее
полезно тем младенцам, у которых есть
тяжелая гипогликемия как
временная мера до стабильного внутривенного доступа
можно получить (например, ожидая
прибытие транспортной бригады).
Несколько других агентов могут быть
ценно для лечения младенцев в
кому диагноз
гиперинсулинемия подтверждена и кто остается
стойкая гипогликемия, несмотря на
введение глюкозы в / в
От 15 до 20 мг / кг в минуту.
Диазоксид в дозе 5 мг / кг каждые
8 часов угнетает поджелудочную
секреция инсулина.Соматостатин или его
аналог октреотида пролонгированного действия также
подавляет высвобождение инсулина, а также
гормон роста и глюкагон
секреция и используется чаще всего
до операции у младенцев, нуждающихся в
панкреатэктомия по поводу рефрактерной
гипогликемия и гиперинсулинемия.
Итого (95%) или почти завершено
панкреатэктомия может потребоваться для
управлять случаями гиперинсулинемии
из-за генных мутаций или островковой клетки
аденомы. Однако гипогликемия
рецидивирует до 33% хирургически
леченных пациентов, и от 40% до 60%
в более позднем возрасте заболевают сахарным диабетом.
Последствия гипогликемии
ГИПОГЛИКЕМИЧЕСКАЯ ТРАВМА МОЗГА
Хотя гипогликемия
связаны с рядом физиологических
изменения, самые глубокие последствия
видны в мозгу, где глюкоза
является основным субстратом для энергии
обмен веществ и местная энергия
магазины и поставка альтернативных
субстраты ограничены. Серьезный
гипогликемия у новорожденного — это
связано с селективным некрозом нейронов
в нескольких областях мозга, в том числе
поверхностная кора, зубчатая извилина,
гиппокамп и хвостатая скорлупа.Исходные события в
гипогликемической энцефалопатии до сих пор нет
полностью понял, но мозг
травма, похоже, возникла в результате
количество запущенных процессов
когда концентрация глюкозы в крови
уменьшение (Рисунок⇓
).
Умеренный
снижение уровня глюкозы в крови
концентрация связана с
компенсаторное увеличение мозгового кровотока
которые, как предполагалось, представляют
средство поддержания доставки
церебральная глюкоза. Недоношенными
новорожденные, такие изменения церебральной
кровоток может предрасполагать к
внутрижелудочковое кровоизлияние и может
мало влияют на нейроны
поставка глюкозы из-за передачи
глюкоза через гематоэнцефалический барьер
зависит от активности
переносчики глюкозы в сосуды
эндотелий и клеточные мембраны.Уровни переносчика глюкозы
уменьшилась у плода и новорожденного
по сравнению с младенцами старшего возраста и
может ограничивать скорость церебрального
поглощение глюкозы.
Рисунок 1.
Предлагаемый механизм патогенеза гипогликемического поражения головного мозга у новорожденных.
АТФ = аденозин-5′-трифосфат; PCr = фосфокреатин. Используется с разрешения Ross Products
Подразделение, Abbott Laboratories Inc., Колумбус, Огайо, 43216. Из Semin Neonat Nutr Metab . 1997;
4, подразделение Ross Products, Abbott Laboratories Inc.
Если поступление глюкозы в мозг
не поддерживается, может быть
снижение церебральной электрической
активность, разрушение мембраны с
высвобождение свободных жирных кислот и
измененный метаболизм аминокислот,
включая увеличение производства
глутамат. Глутамат, который является одним
возбуждающей аминокислоты
нейротрансмиттеры найдены только в
центральная нервная система, считается
играть важную роль в
патофизиология гипогликемического поражения головного мозга.
Гипогликемия связана с
повышенная концентрация глутамата
в синаптической щели, скорее всего, из-за
к комбинации увеличенного
высвобождение глутамата из пресинаптического
нейроны и снижение аденозина
5′-трифофат (АТФ) -зависимый
поглощение глутамата глиальными клетками.Глутамат связывается с постсинаптическими рецепторами,
запускающий выпуск второго
мессенджеры через метаботропный глутамат
рецепторы и изменения в
трансмембранные ионные потоки через ионотропные
рецепторы глутамата. Хотя там
несколько типов ионотропных
рецепторы, N -метил-D-аспартат
Рецептор глутамата (NMDA) -типа,
который связан с ионом
канал, по которому натрий и
кальций в клетку и калий
вне клетки преобладает в
незрелый мозг. У всех видов
изучено, включая человека, количество
функциональных рецепторов NMDA
увеличивается в процессе развития мозга,
впоследствии уменьшается до взрослого
уровни.
Увеличенное количество NMDA
рецепторы у позднего плода и раннего
периоды новорожденных, скорее всего, отражают
роль рецептора как одного из
первичные медиаторы долгосрочных
потенцирование, процесс, который
связаны с синаптогенезом и
формирование памяти. NMDA
рецепторная активность также
может быть вовлечен в
регулирование процесса
апоптоза, или
запрограммированная гибель клеток,
через изменения в
цитоплазматический и ядерный
концентрации кальция.
У человеческого плода
третий триместр плода
развитие и ранние
неонатальный период
характеризуется активным
формирование и
модификация синаптического
связи и
ветвление дендритов
связаны с
увеличенный NMDA
рецепторы.Таким образом,
нормальный уровень NMDA
рецепторная активность
критически важен для
развитие незрелых
мозг. Однако избыток
активация NMDA
рецепторы глутамата
увеличивает цитоплазматический
концентрации
натрия и кальция до уровней, которые
превышают возможности нейронных
гомеостатические механизмы, тем самым
изменение трансмембранного иона
градиенты. Гипогликемия конкретно
увеличивает чувствительность NMDA
рецепторы активации глутаматом,
что может привести к снижению
порог глутамат-индуцированного
эксайтотоксичность.Во время гипогликемии
энергозависимые механизмы восстановления
нормальные трансмембранные градиенты
натрий и кальций не могут работать
из-за истощения АТФ и
фосфокреатин, связанный с
гипогликемия. Избыток кальция
приток активирует клеточный
фосфолипазы и протеазы, альтеры
митохондриальный метаболизм, триггеры отсутствуют
радикальное образование, изменяет закономерности
синаптической передачи и
в конечном итоге может привести к выборочному
нейрональный некроз.
Появляется все больше свидетельств того, что
специфические изменения митохондрий
функция может играть важную роль
в ранних событиях, ведущих к
гипогликемическая энцефалопатия.Уменьшено
потоки субстрата через
цикл трикарбоновых кислот приводит к
снижение доступности сокращения
эквиваленты в митохондриях. Как
результат неполное сокращение
молекулярного кислорода внутри
митохондрии и повышенное образование
свободные радикалы кислорода, которые повреждают
обе митохондриальные мембраны и
митохондриальная ДНК. Фрагментация
митохондриальной ДНК вмешивается
с синтезом электронного транспорта
цепные ферменты, такие как субъединицы
цитохромоксидаза и
никотинамид аденин динуклеотид
(НАДН) -дегидрогеназа, являющаяся
кодируется митохондриальной
геном.Таким образом, способность клетки
для восстановления уровня АТФ нарушается.
Местное истощение высокоэнергетических
фосфаты, а также изменения
митохондриальные мембраны приводят к
снижение секвестрации кальция
митохондриями как цитоплазматическая
кальций. Митохондриальная дисфункция
также может вносить непосредственный вклад в
нейрональный некроз, инициируя
процесс апоптоза. Последние исследования
указали, что выпуск
цитохром с из митохондрий
требуется для активации ферментов, которые
вызвать апоптоз и это
цитохром с выделяется как окислительный
фосфорилирование не удается.
Гипогликемия также могла
обострить черепно-мозговую травму в периоды
церебральная гипоксия в незрелом мозге.
Как и при гипогликемии, церебральная
гипоксия связана с истощением
высокоэнергетических фосфатов, повышенный
внеклеточный глутамат
концентрации, активация ионотропных
рецепторы глутамата и повышенное
внутриклеточный натрий и кальций. В
кроме того, анаэробный гликолиз во время
гипоксия ускоряет истощение
глюкоза в головном мозге. Таким образом
сочетание гипогликемии и гипоксии
можно ожидать, что действовать
синергетически в производстве повреждения нейронов.Хотя гипогликемия
быть нейропротекторным во время церебральных
ишемия у взрослых, исследования у незрелых
животные продемонстрировали, что
сопутствующая гипогликемия
обостряет гипоксически-ишемическое повреждение головного мозга,
возможно за счет ускорения истощения
высокоэнергетические фосфаты.
Гипогликемия также устраняет гипоксию.
расширение сосудов головного мозга, таким образом
нарушение компенсаторных механизмов
это могло бы иначе улучшить кислород
доставка в мозг в периоды
гипоксемия. Хотя дальше
необходимо расследование, эти результаты
указать, что поддержание
нормогликемия особенно критична у младенцев в
риск эпизодов гипоксемии, например
как те, у кого есть значительные
респираторный дистресс.
КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ
Физиологические нарушения
связанные с острой гипогликемией в
новорожденный результат реакции на стресс,
с выделением катехоламинов и
глюкагон и последующий липолиз
и гликогенолиз в попытке
увеличить доступность субстрата для
нормальные обменные процессы. Таким образом,
даже при бессимптомной гипогликемии,
есть значительные краткосрочные
воздействие на младенца, которое может привести
в истощении эндогенных
субстрат, оставляя младенца неподготовленным
для обработки последующих физиологических
стресс.У доношенных детей короткий период
повышенной симпатической активности
и измененный метаболизм в печени
обычно переносится хорошо. Однако в
недоношенный ребенок или ребенок с SGA,
добавлен физиологический стресс, связанный
с низким уровнем глюкозы в крови
концентрация может быть достаточной для осаждения
кардиореспираторная нестабильность и
осложнять неотложную помощь
существенно. Быстро, быстро
нормализация низкого уровня глюкозы в крови
концентрации необходимы для минимизации
гормональный и метаболический
расстройства. Если нормальный уровень глюкозы в крови
концентрация может быть достигнута в
своевременно, острые последствия
единичный эпизод гипогликемии может
быть минимизированным.
Долгосрочные последствия неонатального
гипогликемия остается спорным вопросом.
Повторные эпизоды симптоматического
гипогликемия, наблюдаемая у младенцев
страдающие стойким гиперинсулинизмом,
были связаны с выборочными
нейрональный некроз и длительный
нарушение когнитивных и двигательных функций
функция. В ранних исследованиях также сообщалось
плохие результаты развития нервной системы
в IDM. Однако более свежие данные
предполагают, что только гипогликемия
не влияет на долгосрочные результаты в
IDM; скорее, неблагоприятные исходы
были связаны с наличием
врожденные аномалии.
Доступно очень мало данных
относительно долгосрочного результата в
подавляющее большинство гипогликемических
младенцы с бессимптомным течением
гипогликемия, обнаруживаемая на
рутинный скрининг и лечится
быстро. Исследования у нормальных взрослых
показали, что когнитивная функция
нарушается во время легкой
инсулино-индуцированная гипогликемия (кровь
значения глюкозы <3,4 ммоль / л [<60 мг / дл]). Взрослые диабетики, которые
иметь в анамнезе повторяющиеся эпизоды
гипогликемии
имеют стойкие когнитивные дефициты, так как
а также легкая атрофия коры головного мозга,
находки, которые не наблюдались в
диабетики, которые не испытали
значительная гипогликемия.
Большинство исследований у новорожденных,
хотя неизбежно ограничен
объем, не смогли продемонстрировать
любые долгосрочные последствия в перспективе
младенцы, испытавшие краткое
эпизоды гипогликемии. Изменения
в стволе мозга слуховые вызванные
ответы (BAER) были зарегистрированы в
несколько младенцев (от 1 до 5 дней) во время
эпизоды гипогликемии
неуточненной этиологии. Аномальный
BAER были обнаружены в крови
концентрация глюкозы в диапазоне от
От 0,7 до 2,5 ммоль / л (от 12 до 45 мг / дл),
и в двух младенцах они остались
ненормально в течение нескольких часов после
была введена глюкоза.Однако длительного наблюдения не проводилось.
сообщил об этих младенцах. Второй
исследование, в котором проанализированы факторы
влияющих на исход в возрасте 18 месяцев в
когорта недоношенных детей, обнаруженная
что те, у кого был хотя бы один
уровень глюкозы в крови меньше чем
2,6 ммоль / л (46 мг / дл) на 5 или
больше дней было значительно меньше
баллы по стандартизированным тестам
умственное и двигательное развитие и
в три раза выше заболеваемость
церебральный паралич, чем у тех, у кого было меньше
эпизоды гипогликемии или те
кто испытал одиночный
эпизод более тяжелой гипогликемии.Различия остались значительными
когда другие факторы риска, такие как
масса тела при рождении и внутрижелудочковые
кровоизлияния были учтены. Таким образом, там
является свидетельством того, что
легкая или умеренная гипогликемия может повлиять на
исход, по крайней мере, у младенцев из группы высокого риска.
Заключение
Нарушения гомеостаза глюкозы
которые приводят к гипогликемии,
распространен среди новорожденных. Осознание
факторы риска, которые предрасполагают младенцев к
гипогликемия позволяет проводить скрининг
тех, кто находится в группе риска, так что клинически
неопределяемая гипогликемия может быть
лечить быстро, тем самым предотвращая
развитие тяжелых или
симптоматическая гипогликемия, которая
связанные с неблагоприятными исходами.Однако ведение пациентов с высоким риском
младенцев осложняется отсутствием
консенсус по глюкозе в крови
значение, которое составляет гипогликемию
а также неточности в
методы, используемые для измерения уровня глюкозы в крови
значения. Еще одна нерешенная проблема:
бессимптомная гипогликемия
связан с постоянными эффектами
на функции мозга у новорожденного.
Никакие убедительные исследования не демонстрируют
отдаленные последствия бессимптомного
гипогликемия у доношенных детей, но это
вероятно, что гипогликемия
способствует ненормальному
исход развития нервной системы у младенцев, у которых
другие факторы риска черепно-мозговой травмы,
такие как недоношенность или
гипоксически-ишемическое повреждение головного мозга.В этих
младенцы, поддерживающие уровень глюкозы в крови
концентрации значительно выше
порог гипогликемии может
улучшить неврологический исход.
Необходимы дальнейшие исследования, чтобы
определить последствия
гипогликемия у доношенных детей.
ПРЕДЛАГАЕМЫЕ ЧТЕНИЯ
Гипогликемия новорожденных: симптомы, причины и диагноз
Неонатальная гипогликемия или низкий уровень сахара в крови у новорожденного возникает, когда уровень глюкозы в крови новорожденного ниже, чем необходимо организму ребенка. Глюкоза — главный источник топлива для тела и мозга. У новорожденного низкий уровень сахара в крови имеет множество причин.
Это также может вызвать проблемы, в том числе проблемы с дыханием и кормлением.Состояние поддается лечению, но если его не выявить, оно может быть фатальным, особенно если виновато основное заболевание.
Веривелл / JR Bee
Распространенность
Согласно некоторым исследованиям, неонатальная гипогликемия встречается примерно у 4 человек на 1000 доношенных детей. Обычно это связано с факторами риска, включая возраст матери на момент родов, наличие у матери диабета или слишком маленький или слишком большой ребенок. Фактически, заболеваемость новорожденными из группы высокого риска может достигать 30 процентов.
Исследование, опубликованное в журнале «Педиатрический журнал », обнаружило, что более половины новорожденных с факторами риска могут стать гипогликемическими. Факторы риска, согласно исследованию 2012 года, включают в себя слишком маленькое или слишком большое рождение, наличие матери-диабетика или рождение поздно недоношенными (роды на сроках от 34 до 36 недель). Исследователи в этом исследовании рассмотрели 514 младенцев, родившихся в возрасте 35 недель или позже, и определили, что они подвержены риску гипогликемии. Анализ крови на глюкозу проводился в течение первых 48 часов после рождения.
Немногим более половины новорожденных страдали гипогликемией, 19 процентов имели тяжелую гипогликемию, а еще 19 процентов имели более одного эпизода гипогликемии.
Исследователи пришли к выводу, что неонатальная гипогликемия является обычным явлением для новорожденных с определенными факторами риска, а множественные факторы риска подвергают новорожденных более высокому риску. Исследователи не сделали никаких выводов относительно долгосрочных результатов.
Причины и факторы риска
Младенцы получают глюкозу от матери через плаценту еще до своего рождения.После рождения источником глюкозы для них является грудное молоко и смеси. Глюкоза также вырабатывается в печени. Уровень сахара в крови может упасть, если в крови слишком много инсулина (гормона, вытягивающего глюкозу из крови), если ребенок не вырабатывает достаточно, не потребляет слишком много или если ребенок не может есть.
У некоторых новорожденных есть определенные факторы риска, которые облегчают им развитие гипогликемии новорожденных. Они могут включать:
Симптомы
У новорожденных уровень глюкозы в крови 30 мг / дл (миллиграммы на децилитр) в первые 24 часа жизни и менее 45 мг / дл представляет собой неонатальную гипогликемию.Симптомы неонатальной гипогликемии у новорожденного не всегда очевидны. Более того, симптомы у каждого новорожденного могут отличаться.
Симптомы могут включать:
Если ваш новорожденный испытывает какие-либо из этих симптомов, поговорите с медсестрами и врачами о анализах крови.Даже если у новорожденного нет симптомов и вы знаете, что существуют факторы риска, все же лучше обсудить их со своим врачом.
Диагностика
Диагностика неонатальной гипогликемии проводится с помощью анализа на уровень глюкозы в сыворотке крови. Это анализ крови, который измеряет уровень сахара в крови новорожденного с помощью пяточной палочки. Это простой и минимально инвазивный способ анализа крови новорожденных, когда кровь берется из пятки стопы.
Если уровень сахара в крови низкий, врач будет проверять его до нормального уровня в течение 12–24 часов.Иногда проводится дополнительное обследование новорожденных для выявления нарушений обмена веществ, состояний, которые влияют на нормальный метаболический процесс и могут вызвать низкий уровень сахара в крови.
Лечение
Лечение неонатальной гипогликемии зависит от наличия симптомов гипогликемии, наличия грудного молока и способности кормить грудью или кормить из бутылочки и смеси. Новорожденным с низким уровнем сахара в крови потребуется дополнительное грудное молоко или искусственное вскармливание. Некоторым новорожденным может потребоваться раствор сахара (глюкоза) внутривенно или через вену, особенно если ребенок не может есть через рот или если уровень глюкозы в крови очень низкий.Взаимодействие с другими людьми
Лечение будет продолжаться в течение нескольких часов или дней или до тех пор, пока новорожденный не сможет поддерживать нормальный уровень сахара в крови. Недоношенным младенцам, младенцам с инфекциями или детям, рожденным с низкой массой тела при рождении, может потребоваться более длительное лечение. Если низкий уровень сахара в крови сохраняется, новорожденному будут даны лекарства для повышения уровня сахара в крови. В очень редких случаях новорожденным с очень низким уровнем сахара в крови, у которых не наблюдается улучшения, может потребоваться удаление части поджелудочной железы, чтобы снизить выработку инсулина.
Слово от Verywell
Перспективы благоприятные для детей, рожденных с низким уровнем сахара в крови, у которых нет симптомов, и даже с симптомами, когда они хорошо реагируют на лечение.Маловероятно, что гипогликемия повлияет на младенцев по мере их роста, если они быстро получат лечение.
Сохраняющийся очень низкий уровень сахара в крови может повлиять на умственную функцию новорожденного. Он также может повлиять на сердце и вызвать судороги. Однако это случается редко, и новорожденные, страдающие низким уровнем сахара в крови в течение длительного времени, обычно имеют основное заболевание, от которого им потребуется дальнейшее лечение.

 A., Walsh M.C., eds. Fanaroff and Martin’s Neonatal-Perinatal Medicine. 8th ed. Philadelphia, PA: Mosby Elsevier; 2006: 1467–91.
A., Walsh M.C., eds. Fanaroff and Martin’s Neonatal-Perinatal Medicine. 8th ed. Philadelphia, PA: Mosby Elsevier; 2006: 1467–91. J. Physiol. 1998; 508: 937–47.
J. Physiol. 1998; 508: 937–47.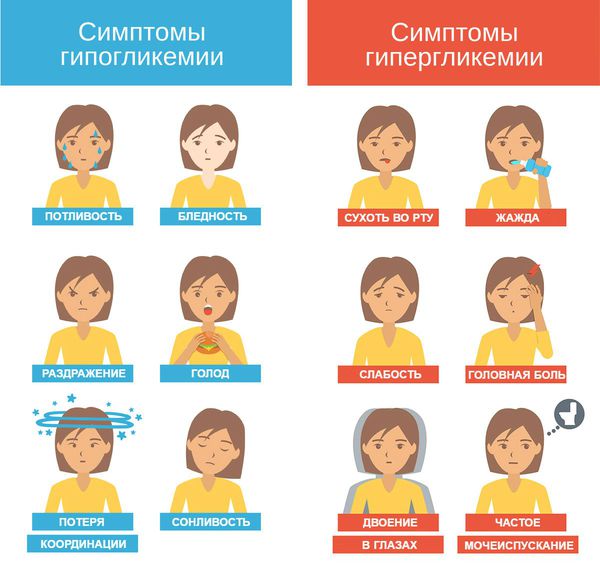 2012; 3(4): 36–43.
2012; 3(4): 36–43. Acta Paediatr. Scand. 1981; 70: 195–200.
Acta Paediatr. Scand. 1981; 70: 195–200. Singapore Med. J. 2010; 51(11): 853–5.
Singapore Med. J. 2010; 51(11): 853–5. Semin. Fetal Neonatal Med. 2005; 10(4): 351–61.
Semin. Fetal Neonatal Med. 2005; 10(4): 351–61.
