Гистаминовая реакция кожи после шугаринга: причины, лечение, профилактика
Содержание статьи:
Гистаминовая реакция после шугаринга представляет собой зудящие высыпания на коже. Состояние нормализуется в течение суток. Если этого не произошло, то рекомендуется использовать местные средства и применять прописанные врачом препараты.
Что такое гистаминовая реакция
Гистаминовая реакция – высыпания на кожном покрове.
Визуально сыпь напоминает крапивницу, поэтому другие названия этого состояния – механическая крапивница, или псевдокрапивница.
Это индивидуальная реакция организма на механическое удаление обычных или пушковых волос. Эти волоски имеются в следующих зонах:
- живот;
- лицо;
- поясница;
- спина;
- верхние конечности.
После удаления волос возникает стрессовая реакция и как следствие выделение гистамина.
Эту реакцию предугадать невозможно. Ее появление не зависит от техники депиляции или от выбранной пасты.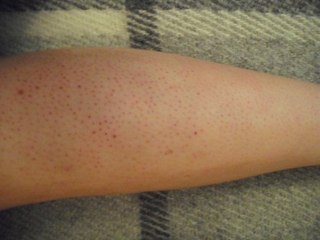 Она обусловлена индивидуальными особенностями организма.
Она обусловлена индивидуальными особенностями организма.
Признаки
На фоне гистаминового выброса наблюдается сильное покраснение кожи, реакция сопровождается отеком и зудом. Затем происходит активизация белых кровяных телец и как следствие развитие воспалительного процесса.
Отеки, образовавшиеся вокруг волосяной лунки, на вершине имеют красноватую точку.
Появление точечного покраснения вокруг волосяного фолликула объясняется тем, что волос был не обломан, а удален вместе с корнем. Организмом при этом был запущен процесс регенерации.
Гиперемия кожи свидетельствует об усилении кровотока в том участке, в котором проводилась сахарная эпиляция. Длительность этого симптома – 20 минут/24 часа. В редких случаях проявление наблюдается на протяжении 15-20 дней.
статьи по теме
Причины гистаминовой реакции кожи на шугаринг: как и почему появляется гистамин после сахарной эпиляции
Причины гистаминовой реакции кожи на шугаринг могут быть связаны с индивидуальными особенностями организма, с нарушениями рекомендаций мастера, а также с погрешностями в проведении сахарной депиляции.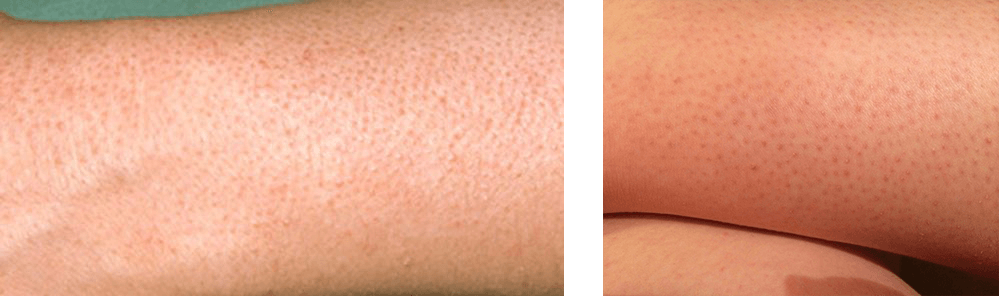
Гиперчувствительная иммунная система бурно реагирует на определенные вещества, и относится к ним как к опасным раздражителям.
Затем, стремясь их уничтожить, она стимулирует вырабатывание антител. Это приводит к выделению гистамина. Он несет ответственность за развитие воспалительного аллергического процесса.
Вторая причина — нарушение рекомендаций мастера. Раздражение возникает на фоне подбривания волосков, или несвоевременного использования косметических средств, обладающих агрессивным составом.
Третья причина — погрешности в проведении сахарной депиляции. Гистаминовая реакция возможна при многократной обработке одного участка.
Вероятнее всего, гистаминовая реакция имеет эпизодический характер. Она может возникать только после первой процедуры. Чаще всего после повторных сеансов этот симптом исчезает.
Что нельзя делать при гистаминовой реакции
При гистаминовой реакции нельзя пренебрегать рекомендациями мастера по уходу, травмировать пораженные участки как механическим (растирать участки, тереть мочалкой и т. д.) так и химическим воздействием (крема, пудры и т. п.).
д.) так и химическим воздействием (крема, пудры и т. п.).
Категорически запрещается делать следующее:
- Травмировать пораженные участки, расчесывать их. На руках живет огромное количество микроорганизмов и бактерий. Когда вы начинаете расчесывать обработанные участки кожи, микробы “мигрируют” туда. Это приводит к усугублению клинической картины.
- Подбривать волоски. Активное механическое воздействие способствует тому, что раздражение усугубляется. Присутствует не только мучительный зуд, но и жжение. Симптоматика не проходит в течение нескольких дней.
- Наносить агрессивные косметические средства на пораженные участки. Это касается не только кремов и лосьонов, но и пудры. В ином случае симптоматика усиливается, а патологический процесс усугубляется.
- Тереть зоны с гистаминовой реакцией жесткой мочалкой. Сочетание грубого механического воздействия с водой может привести к проникновению инфекции.
Что необходимо делать при гистаминовой реакции кожи после шугаринга: как лечить гистаминовую реакцию от сахарной эпиляции
Если появились зудящие прыщи после процедуры сахарной эпиляции, необходимо успокоить клиента и оказать ему первую помощь.
Мастер не является врачом-дерматологом, он не может ставить диагноз и назначать лечение.
В случае если реакция длится дольше суток, то человеку лучше обратиться за консультацией к врачу.
Первая помощь
Первая помощь заключается в обрабатывании пораженных участков местными средствами. Для этого используются мази и кремы.
Сразу после появления раздражения необходимо обработать пораженные участки:
- Хлоргексидином
оказывает мощное антисептическое воздействие. Кожа протирается 1-2 раза в день. Улучшение наступает уже после 1 процедуры. - Мазью «Илон»
Это дезинфицирующее средство, оказывающее антисептическое воздействие. Способствует снятию воспаления. Рекомендуется применять при появлении «белых» прыщиков – средство удаляет гной. Наносить 1-2 раза/24 часа. - Кремом «Бепантен»
Стимулятор репарации тканей. Активное вещество – декспантенол. Основной эффект – регенерирующий. При контакте с кожей действующее вещество превращается в пантотеновую кислоту. Наносить 1-2 раза/1 день.
Наносить 1-2 раза/1 день. - Кремом «Судокрем»
Эффекты – заживляющий, антисептический, антибактериальный. Способствует смягчению и успокоению кожи, подсушивает мокнущие участки, способствует быстрому заживлению. Наносится не более 3 раз/24 ч. - Кремом «Деситин»
Эффекты – дерматопротективный, вяжущий. Способствует оказанию защитного покрытия на кожном покрове. Уменьшает воздействие раздражающих веществ. Наносится 1-2 раза/24 часа.
Эти средства совершенно безопасны, и практически не имеют противопоказаний.
Лечение
Лечение может назначить только врач дерматолог, потому что специалист по шугарингу может ошибиться в постановке диагноза, и своим «лечением» сделать только хуже.
Врач-дерматолог обычно назначает применение антигистаминных препаратов 1 и 2 поколения. Они способствуют нейтрализации гистаминового эффекта, при помощи блокировки гистаминовых рецепторов.
Рекомендованные препараты:
- Клемастин (Тавегил)
Современный противоаллергический препарат, не обладающий снотворной активностью. Уменьшает отечность и зуд.
Уменьшает отечность и зуд. - Лоратадин (Кларитин)
Эффекты — противозудное, противоаллергическое, h2-антигистаминное. - Цетиризин (Цетрин, Зодак)
Блокатор гистаминовых h2-рецепторов III поколения. Влияет на «раннюю» стадию аллергической реакции и уменьшает миграцию эозинофилов. Не обладает антисеротониновым, седативным и антихолинергическим эффектом.
Профилактика возникновения гистаминовой реакции при процедуре шугаринга
Профилактика возникновения гистаминовой реакции при процедуре шугаринга предполагает соблюдение всех рекомендаций по уходу.
С целью исключения риска развития гистаминовой реакции после удаления волос рекомендуется:
- Делать депиляцию пушковых волос над верхней губой (зона усиков) за 3-4 дня до мероприятия. Это поможет перестраховаться – обычно этого времени хватает для исчезновения неприятного симптома.
- Придерживаться ограничений накладываемых после шугаринга (сослаться на статью: что нельзя делать после шугаринга).

- Соблюдать все рекомендации по постпроцедурному уходу (сослаться на статью: уход за кожей после шугаринга).
- Временно отказаться от использования косметических средств. Сразу после шугаринга нельзя наносить тональные кремы и пудру.
- После эпиляции нужно протереть обработанные участки мирамистином (хлоргексидином).
- Удаление пушковых волосков желательно делать вечером. После сеанса не следует ходить по улицам и магазинам. Нужно как можно скорее идти домой. Это нужно для того, чтобы минимизировать вред, который наносится поврежденной коже уличной грязью.
- Не трогать руками обработанную зону. Этот участок в первые часы после эпиляции очень уязвим, так как а на руках находится большое количество патогенных микроорганизмов, которые проникая через поврежденные участки кожи могут вызвать воспалительную реакцию.
Делайте сахарную эпиляцию только у профессионального мастера, с большим опытом работы и хорошими отзывами. Не гонитесь за низкой ценой, ваше здоровье и красота вашей кожи бесценны!
Гистаминовая реакция после шугаринга – индивидуальная реакция организма, которая обусловлена удалением пушковых волосков.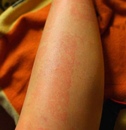 Чаще всего после нескольких процедур она больше никогда не возникает.
Чаще всего после нескольких процедур она больше никогда не возникает.
Если симптом держится до суток, то специального лечения не требуется. Если раздражение присутствует дольше, рекомендуется обратиться к врачу.
Гистаминовая реакция после шугаринга: видео
Чтобы избежать побочных эффектов после шугаринга, необходимо придерживаться рекомендаций по уходу за кожей до и после процедуры. А из видео вы узнаете, что делать в случае покраснений, раздражений и высыпаний на коже после эпиляции сахаром.
А вы сталкивались когда-нибудь с гистаминовой реакцией? Расскажите, что вы делали, какие средства использовали – возможно, ваши советы помогут и другим людям.
Что делает гистамин. Кожа и гистамин
Обязательно слышали о необходимости ее нейтрализации при помощи антигистаминных средств. Услышав название данных препаратов, можно подумать, что гистамин – это аллерген, но на самом деле ситуация совершенно иная.
Гистамин представляет собой биологическое вещество, всегда находящееся в организме и не имеющее ничего общего с аллергенами.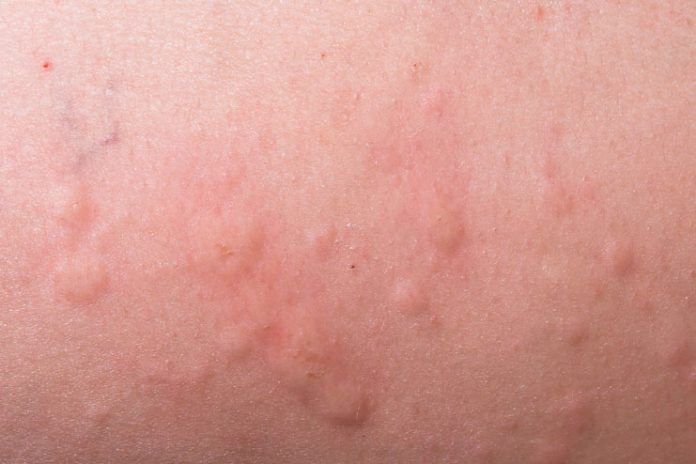 Активизация его функций и выброс в большом количестве в кровь происходит исключительно при определенных факторах, основным из которых и является аллергическая реакция. Подробней о механизме действия гистамина, его значении для организма и особенностях данного вещества поговорим сегодня.
Активизация его функций и выброс в большом количестве в кровь происходит исключительно при определенных факторах, основным из которых и является аллергическая реакция. Подробней о механизме действия гистамина, его значении для организма и особенностях данного вещества поговорим сегодня.
Значение, роль и функции гистамина в организме
Секреция данного вещества происходит из аминокислоты, являющейся основным компонентом белка и называющейся «гистидин». В обычном – неактивном состоянии, гистамин содержится в подавляющем числе клеток организма, которые получили название «гистиоциты». В таком случае вещество неактивно.
При воздействии же целого ряда факторов гистамин способен активизироваться и выбрасываться в больших количествах в общие кровоточные пути организма. В такой форме вещество способно оказывать существенное физиологическое воздействие на организм человека посредством реализации биохимических процессов.
Факторами, активирующими гистамин, считаются:
- травмы
- патологии
- стрессовые ситуации
- прием некоторых препаратов
- аллергическая реакция
- облучение радиацией
Помимо непосредственно внутриорганизменной секреции, гистамин также поступает в организм человека через продукты питания или из медикаментов. На биологическом уровне вещество участвует во многих биохимических процессах. Примером подобного можно считать активное поступление вещества к пораженным тканям для снижения уровня воспаления таковых.
Вне зависимости от того, что провоцирует активизацию гистамина — этот процесс очень важно контролировать.
В противном случае вещество способно спровоцировать:
- спазмы гладких мышц тела, что нередко провоцирует кашель, проблемы с дыханием или
- усиленную секрецию адреналина, увеличивающую сердцебиение и
- увеличенную выработку пищеварительных соков и слизистой в организме
- сужение или расширение сосудистых структур, нередко чреватое появлением сыпью, отеков, гиперемией кожи и подобными явлениями
- анафилактический шок, обязательно сопровождающий судорогами, потерями сознания и рвотой
В целом, гистамин важен для организма, но в определенных обстоятельствах доставляет некоторые неудобства и требует должного внимания к своему уровню. К счастью, в условиях современного уровня медицинской помощи проводить необходимые мероприятия несложно.
Как определить уровень гистамина в крови
Норма гистамина в крови от 0 до 0,93 нмоль/л
Определение уровня гистамина в крови реализуется посредством проведения обычного . Лабораторные исследования в любом случае позволяют не просто определить переизбыток или, что бывает крайне редко, недостаток вещества, но и существенность имеющихся отклонений.
При желании провести анализ крови с целью определения уровня гистамина необходимо придерживаться базовых правил:
- сдавать биоматериал натощак и в утреннее время с 8:00 до 11:00
- исключить за 1-2 дня до проведения диагностики прием алкогольных напитков и медикаментов, способствующих неправильной деятельности гистамина в организме
- отказаться от сигарет за 3-4 часа до анализа
Обычно результаты обследования готовы уже на 2-3-ий день после его проведения и могут быть сразу же оценены профильным специалистом.
Отметим, что определение уровня гистамина, так скажем, «на глаз» можно провести и в домашних условиях. Для этого необходимо слегка поцарапать руку или ногу и проследить за тем, насколько сильное и красное будет воспаление. Если воспалительный процесс развился существенно, значит – гистамина в организме много. В ином случае, вещество находится на нормальном уровне или даже в недостатке.
Группы гистаминовых рецепторов
Из-за широкой спецификации воздействия гистамина на системы организма он является агонистом сразу для нескольких групп рецепторов, которые в биологии так и называются – рецепторы гистамина.
Основными из них являются:
- h2-рецепторы – отвечают за участие вещества в секреции некоторых гормонов организма и спазмах гладкой мускулатуры, а также косвенно участвуют в сосудорасширении и сосудосужении под воздействием гистамина.
- h3-рецепторы – стимулируют секрецию желудочного сока и слизи.
- h4-рецепторы – участвуют в деятельности нервной системы (преимущественно – секреция соответствующих гормонов: серотонин, норадреналин и т.п.).
- h5-рецепторы – помогают группе рецепторов «h2» и имеют ограниченное воздействие на ряд неотмеченных ранее систем организма (костный мозг, внутренние органы и т.п.).
Обычно при активизации деятельности гистамина задействуются сразу все группы гистаминовых рецепторов. В зависимости от локализации фактора-провокатора подобной активизации какая-то группа рецепторов, естественно, функционирует более активно.
Применение вещества в медицине
Детально изучив гистамин и сформировав о нем единое понятие, доктора и представители
5 реакций кожи на шугаринг и как с ними бороться
Говорить о том, что все мы разные можно бесконечно. Поэтому неудивительно, что реакция на раздражители тоже будет разной. Вот о ней, о реакции на процедуру и сахарную пасту, мы и поговорим.
Покраснение
Абсолютно нормальная реакция кожи – кратковременное покраснение в зоне шугаринга. После удаления волоса фолликул раздражается и сигнализирует о проблеме покраснением. В норме исчезновение реакции через полтора–два часа.
Воспаление
У большинства клиентов реакция кожи на шугаринг весьма прогнозируема. Если мастер соблюдает протокол, то она незначительная и проходит в течение часа-полутора после процедуры. Остается только радоваться бесконечной гладкости и красоте. Но есть и такие клиенты, у которых реакция… весьма специфическая. Например, появление гнойничков на коже.
Почему они могут появиться?
Мастер забыл или пропустил одну из процедур протокола, а именно:
- С поверхности кожи были недостаточно тщательно удалены остатки пасты. В результате, они закупорили поры, образовалась сальная пробка, которая способствовала появлению воспаления.
- Забыли нанести защитную эмульсию на водной основе (без масла) или нанесли ее… но она все же на масляной основе, жирная. Эмульсия специально наноситься, чтобы ускорить заживление и защитить устья фолликулов.
Клиент «постарался», чтобы вызвать воспалительный процесс:
- Были забыты все рекомендации мастера о правилах поведения после шугаринга (да, это действительно важно).
- После процедуры была надета грязная или тесная синтетическая одежда.
В очень редких случаях, такая реакция может является индивидуальной особенностью организма.
Если такое происходит, можно порекомендовать клиенту:
- Обратиться к дерматологу.
- Регулярно протирать кожу обеззараживающим составом, например, Кутасептом Ф или Мирамистином.
- Не забывать про личную гигиену.
Гистаминовая реакция
Реакция, которая внешне напоминает крапивницу. Отеки вокруг волосяной лунки выглядят как небольшой локальный отек с красной точкой на вершине. Она не так распространена, как покраснение. Чаще всего, гистаминовая реакция может проявиться при удалении пушкового волоса.
Как правило, проходит сама, а в редких случаях для облегчения ситуации можно использовать антигистаминный препарат. Только не занимайтесь самолечением! Стоит порекомендовать клиенту, который является «счастливым обладателем» такой реакции, обратиться к доктору. Обязательное условие – безукоризненное следование всем рекомендациям, а также использование после процедуры эмульсий с пантенолом.
Синяки
При недостаточной подготовке мастера, клиенты могут получить (вместе с гладкой и красивой кожей) пару-тройку синяков. Лучшее, что в этом случае может сделать мастер – разобраться сразу, почему так произошло, и больше так не делать. Основная причина – неправильная техника рывка (слабое натяжение, неверно выбранное направление, слабый рывок или рывок не с начала стежка, а с середины).
Кровяная роса
Согласитесь, название, как из фильма ужасов. И неопытного мастера, и клиента внешний вид тоже… удивит. Такое явление, как точечное появление капелек крови из волосяного устья – индивидуально. Причина: повреждение волосяного фолликула, рядом с которым находился капилляр. Это форс-мажор. Случиться может с любым, даже самым опытным мастером. Главное в этой ситуации – правильная реакция. Пораженное место необходимо обработать с использованием Кутасепта Ф и можно дальше продолжать шугаринг. Со временем (и это стоит спокойно объяснить клиенту) волос становится более тонким и при вырывании не травмирует капилляр.
В качестве вывода
Любая реакция на процедуру должна получить от мастера шугаринга профессиональную оценку. Не стоит даже вида показывать, что вы удивлены, испуганы или не понимаете, что происходит. Это отличает профессионала от дилетанта. Помните, как нотки тревоги в голосе мамы, когда она вынимала из пальца занозу, еще сильнее пугали в детстве? Здесь также. Совершенствуйтесь. Знайте, что такое может произойти, и что в такой ситуации делать. Будьте уверены в себе, и любите своих клиентов!
Антигистаминные препараты в дерматологии — Клиническая дерматология и венерология — 2018-01
Антигистаминные препараты (АГП) широко применяют в медицине и относят к первой линии терапии многих аллергических состояний. В дерматологии АГП также рекомендованы при различных заболеваниях. В последних клинических рекомендациях РОДВК (2015) применение АГП предписано при лечении таких аллергодерматозов, как крапивница, атопический дерматит, контактный дерматит и токсикодермия. АГП также рекомендованы в терапии герпетиформного дерматита, почесухи, многоформной эритемы, себорейного дерматита, розового лишая. Эти заболевания, несмотря на различия в патогенезе и клинических проявлениях, объединяет общий симптом — зуд. Зуд является важным симптомом не только многих дерматозов, но и целого ряда соматических нарушений. Болезни внутренних органов, паразитарные, заболевания нервной системы, медикаментозные и другие интоксикации также могут сопровождаться зудом. Зуд обусловливает появление расчесов кожи, которые могут воспаляться, что сопровождается дегидратацией кожи, присоединением вторичных инфекций. Это в свою очередь значительно ухудшает качество жизни больных, вызывает чувство депрессии и провоцирует суицидальные попытки [1, 2].
Механизмы зуда
Зуд определяется как ощущение, вызывающее сознательное или рефлекторное желание расчесывания. Единой классификации зуда на сегодняшний момент нет. Основные причины зуда можно классифицировать как пруритосептивный кожный зуд, нейропатический и нейрогенный зуд, возникающий как следствие патологии нервной системы и нейрохимической активности, и психогенный зуд, развивающийся при бредовых состояниях.
Ощущение зуда, но не боли, прямо связано с кожей. В коже имеются свободные нервные окончания, которые являются прямыми сенсорами боли и зуда. По классификации Эрлангера—Гассера существует два типа сенсоров, проводящих сигнал зуда: волокна A и C типов [3]. Волокна типа A покрыты миелином и подразделяются на Aa, Аβ, Аg и Аδ подтипы, различающиеся размером (примерно 15, 6, 3 и 3 мкм соответственно) и скоростью проведения сигнала (примерно 100, 50, 25 и 12 м/с соответственно), из них только самые мелкие по размеру и медленные по скорости проведения сигнала Aδ-волокна задействованы в проведение сигнала зуда [3]. К Aδ-рецепторам по характеристикам близки немиелинизированные волокна типа С (1 мкм и 1 м/с), которые считаются основными проводниками зуда. Они также делятся на два типа: распознающие механические и тепловые сигналы (СМН) и нераспознающие их (СMi). Именно CMi отвечают на гистамин высвобождением нейропептидов, таких как субстанция Р, кальцитонин-ассоциированный пептид и другие, что приводит к васкулярной реакции и активации тучных клеток [4]. Кроме гистамина, медиаторами зуда в коже являются серотонин, алармины тимический стромальный лимфопоэтин (ТСЛП) и β-аланин, ферменты трипсин, триптазы, катепсины, калликреины, интерлейкин-31 (ИЛ-31) и другие гуморальные факторы [5, 6]. На аксонах нервных клеток имеется ряд рецепторов, чувствительных к медиаторам зуда, в частности Н1-рецептор гистамина, PAR2-рецепторы, взаимодействующие с ферментами, рецепторы к ТСЛП и ИЛ-31 и другие [5, 7—9].
В проведении сигналов гистамина, ферментов и ряда других медиаторов через нервные волокна участвует семейство сцепленных с G-белком рецепторов (G protein coupled receptors, GPCRs) [10]. Одним из наиболее описанных рецепторов зуда является Mrgpr (от Мas-related G protein–coupled receptor, где Mas относится к рецепторам к ангиотензину 1—7). Mrgprs (иногда обозначают как Mrg/SNSR) входит в семейство GPCRs, включающее более 50 белков у мыши и 10 — у человека, преимущественно экспрессированных на мелких нейронах спинных ганглиев и отсутствующих в центральной нервной системе и других тканях тела [11, 12]. Кроме Mrgprs, на нейронах экспрессированы PARs, гистаминовые Н1-рецепторы, toll-подобные рецепторы (TLR), рецепторы к ИЛ-31, а также рецепторы, чувствительные к изменению потенциала (transient receptor potential subfamily, TRPV1/A1) и ряд других [13]. На мышиной модели показано, что рецепторы зуда и боли могут быть различными. Так, инактивация рецептора MrgprA3 отменяла формирование зуда в ответ на антималярийный препарат хлорокин, но не влияла на чувство боли [13—15]. Для человека таких данных пока нет. Считается, что низкий уровень сигнала через специфические рецепторы вызывает зуд, усиление сигнала подавляет зуд и вызывает чувство боли. Расчесывание усиливает сигнал, что приводит к снижению зуда за счет накопления болевого сигнала и активации Bhlhb5+ нейронов, подавляющих зуд [15, 16].
Зуд связан с продукций гуморальных факторов, спектр которых различен при разных заболеваниях.
Атопический дерматит
Атопический дерматит (АтД) является дерматозом, при котором основным симптомом и важным диагностическим критерием, характеризующим заболевание, является зуд. Кожа контактирует с большим количеством патогенов и экзогенных веществ, подвержена физическим и химическим воздействиям, что требует значительной плотности нервных окончаний. В 1 см2 кожи находится порядка 300 чувствительных окончаний, связанных афферентными волокнами со спинным и головным мозгом. Показано, что у лиц с АтД плотность нервных окончаний выше, чем у здоровых доноров [17, 18]. Результаты экспериментов на мышах показали, что собственно повышение плотности в коже нервных окончаний не приводит в зуду. Так, у мышей NC/Nga, имеющих высокую плотность нервных окончаний в коже, не наблюдали АтД-подобного зуда [19]. Аналогичные результаты получены и в других моделях. По-видимому, повышение плотности нервных окончаний в коже больных АтД является не предрасполагающим фактором, а возникает как результат нарушения целостности кожного покрова, что ассоциировано с повышенным ростом как эпидермиса, так и нервных окончаний в коже. Известно, что повышение иннервации кожи вызвано дисбалансом продукции факторов элонгации и ограничения роста аксонов, продуцируемых кератиноцитами [20].
АтД относится к атопической триаде (АтД, аллергические риноконъюнктивиты, атопическая бронхиальная астма) и возникает в результате сочетанного влияния факторов окружающей среды и генетической предрасположенности [21]. У 30% больных АтД наблюдается дефект кожного покрова и сниженная экспрессия белка филаггрина (от Filamen Aggregating Protein), участвующего в формировании верхнего плотного рогового слоя эпидермиса [22]. У детей, имеющих одного или двух родителей с аллергией, предрасположенность к атопическому процессу составляет 50 и 80% соответственно [23]. У 10—30% АтД провоцируется пищевыми продуктами — яйцами, молоком, арахисом, соей, пшеницей [24].
Дефект кожного барьера снижает влажность и прочность кожи и способствует проникновению различных ирритантов. При АтД наблюдается активация Т-хелперов 2-го типа (Тх2), продуцирующих ИЛ-4, ИЛ-5, ИЛ-13 при обострении, а также цитокины Тх1, интерферон-γ и ИЛ-12 при хроническом течении [25]. Вызванный цитокинами зуд обусловливает расчесывание кожи и выброс кератиноцитами фактора некроза опухоли и провоспалительных цитокинов ИЛ-1 и ИЛ-6. В коже больных АтД снижена продукция антимикробных пептидов β-дефензинов и кателицидина, что приводит к повышенной колонизации кожи Staphylococcus aureus у 90% больных. Результаты последних исследований MeDALL, объединивших 44 научных работы и включивших 44 тыс. детей от рождения и до 20 лет, показали, что формирование IgE наблюдается только у 38% больных, а в остальных случаях аллергические реакции опосредованы другими механизмами [26]. Таким образом, зуд при АтД может быть вызван разными факторами.
Контактный дерматит
Контактный дерматит (КД) является одной из разновидностей аллергической реакции I типа, опосредованной формированием антител IgE к веществам, входящим в состав различных изделий или средств бытовой химии, имеющим контакт с кожей. Наиболее известна аллергия на перчатки из латекса, шампуни, некоторые мази и т. д. Механизм аллергизации опосредован формированием Тх2 и продукцией IgE. Соответственно зуд при КД вызван высвобождением гистамина.
Крапивница характеризуется зудом, волдырями, иногда отеком Квинке, может быть острой и хронической. Основными эффекторами крапивницы являются тучные клетки, секретирующие ряд факторов, из которых основным является гистамин [27]. При крапивнице антитела IgE часто не регистрируют. Дегрануляция тучных клеток может быть спровоцирована различными физическими и химическими факторами (холод, свет и т. д.). Соответственно первой линией терапии являются АГП.
Токсикодермия
Токсикодермия возникает при попадании аллергена в кожу гематогенным путем, при этом аллергическая реакция наблюдается не только в коже, но и во всем организме. Примерами токсикодермии являются синдромы Стивена—Джонсона и Лайела, мультиформная эритема, эпидермальный некролиз и др. Токсикодермия является системным заболеванием, формирующимся по I (IgE-опосредованному) или IV (IgG-опосредованному) типам [28]. Из-за системного характера реакции требуется использование системной терапии. Часто наблюдаются реакции на сульфаниламиды, антибиотики, барбитураты, витамины. Реже возникает алиментарная токсикодермия, вызванная пищевыми продуктами и добавками. При легких формах IgE-опосредованной токсикодермии кожные проявления можно купировать АГП. Предпочтительным является элиминация агента, вызвавшего токсикодермию.
Гистамин и его роль в организме
Гистамин (имидазолил-2-этиламин) — это биогенный амин (C5H9N3), образующийся в организме из гистидина при декарбоксилировании гистидиндекарбоксилазой. Гистамин входит в состав гранул тучных клеток, эозинофилов и базофилов в виде комплекса с гепарином. Свободный гистамин быстро окисляется под действием гистаминазы. В состав гранул входит также ряд других медиаторов зуда — серотонин, лизанды TLR, ИЛ-31 и др. Гистамин в организме человека выполняет ряд физиологических функций, играет роль нейротрансмиттера и участвует во многих патобиологических процессах воспалительного характера. Гистамин стимулирует секрецию слизистой оболочки носа, способствует сокращению гладких мышц бронхов и кишечника. Гистамин вызывает гиперемию тканей, дилатацию мелких кровеносных сосудов, повышение сосудистой проницаемости для воды, белков, нейтрофилов, воспалительный отек и зуд. При аллергических заболеваниях и любых патологических процессах с выраженным воспалительным компонентом уровень гистамина в организме всегда повышен. Это показано при хронических инфекционно-воспалительных заболеваниях органов дыхательного и урогенитального трактов, острых респираторных вирусных инфекциях, гриппе. При этом суточное количество гистамина в моче при гриппе примерно такое же, как и при обострении аллергических заболеваний. Следовательно, патогенетически обоснованным и клинически полезным шагом является снижение активности гистаминовой системы в условиях ее повышенной активности. Принципиально подавить гистаминергическую активность организма можно либо через уменьшение количества свободного гистамина (торможение синтеза, активация метаболизма, торможение высвобождения из депо), либо через блокаду сигналов гистаминовых рецепторов.
Существует четыре типа гистаминовых рецепторов, обозначаемых h2, h3, h4 и Н4, выполняющих различные функции и распределенных в организме в зависимости от их функций. Так, Н1-рецепторы экспрессированы на гладких мышцах, эндотелиальных клетках сосудов, на постсинаптических мембранах нервных клеток ЦНС. Н2-рецепторы экспрессированы преимущественно на париетальных клетках желудка, где контролируют выброс желудочного сока. Н3-рецепторы экспрессированы на пресинаптических мембранах нервных клеток, где регулируют выброс нейромедиаторов ацетилхолина, серотонина, норадреналина, γ-аминомасляной кислоты и т. д. Н4 были открыты в 2000 г. [29, 30]. Эти рецепторы экспрессированы на клетках костного мозга, лейкоцитах, эпителии различных органов. Данный вид рецепторов участвует в хемотаксисе клеток, выбросе нейтрофилов из костного мозга, воспалительных реакциях, в том числе аллергических [30, 31]. В аллергических реакциях участвуют Н1, Н2 и Н4-рецепторы гистамина. Одним из наиболее значимых механизмов снижения активности гистаминовой системы является блокада сигналов гистаминовых рецепторов.
Антигистаминные препараты
Механизм действия АГП основан на блокаде связывания гистамина с рецептором Н1, экспрессированном на поверхности эндотелиальных клеток. Современные антигистаминные препараты имеют более высокое сродство к Н1-рецептору, что приводит к преимущественному связыванию рецептора с препаратом, а не с гистамином. Основной мишенью действия АГП является блокада воспалительного процесса, вызванного связыванием антител IgE с аллергеном. В результате действия АГП снижается зуд и отек.
Согласно классификации, принятой Европейской академией аллергологов и клинических иммунологов, все АГП подразделяются на два поколения в зависимости от их влияния на ЦНС. h2-антагонисты I поколения проникают через гематоэнцефалический барьер (ГЭБ) и могут как стимулировать, так и подавлять работу ЦНС. При приеме АГП I поколения, помимо седативного эффекта, отмечается влияние на когнитивные функции. Значимым отличием АГП II поколения является отсутствие седативного действия, так как препараты этой группы не проникают через ГЭБ. К важным показателям эффективности АГП относятся объем распределения, занятость Н1-гистаминовых рецепторов, скорость наступления эффекта и селективность в отношении Н1-рецепторов. При приеме АГП I поколения отмечаются кратковременный эффект, быстрое развитие тахифилаксии, низкая избирательность действия. Препараты этой группы, помимо гистаминовых Н1-рецепторов, блокируют рецепторы ацетилхолина, адреналина, серотонина, дофамина и ионные каналы, вызывая множество побочных эффектов: тахикардию, сухость слизистых оболочек, повышение вязкости мокроты. В отличие от АГП I поколения АГП II поколения практически не проникают через ГЭБ и не вызывают седативного эффекта. АГП II поколения способны селективно блокировать h2-рецепторы, быстро оказывать клинический эффект на протяжении 24 ч, практически не вызывают тахифилаксию и имеют высокий профиль безопасности. Безопасность АГП зависит также от их метаболизма в печени. При приеме препаратов, которые не метаболизируются в печени, нет опасности лекарственного взаимодействия, т. е. эффективность не зависит от сопутствующей терапии, а максимальная концентрация достигается в кратчайшие сроки, что обеспечивает быстрое наступление терапевтического эффекта.
Особое место среди препаратов II поколения занимает левоцетиризин. Наряду со всеми преимуществами неседативных АГП, левоцетиризин обладает не только высокой селективностью к Н1-рецепторам, но и самым быстрым и длительным антигистаминным эффектом при однократном приеме в день. Преимуществом левоцетиризина является отсутствие метаболитов, что обеспечивает возможность его сочетания с другими препаратами. Отмечается высокая приверженность больных лечению за счет высокого профиля безопасности препарата и возможности его длительного приема. Так, в исследовании M. Ferrer и соавт. [32] проведен анализ выбора АГП при терапии аллергодерматозов различного генеза у детей 2—12 лет методом анкетирования родителей. Оценивали удовлетворенность АГП, используемыми в настоящее время, а также намерение родителей в будущем продолжать данную терапию. Показатели удовлетворенности родителей эффективностью и переносимостью терапии АГП были первичными результатами исследования, показатели удовлетворенности врачей — вторичными, оценка родителями влияния АГП на сон и успеваемость в школе их ребенка, а также готовность родителей и врачей использовать/рекомендовать тот же АГП в будущем были третьей целью исследования. В общей сложности в исследование был включен 4581 пациент; 67% из них имели аллергический ринит, 15% — крапивницу, 33% — астму, 18% — АтД, 5% — пищевую аллергию, 2% — лекарственную гиперчувствительность. Было однозначно показано преимущество АГП II поколения. Левоцетиризин (n=2339) и фексофенадин (n=42) показали лучшую эффективность, переносимость, глобальное удовлетворение, меньше влияли на способность ребенка функционировать в школе, на качество сна. Кроме того, более 97% родителей и врачей указали на свое желание продолжать или рекомендовать использование левоцетиризина в будущем [32].
Применение антигистаминных препаратов в дерматологии
Применение Н1-блокаторов является стандартом при лечении аллергических заболеваний и терапией первой линии при хронической идиопатической крапивнице легкой и средней степени. Данные вещества являются обратными агонистами Н1-гистаминовых рецепторов: в результате их приема уменьшаются зуд, сосудистая проницаемость, кожные высыпания. АГП II поколения рекомендованы в качестве базовой терапии первой линии при острой и хронической крапивнице. Назначение h2-гистаминоблокаторов I поколения в терапии крапивницы в настоящее время ограничено из-за их низкой эффективности и риска побочных эффектов (седация, антихолинергические эффекты, расстройства сна и т. д.) и показано только в ряде исключительных случаев.
Антагонисты h2-гистаминовых рецепторов широко применяют для лечения зуда при АтД (степень рекомендации 1, уровень доказательности B) в целях улучшения качества жизни пациентов путем ингибирования сосудистых и неврологических эффектов. Так, в ходе рандомизированного плацебо-контролируемого параллельного исследования, включившего 510 детей с АтД, показана эффективность левоцетиризина в купировании высыпаний и зуда [33, 34].
АГП эффективны также при крапивнице. В обзоре Sharma и соавт. проведен анализ баз данных Cochrane Skin Group Specialised Register, CENTRAL, MEDLINE, EMBASE и PsycINFO, включивших 9759 участников: сравнивалась эффективность АГП при крапивнице. Среди известных АГП левоцетиризин был эффективен в дозе 5 и 10 мг при относительно длительном приеме; в дозе 20 мг — при использовании коротким курсом [35]. При сравнении эффективности левоцетиризина и дезлоратадина в дозах 2 и 5 мг обнаружена лучшая эффективность левоцетиризина (р<0,02).
Влияние Н1-антигистаминных средств на зуд варьирует у пациентов с АтД и отличается от эффектов крапивницы, которая лучше отвечает на АГП, что связано с более сложным механизмом патогенеза АтД. В настоящее время проводятся исследования II фазы эффективности Н4-гистаминоблокаторов. Результаты показали, что Н4-антагонист JNJ-39758979 также подавляет зуд, но и его действие не полностью эффективно [36].
В основных международных документах EADV (2012) и AAD (2014), РОДВК (2015) рекомендовано кратковременное прерывистое применение седативных АГП при лечении пациентов АтД [37]. Терапевтическая ценность АГП I поколения заключается, главным образом, в их седативных свойствах за счет нормализации ночного сна и уменьшения интенсивности зуда.
Другую точку зрения высказывают многие исследователи, которые поддерживают терапию АГП при АтД, и рекомендуют препараты этой группы в качестве адъювантной терапии в комбинации с противовоспалительными препаратами (топические стероиды, ингибиторы кальциневрина) и увлажняющими средствами. В работах ряда японских авторов показано, что АГП уменьшают зуд, связанный с AтД, понижают класс кортикостероидов для наружного применения [38—40]. Переход к топическим кортикостероидам более низкой степени активности приводит к уменьшению возможности развития побочных эффектов, что значительно повышает комплаентность лечения [40].
В ряде последних исследований [41—45] показано, что седативные и неседативные АГП II поколения показывают одинаковую противозудную эффективность при лечении больных АтД. Отсутствие антихолинергических воздействий, незначительная частота встречаемости нежелательных реакций, таких как сонливость, недомогание и ухудшение работоспособности, свидетельствуют о преимуществах АГП II поколения.
Можно отметить еще один фактор, который позволяет говорить о преимуществе использования в лечении АтД неседативных АГП. АтД часто сочетается с другими заболеваниями аллергической природы. Это является еще одним важным показанием в пользу выбора неседативных АГП. Неседативные АГП рекомендуются в качестве стандартного лечения АтД при наличии крапивницы или других атопических состояний (аллергический ринит и/или конъюнктивит) [41, 42].
Недавно в РФ появился левоцетиризин под торговым названием Аллервэй (компания «Д-р Редди’с Лабораторис Лтд.», Индия), доступный в виде таблеток в дозировке 5 мг, рекомендованных к применению у детей с 6 лет, подростков и взрослых для лечения симптомов аллергического ринита, крапивницы и других аллергических дерматозов, сопровождающихся зудом и высыпаниями [46].
Аллервэй, являясь АГП последнего поколения, обладает рядом преимуществ. Он оказывает мощный антигистаминный эффект за счет самого высокого среди АГП II поколения сродства с Н1-рецепторами и низкого объема распределения [47, 48]; начинает действовать уже через 12 мин [49]; обеспечивает стойкий эффект на 24 ч при приеме 1 раз в день [46]; безопасен при длительном применении [50]. На основании результатов исследования биоэквивалентности было сделано заключение, что препарат Аллервэй биоэквивалентен оригинальному препарату левоцетиризина (ксизал). Оба средства продемонстрировали удовлетворительный профиль безопасности, каких-либо различий в частоте и виде нежелательных побочных реакций не обнаружено.
АГП рекомендованы в качестве адъювантной терапии для лечения зуда при АтД в комбинации с противовоспалительными препаратами и эмолентами. При выборе АГП предпочтение отдается группе неседативных препаратов. Неседативные АГП рекомендуются в качестве стандартного лечения АтД при наличии крапивницы или других атопических состояний. Аллервэй (левоцетиризин) обладает высокой эффективностью, безопасностью, оптимальным фармакоэкономическим индексом, обеспечивающим терапию с гарантированным качеством для большего числа пациентов.
Авторы заявляют об отсутствии конфликта интересов.
1e-mail: [email protected]
2e-mail: [email protected]
Современные антигистаминные препараты в лечении аллергических заболеваний | Горячкина Л.А.
На протяжении 60 лет антигистаминные препараты (АГП) используются в терапии следующих аллергических заболеваний:
• аллергический ринит (сезонный и круглогодичный)
• аллергический конъюнктивит
• кожные аллергические заболевания (атопический дерматит, острая и хроническая крапивница, отек Квинке и др.)
• аллергические реакции на укусы и ужаления насекомых
• профилактика осложнений при СИТ и др.
Попытки использовать вновь получаемые антигистаминные препараты шире, чем это логически обосновано, дискредитируют даже те лекарственные средства, эффективность которых для лечения гистаминергических симптомов чрезвычайно высока.
Аллергические заболевания, в частности, аллергический ринит, атопическая астма, хроническая идиопатическая крапивница, атопический дерматит, относятся к числу наиболее распространенных патологических состояний у человека. Хотя эти заболевания обычно не создают угрозы для жизни, тем не менее они могут значительно ухудшить качество жизни больных. Аллергические заболевания имеют сходный патогенез и по сути дела могут рассматриваться, как местные проявления системного аллергического воспаления. Одним из главных медиаторов аллергических реакций является гистамин, поэтому средствами выбора в лечении аллергических заболеваний, прежде всего ринита и хронической крапивницы, остаются блокаторы Н1–гистаминовых рецепторов.
АГП I поколения
Фармакологические эффекты антигистаминных препаратов I поколения (этаноламины, этилендиамины и др.) определяются их чрезвычайно высокой липофильностью и способностью блокировать рецепторы разных типов:
- антигистаминное действие (блокада рецепторов гистамина)
- антихолинергическое действие (уменьшение экзокринной секреции, повышение вязкости секретов)
- центральная холинолитическая активность (седативное и снотворное действие)
- усиление действия депрессантов ЦНС
- потенцирование эффекта катехоламинов (колебания АД)
- местное анестезирующее действие.
Фармакологические особенности действия антигистаминных препаратов I поколения дают большой спектр побочных эффектов.
Побочные действия АГП I поколения
- Седативный и снотворный эффекты: сонливость, чувство усталости или возбуждения, дрожь, нарушение сна
- Нарушение координации движений, концентрации внимания и атаксия (эффекты потенцируются алкоголем)
- Головокружение, головные боли, понижение давления
- Сухость во рту, онемение слизистой полости рта
- Боли в желудке, запоры, тошнота, задержка мочи (атропиноподобные эффекты)
- Кожные высыпания
- Бронхоспазм
- Кардиоваскулярные эффекты, тахикардия
- При парентеральном введении – транзиторное падение артериального давления, периферическая вазодилатация.
Противопоказания к применению АГП I поколения
- Работа, требующая психической и двигательной активности, внимания
- Заболевания: бронхиальная астма, язвенная болезнь желудка и двенадцатиперстной кишки с пилородуоденальным стенозом, гиперплазия предстательной железы, задержка мочеиспускания, сердечно–сосудистые заболевания
- Фармакологическая несовместимость со следующими препаратами: холинолитиками, противосудорожными препаратами, нейролептиками, трициклическими антидепрессантами, ингибиторами МАО, средствами для лечения паркинсонизма и диабета.
Показания к применению АГП I поколения
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
Широкий спектр фармакологической активности расширяет возможности их использования не только при аллергических заболеваниях:
- Аллергические реакции немедленного типа (ринит, конъюнктивит, зуд, сенная лихорадка, атопический и контактный дерматит, сывороточная болезнь)
- Профилактическое применение при введении либераторов гистамина (тубокурарин)
- Бессонница
- Паркинсонизм
- Рвота беременных
- Вестибулярные расстройства
- Простудные заболевания.
Антигистаминные препараты I поколения используют и будут использовать, главное – делать это разумно, учитывая все характеристики этих препаратов. Они существуют в виде раствора, поэтому в тех ситуациях, когда требуется применение растворов, нужно использовать антигистаминные препараты I поколения.
Для лечения хронических заболеваний, требующих длительного применения препаратов, более показано использование антигистаминных препаратов II поколения (лоратадин, цетиризин, эбастин и др.) и их метаболитов, которые в литературе нередко называют препаратами III поколения (фексофенадин, дезлоратадин, норастемизол и др.).
АГП II поколения
У антигистаминных препаратов II поколения (астемизол, терфенадин) в терапевтических дозах отсутствует седативный эффект, однако при применении их в практике обнаружились осложнения другого рода.
Начиная с 1986 г., в ряде публикаций дано описание удлинения интервала QT и трепетания–мерцания желудочков сердца, связанных с применением астемизола. Пациенты отрицали факт превышения дозы препарата, однако уровни его в плазме и кинетика выведения четко указывали на передозировку.
Воздействие на деятельность сердца также описывалось у терфенадина, примененного в комбинации с кетоконазолом или эритромицином. Это обусловлено повышением концентрации терфенадина в плазме под действием вышеперечисленных препаратов, ингибирующих цитохром Р450.
Использование этих препаратов в терапевтических дозах вызывало нарушения сердечного ритма (кардиотоксический эффект), что связано с особенностями их метаболизма и фармакокинетики. Антигистаминное действие осуществляется за счет активных метаболитов, которые образуются в печени при участии ферментов системы цитохрома P450. Макролиды и противогрибковые препараты обладают способностью ингибировать активность этого фермента, следствием чего является накопление исходного препарата в крови и ткани сердца, что приводит к нарушениям сердечного ритма. Не исключена возможность этих осложнений и при применении эбастина.
Кроме того, к факторам риска развития аритмий при приеме АГП относят: нарушение функций печени, злоупотребление алкоголем, электролитные нарушения, заболевания сердца, одновременное использование противоаритмических и психотропных средств.
Лоратадин, метаболизирующийся двумя изоферментами системы цитохрома Р450, подобных осложнений лишен. Лоратадин не имеет отрицательного влияния на деятельность сердца, что является бесспорным преимуществом этого препарата.
Метаболиты антигистаминных препаратов II поколения (фексофенадин, дезлоратадин, норастемизол и др.) при отсутствии седативного, кардиотоксического и других нежелательных эффектов имеют значительно лучший профиль безопасности.
Однако АГП подавляют не все симптомы аллергии, например, они оказывают небольшое влияние на заложенность носа у больных сезонным аллергическим ринитом и малоэффективны при атопической астме. Это не удивительно, так как препараты этой группы действуют лишь на один компонент аллергического каскада, что определяет необходимость разработки новых, более эффективных противоаллергических средств. Ниже обсуждаются механизмы действия и результаты клинических исследований дезлоратадина (Эриус), который не только селективно блокирует Н1–гистаминовые рецепторы, но и обладает выраженной противоаллергической и противовоспалительной активностью за счет подавления различных элементов раннего и позднего аллергического ответа.
Дезлоратадин
Дезлоратадин – активный метаболит лоратадина, хорошо известного селективного блокатора Н1–гистаминовых рецепторов II поколения. Дезлоратадин обладает сходными фармакодинамическими свойствами, однако по активности превосходит лоратадин (в 2,5–4 раза) и другие препараты этой группы. В экспериментальных исследованиях антигистаминные средства располагались в следующем порядке по сродству к Н1–гистаминовым рецепторам (по убыванию): дезлоратадин > хлорфенирамин > гидроксизин > мизоластин > терфенадин > цетиризин > эбастин > лоратадин > фексофенадин [2,11]. In vitro дезлоратадин обладает значительно менее выраженным сродством к Н2– и мускариновым рецепторам, чем к Н1–рецепторам [15,16]. Селективность препарата подтверждают и результаты плацебо–контролируемых фармакологических и клинических исследований, в которых дезлоратадин не вызывал антихолинергических симптомов, таких как сухость во рту и нарушение зрения [11].
Доклинические исследования показали, что дезлоратадин ингибирует многие медиаторы, принимающие участие в развитии системного аллергического воспаления, включая цитокины и хемокины, а также молекулы адгезии. Например, дезлоратадин снижал выброс гистамина, триптазы, лейкотриена С4 и простагландина D2 тучными клетками и базофилами in vitro [8,11,14], стимулированную секрецию тучными клетками человека интерлейкинов 3 и 4, фактора некроза опухоли a и гранулоцитарно–макрофагального колониестимулирующего фактора [19], секрецию интерлейкина–8 тучными клетками, базофилами и эндотелиальными клетками [20,23], и высвобождение RANTES в препаратах эпителия полипов носа [18], активность молекул адгезии, в том числе Р–селектина и ICAM–1, in vitro [23,25]. Недавно опубликованы данные о подавляющем действии препарата на хемотаксис и активацию эозинофилов in vitro и образование супероксидного радикала [1]. Таким образом, дезлоратадин обладает широким спектром противоаллергической и противовоспалительной активности, что должно способствовать повышению его эффективности при лечении аллергических заболеваний.
У здоровых людей дезлоратадин метаболизируется главным образом, путем глюкуронирования с образованием 3–ОН формы. Фармакокинетика дезлоратадина линейная и пропорциональна дозе. Период его полувыведения составляет 21–24 ч, что позволяет назначать этот препарат один раз в сутки. У больных с нарушением функции печени Cmax и AUC дезлоратадина были значительно выше, чем у здоровых людей, хотя концентрация препарата не превышала таковую при применении дезлоратадина в высокой дозе (45 мг/сут) в течение 10 дней. В более низкой терапевтической дозе 5 мг/сут дезлоратадин, вероятно, безопасен для больных с нарушенной функцией печени.
Прием пищи может оказать нежелательное влияние на скорость и степень всасывания лекарственных веществ. Фармакокинетика и биодоступность дезлоратадина были сходными при приеме препарата натощак или после стандартизированной пищи у здоровых людей (Cmax натощак и после еды составила 3,3 и 3,53 нг/мл соответственно, р=0,17) [9]. Таким образом, дезлоратадин можно принимать как после еды, так и натощак.
Клиническая эффективность
Сезонный аллергический ринит
Сезонный аллергический ринит
Одно из главных показаний к применению блокаторов Н1–гистаминовых рецепторов – аллергический ринит. Эффективность дезлоратина в дозе 5 мг 1 раз в сутки у больных сезонным аллергическим ринитом изучалась в 4 рандомизированных, двойных слепых, плацебо–контролируемых исследованиях [22,24,25,30]. В эти исследования включали больных старше 12 лет, у которых имелись среднетяжелый и тяжелый сезонный аллергический ринит, по крайней мере, двухлетний анамнез поллиноза, положительная кожная проба на сезонный аллерген в течение предыдущего года и отсутствовали анатомические изменения носа. В течение 3–4-х дней вводного периода и во время лечения больные оценивали выраженность различных симптомов ринита по 4–балльной шкале (0 – нет, 3 – выраженный). До приема утренней дозы пациенты давали оценку симптомам, которая отражает эффект препарата в конце интервала дозирования (действие некоторых лекарственных средств может оказаться неполным в течение этого интервала). Кроме того, утром и вечером больные оценивали выраженность симптома за предыдущие 12 ч. Затем определяли среднее значение полученных индексов. Критерием эффективности была динамика индексов отдельных симптомов и суммарного индекса симптомов.
Во всех исследованиях дезлоратадин по эффективности достоверно превосходил плацебо и уменьшал все симптомы ринита (ринорею, зуд, чихание и т.д.). Особый интерес представляют результаты изучения деконгестивного действия дезлоратадина при аллергическом рините. АГП, как правило, слабо влияют на заложенность носа, поэтому в клинических исследованиях этот симптом обычно даже не учитывается при расчете суммарного индекса симптомов. Лечение дезлоратадином привело к значительному уменьшению индекса заложенности носа (по сравнению с плацебо) в течение нескольких часов после приема первой дозы, и деконгестивный эффект сохранялся на протяжении всего исследования (15–28 дней). F.Horak и соавт. [12] использовали специальную камеру, позволяющую провести контролируемую провокацию аллергеном, для оценки эффектов дезлоратадина на симптомы сезонного аллергического ринита. Медиана времени до уменьшения симптомов составила 48,5 мин, что указывало на быстрый эффект первой дозы. У всех 28 пациентов, подвергавшихся действию аллергена в течение 4 ч на 1–й и 4–й дни применения дезлоратадина, отмечено уменьшение суммарных индексов симптомов по крайней мере на 25% в течение 160 мин, а у 19 (68%) – в течение 60 мин. У больных, у которых суммарный индекс симптомов уменьшился, по крайней мере, на 2 балла, средний индекс заложенности носа уменьшился почти на 10% через 10 мин, на 22% через 20–30 мин, на 40% через 60 мин и почти на 50% через 90–120 мин (рис.1).
Рис. 1. Снижение индекса заложенности носа при применении дезлоратадина
Таким образом, дезлоратадин оказался единственным блокатором Н1–гистаминовых рецепторов, который в контролируемых исследованиях давал постоянный деконгестивный эффект. Этот эффект проявлялся в течение нескольких минут или часов после приема первой дозы и сохранялся до 4 недель. Напротив, в сходных двойных слепых плацебо–контролируемых рандомизированных исследованиях других антигистаминных препаратов, таких как цетиризин (5–10 мг 1 раз в сутки), признаков деконгестивного действия не выявлено [13,28] или оно было непостоянным. Деконгестивный эффект дезлоратадина имеет важное клиническое значение. Обструкцией носа страдают 47–64% больных сезонным и круглогодичным аллергическим ринитом [34], почти в два раза повышен риск нарушений дыхания во время сна [37]. Кроме того, отечность и воспаление слизистой оболочки носа могут ограничить всасывание других лекарственных средств [21]. Больные, страдающие заложенностью носа, чаще дышат через рот, что может способствовать ингаляции аллергенов и прогрессированию ринита [5]. Следует отметить, что обструкция носа связана с воспалительными изменениями слизистой оболочки носовой полости, которые возникают в результате повышения секреции различных провоспалительных медиаторов. Соответственно, деконгестивное действие дезлоратадина подтверждает тот факт, что его эффект нельзя объяснить только блокадой Н1–гистаминовых рецепторов.
В нескольких многоцентровых рандомизированных двойных слепых плацебо–контролируемых исследованиях изучалась эффективность дезлоратадина у больных сезонным аллергическим ринитом, сочетавшимся с бронхиальной астмой [4,26]. Критериями включения в эти исследования были наличие сезонного аллергического ринита и астмы в течение по крайней мере 2 лет, применение только агонистов b2–адренорецепторов по потребности, объем форсированного выдоха за 1 с (ОФВ1) і 70% от должного и положительная кожная проба на сезонный аллерген в течение года до начала исследования. Из исследований исключали больных, получавших кортикостероиды, антигистаминные средства или деконгестанты в любых формах, пользовавшихся сальбутамолом более 12 раз в сутки, а также пациентов, страдавших другими серьезными заболеваниями. Все 4–недельные исследования предполагали 3–4–дневный вводный период, во время которого больные оценивали исходную выраженность симптомов по 4–балльной шкале (0 – нет, 3 – выраженный). Симптомы оценивали в конце интервала дозирования перед приемом утренней дозы (т.е. в конце действия препарата). Кроме того, утром и вечером оценивали выраженность симптомов за предыдущие 12 ч и определяли среднее значение двух индексов. Исследования проводили во время сезона аллергии.
У 311 больных сезонным аллергическим ринитом/ астмой терапия дезлоратадином 1 раз в сутки привела к значительному уменьшению симптомов ринита. В группе дезлоратадина суммарный индекс симптомов ринита за предыдущие 12 ч снизился по сравнению с исходным на 31–35% на 1–2 неделе и 1–4 неделе соответственно, а в группе плацебо – на 20–25% (р<0,001 для каждого сравнения между группами). Уже на 1–й день (в течение 12 ч после приема первой дозы) дезлоратадин снижал суммарный индекс симптомов на 21% по сравнению с исходным, а плацебо – на 7% (р<0,001) [33]. Сходные данные получили Nathan и соавт. [24], которые оценивали эффект дезлоратадина на заложенность носа у 613 больных, страдавших сезонным аллергическим ринитом и астмой в течение, по крайней мере, 2 лет. Динамика заложенности носа, как и суммарного индекса симптомов, в группе дезлоратадина была значительно более выраженной, чем в группе плацебо. Деконгестивный эффект проявлялся уже на 1–й день приема дезлоратадина.
В перечисленных клинических исследованиях продемонстрированы безопасность и хорошая переносимость дезлоратадина. Частота нежелательных явлений в основной и контрольной группах была сходной. Головная боль была единственным нежелательным явлением (его частота превышала 5%), однако она была одинаковой в группах сравнения [33]. Клинически значимых изменений электрокардиографических (например, интервала QT) или лабораторных параметров не выявили.
Таким образом, результаты клинических исследований демонстрируют эффективность дезлоратадина у больных астмой и сопутствующим аллергическим ринитом, что позволяет включать препарат в схему лечения таких пациентов. Эти данные еще раз подтверждают тот факт, что эффекты дезлоратадина не ограничиваются блокадой Н1–рецепторов. Однако следует отметить, что эффективность дезлоратадина у больных астмой без аллергического ринита еще предстоит изучить в клинических исследованиях.
Хроническая идиопатическая крапивница
Хроническая идиопатическая крапивница (ХИК) – это распространенное заболевание кожи, поражающее около 0,1–3% населения США и Европы и проявляющееся зудом и кожными высыпаниями, которые могут сохраняться годами. У больных ХИК наблюдается ухудшение качества жизни, главным образом в результате зуда кожи, плохого сна и обезображивающих высыпаний. Влияние этого заболевания на качество жизни можно сравнить с таковым при хронической болезни сердца [27]. Основой лечения ХИК являются антигистаминные средства, хотя они не всегда дают адекватный эффект, что заставляет продолжать поиск новых препаратов, обладающих более высокой фармакологической активностью и длительностью действия.
Недавно завершено двойное слепое плацебо–контролируемое многоцентровое исследование дезлоратадина у 190 больных среднетяжелой и тяжелой хронической идиопатической крапивницей [32]. При обострении заболевания пациентам назначали дезлоратадин 5 мг/сут или плацебо. Длительность лечения могла достигать 6 недель. Первичным критерием эффективности была средняя динамика индекса зуда в течение первых 7 дней лечения по сравнению с исходным показателем. В группе дезлоратадина индекс зуда уменьшился на 56%, а в группе плацебо – на 22% (р<0,001). При лечении дезлоратадином была отмечена также большая динамика вторичных показателей эффективности по сравнению с плацебо: числа высыпаний (–48% и –16%, р<0,001), размера самых крупных волдырей (–49% и –17%, р<0,001) и суммарного индекса симптомов (–51,6% и 19,3%, р<0,001). Терапия дезлоратадином по сравнению с плацебо привела также к значительному улучшению сна и повседневной активности. В течение первой недели лечения степень нарушения сна при применении дезлоратадина и плацебо уменьшилась на 53% и 18% соответственно (р<0,001). Сходную динамику претерпела степень нарушения повседневной активности, которая уменьшилась на 50% и 20% (р<0,001) в двух группах соответственно. Через 6 недель в группе дезлоратадина сохранялось статистически значимое уменьшение зуда по сравнению с группой плацебо (р<0,001), что указывало на стойкость эффекта препарата. По всем другим показателям эффективности (включая нарушения сна и повседневной активности) дезлоратадин также значительно превосходил плацебо.
Одной из главных целей лечения ХИК является быстрое купирование симптомов. После приема первой дозы препарата зуд уменьшился на 45% в группе дезлоратадина и только на 20% в группе плацебо (р<0,001). Динамика суммарного индекса симптомов, степени нарушения сна, повседневной активности, числа и размера высыпаний отражала быстрое начало действия и длительность эффекта дезлоратадина.
Как больные, так и исследователи высоко оценивали общую положительную динамику симптомов ХИК и ответ на лечение дезлоратадином. Переносимость дезлоратадина была хорошей. С лечением связывали лишь один случай нежелательных явлений (головная боль), однако этот пациент продолжил участие в исследовании.
Таким образом, дезлоратадин по сравнению с плацебо давал быстрый, выраженный и стойкий эффект у больных хронической идиопатической крапивницей и уменьшал нарушения сна и повседневной активности, что могло способствовать улучшению качества жизни обследованных больных.
Заключение
Дезлоратадин (Эриус) – мощный и селективный блокатор Н1–гистаминовых рецепторов, по фармакологической активности превосходящий другие препараты этой группы. Дезлоратадин дает не только антигистаминный эффект, но и блокирует многие другие медиаторы, участвующие в развитии системного аллергического воспаления, т.е. оказывает противоаллергическое и противовоспалительное действие. Важным достоинством препарата является удобная схема применения (один раз в сутки).
В двойных слепых плацебо–контролируемых рандомизированных исследованиях доказана эффективность дезлоратадина в дозе 5 мг один раз в сутки у больных сезонным аллергическим ринитом и хронической идиопатической крапивницей, которые являются основными показаниями к назначению Н1-блокаторов. В отличие от других АГП II поколения, у больных сезонным аллергическим ринитом дезлоратадин уменьшал не только чихание, ринорею и зуд, но и заложенность носа. Продемонстрирована также эффективность дезлоратадина у больных с сочетанием аллергического ринита и атопической астмы.
Дезлоратадин хорошо переносится, не вызывает сонливости и удлинения интервала QT на ЭКГ. Безопасность дезлоратадина подтверждает многолетний опыт применения лоратадина, активным метаболитом которого он является.
Литература:
1. Agrawal D., Berro A., Townely R. Desloratadine attenuation of eosinophil chemotaxis, adhesion, and superoxide generation. Allergy,. 2000, 55 (suppl. 63), S276, Abstract 990.
2. Anthes J., Richard C., West R. et al. Functional characteristics of desloratadine and other anhistamines in human Yl receptors. Allergy, 2000, 55 (suppl. 63), S279 (Abstract 994).
3. Baena–Cagnani C. and the Desloratadine Study Group. Desloratadine improved asthma symptoms and decreased beta2–agonist use in patents with seasonal allergic rhinitis and concomitant asthma. XXth Congress of Europ. Academy of Allergology and Clinical Immunology, Berlin, 2001.
4. Baena–Cagnani C. Desloratadine activity in concurrent seasonal allergic rhinitis and asthma. Allergy, 2001, 56 (suppl. 65), 21–27.
5. Corren J. Allergic rhinitis and asthma: how important is the link? J. Allergy Clin. Immunol., 1997, 99, S781–S786.
6. DuBuske L. Second–generation antihistamies: the risk of ventricular arrhythmias. Clin. Ther., 1999, 21 (2), 281–285.
7. Geha R., Meltzer E. Desloratadine: a new, nonsedating, oral antihistamine. J. Allergy Clin. Immunol., 2001, 107 (4), 751–762.
8. Genovese A., Patella V., De Crcsccnzo G. ct al. Loratadine and desethoxycar–bonyl–loratadine inhibit the immunological release of mediators from human Fc epsilon R1+ cells. Clin. Exp. Allergy, 1997, 27, 559–567.
9. Gupta S., Banfield C., Kantesaria B. et al. Pharmacokinetic and safety profile of desloratadine and fexofenadine when coadministered with azithromycin: a randomized, placebo–controlled, parallel–group study. Clin. Ther., 2001, 23 (3), 451–466.
10. Gupia S., Padhi d., Banfield C. el al. The oral bioavailabuity of desloratadine is unaffected by food. Allergy, 2000, 55 (suppl. 63), Abstract 959.
11. Henz B. The pharmacological profile of desloratadie: a review. Allergy, 2001, 56 (suppl. 65), 7–13.
12. Horak F., Stubner U., Zieglmayer R. et al. Onset and duration of action of desloratadine. XIX Congress of Europ. Academy of Allergology and Clinical Immunology, Lisbon, 2000.
13. Howarth P., Stem M., Roi L. et al. Double–blind, placebo–controlled study comparing the efficacy and safety of fexofenadine hydrochloride (120 and 180 mg once daily) and cetirizine in seasonal allergic rhinitis. J. Allergy Clin. Immunol., 1999, 104, 927–933.
14. Kleine–Tebbe J., Josties C., Frank G. et ai. Inhibition of IgE–mediated and IgE–independent histamine release from human basophil leukocytes in vitro by Hl–antagonist, descarbo–ethoxyloratadine. J. Allergy Clin. Immunol., 1994, 93, 494–500.
15. Kreutner W., Hey J., Anthes J. et al. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI receptor antagonist, 1st communication: receptor selectivity, antihistaminic activity, and antiallergic effects. Arzneimittelforschung, 2000, 50, 345–352.
16. KLreutner W., Hey J., Anthes J. et al. Preclinical studies of desloratadine, a nonsedating, selective histamine HI receptor antagonist with antiallergic activity. Allergy, 2000, 55 (suppl. 63), S278 (Abstract 997).
17. Kreutner W., Hey J., Chiu P., Barnett A. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine HI–receptor antagonist, 2nd communication: lack of central nervous system and cardiovascular effects. Arzneimittelfoschung. 2000, 50 (5), 441–448.
18. Lebel B., Bousquet J., Czarlewski W., CampbcU A. Loratadine reduces RANTES release by an epithelial cell line. J. Allergy Clin. Tmmunol., 1997, 99, (S444), Abstract 1802.
19. Lippert U., Moller A., Welker P. et al. Inhibition of cytokine secretion from human leukemic mast cells and basophils by HI– and h3–receptor antagonists. Exp. Dermatol., 2000, 9, 118–124.
20. Lippert U., Kruger–Krasagakes S., Moller A. el al. Pharmacological modulation of IL–6 and IL–8 secretion by the HI–antagonist descarboethoxy–loratadine and dex–amethasone by human mast and basophilic cell lines. Exp. Dermatol., 1995, 4, 272–276.
21. Lipworth B., Jackson C. Safety of inhaled and intranasal corticosteroids: lessons for the new millenium. Drug Saf., 2000, 23, 11–33.
22. Lorber R., Salmun L., Danzig M. Desloratadine is effective at relieving nasal congestion, as demonstrated in three placebo–controlled trials in patients with seasonal allergic rhinitis. New Trends in Allergy – V meeting, Davos, 2000. .
23. Molet S., Gosset P., Lasalle P. et al. Inhibitory activity of loratadine and descar–boxyethoxyloratadine on histamine–induced activation of endothelial cells.iell B., Lawlor R., Simpson J. el al. The impact of chronic urticaria on the quality of life. Br. J. Dermatol., 1997, 136, 197–201.
28. Pearlman D., Lumry W., Winder J., Noonan M. Once–daily cetirizine effective in the treatment of seasonal allergic rhinitis: a randomized, double–blind, placebo–controlled study. Clin. Pediatr. (Phila), 1997, 36. 209–215.
29. Pedersen P., Weeke E. Asthma and allergic rhinitis in the same patients. Allercv, 1983, 38, 25–29.
30. Premier B. and the Desloratadine Study Group. Desloratadine once daily reduces nasal congestion in patients with seasonal allergic rhinitis, 17th Int. Congress of Allergology and Clinical Immunology, Sydney, 2000.
31. Ratner P. and the Desloratadine Study Group. Desloratadine improved ASTHMA symptoms and reduced bronchodilatator use in 2 studies of patients with asthma and SAR. Ann. Meeting of American College of Allergy, Asthma in4 Immunology, Seattle, 2000.
32. Ring J., Hein R., Gauger A. Desloratadine in the treatment of chronic idiopathic urticaria. Allergy, 2001, 56 (suppl. 65), 28–32. Bachcrt C. Decongestant efficacy of desloratadine in patients with seasonal allergic rhinitis. Allergy, 2001, $6 (suppl. 65), 14–20.
33. Schenkel E. and the Desloratadine Study Group. Desloratadine improved SAR symptoms in patients with mild–to–moderate asthma and SA–R. Ann. Meeting of American College of Allergy, Asthma and Immunology, Seattle, 2000.
34. Sibbald B., Rink E. Epidemiology of seasonal and perennial rhinitis: clinical presentation and medical history. Thorax, 1991, 46, 895–901.
35. Vignota A., Crampette L., Mondain M. et al. Inhibitory activity of loratadine and descarboethoxyloratadine on expression of ICAM–1 and HLA–DR by nasal epithelial cells. Allergy, 1995, 50, 200–203.
36. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunc–tivitis and atopic eczema: ISSAC– International Study of Asthma and Allergies in Childhood Steering Committee. Lancety. 1998, 351 (9111), 1225–1232.
37. Young T., Finn L., Kom H. et al. Nasal obstruction as a risk factor for sleep–disordered breathing. J. Allergy Clin. Tmmunol., 1997, 99, S757–S762.
Дезлоратадин –
Эриус (торговое название)
(Shering Plough)
Лоратадин –
Веро-лоратадин (торговое название)
(Верофарм)
.
причины, симптомы, диагностика и лечение
Псевдоаллергия – это повышенная реактивность на определенные вещества, поступающие в организм, с развитием клинических признаков, характерных для истинной аллергии. При этом иммунологические реакции, возникающие при аллергии, отсутствуют, а воспалительный процесс развивается вследствие нарушения обмена гистамина, неадекватной активации комплемента и других механизмов. Для развития псевдоаллергии требуется довольно большое количество вещества, вызывающего непереносимость (пищевого продукта, добавки или лекарства). Диагностика псевдоаллергии основана на исключении истинной аллергии. Лечение предусматривает отказ от проблемных продуктов, использование антигистаминных средств.
Общие сведения
Псевдоаллергия (ложная аллергия) – развитие патологического процесса, идентичного аллергической реакции по клиническим проявлениям, но с отсутствием иммунологической стадии (вещество, вызвавшее реакцию, не является антигеном, не происходит выработки иммуноглобулинов). Псевдоаллергическая реакция начинается сразу с выброса клетками медиаторов воспаления. Чаще всего псевдоаллергия возникает на пищевые продукты, пищевые добавки и лекарственные средства, поступающие в организм. По данным статистики, именно псевдоаллергические реакции являются наиболее распространенными, встречаясь в течение жизни почти у 70% населения (истинная аллергия наблюдается значительно реже – у 1-10% взрослых и детей).
Псевдоаллергия
Причины
Существует три основных фактора, способствующих развитию псевдоаллергических реакций. Это нарушение обмена гистамина, неадекватная активация комплемента и нарушение метаболизма жирных кислот. Чаще всего псевдоаллергия возникает при нарушении обмена гистамина вследствие повышенной гистаминолиберации, сниженной гистаминопексии, дисбактериоза и избыточного употребления гистаминосодержащих продуктов.
Интенсивное высвобождение гистамина происходит в результате воздействия на тучные клетки и базофилы веществ-либераторов: яиц и морепродуктов, шоколада, клубники, орехов, консервированных продуктов и т. д. Кроме того, гистамин может высвобождаться из клеток при воздействии различных физических факторов: высокой и низкой температуры, вибрации, ультрафиолетового излучения; химическом воздействии кислот и щелочей, медикаментов.
Псевдоаллергия нередко развивается при хронических заболеваниях ЖКТ, сопровождающихся нарушением кислотности желудочного сока и повреждением слизистой оболочки желудка и кишечника, что приводит к более легкому проникновению либераторов к тучным клеткам, имеющимся в пищеварительном тракте и интенсивному выбросу гистамина и других медиаторов воспаления.
Псевдоаллергия может возникать при нарушении процесса инактивации гистамина (сниженной гистаминопексии) вследствие заболеваний кишечника и печени, при дисбактериозе, различных интоксикациях, длительном приеме некоторых медикаментов.
Псевдоаллергические реакции довольно часто развиваются при употреблении пищевых продуктов, содержащих повышенное количество гистамина, тирамина. К таким продуктам относятся различные виды сыра, красное вино, полуфабрикаты, подвергнутые ферментированию и консервированию: мясные и рыбные консервы, колбасы и ветчина, сосиски, маринованные помидоры и огурцы, сельдь, а также шоколад, шпинат, какао бобы, пивные дрожжи и др.
Еще один причинный фактор, вызывающий развитие псевдоаллергии – различные пищевые добавки, являющиеся красителями (тартазин и нитрит натрия), консервантами (бензойная кислота, глутамат натрия, салицилаты), ароматизаторами, загустителями и т. п. Псевдоаллергия может возникать и при попадании в организм продуктов, загрязненных пестицидами, нитратами и нитритами, тяжелыми металлами, токсинами микроорганизмов.
Значительно реже псевдоаллергия развивается вследствие неадекватной активации комплемента при некоторых иммунодефицитных состояниях, в частности при наследственном ангионевротическом отеке. Иногда появление псевдоаллергии может быть обусловлено употреблением некоторых нестероидных противовоспалительных средств, нарушающих обмен арахидоновой кислоты.
Симптомы псевдоаллергии
Клинические признаки ложной аллергии сходны с симптомами, встречающимися при аллергических заболеваниях. При этом патологический процесс приводит к локальному или системному повышению проницаемости периферических сосудов, отеку, воспалению, спазму мышц внутренних органов, повреждению клеток крови.
Клинические проявления псевдоаллергии зависят от преимущественного поражения определенного органа и системы организма. Чаще всего это высыпания на кожных покровах по типу крапивницы, локальный отек кожи в области лица и шеи (отек Квинке). Нередко наблюдается нарушение функции желудочно-кишечного тракта с появлением болей в животе, тошноты и рвоты, метеоризма, диареи, признаки поражения бронхолегочной (одышка, удушье, кашель) и сердечно-сосудистой системы (нарушения сердечного ритма, отеки на ногах, обморочные состояния из-за снижения артериального давления).
Появляющиеся симптомы псевдоаллергии имеют свои особенности в зависимости от причинного фактора, вызвавшего развитие патологического процесса. Так, резкое высвобождение гистамина клетками приводит к выраженному повышению его концентрации в крови и появлению вегетативно-сосудистых проявлений в виде гиперемии кожи, чувства жара во всем теле, головных болей по типу мигренозных, головокружения, затруднения дыхания. При этом часто отмечаются признаки неблагополучия со стороны ЖКТ (тошнота, сниженный аппетит, урчание в животе, поносы). Нарушения обмена арахидоновой кислоты при псевдоаллергии проявляются симптомами, наблюдаемыми при бронхиальной астме (чувство нехватки воздуха, кашель, приступы удушья).
При псевдоаллергии могут наблюдаться анафилактоидные реакции, сходные с анафилактическим шоком, но отличающиеся от него отсутствием выраженных нарушений системы кровообращения, поражением преимущественно одного органа или системы, благоприятным исходом заболевания.
Диагностика
Диагностика псевдоаллергии основана на тщательном анализе анамнестических сведений, выявлении симптоматики, встречающейся преимущественно при псевдоаллергических реакциях и проведении лабораторных исследований, позволяющих исключить истинную аллергию.
Отличительные клинические признаки псевдоаллергии: развитие у детей старше года и у взрослых, возникновение реакции на либератор при первом контакте и отсутствие постоянных обострений при повторных контактах с ним, наличие четкой зависимости проявлений псевдоаллергии от количества поступающего продукта, отсутствие перекрестной чувствительности, локальность, ограниченность патологического процесса и его клинических проявлений одним органом (системой).
При проведении лабораторных исследований при псевдоаллергии обычно отсутствует эозинофилия в анализе крови, уровень общего иммуноглобулина E в пределах нормы, а результаты определения специфических иммуноглобулинов в крови и кожные аллергопробы отрицательные.
В специализированных клиниках для выявления псевдоаллергии и проведения дифференциальной диагностики с истинными аллергическими реакциями могут применяться такие методы, как проведение теста с введением в 12-перстную кишку гистамина (если имеется непереносимость пищевых продуктов), определение флюоресценции лимфоцитов (при крапивнице), индометациновый тест (при аспириновой бронхиальной астме), элиминационно-провокационные тесты и пр.
Лечение псевдоаллергии
В первую очередь необходимо прекратить (по возможности) поступление в организм веществ-либераторов, которые вызывают появление патологической псевдоаллергической реакции у данного пациента (прекратить прием аспирина и других нестероидных противовоспалительных средств при аспириновой астме, пищевого красителя тартазина – при пищевой непереносимости и т. д.).
Если развитие псевдоаллергии связано с повышенным высвобождением гистамина клетками, ограничивают прием продуктов, стимулирующих этот процесс и содержащих гистамин в повышенных количествах, а также рекомендуют прием перорально кромолин-натрия в достаточно больших дозах. При наличии заболеваний ЖКТ (гастродуоденита с повышенной секреторной функцией, язвенной болезни 12-перстной кишки) рекомендуется диетическое питание с использованием овсяной каши, рисового отвара, а также прием лекарственных препаратов, снижающих секрецию и обладающих обволакивающим действием на слизистую желудка и кишечника. При наличии дисбактериоза проводят его коррекцию и снижают количество углеводов в пищевом рационе.
При псевдоаллергии с клиническими проявлениями в виде крапивницы (при нарушении инактивации гистамина), назначают введение раствора гистамина в постепенно возрастающей дозе. При псевдоаллергическом наследственном отеке Квинке вводят С1-ингибитор или свежую (свежезамороженную) плазму, а также препараты тестостерона.
Профилактика
Профилактика псевдоаллергии основана на исключении факторов, которые вызывают ее развитие: отказе от приема потенциальных пищевых продуктов-либераторов, некоторых лекарственных препаратов и рентгеноконтрастных веществ, соблюдении элиминационной диеты, своевременном лечении сопутствующих заболеваний ЖКТ.
Ваши варианты лечения крапивницы
Перейти к основному содержанию
- Проверьте свои симптомы
- Найти врача
- Найти стоматолога
- Подключиться к Care
- Найдите самые низкие цены на лекарства
- Здравоохранение
А-Я
Здоровье от А до ЯОбщие условия
- ADD / ADHD
- Аллергии
- Артрит
- Рак
- Коронавирус (COVID-19)
- Депрессия
- Диабет
- Здоровье глаз
- Сердечное заболевание
- Заболевание легких
- Ортопедия
- Контроль над болью
- Сексуальные условия
- Проблемы с кожей
- Нарушения сна
- Посмотреть все
Ресурсы
- Проверка симптомов
- WebMD блоги
- Подкасты
- Информационные бюллетени
- Вопросы и Ответы
- Страхование
- Найти доктора
- Условия для детей от А до Я
- Операции и процедуры от А до Я
- Избранные темы
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| Определение
| ||
Срок
| |||
Гистаминовая реакция — здоровье Сердечный
Гистамин — это органическое соединение, выделяемое иммунной системой во время аллергической реакции. Гистаминовая реакция относится к симптомам аллергии, которые возникают при стимуляции гистаминовых рецепторов в организме.
Термин «гистамин» относится к органическому азотистому соединению, полученному в результате декарбоксилирования аминокислоты гистидина.Гистамин выделяется тучными клетками и базофилами во время аллергической реакции. Гистамин может поражать различные части тела. В нашем организме есть несколько гистаминовых рецепторов. Гистаминовая реакция возникает в результате воздействия гистамина на определенный гистаминовый рецептор. Как правило, гистамин может вызвать воспалительную реакцию организма, расширяя кровеносные сосуды. В результате увеличивается проницаемость кровеносных сосудов, что, в свою очередь, позволяет большему количеству жидкости проникать в кожу и вызывать отек.Расширение кровеносных сосудов также может вызвать покраснение.
Причины
Аллергическая реакция — это реакция гиперчувствительности иммунной системы на определенные потенциально безвредные вещества, которые называются аллергенами. Некоторые из распространенных аллергенов:
- Пыль
- Пыльца
- Перхоть животных
- Форма
- Клещи
- Укусы насекомых
- Укусы, особенно пчел, ос, огненных муравьев и шершней
Хотите написать нам? Что ж, мы ищем хороших писателей, которые хотят распространять информацию.Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Употребление определенных продуктов питания также может вызывать аллергическую реакцию у некоторых людей. Площадь некоторых распространенных пищевых аллергенов:
- Арахис
- Пшеница
- Молочные продукты
- Моллюски
- Древесные орехи
- Яйца
- Соя
Симптомы
Сверхчувствительная иммунная система распознает такие безвредные вещества как чужеродных захватчиков, а затем стимулирует выработку антител для их уничтожения.Это, в свою очередь, вызывает высвобождение химических веществ, таких как гистамин, который вызывает воспалительную реакцию организма. Во время аллергической реакции кровеносные сосуды расширяются, так что белые кровяные тельца могут получить доступ к чужеродным захватчикам. Эта реакция может вызвать несколько симптомов, вызвав срабатывание рецепторов h2 и h3.
- Когда он стимулирует рецепторы h2, можно ожидать таких симптомов, как кожная сыпь, крапивница, отек, зуд, а также головные боли и респираторные реакции.
- гистаминовых рецепторов h3 также присутствуют в клетках слизистой оболочки желудка. Когда гистамин стимулирует эти рецепторы, увеличивается продукция желудочного сока, что вызывает раздражение слизистой оболочки пищеварительного тракта.
- Легкая реакция характеризуется симптомами аллергии, такими как повышенная чувствительность кожи, кожная сыпь, зуд и крапивница, отек, зуд и слезотечение, насморк и отек в полости носовых пазух, приводящие к заложенности носа.
- Когда гистамин вызывает сокращение гладких мышц, может возникнуть затруднение дыхания или одышка из-за обструкции дыхательных путей.Это классические симптомы астмы.
- В тяжелых случаях эта реакция может привести к опасному для жизни состоянию, известному как анафилаксия . Анафилаксия — это системная реакция, при которой дыхательные пути чрезмерно сужаются или набухают, что может вызвать сильную одышку и хрипы. Другие симптомы анафилактической реакции включают головную боль, желудочно-кишечные проблемы, такие как диарея и рвота, а также головокружение, спутанность сознания и внезапное падение артериального давления.
Лечение
Гистаминовая реакция лечится с помощью антигистаминных препаратов. Эти препараты нейтрализуют действие гистаминов на организм, блокируя гистаминовые рецепторы. Антигистаминные препараты подавляют действие гистаминов, блокируя сообщения, посылаемые ими гистаминовым рецепторам. Существует два типа антигистаминных препаратов: антагонисты h2 и антагонисты h3.
Антагонисты h2: Термин «антигистаминные препараты» чаще используется для обозначения антигистаминных препаратов h2, которые используются для лечения симптомов местного воспаления и насморка или заложенности носа.Некоторые распространенные антагонисты H2 — дифенгидрамин, лоратадин и цетиризин
.
Антагонисты h3: Они в основном используются для снижения выработки желудочной кислоты и для лечения таких состояний, как гастроэзофагеальная рефлюксная болезнь и пептические язвы. Некоторые распространенные антагонисты h3 — это циметидин, роксатидин, фамотидин, ранитидин и низатидин.
Аллергическая реакция с легкими или умеренными симптомами легко лечится антигистаминными препаратами. Однако высвобождение большого количества гистамина в организме может вызвать анафилаксию, которая требует немедленной медицинской помощи из-за ее опасного для жизни характера.Поэтому не следует пренебрегать симптомами гистаминовой или аллергической реакции. Об этих симптомах следует немедленно сообщить врачу, чтобы обеспечить быстрое лечение заболевания.
Заявление об ограничении ответственности : Информация, представленная в этой статье, предназначена исключительно для обучения читателя. Он не предназначен для замены совета медицинского эксперта.
Симптомы, диагностика, лечение и лечение гистаминовой токсичности
Обзор
Отравление гистамином, также известное как отравление скомброидом, является формой пищевого отравления.
Токсичность гистамином иногда путают с аллергической реакцией на рыбу. Вот почему:
Некоторые виды рыб содержат естественный высокий уровень химического гистидина. Это химическое вещество может быть преобразовано бактериями в гистамин. При аллергической реакции тучные клетки выделяют гистамин, который вызывает симптомы аллергии. Итак, если человек ест рыбу с высоким уровнем гистамина, реакция может напоминать аллергическую реакцию на эту пищу.
Некоторые виды рыб более склонны к отравлению гистамином.К ним относятся тунец, скумбрия, махи махи, анчоусы, сельдь, луфарь, амберджек и марлин.
Наиболее частая причина острого отравления гистамином — результат ненадлежащего охлаждения или испорченная рыба. Это вызывает чрезмерный рост бактерий, которые превращают гистидин в высокий уровень гистамина.
Лица с необычно низким уровнем фермента диаминоксидазы могут быть более восприимчивыми к токсичности гистамина.
Симптомы и диагностика
Симптомы отравления гистамином (отравление скомброидом) обычно проявляются в течение 5–30 минут после употребления в пищу испорченной рыбы, хотя бывают случаи, когда симптомы проявляются с задержкой до двух часов.
Эти симптомы могут включать:
• Промывание лица и тела
• Тошнота
• Жжение во рту
• Головная боль
• Обморок, иногда с нечеткостью зрения
• Спазмы в животе
• Диарея
• Свистящее дыхание или другие проблемы с дыханием
• Отек лица и языка
Симптомы обычно длятся несколько часов или день. В редких случаях симптомы могут сохраняться в течение нескольких дней.
Диагностика состояния часто основывается на обстоятельствах. Например, вспышки типичных симптомов у нескольких человек, которые ели один и тот же зараженный продукт, скорее всего, указывают на токсичность гистамина.
В отдельных случаях, если у человека наблюдаются тяжелые симптомы, лучше всего проконсультироваться с аллергологом / иммунологом, чтобы определить, существует ли пищевая аллергия.
Лечение и ведение
Лечение отравления гистамином зависит от тяжести симптомов.В легких случаях симптомы обычно проходят за короткий период времени без лекарств. Иногда могут помочь антигистаминные препараты.
В тяжелых случаях необходима поездка в отделение неотложной помощи больницы для оказания помощи с внутривенной инфузией, кислородом или другими лекарствами и лечением.
Узнайте больше о пищевой аллергии.
2019 Записи, не относящиеся к CME »
Будьте в курсе последней информации и общайтесь с другими.

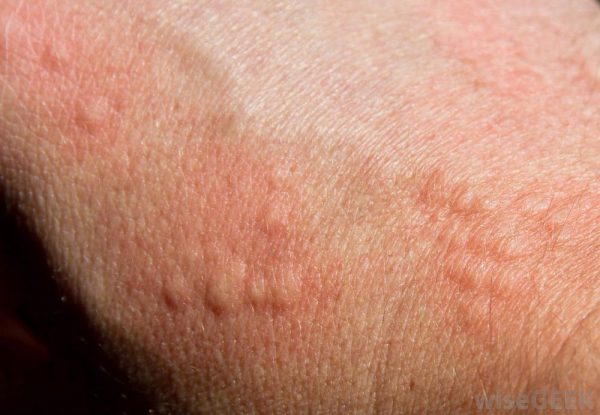 Наносить 1-2 раза/1 день.
Наносить 1-2 раза/1 день.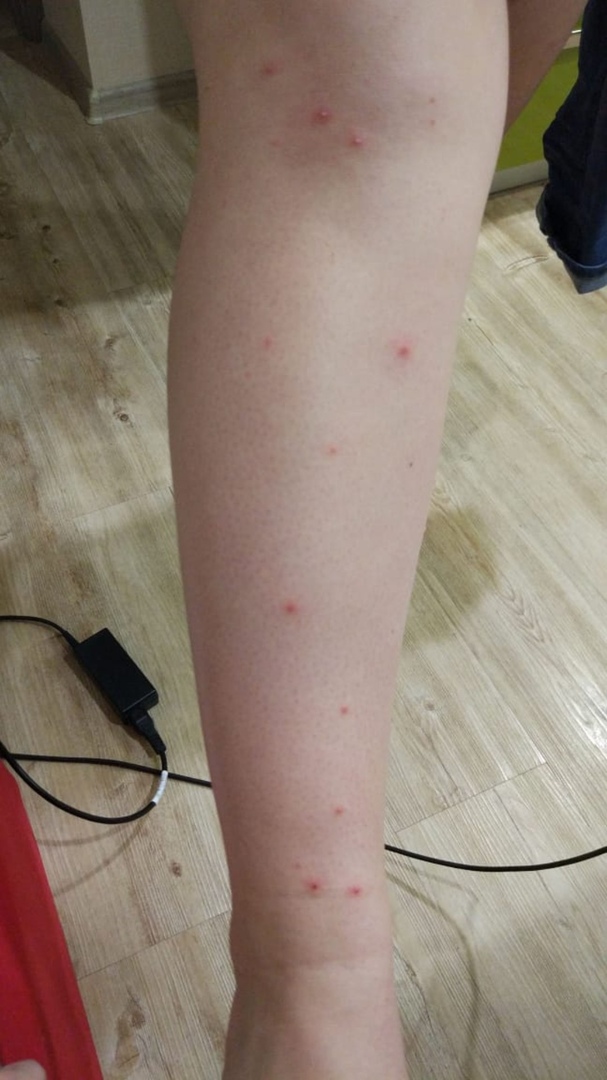 Уменьшает отечность и зуд.
Уменьшает отечность и зуд.