Нарушения секреции и действия антидиуретического гормона
Поддержание нормального объема внеклеточной жидкости крайне важно для полноценной
функции клеток организма. Внеклеточная осмолярность влияет на форму клетки и
распределение ионов по обе стороны клеточной мембраны. Адекватные концентрации ионов
во внеклеточных средах необходимы для нормального функционирования ионных каналов,
формирования мембранных потенциалов и других процессов межклеточного взаимодействия.
За регуляцию водно-солевого обмена и стабильность осмотического давления плазмы
крови в организме отвечает комплексная регуляторная система, включающая эндокринные,
нервные и паракринные механизмы.
Компонентами данной системы являются ось гипоталамус-нейрогипофиз, осморецепторная и
барорецепторная сенсорные системы и почки.
Приоритет в поддержании водного баланса имеют гипоталамо-нейрогипофизарная ось и ее
ключевой гормон — антидиуретический гормон (АДГ), вазопрессин.
Физиологические эффекты АДГ
АДГ на уровне почки повышает реабсорбцию воды в дистальных канальцах и собирательных
трубочках. Данный эффект вазопрессина осуществляется посредством его связывания со
специфическими G-протеинассоциированными рецепторами на базолатеральной мембране
интерстициальной поверхности клеток канальцев почки и повышения активности
аденилатциклазы, с последующим синтезом циклического аденозинмонофосфата АМФ
(цАМФ). Известно три типа рецепторов к вазопрессину – V1, V2, V3. Водный баланс
регулируется вазопрессином через рецепторы V2. Проницаемость клеток дистальных
канальцев и собирательных трубочек определяется числом водных каналов (аквапоринов) в
апикальной мембране. При отсутствии АДГ число аквапоринов невелико, и эпителий
практически непроницаем для воды, поэтому из организма выводится большое количество
гипотонической мочи. Присоединение АДГ к рецепторам ведет к увеличению концентрации
внутриклеточного мессенджера – цАМФ, активирующего протеинкиназу, что обеспечивает
пассивную реабсорбцию воды, посредством встроенных в апикальную мембрану водных
каналов.
Основное место экспрессии V1-рецепторов, приводящей к вазоконстрикции, – гладкая
мускулатура сосудов. В физиологических концентрациях АДГ не влияет на АД, а
вазопрессорный эффект проявляется при выбросе больших количеств гормона на фоне
резкого падения АД (при кровопотере, шоке). V1-рецепторы найдены также в мозговом слое
почек, печени и мозге (гипокамп, гипоталамус). В гепатоцитах АДГ стимулирует
гликогенолиз и глюконеогенез. Кроме того, АДГ, взаимодействуя с V1-рецепторами в ЦНС,
усиливает память. Активация тромбоцитарных V1-рецепторов способствует их агрегации.
V3-рецепторы локализованы в кортикотрофах аденогипофиза, их стимуляция способствует
повышению секреции адренокортикотропного гормона.
Регуляция секреции АДГ
Вазопрессин синтезируется в супраоптических и паравентрикулярных ядрах гипоталамуса.
Далее гормон образует комплексы со специфическими белками-носителями (нейрофизинами)
и транспортируется по аксонам через супраоптикогипофизарный тракт в нейрогипофиз, где
происходит его освобождение под действием различных стимулов.
В физиологических условиях главным фактором, регулирующим секрецию вазопрессина,
является осмолярность плазмы. Осморецепторы гипоталамуса чувствительны к колебаниям
осмолярности – сдвиг всего на 1% приводит к заметным изменениям секреции вазопрессина.
При снижении осмолярности плазмы ниже порогового уровня (около 280 мосм/кг) секреция
гормона тормозится, что приводит к выведению большого объема максимально разведенной
мочи. Когда осмолярность достигает приблизительно 295 мосм/кг, концентрация АДГ
становится достаточной для обеспечения максимального антидиуретического эффекта (объем
мочи
Секреция АДГ зависит от объема циркулирующей крови (ОЦК) и регулируется
барорецепторами легочных артерий (барорецепторы системы низкого давления), аорты и
сонных артерий (барорецепторы системы высокого давления).
При вазовагальных приступах, кетоацидозе, острой гипоксии и укачивании, проявляющихся
таким основным симптомом, как тошнота, уровень АДГ может возрастать в 100-1000 раз. К
К
факторам, стимулирующим выделение АДГ, также относят острую гипогликемию, стресс
(болевой, эмоциональный), физическую нагрузку, повышение температуры ядра тела,
никотин, некоторые лекарственные препараты (стимуляторы β-адренорецепторов,
холиномиметики, цитостатики, фенобарбитал, карбамазепин, клофибрат, хлорпропамид).
Угнетают его секрецию снижение температуры тела, предсердный натрийуретический
гормон, глюкокортикоиды, алкоголь, блокаторы β-адренорецепторов, холинолитики, морфин.
Абсолютная или относительная недостаточность АДГ и несахарный диабет
Под этими названиями объединяют несколько заболеваний с разной этиологией, для которых
характерна гипотоническая полиурия – выделение большого количества мочи с низким
удельным весом. Это может быть обусловлено дефицитом АДГ (центральный несахарный
диабет), резистентностью почек к АДГ (нефрогенный несахарный диабет), чрезмерным
потреблением воды (нервная полидипсия).
В эндокринологической практике несахарный диабет центрального генеза является основной
причиной полиурии. Центральный (гипоталамический, нейрогенный,
вазопрессинчувствительный) несахарный диабет развивается при патологии структуры гена
вазопрессина, в случае хирургического повреждения нейронов, при врожденных
анатомических дефектах гипоталамуса или гипофиза, опухолях, инфильтративных,
аутоиммунных и инфекционных заболеваниях с повреждением нейронов, при повышенном
метаболизме вазопрессина. Приблизительно в 10% случаев центрального несахарного
диабета у детей этиология заболевания неясна.
Диагностика
В диагностике несахарного диабета существенное место занимают анамнестические данные и
жалобы. Так, в первую очередь необходимо убедиться, имеют ли место патологическая
полиурия и полидипсия (превышающая 2 л/м2/сут). Врача должны интересовать следующие
вопросы: каков объем выпиваемой и выделяемой жидкости в сутки; влияет ли
полиурия/полидипсия на обычную активность пациента; имеет ли место ночной энурез или
никтурия; каков объем выпиваемой на ночь жидкости; установлены ли в анамнезе или при
клиническом обследовании данные, указывающие на дефицит или избыточную секрецию
других гормонов либо наличие внутричерепной опухоли.
Полиурия возникает, когда секреция АДГ становится недостаточной для обеспечения
концентрационной способности почек, т. е. снижается более чем на 75%. Гиперосмолярность
плазмы, обусловленная полиурией, компенсируется полидипсией. Независимо от тяжести
полиурии полидипсия может поддерживать осмолярность плазмы на нормальном уровне.
Нарушение механизма формирования ощущения жажды или ограничение потребления
жидкости являются причинами гиперосмолярности плазмы и гипернатриемии у больного
несахарным диабетом.
Таким образом, главные симптомы несахарного диабета – полиурия и полидипсия. Объем
мочи колеблется от нескольких литров в сутки при парциальном центральном несахарном
диабете (с частичным дефицитом АДГ) до 20 литров в сутки при полном центральном
несахарном диабете (с отсутствием АДГ), причем полиурия возникает, как правило,
внезапно. Больные пьют очень много и обычно предпочитают холодные напитки. Если
потребление жидкости ограничивают, то осмолярность плазмы быстро возрастает и
появляются симптомы поражения ЦНС (раздражительность, заторможенность, атаксия,
гипертермия и кома).
Неврологические симптомы при несахарном диабете гипоталамического генеза включают
головные боли, рвоту, ограничение полей зрения. Гипопитуитаризм гипоталамического
происхождения часто ассоциирован с несахарным диабетом. 70% пациентов с несахарным
диабетом вследствие опухолей гипофиза/гипоталамуса имеют дефицит соматотропного
гормона (СТГ) и 30% – дефицит других гормонов аденогипофиза.
У новорожденных и детей грудного возраста клиническая картина несахарного диабета
значительно отличается от таковой у взрослых и достаточно трудна для диагностики: дети
раннего возраста не могут выразить желание о повышенном потреблении жидкости, и если
патология не будет диагностирована вовремя, возможно развитие необратимых повреждений
мозга. Новорожденные с несахарным диабетом вследствие перинатальных гипоталамических
повреждений теряют в весе, развивается гипернатриемия. У детей грудного возраста
ведущими симптомами являются повторные эпизоды гипернатриемии и рвоты. Летальные
Летальные
исходы связаны с комой и судорогами. Дети плохо растут, страдают от анорексии и рвоты
при приеме пищи. Дети могут предпочитать воду молоку. Частой причиной обращения к
врачу становится задержка умственного развития. Эти симптомы – следствие хронической
гиповолемии и гиперосмолярности плазмы крови. Осмолярность мочи никогда не бывает
высокой. К моменту установления диагноза ребенок обычно имеет выраженный дефицит
веса, сухую и бледную кожу, у него отсутствуют потоотделение и слезоотделение. Полиурия
может вызывать энурез, никтурия нарушает сон, приводит к усталости. Явная
гипертоническая дегидратация возникает только при недостатке питья.
Лабораторные диагностические критерии несахарного диабета: большой объем мочи (как
правило, > 3 л/сут), гипостенурия, то есть удельный вес мочи во всех порциях за сутки
меньше 1008 при отсутствии азотемии, низкий уровень АДГ в плазме крови, не
соответствующий ее осмолярности.
Существенное значение в диагностике центрального несахарного диабета имеет МРТ
головного мозга. В норме нейрогипофиз представляет собой область яркого свечения на Т1-
взвешенных снимках. Яркое пятно нейрогипофиза отсутствует или слабо прослеживается при
центральной форме несахарного диабета вследствие сниженного синтеза вазопрессина.
Кроме того, с помощью МРТ выявляют опухоли, пороки развития гипоталамо-гипофизарной
области, при которых может иметь место несахарный диабет.
Лечение
Цель лечения – возмещение дефицита АДГ, чаще всего для этого используют десмопрессин –
препарат АДГ пролонгированного действия. Антидиуретический эффект его длится 8-20
часов, вазопрессорный эффект минимален. Детям и взрослым препарат назначают в виде
капель в нос или в виде аэрозоля для интраназального введения. Лучше начинать лечение
вечером, чтобы подобрать наименьшую эффективную дозу, предотвращающую никтурию.
Обычно достаточно 5-10 мкг десмопрессина 1-2 раза в сутки.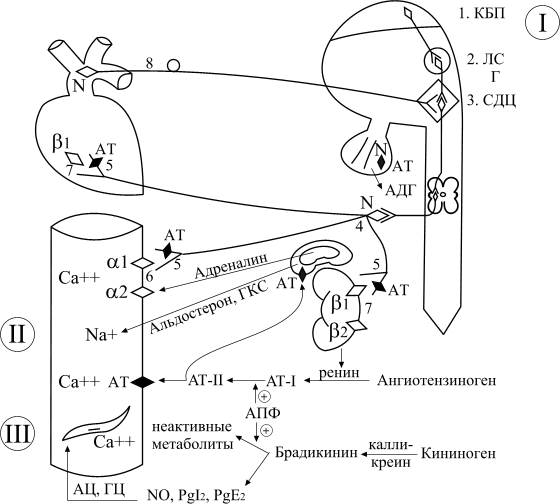
Можно назначать хлорпропамид, так как он не только усиливает действие АДГ на почечные
канальцы, но и стимулирует секрецию АДГ. Хлорпропамид назначают внутрь в дозах 250-
500 мг/сут. Стимулируют секрецию АДГ клофибрат и карбамазепин, последний также
повышает чувствительность почек к АДГ.
Нефрогенный несахарный диабет
Это – синдром гипотонической полиурии, обусловленный резистентностью почек к
антидиуретическому действию АДГ. Полиурия возникает, когда чувствительность почек к
АДГ снижается настолько, что физиологические концентрации вазопрессина не могут
обеспечить концентрирование мочи. Основные признаки таковы:
1. Нормальная скорость клубочковой фильтрации и канальцевой экскреции.
2. Гипостенурия.
3. Нормальный или повышенный уровень АДГ.
4. Лечение препаратами АДГ не повышает осмолярности и не уменьшает объема мочи.
Как и центральный несахарный диабет, нефрогенный несахарный диабет может быть
наследственным или приобретенным. Наследственная форма заболевания проявляется, как
Наследственная форма заболевания проявляется, как
правило, уже у грудных детей. Возможные причины приобретенного нефрогенного
несахарного диабета: гипокалиемия, гиперкальциемия, серповидноклеточная анемия,
обструкция мочевых путей, а также прием лекарственных средств (например, лития,
демеклоциклина или метоксифлурана).
Главная черта нефрогенного несахарного диабета – пассивная реабсорбция воды в
дистальных канальцах и собирательных трубочках не усиливается под влиянием АДГ, что
приводит к гипостенурии. Нефрогенный несахарный диабет может быть обусловлен
нарушением связывания АДГ с рецепторами типа V2, нарушением передачи сигнала от
рецепторов либо обоими дефектами.
При наследственном нефрогенном несахарном диабете нарушена передача сигнала от
рецепторов АДГ к аденилатциклазе, продукция цАМФ в ответ на действие АДГ снижена,
количество водных каналов в клетках дистальных канальцев и собирательных трубочек не
увеличивается под воздействием АДГ.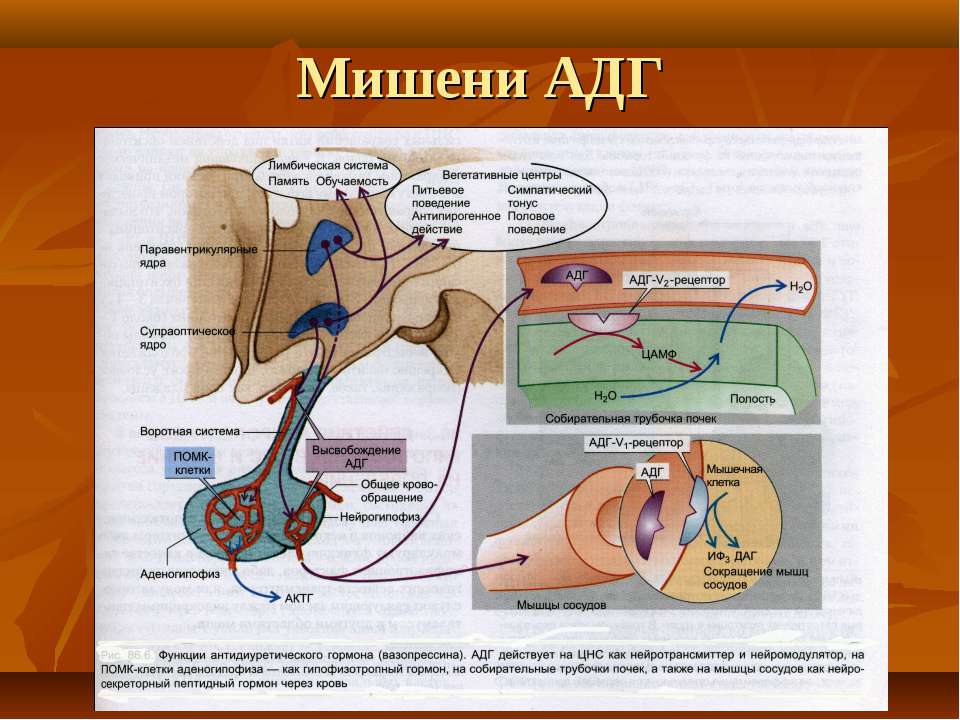 Гиперкальциемия и гипокалиемия также нарушают
Гиперкальциемия и гипокалиемия также нарушают
концентрационную способность почек. Гипокалиемия стимулирует образование
простагландина E2 и тем самым препятствует активации аденилатциклазы. Гиперкальциемия
уменьшает содержание растворенных веществ в мозговом веществе почек и блокирует
взаимодействие рецепторов АДГ с аденилатциклазой. Демеклоциклин и литий подавляют
образование цАМФ, стимулированное АДГ.
При нефрогенном несахарном диабете неэффективны ни препараты АДГ (вазопрессин,
аргипрессин, липрессин, десмопрессин), ни препараты, которые стимулируют секрецию АДГ
или усиливают его действие на почки. Наиболее действенный метод лечения – назначение
тиазидных диуретиков и умеренное ограничение потребления соли. Тиазидные диуретики
можно использовать также при центральном несахарном диабете. Эти препараты блокируют
реабсорбцию хлорида в дистальных извитых канальцах и тем самым уменьшают содержание
натрия в крови. В ответ на снижение концентрации натрия реабсорбция воды в
проксимальных отделах нефрона усиливается, а объем жидкости, поступающей в
собирательные трубочки, уменьшается. Ограничение потребления соли увеличивает эффект
Ограничение потребления соли увеличивает эффект
тиазидных диуретиков.
Ингибиторы синтеза простагландинов (ибупрофен, индометацин, аспирин) уменьшают
поступление растворенных веществ в дистальные отделы нефрона, тем самым снижая объем
и увеличивая осмолярность мочи. Эти препараты можно использовать как дополнительное
средство лечения нефрогенного несахарного диабета.
Несахарный диабет у беременных
Это преходящее состояние, обусловленное разрушением АДГ в крови плацентарными
ферментами, например цистиниламинопептидазой. Несахарному диабету у беременных
свойственны признаки как центрального, так и нефрогенного несахарного диабета. Полиурия
возникает обычно в третьем триместре, а после родов проходит без лечения. Уровень АДГ
снижен. Полиурия не уменьшается при лечении вазопрессином или аргипрессином, но
поддается лечению десмопрессином.
Нервная полидипсия
Это заболевание называют также первичной полидипсией, или дипсогенным несахарным
диабетом.
Заболевание может быть обусловлено как органическими, так и функциональными
нарушениями отделов ЦНС, контролирующих секрецию АДГ и утоление жажды.
Полидипсия возникает, когда порог осмолярности плазмы для утоления жажды становится
более низким, чем порог осмолярности для запуска секреции АДГ (в норме порог
осмолярности плазмы для утоления жажды выше, чем для секреции АДГ). Такое извращение
нормального соотношения между жаждой и секрецией АДГ обусловливает стойкую
полидипсию и полиурию.
Диагностические критерии нервной полидипсии: гипоосмолярность плазмы, мочи,
сниженный уровень АДГ в плазме.
Для лечения нервной полидипсии препараты АДГ и тиазидные диуретики применять нельзя,
так как они ограничивают выведение воды, не уменьшая ее потребления, и потому могут
вызывать тяжелую водную интоксикацию. Основные усилия врача должны быть направлены
на коррекцию поведения и психики больного с тем, чтобы уменьшить потребление жидкости.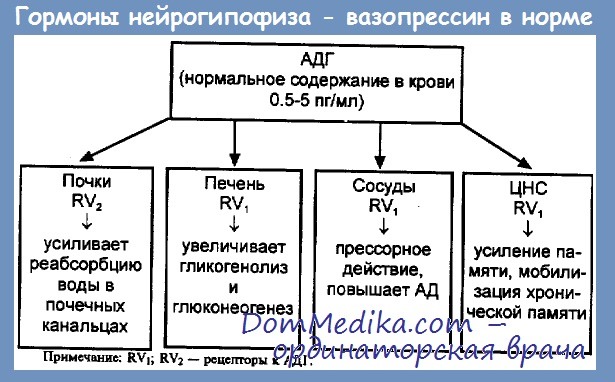
Дифференциальная диагностика полиурических синдромов
Без специальных проб трудно определить причину полиурии, но некоторые симптомы все же
помогают установить предварительный диагноз. Большой объем мочи, гипоосмолярность
плазмы (
Проба с ограничением жидкости – самый распространенный и надежный метод
дифференциальной диагностики полиурических синдромов. Ограничение потребления
жидкости приводит к дегидратации, которая в норме стимулирует максимальную секрецию
АДГ, что, в свою очередь, обусловливает максимальное концентрирование мочи. Поэтому
введение АДГ не повышает осмолярности мочи.
В норме и при нервной полидипсии на фоне дегидратации осмолярность мочи превышает
осмолярность плазмы. После введения АДГ осмолярность мочи повышается незначительно
(менее чем на 10%). Если осмолярность мочи, несмотря на явную дегидратацию, не
превышает осмолярность плазмы, нервную полидипсию можно исключить. При центральном
При центральном
или нефрогенном несахарном диабете осмолярность мочи на фоне дегидратации не
превышает осмолярности плазмы. После введения АДГ у здоровых людей и больных с
нервной полидипсией осмолярность мочи возрастает менее чем на 10%, у больных с
центральным несахарным диабетом – более чем на 50%, а у больных с нефрогенным
несахарным диабетом – менее чем на 50%.
Если диагноз центрального несахарного диабета установлен, обязательно проводят КТ или
МРТ гипоталамо-гипофизарной области, чтобы исключить краниофарингиому, менингиому и
инфильтративный процесс.
Синдром гиперсекреции АДГ
Другие названия: синдром неадекватной продукции АДГ, гипергидропексический синдром,
синдром Пархона, несахарный антидиабет.
Этот синдром характеризуется гипонатриемией, гипоосмолярностью плазмы и выведением
достаточно концентрированной мочи (осмолярность мочи обычно > 300 мосмоль/кг).
Синдром может быть обусловлен избыточной нерегулируемой секрецией АДГ или
усилением его действия на клетки дистальных отделов нефрона. Судя по результатам
Судя по результатам
определения АДГ в плазме больных с гипонатриемией, синдром гиперсекреции АДГ – самая
частая причина гипонатриемии. Действительно, уровень АДГ повышен у 95% больных с
гипонатриемией.
Постоянная секреция АДГ или повышение чувствительности клеток почек к АДГ вызывают
задержку потребляемой жидкости, гипонатриемию и некоторое увеличение объема
внеклеточной жидкости, которое приводит к торможению абсорбции натрия в
проксимальных почечных канальцах и к натрийурезу. Кроме того, увеличение ОЦК
стимулирует секрецию предсердного натрийуретического гормона, который также
способствует натрийурезу. Усиливается экскреция мочевой кислоты, вследствие чего
развивается гипоурикемия, часто наблюдаемая при синдроме гиперсекреции АДГ.
Причиной синдрома могут быть любые поражения ЦНС, включая объемные процессы,
инфекции, сосудистые и метаболические нарушения. Синдром гиперсекреции АДГ может
быть обусловлен усилением физиологических неосмотических стимулов секреции АДГ
(например, при острых психозах, стрессах и болях).
Способность почек выводить воду нарушена почти у 66% больных с мелкоклеточным раком
легкого. Клетки опухоли секретируют АДГ или АДГ-подобные пептиды (обладающие
иммунологическими и биологическими свойствами АДГ), а также нейрофизин. Дыхание под
постоянным положительным давлением, активируя барорецепторы системы низкого
давления, также может вызывать синдром гиперсекреции АДГ.
В клинической картине на первом плане – симптомы водной интоксикации. Выраженность
симптомов зависит от степени и скорости развития гипонатриемии и гипергидратации. При
острой гипонатриемии, когда концентрация натрия в сыворотке падает ниже 120 ммоль/л,
синдром гиперсекреции АДГ проявляется сонливостью, судорогами, комой и часто
заканчивается смертью. Содержание воды в головном мозге при хронической гипонатриемии
увеличивается не столь значительно, как при острой гипонатриемии (при снижении
концентрации натрия до одного и того же уровня), поэтому хроническая гипонатриемия
характеризуется меньшей смертностью, чем острая. При хронической гипонатриемии, даже
При хронической гипонатриемии, даже
если концентрация натрия не достигает 125 ммоль/л, у половины больных симптомы
отсутствуют, а частота смертельных исходов очень мала. Когда концентрация натрия у таких
больных снижается до 115-120 ммоль/л, возникают тошнота, рвота, головная боль и боль в
животе, пропадает аппетит.
Диагноз синдрома гиперсекреции АДГ устанавливают, если у больного обнаружена
гипонатриемия на фоне разведения мочи ниже максимального. Исключают гиповолемию,
болезни щитовидной железы, надпочечников, печени, сердца и почек. У больных с тяжелой
сердечной, почечной недостаточностью и циррозом печени с асцитом, а также после
введения больших объемов гипотонических растворов обычно развивается гипонатриемия
разведения. Гипонатриемия наблюдается и при состояниях, сопровождающихся потерей
соли, таких, как диарея, болезни почек, сахарный диабет. Однако в этих случаях (за
исключением болезней почек) обычно имеются признаки дегидратации и снижение
экскреции натрия с мочой. При синдроме гиперсекреции АДГ и почечной недостаточности
При синдроме гиперсекреции АДГ и почечной недостаточности
уровень натрия в моче превышает 20 мэкв/л, а его экскреция выше 1%. У больных с
синдромом гиперсекреции АДГ ограничение жидкости до 600-800 мл/сут на протяжении 2-3
суток должно приводить к снижению веса на 1,8-2,7 кг, исчезновению гипонатриемии и
прекращению потери натрия с мочой. В то же время при сольтеряющих формах почечной
недостаточности ограничение жидкости не устраняет ни гипонатриемию, ни потерю соли с
мочой.
Цель лечения при синдроме гиперсекреции АДГ – нормализация осмолярности плазмы и
устранение гипергидратации. Тактика лечения зависит от скорости развития гипонатриемии
(острая или хроническая), концентрации натрия в сыворотке и состояния больного.
При острой гипонатриемии или обострении хронической гипонатриемии (концентрация
натрия в сыворотке
Ограничение потребления жидкости – лучший способ лечения хронического синдрома
гиперсекреции АДГ, который позволяет нормализовать концентрацию натрия в сыворотке
практически у всех больных с исходной концентрацией натрия > 120 ммоль/л. Объем
Объем
потребляемой жидкости должен быть равен сумме объема выделяемой мочи и скрытых
потерь жидкости. Если больному трудно выдерживать такой режим, можно назначить
демеклоциклин или литий. Оба препарата блокируют действие АДГ на собирательные
трубочки, но литий для лечения синдрома гиперсекреции АДГ применяют редко, поскольку
он вызывает много побочных эффектов. Демеклоциклин безопаснее, но при его применении
необходимо обращать особое внимание на функцию печени, так как при печеночной
недостаточности препарат накапливается в организме и оказывает нефротоксическое
действие. Следует подчеркнуть, что лечить надо основное заболевание, обусловливающее
гипонатриемию.
СТАТТІ ЗА ТЕМОЮ
30. 05.2021
05.2021
Онкологія та гематологія
Програма Guardian: мовою доказової медицини про туроктоког альфа
Туроктоког альфа (препарат НовоЕйт, фармацевтична компанія Novo Nordisk, Данія) – це рекомбінантний людський фактор коагуляції VIII (FVIII) з усіченим В-доменом без будь-яких інших модифікацій у послідовності амінокислот. Засіб є очищеним білком, який складається з 1445 амінокислот і має молекулярну масу близько 166 кДа. Його виготовляють за допомогою технології рекомбінантної ДНК у клітинах яєчників китайського хом’яка й отримують без додавання будь-яких білків людського чи тваринного походження в процесі культивування клітин, очищення або виробництва готового препарату….
30. 05.2021
05.2021
Дерматологія
Онкологія та гематологія
Роль імунотерапії у лікуванні меланоми шкіри
12-14 березня на міжнародній медичній науково-освітній платформі Medical Knowledge Hub відбулася друга Школа дерматоонкології. Онлайн-захід був орієнтований на лікарів, які займаються діагностикою та лікуванням пухлин шкіри, а саме дерматологів, онкологів, онкохірургів, патоморфологів, суміжних спеціалістів. Особливою подією школи став сателітний симпозіум компанії MSD, у рамках якого провідні фахівці висвітлили сучасні погляди на діагностику та лікування меланоми….
Вазопрессин: механизм действия и клиническая физиология | Наточин
Круг проблем физиологии, биохимии и клини ки аргинин-вазопрессина (антидиуретического гормона — АДГ) многообразен, имеющиеся дан ные не могут быть в полном объеме представлены ни в большом обзоре, ни в достаточно объемной монографии. Сохранение термина АДГ наряду с вазопрессином оправдано, поскольку у ряда видов позвоночных функцию АДГ выполняют другие на- нопептиды гипофиза, в том числе лизин-вазопрес-
Сохранение термина АДГ наряду с вазопрессином оправдано, поскольку у ряда видов позвоночных функцию АДГ выполняют другие на- нопептиды гипофиза, в том числе лизин-вазопрес-
1 Работа поддержана Российским фондом фундаментальных исследований (гранты 99-04-49198 и 00-15-97803) и Програм мой президиума РАН. син, аргинин-вазотоцин, гидрин 2 [17, 54, 65]. Ва зопрессину посвящены оригинальные статьи, об зоры [4, 6, 63], монографии и сборники [54, 86]. Идентифицированы клинические синдромы, свя занные с неадекватной секрецией АДГ (синдром Швартца-Бартера), дефицитом секреции АДГ (не сахарный диабет), нечувствительностью клеток ка нальцев к этому гормону (нефрогенный несахар ный диабет) [3, 5]. Отсутствие реакции почки на АДГ может быть обусловлено дефектом многих элементов каскада, от которых зависит увеличение проницаемости для воды в ответ на прием гормона. Описаны формы диабета, обусловленные мутацией гена У2-рецептора [21, 83], гена аквапорина 2 [80]. В настоящей статье будет уделено внимание вопро сам механизма действия и клинической физиоло гии вазопрессина, в решении которых наш коллек тив принимал участие, и итоги исследований дали новое видение ряда этих проблем.
В 1895 г. G. Oliver и Е. Schafer обнаружили спо собность экстракта задней доли гипофиза повы шать артериальное давление, а в 1913 г. R. von den Velden обнаружил его антидиуретическое действие при несахарном диабете. Долгое время полагали, что прессорной агент и антидиуретическое начало — разные вещества, пока не была установлена их химическая идентичность. В 20-х годах XX века, когда было сформулировано представление о гор моне, это активное начало было названо вазопрес сином. Его синтез был осуществлен V. Du Vigneaud, биохимиком из университета Джорджа Вашингтона в Сент-Луисе, который был удостоен Нобелевской премии за синтез окситоцина и вазо прессина. Аргинин-вазопрессин представляет со бой нанопептид: Цис-Тир-Фен-Глу-Асп- Цис-Про-Apr-Гли; в 60-е годы в Чехословакии был синтезирован его аналог — 1-дезамино-8О-ар- гинин-вазопрессин (dDAVP, десмопрессин), полу чивший широкое клиническое применение в каче стве агониста Vj-рецепторов [54].
Функции вазопрессина
АДГ вырабатывается в ядрах гипоталамуса, его функция, начиная с бесхвостых амфибий, заклю чается в осмотической регуляции, в сохранении во ды в организме [17, 65]. У бесхвостых амфибий (ля гушки, жабы) АДГ повышает проницаемость для воды клеток эпителия кожи, мочевого пузыря, по чечных канальцев, усиливает транспорт ионов на трия, что обеспечивает осморегуляцию [17, 66]. Во да поступает во внутреннюю среду через покровы в пресной воде, всасывается в кровь в конечных от делах канальцев и в мочевом пузыре. Вазопрессин и соответственно агонисты V,- и У2-рецепторов да ют различные эффекты, они оказывают влияние на тонус сосудов [24, 29], антидиуретическое действие [46, 54], влияют на функцию кровяных пластинок [16], способствуют выделению VIII фактора свер тывания крови [54], оказывают инотропное дейст вие в мышце желудочка сердца [31], влияют на по ведение [35, 73, 81], модулируют вокальную функ цию [36], при введении в определенные участки мозга индуцируют гипергликемию [87], влияют на температуру тела [75], внутриглазное давление [34] и состав жидкостей внутреннего уха [47].
У бесхвостых амфибий (ля гушки, жабы) АДГ повышает проницаемость для воды клеток эпителия кожи, мочевого пузыря, по чечных канальцев, усиливает транспорт ионов на трия, что обеспечивает осморегуляцию [17, 66]. Во да поступает во внутреннюю среду через покровы в пресной воде, всасывается в кровь в конечных от делах канальцев и в мочевом пузыре. Вазопрессин и соответственно агонисты V,- и У2-рецепторов да ют различные эффекты, они оказывают влияние на тонус сосудов [24, 29], антидиуретическое действие [46, 54], влияют на функцию кровяных пластинок [16], способствуют выделению VIII фактора свер тывания крови [54], оказывают инотропное дейст вие в мышце желудочка сердца [31], влияют на по ведение [35, 73, 81], модулируют вокальную функ цию [36], при введении в определенные участки мозга индуцируют гипергликемию [87], влияют на температуру тела [75], внутриглазное давление [34] и состав жидкостей внутреннего уха [47].
Организм человека как целостная система взаи модействует с окружающей средой и приспосабли вается к ее меняющимся условиям, в том числе водному, солевому и температурному режиму. Ва зопрессин определяет поддержание стабильного осмотического давления крови и тем самым вне клеточной жидкости [6, 17]. Исследование физико химических показателей сыворотки крови у здоро вых людей в обычных и экстремальных условиях, а также у пациентов при ряде патологических со стояний показало, что наиболее строго системы ре гуляции контролируют осмоляльность внеклеточ ной жидкости, концентрацию в ней свободного Са2+, pH, вариабельность концентрации ионов К+ и ряда других веществ [60]. При обследовании поч ти 200 космонавтов и астронавтов после полета не было найдено отличий средних значений осмо ляльности сыворотки крови по сравнению с исход ными, дополетными величинами, но вариабель ность этого показателя после приземления возрос ла на 44% (60]. От осмоляльности крови и внекле точной жидкости зависит объем клеток: растет ос моляльность крови — объем клетки уменьшается, наступает гипоосмия — и он увеличивается. Это обусловлено тем, что через водопроницаемую плазматическую мембрану из клетки при гиперос- мии вода оттекает по осмотическому градиенту во внеклеточную жидкость.
Ва зопрессин определяет поддержание стабильного осмотического давления крови и тем самым вне клеточной жидкости [6, 17]. Исследование физико химических показателей сыворотки крови у здоро вых людей в обычных и экстремальных условиях, а также у пациентов при ряде патологических со стояний показало, что наиболее строго системы ре гуляции контролируют осмоляльность внеклеточ ной жидкости, концентрацию в ней свободного Са2+, pH, вариабельность концентрации ионов К+ и ряда других веществ [60]. При обследовании поч ти 200 космонавтов и астронавтов после полета не было найдено отличий средних значений осмо ляльности сыворотки крови по сравнению с исход ными, дополетными величинами, но вариабель ность этого показателя после приземления возрос ла на 44% (60]. От осмоляльности крови и внекле точной жидкости зависит объем клеток: растет ос моляльность крови — объем клетки уменьшается, наступает гипоосмия — и он увеличивается. Это обусловлено тем, что через водопроницаемую плазматическую мембрану из клетки при гиперос- мии вода оттекает по осмотическому градиенту во внеклеточную жидкость. Когда возрастает реаб сорбция воды в почке человека при синдроме не адекватной секреции АДГ, снижается осмоляль ность крови, наступает гипоосмия, внеклеточная жидкость становится гипотоничнее внутриклеточ ного содержимого. Вода по водным каналам (аква- поринам) по осмотическому градиенту начинает поступать в клетки, это приводит к их набуханию. Изменение объема клеток вызывает сдвиги метабо лизма в клетке, изменение ее функционального со стояния, ее реакции на регулирующие внеклеточ ные воздействия, включая действие гормонов и ме диаторов.
Когда возрастает реаб сорбция воды в почке человека при синдроме не адекватной секреции АДГ, снижается осмоляль ность крови, наступает гипоосмия, внеклеточная жидкость становится гипотоничнее внутриклеточ ного содержимого. Вода по водным каналам (аква- поринам) по осмотическому градиенту начинает поступать в клетки, это приводит к их набуханию. Изменение объема клеток вызывает сдвиги метабо лизма в клетке, изменение ее функционального со стояния, ее реакции на регулирующие внеклеточ ные воздействия, включая действие гормонов и ме диаторов.
Если свести воедино многие из перечисленных эффектов вазопрессина в основное физиологиче ское назначение этого гормона, можно высказать мысль о том, что оно состоит в создании условий для стабилизации объема клеток в организме бла годаря поддержанию эуосмии и приведении объе ма крови в соответствие емкости сосудистого рус ла. Это во многом определяет эффективную работу физиологических систем организма, продуктив ность которых определяется высокой стабильно стью физико-химических показателей жидкостей внутренней среды, которые зависят от систем ос морегуляции и волюморегуляции. Только в усло виях постоянства состава околоклеточной среды клетки могут точно реагировать на приходящие к ним сигналы (нервные стимулы, гормоны, локаль но образующиеся физиологически активные веще ства).
Только в усло виях постоянства состава околоклеточной среды клетки могут точно реагировать на приходящие к ним сигналы (нервные стимулы, гормоны, локаль но образующиеся физиологически активные веще ства).
Когда человек попадает в условия пустыни, ра ботает в горячем цехе, наступает дефицит воды в организме, появляется жажда. Желание пить воду возникает для компенсации потери жидкости, од новременно активируются системы сохранения во ды в теле. Сигнал об осмоляльности крови, воспри нятый осморецепторами [4, 55], передается к ней ронам ядер гипоталамической области головного мозга. При гиперосмии эти нейроны активируют ся, из окончаний аксонов в задней доле гипофиза в кровь человека секретируется аригин-вазопрессин, его концентрация в крови у человека возрастает с 1 до 5 пг/мл. Секреция вазопрессина растет при ги поволемии, стрессе [4].
Эффекты вазопрессина в почке «
С током крови АДГ достигает почек и в клетках собирательных трубок увеличивает проницаемость плазматических мембран для воды. В итоге возрас тает всасывание воды в кровь из просвета почечных канальцев для восстановления водного баланса. В обращенных в сторону внеклеточной жидкости мембранах клеток почечных канальцев (собира тельных трубок) имеются рецепторы вазопрессина [37]. После взаимодействия вазопрессина с V2-pe- цепторами базолатеральных мембран в клетке уве личивается концентрация цАМФ, этот вторичный посредник активирует протеинкиназу А, и в люми нальную мембрану встраиваются водные каналы — аквапорин 2 [46, 63, 69]. Итог — увеличение про ницаемости клеток канальца для воды, усиление ее всасывания в кровь, возвращение к норме осмо ляльности крови. Эта схема описана в руководствах [4, 6, 54], согласно ей осмотический гомеостаз за висит от эффективности осморегулирующего реф лекса и концентрации в крови одного гормона — вазопрессина. Концентрация в плазме крови АДГ определяется соотношением его секреции гипофи зом и скорости клиренса крови, т. е. ферментатив ным расщеплением гормона и удалением его пече нью или почкой.
В итоге возрас тает всасывание воды в кровь из просвета почечных канальцев для восстановления водного баланса. В обращенных в сторону внеклеточной жидкости мембранах клеток почечных канальцев (собира тельных трубок) имеются рецепторы вазопрессина [37]. После взаимодействия вазопрессина с V2-pe- цепторами базолатеральных мембран в клетке уве личивается концентрация цАМФ, этот вторичный посредник активирует протеинкиназу А, и в люми нальную мембрану встраиваются водные каналы — аквапорин 2 [46, 63, 69]. Итог — увеличение про ницаемости клеток канальца для воды, усиление ее всасывания в кровь, возвращение к норме осмо ляльности крови. Эта схема описана в руководствах [4, 6, 54], согласно ей осмотический гомеостаз за висит от эффективности осморегулирующего реф лекса и концентрации в крови одного гормона — вазопрессина. Концентрация в плазме крови АДГ определяется соотношением его секреции гипофи зом и скорости клиренса крови, т. е. ферментатив ным расщеплением гормона и удалением его пече нью или почкой. Считается, что проницаемость для воды осморегулирующего эпителия зависит только от сдвигов концентрации АДГ в плазме кро ви [4, 63], однако один наш эксперимент поколебал эту общепринятую схему [64], см. ниже.
Считается, что проницаемость для воды осморегулирующего эпителия зависит только от сдвигов концентрации АДГ в плазме кро ви [4, 63], однако один наш эксперимент поколебал эту общепринятую схему [64], см. ниже.
Рецепторы вазопрессина имеются в плазматиче ских мембранах различных клеток почки. АДГ уве личивает проницаемость для воды клеток связую щего отдела нефрона и собирательных трубок [19], меняет соотношение объема фильтруемой жидко сти в клубочках различных популяций нефронов при переходе от водного диуреза к антидиурезу [6], в мембранах клетках толстого восходящего отдела петли Генле стимуляция У2-рецепторов приводит к образованию цАМФ и увеличению реабсорбции ионов Na, Са, Mg [37], в клетках собирательных трубок коры АДГ стимулирует транспорт ионов хлора [27], а в клетках собирательных трубок на ружного мозгового вещества почки, где имеется транспортер мочевины [18], АДГ усиливает ее ре абсорбцию. В постнатальном онтогенезе вазопрес син восстанавливает гетерогенность нефронов у крыс с наследственным несахарным диабетом (ли ния Браттлеборо) [85]. Вазопрессин влияет на гло мерулярную фильтрацию благодаря изменению то нуса сосудов и действию на клетки мезангия [6]. Их сокращение приводит к уменьшению поверхности капилляров, через стенку которых происходит ультрафильтрация жидкости в полость капсулы клубочка, снижается коэффициент гломерулярной ультрафильтрации. Этот эффект обусловлен обра зованием цАМФ и не зависит от секреции ренина. Все перечисленные эффекты вазопрессина направ лены на обеспечение максимальной реабсорбции осмотически свободной воды, осмотическое кон центрирование мочи. Для этого требуется увеличе ние осмоляльности мозгового вещества, повыше ние проницаемости плазматических мембран для воды.
Вазопрессин влияет на гло мерулярную фильтрацию благодаря изменению то нуса сосудов и действию на клетки мезангия [6]. Их сокращение приводит к уменьшению поверхности капилляров, через стенку которых происходит ультрафильтрация жидкости в полость капсулы клубочка, снижается коэффициент гломерулярной ультрафильтрации. Этот эффект обусловлен обра зованием цАМФ и не зависит от секреции ренина. Все перечисленные эффекты вазопрессина направ лены на обеспечение максимальной реабсорбции осмотически свободной воды, осмотическое кон центрирование мочи. Для этого требуется увеличе ние осмоляльности мозгового вещества, повыше ние проницаемости плазматических мембран для воды.
Эффекты стимуляции различных типов рецепторов вазопрессина
Описано несколько типов рецепторов вазопрес сина — V„ Vla, V2 [15, 44, 46, 61] и выявлены свя занные с ними гены, их мутации [48, 53, 70, 79]. Стимуляция V.-рецепторов обеспечивает модуля цию эффекта вазопрессина [1, 33], вазоконстрик цию [61], гликогенолиз, освобождение АКТГ, со кращение мышц кишечника.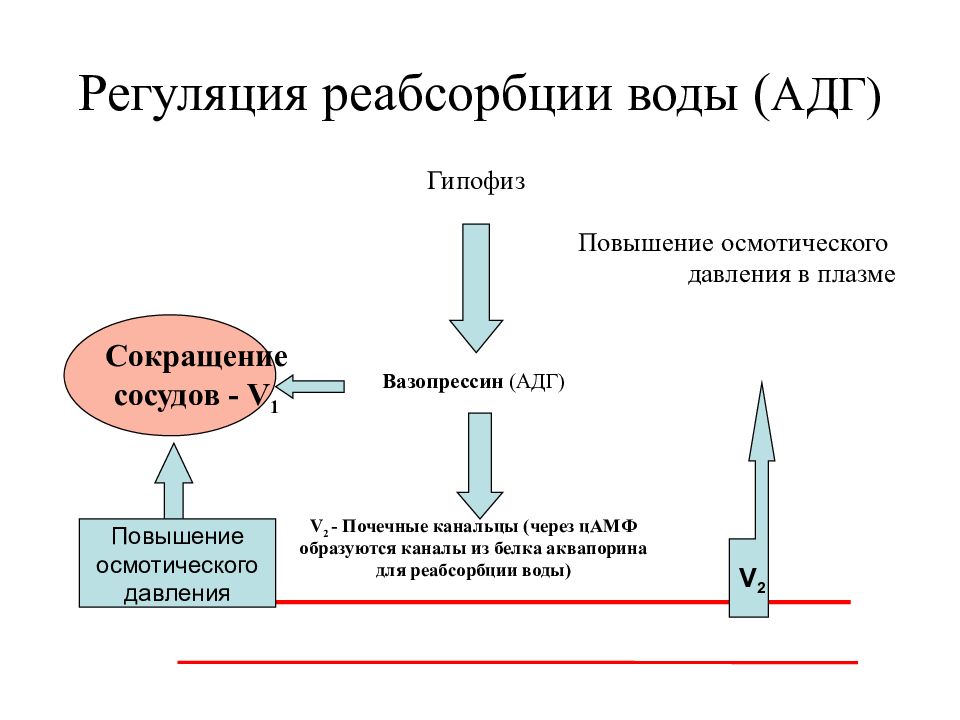 Специфический аго нист рецепторов этого типа реместип применяют при остром геморрагическом гастрите, послеопера ционной кишечной непроходимости, кровотече нии, вызванном варикозным расширением сосудов пищевода. Стимуляция V.-рецепторов влияет на тонус сосудов [54], внутриглазное давление [34], блокада центральных У,-рецепторов уменьшает ги потензивное состояние [23]. В свою очередь анта гонисты У1а/У2-рецепторов [88], селективные анта гонисты V,- и У2-рецепторов нашли применение в экспериментальных исследованиях [43, 76, 77] и клинической практике [20] при лечении гипоос- мии, гипонатриемии [72], гипертензивных состоя ний [84].
Специфический аго нист рецепторов этого типа реместип применяют при остром геморрагическом гастрите, послеопера ционной кишечной непроходимости, кровотече нии, вызванном варикозным расширением сосудов пищевода. Стимуляция V.-рецепторов влияет на тонус сосудов [54], внутриглазное давление [34], блокада центральных У,-рецепторов уменьшает ги потензивное состояние [23]. В свою очередь анта гонисты У1а/У2-рецепторов [88], селективные анта гонисты V,- и У2-рецепторов нашли применение в экспериментальных исследованиях [43, 76, 77] и клинической практике [20] при лечении гипоос- мии, гипонатриемии [72], гипертензивных состоя ний [84].
Стимуляция У2-рецепторов вызывает увеличе ние проницаемости для воды клеток осморегули рующего эпителия, в том числе собирательных тру бок в почке [46, 54], выделение VIII фактора свер тывания крови. Это и определяет эффективность агониста этих рецепторов десмопрессина при неса харном диабете, ночном энурезе, болезни Виллеб- рандта, при сложных формах нарушения гемостаза (уремическое кровотечение, цирроз) и лечении по бочных эффектов действия лекарств и нарушении гемостаза (аспирин, тиклопедин) [68, 78]. Стиму ляция У2-рецепторов наряду с увеличением реаб сорбции воды в собирательных трубках мозгового вещества почки способствует возрастанию реаб сорбции мочевины, в клетках толстого восходяще го отдела петли Генле увеличивается реабсорбция ионов Na, Mg, К, Са.
Механизм антидиуретического действия вазопрессина
На рубеже 50-60-х годов стало очевидно, что в ответ на действие пептидного гормона на клетку в ней образуется вещество, которое вызывает изме нение химических процессов в клетке и в конечном счете изменяет ее функции. Выяснение механизма действия АДГ во многом зависело от результатов исследований, увенчанных присуждением не скольких Нобелевских премий по физиологии и медицине — среди них открытие Э. У. Сазерлен дом роли цАМФ в механизме действия гормонов [82], создание Р. Ялоу радиоиммунного метода оп ределения пептидных гормонов, в том числе вазо прессина, пришедшего на смену биологическому тестированию его активности, исследования С. Бергстрома, Б. Самуэльсона и Дж. Вейна, которые открыли простагландины, оказавшиеся физиоло гическими конкурентами антидиуретического эф фекта вазопрессина [2, 10, 19].
Пептидные гормоны не способны проникать че рез клеточную мембрану, и физиологическая реак ция клетки зависит от системы внутриклеточной сигнализации. Вазопрессин не проникает в клетку, в плазматическую мембрану клетки встроены ре цепторы вазопрессина, обращенные с ее внешней стороны к внеклеточной жидкости. Состав этой жидкости постоянно обновляется, она образуется из крови и вскоре удаляется из ткани кровеносны ми или лимфатическими сосудами, чтобы поддер живалась необходимая концентрация АДГ. Во вне клеточную жидкость из крови диффундирует АДГ, взаимодействует с рецептором, встроенным в плаз матическую мембрану клетки, меняется конформа ция молекулы рецептора и дальнейшие события происходят уже с внутренней стороны плазматиче ской мембраны клетки. Эффект АДГ удалось вос произвести при добавлении цАМФ к клетке либо при угнетении активности фосфодиэстеразы цАМФ, что увеличивало время его жизни в клетке из-за замедления расщепления цАМФ [63].-рецептором образуется цАМФ и происходит встраивание аквапорина 2 в люминаль ную мембрану [12, 50, 52, 58], что увеличивает ее проницаемость для воды [56, 58] и начинается ее всасывание по осмотическому градиенту в кровь. В результате нормализуется концентрация раство ренных веществ в крови, восстанавливается осмо ляльность крови. В условиях патологии при неф ротоксическом действии цисплатина снижается содержание аквапоринов [49].
Чтобы избежать ошибки и «чужой» цАМФ из другой клетки или из крови не мог бы активировать процессы в данной клетке, плазматическая мем брана непроницаема для АТФ и цАМФ, последний оказывает действие внутри своей же клетки, инак тивируется в ней фосфодиэстеразой цАМФ. Удли нить время жизни цАМФ в клетке можно, если снизить активность фосфодиэстеразы цАМФ, к ингибиторам активности этого фермента относятся теофиллин, в меньшей степени кофеин.
Кроме цАМФ, имеются вторичные посредники иной химической природы, которые участвуют во внутриклеточной сигнализации при активации V.- рецепторов вазопрессином. В качестве вторичного посредника участвуют инозиттрифосфат, диацилг- лицерин, ионы Са [39]. Они в гранулярных клетках эпителия мочевого пузыря и в клетках почечных канальцев снижают эффект АДГ, связанный со стимуляцией транспорта ионов и воды [46].
Мысль о роли гиалуронидазы в механизме дей ствия вазопрессина и увеличении проницаемости для воды высказал А. Г. Гинецинский [32], острая дискуссия продолжалась многие годы, и до настоя щего времени вопрос о месте этого механизма в единой схеме действия АДГ остается дискуссион ным. В то же время до последних лет ведется поиск значения этого фермента в действии АДГ [30, 41, 42, 45].
Модуляция эффекта вазопрессина
Стимуляция вазопрессином Vj-рецепторов мем бран клеток почечных канальцев или мочевого пу зыря при его действии со стороны внеклеточной жидкости приводила к аккумуляции в клетке цАМФ и встраиванию в люминальную мембрану аквапорина 2 [52, 69]. При одновременном дейст вии на базальную плазматическую мембрану вазо прессина и антагонистов V.-рецепторов усиливает ся эффект вазопрессина, связанный с увеличением проницаемости для воды и реабсорбцией ионов в начальных частях дистального канальца [33]. Эти данные позволяют предположить, что в базальную плазматическую мембрану встроены V2— и V.-ре цепторы; первые в данном случае являются тригге рами (они стимулируют процесс), а вторые — мо дуляторами физиологического эффекта, они меня ют силу реакции, не давая возможности для чрез мерной реакции. Рецепторы вазопрессина имеются и на апикальной плазматической мембране, т. е. они обращены в сторону просвета канальца, и в сторону полости мочевого пузыря [И]. При дейст вии агониста на эти рецепторы меняется реакция клеток на одновременную стимуляцию V2-peuenTO- ров базолатеральных мембран клетки.
Аутакоиды и восстановление водонепроницаемости клеток после действия АДГ
Выше речь шла о неожиданном результате экс перимента на мочевом пузыре, который показал, что сбалансированная регуляция осмотического давления крови основана не только на секреции и инактивации АДГ, но и на локальной продукции физиологически активных веществ [9, 64]. В этих опытах впервые было установлено, что водонепро ницаемость клеток эпителия осморегулирующих органов зависит от эндогенной продукции в очень низких концентрациях аутакоидов, выявлены мо лекулярные механизмы функции этой системы [52, 64]. В опытах на изолированном мочевом пузыре лягушки, который участвует в осморегуляции у ам фибий наряду с почками [17], а клетки его эпите лия реагируют на АДГ так же, как и клетки эпите лия собирательных трубок почек млекопитающих, установлено сходство молекулярных механизмов реакции на АДГ у человека и бесхвостых амфибий [63]. Проницаемость для воды слизистой оболочки мочевого пузыря лягушки, как и клеток собира тельных трубок почки млекопитающих, может уве личиваться этим гормоном в 50 раз и более [64]. В опытах in vitro мочевой пузырь с введенным внутрь него гипотоническим физиологическим раствором помешали в раствор Рингера, со стороны серозной оболочки мочевого пузыря находился физиологи ческий раствор, внутри пузыря со стороны слизи стой оболочки — гипотонический раствор, что соз давало возможность для движения воды по осмо тическому градиенту при увеличении проницаемо сти клеток эпителия для воды. К раствору у сероз ной оболочки добавляли 10“»М аргинин-вазото- цин, проницаемость для воды возрастала в десятки раз. Через некоторое время этот физиологический раствор, содержащий АДГ, меняли на свежий рас твор Рингера без гормона. Возросшая проницае мость для воды медленно, в течение 15-20 мин снижалась. Возникло предположение о том, что за медленное снижение проницаемости даже в опы тах in vitro зависит от связывания части АДГ с ре цептором и надо более энергично отмыть остав шийся АДГ частыми сменами физиологического раствора. Эта процедура была выполнена, вначале проницаемость для воды стала снижаться, а затем увеличилась до значений, сопоставимых с действи ем АДГ [64]. Для объяснения этой парадоксальной ситуации возникло предположение о том, что, мо жет быть восстановление водонепроницаемости тоже является регулируемым процессом и клетки выделяют местно-действующее физиологически активное вещество, восстанавливающее водоне проницаемость эпителия. Было показано, что при отсутствии АДГ и удалении аутакоидов молекуляр ный механизм повышения проницаемости тот же — найдена корреляция между возрастанием прони цаемости и аккумуляцией в клетке цАМФ [64], в люминальной мембране клетки обнаружено обра зование агрегатов внутримембранных частиц [52], которые служат местом скопления встраивающих ся в мембрану аквапоринов.
Биохимическая идентификация веществ, сни жающих проницаемость для воды, показала, что клетки мочевого пузыря лягушки выделяют эйко заноиды, в частности простагландин Е2 [64]. Они были выявлены в жидкости, взятой после инкуба ции мочевых пузырей в физиологическом раство ре, а после добавления простагландинов Е2, E.F2aK раствору у серозной оболочки возросшая прони цаемость мочевого пузыря для воды снижалась до нормальных низких значений [13].
Обычно большое внимание уделяют механизму увеличения проницаемости для воды при добавле нии АДГ [3, 5, 6], но мало разработан вопрос о ре гуляции перехода от состояния высокой проницае мости канальцев для воды при ее реабсорбции к во донепроницаемости канальцевой стенки, когда обеспечивается выделение воды из организма. По лагают, что достаточно прекратить секрецию и уда лить из крови АДГ и сама собой восстановится во донепроницаемость канальцевой стенки. Имеются данные об эндоцитозе аквапоринов [26], но важно выяснить, какая система регулирует этот процесс. Это имеет и важное клиническое значение, так как при ряде патологических состояний увеличение ре абсорбции воды приводит к гипоосмии, гипонат риемии, лечение которых представляет собой не простую задачу при отсутствии клинически доступ ных акваретиков, антагонистов У2-рецепторов или иных способов угнетения эффекта АДГ.
Почка сформировалась в эволюции как поли- функциональный орган, подчиненный множест венному контролю экстраренальных факторов ре гуляции — нервных и эндокринных и системе ау торегуляции, в частности почечного кровотока, клубочковой фильтрации. В почке синтезируется и действует большое число физиологически актив ных веществ, которые контролируют ряд ее функ ций и меняют реакцию клеток канальцев на гор моны и медиаторы. В почке образуются и местно действуют продукты метаболизма арахидоновой кислоты [2, 10, 51], имеется и специфическое по отношению к мембранам клеток разных отделов нефрона распределение рецепторов этих физиоло гически активных веществ. Для простагландина Е2 выявлено несколько типов рецепторов, установле ны их локализация в почке [62] и особенности вто ричных посредников при активации разных типов рецепторов. Это предопределяет возможность как активации (или угнетения) тех или иных функций клеток данного типа, так и модуляции эффекта ва зопрессина и других гормонов, действующих на эти же клетки.
При отсутствии вазопрессина в крови почки вы деляют гипотоническую мочу. Наши данные пока зали, что поддержание низкой проницаемости, пе реход в состояние водонепроницаемости и сохра нение такого состояния оказались регулируемыми процессами, зависимыми от извне действующих на клетку веществ, заставляющих ее повиноваться приходящим к мембране клетки стимулам. Их осо бенность в том, что эти стимулы исходят отданной или соседней клетки, заставляют ее же подчинят- сья им и перестраивать свою работу. Оказалось, что увеличение осмотической проницаемости без АДГ связано с тем, что от мембран клетки удаляются синтезируемые ею простагландины [9, 74], а вос становление водонепроницаемости при удалении АДГ нуждается в присутствии простагландинов. В проведенных нами опытах с применением ингиби торов циклооксигеназы (вальторен, индометацин) и блокадой фосфолипазы А, с помощью кинакрина было показано, что уменьшение секреции простаг ландинов приостанавливает восстановление водо непроницаемости.
Синдром неадекватной секреции вазопрессина
Это состояние, зависящее от резкого увеличе ния в крови концентрации АДГ, сопровождается гипоосмией и наблюдается при ряде форм пато логии — заболеваниях центральной нервной сис темы (тромбоз сосудов мозга, острый психоз, травма, острая перемежающаяся порфирия, син дром острого идиопатического полиневрита, суб дуральная гематома, энцефалит, субарахноидаль ное кровотечение, менингит), болезнях органов грудной полости (пневмония, астма, туберкулез), опухолях и метастазах опухолей ряда органов (поджелудочная железа, желудок, мелкоклеточная карцинома легких и др.) (см. таблицу). Безуслов но, требуется коррекция гипоосмии и гипонат риемии [22, 25, 40].
Изменение концентрации вазопрессина в плазме крови при фи зиологических и патологических состояниях (изменено по [7])
Увеличение концентрации вазопрессина
Артериальная гипотензия
Беременность
Болевой синдром
Бронхогенная карцинома
Гестоз
Гиперосмия
Гиповолемия
Дегидратация
Застойная сердечная недос таточность
Лекарственная терапия (апо морфин, винкристин, нико тин, циклофосфамид) Менингит
Недостаточность глюкокор тикоидов
Нефрогенный несахарный диабет
Пневмония
Опухоль мозга (первичная, метастазы)
Опухоли APUD-системы
Острая перемежающаяся порфирия
Синдром избыточной секре ции АДГ
Синдром Жюльена-Барре Стресс
Тошнота
Туберкулез легких Туберкулезный менингит Энцефалит
Снижение концентрации вазопрессина
Гиперволемия
Г ипоосмия
Нефротический синдром
Потребление избытка воды Психогенная полидипсия
Центральный несахарный диабет
Причиной снижения осмоляльности крови яв ляется увеличенная реабсорбция воды в почке как следствие высокой концентрации в крови вазо прессина. Клинически важно дифференцировать этот синдром от состояний, сопровождающихся гипоосмией, таких как психогенная полидипсия, водная интоксикация, гипокортицизм. Дифферен циально-диагностический прием состоит в измере нии осмоляльности сыворотки крови: если она вы ше 295 мОсм/кг Н2О, то полиурия гипофизарного генеза, жажда у пациента обусловлена гиперосми- ей. Если осмоляльность плазмы кров.и ниже 280 мОсм/кг Н2О, можно думать о первичной поли дипсии, водной интоксикации, синдроме неадек ватной секреции вазопрессина. При этом синдроме осмоляльность мочи превысит осмоляльность кро ви, будет выделяться осмотически концентриро ванная моча из-за действия вазопрессина на почку, в то время как для первичной полидипсии харак терна полиурия с низкой осмоляльностью мочи из- за приема большого количества воды и вызванного этим снижения секреции вазопрессина.
Ночной энурез, хроническая почечная недостаточность (ХПН)
Естественно, возникал вопрос о клиническом значении результатов исследования взаимодейст вия вазопрессина и аутакоидов, выяснении воз можных нарушений функции этой системы у чело века, способах лечения таких состояний, если они будут найдены. Исследования были выполнены в педиатрической и нефрологической клиниках и охарактеризованы 2 формы патологии — в одном случае (ночное энурез) развитие заболевания свя зано с дефицитом АДГ или снижением его эффек та, в другом (ХПН) состояние почки столь измене но, что осмотическое концентрирование, а затем и осмотическое разведение мочи при действии АДГ оказываются неосуществимыми.
Одной из частых форм патологии у детей явля ется ночной энурез, которым страдает в некоторых странах от 15 до 28% детей. Согласно одной из ги потез, его механизм объеняют тем, что при ночном энурезе и некоторых иных формах патологии на блюдается инвертированный ритм секреции вазо прессина (у здоровых секреция АДГ возрастает но чью) [14, 28, 71] — ночью он не увеличивается, как в норме, а снижен, в результате чего наблюдается большой диурез, а из-за дефекта восприятия уве личенного поступления жидкости в мочевой пу зырь во время глубокого сна наблюдаются эксцес сы в виде ночного энуреза. Наряду с таким вари антом патогенеза существует и иной. Было показа но, что у этих детей снижена реабсорбция ионов в толстом восходящем отделе петли Генле, это обу словливает увеличение ночного мочеотделения [68]. Снижение всасывания ионов в клетках этих канальцев почки могло быть обусловлено недоста точной секрецией в кровь вазопрессина либо его неэффективным действием, если какие-то факто ры препятствуют реакции клетки на гормон, такую роль могла играть избыточная секреция аутакоидов у этих пациентов [67]. Установлено, что у 85% па циентов с ночным энурезом нормализацию транс порта воды и ионов в почке и благоприятное кли ническое действие оказывает десмопрессин; хоро ший результат у части детей наблюдался при их ле чении блокаторами циклооксигеназы и благодаря этому уменьшении секреции аутакоидов [68].
У части пациентов с ночным энурезом выявлен иной генез — ночная полиурия обусловлена сни жением реабсорбции ионов Na и Mg с сопровож дающими анионами, т. е. наблюдается не водный диурез, а салурез [63]. Выявлена высокодостовер ная корреляция между возрастанием экскреции ионов Na и Mg, что позволило предположить ло кализацию снижения реабсорбции этих ионов в клетках толстого восходящего отдела петли Генле, где действует АДГ и ему может противостоять про стагландин Е2. Известно, что реабсорбция ионов Na стимулируется в клетках этого канальца вазо прессином [37, 38], поэтому показано возмещение его дефицита. Оказалось, что возрастание салуреза сопровождается увеличением выделения с мочой простагландина Е2 [57]. Можно было предполо жить, что применение десмопрессина либо вольта- I рена (ингибитор простагландинсинтетазы) усилит реабсорбцию ионов Na, Mg и воды и окажет лечеб- i ное действие при ночном энурезе: десмопрессин > оказался эффективным у 85% пациентов, вольта- рен — у 35% [63]. Очевидно, патогенез заболевания полиморфен и выбор типа лекарственной терапии должен зависеть от характера нарушений системы регуляции у данного пациента [63, 78]. Нами была высказана мысль о существовании заболеваний, патогенез которых основан на избыточной локаль ной секреции аутакоидов, что и определяет клини ческую картину болезни; они были названы ауто- коидозами [8].
С другой стороны, были найдены заболевания, при которых АДГ неэффективен, а усиление сек реции аутакоидов играет компенсаторную роль и помогает дольше сохранять функциональную эф фективность почки. Примером служат конечные стадии ХПН: секреция в почке простагландина Е2 снижает реабсорбцию ионов в толстом восходящем отделе петли Генле [67] и способствует увеличению диуреза, выделению конечных продуктов обмена, позволяет дольше сохранить жизнь пациентов без подключения к искусственной почке. У пациентов с ХПН, у которых снижение скорости клубочковой фильтрации составляет 30 мл/мин и менее, имеется изостенурия и вазопрессин оказывается неэффек тивным в регуляции функции почки. Наши данные позволяют корректно объяснить известный клини цистам факт — пациентам с ХПН не показано при менение нестероидных противовоспалительных средств. Ясно, что их потребление привело бы к снижению секреции простагландинов, а потому к уменьшению диуреза и тем самым к нарастанию уремии.
Важное значение аутакоиды имеют в регуляции артериального давления (эндотелии, простаглан дин F2a, тромбоксан А2, простагландин 12, эндоте лий гиперполяризующий фактор и др.) наряду с эфферентными нервами, ангиотензином II, кате холаминами, вазопрессином. Выявление множест венности эндокринных факторов, которые участ вуют в регуляции функций почки, регуляции сосу дистого тонуса, выдвигает проблему взаимозависи мости эффекта вазопрессина и аутакоидов.
Заключение
Представленные данные существенны для об щей эндокринологии. Обычно рассматривают 2 уровня физиологических регуляций в организме человека — нервную и эндокринную регуляцию. В первом случае сигнал передается по эфферентным нервным волокнам к клеткам определенных орга нов и тканей, во втором — гормон попадает в кровь и одновременно разносится по всему организму. Факты, приведенные в обзоре на примере регуля ции водного обмена при участии вазопрессина, по казывают значение еще одного уровня системы ре гуляций, связанного с локальным выделением фи зиологически активных веществ клетками эффек торного органа в межклеточную жидкость, дейст вующих на ту же (аутокринно) или соседнюю (па- ракринно) клетку и противодействующих вазо прессину. Это обеспечивает баланс в системе регу ляции, восстановление водонепроницаемости эпи телия. Аутакоиды влияют на мембранные рецепто ры, стимулируют образование специфических вто ричных мессенджеров. Если ранее регуляцию вод ного обмена рассматривали только как функцию действия одного гормона — АДГ, то теперь стано вится очевидным, что функционирует пара ве ществ: вазопрессин — аутакоид, в частности про стагландин Е2. Тем самым в эндокринной регуля ции водного обмена тоже играет роль пара физио логически активных веществ — вазопрессин и ау такоид, а не 2 гормона, как во многих других слу чаях — инсулин/глюкагон, альдостерон/ предсерд ный натрийуретический фактор, паратгормон/ кальцитонин. Это пример еще одного типа регуля ций в сочетании с нервной и эндокринной систе мами. Обращает на себя внимание тот факт, что, подобно регуляции водного обмена, столь же важ ную роль в энергетическом обмене играет откры тый в середине 90-х годов лептин, образующийся в клетках белого жира и сигнализирующий о состоя нии жировых депо. Когда эти клетки заполнены жиром, секретируются лептины и тормозится центр аппетита. Появление в эволюции регуляции с образованием физиологически активных ве ществ, определяющих отношение организма к воде и еде, не в одном эндокринном органе, а в большом числе клеток эффекторных органов, вероятно, по вышало надежность системы. Аутакоиды наряду с вазопрессином имеют важное значение в регуля ции водно-солевого обмена не только у здоровых организмов, но и при патологии человека, а устра нение этих дефектов оказывает лечебное действие при фармакологической блокаде гиперпродукции аутакоидов.
1. Гончаревская О. А., Наточин Ю. В. // Докл. АН. — 1994. — Т. 337, № I. — С. 125-127.
2. Данн М. Дж. // Почечная эндокринология / Под ред. М. Дж. Данне. — М., 1987. — С. 11-111.
3. Дедов И. И., Мельниченко Г. А., Фадеев В. В. Эндокринология. — М., 2000.
4. Иванова Л. Н. // Физиология почки и водно-солевого обмена- СПб, 1993. — С. 46-50.
5. Кеттайл В. М., Арки Р. А. Патофизиология эндокринной системы: Пер. с англ. — М.; СПб, 2001.
6. Наточин Ю. В. // Физиология почки и водно-солевого обмена. — СПб.
7. Наточин Ю. В., Немцов В. И., Эмануэль В. Л. Биохимия крови и диагностика. — СПб, 1993.
8. Наточин Ю. В., Кузнецова А. А. // Тер. арх. — 1997. — № 12. — С. 67-72.
9. Наточин Ю. В. // Вести. РАН. — 2000. — Т. 70, № 1. — С. 21-35.
10. Перов Ю. Л. И Физиология почки и водно-солевого обмена. — СПб, 1993. — С. 494-552.
11. Пруцкова Н. П., Шахматова Е. И., Наточин Ю. В. // Рос. физиол. журн. — 2000. — Т. 86, № 1. С. 76-85.
12. Снигиревская Е. С., Комиссарчик Я. Ю. // Цитология. -1996- Т. 41, № 10. — С. 864-870.
13. Шахматова Е. И., Пруцкова Н. П., Наточин Ю. В. // Рос. физиол. журн. — 1997. — Т. 83, № 11 — 12. — С. 168-172.
14. Aikawa Т., Kasahara Т., Uchiyama М. Ц Scand. J. Urol. Ne phrol. — 1999. — Vol. 33. — Suppl. 202. — P. 47-49.
15. Ancellin N., Preisser L., Le-Maout S. et al. // Cell Signal. -1999- Vol. 11, N 10. — P. 743-751.
16. Balduini C. L., Noris P., Belletti S. et al. // Haematologica. -1999- Vol. 84, N 10. — P. 891-896.
17. Bentley P. J. Endocrines and Osmoregulation. A Comparative Account of the Regulation of Water and Salt in Vertebrates. — Berlin, 1971.
18. Bradford A. D., Terris J. M., Ecelbarger C. A. et al. // Am. J. Physiol. — 2001. — Vol. 281, N 1. — P. F133-F143.
19. Breyer M., Jacobson H., Hebert R. // Kidney Int. — 1990. — Vol. 38. — P. 618-624.
20. Barnier M., Pricker A. F, Hayoz D. et al. // Eur. J. Clin. Phar macol. — 1999. — Vol. 55, N 9. — P. 633-637.
21. Chan Seem С. P., Dossetor J. F, Penney M. D. // Ann. Clin. Biochem. — 1999. — Vol. 36, N 6. — P. 779-782.
22. Cherney D. Z., Zevallos G., Oreopouios D., Halperin M. L. // Perit. Dial. Int. — 2001. — Vol. 21, N 1. — P. 7-13.
23. Collins H. L., Rodenbaugh D. Ж, DiCarlo S. E. // Am. J. Physiol. — 2001. — Vol. 281, N 2. — P. R375-R380.
24. Correia A. G., Denton К. M., Evans R. G. // J. Hypertens. — 2001. — Vol. 19, N 3, Pt 2. — P. 649-657.
25. Decaux G. // J. Lab. Clin. Med. — 2001. — Vol. 138, N 1. — P. 18-21.
26. Dibas A., Mia A., Yorio T. // Proc. Soc. Exp. Biol. Med. -1999- Vol. 223, N 2. — P. 203-209.
27. Djelidi S„ Fay M., Gluzeaud F. et al. // FEBS Lett. — 1999. — Vol. 460, N 3. — P. 533-538.
28. Djurhuus J. C„ Rittig S. // Eur. Urol. — 1998. — Vol. 33. — Suppl. 3. — P. 30-33.
29. Fernandez N., Martinez M. A., Garcia Villaion A. L. et al. // Br. J. Pharmacol. — 2001. — Voi. 132, N 8. — P. 1837-1844.
30. Flamion B., Lacremans J., Mertens-Strijthagen J. // J. Am. Soc. Nephrol. — 1997. — Vol. 8. — P. 7A.
31. Fujisawa S., Iijima T. // Jpn. J. Pharmacol. — 1999. — Vol. 81, N 3. — P. 309-312.
32. Ginetzinsky A. G. // Nature. — 1958. — Vol. 182. — P. 1218- 1219.
33. Goncharevskaya O. A., Shakhmatova E. I., Natochin Yu. V. // Eur. J. Physiol. — 1995. — Vol. 430. — P. 1004-1011.
34. Gondim E. L., Liu J. H., Costa V. P., Weinreb R. N. // Curr. Eye Res. — 2001. — Vol. 22, N 4. — P. 295-303.
35. Goodson J. L., Bass A. H. // Nature. — 2000. — Vol. 403, N 6771. — P. 769-772.
36. Goodson J. L., Bass A. H. // Brain Res. Rev. — 2001. — Vol. 35, N 3. — P. 246-265.
37. Greger R. // Comprehensive Human Physiology / Eds R. Greger, U. Windhorst. — Berlin; Heidelberg, 1996. — Vol. 2. — P. 1517-1544.
38. Greger R. // Am. J. Med. Sci. — 2000. — Vol. 319, N 1. — P. 5162. Greger R. // Z. Kardiol. — 2000. — Bd 89. — Suppl. 2. — S. 4-8.
39. Gross P. // Semin. Nephrol. — 2001. — Vol. 21, N 3. — P. 269-272.
40. Hansell P., Marie C., Alcorn D. et al. // Acta Physiol. Scand.-1999. — Vol. 165. — P. 115-116.
41. Hansell P., Goransson V., Odlind C. et al. // Kidney Int. -1999- Vol. 58. — P. 2061-2068.
42. Hirano T., Yamamura Y., Nakamura S. et al. // J. Pharmacol. Exp. Ther. — 2000. — Vol. 292, N I. — P. 288-294.
43. Hoyle С. H. // Brain Res. — 1999. — Vol. 848, N 1-2. — P. 1-25.
44. Ivanova L. N., Melidi N. N. // Eur. J. Physiol. — 2001. — Vol. 443, N 1. — P. 72-77.
45. Jackson E. K. // The Pharmacological Basis of Therapeutics / Eds J. G. Hardman et al. — New York, 1996. — P. 715-731.
46. Juhn S. K, Li W„ Kim J. Y. et al. // Am. J. Otol. — 1999. — Vol. 20, N 6. — P. 800-806.
47. Kikuchi S., Tanoue A., Goda N. et al. // Jpn. J. Pharmacol. — 1999. — Vol. 81, N 4. — P. 388-392.
48. Kim S. Ж, Lee J. U„ Nah M. Y. et al. // J. Am. Soc. Nephrol.2001. — Vol. 12, N 5. — P. 875-882.
49. Klussmann E., Татта G., Lorenz D. et al. // J. Biol. Chem. -1999- Vol. 276, N 23. — P. 20451-20457.
50. Kohjimoto J., Honeman T. Ж, Johanssen J. et al. // Kidney Int. — 2000. — Vol. 58, N 2. — P. 638-646.
51. Komissarchik Y. Y., Snigirevskaya E. S., Shakhmatova E. I., Natochin Y. V. // Tissue Res. — 1998. — Vol. 293. — P. 517- 525.
52. Koukoulas L, Webb G. C., Bottema C. D. et al. // Gene. — 1999. — Vol. 240, N 1. — P. 183-192.
53. Kovach L., Lichardus B. Vasopressin: Disturbed Secretion and its Effects. — Dordrecht, 1989.
54. Kuramochi G., Kobayashi I. // Am. J. Nephrol. — 2000. — Vol. 20, N 1. — P. 42-47. ‘Kuwahara M., Shinbo I., Sato K. et al. // Biochemistry. — 1999. — Vol. 38, N 49. — P. 16340-16346.
55. Kuznetsova A. A., Shakhmatova E., Prutskova N. P., Na tochin Y. V. 11 Scand. J. Urol. Nephrol. — 2000. — Vol. 34, N 1. — P. 27-31.
56. Kwon T. H., Hager H., Nejsum L. N. et al. // Semin. Nephrol.2001. — Vol. 21, N 3. — P. 231-238.
57. Laski M. E., Pressley T. A. // Ibid. — 1999. — Vol. 19, N 6. — P. 533-550.
58. Leach Huntoon C. S., Grigoriev A. I., Natochin Yu. V. Fluid and Electrolyte Regulation in Spacewflight. — San Diego, 1998.
59. Loichot C., Krieger J. P., De Jong W. et al. // Naunyn- Schmiedeber’s Arch. Pharmacol. — 2001. — Vol. 363, N 4. — P. 369-375.
60. Morath R., Klein T., Seyberth H. W., Nusing R. M. // J. Am. Soc. Nephrol. — 1999. — Vol. 10, N 9. — P. 1851-1860.
61. Natochin Yu. И // Sov. Sci. Rev. F. Physiol. Gen. Biol. Har wood Acad. Publ. — 1994. — Vol. 7. — P. 85-147.
62. Natochin Y. V., Parnova R. G., Shakhmatova E. 1. et al. // Eur. J. Physiol. — 1996. — Vol. 433. — P. 136-145.
63. Natochin Yu. K, Chernigovskaya T. V. // Comp. Biochem. Physiol. — 1997. — Vol. 118A. — P. 63-79.
64. Natochin Yu. V., Shakhmatova E. I., Komissarchik Ya. Yu. et al. // Ibid. — 1998. — Vol. 121A. — P. 59-66.
65. Natochin Yu. И, Bogolepova A. E., Kuznetsova A. A., Shakhma tova E. I. // Scand. J. Urol. Nephrol. — 2000. — Vol. 34. — P. 327-330.
66. Natochin Y. V., Kuznetsova A. A. // Pediatr. Nephrol. — 2000.Vol. 14, N 1. — P. 42-47.
67. Nielsen S., Chou C., Marples D. et al. // Proc. Natl. Acad. Sci. USA. — 1995. — Vol. 92. — P. 1013-1017.
68. North W. G., Fay M. J., Du J. // Peptides. — 1999. — Vol. 20, N 7. — P. 837-842.
69. Ozawa T., Tanaka H., Nakano R. et al. // J. Neurol. Neurosurg. Psychiatry. — 1999. — Vol. 67, N 4. — P. 542-545.
70. Palm C., Gross P. // Nephrol. Dial. Transplant. — 1999. — Vol. 14, N 11. — P. 2559-2562.
71. Parker K. J., Lee T. M. // Horm. Behav. — 2001. — Vol. 39, N 4. — P. 285-294.
72. Parnova R. G., Shakhmatova E. I., Plesneva S. A. et al. // Bio chim. Biophys. Acta. — 1997. — Vol. 1356. — P. 160-170.
неклассические эффекты и роль в патогенезе ассоциированных с возрастом заболеваний uMEDp
Согласно общепринятому мнению, вазопрессин (или антидиуретический гормон – АДГ) оказывает два важнейших классических физиологических эффекта – антидиуретический и вазопрессорный. Однако рецепторы к вазопрессину экспрессируются во многих органах и системах человеческого организма. Это означает, что физиологические эффекты данного гормона намного шире, чем можно предположить. В статье рассматриваются малоизвестные неклассические эффекты АДГ, свидетельствующие о его роли в регуляции гипоталамо-гипофизарно-адреналовой системы, костного метаболизма, углеводного и липидного обменов, системы гемостаза, эндотелиальной функции, механизмов стресса, хронического воспаления, инфекции и клеточной пролиферации. Кроме того, проанализированы недостаточно изученные на сегодняшний день физиологические эффекты АДГ, связанные с регуляцией болевой рецепции, когнитивной функции, социального поведения и участием в механизмах клеточного и системного старения.
Таблица 1. Локализация рецепторов к вазопрессину в организме человека
Рисунок. Неклассические физиологические эффекты вазопрессина
Таблица 2. Локализация рецепторов к вазопрессину, которые влияют на уровень глюкозы в крови
Введение
Вазопрессин (аргинин-вазопрессин, антидиуретический гормон – АДГ, аргипрессин) представляет собой пептидный гормон с очень коротким периодом полураспада – 16–24 минуты [1]. Он синтезируется в нейронах супраоптического и паравентрикулярного ядра гипоталамуса в виде предшественника – препроАДГ, который сначала там же трансформируется в проАДГ, а затем в составе нейросекреторных гранул по аксонам нейронов гипоталамуса поступает в нейрогипофиз. Во время транспортировки происходит так называемый процессинг: проАДГ расщепляется на зрелый АДГ (нонапептид молекулярной массой 1100 Да) и белок нейрофизин. Выброс АДГ и нейрофизина в кровь происходит путем экзоцитоза и опосредуется зависимыми от кальция механизмами. В крови и тканевой жидкости АДГ легко проникает сквозь стенки капилляров почечных клубочков.
Согласно общепринятому мнению, вазопрессин оказывает два важнейших физиологических эффекта – антидиуретический и вазопрессорный. Первый связан с удержанием воды в организме за счет увеличения ее реабсорбции в дистальных канальцах и собирательных трубочках нефронов почек, второй – с повышением периферического сосудистого сопротивления на фоне увеличения объема циркулирующей крови вследствие задержки жидкости в организме. При этом в физиологических условиях вазопрессорный эффект АДГ не превалирует, поскольку при увеличении секреции АДГ артериальное давление повышается не более чем на 5–10 мм рт. ст. [2].
Все эффекты вазопрессин оказывает через рецепторы V1 и V2. Вазопрессиновые рецепторы являются классическими мембранными рецепторами, связанными с гетеротримерными G-белками.
V1A- и V1B-рецепторы связаны с Gq-белками и стимулируют фосфолипазно-кальциевый механизм передачи гормонального сигнала. V1A(V1R)-рецепторы локализованы в гладких мышцах сосудов и в печени, а также в центральной нервной системе. V1B(V3)-рецепторы экспрессируются в передней доле гипофиза (аденогипофизе) и головном мозге, где вазопрессин выступает нейромедиатором.
V2-рецепторы связаны с Gs-белками и стимулируют аденилатциклазный механизм передачи гормонального сигнала, локализованы преимущественно в почках и служат мишенью для многих лекарственных средств, направленных на борьбу с несахарным диабетом [3].
Рецепторы к вазопрессину экспрессируются во многих клетках и тканях организма человека (табл. 1) [4].
Совершенно очевидно, что при таком распределении рецепторного аппарата вазопрессин характеризуется не только двумя указанными классическими эффектами. Кроме регуляции диуреза, объема циркулирующей крови и тонуса сосудистой стенки АДГ обладает и другими не менее важными неклассическими физиологическими эффектами (рисунок) [4–7].
Гипоталамо-гипофизарно-адреналовая система
Гипоталамо-гипофизарно-адреналовая система играет крайне важную роль в управлении гомеостазом организма в период стресса. Она реагирует на стресс резким увеличением секреции адренокортикотропного гормона (АКТГ), что в свою очередь приводит к выбросу из коркового вещества надпочечников в кровь огромного количества кортикостероидов, участвующих в обменных процессах.
Дисфункция гипоталамо-гипофизарно-адреналовой системы способствует развитию постоянного субклинического системного воспаления из-за длительного дефицита кортикостероидов при хроническом стрессе [4]. На секрецию АКТГ в основном влияет кортикотропин-рилизинг-гормон (КТРГ). Но и вазопрессин имеет значение для секреции АКТГ в стрессовой ситуации, поскольку непосредственно воздействует на V1В-рецепторы гипофиза и синергично усиливает эффекты гипоталамического КТРГ.
В экспериментах показано, что внутрибрюшинное или пероральное введение антагониста V1В-рецепторов к вазопрессину предотвращает рост уровня АКТГ в ответ на вводимый вазопрессин [8]. Кроме того, у мышей, лишенных V1В-рецепторов к вазопрессину, уровень АКТГ не повышался после введения вазопрессина. Предотвратить рост АКТГ у мышей можно было также введением антагонистов V1В-рецепторов к вазопрессину. Экспериментальные данные свидетельствуют о том, что КТРГ не может компенсировать блокаду V1В-рецепторов к вазопрессину. Вазопрессин повышает секрецию АКТГ в ответ на острый стресс и не играет существенной роли в регуляции уровней АКТГ и кортикостероидов в отсутствие стресса [8]. Это подтверждают эксперименты на крысах линии Brattleboro
с врожденным отсутствием вазопрессина, у которых базальный уровень АКТГ и кортикостероидов не отличался от таковых у животных контрольной группы [8]. Однако при остром стрессе индуцированный уровень АКТГ у крыс линии Brattleboro
оказался значительно ниже, чем у здоровых особей контрольной группы (результаты достоверны). В то же время при хроническом (длительном или повторном) стрессовом воздействии уровень АКТГ у крыс контрольной группы повышался в большей степени за счет вазопрессина, чем за счет КТРГ. Поэтому крысы, лишенные вазопрессина, были менее устойчивы как к острому, так и к хроническому стрессу [8].
Наряду с эффектом синергизма в отношении АКТГ вазопрессин продемонстрировал эффект регуляции секреции гормонов надпочечников за счет воздействия на V1А- и V1В-рецепторы (V1А-рецепторы расположены в коре надпочечников, V1В-рецепторы – в хромаффинных клетках мозгового вещества надпочечников). Существует предположение, что вазопрессин продуцируется и секретируется в хромаффинных клетках мозгового вещества надпочечников в ответ на воздействие ацетилхолина и стресс [9]. Вазопрессин действует на V1В-рецепторы хромаффинных клеток, секретирующих также адреналин и норадреналин в ответ на острый и хронический стресс (ауто- и паракринные механизмы). Значение V1В-рецепторов к вазопрессину в надпочечниках показано в эксперименте на мышах, лишенных V1В-рецепторов. Базальные уровни эпинефрина и норэпинефрина были одинаковыми у V1В-дефицитных мышей и здоровых особей контрольной группы. Тем не менее в условиях острого и хронического стресса уровни эпинефрина и норэпинефрина были значительно меньше у нокаутированных по V1В-рецепторам мышей [9].
Кроме того, вазопрессин воздействует на V1А-рецепторы коры надпочечников и стимулирует гипертрофию и гиперплазию клеток преимущественно клубочковой зоны. Как следствие – увеличиваются синтез и секреция альдостерона и кортикостероидов. Данный эффект вазопрессина может быть заблокирован на фоне применения антагонистов V1А-рецепторов к вазопрессину или выявлен у мышей, лишенных V1А-рецепторов. Крысы линии Brattleboro с врожденным дефицитом или полным отсутствием вазопрессина демонстрируют уменьшение секреции альдостерона [10].
Высказываются предположения о роли вазопрессина в патофизиологии синдрома Иценко – Кушинга. Этот синдром может развиться вследствие АКТГ-независимой опухоли или гиперплазии надпочечников. Показано, что в этих опухолевых клетках либо заметно выражена экспрессия V1А-рецепторов к вазопрессину, либо имеют место мутации V1А-рецепторов, что способствует увеличению чувствительности к вазопрессину и повышению секреции кортикостероидов [11].
Таким образом, вазопрессин не только регулирует функции гипоталамо-гипофизарно-адреналовой системы, но и характеризуется периферическими эффектами в отношении секреции гормонов надпочечников по механизмам ауто- и паракринных влияний.
Система гемостаза
Как известно, десмопрессин – синтетический аналог вазопрессина – первоначально использовали в лечении несахарного диабета. Позднее было показано, что десмопрессин можно применять при болезни Виллебранда и умеренной гемофилии, а также при операциях c большой потерей крови для уменьшения гемотрансфузий. Десмопрессин также используют при кровотечениях, вызванных тромбоцитопатией на фоне терапии аспирином, тиклопидином, при уремии и хронических заболеваниях печени [4]. Десмопрессин оказывает кровоостанавливающее действие за счет увеличения в сыворотке крови уровней фактора фон Виллебранда, фактора свертывания крови VIII и активатора тканевого плазминогена, которые синтезируются в эндотелиоцитах и хранятся в них в особых секреторных гранулах – тельцах Вейбеля – Паладе [12]. Эти особые цитоплазматические включения в эндотелиальных клетках были обнаружены в 1964 г. и названы по именам открывших их ученых – швейцарского анатома Эвальда Вейбеля и румынского физиолога Джорджа Эмиля Паладе (в 1974 г. стал лауреатом Нобелевской премии по физиологии за открытие секреторного клеточного пути). Тельца Вейбеля – Паладе служат для хранения синтезированных клеткой белков, которые могут быть быстро секретированы из клетки при ее активации (кроме указанных факторов свертывающей системы крови в них содержится мембранный белок Р-селектин, относящийся к белкам клеточной адгезии и служащий лигандом для секвестрации лейкоцитов на участке повреждения). Фактор фон Виллебранда оказывает кровоостанавливающее действие, связывая тромбоциты и, будучи белком-носителем для фактора свертывания крови VIII, восстанавливает его почечный клиренс и ферментативное расщепление.
Десмопрессин действует на эндотелиальные клетки и стимулирует не только синтез, но и активное высвобождение тканевого активатора плазминогена, фактора фон Виллебранда и фактора свертывания крови VIII из телец Вейбеля – Паладе. В результате в сыворотке крови резко повышается уровень указанных факторов гемостаза. При этом в клинической практике данный эффект развивается медленнее и выражен слабее, если вместо парентеральных форм десмопрессина используются интраназальные. Поэтому в чрезвычайной ситуации именно парентеральное введение десмопрессина может оказаться предпочтительным для управления системой гемостаза [13].
Десмопрессин воздействует на факторы свертывания крови также через активацию циклического аденозинмонофосфата (цАМФ) в экстраренальных V2-рецепторах, широко представленных в эндотелиальных клетках [14].
Инфекция
Верхние и нижние мочевые пути считаются стерильной средой. Их инфицирование связано с ретроградным восхождением основного уропатогена – кишечной палочки из мочевого пузыря. Выраженный аффинитет уропатогенной кишечной палочки к эпителию мочевого пузыря и канальцев почек обусловлен факторами адгезии и инвазии. Для грамотрицательных бактерий, к которым относится кишечная палочка, неотъемлемым структурным компонентом цитоплазматической мембраны являются липополисахариды, активно участвующие в иммунных реакциях. В клетках органов и систем человека экспрессируются Toll-like-рецепторы (Toll-like receptor – TLR), получившие свое название благодаря сходству с белком, кодируемым открытым в 1985 г. геном Toll у дрозофилы [4]. TLR – класс клеточных рецепторов с одним трансмембранным фрагментом, распознающих консервативные структуры микроорганизмов и активирующих клеточный иммунный ответ. Именно этим объясняется их ключевая роль во врожденном иммунитете. У человека описано десять типов TLR. TLR 4-го типа (TLR4) связывается с основной консервативной структурой клеточной стенки грамотрицательных бактерий – липополисахаридами и запускает каскад ферментных реакций. В результате активизируется ядерный фактор каппа B (nuclear factor kappa B, NF-kappa B), способствующий синтезу провоспалительных цитокинов [4]. Цитокиновый каскад активирует клетки иммунной системы и развивается воспалительная реакция, приводящая к деструктивным процессам в бактериальной клетке. Таким образом, TLR служат механизмом активации врожденного иммунитета, повышающим эффективность иммунной защиты и предотвращающим, в частности пиелонефрит [15].
Десмопрессин ингибирует липополисахарид-индуцированную активацию NF-kappa B, препятствуя высвобождению провоспалительных цитокинов и снижая выраженность воспаления. Антагонисты V2-рецепторов к вазопрессину нивелируют его эффекты на воспаление, вызывая повышенную секрецию провоспалительных медиаторов и нейтрофилов. Не исключено, что вазопрессин участвует в модификации воспалительных реакций, существенно влияет на врожденный иммунитет и подавляет воспаление ткани почек.
Эксперименты показали, что у крыс, лишенных воды, значительно повышается риск пиелонефрита, а достаточный диурез способен ускорить выздоровление при Enterococcus-индуцированном пиелонефрите [16].
Пожилые пациенты склонны к обезвоживанию. Это может быть одной из причин высокой частоты развития у них пиелонефрита. Гипергидратация снижает уровень вазопрессина, что может усилить врожденный иммунитет при пиелонефрите.
Таким образом, гормональный контроль врожденного иммунитета со стороны, в частности, вазопрессина, способен в определенной степени объяснить различную предрасположенность к пиелонефриту [16].
Боль
Вазопрессин оказывает существенное влияние на восприятие боли посредством V1А- и V1В-рецепторов, расположенных в нейрональных клетках гипоталамуса, гиппокампа, миндалины и других структурах мозга [4, 17]. Исследования показали, что вазопрессин способен повышать болевой порог чувствительности, поскольку в ответ на стрессовое воздействие или боль центральный (гипоталамический) и периферический (плазменный и тканевой) уровни вазопрессина повышаются [17]. Однако считается, что обезболивающее действие вазопрессина не опосредовано периферическим вазопрессином, так как гематоэнцефалический барьер препятствует его обратному поступлению в головной мозг.
Например, в экспериментах показано, что инъекция вазопрессина не уменьшает болевой порог при болевых воздействиях на крыс, но на фоне применения вазопрессина удается изменить восприятие боли [17]. При введении вазопрессина непосредственно в желудочки мозга в экспериментальных работах на лабораторных животных болевой порог существенно повышался [17].
В эксперименте у крыс линии Brattleboro с врожденным дефицитом вазопрессина имела место выраженная реакция даже на незначительные болевые воздействия. Но после интравентрикулярного введения вазопрессина болевой порог значительно возрастал, что свидетельствовало о вазопрессин-зависимом обезболивающем эффекте. Кроме того, внутримозговые анальгетические эффекты вазопрессина блокировались после интравентрикулярного введения антисыворотки к вазопрессину [18].
D.K. Ahn и соавт. (2001) в экспериментальных работах продемонстрировали, что анальгетические эффекты вазопрессина могут блокироваться антагонистами V1А-рецепторов, но не антагонистами V2-рецепторов к вазопрессину. Это навело авторов на мысль, что вазопрессин оказывает обезболивающее действие исключительно за счет V1А-рецепторов [19].
L.R. Watkins и соавт. (1986) показали, что не только внутримозговые, но и подоболочечные инъекции вазопрессина дают антиноцицептивный эффект, который, возможно, распространяется и на спинной мозг [20].
При острых головных болях интраназальное введение вазопрессина оказывалось эффективным. У пациентов снижалась степень выраженности боли. Это скорее всего подтверждает существование пути, соединяющего обонятельный нейроэпителий и головной мозг и позволяющего вазопрессину миновать гематоэнцефалический барьер [21].
Костный метаболизм
Гипофизарные гормоны, включая вазопрессин, воздействуют на костный метаболизм. Прямое влияние оказывают вазопрессин и окситоцин, косвенное (опосредованное) – тироксин, половые гормоны и гормоны надпочечников, синтез которых контролируется соответствующими гипофизарными тропными гормонами. Окситоцин влияет на активность остеобластов, а мутации гена рецептора окситоцина могут сопровождаться значительной остеопенией. Вазопрессин является ключевым регулятором костной ткани, контролируя активность как остеобластов, так и остеокластов посредством V1А- и V2-рецепторов, обильно представленных в обеих группах остеоцитов. Модулируя активность внутриклеточных ферментов киназ, вазопрессин способен стимулировать остеокласты, отвечающие за резорбцию кости и развитие остеопороза. В то же время антагонисты V1А- и V2-рецепторов к вазопрессину повышают активность остеобластов и способствуют новому синтезу костной ткани, блокируя активность остеокластов, механизмы которой пока не вполне понятны [22].
Кроме того, примерно 50% хронических синдромов гипонатриемии – следствие синдрома Пархона, связанного с неадекватной, обычно избыточной, секрецией вазопрессина. Как известно, около 30% натрия в организме хранится в костной ткани. То есть при хронической гипонатриемии вследствие синдрома Пархона могут наблюдаться ускоренная резорбция костной ткани остеокластами и избыточное выделение натрия из остеоцитов [23].
J. Barsony и соавт. (2011) показали, что гипонатриемия напрямую стимулирует остеокластогенез и остеокластную резорбцию костей у молодых крыс за счет непосредственной активации клеток-предшественников остеокластов [24]. Подобный эффект не обусловлен гипоосмолярностью плазмы, но всегда развивается на фоне гипонатриемии. Авторы также установили, что на фоне гипоосмолярности увеличивается концентрация внутриклеточного кальция, что приводит к апоптозу остеокластов. Таким образом, гипонатриемия ответственна за повышенный остеокластогенез и повышенную активность остеокластов. Увеличение остеокластогенеза можно выявить даже при легкой степени гипонатриемии [24].
Существует также предположение, что гипонатриемия повышает пролиферацию остеокластов за счет индукции окислительного стресса. Витамин С (аскорбиновая кислота) считается мощным антиоксидантом. Поступление витамина С в клетку является натрий-зависимым процессом и опосредуется натрий-зависимым транспортером аскорбиновой кислоты. Этот транспортер модулируется внеклеточным натрием, и даже незначительное снижение уровня внеклеточного натрия вызывает заметное снижение поглощения клеткой меченого витамина С. В результате уменьшения внутриклеточной концентрации витамина С содержание свободных радикалов кислорода в клетке увеличивается, а степень выраженности окислительного стресса становится прямо пропорциональной уровню гипонатриемии. При этом в остеоцитах обнаруживаются признаки окислительных повреждений ДНК [24].
В ряде исследований установлена связь между выполнением упражнений на выносливость и развитием остеопении [25]. В частности, спортсмены, которые употребляют большое количество гипотонической жидкости во время и после тренировок, склонны к гипонатриемии. Ее развитию способствует постоянная секреция вазопрессина. Костная ткань предположительно служит природным буфером для существенных изменений концентрации натрия в плазме. Результаты исследования показали, что у выносливых спортсменов как до, так и после тренировки уровни натрия в плазме были в пределах нормы. Правда, после тренировки абсолютный уровень натрия был ниже, чем до тренировки. Изменение уровня натрия до и после тренировки напрямую связано с изменением минерального состава кости. На основании полученных результатов был сделан вывод, что вазопрессин может быть связан с остеопенией непосредственно через воздействие на остеокласты и косвенно через развитие гипонатриемии, что способствует выведению натрия из остеоцитов [25].
У пациентов с хронической гипонатриемией имеет место повышенная заболеваемость остеопорозом. Кроме того, установлена связь гипонатриемии с падениями и переломами у пожилых пациентов. Так, у 9,1% пациентов, наблюдаемых в клинике экстренной медицинской помощи, отмечались гипонатриемические переломы костей [26].
Метаболический синдром
Метаболический синдром – комплекс гормонально-метаболических нарушений, определяемый наличием тесно связанных компонентов, таких как ожирение, инсулинорезистентность, артериальная гипертензия, провоспалительные и протромботические факторы, дислипидемия (прежде всего повышение уровня триглицеридов и липопротеинов, содержащих аполипопротеин B, и снижение уровня липопротеинов высокой плотности, неалкогольная жировая болезнь печени, синдром апноэ сна. Метаболический синдром достоверно повышает риск сахарного диабета и сердечно-сосудистых заболеваний. Традиционные факторы риска метаболического синдрома хорошо известны. Тем не менее дискуссия, это точно определенный синдром или маркер многочисленных факторов риска сахарного диабета и ишемической болезни сердца, продолжается до сих пор. Биомаркерами метаболического синдрома являются инсулинорезистентность, лептин, изменения обмена эпинефрина и норэпинефрина, повышение уровня липопротеинов низкой плотности, мочевой кислоты, C-реактивного белка, ингибитора 1 активатора плазминогена и альдостерона [27].
Бытует мнение, что генетические, экологические и гормональные факторы, психологический стресс, нарушение регуляции гипоталамо-гипофизарной системы, дисфункция вегетативной нервной системы занимают далеко не последнее место в патогенезе метаболического синдрома [28].
Физиологические эффекты вазопрессина – вазоконстрикция, агрегация тромбоцитов, стимуляция гликогенолиза в печени, воздействие на липиды, регулирование секреции АКТГ в гипофизе и метаболизма инсулина и глюкагона – не исключают возможность его участия в развитии метаболического синдрома [27, 28].
Психологический стресс может быть этиологическим фактором метаболического синдрома. Как правило, КТРГ и вазопрессин, влияя на гипофиз, активируют секрецию АКТГ. Эффекты вазопрессина на секрецию АКТГ опосредованы V1В-рецепторами. В свою очередь повышение плазменного уровня АКТГ сопряжено с увеличением стимуляции коры надпочечников и повышением уровня кортизола в сыворотке крови, что приводит к ожирению, инсулинорезистентности и гипергликемии. АКТГ, стимулированный выбросом вазопрессина, не реагирует по механизмам отрицательной обратной связи на уровень плазменного кортизола в отличие от секреции АКТГ, индуцированной КТРГ. Кроме того, вазопрессин способен непосредственно участвовать в синтезе и секреции кортизола за счет V1А-рецепторов коры надпочечников [29].
Сложно точно измерить плазменный уровень вазопрессина из-за короткого периода полураспада (24 минуты), быстрого выведения из плазмы, а также адгезии к тромбоцитам. Копептин является суррогатным маркером вазопрессина, и его уровень коррелирует с уровнем вазопрессина в плазме крови. Измерить плазменный уровень копептина легко, поскольку его молекула достаточно стабильна, имеет длительный период полувыведения и не прикрепляется к тромбоцитам.
U. Saleem и соавт. (2009) отметили повышенный уровень копептина у пациентов с метаболическим синдромом [27]. Пациенты с самым высоким уровнем копептина (третий или четвертый квартиль плазменных референсных значений) в 70–100% имели шансы приобрести метаболический синдром по сравнению с теми, у кого уровень копептина находился в нижнем квартиле референсных значений. С увеличением числа компонентов метаболического синдрома плазменный уровень копептина неуклонно возрастал. Более высокий плазменный уровень копептина также продемонстрировал наличие достоверной положительной связи с более высоким уровнем триглицеридов и более низким уровнем липопротеинов высокой плотности и наличие достоверной отрицательной связи со степенью физической активности [27].
В исследовании, проведенном в Швеции в 1991–1994 гг., участвовали 2064 пациента. Период наблюдения составил 15,8 года [29]. По мнению авторов, уровень копептина в начале исследования служил важным прогностическим фактором в отношении риска развития абдоминального ожирения и сахарного диабета 2 типа – в течение всего периода наблюдения [29]. Исходный уровень копептина также позволил спрогнозировать риск развития сахарного диабета у пациентов без исходных нарушений метаболизма глюкозы. Таким образом, тест с копептином может быть использован в качестве теста-скрининга для выявления лиц с высокой степенью риска сахарного диабета, даже если у них исходно имелась нормогликемия. Выявлено также, что связь между базальным уровнем копептина и риском сахарного диабета не зависела от степени ожирения. Уровень копептина исходно был связан с выраженностью микроальбуминурии при долгосрочном наблюдении, что зависело от исходных компонентов метаболического синдрома. В эксперименте у крыс хроническая инфузия десмопрессина приводила к увеличению протеинурии, а блокада эффектов вазопрессина снижала степень выраженности протеинурии и улучшала функцию почек [29].
Сахарный диабет
Рецепторы к вазопрессину представлены в поджелудочной железе и печени: V1А-рецепторы обнаружены в гепатоцитах, а V1В-рецепторы – как в альфа-, так и бета-клетках островков Ларгенганса поджелудочной железы. В печени вазопрессин усиливает гликолиз, что сопровождается повышением уровня глюкозы крови (глюкагоноподобный эффект). Данный эффект вазопрессина можно наблюдать, даже если рецепторы к глюкагону заблокированы (хотя рецепторы к глюкагону и вазопрессину в печени разные).
Инфузия вазопрессина вызывает достоверное и существенное повышение плазменного уровня глюкозы у лиц с нормогликемией, что доказано в клинико-экспериментальных исследованиях.
В эксперименте у мышей, нокаутированных по генам V1А- и V1В-рецепторов, нарушался метаболизм глюкозы и повышался катаболизм жирных кислот, что могло свидетельствовать о роли вазопрессина при метаболических заболеваниях [8].
У пациентов с мутацией гена AVPR1A, кодирующего экспрессию V1А-рецептора к вазопрессину, частота гипергликемии натощак в частности и сахарного диабета в целом выше, чем у лиц, не имеющих мутации указанного гена [30].
R. Roussel и соавт. (2011) установили обратную зависимость между потреблением жидкости и риском гипергликемии в течение девяти лет наблюдения. У пациентов, употреблявших более одного литра жидкости в сутки, риск сахарного диабета был на 27% ниже, чем у тех, кто выпивал менее 500 мл жидкости. Авторы сделали вывод, что при приеме небольшого количества жидкости риск сахарного диабета возрастает. Причем он ассоциируется с более высоким уровнем вазопрессина в плазме крови [31].
У пациентов с сахарным диабетом 1 типа наблюдается избирательное истощение бета-клеток поджелудочной железы, которое характеризуется нарушениями секреции инсулина при относительно сохранной секреции глюкагона альфа-клетками. Эффекты инсулина и глюкагона являются антагонистическими, но секреция инсулина вызывает ингибирование секреции глюкагона. Таким образом, у пациентов с сахарным диабетом 1 типа секреция глюкагона значительно увеличивается, что дает дополнительный гипергликемический эффект. При сахарном диабете 1 типа даже физиологические уровни вазопрессина способны вызывать значительное увеличение уровня глюкозы в крови, стимулируя секрецию глюкагона, усиливающего синтез глюкозы в печени (глюконеогенез) [32].
В отличие от интактной группы контроля у крыс со стрептозотоцин-индуцированным сахарным диабетом инфузия вазопрессина способствовала повышению в два раза секреции глюкагона. Более того, у крыс с лабораторной моделью сахарного диабета базальный уровень вазопрессина был выше. Таким образом, поджелудочная железа диабетических крыс более чувствительна к вазопрессину с точки зрения его влияния на секрецию глюкагона. Полученные результаты показали, что более низкие уровни вазопрессина способствуют повышению секреции глюкагона, а более высокие – увеличению секреции инсулина. На основании этого можно сделать вывод, что альфа-клетки поджелудочной железы более чувствительны к эффектам вазопрессина, чем бета-клетки. При базальных уровнях изучаемых гормонов вазопрессин в большей степени влияет на секрецию глюкагона, чем на секрецию инсулина. Не исключено, что в ближайшее время антагонисты V1В-рецепторов к вазопрессину, способные ингибировать секрецию глюкагона, будут рассматривать как препараты для лечения сахарного диабета [32].
У крыс с сахарным диабетом выявлена гипертрофия супраоптического и паравентрикулярного ядра гипоталамуса (место непосредственного синтеза вазопрессина). Это позволило некоторым исследователям высказать предположение, что при сахарном диабете возможна гиперактивность нейронов данной зоны, секретирующих вазопрессин [33]. Кроме того, концентрация вазопрессина в тканях поджелудочной железы человека и крыс значительно превосходит его концентрацию в сыворотке крови. При этом вазопрессин находится в периваскулярном пространстве поджелудочной железы, а не в островковых или ацинарных клетках. Вполне вероятно, что поджелудочная железа может независимо от гипофиза секретировать вазопрессин как локальный гормон, необходимый ей для синтеза глюкагона [32, 33].
У пациентов с ожирением при инфузии КТРГ и вазопрессина отмечается гиперактивный ответ гипофиза в виде резко повышенного выброса в кровь АКТГ. Как следствие – более высокий уровень кортизола в крови и гипергликемия. Это говорит о том, что вазопрессин может воздействовать на механизмы гипергликемии за счет влияния на островковые клетки поджелудочной железы, а также на V1В-рецепторы в гипофизе [27]. Локализация рецепторов к вазопрессину, влияющих на уровень глюкозы в крови, представлены в табл. 2 [4].
Липидный обмен
Влияние вазопрессина на липидный обмен обусловлено несколькими механизмами.
С одной стороны, вазопрессин стимулирует симпатическую нервную систему, активно участвующую в метаболизме жиров [34]. На фоне симпатической гиперактивности закономерно повышается секреция эпинефрина надпочечниками, что сопровождается активацией метаболизма триглицеридов в жировой ткани. Периферические нервные терминали, как и кровеносные сосуды, необходимы для функционирования клеток жировой ткани. В ряде исследований показано, что любое нарушение функции этих структур влияет на липидный обмен.
Так, при введении адреналина и норадреналина повышается уровень свободных жирных кислот, побочным продуктом метаболизма которых и являются триглицериды [35]. В опытах на крысах зафиксирован антилиполитический (липоаккумулирующий) эффект вазопрессина, опосредованный V1А-рецепторами и обусловленный способностью вазопрессина ингибировать тканевые липазы, что приводит к нарушению распада триглицеридов, усилению липолиза и повышению сывороточных уровней глицерина и кетоновых тел. Коме того, вазопрессин ингибирует эффекты изопротеренола. При введении изопротеренола V1А-вазопрессин-дефицитным мышам липолиз в бурой жировой ткани усиливался в три раза [35].
Как известно, стимуляция метаболизма липидов в бурой жировой ткани повышает температуру тела. После введения вазопрессина лабораторным животным температура тела снижалась за счет ингибирования метаболизма липидов. Даже у крыс с поражениями переднего отдела гипоталамуса введение вазопрессина вызывало аналогичный эффект [36].
С другой стороны, периферические механизмы регуляции обмена жиров вазопрессин осуществляет посредством регуляции метаболизма инсулина, глюкагона, глюкокортикоидов и эпинефрина. Вазопрессин также ингибирует тканевую липазу и активно влияет на уровень глюкозы крови – основного субстрата для сжигания жиров [8]. Инсулин является самым мощным липоаккумулирующим гормоном. Инсулинотерапия сахарного диабета закономерно приводит к ожирению за счет ингибирования метаболизма жиров, поскольку инсулин снижает концентрацию цАМФ в клетках [36]. Сигнальными молекулами для инсулина являются киназа Akt и p70S6-киназа, нарушения функции которых на фоне мутаций V1А-рецепторов к вазопрессину чреваты инсулинорезистентностью. Кроме того, вазопрессин стимулирует гликогенолиз в печени за счет стимуляции секреции глюкагона и адреналина. В итоге увеличивается уровень глюкозы крови. У мышей, дефицитарных по V1В-рецепторам к вазопрессину, происходит стимуляция липогенеза за счет увеличения чувствительности к инсулину [37].
Артериальная гипертензия
Тесное взаимодействие симпатической нервной системы, ренин-ангиотензин-альдостероновой системы (РААС) и вазопрессина способствует повышению системного артериального давления. Однако в физиологических условиях от вазопрессина не зависит поддержание уровня артериального давления, хотя дефицит вазопрессина приводит к мощному расширению сосудов при септическом шоке [38, 39].
Представители негроидной расы характеризуются более высоким уровнем вазопрессина и более высоким уровнем артериального давления. Диурез у лиц негроидной расы ниже, а концентрация мочи выше, особенно в дневное время, чем у представителей европеоидной расы.
Как показали результаты исследований, даже когда артериальное давление в пределах нормы, пульсовое давление выше у лиц негроидной расы. Выявлена достоверная связь между высокой концентрацией мочи и уровнем пульсового давления у чернокожих мужчин. Чернокожие мужчины и женщины сравнимы друг с другом по объему мочи и концентрационной способности почек. Однако в отличие от женщин мужчины лучше удерживают солевой состав и концентрацию мочи [40].
У здоровых людей, которые употребляют меньше жидкости, натрий из организма выводится медленнее, чем у тех, кто принимает больше жидкости [41]. Выявлена связь между скоростью потока мочи и скоростью экскреции натрия с мочой у здоровых людей. Так, выведение натрия с мочой не зависело от скорости потока мочи до тех пор, пока поток мочи превышал 1 л. Как только поток мочи становился менее 1 л, экскреция натрия уменьшалась. Это говорит о том, что более высокий уровень вазопрессина необходим для адекватной абсорбции натрия в почках. Натрий абсорбируется, только когда уровень вазопрессина достигает определенного порогового значения.
Более высокий уровень вазопрессина у представителей негроидной расы в отличие от представителей европеоидной расы может быть связан с установкой гипоталамической системы осмостата на более низкие уровни сывороточной осмоляльности. Более высокий уровень вазопрессина у чернокожих помогает им выживать в неблагоприятных условиях засух, дефицита воды и голода. Подобная адаптация позволяет снизить экскрецию натрия. Очевидно, поэтому ингибиторы ангиотензинпревращающего фермента не так эффективны у чернокожих пациентов с артериальной гипертензией, как у европейцев [40].
Вазопрессин также может влиять на повышение чувствительности к солям при хронических заболеваниях почек. Высокий уровень вазопрессина вызывает активацию прегломерулярных рецепторов типа V1А и V2 в почках [42]. Кроме того, при уровне вазопрессина в крови, более высоком, чем требуется для поддержания антидиуретического ответа, может иметь место сокращение гладких мышц, опосредованное V1А-рецепторами. Тем не менее такая реакция быстро нивелируется неповрежденной вегетативной нервной системой и интактными сердечно-сосудистыми рефлексами, вызывающими активацию блуждающего нерва и брадикардию.
При нарушении вегетативной нервной системы после острой инфузии вазопрессина значительно повышается уровень среднего артериального давления. Результаты клинических исследований показали, что для увеличения этого уровня на 10 мм рт. ст. пациентам с вегетативными нарушениями (по сравнению со здоровыми лицами) необходима в 1000 раз более высокая концентрация вазопрессина. Эти данные свидетельствуют о том, что более высокий уровень вазопрессина способен существенно влиять на сердечно-сосудистую систему при первичной артериальной гипертензии и одновременном нарушении функции вегетативной нервной системы [43, 44].
Хроническая болезнь почек
Традиционные факторы риска прогрессирования хронической болезни почек, такие как сахарный диабет, артериальная гипертензия и альбуминурия, хорошо известны. Тем не менее данные ряда исследований позволяют предположить, что при увеличении уровня вазопрессина ухудшается клиническое течение хронической болезни почек. Как известно, количество употребляемой воды и уровень вазопрессина находятся в обратной зависимости. Низкий 24-часовой объем мочи и недостаточное потребление воды коррелируют с ухудшением течения хронической болезни почек и связаны с высокими уровнями вазопрессина. Повышение мочевого осмотического давления обусловлено не только прогрессированием хронической почечной недостаточности, но и началом хронического гемодиализа в течение 72 месяцев после ее формирования [45].
В экспериментах показано, что непрерывное введение десмопрессина ухудшает течение альбуминурии и хронической болезни почек, а селективная блокада V2-рецепторов к вазопрессину оказывает противоположный эффект. Кроме того, повышенные уровни копептина – суррогатного маркера вазопрессина – связаны с альбуминурией и уменьшением скорости клубочковой фильтрации у больных после трансплантации почки [46]. Таким образом, стимуляция V2-рецепторов к вазопрессину ассоциируется с ухудшением функции почек.
Алкоголь и табак по-разному влияют на скорость клубочковой фильтрации: алкоголь блокирует V2-рецепторы, а табак стимулирует их [47, 48].
Вазопрессин также способен ухудшить течение хронической болезни почек за счет стимуляции РААС посредством V2-рецепторов. Данный эффект десмопрессина может быть заблокирован ингибитором ангиотензинпревращающего фермента. Увеличение активности РААС вызывает сужение эфферентных артериол клубочков, что чревато развитием гиперфильтрации и гломерулопатии с протеинурией [49, 50]. Такой неблагоприятный эффект в большей степени актуален для лиц с высоким потреблением белка, мужчин и представителей негроидной расы [51, 52].
Хроническое воспаление
Воспалительные состояния, такие как пневмония, энцефалит, малярия и респираторный дистресс-синдром у взрослых, обусловлены повышенным образованием воспалительных цитокинов (интерлейкинов 1 и 6), которые, как стало известно, связаны с вазопрессином [53]. Интерлейкин 6 стимулирует вазопрессин-секретирующие нейроны, что способствует повышению плазменного уровня вазопрессина и потенциально развитию гипонатриемии, хотя механизм остается неясным. Тем не менее существует предположение, что интерлейкин 6 диффундирует через гематоэнцефалический барьер или активно секретируется мозговыми перицитами [54].
С одной стороны, вазопрессин предположительно оказывает иммуномодулирующее действие, которое наиболее активно проявляется в легких и состоит в способности вазопрессина снижать тканевую концентрацию интерлейкина 6 [55]. Противовоспалительные эффекты вазопрессина могут быть опосредованы через его участие в регуляции секреции АКТГ, который стимулирует кору надпочечников и выбрасывает в кровь подавляющие воспаление кортикостероиды. Нарушения этих взаимоотношений чреваты хроническим субклиническим воспалением. Подобный механизм, в частности, описан у пациентов с ревматоидным артритом, протекающим на фоне низкого уровня кортизола в крови. С другой стороны, вазопрессин является и провоспалительным пептидом, который может стимулировать, например, избыточную секрецию усугубляющего воспаление пролактина [56].
Социальное поведение
Вазопрессин может играть существенную роль в регуляции гипоталамо-гипофизарно-адреналовой системы в ответ на психологический стресс.
Вазопрессин вместе с окситоцином влияет на психологические и когнитивные функции: эндогенный вазопрессин усиливает тревогу, а эндогенный окситоцин оказывает анксиолитическое действие [57]. Таким образом, с этими нейропептидами связаны разные психологические реакции. Баланс между ними определяет социальные и эмоциональные реакции. Нарушение баланса описано при депрессии, тревоге, шизофрении, аутизме, расстройствах личности и обсессивно-компульсивном расстройстве [57]. У пациентов, страдающих этими заболеваниями, уровни вазопрессина в плазме и паравентрикулярном ядре гипоталамуса значительно повышены.
В эксперименте при введении инъекций гипертонического раствора наблюдались симптомы паники. Поэтому высказано предположение, что вазопрессин способен индуцировать панические симптомы [58].
Во время острого приступа шизофрении плазменный уровень вазопрессина повышается, а нейролептики (галоперидол) снижают его, что ассоциируется с улучшением контроля психиатрических симптомов. Фенциклидин может вызвать серьезные симптомы шизофрении из-за повышения уровня вазопрессина в плазме, а также изменения церебральной экспрессии и распределения рецепторов к вазопрессину.
При аутизме нередко выявляются мутации гена V1А-рецептора к вазопрессину, что повышает вероятность возможного участия вазопрессина в нарушениях социального поведения при аутизме [59].
Внутримозговые инъекции вазопрессина у животных вызывали агрессивное поведение и повышенную тревожность. Микроинъекция антагониста V1А-рецептора, отвечающего за выражение повышенной тревожности к вазопрессину, снижала беспокойство у крыс. Эксперименты показали, что на фоне блокады V1А-рецептора ухудшается память. У самцов грызунов вазопрессин отвечает за предпочтения партнеров и отеческую заботу после спаривания, а антагонисты вазопрессиновых рецепторов кардинально изменяют это поведение [60].
Когнитивная функция
Когнитивные функции могут зависеть от степени гидратации и дегидратации мозговой ткани [61]. Обезвоживание мозга способно привести к серьезным нарушениям и смерти. Но даже умеренное обезвоживание и потеря 1–2% массы тела может вызвать сбои когнитивной функции [62].
Пожилые пациенты с сахарным диабетом и дети в большей степени склонны к обезвоживанию. Можно предположить у них возникновение поведенческих проблем из-за обезвоживания. Умеренное обезвоживание может произойти в процессе ежедневной деятельности и быть связано с ухудшением когнитивных функций, зрительной бдительности, ростом напряженности, тревоги и усталости [63].
Имеются данные о возможной связи вазопрессина с головой болью [64, 65].
Клеточная пролиферация
Влияние вазопрессина на пролиферацию и рост клеток обусловлено способностью через V1А-рецепторы непосредственно стимулировать синтез белка и клеточных факторов роста [65]. Такие эффекты вазопрессина описаны в отношении эпителия кишечника, почек и некоторых клеток и тканей [67–69].
Между тем установлено, что опухолевые клетки также содержат рецепторы к вазопрессину. Например, клетки мелко-клеточного рака легкого имеют V1А-рецепторы и секретируют нейропептиды [70].
Вазопрессин играет определенную роль в регенерации органов, в частности печени, а также в образцах неонатальных кардиомиоцитов мыши [8].
Биологическое старение
Вазопрессин может регулировать процессы старения в результате взаимодействия с трансмембранным белком KLOTHO, который широко экспрессируется в организме и выступает в качестве гормона, но в основном влияет на почки и центральную нервную систему. Этот белок является основным фактором, определяющим продолжительность жизни [71]. Он циркулирует в крови и связывается с рецепторами в различных клетках, повышая их устойчивость к окислительному стрессу, ускоряющему процесс старения. Связывание KLOTHO с рецепторами подавляет внутриклеточный каскад инсулина, что также повышает устойчивость к окислительному стрессу.
Лабораторные крысы с дефицитом белка KLOTHO имеют меньшую продолжительность жизни, преждевременно стареют и умирают менее чем за пять месяцев [71]. Помимо этих эффектов дефицит белка KLOTHO вызывает мышечную дистрофию, остеопению, сосудистую кальцификацию, потерю слуха, другие возрастные расстройства [71, 72].
Согласно последним данным, плотность белка KLOTHO существенно снижена у обезвоженных мышей. Вследствие обезвоживания повышаются осмолярность, плазменный уровень вазопрессина, альдостерона и 1,25(OH)D. Таким образом, вазопрессин способствует снижению плотности белка KLOTHO. Пожилые пациенты с сахарным диабетом склонны к обезвоживанию и могут подвергаться повышенному риску повреждения почек, ускоренного старения и ранней смерти, возможно в связи с вторичным повышением уровня вазопрессина и его влиянием на белок KLOTHO – маркер продолжительности жизни [73–75].
Заключение
Cогласно общепринятому мнению, вазопрессин характеризуется двумя важнейшими классическими физиологическими эффектами – антидиуретическим и вазопрессорным. Однако рецепторы к вазопрессину представлены во многих органах и системах человеческого организма. Это позволяет говорить о том, что физиологические эффекты данного гормона намного шире, чем можно предположить.
Результаты клинико-экспериментальных исследований, которые легли в основу этой статьи, показывают, как мало известно об этом уникальном гормоне, который принимает активное участие в регуляции многих биологических функций в организме человека и обладает широким спектром неклассических физиологических эффектов. Среди них регуляция гипоталамо-гипофизарно-адреналовой системы, костного метаболизма, углеводного и липидного обменов, системы гемостаза, эндотелиальной функции, механизмов стресса, хронического воспаления, инфекции и клеточной пролиферации, а также участие в механизмах регуляции боли, мнемо-когнитивной функции, обеспечении социального поведения, реализации механизмов клеточного и системного старения. Вполне возможно, что очень скоро многие из этих неклассических физиологических эффектов вазопрессина найдут практическое применение в клинической медицине.
Антидиуретический гормон (АДГ)
Другие названия: Вазопрессин, Antidiuretic hormone, Vasopressin, ADH.
Код услуги для заказа 99002 Антидиуретический гормон (АДГ) в медицинской лаборатории Синэво.
Антидиуретический гормон является пептидом, образующимся в супраоптических и паравентрикулярных ядрах гипоталамуса. Выход АДГ из накопительных везикул в нейрогипофиз регулируется, в первую очередь, осмолярностью плазмы. Если осмолярность плазмы поднимается выше критического уровня, выход АДГ резко ускоряется. Быстрое увеличение осмолярности плазмы лишь на 2% приводит к усилению секреции АДГ в 4 раза, тогда как уменьшение осмолярности на 2% сопровождается полным прекращением секреции АДГ. Гемодинамические факторы также оказывают выраженное регуляторное влияние на выход АДГ. Повышение секреции наблюдается при снижении артериального давления, АДГ вызывает сужение кровеносных сосудов. Кроме того, секреция АДГ оказывается усиленной при чрезмерном снижении объема циркулирующей жидкости, острой кровопотере, при стрессе, боли, введении барбитуратов, анальгетиков. АДГ имеет суточный ритм секреции с повышением ночью. Уровень АДГ снижается лёжа, и растёт при переходе в вертикальное положение.
Главный биологический эффект АДГ – антидиуретический, благодаря которому происходит увеличение реабсорбции воды в дистальной части почечных канальцев, что предотвращает обезвоживание организма.
Показания к назначению:
- диагностика синдрома Пархона
- дифференциальная диагностика синдрома полиурии (например, несахарный диабет)
Метод: радиоиммунный анализ (RIA)
Анализатор: Buhlmann Laboratories AG (Швейцария)
Единицы измерения: нг/л:
Материал для исследования: сыворотка венозной крови
Подготовка:
- Важным условием обеспечения качества лабораторного исследования крови является взятие материала натощак, в утреннее время (до 12:00).
- За 12 часов до исследования следует исключить прием алкоголя, курение, прием пищи, ограничить физическую активность.
- Утром в день взятия крови на исследование можно выпить воду.
- Исключить прием лекарств; если отменить прием лекарств невозможно, необходимо проинформировать об этом лабораторию.
- Взятие материала желательно проводить до проведения любых медицинских диагностических манипуляций.
Интерпретация результатов:
Результат лабораторных исследований не является достаточным основанием для постановки диагноза. Интерпретация результатов и постановка диагноза осуществляется только лечащим врачом.
Референтные значения: нг/л
1,0-8,0
Повышение уровня:
- синдром Пархона;
- гипотензия;
- снижение объема циркулирующей жидкости
- стресс
- выраженный болевой синдром
- острая кровопотеря
Понижение уровня:
- несахарный диабет
- состояния, сопровождающиеся снижением осмолярности плазмы
Факторы, влияющие на результат:
Повышение:
Барбитураты, анальгетики
Где сдать анализ
Антидиуретический гормон (АДГ)
Сдать анализ Антидиуретический гормон (АДГ) можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.
Анализ на вазопрессин (Антидиуретический гормон, АДГ), осмоляльность плазмы
Диагностическое направление
Оценка антидиуретической функции
Общая характеристика
Антидиуретический гормон (АДГ, вазопрессин) является пептидом, состоящим из 9 аминокислотных остатков. Синтезируется как прогормон в гипоталамических нейронах, чьи клеточные тела берут начало в супраоптическом и паравентрикулярном ядрах. Главный биологический эффект АДГ – антидиуретический: увеличение резорбции воды в дистальной части почечных канальцев, что предотвращает таким образом обезвоживание организма. Кроме того, вазопрессин вызывает сужение кровеносных сосудов. АДГ имеет суточный ритм секреции с повышением ночью. Уровень АДГ растёт при переходе в вертикальное положение, снижается лёжа. Выход АДГ из накопительных везикул в нейрогипофиз регулируется в первую очередь осмоляльностью плазмы, в меньшей степени — ОЦК. Быстрое увеличение осмоляльности плазмы лишь на 2% приводит к усилению секреции АДГ в 4 раза, тогда как уменьшение осмоляльности на 2% сопровождается полным прекращением секреции АДГ.
Показания для назначения
1.При выявлении низкого удельного веса мочи (
Маркер
Маркер гормональной активности гипоталамуса и регуляции водного обмена.
Клиническая значимость
1. Диагностика несахарного диабета. 2. Как дополнение к диагностике синдрома неадекватной секреции антидиуретического гормона, в т.ч. эктопической продукции вазопрессина.
Состав показателей:
Вазопрессин
Метод:
Радиоиммуноанализ
Единица измерения:
Нанограмм на литр
Референтные значения:
Возраст
Комментарии
Осмолярность
Метод:
Криоскопия
Единица измерения:
мосм/л
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
Плазма
Условия доставки:
1 Месяцев. при температуре от -20 до -20 градусов Цельсия
Контейнер:
Вакутейнер с литий-гепарином
Объем:
4 Миллилитров
Плазма
Условия доставки:
1 Месяцев. при температуре от -20 до -20 градусов Цельсия
Контейнер:
Система с ЕДТА без разделительного геля
Объем:
4 Миллилитров
Правила подготовки пациента
Стандартные условия: Утром, до 10-00, строго натощак (не менее 8-12 часов перерыв после последнего приема пищи). Перед забором крови пациенту необходимо 20 минут посидеть. Положение пациента во время забора крови должно быть всегда одинаковым (при повторном исследовании данного гормона): либо сидя, либо лежа.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Антипсихотические средства (фенотиазины, галоперидол), барбитураты, карбамазепин, хлорпропамид, цисплатин, клофибрат, циклофосфамид, фуросемид (редко), наркотические анальгетики, тиазиды, толбутамид, трициклические антидепрессанты, винбластин, винкристин,
- Демеклоциклин, этанол, карбонат лития, фенитоин, предсердный натрий-уретический гормон.
Интерпретация:
- Эктопическая секреция АДГ (опухоли APUD-системы). Синдромы с избыточной продукцией АДГ: острая перемежающаяся порфирия, синдром Жульена-Барре, опухоль мозга, сосудистые и неинфекционные заболевания мозга, почечный несахарный диабет, туберкулез легких, туберкулезный менингит.
- Центральный несахарный диабет, психогенная полидипсия, нефротический синдром. При сравнении уровня вазопрессина пациента с уровнем, соответствующим осмоляльности, происходит оценка пониженных уровней данного гормона.
Антидиуретический гормон АДГ вазопрессин — Справочник химика 21
Антидиуретический гормон (вазопрессин АДГ) [c.271]
Антидиуретический гормон (вазопрессин) представляет собой нонапептид следующего строения [c.390]
Антидиуретический гормон (АДГ, вазопрессин) [c.334]
Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин оказывает мощное антидиуретическое действие—стимулирует обратный ток воды через мембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет—заболевание, характеризующееся вьщелением чрезвычайно больших количеств жидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек. [c.257]
Из задней доля гипофиза, или нейрогипофиза выделены два гормона. Вазопрессин, или антидиуретический гормон, угнетает мочеобразование и повышает кровяное давление. Окситоцин вызывает сокращение мускулатуры матки и других гладких [c.196]
Экспериментально задержку больших количеств воды в организме (так называемое водное отравление) удается вызвать путем парентерального введения животным экстракта задней доли гипофиза, содержащего антидиуретический гормон — вазопрессин (продажный питуитрин, стр. 201). [c.389]
В задней доле гипофиза (этот отдел называют так-, же нейрогипофизом) депонируются антидиуретический гормон (вазопрессин) и окситоцин. [c.73]
Вазопрессин часто называют антидиуретическим гормоном, так как он контролирует реабсорбцию воды в почечных канальцах. Действие вазопрессина осуществляется по мембрано-опосредованному механизму В результате связывания вазопрессина с рецепторами в почечных канальцах запускается каскад реакций. Образование цАМФ и активация протеинкиназы приводят к фосфорилированию мембранных белков в почках, что влияет на транспорт воды. [c.150]
Задняя доля гипофиза вырабатывает окситоцин — гормон, вызывающий сокра щение матки при родах, и вазопрессин, или антидиуретический гормон, обусловливающий увеличение кровяного давления. Средняя доля гипофиза вырабатывает [c.447]
Вазопрессин, или антидиуретический гормон секретируется в кровь задней долей гипофиза, а синтезируется в нейронах гипоталамуса. Секрецию вазопрессина стимулируют повышение осмотического давления крови, воспринимающееся осморецепторами мозга уменьшение объема крови, воспринимающееся барорецепторами кровеносных сосудов боль, возбуждение. [c.421]
ЗАДНЯЯ ДОЛЯ ГИПОФИЗА (НЕЙРОГИПОФИЗ). Этот отдел гипофиза развивается как нижний вырост гипоталамуса. Он не синтезирует никаких гормонов, а лишь хранит и высвобождает два гормона — антидиуретический гормон (АДГ, вазопрессин) и окситоцин. АДГ секретируется в кровь при уменьшении содержания воды в плазме он усиливает обратное всасывание воды в дистальных канальцах и собирательных трубочках почек, что ведет к ее реабсорбции из первичной мочи назад в плазму. В результате организм защищается от обезвоживания, вьщеляя наружу меньший объем более концентрированной мочи (разд. 20.6). Окситоцин стимулирует сокращение матки при родах и активное выведение молока из сосков (разд. 21.8.13). [c.340]
Обмен воды находится под контролем эндокринной и нервной систем. Отдельные гормоны регулируют выделение воды из организма. Основным регулятором является гормон гипофиза — вазопрессин, или антидиуретический гормон, который уменьшает выведение жидкости почками (диурез) за счет сокращения сосудов почек. Секреция этого гормона повышается при снижении объема плазмы крови, что способствует задержанию воды в организме и нормализует объем плазмы крови. Такие изменения наблюдаются при физических нагрузках, когда происходит снижение объема плазмы крови за счет интенсивного потоотделения. [c.69]
Задняя доля гипофиза содержит два гормона — окситоцин и вазопрессин (антидиуретический гормон). Окситоцин стимулирует сокращение гладких мышц матки и функцию молочных желез. Вазопрессин повышает кровяное давление и регулирует ресорбцию воды почками, уменьшая количество суточной мочи. При недостаточности этого гормона количество суточной мочи резко увеличивается (до 25 л сут ) и развивается заболевание несахарный диабет. Следовательно, этот гормон играет важную роль в регуляции содержания воды в организме, поддержании физиологического объема крови. [c.142]
Вазопрессин (антидиуретический гормон) повышает проницаемость стенки почечных канальцев по отношению к воде, что способствует лучшему ее обратному всасыванию. Действие этого гормона приводит к уменьшению объема мочи (название этого гормона антидиуретический расшифровывается как уменьшающий объем , так как термин диурез обозначает объем мочи). [c.118]
Вазотоцин — вазопрессорный гормон задней доли гипофиза у всех позвоночныя ва исключением млекопитающих. Этот гормон синтезирсшан Катсояннис и Дю-Виньо в 1958 г. до изучения структуры природного гормона. Авторами синтезиротан нона-пептид, состоящий из кольца с —S — S — мостиком окситоцина и боковой цепн вазопрессина. Полученный препарат обладает активностью вазопрессина и окситоцина, которая в четыре-пять раз слабее. Вазотоцин — естественный гормон у птиц, рептилий, амфибий и рыб. Изучение его физиологического действия показало, что он обладает различным действием у представителей разных классов позвоночных. У наземных животных он проявляет антидиуретический эффект, т. е. вызывает задержку воды в организме, у рыб — стимулирует диурез и увеличивает выделение воды во внешнюю среду. Эти отличия могут быть связаны с характером среды обитания, так как в обоих случаях его действие направлено на поддержание гомеостаза. [c.270]
Задняя доля гипофиза содержит два активных гормона—вазопрессин и окситоцин. Вазопрессин, получивший свое название благодаря способности повышать артериальное давление при введении в фармакологических дозах, правильнее называть антидиуретическим гормоном (АДГ), поскольку его самое важное физиологическое действие заключается в стимуляции реабсорбции воды в дистальных почечных канальцах. Название другого гормона окситоцин также связано с его эффектом, который заключается в ускорении родов из-за усиления сокращения гладких мышц матки. Вероятная физиологическая роль этого гормона—стимуляция выброса молока из молочной железы. [c.183]
АНТИДИУРЕТИЧЕСКИЙ ГОРМОН (АДГ ВАЗОПРЕССИН) [c.184]
Вазопрессин (антидиуретический гормон) Задняя гипофиза доля 9 аминокислот Повышение кровяного давления в результате сужения мелких кровеносных сосудов усиленная реабсорбция воды в почечных канальцах [c.343]
Реабсорбция и секреция различных веществ регулируются ЦНС и гормональными факторами. Например, при сильных болевых раздражениях или отрицательных эмоциях может возникнуть анурия (прекращение процесса мочеобразования). Всасывание воды возрастает под влиянием антидиуретического гормона вазопрессина. Альдостерон увеличивает реабсорбцию натрия в канальцах, а вместе с ним и воды. Всасывание кальция и фосфата изменяется под влиянием паратиреоидного гормона. Паратгормон стимулирует секрецию фосфата, а витамин О задерживает ее. [c.612]
Гормоны гипофиза. В гипофизе синтезируются тропные гормоны — тропины (от греч. tropos — поворот, направленность), оказывающие стимулирующее действие на эндокринные железы. К ним относится гормон роста — соматотропин, представляющий собой полипептид, содержащий 191 аминокислотный остаток. Соматотропин оказывает влияние практически на все клетки и отвечает за нормальный рост организма. Среди других синтезируемых гипофизом гормонов отметим ли-потропины, оказывающие специфическое жиромобилизующее действие лютропин, отвечающий за половое созревание антидиуретический гормон вазопрессин, представляющий собой нонапептид следующего строения [c.295]
Задняя доля гипофиза (нейро- гипофиз) Вазопрессин (антидиуретический гормон) — вырабатывается в гипоталамусе, храютгся и вы-деляегея в кровь из задней доли гипофиза Поли- пептид Суживает мелкие кровеносные сосуды и повышает кровяное давление ускоряет обратное всасывание воды при мочеобразова-нии и способствует уменьшению объема мочи Несахарный диабет [c.97]
Вазопрессин (антндиуретин, адиуретнн) обладает антидиуретическим действием, т. е. вызывает обратное всасывание воды почками под влиянием вазопрессина суточная первичная моча концентрируется (объем первичной мочи составляет 15 л, в то время как объем выделяемой организмом мочн только 1—1,5 л). В относительно больших дозах вазопрессин также повышает давление. Tax как уже 2 нг этого гормона могут вызывать у человека заметный антидиуретический эффект, то по своему физиологическому действию и фармакологическим свойствам он принадлежит к [c.248]
Недавно из лаборатории Дю-Виньо вышла работа, в которой описан синтез вазопрессина свиньи [580]. Заслуживает внимания тот факт, что концевым остатком в молекулах упомянутых выше гормонов является глицинамид. В связи с этим возникает важный вопрос не существуют ли подобные связи и в белках В молекуле вазопрессина свиньи остаток аргинина замещен лизином. Несмотря на это видовое различие, оба вазопрес- ина обладают почти одинаковой физиологической активностью. Окситоцин является одним из главных гормонов задней доли. нпофиза он вызывает сокращение мускулатуры матки и выделение молока. Вазопрессин повышает артериальное давление, что связано с его сосудосуживающим действием кроме того, он проявляет антидиуретическое действие. Подобие строения молекул вазопрессина и окситоцина позволяет объяснить наличие слабой окситоцической активности у препаратов вазопрессина и, возможно, также наличие слабой прессорной активности у препаратов окситоцина. [c.74]
Для проверки влияния дисульфидной связи на активность Arg -вазопрессина (для окситоцина см. стр. 398, 419). Фонг и сотр. [751а] десульфурировали последний и провели испытания полученного препарата на антидиуретическую и прессорную активность (на собаках и крысах). Авторы показали, что модифицированный гормон не обнаруживает антидиуретического эффекта, но повышает кровяное давление у собак и крыс, проявляя при этом активность 90 и 33 М. Е./мг соответственно [активность Arg -вазопрессина равна 360 М. Е./мг (на собаках) и 340 Ш. Е./мг (на крысах)]. На основании полученных результатов был сделан вывод, что дисульфидный мостик необходим для проявления антидиуретической, но не прессорной активности. [c.427]
Гормоны нейрогипофиза. Вазопрессин — полипептид из восьми аминокислот, молекулярный вес 1025. Повышает кровяное давление, сужая периферические ар-териолы и капилляры. Однако он расширяет сосуды мозга и почек. В малых дозах оказывает антидиуретическое действие, т. е. усиливает обратное всасывание воды в мочевых канальцах. [c.65]
Данные гормоны характеризуются высокой биологической активностью. Окситоцин оказывает влияние на мускулатуру матки в послеродовой период а вазопрессин действует на гладкую мускулатуру кровеносных сосудов (вызывает так называемый нрессорный эффект), а также влияет на деятельность почек у высших животных и человека (антидиуретический фактор) [c.173]
Центральный несахарный диабет – современные представления о диагностике и лечении | Анциферов М.Б., Маркина Н.В.
Центральный несахарный диабет (ЦНД) – это тяжелое заболевание гипоталамо-гипофизарной системы, имеющее в своей основе дефект синтеза или секреции антидиуретического гормона (АДГ). Распространенность ЦНД варьирует от 0,004–0,01%. Заболевание чаще встречается у женщин, чем у мужчин, и начинается в 20–30-летнем возрасте [17].
Синтез и секреция антидиуретического гормона
Антидиуретический гормон вазопрессин синтезируется в супраоптических и паравентрикулярных ядрах гипоталамуса. Связываясь с белком-носителем нейрофизином, комплекс АДГ-нейрофизин в виде гранул транспортируется к терминальным расширениям аксонов нейрогипофиза и срединного возвышения. В контактирующих с капиллярами окончаниях аксонов происходит накопление АДГ. Секреция АДГ зависит от осмоляльности плазмы, циркулирующего объема крови и уровня АД. На изменения электролитного состава крови реагируют осмотически чувствительные клетки, находящиеся в околожелудочковых отделах переднего гипоталамуса. Повышенная активность осморецепторов при повышении осмоляльности крови стимулирует вазопрессинергические нейроны, из окончаний которых в общий кровоток выделяется вазопрессин. В физиологических условиях осмоляльность плазмы находится в пределах 282–300 мОсм/кг [5]. В норме порогом для секреции АДГ является осмоляльность плазмы крови начиная с 280 мОсм/кг. Более низкие значения для секреции АДГ могут наблюдаться при беременности, острых психозах, онкологических заболеваниях. Снижение осмоляльности плазмы, вызванное приемом большого количества жидкости, подавляет секрецию АДГ. При уровне осмоляльности плазмы более 295 мОсм/кг отмечаются повышение секреции АДГ и активация центра жажды (рис. 1). Контролируемый осморецепторами сосудистого сплетения передней части гипоталамуса активированный центр жажды и АДГ препятствует дегидратации организма [18].
Регуляция секреции вазопрессина зависит и от изменений объема крови. При кровотечениях существенное влияние на секрецию вазопрессина оказывают волюморецепторы, расположенные в левом предсердии. В сосудах АД действует через V1-бароосморецепторы, которые располагаются на гладкомышечных клетках сосудов. Вазоконстрикторное действие вазопрессина при кровопотере обусловлено сокращением гладкомышечного слоя сосуда, что препятствует падению АД. При снижении АД более чем на 40% отмечается повышение уровня АДГ, в 100 раз превышающее значение его базальной концентрации [1, 3]. На повышение АД реагируют барорецепторы, расположенные в каротидном синусе и дуге аорты, что в конечном итоге приводит к снижению секреции АДГ. Кроме этого, АДГ участвует в регуляции гемостаза, синтезе простагландинов, способствует высвобождению ренина [6].
Ионы натрия и маннитол являются мощными стимуляторами секреции вазопрессина. Мочевина не влияет на секрецию гормона, а глюкоза приводит к торможению его секреции [3].
Механизм действия антидиуретического гормона
АДГ является самым важным регулятором задержки воды и обеспечивает гомеостаз жидкости совместно с предсердным натрийуретическим гормоном, альдостероном и ангиотензином II.
Главный физиологический эффект вазопрессина заключается в стимуляции реабсорбции воды в собирательных канальцах коркового и мозгового слоя почек против осмотического градиента давления [6].
В клетках почечных канальцев АДГ действует через V2-барорецепторы (вазопрессиновые рецепторы 2 типа), которые располагаются на базолатеральных мембранах клеток собирательных канальцев. Взаимодействие АДГ с V2-рецепторами приводит к активации вазопрессинчувствительной аденилатциклазы и повышению продукции циклического аденозинмонофосфата (АМФ). Циклический АМФ активизирует протеинкиназу, А, которая в свою очередь стимулирует встраивание белков водных каналов, аквапорина-2 в апикальную мембрану клеток. Это обеспечивает транспорт воды из просвета собирательных трубочек в клетку и далее: через находящиеся на базолатеральной мембране белки водных каналов аквапорина-3 и аквапорина-4 вода транспортируется в межклеточное пространство, а затем в кровеносные сосуды. В результате образуется концентрированная моча с высокой осмоляльностью (рис. 2).
Осмотическая концентрация — это суммарная концентрация всех растворенных частиц. Она может трактоваться как осмолярность и измеряться в осмоль/л или как осмоляльность — в осмоль/кг. Различие между осмолярностью и осмоляльностью заключается в способе получения данной величины. Для осмолярности — это расчетный способ по концентрации основных электролитов в измеряемой жидкости. Формула расчета осмолярности:
Осмолярность = 2 х {Na (ммоль/л) + К (ммоль/л)} + глюкоза (ммоль/л) + мочевина (ммоль/л) + 0,03 х общий белок (г/л) [5].
Осмоляльность плазмы, мочи и других биологических жидкостей — это осмотическое давление, зависящее от количества ионов, глюкозы и мочевины, которое определяется с помощью прибора осмометра. Осмоляльность меньше осмолярности на величину онкотического давления.
При нормальной секреции АДГ осмолярность мочи всегда выше 300 мОсм/л и может увеличиваться даже до 1200 мОсм/л и выше. При дефиците АДГ осмолярность мочи ниже 200 мосм/л [4, 5].
Этиологические факторы центрального несахарного диабета
Среди первичных причин развития ЦНД выделяют наследственную семейную форму заболевания, передаваемую по аутосомно-доминантному или аутосомно-рецессивному типу наследования. Наличие заболевания прослеживается в нескольких поколениях и может затрагивать ряд членов семьи, оно обусловлено мутациями, приводящими к изменениям в строении АДГ (DIDMOAD- синдром). Врожденные анатомические дефекты развития среднего и промежуточного мозга также могут быть первичными причинами развития ЦНД. В 50–60% случаев первичную причину ЦНД установить не удается — это так называемый идиопатический несахарный диабет [17].
Среди вторичных причин, приводящих к развитию ЦНД, называют черепно-мозговую травму (сотрясение головного мозга, травма глазницы, перелом основания черепа).
Развитие вторичного НСД может быть связано с состояниями после транскраниальной или транссфеноидальной операций на гипофизе по поводу таких опухолей головного мозга, как краниофарингиома, пинеалома, герминома, приводящих к сдавлению и атрофии задней доли гипофиза [12].
Воспалительные изменения гипоталамуса, супраоптикогипофизарного тракта, воронки, ножки, задней доли гипофиза также являются вторичными причинами развития ЦНД.
Ведущим фактором в возникновении органической формы заболевания является инфекция. Среди острых инфекционных заболеваний выделяют грипп, энцефалит, менингит, ангину, скарлатину, коклюш; среди хронических инфекционных заболеваний — туберкулез, бруцеллез, сифилис, малярию, ревматизм [9, 10].
Среди сосудистых причин ЦНД можно назвать синдром Шиена, нарушения кровоснабжения нейрогипофиза, тромбозы, аневризмы.
В зависимости от анатомической локализации ЦНД может быть постоянным или транзиторным. При повреждении супраоптического и паравентрикулярных ядер функция АДГ не восстанавливается.
В основе развития нефрогенного НД лежат врожденные рецепторные или ферментативные нарушения дистальных канальцев почек, приводящие к резистентности рецепторов к действию АДГ. При этом содержание эндогенного АДГ может быть нормальным или повышенным, а прием АДГ не устраняет симптомы заболевания. Нефрогенный НД может встречаться при длительно текущих хронических инфекциях мочевыводящих путей, мочекаменной болезни (МКБ), аденоме предстательной железы.
Симптоматический нефрогенный НД может развиться при заболеваниях, сопровождающихся повреждением дистальных канальцев почек, таких как серповидно-клеточная анемия, саркоидоз, амилоидоз. В условиях гиперкальциемии снижается чувствительность к АДГ и уменьшается реабсорбция воды.
Психогенная полидипсия развивается на нервной почве преимущественно у женщин менопаузального возраста (табл. 1). Первичное возникновение жажды обусловлено функциональными нарушениями в центре жажды [14]. Под влиянием большого количества жидкости и увеличения объема циркулирующей плазмы посредством барорецепторного механизма происходит снижение секреции АДГ. Исследование мочи по Зимницкому у этих пациентов выявляет снижение относительной плотности, тогда как концентрация натрия и осмолярность крови остается нормальной или пониженной. При ограничении употребления жидкости самочувствие больных остается удовлетворительным, при этом уменьшается количество мочи, а ее осмолярность повышается до физиологических пределов [11].
Клиническая картина центрального несахарного диабета
Для манифестации НД необходимо снижение секреторной способности нейрогипофиза на 85% [2, 8].
Основными симптомами НД являются обильное учащенное мочеиспускание и сильная жажда. Часто объем мочи превышает 5 л, может даже достигать 8–10 л в сутки.
Гиперосмолярность плазмы крови стимулирует центр жажды. Пациент не может обходиться без приема жидкости более 30 мин. Количество выпитой жидкости при легкой форме заболевания обычно достигает 3–5 л, при средней степени тяжести — 5–8 л, при тяжелой форме — 10 л и более. Моча обесцвечена, ее относительная плотность — 1000–1003 г/л. В условиях избыточного употребления жидкости у больных снижается аппетит, происходит перерастяжение желудка, снижается желудочно-кишечная секреция, замедляется моторика ЖКТ, развиваются запоры. При поражении гипоталамической области воспалительным или травматическим процессом наряду с НД могут наблюдаться и другие нарушения, такие как ожирение, патология роста, галакторея, гипотиреоз, сахарный диабет (СД) [3, 5]. При прогрессировании заболевания обезвоживание приводит к сухости кожи и слизистых, уменьшению слюно- и потоотделения, развитию стоматитов и назофарингитов. При резком обезвоживании начинают нарастать общая слабость, сердцебиение, отмечается снижение АД, быстро усиливается головная боль, появляется тошнота. Больные становятся раздражительными, могут быть галлюцинации, судороги, коллаптоидные состояния.
Диагностика центрального несахарного диабета
Для подтверждения диагноза на первом этапе обследования должны быть исключены наиболее частые причины нефрогенного НД (сахарный диабет, гиперкальциемия, гипокалиемия, воспалительные заболевания почек). При выявлении гиперосмолярности плазмы (более 3000 мОсм/кг), гипернатриемии и гипоосмолярности мочи (100–200 мОсм/кг) переходят ко второму этапу обследования [5].
На этом этапе обследования проводят пробу с дегидратацией (проба с сухоедением) для исключения первичной полидипсии и тест с десмопрессином для исключения нефрогенного НД.
Классическая проба с сухоедением заключается в запрещении употребления любой жидкости в течение 6–14 ч. До и в ходе теста (каждые 1–2 ч) измеряются масса тела, АД, пульс, определяется осмоляльность плазмы крови, содержание натрия в плазме крови, объем и осмоляльность мочи. Проба с сухоедением прекращается при потере пациентом массы тела более 5%, невыносимой жажде, нарастании содержания натрия и повышении осмоляльности крови выше границ нормы. Если в ходе пробы осмоляльность крови > 300 мОсм/кг, уровень натрия >145 ммоль/л, при этом осмоляльность мочи <300 мОсм/кг, для дальнейшей дифференциальной диагностики центрального и нефрогенного НД проводят тест с десмопрессином. Для этого пациент принимает 10 мкг или 0,1 мг десмопрессина или п/к, в/м или в/в вводится эквивалентная доза, равная 2 мкг десмопрессина. Пациенту разрешается выпить жидкости, по объему не превышающей 1,5-кратный объем выделенной мочи во время пробы с сухоедением. Через 2 и 4 ч собирается моча для определения объема и осмоляльности.
Если после введения десмопрессина уровень осмоляльности мочи увеличивается более чем на 50%, диагностируется центральная форма НД. Если эффект от вводимого препарата менее 50% или отсутствует, это свидетельствует о нефрогенной форме НД.
Трудности в диагностике представляют частичные формы ЦНД, нефрогенного НД, первичной полидипсии, т. к. в этих случаях отсутствует яркая клиническая картина. После пробы с сухоедением осмоляльность мочи у этих пациентов определяется в диапазоне от 300 до 750 мОсм/кг, после приема десмопрессина осмоляльность мочи составляет <750 мОсм/кг. Дальнейшее обследование пациентов на фоне приема низких доз десмопрессина (10 мкг х 1–2 р./сут, 0,1 мг х 1–2 р./сут) в течение 7 дней включает определение суточного диуреза, осмоляльности крови и мочи. У пациентов с первичной полидипсией на фоне приема препаратов десмопрессина общее самочувствие не улучшается.
Пациентам с подтвержденным диагнозом ЦНД проводится магнитно-резонансная томография головного мозга для установления причины заболевания и выявления патологических изменений гипоталамо-гипофизарной области [5].
Лечение
Заместительная терапия ЦНД проводится синтетическим аналогом АДГ — десмопрессином. Особенности химической структуры десмопрессина заключаются в замещении L-аргинина в 8-ом положении цепи D-аргинином, а также дополнительное дезаминирование цистеина в 1-ом положении. Препарат действует только на V2-рецепторы почечных канальцев и не действует на V1-рецепторы гладкой мускулатуры кровеносных сосудов. В связи с этим на фоне приема препарата отмечаются минимальная сосудосуживающая активность и более выраженный и продолжительный антидиуретический эффект [16].
Среди лекарственных форм десмопрессина выделяют: таблетированную пероральную форму, таблетированную подъязычную форму и интраназальный спрей (табл. 2). При ЦНД средние терапевтические дозы таблетированного десмопрессина варьируют от 0,1 мг до 1,6 мг/сут, кратность приема составляет 2–3 р./сут. При употреблении таблетированной подъязычной формы начальная доза препарата — 60 мкг 2–3 р./сут, средняя суточная — от 60 до 360 мг/сут. При интраназальном введении препарата суточная доза — от 10 мкг до 40 мкг/сут, что обусловлено индивидуальной чувствительностью к препарату; кратность приема — 2 р./сут [7, 13].
При приеме таблетированной формы антидиуретический эффект наблюдается через 1–2 ч. Интраназальное введение обеспечивает более быстрое начало действия через 15–30 мин, т. к. введение препарата не связано с приемом пищи, что обеспечивает большую биодоступность [15]. Также быстрый терапевтический эффект отмечается при применении сублингвальной формы препарата, начало действия которой — 15–45 мин после приема. Интервал между приемом препарата и приемом пищи составляет 5–10 мин.
Необходимо учитывать, что прием пищи снижает абсорбцию препарата и его эффективность, поэтому рекомендовано принимать таблетированную форму препарата натощак за 30–40 мин до приема пищи или через 2 ч после него. Интраназальный спрей может применяться независимо от приема пищи у пациентов с различными заболеваниями ЖКТ, у больных в условиях реанимационных отделений. В то же время катаральные явления у пациентов существенно затрудняют лечение этой формой десмопрессина. Подъязычная форма введения препарата практически не связана с приемом пищи, легко титруется. Эта форма десмопрессина позволяет более точно подбирать необходимую дозу препарата.
При замене или при переходе с одной формы десмопрессина на другую производят перерасчет принимаемой дозы (табл. 3).
Заключение
В настоящее время для эффективного лечения пациентов с ЦНД используются различные формы десмопрессина. Только индивидуальный подбор препарата и титрация его дозы позволяют добиться клинической и лабораторной компенсации заболевания.
Литература
- Джон Ф. Лейкок, Питер Г. Вайс. Основы эндокринологии. М.: Медицина, 2000.
- Дзеранова Л.К., Пигарова Е. А. Минирин в лечении несахарного диабета // РМЖ. 2005.
-
Т. 13. № 28. С.1961–1965. -
Кочергина И. И. Несахарный диабет: избранные лекции по эндокринологии / Под. ред. А. А. Аметова. М.: Медицинское информационное агентство, 2009. С. 217–254. - Мельниченко Г.А., Петеркова В.А., Фофанова О. В. Диагностика и лечение несахарного диабета: метод. рекомендации. М., 2003.
- Пигарова Е.А., Дзеранова Л.К., Рожинская Л. Я. Центральный несахарный диабет: дифференциальная диагностика и лечение: метод. рекомендации. М., 2010.
-
Ball S. G. Vasopressin and disoders of water balance: the physiology and patophysiology // Ann. Clin. Biochem. 2007. Vol. 44. P. 417–431. -
Goldman M.B. et al. The influence of polydipsia on water excretion in hyponatremic, polydipsic, schizophrenic patients // J. Clin. Endocrinol. Metabol. 1996. Vol. 81 (4). P. 1465–1470. -
Goodfriend T.L., Friedman A.L., Shenker Y. Chapter 133. Hormonal regulation of electrolyte and water metabolism. Endocrinology, 5 th Edition / Ed. by De Groot L.J., Jameson J. L. Philadelphia: Saunders, 2006. Vol. 2. P. 1324–1367. - Laczi F. Diabetes insipidus: etiology, diagnosis and therapy // Orv. Hetil. 2002. Vol. 17.143 (46). P. 2579–2585.
- Maghnie M. Diabetes insipidus // Horm. Res. 2003. Vol. 59 (Suppl.). P. 142–154.
-
McKinley M.J., Jonson A. K. The physiological regulation of thirst and fluid intake // News Physiol. Sci. 2004. Vol. 19. P. 1–6. -
Nemergut E. C. Predictors of diabetes insipidus after transsphenoidal surgery a review of 881 patients // J. Neurosurg. 2005. Vol. 103. P. 448–454. -
Robertson G. L. Disorders of Neurohypophysis. // Harrisons Principles of Internal Medicine, edited by Braunwald E., Fauci A.S., Kasper D.L., Hauser S.L., Longo D.L., Jameson J. L. New York: Mc Graw-Hill, 2005. P. 2097–2101. -
Robinson A.G., Verbaliis J. G. Posterior pituitary. //Ch. 9 in William`s textbook of endocrinology, 11th ed. — Saunders, 2000.Vol. 2. P. 263–273. -
Sheehan J.M., Sheehan J.P., Douds G.L., Page R. B. DDAVP use in patients undergoing transsphenoidal surgery for pituitary adenomas //Acta Neurochir. (Wien). 2006. Vol. 148(3). P. 287–291. -
Vande Walle J., Stockner M., Raes A., Norgaard J. P. Desmopressin 30 years in clinical use: a safety review // Curr. Drug. Saf. 2007. Vol. 2 (3). P. 232–238. -
Verbalis J. G. Diabetes insipidus // Rev. Endocr. Metab. Disord. 2003. Vol. 4. P. 177–185. - Prager-Khoutorsky M., Bourque C. W. Osmosensation in vasopressin neurons changing acin density to optimize function // Trends Neurosci. 2010. Vol. 33 (2). P. 76–83.
.
Остерегайтесь покупателей
— Новости USC
Спортсмены, которые принимают добавку DHEA для повышения уровня тестостерона и улучшения результатов, могут на самом деле повышать уровень гормона, который потенциально может нанести вред простате, согласно исследователям из Медицинской школы им. Кека при Университете Южной Калифорнии.
DHEA, сокращенно от дегидроэпиандростерона, представляет собой гормон, который расщепляется на различные половые гормоны, включая тестостерон, который помогает наращивать мышцы.
Исследователи сообщают в мартовском выпуске журнала Fertility and Sterility, однако, тестостерон, созданный из DHEA, не остается долго в крови, а вместо этого быстро распадается на другие гормоны, связанные с ростом предстательной железы.
«Наше исследование показало, что прием ДГЭА не увеличивает уровень тестостерона, но увеличивает количество побочных гормонов — гормонов, которые потенциально вредны для простаты», — сказала Ребекка З. Сокол, профессор акушерства, гинекологии и медицины в школе Кек и старший автор статьи.
«Пользователи не только не получают тестостерон, но и могут получать что-то вредное в процессе».
Сокол отметил, что интерес к безрецептурным стероидным добавкам DHEA вырос после того, как бывший бейсболист Марк МакГвайр сказал, что использовал андростендион или андро, аналогичную таблетку для накачки мышц, чтобы помочь достичь своего исторического рекорда по количеству пробежек в 1998 году.
Молодые спортсмены легко могут получить DHEA в магазинах здорового питания и центрах питания в дозах 25 и 50 мг, хотя многие принимают 200 мг или более за один раз.
Сокол и его коллеги протестировали ДГЭА в случайном двойном слепом плацебо-контролируемом исследовании 12 здоровых мужчин в возрасте от 18 до 42 лет. Это было первое подобное исследование, в котором сравнивали промежуточную дозировку DHEA и относительно высокую дозу DHEA у мужчин пожилого возраста.
Каждый день в течение шести месяцев каждый мужчина принимал либо 50 мг DHEA, либо 200 мг DHEA, либо сахарную пилюлю.Исследователи проверили кровь на уровень различных гормонов (ДГЭА, сульфат ДГЭА, андростендион, тестостерон, эстрадиол, дигидротестостерон и глюкуронид 5а-андростан-3а-17b-диола, сокращенно АДГ).
Исследователи также выполнили многочисленные медицинские тесты и контролировали размер простаты мужчин с помощью цифровых исследований.
Команда обнаружила, что в течение шести месяцев регулярный прием ДГЭА — независимо от дозы — увеличивал уровень циркулирующих ДГЭА, сульфата ДГЭА и АДГ, циркулирующих в крови мужчин.
Сокол и ее коллеги ожидали повышения уровня тестостерона, но остались прежними. Уровни циркулирующих в крови андростендиона, эстрадиола и дигидротестостерона также существенно не изменились.
«Когда организм получает избыток ДГЭА, он, по-видимому, предпочтительно превращает ДГЭА в тестостерон, затем в ДГТ, а затем в АДГ», — сказал Сокол.
Тестостерон может быстро распадаться на ДГТ, который быстро распадается на более стабильный гормон АДГ.Повышенный уровень этого гормона продолжает циркулировать в крови.
Другие исследования показали, что АДГ является фактором роста простаты и может вызвать доброкачественную гипертрофию простаты, увеличение простаты, обычно наблюдаемое с возрастом у мужчин, сказала она.
Когда они проводили цифровые экзамены, исследователи школы Кека не обнаружили признаков увеличения предстательной железы, сказал Сокол, но продолжительность исследования, возможно, была слишком короткой, чтобы обнаружить увеличение.
Цифровая экспертиза также может не обнаружить изменений в размере.
Исследователи не уверены в потенциальных эффектах повышенного содержания ДГЭА и сульфата ДГЭА в крови.
«Возможно, ДГЭА сам по себе способствует развитию мышц, но это не подтверждено документально», — сказал Сокол. ДГЭА обычно вырабатывается надпочечниками.
Сокол отметил, что необходимы дальнейшие исследования специфических эффектов DHEA и подобных гормонов, которые классифицируются как пищевые добавки и не регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
«Маленькие дети старшего школьного и студенческого возраста принимают этот препарат, потому что думают, что он улучшит их спортивные результаты», — сказала она. «Но мало что известно о том, что на самом деле делает этот препарат».
Свяжитесь с Джоном Вайнером по телефону (323) 442-2830 или [email protected].
Имплантаты и их использование в производстве мясного скота
Опубликовано в марте 2017 г. | Id: AFS-3290
От
Дэвид Лалман
Термин «имплант» используется для обозначения группы продуктов, используемых в животноводстве.
которые увеличивают скорость и эффективность роста, как метаболического, так и экономического.Имплантаты
содержат натуральные или синтетические анаболические соединения, которые вызывают физиологические реакции
в животном похож на естественные гормоны. Имплантаты обычно изготавливаются из порошка.
который спрессован в небольшой шарик. Гранула помещается или имплантируется под
кожа на тыльной стороне уха животного. У каждого типа или марки имплантата есть
специальный аппликатор, называемый пистолетом для имплантации, который используется для правильного введения
имплант.
Текущее использование имплантатов
Имплантаты давно используются в мясном животноводстве. Первый рекламный ролик
имплант был представлен в 1957 году. С тех пор использование имплантатов стало широко распространенным.
принятые в секторе откорма крупного рогатого скота и животноводстве в мясной промышленности.В соответствии
По данным исследования, проведенного NAHMS в 2011 г., 92,3% всего крупного рогатого скота на откормочных площадках имплантируются на
хотя бы один раз на завершающей стадии.
В двух недавних исследованиях в Оклахоме приняли участие 729 производителей, получивших «Руководство по мясному скоту».
(Джонсон, 2008 г. и Вестал и др., 2007 г.). Тридцать семь процентов производителей телят
с более крупными операциями (более 100 коров) указали, что они имплантировали своих бычков,
в то время как только 9 процентов производителей телят с меньшими производственными мощностями (менее 100
коровы) имплантировали телят-бычков (Vestal et al., 2007). Примерно 60 процентов
животноводов имплантируют свой скот (Johnson, 2008). Фактически, 58,6%
крупный рогатый скот с определенных животноводческих хозяйств почти всегда имплантировал своих бычков,
в то время как только 28,8% бычков животноводческих хозяйств, в которых входил теленок,
компонент был имплантирован. Данные Национального исследования Стокера 2008 года показали, что 78,6
процент животноводческих хозяйств с более чем 1000 голов имплантируют скот, выпадение
до 52.7 процентов в операциях с менее чем 200 складскими запасами.
Типы имплантатов
Компаунды, используемые в имплантатах, делятся на две основные категории. Эстрогенные соединения
имитировать эффекты естественного гормона эстрогена. Бензоат эстрадиола,
эстрадиол 17-бета и зеранол являются эстрогенными соединениями.Как вариант, андрогенный
соединения имитируют действие естественного гормона тестостерона. Тестостерон
пропионат и тренбалона ацетат (ТВА) являются основными используемыми андрогенными соединениями.
в имплантатах. Синтетический прогестерон также используется в имплантатах; однако его эффект
на животном менее выражен, чем у двух других типов соединений. В таблице 1
список комбинаций соединений и дозировок, поставляемых в коммерчески доступных
имплантаты.
Все имплантаты предназначены для медленного высвобождения соединений со временем в кровоток.
животного. Разные имплантаты рассчитаны на разный срок службы.
для всех соединений, которые будут высвобождены. Этот эффективный период или продолжительность жизни
имплантат обычно называют периодом «выплаты».Обозначьте утверждения диапазона выплат
от 60 дней до 400 дней. Факторы, влияющие на выплату, включают форму имплантата,
правильное введение имплантата и приток крови к уху.
Влияние имплантатов на продуктивность мясного скота
Кормящие телята
Продукция
Implant доступна для телят весом менее 400 фунтов.Имплантаты
разрешено использовать для кормления телят, содержат более низкую дозу активного ингредиента по сравнению с
к продуктам, разрешенным для использования с более старым скотом. Эти имплантаты обычно вводят
телятам от двух до четырех месяцев. Исследования показали
что имплантаты, введенные во время фазы кормления, увеличивают среднесуточный прирост (ADG)
телят-бычков примерно на 0.10 фунтов в день. Отклик у телок незначительно
ниже. Имплантаты с церанолом и эстрадиолбензоатом / прогестероном, по-видимому, слегка
лучший ответ, чем у продуктов с эстрадиолом 17-бета. Большинство имплантатов для теленка предназначены для
выплата примерно от 100 до 120 дней. В некоторых случаях сосательный
период достаточно длительный, чтобы можно было провести повторную имплантацию. Имплантированные бычки
дважды с имплантатами зеранол или эстрадиолбензоат / прогестерон набрал примерно
0.На 12 фунтов в день больше, чем у не имплантированных контрольных животных. Дополнительный имплант
не оказал такого же эффекта, как первоначальный имплант.
Телятам должно быть от 30 до 45 дней до имплантации. Предназначены бычки
для разведения не следует имплантировать. Телята-бычки, не предназначенные для разведения, должны
быть кастрированным во время имплантации, так как возможно подавление одного эффекта имплантата
развитие мошонки, что затрудняет последующую кастрацию.
Stocker Calves
Телята, которых отнимают от груди и помещают на травяные или мелкозерновые пастбища на период
Время до откорма откорма на откормочной площадке называется телят поголовья. Есть несколько
доступны имплантаты для телят племенного скота (Таблица 1). Испытания имплантатов показали
улучшение ADG крупного рогатого скота с 8 до 20 процентов.Многочисленные
испытания показывают, что производители могут ожидать от 10% до 15% (0,18 фунта
в день до 0,27 фунтов в день) улучшение ADG по сравнению с неимплантированным контролем. Эти
исследования проводились в течение различных периодов времени, но в среднем было приблизительно
150 дней, что является типичным периодом выпаса скота. Результаты исследований неубедительны
относительно ценности одного типа соединения над другими.
AFS-3290 Таблица 1. Имплантаты, доступные для телят Stocker.
Выплата за имплантаты Stocker обычно составляет от 80 до 100 дней, хотя
несколько продуктов доступны с гораздо более длительными периодами выплаты. Повторная имплантация чулок
следует учитывать, если период выпаса превышает 120 дней, этикетка имплантата
указывает период выплат менее 120 дней и ожидаемый ADG в течение второго
фаза пастбищного периода умеренная или высокая.Повторная имплантация в этих ситуациях
дала улучшение ADG на 4-6% по сравнению с одним имплантатом. В качестве альтернативы,
имплантаты, рассчитанные на более длительный срок окупаемости, могут использоваться в качестве первоначального и единственного имплантата.
чтобы обеспечить активный имплантат в течение длительного пастбищного сезона. Это устранило бы
необходимо собирать и обрабатывать животных в разгар пастбищного сезона. Факторы
влияющих на реакцию запасных частей на имплантаты, многочисленны и включают пол, вес, генетические особенности.
потенциал роста, доступность кормов, качество рациона, добавки и окружающая среда
условия.Исследования показали, что по мере увеличения ADG неимплантированного контроля (из-за
на качество пастбищ или другие факторы), реакция на имплант также увеличивается. Нет
были зарегистрированы побочные эффекты от имплантации крупного рогатого скота, который
тарифы. Исследования показали, что реакция на имплантаты, добавки и ионофоры
являются 100-процентной добавкой для крупного рогатого скота, и может иметь небольшой синергетический эффект
отношение.Следует ожидать полной пользы как от имплантата, так и от добавки.
программа, если оба используются для крупного рогатого скота.
Откормочная площадка крупного рогатого скота
Имплантаты
широко используются в индустрии кормления в США для улучшения ADG и
эффективность корма. Срок завершения может составлять от 120 до 240 дней.Один
имплантат может улучшить ADG на 0,35 фунта в день у бычков и 0,25 фунта в день у бычков.
телки. Конверсия корма может быть улучшена на 0,5 фунта корма на фунт прироста. Агрессивный
(высокая анаболическая концентрация) программы имплантации откормочных площадок могут привести к 21%
улучшение суточного прироста и повышение конверсии корма до 11 процентов.
Повышенная эффективность и увеличение веса дают значительную экономическую отдачу.Программа имплантации для откорма крупного рогатого скота должна учитывать множество факторов, в том числе:
решения относительно времени установки имплантата, ингредиента имплантата и количества имплантата
раз.
Имплантаты могут оказывать сильное влияние на характеристики туши крупного рогатого скота. В общем,
когда скот кормят одинаковое количество дней, имплантаты улучшают вес туши и рибай
области, уменьшая при этом показатели мраморности.В этих условиях имплантаты могут уменьшить
процентная доля крупного рогатого скота, оценивающего по крайней мере USDA Choice от 2 до 24 процентов.
Имплантаты также могут немного увеличить зрелость скелета, что также влияет на качество USDA.
Оценка. Тип имплантата, пол и генотип животного влияют на эти реакции.
Однако, если крупный рогатый скот выращивается при постоянной толщине подкожного жира, имплантаты могут иметь
практически не влияет на оценку качества.Для полного обзора эффектов имплантата откормочной площадки,
см. Duckett et al., 1997.
Телята-кормилицы против телят-кормилиц
Многие производители придерживаются практики оставлять телят нетронутыми до отъема.
чем их кастрировать. Идея состоит в том, что в яичках вырабатываются естественные гормоны.
увеличить ADG и вес телят при отъеме.Многочисленные исследования показали, что
которые имплантированные бычки прибавляют со скоростью, равной или большей, чем у бычков.
Кастрация быков как маленьких телят, а не в более зрелом возрасте, снижает общий
нагрузка на икры. Стресс и гормональные эффекты кастрации при отлучении от груди могут уменьшить
потенциал роста после отъема и способность теленка обычно противостоять болезням
связанных с отлучением от груди и маркетингом.Эта разница в производительности после отъема
быков по сравнению с бычками признается покупателями крупного рогатого скота, о чем свидетельствует тот факт, что
бычки будут требовать надбавки от 5 до 10 долларов за центнер по сравнению с интактными бычками. Продюсеры
желая максимизировать ценность телят-самцов при отъеме, следует рассмотреть возможность ранней кастрации
при рождении или в возрасте от двух до четырех месяцев и использовать имплантат, одобренный для кормления
телят.
Пожизненные стратегии имплантации
В современной мясной промышленности довольно часто крупный рогатый скот получает три или более
имплантаты в течение срока их службы. Для производителей, которые работают только в одном сегменте
промышленность, решение об имплантации простое. Однако для производителей, которые сохраняют право собственности
животного через две или более фаз и сбыт крупного рогатого скота по цене за тушу
сетки, решения по имплантации становятся более сложными.Вполне возможно, что имплантаты введены
в одной фазе может иметь эффект переноса в последующих фазах, однако во многих исследованиях
этот эффект переноса не материализовался (Reuter and Beck, 2013). Утвержденные имплантаты
для телят-сосунов менее эффективны, чем одобренные для животноводческих хозяйств, которые менее эффективны.
мощнее, чем многие имплантаты откормочной площадки. Стратегия максимального увеличения прироста жизни животного
в то время как сведение к минимуму вредного воздействия на качество туши и поведение животных является
программа имплантации с использованием все более мощных имплантатов.Во время фазы кормления грудью низкий
будет использоваться имплантат потенции, а затем один или два умеренных имплантата в растущем
фаза, за которой следует умеренный имплант при размещении на кормовом дворе, а затем
имплантат высокой активности от 80 до 100 дней до убоя. Эффекты нескольких
имплантаты с оценкой мраморности могут стать более драматичными, поскольку три или более имплантата
используется в течение жизни животного.Производители, сохраняющие право собственности на животных через
более чем на одном этапе производства следует оценить общую программу имплантатов для
как они продают свой скот. Факторы, которые следует учитывать, — это стоимость корма, базовая
значение дополнительного веса туши, разброс Choice-Select и потенциальная стоимость
маркетинга крупного рогатого скота в специализированные программы для крупного рогатого скота без гормональной обработки (NHTC).
Имплантация ремонтных телок
Производители часто задают вопрос: «Безопасно ли имплантировать ремонтных телок?» Исследовать
показала, что телкам, предназначенным для использования в качестве племенных животных, можно имплантировать
время между 45-дневным возрастом и отлучением от груди без значительного влияния на последующее зачатие
нормы или трудности отела.Телки, имплантированные сразу при рождении, после отъема
или несколько раз до отъема имели значительно более низкие показатели зачатия по сравнению с
телкам, получившим один имплант перед отъемом.
Большинство производителей должны уметь определять потенциальных ремонтных телок при отъеме.
Затем производитель может имплантировать телок для увеличения прироста, а не имплантировать.
телки, предназначенные для разведения.См. Главу 29 для более подробного обсуждения
имплантация ремонтных телок.
Экономика
Имплантаты — одна из самых экономичных технологий, доступных животноводам.
Имплантаты Stocker обычно приносят более 15 долларов на каждый вложенный доллар. Имплантаты
эффективно увеличить скорость роста, увеличить отложение белка и повысить эффективность корма
что приводит к общему снижению затрат на производство говядины примерно на 7%.
(Лоуренс и Ибарбуру.). Кормящий теленок, имплантированный в возрасте трех месяцев и 150 лет.
за несколько дней до отлучения можно ожидать увеличения стоимости с 15 до 30 долларов.
Гарантия качества говядины
Расположение имплантата
Единственное одобренное место для имплантации имплантатов всех марок — подкожно в
средняя треть задней части уха.Имплант не должен быть ближе к
голова, чем край ушного хрящевого кольца, наиболее удаленный от головы. Процедура
Установка имплантата должна производиться в максимально санитарных условиях. Уборка
рекомендуется содержать ухо, содержать оборудование в чистоте и использовать острую иглу. Проблемы
абсцессы уха являются наиболее частой причиной дефектов имплантата и обычно связаны
к плохой санитарии при имплантации.Правильное удерживание животных делает имплантацию
размещение более точное, а процедура более безопасная для обслуживающего персонала. Следите за всеми производителями
рекомендации по установке имплантата.
На рис. 1 показано правильное расположение. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) больше не
позволяет устанавливать имплантаты у основания уха.
Рисунок 1. Правильное расположение имплантатов.
Процедура имплантации
Имплантация должна выполняться квалифицированным и обученным специалистом.Трудоустройство
следующие шаги значительно уменьшат вероятность ошибок имплантации, таких как
в виде абсцессов, раздавленных гранул или отсутствующих имплантатов. Достижение активного, неповрежденного
незагрязненный имплантат в каждой икре — цель. Скорость придет с практикой; Это
Лучше сделать это правильно с первого раза, чем возвращаться и исправлять ошибки.
Точно так же гораздо лучше найти время и сделать все правильно, чем платить за имплант.
и не реализовать преимущество от 20 до 30 долларов на человека, потому что работа была сделана неправильно.
- Прочтите этикетки всех продуктов для здоровья животных. Обеспечьте правильную дозировку, местоположение
и процедуры соблюдаются. Убедитесь, что продукт маркирован для использования в классе
животное, которому он вводится. Любое отклонение от указаний на этикетке влечет
возможность суровых правовых санкций и должна быть направлена лицензированным ветеринаром
(Фигура 2).Рисунок 2.
- Приобретите все необходимое оборудование для поддержания санитарии. Поднос и большая губка
пропитанный дезинфицирующим средством, следует использовать для хранения аппликатора имплантата между использованиями.
Дополнительная игла для аппликатора должна быть доступна на тот случай, если игла станет
тупой, зазубренный, изогнутый или сломанный. Чистый стол вдали от летящего мусора должен
использоваться для хранения аппликатора и имплантатов между использованиями (рис. 2). - Ознакомьтесь с работой аппликатора имплантата.
- Правильно удерживайте животное, чтобы оно не двигалось. При необходимости дополнительно ограничить
голову с помощью недоуздка (рис. 3).Рисунок 3.
- Осмотрите ухо животного.Проверьте наличие предыдущих имплантатов или абсцессов, наличие уха
бирки или отверстия для ушных бирок, грязь, навоз или другой мусор. Очистите и высушите область имплантата.
соскребая лезвием ножа или протирая бумажным полотенцем и дезинфицирующим средством (Рис.
4). Не пытайтесь имплантировать через грязь или навоз. Если имплант присутствует, не
реимплант.Рисунок 4.
- При необходимости вытрите руки перед тем, как брать аппликатор.Грязь, навоз и кровь
может загрязнить внутренние части аппликатора. - Протрите иглу через губку, чтобы продезинфицировать ее. Протяните кончик иглы поперек
губка скосом вниз к губке, чтобы очистить любой материал
внутри иглы (Рисунок 5).Рисунок 5.
- Зажмите кончик уха животного между большим и указательным пальцами левой руки.
(для левого уха).Приложите кончик иглы аппликатора к уху с небольшим усилием.
угол, скошенной стороной вверх или в сторону от уха, на внешнем крае зоны имплантата (Рис.
6).Рисунок 6.
- Вставьте иглу под кожу уха и вставьте ее полностью. Убедитесь, что он находится под
кожа, а не хрящ и не проколота на всем протяжении уха.Если
игла ускользает от задней части уха, вернитесь к шагу 7. Грязь или другой мусор.
скорее всего, он застрял в скосе иглы, и, если его не очистить, будет имплантирован
в ухо с имплантатом при следующей попытке. Использование острых игл и замедление
вниз может уменьшить пропуски. - Выдвиньте иглу из уха примерно на длину имплантата.Некоторый
модели аппликаторов имплантатов имеют иглы, которые автоматически отводят иглу. - Нажмите на спусковой крючок, чтобы установить имплантат, и полностью выньте иглу.
- Пощупайте место имплантата, чтобы убедиться, что гранулы правильно отложены, а не сгруппированы
вверх или раздавлен (Рисунок 7). Если да, проверьте снаряжение, как следует удерживайте животное и
замедлять.Рисунок 7.
- Верните аппликатор в лоток и протрите губкой, чтобы продезинфицировать ее.
Другие проблемы
- Имплантаты не требуют убойного удаления, так как ухо всегда удаляется как отходы во время
процесс убоя. - Никакие имплантаты не разрешены для использования в классах крупного рогатого скота, кроме телят, поголовье и
откормочные животные. Это включает племенных животных, выбракованных коров, молочного скота и телятины.
телят. - Имплантаты нельзя вводить при рождении из-за гормонального развития теленка.
В инструкциях на этикетке указывается минимальный возраст для введения 30 или 45 дней.
имплантатов теленка, в зависимости от имплантата. - Имплантаты следует хранить должным образом для поддержания эффективности. Хранить в чистом, сухом
поместите в герметичный пластиковый пакет, чтобы не допустить попадания влаги и мусора. См. Этикетку для
температура хранилища. - Если возможно, имплантируйте скотину в засушливые дни, когда скот сухой и свободен от грязи. Этот
снизит частоту возникновения абсцессов. - Один производитель имплантатов предлагает линейку имплантатов, которые включают как анаболические, так и анаболические
составная гранула и гранула, содержащая дозу антибиотика ТиланTM. Цель
гранулы антибиотика растворяется вскоре после приема и снижает частоту
абсцессов в месте имплантации.
Безопасность имплантатов
Здоровье животных
Предполагается, что имплантаты напрямую вызывают или могут быть связаны с несколькими нежелательными
изменения у животных.Ответы, обычно связанные с репродуктивными процессами,
наблюдается у телок, включая признаки течки, выпадения влагалища или прямой кишки, развитие
вымени и другие проблемы. Имплантаты могут увеличить частоту появления пузырей в
рулит. Буллеры — это бычки, которые будут устанавливаться аналогично поведению
корова в течке. Однако считается, что травля вызвана физиологическими причинами.
дефект животного и имплантаты лишь усугубляют это состояние.Оценки
Частота появления буллеров колеблется от 1 процента до 4 процентов.
Безопасность пищевых продуктов
Таблица 2 показывает эстрогенную активность продуктов, обычно потребляемых в США. Говядина.
от бычков и телок, скармливаемых на убой, имеют очень низкий уровень эстрогенной активности,
независимо от статуса имплантата.Фактически, мороженое содержит в 553 раза больше эстрогена.
чем говядина. Безопасность имплантатов гарантируется, если продукты, одобренные FDA, используются в соответствии с
к их этикеткам. История и несколько организаций, включая, помимо прочего,
FDA США, Всемирная организация здравоохранения и Продовольственная и сельскохозяйственная организация
пришли к выводу, что использование имплантатов в производстве говядины не представляет опасности для
потребители.
Таблица 2 . Эстрогенная активность нескольких распространенных продуктов.
| Пищевые эстрогенные | Действия a | |
|---|---|---|
| Масло соевое | 1000000 | |
| Капуста | 12000 | |
| Зародыши пшеницы | 2000 | |
| Горох | 2000 | |
| Яйца | 17500 | |
| Мороженое | 3000 | |
| Молоко | 65 | |
| Говядина от стельной коровы | 700 | |
| Говядина от имплантированного КРС | 11 | |
| Говядина неимплантированного КРС | 8 |
a Нанограмм эстрогена на 500 граммов пищи.Источник: Престон.
Список литературы
Джонсон, Р. (2008) Принятие рекомендуемых методов управления животноводческим скотом
Производство. РС. Тезис. Государственный университет Оклахомы.
Kuhl, G.L. (1997) Stocker Cattle Responses to Implants.Ход работы: Воздействие имплантатов
по продуктивности и туше мясного скота. Государственный университет Оклахомы, P-957.
Стр. 51.
Лоуренс, Джон Д. и Маро А. Ибарбуру. Государственный университет Айовы. http://econ2.econ.iastate.edu/faculty/lawrence/documents/GET7401-LawrencePaper.pdf
Мадер Т. (1997) Перенос и пожизненные эффекты стимулирующих рост имплантатов.Ход работы:
Влияние имплантатов на продуктивность и ценность туши мясного скота. Оклахома Стэйт
Университет, P-957. Стр.88.
Paisley, S.I. et al. (1997) Влияние имплантатов на производительность бычков, перезимовавших в сухую погоду.
в родной прерии Таллграсс. Отчет об исследованиях в области зоотехники, Государственный университет Оклахомы.
Престон Р. (1997) Обоснование безопасности имплантатов.Ход работы: Воздействие имплантатов
по продуктивности и туше мясного скота. Государственный университет Оклахомы, P-957.
Стр. 199.
Рейтер, Р. Р. и П. А. Бек (2013). Междисциплинарный симпозиум Южной секции по говядине:
Эффект переноса систем крупного рогатого скота на продуктивность откормочной площадки и характеристики туши.
Журнал зоотехники.Том 91, стр. 508.
Selk, G. (1997) Имплантаты для молочных бычков и телят и их потенциальная замена
Телки. Ход работы: влияние имплантатов на производительность и ценность туши говядины
Крупный рогатый скот. Государственный университет Оклахомы, P-957. Стр. 40.
USDA-NAHMS. Тенденции в здравоохранении и практике управления на U.С. Откормочные площадки, 1994-2011 гг.
(Июль 2013 г.) Национальная система мониторинга здоровья животных, Департамент США
Сельское хозяйство.
Vestal, M. et. al. (2007) Практика производства коров и телят в Оклахоме — Часть I. OSU
Информационный бюллетень по расширению AGEC-245, Служба по расширению кооперативов Оклахомы, штат Оклахома
Университет.
Веттеманн, Р.П. и Ф. Леман (1997) Буллер Стирс — Причины и меры борьбы. Ход работы:
Влияние имплантатов на продуктивность и ценность туши мясного скота. Оклахома Стэйт
Университет, P-957. Стр.123.
Райан Рейтер,
Диетолог для мясного крупного рогатого скота
Gant Mourer
Помощник специалиста по расширению
Дэвид Лалман
Специалист по мясному скоту
Крис Ричардс
Специалист по мясному скоту
Была ли эта информация полезной?
ДА НЕТ
Проблемы и соображения по обнаружению цен на крупный рогатый скот в ФРС
Настоящий отчет был подготовлен по заказу Национальной ассоциации животноводов с целью предоставления рекомендаций в поддержку соображений политики в области животноводства, особенно в связи с открытием цен на рынках откорма крупного рогатого скота.Целевая группа экономистов-аграрников, которая подготовила этот отчет, имеет более чем 120-летний опыт работы в качестве экономических аналитиков и исследователей в области животноводства. Примерно за три недели эта целевая группа собрала, рассмотрела, обобщила и обобщила имеющиеся исследования, информацию и знания об экономике животноводства.
Мясной скот Финансы животноводства и ранчо
ПОСМОТРЕТЬ ВСЕ
Стресс и иммунологическая реакция телок, по разному оцениваемых по остаточному потреблению корма, после провокации адренокортикотропным гормоном | Journal of Animal Science and Biotechnology
Все процедуры с участием животных в этом исследовании проводились в соответствии с экспериментальной лицензией Министерства здравоохранения и детей Ирландии в соответствии с Законом о жестоком обращении с животными 1876 г. и Европейскими сообществами (Поправка к Закону о жестоком обращении с животными 1876 г.) ) Постановление 2002 и 2005 гг. (Http: // www.dohc.ie/other_health_issues/uaeosp).
Содержание животных и определение RFI
Данные по продуктивности и RFI были собраны на 34 отъемных телках симментальской породы, которые были потомками хорошо охарактеризованного и дивергентно разводимого стада коров-сосунков RFI, созданного в Teagasc Grange, как описано [12,13, 14]. На этапе после отъема индивидуальное ежедневное потребление корма регистрировалось для телок (средняя начальная масса тела = 299 ± 4 кг, средний начальный возраст = 258 ± 27 дней) в течение 91-дневного периода, после чего для каждого рассчитывались коэффициенты RFI. животное.Телок содержали в здании с решетчатым полом с системой кормления Calan gate (American Calan Inc., Northwood, NH), и им давали период адаптации в течение 14 дней для адаптации к их рациону и окружающей среде перед началом регистрации индивидуального потребления (период измерения RFI). . Телкам индивидуально предлагали травяной силос и 2 кг концентрата один раз в день (в 08:00). Предлагаемый концентрат содержал 430 кг проката ячменя, 430 кг свекольного жома, 80 кг соевого шрота, 45 кг патоки и 15 кг минералов и витаминов на тонну.Количество травяного силоса рассчитывалось примерно в 1,1 раза больше, чем в предыдущий день. Химический состав и усвояемость сухого вещества in vitro предлагаемого травяного силоса и концентрата приведены в Таблице 1.
Таблица 1 Химический состав диетических ингредиентов, предлагаемых в течение экспериментального периода остаточного потребления корма
Телок взвешивали (перед кормлением) два дня подряд в начале и в конце периода измерения RFI и каждые 21 день в течение экспериментального периода.Среднесуточный прирост был рассчитан как коэффициент линейной регрессии веса (кг) во времени с использованием процедуры REG системы статистического анализа (SAS Institute Inc., Кэри, Северная Каролина). Метаболическая масса тела в середине теста (MBW) оценивалась из точки пересечения и наклона линии регрессии после аппроксимации линейной регрессии по всем наблюдениям за метаболической массой тела (BW 0,75 ). Коэффициент конверсии корма (F: G ) для каждого животного рассчитывали как отношение дневного DMI к ADG.Остаточное потребление корма рассчитывали для каждого животного как разницу между фактическим и ожидаемым DMI. Ожидаемый DMI был рассчитан для каждого животного с использованием модели множественной регрессии, регрессируя DMI на MBW и ADG. Используемая модель:
$$ {\ mathrm {Y}} _ {\ mathrm {j}} = {\ upbeta} _0 + {\ upbeta} _1 {MLW} _ {\ mathrm {j}} + {\ upbeta} _2 {ADG} _ {\ mathrm {j}} + {\ mathrm {e}} _ {\ mathrm {j}}, $$
Где Y j — средний DMI j-го животного, β 0 — пересечение частичной регрессии, β 1 — коэффициент частичной регрессии на MBW 0.75 , β 2 — коэффициент частичной регрессии на ADG, а e j — неконтролируемая ошибка j-го животного. Коэффициент детерминации ( R
2 ) из этой модели было равно 0,66 ( P <0,001), и впоследствии модель была использована для прогнозирования DMI для каждого животного.
Телки были выпущены на пастбище после окончания экспериментального периода RFI. В течение всего пастбищного сезона (7 мес.) Телок выпасали поочередно как одну группу при умеренной поголовье на преимущественно многолетнем райграсе ( Lolium perenne L.) выпас до содержания в конце октября, когда закончился пастбищный сезон [среднее значение ADG 0,80 кг / день (SEM = 0,03)]. Для эксперимента с физиологическим стрессом — 12 наивысших [среднее (0,48 ± 0,08) кг / день]; Высокий RFI и 12 самых низких [среднее — (0,50 ± 0,08) кг / день]; Были выбраны животные с низким рейтингом RFI после отъема.
Катетеризация яремной вены
Во время стрессовой нагрузки АКТГ 24 телки (средний возраст 605 ± 13 дней; средний вес 516 ± 31,4 кг) были помещены в помещение с решетчатым полом и им предложили силос из травы ad libitum . Начальный вес ( P = 0,52) и возраст ( P = 0,88) не различались между группами с высоким и низким RFI. В рамках стандартной практики содержания и управления исследованиями животных приучили к животноводам и рутинному обращению примерно за 14 дней до введения АКТГ. Чтобы облегчить интенсивный сбор крови и минимизировать стресс при манипуляциях во время забора крови, телкам в асептических условиях устанавливали постоянные яремные катетеры на d -1. Для процедуры использовались спинальные иглы Anes 12-го калибра (Popper and Sons, Inc., New Hyde Park, NY) и поливиниловую трубку (внутренний диаметр приблизительно 1,47 мм; Ico Rally Corp., Пало-Альто, Калифорния; каталожный номер SVL 105–18 CLR), прикрепленный к игле 18 калибра на конце забора крови. После катетеризации проходимость катетера поддерживалась промывкой 3,5% цитратом натрия после каждого взятия крови.
Проба АКТГ
Исследовали ответ коры надпочечников на стандартизованную дозу АКТГ (1,98 МЕ / кг метаболической массы тела 0,75 ). Доза, выбранная для экзогенного АКТГ, была ранее установлена нашей группой [15] как эффективная для адекватного стимулирования ответов HPA, с результирующим повышением уровня кортизола, недостаточным для отрицательного воздействия на здоровье животных.Дексаметазон (20 мкг / кг массы тела; Faulding Pharmaceuticals Plc, Великобритания) вводили внутримышечно (в / м) в день -1, за 12,40 ч до заражения телок АКТГ (Synacthen Ampoules, Novartis Pharmaceutical Ltd., Великобритания) на следующее утро (d 0). У крупного рогатого скота DEX быстро всасывается, и Toutain et al. Сообщили о периоде полувыведения DEX. до составляет от 291 до 335 мин [16, 17]. Дексаметазон вводили для выравнивания системных концентраций кортизола [9] у животных в группах RFI, чтобы облегчить более справедливое исследование АКТГ на высвобождение кортизола [18, 19].
В день 0 серийные пробы гепаринизированной крови были собраны при -40, -20, 0, 20, 40, 60, 80, 100, 120, 150, 180, 210, 240, 270, 300, 330 и 390 мин. относительно времени введения АКТГ каждой телке. Образцы плазмы отделяли центрифугированием при 1600 × g при 8 ° C в течение 15 минут и затем хранили при -20 ° C до анализа.
Концентрация кортизола определялась для всех телок во все моменты времени забора крови, тогда как концентрация АКТГ определялась только в моменты времени забора крови -40, -20, 20, 80, 120, 180 и 390 мин относительно введения АКТГ.Концентрацию кортизола в плазме определяли с помощью наборов Correlate-EIA от Assay Designs (Ann Arbor, MI, USA). Коэффициенты вариации (CV) между анализами и внутри анализов составили 6,25% и 4,89% соответственно. Концентрации АКТГ в плазме измеряли с помощью радиоиммуноанализа на АКТГ человека с двумя антителами (RIA; DiaSorin Inc., Стиллуотер, Миннесота, США), ранее утвержденного для бычьего АКТГ [15]. CV между анализами и внутри анализа составили 8,85% и 7,67% соответственно.
Гематология
Дополнительный образец крови собирали в вакуумированную пробирку объемом 6 мл, содержащую K 3 ЭДТА при -40, -20, 0, 20, 80, 150, 270, 330 и 390 мин относительно введения CRH. для определения показателей гематологии крови; Были определены количество лейкоцитов (WBC), количество эритроцитов (RBC), концентрация гемоглобина (HGB), процент гематокрита (HCT%), количество тромбоцитов (PLT) и общее количество циркулирующих нейтрофилов, лимфоцитов, моноцитов, эозинофилов и базофилов. в течение 1 часа после сбора в соответствии с процедурами, описанными Lynch et al.[19].
Статистический анализ
Данные были проверены на нормальность и однородность дисперсии с помощью гистограмм, графиков QQ и формальных статистических тестов в рамках процедуры UNIVARIATE SAS (версия 9.1.3; SAS Institute, 2006). Данные, которые не были нормально распределены, были преобразованы путем возведения переменной в степень лямбда. Соответствующее значение лямбда было получено путем проведения анализа преобразования Бокса-Кокса с использованием процедуры TRANSREG SAS. Преобразованные данные использовали для расчета значений P .Соответствующие средние значения наименьших квадратов и SE непреобразованных данных представлены в результатах для ясности. Чтобы оценить реакцию с течением времени для плазменных концентраций кортизола, АКТГ и гематологических переменных, они были проанализированы с использованием ANOVA с повторными измерениями (СМЕШАННАЯ процедура), с условиями для группы RFI, времени кровотечения, пера и их взаимодействия, включенных в модель. Исходные плазменные концентрации телок (среднее значение -40, -20 и 0 мин до введения АКТГ для кортизола и гематологических переменных и -40 и -20 для концентрации АКТГ в плазме) были включены в качестве ковариант.Тип используемой ковариационно-дисперсионной структуры был выбран в зависимости от величины информационного критерия Акаике (AIC) для моделей, работающих в условиях сложной симметрии, неструктурированных, авторегрессионных, гетерогенных авторегрессионных 1-го порядка или дисперсионно-ковариационных структур Теплица. Была выбрана модель с наименьшим значением AIC. Различия между средними значениями для двух групп RFI определялись тестами F с использованием суммы квадратов типа III. Опция PDIFF и тест Тьюки применялись при необходимости для оценки парных сравнений между средними значениями группы RFI.Вероятность P <0,05 была выбрана в качестве уровня значимости, и статистические тенденции были зарегистрированы, когда P <0,10. Коэффициенты корреляции Спирмена между признаками определяли с помощью PROC CORR SAS.
Средний дневной прирост
Целевой уровень обучения / возрастной диапазон:
9–12 th Классы
Время:
55 минут
Виртуальное обучение:
Используйте этот документ, чтобы преобразовать урок в виртуальный учебный модуль для ваших учеников.Используйте описанные шаги для создания различных элементов Google Classroom или другой платформы онлайн-обучения. Вы также можете отправить шаги непосредственно учащимся в формате PDF, представить их на виртуальной встрече или подключить их к любой другой системе виртуальных учебных модулей.
Цель / задача:
Учащиеся будут использовать данные об привесе домашнего скота для построения и интерпретации линейных графиков.
Материалы:
- 10 игрушечных животных или изображений мясного скота, пронумерованных 1-10
- 10 игрушечных свиней или изображений свиней, пронумерованных 1-10
- 10 игрушечных цыплят или изображений цыплят, пронумерованных 1-10
- листов миллиметровая бумага с “квадратами.
- Линейки
Словарь (с определениями)
- Средний дневной прирост — вес животного, деленный на количество дней на корме, чтобы представить вес в фунтах, набираемый этим животным каждый день
- Наклон / Форма пересечения — уравнение прямой в виде y = mx + b, где m — наклон прямой, а b — ее точка пересечения с y.
- Линия наилучшего соответствия — прямая линия, которая наилучшим образом представляет данные на диаграмме рассеяния.Эта линия может проходить через некоторые точки, ни одну из точек или все точки.
Подход по интересам или мотиватор:
- До прихода студентов скопируйте данные по каждому животному из таблицы данных корма в Excel на отдельные листы бумаги. Пронумеруйте фигурки бычков, свиней и говядин, чтобы у каждого животного был свой набор данных.
- Студенты войдут в класс и выберут из фигурки курицу, свинью или говяжьего бычка. Затем они соберут листок бумаги с данными о своем животном.
Предпосылки — Сельскохозяйственные связи:
Эффективность мясных животных можно рассчитать несколькими способами. Один из них — со среднесуточным привесом (ADG), то есть просто днями кормления / изменения веса. Для фермеров ADG показывает, насколько быстро животное набирает вес. Чем быстрее животное прирастет, тем быстрее оно будет готово к выпуску на рынок, что может снизить производственные затраты.
ADG мясного скота, свиней и кур значительно улучшился за последние 50 лет. В 1950 году был ADG для кур.044, а в 2014 году — 0,129. Это увеличение указывает на улучшение генетики и питания домашнего скота. На ADG могут влиять здоровье животных, питание животных, рационы питания, среда обитания животных и другие внешние факторы, а также генетика животного.
Способность животных быстро набирать вес является ключом к выработке достаточного количества белка, чтобы прокормить растущий средний класс. По мере того, как животные становятся более продуктивными, предложение мяса увеличивается, и, следовательно, общая цена снижается. Сельское хозяйство должно работать, чтобы к 2050 году обеспечить питательными продуктами питания более 9 миллиардов человек, поэтому повышение продуктивности животноводства очень важно.
Продуктивность мясного скота может быть повышена с помощью имплантатов синтетических гормонов. Эти небольшие имплантаты вводятся в ухо и растворяются после высвобождения всего гормона. Гормональные имплантаты заменяют часть выработки гормонов, потерянную после кастрации, без агрессивности или плохого качества мяса. Имплантированная говядина содержит очень небольшое количество дополнительных эстрогенов и прогестерона в мясе.
Процедуры (основные моменты, пошаговые задания и полное содержание, которое будет представлено учащимся)
- Учащиеся будут использовать данные на своем листе бумаги, чтобы построить набор осей и нанести данные 10 точек.Дни будут указаны на оси абсцисс, а вес — на оси ординат.
- Учащиеся нанесут точки на свой график.
- Затем учащиеся начертят на миллиметровой бумаге наиболее подходящую линию. После того, как эта линия будет нарисована, учащиеся должны выбрать две точки, чтобы написать уравнение наиболее подходящей линии.
- Затем учащиеся предсказывают значения y для шести точек, выбирая 3 значения x, которые меньше максимального значения x, и 3 значения x, которые больше максимального значения x.
- После того, как каждый ученик заполнит свой график, попросите учеников поделиться своими выводами с классом.Запишите уравнение каждого учащегося для определения наилучшей линии на доске. Попросите учащихся использовать свои данные для расчета среднего дневного прироста за каждый период (каждый набор данных) и общего среднего суточного прироста за жизнь животного.
- Начать обсуждение в классе значимости данных. Спросите студентов:
- Что представляют эти данные?
- Вес в фунтах, который животное набирает в день, или среднесуточный привес (ADG)
- Почему ADG может быть важен для фермеров и потребителей?
- Эффективность снижает цену
- Эффективность способствует экологической устойчивости
- ADG может указывать на проблемы со здоровьем в стаде (больные животные не едят / не набирают)
- ADG может указывать на эффективность рациона корма
- Был бы более высокий ADG или более низкий АГДГ будет выгоден?
- Как эффективность мясных животных может повлиять на голод в мире и способность прокормить растущее население?
- Какое животное наиболее продуктивно? Наименее эффективный? Как вы думаете, почему?
- Как наука и технологии могут улучшить ADG?
- Гормональные имплантаты (эстроген), которые могут улучшить потребление корма и его эффективность
- Кормовые рационы сбалансированы для максимального улучшения питания животных за счет удовлетворения всех потребностей здоровья животных
- Что представляют эти данные?
Основные файлы (карты, диаграммы, изображения или документы)
Источники / Источники / Цитаты
Автор (ы)
Джим Уолзер — Средняя школа Ридж Вью
Келси Фейвр — IALF
Результаты национальной сельскохозяйственной грамотности
- Наука, технологии, инженерия и математика Результаты:
- Обсудить рост населения и преимущества и проблемы, связанные с наукой и технологиями, применяемыми в сельскохозяйственных системах
- Культура, общество, экономика и география Результаты
- Обсудите, как методы ведения сельского хозяйства повысили продуктивность сельского хозяйства и повлияли на развитие мировой экономики, население развитие и устойчивость
Основные стандарты штата Айова
- Math:
- F-IF.B.4 Для функции, моделирующей взаимосвязь между двумя величинами, интерпретируйте ключевые особенности графиков и таблиц с точки зрения количеств и схематических графиков, показывающих ключевые особенности при словесном описании связи.
- F-IF.B.4 Для функции, которая моделирует взаимосвязь между двумя величинами, интерпретирует ключевые характеристики графиков и таблиц с точки зрения количеств и схематических графиков, показывающих ключевые особенности при словесном описании взаимосвязи. Ключевые особенности включают: перехват; интервалы, в которых функция возрастает, убывает, положительна или отрицательна; относительные максимумы и минимумы; симметрии; конечное поведение; и периодичность.
- F-IF.B.5 Свяжите область определения функции с ее графиком и, если применимо, с количественной зависимостью, которую он описывает. Например, если функция h (n) дает количество человеко-часов, необходимое для сборки n двигателей на заводе, то положительные целые числа будут подходящей областью для функции.
- Наука:
- HS-ESS3-3: Создание вычислительной модели или симуляции явления, спроектированного устройства, процесса или системы.
- HS-ESS3-6: Используйте вычислительное представление явлений или проектных решений для описания и / или поддержки заявлений и / или объяснений.
Эта работа находится под международной лицензией Creative Commons Attribution 4.0.
Анализ метаболизма жидкости в рубце, связанный с эффективностью корма у кроссбредных бычков
Это исследование было одобрено Комитетом по уходу и использованию животных (IACUC) в Центре исследований мясных животных США. Все эксперименты проводились в соответствии с процедурами, утвержденными IACUC, и соответствовали руководящим принципам, рекомендованным в Руководстве по уходу и использованию сельскохозяйственных животных в сельскохозяйственных исследованиях и обучении 31 .Общий рабочий процесс, используемый для идентификации биомаркеров кормовой эффективности, представлен на рис. 5.
Рис. 5
Обзор рабочего процесса, используемого при идентификации биомаркеров кормовой эффективности у гибридных бычков.
Схема эксперимента
В данном исследовании использовались бычки-ангусы (n = 144). После отъема бычкам имплантат (200 мг тренболона ацетата и 40 мг эстрадиола-17β; Revalor-XS; Merck Animal Health, Мэдисон, Нью-Джерси, США) и поместили в помещение с электронными воротами Calan Broadbent (American Calan, Inc., Northwood, NH) для измерения индивидуального потребления корма. Быков обучили пользоваться воротами Калана в период адаптации (примерно 21 день). Потребление корма измеряли в течение 105 дней с животными, взвешенными на 0, 1, 21, 42, 63, 84, 104 и 105 дней эксперимента. В начале исследования (0 дней) средний возраст и масса крупного рогатого скота составляли 310 ± 1,5 дня и 403,1 ± 37,2 кг соответственно. Рацион состоял из 8% измельченного сена люцерны, 20% зерен мокрой перегонки с растворимыми веществами, 67,75% кукурузы сухого проката и 4%.25% коммерческая витаминно-минеральная добавка; добавка содержала монензин (Rumensin 80; Elanco Animal Health, Greenfield, IN) в количестве примерно 300 мг / животное в день. Крупный рогатый скот был адаптирован к рациону не менее 35 дней. Рацион ежедневно смешивался в грузовике для кормов (Roto-Mix IV 274-12B, Dodge City, KS, USA; точность шкалы ± 0,09 кг) в соответствии с количеством, рассчитанным для каждого бычка, и бычков кормили один раз в день. Из рациона отбирали частичную выборку ежедневно и объединяли для формирования еженедельной выборки для определения DM корма.Орты измеряли один раз в неделю. Общий DMI был суммой общего количества скармливаемых DM за вычетом общего количества ортов. Начальная и конечная BW рассчитывались путем регрессии квадратного уравнения BW в день исследования. ADG рассчитывали путем вычитания начальной BW из конечной BW и деления на дни эксперимента. Потребление сухого вещества рассчитывали как предложенное сухое вещество за вычетом сухого вещества орт и деление на дни в ходе эксперимента. После окончания исследования потребления бычки получали тот же рацион ad libitum и оставались в том же загоне до убоя (5–8 дней).Кровь собирали на 84 день исследования кормления через яремную вену в пробирки, содержащие ЭДТА, и сразу же помещали на лед. Образцы центрифугировали при 3000 × g в течение 25 минут при 4 ° C, а плазму хранили при -80 ° C. На основании данных DMI и ADG для исследования жидкости рубца были отобраны бычки с наибольшим ( n = 8) и наименьшим ( n = 8) ADG, DMI которого находился в пределах 0,32 SD от среднего (рис. 6). . Через 5 дней после периода кормления 4 бычков забивали в день (по 2 бычка для каждой обработки) в течение 4 последовательных дней в одно и то же время суток.До убоя бычки имели неограниченный доступ к корму и воде. Сразу после убоя рубец каждого бычка был разрезан, и вся рубцовая жидкость была профильтрована через 4 слоя марли. Аликвоту жидкости рубца объемом 2 мл индивидуально собирали в микроцентрифужную пробирку и хранили при -80 ° C.
Рисунок 6
Отбор проб рубца. Две группы животных были отобраны по наибольшему среднесуточному привесу (высокий ADG; открытый красный треугольник; n = 8) и наименьшему количеству ADG бычков (низкий ADG; зеленый плюс; n = 8) с одинаковым средним показателем сухости поступление вещества (пунктирная линия) от общей популяции (черные точки; n = 144).
Ненаправленный метаболомический анализ
Чтобы оптимизировать профилирование образцов для полярных и неполярных метаболитов, была адаптирована двухэтапная ручная экстракция растворителем для жидкости рубца 32 . Все растворители, использованные для экстракции и подвижной фазы хроматограммы, были UPLC-MS Optima Grade (Fisher Chemical Ltd., Waltham, MA). Двойные образцы жидкости рубца были взяты для каждого бычка. После размораживания образцов на льду и встряхивания 50 мг взвешивали и разбавляли 1 мл смеси метанол / вода (1: 1 об. / Об.), Встряхивали и центрифугировали при 16000 × g в течение 10 мин при 4 ° C.Супернатант и твердый осадок разделяли в разных флаконах для водной (супернатант) и органической (осадок) экстракции соответственно. Для водной экстракции супернатант переносили в новый сосуд, сушили в потоке азота и ресуспендировали в 500 мкл метанола / воды (1: 1 об. / Об.). Для органической экстракции твердый осадок растворяли в 1 мл дихлорметана / метанола (3: 1 об. / Об.), Центрифугировали (16000 × g, 10 мин при 4 ° C), сушили в токе азота и ресуспендировали в 500 ° C. мкл смеси метанол / вода (1: 1 об. / об.).Анализ UPLC / MS выполняли с использованием системы ультраэффективной жидкостной хроматографии Waters ACQUITY (UPLC) (Waters Corp., Милфорд, Массачусетс), снабженной автосэмплером и связанной с гибридной трехквадрупольной времяпролетной масс-спектрометрией ( XEVO-G2-S-qTOF; Waters Corp.). Калибровку прибора проводили перед анализом образцов, используя 0,5 н. M раствора формиата натрия. Объем для инъекции рубцовой жидкости составлял 10 мкл, а температура образца составляла 4 ° C. Для получения информации о пригодности и стабильности системы образцы контроля качества (QC) вводили через регулярные промежутки времени на протяжении всего аналитического цикла.Образцы для контроля качества готовили путем смешивания аликвот экстракции жидкости из рубца (10 мкл) с получением отдельных образцов для контроля качества для водных и органических экстрактов.
Жидкостную хроматографию для водной экстракции проводили с использованием колонки Acquity UPLC BEH HILIC (2,1 × 100 мм × 1,7 мкм; Waters Corp.). Разделение проводили при скорости потока 0,5 мл и температуре колонки 30 ° C. Подвижная фаза A представляла собой 0,1% муравьиную кислоту с 10 мл ацетата аммония M при pH 8,0 в воде, а подвижная фаза B была равна 0.1% муравьиная кислота в ацетонитриле: воде (95: 5 об. / Об.) С 10 м ацетата аммония M при pH 8,0. Градиент подвижной фазы B: A составлял от 99: 1 до 0,1: 99,9 за 5 минут с последующими 2 минутами повторного уравновешивания при начальных условиях.
Жидкостную хроматографию для экстракции органических веществ проводили с использованием колонки Acquity UPLC BEH (Ethylene Bridged Hybrid Technology; Waters Corp.) C18 (2,1 × 50 мм × 1,7 мкм) при скорости потока 0,4 мл мин и температуре 40 ° C. температура колонки. Подвижная фаза А была 0.1% муравьиная кислота в воде и подвижная фаза B 0,1% муравьиная кислота в ацетонитриле. Градиент подвижной фазы A: B составлял 85: 15: 0% в течение 2 минут, возрастал до 50:50 через 5 минут и линейно увеличивался до 99,9: 0,01% через 18 минут, чтобы достичь начального состояния на 19-й минуте, а затем через 3 минуты. мин повторного уравновешивания.
Масс-спектрометрия проводилась как в положительном, так и в отрицательном режимах. Напряжение на капилляре составляло 3,2 кВ и 2,4 кВ для положительного и отрицательного режима соответственно. Параметры системы были установлены следующим образом: температура источника 120 ° C, температура десольватации 350 ° C, поток газа в конусе (азот) 25 л / ч и поток газа десольватации (азот) 900 л / час.Данные были собраны в режиме центроида с использованием замкового распылителя для обеспечения точности и воспроизводимости. Лейцин-энкефалин использовали в качестве запорной массы в растворе с концентрацией 2 нг / мл. Частота распыления замка была установлена на 15 с, а данные о массе замка были усреднены за 15 сканирований для исправления. Диапазон масс сканирования составлял от 50 до 1200 m / z с использованием расширенного динамического диапазона. Анализ МС / МС проводился путем увеличения энергии столкновения от 10 до 50 В с использованием аргона в качестве газа столкновения.
Данные и статистический анализ (ненаправленная метаболомика)
Исходные данные были проанализированы с использованием Progenesis QI v1.0 (Waters Corp.). Данные были выровнены и нормализованы с использованием общей интенсивности ионов. Соединения рубца были идентифицированы путем сравнения с онлайн-базой данных по метаболомам крупного рогатого скота (http://www.cowmetdb.ca/
) с использованием точных значений m / z и времени удерживания. Тест t и анализ основных компонентов (PCA) были проведены для выявления и визуализации различий между бычками с наименьшим ADG и наибольшим ADG; данные были отфильтрованы с использованием уровня значимости P <0.10 (таблица 1). Процедура PROC MULTTEST SAS 9.3 (SAS Inst. Inc., Кэри, Северная Каролина) была проведена для корректировки множественности набора исходных значений p . Данные, проверенные на нормальность, были преобразованы в журнал и стандартизированы с использованием метода масштабирования по Парето. Анализ пути был выполнен с использованием библиотеки путей Bos taurus , которая объединяет глобальный анализ обогащения пути и анализ топологии пути относительной центральности из программного обеспечения MetaboAnalyst 3.0. Идентификация и визуализация верхнего измененного пути проводились на основе KEGG (http: // www.genome.jp/kegg/) источники базы данных. Важность метаболита в данной метаболической сети рассчитывается с помощью мер его центральности (степень центральности и центральность промежуточности), измеряя количество связей, которые интересующий путь имеет с другими путями, а последний измеряет количество кратчайших путей, через которые проходит представляющий интерес путь 33 . Воздействие на пути метаболизма рассчитывается путем суммирования показателей важности каждого из подходящих метаболитов, а затем определяется сумма показателей важности всех метаболитов на каждом пути.
Для выявления потенциально различных метаболитов были также выполнены одномерные и многомерные анализы с использованием программного обеспечения MetaboAnalyst 3.0 в соответствии с ранее опубликованной рекомендованной статистической процедурой для метаболомического анализа 33,34,35,36,37 .
Частичный дискриминирующий анализ методом наименьших квадратов (PLS-DA) был проведен для идентификации значимых метаболитов, ответственных за дифференциацию бычков с наименьшим и наибольшим ADG, с использованием уровней значимости P <0.05, кратное изменение> 1,1 и важная переменная в прогнозе (VIP> 1,0). Модель PLS-DA представляет собой тип регрессии частичных наименьших квадратов (PLS), где зависимая переменная представляет собой двоичный результат (т. Е. Больший ADG против наименьшего ADG), а независимые переменные — это метаболиты, обнаруженные и выбранные на основе критериев VIP. . Значения VIP создаются моделью PLS-DA и представляют собой взвешенную сумму квадратов загрузки PLS, которая учитывает величину ортогональной дисперсии, объясняемую каждым компонентом 35 .
Переменная важность в проекции со значениями> 1,0 предполагает, что метаболит значительно участвует в разделении групп 37 . Тестирование перестановок (100 раз) было выполнено, чтобы свести к минимуму вероятность того, что наблюдаемое разделение на PLS-DA было случайным.
Характеристическая кривая приемника-оператора (ROC) была рассчитана веб-службой ROCCET, используемой для оценки прогностической способности потенциальных метаболических биомаркеров 35 . Площадь под кривой (AUC) от кривой ROC была метрикой, используемой для интерпретации производительности различных моделей биомаркеров для определения наилучшей точки отсечения для чувствительности и специфичности.В контексте нашего эксперимента, предназначенного для различения бинарных результатов по ADG: чувствительность — это вероятность положительного результата у бычка с фактическим истинно положительным результатом (истинно положительный результат), а специфичность — это вероятность отрицательного результата теста у бычка с фактический отрицательный результат (истинно отрицательный).
Идентичность выбранных биомаркеров была подтверждена с помощью фрагментного ионного анализа МС / МС с использованием программного обеспечения менеджера приложений Mass-Fragment (Water MassLynk v4.1, Waters Corp.). Фрагментацию молекул-кандидатов МС / МС сравнивали с базой данных ChemSpider (www.chemspider.com) с помощью химически интеллектуальных алгоритмов сопоставления пиков.
Количественный анализ биомаркеров
Для проверки биомаркеров эффективности корма были количественно определены метаболиты, выбранные из анализа биодоступности (в соответствии с тестом t , AUC и анализом путей). Насыщенные / ненасыщенные жирные кислоты определяли количественно с использованием методики МС с изотопным разведением, основанной на Isaac et al . 38 . Кроме того, жирные кислоты плазмы были количественно определены и коррелированы с концентрацией жирных кислот в рубце для определения доступных маркеров эффективности корма. Исходный раствор линолевой кислоты-D 11 (Cayman
93, Ann Arbor, MI), используемый в качестве внутреннего стандарта (IS), был приготовлен в смеси хлороформ: метанол (2: 1, объем / объем) при концентрации 0,5 мкг. / мл. Калибровочную кривую для смеси насыщенных / мононенасыщенных жирных кислот (Cayman17942) и для смеси полиненасыщенных жирных кислот (Cayman17941) получали путем серийного (12-кратного) разбавления 10 мкг / мл в смеси изопропанол: ацетонитрил: вода (2: 1: 1, объем / объем / объем).Пентадекановая кислота не присутствовала в смеси жирных кислот; поэтому индивидуальная калибровочная кривая была построена путем серийного разбавления 24 мкг / мл (Sigma-Aldrich M9005, Сент-Луис, Миссури).
Образцы жидкости рубца и плазмы размораживали на льду и 200 мкл экстрагировали 800 мкл хлорформа: метанола (2: 1, об. / Об.) И 20 мкл IS (линолевая кислота-D 11 ). Образцы встряхивали и центрифугировали при 12000 × g в течение 5 минут при 4 ° C. Нижнюю органическую фазу собирали в новый сосуд и упаривали в токе азота.Образцы повторно разбавляли 500 мкл изопропанола: ацетонитрила: воды (2: 1: 1, объем / объем / объем).
Жирные кислоты определяли количественно с использованием UPLC-XEVO-G2-S-qTOF (Waters Corp.). Вводимый объем экстракции составлял 10 мкл, а температура автоматического отбора пробы составляла 4 ° C. Разделение проводили с использованием технологической колонки C18 с заряженной поверхностью для гибридной технологии Acquity UPLC (2,1 × 100 мм × 1,7 мкм; Waters) при 0,4 мл / мин и 55 ° C. Подвижная фаза A представляла собой ацетонитрил: вода (60:40, объем / объем), а подвижная фаза B представляла собой изопропанол: ацетонитрил (90:10, объем / объем), и обе были приготовлены с 10 н. Формиатом аммония M и 0.1% муравьиная кислота. Градиент элюирования был следующим: 70% А в течение 1 минуты, от 70 до 67% в течение 1 минуты, от 67 до 57% в течение 1 минуты, от 57 до 50% в течение 1 минуты, от 50 до 30% в течение 4 минут, от 30 до 1%. более 1 мин и выдерживали 2 мин, возвращали к исходным условиям через 10 с и поддерживали в течение 2 мин.
Масс-спектрометрия проводилась в режиме отрицательной ионизации. Параметры были следующими: капиллярное напряжение 1000 В, напряжение конуса образца 30 В, температура источника 120 ° C и газ десольватации (азот) 900 л / час. Скорость сбора данных была установлена на 0.2 с. Диапазон сканируемых масс составлял от 100 до 500 m / z. Данные qTOF-MS / MS были собраны в режиме центроида с использованием замковой массы.
Сбор данных осуществляли с использованием программного обеспечения MassLynk (версия 4.1, Waters Corporation, Милфорд, США), а процесс и количественное определение жирных кислот определяли с помощью диспетчера приложений TargetLynk. Различия между двумя группами анализировали с помощью независимого t-критерия и площади под кривой (AUC) с помощью программного обеспечения MetaboAnalyst 3.0.
Сезон конференций: Делаем неизбежное терпимым
Существует множество советов о том, как избавиться от стресса в нашей жизни, и часто этот совет приводит к еще большему стрессу.
Это потому, что предполагается, что мы можем избавиться от стресса, если будем делать все правильно: лучше питаться, больше спать, регулярно заниматься спортом, медитировать, менять свое отношение, планировать наперед, организовываться… до бесконечности. Когда стресс остается, это должно быть потому, что мы не смогли этого сделать.
Как сказал бы ваш внутренний подросток из 1990-х: «Будь настоящим!»
«Настоящее» означает принятие того, что стресс — особенно предконференционный — неизбежен. Мы не можем устранить это, но мы можем научиться управлять этим.
Не нужно оскорблять свой интеллект долгими разговорами «планируй заранее и будь организован». Вы уже знаете, как это сделать. Вы также знаете, что, несмотря на то, насколько хорошо вы планируете и насколько тщательно вы организовываете, все происходит. Уловка состоит в том, чтобы знать, что наступают моменты закона Мерфи, и быть готовым с ними справиться.
Это не «А что, если?» Это «Когда?»
По словам Джуди Торел, фитнес-тренера и тренера по здоровью из Олбани, это может быть так же просто, как изменить ваше отношение к этим моментам.«Не создавайте нереалистичных ожиданий», — говорит она. «Знайте, что что-то пойдет не так, и сформулируйте это так:« Это то, что должно произойти ».
Чувствуете себя игривым? Начните игру в бинго или сделайте ставки вместе со своими сотрудниками в зависимости от того, где, по вашему мнению, Мерфи ударит первой: материалы, потерянные в пути, оратор пропустил свой самолет, лопнувшие трубы в выставочном зале. Если ваше предположение сбудется, вы выиграете. Если ни одно из них не сбудется, выигрывают все!
Это не игра разума; признание того, что неожиданное является частью процесса, работает и на физическом уровне, снижая уровень кортизола — гормона стресса — в мозгу.
У вас есть это
Теперь, когда вы готовы к Мерфи, напомните себе, что он не сравнится с вашими сумасшедшими навыками конференции. Независимо от того, насколько сложна ситуация, есть вероятность, что вы уже сталкивались с кризисом, столь же большим — или еще большим — раньше, и вы справлялись с ним. Это твоя работа, и у тебя хорошо получается!
«Два разных предложения могут вызвать совершенно разные химические реакции в вашем теле», даже если они говорят в основном одно и то же, — говорит Торел. Подумайте: «Основной доклад через 15 минут, докладчик в тюрьме, и все испорчено» вместо «Основной доклад через 15 минут, докладчик в тюрьме — но мы что-нибудь придумаем».”
Идите этим путем
Никогда не недооценивайте силу пятиминутной ходьбы. Принесите кроссовки в офис и запланируйте на свой день две пятиминутные или 10-минутные прогулки. Вот что важно, говорит Торел: «Идите достаточно быстро, чтобы заставить себя пыхтеть и пыхтеть. Когда вы это делаете, вы физически сжигаете гормоны стресса ».
Не пытайтесь вспотеть — вы все равно должны выглядеть презентабельно! — но убедитесь, что у вас учащается дыхание и пульс.Это не только снизит уровень кортизола, но и активирует гормоны, которые Торел называет «леденцами для мозга» — эндорфины, дофамин, серотонин, которые поднимают настроение.
Если можете, включите эти мощные прогулки в свой распорядок дня и во время конференции. Ваш мозг и ваши коллеги будут вам благодарны!
Do the java jive
Если вы не один из тех людей, чей организм просто не может справиться с кофеином, чашка кофе может быть именно тем, что вам нужно во время стрессовой растяжки.«Кофеин стимулирует мозг и помогает ясно мыслить», — говорит Торел. Это также помогает восстановить синхронизацию вашего мозга и тела, чтобы помочь вам более эффективно переносить стресс.
От 85 до 100 миллиграммов кофеина — что эквивалентно одной чашке джо — должно быть достаточно. Не переусердствуйте и садитесь на экспресс до Джиттерсвилля.
Вперед, команда!
Держите хозяев поля в курсе. Напомните им заранее, что ваш график будет плотным. Помогите им подготовиться к тому, чтобы помочь вам.
На работе делегируйте любые задачи своим коллегам, но знайте их стиль работы и делегируйте соответствующие полномочия. Не отдавайте проект, требующий недельного планирования, Сьюзи-официантке или Дэн-исполнителю в срок; пусть методичная Мэри справится с этим.
Помните, однако, что Сьюзи и Дэн тоже делают блестящие работы, иначе их бы не было в вашей команде. Поручайте им правильные задачи и принимайте их стиль работы. Доверяйте там, где это необходимо.
Дедлайны vs.Руководящие принципы
Некоторые крайние сроки не подлежат обсуждению (отель требует подсчет гостей на ужин и выбор блюд за неделю до мероприятия). Другие гибкие (значки с именами должны быть готовы за два дня до этого, но если вы все еще прикрепляете зажимы и ленты утром… никто не будет голодать).
Если вы делегируете работу, убедитесь, что ваши коллеги тоже знают разницу, и что они знают, с какими сроками они имеют дело.
«Это не ты; это я «
Каждый по-своему справляется со стрессом.Научитесь распознавать стили совладания со своими коллегами, чтобы не принимать их поведение на свой счет и не усугублять собственный стресс. Если вы знаете, что Сердечная Ванда превращается в Официозную Офелию перед конференцией, вы не останетесь без сомнения, что вы сделали, чтобы разозлить ее.
То же самое и с их собственным стилем. Предупредите их, чтобы они знали, «как у вас дела» в это время года.
Ложись (время)
Возможно, вам кажется, что в сутках мало часов, но у вас есть время, чтобы расслабиться и восстановить силы.Используйте для этого любую возможность. Вег вне. Chill (с Netflix или без). Сходите в кофейню или в парк.
Нет времени на все это? Торел рекомендует сделать 10-минутный перерыв на растяжку. Лягте на пол, ноги над головой, с закрытыми глазами. Это работает — и каждый может найти 10 минут, независимо от того, насколько он занят.
Празднуйте!
Что бы ни пошло не так, Мерфи не собирается полностью испортить вашу конференцию. Это будет успешное мероприятие, на котором что-то пойдет не так.Отметьте этот успех. Вознаградите себя и свою команду за еще одну успешную попытку.
Стресс перед конференцией неизбежен, но не должен быть невыносимым. Ожидайте этого, приветствуйте, разберитесь с этим и наслаждайтесь поездкой!
Оптимизация эффективности кормов на откормочной площадке — Совет по исследованиям мясного скота
Расходы на покупку теленка и корма, необходимые для его откорма, являются двумя самыми большими переменными расходами, с которыми сталкивается сектор кормления КРС. Использование меньшего количества корма для откорма теленка существенно повысит рентабельность производства говядины и может уменьшить воздействие на окружающую среду.Стоимость кормов высока из-за плохих условий выращивания в основных странах-производителях зерна, из-за использования кормового зерна в производстве этанола, а также из-за растущей конкуренции земли за растениеводство по сравнению с развитием городов.
Ключевые моменты
|
Отношение подачи к приросту
Отношение подачи к приросту (F: G) является ключевым показателем эффективности. Также известный как коэффициент конверсии корма (FCR), F: G является мерой эффективности животного в преобразовании питательных веществ корма в увеличенную массу тела. F: G — важная переменная в стоимости прикончить животное. Эффективность также может быть выражена как прибавка к кормлению или G: F, и в этом случае более желательным является большее число.
Из-за изменчивости содержания воды в кормах измеряется сухое вещество (СВ).
Представьте себе двух телят-бычков, которых кормят кормом. Оба бычка набирают в среднем 3,5 фунта (1,59 кг / день). Со временем мы установили, что бычок А потребляет в среднем 21 фунт (9,53 кг) сухого вещества в день, что соответствует соотношению корма к приросту 6: 1. Бык B потребляет 28 фунтов / день (12,70 кг / день), соотношение F: G — 8: 1, и поэтому он менее эффективен в корме, чем Steer A. Исходя из стоимости рациона 187 долларов за тонну * (или 0.085 центов за фунт), кормление быка А стоит 1,79 доллара в день. Steer B стоит 2,38 доллара в день. Если оба бычка достигнут своего конечного веса в течение 200 дней, то убойное животное с менее эффективным кормлением (бычье B) обойдется производителю на 119 долларов дороже, чем животное с более высокой производительностью корма (бычье A). (* Примечание: этот пример может не отражать текущую стоимость корма.)
Этот пример иллюстрирует важность улучшения и максимизации эффективности использования кормов для крупного рогатого скота, что может повысить или снизить прибыльность в секторе кормления.
Прогресс исследований эффективности кормов
Многочисленные исследовательские проекты на протяжении многих лет успешно привели к существенному улучшению темпов роста, количества дней кормления, веса туши и корма для набора.
| Если исходить из текущих затрат на корма, дальнейшее улучшение корма для прироста на 1% сэкономит сектору откормочных площадок 11,1 миллиона долларов в год. |
С 1950-х годов соотношение кормов и прироста заметно улучшилось благодаря прикладным исследованиям и разработкам.За последние 30 лет соотношение корма и прироста увеличилось на 30%. Заметные улучшения произошли благодаря исследованиям в области диеты, переработки зерна и стимуляторов роста.
Управление питанием
Замена корма зерном в рационах откорма может привести к значительному повышению эффективности кормления. Бычки, получавшие рацион с более высоким содержанием зерна, быстрее растут, быстрее заканчивают и производят более тяжелые и толстые тушки. Исследования также показывают, что тип и качество зерна и баланс основных питательных веществ, таких как витамины, белки и микроэлементы, значительно влияют на эффективность корма.Сбалансированные рационы увеличивают среднесуточный прирост и могут снизить стоимость корма на фунт прироста. Чтобы предотвратить ацидоз рубца и абсцессы печени, необходимо соответствующим образом перевести крупный рогатый скот с кормовых кормов на высокоэнергетические рационы на зерновой основе.
Обработка зерна
Усвояемость зерна, такого как кукуруза, ячмень и овес, улучшается при переработке зерна. Было показано, что такие методы обработки, как паровое отслаивание, улучшают эффективность подачи по сравнению с сухой прокаткой. Разламывая внешнюю оболочку зерна, микробы рубца лучше усваивают крахмал и минералы зерна.Обработка также позволяет смешивать зерно с добавками, что влияет на вкусовые качества и проходимость. Однако слишком мелкая обработка зерна приводит к ацидозу. Поиск идеального метода и уровня обработки способствует улучшению F: G.
Стимуляторы роста
| Анализ показывает, что производственные затраты были бы на 10% выше, если бы производители не использовали имплантаты, ионофоры или бета-агонисты. |
Стимуляторы роста являются одними из многих сложных инструментов, используемых откормочными площадками и другими производителями для выращивания большего количества говядины, более быстрыми темпами, с меньшим использованием корма при сохранении высоких стандартов здоровья животных, качества туши и безопасности пищевых продуктов.К стимуляторам роста относятся ионофоры, ростовые имплантаты и бета-агонисты. Ряд продуктов в каждой категории одобрен для использования Управлением ветеринарных препаратов Министерства здравоохранения Канады.
Одно исследование 2 показало, что общий среднесуточный привес был на 21% выше, а эффективность корма была на 23% выше для крупного рогатого скота, подвергнутого обработке зерном, при использовании имплантатов и ионофоров по сравнению с контрольным скотом. Экономисты Джон Лоуренс и Маро Ибарбуру из Университета штата Айова сообщили, что среднесуточный прирост откорма увеличивался при использовании ионофоров, имплантатов и бета-агонистов на 3%, 16% и 16% соответственно.Эффективность корма улучшилась на 4% при использовании ионофоров, 10% при использовании имплантатов и 14% при использовании бета-агонистов.
Ионофоры
Ионофоры — это противомикробные препараты, поступающие с кормом для крупного рогатого скота, которые улучшают доступность питательных веществ для животных и предотвращают такие заболевания, как кокцидиоз.
| Как и в случае со всеми усовершенствованными технологиями, надлежащее и оптимальное использование продуктов, стимулирующих рост, может улучшить продуктивность и ценность животных, в то время как неправильное использование не приведет к выгоде, снижению стоимости туши и / или потере денег. |
Ионофоры повышают эффективность корма, воздействуя на микробы рубца. Большинство микробов рубца превращают сложную клетчатку и крахмал в кормах и зерне в простые молекулы, которые могут всасываться в кровоток и обеспечивать животное энергией и белком. Бактерии рубца, известные как метаногены, превращают пищевые волокна и крахмал в газообразный метан. Метан содержит энергию, но животное не может его усвоить, поэтому его изрыгает и тратит впустую. Ионофоры улучшают эффективность корма и прибавку в весе за счет избирательного подавления метаногенных бактерий и позволяют полезным бактериям рубца обеспечивать животным доступность большей энергии корма.
Ионофоры часто ошибочно включают в дискуссии об опасностях использования противомикробных препаратов в животноводстве и потенциальной связи с устойчивостью к противомикробным препаратам у людей. Эти противомикробные препараты классифицируются как « с низкой значимостью» в медицине человека , что означает, что они не используются для лечения бактериальных инфекций у людей, и поэтому сокращение или отказ от их использования окажет пагубное воздействие на животноводство с незначительной пользой для здоровья человека или без нее. Когда группы защитников распространяют статистику вроде «более 80 процентов всех антибиотиков, используемых в Соединенных Штатах, используются для пищевых животных, и подавляющее большинство из них используется для животных, которые не болеют», они не только игнорируют гораздо более высокие группы населения и организм. вес домашнего скота по сравнению с американцами, они включают в расчет ионофоры.
Имплантаты гормонального роста
Другие стимуляторы роста влияют на то, как питательные вещества используются животным после того, как питательные вещества попадают в кровоток. Ростовые имплантаты, доставленные через гранулу под кожу в ухе животного, усиливают репродуктивные гормоны, которые естественным образом вырабатываются у животного. У бычков имплантаты заменяют некоторые гормоны, которые были удалены при кастрации животного.
Имплантаты обычно способствуют отложению белка и препятствуют отложению жира.Это улучшает как привес, так и конверсию корма. Отложение жира требует вдвое больше энергии корма, чем отложение белка. В дополнение к этому, мышечная ткань содержит около 70% воды, а жир содержит менее 25% воды. Это означает, что на каждые десять фунтов мышечной массы около трех фунтов приходится на сухой корм, а семь фунтов — на воду. Это соотношение меняется на обратное при росте жира (примерно семь фунтов из сухого корма и три фунта из воды). Агрессивные режимы имплантации могут отрицательно повлиять на качество туши (зрелость, мраморность, нежность и, возможно, постный цвет), особенно при использовании на неправильных типах крупного рогатого скота.
Ростовые имплантаты в сочетании с ионофорными кормовыми добавками эффективны в программах откорма. Исследования показали, что ростовые имплантаты обычно улучшают дневной прирост и эффективность кормления; в то время как кормовые добавки с ионофором в сочетании с ростовыми имплантатами уменьшают количество корма, необходимое для данного количества прироста, еще на 7-8%.
Безопасность стимуляторов роста проверена многими экспертами и агентствами, включая Министерство здравоохранения Канады, Всемирную организацию здравоохранения и Продовольственную и сельскохозяйственную организацию Объединенных Наций.Все пришли к выводу, что гормоны можно безопасно использовать при производстве говядины. Уровни, обнаруженные в пищевых продуктах, таких как говядина, слишком низки, чтобы представлять опасность для здоровья человека.
Чтобы представить эти уровни в перспективе, рассмотрим уровни эстрогенов, которые естественным образом встречаются у всех растений и животных, включая человека. Эта таблица показывает, что человек должен был бы съедать 3 миллиона гамбургеров каждый день из крупного рогатого скота, которым вводили гормоны роста, прежде чем он или она подвергнется воздействию такого количества эстрогена, какое в среднем ежедневно вырабатывает женщина.
Имплантаты, содержащие тестостерон, аналогичны; существует коэффициент запаса прочности в несколько тысяч раз, основанный на предположении, что люди потребляют от 6 до 7 порций говядины в день.
Агонисты бета-адренорецепторов
Бета-адренергические агонисты — новейший класс стимуляторов роста, коммерчески доступных с 2004 года. Эти кормовые добавки не являются противомикробными средствами, не имитируют и не дополняют репродуктивные гормоны.Лекарства от астмы также являются бета-агонистами.
«Бета-адренергический агонист» — сложное название, описывающее, что делают эти продукты. «Адренергический» означает «похожий на адреналин». «Агонист» (противоположность антагонисту) означает, что «действует аналогичным образом». «Бета» относится к конкретному рецептору, с которым он связывается на поверхности мышечных клеток. Таким образом, бета-адренергический агонист — это вещество, которое связывается с бета-рецептором в мышцах и действует как адреналин. Адреналин направляет кровоток от органов пищеварения к мышцам во время реакции «бей или беги».Точно так же бета-агонисты перенаправляют питательные вещества так, что в мышечной ткани происходит больший рост, чем во внутренних органах.
Все бета-агонисты, одобренные для мясного крупного рогатого скота (например, рактопамин и зилпатерол), увеличивают отложение белка (рост мышц), скорость роста, эффективность корма и похудание туши. Некоторые бета-агонисты также снижают обмен белка (уменьшают разрушение мышц), что приводит к увеличению процента повязки. Бета-агонисты кормят в конце периода кормления, когда рост мышц замедляется, отложение жира ускоряется, а эффективность корма падает.
Как и в случае с агрессивными имплантатами, с бета-агонистами следует обращаться соответствующим образом на правильном классе крупного рогатого скота, чтобы избежать негативных последствий для качества туши. Преимущество кормления бета-агонистами может быть потеряно, если продукт скармливается слишком долго или если задержка между изъятием продукта и убоем слишком велика.
Обеспокоенность по поводу использования бета-агонистов в животноводстве популярна в средствах массовой информации. Некоторые страны-импортеры проводят политику абсолютной нетерпимости к определенным видам бета-агонистов, что также делает их использование проблемой в некоторых торговых переговорах.Фактически, человеку нужно было бы съесть более 180 порций говядины в день , или 30 порций печени в день, от крупного рогатого скота, которым вводили бета-агонисты, чтобы получить эффект от одного «приема» лекарства от астмы.
Определение веса готовой продукции
Определение того, когда животное достигло своего конечного веса, является важным аспектом эффективности корма. Как только скорость прироста животного снижается, большая часть потребляемого корма превращается в отходы жира, а не в пригодное для употребления мясо, и, следовательно, не является рентабельным.Производители могут взвешивать и отслеживать отдельных животных или загоны, чтобы отслеживать прирост и определять, когда будет достигнут конечный вес.
Генетика
В дополнение к методам управления, которые оптимизируют эффективность кормления откормочных площадок, важен отбор крупного рогатого скота, который является генетически эффективным кормом. Было проведено много исследований, направленных на генетическое улучшение эффективности кормов путем измерения остаточного потребления корма (RFI). Достижения в разведении терминальных животных посредством скрещивания также увеличивают прирост, сортировку и выход разделки.
Загрузки
Обеспокоены гормонами крупного рогатого скота? Разработано производителями говядины провинции Альберта.
