Виды боли – классификация, описание
Количество просмотров: 11 027
Дата последнего обновления: 22.03.2021 г.
Среднее время прочтения: 5 минут
Содержание:
Какие бывают виды боли
Какая еще бывает боль
Как снять боль
Боль знакома практически каждому. Исключение составляют люди с редкими недугами, при которых нервная система не реагирует на болевые импульсы, возникающие при повреждении тканей1. И это очень опасно, так как эти ощущения – важные сигналы о неполадках в нашем организме.
Боль – это комплексная реакция, которую формируют биологическая, эмоциональная, психологическая и социальная составляющие2.
При этом часто сила болевых ощущений не соответствует тяжести патологических изменений. Это связано с индивидуальным восприятием боли, на которое влияют возраст, пол, этнические и другие особенности3.
Какие бывают виды боли
Виды боли различают по механизмам развития, длительности и другим характеристикам. В первую очередь, боль делят на 4 вида2:
- Кратковременную (транзиторную), которая появляется внезапно на короткий промежуток времени, проходит самостоятельно и обычно не требует лечения.
- Острую, обусловленную чаще всего повреждением тканей. Это нормальный ответ на чрезмерное механическое (давление, сжатие, удар), термическое (очень высокая или низкая температура) или химическое воздействие. При этом виде боли причину можно обнаружить достаточно быстро. Основное лечение направлено на устранение последствий повреждения, а обезболивание является дополнительным методом.
- Подострую, которую диагностируют в тех случаях, когда она длится от 2 до 6 месяцев. При этом виде болевой синдром в большей мере обусловлен психологическим компонентом.
- Хроническую, возникающую в ответ на тяжелое поражение или при вовлечении в процесс определенных структур нервной системы.
 От острой боли отличается не только длительностью более 6 месяцев, но и тем, что организм не может самостоятельно восстановить свои функции. К ней относят невралгии, головные, мышечные, тазовые и другие боли3. Степень выраженности болевых ощущений со временем все меньше зависит от силы повреждающего фактора, установить органическую причину становится все сложнее, и часто даже углубленное обследование не дает результатов. Возникают дополнительные симптомы: нарушения сна, аппетита, депрессивные переживания, расстройства внимания, памяти и т.д.Пациенты часто меняют обезболивающие препараты, которые перестают помогать. А болевой синдром превращается в самостоятельную болезнь, лечение которой зависит от вида боли.
От острой боли отличается не только длительностью более 6 месяцев, но и тем, что организм не может самостоятельно восстановить свои функции. К ней относят невралгии, головные, мышечные, тазовые и другие боли3. Степень выраженности болевых ощущений со временем все меньше зависит от силы повреждающего фактора, установить органическую причину становится все сложнее, и часто даже углубленное обследование не дает результатов. Возникают дополнительные симптомы: нарушения сна, аппетита, депрессивные переживания, расстройства внимания, памяти и т.д.Пациенты часто меняют обезболивающие препараты, которые перестают помогать. А болевой синдром превращается в самостоятельную болезнь, лечение которой зависит от вида боли.
Наверх к содержанию
Какая еще бывает боль
Для видов острой боли существует отдельная классификация по локализации (месту происхождения)3:
- Поверхностная – возникает при повреждении кожи, слизистых, обычно интенсивная, колющая, жгучая, пульсирующая.
- Глубокая – говорит о поражении костно-мышечного аппарата, чаще ноющая, сложнее определяется ее локализация.
- Висцеральная – связана с патологическими процессами во внутренних органах, часто неясного характера, тупая, может сопровождаться такими проявлениями, как тошнота, рвота, падение артериального давления, выраженная потливость и т.д.
- Отраженная – представляет из себя проекцию болевых ощущений на определенные участки кожи, которые связаны с теми или иными органами.
Международная ассоциация по изучению боли выделяет еще один специфический вид – психогенную боль3. Она может быть связана с эмоциональным или мышечным перенапряжением, психозами и другими психическими расстройствами, а также депрессией.
Возможные причины боли
Болевой синдром может сопровождать огромное число заболеваний. Только среди причин головной боли (цефалгии) называют не менее 150 диагнозов.
К врачу чаще всего приходят, когда болевые ощущения беспокоят при4:
- мигрени и других цефалгиях,
- болезнях зубов,
- простуде и гриппе,
- ревматических и других артритах,
- заболеваниях желудка и кишечника,
- болезнях органов малого таза,
- беременности,
- невралгиях, а также при болях в спине и мышцах.

Наверх к содержанию
Как снять боль
Для эффективного лечения боли, особенно острой, необходимо выявить причину и воздействовать на нее. Для того, чтобы уменьшить выраженность различных видов боли, назначают обезболивающие препараты.
При костно-мышечной, зубной, послеоперационной боли и при инфекционно-воспалительных процессах особенно эффективны нестероидные противовоспалительные средства (НПВС). При легкой и умеренной степени их применяют самостоятельно, а в тяжелых случаях комбинируют с наркотическими обезболивающими.
Одним из препаратов из группы НПВС, который используют для уменьшения болей при воспалительных процессах, травмах, различных острых заболеваниях, является Мотрин®. Он выпускается в виде таблеток для приема внутрь.
Средство обладает выраженным обезболивающим, противовоспалительным и жаропонижающим действием, которое может продолжаться до 12 часов5,6. Принимать Мотрин® для обезболивания можно по следующей схеме: 2 таблетки как старт обезболивание и затем по 2 таблетки каждые 12 часов или по 1 таблетке каждые 8 часов. Принимать препарат без наблюдения врача можно не больше 5 дней. Если за это время боль не уменьшается, то необходима консультация врача для выяснения причины данного состояния.
Не игнорируйте боль. Чем раньше вы обратитесь к специалисту, который поставит точный диагноз, тем выше шансы на успешное излечение.
Наверх к содержанию
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
Литература:
- Боль и ее основные характеристики. Первостольник. 2014; 02: 17
- И.В.Дамулин1, А.А.Струценко2. Боль: патогенетические, клинические и терапевтические аспекты. Трудный пациент. 2018; 11: 40-44
- О.А.Лесная. Боль в практике врача: сложный феномен и непростые пути решения. Трудный пациент.
 2019; 03: 21-26
2019; 03: 21-26 - Помощь при различных видах боли. Участковый терапевт. 2017; 03: 8-9
- Инструкция по применению Мотрин®.
- Fricke JR et al. Efficacy and safety of naproxen sodium and ibuprofen for pain relief after oral surgery. Curr Ther Research. 1993; 54(6):619-627.
Послеоперационные боли: как уменьшить, применение нестероидных противовоспалительных препаратов
Количество просмотров: 22 821
Дата последнего обновления: 22.03.2021 г.
Среднее время прочтения: 9 минут
Содержание:
Количество хирургических вмешательств растет1, совершенствуются техники операций и методики обезболивания. Однако послеоперационные боли остаются ожидаемым явлением и все так же требуют внимания врачей. Интенсивный болевой синдром, который наблюдается минимум у 40% пациентов1, утяжеляет течение восстановительного периода, способствует развитию осложнений2, увеличивает сроки выздоровления, может перейти в хронический процесс3.
Международная ассоциация по изучению боли (IASP) в 2010 году приняла декларацию, которая признала адекватное лечение боли одним из главных прав человека3.
По данным крупных исследований4 высокая интенсивность послеоперационных болевых ощущений отмечается пациентами после акушерских, гинекологических, ортопедических и абдоминальных (на органах брюшной полости) хирургических вмешательств, с которыми связаны послеоперационные боли в животе, грудной клетке, суставах. Очень важны характеристики боли в первые сутки, именно она определяет то, как будет в дальнейшем развиваться болевой синдром и станет ли он хроническим4.
Наверх к содержанию
Почему возникают послеоперационные боли
Послеоперационная боль по МКБ-10 (Международной классификации болезней) относится к неуточненным видам боли и не несет никакой сигнальной информации ни для пациента, ни для врача, так как понятны причины и механизмы ее возникновения. Поэтому современные принципы ведения больных после операций предусматривают максимальное избавление их от неприятных болевых ощущений. Тем более, что боль оказывает негативное влияние не только на заживление, но и на жизненно важные процессы в организме: работу сердечно-сосудистой, дыхательной, пищеварительной, центральной нервной системы, а также на свертывание крови4.
Поэтому современные принципы ведения больных после операций предусматривают максимальное избавление их от неприятных болевых ощущений. Тем более, что боль оказывает негативное влияние не только на заживление, но и на жизненно важные процессы в организме: работу сердечно-сосудистой, дыхательной, пищеварительной, центральной нервной системы, а также на свертывание крови4.
Формирование болезненных ощущений обеспечивается многоуровневой реакцией, которая связывает непосредственную зону повреждения (раневую поверхность) и центральную нервную систему. Начинается она с механических стимулов в области разреза и выделения биологически активных веществ (простагландинов, брадикининов и других)4, а заканчивается обработкой информации в коре головного мозга и подключением эмоционального и психологического компонентов.
Болевой синдром развивается в результате возникновения зон повышенной болевой чувствительности (гипералгезий). Первичная гипералгезия связана непосредственно с повреждением и формируется вблизи раны. Область вторичной гипералгезии захватывает более обширный участок и возникает позже, в течение следующих 12-18 часов4, так как связана со стимуляцией других видов рецепторов. Именно она и отвечает за сохранение и усиление болевых ощущений на вторые-третьи сутки после операции, а в последующем, за развитие хронического болевого синдрома7.
Наверх к содержанию
Как уменьшить послеоперациооную боль
К задачам послеоперационного обезболивания специалисты относят4:
- качественный период восстановления,
- ускорение реабилитации и выписки из стационара,
- уменьшение числа осложнений, в том числе развития хронической послеоперационной боли.
Наиболее эффективной считается так называемая мультимодальная схема4 послеоперационного обезболивания, концепция которой предполагает использование оптимальной комбинации лекарственных средств из разных групп в минимальных дозах4.
Группы препаратов, которые используются как обезболивающие после операции:
- Опиоидные анальгетики. Традиционно считались основой для операционного обезболивания, однако их изолированное применение дает ожидаемый результат всего в 25-30% случаев4, а введение максимально эффективной дозы связано с высоким риском побочных эффектов4, в том числе угнетение дыхания. Также после их отмены часто возникает еще большая болевая чувствительность.
- Нестероидные противовоспалительные средства (НПВС). Формирование послеоперационного болевого синдрома напрямую связано с травмой тканей и воспалением. Поэтому назначение НПВС, как препаратов, обладающих мощным противовоспалительным и обезболивающим эффектом, показано с первых минут после операции, а иногда во время хирургического вмешательства.
Они действуют непосредственно на причину развития повышенной чувствительности, а именно – на выработку простагландинов и других биологически активных веществ, участвующих в воспалительном процессе. Есть методики, которые предлагают использовать НПВС еще за 20-30 минут до разреза, что позволяет снизить интенсивность боли в области послеоперационных швов.4
При назначении с препаратами из предыдущей группы, НПВС дают возможность уменьшить дозу и усилить эффект опиоидов и предупредить их побочные эффекты4.
- Неопиоидные обезболивающие средства центрального действия. Не оказывают влияния на механизмы воспаления, но способны подавлять вторичную повышенную болевую чувствительность на уровне передачи нервных импульсов. Их применение за полчаса до окончания операции обеспечивает спокойное и безболезненное пробуждение после наркоза4. Хорошо зарекомендовали себя в комплексном обезболивании.
- Средства, влияющие на восприятие боли. Вводятся для предупреждения гиперчувствительности и развития хронического болевого синдрома4.
- Регионарное обезболивание (анальгезия).
 Применение метода основано на прерывании потока болевых импульсов от зоны повреждения к спинному и головному мозгу4.
Применение метода основано на прерывании потока болевых импульсов от зоны повреждения к спинному и головному мозгу4.
Для каждого пациента комплексная схема обезболивания подбирается индивидуально. Во внимание принимаются такие факторы, как возраст, пол, объем хирургического вмешательства, сопутствующая патология, психические особенности, чувствительность к боли и ее наличие до операции.
Наверх к содержанию
Сколько длится послеоперационная боль
На этот вопрос однозначно ответить нельзя, но острая боль исчезает полностью, когда сформирована рубцовая ткань и больше нет оснований для возникновения болевых импульсов. Сколько продлится этот период, зависит от самого пациента — способностей тканей его организма к регенерации (восстановлению), адекватности обезболивания, психологического настроя и общего состояния.
Если боли в области послеоперационных швов длятся более 3 месяцев, с перерывами или без, и не связаны с процессом заживления, то это признаки развития хронического болевого синдрома. В его основе лежит повреждение нервов или формирование патологических импульсов6. Частота его развития колеблется от 5 до 50% (в среднем у каждого пятого пациента6) и является одним из показателей успешности хирургического лечения7. Такая разница объясняется различием в методиках вмешательства и их травматичности7.
Для формирования хронической послеоперационной боли, в том числе рубцов, предрасполагающими факторами являются6:
- женский пол;
- возраст до 35 лет6;
- стресс, тревога перед операцией, предоперационная боль;
- вид вмешательства – если оперативное лечение связано с высокой вероятностью повреждения крупных нервов (ампутации конечностей, операции на органах грудной клетки, удаление молочных желез), то риск хронизации боли намного выше;
- продолжительность операции;
- течение послеоперационного периода – интенсивная острая боль, большие дозы анальгетиков, применение лучевой и химиотерапии;
- чрезмерная опека и поддержка со стороны близких в восстановительном периоде,
- длительный постельный режим.

Профилактика развития хронического болевого синдрома проводится в несколько этапов:
- Первичная – связана с самим хирургическим вмешательством: по возможности, выбор нехирургического метода лечения, выполнение операции наименее травматичным способом, например, использование эндоскопической техники.
- Вторичная – интенсивное обезболивание после операции. Это наиболее перспективный метод, который можно дополнить предоперационным введением анальгетиков, способствующим ослаблению болевой импульсации после вмешательства. В качестве обезболивающих после операции применяют различные анальгетики, НПВС, регионарную анестезию, седативные средства7.
Одним из препаратов группы , который помогает бороться с острой и хронической послеоперационной болью, является Мотрин®. Выпускается в таблетках по 250 мг. Он обладает выраженным противовоспалительным и обезболивающим действием, которое может длиться до 12 часов9. В послеоперационном периоде (в травматологии, ортопедии, гинекологии, челюстно-лицевой хирургии) его можно принимать взрослым и детям старше 12 лет8.
Если вы точно не знаете причин боли в послеоперационной ране, но обратиться к врачу быстро нет возможности, то самостоятельно принимать Мотрин® можно не более 5 дней9. Обязательно нужно связаться с доктором и выяснить причину болей.
Современная комплексная (мультимодальная) тактика обезболивания включает использование комбинации нестероидных противовоспалительных средств, местных анестетиков, анальгетиков центрального действия и препаратов, действующих на уровне проводимости нервных импульсов. Она должна применяться на протяжении всего периода существования зоны поврежденных тканей до окончательного заживления.
Наверх к содержанию
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
Литература:
- В.Д.Слепушкин, Г.В.Цориев, А.Б.Плиева. Хронобиологическая характеристика послеоперационной боли и механизм ее возникновения. Известия Самарского научного центра РАМ, том 16, №5(4), 2014, с. 1418-1422.
- А.А.Антипов, К.А.Линев, В.С.Пеляшов, Г.А.Яковлева. Аудит послеоперационной боли. Решионарная анестезия и лечение острой боли. Том VIII, №2, 2014.
- Е.Ю.Халикова. Нейропатическая боль как компонент острой и хронической постоперационной и посттравматической боли: от диагностики к рациональной фармакотерапии. Регулярные выпуски «РМЖ», №0 от 10.12.2014, с. 38.
- А.М.Овечкин. Послеоперационная боль: состояние проблемы и современные тенденции послеоперационного обезболивания. Регионарная анестезия и лечение острой боли, том IX, №2, 2015, с. 29-40.
- Терапия послеоперационной боли у взрослых (по материалам заседания Совета экспертов). Consilium Medicum. Хирургия. (Прил.) 2016; 02: с. 32-39.
- А.М.Овечкин. Хроническая послеоперационная боль – масштаб проблемы и способы профилактики. Российский журнал боли, 2016, №1, с. 3-14.
- Л.А.Медведева, О.И.Загорулько, Ю.В.Белов. Хроническая послеоперационная боль: современное состояние проблемы и этапы профилактики. 2017, №62(4), с. 305-309.
- Инструкция по применению Мотрин®.
- Fricke JR et al. Efficacy and safety of naproxen sodium and ibuprofen for pain relief after oral surgery. Curr Ther Research. 1993; 54(6):с. 619-627.
Диагностика и лечение боли
Боль является защитной реакцией организма на возникшее патологическое состояние (повреждение, воспаление, гипоксию). Большинство пациентов, обращающихся на прием к неврологу, предъявляют жалобы на наличие боли. В своей практике чаще всего невролог сталкивается с головной болью и болью в спине, однако существует множество других состояний, сопровождающихся болевыми синдромами. Не всегда наличие болевого синдрома связано с неврологическим заболеванием. Так, например, боль в плечевом суставе при движении и в покое может быть не проявлением грыжи межпозвонкового диска, а следствием повреждения вращательной манжеты плеча, связанного с ранее выполненным неловким движением или подъемом тяжестей. И наоборот, наличие, к примеру, болей в области передней грудной стенки слева часто связывают с ишемией миокарда, хотя это может быть связано с вертеброгенной торакалгией на фоне остеохондроза грудного отдела позвоночника.
И наоборот, наличие, к примеру, болей в области передней грудной стенки слева часто связывают с ишемией миокарда, хотя это может быть связано с вертеброгенной торакалгией на фоне остеохондроза грудного отдела позвоночника.
Для того, чтобы разобраться в причинах возникшего состояния, врач должен собрать жалобы пациента, уточнить характеристики боли (интенсивность, остроту, продолжительность болей), а также выяснить, что может провоцировать или усиливать боль. Чем больше характеристик боли сможет дать пациент, тем проще поставить диагноз. Существует более 50 характеристик дескрипторов боли.
Следующим этапом врач выясняет: как давно возникло данное состояние, с какими состояниями пациент наблюдался неврологом или врачами других специальностей. Если пациент уже ранее обследовался и лечился у невролога, необходимо ознакомиться с выполненными исследованиями. Для того, чтобы иметь полное представление о состоянии здоровья пациента, необходимо собрать информацию о ранее перенесенных заболеваниях (в том числе инфекционных), принимаемых лекарствах, выполненных операциях, наличии аллергических реакций на препараты и продукты питания. И многое, многое другое… Опытные врачи говорят: «хорошо собранный анамнез — это 70% диагноза!».
Далее врач производит осмотр пациента, при этом в некоторых случаях требуется не просто выполнение неврологического осмотра, но и глубокое нейроортопедическое исследование, позволяющее отличить ортопедические, ревматологические проблемы от чисто неврологических.
Выполнив вышеперечисленные действия, врач устанавливает предварительный диагноз, составляет план лечения и обследования. План лечения включает в себя рекомендуемые врачом методы лечения (консервативное лечение, методики купирования болевых синдромов, физиолечение). В большинстве случаев для оценки состояния пациента и установления правильного диагноза требуется дополнительное обследование. Врач составляет план обследования, включающий в себя необходимые методы обследования (лабораторной диагностики, лучевой диагностики (УЗИ, МРТ, КТ), инструментальных методов обследования (ЭЭГ, электронейромиография), консультации врачей других специальностей (терапевта, офтальмолога, оториноларинглога и пр. ). Дополнительно могут быть даны рекомендации по образу жизни (например, ортопедический режим с ограничением определенного типа движений, лечебная физкультура), диете.
). Дополнительно могут быть даны рекомендации по образу жизни (например, ортопедический режим с ограничением определенного типа движений, лечебная физкультура), диете.
Таким образом, сформулировав диагноз, врач определяется с методами лечения, которые можно использовать у данного пациента. В нашей клинике мы используем не только доказавшие свою эффективность «старые» методы лечения, но и такие высокоэффективные методы как:
- Внутрикостная блокада, позволяющая купировать выраженную боль как при мигренозном статусе, так и при «выпавшей» грыже диска;
- Паравертебральные блокады;
- Эпидуральные сакральные блокады;
- Локальная инъекционная терапия;
- Кинезиотейпирование;
- Иглорефлексотерапия;
- Плазмолифтинг.
Все это требует времени, поскольку прием в «телеграфном стиле» не позволяет не только разобраться в причинах возникшей боли, но и выбрать эффективный метод лечения. В нашей клинике первичный неврологический прием продолжается не менее 30 минут, а в случае обращения пациентов старшей возрастной группы или с множественными сопутствующими заболеваниями – требуется не менее 1 часа.
Имея за плечами 18-летний опыт работы в нейрохирургии, считаю, что лучшая операция — та, которая не выполнена. Поэтому в лечении болевых синдромов основной девиз: «лучше семь раз отмерить, чем один раз отрезать!». Однако, при неэффективности консервативного лечения невролог может принять решение о необходимости выполнения нейрохирургической операции.
Как не существует «панацеи», так и нет универсального рецепта или метода лечения. У пациента могут быть ограничения или противопоказания. Кроме того, пациент вправе отказаться от выполнения манипуляции. Считаю, что всегда необходимо руководствоваться принципами безопасности для пациента. Именно поэтому в нашей клинике манипуляции осуществляются в специально оборудованном помещении, соответствующим все необходимым требованиям.
Острая и хроническая боль
Боль не нуждается в представлении. Что такое боль, знают все люди. Её на протяжении жизни испытывает каждый человек.
С точки зрения медицины боль — это вид чувства, своеобразное неприятное ощущение. К понятию «боль» также относят эмоциональные и рефлекторные реакции, которые возникают в ответ на раздражающий фактор.
Международная ассоциация по изучению боли (IASP) дает следующее определение боли: это «неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения». Боль является важнейшим компонентом защитной системы организма. Она подает сигнал о повреждении ткани, развитии патологического процесса, воспаления.
Характеристики боли:
- Колющая.
- Режущая.
- Стреляющая.
- Тупая.
- Ноющая.
- Распирающая.
- Тянущая.
- И другие.
Острая боль возникает внезапно, резко. Как правило пациент может четко указать на причину такой боли.
Под хронической болью обычно понимают боль, которая продолжается более 3-4 месяцев. С такой болью бывает труднее справиться, чем с острой болью, так как в развитии и поддержании боли начинает участвовать центральная нервная система. Хронические боли часто предшествуют и сопровождают депрессию.
Причинами хронической боли могут быть:
- Травмы и операции.
- Перенесенный инфаркт или инсульт.
- Серьезные стрессовые ситуации.
Соматическая боль возникает при повреждении связок, мышц, костей, сосудах и других тканях человеческого организма. Часто такая боль воспринимается как тупые, не точно локализованные ощущения.
Висцеральная (внутренняя) боль возникает во внутренних органах.
Психогенную боль диагностируют в отсутствие органического заболевания или, когда оно не может объяснить характер и выраженность болевого синдрома. Возможно возникновение психогенных болей при психических заболеваниях, фобиях, истериях, тревогах, депрессии. Важную роль играют психосоциальные факторы — стремление получить какую-либо материальную или моральную выгоду, неудовлетворенность жизнью, отношениями, работой и т. д.
Невропатическая боль возникает в том случае, когда имеет место не раздражение рецепторов, а непосредственное повреждение или развитие патологического процесса в самой нервной ткани (ганглии, нервы и т. д.). Импульсы от поврежденных нервных волокон неправильно интерпретируются таламусом и другими структурами ЦНС, что приводит к возникновению болевых ощущений, часто имеющих достаточно выраженный и стойкий характер.
Фантомная боль — это ощущение боли, локализующейся в отсутствующей конечности или в зоне тела, где отсутствует поверхностная и/или глубокая чувствительность. Чаще всего фантомные боли возникают после ампутации конечности, при параличе конечностей.
Патологические виды боли проявляются при патологии в корковых и подкорковых отделах центральной нервной системы. К ним относится, например, гиперпатия — извращенная чувствительность, проявляющаяся повышением порога восприятия, затруднено определение точной локализации раздражителя, возможен период последействия (ощущения сохраняются после прекращения действия раздражителя).
Интересен факт, что при возникновении болевых ощущений и зависти участвуют одни и те же анатомические образования головного мозга.
В нашей клинике применяется индивидуальный подход в лечении любого болевого синдрома. Наша задача — разобраться в причинах конфликта в теле, который вызывает боль и сформировать программу лечения и дальнейшей реабилитации. Часто мы используем комплексный подход в лечении для достижения максимального результата.
| Название услуги | Цена |
| Консультация невролога | от 700 ₽ |
Подробнее о методах и видах лечения смотрите здесь.
причины возникновения и методы лечения
Мы все боимся боли. Она тревожит, приносит дискомфорт, выводит из строя, а порой причиняет невыносимые страдания. А вот врачи древности называли боль «цепным псом организма». Ведь именно она сигнализирует, что необходима срочная помощь. Но что делать, если «пес» сорвался с цепи?
Наш эксперт – врач-невролог, доцент кафедры нервных болезней лечебного факультета Первого МГМУ им. И. М. Сеченова, кандидат медицинских наук Наталья Вахнина.
Боль – это важный защитный механизм. Недаром люди, с рождения лишенные болевых ощущений, как правило, не доживают и до 3 лет. Но если боль долго игнорировать или лечиться неправильно, она станет хронической. В этом случае она перестает быть полезной, и от нее уже будет очень нелегко избавиться. К тому же у каждого 2-3-го пациента с хронической болью развиваются депрессия или тревожные расстройства.
Многоликая и загадочная
По времени боль бывает транзиторной (длится совсем недолго), острой (может беспокоить, пока больное место не заживет, но не свыше 1,5 месяца) и хронической (продолжается свыше 3 месяцев). Ее силу неврологи измеряют по особой шкале (от 0 до 10). Этот показатель субъективный и зависит только от ощущений пациента.
А вот найти место, где болит, не всегда легко, ведь боль бывает как местной, так и иррадиирующей (например, при стенокардии она может отдавать под лопатку или в руку, а при болезнях тазовых органов — в спину). А еще она бывает отраженной — в этом случае болит тот участок кожи, который иннервируется из того же участка спинного мозга, что и внутренний орган — истинный источник патологии. Кроме того, боль может различаться и по виду. Она бывает ноцицептивной, нейропатической и психогенной.
Что вас беспокоит?
Ноцицептивная боль – самая частая (до 80% случаев)
Причины. Самые частые – это воспаление, механическая травма или ожог (термический и химический). Боль в спине, головные боли при похмелье или спазмы в животе при месячных также относятся к этой категории. Такую боль вызывает раздражение периферических болевых рецепторов, расположенных практически во всех органах и тканях.
Жалобы. Пациенты описывают эту боль словами «сжимающая», «ноющая», «пульсирующая», «режущая».
Чем лечить? Главное – исключить опасную боль, связанную с повреждением внутренних органов. Если же какой-то серьезной причины не предполагается, необходимо принять нестероидный противовоспалительный препарат или анальгетик. Но и чрезмерный прием лекарств опасен. Если пить обезболивающие при головной боли чаще 3 раз в неделю, это может вызвать лекарственно-индуцированную головную боль. С такой справиться гораздо сложнее.
Нейропатическая боль (до 8% случаев)
Причины. Травма нерва или хронические заболевания (сахарный диабет, алкоголизм, невралгия тройничного нерва, опоясывающий лишай и другие). Фантомную боль после ампутации конечности тоже можно отнести к нейропатической. Такая боль вызвана повреждением нервной системы, из-за которого повышается активация путей проведения боли.
Жалобы. На «жгучую», «режущую», «колющую», «стреляющую» боль. При этом повышается чувствительность к болевым стимулам, что медики называют гиперестезией. В таком случае человек может остро реагировать даже на соприкосновение тела с простыней или мягкой одеждой. Симптомы могут усиливаться во время отдыха (не дают спать), но уменьшаться при физической активности. Но может все происходить и наоборот.
Чем лечить? Противосудорожные препараты (габапентин, тебантин, прегабалин), антидепрессанты (амитриптилин, дулоксетин), витамины группы В.
Психогенная боль
Причины. Сильный стресс и психические расстройства. Депрессия, тревога, неврастения, шизофрения и другие. В этом случае никакой неврологической или соматической причины нет, а боль, тем не менее, есть.
Жалобы. Отличаются огромным разнообразием. Боли по описанию могут быть вычурными, ни на что не похожими. Больные используют необычные метафоры для описания своей боли («как будто черви ползают под кожей», «словно кто-то пальцами перебирает мозги» и т. п.)
Чем лечить? Антидепрессанты (амитриптилин, дулоксетин), транквилизаторы, нейролептики. Из немедикаментозных способов — психотерапия.
С каждым бывает
Неспецифические – скелетно-мышечные боли (СМБ) составляют примерно треть от всех острых и хронических болевых синдромов.
Причина. Остеохондроз. А среди триггеров — стрессы, переохлаждение, высокие нагрузки или, наоборот, гиподинамия.
Жалобы. На боли в поясничном и крестцовом отделах позвоночника, ягодице, шее и области над плечами. У половины пациентов болит сразу в нескольких областях одновременно. Но боль в нижней части спины (БНЧС) стоит на 1-м месте (имеется у 80% людей), а в шейном отделе позвоночника (цервикалгия) — на 4-м (ее хотя бы однажды испытывали 2 из 3 людей, а 30-50% взрослых людей сталкиваются с ней ежегодно).
Чем лечить? Приемом нестероидных противовоспалительных препаратов (НПВП) в местных формах или в таблетках и миорелаксантов (лекарств, снимающих мышечный спазм, который усиливает боль). Нередко можно обойтись только НПВП.
Среди 200 препаратов этой группы выделяются лекарства, содержащие диклофенак и другие активные вещества. Диклофенак при длительном или частом применении, особенно у людей с проблемами ЖКТ, может давать осложнения (язвы и прободение желудка, внутренние кровотечения), а также повышать артериальное давление, усиливать отеки. Более предпочтительны препараты на основе ацеклофенака (аэртал, ацеклагин, аленталь).
При недостаточной эффективности НПВП требуются миорелаксанты (мидокалм, калмирекс, сирдалуд). Они применяются курсом (1-2 недели). При выраженной боли лечение начинают с инъекций, затем переходят на таблетки.
Спешить нельзя помедлить
У пациентов с болью есть два крайних подхода: сразу же бежать к доктору или длительно игнорировать ее. Вторая реакция, конечно, опаснее.
По мнению врачей, действовать надо так: если где-то заболело не очень сильно и причина очевидна и неопасна, достаточно принять анальгетик или нестероидный противовоспалительный препарат и, если через 1-2 дня не полегчало, идти к врачу (терапевту или неврологу).
Исключение – острая боль в животе или грудной клетке. При таких симптомах надо немедленно вызывать скорую помощь, так как это может быть симптомом очень опасного заболевания (аппендицит, инфаркт, разрыв аневризмы и прочее). Особенно опасно принимать анальгетики при боли в животе. Ведь так можно «смазать» картину заболевания и дотянуть до развития смертельных осложнений, таких как перитонит или прободение язвы.
К неврологу не нужно сразу нести никаких результатов исследования. Ведь для каждого из них есть свои показания, и врач сам назначит, что нужно: рентген, МРТ, КТ или другие исследования. Однако в 90% случаев ничего этого и не понадобится. Опытному врачу часто достаточно осмотреть и опросить пациента, выяснив локализацию, иррадиацию, давность, интенсивность и характер боли, чтобы определиться с причиной боли и назначить лечение.
Опасный момент
Иногда неврологу приходится направлять больного на дообследование или консультацию к другим специалистам (психиатру, хирургу, ревматологу, гинекологу, онкологу и др.). Это происходит нечасто — опасные причины боли встречаются не чаще чем в 5% случаев. Тем не менее это бывает, и хороший невролог знает, на что обратить внимание.
Например, нетипично, когда на сильную боль в спине, возникшую без явной причины, жалуется пожилой человек или пациент, с наличием онкологического заболевания в анамнезе – в этом случае лучше перестраховаться и отправить его на КТ или МРТ, чтобы исключить рак или его рецидив. Необходимо также исключить остеопороз, лечением которого занимаются эндокринологи. Кстати, врач обязательно задаст вопрос и о постоянно принимаемых лекарствах: ведь, например, кортикостероиды ведут к развитию остеопороза.
У молодых людей до 20 лет сильные скелетно-мышечные боли, возникшие без травм, тоже редкость – в этом случае не помешает консультация ревматолога. Наличие резкого похудения, повышенной температуры и других тревожных симптомов также нельзя обойти вниманием. А еще подозрительно, когда боль в спине не утихает в покое (что нехарактерно для обычного «прострела»).
ВАЖНО
Ощущение боли очень субъективно. Есть факторы, которые усиливают это переживание или, наоборот, снижают. Чем сильнее ощущается боль, тем выше риск ее перехода в хроническую форму. Боль усиливают:
— гиподинамия;
— бессонница;
— страх, тревога;
— пессимизм;
— недоверие врачу;
— социальная изоляция;
— пассивная позиция.
Ссылка на публикацию:
Аргументы и факты
Когнитивный аспект хронической боли | «НейроNEWS: психоневрологія та нейропсихіатрія»
Клиницисты, работающие с пациентами с хронической болью, знают, что представления о боли у лиц со сходной этиологией заболевания могут значительно отличаться. Некоторые представления приводят к неадекватной психофизиологической адаптации, обострению боли, усилению страданий и нетрудоспособности. Например, если боль интерпретируется как сигнал о стойком повреждении ткани, а не как результат реальной проблемы, которую можно решить, это приводит к большим страданиям и нарушению поведения при той же ноцицептивной стимуляции [42]. Если человек считает, что его боль непреодолима, он не прилагает усилий к адаптации и не использует когнитивные и поведенческие приемы, позволяющие справляться с болью. Люди, расценивающие свою боль как необъяснимую тайну, сводят к минимуму собственные возможности по ее контролю и уменьшению. Более того, представления страдающих болью пациентов о болезни могут влиять на восприятие симптомов. Например, E. Cassell приводит случай, когда пациент мог легко контролировать свою боль с помощью кодеина, но при этом считал, что применяет кодеин против ишиаса [10]. Однако когда он узнал, что боль связана с метастазами рака, дозу кодеина пришлось значительно увеличить. D. Spiegel и J. Bloom обнаружили, что выраженность боли у онкологических больных можно предсказать по количеству используемых анальгетиков, эмоциональному состоянию и интерпретации боли [42]. Пациенты, которые связывали боль с прогрессированием заболевания, страдали больше, чем таковые с более благоприятной интерпретацией, несмотря на одинаковую степень прогрессирования заболевания.
Боль может изменять способ восприятия информации, как относящейся к боли, так и любой другой. Например, хроническая боль может привести к концентрации внимания на всех афферентных сигналах организма. Arntz и Schmidt предположили, что обработка внутренней информации у пациентов с хронической болью может носить тревожный характер [4]. Возможно, такие пациенты слишком озабочены болью, акцентируются на физических симптомах и интерпретируют их как болезненную стимуляцию. Действительно, результаты обследования лиц с различной патологией подтверждают наличие гиперчувствительности, которая характеризуется снижением порога идентификации опасных раздражителей. Пациенты интерпретируют даже незначительные афферентные сигналы как указание на болезнь и предпринимают различные усилия с целью избежать усиления боли; чаще всего это отказ от физической активности [35]. Например, при острой боли в спине часто назначается постельный режим для снижения нагрузки на позвоночник. Такие пациенты затем могут прийти к выводу о том, что любая нагрузка на спину может ухудшить их состояние; они даже могут распространить это мнение и на другие виды хронической боли, когда неподвижность не только не обязательна, но даже вредна.
В своих исследованиях A. Schmidt обнаружил, что при боли в пояснице действия пациентов не зависят от степени физического усилия, необходимого для выполнения движения, или от представления о боли в настоящий момент [38]. Поведение таких пациентов при физической нагрузке в большей степени связано с их предшествующими переживаниями боли. Негативное мнение о собственных возможностях и ожидание усиления боли влияют на поведение больше, чем реальные события или ощущения. В другом исследовании E. Council et al. [12] отметили, что 83% лиц с болью в области поясницы сообщили, что не в состоянии выполнять ряд движений, включая поднятие ноги и боковые наклоны из-за ожидаемой боли; и только
5% пациентов были действительно не в состоянии выполнить упражнения из-за отсутствия физической возможности. Избегание физической нагрузки было связано не с наличием боли, а с усвоенным ожиданием ее усиления в связи с увеличением физической нагрузки и мнением пациентов о степени собственной нетрудоспособности [46]. Эти результаты согласуются с механизмом выработки условного рефлекса, описанного И.П. Павловым. Негативное восприятие пациентами своей способности к физической нагрузке образует порочный круг, который препятствует физической активности, усиливая ощущение беспомощности и нетрудоспособности [38].
На формирование установок и ожиданий большое влияние оказывает гендерная характеристика пациента. В работе А.Б. Данилова было показано, что женщины, страдающие мигренью, чаще обращаются к врачу, предъявляют больше жалоб, обнаруживают большее количество провоцирующих факторов, что, вероятно, связано с их большей склонностью интерпретировать афферентные сигналы как «боль», «патологию», в то время как мужчины чаще интерпретируют идентичные афферентные стимулы как «дискомфорт» [2]. Социальная приемлемость головной боли для женщин играет благоприятную роль, позволяя раньше обнаружить заболевание и начать лечение, однако приводит к более частому развитию болевого поведения в виде демонстрации симптомов и более частому злоупотреблению лекарствами. M. Jensen et al. продемонстрировали, что мнение пациентов о том, что эмоции влияют на их боль, что близкие должны проявлять заботу, когда они испытывают боль, и что они нетрудоспособны из-за боли сочетается с психосоциальной дезадаптацией [23]. Например, больные, считающие, что они нетрудоспособны из-за боли, и что им следует избегать физической активности, поскольку боль означает повреждение, в большей степени страдали физической нетрудоспособностью, чем пациенты с другими представлениями.
Как только когнитивные схемы болезни сформировались, они становятся стабильными и с трудом поддаются модификации. Пациенты стремятся избегать переживаний, которые могут обесценить их представления, и руководствуются ими в своем поведении даже в ситуациях, когда эти представления уже бессмысленны. Таким образом, при выработке условного рефлекса такие больные не получают корректирующей обратной связи.
Результаты нескольких исследований позволяют предположить, что при успешном ходе реабилитации происходит значительный когнитивный сдвиг от представлений о беспомощности и пассивности к представлениям о необходимости активных дейс-твий и способности функционировать, несмотря на боль. Например, в некоторых исследованиях было обнаружено, что лица с хронической болью, которые считают свою боль «необъяснимой тайной», демонстрируют более высокий уровень психологического стресса и боли, а также более низкую приверженность лечению, чем пациенты, которые считают, что понимают причины своей боли.
Результаты исследования C. Newton и H. Barbaree подтверждают предположение о том, что изменения представлений о головной боли могут способствовать ее облегчению [33]. Многие другие исследования лечения головной боли свидетельствуют о том, что сокращение негативных оценок является одним из способов облегчить боль и связанные с ней страдания. Рассматривая эффективность метода биологической обратной связи для пациентов с болью в спине, A. Nouwen и J. Solinger пришли к следующему заключению: «… одновременное снижение мышечного напряжения и сокращение сообщений о боли убеждают пациентов в том, что мышечное напряжение и связанную с ним боль можно контролировать» [34]. Поскольку большинство пациентов не могли использовать самоконтроль, вполне вероятно, что именно ощущение самоконтроля, а не реальный контроль над физиологическими функциями или событиями, является ключевым моментом для дальнейшего снижения боли. Создается впечатление, что мнение пациентов о том, в какой степени достигнут произвольный контроль над мышцами, определяет результат, даже когда их представления не сопровождаются устойчивым снижением мышечной реактивности. Это подтверждает исследование E. Blanchard [7], в котором было показано, что снижение частоты и интенсивности головной боли отмечалось не только у лиц, прошедших курс биологической обратной связи, но и у таковых с имитацией данного метода. Эти примеры свидетельствуют, что эффект лечения может быть связан не с физиологическим механизмом, на котором оно основано, а с ощущением контроля над болью.
Очевидно, что для людей с хронической головной болью очень важно развить адаптивные представления о взаимосвязи между повреждающим воздействием, болью, страданием и нетрудоспособностью, чтобы снизить роль боли в выполнении различных функций. Результаты многочисленных исследований исходов лечения показали, что изменение уровня боли не происходит параллельно изменениями других важных переменных, включая уровень двигательной активности, применение лекарственных средств, возобновление работы, ожидаемой способности справляться с болью и продолжение лечения [18].
Представление об управляемости
Исследования показывают, что управляемость аверсивной стимуляцией, то есть способность контролировать, преодолевать неблагоприятные воздействия, снижает ее влияние на индивидуума [23]. Наоборот, упорное ожидание может привести к более острому восприятию последующей ноцицептивной стимуляции [28]. Поскольку люди, связывающие физическую активность с болью, ожидают усиления боли при попытке чем-то заняться, они могут реально испытывать усиление боли, когда начинают что-либо делать. Либо такие пациенты вообще стараются избегать физической активности. Пациенты с хронической болью обычно обладают недостаточным самоконтролем. Возможно, это связано с образом жизни, причем их усилия повлиять на боль оказываются безуспешными. Большая часть лиц с хронической болью считают, что их возможности контролировать собственную боль незначительны [47]. Подобные негативно окрашенные неадекватные суждения о ситуации и собственной эффективности часто усугубляют деморализацию, пассивность и гиперреакцию на ноцицептивную стимуляцию (обычно у пациентов, страдающих хронической болью).
Взаимосвязь между ощущением способности контролировать боль и самой болью была продемонстрирована при различных болевых синдромах.
D. Mizener et al. показали, что успешное лечение пациентов с мигренью сопровождалось повышением ощущения контроля над физиологической активностью и над своим здоровьем в целом, что в значительной мере коррелировало со снижением выраженности головной боли [32]. H. Flor и D. Turk исследовали соотношение общих представлений людей и представлений о возникновении боли, с одной стороны, и понятий о самоконтроле, выраженности боли и уровне нетрудоспособности – с другой, у пациентов, страдающих болью в спине и ревматоидным артритом [19]. Общие и ситуационно-обусловленные представления о невозможности контроля боли и беспомощности в обеих выборках были в большей степени связаны с болью и нетрудоспособностью, чем биологические параметры заболевания. Представления людей о степени контролируемости собственной боли связаны и с другими показателями, например с применением препаратов, уровнем активности и физиологическим функционированием.
Когнитивные ошибки
В дополнение к специфическим представлениям о самоэффективности многие исследователи выдвигали предположения о том, что часто встречающийся набор «когнитивных ошибок» усиливает восприятие боли, эмоциональный стресс и нетрудоспособность [38]. Когнитивная ошибка является негативным искажением представления о себе или о ситуации.
С целью оценки когнитивных искажений был разработан вопросник для выявления когнитивных ошибок [27]. Он позволяет выявить, что пациенты с хронической болью (в частности, с болью в области поясницы) особенно склонны к таким когнитивным ошибкам, как придание событиям катастрофичности (самоубеждение, размышления и картины, предвещающие отрицательные результаты, или ошибочная крайне негативная интерпретация результата события), чрезмерное обобщение (предположение, что негативный результат одного события обязательно применим к результату будущего или аналогичного события), персонализация («я виноват, что это случилось»), селективное выделение (ожидание только негативных последствий события). B. Dufton сообщил, что лица, испытывающие хроническую боль, имеют тенденцию к когнитивным ошибкам [16]. Эти ошибки связаны скорее с эмоциональными трудностями жизни с болью, чем непосредственно с интенсивностью боли. Кроме того, склонность к таким ошибкам наблюдалась у людей в состоянии более выраженной депрессии.
Как и в случае самоэффективности, конкретные когнитивные ошибки и искажения у пациентов с хронической болью связаны с депрессией, самоотчетом о выраженности боли и нетрудоспособностью [19, 21].
Подобные негативные суждения предсказывают адаптивность к продолжительной хронической боли, в определенной мере могут служить связующим звеном между тяжестью заболевания и адаптивностью и являются уникальным вкладом в прогнозирование адаптивности (в дополнение к другим когнитивным факторам) [40].
Катастрофичность является наиболее важной когнитивной ошибкой, которая больше всего влияет на боль и нетрудоспособность [25]. Ряд работ, включая лабораторные исследования острой боли на здоровых добровольцах и исследования в естественных условиях пациентов, страдающих болью, показали, что катастрофичность и стратегии психофизиологической адаптации важны для определения реакции на боль. Люди, использовавшие менее катастрофичные утверждения и более адаптивные стратегии психофизиологической адаптации, расценивали искусственно вызванную боль как менее интенсивную и переносили болезненное раздражение дольше, чем те, кто высказывал более катастрофичные суждения. В нескольких исследованиях острой и хронической боли люди с катастрофичным настроем сообщали о более выраженной боли, стрессе и нетрудоспособности [30].
При послеоперационной боли когнитивные стратегии психофизиологической адаптации и катастрофичные суждения в значительной степени коррелируют с применением лекарственных средств, сообщениями о боли и суждениями медицинских сестер о переносимости боли пациентами [9]. В процессе проведения когнитивно-поведенческой терапии снижение катастрофичности было в значительной мере связано с повышением переносимости боли и улучшением физического и психологического состояния. По завершении лечения снижение катастрофичности определялось затиханием боли и улучшением физического состояния. У лиц с болью в пояснице и ревматоидным артритом выраженная вариабельность боли и нетрудоспособности объяснялась когнитивными факторами, такими как катастрофичность, беспомощность, психофизиологическая адаптация и наличие ресурсов для адаптации [19]. В обеих группах когнитивные переменные — катастрофичность и психофизиологическая адаптация – обладали гораздо большей объяснительной силой, чем параметры, связанные с заболеванием или ухудшением состояния. Наконец, E. Keefe et al. обнаружили, что пациенты с ревматоидным артритом, сообщавшие о высокой интенсивности боли, физической нетрудоспособности и депрессии, демонстрировали повышенную катастрофичность суждений при заполнении опросника в предшествующие 6 месяцев [24].
Психофизиологическая адаптация
Саморегуляция боли и ее влияние на поведение зависят от того, как именно люди справляются с болью, адаптируются к ней и минимизируют стресс, обусловленный болью, – иными словами, от стратегий психофизиологической адаптации. Психофизиологическая адаптация предполагает спонтанно предпринимаемые целенаправленные и преднамеренные действия; она оценивается в терминах внешнего и скрытого поведения. Внешние поведенческие стратегии адаптации включают отдых, использование техник релаксации или применение лекарственных средств. К скрытым стратегиям психофизиологической адаптации относятся различные способы самоотвлечения от боли: самовнушение, поиск информации и решение проблемы. Стратегии психофизиологической адаптации предназначены для воздействия на восприятие интенсивности боли и способность справляться с болью или переносить ее, продолжая выполнять повседневные обязанности [13].
Обнаружено, что стратегии активной психофизиологической адаптации (усилия для продолжения функционирования, несмотря на боль, или самоотвлечение от боли, например погружение в работу или игнорирование боли) связаны с адаптивным функционированием, в то время как стратегиями пассивной психофизиологической адаптации (зависимость от других людей, которые помогают контролировать боль, и снижение собственной активности) приводят к усилению боли и депрессии [26].
Однако доказательств преимущества какой-либо одной стратегии активной психофизиологической адаптации по сравнению с другими не существует. Вероятно, различные стратегии будут наиболее эффективными для определенных людей в определенное время, но не всегда и не для всех. Ряд исследований показал, что если люди обучены применению методов психофизиологической адаптации, их восприятие интенсивности боли снижается, а ее переносимость возрастает [17]. Наиболее важным фактором плохой психофизиологической адаптации является катас-трофичность ситуации в представлении больного, а не различия в происхождении конкретных стратегий психофизиологической адаптации [22]. D. Turk et al. пришли к следующему заключению: «… что отличает индивидуумов с низкой переносимостью боли от лиц с высокой переносимостью боли, так это особенности когнитивных процессов, катастрофичность мышления и ощущения, которые предшествуют, сопровождают и следуют за аверсивной стимуляцией» [45].
Выводы
Разнообразные реакции пациентов на ноцицептивную стимуляцию и лечение становятся понятнее, если рассматривать боль как личностное переживание, возникающее под влиянием разной степени внимания к ситуации, ее смыслу и предшествующему опыту, а не только физической патологии. В большинстве случаев биомедицинские факторы провоцируют изначальное сообщение о боли. Однако с течением времени возникают вторичные проблемы, связанные с нарушением адаптации, что может усиливать и удерживать ситуацию. Пассивность приводит к повышению концентрации внимания на боли и к поглощенности своим организмом и болью. Эти изменения в поведении повышают вероятность неправильного понимания симптомов, придания им особого значения и ощущения собственной нетрудоспособности. Снижение физической активности, раздражительность, боязнь повторного повреждения, боль и окружение, которое, возможно, невольно поддерживает пациента в роли больного, может препятствовать облегчению боли, успешной реабилитации, снижению нетрудоспособности и повышению адаптации. В этом отношении чрезвычайно важна роль интерпретации больным своих симптомов и ситуации. В то же время боль, которая со временем не исчезает, не следует рассматривать как исключительно физическую или исключительно психологическую реакцию. Скорее, переживание боли – это сложное сочетание ряда взаимозависимых биомедицинских, психологических и поведенческих факторов, отношения между которыми динамичны и изменяются с течением времени. Разнообразное взаимодействие факторов, влияющих на человека, страдающего хронической болью, свидетельс-твует о сложности феномена и о том, что лечение должно проводиться с учетом всех составляющих боли.
Список литературы находится в редакции.
Статья печатается в сокращении.
Журнал неврологии и психиатрии имени С.С. Корсакова. – 2010. – № 4. – С. 113-118.
Головная боль напряжения | Медицинский центр «Президент-Мед»
Головная боль напряжения (тензионного типа) – наиболее распространенная разновидность головной боли. Головная боль напряжения (ГБН) характеризуется как боль или дискомфорт в какой-либо части головы, и, как правило, ассоциируется с мышечным стеснением в этих областях. Считается, что свыше 20 процентов населения страдают ГБН, причем женщины болеют чаще. Этот вид головной боли может возникнуть в любом возрасте, но обычно встречается у взрослых и подростков старшего возраста.
Приступы боли могут появляться периодически (<15 дней в месяц) или хронически (>15 дней). Эпизодическая ГБН бывает легкой/умеренной, постоянной/прерывистой, может ощущаться как давление. Такая боль длится от 30 минут до нескольких дней. Эпизодические головные боли, как правило, начинаются постепенно, чаще бывают в середине дня.
Чем опасна головная боль напряжения
Чрезмерное использование обезболивающих для лечения ГБН может вызвать ежедневно усиливающиеся хронические головные боли. Они обычно начинаются рано утром и сопровождаются плохим аппетитом, тошнотой, беспокойством, раздражительностью, проблемами с концентрацией, депрессией. Хроническая ежедневная головная боль зачастую устойчива к болеутоляющим. Она может варьироваться по интенсивности, продолжительности и локализации, симптомы иногда выражены сильнее, чем при эпизодической ГБН. При хронической головной боли напряжения рекомендуется консультация и обследование у невролога и других специалистов.
Симптомы головной боли напряжения
Пациенты часто описывают боль, как жесткий обруч вокруг головы или давление сверху. Ощущения иногда распространяются на мышцы шеи, плеча.
Основные характеристики головной боли напряжении:
- тупая, давящая;
- плотная, сжимающая тисками;
- распространяющаяся на всю голову;
- затрагивающая виски, заднюю часть шеи, плечи;
- вызывающая болезненность кожи головы.
ГБН не вызывает тошноту/рвоту, но может провоцировать трудности с засыпанием. Люди с головной болью напряжения пытаются облегчить состояние, массируя кожу головы и нижнюю часть шеи.
Причины возникновения головной боли напряжения
Не выявлено конкретной причины для головной боли тензионного типа. У некоторых людей она связана со спазмом мышц в задней части шеи.
К наиболее распространенным факторам (триггерам), вызывающим ГБН, относят:
- чувство тревоги, эмоциональный стресс, депрессию;
- плохую осанку;
- недостаток сна;
- физическое истощение;
- травму головы;
- употребление алкоголя;
- слишком большие дозы кофеина;
- простуду, грипп, синусит;
- стоматологические проблемы, например, скрежетание зубами, сжимание челюстей;
- курение;
- усталость или перенапряжение.
Любая деятельность, при которой голова находится в одном положении длительное время, может вызвать боль. Набор текста или другие действия за компьютером, тонкая ручная работа (ювелиры, зубные техники, радиомонтажники и т. д.), продолжительное использование микроскопа – триггеры для ГБН. Сон в слишком холодной комнате, шея во время сна в ненормальном положении также могут вызвать головную боль напряжения.
Лечение головной боли напряжения
Очевидно, что лучшее лечение – устранение причины головной боли напряжения, установить которую может только врач. Самостоятельное использование обезболивающих препаратов (чаще чем два раза в неделю) увеличивает риск развития хронической ежедневной головной боли. Бесконтрольный прием парацетамола чреват осложнениями на печень. Ибупрофен и аспирин в высоких дозах вызывают раздражение желудка. Назначить терапию обязательно должен врач. Ключевой момент – индивидуальный подход к каждой ситуации. Невролог подберет правильное лечение: методику релаксации, массаж, когнитивно-поведенческую терапию, акупунктуру, при необходимости назначит антидепрессанты, даст рекомендации по изменению режима дня и образа жизни, направит на консультацию к психотерапевту.
Основная цель – снять симптомы боли и предотвратить их появление, минимизируя триггеры. Врач поможет «управлять» головной болью напряжения, выявив ее причину и порекомендовав внести изменения в свою жизнь, а также назначив «правильные» лекарства.
Чтобы получить подробную консультацию и избавиться от головной боли записывайтесь к специалистам медицинских центров «Президент-Мед»
Автор: Мамунц Цовинар Алексеевна
Главный врач Президент-Мед г. Видное
Высшее медицинское, Пермский государственный медицинский институт, лечебный факультет, специальность-лечебное дело
Записаться к врачу
Характеристики боли, психологические аспекты, качество жизни и стратегии выживания у пациентов с хронической болью в спине в городе Колумбия
Резюме
Введение
Хроническая боль в спине является одной из основных причин длительной нетрудоспособности в среднем возрасте. Его последствия включают снижение производительности труда и увеличение затрат для пострадавших людей, их работодателей и общества в целом.
Цель
Определить стратегии совладания, характеристики боли, включая психологические аспекты, и качество жизни пациентов с хронической болью в спине.
Материалы и методы
Обследовано 50 пациентов из трех учреждений, оказывающих физиотерапевтические услуги в городе Синселехо. Использовался неэкспериментальный описательный дизайн крестообразного типа; Каждый участник прошел лечение с помощью интервью для оценки болевых характеристик, а также с использованием визуальной аналоговой шкалы (ВАШ), опросника стратегий выживания (QSC) и опросника качества жизни Euroqol (EQ5D2).
Результаты
У большинства пациентов была диагностирована цервикалгия и боль в пояснице.Ощущаемая интенсивность боли в целом была умеренной. Наиболее часто используемые стратегии выживания — это молитва и надежда, а наименее применяемые — катастрофические. Пациенты отметили высокий уровень качества жизни по шкалам самообслуживания и мобильности. Кроме того, были установлены статистически значимые взаимосвязи между текущей интенсивностью боли и стратегией совладания с ее игнорированием (положительный результат) и между продолжительностью боли и стратегией совладания, согласованной с минимизацией боли (отрицательный результат).
Выводы
Результаты показывают, что использование стратегий игнорирования боли увеличивается с интенсивностью боли и уменьшается с увеличением продолжительности.Кроме того, восприятие боли зависит от возраста и опыта.
Resumen
Introducción
El dolor de espalda crónico es una de las majorales causas de discapacidad a largo plazo en la edad madura. Sus concuencias includes: disminución de la productividad labral y el aumento en los costos para los Individual afectados, sus empleadores y la sociedad en general.
Objetivo
Determinar las estrategias para afrontar el dolor, características de éste, включая аспекты psicológicos y calidad de vida en pacientes con dolor de espalda crónico.
Materiales y métodos
Se encuestaron 50 pacientes de tres instituciones que prestan servicios de fisioterapia en la ciudad de Sincelejo. Se utilizó un Disño нет экспериментального, descriptivo transversal. Вы можете участвовать в поиске энтузиастов оценки качества жизни хунта с Escala Analógica Visual (VAS), el Cuestionario de Estrategias de Afrontamiento del Dolor (QSC) и el Cuestionario de Calidad de Vida EuroDol (EQ5).
Resultados
La mayoría de los pacientes Presentaron un Diagnóstico de lumbalgia y cervicalgia.En general su percepción de dolor era moderado. Las estrategias de afrontamiento más utilizadas eran rezar y tener esperanza, mientras que la menos usada era la catastrofización. Los pacientes reportaron un buen nivel de calidad de vida en las escalas de cuidado personal y movilidad. Además, se establecieron relaciones estadísticamenteignativas entre la tensidad del dolor actual y la estrategia de afrontamiento de ignorar el dolor (positiva) и entre la duración del dolor y la Capacidad para afrontarlo basada en minimizga el dolaor (positiva).
Заключения
Los hallazgos sugieren que el uso de estrategias para ignorar el dolor se incrementa con latensidad del mismo y disminuye en medida que se extenda en el tiempo. Adicionalmente, la percepción del dolor es sensible a la edad y a las experience.
Ключевые слова
Боль в спине
Хроническая боль
Устранение боли
Качество жизни
Адаптация, психологическая
Palabras clave
Dolor de espalda
Dolor crónico
de vivo
Mane Adaptación psicológica
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию
© 2017 Sociedad Colombiana de Anestesiología y Reanimación.Опубликовано Elsevier España, S.L.U.
Рекомендуемые статьи
Ссылки на статьи
Классификация и характеристики боли, связанной с болезнью Паркинсона
Психоневрологические симптомы и боль являются одними из наиболее распространенных немоторных симптомов болезни Паркинсона (БП). Корреляция между болью и БП была признана с момента ее классических описаний. Боль возникает примерно у 60% пациентов с БП, в два-три раза чаще в этой популяции, чем у здоровых людей того же возраста.Это ранний и потенциально инвалидизирующий симптом, который может предшествовать двигательным симптомам на несколько лет. Чаще всего поражаются нижняя часть спины и нижние конечности. Наиболее часто используемая классификация боли при БП включает скелетно-мышечные, дистонические, центральные или нейропатические / корешковые формы. Его различные клинические характеристики, различная взаимосвязь с двигательными симптомами и непоследовательная реакция на дофаминергические препараты предполагают, что механизм, лежащий в основе боли при БП, сложен и многогранен, включая периферическую нервную систему, генерацию и усиление боли двигательными симптомами и нейродегенерацию связанных областей модуляции боли.Хотя боль при ДП является распространенным явлением и является значительным источником инвалидности, ее клинические характеристики, патофизиология, классификация и лечение еще предстоит определить.
1. Введение
Хотя наиболее общепринятые критерии диагностики болезни Паркинсона (БП) зависят от двигательных симптомов, другие признаки и жалобы, связанные с болезнью, такие как потеря обоняния, запор, депрессия, измененные режим сна и необъяснимая боль могут быть обнаружены за годы до появления любого из основных моторных признаков [1].Одно знаменательное исследование показало, что практически все пациенты с БП сообщают по крайней мере об одном немоторном симптоме (НМС), когда эти проявления активно преследуются с помощью специальных вопросников, достигая в среднем восьми различных симптомов на каждого пациента. В этом же исследовании наиболее частыми НМС были психоневрологические, желудочно-кишечные и болевые симптомы [2]. На ранних стадиях заболевания наиболее частыми НМС являются гипосмия, боль и нарушения сна [3]. Кроме того, боль, депрессия и тревога связаны с худшим качеством жизни [3–5].Хотя корреляция между болью и БП была признана с момента ее первых описаний, включая цитату Джеймса Паркинсона о «ревматической боли, распространяющейся от рук до пальцев» [6], проблема боли при БП только недавно привлекла заслуженное внимание в обеих странах. клинические и исследовательские установки.
Боль присутствует примерно у 60% пациентов с болезнью Паркинсона и встречается в этой популяции в два-три раза чаще, чем у лиц соответствующего возраста без болезни Паркинсона [7–9]. Это ранний симптом, который может предшествовать двигательным симптомам на несколько лет [1, 10, 11].У людей, которые болеют этим заболеванием менее шести лет, это может быть наиболее тревожным ЗНС, особенно если оно имеет скелетно-мышечное или висцеральное происхождение [12]. Хотя это часто встречается на любой стадии заболевания [12], около 40% пациентов могут не сообщать об этой жалобе при обычных посещениях врача [13].
Боль не зависит от пола, возраста или географических / культурных переменных [14]. Хотя некоторые авторы сообщают о более высокой частоте у женщин [2, 7], это не подтверждается большинством исследований [8, 15–17].Аналогичным образом, хотя в некоторых исследованиях сообщалось о более низком среднем возрасте пациентов с болью [9, 15], а в других даже предполагалось, что начало болезни Паркинсона в возрасте до 65 лет является фактором риска боли [9], большинство авторов [8, 17] –19] не удалось найти существенных различий. Также следует ожидать увеличения распространенности боли на протяжении клинического и нейродегенеративного прогрессирования заболевания; однако большинство исследований не показало корреляции между наличием или интенсивностью боли и клинической стадией или длительностью заболевания [7, 19–21].
Боль обычно возникает на той стороне, на которой двигательные симптомы появляются впервые или являются более серьезными [22]. Хотя основными факторами риска развития спонтанной боли при БП являются наличие двигательных колебаний и выраженность двигательных симптомов [9, 16], это не всегда так [23], поскольку некоторые пациенты с болью и двигательными осложнениями проявляют боль. на стороне, не пораженной заболеванием [16]. В исследовании влияния лечения леводопой и глубокой стимуляции мозга (DBS) на период «выключения» при БП оба вмешательства улучшили соматические болевые пороги независимо от какого-либо улучшения двигательных симптомов [24].С точки зрения локализации боли, хотя она может быть весьма различной, наиболее часто поражаются поясница и ноги [14]. Боль в плече, о которой обычно сообщают пациенты с БП [2, 16], может быть первым симптомом БП у 2-8% пациентов и даже может предшествовать появлению двигательных симптомов [25]. Считается, что это связано с двумя различными механизмами: один, непосредственно связанный с неврологическим симптомом, является ревматическим и чувствительным к дофамину; другой, как полагают, связан с дегенеративными поражениями, которые могут ухудшаться по мере прогрессирования БП [18].
Поскольку депрессия и боль являются преобладающими НМС при БП, а хроническая боль является известным фактором риска депрессии [39], следует ожидать связи между этими двумя симптомами [40]. Действительно, люди с болью и БП имеют более высокие баллы по шкале оценки депрессии [41]. Хотя в некоторых исследованиях не удалось найти какой-либо связи [16, 17], имеющиеся данные свидетельствуют о том, что наличие депрессии является важной переменной, которую следует принимать во внимание при исследованиях боли при БП, особенно из-за частоты, с которой она обнаруживается тот факт, что он может изменить восприятие боли.Кроме того, это потенциально поддается лечению [40].
Системные заболевания, такие как сахарный диабет, остеопороз и ревматические заболевания, также связаны с большей распространенностью боли при БП [42]. Наконец, есть доказательства связи между генетическими факторами и мышечно-скелетной болью, подтипом боли при БП. Например, мутации в генах SCN9A (натриевой канал Nav1.7) и FAAH (амидгидролаза жирных кислот, ключевой фермент метаболизма каннабиноидов) были связаны с более высокой восприимчивостью к этому симптому при БП [43, 44].
2. Оценка и классификация боли при БП
Распространенность боли при БП может варьироваться от 34% [45] до 83% [7] в зависимости от методических оценок. Возможные объяснения этого большого диапазона включают инструменты и критерии, используемые для диагностики и профиля изучаемой популяции. Например, в то время как в некоторых исследованиях этот симптом считался присутствующим только тогда, когда он длился более трех месяцев [8, 9, 17, 46], в других не указывались какие-либо временные критерии [18, 19, 47]. Среди диагностических инструментов для оценки боли при БП наиболее широко используется Краткий перечень боли [5, 7, 9, 19–21]; однако, поскольку он анализирует боль только за предыдущие 24 часа, он может недооценить ее распространенность.Поскольку боль — это неприятное сенсорное и эмоциональное переживание [48], рекомендуется использовать многомерную шкалу для ее оценки [49]. Широко используемый опросник McGill Pain Questionnaire [9, 18, 47, 50] является примером этого типа шкалы, оценивающей сенсорно-дискриминационную и аффективно-мотивационную области [51].
Тем не менее, нет единого мнения относительно оценки и классификации боли у пациентов с БП. Первая классификация, опубликованная Фордом [52], является наиболее часто используемой, но другие предложения были выдвинуты в результате растущего интереса к предмету [9, 25, 53, 54].
2.1. Классификация Форда
Классификация Форда [52] основана на исследованиях Гетца и Куинна [15, 55] и использует подход, который включает этиологию боли и ее связь с двигательными симптомами (Таблица 1). Он классифицирует боль, связанную с БП, на пять групп: скелетно-мышечная, дистоническая, нейропатическая / корешковая, центральная или первичная и акатизия.
| ||||||||||||||||||||||||||
Костно-мышечная боль — наиболее распространенный и легко определяемый тип боли [11].Это связано с ригидностью мышц и брадикинезией, а также с недостатком подвижности, нарушениями осанки и дисбалансом походки [56]. Боль в пояснице — обычно самая частая жалоба, но также распространены боли в шее и ногах. Боль в суставах чаще всего встречается в плечах, бедрах, коленях и лодыжках [56]. В случае боли, связанной с ригидностью, рекомендуется коррекция дофаминергической терапии вместе с физиотерапией и физическими упражнениями для облегчения симптомов. Нестероидные противовоспалительные препараты и анальгетики могут помочь при ортопедических и ревматологических заболеваниях.
Дистония — это двигательное расстройство, характеризующееся устойчивыми или прерывистыми мышечными сокращениями, которые приводят к ненормальным, часто повторяющимся движениям и / или позам [57]. Эти сокращения могут вызывать самые сильные боли, которые испытывают пациенты с БП, и могут быть облегчены внутримышечными инъекциями ботулинического токсина, а также корректировкой дофаминергической терапии [58]. Важно попытаться соотнести время дофаминергической терапии с возникновением боли, поскольку она может наблюдаться как раннее утро или как феномен истощения (WO), указывающий на дофаминергический дефицит [56].Лечение DBS субталамического ядра или бледного внутреннего шара может положительно повлиять на этот симптом [59, 60].
Очень локализованная боль с невропатическими характеристиками (жжение, поражение электрическим током и парестезия), ограниченная нервом или территорией нервного корешка, была классифицирована Фордом как невропатическая / корешковая и также может быть названа периферической невропатической болью. От него страдают от 5% до 14% больных БП с болью [9, 15, 19]. Насколько нам известно, нет исследований, в которых оценивалась бы только периферическая нейропатическая боль при БП; однако считается, что у большинства пациентов с БП этот тип боли связан с очаговой компрессией, связанной с дегенеративным заболеванием суставов [56, 61], и может потребоваться обследование с помощью электронейромиографии и нейровизуализации.Лекарствами первой линии для лечения нейропатической боли являются амитриптилин, дулоксетин и прегабалин [62].
Центральная или первичная боль проявляется невропатическими характеристиками и, по-видимому, связана с нарушением центральной модуляции боли, вызванной дофаминергической недостаточностью в базальных ганглиях. От него страдают от 4% до 10% больных БП с болью [7, 8]. Обычно он не ограничивается нервной территорией и, как было описано, влияет на атипичные участки тела, такие как лицо, голова, глотка, эпигастрий, живот, таз, прямая кишка и гениталии [63].Этот тип боли может быть связан с вегетативными проявлениями, с висцеральными ощущениями и может уменьшиться после приема леводопы [52]. Поскольку его нельзя отнести к какой-либо другой группе, это считается диагнозом исключения.
Акатизия определяется как чувство внутреннего беспокойства и неспособности оставаться неподвижным, проявляющееся как постоянная потребность в движении или изменении положения. Хотя это иногда описывается как болезненное ощущение, обычно это не так, и его не следует рассматривать как сенсорное нарушение [7].Javoy-Agid и Agid [64] предполагают, что акатизия является результатом дисфункции дофамина в дофаминергическом мезокортиколимбическом пути, который берет начало в вентральной тегментальной области и нарушается при БП. Синдром беспокойных ног также вызван схожей дисфункцией дофамина в этой области, и оба состояния поддаются дофаминергической терапии [65].
2.2. Другие инструменты оценки
Исследование DoPaMiP ( Douleur et maladie de Parkinson en Midi-Pyrénées ) предполагает, что первоначальное различие может быть сделано между болью, связанной с БП (PRPD), и болью, не связанной с PD (PUPD).Это различие было проведено группой экспертов, которая основывала свои выводы на взаимосвязи между болью и БП, о которой сообщил пациент, клинических характеристиках боли (таких как локализация, продолжительность и частота), отягчающих факторах и связи между болью и болезнью. симптомы болезни, двигательные осложнения и лекарства от паркинсонизма. PRPD можно далее разделить на (1) боль, непосредственно связанную с БП, когда ее нельзя отнести к какой-либо другой проблеме со здоровьем, и (2) боль, косвенно связанную с БП, когда она вызвана другим заболеванием (например,g., остеоартрит), но он усугубляется БП из-за ригидности и неправильной позы или движений. Следовательно, чтобы считаться PRPD, боль должна быть вызвана или усилена PD, в то время как для того, чтобы считаться PUPD, она должна быть связана с другими причинами, а не усугубляться PD [9].
Анкета Марбург / Сан-Паулу / Кретей использует трехэтапный подход. Они состоят из (1) установления временной связи между болью и симптомами БП; (2) определение того, связана ли боль с двигательными колебаниями; и (3) определение того, связана ли боль с лечением против паркинсонизма.Если ответ в любом из этих трех случаев утвердительный, боль классифицируется как PRPD; в противном случае он классифицируется как PUPD. В первом случае его можно дополнительно классифицировать как скелетно-мышечное, невропатическое или связанное с психомоторным возбуждением.
В некоторых случаях связь между болью и БП трудно определить. Несмотря на очевидную травму при визуализации, причинно-следственную связь нелегко наблюдать (например, грыжа диска и боль в пояснице). Например, в исследовании DoPaMiP пациенты с остеоартритом были классифицированы как PRPD или PUPD.Авторы согласны с тем, что при таком подходе могла иметь место ошибка отбора [9]. У этого подхода есть два недостатка: он не определяет какой-либо подтип боли и не дает индивидуального ответа на дофаминергическую терапию [66]. Восприятие боли и других сенсорных модальностей явно изменено у людей с БП [67], поэтому нет необходимости разделять боль, связанную или не связанную с заболеванием.
«Шкала боли при болезни Паркинсона Кинга», предложенная многоцентровой группой, в которую входила больница Кингс-Колледжа в Лондоне, официально поддерживается «Международной группой по изучению немоторной болезни Паркинсона и двигательных расстройств» для оценки боли при БП.Это анкета с четырнадцатью вопросами, охватывающими семь областей: (1) скелетно-мышечная боль; (2) хроническая боль; (3) боль, связанная с флуктуациями; (4) ночная боль; (5) орофациальная боль; (6) изменение цвета и отек / припухлость; и (7) корешковая боль. Для каждого вопроса присваиваются баллы от 0 до 3 и от 0 до 4 в зависимости от интенсивности и частоты симптома соответственно. Оценки серьезности и частоты умножаются, и результат добавляется к результату других пунктов, чтобы получить оценку для каждой области и, таким же образом, общую оценку для семи областей (0–168).В ходе валидационного исследования была обнаружена сильная корреляция между оценками по этой шкале и оценками по шкалам оценки тяжести болезни Паркинсона и качества жизни. По мнению авторов, оценка в каждой области должна использоваться для определения типа боли, которую испытывает пациент, в то время как общая оценка дает представление о влиянии боли на жизнь человека [53]. Это новый подход к боли при БП; Несмотря на то, что это может оказаться слишком долгим для выполнения в повседневной клинической практике, это позволит провести дальнейшее углубленное тестирование в клинических испытаниях для лечения этого конкретного аспекта БП.
3. Патофизиология боли при болезни Паркинсона
Двигательные симптомы при БП в основном являются результатом дегенерации дофаминергических нейронов в компактной части черной субстанции, влияющей на нигростриатальный путь и снижающей стимуляцию моторной коры базальными ядрами и таламусом. (Фигура 1). Патологическим признаком заболевания является наличие телец Леви, которые представляют собой сферические эозинофильные цитоплазматические включения в дегенерированных нейронах, содержащие в основном α -синуклеин и убиквитин.Однако изменения не ограничиваются этой областью головного мозга и могут быть обнаружены в других ядрах ствола и коры головного мозга и даже в периферических нейронах, например, в миэнтериальном сплетении [68]. Анализ распределения этих патологических маркеров при БП Braak et al. [68] позволили понять как моторную, так и NMS болезни посредством логического шестиэтапного восходящего прогрессирования в каудоростральном направлении. Согласно этой гипотезе, дегенеративный процесс начинается в каудальных областях ствола мозга, таких как дорсальные двигательные ядра языкоглоточного и блуждающего нервов и переднее обонятельное ядро, проходя через голубое пятно и базальное ядро Мейнерта, ядра дорсального шва, миндалины, гипоталамуса и распространяется практически по всей коре головного мозга [68–70].Двигательные симптомы проявляются на стадии 3 после поражения среднего мозга. До этой стадии дегенерация дорсального моторного ядра блуждающего нерва (стадия 1) может помочь объяснить некоторые вегетативные жалобы, такие как запор и гипотензия, в то время как серотонинергическая и норадренергическая дисфункция ядер шва и голубого пятна, соответственно (стадия 2), может объяснить часть симптомов, связанных с болью, которые возникают на ранних стадиях болезни Паркинсона [26, 27]. Точный механизм, с помощью которого происходит дегенерация клеток, еще предстоит выяснить, но считается, что он включает в себя каскад событий, включая взаимодействие между генетическими факторами и факторами окружающей среды, нарушение обработки белка, окислительный стресс, митохондриальную дисфункцию, эксайтотоксичность, нарушение иммунной регуляции и воспалительные реакции [ 28].
Базальные ядра играют центральную роль в модуляции различных путей и функционируют как компоненты серии параллельных цепей, связанных с моторной, лимбической и ассоциативной системами (рис. 1). Нейроны полосатого тела могут реагировать на различные сенсорные стимулы, прикладываемые к различным частям тела [29]. Из четырех основных дофаминергических путей два производят большую часть дофамина в головном мозге: нигростриатальный путь, который непосредственно участвует в БП, и мезолимбический путь, который связан с системой вознаграждения и центральной модуляцией боли.Последний соединяет вентральную тегментальную область среднего мозга с подкорковыми структурами, такими как прилежащее ядро, таламус и миндалевидное тело. Третий путь, мезокортикальный путь, связан с аффективными и мотивационными измерениями восприятия боли и позволяет вентральной тегментальной области сообщаться с префронтальной корой и передней поясной корой [30]. Поражение вентральной тегментальной области может повысить чувствительность к боли, тогда как электрическая стимуляция той же области может иметь обезболивающий эффект [31].Исследование с использованием позитронно-эмиссионной томографии обнаружило повышенную активацию островка, префронтальной коры и передней поясной извилины в период «выключения» [32]. Все это области лимбической системы, связанные с аффективно-мотивационным аспектом боли [33]. Поскольку дофаминергические пути и сеть обработки боли перекрываются, гипофункция дофаминергической системы полосатого тела может приводить к усилению сенсорных стимулов, что приводит к спонтанному болевому ощущению при низком уровне дофамина [29].
Хотя участие дофамина в центральной модуляции боли хорошо установлено, ее роль в передаче ноцицептивных стимулов от периферии к остаткам мозга спорна [24]. В различных исследованиях изучалась взаимосвязь между порогом боли, вызванной тепловыми или электрическими раздражителями, и лечением леводопой или DBS [34–37]. Как правило, болевой порог ниже, когда уровни леводопы ниже, и имеет тенденцию возвращаться к норме после введения леводопы или после DBS даже без связанного улучшения моторики.Другими словами, боль у этих пациентов нельзя объяснить только следствием двигательных симптомов, таких как ригидность, тремор и дистония [24].
Conte et al. [67] предлагают два механизма помимо гипофункции полосатого тела для объяснения различных результатов своих исследований: дегенерация норадренергических и серотонинергических нейронов в ядрах голубого пятна и шва соответственно, что может быть даже более выраженным, чем в черной субстанции [38]. и потеря нервных волокон и тельцов Мейснера в эпидермисе [71].Вместе с голубым пятном, гигантоцеллюлярным ядром и ядрами бульбарного шва периакведуктальное серое вещество и парабрахиальные ядра играют важную роль в модуляции ноцицептивной передачи спинного мозга, например, в подавлении ноцицептивных стимулов, исходящих от дорсальной части тела. рог нейрона. Нарушение в этой области подавления боли может вызвать усиление болевых ощущений [72]. Дегенерация периферических ноцицепторов также встречается при других синдромах хронической боли, таких как фибромиалгия [73, 74].
Его различные клинические характеристики, различная взаимосвязь с моторными симптомами и вариабельная реакция на дофаминергические препараты предполагают, что боль при БП имеет сложный механизм, который включает периферическую нервную систему, генерацию и усиление боли двигательными симптомами и дофаминергическую дегенерацию нейронов в области, отвечающие за центральные механизмы.
4. Связь между лечением леводопой и болью при болезни Паркинсона
Леводопа является наиболее широко используемым и эффективным лекарством при лечении моторных признаков болезни Паркинсона.Однако при использовании в течение нескольких лет практически у всех типичных пациентов будут возникать осложнения, связанные с фармакокинетическими и фармакодинамическими характеристиками. Наиболее известные из них включают двигательные флуктуации, такие как WO, при которых терапевтические эффекты леводопы длятся не так долго, как раньше, и дискинезии [75]. Хотя это было обнаружено только недавно, немоторные колебания происходят аналогичным образом почти у всех пациентов и могут быть основными детерминантами инвалидности и худшего качества жизни [76].НМС можно разделить на три категории: психоневрологические, вегетативные и сенсорные. Хотя большинство из них проявляется в периоды «выключения» и ОВ, некоторые из них, например возбуждение, психоз, потоотделение и боль, могут проявляться, когда уровни леводопы находятся на пике. В этой ситуации боль, по-видимому, больше связана с непроизвольными движениями (дискинезиями или дистонией), чем с уровнем дофамина как таковым. Колебания сенсорных симптомов могут быть следствием отказа первичных соматосенсорных механизмов [77].
Боль может быть одной из основных жалоб, сообщаемых во время WO, и возникает примерно у 50% пациентов [78–80].О хронической боли (т.е. боли, продолжающейся более трех месяцев) сообщают более 70% пациентов с WO, что позволяет предположить, что WO является фактором риска развития хронической боли (неопубликованные личные данные). Боль в животе, которая не поддается применению анальгетиков и может быть облегчена только новой дозой леводопы, может считаться признаком WO [81, 82]. Боль, возникающая только во время WO, может рассматриваться как центральная по происхождению, тогда как, если она обостряется в этот период, она может быть центральной, скелетно-мышечной, дистонической или нейропатической / корешковой [83].
Клинические характеристики боли во время WO и периодов «выключения» не установлены. Насколько нам известно, только два исследования в литературе анализировали боль в периоды «выключения» и представляли собой лишь частичный анализ [18, 50]. Недавнее исследование (неопубликованные личные данные) с использованием опросника McGill Pain Questionnaire показало, что пациенты с болью во время WO имели более высокий балл по аффективно-мотивационному измерению. В исследовании DoPaMiP группа с болью, связанной с БП, также имела более высокий балл по этому параметру, чем группа боли, не связанной с БП [9].Это открытие может быть связано с гипотезой о дофаминергической дисфункции мезокортиколимбического пути, которая связана с аффективным / мотивационным аспектом боли [84]. Другими словами, дегенерация дофаминергических нейронов вентральной тегментальной области может снизить болевой порог и одновременно активировать структуры лимбической системы, связанные с неприятным восприятием боли.
5. Заключение
В последние годы НМС PD привлекает все большее внимание врачей и исследователей.Боль присутствует на доклинической и начальной стадиях заболевания и существенно влияет на качество жизни. Его клинические характеристики различаются и могут быть связаны с периодами «выключения» или WO леводопы. Хотя боль при БП широко распространена и приводит к инвалидности, ее клинические характеристики, патофизиология и даже лучший способ ее классификации и лечения еще предстоит определить. Необходимы дальнейшие исследования, чтобы прояснить эти моменты и выяснить роль дофаминергических и недопаминергических путей в ноцицепции, центральной модуляции боли и аффективных / мотивационных аспектах восприятия боли.
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Характеристики хронической боли
Хроническая боль — это заболевание, которое влечет за собой дискомфорт различного типа и происхождения. У некоторых людей боль локализуется в определенной области, например, в голове или спине. В других случаях боль носит более общий характер. Хроническая боль также может иметь различный уровень инвалидности — от легкого расстройства до полного истощения.Природа боли также может быть уникальной. Например, мигрень обычно вызывает пульсирующую боль. Это контрастирует с качеством затягивания при головной боли напряжения или пронизывающей, колющей боли кластерной головной боли.
Понгсак Тавансаенг / EyeEm / Getty Images
Некоторые люди, страдающие головной болью, испытывают хроническую боль, что означает, что их головная боль возникает в большинстве дней в течение как минимум трех месяцев. Давайте рассмотрим основы хронической боли и то, как это может быть связано с теми, кто страдает от головных болей.
Насколько распространена хроническая боль?
Хроническая боль затрагивает миллионы американцев — фактически, хроническая боль является основной жалобой примерно в 20% всех обращений к врачу. Одна статья в журнале Pain Medicine описывает распространенность хронической боли. На основании анкеты, заполненной более чем 10 000 респондентов в Соединенных Штатах, 3,5% сообщили, что страдают от хронической головной боли. Чуть более 10% сообщили, что страдают от болей в спине, 7,1% — от болей в ногах и ступнях, и 4 человека.1% от боли в руках и кистях.
Что сопровождает хроническая боль?
Физические страдания, которые испытывают люди, страдающие хронической болью, часто сочетаются с психическим и эмоциональным бременем. Депрессия и злоупотребление психоактивными веществами часто наблюдаются у тех, кто страдает хронической болью. Помните, что эта ассоциация не означает, что одно вызывает другое. Скорее, ассоциация подразумевает связь или потенциальную связь между двумя условиями. В целом негативное влияние хронической боли на качество жизни и повседневное функционирование неоспоримо.
Как оценивается хроническая боль
Есть множество шкал боли. Одна очень короткая шкала из трех пунктов, используемая многими врачами для выявления хронической боли, — это шкала PEG. Эта шкала была разработана для врачей, чтобы оценить не только тяжесть боли пациента, но и эмоциональное и физическое воздействие, которое эта боль оказывает на их повседневную жизнь. Три вопроса шкалы PEG включают следующее:
1. Какое число лучше всего описывает вашу боль в среднем за последнюю неделю?
Пациенты оценивают свой ответ по шкале от 0 до 10, где 0 означает «нет боли», а 10 — «боль настолько сильна, насколько вы можете себе представить».”
2. Какое число лучше всего описывает, как в течение прошлой недели боль мешала вам получать удовольствие от жизни?
Пациенты оценивают свой ответ по шкале от 0 до 10, где 0 означает «не мешает», а 10 — «полностью мешает».
3. Какое число лучше всего описывает, как в течение прошлой недели боль мешала вашей общей активности?
Опять же, пациенты оценивают свой ответ по шкале от 0 до 10, где 0 означает «не мешает», а 10 — «полностью мешает».”
Лечение
Лечить хроническую боль довольно сложно и часто требуется тщательное наблюдение специалиста по боли. Пациенты, страдающие хроническими головными болями, такими как хроническая мигрень, часто регулярно наблюдаются неврологом или специалистом по головной боли. Лечение обычно включает в себя как медикаменты, так и поведенческую терапию, например когнитивно-поведенческую терапию. Кроме того, иногда используются альтернативные методы лечения, такие как иглоукалывание.
Как это связано с головной болью
Хотя большинство из нас считает головные боли эпизодическим явлением, они также могут быть хроническими.Хроническая ежедневная головная боль (ХДБ) — это головная боль, которая возникает в течение пятнадцати или более дней в месяц на протяжении более 3 месяцев. Примеры хронической ежедневной головной боли включают хроническую мигрень и хроническую головную боль напряжения. Хроническая головная боль может быть столь же изнурительной, как и другие источники хронической боли. Если вы страдаете хронической болью — будь то головная боль или нет — обратитесь за советом и помощью к специалисту.
Слово от Verywell
Хроническая боль — это инвалидизирующее заболевание, от которого страдают миллионы американцев.Вы не одиноки, если обнаруживаете, что ежедневно справляетесь с болью. Использование надлежащих механизмов преодоления и режимов лечения боли крайне важно для вашего физического и психического здоровья. Сохраняйте инициативу в своем здоровье и не расстраивайтесь.
Характеристики боли
ХАРАКТЕРИСТИКИ
БОЛИ
Факторами, которые следует учитывать при полной оценке боли, являются следующие:
интенсивность, время, местоположение, качество, личное значение, отягчающее и
смягчающие факторы и болевое поведение.Оценка боли начинается с
внимательно наблюдая за пациентом, отмечая его общую позу и
наличие или отсутствие явного болезненного поведения и просьба описать,
по его или ее собственным словам, особенности боли. Слова, используемые для описания
боль может указывать на этиологию. Например, классическое описание
Боль в груди, вызванная инфарктом миокарда, включает давление или
сдавливание на груди. Подробная история должна следовать за начальным
описание боли.
Интенсивность
Интенсивность боли
варьируется от нулевого до легкого дискомфорта и до мучительных мучений. Нет корреляции
между сообщаемой интенсивностью и стимулом, который ее произвел. Сообщенный
на интенсивность влияет боль человека
порог и толерантность к боли .
Болевой порог — это наименьший раздражитель, по которому человек сообщает о боли, и
толерантность — это максимальное количество боли, которое может вынести человек.К
понять вариации, медсестра может спросить о текущей интенсивности боли как
ну как минимум и худшую боль по напряжению. Доступны различные инструменты и опросы.
полезно для пациентов, пытающихся описать интенсивность боли. Примеры шкалы боли
показаны на рис. 13-5.
Время
Иногда этиологию боли можно определить, когда учитываются временные аспекты.
известный. Поэтому медсестра интересуется началом, продолжительностью, родством.
между временем и интенсивностью, а также есть ли изменения в ритмических паттернах.Пациента спрашивают, началась ли боль внезапно или усилилась постепенно. Внезапный
боль, которая быстро достигает максимальной интенсивности, свидетельствует о разрыве ткани и немедленно
вмешательство необходимо. Боль от ишемии постепенно усиливается и становится
интенсивно в течение длительного времени. Хроническая боль при артрите иллюстрирует
полезность определения взаимосвязи между временем и интенсивностью, потому что
люди с артритом обычно сообщают, что боль усиливается по утрам.
Местоположение
Местоположение боли
Лучше всего определяется, когда пациент указывает на пораженный участок тела.Некоторые общие формы оценки содержат рисунки человеческих фигур, а пациент
просят заштриховать пораженную область. Это особенно полезно, если боль
излучает ( отнесено к боли ). Затененный
цифры помогают определить эффективность лечения или изменения
локализация боли с течением времени.
Качество
Медсестра спрашивает
пациент может описать боль своими словами, не предлагая подсказок.Например, пациента просят описать, что такое боль.
Пациенту должно быть предоставлено достаточно времени, чтобы описать боль и
медсестра внимательно записывает все используемые слова. Если пациент не может
описать качество боли, такие слова, как жжение, боль, пульсация или
могут быть предложены ножевые ранения. Важно задокументировать точные слова, используемые для
опишите боль и какие слова подсказала медсестра, проводившая
оценка.
Личный
Значение
Пациенты испытывают боль
по-разному, и переживание боли может означать много разных вещей. это
Важно спросить, как боль повлияла на повседневную жизнь человека. Некоторые люди
может продолжать работать или учиться, пока
другие могут быть отключены. Пациента спрашивают, изменились ли семейные финансы.
затронутый. Для других повторение боли может означать обострение болезни,
например, распространение рака.Смысл, связанный с переживанием боли, помогает
медсестра понимает, как это влияет на пациента, и помогает в планировании
лечение.
Отягощающие
и смягчающие факторы
Медсестра спрашивает пациента, что, если что-либо усугубляет боль и
что делает его лучше и конкретно спрашивает о взаимосвязи между
активность и боль. Это помогает обнаружить факторы, связанные с болью. Для
Например, у пациента с запущенным метастатическим раком боль при кашле может
сигнал компрессии спинного мозга.Медсестра выясняет,
факторы влияют на боль, поскольку их можно легко изменить, чтобы помочь пациенту.
Например, повышение температуры в комнате может помочь пациенту расслабиться и улучшить состояние здоровья.
боль пациента. Наконец, пациента спрашивают, вызвана ли боль или
влияет на качество сна или беспокойство. Оба могут значительно повлиять на боль
интенсивность и качество жизни.
Знание смягчения
факторы помогают медсестре разработать план лечения.Следовательно, это
важно спросить об использовании пациентом лекарств (прописанных и превышающих
счетчик), а также количество и периодичность. Кроме того, медсестра спрашивает, есть ли травяные
лекарства, нефармакологические вмешательства или альтернативные методы лечения.
используется с успехом. Эта информация помогает медсестре определить способ обучения.
потребности.
Боль
Поведение
Когда испытывает боль,
люди выражают боль по-разному.Эти невербальные и
поведенческие проявления боли не являются последовательными или надежными индикаторами
качество или интенсивность боли, и их не следует использовать для определения
наличие или степень испытываемой боли. Пациенты могут трясти, плакать, тереться.
пораженный участок, охраняйте пораженный участок или обездвиживайте его. Другие могут стонать,
стонать, кряхтеть или вздыхать. Не все пациенты демонстрируют одинаковое поведение, и
могут быть разные значения, связанные с одним и тем же поведением.
Иногда в
невербальный пациент, болевое поведение используется в качестве прокси для оценки боли. это
неразумно выносить суждения и разрабатывать планы лечения на основе поведения, которое
может указывать или не указывать на боль. В случае бессознательного человека боль должна
всегда предполагается присутствовать и лечить. Все пациенты имеют право
адекватное обезболивание.
Физиологические реакции на
боль, такая как тахикардия, гипертония, тахипноэ, бледность, потоотделение,
мидриаз, повышенная бдительность и повышенный мышечный тонус связаны с
стимуляция вегетативной нервной системы.Эти ответы недолговечны, так как
тело адаптируется к стрессу. Эти физиологические признаки могут быть результатом
изменение состояния пациента, например, начало гиповолемии. С использованием
физиологические признаки, указывающие на боль, ненадежны. Хотя важно
наблюдать за любым болевым поведением, отсутствие этого поведения
не указывает на отсутствие боли.
Распространенность, клинические характеристики и смертность пациентов с инфарктом миокарда без боли в груди | Острые коронарные синдромы | JAMA
Контекст Хотя боль в груди широко считается ключевым симптомом при диагностике
инфаркта миокарда (ИМ), не все пациенты с ИМ имеют
боль.Масштабы этого явления в значительной степени неизвестны.
Цели Определить частоту, с которой пациенты с ИМ поступают без
боли в груди и изучить их последующее лечение и результат.
Дизайн Проспективное обсервационное исследование.
Условия и пациенты Всего в июне 1994 г. было зарегистрировано 434 877 пациентов с подтвержденным ИМ.
Март 1998 г. в Национальном регистре инфаркта миокарда 2, который включает
1674 больницы в США.
Основные показатели результата Распространенность предлежаний без боли в груди; клинические характеристики,
лечение и смертность среди пациентов с ИМ без боли в груди по сравнению с пациентами с
боль в груди.
Результаты Из всех пациентов с диагнозом ИМ у 142 445 (33%) не было грудной клетки.
боль при обращении в больницу. Эта группа пациентов с ИМ в среднем составляла
На 7 лет старше тех, кто страдает болью в груди (74,2 против 66,9 лет), с более высоким
доля женщин (49.0% против 38,0%) и пациентов с сахарным диабетом (32,6%
против 25,4%) или предшествующей сердечной недостаточности (26,4% против 12,3%). Кроме того, пациенты с ИМ без
Боль в груди имела более длительную задержку до поступления в больницу (в среднем 7,9 против 5,3
часов), менее вероятно, что у них был диагностирован подтвержденный ИМ в то время.
госпитализации (22,2% против 50,3%) и реже получали тромболизис
или первичная ангиопластика (25,3% против 74,0%), аспирин (60,4% против 84,5%), β-адреноблокаторы
(28,0% против 48,0%) или гепарин (53.4% против 83,2%). Пациенты с инфарктом миокарда
без боли в груди уровень госпитальной летальности составил 23,3% по сравнению с 9,3%.
среди пациентов с болью в груди (скорректированное отношение шансов для смертности 2,21 [95%
доверительный интервал 2,17–2,26]).
Выводы Наши результаты показывают, что пациенты без боли в груди при поступлении
представляют большую часть населения с ИМ и подвержены повышенному риску
задержки в обращении за медицинской помощью, менее агрессивное лечение и госпитализация
смертность.
Боль в груди считается основным клиническим признаком среди
пациенты с острым инфарктом миокарда (ИМ). 1
Всемирная организация здравоохранения требует наличия боли в груди как одного из
краеугольные черты в его диагнозе ИМ. 2
Исследование Rapid Early Action for Coronary Treatment, рандомизированное контролируемое
клиническое испытание, спонсируемое Национальным институтом здоровья, было разработано
отчасти для проверки эффективности информирования общественности о симптомах ИМ
и преимущества раннего лечения инфаркта миокарда. 3 Это
Медиа-кампания использовала в качестве отличительного признака наличие боли в груди.
Хотя не все пациенты с инфарктом миокарда проявляют классические симптомы боли в груди, 4 степень, в которой встречается это явление, в значительной степени
неизвестный. Barron et al. 5 сообщили, что отсутствие
боли в груди при обращении в больницу были одними из наиболее значимых факторов
прогнозирование более низкого использования тромболитической терапии среди подгруппы пациентов с ИМ
право на такое лечение в Национальном регистре инфаркта миокарда
2 (НРМИ-2).Меньше ли вероятность того, что эти пациенты получат другие важные
методы лечения инфаркта миокарда остаются неясными.
Популяция пациентов с инфарктом миокарда без боли в груди
были хорошо охарактеризованы. Хотя широко известно, что у больных сахарным диабетом
mellitus может не иметь боли в груди во время инфаркта миокарда (возможно, вторично по отношению к вегетативной
дисфункция), 6 другие клинические факторы, связанные
у пациентов, которые не испытывают боли в груди, остаются в значительной степени неопределенными.Понимание
факторы, связанные с атипичными проявлениями (например, отсутствие боли в груди), могут
помочь в более раннем выявлении и лечении этих пациентов с ИМ.
Основной целью данного исследования было определение соотношения
пациентов с ИМ в NRMI-2, поступивших в больницу без боли в груди,
и оценить клинические факторы, связанные с этим типом презентации.
Мы проверили гипотезу о том, что пациенты с ИМ без боли в груди по сравнению с
те, кто страдает болью в груди, явятся позже за медицинской помощью, будут
с меньшей вероятностью будет диагностирован острый ИМ при первоначальной оценке, и
в течение первых 24 часов будут получать меньше необходимых медицинских услуг.Мы также оценили связь между наличием атипичных представлений
симптомы и госпитальная смертность, связанные с ИМ.
Популяция пациентов и сбор данных
NRMI-2 — это национальный реестр, предназначенный для сбора, анализа и
сообщать больничные данные о пациентах, поступивших с подтвержденным ИМ, из 1674 участвовавших
больницы.Список больниц и исследователей, участвующих в NRMI-2
можно получить в Stat Probe Inc (Лексингтон, Кентукки). Всего 772 586 пациентов
были зачислены с июня 1994 г. по март 1998 г.
Пациенты, перенесшие межбольничный перевод, были исключены из этого списка.
анализ из-за возможности неполного отчета об их представлении
характеристики в больнице, в которой они были первоначально оценены, и
их последующего исхода (41,0%).Пациенты также были исключены, если переменная
Боль в груди присутствовала, но не была указана в истории болезни (4,4%).
Большинство пациентов, включенных в это исследование, имели острый
ИМ, и несколько случаев (<4%) впоследствии были диагностированы как ИМ во время
ход госпитализации. Диагноз ИМ был основан на клинических данных.
соответствует ИМ и по крайней мере 1 из следующего: (1) общая креатинкиназа
или уровень креатинкиназы-MB больше или равен удвоенному верхнему пределу
нормальных, (2) электрокардиографические данные, указывающие на острый ИМ, (3) альтернативные
ферментативные, сцинтиграфические данные или данные вскрытия, указывающие на острый ИМ, или (4) Международная классификация болезней, девятая редакция, клиническая
Модификация код диагностики 410.Х1.
Данные каждого пациента были введены в 2-страничную форму отчета о болезни
обучили составителей диаграмм и направили в ClinTrials Research (Лексингтон, США).
Кай). Регулярно выполнялись двойной ввод данных и 87 электронных проверок данных
центром сбора данных, чтобы обеспечить точность, согласованность и
полнота данных. Неточный и внутренне противоречивый отчет о случае
формы были исключены из анализа и возвращены в регистратуру больницы на
дополнительный просмотр и исправление.Больницам настоятельно рекомендовалось записаться
последовательные пациенты с острым ИМ. Это исследование основано на обработанных данных NRMI-2.
по состоянию на март 1998 г.
Боль в груди определялась как любой симптом дискомфорта в груди, ощущения
или давление, или боль в руке, шее или челюсти, возникшие в период до
прибытие в больницу или предшествующее диагностированию острого ИМ. Переменная боли в груди
определялось как отсутствие боли в груди до или во время госпитализации, и
включали (но не ограничиваясь) одышку (только), тошноту / рвоту, сердцебиение,
обморок или остановка сердца.Однако конкретный симптом (кроме грудного
боль) не было извлечено из медицинской карты. Включены другие переменные
в этом исследовании учитывались возраст, пол, раса, диабет, гипертония, инсульт, перенесенный инфаркт,
предшествующая сердечная недостаточность, предшествующая ангиопластика коронарной артерии, предшествующая коронарная артерия
операция по шунтированию (АКШ), гиперхолестеринемия (в анамнезе или текущая сыворотка)
общий холестерин> 6,22 ммоль / л [240 мг / дл]), семейный анамнез коронарной артерии
заболевание (у ближайшего родственника диагностирована ишемическая болезнь сердца до
возраст 60 лет), впервые зарегистрированы артериальное давление и пульс, вид транспорта
(самостоятельно или скорая помощь), Killip класс при первичной оценке, характеристики
исходной электрокардиограммы (ЭКГ), тип ИМ (инфаркт с зубцом Q, без зубца Q
инфаркт), локализация ИМ (передний, нижний, задний, латеральный, правый желудочек,
другое), диагноз при поступлении (ИМ, исключенный ИМ, другое), временной интервал от появления симптома
от начала до прибытия в больницу, время от прибытия в больницу до первой ЭКГ и время
от прибытия в больницу до получения тромболитической терапии или первичной ангиопластики,
лекарства в течение первых 24 часов (аспирин, гепарин, β-адреноблокаторы, нитраты,
блокатор кальциевых каналов), инвазивные кардиологические процедуры (коронарография,
ангиопластика коронарной артерии, операция АКШ), гипотензия, требующая вмешательства,
сердечная недостаточность, требующая медикаментозного лечения, кардиогенный шок, рецидивирующая ишемия
(симптомы, сопровождающиеся изменениями ЭКГ, новой сердечной недостаточностью или и тем, и другим), рецидивирующие
инфаркт (что подтверждается новыми диагностическими изменениями сегмента ST или вторым
повышение уровня сердечных ферментов), фракция выброса левого желудочка в целом
продолжительность пребывания, общее количество дней в отделении интенсивной терапии и госпитальная смертность.Пациенты, подходящие для реперфузионной терапии, были определены как кандидаты, представившие
в течение 12 часов с момента появления симптомов, с подъемом сегмента ST или левой ножкой пучка Гиса
блок на начальной ЭКГ и без противопоказаний к тромболитической терапии.
Различия между двумя исследуемыми группами оценивались с помощью критерия χ 2 для категориальных переменных с помощью теста t
для непрерывных переменных и непараметрическим критерием медианы для медианы
сравнения.Для определения фактора риска использовался логистический регрессионный анализ.
профиль, связанный с атипичным представлением (зависимая переменная). Только те
ранее существовавшие переменные, которые могли предшествовать развитию представления
симптомы (такие как демографические характеристики, предыдущий кардиологический и медицинский анамнез,
статус плательщика и регион) были включены в первую модель. Кроме того, задержка
при обращении за медицинской помощью, определяемый как временной интервал от появления симптома до
прибытие в больницу на 6 и более часов, было включено в модель как двоичный
поле.
Анализ логистической регрессии использовался для выявления независимых предикторов.
смертности, а главная независимая переменная, боль в груди, была вынуждена
модель. Другими переменными, включенными в модель смертности, были возраст, раса,
пол, регион, статус плательщика, время появления симптома ИМ, исходные данные ЭКГ
(Подъем сегмента ST, блокада левой ножки пучка Гиса), расположение ИМ, класс Киллипа,
Тип ИМ и гиперхолестеринемия в анамнезе, статус курения, диабет,
гипертония, стенокардия, перенесенный инфаркт миокарда, ангиопластика коронарной артерии, операция АКШ,
сердечная недостаточность и инсульт.Отдельная модель была разработана для включения дополнительных
влияние дополнительных лекарств, введенных в течение первых 24 часов:
аспирин, гепарин, β-адреноблокаторы, нитроглицерин внутривенно и ангиотензинпревращающие
ингибиторы ферментов. Скорректированная смертность (отношения шансов [OR] и 95% достоверность
интервалы [CIs]) определяли для всей исследуемой популяции.
Одна треть пациентов с ИМ в исследуемой популяции обратилась без грудной клетки
боль (т. е. атипичные симптомы) при первоначальной оценке, и две трети были представлены
с болью в груди (Таблица 1).Пациенты
с ИМ без боли в груди, как правило, были старше (средний возраст 74,2 против 66,9
лет) и были женщинами (49,0% против 38,0% мужчин). Пациенты в возрасте 75 лет или
пожилые люди чаще обращались без боли в груди, а те, кто моложе
65 лет чаще жаловались на боли в груди. Пациенты без грудной клетки
боль была более распространена при диабете, гипертонии, сердечной недостаточности,
и инсульт, а также более низкая распространенность курения в анамнезе, гиперхолестеринемии,
семейный анамнез ишемической болезни сердца или предшествующая реваскуляризация с
либо ангиопластика коронарной артерии, либо операция АКШ.
Пациенты, перенесшие ИМ без боли в груди, чаще имели
задержки с момента появления симптомов до поступления в больницу (в среднем,
7,9 против 5,3 часа), хотя с большей вероятностью они были доставлены в
в больницу через скорую помощь (56,8% против 46,5%). При первоначальной оценке пациенты с ИМ
без боли в груди, как правило, относились к более высокому классу Киллипа, чем пациенты, которые
поступил с болью в груди, имел более высокую долю инфаркта без зубца Q,
и имели немного меньшую вероятность перенесенного инфаркта миокарда.Группа МИ
без боли в груди при первичном обращении значительно реже
поступить с первичным диагнозом ИМ.
Многофакторные предикторы атипичных симптомов
Представлен профиль факторов риска у пациентов с ИМ без боли в груди.
в таблице 2. Шесть важных переменных
связанные с атипичным представлением (в нисходящей иерархии), были
сердечная недостаточность, перенесенный инсульт, пожилой возраст, диабет, женский пол и небелое население
расовая / этническая группа.Пациенты, которые курили, страдали гиперхолестеринемией или имели
наличие в анамнезе ишемической болезни сердца (стенокардия, инфаркт, коронарная ангиопластика,
или операция АКШ) имела большую вероятность боли в груди при первичном обращении в больницу.
презентация. Наличие большего количества из этих 6 факторов риска (как
определено из таблицы 2) был связан
с повышенной вероятностью того, что у пациента с ИМ не будет боли в груди
(Таблица 3). Например, если
У пациента с ИМ не было ни одного из этих 6 факторов риска, только 17.5% таких пациентов
не будет боли в груди. И наоборот, если у пациента было хотя бы 3 фактора риска,
была почти 50% или более вероятность того, что эти пациенты не
есть боль в груди.
Среди подгруппы пациентов с ИМ, подходящих для острой реперфузии
терапии, те, у кого не было боли в груди, значительно реже получали лечение
с тромболизисом, первичной ангиопластикой или любой реперфузионной терапией (Таблица 4).Пациенты с ИМ без
боль в груди также имела значительно более длительные интервалы времени от двери до лечения с
либо тромболитическая терапия (в среднем 2,3 против 1,1 часа), либо первичная ангиопластика
(в среднем 4,7 против 2,9 часа). Первоначальная ЭКГ была получена намного позже в ИМ
группа без боли в груди (в среднем 31,8 против 15,6 минут). Пациенты, испытывающие
ИМ без боли в груди реже получали аспирин или другие антитромбоцитарные препараты.
агенты, гепарин или β-адреноблокаторы в течение первых 24 часов, а также
получили значительно меньше коронарных ангиограмм или последующей коронарной реваскуляризации
с ангиопластикой или операцией АКШ.
Пациентов, перенесших ИМ без боли в груди, было значительно больше.
вероятность смерти в больнице по сравнению с пациентами с ИМ с болью в груди (23,3%
против 9,3%). Однако пациенты с ИМ с болью в груди в среднем были более вероятны.
умереть раньше, чем пациенты с инфарктом миокарда без боли в груди. Пациенты, испытавшие
ИМ без боли в груди с большей вероятностью разовьёт инсульт, гипотензию или
сердечная недостаточность, которая требовала вмешательства и имела более низкую среднюю фракцию выброса
при измерении.Общая продолжительность пребывания у пациентов с ИМ была значительно больше.
без боли в груди, но разница в общем количестве дней в
отделение интенсивной терапии (таблица 5).
В многомерном логистическом регрессионном анализе презентация с
отсутствие боли в груди было одним из наиболее важных независимых предикторов
связанные со смертностью (более чем в 2 раза повышенный риск внутрибольничной смерти) по сравнению с
с пациентами с ИМ с болью в груди (ОШ 2,21; 95% ДИ 2.17-2.26) (таблица 6). В отдельной модели логистической регрессии, которая включала
дополнительное влияние дополнительных лекарств, вводимых в течение
первые 24 часа (т. е. использование аспирина, гепарина, β-адреноблокаторов, внутривенное
нитроглицерин и ингибиторы ангиотензинпревращающего фермента), операционная в стационаре
смертность среди пациентов с ИМ без боли в груди составила 1,59 (95% ДИ, 1,57–1,61) по сравнению с
с больными ИМ с болью в груди. Это дифференциальное (более низкое) использование ранних фармакологических
лечение пациентов с ИМ без боли в груди составило более 28%
более высокой смертности, наблюдаемой в этой популяции пациентов с высоким риском.
Насколько нам известно, этот анализ представляет собой крупнейший наблюдательный
исследование, сравнивающее характеристики, методы лечения и результаты
Пациенты с инфарктом миокарда с болями в груди и без них в США. Мы нашли это
У 1 из 3 пациентов, у которых при первичной госпитализации был диагностирован ИМ, не было
боль в груди при поступлении и вопреки имеющимся сведениям, пациенты с
диабет составлял менее одной трети этой группы.Хотя диабет был
важный фактор риска атипичного проявления, другие сопутствующие факторы риска
при отсутствии боли в груди включал пожилой возраст, женский пол, цвет небелой расы / этнической принадлежности
группа, и предшествующая история застойной сердечной недостаточности и инсульта.
Важно отметить, что обращение в больницу задержалось более чем на 2 человека.
часов для пациентов с ИМ без боли в груди по сравнению со временем задержки для
пациенты с болью в груди. Кроме того, по прибытии в больницу пациенты
без боли в груди с меньшей вероятностью были распознаны как имеющие ИМ, и
реже получали терапию, улучшающую выживаемость, такую как тромболизис
или первичная ангиопластика (среди подходящих кандидатов), аспирин, β-адреноблокатор
терапия, или гепарин.Кроме того, пациенты с ИМ без боли в груди были значительно
менее вероятно получение своевременной ЭКГ или стратегии реперфузии. Пациенты, которые
перенесенный ИМ без боли в груди имел более чем 2-кратный повышенный риск
госпитальной смерти, чем пациенты с инфарктом миокарда, у которых возникла боль в груди, даже после
с поправкой на различия в характеристиках клинической картины. Двадцать восемь
процент более высокой смертности, наблюдаемой у пациентов с ИМ без боли в груди
может быть связано с меньшим использованием ранних фармакологических методов лечения.
В рамках этого анализа мы исследовали национальную выборку пациентов, которые
признался с МИ. Таким образом, мы можем оценить чувствительность симптома
боль в груди (количество пациентов с ИМ с болью в груди, деленное на общее количество
пациентов с инфарктом миокарда), а также частота ложноотрицательных результатов (количество пациентов с ИМ без
боль в груди, деленная на общее количество пациентов с ИМ). Однако этот наблюдательный
исследование не включало когорту пациентов без ИМ. Таким образом, мы не могли
определить специфичность или прогностическую ценность этого симптома.Хотя это
может быть так, важно подчеркнуть, что наши выводы относительно
низкая чувствительность к боли в груди (или относительно высокий уровень ложноотрицательных результатов для
отсутствие боли в груди) среди пациентов с задокументированным ИМ должны
проявлять осторожность при рассмотрении диагноза ИМ маловероятным при отсутствии
боль в груди, особенно с учетом худших исходов у пациентов с ИМ без
боль в груди.
Хотя можно было охарактеризовать, есть ли у пациентов с ИМ грудная клетка
боль при первичном обращении, дополнительные сведения о предъявленных жалобах
выходили за рамки NRMI-2.В отчете об атипичных презентациях за 1977 год
из штата Мичиган, Бин 4 описал следующие 10-дюймовые маскарады
ИМ »в вероятном порядке ранжирования по частоте: (1) застойная сердечная недостаточность, (2)
классическая стенокардия без особо тяжелого или длительного приступа,
(3) сердечная аритмия, (4) атипичное расположение боли, (5) центральная нервная система.
системные проявления, напоминающие инсульт, (6) опасения и нервозность,
(7) внезапная мания или психоз, (8) обморок, (9) непреодолимая слабость и
(10) острое расстройство желудка.Хотя сообщалось об атипичных проявлениях,
Бин признал, что истинная степень отсутствия боли в груди у пациентов с ИМ остается
в значительной степени неизвестно. Почти 25 лет спустя, даже с появлением лучшего
методы выявления ИМ, распространенность атипичных представлений пациентов
с задокументированным ИМ до сих пор остаются неизвестными.
Может быть труднее получить в анамнезе боль в груди и другие симптомы.
от пациентов с атипичным ИМ. Мы обнаружили, что пациенты с ИМ
с болью в груди, в среднем, умирали раньше, чем пациенты с ИМ
без боли в груди.Данные NRMI-2 предполагают, что одышка может иметь
представляют собой основной компонент жалоб у пациентов с ИМ.
без боли в груди. Например, пациенты с ИМ без боли в груди были больше
вероятно проявится при отеке легких (класс по Киллипу II и III), требуется
медикаментозное лечение сердечной недостаточности и наличие в анамнезе сердечной недостаточности
неудачи, чем пациенты, перенесшие ИМ с болью в груди. Кроме того, в
в этом национальном регистре пациенты с ИМ без боли в груди с большей вероятностью
у вас остановка сердца и инсульт.Невозможность запечатлеть истинное состояние пациента.
Основная жалоба в этом исследовании (при отсутствии боли в груди) — важная
ограничение, но мы считаем, что это не ставит под угрозу наши выводы. Степень
этой проблемы можно еще больше недооценить, потому что значительное количество
пациентов с ИМ могут иметь атипичную боль в груди, хотя их боль может
быть плевритным, позиционным или воспроизводимым при пальпации грудной клетки. Кроме того,
некоторые пациенты с ИМ протекают полностью бессимптомно и не госпитализированы, а
диагноз распознается только после интерпретации последующего (рутинного)
ЭКГ.
Выявление признаков и симптомов острого ИМ имеет первостепенное значение для успеха
управление и раннее лечение. Пациенты должны понимать, что их симптомы
может соответствовать сердечной причине, и многочисленные отчеты показали, что
пациенты могут отложить обращение за помощью, если они не знают, что их симптомы могут
соответствовать МИ. 3 Эта проблема
дополнительно усугубляется, если пациенты считают, что боль в груди является необходимым признаком
особенность МИ.
Даже если система экстренного реагирования, такая как 911, активируется раньше,
персонал службы экстренной медицинской помощи должен решить, следует ли транспортировать пациента,
и впоследствии медсестры и врачи должны решить, как отсортировать и лечить
эти пациенты по прибытии в отделение неотложной помощи. Медицинские работники
нужна информация, чтобы предупредить их о распознавании нетипичных представлений в группе высокого риска
группы, например, с сердечной недостаточностью, инсультом или диабетом в анамнезе,
возраст старше 75 лет, женский пол и небелая расовая / этническая группа.В
последние 3 группы (пожилые люди, женщины и этнические меньшинства) представляют особенно
уязвимые группы населения, которые, согласно другим исследованиям, подвержены риску
для недолечения в ИМ. 5 , 7 -11
Повышение осведомленности о проявлениях ИМ без боли в груди может уменьшить неравенство
в лечении этих групп.
Насколько нам известно, исход у пациентов с ИМ без боли в груди
ранее не сообщалось.В этом наборе данных пациенты с ИМ без грудной клетки
Смертность в больнице более чем в два раза выше, чем у пациентов с грудной клеткой.
боль. Масштабы этих различий в смертности не ожидались, и
сохраняется, несмотря на поправку на разницу в возрасте, сопутствующих заболеваниях и степени тяжести
презентации. Мы не можем исключить возможность того, что остаточное смешение
могли частично объяснить более высокую больничную смертность в группе
без боли в груди. Однако степень различий, наблюдаемых у пациента
отсрочка и более низкое использование методов лечения инфаркта миокарда значительно улучшают выживаемость
способствовали худшему исходу у пациентов с инфарктом миокарда без боли в груди.
В большинстве рандомизированных клинических исследований лечения ИМ
требуется наличие боли в груди, и несколько исследований касались клинических
значение и исход пациентов с инфарктом миокарда без боли в груди. Beller 12 сообщил, что боль в груди часто является последним маркером.
ишемии в ишемическом каскаде, которой часто предшествуют нарушения перфузии,
аномалии движения стенок и изменения ЭКГ. Несколько исследований показали, что
несоответствие между болью в груди и проходимостью артерий.Califf et al. 13 показали тромболизис и ангиопластику в
Исследование инфаркта миокарда показало, что 16% пациентов с полным облегчением грудной клетки
боль после того, как активатор плазминогена тканевого типа имел окклюзию артерии на 90 °
минут, и у 29% пациентов с частичным облегчением боли в груди все еще оставалась закупоренная артерия
через 90 минут. Ohman et al. 14 показали, что в
тот же тромболизис и ангиопластика в когорте инфаркта миокарда, 12%
у пациентов была повторная окклюзия после успешной литической терапии, но у 42% пациентов не было
проявлять симптомы.Эти анализы иллюстрируют неопределенность и несоответствие.
что может существовать между разрешением боли в груди пациента и проходимостью
коронарной артерии, связанной с инфарктом, после реперфузии. Совсем недавно, используя
данные из реестра тромболизиса при инфаркте миокарда, Cox et al. 15 показали, что применение тромболитической терапии
ИМ с подъемом сегмента ST в группе, у которой боль в груди исчезла, был
безопасно и не было связано с чрезмерными осложнениями.В этом исследовании
более чем у 90% этих пациентов без боли в груди развилась ферментативная
свидетельство МИ. Исследователи тромболизиса при инфаркте миокарда предполагают:
что целесообразно проводить реперфузионную терапию среди других подходящих
Пациенты с ИМ, даже если их симптомы уменьшились. 15
Основные ограничения данных NRMI-2 были описаны ранее. 16 , 17 Данные из NRMI-2 были получены извне
подтверждены и сопоставимы с Cooperative Cardiovascular
Проект в отношении основных показателей процесса и результатов в ретроспективе
обзор диаграммы. 18 Основные ограничения наших
исследования включают отсутствие когорты без ИМ и отсутствие дополнительных
подробности предъявляемых жалоб при отсутствии боли в груди. Кроме того,
систематическая ошибка при проверке, возникшая в результате более высокой вероятности того, что врачи
будет принимать пациентов с болью в груди и отправлять домой тех пациентов с ИМ без
боль в груди, возможно, была возможна. Однако пациенты с пропущенным ИМ, которые
ненадлежащим образом выписаны домой из отделения неотложной помощи значительно
худшие результаты. 19 -21
Таким образом, хотя возможна ошибка проверки, эффект исключения этого
когорта пациентов с пропущенным ИМ будет склонять наши результаты к
нуль, и истинное влияние (после включения этой группы высокого риска пропущенных
ИМ, который более вероятен у пациентов с атипичными проявлениями) будет
даже больше, чем мы наблюдали. Кроме того, как и в любом наблюдательном исследовании, неизмеримые
искажающие факторы могли частично объяснить наши наблюдения, хотя величина
Нельзя игнорировать различия в задержке пациентов и лечении.
Возможное разветвление наших результатов для клинической практики:
информировать пациентов и врачей о степени связанных с инфарктом миокарда.
с нетипичными характеристиками и для более быстрой и точной идентификации
этих пациентов с ИМ, повышая индекс подозрительности у некоторых пациентов
без боли в груди, но не у всех пациентов без боли в груди. Если врачи
неверно истолковали наши выводы и без разбора подняли индекс
подозрительность для всех пациентов и снижение их порога для последующих госпитализаций,
частота госпитализаций может увеличиваться за счет более низких
точность и большие экономические последствия.
Значительное количество пациентов с ИМ без боли в груди
по первоначальной оценке. Мы обнаружили, что у этих пациентов была значительная задержка
обращались за помощью, реже получали важные виды лечения и
худшие результаты. Национальные инициативы в области здравоохранения, которые просвещают общественность и
медицинские работники должны подчеркнуть, что наличие боли в груди не
обязательно отличительный признак в MI и должен включать другие функции
инфаркта миокарда для более быстрого распознавания и лечения инфаркта миокарда в
отсутствие боли в груди.Более раннее признание этого факта может позволить
группы пациентов, которые следует рассмотреть раньше, чем обратиться в медицинское учреждение
и медицинские работники для идентификации таких пациентов, чтобы они могли получить
своевременные диагностические и терапевтические вмешательства, повышающие выживаемость.
Для проспективного и точного выявления ИМ необходимы дополнительные исследования.
пациенты без боли в груди.
1.
Браунвальд Э. Болезни сердца, четвертое издание. Филадельфия, Пенсильвания: WB Saunders Co; 1992: 1214-1215.
2.Gillum RF, Fortmann SP, Prineas RJ, Kottke TE. Международные диагностические критерии острого инфаркта миокарда и
острый инсульт. Am Heart J. 1984; 108: 150-158. Google Scholar4.Bean WB. Маскарады инфаркта миокарда. Ланцет. 1977; 1: 1044-1046. 5 Баррон Х.В., Боулби Л.Дж., Брин Т.
и другие. Использование реперфузионной терапии при остром инфаркте миокарда в США
Состояния. Тираж. 1998; 97: 1150-1156.Google Scholar6.Acharya DU, Shekhar YC, Aggarwal A, Anand IS. Отсутствие боли при инфаркте миокарда у диабетиков: вегетативно.
дисфункция ответственна? Am J Cardiol. 1991; 68: 793-796.Google Scholar7.Taylor HA, Canto JG, Sanderson B, Rogers WJ, Hilbe J. Ведение и исходы для чернокожих пациентов с острым инфарктом миокарда
в эпоху реперфузии. Am J Cardiol. 1998; 82: 1019-1023.Google Scholar 8. McLaughlin TJ, Soumerai SB, Willison DJ.
и другие.Соблюдение национальных рекомендаций по медикаментозному лечению подозрений на острое заболевание.
Инфаркт миокарда: данные о недостаточном лечении у женщин и пожилых людей. Arch Intern Med. 1996; 156: 799-805.Google Scholar9.Chandra NC, Ziegelstein RC, Rogers WJ.
и другие. Наблюдения за лечением женщин с миокардиальной
инфаркт. Arch Intern Med. 1998; 158: 981-988.Google Scholar 10.Weaver WD, Litwin PE, Martin JS.
и другие. для проектной группы MITI. Влияние возраста на использование тромболитической терапии и смертность при острой
инфаркт миокарда. J Am Coll Cardiol. , 1991; 18: 657-662. Google Scholar, 11. Krumholz HM, Murillo JE, Chen JJ.
и другие. Тромболитическая терапия для подходящих пожилых пациентов с острым миокардом
инфаркт. JAMA. 1997; 277: 1683-1688. Google Scholar, 12.
Beller GA. Клиническая ядерная кардиология. Филадельфия, Пенсильвания: WB Saunders Co; 1995: 98.
13.Калифф Р.М., О’Нил В., Стэк Р.
и другие. Неспособность простых клинических измерений предсказать статус перфузии
после внутривенного тромболизиса. Ann Intern Med. 1988; 108: 658-662. Google Scholar, 14. Ohman EM, Califf RM, Topol EJ.
и другие. Последствия реокклюзии после успешной реперфузионной терапии в
острый инфаркт миокарда. Тираж. 1990; 82: 781-791.Google Scholar15.Cox DA, Rogers WJ, Aguirre FV.
и другие. Влияние на исход наличия или отсутствия боли в груди в начале
терапии р-ТПА при остром инфаркте миокарда. Am J Cardiol. 1994; 73: 729-736.Google Scholar 16. Роджерс У. Дж., Боулби Л. Дж., Чандра, Северная Каролина.и другие. Лечение инфаркта миокарда в США (с 1990 по 1993 год):
наблюдения из Национального регистра инфаркта миокарда. Тираж. 1994; 90: 2103-2114.Google Scholar, 17.Canto JG, Rogers WJ, Bowlby LJ.
и другие. На догоспитальной электрокардиограмме при остром инфаркте миокарда:
полностью ли реализован его потенциал? J Am Coll Cardiol. 1997; 29: 498-505.Google Scholar 18.Every NR, Frederick PD, Robinson M.
и другие. Сравнение Национального регистра инфаркта миокарда 2 с
совместный сердечно-сосудистый проект. J Am Coll Cardiol. 1999; 33: 1886-1894.Google Scholar19.Rouan GW, Hedges JR, Toltzis R, Goldstein-Wayne B, Brand D, Goldman L. Клиника боли в груди для улучшения последующего наблюдения за пациентами, выписанными из
отделение неотложной помощи городской университетской клинической больницы. Ann Emerg Med. 1987; 16: 1145-1150.Google Scholar20.Lee TH, Rouan GW, Weisberg MC.
и другие. Клиническая характеристика и естественный анамнез пациентов с острым
Инфаркт миокарда отправлен домой из реанимации. Am J Cardiol. 1987; 60: 219-224. Google Scholar, 21, Маккарти, Б. Д., Бешанский, Д. Р., Д’Агостино, Р. Б., Селкер, HP. Пропущенный диагноз острого инфаркта миокарда в отделении неотложной помощи:
результаты многоцентрового исследования. Ann Emerg Med. 1993; 22: 579-582.Google Scholar
Временные и спектральные характеристики ожиданий и ошибок прогноза боли и термоцепции
Существенных изменений:
1) Существует огромное количество литературы по связанной с болью тета-, альфа- и гамма-активности, которые авторы должны упомянуть во введении, чтобы подготовить читателя к результатам.Точно так же раздел «Обсуждение» очень сфокусирован на эффектах визуализации, несмотря на огромное количество литературы по колебаниям, связанным с болью. Интересно, что единственная статья, на которую авторы ссылаются в отношении гамма-активности, полагается на артефакт (Zhang et al., 2012). Авторы должны обсудить свои выводы в свете нейрофизиологических исследований.
Спасибо, что указали на это. Теперь мы интегрировали несколько параграфов во Введении, а также в Обсуждение части пересмотренной статьи и добавили ссылки на существующие, сосредоточив больше внимания на нейрофизиологических исследованиях боли.
2) В отличие от Fazeli and Büchel, 2018, поведенческие данные не показывают эффектов PE. Имеет ли смысл анализировать эффекты ПЭ в данных визуализации, если поведенческие эффекты ПЭ не обнаружены?
Это важный вопрос, который относится к нейробиологическим исследованиям в целом. По сути, эксперимент связывает возмущение (в нашем случае ожидания, тепловую стимуляцию и ошибки прогноза) с считыванием (поведенческий ответ, нейрофизиологический ответ, вегетативный ответ и т. Д.).). Во многих случаях важно считывание поведенческих данных, потому что это эффект, который определяет, является ли возмущение эффективным, например во многих клинических исследованиях, где успешное вмешательство должно изменить симптомы заболевания (например, боль, на которую указывают оценки боли). Однако в исследованиях, пытающихся понять нейрофизиологические механизмы, имеет смысл интерпретировать нейрофизиологические данные как результат возмущения даже при отсутствии поведенческого эффекта. Кроме того, рейтинг ВАШ (или любое считывание поведенческих данных) объединяет многие нейронные процессы, и, хотя тщательный экспериментальный план пытается изолировать интересующие эффекты, он по-прежнему подвержен многим когнитивным и эмоциональным процессам, которые напрямую не участвуют в конкретном процессе. в вопросе (e.грамм. ошибка предсказания). Следовательно, на поведенческую реакцию влияет множество (не связанных) влияний, которые могут скрыть рассматриваемый эффект.
В исследовании Geuter, Boll, Eippert и Büchel, 2017, мы наблюдали эффект ошибки предсказания с использованием автономных показателей (SCR, ученик). Однако в исследовании с использованием более сложной парадигмы (Fazeli and Büchel, 2018), где мы использовали оценки боли, мы не смогли выявить эффект ошибки поведенческого прогнозирования (аналогично настоящему исследованию). Следовательно, возможно, что оценки поведенческой боли менее чувствительны к ПЭ, и что было бы лучше использовать автономные считывания.
3) Исследование касается ожиданий и ПЭ при боли. С этой целью была проведена парадигма подсказок с тремя интенсивностями теплового стимула. Однако самая низкая интенсивность стимула воспринималась не как болезненная, а как теплая. Таким образом, некоторые ПЭ относятся к ошибкам, касающимся интенсивности боли, а другие ПЭ — к ошибкам, касающимся боли, а не безболезненного тепла. Более того, слабый болевой сигнал на самом деле не является болевым сигналом. Таким образом, действительно ли исследование касается ПЭ при боли? Разве не нужно ограничивать анализ болезненными раздражителями? Или исследование следует переформулировать как изучение ПЭ в тепловом восприятии?
В связи с этим неясно, было ли правильным решение поддерживать температуру стимуляции на одном уровне для всех участников.Поскольку это внутрисубъектный дизайн, авторы хотят максимизировать различия в восприятии (например, нет, слабая, сильная боль).
Теплочувствительные ноцицепторы C-волокон имеют средний тепловой порог 41 ° C (Treede et al., 1995), и поэтому наша самая низкая температура стимула (42 ° C) была установлена выше этого порога. Хотя интенсивность этого стимула не всегда оценивалась как болезненная (см. Ниже), мы все же считаем, что этот выбор действителен, исходя из нейрофизиологических свойств С-волокон.Как следствие, можно предположить, что эти стимулы активируют ноцицептивную систему и, таким образом, могут вызывать боль. Кроме того, мы использовали довольно грубую шкалу ВАШ всего с четырьмя уровнями, чтобы позволить кратковременное нажатие кнопок, что могло внести неоднозначность оценки на более низких уровнях боли. Наконец, использование трех температур позволило нам охватить широкий диапазон температур, связанных с ноцицепцией. Мы также хотели максимально приблизиться к предыдущему исследованию фМРТ и использовать те же свойства стимула (Fazeli and Buechel, 2018).Теперь это было разъяснено в рукописи.
4) Настоящее исследование концептуализирует ПЭ как абсолютную ПЭ без знака, то есть аналогичная ПЭ возникает, когда сенсорные доказательства менее или более интенсивны, чем ожидалось. Однако другие концепции PE предполагают абсолютную знаковую PE, то есть противоположные нейронные эффекты возникают, когда сенсорные свидетельства менее или более интенсивны, чем ожидалось. Более того, третья концепция предполагает отрицательную ПЭ, то есть ПЭ возникает только тогда, когда сенсорные свидетельства более интенсивны, чем ожидалось.Авторы должны четко объяснить и мотивировать свое определение ПЭ. Более того, авторы могут провести аналогичный анализ для других определений ПЭ.
Спасибо за это предложение. Мы расширили наш анализ и изучили дополнительные ошибки прогнозов. Первоначально мы воздерживались от такого анализа, потому что подписанный PE не ортогонален коэффициенту ожидания. Однако, предполагая, что ожидание должно наблюдаться раньше (после сигнала), а ПЭ позже (после ноцицептивного стимула), можно проверить наличие подписанного ПЭ в фазе боли.Мы выполнили эти анализы. Однако они не выявили значимого эффекта (все p> 0,05). Теперь это добавлено к рукописи. Кроме того, мы исследовали «отрицательную ПЭ», которую мы называем «ПЭ боли» (как у Geuter et al., 2017). По сути, это привело к фактору, при котором только 3 комбинации сигнала-стимула привели к ПЭ, а именно: слабый сигнал боли + средний сигнал боли / низкий сигнал боли + высокий уровень боли / средний сигнал боли + высокий уровень боли. Однако значимых результатов это не дало (все p>.05).
5) Связь между GBO и PE отрицательная, т.е. чем больше PE, тем ниже амплитуда GBO. Этот паттерн противоречит всем предыдущим выводам по GBO и PE и, следовательно, скорее противоречит, чем поддерживает кодирование PE с помощью GBO.
Мы включили в обсуждение два направления, чтобы связать эти результаты с литературой, связывающей PE с GBO. Во-первых, было обнаружено, что γ-колебания перед стимулом отрицательно модулируют последующую болевую реакцию, т.е.е. боль воспринималась как более болезненная, и вызванные потенциалы демонстрировали большую амплитуду при более низкой предстимульной γ-активности (Tu et al., 2016), что подразумевает механизмы, сопоставимые с нашим обнаружением ошибок предсказания. Во-вторых, реакция γ, связанная с интенсивностью стимула без ошибки прогноза, влечет за собой увеличение GBO (рис. 5), которое различается для разных интенсивностей стимула и должно быть принято во внимание. Мы добавили параграф в Обсуждение и описали это понятие:
«Однако, с другой точки зрения, ранняя отрицательная модуляция активности γ напрямую связана с относительным увеличением γ с течением времени (см. Рисунок 7 — приложение к рисунку 3 для схематической демонстрации), что предполагает потенциальный механизм нейронного кодирования. ошибок предсказания боли.Кроме того, гамма-колебания перед стимулом негативно модулируют последующую болевую реакцию, то есть боль воспринимается как более болезненная, а вызванные потенциалы имеют большую амплитуду при более низкой гамма-активности перед стимулом (Tu et al., 2016).
6) Связь между альфа-бета-колебаниями и ожиданиями не совсем ясна. Текст и рисунок 6 указывают на положительную взаимосвязь, тогда как позже он описывает уменьшение мощности диапазона альфа-бета, связанное с манипуляцией ожиданиями, т.е.е., отрицательные отношения.
Приносим извинения за эту ошибку в рукописи, которая была исправлена. Теперь мы правильно говорим о ПОЛОЖИТЕЛЬНЫХ отношениях во всех частях рукописи.
7) Эффекты ожидания были проанализированы с синхронизацией с сигналом. Таким образом, их время относительно применения теплового стимула неясно, то есть неизвестно, возникают ли ожидаемые эффекты до или после применения стимула. Авторы должны найти способ прояснить это.
Спасибо, что указали на это. Благодаря нашему пересмотренному анализу, эффект ожидания явно распространяется на моменты времени до начала действия стимула. Чтобы прояснить это в отредактированной рукописи, мы отметили область появления стимула в частотно-временном представлении эффекта.
8) Есть ли причина, по которой авторы сосредоточились только на боли? Визуальная часть может служить контрольным экспериментом, а болевая часть — контролем визуального эксперимента. Было бы желательно увидеть, есть ли аналогичные эффекты ошибки предсказания в любых модальностях.В качестве альтернативы авторы могут объяснить мотивацию состояния визуального контроля и почему это не имеет отношения к настоящему исследованию.
Нашей основной целью было выявить эффекты с высоким временным разрешением с помощью ЭЭГ и в то же время максимально приблизиться к нашему предыдущему исследованию фМРТ (Fazeli and Büchel, 2018). Поэтому мы использовали экспериментальный план, который был почти идентичен предыдущему исследованию. Мы согласны с этим рецензентом в том, что визуальная часть эксперимента интересна сама по себе, и мы планируем совместно проанализировать данные ЭЭГ из этого исследования вместе с данными фМРТ от Fazeli and Büchel, 2018 и суммировать результаты в другой статье.Мы твердо убеждены, что это выходит за рамки данной рукописи с упором на исследование свойств ноцицептивных ответов.
9) Есть проблемы с анализом гамма-колебаний. Есть дополнительные и важные шаги, необходимые для предотвращения того, чтобы результаты были основаны на мышечных артефактах (например, Zhang et al., 2012). Авторы могут захотеть предпринять следующие шаги:
a) Проверка частотно-временных разложенных данных ICA на уровне единичного исследования
b) Постройте график испытаний после z-преобразования на основе среднего значения и стандартного отклонения для всего компонента или, возможно, для всех компонентов.Z-преобразование должно выполняться отдельно для каждой частоты.
c) Компоненты артефактов или испытания легко видны, и их следует сравнивать с необработанным временным графиком ICA, поскольку здесь также можно легко обнаружить мышечные спайки. Однако графики СКР более чувствительны. Процедура обнаружения артефактов может потребовать более тонкого скользящего окна, чем те 50 мс, которые использовали авторы.
d) Одиночные и отдельные мышечные спайки показаны в виде столбцов, аналогично рисунку, представленному в Zhang et al., 2012. Перекрывающиеся мышечные спайки выглядят как «облака» и могут быть ошибочно приняты за активность коры. Полезна конфиденциальная однократная пробная проверка данных, преобразованных ICA.
е). Поскольку у авторов небольшое количество испытаний для некоторых комбинаций (~ 1%), они могут захотеть больше сосредоточиться на отклонении компонентов, чем на отклонении проб. От авторов может потребоваться исключить до 30 компонентов из дальнейшего анализа. Программное обеспечение Vision Analyzer от Brain Products имеет некоторые функции, которые авторы могут найти полезными, например, интерфейс Matlab для экспорта данных в FieldTrip, а также отличную функцию наложения очищенных и неочищенных данных после удаления компонента.
Это важный момент, и мы благодарим рецензента за указание на это и за то, что он дал нам четкое руководство в виде пошагового подхода к удалению артефактов. Теперь мы повторно проанализировали весь наш набор данных, следуя этому подходу. Отредактированная рукопись теперь включает подробное описание этих шагов (в результате чего было отклонено до 30 компонентов) и гистограмму, показывающую количество отклоненных артефактов на участника для обзора (рисунок 1 — приложение к рисунку 1).Важно отметить, что мы смогли воспроизвести все эффекты, используя этот более строгий подход, и соответственно изменили результаты и цифры в исправленной рукописи.
10) Обычно менее половины образца проявляют связанную с болью гамма-активность. Не могли бы авторы предоставить график гистограммы для гамма-амплитуды с поправкой на базовый уровень по всей выборке?
Спасибо, что указали на это. Теперь мы предоставили гистограмму для скорректированной по базовому уровню гамма-амплитуды для состояний с низкой и высокой степенью боли.Кроме того, мы добавили график, показывающий разницу между состояниями слабой и сильной боли (Рисунок 5 — рисунок в приложении 4).
11) Есть ли причина не включать анализ источника для кодирования интенсивности боли? Авторы предоставили исходный анализ для всех других аспектов и должны сделать то же самое для кодирования боли для всех частот.
Мы включили анализ источников всех нейрофизиологических эффектов в дополнительные материалы.
12) Анализ должен быть достаточно подробно объяснен для повторения.В частности, следует пояснить, для каких тестов перестановки кластеров время-частота-электродные пространства проводились. Более того, следует подробно описать, как рассчитывались эффекты ошибки предсказания (взаимодействие между интенсивностью стимула и ожиданиями в ANOVA?).
Спасибо, что указали на это, теперь мы расширили наши пояснения относительно нашего анализа, особенно для пространств время-частота-электроды, а также для расчета эффекта абсолютной ошибки предсказания.
[Примечание редакции: до принятия были предложены дальнейшие изменения, как описано ниже.]
Существенные изменения:
1) Одна проблема, которая не была полностью решена, — это озабоченность по поводу шкалы оценки боли, где «1» явно выходит за пределы диапазона боли и оценивается как нейтральный. Более того, слабый болевой сигнал на самом деле не является болевым сигналом. Важно не периферия и использование С-волокон, а субъективное восприятие боли участниками.Существует множество литературы, показывающей, что участники различаются по болевой чувствительности. Алгоритм QUEST для индивидуальной адаптации интенсивности боли из Taesler and Rose, 2017 был бы более подходящим для определения различных уровней интенсивности боли. При внутрисубъектном анализе следует (вероятно) всегда использовать индивидуально адаптированную интенсивность боли. Этот вопрос о том, что стимулы варьировались от безболезненного тепла до умеренной боли, должен быть подробно рассмотрен во всей рукописи (включая заголовок) и добавлен в абзац об ограничениях.Важно, чтобы следующие вопросы были решены убедительно и чтобы эти соображения были включены в раздел «Обсуждение». Действительно ли исследование касается ПЭ при боли? Разве не нужно ограничивать анализ болезненными раздражителями? Или исследование следует переформулировать как изучение ПЭ в тепловом восприятии?
Хотя наша самая низкая температура стимула была выше порога для периферических ноцицепторов, мы согласны с тем, что по крайней мере некоторые из испытаний с низкой болью не привели к субъективному восприятию боли.Поэтому мы последовали предложению рецензентов и провели дополнительный анализ, который включал только тепловые стимулы средней и высокой интенсивности. Анализ поведенческих данных показывает четкие эффекты интенсивности стимула, ожидания и эффекта ошибки предсказания (PE). Это похоже на анализ, включающий все стимулы, но эффект PE, который был трендом (p <0,1) в полном анализе, теперь значим при p <0,001. В соответствии с первоначальным анализом, новый анализ ЭЭГ только со средней и высокой интенсивностью стимула выявил отрицательный эффект абсолютной ошибки предсказания в гамма-диапазоне и эффект альфа-бета интенсивности стимула.Эти результаты теперь включены в рукопись, включая новый рисунок.
2) Ответ на центральный вопрос об отсутствии поведенческих эффектов не совсем убедителен. Главный аргумент состоит в том, что действительно имеет смысл исследовать эффекты визуализации ПЭ без каких-либо поведенческих эффектов. Однако было бы уместно более обоснованное рассмотрение значимости эффектов визуализации ПЭ при отсутствии поведенческих эффектов. Эти соображения также следует включить в раздел «Обсуждение».
Хотя сокращение дизайна до стимулов средней и высокой интенсивности привело к значительному эффекту ошибки прогнозирования в поведенческих данных, мы включили подробное и более общее обсуждение того, имеет ли смысл исследовать эффекты визуализации ПЭ без каких-либо поведенческих эффектов на основе уровня тенденции. эффект полной модели.
«Мы наблюдали поведенческий эффект ошибок прогнозирования на воспринимаемую интенсивность стимула в модели уменьшенной боли, но этот эффект был только тенденцией в полной модели.Последний результат повторяет предыдущее исследование (Fazeli and Büchel, 2018), указывая на устойчивый эффект. Интересно, что влияние ошибок предсказания на восприятие увеличилось и стало значительным, когда мы ограничили наш анализ явно болезненными стимулами (модель уменьшенной боли). Это говорит о том, что ошибка предсказания, по-видимому, сильнее влияет на восприятие боли, тогда как эффект слабее в контексте термоцепции. Однако это предположение должно быть подтверждено в будущем исследовании.
На более концептуальном уровне исследование нейрофизиологических эффектов даже в отсутствие поведенческого эффекта считалось значимым (Wilkinson and Halligan, 2004).В частности, авторы утверждают, что, поскольку обычно неизвестно, какие части когнитивного процесса (и каким образом) вызывают конкретную поведенческую реакцию, не следует переоценивать взаимосвязь между нейрофизиологическими данными и поведенческими реакциями, и поэтому утверждение о том, что поведенческие эффекты эталон или «золотой стандарт». Исследования, направленные на понимание нейрофизиологических механизмов познания, обычно связывают нейрофизиологические данные с известным возмущением (т.е. экспериментальный дизайн), что само по себе имеет смысл ».
3) Связь между GBO и PE отрицательная, т.е. чем больше PE, тем ниже амплитуда GBO. Этот паттерн противоречит всем предыдущим выводам по GBO и PE и, следовательно, скорее противоречит, чем поддерживает кодирование PE с помощью GBO. Ответ авторов по этому поводу в предыдущем раунде был недостаточно ясным. Нужны ясные и простые аргументы. Кроме того, в аннотацию следует добавить необычное обратное кодирование ФЭ гамма-колебаниями.
Спасибо за этот комментарий. Теперь мы прямо заявляем, что наши результаты противоречат гамма-ответу из-за ошибок прогноза в рукописи (т. Е. В аннотации и обсуждении). Однако теперь мы также обсуждаем, что наши результаты соответствуют направлению гамма-ответов в экспериментах по сопоставлению слов и рабочей памяти. В этой литературе успешное согласование (то есть отсутствие ошибки предсказания) между внешним входом и внутренним представлением вызывает увеличение мощности гамма-излучения (Herrmann et al., 2004; Осипова и др., 2006; Wang et al., 2018), что согласуется с нашими выводами.
4) Кластерный тест перестановки является центральным для контроля ложных срабатываний. Теперь выяснилось, что кластеризация проводилась по электродам. Однако лучше всего кластеризовать электроды, время и пространство. Поэтому очень важно настроить процедуру кластеризации.
Приносим извинения за то, что в нашей предыдущей редакции мы не внесли ясности.Теперь мы пояснили, что кластеризация действительно выполнялась по электродам, времени и пространству: «Образцы (превышающие пороговое значение F (1,28) = 4,196) были сгруппированы в связанные наборы на основе временных (то есть смежных временных точек), пространственных (т.е. соседние электроды) и спектральная (т.е. +/- 1 Гц) смежность ».
5) Неясно, уместно ли применять поправку к исходному уровню в отношении всего сегмента исследования. Не могли бы авторы предоставить ссылку, чтобы обосновать свой подход? В противном случае они могут рассмотреть возможность применения стандартной коррекции базовой линии.
Хотя в этом подходе нет ничего необычного (Grandcamp and Delorme, 2011), мы последовали совету рецензентов и повторно проанализировали наши данные с использованием обычного базового подхода и соответствующим образом изменили часть результатов. Мы благодарим рецензентов за предложение изменить подход к коррекции базовой линии, поскольку это явно улучшило качество и чувствительность данных. Мы описываем наш базовый подход следующим образом:
«Спектральные оценки были усреднены для каждого испытуемого в ходе испытаний. После этого была проведена нормализация z-базовой линии на основе базовой линии 500 мс до начала сигнала.Для данных с синхронизацией метки в качестве базового был выбран временной интервал от -650 мс до -150 мс. Расстояние от начала сигнала до базового периода 150 мс было установлено из-за длины окна половинной конусности 150 мс, то есть точки данных между -150 мс и 0 мс загрязнены началом сигнала. Для испытаний с синхронизацией стимула дополнительно учитывались переменная длительность сигнала (1500-1900 мс) и переменное смещение стимула, основанное на времени нарастания (225-375 мс), что привело к соответствующему исходному уровню от -2950 мс до -2450 мс от появление боли.Для базовой коррекции частотно-временных данных рассчитывались среднее значение и стандартное отклонение для базового периода (для каждой комбинации субъект-канал-частота отдельно). Средняя спектральная оценка базовой линии была вычтена из каждой точки данных, а полученные значения, центрированные по базовой линии, были разделены на стандартное отклонение базовой линии (классическая нормализация базовой линии — аддитивная модель; см. Grandchamp and Delorme, 2011) ».
6) Рецензенты предлагают авторам рассмотреть возможность отказа от локализации источника.Большинство изображений не имеют особого смысла. Единственное исключение, которое напоминает содержательное решение для анализа ожиданий, кажется преувеличенным. Авторы справедливо упоминают в рукописи, что передняя островковая часть участвует в когнитивной обработке, такой как ожидание. Однако кластер активности указывает на задний островок и его большая часть простирается до язычной извилины. Неуместно полагаться на интерпретацию одного (из многих) удаленно интерпретируемого анализа источников.Он предлагает выборочную интерпретацию результатов, которые соответствуют гипотезам.
Мы отказались от локализации исходного кода, как было предложено.
7) Для интерпретации эффекта EXP и PE авторы должны быть уверены, что нет различий в субъективной интенсивности боли между 3 условиями EXP и 2 условиями PE. Вопрос в том, является ли ошибка прогноза реальной ошибкой или болевые раздражители «естественно» воспринимались как более или менее болезненные, чем предполагалось.Предыдущие исследования показали, что испытание боли может существенно колебаться у испытуемых даже без какого-либо вмешательства.
Мы не совсем уверены, полностью ли мы понимаем этот комментарий. Мы предполагаем, что утверждение «… авторы должны быть уверены, что нет различий в субъективной интенсивности боли между 3 состояниями EXP и 2 состояниями PE…» содержит опечатку, поскольку (i) полный дизайн выявляет 3 уровня ожидания и 3 уровня ошибок прогнозирования и (ii) различия в субъективной боли из-за ошибок ожидания и прогноза являются предметом внимания статьи.
Тем не менее, у нас есть несколько идей, что здесь может иметь в виду:
1) Три фактора (INT, EXP и PE) ортогональны (некоррелированы), следовательно, различия в интенсивности стимула не влияют на оценки факторов EXP и PE.
2) Наибольшая часть кластера ожидания связана с активностью, предшествующей тепловому стимулу, и, таким образом, на эффект ожидания не влияют различия, связанные с субъективной болью.
3) Мы также провели анализ поведенческих данных только в испытаниях, которые остались в анализе данных ЭЭГ после отклонения испытания.Это не повлияло на результаты, поскольку все сравнения остались значимыми.
4) Различия в восприятии боли при одинаковой интенсивности стимулов действительно очень часто. Однако эти различия не могут систематически искажать наши результаты, поскольку они «попадают» в остатки нашей статистической модели.
8) Непонятно, почему существует значительный кластер ожидания в диапазоне альфа / бета между 1-2 с после начала сигнала. При визуальном осмотре и «проверке правдоподобия» этот кластер не особо выделяется из разрозненных, казалось бы, незначительных кластеров во всем частотно-временном диапазоне.Значения F при 2,5 с / 70 Гц даже кажутся выше, чем у значимого кластера.
В то время как при тестировании перестановки кластеров большие кластеры с более низкими значениями F могут достигать большей массы кластера, чем кластеры с явно более высокими значениями F в отдельных выборках, новый анализ с другим подходом базовой линии теперь привел к очень четкому низкочастотному альфа-к -бета-кластер для эффекта ожидания.
https://doi.org/10.7554/eLife.62809.sa2
Характеристики нейропатической боли и ее взаимосвязь с качеством жизни у 72 пациентов с травмой спинного мозга
Это исследование было проведено для выяснения взаимосвязи между невропатической болью и клиническими проявлениями, включая качество жизни, после травмы спинного мозга.Используя систему оценки NPSI, мы обнаружили, что парестезия / дизестезия была наиболее частой жалобой на невропатическую боль после травмы спинного мозга. Невропатическая боль была значительно связана с локализацией боли, продолжительностью после травмы и факторами качества жизни. Простой проверенный самоанализ NPSI оказался эффективным для детальной оценки характеристик невропатической боли, связанной с травмой спинного мозга.
Из пяти подтипов нейропатической боли по NPSI пациенты с ТСМ чаще всего сообщали о парестезии / дизестезии.Это согласуется с предыдущим отчетом о том, что распространенность дизестезии после травмы спинного мозга составляет ~ 80%. 18 Аналогичным образом, исследования с использованием вопросника NPSI сообщают, что парестезия / дизестезия является наиболее частым и интенсивным типом нейропатической боли у пациентов с синдромом запястного канала 12 и послеоперационной интрамедуллярной опухолью спинного мозга. 13 Напротив, преобладающим типом невропатической боли, связанной с опоясывающим герпесом, является спонтанная жгучая боль. 11 Эти данные показывают, что NPSI эффективен для уточнения и различения различных характеристик невропатической боли при различных заболеваниях и патологических состояниях.
Мы обнаружили, что, хотя статистическая значимость не была достигнута, невропатическая боль ниже уровня была более интенсивной, чем боль на уровне общей оценки NPSI. Точно так же проспективное исследование Siddall et al. 19 показали, что через 6 месяцев после ТСМ пациенты с невропатической болью ниже уровня с большей вероятностью сообщали о своей боли как о сильной или мучительной, чем пациенты с болью на уровне. При изучении разбивки характеристик боли в нашем исследовании, спонтанная жгучая боль была значительно более интенсивной у пациентов с болью ниже уровня, чем у пациентов с болью на уровне.Считается, что боль ниже уровня отражает серьезное повреждение и дегенерацию спиноталамического тракта. 13 Таким образом, наши результаты показывают, что невропатическая боль, происходящая из поврежденного спиноталамического тракта, может ощущаться в основном как поверхностная спонтанная боль пациентами с травмой спинного мозга.
Наше исследование показало, что пациенты со степенью AIS B демонстрировали тенденцию к более интенсивной нейропатической боли, чем пациенты с другими степенями AIS. Хотя ранее сообщалось о взаимосвязи между полнотой травмы и распространенностью боли, 1, 20 наше исследование является первым исследованием, которое проясняет связь полноты травмы с интенсивностью невропатической боли.Анализ доли пациентов с болью ниже уровня в каждой степени показал, что пациенты со степенью B имели самую высокую частоту боли ниже уровня (80%), что отражает наиболее интенсивную боль в этой группе.
Причина, по которой пациенты со степенью B по AIS испытывали наибольшую боль, остается неясной. Предыдущие отчеты не дают большого понимания, потому что очень немногие исследовали взаимосвязь между оценкой SCI и болью. Однако Siddall et al. 19 аналогичным образом сообщили, что распространенность аллодинии была значительно выше у пациентов с неполной ТСМ, чем у пациентов с полной ТСМ.Правдоподобное объяснение состоит в том, что, хотя нервные пути в случаях полной ТСМ прерываются в месте повреждения, в случаях неполной ТСМ есть сохраненные тракты, которые позволяют передавать болевые ощущения через поражение. 21 Возможно, соотношение поврежденных и сохранившихся трактов определяет интенсивность невропатической боли, приводящей к наибольшей нейропатической боли у пациентов степени B, в то время как пациенты с оценками C и D по шкале AIS имеют больше ощущений от сохраненных трактов.
Предыдущее исследование изучало связь невропатической боли с хирургическим вмешательством и пришло к выводу, что не было значительных различий в распространенности невропатической боли в хирургических и нехирургических группах. 22 Тем не менее, это исследование просто проводило качественный анализ, чтобы выяснить, присутствует ли нейропатическая боль у пациентов с травмой спинного мозга или отсутствует. Напротив, наш количественный анализ невропатической боли SCI показал, что пациенты, перенесшие операцию, показали значительно менее выраженную вызванную боль по сравнению с пациентами, у которых не было хирургического вмешательства. Хотя показания к хирургическому вмешательству и подход были оставлены на усмотрение хирурга в каждом институте, результаты нашего исследования показывают, что хирургическое вмешательство может способствовать уменьшению невропатической боли после ТСМ.
Наши результаты также показали, что пациенты, заполнившие анкету NPSI> через 1 год после травмы, сообщили о более интенсивной нейропатической боли, чем пациенты, ответившие в течение года после травмы. Предыдущее исследование показало, что невропатическая боль на низком уровне возникает раньше, чем на низком уровне. 1 В соответствии с этими выводами, наши данные показали, что более высокая доля пациентов, ответивших> 1 год после ТСМ, имела боль ниже уровня, чем пациентов, ответивших в течение года, что позволяет предположить, что более позднее начало интенсивной боли ниже уровня более высокий балл NPSI.
Наше исследование обнаружило значительную корреляцию между невропатической болью и суббаллами SF-36 для телесной боли, общего состояния здоровья и психического здоровья; предыдущее исследование также обнаружило сильную корреляцию между настроением или депрессией и невропатической болью. 23 Однако невропатическая боль не коррелировала с какими-либо другими подпунктами SF-36. Разумно, что невропатическая боль не коррелировала со всеми факторами качества жизни, поскольку на пациентов с ТСМ влияет не только боль, но и ограничения в движении, ходьбе и контроле за пищеварением и сексуальной функцией. 1 Таким образом, невропатическая боль является одним из нескольких факторов, которые следует учитывать и лечить комплексно для улучшения качества жизни у пациентов с ТСМ.
В нашем исследовании невропатическая боль была диагностирована с использованием определений Международной ассоциации изучения боли. 4 В других исследованиях нейропатическая боль была диагностирована с использованием таких инструментов скрининга, как «Оценка нейропатических симптомов и признаков» Лидса или Опросник нейропатической боли.

 От острой боли отличается не только длительностью более 6 месяцев, но и тем, что организм не может самостоятельно восстановить свои функции. К ней относят невралгии, головные, мышечные, тазовые и другие боли3. Степень выраженности болевых ощущений со временем все меньше зависит от силы повреждающего фактора, установить органическую причину становится все сложнее, и часто даже углубленное обследование не дает результатов. Возникают дополнительные симптомы: нарушения сна, аппетита, депрессивные переживания, расстройства внимания, памяти и т.д.Пациенты часто меняют обезболивающие препараты, которые перестают помогать. А болевой синдром превращается в самостоятельную болезнь, лечение которой зависит от вида боли.
От острой боли отличается не только длительностью более 6 месяцев, но и тем, что организм не может самостоятельно восстановить свои функции. К ней относят невралгии, головные, мышечные, тазовые и другие боли3. Степень выраженности болевых ощущений со временем все меньше зависит от силы повреждающего фактора, установить органическую причину становится все сложнее, и часто даже углубленное обследование не дает результатов. Возникают дополнительные симптомы: нарушения сна, аппетита, депрессивные переживания, расстройства внимания, памяти и т.д.Пациенты часто меняют обезболивающие препараты, которые перестают помогать. А болевой синдром превращается в самостоятельную болезнь, лечение которой зависит от вида боли.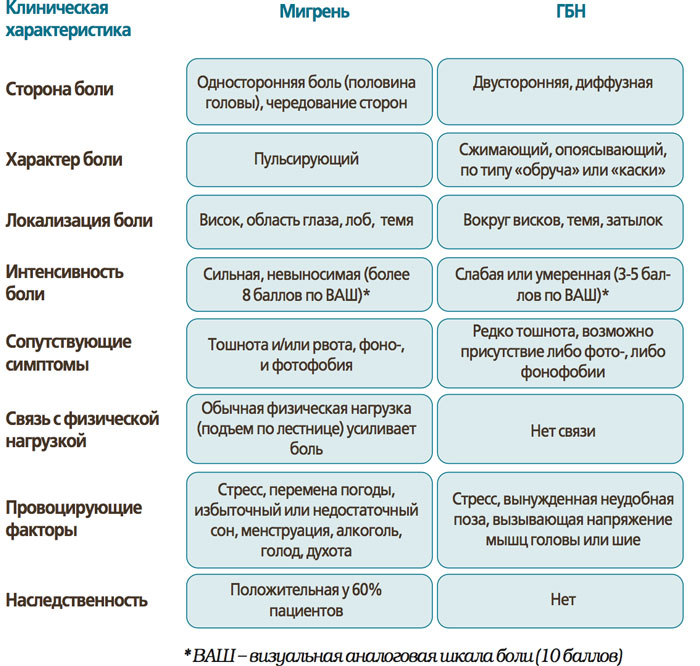
 2019; 03: 21-26
2019; 03: 21-26 Применение метода основано на прерывании потока болевых импульсов от зоны повреждения к спинному и головному мозгу4.
Применение метода основано на прерывании потока болевых импульсов от зоны повреждения к спинному и головному мозгу4.