Патогенез, симптомы и лечение синдрома Иценко-Кушинга у человека
Патогенез, симптомы и лечение синдрома Иценко-Кушинга у человека
Синдром Иценко-Кушинга (или гиперкортицизм) – патология, спровоцированная чрезмерной выработкой гормона надпочечников. Заболевание отличается разнообразием симптомов. Лечение синдрома Иценко-Кушинга заключается в нормализации синтеза кортизола – гормона коры надпочечников.
Патогенез синдрома Иценко-Кушинга
Патологическое состояние долгое время протекает без явных клинических признаков. Патогенез синдрома Иценко-Кушинга связан с:
- наличием опухолей печени, легких или половых органах, которые могут вырабатывать гормоны с кортикоподобным эффектом;
- новообразованием, локализованным в коре надпочечников;
- микроаденомой гипофиза.
Нередко рассматриваемое состояние начинает развиваться только при наличии провоцирующих факторов. Это могут быть черепно-мозговые травмы, сложные роды у женщины, острые инфекционные заболевания и другие патологии.
Это могут быть черепно-мозговые травмы, сложные роды у женщины, острые инфекционные заболевания и другие патологии.
Одной из форм заболевания является медикаментозный синдром Иценко-Кушинга. Он возникает на фоне длительного приема лекарственных препаратов из категории гормональных – преднизолона, дексаметазона и других.
Диагноз «Эндогенный гиперкортицизм у мужчин» ставят чаще всего на фоне травмы головы.
Причины вторичного гиперкортицизма индивидуальны. После грамотного лечения синдром Иценко-Кушинга редко рецидивирует, хотя и относится к хроническим патологиям. Спровоцировать выраженную симптоматику могут ослабление иммунитета, нарушения обмена других гормонов (чаще у женщин – в том числе это связано с беременностью и родами).
Симптомы синдрома Иценко-Кушинга у женщин и мужчин
К основным признакам рассматриваемой патологии относятся:
- существенное увеличение веса тела, связанное с формированием объемных жировых отложений;
- истончение кожных покровов;
- акне.

Симптомы синдрома Иценко-Кушинга у женщин дополняются нарушением менструального цикла (вплоть до полного прекращения месячных), ростом волос на лице по мужскому типу. Мужчин беспокоят снижение полового влечения и эректильная дисфункция.
Также могут возникать такие признаки:
- раздражительность;
- резкие перепады настроения;
- постоянная головная боль;
- хроническая усталость;
- общая слабость.
- периодическое повышение артериального давления.
Диагностические мероприятия
Установить диагноз исключительно по жалобам пациента сложно. Наиболее достоверными и информативными являются анализы на АКТГ – при синдроме Иценко-Кушинга количество гормона в крови будет существенно увеличено.
Дополнительно назначаются компьютерная томография, магнитно-резонансная томография, которые позволят определить точную локализацию опухоли либо выявить другие факторы, провоцирующие развитие патологии.
Обязательно проводится дифференциальная диагностика синдрома Иценко-Кушинга – для этого исследуют слюну, мочу, проводят тест на выработку кортизола при провокациях.
Лечение синдрома Иценко-Кушинга
После осмотра пациента и подтверждения диагноза ставится вопрос о методе лечения. При наличии опухоли гипофиза обязательно выполняют хирургическое вмешательство по ее удалению, в восстановительном периоде показана лучевая терапия. Дополнительно назначается медикаментозная терапия.
Как лечить синдром Иценко-Кушинга у детей? В педиатрии сначала применяют терапевтические методы стабилизации работы надпочечников. Если у ребенка обнаружена опухоль гипофиза или коры надпочечников, врачи сначала предложат родителям провести курс химиотерапии и только при отсутствии положительных результатов – хирургическое вмешательство.
То, как скоро выздоравливает больной, зависит от ряда факторов – в том числе и от образа жизни. Клинические рекомендации при функциональном гиперкортицизме:
- откорректировать рацион питания;
- контролировать психоэмоциональный фон;
- пройти курс психотерапевтического лечения;
- вести активный образ жизни;
- принимать витаминные препараты.

По мере выздоровления у человека могут появиться боли в суставах и мышцах. Принимать лекарственные препараты для устранения подобного дискомфорта не стоит. Облегчить состояние помогут теплые ванны с отварами лекарственных трав, профессиональный массаж и умеренные физические нагрузки.
Профилактика синдрома Иценко-Кушинга
Для профилактики заболевания важно:
- не принимать гормональные препараты без назначения врача;
- не реже раза в год проходить обследование турецкого седла (имеет значение в диагностике поражений гипофиза) – рентгенологический метод поможет выявить его «провал» и изменение формы на ранней стадии;
- периодически контролировать уровень кортизола в крови.
Если ранее было проведено удаление гипофиза или надпочечника из-за злокачественной или доброкачественной опухоли, то необходимо в постоянном режиме принимать стероиды.
Более подробно на вопросы по теме ответит специалист нашей клиники. Он же объяснит, в чем отличие болезни и синдрома Иценко-Кушинга. Записаться на консультацию к врачу можно на страницах сайта https://www.dobrobut.com/.
Он же объяснит, в чем отличие болезни и синдрома Иценко-Кушинга. Записаться на консультацию к врачу можно на страницах сайта https://www.dobrobut.com/.
Связанные услуги:
Диагностика
Консультация эндокринолога
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
22232425262728
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
ГИПЕРКОРТИЗОЛИЗМ: КЛАССИФИКАЦИЯ, ПАТОГЕНЕЗ, КЛИНИКА.
 ДИАГНОСТИКА ЭНДОГЕННОГО ГИПЕРКОРТИЗОЛИЗМА | Тишковский (S.V. Tishkovskiy)
ДИАГНОСТИКА ЭНДОГЕННОГО ГИПЕРКОРТИЗОЛИЗМА | Тишковский (S.V. Tishkovskiy)
Болезнь Иценко-Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения. / Г. А. Мельниченко [и др.] // Проблемы эндокринологии. – 2015. – № 2. – С. 55-79.
Melnichenko GA, Dedov II , Belaja ZhE, Rozhinskaja LJa , Vagapova G R. Bolezn Icenko-Kushinga: klinika, diagnostika, differencialnaja diagnostika, metody lechenija [Cushing’s Disease: clinic, diagnosis, differential diagnosis, treatment methods]. Problemy jendokrinologii [Problems of endocrinology]. 2015;2:55-79. (Russian).
Болезнь Иценко-Кушинга: клиника, диагностика, лечение: практическое руководство для врачей / под ред. И. И. Дедова, Г. А. Мельниченко. – М., 2012. – 64 с.
Dedov II, Melnichenko GA, editors. Bolezn Icenko- Kushinga: klinika, diagnostika, lechenie: prakticheskoe rukovodstvo dlja vrachej. Moscow; 2012. 64 p. (Russian).
Дедов, И. И. Клиническая нейроэндокринология / И. И. Дедов. – М.: УП Принт, 2011. – 343 с.
И. Дедов. – М.: УП Принт, 2011. – 343 с.
Dedov II. Klinicheskaja nejrojendokrinologija [Clinical neuroendocrinology]. Moscow; 2011. 343 p. (Russian).
Дедов, И. И. Первый опыт использования селективного забора крови из нижних каменистых синусов в России (клиническое наблюдение) / И. И. Дедов, И. И. Ситкин, Ж. Е. Белая // Проблемы эндокринологии. – 2009. – Т. 55, № 6. – С. 11-16.
Dedov II, Sitkin II, Belaja ZhE. Pervyj opyt ispolzovanija selektivnogo zabora krovi iz nizhnih kamenistyh sinusov v Rossii (klinicheskoe nabljudeniye) [The first experience of the use of selective blood sampling from the lower stony sines in Russia (clinical observation)]. Problemy jendokrinologii [Problems of endocrinology]. 2009;55(6):11-16. (Russian).
Диагностика, дифференциальная диагностика и лечение эндогенного гиперкортицизма / Е. А. Трошина [и др.] // Проблемы эндокринологии. – 2010. – Т. 56, № 2. – С. 53-63.
Troshina EA, Belcevich DS, Molashenko NV, Gazizova DO. Diagnostika, differencialnaja diagnostika i lechenie jendogennogo giperkorticizma [Diagnosis, differential diagnosis and treatment of endogenous hypercorticism]. Problemy jendokrinologii [Problems of endocrinology]. 2010;56(2):53-63. (Russian).
Diagnostika, differencialnaja diagnostika i lechenie jendogennogo giperkorticizma [Diagnosis, differential diagnosis and treatment of endogenous hypercorticism]. Problemy jendokrinologii [Problems of endocrinology]. 2010;56(2):53-63. (Russian).
Использование ультрачувствительного метода определения биологически активного свободного кортизола в слюне для оценки глюкокортикоидной функции коры надпочечников / Н. П. Гончаров [и др.] // Проблемы эндокринологии. – 2008. – № 3. – С. 27-35.
Goncharov NP, Kaimia GV, Marova YeI, Kolesnikova GS, Arapova SD, Rozhinskaya LYa. Ispolzovanie ultrachuvstvitelnogo metoda opredeleniya biologicheski aktivnogo svobodnogo kortizola v sljune dlja ocenki gljukokortikoidnoj funkcii kory nadpochechnikov [Use of the ultrasensitive technique to determine biologically active salivary free Cortisol for evaluating the glucocorticoid function of the adrenal cortex]. Problemy jendokrinologii [Problems of endocrinology]. 2008;3:27-35. (Russian).
Кирилюк, М. Л. Диагностика и лечение гипофизарного синдрома Кушинга / М. Л. Кирилюк // Международный эндокринологический журнал. – 2014. – № 6 (62). – С. 182-193.
Kiriljuk ML. Diagnostika i lechenie gipofizarnogo sindroma Kushinga [Diagnosis and treatment of hypophyseal Cushing’s Syndrome]. Mezhdunarodnyj jendokrinologicheskij zhurnal [International endocrinology journal]. 2014;62(6):182-193. (Russian).
Кузнецов, Н. С. Актуальность и перспективные направления изучения проблемы субклинического синдрома Кушинга / Н. С. Кузнецов, Н. В. Латкина, Ю. А. Каминарская // Эндокринная хирургия. – 2016. – № 1. – С. 13-22.
Kuznecov NS, Latkina NV, Kaminarskaja Ju.A. Aktualnost i perspektivnye napravlenija izuchenija problemy subklinicheskogo sindroma Kushinga [Relevance and perspective concept of investigation of subclinical Cushing’s syndrome]. Jendokrinnaja hirurgija [Endocrine Surgery]. 2016;1:13-22. (Russian).
Кузнецов, Н. С. Субклинический синдром Кушинга, обусловленный одно- и двусторонними образованиями надпочечников. Проблемы диагностики и показаний к хирургическому лечению. Обзор литературы / Н. С. Кузнецов, О. В. Тихонова // Эндокринная хирургия. – 2015. – № 1. – С. 22-34.
Субклинический синдром Кушинга, обусловленный одно- и двусторонними образованиями надпочечников. Проблемы диагностики и показаний к хирургическому лечению. Обзор литературы / Н. С. Кузнецов, О. В. Тихонова // Эндокринная хирургия. – 2015. – № 1. – С. 22-34.
Kuznecov NS, Tihonova OV. Subklinicheskij sindrom Kushinga, obuslovlennyj odno- i dvustoronnimi obrazovanijami nadpochechnikov. Problemy diagnostiki i pokazanij k hirurgicheskomu lecheniju. Obzor literatury [Subclinical Cushing’s syndrome due to unilateral or bilateral adrenal incidentalomas. Problems of diagnostic and indication to surgical treatment. Review of literature]. Jendokrinnaja hirurgija [Endocrine Surgery]. 2015;1:22- 34. (Russian).
Манушарова, Р. А. Диагностика и лечение болезни Иценко-Кушинга / Р. А. Манушарова, Д. И. Черкезов // Медицинский совет. – 2010. – № 1-2. – С. 82-86.
Manusharova RA, Cherkezov DI. Diagnostika i lechenie bolezni Icenko-Kushinga [Diagnosis and treatment of Cushing’s disease]. Medicinskij sovet [Medical advice]. 2010;1-2:82-86. (Russian).
Medicinskij sovet [Medical advice]. 2010;1-2:82-86. (Russian).
Марова, Е. И. Болезнь Иценко-Кушинга: методическое пособие для врачей / Е. И. Марова, С. Д. Арапова, Л. В. Бельченко. – М., 2000. – 45 с.
Marova EI, Arapova SD, Belchenko LV. Bolezn Icenko- Kushinga: metodicheskoe posobie dlja vrachej [Cushing’s disease: a methodical guide for doctors]. Moscow; 2000. 45 p. (Russian).
Мельниченко, Г. А. Диагностика и лечение нейроэндокринных заболеваний: методическое пособие для врачей / Г. А. Мельниченко. – М., 2003. – 56 с .
Melnichenko GA. Diagnostika i lechenie nejrojendokrinnyh zabolevanij: metodicheskoe posobie dlja vrachej [Diagnosis and treatment of neuroendocrine diseases]. Moscow; 2003. 56 p. (Russian).
Мохорт, Т. В. Клиническая эндокринология: учебник / Т. В. Мохорт, З. В. Забаровская, А. П. Шепелькевич. – Минск: Вышэйшая школа, 2015. – 419 c.
Mohort TV, Zabarovskaja ZV, Shepelkevich AP. Klinicheskaja jendokrinologija: uchebnik [Clinical endocrinology]. Minsk; 2015. 419 p. (Russian).
Minsk; 2015. 419 p. (Russian).
Панькив, В. И. Болезнь Иценко-Кушинга. Диагностика, клиника, лечение / В. И. Панькив // Международный эндокринологический журнал. – 2011. – № 5 (37). – С. 159-165.
Pankiv VI. Bolezn Icenko-Kushinga. Diagnostika, klinika, lechenie [Cushing’s Disease: diagnosis, clinic, treatment methods]. Mezhdunarodnyj jendokrinologicheskij zhurnal [International endocrinology journal]. 2011;37(5):159- 165. (Russian).
Современный взгляд на скрининг и диагностику эндогенного гиперкортицизма / Ж. Е. Белая [и др.] // Проблемы эндокринологии. – 2012. – Т. 58, № 4. – С. 35-41.
Belaia ZhE, Rozhinskaia LIa, Melnichenko GA, Dedov II. Sovremennyj vzgljad na skrining i diagnostiku jendogennogo giperkorticizma [Current views of the screening and diagnostics of endogenous hypercorticism]. Problemy jendokrinologii [Problems of endocrinology]. 2012;58(4):35-41. (Russian).
Союстова, Е. Л. Болезнь Иценко-Кушинга. Случай из практики / Е. Л. Союстова, О. Ю. Поварова, Е. Э. Казанцева // Клиническая практика. – 2012. – № 1. – С. 53-58.
Л. Союстова, О. Ю. Поварова, Е. Э. Казанцева // Клиническая практика. – 2012. – № 1. – С. 53-58.
Sojustova EL, Povarova OJu, Kazanceva EJe. Bolezn Icenko-Kushinga. Sluchaj iz praktiki [Cushing`s disease. The case history]. Klinicheskaja praktika [Clinical practice]. 2012;1:53-58. (Russian).
Эктопический АКТГ-зависимый синдром Кушинга. Клинический случай / Е. В. Цветкова [и др.] // Бюллетень федерального центра сердца, крови и эндокринологии им. В. А. Алмазова. – 2013. – № 3. – С. 85-91.
Cvetkova EW, Dalmatova AB, Druk IV, Grineva EN. Jektopicheskij AKTG-zavisimyj sindrom Kushinga. Klinicheskij sluchaj [Ectopic ACTH Cushing’s syndrome case report]. Bjulleten federalnogo centra serdca, krovi i jendokrinologii im. V.A. Almazova Transljacionnaja medicina [Translation medicine]. 2013;3:85-91. (Russian).
Эндокринология. Национальное руководство / под ред. И. И. Дедова, Г. А. Мельниченко. – М.: ГЭОТАР- Медиа, 2016. – 752 с.
Dedov II, Melnichenko GA. Jendokrinologija. Nacionalnoe rukovodstvo [Endocrinology. National leadership]. Moscow; 2016. 752 p. (Russian).
Jendokrinologija. Nacionalnoe rukovodstvo [Endocrinology. National leadership]. Moscow; 2016. 752 p. (Russian).
Cavagnini, F. Adrenal Causes of Hypercortisolism / F. Cavagnini, F. Pecori Giraldi // Endocrinology. – 2006. – № 2. – P. 2353-2378.
Cavagnini F, Pecori Giraldi F. Adrenal Causes of Hypercortisolism Endocrinology. 5th ed. 2006;2:2353- 2378.
Cushing’s syndrome caused by nodular adrenal hyperplasia in children with McCune-Albright syndrome / J.M.W. Kirk [et al.] // J. Pediat. – 1999. – Vol. 134, № 6. – P. 789-792.
Kirk JM, Brain CE, Carson DJ, Hyde JC, Grant DB. Cushing’s syndrome caused by nodular adrenal hyperplasia in children with McCune-Albright syndrome. J. Pediat. 1999;134(6):789-792.
Evidence for the low dose dexamethasone suppression test to screen for Cushing’s syndrome — recommendations for a protocol for biochemistry laboratories / P. J. Wood [et al.] // Ann. Clin. Biochem. – 1997. – Vol. 34, Pt. 3. – P. 222-229.
– P. 222-229.
Wood PJ, Barth JH, Freedman DB, Perry L, Sheridan B. Evidence for the low dose dexamethasone suppression test to screen for Cushing’s syndrome — recommendations for a protocol for biochemistry laboratories. Ann. Clin. Biochem. 1997;34(3):222-229.
Regional differences in treatment for osteoporosis. The Global Longitudinal Study of Osteoporosis in Women (GLOW) / A. Diez-Perez [et al.] // Bone. – 2011. – Vol. 49, № 3. – P. 493-498.
Díez-Pérez A, Hooven FH, Adachi JD, Adami S, Anderson FA. Regional differences in treatment for osteoporosis. The Global Longitudinal Study of Osteoporosis in Women (GLOW). Bone. 2011;49(3):493-498.
Slyper, A. H. Use of a two-site immunoradiometric assay to resolve a factitious elevation of ACTH in primary pigmented nodular adrenocortical disease / A. H. Slyper, J. W. Finding // J. Ped. Endocrinol. – 1994. – Vol. 7, № 1. – P. 61-63.
Slyper AH, Finding JW. Use of a two-site immunoradiometric assay to resolve a factitious elevation of ACTH in primary pigmented nodular adrenocortical disease. J. Ped. Endocrinol. 1994;7(1):61-63.
J. Ped. Endocrinol. 1994;7(1):61-63.
The desmopressin and combined CRH-desmopressin tests in the differential diagnosis of ACTH-dependent Cushing’s syndrome: Constraints imposed by the expression of V2 vasopressin receptors in tumors with ectopic ACTH secretion / S. Tsagarakis [et al.] // J. Clin. Endocrinol. Metab. – 2002. – Vol. 87, № 4. – P. 1646- 1653.
Kaskarelis J Sotiropoulou C, Raptis SA, Thalassinos N. The desmopressin and combined CRH-desmopressin tests in the differential diagnosis of ACTH-dependent Cushing’s syndrome: Constraints imposed by the expression of V2 vasopressin receptors in tumors with ectopic ACTH secretion. J. Clin. Endocrinol. Metab. 2002;87(4):1646-1653.
The Diagnosis of Cushing’s Syndrome. An Endocrine Society Clin Pract Guideline / L. K. Nieman [et al.] // J. Clin. Endocrinol. Metab. – 2008. – Vol. 93, № 5. – P. 1526- 1540.
Nieman LK, Biller BM, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The Diagnosis of Cushing’s Syndrome. An Endocrine Society Clin Pract Guideline. J. Clin. Endocrinol. Metab. 2008;93(5):1526-1540.
The Diagnosis of Cushing’s Syndrome. An Endocrine Society Clin Pract Guideline. J. Clin. Endocrinol. Metab. 2008;93(5):1526-1540.
The ectopic adrenocorticotropin syndrome: clinical features, diagnosis, management, and long-term followup / A. M. Isidori [et al.] // J. Clin. Endocrinol. Metab. – 2006. – № 91. – P. 371-377.
Isidori AM, Kaltsas GA, Pozza C, Frajese V. The ectopic adrenocorticotropin syndrome: clinical features, diagnosis, management, and long-term follow-up. J. Clin. Endocrinol. Metab. 2006;91:371-377.
Use of oral corticosteroids in the United Kingdom / T. P. van Staa [et al.] // QJM. – 2000. – № 93. – P. 105-111.
Van Staa TP, Leufkens HG, Abenhaim L, Begaud B, Zhang B, Cooper C. Use of oral corticosteroids in the United Kingdom. QJM: an International Journal of Medicine. 2000;93:105-111.
Болезнь Иценко-Кушинга — диагностика и лечение в медицинском центре «Андреевские больницы
Синдром Иценко-Кушинга — это группа признаков, вызванных увеличенным количеством глюкокортикоидных гормонов в крови.
Заболевание сопровождается появлением характерных симптомов. В то же время следует помнить, что некоторые опухолевидные образования также могут вызвать подобные признаки, что требует более тщательной диагностики.
Причины синдрома Иценко-Кушинга
Наиболее часто данный синдром развивается в результате роста опухоли гипофиза. Может возникнуть на фоне воспалительных процессов головного мозга и в результате гормональных изменений после родов. Помимо этого, опухоли надпочечников и легких, бронхов, поджелудочной железы и средостения также могут сопровождаться появлением данного состояния.
Во время поиска причин следует учесть, что прием некоторых препаратов, в частности преднизолона, также может вызвать схожие симптомы. Кроме того, существует псевдосиндром, который чаще наблюдается у людей, злоупотребляющих алкоголем и страдающих депрессией.
У женщин синдром Иценко-Кушинга встречается в десять раз чаще, чем у мужчин. Диагноз выставляется в возрасте 20-40 лет.
Симптомы синдрома Иценко-Кушинга
В первую очередь наблюдается избыточное отложение жира в области лица, шеи и верхней части туловища. При этом конечности, напротив, становятся худыми и тонкими. Кожа приобретает синюшный оттенок. Постепенно появляется капиллярная сетка. Особенно выражена она на груди, местах сгиба рук и бедрах. В области постоянного трения может быть выраженное потемнение кожи. У женщин появляются волосы на лице по мужскому типу, тогда как у мужчин преобладают женские черты лица.
Что касается общего состояния, то в первую очередь следует отметить повышение артериального давления и изменения со стороны скелета в виде патологических переломов.
Анализ крови позволяет выявить повышенное количество эритроцитов, гемоглобина и холестерина. В зависимости от выраженности симптомов выделяют три стадии течения заболевания: легкую, среднюю и тяжелую.
Диагностика синдрома Иценко-Кушинга
Диагностика начинается с анализа крови на содержание АКТГ. Далее проводится полное обследование с целью выявления причины повышенной выработки гормона. Особенно часто используются тесты, позволяющие исключить или подтвердить опухоль надпочечников.
Далее проводится полное обследование с целью выявления причины повышенной выработки гормона. Особенно часто используются тесты, позволяющие исключить или подтвердить опухоль надпочечников.
Лечение синдрома Иценко-Кушинга
Способ лечения зависит от того, что именно стало причиной заболевания. При наличии опухоли гипофиза проводится его удаление или процедуры, позволяющие остановить рост опухоли.
При поражении надпочечников проводят удаление надпочечника. При этом наличие выраженных симптомов свидетельствует о двухстороннем поражении, что требует удаления обоих надпочечников. Вследствие этого возникает необходимость использования заместительной терапии, так как развивается надпочечниковая недостаточность.
Особенно часто используется лапароскопическая адреналэктомия. Она позволяет остановить проявление синдрома Иценко-Кушинга без проведения операции.
Рак надпочечников лечится индивидуально в зависимости от тяжести течения заболевания. При отсутствии эффекта от лучевой терапии, используется хлодитан, который позволяет уменьшить выработку гормонов.
Помимо всего перечисленного, проводится симптоматическое лечение, включающее в себя назначение витаминов, белковых препаратов, мочегонные средства, гипотензивные и сердечные гликозиды.
Профилактика синдрома Иценко-Кушинга
Избежать заболевания поможет правильное ведение родов для исключения травм у ребенка. При наличии онкологических заболеваний рекомендуется проводить контроль уровня АКТГ. Особенно внимательно следует отнестись к своему состоянию людей, принимающих преднизолон.
Синдром Кушинга | Симптомы | Диагностика | Лечение
Синдром Кушинга (синдром Иценко-Кушинга, гиперкортицизм) – заболевание, характеризующихся длительным хроническим воздействием на организм человека избыточного количества гормонов коры надпочечников (кортизол, кортикостерон). Синдром Кушинга у детей может проявиться уже в грудном возрасте.
Причины
Заболевание возникает в результате нарушения деятельности надпочечников, работы гипофиза или гипоталамуса. Причины развития синдрома Кушинга:
Причины развития синдрома Кушинга:
- генетическая предрасположенность;
- опухоль гипофиза;
- избыточный синтез адренокортикотропного гормона;
- рак поджелудочной железы, рак легкого;
- аденома бронхов;
- рак, аденома, гиперплазия надпочечников;
- длительный прием препаратов, содержащих глюкокортикоиды.
Симптомы синдрома Кушинга
Характерные для синдрома Кушинга симптомы представляют собой:
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика
Для диагностики синдрома Иценко-Кушинга врач-эндокринолог назначает ряд исследований:
Лечение синдрома Кушинга
Лечение синдрома Иценко-Кушинга включает в себя:
- препараты, снижающие выработку гормонов в коре надпочечников;
- препараты, нормализующие белковый, углеводный, минеральный обмен;
- лучевую терапию;
- химиотерапию;
- хирургическое вмешательство (удаление гипофиза, аденомы надпочечников).

Опасность
Если своевременно не начать лечение синдрома Кушинга, это может привести к опасным последствиям:
Группа риска
Основную группу риска составляют женщины в возрасте 25-40 лет.
Профилактика
Для профилактики синдрома Кушинга пациентам рекомендуется:
- раз в год проводить рентгенографическое исследование турецкого седла;
- контролировать содержания адренокортикотропного гормона в плазме крови;
- в случае удаления гипофиза, надпочечников постоянно принимать стероиды.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Болезнь Иценко-Кушинга | #10/03 | «Лечащий врач» – профессиональное медицинское издание для врачей. Научные статьи.
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повышенной секрецией адренокортикотропного гормона (АКТГ), увеличением продукции гормонов корой надпочечников.
Считается, что при БИК у 85% больных имеется аденома передней доли гипофиза (кортикотропинома), что, по современным представлениям, является первопричиной заболевания. Кортикотропиномы характеризуются небольшими размерами. Это так называемые микроаденомы, располагающиеся внутри турецкого седла. Макроаденомы встречаются при БИК значительно реже. У 15% пациентов с БИК находят диффузную или узелковую гиперплазию АКТГ-продуцирующих клеток (кортикотрофов). Редко у больных БИК обнаруживается первичное «пустое» турецкое седло, либо никаких изменений в этой области на КТ и МРТ не выявляется.
Этиология и патогенез
Причина болезни Иценко-Кушинга точно не установлена. БИК чаще встречается у женщин, редко диагностируется в детском и пожилом возрасте. У женщин заболевание развивается в возрасте от 20 до 40 лет, есть зависимость от беременности и родов, а также от травм головного мозга и нейроинфекций. У подростков БИК часто начинается в период полового созревания.
Установлено, что большинство таких опухолей по своей природе являются моноклональными, что свидетельствует о наличии генных мутаций в исходных клетках.
В онкогенезе АКТГ-продуцирующих опухолей гипофиза важная роль принадлежит аномальной чувствительности гипофиза к гипоталамическим факторам. Усиление стимулирующего действия нейрогормонов или ослабление ингибирующих сигналов имеет значение в процессах образования и роста опухоли гипофиза. Нарушение действия ингибирующих нейрогормонов, таких, как соматостатин и допамин, может сопровождаться усилением деятельности стимулирующих нейрогормонов. Кроме того, имеются данные, свидетельствующие о том, что неконтролируемая клеточная пролиферация опухолей гипофиза может стать результатом нарушения действия ростовых факторов.
Потенциальным механизмом развития кортикотропином может стать спонтанная мутация генов рецепторов КРГ или вазопрессина.
Автономная секреция АКТГ опухолью приводит к гиперфункции коры надпочечников. Поэтому основная роль в патогенезе БИК отводится повышению функции коры надпочечников. При АКТГ-зависимой форме болезни Иценко-Кушинга имеет место повышение функциональной активности всех трех зон коры надпочечников: изменения в клетках пучковой зоны ведут к гиперсекреции кортизола, клубочковой — к повышению альдостерона и сетчатой — к усилению синтеза дегидроэпиандростерона (ДГЭС).
Поэтому основная роль в патогенезе БИК отводится повышению функции коры надпочечников. При АКТГ-зависимой форме болезни Иценко-Кушинга имеет место повышение функциональной активности всех трех зон коры надпочечников: изменения в клетках пучковой зоны ведут к гиперсекреции кортизола, клубочковой — к повышению альдостерона и сетчатой — к усилению синтеза дегидроэпиандростерона (ДГЭС).
Для болезни Иценко-Кушинга характерно не только повышение функционального состояния коры надпочечников, но и увеличение их размеров. В 20% случаев на фоне гиперплазии надпочечников обнаруживаются вторичные аденомы небольших размеров (1–3 см).
При кортикотропиномах кроме гиперсекреции АКТГ наблюдается нарушение функции гипофизарных гормонов. Так, базальная секреция пролактина у больных с БИК нормальная или незначительно повышена. Соматотропная функция гипофиза у больных с кортикотропиномами снижена. Стимулирующие тесты с инсулиновой гипогликемией, аргинином и L-Допа показали снижение резервов СТГ при болезни Иценко-Кушинга. Уровень гонадотропных гормонов (ЛГ, ФСГ) у больных снижен. Это обусловлено прямым супрессивным действием избытка эндогенных кортикостероидов на секрецию рилизинг-гормонов гипоталамусом.
Уровень гонадотропных гормонов (ЛГ, ФСГ) у больных снижен. Это обусловлено прямым супрессивным действием избытка эндогенных кортикостероидов на секрецию рилизинг-гормонов гипоталамусом.
Клиническая картина
Клиническая картина болезни Иценко-Кушинга обусловлена избыточной секрецией кортикостероидов и, в первую очередь, глюкокортикоидов. Увеличение массы тела характеризуется своеобразным («кушингоидный» тип ожирения) неравномерным перераспределением подкожно-жировой клетчатки в области плечевого пояса, надключичных пространств, в области шейных позвонков («климактерический горбик»), живота, при сравнительно тонких конечностях. Лицо становится круглым («лунообразное»), щеки — багрово-красного цвета («матронизм»). Кроме того, при БИК наблюдаются трофические изменения кожи. При осмотре кожные покровы истонченные, сухие с наклонностью к гиперкератозу и имеют багрово-цианотичную окраску. На бедрах, груди, плечах, животе появляются своеобразные полосы растяжения (стрии) красно-фиолетового цвета. Характер стрий — «минус» ткань. Эти стрии отличаются от бледных или розовых полос растяжения, которые встречаются при ожирении, в период беременности или родов. Появление стрий при БИК связано с нарушением белкового обмена (катаболизм белков), в результате чего кожа истончается. Наличие гематом при незначительных травмах является следствием повышенной ломкости капилляров и истончения кожи. Наряду с этим отмечается гиперпигментация кожных покровов в местах трения (шея, локтевые суставы, подмышечные впадины). У женщин часто наблюдается повышенное оволосение (гирсутизм) на лице (усы, борода, бакенбарды) и груди. Половые расстройства в виде вторичного гипогонадизма являются одним из ранних симптомов при БИК.
Характер стрий — «минус» ткань. Эти стрии отличаются от бледных или розовых полос растяжения, которые встречаются при ожирении, в период беременности или родов. Появление стрий при БИК связано с нарушением белкового обмена (катаболизм белков), в результате чего кожа истончается. Наличие гематом при незначительных травмах является следствием повышенной ломкости капилляров и истончения кожи. Наряду с этим отмечается гиперпигментация кожных покровов в местах трения (шея, локтевые суставы, подмышечные впадины). У женщин часто наблюдается повышенное оволосение (гирсутизм) на лице (усы, борода, бакенбарды) и груди. Половые расстройства в виде вторичного гипогонадизма являются одним из ранних симптомов при БИК.
В симптомокомплексе БИК наиболее существенным в клинической картине заболевания является поражение сердечно-сосудистой системы. Сочетание артериальной гипертонии с нарушениями метаболизма в сердечной мышце приводит к хронической недостаточности кровообращения и другим изменениям со стороны сердечно-сосудистой системы. Миопатия часто является характерным симптомом гиперкортицизма, который выражается дистрофическими изменениями мышц и гипокалиемией. Атрофические процессы, затрагивающие поперечно-полосатую и мышечную систему, особенно заметны в верхних и нижних конечностях («истончение» рук и ног). Атрофия мышц передней брюшной стенки ведет к увеличению живота.
Миопатия часто является характерным симптомом гиперкортицизма, который выражается дистрофическими изменениями мышц и гипокалиемией. Атрофические процессы, затрагивающие поперечно-полосатую и мышечную систему, особенно заметны в верхних и нижних конечностях («истончение» рук и ног). Атрофия мышц передней брюшной стенки ведет к увеличению живота.
Содержание калия в эритроцитах и мышечной ткани (в том числе и в миокарде) значительно снижено. Нарушения электролитного обмена (гипокалиемия и гипернатриемия) лежат в основе электролитно-стероидной кардиопатии и миопатии. При БИК нарушения углеводного обмена различной степени выраженности наблюдаются у большого числа больных. При этом у 70–80% пациентов выявляется нарушенная толерантность к глюкозе, а у остальных — сахарный диабет 2 типа. Клинические проявления диабета характеризуются гиперинсулинемией, инсулинорезистентностью и отсутствием склонности к кетоацидозу. Диабет имеет, как правило, благоприятное течение, и для его компенсации достаточно назначения диеты и пероральных сахароснижающих препаратов.
Вторичный иммунодефицит проявляется гнойничковыми (акне) или грибковыми поражениями кожи и ногтевых пластин, трофическими язвами голеней, длительным периодом заживления послеоперационных ран, хроническим и трудно поддающимся лечению пиелонефритом. Энцефалопатия в виде изменения вегетативной нервной системы при БИК ярко выражена и многообразна. Синдром вегетативной дистонии характеризуется эмоционально-личностными сдвигами: от нарушения настроения, сна и до выраженных психозов.
Системный остеопороз представляет собой распространенное и нередко тяжело протекающее проявление гиперкортицизма при БИК в любом возрасте. Остеопороз является причиной болей в позвоночнике, часто приводит к снижению высоты тел позвонков и спонтанным переломам ребер и позвонков.
В зависимости от выраженности гиперкортицизма и формирования клинических симптомов различают несколько степеней тяжести БИК. Легкая форма характеризуется умеренной выраженностью симптомов заболевания; средняя — выраженностью всех симптомов при отсутствии осложнений. Тяжелая форма отличается выраженностью симптомов и наличием осложнений (сердечно-легочная недостаточность, стероидный диабет, прогрессирующая миопатия, патологические переломы, тяжелые психические расстройства). В зависимости от скорости нарастания клинической симптоматики различают быстропрогрессирующее (три–шесть месяцев) и торпидное течение заболевания, которое проявляется сравнительно медленным (от одного года и более) развитием гиперкортицизма.
Тяжелая форма отличается выраженностью симптомов и наличием осложнений (сердечно-легочная недостаточность, стероидный диабет, прогрессирующая миопатия, патологические переломы, тяжелые психические расстройства). В зависимости от скорости нарастания клинической симптоматики различают быстропрогрессирующее (три–шесть месяцев) и торпидное течение заболевания, которое проявляется сравнительно медленным (от одного года и более) развитием гиперкортицизма.
При подозрении на БИК необходимо проверить, имеется ли у больного гиперкортицизм, затем провести дифференциальную диагностику форм гиперкортицизма (БИК, АКТГ-эктопированный синдром, синдром Иценко-Кушинга), сходных синдромов (ожирение, метаболический синдром, пубертатно-юношеский диспитуитаризм, алкогольное поражение печени) и установить локализацию основного патологического процесса.
Диагноз и дифференциальный диагноз
При подозрении на болезнь Иценко-Кушинга после сбора анамнеза и клинического осмотра у всех больных с помощью методов лабораторной диагностики необходимо подтвердить наличие гиперкортицизма.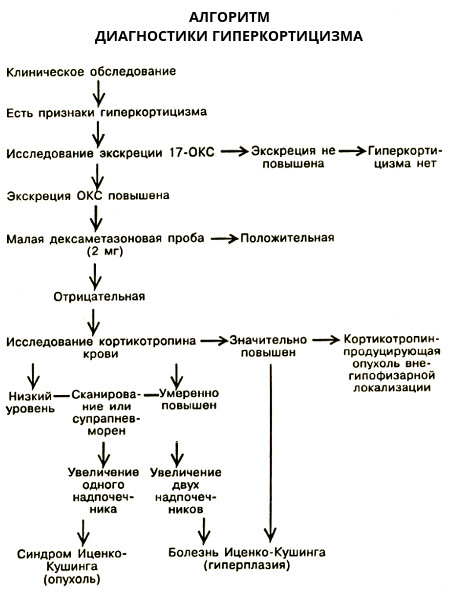 На первом этапе выявляется повышенная продукция кортизола. С этой целью определяют суточный ритм секреции кортизола в плазме крови утром (8.00-9.00) и вечером (23.00-24.00). Для больных БИК характерно повышение утреннего уровня кортизола в плазме крови, а также нарушение ритма секреции кортизола, т. е. в ночное или вечернее время уровень кортизола остается повышенным. Определение суточной экскреции свободного кортизола в моче является также необходимым методом лабораторной диагностики для подтверждения гиперкортицизма. Уровень свободного кортизола в моче определяется РИА-методом. Для здоровых лиц содержание кортизола колеблется от 120 до 400 нмоль/с. У больных с БИК экскреция кортизола в суточной моче повышена.
На первом этапе выявляется повышенная продукция кортизола. С этой целью определяют суточный ритм секреции кортизола в плазме крови утром (8.00-9.00) и вечером (23.00-24.00). Для больных БИК характерно повышение утреннего уровня кортизола в плазме крови, а также нарушение ритма секреции кортизола, т. е. в ночное или вечернее время уровень кортизола остается повышенным. Определение суточной экскреции свободного кортизола в моче является также необходимым методом лабораторной диагностики для подтверждения гиперкортицизма. Уровень свободного кортизола в моче определяется РИА-методом. Для здоровых лиц содержание кортизола колеблется от 120 до 400 нмоль/с. У больных с БИК экскреция кортизола в суточной моче повышена.
В сомнительных случаях для дифференциальной диагностики между патологическим эндогенным и функциональным гиперкортицизмом проводится малая проба с дексаметазоном. Она основана на подавлении продукции эндогенного АКТГ высокими концентрациями кортикостероидов по принципу обратной связи. Если секреция кортизола не снижается на 50% и более от исходного уровня, это свидетельствует о наличии гиперкортицизма.
Если секреция кортизола не снижается на 50% и более от исходного уровня, это свидетельствует о наличии гиперкортицизма.
Таким образом проводится дифференциальная диагностика патологического и функционального гиперкортицизма.
При выявлении повышенной продукции кортизола необходимо провести следующий этап обследования — дифференциальную диагностику между формами эндогенного патологического гиперкортицизма (БИК, СИК, АКТГ-эктопированный синдром), болезнью Иценко-Кушинга, АКТГ-эктопированным синдромом и синдромом Иценко-Кушинга. Этот этап обследования включает в себя определение ритма секреции АКТГ в плазме крови и проведение большой пробы с дексаметазоном.
Для БИК характерны нормальное или повышенное (до 100 –200 пг/мл) утреннее содержание АКТГ и отсутствие его снижения в ночное время. При АКТГ-эктопированном синдроме секреция АКТГ повышена и может колебаться от 100 до 200 пг/мл и выше, и при этом также отсутствует ритм его секреции.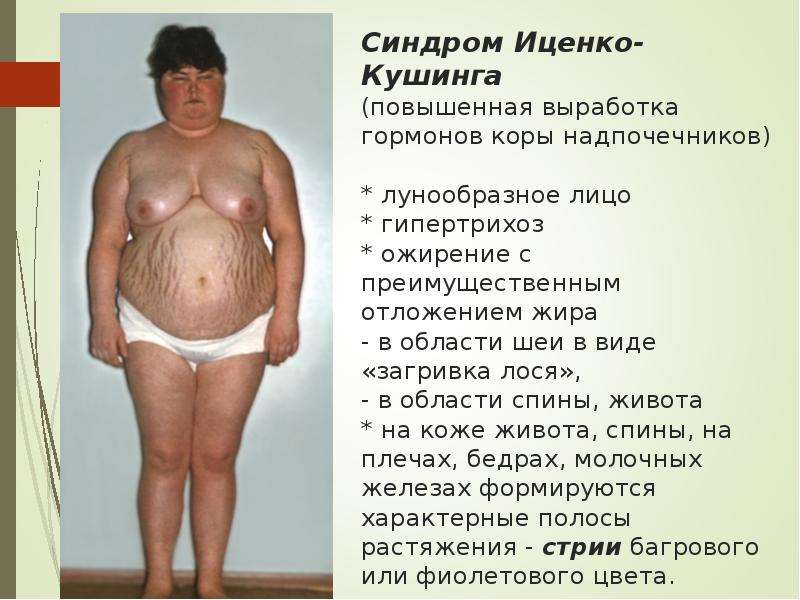 При АКТГ-независимых формах гиперкортицизма (синдром Иценко-Кушинга, макро- или микроузелковая дисплазия надпочечников) утреннее содержание АКТГ, как правило, снижено при отсутствии ритма его секреции.
При АКТГ-независимых формах гиперкортицизма (синдром Иценко-Кушинга, макро- или микроузелковая дисплазия надпочечников) утреннее содержание АКТГ, как правило, снижено при отсутствии ритма его секреции.
Большая проба с дексаметазоном в настоящее время широко применяется для диагностики патологического гиперкортицизма.
При БИК, как правило, происходит снижение уровня кортизола на 50% и более от исходного уровня, тогда как при АКТГ-эктопированном синдроме это наблюдается лишь в редких случаях. При АКТГ-независимых формах синдрома Иценко-Кушинга указанного снижения уровня кортизола также не отмечается, так как продукция гормонов опухолью не зависит от гипоталамо-гипофизарных взаимоотношений.
В зарубежной литературе для диагностики БИК широко используется проба с кортиколиберином (КРГ). Введение КРГ приводит к стимуляции секреции АКТГ у больных БИК. При БИК содержание АКТГ в плазме крови увеличивается более чем на 50%, а уровень кортизола на 20% от исходного. При АКТГ-эктопированном синдроме концентрация АКТГ практически не меняется.
При АКТГ-эктопированном синдроме концентрация АКТГ практически не меняется.
Методы топической диагностики при БИК используются для выявления патологического процесса в гипоталамо-гипофизарной области и надпочечниках (диагностика микро- или макроаденомы гипофиза и гиперплазии надпочечников). К таким методам следует отнести рентгенографию костей черепа, КТ или МРТ головного мозга, УЗИ надпочечников и КТ или МРТ надпочечников.
Визуализация кортикотропином представляет собой наиболее диагностически сложную задачу, так как размер их бывает очень небольшой (2–10 мм). При этом в поликлинических условиях в первую очередь проводится рентгенография костей черепа (боковая рентгеновская краниограмма) с целью выявления рентгенологических признаков аденомы гипофиза. Существуют следующие явные или косвенные признаки аденомы гипофиза: изменение формы и увеличение размеров турецкого седла, локальный или тотальный остеопороз спинки седла, «двухконтурность» дна, выпрямление передних и задних клиновидных отростков.
В настоящее время магнитно-резонансную томографию и/или компьютерно-томографическое исследование принято считать основными методами диагностики аденомы гипофиза. Методом выбора при визуализации кортикотропином является МРТ или МРТ с контрастированием. Преимуществами этого метода, по сравнению с КТ, можно считать лучшую выявляемость микроаденомы гипофиза и синдрома «пустого» турецкого седла, который может встречаться при болезни Иценко-Кушинга.
Лечение БИК
Лечение БИК должно быть направлено на исчезновение основных клинических симптомов гиперкортицизма, стойкую нормализацию уровня АКТГ и кортизола в плазме крови с восстановлением их суточного ритма и нормализацию кортизола в суточной моче.
Все методы лечения болезни Иценко-Кушинга, которые используются в настоящее время, можно разделить на четыре группы: нейрохирургическое (транссфеноидальная аденомэктомия), лучевое (протонотерапия, γ-терапия), комбинированное (лучевая терапия в сочетании с односторонней или двусторонней адреналэктомией) и медикаментозное лечение.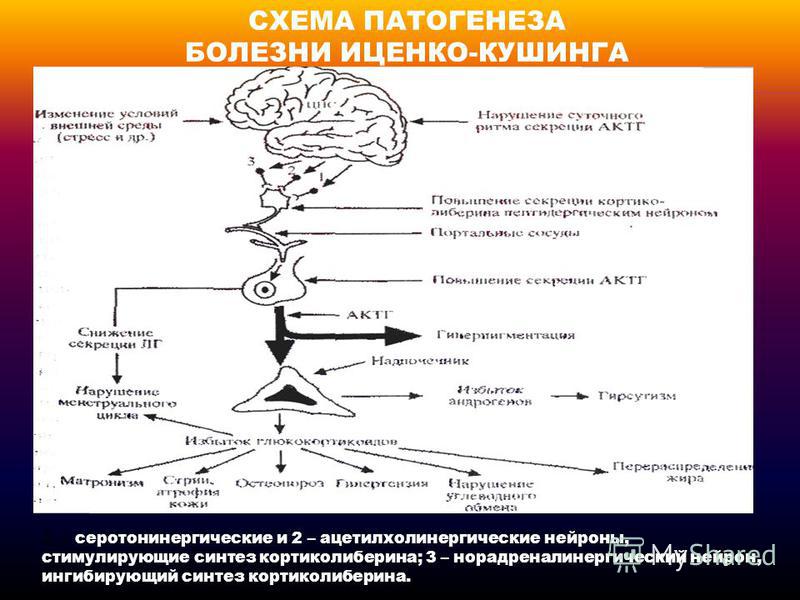 Из них основные виды — нейрохирургическое, лучевое и комбинированное; медикаментозная терапия применяется как дополнение к ним.
Из них основные виды — нейрохирургическое, лучевое и комбинированное; медикаментозная терапия применяется как дополнение к ним.
В настоящее время во всем мире предпочтение отдается транссфеноидальной аденомэктомии. Этот метод позволяет добиться быстрой ремиссии заболевания с восстановлением гипоталамо-гипофизарных взаимоотношений у 84–95% больных уже через шесть месяцев. Показанием к аденомэктомии служит четко локализованная (на основании данных КТ или МРТ) опухоль гипофиза. Аденомэктомия может быть проведена повторно, если имеется подтвержденный на КТ или МРТ продолженный рост аденомы гипофиза, в любые сроки после операции. Этот метод характеризуется минимальным количеством осложнений (около 2–3%) и очень низкой послеоперационной летальностью (0–1%).
Адреналэктомия — тотальная одно- или двусторонняя — применяется только в комбинации с лучевой терапией. При крайне тяжелой и прогрессирующей форме заболевания осуществляется двусторонняя адреналэктомия в сочетании с лучевой терапией для профилактики развития синдрома Нельсона (прогрессирование роста аденомы гипофиза при отсутствии надпочечников). После тотальной двусторонней адреналэктомии пациент пожизненно получает заместительную гормональную терапию.
После тотальной двусторонней адреналэктомии пациент пожизненно получает заместительную гормональную терапию.
Из методов лучевой терапии в настоящее время используются протонное облучение и дистанционная γ-терапия, при этом предпочтение отдается протонотерапии. Протонное облучение наиболее эффективно в связи с тем, что энергия выделяется в области аденомы гипофиза и при этом окружающие ткани затрагиваются минимально. Абсолютным противопоказанием к проведению протонотерапии является опухоль гипофиза более 15 мм в диаметре и супраселлярное ее распространение с дефектом полей зрения.
γ-терапия как самостоятельный метод лечения применяется в последнее время редко и только при невозможности проведения аденомэктомии или протонотерапии. Эффективность действия этого метода следует оценивать не раньше, чем через 12–15 и более месяцев после проведения курса облучения.
Медикаментозная терапия при БИК должна использоваться в следующих случаях: подготовка пациента к проведению лечения основным методом, облегчение течения послеоперационного периода и сокращение срока наступления ремиссии заболевания.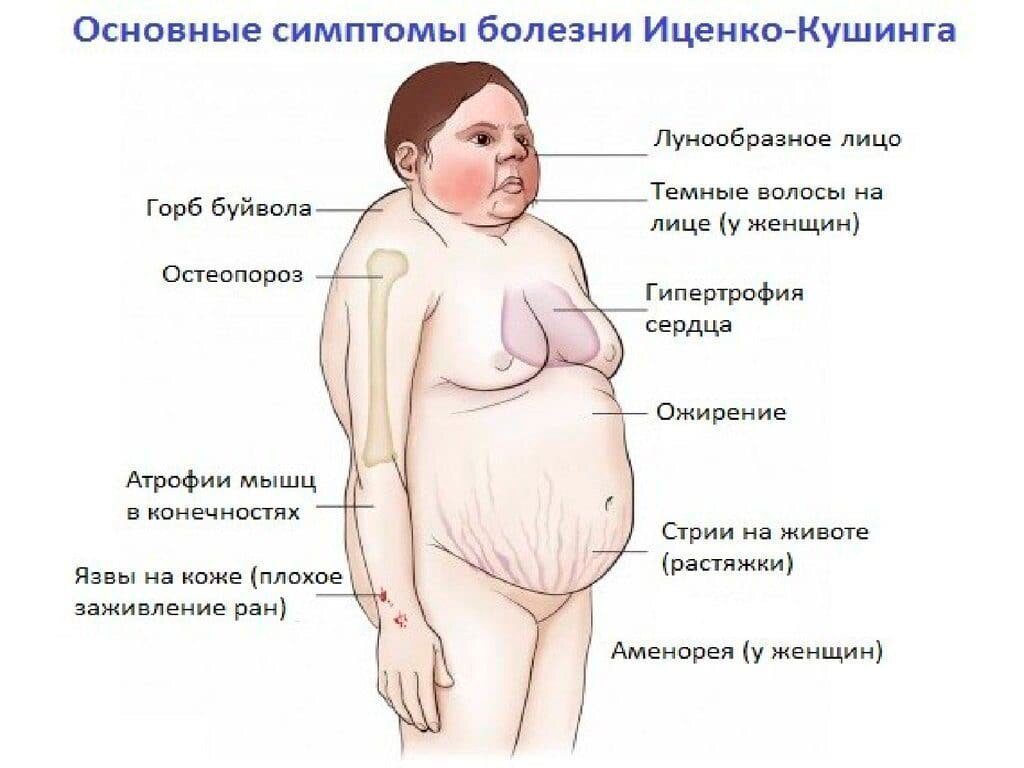 Фармакологические препараты, применяемые с этой целью, делятся на несколько групп: производные аминоглютетимида (мамомит 250 мг, ориметен 250 мг, средняя суточная доза — 750 мг/сут, максимальная суточная доза — 1000–1500 мг/сут), производные кетоконазола (низорал 200 мг/сут, суточная доза — 400–600 мг/сут, максимальная суточная доза — 1000 мг/сут) и производные пара-хлорфенила (хлодитан, лизодрен, митотан, начальная доза — 0,5 г/сут, лечебная доза — 3–5 г/сут). Принципы медикаментозной терапии следующие: после определения степени переносимости лекарственного средства лечение надо начинать с максимальных доз. На фоне приема препарата необходимо осуществлять контроль за содержанием кортизола в плазме крови и суточной моче не реже чем один раз в 10–14 дней. В зависимости от уровня снижения кортизола в каждом конкретном случае подбирается поддерживающая доза препарата. Передозировка препаратами, блокирующими биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Фармакологические препараты, применяемые с этой целью, делятся на несколько групп: производные аминоглютетимида (мамомит 250 мг, ориметен 250 мг, средняя суточная доза — 750 мг/сут, максимальная суточная доза — 1000–1500 мг/сут), производные кетоконазола (низорал 200 мг/сут, суточная доза — 400–600 мг/сут, максимальная суточная доза — 1000 мг/сут) и производные пара-хлорфенила (хлодитан, лизодрен, митотан, начальная доза — 0,5 г/сут, лечебная доза — 3–5 г/сут). Принципы медикаментозной терапии следующие: после определения степени переносимости лекарственного средства лечение надо начинать с максимальных доз. На фоне приема препарата необходимо осуществлять контроль за содержанием кортизола в плазме крови и суточной моче не реже чем один раз в 10–14 дней. В зависимости от уровня снижения кортизола в каждом конкретном случае подбирается поддерживающая доза препарата. Передозировка препаратами, блокирующими биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Из препаратов, ингибирующих действие АКТГ, преимущественно используются бромокриптин-парлодел (в дозе 2,5 –5 мг) или отечественный препарат абергин, (в дозе 4–8 мг).
Коррекцию электролитного обмена необходимо проводить как до начала лечения основного заболевания, так и в ранний послеоперационный период. Наиболее целесообразно применение препаратов калия (раствор хлористого калия или таблеток ацетата калия 5,0 г и более в день) в сочетании с спиронолактонами, в частности верошпироном. Рекомендуемая доза верошпирона до 200 мг/сут перорально.
Подходы к лечению артериальной гипертонии при гиперкортицизме такие же, как и при артериальной гипертонии без повышения функции надпочечников. Надо отметить, что у большинства пациентов с БИК не удается достичь оптимального АД без снижения уровня кортизола.
Патогенетический подход к терапии сахарного диабета при гиперкортицизме предполагает эффективное воздействие на основные звенья: инсулинорезистентность периферических тканей и неспособность инсулярного аппарата преодолеть эту резистентность. Обычно предпочтение отдается сульфаниламидным препаратам второго поколения, так как они обладают большей активностью и меньшей гепато- и нефротоксичностью.
Обычно предпочтение отдается сульфаниламидным препаратам второго поколения, так как они обладают большей активностью и меньшей гепато- и нефротоксичностью.
Начинать лечение сульфонилмочевинными препаратами следует с минимальной дозы. При необходимости дозу увеличивают, ориентируясь на результаты измерений уровня глюкозы в крови. Если лечение не дает желаемых результатов, следует сменить препарат. Во время лечения любыми сахароснижающими средствами больной должен соблюдать диету. Если лечение максимальными дозами производными сульфонилмочевины (ПСМ) оказывается безрезультатным, можно использовать их комбинацию с бигуанидами. Теоретическое обоснование необходимости комбинированной терапии основывается на том, что препараты этих групп имеют различные точки приложения своего основного действия. Метформин — 400 мг (cиофор — 500 и 850 мг, глюкофаж — 500, 850 и 1000 мг) — единственный на сегодняшний день препарат бигуанидов, который снижает инсулинорезистентность. Инсулинотерапия показана при БИК в тех случаях, когда не удается нормализовать уровень глюкозы в крови с помощью пероральных сахароснижающих препаратов или планируется хирургическое вмешательство. Применяется инсулин короткого действия, препараты средней длительности и длительного действия и их комбинация. Операция должна планироваться на первую половину дня: перед операцией вводят инсулин короткого действия или средней продолжительности действия п/к. Во время операции проводят инфузию 5% глюкозы в/в с добавлением инсулина короткого действия из расчета 5 — 10 ЕД/л, скорость инфузии — 150 мл/ч. Инфузию 5% глюкозы с инсулином короткого действия продолжают и после операции, пока больной не начнет самостоятельно принимать пищу. Затем пациент переводится на пероральные сахароснижающие препараты и осуществляется контроль сахара крови.
Применяется инсулин короткого действия, препараты средней длительности и длительного действия и их комбинация. Операция должна планироваться на первую половину дня: перед операцией вводят инсулин короткого действия или средней продолжительности действия п/к. Во время операции проводят инфузию 5% глюкозы в/в с добавлением инсулина короткого действия из расчета 5 — 10 ЕД/л, скорость инфузии — 150 мл/ч. Инфузию 5% глюкозы с инсулином короткого действия продолжают и после операции, пока больной не начнет самостоятельно принимать пищу. Затем пациент переводится на пероральные сахароснижающие препараты и осуществляется контроль сахара крови.
Лечение стероидного остеопороза (СОП) даже после ликвидации гиперкортицизма длительное. Препараты для лечения СОП условно можно разделить на три группы: средства, влияющие на процессы костной резорбции, препараты, стимулирующие костное формирование, и препараты многопланового действия. К препаратам, снижающим резорбцию костной ткани, относится кальцитонин (миокальцик). Этот препарат используется в двух лекарственных формах: в ампулах и в виде назального спрея. Курсы длительностью два месяца следует проводить три раза в год. Бисфосфонаты (фосамакс, ксидифон) относятся к препаратам, которые снижают резорбцию костной ткани. При терапии бисфосфонатами рекомендуется дополнительный прием солей кальция (500–1000 мг в сутки). Одним из наиболее эффективных препаратов, стимулирующих костеобразование и увеличивающих массу кости, являются соли фтора. Лечение продолжают от шести месяцев до одного года.
Этот препарат используется в двух лекарственных формах: в ампулах и в виде назального спрея. Курсы длительностью два месяца следует проводить три раза в год. Бисфосфонаты (фосамакс, ксидифон) относятся к препаратам, которые снижают резорбцию костной ткани. При терапии бисфосфонатами рекомендуется дополнительный прием солей кальция (500–1000 мг в сутки). Одним из наиболее эффективных препаратов, стимулирующих костеобразование и увеличивающих массу кости, являются соли фтора. Лечение продолжают от шести месяцев до одного года.
Считается, что анаболические стероиды уменьшают костную резорбцию и индуцируют положительный кальциевый баланс благодаря увеличению абсорбции кальция из кишечника и реабсорбции кальция почками. Кроме того, по некоторым данным, они стимулируют активность остеобластов и увеличение мышечной массы. Они назначаются в основном парентерально, прерывистыми курсами по 25–50 мг один-два раза в месяц в течение двух месяцев три раза в год.
Препараты активного метаболита витамина Д (оксидевит, альфа Д3-Тева) широко применяются при БИК. При СОП они используются в дозе 0,5–1,0 мкг/дн как в качестве монотерапии, так и в комбинации с другими препаратами (Д3+кальцитонин, Д3+соли фтора, Д3+бисфосфанаты). При комплексном лечении БИК и СОП также возможно применение препарата остеопан, содержащего кальций, витамин Д3, магний и цинк, назначая по две таблетки три раза в день.
При СОП они используются в дозе 0,5–1,0 мкг/дн как в качестве монотерапии, так и в комбинации с другими препаратами (Д3+кальцитонин, Д3+соли фтора, Д3+бисфосфанаты). При комплексном лечении БИК и СОП также возможно применение препарата остеопан, содержащего кальций, витамин Д3, магний и цинк, назначая по две таблетки три раза в день.
Симптоматическое лечение СОП включает в себя обезболивающую терапию: анальгетики, назначение нестероидных противовоспалительных средств, а также центральных миорелаксантов, так как на генез боли при СОП оказывает влияние и спазм параспинальных мышц. Соли кальция самостоятельного значения при лечении стероидного ОП не имеют, но являются обязательным компонентом комплексной терапии. В клинической практике предпочтение в настоящее время отдается быстрорастворимым солям кальция. Кальций форте содержит в одной растворимой таблетке 500 мг кальция-элемента. Препараты кальция следует назначать в один прием, на ночь. При лечении СОП кальций надо применять ежедневно в суточной дозе 500–1000 мг в комбинации с препаратами патогенетической терапии ОП. Абсолютным показанием для назначения корсета при СОП являются боли в спине и наличие компрессионных переломов тел позвонков.
Абсолютным показанием для назначения корсета при СОП являются боли в спине и наличие компрессионных переломов тел позвонков.
Прогноз БИК зависит от длительности, тяжести заболевания и возраста больного. При небольшой длительности заболевания, легкой форме и возрасте до 30 лет прогноз благоприятный. После адекватного лечения наблюдается выздоровление. При среднетяжелой форме заболевания и при длительном его течении у больных после нормализации функции гипофиза и надпочечников часто остаются необратимые изменения со стороны сердечно-сосудистой системы и костной системы, которые требуют дополнительного лечения. Вследствие двусторонней адреналэктомии у пациентов развивается хроническая надпочечниковая недостаточность. При стабильной надпочечниковой недостаточности и отсутствии тенденции к росту аденомы гипофиза прогноз благоприятный, хотя трудоспособность больных ограничена.
С. Д. Арапова, кандидат медицинских наук
Е. И. Марова, доктор медицинских наук, профессор
Эндокринологический научный центр РАМН, Москва
Современные возможности лечения болезни Иценко-Кушинга uMEDp
Первые описания синдрома Кушинга относятся к концу ХIХ – началу ХХ вв. Отдельные симптомы этого заболевания были известны задолго до его «официального» открытия. В 1932 г. выдающийся американский нейрохирург Харви Уильямс Кушинг опубликовал работу «Базофильные аденомы гипофиза и их клинические проявления (гипофизарный базофилизм)», где описал 12 пациентов с характерной клинической картиной синдрома, связав ее с наличием базофильной аденомы в передней доле гипофиза. Однако известно, что еще в 1924 г. воронежский невропатолог Николай Михайлович Иценко опубликовал свои наблюдения за больными, клиническая картина заболевания которых характеризовалась, как описывал Иценко, багрово-цианотичной окраской лица с изменением его очертаний, перераспределением жира, «мраморностью» кожных покровов, наличием атрофических стрий на передней стенке живота и в области бедер, повышением артериального давления и нарушением менструального цикла. При патологоанатомическом исследовании были обнаружены изменения в области серого бугра, супраоптического и паравентрикулярного ядер и в других отделах гипоталамуса.
Отдельные симптомы этого заболевания были известны задолго до его «официального» открытия. В 1932 г. выдающийся американский нейрохирург Харви Уильямс Кушинг опубликовал работу «Базофильные аденомы гипофиза и их клинические проявления (гипофизарный базофилизм)», где описал 12 пациентов с характерной клинической картиной синдрома, связав ее с наличием базофильной аденомы в передней доле гипофиза. Однако известно, что еще в 1924 г. воронежский невропатолог Николай Михайлович Иценко опубликовал свои наблюдения за больными, клиническая картина заболевания которых характеризовалась, как описывал Иценко, багрово-цианотичной окраской лица с изменением его очертаний, перераспределением жира, «мраморностью» кожных покровов, наличием атрофических стрий на передней стенке живота и в области бедер, повышением артериального давления и нарушением менструального цикла. При патологоанатомическом исследовании были обнаружены изменения в области серого бугра, супраоптического и паравентрикулярного ядер и в других отделах гипоталамуса. Выявленные изменения позволили Н.М. Иценко считать, что поражение гипоталамической области является ведущим в патогенезе описанного синдрома. Именно поэтому в отечественной литературе заболевание, связанное с поражением гипоталамо-гипофизарной области, называется «Болезнь Иценко-Кушинга».
Выявленные изменения позволили Н.М. Иценко считать, что поражение гипоталамической области является ведущим в патогенезе описанного синдрома. Именно поэтому в отечественной литературе заболевание, связанное с поражением гипоталамо-гипофизарной области, называется «Болезнь Иценко-Кушинга».
Болезнь Иценко-Кушинга (БИК) относится к АКТГ-зависимой форме гиперкортицизма, является тяжелым многосистемным заболеванием гипоталамо-гипофизарного происхождения. БИК является редким заболеванием и встречается с частотой 2–3 новых случая на миллион населения с преобладанием женщин над мужчинами в соотношении 3:1 [1].
Опухоли гипофиза, по данным различных авторов, встречаются у 75–80% пациентов БИК. Они относятся к микроаденомам и характеризуются небольшими размерами (до 10 мм), располагаясь в пределах турецкого седла. Так, по данным магниторезонансной томографии (МРТ) средний диаметр кортикотропинóм обычно составляет 5–6 мм. Однако у части пациентов, кортикотропиномы могут представлять собой скопления мелких образований аденоматозной ткани в виде «гнезд», визуализация которых очень сложна. В некоторых случаях встречаются совсем маленькие аденомы (менее 1–2 мм), диагностика которых затруднена, еще реже могут встречаться макроаденомы гипофиза. У небольшого количества пациентов БИК (20–25%) имеет место диффузная гиперплазия аденогипофиза или гиперфункция кортикотрофов без формирования аденомы.
В некоторых случаях встречаются совсем маленькие аденомы (менее 1–2 мм), диагностика которых затруднена, еще реже могут встречаться макроаденомы гипофиза. У небольшого количества пациентов БИК (20–25%) имеет место диффузная гиперплазия аденогипофиза или гиперфункция кортикотрофов без формирования аденомы.
В работе, проведенной А.В. Воронцовым на базе ЭНЦ, было показано, что 72% всех выявленных с помощью МРТ кортикотропином располагались эндоселлярно и размеры их не превышали 1 см; 20% имели эндосупраселлярную локализацию, а 8% опухолей имели пара- и инфраселлярное распространение [2]. Таким образом, исследование показало высокую ценность МРТ в диагностике кортикотропином.
Как в опухолевых кортикотрофах, так и в гиперплазированных, иммуногистохимическое исследование определяет содержание одного адренокортикотропного гормона (АКТГ ) или нескольких гормонов гипофиза. Ультраструктурно в гипертрофированных кортикотрофах наблюдается увеличение размера органелл и секреторных гранул до 400–600 нм [3].
В основе патогенеза кортикотропином лежат хромосомные мутации, вследствие которых происходит повышение экспрессии гипофизарных протоонкогенов и снижение экспрессии генов-супрессоров в стволовых и высокодифференцированных клетках аденогипофиза, что приводит к клональному росту трансформированных клеток. Наравне с этим нарушению клеточного цикла способствуют ростовые факторы, ангиогенез, цитокины. Эта цепь заканчивается усиленной клеточной пролиферацией и неконтролируемой гиперсекрецией гормонов [3].
Важнейшую роль в регуляции функции гипофиза играют соматостатин, дофамин и глюкокортикоиды (по механизму обратной связи), вызывая снижение гиперсекреции гормонов и уменьшение пролиферации клеток за счет воздействия на G-белки и снижения концентрации цАМФ. В опухолевом образовании эти процессы нарушаются за счет изменения состава G-белков (мутации гена Gsp) и изменения функциональной связи между молекулами рецепторов и эффекторами.
Таким образом, комплексное морфофункциональное изучение кортикотропином и/или гиперплазии кортикотрофов позволяет расширить понимание клинического течения заболевания, проникнуть в суть патогенеза, разработать новые направления медикаментозного лечения БИК и определить прогноз дальнейшего течения заболевания.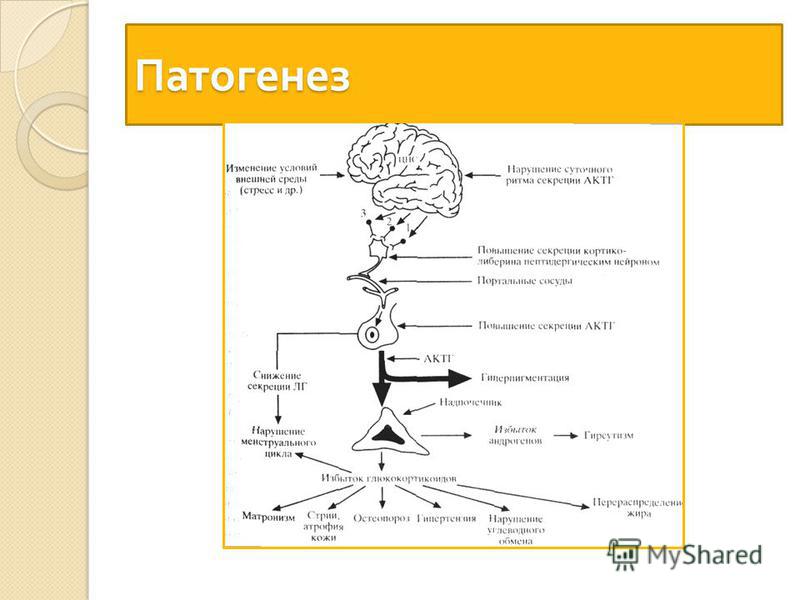
Лечение болезни Иценко-Кушинга представляет собой сложную проблему, эффективное решение которой зависит от точности диагностики патологического процесса, правильной оценки активности гиперкортицизма, тяжести заболевания, а также от индивидуального подхода к выбору методов лечения.
Крайне важное значение для выбора метода лечения БИК имеет выявление аденомы гипофиза. В последние годы частота обнаружения аденомы гипофиза при БИК возрастает по мере появления и совершенствования высокотехнологичных методов визуализации гипофиза, таких как магниторезонансная и мультиспиральная компьютерная томографии (МСКТ) с контрастным усилением. С помощью этих методов можно диагностировать микроаденому гипофиза (кортикотропиному) на самых ранних этапах развития заболевания, установить ее точную локализацию, размеры, направление роста, взаимоотношение с окружающими тканями [4]. В данной связи изменились и подходы к лечению этого тяжелого заболевания. Это стало возможным не только благодаря ранней диагностике кортикотропином, но и внедрению в клиническую практику новых патогенетических методов лечения: микрохирургической техники для удаления аденом гипофиза и нового вида лучевой терапии – радиохирургии (протонотерапия, «гамма-нож» (Gamma-Knife), техника линейного ускорителя на аппарате «Novalis»).
Внедрение выше перечисленных методов лечения существенно повысило эффективность лечения, а у эндокринолога появилась возможность выбрать оптимальный в каждом конкретном случае метод терапии [6–14].
Современная стратегия лечения болезни Иценко-Кушинга направлена прежде всего на нормализацию уровня АКТГ и кортизола, уменьшение имеющихся симптомов гиперкортицизма и восстановление гипоталамо-гипофизарных нарушений. Все пациенты с верифицированным диагнозом, даже при мягком проявлении заболевания, должны как можно раньше подвергаться лечению, так как гиперкортицизм вызывает тяжелые сопутствующие осложнения, которые определяют неблагоприятный прогноз. Главная цель лечения БИК – обратное развитие симптомов гиперкортицизма, стойкая нормализация уровня кортизола и АКТГ в плазме крови с восстановлением их суточного ритма и нормализация уровня кортизола в суточной моче.
На сегодняшний день за рубежом и в России широко используются два основных патогенетических метода лечения болезни Иценко-Кушинга – нейрохирургический метод и лучевая терапия (радиохирургия). Нейрохирургический и радиохирургический методы могут быть использованы как самостоятельные методы лечения БИК у взрослых, а также у детей и подростков. Вопрос о выборе метода в каждом конкретном случае решается врачом индивидуально, но основными факторами, определяющими его выбор, должны быть наличие аденомы гипофиза по данным МРТ или МСКТ головного мозга, размеры аденомы, характер ее роста. При выборе метода лечения должны учитываться тяжесть заболевания, наличие тяжелых сопутствующих осложнений, которые связаны с основным заболеванием, и желание пациента.
Нейрохирургический и радиохирургический методы могут быть использованы как самостоятельные методы лечения БИК у взрослых, а также у детей и подростков. Вопрос о выборе метода в каждом конкретном случае решается врачом индивидуально, но основными факторами, определяющими его выбор, должны быть наличие аденомы гипофиза по данным МРТ или МСКТ головного мозга, размеры аденомы, характер ее роста. При выборе метода лечения должны учитываться тяжесть заболевания, наличие тяжелых сопутствующих осложнений, которые связаны с основным заболеванием, и желание пациента.
Транссфеноидальная аденомэктомия
Учитывая, что болезнь Иценко-Кушинга обусловлена наличием АКТГ-секретирующей аденомы гипофиза, успехи в лечении БИК в последние годы связывают с внедрением в клиническую эндокринологию транссфеноидальной микрохирургии. Этот метод, открывший новую эру в лечении практически любой формы БИК, признан всеми ведущими центрами Европы, Америки и России, так как считается наиболее безопасным и эффективным методом лечения этого заболевания, особенно при наличии аденомы гипофиза, определяемой при МРТ или МСКТ. При радикально проведенной операции достигается быстрая и стойкая ремиссия заболевания. В случае рецидива заболевания и подтвержденной на МРТ или МСКТ опухоли гипофиза нейрохирургическое вмешательство может быть проведено повторно.
При радикально проведенной операции достигается быстрая и стойкая ремиссия заболевания. В случае рецидива заболевания и подтвержденной на МРТ или МСКТ опухоли гипофиза нейрохирургическое вмешательство может быть проведено повторно.
По мнению большинства исследователей, результаты транссфеноидальной аденомэктомии во многом зависят от размеров и топографического расположения опухоли, а также правильности диагностики, позволяющей установить точный дифференциальный диагноз между БИК и другими формами гиперкортицизма [6, 8, 10].
Главным преимуществом оперативного вмешательства, по сравнению с другими методами лечения, является быстрое наступление ремиссии заболевания в случае радикального удаления кортикотропиномы. При успешно проведенной операции уже в ранний послеоперационный период (5–14-й дни) может наблюдаться снижение уровня кортизола и АКТГ в плазме крови и суточной моче. Примерно через 3 месяца происходит регрессия основных клинических симптомов заболевания, а через 6 месяцев развивается полная клинико-гормональная ремиссия. В многочисленных исследованиях было показано, что при интраоперационном и гистологическом подтверждении опухоли гипофиза быстрая и стойкая ремиссия заболевания после транссфеноидального удаления эндоселлярных кортикотропином наступает у 78–92% пациентов [8, 10, 17].
В многочисленных исследованиях было показано, что при интраоперационном и гистологическом подтверждении опухоли гипофиза быстрая и стойкая ремиссия заболевания после транссфеноидального удаления эндоселлярных кортикотропином наступает у 78–92% пациентов [8, 10, 17].
Аденомэктомия редко сопровождается серьезными осложнениями (около 3–5%) и послеоперационной (0–1%) летальностью. Из осложнений встречаются воспалительные процессы в придаточных пазухах носа и несахарный диабет, которые купируются в течение короткого времени после назначения патогенетической терапии. Более серьезные осложнения в виде назальной ликвореи и менингита встречаются редко и чаще связаны с характером роста макрокортикотропиномы. Риск развития гипо- и пангипопитуитаризма после первичного удаления кортикотропиномы минимален.
У 59% пациентов радикальное удаление АКТГ-секретирующей опухоли гипофиза сопровождается вторичной надпочечниковой недостаточностью, требующей заместительной гормональной терапии. Дозы заместительной гормональной терапии подбираются индивидуально, а ее длительность обычно составляет 6–12 месяцев. Развитие надпочечниковой недостаточности, по мнению ряда авторов, является хорошим прогностическим критерием длительной ремиссии заболевания [7, 8, 10, 16].
Дозы заместительной гормональной терапии подбираются индивидуально, а ее длительность обычно составляет 6–12 месяцев. Развитие надпочечниковой недостаточности, по мнению ряда авторов, является хорошим прогностическим критерием длительной ремиссии заболевания [7, 8, 10, 16].
Результат операции считается неэффективным, если в клинической картине заболевания нет положительной динамики и через 6 месяцев отсутствует нормализация ритма кортизола и АКТГ в плазме крови и свободного кортизола в суточной моче.
Противопоказанием к проведению транссфеноидальной аденомэктомии являются тяжелые сопутствующие соматические заболевания, имеющие плохой прогноз, и крайне тяжелые соматические проявления основного заболевания.
За рубежом транссфеноидальная аденомэктомия при подтвержденном диагнозе БИК иногда проводится и при отсутствии на МРТ или МСКТ признаков опухоли гипофиза, однако эффективность операции при этом ниже (только 57%), чем при верифицированной аденоме. Во многом эффективность таких операций зависит от опыта нейрохирурга [9, 17].
Во многом эффективность таких операций зависит от опыта нейрохирурга [9, 17].
Несмотря на очевидные успехи в нейрохирургическом лечении БИК, по данным литературы, у 15–25% пациентов возникают рецидивы в течение 10-ти лет. Основными факторами риска развития рецидива являются неполное удаление опухоли, чаще всего связанное с ее инвазией в окружающие структуры (в кавернозные синусы), и повышенный уровень клеточной пролиферации при иммуногистохимическом исследовании.
Таким образом, транссфеноидальная аденомэктомия – эффективный самостоятельный метод лечения БИК, который приводит к быстрой и стойкой ремиссии заболевания у 80–85% пациентов.
Адреналэктомия
Говоря об адреналэктоми, мы имеем в виду тотальную одностороннюю или двустороннюю адреналэктомию. Сочетание односторонней адреналэктомии с лучевой терапией может проводиться при средней и среднетяжелой формах БИК, если пациенту по каким-либо причинам не удается провести аденомэктомию. Односторонняя тотальная адреналэктомия может быть проведена, если у пациента отсутствует ремиссия заболевания после аденомэктомии и лучевой терапии.
Односторонняя тотальная адреналэктомия может быть проведена, если у пациента отсутствует ремиссия заболевания после аденомэктомии и лучевой терапии.
При тяжелой и крайне тяжелой форме заболевания проводится двусторонняя тотальная адреналэктомия. Двусторонняя адреналэктомия является операцией, направленной на спасение жизни больного, но не на устранение патогенетической причины заболевания, поэтому ее также надо сочетать с лучевой терапией для профилактики развития синдрома Нельсона (прогрессирование роста кортикотропиномы при отсутствии надпочечников).
Лучевая терапия
Радиохирургия является самостоятельным патогенетическим методом лечения БИК. Радиохирургия может осуществляться облучением аденомы узкими пучками ускоренных частиц (протонов), мегавольтным тормозным излучением медицинских ускорителей, гамма-излучением на установке «гамма-нож». Эти виды нейрохирургического лечения являются перспективными, поскольку эффективность их достигает 80%.
Протонотерапия действенна в лечении пациентов с БИК, как с выявленной аденомой гипофиза, так и при ее отсутствии по данным МРТ с контрастом.
Известно, что у 80% пациентов с БИК при МРТ или МСКТ обнаруживается аденома передней доли гипофиза. Однако наибольшие трудности для диагностики и лечения составляют больные, у которых при доказанной АКТГ-зависимой форме гиперкортицизма на МРТ выявляются лишь косвенные признаки аденомы гипофиза в виде диффузной неоднородности структуры аденогипофиза или нормальная структура гипофиза без признаков аденомы (20%). Выбор тактики лечения таких пациентов во всем мире остается неоднозначным. Как правило, отсутствие признаков аденомы на МРТ при БИК расценивается как показание для тотальной или субтотальной гипофизэктомии, заведомо ведущей к развитию гипопитуаризма – полного или парциального, – но при этом не всегда приводящей к ремиссии БИК.
До назначения протонотерапии пациентам без явных признаков аденомы гипофиза по данным МРТ необходимо провести расширенный диагностический поиск для исключения АКТГ-эктопического синдрома (магниторезонансное исследование головного мозга с контрастным усилением, забор крови на АКТГ из каменистых синусов в ходе проведения пробы с десмопрессином).
Протонотерапия использует энергию протонов, генерируемых в больших ядерных ускорителях, исходно созданных для исследовательских целей в области ядерной физики. Метод многопольно-конвергентного облучения гипофиза протонным пучком с бипланарной ротацией головы (протонотерапия) используется в ФГУ ЭНЦ для лечения гормонально-активных опухолей гипофиза более 25 лет. Как правило, всю дозу (50–70 Гр) пациент получает за один сеанс; она зависит от объема облучения, активности заболевания, предполагаемого гистологического строения опухоли, предшествующего лечения, возраста, данных о наличии или отсутствии микроаденомы по результатам МРТ головного мозга [12–14].
Анализ зависимости клинического эффекта от применяемых доз облучения позволил заключить: поглощенная доза излучения при БИК должна быть не менее 50 Гр в точке конвергенции. При этом сроки наступления клинической и гормональной ремиссии варьируют в достаточно широких пределах (от 3–6 месяцев до 2 лет) и зависят от степени тяжести заболевания и возраста больных.
Процедура протонного облучения обычно легко переносится пациентами. При этом никогда не наблюдается местных лучевых реакций, присущих гамма-терапии (гиперемия кожи в зоне облучения, алопеция). Примерно у трети пациентов в первые сутки после облучения отмечается чувство «тяжести» в голове, реже – тошнота, головная боль. Это обусловлено локальным постлучевым отеком области турецкого седла, раздражающим твердую мозговую оболочку. Подобные состояния носят преходящий характер, легко купируются дегидратационной терапией в сочетании с анальгетиками.
В отличие от гамма-терапии эффективность которой не превышает 60%, результаты протонотерапии очень высоки, особенноу пациентов молодого возраста (10–25 лет) с легкой формой заболевания (96%), в этом случае протонотерапия может быть использована как самостоятельный метод лечения [12, 18, 19].
При средней и среднетяжелой формах заболевания протонотерапию следует применять в комбинации с односторонней адреналэктомией, а при крайне тяжелой форме – с двусторонней адреналэктомией. Первые клинические признаки улучшения могут наблюдаться уже через 1–1,5 месяца – примерно 60% пациентов отмечается уменьшение частоты головных болей, улучшение общего самочувствия. У женщин обычно в эти сроки восстанавливается нарушенный во время заболевания менструальный цикл, что является благоприятным прогностическим фактором. В первые 3–6 месяцев после облучения примерно у половины пациентов начинается снижение веса и / или перераспределение подкожно-жировой клетчатки, что сопровождается побледнением стрий и нормализацией АД. При оценке отдаленных результатов протонотерапии у пациентов с БИК, проведенной в ФГУ ЭНЦ (максимальный период наблюдения 25 лет), установлена высокая эффективность данного метода: положительный клинический эффект через год после протонотерапии наблюдается более чем у 90% пациентов. При этом клинико-гормональная ремиссия с нормализацией уровня гормонов отмечается более чем у 80% пациентов.
Первые клинические признаки улучшения могут наблюдаться уже через 1–1,5 месяца – примерно 60% пациентов отмечается уменьшение частоты головных болей, улучшение общего самочувствия. У женщин обычно в эти сроки восстанавливается нарушенный во время заболевания менструальный цикл, что является благоприятным прогностическим фактором. В первые 3–6 месяцев после облучения примерно у половины пациентов начинается снижение веса и / или перераспределение подкожно-жировой клетчатки, что сопровождается побледнением стрий и нормализацией АД. При оценке отдаленных результатов протонотерапии у пациентов с БИК, проведенной в ФГУ ЭНЦ (максимальный период наблюдения 25 лет), установлена высокая эффективность данного метода: положительный клинический эффект через год после протонотерапии наблюдается более чем у 90% пациентов. При этом клинико-гормональная ремиссия с нормализацией уровня гормонов отмечается более чем у 80% пациентов.
Основным побочным действием протонотерапии, как и других методов лучевого воздействия, является постепенное развитие гипопитуитаризма. Это связано с дегенеративно-дистрофическими постлучевыми процессами, с течением времени возникающими в ткани гипофиза. Причем из-за медленной постлучевой инволюции гипофиза появление данного осложнения сначала может быть скрытым (в частности СТГ-недостаточность), а по прошествии 3–5-ти лет иметь субклинический характер течения и манифестировать. Со временем процент пациентов, требующих заместительной терапии, увеличивается.
Это связано с дегенеративно-дистрофическими постлучевыми процессами, с течением времени возникающими в ткани гипофиза. Причем из-за медленной постлучевой инволюции гипофиза появление данного осложнения сначала может быть скрытым (в частности СТГ-недостаточность), а по прошествии 3–5-ти лет иметь субклинический характер течения и манифестировать. Со временем процент пациентов, требующих заместительной терапии, увеличивается.
Можно полагать, что гипогонадизм в какой-то мере обусловлен избыточным количеством пролактина, ингибирующего продукцию гонадотропинов. Постлучевая гиперпролактинемия вызвана радиационными повреждениями воронки гипофиза и склерозом диафрагмы турецкого седла. Это состояние обычно компенсируется приемом небольших доз агонистов рецепторов дофамина (абергина или парлодела) или агонистов каберголина (достинекс).
По данным ФГУ ЭНЦ, сочетание гипокортицизма, гипогонадизма, гипотиреоза и гиперпролактинемии в разных комбинациях наблюдалось у 46,1 % всех больных, отклонение от нормы только одной функции отмечалось у 28,0% больных, 4,5% пациентов имели гипопитуитаризм, у 21,6% больных не было указанных осложнений [12–14].
Таким образом, протонотерапия является адекватным методом лечения болезни Иценко-Кушинга, позволяющим добиться выздоравления у 83,6% пациентов. Вместе с тем в разные сроки после протонотерапии (от 5 до 10 лет) у пациентов возникают нарушения гипофизарных функций в различных сочетаниях, что требует длительного наблюдения за такими больными и назначения соответствующей терапии.
Медикаментозная терапия
В настоящее время нет эффективных фармакологических препаратов, способных привести к ремиссии БИК, поскольку все они обладают весьма существенным недостатком: при отмене препарата вновь быстро развиваются все симптомы БИК, а значения кортизола и АКТГ возвращаются к исходному уровню. В связи с этим медикаментозная терапия как самостоятельный метод лечения болезни Иценко-Кушинга не применяется. Фармакологические средства при БИК используются в качестве вспомогательной терапии к основным методам лечения (к хирургическому и радиохирургическому лечению) при отсутствии ремиссии заболевания или рецидиве.
В зависимости от механизма действия выделяют три группы препаратов: нейромодуляторы (ципрогептадин (перитол), бромкриптин, каберголин, соматостатин, вальпроат натрия) блокируют секрецию АКТГ аденомой гипофиза; ингибиторы стероидогенеза (кетоконазол, аминоглютетимид, митотан, метирапон) снижают уровень кортизола за счет прямого ферментного ингибирования синтеза надпочечниками или подавления адренолитической активности; антагонисты глюкокортикоидов (мифепристон RU-486) блокируют действие кортизола на уровне рецепторов.
Точный механизм действия нейромодуляторов пока до конца неясен: вероятнее всего, снижение секреции АКТГ происходит за счет воздействия на гипоталамо-гипофизарную ось. Но несмотря на центральные механизмы действия, нейромодуляторы обладают низкой эффективностью при БИК: по данным различных авторов, лишь у 40–50% пациентов наблюдается временный положительный эффект в виде снижения уровня АКТГ и кортизола в плазме.
В настоящее время ведутся интенсивные исследования таких новых средств, как розиглитазон и ретиноидная кислота, которые, связывая различные гормональные рецепторы, участвующие в гипоталамо-гипофизарной регуляции, способны подавлять секрецию АКТГ. Однако опубликованные начальные результаты говорят о том, что использование данных препаратов приводит к временной нормализации секреции АКТГ и кортизола.
Однако опубликованные начальные результаты говорят о том, что использование данных препаратов приводит к временной нормализации секреции АКТГ и кортизола.
Недавно были получены данные о наличии в удаленных кортикотропиномах экспрессии рецепторов соматостатина 1–5-го подтипов и рецепторов дофамина 2-го типа. Коэкспрессия двух и более подтипов рецепторов соматостатина определялась в 80% кортикотропином с преобладанием 1-го и 3-го подтипов, рецепторы дофамина 2-го типа экспрессировали около 30% опухолей гипофиза.
Перспективным медикаментозным методом лечения при БИК может стать применение аналогов соматостатина, имеющих сродство к рецепторам соматостатина 1–5-го субтипов и агонистов дофамина. В настоящее время проводятся клинические исследования аналога соматостатина – пазиреотида, – как в качестве монотерапии, так и в комбинации с каберголином и низкими дозами кетоконазола [20].
При исследовании биоптатов удаленных кортикотропином при помощи методов количественной ПЦР в режиме реального времени и иммуногистохимических исследований были обнаружены рецепторы соматостатина (подтипы 1–5) и дофамина [21]. Так, по данным различных авторов рецепторы субтипа 1 экспрессируются в 33% кортикотропином, тогда как рецепторы субтипа 3 и 5 – в 50–83% этих опухолей. Эта информация подтверждается и тем, что при введении мультилигандного аналога соматостатина – пазиреотида – с высоким сродством к субтипам рецепторов 2, 3 и 5 значительно снижаются уровни АКТГ и кортизола в крови у лабораторных животных, что позволяет предположить эффективность этого препарата у пациентов с БИК (в настоящее время проводятся испытания препарата в клинических условиях). В исследовании D.L. Batista [22] изучался антипролиферативный эффект пазиреотида при использовании культурального метода на клетках кортикотропином человека in vitro. В результате показана выраженная супрессия клеточной пролиферации и секреции АКТГ.
Так, по данным различных авторов рецепторы субтипа 1 экспрессируются в 33% кортикотропином, тогда как рецепторы субтипа 3 и 5 – в 50–83% этих опухолей. Эта информация подтверждается и тем, что при введении мультилигандного аналога соматостатина – пазиреотида – с высоким сродством к субтипам рецепторов 2, 3 и 5 значительно снижаются уровни АКТГ и кортизола в крови у лабораторных животных, что позволяет предположить эффективность этого препарата у пациентов с БИК (в настоящее время проводятся испытания препарата в клинических условиях). В исследовании D.L. Batista [22] изучался антипролиферативный эффект пазиреотида при использовании культурального метода на клетках кортикотропином человека in vitro. В результате показана выраженная супрессия клеточной пролиферации и секреции АКТГ.
Роль рецепторов к соматостатину и дофамину в кортикотропиномах и других АКТГ-продуцирующих опухолях до сих пор недостаточно изучена. Однако авторы полагают, что экспрессия этих рецепторов в кортикотропиномах связана с ослаблением воздействия факторов, ингибирующих рост опухоли. Таким образом, наличие рецепторов к соматостатину и дофамину дает возможность воздействовать на опухоль медикаментозными средствами.
Таким образом, наличие рецепторов к соматостатину и дофамину дает возможность воздействовать на опухоль медикаментозными средствами.
По структуре и функции рецепторы соматостатина подразделяются на 5 подтипов, обладающих различными ингибирующими эффектами на процессы, протекающие в организме человека.
Соматостатин является эндогенным ингибитором различных секретируемых гипофизом пептидов, включая гормон роста и адренокортикотропный гормон. Аналоги соматостатина действуют как агонисты рецепторов соматостатина (РС), что приводит к ингибированию высвобождения гормонов.
В настоящее время отсутствуют эффективные лекарственные препараты, действующие на опухоль гипофиза (кортикотропиному), которая вызывает БИК. Изучается несколько препаратов, в числе которых новый аналог соматостатина – пазиреотид (SOM 230), который действует на несколько подтипов рецепторов, но с высокой аффинностью к рецепторам соматостатина субтипов 2, 3 и 5. Этот препарат является единственным аналогом соматостатина, действующим на три подтипа рецепторов. При этом именно рецептор субтипа 5 является основным рецептором, который экспрессируется в кортикотропных аденомах. Этот препарат специально разрабатывался как действующий на кортикотропиному для лечения БИК. Пазиреотид (SOM 230), действующий на рецепторы субтипа 2, 3 и 5, может снижать уровень кортизола и в результате приводить к клинически значимому снижению АКТГ.
При этом именно рецептор субтипа 5 является основным рецептором, который экспрессируется в кортикотропных аденомах. Этот препарат специально разрабатывался как действующий на кортикотропиному для лечения БИК. Пазиреотид (SOM 230), действующий на рецепторы субтипа 2, 3 и 5, может снижать уровень кортизола и в результате приводить к клинически значимому снижению АКТГ.
К настоящему времени завершена II фаза рандомизированного проспективного слепого исследования по действию пазиреотида (SOM 230) у 39 пациентов с БИК, у которых отсутствовала ремиссия заболевания после нейрохирургического лечения или лучевого лечения. Вводили препарат подкожно в дозе 600 мг 2 раза в день в течение 15-ти дней. На момент окончания исследования уровень свободного кортизола в моче снизился у 76% пациентов, а у 17% он достиг нормального значения. Наблюдалось также достоверное снижение уровня кортизола и АКТГ в плазме крови. Препарат в целом хорошо переносился, но были зафиксированы легкие нежелательные эффекты со стороны желудочно-кишечного тракта и повышение гликемии. Сейчас проводится исследование III фазы эффективности пазиреотида (SOM 230) в лечении БИК при введении препарата в дозе 600 или 900 мкг 2 раза в день в течение 6-ти месяцев. Результаты исследования помогут определить роль этого многообещающего препарата в лечении БИК, в случаях когда не достигнута ремиссия заболевания после нейрохирургической операции или радиохирургического лечения.
Сейчас проводится исследование III фазы эффективности пазиреотида (SOM 230) в лечении БИК при введении препарата в дозе 600 или 900 мкг 2 раза в день в течение 6-ти месяцев. Результаты исследования помогут определить роль этого многообещающего препарата в лечении БИК, в случаях когда не достигнута ремиссия заболевания после нейрохирургической операции или радиохирургического лечения.
Другим возможным вариантом медикаментозной терапии у пациентов с кортикотропными опухолями, экспрессирующими рецептор D2, является агонист дофаминовых рецепторов каберголин [23].
Применение препаратов третьей группы – антагонистов действия глюкокортикоидов, в частности мифепристона, – в настоящее время находится на стадии клинических испытаний. При этом предполагается, что наилучший их эффект может быть достигнут в лечении АКТГ-независимого синдрома Кушинга. Данные об использовании этих препаратов в лечении БИК – единичны. Показано, что мифепристон, блокируя глюкокортикоидные рецепторы, ведет к повышению уровня АКТГ и кортизола, и тем самым вызывает гипокалиемию [20].
Препараты, блокирующие биосинтез стероидов в надпочечниках (кетоконазол, аминоглютетимид, хлодитан), применяются при подготовке к проведению основных методов лечения БИК (аденомэктомия или лучевая терапия) или как дополнение к ним с целью сокращения срока наступления ремиссии (после курса лучевой терапии), а также при отсутствии ремиссии заболевания или рецидиве. Не рекомендуется применять терапию блокаторами стероидогенеза как самостоятельный метод лечения БИК. Выбор препарата зависит от степени выраженности гиперкортицизма, тяжести клинических проявлений и его переносимости.
Кетоконазол – дериват имидазола – в адекватных дозах снижает стероидную продукцию в надпочечниках, ингибируя многие стероидные ферменты: 11β-, 17β- и 18β-гидроксилазу, снижает продукцию кортизола при гиперкортицизме различной этиологии у 50–70% пациентов [24]. Как показали недавние исследования, кроме воздействия на надпочечники, кетоконазол может также оказывать прямое действие на опухолевые кортикотрофы in vitro и снижать секрецию АКТГ.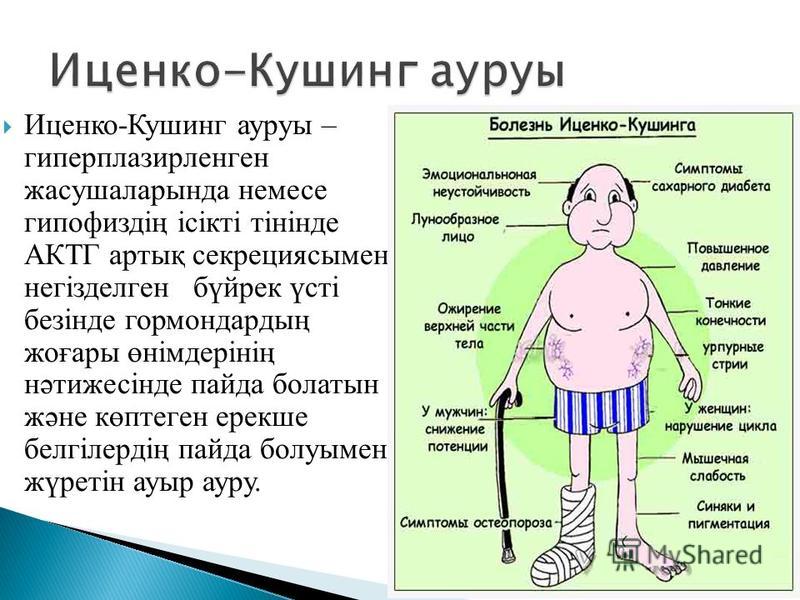 Помимо этого было показано, что добавление при инкубации опухоли аналога соматостатина – пазиреотида – приводит к более значительному снижению роста опухолевых клеток и секреции АКТГ. Предполагается, что совместное использование кетоконазола и пазиреотида может быть более эффективным для медикаментозного лечения болезни Иценко-Кушинга.
Помимо этого было показано, что добавление при инкубации опухоли аналога соматостатина – пазиреотида – приводит к более значительному снижению роста опухолевых клеток и секреции АКТГ. Предполагается, что совместное использование кетоконазола и пазиреотида может быть более эффективным для медикаментозного лечения болезни Иценко-Кушинга.
Кроме того, кетоконазол обычно хорошо переносится больными. При его использовании в качестве монотерапии получены наилучшие результаты – около 70% положительного эффекта. Некоторые авторы предлагают применять кетоконазол как основной метод лечения БИК у пожилых пациентов и при рецидивах БИК.
Аминоглютетимид (мамомит, ориметен, элиптен) ингибирует синтез всех предшественников кортизона и других стероидов, блокируя конверсию холестерина в прегненолон. Это приводит к снижению всех конечных продуктов стероидогенеза (кортизола, половых стероидов, минералкортикоидов), что в свою очередь ведет к дополнительной стимуляции АКТГ-секретирующей аденомы. Этим, вероятно, объясняется невысокая эффективность данного препарата в отношении БИК, что предполагает комбинирование аминоглютетимида с другими видами лечения [23].
Этим, вероятно, объясняется невысокая эффективность данного препарата в отношении БИК, что предполагает комбинирование аминоглютетимида с другими видами лечения [23].
Хлодитан (митотан, o,p’-DDD) является адренолитическим препаратом: он вызывает токсическое повреждение митохондрий клеток коры надпочечников, что приводит к дегенерации и атрофии их секреторных элементов. Несмотря на хорошие результаты в лечении БИК применение хлодитана в России ограничено: во-первых, из-за выраженных побочных эффектов в виде рвоты, депрессии и др., а во-вторых, данный препарат не зарегистрирован на территории РФ.
Необходимо знать, что передозировка препаратов, блокирующих биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Помимо нейромодуляторов и блокаторов стероидогенеза при БИК применяют симптоматическую терапию для снижения выраженности симптомов гиперкортицизма. К ней прежде всего относится лечение артериальной гипертензии (ингибиторы ангиотензин-превращающего фермента, β-блокаторы в сочетании с калийсберегающими диуретинами), стероидной кардиопатии, гипокалиемии, стероидного диабета, иммунодефицитного состояния.
Под патогенетическим видом лечения стероидного остеопороза подразумевают в первую очередь достижение клинической ремиссии заболевания и нормализацию продукции кортизола надпочечниками. При этих условиях достигается снижение степени потери костной массы и уменьшается риск переломов. Однако восстановительный процесс при стероидном остеопорозе протекает медленно – от года до нескольких лет. Кроме того, скорость этого процесса зависит от исходной степени потери костной массы и возраста пациента. Чем больше потеря костной массы, чем старше пациент (или находится в возрасте пубертета), тем труднее получить положительные результаты восстановления костной массы. В этих условиях требуется дополнительное лечение стероидного остеопороза, направленное на подавление резорбции и стимуляцию костеобразования, повышение всасывания солей кальция в желудочно-кишечном тракте и регуляцию реабсорбции кальция в канальцах почки.
Препаратами первой линии лечения стероидного остеопороза являются бисфосфанаты и кальцитонины, которые снижают резорбцию костной ткани. Из бисфосфонатов в настоящее время в клинической практике наиболее распространен алендронат (фосамакс) и препарат алендроновой кислоты. Внутривенная форма препарата Бонвива может иметь преимущество у пациентов с поражением ЖКТ.
Из бисфосфонатов в настоящее время в клинической практике наиболее распространен алендронат (фосамакс) и препарат алендроновой кислоты. Внутривенная форма препарата Бонвива может иметь преимущество у пациентов с поражением ЖКТ.
Кальцитонин, в частности миокальцик, наряду с торможением костной резорбции обладает выраженным анальгетическим действием. Одновременно с препаратами кальцитонина больным надо рекомендовать дополнительный прием препаратов кальция (500–1000 мг в сутки) и активных метаболитов витамина Д3. Основным механизмом действия этого витамина является усиление кишечной абсорбции кальция, стимуляция костной резорбции, улучшение минерализации костной матрицы.
Анаболические стероиды уменьшают костную резорбцию и индуцируют положительный кальциевый баланс благодаря увеличению абсорбции кальция из кишечника и реабсорбции кальция почками. Симптоматическое лечение стероидного остеопороза включает в себя обезболивающую терапию: анальгетики, нестероидные противовоспалительные средства, а также центральные миорелаксанты, так как в генезе боли при стероидном остеопорозе имеет значение и спазм параспинальных мышц.
Таким образом, современные методы первичного самостоятельного патогенетического лечения болезни Иценко-Кушинга представлены транссфеноидальной аденомэктомией и радиохирургией. При отсутствии эффекта от применения этих методов лечения возможна их комбинация. Хотя в настоящее время медикаментозная терапия не является основной, ее роль повышается с разработкой новых нейрорегуляторов АКТГ и блокаторов биосинтеза стероидов в надпочечниках.
Прогноз лечения болезни Иценко-Кушинга зависит от длительности, тяжести заболеваниям и выраженности гиперкортицизма. Ранняя диагностика заболевания улучшает прогноз. При небольшой длительности заболевания, легкой форме и возрасте пациента до 30 лет прогноз благоприятный. После успешного лечения наблюдается выздоровление. У больных со средней формой заболевания и нерезко выраженными осложнениями также может наступить выздоровление, если лечение начато рано и проведено правильно. У больных со среднетяжелой формой и длительным течением заболевания после нормализации гипоталамо-гипофизарно-надпочечниковой функции часто остаются необратимые нарушения со стороны сердечно-сосудистой системы, нарушения углеводного обмена и остеопороз. При крайне тяжелой форме, в случае проведения двусторонней адреналэктомии, у больных развивается хроническая надпочечниковая недостаточность, требующая пожизненной заместительной терапии глюко- и минералокортикоидами.
При крайне тяжелой форме, в случае проведения двусторонней адреналэктомии, у больных развивается хроническая надпочечниковая недостаточность, требующая пожизненной заместительной терапии глюко- и минералокортикоидами.
После проведения лечения качество жизни пациентов улучшается, однако остается ниже, чем у людей без БИК такого же возраста и пола.
В заключение следует сказать, что болезнь Ицеко-Кушинга является тяжелым хроническим заболеванием у лиц трудоспособного возраста, смертность от которого, при отсутствии своевременного и адекватного лечения, превышает этот показатель в общей популяции. Преждевременному летальному исходу при БИК могут способствовать острые сердечно-сосудистые осложнения, тромбоэмболия, нарушение мозгового кровообращения, выраженные эндокринно-обменные нарушения, тяжелые соматические и неспецифические инфекционные заболевания.
Эндогенный синдром Кушинга: история вопроса, патофизиология, этиология
Chaudhry HS, Bhimji SS. Синдром Кушинга. 2018, январь [Medline]. [Полный текст].
Мариеб Нью-Джерси, Спанглер С., Кашгарян М., Хейманн А., Шварц М.Л., Шварц П.Е. Синдром Кушинга вторичный по отношению к эктопической продукции кортизола карциномой яичников. Дж. Клин Эндокринол Метаб . 1983 Октябрь 57 (4): 737-40. [Медлайн].
Кэри Р.М., Варма С.К., Дрейк С.Р. мл., Торнер М.О., Ковач К., Ривье Дж. И др. Внематочная секреция кортикотропин-рилизинг-фактора как причина синдрома Кушинга. Клиническое, морфологическое и биохимическое исследование. N Engl J Med . 1984 июл 5. 311 (1): 13-20. [Медлайн].
Браун Р.Дж., Келли М.Х., Коллинз М.Т. Синдром Кушинга при синдроме МакКьюна-Олбрайта. Дж. Клин Эндокринол Метаб . 2010 апр. 95 (4): 1508-15. [Медлайн].
Assie G, Bahurel H, Coste J, Silvera S, Kujas M, Dugue MA и др. Прогрессирование кортикотрофной опухоли после адреналэктомии при болезни Кушинга: переоценка синдрома Нельсона. Дж. Клин Эндокринол Метаб .2007, январь 92 (1): 172-9. [Медлайн].
Lindholm J, Juul S, Jorgensen JO, Astrup J, Bjerre P, Feldt-Rasmussen U, et al. Заболеваемость и поздний прогноз синдрома Кушинга: популяционное исследование. Дж. Клин Эндокринол Метаб . 2001, январь, 86 (1): 117-23. [Медлайн].
Клин Эндокринол Метаб . 2001, январь, 86 (1): 117-23. [Медлайн].
Graversen D, Vestergaard P, Stochholm K, Gravholt CH, Jorgensen JO. Смертность при синдроме Кушинга: систематический обзор и метаанализ. Eur J Intern Med .2012 г., 23 (3): 278-82. [Медлайн].
Хара Т., Акуцу Х., Ямамото Т., Исикава Э., Мацуда М., Мацумура А. Болезнь Кушинга, проявляющаяся перфорацией желудочно-кишечного тракта: клинический случай. Эндокринол, метаболизм при диабете, Rep . 2013. 2013: 130064. [Медлайн].
Graham BS, Tucker WS Jr. Оппортунистические инфекции при эндогенном синдроме Кушинга. Энн Интерн Мед. . 1984 Сентябрь 101 (3): 334-8. [Медлайн].
Дави М.В., Косаро Э., Пьячентини С. и др.Прогностические факторы при эктопическом синдроме Кушинга из-за нейроэндокринных опухолей: многоцентровое исследование. евро J Эндокринол . 2017 Апрель 176 (4): 451-9. [Медлайн].
евро J Эндокринол . 2017 Апрель 176 (4): 451-9. [Медлайн].
Перейра А.М., Дельгадо В., Ромейн Дж. А., Смит Дж. У., Бакс Дж. Дж., Фелдерс Р. А.. После успешного лечения синдрома Кушинга сердечная дисфункция полностью восстанавливается. евро J Эндокринол . 2010 Февраль 162 (2): 331-40. [Медлайн].
Tyrrell JB, Findling JW, Aron DC, Fitzgerald PA, Forsham PH.Ночной тест на подавление высоких доз дексаметазона для быстрой дифференциальной диагностики синдрома Кушинга. Энн Интерн Мед. . 1986 Февраль 104 (2): 180-6. [Медлайн].
Ниман Л.К., Биллер Б.М., Финдлинг Дж.В., Ньюэлл-Прайс Дж., Сэвидж М.О., Стюарт П.М. и др. Диагноз синдрома Кушинга: Руководство по клинической практике эндокринного общества. Дж. Клин Эндокринол Метаб . 2008 май. 93 (5): 1526-40. [Медлайн].
Кэрролл Т., Рафф Х., Финдлинг Дж. У. Ночной слюнный кортизол для диагностики синдрома Кушинга: метаанализ. Endocr Pract . 2009 май-июнь. 15 (4): 335-42. [Медлайн].
Эламин М.Б., Мурад М.Х., Муллан Р., Эриксон Д., Харрис К., Надим С. и др.Точность диагностических тестов синдрома Кушинга: систематический обзор и метаанализ. Дж. Клин Эндокринол Метаб . 2008 май. 93 (5): 1553-62. [Медлайн].
Elias PC, Martinez EZ, Barone BF, Mermejo LM, Castro M, Moreira AC. При диагностике синдрома Кушинга ночной слюнный кортизол лучше, чем свободный кортизол в моче. Дж. Клин Эндокринол Метаб . 2014 июнь 99 (6): 2045-51. [Медлайн].
2014 июнь 99 (6): 2045-51. [Медлайн].
Яновски Я., Катлер Г.Б. мл., Хрусос Г.П., Ниман Л.К.Стимуляция кортикотропин-рилизинг-гормона после приема низких доз дексаметазона. Новый тест, позволяющий отличить синдром Кушинга от состояний псевдо-Кушинга. JAMA . 1993 5 мая. 269 (17): 2232-8. [Медлайн].
Яновски Я., Катлер Г.Б. мл., Хрусос Г.П., Ниман Л.К. Стимуляция кортикотропин-рилизинг-гормона после приема низких доз дексаметазона. Новый тест, позволяющий отличить синдром Кушинга от состояний псевдо-Кушинга. JAMA .1993 5 мая. 269 (17): 2232-8. [Медлайн].
Мартин Н.М., Дилло В.С., Банерджи А., Абдулали А., Джаясена С.Н., Дональдсон М. и др. Сравнение теста на кортикотропин-рилизинг-гормон, подавляющего дексаметазон, и теста на подавление низких доз дексаметазона в диагностике синдрома Кушинга. Дж. Клин Эндокринол Метаб . 2006 июл.91 (7): 2582-6. [Медлайн].
Дж. Клин Эндокринол Метаб . 2006 июл.91 (7): 2582-6. [Медлайн].
Вестер В.Л., Рейнке М., Копер Дж. В. и др. Кортизол волосистой части головы для диагностики синдрома Кушинга. евро J Эндокринол . 2017 июн 176 (6): 695-703. [Медлайн].
Элхомси Г., Старос Э. Тест подавления дексаметазона. Медицинские препараты и болезни. Доступно на http://emedicine.medscape.com/article/2114191-overview. Дата обращения: 30.05.15.
Арон, округ Колумбия, Рафф Х., Финдлинг Дж. У. Эффективность против эффективности: ограниченное значение в клинической практике тестирования супрессии высоких доз дексаметазона в дифференциальной диагностике адренокортикотропин-зависимого синдрома Кушинга. Дж. Клин Эндокринол Метаб . 1997 июн. 82 (6): 1780-5. [Медлайн].
Реймондо Дж., Паккотти П., Минетто М., Термин А, Стура Дж., Бергуи М. и др.Тест на кортикотропин-рилизинг-гормон является наиболее надежным неинвазивным методом дифференциации гипофиза от эктопической секреции АКТГ при синдроме Кушинга. Клин Эндокринол (Oxf) . 2003 июн. 58 (6): 718-24. [Медлайн].
Oldfield EH, Doppman JL, Nieman LK, Chrousos GP, Miller DL, Katz DA, et al. Взятие пробы из каменной пазухи с кортикотропин-рилизинг-гормоном и без него для дифференциальной диагностики синдрома Кушинга. N Engl J Med . 1991 26 сен.325 (13): 897-905. [Медлайн].
[Медлайн].
Mulligan GB, Eray E, Faiman C, Gupta M, Pineyro MM, Makdissi A, et al. Уменьшение ложноотрицательных результатов при отборе проб из нижней каменистой пазухи с одновременным измерением пролактина и кортикотропина. Endocr Pract . 2011 янв-фев. 17 (1): 33-40. [Медлайн].
Такер МЭ. Новые рекомендации касаются лечения синдрома Кушинга. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/849084.5 августа 2015 г .; Дата обращения: 3 сентября 2015 г.
Эндокринное общество Эймса С. опубликовало руководство по лечению синдрома Кушинга. Консультант по эндокринологии . 26 августа 2015 г.
Колао А., Петерсенн С., Ньюэлл-Прайс Дж., Финдлинг Дж. В., Гу Ф., Мальдонадо М. и др. 12-месячное исследование фазы 3 пасиреотида при болезни Кушинга. N Engl J Med . 2012 8 марта. 366 (10): 914-24. [Медлайн].
N Engl J Med . 2012 8 марта. 366 (10): 914-24. [Медлайн].
Биллер БМК, Ньюэлл-Прайс Дж., Флезериу М. и др.OR16-2 Лечение осилодростатом при болезни Кушинга (CD): результаты фазы III, многоцентрового, двойного слепого, рандомизированного исследования отмены (LINC 3). J Endocr Soc . 2019 апрель-май. 3 (Дополнение_1): [Полный текст].
Johanssen S, Allolio B. Мифепристон (RU 486) при синдроме Кушинга. евро J Эндокринол . 2007 ноябрь 157 (5): 561-9. [Медлайн].
Fleseriu M, Biller BM, Findling JW, Molitch ME, Schteingart DE, Gross C, et al.Мифепристон, антагонист рецепторов глюкокортикоидов, оказывает клинические и метаболические преимущества у пациентов с синдромом Кушинга. Дж. Клин Эндокринол Метаб . 2012 июн.97 (6): 2039-49. [Медлайн].
Безопасность и эффективность LC1699 для лечения пациентов с болезнью Кушинга. ClinicalTrials.gov. Доступно на https://clinicaltrials.gov/ct2/show/NCT02180217. Дата обращения: 13.07.15.
Bertagna X, Pivonello R, Fleseriu M, Zhang Y, Robinson P, Taylor A, et al. LCI699, мощный ингибитор 11β-гидроксилазы, нормализует уровень кортизола в моче у пациентов с болезнью Кушинга: результаты многоцентрового исследования, подтверждающего правильность концепции. Дж. Клин Эндокринол Метаб . 2014 Апрель 99 (4): 1375-83. [Медлайн].
Деккерс О.М., Хорват-Пухо Э., Йоргенсен Дж.О., Каннегитер С.К., Эренштейн В., Ванденброук Дж. П. и др. Мультисистемная заболеваемость и смертность при синдроме Кушинга: когортное исследование. Дж. Клин Эндокринол Метаб . 2013 июнь 98 (6): 2277-84. [Медлайн].
Боскаро М., Бертерат Дж., Финдлинг Дж., Флезериу М., Аткинсон А.Б., Петерсенн С. и др. Расширенное лечение болезни Кушинга пасиреотидом: результаты 2-летнего исследования фазы II. Гипофиз . 2014 17 августа (4): 320-6. [Медлайн].
Болезнь Кушинга | Сеть гормонального здоровья
Что такое болезнь Кушинга?
Кортизол — это гормон, вырабатываемый надпочечниками, который напрямую связан с реакцией на стресс. У здорового человека высвобождение адренокортикотропного гормона (АКТГ), гормона, вырабатываемого гипофизом, стимулирует выработку и высвобождение кортизола надпочечниками. Когда человек сталкивается со стрессовой ситуацией, организм выделяет больше кортизола. Иногда организм не может должным образом регулировать выработку кортизола и вырабатывается слишком много кортизола. Когда вырабатывается слишком много кортизола, у пациента развивается синдром Кушинга. Болезнь Кушинга — это одна из форм синдрома Кушинга.Болезнь Кушинга возникает, когда доброкачественная опухоль в гипофизе заставляет гипофиз вырабатывать слишком много АКТГ, гормона, ответственного за выработку кортизола. Слишком много АКТГ в организме заставляет надпочечники вырабатывать высокий уровень кортизола.
У здорового человека высвобождение адренокортикотропного гормона (АКТГ), гормона, вырабатываемого гипофизом, стимулирует выработку и высвобождение кортизола надпочечниками. Когда человек сталкивается со стрессовой ситуацией, организм выделяет больше кортизола. Иногда организм не может должным образом регулировать выработку кортизола и вырабатывается слишком много кортизола. Когда вырабатывается слишком много кортизола, у пациента развивается синдром Кушинга. Болезнь Кушинга — это одна из форм синдрома Кушинга.Болезнь Кушинга возникает, когда доброкачественная опухоль в гипофизе заставляет гипофиз вырабатывать слишком много АКТГ, гормона, ответственного за выработку кортизола. Слишком много АКТГ в организме заставляет надпочечники вырабатывать высокий уровень кортизола.
Болезнь Кушинга также может возникать при диффузном росте гипофиза, также называемом гиперплазией гипофиза. Гиперплазия гипофиза может привести к высвобождению слишком большого количества АКТГ, что затем приводит к чрезмерной выработке кортизола надпочечниками.
Что вызывает болезнь Кушинга?
Болезнь Кушинга — редкое заболевание, от которого ежегодно страдают от 10 до 15 человек на миллион. Это чаще встречается у женщин и чаще всего встречается у людей в возрасте от 20 до 50 лет. Аденома гипофиза является наиболее частой причиной болезни Кушинга. Аденома — это опухоль гипофиза, которая почти всегда бывает доброкачественной. Опухоль бывает трудно диагностировать, потому что она довольно маленькая. Помощь эндокринолога в диагностическом процессе может повысить шансы на быструю и успешную диагностику пациентов с симптомами болезни Кушинга.
Каковы признаки и симптомы болезни Кушинга?
Изменений внешнего вида:
- Широкие фиолетовые растяжки на коже (грудь, подмышки, живот, бока)
- Быстрое и необъяснимое увеличение веса с округлым лицом и животом
- Увеличение жира на шее, над ключицей и в верхней части спины
- Изменения кожи (синяки без травм, угри, рост волос) и красные щеки
Настроение и мышление:
- Потеря памяти или неспособность ясно мыслить
- Депрессия
- Расстройства настроения и поведения
Другие симптомы:
Как диагностируется болезнь Кушинга?
Диагностика болезни Кушинга может быть трудной, потому что симптомы могут иметь множество различных причин, а повышение уровня кортизола может происходить циклически. В результате уровень кортизола не может быть повышен во время тестирования.
В результате уровень кортизола не может быть повышен во время тестирования.
Три теста обычно используются для диагностики болезни Кушинга. Один из самых чувствительных тестов измеряет уровень кортизола в слюне между 23:00. и полночь. Образец слюны собирается в небольшой пластиковый контейнер и отправляется в лабораторию для анализа. У здоровых людей в этот период времени уровень кортизола очень низкий. Напротив, у людей с болезнью Кушинга высокий уровень.
Уровень кортизола также можно измерить в моче, собранной за 24 часа.
В другом скрининговом тесте у людей с подозрением на болезнь Кушинга измеряли уровень кортизола утром после приема ночной дозы дексаметазона, лабораторного стероида. Обычно дексаметазон вызывает падение кортизола до очень низкого уровня, но у людей с болезнью Кушинга этого не происходит.
Если эти тесты показывают высокий уровень кортизола, врач измеряет уровень АКТГ в крови. При болезни Кушинга уровень кортизола высокий, а уровень АКТГ нормальный или высокий. Если эти результаты будут видны, врач назначит МРТ гипофиза, чтобы точно определить местонахождение опухолей.
Если эти результаты будут видны, врач назначит МРТ гипофиза, чтобы точно определить местонахождение опухолей.
Если вы боретесь с симптомами повышенного уровня кортизола, запишитесь на прием к эндокринологу, чтобы исключить болезнь Кушинга.
Как лечится болезнь Кушинга?
Первый выбор терапии болезни Кушинга — хирургическое удаление опухоли. Уровень излечения от опытного хирурга-гипофиза составляет около 90% у людей с небольшими опухолями.Пациенту обычно проводят транссфеноидальную микрохирургию через носовые пазухи.
Людям, которые не излечились с помощью одной операции, может потребоваться повторная операция. Когда операция не помогает, лучевая терапия может лечить любые оставшиеся опухолевые клетки. Излучению требуется некоторое время, чтобы полностью подействовать. Некоторые лекарства, блокирующие выработку кортизола надпочечниками (например, кетоконазол, метирапон или митотан), можно использовать в ожидании воздействия радиации. В некоторых случаях препарат, называемый агонистом дофамина, например каберголин, может снизить уровень АКТГ и выработку кортизола. Пасиреотид (вводимый путем инъекции под кожу) также может снизить уровень АКТГ и выработку кортизола. Мифепристон, глюкокортикоидный агент, является еще одним лекарством, которое останавливает действие кортизола на организм. В редких случаях надпочечники удаляются хирургическим путем, чтобы остановить чрезмерную выработку кортизола.
Пасиреотид (вводимый путем инъекции под кожу) также может снизить уровень АКТГ и выработку кортизола. Мифепристон, глюкокортикоидный агент, является еще одним лекарством, которое останавливает действие кортизола на организм. В редких случаях надпочечники удаляются хирургическим путем, чтобы остановить чрезмерную выработку кортизола.
Болезнь Кушинга | Программа UCLA по опухолям гипофиза
Болезнь Кушинга — это серьезное заболевание, связанное с избытком стероидного гормона кортизола в крови, вызванное опухолью гипофиза, секретирующей адренокортикотропный гормон (АКТГ).АКТГ — это гормон, вырабатываемый нормальным гипофизом. АКТГ стимулирует надпочечники (расположенные в верхней части почек) для выработки кортизола, обычно называемого гормоном стресса.
Болезнь Кушинга: помощь специалистов в Южной Калифорнии
Наш комплексный подход к диагностике и лечению болезни Кушинга отличает Программу UCLA по лечению опухолей гипофиза. Наши врачи ежегодно лечат большое количество пациентов и проводят более 100 операций на гипофизе в год, что делает нас одной из лучших программ в США
Воспользуйтесь ссылками, чтобы узнать больше о болезни Кушинга:
Болезнь Кушинга: физиология
Болезнь Кушинга встречается редко, ежегодно поражая от 10 до 15 человек на миллион, чаще всего у взрослых в возрасте от 20 до 50 лет. На женщин приходится более 70 процентов заболевших.
На женщин приходится более 70 процентов заболевших.
Большинство пациентов с болезнью Кушинга имеют небольшие опухоли (микроаденомы гипофиза). Однако диагностика болезни Кушинга может быть трудной, и диагноз часто откладывается. Эндокринолог всегда должен контролировать обследование на болезнь Кушинга. В программе UCLA по лечению опухолей гипофиза наши специалисты имеют многолетний опыт диагностики и лечения болезни Кушинга.
Болезнь Кушинга: понимание нормальной физиологии кортизола
Кортизол влияет на организм разными способами, в том числе:
- Поддержание нормального артериального давления; неадекватное производство кортизола обычно связано с низким кровяным давлением.
- Реагирование на стрессовые ситуации. Кортизол — один из гормонов «борьбы или бегства».
- Повышенный уровень кортизола в крови необходим для того, чтобы вы могли справиться с острыми стрессовыми ситуациями, включая хирургическое вмешательство.
- Неадекватное высвобождение кортизола может быть фатальным.

Надпочечники вырабатывают кортизол в различных количествах в течение дня:
- В полночь уровень кортизола в крови и слюне очень низкий.
- Уровень кортизола в крови обычно самый высокий ранним утром.
Болезнь Кушинга против синдрома Кушинга
Болезнь Кушинга — это не то же самое, что синдром Кушинга. Синдром Кушинга относится к общему состоянию, характеризующемуся повышенным уровнем кортизола в крови. Повышенный уровень кортизола может возникать по причинам, не связанным с опухолью гипофиза, в том числе:
- Опухоли надпочечников, продуцирующие кортизол
- Определенные виды рака в других частях тела могут вырабатывать АКТГ, который затем стимулирует нормальные надпочечники, вырабатывая чрезмерное количество кортизола.Это называется эктопической выработкой АКТГ.
Синдром Кушинга встречается гораздо чаще, чем болезнь Кушинга. Наиболее частой причиной повышенного уровня кортизола является прием препаратов, содержащих кортизол, в том числе: гидрокортизон, таблетки преднизона, кожные мази, ингаляторы от астмы и совместные инъекции стероидов
Менее распространенные причины повышенного уровня кортизола:
- Опухоль надпочечника
- «Псевдо-Кушинга», хронически повышенный уровень кортизола, вызванный: депрессией, злоупотреблением алкоголем, нервной анорексией или высоким уровнем эстрогена
Пациентов с «псевдо-Кушингом» бывает трудно отличить от пациентов с истинным синдромом Кушинга. Вашему врачу может потребоваться назначить специальные гормональные тесты для уточнения диагноза.
Вашему врачу может потребоваться назначить специальные гормональные тесты для уточнения диагноза.
Болезнь Кушинга используется исключительно для описания состояния избыточного кортизола, возникающего из-за опухоли гипофиза, секретирующей гормон АКТГ.
Болезнь Иценко-Кушинга: симптомы
Симптомы, связанные с болезнью Кушинга и синдромом Кушинга, одинаковы, поскольку оба связаны с избытком кортизола. Симптомы могут включать:
- Изменения физических характеристик тела
- Полнота и округлость лица (так называемая «лунная фация»)
- Добавлен жир на шее сзади (так называемый «буйволиный горб»)
- Легкий синяк на коже
- Растяжки на животе фиолетовые (брюшные стрии)
- Чрезмерное увеличение веса, наиболее выраженное в области живота, при этом ноги и руки остаются тонкими
- Щеки красные («полнокровие»)
- Чрезмерный рост волос на лице, шее, груди, животе и бедрах
- Общая слабость и утомляемость; истощение мышц, особенно заметно в верхней части бедер.
 Вам может быть трудно вставать со стула.
Вам может быть трудно вставать со стула. - Нарушения менструального цикла
- Снижение фертильности и / или полового влечения
- Высокое кровяное давление, которое часто трудно поддается лечению
- Сахарный диабет, часто тяжелый
- Расстройства настроения и поведения; у некоторых пациентов есть психические расстройства, требующие госпитализации
Хотя это и нечасто, у некоторых пациентов с болезнью Кушинга наблюдаются большие опухоли гипофиза (макроаденомы).В дополнение к тяжелым гормональным эффектам, связанным с повышением уровня кортизола в крови, большая опухоль может сдавливать соседние структуры, что приводит к:
- Потеря зрения
- Другие проблемы со зрением могут включать:
- Потеря остроты зрения (нечеткое зрение), особенно если макроаденома растет вперед и сдавливает зрительный нерв.
- Неспособность воспринимать цвета так же ярко, как обычно
- Повышенное сжатие нормальной железы может вызвать гормональную недостаточность, называемую гипопитуитаризмом.
 Симптомы зависят от того, какой гормон задействован.
Симптомы зависят от того, какой гормон задействован.- Снижение уровня половых гормонов, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ).
- У мужчин это может привести к низкому уровню тестостерона, вызывая снижение полового влечения и импотенцию.
- В некоторых случаях может наблюдаться потеря волос на теле и лице.
- У женщин это может привести к бесплодию.
- Большие опухоли гипофиза могут незначительно повышать уровень пролактина в крови.Врачи считают, что это происходит из-за сдавливания ножки гипофиза, связи между мозгом и гипофизом. Это называется «эффектом стебля».
- У женщин в пременопаузе это может привести к сокращению или потере менструального цикла и / или выработки грудного молока (галакторея).
- Уровень пролактина повышен лишь незначительно, в отличие от пролактином, у которых уровень пролактина обычно очень высок.
- Снижение уровня половых гормонов, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ).
Болезнь Иценко-Кушинга: диагноз
Ранние стадии болезни Кушинга бывает трудно распознать, особенно потому, что изменения в организме развиваются медленно. Сравнение старых и недавних фотографий часто показывает изменения во внешнем виде и физических характеристиках тела.
Сравнение старых и недавних фотографий часто показывает изменения во внешнем виде и физических характеристиках тела.
Диагноз бывает трудно поставить, потому что иногда повышение уровня гормонов приходит и уходит: так называемая «циклическая» или «периодическая» болезнь Кушинга.
У беременных беременность может усилить симптомы болезни Кушинга.
Ваш врач проведет тщательный медицинский осмотр и спросит вас о ваших симптомах и истории болезни. В общем, первый шаг в постановке диагноза — это установление состояния избыточного кортизола в крови (т.е. Синдром Кушинга). Если предположить, что потребление кортизола исключено, обычно это делается с помощью гормонального анализа. После установления этого диагноза проводится МРТ, чтобы определить, видна ли опухоль гипофиза.
При болезни Кушинга обычно обнаруживаются очень маленькие (микроаденомы) опухоли. Если опухоль не видна, показан забор пробы нижней каменной пазухи (см. Ниже).
Проверки включают:
Гормональное тестирование
Тестирование на чрезмерный уровень кортизола может быть сложным и трудным. Анализы крови могут не выявить чрезмерной секреции кортизола, потому что уровень кортизола в крови естественным образом меняется в течение дня. Поэтому простое измерение уровня кортизола в крови обычно не является окончательным. Тесты, которые мы закажем, включают:
Анализы крови могут не выявить чрезмерной секреции кортизола, потому что уровень кортизола в крови естественным образом меняется в течение дня. Поэтому простое измерение уровня кортизола в крови обычно не является окончательным. Тесты, которые мы закажем, включают:
- 24-часовое измерение свободного кортизола в моче (UFC)
- Анализ слюны на кортизол
- АКТГ крови
- Если низкий, может указывать на наличие опухоли надпочечников, продуцирующей кортизол
24-часовое измерение свободного кортизола в моче (UFC)
Количество кортизола, обнаруженное в моче, собранной за 24-часовой период, является важным показателем при диагностике синдрома Кушинга.Этот тест суммирует общую суточную выработку кортизола.
- При болезни Кушинга уровень свободного кортизола (UFC) в суточной моче обычно по крайней мере в четыре-пять раз выше нормы.
- Вашему врачу может потребоваться два или более повышенных 24-часовых теста UFC для подтверждения диагноза синдрома Кушинга.

- В редких случаях болезнь Кушинга может приходить и уходить («периодическая болезнь Кушинга»), требуя многократных 24-часовых тестов UFC.
- Вашему врачу может потребоваться два или более повышенных 24-часовых теста UFC для подтверждения диагноза синдрома Кушинга.
Анализ слюны на кортизол
В некоторых случаях эндокринолог может попросить проверить уровень кортизола в слюне.Как и в случае с уровнем кортизола в крови, количество кортизола в слюне в полночь или около нее обычно очень низкое. Многократное повышение уровня кортизола в полуночной слюне может помочь подтвердить диагноз синдрома Кушинга.
Важно не чистить зубы непосредственно перед взятием образца.
Этот тест может быть недействителен для курильщиков.
МРТ
Как только ваш врач заподозрит болезнь Кушинга на основании клинических данных и гормональных тестов, магнитно-резонансная томография (МРТ) гипофиза — лучший способ обнаружить наличие аденомы при болезни Кушинга.
МРТ выявляет аденому гипофиза примерно в 70 процентах случаев. Важно, чтобы вы прошли эти визуализационные тесты в гипофизарном центре, специализирующемся на визуализации небольших опухолей. В программе UCLA по изучению опухолей гипофиза мы используем мощные МРТ-сканеры 3T (Tesla), которые могут повысить шансы на выявление очень маленьких опухолей.
В программе UCLA по изучению опухолей гипофиза мы используем мощные МРТ-сканеры 3T (Tesla), которые могут повысить шансы на выявление очень маленьких опухолей.
В Калифорнийском университете в Лос-Анджелесе наш нейрорадиолог лично наблюдает за МРТ по мере его получения, чтобы выполнить оптимальные последовательности сканирования для обнаружения крошечных опухолей гипофиза, которые нигде не наблюдаются.
Взятие пробы нижней каменной пазухи
В некоторых случаях МРТ не может определить аномалию. Если ваш врач подозревает болезнь Кушинга, он или она может назначить суперселективный отбор пробы нижней каменной пазухи (IPSS).
IPSS
должен выполняться опытным интервенционным нейрорадиологом, потому что он сопряжен с риском и, если его выполнить ненадлежащим образом, может дать ложные результаты.
Нижние каменистые пазухи — это вены, расположенные по обеим сторонам гипофиза.
- Кровь, покидающая правую половину гипофиза, стекает в правую нижнюю каменистую пазуху и наоборот.

- Специально обученные интервенционные нейрорадиологи могут ввести крошечный катетер в нижнюю каменистую пазуху. Затем образцы крови берутся из каждой пазухи и из вены чуть ниже сердца.
Если уровень АКТГ в нижнем каменистом синусе такой же, как и в вене под сердцем, это говорит о том, что опухоль где-то еще в организме (эктопическая, а не гипофизарная) производит АКТГ.
При болезни Кушинга уровень АКТГ в нижней каменной пазухе намного выше по сравнению с веной ниже сердца
Болезнь Кушинга: другие исследования
Если тестирование IPSS недоступно, другие тесты включают тест подавления дексаметазона. Дексаметазон — мощное лекарство, которое действует аналогично, но более мощно, чем кортизол. Этот тип тестирования может указывать на опухоль гипофиза или внематочную опухоль, но не так убедителен, как IPSS.
Узнайте больше о тестировании на гормоны в Программе лечения опухолей гипофиза UCLA.
Болезнь Кушинга: варианты лечения
Для лечения болезни Кушинга требуется опытная команда экспертов. Чтобы добиться наилучшего результата, вам следует обратиться за лечением в больницу, в которой есть специальная программа лечения опухолей гипофиза.
Чтобы добиться наилучшего результата, вам следует обратиться за лечением в больницу, в которой есть специальная программа лечения опухолей гипофиза.
Варианты лечения включают:
Хирургия болезни Кушинга
Хирургическое удаление аденомы гипофиза — единственное долгосрочное лечение болезни Кушинга.
- Когда операцию выполняет опытный хирург-гипофиз, эффективность лечения небольших опухолей (микроаденом) составляет от 80 до 85 процентов.Если опухоль распространилась на близлежащие внутренние структуры, показатель излечения составляет от 50 до 55 процентов.
- Нейрохирурги, специализирующиеся на хирургии опухолей гипофиза, используют методику, при которой опухоль удаляется как единое целое. Они находят опухоль и рассекают ее по краю.
- Эндоскопический эндоназальный доступ — это минимально инвазивный доступ с использованием естественного носового прохода. Разрез головы не требуется. Наши нейрохирурги имеют повышенную подготовку и большой опыт, необходимые для выполнения этой сложной процедуры.

- Эндоскопическая техника может быть очень эффективной для безопасного удаления опухоли, в то же время сводя к минимуму время госпитализации и дискомфорт.
Лечебная терапия болезни Кушинга
Не существует эффективного лекарства, которое снижает выработку АКТГ и уменьшает опухоль гипофиза. Есть лекарства, которые подавляют выработку кортизола надпочечниками. У некоторых пациентов эти препараты могут эффективно уменьшить симптомы, связанные с повышенным уровнем кортизола, когда:
- Операция не позволяет полностью удалить опухоль.
- У очень больного пациента перед операцией необходимо принять лекарство.
Лучевая терапия болезни Кушинга
В некоторых случаях хирурги не могут удалить опухоль хирургическим путем. Лучевая терапия может быть очень эффективной в борьбе с ростом этих опухолей.
Стереотаксическая радиохирургия — это метод, при котором высоко сфокусированное излучение может быть доставлено к опухоли-мишени. Поскольку пучок излучения тщательно продуман, окружающие структуры мозга получают только часть дозы излучения и обычно остаются невредимыми (за исключением нормального гипофиза).
Поскольку пучок излучения тщательно продуман, окружающие структуры мозга получают только часть дозы излучения и обычно остаются невредимыми (за исключением нормального гипофиза).
Последствием лучевой терапии является то, что она может вызвать замедленную гипофизарную недостаточность. Обычно это происходит через несколько лет после лечения, поэтому важно продолжать долгосрочное наблюдение у эндокринолога. Может потребоваться гормональная замена.
Другие варианты лечения
Если опухоль не может быть удалена хирургическим путем и не поддается лечению или облучению, ваш врач может порекомендовать удаление надпочечников (двусторонняя адреналэктомия) или BLA.Если вы проходите BLA:
- После операции вам потребуется замена кортизола на гидрокортизон или преднизон.
- Вы должны носить браслет или ожерелье с медицинским предупреждением.
- Возможен быстрый рост опухоли (синдром Нельсона), поскольку БЛА не влияет на рост опухоли гипофиза.

Болезнь Кушинга: клинические испытания
Программа по гипофизу Калифорнийского университета в Лос-Анджелесе предлагает клинические испытания для лечения болезни Кушинга.
Свяжитесь с нами
Чтобы записаться на прием к одному из наших врачей в программе лечения опухолей гипофиза, позвоните по телефону (310) 825 5111.
Вы также можете написать нам по адресу [email protected]
Обновленная информация о лечении болезни Кушинга | Клинический диабет и эндокринология
Кушинг Х. Базофильные аденомы гипофиза. Ann R Coll Surg Engl. 1969. 44 (4): 180–1.
CAS
PubMed
PubMed Central
Google ученый
Ньюэлл-Прайс Дж., Бертанья Х, Гроссман А.Б., Ниман Л. К. Синдром Кушинга.Ланцет. 2006. 367 (9522): 1605–17. DOI: 10.1016 / S0140-6736 (06) 68699-6.
К. Синдром Кушинга.Ланцет. 2006. 367 (9522): 1605–17. DOI: 10.1016 / S0140-6736 (06) 68699-6.
CAS
PubMed
Статья
Google ученый
Пивонелло Р., Де Мартино М.К., Де Лео М., Ломбарди Дж., Колао А. Синдром Кушинга. Endocrinol Metab Clin North Am. 2008. 37 (1): 135–49. DOI: 10.1016 / j.ecl.2007.10.010. ix.
CAS
PubMed
Статья
Google ученый
Куэвас-Рамос Д., Флезериу М.Лечение болезни Кушинга. Минерва Эндокринол. 2016; 41 (3): 324–40.
PubMed
Google ученый
Lonser RR, Nieman L, Oldfield EH. Болезнь Кушинга: патобиология, диагностика и лечение. J Neurosurg. 2016: 1–14. DOI: 10.3171 / 2016.1.jns152119.
J Neurosurg. 2016: 1–14. DOI: 10.3171 / 2016.1.jns152119.
Arnaldi G, Angeli A, Atkinson AB, Bertagna X, Cavagnini F, Chrousos GP, Fava GA, Findling JW, Gaillard RC, Grossman AB, Kola B, Lacroix A, Mancini T, Mantero F, Newell- Прайс Дж., Ниман Л.К., Сонино Н., Вэнс М.Л., Джустина А., Боскаро М.Диагностика и осложнения синдрома Кушинга: согласованное заявление. J Clin Endocrinol Metab. 2003. 88 (12): 5593–602. DOI: 10.1210 / jc.2003-030871.
CAS
PubMed
Статья
Google ученый
Colao A, Boscaro M, Ferone D, Casanueva FF. Лечение болезни Кушинга: современное состояние. Эндокринная. 2014; 47 (1): 9–20. DOI: 10.1007 / s12020-013-0129-2.
CAS
PubMed
Статья
Google ученый
Бертанья X, Guignat L, Groussin L, Bertherat J. Болезнь Кушинга. Лучшая практика Res Clin Endocrinol Metab. 2009. 23 (5): 607–23. DOI: 10.1016 / j.beem.2009.06.001.
CAS
PubMed
Статья
Google ученый
Lamberts SW, de Lange SA, Stefanko SZ. Адренокортикотропин-секретирующие аденомы гипофиза происходят из передней или промежуточной доли при болезни Кушинга: различия в регуляции секреции гормонов.J Clin Endocrinol Metab. 1982; 54 (2): 286–91. DOI: 10.1210 / jcem-54-2-286.
CAS
PubMed
Статья
Google ученый
Ниман Л.К., Биллер Б.М., Финдлинг Дж.В., Мурад М.Х., Ньюэлл-Прайс Дж., Сэвидж М.О., Табарин А. Лечение синдрома Кушинга: руководство по клинической практике эндокринного общества. J Clin Endocrinol Metab. 2015; 100 (8): 2807–31. DOI: 10.1210 / jc.2015-1818.
J Clin Endocrinol Metab. 2015; 100 (8): 2807–31. DOI: 10.1210 / jc.2015-1818.
CAS
PubMed
PubMed Central
Статья
Google ученый
Biller BM, Grossman AB, Stewart PM, Melmed S, Bertagna X, Bertherat J, Buchfelder M, Colao A, Hermus AR, Hofland LJ, Klibanski A, Lacroix A, Lindsay JR, Newell-Price J, Nieman LK, Petersenn S , Сонино Н., Сталла Г.К., Свиринген Б., Вэнс М.Л., Васс Дж.А., Боскаро М. Лечение адренокортикотропин-зависимого синдрома Кушинга: утверждение консенсуса. J Clin Endocrinol Metab. 2008. 93 (7): 2454–62. DOI: 10.1210 / jc.2007-2734.
CAS
PubMed
PubMed Central
Статья
Google ученый
Valassi E, Biller BM, Swearingen B, Pecori Giraldi F, Losa M, Mortini P, Hayden D, Cavagnini F, Klibanski A. Отсроченная ремиссия после транссфеноидальной хирургии у пациентов с болезнью Кушинга. J Clin Endocrinol Metab. 2010. 95 (2): 601–10. DOI: 10.1210 / jc.2009-1672.
Отсроченная ремиссия после транссфеноидальной хирургии у пациентов с болезнью Кушинга. J Clin Endocrinol Metab. 2010. 95 (2): 601–10. DOI: 10.1210 / jc.2009-1672.
CAS
PubMed
PubMed Central
Статья
Google ученый
Тритос Н.А., Биллер Б.М., Свиринген Б. Лечение болезни Кушинга. Nat Rev Endocrinol.2011; 7 (5): 279–89. DOI: 10.1038 / nrendo.2011.12.
CAS
PubMed
Статья
Google ученый
Пивонелло Р., Де Лео М., Коццолино А., Колао А. Лечение болезни Кушинга. Endocr Rev.2015; 36 (4): 385–486. DOI: 10.1210 / er.2013-1048.
CAS
PubMed
PubMed Central
Статья
Google ученый
Флезериу М., Петерсенн С. Медицинское лечение болезни Кушинга: каково будущее? Гипофиз.2012. 15 (3): 330–41. DOI: 10.1007 / s11102-012-0397-5.
CAS
PubMed
PubMed Central
Статья
Google ученый
Fleseriu M, Loriaux DL, Ludlam WH. Лечение второй линии болезни Иценко-Кушинга, когда начальная операция на гипофизе безуспешна. Curr Opin Endocrinol Diabetes Obes. 2007. 14 (4): 323–8. DOI: 10.1097 / MED.0b013e328248b498.
PubMed
Статья
Google ученый
van den Bosch OF, Stades AM, Zelissen PM. Повышенная длительная ремиссия после адекватной медикаментозной терапии для подавления кортизола в качестве дооперационного лечения болезни Кушинга. Клин Эндокринол (Oxf). 2014; 80 (2): 184–90. DOI: 10,1111 / с.12286.
Клин Эндокринол (Oxf). 2014; 80 (2): 184–90. DOI: 10,1111 / с.12286.
Артикул
CAS
Google ученый
Lacroix A, Feelders RA, Stratakis CA, Nieman LK. Синдром Кушинга. Ланцет. 2015; 386 (9996): 913–27. DOI: 10,1016 / s0140-6736 (14) 61375-1.
CAS
PubMed
Статья
Google ученый
Александраки К.И., Гроссман А.Б. Терапевтические стратегии лечения тяжелого синдрома Кушинга. Наркотики. 2016; 76 (4): 447–58. DOI: 10.1007 / s40265-016-0539-6.
CAS
PubMed
Статья
Google ученый
Тритос Н.А., Биллер Б.М. Обновленная информация о лучевой терапии у пациентов с болезнью Кушинга. Гипофиз. 2015; 18 (2): 263–8. DOI: 10.1007 / s11102-014-0615-4.
Гипофиз. 2015; 18 (2): 263–8. DOI: 10.1007 / s11102-014-0615-4.
CAS
PubMed
Статья
Google ученый
Куэвас-Рамос Д., Флесериу М. Лечение болезни Кушинга: механистическое обновление. J Endocrinol. 2014; 223 (2): R19–39. DOI: 10.1530 / joe-14-0300.
CAS
PubMed
Статья
Google ученый
Флезериу М., Петерсенн С. Медикаментозная терапия болезни Кушинга: ингибиторы стероидогенеза надпочечников и блокаторы глюкокортикоидных рецепторов. Гипофиз. 2015; 18 (2): 245–52. DOI: 10.1007 / s11102-014-0627-0.
CAS
PubMed
Статья
Google ученый
Дэниел Э., Ньюэлл-Прайс Дж. Д. Терапия эндокринных заболеваний: ингибиторы ферментов стероидогенеза при синдроме Кушинга. Eur J Endocrinol. 2015; 172 (6): R263–80. DOI: 10.1530 / eje-14-1014.
CAS
PubMed
Статья
Google ученый
Feelders RA, Hofland LJ. Лечение болезни Кушинга. J Clin Endocrinol Metab. 2013. 98 (2): 425–38. DOI: 10.1210 / jc.2012-3126.
CAS
PubMed
Статья
Google ученый
Loose DS, Kan PB, Hirst MA, Marcus RA, Feldman D. Кетоконазол блокирует стероидогенез надпочечников, ингибируя цитохром P450-зависимые ферменты. J Clin Invest. 1983; 71 (5): 1495–149.
CAS
PubMed
PubMed Central
Статья
Google ученый
Сталла Г.К., Сталла Дж., Хубер М., Лёффлер Дж. П., Холлт В., фон Вердер К., Мюллер О.А. Кетоконазол подавляет функцию кортикотропных клеток in vitro. Эндокринология. 1988. 122 (2): 618–23.DOI: 10.1210 / эндо-122-2-618.
CAS
PubMed
Статья
Google ученый
Castinetti F, Guignat L, Giraud P, Muller M, Kamenicky P, Drui D, Caron P, Luca F, Donadille B, Vantyghem MC, Bihan H, Delemer B, Raverot G, Motte E, Philippon M , Morange I, Conte-Devolx B, Quinquis L, Martinie M, Vezzosi D, Le Bras M, Baudry C, Christin-Maitre S, Goichot B, Chanson P, Young J, Chabre O, Tabarin A, Bertherat J, Brue T Кетоконазол при болезни Кушинга: стоит ли попробовать? J Clin Endocrinol Metab.2014; 99 (5): 1623–30. DOI: 10.1210 / jc.2013-3628.
CAS
PubMed
Статья
Google ученый
van der Pas R, Hofland LJ, Hofland J, Taylor AE, Arlt W, Steenbergen J, van Koetsveld PM, de Herder WW, de Jong FH, Feelders RA. Флуконазол подавляет стероидогенез надпочечников у человека in vitro. J Endocrinol. 2012. 215 (3): 403–12. DOI: 10.1530 / joe-12-0310.
PubMed
Статья
CAS
Google ученый
Riedl M, Maier C, Zettinig G, Nowotny P, Schima W, Luger A. Долгосрочный контроль гиперкортизолизма с помощью флуконазола: клинический случай и исследования in vitro. Eur J Endocrinol. 2006. 154 (4): 519–24. DOI: 10.1530 / eje.1.02120.
CAS
PubMed
Статья
Google ученый
Валасси Э., Креспо И., Гич И., Родригес Дж., Уэбб С.М. Пересмотр медикаментозной терапии ингибиторами стероидогенеза при синдроме Кушинга. Клин Эндокринол (Oxf).2012; 77 (5): 735–42. DOI: 10.1111 / j.1365-2265.2012.04424.x.
Клин Эндокринол (Oxf).2012; 77 (5): 735–42. DOI: 10.1111 / j.1365-2265.2012.04424.x.
CAS
Статья
Google ученый
Verhelst JA, Trainer PJ, Howlett TA, Perry L, Rees LH, Grossman AB, Wass JA, Besser GM. Краткосрочные и долгосрочные ответы на метирапон при лечении 91 пациента с синдромом Кушинга. Клин Эндокринол (Oxf). 1991. 35 (2): 169–78.
CAS
Статья
Google ученый
Дэниэл Э, Эйлвин С., Мустафа О, Болл С., Мунир А., Боэларт К., Хортис В., Катбертсон Д. Д., Дауси С., Раджив С. П., Дэвис Дж., Приветствие К., Дрейк В., Гунгана К., Гроссман А., Гурнелл М. AS, Karavitaki N, Huguet I, Kearney T., Mohit K, Meeran K, Hill N, Rees A, Lansdown AJ, Trainer PJ, Minder AE, Newell-Price J. Эффективность метирапона при лечении синдрома Кушинга: ретроспективное многоцентровое исследование в 195 пациентов. J Clin Endocrinol Metab. 2015; 100 (11): 4146–54. DOI: 10.1210 / jc.2015-2616.
Эффективность метирапона при лечении синдрома Кушинга: ретроспективное многоцентровое исследование в 195 пациентов. J Clin Endocrinol Metab. 2015; 100 (11): 4146–54. DOI: 10.1210 / jc.2015-2616.
CAS
PubMed
Статья
Google ученый
Corcuff JB, Young J, Masquefa-Giraud P, Chanson P, Baudin E, Tabarin A. Быстрый контроль тяжелого неопластического гиперкортизолизма с помощью метирапона и кетоконазола. Eur J Endocrinol. 2015; 172 (4): 473–81. DOI: 10.1530 / EJE-14-0913.
CAS
PubMed
Статья
Google ученый
Трэйна А.Н., Фарр А., Малик Р., Бингхэм Р.Дж. Метирапон для длительного лечения синдрома Кушинга. Case Rep Endocrinol. 2013; 2013: 782068.DOI: 10,1155 / 2013/782068.
PubMed
PubMed Central
Google ученый
Ламберт А., Митчелл Р., Фрост Дж., Рэтклифф Дж. Г., Робертсон В. Р.. Прямое ингибирование in vitro стероидогенеза надпочечников с помощью этогоидата. Ланцет. 1983; 2 (8358): 1085–6.
CAS
PubMed
Статья
Google ученый
Heyn J, Geiger C, Hinske CL, Briegel J, Weis F. Медицинское подавление гиперкортизолемии при синдроме Кушинга с особым вниманием к этомуидату.Гипофиз. 2012. 15 (2): 117–25. DOI: 10.1007 / s11102-011-0314-3.
CAS
PubMed
Статья
Google ученый
Schulte HM, Benker G, Reinwein D, Sippell WG, Allolio B. Инфузия этогоидата в низких дозах: коррекция гиперкортизолемии у пациентов с синдромом Кушинга и зависимость доза-реакция у здоровых субъектов. J Clin Endocrinol Metab. 1990; 70 (5): 1426–30. DOI: 10.1210 / jcem-70-5-1426.
Инфузия этогоидата в низких дозах: коррекция гиперкортизолемии у пациентов с синдромом Кушинга и зависимость доза-реакция у здоровых субъектов. J Clin Endocrinol Metab. 1990; 70 (5): 1426–30. DOI: 10.1210 / jcem-70-5-1426.
CAS
PubMed
Статья
Google ученый
Greening JE, Brain CE, Perry LA, Mushtaq I, Sales Marques J, Grossman AB, Savage MO. Эффективный краткосрочный контроль гиперкортизолемии низкими дозами томидата при тяжелой детской болезни Кушинга. Horm Res. 2005. 64 (3): 140–3. DOI: 10,1159 / 000088587.
CAS
PubMed
Статья
Google ученый
Дрейк В.М., Перри Л.А., Хайндс С.Дж., Лоу Д.Г., Резнек Р.Х., Бессер Г.М. Экстренное и длительное применение этомидата внутривенно для контроля гиперкортизолемии у пациента с синдромом Кушинга и перитонитом. J Clin Endocrinol Metab. 1998. 83 (10): 3542–4. DOI: 10.1210 / jcem.83.10.5156.
J Clin Endocrinol Metab. 1998. 83 (10): 3542–4. DOI: 10.1210 / jcem.83.10.5156.
CAS
PubMed
Google ученый
Сох Л.М., Гунгана К., Аккер С.А., Джонс П., Хачи Х., Додзо К., Дрейк В.М. Этомидат в неотложной помощи при гиперкортизолемии. Eur J Endocrinol. 2012. 167 (5): 727–8. DOI: 10.1530 / EJE-12-0698. ответ автора 729.
CAS
PubMed
Статья
Google ученый
Преда В.А., Сен Дж., Каравитаки Н., Гроссман А.Б. Этомидат в лечении гиперкортизолемии при синдроме Кушинга: обзор. Eur J Endocrinol. 2012. 167 (2): 137–43. DOI: 10.1530 / EJE-12-0274.
CAS
PubMed
Google ученый
Zarnecki KG, Kelly N, Peppard W, Herrmann D, Findling JW. Непрерывная инфузия этомидата для лечения тяжелого гиперкортизолизма при АКТГ-зависимом синдроме Кушинга: серия случаев.96-е ежегодное собрание и выставка эндокринного общества. Чикаго: 2014. SAT-0819.
van Erp NP, Guchelaar HJ, Ploeger BA, Romijn JA, Hartigh J, Gelderblom H. Митотан оказывает сильное и стойкое индуцирующее действие на активность CYP3A4. Eur J Endocrinol. 2011. 164 (4): 621–6. DOI: 10.1530 / EJE-10-0956.
PubMed
Статья
CAS
Google ученый
Baudry C, Coste J, Bou Khalil R, Silvera S, Guignat L, Guibourdenche J, Abbas H, Legmann P, Bertagna X, Bertherat J.Эффективность и переносимость митотана при болезни Кушинга у 76 пациентов из одного центра. Eur J Endocrinol. 2012. 167 (4): 473–81. DOI: 10.1530 / EJE-12-0358.
Eur J Endocrinol. 2012. 167 (4): 473–81. DOI: 10.1530 / EJE-12-0358.
CAS
PubMed
Статья
Google ученый
Робинсон Б.Г., Хейлз И.Б., Хенникер А.Дж., Хо К., Латтрелл Б.М., Сми И.Р., Стил Дж. Влияние o, p’-DDD на потребность в заместительной терапии надпочечниками. Клин Эндокринол (Oxf). 1987. 27 (4): 437–44.
CAS
Статья
Google ученый
Стефанеану Л., Ковач К., Хорват Э., Бухфельдер М., Фальбуш Р., Ланкранджан Л. Экспрессия гена рецептора допамина D2 в аденогипофизарных аденомах человека. Эндокринная. 2001. 14 (3): 329–36.
CAS
PubMed
Статья
Google ученый
Фероне Д., Пивонелло С., Витале Г., Зателли М.К., Колао А., Пивонелло Р. Молекулярные основы фармакологической терапии при болезни Кушинга. Эндокринная. 2014; 46 (2): 181–98. DOI: 10.1007 / s12020-013-0098-5.
CAS
PubMed
Статья
Google ученый
Pivonello R, Ferone D, de Herder WW, Kros JM, De Caro ML, Arvigo M, Annunziato L, Lombardi G, Colao A, Hofland LJ, Lamberts SW. Экспрессия и функция дофаминовых рецепторов в кортикотрофных опухолях гипофиза. J Clin Endocrinol Metab. 2004. 89 (5): 2452–62. DOI: 10.1210 / jc.2003-030837.
CAS
PubMed
Статья
Google ученый
Godbout A, Manavela M, Danilowicz K, Beauregard H, Bruno OD, Lacroix A. Монотерапия каберголином в долгосрочном лечении болезни Кушинга. Eur J Endocrinol. 2010. 163 (5): 709–16. DOI: 10.1530 / eje-10-0382.
Монотерапия каберголином в долгосрочном лечении болезни Кушинга. Eur J Endocrinol. 2010. 163 (5): 709–16. DOI: 10.1530 / eje-10-0382.
CAS
PubMed
Статья
Google ученый
Pivonello R, De Martino MC, Cappabianca P, De Leo M, Faggiano A, Lombardi G, Hofland LJ, Lamberts SW, Colao A. Медицинское лечение болезни Кушинга: эффективность хронического лечения агонистом дофамина каберголин у пациентов, безуспешно пролеченных хирургическим путем.J Clin Endocrinol Metab. 2009. 94 (1): 223–30. DOI: 10.1210 / jc.2008-1533.
CAS
PubMed
Статья
Google ученый
Vilar L, Naves LA, Azevedo MF, Arruda MJ, Arahata CM, Moura ESL, Agra R, Pontes L, Montenegro L, Albuquerque JL, Canadas V. Эффективность каберголина в монотерапии и в сочетании с кетоконазолом в лечение болезни Кушинга. Гипофиз. 2010. 13 (2): 123–9. DOI: 10.1007 / s11102-009-0209-8.
Эффективность каберголина в монотерапии и в сочетании с кетоконазолом в лечение болезни Кушинга. Гипофиз. 2010. 13 (2): 123–9. DOI: 10.1007 / s11102-009-0209-8.
CAS
PubMed
Статья
Google ученый
Burman P, Eden-Engstrom B, Ekman B, Karlsson FA, Schwarcz E, Wahlberg J. Ограниченное значение каберголина при болезни Кушинга: проспективное исследование 6-недельного лечения у 20 пациентов. Eur J Endocrinol. 2016; 174 (1): 17–24. DOI: 10.1530 / eje-15-0807.
CAS
PubMed
Статья
Google ученый
Auriemma RS, Pivonello R, Ferreri L, Priscitelli P, Colao A. Каберголин используется при опухолях гипофиза и клапанных нарушениях.Endocrinol Metab Clin North Am. 2015; 44 (1): 89–97. DOI: 10.1016 / j.ecl.2014.10.007.
DOI: 10.1016 / j.ecl.2014.10.007.
PubMed
Статья
Google ученый
van der Hoek J, Waaijers M, van Koetsveld PM, Sprij-Mooij D, Feelders RA, Schmid HA, Schoeffter P, Hoyer D, Cervia D, Taylor JE, Culler MD, Lamberts SW, Hofland LJ. Отличительные функциональные свойства нативного рецептора соматостатина подтипа 5 по сравнению с подтипом 2 в регуляции высвобождения АКТГ кортикотрофными опухолевыми клетками.Am J Physiol Endocrinol Metab. 2005; 289 (2): E278–87. DOI: 10.1152 / ajpendo.00004.2005.
PubMed
Статья
CAS
Google ученый
Nielsen S, Mellemkjaer S, Rasmussen LM, Ledet T, Olsen N, Bojsen-Moller M, Astrup J, Weeke J, Jorgensen JO. Экспрессия рецепторов соматостатина на аденомах гипофиза человека in vivo и ex vivo. J Endocrinol Invest. 2001. 24 (6): 430–7. DOI: 10.1007 / BF03351043.
J Endocrinol Invest. 2001. 24 (6): 430–7. DOI: 10.1007 / BF03351043.
CAS
PubMed
Статья
Google ученый
Куэвас-Рамос Д., Флезериу М. Лиганды рецептора соматостатина и устойчивость к лечению при аденомах гипофиза. J Mol Endocrinol. 2014; 52 (3): R223–40. DOI: 10.1530 / JME-14-0011.
CAS
PubMed
Статья
Google ученый
Сталла Г.К., Брокмайер С.Дж., Реннер Ю., Ньютон К., Бухфельдер М., Сталла Дж., Мюллер О.А. Октреотид оказывает различные эффекты in vivo и in vitro при болезни Кушинга. Eur J Endocrinol. 1994. 130 (2): 125–31.
CAS
PubMed
Статья
Google ученый
van der Pas R, Feelders RA, Gatto F, de Bruin C, Pereira AM, van Koetsveld PM, Sprij-Mooij DM, Waaijers AM, Dogan F, Schulz S, Kros JM, Lamberts SW, Hofland LJ . Предоперационная нормализация уровня кортизола при болезни Кушинга после лечения: последствия для экспрессии подтипа рецепторов соматостатина и допамина и реакции in vitro на аналоги соматостатина и агонисты дофамина.J Clin Endocrinol Metab. 2013; 98 (12): E1880–90. DOI: 10.1210 / jc.2013-1987.
PubMed
Статья
CAS
Google ученый
Boscaro M, Ludlam WH, Atkinson B, Glusman JE, Petersenn S, Reincke M, Snyder P, Tabarin A, Biller BM, Findling J, Melmed S, Darby CH, Hu K, Wang Y, Freda PU , Гроссман А.Б., Фроман Л.А., Бертерат Дж. Лечение гипофизарно-зависимой болезни Кушинга с помощью мультирецепторного лиганда аналога соматостатина пасиреотида (SOM230): многоцентровое исследование фазы II. J Clin Endocrinol Metab. 2009. 94 (1): 115–22. DOI: 10.1210 / jc.2008-1008.
J Clin Endocrinol Metab. 2009. 94 (1): 115–22. DOI: 10.1210 / jc.2008-1008.
CAS
PubMed
Статья
Google ученый
Колао А., Петерсенн С., Ньюэлл-Прайс Дж., Финдлинг Дж. В., Гу Ф., Мальдонадо М., Шонхерр Ю., Миллс Д., Сальгадо Л. Р., Биллер Б. М., Пасиреотид Б.С.Г. 12-месячное исследование фазы 3 пасиреотида при болезни Кушинга. N Engl J Med. 2012; 366 (10): 914–24. DOI: 10.1056 / NEJMoa1105743.
CAS
PubMed
Статья
Google ученый
Findling JW, Fleseriu M, Newell-Price J, Petersenn S, Pivonello R, Kandra A, Pedroncelli AM, Biller BM. Кортизол в слюне поздно вечером может быть ценным для оценки ответа на лечение у пациентов с болезнью Кушинга: 12-месячное исследование пасиреотида III фазы.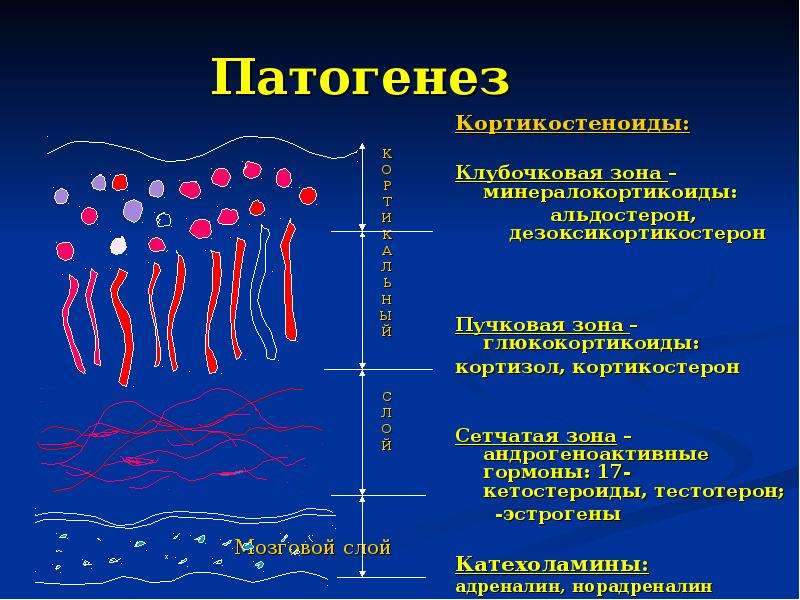 Эндокринная. 2016. DOI: 10.1007 / s12020-016-0978-6.
Эндокринная. 2016. DOI: 10.1007 / s12020-016-0978-6.
PubMed
Google ученый
Пивонелло Р., Петерсенн С., Ньюэлл-Прайс Дж., Финдлинг Дж. В., Гу Ф., Мальдонадо М., Тровато А., Хьюз Г., Салгадо Л. Р., Лакруа А., Шополь Дж., Биллер Б. М..Лечение пасиреотидом значительно улучшает клинические признаки и симптомы у пациентов с болезнью Кушинга: результаты исследования фазы III. Клин Эндокринол (Oxf). 2014. 81 (3): 408–17. DOI: 10,1111 / сенз.12431.
CAS
Статья
Google ученый
Geer EB, Stalla GK, Mazzuco TL, et al. Промежуточный анализ текущего международного исследования с расширенным доступом для оценки безопасности и эффективности пазиреотида SC у пациентов с болезнью Кушинга. Заболевания гипофиза — синдром Кушинга (плакаты). Бостон: 2016. SAT-556.
Заболевания гипофиза — синдром Кушинга (плакаты). Бостон: 2016. SAT-556.
Schopohl J, Gu F, Rubens R, Van Gaal L, Bertherat J, Ligueros-Saylan M, Trovato A, Hughes G, Salgado LR, Boscaro M, Pivonello R. Пасиреотид может вызывать устойчивое снижение уровня кортизола в моче. и обеспечить клиническую пользу у пациентов с болезнью Кушинга: результаты открытого открытого расширенного исследования. Гипофиз. 2015; 18 (5): 604–12. DOI: 10.1007 / s11102-014-0618-1.
CAS
PubMed
Статья
Google ученый
Trementino L, Cardinaletti M, Concettoni C, Marcelli G, Boscaro M, Arnaldi G. Эффективность пасиреотида до 5 лет у пациента с болезнью Кушинга и ранее существовавшим диабетом: обзор литературы и соображения клинической практики. Гипофиз. 2015; 18 (3): 359–65. DOI: 10.1007 / s11102-014-0582-9.
Гипофиз. 2015; 18 (3): 359–65. DOI: 10.1007 / s11102-014-0582-9.
PubMed
Статья
Google ученый
MacKenzie Feder J, Bourdeau I, Vallette S, Beauregard H, Ste-Marie LG, Lacroix A.Монотерапия пасиреотидом при болезни Кушинга: одноцентровый опыт с 5-летним продлением фазы III исследования. Гипофиз. 2014. 17 (6): 519–29. DOI: 10.1007 / s11102-013-0539-4.
CAS
PubMed
Статья
Google ученый
Петерсенн С., Салгадо Л.Р., Шополь Дж. И др. Пасиреотид поддерживал снижение уровня свободного кортизола в моче и улучшение клинических признаков у пациентов с болезнью Кушинга, получающих лечение в течение 60 месяцев.Заболевания гипофиза — это не передний гипофиз (плакаты). Бостон: 2016. SAT-548.
SAT-548.
Simeoli C, Auriemma RS, Tortora F, De Leo M, Iacuaniello D, Cozzolino A, De Martino MC, Pivonello C, Mainolfi CG, Rossi R, Cirillo S, Colao A, Pivonello R. пасиреотид при болезни Кушинга: влияние длительного лечения на массу опухоли в опыте одного центра. Эндокринная. 2015; 50 (3): 725–40. DOI: 10.1007 / s12020-015-0557-2.
CAS
PubMed
Статья
Google ученый
Шимон И., Рот Л., Инбар Э. Гипофизарно-направленная лечебная терапия с пасиреотидом для кортикотрофной макроаденомы: уменьшение объема гипофиза и обзор литературы. Гипофиз. 2012. 15 (4): 608–13. DOI: 10.1007 / s11102-012-0427-3.
CAS
PubMed
Статья
Google ученый
Ceccato F, Scaroni C, Boscaro M. Клиническое использование пасиреотида при болезни Кушинга у взрослых. Ther Clin Risk Manag. 2015; 11: 425–34. DOI: 10.2147 / tcrm.s37314.
CAS
PubMed
PubMed Central
Google ученый
Генри Р.Р., Чиаральди Т.П., Армстронг Д., Берк П., Лигуэрос-Сайлан М., Мудалиар С. Гипергликемия, связанная с пасиреотидом: результаты механистического исследования на здоровых добровольцах. J Clin Endocrinol Metab. 2013. 98 (8): 3446–53. DOI: 10.1210 / jc.2013-1771.
CAS
PubMed
Статья
Google ученый
Reznik Y, Bertherat J, Borson-Chazot F, Brue T., Chanson P, Cortet-Rudelli C, Delemer B, Tabarin A, Bisot-Locard S, Verges B. Управление гипергликемией при болезни Кушинга: предложения экспертов по использованию пасиреотида. Метаб. Диабета. 2013. 39 (1): 34–41. DOI: 10.1016 / j.diabet.2012.10.005.
Управление гипергликемией при болезни Кушинга: предложения экспертов по использованию пасиреотида. Метаб. Диабета. 2013. 39 (1): 34–41. DOI: 10.1016 / j.diabet.2012.10.005.
CAS
PubMed
Статья
Google ученый
Breitschaft A, Hu K, Hermosillo Resendiz K, Darstein C, Golor G. Управление гипергликемией, связанной с пасиреотидом (SOM230): исследование здоровых добровольцев.Диабет Res Clin Pract. 2014. 103 (3): 458–65. DOI: 10.1016 / j.diabres.2013.12.011.
CAS
PubMed
Статья
Google ученый
Colao A, De Block C, Gaztambide MS, Kumar S, Seufert J, Casanueva FF. Управление гипергликемией у пациентов с болезнью Кушинга, получавших пасиреотид: рекомендации медицинских экспертов./185/185.jpg) Гипофиз. 2014. 17 (2): 180–6. DOI: 10.1007 / s11102-013-0483-3.
Гипофиз. 2014. 17 (2): 180–6. DOI: 10.1007 / s11102-013-0483-3.
CAS
PubMed
Статья
Google ученый
Katznelson L. Устойчивое улучшение уровня АКТГ в плазме и клинического статуса у пациента с синдромом Нельсона, получавшего пасиреотид LAR, мультирецепторный аналог соматостатина. J Clin Endocrinol Metab. 2013; 98 (5): 1803–1807. DOI: 10.1210 / jc.2013-1497.
CAS
PubMed
Статья
Google ученый
Лакруа А., Петерсенн С., Биллер БМК и др. Ежемесячный пасиреотид LAR улучшает свободный кортизол в моче (UFC) у пациентов с болезнью Кушинга: результаты рандомизированного двойного слепого многоцентрового исследования фазы III.Заболевания гипофиза — это не передний гипофиз (плакаты).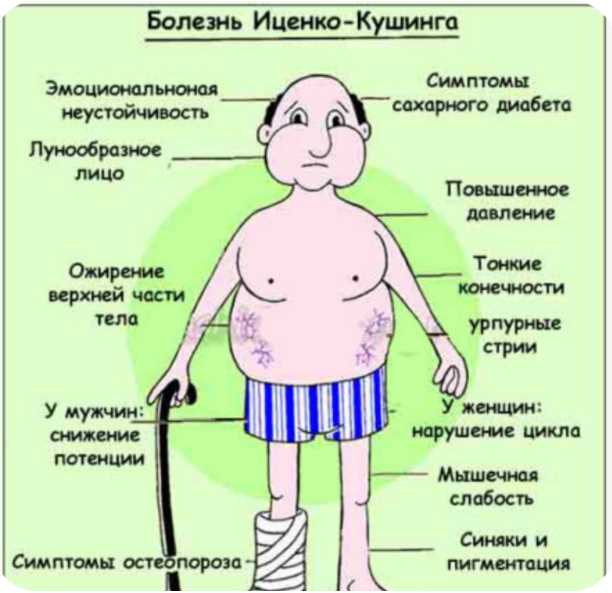 Бостон: 2016. SAT-546.
Бостон: 2016. SAT-546.
Сонино Н., Фава Г.А., Фалло Ф., Франческетто А., Беллуардо П., Боскаро М. Влияние антагонистов серотонина, ритансерина и кетансерина, на болезнь Кушинга. Гипофиз. 2000. 3 (2): 55–9.
CAS
PubMed
Статья
Google ученый
Nieman LK. Последние сведения о медицинской терапии болезни Кушинга. Curr Opin Endocrinol Diabetes Obes.2013. 20 (4): 330–4. DOI: 10.1097 / MED.0b013e3283631809.
CAS
PubMed
PubMed Central
Google ученый
Ambrosi B, Dall’Asta C, Cannavo S, Libe R, Vigo T, Epaminonda P, Chiodini I, Ferrero S, Trimarchi F, Arosio M, Beck-Peccoz P. Эффекты хронического приема PPAR- гамма-лиганд росиглитазон при болезни Кушинга. Eur J Endocrinol. 2004. 151 (2): 173–8.
Эффекты хронического приема PPAR- гамма-лиганд росиглитазон при болезни Кушинга. Eur J Endocrinol. 2004. 151 (2): 173–8.
CAS
PubMed
Статья
Google ученый
Morcos M, Fohr B, Tafel J, Pfisterer F, Hamann A, Humpert P, Bode H, Schwenger V, Zeier M, Becker C, Kasperk C, Schilling T, Hammes HP, Bierhaus A, Nawroth PP. Длительное лечение синдрома центрального Кушинга розиглитазоном. Exp Clin Endocrinol Diabetes. 2007. 115 (5): 292–7. DOI: 10,1055 / с-2007-970162.
CAS
PubMed
Статья
Google ученый
Pecori Giraldi F, Scaroni C, Arvat E, Martin M, Giordano R, Albiger N, Leao AA, Picu A, Mantero F, Cavagnini F.Эффект длительного лечения росиглитазоном, агонистом PPARgamma, у пациентов с болезнью Кушинга. Клин Эндокринол (Oxf). 2006. 64 (2): 219–24. DOI: 10.1111 / j.1365-2265.2006.02452.x.
Клин Эндокринол (Oxf). 2006. 64 (2): 219–24. DOI: 10.1111 / j.1365-2265.2006.02452.x.
Артикул
CAS
Google ученый
Bertagna X, Bertagna C, Luton JP, Husson JM, Girard F. Новый аналог стероида RU 486 подавляет действие глюкокортикоидов у человека. J Clin Endocrinol Metab. 1984. 59 (1): 25–8. DOI: 10.1210 / jcem-59-1-25.
CAS
PubMed
Статья
Google ученый
Johanssen S, Allolio B. Мифепристон (RU 486) при синдроме Кушинга. Eur J Endocrinol. 2007. 157 (5): 561–9. DOI: 10.1530 / EJE-07-0458.
CAS
PubMed
Статья
Google ученый

Fleseriu M, Biller BM, Findling JW, Molitch ME, Schteingart DE, Gross C. Мифепристон, антагонист рецепторов глюкокортикоидов, оказывает клинические и метаболические преимущества у пациентов с синдромом Кушинга. J Clin Endocrinol Metab. 2012. 97 (6): 2039–49.DOI: 10.1210 / jc.2011-3350.
CAS
PubMed
Статья
Google ученый
Bertagna X, Bertagna C, Laudat MH, Husson JM, Girard F, Luton JP. Гипофизарно-надпочечниковый ответ на антиглюкокортикоидное действие RU 486 при синдроме Кушинга. J Clin Endocrinol Metab. 1986. 63 (3): 639–43. DOI: 10.1210 / jcem-63-3-639.
CAS
PubMed
Статья
Google ученый
Castinetti F, Conte-Devolx B, Brue T. Медикаментозное лечение синдрома Кушинга: антагонисты глюкокортикоидных рецепторов и мифепристон. Нейроэндокринология. 2010; 92 Приложение 1: 125–30. DOI: 10,1159 / 000314224.
Нейроэндокринология. 2010; 92 Приложение 1: 125–30. DOI: 10,1159 / 000314224.
CAS
PubMed
Статья
Google ученый
van der Lely AJ, Foeken K, van der Mast RC, Lamberts SW. Быстрое купирование острого психоза при синдроме Кушинга с помощью антагониста кортизоловых рецепторов мифепристона (RU 486).Ann Intern Med. 1991. 114 (2): 143–4.
PubMed
Статья
Google ученый
Кармайкл Дж. Д., Флезериу М. Мифепристон: есть ли место в лечении болезни Кушинга? Эндокринная. 2013; 44 (1): 20–32. DOI: 10.1007 / s12020-012-9846-1.
CAS
PubMed
Статья
Google ученый
Castinetti F, Fassnacht M, Johanssen S, Terzolo M, Bouchard P, Chanson P, Do Cao C, Morange I, Pico A, Ouzounian S, Young J, Hahner S, Brue T, Allolio B, Conte -Деволкс Б.Достоинства и недостатки мифепристона при синдроме Кушинга. Eur J Endocrinol. 2009. 160 (6): 1003–10. DOI: 10.1530 / EJE-09-0098.
CAS
PubMed
Статья
Google ученый
Кацнельсон Л., Лорио Д.Л., Фельдман Д., Браунштейн Г.Д., Штейнгарт Д.Э., Гросс С. Глобальный клинический ответ у пациентов с синдромом Кушинга, получавших мифепристон. Клин Эндокринол (Oxf). 2014; 80 (4): 562–9. DOI: 10,1111 / сенз.12332.
CAS
Статья
Google ученый
Fleseriu M, Findling JW, Koch CA, Schlaffer SM, Buchfelder M, Gross C. Изменения уровней АКТГ в плазме и размера кортикотрофной опухоли у пациентов с болезнью Кушинга во время длительного лечения мифепристоном, антагонистом глюкокортикоидных рецепторов. J Clin Endocrinol Metab. 2014. 99 (10): 3718–27. DOI: 10.1210 / jc.2014-1843.
CAS
PubMed
PubMed Central
Статья
Google ученый
Fein HG, Vaughan 3rd TB, Kushner H, Cram D, Nguyen D.Устойчивое снижение веса у пациентов, получавших мифепристон от синдрома Кушинга: последующий анализ исследования SEISMIC и долгосрочное продление. BMC Endocr Disord. 2015; 15:63. DOI: 10.1186 / s12902-015-0059-5.
PubMed
PubMed Central
Статья
CAS
Google ученый
Raux-Demay MC, Pierret T., Bouvier d’Yvoire M, Bertagna X, Girard F. Временное ингибирование антиглюкокортикоидного действия RU 486 дексаметазоном.J Clin Endocrinol Metab. 1990. 70 (1): 230–3. DOI: 10.1210 / jcem-70-1-230.
CAS
PubMed
Статья
Google ученый
Fleseriu M, Molitch ME, Gross C, Schteingart DE, Vaughan 3rd TB, Biller BM. Новый терапевтический подход к лечению синдрома Кушинга: блокада глюкокортикоидных рецепторов мифепристоном. Endocr Pract. 2013. 19 (2): 313–26. DOI: 10.4158 / EP12149.RA.
PubMed
Статья
Google ученый
Леви Дж., Элкас Дж., Армстронг А.Ю., Неман Л.К. Эндометриальные эффекты длительной терапии селективным модулятором рецепторов прогестерона улипристала ацетатом: клинический случай. J Reprod Med. 2016; 61: 159–62.
PubMed
Google ученый
Kamenicky P, Droumaguet C, Salenave S, Blanchard A, Jublanc C, Gautier JF, Brailly-Tabard S, Leboulleux S, Schlumberger M, Baudin E, Chanson P, Young J. Mitotane, метирапазол и кетоконазол Комбинированная терапия как альтернатива спасательной адреналэктомии при тяжелом АКТГ-зависимом синдроме Кушинга.J Clin Endocrinol Metab. 2011. 96 (9): 2796–804. DOI: 10.1210 / jc.2011-0536.
CAS
PubMed
Статья
Google ученый
Pivonello R, De LM, De Martino MC. Эффективность и безопасность комбинированной терапии низкими дозами кетоконазола и каберголина у пациентов с болезнью Кушинга, частично поддающихся монотерапии каберголином. В: 11-й Европейский конгресс эндокринологов, Стамбул, Турция. 2009.
Barbot M, Albiger N, Ceccato F, Zilio M, Frigo AC, Denaro L, Mantero F, Scaroni C. Комбинированная терапия болезни Кушинга: эффективность двух схем лечения: следует ли начинать с каберголина или кетоконазола? Гипофиз. 2014. 17 (2): 109–17. DOI: 10.1007 / s11102-013-0475-3.
CAS
PubMed
Статья
Google ученый
Feelders RA, de Bruin C, Pereira AM, Romijn JA, Netea-Maier RT, Hermus AR, Zelissen PM, van Heerebeek R, de Jong FH, van der Lely AJ, de Herder WW, Hofland LJ, Lamberts SW.Пасиреотид отдельно или с каберголином и кетоконазолом при болезни Кушинга. N Engl J Med. 2010. 362 (19): 1846–8. DOI: 10.1056 / NEJMc1000094.
CAS
PubMed
Статья
Google ученый
van der Pas R, de Bruin C, Pereira AM, Romijn JA, Netea-Maier RT, Hermus AR, Zelissen PM, de Jong FH, van der Lely AJ, de Herder WW, Webb SM, Lamberts SW , Hofland LJ, Feelders RA. Суточный ритм кортизола и качество жизни после успешного лечения болезни Кушинга.Гипофиз. 2013. 16 (4): 536–44. DOI: 10.1007 / s11102-012-0452-2.
CAS
PubMed
Статья
Google ученый
Fleseriu M, Pivonello R, Pedroncelli AM, et al. Дизайн исследования фазы II исследования подкожного пасиреотида в отдельности или в комбинации с каберголином у пациентов с болезнью Кушинга. Пролактинома и акромегалия 2. Чикаго: 2014. MON-0715.
Амар Л., Азизи М., Менард Дж., Пейрард С., Уотсон К., Плуэн П.Ф.Ингибирование альдостерон-синтазы с помощью LCI699: исследование, подтверждающее концепцию у пациентов с первичным альдостеронизмом. Гипертония. 2010. 56 (5): 831–8. DOI: 10.1161 / HYPERTENSIONAHA.110.157271.
CAS
PubMed
Статья
Google ученый
Бертанья X, Пивонелло Р., Флезериу М., Чжан И., Робинсон П., Тейлор А., Уотсон К.Э., Мальдонадо М., Хамрахиан А.Х., Боскаро М., Биллер Б.М. LCI699, мощный ингибитор 11бета-гидроксилазы, нормализует уровень кортизола в моче у пациентов с болезнью Кушинга: результаты многоцентрового исследования, подтверждающего правильность концепции.J Clin Endocrinol Metab. 2014; 99 (4): 1375–83. DOI: 10.1210 / jc.2013-2117.
CAS
PubMed
Статья
Google ученый
Гуэльо Д., Гроссман А.Б. Новые лекарства от болезни Кушинга. Экспертное мнение Emerg Drugs. 2015; 20 (3): 463–78. DOI: 10.1517 / 14728214.2015.1047762.
CAS
PubMed
Статья
Google ученый
Fleseriu M, Pivonello R, Young J, Hamrahian AH, Molitch ME, Shimizu C, Tanaka T, Shimatsu A, White T, Hilliard A, Tian C, Sauter N, Biller BM, Bertagna X.Осилодростат, мощный пероральный ингибитор 11бета-гидроксилазы: 22-недельное проспективное исследование фазы II болезни Кушинга. Гипофиз. 2016; 19 (2): 138–48. DOI: 10.1007 / s11102-015-0692-z.
CAS
PubMed
Статья
Google ученый
Пивонелло Р., Хатипоглу Б., Бертанья Х, Флезериу М., Молитч М.Э., Шимицу К., Танака Т., Шимацу С., Биллер БМК, Равичандран С., Кандра А., Заутер Н., Янг Дж. Долгосрочные (19 -Месяц) контроль свободного кортизола в моче с помощью Osilodrostat у пациентов с болезнью Кушинга: результаты расширения исследования LINC-2.В: Европейский конгресс эндокринологов, Мюнхен, Германия. 2016.
Google ученый
Li L, Vashisht K, Boisclair J, Li W, Lin TH, Schmid HA, Kluwe W, Schoenfeld H, Hoffmann P. Osilodrostat (LCI699), мощный ингибитор 11бета-гидроксилазы, вводимый в сочетании с мультирецепторно-ориентированный аналог соматостатина пасиреотид: 13-недельное исследование на крысах. Toxicol Appl Pharmacol. 2015. 286 (3): 224–33. DOI: 10.1016 / j.taap.2015.05.004.
CAS
PubMed
Статья
Google ученый
Рут Т.Е., Филип Л., Магид А.Г., Николас Ф. Фармакология Cor-003 (левокетоконазол), исследуемого препарата для лечения эндогенного синдрома Кушинга. В: Заболевания гипофиза — это не передний гипофиз (плакаты). Тезисы собраний, стр. SAT-547-SAT-547. 98-е ежегодное собрание и выставка эндокринного общества, 1–4 апреля 2016 г. — Бостон — см. Дополнительную информацию по адресу: http: // press.endocrine.org/doi/10.1210/endo-meetings.2016.np.15.sat-547#sthash.XMa9gMmK.dpuf
Шварц С.Л., Ренделл М., Ахманн А.Дж., Томас А., Арауз-Пачеко С.Дж., Уэллс Б.Р. Профиль безопасности и метаболические эффекты 14 дней лечения DIO-902: результаты фазы IIa многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования в параллельных группах у пациентов с сахарным диабетом 2 типа. Clin Ther. 2008. 30 (6): 1081–8. DOI: 10.1016 / j.clinthera.2008.05.021.
CAS
PubMed
Статья
Google ученый
Salvatori R, DelConte A, Geer EB, Koziol T, Jorkasky D. Открытое исследование для оценки безопасности и эффективности левокетоконазола (COR-003) при лечении эндогенного синдрома Кушинга. Опухоли надпочечников, регуляция и действие глюкокортикоидов. Сан-Диего: 2015. FRI-376.
Лю Н.А., Цзян Х., Бен-Шломо А., Вавровски К., Фан XM, Лин С., Мелмед С. Нацеливание на кортикотрофные опухоли гипофиза у рыбок данио и мышей с помощью ингибитора циклин-зависимой киназы (CDK). Proc Natl Acad Sci U S A.2011. 108 (20): 8414–9. DOI: 10.1073 / pnas.10180
.
CAS
PubMed
PubMed Central
Статья
Google ученый
Лю Н.А., Араки Т., Куэвас-Рамос Д., Хонг Дж., Бен-Шломо А., Тон Y, Тон М, Мелмед С. Циклин Е-опосредованная регуляция проопиомеланокортина человека как терапевтическая мишень для лечения болезни Кушинга. J Clin Endocrinol Metab. 2015; 100 (7): 2557–64. DOI: 10.1210 / jc.2015-1606.
CAS
PubMed
Статья
Google ученый
Castillo V, Giacomini D, Paez-Pereda M, Stalla J, Labeur M, Theodoropoulou M, Holsboer F, Grossman AB, Stalla GK, Arzt E. Ретиноевая кислота как новое лекарственное средство для лечения болезни Кушинга у собак. Эндокринология. 2006. 147 (9): 4438–44. DOI: 10.1210 / en.2006-0414.
CAS
PubMed
Статья
Google ученый
Pecori Giraldi F, Ambrogio AG, Andrioli M, Sanguin F, Karamouzis I, Corsello SM, Scaroni C, Arvat E, Pontecorvi A, Cavagnini F.Возможная роль ретиноевой кислоты у пациентов с болезнью Кушинга. J Clin Endocrinol Metab. 2012. 97 (10): 3577–83. DOI: 10.1210 / jc.2012-2328.
PubMed
Статья
CAS
Google ученый
Vilar L, Albuquerque JL, Lyra R, Trovao Diniz E, Rangel Filho F, Gadelha P, The AC, Ibiapina GR, Gomes BS, Santos V, Melo da Fonseca M, Frasao Viana K, Lopes IG, Араужо Д., Навес Л. Роль изотретиноиновой терапии болезни Кушинга: результаты проспективного исследования.Int J Endocrinol. 2016; 2016: 8173182. DOI: 10.1155 / 2016/8173182.
PubMed
PubMed Central
Статья
Google ученый
Fukuoka H, Cooper O, Ben-Shlomo A, Mamelak A, Ren SG, Bruyette D., Melmed S. EGFR в качестве терапевтической мишени для аденом гипофиза человека, собак и мышей, секретирующих АКТГ. J Clin Invest. 2011. 121 (12): 4712–21. DOI: 10.1172 / JCI60417.
CAS
PubMed
PubMed Central
Статья
Google ученый
Reincke M, Sbiera S, Hayakawa A, Theodoropoulou M, Osswald A, Beuschlein F, Meitinger T, Mizuno-Yamasaki E, Kawaguchi K, Saeki Y, Tanaka K, Wieland T, Graf E, Saeger W, Ronchi CL, Allolio B , Buchfelder M, Strom TM, Fassnacht M, Komada M. Мутации в гене деубиквитиназы USP8 вызывают болезнь Кушинга. Нат Жене. 2015; 47 (1): 31–8. DOI: 10,1038 / нг. 3166.
CAS
PubMed
Статья
Google ученый
Hayashi K, Inoshita N, Kawaguchi K, Ibrahim Ardisasmita A, Suzuki H, Fukuhara N, Okada M, Nishioka H, Takeuchi Y, Komada M, Takeshita A, Yamada S.Мутационный статус USP8 может предсказывать лекарственную чувствительность кортикотрофных аденом при болезни Кушинга. Eur J Endocrinol. 2016. 174 (2): 213–26. DOI: 10.1530 / EJE-15-0689.
CAS
PubMed
Google ученый
де Брюин С., Перейра А.М., Фелдерс Р.А., Ромейн Дж. А., Роэльфсема Ф., Сприй-Моой Д.М., ван Акен М. О., ван дер Лелий А. Дж., Де Гердер В. В., Ламбертс Ю. Ю., Хофланд Л. Дж.. Совместная экспрессия подтипов дофаминовых и соматостатиновых рецепторов в кортикотрофных аденомах.J Clin Endocrinol Metab. 2009. 94 (4): 1118–24. DOI: 10.1210 / jc.2008-2101.
PubMed
Статья
CAS
Google ученый
де Брюин К., Фелдерс Р.А., Ламбертс ЮЗ, Хофланд Л.Дж. Соматостатин и дофаминовые рецепторы как мишени для лечения синдрома Кушинга. Rev Endocr Metab Disord. 2009. 10 (2): 91–102. DOI: 10.1007 / s11154-008-9082-4.
CAS
PubMed
Статья
Google ученый
Culler MD. Соматостатин-дофаминовые химеры: новый подход к лечению нейроэндокринных опухолей. Horm Metab Res. 2011. 43 (12): 854–7. DOI: 10.1055 / с-0031-1287769.
CAS
PubMed
Статья
Google ученый
Halem HA. PP29-1: новое химерное соединение соматостатин-дофамин вызывает дозозависимое подавление секреции гормона роста, стимулированной GHRH, и увеличивает чувствительность к инсулину у нормальных крыс. В: 98-е ежегодное собрание и выставка эндокринного общества, Бостон, США.2016.
Google ученый
Halem HA, Ufret M, Jewett I, et al. Подавление кортикостерона in vivo в моделях болезни Кушинга на грызунах с помощью селективного антагониста рецептора пептида MC2. Развитие гипофиза и неоплазия. Бостон: 2016. OR29-26.
Halem HA, Ufret M, Prairie N, et al. Новые селективные антагонисты рецепторов пептида MC2 как потенциальное лечение болезни Кушинга. Новые аспекты оси HPA: от скамейки до смартфона.Чикаго: 2014. OR48-45.
| Определение (CHV) | редкое гормональное заболевание, которое возникает, когда организм вырабатывает слишком много гормона кортизола |
| Определение (CHV) | редкое гормональное заболевание, которое возникает, когда организм вырабатывает слишком много гормона кортизола |
| Определение (MEDLINEPLUS) | Синдром Кушинга — гормональное нарушение.Причина — длительное воздействие слишком большого количества кортизола, гормона, вырабатываемого надпочечниками. Иногда прием синтетических гормонов для лечения воспалительного заболевания приводит к болезни Кушинга. Некоторые виды опухолей вырабатывают гормон, из-за которого организм вырабатывает слишком много кортизола. Синдром Кушинга встречается редко. Некоторые симптомы
Лабораторные тесты могут показать, есть ли он у вас, и найти причину.Ваше лечение будет зависеть от того, почему у вас слишком много кортизола. Если это связано с тем, что вы принимали синтетические гормоны, более низкая доза может контролировать ваши симптомы. Если причиной является опухоль, может потребоваться хирургическое вмешательство и другие методы лечения. NIH: Национальный институт диабета, болезней органов пищеварения и почек |
| Определение (NCI) | Синдром, вызванный высоким уровнем кортизола в крови либо из-за чрезмерного производства и секреции кортикостероидов, вторичных по отношению к новообразованиям гипофиза или надпочечников, либо из-за приема глюкокортикоидных препаратов.Признаки и симптомы включают круглое лицо, ожирение верхней части тела, хрупкую и тонкую кожу, пурпурные растяжки на коже, усталость, мышечную слабость, гипертонию, сахарный диабет, гипертрихоз и аменорею у женщин, импотенцию у мужчин и остеопороз. |
| Определение (NCI_NCI-GLOSS) | Состояние, при котором в организме слишком много кортизола (гормона, вырабатываемого наружным слоем надпочечников).Синдром Кушинга может быть вызван приемом слишком большого количества стероидных препаратов или некоторыми типами опухолей. Опухоли, вырабатывающие адренокортикотропный гормон (АКТГ), заставляют надпочечники вырабатывать слишком много кортизола. Симптомы синдрома Кушинга включают круглое лицо, тонкие руки и ноги, сильную усталость и мышечную слабость, высокое кровяное давление, высокий уровень сахара в крови, фиолетовые или розовые растяжки на коже и увеличение веса, особенно в области живота. |
| Определение (MSH) | Состояние, вызванное длительным воздействием избыточного уровня кортизола (ГИДРОКОРТИЗОНА) или других глюкокортикоидов из эндогенных или экзогенных источников.Для него характерно ОЖИРЕНИЕ верхней части тела; ОСТЕОПОРОЗ; ГИПЕРТЕНЗИЯ; САХАРНЫЙ ДИАБЕТ; ГИРСУТИЗМ; АМЕНОРЕЯ; и избыток жидкости в организме. Эндогенный синдром Кушинга или спонтанный гиперкортизолизм делится на две группы: вызванные избытком АДРЕНОКОРТИКОТРОПИНА и те, которые не зависят от АКТГ. |
| Определение (CSP) | состояние, чаще наблюдаемое у женщин, из-за гиперадренокортицизма, возникающего в результате новообразований коры надпочечников или передней доли гипофиза, или из-за длительного чрезмерного приема глюкокортикоидов в терапевтических целях; Симптомы и признаки могут включать быстро развивающееся ожирение лица, шеи и туловища, кифоз, вызванный остеопорозом позвоночника, гипертонию, сахарный диабет, аменорею, гипертрихоз у женщин, импотенцию у мужчин, темный цвет лица с пурпурными отметинами, полицитемию, боль в живот и спина, мышечное истощение и слабость. |
| Концепции | Заболевание или синдром ( T047 ) |
| MSH | D003480 |
| ICD9 | 255.0 |
| ICD10 | E24 |
| SnomedCT | 154705004, 1 004, 47270006 |
| Английский | Синдром Кушинга, синдром Кушинга, синдром Кушинга, СИНДРОМ Кушинга, синдром Кушинга, неуточненный, синдром Кушинга, базофилизм Кушинга, базофилизм гипофиза, синдром, синдром Кушинга, синдром Кушинга (диагноз), синдром Кушинга, синдром Кушинга, синдром / синдром поиска Кушинга [болезнь] , синдром Кушинга, синдром Кушинга, синдром (расстройство) Кушинга, синдром Кушинга БДУ (расстройство), синдром Кушинга, синдром Кушинга III, болезнь Иценко, синдром Иценко-Кушинга, супрареногенный синдром, синдром Кушинга; синдром или заболевание, гиперкортизолизм, синдром Кушинга, синдром Кушинга БДУ, синдром Кушинга |
| Португальский | СИНДРОМ ДЕ КУШИНГ, Синдром де Кушинг, |
| Испанский | SINDROME DE CUSHING, síndrome de Cushing, SAI (trastorno), síndrome de Cushing, SAI, síndrome de Cushing, síndrome de Itsenko — Cushing, Síndrome de Cushing |
| голландский | синдрум ван Кушинга, Кушинга; Синдрум Зиекта, Синдрум ван Кушинга, Ниет Геспецифисерд, Синдрум Кушинга, Синдрум ван Кушинга, Синдрум, Кушинг — |
| немецкий | Синдром, синдром Кушинга, синдром Кушинга, синдром Кушинга, nicht naeher bezeichnet, синдром Кушинга, синдром Кушинга |
| Шведский | Синдром Кушинга |
| Японский | ク ッ シ ン グ シ ウ コ ウ グ ン, Кушинг 症候群, ッ シ ン グ 症候群, 体 好 塩 基 細胞 腺 腫, 脳 下 垂体 好 塩 基 細胞 腺 腫 |
| Чешский | Синдром Кушинга, гиперкортизолизм |
| финский | Кушингин ойрейхтымя |
| Русский | ИЦЕНКО-КУШИНГА БОЛЕЗНЬ, ИЦЕНКО-КУШИНГА СИНДРОМ, КУШИНГА СИНДРОМ, ИЦЕНКО-КУШИНГА БОЛЕЗНЬ, ИЦЕНКО-КУШИНГА СИНДРОМ, КУШИНГА СИНДРОМ |
| французский | СИНДРОМ ДЕ КУШИНГА, синдром де Кушинга, гиперкортизолизм |
| Итальянский | Иперкортизолизм, Синдром ди Кушинга |
| Корейский | 쿠싱 증후군, 상세 불명 의 쿠싱 증후군 |
| хорватский | КУШИНГОВ СИНДРОМ |
| Польский | Зеспул Кушинга |
| Венгерский | Синдром Кушинга, синдром Кушинга, Cushing-tünetegyüttes |
| норвежский | Синдром Кушинга, Гиперкортизолизм |
Синдром Кушинга | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
2016 обзор, выполненный Марком Д.Келлог, доктор философии, MT (ASCP), DABCC, доцент Гарвардской медицинской школы.
(март 2013 г.). Синдром Кушинга. Клиника Майо. Доступно в Интернете по адресу http://www.mayoclinic.org/diseases-conditions/cushing-syndrome/basics/definition/con-20032115. По состоянию на 10 февраля 2016 г.
(апрель 2012 г.). Синдром Кушинга. Национальная информационная служба по эндокринным и метаболическим заболеваниям. Доступно в Интернете по адресу http://www.niddk.nih.gov/health-information/health-topics/endocrine/cushings-syndrome/Pages/fact-sheet.aspx. По состоянию на 10 февраля 2016 г.
Ющак А. Моррис Д., Гроссман А., Ниман Л. Эндокринология: взрослые и детские Сент-Луис: Эльзивер Сондерс.
Кларк В. Современная практика клинической химии. Вашингтон, округ Колумбия, AACC Press.
Источники, использованные в предыдущих обзорах
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Браун, Т. (27 января 2004 г.).Синдром Кушинга. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000410.htm.
(июнь 2002 г.). Синдром Кушинга. NIDDK, NIH Publication No. 02-3007 [Информация в режиме онлайн]. Доступно в Интернете по адресу http://www.niddk.nih.gov/health/endo/pubs/cushings/cushings.htm.
Рафф, Х. и Финдлинг, Дж. (2003). Физиологический подход к диагностике синдрома Кушинга. Ann Intern Med. 2003; 138: 980-991 [он-лайн журнал].PDF-файл доступен для загрузки по адресу http://www.annals.org/cgi/reprint/138/12/980.pdf.
(© 2002). Синдром Кушинга. Центр болезней поджелудочной железы и желчевыводящих путей, Университет Южной Калифорнии, Отделение хирургии [Он-лайн информация]. Доступно в Интернете по адресу http://www.surgery.usc.edu.
Мротек, Дж. И Чейз, К. [Хенвуд, М. и Аннасвами, Р., редакторы] (январь 2005 г., обзор). Эндо 101, Эндокринная система, гормоны и железы. The Hormone Foundation [Он-лайн информация]. Доступно в Интернете по адресу http: // www.гормон.org/endo101/endo101_2.html.
(апрель 2004 г., пересмотрено) Синдром Кушинга. UrologyHealth.org [Он-лайн информация]. Доступно в Интернете по адресу http://www.urologyhealth.org/search/index.cfm?topic=43&search=Cushing&searchtype=and.
Кларк, В. и Дюфур, Д. Р., редакторы (2006). Современная практика клинической химии, AACC Press, Вашингтон, округ Колумбия. Пп 377-379, 380ф, 363.
(июль 2008 г.). Синдром Кушинга. Национальная информационная служба по эндокринным и метаболическим заболеваниям [онлайн-информация].Доступно в Интернете по адресу http://endocrine.niddk.nih.gov/pubs/cushings/cushings.htm. Доступно 4 января 2009 г.
(26 июня 2008 г.). Страница информации о синдроме Кушинга NINDS. Национальный институт неврологических расстройств и инсульта [Он-лайн информация]. Доступно в Интернете по адресу http://www.ninds.nih.gov/disorders/cushings/cushings.htm. Доступно 4 января 2009 г.
Холт, Э. (18 марта 2008 г., обновлено). Синдром Кушинга. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http: // www.nlm.nih.gov/medlineplus/ency/article/000410.htm. Доступно 4 января 2009 г.
(январь 2008 г., проверено). Синдром Кушинга. UrologyHealth.org [Он-лайн информация]. Доступно в Интернете по адресу http://www.urologyhealth.org. Доступно 4 января 2009 г.
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание]. С. 471-472.
(сентябрь 2010 г.). Синдром Кушинга. Клиника Майо. Доступно на сайте http: //www.mayoclinic.com / health / cushings-Syndrome / DS00470 / DSECTION = тесты-и-диагностика. Доступ 27 августа 2012 г.
(июль 2011 г.). Заболевания надпочечников. Фонд Американской урологической ассоциации. Доступно в Интернете по адресу http://www.urologyhealth.org/urology/index.cfm?article=89. Доступ 24 августа 2012 г.
(декабрь 2011 г.) Синдром Кушинга. Медлайн Плюс. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000410.htm. Доступ 24 августа 2012 г.
(апрель 2012 г.) Синдром Кушинга.Национальная информационная служба по эндокринным и метаболическим заболеваниям. Доступно в Интернете по адресу http://endocrine.niddk.nih.gov/pubs/cushings/cushings.aspx. Доступ 24 августа 2012 г.
(март 2012 г.) Глюкокортикоидный синдром и синдром Кушинга. Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/921086-overview#a0104. Доступ 24 августа 2012 г.
Фитцджеральд PA: синдром Кушинга, в Current Medical Diagnosis and Treatment 2013, 52-е изд. М.А. Пападакис, С.Дж. Макфи, М.В. Рабоу, ред.Макгроу-Хилл. Глава 26. Доступно в Интернете по адресу http://www.accessmedicine.com.libproxy2.upstate.edu/content.aspx?aID=15168&searchStr=cushing+syndrome. По состоянию на август 2012 г.
Губер HA, Фараг AF: Оценка эндокринной функции, в клинической диагностике и управлении лабораторными методами, 22-е изд. Р. А. Макферсон, М. Р. Пинкус, ред., Эльзивье. Глава 24, 2011.
Национальный институт рака. Словарь терминов по раку: Octreotide Scan. Доступно в Интернете по адресу http://www.cancer.gov/dictionary?cdrid=3
.По состоянию на октябрь 2012 г.
Краткое сообщение о болезни Кушинга
Комментарий — (2020) Том 9, Выпуск 7
Химабиндху Гуде *
* Переписка:
Химабиндху Гуде, Департамент биотехнологии, Научный колледж Университета Османии, Университет Османии,
Индия, Тел .: +918143389651, Эл. Почта:
Информация об авторе »
Болезнь Кушинга
Болезнь Кушинга — редкое и серьезное заболевание, вызываемое
опухоль гипофиза.Он производит избыток стероидного гормона кортизола в
секреты уровня крови АКТГ (адренокортикотропный гормон).
Адренокортикотропный гормон — это гормон, вырабатываемый гипофизом.
железа. Адренокортикотропный гормон стимулирует надпочечники
вырабатывают кортизол, который также называют гормоном стресса.
В 1924 году советский невролог Николай Иценко сообщил о гипофизе.
аденома у двух пациентов. Чрезмерный адренокортикотропный
секреция гормона приводит к чрезмерной выработке кортизола
надпочечники.В связи с этим добавлено имя Иценко.
титулу в некоторых странах Восточной Европы и Азии, а
болезнь называется болезнью Иценко-Кушинга.
Болезнь Кушинга — это не то же самое, что синдром Кушинга. Кушинга
синдром относится к общему состоянию и характеризуется чрезмерным
уровень кортизола в крови. Но симптомы болезни Кушинга
и синдром Кушинга такие же.
Болезнью Кушинга чаще всего страдают взрослые от 20 до 50 лет
возраст. Женщины страдают больше, чем мужчины (70 процентов
случаев, наблюдаемых у женщин).
Кортизол обычно высвобождается во время стрессовых состояний или
ситуации. Прочие функции, в том числе:
• Контроль использования углеводов, жиров и белков
кузов
• Снижает реакцию иммунной системы на воспаление (отек)
• Регулирует кровяное давление и водный баланс
Симптомы болезни Кушинга включают физические характеристики
кузова
• Круглое лицо (также называемое лунным лицом)
• Жир на задней части шеи (также называемый буйволиным горбом)
• Легкие синяки на коже
• Растяжки на животе (полосы живота) фиолетового цвета
• Увеличение веса, чаще всего наблюдается в области живота
• Красные щеки (полнокровие)
• Рост волос на лице, шее, груди, животе и бедрах
• Слабость и утомляемость; истощение мышц, особенно заметно в
верхняя часть бедер.
• Затруднение при вставании со стула.
• Нарушения менструального цикла
• Снижение фертильности и / или полового влечения
• Высокое кровяное давление, которое часто трудно поддается лечению
• Сахарный диабет, часто тяжелый
• Перепады настроения и расстройства поведения; некоторые пациенты могут
имеют психические расстройства, требующие госпитализации
• Потеря зрения
• Снижение либидо
• Снижение фертильности
• Эректильная дисфункция
• Депрессия
• Беспокойство
• Раздражительность
• Когнитивные трудности
• Нарушение роста у детей
• Потеря костной массы (остеопороз)
• Пигментация на коже
Болезнь Кушинга бывает трудно распознать на ранней стадии.Иногда уровни гормонов будут колебаться, что называется циклическим или
периодическая болезнь Кушинга. У беременных беременность
может ухудшить симптомы болезни Кушинга.
Для диагностики заболевания необходимо сделать следующие анализы
• Гормональное тестирование
• МРТ (магнитно-резонансная томография)
• Отбор проб нижней каменной пазухи
• Тест подавления дексаметазоном (если тест IPSS недоступен)
• Тест на свободный кортизол в моче
• Тест на кортизол в слюне поздно ночью (полночь)
• Лечение болезни Кушинга
• Лекарство
• Хирургия
• Лучевая терапия
• Другие варианты лечения
Замена кортизола гидрокортизоном или преднизоном после
хирургия
Информация об авторе
Химабиндху Гуде *
Департамент биотехнологии, Научный колледж Османийского университета, Османийский университет, Хайдарабад, Телангана, Индия
Образец цитирования: Gude H (2020) Краткое сообщение о болезни Кушинга.EndocrinolMetabSyndr 2020; 9: 322. DOI: 10.35248 / 2161-1017.20.9.322
Дата получения:
10 ноября 2020/ Дата принятия:
17 нояб.2020 г./ Дата публикации:
24 нояб.2020 г.
Авторские права: © 2020 Gude H. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Источники финансирования: Нет
.

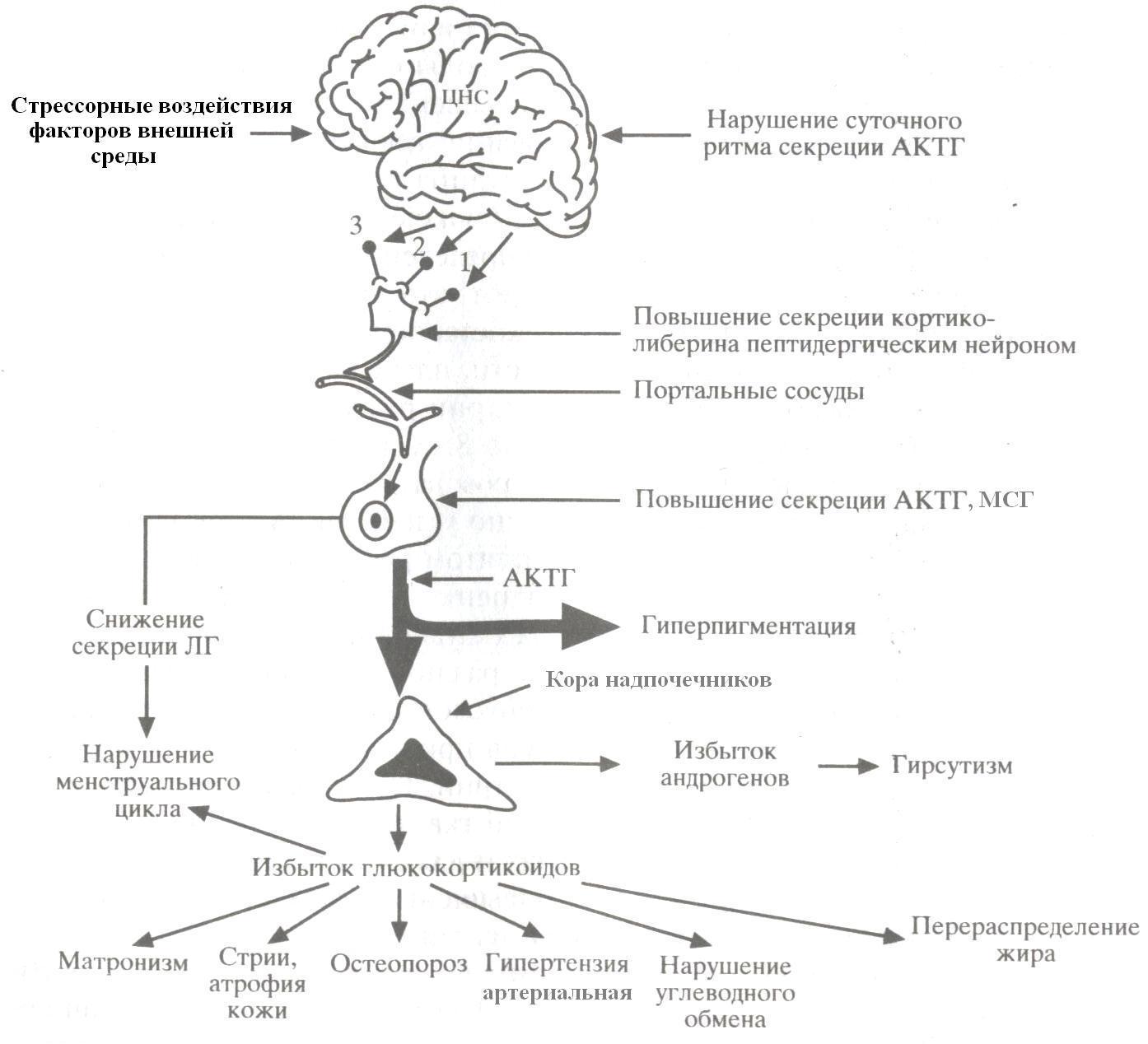
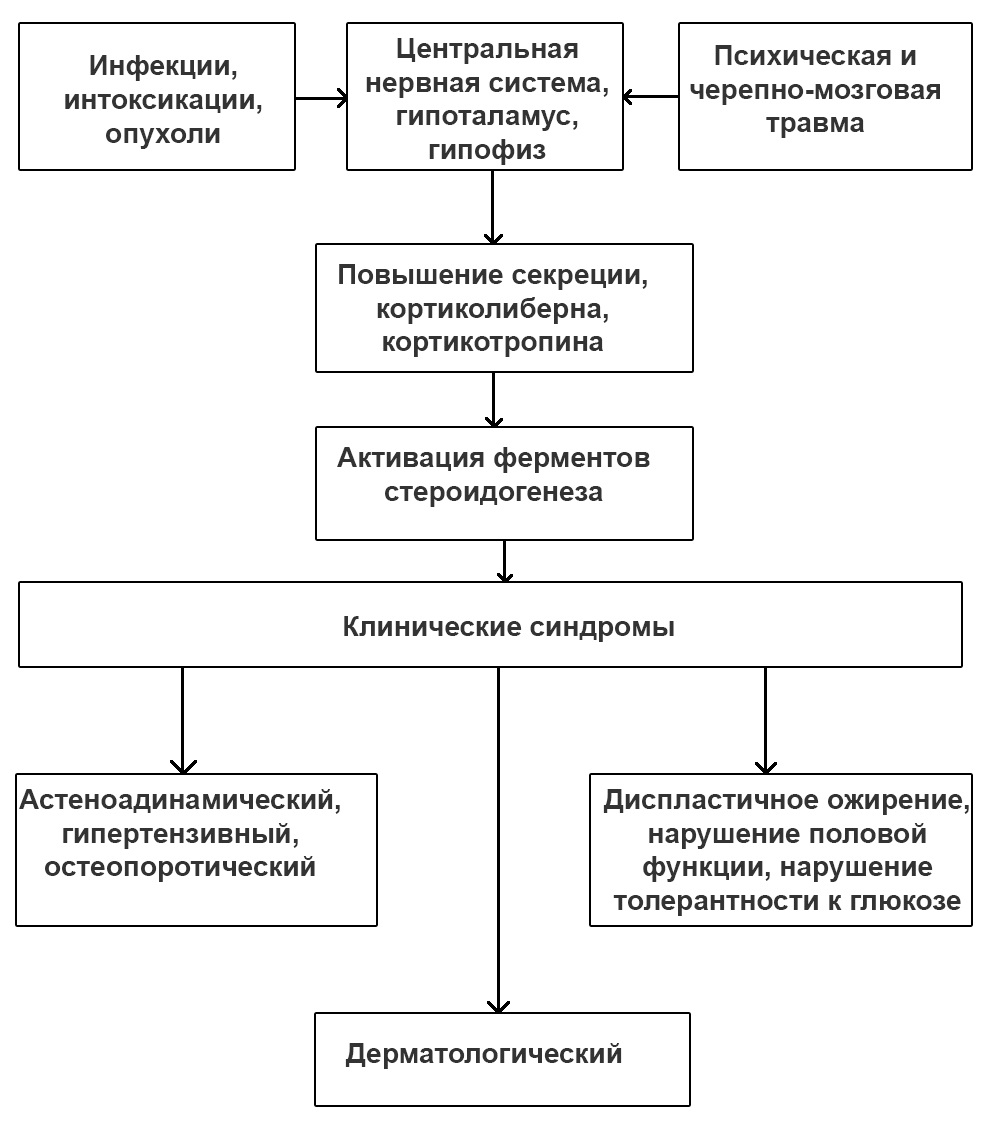


 Вам может быть трудно вставать со стула.
Вам может быть трудно вставать со стула. Симптомы зависят от того, какой гормон задействован.
Симптомы зависят от того, какой гормон задействован.


