Ингибиторы тирозинкиназы рецептора эпидермального фактора роста третьего поколения демонстрируют высокую активность при наличии мутации T790M
Новости онкологии
26.05.2015
Ингибиторы тирозинкиназы рецептора эпидермального фактора роста третьего поколения демонстрируют высокую активность при наличии мутации T790M
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Обнаружение мутации гена (делеция в 19 экзоне – Del19 и точечная замена в 21 экзоне – L858R) рецептора эпидермального фактора роста (EGFR) предсказывает высокую чувствительность опухоли к ингибиторам тирозинкиназы, таким как гефитиниб и эрлотиниб. Мутация гена EGFR встречается у 9-12% больных немелкоклеточным раком легкого в европейской популяции и у 20-25% в азиатской. Мутации преимущественно наблюдаются в аденокарциномах и у некурящих больных. Ингибиторы тирозинкиназы по результатам рандомизированных исследований достоверно увеличивают частоту объективных эффектов и медиану времени до прогрессирования по сравнению с химиотерапией у ранее нелеченных больных с мутацией гена EGFR. Медиана продолжительности жизни для этих больных составляет 20-33 месяца, что разительно контрастирует с 8-10 месяцами у больных с метастатическим немелкоклеточным раком легкого без мутации.
Мутации преимущественно наблюдаются в аденокарциномах и у некурящих больных. Ингибиторы тирозинкиназы по результатам рандомизированных исследований достоверно увеличивают частоту объективных эффектов и медиану времени до прогрессирования по сравнению с химиотерапией у ранее нелеченных больных с мутацией гена EGFR. Медиана продолжительности жизни для этих больных составляет 20-33 месяца, что разительно контрастирует с 8-10 месяцами у больных с метастатическим немелкоклеточным раком легкого без мутации.
Однако, несмотря на столь выразительные успехи, эффект ингибиторов тирозинкиназы EGFR продолжается около года, и большинство больных после этого срока демонстрируют прогрессирование болезни. Существует три основных механизма развития резистентности к ингибиторам тирозинкиназы первого поколения (гефитиниб, эрлотиниб). Примерно в половине случаев резистентность обусловлена возникновением дополнительной мутации в тирозинкиназной части рецептора – T790M (замена треонина на метионин в позиции 790), что нарушает связывание гефитиниба или эрлотиниба с активными центрами. Еще в 35-40% случаев резистентность обусловлена активацией дополнительных сигнальных путей в опухолевой клетке, таких как c-Met, PI3KCA, что нивелирует негативный эффект блокады EGFR. У 10-15% больных резистентность к ингибиторам тирозинкиназы сочетается с морфологической трансформацией аденокарциномы в мелкоклеточный рак, механизм подобной трансформации остается не до конца ясным. К сожалению, ингибиторы тирозинкиназы второго поколения, такие как афатиниб, оказались недостаточно эффективными при развитии резистентности к ингибиторам первого поколения вследствие мутации T790M. Ингибиторы тирозинкиназы третьего поколения были синтезированы с целью индуцировать противоопухолевый эффект как при наличии мутаций Del19 и L858R, так и мутации T790M. В апрельском номере The New England Journal опубликованы результаты I-II фазы двух ингибиторов третьего поколения AZD9291 и роцилетиниба у больных немелкоклеточным раком легкого [1,2].
Еще в 35-40% случаев резистентность обусловлена активацией дополнительных сигнальных путей в опухолевой клетке, таких как c-Met, PI3KCA, что нивелирует негативный эффект блокады EGFR. У 10-15% больных резистентность к ингибиторам тирозинкиназы сочетается с морфологической трансформацией аденокарциномы в мелкоклеточный рак, механизм подобной трансформации остается не до конца ясным. К сожалению, ингибиторы тирозинкиназы второго поколения, такие как афатиниб, оказались недостаточно эффективными при развитии резистентности к ингибиторам первого поколения вследствие мутации T790M. Ингибиторы тирозинкиназы третьего поколения были синтезированы с целью индуцировать противоопухолевый эффект как при наличии мутаций Del19 и L858R, так и мутации T790M. В апрельском номере The New England Journal опубликованы результаты I-II фазы двух ингибиторов третьего поколения AZD9291 и роцилетиниба у больных немелкоклеточным раком легкого [1,2].
В исследование AZD9291 было включено 253 больных немелкоклеточным раком легкого с наличием мутаций Del19 или L858R и прогрессированием на фоне лечения ингибиторами тирозинкиназы первого поколения. AZD9291 назначали в дозах от 20 до 240 мг внутрь ежедневно постоянно до признаков непереносимой токсичности или прогрессирования заболевания. После оценки переносимости препарата в разных дозах произведен дополнительный набор пациентов на каждый дозовый уровень. На этапе повышения дозы от 20 мг до 240 мг не отмечено дозолимитирующей токсичности. Наиболее частыми побочными эффектами для всех 253 больных, включенных в исследование, были диарея, кожная сыпь, тошнота и снижение аппетита. В большинстве своем они были 1-2 степени, частота осложнений 3-4 степени, обусловленных приемом препарата, колебалась от 3% до 25% на разных дозовых уровнях. Частота объективного эффекта для всех больных составила 51%. Среди больных с подтвержденной мутацией T790M частота объективных эффектов составила 61%, при ее отсутствии – 21%. Медиана времени до прогрессирования была 9,6 месяца и 2,8 месяца соответственно. Рекомендуемой к дальнейшему изучению в качестве монотерапии была выбрана доза AZD9291 80 мг, которая при равной противоопухолевой эффективности с более высокими дозами обладает меньшей токсичностью.
AZD9291 назначали в дозах от 20 до 240 мг внутрь ежедневно постоянно до признаков непереносимой токсичности или прогрессирования заболевания. После оценки переносимости препарата в разных дозах произведен дополнительный набор пациентов на каждый дозовый уровень. На этапе повышения дозы от 20 мг до 240 мг не отмечено дозолимитирующей токсичности. Наиболее частыми побочными эффектами для всех 253 больных, включенных в исследование, были диарея, кожная сыпь, тошнота и снижение аппетита. В большинстве своем они были 1-2 степени, частота осложнений 3-4 степени, обусловленных приемом препарата, колебалась от 3% до 25% на разных дозовых уровнях. Частота объективного эффекта для всех больных составила 51%. Среди больных с подтвержденной мутацией T790M частота объективных эффектов составила 61%, при ее отсутствии – 21%. Медиана времени до прогрессирования была 9,6 месяца и 2,8 месяца соответственно. Рекомендуемой к дальнейшему изучению в качестве монотерапии была выбрана доза AZD9291 80 мг, которая при равной противоопухолевой эффективности с более высокими дозами обладает меньшей токсичностью.
Другой препарат третьего поколения ингибиторов тирозинкиназы – роцилетиниб (roсiletinib) был изучен в рамках I-II фазы. На первый этап включались больные немелкоклеточным раком легкого с наличием мутации гена EGFR и прогрессированием на фоне лечения ингибиторами тирозинкиназы первого поколения. На второй этап включались больные с прогрессированием на фоне ингибиторов тирозинкиназы и наличием мутации T790M, которые получали препарат в дозах 500-625-750 мг перорально два раза в день ежедневно до признаков серьезной токсичности или прогрессирования. В исследование было включено 130 больных. При эскалации дозы препарата не отмечено дозолимитирующей токсичности. Основными проявлениями токсичности были гипергликемия, тошнота, слабость, диарея и снижение аппетита. В подавляющем большинстве вышеперечисленные осложнения были 1-2 степени, за исключением гипергликемии, частота 3-4 степени которой составляла 22%. Гипергликемия контролировалась уменьшением дозы и назначением метформина. Объективный эффект был оценен у 63 больных, получивших терапевтически активные дозы (500 мг и более). Среди 46 больных с наличием мутации T790M частота объективного эффекта составила 59%, при отсутствии данной мутации – 29%. Медиана времени до прогрессирования (ожидаемая) составляет 13,1 мес. и 5,6 мес. соответственно.
Объективный эффект был оценен у 63 больных, получивших терапевтически активные дозы (500 мг и более). Среди 46 больных с наличием мутации T790M частота объективного эффекта составила 59%, при отсутствии данной мутации – 29%. Медиана времени до прогрессирования (ожидаемая) составляет 13,1 мес. и 5,6 мес. соответственно.
Таким образом, оба изученных препарата продемонстрировали высокую эффективность при назначении больным с немелкоклеточным раком легкого и резистентностью к ингибиторам тирозинкиназы вследствие повторной мутации T790M. Оба препарата обладают существенно меньшей активностью у больных с другими механизмами развития резистентности. Это делает актуальным необходимость получения ДНК из опухолевой клетки при выполнения биопсии опухоли или выделения ее из плазмы для определения мутации T790М. Для больных с подобной мутацией возможно продолжение лечения ингибиторами тирозинкиназы третьего поколения и использование химиотерапии в случае дальнейшего прогрессирования. Дополнительные 10-13 месяцев времени до прогрессирования на фоне ингибиторов тирозинкиназы третьего поколения должны существенно увеличить продолжительность жизни больных с мутированным геном EGFR. Требуется поиск эффективных стратегий у больных с резистентностью к ингибиторам тирозинкиназы первого-второго поколения с отсутствием мутации T790M.
Дополнительные 10-13 месяцев времени до прогрессирования на фоне ингибиторов тирозинкиназы третьего поколения должны существенно увеличить продолжительность жизни больных с мутированным геном EGFR. Требуется поиск эффективных стратегий у больных с резистентностью к ингибиторам тирозинкиназы первого-второго поколения с отсутствием мутации T790M.
Ключевые слова: немелкоклеточный рак легкого, аденокарцинома, мутация гена эпидермального фактора роста, ингибиторы тирозинкиназы, AZD9291, ролецитиниб.
Литература:
- Jänne PA, Yang J, Kim D-W, et al. AZD9291 in EGFR inhibitor–resistant non–small-cell lung cancer. N Engl J Med 2015; 372: 1689-99.
- Sequist LV, Soria J-C, Goldman JW, et al. Rociletinib in EGFR-Mutated Non–Small-Cell Lung Cancer. N Engl J Med 2015; 372: 1700-9.
Новый необратимый ингибитор тирозинкиназы Афатиниб демонстрирует свою противоопухолевую активность у больных немелкоклеточным раком легкого с мутацией гена рецептора эпидермального фактора роста
Новости онкологии
03. 12.2013
12.2013
Новый необратимый ингибитор тирозинкиназы Афатиниб демонстрирует свою противоопухолевую активность у больных немелкоклеточным раком легкого с мутацией гена рецептора эпидермального фактора роста
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Обнаружение активирующей мутации гена рецептора эпидермального фактора роста (EGFR) позволило диагностировать опухоли легкого, чья пролиферативная активность зависит от EGFR-сигнального пути. Эта зависимость повышает чувствительность этих опухолей к ингибиторам тирозинкиназы мутированного рецептора. Назначение представителей первого поколения ингибиторов тирозинкиназы гефитиниба или эрлотиниба больным с мутацией гена EGFR приводило к существенному сокращению размеров опухолевых очагов и уменьшению симптомов заболевания на относительно длительный срок. Рандомизированные исследования III фазы продемонстрировали преимущество в увеличении времени до прогрессирования и лучшую переносимость по сравнению с цисплатиновой химиотерапией при проведении первой линии системной терапии больных с наличием мутации гена EGFR. Назначение ингибиторов тирозинкиназы в качестве системной терапии второй линии в случае прогрессирования после цисплатин-содержащих комбинаций увеличивает продолжительность жизни по сравнению химиопрепаратами.
Рандомизированные исследования III фазы продемонстрировали преимущество в увеличении времени до прогрессирования и лучшую переносимость по сравнению с цисплатиновой химиотерапией при проведении первой линии системной терапии больных с наличием мутации гена EGFR. Назначение ингибиторов тирозинкиназы в качестве системной терапии второй линии в случае прогрессирования после цисплатин-содержащих комбинаций увеличивает продолжительность жизни по сравнению химиопрепаратами.
В настоящее время на рынок выходят представители второго поколения ингибиторов тирозинкиназы, в частности, афатиниб. Афатиниб относится к числу необратимых ингибиторов тирозинкиназы сразу нескольких рецепторов семейства EGFR (erbB1, Her-2/erbB2, erbB4). При этом в эксперименте было показано, что для блокировки работы тирозинкиназы требуется значительно меньшая концентрация афатиниба в сравнении с ингибиторами первого поколения. В экспериментальных работах было показано, что афатиниб сохраняет свою активность в случае мутации Т790М гена эпидермального фактора роста.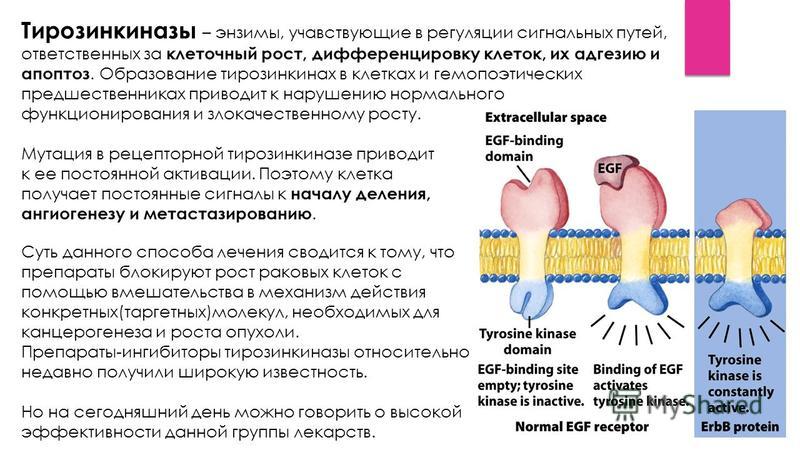 Именно эта повторная мутация наблюдается у 50% больных с развившейся клинической резистентностью к ранее эффективным ингибиторам тирозинкиназы гефитинибу или эрлотинибу. Афатиниб был изучен в нескольких исследованиях, результаты которых были недавно опубликованы.
Именно эта повторная мутация наблюдается у 50% больных с развившейся клинической резистентностью к ранее эффективным ингибиторам тирозинкиназы гефитинибу или эрлотинибу. Афатиниб был изучен в нескольких исследованиях, результаты которых были недавно опубликованы.
В исследовании Lux-Lung 3 проводили сравнение эффективности и токсичности афатиниба в дозе 40 мг с последующим увеличением до 50 мг при отсутствии токсичности перорально ежедневно до признаков прогрессирования и химиотерапии комбинацией цисплатина (75 мг/м2) и пеметрекседа (500 мг/м2) каждые 3 недели 6 курсов у 345 больных аденокарциномой легкого IIIB-IV стадии с наличием мутации гена EGFR [1]. Медиана времени до прогрессирования в группе афатиниба и химиотерапии составила 11,1 мес. и 6,9 мес. соответственно (HR=0,58, p=0,001). Увеличение времени до прогрессирования наблюдали во всех подгруппах больных. Частота объективного эффекта была достоверно выше в группе афатиниба: 56% и 23%. После прогрессирования в группе химиотерапии 65% больных получали ингибиторы тирозинкиназы в качестве второй линии. В группе афатиниба 62% больных получали химиотерапию после прогрессирования болезни. На момент проведения анализа медиана продолжительности жизни не была достигнута. Наиболее частыми побочными эффектами в группе афатиниба были диарея, кожная сыпь и стоматит, в группе химиотерапии – тошнота и рвота, слабость.
После прогрессирования в группе химиотерапии 65% больных получали ингибиторы тирозинкиназы в качестве второй линии. В группе афатиниба 62% больных получали химиотерапию после прогрессирования болезни. На момент проведения анализа медиана продолжительности жизни не была достигнута. Наиболее частыми побочными эффектами в группе афатиниба были диарея, кожная сыпь и стоматит, в группе химиотерапии – тошнота и рвота, слабость.
В рамках исследования LUX-Lung 3 изучены качество жизни и динамика симптомов заболевания на фоне лечения афатинибом и химиотерапией цисплатином и пеметрекседом [2]. Больные каждые 3 недели заполняли опросники качества жизни EORTC С30 и симптомов болезни Рак легкого-13. В группе афатиниба отмечено достоверное уменьшение выраженности кашля и одышки, но не боли. Больные, получавшие афатиниб, отмечали улучшение общего и физического состояния, лучшую способность к умственной деятельности по сравнению с группой химиотерапии. Авторы делают вывод о преимуществе афатиниба в контроле симптомов болезни и лучшей переносимости по сравнению с химиотерапией.
Данное исследование является самым крупным среди подобных работ по сравнению эффективности ингибиторов тирозинкиназы и химиотерапии у больных немелкоклеточным раком легкого с мутацией гена EGFR. Важным достоинством данного исследования является использование в контрольной группе самого эффективного режима для лечения больных с аденокарциномой, каковым является комбинация цисплатина и пеметрекседа. В более ранних работах были использованы комбинации карбоплатина и паклитаксела или цисплатина и гемцитабина. В очередной раз ингибиторы тирозинкиназы, в частности, афатиниб, продемонстрировали свое преимущество по сравнению с химиотерапией в качестве первой линии системного лечения у больных немелкоклеточным раком легкого с наличием мутации гена EGFR.
Несмотря на высокую активность ингибиторов тирозинкиназы мутированного EGFR, у всех больных впоследствии развивается резистентность к этим препаратам и прогрессирование заболевания. Основным механизмом развития резистентности является дополнительная мутация T790M в 20 экзоне гена EGFR, следствием которого является потеря чувствительности к ингибиторам первого поколения. Афатиниб, в отличие от гефитиниба и эрлотиниба, демонстрировал противоопухолевую активность на клеточных линиях рака легкого с наличием мутации T790M. Вот почему интерес вызывало исследование LUX-Lung 4, в котором афатиниб в дозе 50 мг внутрь ежедневно назначали больным немелкоклеточным раком легкого, которые прогрессировали на фоне приема гефитиниба и эрлотиниба [3]. При этом оговаривалось, что продолжительность приема ингибиторов тирозинкиназы в первой линии должна составлять не менее 12 недель. Исследование было проведено в Японии и в него было включено 62 больных: у 45 (73%) имелась мутация гена EGFR, у 11 отсутствовала мутация и у 6 больных мутация не определялась в связи с отсутствием опухолевой ткани для выполнения анализа. Оценка лечения афатинибом была проведена у 61 больного, из них у 5 (8%) зарегистрирована частичная регрессия опухоли и еще у 35 (57%) стабилизация на срок более 6 недель. Большинство регрессий наблюдали в ближайшие 8 недель от начала приема препарата, медиана их продолжительности составила 24 недели. Медиана времени до прогрессирования составила 4,4 месяца при медиане продолжительности жизни 18,4 месяца. Наблюдаемый эффект афатиниба не зависел от пола, какой препарат из группы ингибиторов тирозинкиназы получал больной ранее (гефитиниб или эрлотиниб), числа предшествующих линий химиотерапии и характера мутации гена эпидермального фактора роста.
У двух больных прогрессирование сопровождалось появлением мутации T790M по данным повторной биопсии. У одного больного на фоне приема афатиниба получена стабилизация процесса в течение 9 месяцев, у другого наблюдали короткую (1 месяц) стабилизацию опухолевого процесса.
У всех больных отмечены побочные эффекты на фоне приема афатиниба, что потребовало редукции дозы препарата с 50 мг до 40 мг у 69% больных. Наиболее часто наблюдали диарею (100%), кожную сыпь (92%) и стоматит (86%). Частота этих осложнений 3 степени составила 37%, 27% и 10% соответственно. Лечение было прекращено досрочно по причине токсичности у 18 (29%) пациентов.
Афатиниб является представителем второго поколения ингибиторов тирозинкиназы эпидермального фактора роста. Препарат показал, как и другие ингибиторы ранее, свою эффективность в сравнении с платиносодержащей химиотерапией в качестве первой линии у больных с мутированным эффектом. Афатиниб обладает умеренной эффективностью у больных с прогрессированием на фоне ранее назначенных ингибиторов тирозинкиназы в качестве системной терапии третьей-четвертой линии. Несмотря на умеренный противоопухолевый эффект и короткий срок медианы времени до прогрессирования, общая продолжительность жизни больных составила более 18 месяцев. Не получено убедительных свидетельств, что афатиниб эффективен у больных с резистентностью к ингибиторам тирозинкиназы вследствие повторной мутации Т790М из-за малого числа наблюдений. Следует продолжить изучение этого препарата у данной группы больных. Проведенные исследования свидетельствуют в пользу большей кожной и гастроинтестинальной токсичности афатиниба по сравнению с препаратами первого поколения. Препарат афатиниб зарегистрирован в России под торговым названием Гиотриф для лечения больных немелкоклеточным раком легкого с мутацией гена EGFR, ранее не получавших ингибиторов тирозинкиназы. Для определения места афатиниба в лечении больных немелкоклеточным раком легкого с мутацией гена EGFR потребуется проведение дополнительных рандомизированных исследований, в том числе и прямого сравнения с широко используемыми представителями первого поколения – гефатинибом и эрлотинибом.
Литература:
- Sequist LV, Yang JC-H, Yamamoto N, et al: Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 31:3327-3334, 2013.
- Yang JC-H, Hirsh V, Schuler M, et al: Symptom control and quality of life in LUX-Lung 3: A phase III study of afatinib or cisplatin/pemetrexed in patients with advanced lung adenocarcinoma with EGFR mutations. J Clin Oncol 31:3342-3350, 2013.
- Katakami N, Atagi S, Goto K, et al: LUX-Lung 4: A phase II trial of afatinib in patients with advanced non–small-cell lung cancer who progressed during prior treatment with erlotinib, gefitinib, or both. J Clin Oncol 31:3335-3341, 2013.
Разнообразие механизмов резистентности к роцилетинибу, селективному ингибитору тирозинкиназы EGFR третьего поколения
Новости онкологии
16.06.2016
Разнообразие механизмов резистентности к роцилетинибу, селективному ингибитору тирозинкиназы EGFR третьего поколения
Эффективность роцилетиниба, ингибитора тирозинкиназы (ИТК) EGFR, была показана у больных немелкоклеточным раком легкого (НМРЛ) с прогрессированием заболевания на фоне предшествующего лечения ИТК в связи с развитием дополнительной мутации в тирозинкиназной части рецептора – T790M. С целью понимания врожденных и приобретенных механизмов резистентности к терапии роцилетинибом авторами настоящего исследования было выделено ДНК из опухолевых клеток, циркулирующих в крови пациентов. Для этого было исследовано в общей сложности 115 образцов плазмы крови больных НМРЛ с мутацией T790M (n=43), вошедших в исследования TIGER-X (n=42) (NCT01526928) и TIGER-2 (n=1) (NCT02147990). Механизмы развития резистентности к роцилетинибу были самыми разнообразными, включая появление многочисленных мутаций и активацию дополнительных сигнальных путей. Множественная резистентность была выявлена у 23% больных. Она была связана с появлением активирующих мутаций в структуре гена KRAS (у 3 больных), появлением новой мутации L7981 в структуре гена EGFR (у 1 пациента), появлением мутации EGFRC797S (у 1 пациента). Активация таких дополнительных сигнальных путей в опухолевой клетке, как c-MET, была самым частым механизмом развития резистентности, выявленным у 26% больных. У пациентов с гетерогенным механизмом резистентности на момент начала лечения (имевших как мутацию T790M, так и активацию сигнального пути c-MET) уровень ответа на лечение был ниже, а время до прогрессирования заболевания – значительно меньше (p<0,05). В подтверждение полученных результатов, у больных НМРЛ при развитии резистентности к эрлотинибу и получении роцилетиниба может развиться и к нему резистентность в связи с активацией сигнального пути c-MET. Одним из способов ее преодоления является комбинация роцилетиниба с ингибитором MEK кризотинибом.
Таким образом, авторами были выявлены разнообразные и гетерогенные механизмы развития резистентности к терапии роцилетинибом. Влияние механизмов множественной резистентности на прогноз заболевания больных дополнительно подчеркивает всю важность гетерогенности злокачественных новообразований у наших пациентов. Полученные результаты показывают необходимость выделения ДНК из циркулирующих опухолевых клеток, что позволяет не только определить причины резистентности к таргетным препаратам, но и разработать индивидуальный для каждого пациента подход к ее преодолению.
Источник: Chabon J, Simmons A, Newman A, et al. 2016 ASCO Annual Meeting. Abstract number 9000.
Обновление недавних доклинических и клинических исследований T790M мутантно-специфических необратимых ингибиторов тирозинкиназы рецептора фактора роста эпидермального фактора роста
Update on recent preclinical and clinical studies of T790M mutant-specific irreversible epidermal growth factor receptor tyrosine kinase inhibitors
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5135794/
Ингибиторы тирозинкиназы рецептора эпидермального фактора роста первого и второго поколений (1 / 2G EGFR-TKI), гефитиниб, эрлотиниб и афатиниб, были одобрены в качестве стандартных препаратов первой линии для расширенного мутационного положительного немелкоклеточного рака легкого EGFR , EGFR-TKI третьего поколения (3G) были разработаны для преодоления мутации EGFR T790M, которая является наиболее распространенным механизмом приобретенной резистентности к обработке 1 / 2G EGFR-TKI. Эта резистентная мутация развивается у половины пациентов, которые реагируют на терапию 1 / 2G EGFR-TKI. Структуры новых 3G EGFR-TKI отличаются от структур 1 / 2G EGFR-TKI. В частности, 3G EGFR-TKI имеют более низкое сродство к EGFR дикого типа и поэтому связаны с более низкими показателями токсичности кожи и желудочно-кишечного тракта. Тем не менее, многие из неблагоприятных событий (AE), которые наблюдаются у пациентов, получающих 3G EGFR-TKI, не наблюдались у пациентов, получавших 1 / 2G EGFR-TKI. Хотя доклинические исследования выявили множество возможных механизмов для этих АЭ, причины некоторых АЭ остаются неизвестными. Сообщалось также о многих механизмах резистентности к терапии 3G EGFR-TKI. Здесь мы рассмотрели недавние клинические и доклинические изменения, связанные с новыми 3G EGFR-TKI, включая osimertinib, rociletinib, olmutinib, EGF816 и ASP8273.
Первичные обратимые ингибиторы тирозинкиназы рецептора эпидермального фактора роста (1G EGFR-TKIs) gefitinib и erlotinib являются производными хиназолина, как и необратимый EGFR-TKI afatinib второго поколения (2G). Эти препараты эффективны для лечения прогрессирующего мутационного положительного немелкоклеточного рака легкого EGFR (НМРЛ), особенно у пациентов, которые переносят мутацию EGFR exon 21 L858R (EGFR
L858R) или exon 19 (EGFR
del19). Соответственно, все эти препараты в настоящее время являются стандартными методами первой линии для этих пациентов [1-6]. Однако эти препараты также ингибируют EGFR дикого типа (EGFRwt), а диарея и кожные угри / сыпь являются распространенными нежелательными явлениями (AE). После периода от 9 до 11 месяцев эффективного лечения неизбежно возникает резистентность к 1G / 2G EGFR-TKI. Около 50-60% случаев приобретенной резистентности связаны с мутацией EGFR T790M, которая представляет собой замещение треонина метионином в положении 790 аминокислоты, EGFR
T790M [7-12]. Новые EGFR-TKI третьего поколения (3G) были разработаны для преодоления этого основного механизма резистентности, а также с меньшей способностью ингибировать EGFRwt, тем самым сводя к минимуму АЭ, которые наблюдаются в терапии 1G / 2G EGFR-TKI. Здесь мы рассмотрели недавние доклинические и клинические изменения, связанные с 3G EGFR-TKI, с особым упором на необычные АЭ, связанные с этими новыми препаратами. Мы также рассмотрели механизмы приобретенной резистентности к этим препаратам и возможные решения, с помощью которых эти механизмы сопротивления могут быть преодолены.
Обзор литературы по клиническим исследованиям, опубликованным в период с января 2013 года по июнь 2016 года, был проведен с использованием PubMed и MEDLINE с ключевыми словами «немелкоклеточный рак легкого», «мутацией рецептора эпидермального фактора роста T790M», «osimertinib», «rociletinib», «olmutinib», «EGF816» и «ASP8273». Мы также провели ручной поиск тезисов, представленных на крупных встречах в онкологии.
Osimertinib (AZD9291) представляет собой моноанилинопиримидиновое соединение, которое необратимо направляет опухоли, укрывающие EGFR
L858R, EGFR
del19 и EGFR
T790M, мало влияя на EGFRwt. Это соединение обеспечивает ковалентную связь с остатком цистеина в положении 797 EGFR (Cys797), а также обладает активностью против других киназ, которые содержат цистеиновый остаток в аналогичной киназной области, такой как ErBB2, ErBB4 и BLK (BLK-протоонкоген, Src семейная тирозинкиназа, предыдущее название: B-лимфоидная тирозинкиназа). Как EGFR
T790M, рецептор инсулина и инсулиноподобный рецептор фактора роста 1 также имеют метионин-гейткипер в своих доменах киназы. Тем не менее, osimertinib не обладает значительной активностью в отношении любого из этих рецепторов [13, 14].
На первом этапе I / II клиническое исследование перорального введения осимертиниба (AURA), 80 мг / день было выбрано в качестве дозы для последующих исследований фазы II или III, хотя истинная дозозависимая токсичность не наблюдалась на этом уровне дозы [ 15]. В объединенном анализе двух исследований (AURA-фаза 2-го поколения и AURA 2) результаты были исследованы у пациентов, у которых был EGFR-мутантно-позитивный НМРЛ, болезнь которого прогрессировала после предыдущей терапии EGFR-TKI, у опухолей которой был EGFR
T790M, и которые получали осимертиниб при дозе 80 мг / сут. Среди 397 пациентов с оценкой подтвержденный показатель объективной реакции (ОРР) составил 66%, а показатель контроля заболеваемости (DCR) составил 91%. Медианная выживаемость без прогрессирования (PFS) составила 11,0 месяцев (n = 411). Наблюдаемые связанные с лечением АЭ перечислены в таблице 1, и только
Аббревиатуры: рецептор эпидермального фактора роста EGFR, ингибитор тирозинкиназы TKI, объективная частота ответа ORR, выживаемость без прогрессирования PFS, неблагоприятное событие AE, интерстициальное заболевание легких ILD, немелкоклеточный рак НМРЛ, доверительный интервал CI, интервал QTc QT, скорректированный для частота сердечных сокращений, NA недоступна
aДля каждого AE сообщаемые значения в этом столбце (процент пациентов, получающих терапию, которые испытывают AE, процент пациентов, получавших терапию, которые испытали AE в классе ≥ 3)
bВключение пациентов сопровождалось сенсибилизирующими мутациями EGFR после терапии EGFR-TKI (независимо от EGFR
Статус T790M), вставку или удаление EGON exon 20, мутацию de novo T790M и пациенты с непереносимым прогрессирующим EGFR мутационным положительным NSCLC
В ноябре 2015 года osimertinib получил одобрение Управления по контролю за продуктами и лекарствами США (FDA) для метастатического EGFR, предварительно обработанного EGFR-TKI
T790M-положительный НМРЛ, как и сопутствующий диагностический тест (cobas® EGFR Mutation Test v2), который используется для определения опухолевого EGFR
Т790Й. К июлю 2016 года osimertinib также получил одобрения в Европейском союзе, Японии, Южной Корее, Канаде, Швейцарии, Израиле и Мексике. Подтверждающее исследование фазы III (AURA 3, ClinicalTrials.gov, NCT02151981) сравнивает osimertinib с химиотерапией на основе платины у пациентов, у которых развился мутационно-позитивный NSCLC EGFR, болезнь которого прогрессировала после терапии EGFR-TKI первой линии и у которых опухоли гавани EGFR
Т790Й. Это исследование завершило начисление пациентов и продолжается.
Поскольку osimertinib обладает активностью против сенсибилизирующих мутаций EGFR и связан с уменьшением AE кожи сыпи и диареи, он также был протестирован как лечение первой линии для метастатического EGFR-мутационно-положительного NSCLC. Две когорты расширения в исследовании AURA зарегистрировали пациентов с метастатическим EGFR-мутационно-положительным НМРЛ и проверили безопасность и эффективность монотерапии первой линии осимертиниба. Монотерапия Osimertinib была испытана при 80 и 160 мг / день, и в общей сложности было зарегистрировано 60 пациентов (30 на каждом уровне дозы). ОРР составлял 67% при 80 мг / день и 87% при 160 мг / сут. DCR составлял 93% при 80 мг / день и 100% при 160 мг / сут. В течение 80 мг / сут медиана PFS не была достигнута во время отсечки данных для анализа, а 18-месячная выживаемость без прогрессирования составила 57%. В течение 160 мг / сут медиана PFS составляла 19,3 месяца, а 18-месячная выживаемость без прогрессирования составила 53%. Все уровни кожной сыпи и диареи развились у 70 и 87% пациентов, получавших соответственно 80 мг / день, а также 60 и 80% пациентов, получавших 160 мг / сут соответственно. У 3% и 7% пациентов развилась степень ≥ 3 кожной сыпи и сорт ≥ 3 диареи при 160 мг / сут соответственно. Пролонгация ILD и QTc развивалась у 10 и 0% пациентов, получавших 80 мг / день, а также у 7 и 10% пациентов, получавших 160 мг / сут соответственно [18]. Рандомизированное исследование фазы III (исследование FLAURA, ClinicalTrials.gov, NCT02296125) сравнивает осимертиниб с гефитинибом или эрлотинибом как терапию первой линии у пациентов с расширенным мутационным положительным НМРЛ. Исследование завершило начисление пациентов и продолжается.
Осимертиниб показал клиническую активность метастазов головного мозга в исследованиях AURA и AURA 2 [19]. Лептоменингиальный метастаз — еще одно вредное усложнение продвинутого мутационного положительного НМРЛ [20]. Изучение фазы I (исследование BLOOM, ClinicalTrials.gov, NCT02228369) продолжается для проверки безопасности и эффективности монотерапии осимертинином против метастазов головного и лептоминемиального метастазов. В предварительном отчете osimertinib при 160 мг / сут показал многообещающую активность против метастазирования лептоменингов [21].
Комбинированная терапия — это еще одна стратегия лечения, позволяющая улучшить противоопухолевую активность. В исследовании TATTON (ClinicalTrials.gov, NCT02143466) osimertinib объединяли с ингибитором MET (AZD6094, саволитинибом), ингибитором MEK (селуметинибом) или моноклональным антителом против PD-L1 (MEDI4736, durvalumab) [22]. Однако предварительный отчет показал, что частота ILD была высокой в группе osimertinib plus durvalumab. Исследование фазы III osimertinib plus durvalumab против монотерапии осимертинином (исследование CAURAL, ClinicalTrials.gov, NCT02454933) также показало высокую частоту ILD в комбинации, и поэтому прекращение комбинированной терапии osimertinib plus durvalumab было прекращено [23]. Исследования других комбинированных терапий продолжаются, например, для осимертиниба в сочетании с некротимумабом, рамуцирумабом или бевацизумабом (ClinicalTrials.gov, NCT02496663, 02789345 и 02803203). В дополнение к метастатическому заболеванию клинические испытания монотерапии осимертинибом для EGFR-мутационно-позитивного НМРЛ также продолжаются в адъювантной обстановке (исследование ADAURA, ClinicalTrials.gov, NCT02511106).
Другой важной проблемой в разработке 3G EGFR-TKI является применение жидких биопсий для обнаружения EGFR
T790M в образцах крови или мочи [24-27]. Образцы плазмы собирали в исследовании AURA, и бесклеточная ДНК плазмы была генотипирована с использованием технологии цепной реакции цифровой полимеразной гранулы, эмульсии, амплификации и магнетиков (BEAMing) (Sysmex Inostics, Inc., Mundelein, IL, USA) [ 25, 28]. Чувствительность на основе плазмы для обнаружения EGFR
T790M составлял 70%. ORR и медиана PFS были сходны у пациентов с EGFR
T790M-положительная плазма и те, у которых EGFR
T790M-положительная ткань, которая была определена как золотой стандарт (ORR: 63 против 62%, медиана PFS: 9,7 против 9,7 месяца). Авторы пришли к выводу, что у пациентов с EGFR
T790M-положительная плазма может избежать повторной биопсии опухоли для EGFR
T790M, в то время как те, у кого EGFR
T790M-отрицательная плазма должна подвергаться повторной биопсии опухоли [29]. Сообщалось также о механизмах резистентности к терапии осимертинибом. В исследовании доклинической клеточной линии была получена мутация EGFR C797S (замещение цистеина серином в положении 797 аминокислот, EGFR
C797S) был идентифицирован как механизм резистентности к терапии осимертинибом. Это понятно, потому что osimertinib образует ключевую ковалентную связь с EGFR в положении отмеченного остатка цистеина. Устойчивые клетки, содержащие сенсибилизирующие мутации (EGFR
L858R / C797S и EGFR
del19 / C797S) сохраняют чувствительность к хиназолиновым 1G / 2G EGFR-TKI, таким как гефитиниб и афатиниб, но устойчивы к этим препаратам в присутствии EGFR
T790M (EGFR
L858R / T790M / C797S и EGFR
del19 / Т790М / C797S). Однако устойчивые клетки, которые питают EGFR
L858R / T790M / C797S остаются частично чувствительными к цетуксимабу из-за нарушения димеризации EGFR [30]. Еще одно доклиническое исследование также показало, что EGFR
C797S — механизм сопротивления [31]. Кроме того, авторы этого исследования продемонстрировали, что если EGFR
C797S произошел в транс (на другой аллель) из EGFR
T790M, то резистентные клетки были чувствительны к комбинации 1G / 3G EGFR-TKI. Напротив, если две мутации произошли в цис (на той же аллели), то клетки были устойчивы к комбинированной терапии. Другие механизмы резистентности к терапии осимертинибом также были выявлены в исследованиях клеточных линий, включая NRAS
E63K и коэффициенты копирования для NRAS дикого типа и KRAS дикого типа. Комбинированная терапия осимертинибом и селуметинибом предотвращала и замедляла развитие резистентности [32].
В клинических условиях EGFR
C797S был впервые описан у пациента, у которого развилась приобретенная устойчивость к терапии осимертинибом. В этом случае EGFR
C797S был обнаружен в бесклеточном анализе ДНК плазмы, который был выполнен с использованием секвенирования следующего поколения. Последующее исследование собрало образцы плазмы у 15 пациентов, получивших терапию осимертинибом, и имело ранее существовавший плазменный EGFR
T790M, который был обнаружен с использованием цифровой цепной реакции с каплями. При развитии резистентности у 6 (40%) пациентов была EGFR
del19 / T790M / C797S, 5 (33%) пациентов имели EGFR
Только T790M и EGFR
T790M больше не обнаруживался у 4 (27%) пациентов, которые сохраняли ранее сенсибилизирующие мутации [33]. Механически EGFR
C797S параллельна приобретенной мутации Bruton tyrosine kinase (BTK) C481S, которая наблюдается у пациентов с хроническим лимфоцитарным лейкозом, которые развивают приобретенную резистентность к терапии с помощью ibrutinib, необратимого ингибитора BTK. Было обнаружено, что в сочетании с цетуксимабом был обнаружен новый селективный аллостерический ингибитор EGFR-устойчивости-мутаций (EAI045) в модели мыши NSCLC, содержащей EGFR
L858R / Т790М / C797S. Цетуксимаб блокирует димеризацию EGFR и делает киназу восприимчивой к этому аллостерическому агенту [34]. EGFR
C797S был также обнаружен в образцах повторной биопсии опухоли у пациента, у которого развилась приобретенная устойчивость к осимертинибу [35]. Сообщалось о нескольких других приобретенных резистентных механизмах у пациентов, перенесших прогрессирование заболевания при терапии осимертинибом: приобретенный EGFR
L718Q, трансформация мелких клеток, амплификация МЕТ, усиление HER2, BRAF
Мутация V600E, PIK3CA
Мутация E545K, потеря EGFR
T790M плюс активация альтернативного пути, а также активация EGFR-лиганда [36-41]. В отчете о случаях пациент, который разработал МЕТ-амплификацию, ответил на терапию кризотинибом, ингибитором ALK и MET [36].
Rociletinib (CO-1686) представляет собой 2,4-дизамещенное пиримидиновое соединение, которое необратимо нацелено на опухоли, укрывающие EGFR
L858R, EGFR
del19 и EGFR
T790M, мало влияя на EGFRwt. Существует мета-акриламид, который указывает на Cys797 и образует ковалентную связь. Это соединение также обладает активностью против других киназ, таких как FAK, CHK2, ErBB4 и JAK3 [42, 43]. Метаболит rociletinib, M502, обладает эффективностью против рецептора инсулина и рецептора инсулиноподобного фактора роста 1, что может привести к АЭ гипергликемии [44].
В ранней фазе клинического исследования (TIGER X, ClinicalTrials.gov, NCT01526928) было установлено, что перорально вводимый роцилетиниб по 500 мг два раза в день является рекомендуемой дозой для последующего клинического исследования [45, 46]. Отчет об обновлении 208 пациентов, получавших роцилетиниб по 500 мг два раза в день, показал, что любой уровень гипергликемии, диареи, тошноты и удлинения QTc развился у 57,2, 56,7, 43,8 и 26,4% пациентов соответственно. Из пациентов 28,8 и 7,7% развивали степень гипергликемии 3 ≥ 3 и удлинение QTc класса ≥ 3 соответственно. ILD наблюдался у 0,5% пациентов на этом уровне дозы [47]. Неожиданная AE внезапно возникшей катаракты развилась у 21 из 40 пациентов (53%), которых лечили роцилетинибом в однобольничном исследовании, и большинство из этих пациентов потребовало хирургического ремонта [48]. В исследовании TIGER-X общая заболеваемость катарактой составила 9,1% у пациентов, получавших терапию роцилетинибом при дозе 500-750 мг два раза в день [47]. Кроме того, этот препарат имеет ограниченную активность против метастазов центральной нервной системы [49, 50]. В первом докладе исследования TIGER-X ORR роцилетиниба у пациентов, которые питались EGFR
T790M составлял 59% [45]; однако те пациенты, которые добились частичного ответа (PR) в качестве своего лучшего ответа, не имели последующего подтвержденного PR не менее 4 недель, по критериям RECIST (версия 1.1) [51]. Rociletinib не получил ускоренного одобрения УЛХ США. В официальном отчете исследования TIGER-X обновлен подтвержденный ORR до 33,9% для популяции эффективности 443 пациентов, которые получали роцилетиниб при дозах 500-750 мг два раза в день и которые централизованно подтвердили EGFR
T790M-положительный НМРЛ. PFS составляла 5,7 месяца у 208 пациентов, которые получали терапию роцилетинибом по 500 мг два раза в день. Профиль безопасности 548 пациентов из исследования показан в таблице 1 [47]. Исследование биомаркеров, в котором использовались образцы ткани, плазмы (BEAMing) и мочи (анализ методом Trovera Quantitative NGS, Trovagene, San Diego, CA, USA) для обнаружения EGFR
T790M показал чувствительность 80,9 и 81,1% на основе плазмы и мочи соответственно. Утвержденные ORR у пациентов с EGFR
T790M-положительная ткань, плазма и моча составляли 33,9, 32,1 и 36,7% соответственно. Пациенты с внутрисосудистым заболеванием M1a / M0 имели более низкую плазматическую чувствительность, чем пациенты с отдаленным метастатическим заболеванием M1b (56,8 против 88,4%, p
Текущие клинические исследования включают исследование TIGER-2 (ClinicalTrials.gov, NCT02147990), которое является исследованием фазы II, которое предназначено для проверки безопасности и эффективности роцилетиниба в качестве лечения второй линии для продвинутого мутационного положительного NSCLC EGFR, после прогрессирования на предшествующей терапии EGFR-TKI. Кроме того, исследование TIGER-3 (ClinicalTrials.gov, NCT02322281) представляет собой исследование фазы III, которое пытается сравнить роцилетиниб с одноагентной цитотоксической химиотерапией в качестве третьей линии или более поздней терапии для расширенного мутационного положительного НМРЛ EGFR у пациентов, для которых EGFR -TKI и платино-дублетная терапия потерпели неудачу. Пациенты с EGFR
T790M-положительное и неотрицательное заболевание имели право на два вышеупомянутых исследования.
Rociletinib также тестируется в установке первой линии в TIGER-1 (ClinicalTrials.gov, NCT02186301), которая представляет собой рандомизированное исследование фазы II / III, которое сравнивает роцилетиниб с эрлотинибом как лечение первой линии для продвинутого мутационного положительного NSCLC EGFR , Исследования комбинированной терапии продолжаются, например, для роцилетиниба в комбинации с траметинибом (ингибитором МЕК) (ClinicalTrials.gov, NCT02580708) или атезолизумабом (MPDL3280A, моноклональным антителом против PD-L1) (ClinicalTrials.gov, NCT02630186). Тем не менее, в мае 2016 года Clovis Oncology, Inc. объявила, что прекратила регистрацию во всех текущих спонсируемых исследованиях rociletinib и отозвала свою заявку на разрешение на маркетинг для rociletinib из европейских регулирующих органов [53].
Доклиническое исследование выявило эпителиально-мезенхимальный переход как возможный механизм резистентности к терапии роцилетинибом, который можно преодолеть с помощью ингибиторов АКТ [43]. Исследование клеточной линии выявило МЕТ-амплификацию с EGFR или без него
T790M как механизм сопротивления CNX-2006 (инструментальный состав роцилетиниба). В клеточной линии, которая имела МЕТ-амплификацию без EGFR
T790M, ингибитор тирозинкиназы MET смог преодолеть резистентность сам по себе, предполагая, что онкогенный сдвиг от EGFR до MET. Авторы описали это явление как «онкогенную замену» [54].
В клинических исследованиях механизмы резистентности к роцилетинибу были идентифицированы с использованием профилирования ДНК с циркулирующей циркуляцией плазмы (персонализированное профилирование раком посредством глубокого секвенирования, CAPP-Seq). Увеличение числа копий МИК является наиболее частым механизмом и наблюдалось у 43 (26%) пациентов в недавнем исследовании [55]. В этом исследовании устойчивые к рокетминибину ксенотрансплантаты также развивали МЕТ-амплификацию, которую можно было преодолеть с помощью терапии кризотинибом. EGFR
C797S и новый EGFR
Каждый L798I идентифицировали у одного пациента. Были также описаны другие механизмы, включающие MET, EGFR, PIK3CA, ERRB2, KRAS и RB1. Девятнадцать процентов пациентов проявили резистентные механизмы, поражающие множественные гены, что еще больше подчеркивает важность гетерогенности опухоли [55]. В другом исследовании повторная биопсия опухоли после прогрессирования на терапии роцилетинибом показала, что потеря EGFR
T790M плюс амплификация EGFR и трансформация мелких клеток были механизмами сопротивления. Авторы подчеркнули концепцию гетерогенности опухоли, в которой EGFR
T790M-положительные и -негативные опухолевые клетки могут сосуществовать в опухоли перед терапией роцилетинибом и для которых недостаточно ориентировать только один механизм сопротивления [56]. Краткий клинический отчет показал, что после развития резистентности к роцилетинибу некоторые пациенты все еще ответили на терапию осимертинибом [57].
Olmutinib (BI 1482694 / HM61713) является необратимым ингибитором киназы, который связывается с остатком цистеина вблизи киназного домена. Olmutinib показывает активность против клеточных линий и опухолей ксенотрансплантата, укрывающих EGFR
L858R / T790M и EGFR
del19, мало влияя на клеточные линии с EGFRwt [58].
На первом этапе исследования I / II (ClinicalTrials.gov, NCT01588145), проведенного в Южной Корее, пероральный прием олмутиниба в дозе 800 мг / день был определен как рекомендуемая доза для последующих исследований. В этом исследовании 76 EGFR
T790M-положительные пациенты получали терапию олмутинибом в дозе 800 мг / сут, а медиана PFS составляла 6,9 месяца. Подтвержденный ОРР составлял 54% среди 70 пациентов с оценкой, а также наблюдалась активность против метастазов центральной нервной системы [59]. Связанные с лечением АЭ из этого исследования перечислены в таблице 1. Один пациент испытал ILD и прекратил терапию, но не было АЭ гипергликемии [59].
В декабре 2015 года Олмутиниб получил прорывную терапию для НМРЛ УЛХ США. В мае 2016 года он был одобрен в Южной Корее для расширенного EGFR
T790M-положительные пациенты с НМРЛ, которые были предварительно обработаны EGFR-TKIs [60]. Что касается будущей клинической разработки олмутиниба, то в исследовании II фазы ELUXA 1 (ClinicalTrials.gov, NCT02485652) набирают пациентов с расширенным EGFR
T790M-положительный НМРЛ после предшествующей терапии EGFR-TKI. Другие глобальные планы клинических испытаний для olmutinib доступны онлайн [61]. Что касается лечения первой линии, то в Южной Корее было проведено исследование фазы II олмутиниба первой линии для продвинутого мутационного положительного НМРЛ EGFR (ClinicalTrials.gov, NCT02444819).
Приобретенную резистентность к olmutinib сообщили у пациента, у которого развилась EGFR
C797S после периода эффективной терапии олмутинибом [62].
EGF816 необратимо нацеливает EGFR путем образования ковалентной связи с Cys797. Доклинические данные показывают активность против клеточных линий и моделей ксенотрансплантации, укрывающих EGFR
L858R / T790M, EGFR
del19 / T790M, EGFR
del19 и EGFR
L858R, мало влияя на клеточные линии, несущие EGFRwt [63]. В раннем фазе клинического исследования (ClinicalTrials.gov, NCT02108964) 152 пациента были зачислены для приема перорально EGF816 при 75-350 мг / день. Общие АЭ в этом исследовании показаны в Таблице 1. Степень ≥ 3 АЭ включают сыпь (16,4%), анемию (2,6%), крапивницу (2,6%), диарею (2,0%) и усталость (2,0%). Тип и распределение кожной сыпи отличались от угревой сыпи, которая наблюдается у пациентов, получавших 1G / 2G EGFR-TKI. У двух и двух пациентов развилась реактивация вируса гепатита В и повышенный уровень липазы, соответственно [64]. Подтвержденные ORR и DCR среди 147 пациентов оценивались в 46,9 и 87,1% соответственно. Оценочная PFS для всех уровней дозы составляла 9,7 месяца [64]. В доклиническом исследовании EGF816 также показал активность против введения экзона 20 EGFR. Таким образом, исследование на ранней стадии также включало пациентов с опухолями, укрывавшими это генетическое изменение [63]. Прод
Quizartinib (AC220) является мощным ингибитором тирозинкиназы III класса III, который демонстрирует отчетливый профиль ингибирования против изоформ мутантного FLT3, -PDGFRA и -KIT
Quizartinib (AC220) is a potent second generation class III tyrosine kinase inhibitor that displays a distinct inhibition profile against mutant-FLT3, -PDGFRA and -KIT isoforms
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3637582/
Активация мутаций тирозинкиназ рецептора класса III (RTK) FLT3, PDGFR и KIT ассоциируется с множественными опухолями человека, включая гематологические злокачественные опухоли, например: системные расстройства тучных клеток (KIT), не-CML-миелопролиферативные новообразования (PDGFR) и подмножества острых лейкозов (FLT3 и KIT). Ингибиторы тирозинкиназы первого поколения (TKI) быстро интегрируются в повседневную профилактику рака. Тем не менее, расширяющийся спектр TK-мутаций, проблемы биодоступности и возникающая проблема устойчивости к первичной или вторичной резистентности TKI привели к поиску новых TKI второго поколения для улучшения целевой активности и для преодоления устойчивых клонов.
Недавно было продемонстрировано, что Quizartinib является селективным ингибитором FLT3 с превосходной фармакокинетикой и перспективной активностью in vivo в исследовании II фазы для пациентов с FLT3 ITD + AML. Анализы in vitro киназы предположили, что в дополнение к FLT3 квизартиниб также нацелен на изоформ XK класса III.
Для определения антипролиферативной и проапоптотической эффективности квизартиниба использовали различные линии клеток лейкемии FLT3 или KIT и местные бласты. Чтобы лучше сравнивать различия между изоформами мутантных киназ, мы создали изогенную клеточную линию BaF3, экспрессирующую различные изоформы FLT3, KIT или BCR / ABL. Используя иммуноблоттинг, мы исследовали влияние квизартиниба на активацию мутантных изотопов KIT или FLT3.
Киназное ингибирование (мутантных) изотопов KIT, PDGFR и FLT3 с помощью квизартиниба приводит к сильному ингибированию клеточной пролиферации и индукции апоптоза в моделях лейкемии in vitro, а также в местных лейкозах, обработанных ex vivo. Однако закономерности чувствительности сильно варьируются в зависимости от лежащей в основе (мутантной) -киназы-изоформы, причем некоторые изоформы относительно нечувствительны к этому агенту (например, мутации FLT3 D835V и KIT-кодона D816). Оценка чувствительности в изогенном клеточном фоне подтверждает прямую связь с лежащей в основе мутантной ТК-изоформой, которая далее подтверждается иммуноблоттинговыми экспериментами, демонстрирующими ингибирование киназы, согласующееся с клеточной чувствительностью / резистентностью к квизартинибу.
Quizartinib является мощным ингибитором TK второго класса класса III, но специфический, ограниченный мутацией спектр активности может потребовать скрининга мутаций до терапии.
Молекулы усиления функциональных мутаций тирозинкиназ рецептора FLT3, KIT и PDGFR класса III (RTK) играют важную роль как события, связанные с онкогенезом, в нескольких гематологических злокачественных новообразованиях. Например, мутации FLT3 преимущественно обнаруживаются в AML, ассоциирующихся с плохим прогнозом [1-4], но также сообщаются в (педиатрической) острой лимфобластной лейкемии (ALL) [5]. Мутации KIT встречаются в подавляющем большинстве системных мастоцитозов (SM) [6] и подмножествах острого лейкоза, включая фактор связывания ядра (CBF) [7] и педиатрический [8] AML. Определенные мутации FLT3 и KIT коррелируют с худшим результатом во взрослом AML [4,9,10].
Мутации PDGFR часто встречаются при миелопролиферативных расстройствах, таких как хромосомная хроническая миелобластная лейкемия в Филадельфии (ХМЛ), где PDGFR альфа или бета-предохранители с другим геном, позволяющим автоактивацию тирозинкиназы. Было описано несколько партнеров по слиянию, в том числе FIP1L1, приводящий к слиянию гена FIP1L1-PDGFRA. Эта транслокация была связана с гиперэозинофильными синдромами и мастоцитозом с эозинофилией [11-13].
Было разработано множество ингибиторов тирозинкиназы для целей RTK III класса (см. Также раздел «Обсуждение»). Эти TKI имеют переменный спектр активности против различных RTK класса III и против различных мутантных изоформ этих киназ. На сегодняшний день перевод с скамьи на постель привел к лишь скромной или короткодействующей эффективности этих ингибиторов в большинстве субъектов [14-23], и только несколько агентов получили одобрение FDA для отдельных показаний, таких как ХМЛ и ГЭК. За исключением Ph + ALL, до сих пор не одобрены TKI для лечения острого лейкоза.
Quizartinib — новый ингибитор тирозинкиназы класса III рецептора III класса с превосходными фармацевтическими свойствами и превосходным фармакокинетическим профилем по сравнению с другими агентами. Было продемонстрировано, что Quizartinib обладает высокой эффективностью и переносимостью в моделях ксенотрансплантата опухоли, которые экспрессируют мутантную киназу FLT3 ITD [24,25].
В предыдущем исследовании использовался рекомбинантный фермент в анализах in vitro-киназы, чтобы идентифицировать, что квизартиниб нацелен на соответствующие RTK класса III, такие как дикие типы и изотропные свойства KIT и PDGFR с функцией усиления [24].
Используя несколько анализов на основе клеток, мы теперь показываем, что квизартининовая терапия лейкемических клеток приводит к ингибированию мутантных изотопов KIT, PDGFR и FLT3 — с результирующим ингибированием клеточной пролиферации и индукции апоптоза. Эти эффекты наблюдаются как in vitro, так и ex vivo (первичные лейкозные бласты). Важно отметить, что сильная противоопухолевая активность наблюдалась против различных (мутированных) киназных изоформ, включая мутации FIP1L1-PDGFRA и FLT3 ITD, FLT3 TKD1 и FLT3 TKD2. В то время как некоторые изоформы мутантов-KIT и -FLT3 чувствительны к лечению визартинибом, некоторые мутации, такие как FLT3 D835V и наиболее распространенная мутация усиления функции KIT, обнаруженная в AMF CBF, KIT D816V, были относительно нечувствительны к лечению quizartinib.
Quizartinib в настоящее время находится под клиническим исследованием в FLT3 ITD и AML дикого типа. Наши данные показывают, что квизартиниб может быть привлекательным агентом для клинических исследований в других условиях, описанных здесь. Это не включало бы группу AML мутантного KIT CBF, у которой были мутации KIT D816V. Тем не менее, пациенты с AMF CBF с мутациями KIT D816Y или exon 11 или пациенты с солидными опухолями, связанными с мутациями KIT и PDGFR, такие как GIST, могут извлечь выгоду из этого агента. Анализ клинической мутации может помочь выявить людей, которые наиболее склонны реагировать на квизартиниб.
Ранее сообщалось, что Quizartinib является мощным ингибитором диализных диализных FLT3 и FLT3 ITD-киназ [24]. Структурные соображения предполагают, что квизартиниб может ингибировать другие члены семейства RTK класса III, которые часто мутируются при лейкемии или миелопролиферативных расстройствах (например, KIT и PDGFR). Эти результаты побудили нас оценить чувствительность квизартиниба в различных моделях клеточной линии лейкемии, несущих мутации RTK.
Линии клеток лейкемии человека мачты HMC1.1 (KIT V560G) и HMC1.2 (KIT V560G + D816V), линия мышиных тучных клеток p815 (несущая мутацию KIT D814Y, аналогичную мутации человеческого D816Y), линии клеток эозинофильной лейкемии EOL-1 (FIP1L1-PDGFRA), клеточная линия CBF AML Kasumi-1 (N822K), клеточная линия миелоидного лейкоза MOLM14 (гетерозиготный FLT3 ITD), M-07e (KIT) с зависимым от фактора роста фактора роста, линия клеток APL HL60 ( независимый от фактора роста, дикого типа FLT3 и KIT), клеточная линия лимфобластной лейкемии Jurkat (неизвестный активированный RTK) и клеточная линия клеточного криза CML K562 (BCR / ABL1) обрабатывались quizartinib дозозависимым образом в течение 48 часов, а клеточная антипролиферативная способность была измерена с использованием анализа на основе XTT.
Пролиферация клеточных линий с FLT3 ITD (MV4; 11, MOLM14), FIP1L1-PDGFRA (EOL-1), лиганд-стимулированный KIT (M0-7e) дикого типа или некоторые мутации KIT (KIT exon 11 V560G, HMC1. 1, Kasumi KIT exon 17 N822K) сильно ингибировался quizartinib (рис. 1). Напротив, пролиферация клеточной линии с экспрессией KON exon 11 V560G и KIT exon 17 D816V на одном и том же аллеле (HMC1.2) в основном нечувствительна к квизартинибу. Примечательно, что линия клеток мыши p815, несущая альтернативную (тирозиновую) замену в том же кодоне (KIT D814Y, что соответствует D816Y в человеческом KIT), сохранила промежуточную чувствительность к квизартинибу.
Quizartinib ингибирует клеточную пролиферацию KIT-, FLT3- или PDGFR-зависимых клеток лейкемии. Проводят серию разведения quizartinib для нескольких клеточных линий, содержащих мутант-FLT3, ABL1 или PDGFRA (1A) или изоформы мутантного KIT (1B), и оценивают пролиферацию клеток с использованием анализа на основе XTT. Чувствительность к quizartinib значительно варьировалась между тестируемыми клеточными линиями. IC50 и изоформы мутаций для всех тестируемых клеточных линий приведены в таблице 1.
В качестве экспериментальных контролей мы также тестировали квизартиниб против нескольких клеточных линий, у которых отсутствовал активированный титан III RTK (K562 [BCR-ABL1], Jurkat [неизвестный тирозинкиназный онкоген] и HL60 (неизвестный онкоген тирозинкиназы, но выраженный FLT3 дикого типа ], quizartinib не имел значимых антипролиферативных эффектов против этих клеточных линий (IC50> 10000 нМ, таблица 1).
Нелинейный регрессионный анализ IC50 (антипролиферация)
* проверено до 10 000 нМ.
В таблице суммированы оценочные значения IC50, полученные методом нелинейного регрессионного анализа для антипролиферативной активности квизартиниба в клеточных линиях лейкемии и первичных лейкозных лейках.
Клеточная линия HMC1.2 дополнительно предварительно обрабатывалась с уменьшенной сывороткой (0,5% FBS) для устранения влияния методологических аспектов на профили чувствительности. Чтобы исключить неспецифическую цитотоксичность, связанную с растворителем, клеточную линию MOLM-14 обрабатывали ДМСО, используя самую высокую концентрацию для экспериментов с дозой квизартиниба.
Только ДМСО, используемый в наивысшей концентрации в любом из экспериментов по дозировке квизартиниба, не имел значительного антипролиферативного эффекта (клеточная линия MOLM14, таблица 1).
Чтобы дополнительно показать специфичность антипролиферативного эффекта квизартиниба, мы проверили влияние этого препарата на M-07e, культивируемое в GM-CSF, а не на SCF: в то время как SCF-стимулированный M-07e был чувствителен к quizartinib (IC50 77 нМ ), Стимулированный GM-CSF M-07e был полностью устойчивым (quizartinib IC50> 10000 нМ).
Примечательно, что образцы чувствительности, наблюдаемые для различных мутантных изоформ RTK, не полностью согласуются с IC50, ранее опубликованными в анализе киназы, представленном Zarrinkar и его коллегами [24] (например, IC50KIT D816V 150 нМ против> 1500 нМ в наших анализах). Существует несколько возможных объяснений этого несоответствия. Во-первых, результаты Zarrinkar et al. были выполнены с использованием связывания лекарственных средств с рекомбинантными киназами, в отличие от ферментативного ингибирования полноразмерных клеточных киназ. Во-вторых, хотя мы не изменяли уровни FBS до введения квизартиниба (10% для клеточных линий лейкемии, 20% для нативных лейкозов) — более ранний отчет Zarrinkar et al. [24] использовали клетки, которые были предварительно сенсибилизированы под воздействием сниженных уровней сыворотки (0,5% FBS) за 12 часов до терапии.
Дезинфекция сыворотки является широко используемым методом для снижения взаимодействия сывороточных лекарств, но также имеет глубокие клеточные эффекты, включая накопление и синхронизацию клеток в G1 / G0 [26]. Более того, учитывая высокое связывание белка квизартиниба (99% связанное с белком), неудивительно, что изменения в концентрации сыворотки влияют на эффективность лекарственного средства в моделях на основе клеток.
Например, мы повторили наши эксперименты с KIT D816V-положительной клеточной линией HMC1.2, но на этот раз культивировали клетки в средах, восстановленных в сыворотке, в течение ночи до лечения quizartinib на следующий день. Это изменение экспериментальных условий глубоко изменило антипролиферативный эффект квизартиниба, поскольку IC50 для клеток, лишенных сыворотки, составлял ~ 260 нМ по сравнению с сывороточными переполненными состояниями (IC50 ~ 1700 нМ). Эффективность клеток, лишенных сыворотки, находится в диапазоне предсказанного IC50 для мутации D816V, о которой сообщает Zarrinkar et al. [24] (таблица 1).
Этот эффект был дополнительно подтвержден с использованием модели изогенных клеток, а также нативных FLT3 ITD-положительных лейкозных бластов, как описано ниже. (См. Таблицу 2 и Дополнительный файл 1: Рисунок S1 для аналогичных экспериментов с использованием нативных клеток и в Таблице 3 для экспериментов по лишению сыворотки с использованием клеток Ba / B3 FLT3 ITD и KIT D816V).
Нелинейный регрессионный анализ IC50 (апоптоз / жизнеспособность)
* проверено до 10 000 нМ.
В таблице суммированы оценочные значения IC50, полученные методом нелинейной регрессии для цитотоксической активности квизартиниба в клеточных линиях лейкемии и первичных лейкемических лейкозах. Собственные взрыватели пациентов культивировали в 20% FBS. »К« Клеточные линии культивировали в 10% FBS; местные взрыватели были культивированы в 20% FBS. Чтобы проанализировать аспекты методологии в отношении профилей чувствительности, две родные образцы пациентов FLT3 ITD + (патент 695 с недавно диагностированным AML, патент 139 с рецидивирующим AML) были совместно обработаны с уменьшенной сывороткой (0,5% FBS).
Кроме того, оценки IC50 для проапоптотического эффекта квизартиниба в чувствительной к иматинибу линии GIST-массивной опухолевой клеточной линии GIST882, содержащей мутацию K642E, и клеточной линии GIST48, нечувствительной к иматинибу, содержащей мутацию V560D в дополнение к мутации D820A в тирозинкиназе домена, показаны профили чувствительности, подобные иматинибу.
Оцененные IC50 для проапоптотического и антипролиферативного эффектов квизартиниба в модели изогенных клеток клеток Ba / F3, трансфецированных различными мутантными ТЗ
* (не достигается при испытанных дозах до 10 000 нМ).
Чувствительность квизартиниба различна и сильно различается между различными изоформами тирозинкиназы, трансфицированными в изогенный фоновый фон Ba / F3. Оцененные IC50 были рассчитаны с использованием нелинейного регрессионного анализа среднего значения по меньшей мере трех экспериментов для каждой клеточной линии.
Если применимо, IC50s лейкемических клеточных линий, содержащих подобную мутацию, предоставляются (строки справа).
Влияние сывороточной депривации на профили чувствительности квизартиниба испытывали в двух клеточных штаммах (Ba / F3 FLT3 ITD или KIT D816V): клетки культивировали в средах с пониженной концентрацией сыворотки (0,5% FBS) и обрабатывали квизартинибом на следующий день.
Связанная с растворителем неспецифическая цитотоксичность была исключена с использованием родительского штамма клеток Ba / F3, обработанного ДМСО, в наивысшей концентрации, используемой для экспериментов с дозой квизартиниба.
Экстраординарный антипролиферативный эффект, наблюдаемый в некоторых тестируемых моделях клеток, также сопровождался микроскопически конденсированными пикнотическими клетками, которые накапливались с течением времени. Это наблюдение позволяет предположить, что квизартиниб может индуцировать апоптоз посредством ингибирования (мутантного) FLT3, KIT или PDGFRA.
Используя анализ иммунофлюоресценции на основе V-аннексина, мы смогли продемонстрировать мощную дозозависимую индукцию апоптоза в нескольких клеточных линиях лейкемии:
По аналогии с продемонстрированными антипролиферативными эффектами оценка квизартиниба в нескольких клеточных линиях, у которых отсутствует активированный титан III RTK (K562, Jurkat и HL60), не выявила каких-либо значительных проапоптотических эффектов. Напротив, клеточные линии, несущие FLT3 ITD (MV4; 11, MOLM14), FIP1L1-PDGFRA (EOL-1), SCF (но не GM-CSF) -тимулированный KIT (M0-7e) дикого типа или некоторые мутации KIT ( KIT exon 11 V560G, HMC1.1, Kasumi KIT exon 17 N822K) сильно претерпели апоптоз при воздействии визартиниба с IC50s в нижних наномолярных диапазонах (таблица 2). Примечательно, что IC50s были похожи или несколько выше по сравнению с антипролиферативными эффектами, достигаемыми в этих клеточных линиях (сравните с Таблицей 1).
HMC1.2, линия сестринских клеток HMC1.1, несущая дополнительную мутацию KIT D816V, выявила полную потерю чувствительности к quizartinib во всех тестируемых дозах (рисунок 2, IC50s представлены в таблице 2). Этот вывод показывает, что отдельная изоформа мутант-KIT непосредственно настраивает чувствительность к квизартинибу. В этом контексте следует отметить, что KIT D814Y-позитивная (D816Y в человеческом KIT) мышиная клеточная линия p815 все еще способна индуцировать апоптоз с IC50 в сотнях наномолярных диапазонах (рис. 2).
Quizartinib сильно индуцирует апоптоз в отдельных моделях клеток лейкемии. Клеточные линии лейкемии, содержащие мутации FLT3, KIT или PDGFRA, обрабатывали различными дозами квизартиниба в течение 48 часов, а индукцию апоптоза измеряли с использованием аннексинового V-анализа. Типичные плотности плотности, указывающие апоптоз ранней фазы (аннексин V-позитивные клетки) или поздние фазы апоптотических клеток (пропидиум-иодидная положительность), показаны в квадрате плотности плотности квадранта. В то время как клеточная линия FLT3 ITD + MOLM14 (A) и клеточная линия мутантного KIT V560G + HMC1.1 (B) обнаруживают сильную чувствительность в нижнем наномолярном диапазоне, сестринскую клеточную линию HMC1.2 (C), укрывающую дополнительный KIT D816V, нечувствительна к лечению quizartinib. Данные, представленные в кривых зависимости доза-реакции справа, представляют среднее среднее по меньшей мере из трех отдельных экспериментов (каждый из которых нормирован на необработанные элементы управления, которые установлены на ноль). IC50 всех тестируемых клеточных линий представлены в таблице 2.
Quizartinib эффективно ингибирует клеточную пролиферацию и индуцирует апоптоз в клеточных линиях лейкемии, которые зависят от активности FLT3, KIT или PDGFRA. Однако эффективность визартиниба значительно отличается между тестируемыми клеточными линиями — от полной нечувствительности к дозам в области низких наномолекул.
Дивергентные ингибирующие эффекты могут быть обусловлены дифференциальными профилями чувствительности различных (мутантных) RTK-изоформ (сравнить данные о HMC1.1 по сравнению с клетками HMC1.2), но могут также быть скрыты дополнительными геномными аномалиями, способствующими лейкогенезу и резистентности к терапии.
Чтобы исключить клеточную специфическую нецелевую биологию, мешающую эффектам ингибирования киназы, мы тестировали мутации RTK с лейкемией в изогенном клеточном фоне: различные изоформы человека (мутантные) FLT3 или KIT стабильно трансфицировали в IL3-зависимом мышином pro B-клеточная линия Ba / F3. Активацию трансфицированных мутантных изоформ продемонстрировали путем выбора для клеток с независимой от фактора роста фактора роста IL-3. Однако клетки BaF3, экспрессирующие изотопы KIT или FLT3 дикого типа, требовали добавления соответствующего лиганда (KIT (SCF) или FLT3 (FLT3L)).
Мы смогли напрямую перекрестно проверить клинически наиболее релевантные мутации RTK при остром лейкозе (т.е. FLT3-ITD, KIT D816V / Y, BCR / ABL1), трансфецированные в изогенный фон Ba / F3 против панели лейкемических клеточных линий, несущих соответствующий RTK-мутация. Сравнение ингибирования клеточной пролиферации после лечения квизартинибом выявило сильную корреляцию между естественными и сконструированными клеточными линиями, экспрессирующими идентичные мутантные киназы (рис. 3А): клетки Ba / F3, стабильно трансфицированные вектором, кодирующим ITD FLT3, были одинаково чувствительны к квизартинибу по сравнению с человеческая FLT3 ITD положительная лейкозная клеточная линия MOLM14. И наоборот, трансфекция мутации KIT D816V сохраняла клетки Ba / F3, очень устойчивые к квизартинибу, что согласуется с данными, полученными в клеточной линии клеток лейкемии человека HMC1.2, как обсуждалось ранее. Интересно отметить, что замена замещения валина тирозином на кодоне 816 (D816Y) придавала клеткам Ba / F3 относительную чувствительность к квизартинибу — так же была положительная клеточная линия KIT D814Y p815.
Клеточные эффекты квизартиниба являются опосредуемыми тирозинкиназой (A). Quizartinib проявляет различные антипролиферативные эффекты генетически измененных клеток Ba / F3 в зависимости от трансфекции изоформы формы тирозинкиназы. Таким образом, чувствительность ингибирования пролиферации аналогична чувствительности, достигаемой в клеточных линиях естественной лейкемии, несущих подобную мутацию. Оцененные IC50 представлены в таблице 3 вместе с IC50 для проапоптотических эффектов в одном и том же сотовом контексте. (B) Наблюдаемые клеточные эффекты непосредственно связаны с эффективностью ингибирования фосфорилирования изоформ мутантных KIT и FLT3. Целые клеточные лизаты клеток Ba / F3, трансфецированные различными изоформами мутантов человека-KIT или -FLT3, были иммуноблоттированы с использованием панфосфотирозинового антитела или антитела общего KIT или -FLT3. Предварительная обработка клеток визартинибом выявила ингибирование фосфорилирования изоформным специфическим ингибированием. Примечательно, что ингибирование фосфорилирования мутации D816V было значительно снижено по сравнению с изоформами D816Y и D816F.
Это наблюдение не уникально для квизартиниба, но оно соответствует предыдущим данным для других ингибиторов тирозинкиназы KIT, таких как дазатиниб [27]. В этом контексте недавнее исследование показало структурные причины, лежащие в основе чувствительности к лекарственным средствам различных киназ мутантов-КИТ с использованием сунитиниба и мезилата иматиниба [28].
Неожиданно трансфекция BCR / ABL1 в клетки Ba / F3 не только не останавливала пролиферацию клеток, но и придавала преимущество пролиферации для обработанных квизартинибом клеток дозозависимым образом. Это наблюдение заслуживает дальнейшего изучения в отношении молекулярных механизмов.
Вместе эти данные свидетельствуют о прямом мутантном специфическом тирозинкиназе-опосредованном эффекте квизартиниба в отношении модуляции клеточной пролиферации. В таблице 3 представлена дополнительная информация о моделях чувствительности в отношении ингибирования пролиферации, а также индукции апоптоза, для нескольких изоформ мутантов-FLT3, -KIT и BCR / ABL1, трансфицированных в изогенный сотовый фон Ba / F3: Следует отметить, что трансфекция мутация доменной киназы FLT3 D835V, гомологичная D816V в KIT, обнаруживает ограниченную чувствительность к квизартинибу, что соответствует недавнему исследованию Смита и его коллег, демонстрирующему конформационное столкновение, предотвращающее правильное связывание квизартиниба с карманом связывания FLT3 [29] , Важно отметить, что наши данные показывают, что альтернативная замена аспарагиновой кислоты тирозиновым остатком (D835Y) делает клетки чувствительными, что подчеркивает наши результаты для KIT D816Y, как обсуждалось выше.
В наших экспериментах по клеточной биологии чувствительность тестируемых клеточных линий к квизартинибу была связана с ингибированием (мутантного) класса III RTK. Модели изогенных клеток подтверждают, что IC50 получены для линий клеток лейкемии, содержащих подобные мутации, что дополнительно указывает на прямое взаимодействие ингибирования тирозинкиназы и наблюдаемые антипролиферативные и проапоптотические эффекты в тестируемых клеточных линиях (а не на побочных эффектах).
Чтобы решить этот вопрос на уровне белка, мы дополнительно провели эксперименты по иммуноблоттингу для клеточных линий Ba / F3, трансфицированных мутантными киназами KIT или FLT3, и обработали квизартинибом в течение 90 минут. Действительно, чувствительность к квизартинибу, о чем свидетельствует потеря автофосфорилирования RTK, оказалась киназной специфичностью и соответствовала функциональным анализам с использованием тех же клеточных линий. Примечательно, что мутация KIT D816V, обменивающая аспарагиновую кислоту для валина на кодоне 816 и, таким образом, делая аутофосфорилированную киназу, не демонстрирует значительного снижения уровней фосфорилирования — при замене тирозина или фенилаланина на тот же кодон (D816Y или D816F), аналогично приводящий к аутоактивности киназы, доказательство чувствительности к лечению визартиниба с потерей аутофосфорилирования в наномолярных диапазонах (рис. 3B). Интересно отметить, что D816Y таким образом дефосфорилировали на гликозилированной мембране (~ 145 кДа), а также внутриклеточной изоформы (~ 125 кДа), тогда как чувствительность D816F была фактически ограничена гликозилированной изоформой.
Эти результаты согласуются с анализами жизнеспособности, представленными на рис. 3А и 3, и снова спорят о неспецифической нецелевой, но для TK-опосредованных эффектов. Более того, он подчеркивает, что образцы чувствительности TKI представляют собой не только тирозинкиназу, киназную область или специфичность кодона, но могут даже зависеть от типа аминокислотной замены у данного кодона.
Мы также оценили антипролиферативные эффекты квизартиниба с использованием нативных бластов, выделенных у пациентов с недавно диагностированным AML с FLT3- или KIT-активированным (дополнительные характеристики пациента приведены в дополнительном файле 2: Таблица S1 с онлайн-версией статьи).
Примечательно, что квизартиниб способен ингибировать пролиферацию бластов AMF ex vivo CBF и FLT3 ITD-положительных бластов в верхних наномолярных или нижних микромолярных диапазонах (таблица 1).
CBF AML ассоциируется с высокой экспрессией CD117 (то есть KIT) и / или аутоактивирующими мутациями в гене KIT [7]. Был выполнен мутационный скрининг KIT экзонов 8, 9, 11, 13 и 17. Не было обнаружено аутоактивационной мутации в нашей группе пациентов, используемой для анализов антипролиферации, что указывает на паракринную активацию KIT в группе пациентов с чувствительностью квизартиниба, как было показано ранее для ~ 50% пациентов с диким типом FLT3 / KIT [30].
У пациентов с лейкемией, ассоциированной с FLT3, антипролиферативный эффект квизартиниба был непоследовательным — с выявленными рефрактерными и чувствительными случаями. Например, один случай, чувствительный к лечению визартинибом, был у пациента с перегруппировкой MLLT3-MLL (пациент № 368). Мы не смогли обнаружить какие-либо мутации FLT3 или KIT у этого пациента, хотя кариотипирование выявило трисомию хромосомы 13 (геномное местоположение FLT3), что потенциально способствовало ответной реакции при помощи амплификации FLT3. Мощное ингибирование амплифицированного гена дикого типа FLT3 через квизартиниб недавно было показано в модели клеток лейкоза in vitro с использованием клеточной линии SEM-K2 ALL от Gunawardane и его коллег [31]. Другой из наших случаев, демонстрирующих чувствительность к quizartinib, поддерживал FLT3 ITD, но, интересно, еще два случая с FLT3 ITD были резистентны к quizartinib (пациент № 176 и № 602).
Последовательность FLT3 ITD показала, что внутреннее тандемное дублирование было расположено в бета-листе первого домена тирозинкиназы в обоих устойчивых случаях. Этот специфический класс мутантной киназы устойчив к ингибированию FLT3 мидостаурином (PKC412) и связан с плохим клиническим исходом [32-34]. Наши данные показывают аналогичный профиль чувствительности для квизартиниба против мутантных киназ FLT3 ITD-beta1.
Затем мы проверили изолированные нативные бласты, полученные от пациентов с недавно диагностированным AML, чтобы подтвердить проапоптотический эффект, наблюдаемый для квизартиниба при лейкемии in vitro и изогенных мутантных TK-моделях (IC50 для всех пациентов представлены в таблице 2, характеристики пациентов доступны в качестве дополнительного материала в Дополнительный файл 2: Таблица S1).
Один образец, взятый из аспирата костного мозга пациента с de novo AML, был идентифицирован, чтобы содержать мутацию FLD3 ITD в домене juxtamembrane гена (пациент # 601). IC50 находилась в верхнем наномолярном диапазоне, что значительно выше по сравнению с моделями FLT3 ITD in vitro. Причина этого расхождения неизвестна, но обычно наблюдается при взрыве ex vivo по сравнению с моделями in vitro [35,36]. В дополнение к приведенным выше комментариям о влиянии концентрации сыворотки на чувствительность к квизартинибу, другие геномные аномалии, приобретенные в контексте сложного цитогенетического AML, возможно, способствовали наблюдаемым эффектам в культивируемых ex vivo-бластах.
Во втором образце пациента, полученном из аспирата костного мозга пожилого пациента с MLL-ассоциированным AML, включая трисомию хромосомы 13 (приводящую к избыточному представлению гена FLT3), индуцированный апоптозом лечение quizartinib в этих клетках с IC50 ~ 3000 нМ , Из-за высокой биодоступности квизартиниба, ex vivo IC50s в нижних микромолярных диапазонах может трансформироваться в антилейкемическую активность in vivo — но это наблюдение нуждается в клинической валидации.
Подмножество проанализированных образцов нативного лейкоза представляло большую долю мертвых / апоптотических клеток в необработанных контрольных образцах. Этот скрытый традиционный анализ с помощью аннексина / PI-окрашивания проапоптотических эффектов, вызванных лечением визартинибом. Тем не менее, мы смогли оценить снижение доли жизнеспособных клеток в когорте пациентов с ОФТ CBF через 48 часов после лечения квизартинибом по сравнению с неинфекционными клетками (рис. 4 для репрезентативного анализа одного пациента). В таблице 2 приведено резюме IC50 всех тестируемых образцов.
Quizartinib снижает долю жизнеспособных клеток в образцах местных лейкозных клеток. Образцы пациентов культивировали в DMEM, содержащем 20% FBS, и обрабатывали различными концентрациями квизартиниба в течение 48 часов. (A) Показан график одного пациента. Фракцию мононуклеарных клеток вводили в FSC / SSC-разброс, и жизнеспособность была подтверждена с использованием пятна аннексина V / пропидия йодистого (PI), демонстрирующего отрицательность для аннексина V и PI. (B) Относительное снижение доли жизнеспособных клеток в ответ на квизартиниб оценивали с помощью проточной цитометрии. Справа показан график зависимости дозы от всех тестируемых концентраций квизартиниба. Оценочные IC50 с помощью нелинейного регрессионного анализа всех тестируемых образцов пациентов приведены в таблице 2.
Цитотоксический эффект квизартиниба широко варьировался. Анализ состояния мутации KIT выявил ген дикого типа для KIT у большинства пациентов — некоторые из них были чувствительны к терапии quizartinib, утверждая, что для паракринной активации KIT или FLT3 [30].
Интересно, что, как и результаты нашей клеточной линии, у двух пациентов с мутацией KIT D816V выявлена относительная нечувствительность к квизартинибу. Однако, как было предсказано нашими моделями in vitro (см. Также рисунок 3), один пациент с AMF CBF, несущий менее распространенную мутацию KIT D816Y, продемонстрировал чувствительность с IC50 для снижения жизнеспособных клеток приблизительно 1300 нМ. Примечательно, что это находится в том же диапазоне, что и для проапоптотического эффекта ex vivo-бластов недавно диагностированного пациента, не имеющего наивысших результатов лечения (пациент № 601), несущего мутацию FLT3 ITD (JM). Дополнительные характеристики пациента приведены в дополнительном файле 2: Таблица S1 с онлайн-версией статьи.
В целом, сообщаемые IC50 в нашем исследовании для местных лейкозных клеток лежат в отличие от предыдущего отчета Zarrinkar и его коллег [24], которые предложили IC50 для FLT3 ITD-положительных родных бластов в нижних наномолярных диапазонах.
В этом контексте необходимо обсудить несколько вопросов. Помимо отдельных дополнительных эффектов, связанных с конкретным ячеек-контекстом (таких как дополнительные мутации, передающие пути передачи сигнала или чувствительность к лекарственным средствам), которые могут быть затенены ТК-целевыми эффектами квизартиниба, необходимо рассмотреть пару аспектов, связанных с методологией: Как обсуждалось ранее, мы не использовали сывороточные восстановленные условия в наших анализах, но богатые сывороткой средой, содержащие 10% FBS для клеточных линий и 20% FBS для экспериментов с местными взрывными веществами. Кроме того, сообщалось, что бласты, полученные у пациентов с рецидивирующим лейкемией FLT3 ITD, могут проявлять более высокую чувствительность к ингибиторам тирозинкиназы из-за более высокой зависимости от интенсивности передачи сигналов лейкемии от FLT3 в режиме рецидива по сравнению с детекцией novo AML [37]. Примечательно, что исследование Zarrinkar оценивало эффективность к quizartinib у рецидивирующих пациентов, в то время как наша работа включала только образцы из недавно диагностированных пациентов. Мы рассмотрели эти проблемы и обратились к недавно диагностированному пациенту с AML, а также к пациенту с рецидивирующим AML, который обезвреживает мутацию FLD3 ITD, с квизартинибом дозозависимым образом. Оба образца культивировали в сыворотке (20% FBS), а также в условиях снижения сыворотки (0,5% FBS). В соответствии с нашей теорией средняя концентрация для индуцирования апоптоза была заметно снижена с помощью IC50 в области низких наномолекул в образцах, культивированных в условиях снижения сыворотки. Более того, чувствительность к квизартинибу была увеличена у рецидивирующего лейкоза. Иллюстративные диаграммы плотности на уровне AnnexinV, иллюстрирующие влияние условий культивирования на достижимые проапоптотические эффекты (~ 22% против 80% мертвых / апоптотических клеток при воздействии 10 нМ квизартиниба при культивировании в 20% или 0,5% FBS) как дополнительный файл 1: Рисунок S1; IC50 представлены в таблице 2.
Помимо острой лейкемии, мутации KIT обнаруживаются в значительной части желудочно-кишечных стромальных опухолей (GIST) [38], в подгруппах семиномов [39] и меланомы [40]. Мутации PDGFR также сообщаются в миелопролиферативных расстройствах и GIST также [38].
KIT или PDGFRA ингибирование тирозинкиназы является единственным известным вариантом лечения для продвинутого GIST. Благодаря отличным биодоступностям квизартиниба достигается более высокая концентрация в плазме по сравнению с другими ингибиторами с аналогичным профилем чувствительности. Это может быть выгодным, в частности, для лечения твердых опухолевых поражений.
Мы обработали чувствительную к иматинибу клеточную линию GIST (GIST822), содержащую мутацию KON exon 13 (K642E) и вторую клеточную линию GIST48, содержащую мутацию V560D, чувствительную к иматинибу, плюс вторичную мутацию активации, не зависящую от иматиниба (D820A), с изменяющейся концентрации квизартиниба. Из-за гораздо более медленного времени удвоения клеток in vitro линий клеток GIST по сравнению с лейкемическими клеточными линиями клетки GIST обрабатывали в течение 7 дней. На рисунке 5 показан сильный проапоптотический эффект квизартиниба, нацеленного на мутацию KIT K642E в клеточной линии GIST822, тогда как линия клеток GIST48, не чувствительная к иматинибу, не обнаружила каких-либо значительных признаков индукции апоптоза после лечения визартинибом. Рассчитанные IC50 представлены в таблице 2.
Quizartinib избирательно индуцирует апоптоз в желудочно-кишечных стромальных опухолях (GIST). Клеточная линия GIST822, чувствительная к иматинибу, содержащая мутацию KIT K642E (A) и не содержащую иматиниба клеточной линии GIST48, содержащую KIT V560D плюс дополнительную мутацию D820A, обрабатывалась quizartinib в течение 7 дней и анализировалась для индукции апоптоза. Предусмотрены точечные участки плотности квадранта, показывающие фракцию апоптотических клеток, как указано позитивностью аннексина V (квадрант LR: ранний апоптоз) и / или положительное простатическое пятно пропидия (UR: поздний апоптоз, UL: мертвые клетки), обработанный quizartinib, против лечения клетки. Оценочные IC50 с помощью анализа нелинейной дозовой регрессии представлены в таблице 2.
Ингибиторы тирозинкиназы быстро входят в клинику. Эти агенты подвергаются интенсивному клиническому исследованию для лечения острого лейкоза. Например, следующие ингибиторы исследуются для мутантных ABL1, FLT3 или KIT-ассоциированных подтипов (клинические исследования): сорафениб (например, AML: NCT00217646, NCT00373373), сунитиниб (например, AML: NCT00783653), дазатиниб (например, CBF-AML: NCT00850382 , SM: NCT00979160, Ph + ALL: NCT00103701, NCT00940524), иматиниб (например, AML: NCT00707408, NCT00744081, активированные RTK / различные опухоли: NCT00171912), lestaurtinib (например, AML: NCT00030186, NCT00079482), тандутиниб (например, AML: NCT00064584, NCT00274248 ), masitinib (например, SM: NCT00814073) и нилотиниб (например, AML: NCT01222143, SM / HES: NCT00109707).
Quizartinib (ранее AC220), N- (5-трет-бутил-изоксазол-3-ил) -N ‘- {4- [7- (2-морфолин-4-илэтокси) имидазо [2,1-b ] [1,3] бензотиазол-2-ил] фенил} мочевины дигидрохлорид, является новым тирозинкиназным ингибитором класса III с перспективными in vitro, а также in vivo активностью против дикого типа FLT3 и мутантными изоформами [24]. По сравнению с другими ингибиторами тирозинкиназы в оценке для лечения подтипов острой лейкемии, quizartinib обеспечивает превосходную биодоступность при более длинных и более высоких концентрациях в плазме, достигнутых in vivo [25], тем самым более эффективно нацеливая и подавляя активированные киназы.
Ранние данные исследования II фазы квизартиниба в рефрактерных или рецидивирующих пациентах FLT3 ITD + выявили приемлемый профиль безопасности. Ранее был представлен промежуточный анализ 62 пациентов (29 женщин, 33 мужчин) (Cortes, EHA Annual Meeting 2011, № 1019): Общие побочные эффекты, связанные с наркотиками, для пациентов с оценкой были тошнота, удлинение QTc, рвота, усталость, дисгезия, анорексия, фебрильная нейтропения, диарея и диспепсия. Тяжелые неблагоприятные события, связанные с наркотиками, у более чем 15% пациентов были лихорадочной нейтропенией и бессимптомной пролонгацией QTc 3 степени. 85% пациентов оценивались по эффективности: показатель CR (CRc = CR + CRp + CRi) составил 43% (1 CRp, 22 CRi), а показатель PR составлял 28%. Следует отметить, что у пациентов, резистентных к любой предшествующей терапии, у 56% пациентов был CRc, а у 22% был PR в ответ на лечение quizartinib. 26% пациентов были связаны с концепциями аллогенной трансплантации.
Теперь мы сообщаем, что квизартиниб не только нацелен на дикого типа FLT3 и мутантные киназы ITD [24], но также сильно ингибирует клеточную пролиферацию и индуцирует апоптоз клеток, экспрессирующих широкий спектр других клинически значимых изотопов RTK класса (мутантного) RTK, связанных с различными заболеваниями, включая педиатрический и взрослый лейкоз (FLT3 и KIT), GIST, семинома и меланома (KIT), а также миелопролиферативные новообразования, связанные с эозинофилией (PDGFRA). Таким образом, чувствительные к Quizartinib мутации были обнаружены в juxtamembrane (ITD), но также в доменах тирозинкиназы (TKD I-K663Q, TKD II-D835Y) FLT3, а также в KIT JM- (V560G) и TK-доменах ( D816Y). Однако, как и во всех ингибиторах тирозинкиназы, квизартиниб имеет отчетливый профиль потенции против различных аутоактивирующих мутантных RTK-изоформ, а некоторые мутации в TKD FLT3 (DDD-D835V, B1-sheet ITD) и KIT (D816V) оказались устойчивыми к квизартинибу. Устойчивость мутаций FLT3 ITD, расположенных на листе бета-1 первого TKD, ранее была показана для других TKI [32-34]. В отличие от транскрипции слияния BCR-ABL1, демонстрирующей устойчивость к квизартинибу, мутация FIP1L1-PDGFRA слияния показала необычайную чувствительность. В AMF CBF, который часто зависит от КТ-опосредованной (усиленной функции) трансдукции сигнала, квизартиниб продемонстрировал различную антипролиферативную и цитотоксическую эффективность в клетках in vitro и ex vivo лейкемии — в некоторых случаях в пределах низкого наномолярного диапазона FLT3 ITD ( JM) положительные образцы. Однако было показано, что наиболее распространенная мутация KIT в AMF CBF, замещающая валин для аспарагиновой кислоты на кодоне 816 (KIT D816V), была в основном нечувствительной к квизартинибу в клеточных линиях in vitro и ex vivo лейкемии, первичных миелобластах и в изогенной Ba / F3 — при замещении остатка тирозина (D816Y) сохранялась определенная чувствительность к квизартинибу. Поэтому генотипирование тирозинкиназы может стать предпосылкой для клинического использования этого агента.
Более того, исходя из наших данных, мы предполагаем, что квизартиниб может быть перспективным агентом в твердых опухолях, связанных с мутациями KIT, такими как GIST или меланома: в дополнение к благоприятной активности против киназ KIT, экспрессированных в GIST (и других новообразованиях мутантных KIT ), превосходная фармакокинетика с беспрецедентными достижимыми концентрациями в плазме может быть выгодной для целенаправленных массивных опухолей опухоли, которые нарушают потребление наркотиков. Таким образом, наши данные открывают новые возможности для клинического исследования, и дальнейшее тестирование эффективности квизартиниба в этих условиях является оправданным.
Следует отметить, что IC50 в наших исследованиях были согласованы между всеми используемыми моделями клеток, но выше по сравнению с предыдущим докладом [24]. Это явление наблюдалось во всех анализах и, следовательно, скорее всего, из-за методологических причин, как мы проиллюстрировали несколькими экспериментальными данными:
В то время как индивидуальные дополнительные эффекты, специфичные для конкретного сотового контекста (такие как дополнительные мутации), не могут быть полностью исключены, чтобы иметь скрытые профили чувствительности в некоторых моделях клеток, методологические различия, скорее всего, будут объяснять большую часть выявленных расхождений: в отличие от предыдущих исследований, (0,5% FBS), мы использовали среду, заполненную сывороткой, во всех анализах (10% FBS для клеточных линий, 20% для местных бластов).
Более того, данные от Zarrinkar и его коллег были основаны на лечении рефрактерных / рецидивированных образцов AML [24] — напротив, образцы, проверенные в наших анализах, были выделены у пациентов с недавно диагностированным заболеванием. Однако считается, что рефрактерные / рецидивирующие образцы пациентов имеют более высокую чувствительность к TK-ингибированию из-за более высокой зависимости от соответствующей онкогенной (мутантной) тирозинкиназы [37].
Чтобы подчеркнуть наши теории, мы предоставили существенные экспериментальные данные, используя богатые сывороткой и культуральные условия, богатые сывороткой, в клеточных линиях и нативных бластах, полученных от недавно диагностированных, а также рецидивирующих пациентов для лечения квизартинибом дозозависимым образом. Высокая корреляция уровней сыворотки и достижимых IC50 была подтверждена во всех моделях клеток. Кроме того, было проверено лечение новых диагностированных или рецидивированных образцов ВИЧ-положительной лейкемии FLT3 с положительной реакцией на лейкемию, более высокий профиль чувствительности к рецидиву AML. Таким образом, данные должны быть интерпретированы в этом контексте.
Резюмируя, наши результаты показывают, что квизартиниб является перспективным средством для лечения нескольких гематологических и твердых опухолей человека. Однако из-за специфичного для визартиниба мутации ограниченного спектра активности может потребоваться скрининг мутаций тирозинкиназы, чтобы идентифицировать пациентов, которые, скорее всего, будут реагировать на терапию визартинибом.
Клеточная линия клеточного кризиса CML K562 была щедрым подарком доктора Лопеса, Университета здоровья и науки штата Орегон, Портленд, штат Орегон. FLT3 ITD-положительная линия клеток AML MOLM14 (гетерозиготная для ITD DFREYE в положении аминокислоты 593-598 [2]) была получена через сотовый центр Fujisaki (Окаяма, Япония). Острая линия миелоидной лейкемии HL60, KIT N822K положительная линия CBF AML клеток Kasumi1 [41] и FLT3 ITD положительная линия AML клеток MV4-11 были получены из Немецкой коллекции микроорганизмов и клеточных культур (DSMZ). Клетки MV4-11 являются гемизиговыми для ITD аминокислот VDFREYEYDH в положении 592-601 [42]. Зависимая от IL-3-зависимая мышиная про-B-клетка Ba / F3, положительная клеточная линия FIP1L1-PDGFRA EOL-1 [43], у пациента с эозинофильным лейкозом после гиперэозинофильного синдрома [44] и p815 линия тучных клеток была получена из Американской коллекции типовых культур (ATCC, Manassas, VA). Муссонная изоформа мыши KIT D814Y, экспрессированная клеточной линией p815 [45], гомологична мутации человеческого KIT D816Y. Клеточную линию клеток M-07e, зависимую от фактора роста гемопоэтических клеток человека, любезно предоставили доктор Х.Броксмайер (отдел микробиологии и иммунологии, онкологический центр Вальтера, Медицинская школа Университета Индианы, Индианаполис, Инн.). Линия тучных клеток HMC-1.1 человека, экспрессирующая изометрию мутантного мутантного домена KIT (V560G), была предоставлена доктором Баттерфилдом (Отдел аллергических заболеваний, отдел внутренней медицины, клиника Майо, Рочестер, MN). Спонтанно возникающий субклон линии клеток HMC-1.1, HMC-1,2, который имеет дополнительную мутацию в цикле активации (D816V) [46], любезно предоставлен доктором Акином (Лаборатория аллергических заболеваний, Национальный институт аллергии и Инфекционные болезни, NIH, Bethesda, MD). Все клеточные линии культивировали в средах RPMI, содержащих 10% FBS.
Клетки M-07e культивировали с использованием рекомбинантного колониестимулирующего фактора гранулоцитов-макрофагов человека (GM-CSF, R & D, Minneapolis, MN) в качестве добавки к росту, как описано ранее [47]. Отрицательность для микоплазменного заражения была подтверждена с использованием плюрипотентного набора для испытания на микоплазму ПЦР (AppliChem, Дармштадт, Германия). Последовательность подтверждена клеточной линией, содержащей мутант KIT, FLT3 или BCR-ABL1.
Линии желудочно-кишечного тракта опухоли стромы GIST822, несущие мутацию KON exon 13 (K642E) и GIST48, содержащую мутацию V560D, чувствительную к иматинибу, плюс вторичную мутацию активации, не зависящую от иматиниба (D820A), были щедро предоставлены доктором Коппом (University of Тюбинген) [48,49].
Направленный мутагенез и генерация клеточных линий Ba / F3, стабильно экспрессирующих мутантные штаммы KIT D816V, D816Y, D816F, FLT3 ITD, D835Y, D835Y, K663Q и FLT3, были выполнены, как описано ранее [50-52].
KIT. КДНК Wildtype, клонированная в плазмидный вектор pJP1563, была получена из плазмидного репозитория DNASU в Институте биодизайна Аризонского государственного университета (ASU). Трансфекцию липофекции в родительскую клеточную линию Ba / F3 проводили для стабильного экспрессии KIT Wildtype путем двойного отбора для резистентности к неомицину (pCMVneo), бластицидина (pJP1563) или гентамицина (G418, всех других плазмид) и IL-3-независимого роста. Линию клеток Wildtype Ba / F3 KIT культивировали с использованием рекомбинантного человеческого фактора стволовых клеток (SCF / KITLigand, R & D, Minneapolis, MN) в качестве добавки роста.
Маломолекулярные соединения квизартиниба получали из Ambit Biosystems и растворяли в ДМСО для создания 10 ммоль / л исходных растворов и хранили при -20 ° C.
Анти-KIT и анти-FLT3 кроличьи поликлональные антитела использовались при разведении от 1: 5000 до 1: 1000. Антитела анти-фосфотирозина p-KIT (Tyr568 / 570 и Tyr703), антитела p-FLT3 (Tyr 589/591) и пан-антифосфотирозиновое антитело (клон PY20) вводились при разведениях от 1: 100 до 1: 2000 (все от Cell Signaling Технологии).
В соответствии со стандартными протоколами (LI-COR Biosciences, Lincoln, NE) были получены инфракрасные конъюгированные с антителами к краснутой кошки антитела против кроликов или против мышиных антител для использования в системе обнаружения изображений LI-COR®.
Аспират костного мозга и образцы периферической крови у пациентов с AML были собраны в 5000 U гепарине после информированного согласия и одобрения комитета по этике Университета Тюбингена или Ульма. Моноядерные клетки были выделены фракционированием градиента плотности Ficoll Hypaque [35]. Дополнительные образцы острой миелоидной лейкемии были щедро предоставлены германо-австрийским биогенным лейкозом AMLG (AMLSG) (характеристики пациентов, обобщенные в дополнительном файле 2: таблица S1). Нативные взрывы ex vivo культивировали в среде DMEM, содержащей 20% FBS.
Клеточные гранулы лизировали 100-150 мкл буфера для лизиса белка (50 ммоль / л Tris, 150 ммоль / л NaCl, 1% NP40, 0,25% дезоксихолата с добавленными ингибиторами апротинина, AEBSF, лейпептина, пепстатина, ортованадата натрия и пирувата натрия , соответственно, коктейли ингибитора фосфатазы «2» и «1» или «3» (Sigma, St. Louis, MO). Белок из клеточных лизатов (от 75 до 200 мкг белка) использовали для анализа цельного клеточного белка после денатурации с помощью анализов западного иммуноблота используя систему BioRad Criterion (разделение белков SDS-PAGE в 3-8% или 10% полиакриламидных гелях с последующим электроблоттингом на нитроцеллюлозные мембраны). Неспецифическое связывание блокировалось путем инкубации блотов в обезжиренном сухом молоке или BSA. Первичные антитела инкубировали для один час или ночь, а затем несколько промывок забуференного Трисом соляного раствора (TBS), содержащего 0,005% Твин 20. Соответствующее вторичное антитело применяли в течение 30 минут с последующим несколькими промывками. Реактивные белки антител были обнаружены с использованием L I-COR Odyssey® флуоресцентная оптическая система (LI-COR Biosciences, Lincoln, NE).
Индукцию апоптоза при лечении квизартинибом анализировали в серии разбавления (0-5000 нМ) и транслокацию фосфатидилсерина из внутреннего наружного листка плазматической мембраны в качестве раннего индикатора апоптоза анализировали с использованием анализа на основе апринтина V (Immunotech, Марсель, Франция) и проточный цитометр FACScalibur®, нагруженный программным обеспечением для анализа CellQuest® (BD, Heidelberg, Germany) [27,47].
Доля взрывов ex vivo лейкемии не была доступна для индукции анализов апоптоза с использованием окрашивания Appin V / PI из-за более высокого процента апоптозных клеток в необработанной отрицательной контрольной популяции. Тем не менее, анализы жизнеспособности оценивали с использованием экспериментов по цитометрии FSC / SSC-flow с затвором на популяции живых клеток. Снижение жизнеспособных клеток в присутствии квизартиниба измеряли через 48 часов после лечения quizartinib.
Клетки добавляли к 96-луночным планшетам при плотностях 50 000 клеток на лунку. Quizartinib добавляли в серии разбавления (0-5000 нМ) и пролиферацию измеряли в течение 48 часов с использованием внутренней соли 2,3-бис [2-метокси-4-нитро-5-сульфофенил] -2H-тетразолия-5-карбоксанилида ( XTT) (Sigma, MO) [27,47].
Геномную ДНК выделяли с использованием набора для очистки ДНК DNeasy® (Qiagen, Hilden, Germany). Состояние мутации FLT3 оценивали с помощью стандартных стандартных методов ПЦР. Состояние мутации KIT экзона 8, 9, 11, 13 и 17 анализировали с помощью ПЦР с последующим двунаправленным секвенированием. Наборы праймеров следующие: KIT exon 8, смысл: GCT GAG GTT TTC CAG CAC TC; KIT exon 8, антисмысловой: AAT TGC AGT CCT TCC CCT CT; KIT exon 9, смысл: AGCCAGGGCTTTTGTTTTCT; KIT exon 9, антисмысловой: CAGAGCCTATAAACATCCCCTTA; KIT exon 11, смысл: CCTTTGCTGATTGGTTTCGT; KIT exon 11, антисмысловой: AAACAAAGGAAGCCACTGGA; KIT exon 13, смысл: GTTCCTGTATGGTACTGCATGCG; KIT exon 13, антисмысловой: CAGTTTATAATCTAGCATTGCC; KIT exon 17, смысл: GGTTTTCTTTTCTCCTCCAACC; KIT exon 17, антисмысловой: GGATTTACATTATGAAAGTCACAGG.
Ингибирование пролиферации или доля апоптотических / жизнеспособных клеток оценивали на диаграммах разведения. Для вычисления IC50 с использованием Prism® (GraphPad Software, Inc., LaJolla, CA) или программного обеспечения MasterPlex® (Hitachi Solutions, Tokyo, Japan) был выполнен нелинейный 4-параметрический регрессионный анализ медианного эффекта.
ОМЛ: острый миелоидный лейкоз; ВСЕ: Острый лимфоидный лейкоз; ХМЛ: Хронический миелоидный лейкоз; FIP1L1: FIP1-подобный 1; FLT3: FMS-подобная тирозинкиназа 3; GIST: Желудочно-кишечная стромальная опухоль; HES: гиперэозинофильный синдром; IC50: концентрация, достаточная для достижения 50% ингибирования; IL3: интерлейкин 3; ITD: внутреннее дублирование тандем; KIT: v-kit Харди-Цукерман 4 гомологический онкоген кошачьей саркомы; PDGFRA: рецептор рецептора фактора роста, полученный из тромбоцитов; RTK: тирозинкиназы рецептора класса III; СМ: системный мастоцитоз; TKD1 / 2: домен тирозинкиназы 1, соответственно. 2; TKI: ингибитор тирозинкиназы; XTT: 2,3-Бис- (2-метокси-4-нитро-5-сульфофенил) -2Н-тетразолий-5-карбоксанилид-натриевая соль.
Автор (ы) заявляют, что у них нет конкурирующих интересов.
Доктор КМКС задумал дизайн исследования, провел эксперименты, проанализировал и интерпретировал данные и составил рукопись. ФА: в основном участвовал в разработке и приобретении экспериментов, анализе данных и помогал составлять рукопись. Доктор Х. Д. задумал исследование, проанализировал и интерпретировал данные и критически пересмотрел рукопись. Д-р К. Д. участвовал в приобретении данных, анализе и интерпретации данных и критической переработке рукописи. Д-р MCH разработал эксперименты, проанализировал и интерпретировал данные и критически переработал рукопись. Dr. MMS задумал дизайн исследования, проанализировал и интерпретировал данные и подготовил рукопись. Все авторы прочитали и утвердили окончательную рукопись.
Поддержка грантов частично Фондом Deutsche Krebshilfe (MMS, KKS), Программа IZKF медицинского факультета Тюбингена (MMS) и Программа стипендий Carreras (KKS), грант от Общества лейкемии и лимфомы (MCH) и Merit Review Грант Департамента по делам ветеранов (MCH). Мы подтверждаем поддержку Deutsche Forschungsgemeinschaft и Публичного фонда открытого доступа Университета Тюбингена.
Родные FLT3 Положительные дозы пациентов с ИДД были обработаны квизартинибом дозозависимым образом и культивировались в условиях восстановления сыворотки (0,5%) по сравнению с сывороточными (20%). Клетки инкубировали в течение 48 часов, а индукцию апоптоза измеряли с использованием анализа на основе аннексина V. Показаны графики Densitiy для quizartinib при 10 нМ. Оцененные IC50 представлены в таблице 2.
Нажмите здесь для файла
Дополнительная информация о характеристиках пациента доступна на веб-сайте МОЛЕКУЛЯРНОГО РАКА (см. «Дополнительный файл 2 Таблица S1 / Дополнительный файл1 Рисунок S1»).
Нажмите здесь для файла
Мы благодарим доктора Барбару Иллинг и Кэтрин-Анриетт Раш за отличную помощь в сборе данных.
Албитиниб | Капсулы рег. №: ЛП-003723 | |||
Алеценза® | Капсулы рег. №: ЛП-005109 Дата перерегистрации: 12.02.20 | Произведено: EXCELLA (Германия) Выпускающий контроль качества: F.Hoffmann-La Roche (Швейцария) | ||
Афинитор® | Таб. 10 мг: 30, 60 или 90 шт. рег. №: ЛСР-002260/10 Дата перерегистрации: 08.10.19 | |||
Афинитор® | Таб. 2.5 мг: 30 шт. рег. №: ЛП-001690 Дата перерегистрации: 16.09.19 | |||
Афинитор® | Таб. 5 мг: 30, 60 или 90 шт. рег. №: ЛСР-002260/10 Дата перерегистрации: 08.10.19 | |||
Босулиф | Таб., покрытые пленочной оболочкой, 100 мг: 28 шт. рег. №: ЛП-002711 Таб., покрытые пленочной оболочкой, 500 мг: 28 шт. рег. №: ЛП-002711 | Произведено: EXCELLA (Германия) | ||
Вотриент® | Таб., покр. пленочной оболочкой, 200 мг: 30 или 90 шт. рег. №: ЛСР-008805/10 Дата перерегистрации: 22.11.16 Таб., покр. пленочной оболочкой, 400 мг: 30 или 60 шт. рег. №: ЛСР-008805/10 Дата перерегистрации: 22.11.16 | Первичная, вторичная упаковка и выпускающий контроль качества: Glaxo Operations UK (Великобритания) Glaxo Wellcome (Испания) | ||
Генфатиниб | Таб., покр. пленочной оболочкой, 100 мг: 20 , 60, 100 или 180 шт. рег. №: ЛСР-008978/10 Дата перерегистрации: 08.02.13 | Производство и первичная упаковка: Laboratorio VARIFARMA (Аргентина) | ||
Генфатиниб | Таб., покр. пленочной оболочкой, 400 мг: 30 шт. рег. №: ЛСР-008978/10 | Производство и первичная упаковка: Laboratorio VARIFARMA (Аргентина) | ||
Гефитиниб | Таб., покр. пленочной оболочкой, 250 мг: 10 или 30 шт. рег. №: ЛП-003076 Дата перерегистрации: 05.03.19 | |||
Гефитиниб | Таб., покр. пленочной оболочкой, 250 мг: 30 шт. рег. №: ЛП-005823 | |||
Гефитиниб | Таб., покр. пленочной оболочкой, 250 мг: 30 шт. рег. №: ЛП-006318 | |||
Гефитиниб Канон | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-005528 | |||
Гефитиниб-Натив | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-004258 | |||
Гефитиниб-ТЛ | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-005458 | |||
Гиотриф® | Таб., покр. пленочной оболочкой, 20 мг: 30 шт. рег. №: ЛП-002275 Дата перерегистрации: 12.10.18 Таб., покр. пленочной оболочкой, 30 мг: 30 шт. рег. №: ЛП-002275 Дата перерегистрации: 12.10.18 Таб., покр. пленочной оболочкой, 40 мг: 30 шт. рег. №: ЛП-002275 Дата перерегистрации: 12.10.18 Таб., покр. пленочной оболочкой, 50 мг: 30 шт. рег. №: ЛП-002275 Дата перерегистрации: 12.10.18 | |||
Гистамель | Капсулы рег. №: ЛП-002066 | |||
Глемихиб® | Таб., покр. пленочной оболочкой, 100 мг: 100 или 120 шт. рег. №: ЛП-004236 Таб., покр. пленочной оболочкой, 400 мг: 100 или 120 шт. рег. №: ЛП-004236 | |||
Гливек® | Капс. 100 мг: 24, 36, 48, 96, 120 или 180 шт. рег. №: П N013241/01 | |||
Гливек® | Капс. 50 мг: 30 шт. рег. №: П N013241/01 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 100 мг: 30 шт. рег. №: ЛП-004202 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 140 мг: 30 шт. рег. №: ЛП-004202 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 20 мг: 60 шт. рег. №: ЛП-004202 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 50 мг: 60 шт. рег. №: ЛП-004202 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 70 мг: 60 шт. рег. №: ЛП-004202 | |||
Дазатиниб-Натив | Таб., покр. пленочной оболочкой, 80мг: 30 шт. рег. №: ЛП-004202 |
Терапия с применением ингибитора тирозинкиназы (TKI)
Ингибиторы тирозинкиназы (TKI) — это тип таргетной терапии. TKI представлены в виде таблеток, принимаемых внутрь. Таргетная терапия выявляет и атакует определенные типы раковых клеток, нанося меньший ущерб нормальным клеткам. При ХМЛ TKI нацелены на аномальный белок BCR-ABL1, который вызывает неконтролируемый рост клеток ХМЛ и блокирует его функцию, вызывая гибель клеток ХМЛ.
Четыре препарата TKI одобрены в качестве начальной терапии (терапии первой линии) при хронической фазе ХМЛ.Этих препаратов
- мезилат иматиниба (Gleevec®)
- Дазатиниб (Sprycel®)
- Нилотиниб (Тасигна®)
- Босутиниб (Bosulif®).
«Первоначальное» лечение — это первое лечение болезни. Если первое лечение не работает из-за непереносимости (непереносимые побочные эффекты) определенного лекарственного средства или лекарственной устойчивости (ХМЛ не реагирует на препарат) во время терапии, пробуют второй вариант лечения. Если и первоначальное лечение, и последующее лечение (вторая линия) не работают, пациенту может быть предложен третий вариант лечения (третья линия).
В случае резистентности и / или непереносимости препаратов второго ряда другим вариантом TKI для лечения является Понатиниб (Iclusig®).
Пациенты с сердечными заболеваниями или заболеваниями периферических сосудов в анамнезе нуждаются в тщательном и частом наблюдении во время лечения TKI. Это случается редко, но у некоторых пациентов, получавших TKI, развиваются серьезные побочные эффекты со стороны сердца, включая застойную сердечную недостаточность и удлинение интервала QT (изменения ритма сердцебиения). Многие пациенты, у которых развиваются неблагоприятные сердечные эффекты, также имеют другие проблемы со здоровьем и факторы риска, включая пожилой возраст и сердечные заболевания в анамнезе.
Для получения информации о лекарствах, перечисленных на этой странице, посетите раздел «Список лекарств».
Наркотиков взаимодействий
Определенные лекарства, травяные добавки и даже продукты питания могут влиять на то, как TKI работают в организме. Кортикостероиды, противосудорожные препараты, антациды и травяная добавка зверобой могут снизить эффективность некоторых ИТК. Некоторые антибиотики, противогрибковые препараты и продукты из грейпфрута могут повышать уровень ИОТ в крови до высоких, небезопасных уровней.
TKI могут иметь серьезные или даже смертельные взаимодействия с другими лекарствами, отпускаемыми по рецепту, безрецептурными лекарствами, добавками и даже некоторыми продуктами питания. Пациенты всегда должны предоставлять своим врачам список любых лекарств, травяных добавок и витаминов, которые они принимают, чтобы быть уверенными в том, что принимать продукты вместе с их TKI безопасно. И важно спросить врача о любых продуктах, которых следует избегать.
Соблюдение TKI
Пациентам важно принимать ИДК в соответствии с предписаниями врача.Приверженность пероральной терапии означает, что пациент
- Принимает правильную дозу лекарства
- Принимает лекарство в нужное время
- Никогда не пропускает дозу
- Никогда не принимает дополнительную дозу
- Не принимает дозу вместе с продуктами питания, жидкостями или другими запрещенными лекарствами
У большинства пациентов TKI могут контролировать ХМЛ. Пациентам не следует пропускать приемы, чтобы уменьшить побочные эффекты лекарства.Пациенты должны сообщать своим врачам о любых побочных эффектах, которые они испытывают. Врачи могут предоставить поддерживающее лечение, чтобы помочь пациентам справиться с этими побочными эффектами.
Пациенты должны принимать лекарства в соответствии с предписаниями, чтобы получить наилучший ответ. Плохое соблюдение режима приема лекарств — основная причина неадекватной реакции на назначенное лечение. Пациентам не следует прекращать прием лекарств и принимать меньше предписанного количества, если они не следуют указаниям врача.Принятие меньшего количества, чем предписано, может повлиять на эффективность лекарства и может привести к неблагоприятным результатам лечения.
Ремиссия без лечения
Ремиссия без лечения (СКР) достигается, когда у пациента, прекратившего терапию ИТК, сохраняется основной молекулярный ответ (КПК) и нет необходимости возобновлять терапию. Пациенты в хронической фазе ХМЛ, которые принимали TKI не менее трех лет и которые имеют стабильный, продолжительный и глубокий молекулярный ответ (DMR) в течение не менее двух лет, считаются хорошими кандидатами для прекращения терапии TKI и попытки лечения: свободная ремиссия (СКР).В настоящее время рекомендации Национальной комплексной онкологической сети (NCCN) рекомендуют подходящим пациентам попробовать СКР при условии обеспечения надлежащего, высококачественного, хорошо регулируемого и сертифицированного мониторинга.
Рекомендации пациента
Зачем учитывать СКР? Есть много потенциальных преимуществ ремиссии без лечения для пациентов с ХМЛ. Они могут включать комбинацию лечения, стоимости и факторов, связанных с пациентом. Отказ от лечения может:
- Снижает риск побочных эффектов TKI и лекарств в будущем.Хотя TKI обычно хорошо переносятся, они вызывают побочные эффекты, которые могут повлиять на здоровье и качество жизни
- Помощь молодым пациентам женского пола, которые рассматривают возможность создания семьи и которым могут потребоваться периоды без лечения
- Упростите ежедневный прием лекарств
- Исключите доплаты пациентов и расходы на страхование для продолжающегося лечения, сократив расходы как для пациентов, так и для системы здравоохранения.
Синдром отмены TKI. После прекращения терапии TKI у некоторых пациентов может появиться скелетно-мышечная боль или появиться сыпь. Как правило, с болью можно справиться с помощью безрецептурных обезболивающих. Синдром отмены TKI был зарегистрирован примерно у 10–30% пациентов, прекративших терапию TKI.
Проблемы пациентов. Основное беспокойство, которое испытывают пациенты по поводу прекращения терапии TKI, — это страх рецидива или прогрессирования CML. Задавайте вопросы и запрашивайте дополнительную информацию.Убедитесь, что на все вопросы даны ответы, прежде чем принимать решение о продолжении.
Для получения дополнительной информации о ремиссии без лечения загрузите или закажите бесплатный информационный бюллетень «Ремиссия без лечения».
Ссылки по теме
- Загрузите или закажите бесплатные буклеты Общества лейкемии и лимфомы
- Для получения информации о лекарствах, упомянутых на этой странице, посетите Списки лекарств.
Список ингибиторов BTK (ингибитор тирозинкиназы Bruton)
Другие названия: Ингибитор тирозинкиназы Bruton, ингибитор тирозинкиназы Bruton
Ингибиторы тирозинкиназы Bruton (BTK) ингибируют фермент BTK, который является важной частью сигнального пути B-клеточного рецептора.Некоторые B-клеточные лейкозы и лимфомы используют передачу сигналов B-клеточного рецептора для роста и выживания.
Следовательно, использование ингибиторов BTK при раке состоит в том, чтобы заблокировать эту передачу сигналов и вызвать гибель клеток (рака).
Для чего используются ингибиторы тирозинкиназы брутона (BTK)?
Ингибиторы тирозинкиназы Bruton (BTK) эффективны против:
Не все ингибиторы BTK одобрены для всех этих условий.
Как действуют ингибиторы тирозинкиназы брутона (BTK)?
Чтобы объяснить, как работают ингибиторы BTK, мы сначала должны объяснить, что такое В-клетка и сигнальный путь рецептора В-клеток.
B-клетки, также известные как B-лимфоциты, представляют собой тип лимфоцитов, которые представляют собой тип лейкоцитов. Поверхность каждого В-лимфоцита содержит около 10 000 белковых комплексов, называемых мембраносвязанными антителами. Антитела также могут называться иммуноглобулинами.
Все мембраносвязанные антитела для одной конкретной B-клетки одинаковы; однако между B-клетками антитела незначительно различаются по своей вариабельной части, что означает, что существует большое разнообразие антител, связанных с мембраной B-клеток (несколько миллиардов).
Это разнообразие означает, что если чужеродный захватчик (также называемый антигеном) проникает в организм, например, болезнетворные бактерии или вирус, там будет B-клетка с правильными мембраносвязанными антителами, доступными для присоединения к ней. Как только В-клетка связывается с антигеном, она активируется с помощью определенных Т-клеток и начинает клонировать себя, создавая сотни тысяч копий, и они начинают дифференцироваться, принимая на себя определенные роли. Например, клетки памяти, которые позже распознают один и тот же антиген, и эффекторные клетки, которые начинают продуцировать уникальные антитела для этого конкретного захватчика.
B-клетки также содержат рецепторы B-клеток. Эти рецепторы играют решающую роль в биологии нормальных В-клеток и способствуют связыванию, интернализации и процессингу антигена. Стимуляция B-клеточных рецепторов вызывает активацию множества ферментов, включая тирозинкиназу Bruton (BTK), которая является частью сигнального пути B-клеточного рецептора, который взаимодействует с другими клетками иммунной системы и приводит к пролиферации и активации B-клеток.
Исследования 1970-х годов показали, что В-клетки могут способствовать росту некоторых экспериментальных опухолей у мышей.С тех пор исследования показали, что B-клетки составляют до 25% всех клеток при некоторых видах рака. Проникающие В-клетки также играют важную роль в развитии рака груди и яичников.
Ингибируя фермент BTK, участвующий в передаче сигналов рецептора B-клеток, ингибиторы BTK вызывают отслоение злокачественных B-клеток из участков рака в кровь, что приводит к гибели клеток. Ингибирование BTK снижает пролиферацию злокачественных В-клеток и снижает выживаемость злокачественных клеток. Однако действие ингибиторов БТК распространяется также на доброкачественные клетки, что объясняет их побочные эффекты.
Каковы побочные эффекты ингибиторов брутон-тирозинкиназы (BTK)?
Ингибиторы
BTK были связаны с некоторыми серьезными побочными эффектами. Ибрутиниб был первым ингибитором БТК, одобренным в 2013 году, но последующие ингибиторы БТК связаны с меньшим количеством побочных эффектов.
Ибрутиниб связан с высоким риском кровотечения (примерно у 50% пациентов развивается незначительное кровотечение), фибрилляции предсердий (16% пациентов) и высокого кровяного давления (почти у 40% пациентов с ХЛЛ, принимающих ибрутиниб, развивается высокое кровяное давление).
Устойчивость к ибрутинибу также является проблемой. Это означает, что лекарство больше не работает должным образом, и обычно это происходит из-за приобретенной мутации. У людей, у которых ибрутиниб прогрессировал, но которые резко его прервали, наблюдается более агрессивное клиническое прогрессирование заболевания, поэтому рекомендуется совмещение отмены ибрутиниба с последующей линией терапии. Показатели излечения от ибрутиниба достигают 18%.
Акалабрутиниб имеет более благоприятный профиль безопасности, чем ибрутиниб: высокое кровяное давление встречается у 7% пациентов, нейтропения — у 11% и пневмония — у 10%.Сильное кровотечение встречается нечасто. Акалабрутиниб может быть предпочтительным у пациентов, которые не могут переносить ибрутиниб из-за сопутствующих условий или токсичности. Однако монотерапия акалабрутинибом ассоциируется с низкой частотой излечения (около 2%), и комбинированная терапия может быть более эффективной.
Наиболее частые побочные эффекты, связанные с занубрутинибом, включают нейтропению (14%), анемию (8%), нейтропению (7%) и пневмонию (4%). Высокое кровяное давление было зарегистрировано только у 3% пациентов, а фибрилляция предсердий — только у 1.9%, в основном у лиц с предрасполагающими факторами риска. Незначительные кровотечения наблюдались у 2,5% пациентов. Сообщалось о показателях излечения 3% при применении монотерапии занубрутинибом.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Границы | Ингибиторы тирозинкиназы EGFR нового поколения для лечения рака легких с мутантным EGFR за пределами первой линии
Введение
За последнее десятилетие научные достижения постепенно улучшили результаты для пациентов, у которых диагностирован рак легких, вызванный целевыми мутациями онкогенов.Первый онкогенный фактор немелкоклеточного рака легкого (НМРЛ) был открыт в 2004 году с идентификацией активирующих мутаций в киназном домене рецептора эпидермального фактора роста ( EGFR ) у пациентов с резкими реакциями на тирозин EGFR . ингибиторы киназ (TKI) (1–3). EGFR Мутации составляют 10–17% случаев НМРЛ в Северной Америке и Европе и 30–50% НМРЛ в странах Азии и наиболее распространены среди пациентов с аденокарциномой, НМРЛ и легких или некурящих в анамнезе (4, 5) .TKI первого поколения — гефитиниб (Iressa ® , AstraZeneca, Лондон, Великобритания) и эрлотиниб (Tarceva ® , F. Hoffmann-La Roche, Базель, Швейцария) и TKI второго поколения афатиниб (Giotrif ® ). , Boehringer Ingelheim, Ingelheim, Германия) показали более высокую частоту ответа (RR), улучшение выживаемости без прогрессирования (PFS) и качества жизни по сравнению со стандартной химиотерапией на основе платины у пациентов с хорошим статусом работоспособности (0–2), опухоли которых имеют активирующая (сенсибилизирующая) мутация EGFR (6–13).
Эти данные установили, что EGFR TKI являются препаратом выбора для пациентов с недавно диагностированным EGFR -мутантным распространенным НМРЛ. Следует отметить, что ни одно из этих исследований не продемонстрировало преимущества с точки зрения общей выживаемости (ОВ) из-за высокого уровня кроссовера. Однако незапланированный объединенный анализ ОВ пациентов, включенных в исследования фазы III LUX-Lung 3 или LUX-Lung 6, продемонстрировал пользу ОВ для афатиниба по сравнению с химиотерапией на основе платины у пациентов, чьи опухоли содержат мутаций EGFR Del19 по сравнению с EGFR Мутации L858R: 27,3 против 24,3 месяцев, соответственно [отношение рисков (HR) 0,81; 95% доверительный интервал (ДИ) 0,66–0,99; p = 0,037] (14). Однако это преимущество не было подтверждено в фазе IIb LUX-Lung 7, разработанной для непосредственного сравнения афатиниба и гефитиниба в терапии первой линии пациентов с мутантным НМРЛ EGFR (15). К сожалению, у большинства пациентов наблюдается прогрессирование после 12 месяцев лечения ИТК первой линии, и выявлены многочисленные механизмы приобретенной устойчивости.Среди них наиболее распространенным механизмом (~ 50% случаев) является приобретение миссенс-мутации в экзоне 20 EGFR , мутации T790M (p.Thr790Met) (16).
До недавнего времени стандартная химиотерапия была основным вариантом лечения после прогрессирования заболевания. Для пациентов, начавших химиотерапию, роль EGFR обслуживания ИТК остается спорным. Ретроспективный анализ показал, что до 23% пациентов испытывают обострение заболевания после прекращения терапии TKI (17), что побудило многих клиницистов продолжить введение EGFR TKI при начале химиотерапии.Было высказано предположение, что некоторые клоны в устойчивом раке остаются чувствительными к ингибированию EGFR и что отмена TKI может «высвободить» эти клоны с последующими неблагоприятными исходами. Рандомизированное исследование IMPRESS III фазы предоставило первые проспективные данные для ответа на этот клинический вопрос. Пациенты, прогрессирующие на гефитинибе первой линии, были рандомизированы для получения цисплатина-пеметрекседа с гефитинибом или плацебо. Испытание не подтвердило преимущества сохранения TKI EGFR при сопоставимых RR и PFS в двух группах (18).Недавно был представлен окончательный анализ ОС; пациенты в группе гефитиниба имели значительно более низкую ОВ по сравнению с группой плацебо (13,4 против 19,5 месяцев, HR = 1,44, p = 0,016), что подтверждает пагубный эффект поддержания ингибирования EGFR . Следует отметить, что этот пагубный эффект преимущественно наблюдался среди пациентов, опухоли которых содержали мутацию T790M, обнаруженную через циркулирующую опухолевую ДНК (цтДНК; HR = 1,49; 95% ДИ, 1,02–2,21) (19).
На сегодняшний день было разработано множество TKI третьего поколения EGFR , нацеленных как на сенсибилизирующие мутации EGFR , так и на EGFR T790M.В этом обзоре мы описываем доступные постпрогрессивные методы лечения, включая осимертиниб (ранее известный как AZD9291) как единственный препарат, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Европейским агентством по лекарственным средствам (EMA) для лечения пациентов с метастазами EGFR T790M + NSCLC, которые прогрессировали на или после терапии EGFR TKI (20), и другие необратимые TKI нового поколения EGFR , находящиеся в стадии клинической разработки (таблица 1).
Таблица 1. EGFR Поколения TKI для метастатического EGFR -мутант NSCLC .
Идентификация приобретенного механизма устойчивости к первому / второму поколению EGFR TKI
Для пациентов, у которых болезнь прогрессирует на гефитинибе, эрлотинибе или афатинибе, понимание основных механизмов устойчивости имеет важное значение для выбора оптимального лечения после прогрессирования заболевания. На сегодняшний день повторные биопсии являются стандартом лечения; однако этот подход имеет некоторые ограничения — не все пациенты поддаются этой процедуре, и не все прогрессирующие поражения доступны для биопсии.Кроме того, появляется все больше свидетельств того, что единичная биопсия может не точно отражать внутреннюю гетерогенность резистентной опухоли. Жидкая биопсия — эффективная альтернатива тканевой биопсии. Этот подход, который был подтвержден (21), представляет собой суррогатный источник ДНК и представляет собой новую стратегию генотипирования опухолей, в основном применимую во время прогрессирования для пациентов с мутацией EGFR (22–24). В случаях, когда мутация T790M выявляется в периферической крови, лечение TKI EGFR третьего поколения оправдано (25).
Помимо T790M, были идентифицированы и другие механизмы устойчивости. В глобальном масштабе они могут быть классифицированы как изменения целевого гена (например, амплификации EGFR и мутации, такие как T790M), активация нижестоящего обходного сигнального пути (например, амплификации MET и HER2 или мутации в BRAF, PIK3CA ), и фенотипические изменения (включая трансформацию мелкоклеточного рака легкого и переход эпителия в мезенхиму) (26, 27).
Ориентация на EGFR T790M + NSCLC
Второе поколение EGFR TKIs
После открытия, что T790M является основным механизмом резистентности к TKI EGFR первого поколения, гефитинибу и эрлотинибу, было разработано много новых препаратов, нацеленных на T790M. Хотя ингибиторы EGFR второго поколения, такие как нератиниб, афатиниб и дакомитиниб, проявляли многообещающую анти-T790M активность в лабораторных условиях, их клиническая активность в отношении T790M + NSCLC была низкой, с RR менее 10% среди пациентов, устойчивых к гефитинибу или эрлотинибу (28 –30).Кроме того, наблюдалась повышенная токсичность, в основном кожная и пищеварительная (таблица 1), из-за ингибирования EGFR дикого типа при более низких концентрациях, чем те, которые необходимы для ингибирования T790M. Таким образом, на сегодняшний день ни один из агентов второго поколения не считается эффективным монотерапевтическим средством у пациентов, прогрессирующих на TKI первого поколения.
На основании доклинических наблюдений, что афатиниб плюс цетуксимаб (моноклональное антитело против EGFR ) преодолел T790M-опосредованную резистентность (31), эта комбинация была оценена в испытании фазы Ib, в котором участвовали 126 пациентов с тяжелым предварительным лечением с прогрессирующим EGFR — мутантный НМРЛ, у которого развилась устойчивость к эрлотинибу / гефитинибу.Общая частота ответа (ЧОО) составила 29% и была сопоставима для опухолей T790M + и T790M- (32 против 25%), а медиана PFS составила 4,7 месяца (95% ДИ, 4,3–6,4) (32). Однако двойное ингибирование EGFR привело к повышенной токсичности с различными нежелательными явлениями (НЯ) 3-4 степени (в основном, сыпью, диареей и утомляемостью), о которых сообщалось до 46% пациентов (32). В настоящее время открыто рандомизированное исследование фазы II / III (NCT02438722) афатиниба в сочетании с цетуксимабом в сравнении с одним афатинибом у не получавших лечения пациентов с распространенным мутантным НМРЛ по EGFR .
Третье поколение EGFR TKIs
Многие ингибиторы EGFR третьего поколения в настоящее время последовательно разрабатываются для более эффективного воздействия на мутацию T790M. В отличие от TKI второго поколения, поскольку эти препараты проявляют повышенную специфичность к T790M и, следовательно, к мутантному EGFR по сравнению с EGFR дикого типа EGFR , они хорошо переносятся, что приводит к небольшому количеству побочных эффектов для EGFR дикого типа. Среди них осимертиниб (AZD9291) первым получил одобрение FDA и EMA в ноябре 2015 года и феврале 2016 года соответственно для лечения метастатического НМРЛ EGFR T790M +, который прогрессировал после терапии EGFR TKI или после нее.В таблице 2 представлены доступные данные об эффективности TKI нового поколения EGFR .
Таблица 2. Эффективность ингибиторов тирозинкиназы третьего поколения (TKI) в активации мутаций рецептора эпидермального фактора роста ( EGFR ) и у пациентов с T790M + NSCLC .
Осимертиниб (AZD9291; Tagrisso ® )
Осимертиниб представляет собой моноанилинопиримидиновое соединение, которое действует как ковалентный EGFR TKI. В анализах рекомбинантного фермента EGFR осимертиниб показал сильную активность против различных мутаций EGFR (L858R, L858R / T790M, делеция экзона 19 и делеция экзона 19 / T790M) и продемонстрировал почти в 200 раз большую эффективность против L858R-T790M. тип EGFR .Осимертиниб метаболизируется с образованием как минимум двух циркулирующих метаболитов: AZ5104 и AZ7550. В биохимических анализах AZ7550 имел профиль активности и селективности, сравнимый с осимертинибом, хотя AZ5104 показал более высокую эффективность против делеций экзона 19, мутантов T790M (как ~ 8-кратных), так и дикого типа (~ 15-кратных) EGFR (33) . Его фармакокинетическая экспозиция существенно не различалась между азиатскими и неазиатскими пациентами, демонстрируя минимальный пищевой эффект (34). Кроме того, данные клинического фармакокинетического исследования (NCT02163733) показали, что на экспозицию осимертиниба не влияло одновременное введение омепразола (35).Таким образом, в отличие от TKI первого и второго поколений, агенты, изменяющие pH желудочного сока, могут использоваться одновременно с осимертинибом без ограничений.
Исследование фазы I / II повышения дозы осимертиниба (AURA, NCT01802632) было проведено у пациентов с местнораспространенным или метастатическим НМРЛ с мутацией EGFR , прогрессирующим на TKI EGFR первого или второго поколения. Пациенты не были предварительно отобраны в соответствии со статусом T790M (36). В исследование были включены 253 пациента, которые получали осимертиниб в пяти дозах от 20 до 240 мг в день, распределенных между двумя когортами, когортами с увеличением и увеличением дозы.Среди 31 пациента, включенных в когорту с увеличением дозы, не было выявлено токсичности, ограничивающей дозу (DLT), и не была достигнута максимальная переносимая доза (MTD). Еще 222 пациента получили лечение в пяти группах увеличения дозы. Мутация EGFR -T790M была обнаружена в опухолях 138 пациентов (62%) в когортах расширения. Из 253 пациентов, получавших все уровни доз, 239 были оценены на предмет ответа. ЧОО и уровень контроля заболевания (DCR) во всей популяции составляли 51% [95% ДИ, 45–58%] и 84% [95% ДИ, 79–88%], соответственно.Среди 138 пациентов с централизованно подтвержденной мутацией EGFR -T790M, 127 пациентов подлежали оценке на предмет ответа. Результаты были значительно лучше в популяции EGFR T790M + по сравнению с пациентами с опухолью T790M- с ЧОО 61% [95% ДИ, 52–70%] по сравнению с 21% [95% ДИ, 12–34%], DCR 95% [95% ДИ, 90–98%] по сравнению с 61% [95% ДИ, 47–73%] и медиана ВБП 9,6 месяцев [95% ДИ, 8,3 — не достигнуто] по сравнению с 2,8 месяцами [95% CI, 2.1–4.3], соответственно (36). ДЛТ не наблюдалось ни на одном уровне доз.Наиболее частыми НЯ, в основном 1-2 степени, были диарея (47%), кожная токсичность (сыпь / угри, 40%), тошнота (22%) и анорексия (21%). При увеличении частоты и тяжести НЯ (сыпь, сухость кожи и диарея) по отношению к ингибированию EGFR дикого типа при более высоких уровнях доз (160 и 240 мг), 80 мг в день была выбрана в качестве рекомендуемой дозы для дальнейшей клинической практики. испытания (36).
Недавно были обновлены данные по эффективности и безопасности, полученные в когорте пациентов с централизованно подтвержденным НМРЛ T790M, в группе пациентов с расширенной дозой 80 мг (дата отсечения: 4 января 2016 г.).Из 63 пациентов 61 пациент подлежал оценке на предмет ответа. ЧОО и DCR составляли 71% [95% ДИ, 57–82%] и 93% [95% ДИ, 84–98%], соответственно, при медиане ВБП 9,7 месяцев [95% ДИ, 8,3–13,6] ( 37).
Суточная доза 80 мг, оцененная в расширенной когорте фазы II T790M + исследования AURA (описанном выше), была оценена в дополнительном исследовании фазы II «AURA2» (NCT02094261), предназначенном для пациентов с подтвержденным мутантом EGFR T790M + местнораспространенным или метастатический НМРЛ, прогрессирующий на одобренном EGFR TKI.Был проведен предварительно запланированный объединенный анализ обоих исследований. Среди 411 пациентов (201 из расширения AURA и 210 из AURA2) 397 подлежали оценке. ЧОО и DCR составили 66% [95% ДИ, 61–71%] и 91% [95% ДИ, 88–94%] соответственно. Медиана ВБП составила 11,0 [95% ДИ, 9,6–12,4] месяцев при средней продолжительности ответа 12,5 месяцев [95% ДИ, 11,1 месяца — не поддается расчету] (37).
Осимертиниб также продемонстрировал активность в препаратах первой линии. Недавно были представлены данные двух расширенных групп пациентов с распространенным НМРЛ с мутацией EGFR , ранее не получавшими лечения.Шестьдесят пациентов получали осимертиниб 80 мг ( n = 30) или 160 мг ( n = 30) один раз в сутки, и все они подлежали оценке. Подтвержденная ЧОО составила 77% [95% ДИ, 64–87%] с ДИ 98% [95% ДИ, 89–100%]. Медиана ВБП составила 19,3 месяца [95% ДИ, от 13,7 до не поддается расчету] (38).
Продолжается ряд испытаний осимертиниба в различных условиях фазы III. Исследование фазы III FLAURA (First-Line-AURA; NCT02296125) с участием пациентов с НМРЛ с мутированным EGFR , ранее не получавших лечения, было разработано для сравнения осимертиниба в дозе 80 мг в сутки идействующий стандарт лечения гефитиниб или эрлотиниб. Исследование AURA3 (NCT02151981) — открытое рандомизированное исследование второй линии, предназначенное для сравнения осимертиниба с дуплетной химиотерапией на основе платины у пациентов с EGFR T790M + местнораспространенным или метастатическим НМРЛ. В пресс-релизе от 18 июля 2016 года AstraZeneca объявила, что исследование AURA3, в котором участвовало более 400 пациентов, достигло своей основной конечной точки, продемонстрировав более высокую выживаемость после лечения по сравнению со стандартной химиотерапией на основе платины.
В условиях адъюванта текущее исследование ADAURA (ADjuvant-AURA; NCT02511106) представляет собой двойное слепое рандомизированное плацебо-контролируемое исследование, оценивающее эффективность и безопасность осимертиниба по сравнению с плацебо у пациентов с EGFR -мутированной стадией IB– IIIA NSCLC после полной резекции опухоли. Результатов пока нет.
Роцилетиниб (CO-1686)
Роцилетиниб — еще один пероральный необратимый мутант-селективный ингибитор часто мутировавших форм EGFR , включая T790M, с минимальной активностью против EGFR дикого типа в доклинических исследованиях (39).Фаза I / II исследования рокилетиниба (TIGER-X; NCT01526928) была проведена у пациентов с мутантным НМРЛ EGFR с приобретенной устойчивостью к TKI EGFR первого или второго поколения (40). В расширенной (фаза II) части исследования пациенты с T790M + NSCLC получали рокилетиниб в дозах 500, 625 или 750 мг два раза в день. На момент составления отчета в исследование было включено 130 пациентов. МПД не идентифицирован. Наиболее частым НЯ 3 степени была гипергликемия, встречающаяся у 20 из 92 пациентов (22%), получавших терапевтические дозы.Среди 46 пациентов с T790M +, подлежащих оценке, ЧОО составила 59% [95% ДИ, 45–73%]. Для 17 оцениваемых пациентов с болезнью T790M– ЧОО составила 29% [95% ДИ, 8–51%] (40).
В ноябре 2015 года Clovis Oncology выпустила пресс-релиз, содержащий данные объединенного анализа TIGER-X и TIGER-2 (NCT02147990), еще одного исследования фазы II, посвященного изучению рокилетиниба второй линии у пациентов с EGFR T790M + NSCLC, прогрессирующим на минимум на ингибитор EGFR . Среди 325 пациентов ЧОО (диапазон доз 500–750 мг два раза в сутки) составляла 30.2% [95% ДИ, 25,2–35,5%]. ЧОО составляла 32% [95% ДИ, 25-40%] и 23% [95% ДИ, 14-34%] у пациентов, получавших 625 мг ( n = 170) и 500 мг ( n = 79) соответственно. Средняя продолжительность ответа на две лечебные дозы составила 8,8 и 9,1 месяца соответственно. Из-за различного RR, независимый обновленный анализ был проведен у пациентов (популяции, планирующие лечение), включенных в исследование TIGER-X, подтвердив ORR 45% [95% ДИ, 31-60%] и 17% [95% ДИ, 4–41%] среди пациентов с заболеваниями T790M + и T790M– соответственно (41).Таким образом, Clovis решила прекратить участие во всех продолжающихся исследованиях рокилетиниба, включая исследование фазы III TIGER-3 (NCT02322281), и отозвала свою заявку на одобрение регулирующих органов в Европейском союзе.
Ольмутиниб (BI-1482694 / HM61713; Olita ™)
Ольмутиниб представляет собой пероральный мутант-специфичный TKI EGFR , активный против мутантных изоформ EGFR , включая T790M, при сохранении EGFR дикого типа (42). Испытание фазы I / II HM-EMSI-101 (NCT01588145) было проведено для оценки безопасности, переносимости, фармакокинетики и предварительной активности олмутиниба у корейских пациентов с НМРЛ, предварительно обработанными EGFR TKI (43).Пациенты получали олмутиниб в дозах от 75 до 1200 мг / сут. ЧОО составила 58,8% у 34 пациентов, получавших олмутиниб в дозе более 650 мг. Наиболее частыми DLT были желудочно-кишечные симптомы и повышение уровней аспартатаминотрансферазы, аланинаминотрансферазы, амилазы и липазы. Рекомендуемая доза для фазы II составляла 800 мг / сут. В части II исследования были включены 76 пациентов с центрально подтвержденным Т790М + НМРЛ, 70 из которых подлежали оценке на предмет ответа. ЧОО составляла 61%, а медиана ВБП ( n = 76) составляла 6.9 месяцев [95% ДИ, 5,36–9,49]. Наиболее частыми НЯ, связанными с приемом лекарств (всех степеней), были диарея (59%), зуд (42%), сыпь (41%) и тошнота (39%) (44). Эти данные подтверждают предыдущие предварительные результаты испытаний, представленные на Азиатском конгрессе Европейского общества медицинской онкологии в декабре 2015 г. (45). Эти результаты легли в основу присвоения FDA статуса прорывной терапии в 2015 году и первого разрешения на лечение пациентов с EGFR T790M + НМРЛ в Южной Корее в 2016 году.Следуя многообещающим ранним клиническим данным, Boehringer Ingelheim запустила программу клинических испытаний ELUXA для изучения олмутиниба в качестве монотерапии в различных условиях, а также в сочетании с другими противоопухолевыми препаратами. Тем не менее, из-за неожиданного увеличения кожной токсичности 3/4 степени (эпидермолиза) в предыдущих исследованиях компания Boehringer решила окончательно остановить разработку этого препарата.
ASP8273
ASP8273 представляет собой еще один пероральный необратимый TKI, который ингибирует киназную активность мутаций EGFR , включая T790M, с ограниченной активностью против EGFR дикого типа (46).Кроме того, было показано, что ASP8273 подавляет передачу сигналов через ERK и Akt. Этот агент проявил активность в мутантных клеточных линиях EGFR , устойчивых к другим TKI EGFR , включая осимертиниб и рокилетиниб (47). ASP8273 оценивался в рамках открытого исследования фазы I / II (NCT02192697) на безопасность и эффективность (48). Тридцать японских пациентов были включены в когорты фазы I повышения дозы по семи уровням доз (25-600 мг / день), а 15 пациентов были включены в когорты увеличения ответа по четырем уровням доз (100-400 мг / день).Статус T790M был 49% положительным, 13% отрицательным и 38% неизвестным, соответственно. Ответы наблюдались у пациентов, включенных в когорты ≥100 мг / день. Частичные ответы были достигнуты у 50% (18/36) всех подлежащих оценке пациентов и 80% (12/15) пациентов с T790M + NSCLC (включая подтвержденные и неподтвержденные). Наиболее частыми НЯ (всех степеней) были диарея (56%), тошнота (31%), рвота (31%) и тромбоцитопения (31%). Исходя из переносимости и предварительной противоопухолевой активности, рекомендованная доза для фазы II была выбрана 300 мг один раз в сутки (48).Безопасность, переносимость и противоопухолевая активность ASP8273 300 мг / день у пациентов с положительной мутацией NSCLC EGFR и ранее получавших EGFR TKI были недавно представлены в общей сложности у 63 пациентов, в том числе у семи пациентов, получавших дозу: в части эскалации, 18 — в расширении ответа, 19 — в рекомендуемой дозовой части фазы II и 19 — в когорте влияния еды (49). Большинство опухолей (> 90%) были положительными на мутацию T790M на основании местного тестирования. Все пациенты, кроме одного (98%), ранее получали EGFR TKI, причем эрлотиниб был наиболее распространенным ингибитором.Среди 63 пациентов, получавших ASP8273 300 мг, ЧОО составила 30% [95% ДИ, 19,2–43,0%], а медиана ВБП составила 6,0 [95% ДИ, 4,1–9,8] месяцев. Для подгрупп с опухолями T790M + ЧОО, оцененные с помощью местного или центрального тестирования, были одинаковыми: 31% [95% ДИ, 19,5–44,5%] и 29% [95% ДИ, 13,2–48,7%], соответственно. Медиана ВБП для пациентов с T790M + (местное тестирование) составляла 6,0 месяцев [95% ДИ, 5,3–9,8] и 6,8 месяцев [95% ДИ, от 5,5 месяцев до не подлежащих оценке] для пациентов с T790M + (центральное тестирование). Наиболее частыми НЯ, связанными с приемом лекарств (все степени), были диарея (48%), тошнота (27%), гипонатриемия (19%), парестезия (14%) и рвота (13%).Шесть пациентов (10%) прекратили лечение из-за связанной с лечением токсичности (49). На основании этого исследования доза ASP8273 300 мг в день была выбрана для недавно начатого большого ( n = 600) международного рандомизированного исследования III фазы (SOLAR) для сравнения клинической эффективности и безопасности / переносимости ASP8273 с эрлотиниб или гефитиниб в качестве начального лечения распространенного мутантного НМРЛ EGFR (NCT02588261).
Назартиниб (EGF816)
Назартиниб представляет собой новый необратимый мутант-селективный ингибитор EGFR , который специфически нацелен как на активирующие мутации EGFR (L858R, Del19), так и на устойчивую мутацию T790M, сохраняя при этом EGFR дикого типа (50).NCT02108964 (EGF816X2101) — это первое исследование назартиниба фазы I / II на людях у пациентов с местно-распространенным или метастатическим НМРЛ с мутацией EGFR . Недавно были представлены обновленные результаты этапа I фазы увеличения дозы. Пациентам назначали назартиниб один раз в сутки в дозах от 75 до 350 мг. На дату окончания исследования 29 января 2016 г. было пролечено 152 пациента в семи когортах (51). Среди них 147 пациентов подлежали оценке на предмет ответа. Подтвержденная ЧОО составила 46.9% [95% ДИ, 38,7–55,3%], а DCR составлял 87,1% [95% ДИ, 80,6–92,0%]. Расчетная медиана ВБП для всех уровней доз составила 9,7 месяцев [95% ДИ 7,3–11,1]. Среди 69 пациентов с подтвержденным ответом на дату отсечения оценочная средняя продолжительность ответа составила 9,5 месяцев [95% ДИ, 9,2–14,7]. Наиболее частыми токсическими эффектами (всех степеней) были сыпь (54%), диарея (37%) и зуд (34%). Интересно, что высыпания, наблюдаемые в исследовании, имели тенденцию иметь другой паттерн, расположение и гистологию, чем те, которые наблюдались с другими TKI EGFR , которые нацелены на EGFR дикого типа.Диарея была наиболее частым НЯ степени 3/4 (16%), и следует отметить, что частота диареи и сыпи имела тенденцию к увеличению с увеличением доз назартиниба (51). Часть фазы II, выполненная в шести когортах, продолжается (Рисунок 1). Кроме того, препарат исследуется в связи с INC280, специфическим ингибитором MET (на основе потенциального пути ускользания для TKI EGFR третьего поколения) в продолжающемся исследовании фазы Ib / II у пациентов с прогрессирующим EGFR . мутантный НМРЛ (NCT02335944) и ниволумаб, моноклональное антитело против PD-1, в испытании фазы II у пациентов с мутантным EGFR / T790M + NSCLC, у которых прогрессировал TKI первой линии EGFR (NCT02323126).
Рис. 1. Дизайн исследования назартиниба у пациентов с EGFR m + NSCLC (NCT0210896) . EGFR m +, EGFR положительный по мутации; МПД — максимально переносимая доза; каждые сутки, один раз в день; НМРЛ, немелкоклеточный рак легкого; RP2D, рекомендуемая доза для фазы 2.
Авитиниб (AC0010)
Авитиниб — еще один ингибитор нового поколения EGFR , который, как и вышеупомянутые агенты, нацелен на активацию мутаций, активирующих EGFR , преодолевая индуцированную T790M мутацию с ограниченной активностью против EGFR дикого типа.Клинические испытания были начаты в Китае и США параллельно с использованием авитиниба в качестве терапии второй линии у пациентов с НМРЛ, прогрессирующих на TKI EGFR первого поколения, и которые приобрели мутацию привратника T790M. Два испытания, посвященных оценке безопасности, переносимости, фармакокинетики и противоопухолевой активности авитиниба, продолжаются; исследование фазы I / II (NCT02274337) у пациентов с запущенным НМРЛ, прогрессирующих на предшествующей терапии препаратом EGFR TKI, и исследование фазы I (NCT02330367), предназначенное для определения MTD и / или рекомендованной дозы фазы 2 у ранее леченного мутанта EGFR пациент с НМРЛ с мутацией, устойчивой к T790M.
PF-06747775
PF-06747775 — еще один низкомолекулярный ингибитор EGFR T790M с минимальной активностью против EGFR дикого типа. Он изучается в клинических испытаниях фазы I / II (NCT02349633) у пациентов с распространенным НМРЛ с мутациями EGFR (Del19 или L858R ± T790M). Результатов пока нет.
HS-10296
HS-10296 представляет собой низкомолекулярный ингибитор EGFR -активирующих мутаций и T790M-устойчивых мутаций с ограниченной активностью против EGFR дикого типа.Открытое многоцентровое исследование фазы I / II HS-10296 с повышением дозы, увеличением дозы и расширением когорт у пациентов с местнораспространенным или метастатическим НМРЛ, у которых прогрессирование произошло после предшествующей терапии агентом EGFR TKI, в настоящее время набирает участников. (NCT02981108).
Третье поколение EGFR TKI в метастазах центральной нервной системы (ЦНС)
Данные о заболеваемости метастазами в мозг и лептоменингеальных метастазов у пациентов с НМРЛ с мутацией EGFR получены из ретроспективных когорт, что составляет 24 и 9%, соответственно.Гефитиниб, эрлотиниб и афатиниб обладают впечатляющей внутричерепной активностью с ОР 60–80% (52, 53). Однако для пациентов с прогрессированием ЦНС на этих препаратах первого и второго поколения дальнейшие эффективные методы лечения ограничены. Среди TKI EGFR третьего поколения осимертиниб был единственным ингибитором, демонстрирующим устойчивую регрессию опухоли как на доклинических, так и на клинических моделях (54). Осимертиниб лучше проникает через гематоэнцефалический барьер мышей, чем гефитиниб, рокилетиниб или афатиниб, и индуцировал устойчивую регрессию опухоли в модели метастазов в мозг мыши с мутантным EGFR PC9 в клинически значимых дозах, в то время как рокилетиниб не приводил к регрессии опухоли (55) .Активность ЦНС была подтверждена в расширенной когорте исследования фазы II исследования AURA (NCT01802632) и исследовании фазы II исследования AURA2 (NCT02094261) (56). Исследование BLOOM фазы I (NCT02228369) было разработано с целью впервые оценить безопасность, переносимость, фармакокинетику и предварительную противоопухолевую активность двух TKI третьего поколения EGFR , орсиметиниба и AZD3759. AZD3759 был первым TKI EGFR , первоначально разработанным для эффективного преодоления гематоэнцефалического барьера для борьбы с метастазами в ЦНС у пациентов с мутантным НМРЛ EGFR (57, 58).Когорта осимертиниба в исследовании включала 21 пациента из Азии с запущенным или метастатическим НМРЛ, несущим мутацию L858R ( n = 13) или делецию экзона 19 ( n = 9), и подтвержденный диагноз лептоменингеальных метастазов по положительным результатам в спинномозговой жидкости. цитология. На момент начала исследования мутация T790M была обнаружена в спинномозговой жидкости у двух пациентов и в плазме крови у шести. Пациенты получали осимертиниб в дозе 160 мг / сут. Все пациенты подлежали оценке эффективности; семь (33%) имели подтвержденный радиологический ответ, девять (43%) имели стабильное заболевание, а улучшение неврологической функции было отмечено у пяти (24%) пациентов (59).Предварительные результаты когорты AZD3759 были недавно представлены (60). Двадцать девять пациентов с распространенным НМРЛ с мутантным EGFR и метастазами в головной мозг, включая лептоменингеальные метастазы, получали лечение в когортах с возрастающей дозой 50–500 мг два раза в день (BID). Фармакокинетический анализ показал отличное проникновение в ЦНС при соотношении 1: 1 с плазмой. Профиль переносимости AZD3759 соответствовал эффектам класса EGFR TKI и включал сыпь 3/4 степени (7%), зуд (7%), диарею (3%) и акне (3%).MTD составлял 300 мг BID, но исследователи рекомендовали 200 мг BID для фазы II дозирования. AZD3759 продемонстрировал обнадеживающую внутричерепную противоопухолевую активность. Среди 21 пациента с поддающимися измерению метастазами в головной мозг 11 продемонстрировали уменьшение опухоли в целевом поражении головного мозга при дозах AZD3759 ≥50 мг BID. В этой группе было шесть частичных ответов (три подтвержденных, три неподтвержденных). Среди 22 пациентов с поддающимися измерению экстракраниальными поражениями у восьми наблюдалось уменьшение опухоли с одним неподтвержденным частичным ответом (60).Основываясь на этих многообещающих результатах, в исследовании BLOOM продолжается набор пациентов в когорты AZD3759 с расширением головного мозга и лептоменингеальных метастазов.
Механизмы устойчивости к третьему поколению EGFR TKIs
Как и в случае с TKI EGFR первого и второго поколения, появляются мутации, опосредующие резистентность к TKI EGFR третьего поколения (61–65). Среди них, хотя мутация C797S в экзоне 20 EGFR была наиболее частым механизмом, ответственным за устойчивость к осимертинибу (62), она встречается менее чем у 3% пациентов, получавших рокилетиниб (66).О мутации C797S также сообщалось в одном случае, который привел к устойчивости к олмутинибу (65). Совсем недавно были описаны две новые третичные мутации EGFR . Приобретенная мутация L798I наблюдалась у cis с T790M у одного пациента после терапии рокилетинибом (66). Впоследствии другая мутация в том же кодоне (L798Q) была обнаружена у одного пациента во время прогрессирования при приеме осимертиниба (67).
Приобретенная устойчивость, связанная с мутацией EGFR T790M, может происходить путем отбора уже существующих клонов EGFR T790M + или посредством генетической эволюции исходных EGFR T790M- устойчивых к лекарству клеток, что позволяет предположить, что раковые клетки, которые выживают в третьем поколении TKI могут служить ключевым резервуаром, из которого может возникать приобретенная устойчивость во время лечения (68).
Сообщалось о дополнительных EGFR -независимых механизмах устойчивости. Мутации NRAS , включая новую мутацию E63K, и амплификации дикого типа NRAS или KRAS были описаны как механизмы приобретенной устойчивости к осимертинибу, а также к гефитинибу и афатинибу (69). Амплификации генов HER2, и MET также были описаны как потенциальные механизмы приобретенной устойчивости к осимертинибу и рокилетинибу у пациентов с EGFR T790M + NSCLC (66, 70).Кроме того, потеря T790M во время прогрессирования может быть опосредована чрезмерным ростом клеток, несущих амплификацию HER2 или мутации BRAF V600E или PIK3CA , как было недавно обнаружено в плазме крови пациентов, включенных в исследование фазы I AURA ( 71).
Наконец, трансформация мелкоклеточного рака легкого наблюдалась в двух случаях устойчивости к рокилетинибу и у одного пациента, устойчивого к осимертинибу; T790M был утерян, в то время как исходная мутация EGFR сохранялась в трансформированном малыми клетками раке в каждом случае (72, 73).
Преодоление устойчивости к третьему поколению EGFR TKIs
Благоприятные профили токсичности TKI третьего поколения EGFR делают их особенно привлекательными кандидатами для комбинированной терапии, и многие испытания в настоящее время планируются или продолжаются (таблица 3).
Таблица 3. Текущие и предстоящие испытания комбинации EGFR третьего поколения на основе TKI .
Доклинические модели клеток с мутациями EGFR L858R / T790M / C797S показали чувствительность in vitro к цетуксимабу, антителу, которое блокирует димеризацию EGFR (74, 75), но это не было подтверждено в анализах in vivo .Однако аллостерический ингибитор EAI045 в комбинации с цетуксимабом проявлял механистический синергизм и был эффективен на мышиных моделях рака легких, управляемых EGFR, L858R / T790M и EGFR, L858R / T790M / C797S (76). Интересно, что аллельный контекст, в котором был приобретен C797S, может предсказывать реакцию на последующее лечение TKI. Например, если мутации C797S и T790M находятся в trans , клетки будут устойчивы к TKI EGFR третьего поколения, но чувствительны к комбинации TKI первого и третьего поколения, и когда C797S развивается в T790 дикого типа. клеток, это приводит к устойчивости к TKI третьего поколения, в то время как чувствительность к TKI первого поколения сохраняется (61).Эти данные имеют большое клиническое значение для секвенирования этой мутации у пациентов с приобретенной устойчивостью к осимертинибу.
Navitoclax (ABT-263), ингибитор семейства BCL-2, усиливает апоптотический ответ клеток EGFR T790M с поздней устойчивостью с пониженной чувствительностью к ингибированию EGFR . Комбинация навитоклакса с третьим поколением EGFR TKI WZ4002 (в доклинической разработке) вызвала больший апоптоз по сравнению с одним WZ4002 в анализах in vivo и in vitro .Этот подход может быть эффективной стратегией лечения EGFR T790M-положительных злокачественных опухолей, которые имеют пониженный апоптотический ответ на ингибирование EGFR (68). Кроме того, комбинация WZ4002 с траметинибом, другим ингибитором MEK , предотвращает развитие приобретенной устойчивости в моделях мутантного рака легких EGFR (77). В настоящее время проводится исследование фазы Ib для оценки безопасности и переносимости комбинации осимертиниб / навитоклакс у пациентов с мутантным НМРЛ EGFR после устойчивости к предшествующим TKI EGFR (NCT02520778).
In vitro комбинация осимертиниба с ингибитором MEK 1/2 селуметиниб предотвращала появление резистентности в клетках PC9 (Ex19del) и отсроченную резистентность в клетках NCI-h2975 (L858R / T790M). In vivo , одновременное применение осимертиниба с селуметинибом вызывало регрессию резистентных к осимертинибу опухолей в трансгенной модели EGFR -мутант / T790M (69). Эта связь, среди прочего, оценивается в исследовании TATTON фазы Ib (NCT02143466), предназначенном для оценки безопасности, переносимости и предварительной противоопухолевой активности осимертиниба в сочетании с дурвалумабом (моноклональным антителом против PD-L1), саволитинибом ( Ингибитор МЕТ ) или селуметиниб у пациентов с распространенным НМРЛ с мутантным EGFR , у которых прогрессирует TKI EGFR .Недавно были представлены предварительные результаты группы осимертиниб / дурвалумаб (78). По оценке исследователя, ЧОО составила 67% у девяти пациентов с опухолями T790M + по сравнению с 21% у 14 пациентов с НМРЛ T790M-. Интерстициальное заболевание легких было зарегистрировано у 38% (13/34) пациентов, что выше, чем можно было бы ожидать от одного препарата, включая пять событий 3/4 степени (78). Таким образом, набор в группу осимертиниб + дурвалумаб был остановлен, но продолжаются когорты расширения групп ингибиторов MET и MEK .Кроме того, исследование CAURAL фазы III (NCT02454933) проводится у пациентов с метастатическим EGFR -мутантным T790M + NSCLC второй линии, тестирующих осимертиниб плюс дурвалумаб по сравнению с монотерапией осимертинибом. Это исследование также было преждевременно прекращено из-за легочной токсичности, наблюдаемой в исследовании TATTON.
Двойная блокада EGFR оценивается в исследовании фазы I (NCT02496663), в котором осимертиниб сочетается с моноклональным антителом против EGFR нецитуумумабом для оценки безопасности и определения оптимальной дозы для пациентов с EGFR с мутантным прогрессирующим NSCLC. на предыдущем EGFR TKI.
Как сообщалось, двойной рецептор фактора роста эндотелия сосудов (VEGFR) и блокада EGFR ингибируют рост опухоли в моделях ксенотрансплантатов с устойчивостью к TKI EGFR (79). Эта гипотеза была подтверждена в двух клинических испытаниях фазы II с участием пациентов с мутантным НМРЛ по EGFR , ранее не получавших лечения, рандомизированном японском исследовании (JO25567), сравнивающем эрлотиниб плюс бевацизумаб и только эрлотиниб, и одноранговом европейском исследовании (BELIEF). Медиана ВБП была сходной и обнадеживающей в обоих испытаниях, поддерживающих комбинацию в условиях первой линии (80, 81).Следуя этой стратегии, было разработано испытание фазы I для оценки безопасности двух комбинированных стратегий на основе осимертиниба с нецитумумабом или рамуцирумабом (моноклональное антитело против VEGFR2 ) у пациентов с распространенным EGFR T790M + NSCLC после прогрессирования на первом этапе. линия EGFR TKI-терапия (NCT02789345). Наконец, комбинация осимертиниба / бевацизумаба будет оцениваться в другом исследовании фазы I / II 3 + 3 с увеличением дозы (NCT02803203) для проверки безопасности комбинации этих препаратов.
Пациентам, опухоли которых претерпевают трансформацию мелкоклеточного рака легких, рекомендуется химиотерапия на основе платины и этопозида.
Заключение
За последнее десятилетие мы увидели значительные успехи в лечении пациентов с мутантным НМРЛ EGFR . Три EGFR TKI в настоящее время одобрены FDA и EMA для лечения пациентов первой линии с сенсибилизирующими мутациями EGFR при метастатическом НМРЛ. Несмотря на этот прогресс, развитие приобретенной резистентности является печальной реальностью и остается важной проблемой в клинических условиях.ИМК второго поколения не были успешно разработаны, и на сегодняшний день осимертиниб является единственным мутантом EGFR / T790M + TKI третьего поколения, одобренным FDA и EMA для пациентов с продвинутым НМРЛ T790M, у которых прогрессирует первая линия EGFR . ТКИ. Осимертиниб продемонстрировал убедительные данные об эффективности и безопасности в исследованиях фазы I и II, в основном при назначении второй или последующей линии, но также и в качестве препарата первой линии, что делает его очень привлекательным препаратом в этом сценарии. Клиническая разработка осимертиниба представляет собой одну из самых быстрых программ разработки лекарств от рака, которая занимает всего 2 года, 8 месяцев и 1 неделю с момента введения первой дозы пациенту до первого одобренного показания.До недавнего времени пациенты с распространенным НМРЛ с мутациями, активирующими EGFR , которые прогрессируют на первой линии EGFR TKI, традиционно получали химиотерапию с дублетом платины. Эти комбинации показывают ЧОО примерно 30%, что незначительно выше, чем наблюдаемое в популяциях T790M-, но значительно ниже, чем те, о которых сообщалось в когортах T790M + в ходе разработки испытаний осимертиниба фазы I – III. Кроме того, учитывая обнадеживающую эффективность со стороны ЦНС, осимертиниб также является привлекательным в качестве терапии первой линии для пациентов с метастазами в головной мозг и / или лептоменингеальные метастазы.Надеемся, что исследование фазы III FLAURA (NCT02296125) вскоре даст ответ на вопрос, где следует разместить осимертиниб. Среди других TKI нового поколения EGFR и с учетом того, что разработка рокилетиниба и олмутиниба в качестве монотерапевтических средств была остановлена, ASP8273 в настоящее время является самым передовым агентом в клинике.
На рисунке 2 показаны возможные алгоритмы лечения после прогрессирования у пациентов с распространенным НМРЛ с мутированием EGFR . Гетерогенность устойчивых видов рака, по-видимому, играет важную роль как в эффективности, так и в устойчивости к этим новым агентам, специфичным для T790M, и комбинированные стратегии могут быть эффективными в отсрочке и / или предотвращении устойчивости.Наконец, в эпоху персонализированной медицины анализ как опухолевой ткани, так и цтДНК должен быть приоритетом для улучшения наших знаний на благо наших пациентов.
Рисунок 2. Возможный алгоритм лечения пациентов с распространенным НМРЛ с мутацией EGFR . КТ, химиотерапия; EGFR , рецептор эпидермального фактора роста; MoR, механизм сопротивления; НМРЛ, немелкоклеточный рак легкого; SCLC, мелкоклеточный рак легкого; TKI, ингибитор тирозинкиназы.
Авторские взносы
Рукопись подготовила
И.С. DP контролировал и принял окончательную версию.
Заявление о конфликте интересов
IS не сообщает о конфликте интересов. DP: Консультативные советы AstraZeneca, Pfizer, Novartis, Clovis и Roche.
Благодарности
Авторы благодарят Сару Маккензи PhD за редактирование на английском языке.
Финансирование
Никакие источники финансирования не использовались для подготовки этого обзора.
Список литературы
1. Линч Т.Дж., Белл Д.В., Сорделла Р., Гурубхагаватула С., Окимото Р.А., Бранниган Б.В. и др. Активирующие мутации в рецепторе эпидермального фактора роста, лежащие в основе реакции немелкоклеточного рака легкого на гефитиниб. N Engl J Med (2004) 350: 2129–39. DOI: 10.1056 / NEJMoa040938
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Пао В., Миллер В., Заковски М., Доэрти Дж., Полити К., Саркария И. и др. Мутации гена рецептора EGF распространены при раке легких у «никогда не курильщиков» и связаны с чувствительностью опухолей к гефитинибу и эрлотинибу. Proc Natl Acad Sci U S A (2004) 101: 13306–11. DOI: 10.1073 / pnas.0405220101
CrossRef Полный текст | Google Scholar
3. Паез Дж. Г., Янне П. А., Ли Дж. К., Трейси С., Грейлих Н., Габриэль С. и др. Мутации EGFR при раке легких: корреляция с клиническим ответом на терапию гефитинибом. Наука (2004) 304: 1497–500. DOI: 10.1126 / science.1099314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Крис М.Г., Джонсон Б.Э., Берри Л.Д., Квятковски Д.Д., Яфрат А.Дж., Вистуба II и др.Использование мультиплексных анализов онкогенных факторов при раке легких для выбора целевых препаратов. JAMA (2014) 311: 1998–2006. DOI: 10.1001 / jama.2014.3741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Барлези Ф., Мазьер Дж., Мерлио Дж. П., Дебьёвр Д., Моссер Дж., Лена Х. и др. Регулярное молекулярное профилирование пациентов с распространенным немелкоклеточным раком легкого: результаты годичной общенациональной программы Французской кооперативной торакальной интергруппы (IFCT). Ланцет (2016) 387: 1415–26.DOI: 10.1016 / S0140-6736 (16) 00004-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Mok TS, Wu Y-L, Thongprasert S, Yang C-H, Chu D-T, Saijo N, et al. Гефитиниб или карбоплатин – паклитаксел при аденокарциноме легких. N Engl J Med (2009) 361: 947–57. DOI: 10.1056 / NEJMoa0810699
CrossRef Полный текст | Google Scholar
7. Хан Джи, Пак К., Ким С.В., Ли Д.Х., Ким Х.Й., Ким Х.Т. и др. ПЕРВЫЙ СИГНАЛ: иресса первого ряда в сравнении с гемцитабином и цисплатином у никогда не куривших с аденокарциномой легкого. J Clin Oncol (2012) 30: 1122–8. DOI: 10.1200 / JCO.2011.36.8456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Иноуэ А., Кобаяси К., Маэмондо М., Сугавара С., Оидзуми С., Исобе Х. и др. Обновленные результаты общей выживаемости в рандомизированном исследовании фазы III, в котором сравнивали гефитиниб и карбоплатин-паклитаксел при немелкоклеточном раке легкого, не подвергавшемся химиотерапии, с чувствительными мутациями гена EGFR (NEJ002). Энн Онкол (2013) 24: 54–9. DOI: 10.1093 / annonc / mds214
CrossRef Полный текст | Google Scholar
9.Маэмондо М., Иноуэ А., Кобаяси К., Сугавара С., Оидзуми С., Исобе Х. и др. Гефитиниб или химиотерапия немелкоклеточного рака легкого с мутированным EGFR. N Engl J Med (2010) 362: 2380–8. DOI: 10.1056 / NEJMoa0
0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Мицудоми Т., Морита С., Ятабэ Ю., Негоро С., Окамото И., Цурутани Дж. И др. Гефитиниб по сравнению с цисплатином плюс доцетакселом у пациентов с немелкоклеточным раком легкого, несущим мутации рецептора эпидермального фактора роста (WJTOG3405): открытое рандомизированное исследование фазы 3. Lancet Oncol (2010) 11: 121–8. DOI: 10.1016 / S1470-2045 (09) 70364-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Секвист Л.В., Ян Дж.С.-Х, Ямамото Н., О’Бирн К., Хирш В., Мок Т. и др. Фаза III исследования афатиниба или цисплатина в сочетании с пеметрекседом у пациентов с метастатической аденокарциномой легких с мутациями EGFR. J Clin Oncol (2013) 31: 3327–34. DOI: 10.1200 / JCO.2012.44.2806
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Wu Y-L, Zhou C, Hu C-P, Feng J, Lu S, Huang Y и др. Афатиниб в сравнении с цисплатином и гемцитабином для лечения первой линии азиатских пациентов с распространенным немелкоклеточным раком легкого, несущим мутации EGFR (LUX-Lung 6): открытое рандомизированное исследование фазы 3. Lancet Oncol (2014) 15: 213–22. DOI: 10.1016 / S1470-2045 (13) 70604-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Rosell R, Carcereny E, Gervais R, Vergnenegre A, Massuti B, Felip E, et al.Эрлотиниб по сравнению со стандартной химиотерапией в качестве лечения первой линии для европейских пациентов с поздним немелкоклеточным раком легкого с положительной мутацией EGFR (EURTAC): многоцентровое открытое рандомизированное исследование фазы 3. Lancet Oncol (2012) 13: 239–46. DOI: 10.1016 / S1470-2045 (11) 70393-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ян Дж. К. Х., Ву И-Л, Шулер М., Себастьян М., Попат С., Ямамото Н. и др. Афатиниб в сравнении с химиотерапией на основе цисплатина для аденокарциномы легких с положительной мутацией EGFR (LUX-Lung 3 и LUX-Lung 6): анализ данных общей выживаемости из двух рандомизированных исследований фазы 3. Lancet Oncol (2015) 16: 141–51. DOI: 10.1016 / S1470-2045 (14) 71173-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Паз-Арес Л., Тан Э. Х., Чжан Л., Хирш В., О’Бирн К., Бойер М. и др. Афатиниб по сравнению с гефитинибом у пациентов с НМРЛ с положительной мутацией EGFR: данные об общей выживаемости из исследования фазы IIb LUX-light 7. Ann Oncol (2016) 27 (Suppl 6): vi552–87. DOI: 10.1093 / annonc / mdw435.42
CrossRef Полный текст | Google Scholar
16.Yu HA, Arcila ME, Rekhtman N, Sima CS, Zakowski MF, Pao W. и др. Анализ образцов опухолей во время приобретенной устойчивости к терапии EGFR-TKI у 155 пациентов с мутантным EGFR раком легких. Clin Cancer Res (2013) 19: 2240–7. DOI: 10.1158 / 1078-0432.CCR-12-2246
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Чафт Дж. Э., Окснард Г. Р., Сима С. С., Крис М. Г., Миллер В. А., Рили Дж. Дж. Обострение заболевания после отмены ингибитора тирозинкиназы у пациентов с EGFR-мутантным раком легкого и приобретенной резистентностью к эрлотинибу или гефитинибу: значение для дизайна клинических испытаний. Clin Cancer Res (2011) 17: 6298–303. DOI: 10.1158 / 1078-0432.CCR-11-1468
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Сориа Дж. К., Ву И-Л, Накагава К., Ким С. В., Ян Дж. Дж., Ан М-Дж и др. Гефитиниб плюс химиотерапия по сравнению с плацебо плюс химиотерапия при немелкоклеточном раке легкого с положительной мутацией EGFR после прогрессирования на гефитинибе первой линии (IMPRESS): рандомизированное исследование фазы 3. Ланцет Онкол (2015) 16: 990–8. DOI: 10.1016 / S1470-2045 (15) 00121-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Сория Дж. К., Ким С. В., Ву И-Л, Накагава К., Ян Дж. Дж., Ан М. Дж. И др. Гефитиниб / химиотерапия в сравнении с химиотерапией при НМРЛ с положительной мутацией EGFR после прогрессирования на гефитинибе 1-й линии (исследование IMPRESS): окончательный анализ общей выживаемости (OS). Ann Oncol (2016) 27 (Дополнение 6): vi416–54. DOI: 10.1093 / annonc / mdw383.01
CrossRef Полный текст | Google Scholar
20. Новелло С., Барлези Ф, Калифано Р., Куфер Т., Экман С., Левра М.Г. и др. Метастатический немелкоклеточный рак легкого: клинические рекомендации ESMO по диагностике, лечению и последующему наблюдению. Ann Oncol (2016) 27 (Дополнение 5): v1–27. DOI: 10.1093 / annonc / mdw326
CrossRef Полный текст | Google Scholar
21. Дуйяр Дж. Й., Осторос Дж., Кобо М., Чулеану Т., МакКормак Р., Вебстер А. и др. Гефитиниб первой линии у кавказских пациентов с НМРЛ с мутацией EGFR: открытое исследование фазы IV в одной группе. Br J Cancer (2014) 110: 55–62. DOI: 10.1038 / bjc.2013.721
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Маркетти А., Дель Граммастро М., Фелисиони Л., Малатеста С., Филиче Г., Сенти I и др.Оценка мутаций EGFR в препаратах циркулирующих опухолевых клеток от пациентов с НМРЛ с помощью секвенирования следующего поколения: к жидкостной биопсии в реальном времени для лечения. PLoS One (2014) 9: e103883. DOI: 10.1371 / journal.pone.0103883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Маркетти А., Пальма Дж. Ф., Фелисиони Л., Де Пас TM, Киари Р., Дель Граммастро М. и др. Раннее прогнозирование ответа на ингибиторы тирозинкиназы путем количественной оценки мутаций EGFR в плазме пациентов с НМРЛ. J Thorac Oncol (2015) 10: 1437–43. DOI: 10.1097 / JTO.0000000000000643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Суока-Араган Н., Катаками Н., Сатоучи М., Йокота С., Аое К., Иванага К. и др. Мониторинг EGFR T790M с плазменной ДНК больных раком легких в проспективном наблюдательном исследовании. Cancer Sci (2016) 107: 162–7. DOI: 10.1111 / cas.12847
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Окснард Г. Р., Тресс К. С., Олден Р. С., Лоуренс Р., Павелец С. П., Кантарини М. и др.135O_PR: генотипирование плазмы для прогнозирования пользы от осимертиниба у пациентов (пациентов) с распространенным НМРЛ. J Thorac Oncol (2016) 11 (Дополнение 4): S154. DOI: 10.1016 / S1556-0864 (16) 30328-8
CrossRef Полный текст | Google Scholar
26. Gainor JF, Shaw AT. Новые парадигмы в развитии устойчивости к ингибиторам тирозинкиназы при раке легких. J Clin Oncol (2013) 31: 3987–96. DOI: 10.1200 / JCO.2012.45.2029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Cortot AB, Jänne PA. Молекулярные механизмы резистентности аденокарцином легких, мутантных по рецептору эпидермального фактора роста. Eur Respir Rev (2014) 23: 356–66. DOI: 10.1183 / 080.00004614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Секвист Л.В., Бессе Б., Линч Т.Дж., Миллер В.А., Вонг К.К., Гитлитц Б. и др. Нератиниб, необратимый ингибитор тирозинкиназы рецептора Pan-ErbB: результаты исследования фазы II у пациентов с распространенным немелкоклеточным раком легкого. J Clin Oncol (2010) 28: 3076–83. DOI: 10.1200 / JCO.2009.27.9414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Миллер В.А., Хирш В., Кадранель Дж., Чен И.М., Парк К., Ким С.В. и др. Афатиниб по сравнению с плацебо у пациентов с запущенным метастатическим немелкоклеточным раком легкого после неэффективности эрлотиниба, гефитиниба или обоих, а также одной или двух линий химиотерапии (LUX-Lung 1): рандомизированное исследование фазы 2b / 3. Lancet Oncol (2012) 13: 528–38. DOI: 10.1016 / S1470-2045 (12) 70087-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Реккамп К.Л., Джакконе Дж., Камидж Д.Р., Гаджил С.М., Хури Ф.Р., Энгельман Дж. А. и др. Фаза 2 испытания дакомитиниба (PF-00299804), перорального необратимого ингибитора pan-HER (рецептора эпидермального фактора роста человека), у пациентов с далеко зашедшим немелкоклеточным раком легкого после неэффективности предшествующей химиотерапии и эрлотиниба. Рак (2014) 120: 1145–54. DOI: 10.1002 / cncr.28561
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Regales L, Gong Y, Shen R, de Stanchina E, Vivanco I, Goel A и др. Двойное нацеливание на EGFR может преодолеть основную мутацию лекарственной устойчивости в мышиных моделях мутантного рака легких по EGFR. Дж. Клин Инвест (2009) 119: 3000–10. DOI: 10.1172 / JCI38746
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Janjigian YY, Smit EF, Groen HJM, Horn L, Gettinger S, Camidge DR, et al. Двойное ингибирование EGFR афатинибом и цетуксимабом при устойчивом к ингибиторам киназ EGFR-мутантном раке легкого с мутациями T790M и без них. Cancer Discov (2014) 4: 1036–45. DOI: 10.1158 / 2159-8290.CD-14-0326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Cross DAE, Ashton SE, Ghiorghiu S, Eberlein C, Nebhan CA, Spitzler PJ, et al. AZD9291, необратимый TKI EGFR, преодолевает T790M-опосредованную устойчивость к ингибиторам EGFR при раке легких. Cancer Discov (2014) 4: 1046–61. DOI: 10.1158 / 2159-8290.CD-14-0337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Планчард Д., Браун К. Х., Ким Д. В., Ким С. В., Охе И, Фелип Е. и др. Осимертиниб Западная и азиатская клиническая фармакокинетика у пациентов и здоровых добровольцев: влияние на состав, дозу и частоту дозирования в основных клинических исследованиях. Cancer Chemother Pharmacol (2016) 77: 767–76. DOI: 10.1007 / s00280-016-2992-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Вишванатан К., Дикинсон П.А., Буй К., Вейлерт Д., Со К., Томас К. и др. Влияние пищевых продуктов и модификаторов pH желудочного сока на фармакокинетику AZD9291.AACR. Mol Cancer Ther (2015) 14 (Приложение 2): аннотация B153. DOI: 10.1158 / 1535-7163.TARG-15-B153
CrossRef Полный текст | Google Scholar
36. Янне П.А., Ян Дж. К. Х., Ким Д. В., Планчард Д., Охе И., Рамалингам С. С. и др. AZD9291 при немелкоклеточном раке легкого, устойчивом к ингибиторам EGFR. N Engl J Med (2015) 372: 1689–99. DOI: 10.1056 / NEJMoa1411817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Yang J, Ramalingam SS, Jänne PA, Cantarini M, Mitsudomi T.LBA2_PR: осимертиниб (AZD9291) у предварительно получавших лечение пациентов с T790M-положительным распространенным НМРЛ: обновленные результаты фазы 1 (P1) и объединенные результаты фазы 2 (P2). J Thorac Oncol (2016) 11 (Дополнение 4): S152–3. DOI: 10.1016 / S1556-0864 (16) 30325-2
CrossRef Полный текст | Google Scholar
38. Рамалингам С., Ян Дж. К. Х., Ли С. К., Курата Т., Ким Д. В., Джон Т. и др. LBA1_PR: осимертиниб в качестве терапии первой линии для распространенного НМРЛ с положительной мутацией EGFR: обновленные результаты по эффективности и безопасности, полученные в двух когортах расширения фазы I. J Thorac Oncol (2016) 11 (Дополнение 4): S152. DOI: 10.1016 / S1556-0864 (16) 30324-0
CrossRef Полный текст | Google Scholar
39. Уолтер А.О., Сджин РТТ, Харингсма Х.Д., Охаши К., Сун Дж., Ли К. и др. Открытие мутантно-селективного ковалентного ингибитора EGFR, который преодолевает опосредованную T790M устойчивость при NSCLC. Cancer Discov (2013) 3: 1404–15. DOI: 10.1158 / 2159-8290.CD-13-0314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Секвист Л.В., Сория Дж. К., Голдман Дж. У., Уэйкли Х.А., Гаджил С.М., Варга А. и др.Роцилетиниб при немелкоклеточном раке легкого с мутацией EGFR. N Engl J Med (2015) 372: 1700–9. DOI: 10.1056 / NEJMoa1413654
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Sequist LV, Soria J-C, Camidge DR. Обновите данные по рокилетинибу с подтвержденной частотой ответов RECIST. N Engl J Med (2016) 374: 2296–7. DOI: 10.1056 / NEJMc1602688
CrossRef Полный текст | Google Scholar
42. Ли К-О, Ча М., Ким М., Сон Дж., Ли Дж. Х., Ким И и др.Открытие HM61713 как доступного перорально и мутантного селективного ингибитора EGFR. Clin Cancer Res (2014) 74 (Приложение 19): LB – 100. DOI: 10.1158 / 1538-7445.AM2014-LB-100
CrossRef Полный текст | Google Scholar
43. Пак К., Ли Дж. С., Ли К. Х., Ким Дж. Х., Мин Й. Дж., Чо Дж. Й. и др. Обновленные результаты по безопасности и эффективности фазы I / II исследования HM61713 у пациентов (пациентов) с немелкоклеточным раком легкого (НМРЛ) с положительной мутацией EGFR, у которых ранее не применялся ингибитор EGFR-тирозинкиназы (TKI). J Clin Oncol (2015) 33: реферат 8084.
Google Scholar
44. Пак К., Ли Дж.С., Ли К.Х., Ким Дж.Х., Чо BC, Мин Ю.Дж. и др. Ольмутиниб (BI 1482694; HM61713), мутант-специфический ингибитор EGFR, при T790M + NSCLC: эффективность и безопасность при RP2D. J Clin Oncol (2016) 34: аннотация 9055.
Google Scholar
45. Ли Дж.С., Пак К., Хан Джи, Ли К.Х., Ким Дж.Х., Чо Е.К. и др. 425PDC Клиническая активность и безопасность мутантного ингибитора EGFR, BI1482694, у пациентов (пациентов) с T790M-положительным НМРЛ. Ann Oncol (2015) 26 (Suppl 9): ix125–47. DOI: 10.1093 / annonc / mdw532.09
CrossRef Полный текст | Google Scholar
46. Сакагами Х., Конагай С., Ямамото Х., Танака Х., Мацуя Т., Мори М. и др. ASP8273, новый мутант-селективный необратимый ингибитор EGFR, подавляет рост клеток немелкоклеточного рака легкого (NSCLC) с активирующими EGFR и мутациями устойчивости к T790M. Cancer Res (2014) 74 (Suppl 19): аннотация 1728. DOI: 10.1158 / 1538-7445.AM2014-1728
CrossRef Полный текст | Google Scholar
47.Конагай С., Сакагами Х., Ямамото Х., Танака Х., Мацуя Т., Мимасу С. и др. ASP8273 селективно ингибирует мутантный сигнальный путь EGFR и вызывает уменьшение опухоли в моделях опухолей с мутацией EGFR. Cancer Res (2015) 75 (Suppl 15): abstract 2586. doi: 10.1158 / 1538-7445.AM2015-2586
CrossRef Полный текст | Google Scholar
48. Гото Й., Нокихара Х., Мураками Х., Симидзу Т., Сето Т., Кривошик А. и др. ASP8273, мутант-селективный необратимый ингибитор EGFR у пациентов (пациентов) с НМРЛ, несущих активирующие мутации EGFR: предварительные результаты первого исследования фазы I на людях в Японии. J Clin Oncol (2015) 33: реферат 8014.
Google Scholar
49. Yu HA, Spira A, Horn L, Weiss J, Jack H, Giaccone G и др. Противоопухолевая активность ASP8273 300 мг у субъектов с немелкоклеточным раком легкого с положительной мутацией EGFR: промежуточные результаты продолжающегося исследования фазы 1. J Clin Oncol (2016) 34: аннотация 9050.
Google Scholar
50. Лелис Дж., Эппл Р., Марсиль Т.Х., Лонг Й.О., Макнил М., Чен Б. и др. Открытие (R, E) -N- (7-Хлор-1- (1- [4- (диметиламино) бут-2-еноил] азепан-3-ил) -1H-бензо [d] имидазол-2-ила ) -2-метилизоникотинамид (EGF816), новый эффективный ковалентный ингибитор онкогенных (L858R, ex19del) и устойчивых (T790M) мутантов EGFR для лечения немелкоклеточного рака легких с мутантным EGFR. J Med Chem (2016) 59: 6671–89. DOI: 10.1021 / acs.jmedchem.5b01985
CrossRef Полный текст | Google Scholar
51. Тан DSW, Ян Дж. Си-Хи, Лейл Н. Б., Рили Дж., Секвист Л. В., Фелип Е. и др. Обновленные результаты исследования фазы 1 EGF816, мутант-селективного ингибитора тирозинкиназы третьего поколения EGFR (TKI) при запущенном немелкоклеточном раке легкого (NSCLC), несущем T790M. J Clin Oncol (2016) 34: аннотация 9044.
Google Scholar
52. Пак С.Дж., Ким Х.Т., Ли Д.Х., Ким К.П., Ким С.В., Сух С.и др.Эффективность ингибиторов тирозинкиназы рецептора эпидермального фактора роста при метастазировании в мозг у пациентов с немелкоклеточным раком легкого, несущих мутацию экзона 19 или 21. Рак легкого (2012) 77: 556–60. DOI: 10.1016 / j.lungcan.2012.05.092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Fan Y, Xu X, Xie C. Терапия EGFR-TKI для пациентов с метастазами в мозг от немелкоклеточного рака легкого: объединенный анализ опубликованных данных. Onco Targets Ther (2014) 7: 2075–84.DOI: 10.2147 / OTT.S67586
CrossRef Полный текст | Google Scholar
54. Ким Д., Ян Дж., Кросс Д., Баллард П., Янг П., Йейтс Дж. Доклинические данные и клинические случаи активности AZD9291 в метастазах в мозг (BM) немелкоклеточного рака легкого (NSCLC) мутантного EGFR. Ann Oncol (2014) 25 (Дополнение 4): 146–64.
Google Scholar
55. Баллард П., Йейтс Дж. У. Т., Янг З., Ким Д. В., Ян Дж. К. Х., Кантарини М. и др. Доклиническое сравнение осимертиниба с другими EGFR-TKI на моделях метастазов в головной мозг с мутантным EGFR NSCLC и ранние доказательства активности клинических метастазов в мозг. Clin Cancer Res (2016) 22: 5130–40. DOI: 10.1158 / 1078-0432.CCR-16-0399
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Ан М. Дж., Цай С. М., Ян Дж. Си. Х., Шеперд Ф. А., Сатоучи М., Ким Д. В. и др. Активность AZD9291 у пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) и метастазами в головной мозг с мутантным EGFR: данные исследований фазы II. Eur J Cancer (2015) 51 (Приложение 3): S625–6. DOI: 10.1016 / S0959-8049 (16) 31724-5
CrossRef Полный текст | Google Scholar
57.Цзэн К., Ван Дж., Ченг З., Чен К., Джонстрём П., Варнас К. и др. Открытие и оценка клинического кандидата AZD3759, сильнодействующего перорально активного ингибитора тирозинкиназы рецептора эпидермального фактора роста, проникающего в центральную нервную систему. J Med Chem (2015) 58: 8200–15. DOI: 10.1021 / acs.jmedchem.5b01073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Ким Д. В., Ян Ч., Чен К., Ченг З., Инь Л., Мартин П. и др. AZD3759, ингибитор EGFR с проникновением через гематоэнцефалический барьер (BBB) для лечения немелкоклеточного рака легкого (NSCLC) с метастазами в головной мозг (BM): доклинические данные и клинические случаи. J Clin Oncol (2015) 33: реферат 8016.
Google Scholar
59. Ян Дж. Си-Х, Ким Д. В., Ким С. В., Чо BC, Ли Дж. С., Инь XYX и др. Активность осимертиниба у пациентов (пациентов) с лептоменингеальной (LM) болезнью, вызванной немелкоклеточным раком легкого (NSCLC): обновленные результаты исследования BLOOM, фазы I. J Clin Oncol (2016) 34: аннотация 9002.
Google Scholar
60. Ан М. Дж., Ким Д. В., Ким Т. М., Лин Си Си, Ратнаяке Дж., Карли Д. и др. Фаза I исследования AZD3759, ингибитора EGFR, проникающего в ЦНС, для лечения немелкоклеточного рака легких (НМРЛ) с метастазами в головной мозг (BM) и лептоменингеальными метастазами (LM). J Clin Oncol (2016) 34: аннотация 9003.
Google Scholar
61. Niederst MJ, Hu H, Mulvey HE, Lockerman EL, Garcia AR, Piotrowska Z, et al. Аллельный контекст мутации C797S, полученный при лечении ингибиторами EGFR третьего поколения, влияет на чувствительность к последующим стратегиям лечения. Clin Cancer Res (2015) 21: 3924–33. DOI: 10.1158 / 1078-0432.CCR-15-0560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62.Thress KS, Paweletz CP, Felip E, Cho BC, Stetson D, Dougherty B, et al. Приобретенная мутация EGFR C797S опосредует устойчивость к AZD9291 при немелкоклеточном раке легкого, несущем EGFR T790M. Nat Med (2015) 21: 560–2. DOI: 10,1038 / нм.3854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Yu HA, Tian SK, Drilon AE, Borsu L, Riely GJ, Arcila ME и др. Приобретенная устойчивость мутантного EGFR рака легкого к T790M-специфическим цитокинам EGF
, ингибиторам тирозинкиназы, моноклональным антителам, агентам, индуцирующим дифференцировку — греч.врач
Последнее обновление: 25 ноября 2019 г., 18:29
Сводка
Эти препараты не обладают неспецифической цитотоксичностью, как в предыдущем разделе, а скорее специфичны для некоторых аспектов опухолевых клеток. Есть много видов.
Моноклональные антитела могут связываться с рецепторами фактора роста, такими как HER2, и противодействовать им при раке груди. Трастузумаб связывается с HER2 и подавляет его.
Такие препараты, как иматиниб, могут связываться с внутриклеточными тирозинкиназами и ингибировать их, что особенно характерно для филадельфийской хромосомы при ХМЛ.
Лекарства могут связываться с поверхностными белками опухолевых клеток и вызывать их гибель за счет антителозависимой клеточной цитотоксичности и активации комплемента. Ритуксимаб связывается и убивает B-клетки в B-клеточных лимфомах.
Лекарства могут усиливать противоопухолевый эффект иммунной системы за счет ингибирования белков, подавляющих лейкоциты. Ниволумаб является примером.
Лекарства могут заставить опухолевые клетки дифференцироваться в более зрелые и менее злокачественные клетки. Третиноин может вызывать дифференцировку при остром промиелоцитарном лейкозе.
Гормоночувствительные опухоли груди, предстательной железы или эндометрия можно лечить соответствующими гормоноснижающими препаратами или антагонистами рецепторов гормонов. Тамоксифен блокирует рецептор эстрогена при раке груди. Финастерид блокирует фермент, который превращает тестостерон в ДГТ. Леупролид или дегареликс могут вызывать химическую кастрацию, ингибируя высвобождение ФСГ и ЛГ из гипофиза.
Введение в нецитотоксические противоопухолевые препараты
Мы обсудили цитотоксические препараты, которые цитотоксичны для всех клеток, но в основном для опухолевых клеток.Теперь мы обсудим нецитотоксические агенты. Они не являются непосредственно цитотоксичными, а скорее ингибируют механизмы, специфически необходимые для роста и деления опухолевых клеток. В результате они менее токсичны, чем цитотоксические препараты, и поэтому вызывают меньше побочных эффектов.
Можно выделить два типа нецитотоксических противоопухолевых препаратов:
- Биологические агенты — эти препараты имеют биологическое происхождение и влияют на определенные биологические процессы в опухолевых клетках
- Цитокины с противоопухолевым действием
- Лекарства, связывающиеся с рецепторами факторов роста и факторами роста
- Лекарства, ингибирующие рецепторные тирозинкиназы
- Лекарства, ингибирующие внутриклеточные тирозинкиназы
- Антитела к маркерам лимфоцитов
- Лекарства, вызывающие «растормаживание» иммунной системы
- Лекарства, вызывающие дифференцировку опухолевых клеток
- Прочие
- Гормональные агенты — препараты, действующие только на гормоночувствительные опухоли
Многие биологические агенты — это моноклональные антитела со специфическими мишенями.
Цитокины с противоопухолевым действием
Важными лекарствами здесь являются рекомбинантный человеческий интерферон α (rhIFN-α) и рекомбинантный человеческий интерлейкин 2 (rhIL-2).
Механизм действия:
rhIFN-α, как и эндогенный интерферон α, оказывает антипролиферативное и иммуностимулирующее действие.
rhIL-2, как и эндогенный IL-2, стимулирует цитотоксические Т-клетки и NK-клетки , которые продолжают атаковать опухолевые клетки.
Побочные эффекты:
rhIFN-α может вызывать симптомы гриппа.
rhIL-2 увеличивает проницаемость сосудов, вызывая потерю жидкости в интерстиции, что приводит к гиповолемии.
Лекарственные средства, связывающиеся с рецепторами факторов роста и факторами роста
Многие опухоли экспрессируют рецепторы факторов роста и стимулируются присутствием этих факторов роста. Эти препараты эффективны только в том случае, если опухоль экспрессирует рецептор фактора роста, на который они действуют. Эти препараты представляют собой моноклональные антитела против рецепторов этих факторов роста или самих факторов роста.Поскольку все они являются моноклональными антителами, все они заканчиваются на -mab.
- Ингибитор EGFR / HER1: цетуксимаб
- Ингибитор EGFR2 / HER2: трастузумаб (герцептин)
- Ингибитор VEGF: бевацизумаб
- Ингибитор VEGFR2: рамуцирумаб
- PDG
Трастузумаб лечит HER2-положительный рак груди.
Бевацизумаб лечит колоректальный и почечный рак.
Механизм действия:
EGFR — фактор роста эпидермиса.VEGF является фактором роста эндотелия сосудов и участвует в ангиогенезе, в котором опухоли, очевидно, нуждаются в большом количестве. PDGF — это фактор роста тромбоцитов.
Когда антитела связываются с рецепторами на клеточной поверхности, они не только блокируют сайт связывания лиганда, но также вызывают эндоцитоз рецептора и стимулируют антителозависимую клеточную цитотоксичность ( ADCC ), что означает, что иммунная система распознает антитело и убивает опухолевую клетку.
Лекарственные средства, ингибирующие рецепторные тирозинкиназы
Эти препараты ингибируют рецепторные тирозинкиназы, тирозинкиназы, которые связаны с рецепторами факторов роста.Все они имеют окончание -nib.
Это:
- 1 st gen. Ингибитор EGFR / HER1: эрлотиниб
- 2 nd gen. Ингибитор EGFR1-4: афатиниб
- 3 rd gen. Ингибитор EGFR: осимертиниб
- EGFR + Ингибитор EGFR2: лапатиниб
- Ингибитор ALK: кризотиниб
- Ингибитор VEGFR2: акситиниб
- VEGFR + PDGFR + c-Kit Ингибитор 9GFR 9000: 9GFR 9000 + ингибитор церафениб-9000: сорафениб
- Ингибитор МЕТ: кабозантиниб
Показания:
Эрлотиниб лечит рак легких с помощью активирующих мутаций в HER1.
Иматиниб лечит хронический миелоидный лейкоз (ХМЛ).
Механизм действия:
ALK — киназа анапластической лимфомы. МЕТ — это онкоген, который вы могли вспомнить по патогенам; это рецептор фактора роста, называемого «мезенхимально-эпителиальный фактор перехода».
Хронический миелолейкоз характеризуется печально известной филадельфийской хромосомой, которая кодирует всегда активную внутриклеточную тирозинкиназу. Иматиниб подавляет внутриклеточную тирозинкиназу.
Ингибируя эти рецепторные тирозинкиназы, рецепторы фактора роста не могут передавать сигнал в клетку, эффективно ингибируя рецептор.
Антитела к маркерам лимфоцитов
Важными препаратами здесь являются ритуксимаб, алемтузумаб, даратумумаб, элотузумаб и т. Д. Как следует из названия, эти препараты являются моноклональными антителами.
Показания:
Ритуксимаб лечит В-клеточные лимфомы, ХЛЛ и ревматоидный артрит.
Механизм действия:
Эти препараты связываются с маркерами клеточной поверхности, такими как CD20 и CD38. Связывая эти поверхностные маркеры, они вызывают гибель клетки-мишени по трем механизмам:
- Активируется система комплемента, которая лизирует клетку-мишень
- Опосредованная антителами клеточная цитотоксичность привлекает NK-клеток для уничтожения клетки-мишени
- Клетка-мишень подвергается апоптозу
Некоторые из этих лекарств являются антителами, конъюгированными с цитотоксическими наркотики.Это позволяет нацеливать цитотоксические препараты против любой клетки, экспрессирующей поверхностный маркер, с которым связывается антитело.
Ритуксимаб связывается с CD20, маркером В-клеток.
Агенты, вызывающие «растормаживание» иммунной системы
Иммунный ответ всегда содержит баланс между стимулирующими и тормозящими сигналами, чтобы предотвратить чрезмерную стимуляцию. В случае лечения рака подавление некоторых из этих ингибирующих сигналов может быть эффективным для усиления противоракового ответа иммунной системы.
Эти препараты также называют ингибиторами иммунных контрольных точек.
Важными препаратами здесь являются ипилимумаб, ниволумаб и атезолизумаб.
Показания:
Ипилимумаб и ниволумаб лечат запущенную меланому.
Механизм действия:
Ипилимумаб связывается и блокирует CTLA-4. Этот поверхностный белок находится на регуляторных Т-клетках. Его функция заключается в подавлении Т-клеток. Блокируя этот тормозящий сигнал, Т-клетки растормаживаются или стимулируются.
Ниволумаб связывается и блокирует PD-1, поверхностный белок, обнаруженный на опухолевых клетках, который связывается с PD-L1 на опухолеспецифических Т-клетках и запускает их апоптоз. Блокируя этот сигнал, опухолеспецифические Т-клетки не умирают, а вместо этого могут убивать опухолевые клетки.
Лекарственные средства, индуцирующие дифференцировку опухолевых клеток
Заставляя опухолевые клетки дифференцироваться в зрелые клетки, они больше не могут делиться и причинять вред. Некоторые препараты могут вызывать эту дифференциацию, например третиноин и триоксид мышьяка.
Показания:
Третиноин и триоксид мышьяка лечат острый промиелоцитарный лейкоз (APML).
Механизм действия:
Третиноин (полностью транс-ретиноевая кислота) представляет собой производное витамина А. Клетки APML экспрессируют аномальную форму рецептора ретиноевой кислоты, которая не позволяет ретиноевой кислоте стимулировать дифференцировку клеток в зрелые клетки. Третиноин преодолевает это и позволяет клетке правильно дифференцироваться.
Триоксид мышьяка стимулирует распад аномального рецептора ретиноевой кислоты, также позволяя клетке дифференцироваться.
Побочные эффекты:
Третиноин обладает сильным тератогенным действием.
Другие биологические агенты
Сюда можно включить талидомид, бортезомиб и денилейкин дифтитокс.
Показания:
Талидомид и бортезомиб лечат множественную миелому.
Денилейкин дифтитокс лечит Т-клеточные лимфомы.
Механизм действия:
Талидомид снижает уровни IL-6 и TNF -α (которые обычно стимулируют клетки миеломы) и усиливает активность Т-клеток и NK-клеток.
Денилейкин дифтитокс на самом деле представляет собой комбинацию ИЛ-2 и дифтерийного токсина. Только злокачественные лимфоциты экспрессируют рецептор IL-2, поэтому этот препарат переносит дифтерийный токсин в опухолевые клетки.
Механизмы устойчивости к противоопухолевым средствам
Опухоли могут развить резистентность к определенным противоопухолевым агентам. Эти механизмы часто являются результатом мутаций. Если небольшая часть опухолевых клеток в опухоли устойчива к противоопухолевому препарату, которым в настоящее время лечатся пациент, эта популяция имеет эволюционное преимущество перед неустойчивыми опухолевыми клетками.В конечном итоге вся опухоль будет заменена устойчивыми клетками.
Есть много механизмов, которые могут опосредовать это сопротивление:
- Опухолевые клетки могут вытеснять лекарства из клеток с помощью Р-гликопротеина, неспецифического переносчика
- Опухолевые клетки могут снижать потребление ими лекарства
- Опухолевые клетки могут снижать внутриклеточную метаболическую активацию пролекарств
- Опухолевые клетки могут увеличивать свою способность к репарации ДНК
- Опухолевые клетки могут изменять фермент, на который нацелен препарат
Лекарства, используемые для химиопрофилактики рака
Некоторые лекарства назначают людям с высоким риском развития рака, чтобы предотвратить его развитие:
- НПВП — для предотвращения колоректального рака
- Тамоксифен — для предотвращения ER-положительного рака молочной железы
- Финастерид — для предотвращения рака простаты
По-видимому, гормональные противораковые препараты не входят в учебную программу Фарма 2 (скорее for pharma 3), поэтому вам не нужно ничего знать ниже для экзамена pharma 2.
Гормональные агенты
Гормональные препараты эффективны только при опухолях, чувствительных к гормонам. Некоторые опухоли экспрессируют рецепторы гормонов и зависят от стимуляции этих рецепторов для роста. Уменьшая эту стимуляцию, мы можем подавить рост опухоли.
Это можно сделать двумя способами:
- Снижение эндогенной продукции гормона, стимулирующего опухоль
- Использование антагониста гормона для блокирования рецептора гормона
В некоторых других случаях гормональные препараты просто подавляют рост опухоли напрямую.
Глюкокортикоиды
Дексаметазон — самый важный глюкокортикоидный препарат в терапии рака.
Показания:
Дексаметазон используется для лечения ОЛЛ, лимфом и множественной миеломы. Он также может снизить внутричерепное давление и, следовательно, может быть полезен при лечении опухолей головного мозга. Он также снижает уровень кальция в сыворотке и поэтому может использоваться у пациентов с метастазами в кости. Наконец, это может уменьшить тошноту, вызванную цитотоксическими агентами.
Механизм действия:
Глюкокортикоиды обладают антипролиферативным действием на лимфоциты.
Половые гормоны и родственные соединения
Говоря о гормоночувствительных опухолях, мы обычно имеем в виду рак груди, предстательной железы или эндометрия, который экспрессирует рецепторы эстрогена (ER), прогестерона (PR) или андрогенов (AR).
Для этих опухолей мы можем использовать аналоги эстрогенов, антагонисты эстрогенов, ингибиторы синтеза эстрогенов, синтетические прогестероны, антипрогестероны, антагонисты рецепторов андрогенов, ингибиторы синтеза андрогенов, агонисты GnRH, антагонисты GnRH, аналоги соматостатина и агонисты рецепторов дофамина.
Аналоги эстрогенов
Аналоги эстрогена, такие как этинилэстрадиол и диэтилстильбоэстрол ( DES ), фактически стимулируют рост опухолей, продуцирующих рецепторы эстрогена. Это может показаться нежелательным эффектом, но с комбинацией цитотоксического препарата это может фактически усилить действие цитотоксического препарата.
Антагонисты эстрогенов
Этот класс препаратов также называется селективными модуляторами рецепторов эстрогена (SERM) и включает тамоксифен, торемифен, ралоксифен и фулвестрант.
Показания:
Рак груди в постменопаузе, положительный по рецепторам эстрогена. Их также можно использовать для химиопрофилактики пациентов с высоким риском развития этого рака.
Механизм действия:
Эти препараты блокируют рецептор эстрогена на опухолевых клетках, подавляя их рост.
Побочные эффекты:
Тамоксифен и торемифен увеличивают риск рака эндометрия, поскольку они действуют скорее как агонисты, а не как антагонисты эндометрия.Ралоксифен не имеет такого эффекта.
Ингибиторы синтеза эстрогенов
Эти препараты не действуют напрямую на опухоль, а скорее снижают уровень эстрогена в организме, что косвенно снижает рост опухоли. Важными препаратами здесь являются форместан, экземестан, анастрозол, летрозол и ворозол.
Показания:
Рак молочной железы, положительный по рецепторам эстрогена, особенно опухоли, устойчивые к тамоксифену.
Механизм действия:
Эти препараты ингибируют ароматазу , фермент, превращающий андрогены в эстрогены.
Прогестероны синтетические / прогестины
Прогестины — это синтетические прогестероны. Важными препаратами здесь являются ацетат медроксипрогестерона и ацетат мегестрола.
Показания:
Метастатический рак эндометрия и груди.
Механизм действия:
Эти препараты обеспечивают отрицательную обратную связь с гипофизом, снижая секрецию ФСГ и ЛГ, что, в свою очередь, снижает уровень эстрогенов и андрогенов.
Антипрогестероны / антипрогестины
К этому классу относится только один важный препарат: мифепристон.
Показания:
Рак молочной железы, положительный по рецепторам прогестерона. (согласно лекции, я не думаю, что на самом деле он используется для этого)
Механизм действия:
Конкурентный антагонист рецепторов прогестерона.
Антагонисты рецепторов андрогенов
Важными препаратами здесь являются флутамид, бикалутамид и нилутамид.
Показания:
Эти препараты часто используются вместе с аналогами / антагонистами ГнРГ и орхидэктомией для снижения уровня андрогенов у пациентов с раком простаты.
Механизм действия:
Эти препараты являются конкурентными антагонистами рецептора андрогенов.
Ингибиторы синтеза андрогенов / ингибиторы 5-альфа-редуктазы
Важными препаратами здесь являются финастерид и дутастерид.
Показания:
Терапия и химиопрофилактика рака простаты.
Механизм действия:
Эти препараты ингибируют 5-альфа-редуктазу, фермент, который превращает тестостерон в более мощный дигидротестостерон в простате.
Агонисты гонадолиберина
Важнейшими препаратами здесь являются бусерелин, гозерелин, лейпролид и трипторелин.
Показания:
Рак груди, рак простаты.
Механизм действия:
Синтетические агонисты GnRH во много раз более эффективны, чем эндогенные GnRH.Прием агонистов ГнРГ постоянно вызывает первоначальное повышение ФСГ и ЛГ, но после этого гипофиз будет подавлять рецепторы ГнРГ. Это приводит к снижению секреции ФСГ и ЛГ, пока продолжается лечение. Это называется медицинская или химическая кастрация .
Антагонисты ГнРГ
Важным лекарством здесь является дегареликс.
Показания:
Рак груди, рак простаты.
Механизм действия:
Эти препараты подавляют секрецию ФСГ и ЛГ гипофизом, снижая уровень андрогенов и эстрогенов в сыворотке крови.
Аналоги соматостатина
Важнейшими препаратами здесь являются октреотид и ланреотид.
Показания:
Гастринома, карциноидный синдром, ВИПома, инсулинома, глюкагонома.
Механизм действия:
Эти препараты являются аналогами соматостатина и, следовательно, вызывают опосредованное соматостатином ингибирование гормон-секретирующих опухолей GI .
Агонисты дофаминовых рецепторов
Единственный важный препарат — бромокриптин.
Показания:
Пролактинома.
Механизм действия:
Бромокриптин — агонист дофаминовых рецепторов, подавляющий пролиферацию пролактин-продуцирующих клеток.
Предыдущая страница:
13. Противоопухолевые препараты. Алкилирующие агенты, антиметаболиты, препараты, повреждающие микротрубочки, ингибиторы топоизомеразыСледующая страница:
15. Иммунодепрессанты, иммуномодуляторы, лечение ревматоидного артритаИнгибитор тирозинкиназы — DocCheck Flexikhibase, Tyrosinkinaseinhibitor, Тирозинкиназа-ингибитор — DocCheck Flexikhibmer
901rosinkSynrosinki: Syn
Englisch : ингибитор тирозинкиназы, TKI1 Определение
Tyrosinkinaseinhibitoren , kurz TKI , sind Arzneistoffe, die verschiedene Tyrosinkinasen hemmen.Sie zählen neben den Serin / Threonin-Kinase-Hemmern (STKI) zur Gruppe der Proteinkinaseinhibitoren.
2 Wirkmechanismus
Tyrosinkinaseinhibitoren binden an verschiedenembranständige oder zytoplasmatische Tyrosinkinasen (z.B. EGF-Rezeptor, VEGF-Rezeptor) und hemmen dadurch ihre энзиматические активные, способствующие эффективному использованию сигналов. Auf diese Weise können unerwünschte intrazelluläre Signalkaskaden Pharmakologisch mehr oder weniger spezifisch unterbrochen werden.
TKIs benutzen dabei 4 Verschiedene Mechanismen: Sie konkurrieren entweder mit Adenosintriphosphat (ATP), der phosphorylierenden Einheit oder dem Substrat — oder sie binden außerhalb des aktiven Zentrums und beinflus.
3 Индикация
Tyrosinkinaseinhibitoren kommen in verschiedenen Indikationen zum Einsatz. Als Chemotherapeutika werden sie z.B. zur Therapie von malignen Tumoren genutzt, vor allm bei chronisch myeloischer Leukämie (CML), aber auch beim NSCLC или Brustkrebs.Bei vielen in der Onkologie verwendeten Tyrosinkinasehemmern handelt es sich um Orphan Drugs, die nur bei Tumoren eingesetzt werden können, die eine bestimmte Mutation aufweisen. Ihre Anwendung setzt die Bestimmung des Tumorgenoms oder den Immunhistochemischen Nachweis der Tyrosinkinase voraus.
Weitere Indikationen sind chronisch-entzündliche Erkrankungen wie rheumatoide Arthritis, Morbus Crohn, Colitis ulcerosa und chronische Immunthrombozytopenie.
4 Einteilung
In der Gruppe der Tyrosinkinaseinhibitoren lassen sich nach ihrem Zielprotein weitere Untergruppen Differenzieren.Hemmt ein Arzneistoff mehrere Tyrosinkinasen, spricht man von einem Multikinase-Inhibitor. Die folgende Einordnung ist nicht trennscharf, da Multikinase-Inhibitoren manchmal auch nur der Tyrosinkinase zugeordnet werden, bei welcher der Tyrosinkinaseinhemmer die geringste mittlere ингибиторная Концентрация (IC 50 ) aufweist. Weil ständig neue Wirkstoffe entwickelt werden, erhebt die Liste keinen Anspruch auf Vollständigkeit.
MEK-Inhibitoren können sowohl den Tyrosinkinasehemmern als auch den Serin / Threonin-Kinase-Hemmern zugeordnet werden, da es sich bei MEKs um bispezifische Proteinkinasen handelt, die Serin-önd-Threoninns, тирозинкиназен, фосфорилированный тиреонин.
4,1 ALK-ингибитор
ALK-Inhibitoren hemmen das Enzym anaplastische Lymphomkinase (ALK). ALK ist eine Rezeptortyrosinkinase, die eine wichtige Rolle bei der Entwicklung des ZNS spielt. Das ALK-Gen kann auf mehrere Arten onkogenetisch wirken und spielt eine wichtige beim NSCLC.
4,2 AXL-ингибитор
Das Target der AXL-Inhibitoren ist die AXL-Rezeptortyrosinkinase, которые несут в себе незапланированные функции, связанные с НЛО. Das AXL-Gen ist ein Schlüsselfaktor für die Immunevasion und Die Zytostatikaresistenz aggressiv wachsender und rasch metastasierender Tumore.
4.3 BCR-ABL-Inhibitoren
BCR-ABL-Inhibitoren sind TKIs, die überwiegend zur Erstlinientherapie der chronischen myeloischen Leukämie (CML) eingesetzt werden. Mehr als 90% der CML-Fälle werden durch das so genannte Philadelphia-Chromosom ausgelöst, bei dem das Fusionsgen BCR-ABL vorliegt. BCR-ABL-Inhibitoren hemmen das Genprodukt, является конститутивным активным BCR-ABL-тирозинкиназой.
4,4 БТК-Ингибиторен
BTK-Inhibitoren richten sich gegen die Bruton-Tyrosinkinase (BTK), die hauptsächlich von B-Zellen exprimiert wird.Das Einsatzgebiet der BTK-Inhibitoren sind vor allem B-Zell-Lymphome.
4,5 EGFR-Inhibitoren
EGFR-Inhibitoren связывается с EGF-Rezeptor (HER1 bzw. ErbB-1) и сужается к dadurch.
4,6 HER2 / neu-Inhibitoren
HER2 / neu-Inhibitoren связывается с Rezeptortyrosinkinase HER2 / neu aus der Familie ErbB-Membranrezeptoren.
4,7 FGFR-ингибитор
FGFR-Inhibitoren binden an die Rezeptortyrosinkinase FGFR («рецептор фактора роста фибробластов»), deren Signalmolekül der Fibroblasten-Wachstumsfaktor (FGF) ist.Sie entfalten durch die Hemmung des FGFR / ERK-Signalwegs einen antiproliferative Effekt auf Tumorzellen.
4,8 FLT3-ингибитор
FLT3-Inhibitoren hemmen den Zytokinrezeptor FLT3 (CD135), der zur Klasse III der Rezeptortyrosinkinasen gehört. Er wird auf der Oberfläche hämatopoetischer Stammzelle exprimiert. FLT3-Inhibitoren werden bei akuter myeloischer Leukämie (AML) eingesetzt.
4,9 JAK-ингибитор
JAK-Inhibitoren hemmen zytoplasmatische Januskinasen wie JAK1, JAK2, JAK3 и TYK2.Diese Tyrosinkinasen werden durch die Bindung von Zytokinen an Rezeptoren auf der Zelloberfläche aktiviert.
4.10 MEK-ингибитор
MEK-Inhibitoren beinflussen den Ras / Raf / MAPK-Signalweg, содержит протеинкиназен MEK1 и MEK2. Dieser Signalweg ist bei vielen Tumoren überaktiv.
4,11 c-Met-Inhibitoren
c-Met-Inhibitoren ингибирует энзиматическую активность тирозинкиназы c-Met. Eine Fehlregulation von c-Met стимулирует вторжение и метастазирование опухолей, вызывающих ангиогенез.
4.12 TRK-Inhibitoren
TRK-Inhibitoren sind TKIs, а также Tropomyosinrezeptorkinasen TrkA, TrkB и TrkC hemmen. Mit ihnen therapiert man metastasierte solide Tumoren, bei denen ein NTRK-Fusionsgen nachgewiesen wurde.
4,13 VEGFR-Inhibitoren
VEGFR-Inhibitoren вызывает TKI, умирает VEGF-Rezeptoren binden. Sie sind essenziell für die Vaskulogenese und Angiogense von Tumoren.
4,14 SYK-ингибитор
SYK-Inhibitoren sind Tyrosinkinaseinhibitoren, хорошо известен цитозолиной Milztyrosinkinase («тирозинкиназа селезенки», Syk) гемменаз, умереть от всего человеческого организма.Vertreter dieser Gruppe sind:
4,15 CSF1R-ингибитор
CSF1R-Inhibitoren sind TKI, die den Kolonie-stimulierenden Faktor 1-Rezeptor (CSF1R) hemmen, der die Proliferation, Differenzierung und Funktion der Makrophagen beeinflusst.
4,16 Мультикиназный ингибитор
Мультикиназный ингибитор hemmen mehrere Tyrosinkinasen gleichzeitig. Wenn ihre Wirkung bei einer Tyrosinkinase überwiegt, werden sie mitunter auch einer spezifischen Gruppe zugerechnet.
5 Pharmakologie
5.1 Resistenz
Ein limitierender Faktor des therapeutischen Einsatzes von Tyrosinkinasehemmern ist die Resistenzentwicklung der Tumorzellen gegen die verschiedenen Wirkstoffe. Die Resistenz kann primär vorhanden sein oder sich sekundär unter der Therapie entwickeln.
Eine Resistenz kann verschiedene Ursachen haben, u.a .:
- Экспрессия или амплификация генов, das die medikamentös gehemmte Tyrosinkinase kodiert. Dadurch kommt es zu einer vermehrten Bildung der betreffenden Tyrosinkinase.Sie kann in der Regel nicht durch eine Dosiserhöhung des TKIs abgefangen werden, da es dann zu intolerablen Nebenwirkungen kommt.
- Punktmutationen des kodierenden Gens. Dadurch wird die Bindung der TKIs an «их» тирозинкиназа beeinträchtigt oder verhindert. Eine klinisch bedeutsame Mutation ist z.B. die T315I-Mutation, хорошо умереть Wirksamkeit von BCR-ABL-Inhibitoren vermindert.
- Verlangsamte Wirkstoffaufnahme oder schnellere Wirkstoffelimination durch die Tumorzellen
- Aktivierung alternativer Signalwege, die von Tyrosinkinasen unabhängig sind
- Ungenügende Wirkstoffkonzentration im Tumor, основание durch die spezifische Tumorarchitektur [1]
Um Resistenzen der Tumorzellen durch Mutationen zu umgehen, werden fortlaufend neue TKIs entwickelt, die andere Bindungsstellen am Zielrezeptor besitzen.
5.2 Фармакокинетик
Die Pharmakokinetischen Eigenschaften vieler Tyrosinkinaseinhibitoren sind schlecht vorhersehbar und erschweren eine optimale Dosierung. [2] Im Einzelfall kann es dadurch zu einer verminderten Wirkung oder zu erhöhter Toxizität kommen. Obwohl die meisten TKIs mit fixen Dosierungsschemata angewendet werden, wird von einigen Autoren ein therapeutisches Drug Monitoring empfohlen, um die Behandlung zu optimieren. [2]
5.3 Spezifität
Die Affinität der Tyrosinkinaseinhibitoren zu den jeweils von ihnen gehemmten Tyrosinkinasen lässt sich durch die mittlere ignitorische Konzentration, kurz IC 50 , quantifizieren. Je geringer der IC 50 -Wert, desto höher ist die therapeutische Potenz des Wirkstoffs.
6 Quellen
- ↑ Morosi L. et al .: Применение трехмерной масс-спектрометрической визуализации к TKI. Clin Pharmacol Ther. 2017 ноябрь; 102 (5): 748-751. DOI: 10.1002 / cpt.
