Медицинский центр «Консультант» — Группа анестезиологии-реанимации
Это самый технически сложный и вместе с тем самый безопасный вид анестезиологического пособия как для пациента, так и для врача-анестезиолога. Данный вид наркоза может использоваться при любом типе операций, как малых, так и больших, длительных и очень длительных. Полное название эндотрахеальной анестезии звучит так — «многокомпонентная сбалансированная комбинированная анестезия в условиях искусственной вентиляции легких» с использованием внутривенных и газообразных анестетиков. Существует 5 основных составляющих данной анестезии.
Аналгезия, или обезболивание
Пациент, идущий на оперативное вмешательство, не должен чувствовать боли. Препараты, обеспечивающие это условие вводятся через периферический катетер, установленный в вену.
Седация, или комфортный сон
Пациент, идущий на операцию, не должен испытывать дискомфорт во время ее проведения (звуки инструмента в операционной, разговоры хирурга с ассистентами и медперсоналом и т.д.). Препараты, обеспечивающие это условие, также вводятся через периферический катетер, установленный в вену.
ИВЛ, или искусственная вентиляция легких
Операция, проводимая по различным причинам, расценивается нашим организмом, как травма, пусть и наносимая с самой благородной целью, но травма. Поэтому проведение операции требует для организма колоссальных энергоресурсов и энергозатрат. Это первая и самая важная причина применения ИВЛ, проводя которую врач-анестезиолог в значительной мере экономит собственные энергоресурсы пациента, которые понадобятся ему для скорейшего заживления раны и выздоровления. Второй, не менее важной причиной, является угнетающее действие препаратов для обезболивания и седации на дыхательный центр центральной нервной системы. С увеличением длительности и объема операции, увеличивается и их дозировка. Пациент как бы «забывает» дышать, точнее он дышит, но недостаточно для обеспечения кислородом организма в условиях травмы. Вот почему функция дыхания пациента замещается или протезируется. Происходит это только на момент операции и незаметно для пациента. После того как пациент обезболен и глубоко спит, в трахею устанавливается одноразовая стерильная интубационная трубка или в ротоглотку- ларингеальная маска. Следует отметить, что как это произойдет, впрочем, как и извлечение этой трубки из трахеи или маски, пациент не будет чувствовать, знать и тем более помнить. Здесь очень важно, чтобы анестезиолог, проводящий операцию, имел достаточный опыт. Следует добавить, что аппарат, который обеспечивает ИВЛ, должен быть очень качественным, так как он будет выдавать пациенту свою особую определенную газовую смесь. Аппараты ИВЛ в клинике новые, прошедшие необходимые тесты и калибруются перед каждой операцией. Врач-анестезиолог определяет и видит в режиме реального времени сколько по объему пациент вдохнул, сколько выдохнул (с погрешностью до миллилитра), какой газовый состав у вдыхаемого и выдыхаемого воздуха.
С увеличением длительности и объема операции, увеличивается и их дозировка. Пациент как бы «забывает» дышать, точнее он дышит, но недостаточно для обеспечения кислородом организма в условиях травмы. Вот почему функция дыхания пациента замещается или протезируется. Происходит это только на момент операции и незаметно для пациента. После того как пациент обезболен и глубоко спит, в трахею устанавливается одноразовая стерильная интубационная трубка или в ротоглотку- ларингеальная маска. Следует отметить, что как это произойдет, впрочем, как и извлечение этой трубки из трахеи или маски, пациент не будет чувствовать, знать и тем более помнить. Здесь очень важно, чтобы анестезиолог, проводящий операцию, имел достаточный опыт. Следует добавить, что аппарат, который обеспечивает ИВЛ, должен быть очень качественным, так как он будет выдавать пациенту свою особую определенную газовую смесь. Аппараты ИВЛ в клинике новые, прошедшие необходимые тесты и калибруются перед каждой операцией. Врач-анестезиолог определяет и видит в режиме реального времени сколько по объему пациент вдохнул, сколько выдохнул (с погрешностью до миллилитра), какой газовый состав у вдыхаемого и выдыхаемого воздуха. В любой момент пропорции газовой смеси анестезиолог может изменить, исходя из этапов операции или потребности организма пациента в ту или иную единицу времени.
В любой момент пропорции газовой смеси анестезиолог может изменить, исходя из этапов операции или потребности организма пациента в ту или иную единицу времени.
Миорелаксация, или расслабление мышц
Необходима по нескольким причинам: нейтрализовать двигательную активность пациента во время сна — пациент спит, и ему во время наркоза снятся сны, не кошмары, а вполне нормальные сны (кто-то плавает в море, кто-то играет в хоккей, кто-то работает). Все это сопровождается движениями, которые могут помешать оперирующему хирургу или попросту расстерилизовать его. Для того, чтобы выполнить ряд операций, особенно это операции на брюшной полости, необходимо, чтобы оперируемый орган также был в покое, это обеспечивает расслабление мускулатуры тела.
Поддержание гомеостаза
Поддержание гомеостаза, или внутренней среды организма, пациента на нормальном уровне — это ряд мероприятий, направленных на помощь организму перенести стресс, травму, операцию. Сюда входит внутривенное введение различных групп лекарственных препаратов: антибиотики, противоаллергические препараты, противорвотные препараты, противовоспалительные, противоотечные, препараты снижающие кровотечение из раны после операции и много других, которые вводятся исключительно по показаниям.
Сюда входит внутривенное введение различных групп лекарственных препаратов: антибиотики, противоаллергические препараты, противорвотные препараты, противовоспалительные, противоотечные, препараты снижающие кровотечение из раны после операции и много других, которые вводятся исключительно по показаниям.
На операционном столе пациент засыпает в течение 20-30 секунд. Засыпает спокойно, без «провалов», галлюцинаций и кошмаров. Просыпается также легко, полное восстановление сознания наступает в течение 15-30 минут после окончания операции.
После операции
Пробуждение после данного типа анестезии спокойное и быстрое, как правило, в течение 15-30 минут сознание восстанавливается полностью, то есть пациент отдает себе отчет, где и по какой причине он находится, что с ним произошло. За пациентом в течение раннего послеоперационного периода постоянно наблюдают медицинская сестра и врач анестезиолог-реаниматолог.
Отличительные особенности проведения общей анестезии в клинике:
- Выполнение общей анестезии опытными врачами-анестезиологами, которые информированы о каждом этапе операции и понимают, где и когда стоит быть особенно осторожными.

- Тотальный контроль в режиме реального времени за жизненными функциями организма во время операции. В условиях анестезии обеспечивается мониторинг, включающий в себя контроль АД в динамике, контроль ЧСС в динамике, ЭКГ, контроль за дыхательной функцией организма (степень насыщения крови кислородом и частота дыхания), контроль за температурой тела во время оперативного вмешательства. Такой контроль с постоянным присутствием врача позволяет исключить такие неблагоприятные моменты для пациента как раннее или запоздалое пробуждение, так как малейшее изменение в состоянии пациента будет фиксироваться аппаратурой, а врач моментально предпримет действия для коррекции ситуации.
| Спонсоры | Ведущий спонсор: University of Tennessee, Chattanooga | ||||||
|---|---|---|---|---|---|---|---|
| Источник | University of Tennessee, Chattanooga | ||||||
| Краткое содержание | Пневмония, связанная с искусственной вентиляцией легких (ВАП), является распространенной проблемой среди пациентов интенсивной терапии и основным источником инфекции среди пациентов, получающих искусственную вентиляцию легких. | ||||||
| Подробное описание | Все пациенты выделяют жидкости в верхние дыхательные пути от основания языка и других связанные структуры. Эти «подсвязочные» выделения обычно выводятся при глотании, но когда человеку требуется искусственная вентиляция легких, этот процесс блокируется дыхательной трубкой и подсвязочные выделения имеют тенденцию к накоплению. Удаление этих подсвязочных выделений очень важно, потому что бактерии, которые обычно населяют заднюю часть нашего горла, могут проникнуть и в конечном итоге колонизировать собранные бассейны подсвязочного секрета. Этот процесс называется «микро-аспирация» и было показано, что она является сильным фактором риска развития Вентиляционная пневмония (ВАП). Раньше врачи и медсестры пытались ограничить эти выделения, пропуская через дыхательную трубку маленькие всасывающие трубки, но это было оказалось неэффективным и увеличивало риск кровотечения и повреждения легких. | ||||||
| Общий статус | Снято | ||||||
| Дата начала | 2 ноября 2020 г. | ||||||
| Дата завершения | 2 ноября 2020 г. | ||||||
| Дата первичного завершения | 2 ноября 2020 г. | ||||||
| Тип исследования | Наблюдательный | ||||||
| Первичный результат |
| ||||||
| Вторичный результат |
| ||||||
| Состояние | |||||||
| Приемлемость | Метод отбора проб: Невероятностная выборка Критерии: Критерии включения: 1. Возраст> 18 лет 2. Пациенты, которым требуется искусственная вентиляция легких в связи с измененным психическим статусом, передозировкой наркотиков или любое состояние, при котором защита дыхательных путей от аспирации клинически оправдана 3. Пациенты, которым требуется искусственная вентиляция легких после кардиоторакального обхода или клапана. заместительная хирургия 4. Пациенты, которым требуется искусственная вентиляция легких после инсульта, внутричерепного кровотечения, субдурального кровотока. Пол: Все Минимальный возраст: 18 лет Максимальный возраст: Нет данных Здоровые волонтеры: Нет | ||||||
| Общий Официальный |
| ||||||
| Расположение |
| ||||||
| Расположение Страны | Соединенные Штаты | ||||||
| Дата проверки | Ноябрь 2020 | ||||||
| Ответственная сторона | Тип: Спонсор | ||||||
| Имеет расширенный доступ | Нет | ||||||
| Состояние Просмотр | |||||||
| Информация о дизайне исследования | Наблюдательная модель: Кейс-контроль Временная перспектива: Перспективный | ||||||
Реанимация.
 Гранд Медика. Медицинский клинический центр.
Гранд Медика. Медицинский клинический центр.
Здоровье человека – это бесценный и хрупкий дар, который каждый должен оберегать. Никто не застрахован от болезней и травм. На протяжении всей жизни вы можете вести здоровый образ жизни, рационально питаться, но вдруг случается так, что вы неожиданно заболели и вам необходимо оперативное вмешательство. В этом случае на первый план выходит безопасность операций, качество анестезиологии, реанимации и реабилитации.
Преимущества реанимации и анестезиологии в нашей клинике
- Персонал клиники проходит строгий отбор. Это всегда врачи со стажем, званиями и хорошей репутацией.
- Подбор индивидуального анестезиологического пособия.
- Все операционные оснащены самыми передовыми аппаратами поддержки жизнеобеспечения ведущих фирм — таких, как General Electric и Fresenius.
- Препараты, используемые для проведения анестезии, обладают высокой специфичностью и легко переносятся.

- Вам представляется полная информация о способе проведения операции, анестезиологическом пособии, о побочных действиях и возможных рисках.
Подготовка к операции
Первый шаг к успешной операции – тщательная предоперационная подготовка. Анестезиолог выясняет состояние здоровья пациента, наличие хронических заболеваний. При необходимости проводится дополнительная терапия. Правильная анестезия – залог успеха проведения операции. Поэтому в частных клиниках тщательно подбирают способ анестезиологического пособия с учетом возраста и состояния пациента.
Реанимационные залы для послеоперационной терапии оснащены современным оборудованием.
Методы анестезии
- Общая анестезия – с сохранением самостоятельного дыхания или дыхание с помощью аппарата ИВЛ. Пациент находится в состоянии медикаментозного сна.
- Анестезия с сохранением собственного дыхания используется при малых операциях, когда не требуются длительный наркоз.
 Используется масочный или внутривенный наркоз. При длительной операции используют эндотрахеальный наркоз и за пациента «дышит» аппарат ИВЛ.
Используется масочный или внутривенный наркоз. При длительной операции используют эндотрахеальный наркоз и за пациента «дышит» аппарат ИВЛ.
- Местная анестезия – обезболивание определенного участка. Выполняется хирургом.
- Проводниковая анестезия – введение анестетика в стволы крупных нервов и их сплетений. Блокируются зоны, которые иннервируются данными нервными окончаниями. Широко используется в гинекологической и урологической практике. Имеет минимальное количество побочных эффектов.
В нашей клинике вам подберут способ анестезии с минимальным количеством побочных эффектов. Безопасность каждой операции – залог успеха клиники. При использовании общего наркоза состояние пациента контролируется с помощью непрерывного наблюдения. Специальные мониторы, подключенные к больному, показывают основные жизненные показатели (артериальное давление, пульс, частоту дыхательных движений, насыщенность крови кислородом и т.д.). Во время проведения операции анестезиолог оценивает состояние крови, опираясь на данные газовых показателей, которые также отображаются на мониторе.
Наблюдение и Реабилитация
Пациент проходит послеоперационное наблюдение в палате пробуждения или в палате интенсивной терапии – в зависимости от тяжести состояния пациента, сложности и времени оперативного вмешательства. Палаты оснащены оборудованием, необходимым для мониторинга жизненно важных функций организма:
- модульные мониторы неотложных состояний, обладающие уникальной технологией регистрации параметров, витальных функций организма в режиме реального времени с передачей информации на пульт дежурного врача.
- наркозно-дыхательное оборудование с «интеллектуальным» режимом подключения вспомогательной вентиляции легких и автоматической интерпретацией клинических данных фирмы General Electric
- автоматизированные инфузионные дозирующие системы, позволяющие точно вводить количество лекарственных препаратов фирмы Frestnius
- многофункциональные кровати, способные придать любое положение телу пациента, обеспечивая максимальный комфорт.

Работа анестезиологов-реаниматологов обеспечивает должный уровень безопасности всех хирургических вмешательств в нашей клинике, делая безболезненным лечение членов семьи.
Памятка пациенту перед операцией под общим наркозом
- Последний приём пищи и жидкости должен быть накануне операции,
не позднее 22-00. Дети не позднее, чем за 6-8 часов до операции. - Утром, в день операции, почистите зубы.
- Курить перед операцией нельзя.
- В течение суток до проведения анестезии не принимать алкоголь.
- Ногти на руках должны быть свободны от маникюрного лака.
- Если ваш врач разрешил вам оставить утренний приём какого-либо лекарства (которое вы постоянно принимали до операции), то оптимальное всего проглотить таблетки, не запивая их жидкостью. Если же вам трудно поступить, таким образом, то запейте таблетки минимальным глотком воды.

- Перед операцией снять с себя все украшения (кольца, серьги и т. д.), съёмные зубные протезы.
Если вы нарушили какое-либо из этих условий, анестезиолог вправе отказать в проведении анестезиологического пособия.
Обследование перед наркозом: Общий анализ крови, включая тромбоциты, ЭКГ (действительны в течение 14 дней), анализ крови на ВИЧ, RW, HbsAg, HCVAg (действительны в течение месяца).
Обязательно сообщите анестезиологу, если
- Вы страдаете сахарным диабетом.
- У вас повышенное давление.
- Вы страдаете ишемической болезнью сердца или переносили инфаркт миокарда.
- У вас есть хронические заболевания органов дыхания (например, бронхиальная астма).
- В ближайшее время (две недели) переносили ОРВИ или грипп.
- Вы постоянно принимаете любые лекарственные препараты (желательно заранее подготовить список этих препаратов).
- Вам уже делали анестезию, и после нее возникли осложнения.

К причинам, исключающим возможность проведения анестезии в амбулаторных условиях, можно отнести: нестабильность соматического состояния (декомпенсация хронических заболеваний), острые воспалительные или инфекционные заболевания, не связанные с предстоящим вмешательством, патологическое ожирение, наличие наркотической зависимости, отсутствие голодной паузы.
Также нужно иметь в виду, что в случае непредвиденных реакций на обезболивание, которые случаются крайне редко, некоторым пациентам может потребоваться госпитализация для наблюдения в послеоперационном периоде.
После общего наркоза
- Запрещены все виды деятельности, требующие повышенного внимания в течение 24 часов после окончания наркоза:
— управление автомобилем и прочими транспортными средствами;
— работа со сложным техническим оборудованием, которое при не правильной его эксплуатации может представлять опасность для вашего здоровья.
- Исключите приём алкоголя.
- Не рекомендуется принимать ни каких важных решений, а также подписывать какие-либо документы в течение 24 часов, так как после наркоза и операции есть риск нарушения не только физической активности, но и изменения вашего психического состояния.
- Не принимайте после анестезии никаких лекарств, если только прием последних не был согласован с вашим лечащим доктором.
- Начинать пить не ранее, чем через 1,5 — 2 часа после окончания наркоза. Пить сразу не много воды, а по 1-2 глотка, с перерывами. Если не возникает тошноты, то можно пить дальше и больше, по самочувствию и начинать есть.
- После того, как вам будет разрешено покинуть клинику, рекомендуем вам договориться с кем-либо из своих родственников, друзей или близких, что бы вас встретили в клинике и сопроводили домой.
Удаление огромной опухоли и извлечение пули из головы
Медицина в Подмосковье развивается быстрыми темпами. В 2018 году в регионе провели более 1,2 тысячи операций с использованием методов высокотехнологичной помощи. Для пациентов такая терапия означает снижение рисков для жизни и здоровья, более легкий процесс восстановления. Получить высокотехнологичную медицинскую помощь можно в 21 медицинском учреждении региона, основные направления – педиатрия, онкология, травматология, ортопедия, гинекология, офтальмология, лечение тяжелых ожогов, трансплантация тканей и органов, различные виды хирургии. О том, какие уникальные операции проводят врачи Московской области, читайте в материале портала mosreg.ru.
В 2018 году в регионе провели более 1,2 тысячи операций с использованием методов высокотехнологичной помощи. Для пациентов такая терапия означает снижение рисков для жизни и здоровья, более легкий процесс восстановления. Получить высокотехнологичную медицинскую помощь можно в 21 медицинском учреждении региона, основные направления – педиатрия, онкология, травматология, ортопедия, гинекология, офтальмология, лечение тяжелых ожогов, трансплантация тканей и органов, различные виды хирургии. О том, какие уникальные операции проводят врачи Московской области, читайте в материале портала mosreg.ru.
Какие сервисы сферы здравоохранения доступны через портал госуслуг Московской области>>
Операции на работающем сердце
Источник:
Пресс-служба Губернатора Московской области, Александр Козлов
Московский областной научно-исследовательский клинический институт имени Владимирского (МОНИКИ) – одно из ведущих медицинских учреждений региона. В 2018 году в него поступили аппараты УЗИ и искусственной вентиляции легких высокого класса, позволяющие проводить операции по трансплантации органов. Кроме того, в прошлом году в МОНИКИ начали делать операции по уменьшению размеров желудка.
В 2018 году в него поступили аппараты УЗИ и искусственной вентиляции легких высокого класса, позволяющие проводить операции по трансплантации органов. Кроме того, в прошлом году в МОНИКИ начали делать операции по уменьшению размеров желудка.
В апреле 2018 года кардиохирурги института провели операцию по протезированию сердечного клапана беременной женщине. Манипуляции выполнялись в условиях искусственного кровообращения на работающем сердце. Благодаря профессиональной работе врачей операция прошла успешно для матери и ребенка.
Совместно с Московским областным НИИ акушерства и гинекологии (МОНИИАГ) специалисты МОНИКИ помогли родить здорового ребенка пациентке с тяжелой формой сахарного диабета, находящейся на гемодиализе. Вынашивание беременности при таком заболевании — уникальный случай в медицинской практике. Малыш родился недоношенным, но успешно адаптируется и набирает вес.
Как в Подмосковье получить полис ОМС>>
Операции без ножа
Источник:
Министерство здравоохранения Московской области
Не отстают от ведущих специалистов врачи других подмосковных медицинских учреждений.![]() В декабре в Мытищинской городской клинической больнице впервые установили больному кардиостимулятор. Врачи действовали под местной анестезией через небольшой разрез. Это сократило период восстановления пациента до нескольких дней. Раньше подобные операции проводили только в МОНИКИ.
В декабре в Мытищинской городской клинической больнице впервые установили больному кардиостимулятор. Врачи действовали под местной анестезией через небольшой разрез. Это сократило период восстановления пациента до нескольких дней. Раньше подобные операции проводили только в МОНИКИ.
Среди рекордов хирургов Мытищинской больницы – уникальная операция по удалению тромба. Манипуляция проводилась через прокол и длилась всего 15 минут.
Еще одна ювелирная работа мытищинских рентгенохирургов – сложнейшая операция на головном мозге при помощи эндоваскулярного вмешательства – без наркоза, разрезов и швов.
Новый метод лечения сосудов без ножа освоили хирурги из Реутова. Раньше 78-летнему пациенту могли бы просто отказать в операции: она требовала открытия брюшной полости, что опасно, учитывая возраст мужчины. Консилиум врачей реутовского хирургического центра решил выполнить операцию рентгенэндоваскулярным методом: специальными инструментами, доставляемыми под рентген-контролем к месту операции по сосудам от прокола диаметром 1-2 миллиметра. В результате пациенту полностью восстановили кровоснабжение ноги.
В результате пациенту полностью восстановили кровоснабжение ноги.
В январе 2019 года в подольской больнице оперировали 99-летнюю пациентку. Женщину фактически поставили на ноги после перелома бедра. Малоинвазивный метод позволил свести к минимуму осложнения после операции.
Как получить услугу по бесплатному протезированию в Подмосковье>>
Сохранение зрения недоношенным детям
Источник:
©, pixabay.com
Новые технологии внедряются в Подмосковье в области педиатрии и неонатологии. В Щелковском центре материнства и детства новорожденным с экстремально низкой массой тела возвращают зрение без использования интубационного наркоза. В результате младенцы не задерживаются на искусственной вентиляции легких и в целом легче переносят медицинское вмешательство.
А в роддоме Королева в прошлом году успешно провели сложную операцию по спасению недоношенного ребенка: его извлекли в плодном пузыре, что является высшим пилотажем у акушеров-гинекологов.
Как получить высокотехнологичную медицинскую помощь в Подмосковье>>
Удаление 15-килограммовой опухоли
Источник:
Министерство здравоохранения Московской области
Уникальные операции имеют место и в практике врачей-онкологов Подмосковья. Так, в Домодедове специалисты успешно удалили опухоль брюшной полости весом 7,5 килограмма. В Королевской городской больнице онкологи и гинекологи провели уникальную операцию по удалению кистомы яичника весом почти 15 килограммов. Хирурги Московского областного онкологического диспансера в Балашихе впервые провели уникальную малотравматичную лапароскопическую операцию на поджелудочной железе, она длилась более 10 часов. Благодаря новой технологии пациента смогли выписать из больницы через неделю. При проведении аналогичной полостной операции восстановление заняло бы не меньше двух недель.
Как оформить ежегодную выплату донорам в Подмосковье>>
Восстановление костей пострадавшим в ДТП
Источник:
Фотобанк Московской области, Владимир Лебедев
Травматологи из Ступина выполняют операции по остеосинтезу – восстановлению костей пациентов. В декабре прошлого года пациенту, серьезно пострадавшему в ДТП, сделали сразу три удачных операции: малоинвазивный остеосинтез обоих бедер титановыми штифтами с блокированием и фиксацию перелома предплечья титановой пластиной. В январе 2019 года ступинские врачи спасли руку пациента после дорожной аварии. Мужчине пересадили в предплечье его собственную часть подвздошной кости.
В декабре прошлого года пациенту, серьезно пострадавшему в ДТП, сделали сразу три удачных операции: малоинвазивный остеосинтез обоих бедер титановыми штифтами с блокированием и фиксацию перелома предплечья титановой пластиной. В январе 2019 года ступинские врачи спасли руку пациента после дорожной аварии. Мужчине пересадили в предплечье его собственную часть подвздошной кости.
Как пройти диспансеризацию в Московской области>>
Извлечение пули, которая 33 года была в голове
Источник:
Министерство здравоохранения Московской области
Удивительный случай произошел в практике травматологов Ивантеевки. К ним обратился пациент с жалобами на плохое самочувствие и приступы усталости. При МРТ врачи обнаружили в голове у мужчины инородное тело – металлическую пулю. По воспоминаниям пациента он получил ее в тире 33 года назад, в девятилетнем возрасте.
Операцию по извлечению пули провели успешно, она заняла всего 11 минут под местной анестезией.
Как получить льготные лекарства в Подмосковье>>
Передача опыта онлайн
Источник:
Министерство здравоохранения Московской области
Врачи Московской области постоянно повышают свою квалификацию, получают новые знания и передают свой опыт в рамках всероссийских и международных мероприятий. Так, в прошлом году подмосковные специалисты впервые участвовали в международном марафоне «24-часовая живая роботическая хирургия». Операцию, которую проводили врачи МОНИИАГ, транслировали на весь мир.
Кроме того, делегация Московской области посетила Всероссийский конгресс «Анестезия и реанимация в акушерстве и неонатологии». В ходе мероприятия были достигнуты договоренности о сотрудничестве с немецкими представителями профессии.
Мытищинская клиническая больница принимала на стажировку врачей из Голландии, а реутовские травматологи прошли обучение в итальянском госпитале Ospedale Di Suzzara и в этом году ждут ответного визита.
Как записаться на прием к врачу в Подмосковье>>
Отделение анестезиологии-реанимации в ЦКБ РАН
В год в ЦКБ РАН проводится около 4500 самых различных операций, что невозможно представить без серьезной службы анестезиологии-реанимации.
Напряженный график сложнейших, а подчас уникальных операций, требует наличия высококвалифицированных анестезиологов-реаниматологов, профессионально владеющих различными видами общей, регионарной и комбинированной анестезии, и методиками послеоперационной реабилитации.
До операции:
Возможность перевода пациентов в отделение реанимации для проведения предоперационной подготовки. Это является своеобразной профилактикой возможных осложнений во время операции и помогает всесторонне оценить состояние пациента.
Во время операции:
Каждое анестезиологическое место оснащено современной наркозной и следящей аппаратурой. В клиническую практику внедрено применение современных безопасных ингаляционных анестетиков (севоран, ксенон). Возможно проведение раздельной интубации трахеи с однолегочной вентиляцией, если этого требует ход операции.
В клиническую практику внедрено применение современных безопасных ингаляционных анестетиков (севоран, ксенон). Возможно проведение раздельной интубации трахеи с однолегочной вентиляцией, если этого требует ход операции.
После операции:
После операции пациент попадает в заботливые руки врачей и медсестер отделения анестезиологии-реанимации. Их задача: снизить риск послеоперационных осложнений, устранить послеоперационную боль, обеспечить тщательный уход за больными и подготовить его к переводу в профильное отделение, под контроль лечащего врача.
В палатах отделения реанимации имеются системы для подключения постоянной ингаляции кислорода, аппараты искусственной вентиляции легких, обеспечивающие возможность как поддержки самостоятельного дыхания, так и проведения продленной искусственной вентиляции у больных после длительных или травматичных оперативных вмешательств. При необходимости проводится экстренная гемофильтрация, внедрен метод мембранного плазмафереза.
При необходимости проводится экстренная гемофильтрация, внедрен метод мембранного плазмафереза.
Наши врачи постоянно повышают свой профессиональный уровень, регулярно изучают мировую периодику, посещают конференции, симпозиумы. Сочетание огромного практического опыта сотрудников отделения, современного оборудования и новейших лекарственных препаратов позволяет проводить операции любой сложности на максимально безопасном для пациентов уровне.
Исследования под наркозом
Опыт врачей отделения востребован не только хирургами, но и врачами амбулаторно-поликлинических служб. У нас есть возможность провести исследования желудочно-кишечного тракта, бронхоскопию под наркозом. При этом состояние пациента будет контролировать анестезиологическая бригада, вооруженная современной анестезиологической аппаратурой, гарантирующей максимальный комфорт и безопасность.
В отделении оказывается помощь пациентам с жизнеугрожающими состояниями при заболеваниях
- Центральной нервной системы
- Сердечно-сосудистой системы
- Системы дыхания
- Эндокринной системы
- Желудочно-кишечного тракта
- Мочевыделительной системы
- Костей и суставов
А также с такими грозными осложнениями, как сепсис, шоки различной этиологии, ДВС-синдром и другие критические состояния.
Ветеринарная хирургия в Москве – Dr.Hug
Многопрофильный центр Dr.Hug в городе Москва предлагает все виды хирургической помощи домашним животным. В нашей клинике проводятся операции любой сложности. Новейшее оборудование операционной позволяет проводить сложнейшие операции, при онкологических заболеваниях, при получении травм позвоночника и опорно-двигательного аппарата и т. д. Ветеринары-хирурги клиники Dr.Hug готовы помочь 365 дней в году в любое время стуок.
Виды хирургических операций в Dr.Hug:
- Абдоминальная хирургия. Специалисты нашего центра проводят все виды операций в брюшной полости: диагностические лапаротомии, резекция кишечника, удаление пупочных, паховых и промежностных грыж, операции на желудке, печени, желчных протоках, поджелудочной железе, селезенке, мочевыделительной системе и на органах репродуктивной системы.
- Нейрохирургия. Нашим ветеринарным хирургам под силу сложнейшее оперативное вмешательство, на отделах спинного мозга и периферической нервной системы.

- Ортопедические операции. Хирургическое лечение врожденных и приобретенных хронических заболеваний опорно-двигательного аппарата, остеосинтезы, остеотомия и т. д.
- Онкологические операции. Клиника Dr.Hug располагает всем необходимым оборудованием, для успешного лечения онкологических заболеваний. Врачи-онкологи проводят операции по удалению опухолей вне зависимости от локализации.
- Экстренная хирургия. Проведение внеплановых операций для немедленного спасения жизни при гнойных процессах, травмах, интоксикации, быстро развивающихся инфекциях.
- Офтальмологические операции. Удаление тонкого слоя роговицы, трансплантация роговицы, удаление хрусталика, хирургическое лечение катаракты и глаукомы, операции на веках.
- Операции на органах грудной клетки. Торакотомия, торакоскопия
- Стоматологические операции. Удаление молочных и разрушенных зубов, имплантация, пластика десен.
Другие услуги ветеринарного врача-хирурга в Dr.Hug
В нашей клинике ветеринар-хирург проводит эндоскопические исследования, хирургическую обработку ран, накладывает и снимает швы, создает искусственные связки, ампутирует конечности и т. д.
д.
Как подготовить домашнее животное к операции?
Перед проведением плановой операции врач назначает ряд анализов, чтобы оценить работу организма в целом и состояние иммунитета. Кроме того, подбирается вид анестезии (исключается аллергия). В зависимости от вида операции ветеринарный врач дает рекомендации по диете. Зрелым животным часто проводят премедикацию – подготавливают организм к наркозу, чтобы минимизировать риск нарушения работы сердца и безопасно вывести животное из наркоза после операции.
Хирургическое лечение домашних животных в нашем центре проводится в современной стерильной операционной с особым микроклиматом. Оборудование операционной в клинике Dr.Hug:
- Многофункциональный операционный стол
- Операционный электрокоагулятор
- Наркозный аппарат с ИВЛ (искусственная вентиляция легких)
- Электрокардиомонитор
- Двукупольные светильники
После операции животное переводят в отделение реанимации, а затем при положительной динамике в стационар для прохождения реабилитационного курса. И только с выздоровлением животного заканчивается хирургическое лечение!
И только с выздоровлением животного заканчивается хирургическое лечение!
Гастрошизис | Морозовская ДГКБ ДЗМ
Гастрошизис — это аномалия развития, при которой имеется дефект передней брюшной стенки сбоку от нормально сформированной пуповины (чаще справа), через который из брюшной полости эвентрируются (выпячиваются) внутренние органы (петли тонкой и толстой кишки, желудок, печень, у девочек матка и придатки), покрытые фибринозным футляром. Этот порок развития формируется в результате возникновения дефекта в том месте, где располагается вторая пупочная вена в течение первых 4-х недель внутриутробного развития (P.Puri, M.Hollwarth 2009). Гастрошизис сочетается с незавершенным поворотом кишечника, возможно формирование атрезии кишечника, перфорации и некроза кишки в результате внутриутробного заворота. Частота встречаемости данного порока 1 случай на 4000 — 6000 живорожденных детей (P.Puri, M.Hollwarth 2009). Дети обычно рождаются недоношенными на 35-37 неделе внутриутробного развития, с малой массой тела.
В большинстве случаев данный порок диагностируется антенатально после 14-й недели внутриутробного развития. При УЗИ определяются петли кишечника вне брюшной полости, не покрытые грыжевым мешком. При внутриутробном выявлении гастрошизиса необходимо динамическое наблюдение, выявление сопутствующих пороков развития, кариотипирование плода. Если принято решение о сохранении беременности, необходимо четко согласовать действия родителей, педиатров, акушеров и неонатальных хирургов. Роды возможны естественным путем в специализированном родильном доме, с целью незамедлительной адекватной помощи ребенку сразу после рождения. Необходимо предотвратить охлаждение ребенка и обеспечить венозный доступ для адекватного введения жидкости и антибиотиков. Петли кишечника погружаются в пластиковый мешок, укрываются стерильными сухими салфетками, поверх которых накладывается фиксирующая повязка. В желудок ребенку устанавливают зонд, проводят обезболивание. Ребенок незамедлительно переводится в специализированный стационар.
Предоперационая подготовка проводится в условиях отделения интенсивной терапии, включает инфузионную и антибактериальную терапию. Необходимо выполнение дополнительных методов обследования для исключения сопутствующих аномалий развития.
Классификация гастрошизиса (В.Г. Баиров, С.А. Караваева 2010):
- Простая форма (изолированный порок) без висцероабдоминальной диспропорции или с висцероабдоминальной диспропорцией;
- Осложненная форма (сочетанные пороки развития, дородовые осложнения со стороны желудочно-кишечного тракта) без висцероабдоминальной диспропорции или с висцероабдоминальной
диспропорцией.
В предоперационной подготовке необходимо выполнить промывание желудка и высокое промывание толстой кишки с целью уменьшения объема эвентрированных органов, что значительно облегчает их погружение в брюшную полость во время операции.
Оперативное лечение заключается в погружении органов в брюшную полость и ушивание дефекта передней брюшной стенки. Методы оперативного лечения зависят от состояния петель кишечника, выраженности фибринозного футляра, степени соотношения объема брюшной полости и объема эвентрированных (выпавших) внутренних органов. При простой форме гастрошизиса с хорошим состоянием петель кишечника и адекватным объемом брюшной полости выполняется процедура Бианки, заключающаяся в безнаркозном вправлении эвентрированных петель кишечника с первичной пластикой передней брюшной стенки. При выраженной диспропорции брюшной полости и объема эвентрированных (выпавших) внутренних органов дефект передней брюшной стенки закрывают пластиной ксеноперикарда или другого синтетического материала, или используют силастиковый мешок, который подшивают к краям дефекта, с последующей пластикой передней брюшной стенки. В случае выявления атрезии кишечника формируется энтеростома.
Методы оперативного лечения зависят от состояния петель кишечника, выраженности фибринозного футляра, степени соотношения объема брюшной полости и объема эвентрированных (выпавших) внутренних органов. При простой форме гастрошизиса с хорошим состоянием петель кишечника и адекватным объемом брюшной полости выполняется процедура Бианки, заключающаяся в безнаркозном вправлении эвентрированных петель кишечника с первичной пластикой передней брюшной стенки. При выраженной диспропорции брюшной полости и объема эвентрированных (выпавших) внутренних органов дефект передней брюшной стенки закрывают пластиной ксеноперикарда или другого синтетического материала, или используют силастиковый мешок, который подшивают к краям дефекта, с последующей пластикой передней брюшной стенки. В случае выявления атрезии кишечника формируется энтеростома.
В послеоперационном периоде проводится искусственная вентиляция легких, инфузионная терапия с полным парентеральным питанием, адекватная антибактериальная терапия. После восстановления перистальтики кишечника начинают кормление в желудок.
После восстановления перистальтики кишечника начинают кормление в желудок.
В послеоперационном периоде возможны такие осложнения, как тромбоз сосудов брыжейки, некротический энтероколит новорожденных, спаечная кишечная непроходимость, присоединение вторичной инфекции, сепсис.
Несмотря на тяжелое течение заболевания и длительный реабилитационный период, гастрошизис является полностью коррегируемым пороком развития. Дети, оперированные по поводу гастрошизиса, не отстают от своих сверстников в психомоторном развитии и ведут активный образ жизни.
Защитите легкие во время абдоминальной хирургии | Анестезиология
ПОСЛЕ 2 десятилетий военной диктатуры в 1985 году в Бразилии был избран гражданский президент. События вокруг инаугурации касались как периоперационной медицины, так и дипломатии. После операции на брюшной полости у избранного президента развилось наиболее серьезное послеоперационное легочное осложнение: тяжелый острый респираторный дистресс-синдром (ОРДС). Он так и не вступил в должность.
Он так и не вступил в должность.
Легочные осложнения, такие как пневмония, бронхоспазм, выпот, невозможность отлучения от груди и дыхательная недостаточность послеэкстубации, являются ведущими причинами послеоперационных осложнений, уступая только раневой инфекции. Тяжелые послеоперационные легочные осложнения, приводящие к повторной интубации и последующей внеплановой госпитализации в отделение интенсивной терапии, приводят к более чем 90-кратному увеличению риска смерти. 1 Как следствие, крайне важно улучшить наше понимание проблемы и изучить методы ее минимизации.
В этом выпуске журнала Anesthesiology, Severgnini et al . 2 сообщают о важных новых данных, предполагающих связь между интраоперационной стратегией искусственной вентиляции легких и послеоперационными легочными осложнениями у пациентов, перенесших средние / большие операции на брюшной полости. Стимулируемые предыдущими результатами в отделении интенсивной терапии 3,4 и предварительными интраоперационными результатами 5 , авторы исследовали эффект защитной вентиляции против так называемой «стандартной вентиляции» во время абдоминальной хирургии.Главный вывод заключается в том, что применение защитной дыхательной стратегии с физиологическими дыхательными объемами и высоким положительным давлением в конце выдоха (ПДКВ) во время абдоминальной хирургии, длящейся более 2 часов, улучшило респираторную функцию и снизило клиническую оценку легочной инфекции в первые дни после операции, даже если это не повлияло на продолжительность пребывания в больнице.
Стимулируемые предыдущими результатами в отделении интенсивной терапии 3,4 и предварительными интраоперационными результатами 5 , авторы исследовали эффект защитной вентиляции против так называемой «стандартной вентиляции» во время абдоминальной хирургии.Главный вывод заключается в том, что применение защитной дыхательной стратегии с физиологическими дыхательными объемами и высоким положительным давлением в конце выдоха (ПДКВ) во время абдоминальной хирургии, длящейся более 2 часов, улучшило респираторную функцию и снизило клиническую оценку легочной инфекции в первые дни после операции, даже если это не повлияло на продолжительность пребывания в больнице.
Ателектаз развивается в течение нескольких минут после введения общей анестезии и является важным источником интраоперационных нарушений газообмена.Во время операции они могут усугубляться воспалением, вызванным хирургическим разрезом и бактериальной транслокацией, ограничением грудной стенки, смещением диафрагмы в головку диафрагмы хирургическими ретракторами и положением на спине. В послеоперационном периоде наблюдается рестриктивная дисфункция легких, вторичная по отношению к диафрагмальной дисфункции, которая ставит под угрозу дыхательную механику и газообмен, усиливается болью и клинически проявляется как заметное уменьшение соотношения движений брюшной полости и грудной клетки. Соответственно, анестезирующие и хирургические периоперационные воздействия могут создать условия «множественного поражения легких», которые могут быть дополнительно усилены стрессом ткани, вызванным интраоперационной механической вентиляцией (рис.1). Это подчеркивает необходимость вмешательства, чтобы минимизировать совокупный эффект этих оскорблений.
В послеоперационном периоде наблюдается рестриктивная дисфункция легких, вторичная по отношению к диафрагмальной дисфункции, которая ставит под угрозу дыхательную механику и газообмен, усиливается болью и клинически проявляется как заметное уменьшение соотношения движений брюшной полости и грудной клетки. Соответственно, анестезирующие и хирургические периоперационные воздействия могут создать условия «множественного поражения легких», которые могут быть дополнительно усилены стрессом ткани, вызванным интраоперационной механической вентиляцией (рис.1). Это подчеркивает необходимость вмешательства, чтобы минимизировать совокупный эффект этих оскорблений.
Рис. 1.
( A ) Интраоперационные анестетики и хирургические инсульты, создающие условия для «множественного поражения» легкого при абдоминальной хирургии. Деблокирование легких происходит вскоре после индукции анестезии в зависимых слабо расширенных областях в результате снижения регионального транспульмонального давления ( блок-стрелки , панель повреждения легкого с низким объемом). Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ).Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы.
Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ).Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
SIRS = синдром системной воспалительной реакции.
Рис. 1.
( A ) Интраоперационные анестезиологические и хирургические инсульты, создающие условия для «множественного поражения» легкого при абдоминальной хирургии. Деблокирование легких происходит вскоре после индукции анестезии в зависимых слабо расширенных областях в результате снижения регионального транспульмонального давления ( блок-стрелки , панель повреждения легкого с низким объемом). Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ). Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
Механическая вентиляция легких может вызвать серьезное повреждение легких, что приводит к увеличению смертности у пациентов с ОРДС. 3,4 Это открытие изменило парадигму настроек механической вентиляции с одной из настроек, направленных исключительно на оптимизацию газообмена, на оптимизацию газообмена при минимальном повреждении легких. При отсутствии чрезмерного давления на дыхание, которое могло бы вызвать баротравму, причины повреждения легких, вызванного вентилятором, могут быть охарактеризованы как чрезмерное раздувание аэрированных участков легких (волютравма), циклическое снижение рекрутинга легких (ателектравма) и увеличение количества местных провоспалительных медиаторов в результате биофизических сил. при отсутствии грубого ультраструктурного повреждения (биотравмы).В процессе механотрансдукции клетки, выстилающие капилляры, дыхательные пути и альвеолы, преобразуют механические силы в вредные химические сигналы, которые взаимодействуют с репаративными путями, вызывая повреждение легких. 6 В областях легких с небольшим объемом повреждающие механические силы могут возникать из-за концентрации напряжения на границе между ателектатической и расширенной областями, 7 распространение границ раздела воздух / жидкость в дыхательных путях, вызывающее повреждение эпителия бронхов, 8 и энергия, выделяющаяся при разрыве жидких мостиков во время повторного открытия дыхательных путей.
При отсутствии чрезмерного давления на дыхание, которое могло бы вызвать баротравму, причины повреждения легких, вызванного вентилятором, могут быть охарактеризованы как чрезмерное раздувание аэрированных участков легких (волютравма), циклическое снижение рекрутинга легких (ателектравма) и увеличение количества местных провоспалительных медиаторов в результате биофизических сил. при отсутствии грубого ультраструктурного повреждения (биотравмы).В процессе механотрансдукции клетки, выстилающие капилляры, дыхательные пути и альвеолы, преобразуют механические силы в вредные химические сигналы, которые взаимодействуют с репаративными путями, вызывая повреждение легких. 6 В областях легких с небольшим объемом повреждающие механические силы могут возникать из-за концентрации напряжения на границе между ателектатической и расширенной областями, 7 распространение границ раздела воздух / жидкость в дыхательных путях, вызывающее повреждение эпителия бронхов, 8 и энергия, выделяющаяся при разрыве жидких мостиков во время повторного открытия дыхательных путей. 9
9
Сведение к минимуму этих повреждающих механических факторов может быть достигнуто с помощью искусственной вентиляции легких, которая помогает избежать прекращения рекрутирования легких без чрезмерного чрезмерного растяжения. Следующие принципы «защитной» механической вентиляции , соответственно, нацелены на удержание всех областей легких на линейной части их локальной кривой давление-объем. Существенным понятием является понятие транспульмонального давления, разницы между альвеолярным и внутриплевральным давлениями и важного фактора, определяющего инфляцию легких.Транспульмональное давление лучше, чем давление плато, описывает расширяющие силы, приложенные к легким. Оптимальное транспульмональное давление ограничивает риски чрезмерного растяжения и баротравмы, избегая при этом нарушения функции легких. Клинические стратегии для достижения защитной механической вентиляции включают использование малых дыхательных объемов, ограничение давления на плато, ПДКВ и маневры рекрутмента. Этот подход имел заметный успех в снижении смертности у пациентов с ОРДС за счет использования физиологических дыхательных объемов (6 мл / кг прогнозируемой массы тела) и ограничения давления плато в конце вдоха. 4 Вместо этого точный подход к применению ПДКВ и стратегий набора во время ОРДС все еще не установлен. Хотя высокий ПДКВ, вероятно, полезен при тяжелом ОРДС, он может быть вредным для исходов у пациентов с легким и умеренным ОРДС. 10 Интересно, что подгруппа пациентов с менее тяжелым ОРДС в известном сетевом исследовании ОРДС, то есть пациенты с наивысшим квартилем комплаентности (наилучшая респираторная механика), по-видимому, не продемонстрировала преимущества в отношении выживаемости при низком дыхательном объеме. 4
Этот подход имел заметный успех в снижении смертности у пациентов с ОРДС за счет использования физиологических дыхательных объемов (6 мл / кг прогнозируемой массы тела) и ограничения давления плато в конце вдоха. 4 Вместо этого точный подход к применению ПДКВ и стратегий набора во время ОРДС все еще не установлен. Хотя высокий ПДКВ, вероятно, полезен при тяжелом ОРДС, он может быть вредным для исходов у пациентов с легким и умеренным ОРДС. 10 Интересно, что подгруппа пациентов с менее тяжелым ОРДС в известном сетевом исследовании ОРДС, то есть пациенты с наивысшим квартилем комплаентности (наилучшая респираторная механика), по-видимому, не продемонстрировала преимущества в отношении выживаемости при низком дыхательном объеме. 4
Определения защитной вентиляции для подавляющего большинства пациентов под наркозом, перенесших операцию, не существует — большинство из них не страдают ОРДС. Примечательно, что, учитывая большое количество пациентов, получающих общую анестезию с ИВЛ, в литературе представлена лишь ограниченная информация, касающаяся патофизиологии хирургического повреждения легких, его профилактики и лечения.
Примечательно, что, учитывая большое количество пациентов, получающих общую анестезию с ИВЛ, в литературе представлена лишь ограниченная информация, касающаяся патофизиологии хирургического повреждения легких, его профилактики и лечения.
Результаты Severgnini et al . 2 предполагают, что защитная дыхательная стратегия, состоящая из ПДКВ, маневров набора и физиологических дыхательных объемов, может улучшить некоторые аспекты респираторной функции в течение как минимум 5 дней после операции, включая оксигенацию, спирометрию и результаты рентгенографии грудной клетки. На клиническую оценку легочной инфекции, основанную на оксигенации и результатах рентгенографии грудной клетки, помимо температуры, количества лейкоцитов и объема трахеального секрета, также благоприятно влияла защитная вентиляция.
Мы предполагаем, основываясь на представленных данных, что предотвращение нарушения функции легких, а не снижение дыхательного объема, могло быть преобладающим фактором, связанным с этими полезными результатами. Действительно, дыхательные объемы в каждой группе были одинаковыми (7,7 против 9,5 мл / кг прогнозируемой массы тела), тогда как значения PEEP (10 против 0 см H 2 O) существенно различались. То, что ПДКВ было эффективным для набора областей легких в этой группе пациентов, подтверждается тем фактом, что давление плато было одинаковым (18 и 16 см H 2 O) в исследуемых группах, тогда как значения PEEP различались на 10 см H 2 O.
Действительно, дыхательные объемы в каждой группе были одинаковыми (7,7 против 9,5 мл / кг прогнозируемой массы тела), тогда как значения PEEP (10 против 0 см H 2 O) существенно различались. То, что ПДКВ было эффективным для набора областей легких в этой группе пациентов, подтверждается тем фактом, что давление плато было одинаковым (18 и 16 см H 2 O) в исследуемых группах, тогда как значения PEEP различались на 10 см H 2 O.
Недавно было показано, что применение ПДКВ к нормальным легким приводит не только к расширению больших областей легких, но также к однородности объема легких и распределению вентиляции в небольших, вероятно, микроскопических областях легких. 11 Возможно, что расширение легких в группе защитной вентиляции, вызванное ПДКВ и маневрами рекрутмента, могло изменить микромеханику легких, уменьшив величину повреждающих физических сил и, в конечном итоге, обеспечив лучшие результаты. 6 Этот заметный эффект ПДКВ у 28 пациентов, перенесших абдоминальную операцию без начального заболевания легких, контрастирует с бесполезностью применения высокого ПДКВ у 276 пациентов с ОРДС, изученных в исследовании ALVEOLI при поддержке Национальных институтов здравоохранения. 12
6 Этот заметный эффект ПДКВ у 28 пациентов, перенесших абдоминальную операцию без начального заболевания легких, контрастирует с бесполезностью применения высокого ПДКВ у 276 пациентов с ОРДС, изученных в исследовании ALVEOLI при поддержке Национальных институтов здравоохранения. 12
Следует отметить, что эффекты вентиляционной стратегии сохранялись в течение 5 дней после операции, когда можно было ожидать, что возобновление спонтанного дыхания обеспечит эквивалентные уровни вздутия легких в обеих группах пациентов, которым в остальном управляли одинаково с точки зрения контроля боли.Это говорит о том, что травмы, связанные со стратегией вентиляции, во время абдоминальной хирургии не только характеризуются как потеря аэрации легких, но и представляют собой стойкие структурные изменения. Возможные патологические процессы включают небольшое повреждение дыхательных путей 13,14 и дисфункцию сурфактанта, 15 , что может вызвать региональное воспаление легких и травму во время искусственной вентиляции легких. 13 Такие факторы могут иметь решающее значение для исхода у пациентов с сопутствующими заболеваниями или интраоперационными осложнениями.
13 Такие факторы могут иметь решающее значение для исхода у пациентов с сопутствующими заболеваниями или интраоперационными осложнениями.
В качестве небольшого исследования, сфокусированного на большинстве клинически полученных измерений, работа Severgnini et al . 2 имеет несколько ограничений. Масштабы эффекта, наблюдаемого в исследовании, заметны и расходятся с некоторыми предыдущими наблюдениями. Treschan et al. 16 сравнили легочные эффекты ИВЛ с низким — и с высоким дыхательным объемом у пациентов, перенесших обширные операции на брюшной полости.Они обнаружили лишь небольшие побочные эффекты высокого дыхательного объема (12 куб. См / кг) на послеоперационное тестирование функции легких, которое произошло уже через 5 дней после операции, даже несмотря на то, что размер выборки был в два раза больше. Можно утверждать, что на основе оценок Ariscat, процента курильщиков, продолжительности анестезии и значений PCO в конце выдоха 2 при условии, что группа защитной вентиляции в Severgnini et al. 2 исследование состояло из лиц с более низким риском послеоперационной дыхательной недостаточности.Кроме того, их методика, используемая для тестирования функции легких, подвержена систематическим ошибкам, связанным с недостаточным ослеплением эксперта. В будущем необходимы масштабные исследования результатов, чтобы установить влияние этих факторов на различные дыхательные стратегии, а также необходимы патофизиологические исследования для лучшего понимания механизмов периоперационного повреждения легких.
2 исследование состояло из лиц с более низким риском послеоперационной дыхательной недостаточности.Кроме того, их методика, используемая для тестирования функции легких, подвержена систематическим ошибкам, связанным с недостаточным ослеплением эксперта. В будущем необходимы масштабные исследования результатов, чтобы установить влияние этих факторов на различные дыхательные стратегии, а также необходимы патофизиологические исследования для лучшего понимания механизмов периоперационного повреждения легких.
Таким образом, исследование Severgnini et al. 2 обращает наше внимание на тот факт, что стратегия защитной механической вентиляции во время абдоминальной хирургии может снизить послеоперационную респираторную заболеваемость. Интраоперационная искусственная вентиляция легких полностью находится под контролем анестезиолога. Таким образом, мы поощряемся к углублению нашего понимания этой темы, чтобы обеспечить ориентированную на патофизиологию механическую вентиляцию легких, адаптированную к конкретным подгруппам пациентов, и в конечном итоге улучшить результаты анестезии и хирургии.
Защитите легкие во время абдоминальной хирургии | Анестезиология
ПОСЛЕ 2 десятилетий военной диктатуры в 1985 году в Бразилии был избран гражданский президент.События вокруг инаугурации касались как периоперационной медицины, так и дипломатии. После операции на брюшной полости у избранного президента развилось наиболее серьезное послеоперационное легочное осложнение: тяжелый острый респираторный дистресс-синдром (ОРДС). Он так и не вступил в должность.
Легочные осложнения, такие как пневмония, бронхоспазм, выпот, невозможность отлучения от груди и дыхательная недостаточность послеэкстубации, являются ведущими причинами послеоперационных осложнений, уступая только раневой инфекции.Тяжелые послеоперационные легочные осложнения, приводящие к повторной интубации и последующей внеплановой госпитализации в отделение интенсивной терапии, приводят к более чем 90-кратному увеличению риска смерти. 1 Как следствие, крайне важно улучшить наше понимание проблемы и изучить методы ее минимизации.
1 Как следствие, крайне важно улучшить наше понимание проблемы и изучить методы ее минимизации.
В этом выпуске журнала Anesthesiology, Severgnini et al . 2 сообщают о важных новых данных, предполагающих связь между интраоперационной стратегией искусственной вентиляции легких и послеоперационными легочными осложнениями у пациентов, перенесших средние / большие операции на брюшной полости.Стимулируемые предыдущими результатами в отделении интенсивной терапии 3,4 и предварительными интраоперационными результатами 5 , авторы исследовали эффект защитной вентиляции против так называемой «стандартной вентиляции» во время абдоминальной хирургии. Главный вывод заключается в том, что применение защитной дыхательной стратегии с физиологическими дыхательными объемами и высоким положительным давлением в конце выдоха (ПДКВ) во время абдоминальной хирургии, длящейся более 2 часов, улучшило респираторную функцию и снизило клиническую оценку легочной инфекции в первые дни после операции, даже если это не повлияло на продолжительность пребывания в больнице.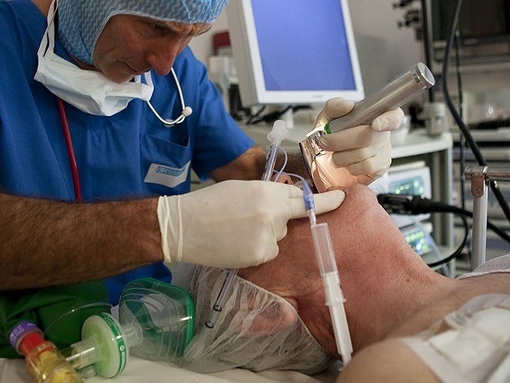
Ателектаз развивается в течение нескольких минут после введения общей анестезии и является важным источником интраоперационных нарушений газообмена. Во время операции они могут усугубляться воспалением, вызванным хирургическим разрезом и бактериальной транслокацией, ограничением грудной стенки, смещением диафрагмы в головку диафрагмы хирургическими ретракторами и положением на спине. В послеоперационном периоде наблюдается рестриктивная дисфункция легких, вторичная по отношению к диафрагмальной дисфункции, которая ставит под угрозу дыхательную механику и газообмен, усиливается болью и клинически проявляется как заметное уменьшение соотношения движений брюшной полости и грудной клетки.Соответственно, анестезирующие и хирургические периоперационные воздействия могут создать условия «множественного поражения легких», которые могут быть дополнительно усилены стрессом тканей, вызванным интраоперационной механической вентиляцией легких (рис.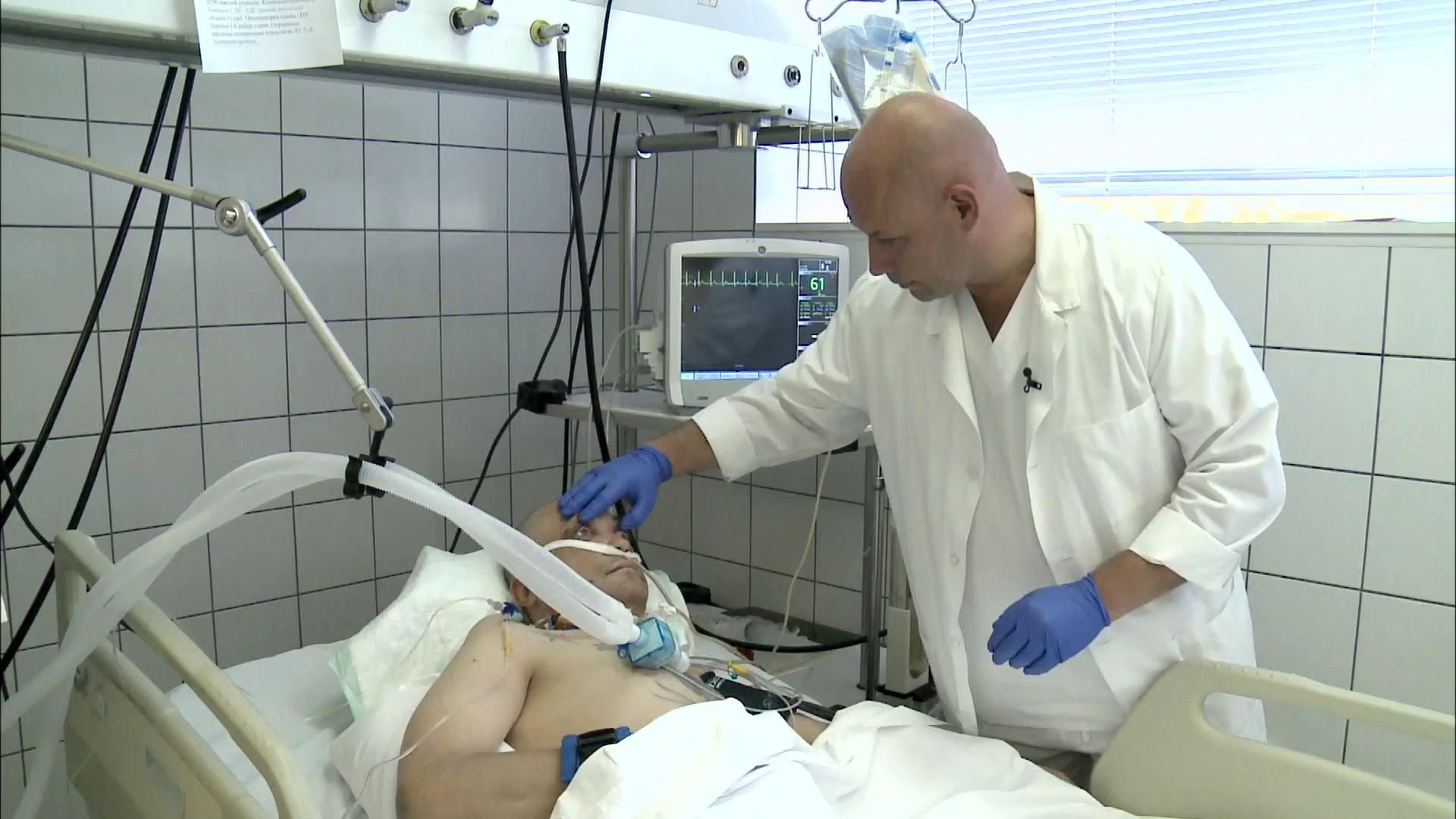 1). Это подчеркивает необходимость вмешательства, чтобы минимизировать совокупный эффект этих оскорблений.
1). Это подчеркивает необходимость вмешательства, чтобы минимизировать совокупный эффект этих оскорблений.
Рис. 1.
( A ) Интраоперационные анестетики и хирургические инсульты, создающие условия для «множественного поражения» легкого при абдоминальной хирургии.Деблокирование легких происходит вскоре после индукции анестезии в зависимых слабо расширенных областях в результате снижения регионального транспульмонального давления ( блок-стрелки , панель повреждения легкого с низким объемом). Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ). Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
Рис. 1.
( A ) Интраоперационные анестезиологические и хирургические инсульты, создающие условия для «множественного поражения» легкого при абдоминальной хирургии. Деблокирование легких происходит вскоре после индукции анестезии в зависимых слабо расширенных областях в результате снижения регионального транспульмонального давления ( блок-стрелки , панель повреждения легкого с низким объемом). Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ).Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы.
Это усугубляется параличом диафрагмы и применением хирургических ретракторов. Во время механической вентиляции эти зависимые области подвержены риску повреждения легких с низким объемом, с циклическим отключением конечных дыхательных путей и альвеол, концентрацией механических сил, напряжением сдвига и касательными силами ( пунктирных стрелок ), способствующими разрушению напряжения клеточной мембраны, и повреждение бронхиолярных эпителиальных клеток из-за градиентов давления при открытии дыхательных путей ( тонких стрелок ).Снижение податливости в этих исключенных регионах также способствует гиперинфляции в независимых областях с более высоким транспульмональным давлением ( блок-стрелки , панель гиперинфляции). Системное воспаление, вызванное хирургическим разрезом, манипуляциями с тканями, бактериальной транслокацией и эндотоксемией, может дополнительно способствовать повреждению легких. ( B ) Пациент со спонтанным дыханием в сознании с меньшей неоднородностью регионарной аэрации легких и более каудальным положением диафрагмы. SIRS = синдром системной воспалительной реакции.
SIRS = синдром системной воспалительной реакции.
Механическая вентиляция легких может вызвать серьезное повреждение легких, что приводит к увеличению смертности у пациентов с ОРДС. 3,4 Это открытие изменило парадигму настроек механической вентиляции с одной из настроек, направленных исключительно на оптимизацию газообмена, на оптимизацию газообмена при минимальном повреждении легких. При отсутствии чрезмерного давления на дыхание, которое могло бы вызвать баротравму, причины повреждения легких, вызванного вентилятором, могут быть охарактеризованы как чрезмерное раздувание аэрированных участков легких (волютравма), циклическое снижение рекрутинга легких (ателектравма) и увеличение количества местных провоспалительных медиаторов в результате биофизических сил. при отсутствии грубого ультраструктурного повреждения (биотравмы).В процессе механотрансдукции клетки, выстилающие капилляры, дыхательные пути и альвеолы, преобразуют механические силы в вредные химические сигналы, которые взаимодействуют с репаративными путями, вызывая повреждение легких. 6 В областях легких с небольшим объемом повреждающие механические силы могут возникать из-за концентрации напряжения на границе между ателектатической и расширенной областями, 7 распространение границ раздела воздух / жидкость в дыхательных путях, вызывающее повреждение эпителия бронхов, 8 и энергия, выделяющаяся при разрыве жидких мостиков во время повторного открытия дыхательных путей. 9
6 В областях легких с небольшим объемом повреждающие механические силы могут возникать из-за концентрации напряжения на границе между ателектатической и расширенной областями, 7 распространение границ раздела воздух / жидкость в дыхательных путях, вызывающее повреждение эпителия бронхов, 8 и энергия, выделяющаяся при разрыве жидких мостиков во время повторного открытия дыхательных путей. 9
Сведение к минимуму этих повреждающих механических факторов может быть достигнуто с помощью искусственной вентиляции легких, которая помогает избежать прекращения рекрутирования легких без чрезмерного чрезмерного растяжения. Следующие принципы «защитной» механической вентиляции , соответственно, нацелены на удержание всех областей легких на линейной части их локальной кривой давление-объем. Существенным понятием является понятие транспульмонального давления, разницы между альвеолярным и внутриплевральным давлениями и важного фактора, определяющего инфляцию легких. Транспульмональное давление лучше, чем давление плато, описывает расширяющие силы, приложенные к легким. Оптимальное транспульмональное давление ограничивает риски чрезмерного растяжения и баротравмы, избегая при этом нарушения функции легких. Клинические стратегии для достижения защитной механической вентиляции включают использование малых дыхательных объемов, ограничение давления на плато, ПДКВ и маневры рекрутмента. Этот подход имел заметный успех в снижении смертности у пациентов с ОРДС за счет использования физиологических дыхательных объемов (6 мл / кг прогнозируемой массы тела) и ограничения давления плато в конце вдоха. 4 Вместо этого точный подход к применению ПДКВ и стратегий набора во время ОРДС все еще не установлен. Хотя высокий ПДКВ, вероятно, полезен при тяжелом ОРДС, он может быть вредным для исходов у пациентов с легким и умеренным ОРДС. 10 Интересно, что подгруппа пациентов с менее тяжелым ОРДС в известном сетевом исследовании ОРДС, то есть пациенты с наивысшим квартилем комплаентности (наилучшая респираторная механика), по-видимому, не продемонстрировала преимущества в отношении выживаемости при низком дыхательном объеме.
Транспульмональное давление лучше, чем давление плато, описывает расширяющие силы, приложенные к легким. Оптимальное транспульмональное давление ограничивает риски чрезмерного растяжения и баротравмы, избегая при этом нарушения функции легких. Клинические стратегии для достижения защитной механической вентиляции включают использование малых дыхательных объемов, ограничение давления на плато, ПДКВ и маневры рекрутмента. Этот подход имел заметный успех в снижении смертности у пациентов с ОРДС за счет использования физиологических дыхательных объемов (6 мл / кг прогнозируемой массы тела) и ограничения давления плато в конце вдоха. 4 Вместо этого точный подход к применению ПДКВ и стратегий набора во время ОРДС все еще не установлен. Хотя высокий ПДКВ, вероятно, полезен при тяжелом ОРДС, он может быть вредным для исходов у пациентов с легким и умеренным ОРДС. 10 Интересно, что подгруппа пациентов с менее тяжелым ОРДС в известном сетевом исследовании ОРДС, то есть пациенты с наивысшим квартилем комплаентности (наилучшая респираторная механика), по-видимому, не продемонстрировала преимущества в отношении выживаемости при низком дыхательном объеме. 4
4
Определения защитной вентиляции для подавляющего большинства пациентов под наркозом, перенесших операцию, не существует — большинство из них не страдают ОРДС. Примечательно, что, учитывая большое количество пациентов, получающих общую анестезию с ИВЛ, в литературе представлена лишь ограниченная информация, касающаяся патофизиологии хирургического повреждения легких, его профилактики и лечения.
Результаты Severgnini et al . 2 предполагают, что защитная дыхательная стратегия, состоящая из ПДКВ, маневров набора и физиологических дыхательных объемов, может улучшить некоторые аспекты респираторной функции в течение как минимум 5 дней после операции, включая оксигенацию, спирометрию и результаты рентгенографии грудной клетки. На клиническую оценку легочной инфекции, основанную на оксигенации и результатах рентгенографии грудной клетки, помимо температуры, количества лейкоцитов и объема трахеального секрета, также благоприятно влияла защитная вентиляция.
Мы предполагаем, основываясь на представленных данных, что предотвращение нарушения функции легких, а не снижение дыхательного объема, могло быть преобладающим фактором, связанным с этими полезными результатами. Действительно, дыхательные объемы в каждой группе были одинаковыми (7,7 против 9,5 мл / кг прогнозируемой массы тела), тогда как значения PEEP (10 против 0 см H 2 O) существенно различались. То, что ПДКВ было эффективным для набора областей легких в этой группе пациентов, подтверждается тем фактом, что давление плато было одинаковым (18 и 16 см H 2 O) в исследуемых группах, тогда как значения PEEP различались на 10 см H 2 O.
Недавно было показано, что применение ПДКВ к нормальным легким приводит не только к расширению больших областей легких, но также к однородности объема легких и распределению вентиляции в небольших, вероятно, микроскопических областях легких. 11 Возможно, что расширение легких в группе защитной вентиляции, вызванное ПДКВ и маневрами рекрутмента, могло изменить микромеханику легких, уменьшив величину повреждающих физических сил и, в конечном итоге, обеспечив лучшие результаты. 6 Этот заметный эффект ПДКВ у 28 пациентов, перенесших абдоминальную операцию без начального заболевания легких, контрастирует с бесполезностью применения высокого ПДКВ у 276 пациентов с ОРДС, изученных в исследовании ALVEOLI при поддержке Национальных институтов здравоохранения. 12
11 Возможно, что расширение легких в группе защитной вентиляции, вызванное ПДКВ и маневрами рекрутмента, могло изменить микромеханику легких, уменьшив величину повреждающих физических сил и, в конечном итоге, обеспечив лучшие результаты. 6 Этот заметный эффект ПДКВ у 28 пациентов, перенесших абдоминальную операцию без начального заболевания легких, контрастирует с бесполезностью применения высокого ПДКВ у 276 пациентов с ОРДС, изученных в исследовании ALVEOLI при поддержке Национальных институтов здравоохранения. 12
Следует отметить, что эффекты вентиляционной стратегии сохранялись в течение 5 дней после операции, когда можно было ожидать, что возобновление спонтанного дыхания обеспечит эквивалентные уровни вздутия легких в обеих группах пациентов, которым в остальном управляли одинаково с точки зрения контроля боли.Это говорит о том, что травмы, связанные со стратегией вентиляции, во время абдоминальной хирургии не только характеризуются как потеря аэрации легких, но и представляют собой стойкие структурные изменения. Возможные патологические процессы включают небольшое повреждение дыхательных путей 13,14 и дисфункцию сурфактанта, 15 , что может вызвать региональное воспаление легких и травму во время искусственной вентиляции легких. 13 Такие факторы могут иметь решающее значение для исхода у пациентов с сопутствующими заболеваниями или интраоперационными осложнениями.
Возможные патологические процессы включают небольшое повреждение дыхательных путей 13,14 и дисфункцию сурфактанта, 15 , что может вызвать региональное воспаление легких и травму во время искусственной вентиляции легких. 13 Такие факторы могут иметь решающее значение для исхода у пациентов с сопутствующими заболеваниями или интраоперационными осложнениями.
В качестве небольшого исследования, сфокусированного на большинстве клинически полученных измерений, работа Severgnini et al . 2 имеет несколько ограничений. Масштабы эффекта, наблюдаемого в исследовании, заметны и расходятся с некоторыми предыдущими наблюдениями. Treschan et al. 16 сравнили легочные эффекты ИВЛ с низким — и с высоким дыхательным объемом у пациентов, перенесших обширные операции на брюшной полости.Они обнаружили лишь небольшие побочные эффекты высокого дыхательного объема (12 куб. См / кг) на послеоперационное тестирование функции легких, которое произошло уже через 5 дней после операции, даже несмотря на то, что размер выборки был в два раза больше. Можно утверждать, что на основе оценок Ariscat, процента курильщиков, продолжительности анестезии и значений PCO в конце выдоха 2 при условии, что группа защитной вентиляции в Severgnini et al. 2 исследование состояло из лиц с более низким риском послеоперационной дыхательной недостаточности.Кроме того, их методика, используемая для тестирования функции легких, подвержена систематическим ошибкам, связанным с недостаточным ослеплением эксперта. В будущем необходимы масштабные исследования результатов, чтобы установить влияние этих факторов на различные дыхательные стратегии, а также необходимы патофизиологические исследования для лучшего понимания механизмов периоперационного повреждения легких.
См / кг) на послеоперационное тестирование функции легких, которое произошло уже через 5 дней после операции, даже несмотря на то, что размер выборки был в два раза больше. Можно утверждать, что на основе оценок Ariscat, процента курильщиков, продолжительности анестезии и значений PCO в конце выдоха 2 при условии, что группа защитной вентиляции в Severgnini et al. 2 исследование состояло из лиц с более низким риском послеоперационной дыхательной недостаточности.Кроме того, их методика, используемая для тестирования функции легких, подвержена систематическим ошибкам, связанным с недостаточным ослеплением эксперта. В будущем необходимы масштабные исследования результатов, чтобы установить влияние этих факторов на различные дыхательные стратегии, а также необходимы патофизиологические исследования для лучшего понимания механизмов периоперационного повреждения легких.
Таким образом, исследование Severgnini et al. 2 обращает наше внимание на тот факт, что стратегия защитной механической вентиляции во время абдоминальной хирургии может снизить послеоперационную респираторную заболеваемость. Интраоперационная искусственная вентиляция легких полностью находится под контролем анестезиолога. Таким образом, мы поощряемся к углублению нашего понимания этой темы, чтобы обеспечить ориентированную на патофизиологию механическую вентиляцию легких, адаптированную к конкретным подгруппам пациентов, и в конечном итоге улучшить результаты анестезии и хирургии.
2 обращает наше внимание на тот факт, что стратегия защитной механической вентиляции во время абдоминальной хирургии может снизить послеоперационную респираторную заболеваемость. Интраоперационная искусственная вентиляция легких полностью находится под контролем анестезиолога. Таким образом, мы поощряемся к углублению нашего понимания этой темы, чтобы обеспечить ориентированную на патофизиологию механическую вентиляцию легких, адаптированную к конкретным подгруппам пациентов, и в конечном итоге улучшить результаты анестезии и хирургии.
Послеоперационная легочная дисфункция и механическая вентиляция в кардиохирургии
Послеоперационная легочная дисфункция (PPD) является частым и значительным осложнением после кардиохирургических операций.Это способствует увеличению заболеваемости и смертности, увеличению продолжительности госпитализации и связанных с ней затрат. Его патогенез не ясен, но, по-видимому, он связан с развитием системной воспалительной реакции с последующим воспалением легких. Было описано, что этому воспалительному ответу способствуют многие факторы, в том числе хирургическая процедура с разрезом стернотомии, эффекты общей анестезии, местного охлаждения, экстракорпорального кровообращения (ECC) и механической вентиляции (VM).Стратегии защитной вентиляции могут снизить частоту ателектазов (которые по-прежнему остаются одной из основных причин PDD) и легочных инфекций у хирургических пациентов. Таким образом, открытый доступ легких (OLA), стратегия защитной вентиляции, продемонстрировал ослабление воспалительной реакции и улучшение параметров газообмена и послеоперационных функций легких с лучшей остаточной функциональной емкостью (FRC) по сравнению с традиционной вентиляционной стратегией. Кроме того, поддержание низкочастотной вентиляции во время неотложной помощи при сердечно-сосудистых заболеваниях снижает частоту развития ПДД после кардиохирургии, сохраняя функцию легких.
Было описано, что этому воспалительному ответу способствуют многие факторы, в том числе хирургическая процедура с разрезом стернотомии, эффекты общей анестезии, местного охлаждения, экстракорпорального кровообращения (ECC) и механической вентиляции (VM).Стратегии защитной вентиляции могут снизить частоту ателектазов (которые по-прежнему остаются одной из основных причин PDD) и легочных инфекций у хирургических пациентов. Таким образом, открытый доступ легких (OLA), стратегия защитной вентиляции, продемонстрировал ослабление воспалительной реакции и улучшение параметров газообмена и послеоперационных функций легких с лучшей остаточной функциональной емкостью (FRC) по сравнению с традиционной вентиляционной стратегией. Кроме того, поддержание низкочастотной вентиляции во время неотложной помощи при сердечно-сосудистых заболеваниях снижает частоту развития ПДД после кардиохирургии, сохраняя функцию легких.
1. Введение
Послеоперационная легочная дисфункция (PPD) — довольно частое осложнение после кардиохирургических операций [1]; У 40% пациентов, повторно госпитализированных в отделения интенсивной терапии (ОИТ), наблюдается дыхательная недостаточность [2], и адекватное терапевтическое лечение, которое могло бы снизить ее частоту, до сих пор неизвестно.
Патофизиология PPD сложна, и ее механизмы не ясны (Таблица 1). Тем не менее, существует множество связанных с хирургическим вмешательством факторов, которые предрасполагают кардиохирургических пациентов к патогенезу послеоперационных легочных осложнений, таких как эффекты общей анестезии в сочетании с эффектами среднего стернотомического разреза, искусственного кровообращения (CBP), расслоения внутренней молочной артерии, и использование местного охлаждения для защиты миокарда [3].
| ||||||||||||||||||||||||||||||||||||||
Клинические проявления PPD включают плевральный выпот с частыми проявлениями (27–95%) [4] и ателектаз (16.6–88%) [5] и послеоперационная гипоксемия без клинических симптомов (3–10%) [6] и острый респираторный дистресс-синдром (ОРДС), которые имеют низкую частоту (0,5–1,7%) [7], но высокую смертность ( 50–90%) [8].
Кроме того, кардиохирургия вызывает воспалительную реакцию всего тела, которая в значительной степени связана с повреждением легких [9]. Этот системный воспалительный ответ связан с аномалиями газообмена, такими как повышенная фракция легочного шунта [10], повышенное сопротивление легочных сосудов [11] и внутрилегочная агрегация лейкоцитов и тромбоцитов [12]; также с изменениями в механике легких, что приводит к снижению податливости легких и снижению функциональной остаточной емкости (FRC) и жизненной емкости легких (VC) или и того, и другого.
2. Факторы, связанные с развитием ППД после кардиохирургических вмешательств
2.1. Общая анестезия
Хорошо известно, что функциональное нарушение легких неизбежно после любой серьезной операции, состояние, которое, скорее всего, связано с общей анестезией.
Есть много факторов, связанных с общей анестезией, которые влияют на легочную функцию. Анестезия при длительном положении лежа на спине вызывает смещение диафрагмы вверх; это, в сочетании с расслаблением грудной стенки и изменением податливости грудной стенки, а также с модификацией объема крови в грудной клетке, приводит к изменению несоответствия вентиляции и перфузии и аномальной фракции легочного шунта [13].Более того, большинство препаратов, используемых при анестезии, также влияют на легочную функцию; например, ингаляционные анестетики подавляют гипоксическую вазоконстрикцию легких, а наркотики снижают гипоксический и гиперкапнический респираторный ответ.
Все эти комбинированные факторы приводят к расширенному альвеолярно-артериальному градиенту кислорода [14] и снижению жизненной емкости и функциональной остаточной емкости легких [13]; а также способствует возникновению гипоксемии и ателектазов [14].
2.2. Экстракорпоральное кровообращение (ECC)
Экстракорпоральное кровообращение (операция на помпе) имеет очевидные последствия для послеоперационной функции легких. Сосудистый вклад в легкие зависит почти исключительно от легочных артерий. Основная функция бронхиального кровообращения — питание легочных структур; таким образом, он отвечает примерно за 1% малого круга кровообращения. Однако, когда артериальное кровообращение хронически нарушено, бронхиальное кровообращение играет ведущую роль.
Когда начинается ЭКК, прекращение легочной вентиляции приводит к коллапсу легких с потерей сурфактанта и альвеолярному коллапсу, что способствует задержке секрета и ателектазу. Кроме того, прекращается малое кровообращение, что приводит к ишемии легких с повреждением стенок капилляров и выбросом медиаторов воспаления [15]. Все это увеличивает нарушения газообмена и приводит к закрытию мелких дыхательных путей.
Таким образом, по сравнению с операцией на помпе, операция без помпы была связана со снижением воспалительной реакции и более низкими уровнями циркулирующих нейтрофилов и моноцитов [16].
Кроме того, многие исследования показали, что процедуры без ЭК имеют более низкую частоту легочных осложнений, более раннюю экстубацию, более короткую продолжительность МК и более низкую частоту пневмонии по сравнению с процедурами с ЭКК [17].
Таким образом, кажется очевидным, что использование ECC имеет очевидные последствия для послеоперационной функции легких по сравнению с другими типами серьезной хирургии, и, по-видимому, вызывает дополнительное повреждение легких и задержку восстановления легких, вероятно, из-за повреждающих эффектов ассоциированный системный воспалительный ответ.
С другой стороны, некоторые исследования показали, что операция без помпы не всегда более эффективна, чем операция с помпой, что показывает, как Groeneveld et al. продемонстрировали, что ECC не всегда является определяющим фактором развития PDD [18].
2.3. Хирургические эффекты и системная температура
Существуют некоторые факторы, связанные исключительно с кардиохирургией, которые влияют на легочную функцию и способствуют деформированию PPD, такие как средний разрез стернотомии, гипотермия для защиты миокарда, расслоение внутренней молочной артерии и использование сердечно-легочный обход.
Неясно влияние срединного разреза стернотомии на PPD. Исследования, сравнивающие разрез стернотомии с разрезом торакотомии, показали, что минимальное прерывание грудной стенки, меньшая травма и незначительное сжатие легких делают стернотомию относительно безболезненной процедурой [14]. Многие другие исследования, например, Barnas et al. [19] или Ranieri et al. [20], также продемонстрировали, что разрез стернотомии не влияет на механические свойства грудной стенки.
Хотя у пациентов с нормотермией наблюдается снижение фракции шунта, PA-a O 2 , и альвеоло-артериального градиента CO 2 ; Центральная температура не оказывала значительного влияния на газообмен (разница парциального давления кислорода в альвеолярных артериях, или PA-a O 2 ) после аортокоронарного шунтирования.Это предполагает, что нормотермия может быть полезной для сохранения легочной функции после операции искусственного кровообращения [21].
При всем этом кажется очевидным, что на тяжелую легочную дисфункцию, развившуюся после кардиохирургического вмешательства, влияют два основных фактора. Один из них — это механический стресс и биотравма, вызванные механической вентиляцией легких и использованием неадекватной стратегии вентиляции с большими объемами и низким уровнем PEEP, которые стимулируют ателектаз. Во-вторых, это чрезмерная системная воспалительная реакция на кардиохирургическое вмешательство и связанные с ней факторы, такие как эффекты общей анестезии, разреза стернотомии, местного охлаждения и экстракорпорального кровообращения.
2.4. Механическая вентиляция (МВ)
Механическая вентиляция может вызвать значительные изменения в структуре и функции легких. Это повреждение легких во время искусственной вентиляции легких вызывает воспаление легких, которое может распространяться на отдаленные органы и значительно влиять на результаты лечения [22].
В дополнение к повреждению легкого, в кардиохирургии участвует множество факторов, которые также влияют на легочную функцию и играют важную роль в этой воспалительной реакции, включая экстракорпоральное кровообращение (ECC), хирургическое вмешательство и травмы, вызванные ишемией. -реперфузия.
Поражение легких, вызванное вентиляцией, с воспалением легких является результатом как механической, так и биологической травмы [23].
Механическая травма включает волюмотравму и баротравму. Термин баротравма используется для обозначения повреждения легких, связанного с применением высокого давления в дыхательных путях [24]; Таким образом, волютравма относится к чрезмерному растяжению альвеол при использовании больших дыхательных объемов. Напряжение, вызванное этой механической травмой, может быть достаточно сильным, чтобы вызвать разрушение анатомической структуры легкого с повреждением эпителия, потерей целостности эпителия и отеком.
Биологическая травма — это биологическая реакция на механическую вентиляционную нагрузку. Вентиляция с высоким дыхательным объемом вызывает высвобождение медиаторов воспаления, которые способствуют этой биотравме, вызванной вентиляцией [25], путем активации как местных, так и системных воспалительных реакций, что вызывает высвобождение цитокинов и других растворимых медиаторов воспаления и активацию комплемента, лейкоцитов, и эндотелиальные клетки, что приводит к нарушению нормальной функции тканей и органов за счет изменения клеточных путей.
Биотравма возникает в результате сил, действующих во время механической вентиляции с циклическим открытием и схлопыванием альвеол и их чрезмерным растяжением, которые вызывают высвобождение провоспалительных цитокинов, рекрутирование лейкоцитов и локальное инициирование воспалительных процессов. До сих пор остается неясным, как механические силы переводятся в биохимические сигналы, вызывающие биотравму [26]. Согласно экспериментальным исследованиям, в которых изучалась взаимосвязь между механическим растяжением альвеолокапиллярной мембраны и производством медиаторов, гипотеза биотравмы предполагает, что повреждение легких вызвано высвобождением этих провоспалительных медиаторов и чрезмерной активацией иммунной системы; Таким образом, предложенные теории подразумевают механорецепторы, чувствительные к растяжению каналы, активацию воспалительного каскада [27] и активацию транскрипции ядерного фактора каппа [28] (NF- κ B), который становится основным фактором модификации. последовательности нуклеиновой кислоты в ядре клетки и синтез воспалительных факторов (TNF- α , IL-1 β , IL-6 и IL-8) [26].
Биотравма вызывает различные биологические реакции, такие как действие свободных радикалов кислорода, клеточные механизмы роста или деления и апоптоз, измененная экспрессия генов и белков, активация каскада свертывания и стимуляция различных элементов иммунной системы, которые, соответственно, приводят к каскаду воспалений. И этот преувеличенный воспалительный ответ, инициированный локально в легочной ткани, может проникать в системный кровоток, вызывая системный воспалительный ответ [29].
Наличие ателектаза является одной из основных причин PDD и первичным фактором развития воспаления легких [27], и существует корреляция между размером ателектаза и внутрилегочным шунтом [30].
Ателектаз связан со слишком низким объемом легких в конце выдоха, и их развитие связано с потерей сурфактанта и циклическим открытием и коллапсом нестабильных единиц легкого, чему способствует вентиляция с нулевым или недостаточным ПДКВ [31].Этот повторяющийся коллапс и повторное открытие альвеол называется ателектравмой [32].
Когда ателектатические легочные единицы подвергаются воздействию высокого давления вентиляции, попеременное раскрытие и схлопывание альвеол создает повреждающие поперечные силы, локализованные в этих зависимых частях. Эти поперечные силы, приложенные к спавшимся единицам, могут быть достаточно высокими, чтобы повредить эпителий дыхательных путей и вызвать «вызванный стрессом отказ» мембраны альвеолярных капилляров, приводящий к повышенной проницаемости микрососудов, отеку и притоку плазматических белков, вызывающих дисфункцию сурфактанта и инициирующую воспалительная реакция [33–35].Таким образом, Dreyfuss et al. [35] продемонстрировали, что волютравма (вентиляция с высокими дыхательными объемами, вызывающими высокое транспульмонарное давление), а не баротравма (вентиляция с высоким давлением, вызывающим низкое транспульмонарное давление), была основным определяющим фактором легочного повреждения и воспалительной реакции.
3. Терапевтические меры, минимизирующие PPD после кардиохирургических вмешательств
3.1. Стратегия защитной вентиляции: открытый доступ к легким (OLA)
Хорошо изучено, что стратегии защитной вентиляции могут снизить частоту ателектазов и легочных инфекций у хирургических пациентов [36].Стратегия искусственной вентиляции легких OLA была первоначально разработана для лечения пациентов с ОРС; его цель состоит в том, чтобы уменьшить силы сдвига, создаваемые циклическим открытием и закрытием ателектазных альвеол, и минимизировать развитие диффузного альвеолярного повреждения, отека легких, рекрутирования воспалительных клеток и выработки цитокинов [37, 38] из травмирующих стратегий вентиляции с помощью высокий дыхательный объем.
Стратегия OLA должна применяться с маневрами набора и достаточным PEEP для увеличения транспульмонального давления, достаточного для поддержания максимально возможного количества альвеол в открытом состоянии с минимальным дельта-давлением (Pplateau-PEEP) для предотвращения чрезмерного растяжения легких [39].Низкое дельта-давление обычно достигается за счет использования малых дыхательных объемов (4–6 мл / кг). Serita et al. [40] обнаружили, что индивидуальные маневры по рекрутменту привели к улучшению оксигенации и комплаентности легких у пациентов, перенесших селективную кардиохирургию.
Используя вентиляционную стратегию OLA, внезапные изменения объема в больших альвеолярных зонах сводятся к минимуму [41], а ателектазы не наблюдались при компьютерной томографии у здоровых детей под наркозом. Эта вентилирующая стратегия также ослабляет изменения сурфактанта, что, как следствие, снижает потерю белков в альвеолах [42].
Так как эта стратегия предотвращает циклический коллапс альвеол за счет их открытия в конце выдоха, нагрузка на альвеолокапиллярную мембрану ограничивается. Наблюдалось уменьшение биохимических маркеров, выделяемых поврежденными клетками после вентиляции с высоким давлением, что подтверждает это [43].
Важно отметить, что применение адекватного уровня PEEP и предотвращение коллапса в конце выдоха сводит к минимуму воспалительную реакцию и снижает бактериальную транслокацию [44].Кроме того, два недавних исследования пациентов, перенесших абдоминальную операцию, показали, что воспаление легких можно уменьшить [45] и предотвратить прокоагулянтные альвеолярные изменения [46], используя более низкий дыхательный объем и ПДКВ.
Как показали многие исследования, стратегия OLA имеет множество преимуществ. Миранда и др. [47] показали, что вентиляция OLA (дыхательный объем 6 мл / кг, PEEP 14 см H 2 O), применяемая сразу после интубации, значительно ослабляет воспалительную реакцию за счет снижения уровня IL-6, IL-8, IL-10, TNF. Уровни -альфа и гамма-интерферона в плазме по сравнению с традиционной вентиляцией (дыхательный объем 8 мл / кг, ПДКВ 5 см H 2 O).Во время ИВЛ применение OLA сопровождалось значительным увеличением PaO 2 / FiO 2 , что свидетельствует о значительном снижении ателектазов [48]. Позднее эти исследователи обнаружили [49], что влияние OLA на объем легких сохранялось после экстубации; На следующий день после экстубации группа, получавшая ИВЛ с помощью OLA, показала FRC на 40% выше, чем в группе, получавшей традиционную вентиляцию. Этот эффект на FRC сохранялся до 5-го дня после экстубации.Кроме того, в группе OLA наблюдалось значительное снижение частоты гипоксемии (SpO 2 <90% с окружающим воздухом) на следующий день после экстубации по сравнению с группой с традиционной вентиляцией.
Кроме того, Ranieri et al. [50] обнаружили в предыдущих экспериментальных данных у пациентов с ОРДС, что уровни фактора некроза опухоли альфа (TNF α ), интерлейкина-6 (IL-6) и IL-8 в бронхоальвеолярном лаваже (БАЛ) были ниже. со стратегией искусственной вентиляции легких, титрованной для оптимального положительного давления в конце выдоха (ПДКВ) и низких дыхательных объемов, чем со стратегией, в которой использовались высокие дыхательные объемы.В многоцентровом исследовании с участием 861 пациента вентиляция с низким дыхательным объемом (6 мл / кг) снизила плазменные концентрации ИЛ-6 и значительно снизила 28-дневную смертность пациентов с ОРДС. Это говорит о том, что применение подходящих дыхательных стратегий явно влияет на развитие воспалительной реакции после кардиохирургии.
Стратегия OLA не оценивалась клинически с точки зрения исходов (смертность или повторная госпитализация в ОИТ). Несмотря на то, что когда были изучены причины повторной госпитализации в ОИТ после кардиохирургического вмешательства, Chung et al.[51] установили, что после выписки из отделения интенсивной терапии процентное увеличение необходимой фракции вдыхаемого кислорода коррелировало с повышенным риском повторной госпитализации. Учитывая, что стратегия OLA снижает частоту гипоксемии и увеличивает FRC при выписке, эти результаты позволяют предположить, что она может снизить частоту повторной госпитализации в ОИТ.
С другой стороны, вентиляционная стратегия OLA имеет некоторые отмеченные неблагоприятные эффекты. Например, высокое ПДКВ может пагубно повысить внутричерепное давление и нарушить наполнение желудочков, постнагрузка ПЖ увеличивается, но сократимость не нарушается [52, 53].
Сердечно-сосудистые эффекты особенно заметны у пациентов с истощением жидкости.
Dyhr et al. [54] обнаружили, что сердечный выброс не зависел от высоких уровней PEEP после маневра рекрутмента у кардиохирургических пациентов. Позднее эти результаты были подтверждены Miranda et al. [55], которые, используя катетер в легочную артерию у пациентов, перенесших операцию на сердце, показали, что вентиляция OLA не влияет на сопротивление легочных сосудов или фракцию выброса правого желудочка.
Как мы уже говорили, высокое PEEP может увеличить постнагрузку RV.Даже в этом случае высокие уровни PEEP, используемые во время вентиляции OLA, вероятно, не повлияли на постнагрузку правого желудочка, поскольку удалось избежать ателектаза и использовать низкие дыхательные объемы. Это связано с тем, что было показано, что ателектаз вызывает значительное увеличение постнагрузки ПЖ [56]. Этот эффект обусловлен двумя различными механизмами: местной гипоксической вазоконстрикцией легких, вызванной в неаэрированных областях легкого [53], и компрессией капилляров из-за чрезмерного растяжения в аэрированных областях легких.
Несколько клинических и экспериментальных исследований показали, что стратегия OLA и изолированные маневры рекрутмента увеличивают постнагрузку на ПЖ у пациентов без нарушения ПЖ в анамнезе, перенесших кардиохирургические операции [57, 58].Кроме того, Миранда и др. [55] в исследовании, о котором мы упоминали ранее, показали, что высокие уровни PEEP во время вентиляции OLA не уменьшали преднагрузку ПЖ, когда пациенты имели адекватную предыдущую преднагрузку.
Тем не менее, исчерпывающий мониторинг абсолютно необходим, когда изолированные маневры рекрутмента выполняются у пациентов с предыдущей сердечной недостаточностью справа. Важно быть предельно осторожным с этими пациентами и избегать их, если нежелательные явления можно предсказать согласно наблюдаемым значениям.
Принимая все это во внимание, наша группа рекомендует стратегию OLA, начав ее после интубации в операционной и продолжая придерживаться этой стратегии до тех пор, пока пациент не будет экстубирован. Мы поддерживаем OLA в этом контексте, так как мы не обнаружили побочных эффектов и, как мы упоминали ранее, он имеет важные потенциальные преимущества (например, уменьшение вызванного вентилятором воспаления легких, повышение PaO 2 / FiO 2 , ослабление послеоперационное снижение FRC и снижение частоты гипоксемии).
3.2. Стратегия вентиляции во время ECC
Было высказано предположение, что апноэ во время ECC способствует активации лизосомальных ферментов в малом круге кровообращения, которые, в свою очередь, коррелируют с частотой послеоперационной легочной дисфункции [59]. Гиповентиляция во время неотложной помощи при сердечно-сосудистых заболеваниях связана с развитием микроателектазов, гидростатического отека легких, плохой комплаентностью и повышением частоты инфекций [60]. Таким образом, гипотеза состоит в том, что поддержание искусственной вентиляции легких во время неотложной помощи при сердечно-сосудистых заболеваниях может ограничить послеоперационные легочные осложнения [61].
Ателектаз является основным фактором, определяющим послеоперационный газообмен в легких, и может играть большую роль в нарушениях дыхания после кардиохирургии, чем отек из-за повышенной проницаемости.
Чтобы предотвратить все эти осложнения, были применены некоторые маневры, такие как прерывистая вентиляция или применение постоянного давления в дыхательных путях (CPAP) во время неотложной помощи при неотложной помощи [62, 63]. Применение CPAP во время CPB было описано как эффективное дополнение в некоторых исследованиях [63]. Loeckinger et al.[61] изучали постоянное положительное давление в дыхательных путях (CPAP) на высоте 10 см H 2 O во время неотложной помощи и его влияние на послеоперационный газообмен в легких. Они обнаружили значительно более высокое значение PaO 2 , значительно более низкое значение PA-a O 2 через 4 часа после ECC и лучший газообмен после экстубации в группе CPAP по сравнению с контролем. Совсем недавно John и Ervine [64] продемонстрировали в своем рандомизированном исследовании, что поддержание вентиляции с дыхательным объемом 5 мл / кг во время неотложной помощи при сердечно-сосудистых заболеваниях дает другие преимущества по сравнению с прекращением вентиляции.Они показали уменьшение внесосудистой жидкости в легких и более короткое время экстубации в группе искусственной вентиляции легких по сравнению с контрольной группой. Таким образом, Davoudi et al. [65] в проспективном рандомизированном исследовании показали, что продолжающаяся вентиляция с низким дыхательным объемом во время CPB улучшает оксигенацию после обходного прохода и механику легких.
С другой стороны, даже несмотря на то, что использование CPAP [61], маневров набора [66] или вентиляции с низким дыхательным объемом во время CBP продемонстрировало уменьшение воспаления и улучшение оксигенации, механики легких и фракции шунта, это положительное влияние было показано, что они преходящи с сомнительным влиянием на клинический исход [67].
Другой вариант, предложенный для ослабления дисфункции легких после ККЭ, — это поддержание вентиляции вместе с перфузией легочной артерии во время КРЭ. Таким образом, Friedman et al. [68] продемонстрировали в экспериментальном сравнительном исследовании, что вентиляция с перфузией легочной артерии во время ECC может иметь преимущества в сохранении функции легких за счет снижения секвестрации тромбоцитов и нейтрофилов и ослабления ответа TXB2 после ECC. С другой стороны, другое экспериментальное исследование Serraf et al.[69] не показали значительного улучшения легочного сосудистого сопротивления, респираторного индекса или напряжения кислорода при непрерывной вентиляции во время неотложной медицинской помощи.
На основании этих результатов доказательства очевидных преимуществ поддержания вентиляции во время неотложной помощи при сердечно-сосудистых заболеваниях не совсем ясны. Даже в этом случае непрерывная вентиляция с низкой частотой во время ECC кажется простым, безопасным, недорогим и потенциально весьма полезным методом, и было предложено, чтобы это был простой метод без дополнительных затрат.
3.3. Ранняя экстубация и неинвазивная механическая вентиляция
Как мы уже говорили, вентиляция с высоким дыхательным объемом и низким или нулевым ПДКВ у кардиохирургических пациентов связана с воспалительной реакцией, которая способствует биотравме, вызванной вентиляцией [25]. Вентиляция с высоким дыхательным объемом в ближайшем послеоперационном периоде кардиохирургических вмешательств была связана с длительной механической вентиляцией легких, более длительным пребыванием в ОИТ и повышенным риском дисфункции органов [70]. Таким образом, во избежание коллапса легких и уменьшения ателектаза настоятельно рекомендуется использовать низкие дыхательные объемы (около 6 мл / кг) и адекватный уровень ПДКВ в интраоперационном и послеоперационном периоде.Это также может сократить продолжительность ИВЛ и частоту повторной интубации [71].
Доказано, что ранняя экстубация (менее 6–8 часов) после кардиохирургии снижает количество осложнений в послеоперационном периоде, а также снижает продолжительность пребывания в ОИТ и затраты [69].
Camp et al. [72] продемонстрировали, что ранняя экстубация (в течение 9 часов после кардиохирургии) связана с улучшенным исходом и, как было показано, является лучшим предиктором неосложненного выздоровления и снижения поздней смертности после кардиохирургического вмешательства.
Более того, в недавнем Кокрановском обзоре [73] сделан вывод о том, что ранняя интубация не связана с повышенным риском послеоперационных осложнений или повторной интубации и приводит к сокращению продолжительности пребывания в ОИТ.
Ателектаз играет важную роль в развитии послеоперационной дыхательной недостаточности [74]. Неинвазивную механическую вентиляцию легких (НИВ) следует применять для предотвращения острой дыхательной недостаточности (ОПН) у пациентов с высоким риском ее развития [75].
NIV также использовался для лечения установленной послеоперационной острой дыхательной недостаточности, хотя есть неокончательные результаты [76], и он не продемонстрировал явной эффективности после того, как ОПН уже установлена [77].
В остальном профилактическое использование НИВЛ или СИПАП продемонстрировало снижение респираторной работы и улучшение газообмена, оксигенации и альвеолярной вентиляции [78–80], а также может быть использовано для отлучения пациентов от ИВЛ [75]. Сообщается, что при правильном использовании НИВЛ снижает ателектаз и PPD, а также снижает частоту повторных интубаций, продолжительность пребывания в отделении интенсивной терапии, а также повторную госпитализацию в больницу и отделение интенсивной терапии [79, 80].
4. Заключение
PPD — частое и почти неизбежное последствие кардиохирургических вмешательств, частота которых до сих пор остается неприемлемо высокой.Его патогенез не ясен, но было показано, что в его развитии участвуют многие факторы. Таким образом, есть два основных механизма, которые были идентифицированы как фундаментальные причины развития PPD, первый — это стресс от операции и связанные с ней факторы (ECC, средний разрез стернотомии, гипотермия для защиты миокарда, расслоение внутреннего артерия молочной железы и т. д.), которые вызывают серьезную системную воспалительную реакцию. Другой важный фактор — повреждение легких, вызванное воспалением и усугубленное неоптимальной механической вентиляцией легких.
Принимая все это во внимание, наша группа рекомендует использовать стратегию OLA у пациентов, перенесших кардиохирургическое вмешательство с ранним началом (после оротрахеальной интубации), сочетая низкие дыхательные объемы (дыхательный объем 6 мл / кг) с маневрами набора и установление ПДКВ 8–14 см H 2 О. Кроме того, поддержание низкочастотной вентиляции во время неотложной помощи при сердечно-сосудистых заболеваниях представляется весьма многообещающей стратегией с важными преимуществами для сохранения функции легких. С помощью этих двух процедур ИВЛ мы, вероятно, могли бы ослабить воспалительную реакцию, улучшить параметры газообмена и послеоперационные функции легких с лучшим FRC, а также снизить частоту повторной госпитализации при UCI с лучшим результатом.И всех этих преимуществ можно добиться практически без гемодинамических изменений или даже без них.
Ранняя экстубация хорошо документирована и должна быть целью у взрослых после кардиохирургических вмешательств, так как она может уменьшить послеоперационные осложнения и сократить пребывание в ОИТ и затраты.
NIV, примененная на ранней стадии, показала свою эффективность в снижении ателектазий и PPD, минимизации количества повторных интубаций, продолжительности пребывания в отделении интенсивной терапии, а также повторных госпитализаций в больницы и отделения интенсивной терапии.
Конфликт интересов
У авторов нет конфликта интересов.
Влияние операции на объем легких и стандартные параметры мониторинга у новорожденных, находящихся на ИВЛ.
Резюме
У новорожденных торакоабдоминальная хирургия — серьезное вмешательство
в отношении газообмена и механики легких. Это предполагаемое клиническое
в исследовании сравнивали вызванные операцией изменения функциональной остаточной емкости (FRC)
и показателей неоднородности вентиляции (VI) при изменении условных
параметры мониторинга.
Из 29 новорожденных, находящихся на ИВЛ (средний вес 2770 ± 864 г
хирургия), 13, девять и седьмая — грудная, абдоминальная или врожденная
хирургия диафрагмальной грыжи (CDH) соответственно.Многократное дыхание
метод вымывания (MBWO) с использованием гептафторпропана в качестве индикаторного газа (Babylog®
8000; Dräger, Любек, Германия) было выполнено <6 ч.
до операции, через 22–24 ч после операции и <6 ч до
экстубация. Данные по газообмену, механике дыхания, FRC и VI.
записано.
При торакоабдоминальной хирургии изменились показатели FRC и VI в
специфический для процедуры способ; однако эти изменения не нашли отражения в
обычные механические или вентиляционные параметры мониторинга.FRC уменьшился
у младенцев без CDH, тогда как у младенцев с CDH показатели FRC увеличились, а показатели VI снизились.
Несмотря на улучшения, различия в FRC и VI между CDH и не-CDH
у младенцев с ИБС выявлено стойкое нарушение функции легких.
MBWO можно с успехом использовать для измерения воздействия операции на
легкое. В то время как показатели FRC и VI изменились после операции, традиционный мониторинг
параметров не сделал.
Выживаемость новорожденных после корректирующих операций на сердце 1, 2
или дефекты брюшной стенки 3 или
для врожденной диафрагмальной грыжи (ВГД) 4 улучшилось за последнее десятилетие.Тем не менее,
вскрытие грудной полости и / или брюшной стенки остается значительным
вмешательство в отношении временных изменений газообмена и легких
объем.
В дополнение к мониторингу аппарата ИВЛ, анализы газов крови и повторные рентгенограммы
обычно выполняются у младенцев, находящихся на ИВЛ, для контроля клинического развития.
Между тем, имеется коммерческое оборудование для оценки аэрации легких путем измерения
функциональная остаточная емкость (FRC) и неоднородность вентиляции (VI)
индексы 5–7.Этот неинвазивный метод основан на множестве
Методика измерения вымывания из дыхания (MBWO) с использованием индикаторного газа 8. Однако оборудование, используемое для одновременного
измерение расхода воздуха и молярной массы дыхательного газа обычно громоздко и
громоздка для рутинного применения у интубированных новорожденных или недоношенных детей,
и требует значительной площади 9.
Недавно мы проверили прототип расширенного неонатального аппарата ИВЛ.
для анализа MBWO у маленьких вентилируемых поросят 10. В этом аппарате используется миниатюрный легкий датчик газа
и гептафторпропан (HFP) в качестве индикаторного газа.
Мы предположили, что этот метод может быть успешно использован в клинической практике.
установка для измерения воздействия операции на легкое. Цель настоящего
В проспективном клиническом исследовании использовался метод HPF-MBWO для изучения
влияние торако-абдоминальной хирургии на легкие и сравнить изменения
в показателях FRC и VI при изменении традиционных параметров мониторинга.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристики пациента
Это проспективное клиническое исследование было проведено в отделении интенсивной терапии.
Клиники неонатологии Charité Universitätsmedizin Berlin (кампус
Митте, Берлин, Германия).62 новорожденных, рожденных в период с ноября 2006 г.
и июнь 2008 г. и потребовавшие хирургического вмешательства потенциально подходили для исследования.
Критериями включения были предполагаемая операция и письменное согласие родителей.
Из-за оборудования объем мертвого пространства аппарата ( В, D, ок. ) составляет 4,5 мл, только младенцы с дыхательным объемом ( В, T )> 10 мл, измеренным после интубации с помощью
Babylog® (BL) 8000 (Dräger, Любек, Германия)
были включены. 33 ребенка были исключены из-за отсутствия потребности в механическом обучении.
вентиляция после операции (n = 10), измерения
невозможно выполнить согласно протоколу (n = 11),
a V T <10 мл (n = 7),
или родители отказываются дать согласие (n = 5).
Остальные 29 младенцев были разделены на три группы в соответствии с
Область хирургии: 13 младенцев перенесли торакальные операции (врожденное сердце
заболевание или атрезия пищевода), девять младенцев перенесли абдоминальные операции (гастрошизис,
omphalocele или volvulus), и у семи младенцев была CDH, где обе полости
были открыты. Исследование было одобрено этическим комитетом Charité.
Universitätsmedizin Berlin.
Оборудование для измерения FRC
FRC измеряли с помощью модифицированного BL 8000.Вкратце, ранее описанный
инфракрасный датчик HFP 10 был размещен
между датчиком потока BL 8000 и эндотрахеальной трубкой (ET).
Постоянный поток вентилятора находился в диапазоне 8–16 л · мин –1 в зависимости от необходимого давления на вентиляции. Использование механического
клапан, медицинский HFP (Solvay, Ганновер, Германия) от газа
цилиндр подавался в инспираторную ветвь дыхательного контура для достижения
постоянная концентрация ГФП 0,8%. FRC рассчитывалась согласно
к методике MBWO с использованием сигнала потока (датчик потока, BL 8000)
и сигнал концентрации (датчик HFP) с помощью программного обеспечения, разработанного
пользователя Dräger.Индекс клиренса легких (LCI) рассчитывался как
количество оборотов, необходимых для снижения концентрации индикаторного газа в конце прилива
до 1/40 от начальной концентрации. Первые три момента (M 0 , M 1 , M 2 ) кривой размыва и момент
передаточные числа (M 1 / M 0 , M 2 / M 0 )
и средние числа разведения в альвеолярных отложениях (AMDN 1 , AMDN 2 ) были получены из расчетов, начатых на 0-м дыхании.
цикл и закончился, если концентрации упали ниже 1/40 начальной концентрации.Все индексы VI рассчитывались с помощью специализированного программного обеспечения с использованием данных
BL 8000, как описано ранее 11. Время задержки между сигналом датчика потока и концентрацией HFP
была компенсирована электронным способом. Частота дискретизации составляла 125 Гц и
все сигналы были сохранены.
Измерения
FRC были начаты вручную и остановлены автоматически после
N циклов, когда количество вентилируемого альвеолярного воздуха ( V T — V D ) · N превысило расчетную FRC
в 10 раз.В каждом случае минимальное количество циклов было установлено на N = 40. V D было рассчитано на основе сигнала HFP с помощью программного обеспечения Dräger.
с помощью уравнения Бора. Электронная двухточечная калибровка датчика HFP
с использованием внутренних световых сигналов и одноточечной калибровки датчика расхода
BL 8000 в соответствии с рекомендациями производителя выполнялся перед каждым FRC.
измерения, и оборудование также было проверено с использованием модели легких перед
каждое измерение 10.
Протокол
Все измерения проводились в положении пациента на спине в
три определенных момента времени: в пределах 6 часов до операции, 22–24 часа
после операции и в течение 6 ч до экстубации.
В протоколе исследования не указывались параметры вентиляции, кроме
режим должен был быть обычной или синхронизированной прерывистой принудительной вентиляцией (нет
высокочастотная вентиляция). Кислородная фракция вентиляции и вдоха ( F I, O 2 ) была скорректирована с учетом артериального давления.
напряжение углекислого газа ( P a, CO 2 )
от 35 до 55 Торр (4,67–7,33 кПа) и нормоксия
по клиническим диагнозам ( у.е.грамм. синюшная сердечная недостаточность).
Для каждого измерения FRC частота дыхания ( f R ), V T , утечка ET и респираторная податливость ( C или ), которая была рассчитана с помощью анализа линейной регрессии.
взято из BL 8000.
Помимо параметров MBWO (FRC, LCI, M 1 / M 0 ,
M 2 / M 0 , 1 драм и 2 драм),
вентиляционное давление (пиковое давление воздуха (PIP) и положительное
регистрировали давление в конце выдоха (PEEP) и газы крови.Дополнительно: F I, O 2 , артериальное давление кислорода ( P a, O 2 ) / F I, O 2 , P a, CO 2 , сатурация артериальной крови кислородом ( S a, O 2 ), артериальное давление и частота сердечных сокращений (M1166A;
Philips Medical Healthcare, Гамбург, Германия) регистрировались на каждом из
три запланированных момента времени для оценки параметров кровообращения после
хирургия.Данные, полученные из карт пациентов, включали гестационный возраст, роды.
вес, пол, многоплодие, внутриутробный прием стероидов, режим
родоразрешение и оценка по шкале Апгар на 1 и 5 мин.
измерений FRC были выполнены одинаково на каждом из трех запланированных
моменты времени. После подготовки и калибровки оборудования с идентичным
регулировки модифицированного BL 8000, ET ребенка был зажат, чтобы избежать
Дестабилизация FRC. В течение 5 с был подключен модифицированный BL 8000.
и период стабилизации продолжался 15 минут при непрерывном механическом
вентиляция.Образцы артериальной крови на газы крови (ABL 800Flex; Радиометр
Medical ApS, Броншой, Дания) и измерения FRC.
были начаты с процедуры промывки HFP (промывка FRC )
и последовательную процедуру промывки (промывка FRC ). Такой
цикл был принят для оценки, и среднее значение FRC для промывки
и промывка FRC была рассчитана, если отклонение между промывкой FRC и промывкой было <20% и V T было> 10 мл из-за увеличения V D, приложение .Все измерения функции легких повторяли трижды для каждого из трех
ситуации.
Статистика
CDH — слишком редкий диагноз (~ 1 на каждые 3500 рождений) для
расчет размера выборки. Размер выборки 22 был рассчитан только для не-CDH.
младенцев, как требуемых для выявления разницы FRC 2 мл · кг -1 после операции, предполагая стандартное отклонение (sd) различий FRC (на основе пилотного исследования)
3,8 мл · кг −1 , и альфа-ошибка 0.05 и
бета-ошибка 0,1.
Характеристики пациентов между группами пациентов сравнивались с использованием
Критерии хи-квадрат и ANOVA, если необходимо. Оценка по шкале Апгар, возраст на момент
операция и продолжительность интубации и операции выражаются как медиана и
диапазона и сравнивались с помощью критерия Краскела – Уоллиса. Все физиологические
параметры представлены как среднее ± стандартное отклонение в таблицах и среднее значение (95%
CI) цифрами. Различия между группами пациентов были проверены с использованием
ANOVA с апостериорным тестом Стьюдента – Ньюмана – Кеуля .ANOVA для повторных измерений с тестом Dunnett post hoc (сравнение
с базовым уровнем) был использован для анализа развития параметров. Бонферрони
Коррекция p-значения для множественных сравнений внутри и между группами
использовался. Статистический анализ проводился с помощью программы Statgraphics Centurion.
программное обеспечение (версия 15.0; Statpoint Inc., Херндон, Вирджиния, США) и GraphPad
ПРИЗМА версия 4 (Сан-Диего, Калифорния, США). Статистическая значимость была
определяется как p-значение <0,05.
РЕЗУЛЬТАТЫ
Субъектов
Три группы пациентов ( i.е. грудной, брюшной и CDH
хирургии) были схожими с точки зрения дооперационных характеристик пациентов (таблица 1). Всего четыре (13,8%)
из 29 младенцев получали дородовые стероиды, а двое (6,9%)
из 29 прошли курс лечения сурфактантом. В то время как средняя масса тела была
одинаково для всех трех групп, был большой разброс во времени операции
без статистически значимых различий в медиане по Бонферрони
исправление (таблица 2⇓).
Таблица 1—
Характеристики пациента при рождении
Таблица 2—
Характеристики пациента во время операции
Параметры вентиляции, газов крови и кровообращения
Межгрупповое сравнение показало, что вентиляция легких до и после операции
параметры (PIP, PEEP, f R , V T ,
индекс оксигенации и индекс вентиляционной эффективности), параметры газов крови ( P a, O 2 / F I, O 2 , P a, CO 2 , S а, О 2 )
и параметры кровообращения (частота сердечных сокращений, систолическое и диастолическое кровяное давление).
давление) не были статистически значимыми между тремя
группы пациентов.Только у младенцев с CDH по сравнению с двумя другими группами пациентов
было f R значительно выше (p <0,001) до
хирургия и V T значительно ниже (p <0,001)
как до, так и после операции.
Во всех трех группах пациентов внутригрупповое сравнение не показало статистически
значительное влияние операции на параметры вентиляции, газов крови и кровообращения,
соответственно.
Влияние операции на функцию легких
Предоперационный C или и FRC для каждой группы пациентов
показаны на рисунке 1⇓.У младенцев с CDH оба параметра были ниже, в то время как значимых
различия между грудными детьми в торакальной и абдоминальной хирургии. Самый предоперационный
Индексы VI были выше у детей с CDH, тогда как достоверных
различия между двумя другими группами пациентов (рис. 2⇓).
Рис. 1–
a) Респираторная податливость ( C или )
и б) функциональная остаточная емкость (FRC) у младенцев до
хирургия грудной, брюшной или врожденной диафрагмальной грыжи (ВГД). # : р = 0,001; ¶ : незначительно; + : p <0,0001.
Рис. 2—
Сравнение различных неоднородностей вентиляции (VI).
показатели у младенцев до грудного (□), брюшного (░)
или врожденная диафрагмальная грыжа (▒). LCI: клиренс легких
индекс; M 1 / M 0: отношение момента первого к нулю; M 2 / M 0: отношение секундного момента к нулевому; драм 1 драм
и AMDN 2 : альвеолярные средние числа разведений 1 и 2 соответственно. # : р = 0,028; ¶ : незначительно; + : p = 0,02; § : p = 0,033; ƒ : p = 0,01.
Развитие функции легких после операции у разных пациентов различалось.
группы (таблица 3⇓).
Наблюдались явные различия в прогрессировании параметров между грудным и грудным отделами.
абдоминальная хирургия и хирургия CDH младенцев. Торакальная хирургия привела к изменениям в
FRC, LCI и отношения моментов, в то время как C или остались почти
постоянный. Через 24 часа после торакальной операции FRC был ниже и вентилируемый.
Индексы VI, LCI и M 1 / M 0 были выше (p <0.05).
Перед экстубацией все легочные параметры вернулись к исходным значениям, кроме
для FRC, который оставался повышенным (p <0,001).
Таблица 3—
Развитие легочных параметров после операции у трех
группы пациентов
Через 24 часа после абдоминальной операции FRC был ниже, но восстановился до
исходный уровень к моменту экстубации. C или тоже уменьшилось
после абдоминальной хирургии, но незначительно. Однако до экстубации C или превысили базовый уровень (p <0.001). Никаких существенных
Различия наблюдались по индексам VI.
Развитие параметров у детей с CDH и без CDH различается. Помимо C или , было улучшение во всех легочных
параметры после операции. По сравнению с исходным уровнем FRC увеличился (p <0,01)
и все индексы VI (LCI, M 1 / M 0 , M 2 / M 0 , 1 драм, 2 драм) (p <0,05).
C или и FRC сравнивались между группами пациентов
перед экстубацией (рис.3⇓).
Не было значительных различий у младенцев после грудного или грудного вскармливания.
абдоминальная хирургия. Однако, несмотря на тенденцию к увеличению C или и улучшение FRC у пациентов с CDH, оба параметра остались.
ниже по сравнению с другими группами пациентов. При экстубации не было
достоверные различия показателей VI между тремя группами пациентов.
Рис. 3–
a) Респираторная податливость ( C или )
и б) функциональная остаточная емкость (FRC) у младенцев до
экстубация.CDH: врожденная диафрагмальная грыжа. # : р = 0,001; ¶ : незначительно; + : p = 0,018.
ОБСУЖДЕНИЕ
Наше исследование показало, что HFP-MBWO является подходящим методом для измерения
влияние операции на легкое. Главный вывод заключался в том, что индексы FRC и VI
измеренные во время ИВЛ, подверглись хирургическому вмешательству больше, чем
обычные параметры мониторинга. Кроме того, влияние на FRC и VI
индексы зависят от процедуры.
Три группы пациентов были схожи по клиническим характеристикам (таблицы 1 и 2).
Большой разброс в возрасте младенцев, перенесших грудную и абдоминальную
хирургия отражала диагноз и клинические требования, тогда как все
Младенцы CDH перенесли операцию на второй послеродовой день по нашему стандарту
протокол.
До операции показатели функции легких у младенцев были аналогичными.
требуется абдоминальная или торакальная хирургия, вероятно, потому что легкое было только
косвенно затронуты.Напротив, младенцы с CDH с поражением пренатальных легких
разработка 12 имела более низкий FRC
и C или и выше индексы VI, указывающие на нарушение вентиляции
однородность. Хотя легкие у младенцев, нуждающихся в абдоминальной или торакальной хирургии
считаются нормальными, мы обнаружили, что в обеих группах были относительно низкие
Значения FRC (16,38 ± 4,0 и 17,12 ± 3,9 мл · кг -1 соответственно). Эти наблюдения можно объяснить
выводы фон Унгерн-Штернберг et al. 8 в исследовании 14 младенцев, находящихся под наркозом (2.76–7,5 кг;
в возрасте 0–6 месяцев), которые продемонстрировали, что нервно-мышечная блокада
привело к снижению FRC с 21,3 ± 4,7 мл · кг −1 до 12,2 ± 4,8 мл · кг −1 , что могло
восстанавливается дополнительным ПДКВ на 3 см вод. ст. 2 О. В нашем исследовании
ПДКВ применялся до нервно-мышечной блокады и не изменялся, а FRC
измерения до и через 24 ч после операции проводились в нервно-мышечной
блокада.
Мы обнаружили, что влияние операции на измерения функции легких было процедурой
специфический.В течение 24 часов после операции FRC снизился у младенцев, перенесших
торакальной или абдоминальной хирургии, показатели VI повышались у новорожденных, перенесших
торакальной хирургии, в то время как показатели FRC и VI улучшились у детей с CDH (таблица 3⇑). Несколько исследований по механике дыхания
у новорожденных измеряли параметры как до 13 лет, так и после операции 14,15. Dimitriou et al. 16 продемонстрировано у младенцев с абдоминальной
дефекты стенок, первичное закрытие и хирургическая репозиция грыжи
внутренностей в брюшную полость было связано с ухудшением C или .Поскольку этот наблюдаемый эффект был временным, они интерпретировали
снижение C или при увеличении внутрибрюшной
давление. Пока оказалось, что та же C resp тренд
наблюдалась у новорожденных после абдоминальной хирургии в нашем исследовании, результаты
не достигают статистической значимости.
Различия в измерениях функции легких у младенцев с CDH и без CDH
не были результатом каких-либо различий в объемной нагрузке, продолжительности эксплуатации
или анестезия, которые были одинаковыми для всех трех групп пациентов (таблица 2).У пяти пациентов с врожденным
CDH, Dinger et al. 17
продемонстрировали, что FRC увеличивается со временем в зависимости от PEEP и аспирации.
грудной клетки. Текущие данные FRC и C или являются
аналогично сообщениям Dinger et al. 17; однако мы не меняли ПДКВ после операции.
и дренажные дренажные трубки обычно не устанавливаются из-за побочных эффектов 4. Dinger et al. 17 объяснил увеличение FRC у младенцев с CDH после
хирургия как чрезмерное растяжение гипоплазированных легких.Однако Fehrenbach et al. 18 и Weibel 19 описали рост легких после пневмонэктомии.
у взрослых мышей в результате неоальвеоляризации. Еще неизвестно, какие
этих эффектов отвечает за усиление FRC у наших младенцев с CDH после
необходим хирургический ремонт и дальнейшее исследование.
Во время экстубации различия в измерениях функции легких
между CDH и младенцами без CDH снизилась, но все еще осталась. Наблюдаемые
более быстрое увеличение FRC по сравнению с C или у младенцев с CDH
согласуется с недавним исследованием Roehr et al. 20 показывает, что, несмотря на очевидно хорошо надутые легкие,
Пациенты с CDH имели худшие параметры приливного дыхания и более низкие C или после выписки по сравнению с пациентами без CDH. Грудной и абдоминальный
у хирургических младенцев были аналогичные FRC при экстубации (19,04 ± 6,0 и
18,88 ± 4,0 мл · кг -1 соответственно).
Хотя все дети были успешно экстубированы и нервно-мышечная блокада
был удален, значения FRC были немного ниже, чем сообщалось von
Унгерн-Штернберг et al. 8
у интубированных младенцев до анестезиологических процедур (21,3 ± 4,7 мл · кг -1 ). Однако младенцы в настоящем исследовании были моложе
и легче, чем в исследовании von Ungern-Sternberg et al. 8, и текущие значения FRC соответствуют
с таковыми для вентилируемых недоношенных детей 21, 22 и невентилируемых
доношенные дети контрольной группы (18,4 мл · кг -1 ) 23
Выполнение методик MBWO у младенцев, находящихся на ИВЛ, затруднено, поскольку
измерения чувствительны к любой утечке ET 24, 25.Пока это
Проблема может быть легко решена у пожилых пациентов, находящихся на ИВЛ, с помощью наручников
Инопланетяне 8, инопланетяне без наручников рекомендуется
у новорожденных как для защиты дыхательных путей, так и для предотвращения стеноза подсвязочного канала 26. В нашем исследовании мы могли исключить значительную
влияние утечки ET на измерения FRC. Во время измерения мы старались избегать
любая утечка ET; при необходимости меняли положение головы. В предыдущем исследовании in vitro мы обнаружили, что абсолютное значение относительной FRC
погрешность была <3% для утечек ET <20% и 6% для ET
утечки <40%.В нашем исследовании утечка ET составила <20% в
95% всех младенцев и 40% утечек ЭТ никогда не превышались.
Характеристики индикаторного газа MBWO ( например, V D, приложение , используемые газовые датчики, свойства индикаторных газов и количество оцениваемых
дыхательные циклы во время промывки и вымывания индикаторного газа) также
зависит от метода. Большинство измерений MBWO у новорожденных, находящихся на ИВЛ, выполняется
с использованием изготовленного на заказ оборудования и азота 27, гелия 28 или
гексафторид серы (SF6) 7
как трассирующие газы.Коммерческая система MBWO у пациентов, находящихся на ИВЛ 9, использованная von Ungern-Sternberg et al. 8 основан на УЗИ
спирометрия с элегазом в качестве индикаторного газа. Это оборудование имеет высокий В, D, приложение , а также громоздкую и тяжелую измерительную головку, и его использование было показано на
быть осуществимым преимущественно для вентилируемых младенцев старшего возраста или детей дошкольного возраста
в возрасте от 13 месяцев до 7 лет 29–31. К
для сравнения, наша измерительная головка HFP была разработана для использования в небольших легких и
меньше и легче.Хотя HFP и SF6 являются инертными газами, первый
имеет более высокую молекулярную массу (170,03 против 146,05 г · моль −1 ), растворимость в воде (0,23 против 0,04561 г · л −1 ) и удельную (воздух = 1)
гравитация (5,9 против 5,114) и более низкое давление пара (4 против 21,5 бар). Кроме того, концентрации индикаторных газов
ниже для HFP по сравнению с SF6 (0,8 против 4% 9, 32). Недавно мы исследовали точность in vitro
HFP-MBWO у вентилируемых поросят 10
и обнаружил, что это позволяет воспроизводимые измерения показателей FRC и VI,
и не наблюдалось соответствующего накопления HFP 33.
Настоящее исследование показало, что HFP-MBWO был ценным инструментом для мониторинга
влияние хирургического вмешательства на функцию легких. Во-первых, ограничение исследования было
относительно небольшое количество пациентов в каждой группе лечения, у которых могут быть
ограничивает статистическую мощность для сравнения различий в функции легких и
увеличил риск ошибки типа II. Расчетный размер выборки составил всего
достигнуто для младенцев без CDH. Во-вторых, все еще относительно высокое значение В, D, приложение для комбинированного датчика потока и HFP означало, что обследовать можно было только пациентов со значениями В T > 10 мл, что уменьшило
количество подходящих пациентов.Будем надеяться, технический прогресс и прибавился
усилия производителей приведут к созданию новых, легких основных датчиков
с В D, приложение <1 мл, что обеспечит надежную
измерения даже у недоношенных детей. В-третьих, насколько мониторинг FRC
можно использовать для оптимизации настроек вентилятора и реализации «открытого
концепция легких »34 осталось
неизвестно даже у этих маленьких пациентов.
В заключение, HFP-MBWO является подходящей техникой для оценки эффекта
торако-абдоминальной хирургии на легком.Исследование показало, что младенцы
с CDH имеют низкие значения FRC и нарушенное перемешивание газов перед операцией, что
улучшается, но не нормализуется после этого. Напротив, младенцы, получающие
торакальная хирургия показала временное снижение после операции, тогда как у младенцев
Получив абдоминальную операцию, мало что изменилось. Эти изменения были
не отражаются в механических или вентиляционных переменных. Необходимое условие для клинической
Использование HFP-MBWO заключается в том, что измерительные головки должны быть миниатюризированы таким образом, чтобы измерения
у недоношенных детей возможны, и этот метод интегрирован в
стандартный мониторинг аппаратов искусственной вентиляции легких новорожденных.
Заявление о поддержке
H. Proquitté получил грант в размере 2000 евро от
Charité Universitätsmedizin Berlin (Берлин, Германия).
Благодарности
Это исследование было представлено на ежегодном собрании GNPI в Цюрихе.
2008 г., и на ежегодном собрании Европейского респираторного общества в Берлине.
2008.
H. Proquitté, O. Freiberger., S. Yilmaz and C.C. Roehr
провели измерения; H. Proquitté., Г. Шмалиш, Р. Р. Вауэр
спланировал и рассчитал исследование. К. Бамберг и П. Дегенхардт были ответственными
для пренатальной диагностики и хирургии соответственно. Статья написана
Х. Прокитте и Г. Шмалиш, отвечавший за статистику.
Мы благодарим С. Батлера, Куджи, Австралия, за тщательное редактирование языка.
текста.
- Получено 7 апреля 2009 г.
- Принято 8 сентября 2009 г.
Список литературы
- ↵
эль-Зейн C, Ильбави Миннесота.Последние достижения в неонатальной кардиохирургии. World J Surg 2008; 32: 340–345.
- ↵
Заннини Л., Борини И. Современное состояние кардиохирургии у пациентов
при врожденном пороке сердца. J Cardiovasc Med 2007; 8: 3–6. - ↵
Ислам С. Результаты лечения дефектов брюшной стенки. Curr Opin Pediatr 2008; 20: 305–310.
- ↵
Boloker J, Bateman DA, Wung JT, et al. Врожденный диафрагмальный
грыжа у 120 младенцев, лечившихся последовательно с разрешающим гиперкапноэ / спонтанным
дыхание / плановый ремонт. J Pediatr Surg 2002; 37: 357–366. - ↵
Schmalisch G, Proquitte H, Roehr CC, et al. Эффект
изменения настроек вентилятора по показателям неоднородности вентиляции в
небольшие вентилируемые легкие. BMC Pulm Med 2006; 6: 20 Riou Y, Storme L, Leclerc F, et al. Сравнение четырех
методы измерения повышения FRC у грудных детей на ИВЛ. Intensive Care Med 1999; 25: 1118–1125.- ↵
Vilstrup CT, Bjorklund LJ, Larsson A, et al. Функциональный
остаточная мощность и однородность вентиляции в механически вентилируемых малых
новорожденные. J Appl Physiol 1992; 73: 276–283. - ↵
фон Унгерн-Штернберг Б.С., Хаммер Дж., Шиблер А., и др.
Снижение функциональной остаточной емкости и однородности вентиляции после
нервно-мышечная блокада у детей младшего и дошкольного возраста под наркозом. Анестезиология 2006; 105: 670–675. - ↵
Schibler A, Henning R. Измерение функциональной остаточной емкости
у кроликов и детей с помощью ультразвукового расходомера. Pediatr Res 2001; 49: 581–588. - ↵
Proquitte H, Kusztrich A, Auwarter V, et al. Функциональный
измерение остаточной емкости гептафторпропаном у новорожденных, находящихся на ИВЛ
легкие: in vitro и in vivo проверки. Crit Care
Мед 2006; 34: 1789–1795. - ↵
Shao H, Sandberg K, Sjoqvist BA, et al. Моментальный анализ
вымывания азота при нескольких вдохах у здоровых недоношенных детей. Педиатр
Пульмонол 1998; 25: 52–58. - ↵
Peralta CF, Яни Дж., Cos T, и др. Левое и правое легкое
объемы у плодов с диафрагмальной грыжей. Ультразвук Obstet Gynecol 2006; 27: 551–554. - ↵
Matthews IL, Kaldestad RH, Bjornstad PG, et al. до операции
функция легких у новорожденных с моножелудочковым сердцем по сравнению с
здоровый контроль. Acta Paediatr 2007: 96: 44–48. - ↵
Накаяма Д.К., Мутич Р., Мотояма Е.К. Легочная дисфункция в хирургии
состояния новорожденного.Crit Care Med 1991; 19: 926–933. - ↵
DiCarlo JV, Raphaely RC, Steven JM, et al. Легочная механика
у младенцев после кардиохирургических вмешательств. Crit Care Med 1992; 20: 22–27. - ↵
Dimitriou G, Greenough A, Giffin F, et al. Временное обесценение
функции легких у младенцев с дефектами передней брюшной стенки,
перенесла операцию. J Pediatr Surg 1996; 31: 670–672. - ↵
Динджер Дж., Петер-Керн М., Гебель П., и др. Эффект PEEP
и отсасывание через дренаж грудной клетки на функциональную остаточную емкость и легкое
комплаентность после хирургического вмешательства при врожденной диафрагмальной грыже: предварительная
наблюдения у 5 больных. J Pediatr Surg 2000; 35: 1482–1488. - ↵
Fehrenbach H, Voswinckel R, Michl V, et al. Неоальвеоляризация
способствует компенсаторному росту легких после пневмонэктомии у мышей.Eur Respir J 2008; 31: 515–522. - ↵
Weibel ER. Как сделать альвеолу. Eur Respir J 2008; 31: 483–485.
- ↵
Roehr CC, Proquitté H, Jung A, et al. Ослабленный
соматический рост и задержка развития легких у младенцев с врожденным диафрагмальным
грыжа — данные 10-летнего проспективного наблюдения в одном центре
изучать. J Pediatr Surg 2009; 44: 1309–1314. - ↵
Dimitriou G, Greenough A, Laubscher B.Соответствующий положительный конец
уровень давления на выдохе у недоношенных новорожденных, получавших сурфактант. Евро
J Pediatr 1999; 158: 888–891. - ↵
Динджер Дж., Топфер А., Шаллер П., и др. Функциональный остаток
емкость и растяжимость дыхательной системы после лечения сурфактантом
у недоношенных детей с тяжелым респираторным дистресс-синдромом. Евро
Дж. Педиатр, 2002; 161: 485–490. - ↵
Hulskamp G, Lum S, Stocks J, et al. Ассоциация недоношенных,
заболевание легких и размер тела с неоднородностью объема легких и вентиляции
у новорожденных без седации: многоцентровое исследование. Thorax 2009; 64: 240–245. - ↵
Fox WW, Schwartz JG, Shaffer TH. Последствия утечки через эндотрахеальную трубку
по определению функциональной остаточной емкости у интубированных новорожденных. Pediatr Res 1979; 13: 60–64. - ↵
Зайденберг Дж., Хомбергер Дж., Фон дер Хардт Х.Эффект эндотрахеального
негерметичность трубки при определении остаточной функциональной емкости по промывке азотом
метод на малогабаритной модели легкого. Pediatr Pulmonol 1994; 17: 106–112. - ↵
Bernstein G, Knodel E, Heldt GP. Размер утечки в дыхательных путях у новорожденных и
автоциклирование трех вентиляторов, запускаемых потоком. Crit Care Med 1995; 23: 1739–1744. - ↵
Эдберг К.Е., Сандберг К., Зильберберг А., и др. Объем легких,
смешение газов и механика дыхания при механической вентиляции очень низкая
новорожденные с массой тела при рождении с идиопатическим респираторным дистресс-синдромом. Pediatr Res 1991; 30: 496–500. - ↵
Голдсмит Л.С., Гринспен Дж.С., Рубенштейн С.Д., и др. Немедленно
улучшение объема легких после введения экзогенного сурфактанта: рекрутирование альвеол по сравнению с увеличенным растяжением. J Pediatr 1991; 119: 424–428. - ↵
von Ungern-Sternberg BS, Frei FJ, Hammer J, et al. Удар
глубины анестезии пропофолом от функциональной остаточной емкости и вентиляции
распространение у здоровых дошкольников. Бр. Дж. Анаэст 2007; 98: 503–508. фон Унгерн-Штернберг BS, Regli A, Frei FJ, et al. глубже
уровень кетаминовой анестезии не влияет на функциональную остаточную емкость
и распределение вентиляции у здоровых дошкольников. Педиатр
Анаэст 2007; 17: 1150–1155.- ↵
фон Унгерн-Штернберг Б.С., Хаммер Дж., Фрей Ф.Дж., и др. лежа
равно склонен? Влияние техники позиционирования на функцию дыхания у
под наркозом и парализованы здоровые дети. Intensive Care Med 2007; 33: 1771–1777. - ↵
Pillow JJ, Ljungberg H, Hulskamp G, et al. Функциональный
Измерение остаточной емкости у здоровых младенцев: ультразвуковой расходомер по сравнению с масс-спектрометром . Eur Respir J 2004; 23: 763–768. - ↵
Auwarter V, Proquitte H, Schmalisch G, et al. Определение
1,1,1,2,3,3,3-гептафторпропан (HFP) в крови в свободном пространстве
газовая хроматография-масс-спектрометрия. J Anal Toxicol 2005; 29: 574–576. - ↵
Lachmann B. Откройте легкое и держите легкое открытым. Интенсивный
Care Med 1992; 18: 319–321.
Послеоперационные легочные осложнения — Physiopedia
Введение
Послеоперационные легочные осложнения — это общий термин неблагоприятных изменений дыхательной системы, возникающих сразу после операции. [1] Наиболее частые проявления включают изменение функции дыхательных мышц, уменьшение объема легких, дыхательную недостаточность и ателектаз. [1]
Заболеваемость и влияние
До 23% пациентов, перенесших серьезную операцию, страдают от КПП. [1] Фактически, частота ППК встречается чаще, чем сердечные осложнения. [2] У людей, поддерживающих ППК, от 14% до 30% умирают в течение 30 дней после серьезной операции по сравнению с 0.От 2% до 3% пациентов, у которых нет КПК. [3] [4] Что касается заболеваемости, PPC увеличивает продолжительность пребывания в больнице на 13-17 дней. [1]
Список КПК
Факторы риска
Существует ряд факторов для прогнозирования развития PPC, которые подразделяются на изменяемые и немодифицируемые. [1]
Не подлежит изменению
- Возраст -> 60 или 65 лет имеет повышенный риск. [5]
- Тип операции — Установлено, что лечение аневризмы брюшной аорты, грудная клетка, верхняя часть живота, шеи, нейрохирургия и обширная сосудистая хирургия имеют более высокий риск, чем другие виды хирургии. [6] [7]
Возможность изменения
- Сопутствующие заболевания — Пациенты со следующими состояниями имеют более высокий риск развития ППК: хроническая обструктивная болезнь легких, застойная сердечная недостаточность, хроническое заболевание печени. [6]
- Курение
- Анемия до операции
- Общая анестезия — использование ГА нарушает многие аспекты респираторной функции, следовательно, увеличивает риск развития ППК у пациента. [1]
- Низкий дыхательный объем — Люди, у которых спонтанно снижается дыхательный объем, относятся к группе повышенного риска. [1]
- Нервно-мышечные блокаторы
- Назогастральный зонд
КПК и физиотерапия
Услуги физиотерапии считаются профилактическими мерами на разных этапах выздоровления. [1]
Предоперационная
Предоперационные аэробные упражнения и тренировка инспираторных мышц рекомендуются для снижения ППК и LOS у кардиохирургических пациентов и пациентов с абдоминальной хирургией. [8] Установлено, что предоперационная ТИМ снижает послеоперационный ателектаз и пневмонию. [9]
Послеоперационный
Список литературы
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 Miskovic A, Lumb AB. Послеоперационные легочные осложнения. BJA: Британский журнал анестезии. 2017 1 марта; 118 (3): 317-34.
- ↑ Лоуренс В.А., Хилсенбек С.Г., Малроу С.Д., Дханда Р., Сапп Дж., Стр. CP.Заболеваемость и пребывание в больнице при сердечных и легочных осложнениях после абдоминальных операций. Журнал общей внутренней медицины. 1995 декабрь 1; 10 (12): 671-8.
- ↑ Herbstreit F, Peters J, Eikermann M. Нарушение целостности верхних дыхательных путей из-за остаточных тезисов встречи Повышенная сжимаемость дыхательных путей и притупление мышечной активности Genioglossus в ответ на отрицательное фарингеальное давление. Анестезиология: Журнал Американского общества анестезиологов. 1 июня 2009 г .; 110 (6): 1253-60.
- ↑ Кор Д. Д., Уорнер Д. О., Альсара А., Фернандес-Перес Э. Р., Малинчок М., Кашьяп Р. и др.Получение и диагностическая точность модели прогнозирования хирургического повреждения легких. Анестезиология. 2011; 115 (1): 117-128.
- ↑ Brooks-Brunn JA. Предикторы послеоперационных легочных осложнений после абдоминальной хирургии. Грудь. 1997, 1 марта; 111 (3): 564-71.
- ↑ 6,0 6,1 Брюкманн Б., Вилла-Урибе Ю.Л., Бейтман Б.Т., Гросс-Сундруп М., Гесс Д.Р., Шлетт К.Л. и др. Разработка и проверка шкалы для прогнозирования послеоперационных респираторных осложнений.Анестезиология: Журнал Американского общества анестезиологов. 2013, 1 июня; 118 (6): 1276-85.
- ↑ Arozullah AM, Khuri SF, Henderson WG, Daley J. Разработка и проверка многофакторного индекса риска для прогнозирования послеоперационной пневмонии после серьезной некардиальной хирургии. Анналы внутренней медицины. 2001 20 ноября; 135 (10): 847-57.
- ↑ Valkenet K, van de Port IG, Dronkers JJ, de Vries WR, Lindeman E, Backx FJ. Влияние предоперационной лечебной физкультуры на послеоперационный результат: систематический обзор.Клиническая реабилитация. 2011 Февраль; 25 (2): 99-111.
- ↑ Ман СМ, Рив Дж. К., Элкинс МР. Послеоперационные результаты после предоперационной тренировки инспираторных мышц у пациентов, перенесших кардиоторакальные или верхние абдоминальные операции: систематический обзор и метаанализ. Клиническая реабилитация. 2015 Май; 29 (5): 426-38.
Периоперационные легочные обследования — Консультант по пульмонологии
Что нужно знать каждому врачу:
Дыхательная система особенно уязвима к побочным эффектам общей анестезии и хирургического вмешательства, и часто встречаются послеоперационные легочные осложнения.В целом на легочные осложнения приходится около 25% смертей в послеоперационном периоде. Легочные осложнения также способствуют увеличению продолжительности пребывания в отделении интенсивной терапии и в стационаре, увеличению времени восстановления и увеличению стоимости лечения.
Классификация:
Хотя список потенциальных послеоперационных легочных осложнений велик, наиболее заметными среди них являются следующие:
Острая дыхательная недостаточность
Ателектаз
Пневмония
Аспирационный пневмонит
Острое повреждение легких, связанное с переливанием крови (TRALI) и перегрузка кровообращения, связанная с переливанием крови (TACO)
Обострение ранее существовавшего заболевания легких
Плевральный выпот
Повреждение диафрагмального нерва
Тромбоэмболия легочной артерии
Обструктивное апноэ сна
Вы уверены, что у вашего пациента есть послеоперационное легочное осложнение? Что вы должны ожидать найти?
Клинические признаки общих послеоперационных респираторных осложнений включают:
Острая дыхательная недостаточность
Острая дыхательная недостаточность (ОПН) в послеоперационном периоде обычно определяется как продолжающаяся потребность в ИВЛ после 24-48 часов после операции.ОПН может быть связана либо с невозможностью отлучить от аппарата ИВЛ, либо с необходимостью восстановления искусственной вентиляции легких после неудачной экстубации. ARF может быть следствием недостаточной оксигенации, недостаточной вентиляции или сочетания этих двух факторов.
Пациенты, которые дышат спонтанно с надвигающейся ОПН, обычно имеют тахипное дыхание с частым поверхностным дыханием. Беспокойство, спутанность сознания, использование дополнительных дыхательных мышц и парадоксальные торако-абдоминальные движения на вдохе — другие признаки респираторной недостаточности.Повышенная сонливость может отражать наличие тяжелой гиперкапнии.
Ателектаз
Из-за наличия внутрилегочного шунтирования ателектаи обычно сопровождаются гипоксемией различной степени тяжести. Дополнительные сведения о наличии ателектаза можно получить при физикальном обследовании, которое обычно выявляет притупление звуков перкуссии и трубчатого дыхания над пораженным сегментом.
Пневмония
Пневмонию следует подозревать при наличии лихорадки, лейкоцитоза, кашля с гнойной мокротой и рентгенологических инфильтратов.Клинические данные неспецифичны и только в 70% случаев в одной серии вскрытий позволили поставить правильный прижизненный диагноз.
Аспирационный пневмонит
Аспирация желудочного содержимого клинически проявляется лихорадкой, тахипноэ и гипоксемией. Рентгенологические результаты включают мультифокальные помутнения, которые возникают преимущественно в зависимых областях легкого. Диагноз наиболее точно устанавливается в условиях очевидной аспирации, но его также следует учитывать у пациентов из группы риска из-за рвоты, нарушения сознания или нарушения глотания.
Острая травма легких, связанная с переливанием крови (TRALI)
TRALI развивается в течение 6 часов после переливания продуктов крови. Легкие эпизоды TRALI с лихорадкой и одышкой; более тяжелые случаи характеризуются респираторной недостаточностью, гипоксемией, гипотонией и диффузными помутнениями, отмеченными на рентгенограмме грудной клетки.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Как и TRALI, TACO также развивается в течение 6 часов после переливания продуктов крови. Характерны респираторный дистресс, артериальная гипертензия, гипоксемия, признаки перегрузки объемом при клиническом осмотре, такие как повышенное вздутие яремных вен и периферический отек, а также диффузные помутнения на рентгенограмме грудной клетки.Это следует учитывать у любого пациента с основным заболеванием сердца или почек, у которого развиваются респираторные симптомы после переливания продуктов крови.
Обострение ранее существовавшей болезни легких
Пациенты с обструктивным и / или бронхоспастическим заболеванием легких, например, с хронической обструктивной болезнью легких (ХОБЛ) или астмой, могут испытывать обострение основного заболевания в послеоперационном периоде. Характерны одышка, тахипноэ, усиленный кашель с выделением мокроты или без него, а также хрипы.
Пациенты с интерстициальным заболеванием легких (ВЗЛ), особенно пациенты с идиопатическим фиброзом легких (ИЛФ), подвергаются повышенному риску развития обострений основного заболевания легких после операции, особенно торакальной хирургии. Признаки и симптомы неспецифичны и включают респираторный дистресс, тахипноэ, гипоксемию и новые помутнения на рентгенограмме грудной клетки. Диагноз следует рассматривать у пациента с известным ILD, у которого исключены альтернативные причины послеоперационных легочных осложнений.
Плевральный выпот
Плевральный выпот является обычным явлением с частотой не менее 50% после абдоминальных и торакальных операций. Плевральный выпот, хотя и встречается часто, представляет собой случайную находку, имеющую минимальное клиническое значение. Пациенты могут жаловаться на одышку, а осмотр может выявить снижение шума дыхания в месте излияния. Рентгенограмма грудной клетки может варьироваться от легкого притупления реберно-диафрагмального угла до частичного или, в тяжелых случаях, полного помутнения гемиторакса.
Травма диафрагмального нерва
Повреждение диафрагмального нерва и связанный с ним паралич диафрагмы — хорошо описанные осложнения хирургических вмешательств на сердце и грудной клетке. Хотя односторонний паралич диафрагмы обычно не имеет значения для пациентов с нормальной функцией легких, он может привести к серьезным респираторным нарушениям у пациентов с хроническим заболеванием легких. Двусторонний диафрагмальный паралич, хотя и встречается редко, может быть серьезным осложнением, приводящим к гиперкапнической дыхательной недостаточности, требующей длительной искусственной вентиляции легких.
Пациенты с дисфункцией диафрагмы часто жалуются на ортопноэ из-за дополнительного компромисса, который возникает при потере гравитационной поддержки в положении лежа на спине. При двусторонней диафрагмальной дисфункции может наблюдаться парадоксальный характер дыхания — расширение грудной стенки и движение брюшной стенки внутрь во время вдоха.
Легочная эмболия
Легочная эмболия обычно сопровождается одышкой, плевритической болью в груди, тахипноэ, тахикардией и гипоксемией.Однако эти особенности обычно присутствуют у многих послеоперационных пациентов в результате боли и ателектаза. Развитие гипотензии предполагает наличие массивной тромбоэмболии легочной артерии.
Обструктивное апноэ во сне (OSA)
OSA характеризуется повторяющейся окклюзией верхних дыхательных путей во время сна, вызывая эпизодическую гипоксемию и гиперкапнию и приводя к фрагментации сна. Основным дневным симптомом является гиперсонливость, но ОАС все чаще определяется как причина или усугубляющий фактор ишемической болезни сердца, гипертонической болезни, сахарного диабета и инсульта.
СОАС в послеоперационном периоде может проявляться эпизодической гипоксемией, спутанностью сознания, сердечными аритмиями и даже внезапной сердечной смертью. Из-за изменений в анатомии ротоглотки, которые обычно сопровождают ожирение и СОАС, при наведении анестезии могут возникнуть трудности с вентиляцией через маску и ротоглоточной интубацией.
Осторожно: существуют другие заболевания, которые могут имитировать послеоперационное легочное осложнение:
Ряд послеоперационных легочных осложнений трудно отличить друг от друга:
Ателектаз
Клинические и рентгенологические проявления ателектаза могут быть практически неотличимы от пневмонии.Иногда респираторный дистресс и гипоксемия, связанные с ателектазом, могут быть относительно внезапными по началу, и рентгенограмма грудной клетки может быть четкой, если она была получена до резорбции газа из невентилируемых участков легких. В таких случаях проявления могут имитировать тромбоэмболию легочной артерии.
Пневмония
Ателектаз, тромбоэмболия легочной артерии, острое повреждение легких, аспирационный пневмонит и застойная сердечная недостаточность могут иметь общие клинические и рентгенологические особенности с пневмонией.
Аспирационный пневмонит
Аспирационный пневмонит имеет общие клинические и рентгенологические особенности с нозокомиальной пневмонией. Кроме того, более частое использование препаратов, подавляющих кислотность желудочного сока, что приводит к увеличению бактериальной колонизации желудка, еще больше стирает границы между этими двумя объектами. Однако отсутствие засвидетельствованной аспирации и наличие респираторных симптомов после 48 часов и гнойных выделений свидетельствует против аспирационного пневмонита и способствует диагностике пневмонии.
Острая травма легких, связанная с переливанием крови (TRALI) и перегрузка кровообращения, связанная с переливанием крови (TACO)
Когда одышка, гипоксемия и диффузное помутнение легких развиваются в течение 6 часов после переливания продуктов крови, необходимо учитывать некардиогенный отек легких в форме TRALI и кардиогенный отек легких в форме TACO. Хотя другие классические трансфузионные реакции могут быть связаны с лихорадкой и одышкой (из-за бронхоспазма), они отличаются от TRALI и TACO отсутствием радиографических затемнений на рентгенограмме грудной клетки.Наличие лихорадки и гипотензии способствует диагностике TRALI, а отсутствие лихорадки при наличии гипертонии, признаки перегрузки объемом при обследовании, а также история болезни сердца или почек в пользу диагноза TACO.
Обострение ранее существовавшей болезни легких
Свистящее дыхание у пациентов с ХОБЛ или астмой может указывать на бронхоспазм и обострение их обструктивной болезни легких. Наличие свистящего дыхания при отсутствии отклонений на рентгенограмме грудной клетки свидетельствует в пользу диагностики бронхоспазма.Однако бронхоспазм все же может возникать при наличии аномалий рентгенографии грудной клетки, таких как аспирационная пневмония или пневмония. Кроме того, свистящее дыхание не является специфическим для бронхоспазма и может наблюдаться при кардиогенном отеке легких в отсутствие бронхоспазма.
Из-за неспецифических признаков и симптомов для диагностики обострения ИЛЗ необходимо исключить другие причины послеоперационных легочных осложнений, такие как кардиогенный отек легких, тромбоэмболия легочной артерии, ателектаз и т. Д.
Плевральный выпот
Рентгенологические признаки плеврального выпота могут иногда имитировать ателектаз или другие причины помутнения на рентгеновском снимке грудной клетки.
Травма диафрагмального нерва
Нетравматические причины диафрагмальной дисфункции включают критические заболевания, полинейропатию и миопатию, а также миопатию, возникающую в результате длительного использования нервно-мышечных блокаторов.
Легочная эмболия
Пневмония, ателектаз, аспирационный пневмонит, ОРДС и застойная сердечная недостаточность имеют общие клинические признаки (например,например, одышка, гипоксемия) с тромбоэмболией легочной артерии, но они обычно связаны с более выраженными рентгенологическими отклонениями на рентгенограмме грудной клетки или компьютерной томографии грудной клетки.
Как и / или почему у пациента развилось послеоперационное легочное осложнение?
Несколько факторов, связанных с хирургическим вмешательством, отрицательно влияют на функцию легких и могут способствовать послеоперационным респираторным осложнениям:
Острая дыхательная недостаточность
Эффекты общей анестезии
Введение общей анестезии путем ингаляции или внутривенного введения приводит к почти мгновенной потере тонуса диафрагмальных и межреберных мышц, смещению диафрагмы в головку и уменьшению поперечного диаметра грудного отдела.Эти изменения приводят к снижению функциональной остаточной емкости на 20 процентов и способствуют развитию ателектазов. Исследования, в которых использовалась КТ-визуализация во время и после введения общей анестезии, продемонстрировали наличие ателектаза в зависимых областях легкого в течение десяти минут после индукции ингаляционными или внутривенными анестетиками. Единственным исключением является кетамин, который уникален в поддержании тонуса дыхательных мышц. Ингаляционные агенты, обычно используемые для анестезии, также являются респираторными депрессантами, которые притупляют реакцию как на гипоксемию, так и на гиперкапнию.
В отличие от общей анестезии, нейроаксиальная анестезия (спинальная или эпидуральная) сохраняет диафрагмальную функцию и не снижает респираторную реакцию на CO 2 . Несмотря на эти благоприятные эффекты на респираторную функцию и респираторный драйв, клинически значимое преимущество нейроаксиальной анестезии перед общей анестезией не было последовательно продемонстрировано.
Стратегии интраоперационной вентиляции
Принципы защитной механической вентиляции легких, такие как вентиляция с низким дыхательным объемом и использование положительного давления в конце выдоха (ПДКВ) для снижения заболеваемости и смертности у пациентов с повреждениями легких с острым респираторным дистресс-синдромом (ОРДС), хорошо известны.Однако все шире признается, что эти аналогичные принципы, применяемые к пациентам, получающим искусственную вентиляцию легких и подвергающимся рутинным операциям, уменьшают послеоперационные легочные осложнения. Метаанализ 15 рандомизированных контролируемых исследований с участием 2127 пациентов продемонстрировал, что защитная вентиляция легких во время общей хирургии, определяемая как вентиляция с дыхательным объемом менее 8 мл / кг идеальной массы тела, уменьшала послеоперационные легочные осложнения с 8,7% с 14,7% для обычная вентиляция.Величина эффекта защитной вентиляции легких может быть еще более существенной у людей, которые относятся к группе среднего или высокого риска послеоперационных легочных осложнений, поскольку рандомизированное контролируемое исследование этой группы пациентов из группы риска, перенесших абдоминальную операцию, продемонстрировало, что вентиляция с низким дыхательным объемом снижает послеоперационные легочные осложнения от 27,5% до 10,5%.
Послеоперационная анальгезия
Опиаты обычно вводятся парентеральным или эпидуральным путем при серьезных хирургических вмешательствах, особенно на грудной клетке или брюшной полости.Результаты исследований, в которых сравнивается влияние эпидуральных и парентеральных опиатов на конфликт легочной функции: хотя в большинстве документально подтвержден превосходный обезболивающий эффект эпидурального введения, неясно, приводит ли этот обезболивающий эффект к меньшему нарушению дыхательной механики, газообмена или меньшая частота легочных осложнений. Оба пути введения связаны с риском угнетения дыхания, в результате чего примерно у 3% пациентов развивается гиперкапния.Пациенты пожилого возраста особенно восприимчивы к респираторным депрессивным эффектам опиатов из-за нарушения метаболизма лекарств.
Тип операции
Кардиоторакальные операции и операции на верхних отделах брюшной полости приводят к выраженным нарушениям функции легких в послеоперационном периоде. В течение суток после операции на верхних отделах брюшной полости жизненная емкость легких снижается на 50 процентов. Хотя снижение со временем улучшается, значительные нарушения сохраняются в течение семи дней после операции.Напротив, жизненная емкость легких после процедур на нижних отделах брюшной полости падает только на 25 процентов и обычно возвращается к норме к третьему послеоперационному дню.
Ухудшение функции легких, связанное с операцией на верхних отделах брюшной полости, частично опосредовано диафрагмальной дисфункцией, о чем свидетельствует снижение трансдиафрагмального давления при приливном дыхании и переход от брюшного к грудному дыханию. Были предложены две теории, объясняющие наблюдаемое нарушение диафрагмальной функции:
1- Первичное изменение сокращения диафрагмы возникает в результате местного раздражения, воспаления, хирургической травмы или боли.Обнаружение того факта, что внешняя стимуляция диафрагмальных нервов вызывает нормальное максимальное трансдиафрагмальное давление у пациентов, восстанавливающихся после операции на верхней части брюшной полости, является аргументом против этого механизма.
2-В настоящее время популярная теория состоит в том, что диафрагмальная дисфункция возникает из-за снижения выхода диафрагмального нерва, хотя то, что вызывает снижение нервного возбуждения, остается предметом предположений. Хотя известно, что общая анестезия подавляет выработку центральных респираторных центров и подавляет синаптическую передачу, эти эффекты временны и незначительны.
Степень дисфункции, наблюдаемая после операции на верхних отделах брюшной полости, не определяется после общей анестезии с процедурами, затрагивающими нижнюю часть живота или конечности. Тормозная дуга, инициируемая абдоминальными ноциоцепторами для уменьшения боли, маловероятна, поскольку достижение адекватного контроля боли с помощью эпидуральных опиатов не способствует постоянному улучшению легочной функции или диафрагмальной функции.
Напротив, эпидуральные анестетики, такие как бупивакаин, связаны с улучшением диафрагмальной функции.Поскольку эти агенты вызывают симпатическую блокаду в дополнение к контролю боли, было высказано предположение, что висцеральные симпатические афференты могут быть ответственны за предоставление тормозного сигнала, который ослабляет центральное нервное возбуждение и активность диафрагмального нерва. В пользу этого представления о дуге торможения рефлекса свидетельствует демонстрация на моделях животных, что механическая стимуляция желчного пузыря сильно подавляет электромиографическую активность и движение в диафрагме.
Кардиохирургия оказывает неблагоприятное воздействие на легочную функцию.После аортокоронарного шунтирования (АКШ) объем легких уменьшается примерно на 30 процентов, и последующая нормализация может занять несколько месяцев. Функция легких более серьезно нарушается, когда выполняются забор и трансплантация внутренней артерии молочной железы. Гипоксемия является обычным явлением после АКШ, снижаясь до надира около 55 мм рт.ст. (комнатный воздух) на второй день после операции. Фракция шунта увеличивается с 3 процентов до операции до пиковых 19 процентов после операции. В основе увеличения фракции шунта лежит развитие базилярного ателектаза, который более выражен слева.
Ряд факторов был вовлечен в развитие легочной дисфункции и ателектаза после АКШ: хирургические манипуляции с грудной стенкой и, как следствие, снижение эластичности грудной стенки; интраоперационная ретракция легкого и травма левой нижней доли; интраоперационное повреждение диафрагмальных нервов, приводящее к дисфункции диафрагмы; и развитие ателектаза и острого повреждения легких, связанное с искусственным кровообращением.
Операция по резекции легкого может вызвать самые серьезные нарушения функции легких.Величину необратимой потери функции легких в результате резекции функционирующей паренхимы легкого можно надежно оценить с помощью предоперационного количественного сканирования легких радионуклидной перфузии, выполняемого в сочетании со стандартной спирометрией. Кроме того, факторы в периоперационном периоде временно увеличивают степень поражения.
Стандартный заднебоковой торакотомический разрез включает ретракцию и резекцию ребер, а также пересечение межреберных, широчайших, трапециевидных и передних зубчатых мышц.Вследствие этой обширной травмы грудной стенки общая податливость дыхания снижается на 75 процентов, работа дыхания увеличивается, а объемы легких уменьшаются пропорционально потере функционального легкого. После лобэктомии или клиновидной резекции с помощью торакотомии ОФВ 1 и ФЖЕЛ падают до 25 процентов дооперационных значений через один час после операции и повышаются только до 30 процентов через двадцать четыре часа. Использование более ограниченного разреза для сохранения мышц связано с гораздо меньшим влиянием на функцию легких.
Ателектаз
Как интраоперационные, так и послеоперационные механизмы способствуют развитию и сохранению ателектаза. Ателектаз компрессии и ателектаз резорбции являются основными интраоперационными механизмами, которые способствуют этому периоперационному легочному осложнению. Развитие компрессионного ателектаза является многофакторным по отношению к головному смещению диафрагмы в грудную клетку, дисфункции диафрагмы, вызванной хирургическими манипуляциями на грудной клетке и брюшной полости, и различиям в регионарной вентиляции в легких во время пассивной вентиляции по сравнению со спонтанной вентиляцией.Во время самопроизвольной вентиляции нижняя зависимая часть диафрагмы смещается больше всего, но после введения общей анестезии с механической вентиляцией верхняя независимая часть диафрагмы предпочтительно смещается. Именно в нижних, зависимых областях легких, как правило, возникает послеоперационный ателектаз. Резорбционный ателектаз происходит в результате двух разных механизмов. Это может быть результатом резорбции газов за пределами закупоренных дыхательных путей. При отсутствии закупорки дыхательных путей это также может происходить в областях легких с низкой степенью вентиляции по сравнению с перфузией, когда используются газы с высокой долей вдыхаемого кислорода.В этих областях чистое поглощение кислорода в кровоток превышает отток углекислого газа и региональный приток вентилируемых газов и приводит к рассасыванию ателектазов.
В послеоперационном периоде шинирование в результате боли является обычным механизмом, способствующим ателектазу. Кроме того, нерегулярной причиной может быть повреждение диафрагмального нерва, осложняющее операции на грудной клетке, пищеводе и сердце. Слизистая закупорка центральных дыхательных путей, проблема, с которой сталкиваются особенно пациенты со слабым, неэффективным кашлем, может привести к ателектазу сегмента, доли или даже всего легкого.
Пневмония
Микроаспирация ротоглоточного секрета, по-видимому, является преобладающим механизмом в патогенезе послеоперационной и внутрибольничной пневмонии. Критическим исходным событием является колонизация ротоглотки грамотрицательными аэробными бациллами, процесс, который обычно происходит в ответ на серьезное заболевание или хирургический стресс.
Микроаспирации ротоглоточных организмов способствует наличие эндотрахеальной трубки, постэкстубационная дисфункция глотания и подавленное сознание.Желудок является дополнительным источником бактерий, которые могут способствовать развитию нозокомиальной пневмонии, особенно у пациентов, принимающих препараты, подавляющие кислотность желудочного сока. Гастроэзофагеальный рефлюкс позволяет содержимому желудка, содержащему бактерии, попадать в дыхательные пути либо напрямую, либо сначала колонизируя ротоглотку. Было показано, что простая мера по поддержанию пациентов в полусидячем положении значительно снижает заболеваемость пневмонией.
Аспирационный пневмонит
Аспирация возникает, когда нарушаются механизмы закрытия голосовой щели и кашля, которые обычно защищают дыхательные пути.Кислотное содержимое желудка, попадающее в дыхательные пути, быстро распространяется по бронхиальному дереву и паренхиме легких, вызывая почти мгновенный химический ожог. Кроме того, аспирация кислоты вызывает отсроченное высвобождение воспалительных цитокинов и приток нейтрофилов, что приводит к повреждению альвеолярно-капиллярной мембраны и накоплению богатой белком отечной жидкости в альвеолярном интерстиции и воздушном пространстве. Поверхностно-активное вещество также истощается из-за прямой денатурации кислоты и снижения продукции, что приводит к нестабильности альвеол и ателектазу.
Степень повреждения легких напрямую зависит от pH и объема аспирированного материала. В моделях на животных для повреждения легких необходим рН менее 2,5. Однако другие некислотные компоненты содержимого желудка, такие как желчь, также могут вызывать повреждение.
Острая травма легких, связанная с переливанием крови (TRALI)
Наиболее четко идентифицированный механизм TRALI включает переливание продуктов крови, содержащих лейкоагглютинирующие антитела.Эти антитела обычно присутствуют в продуктах крови, сданных повторнородящими женщинами, которые были сенсибилизированы к чужеродным антигенам HLA или гранулоцитам во время беременности. При переливании реципиенту этих же антигенов антитела приводят к лейкоагглютинации и активации гранулоцитов и моноцитов реципиента в легочном микроциркуляторном русле, что приводит к острому повреждению легких различной степени тяжести.
Второй механизм, участвующий в развитии TRALI, — это введение биологически активных медиаторов, полученных в результате распада клеточных компонентов хранящихся продуктов крови.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Механизм возникновения ТАСО — это повышенное гидростатическое давление в легочной сосудистой сети в результате увеличения объема крови и плазмы из-за переливания продуктов крови. Это приводит к оттоку жидкости из капилляров сначала в интерстициальное пространство легких, а затем в альвеолярное пространство.
Обострение ранее существовавшей болезни легких
Бронхоспазм, изолированный или у пациентов с астмой или ХОБЛ, является частым послеоперационным легочным осложнением, особенно у пациентов с ХОБЛ, перенесших торакальные операции.Существует множество известных факторов, вызывающих бронхоспазм в периоперационном периоде, включая ларингоскопию, как эндотрахеальную интубацию, так и экстубацию, отсасывание дыхательных путей, секрецию трахеи, использование периоперационных препаратов, таких как опиоиды, которые могут увеличивать высвобождение гистамина, или рефлекторное сужение бронхов в ответ на прекращение ингаляции. анестетики.
Механизмы, приводящие к обострению основного интерстициального заболевания легких как послеоперационного легочного осложнения, неизвестны.Предполагаемые триггеры включают повреждение легких, вызванное вентилятором, в результате больших интраоперационных дыхательных объемов во время механической вентиляции, высокие концентрации связанного с вдыхаемым кислородом и / или ишемическое / реперфузионное повреждение в условиях вентиляции одного легкого во время хирургической биопсии легкого.
Плевральный выпот
Разнообразные механизмы могут способствовать развитию плеврального выпота как во время абдоминальной, так и торакальной хирургии. Во всех хирургических условиях плевральный выпот может быть следствием гиперволемии в результате внутривенной инфузионной терапии и переливания продуктов крови в периоперационном периоде.В случаях абдоминальной хирургии ателектаз также может способствовать, поскольку ателектатическое легкое способствует более отрицательному местному плевральному давлению, тем самым способствуя образованию плевральной жидкости в этом пространстве.
Во время и после абдоминальной хирургии свободная перитонеальная жидкость может также выходить за небольшие поры диафрагмы, вызывая плевральный выпот. Манипуляции и раздражение диафрагмы во время операции также способствуют образованию плеврального выпота, поскольку плевральные выпоты чаще встречаются в верхней части брюшной полости, чем при операциях на нижней части брюшной полости.Кроме того, когда операция в брюшной полости имеет локализованную латеральность, образование плеврального выпота чаще встречается на той же стороне, что и операция.
Хотя большинство плевральных выпотов в послеоперационном периоде являются доброкачественными, плевральный выпот может быть связан с пневмонией (т. Е. Парапневмоническим выпотом), легочной эмболом или, что редко, повреждением грудного протока (т.
Травма диафрагмального нерва
В прошлом холодная кардиоплегия, помещенная в перикард, чтобы вызвать остановку сердца в сочетании с аортокоронарным шунтированием и другими кардиологическими процедурами, была частой причиной термического повреждения диафрагмальных нервов.Несмотря на то, что эта техника вышла из моды, диафрагмы все еще уязвимы для травм в результате тракции, ишемии, использования диатермии и пересечения во время ретракции грудины и извлечения внутренних артерий молочной железы.
Повреждение диафрагмального нерва не ограничивается кардиологическими процедурами; это также наблюдается при торакальной хирургии, хирургии шеи и трансплантации печени.
Обструктивное апноэ сна
OSA возникает в результате комбинации анатомических изменений верхних дыхательных путей, которые обычно сопровождают ожирение, и снижения нервного тонуса глоточной мускулатуры, ответственной за поддержание проходимости дыхательных путей.Использование анестетиков, опиоидов и седативных средств у хирургического пациента может спровоцировать или усугубить СОАС за счет дальнейшего снижения активности мускулатуры верхних дыхательных путей, подавления возбуждения от сна и уменьшения респираторной реакции на гиперкапнию. Воздействие опиатов и бензодиазапинов на обструкцию верхних дыхательных путей непропорционально достигнутому уровню седативного эффекта и обезболивания.
Какие люди подвержены наибольшему риску развития послеоперационных легочных осложнений?
Факторы риска развития общих послеоперационных легочных осложнений хорошо известны и обычно подразделяются на факторы риска, связанные с пациентом и процедурой.
Связанные с пациентом факторы риска развития послеоперационных легочных осложнений включают ХОБЛ, возраст> 60 лет, застойную сердечную недостаточность, легочную гипертензию II или выше функционального класса Ассоциации здравоохранения Нью-Йорка, курение, синдром обструктивного апноэ сна (OSA), низкий уровень сывороточного альбумина. <3,5 г / дл, класс II или выше Американского общества анестезиологов (ASA) или, по крайней мере, частичная функциональная зависимость. Некоторые из них заслуживают дополнительного пояснения ниже.
Наличие ХОБЛ было определено как независимый фактор риска послеоперационной дыхательной недостаточности.Однако точная взаимосвязь между тяжестью ХОБЛ или конкретными предоперационными параметрами легочной функции и риском послеоперационной дыхательной недостаточности не установлена. Единственным исключением из этого общего правила является торакотомия с лобэктомией или пневмонэктомией, для которой ОФВ после резекции 1 , определяемый как объем воздуха, который может быть вытеснен из легких за 1 секунду после полного вдоха, менее 40 процентов. прогнозируемого связано с заметно повышенным риском послеоперационной дыхательной недостаточности.
Было показано, что курение является фактором риска послеоперационных легочных осложнений в целом и для длительной искусственной вентиляции легких в частности. Курение не является просто суррогатным маркером ХОБЛ; скорее, это представляет риск, не зависящий от степени легочной недостаточности.
Класс II или выше Американского общества анестезиологов (ASA) связан со значительным повышенным риском послеоперационных легочных осложнений. В этой категории с каждым повышением в классе от пациента с легким системным заболеванием (класс II) до пациента с системным заболеванием, не приводящим к потере трудоспособности (III), к пациенту с инвалидизирующим системным заболеванием, которое представляет собой постоянную угрозу для жизни ( IV) риск увеличивается.
К факторам риска, связанным с процедурой, относятся место хирургического вмешательства, продолжительность операции, неотложная операция, общая анестезия, тип применяемого нейромышечного блокатора и дыхательные стратегии во время анестезии. В целом, риск послеоперационных легочных осложнений снижается по мере удаления хирургического вмешательства от диафрагмы. Голова и шея, нейрохирургия, восстановление аневризмы аорты и сосудистая хирургия также связаны с повышенным риском. Хирургические процедуры продолжительностью более 3–4 часов и использование панкурония, нейромышечного блокатора длительного действия, также связаны с повышенным риском осложнений.
Острая дыхательная недостаточность
Существуют два проверенных индекса или калькулятора, помогающие врачам количественно оценить риск послеоперационной легочной недостаточности у пациента.
Индекс дыхательной недостаточности Arozullah был получен на основе исследования более 81 000 пациентов, перенесших плановые или экстренные внесердечные процедуры. В этом исследовании общая частота послеоперационной респираторной недостаточности (обычно определяемой как потребность в искусственной вентиляции легких после 48 часов) составляла 3.4 процента. В этом исследовании, которое выявило ряд факторов, которые независимо связаны с повышенным риском (Таблица 1), была получена система баллов, которая предсказывала вероятность развития дыхательной недостаточности (Таблица 2). Факторы риска, выявленные в этом и множестве других исследований, включают процедуры, затрагивающие грудную клетку или верхнюю часть живота, хирургический доступ, наличие ХОБЛ и курение.
Таблица 1:
Индекс риска дыхательной недостаточности
Таблица 2:
Индекс респираторной недостаточности и прогнозируемая вероятность послеоперационной респираторной недостаточности
Операции на грудной клетке или верхней части живота.В этой категории лечение аневризмы торакоабдоминальной аорты несет наибольший риск. К другим процедурам, связанным со значительным риском, относятся восстановление аневризмы брюшной аорты, хирургия верхних отделов желудочно-кишечного тракта, торакотомия и кардиохирургия.
Хирургический доступ. Использование поперечного разреза брюшной полости сопряжено с меньшим риском, чем вертикальный разрез по средней линии, а лапароскопическая операция, по-видимому, связана со значительно меньшим риском, чем традиционные открытые процедуры. Для торакальных вмешательств срединная стернотомия и боковая торакотомия с сохранением мышц переносятся лучше, чем задняя торакотомия.В качестве альтернативы традиционной хирургии рака, видеоассистированная торакоскопическая хирургия (VATS) в сочетании с резекцией клина или сегментэктомией, по-видимому, хорошо переносится пациентами с тяжелым заболеванием легких, при этом только 4% случаев респираторной недостаточности в одной серии.
Второй индекс, калькулятор Гупта для послеоперационной респираторной недостаточности, был получен на основе набора данных о более чем 200 000 пациентов, у 6 351 (3,1%) которых была выявлена послеоперационная дыхательная недостаточность.Логистическая регрессия определила тип операции, экстренную операцию, зависимый функциональный статус, предоперационный сепсис и более высокий класс ASA в качестве значимых предикторов дыхательной недостаточности. К этому калькулятору можно получить доступ в Интернете, чтобы помочь врачам рассчитать индивидуальный риск для пациента.
Ателектаз
Факторы, предрасполагающие к ателектазу, включают кардиологические, торакальные и абдоминальные процедуры; шинирование из-за боли; закупорка слизью; и повреждение диафрагмального нерва.
Пневмония
Риск послеоперационной пневмонии наиболее высок после стандартных процедур грудной клетки и верхних отделов брюшной полости, с частотой до 20 процентов в некоторых сериях.Напротив, сообщалось о частоте около 5 процентов в связи с процедурами на нижних отделах брюшной полости. Другие факторы, связанные с повышенным риском послеоперационной пневмонии, включают низкий уровень сывороточного альбумина, наличие ХОБЛ, обширный анамнез курения, пожилой возраст и статус высокого риска в соответствии с рейтинговой шкалой Американского общества анестезиологов (ASA). Также была продемонстрирована прямая связь между продолжительностью операции и частотой послеоперационной пневмонии.
Факторы послеоперационного риска включают наличие назогастрального зонда, иммуносупрессию, нарушение сознания и очевидную аспирацию.Наиболее часто выявляемым фактором риска является необходимость длительной искусственной вентиляции легких.
Аспирационный пневмонит
У хирургического пациента период максимальной уязвимости для аспирации простирается от введения общей анестезии до полного восстановления сознания в послеоперационном периоде. Ряд факторов увеличивают риск аспирации, главным из которых является подавленное сознание, сопровождающее введение анестезии.
Вдыхание воздуха в желудок во время индукции может вызвать вздутие желудка и спровоцировать рвоту.Рвота также может быть вызвана стимуляцией заднего отдела ротоглотки во время интубации и экстубации. Рефлюкс желудочного содержимого облегчается медикаментозной релаксацией нижнего сфинктера пищевода, помещением пациента в положение лежа на спине и манипуляциями с кишечником во время абдоминальных процедур.
По завершении операции экстубация обычно выполняется, когда пациент, хотя и способен адекватно вентилировать, еще не может полностью защитить дыхательные пути.Примечательно, что рефлексы верхних дыхательных путей остаются значительно нарушенными в течение двух часов после выхода из наркоза. Кроме того, остаточная дисфункция голосовой щели может сохраняться до восьми часов после удаления эндотрахеальной трубки. Хотя риск аспирации уменьшается после непосредственного периоперационного периода, прием наркотиков представляет собой постоянный риск, поскольку эти агенты могут вызывать рвоту и угнетать сознание.
В исследовании 215 000 общих анестезиологических процедур в клинике Мэйо частота аспирации в ближайшем периоперационном периоде составила 0.03 процента, но заболеваемость была почти в четыре раза выше в условиях неотложной хирургии. Предрасполагающие факторы, в том числе кишечная непроходимость, дисфункция глотания, депрессивное психическое состояние, хирургическое вмешательство на пищеводе и недавний прием пищи, были выявлены более чем у половины пациентов, перенесших аспирацию. Большинство событий произошло во время введения ларингоскопа при подготовке к интубации и во время экстубации.
Острая травма легких, связанная с переливанием крови (TRALI)
Истинный риск TRALI трудно установить, потому что этот объект, вероятно, недооценен.Одно исследование зафиксировало заболеваемость 0,02 процента на единицу и 0,16 процента на пациента. Большинство случаев сгруппированы в ближайшем послеоперационном периоде, когда часто требуются переливания для устранения кровопотери, возникшей во время операции.
Риск TRALI наиболее тесно связан с характеристиками донора, а не с характеристиками получателя. Использование продуктов крови от доноров-женщин сопряжено со значительно большим риском, чем при использовании продуктов крови от доноров-мужчин, и степень риска дополнительно зависит от количества беременностей, которым подвергся донор.В одном исследовании тяжелобольных пациентов также были выявлены два фактора риска реципиента: сепсис и злоупотребление алкоголем в анамнезе.
Риск TRALI может быть наибольшим при переливании продуктов крови, богатых плазмой (свежезамороженная плазма, тромбоциты), но практически все продукты крови способны вызывать эту реакцию.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Как и в случае с TRALI, частоту TACO трудно установить, поскольку она, вероятно, также занижена.Заболеваемость может составлять от 1% до 8% всех пациентов, получающих продукты крови. К самым сильным факторам риска развития ТАКО относятся хроническая почечная недостаточность, сердечная недостаточность, количество перелитых продуктов крови и баланс жидкости в час.
Обострение ранее существовавшей болезни легких
Хотя бронхоспазм у пациентов с астмой и ХОБЛ является общепризнанным периоперационным легочным осложнением, факторы риска обострения основных заболеваний ХОБЛ и астмы изучены недостаточно.Одно исследование с участием пациентов с ХОБЛ, перенесших частичную резекцию легкого по поводу злокачественной опухоли, показало, что частота обострений приближается к 50%. Факторы риска развития обострения включали мужской пол и повышенную ЗОЛОТОЙ стадию обструкции. Пациенты, у которых развилось обострение, продемонстрировали повышенный последующий риск дополнительных послеоперационных легочных осложнений, увеличенную продолжительность пребывания в стационаре и повышенную смертность.
Факторы риска периоперационных обострений у пациентов с интерстициальным заболеванием легких включают экстренную операцию, операцию на легких и более длительное время анестезии.Торакальные операции, особенно открытая хирургическая биопсия легкого и операция резекции легкого, связаны с более высокой частотой обострений, чем операции на брюшной полости.
Плевральный выпот
Плевральный выпот может иметь частоту около 50% при абдоминальных операциях и почти универсален при посткоронарном шунтировании. При абдоминальной хирургии факторы риска развития плеврального выпота включают хирургическое вмешательство на верхнем или нижнем отделе брюшной полости, наличие ателектаза и наличие свободной жидкости в брюшной полости.
Травма диафрагмального нерва
Пациенты, перенесшие АКШ, подвергаются наибольшему риску повреждения диафрагмального нерва. Другие кардиологические процедуры, лобэктомия, трансплантация легких и трансплантация печени также несут в себе риск повреждения диафрагмального нерва.
Легочная эмболия
Повышенный риск тромбоэмболии легочной артерии сопровождает ряд хирургических вмешательств, в том числе хирургические вмешательства в верхних отделах брюшной полости, нейрохирургические, кардиологические, урологические и ортопедические процедуры нижних конечностей. Нехирургические факторы риска включают ожирение, неподвижность, злокачественные новообразования и тромбофилическое состояние (например,g., лейденская мутация фактора V).
Обструктивное апноэ сна
OSA — распространенное заболевание, при котором заболевание средней и тяжелой степени встречается у 7% взрослого населения. Исследования показали, что примерно у 20 процентов взрослых, которые обращаются за плановой операцией на не верхних дыхательных путях, есть СОАС; распространенность превышает 70 процентов у пациентов, перенесших бариатрические операции.
До 80 процентов хирургических кандидатов с СОАС не диагностируются до их хирургической госпитализации, поэтому высокий индекс подозрений и тщательный сбор анамнеза и физикальное обследование имеют важное значение для выявления пациентов из группы риска.Факторы риска ОАС включают ожирение, пожилой возраст, мужской пол, окружность шеи более 17 дюймов для мужчин и 16 дюймов для женщин, а также черепно-лицевые аномалии, такие как ретрогнатия и макроглоссия. Наличие в анамнезе громкого храпа, наблюдаемых апноэ, дневной гиперсонливости и утренних головных болей также увеличивает вероятность основного обструктивного апноэ.
Риск осложнений, связанных с СОАС, у послеоперационных пациентов наиболее тесно связан с использованием периоперационных опиоидов.
Какие лабораторные исследования следует заказать для постановки диагноза и как интерпретировать результаты?
Ряд лабораторных исследований полезен для определения наличия распространенных легочных осложнений у хирургических пациентов:
Пневмония
Лейкоцитоз — почти универсальный признак пневмонии, но это неспецифическая находка.Посевы мокроты или трахеального аспирата могут быть полезны, но каждый из них может быть заражен организмами, которые колонизируют ротоглотку и проксимальные дыхательные пути.
Острая травма легких, связанная с переливанием крови (TRALI)
Демонстрация наличия лейкоагглютинирующих антител в продуктах донорской крови дает убедительные доказательства в поддержку диагноза TRALI в соответствующих условиях. Обширные серии публикаций демонстрируют наличие таких антител в 70-85 процентах случаев. Из-за затрат и времени не все банки крови готовы проводить необходимое тестирование продуктов донорской крови.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Уровень мозгового натрийуретического пептида (BNP) может быть повышен у пациентов, у которых развивается отек легких после переливания продуктов крови, чтобы помочь в диагностике канцерогенного отека легких.
Легочная эмболия
Отрицательный результат теста на D-димер помогает исключить тромбоэмболию легочной артерии только в тех случаях, когда предварительная вероятность является низкой или средней. Полезность d-димера для послеоперационных пациентов также ограничена высокой распространенностью положительных тестов, полученных в результате недавней операции.
Газ артериальной крови имеет ограниченную ценность, поскольку гипоксемия и расширенный артериально-альвеолярный кислородный градиент не будут различать различные другие факторы при дифференциальной диагностике.
Электрокардиограмма может оказаться полезной, и ее следует получить. Синусовая тахикардия — почти универсальная находка у пациентов с тромбоэмболией легочной артерии; его отсутствие (при условии, что пациент не принимает отрицательные хронотропные препараты) противоречит диагнозу. Иногда тромбоэмболия легочной артерии предвещает новое начало фибрилляции предсердий, но этот ритм также часто наблюдается после кардиоторакальных хирургических вмешательств.Образец S1Q3T3 или новая блокада правой ножки пучка Гиса указывает на деформацию правых отделов сердца и является важным, хотя и необычным, признаком возможного наличия тромбоэмболии легочной артерии.
Какие визуализационные исследования будут полезны при постановке или исключении диагноза послеоперационного легочного осложнения?
Различные визуализационные исследования могут оказаться полезными при оценке послеоперационных пациентов, у которых есть опасения по поводу легочных осложнений.
Пневмония
Пациентам с подозрением на пневмонию необходимо сделать рентгенограмму грудной клетки.Демонстрация новой или ухудшающейся рентгенографической непрозрачности предполагает возможность пневмонии, но аналогичные изменения также могут быть вызваны ателектазом, отеком легких, аспирационным пневмонитом или инфарктом легких. Иногда требуется компьютерная томография грудной клетки, чтобы продемонстрировать непрозрачность, которая не видна на рентгенограмме грудной клетки.
Аспирационный пневмонит
Наличие мультифокальных помутнений в воздушном пространстве, которые распределены преимущественно в зависимых областях легких, явно указывает на аспирацию, хотя это открытие не позволяет отличить химический пневмонит от пневмонии.
Острая травма легких, связанная с переливанием крови (TRALI)
TRALI ассоциируется с наличием затемнения легких на рентгенограмме или КТ грудной клетки, что отражает наличие некардиогенного отека легких.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Подобно TRALI, рентген грудной клетки или компьютерная томография грудной клетки покажут интерстициальное или альвеолярное помутнение. Наличие плеврального выпота, особенно двустороннего, подтверждает диагноз кардиогенного отека легких.
Обострения основного заболевания легких
Отсутствие отека легких или плеврального выпота поможет в диагностике обострения ХОБЛ или астмы, исключив другие послеоперационные легочные осложнения.
Плевральный выпот
Небольшой плевральный выпот можно диагностировать на простом рентгеновском снимке грудной клетки путем притупления реберно-диафрагмального угла (ов). Более крупные плевральные выпоты на рентгеновском снимке грудной клетки скрывают увеличивающиеся участки гемиторакса. В условиях помутнения гемиторакса отклонение трахеи от помутнения подтверждает диагноз плеврального выпота.Альтернативно, если трахея отклонена в сторону помутненного гемиторакса, диагноз ателектаза подтверждается.
Боковой снимок пролежня можно получить для оценки наличия свободно текущей плевральной жидкости, чтобы помочь исключить осложненный плевральный выпот (то есть наличие локализаций). В качестве альтернативы можно использовать ультразвуковое исследование или КТ грудной клетки для дальнейшей оценки плеврального выпота.
Травма диафрагмального нерва
Поднятие одной или обеих гемидиафрагм, часто с ассоциированным базилярным ателектазом, является частым, но неспецифическим рентгенографическим признаком возможного повреждения диафрагмального нерва.Флюороскопическое обследование диафрагмальных движений с приливным дыханием и маневром «принюхиваться» часто помогает при документировании диафрагмального паралича. Ультразвуковое исследование движения диафрагмы у постели больного становится все более популярной альтернативой рентгеноскопии.
Легочная эмболия
Рентгенограмма грудной клетки при тромбоэмболии легочной артерии неспецифична и включает базилярный ателектаз, небольшие плевральные выпоты и периферические клиновидные инфильтраты, указывающие на инфаркт легких. Рентгеновский снимок грудной клетки в наибольшей степени указывает на тромбоэмболию легочной артерии, когда она нормальная, или только минимальная аномалия в условиях тяжелой гипоксемии.Это также потенциально полезно для выявления других причин гипоксемии и респираторного дистресса, таких как пневмония, пневмоторакс или ОРДС.
Ультразвуковое исследование вен нижних конечностей — важный дополнительный тест, который можно легко провести у постели больного. Демонстрация несжимаемой вены является высокочувствительным и специфическим признаком проксимального тромбоза глубоких вен. Документирование проксимального тромбоза глубоких вен у пациента с подозрением на тромбоэмболию легочной артерии дает необходимое обоснование для начала лечения и может устранить необходимость в более дорогостоящих и сложных исследованиях, чтобы продемонстрировать наличие сгустка в легком.
Прикроватная эхокардиография — еще одно потенциально полезное исследование, особенно у пациентов с гипотензией. Признаки расширенного правого желудочка на фоне нормального или недостаточно заполненного левого желудочка должны вызывать подозрение на массивную тромбоэмболию легочной артерии.
Вентиляционно-перфузионное сканирование легких ранее было неинвазивной диагностической процедурой выбора при подозрении на тромбоэмболию легочной артерии, но теперь его в значительной степени вытеснила КТ-ангиография (см. Ниже). Вентиляционно-перфузионное сканирование легких по-прежнему иногда полезно у пациентов со значительной почечной недостаточностью, что исключает введение внутривенного контрастного вещества.Только при наличии соответствия между предварительным тестом и оцененной с помощью сканирования вероятностью тромбоэмболии легочной артерии легочная эмболия может быть исключена (низкая / низкая) или подтверждена (высокая / высокая) с высокой степенью уверенности.
КТ-ангиография стала методом выбора при диагностике тромбоэмболии легочной артерии. Поскольку он требует значительной внутривенной контрастной нагрузки, его использование проблематично у пациентов со значительным нарушением функции почек. Для интерпретации требуется опытный читатель, а результаты следует рассматривать в контексте оценки клиницистом вероятности тромбоэмболии легочной артерии до проведения теста.В этом отношении отрицательное исследование в условиях высокой вероятности предварительного тестирования или положительное исследование в условиях низкой вероятности предварительного тестирования должно побудить к рассмотрению дополнительных исследований, таких как ангиография легких.
Какие диагностические процедуры будут полезны при постановке или исключении диагноза послеоперационного легочного осложнения?
В проблемных случаях иногда помогают дополнительные диагностические процедуры.
Пневмония
У интубированных пациентов бронхоскопия с бронхоальвеолярным лаважем или использование щетки в футляре рекомендуется как средство точного отбора проб из нижних дыхательных путей для определения присутствия или отсутствия бактериальных патогенов.Однако количество ложноположительных и ложноотрицательных результатов составляет около 30 процентов. Если используется любой из этих методов, это необходимо сделать до начала приема антибиотиков.
Аспирационный пневмонит
Диагноз аспирационного пневмонита наиболее точно устанавливается при очевидной рвоте или выделении желудочного содержимого в дыхательные пути при аспирации или бронхоскопии. Чаще диагноз ставят на основании наличия совместимой рентгенологической картины у пациента с факторами риска.
Острая травма легких, связанная с переливанием крови (TRALI)
См. Раздел о лабораторных исследованиях выше.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Трансторакальная эхокардиограмма для оценки функции сердца может помочь при подозрении на кардиогенный отек легких.
Плевральные выпоты
Только отдельные плевральные выпоты в послеоперационном периоде требуют оценки плевроцентеза.
Плевральный выпот — почти универсальная находка при посткоронарном шунтировании.Их необходимо дополнительно обследовать только в том случае, если выпот симптоматический, большой (> 25% гемиторакса), увеличенный или преимущественно правосторонний. Если присутствует какой-либо из них или плевральный выпот на фоне лихорадки или боли в груди, следует выполнить торакоцентез для выявления инфекции плевры, хилоторакса и гемоторакса. Ранние выпоты после операции по шунтированию коронарной артерии обычно экссудативны по критериям Лайта, кровянистые, с преобладанием нейтрофилов и эозинофилов. Триглицериды плевральной жидкости должны быть получены для оценки хилоторакса и pH плевральной жидкости, глюкозы и окраски бактериального грамм с посевом необходимо получить для оценки плевральной инфекции.
Хотя плевральный выпот может быть осложнением до 50% операций на брюшной полости, в одном исследовании только около 10% имели размер более 10 мм и поддались плевроцентезу. Как и при посткоронарном шунтировании плеврального выпота, плевроцентез следует проводить только при наличии симптомов, больших или увеличивающихся, либо при подозрении на плевральную инфекцию, гемоторакс или хилоторакс.
Травма диафрагмального нерва
Электрофизиологическое исследование может быть выполнено в тех случаях, когда рентгеноскопическая или ультразвуковая оценка диафрагмальной функции не является диагностической.Диафрагмальный нерв стимулируется чрескожно в области шеи, и диафрагмальная электромиограмма (ЭМГ) регистрируется с помощью поверхностных электродов или путем прямого прокола диафрагмы записывающим электродом.
Легочная эмболия
См. Раздел, посвященный исследованиям изображений, выше.
Обструктивное апноэ сна
Для окончательного диагноза ОАС необходимо провести полисомнографию в течение ночи в лаборатории сна. Несмотря на то, что это подходящее средство скрининга пациентов, которым запланирована плановая операция, этот подход непрактичен для оценки пациентов, которым требуются более срочные процедуры, и тех, кто уже госпитализирован и ожидает операции.Альтернативный диагностический подход, который становится все более доступным, — это использование портативного полисомнографического оборудования для использования дома или у постели пациента.
Наиболее широко доступным исследованием является мониторинг оксиметрии в течение ночи, где визуальный осмотр записи обеспечивает простую качественную оценку наличия и частоты десатурации, связанной со сном. Из-за недостаточной специфичности ночная оксиметрия не рекомендуется в качестве диагностического инструмента для OSA, но ее высокая чувствительность делает ее полезной для выявления предоперационной популяции с повышенным риском OSA.
Если вы решите, что у пациента есть послеоперационное легочное осложнение, как следует вести себя с пациентом?
При лечении послеоперационных легочных осложнений следует рассмотреть ряд терапевтических вмешательств.
Ателектаз
Стандартные меры легочного туалета, используемые для лечения ателектаза, включают распыление альбутерола, перкуссию грудной клетки, стимулирующую спирометрию и частое отсасывание интубированных пациентов.
Оптоволоконная бронхоскопия (FOB) играет ограниченную роль в лечении серьезных послеоперационных ателектазов.В одном классическом исследовании эффективности FOB в этой ситуации, FOB и физиотерапия грудной клетки были одинаково эффективны при лечении ателектаза, когда воздушная бронхограмма отсутствовала на рентгенограмме грудной клетки, что предположительно указывает на обструкцию проксимальных дыхательных путей из-за закупорки слизью. Напротив, наличие воздушной бронхограммы связано с минимальным ответом на любой из этих методов.
Ввиду отсутствия доказанного превосходства более инвазивного подхода, простые меры легочного туалета следует рассматривать как метод первой линии при ателектазе.Бронхоскопия должна проводиться в случаях, когда физиотерапия грудной клетки противопоказана (например, травма грудной клетки), плохо переносится или безуспешна, а также в случаях, когда тяжелая гипоксемия требует немедленного вмешательства (которое во многих случаях также должно включать интубацию и механическую вентиляцию легких). .
Пневмония
Эмпирическое лечение нозокомиальной пневмонии состоит из антибиотиков широкого спектра действия, которые охватывают золотистый стафилококк (включая штаммы, устойчивые к метициллину) и грамотрицательные палочки.Выбранные конкретные агенты должны отражать конкретный эпидемиологический профиль и паттерны микробиологической восприимчивости в лечебном учреждении.
Аспирационный пневмонит
Лечение аспирационного пневмонита является поддерживающим и включает коррекцию гипоксемии с помощью дополнительного кислорода и, в более тяжелых случаях, искусственной вентиляции легких. Бронхоскопия показана только при подозрении на обструкцию дыхательных путей частицами пищи на основании локализованного хрипа или крупозного ателектаза.Поскольку кислота распространяется и эндогенно нейтрализуется в течение нескольких секунд, бронхоальвеолярный лаваж большого объема неэффективен для уменьшения степени повреждения и не рекомендуется.
Исследования роли системных кортикостероидов не дали окончательных результатов, и использование этих препаратов не является оправданным.
Профилактические антибиотики обычно не рекомендуются, но их часто применяют, когда есть диагностическая неопределенность в отношении того, есть ли у пациента химический пневмонит или бактериальная пневмония.Поскольку до 40 процентов пациентов после аспирации разовьются наложенной бактериальной пневмонией, клиницист должен сохранять бдительность в отношении новой лихорадки, новых или прогрессирующих рентгенологических помутнений и гнойной мокроты. Такие результаты должны побудить к назначению антибиотиков широкого спектра действия.
Острая травма легких, связанная с переливанием крови (TRALI)
Лечение TRALI — поддерживающее; лечение включает использование дополнительного кислорода и, в более тяжелых случаях, механическую вентиляцию легких для лечения гипоксемии.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
Лечение ТАСО — это в первую очередь диурез с использованием петлевых диуретиков в дополнение к поддерживающим мерам с использованием дополнительного кислорода.
Обострения основного заболевания легких
Бронходилататоры короткого действия, в первую очередь бета-2-агонисты, а также ингаляционные холинолитики, являются основой лечения бронхоспазма. В более тяжелых случаях могут потребоваться системные кортикостероиды.
Ведение пациентов с обострениями основного интерстициального заболевания легких в первую очередь является поддерживающим.Часто используются кортикостероиды, но доказательства их эффективности отсутствуют.
Плевральный выпот
Большинство плевральных выпотов в послеоперационном периоде не требуют лечения и проходят спонтанно. Однако при наличии симптомов, больших или увеличивающихся размеров плевральной полости, хилоторакса или гемоторакса, а также при наличии подозрений на наличие плевральной инфекции показан терапевтический торацентез.
Травма диафрагмального нерва
Пациенты с диафрагмальной дисфункцией, как правило, хорошо подходят для неинвазивной вентиляции с положительным давлением, если они бодрствуют и способны эффективно выводить выделения из дыхательных путей.В более тяжелых случаях требуется обычная искусственная вентиляция легких. У некоторых пациентов с постоянным параличом диафрагмы может наблюдаться симптоматическое улучшение после хирургической складки диафрагмы.
Легочная эмболия
Антикоагулянтная терапия гепарином — основа терапии стабильных пациентов без противопоказаний.
Наличие опасной для жизни гипоксемии или шока должно побудить к рассмотрению вопроса о тромболитической терапии, но ее использование в послеоперационном периоде ограничено риском кровотечения в месте недавней операции.Этот риск, по-видимому, снижается до приемлемого уровня после седьмого послеоперационного дня, хотя исключение составляет внутричерепная хирургия, которая исключает использование тромболитических агентов в течение как минимум двух месяцев.
Несколько методов интервенционной радиологии — фрагментация тромба, аспирационная эмболэктомия и интраэмболическая инфузия малых доз тромболитиков — и хирургическая эмболэктомия — альтернативные варианты лечения нестабильных пациентов, которым тромболитики противопоказаны или безуспешны.
Установка фильтра в нижнюю полую вену должна рассматриваться как дополнительное средство для пациентов с гемодинамически нестабильными и неспособными справиться с дополнительной тромбовидной нагрузкой, а также для пациентов, у которых есть абсолютные противопоказания к антикоагуляции.
Обструктивное апноэ сна
Кандидатам на хирургическое вмешательство с известным или подозреваемым ОАС должен обращаться анестезиолог, имеющий опыт лечения затрудненных дыхательных путей. Иногда требуется волоконно-оптическая интубация в сознании, а экстубация по завершении операции должна выполняться только тогда, когда пациент полностью проснулся.Пациентов следует поддерживать в полустоячем положении, а не в положении лежа на спине, поскольку последнее способствует обструкции дыхательных путей.
Должен быть низкий порог для применения устройства постоянного положительного давления в дыхательных путях (CPAP) после экстубации и в последующий послеоперационный период, особенно у пациентов, у которых наблюдается частая десатурация или апноэ. CPAP также следует использовать в ночное время и во время сна.
Опиоиды следует использовать с осторожностью; Использование ненаркотических анальгетиков может помочь снизить потребность в опиоидах.
Каков прогноз для пациентов с рекомендованным лечением?
Прогноз послеоперационных легочных осложнений зависит от конкретного осложнения.
Пневмония
Нозокомиальная пневмония связана с зарегистрированными показателями смертности от 20 до 50 процентов.
Аспирационный пневмонит
Большинство пациентов с аспирационным пневмонитом демонстрируют прогрессирующее рентгенологическое и клиническое улучшение в течение нескольких дней. Однако у части пациентов быстро развивается ОРДС или развивается вторичная бактериальная пневмония.Аспирационный пневмонит является третьей по значимости причиной смертей, связанных с анестезией, на него приходится 10–30% летальных исходов. Это основная причина ОРДС у послеоперационных пациентов. Общая смертность, связанная с массивной аспирацией, составляет около 30 процентов и превышает 50 процентов у пациентов с начальным шоком или остановкой дыхания, вторичной пневмонией или ОРДС.
Острая травма легких, связанная с переливанием крови (TRALI)
TRALI имеет тенденцию к самоограничению в большинстве случаев и обычно характеризуется быстрым очищением инфильтратов и улучшением оксигенации в течение нескольких дней.Однако более продолжительный курс, более одной недели, может наблюдаться примерно у 20 процентов пациентов. Сообщается о смертности от 5 до 10 процентов.
Перегрузка кровообращения, связанная с переливанием крови (TACO)
TACO, как и TRALI, обычно самоограничивается и улучшается с диурезом. Однако это связано с увеличением продолжительности пребывания в больнице и увеличением смертности.
Обострение основного заболевания легких
Существуют ограниченные данные относительно прогноза пациентов, у которых обострение ХОБЛ является послеоперационным осложнением.Одно исследование продемонстрировало, что пациенты с ХОБЛ, у которых возникло обострение после резекции легкого по поводу злокачественного новообразования, имели более высокие показатели дополнительных послеоперационных легочных осложнений и продемонстрировали более высокую смертность по сравнению с пациентами с ХОБЛ, у которых не было обострения.
Пациенты с интерстициальным заболеванием легких, особенно пациенты с идиопатическим фиброзом легких, у которых наблюдается обострение заболевания, имеют плохой прогноз. Смертность для пациента с ИЛФ, у которого наблюдается дыхательная недостаточность, приближается к 50%.Хотя общая частота обострения у всех пациентов с ILD невелика (2,1% в одном исследовании), смертность может приближаться к 40%.
Плевральные выпоты:
Как правило, плевральные выпоты в послеоперационном периоде — это случайные находки, имеющие минимальное клиническое значение.
Повреждение диафрагмального нерва
Прогноз полного восстановления диафрагмального нерва и функции диафрагмы весьма благоприятен при термическом повреждении или тракции, хотя восстановление может занять от нескольких недель до месяцев.
Обструктивное апноэ сна
Несколько исследований показали, что пациенты с СОАС имеют значительно более высокий уровень послеоперационных осложнений, чем пациенты без этого расстройства. Наиболее частым послеоперационным легочным осложнением при СОАС является десатурация кислородом. Другие сообщенные осложнения включают гиперкапнию, повышенную частоту повторной интубации, делирий и увеличение продолжительности госпитализации. Примечательно, что пациенты с СОАС, о которых сообщалось в этих исследованиях, обычно не получали СИПАП после операции; скорее, CPAP часто начинали только после того, как возникло осложнение.Хотя предполагается, что рутинное использование CPAP в послеоперационном периоде у всех пациентов с СОАС может снизить риски осложнений, подтверждающие данные отсутствуют.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Рандомизированное контролируемое исследование, сравнивающее две терапии расширения легких после хирургии верхних отделов брюшной полости
Введение
Легочная функция часто нарушается после хирургических вмешательств на верхних отделах брюшной полости.Терапия по расширению легких, включая стимулирующую спирометрию (IS) или дополнительную терапию положительным давлением выдоха (PEP), обычно назначается с профилактической целью в попытках улучшить легочную функцию и уменьшить послеоперационные легочные осложнения. Терапия расширения легких часто предназначена для воздействия на зависимую область легких, поскольку эта область обычно связана с риском развития послеоперационного ателектаза. 1,2 Частота послеоперационных легочных осложнений после операций на верхних отделах брюшной полости — 5.8% в США, и это частая причина заболеваемости и смертности. 3 Было показано, что послеоперационные легочные осложнения являются одним из наиболее значимых факторов, связанных с плохими исходами для пациентов, более длительным пребыванием в больнице, увеличением числа повторных госпитализаций и повышенной смертностью. 4 Послеоперационные легочные осложнения также связаны со значительными дополнительными больничными расходами. 5 Несмотря на поставленные целевые цели, многочисленные исследования еще не продемонстрировали, что ИИ эффективен в предотвращении или уменьшении послеоперационных осложнений. 6 Имеются доказательства низкого качества, которые демонстрируют отсутствие разницы в частоте послеоперационных осложнений при сравнении ИИ с глубоким дыханием или отсутствием респираторного вмешательства или с другими формами физиотерапии грудной клетки у субъектов, перенесших операцию на верхних отделах брюшной полости. . 7
Измерение непосредственного воздействия маневров по расширению легких на функцию легких у постели больного затруднено, поскольку стандартное исследование функции легких у постели больного не дает информации о функциональной остаточной емкости (FRC).Оценка эффективности терапии с расширением легких часто основывалась на измерениях общих параметров, таких как сатурация кислородом пульсоксиметрии, измерения газов артериальной крови, аускультация грудной клетки и рентгенографические изображения. 6 Эти глобальные параметры не обеспечивают чувствительности, необходимой для объективной оценки регионального перераспределения вентиляционной реакции на терапию расширения легких. Рентгенография грудной клетки и компьютерная томография позволяют получить изображения, которые врачи могут использовать для оценки изменения регионального объема легких, но эти методы имеют ограничения.Стандартные портативные рентгенограммы грудной клетки статичны и могут давать отсроченное обнаружение динамических изменений объема легких. Компьютерная томография является дорогостоящей, трудоемкой и требует переезда пациента. Оба метода визуализации подвергают пациентов воздействию радиации.
Электроимпедансная томография обеспечивает в реальном времени динамическую визуализацию без излучения в режиме реального времени. Электроимпедансная томография дает возможность увидеть изменения от дыхания к дыханию в региональном распределении вентиляции до, во время и после терапии расширения легких.Достоверность и воспроизводимость электроимпедансной томографии для оценки распределения вентиляции выгодно отличается от других методов визуализации и диагностики легких, таких как компьютерная томография, позитронно-эмиссионная томография и тесты функции легких, которые используются для измерения FRC. 8–11 Этот метод может предоставить поддающиеся количественной оценке данные, которые помогут нам определить эффективность терапии расширения легких в нашей популяции пациентов.
Основная цель этого исследования состояла в том, чтобы определить, есть ли значительная разница в процентном соотношении дорсального конца выдоха (EELI) в заднем конце выдоха (EELI) при сравнении терапии расширения легких IS с терапией расширения легких EzPAP. (Положительное давление в дыхательных путях EzPAP с манометром [Smiths Medical, Миннеаполис, Миннесота]) у взрослых людей после операции на верхних отделах брюшной полости в 1, 3 и 5 дни после операции.Мы также были заинтересованы в том, чтобы оценить, существует ли разница в связи группы терапии расширения легких с частотой послеоперационных легочных осложнений. Наша основная нулевая гипотеза заключалась в том, что не будет существенной разницы в изменении дорсального EELI% после операции расширения легких при сравнении IS с терапией расширения легких EzPAP у взрослых людей после операции на верхней части брюшной полости в 1, 3 и 5 дни после операции. вторичная нулевая гипотеза заключалась в том, что не будет значительной связи между частотой послеоперационных легочных осложнений при сравнении IS с терапией расширения легких EzPAP у взрослых людей после хирургии верхних отделов брюшной полости.
БЫСТРЫЙ ВЗГЛЯД
Текущие знания
Стимулирующая спирометрия и терапия положительным давлением в дыхательных путях обычно назначаются с профилактической целью в попытке улучшить распределение вентиляции и уменьшить послеоперационные легочные осложнения. Сообщается о низком качестве доказательств эффективности этих терапевтических вмешательств при их использовании после хирургических вмешательств на верхних отделах брюшной полости.
Чем эта статья пополняет наши знания
Стимулирующая спирометрия и терапия ПКП увеличили глобальное вовлечение легких после операции.Оба метода лечения, по-видимому, в первую очередь задействовали дорсальные области легкого в течение первых 24 часов после операции. В последующие послеоперационные дни были задействованы преимущественно вентральные отделы легкого. Это исследование не показало различий в дорсальном рекрутменте между терапиями после хирургии верхних отделов брюшной полости.
Методы
Дизайн исследования
Это исследование представляло собой одноцентровое рандомизированное контролируемое клиническое испытание, проведенное в отделении неотложной медицинской помощи на 54 койки в Медицинском центре Университета Вирджинии, который представляет собой стационар на 600 коек. объект, расположенный в Шарлоттсвилле, штат Вирджиния.Исследовательский совет по научным исследованиям в области здравоохранения Университета Вирджинии одобрил протокол исследования (IRB-HSR 19029), и он был зарегистрирован в Национальных институтах здравоохранения США.
Субъекты были обследованы во время операции исследователем (JLD), который просматривал ежедневный список предоперационных процедур для выявления потенциальных участников исследования. Соответствующие электронные медицинские карты были рассмотрены на предмет критериев включения и исключения. Подходящими участниками были взрослые люди в возрасте от 18 до 79 лет, перенесшие операцию на верхней части брюшной полости, ожидаемая послеоперационная продолжительность пребывания в больнице> 3 дней и не нуждающаяся в вспомогательном самостоятельном дыхании.Субъекты были исключены из исследования, если они соответствовали любому из критериев, перечисленных в дополнительных материалах (см. Дополнительные материалы на http://www.rcjournal.com). Исследователь исследования (DDR, JLD, RMS, DUG) обратился ко всем подходящим пациентам в периоперационный период, чтобы пригласить к участию. Письменное информированное согласие было получено от всех субъектов в течение 24 часов после операции на верхней части брюшной полости и до включения в исследование.
Рандомизация
Мы использовали простую схему параллельной рандомизации для распределения субъектов в одну из двух равных (1: 1) групп (рис.1). Сгенерированный компьютером список генератора случайных чисел (http://randomization.com/, , дата обращения 14 декабря 2016 г., ) использовался для случайного распределения субъектов исследования в группу терапии расширения легких IS или EzPAP. Распределение по группам было произведено до начала исследования. Человек, не связанный с исследованием, распечатал, перемешал и вставил каждое из случайно сгенерированных чисел в последовательно пронумерованный непрозрачный конверт, который затем запечатали. Распределение исследовательских групп было скрыто от исследователей, субъектов и всех медицинских работников до тех пор, пока не было получено письменное информированное согласие, после чего исследователь (DDR, TPM, JDP, RMS, DUG) получил последовательно пронумерованный и запечатанный конверт для откройте и покажите групповые задания.
Рис. 1.
Блок-схема. ИМТ = индекс массы тела; LOS = продолжительность пребывания; POD = послеоперационный день; EELI = импеданс легких в конце выдоха.
Терапия расширения легких
Сводный отчет из хранилища данных институциональной группы по оценке серьезности диагноза по программе Medicare о хирургических операциях на верхних отделах брюшной полости, выполненных до представления институциональной экспертной комиссии в Медицинском центре Университета Вирджинии, показал, что мы могли разумно ожидать послеоперационного пребывания в больнице от 1 до 5 d для нашей целевой группы.Субъекты были случайным образом распределены для получения терапией по расширению легких с помощью объемного IS (Voldyne 2500, Teleflex, Моррисвилл, Северная Каролина) или EzPAP с положительным давлением в дыхательных путях с манометром респираторным терапевтом 3 раза в день в 1–5 послеоперационные дни. В группе IS испытуемых учили сделать 10 вдохов через загубник IS, а затем 1 минуту нормального дыхания. Этот цикл дыхания повторяли еще 2 раза, по мере того как субъектов поощряли вдыхать до заданного объема вдоха, полученного из таблицы номограмм прогнозирующего объема вдоха IS.
Субъекты, назначенные для приема EzPAP, были обучены дышать через мундштук EzPAP в течение 10 последовательных вдохов при выдохе до целевого давления на выдохе 15 см H 2 О. Этот цикл дыхания был повторен 3 раза с 1 мин эупнейного дыхания. происходящие между каждым циклом из 10 вдохов. Дыхательный терапевт отрегулировал расходомер медицинского воздуха или газообразного кислорода на потоки вдоха 5–12 л / мин, чтобы помочь испытуемым в их усилиях по достижению целевого давления на выдохе 15 см H 2 O во время сеансов терапии расширения легких. .Приверженность терапии расширением легких документировалась респираторными терапевтами в электронной медицинской карте каждого субъекта.
Электроимпедансная томография
Измерения электроимпедансной томографии были выполнены во время одного из 3 сеансов расширенной терапии легких на 1, 3 и 5 день после операции. EELI представляет собой относительное региональное распределение параметров вентиляции на аппарате электроимпедансной томографии PulmoVista 500 ( Dräger Medical, Любек, Германия).Распределение вентиляции отображается на аппарате электроимпедансной томографии как области интереса 1 (вентральная), 2 (средняя вентральная), 3 (средняя дорсальная) и 4 (дорсальная). Измеренные изменения импеданса легких напрямую связаны с изменением объема легких. Для целей этого исследования мы разделили 4 представляющих интерес области по горизонтали и объединили интересующие области 1 и 2, чтобы представить вентральную, и области интереса 3 и 4, чтобы представить дорсальные области, чтобы количественно оценить изменения в соответствующем региональном перераспределении вентиляции.
Устройство PulmoVista 500 было откалибровано и само испытано в соответствии со спецификацией производителя. Каждый испытуемый располагался на стуле или кровати в стандартной позе Фаулера. Окружность грудной клетки была измерена для определения подходящего размера электродного ремня в соответствии с рекомендациями производителя. Ремень с прикрепленным электродом был смочен водой для улучшения проводимости электрода и был помещен вокруг грудной клетки пациента на уровне четвертого-шестого межреберных промежутков в срединно-ключичном положении.Задняя сторона среднего положения ремня располагалась над позвоночником на равном расстоянии от нижнего края лопатки, при этом электроды 1 и 16 передней стороны одинаково граничили с грудиной. Контрольный электрод помещали в верхний правый квадрант живота испытуемого (рис. 2). Перед продолжением записи измерений было подтверждено высокое качество сигнала. Электроимпедансный томографический монитор был расположен вне поля зрения субъектов и респираторных терапевтов, проводивших терапию расширения легких, чтобы минимизировать риск систематической ошибки.
Рис. 2.
Поперечный разрез положения электродной ленты и монитора электроимпедансной томографии.
Исходное измерение EELI регистрировалось в течение 2 минут во время эупноэтического дыхания. Затем респираторный терапевт научил каждого пациента сделать 10 вдохов в течение каждого из 3 циклов терапии расширения легких. Между каждым циклом имела место одна минута дыхания в покое, а затем до завершения сеанса записывались 2 минуты эвпнейного дыхания с измерениями EELI. Лента электродов и электрод сравнения были удалены после сеансов электроимпедансной томографии.Субъекты продолжали получать плановую терапию расширения легких 3 раза в день до последующих измерений электроимпедансной томографии на 3 и 5 дни после операции, если они не были выписаны.
Для корректных измерений EELI требуется постоянный замкнутый контакт электрода и минимальное движение пациента. Удаление ремня с электродом у испытуемых между дневными послеоперационными измерениями электроимпедансной томографии увеличивает риск нарушения достоверности повторных измерений со сравнениями EELI.Мы решили анализировать и сообщать региональные изменения исходного EELI отдельно для каждого из соответствующих послеоперационных дней. Считалось, что субъекты завершили исследование по завершении 5-го дня после операции или при выписке. Продолжение терапии по расширению легких оставалось на усмотрение бригады первичного медперсонала.
Региональное распределение измерений вентиляции было записано на PulmoVista 500 во время сеансов мониторинга. Каждая запись была перенесена на USB-накопитель.Данные загружались с USB-накопителя на персональный компьютер под управлением Windows (Microsoft, Редмонд, Вашингтон) для реконструкции измерения импеданса (Инструмент анализа данных электроимпедансной томографии v6.3, Dräger Medical). Реконструкция позволила нам изолировать наши основные области интересов; первые 2 минуты (исходный уровень перед расширяющей легочной терапией) и последние 2 минуты (после расширяющей легкие) записи (рис. 3). Эти выделения использовались для количественной оценки относительных процентных изменений EELI в ответ на терапию расширения легких.Приведены примеры субъекта на IS и объекта на EzPAP с числовым выводом и соответствующими томографическими изображениями, созданными с помощью инструмента анализа данных электроимпедансной томографии (рис. 4).
Рис. 3.
Глобальный импеданс легких в конце выдоха (EELI) изменяется во время сеанса экспираторной терапии (LET).
Рис. 4.
Примеры томографических изображений стимулирующей спирометрии (IS) и EzPAP и линейного графика распределения вентиляционных изменений импеданса легких в конце выдоха (ΔEELI) после реконструкции измерений.Цветовая шкала томографического изображения: серый = нет / незначительные изменения; голубой = положительные отклонения; оранжевый = отрицательные отклонения. FRC = функциональная остаточная емкость.
Показатели результатов
Исходные демографические и клинические характеристики были собраны из электронной медицинской карты каждого субъекта, которая включает возраст, пол, рост, индекс массы тела, оценку респираторного риска у хирургических пациентов в Каталонии, индекс риска, уровень боли, пребывание в больнице, анамнез курения, сопутствующих кардиореспираторных заболеваний и первичного хирургического вмешательства.Первичным критерием исхода была групповая разница в соответствующем дорсальном ИВЛП после экспансии легких на 1-й, 3-й и 5-й дни после операции. . Послеоперационные легочные осложнения включали гипоксемию, ателектаз и пневмонию. Гипоксемия была определена как S pO 2 <90%, с необходимостью введения или увеличения дополнительного кислорода для поддержания S pO 2 ≥ 90%.Для диагностики этих осложнений потребовались рентгенограмма грудной клетки и рентгенологическое обследование на ателектаз и пневмонию.
Статистический анализ
Априорный анализ мощности был проведен для определения размера исследуемой выборки до начала исследования. Обзор литературы показал увеличение FRC на 20% среди здоровых взрослых людей, которые дышали нормально при атмосферном давлении, а затем против 15 см H 2 O положительного давления на выдохе, когда они сидели в боксе плетизмографа. 12 Мы полагали, что 15% групповая разница в ответе дорсального EELI на терапию расширения легких была разумной и клинически важной. Установив α на 0,05 и 32 β на 0,2, мы определили, что для обеспечения 80% эффективности нашего исследования потребуется 50 субъектов на группу. При рассмотрении возможности отсева до 20% можно было включить до 120 субъектов, чтобы сохранить желаемую статистическую мощность с 50 субъектами в группе в каждый послеоперационный день.
Непрерывные переменные с нормальным распределением были представлены как среднее ± стандартное отклонение и сравнивались с использованием теста независимой выборки t .Непрерывные переменные с ненормальным распределением были представлены в виде медианы (межквартильный размах [IQR]) и сравнивались с использованием критерия Манна-Уитни. Категориальные переменные сравнивали с использованием критерия независимости хи-квадрат с нормальным приближением или точного критерия Фишера, если ожидаемое значение группы было <5, в зависимости от ситуации. Мы оценили нормальность распределения наших данных, используя тест Колмогорова-Смирнова и визуально проверяя гистограммы непрерывных переменных. Первичный исход P (двусторонний) ≤.05 считался статистически значимым. Корректировка Бонферрони применялась, когда для исследовательских сравнений результатов применялись многократные повторные измерения, при этом значимым считалось P (двусторонний) ≤ 0,016. Статистический анализ был выполнен с использованием SPSS 25 для Windows (IBM, Армонк, Нью-Йорк), а графики были созданы с помощью GraphPad Prism 8 (GraphPad, Ла-Холла, Калифорния).
Результаты
Популяция исследования
Всего 180 пациентов прошли скрининг и были приглашены для участия в исследовании.В общей сложности 112 субъектов (62,2%) дали письменное информированное согласие на участие. Субъекты ( N = 112) были одинаково рандомизированы и распределены в соотношении 1: 1 для получения терапии расширения легких IS ( n = 56) или EzPAP ( n = 56). Набор в исследование закончился после того, как было набрано как минимум 50 субъектов в группе, вплоть до 3-го послеоперационного дня. Продолжение набора до 8 дополнительных субъектов привело бы к ненужному использованию времени субъектов и ресурсов исследования, поскольку выбывание из исследования помешало нам сохранить набор по 50 человек в группе до 5-го дня послеоперационного периода.Шестьдесят восемь из 180 подходящих пациентов (37,8%) были исключены, большинство из которых либо отказались участвовать ( n = 33 [49%]), либо имели прогнозируемое пребывание в больнице менее 3 дней ( n = 10 [ 15%]). Средний возраст ± стандартное отклонение (61 ± 13 лет) был одинаковым между группами ( P = 0,60), и женщины составляли 58% исследуемой популяции.
Обе группы имели промежуточный риск развития послеоперационных осложнений, как определено индексом риска «Оценка респираторного риска у хирургических пациентов в Каталонии» (медиана [IQR], 41 [41–41], P =.98). Основные сопутствующие респираторные заболевания включали ХОБЛ (7,1%), астму (5,4%) и обструктивное апноэ во сне (5,4%). Наиболее распространенными хирургическими вмешательствами в верхней части живота были Уиппл (36,6%) и гепатэктомия (30,4%) (Таблица 1). В общей сложности было проведено 1126 процедур расширения легких между группой IS (571) и группой EzPAP (555). Общая приверженность субъектов к терапии экспансии легких составила 97,4% (1,126 / 1156), а приверженность к терапии была аналогичной между группой IS (571/585 [97,6%]) и группой EzPAP (555/571 [97.2%]) ( P = 0,66).
Таблица 1.
Исходные характеристики
Распределение вентиляции в дорсальной области ΔEELI%
В группах IS и EzPAP наблюдалось аналогичное увеличение медианы дорсального EELI% после терапии после расширения легких в каждый из послеоперационных дней (рис. 5). Увеличение дорсального EELI% было наибольшим в 1-й послеоперационный день для обеих групп (16% IS по сравнению с 12% EzPAP, P = 0,39), тогда как оно было наименьшим на 3-й день после операции (6% IS по сравнению с 6% EzPAP, P ). знак равно68). Подобно 1-му послеоперационному дню, увеличение дорсального EELI% было наибольшим среди субъектов, получавших IS (9%), по сравнению с субъектами, получавшими EzPAP (6%) на 5-й послеоперационный день ( P = 0,46).
Рис. 5.
Изменение импеданса легких в конце выдоха (ΔEELI) после терапии расширения легких. A: 1. Послеоперационный день 1. B: Послеоперационный день 3. C: Послеоперационный день 5. Прямоугольники представляют межквартильный размах (IQR), а центральные линии показывают медианное значение.
Глобальный ΔEELI%
Исследовательский анализ глобального ΔEELI% выявил медианное увеличение распределения вентиляции после расширительной терапии легких в 1, 3 и 5 дни после операции для обеих групп (рис.6; Таблица 2). Субъекты, которые получали IS, испытали большее глобальное увеличение EELI% по сравнению с субъектами, которые получали EzPAP в 1 послеоперационный день (31% IS против 25% EzPAP, P = 0,11), на 3-й послеоперационный день (28% против 16% , P = 0,08) и 5-й день после операции (26% против 8%, P = 0,09) соответственно. Наибольшее региональное увеличение EELI% было в дорсальной области для обеих групп на 1-й послеоперационный день, тогда как оно было наибольшим в вентральной области на 3-й и 5-й послеоперационный день.Изменение EELI% при IS было наибольшим в вентральной области, представляющей интерес, по сравнению с EzPAP в каждый послеоперационный день, но эти изменения в вентральном распределении вентиляции не были значительными после статистической корректировки для нескольких повторных измерений (таблица 2).
Рис. 6.
Глобальное и региональное изменение импеданса легких в конце выдоха (ΔEELI) после терапии расширения легких. A: 1. Послеоперационный день 1. B: Послеоперационный день 3. C: Послеоперационный день 5. Данные представлены в виде медианы (межквартильный размах).IS = стимулирующая спирометрия.
Таблица 2.
Глобальные и региональные изменения в распределении вентиляции после терапии расширением легких
Вдыхательная способность
В группе IS наблюдалось постепенное увеличение измеренной инспираторной емкости в каждый из послеоперационных дней. Средняя инспираторная емкость (межквартильный размах) в 1 послеоперационный день составила 1,15 (0,75–1,50) л, на 3 послеоперационный день — 1,25 (1,00–1,50) л, а на 5-й день после операции — 1,25 (0,75–2,50) л. Минимальная инспираторная способность. емкость была 0.50 л в 1-й день после операции, а максимальная средняя емкость вдоха составляла 2,5 л в каждый из 3-х дней после операции. Режим вдоха составлял 0,75 л в 1-й день после операции и 3-й день после операции, тогда как на 5-й день после операции она составляла 1,25 л.
Послеоперационные легочные осложнения
У шести пациентов (5,4%) развились послеоперационные легочные осложнения: 2 в группе IS и 4 в группе EzPAP (относительный риск 0,50, 95% ДИ 0,09–2,62; P = 0,68). Послеоперационные легочные осложнения включали ателектаз ( n = 1) и гипоксемию ( n = 5), и все 6 возникли на 3-й день после операции (таблица 3).Случаев пневмонии не зарегистрировано. Возраст, оценка респираторного риска у хирургических пациентов в Каталонии, индекс риска и сопутствующая респираторная патология были одинаковыми для субъектов, которые это сделали, и тех, у кого не развились послеоперационные легочные осложнения. Послеоперационные легочные осложнения чаще встречались у пациентов, которые получали EzPAP ( n = 4), курили в анамнезе ( n = 4) и были женщинами ( n = 5), но эти ассоциации с послеоперационными легочными осложнениями не были значительными.Никаких побочных эффектов или непредвиденных эффектов, помимо послеоперационных легочных осложнений, выявлено не было. Среднее время пребывания в стационаре (межквартильный размах) было одинаковым между группами (IS, 4 [3–6], по сравнению с EzPAP 4 [3–6]; P = 0,30).
Таблица 3.
Частота послеоперационных легочных осложнений
Обсуждение
Наши результаты могут расширить понимание регионального распределения вентиляции при сравнении IS с терапией расширения легких EzPAP, измеренной с помощью электроимпедансной томографии у взрослых людей после операции на верхних отделах брюшной полости.Основным результатом нашего исследования не было обнаружено значительных различий в региональном распределении дорсального EELI между двумя видами терапии расширения легких. Кроме того, мы не наблюдали разницы в частоте послеоперационных легочных осложнений между группами. Эти результаты подтвердили нашу нулевую гипотезу о том, что нет никакой разницы между этими двумя послеоперационными методами инфляции легких в содействии зависимому рекрутированию легких или частоте послеоперационных легочных осложнений.
Различные факторы способствуют уменьшению объема легких у пациента после абдоминальной хирургии.Менее резистивные и менее податливые области легкого предпочтительно заполняются первыми во время короткого надувания, а затем последовательно заполняются области с более медленными постоянными времени. 13 Терапия расширения легких предназначена для увеличения объема легких и повышения низкого послеоперационного FRC. 14 Для двух устройств, использованных в этом исследовании, требуются различные методы проведения терапевтической экспансии легких. IS поощряет продолжительный, медленный и устойчивый инспираторный маневр с предпосылкой, что последующее расширение легкого задействует ателектатические области легкого.Терапия ПКП включает приливное дыхание против повышенного давления в дыхательных путях. Пациентам рекомендуется выдыхать активно, но не с силой, против предписанного уровня давления. Вариабельность усилий на выдохе может влиять на величину достигнутого давления в дыхательных путях и влиять на приливные вариации EELI, связанные с объемом легких.
У пациентов, перенесших операцию на верхних отделах брюшной полости, может развиться ателектаз, особенно в первые несколько послеоперационных дней. 2,15,16 Хирургическая процедура, остаточные анестезирующие эффекты, боль, продолжительность операции, положение лежа на спине и неглубокое приливное дыхание — каждая из них может способствовать развитию ателектаза.В нашем исследовании группы как IS, так и EzPAP продемонстрировали увеличение общего EELI после терапии расширения легких в каждый из послеоперационных дней. Изменение EELI отражает изменение объема легких. Повышенный EELI указывает на устойчивое увеличение объема легких в течение как минимум 2 минут после завершения сеанса терапии расширения легких.
На 1-й день после операции обе группы продемонстрировали наибольшее увеличение EELI в дорсальных областях. Мы интерпретировали, что как IS, так и EzPAP были эквивалентны в увеличении распределения вентиляции в дорсальных областях, измеренном после терапии расширения легких в 1 послеоперационный день.Это была область, которая обычно ассоциируется с ателектазом. На 3 и 5 дни после операции преобладающим местом распространения ИИ были вентральные области. Мы предположили, что это может быть связано со следующими двумя причинами: большей региональной податливостью передних вентральных областей у субъектов в положении Фаулера и прогрессивно увеличивающейся инспираторной способностью, наблюдаемой в течение 3 и 5 дней после операции, как упоминалось ранее. Терапия ПКП требует активного выдоха.Чрезмерное усилие на выдохе может привести к уменьшению объема легких. Это может сохраняться в некоторых областях легких после терапии расширения легких. Мы предположили, что отрицательный ΔEELI% в интересующих вентральных областях, идентифицированный на рисунке 6, отражает потерю FRC, которая возникла в результате чрезмерного усилия на выдохе. Оценка клиницистом чрезмерных усилий на выдохе и повторное обучение технике экспансии легких могут предотвратить потерю объема легких.
Результаты этого исследования согласуются с другой опубликованной литературой о влиянии расширенной легочной терапии на послеоперационную функцию легких.В Кокрановском обзоре рандомизированных клинических испытаний сравнивали ИИ с отсутствием терапии или физиотерапии, включая кашель и глубокое дыхание, у взрослых субъектов, госпитализированных в больницу для хирургии верхних отделов брюшной полости. 7 Обзор показал, что имеются доказательства низкого качества, свидетельствующие об отсутствии эффективности ИИ в профилактике легочных осложнений. Одноцентровое рандомизированное контролируемое исследование 2017 года, в котором сравнивали ИИ с отсутствием ИИ, не выявило разницы в развитии послеоперационной гипоксемии и легочных осложнений после бариатрической операции. 17 Систематический обзор терапии ПКП после абдоминальной хирургии выявил только 4 рандомизированных контролируемых испытания, все из которых были опубликованы до 1993 г. и проводились с терапией ПКП у субъектов, перенесших абдоминальную операцию. 18 Одно исследование выявило положительные различия; более высокий P aO 2 на 2-й и 3-й дни и меньшая частота ателектазов на 3-й день. 19 Систематический обзор 35 клинических испытаний не показал значительной эффективности различных методов расширения легких в предотвращении послеоперационных легочных осложнений среди взрослые после абдоминальной хирургии. 20 Только 2 статьи ссылались на терапию ПКП. 21,22 Несколько исследований поддержали использование профилактической терапии расширения легких. Исследователи пришли к выводу, что профилактическое использование расширяющей легкие терапии казалось неоправданным для этой группы пациентов.
Изменения глобального EELI в IS и EzPAP были описаны в рандомизированном перекрестном исследовании у здоровых субъектов после эндорологической процедуры. 23 В этом исследовании было обнаружено увеличение общего ΔEELI% во время маневра по расширению легких без остаточного эффекта в течение 5 минут после терапии по расширению легких и без отличий от исходного измерения.Мы сообщили об увеличении общего ΔEELI% по сравнению с исходными измерениями, и это увеличение сохранялось в течение до 2 минут мониторинга терапии после расширения легких.
У нашего исследования было несколько ограничений. Это было одноцентровое исследование. Не было группы субъектов, которая не получала терапию расширения легких, которая служила бы контролем для компараторов IS и EzPAP. Наши стандартные послеоперационные распоряжения включали IS до 10 раз в час в бодрствующем состоянии, что соответствует практике других учреждений. 24,25 Целью нашего исследования было сравнить этот стандарт IS 3 раза в день с EzPAP.
В нашей стандартной методике послеоперационной хирургии верхних отделов брюшной полости используется протокол ускоренного восстановления после операции. Мультимодальный, подтвержденный доказательствами способ ускоренного восстановления после операции также включает анестезиологические методы, в том числе местные, ненаркотические, нейроаксиальные блокады и препараты, модулирующие нейроболевой синдром, вводимые для ограничения применения опиоидов и поддержания уровня боли <4 (шкала от 1 до 10). ).Эти факторы не изучались и, возможно, способствовали наблюдаемой низкой частоте легочных осложнений. Субъекты в нашем исследовании имели средний балл по боли, равный 4. Возможно, что оценка обезболивания повлияла на надежность измерений инспираторной способности субъектов при использовании IS. Боль могла вызвать вариабельность в постоянном достижении целевого уровня давления на выдохе 15 см H 2 O при использовании EzPAP. Оба ограничения могли повлиять на изменение измерений EELI.Ранняя подвижность также приветствуется уже в день операции как компонент ускоренного восстановления после хирургического протокола. Соблюдение протокола мобильности не регистрировалось и может быть мешающей переменной, напрямую связанной с нашими результатами.
Хотя мы сообщили о низкой частоте послеоперационных легочных осложнений, этот результат мог недооценивать истинную частоту ателектазов и пневмонии. Врачи не заказывали рентгенограммы грудной клетки нашим пациентам, если не было зарегистрировано изменение респираторного статуса.У большинства наших субъектов не развивалась гипоксемия или другие признаки ухудшения респираторного статуса. Еще одно ограничение нашего исследования связано с мониторингом электроимпедансной томографии. Изменения EELI во время измерения электроимпедансной томографии отражали один поперечный срез легкого, который пересекает грудную клетку в плоскости электродов. 26 Включение и отключение не обязательно равномерно распределяются по всему легкому. Возможность изменений, которые произошли в других поперечных плоскостях, не учитывалась плоскостью одного электрода, измеренной с помощью электроимпедансной томографии.
Мы попытались снизить риски систематической ошибки для исследования. Генерация случайных последовательностей и сокрытие распределения контролировались, и были представлены неполные данные о результатах. Систематическая ошибка отсева из-за выбывания из исследования, в отличие от отсева из-за выписки из больницы, была низкой. Хотя дизайн исследования не позволял ослеплять устройства для терапии расширения легких, пациенты и респираторные терапевты, которые проводили и тренировали терапию расширения легких, были скрыты от просмотра монитора электроимпедансной томографии во время записи данных.График мониторинга требовал снятия электродной ленты между сеансами. Это могло привести к вопросам изменчивости и воспроизводимости положения ремня. Ранее опубликованные исследования, в которых использовалась электрическая импедансная томография на здоровых людях во время спонтанного приливного дыхания и маневров жизненной емкости в сидячем, лежачем и боковом положениях, продемонстрировали хорошую воспроизводимость. В этом исследовании испытуемых помещали в позу Фаулера, сидя на стуле или в постели.Спинные измерения в этой ориентации положения отражают заднее положение, при этом вентральные измерения являются передними. Это совпадение может быть фактором наблюдаемых результатов.
Это исследование дало дополнительную информацию о текущей опубликованной литературе о влиянии терапии расширения легких у пациентов после хирургических вмешательств на верхних отделах брюшной полости. Использование электроимпедансной томографии для мониторинга объема легких до, во время и после маневров по расширению легких дает новую информацию о временных изменениях в конкретных областях легких, а также об устойчивости воздействия маневров по расширению легких.Эта работа позволила понять надежность и воспроизводимость технологии электроимпедансной томографии при измерении маневров расширения легких у данной популяции пациентов. Рекомендации из Кокрановских обзоров и других недавно опубликованных статей 6,14 по ИИ подчеркивают острую необходимость в дополнительных хорошо спланированных клинических исследованиях. 6,7,14,24 Мы попытались разработать наше исследование, чтобы устранить некоторые из этих недостатков. Наша степень соблюдения плановой частоты IS или EzPAP, целевого объема или давления и количества вдохов / сеансов была стандартизирована, записана и представлена в отчетах.Респираторные терапевты наблюдали за двумя группами пациентов с равным соблюдением режима экспансии легких до завершения или прекращения исследования. Тщательный мониторинг соблюдения режима экспансии легких может быть редкостью у пациентов вне протокола исследования. Респираторные терапевты, которые проводят терапию по расширению легких и следят за соблюдением пациентом назначенного лечения, могли внести свой вклад в наш низкий уровень послеоперационных легочных осложнений.

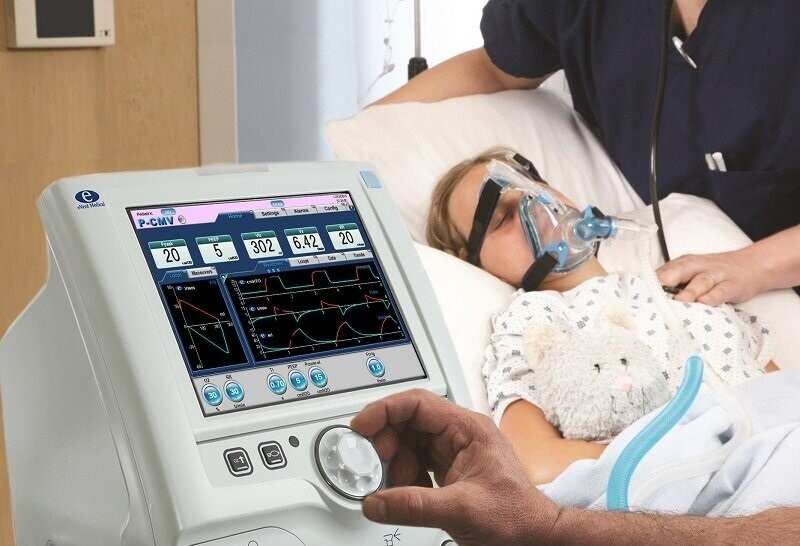
 Пациенты на механическом вентиляция накапливает секрецию, что приводит к аспирации инфицированных выделений. Использование новых эндотрахеальная трубка поколения Hi-Lo может снизить частоту ВАП.
Пациенты на механическом вентиляция накапливает секрецию, что приводит к аспирации инфицированных выделений. Использование новых эндотрахеальная трубка поколения Hi-Lo может снизить частоту ВАП. Новая разработка в лечении пациентов, которым требуется искусственная вентиляция легких, — Hi-Lo. эндотрахеальная трубка. Это устройство имеет «всасывающие порты» с обеих сторон трубки, которые позволяют удаление скопившегося подсвязочного секрета. Стандартным уходом является использование Hi-Lo ET зонд и удалять подсвязочные выделения каждые 4-6 часов. Лампа Hi-Lo предназначена для свести к минимуму любые травмы, связанные с отсасыванием. Более того, недавние исследования этой трубки ET показали, что регулярное отсасывание снижает частоту ВАП. Когда эти «колонизированные» выделения были лечение антибиотиками, это уменьшило количество ВАП и сократило время на дыхательная машина. Наблюдение, что лечение бактериальной колонизации подсвязочного секреции сокращают время на дыхательном аппарате потенциально очень важно клинически. В этом исследовании мы предполагаем, что развитие бактериальной колонизации напрямую способствует дыхательной недостаточности и приводит к увеличению времени нахождения на ИВЛ.
Новая разработка в лечении пациентов, которым требуется искусственная вентиляция легких, — Hi-Lo. эндотрахеальная трубка. Это устройство имеет «всасывающие порты» с обеих сторон трубки, которые позволяют удаление скопившегося подсвязочного секрета. Стандартным уходом является использование Hi-Lo ET зонд и удалять подсвязочные выделения каждые 4-6 часов. Лампа Hi-Lo предназначена для свести к минимуму любые травмы, связанные с отсасыванием. Более того, недавние исследования этой трубки ET показали, что регулярное отсасывание снижает частоту ВАП. Когда эти «колонизированные» выделения были лечение антибиотиками, это уменьшило количество ВАП и сократило время на дыхательная машина. Наблюдение, что лечение бактериальной колонизации подсвязочного секреции сокращают время на дыхательном аппарате потенциально очень важно клинически. В этом исследовании мы предполагаем, что развитие бактериальной колонизации напрямую способствует дыхательной недостаточности и приводит к увеличению времени нахождения на ИВЛ. Главная Цель исследования может привести к сокращению времени, в течение которого пациенты нуждаются в ИВЛ. Недавние исследования выявили группу «защитных белков», называемую тепловым шоком. белки (HSP), которые защищают пациентов от пневмонии. Защитный действие этих белков еще более выражено у пациентов, которым требуется механическое вентиляция. В стрессовых условиях HSP секретируются или высвобождаются в подсвязочный канал. секреции, и уровень секреции достаточен, чтобы предотвратить бактерии «колонизация» верхних дыхательных путей. Помимо изучения скорости бактериальной колонизации этих выделений, часть эти выделения для измерения количества HSP и того, приводит ли снижение секреции к длительное время на аппарате ИВЛ.
Главная Цель исследования может привести к сокращению времени, в течение которого пациенты нуждаются в ИВЛ. Недавние исследования выявили группу «защитных белков», называемую тепловым шоком. белки (HSP), которые защищают пациентов от пневмонии. Защитный действие этих белков еще более выражено у пациентов, которым требуется механическое вентиляция. В стрессовых условиях HSP секретируются или высвобождаются в подсвязочный канал. секреции, и уровень секреции достаточен, чтобы предотвратить бактерии «колонизация» верхних дыхательных путей. Помимо изучения скорости бактериальной колонизации этих выделений, часть эти выделения для измерения количества HSP и того, приводит ли снижение секреции к длительное время на аппарате ИВЛ.
 гематома, менингит или закрытая травма головы 5. Пациенты, которым требуется искусственная вентиляция легких после операции на брюшной полости, у которых на рентгенограмме грудной клетки не было видимых инфильтратов 6. Пациенты, которым требуется искусственная вентиляция легких по поводу первичного заболевания легких (ХОБЛ, эмфизема легких). и т. д.), если на рентгенограмме грудной клетки нет заметных инфильтратов. Критерий исключения: — 1) Пациенты, получающие ИВЛ более 6 часов во время зачисление. 2) Пациенты, которым требуется искусственная вентиляция легких по поводу ОРДС, пневмонии или травмы легких. травма, повреждение. 3) Пациенты, получившие более одной дозы любого антибиотика. 4) Пациенты, перенесшие хирургическую резекцию рака легких или любую другую операцию. непосредственно вовлекает паренхиму легких
гематома, менингит или закрытая травма головы 5. Пациенты, которым требуется искусственная вентиляция легких после операции на брюшной полости, у которых на рентгенограмме грудной клетки не было видимых инфильтратов 6. Пациенты, которым требуется искусственная вентиляция легких по поводу первичного заболевания легких (ХОБЛ, эмфизема легких). и т. д.), если на рентгенограмме грудной клетки нет заметных инфильтратов. Критерий исключения: — 1) Пациенты, получающие ИВЛ более 6 часов во время зачисление. 2) Пациенты, которым требуется искусственная вентиляция легких по поводу ОРДС, пневмонии или травмы легких. травма, повреждение. 3) Пациенты, получившие более одной дозы любого антибиотика. 4) Пациенты, перенесшие хирургическую резекцию рака легких или любую другую операцию. непосредственно вовлекает паренхиму легких
 Используется масочный или внутривенный наркоз. При длительной операции используют эндотрахеальный наркоз и за пациента «дышит» аппарат ИВЛ.
Используется масочный или внутривенный наркоз. При длительной операции используют эндотрахеальный наркоз и за пациента «дышит» аппарат ИВЛ. 



