Все о вакцине против полиомиелита
Полиомиелит (детский спинномозговой паралич) — инфекционное заболевание, вызываемое вирусами полиомиелита 1,2 и 3 типов. В основном заболевание поражает детей в возрасте до 5 лет.
Полиомиелит — тяжелое заболевание, вызывающее параличи мышц, может стать причиной развития дыхательной и сердечно-сосудистой недостаточности из-за паралича межреберных и диафрагмальных мышц. Паралич дыхательных мышц нередко становится причиной летального исхода.
Передается полиомиелит фекально-оральным путем, реже – воздушно-капельным.
Профилактика полиомиелита заключается во введении вакцины.
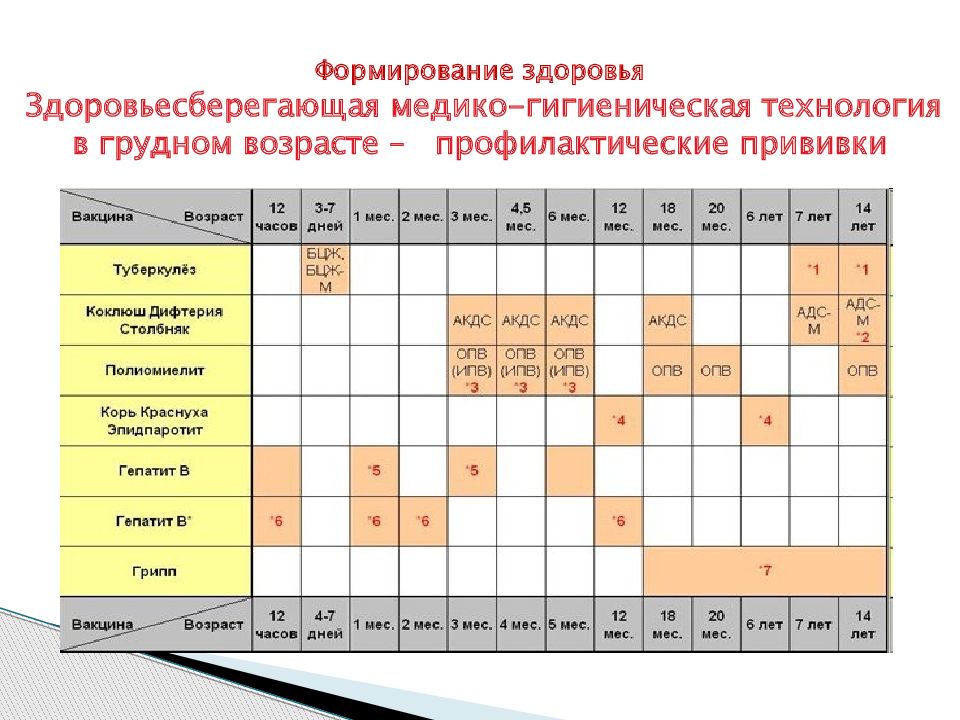
В России прививки против полиомиелита обязательны и входят в Национальный календарь профилактических прививок, утвержденный приказом Министерства здравоохранения Российской Федерации от 21 марта 2014 г. № 125н., согласно которому всем детям первого года жизни необходимо сделать три прививки от полиомиелита.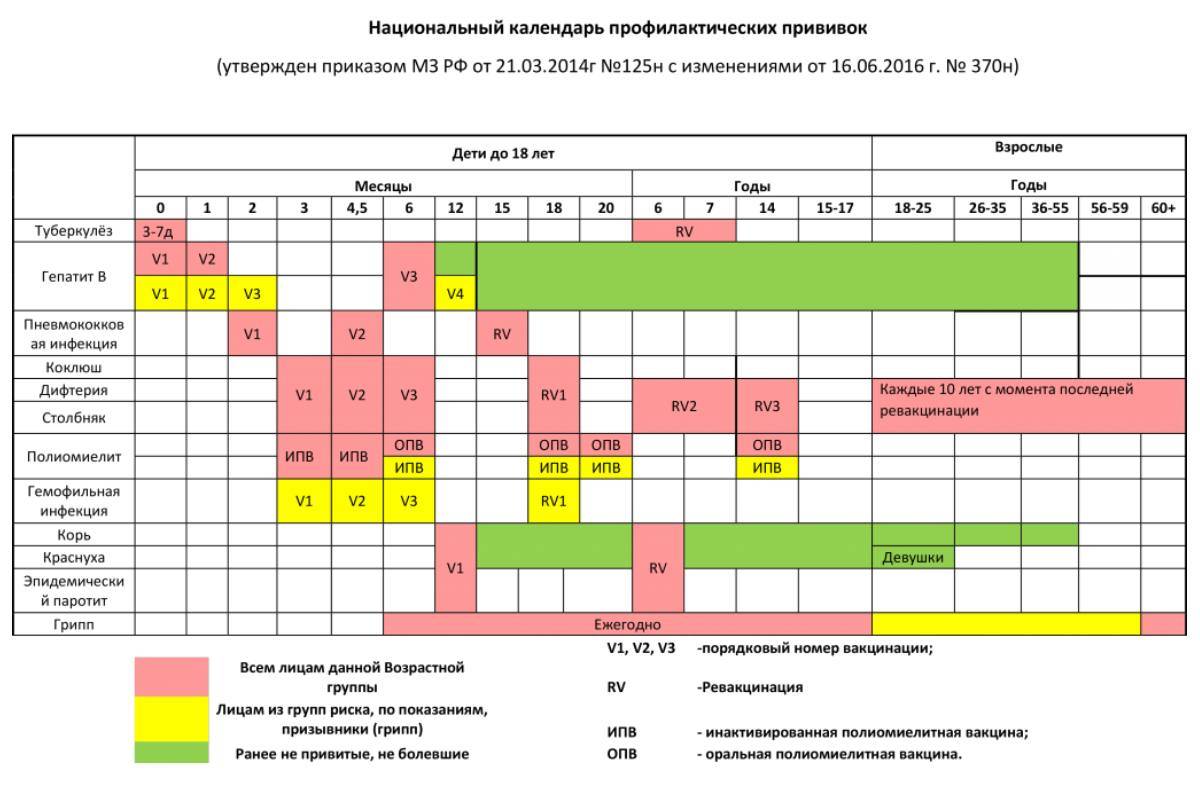 Детей начинают вакцинировать с 3х месяцев с интервалом в 6 недель (далее в 4.5 и 6 месяцев).
Детей начинают вакцинировать с 3х месяцев с интервалом в 6 недель (далее в 4.5 и 6 месяцев).
Существует 2 типа вакцин против полиомиелита:
Живая (ОПВ – оральная полиомиелитная вакцина) – содержит живые ослабленные вирусы 1,2,3 типов.
Инактивированная (ИПВ) – содержит убитые вирусы 1,2,3 типов.
Все дети первого года жизни вакцинируются инактивированной вакциной, которая вводится с помощью инъекции. Последующие прививки (ревакцинации) проводятся в 18, 20 месяцев и в 14 лет. Для ревакцинации используется живая вакцина, которая закапывается в рот.
Живая полиомиелитная вакцина имеет принципиальное отличие от инактивированной, которое заключается в том, что попадая в желудочно-кишечный тракт, видоизменяется, выделяясь с калом в течение 6 недель после вакцинации. Это может привести к вакциноассоциированному полиомиелиту (ВАП) как у самого привитого (в случае иммунодефицитного состояния), так среди не привитых контактных лиц.
Частота развития вакциноассоциированного полиомиелита невелика, по статистике около 10 случаев в год по стране. Приходится в основном на детей с выраженными нарушениями иммунитета и с тяжелыми хроническими заболеваниями.
Приходится в основном на детей с выраженными нарушениями иммунитета и с тяжелыми хроническими заболеваниями.
В связи с тем, что дети, привитые живой полиомиелитной вакциной, выделяют вирус в окружающую среду, в организованных детских коллективах предусмотрено разобщение непривитых детей от привитых сроком на 60 дней.
Вирус, выделяясь из кишечника и носоглотки, попадает на руки, одежду, игрушки и другие предметы.
Живая полиомиелитная вакцина не применяется у детей из групп риска ( с иммунодефицитными состояниями, кишечными аномалиями), а также в случае, если в семье есть ребенок непривитый против полиомиелита.
Противопоказания к проведению вакцинации определяет только врач.
Если взрослый никогда не был привит против полиомиелита,то выезжая в страны, неблагополучные по полиомиелиту он может пройти трехкратную иммунизацию против полиомиелита. Всемирная организация здравоохранения (ВОЗ) рекомендует путешественникам в страны, эндемичные по полиомиелиту, иметь полную вакцинацию против полиомиелита.
Возможны ли побочные эффекты вакцинации?
Реакция на вакцинацию практически отсутствует. В крайне редких случаях возможно временное повышение температуры тела на 5-14 день после прививки.
Риск, связанный с побочным действием вакцины, в десятки тысяч раз меньше риска заболевания полиомиелитом.
Что нужно знать о процедуре вакцинации
Если вы понимаете важность прививок, то несколько советов помогут вам правильно подготовиться к процедуре, чтобы она прошла для малыша максимально легко.
Как подготовить ребенка к вакцинации. Несколько важных правил.
Перед вакцинацией
Правило 1. На момент прививки ребенок должен быть абсолютно здоров.
Причем, здоров, прежде всего, с точки зрения мамы. У него должны быть нормальная температура и не должно быть других жалоб. Поведение, настроение, сон, аппетит – все как обычно. Если ребенок накануне капризничал, отказывался от любимой еды, то лучше понаблюдать, подождать. В то же время, если у ребенка уже несколько недель насморк, но температура нормальная и прекрасный аппетит, то никакой нагрузки на иммунитет этот насморк не оказывает и прививке не помешает.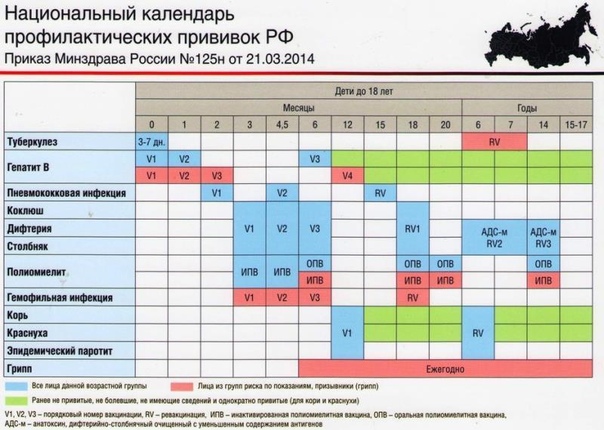
То же можно сказать и о режиме дня: малыш должен быть не голоден, но и не накормлен до отвала, он должен быть выспавшимся и не перевозбужденным. Если малыш недавно ходит в детский сад и пока еще часто болеет, то оптимальным будет забрать его за несколько дней до вакцинации (например, не водить его в сад со среды, а прививку сделать в пятницу, до понедельника вы сможете проследить за реакцией ребенка). За несколько дней до прививки не следует изменять среду и режим питания ребенка.
Правило 2. Минимизируйте контакты ребенка до прививки, в день прививки и после.
За 2-3 дня до прививки и столько же дней после нее не ходите с малышом в гости и на мероприятия, где бывает большое количество людей. Малыш может подхватить там инфекцию, инкубационный период которой составляет 2-3 дня, т.е. в день прививки или на следующие сутки малыш уже может заболеть, а в сочетании с вакциной болезнь может принять сложную форму.
Крайне нежелательно делать прививку тогда, когда имеется реальный риск заболеть. Таким днем очень часто является день посещения поликлиники. Разграничьте во времени походы по многочисленным кабинетам и прививку. Сначала пройдите всех специалистов, если все они «дали добро», помните, что инкубационный период большинства ОРВИ не превышает 2 дня. Если через 2 дня ребенок здоров – можно идти на прививку.
Таким днем очень часто является день посещения поликлиники. Разграничьте во времени походы по многочисленным кабинетам и прививку. Сначала пройдите всех специалистов, если все они «дали добро», помните, что инкубационный период большинства ОРВИ не превышает 2 дня. Если через 2 дня ребенок здоров – можно идти на прививку.
В день прививки, если есть возможность не сидеть в коридоре, а занять очередь и погулять — погуляйте на свежем воздухе. Подойдет время — позовут.
В любом случае, во время пребывания в поликлинике постарайтесь ребенка своевременно раздеть (чтоб не потел) и имейте при себе один из солевых растворов в виде капель для введения в носовые ходы («Салин», «Аква марис», обычный физраствор и т. п.). Упомянутые капли надо капать ребенку в нос каждые 15-20 минут по 2-3 капли в каждую ноздрю (реальное уменьшение вероятности ОРВИ).
Правило 3. Если ребенок – аллергик, то на момент прививки аллергия должна быть в стадии ремиссии.
Если имеются проявления аллергического дерматита, то прививку можно делать лишь тогда, когда, как минимум, 3 недели нет новых высыпаний. Но здесь (сыпь, сопли, любые реальные симптомы) последнее слово уже за доктором. Если сомневаетесь — это реальный повод сделать накануне прививки клинический (общий) анализ крови. Если вы будете делать этот анализ по своей инициативе (т. е. за свои средства), то по стоимости заплатите немножко больше, но попросите, чтобы определили уровень тромбоцитов и время свертывания — дополнительная подстраховка.
Но здесь (сыпь, сопли, любые реальные симптомы) последнее слово уже за доктором. Если сомневаетесь — это реальный повод сделать накануне прививки клинический (общий) анализ крови. Если вы будете делать этот анализ по своей инициативе (т. е. за свои средства), то по стоимости заплатите немножко больше, но попросите, чтобы определили уровень тромбоцитов и время свертывания — дополнительная подстраховка.
Правило 4. Чем меньше нагрузка на кишечник, тем легче переносится прививка.
За день до прививки, в день прививки и на следующий день — по возможности ограничьте объем и концентрацию съедаемой пищи. Не предлагайте еду, пока не попросит. При использовании молочных смесей или готовых растворимых каш для детского питания уменьшите концентрацию. Написано на упаковке: на 200 мл воды положить 6 ложек порошка. Положите 5! А если у ребенка лишний вес — 4,5! При естественном вскармливании проблем обычно не бывает — грудное молоко само по себе прекрасная профилактика послепрививочных реакций.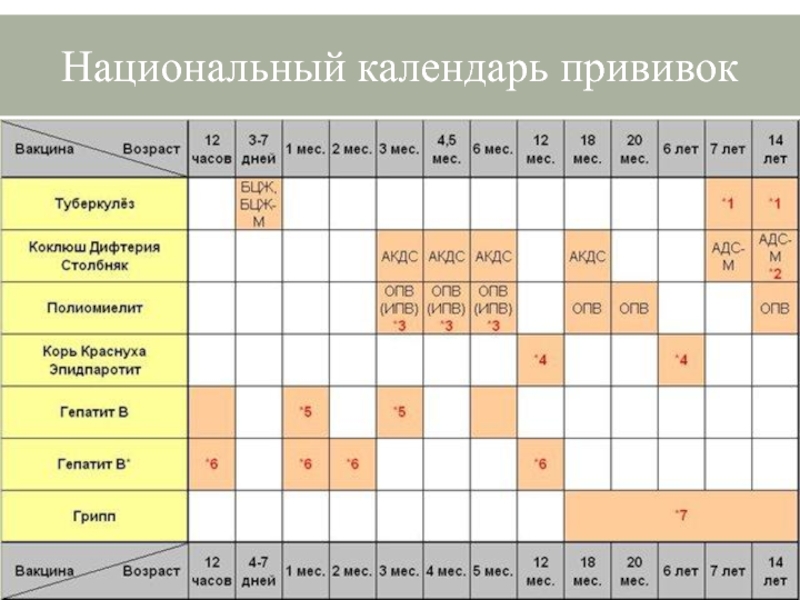 Но после прививки ребенок вполне может испытывать умеренное недомогание, что проявляется большей капризностью, и его чаще кормят. Соответственно, в день прививки ребенок съедает еды больше, чем в обычные дни, потом у него болит живот. Если речь идет о свободном вскармливании, то алгоритм действий таков:
Но после прививки ребенок вполне может испытывать умеренное недомогание, что проявляется большей капризностью, и его чаще кормят. Соответственно, в день прививки ребенок съедает еды больше, чем в обычные дни, потом у него болит живот. Если речь идет о свободном вскармливании, то алгоритм действий таков:
- если можно напоить, а можно накормить, так следует напоить;
- если можно накормить сейчас, а можно через полчаса – лучше через полчаса;
- если можно подержать у груди 10 минут, а можно 30 — лучше 10.
Правило 5. Подготовить ребенка к прививке какими-либо лекарствами невозможно.
Большинство лекарств, якобы облегчающих переносимость прививки — способ психотерапии родственников и врачей. В любом случае нельзя давать ребенку лекарства по своей инициативе. Если врач настаивает на использовании антигистаминных средств, не применяйте такие препараты, как супрастин и тавегил (они «высушивают» слизистые оболочки, а если после прививки будет подъем температуры, то сочетание двух этих факторов может увеличить риск осложнений со стороны дыхательных путей).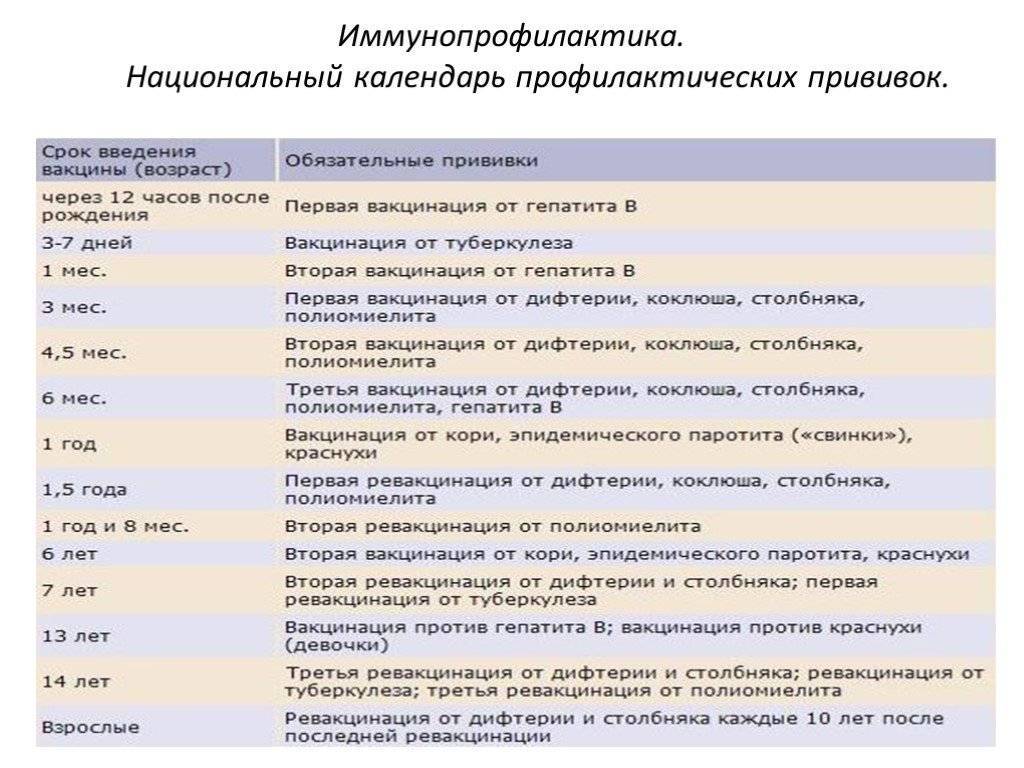 В любом случае прием антигистаминных препаратов следует сочетать с приемом препаратов кальция.
В любом случае прием антигистаминных препаратов следует сочетать с приемом препаратов кальция.
Правило 6. Не колите прививки в сильную жару, в мороз, в период эпидемии.
Нельзя делать прививку в непривычных, нестандартных для данного ребенка климатических условиях. Если на улице жара, сильный холод, то лучше отложить поход к врачу.
Во время вакцинации
Правило 7. Будьте готовы ответить на вопросы врача или медсестры.
Врач или медицинская сестра зададут несколько вопросов перед выполнением прививки. Эти вопросы задаются с целью выяснить, не имеются ли у ребёнка противопоказания для использования определённых вакцин. Чтобы не растеряться, можно подготовиться заранее.
Типичные вопросы:
Возникала ли у вашего ребёнка тяжелая реакция на введение какой-либо вакцины ранее?
У детей часто отмечается неприятное чувство в области укола или повышение температуры тела после прививки. Однако о более тяжёлых реакциях врачу или медицинской сестре необходимо сообщить, некоторые из них могут быть противопоказанием для повторного введения той же вакцины.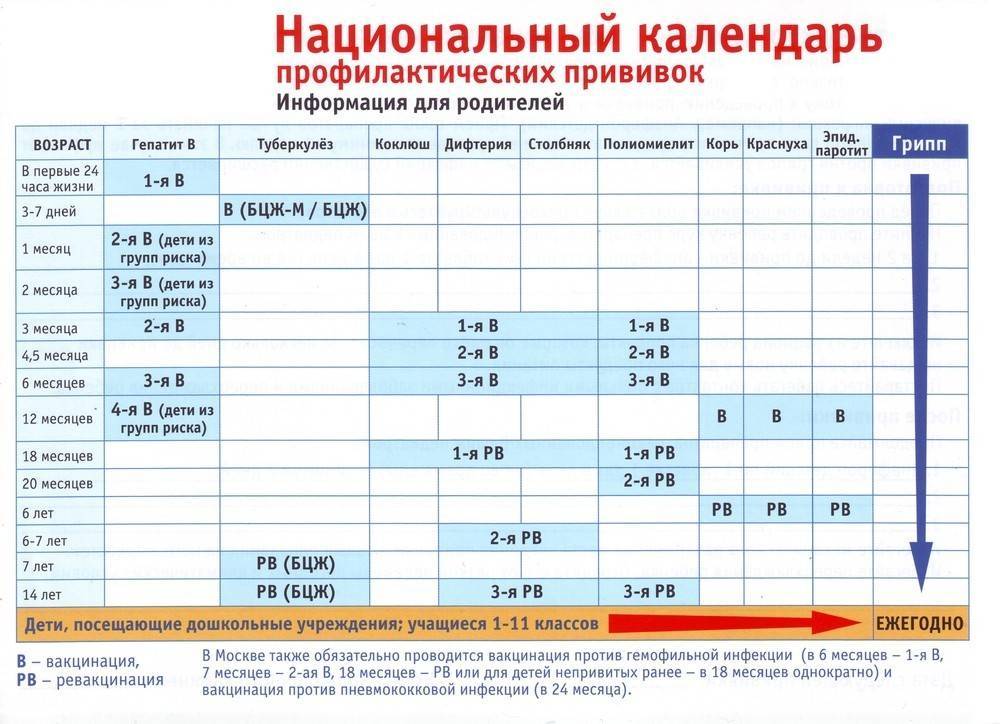
Есть ли у вашего ребёнка тяжелые аллергии?
Для ребёнка, у которого тяжёлая аллергия на компонент вакцины, её введение может быть противопоказано. Под тяжёлыми аллергиями подразумеваются те, которые могут привести к угрожающим жизни состояниям. Более лёгкие аллергии не являются проблемой. На самом деле, вы можете не знать, на какие компоненты каких вакцин у вашего ребёнка есть аллергия. Поэтому вам необходимо сообщить обо всех аллергических реакциях, о которых вам известно. А врач или медицинская сестра смогут сопоставить их с ингредиентами конкретных вакцин. Тяжёлые аллергические реакции на вакцины крайне редки (порядка 1 случая на миллион введённых доз), и медицинский персонал специально обучен тому, как им противостоять в случае возникновения. Среди аллергий, о которых вы можете знать: яйца, желатин, некоторые антибиотики и дрожжи, которые имеют отношение к определенным вакцинам, а также латекс, содержащийся в материале шприца или пробке флакона с вакциной.
Имеются ли у вашего ребёнка проблемы с иммунной системой?
Ребёнку с подавленным иммунитетом может быть противопоказано введение определенных вакцин (живых). Подавление иммунитета зачастую вызывается такими заболеваниями как СПИД, лейкемия, рак или медицинскими процедурами – лечение стероидами, химиотерапия.
Правило 8. Задавайте врачу вопросы.
В поликлинике обязательно поинтересуйтесь у врача, каким препаратом будет проведена вакцинация, какие у него есть побочные эффекты и осложнения. Помните, что знаком – значит, вооружен.
В прививочном кабинете проверьте, достала ли медсестра вакцину из холодильника, спросите, соблюдены ли правила ее хранения и транспортировки, вы имеете право попросить почитать инструкцию на препарат. Вы должны своими глазами увидеть и своими руками почувствовать холодную ампулу!
После прививки
Правило 9. После прививки не уходите сразу домой.
Сразу после прививки теоретически домой уходить нельзя, и доктор вас предупредит, чтоб посидели в коридоре минут 30.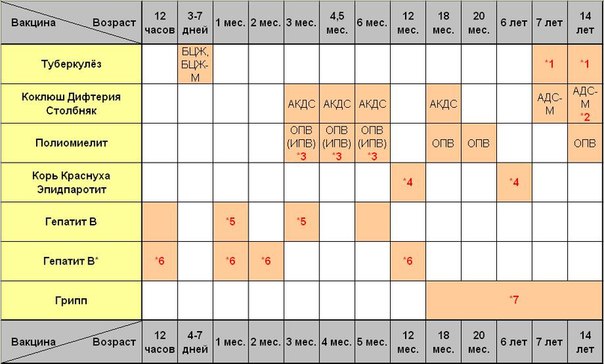 Это правильно (не уходить), но лучше все-таки часок погулять на свежем воздухе рядом с поликлиникой. Внимательно следите за малышом, при любых признаках нестандартного поведения немедленно обратитесь к врачу.
Это правильно (не уходить), но лучше все-таки часок погулять на свежем воздухе рядом с поликлиникой. Внимательно следите за малышом, при любых признаках нестандартного поведения немедленно обратитесь к врачу.
Наблюдение за ребенком после прививки
.
После прививки ваш ребенок нуждается в большей любви и внимании. Многие прививки, которые защищают детей от серьезных болезней, также могут вызвать временный дискомфорт. Вот ответы на вопросы, которые задают родители по поводу беспокойства, жара или боли, иногда появляющихся у детей после прививок.
Мой ребенок стал беспокойным, после того как ему сделали прививку. Что мне делать?
После прививки ребенок может начать нервничать из-за боли или жара. Следуйте указаниям вашего врача по поводу приема жаропонижающих или обезболивающих препаратов. Не давайте аспирин. Если ребенок не успокаивается более суток, позвоните своему врачу или в отделение скорой помощи ближайшей больницы.
У моего ребенка опухла рука или нога, она горячая и красная.
 Что мне делать?
Что мне делать?
Чтобы облегчить состояние ребенка, вы можете сделать следующее. При необходимости приложите к больному месту чистую, прохладную, влажную ткань.
Если краснота или болезненность будут усиливаться по прошествии суток, позвоните своему врачу или в отделение скорой помощи ближайшей больницы.
Следуйте указаниям вашего врача по поводу приема жаропонижающих или обезболивающих препаратов. Не давайте аспирин.
Я думаю, что у моего ребенка жар. Что мне делать?
Измерьте температуру ребенка, чтобы узнать, действительно ли это жар. Простой способ сделать это – измерить температуру под мышкой с помощью электронного термометра (либо воспользоваться тем способом, который вам порекомендовали ваш врач или медсестра).
Вот что вы можете сделать, чтобы помочь сбить температуру.
- Давайте ребенку обильное питье.
- Одевайте ребенка легко. Не накрывайте и не кутайте его.
- Обтирайте ребенка губкой в неглубокой ванне с чуть теплой (не холодной) водой.

- Дайте жаропонижающее или обезболивающее лекарство – в зависимости от веса ребенка, в соответствии с указаниями врача. Не давайте аспирин.
Вновь проверьте температуру ребенка через 1 час. При необходимости продолжайте давать лекарства 1-3 дня в соответствии с указаниями, данными ниже (если ничего не указано, следуйте дозировке, указанной на упаковке препарата).
Что делать, если у ребенка понос?
Желудочно-кишечный тракт ребенка является очень чувствительным и неустойчивым, поэтому прививка способна вызвать расстройства пищеварения. Это связано с двумя причинами.
- Прививка содержит микробы, которые способны оказать воздействие на слизистую кишки. Если перед инъекцией ребенок имел любые проблемы с пищеварением (например, вздутие живота, колики или запор), то кишечник ослаблен, и прививка вполне может спровоцировать понос.
- Родители накормили ребенка слишком обильно, против его желания или продуктами, которые вызвали расстройство пищеварения.

Если понос удается прекратить приемом биопрепаратов (линекс, бифиформ, энтерол и др.), то беспокоиться не стоит. Если же цвет кала стал зеленым, или появилась примесь крови, или понос не удается остановить в течение суток – необходимо обратиться к врачу.
Если у ребенка возникла рвота, что делать?
Рвота после прививки может быть только однократно в течение дня. Если рвота развилась у ребенка спустя несколько дней после прививки, необходимо обратиться к врачу, так как в этом случае она может быть признаком совершенно иного заболевания, не связанного с вакцинацией.
Мой ребенок выглядит очень больным. Мне вызвать врача?
Если вы хоть немного обеспокоились тем, как выглядит или чувствует себя ваш ребенок, позвоните своему врачу или в отделение скорой помощи ближайшей больницы.
Итак, при возникновении следующих симптомов после прививки лучше не полагаться на самолечение: если ребенок беспокоен более одних суток с момента прививки, если краснота или болезненность на месте укола будут усиливаться по прошествии суток, если долго не спадает температура, если цвет кала стал зеленым, или появилась примесь крови, или понос не удается остановить в течение суток, если у ребенка развилась рвота спустя несколько дней после прививки. В этих случаях позвоните своему врачу или в отделение скорой помощи ближайшей больницы.
В этих случаях позвоните своему врачу или в отделение скорой помощи ближайшей больницы.
Материалы раздела подготовлены на основе информации сайта доктора Комаровского — http://www.komarovskiy.net/
Обязательная вакцинация: когда, как и зачем
В последнее время в Беларуси, как и в других странах, не прекращаются дискуссии на тему обязательной вакцинации, поэтому у родителей возникает множество вопросов, касающихся прививок.
Представляем информацию о прививках, входящих в Национальный календарь обязательной вакцинации.
Вирусный гепатит В (ВГВ)
Это заболевание, которое поражает печень. И если в младенчестве возникает острый вирусный гепатит В, то практически в 90% случаев он переходит в хроническую форму, создавая в дальнейшем риск развития цирроза и рака печени. В этих случаях, к сожалению, даже пересадка печени не всегда помогает. Лечение гепатита В длится долго и не всегда является эффективным. Иногда развивается молниеносная форма, быстро приводящая к смерти.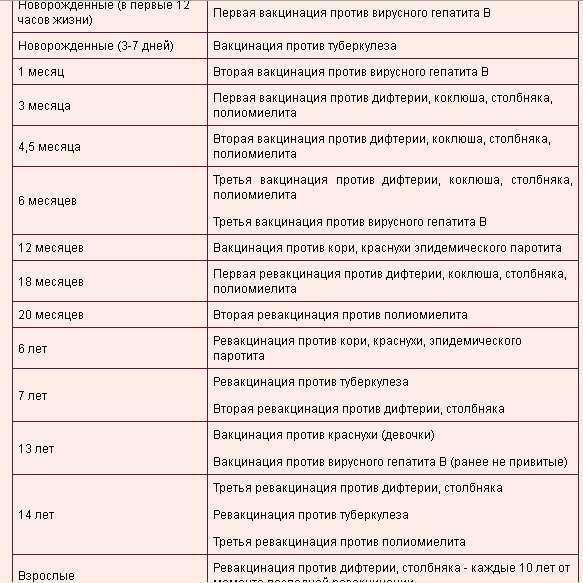
Современные вакцины против ВГВ содержат не целый вирус, а только его отдельный компонент, который при введении в организм не может вызвать заболевание, но обеспечивает выработку защиты. Кроме этого, в состав вакцины входят незначительные количества веществ, которые усиливают иммунный ответ организма и способствуют сохранению качества вакцины.
Схема вакцинации (курс из трех прививок, формирующий базовый иммунитет): первые 12 часов – 1 месяц – 5-6 месяц (в зависимости от индивидуального графика). Именно такая схема вакцинации обеспечивает ребенку защиту на 10. 20 и более лет. Ревакцинация (то есть поддерживающая прививка) не проводится. Переносится эта прививка достаточно хорошо. Примерно у 5-7 деток из 100 привитых может наблюдаться незначительное повышение уровня билирубина. Это состояние проходит самостоятельно, без какого-либо лечения. У 1-2 деток из 100 привитых могут возникать местные проявления в виде уплотнения в месте введения вакцины.
Туберкулез
Туберкулез – это хроническая бактериальная инфекция, которая занимает одно из первых мест в мире по показателям заболеваемости и смертности.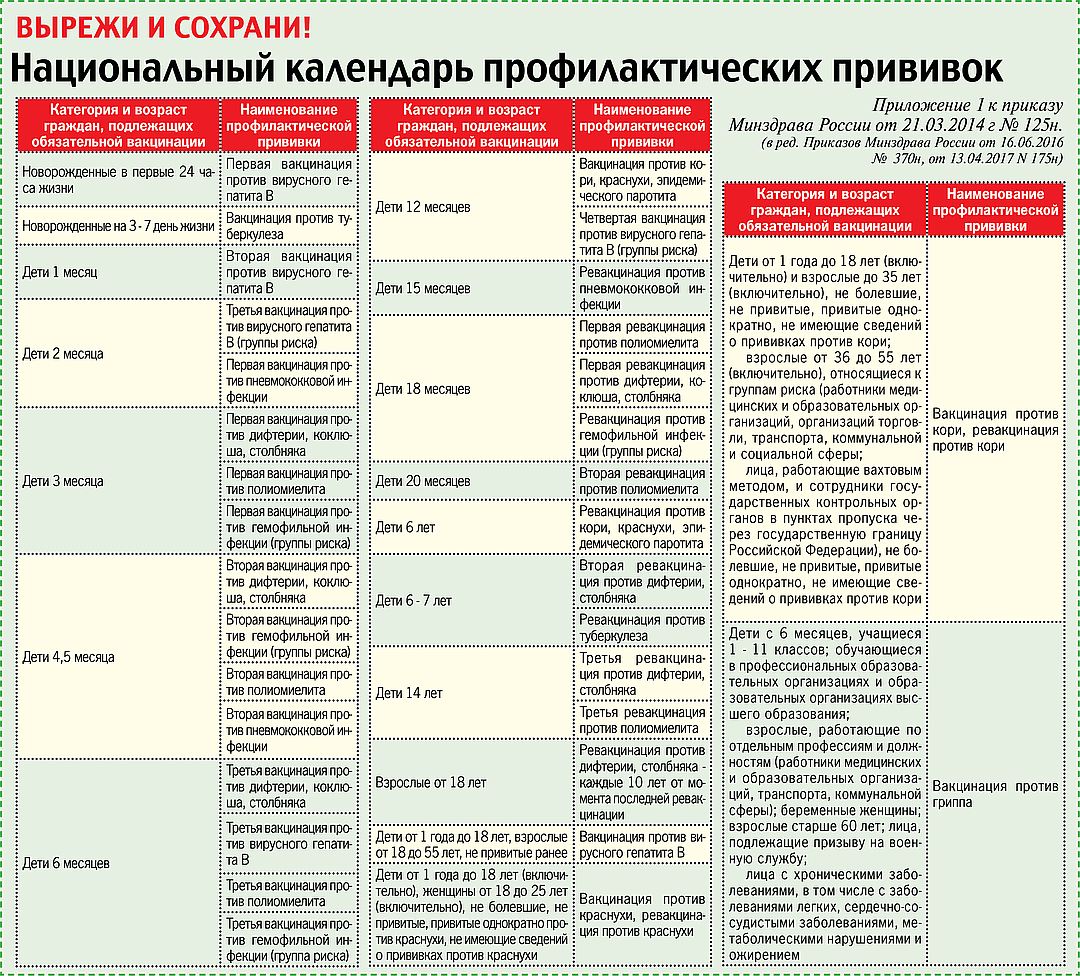 Заражение происходит воздушно-капельным путем от больных, которые выделяют палочку туберкулеза с мокротой при чихании, кашле, разговоре. Возбудитель туберкулеза способен поразить многие органы и системы организма: легкие, мозг, почки, кости, глаза, кожу, лимфатическую систему. Наиболее тяжелые формы туберкулеза возникают у новорожденных детей.
Заражение происходит воздушно-капельным путем от больных, которые выделяют палочку туберкулеза с мокротой при чихании, кашле, разговоре. Возбудитель туберкулеза способен поразить многие органы и системы организма: легкие, мозг, почки, кости, глаза, кожу, лимфатическую систему. Наиболее тяжелые формы туберкулеза возникают у новорожденных детей.
Вакцинация против туберкулеза проводится однократно в период с 3 по 5 сутки жизни ребенка. После введения вакцины в период до одного года может длиться поствакцинальный процесс, за развитием которого наблюдают врачи-педиатры. По окончанию этого процесса у деток в месте введения вакцины формируется маленький незаметный рубчик в размере 0,5-1 см.
Какой цели мы добиваемся с помощью данной вакцины?
Вакцины против туберкулеза защищают от наиболее тяжелых форм заболевания (таких как поражение головного мозга, костей и т. д.). И нужно отметить, что эффект есть, эти тяжелые случаи у нас не регистрируются. Однако, если мы откажемся от вакцинации, они появятся вновь.
В последующем один раз в год ребенку будет проводиться туберкулиновая проба (реакция Манту), которая не является прививкой (не формирует защиты). Проба Манту – это диагностический тест, по результатам которого можно судить о возможном «столкновении» организма с возбудителем туберкулеза. В 7 лет, если эта реакция отрицательная, необходима ревакцинация. То же самое касается и 14 лет: если реакция Манту отрицательная и ребенок относится к группе риска (например, дети из неблагополучных семей), то проводится еще одна ревакцинация.
Как переносится прививка?
Через 4-6 недель после проведения прививки в месте инъекции появляется пятно. Затем инфильтрат (участок ткани, увеличенный в объеме и повышенной плотности) диаметром не более 5-10 мм. В дальнейшем там образуется пузырек-гнойничок (его размер не превышает 10 мм) с прозрачным, а затем мутным содержимым, потом – корочка. Через 5-6 месяцев у большинства детей остается нежный поверхностный рубчик, наличие которого свидетельствует о сформировавшейся защите от туберкулеза.
Место введения вакцины нельзя обрабатывать йодом и другими дезинфицирующими растворами, а также накладывать повязку. Нельзя выдавливать содержимое пузырька. Если пузырек вскрылся, его не следует обрабатывать чем-либо – вскоре он подсохнет и превратиться в корочку. Ее нельзя удалять или тереть мочалкой при купании.
Прививка против туберкулеза – эта та прививка, на которую развивается наибольшее количество осложнений. Но сразу хочется разъяснить: на 15 тысяч прививок против туберкулеза развивается 10 осложнений. В чем они проявляются? В основном это увеличение лимфатических узлов с той стороны, где была сделана прививка. Как правило, проблема решается при помощи консервативного лечения и детки выходят из этого состояния без всяких последствий.
Часто задаваемый вопрос: почему в других странах прививают только отдельных деток, а мы прививаем всех? Безусловно, это зависит от уровня заболеваемости. Вакцинация защищает в основном детей. И уровень заболеваемости туберкулезом среди них низкий. Для туберкулеза вакцинация – это только одно из профилактических мероприятий. Ряд других факторов оказывает серьезное влияние на уровень заболеваемости. Когда мы с помощью комплекса мероприятий обеспечим в нашей стране такой уровень заболеваемости, который существует, например, в странах Западной Европы, мы тоже будем вакцинировать только отдельных деток (относящихся к группе риска). Но на сегодняшний день ситуация в стране диктует другие требования.
Для туберкулеза вакцинация – это только одно из профилактических мероприятий. Ряд других факторов оказывает серьезное влияние на уровень заболеваемости. Когда мы с помощью комплекса мероприятий обеспечим в нашей стране такой уровень заболеваемости, который существует, например, в странах Западной Европы, мы тоже будем вакцинировать только отдельных деток (относящихся к группе риска). Но на сегодняшний день ситуация в стране диктует другие требования.
Коклюш, дифтерия, столбняк (КДС)
Возбудитель коклюша вызывает длительнотекущее тяжелое инфекционное заболевание, которое характеризуется приступами судорожного кашля на фоне общей интоксикации организма (повышение температуры тела, нарушение сна и т.д.). Коклюш наиболее опасен осложнениями: носовыми кровотечениям, судорогами, воспалением легких, повреждением мозга и др. Отмечаются смертельные исходы заболевания, особенно у непривитых детей в возрасте до 6 месяцев. Ежегодно в мире от осложнений, вызванных коклюшем, умирает около 350 тыс. человек. Возбудитель коклюша легко передается от больного человека к здоровому воздушно-капельным путем при кашле и разговоре.
человек. Возбудитель коклюша легко передается от больного человека к здоровому воздушно-капельным путем при кашле и разговоре.
Возбудитель дифтерии при попадании в организм вырабатывает токсин, который поражает сердечно-сосудистую и нервную системы. При заболевании дифтерией поднимается температура тела, возникают боли при глотании, миндалины покрываются сероватой пленкой, развивается отек слизистой и сужение дыхательных путей. Больной может умереть от удушья. ИЗ 100 непривитых при заболевании дифтерией 10 человек умирают. В случаи выздоровления часто имеют место тяжелые осложнения со стороны сердечно-сосудистой системы, почек и надпочечников. Заразиться дифтерией достаточно просто: возбудитель передается от человеку к человеку воздушно-капельным путем (т.е. при разговоре, чихании, кашле и т.д.). Причем источником инфекции может быть здоровый человек бактерионоситель).
Возбудитель столбняка при попадании в организм вырабатывает токсин, который обладает нервно-паралитическим действием. Практически в 100% случаев заболевание столбняком у непривитых лиц заканчивается смертельным исходом. Возбудитель столбняка распространен повсеместно не только в природе, но и на предметах домашней обстановки, обихода, одежде и т. д. заболевание развивается при попадании возбудителя столбняка на поврежденные кожные покровы (в раны, ссадины, царапины, порезы и т. д.).
Практически в 100% случаев заболевание столбняком у непривитых лиц заканчивается смертельным исходом. Возбудитель столбняка распространен повсеместно не только в природе, но и на предметах домашней обстановки, обихода, одежде и т. д. заболевание развивается при попадании возбудителя столбняка на поврежденные кожные покровы (в раны, ссадины, царапины, порезы и т. д.).
Против этих трех инфекционных заболеваний используются комбинированные вакцины (в состав вакцины входят компоненты против 3-6 инфекций одновременно).
Схема вакцинации: 3, 4 и 5 месяцев. В 18 месяцев проводится ревакцинация. В дальнейшем против коклюша прививки не проводятся. А вот ревакцинация против дифтерии и столбняка проводится далее в 6, 11, (только против дифтерии) и 16 лет. Далее – взрослому каждые 10 лет, потому что этот иммунитет нужно поддерживать.
Как переносится эта прививка?
На прививку регистрируются такие реакции, как повышение температуры, а также местные реакции, то есть уплотнение, покраснение и болезненность в месте введения вакцины.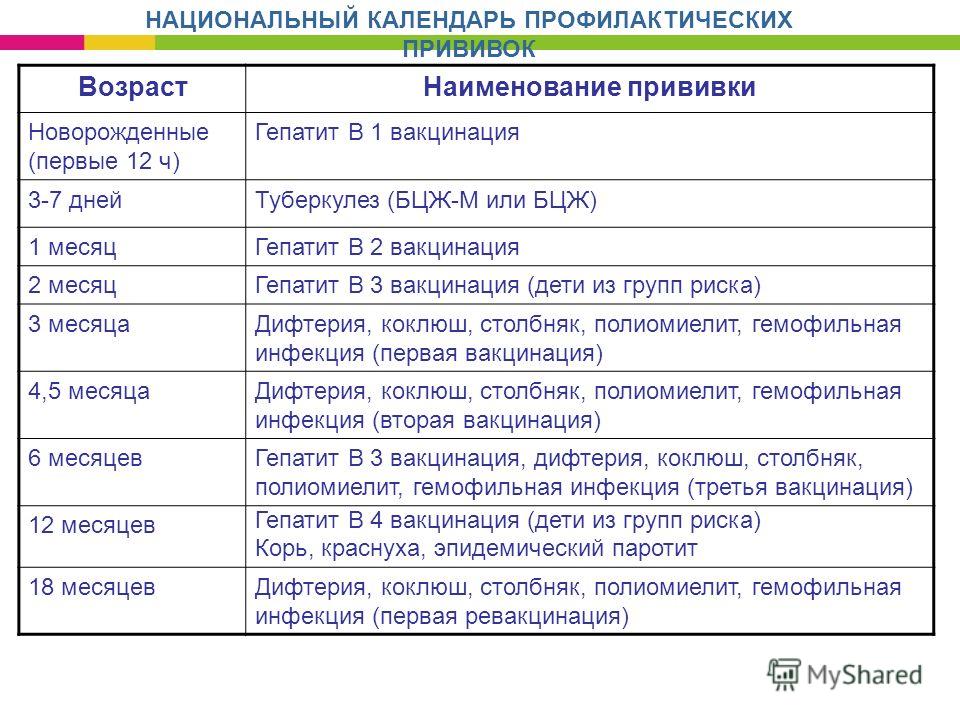 Ребенок может быть плаксивым, перевозбужденным или, наоборот, сонливым, вялым, плохо кушать. Как правило, эти реакции не превышают 3 дней и проходят самостоятельно. Повышение температуры, как правило, связано с коклюшным компонентом вакцины.
Ребенок может быть плаксивым, перевозбужденным или, наоборот, сонливым, вялым, плохо кушать. Как правило, эти реакции не превышают 3 дней и проходят самостоятельно. Повышение температуры, как правило, связано с коклюшным компонентом вакцины.
Полиомиелит
Данное заболевание вызывается вирусом, который поражает нервную систему и заканчивается развитием стойких парезов (нарушение движений) и параличей (отсутствием движений) или смертельным исходом. Источником инфекции является больной человек или бессимптомный носитель. Заражение происходит при контакте с источником инфекции через загрязненные вирусом руки, предметы обихода, воду, пищевые продукты и т. д. С 2002 года Республика Беларусь, как и остальные страны Европейского региона, признана свободной от дикого вируса полиомиелита. Однако в ряде стран Азии и Африки в настоящее время продолжают регистрироваться случаи полиомиелита, вызванного диким вирусом, и вероятность его заноса в наш регион существует. Поэтому необходимо проводить прививки и создавать невосприимчивость к данной инфекции у каждого ребенка.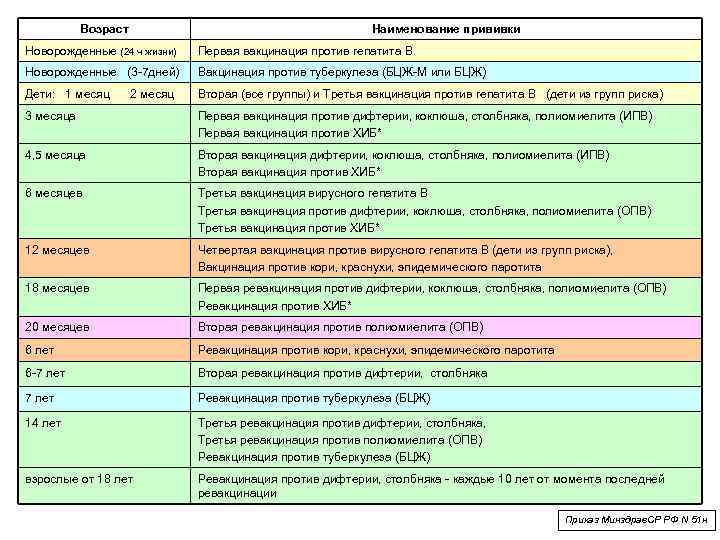 С вязи с этим количество проводимых прививок постепенно уменьшается. Если раньше их было 9, то сейчас – 6.
С вязи с этим количество проводимых прививок постепенно уменьшается. Если раньше их было 9, то сейчас – 6.
Схема вакцинации: она совпадает с вакцинацией против коклюша, дифтерии, столбняка. То есть это 3, 4, 5 месяцев. Поддерживающие прививки – 18 месяцев, 24 месяца, 7 лет.
Для проведения этой прививки применяется два вида вакцин: живая и инактивированная. Для вакцинации используется комбинированная схема, то есть начинают формировать защиту с помощью инактивированной вакцины, которая не содержит живого вируса. Затем прививки продолжаются уже с использованием живой полиомиелитной вакцины, обеспечивающей дополнительную защиту с помощью формирования местного иммунитета в кишечнике. Инактивированная вакцина вводится в виде укола, живая – в виде капель. Именно такая комбинированная схема дает наиболее высокий эффект.
Как переносится прививка?
Это одна из самых хорошо переносимых прививок нашего календаря. Редко (примерно у 3-5 деток из 100) возникают местные реакции. Общих реакций на полиомиелитную вакцину, как правило, не бывает.
Общих реакций на полиомиелитную вакцину, как правило, не бывает.
Корь, эпидемический паротит, краснуха.
Корь – это высокозаразное инфекционное заболевание. Вирус кори передается от больного к здоровому человеку при разговоре, кашле, чихании и т.д. Практически в 100% случаев не защищенные против кори лица восприимчивы к данной инфекции. Заболевание начинается с повышения температуры тела до 39-40, появление насморка, кашля, чихания, светобоязни. На слизистой рта и коже появляется сыпь. У детей первого года жизни корь протекает особенно тяжело: поражаются внутренние органы (печень, селезенка). После перенесенного заболевания нередко возникают осложнения: поражение мозга (энцефалит, менингоэнцефалит), легких (пневмония), органов слуха и т.д.
Вирус, вызывающий заболевание эпидемическим паротитом, при попадании в организм здорового незащищенного человека начинает активно размножаться в слюнных железах. При этом происходит увеличение одной или несколько слюнных желез, повышается температура тела, развивается общее недомогание, боль в мышцах, потеря аппетита.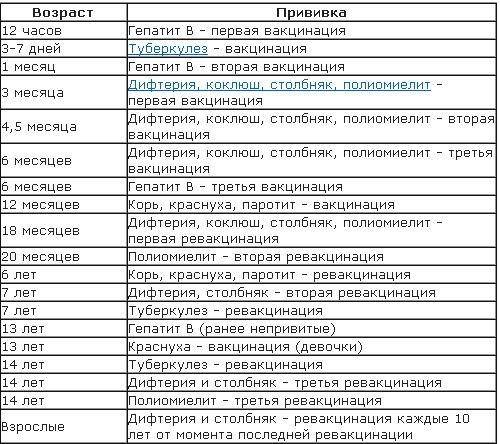 Вирус может попасть от больного к здоровому не только воздушно-капельным путем, но и через загрязненные предметы (например, игрушки). Смертельных исходов при эпидемическом паротите не бывает. Однако заболевание опасно своими осложнениями:
Вирус может попасть от больного к здоровому не только воздушно-капельным путем, но и через загрязненные предметы (например, игрушки). Смертельных исходов при эпидемическом паротите не бывает. Однако заболевание опасно своими осложнениями:
- у мальчиков не редко поражаются половые железы, что в дальнейшем может быть причиной бесплодия,
- зачастую воспаляется поджелудочная железа и развивается панкреатит,
- поражается головной мозг, что приводит к развитию серозного менингита,
- воспаляются крупные суставы (артриты) и т. д.
- поражение органов слуха вследствие перенесенного эпидемического паротита приводит к полной глухоте.
Краснуха – это вирусная инфекция, которая передается от больного человека воздушно-капельным путем (при разговоре, кашле, длительном пребывании в одном помещении). У детей краснуха протекает, как правило, легко: незначительно повышается температура тела, появляется сыпь на коже, увеличиваются лимфатические узлы. У взрослых заболевание протекает тяжелее: нередки поражения суставов и внутренних органов. После перенесенной краснухи отмечаются осложнения в виде поражения головного мозга, почек и т.д. Заражение краснухой беременной женщины может заканчиваться трагично: мертворождением, преждевременными родами или рождением ребенка с уродствами. Такие дети остаются инвалидами на всю жизнь. У них имеются сочетание тяжелых врожденных пороков со стороны сердца, органов зрения (слепота), слуха (глухота), центральной нервной системы, печени и т.д., наблюдается умственное недоразвитие, расстройство речи, нарушение координации движения.
У взрослых заболевание протекает тяжелее: нередки поражения суставов и внутренних органов. После перенесенной краснухи отмечаются осложнения в виде поражения головного мозга, почек и т.д. Заражение краснухой беременной женщины может заканчиваться трагично: мертворождением, преждевременными родами или рождением ребенка с уродствами. Такие дети остаются инвалидами на всю жизнь. У них имеются сочетание тяжелых врожденных пороков со стороны сердца, органов зрения (слепота), слуха (глухота), центральной нервной системы, печени и т.д., наблюдается умственное недоразвитие, расстройство речи, нарушение координации движения.
Схема вакцинации: прививка делается однократно в 12 месяцев. В одном уколе вводится сразу три компонента. Для поддержания иммунитета в 6 лет проводится еще одна прививка. И формируется длительный иммунитет на 20 и более лет (по некоторым данным – пожизненный)
Вакцина против кори, эпидемического паротита, краснухи редко вызывает реакцию и поэтому считаются малореактогенными (после их введения появляется незначительное количество реакций). В первые сутки после иммунизации в месте введения вакцины могут появиться местные реакции в виде покраснения, болезненности ( у 2-6 из 100привитых). К концу первой недели после иммунизации (на 5-6 день) или через 10-11 дней после проведения прививки у 5-15 из 100 привитых возможно повышение температуры тела, незначительное недомогание. Все эти реакции являются закономерными и говорят о начале формирования защиты от инфекции. Редко могут отмечаться такие специфические поствакцинальные реакции, как кратковременная сыпь, незначительное увеличение затылочных или шейных лимфатических узлов и околоушных желез. Данные реакции исчезают самопроизвольно в течение нескольких дней, не требуя медикаментозного лечения и не нанося вреда организму.
В первые сутки после иммунизации в месте введения вакцины могут появиться местные реакции в виде покраснения, болезненности ( у 2-6 из 100привитых). К концу первой недели после иммунизации (на 5-6 день) или через 10-11 дней после проведения прививки у 5-15 из 100 привитых возможно повышение температуры тела, незначительное недомогание. Все эти реакции являются закономерными и говорят о начале формирования защиты от инфекции. Редко могут отмечаться такие специфические поствакцинальные реакции, как кратковременная сыпь, незначительное увеличение затылочных или шейных лимфатических узлов и околоушных желез. Данные реакции исчезают самопроизвольно в течение нескольких дней, не требуя медикаментозного лечения и не нанося вреда организму.
В любом случае при появлении у ребенка реакции либо других проявлений обязательно проинформируйте об этом своего педиатра, который оценит выраженность их проявления и при необходимости выдаст индивидуальные рекомендации.
Из всех существ на Земле особенно беззащитны наши дети. Суровый закон природы сталкивает их с первого вздоха с миллионами незаметных, но крайне опасных врагов. Это вирусы, бактерии и другие микроорганизмы. И борьба с ними, как известно истории человечества, выживали далеко не все! Так, до изобретения антибиотиков и профилактических прививок на Земле (а это мене 100 лет) детская, да и общая смертность от инфекций была выше в 10-20 раз! Чума, холера, корь и оспа унесла миллионы жизней, а сегодня, благодаря развитию профилактической медицины, некоторые из этих инфекций можно встретить только на страницах медицинских учебников. И заслугу прививок в этом отрицать глупо и невозможно. У вашего малыша есть шанс справиться с инфекцией без прививок, но стоит ли испытывать судьбу?
Суровый закон природы сталкивает их с первого вздоха с миллионами незаметных, но крайне опасных врагов. Это вирусы, бактерии и другие микроорганизмы. И борьба с ними, как известно истории человечества, выживали далеко не все! Так, до изобретения антибиотиков и профилактических прививок на Земле (а это мене 100 лет) детская, да и общая смертность от инфекций была выше в 10-20 раз! Чума, холера, корь и оспа унесла миллионы жизней, а сегодня, благодаря развитию профилактической медицины, некоторые из этих инфекций можно встретить только на страницах медицинских учебников. И заслугу прививок в этом отрицать глупо и невозможно. У вашего малыша есть шанс справиться с инфекцией без прививок, но стоит ли испытывать судьбу?
Прививка от Полиомиелита. Когда и как проводится вакцинация.
Полиомиелит представляет собой вирусную желудочно-кишечную инфекцию. Одно из опасных осложнений болезни – параличи.
Вакцинация против полиомиелита призвана не допустить развития болезни. Существует два типа вакцины, которые применяются в медицинских клиниках:
Существует два типа вакцины, которые применяются в медицинских клиниках:
- инактивированная вакцина, которая содержит убитый вирус. Вводится внутримышечно;
- оральная вакцина, в состав которой входит ослабленный живой полиовирус. Вводят через рот в форме ярких капелек.
Всемирной организацией здравоохранения проводится программа, направленная на искоренение болезни. Россия входит в состав стран-участников. Однако, соседство с другими государствами, где прививка от болезни не является обязательной, не позволяют предотвратить риск заболевания без вакцины.
Схема вакцинации
Прививка против полиомиелита входит в перечень обязательных согласно Национальному календарю прививок. Первые три раза используется инактивированная вакцина, с четвертого по шестой – оральная.
Если у малыша нет проблем по неврологии, вакцинация проводится в возрасте 3; 4,5; 6; 18 и 20 месяцев, а потом в возрасте 14 лет.
Поводом отложить вакцинацию являются нарушения иммунитета.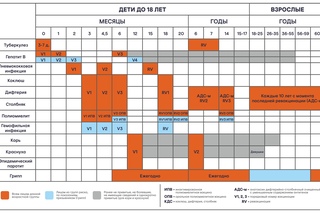 В этом случае ребенок обязан избегать любых контактов с теми, кто получил живой вирус. Соблюдать карантин следует как минимум две недели.
В этом случае ребенок обязан избегать любых контактов с теми, кто получил живой вирус. Соблюдать карантин следует как минимум две недели.
Как переносится прививка
Вакцина практически не имеет побочных эффектов. При введении инъекции внутримышечно на месте укола может образоваться небольшое покраснение. Как правило, оно проходит в течение нескольких часов.
В день прививки ребенок может немного капризничать, допустимо незначительное повышение температуры тела.
При первых беспокойствах следует незамедлительно обратиться за консультацией к специалисту.
Где пройти вакцинацию
Поставить прививку от полиомиелита или получить дозу оральной вакцины можно в медицинском центре «Здоровье нации» в Липецке.
Процедура включает осмотр врача, проведение консультации и посещение прививочного кабинета.
Чтобы выбрать удобное время для записи, а также задать вопросы специалистам, достаточно заполнить форму на сайте или позвонить по телефону.
Вы можете сделать прививку от полиомиелита в медицинском центре Здоровье Нации.
Запишитесь на вакцинацию в удобное для Вас время
Записаться
Чтобы пройти вакцинацию, необходимо проконсультироваться с терапевтом или педиатром. Прием необходим, чтобы исключить возможные противопоказания и избежать аллергических реакций после введения вакцины.
20 вопросов о вакцинации, которые родители задают чаще всего
В России существует национальный календарь прививок — это принятая схема вакцинации для защиты от наиболее распространенных инфекций, которые могут крайне тяжело протекать у маленьких детей. Нельзя сказать, что это жесткий документ — согласно законодательству, у родителей есть выбор: они могут прививать ребенка, а могут отказаться от прививок, взяв на себя ответственность за это.
Прививки, которые входят в национальный календарь: БЦЖ (вакцина против туберкулеза), вакцина против гепатита В, пневмококка, полиомиелита, кори, паротита и краснухи, АКДС (вакцина против дифтерии, столбняка и коклюша), а также ежегодная прививка против гриппа. Прививка от гемофильной инфекции включена в нацкалендарь для групп риска, но это не значит, что она не нужна любому здоровому ребенку, просто государство готово оплатить ее только детям с проблемами со здоровьем.
Прививка от гемофильной инфекции включена в нацкалендарь для групп риска, но это не значит, что она не нужна любому здоровому ребенку, просто государство готово оплатить ее только детям с проблемами со здоровьем.
Дополнительные прививки, которые можно сделать по желанию (и за отдельную плату) — это, например, вакцины против ветряной оспы, ротавирусной инфекции, клещевого энцефалита, гепатита А, менингококковой инфекции.
Любая прививка не приводит к абсолютной защите от инфекции. Привитый ребенок может перенести инфекцию в более легкой форме, без осложнений. Никто не гарантирует, что он никогда не заболеет, все зависит от эффективности работы иммунной системы: у одних антитела сохраняются очень долго, а у других быстро теряются. Тем не менее большинство вакцин способствуют формированию иммунных клеток памяти, которые приводят к адекватному ответу организма. При повторной встрече с микробом они начинают быстро работать и хорошо отвечать на контакт.
К сожалению, никто не застрахован от тяжелого течения болезни с осложнением. Пожалуйста, взвесьте: вам нужно серьезное течение с осложнением или теоретическая возможность легкого течения? Получается, что это личностный выбор каждого родителя: «Только я могу решить, что хочу делать ребенку, а что нет». Это неправильно, и в некоторых государствах сейчас принята другая тактика: ребенку рекомендовано в определенный срок явиться на вакцинацию — медсестра измеряет ему температуру и делает прививку (врач даже не касается этого вопроса).
Пожалуйста, взвесьте: вам нужно серьезное течение с осложнением или теоретическая возможность легкого течения? Получается, что это личностный выбор каждого родителя: «Только я могу решить, что хочу делать ребенку, а что нет». Это неправильно, и в некоторых государствах сейчас принята другая тактика: ребенку рекомендовано в определенный срок явиться на вакцинацию — медсестра измеряет ему температуру и делает прививку (врач даже не касается этого вопроса).
У нас несколько другой подход: чтобы допустить к вакцинации, иногда необходимо просмотреть определенное количество анализов (так как некоторые родители проводят лабораторное обследование без рекомендаций врача), осмотреть ребенка, померить температуру и только потом допускать к вакцинации.
Я делюсь своими знаниями о прививках, мировым опытом, научными данными, плюсами вакцинации, а право принимать решение оставляю за ними. Заставлять их и говорить: «Вы делаете неправильно», — это не дает никакого эффекта. В принципе, большинство родителей все же приходят на вакцинацию, даже те, дети которых имеют серьезные проблемы со здоровьем.
До приема родителям следует изучить информацию о заболевании, от которого они планируют прививать ребенка, и выяснить, каковы могут быть последствия этой болезни: полистать картинки в интернете, послушать, к примеру, как кашляет не привитый от коклюша пациент. Взвесить все: нужны ли такие последствия или все-таки планово проводить профилактику этих инфекций.
Нет. Не существует документов, регламентирующих сдачу анализов перед каждой прививкой. Сдавать анализы необходимо только определенным группам пациентов, у которых есть проблемы со стороны крови. Главное перед вакцинацией — соматическое здоровье в течение двух недель как минимум, отсутствие заболевших в окружении и желание привиться. Если пациент болел какой-то тяжелой инфекцией: бронхитом, пневмонией, долго лечился антибиотиками, то интервал должен составлять месяц. А после банальной ОРВИ не затяжного характера (даже с температурой 39) достаточно двух недель.
Перед прививкой нет необходимости в назначении антигистаминных препаратов. В некотором случае они назначаются для аллергиков, но и этот опыт сохраняется пока только у нас. Врачи в большинстве европейских стран даже при вакцинации аллергиков не назначают плановый прием антигистаминных препаратов.
В некотором случае они назначаются для аллергиков, но и этот опыт сохраняется пока только у нас. Врачи в большинстве европейских стран даже при вакцинации аллергиков не назначают плановый прием антигистаминных препаратов.
К нормальным вакцинальным реакциям, которые могут возникнуть примерно у 10 % детей, относятся: высокая температура, местные проявления (краснота, припухлость, отечность). Например, после прививки от кори, краснухи, паротита с четвертого по 15-й день может появиться коре- и краснушеподобная сыпь, увеличение слюнных желез, легкие катаральные проявления — кашель, першение в горле, небольшой насморк. Все это кратковременно, чаще всего не сопровождается интоксикацией, ребенок достаточно хорошо себя чувствует, температура снижается после жаропонижающих.
Отек больше восьми сантиметров на месте вакцинации считается патологической аллергической местной реакцией на вакцину: у шестимесячного ребенка он занимает почти все бедро. Бывают общие аллергические реакции в виде сыпи, но это возникает крайне редко и тоже требует определенных действий со стороны врачей: не всегда родители вспоминают, что ребенок в день прививки ходил на день рождения и там впервые попробовал, например, соломку в шоколаде, покрытую кунжутом.
Любые состояния, которые возникают после прививки, требуют расследования: доктор должен определить, связано это с введенной вакциной или нет. И в большинстве случаев это не связано. Наш опыт показывает, что дети, которые едут к нам с диагнозом патологической реакции на прививку, в 90 % случаев имеют какие-то заболевания: ОРВИ, острые кишечные инфекции, впервые выявленные проблемы со стороны почек.
Если реакции после введения вакцины нет, это не значит, что антитела не вырабатываются: все зависит от особенностей иммунной системы человека. Кто-то даже на мягкие вакцины реагирует повышением температуры, а кто-то бессимптомно переносит любую вакцинацию.
Самая тяжелая реакция на прививку во всем мире — анафилактический шок, это острая аллергическая реакция на компоненты вакцины. Такая острая аллергическая реакция происходит в первые 30 минут после введения вакцины, максимально — в течение двух часов. Поэтому как минимум первые 30 минут любой привитый должен находиться в учреждении и сидеть рядом с кабинетом, где проводилась вакцинация. В каждом прививочном кабинете есть укладка для оказания первой помощи, в том числе при анафилактическом шоке.
В каждом прививочном кабинете есть укладка для оказания первой помощи, в том числе при анафилактическом шоке.
Анафилактический шок на вакцины — крайне редкая ситуация, один случай на 100 тысяч используемых доз. Он бывает не только от вакцин, провокатором может стать все что угодно: конфета, лекарства, клубника, сосиски, яйца — можно съесть выпечку, в которых содержится яйцо и «выдать» анафилактический шок. Мы от этого не застрахованы.
Аутизм, ДЦП, органические поражения центральной нервной системы не связаны с вакцинацией. У нас есть огромное количество пациентов с органическим поражением ЦНС и ДЦП, и они не привиты.
Доказано, что микродобавки, которые содержатся в вакцинах, не оказывают никакого воздействия на организм привитого. То, что ребенок получает при массовой вакцинации из дополнительных веществ, — малая толика того, что мы получаем в жизни. Если говорить о гидроксиде алюминия, то он содержится в воздухе в больших городах с фабриками и заводами: родители не думают, что каждый день, ведя на прогулку своего маленького ребенка, они вдыхают этот воздух. Или, например, в морской рыбе, которую мы с удовольствием едим, огромное количество ртути — в частности, в тунце, который очень распространен в европейских странах.
Или, например, в морской рыбе, которую мы с удовольствием едим, огромное количество ртути — в частности, в тунце, который очень распространен в европейских странах.
Сколько угодно. Они делаются на расстоянии два-три сантиметра друг от друга, в бедро или в плечо. Антигенная нагрузка несколько увеличивается, но она не так высока. В вакцине АКДС отечественного производства три тысячи антигенов. В современных многокомпонентных вакцинах (например, «Пентаксиме») — около 25–27. Это в разы меньше, чем в АКДС, которую ребенок в три месяца воспринимает совершенно адекватно.
Да, живую и «убитую» вакцины можно ставить в один день, только наблюдение в поствакцинальном периоде в таком случае будет длиннее: на инактивированные вакцины реакция может быть в первые три дня, на живые — с четвертого по 15-й день. Поэтому за температурой надо будет следить несколько дольше.
Единственное, нельзя ни с чем совмещать прививку БЦЖ, ее всегда делают отдельно.
У ВОЗ есть программа о переходе на полное использование инактивированных вакцин против полиомиелита. Живую вакцину хотят отменить, чтобы прекратить циркуляцию полиовируса вакцинного штамма, так как в живой вакцине содержится ослабленный полиовирус. Привитые этой вакциной в течение двух месяцев с фекалиями выделяют полиовирус и могут быть источником инфекции.
Живую вакцину хотят отменить, чтобы прекратить циркуляцию полиовируса вакцинного штамма, так как в живой вакцине содержится ослабленный полиовирус. Привитые этой вакциной в течение двух месяцев с фекалиями выделяют полиовирус и могут быть источником инфекции.
Реализация этой программы, по крайней мере, в России, пока довольно сложна: нам не хватает доз, чтобы прививать все население. Сейчас у нас действует схема сочетанного использования: две инактивированные вакцины, третья и последующие — живые. Первые два введения полностью защищают от паралитических форм полиомиелита и по нацкалендарю предоставляются бесплатно. Если родители хотят, то могут дальше прививать ребенка инактивированной вакциной, а не живой. Эффективность такой схемы высока.
Отечественная вакцина содержит цельноклеточный коклюшный компонент и считается вакциной, после которой с большей частотой возникает температура. «Пентаксим» же содержит бесклеточный коклюшный компонент, он более мягкий, помимо этого, защищает сразу от пяти инфекций.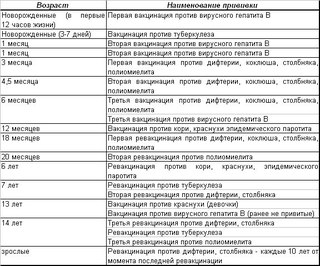 От шести инфекций защищает «Инфанрикс Гекса». В силу того, что у иностранных вакцин другой состав по коклюшному компоненту, у них несколько ниже эффективность. Если у АКДС это пять-семь лет эффективной защиты от коклюша, то, например, у «Инфанрикс Гекса» — четыре-шесть лет.
От шести инфекций защищает «Инфанрикс Гекса». В силу того, что у иностранных вакцин другой состав по коклюшному компоненту, у них несколько ниже эффективность. Если у АКДС это пять-семь лет эффективной защиты от коклюша, то, например, у «Инфанрикс Гекса» — четыре-шесть лет.
Нет, нельзя! Дело в том, что от разных инфекций нужно разное количество вакцинаций. Если мы говорим о профилактике коклюша, то для длительной защиты нужно четыре прививки. После первой через пару недель выработаются антитела, но они могут сохраняться недолго, поэтому требуется дополнительное введение. Что касается дифтерии и столбняка, то достаточно двух прививок с ревакцинацией через год — это дает хорошую защиту. Для длительной защиты от полиомиелита необходимо четыре прививки. Так что нельзя сказать, что после одного введения защита не будет выработана, но она будет кратковременной.
Никаких ограничений по последовательности введения вакцин нет (если у пациента нет противопоказаний): можно начинать с вакцины, которая наиболее актуальна на сегодняшний день.
Да, до сих пор 90 % детей, болеющих ветряной оспой, переносят ее довольно гладко. Но ветрянка опасна бактериальными осложнениями, которые могут возникнуть: сильный зуд приводит к расчесыванию, инфицированию, и такая ситуация может требовать назначения антибактериальной терапии.
Одним из серьезных осложнений ветряной оспы является ветряночный энцефалит. Наиболее часто он встречается у детей девяти-десяти лет, тех, кто не переболел в раннем детстве. Когда дети заканчивают детский сад, идут в школу, родители прекрасно понимают, что с возрастом возможность более тяжелого течения ветряной оспы возрастает, и решают вакцинировать детей.
К сожалению, пока вакцина от ветряной оспы не введена в нацкалендарь и не будет проводиться массовой вакцинации детей, мы будем видеть сезонные вспышки этой болезни.
В России привитость населения составляет более 95–98 %, но как только этот процент будет снижаться, мы можем увидеть вспышки любых заболеваний. Недавний пример — эпидемия кори в Европе и на Украине. Сейчас у нас ограниченные случаи заболевания, они не дают большого распространения, но тем не менее корью болеют взрослые и дети. Большая часть пациентов не имели прививок, а некоторые из них утеряли защиту.
Сейчас у нас ограниченные случаи заболевания, они не дают большого распространения, но тем не менее корью болеют взрослые и дети. Большая часть пациентов не имели прививок, а некоторые из них утеряли защиту.
В 90-х годах произошла последняя вспышка дифтерии: была перестройка, многие отказывались от вакцинации. В нашем институте были перепрофилированы многие отделения для борьбы с дифтерией. К сожалению, дети погибали. Те доктора, которые работали тогда, рассказывали: вечером пациент поступил, вводят сыворотку, а к утру приходишь — а его нет. После этого таких больших вспышек, слава богу, не было.
Обложка: Sherry Young — stock.adobe.com
Вакцинация и ревакцинация от полиомиелита детям
Благодаря массовой вакцинации в современном мире полиомиелит – заболевание редкое. Однако эта вирусная инфекция по-прежнему относится к крайне опасным, ведь, поражая спинной мозг, она может вызывать пожизненные параличи рук и ног. Случаи полиомиелита наблюдаются повсеместно, инфекция передается через загрязненные предметы и реже воздушно-капельным путём (например, при общении больных и здоровых детей).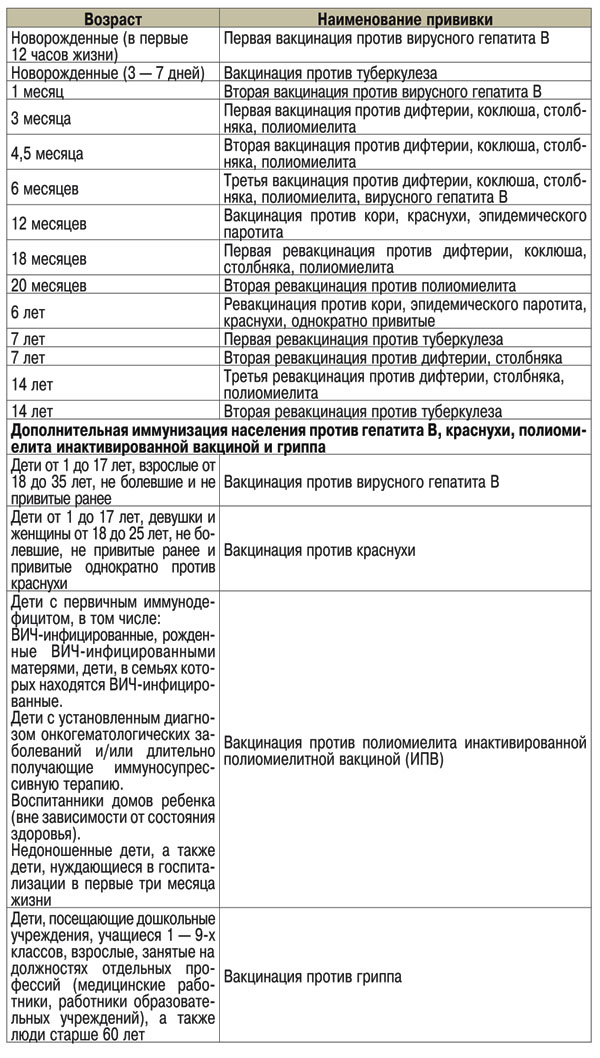
Заболевание начинается с повышения температуры, ребенок становится вялым и пассивным, жалуется на боль в суставах. Первые симптомы очень похожи на грипп, однако довольно быстро развиваются проблемы с кишечником – появляются боли в животе и диарея.
В настоящее время не существует лекарства от полиомиелита, поэтому защитить ребенка от опасного заболевания и его последствий может только вакцинация.
Прививки от полиомиелита
В нашей стране прививки от полиомиелита выполняются двумя типами вакцин: инактивированными или живыми. Инактивированная полиовакцина не содержит живых вирусов. Благодаря этому она безопасна для ребенка и в большинстве случаев хорошо переносится маленькими пациентами.
В клинике Лахта Junior используется «Полиорикс» — инактивированная вакцина, которая вводится внутримышечно в переднюю поверхность бедра или дельтовидную мышцу. «Полиорикс» можно начинать использовать с 3-месячного возраста, то есть в первую вакцинацию от полиомиелита.
На первом году жизни вакцинация от полиомиелита проводится три раза с интервалом в 1,5 месяца –в 3, 4,5 и 6 месяцев.
Первая ревакцинация проводится в 1,5 года, затем с периодичность раз в 5 лет до 18 лет — это необходимо для поддержания полноценного иммунитета.
Живые вакцины от полиомиелита
Такой препарат для прививки содержит живые, хоть и ослабленные вирусы полиомиелита трех типов. Вакцину выпускают в виде капель и дают ребенка из ложечки или на кусочке сахара.
В нашей клинике мы не используем такой вариант вакцинации по ряду причин:
- Существуют определенные сложности с дозировкой вакцины в виде капель, что повышает риск передозировки препарата. Возможны и противоположные ситуации- из-за горького вкуса малыши нередко срыгивают вакцину, в результате нарушается формирование иммунитета
- После введения живой вакцины малыш выделяет вирус с фекалиями на протяжении двух месяцев, что может привести к заражению непривитых детей (особенно это опасно, если в доме есть малыши)
- При использовании живой вакцины повышает риск постпрививочных осложнений и побочных реакций
Пневмококковая инфекция | Прививки.
 уз — Предупредить. Защитить. Привить.
уз — Предупредить. Защитить. Привить.
Новые инфо материалы по иммунизации во время пандемии COVID-19
для медицинский работников и родителей
Вакцинация во время пандемии COVID-19
Вопросы и ответы для РОДИТЕЛЕЙ
Вакцинация во время пандемии COVID-19
Вопросы и ответы для МЕДРАБОТНИКОВ
В ВОЗ отмечают 40-летие победы над оспой
и призывают проявить такую же солидарность в борьбе с COVID-19
Может ли БЦЖ вакцина помочь в борьбе с коронавирусом?
Международные исследования анализируют влияние БЦЖ вакцины на коронавирус
Совместное заявление ВОЗ и ЮНИСЕФ
Во время пандемии COVID-19 крайне важно сохранить услуги плановой иммунизации
В условиях пандемии COVID-19 вакцинацию необходимо продолжать, чтобы она сохраняла свою эффективность
Европейская неделя иммунизации — 2020
ГАВИ, ВОЗ, ЮНИСЕФ: успешное сотрудничество и новые планы
22-23 ноября 2019 года в конференц-зале гостиницы Hyatt Regency Tashkent при поддержке ВОЗ Министерство здравоохранения провело ежегодную национальную конференцию по иммунизации
Первый этап вакцинации против ВПЧ прошел успешно и эффективно
Минздрав провел конференцию по итогам первого этапа прививочной кампании против ВПЧ в Узбекистане.
Первые результаты вакцинации от ВПЧ!
Как вы знаете, с 21 октября 2019 года по всей республике проводится вакцинация против ВПЧ.
В Узбекистане дан старт вакцинации против вируса папилломы человека
В столице состоялась пресс-конференция, посвященная началу вакцинации против вируса папилломы человека.
Встреча с блогерами о ВПЧ
«Мероприятие полностью меня поглотило».
Профилактика рака шейки матки и внедрение ВПЧ вакцины в Узбекистане
Все о вакцинации от ВПЧ
Встреча с Ассоциацией частных школ Узбекистана по внедрению ВПЧ вакцины
Научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
20 августа 2019 года В Ташкенте под слоганом «Будущее без рака шейки матки» прошла научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
Техническая поддержка Узбекистану в оценке температурных рисков в системе холодовой цепи для вакцин
В рамках оказания технической поддержки Узбекистану в достижении лучших стандартов качества и безопасности вакцин, с 13 по 24 августа 2019 года проходит миссия в составе консультантов ВОЗ г-жи Claire Frijs-Madsen и г-жи Erida Nelaj.
Рабочий визит делегации Республики Узбекистан по опыту внедрения внедрения вакцинации против ВПЧ в Молдове
«Это наши мамы, наши сестры, наши дочери, которых мы можем защитить от рака шейки матки уже сегодня благодаря вакцине от ВПЧ и программе скрининга», — неоднократно повторяли представители Молдовы.
Прививки: абсолютно исчерпывающая инструкция для взрослых и детей Даже для тех, кто не верит в вакцинацию
Антипрививочное движение продолжает шириться, а вместе с ним растети частота вспышек инфекций
Совсем недавно в рамках Европейской недели иммунизации состоялась очень необычная и интересная встреча
Вакцина против полиомиелита — обзор
Испытание по последовательному графику cIPV с последующим введением OPV
Последовательные схемы cIPV с последующим введением tOPV, состоящие из одной или двух доз cIPV с последующим введением одной или двух доз tOPV, были зарегистрированы во многих странах. клинические испытания нескольких вакцин, содержащих cIPV (автономные или комбинации wP / aP [бесклеточный коклюш]) в восьми странах (Бразилия, Китай, Франция, Гватемала, Мексика, Тайвань, Великобритания и США) с 1986 г. (Sanofi Pasteur, исследования HE9812 и IPV33-EXT, неопубликованные, данные в файле). 143 143 146 148 149 207 218–231 Эти испытания были либо нерандомизированными открытыми исследованиями, либо РКИ между последовательными схемами cIPV с последующим tOPV и схемами только cIPV и / или tOPV. Результаты этих исследований демонстрируют, что введение хотя бы одной дозы cIPV в начале схемы увеличивает уровни сывороточных антител после первичной серии по сравнению с схемами только tOPV, а также индуцирует определенную степень защиты слизистой оболочки кишечника (см. « Иммунитет слизистых оболочек / защита, вызванная инактивированной вакциной против полиомиелита »позже).С 1997 по 1999 год в Соединенных Штатах использовался последовательный график cIPV с последующим tOPV, в котором две дозы cIPV вводились в возрасте 2 и 4 месяцев, а затем две дозы tOPV вводились в возрасте от 6 до 18 месяцев. и снова при поступлении в школу. Таблица 48.5 суммирует превосходную иммуногенность этого режима.
(Sanofi Pasteur, исследования HE9812 и IPV33-EXT, неопубликованные, данные в файле). 143 143 146 148 149 207 218–231 Эти испытания были либо нерандомизированными открытыми исследованиями, либо РКИ между последовательными схемами cIPV с последующим tOPV и схемами только cIPV и / или tOPV. Результаты этих исследований демонстрируют, что введение хотя бы одной дозы cIPV в начале схемы увеличивает уровни сывороточных антител после первичной серии по сравнению с схемами только tOPV, а также индуцирует определенную степень защиты слизистой оболочки кишечника (см. « Иммунитет слизистых оболочек / защита, вызванная инактивированной вакциной против полиомиелита »позже).С 1997 по 1999 год в Соединенных Штатах использовался последовательный график cIPV с последующим tOPV, в котором две дозы cIPV вводились в возрасте 2 и 4 месяцев, а затем две дозы tOPV вводились в возрасте от 6 до 18 месяцев. и снова при поступлении в школу. Таблица 48.5 суммирует превосходную иммуногенность этого режима.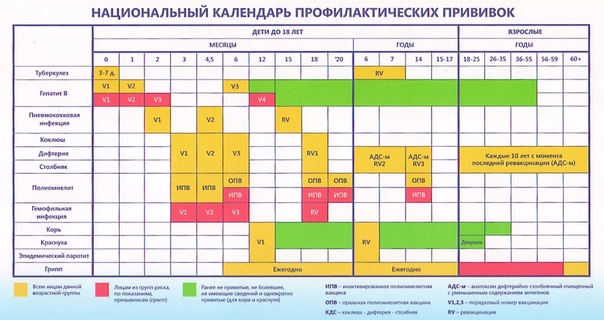 143–149 Израиль и Дания также какое-то время использовали такие последовательные графики, что дало успешные результаты. В Израиле использовались две схемы: cIPV в возрасте 2, 4, 6 и 12 месяцев с tOPV в возрасте 7 и 13 месяцев или cIPV в возрасте 2, 4 и 12 месяцев плюс tOPV в возрасте 4, 6 месяцев. , и 12-месячного возраста.Устойчивый полиомиелит в секторе Газа, несмотря на широкое использование тОПВ, побудил власти перейти на смешанный последовательный график, что привело к быстрому сокращению изоляций диких штаммов. 232 Исследование, проведенное в Соединенном Королевстве, показало преимущества последовательной схемы, состоящей из одной дозы cIPV, за которой следуют две дозы tOPV с точки зрения иммуногенности. 222
143–149 Израиль и Дания также какое-то время использовали такие последовательные графики, что дало успешные результаты. В Израиле использовались две схемы: cIPV в возрасте 2, 4, 6 и 12 месяцев с tOPV в возрасте 7 и 13 месяцев или cIPV в возрасте 2, 4 и 12 месяцев плюс tOPV в возрасте 4, 6 месяцев. , и 12-месячного возраста.Устойчивый полиомиелит в секторе Газа, несмотря на широкое использование тОПВ, побудил власти перейти на смешанный последовательный график, что привело к быстрому сокращению изоляций диких штаммов. 232 Исследование, проведенное в Соединенном Королевстве, показало преимущества последовательной схемы, состоящей из одной дозы cIPV, за которой следуют две дозы tOPV с точки зрения иммуногенности. 222
Частное использование этого последовательного графика было также предпринято в Румынии из-за необычно высокого уровня ВАПП, вызванного одновременными внутримышечными инъекциями. 233 В течение ограниченного времени младенцы в одной провинции Румынии получали cIPV в возрасте 2, 3 и 4 месяцев вместе с tOPV в возрасте 4 и 9 месяцев. 234 Схема хорошо переносилась и обладала высокой иммуногенностью. Впоследствии в этом регионе не было случаев полиомиелита, но было задействовано слишком мало детей, чтобы делать выводы о профилактике ВАПП.
234 Схема хорошо переносилась и обладала высокой иммуногенностью. Впоследствии в этом регионе не было случаев полиомиелита, но было задействовано слишком мало детей, чтобы делать выводы о профилактике ВАПП.
Завершенное испытание в Чили 235 с использованием bOPV 1 и 3 сравнивало гуморальный и кишечный иммунитет после трех доз cIPV с двумя последовательными схемами cIPV с последующим bOPV 1 и 3 (cIPV-cIPV-bOPV 1 и 3 или cIPV -bOPV 1 и 3 -bOPV 1 и 3 ) в возрасте 8, 16 и 24 недель.Все получили пероральное контрольное заражение mOPV 2 на 28 неделе. На 28 неделе более 98% всех субъектов группы имели сероконверсию против типов 1 и 3, а сероконверсия типа 2 превысила 96% после трех или двух доз cIPV. Интересно, что в группе cIPV-bOPV 1 и 3 -bOPV 1 и 3 сероконверсия 2 типа была достигнута на 77,6%. Важно отметить, что две трети не ответивших на вопросы типа 2 на 28 неделе в этой группе имели сероконверсию в течение 1 недели после заражения мОПВ 2 , что свидетельствует о примировании против типа 2, что дает комбинированный коэффициент защиты / примирования типа 2 для cIPV-bOPV на 92%. 1 и 3 -bOPV 1 и 3 последовательный режим.Как и ожидалось, материнские антитела значительно мешали иммунным ответам. Ключевое наблюдение в этом исследовании заключалось в том, что bOPV 1 и 3 , по-видимому, повышают уровни антител (а также кишечный иммунитет, измеренный по выделению типа 2 после заражения mOPV 2 ) против типа 2, что предполагает некоторый перекрестный (гетеротипический) усиливающий эффект против типа 2 (у субъектов, получавших одну дозу cIPV) двумя другими серотипами, включенными в bOPV 1 и 3 .
1 и 3 -bOPV 1 и 3 последовательный режим.Как и ожидалось, материнские антитела значительно мешали иммунным ответам. Ключевое наблюдение в этом исследовании заключалось в том, что bOPV 1 и 3 , по-видимому, повышают уровни антител (а также кишечный иммунитет, измеренный по выделению типа 2 после заражения mOPV 2 ) против типа 2, что предполагает некоторый перекрестный (гетеротипический) усиливающий эффект против типа 2 (у субъектов, получавших одну дозу cIPV) двумя другими серотипами, включенными в bOPV 1 и 3 .
Ключевым преимуществом последовательной схемы вакцинации cIPV перед OPV является устранение риска VAPP, поскольку теперь хорошо задокументировано, что начало иммунизации против полиомиелита cIPV может устранить возникновение VAPP, связанного с первыми дозами OPV.Эта стратегия оказалась очень успешной в США 236 и в Венгрии. 154 С 1992 по 2006 год Венгрия перешла от трех ежегодных кампаний мОПВ к последовательному графику введения одной дозы цИПВ с последующим тОПВ и увидела полное прекращение ВАПП.
С учетом последних данных, описанных выше, этот тип календаря может быть полезным в контексте, когда bOPV 1 и 3 будут использоваться исключительно в качестве вакцины OPV и где это будет иметь решающее значение для гарантии того, что иммунитет против полиомиелита 2 типа будет таким же высоким. насколько это возможно в популяциях в случае повторного интродукции полиовируса типа 2 в эти сообщества.
The Lancet: Новая вакцина от полиомиелита против штамма, который угрожает искоренению, безопасна и вызывает иммунный ответ у взрослых, маленьких детей и младенцев
Испытания фазы 2 с участием 1200 взрослых, маленьких детей и младенцев показывают, что новая вакцина против полиовируса может иметь потенциал для преодоления вспышек, вызванных мутировавшим штаммом полиомиелита, связанным с пероральной вакциной, которая обычно циркулирует в районах с низким охватом иммунизацией и представляет собой одну из самых больших препятствия на пути искоренения.
Ученые разработали первую вакцину против полиовируса против мутировавшей формы болезни, которая вызывает вспышки болезней в Африке и Азии. Согласно новому исследованию, опубликованному в двух статьях в г., новая вакцина, генетически более стабильная, чем лицензированная оральная вакцина Сэбина [1], кажется такой же безопасной и обеспечивает аналогичный иммунный ответ при тестировании у здоровых взрослых, детей и младенцев. Ланцет .
Согласно новому исследованию, опубликованному в двух статьях в г., новая вакцина, генетически более стабильная, чем лицензированная оральная вакцина Сэбина [1], кажется такой же безопасной и обеспечивает аналогичный иммунный ответ при тестировании у здоровых взрослых, детей и младенцев. Ланцет .
Новая вакцина, известная как nOPV2, направлена против полиовируса типа 2, имеет улучшенную генетическую стабильность и с меньшей вероятностью мутирует и превращается в форму вируса, которая может вызвать инфекцию и паралитическое заболевание.
Основываясь на результатах этих клинических испытаний фазы 2, вакцина nOPV2 получила рекомендацию ВОЗ в Списке применения для чрезвычайных ситуаций (EUL), что делает ее первой вакциной, прошедшей этот путь и предназначенной для чрезвычайных ситуаций в области здравоохранения во всем мире. Теперь цель состоит в том, чтобы использовать вакцину для реагирования на вспышки полиовируса вакцинного происхождения, число которых растет в Африке, а также в Афганистане, Пакистане, Филиппинах, Малайзии и других странах. В настоящее время для борьбы со вспышками используется оригинальная пероральная вакцина Сэбина от полиомиелита 2 типа, что может привести к возникновению новых вспышек в районах с постоянно низким охватом иммунизацией.
В настоящее время для борьбы со вспышками используется оригинальная пероральная вакцина Сэбина от полиомиелита 2 типа, что может привести к возникновению новых вспышек в районах с постоянно низким охватом иммунизацией.
Ведущий автор исследования на взрослых, профессор Пьер Ван Дамм из Университета Антверпена в Бельгии говорит: «У миллионов людей потенциально нет иммунитета к распространению вируса вакцинного происхождения, которое возникает, когда ослабленный живой вирус при оральном полиомиелите вакцины мутируют и восстанавливают свою способность становиться заразными, вызывать заболевания и распространяться в сообществах с низким уровнем вакцинации. Вакцина nOPV2 кажется по крайней мере такой же безопасной и эффективной, как вакцина Сэбина, и более стабильной в генетическом отношении, и может стать ключевым прорывом в борьбе с полиомиелитом. -свободный мир.»[2]
Полиовирус вакцинного происхождения — глобальная чрезвычайная ситуация в области общественного здравоохранения
Полиомиелит — это очень заразное вирусное заболевание, которое в основном поражает детей в возрасте до пяти лет, при этом примерно у одного из 200 случаев инфицирования возникает паралич. Из тех, кто парализован, 5-10% умирают, когда их дыхательные мышцы становятся неподвижными. Хотя лекарства нет, полиомиелит можно предотвратить с помощью вакцинации против трех типов полиомиелита, 1, 2 и 3, в трехвалентных вакцинах.
До того, как были приостановлены из-за пандемии COVID-19, кампании вакцинации почти полностью искоренили дикий вирус полиомиелита в мире — число случаев заболевания снизилось более чем на 99% с 1988 года, с примерно 350 000 случаев до 33 зарегистрированных случаев в 2018 году [3].ВОЗ объявила, что полиовирусы дикого типа 2 и 3 ликвидированы, а полиовирусы дикого типа 1 сохраняются только в некоторых частях Афганистана и Пакистана.
В странах с низким и средним уровнем доходов оральная вакцина используется из-за ее низкой стоимости и простоты использования, требующей всего две капли на дозу, а также потому, что она вызывает кишечный иммунитет, который снижает передачу живого вируса в условиях плохой санитарии. . В большинстве стран с высоким уровнем доходов используется более дорогая вакцина для инъекций, которая содержит инактивированные вирусы, не способные вызывать заболевание, но не индуцирует кишечный иммунитет, а это означает, что вакцинированные лица все еще могут распространять вирус, полученный через рот.
В последние годы усилия по искоренению были затруднены из-за учащающихся вспышек циркулирующего полиовируса вакцинного происхождения (цПВВП), причем более 90% случаев были вызваны мутациями в штамме полиовируса типа 2. Этот риск привел к глобальному отказу от компонента типа 2 из пероральной трехвалентной вакцины в мае 2016 года. Однако эти усилия не смогли обуздать все случаи передачи полиовируса 2 типа: число случаев цПВВП 2 типа увеличилось с 71 в 2018 году до 739. дел в 2020 г. (по состоянию на 3 декабря 2020 г.).В ответ на это ВОЗ продолжила классифицировать цПВВП 2 типа как чрезвычайную ситуацию в области общественного здравоохранения, имеющую международное значение, 22 октября 2020 г. [4].
Разработка более генетически стабильных вакцин против полиовируса 2 типа
Для решения этой глобальной чрезвычайной ситуации Глобальная инициатива по ликвидации полиомиелита поддержала разработку более генетически стабильных полиовирусов типа 2 для вакцин. Подобно лицензированной моновалентной пероральной вакцине против полиомиелита типа 2 (mOPV2) Сэбина, новые пероральные вакцины-кандидаты (nOPV2-c1 и nOPV2-c2) получены из живого инфекционного вируса, но были модифицированы для снижения вероятности возврата к типу вируса. вируса, который в редких случаях может вызвать инфекцию и болезнь.
Предыдущее исследование фазы 1 с участием 30 здоровых взрослых добровольцев, опубликованное в журнале The Lancet , показало, что новые вакцины-кандидаты были безопасными, иммуногенными и более генетически стабильными, чем 60-летний лицензированный mOPV2 [5].
В новом исследовании, опубликованном сегодня, ученые оценили два кандидата nOPV2 в параллельных клинических исследованиях у взрослых, маленьких детей и младенцев в двух разных странах, чтобы оценить их безопасность и иммуногенность по сравнению с лицензированным mOPV2 Sabin, который они призваны заменить.
Испытание вакцин-кандидатов на здоровых взрослых
Поскольку исходный mOPV2 компании Sabin был отозван в 2016 году, до того, как были разработаны кандидаты nOPV2, было невозможно сравнить вакцины одновременно. По этой причине бельгийские исследователи провели два рандомизированных испытания на здоровых бельгийских взрослых (в возрасте 18-50 лет): проспективное исследование фазы 4 mOPV2 по Сэбину с января по март 2016 г. (до глобальной отмены), чтобы предоставить исторические контрольные данные, и фазу 2. исследование обоих кандидатов нОПВ2 с октября 2018 г. по февраль 2019 г.Участники обоих испытаний ранее были полностью вакцинированы против полиомиелита в рамках плановой иммунизации.
В историческом контрольном исследовании приняли участие 100 участников, которые получили одну или две дозы mOPV2 Сэбина. В исследовании фазы 2 250 добровольцев были случайным образом распределены для получения одной или двух доз кандидата нОПВ2 или плацебо с интервалом 28 дней. Иммунные ответы оценивали в день вакцинации, а затем через 4 недели после их первой и второй вакцинации. Участники записывали любые побочные эффекты на протяжении всего исследования.
Результаты показали, что оба кандидата нОПВ2 были так же безопасны и хорошо переносились, как мОПВ2, и вызывали аналогичный иммунный ответ — достижение 100% серопротекции (ответ антител, способный предотвратить инфекцию) после одной дозы для обоих кандидатов нОПВ2 по сравнению с 97% и 98% для одной или двух доз мОПВ2.
Побочные реакции на вакцины были легкими и одинаковыми для разных групп вакцины (наиболее частыми эффектами были утомляемость, головная боль, боль в животе, диарея и боль в мышцах).Произошло четыре серьезных побочных эффекта, одно из которых было сочтено, возможно, связанным с вакциной nOPV2-c2 — гриппоподобное заболевание, которое длилось 6 дней после приема второй дозы. Первоначальный анализ вирусов, выделяемых в образцах стула, показал более высокую генетическую стабильность кандидатов nOPV2, чем mOPV2 Сэбина.
Испытания вакцины на здоровых детях и младенцах
После этих многообещающих результатов по безопасности у полностью вакцинированных взрослых исследователи провели в Панаме два рандомизированных испытания на здоровых маленьких детях (в возрасте 1-4 лет) и младенцах (в возрасте 18-22 недель), которые ранее были иммунизированы существующими вакцинами: исторический контрольное исследование фазы 4 с mOPV2 по Сэбину с октября 2015 года по апрель 2016 года (до глобальной отмены) и исследование фазы 2 с низкими и высокими дозами двух кандидатов nOPV2 в период с сентября 2018 года по сентябрь 2019 года.
В целом, 150 детей (50 в контрольном исследовании и 100 в исследовании нОПВ2) и 684 младенца (110 в контрольной группе и 574 в исследовании нОПВ2) были включены в исследование и получили по крайней мере одну вакцинацию в рамках исследования. Иммунные ответы оценивали через 1 и 4 недели после первой вакцинации и через 4 недели после второй вакцинации. Родители регистрировали любые побочные эффекты в течение 28 дней после каждой вакцинации.
Результаты показывают, что у младенцев одна или две дозы обоих кандидатов нОПВ2 были безопасными и хорошо переносились с иммуногенностью, аналогичной мОПВ2, несмотря на то, что реципиенты мОПВ2 имели более высокий исходный иммунитет в начале исследования.
Неблагоприятные реакции на вакцины были мягкими и одинаковыми независимо от вакцины или дозы (наиболее частыми эффектами были потеря аппетита, ненормальный плач, раздражительность и лихорадка), и никаких серьезных нежелательных явлений, связанных с вакцинацией, не считалось. Смерть одного младенца, поступившего в больницу после развития пневмонии, не считалась связанной с нОПВ2.
У кандидатов на nOPV2 также была более низкая скорость выделения стула через 28 дней после вакцинации, чем у mOPV2 в контрольном исследовании.
Ведущий автор исследований у детей и младенцев, доктор Рикардо Рюттиманн из американской некоммерческой организации «Борьба с инфекционными заболеваниями в развивающихся странах», говорит: «Наши результаты показывают, что оба новых кандидата OPV2 безопасны, хорошо переносятся и обладают иммуногенностью у детей младшего возраста. и младенцы. Однако постоянный мониторинг на местах и дополнительные исследования укрепят эти наблюдения, чтобы подтвердить безопасность и эффективность вакцины, поскольку она используется в рамках EUL для реагирования на вспышки. В конечном итоге, чтобы искоренить все формы полиомиелита, страны должны улучшить плановые и дополнительные кампании иммунизации, чтобы обеспечить охват достаточного количества детей, чтобы повысить иммунитет населения до достаточно высокого уровня, чтобы вирус больше не мог выжить.»[1]
Авторы отмечают некоторые ограничения своих исследований, в том числе то, что они включали всего 1200 человек, поэтому по-прежнему потребуется дополнительная информация о долгосрочной безопасности и продолжительности защиты. Они также отмечают, что, хотя исследования были разработаны таким образом, чтобы их можно было согласовать, насколько это возможно, с точки зрения исследовательских центров, населения, дизайна и анализа, прямое сравнение было невозможно из-за отмены мОПВ2 в мире в 2016 году.
В связанном комментарии Кимберли Томпсон из некоммерческой организации Kids Risk, США (которая не принимала участия в исследовании) приветствует эти многообещающие результаты и пишет: «В обоих исследованиях использовались наилучшие возможные методы для сравнения новых и моновалентных ОПВ2, учитывая глобальные масштабы. Ограничения содержания OPV2.И то, и другое ограничено небольшим количеством участников испытания (например, наблюдение реверсии и редких событий, таких как паралитический полиомиелит, вызванный вакциной, потребует использования у миллионов людей, как и ОПВ), различными профилями иммунитета участников и возможностью вторичного моновалентного ОПВ2 воздействие на исторические контрольные образцы, но не на новые испытания OPV2 ».
Она добавляет: «Будущие исследования покажут истинную ценность нового OPV2, а также аналогичные усилия по разработке новых штаммов OPV для типов 1 и 3.В конечном итоге разработка новых ОПВ может привести к созданию более удобной для доставки и более рентабельной вакцины против полиовируса, чем инактивированная вакцина против полиомиелита, для стран, которые полагаются на ОПВ ».]
###
Рецензируемые / рандомизированные контролируемые испытания / Люди
ПРИМЕЧАНИЕ ДЛЯ РЕДАКТОРОВ
Исследование на взрослых спонсировалось Университетом Антверпена при финансовой поддержке Фонда Билла и Мелинды Гейтс. Его провели исследователи из Университета Антверпена, Вильрейк, Бельгия; Гентский университет и больница Гентского университета, Гент, Бельгия; Фонд Билла и Мелинды Гейтс, Сиэтл, Вашингтон, США; PATH, Вашингтон, округ Колумбия, США; Центры по контролю и профилактике заболеваний, Атланта, США; Медицинская школа Дартмута Гейзеля, Ганновер, Нью-Хэмпшир, США; Глобальные исследования инфекционных заболеваний, Рио-де-Жанейро, Бразилия; Сиенский университет, Сиена, Италия; PT Bio Farma, Бандунг, Индонезия..
Исследование на детях и младенцах спонсировалось фондом «Борьба с инфекционными заболеваниями в развивающихся странах» при финансовой поддержке Фонда Билла и Мелинды Гейтс. Его провели исследователи из Госпиталя дель Ниньо, доктор Хосе Ренан Эскивель, Панама, Панама; Sistema Nacional de Investigación, Senacyt, Панама; Фонд Билла и Мелинды Гейтс, Сиэтл, Вашингтон, США; PATH, Вашингтон, округ Колумбия, США; Медицинская школа Дартмута Гейзеля, Ганновер, Нью-Хэмпшир, США; Севаксин, Панама-Сити, Панама; Севаксин, Чирики, Панама; VaxTrials, Панама-Сити, Панама; «Борьба с инфекционными заболеваниями в развивающихся странах», Майами, Флорида, США; Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний, Атланта, Джорджия, США; PT Bio Farma, Бандунг, Индонезия; Глобальные исследования инфекционных заболеваний, Рио-де-Жанейро, Бразилия; Сиенский университет, Сиена, Италия.
Этикетки были добавлены к этому пресс-релизу в рамках проекта Академии медицинских наук, направленного на улучшение передачи доказательств. Для получения дополнительной информации см. Http: // www.
[1] Альберт Сабин разработал обычную пероральную вакцину против полиомиелита в 1950-х и 1960-х годах. Моновалентные ОПВ 2-го типа (мОПВ) придают иммунитет ко 2-му из трех серотипов ОПВ (ОПВ — GPEI (polioeradication.org)
[2] Цитаты авторов и не могут быть найдены в тексте статей.
[3] Полиомиелит (who.int)
[4] Заявление Двадцать шестого комитета ММСП по полиомиелиту (who.int)
[5] Безопасность и иммуногенность двух новых живых аттенуированных моновалентных (серотип 2) пероральных полиовакцин для здоровых взрослых: двойное слепое одноцентровое исследование фазы 1 — The Lancet
Две новые вакцины против полиовируса, безопасные и эффективные для взрослых, детей и младенцев
По данным нескольких исследований, опубликованных в журнале The Lancet , два новых кандидата на пероральную полиовакцину типа 2 (OPV2) были безопасными, хорошо переносимыми и иммуногенными у здоровых взрослых, маленьких детей и младенцев. 1,2
Эти 2 рандомизированных, частично замаскированных исследования были нацелены на возникновение и распространение циркулирующих полиовирусов вакцинного происхождения 2 типа и вакцино-ассоциированного паралитического полиомиелита от моновалентной ОПВ2 по Сэбину. В связи с глобальным отказом от моновалентного OPV2 по Сэбину в 2016 году в обоих исследованиях было проведено проспективное историческое контрольное исследование 4 фазы для получения исходных данных с моновалентным OPV2 и исследование фазы 2 2 новых кандидатов OPV2, OPV2-c1 и OPV2-c2.
Основной целью обоих исследований было сравнение безопасности и иммуногенности OPV2-c1 и OPV2-c2 с моновалентным OPV2.Иммунные ответы оценивали на исходном уровне, а затем через 28 дней после первой и второй дозы OPV2-c1 и OPV2-c2. Исследователи также оценили не меньшую эффективность OPV2-c1 и OPV2-c2 по сравнению с моновалентным OPV2 с 10% разницей в риске.
Продолжить чтение
Для исследования на здоровых взрослых (в возрасте 18–50 лет) 1 историческое контрольное исследование включало 100 участников, которых случайным образом распределили в соотношении 1: 1 для получения 1 или 2 доз моновалентной ОПВ2.В исследовании фазы 2 (идентификатор ClinicalTrials.gov: NCT04544787) 200 участников, ранее имевших вакцинацию OPV, были случайным образом распределены для получения 1 или 2 доз OPV2-c1 или OPV2-c2. Еще 50 участников, ранее вакцинированных инактивированной полиовирусной вакциной (IPV), были случайным образом распределены для получения OPV2-c1, OPV2-c2 или плацебо.
Во втором исследовании 2 исследователи провели 2 одноцентровых многоцентровых испытания на здоровых детях в возрасте от 1 до 4 лет и младенцах в возрасте от 18 до 22 недель, которые ранее были иммунизированы существующими вакцинами.В историческом контрольном исследовании (идентификатор ClinicalTrials.gov: NCT02521974) было 50 детей и 110 младенцев. Дети получили 2 дозы моновалентной ОПВ2; все младенцы получили 1 дозу моновалентного OPV2, и 50 детей рандомизированно получили вторую дозу через 28 дней.
В исследование фазы 2 (идентификатор ClinicalTrials.gov: NCT03554798) было включено 100 детей и 574 младенца. Дети получали 2 высокие дозы OPV2-c1 или OPV2-c2 с интервалом 28 дней, а младенцы получали 1 низкую или высокую дозу OPV2-c1 или OPV2-c2, и 50 были случайным образом распределены в каждой подгруппе для получения второй дозы через 28 дней. .Рандомизация была 1: 1 для каждого уровня дозы и 1: 4 для 1 против 2 доз, пока не были включены 50 участников, принимавших 2 дозы.
Результаты обоих исследований показали, что новые кандидаты OPV2 были безопасными и хорошо переносимыми, с иммуногенностью, аналогичной моновалентному OPV2, несмотря на высокий исходный иммунитет. У взрослых, маленьких детей и младенцев побочные реакции на вакцины были легкими и одинаковыми для разных групп вакцины.
У взрослых наиболее частыми побочными эффектами были головная боль, усталость, боль в животе, диарея и миалгия.Из 4 серьезных нежелательных явлений, которые в основном касались желудочно-кишечных расстройств, только 1, возможно, был связан с вакциной OPV2-c2.
У детей и младенцев наиболее частые побочные эффекты были легкими или умеренными и включали аномальный плач, раздражительность, временную потерю аппетита, рвоту и лихорадку. У троих детей были серьезные побочные эффекты, приведшие к госпитализации, но ни один из них не был признан причинно связанным с вакцинацией.
У взрослых уровень серопротекции составлял 100% после первой дозы (28 день) и второй дозы (56 день) любого нового кандидата OPV2 по сравнению с 97% и 98% для 1 или 2 доз моновалентной OPV2, соответственно.Среди взрослых, вакцинированных ИПВ, 89% (42/47) были серопозитивными на исходном уровне, и этот показатель увеличился до 100% в обеих группах новой ОПВ2 после первой дозы.
Учитывая историю иммунизации, у детей был высокий исходный уровень серопротекции против полиовируса 2 типа: 100% в группе моновалентной OPV2, 100% в группе OPV2-c1 и 94% в группе OPV2-c2. Хотя уровни сероконверсии были выше после новых кандидатов OPV2, чем после моновалентной OPV2, многие смешивающие факторы включали «количество, тип и время с момента последней вакцинации типа 2, а также возможное воздействие окружающей среды на моновалентную вакцину OPV2 вакциной типа 2 перед отменой OPV типа 2 », — отметили исследователи. 2
У младенцев критерий не меньшей эффективности соответствовал как низкой, так и высокой дозе нового OPV2-c1 (-0,7%; 95% ДИ, -7,4-6,7 и -0,1%; 95% ДИ, -6,4-7,2, соответственно). В то время как не меньшая эффективность была также достигнута для нового OPV2-c2 в высоких дозах (-0,7%; 95% ДИ, -5,3-7,9), это не было верно для нового OPV2-c2 в низких дозах (-3,3%; 95% ДИ). , -10,6-4,5).
В то время как дальнейшие исследования продолжаются, первоначальный анализ скорости выделения вируса из стула позволяет предположить, что новые кандидаты OPV2 обладают более высокой генетической стабильностью, чем моновалентный OPV2.
Ограничения включали необходимость проведения 2 отдельных исследований, небольшое количество участников испытаний и невозможность сравнить иммуногенность и вирусное выделение у детей в возрасте от 1 до 5 лет.
Наряду с производственными и эпидемиологическими соображениями, результаты обоих исследований «способствовали выбору новой OPV2-c1 в качестве первой новой вакцины, которая будет включена в список использования в чрезвычайных ситуациях [Всемирной организации здравоохранения] для использования в циркулирующем полиовирусе вакцинного происхождения 2 типа. вспышки », — заключили Саез-Льоренс и др. 2
Раскрытие информации: один автор каждого исследования заявил о своей принадлежности к фармацевтической промышленности. Пожалуйста, смотрите исходную ссылку для получения полного списка раскрытия информации авторами.
Список литературы
1. Де Костер И., Леру-Роэлс И., Бандиопадхьяй А.С. и др. Безопасность и иммуногенность двух новых кандидатов на пероральную полиовакцину типа 2 по сравнению с моновалентной пероральной полиовакциной 2 типа у здоровых взрослых: два клинических испытания. Ланцет . 2021; 397 (10268): 39-50. DOI: 10.1016 / S0140-6736 (20) 32541-1
2. Саез-Льоренс X, Bandyopadhyay AS, Gast C, et al. Безопасность и иммуногенность двух новых кандидатов на пероральную полиовакцину типа 2 по сравнению с моновалентной пероральной полиовакциной 2 типа у детей и младенцев: два клинических испытания. Ланцет . 2021; 397 (10268): 27-38. DOI: 10.1016 / S0140-6736 (20) 32540-X
Эволюция использования инактивированной полиовирусной вакцины для конечной стадии и не только | Журнал инфекционных болезней
(См. Основную статью Ресика и др. На страницах 895–901.)
Спустя более 6 десятилетий после лицензирования инактивированной полиовакцины (ИПВ) в качестве первой вакцины против полиомиелита оптимальное использование ИПВ для профилактики полиомиелита продолжает оставаться предметом интереса. С началом последовательного глобального отказа от рутинного использования пероральных полиомиелитных вакцин (ОПВ), начиная с отмены ОПВ 2-го типа, которая была завершена к маю 2016 г., на промежуточной фазе завершающей стадии ликвидации растет зависимость от ИПВ. Основная роль ИПВ на этой фазе состоит в том, чтобы вызвать иммунитет против типов, которых больше нет в ОПВ, так что в случае повторного интродукции полиовирусов (например, в результате перерыва в лабораторных условиях сдерживания) популяция будет в значительной степени защищена от паралитического заболевания.Продолжение схемы полностью ИПВ с использованием как минимум двух доз рекомендовано в течение не менее 10 лет после сертификации ликвидации диких полиовирусов (ДПВ) и прекращения использования всех ОПВ [1]. В последние годы количество стран, использующих ИПВ в календарях плановой иммунизации, резко увеличилось, при этом большинство стран, использующих ОПВ, вводят 1 дозу ИПВ в соответствии со Стратегическим планом ликвидации полиомиелита и заключительного этапа Глобальной инициативы по ликвидации полиомиелита [2]. Однако производственные проблемы, связанные с обеспечением достаточного количества полных доз ИПВ, привели к его нехватке и задержке повсеместного внедрения во многих странах.В отчете Ресика и др. В этом выпуске журнала The Journal of Infectious Diseases рассматривается хорошо известная, но недостаточно изученная стратегия преодоления ограничений предложения [3].
Важно проанализировать преимущества ИПВ в достижении и поддержании искоренения полиомиелита. ИПВ — одна из самых безопасных и хорошо переносимых вакцин, когда-либо разработанных, без каких-либо серьезных побочных эффектов, причинно связанных с ее использованием, обнаруженных в ходе клинических испытаний, проводимых на протяжении десятилетий [4]. Кроме того, отсутствует риск вакцинно-ассоциированного паралитического полиомиелита или появления полиовирусов вакцинного происхождения (ПВРП) при использовании ИПВ — значительное преимущество ИПВ перед ОПВ на заключительных этапах ликвидации.Гуморальная иммуногенность ИПВ также одинакова для разных географических регионов и популяций, в отличие от ОПВ, иммуногенность которой в развивающихся странах обычно низкая [5]. Высокий уровень материнских антител в раннем младенчестве является самым большим фактором риска отсутствия вакцины с ИПВ [6]. Следовательно, ожидается, что позднее введение последней дозы будет ключом к закрытию пробелов в иммунитете в схемах только ИПВ, как сообщается в исследованиях, оценивающих графики плановой иммунизации, разработанные для конечной стадии, и 4- и 8-месячный график, оцененный Resik et al. al согласуется с этим [3, 7].
Роль ИПВ в индукции иммунитета слизистых оболочек остается менее определенной. IPV считается сопоставимым с OPV в снижении экскреции через ротоглотку, как показывают исследования с провокацией OPV, но он уступает OPV в индукции первичного иммунитета слизистой оболочки кишечника [8–10]. Это отсутствие значимого воздействия на первичный иммунитет слизистой оболочки кишечника считается основным недостатком ИПВ, поскольку принцип искоренения зависит от успешного прерывания передачи вируса. Также не наблюдается увеличения первичной кишечной иммуногенности ИПВ с экспериментальными препаратами с в несколько раз более высоким содержанием антигена D, хотя такие препараты оказывают линейное благоприятное влияние на гуморальную иммуногенность [11, 12].Таким образом, реципиенты, получающие только ИПВ, независимо от первичного режима и доз, выделяют вирус вакцины после перорального заражения почти так же, как и невакцинированные, с незначительным влиянием на сокращение продолжительности и титра выделения вируса [9, 13 , 14]. Напротив, у детей, ранее подвергавшихся воздействию ОПВ, доза ИПВ — либо полная доза внутримышечно, либо дробная доза внутрикожным путем — оказывала благоприятное влияние на снижение распространенности выделения, и этот эффект был не меньше, чем дополнительная доза ОПВ [15–17].
В исследованиях, проведенных в Соединенных Штатах в конце 1950-х годов, предшествующая вакцинация ИПВ снизила передачу дикого полиовируса (ДПВ) в сообществах среднего класса, возможно, из-за уменьшения орофарингеального выделения [18]. Напротив, несмотря на национальный охват ИПВ3 на уровне 95% и 5 доз ИПВ в своем календаре плановой иммунизации, Израиль сообщил о широком распространении ДПВ типа 1 в течение более года в 2013 г. без каких-либо случаев паралича [19]. По сравнению с передачей ДПВ имеется меньше информации о динамике передачи полиовирусов типа Сабина (SL), которые обладают меньшей силой инфицирования, чем ДПВ или полиовирусы вакцинного происхождения (ВРПВ).Таким образом, неясно, оказывает ли получение IPV более значимое влияние на предотвращение появления VDPV и передачи вирусов, подобных Сабину, по сравнению с WPV. В Джокьякарте, Индонезия, после перехода на режим только ИПВ вирусы ПВП не были обнаружены, хотя этот район окружен провинциями, использующими ОПВ при плановой иммунизации, а вирусы, подобные Сабину, были обнаружены в Джокьякарте, что предполагает проникновение из соседних районов [20 ]. Вопрос о влиянии ИПВ на циркуляцию вирусов, подобных Сэбину, важен, поскольку наиболее вероятно, что нарушение условий содержания в лаборатории клинических образцов будет касаться вирусов, подобных Сэбину, а не ДПВ.Анализ с помощью эпиднадзора за случаями заболевания и окружающей среды в Нигерии продемонстрировал, что комбинированные мероприятия по дополнительной иммунизации (ДМИ) ИПВ и ОПВ лучше влияют на прерывание передачи ВРПВ по сравнению с ДМИ только с ОПВ [21], предположительно частично из-за усиления кишечной иммунитет у лиц, ранее подвергавшихся воздействию ОПВ. Аналогичные тенденции наблюдались в Пакистане в отношении прерывания передачи ДПВ [22]. В целом, различное влияние ИПВ на передачу ДПВ по сравнению с ПВРП и вирусами, подобными Сабину, может стать более значительным в постсертификационную эру и на этапе последовательной отмены ОПВ.
Поскольку производство ИПВ дороже, чем ОПВ, в настоящее время проводится несколько инициатив по исследованиям и разработкам для смягчения ограничений по стоимости и поставкам с акцентом на усиление как гуморальной, так и кишечной иммуногенности ИПВ посредством использования адъюванта и сохранения антигена, введения дробная доза (одна пятая от нормальной дозы) внутрикожным путем в качестве стратегии экономии дозы и разработка новых производственных платформ и клеточных линий для повышения урожайности. Также предпринимаются усилия по разработке ИПВ из менее заразных источников для снижения пострадикационных рисков нарушения условий локализации [4].В нескольких исследованиях сообщалось о безопасности и иммуногенности фракционной дозы ИПВ при внутрикожном введении с помощью иглы и шприца или устройств для доставки [23]. Учитывая ограниченность стоимости и поставок, дробное введение IPV оказалось многообещающим, в зависимости от времени введения, графика иммунизации и количества введенных доз.
Одним из общепринятых факторов, снижающих иммуногенность фракционной дозы ИПВ, были трудности внутрикожного введения [24].В исследовании Resik et al. Сообщается о новой стратегии экономии дозы, которая может облегчить воспринимаемые трудности внутрикожной доставки [3]. В этом рандомизированном контролируемом клиническом исследовании, проведенном среди младенцев на Кубе, они сообщили о не меньшей степени сероконверсии для всех 3 серотипов для фракционного ИПВ, вводимого внутримышечно, по сравнению с фракционным ИПВ, вводимым внутрикожным путем, после 2 доз, вводимых в 4 и 8 раза. мес., ранее не вакцинированным от полиомиелита младенцам.Эти результаты являются многообещающими и открывают новое измерение в спектре стратегий сохранения дозы / антигена, предлагая возможное решение проблем доставки ИПВ. Использование внутримышечного пути предположительно будет значительно более приемлемым для программ иммунизации во всем мире, особенно в развивающихся странах, а экономия доз может привести как к снижению стоимости вакцины, так и к снижению нагрузки на производителей, необходимых для производства достаточных полных доз внутримышечной ИПВ. обеспечить иммунизацию всех детей двумя дозами.Хотя после сертификации эрадикации ДПВ и отмены ОПВ будет рекомендовано минимум 2 дозы, данные также предполагают, что даже однократная внутримышечная доза приводит к высоким показателям иммунного примирования.
По мере того, как глобальные усилия по ликвидации полиомиелита готовятся к полному отказу от ОПВ и наступает эра использования только ИПВ, своевременная оптимизация затрат на ИПВ, варианты производства и доставки будут иметь решающее значение для долгосрочного успеха программы. Обнадеживающие результаты, о которых сообщает Resik et al, могут быть расширены для получения клинических данных, основанных на иммуногенности внутримышечно вводимых дробных доз ИПВ в более молодых возрастных группах, с целью разработки политики для конечной стадии полиомиелита и в дальнейшем.
Банкноты
Благодарность. Мы благодарим Джона Ф. Модлина (Фонд Билла и Мелинды Гейтс) за его вклад в эту статью.
Возможный конфликт интересов. Авторы удостоверяют отсутствие потенциальных конфликтов интересов.
Оба автора подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
3.
Resik
S и др.
.
Иммуногенность внутримышечной фракционной дозы инактивированной полиовирусной вакцины
.
J Infect Dis
2019
. В этом выпуске 4.
Bandyopadhyay
AS
,
Garon
J
,
Seib
K
,
Orenstein
WA
.
Вакцинация от полиомиелита: прошлое, настоящее и будущее
.
Future Microbiol
2015
;
10
:
791
—
808
,5.
Саттер
RW
.
Вакцина против полиовируса — живая.
In:
Plotkin
SA
,
Orenstein
WA
,
Offit
PA
, ред.
Вакцины
. 6-е изд.
Филадельфия
:
Эльзевье-Сондерс
,
2013
:
621
—
2
. 6.
Dayan
GH
,
Thorley
M
,
Yamamura
Y
и др.
Серологический ответ на инактивированную полиовирусную вакцину: рандомизированное клиническое испытание, сравнивающее 2 схемы вакцинации в Пуэрто-Рико
.
J Infect Dis
2007
;
195
:
12
—
20
,7.
Gaensbauer
JT
,
Gast
C
,
Bandyopadhyay
AS
и др.
Влияние материнских антител на иммуногенность инактивированной вакцины против полиомиелита у младенцев, иммунизированных бивалентной пероральной вакциной против полиомиелита: последствия для конечной стадии ликвидации полиомиелита
.
Clin Infect Dis
2018
;
67
:
57
—
65
,8.
Онорато
IM
,
Modlin
JF
,
McBean
AM
,
Thoms
ML
,
Losonsky
GA
,
Bernier
RH
.
Иммунитет слизистых оболочек, индуцированный инактивированной и пероральной вакцинами против полиомиелита с повышенной активностью
.
J Infect Dis
1991
;
163
:
1
—
6
.9.
Hird
TR
,
Grassly
NC
.
Систематический обзор иммунитета слизистых оболочек, индуцированного пероральными и инактивированными полиовирусными вакцинами, против выделения вируса после перорального заражения полиовирусом
.
PLoS Pathog
2012
;
8
:
e1002599
.10.
Видор
E
.
Инактивированный вакциной против полиовируса.
In:
Plotkin
SA
,
Orenstein
WA
,
Offit
PA
, ред.
Вакцины
. 6-е изд.
Филадельфия
:
Эльзевье-Сондерс
,
2013
:
573
—
97
. 11.
Саес-Льоренс
X
,
Клеменс
R
,
Леру-Роелс
G
и др.
Иммуногенность и безопасность новой моновалентной высокодозной инактивированной вакцины против полиовируса типа 2 для младенцев: сравнительное, слепое, рандомизированное, контролируемое исследование
.
Lancet Infect Dis
2016
;
16
:
321
—
30 900 13.12.
Saleem
AF
,
Mach
O
,
Yousafzai
MT
и др.
Иммуногенность различных схем вакцинации против полиовируса: рандомизированное контролируемое исследование в Карачи, Пакистан
.
J Infect Dis
2018
;
217
:
443
—
50
. 13.
Bandyopadhyay
AS
,
Modlin
JF
,
Wenger
J
,
Gast
C
.
Иммуногенность новых схем первичной иммунизации инактивированной полиовакциной и двухвалентной пероральной полиовакциной для конечной стадии полиомиелита: обзор
.
Clin Infect Dis
2018
;
67
:
35
—
41
,14.
Генри
JL
,
Jaikaran
ES
,
Дэвис
JR
и др.
Исследование вакцинации против полиовакцина в младенчестве: выделение после заражения живым вирусом у детей, которым была введена убитая или живая полиовакцина
.
J Hyg (Лондон)
1966
;
64
:
105
—
20
.15.
Джон
J
,
Гири
S
,
Картикеян
AS
и др.
Влияние одной дозы инактивированной полиовакцины на кишечный иммунитет против полиовируса у детей, ранее получавших пероральную вакцину: открытое рандомизированное контролируемое исследование
.
Ланцет
2014
;
384
:
1505
–
12
.16.
Jafari
H
,
Deshpande
JM
,
Sutter
RW
и др.
Ликвидация полиомиелита. Эффективность вакцины против инактивированного полиовируса в Индии
.
Наука
2014
;
345
:
922
—
5
,17.
Gamage
D
,
Mach
O
,
Palihawadana
P
и др.
Повышение иммунитета слизистых оболочек после дробной инактивированной вакцины против полиовируса
.
J Infect Dis
2018
;
218
:
1876
—
82
0,18.
Морской
WM
,
Подбородок
TD
,
Гравий
CR
.
Ограничение фекальной и глоточной экскреции полиовируса у детей, вакцинированных Солком. Семейное исследование во время эпидемии полиомиелита 1 типа
.
Am J Hyg
1962
;
76
:
173
—
95
,19.
Anis
E
,
Kopel
E
,
Singer
SR
и др.
Коварная реинтродукция дикого полиовируса в Израиль
.
евро Surveill
2013
;
18
:
20586
.20.
Wahjuhono
G
,
Revolusiana
,
Widhiastuti
D
и др.
Переход с пероральной вакцины на инактивированную полиовакцину в провинции Джокьякарта, Индонезия: обзор охвата, иммунитета и эпиднадзора за окружающей средой
.
J Infect Dis
2014
;
210
(
Дополнение 1
):
S347
—
52
.21.
Shirreff
G
,
Wadood
MZ
,
Vaz
RG
,
Sutter
RW
,
Grassly
NC
.
Расчетный эффект кампаний по вакцинации инактивированного полиовируса, Нигерия и Пакистан, январь 2014 г. — апрель 2016 г.
.
Emerg Infect Dis
2017
;
23
:
258
—
63
,22.
Grassly
NC
,
Wadood
MZ
,
Safdar
RM
,
Mahamud
AS
,
Sutter
RW
.
Эффект кампаний по вакцинации против полиовируса, Пакистан, 2014-2017 гг.
.
Emerg Infect Dis
2018
;
24
:
2113
—
5
,23.
Nelson
KS
,
Janssen
JM
,
Troy
SB
,
Maldonado
Y
.
Внутрикожная фракционная инактивированная вакцина против полиомиелита: обзор литературы
.
Вакцина
2012
;
30
:
121
–
5
.24.
Zehrung
D
,
Jarrahian
C
,
Wales
A
.
Внутрикожная доставка для экономии дозы вакцины: обзор актуальных проблем
.
Вакцина
2013
;
31
:
3392
—
5
.
© Автор (ы) 2019. Опубликовано Oxford University Press для Общества инфекционных болезней Америки.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), что разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Необходимость вакцины против SARS-CoV-2
Многое зависит от разработки вакцины против SARS-CoV-2. Мы не только хотим остановить эту глобальную катастрофу, но и стремимся к возвращению к нормальной жизни. Мы хотим выбросить наши маски, обнять наших друзей и семью, навестить своих близких в домах престарелых, лично посмотреть игры с мячом, пойти в салон, попрыгать в бассейне по соседству.Чтобы делать это безопасно, нам нужна вакцина против SARS-CoV-2, которая обеспечивает прочную защиту, безопасна, производство которой можно довести до невообразимых уровней, и она будет доступна во всем мире как для богатых, так и для стран с низкими доходами. К счастью, у нас есть дорожная карта, которая может нас туда привести.
Для детей 1950-х лето могло быть временем страха. Если полиомиелит обнаружился в вашем районе, плавательные бассейны были закрыты (это трудно продать двум заядлым пловцам, живущим на другом континенте). Вызванный энтеровирусом, распространяющимся фекально-оральным путем, полиомиелит был самым опасным из всех детских вирусов из-за призрака пожизненного паралича — судьбу, хорошо понимаемую нашими отцами, обоими врачами, которые проходили самый известный в истории полиомиелит. -индуцированный паралитик, президент Франклин Д.Рузвельт во время Второй мировой войны. В 1962 году нас обоих вызвали в кабинеты медсестер в наших школах, где нам выдали кубик сахара, содержащий живую аттенуированную вакцину против полиомиелита (вакцину Сэбина). Мы оба уже получили инъекции инактивированного вируса полиомиелита (вакцина Солка). Вакцина Солка была известна своей эффективностью, но эксперты полагали, что вакцина Сэбина обеспечит лучшую защиту на всю жизнь. Ясно, что мы участвовали в общенациональном научном эксперименте без тонкостей информированного согласия или надзора со стороны Совета по мониторингу безопасности данных.Учитывая летние новостные сводки, показывающие ряд за рядом «железных легких», помогающих дышать детям с паралитическим полиомиелитом, наше общество доверилось ученым и приняло этот риск.
Наш коллега из Университета Северной Каролины (UNC), доктор Джим Брайан, недавно рассказал о своем опыте работы в качестве сотрудника службы эпидемической разведки (EIS) в Центрах по контролю и профилактике заболеваний (CDC) во время первого общенационального распространение вакцины Сэбина. Одним из первых заданий доктора Джима было расследование вспышки паралитического полиомиелита в маленьком сельском городке в Южной Каролине в изолированной начальной школе.Когда доктор Джим прибыл в школу, он принес с собой знания о том, что вакцина Солка широко доступна, безопасна и эффективна, поскольку количество случаев паралитического полиомиелита в стране резко сократилось с 54 000 до 1 000 случаев в год за предыдущее десятилетие. Доктор Джим быстро узнал, что эта вспышка в Южной Каролине произошла из-за того простого факта, что эти дети не были вакцинированы.
В связи с широким использованием вакцины Сэбина д-р Джим был членом исследовательской группы, которая определила, что случаи полиомиелита имели место среди домашних контактов (в основном взрослых) детей, получавших вакцину Сэбина.Главный хирург доктор Лютер Терри сформировал консультативную группу, в которую вошли Сабин и Солк, а также доктор Джим, чтобы проконсультировать его по вопросам безопасности пероральной вакцины против полиомиелита. После интенсивного обсуждения группа пришла к окончательному решению: вакцина Сэбина безопасна. За прошедшие десятилетия использование в первую очередь вакцины против полиомиелита Сэбина привело к искоренению полиомиелита во всем промышленно развитом мире, хотя очаги заболевания существуют в регионах Пакистана, Афганистана и Африки. По иронии судьбы вакцина Солка теперь рекомендована для использования Центром контроля заболеваний США в США.S.
Во второй половине 20-го века и в этом веке был разработан замечательный набор новых вакцин. Когда-то обычные детские вирусные инфекции, такие как корь, эпидемический паротит, краснуха и ветряная оспа, становятся редкостью из-за вакцин. Есть надежда, что раковые заболевания, связанные с гепатитом В и вирусом папилломы человека (ВПЧ), также будут ликвидированы с помощью агрессивных программ вакцинации.
Параллельно с пониманием естественной истории болезни COVID-19 и коррелятов иммунитета к этому вирусу, исследования вакцин-кандидатов продвинулись очень быстро.После первого зарегистрированного случая в декабре 2019 года вирусная этиология, вирус SARS-CoV-2 и его геномная последовательность были идентифицированы в рекордно короткие сроки. Вскоре после этого структура белка шипа (S) SARS-CoV-2 была решена с высоким разрешением, выделив потенциальную мишень вакцины.
Исследования других коронавирусных вакцин
Ключевые результаты предыдущих исследований других коронавирусных вакцин способствовали разработке вакцины против SARS-CoV-2. Исследования родственных вакцин против SARS-CoV и MERS-CoV показали, что белок-шип (S) на поверхности является идеальной мишенью для вакцины.При SARS-CoV и SARS-CoV-2 этот белок опосредует слияние с рецептором ангиотензинпревращающего фермента 2 (ACE2), и было показано, что антитела, нацеленные на S-белок, препятствуют этому связыванию и нейтрализуют вирус.
Лишь небольшое количество вакцин против SARS-CoV дошло до фазы 1 клинических испытаний, прежде чем финансирование было прекращено из-за исчезновения вируса из человеческих популяций. Вакцины против БВРС-КоВ, также нацеленные на белок S, находятся в стадии доклинической и клинической разработки, включая нереплицирующиеся вирусные векторы и вакцины на основе ДНК.
Ключевые проблемы разработки вакцин
При клинической разработке вакцин необходимо решить множество вопросов. Целью на ранних этапах разработки является определение безопасной, хорошо переносимой и иммуногенной дозы и режима дозирования. Для некоторых вакцин-кандидатов может потребоваться использование адъюванта для усиления иммунного ответа. Более поздние клинические испытания определяют потенциальную продолжительность защитного иммунитета и потенциальную потребность в повторных иммунизациях. Строгий контроль безопасности продолжается на всех этапах тестирования, а также после того, как вакцина поступит на рынок.Одна из долгосрочных проблем безопасности, которую необходимо изучить для этого вируса, заключается в том, развиваются ли у вакцинированных субъектов какие-либо иммунопатологические побочные эффекты при заражении SARS-CoV-2. У некоторых людей с тяжелыми случаями COVID-19 могут развиться иммунопатологические явления, такие как цитокиновый шторм с поражением нескольких органов. Медицинское сообщество должно отслеживать любое увеличение частоты или тяжести этого типа неблагоприятного исхода у вакцинированных.
Помимо достижения целей клинической разработки, необходимо осуществить успешную передачу технологии для увеличения производства вакцины, которая удовлетворяла бы потребность в глобальных поставках.Существует высокий финансовый риск инвестировать время и ресурсы в эти мероприятия до того, как будет доказана их значительная безопасность и иммуногенность. Тем не менее, в условиях этой пандемии некоторые крупные инвестиции делаются в рамках некоторых глобальных государственно-частных партнерств. Одним из примеров является работа, проводимая в рамках группы Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI). CEPI — международная неправительственная организация, финансируемая Wellcome Trust, Фондом Билла и Мелинды Гейтс, Европейской комиссией и 8 странами (Австралия, Бельгия, Канада, Эфиопия, Германия, Япония, Норвегия и Великобритания).CEPI занимается не только COVID-19, но и изучает способы более быстрой разработки вакцины в случае вероятности пандемии, уделяя особое внимание 5 вирусным патогенам (MERS-CoV, Lassa, Nipah, Rift Valley Fever и Chikungunya) на список приоритетов Всемирной организации здравоохранения (ВОЗ), плюс болезнь X, патоген человека, который еще не был обнаружен.
Текущее направление разработки вакцины против SARS-CoV-2
В таблице ниже перечислены типы вакцины против SARS-CoV-2 на ранней стадии клинической разработки.В настоящее время 8 экспериментальных вакцин проходят клинические испытания и более 70 вакцин находятся в стадии доклинической разработки. Платформы вакцин основаны на современных инструментах генной инженерии, а также на известных технологиях инактивации вакцин.
Существует также программа (не указанная в таблице) по перепрофилированию живой аттенуированной вакцины БЦЖ, используемой для профилактики туберкулеза, для определения того, может ли неспецифическое усиление иммунного ответа защитить от развития симптоматического заболевания у медицинских работников, подверженных риску заражения атипичной пневмонией. -CoV-2 инфекция.Исследования на мышах показали, что индуцированный БЦЖ иммунитет защищает от заражения некоторыми респираторными вирусами, включая вирусы простого герпеса типа 1 и гриппа A2. В настоящее время в Австралии и Нидерландах проходят два испытания фазы 3, в которых в общей сложности участвуют около 5670 пациентов.
| Имя | Тип вакцины | Разработчик (и) | Нормативный статус |
| мРНК-1273 | Липидная наночастица (LNP) -мРНК | Moderna / Национальный институт аллергии и инфекционных заболеваний (NIAID) | Этап 2 [Заявка утверждена] Этап 1 NCT04283461 |
| BNT162 | LNP-мРНК | BioNTech SE / Pfizer / Fosun Pharma | Фаза 1/2 NCT04368728 |
| INO-4800 | ДНК плазмида | Inovio Pharmaceuticals | Фаза 1 NCT04336410 |
| Ad5-nCoV | Нереплицирующийся вирусный вектор | CanSino Biological Inc./ Пекинский институт биотехнологии | Фаза 2 ChiCTR2000031781 Фаза 1 ChiCTR2000030906 |
| ЧАДОКС1 | Нереплицирующийся вирусный вектор | Оксфордский университет | Фаза 1/2 NCT04324606 |
| НЕТ | Вирус инактивированный | Уханьский институт биологических продуктов / Sinopharm | Фаза 1/2 ChiCTR2000031809 |
| НЕТ | Вирус инактивированный | Пекинский институт биологических продуктов / Sinopharm | Фаза 1/2 ChiCTR2000032459 |
| НЕТ | Вирус инактивированный | Sinovac | Фаза 1/2 NCT04352608 |
Вот краткое объяснение того, как работают 4 различных типа вакцин-кандидатов против SARS-CoV-2.
Липидные наночастицы-мРНК вакцины
В этой стратегии вакцины информационная РНК (мРНК) упакована в липидные наночастицы (LNP), позволяя ей проникать в клетку. Затем мРНК транслируется в белковый антиген в цитозоле. Как и другие стратегии, основанные на продукции внутриклеточного антигена, эти вакцины могут вызывать сильный Т-клеточный ответ в дополнение к ответу антител. Вакцины с LNP-мРНК в настоящее время не используются, но они разрабатываются как для лечения рака, так и для лечения инфекционных заболеваний.
мРНК-1273 — это вакцина LNP-мРНК, которая стала первым начатым испытанием вакцины против SARS-CoV-2 Фазы 1. Moderna и Исследовательский центр вакцин NIH совместно разрабатывают вакцину, которая кодирует полноразмерный стабилизированный до слияния спайк-белок (S) из SARS-CoV-2. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США недавно одобрило исследование фазы 2 мРНК-1273.
Аналогичным образом, BNT162, разрабатываемый Fosun Pharma, Pfizer и BioNTech, представляет собой вакцину LNP-мРНК. Они тестируют 4 химически модифицированных варианта мРНК, каждая из которых кодирует белок S, в объединенных испытаниях фазы 1/2 в Германии и США.С.
ДНК плазмидные вакцины
Графическое изображение вирусной частицы SARS-CoV-2 и четырех типов вакцин-кандидатов, которые в настоящее время проходят клинические испытания.
Источник: Американское общество микробиологии.
ДНК-плазмидные вакцины кодируют гены антигенов на небольшом круглом участке ДНК. Плазмида вводится в соответствующую ткань, где клетки забирают ее. Чтобы повысить эффективность и специфичность использования, некоторые компании разработали запатентованную технологию доставки.
Inovio Pharmaceuticals разработала ДНК-плазмидную вакцину-кандидат, смоделированную на основе последовательности белка S вируса. Плазмида доставляется в клетки с помощью запатентованной системы инъекций и электропорации. Одно испытание Фазы 1 проводится в США, а второе — в Южной Корее.
Нереплицирующиеся вирусные векторные вакцины
Идея использования вирусов для переноса генов в клетки человека может быть более знакома в контексте генной терапии, но вакцинологи ухватились за аналогичную идею — вирусные векторные вакцины используют оболочку вируса, способного инфицировать клетки человека, чтобы доставить 1 или более гены антигена от другого патогена (или даже патогенов).Естественная способность вируса инфицировать клетки человека остается неизменной, но инфицированные клетки производят антигенный белок (белки) вместо вирусных белков. Некоторые вирусные вакцинные векторы дополнительно сконструированы так, чтобы не реплицироваться, что обеспечивает дополнительную защиту от невозможности копировать себя внутри инфицированных клеток. В настоящее время используется множество ветеринарных векторных вакцин против вирусов, которые показали, что эта стратегия является безопасной и эффективной.
CanSino Biologics разработала новую рекомбинантную вакцину против коронавируса Ad5-nCoV, которая включает ген S SARS-CoV-2 в вектор аденовируса типа 5 (Ad5).Вектор способен доставлять ген S непосредственно в ядра многих типов клеток человека, где ген затем транслируется в антиген белка S. Кроме того, исследования показывают, что вектор Ad5 вызывает сильные антитела и Т-клеточные ответы на его трансгенные антигены. Испытания фазы I Ad5-nCoV начались в марте, а во второй фазе проводится набор.
Оксфордская группа по вакцинам при Оксфордском университете определила новую вакцину-кандидат от COVID-19, вектор вакцины против аденовируса шимпанзе под названием ChAdOx1.Иммунитет к переносчикам, ранее существовавший в человеческой популяции, является проблемой для векторов, полученных из вирусов человека, но использование вируса другого вида позволяет обойти это потенциальное осложнение. Команда Оксфорда ранее разработала вакцину MERS. Начало их комбинированного исследования Фазы 1/2 неизбежно.
Вакцины против COVID-19, инактивированные формалином и адъювантные квасцы
Инактивированные вакцины состоят из патогенов, убитых нагреванием, радиацией или химическим путем. Вакцина Солка от полиомиелита представляет собой химически инактивированную вакцину, и многие инактивированные вакцины от болезней человека используются десятилетиями.Эти вакцины обычно вызывают более слабый иммунный ответ, чем живые аттенуированные вакцины, и могут зависеть от адъюванта, способствующего более устойчивому иммунному ответу.
Sinovac разрабатывает вакцину-кандидат, инактивированную формалином и адъювантом квасцов, которая, как было показано, защищает макак-резус от инфекции SARS-CoV-2. Их объединенное испытание Фазы 1/2 продолжается. Точно так же Пекинский институт биологических продуктов и Уханьский институт биологических продуктов совместно разрабатывают инактивированную вакцину, которая проходит объединенную фазу 1/2 испытаний.
На разработку вакцины, готовой к выпуску на рынок, может уйти от 12 до 18 месяцев, если исходить из доклинического отбора вакцины-кандидата, подтверждения концепции в клинических испытаниях, расширения производства и доступности на рынке. Вакцины против SARS-CoV-2, которые в настоящее время находятся в стадии клинической разработки, могут быть лицензированы и доступны слишком поздно, чтобы повлиять на первую волну этой пандемии. Однако они могут быть полезны для снижения заболеваемости и смертности при возникновении дополнительных волн или в постпандемическом сценарии с сезонной циркуляцией SARS-CoV-2.
Поскольку мы с нетерпением ждем разработки вакцины против SARS-CoV-2, необходимо ответить на следующие вопросы.
- Будет ли вакцина вызывать защитный иммунный ответ?
- Насколько безопасна вакцина?
- Сколько будет стоить вакцина и как она будет покрываться?
- Каким образом будет определен приоритет распределения вакцины, чтобы наиболее уязвимые и их поставщики медицинских услуг получили ее в первую очередь?
- Если существует несколько конкурирующих эффективных вакцин, как это было для полиомиелита, как мы определим, какой из них отдать приоритет? Кто будет принимать эти решения?
Наконец, поскольку мы готовимся к потенциальной второй волне COVID-19 этой осенью, каждый должен сделать прививку от гриппа.Каждый год только половина взрослого населения США получает прививку от гриппа. Прививка от гриппа не идеальна, но, сделав ее, вы снизите риск госпитализации, предоставив больше ресурсов для борьбы со следующей волной COVID-19. Если вы хотите помочь себе и нашим героическим специалистам в области здравоохранения, сделайте прививку от гриппа!
ПРАЙМ PubMed | Первичная и бустерная вакцинация инактивированной полиовирусной вакциной (ИПВ) иммуногенна и хорошо переносится младенцами и детьми ясельного возраста в Китае
Citation
Li, Rongcheng, et al.«Первичная и бустерная вакцинация инактивированной полиовирусной вакциной (ИПВ) является иммуногенной и хорошо переносится младенцами и детьми ясельного возраста в Китае». Vaccine, vol. 34, нет. 12, 2016, с. 1436-43.
Li R, Li CG, Li Y и др. Первичная и бустерная вакцинация инактивированной полиовирусной вакциной (ИПВ) иммуногенна и хорошо переносится младенцами и детьми ясельного возраста в Китае. Вакцина . 2016; 34 (12): 1436-43.
Li, R., Li, C.G., Li, Y., Liu, Y., Zhao, H., Chen, X., Куриякосе, С., Ван дер Мерен, О., Хардт, К., Хезаре, М., и Рой-Ганта, С. (2016). Первичная и бустерная вакцинация инактивированной полиовирусной вакциной (ИПВ) иммуногенна и хорошо переносится младенцами и детьми ясельного возраста в Китае. Вакцина , 34 (12), 1436-43. https://doi.org/10.1016/j.vaccine.2016.02.010
Li R, et al. Первичная и повторная вакцинация инактивированной полиовирусной вакциной (ИПВ) в Китае является иммуногенной и хорошо переносимой. Вакцина. , 14 марта 2016 г .; 34 (12): 1436-43. PubMed PMID: 26873055.
TY — JOUR
T1 — Первичная и бустерная вакцинация инактивированной полиовирусной вакциной (ИПВ) иммуногенна и хорошо переносится младенцами и детьми ясельного возраста в Китае.
AU — Ли, Жунчэн,
AU — Ли, Чанг Гуй,
AU — Ли, Яньпин,
AU — Лю, Юпин,
AU — Чжао, Хун,
AU — Чэнь, Сяолин,
AU — Куриякосе, Шерин,
Австралия — Ван дер Мерен, Оливье,
AU — Хардт, Карин,
AU — Хезаре, Марджан,
AU — Рой-Ганта, Сумита,
1 год — 2016/02/09 /
PY — 2015/10/15 / получено
PY — 2016/01/26 / исправлено
PY — 2016/02/01 / принято
PY — 2016/2/14 / entrez
PY — 2016/2/14 / pubmed
PY — 2016/10/8 / medline
КВт — Booster
КВт — Китай
KW — Искоренение
KW — Инактивированная вакцина против полиовируса
KW — Оральная вакцина против полиовируса
KW — Полиомиелит
KW — Полиовирус
KW — Вакцина
SP — 1436
EP — 43
JF — Вакцина
JO — Вакцина
ВЛ — 34
ИС — 12
N2 — ВВЕДЕНИЕ. Замена живых аттенуированных пероральных полиовакцин (ОПВ) инактивированными полиовирусными вакцинами (ИПВ) является частью глобальной стратегии ликвидации полиомиелита.В 2000 году Китай был объявлен зоной, свободной от полиомиелита, но продолжает регистрировать случаи вакцино-ассоциированного полиомиелита и вспышек полиовируса вакцинного происхождения. В двух пилотных исследованиях безопасности и двух более крупных исследованиях иммуногенности оценивалась не меньшая эффективность ИПВ (Poliorix ™, GSK Vaccines, Бельгия) по сравнению с ОПВ у младенцев и ревакцинация детей ясельного возраста, получавших ИПВ или ОПВ в Китае. МЕТОДЫ. В пилотных исследованиях безопасности 25 младенцев получили первичную вакцинацию 3 дозами ИПВ (исследование A, www.clinicaltrial.gov NCT00937404), а 25 детей получили бустерную вакцинацию ИПВ после прайминга тремя дозами ОПВ (исследование B, NCT01021293).В рандомизированном контролируемом исследовании иммуногенности и безопасности (исследование C, NCT00920439) младенцы получали трехдозовую первичную вакцинацию ИПВ (N = 541) или ОПВ (N = 535) в возрасте 2,3,4 месяцев и бустерную вакцину. Доза ИПВ в возрасте 18–24 месяцев (N = 470, исследование D, NCT01323647: продолжение исследования C). Образцы крови собирали до и через месяц после введения дозы-3 и ревакцинации. Реактогенность оценивали с помощью дневниковых карточек. Серьезные нежелательные явления (СНЯ) регистрировались на протяжении каждого исследования. РЕЗУЛЬТАТЫ: Исследование A и B показало, что прайминг IPV и бустинг IPV (после OPV) были безопасными.Исследование C: через месяц после введения дозы-3 все реципиенты ИПВ и ≥ 98,3% ОПВ имели титры серопротективных антител к каждому типу полиовируса. Иммунный ответ, вызванный ИПВ, не уступал китайскому ОПВ. Титры серопротективных антител сохранялись у ≥ 94,7% реципиентов ИПВ и ≥ 96,1% реципиентов ОПВ в течение 18–24 месяцев (исследование D). IPV имел клинически приемлемый профиль безопасности во всех исследованиях. Местные и системные реакции 3 степени были редкими. Никаких СНЯ не было связано с введением ИПВ. ЗАКЛЮЧЕНИЕ. Трехвалентный ИПВ не уступает ОПВ с точки зрения серопротекции (согласно китайскому календарю вакцинации) у детей грудного и раннего возраста с клинически приемлемым профилем безопасности.SN — 1873-2518
UR — https://www.unboundmedicine.com/medline/citation/26873055/primary_and_booster_vaccination_with_an_inactivated_poliovirus_vaccine__ipv__is_immunogenic_and_well_tolerated_in_infants_and_toddlers_in_china
L2 — https://linkinghub.elsevier.com/retrieve/pii/S0264-410X(16)00136-5
БД — ПРЕМЬЕР
DP — Unbound Medicine
ER —
Новые вакцины против полиомиелита демонстрируют хороший иммунный ответ против мутировавшего штамма — прецизионные вакцины
(Прецизионные вакцины)
Клинические исследования показывают, что новая вакцина против полиомиелита может иметь потенциал для преодоления вспышек, вызванных мутировавшим штаммом полиомиелита, связанным с пероральной вакциной.
Согласно исследованиям, опубликованным 9 декабря 2020 г. в издании The Lancet , ученые разработали первую вакцину против полиовируса против мутировавшей формы болезни, которая вызывает вспышки болезней в Африке и Азии.
Эти ученые оценили два кандидата nOPV2 в параллельных клинических исследованиях у взрослых, детей младшего и младшего возраста в двух разных странах, чтобы оценить их безопасность и иммуногенность по сравнению с лицензированным mOPV2 Sabin, который они призваны заменить.
Согласно исследованию, опубликованному в журнале The Lancet, новая вакцина, разработанная так, чтобы быть генетически более стабильной, чем лицензированная оральная вакцина Сэбина, является столь же безопасной и обеспечивает аналогичный иммунный ответ при тестировании у здоровых взрослых, детей и младенцев.
Новая вакцина, известная как nOPV2, направлена против полиовируса типа 2, имеет улучшенную генетическую стабильность и с меньшей вероятностью мутирует и превращается в форму вируса, которая может вызвать инфекцию и паралитическое заболевание.
Основываясь на результатах этих клинических испытаний фазы 2, вакцина nOPV2 была рекомендована ВОЗ в Списке использования для чрезвычайных ситуаций (EUL), что делает ее первой вакциной, которая прошла этот путь и предназначена для чрезвычайных ситуаций в области здравоохранения во всем мире.
Теперь цель состоит в том, чтобы использовать вакцину для реагирования на вспышки полиовируса вакцинного происхождения, число которых растет в Африке, а также в Афганистане, Пакистане, Филиппинах, Малайзии и других странах.
Хотя лекарства нет, полиомиелит можно предотвратить с помощью вакцинации против трех типов полиомиелита, 1, 2 и 3, в трехвалентных вакцинах.
В настоящее время для борьбы со вспышками используется оригинальная пероральная вакцина Сэбина от полиомиелита 2 типа, что может привести к возникновению новых вспышек в районах с постоянно низким охватом иммунизацией.
Ведущий автор исследования на взрослых, профессор Пьер Ван Дамм из Университета Антверпена в Бельгии говорит: «Миллионы людей потенциально не имеют иммунитета к распространению вируса вакцинного происхождения, которое возникает, когда ослабленный живой вирус перорально Вакцины против полиомиелита мутируют и восстанавливают свою способность превращаться в инфекцию, вызывать заболевание и распространяться в сообществах с низкими показателями вакцинации.”
«Вакцина nOPV2 кажется, по крайней мере, такой же безопасной и эффективной, как вакцина Сэбина, и генетически более стабильной, и может стать ключевым прорывом на пути к миру, свободному от полиомиелита».
В странах с низким и средним уровнем доходов оральная вакцина используется из-за ее низкой стоимости и простоты использования, требующей всего две капли на дозу, а также потому, что она вызывает кишечный иммунитет, который снижает передачу живого вируса в условиях плохой санитарии. .
В большинстве стран с высоким уровнем доходов используется более дорогая инъекционная вакцина, которая содержит инактивированные вирусы, не способные вызывать заболевание, но не индуцирующая кишечного иммунитета, а это означает, что вакцинированные лица все еще могут распространять вирус, полученный через рот.
В последние годы усилия по искоренению были затруднены из-за учащающихся вспышек циркулирующего полиовируса вакцинного происхождения (цПВВП), причем более 90% случаев были вызваны мутациями в штамме полиовируса типа 2.
Именно этот риск привел к глобальному отказу от компонента типа 2 из пероральной трехвалентной вакцины в мае 2016 года. Однако эти усилия не смогли обуздать все случаи передачи полиовируса 2 типа, при этом число случаев цПВВП 2 типа увеличилось с 71 в 2018 году до 739 случаев в 2020 г. (по состоянию на 3 декабря 2020 г.).
В ответ на это ВОЗ 22 октября 2020 г. сохранила свою категоризацию цПВВП 2 типа как чрезвычайную ситуацию в области общественного здравоохранения, имеющую международное значение.
Полиомиелит — это очень заразное вирусное заболевание, которое в основном поражает детей в возрасте до пяти лет, причем примерно одна из 200 инфекций приводит к параличу. Из парализованных до 10 процентов умирают, когда их дыхательные мышцы становятся неподвижными.
Для решения этой глобальной чрезвычайной ситуации Глобальная инициатива по ликвидации полиомиелита поддержала разработку более генетически стабильных полиовирусов типа 2 для вакцин.
Как и лицензированная моновалентная пероральная вакцина Сэбина типа 2 (mOPV2), новые пероральные вакцины-кандидаты (nOPV2-c1 и nOPV2-c2) получены из живого инфекционного вируса, но были модифицированы, чтобы снизить вероятность возврата к вирусу. тип вируса, который в редких случаях может вызвать инфекцию и заболевание.
Поскольку исходный mOPV2 Sabin был отозван в 2016 году, до того, как были разработаны кандидаты nOPV2, было невозможно сравнить вакцины в одно и то же время.
По этой причине бельгийские исследователи провели два рандомизированных испытания на здоровых бельгийских взрослых (в возрасте 18-50 лет): проспективное исследование фазы 4 мОПВ2 Sabin с января по март 2016 г. (до глобального прекращения применения), чтобы предоставить исторические контрольные данные, и фазу 2 исследования обоих кандидатов nOPV2 с октября 2018 г. по февраль 2019 г. Участники обоих испытаний ранее были полностью вакцинированы против полиомиелита в рамках плановой иммунизации.
В историческом контрольном исследовании приняли участие 100 участников, которые получили одну или две дозы mOPV2 Сэбина.В исследовании фазы 2 250 добровольцев были случайным образом распределены для получения одной или двух доз кандидата нОПВ2 или плацебо с интервалом 28 дней. Иммунные ответы оценивали в день вакцинации, а затем через 4 недели после их первой и второй вакцинации. Участники записывали любые побочные эффекты на протяжении всего исследования.
Результаты показали, что оба кандидата нОПВ2 были так же безопасны и хорошо переносились, как мОПВ2, и вызывали аналогичный иммунный ответ — достижение 100% серопротекции (ответ антител, способный предотвратить инфекцию) после одной дозы для обоих кандидатов нОПВ2 по сравнению с 97% и 98% для одной или двух доз мОПВ2.
После этих многообещающих результатов по безопасности у полностью вакцинированных взрослых исследователи провели в Панаме два рандомизированных испытания на здоровых маленьких детях (в возрасте 1-4 лет) и младенцах (в возрасте 18-22 недель), которые ранее были иммунизированы существующими вакцинами: исторический контроль исследование фазы 4 с мОПВ2 по Сэбину с октября 2015 года по апрель 2016 года (до глобальной отмены) и исследование фазы 2 с низкими и высокими дозами двух кандидатов нОПВ2 с сентября 2018 по сентябрь 2019 года.
В целом, 150 детей (50 в контрольном исследовании и 100 в исследовании нОПВ2) и 684 младенца (110 в контрольной группе и 574 в исследовании нОПВ2) были зарегистрированы и получили по крайней мере одну вакцинацию в рамках исследования.Иммунные ответы оценивали через 1 и 4 недели после первой вакцинации и через 4 недели после второй вакцинации. Родители регистрировали любые побочные эффекты в течение 28 дней после каждой вакцинации.
Результаты показывают, что у младенцев одна или две дозы обоих кандидатов нОПВ2 были безопасными и хорошо переносились, с иммуногенностью, аналогичной мОПВ2, несмотря на то, что реципиенты мОПВ2 имели более высокий исходный иммунитет в начале исследования.
У кандидатов на nOPV2 также была более низкая скорость выделения стула через 28 дней после вакцинации, чем у mOPV2 в контрольном исследовании.
Ведущий автор исследований у детей и младенцев, доктор Рикардо Рюттиманн из американской некоммерческой организации «Борьба с инфекционными заболеваниями в развивающихся странах», говорит: «Наши результаты показывают, что оба новых кандидата OPV2 безопасны, хорошо переносятся и обладают иммуногенностью у молодых людей. дети и младенцы ».
«Тем не менее, постоянный мониторинг на местах и дополнительные исследования укрепят эти наблюдения, чтобы подтвердить безопасность и эффективность вакцины, поскольку она используется в соответствии с EUL для реагирования на вспышки.”
«В конечном итоге, чтобы искоренить все формы полиомиелита, страны должны улучшить плановые и дополнительные кампании иммунизации, чтобы охватить достаточное количество детей, чтобы повысить иммунитет населения на достаточно высоком уровне, чтобы вирус больше не выжил».
Авторы исследования отмечают некоторые ограничения своих исследований, в том числе то, что они включали всего 1200 человек.
По-прежнему потребуется дополнительная информация о долгосрочной безопасности и продолжительности защиты. Они также отмечают, что, хотя исследования были разработаны таким образом, чтобы их можно было согласовать, насколько это возможно, с точки зрения исследовательских центров, населения, дизайна и анализа, прямое сравнение оказалось невозможным из-за отмены мОПВ2 в мире в 2016 году.
Исследование среди взрослых спонсировалось Университетом Антверпена при финансовой поддержке Фонда Билла и Мелинды Гейтс.
Исследование на детях и младенцах спонсировалось фондом «Борьба с инфекционными заболеваниями в развивающихся странах» при финансовой поддержке Фонда Билла и Мелинды Гейтс.