СИНДРОМ ПАТАУ (ТРИСОМИЯ 13) — Med24info.com
СИНДРОМ ПАТАУ (ТРИСОМИЯ 13)
По многочисленным обобщающим данным, частота синдрома Патау, описанного в 1960 г., колеблется в пределах 1:700—1:8000. Как при болезни Дауна, дети с синдромом Патау чаще рождаются у матерей старшего возраста. Так, по данным Р. Сопеп и В. Erkman (1966), средний возраст матерей, родивших детей с трисомией 13, равен 32,8 года. Частота синдрома Патау среди обоих полов одинакова. Цитологически этот синдром, как и болезнь Дауна, представлен двумя вариантами: простой трисомией и транслокационной формой. В основе синдрома Патау лежит нерасхождение по 13-й паре хромосом. В кариотипе больного наблюдается 47 хромосом с лишней хромосомой 13. При транслокационном варианте в кариотипе больного имеется 46 хромосом. Уменьшение числа хромосом происходит чаще всего в результате слияния двух хромосом группы D (13—15). Следует заметить, что средний возраст матерей, родивших детей с транслокацией хромосом D/D, не превышает 25 лет.
Внешний вид больных с синдромом Патау весьма специфичен. Больные новорожденные имеют нормальные
размеры и массу тела. Клинически отмечаются резкая умственная отсталость, выраженная микроцефалия, неправильно сформированные и низко расположенные уши, аномалии глазного яблока (микрофтальмия и анофтальм), одно- или двустороннее незаращение губы и неба, полидактилия, повышенная гибкость суставов, врожденные пороки внутренних органов (кардиоваскулярной и мочевой систем, желудочно-кишечного тракта), часто наблюдаются судороги. По данным М. С. Игнатовой и Ю. Е. Вельтищева (1978), пороки указанных систем бывают настолько выраженными, что, как правило, дети быстро умирают. Из других клинических симптомов следует отметить гемангиомы на коже лица и рук, флексорную деформацию пальцев кисти, деформацию стопы, пупочные и пахово-мошоночные грыжи, крипторхизм, глухоту. Глухота у больных с трисомией 13 встречается в 80— 85 % случаев. Чаще всего изменения ограничены средним ухом и нижней частью внутреннего уха [Конигсмарк Б.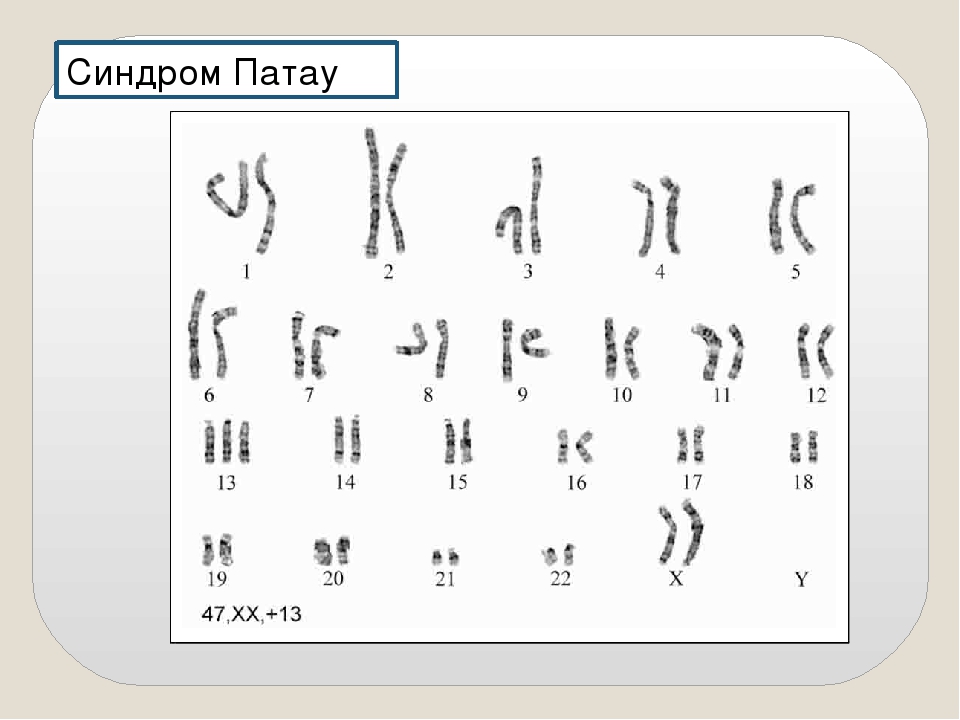 В., Горлин Р. Д., 1980].
В., Горлин Р. Д., 1980].
При патологоанатомическом исследовании бросаются в глаза множественные внешние и внутренние уродства практически всех органов и систем. Масса мозга уменьшена, часто отсутствует передний мозг, отмечается недоразвитие обонятельных луковиц и обонятельных трактов, мозжечок уродлив или недоразвит, наблюдается гетеротопия клеток мозга, отсутствует III желудочек, иногда мозг не разделен на полушарии. Часто обнаруживаются дефекты межжелудочковой и межпредсердной перегородок, камеры сердца расширены. В легких фиброз, умеренный ателектаз, явления хронической неспецифической пневмонии. Отмечаются аномалии почек (гидронефроз, кистозная почка), мочеточников (удвоение) и желудочно-кишечного тракта (меккелев дивертикул, аномалии поворота кишечника). Патология почек и мочевыводящих путей наблюдается в 61,5% случаев.
Параклинически синдром Патау изучен менее подробно, чем синдром Дауна. Сколько-нибудь значительных изменений клеточного состава и биохимических показателей крови не обнаружено.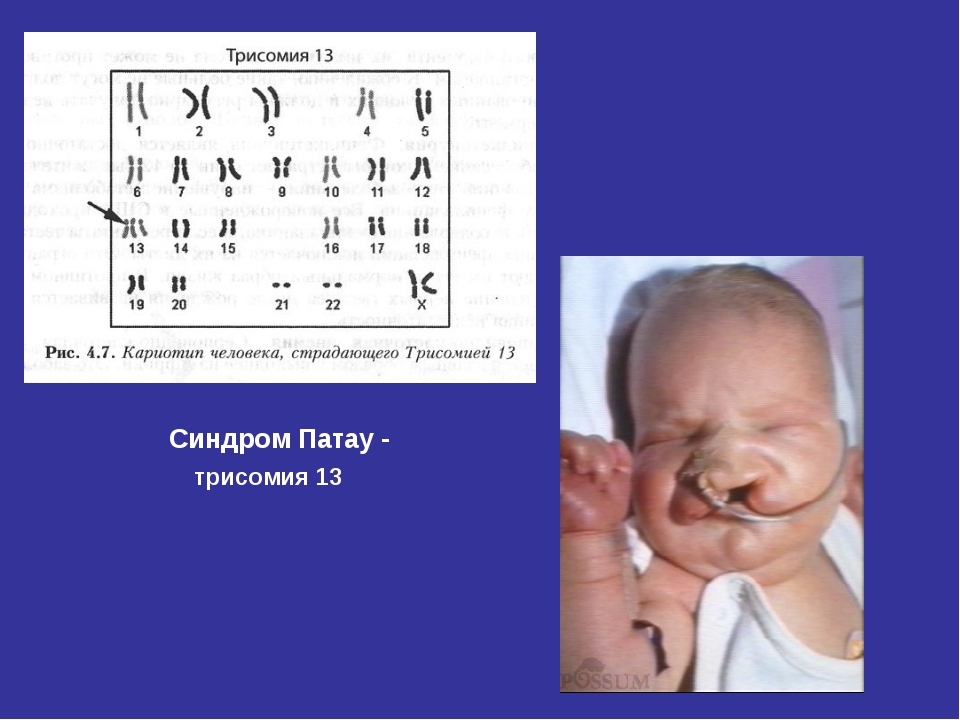 При биохимическом исследовании выявляются аномалии гемоглобина и уменьшение его содержания.
При биохимическом исследовании выявляются аномалии гемоглобина и уменьшение его содержания.
На основании клинических, дерматоглифических параклинических и патологоанатомических данных диагноз поставить несложно. Окончательно он подтверждается цитогенетически. Следует отметить крайне важное для практического врача обстоятельство — трисомные и транслокационные формы синдрома Патау по клиническим признакам практически не отличимы друг от друга, Поэтому цитогенетическое исследование у больных для дифференциальной диагностики этих форм обязательно. При транслокационном варианте трисомии 13 вероятность повторного рождения аномального потомства достигает 25 %, а при трисомном варианте она, вероятно, не превышает аналогичных показателей при болезни Дауна (1—2%). Прогноз при синдроме Патау неблагоприятен, успешных методов лечения нет.
Источник: Лильин Е. Т., Богомазов Е. А., Гофман-Кадошни- ков П. Б., «Генетика для врачей. » 1990
» 1990
А так же в разделе «СИНДРОМ ПАТАУ (ТРИСОМИЯ 13) »
что это такое (фото), кардиотип, диагностика и прогноз
Синдром Патау представляет собой тяжёлую врождённую патологию, имеющую генетическую природу. Хромосомное заболевание встречается с частотой один случай на семь – четырнадцать тысяч новорожденных, мальчики и девочки одинаково подвержены недугу. Проявляется синдром в многочисленных аномалиях развития органов, зачастую несовместимых с жизнью.
Причины возникновения синдрома Патау
В геноме человека содержится 23 пары хромосом. Любые отклонения в их количестве или структуре ДНК приводят к аномалиям развития организма.
Состояние, когда в паре появляется лишняя третья хромосома, носит название трисомия. Генная мутация ведёт к рождению ребёнка с отклонениями в развитии.
Трисомия по 13 хромосоме (синдром, описываемый далее) означает, что именно в тринадцатой паре нуклеопротеидных структур, содержащих наследственную информацию, произошла мутация.
Синдром Патау, при котором изменён кариотип, характеризуется случайным возникновением дефекта при формировании половых клеток родителей – яйцеклетки или сперматозоида. Цитогенетические варианты развития болезни различны, но чаще всего встречаются два из них:
- Простая трисомия проявляется наличием трёх гомологичных хромосом вместо двух.
- Центрическое слияние. Представляет собой соединение двух акроцентрических хромосом, которыми и являются структуры тринадцатой пары.
Заболевание, его клинические проявления и отличие от других недугов были описаны датским медиком Расмусом Бартолином ещё в XVII веке. Обусловленность патологии дефектами генотипа была определена в шестидесятые годы XX века доктором Клаусом Патау.
Синдром Патау, причиной которого является мутация генов, имеет следующие возможные факторы развития:
- Фактор случайности. Внезапный дефект формирования хромосомного набора во время созревания гамет или образования зиготы.

- Наследственность. Если одному из родителей присущ так называемый кариотип Робертсона (описанный выше эффект центрического слияния), то с высокой долей вероятности у него родится ребёнок с трисомией 13. Точный патогенез в данном случае неизвестен. Люди с робертсоновской транслокацией ничем не отличаются от других внешне, и патология не проявляется внутренними особенностями. До рождения у них ребёнка с одним из видов хромосомных мутаций и проведения соответствующих исследований ДНК такие люди не подозревают о наличии у себя подобных аномалий.
- Радиация. Предположение о влиянии данного фактора основано на описании синдрома для тихоокеанских племён после того, как испытания ядерного оружия в регионе вызвали радиационное заражение.
- Возраст матери. Доказано, что чем старше женщина, тем больше вероятность генетических мутаций и рождения нежизнеспособных детей.
К вероятным факторам относят высокий уровень загрязнённости окружающей среды (плохая экологическая ситуация в регионе проживания родителей), половые контакты между родственниками.
Характерные признаки недуга
Синдром Патау характеризуется признаками внешнего характера:
- Небольшой (ниже нормы) вес плода – менее двух килограммов.
- Микроцефалия (череп маленьких размеров, вследствие чего голова по отношению к телу небольшая).
- Лоб низкий, скошенный.
- Узкие глазные щели, узко посаженные глаза, отсутствие части глазной оболочки.
- Запавшая переносица при широком основании носа.
- Дефекты строения ушных раковин.
- Волчья пасть – расщепление нёба и верхней губы, в данном случае чаще всего симметричное.
- Короткая шея.
- Аномалии развития конечностей – большее количество пальцев на кистях рук или на ногах.
Совокупность внутренних и внешних проявлений даёт основание для постановки диагноза. Синдрому Патау присущи симптомы, связанные с аномалиями внутренних органов:
- Центральная нервная система характеризуется такими отклонениями, как уменьшение размеров головного мозга, недоразвитие некоторых его структур и отделов.
 Это приводит к задержке умственного и физического развития, расстройствам психики.
Это приводит к задержке умственного и физического развития, расстройствам психики. - Сердечные патологии: дефекты перегородок, другие формы порока.
- Несоответствие норме диаметра сосудов по всему телу.
- Гормональные дисфункции, связанные с недоразвитием мозговых структур, ответственных за выработку гормонов.
- Нефизиологичное расположение внутренних органов.
- Со стороны репродуктивной системы – гипоплазия половых органов.
- Снижение или полное отсутствие слуха, зрения, связанное с аномалиями строения соответствующих органов.
- Мочевыделительная система характеризуется отклонениями в строении мочевого пузыря, увеличением почек.
- Врождённые пупочные грыжи.
- Фиброкистозные изменения поджелудочной железы.
Во время беременности у женщины, вынашивающей ребёнка с синдромом Патау, может быть диагностировано многоводие, роды происходят раньше времени – в 38 недель. На ранних сроках возможны выкидыши – организм матери отторгает нежизнеспособный эмбрион.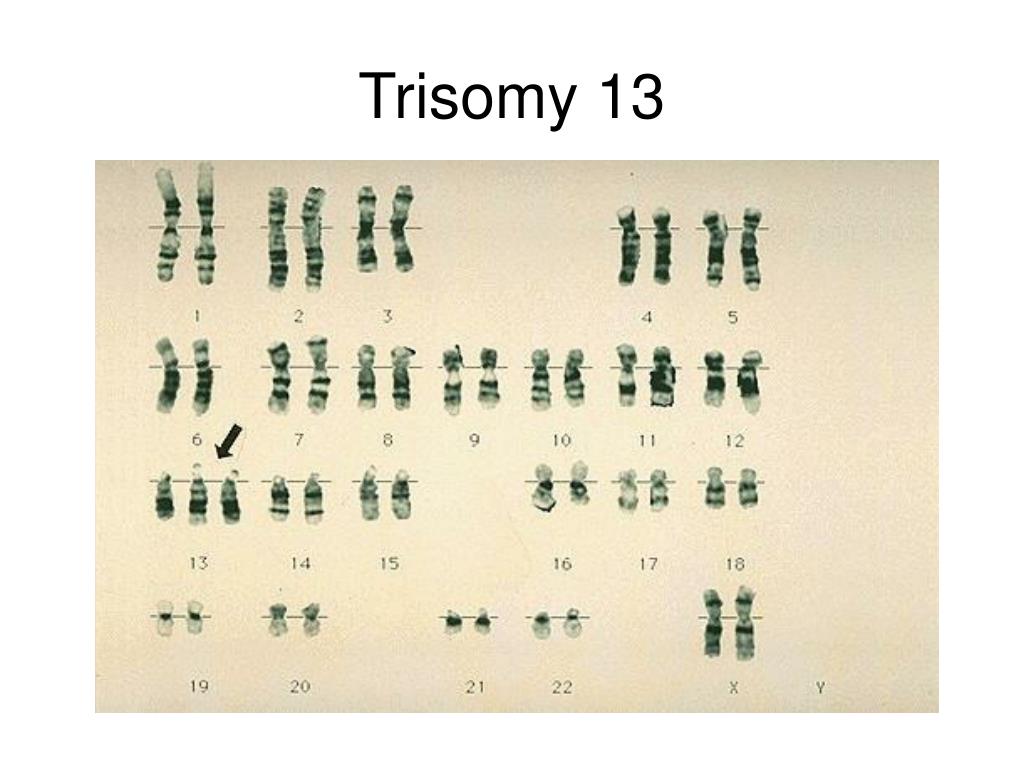
Диагностическое подтверждение патологии
Диагностика патологии может быть проведена ещё при беременности, на разных её сроках. После рождения ребёнка диагноз подтверждается на основании симптомов, наблюдающихся у новорожденного.
При беременности
Пренатальная диагностика на ранних сроках беременности позволяет определить патологию и принять решение относительно дальнейших действий.
Первый скрининг включает в себя лабораторные исследования крови, взятой из вены, и УЗИ. Проводится такое обследование между одиннадцатой и тринадцатой неделями – именно этот срок является минимальным для того, чтобы обнаружить значимые изменения развития эмбриона. Консультация беременных предполагает информирование женщин о вероятном прогнозе для ребёнка в случае наличия хромосомных аномалий.
Анализ крови предполагает исследование таких параметров, как ХГЧ и плазменный белок А (PAPP-A).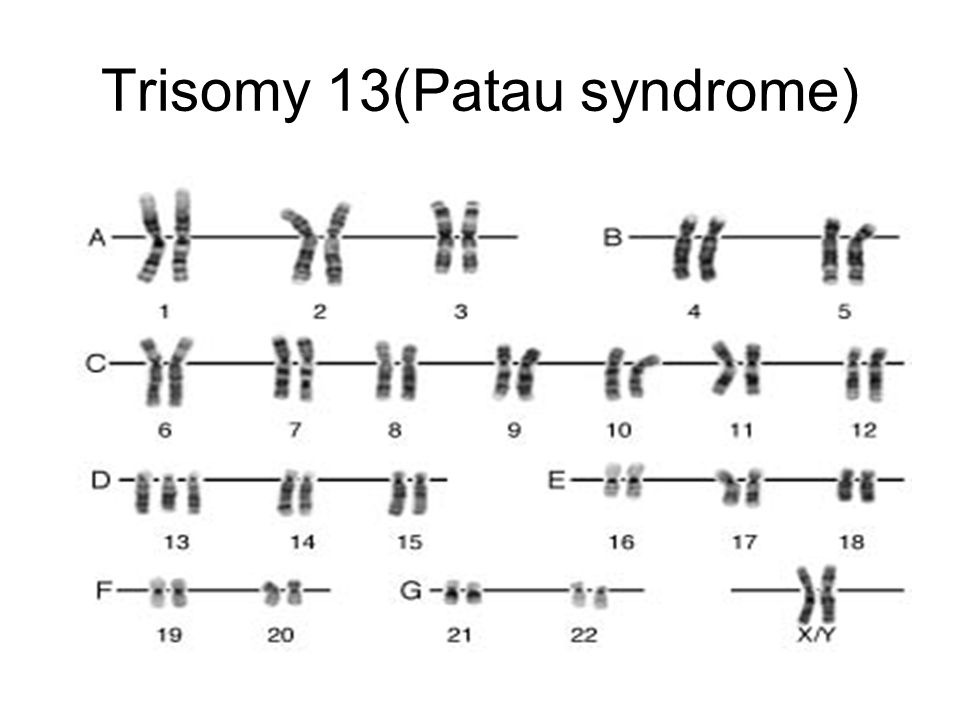 Последний в случае развития трисомии значительно снижен.
Последний в случае развития трисомии значительно снижен.
Ультразвуковое исследование плода при наличии синдрома показывает:
- тахикардию;
- отставание в развитии;
- дефекты формирования головного мозга;
- аномальный размер мочевого пузыря.
При подозрении на трисомию проводятся дополнительные исследования: анализ клеток ворсин хориона (берётся плацентарная ткань), изучение околоплодных вод и пуповинной крови. Каждое из исследований проводится на определённом сроке, все они инвазивны, предполагают хирургическое вмешательство, в процессе которого есть угроза для матери и плода.
Современная медицина даёт женщине возможность сделать неинвазивный пренатальный тест ДНК. Если расшифровка теста свидетельствует о низком риске развития синдрома, то использовать хирургические методы исследования нет необходимости. В случае когда тест показывает высокую вероятность патологии, необходимо всё же прибегнуть к инвазивным способам. Только их результаты могут стать основанием для искусственного прерывания беременности.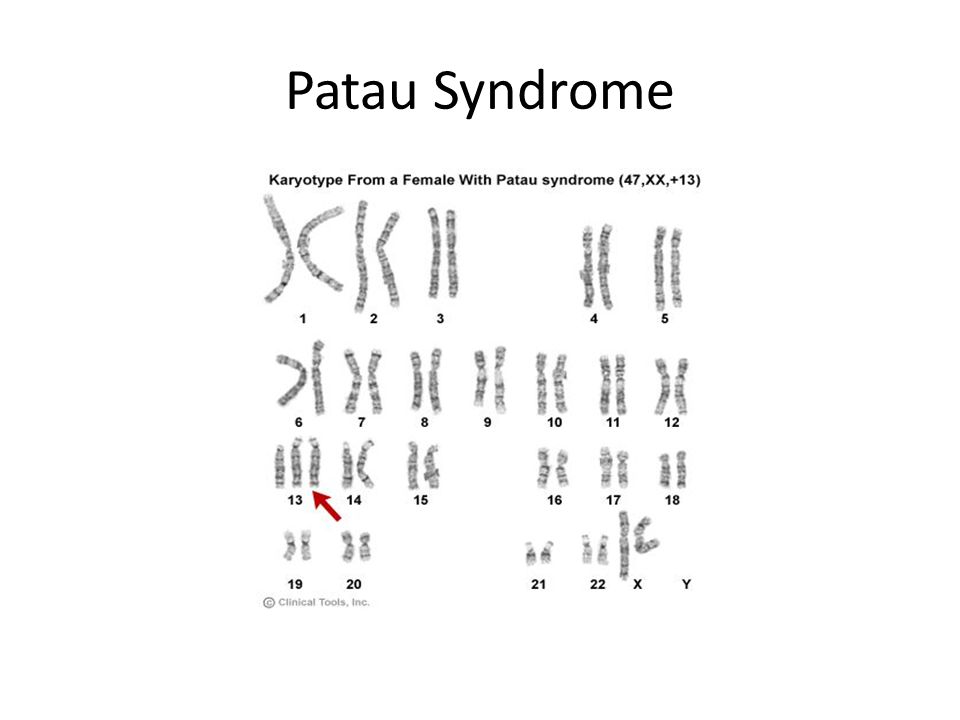
У новорожденных
Результаты обследований беременной женщины дают основание предполагать с высокой долей вероятности развитие у ребёнка описываемого синдрома. Осмотр новорожденного в данном случае подтверждает диагноз. На фото разных детей, страдающих синдромом, прослеживаются схожие признаки. При осмотре критериями являются:
- форма черепа;
- аномалии развития лица;
- патологии строения пальцев рук и ног.
Если по каким-то причинам во время вынашивания плода не были проведены соответствующие исследования, новорожденному могут быть дополнительно проведены:
- ультразвуковое исследование органов брюшной полости;
- эхокардиография;
- нейросонография.
Рекомендации по лечению
Лечение синдрома Патау, к сожалению, невозможно. Терапия сводится лишь к тому, чтобы хирургическим путём устранить некоторые дефекты внутреннего и внешнего развития, а также оказать паллиативную помощь.
Опасность недуга, прогноз и профилактика
Говорить о мерах предотвращения заболевания нецелесообразно, поскольку мутация носит внезапный характер. Тем не менее если у родителей были выявлены отклонения (например, робертсоновская транслокация) и особенно если были случаи рождения детей с хромосомными аномалиями, перед зачатием рекомендуется пройти обследования. В период вынашивания плода таким парам также предлагают дополнительные анализы и исследования.
Тем не менее если у родителей были выявлены отклонения (например, робертсоновская транслокация) и особенно если были случаи рождения детей с хромосомными аномалиями, перед зачатием рекомендуется пройти обследования. В период вынашивания плода таким парам также предлагают дополнительные анализы и исследования.
Поскольку считается, что может прослеживаться взаимосвязь между развитием синдрома и возрастом матери, рекомендуется ответственно подходить к вопросу планирования семьи.
К возможным мерам первичной профилактики можно отнести проживание в районах с хорошими показателями экологии и отсутствие радиационного облучения.
Опасность синдрома в том, что множественные патологии внутренних органов бывают несовместимы с жизнью.
Прогноз для рождённых с трисомией 13 неблагоприятный. Медиана выживаемости (время, к которому умирает 50% больных) составляет 2 дня. Небольшой процент пациентов доживает до года.
При минимальных врождённых дефектах, своевременной хирургической коррекции патологий и должном уходе такие дети могут прожить до возраста 5–10 лет. Тяжёлая умственная отсталость и задержка в психическом развитии сопровождают пациентов на протяжении их жизни.
Тяжёлая умственная отсталость и задержка в психическом развитии сопровождают пациентов на протяжении их жизни.
Загрузка…
синдром патау кариотип — 14 рекомендаций на Babyblog.ru
Репродуктивные гормоны и маркеры ФПК
Фолликуло-стимулирующий гормон, лютеинизирующий гормон
ФСГ и ЛГ секретируются гонадотропными клетками передней доли гипофиза. Гонадотропины ФСГ и ЛГ, хориогонадотропин ХГ и тиротропин ТТГ являются гликопротеинами, молекулы которых состоят из двух ковалентно связанных субъединиц, а и ß . а-субъединицы ФСГ, ЛГ, ТТГ и ХГ идентичны, а ß-субъединицы специфичны для каждого гормона и определяют их биологическую активность. Небольшое количество свободных субъединиц могут циркулировать в крови, однако возможность любого из биологических эффектов реализуется лишь при условии ассоциации а-цепи с ß-цепью.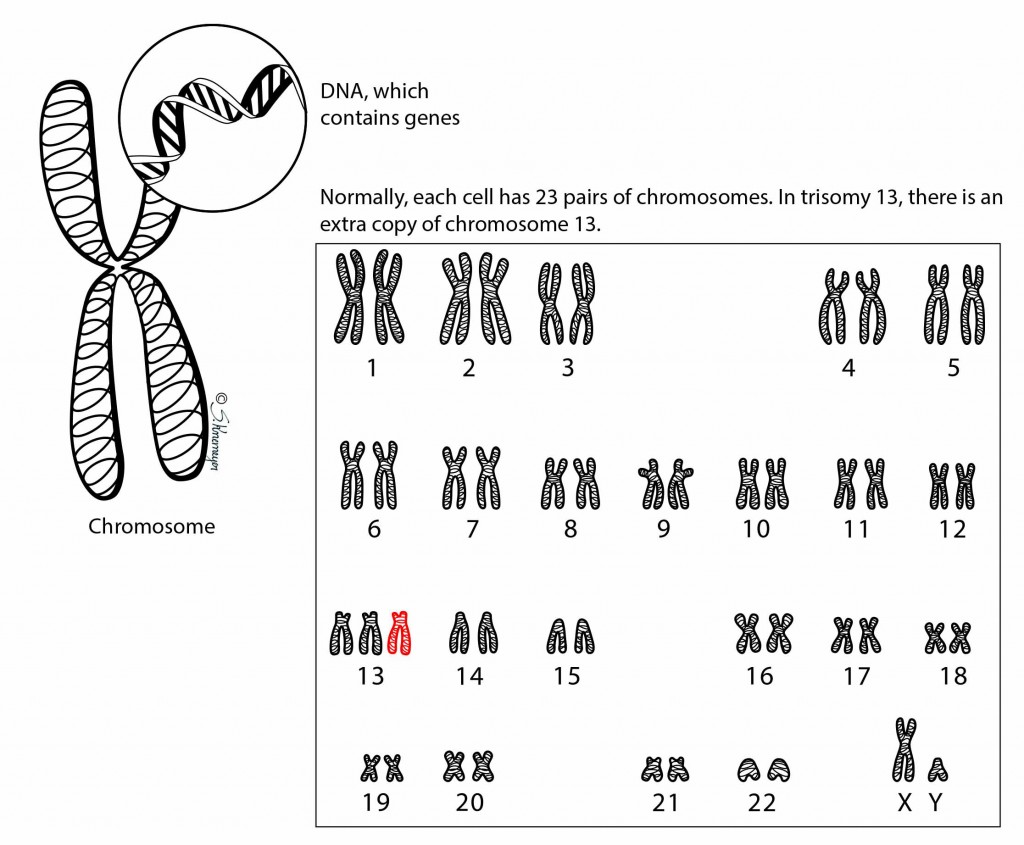 Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
а) Гонадотропин-рилизинг гормон ( Gn — RH ), известным также как ЛГ-рилизинг гормоном ( LH — RH ), или как люлиберин. LH — RH является декапептидом, секретируемым гипоталамусом. LH — RH и его синтетические химические аналоги широко используются в терапевтических и диагностических целях (LH-RH-тест). LH — RH секретируется в портальную венозную систему гипофиза, где он стимулирует образование и пульсирующую секрецию ЛГ и, в меньшей степени, ФСГ.
б) стероидными гормонами, вырабатываемыми половыми железами. Именно эстрогены и гестагены контролируют секрецию гонадотропина по принципу положительной или отрицательной обратной
в) ингибином (гликопротеином, синтезируемым клетками Сертолли в процессе сперматогенеза и специфически ингибирующим секрецию ФСГ).
Эффект гонадотропинов реализуется через специфические рецепторы на поверхности клеточной мембраны. В этом процессе участвует важный межклеточный медиатор циклический аденозин монофосфат (цАМФ, сАМР).
Гонадотропины выводятся из организма с мочой. Так как их биологическая активность и иммунологические свойства в значительной мере остаются неизменными, концентрация этих гормонов в моче здоровых людей соответствует их концентрации в периферической крови.
Функции гонадотропинов у детей
У детей препубертатного периода уровни гонадотропинов и половых стероидов очень низкие. Во время пубертатного периода чувствительность гипофиза к LH — RH возрастает, в результате чего увеличивается секреция гонадотропинов, секреция половых стероидов и развиваются вторичные половые признаки.
Функции гонадотропинов у мужчин
У мужчин ЛГ стимулирует синтез тестостерона в клетках Лейдига, ФСГ стимулирует сперматогенез, синтез ингибина и андроген-связывающего белка в семенных канальцах, а также превращение тестостерона в 17- ß-эстрадиол в клетках сертоли. И тестостерон, и эстрогены оказывают ингибирующий эффект на секрецию гонадотропина посредством гипоталамического подавления L Н- RH.
Функции гонадотропинов у женщин
а) У женщин детородного периода секреция гонадотропинов является наиболее важным условием поддержания менструального цикла. В последние несколько дней предыдущего цикла снижение концентрации стероидных гормонов повышает секрецию ФСГ, что стимулирует рост нескольких граафовых пузырьков. Один из фолликулов развивается более интенсивно, остальные — атрофируются. Растущий созревающий фолликул продуцирует повышающиеся количества эстрогенов, которые оказывают мягкий ингибирующий эффект на секрецию ФСГ. В конце фолликулярной фазы секреция эстрогенов резко возрастает и достигает максимума непосредственно перед овуляцией. Обратная связь концентраций гормонов из отрицательной становится положительной, что выражает ся в овуляторных пиках уровней ЛГ и ФСГ. Овуляция, завершающаяся разрывом фолликула и превращением его в желтое тело, приводит также к падению уровней гонадотропинов и эстрогенов на фоне повышающегося уровня прогестерона. Лютеинизация гранулезных клеток наступает при вторичном подъеме концентрации эстрогенов параллельно с возрастанием уровня прогестерона до максимума в середине лютеиновой фазы.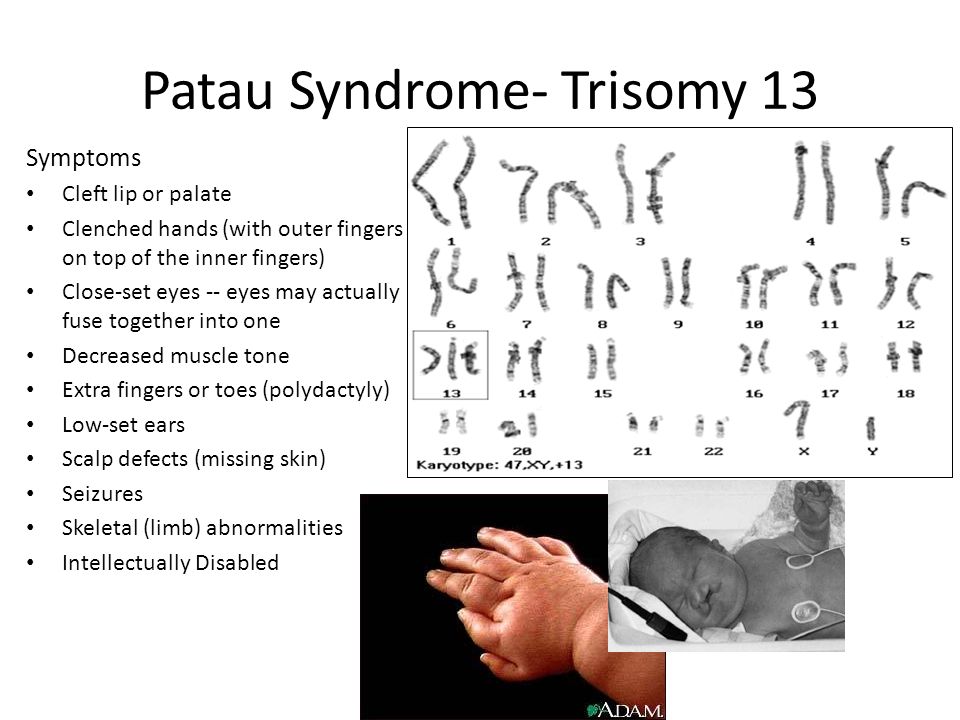 Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.
Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.
б) В перименопаузе циклическая активность яичников снижается вплоть до полного угасания. Циклы в перименопаузе часто бывают ановуляторными и характеризуются значительной флюктуацией уровней стероидных и гипофизарных гормонов. В последствии все примордиальные фолликулы перестают реагировать на гонадотропную стимуляцию под воздействием стероидных гормонов.
в) В менопаузе исчезает отрицательная обратная связь и уровни гонадотропинов, в частности, ФСГ, значительно повышаются по сравнению с детородным периодом.
Рис.1. Динамика концентраций гонадотронпинов (ГТ), эстрадиола (Е2) и прогестерона (Пр) в крови на протяжении менструального цикла и при наступлении беременности.
Патология женщины детородного периода
Если исключается возможность гиперпролактинемии, определение ФСГ представляет собой первую часть исследований нарушений менструального цикла. Рекомендуется проводить одно временное определение ФСГ, ЛГ и пролактина в первой пробе крови. Повышенные уровни ФСГ обычно являются индикатором необратимой недостаточности функции яичников (за исключением очень редкого синдрома резистентности яичников). Пониженная или нормальная концентрация ФСГ при пониженной концентрации ЛГ имеет место при нарушении функции гипофиза или гипоталамуса. Если секреция эстрогенов понижена (при отрицательном анализе на прогестерон), овуляцию можно индуцировать гонадотропинами (Прегонал) или пульсирующим введением LH — RH . Если секреция эстрогенов в норме, лечение нужно начать с кломифена. Незначительное повышение концентрации ЛГ при нормальной концентрации ФСГ может наблюдаться при синдроме поликистозных яичников (РСО, синдром Штейна-Левенталя). Возникновение синдрома связано с гиперсекрецией андрогенов и замедленным синтезом эстрогенов яичниками, что компенсируется их ускоренным синтезом в периферии. Таким образом, уровень эстрогенов в сыворотке крови остается в норме. Довольно часто в этом случае наблюдается незначительная гиперпролактинемия.
У женщин с анорексией уровень гонадотропинов понижен. При стимуляции LH — RH наблюдается повышение содержания ФСГ, уровень ЛГ остается неизменным или незначительно возрастает.
Девочки пубертатного периода
При замедленном половом развитии диагностика проводится по схеме, приведенной для случаев недостаточности яичников. При повышенном уровне ФСГ необходимо провести полное эндокринологическое и генетическое обследование.
В случаях преждевременного созревания концентрация гонадотропинов часто бывает повышен ной по сравнению с нормальными для данного возраста уровнями. Диагностический тест с LH — RH часто приводит к резкому повышению секреции ЛГ.
У женщин в менопаузе пониженное содержание гонадотропинов наблюдается при проведении заместительной терапии ( HRT ) или у пациенток с эстроген-продуцирующими опухолями. Низкие уровни гонадотропинов также обнаруживаются при гипофизарной недостаточности.
Мужчины
Определение ФСГ проводят в случае подозрения на недостаточность половых желез в результате обнаружения азооспермии или олигоспермии. Высокий уровень ФСГ указывает на первичную тестикулярную недостаточность.
Показания к проведению исследований:
Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Недостаточность яичников
• Синдром поликистоза яичников
• Анорексия
• Гипофизарная недостаточность
Девочки пубертатного периода:
• Гипофизарная недостаточность
• Преждевременное половое созревание
• Замедленное половое созревание
• Недостаточность яичников
• Анорексия
Женщины в менопаузе:
• Гипофизарная недостаточность
• Метроррагия
• Гормональная заместительная терапия ( HRT )
Мужчины:
• Гипофизарная недостаточность
• Азооспермия, олигоспермия
Подготовка проб для анализа и содержание гонадотропинов в норме.
Уровни гонадотропинов не имеют циркадного ритма. Пульсирующий характер секреции с интервалами в 1-2 часа особенно характерен для ЛГ, поэтому результаты единичных анализов следует считать приблизительными. Образцы сыворотки или плазмы крови после образования сгустков и/или отделения эритроцитов стабильны в течение времени, достаточного для пересылки образцов по почте. Замороженные образцы можно хранить в течение длительного периода времени.
Не рекомендуется использовать гемолизированные, липемические или иктерические образцы, так как это может оказать влияние на результаты анализа. Снижение уровня гормонов может наблюдаться при приеме оральных контрацептивов, фенотиазинов, эстрогенов.
Современные иммуноанализы ЛГ и ФСГ основаны на использовании моноклональных антител, которые не имеют перекрестной реакции с ХГ.
ФСГ, (мМЕ/л)
ЛГ, (мМЕ/л)
Мужчины
0,7-1,1
0,8-7,6
Женщины
Фолликулярная фаза
2,8 — 11,3
1,1-11,6
Овулятрный пик
5,8-21
17-77
Лютеиновая фаза
1,2-9,0
0-14,7
Постменопауза
21,7-153
11,3-40
Препубертатные дети
<1
<1
Биологический материал :
• сыворотка крови
• гепаринизированная плазма крови
Пролактин
Пролактин человека — полипептид с молекулярной массой около 23 000 Да. В циркулирующей крови он находится в мономерной форме или в форме полимеров с различной биологической активностью. Количественное соотношение этих форм меняется при различных физиологических состояниях. По своей структуре пролактин имеет высокую степень подобия с гормоном роста и плацентарным лактогеном, возможно из-за их общего эволюционного происхождения. Биологический период полу-жизни пролактина около 15-20 мин. О способе выведения его из организма до настоящего времени известно немного.
Физиологические функции пролактина
Пролактин секретируется лактотропными клетками передней доли гипофиза Его секрецию гипотапамусом контролирует сложная система, в которой преобладает ингибирование (в результате перерезания ножки гипофиза секреция пролактина увеличивается). Дофамин — наиболее важное эндогенное соединение, ингибирующее секрецию пролактина, которое, возможно, идентично так называемому пролактин-ингибирующему фактору (PIF). Адреналин, норадреналин, ацетилхолин, соматостатин и простагландины не оказывают такого сильного влияния на секрецию пролактина.
Тиреолиберин (TRH) стимулирует секрецию пролактина, но не является физиологическим триггерным фактором. Другими эндогенными стимуляторами секреции пролактина являются: гамма -амино масляная кислота ( GAВA ), серотонин и мелатонин.
На секрецию пролактина влияет также уровень эстрогенов. Высокие уровни эстрогенов стимулируют секрецию пролактина посредством ингибирования синтеза дофамина, а низкие их уровни, вероятно, ингибируют секрецию пролактина посредством увеличения чувствительности гипофиза к дофамину.
Основной физиологической функцией пролактина является запуск и поддержание процесса лактации.
Во время беременности секреция пролактина постоянно возрастает в результате ускоренного синтеза эстрогенов в фето-плацентарной системе. Эстрогены и пролактин подготавливают молочную железу к лактации, воздействуя на процесс дифференциации альвеол и протоков.
Уровень пролактина повышен в амниотической жидкости и оболочках плода. Возможно, пролактин играет важную роль в формировании легочной ткани эмбриона. Новорожденные имеют относительно высокий уровень пролактина, который снижается в течение нескольких первых месяцев жизни, пока не достигнет уровня, характерного для детского возраста.
Если женщина не кормит грудью, уровень пролактина после родов приходит в норму в течение 4 недель. У кормящих женщин уровень пролактина снижается медленнее, так как кормление стимулирует его секрецию.
Существует теория, что физиологический уровень пролактина необходим для нормального функционирования репродуктивной системы у обоих полов. Однако физиологическая роль пролактина у мужчин пока не доказана.
Патология: Гиперпролактинемия ослабляет функцию гонад обоих полов. У женщин она вызывает нарушения менструального цикла вследствие недостаточности лютеиновой фазы, олигоменорею, аменорею, которая может сочетаться с галактореей. У мужчин она сопровождается потерей либидо или импотенцией. Механизм этого не совсем ясен, но, возможно, он сходен с ингибированием циклической функции яичников у кормящих грудью женщин.
Наиболее распространенные причины гиперпролактиемии следующие:
• секретирующие пролактин опухоли гипофиза, так называемые пролактиномы.
• расположенные над турецким седлом опухоли гипофиза, тормозящие выработку и транспорт дофамина.
• повреждения ножки гипофиза, приводящие к такому же эффекту.
• эктопический синтез пролактина
Кроме того повышение уровня пролактина может быть при:
• первичном гипотиреозе
• поликистозе яичников
• почечной недостаточности
Однако уровень пролактина не является единственным фактором, ответственным за возникновение клинических проявлений гиперпролактинемии. Изменение соотношения форм пролактина с различной биологической активностью или изменение количества рецепторов к пролактину могут также быть причиной возникновения данного заболевания. Именно поэтому в литературе описаны отдельные случаи нормального менструального цикла и беременности при наличии выраженной гиперпролактинемии, а с другой стороны, у бесплодных женщин с нормальным уровнем пролактина отмечен хороший терапевтический эффект при применении препаратов, подавляющих секрецию пролактина. Отдельным клиническим случаем является так называемая «латентная гиперпролактинемия», которая подтверждается в тесте стимуляции метоклопрамидом.
Если гиперпролактинемия подтверждается при анализе нескольких проб крови и исключена фармакологическая причина повышения уровня пролактина, необходимо провести тщательную проверку на наличие опухолей гипофиза ( RTG обследование турецкого седла, СТ области седла проверка угла зрения, тесты на стимуляцию и подавление и т.п.). Вероятность наличия опухоли тем выше, чем выше уровень пролактина.
Рис.2. Содержание пролактина в сыворотке крови здоровых женщин и пациенток с гиперпролактинемией.
Определение уровня пролактина является важным моментом для оценки эффективности проведенного оперативного или консервативного лечения у пациентов с опухолями гипофиза. Лечение таких больных должно всегда проводится под наблюдением эндокринолога.
Показания к проведению исследований:
Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Нарушения лактации
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Мужчины:
• Тестикуляная недостаточность
• Азооспермия, олигоспермия
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Подготовка проб для анализа и содержание пролактина в норме
Информация, приведенная выше для гонадотропинов, справедлива и по отношению к пролактину. Однако, пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Поэтому кровь для анализа берут утром, не ранее, чем через 3 часа после пробуждения.
Рис.3. Суточный ритм секреции пролактина (индивидуальные графики).
Кроме того, уровень пролактина может повышаться в результате физического или эмоционального стресса, воздействий на молочные железы или операций на грудной клетке, после пребывания в сауне, а также после принятия спиртных напитков. Секрецию пролактина стимулирует ряд лекарственных препаратов: фенотиазиды, трициклические антидепрессанты, метилдофа, галоперидол, хлорпромазин, резерпин, циметидин и другие.
Концентрация пролактина выражается в нг/мл. Для перевода концентрации в мкМЕ/мл необходимо использовать следующее соотношение: 1 нг/мл = 30,3 мкМЕ/мл
Пролактин
нг/мл
мкМЕ/л
Мужчины
2,5-17
53-360
Женщины
Фолликулярная фаза
4,5- 33
98-784
Середина цикла
6,3-49
134-975
Лютеиновая фаза
4,9- 40
104-848
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
ß- Эстрадиол (Е2)
17 ß-Эстрадиол — наиболее активный эстроген в периферической крови, секретируемый, в основном, яичниками, а также в меньшем количестве плацентой, надпочечниками и яичками. С точки зрения биосинтеза эстрадиол представляет собой производное холестерина, а его непосредственными пред шественниками являются андростендион и тестостерон. Более 98 % эстрадиола циркулирует в связанном с белками сыворотки крови состоянии, в основном с ГСПГ . Только небольшая часть эстрадиола находится в свободной форме и является носителем гормональной биологической активности. Эстрадиол быстро трансформируется в эстрон с меньшей биологической активностью, а затем в сульфат эстрона. Образование в организме сульфатов и глюкуронидов снижает эффективность метаболизма производных эстрадиола.
Физиологические функции эстрадиола у женщин
Наиболее значительное воздействие эстрогены оказывают на эндометрий, слизистую влагалища и шейку матки. Они также влияют на развитие молочных желез и тормозят выработку гонадотропинов как у мужчин, так и у женщин Биологический эффект эстрогенов осуществляется путем связывания с цитоплазматическими рецепторами эстрогенов в клетках тканей-мишеней.
Половое созревание
Эстрогены играют ключевую роль в формировании и развитии женских половых органов, а также вторичных половых признаков. Они также ускоряют рост трубчатых костей в длину, а затем, воз действуя на эпифиз, вызывают остановку дальнейшего роста.
Детородный период
Эстрадиол поступающий в периферическое кровообращение, почти исключительно секретируется яичниками. Под воздействием ЛГ в поверхностных клетках фоликулов происходит синтез предшественников андрогенов, андростендиона и тестостерона, из которых в гранулезных клетках, стимулированных ФСГ, образуются эстрогены. Изменение уровней эстрадиола в нормальном менструальном цикле описано в разделе, посвященном гонадотропинам.
Менопауза
В менопаузе синтез эстрогенов затухает, и их уровень в сыворотке крови снижается до очень низких значений.
Физиологические функции эстрадиола у мужчин
У мужчин часть эстрогенов синтезируется яичками, а другая часть образуется в периферических тканях путем ароматизации тестикулярных и надпочечниковых андрогенов. У мужчин в возрасте до 50 лет 20 % эстрадиола секретируется яичками, 60 % образуется в процессе ароматизации тесто стерона, а остальные 20 % — при восстановлении эстрона. В возрасте между 50 и 60 годами доля эстрадиола, синтезируемая яичками, относительно возрастает вследствие резкого снижения секреции андрогенов корой надпочечников.
Патология:
Девочки пубертатного периода и женщины детородного возраста:
• Гиперэстрогенемия
• Феминизация у детей
• Гормонсекретирующие опухоли яичника
• Гиперплазия надпочечников
• Гипоэстрогенемия
• Гипоганадизм
• Центральная анорексия (за счет снижения уровня гонадотропинов и нарушения синтеза эстрогенов)
• Прием гормональных контрацептивов
Женщины в менопаузе:
Гиперсекреция эстрогенов (т.е. менопаузальная метроррагия) может быть вызвана двумя причинами:
• повышенным периферическим синтезом
• секрецией эстрогенов опухолевыми тканями.
Мужчины:
Гиперсекреция эстрогенов :
• повышенная периферическая ароматазная активность,
• изменения в метаболизме эстрогенов, возникшие из за нарушений функции печени (напр., по причине алкоголизма)
• эстрогенсекретирующие опухоли (в том числе тестикулярные).
Кроме того, гиперэстрогенемия может наблюдаться при гипертиреозе. Показания к проведению исследований:
Девочки пубертатного периода:
• Замедленное половое созревание
• Ментальная анорексия
• Овариальная недостаточность
Женщины детородного периода:
• Овариальная недостаточность
• Нарушения менструального цикла
• Бесплодие
• Контроль за процессом индуцированной овуляции
• Мониторинг при экстракорпоральном оплодотворении
• Предупреждение синдрома гиперстимуляции
• Поликистоз яичников
• Гипофизарная недостаточность
Женщины в менопаузе:
• Гипофизарная недостаточность
• При назначении гормональной заместительной терапии ( HRT ) и во время ее мониторинга
• Менопаузальная метроррагия
• Опухоли яичников и надпочечников
Мониторинг терапии тамоксифеном (уровень эстрадиола может служить индикатором эстрогенного статуса и помочь в оценке содержания рецепторов к прогестерону в опухолевых тканях).
Мужчины:
• Опухоли
• Азооспермия, олигоспермия
• Заболевания печени
Уровни эстрадиола в норме
Концентрации эстрадиола выражаются в пг/мл или пмоль/л. Для перевода пг/мл в пмоль/л необходимо использовать следующее соотношение: 1 пг/мл = 0,0037 пмоль/л. Нужно иметь в виду, что на фоне приема пероральных контрацептивов показатели эстрадиола могут быть занижены.
Эстрадиол
пг/мл
пмоль/л
Мужчины
<56
<206
Женщины
Фолликулярная фазф
0 –160
0-587
Предовуляторная фаза
34 – 400
124-1468
Лютеиновая фаза
27 – 246
101-905
Менопауза
<30
<110
Препубертатные дети старше 5 лет
<30
<110
Биологический материал:
• Сыворотка крови
• Гепаринизированная плазма крови
Прогестерон Прогестерон — природный гестаген, принадлежащий к группе С21 -стероидов. У небеременных женщин основное количество прогестерона синтезируется яичниками и, в меньшей степени, корой надпочечников. Около 97 % прогестерона находится в связанном состоянии с альбумином и другими транспортными белками: тироксинсвязывающим глобулином и кортикостероидсвязывающим глобулином. Период биологической полужизни прогестерона очень короткий. На 2/3 он метаболизируется в печени и выводится с мочой в виде сульфата или глюкуронида прегнадиола. Некоторые из 5 ß-восстановленных метаболитов прогестерона вызывают повышение базальной температуры тела во время лютеиновой фазы. Физиологическая функция прогестерона
Уровень секретируемого яичниками прогестерона остается низким во время фолликулярной фазы. Под воздействием структурных и биохимических изменений в фолликуле, достигающих пика
при овуляции, лютеинизация гранулезных клеток завершается разрывом фолликула и образованием желтого тела. Это приводит к значительному увеличению синтеза прогестерона, уровень которого достигает максимума примерно за 7 дней до начала менструации. Биологическая роль прогестерона заключается в подготовке стимулированного эстрогенами эндометрия к имплантации оплодотворенной яйцеклетки.
Синтез прогестерона желтым телом возрастает при воздействии ЛГ и хорионического гонадотропина (ХГ). Только что образовавшееся желтое тело содержит наибольшее количество рецепторов, специфичных к ХГ. После имплантации яйцеклетки ХГ стимулирует синтез прогестерона желтым телом беременности до появления плаценты на 8 неделе развития плода. На этом этапе прогестерон начинает синтезироваться плацентой и его главной функцией становится снижение сократительной способности матки для сохранения беременности.
Патология:
- Повышение концентрации прогестерона:
- Снижение концентрации:
• Врожденная гиперплазия надпочечников, обусловленная дефицитом 21- ß-, 17- ß- и 11- ß-монооксигенов
• Хорионэпителиома яичника
• Липидоклеточная опухоль яичника
• Угроза выкидыша
• Синдром галактореи-аминореи
• Прием гормональных контрацептивов
Показания к проведению исследований:
• Овариальная недостаточность
• Нарушения менструального цикла и аменорея
• Карцинома молочной железы (параллельно с определением рецепторов прогестерона)
Уровни прогестерона в норме
Влияние на результаты анализа связывающих белков устраняется использованием соответству ющих блокирующих агентов. Результаты выражаются в нмоль/л и нг/мл (1 нг/мл = 0,3145 нмоль/л).
Прогестерон
(нг/мл)
(нмоль/л)
Мужчины (20 — 70 лет)
0 – 0,75
0 – 2,4
Женщины
Фолликулярная фаза
0 — 1,13
0 -3,6
Овуляторный пик
0,48- 1,72
1,52 – 5,36
Лютеиновая фаза
0,95 — 21
3,02 –66,8
Менопауза
0 — 1
0 – 3,18
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
Тестостерон
Тестостерон является наиболее важным андрогенным и природным анаболическим гормоном мужчин и женщин. Его предшественниками являются дельта-5-прегненолон и прогестерон; важными промежуточными продуктами являются дегидроэпиандростерон и андростендион. У мужчин он синтез ируется преимущественно в семенниках клетками Лейдига; у женщин — корой надпочечников и яичниками, а также в результате периферического метаболизма.
97- 98 % тестостерона циркулирует в крови в связанном состоянии. Основными связывающими белками являются ГСПГ и альбумин. Только свободный тесто стерон (около 2 % у мужчин и 1 % у женщин) обладает биологической активностью.
Физиологическая функция тестостерона
Нормальная секреция тестостерона необходима для поддержания функции воспроизведения у мужчин. Тестостерон контролирует сперматогенез, функцию простаты и потенцию. У обоих полов тестостерон стимулирует либидо, влияет на рост волос и голос.
Секрецию тестостерона клетками Лейдига стимулирует ЛГ. По принципу обратной связи тестостерон, а также образующийся из него эстрадиол, модулируют секрецию гонадотропинов гипофизом. Андрогенный компонент оказывает воздействие только на ЛГ, а эстрогенный — на ФСГ, поэтому нарушения функции семенников влекут за собой повышение уровня гонадотропинов в сыворотке крови. Синтез ФСГ подавляется ингибином семенных канальцев.
У женщин тестостерон секретируют яичники и кора надпочечников. Около половины тестостерона непосредственно секретируется стромой яичников, другая половина образуется в результате периферического метаболизма. Секреция тестостерона надпочечниками резко снижается у обоих полов после 50-60 лет. Патология:
Маленькие дети и дети пубертатного периода
Мужчины:
• Недостаток андрогенов может вызвать замедленное половое созревание, бесплодие и импотенцию.
• Низкий уровень тестостерона в сочетании с высоким уровнем гонадотропинов указывает на первичную тестикулярную недостаточность. Однако в некоторых случаях (например; при синдроме Клайнфельтера) уровень тестостерона может быть в норме.
• Низкий уровень тестостерона в сочетании с низким или нормальным уровнем ЛГ указывает на вторичную тестикулярную недостаточность. В этом случае проводят тест стимуляции LH — RH . Пациенту назначают гонадотропины, кломифен или пульсирующее введение LH — RH . Мониторинг проводится с помощью измерения уровня тестостерона и исследования эякулята.
Женщины:
а) повышенные уровни тестостерона и DHEAS указывают на избыток андрогенов надпочечникового происхождения. В качестве дополнительного исследования проводят определение циркадного цикла кортизола, тест на подавление дексаметазоном и тест на стимуляцию АСТН.
б) повышенный уровень тестостерона при нормальном или слегка повышенном уровне DHEAS указывает на избыток андрогенов овариального происхождения. У женщин с поликистозом яичников уровень тестостерона часто незначительно повышен; повышаются также уровни ЛГ, андростендиона и эстрона в сыворотке крови. Диагностический тест с LH — RH обычно приводит к повышению уровня ЛГ, но не ФСГ. При очень высокой концентрации тестостерона необходимо исключить наличие опухоли яичника, продуцирующей андрогены.
в) нормальные уровни тестостерона и DHEAS при клинически выраженном гиперандрогенизме указывают на повышение содержания свободного тестостерона вследствие снижения связы вающей емкости ГСПГ.
В случае тестикулярной феминизации пациенты имеют женский фенотип, слабый рост волос на лобке, хорошо развитые яички, расположенные либо в брюшной полости, либо в паху, и XY кариотип. Уровень тестостерона при этом соответствует нормальному мужскому уровню. Причиной заболевания является отсутствие рецепторов андрогенов в тканях-мишенях.
Показания к проведению исследований:
Пубертатный период:
• Тестикулярные нарушения у мальчиков
• Овариальные нарушения у девочек
• Нарушения деятельности надпочечников у обоих полов
• Замедленное половое созревание
Мужчины:
• Тестикулярная недостаточность
• Наблюдение за ходом лечения тестикулярной недостаточности
• Бесплодие
• Импотенция
• Гинекомастия
Женщины:
• Гирсутизм
• Тестикулярная феминизация
• Опухоли яичника, продуцирующие тестостерон
• Поликистоз яичников
• Нарушения менструального цикла
• Аменорея
• Бесплодие
Уровни тестостерона в норме
Изменяющийся уровень тестостерона объясняется эпизодической секрецией ЛГ. У женщин отмечен циркадный ритм тестостерона, что объясняется значительным вкладом надпочечников в синтез андрогенов. Поэтому уровень тестостерона у женщин достигает своего максимума в ранние утренние часы.
Повышение концентрации тестостерона может наблюдаться при приеме барбитуратов, кломифена, эстрогенов, пероральных контрацептивов. У мужчин причинами низкого уровня тестостерона могут быть длительный алкоголизм, стресс и физическое истощение.
Уровень тестостерона приводится в нмоль/л (1 нг/мл = 3,47 нмоль/л).
нг/мл
нмоль/л
Мужчины
2,9 – 15,1
9,9 – 52,4
Женщины
0,65 – 1,19
2,3 – 4,1
Примечание:
С возрастом уровень тестостерона постепенно снижается.
Биологический материал:
• сыворотка крови
• плазма крови.
Глобулин, связывающий половые гормоны (ГСПГ)
ГСПГ связывает циркулирующие в крови половые гормоны (тестостерон и эстрогены), переводя их в не активную фракцию. ГСПГ синтезируется в печени. Его уровень повышается под действием эстрогенов и тиреоидных гормонов, при беременности, неврогенной анорексии, циррозе печени. Снижение уровня ГСПГ наблюдается при гипотиреозе, гиперандрогенемии, ожирении, заболеваниях печени, ведущих к снижению синтетической способности.
Так как половые гормоны, связанные с ГСПГ выбывают из активного пула, снижение его уровня у женщин приводит к явлениям гиперандрогении без повышения уровня общих андрогенов. У мужчин повышение уровня ГСПГ приводит к клинике гипоандрогении при нормальном уровне общего тестостерона.
Содержание ГСПГ в норме
нмоль/л
Мужчины
13-71
Женщины
18-114
Дегидроэпиандростерон сульфат ( DHEAS ) DHEAS является надпочечниковым андрогеном, относящимся к группе 17-кетостероидов. DHEAS образуется из сульфата холестерола. Основное количество DHEAS катаболизируется организмом и только 10 % его выделяется с мочой. Ежесуточно в кровяное русло выделяется 10 — 20 мг DHEAS (35 — 70 моль) у мужчин и 3,5 — 10 мг (12 — 35 моль) у женщин. Секреция DHEAS не имеет циркадного ритма, для этого стероида нет также специфических стероидсвязывающих сывороточных белков, поэтому концентрация DHEAS не зависит от изменения содержания этих белков в сыворотке крови. Однако DHEAS способен связываться с альбумином сыворотки крови человека.
Помимо DHEAS в крови циркулирует DHEA (дегидроэпиандростерон) DHEA синтезируется в основном корой надпочечников и, частично, половыми железами. Он образуется в 4 раза медленнее, чем DHEAS , у мужчин и в 2 раза медленнее у женщин. Скорость его метаболизма значительно выше, поэтому концентрация циркулирующего DHEA может быть в 1 000 раз ниже, чем DHEAS . Высокая концентрация в крови, длинный период полу-жизни и высокая стабильность делают DHEAS отличным индикатором андрогенсекретирующей функции надпочечников.
Повышенный уровень тестостерона у женщин может иметь надпочечниковое или овариальное происхождение. Результаты определения DHEAS позволяют выявить причину гиперандрогении.
Патология:
• Значительное повышенная концентрация DHEAS (наблюдается только при гиперандрогении надпочечникового происхождения):
• андрогенсекретирующих опухолях надпоче-чников,
• двусторонней врожденной гиперплазии надпочечников с гиперандрокортицизмом (дефект 21-гидроксилазы и 11- ß-гидроксилазы)
• гирсутизме надпочечникового происхождения
• синдром Кушинга
• эктопический синтез АКТГ.
• Умеренное повышение может быть при поликистозе яичников.
• Снижение наблюдается при недостаточности коры надпочечников
Показания к проведению исследований:
• Опухоли надпочечников
• Дифференциальная диагностика овариальных нарушений
• Остеопороз
• Задержка полового развития
Содержание DHEAS в норме
мкг/дл
мкмоль/л
Мужчины
80 – 560
2,2 – 15,2
Женщины
35 – 430
0,9 – 11,7
Биологический материал:
• Кровь
• Гепаринизированная плазма крови
17-гидрокси-прогестерон 17-гидроксипрогестерон – это промежуточный продукт синтеза стероидов в корковом слое надпочечников и гонадах. Основное клиническое значение определения 17ОН-прогестерона состоит в выявлении дефицита 21-гидроксилазы (фермента, под действием которого 17ОН-прогестерон превращается в11-дезоксикортизол в каскаде стероидогенеза).
Дефицит 21-гидроксилазы является самой распространенной формой (90% случаев) врожденной гиперплозии коры надпочечников (ВГКН, адрено-генитальный синдром). Нарушение синтеза 11-дезоксикортизола приводит к дефициту кортизола и альдостерона, повышению уровня АКТГ, гиперплазии коры надпочечников и усилению секреции надпочечниковых андрогенов. Дефицит альдостерона приводит к формированию синдрома потери соли, который проявляется кризами у 75% новорожденных с ВГКН, в более старшем возрасте кризы могут провоцироваться интеркурентными заболеваниями. Избыточная продукция андрогенов, особенно андростендиона, вызывает вирилизацию, которая служит характерным признаком этой формы ВГКН. У девочек вирилизация начинается еще во внутриутробном периоде и к моменту рождения может достигнуть разной степени от клиторомегалии до полного сращения губно-мошоночных складок и формирования уретры, открывающейся в тело полового члена. После рождения у мальчиков и девочек наблюдается увеличение полового члена/ клитора, угри, ускоренный рост, раннее оволосение лобка. Рост детей 3-10 лет опережает сверстников, в 11-12 лет происходит закрытие эпифизарных зон, поэтому нелеченные дети остаются низкорослыми. Характерны нарушение полового развития и бесплодие, однако, лечение может обеспечить нормальное формирование вторичных половых признаков и фертильность. Особое внимание следует обратить на женщин с невыраженными проявлениями ВГКН, которые обращаются к гинекологам-эндокринологам с жалобами на нарушение менструального цикла, гирсутизм и бесплодие.
Содержание 17ОН-прогестерона в норме:
нг/мл
новорожденные
5-30 дней
0,7-2,5
31-60 дней
мальчики
0,8-5,0
девочки
0,5-2,3
дети
3-14 лет
0,7-1,7
мужчины
0,5-2,1
женщины
фоликулиновая фаза
0,1-0,8
овуляция
0,3-1,4
лютеиновая фаза
0,6-2,3
постменопауза
0,13-0,5
беременные 3 триместр
2,0-12,0
Биологический материал:
• Кровь
• Гепаринизированная плазма крови
Антитела к сперме
Около 15% всех семейных пар, желающих иметь детей, страдают бесплодием. Предполагают, что у 10 из 100 бесплодных пар бесплодие имеет иммунологические причины. Одной из таких причин может быть выработка специфических антител к поверхностным белкам сперматозоидов, которые влияют на подвижность и функции мужских половых клеток. Метод иммуноферментного определения антител к сперме может быть использован для проведения скрининговых обследований по выявлению бесплодия, обусловленного иммунологическими механизамами. В случае бесплодия неясной этиологии рекомендуется проводить исследование на наличие антител к сперме обоим супругам. Показано, что тесты на выявление антител к сперме могут так же применяться для контроля за проводимой терапией. Пограничная концентрация антиспермальных антител в сыворотке 75 Е/мл. Пробы с концентрацией превышающей 75 Е/мл считаются положительными.
Хорионический гонадотропин (ХГЧ)
Хорионический гонадотропин — наиболее важный из гестационных гормонов. ХГЧ продуцируется клетками синцитиотрофобласта плаценты и некоторыми опухолями.
Подобно гипофизарным гонадотропинам, ХГЧ является гликопротеином с молекулярной массой 40 кДа, который состоит из двух субъединиц. ß-субъединица ХГ содержит значительную часть аминокислотной последовательности ß-субъединицы ЛГ, а также 30 аминокислот на С-конце молекулы. В результате такой молекулярной гомологии возможность иммунохимической дифференциации ХГЧ и ЛГ зависит от способности антител определять небольшую часть молекулы ХГЧ, структурно отличающуюся от ЛГ. Использование моноклональных антител или специально обработанных поликлональных антител в ряде случаев делает возможным разрабатывать методы определения ХГЧ с пренебрежимо малой перекрестной реакцией с ЛГ, ФСГ и ТТГ.
Физиологические функции ХГЧ
Определяемые количества ХГЧ появляются в крови матери уже на 8-9 день после оплодотворения яйцеклетки. Во время первого триместра беременности уровень ХГЧ быстро возрастает, удваиваясь каждые 2-3 дня. Концентрация ХГЧ достигает своего максимума на 8-10 неделе беременности, после чего несколько снижается и остается постоянной в течение второй половины беременности. Быстрое возрастание концентрации ХГЧ в периферической крови и моче делает определение ХГЧ идеальным видом анализа для быстрой диагностики беременности. Физиологическая роль ХГЧ в ранние сроки беременности состоит в стимуляции синтеза прогестерона желтым телом. Считается также, что ХГЧ стимулирует синтез тестостерона половыми железами плода мужского пола, а также оказывает воздействие на кору надпочечников эмбриона.
При удалении матки, после родов или аборта ХГЧ детектируется в течение более длительного периода, чем это следует из периода его полу-жизни. Уровень ХГЧ возвращается в норму в течение 2-3 недель после хирургического вмешательства; если уровень ХГЧ не снижается, это указывает на неполное удаление матки или эктопическую беременность. Высокий уровень ХГЧ после миниаборта указывает на продолжающуюся беременность.
Патология:
Беременные женщины:
При внематочной беременности уровень ХГЧ в сыворотке крови и моче значительно ниже, чем при нормальной беременности в соответствующие сроки, либо его уровень повышается медленнее. Однако в случае имплантации эмбриона в достаточно благоприятном месте, уровень ХГЧ может повышаться, до значений, характерных для нормальной беременности. Таким образом, определение ХГЧ можно проводить в целях диагностики внематочной беременности. В случае положительного анализа на ХГЧ проводят дальнейшие исследования, в том числе эхографию, для дифференциации маточной и внематочной, физиологической и патологической беременности.
Пониженная концентрация гормона наблюдается при угрожающем или несостоявшемся выкидыше. Для подтверждения диагноза рекомендуется проводить повторные измерения уровня ХГЧ в динамике и ультразвуковое обследование.
В последние годы при повышенном уровне ХГЧ проводят определение альфа-фетопротеина (АФП) и других независимых маркеров для пренатальной диагностики синдрома Дауна. Кроме того, при повышении уровня ХГЧ необходимо исключать внутриматочную инфекцию.
При пузырном заносе (хорионаденоме) происходят изменения в хориальных ворсинах. Возрастает активность клеток синцитиотрофобласта, что влечет за собой гиперсекрецию ХГЧ. Если в случае нормальной беременности уровень ХГЧ снижается после 10 недели беременности, то при хорионаденоме он продолжает возрастать и может достигнуть миллиона МЕ/л. Оптимальная диагностическая информация достигается при использовании ультразвуковой эхографии.
Повышенные уровни у больных со злокачественными заболеваниями
• опухоли трофобласта или терминального происхождения
• рак яичек
• рак яичников
• хорионкарцинома
• пузырный занос
• рак желудка
• рак печени
• рак тонкой кишки
• рак толстой кишки
• рак почек
• мелкоклеточный бронхогенный рак легких (эктопическая секреция)
• рак яичников
• рак молочных желез (эктопическая секреция)
• рак матки
Женщины:
Злокачественные опухоли трофобласта. Злокачественные новообразования возникают у 5-10 % пациенток с хорионаденомой. Поэтому после удаления хорионаденомы необходимо проводить регулярное обследование пациенток до тех пор, пока уровень ХГЧ не перестанет детектироваться. В течение, как минимум, полугода анализ ХГЧ должен проводиться ежемесячно, в течение 2 последующих лет анализ проводят через более длительные промежутки времени. Определение ХГЧ при лечении пролиферирующих опухолей и хориокарцином цитостатическими агентами позволяет оценить эффективность терапии. Три отрицательных анализа с интервалами в три недели свидетельствуют о ремиссии. В дальнейшем мониторинг проводится, как в случаях беременности с пузырным заносом. Определение а-субъединицы ХГЧ имеет прогностическое значение, так как увеличение ее уровня свидетельствует об ухудшении состояния больной.
Мужчины:
Уровень ХГЧ определяют в случае злокачественных новообразований (например, тератом и других тестикулярных опухолей). Хотя уровень ХГЧ не всегда повышается до минимально детектируемого, или повышается только уровень свободных субъединиц, анализ ХГЧ позволяет оценить эффективность проводимой терапии.
Показания к проведению исследований:
Беременные женщины:
• Детекция беременности
• Внематочная беременность
• Диагностика угрожающего выкидыша
• Пузырный занос (хорионаденома)
• Злокачественные опухоли трофобласта
• Диагностика врожденных злокачественных опухолей плода
• Хромосомные аберрации плода
Мужчины и небеременные женщины:
• Тестикулярные опухоли
• Тератомы и тератобластомы
Содержание ХГЧ в норме
( МЕ/л )
Мужчины
0-2,5
Небеременные женщины
0-5,3
Беременность:
Гестационный возраст (недели)
Медиана (интервал значений)
2-3
300 (150-600)
3-4
700 (360-1400)
4-5
14000. (9000 –21000)
5-6
80000 (40000 –120000.)
6-7
155000 (130000 –200000)
7-8
185000 (150000 –220000)
9
175000 (140000 –210000)
10
170000 (135000 – 205000)
11
140000 (120000 –160000)
12
115000 (100000 -130000)
13
100000 (90000 – 110000)
14 90000 (80000 – 100000) 15 31700 (15900-63400) 16 27100 (13500-54100) 17 23100 (11000-46200) 18 21600 (10800-43200) 19 18200 (9100 – 36400) 20 16400 (8200-32800) 21 14600 (7300-29200) 22 12500 (6300-23000) 23 11000 (5500 – 22000) >24 7000 (3500 – 14000) Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
• моча
• амниотическая жидкость.
Альфафетопротеин (АФП )
АФП является специфическим фетальным а-глобулином с молекулярной массой 65-70 кДа. Первоначально АФП вырабатывается желтым телом. Начиная с 13 недели беременности, когда его уровень достигает максимума в сыворотке крови плода (3 мг/мл), он начинает синтезироваться печенью плода, и его уровень постепенно снижается до 0,08 мг/мл к моменту родов. В течение первого года жизни уровень АФП снижается до очень низких значений, характерных для взрослого человека.
Диагностическое значение АФП во время беременности
Во время физиологической беременности уровень АФП в амниотической жидкости снижается, а в материнской сыворотке, напротив, возрастает. Увеличение уровня АФП всегда служит показателем наличия серьезных нарушений.
Возможность определять дефекты незаращения нервной трубки плода (расщелину позвоночника, анэнцефалию) на базе повышенного уровня АФП в амниотической жидкости, полученной при отхождении околоплодных вод на 15-20 месяце, была показана в 1970г. Затем повышенный уровень АФП в амниотической жидкости стали связывать с наличием других аномалий развития плода.
Диагностика врожденных аномалий по уровню АФП в материнской сыворотке (MC АФП) основывается на тех же принципах. Так как физиологический уровень АФП зависит от срока беременности, результаты анализа МС АФП наиболее часто оценивают по отношению к среднему значению уровня АФП, характерному для данного срока Повышение уровня МС АФП в 2,5 и более раз выше нормы наблюдается при серьезных патологических состояниях, угрожающем выкидыше или гибели плода.
Понижение уровня АФП по сравнению с уровнем нормально развивающейся беременности может свидетельствовать о риске рождения ребенка с трисомией по 21 хромосоме. Однако, поскольку уровень АФП при патологической беременности (при трисомии) составляет лишь 0,7 от его уровня при физиологической беременности, рекомендуется анализ АФП комбинировать с определением других независимых маркеров, например, ХГЧ или его субъединиц, свободного эстирола и др.
Некоторые авторы советуют использовать анализ МС АФП в качестве дополнительного анализа при осложненной беременности.
Патология:
Повышенные уровни у больных со злокачественными опухолевыми заболеваниями:
• первичный рак печени (за исключением анапластической формы, при которой АФП — отрицательный)
• метастазы злокачественных опухолей в печень(при бронхогенной карциноме, раке молочной железы и раке прямой и сигмовидной кишки).
• опухоли терминального происхождения
• рак яичника
• рак яичка
• рак желудка
• рак толстой кишки
• рак поджелудочной железы
• рак молочной железы
• бронхиальные опухоли
Повышенные уровни при заболеваниях доброкачественной этиологии :
• цирроз печени
• острый вирусный гепатит
• хронический гепатит
• хроническая почечная недостаточность
Показания к проведению анализа:
Беременные женщины :
• Контроль за ходом 1-ого триместра беременности
• Угроза выкидыша
• Диагностика врожденных пороков развития
• Диагностика хромосомных аберраций
Пациенты с опухолями :
• Гепатоцеллюлярная карцинома
• Злокачественные опухоли желчного пузыря, желчных путей и поджелудочной железы
• Тестикулярные опухоли
• Тератомы, тератобластомы
• Опухоли, имеющие эмбриональное происхождение
Содержание АФП в норме
Результаты обычно выражаются в МЕ/мл (1 МЕ/мл = 1,21 нг).
МЕ/мл
нг/мл
Вне беременности
0,5 – 5,5
0,6 – 6,66
Во время беременности:
Гестационный возраст (недели)
Медиана (интервал), МЕ/мл
14
21,7 (10,9-21,8)
15
25,0 (12,5-50)
16
28,8 (14,4-57,6)
17
33,1 (16,5-66,2)
18
38,0 (19-76)
19
43,8 (21,9-87,6)
20
50,4 (25,2-100,8)
21
57,9 (28,9-115,8)
22
66,2 (33,1- 132,4)
23
90,0 (45-180)
Биологический материал:
• сыворотка
• гепаринизированная плазма
• амниотическая жидкость
• кистозная жидкость
• асцитическая жидкость
Неконъюгированный эстриол
Эстриол является стероидным гормоном, синтезируемым плацентой. На первой стадии синтеза, которая происходит в эмбрионе, холестерин, образующийся de novo, либо поступающий из крови матери, превращается в прегненолон, который сульфатируется корой надпочечников плода в дегидроэпиандростеронсульфат. Гидроксилирование этого соединения по 16 а-положению и отщепление сульфата сульфатазами плаценты приводит к образованию эстриола. Поскольку в образовании эстриола принимают участие как плод, так и плацента, измерение уровня эстриола может служить идеальным показателем функции фето-плацентарной системы.
Физиологические функции эстриола В материнской крови только небольшая часть эстриола циркулирует в свободном состоянии, основное его количество составляет глюкуронид а-сульфата Во время беременности уровень эстриола постепенно возрастает до 40 недели. Пониженный уровень эстриола или его резкое снижение свидетельствует о патологическом состоянии плода. Определение уровней общего или свободного эстриола используют для мониторинга беременности. Уровень свободного эстриола быстрее отражает ухудшение состояния плода. Патология
Определение эстриола используют для наблюдения за состоянием фетоплацентарной системы , а также для диагностики
Уровень неконъюгированного эстриола снижается при :
• осложненном течении беременности (поздний гестоз, анемия, пиелонефрит, хронические заболевания ЖКТ, патология надпочечников у беременной), сопровождающемся нарушением плацентарного кровообращения и возникновением плацентарной недостаточности, развитием гипоксии и ацидоза у плода
• внутриутробной гипотрофии плода
• алкогольном синдроме плода
• внутриутробном инфицировании плода
• некоторых видах наследственной патологии (врожденной гипоплазии надпочечников, синдроме Дауна, анэнцефалии и др.)
• нарушения сульфатазной активности плаценты (редкое врожденное заболевание, связанное с Х-хромосомой). Отсутствие этого фермента блокирует синтез эстриола из предшественников, что отражается в очень низком уровне эстриола при беременности без каких-либо других признаков неблагополучия плода. Такие беременности часто заканчиваются хирургическим вмешательством в процесс родов, причем рождаются исключительно младенцы мужского пола с признаками ихтиоза, появляющегося вскоре после рождения.
• применении кортикостероидов (н
синдром патау признаки — 18 рекомендаций на Babyblog.ru
Репродуктивные гормоны и маркеры ФПК
Фолликуло-стимулирующий гормон, лютеинизирующий гормон
ФСГ и ЛГ секретируются гонадотропными клетками передней доли гипофиза. Гонадотропины ФСГ и ЛГ, хориогонадотропин ХГ и тиротропин ТТГ являются гликопротеинами, молекулы которых состоят из двух ковалентно связанных субъединиц, а и ß . а-субъединицы ФСГ, ЛГ, ТТГ и ХГ идентичны, а ß-субъединицы специфичны для каждого гормона и определяют их биологическую активность. Небольшое количество свободных субъединиц могут циркулировать в крови, однако возможность любого из биологических эффектов реализуется лишь при условии ассоциации а-цепи с ß-цепью. Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
а) Гонадотропин-рилизинг гормон ( Gn — RH ), известным также как ЛГ-рилизинг гормоном ( LH — RH ), или как люлиберин. LH — RH является декапептидом, секретируемым гипоталамусом. LH — RH и его синтетические химические аналоги широко используются в терапевтических и диагностических целях (LH-RH-тест). LH — RH секретируется в портальную венозную систему гипофиза, где он стимулирует образование и пульсирующую секрецию ЛГ и, в меньшей степени, ФСГ.
б) стероидными гормонами, вырабатываемыми половыми железами. Именно эстрогены и гестагены контролируют секрецию гонадотропина по принципу положительной или отрицательной обратной
в) ингибином (гликопротеином, синтезируемым клетками Сертолли в процессе сперматогенеза и специфически ингибирующим секрецию ФСГ).
Эффект гонадотропинов реализуется через специфические рецепторы на поверхности клеточной мембраны. В этом процессе участвует важный межклеточный медиатор циклический аденозин монофосфат (цАМФ, сАМР).
Гонадотропины выводятся из организма с мочой. Так как их биологическая активность и иммунологические свойства в значительной мере остаются неизменными, концентрация этих гормонов в моче здоровых людей соответствует их концентрации в периферической крови.
Функции гонадотропинов у детей
У детей препубертатного периода уровни гонадотропинов и половых стероидов очень низкие. Во время пубертатного периода чувствительность гипофиза к LH — RH возрастает, в результате чего увеличивается секреция гонадотропинов, секреция половых стероидов и развиваются вторичные половые признаки.
Функции гонадотропинов у мужчин
У мужчин ЛГ стимулирует синтез тестостерона в клетках Лейдига, ФСГ стимулирует сперматогенез, синтез ингибина и андроген-связывающего белка в семенных канальцах, а также превращение тестостерона в 17- ß-эстрадиол в клетках сертоли. И тестостерон, и эстрогены оказывают ингибирующий эффект на секрецию гонадотропина посредством гипоталамического подавления L Н- RH.
Функции гонадотропинов у женщин
а) У женщин детородного периода секреция гонадотропинов является наиболее важным условием поддержания менструального цикла. В последние несколько дней предыдущего цикла снижение концентрации стероидных гормонов повышает секрецию ФСГ, что стимулирует рост нескольких граафовых пузырьков. Один из фолликулов развивается более интенсивно, остальные — атрофируются. Растущий созревающий фолликул продуцирует повышающиеся количества эстрогенов, которые оказывают мягкий ингибирующий эффект на секрецию ФСГ. В конце фолликулярной фазы секреция эстрогенов резко возрастает и достигает максимума непосредственно перед овуляцией. Обратная связь концентраций гормонов из отрицательной становится положительной, что выражает ся в овуляторных пиках уровней ЛГ и ФСГ. Овуляция, завершающаяся разрывом фолликула и превращением его в желтое тело, приводит также к падению уровней гонадотропинов и эстрогенов на фоне повышающегося уровня прогестерона. Лютеинизация гранулезных клеток наступает при вторичном подъеме концентрации эстрогенов параллельно с возрастанием уровня прогестерона до максимума в середине лютеиновой фазы. Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.
б) В перименопаузе циклическая активность яичников снижается вплоть до полного угасания. Циклы в перименопаузе часто бывают ановуляторными и характеризуются значительной флюктуацией уровней стероидных и гипофизарных гормонов. В последствии все примордиальные фолликулы перестают реагировать на гонадотропную стимуляцию под воздействием стероидных гормонов.
в) В менопаузе исчезает отрицательная обратная связь и уровни гонадотропинов, в частности, ФСГ, значительно повышаются по сравнению с детородным периодом.
Рис.1. Динамика концентраций гонадотронпинов (ГТ), эстрадиола (Е2) и прогестерона (Пр) в крови на протяжении менструального цикла и при наступлении беременности.
Патология женщины детородного периода
Если исключается возможность гиперпролактинемии, определение ФСГ представляет собой первую часть исследований нарушений менструального цикла. Рекомендуется проводить одно временное определение ФСГ, ЛГ и пролактина в первой пробе крови. Повышенные уровни ФСГ обычно являются индикатором необратимой недостаточности функции яичников (за исключением очень редкого синдрома резистентности яичников). Пониженная или нормальная концентрация ФСГ при пониженной концентрации ЛГ имеет место при нарушении функции гипофиза или гипоталамуса. Если секреция эстрогенов понижена (при отрицательном анализе на прогестерон), овуляцию можно индуцировать гонадотропинами (Прегонал) или пульсирующим введением LH — RH . Если секреция эстрогенов в норме, лечение нужно начать с кломифена. Незначительное повышение концентрации ЛГ при нормальной концентрации ФСГ может наблюдаться при синдроме поликистозных яичников (РСО, синдром Штейна-Левенталя). Возникновение синдрома связано с гиперсекрецией андрогенов и замедленным синтезом эстрогенов яичниками, что компенсируется их ускоренным синтезом в периферии. Таким образом, уровень эстрогенов в сыворотке крови остается в норме. Довольно часто в этом случае наблюдается незначительная гиперпролактинемия.
У женщин с анорексией уровень гонадотропинов понижен. При стимуляции LH — RH наблюдается повышение содержания ФСГ, уровень ЛГ остается неизменным или незначительно возрастает.
Девочки пубертатного периода
При замедленном половом развитии диагностика проводится по схеме, приведенной для случаев недостаточности яичников. При повышенном уровне ФСГ необходимо провести полное эндокринологическое и генетическое обследование.
В случаях преждевременного созревания концентрация гонадотропинов часто бывает повышен ной по сравнению с нормальными для данного возраста уровнями. Диагностический тест с LH — RH часто приводит к резкому повышению секреции ЛГ.
У женщин в менопаузе пониженное содержание гонадотропинов наблюдается при проведении заместительной терапии ( HRT ) или у пациенток с эстроген-продуцирующими опухолями. Низкие уровни гонадотропинов также обнаруживаются при гипофизарной недостаточности.
Мужчины
Определение ФСГ проводят в случае подозрения на недостаточность половых желез в результате обнаружения азооспермии или олигоспермии. Высокий уровень ФСГ указывает на первичную тестикулярную недостаточность.
Показания к проведению исследований:
Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Недостаточность яичников
• Синдром поликистоза яичников
• Анорексия
• Гипофизарная недостаточность
Девочки пубертатного периода:
• Гипофизарная недостаточность
• Преждевременное половое созревание
• Замедленное половое созревание
• Недостаточность яичников
• Анорексия
Женщины в менопаузе:
• Гипофизарная недостаточность
• Метроррагия
• Гормональная заместительная терапия ( HRT )
Мужчины:
• Гипофизарная недостаточность
• Азооспермия, олигоспермия
Подготовка проб для анализа и содержание гонадотропинов в норме.
Уровни гонадотропинов не имеют циркадного ритма. Пульсирующий характер секреции с интервалами в 1-2 часа особенно характерен для ЛГ, поэтому результаты единичных анализов следует считать приблизительными. Образцы сыворотки или плазмы крови после образования сгустков и/или отделения эритроцитов стабильны в течение времени, достаточного для пересылки образцов по почте. Замороженные образцы можно хранить в течение длительного периода времени.
Не рекомендуется использовать гемолизированные, липемические или иктерические образцы, так как это может оказать влияние на результаты анализа. Снижение уровня гормонов может наблюдаться при приеме оральных контрацептивов, фенотиазинов, эстрогенов.
Современные иммуноанализы ЛГ и ФСГ основаны на использовании моноклональных антител, которые не имеют перекрестной реакции с ХГ.
ФСГ, (мМЕ/л)
ЛГ, (мМЕ/л)
Мужчины
0,7-1,1
0,8-7,6
Женщины
Фолликулярная фаза
2,8 — 11,3
1,1-11,6
Овулятрный пик
5,8-21
17-77
Лютеиновая фаза
1,2-9,0
0-14,7
Постменопауза
21,7-153
11,3-40
Препубертатные дети
<1
<1
Биологический материал :
• сыворотка крови
• гепаринизированная плазма крови
Пролактин
Пролактин человека — полипептид с молекулярной массой около 23 000 Да. В циркулирующей крови он находится в мономерной форме или в форме полимеров с различной биологической активностью. Количественное соотношение этих форм меняется при различных физиологических состояниях. По своей структуре пролактин имеет высокую степень подобия с гормоном роста и плацентарным лактогеном, возможно из-за их общего эволюционного происхождения. Биологический период полу-жизни пролактина около 15-20 мин. О способе выведения его из организма до настоящего времени известно немного.
Физиологические функции пролактина
Пролактин секретируется лактотропными клетками передней доли гипофиза Его секрецию гипотапамусом контролирует сложная система, в которой преобладает ингибирование (в результате перерезания ножки гипофиза секреция пролактина увеличивается). Дофамин — наиболее важное эндогенное соединение, ингибирующее секрецию пролактина, которое, возможно, идентично так называемому пролактин-ингибирующему фактору (PIF). Адреналин, норадреналин, ацетилхолин, соматостатин и простагландины не оказывают такого сильного влияния на секрецию пролактина.
Тиреолиберин (TRH) стимулирует секрецию пролактина, но не является физиологическим триггерным фактором. Другими эндогенными стимуляторами секреции пролактина являются: гамма -амино масляная кислота ( GAВA ), серотонин и мелатонин.
На секрецию пролактина влияет также уровень эстрогенов. Высокие уровни эстрогенов стимулируют секрецию пролактина посредством ингибирования синтеза дофамина, а низкие их уровни, вероятно, ингибируют секрецию пролактина посредством увеличения чувствительности гипофиза к дофамину.
Основной физиологической функцией пролактина является запуск и поддержание процесса лактации.
Во время беременности секреция пролактина постоянно возрастает в результате ускоренного синтеза эстрогенов в фето-плацентарной системе. Эстрогены и пролактин подготавливают молочную железу к лактации, воздействуя на процесс дифференциации альвеол и протоков.
Уровень пролактина повышен в амниотической жидкости и оболочках плода. Возможно, пролактин играет важную роль в формировании легочной ткани эмбриона. Новорожденные имеют относительно высокий уровень пролактина, который снижается в течение нескольких первых месяцев жизни, пока не достигнет уровня, характерного для детского возраста.
Если женщина не кормит грудью, уровень пролактина после родов приходит в норму в течение 4 недель. У кормящих женщин уровень пролактина снижается медленнее, так как кормление стимулирует его секрецию.
Существует теория, что физиологический уровень пролактина необходим для нормального функционирования репродуктивной системы у обоих полов. Однако физиологическая роль пролактина у мужчин пока не доказана.
Патология: Гиперпролактинемия ослабляет функцию гонад обоих полов. У женщин она вызывает нарушения менструального цикла вследствие недостаточности лютеиновой фазы, олигоменорею, аменорею, которая может сочетаться с галактореей. У мужчин она сопровождается потерей либидо или импотенцией. Механизм этого не совсем ясен, но, возможно, он сходен с ингибированием циклической функции яичников у кормящих грудью женщин.
Наиболее распространенные причины гиперпролактиемии следующие:
• секретирующие пролактин опухоли гипофиза, так называемые пролактиномы.
• расположенные над турецким седлом опухоли гипофиза, тормозящие выработку и транспорт дофамина.
• повреждения ножки гипофиза, приводящие к такому же эффекту.
• эктопический синтез пролактина
Кроме того повышение уровня пролактина может быть при:
• первичном гипотиреозе
• поликистозе яичников
• почечной недостаточности
Однако уровень пролактина не является единственным фактором, ответственным за возникновение клинических проявлений гиперпролактинемии. Изменение соотношения форм пролактина с различной биологической активностью или изменение количества рецепторов к пролактину могут также быть причиной возникновения данного заболевания. Именно поэтому в литературе описаны отдельные случаи нормального менструального цикла и беременности при наличии выраженной гиперпролактинемии, а с другой стороны, у бесплодных женщин с нормальным уровнем пролактина отмечен хороший терапевтический эффект при применении препаратов, подавляющих секрецию пролактина. Отдельным клиническим случаем является так называемая «латентная гиперпролактинемия», которая подтверждается в тесте стимуляции метоклопрамидом.
Если гиперпролактинемия подтверждается при анализе нескольких проб крови и исключена фармакологическая причина повышения уровня пролактина, необходимо провести тщательную проверку на наличие опухолей гипофиза ( RTG обследование турецкого седла, СТ области седла проверка угла зрения, тесты на стимуляцию и подавление и т.п.). Вероятность наличия опухоли тем выше, чем выше уровень пролактина.
Рис.2. Содержание пролактина в сыворотке крови здоровых женщин и пациенток с гиперпролактинемией.
Определение уровня пролактина является важным моментом для оценки эффективности проведенного оперативного или консервативного лечения у пациентов с опухолями гипофиза. Лечение таких больных должно всегда проводится под наблюдением эндокринолога.
Показания к проведению исследований:
Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Нарушения лактации
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Мужчины:
• Тестикуляная недостаточность
• Азооспермия, олигоспермия
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Подготовка проб для анализа и содержание пролактина в норме
Информация, приведенная выше для гонадотропинов, справедлива и по отношению к пролактину. Однако, пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Поэтому кровь для анализа берут утром, не ранее, чем через 3 часа после пробуждения.
Рис.3. Суточный ритм секреции пролактина (индивидуальные графики).
Кроме того, уровень пролактина может повышаться в результате физического или эмоционального стресса, воздействий на молочные железы или операций на грудной клетке, после пребывания в сауне, а также после принятия спиртных напитков. Секрецию пролактина стимулирует ряд лекарственных препаратов: фенотиазиды, трициклические антидепрессанты, метилдофа, галоперидол, хлорпромазин, резерпин, циметидин и другие.
Концентрация пролактина выражается в нг/мл. Для перевода концентрации в мкМЕ/мл необходимо использовать следующее соотношение: 1 нг/мл = 30,3 мкМЕ/мл
Пролактин
нг/мл
мкМЕ/л
Мужчины
2,5-17
53-360
Женщины
Фолликулярная фаза
4,5- 33
98-784
Середина цикла
6,3-49
134-975
Лютеиновая фаза
4,9- 40
104-848
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
ß- Эстрадиол (Е2)
17 ß-Эстрадиол — наиболее активный эстроген в периферической крови, секретируемый, в основном, яичниками, а также в меньшем количестве плацентой, надпочечниками и яичками. С точки зрения биосинтеза эстрадиол представляет собой производное холестерина, а его непосредственными пред шественниками являются андростендион и тестостерон. Более 98 % эстрадиола циркулирует в связанном с белками сыворотки крови состоянии, в основном с ГСПГ . Только небольшая часть эстрадиола находится в свободной форме и является носителем гормональной биологической активности. Эстрадиол быстро трансформируется в эстрон с меньшей биологической активностью, а затем в сульфат эстрона. Образование в организме сульфатов и глюкуронидов снижает эффективность метаболизма производных эстрадиола.
Физиологические функции эстрадиола у женщин
Наиболее значительное воздействие эстрогены оказывают на эндометрий, слизистую влагалища и шейку матки. Они также влияют на развитие молочных желез и тормозят выработку гонадотропинов как у мужчин, так и у женщин Биологический эффект эстрогенов осуществляется путем связывания с цитоплазматическими рецепторами эстрогенов в клетках тканей-мишеней.
Половое созревание
Эстрогены играют ключевую роль в формировании и развитии женских половых органов, а также вторичных половых признаков. Они также ускоряют рост трубчатых костей в длину, а затем, воз действуя на эпифиз, вызывают остановку дальнейшего роста.
Детородный период
Эстрадиол поступающий в периферическое кровообращение, почти исключительно секретируется яичниками. Под воздействием ЛГ в поверхностных клетках фоликулов происходит синтез предшественников андрогенов, андростендиона и тестостерона, из которых в гранулезных клетках, стимулированных ФСГ, образуются эстрогены. Изменение уровней эстрадиола в нормальном менструальном цикле описано в разделе, посвященном гонадотропинам.
Менопауза
В менопаузе синтез эстрогенов затухает, и их уровень в сыворотке крови снижается до очень низких значений.
Физиологические функции эстрадиола у мужчин
У мужчин часть эстрогенов синтезируется яичками, а другая часть образуется в периферических тканях путем ароматизации тестикулярных и надпочечниковых андрогенов. У мужчин в возрасте до 50 лет 20 % эстрадиола секретируется яичками, 60 % образуется в процессе ароматизации тесто стерона, а остальные 20 % — при восстановлении эстрона. В возрасте между 50 и 60 годами доля эстрадиола, синтезируемая яичками, относительно возрастает вследствие резкого снижения секреции андрогенов корой надпочечников.
Патология:
Девочки пубертатного периода и женщины детородного возраста:
• Гиперэстрогенемия
• Феминизация у детей
• Гормонсекретирующие опухоли яичника
• Гиперплазия надпочечников
• Гипоэстрогенемия
• Гипоганадизм
• Центральная анорексия (за счет снижения уровня гонадотропинов и нарушения синтеза эстрогенов)
• Прием гормональных контрацептивов
Женщины в менопаузе:
Гиперсекреция эстрогенов (т.е. менопаузальная метроррагия) может быть вызвана двумя причинами:
• повышенным периферическим синтезом
• секрецией эстрогенов опухолевыми тканями.
Мужчины:
Гиперсекреция эстрогенов :
• повышенная периферическая ароматазная активность,
• изменения в метаболизме эстрогенов, возникшие из за нарушений функции печени (напр., по причине алкоголизма)
• эстрогенсекретирующие опухоли (в том числе тестикулярные).
Кроме того, гиперэстрогенемия может наблюдаться при гипертиреозе. Показания к проведению исследований:
Девочки пубертатного периода:
• Замедленное половое созревание
• Ментальная анорексия
• Овариальная недостаточность
Женщины детородного периода:
• Овариальная недостаточность
• Нарушения менструального цикла
• Бесплодие
• Контроль за процессом индуцированной овуляции
• Мониторинг при экстракорпоральном оплодотворении
• Предупреждение синдрома гиперстимуляции
• Поликистоз яичников
• Гипофизарная недостаточность
Женщины в менопаузе:
• Гипофизарная недостаточность
• При назначении гормональной заместительной терапии ( HRT ) и во время ее мониторинга
• Менопаузальная метроррагия
• Опухоли яичников и надпочечников
Мониторинг терапии тамоксифеном (уровень эстрадиола может служить индикатором эстрогенного статуса и помочь в оценке содержания рецепторов к прогестерону в опухолевых тканях).
Мужчины:
• Опухоли
• Азооспермия, олигоспермия
• Заболевания печени
Уровни эстрадиола в норме
Концентрации эстрадиола выражаются в пг/мл или пмоль/л. Для перевода пг/мл в пмоль/л необходимо использовать следующее соотношение: 1 пг/мл = 0,0037 пмоль/л. Нужно иметь в виду, что на фоне приема пероральных контрацептивов показатели эстрадиола могут быть занижены.
Эстрадиол
пг/мл
пмоль/л
Мужчины
<56
<206
Женщины
Фолликулярная фазф
0 –160
0-587
Предовуляторная фаза
34 – 400
124-1468
Лютеиновая фаза
27 – 246
101-905
Менопауза
<30
<110
Препубертатные дети старше 5 лет
<30
<110
Биологический материал:
• Сыворотка крови
• Гепаринизированная плазма крови
Прогестерон Прогестерон — природный гестаген, принадлежащий к группе С21 -стероидов. У небеременных женщин основное количество прогестерона синтезируется яичниками и, в меньшей степени, корой надпочечников. Около 97 % прогестерона находится в связанном состоянии с альбумином и другими транспортными белками: тироксинсвязывающим глобулином и кортикостероидсвязывающим глобулином. Период биологической полужизни прогестерона очень короткий. На 2/3 он метаболизируется в печени и выводится с мочой в виде сульфата или глюкуронида прегнадиола. Некоторые из 5 ß-восстановленных метаболитов прогестерона вызывают повышение базальной температуры тела во время лютеиновой фазы. Физиологическая функция прогестерона
Уровень секретируемого яичниками прогестерона остается низким во время фолликулярной фазы. Под воздействием структурных и биохимических изменений в фолликуле, достигающих пика
при овуляции, лютеинизация гранулезных клеток завершается разрывом фолликула и образованием желтого тела. Это приводит к значительному увеличению синтеза прогестерона, уровень которого достигает максимума примерно за 7 дней до начала менструации. Биологическая роль прогестерона заключается в подготовке стимулированного эстрогенами эндометрия к имплантации оплодотворенной яйцеклетки.
Синтез прогестерона желтым телом возрастает при воздействии ЛГ и хорионического гонадотропина (ХГ). Только что образовавшееся желтое тело содержит наибольшее количество рецепторов, специфичных к ХГ. После имплантации яйцеклетки ХГ стимулирует синтез прогестерона желтым телом беременности до появления плаценты на 8 неделе развития плода. На этом этапе прогестерон начинает синтезироваться плацентой и его главной функцией становится снижение сократительной способности матки для сохранения беременности.
Патология:
- Повышение концентрации прогестерона:
- Снижение концентрации:
• Врожденная гиперплазия надпочечников, обусловленная дефицитом 21- ß-, 17- ß- и 11- ß-монооксигенов
• Хорионэпителиома яичника
• Липидоклеточная опухоль яичника
• Угроза выкидыша
• Синдром галактореи-аминореи
• Прием гормональных контрацептивов
Показания к проведению исследований:
• Овариальная недостаточность
• Нарушения менструального цикла и аменорея
• Карцинома молочной железы (параллельно с определением рецепторов прогестерона)
Уровни прогестерона в норме
Влияние на результаты анализа связывающих белков устраняется использованием соответству ющих блокирующих агентов. Результаты выражаются в нмоль/л и нг/мл (1 нг/мл = 0,3145 нмоль/л).
Прогестерон
(нг/мл)
(нмоль/л)
Мужчины (20 — 70 лет)
0 – 0,75
0 – 2,4
Женщины
Фолликулярная фаза
0 — 1,13
0 -3,6
Овуляторный пик
0,48- 1,72
1,52 – 5,36
Лютеиновая фаза
0,95 — 21
3,02 –66,8
Менопауза
0 — 1
0 – 3,18
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
Тестостерон
Тестостерон является наиболее важным андрогенным и природным анаболическим гормоном мужчин и женщин. Его предшественниками являются дельта-5-прегненолон и прогестерон; важными промежуточными продуктами являются дегидроэпиандростерон и андростендион. У мужчин он синтез ируется преимущественно в семенниках клетками Лейдига; у женщин — корой надпочечников и яичниками, а также в результате периферического метаболизма.
97- 98 % тестостерона циркулирует в крови в связанном состоянии. Основными связывающими белками являются ГСПГ и альбумин. Только свободный тесто стерон (около 2 % у мужчин и 1 % у женщин) обладает биологической активностью.
Физиологическая функция тестостерона
Нормальная секреция тестостерона необходима для поддержания функции воспроизведения у мужчин. Тестостерон контролирует сперматогенез, функцию простаты и потенцию. У обоих полов тестостерон стимулирует либидо, влияет на рост волос и голос.
Секрецию тестостерона клетками Лейдига стимулирует ЛГ. По принципу обратной связи тестостерон, а также образующийся из него эстрадиол, модулируют секрецию гонадотропинов гипофизом. Андрогенный компонент оказывает воздействие только на ЛГ, а эстрогенный — на ФСГ, поэтому нарушения функции семенников влекут за собой повышение уровня гонадотропинов в сыворотке крови. Синтез ФСГ подавляется ингибином семенных канальцев.
У женщин тестостерон секретируют яичники и кора надпочечников. Около половины тестостерона непосредственно секретируется стромой яичников, другая половина образуется в результате периферического метаболизма. Секреция тестостерона надпочечниками резко снижается у обоих полов после 50-60 лет. Патология:
Маленькие дети и дети пубертатного периода
Мужчины:
• Недостаток андрогенов может вызвать замедленное половое созревание, бесплодие и импотенцию.
• Низкий уровень тестостерона в сочетании с высоким уровнем гонадотропинов указывает на первичную тестикулярную недостаточность. Однако в некоторых случаях (например; при синдроме Клайнфельтера) уровень тестостерона может быть в норме.
• Низкий уровень тестостерона в сочетании с низким или нормальным уровнем ЛГ указывает на вторичную тестикулярную недостаточность. В этом случае проводят тест стимуляции LH — RH . Пациенту назначают гонадотропины, кломифен или пульсирующее введение LH — RH . Мониторинг проводится с помощью измерения уровня тестостерона и исследования эякулята.
Женщины:
а) повышенные уровни тестостерона и DHEAS указывают на избыток андрогенов надпочечникового происхождения. В качестве дополнительного исследования проводят определение циркадного цикла кортизола, тест на подавление дексаметазоном и тест на стимуляцию АСТН.
б) повышенный уровень тестостерона при нормальном или слегка повышенном уровне DHEAS указывает на избыток андрогенов овариального происхождения. У женщин с поликистозом яичников уровень тестостерона часто незначительно повышен; повышаются также уровни ЛГ, андростендиона и эстрона в сыворотке крови. Диагностический тест с LH — RH обычно приводит к повышению уровня ЛГ, но не ФСГ. При очень высокой концентрации тестостерона необходимо исключить наличие опухоли яичника, продуцирующей андрогены.
в) нормальные уровни тестостерона и DHEAS при клинически выраженном гиперандрогенизме указывают на повышение содержания свободного тестостерона вследствие снижения связы вающей емкости ГСПГ.
В случае тестикулярной феминизации пациенты имеют женский фенотип, слабый рост волос на лобке, хорошо развитые яички, расположенные либо в брюшной полости, либо в паху, и XY кариотип. Уровень тестостерона при этом соответствует нормальному мужскому уровню. Причиной заболевания является отсутствие рецепторов андрогенов в тканях-мишенях.
Показания к проведению исследований:
Пубертатный период:
• Тестикулярные нарушения у мальчиков
• Овариальные нарушения у девочек
• Нарушения деятельности надпочечников у обоих полов
• Замедленное половое созревание
Мужчины:
• Тестикулярная недостаточность
• Наблюдение за ходом лечения тестикулярной недостаточности
• Бесплодие
• Импотенция
• Гинекомастия
Женщины:
• Гирсутизм
• Тестикулярная феминизация
• Опухоли яичника, продуцирующие тестостерон
• Поликистоз яичников
• Нарушения менструального цикла
• Аменорея
• Бесплодие
Уровни тестостерона в норме
Изменяющийся уровень тестостерона объясняется эпизодической секрецией ЛГ. У женщин отмечен циркадный ритм тестостерона, что объясняется значительным вкладом надпочечников в синтез андрогенов. Поэтому уровень тестостерона у женщин достигает своего максимума в ранние утренние часы.
Повышение концентрации тестостерона может наблюдаться при приеме барбитуратов, кломифена, эстрогенов, пероральных контрацептивов. У мужчин причинами низкого уровня тестостерона могут быть длительный алкоголизм, стресс и физическое истощение.
Уровень тестостерона приводится в нмоль/л (1 нг/мл = 3,47 нмоль/л).
нг/мл
нмоль/л
Мужчины
2,9 – 15,1
9,9 – 52,4
Женщины
0,65 – 1,19
2,3 – 4,1
Примечание:
С возрастом уровень тестостерона постепенно снижается.
Биологический материал:
• сыворотка крови
• плазма крови.
Глобулин, связывающий половые гормоны (ГСПГ)
ГСПГ связывает циркулирующие в крови половые гормоны (тестостерон и эстрогены), переводя их в не активную фракцию. ГСПГ синтезируется в печени. Его уровень повышается под действием эстрогенов и тиреоидных гормонов, при беременности, неврогенной анорексии, циррозе печени. Снижение уровня ГСПГ наблюдается при гипотиреозе, гиперандрогенемии, ожирении, заболеваниях печени, ведущих к снижению синтетической способности.
Так как половые гормоны, связанные с ГСПГ выбывают из активного пула, снижение его уровня у женщин приводит к явлениям гиперандрогении без повышения уровня общих андрогенов. У мужчин повышение уровня ГСПГ приводит к клинике гипоандрогении при нормальном уровне общего тестостерона.
Содержание ГСПГ в норме
нмоль/л
Мужчины
13-71
Женщины
18-114
Дегидроэпиандростерон сульфат ( DHEAS ) DHEAS является надпочечниковым андрогеном, относящимся к группе 17-кетостероидов. DHEAS образуется из сульфата холестерола. Основное количество DHEAS катаболизируется организмом и только 10 % его выделяется с мочой. Ежесуточно в кровяное русло выделяется 10 — 20 мг DHEAS (35 — 70 моль) у мужчин и 3,5 — 10 мг (12 — 35 моль) у женщин. Секреция DHEAS не имеет циркадного ритма, для этого стероида нет также специфических стероидсвязывающих сывороточных белков, поэтому концентрация DHEAS не зависит от изменения содержания этих белков в сыворотке крови. Однако DHEAS способен связываться с альбумином сыворотки крови человека.
Помимо DHEAS в крови циркулирует DHEA (дегидроэпиандростерон) DHEA синтезируется в основном корой надпочечников и, частично, половыми железами. Он образуется в 4 раза медленнее, чем DHEAS , у мужчин и в 2 раза медленнее у женщин. Скорость его метаболизма значительно выше, поэтому концентрация циркулирующего DHEA может быть в 1 000 раз ниже, чем DHEAS . Высокая концентрация в крови, длинный период полу-жизни и высокая стабильность делают DHEAS отличным индикатором андрогенсекретирующей функции надпочечников.
Повышенный уровень тестостерона у женщин может иметь надпочечниковое или овариальное происхождение. Результаты определения DHEAS позволяют выявить причину гиперандрогении.
Патология:
• Значительное повышенная концентрация DHEAS (наблюдается только при гиперандрогении надпочечникового происхождения):
• андрогенсекретирующих опухолях надпоче-чников,
• двусторонней врожденной гиперплазии надпочечников с гиперандрокортицизмом (дефект 21-гидроксилазы и 11- ß-гидроксилазы)
• гирсутизме надпочечникового происхождения
• синдром Кушинга
• эктопический синтез АКТГ.
• Умеренное повышение может быть при поликистозе яичников.
• Снижение наблюдается при недостаточности коры надпочечников
Показания к проведению исследований:
• Опухоли надпочечников
• Дифференциальная диагностика овариальных нарушений
• Остеопороз
• Задержка полового развития
Содержание DHEAS в норме
мкг/дл
мкмоль/л
Мужчины
80 – 560
2,2 – 15,2
Женщины
35 – 430
0,9 – 11,7
Биологический материал:
• Кровь
• Гепаринизированная плазма крови
17-гидрокси-прогестерон 17-гидроксипрогестерон – это промежуточный продукт синтеза стероидов в корковом слое надпочечников и гонадах. Основное клиническое значение определения 17ОН-прогестерона состоит в выявлении дефицита 21-гидроксилазы (фермента, под действием которого 17ОН-прогестерон превращается в11-дезоксикортизол в каскаде стероидогенеза).
Дефицит 21-гидроксилазы является самой распространенной формой (90% случаев) врожденной гиперплозии коры надпочечников (ВГКН, адрено-генитальный синдром). Нарушение синтеза 11-дезоксикортизола приводит к дефициту кортизола и альдостерона, повышению уровня АКТГ, гиперплазии коры надпочечников и усилению секреции надпочечниковых андрогенов. Дефицит альдостерона приводит к формированию синдрома потери соли, который проявляется кризами у 75% новорожденных с ВГКН, в более старшем возрасте кризы могут провоцироваться интеркурентными заболеваниями. Избыточная продукция андрогенов, особенно андростендиона, вызывает вирилизацию, которая служит характерным признаком этой формы ВГКН. У девочек вирилизация начинается еще во внутриутробном периоде и к моменту рождения может достигнуть разной степени от клиторомегалии до полного сращения губно-мошоночных складок и формирования уретры, открывающейся в тело полового члена. После рождения у мальчиков и девочек наблюдается увеличение полового члена/ клитора, угри, ускоренный рост, раннее оволосение лобка. Рост детей 3-10 лет опережает сверстников, в 11-12 лет происходит закрытие эпифизарных зон, поэтому нелеченные дети остаются низкорослыми. Характерны нарушение полового развития и бесплодие, однако, лечение может обеспечить нормальное формирование вторичных половых признаков и фертильность. Особое внимание следует обратить на женщин с невыраженными проявлениями ВГКН, которые обращаются к гинекологам-эндокринологам с жалобами на нарушение менструального цикла, гирсутизм и бесплодие.
Содержание 17ОН-прогестерона в норме:
нг/мл
новорожденные
5-30 дней
0,7-2,5
31-60 дней
мальчики
0,8-5,0
девочки
0,5-2,3
дети
3-14 лет
0,7-1,7
мужчины
0,5-2,1
женщины
фоликулиновая фаза
0,1-0,8
овуляция
0,3-1,4
лютеиновая фаза
0,6-2,3
постменопауза
0,13-0,5
беременные 3 триместр
2,0-12,0
Биологический материал:
• Кровь
• Гепаринизированная плазма крови
Антитела к сперме
Около 15% всех семейных пар, желающих иметь детей, страдают бесплодием. Предполагают, что у 10 из 100 бесплодных пар бесплодие имеет иммунологические причины. Одной из таких причин может быть выработка специфических антител к поверхностным белкам сперматозоидов, которые влияют на подвижность и функции мужских половых клеток. Метод иммуноферментного определения антител к сперме может быть использован для проведения скрининговых обследований по выявлению бесплодия, обусловленного иммунологическими механизамами. В случае бесплодия неясной этиологии рекомендуется проводить исследование на наличие антител к сперме обоим супругам. Показано, что тесты на выявление антител к сперме могут так же применяться для контроля за проводимой терапией. Пограничная концентрация антиспермальных антител в сыворотке 75 Е/мл. Пробы с концентрацией превышающей 75 Е/мл считаются положительными.
Хорионический гонадотропин (ХГЧ)
Хорионический гонадотропин — наиболее важный из гестационных гормонов. ХГЧ продуцируется клетками синцитиотрофобласта плаценты и некоторыми опухолями.
Подобно гипофизарным гонадотропинам, ХГЧ является гликопротеином с молекулярной массой 40 кДа, который состоит из двух субъединиц. ß-субъединица ХГ содержит значительную часть аминокислотной последовательности ß-субъединицы ЛГ, а также 30 аминокислот на С-конце молекулы. В результате такой молекулярной гомологии возможность иммунохимической дифференциации ХГЧ и ЛГ зависит от способности антител определять небольшую часть молекулы ХГЧ, структурно отличающуюся от ЛГ. Использование моноклональных антител или специально обработанных поликлональных антител в ряде случаев делает возможным разрабатывать методы определения ХГЧ с пренебрежимо малой перекрестной реакцией с ЛГ, ФСГ и ТТГ.
Физиологические функции ХГЧ
Определяемые количества ХГЧ появляются в крови матери уже на 8-9 день после оплодотворения яйцеклетки. Во время первого триместра беременности уровень ХГЧ быстро возрастает, удваиваясь каждые 2-3 дня. Концентрация ХГЧ достигает своего максимума на 8-10 неделе беременности, после чего несколько снижается и остается постоянной в течение второй половины беременности. Быстрое возрастание концентрации ХГЧ в периферической крови и моче делает определение ХГЧ идеальным видом анализа для быстрой диагностики беременности. Физиологическая роль ХГЧ в ранние сроки беременности состоит в стимуляции синтеза прогестерона желтым телом. Считается также, что ХГЧ стимулирует синтез тестостерона половыми железами плода мужского пола, а также оказывает воздействие на кору надпочечников эмбриона.
При удалении матки, после родов или аборта ХГЧ детектируется в течение более длительного периода, чем это следует из периода его полу-жизни. Уровень ХГЧ возвращается в норму в течение 2-3 недель после хирургического вмешательства; если уровень ХГЧ не снижается, это указывает на неполное удаление матки или эктопическую беременность. Высокий уровень ХГЧ после миниаборта указывает на продолжающуюся беременность.
Патология:
Беременные женщины:
При внематочной беременности уровень ХГЧ в сыворотке крови и моче значительно ниже, чем при нормальной беременности в соответствующие сроки, либо его уровень повышается медленнее. Однако в случае имплантации эмбриона в достаточно благоприятном месте, уровень ХГЧ может повышаться, до значений, характерных для нормальной беременности. Таким образом, определение ХГЧ можно проводить в целях диагностики внематочной беременности. В случае положительного анализа на ХГЧ проводят дальнейшие исследования, в том числе эхографию, для дифференциации маточной и внематочной, физиологической и патологической беременности.
Пониженная концентрация гормона наблюдается при угрожающем или несостоявшемся выкидыше. Для подтверждения диагноза рекомендуется проводить повторные измерения уровня ХГЧ в динамике и ультразвуковое обследование.
В последние годы при повышенном уровне ХГЧ проводят определение альфа-фетопротеина (АФП) и других независимых маркеров для пренатальной диагностики синдрома Дауна. Кроме того, при повышении уровня ХГЧ необходимо исключать внутриматочную инфекцию.
При пузырном заносе (хорионаденоме) происходят изменения в хориальных ворсинах. Возрастает активность клеток синцитиотрофобласта, что влечет за собой гиперсекрецию ХГЧ. Если в случае нормальной беременности уровень ХГЧ снижается после 10 недели беременности, то при хорионаденоме он продолжает возрастать и может достигнуть миллиона МЕ/л. Оптимальная диагностическая информация достигается при использовании ультразвуковой эхографии.
Повышенные уровни у больных со злокачественными заболеваниями
• опухоли трофобласта или терминального происхождения
• рак яичек
• рак яичников
• хорионкарцинома
• пузырный занос
• рак желудка
• рак печени
• рак тонкой кишки
• рак толстой кишки
• рак почек
• мелкоклеточный бронхогенный рак легких (эктопическая секреция)
• рак яичников
• рак молочных желез (эктопическая секреция)
• рак матки
Женщины:
Злокачественные опухоли трофобласта. Злокачественные новообразования возникают у 5-10 % пациенток с хорионаденомой. Поэтому после удаления хорионаденомы необходимо проводить регулярное обследование пациенток до тех пор, пока уровень ХГЧ не перестанет детектироваться. В течение, как минимум, полугода анализ ХГЧ должен проводиться ежемесячно, в течение 2 последующих лет анализ проводят через более длительные промежутки времени. Определение ХГЧ при лечении пролиферирующих опухолей и хориокарцином цитостатическими агентами позволяет оценить эффективность терапии. Три отрицательных анализа с интервалами в три недели свидетельствуют о ремиссии. В дальнейшем мониторинг проводится, как в случаях беременности с пузырным заносом. Определение а-субъединицы ХГЧ имеет прогностическое значение, так как увеличение ее уровня свидетельствует об ухудшении состояния больной.
Мужчины:
Уровень ХГЧ определяют в случае злокачественных новообразований (например, тератом и других тестикулярных опухолей). Хотя уровень ХГЧ не всегда повышается до минимально детектируемого, или повышается только уровень свободных субъединиц, анализ ХГЧ позволяет оценить эффективность проводимой терапии.
Показания к проведению исследований:
Беременные женщины:
• Детекция беременности
• Внематочная беременность
• Диагностика угрожающего выкидыша
• Пузырный занос (хорионаденома)
• Злокачественные опухоли трофобласта
• Диагностика врожденных злокачественных опухолей плода
• Хромосомные аберрации плода
Мужчины и небеременные женщины:
• Тестикулярные опухоли
• Тератомы и тератобластомы
Содержание ХГЧ в норме
( МЕ/л )
Мужчины
0-2,5
Небеременные женщины
0-5,3
Беременность:
Гестационный возраст (недели)
Медиана (интервал значений)
2-3
300 (150-600)
3-4
700 (360-1400)
4-5
14000. (9000 –21000)
5-6
80000 (40000 –120000.)
6-7
155000 (130000 –200000)
7-8
185000 (150000 –220000)
9
175000 (140000 –210000)
10
170000 (135000 – 205000)
11
140000 (120000 –160000)
12
115000 (100000 -130000)
13
100000 (90000 – 110000)
14 90000 (80000 – 100000) 15 31700 (15900-63400) 16 27100 (13500-54100) 17 23100 (11000-46200) 18 21600 (10800-43200) 19 18200 (9100 – 36400) 20 16400 (8200-32800) 21 14600 (7300-29200) 22 12500 (6300-23000) 23 11000 (5500 – 22000) >24 7000 (3500 – 14000) Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
• моча
• амниотическая жидкость.
Альфафетопротеин (АФП )
АФП является специфическим фетальным а-глобулином с молекулярной массой 65-70 кДа. Первоначально АФП вырабатывается желтым телом. Начиная с 13 недели беременности, когда его уровень достигает максимума в сыворотке крови плода (3 мг/мл), он начинает синтезироваться печенью плода, и его уровень постепенно снижается до 0,08 мг/мл к моменту родов. В течение первого года жизни уровень АФП снижается до очень низких значений, характерных для взрослого человека.
Диагностическое значение АФП во время беременности
Во время физиологической беременности уровень АФП в амниотической жидкости снижается, а в материнской сыворотке, напротив, возрастает. Увеличение уровня АФП всегда служит показателем наличия серьезных нарушений.
Возможность определять дефекты незаращения нервной трубки плода (расщелину позвоночника, анэнцефалию) на базе повышенного уровня АФП в амниотической жидкости, полученной при отхождении околоплодных вод на 15-20 месяце, была показана в 1970г. Затем повышенный уровень АФП в амниотической жидкости стали связывать с наличием других аномалий развития плода.
Диагностика врожденных аномалий по уровню АФП в материнской сыворотке (MC АФП) основывается на тех же принципах. Так как физиологический уровень АФП зависит от срока беременности, результаты анализа МС АФП наиболее часто оценивают по отношению к среднему значению уровня АФП, характерному для данного срока Повышение уровня МС АФП в 2,5 и более раз выше нормы наблюдается при серьезных патологических состояниях, угрожающем выкидыше или гибели плода.
Понижение уровня АФП по сравнению с уровнем нормально развивающейся беременности может свидетельствовать о риске рождения ребенка с трисомией по 21 хромосоме. Однако, поскольку уровень АФП при патологической беременности (при трисомии) составляет лишь 0,7 от его уровня при физиологической беременности, рекомендуется анализ АФП комбинировать с определением других независимых маркеров, например, ХГЧ или его субъединиц, свободного эстирола и др.
Некоторые авторы советуют использовать анализ МС АФП в качестве дополнительного анализа при осложненной беременности.
Патология:
Повышенные уровни у больных со злокачественными опухолевыми заболеваниями:
• первичный рак печени (за исключением анапластической формы, при которой АФП — отрицательный)
• метастазы злокачественных опухолей в печень(при бронхогенной карциноме, раке молочной железы и раке прямой и сигмовидной кишки).
• опухоли терминального происхождения
• рак яичника
• рак яичка
• рак желудка
• рак толстой кишки
• рак поджелудочной железы
• рак молочной железы
• бронхиальные опухоли
Повышенные уровни при заболеваниях доброкачественной этиологии :
• цирроз печени
• острый вирусный гепатит
• хронический гепатит
• хроническая почечная недостаточность
Показания к проведению анализа:
Беременные женщины :
• Контроль за ходом 1-ого триместра беременности
• Угроза выкидыша
• Диагностика врожденных пороков развития
• Диагностика хромосомных аберраций
Пациенты с опухолями :
• Гепатоцеллюлярная карцинома
• Злокачественные опухоли желчного пузыря, желчных путей и поджелудочной железы
• Тестикулярные опухоли
• Тератомы, тератобластомы
• Опухоли, имеющие эмбриональное происхождение
Содержание АФП в норме
Результаты обычно выражаются в МЕ/мл (1 МЕ/мл = 1,21 нг).
МЕ/мл
нг/мл
Вне беременности
0,5 – 5,5
0,6 – 6,66
Во время беременности:
Гестационный возраст (недели)
Медиана (интервал), МЕ/мл
14
21,7 (10,9-21,8)
15
25,0 (12,5-50)
16
28,8 (14,4-57,6)
17
33,1 (16,5-66,2)
18
38,0 (19-76)
19
43,8 (21,9-87,6)
20
50,4 (25,2-100,8)
21
57,9 (28,9-115,8)
22
66,2 (33,1- 132,4)
23
90,0 (45-180)
Биологический материал:
• сыворотка
• гепаринизированная плазма
• амниотическая жидкость
• кистозная жидкость
• асцитическая жидкость
Неконъюгированный эстриол
Эстриол является стероидным гормоном, синтезируемым плацентой. На первой стадии синтеза, которая происходит в эмбрионе, холестерин, образующийся de novo, либо поступающий из крови матери, превращается в прегненолон, который сульфатируется корой надпочечников плода в дегидроэпиандростеронсульфат. Гидроксилирование этого соединения по 16 а-положению и отщепление сульфата сульфатазами плаценты приводит к образованию эстриола. Поскольку в образовании эстриола принимают участие как плод, так и плацента, измерение уровня эстриола может служить идеальным показателем функции фето-плацентарной системы.
Физиологические функции эстриола В материнской крови только небольшая часть эстриола циркулирует в свободном состоянии, основное его количество составляет глюкуронид а-сульфата Во время беременности уровень эстриола постепенно возрастает до 40 недели. Пониженный уровень эстриола или его резкое снижение свидетельствует о патологическом состоянии плода. Определение уровней общего или свободного эстриола используют для мониторинга беременности. Уровень свободного эстриола быстрее отражает ухудшение состояния плода. Патология
Определение эстриола используют для наблюдения за состоянием фетоплацентарной системы , а также для диагностики
Уровень неконъюгированного эстриола снижается при :
• осложненном течении беременности (поздний гестоз, анемия, пиелонефрит, хронические заболевания ЖКТ, патология надпочечников у беременной), сопровождающемся нарушением плацентарного кровообращения и возникновением плацентарной недостаточности, развитием гипоксии и ацидоза у плода
• внутриутробной гипотрофии плода
• алкогольном синдроме плода
• внутриутробном инфицировании плода
• некоторых видах наследственной патологии (врожденной гипоплазии надпочечников, синдроме Дауна, анэнцефалии и др.)
• нарушения сульфатазной активности плаценты (редкое врожденное заболевание, связанное с Х-хромосомой). Отсутствие этого фермента блокирует синтез эстриола из предшественников, что отражается в очень низком уровне эстриола при беременности без каких-либо других признаков неблагополучия плода. Такие беременности часто заканчиваются хирургическим вмешательством в процесс родов, причем рождаются исключительно младенцы мужского пола с признаками ихтиоза, появляющегося вскоре после рождения.
• применении кортикостероидов (например, для стимуляции созревания легочной ткани плода)
• применении некоторых антибиотиков.
Уровень неконъюгированного эстриола повышается при:
• почечной недостаточности.
Показания к проведению исследований:
Беременные женщины :
• Мониторинг состояния плода в третьем триместре беременности
• Диагностика хромосомных аберраций
Уровни неконъюгированного эстриола в норме
Гестационный возраст (недели)
Медиана, нмоль/л
Интервал, нмоль/л
6-7
1,19
0,98-1,38
8-9
1,63
1,37-1,89
10-12
4,03
2,3-5,77
13-14
7,72
5,74-9,68
15-16
10,0
5,4-21,0
17-18
12,0
6,6-25,0
19-20
14,93
10,76-19,1
21-22
24,48
19,34-29,62
23-24
28,33
22,11-34,54
25-26
30,80
23,40-38,19
27-28
32,55
24,39-40,71
29-30
35,38
28,09-42,67
31-32
45,63
35,01-56,26
33-34
43,0
39,08-46,93
35-36
51,68
44,77-53,59
37-38
63,68
54,90-72,47
39-40
65,07
57,61-72,53
Трофабластический ß — гликопротеин (ТБГ)
ТБГ синтезируется клетками трофобласта и является специфическим маркером беременности. В низких концентрациях (0,2-5,0 нг/мл) он определяется в крови здоровых небеременных женщин. Уже со 2 недели его уровень существенно возрастает, что позволяет использовать этот тест для ранней диагностики беременности. При нормальном течении беременности уровень ТБГ прогрессивно возрастает до 20-24 недели, затем стабилизируется и резко падает накануне родов. В послеродовом периоде содержание ТБГ через 30 – 40 часов уменьшается вдвое, а к 16 дню достигает уровня здоровых небеременных женщин. Одним из физиологических эффектов является его иммуносупрессивное действие, что необходимо для нормального развития беременности.
Патология:
Снижение:
• Менее 500нг/мл при сроке 3-5 недель:
• Внематочная беременность
• Функциональная недостаточность трофобласта
• Резкое снижение в более поздние сроки указывает на угрозу спонтанного преждевременного прерывания беременности (при падении в 6 раз в 100% случаев, а в 2-4 раза в 33,3% случаев)
• Уменьшение концентрации ТБГ в ходе лечения угрожающего выкидыша говорит о неэффективности терапии
• Медленное увеличение содержания ТБГ по мере развития беременности или стабилизации его показателей указывает на вероятность позднего выкидыша или преждевременных родов
• Снижение ТБГ наблюдается при наличии у плода трисомий
Повышение:
• Многоплодная беременность
• Сахарный диабет
• Резус-конфликтная беременность (уровень ТБГ увеличивается пропорционально тяжести гемолитической болезни плода)
• Перенашивание
• Онкологические заболевания (мониторинг течения и эффективности терапии):
• Рак матки
• Рак яичников
• Хорионкарцинома (ТБГ/ХГЧ = 0,1 – 1,0)
• Инвазивный занос (ТБГ/ХГЧ = 1,2 – 4,5)
• Пузырный занос (ТБГ/ХГЧ = 6,0 – 12,0)
• Анэнцефалия плода (наряду с исследованием АФП, ХГЧ и неконьюгированного эстриола).
Содержание ТБГ в норме
Гестационный возраст (недели)
ТБГ, нг/мл
2-3
50-150
3-4
150-300
4-5
300-500
5-6
500-1500
6-7
1500-3000
7-8
3000-5000
9
8000 — 10000
10
10000 — 13000
11
13000 — 17000
12
15000 – 18000
13
17000 – 20000
14
19000 – 24000
15
20000 –25000
16
22000 – 28000
17
25000 – 30000
18
30000 – 35000
19
32000 – 37000
20
33000 — 38000
21
35000 — 40000
22
37000 – 42000
23
40000 – 45000
24
45000 – 55000
25
55000 – 100000
26
100000 -200000
27
200000 –300000
28
300000 –400000
29 –40
400000 –500000
Биологический материал:
• Кровь
• Сыворота крови
ПАПП-А (РАРР-А) Белок РАРР-А (pregnancy associated plazma protein A) впервые был обнаружен в сыворотке крови беременных с помощью метода иммунодиффузии в 1974г. РАРР-А вырабатывается у беременных женщин трофобластом, у небеременных — клетками гранулезы, слизистой обочлочкой маточных труб и эндометрием, а у мужчин — клетками Лейдига. Молекулярная масса РАРР-А 200 кД. В сыворотке крови беременных РАРР-А находится в комплексе с проформой основного протеина эозинофилов, что позволяет ему разрывать мембрану цистосом и оказывать повреждающее воздействие на ткани. Подобный эффект вероятно необходим в процессах нидации плодного яйца и развития трофобласта. РАРР-А принимает участие в регуляции кровотока в межворсинчатом пространстве за счет ингибирования гемолиза, индуцированного системой комплимента, угнетает активность плазмина и имеет аффинитет к гепарину. РАРР-А in vitro до-зозависимо ингибирует пролиферативную активность лимфоцитов, индуцированную лейкинами или аллогенными клетками, поэтому он входит в группу белков-иммуносупрессоров.
Рост сывороточной концентрации РАРР-А при беременности зависит от массы плацентарных клеток. Прогностическая ценность по диагностике плацентарной недостаточности (ПН) у РАРР-А ниже, чем у трофобластического ?1-гликопротеина (ТБГ). При ПН уровень РАРР-А снижается, а при начавшемся самопроизвольном выкидыше, сопровождающемся деструкцией клеток синцитиотрофобласта — повышается.
Особый интерес исследования РАРР-А представляют для диагностики синдромов хромосомных трисомий плода по 21 (синдром Дауна), 18 (синдром Эдвардса), 13 (синдром Патау) хромосомам в I триместре беременности. Исследования показали, что уровень РАРР-А в сыворотке крови при названных синдромах снижается в сроке 9-13 недель менее 0,5 Мом. Для синдрома Дауна снижение РАРР-А выявлено в 65%, для синдромов Эдвардса и Патау до 70% случаев, при ложноположительных результатах 5%. Обнаружено снижение РАРР-А менее 0,5 Мом при синдроме Корнелии де Ланге.
Рекомендуется проводить определение РАРР-А оптимально с 9 до 11 недель (по последней менструации), за 7-10 дней до УЗИ эмбриона с измерением толщины его воротникового пространства (ТВП).
Содержание РАРР-А в сыворотке крови при беременности в норме:
Недели беременности по последней менструации
Медиана (Мом), ug/ml
Допустимые значения
0,5 Мом, ug/ml
2 Мом, ug/ml
8
2600
1300
5200
9
4200
2100
8400
10
7560
3780
15120
11
11000
5500
22000
12
15060
7530
30120
13
17000
8500
34000
14
21510
10750
43020
Коэффициенты пересчета единиц измерения:
1 mIU/ml = 450 ug/ml
1 ug/ml=2220 mIU/ml
что это такое, кариотип, хромосомы, симптомы и фото больных
Среди всех хромосомных аномалий особенное место занимают трисомии – появление в одной из пар хромосом одной лишней. Обычно подобные мутации относят к летальным, такие зародыши немедленно отбраковываются на этапе зачатия. Но есть три варианта аномалий, при которых дети выживают, хотя и имеют определенные патологии – это синдром Дауна, аномалия Эдвардса и синдром Патау. Последний относят к наиболее тяжелым аутосомным трисомиям (поражены неполовые хромосомы).
Отклонения в количестве хромосом и генетического материала в них влекут за собой серьезные проблемы развития, уродства и пороки внутренних органов, делая жизнь таких детей более сложной. Но не стоит думать, что дети с подобными проблемами могут родиться только у людей, подвергшиеся действию радиации, ведущих асоциальный образ жизни и имеющих вредные привычки. Нередко хромосомные аномалии плода возникают у вполне здоровых родителей. Откуда же возникает синдром Патау, какие формы бывают и что нужно знать о патологии?
Оглавление: Общие данные о синдроме Распространенность синдрома: данные статистики В чем истинная причина синдрома Патау? Формы синдрома Патау Проявления синдрома Патау: симптомы Основы диагностики синдрома Можно ли лечить синдром Патау?
Общие данные о синдроме
Из трех вариантов трисомий по неполовым хромосомам синдром Патау относят к самому редкому и более тяжелому варианту аномалий. Большинство детей проживает лишь несколько суток после рождения, имея тяжелые комбинированные пороки развития. Лишь часть их них доживает до года и старше. Сама основа синдрома – дефект хромосом была выявлена в 1960 году, и была названа именем автора, описавшего патологию. Признаки данной хромосомной аномалии широко варьируют и могут по-разному комбинироваться среди детей. Но есть и ряд определенных базовых признаков патологии, которые типичны для данной аномалии и выявляются всегда. К ним относят тяжелую степень умственной отсталости, зачастую связанную с аномалией строения самого мозга – он не разделен на полушария. Нередко этой проблеме сопутствуют аномалии в развитии конечностей и полидактилия, пороки развития сердца, спинного мозга и дефекты лицевого скелета. Обычно синдром Патау настолько нагляден, что распознается сразу после появления младенца на свет, из-за тяжелых врожденных аномалий структуры органов и неврологических расстройств дети требуют оказания немедленной помощи.
Распространенность синдрома: данные статистики
Учеными в разных странах приводятся различные данные о встречаемости синдрома – от одного случая на 7-14 тысяч новорожденных до 12-20 тысяч. Нет выраженных географических различий во встречаемости аномалии, предрасположенности к определенной расе или уровню жизни.
Важно
Известно, что возраст родителей, особенно матери, играет ведущую роль в повышении частоты встречаемости. Чем старше мать, особенно после 35 лет, тем выше риски трисомий у плода.
Считается, что частота встречаемости подобного синдрома выше в регионах с низким уровнем медицины и сильным загрязнением окружающей среды, особенно если речь идет о радиоактивных соединениях. Это связано повышением риска мутаций.
В чем истинная причина синдрома Патау?
Все проблемы ребенка с раннего внутриутробного периода связаны с наличием в его клетках дополнительной хромосомы в 13-ой паре. Это формируется в момент зачатия, если отцовская или материнская половая клетка подверглась мутации и в ней осталась не одна хромосома в 13-ой паре, а две (помним, что в половых клетках имеется половинный набор хромосом – то есть их всего 23, вместо 46 в обычных). При зачатии половые клетки сливаются, образуя двойной набор хромосом у зародыша, и в 13-ой паре, таким образом, образуется не две, а три хромосомы. Это и приводит к формированию аномалий в развитии, порокам и низкой жизнеспособности. Точные механизмы, в силу которых может образоваться трисомия по этой (да и по другим парам) хромосоме – неизвестны. Ученые пока строят только предположения, активно изучая механизмы на примере синдрома Дауна.
Чтобы организм полноценно воспроизводил все структуры и функции, ему нужны именно две хромосомы, а не одна или три. Избыток генетического материала формирует сбои нормальных программ закладки тканей и органов, аномальную работу генов. Обычно избыток хромосом приводит к летальным мутациям, но только при этих трех синдромах плод способен выжить, но какой ценой?
Генетики и акушеры, ученые выделяют ряд факторов риска, повышающих вероятность рождения больных детей. Но это не значит, что их наличие – это 100%-ная гарантия больного ребенка, это только повышение вероятности. К ним относят:
- Рождение детей от близкородственных браков (накопление мутаций одного рода)
- Наличие наследственных патологий в семье
- Возраст женщины старше 35 лет, возраст отца более 45 лет
- Неблагополучная экологическая обстановка
- Облучение организма.
Однако это не гарантия рождения больного ребенка, равно как и полное здоровье родителей. Есть много случаев рождения детей с трисомией по 13-ой хромосоме у супругов, которые молоды и здоровы, не имели наследственных патологий в семье. Это говорит о возможности спонтанных мутаций в хромосомном наборе. Поэтому точно сказать, каковы причины развития данного синдрома на сегодняшний день невозможно.
Формы синдрома Патау
Прежде всего, стоит заметить, что синдром Патау – это совершенно иное заболевание, нежели синдром Дауна, они не аналогичны и даже не похожи, так как повреждены совершенно разные хромосомы и из-за этого существенно разнятся особенности обмена и структурные аномалии, которые нередко заметны невооруженным глазом даже людям без медицинского образования. Но существуют разные формы синдрома, от которых зависит прогноз для жизни и степень тяжести синдрома:
- Цитогенетическая форма синдрома развивается из-за наличия лишней хромосомы в половых клетках одного из родителей (материи или отца). Это формируется по причине аномалий мейоза (деления, формирующего половые клетки), в ходе которого хромосомы в одной паре не расходятся, их остается две. Подобная же форма возможна при формировании особого варианта – робертсоновской транслокации. При ней хромосомы не просто не разделяются, они сливаются, образуя особые мутации.
- Простая форма синдрома формируется в самом раннем сроке развития плода, при ней возникает мутация в ходе первого деления, за счет чего все клетки тела приобретают ненормальный набор хромосом. Это грозит обширными поражениями и серьезными мутациями. По мере развития плода, нарастает и тяжесть изменений, обусловленных влиянием лишней хромосомы.
- Мозаичная форма – это наличие лишней хромосомы только в части клеток плода, наряду с вполне нормальными тканями и клетками. Мутации могут быть не столь сильными и выраженными. Страдают только отдельные органы и ткани, что делает прогноз более благоприятным. Иногда первоначально мутации не так выражены на фоне этой формы, и внешних дефектов мало. Подтвердить диагноз тогда может генетическое тестирование.
Проявления синдрома Патау: симптомы
Определенные проявления синдром может давать еще при беременности, но назвать их специфичными нельзя, они могут быть характерны и для многих других проблем. К ним относят рождение плода ранее срока 38-ми недель, многоводие, зачастую с наличием примесей, часто формируются ранние и поздние выкидыши, мертворождение.
Для новорожденного также типичен ряд специфических признаков и черт, отражающих влияние лишней хромосомы. Ребенок рождается с признаками гипотрофии и ЗВУР, у него имеются физические отклонения и проблемы с нервно-психическим развитием. Типично наличие множественных пороков развития и аномалий, особенно касающихся нервной системы – как головного, так и спинного мозга, деформаций конечностей, костей черепа и челюстей, проблем с органами чувств – аномалиями глазных яблок, ушных раковин, среднего и внутреннего уха. Возможно удвоение селезенки, нарушение строения гениталий, расщелины неба.
Важно
Зачастую количество пороков насчитывает более 10-20 в разных локациях, что делает существование ребенка вне утробы матери проблематичным. Чем больше тяжелых отклонений, тем меньше прогноз выживаемости.
Наиболее наглядные и типичные проявления, отличающие синдром Патау от многих других аномалий, это наличие заячьей губы с волчьей пастью, а также микроцефалия (уменьшение размеров головы и мозга), микрофтальмия (уменьшение размеров глазных яблок), недоразвитие кожи в области затылка, дефекты носа и ушей. Также возможны дефекты спинного мозга и периферических нервов, пупочные грыжи, полидактилия (увеличение количества пальцев рук или ног).
Примерно 80% детей имеет пороки сердца в разных их вариантах – это могут быть незакрытый артериальный проток, дефекты перегородок между предсердиями или желудочками, состояние декстракардии. У детей, имеющих синдром Патау, возможны серьезные дефекты в области мозга – особенно типично нарушение его разделения на полушария, а также формирование параллельно с этим дефектов лицевого черепа – проблемы с глазами, недоразвитие носа, расщелины в области неба и губ, циклопия. Возможно образование поликистозного поражения обеих почек и развитие множественных капиллярных гемангиом. Нередко врачи, незнакомые с проявлениями синдрома Патау, могут его ошибочно принимать за другие хромосомные и генные синдромы. Диагноз нужно всегда подтверждать цитогенетическими исследованиями и выявлением трисомии.
Основы диагностики синдрома
Заподозрить подобную патологию можно сразу после рождения по набору типичных признаков, но подтвердить наличие хромосомных аномалий необходимо по данным исследования кариотипа младенца. Кроме того, современная медицина сегодня позволяет диагностировать подобный синдром до родов, по данным инструментальных и лабораторных исследований.
До родов возможно:
- Проведение УЗИ с выявлением пороков развития после 20-ой недели беременности. До этого времени выявить проявления синдрома достаточно тяжело. Подобное обследование не относится к числу обязательных диагностических процедур, его проводят по просьбе родителей или назначению врача, если выявлены отклонения в развитии беременности. Поводами могут быть снижение массы тела плода на скрининге, дефекты черепа и некоторые иные признаки.
- Провести более прицельную диагностику помогают такие исследования во время беременности как изучение кариотипа плода за счет кордоцентеза (получают пуповинную кровь), амниоцентеза (получают образец околоплодных вод с клетками плода) или биопсии ворсинок хориона.
После родов возможно проведение:
- осмотра педиатром или неонатологом с выявлением аномалий развития, подозрительных относительно синдрома симптомов. Если количество аномалий развития невелико, тогда дополнительно применяют УЗИ сердца младенца, брюшной полости и головного мозга. Если необходима оперативная коррекция пороков, проводят консультирование с приглашением хирурга.
- лабораторные исследования – цитогенетическое исследование. При нем могут быть выявлены различные варианты синдрома Патау, как изолированная трисомия по 13-ой паре хромосом. Возможны также варианты робертсоновской транслокации – это дополнительная копия 13-ой хромосомы, которая может быть прикреплена на другие пары. Возможна мозаичная трисомия, которую сложнее всего выявить в период новорожденности. При ней пороки единичные и относительно «мягкие», при подобной патологии прогнозы самые благоприятные.
Можно ли лечить синдром Патау?
Если диагноз выставлен еще при беременности, важно обсуждение вопроса о прерывании беременности по медицинским показаниям. Важно донести до матери тот факт, что до 90% детей гибнут в первые трое суток жизни. Опасен и риск осложнений для самой матери, который возрастает по мере пролонгации беременности.
Если женщина категорически против аборта или сроки уже слишком велики, важно пристально следить за здоровьем матери, чтобы она могла благополучно доносить беременность. Важно также выбрать способ оптимального родоразрешения. Каких-либо препаратов или иных методов исправления синдрома Патау при беременности не существует.
Перед родами врачи готовят все аппараты для оказания помощи ребенку, если есть возможность, роды проводят в специализированном стационаре. При необходимости, ребенку проводят хирургические вмешательства, которые позволяют продлить ему жизнь хотя бы на несколько месяцев.
Обратите внимание
Важно понимать, на сегодняшний день ни единая страна мира не обладает возможностью лечения детей с синдромом Патау, применяют только методы поддержания жизни на некоторое время.
Парецкая Алена, педиатр, медицинский обозреватель
6,563 просмотров всего, 1 просмотров сегодня
Загрузка…
Синдром Патау (трисомия по 13 паре аутосом)
Причина.
Нерасхождение аутосом 13 пары в гаметогенезе
у одного из родителей. Кариотип – 47,
D13+.
Клиника.
Аномалии черепа и лица, окружность
черепа обычно уменьшена, в ряде случаев
имеется выраженная тригоноцефалия.
Умеренная микроцефалия сочетается со
сравнительно низким и скошенным лбом,
узкими глазными щелями, запавшим
предносьем с широким основанием носа,
низко расположенными и деформированными
ушными раковинами. Расстояние между
глазными щелями часто уменьшено. На
коже головы имеются дефекты скальпа
овальной или круглой формы. Часто –
заячья губа и волчья пасть. Аномалии
костно-мышечной системы, полидактилия.
У детей,
проживших более трех месяцев, выявляют
глубокую умственную отсталость.
Патогенез.
Смертность в течение первого года жизни
(90%). Основной причиной смерти детей
являются тяжелые, несовместимые с жизнью
пороки развития: дефекты сердечно-сосудистой
и мочеполовой систем, аномалии толстой
кишки, пупочная грыжа, нарушения строения
глазных яблок, постоянны микроанофтальмия,
дисплазия сетчатки, катаракты. Врожденные
пороки сердца встречаются у 80% детей.
Диагностика.
Основана на клиническом, дерматоглифическом
и цитогенетическом исследованиях.
Частота.
1:7000 среди новорожденных.
Синдром Эдвардса (трисомия по 18 паре хромосом)
Причина.
Нерасхождение аутосом на стадии гамет
(иногда зигот). Лишняя хромосома в 18
паре. Кариотип 47, Е18+. Выражена зависимость
частоты рождения больных детей от
возраста родителей.
Клиника.
Пренатальное недоразвитие, слабая
активность плода, нарушения строения
лица (короткие глазные щели, маленькая
верхняя челюсть) и костно-мышечной
системы практически постоянны. Ушные
раковины деформированы и в подавляющем
большинстве случаев расположены низко.
Грудина короткая, ядра окостенения
расположены неправильно и в меньшем
количестве. Спинномозговые грыжи и
расщелины губ. Интеллектуальный
дефект соответствует олигофрении в
степени идиотии или глубокой имбецильности.
Патогенез.
Наиболее постоянны пороки сердца и
крупных сосудов. Нарушения развития
головного мозга, в основном гипоплазия
мозжечка и мозолистого тела. Из пороков
глаз чаще всего обнаруживается
микроанафтольмия. Врожденное отсутствие
щитовидной железы и надпочечников.
Диагностика.
Клинический осмотр, дерматоглифика,
цитогенетическое обследование.
Лечение.
Отсутствует, 90% детей умирают на первом
году жизни. Выжившие дети умирают от
инфекционных заболеваний.
Частота.
1:7000 у новорожденных; у девочек — в 3 раза
чаще.
Синдром Дауна (трисомия по 21 паре хромосом)
Причина.
Нерасхождение 21 пары аутосом, транслокация
21 аутосомы на аутосому группы D или G. У
94% кариотип – 47 хромосом. Частота
проявления синдрома увеличивается с
возрастом матери.
Клиника.
Признаки, позволяющие диагностировать
заболевание, в типичных случаях выявляются
на самых ранних этапах жизни ребенка.
Малый рост ребенка, маленькая круглая
голова со скошенным затылком, своеобразное
лицо – бедная мимика, косой разрез глаз
со складкой у внутреннего угла, нос с
широкой плоской переносицей, маленькие
деформированные ушные раковины. Рот
обычно полуоткрыт, язык толстый,
неповоротливый, нижняя челюсть иногда
выступает вперед. На щеках часто
отмечается сухая экзема. Обнаруживается
укорочение конечностей, особенно в
дистальных отделах. Кисть плоская,
пальцы рук широкие, короткие. В физическом
развитии отстают, однако не резко, но
нервно-психическое развитие замедленно
(плохо развита речь). С возрастом
выявляется ряд новых черт заболевания.
Голос грубеет, отмечается близорукость,
косоглазие, конъюнктивиты, неправильный
рост зубов, кариес. Слабо развита иммунная
система, инфекционные заболевания
протекают крайне тяжело и в 15 раз чаще,
чем у других детей. Встречается острый
лейкоз. Умственная
отсталость — у всех больных (65-90% —
имбецильность).
Патогенез.
Патологии внутренних органов,
сердечно-сосудистые дефекты.
Диагностика.
Клиническое обследование, подтверждаемое
цитогенетическим анализом кариотипа
и дерматоглификой. Имеет значение
семейный анамнез матери.
Лечение.
Комплексная терапия, включающая
правильную организацию режима, рационально
построенная медико-педагогическая
работа, лечебная физкультура, массаж,
медикаментозное лечение.
Частота.
1:650 новорожденных.
Синдром Патау — BabyCentre UK
Что такое синдром Патау?
Синдром Патау — редкое отклонение, при котором у ребенка слишком много хромосом.
Хромосомы содержат весь генетический материал, который помогает человеческим клеткам делиться и в конечном итоге превращаться в ребенка (NHGRI 2015). Здоровые дети рождаются с 46 хромосомами, распределенными по 23 парам. Младенцы с синдромом Патау имеют дополнительную копию 13 хромосомы в каждой клетке своего тела. Синдром Патау еще называют трисомией 13.Это самая серьезная из всех хромосомных аномалий (Best 2017).
Существует несколько форм трисомии 13:
- Полная трисомия 13: синдром полной Патау является наиболее распространенной и наиболее тяжелой формой состояния, при котором каждая клетка в организме имеет дополнительную 13 хромосому.
- Транслокационная трисомия 13: наследственная форма синдрома, при которой часть хромосомы 13 прикрепляется к другой хромосоме. На этот тип приходится примерно каждый пятый случай синдрома Патау.
- Мозаичная трисомия 13: менее тяжелая и более редкая форма синдрома, при которой некоторые клетки имеют дополнительную 13-ю хромосому вместо каждой клетки.
- Частичная трисомия 13: еще одна редкая форма заболевания, которая возникает, когда в клетках присутствует часть дополнительной хромосомы, а не целая.
(ГАРД 2016)
Ежегодно в Великобритании рождается около 150 детей с синдромом Патау. Синдром Патау вызывает такие серьезные осложнения, что, к сожалению, большинство пострадавших младенцев теряются во время беременности (Best 2017, NHS 2016).
Младенцы, рожденные с синдромом Патау, обычно выживают всего несколько дней (Best 2017, Tidy 2016). Редко некоторые дети с менее тяжелыми формами синдрома живут дольше года (NHS, 2016).
Для некоторых детей возможно, но необычно, дожить до подросткового возраста (Best 2017) (NHS 2016). Младенцы с синдромом Патау имеют серьезные физические и психические нарушения и серьезные проблемы со здоровьем (Best 2017, NHS 2016, Tidy 2016).
Причины синдрома Патау
Причины неизвестны, но риск рождения ребенка с синдромом Патау увеличивается с возрастом (Best 2017, NHS 2016).Полная трисомия 13 происходит случайно из-за генетической аномалии яйцеклетки или сперматозоидов до зачатия (GARD 2016). Когда оплодотворенная яйцеклетка начинает расти, во время деления клетки возникает ошибка, приводящая к появлению дополнительной хромосомы 13 (GARD 2016, NHS 2017).
Эта ошибка возникает случайно. Это не вызвано ничем, что вы сделали, и не передается по наследству (NHS 2016). Тем не менее, есть некоторые свидетельства того, что ваш риск повторной беременности, затронутой трисомией 13, немного выше, чем для женщины, у которой ранее не было беременности с трисомией 13.Причины этого неясны (GARD 2016, Tidy 2016).
Транслокационный синдром Патау, когда дополнительная копия хромосомы 13 прикрепляется к другой хромосоме, может передаваться по наследству. Если у вас или у вашего партнера есть такая перестройка хромосом, есть повышенный шанс передать ее своим детям (GARD 2016). Вы можете узнать, насколько это вероятно, сделав анализ крови, называемый кариотипом. Кариотип рассматривает хромосомы под микроскопом (GARD 2016, SOFT UK nd).
Вам следует предложить генетическое тестирование и консультацию, если ваша беременность или ребенок страдают синдромом Патау (NHS 2016).Это может помочь вам спланировать будущую беременность.
Как я узнаю, есть ли у моего ребенка синдром Патау?
Скрининг на болезнь Патау предлагается всем беременным женщинам. Комбинированный скрининговый тест или более точное неинвазивное пренатальное тестирование (НИПТ) (NHS 2016, 2018) расскажет вам о вашем риске рождения ребенка с синдромом Патау.
Комбинированный скрининговый тест включает анализ крови и ультразвуковое сканирование затылочной прозрачности (NT). Он предлагается вместе со сканированием свиданий примерно через 12 недель (NHS, 2016).
Скрининговые тесты говорят о вероятности того, что вы ждете ребенка с синдромом Патау. Затем диагностические тесты подтверждают, поражен ли ваш ребенок. В зависимости от срока беременности вам предложат:
Если вы пропустите скрининг на синдром Патау, сканирование аномалий в середине беременности выявит признаки этого заболевания, в том числе:
- Тяжелые пороки сердца.
- Аномалии мозга. Младенцы, страдающие синдромом Патау, имеют маленькие головы (микроцефалия), и их мозг не делится на две половины должным образом.
- Расщелина губы и неба и аномалии глаз.
- Анатомические аномалии, например лишние пальцы рук или ног.
- Аномалии, поражающие органы, например, часть кишечника, растущая за пределами тела, и грыжи.
- Проблемы с почками и гениталии необычного размера.
(Лучший 2017, NHS 2016)
К сожалению, из-за серьезности синдрома Патау большинство младенцев погибают из-за выкидыша. Когда ребенок доживает до второго триместра, многие будущие родители принимают трудное решение о прерывании беременности (Tidy, 2016).
Независимо от вашего решения, ваша медицинская бригада предложит вам поддержку и совет. Они должны предоставить вам всю информацию, необходимую для принятия правильного решения в отношении вашей семьи в тяжелое и изолирующее время (ARC nd a, NHS 2016).
Некоторые родители предпочитают готовиться к родам и дням, возможно, дольше, со своим ребенком. В зависимости от типа и степени тяжести синдрома Патау вашему ребенку, вероятно, потребуется интенсивная терапия, чтобы помочь с опасными для жизни состояниями, такими как проблемы с сердцем, затрудненное дыхание и кормление (NHS 2016).
Скорее всего, вы столкнетесь с трудными обсуждениями с медицинской бригадой вашего ребенка о том, как найти правильный баланс между лечением вашего ребенка и освобождением его от дальнейшего медицинского вмешательства (Best 2017, Tidy 2016). Важно иметь как можно больше информации, чтобы вы могли обдумать и обсудить, что лучше для вас, вашего ребенка и остальных членов вашей семьи (ARC nd b).
Где я могу получить помощь и поддержку?
- SOFT UK предлагает поддержку и консультации семьям, страдающим хромосомными нарушениями.
- Контакт оказывает поддержку и консультации семьям детей-инвалидов.
- Antenatal Results and Choices предоставляет поддержку и рекомендации родителям на протяжении всего дородового скрининга и тестирования, а также после него.
Последний раз рассмотрено: ноябрь 2018 г.
Список литературы
ARC. и а. Продолжение беременности . Антенатальные результаты и выбор. www.arc-uk.org [по состоянию на ноябрь 2018 г.]
ARC. nd б. Что говорят родители о прерывании беременности .Антенатальные результаты и выбор. www.arc-uk.org [Доступно в ноябре 2018 г.]
Best R. 2017. Синдром Патау. Medscape. www.emedicine.medscape.com [по состоянию на ноябрь 2018 г.]
GARD. 2015/2016. Трисомия 13. Информационный центр по генетическим и редким заболеваниям. rarediseases.info.nih.gov [Проверено в ноябре 2018 г.]
NHGRI. 2015. Хромосомы Национальный исследовательский институт генома человека. www.genome.gov [Проверено в ноябре 2018 г.]
NHS. 2016 г. Синдром Патау. NHS Choices, Health A-Z. www.nhs.uk [Проверено в ноябре 2018 г.]
NHS. 2018. Скрининговые тесты при беременности. NHS Choices, Здоровье от А до Я, Беременность и младенец. www.nhs.uk [Доступ в ноябре 2018 г.]
Tidy C. 2016. Синдром Патау. Пациент. Patient.info [доступ в ноябре 2018 г.]
Синдром Патау — фотографии, симптомы, лечение, ожидаемая продолжительность жизни
Что такое синдром Патау?
Синдром Патау — это состояние, которое встречается реже, чем все трисомии.С медицинской точки зрения это состояние также известно как трисомия 13, что означает наличие лишней 13-й хромосомы. Это приводит к тяжелым состояниям, таким как неврологические дефекты, включая сердечные заболевания сердца. Показатель заболеваемости этим заболеванием составляет 1: 8000-12000 среди всех живорождений в Соединенных Штатах. Прогноз этого состояния плохой, поскольку уровень смертности среди больных высок. Было отмечено, что средний возраст выживания для пострадавших составляет всего 2,5 дня. Считается счастливым, если пострадавший ребенок прожил не менее 6 месяцев жизни, и более удачливым считается тот случай, когда он достиг подросткового возраста.Молодежь обычно поражается этим заболеванием. Поскольку заболевание свидетельствует о большой гибели плода или новорожденного для пострадавшего.
Симптомы
Состояние действительно требует немедленной и интенсивной медицинской помощи. После того, как человеку поставили диагноз, необходимы время и усилия. Как упоминалось выше, это состояние отражает неврологический дефект и сердечные аномалии. Вот следующие медицинские недостатки, сопровождающиеся синдромом Патау:
Часто встречаются сердечные аномалии.Около 80% случаев синдрома Патау приводят к:
Открытый артериальный проток — это порок сердца, который включает отверстие между нисходящей аортой и легочной артерией. В результате у пострадавшего будет наблюдаться снижение толерантности к активности и застой в легких, поскольку увеличивается приток крови к легочной системе.
Дефект межжелудочковой перегородки — заболевание сердца связано с открытием сообщения между двумя желудочками сердца.Ожидается, что когда это произойдет, у пострадавшего будет снижен системный кровоток. Очень важно, чтобы наша система тела получала насыщенную кислородом кровь, но механизм этого состояния истощает приобретение дополнительного кровотока ко всему телу, особенно к органам vita.
Дефект межпредсердной перегородки — как сообщается в большинстве случаев, эта сердечная проблема может протекать бессимптомно для некоторых из пострадавших. Что происходит с сердцем, так это то, что между левым и правым предсердиями происходит ток крови.В результате у пациента развивается застойное сердце, что в конечном итоге приводит к другим заболеваниям.
Декстрокардия — еще один врожденный порок сердца, при котором происходит изменение нормального расположения камер сердца.
Другим значительным следствием синдрома Патау являются лицевые деформации, такие как отсутствие носа или хоботка. Также возможны расщелины губы или неба. Глаза младенца также могут быть затронуты, поскольку это может привести к микрофтальмию или маленьким глазам.Развивается гипертолеризм, который характеризуется уменьшением расстояния между органами. Это может быть окулярное значение с участием обоих глаз. Другим серьезным заболеванием, которое может развиться при синдроме Патау, является отсутствие глаза или обоих глаз пораженного. Это состояние с медицинской точки зрения называется анофтальмом. У ребенка также могут появиться лишние пальцы рук и ног — состояние, называемое полидактилией. Низко посаженные уши наблюдаются и у младенцев. Также наблюдаются пороки половых органов. Не щадят и мочевыводящую систему, что приводит к дефектам и аномалиям почек.
Причины
Состояние идиопатическое по причине. Доказательств положительной причины состояния не было. Синдром Патау распознается только как состояние, которое связано с генетической аномалией или включением другой хромосомы, трисомии 13. Однако считается, что это состояние вызвано увеличением возраста матери.
Диагностика
Синдром Патау может быть диагностирован на основании физических симптомов и клинических проявлений. Простое физическое обследование может помочь или помочь в диагностике проблемы.Это состояние иногда сравнивают с другим синдромом, называемым синдромом Эдвардса, поэтому для того, чтобы отличить его от другого, проводится генетическое тестирование. Другие тесты на синдром Патау следующие:
- КТ или компьютерная томография — это визуализирующее исследование
- Магнитно-резонансная томография — еще одна форма визуализационного исследования, аналогичная компьютерной томографии, которая включает в себя съемку системы и частей тела.
- Эхокардиограмма — это УЗИ сердца.Диагностика сердечных заболеваний может помочь в ассоциации с синдромом Патау.
Лечение
Лечение синдрома Патау включает симптоматическое лечение. Поскольку ребенок страдает определенным заболеванием, которое сопровождается синдромом Патау, цель практикующего врача — облегчить симптомы дефекта.
Больным делают хирургическое вмешательство, но в редких случаях. Это связано с возможностью смерти среди пострадавших.Поскольку хирургическое вмешательство впервые воздерживается в первые месяцы жизни ребенка, его смертность выше, чем у тех, у кого развита иммунная система. Когда дело доходит до того, что возникает неотложная необходимость в хирургическом вмешательстве, врач прибегает к такому лечению.
По мере того, как у младенца развиваются лицевые деформации, рекомендуется оказывать ему такой же уход, как и нормальный ребенок. Родители ребенка также должны быть надлежащим образом обучены и проконсультированы, поскольку есть вероятность, что они не примут условия своего ребенка.
Генетическое консультирование играет важную роль в этом процессе. Это следует обсудить с парой, которая может иметь риск зачать еще одного ребенка от того же недуга. Консультирование жизненно важно для того, чтобы они получили эмоциональную поддержку и чтобы им были предоставлены возможности выбора.
Ожидаемая продолжительность жизни
Как упоминалось выше, прогноз этого состояния плохой, так как это приведет к высокой смертности пострадавших. Ожидаемая продолжительность жизни ребенка с синдромом Патау — 2 года.5 дней. Это такое небольшое количество и трагический результат состояния. Согласно эпидемиологическим данным, около 82% пострадавших умрут в течение месяца. Больший процент составляет то, что около 95% случаев синдрома Патау умирают в течение 6 месяцев. Бывают случаи, когда ребенку больше 6 месяцев, но это считается очень редкой возможностью.
Факты
- Это очень редкая, но очень тяжелая форма хромосомного нарушения. Как бы то ни было, это состояние помещено или перечислено вместе с другими редкими состояниями в Управлении редких заболеваний Национального института здравоохранения.В Европе они отметили, что случаи этого заболевания зарегистрированы у 1 из 2000 человек в мире.
- Когда ребенок превышает ожидаемый возраст, ожидается, что он или она будет умственно отсталым.
- Рецидив действительно возможен. Генетическое консультирование является обязательным для родителей, у которых был ребенок с трисомией 13 или даже с синдромом Дауна.
- Заболевание впервые было обнаружено и наблюдалось датским врачом по имени Томас Бартолин. Только Dr.Клаус Патау, который подтвердил информацию и данные о болезни, поэтому состояние придумано в честь его имени.
- Заболевание становится все чаще, особенно в Европе. Было отмечено, что в 2008 и 2009 годах диагнозы синдрома Патау были 172, поставленные при пренатальном обследовании. Из-за этого были сделаны плановые аборты, а другие потеряли ребенка в результате выкидышей и внутриутробной смерти.
Снимки синдрома Патау
Фотографии, изображения и изображения синдрома Патау…
Снимки синдрома Патау
источник: livingwithtrisomy13.org
Фотографии синдрома Патау
источник: eyepathologist.com
Изображения синдрома Патау
Синдром Патау: симптомы, причины, лечение
Синдром Патау — врожденное заболевание генетического происхождения из-за наличия трисомии на хромосоме 13 (Ребате Молина, Уриэль Рамос и источники, 2010).
В частности, синдром Патау является третьей по частоте аутосомной трисомией после синдрома Дауна и синдрома Эдвардса (Fogu et al., 2008).
На клиническом уровне эта патология затрагивает несколько систем. Таким образом, различные изменения и аномалия в нервной системе, генерализованный замедление роста, сердечные, почечные и опорно-двигательный аппарат (пороки развития появляются Ribate Molina, Uriel и Ramos Фуэнтес, 2010).
В большинстве случаев диагноз обычно ставится во время беременности, поскольку клинические данные можно обнаружить при обычном ультразвуковом исследовании (Ramos Fuentes, 2016).
Симптомы синдрома Патау
Однако, чтобы исключить ложноположительные результаты и ошибочные диагнозы, обычно проводят несколько генетических тестов для выявления трисомии 13 (Ribate Molina, Uriel and Ramos fuentes, 2010).
Что касается лечения, то в настоящее время нет лекарства от синдрома Патау, выживаемость пострадавших обычно не превышает одного года жизни. Наиболее частые причины смерти — кардиореспираторные осложнения (Ramos Fuentes, 2016).
Характеристика синдрома Патау
Синдром
Патау, также известный как трисомия 13, представляет собой медицинскую патологию генетического происхождения, которая связана с тяжелой умственной отсталостью, а также с множественными физическими расстройствами (Genetics Home Reference, 2016).
У пораженных людей обычно наблюдаются серьезные сердечные аномалии, различные изменения в нервной системе, скелетно-мышечные аномалии, лицевые изменения, мышечная гипотония и другие (Genetics Home Reference, 2016).
В основном из-за серьезного мультисистемного поражения люди, страдающие синдромом Патау, обычно имеют очень низкую продолжительность жизни (Best, 2015).
Этот синдром был первоначально идентифицирован в 1960 году как цитогенетический синдром, то есть генетическое заболевание, связанное с хромосомной аномалией (Best, 2015).
Хромосомы составляют генетический материал клеток, из которых состоит наше тело. В частности, хромосомы состоят из дезоксирибонуклеиновой кислоты, также известной по аббревиатуре ДНК, а также имеет состав, характеризующийся присутствием различных белковых веществ.
Эти хромосомы обычно структурно организованы парами. В случае человека мы представляем 23 пары хромосом, всего 46 из которых.
В случае синдрома Патау генетическая аномалия специфически влияет на 13 хромосому.У пораженных людей имеется трисомия хромосомы 13, то есть у них есть три ее копии.
На более конкретном уровне каждая яйцеклетка и каждый сперматозоид содержат по 23 хромосомы каждая с генетическим материалом материнского и отцовского родителя (Stanford Children’s Health, 2016).
Во время оплодотворения объединение обеих клеток приводит к созданию 23 хромосомных пар или, что то же самое, наличию всего 46 хромосом (Stanford Children’s Health, 2016).
Однако бывают случаи, когда ошибка или событие, измененное во время союза, приводит к наличию генетических аномалий, таких как наличие дополнительной хромосомы в одной из пар (Stanford Children’s Health, 2016).
Таким образом, этот измененный процесс вызовет последовательность нейробиологических событий во время развития плода, которые изменят нормальную или ожидаемую экспрессию генов, что приведет к органическому участию в различных системах.
Статистика
Синдром Патау или трисомия 13 считается редким или редким заболеванием. По оценкам различных исследований, частота этой патологии составляет примерно 1 случай на 5 000–12 000 новорожденных (Национальная организация редких заболеваний, 2007).
Несмотря на это, в большинстве случаев беременность у лиц, страдающих синдромом Патау, обычно не заканчивается, поэтому частота может значительно возрасти (Национальная организация по редким заболеваниям, 2007).
Таким образом, было замечено, что ежегодный уровень самопроизвольных абортов при этой патологии высок, составляя примерно 1% от общего числа (Ramos Fuentes, 2016).
Что касается распределения синдрома Патау по полу, было замечено, что эта патология чаще поражает женщин, чем мужчин (Genetics Home Reference, 2016).
Характерные признаки и симптомы
Клинически синдром Патау может очень неоднородно влиять на организм и в разных случаях, поэтому трудно установить, каковы основные признаки и симптомы этого заболевания.
Однако в различных клинических отчетах, таких как Ribate molina, Puisac Uriel и Ramos Fuentes (2010), выделяются наиболее частые клинические находки у лиц, страдающих синдромом Патау или трисомией 13:
Изменение роста
Наличие общей задержки роста — одно из наиболее частых клинических проявлений.В частности, медленный или замедленный рост на пренатальной и постнатальной стадиях может наблюдаться примерно в 87% случаев синдрома Патау.
Изменения и пороки развития центральной нервной системы (ЦНС)
В случае нервной системы можно наблюдать несколько клинических проявлений: гипотония / гипертония, криз апноэ, голопроэнцефалия, микроцефалия, задержка психомоторного развития или тяжелая умственная отсталость.
- Гипотония / мышечный гипертонус : термин «гипотония» относится к наличию вялости мышц или пониженного мышечного тонуса, а термин «гипертонус» относится к наличию аномально высокого мышечного тонуса.Оба медицинских события происходят у 26-48% пострадавших.
- Кризис или эпизоды апноэ : эпизоды апноэ обычно возникают примерно в 48% случаев и состоят из сокращения или паралича процесса дыхания на короткий период времени.
- Голопрозэнцефалия : этот термин относится к наличию различных пороков развития на уровне головного мозга, затрагивающих в основном переднюю часть. Этот клинический результат наблюдается примерно в 70% случаев синдрома Патау.
- Микроцефалия : около 86% пораженных имеют более низкий периметр черепа, чем ожидалось для их пола и уровня созревания.
- Психомоторная задержка : В результате различных физических уродств люди, страдающие синдромом Патау, будут сталкиваться с серьезными трудностями в координации и выполнении всех типов двигательных действий. Этот результат можно наблюдать в 100% случаев.
- Тяжелая умственная отсталость : когнитивные нарушения и тяжелая умственная отсталость являются клиническими находками, присутствующими во всех случаях с диагнозом синдрома Патау.Оба неврологических состояния развиваются в результате обширного поражения нервной системы.
Изменения и черепно-лицевые аномалии
На уровне лица и черепа также можно наблюдать несколько клинических признаков и симптомов:
- Уплощенная передняя часть : аномальное развитие лобной части черепа является присутствующим признаком во всех случаях синдрома Патау.
- Глазные расстройства : в случае аномалий и патологий, поражающих глаза, они присутствуют примерно в 88% случаев, наиболее частыми из которых являются микрофтальмин, колобома радужной оболочки или гипотелоризм глаза.
- Различные пороки развития ушной раковины : прогрессирование лицевых и черепных аномалий также может влиять на ушную раковину в 80% случаев.
- Расщелина губы и неба : обе пороки развития полости рта встречаются примерно у 56% больных. Термин «расщелина» относится к наличию неполного закрытия губ, показывая трещину в медиальной области, в то время как термин «расщелина неба» относится к неполному закрытию всей структуры, которая составляет небо или крышу неба. рот .
Опорно-уродства
Скелетно-мышечные аномалии и пороки развития могут поражать различные области, наиболее частыми из которых являются шея и конечности.
- Шея : аномалии, которые влияют на эту конкретную область, присутствуют в большинстве случаев, в частности, короткая или недоразвитая шея может наблюдаться у 79% пострадавших, в то время как избыток
Кариотип — Ресурсы для трансгендеров Susan’s Place
A Кариотип — это количество и внешний вид хромосом в ядре клетки эукариота. [1] [2] p28 [3] Этот термин также используется для обозначения полного набора хромосом у вида или отдельного организма.
Кариотипы описывают количество хромосом и то, как они выглядят под световым микроскопом. Обратите внимание на их длину, положение центромер, любые различия между половыми хромосомами и любые другие физические характеристики. [4] Подготовка и изучение кариотипов является частью цитогенетики.
Исследование целых наборов хромосом иногда называют кариологией . Хромосомы изображены (путем перестановки микрофотографии) в стандартном формате, известном как кариограмма или идиограмма : парами, упорядоченными по размеру и положению центромеры для хромосом одинакового размера.
Основное число хромосом в соматических клетках индивидуума или вида называется соматическим числом и обозначается 2n .Таким образом, у человека 2n = 46. В зародышевой линии (половых клетках) число хромосом составляет n (люди: n = 23). [2] p28
Итак, у нормальных диплоидных организмов аутосомные хромосомы присутствуют в двух копиях. Половые хромосомы могут быть, а могут и не быть. Полиплоидные клетки имеют несколько копий хромосом, а гаплоидные клетки — единичные.
Кариотипы можно использовать для многих целей; например, для изучения хромосомных аберраций, функции клеток, таксономических отношений и для сбора информации о прошлых эволюционных событиях.
История исследования кариотипа
Хромосомы были впервые обнаружены в клетках растений Карлом Вильгельмом фон Негели в 1842 году. Их поведение в клетках животных (саламандра) было описано Вальтером Флеммингом, открывшим митоз, в 1882 году. Название было придумано другим немецким анатомом фон Вальдейером в 1888 году.
Следующий этап произошел после развития генетики в начале 20 века, когда стало понятно, что набор хромосом (кариотип) является носителем генов.Левицкий, по-видимому, был первым, кто определил кариотип как фенотипическое проявление соматических хромосом в отличие от их генного содержания. [5] [6] Последующую историю концепции можно проследить в работах Дарлингтона [7] и Уайта. [8] [2]
Изучение кариотипа человека заняло много лет, чтобы ответить на самый главный вопрос: сколько хромосом содержит нормальная диплоидная клетка человека? [9] В 1912 году Ханс фон Винивартер сообщил о 47 хромосомах в сперматогониях и 48 в оогониях, заключая механизм определения пола XX / XO. [10] Художник в 1922 году не был уверен, было ли диплоидное число людей 46 или 48, сначала отдавая предпочтение 46. [11] Позднее он пересмотрел свое мнение с 46 до 48, и он правильно настаивал на том, что люди имеют Система XX / XY. [12] Учитывая их методы, эти результаты были весьма замечательными.
Для окончательного решения проблемы потребовались новые методы:
- Использование клеток в культуре
- Предварительная обработка клеток в гипотоническом растворе, который их набухает и расширяет хромосомы
- Остановка митоза в метафазе раствором колхицина
- Сдавливание препарата на предметном стекле, вынуждающее хромосомы в одну плоскость
- Разрезание микрофотографии и преобразование результата в бесспорную кариограмму.
Только к середине 1950-х годов стало общепризнанным, что кариотип человека включает только 46 хромосом. [13] [14] Интересно, что у человекообразных обезьян 48 хромосом. Хромосома 2 человека образовалась в результате слияния наследственных хромосом, в результате чего их количество уменьшилось.
Наблюдения за кариотипами
Окрашивание
Изучение кариотипов стало возможным благодаря окрашиванию. Обычно подходящий краситель, такой как Giemsa, [15] , наносят после того, как клетки были арестованы во время деления клеток раствором колхицина.Чаще всего для людей используются белые кровяные тельца, поскольку их легко заставить делиться и расти в тканевой культуре. [16] Иногда можно наблюдать неделящиеся (интерфазные) клетки. Пол будущего плода можно определить путем наблюдения за интерфазными клетками (см. Амниотический центез и тельца Барра).
Наблюдения
Обычно наблюдают и сравнивают шесть различных характеристик кариотипов: [17]
- Различия в абсолютных размерах хромосом.Хромосомы могут различаться по абсолютному размеру до 20 раз между родами одного и того же семейства: Lotus tenuis и Vicia faba (бобовые), оба имеют шесть пар хромосом (n = 6), но V. faba хромосомы во много раз больше. Эта особенность, вероятно, отражает разную степень дупликации ДНК.
- Различия в положении центромер. Это вызвано транслокациями.
- Различия в относительном размере хромосом могут быть вызваны только сегментарным обменом неравной длины.
- Различия в основном числе хромосом могут возникать из-за последовательных неравных транслокаций, которые в конечном итоге удаляют весь существенный генетический материал из хромосомы, позволяя его потерю без ущерба для организма (гипотеза дислокации). У людей на одну пару хромосом меньше, чем у человекообразных обезьян, но гены в основном были перенесены (добавлены) в другие хромосомы.
- Различия в количестве и положении сателлитов, которые (когда они возникают) представляют собой маленькие тела, прикрепленные к хромосоме тонкой нитью.
- Различия в степени и распределении гетерохроматиновых областей. Гетерохроматин окрашивается темнее, чем эухроматин, что указывает на более плотную упаковку, и в основном состоит из генетически неактивных повторяющихся последовательностей ДНК.
Таким образом, полный отчет о кариотипе может включать количество, тип, форму и полосатость хромосом, а также другую цитогенетическую информацию.
Часто встречаются вариации:
- Между полами
- Между зародышевой линией и сомой (между гаметами и остальной частью тела)
- Между членами популяции (хромосомный полиморфизм)
- Географические различия между расами
- Мозаики или другие аномальные люди. [8]
Кариотип человека
Большинство (но не все) видов имеют стандартный кариотип. Нормальные кариотипы человека содержат 22 пары аутосомных хромосом и одну пару половых хромосом. Нормальные кариотипы самок содержат две Х-хромосомы и обозначаются 46, ХХ; у мужчин есть хромосома X и Y, обозначенная 46, XY. Любые отклонения от стандартного кариотипа могут привести к аномалиям развития.
Разнообразие и эволюция кариотипов
Хотя репликация и транскрипция ДНК высоко стандартизированы у эукариот, этого нельзя сказать об их кариотипах, которые сильно варьируют.Между видами существуют различия в количестве хромосом и в детальной организации, несмотря на то, что они построены из одних и тех же макромолекул. Эта вариация служит основой для ряда исследований в эволюционной цитологии.
В некоторых случаях существует даже значительное изменение внутри видов. В своем обзоре Годфри и Мастерс заключают:
- «На наш взгляд, маловероятно, что тот или иной процесс может независимо объяснять широкий спектр наблюдаемых структур кариотипа… Но, в сочетании с другими филогенетическими данными, кариотипическое деление может помочь объяснить резкие различия в диплоидных числах между близкородственными видами, которые ранее были необъяснимы. [18] .
Хотя многое известно о кариотипах на описательном уровне, и ясно, что изменения в организации кариотипа оказали влияние на эволюционный курс многих видов, совершенно неясно, какое может быть общее значение.
- «У нас очень плохое понимание причин эволюции кариотипа, несмотря на многочисленные тщательные исследования… Общее значение эволюции кариотипа неясно ». Мейнард Смит. [19]
Изменения в процессе развития
Вместо обычной репрессии генов, некоторые организмы занимаются крупномасштабным устранением гетерохроматина или другими видами видимой адаптации к кариотипу.
- Удаление хромосом. У некоторых видов, как у многих сциаридных мух, целые хромосомы удаляются во время развития. [20]
- Уменьшение хроматина (отец-основатель: Теодор Бовери).В этом процессе, обнаруженном у некоторых веслоногих и круглых червей, таких как Ascaris suum , части хромосом отбрасываются в определенных клетках. Этот процесс представляет собой тщательно организованную перестройку генома, при которой конструируются новые теломеры и теряются определенные участки гетерохроматина. [21] [22] В A. suum все предшественники соматических клеток подвергаются уменьшению хроматина. [23]
- Х-инактивация. Инактивация одной Х-хромосомы происходит на раннем этапе развития млекопитающих (см. Тело Барра и дозовая компенсация).У плацентарных млекопитающих инактивация случайна, как между двумя X; таким образом, самка млекопитающего представляет собой мозаику в отношении ее Х-хромосом. У сумчатых всегда инактивирован отцовский X. У самок человека около 15% соматических клеток избегают инактивации. [24]
Количество хромосом в наборе
Ярким примером изменчивости между близкородственными видами является мунтжак, который исследовали Курт Бениршке и его коллега Дорис Вурстер.Диплоидное число китайского мунтжака, Muntiacus reevesi , оказалось равным 46, все телоцентрические. Когда они посмотрели на кариотип близкородственного индийского мунтжака Muntiacus muntjak , они были удивлены, обнаружив, что у него женские = 6, мужские = 7 хромосом. [25]
- «Они просто не могли поверить в то, что видели … Они молчали два или три года, потому что думали, что что-то не так с их тканевой культурой … Но когда они получили еще пару образцов, они подтвердили [свои выводы]» Hsu p73-4 [14]
Число хромосом в кариотипе между (относительно) неродственными видами сильно варьируется.Самый низкий рекорд у нематоды Parascaris univalens , где гаплоид n = 1; высокий рекорд будет где-то среди папоротников, впереди у Adder’s Tongue Fern Ophioglossum со средним числом 1262 хромосомы. [26] Наивысшим показателем для животных может быть коротконосый осетр Acipenser brevirostrum , имеющий всего 372 хромосомы. [27] Существование дополнительных хромосом или В-хромосом означает, что число хромосом может варьироваться даже в пределах одной межпородной популяции; и анеуплоиды — другой пример, хотя в этом случае они не будут рассматриваться как нормальные члены популяции.
Плоидность
Плоидность — это количество полных наборов хромосом в клетке.
- Полиплоидия, при которой в клетках имеется более двух наборов гомологичных хромосом, встречается в основном у растений. По словам Стеббинса, это имело большое значение в эволюции растений. [28] [29] [30] [31] Доля цветковых растений, которые являются полиплоидными, по оценке Стеббинса, составляет 30-35%, но у злаков средний показатель намного выше, около 70 %. [32] Полиплоидия у низших растений (папоротники, хвощи и псилоты) также распространена, и некоторые виды папоротников достигли уровней полиплоидии, намного превышающих самые высокие уровни, известные у цветковых растений.
Полиплоидия у животных встречается гораздо реже, но в некоторых группах она значительна. [33]
Полиплоидные серии у родственных видов, которые полностью состоят из кратных единственного основного числа, известны как эуплоидные.
- Гапло-диплоидия, при которой один пол диплоидный, а другой гаплоидный.Это обычное явление у перепончатокрылых и некоторых других групп.
- Эндополиплоидия возникает, когда во взрослых дифференцированных тканях клетки перестали делиться путем митоза, но ядра содержат больше, чем исходное соматическое число хромосом. [34] В эндоцикле (эндомитоз или эндоредупликация) хромосомы в «покоящемся» ядре подвергаются редупликации, дочерние хромосомы отделяются друг от друга внутри неповрежденной ядерной мембраны . [35]
Во многих случаях эндополиплоидные ядра содержат десятки тысяч хромосом (которые невозможно точно подсчитать). Клетки не всегда содержат точные кратные (степени двойки), поэтому простое определение «увеличение числа наборов хромосом, вызванное репликацией без деления клетки» не совсем точное.
Этот процесс (особенно изученный на насекомых и некоторых высших растениях, таких как кукуруза) может быть стратегией развития для увеличения продуктивности тканей, которые очень активны в биосинтезе. [36]
Это явление спорадически происходит по всему царству эукариот от простейших до человека; он разнообразен и сложен и во многом служит дифференциации и морфогенезу. [37]
- См. Палеополиплоидию для исследования дупликаций древних кариотипов.
Анеуплоидия
Анеуплоидия — это состояние, при котором количество хромосом в клетках не является типичным для данного вида. Это может привести к хромосомной аномалии, такой как лишняя хромосома или потеря одной или нескольких хромосом.Аномалии числа хромосом обычно вызывают дефект в развитии. Синдром Дауна и синдром Тернера являются примерами этого.
Анеуплоидия также может возникать в группе близкородственных видов. Классическим примером у растений является род Crepis , где гаметический (= гаплоидный)
числа образуют ряд x = 3, 4, 5, 6 и 7; и Crocus , где каждое число от x = 3 до x = 15 представлено как минимум одним видом. Разного рода свидетельства показывают, что тенденции эволюции в разных группах пошли в разных направлениях. [38] Ближе к дому у человекообразных обезьян хромосомы 24×2, а у людей — 23×2. Хромосома 2 человека образовалась в результате слияния наследственных хромосом, в результате чего их количество уменьшилось. [39]
Хромосомный полиморфизм
Некоторые виды животных полиморфны в отношении слияния или диссоциации хромосом. [40] Когда это происходит, число хромосом варьируется от одного человека к другому. Хорошо изученными примерами являются божья коровка Chilocorus stigma , некоторые богомолы из рода Ameles , бурозубка европейская Sorex araneus .В случае моллюска Thais Lapillus (собачий щенок) на побережье Бретани есть некоторые свидетельства того, что две морфы хромосом адаптированы к разным местам обитания. [41]
Породы деревьев
Детальное изучение полос хромосом у насекомых с политенными хромосомами может выявить отношения между близкородственными видами: классический пример — исследование хромосомных полос у гавайских дрозофилидов Хэмптоном Карсоном.
Примерно на Гавайских островах собрана самая разнообразная в мире коллекция мух-дрозофилид, обитающих от тропических лесов до субальпийских лугов.Эти примерно 800 гавайских видов дрозофилид обычно относят к двум родам: Drosophila и Scaptomyza в семействе Drosophilidae.
Политенное кольцевание группы «картинного крыла», наиболее изученной группы гавайских дрозофилид, позволило Карсону построить эволюционное дерево задолго до того, как стал возможен анализ генома. В некотором смысле расположение генов видно в полосах каждой хромосомы. Хромосомные перестройки, особенно инверсии, позволяют увидеть, какие виды находятся в близком родстве.
Результаты очевидны. Инверсии, когда они построены в виде дерева (и не зависят от всей другой информации), показывают четкий «поток» видов от старых островов к новым. Есть также случаи возвращения колонизации на более старые острова и пропуска островов, но они гораздо реже. Используя датирование K-Ar, нынешние острова датируются от 0,4 миллиона лет назад (млн лет назад (Мауна Кеа) до 10 месяцев назад (Неккер)). Самым старым членом Гавайского архипелага, который все еще находится над морем, является атолл Куре, возраст которого может быть 30 млн лет назад.Сам архипелаг (образованный Тихоокеанской платформой, движущейся над горячей точкой) просуществовал гораздо дольше, по крайней мере, в меловой период. Предыдущие острова, ныне находящиеся под морем (гайоты), образуют Императорскую цепь подводных гор. [42]
Все местные виды Drosophila и Scaptomyza на Гавайях, по-видимому, произошли от одного предкового вида, который колонизировал острова, вероятно, 20 миллионов лет назад. Последующее адаптивное излучение было вызвано отсутствием конкуренции и большим разнообразием ниш.Хотя одна беременная самка могла колонизировать остров, более вероятно, что это была группа одного и того же вида. [43] [44] [45] [46]
На Гавайском архипелаге есть и другие животные и растения, которые подверглись аналогичному, хотя и менее впечатляющему, адаптивному излучению. [47] [48]
Изображение кариотипов
Виды бандажа
Цитогенетика использует несколько методов для визуализации различных аспектов хромосом: [49]
- G-бэндинг получают с помощью окрашивания по Гимзе после расщепления хромосом трипсином.Он дает серию светлых и темных окрашенных полос — темные области имеют тенденцию быть гетерохроматическими, поздно реплицируемыми и богатыми AT. Светлые области имеют тенденцию быть эухроматическими, рано реплицирующимися и богатыми GC. Этот метод обычно дает 300-400 полос в нормальном геноме человека.
- R-banding — это обратное G-banding (R означает «обратный»). Темные области являются эухроматическими (области, богатые гуанином-цитозином), а светлые области — гетерохроматическими (области, богатые тимин-аденином).
- C-бэндинг: Giemsa связывается с конститутивным гетерохроматином, поэтому он окрашивает центромеры.
- Q-полосы — это флуоресцентный узор, полученный с использованием хинакрина для окрашивания. Структура полос очень похожа на то, что видно на G-полосе.
- T-banding: визуализируйте теломеры.
- Окрашивание серебром: нитрат серебра окрашивает белок, связанный с областью ядрышковой организации. Это дает темную область, где осаждается серебро, что указывает на активность генов рРНК в ЯОР.
Цитогенетика классического кариотипа
В «классическом» (изображенном) кариотипе краситель, чаще всего Giemsa (G-banding) , реже — хинакрин, используется для окрашивания полос на хромосомах. Гимза специфичен для фосфатных групп ДНК. Хинакрин связывается с областями, богатыми аденином и тимином. Каждая хромосома имеет характерный рисунок полос, который помогает их идентифицировать; обе хромосомы в паре будут иметь одинаковый рисунок полос.
Кариотипы расположены так, что короткое плечо хромосомы находится вверху, а длинное плечо — внизу.Некоторые кариотипы называют короткие и длинные руки p и q соответственно. Кроме того, различным окрашенным областям и подобластям даны числовые обозначения от проксимального до дистального на плечах хромосом. Например, синдром Кри дю чат включает делецию короткого плеча хромосомы 5. Он записывается как 46, XX, 5p-. Критическая область для этого синдрома — делеция 15.2, которая записывается как 46, XX, del (5) (p15.2). [50]
Спектральный кариотип (техника SKY)
Спектральное кариотипирование — это молекулярно-цитогенетический метод, используемый для одновременной визуализации всех пар хромосом в организме в разных цветах.Зонды с флуоресцентной меткой для каждой хромосомы изготавливаются путем мечения хромосомно-специфической ДНК различными флуорофорами. Поскольку существует ограниченное количество спектрально различных флуорофоров, для получения множества разных цветов используется комбинаторный метод маркировки. Спектральные различия, генерируемые комбинаторной маркировкой, фиксируются и анализируются с помощью интерферометра, присоединенного к флуоресцентному микроскопу. Программное обеспечение для обработки изображений затем назначает псевдоцвет каждой спектрально отличной комбинации, позволяя визуализировать индивидуально окрашенные хромосомы. [51]
Этот метод используется для выявления структурных хромосомных аберраций в раковых клетках и других болезненных состояний, когда полосатость Гимзы или другие методы недостаточно точны.
Цифровое кариотипирование
Цифровое кариотипирование — это метод, используемый для количественного определения количества копий ДНК в геномной шкале. Выделяют короткие последовательности ДНК из определенных локусов по всему геному и перечисляют их. [52] . Этот метод также известен как виртуальное кариотипирование.
Хромосомные аномалии
Хромосомные аномалии могут быть числовыми, например, при наличии дополнительных или отсутствующих хромосом, или структурными, как в производной хромосоме, транслокациями, инверсиями, крупномасштабными делециями или дупликациями. Численные аномалии, также известные как анеуплоидия, часто возникают в результате нерасхождения во время мейоза при образовании гамет; трисомии, при которых присутствуют три копии хромосомы вместо двух обычных, являются распространенными числовыми аномалиями.Структурные аномалии часто возникают из-за ошибок гомологичной рекомбинации. Оба типа аномалий могут возникать в гаметах и, следовательно, будут присутствовать во всех клетках тела пораженного человека, или они могут возникать во время митоза и привести к генетической мозаике индивидуума, у которого есть некоторые нормальные и некоторые аномальные клетки.
Хромосомные аномалии, приводящие к заболеваниям у людей, включая
- Синдром Тернера возникает из-за одной Х-хромосомы (45, X или 45, X0).
- Синдром Клайнфельтера, наиболее распространенное мужское хромосомное заболевание, также известное как 47, XXY, вызывается лишней хромосомой X .
- Синдром Эдвардса вызван трисомией (тремя копиями) хромосомы 18.
- Синдром Дауна, распространенное хромосомное заболевание, вызывается трисомией 21 хромосомы.
- Синдром Патау вызывается трисомией 13 хромосомы.
- Также задокументированы трисомия 8, трисомия 9 и трисомия 16, хотя обычно они не доживают до рождения.
Некоторые расстройства возникают в результате потери только части одной хромосомы, в том числе
- Cri du chat (кошачий крик) из усеченной короткой руки на хромосоме 5.Название происходит от характерного крика младенцев, вызванного аномальным формированием гортани.
- 1p36 Синдром делеции, вызванный потерей части короткого плеча хромосомы 1.
- Синдром Ангельмана — в 50% случаев отсутствует сегмент длинного плеча 15 хромосомы.
Хромосомные аномалии могут также возникать в раковых клетках генетически нормального человека; Одним из хорошо задокументированных примеров является филадельфийская хромосома, транслокационная мутация, обычно связанная с хроническим миелогенным лейкозом и реже с острым лимфобластным лейкозом.
См. Также
Список литературы
- ↑ Concise Oxford
толковый словарь - ↑ 2,0 2,1 2,2 Белый M.J.D. 1973. Хромосомы . 6-е изд., Chapman & Hall, Лондон.
- ↑ Стеббинс Г. Л. 1950. Изменение и эволюция растений . Глава XII: Кариотип. Columbia University Press N.Y.
- ↑ King R.C., Stansfield W.D. и Mulligan P.K. 2006. Словарь генетиков .7-е изд., Oxford U.P Oxford & N.Y., стр. 242
- ↑ Левицкий Г.А. 1924. Материальная основа наследственности . Государственное издание Украины, г. Киев. [по-русски]
- ↑ Левицкий Г.А. 1931. Морфология хромосом. Бык. Прикладной бот. Genet. Завод породы . 27 , 19-174.
- ↑ Darlington C.D. 1939. Эволюция генетических систем . Издательство Кембриджского университета. 2-е изд., Переработанное и дополненное, 1958 г. Оливер и Бойд, Эдинбург.
- ↑ 8,0 8,1 Белый M.J.D. 1973. Цитология и эволюция животных . 3-е изд., Cambridge University Press.
- ↑ Коттлер М. 1974. От 48 до 46: цитологический метод, предвзятость и подсчет хромосом человека. Бык. Hist. Мед . 48 , 465-502.
- Перейти к началу страницы Винивартер Х. 1912. Etudes sur la spermatogense humaine. Arch. biologie 27 , 93, 147-9.
- ↑ Художник Т.С. 1922. Сперматогенез человека. Анат. Res. 23 , 129.
- ↑ Художник Т.С. 1923. Исследования сперматогенеза у млекопитающих II. Сперматогенез человека. J. Exp. Зоология 37 , 291-336.
- ↑ Тжио Дж. Х. и Леван А. 1956. Число хромосом человека. Наследие 42 , 1-6.
- ↑ 14,0 14,1 Hsu T.C. 1979. Цитогенетика человека и млекопитающих: историческая перспектива .Springer-Verlag, N.Y.
- ↑ Препарат, включающий красители Метиленовый синий, Эозин Y и Лазурь-A, B, C
- ↑ Gustashaw K.M. 1991. Хромосомные пятна. В Лабораторное руководство по цитогенетике ACT 2-е изд., Изд. М.Дж. Барч. Ассоциация цитогенетических технологов, Raven Press, Нью-Йорк.
- ↑ Стеббинс Г. Л. 1971. Хромосомная эволюция у высших растений . Арнольд, Лондон. p85-6
- ↑ Годфри Л.Р. и Мастерс Дж. К. 2000. Теория воспроизводства кинетофора может объяснить быструю эволюцию хромосом. PNAS 97 , 9821–9823. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=34032
- ↑ Мэйнард Смит Дж. 1998. Эволюционная генетика . 2-е изд, Оксфорд. p218-9
- ↑ Годей С. и Эстебан М.Р. 2001. Удаление хромосом у сциаридных мух. Bioessays 23 : 242–250.
- ↑ Мюллер Ф. Бернард В. и Тоблер Х. 1996. Уменьшение хроматина у нематод. Bioessays 18 : 133–138.
- ↑ Вингаард Г.А. И Грегори Т. 2001. Временной контроль репликации ДНК и адаптивное значение уменьшения хроматина у копепод. J. Exp. Zool. 291 : 310–16.
- ↑ Гилберт С.Ф. 2006. Биология развития . Sinauer Associates, Стэмфорд, штат Коннектикут. 8-е изд, Глава 9
- ↑ King R.C., Stansfield W.D. и Mulligan P.K. 2006. Словарь генетиков . 7-е изд, Oxford U.P Oxford & N.Y.
- ↑ Вурстер Д.Х. и Бениршке К. 1970. Индийский мунтжак, Muntiacus muntjak : олень с низким диплоидным числом. Наука 168 , 1364-1366.
- ↑ Khandelwal S. 1990. Хромосомная эволюция в роде Ophioglossum L. Ботанический журнал Линнеевского общества 102 : 205–217.
- ↑ Kim, D.S .; Nam, Y.K .; Но, J.K .; Park, C.H .; Чепмен, Ф.А. (2005). «Кариотип североамериканского коротконосого осетра Acipenser brevirostrum с наивысшим числом хромосом среди Acipenseriformes» (PDF). Ихтиологические исследования 52 (1): 94–97. DOI: 10.1007 / s10228-004-0257-z. Проверено 18 марта 2008.
- ↑ Стеббинс, Г. Л. 1940. Значение полиплоидии в эволюции растений. Американский натуралист 74 , 54–66.
- ↑ Стеббинс Г. Л. 1950. Изменение и эволюция растений . Издательство Колумбийского университета.
- ↑ Comai L. 2005. Преимущества и недостатки полиплоидности. Обзоры природы, Генетика . 6 , 836-46.
- ↑ Адамс К.Л. & Вендел Дж. Ф. 2005. Полиплоидия и эволюция генома у растений. Текущее мнение в области биологии растений . 8 135-41.
- ↑ Стеббинс Г. Л. 1970. Хромосомная эволюция цветковых растений . Арнольд, Лондон.
- ↑ Грегори Т. И Мейбл Б.К. 2005. Полиплоидия у животных. В Эволюция генома Грегори Т. (ред). Эльзевир, Сан-Диего. p427-517
- ↑ Белый M.J.D.1973. Хромосомы . 6-е изд., Chapman & Hall, Лондон. стр.45
- ↑ Лилли М.А. и Дуронио Р.Дж. (2005). «Новые сведения о контроле клеточного цикла из эндоцикла Drosophila ». Онкоген 24 (17): 2765–75. DOI: 10.1038 / sj.onc.1208610. PMID 15838513.
- ↑ Эдгар Б.А. И Орр-Уивер Т. 2001. Циклы эндоредупликации клеток: больше за меньшее. Ячейка 105 , 297-306.
- ↑ Нагл В. 1978. Эндополиплоидия и политения в дифференцировке и эволюции: к пониманию количественной и качественной изменчивости ядерной ДНК в онтогенезе и филогении .Эльзевир, Нью-Йорк.
- ↑ Стеббинс, Г. Ледли, мл. 1972. Хромосомная эволюция у высших растений . Нельсон, Лондон. p18
- ↑ Иждо Дж. У. и др., 1991. Происхождение хромосомы 2 человека: исконное слияние теломер-теломер. Труды Национальной академии наук 88 : 9051–5.
- ↑ Полиморфизм : когда два или более явно разных фенотипа существуют в одной и той же скрещивающейся популяции вида. Форд Э. 1975 г. Экологическая генетика , 4-е изд.
- ↑ Белый M.J.D. 1973. Хромосомы . Чепмен и Холл, Лондон. p169
- ↑ Клэг Д.А. И Г. Далримпл. 1987. Гавайско-императорская вулканическая цепь, Часть I. Геологическая эволюция. В R.W. Decker, T.L. Райт и П. Штауфер (ред.) Вулканизм на Гавайях . Документ профессионала геологической службы США 1350, 5-54.
- ↑ Карсон Х. Л. 1970. Хромосомные индикаторы эволюции. Наука 168 , 1414–1418.
- ↑ Карсон Х.Л. 1983. Хромосомные последовательности и межостровная колонизация у гавайской дрозофилы . Генетика 103 , 465-482.
- ↑ Карсон Х.Л. 1992. Инверсии в гавайской Drosophila . В: Krimbas C.B. & Powell J.R. (eds) Инверсионный полиморфизм дрозофилы . CRC Press, Бока-Ратон, Флорида. 407-439.
- ↑ Канеширо К.Ю. Гиллеспи Р. и Карсон Х.Л. 1995. Хромосомы и мужские гениталии гавайской дрозофилы: инструменты для интерпретации филогении и географии.В Wagner W.L. И Фанк Э. (ред.) Гавайская биогеография: эволюция на архипелаге горячих точек , Smithsonian Institution Press, Вашингтон, округ Колумбия, 57-71
- ↑ Крэддок Э. М. 2000. Процессы видообразования в адаптивной радиации гавайских растений и животных. Эволюционная биология 31 , 1-43.
- ↑ Ziegler A.C. 2002. Гавайская естественная история, экология и эволюция . Гонолулу: Гавайский университет Press.
- ↑ Густашоу К.М. 1991. Хромосомные пятна. В Лабораторное руководство по цитогенетике ACT 2-е изд., Изд. М.Дж. Барч. Ассоциация цитогенетических технологов, Raven Press, Нью-Йорк.
- ↑ (2005) в Lisa G. Shaffer, Niels Tommerup: ISCN 2005: Международная система цитогенетической номенклатуры человека . Швейцария: S. Karger AG. ISBN 3-8055-8019-3.
- ↑ E. Schr Schck, S. du Manoir, T. Veldman, B. Schoell, J. Wienberg, M. A. Ferguson-Smith, Y. Ning, D.H.Ледбеттер, И. Бар-Ам, Д. Соенксен, Ю. Гарини, Т. Рид. Многоцветное спектральное кариотипирование хромосом человека. Science , 26 июля 1996 г .; 273 (5274): 494. Аннотация
- ↑ Цифровое кариотипирование — Ван и др., 10.1073 / pnas.202610899 — Труды Национальной академии наук
Внешние ссылки
Обсудить
* Некоторая информация полностью или частично предоставлена http://en.wikipedia.org/
PPT — Цитогенетика: кариотипы и хромосомные аберрации Презентация PowerPoint
Цитогенетика: кариотипы и хромосомные аберрации Глава 6
Число хромосом • Количество и внешний вид хромосом являются важной характеристикой в генетическом анализе.Таблица 6-1, стр. 121
Форма хромосомы • По мере того, как хромосомы конденсируются и становятся видимыми во время деления клетки, можно распознать определенные структурные особенности • Центромера • Область хромосомы, к которой прикрепляются волокна микротрубочек во время деления клетки • Расположение центромеры дает хромосома его характерная форма
Хромосомы человека • Реплицированные хромосомы в метафазе состоят из сестринских хроматид, соединенных одной центромерой Рис.6-1, стр. 122
Расположение центромеры • Метацентрическая • Хромосома с центромерой в центре • Субметацентрическая • Хромосома, центромера которой расположена ближе к одному концу, чем к другому • Акроцентрическая • Хромосома, центромера которой расположена очень близко, но не на одном конце
Метафазные хромосомы • Хромосомы идентифицируются по размеру, расположению центромеры, рисунку полос
Набор хромосом человека • Хромосомы человека анализируются путем построения кариотипов • Полный кариотип набор хромосом из клетки, которая была сфотографирована во время деления клетки и расположена в стандартной последовательности
Кариотип человека Рис.6-3, стр. 122
Система присвоения имен хромосомным полосам • Позволяет идентифицировать любую область по описательному адресу (номер хромосомы, плечо, область и полоса)
Добавьте несколько капель крови. Добавьте фитогемагглютинин для стимуляции митоза. Наберите от 10 до 20 мл крови. Инкубируйте при 37 ° C в течение 2–3 дней. Перенести в пробирку с фиксатором. Перенести клетки в пробирку. Добавьте колцемид в культуру на 1-2 часа, чтобы остановить митоз в метафазе. Центрифуга для концентрирования клеток.Добавьте раствор с низким содержанием соли, чтобы удалить эритроциты и увеличить лимфоциты. Капните клетки на предметное стекло микроскопа. Обработка оцифрованных изображений хромосом для создания кариотипа. Осмотрите под микроскопом. Слайд для окрашивания по Гимзе. Рис. 6-6, стр. 124
Метафазные хромосомы (а), организованные в кариотип (б) Рис. 6-7, с. 125
6.3 Построение и анализ кариотипов • Различные окраски и красители создают характерные для каждой хромосомы модели полосатости • Кариотипы выявляют различия в структуре и количестве хромосом • 1959: Открытие того, что синдром Дауна вызывается дополнительной копией хромосомы 21 • Бэндинг хромосом и другие методы могут выявить небольшие изменения в структуре хромосом
Информация, полученная на основе кариотипа • Количество хромосом • Содержание половых хромосом • Наличие или отсутствие отдельных хромосом • Природа и степень крупных структурных аномалий
Четыре стандартные процедуры окрашивания хромосом Это дополнительная информация, которой не будет на экзамене.**
Хромосомная окраска • Новые методы с использованием флуоресцентных красителей создают уникальные узоры для каждой хромосомы Рис. 6-9a, p. 127
Хромосомные аберрации и специфические синдромы Таблица 6-2, стр. 126
Получение клеток для хромосомных исследований • Любое ядро может быть использовано для создания кариотипа • Лимфоциты, клетки кожи, клетки из биопсии, опухолевые клетки • Отбор клеток до рождения • Амниоцентез • Отбор проб ворсин хориона (CVS)
Амниоцентез • Метод отбора проб жидкости, окружающей развивающийся плод, путем введения полой иглы и извлечения взвешенных плодных клеток и жидкости • Используется для диагностики генетических нарушений и нарушений развития плода • Обычно выполняется на шестнадцатой неделе беременности
Удаление около 20 мл амниотической жидкости, содержащей взвешенных клеток, которые были отделены от плода Несколько биохимических анализов с некоторыми из околоплодных вод Центрифугирование Быстрое определение пола плода и анализ очищенной ДНК Фетальные клетки Рост в течение нескольких дней в культуральной среде Биохимический анализ на наличие аллелей, вызывающих много разных таболические расстройства Анализ кариотипа (а) Рис.6-10а, с. 127
Взятие проб хорионических ворсинок (CVS) • Метод отбора хорионических клеток плода путем введения катетера через влагалище или брюшную стенку в матку • Используется для диагностики биохимических и цитогенетических дефектов эмбриона • Обычно выполняется в восьмая или девятая неделя беременности
Ворсинки хориона Развитие плаценты Ультразвук для контроля процедуры Развитие плода Мочевой пузырь Матка Хорион Катетер Амниотическая полость Прямая кишка (а) Рис.6-11а, с. 128
Изучение генетики: неинвазивная пренатальная диагностика • Изучаются методы выделения плодных клеток, которые могут попасть в кровоток матери (плацентарные клетки, белые кровяные тельца, незрелые эритроциты) для генетического тестирования стр. 129
6.4 Вариации числа хромосом • Изменения числа хромосом или структуры хромосом могут вызывать генетические нарушения • В кариотипе могут быть обнаружены два основных типа хромосомных изменений • Изменение числа хромосом • Изменение расположения хромосом
Изменения в номере хромосомы • Полиплоидия • Дублирование всего набора хромосом • 3N = триплоид • 4N = тетраплоид • Анеуплоидия • Относится к одной хромосоме • Трисомия = одна дополнительная хромосома (три копии) • Моносомия = одна отсутствует хромосома пары
Триплоидный кариотип Рис.6-12, с. 130
Триплоидный младенец Рис. 6-13, стр. 131
Причины анеуплоидии • Нерасхождение • Неспособность гомологичных хромосом правильно разделиться во время мейоза • Около половины всех зачатий являются анеуплоидными.
Нерасхождение Дополнительная хромосома (n + 1) Нормальное деление Отсутствующая хромосома (n — 1) Нормальный (n) Нормальный (n) Мейоз I Мейоз II Гаметы (b) Рис. 6-14b, p. 132
Дополнительная хромосома (n + 1) Нерасхождение Дополнительная хромосома (n + 1) Отсутствующая хромосома (n — 1) Отсутствующая хромосома (n — 1) Мейоз I Мейоз II Гаметы (а) Рис.6-14а, с. 132
Эффекты моносомии и трисомии • Аутосомная моносомия — летальное состояние • Устраняется на ранней стадии развития (самопроизвольный аборт) • Некоторые аутосомные трисомии относительно распространены • Большинство приводит к самопроизвольному аборту • Три типа могут привести к живорождению 13, 18, 21)
Трисомии при самопроизвольных абортах
Трисомия 13: синдром Патау (47, + 13) • Летальное состояние • 1 из 10 000 рождений Рис.6-16, с. 133
Трисомия 18: синдром Эдвардса (47, + 18) • Летальное состояние • 1 из 11 000 рождений • 80% — женщины Рис. 6-17b, p. 133
Трисомия 21: синдром Дауна (47, +21) • Трисомия 21 — единственная аутосомная трисомия, которая позволяет дожить до взрослого возраста
6.5 Каковы риски аутосомной трисомии? • Причины аутосомальтрисомии неизвестны • Были предложены следующие факторы: • Генетическая предрасположенность • Воздействие радиации • Вирусная инфекция • Аномальный уровень гормонов • Возраст матери является ведущим фактором риска трисомии • 94% случаев нерасхождения происходит у матери • Мейоз не завершается до овуляции • Эмбрио-маточные взаимодействия, которые обычно приводят к прерыванию аномальных эмбрионов, становятся менее эффективными
Материнский возраст и трисомия 21
6.6 Анеуплоидия половых хромосом • Чаще, чем аутосомная анеуплоидия • Может включать как X-, так и Y-хромосомы • Для нормального развития необходим баланс • Для развития требуется по крайней мере одна копия X-хромосомы • Увеличивается количество X- или Y-хромосом вызывает все более серьезные нарушения фенотипа и поведения
Синдром Тернера (45, X) • Моносомия Х-хромосомы, приводящая к женскому бесплодию. Другие фенотипические характеристики, но в остальном нормальные.• Рис. 6.20 Рис. 6-20, стр. 136
Синдром Клайнфельтера (47, XXY) • Люди (мужчины) имеют некоторые проблемы с фертильностью, но мало дополнительных симптомов • Рис. 6.22 Рис. 6-22, p. 137
Синдром XYY (47, XYY) • Пострадавшие обычно выше нормального роста, и некоторые, но не все, страдают расстройствами личности Рис. 6-23, p. 138
6.7 Структурные изменения в хромосомах • Изменения в структуре хромосом • Делеция — потеря ДНК • Дупликация — дополнительная ДНК • Транслокация — ДНК, которая меняет местоположение • Инверсия — порядок изменений ДНК
Структурная Изменения в хромосомах Рис.6-24, с. 139
6.9 Другие формы хромосомных изменений • Однородительская дисомия • Состояние, при котором обе копии хромосомы унаследованы от одного родителя • Вариация числа копий • Ситуация, в которой конкретный ген или хромосомная область присутствует в множественные копии • Хрупкие участки • Проявляются как пробелы или разрывы в определенных местах хромосомы
Болезни человека, связанные с вариантами числа копий Таблица 6-5, с. 143
Хрупкие участки • Проявляются в виде разрывов или разрывов в хромосомах • Один хрупкий участок на Х-хромосоме связан с распространенной формой умственной отсталости у мужчин, известной как синдром ломкой Х-хромосомы • У женщин это также может быть, но фенотипы гораздо более мягкие
Хрупкие участки на Х-хромосоме
Педиатрия на основе случая Глава
Двухдневный младенец мужского пола жалуется на рвоту желчью и шум в сердце.Он родился от 39-летней женщины G4P3 на 37 неделе беременности. Жизненно важные функции включают T37.1 (ax), P150, R45, BP 75/50, насыщение кислородом 99% в воздухе помещения. Физический осмотр показывает рост, вес и окружность головы на уровне 50-го процентиля. Он выглядит желтушным; у него плоский профиль лица; эпикантальные складки и наклонные глазные щели, плоская переносица, маленький рот с выступающим языком, маленькие чашевидные уши, избыточная затылочная кожа и короткие руки с единственными складками ладоней. Его легкие чисты при аускультации, слышен громкий голосистолический шум.Его живот не вздут. Имеется генерализованная гипотония.
Рентгенограмма брюшной полости показывает «двойные пузырьки» и подозревается атрезия двенадцатиперстной кишки. На эхокардиограмме выявляется дефект межжелудочковой перегородки. Подозревается хромосомная аномалия и выполняется кариотип, подтверждающий трисомию 21.
В эту главу включены некоторые из наиболее распространенных хромосомных аномалий, встречающихся в клинической практике. Будут рассмотрены следующие синдромы: трисомия 21 (синдром Дауна), трисомия 18 (синдром Эдвардса), трисомия 13 (синдром Патау), XXY (синдром Клайнфельтера), 45X (синдром Тернера) и делеция 22q11.2 (Вело-кардио-лицевой синдром / синдром Ди Джорджи).
Трисомия 21 (синдром Дауна)
Это состояние было впервые клинически описано доктором Джоном Лэнгдоном Х. Дауном в 1866 году, но в течение почти столетия причина оставалась загадкой. Лишь в 1959 году была обнаружена дополнительная 21-я хромосома, ответственная за этот синдром. По оценкам CDC, каждый год в США приходится один случай синдрома Дауна на 691 ребенок.
Этиология синдрома Дауна — трисомия по 21 хромосоме.Около 95% людей с синдромом Дауна имеют стандартную трисомию 21 (целая дополнительная хромосома 21 во всех клетках) в результате нерасхождения. Около 90% случаев происходят во время материнского мейоза, преимущественно в мейозе I. Остальные 10% случаются во время отцовского мейоза, в равной степени происходящего между мейозом I и II. Пожилой возраст матери — важный фактор риска нерасхождения. Пять процентов случаев связаны с Робертсоновскими транслокациями и мозаицизмом.
Робертсоновские транслокации при синдроме Дауна возникают, когда часть или вся хромосома 21 перемещается в другую хромосому, обычно хромосому 14.Носители робертсоновской транслокации нормальны, но имеют повышенный риск выкидыша и хромосомных аномалий у детей. Другая транслокация затрагивает хромосому 21q / 21q. Это редко, но важно, потому что родитель-носитель имеет только одну 21-ю хромосому (перемещенная хромосома с удвоенным генетическим материалом). Когда эта хромосома присутствует, у всего потомства будет трисомия 21.
Более мягкие фенотипы могут быть замечены, когда пациенты мозаичны для трисомии 21.Клетки трисомии 21 смешивают со второй «нормальной» линией клеток. Это может быть результатом постзиготического (митотического) нерасхождения или постзиготической потери хромосомы 21 из трисомной зиготы.
Считается, что хромосома 21 содержит от 200 до 250 генов. Поиск основных генов, участвующих в характеристиках этого синдрома, находится в области 21q2121q22.3. По мере развития технологий эта критическая область будет способствовать дальнейшему пониманию нашего понимания синдрома Дауна.
Синдром Дауна обычно можно диагностировать при рождении из-за отличительного фенотипа.Клинические признаки включают микробрахицефалию с плоским затылком и характерные черты лица, включая эпикантальные складки, плоскую переносицу, маленький рот с выступающим языком и маленькие уши с загнутой верхней спиралью. На зрачках могут быть легкие нечеткие непрозрачные пятна Брашфилда. Другие особенности могут включать избыточную затылочную кожу, единственную складку ладони и увеличенное пространство между первым и вторым пальцами ноги. Новорожденные часто имеют гипотонию и чаще имеют другие типы пороков развития. Сердечные аномалии присутствуют от 40% до 50% и включают дефекты межжелудочковой перегородки, за которыми следуют дефекты эндокардиальной подушки, открытый артериальный проток и дефекты межпредсердной перегородки.Желудочно-кишечные аномалии могут включать болезнь Гиршпрунга, дуоденальную или анальную атрезию. Люди также подвержены повышенному риску гипотиреоза, лейкемии (острый лимфоцитарный и нелимфоцитарный лейкоз), болезни Альцгеймера с ранним началом, восприимчивости к инфекционным заболеваниям и атлантоаксиальной нестабильности, что увеличивает риск повреждения позвоночника.
Мнемоникой для запоминания основных осложнений, обнаруженных при синдроме Дауна, является слово ВАЛИДАТ: ДМЖП, атлантоаксиальная нестабильность, лейкемия, иммунодефицит, атрезия двенадцатиперстной кишки, болезнь Альцгеймера, дисфункция щитовидной железы и дефекты эндокардиальной подушки.
Средний IQ составляет около 45 с верхним пределом 70. Типичный уровень функционирования — шестой класс. Детей можно направить в программы стимулирования младенцев, записать в классы специального обучения, а затем получить профессиональную подготовку, которая поможет им стать более независимыми.
Когда на основании клинических данных имеется высокое подозрение на синдром Дауна, для подтверждения диагноза и определения механизма трисомии используется хромосомный анализ (кариотип).Важно проконсультировать родителей, у которых есть один ребенок с синдромом Дауна, о риске рождения второго ребенка с синдромом Дауна. В целом риск рецидива составляет около 1%. Матери преклонного возраста матери сохраняют свой возрастной риск. У отца со сбалансированной Робертсоновской транслокацией риск рецидива составляет от 3% до 5%, тогда как у матери со сбалансированной Робертсоновской транслокацией риск рецидива составляет от 10% до 15%.
Американский колледж акушеров и гинекологов (ACOG) рекомендует предлагать всем беременным женщинам пройти скрининг-тест на синдром Дауна.Это включает в себя анализ крови матери и специальное ультразвуковое исследование. Женщинам, у которых результаты скринингового теста отклоняются от нормы, предлагается пройти диагностический тест, например амниоцентез или забор проб ворсинок хориона.
Специального лечения синдрома Дауна не существует. Однако благодаря достижениям в лечении медицинских и хирургических проблем, которые могут возникнуть, средняя продолжительность жизни увеличилась почти до 50 лет.
Трисомия 18 (синдром Эдвардса)
Младенцы с трисомией 18 серьезно поражены и обычно умирают до рождения или в течение первых месяцев жизни.Менее 10% пациентов выживают более 12 месяцев, а у выживших наблюдается серьезная задержка в развитии. Заболеваемость составляет 1 случай на 4000-8000 живорождений, с преобладанием пораженных женщин. Этиология этого синдрома — трисомия по хромосоме 18. Примерно 94% будут иметь полную трисомию 18. У остальных будет частичная трисомия 18 в результате несбалансированной транслокации или мозаицизма. Клиническая картина частичной и мозаичной трисомии 18 варьируется от легкой с повышенной выживаемостью до неотличимой от полной трисомии 18.Это зависит от того, какая часть хромосомы поражена, и от степени мозаицизма.
Люди с трисомией 18 имеют тяжелую умственную отсталость, задержку внутриутробного развития, задержку развития, а у 90% — врожденный порок сердца (например, дефект межжелудочковой перегородки). Физические особенности могут включать в себя голову неправильной формы с выступающим затылком, низко посаженные уши, микрогнатию, короткую грудину, характерные сжатые кулаки, гипоплазированные ногти на ногах, смещенные пальцы ног и «качающиеся ступни» с выступающей пяточной костью.Сердечная недостаточность и центральное апноэ способствуют детской смертности. Небольшое количество детей с трисомией 18 достигли совершеннолетия.
Риск рецидива полной трисомии 18 составляет менее 1%. Риск трисомии 18 увеличивается с возрастом матери. Показаны хромосомные исследования и генетическое консультирование. Доступен пренатальный скрининг. Женщинам, у которых результаты скринингового теста отклоняются от нормы, предлагается пройти диагностический тест, например амниоцентез или забор проб ворсинок хориона.
Лечение является поддерживающим, но родители могут решить сосредоточиться на уходе за ребенком, а не на обширном лечении и реанимационных мероприятиях у серьезно пострадавшего младенца.
Трисомия 13 (синдром Патау)
Группа находок в этом состоянии была описана еще в 1600-х годах. Клаус Патау и его коллеги первыми приписали синдром трисомии по хромосоме 13 цитогенетическим анализом в 1960 году. Заболеваемость составляет 1 случай на 10–20 000 живорождений. Этиология обычно трисомия для хромосомы 13. Примерно от 5% до 10% вызваны транслокацией (обычно 13; 14 несбалансированная Робертсоновская транслокация).У остальных может быть частичная дупликация мозаицизма 13q или трисомии 13. Оба они могут иметь более мягкий фенотип и лучший результат в отношении выживаемости, чем полная трисомия 13.
Новорожденные с трисомией 13 серьезно поражены и могут прожить от нескольких дней до недель из-за сложных пороков сердца или серьезных неврологических аномалий. Примерно 90% не доживают до первого года жизни. Выжившие люди могут иметь недостаточность роста, серьезную задержку развития и пороки развития центральной нервной системы, такие как голопрозэнцефалия.Другие признаки могут включать микроцефалию, микрофтальмию, центральное апноэ, судороги, потерю слуха, расщелину губы и неба и дефекты мочеполовой системы. Врожденные пороки сердца, такие как дефекты межпредсердной и межжелудочковой перегородок, встречаются в 80%. На руках могут быть единственные складки ладони и постаксиальная полидактилия с перекрытием пальцев на большом пальце, что убедительно указывает на трисомию 13.
Риск рецидива трисомии 13 обычно составляет менее 1%. Риск увеличивается с возрастом матери.Показаны хромосомные исследования и генетическое консультирование. Для трисомии 13 доступен пренатальный скрининг. Женщинам с отклонениями в результатах скринингового теста предлагается пройти диагностический тест, такой как амниоцентез или взятие проб ворсинок хориона.
Лечение является поддерживающим, но родители могут решить сосредоточиться на уходе за ребенком, а не на обширном лечении и реанимационных мероприятиях у серьезно пострадавшего младенца.
Синдром Клайнфельтера
Гарри Фитч Клайнфелтер встретил несколько молодых пациентов мужского пола с маленькими яичками и гинекомастией.В его описании в 1942 году было обнаружено множество открытий, которые впоследствии стали синдромом, носящим его имя. Синдром Клайнфельтера поражает 1 из 500–1000 новорожденных мальчиков. Этиология — лишняя Х-хромосома. Наиболее распространенный хромосомный образец — 47, XXY, но могут встречаться и другие варианты, включая 48, XXYY, 48, XXXY и 49, XXXXY.
У 50–60% этих людей дополнительная Х-хромосома исходит от отца из-за нерасхождения, происходящего в мейозе I. Остальные 40–50% поступают от матери, преимущественно в мейозе I.Важным фактором является преклонный возраст матери.
Характерные признаки синдрома Клайнфельтера в детстве могут быть неспецифическими. Следовательно, диагноз обычно ставится в подростковом или взрослом возрасте, когда пубертатное созревание задерживается, является неполным или отсутствует. Диагноз также может быть поставлен в рамках оценки бесплодия. Хромосомный анализ (кариотип) подтверждает диагноз синдрома Клайнфельтера. В целом когнитивные, поведенческие и физические отклонения ухудшаются по мере увеличения количества Х-хромосом.Те, у кого 48, XXXY, вероятно, будут более серьезными, чем те, у кого 47, XXY. Самые мягкие фенотипы чаще встречаются у лиц с мозаицизмом 46, XY / 47, XXY.
Характерные черты могут включать в себя высокое стройное тело с длинными ногами, широкие бедра, гинекомастию, меньшее количество волос на лице и теле и слабое развитие мышц. Яички маленькие и твердые, с атрофированными семенными канальцами и дисфункциональными клетками Лейдига, что приводит к азооспермии и бесплодию. Уровни тестостерона обычно низкие, в то время как ФСГ и ЛГ повышены.Другие находки могут включать маленький пенис и крипторхизм.
Интеллект может быть нормальным, со средним IQ 90. Учебные и психосоциальные трудности — обычное явление. У мальчиков, у которых есть проблемы с обучением или проблемы с адаптацией в школе, следует учитывать синдром Клайнфельтера. В более зрелом возрасте повышается риск сахарного диабета, рака груди, аутоиммунных заболеваний, венозной тромбоэмболии и хронических заболеваний легких.
Лечение синдрома Клайнфельтера включает заместительную терапию тестостероном, которую следует начинать в обычном начале полового созревания, когда уровень тестостерона становится недостаточным, а уровень гонадотропина повышается.Это позволит достичь пубертатного созревания с углублением голоса, увеличением мышечной массы, улучшенной плотностью костей, увеличением пениса, повышенным либидо, улучшением самооценки и настроения. При раннем распознавании и диагностике можно начать лечение, чтобы позволить более нормальному созреванию пораженного мужчины.
Хотя бесплодие нельзя обратить вспять, у некоторых мужчин с синдромом Клайнфельтера выработка сперматозоидов минимальна, поэтому интрацитоплазматическая инъекция спермы (ИКСИ) может быть вариантом для тех, кто хочет иметь биологических детей.Эта процедура включает извлечение спермы, которая затем вводится непосредственно в яйцеклетку. У потомства повышен риск хромосомных аномалий.
Синдром Тернера
В 1938 году Генри Тернер сообщил о серии молодых женщин с низким ростом, перепончатой шеей и неспособностью к половому созреванию. Одиннадцать лет спустя Чарльз Форд определил, что этиология была связана с отсутствием одной Х-хромосомы. Приблизительно 95% из 45 X плодов умирают в утробе матери. Частота рождения составляет 1 на 2500 живорожденных женщин.Только одна Х-хромосома нормальна и функционирует, другая Х-хромосома отсутствует или структурно аномальна из-за делеции или транслокации. Примерно от 60% до 80% пострадавших сохраняют материнский X; таким образом, потеря Х-хромосомы обычно происходит из-за нерасхождения, происходящего в отцовском мейозе. Пожилой возраст матери или отца не является фактором этого состояния.
Около 50% пациентов имеют кариотип моносомии 45, X. У других может присутствовать заметный мозаицизм (45, X / 46, XX или 45, X / 46, XX / 47, XXX).Более мягкие фенотипы обычно наблюдаются в мозаичных кариотипах. Y-хромосома (45, X / 46, XY) присутствует у 5% людей с синдромом Тернера, и это увеличивает риск развития гонадобластомы.
Важные характеристики, о которых следует помнить, включают низкий рост, перепончатую шею, широкую грудь с широко расставленными сосками, аменорею и коарктацию аорты. Другие находки включают небольшую нижнюю челюсть, выступающие уши, низкую заднюю линию волос, вальгусный локоть (увеличенный опорный угол локтя), короткую четвертую пястную кость и лимфедему кистей и стоп.Средний рост взрослого человека составляет 140 см (4 фута 7 дюймов). Сердечно-сосудистые мальформации могут возникать в 35-40% случаев и включать двустворчатый аортальный клапан и коарктацию аорты. Другие сердечные осложнения в зрелом возрасте включают гипертензию, стеноз аорты, расслоение аорты и разрыв. Пороки развития мочевыводящих путей встречаются примерно от 30% до 40%, включая двойную собирающую систему, подковообразную почку, мальротацию или нарушение кровоснабжения. Интеллект обычно в норме; однако было обнаружено, что около 10% имеют задержку в развитии.
Диагноз ставится на основании хромосомного анализа (кариотипа). Клиническое подозрение может привести к тестированию при рождении. Анализ кариотипа также необходим при оценке низкого роста, что может быть единственным клиническим признаком, имеющимся у молодой девушки. Кариотип также используется для оценки первичной аменореи или задержки полового созревания.
Одно из направлений лечения направлено на достижение нормального роста. Гормон роста оказался успешным в увеличении окончательного роста взрослого человека, и его следует начинать при обнаружении задержки роста.Анаболические стероиды обладают дополнительным эффектом для людей с очень низким ростом или для девочек старшего возраста. Успех терапии гормоном роста определяется возрастом начала, дозой, продолжительностью терапии и включением анаболических стероидов.
Более 90% людей с синдромом Тернера будут иметь гонадную недостаточность из-за дисгенезии яичников. Тем, у кого дефицит эстрогена и прогестина, требуется длительная заместительная терапия для развития вторичных половых признаков и начала менструального цикла.Заместительная терапия эстрадиолом рекомендуется в возрасте 12 лет. Это позволяет половому созреванию нормально развиваться, не влияя на окончательный рост.
Большинство женщин с синдромом Тернера бесплодны, хотя от 2% до 5% могут достичь спонтанной беременности. Доступны экстракорпоральные оплодотворения или другие методы лечения бесплодия, но существует повышенный риск рождения ребенка с хромосомными или врожденными аномалиями. Таким образом, доступна преимплантационная диагностика. Требуется генетическое консультирование и медицинское обследование.
Ожидаемая продолжительность жизни ниже, чем у населения в целом, из-за сердечно-сосудистых заболеваний, гипертонии и эндокринных проблем. Внимание к этим вопросам может снизить заболеваемость и увеличить продолжительность жизни.
Синдром делеции 22q11.2
Другие названия этого состояния включают Вело-Кардио-Лицевой синдром, Синдром Ди Джорджи, Синдром Шпринцена, Синдром конотрункальной аномалии Лица и Кардиофациальный синдром Кайлера. Анджело ДиДжорджи описал пациента в 1965 году с иммунодефицитом и гипопаратиреозом.Позднее Шпринцен сообщил о пациентах с дефектами неба, врожденными пороками сердца и характерными чертами лица. Хотя ранее считалось, что это разные синдромы, субмикроскопическая делеция в хромосоме 22q11.2 была идентифицирована и определена как этиология этих состояний с перекрывающимися признаками. Теперь они обозначены как синдром делеции 22q11.2. Из синдромов микроделеции наиболее распространенным является делеция 22q11.2. Делецию можно обнаружить с помощью FISH (флуоресцентная гибридизация in situ), если есть подозрение на диагноз, или с помощью хромосомного микрочипа.
Заболеваемость составляет 1 на 4000 живорождений. Примерно в 90% случаев имеется большая делеция 3 Mb, содержащая около 30 генов. Остальные люди имеют меньшую делецию в критической области ДиДжорджи. В подавляющем большинстве случаев (93%) имеется делеция de novo 22q11.2, а 7% унаследовали делецию от одного из родителей. У всех пострадавших есть 50% шанс передать делецию своему потомству при каждой беременности.
Классическая триада включает иммунодефицит, врожденные пороки сердца и дефекты неба.Этот синдром имеет аномалии развития, связанные с разрывом глоточного мешка, включая гипоплазию паращитовидных желез, гипоплазию вилочковой железы и врожденные пороки сердца. Клинические последствия этих аномалий могут привести к гипокальциемии из-за низкого уровня паратиреоидного гормона, иммунодефициту из-за проблем с Т-клетками (из-за аномального тимуса) и сердечно-сосудистой мальформации, включая тетралогию Фалло, дефект межжелудочковой перегородки, другие пороки конотрункала и аномалии дуги аорты. .Другие находки могут включать расщелину неба, небоглоточную недостаточность / гиперназальную речь, характерные черты лица (выступающий нос / корень носа, гипопластические крылья носа, маленький рот, асимметричное плачущее лицо, аномалии уха), потерю слуха и почечные аномалии. Люди, страдающие этим синдромом, также могут иметь задержку в развитии, в том числе трудности с речью. Дети также имеют более высокий риск аутизма и проблем с психическим здоровьем, таких как шизофрения.
Улучшение медицинского обслуживания, особенно при сердечных и инфекционных заболеваниях, привело к увеличению продолжительности жизни пациентов с Deletion 22q11.2 синдром.
Вопросы
1. Какие хромосомные нарушения могут проявляться задержкой или неудачей полового созревания?
2. Этот синдром проявляется выпуклым затылком, сжатыми кулаками и «качалкой ступней». Какие 2 осложнения могут вызвать смерть у этих детей?
3. Какой синдром не связан с преклонным возрастом матери?
. . . . . а. Синдром Дауна
. . . . . б. Синдром Тернера
.. . . . c. Синдром Клайнфельтера
. . . . . d. Синдром Патау
4. Верно / неверно. Тест с хромосомным микрочипом можно использовать для диагностики всех генетических состояний, обсуждаемых в этой главе.
5. Все следующие утверждения относительно синдрома Тернера верны, ЗА ИСКЛЮЧЕНИЕМ
. . . . . а. Пожилой возраст матери не является фактором
. . . . . б. Большинство плодов умирают в утробе матери
. . . . . c. Врожденная лимфедема — частая находка
.. . . . d. Наиболее результат — нерасхождение матери
. . . . . е. Все верно
6. Что вызывает гинекомастию у мужчин с синдромом Клайнфельтера?
7. Выберите три признака, которые составляют классическую триаду, наблюдаемую у пациентов с делецией 22q11.2?
. . . . . а. Судороги
. . . . . б. Врожденный порок сердца
. . . . . c. Невысокий рост
. . . . . d. Волчья пасть
. . . . . е. Иммунодефицит
Связанные рентгеновские снимки
Это портативный рентгеновский снимок грудной клетки двухмесячного ребенка с «припадком» (на самом деле тетания из-за гипокальциемии), показывающий кардиомегалию без ожидаемой тени тимуса (т.е., презентация синдрома ДиДжорджи) от: Ямамото Л.Г. Судороги и ДМЖП у 2-месячного младенца. В: Ямамото Л.Г., Инаба А.С., ДиМауро Р. (ред.). Радиологические случаи в педиатрической неотложной медицине, 1995, том 2, случай 2. Прочтите онлайн-случай и его описание по адресу: www.hawaii.edu/medicine/pediatrics/pemxray/v2c02.html
Список литературы
1. Bondy CA для консенсусной группы по изучению синдрома Тернера. Уход за девочками и женщинами с синдромом Тернера: Руководство исследовательской группы по синдрому Тернера.J. Clin Endocrinol Metab 2007; 92 (1): 10-25.
2. Бык MJ и Комитет по генетике. Наблюдение за здоровьем детей с синдромом Дауна. Педиатрия 2011; 128: 393-406.
3. Кэссиди С.Б., Аллансон Дж. Э. (Ред.). Управление генетическими синдромами. Третье издание, 2010 г., Нью-Джерси: John Wiley & Sons, Inc.
4. Firth H, Hurst JA. Oxford Desk Reference Clinical Genetics. 2006, Нью-Йорк: Издательство Оксфордского университета.
5. Горлин Р.Дж., Коэн М.М. мл.Синдромы головы и шеи. 2001, Нью-Йорк: Издательство Оксфордского университета.
6. Джонс К.Л. (Эд). Распознаваемые модели пороков развития человека Смита, шестое издание, 2006 г., Филадельфия: компания Elsevier Saunders.
7. Parker SE, Mai CT, Canfield MA и др. Обновленные национальные оценки распространенности некоторых врожденных дефектов в США, 2004–2006 гг. Врожденные дефекты Res A. 2010; 88: 1008-1016.
8. Саллер Д. Н. мл., Каник Дж. А. Современные методы пренатального скрининга на синдром Дауна и другие аномалии плода.Clin Obstet Gynecol. 2008; 51 (1): 24-36.
Ответы
1. Синдром Тернера и синдром Клайнфельтера.

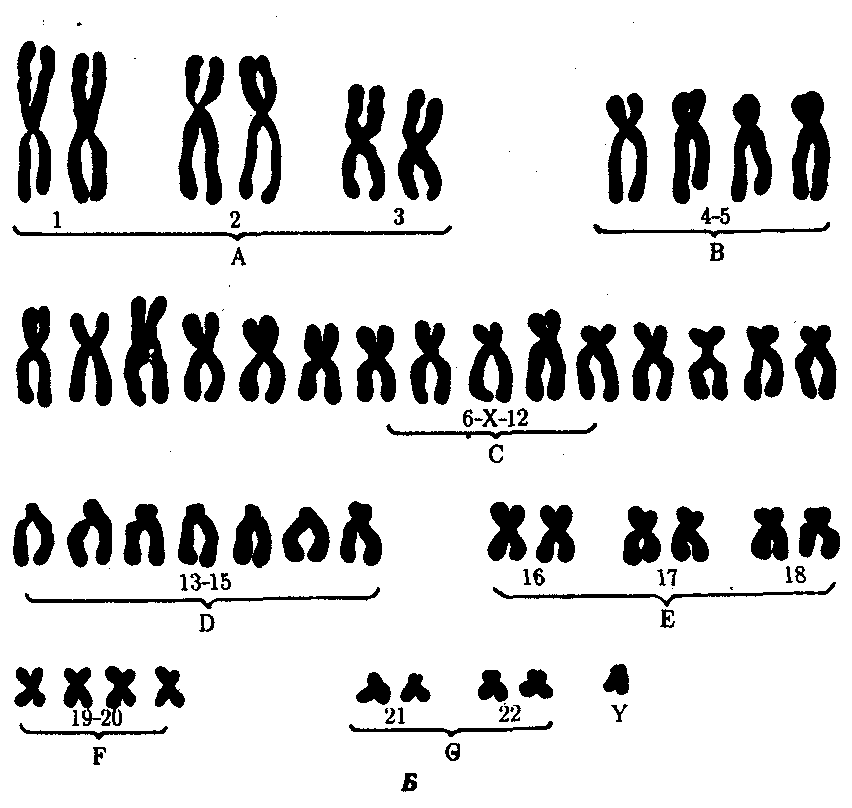
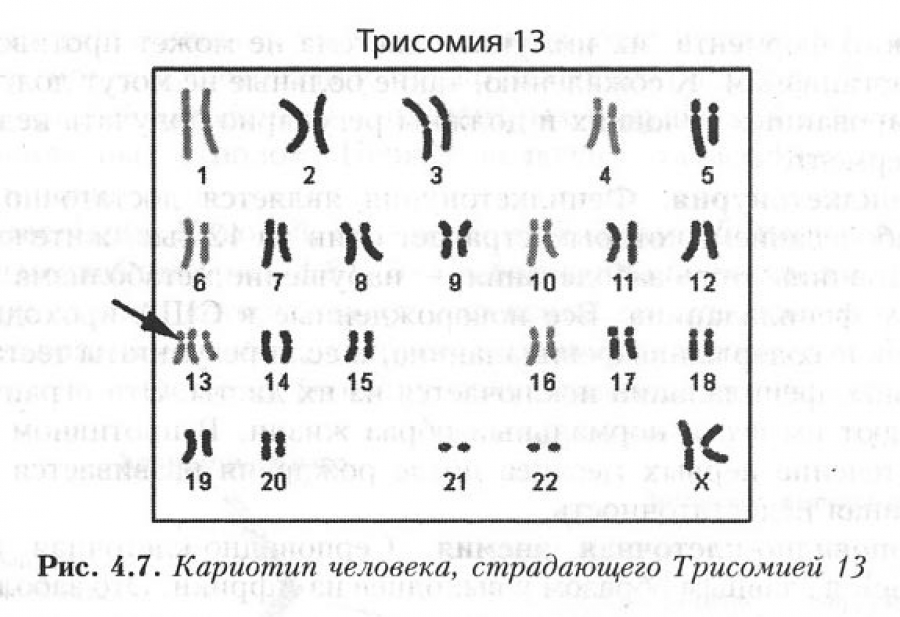 Это приводит к задержке умственного и физического развития, расстройствам психики.
Это приводит к задержке умственного и физического развития, расстройствам психики.