Кишечные инфекции у детей раннего возраста
Кишечные инфекции у детей
«Нам всегда хочется видеть наших детей здоровыми и радостными. Одним из самых распространённых заболеваний, с которым сталкиваются дети раннего возраста, являются кишечные инфекции. Чаще них дети подвержены разве что только ОРВИ. Вызываются эти заболевания самыми разными возбудителями – как вирусами, так и бактериями, такими как сальмонелла, дизентерийная или патогенная кишечная палочка.
Зачастую вирусной причиной возникновения данного заболевания у маленьких детей являются ротавирусы.
Ротавирусная кишечная инфекция чаще встречается у детей раннего возраста. Протекает заболевание с поднятием температуры, обильной рвотой и поносом. Нередко у деток встречаются при этом заложенность носа, отёк носоглотки, кашель.
Лечение любой кишечной инфекции должно быть своевременным, грамотным и продуманным. В первую очередь, необходимо сразу же обратиться к врачу и не заниматься самолечением. У детей младшего возраста отсутствие должного лечения чревато неприятными последствиями – сильным обезвоживанием вследствие рвоты и поноса.
У детей младшего возраста отсутствие должного лечения чревато неприятными последствиями – сильным обезвоживанием вследствие рвоты и поноса.
Помните, что и рвота, и понос – защитные реакции организма на инфекционное поражение желудка и кишечника. И главная цель лечения не остановить эти проявления кишечной инфекции, а дать организму время освободиться от вызвавших болезнь микробов и по возможности помочь в этом.
Главный принцип лечения – восполнение теряемой с поносом жидкости. Если ребенок пьет, то пусть пьет любую жидкость по его выбору, при рвоте – выпаивайте ребенка, т.е. поите часто малыми порциями. Если отмечаются упорные рвоты или отказ от питья, тем более если ребенок не мочится в течение 4-6 часов, то ждать нельзя, срочно обращайтесь к врачу. Скорей всего в такой ситуации потребуется госпитализация в инфекционный стационар и уже внутривенное введение жидкости.
Щадящая диета
В обязательном порядке лечение должно включать щадящую диету, не старайтесь накормить ребенка, аппетит вернется с улучшением состояния. Необходимо позаботиться о снижении температуры у тех детей, у которых есть какие-либо неврологические заболевания или ранее отмечались реакции на высокую температуру. При ряде кишечных инфекций (вызванных бактериями) врач назначит антибактериальные средства. Также врач может прописать препараты, которые выводят из кишечника токсины, а также пробиотические препараты.
Необходимо позаботиться о снижении температуры у тех детей, у которых есть какие-либо неврологические заболевания или ранее отмечались реакции на высокую температуру. При ряде кишечных инфекций (вызванных бактериями) врач назначит антибактериальные средства. Также врач может прописать препараты, которые выводят из кишечника токсины, а также пробиотические препараты.
Ни в коем случае не стоит игнорировать предписания врача и, тем более, пытаться лечить ребенка «бабушкиными» методами.
Обращение к врачу обязательно при поносе у детей первого года жизни и, вне зависимости от возраста — при отсутствии тенденции к улучшению самочувствия в течение суток. Кроме того, появление крови в каловых массах – повод для обращения за врачебной помощью.
Самым правильным решением будет сразу же обратиться в инфекционную больницу.
Причиной возникновения являются ротавирусы
Анализ блок Кишечные бактериальные инфекции
Анализ блок Кишечные бактериальные инфекции
КДЦ МНИИЭМ им. Г.Н.Габричевского » Инфекционные заболевания » Анализ блок Кишечные бактериальные инфекции
Г.Н.Габричевского » Инфекционные заболевания » Анализ блок Кишечные бактериальные инфекции
| Исследование | Цена(первый/повторный) | Как сдавать |
|---|---|---|
| БЛОК: Возбудители кишечных инфекций (Shigella/ Salmonella sp / Campylobacter sp / Adenovirus),определение ДНК — Диарогенные эшерихиозы (энтеропатогенные E. coli (EPEC)/ энтеротоксигенные E. coli (ETEC)/ энтероинвазивные E. coli (EIEC)/ энтерогеморрагические E. coli (EHEC)/ энтероадгезивные E. coli (EAgEC), определение ДН | 1890-00 |
Шигеллез (дизентерия) – относится к группе острых кишечных инфекций – заболеваниям с фекально-оральным механизмом передачи, которые характеризуются симптомами общей интоксикации и диареей. Возбудителем дизентерии является бактерии рода Shigella, поэтому и само заболевание называется «шигеллез». Шигеллы распространены повсеместно.
Пути заражения.
Заражение происходит фекально-оральным способом – т.е. бактерии из кишечника больного человека попадают в желудочно-кишечный тракт здорового человека. Это может произойти через грязные руки, при попадании бактерий в пищевые продукты, воду, через насекомых. Источником возбудителя инфекции при дизентерии являются не только больные, но бактерионосители, которые выделяют шигеллы во внешнюю среду с фекалиями. Больные дизентерией заразны с начала болезни. Длительность выделения возбудителя больными, как правило, не превышает недели, но может затягиваться и до 2—3 недель. Инфицирование шигеллами является результатом несоблюдение правил личной гигиены, плохие санитарно-гигиенические условия.
Развитие болезни.
Ведущим фактором в развитии болезни является поступление токсинов бактерий в кровь. При разрушении микробов выделяется токсин, который играет большую роль в развитии болезни и обусловливает ее проявления. В первую очередь поражается нервная система, а также сердечно-сосудистая система, надпочечники и органы пищеварения. Шигеллы вызывают поражение слизистой толстого кишечника, что проявляется жидким стулом со слизью и примесью крови, болезненностью при дефекации. Однако у многих больных наблюдается лишь водянистая диарея.
Шигеллы вызывают поражение слизистой толстого кишечника, что проявляется жидким стулом со слизью и примесью крови, болезненностью при дефекации. Однако у многих больных наблюдается лишь водянистая диарея.
Острая дизентерия.
Заболевание начинается остро – в течение 24-48 часов после заражения. Чаще всего наблюдается колитический вариант инфекции – т.е. поражение исключительно толстого кишечника. Однако иногда встречаются гастроэнтероколитический или гастроэнтерический варианты – с поражением слизистой желудка и тонкого кишечника.
Проявления острой дизентерии:
- Лихорадка. Температура повышается до высоких цифр. У детей она может достигать 40-41ºС.
- Диарея. Вначале заболевания иногда наблюдается кратковременный водянистый понос, однако затем стул учащается до 10-30 раз в сутки и выделяется в небольшом количестве. В кале появляется примесь большого количества слизи, крови, иногда – гноя. Примесь крови в кале является отличительным признаком дизентерии среди всех острых кишечных инфекций и свидетельствует о поражении (изъязвлении) слизистой кишечника.
 Появление примеси крови в стуле служит поводом для немедленного обращения к врачу.
Появление примеси крови в стуле служит поводом для немедленного обращения к врачу. - Схваткообразные боли в животе.
- Тенезмы – мучительные позывы на дефекацию, а также болезненные ощущения в области ануса во время и после дефекации.
При гастроэнтероколитическом и гастроэнтерическом вариантах заболевания может возникать тошнота, рвота, обильный водянистый стул.
При легком течении заболевания самопроизвольное выздоровление наступает в пределах недели. В тяжелых случаях могут развиться серьезные осложнения, не исключен летальный исход.
Хроническая дизентерия.
Хроническая дизентерия диагностируется в том случае, если заболевание длится более 3 месяцев. При этом течение может быть различным. Наблюдается или непрерывное течение заболевания, или рецидивирующее, которое характеризуется периодическими обострениями. При этом периоды хронической дизентерии чередуются с периодами полного ощущения здоровья. Тяжесть симптомов во время рецидива обычно значительно меньше, чем при острой дизентерии. Признаки интоксикации выражены значительно меньше – температура редко превышает 37,5 ºС, стул частый, однако боли не столь мучительны, примесь крови чаще всего отсутствует.
Признаки интоксикации выражены значительно меньше – температура редко превышает 37,5 ºС, стул частый, однако боли не столь мучительны, примесь крови чаще всего отсутствует.
Бактерионосительство.
Носительство шигелл может быть в том случае, если бактерии продолжают выделяться из кишечника больного после перенесенной дизентерии при отсутствии каких-либо признаков заболевания.
Кроме того, выделяют транзиторное бактерионосительство, которое диагностируют при однократном выделении шигелл из кала здорового человека, не болевшего дизентерией. Чаще всего это происходит случайно при профилактическом обследовании.
Энтероинвазивные E.coli.
Кишечная палочка(E.coli) — возбудитель эшерихиозов, основная аэробная часть микрофлоры кишечника. E.coli является обычным обитателем кишечника многих млекопитающих и приматов, к числу которых принадлежит человек. В организме человека кишечная палочка выполняет полезную роль, подавляя рост вредных бактерий и синтезируя некоторые витамины. Однако существуют разновидности бактерий E.coli способных вызывать у человека острые кишечные заболевания.
Однако существуют разновидности бактерий E.coli способных вызывать у человека острые кишечные заболевания.
Энтероинвазивные кишечные палочки — возбудители поражений весьма напоминающих бактериальную дизентерию. Патогенез тоже носит черты явного сходства: подобно шигеллам энтероинвазивные кишечные палочки проникают и размножаются в клетках эпителия кишечника. Как и шигеллы они неподвижны и не способны ферментировать лактозу.
Поражения характеризуются выраженными болями в животе и профузной водянистой диареей с примесью крови. На инвазивность указывает большое количество полиморфных ядерных лейкоцитов в испражнениях. Путь передачи: фекально-оральный.
Источник инфекции больные люди, животные, а также животные, фекально-загрязнённые продукты питания и вода.
Сальманеллёзы — острые кишечные инфекции животных и человека, вызываемые сальмонеллами (Salmonella spp.).
Источник инфекции: больные животные, больной человек и бактерионосители.
Путь передачи — алиментарный через инфицированные пищевые продукты, как правило, животного происхождения: мясо, мясные продукты, молоко, яйца, особенно утиные и гусиные, студень, при нарушении правил хранения и приготовления продуктов (соприкосновение готовой и сырой продукции, недостаточная термическая обработка продуктов перед употреблением).
Клиническая картина.
Инкубационный период колеблется от 2-6 часов до 2-3 суток. Клинические проявления сальмонеллезов от бессимптомного носительства возбудителя инфекции до тяжелых септических форм.
Различают несколько клинических форм сальмонеллеза:
1.Желудочно-кишечная форма. При этой форме заболевание начинается остро обильной рвотой и диареей (стул водянистый, часто с зеленью, зловонный). Наблюдаются боли, урчание, вздутие живота, слабость, головные боли, головокружение, озноб, повышение температуры тела до 38-40 градусов, боли в мышцах и суставах, судороги мышц конечностей. Длительность заболевания 3-7 суток.
Длительность заболевания 3-7 суток.
2.Тифоподобная форма — имеет такое же начало как и желудочно-кишечная форма, но для неё характерны лихорадка в течение 10-14 суток, увеличение печени и селезёнки, более выражены симптомы общей интоксикации (головная боль, вялость, иногда появление сыпи).
3.Септическая форма — после короткого начального периода развивается картина сепсиса. В 15-17% случаев сальмонеллёзов в периоде реконвалесценции наблюдается кратковременное бактерионосительство. Возможно «транзиторное» носительство (однократное выделение сальмонелл без клинических проявлений) и хроническое бактерионосительство.
Кампилобактериоз — это острое инфекционное зоонозное заболевание, характеризующееся синдромом общей интоксикации, поражением желудочно-кишечного тракта и возможностью генерализации патологического процесса, вызываемого кампилобактериями (Campylobacter spp.)
Источник инфекции: сельскохозяйственные животные, птицы, грызуны, больной человек.
Путь передачи: алиментарный (пищевой), водный, контактно-бытовой.
Факторы передачи: мясо, мясные продукты, птица, молоко, вода.
Заболевание встречается во всех возрастных группах, но преимущественно у детей в возрасте до 5 лет. У взрослых кампилобактериоз чаще наблюдается среди сельских жителей, связанных с животноводством и птицеводством. А также у туристов, посещающих развивающиеся страны в виде «диареи путешественников». Кампилобактериоз регистрируется в течение всего года, но сезонный подъём заболеваемости приходится на летние месяцы.
Клиническая картина.
Инккубационный перид: 1-10 дней (чаще 2-5 дней).
Выделяют две формы кампилобактериоза:
-Типичная (желудочно-кишечная и генерализованная)
-Атипичная (бессимптомная, инаппаратная)
Болезнь начинается остро: озноб, повышение температуры тела до 38-39 градусов, головная боль, слабость, боли в мышцах и суставах. У 50% больных эти проявления продолжаются от нескольких часов до двух суток и лишь затем, возникает желудочно-кишечная симптоматика. У другой половины больных признаки поражения желудочно-кишечного тракта появляются уже в самом начале заболевания. Наиболее постоянными из них являются схваткообразные боли в животе и жидкий водянистый зловонный стул от 5 до 10 раз в сутки. У части больных возникает тошнота и рвота. На 2-3-й день болезни в стуле обнаруживается примесь крови и слизи. Продолжительность заболевания от 2-х до 15-ти суток. Заболевание может осложняться развитием инфекционно-токсического шока, миокардита и пневмонии.
У 50% больных эти проявления продолжаются от нескольких часов до двух суток и лишь затем, возникает желудочно-кишечная симптоматика. У другой половины больных признаки поражения желудочно-кишечного тракта появляются уже в самом начале заболевания. Наиболее постоянными из них являются схваткообразные боли в животе и жидкий водянистый зловонный стул от 5 до 10 раз в сутки. У части больных возникает тошнота и рвота. На 2-3-й день болезни в стуле обнаруживается примесь крови и слизи. Продолжительность заболевания от 2-х до 15-ти суток. Заболевание может осложняться развитием инфекционно-токсического шока, миокардита и пневмонии.
Дифференциальная диагностика
Бактериальные кишечные инфекции следует отличать от других острых инфекций различной этиологии. Наибольшие сложности при этом вызывают вирусные кишечные заболевания, вызываемые другими патогенами (ротавирусы группы А, норовирусы 2 генотипа, астровирус и др.), поэтому большое значение имеет дифференциальная диагностика ОКИ. Предлагаемые нами исследования:
Предлагаемые нами исследования:
— Блок «Бактериальные кишечные инфекции»: ДНК микроорганизмов рода Шигелла (Shigella spp.) и энтероинвазивных E. coli (EIEC), Сальмонелла (Salmonella spp.), термофильных Кампилобактерий (Campylobacter spp.).
Сдать анализ кала ПЦР на острые кишечные инфекции
Метод определения
ПЦР в реальном времени (RT-PCR).
Исследуемый материал
Кал
Доступен выезд на дом
Исследование используют в целях дифференциальной диагностики острых кишечных инфекций.
Состав профиля:
- Shigella spp./Escherichia coli (Enteroinvasive Escherichia coli – EIEC)
- Salmonella spp.

- Campilobacter spp.
- Adenovirus F
- Rotavirus A
- Norovirus GII
- Astrovirus
Спектр возбудителей острых кишечных инфекций (ОКИ) разнообразен, в него входят бактерии, вирусы и простейшие из различных таксономических групп. Основным симптомом более тридцати заболеваний группы ОКИ является острая диарея (понос). К бактериальным возбудителям ОКИ относятся представители родов Salmonella, Shigella, патогенные штаммы Escherichia coli, Campylobacter и пр. Возбудителями вирусных ОКИ могут быть ротавирусы группы А, норовирусы 2-ой геногруппы (GII), астровирусы, аденовирусы группы F и др. Из ОКИ паразитарного происхождения наибольшее клиническое значение имеют амебиаз и лямблиоз.
Большая часть острых кишечных инфекций у детей (от 50 до 80% всех случаев заболеваний) обусловлена вирусными инфекциями, преимущественно вызванными ротавирусами группы А и норовирусом 2-ой геногруппы (GII). В структуре ОКИ бактериального происхождения наиболее часто встречающимися возбудителями у детей являются сальмонеллы. Наряду с сальмонеллезом (около 7% острых кишечных инфекций) актуальны эшерихиоз (4,8% ОКИ), кампилобактериоз (2,9% случаев заболеваний), шигеллез (0,3% случаев острых кишечных инфекций).
В структуре ОКИ бактериального происхождения наиболее часто встречающимися возбудителями у детей являются сальмонеллы. Наряду с сальмонеллезом (около 7% острых кишечных инфекций) актуальны эшерихиоз (4,8% ОКИ), кампилобактериоз (2,9% случаев заболеваний), шигеллез (0,3% случаев острых кишечных инфекций).
Бактериальная диарея, в отличие от вирусной, характеризуется более тяжелым клиническим течением, поскольку патофизиологические механизмы повреждения слизистой оболочки связаны с проникновением микроорганизмов в клетки эпителия и действием бактериальных эндотоксинов. При инвазивных (бактериальных) острых кишечных инфекциях бактериологический метод является «золотым стандартом» диагностики при соблюдении ключевого правила: взятие биоматериала должно проводиться до назначения антимикробной терапии (см. тесты №№457, 458, 460, 461, 462).
Молекулярно-генетические исследования (в т. ч. ПЦР-метод), выявляющие специфические фрагменты ДНК и РНК возбудителей в биоматериале, входят в стандартные схемы диагностики ОКИ и позволяют быстро и эффективно верифицировать комплекс вирусных и бактериальных возбудителей острых кишечных инфекций. Антигенные тесты идентификации возбудителей ОКИ (см. тесты №№463, 481, 482, 483, 485, 486) также являются экспресс-методами, дающими возможность установить диагноз бактериальной или вирусной острой кишечной инфекции на ранних сроках болезни, в том числе и на фоне лечения антибиотиками. Серологические методы, позволяющие обнаружить специфические антитела к возбудителям, являются вспомогательными в диагностике большинства инвазивных ОКИ (см. тесты №№234, 235, 238, 239, 273, 280-290, 292, 293).
Антигенные тесты идентификации возбудителей ОКИ (см. тесты №№463, 481, 482, 483, 485, 486) также являются экспресс-методами, дающими возможность установить диагноз бактериальной или вирусной острой кишечной инфекции на ранних сроках болезни, в том числе и на фоне лечения антибиотиками. Серологические методы, позволяющие обнаружить специфические антитела к возбудителям, являются вспомогательными в диагностике большинства инвазивных ОКИ (см. тесты №№234, 235, 238, 239, 273, 280-290, 292, 293).
Острые кишечные инфекции у детей и их профилактика
В соответствии с рекомендациями ВОЗ термин «острые кишечные инфекции» (ОКИ) объединяет более 30 заболеваний бактериальной, вирусной или протозойной этиологии, основным симптомом которых является острая диарея.ОКИ – полиэтиологическая группа инфекционных заболеваний, сопровождающихся нарушением моторики желудочно-кишечного тракта с развитием диареи, интоксикации, а в ряде случаев — обезвоживания.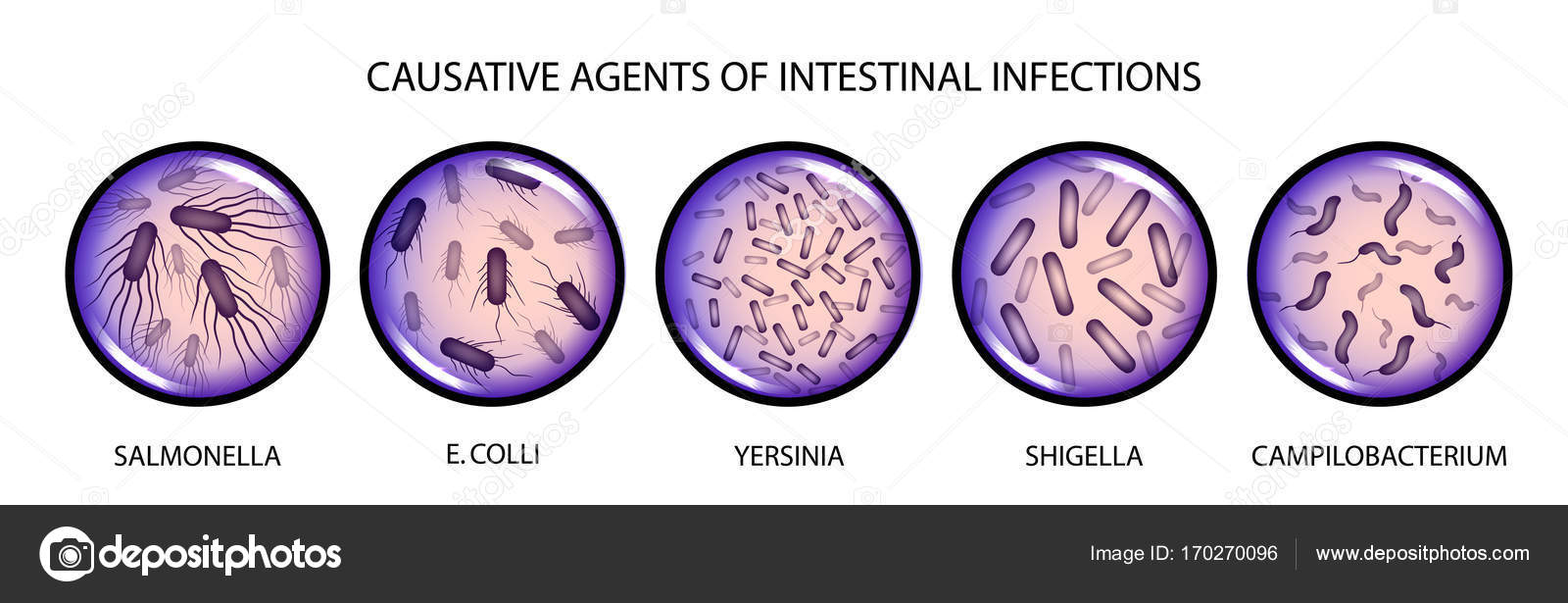 На современном этапе ОКИ по-прежнему имеют широкое распространение. Согласно материалам ВОЗ в развивающихся странах у детей младше 5 лет ежегодно возникает 1 млрд. эпизодов диареи (в среднем 3 – 4 эпизода диареи в год на 1 ребенка). Вследствие диареи ежегодно умирает 3 миллиона детей (около 80% из них — в возрасте до 2 лет). ОКИ занимают 2 место по распространенности после ОРИ. Регистрируется ежегодно 9 – 10 случаев заболевания на 1000 детей в возрасте до 14 лет. По данным ДИКБ за 1999 год в структуре заболеваемости ОКИ 35,4% составила ротавирусная инфекция, 18,4% — шигеллезы, 9,5% — сальмонеллезы, 6,1% — ОКИ, вызванные УПФ, 30,6% — ОКИ неустановленной этиологии.В проблеме их изучения особую актуальность на современном этапе приобретают вопросы своевременной ранней диагностики; характера клинического течения болезни; дифференциальной диагностики; развития осложнений, приводящих к неблагоприятным исходам; а также проводимой адекватной этиопатогенетической терапии. Существенной особенностью ОКИ является полиэтиологичность и широкий диапазон клинических форм — от субклинических до токсических.
На современном этапе ОКИ по-прежнему имеют широкое распространение. Согласно материалам ВОЗ в развивающихся странах у детей младше 5 лет ежегодно возникает 1 млрд. эпизодов диареи (в среднем 3 – 4 эпизода диареи в год на 1 ребенка). Вследствие диареи ежегодно умирает 3 миллиона детей (около 80% из них — в возрасте до 2 лет). ОКИ занимают 2 место по распространенности после ОРИ. Регистрируется ежегодно 9 – 10 случаев заболевания на 1000 детей в возрасте до 14 лет. По данным ДИКБ за 1999 год в структуре заболеваемости ОКИ 35,4% составила ротавирусная инфекция, 18,4% — шигеллезы, 9,5% — сальмонеллезы, 6,1% — ОКИ, вызванные УПФ, 30,6% — ОКИ неустановленной этиологии.В проблеме их изучения особую актуальность на современном этапе приобретают вопросы своевременной ранней диагностики; характера клинического течения болезни; дифференциальной диагностики; развития осложнений, приводящих к неблагоприятным исходам; а также проводимой адекватной этиопатогенетической терапии. Существенной особенностью ОКИ является полиэтиологичность и широкий диапазон клинических форм — от субклинических до токсических. В зависимости от этиологии и патогенеза ОКИ делятся на инвазивные кишечные инфекции, при которых возбудителями болезни являются шигеллы, сальмонеллы, энтероинвазивные эшерихии, кампилобактерии; и секреторные — причиной заболевания являются ротавирусы, аденовирусы, астровирусы, а также бактерии (энтеротоксигенные и энтеропатогенные эшерихии) и паразиты (криптоспоридии, изоспоры, балантидии, микроспоридии).Большое значение имеет клиническая картина, характерная для той или иной нозологической формы кишечных инфекций. Для постановки предварительного диагноза необходимо уточнить первые признаки заболевания, жалобы в момент осмотра, измерить температуру тела, осмотреть стул, провести осмотр заболевшего. Главной задачей на этом этапе, является решение о, предположительно вирусной или, предположительно бактериальной этиологии болезни, поскольку лечение в обоих случаях носит принципиальное отличие в назначении этиотропных препаратов. Другой, не менее важной задачей, является оценка состояния больного с определением степени тяжести патологического процесса и, соответственно вытекающим из этого решением вопроса стационарного или амбулаторного лечения, а в случае госпитализации, необходимости проведения неотложных и интенсивных терапевтических мероприятий.
В зависимости от этиологии и патогенеза ОКИ делятся на инвазивные кишечные инфекции, при которых возбудителями болезни являются шигеллы, сальмонеллы, энтероинвазивные эшерихии, кампилобактерии; и секреторные — причиной заболевания являются ротавирусы, аденовирусы, астровирусы, а также бактерии (энтеротоксигенные и энтеропатогенные эшерихии) и паразиты (криптоспоридии, изоспоры, балантидии, микроспоридии).Большое значение имеет клиническая картина, характерная для той или иной нозологической формы кишечных инфекций. Для постановки предварительного диагноза необходимо уточнить первые признаки заболевания, жалобы в момент осмотра, измерить температуру тела, осмотреть стул, провести осмотр заболевшего. Главной задачей на этом этапе, является решение о, предположительно вирусной или, предположительно бактериальной этиологии болезни, поскольку лечение в обоих случаях носит принципиальное отличие в назначении этиотропных препаратов. Другой, не менее важной задачей, является оценка состояния больного с определением степени тяжести патологического процесса и, соответственно вытекающим из этого решением вопроса стационарного или амбулаторного лечения, а в случае госпитализации, необходимости проведения неотложных и интенсивных терапевтических мероприятий. Источник инфекции при ОКИ – больной человек или носители. Наиболее часто источником являются больные легкими, стертыми и бессимптомными формами инфекции. Основной механизм передачи – фекально-оральный, реализующийся пищевым, водным и контактно-бытовым, реже – воздушно-пылевым путем. Причем если при бактериальных инфекциях большее значение имеют пищевой и водный пути, то при вирусных диареях водный и контактный. Вирусы, как известно, не могут размножаться на пищевых продуктах и передаются «от живого человека – живому человеку». Для вирусных кишечных инфекций более характерен холодный период времени года, а бактериальные чаще встречаются в летне-осенний с пиком, приходящимся на август-сентябрь.Кишечные инфекции начинаются, как правило, остро. Ведущими клиническими симптомами являются диарея, рвота, боли в животе и симптомы интоксикации. Для оценки диареи необходимо учитывать частоту стула, объем дефекации (скудные или обильные выделения), характер испражнений (консистенция, цвет, запах, наличие непереваренных комочков пищи), патологические примеси в кале (слизь, кровь, гной).
Источник инфекции при ОКИ – больной человек или носители. Наиболее часто источником являются больные легкими, стертыми и бессимптомными формами инфекции. Основной механизм передачи – фекально-оральный, реализующийся пищевым, водным и контактно-бытовым, реже – воздушно-пылевым путем. Причем если при бактериальных инфекциях большее значение имеют пищевой и водный пути, то при вирусных диареях водный и контактный. Вирусы, как известно, не могут размножаться на пищевых продуктах и передаются «от живого человека – живому человеку». Для вирусных кишечных инфекций более характерен холодный период времени года, а бактериальные чаще встречаются в летне-осенний с пиком, приходящимся на август-сентябрь.Кишечные инфекции начинаются, как правило, остро. Ведущими клиническими симптомами являются диарея, рвота, боли в животе и симптомы интоксикации. Для оценки диареи необходимо учитывать частоту стула, объем дефекации (скудные или обильные выделения), характер испражнений (консистенция, цвет, запах, наличие непереваренных комочков пищи), патологические примеси в кале (слизь, кровь, гной). При оценке рвоты принимают во внимание ее частоту, длительность, объем и характер рвотных масс (съеденной пищей, с желчью, с кровью — алой или по типу «кофейной гущи»). Имеют значение наличие предшествующей тошноты и чувства облегчения после рвоты, например, при менингитах и других поражениях центральной нервной системы, облегчения рвота не приносит. При определении болей в животе уточняются их продолжительность, интенсивность, характер (схваткообразный или ноющий), их локализация и иррадиация.
При оценке рвоты принимают во внимание ее частоту, длительность, объем и характер рвотных масс (съеденной пищей, с желчью, с кровью — алой или по типу «кофейной гущи»). Имеют значение наличие предшествующей тошноты и чувства облегчения после рвоты, например, при менингитах и других поражениях центральной нервной системы, облегчения рвота не приносит. При определении болей в животе уточняются их продолжительность, интенсивность, характер (схваткообразный или ноющий), их локализация и иррадиация.
Для вирусных диарей характерна клиника гастроэнтерита или энтерита с обильным водянистым стулом без патологических примесей или с небольшим их количеством. Рвота по частоте преобладает над диареей и нередко возникает обезвоживание, обычно I степени. Интоксикация, как правило, не выражена и даже при эксикозе весьма умеренна, температура тела держится на субфебрильных цифрах, иногда достигает 38°С и несколько выше. За невыраженность интоксикации свидетельствует тот факт, что после рвоты ребенок может поесть, играет и ощущает себя вполне удовлетворительно. Редко ротавирусная инфекция может протекать по варианту изолированного гастрита, без диареи. Следует констатировать, что при вирусной диарее отсутствуют воспалительные изменения в гемограмме и копрограмме, а тяжесть болезни определяется степенью дегидратации при невыраженных или кратковременных симптомах интоксикации.При ОКИ бактериальной этиологии характер стула зависит от этиологии заболевания. При сальмонеллезе стул носит энтеритный характер – обильный, водянистый с примесью довольно большого количества слизи зеленого цвета, так называемый стул вида «болотной тины». В случае выраженных эрозий на слизистой кишечника в стуле появляется примесь крови, которая, равномерно распределяясь, придает ему вид «мясных помоев». Для шигеллезов наиболее типичным клиническим вариантом является дистальный колит – стул скудный, первоначально носит каловый характер, в динамике приобретает вид «ректального плевка» с примесью прозрачной слизи, при более тяжелом течении, крови в виде точек или прожилок. Бактериальные диареи, как и вирусные могут протекать по варианту острого гастроэнтерита, но, не зависимо от того, какой синдром преобладает, для них характерна существенно более выраженная интоксикация с температурой тела, достигающей выраженных фебрильных значений (до 39°С, а в некоторых случаях и более).
Редко ротавирусная инфекция может протекать по варианту изолированного гастрита, без диареи. Следует констатировать, что при вирусной диарее отсутствуют воспалительные изменения в гемограмме и копрограмме, а тяжесть болезни определяется степенью дегидратации при невыраженных или кратковременных симптомах интоксикации.При ОКИ бактериальной этиологии характер стула зависит от этиологии заболевания. При сальмонеллезе стул носит энтеритный характер – обильный, водянистый с примесью довольно большого количества слизи зеленого цвета, так называемый стул вида «болотной тины». В случае выраженных эрозий на слизистой кишечника в стуле появляется примесь крови, которая, равномерно распределяясь, придает ему вид «мясных помоев». Для шигеллезов наиболее типичным клиническим вариантом является дистальный колит – стул скудный, первоначально носит каловый характер, в динамике приобретает вид «ректального плевка» с примесью прозрачной слизи, при более тяжелом течении, крови в виде точек или прожилок. Бактериальные диареи, как и вирусные могут протекать по варианту острого гастроэнтерита, но, не зависимо от того, какой синдром преобладает, для них характерна существенно более выраженная интоксикация с температурой тела, достигающей выраженных фебрильных значений (до 39°С, а в некоторых случаях и более). Таким образом, для бактериальной диареи характерны превалирование симптомов интоксикации над клиникой дегидратации, «воспалительные» изменения в гемограмме (лейкоцитоз, нейтрофилез, палочкоядерный сдвиг влево, ускорение СОЭ) и копрограмме (увеличение содержания лейкоцитов и эритроцитов, появление слизи в большом количестве).Одной из основных задач по предупреждению развития острых кишечных инфекций у детей является санитарное просвещение населения.
Таким образом, для бактериальной диареи характерны превалирование симптомов интоксикации над клиникой дегидратации, «воспалительные» изменения в гемограмме (лейкоцитоз, нейтрофилез, палочкоядерный сдвиг влево, ускорение СОЭ) и копрограмме (увеличение содержания лейкоцитов и эритроцитов, появление слизи в большом количестве).Одной из основных задач по предупреждению развития острых кишечных инфекций у детей является санитарное просвещение населения.
Экспертами Всемирной Организации Здравоохранения для эффективного санитарного просвещения населения всей планеты по профилактике ОКИ были разработаны десять «золотых» правил для предотвращения пищевых инфекций.
1. Выбор безопасных пищевых продуктов. Многие продукты, такие как фрукты и овощи, потребляют в сыром виде, в то время как другие — рискованно кушать без предварительной обработки. Например, всегда покупайте пастеризованное, а не сырое молоко. Во время покупки продуктов имейте в виду, что цель их последующей обработки — сделать пищу безопасной и удлинить срок ее хранения. Определенные продукты, которые потребляются сырыми, требуют тщательной мойки.
Определенные продукты, которые потребляются сырыми, требуют тщательной мойки.
2. Тщательно приготавливайте пищу. Многие сырые продукты, главным образом, птица, мясо и сырое молоко, часто обсеменены патогенными микроорганизмами. В процессе варки (жарки) бактерии уничтожаются, но помните, что температура во всех частях пищевого продукта должна достигнуть 70° С. Замороженное мясо, рыба и птица должны тщательно оттаиваться перед кулинарной обработкой.
3. Ешьте приготовленную пищу без промедления. Когда приготовленная пища охлаждается до комнатной температуры, микробы в ней начинают размножаться. Чем дольше она остается в таком состоянии, тем больше риск получить пищевое отравление. Чтобы себя обезопасить, ешьте пищу сразу после приготовления.
4. Тщательно храните пищевые продукты. Если Вы приготовили пищу впрок или хотите после употребления сохранить оставшуюся ее часть, имейте в виду, что она должна храниться либо горячей (около или выше 60° С) либо холодной (около или ниже 10° С). Это исключительно важное правило, особенно если Вы намерены хранить пищу более 4-5 часов.
Это исключительно важное правило, особенно если Вы намерены хранить пищу более 4-5 часов.
Пищу для детей лучше вообще не подвергать хранению. Общая ошибка, приводящая к бесчисленным случаям пищевых отравлений — хранение в холодильнике большого количества теплой пищи. Эта пища в перегруженном холодильнике не может быстро полностью остыть. Когда в середине пищевого продукта слишком долго сохраняется тепло (температура свыше 10° С), микробы выживают и быстро размножаются до опасного для здоровья человека уровня.
5. Тщательно подогревайте приготовленную заранее пищу. Это наилучшая мера защиты от микроорганизмов, которые могли размножиться в пище в процессе хранения (правильное хранение угнетает рост микробов, но не уничтожает их). Еще раз, перед едой, тщательно прогрейте пищу, (температура в ее толще должна быть не менее 70° С).
6. Избегайте контакта между сырыми и готовыми пищевыми продуктами.
Правильно приготовленная пища может быть загрязнена путем соприкосновения с сырыми продуктами.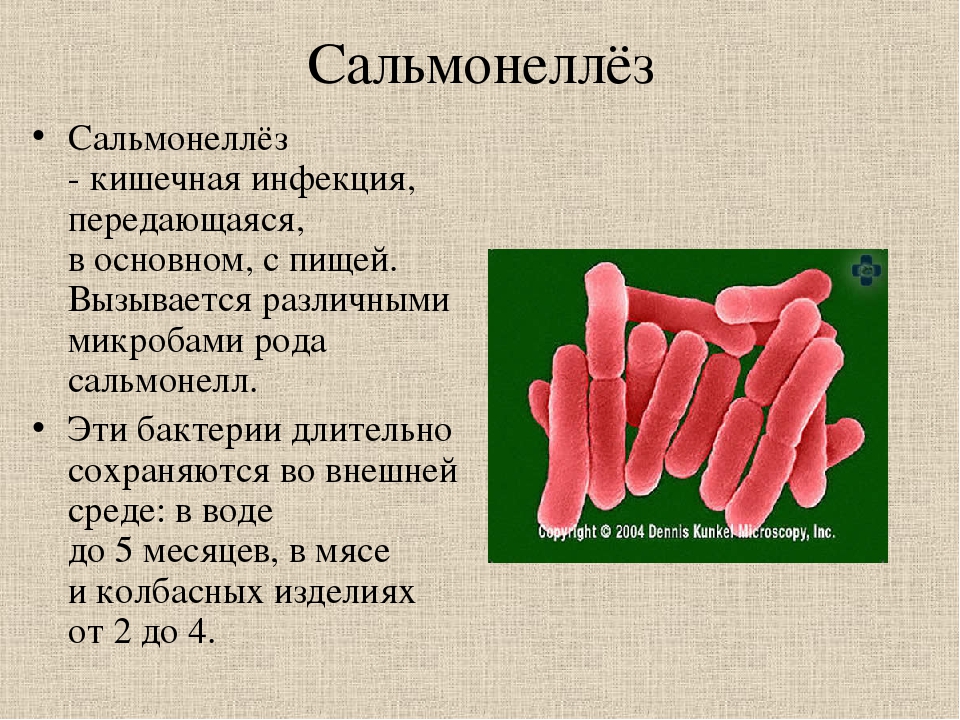 Это перекрестное загрязнение может быть явным, когда например, сырая птица соприкасается с готовой пищей, или может быть скрытым. Например, нельзя использовать одну и ту же разделочную доску и нож для приготовления сырой и вареной (жареной) птицы. Подобная практика может привести к потенциальному риску перезаражения продуктов и росту в них микроорганизмов с последующим отравлением человека.7. Часто мойте руки. Тщательно мойте руки перед приготовлением еды и после каждого перерыва в процессе готовки — особенно, если Вы перепеленали ребенка или были в туалете. После разделки сырых продуктов, таких как рыба, мясо или птица, опять вымойте руки, прежде чем приступить к обработке других продуктов. А если у Вас имеется инфицированная царапина (ранка) на руке, то обязательно перевяжите ее или наложите пластырь прежде, чем приступить к приготовлению пищи. Также помните, что домашние животные — собаки, птицы и особенно, черепахи — часто носители опасных микроорганизмов, которые могут попасть в пищу через Ваши руки.
Это перекрестное загрязнение может быть явным, когда например, сырая птица соприкасается с готовой пищей, или может быть скрытым. Например, нельзя использовать одну и ту же разделочную доску и нож для приготовления сырой и вареной (жареной) птицы. Подобная практика может привести к потенциальному риску перезаражения продуктов и росту в них микроорганизмов с последующим отравлением человека.7. Часто мойте руки. Тщательно мойте руки перед приготовлением еды и после каждого перерыва в процессе готовки — особенно, если Вы перепеленали ребенка или были в туалете. После разделки сырых продуктов, таких как рыба, мясо или птица, опять вымойте руки, прежде чем приступить к обработке других продуктов. А если у Вас имеется инфицированная царапина (ранка) на руке, то обязательно перевяжите ее или наложите пластырь прежде, чем приступить к приготовлению пищи. Также помните, что домашние животные — собаки, птицы и особенно, черепахи — часто носители опасных микроорганизмов, которые могут попасть в пищу через Ваши руки. 8. Содержите кухню в идеальной чистоте. Так как пища легко загрязняется, любая поверхность, используемая для ее приготовления, должна быть абсолютно чистой. Рассматривайте каждый пищевой обрезок, крошки или грязные пятна как потенциальный резервуар микробов. Полотенца для протирания посуды должны меняться каждый день. Тряпки для мытья полов также требуют частой стирки.9. Храните пищу защищенной от насекомых, грызунов и других животных. Животные часто являются переносчиками патогенных микроорганизмов, которые вызывают пищевые отравления. Для надежной защиты продуктов храните их в плотно закрывающихся банках (контейнерах).10. Используйте чистую воду. Чистая вода исключительно важна как для питья, так и для приготовления пищи. Если у Вас есть сомнения в отношении качества воды, то прокипятите ее перед добавлением к пищевым продуктам или перед использованием.
8. Содержите кухню в идеальной чистоте. Так как пища легко загрязняется, любая поверхность, используемая для ее приготовления, должна быть абсолютно чистой. Рассматривайте каждый пищевой обрезок, крошки или грязные пятна как потенциальный резервуар микробов. Полотенца для протирания посуды должны меняться каждый день. Тряпки для мытья полов также требуют частой стирки.9. Храните пищу защищенной от насекомых, грызунов и других животных. Животные часто являются переносчиками патогенных микроорганизмов, которые вызывают пищевые отравления. Для надежной защиты продуктов храните их в плотно закрывающихся банках (контейнерах).10. Используйте чистую воду. Чистая вода исключительно важна как для питья, так и для приготовления пищи. Если у Вас есть сомнения в отношении качества воды, то прокипятите ее перед добавлением к пищевым продуктам или перед использованием.
При возникновении симптомов острой кишечной инфекции (повышение температуры тела, рвота, расстройство стула, боль в животе) необходимо немедленно обратиться за медицинской помощью!
Советы врача: профилактика и лечение летних кишечных инфекций — Советы
Летом люди редко болеют гриппом и ОРВИ, однако именно в теплое время года активизируются кишечные инфекции, которые врачи называют болезнями грязных рук. Как отличить простое расстройство желудка от опасного заболевания и как не заразиться пищевыми инфекциями, корреспонденту «РИАМО в Королеве» рассказала врач-инфекционист поликлиники филиала «Юбилейный» Королевской городской больницы Роза Сивякова.
Как отличить простое расстройство желудка от опасного заболевания и как не заразиться пищевыми инфекциями, корреспонденту «РИАМО в Королеве» рассказала врач-инфекционист поликлиники филиала «Юбилейный» Королевской городской больницы Роза Сивякова.
Онколог из Королева: «Нужно доверять врачам, а не интернету»>>
Особенности летних инфекций
Врачи о диспансеризации: это возможность следить за своим здоровьем
По словам врача, летом активизируются кишечные инфекции, к которым относятся дизентерия, сальмонеллез, брюшной тиф, пищевые токсикоинфекции, а также гепатит А (желтуха), который не стоит путать с гепатитами В и С, которые передаются через кровь. Есть и другие инфекционные заболевания, которые легко подхватить летом.
«Все эти болезни передаются через грязные руки. Научно говоря, путь передачи этих инфекций фекально-оральный. Несоблюдение простых правил гигиены, таких как мытье рук после туалета, смена полотенец, плохо вымытые овощи и фрукты, может привести к быстрому распространению инфекции», – говорит Сивякова.
То, как человек перенесет болезнь, зависит от иммунитета и количества инфекции, попавшей в организм. Заболевание может протекать легко, средне и тяжело, но в любом случае нужно обратиться к врачу, чтобы получить правильное лечение и предотвратить распространение инфекции.
Врач роддома в Королеве про альтернативные роды и новое оборудование>>
Инфекция или отравление?
©
сайт GIPHY
Жители Королева о поликлиниках: «Лор работал раз в неделю, потом и вовсе исчез»
«Признаками кишечной инфекции являются повышение температуры тела, жидкий стул, боль в животе, вздутие, рвота, слабость, иногда появляется сыпь. Рвота может возникнуть и при простом пищевом расстройстве, но при нем не будет температуры, а после того, как организм избавится от нежелательной еды, человеку станет легче. При пищевом расстройстве достаточно выпить активированный уголь, и все пройдет. При кишечных заболеваниях избавиться от инфекции не так просто», – поясняет инфекционист.
При кишечной инфекции организм начинает активно с ней бороться, рвота и жидкий стул становятся постоянными спутниками заболевшего человека. Поэтому если они происходят многократно и не заканчиваются в течение суток, то стоит внимательно отнестись к своему состоянию и обязательно обратиться к врачу.
Кстати, холера и брюшной тиф относятся к особо опасным болезням, но при холере, например, может даже не быть температуры. Именно поэтому необходима консультация специалиста.
Глава династии врачей: «Домыслы и слухи мешают медикам и пациентам»>>
Опасность кишечных инфекций
По словам Сивяковой, рвота и жидкий стул, с одной стороны, защитная реакция организма, но с другой, человек теряет жидкость, а вместе с ней и полезные элементы, такие как калий и электролиты.
Опасность жиросжигателей: психотропные вещества, яды и нулевой эффект
«Организм борется с инфекцией. Сначала микробы попадают в желудок, где в кислой среде их часть погибает. Дальше они попадают в щелочную среду кишечника, и там начинается их воздействие – они вызывают воспаление оболочки и как следствие потерю жидкости. Это приводит к обезвоживанию и сгущению крови, что особенно опасно для детей, пожилых людей и людей с ослабленным иммунитетом», – предупреждает инфекционист.
Дальше они попадают в щелочную среду кишечника, и там начинается их воздействие – они вызывают воспаление оболочки и как следствие потерю жидкости. Это приводит к обезвоживанию и сгущению крови, что особенно опасно для детей, пожилых людей и людей с ослабленным иммунитетом», – предупреждает инфекционист.
При первых признаках кишечной инфекции нужно сразу обращаться к врачу. Лечение детей и пожилых людей нужно начинать как можно раньше, чтобы не допустить осложнений, которые могут привести к тяжелым последствиям и даже летальному исходу. Дело в том, что у детей обезвоживание происходит очень быстро, а инфекция у пожилого человека может привести к ухудшению течения хронических заболеваний.
Врач‑инфекционист: «Клещи ползут из травы, а не падают с деревьев»>>
Лечение
©
сайт администрации городского округа Подольск
«К врачу нужно обратиться в любом случае, потому что все инфекции, хоть и имеют примерно одинаковую клиническую картину, но лечатся по-разному. Например, при повышении температуры человек начинает бесконтрольно принимать антибиотики, а возбудителем инфекции стали не бактерии, а вирус, против которого антибиотики бессильны», – объясняет доктор.
Например, при повышении температуры человек начинает бесконтрольно принимать антибиотики, а возбудителем инфекции стали не бактерии, а вирус, против которого антибиотики бессильны», – объясняет доктор.
Как составить свой план диспансеризации
К тому же если заболевший человек благодаря сильному иммунитету легко перенесет болезнь, то его близкие, живущие вместе с ним, могут не справиться. Поэтому очень важно точно определить инфекцию и предупредить ее распространение. Чем быстрее выявить заболевание, тем проще с ним бороться.
«Лечатся инфекции по-разному. Есть вирусные инфекции: ротавирусная, энтеровирусная, вирус Коксаки, гепатит А. Есть бактериальные: сальмонеллез, дизентерия, брюшной тиф, холера. Есть паразитарные, например, амебная дизентерия, но заболеть ею можно только за границей. Врач может уже на осмотре сказать, какая именно инфекция у пациента и как ее лечить. Очень часто предварительный диагноз подтверждается», – подчеркивает доктор.
Если на приеме у врача подтверждается, что пациент заболел кишечной инфекцией, то собирается эпиданамнез.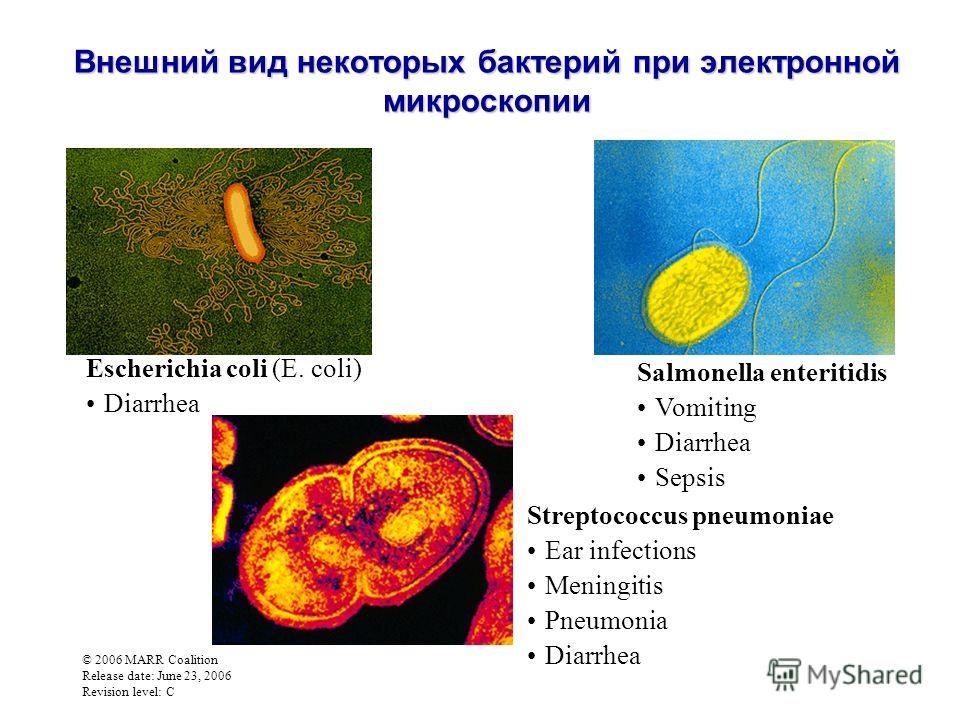 У заболевшего человека выясняют, кто с ним живет, где он работает. Если в сфере питания, в ресторане или кафе, то его изолируют. Дома нужно обязательно проводить дезинфекционные мероприятия, использовать моющие средства, чаще мыть руки, менять полотенца, следить за детьми, чтобы они тоже соблюдали все правила. При таком подходе распространение инфекции удается остановить.
У заболевшего человека выясняют, кто с ним живет, где он работает. Если в сфере питания, в ресторане или кафе, то его изолируют. Дома нужно обязательно проводить дезинфекционные мероприятия, использовать моющие средства, чаще мыть руки, менять полотенца, следить за детьми, чтобы они тоже соблюдали все правила. При таком подходе распространение инфекции удается остановить.
Зависимые от пластики: «Однажды легла под нож и теперь не могу остановиться»>>
Профилактика
Чтобы не заболеть, врач-инфекционист рекомендует тщательно мыть руки, особенно после посещения туалета. Также нужно как следует мыть фрукты и овощи, потому что неизвестно, кто и какими руками их трогал в магазине и на рынке. Нельзя есть лежалую и подпорченную пищу.
Что делать, если заболел или получил травму во время отдыха за границей
«Часто бывает, что люди едят подпорченные фрукты. Лучше этого не делать, если фрукты принесены с рынка или из магазина. Если очень хочется съесть, то нужно как следует прокипятить, чтобы избавиться от возможных бактерий и микробов. Летом вообще не стоит готовить впрок на 2-3 дня – лучше готовить на один раз и сразу съедать. Нельзя есть пищу, которая начала портиться. Опасны не столько бактерии, сколько токсины, которые они вырабатывают. Именно токсины, сразу попадая в кровь, вызывают повышение температуры, слабость и потливость, а потом уже бактерии попадают в кишечник и наносят второй удар», – отмечает врач.
Летом вообще не стоит готовить впрок на 2-3 дня – лучше готовить на один раз и сразу съедать. Нельзя есть пищу, которая начала портиться. Опасны не столько бактерии, сколько токсины, которые они вырабатывают. Именно токсины, сразу попадая в кровь, вызывают повышение температуры, слабость и потливость, а потом уже бактерии попадают в кишечник и наносят второй удар», – отмечает врач.
Во время поездок в страны, где есть риск подхватить холеру и брюшной тиф, нельзя мыть руки и фрукты в открытых источниках. Пить нужно только кипяченую или бутилированную воду. С собой в поездку всегда нужно брать адсорбирующие препараты, такие как активированный уголь, «Энтеросгель», «Смекта», чтобы оказать первую помощь.
Также перед поездкой в опасные в плане кишечных инфекций страны нужно пройти соответствующую вакцинацию. В поликлинике сделают прививку от гепатита А и брюшного тифа. Существуют прививки от дизентерии.
«Нельзя делать прививку за несколько дней до поездки. Оптимально пройти вакцинацию за три месяца до выезда, потому что может быть реакция организма – например, повысится температура. Прививка от гепатита А делается два раза с интервалом в полгода. Поэтому, планируя отпуск, нужно позаботиться и о своем здоровье», – заключает Сивякова.
Прививка от гепатита А делается два раза с интервалом в полгода. Поэтому, планируя отпуск, нужно позаботиться и о своем здоровье», – заключает Сивякова.
Кишечные инфекции и их профилактика
Из года в год в мире регистрируется все больше кишечных инфекций, некоторые их которых, порой, заканчиваются смертельным исходом. Наиболее распространены кишечные инфекции неустановленной этиологии, сальмонеллезная инфекция, бактериальная дизентерия, пищевые токсикоинфекции энтеробактериальной и стафилакокковой природы. Последние годы значительно возросла роль гастроэнтеритов вирусной этиологии, вызванных ротавирусами, норовирусами, энтеровирусами. Неблагополучие по острым кишечным инфекциям в Российской Федерации является отражением мировых тенденций.
Кишечные инфекции — это целая группа заразных заболеваний, которые в первую очередь повреждают пищеварительный тракт. Заражение происходит при попадании возбудителя инфекции через рот, как правило, при употреблении зараженных пищевых продуктов и воды, при вирусных инфекциях, кроме того, через мельчайшие капельки слюны и мокроты при кашле и чихании, через испражнения больного. При контактно-бытовом пути возбудитель может передаваться через загрязненные руки, предметы домашнего обихода (белье, полотенца, посуда, игрушки). Изо рта микробы попадают в желудок, а затем в кишечник, где начинают усиленно размножаться. После попадания микробов в организм наступает бессимптомный инкубационный период, продолжающийся, в большинстве случаев, 6-48часов.
При контактно-бытовом пути возбудитель может передаваться через загрязненные руки, предметы домашнего обихода (белье, полотенца, посуда, игрушки). Изо рта микробы попадают в желудок, а затем в кишечник, где начинают усиленно размножаться. После попадания микробов в организм наступает бессимптомный инкубационный период, продолжающийся, в большинстве случаев, 6-48часов.
Возбудители кишечных инфекций отличаются большой устойчивостью во внешней среде. Сальмонеллы выдерживают нагревание до 65 гр.С в течение 30 минут, сохраняют жизнеспособность в пыли до 80 дней, в почве живут несколько лет. Дизентерийные микробы сохраняются во внешней среде до 30-45 дней. Энтеровирусы выживают в водопроводной воде до 18 дней, норовирусы устойчивы к высыханию, замораживанию, нагреванию до 60гр. С и погибают только от хлорсодержащих дезинфицирующих средств.
Источником инфекции при дизентерии является только больной человек, при сальмонеллезе — больной человек и животные. Например, до 30% сальмонеллы обнаруживаются у овец, до 15% — у свиней, до 40% — у мышевидных грызунов, до 50% — у гусей и уток.
Как правило, кишечные инфекции начинаются остро. Отмечается повышенная температура тела, снижение аппетита, тошнота, рвота, жидкий стул, головная боль и пр. Серьезным последствием кишечной инфекции является обезвоживание организма, особенно тяжело протекающее у детей и у пожилых людей. Клиническая картина заболеваний различается в зависимости от вида кишечной инфекции.
Иногда кишечные инфекции не имеют видимых симптомов, но сопровождаются выделением возбудителей. В плане распространения инфекции такое носительство особенно опасно — ничего не подозревающий человек становится постоянным источником заражения окружающих.Среди людей все чаще выявляются здоровые бактерионосители сальмонелл, здоровые вирусоносители ротавирусной и энтеровирусной инфекции. Взрослый человек может не заметить, что он носитель ротавирусной инфекции, болезнь, как правило, протекает со стертыми симптомами (снижение аппетита, кратковременное повышение температуры), но в этот период человек является заразным! Люди, инфицированные норовирусом, способны заразить окружающих во время разгара заболевания и в течение последующих 2-х суток, а иногда в течение 2-х недель после начала заболевания.
Как уберечься от кишечной инфекции?
Соблюдать питьевой режим
- Использовать для питьевых целей только кипяченую или бутилированную воду.
Соблюдать правила личной гигиены
- Тщательно и часто мыть руки с мылом, особенно после посещения туалета, перед едой, после возвращения с улицы.
- Избавиться от вредной привычки грызть ногти
Соблюдать правила приготовления пищи
- Осуществлять приготовление пищи в оптимальных гигиенических условиях: приготовление пищи должно обеспечивать ее безопасность.
- Соблюдать технологию приготовления блюд, практиковать тушение, запекание и другие способы термической обработки.
- Соблюдать правила кулинарной обработки продуктов
— пользоваться разными досками и ножами для разделки мяса, рыбы, овощей.
- Подвергать фрукты качественной обработке горячей водой, ополаскивая их кипяченой водой.
- Свежие овощи использовать в блюдах после термической обработки.

- Использовать в питании только свежеприготовленную пищу.
Соблюдать правила хранения продуктов
- Cкоропортящиеся продукты — молочные, мясные, рыбные, кондитерские, овощные и приготовленные блюда хранить в холодильнике при температуре (+2) – (+ 6) гр.С.
- Соблюдать условия хранения продуктов и сроки их годности.
- Хранить раздельно сырые и готовые продукты, мясные и молочные продукты.
Соблюдать санитарный режим на кухне
- Регулярно проводить уборку на кухне с применением моющих и дезинфицирующих средств.
- Не допускать контакт пищевых продуктов и готовой пищи с животными, насекомыми, грызунами.
Обращать внимание при покупке продуктов
- на внешний вид продуктов, их запах, упаковку и информацию на этикетке;
- на дату изготовления продуктов – не приобретать и не использовать в питании продукты с истекшим сроком годности;
- приобретать продукты исключительно в местах санкционированной торговли;
- исключить приобретение продуктов сомнительного качества, продуктов с признаками недоброкачественности.

Соблюдать правила поведения на воде
- Купаясь в водоеме, не заглатывать воду.
В настоящее время используются средства специфической защиты населения от кишечных инфекций в виде вакцинации: дизентерийной вакциной против Шигелл Зоне, вакциной для профилактики гепатита А, профилактической вакциной против вируса гепатита В.
Следите за своим здоровьем!
Обращение в лечебно-профилактическое учреждение при любом расстройстве желудочно-кишечного тракта, поможет своевременное поставить диагноз, назначить соответствующее лечение и предупредить распространение инфекции.
Кишечные инфекции
Кишечные инфекции кошек и собак подразделяют на заразные и незаразные заболевания.
К заразным относятся заболевания, вызванные инфекционными агентами (вирусы, бактерии, грибки). Наиболее распространенные вирусные заболевания кошек и собак, такие как бешенство, болезнь Ауески, панлейкопения кошек, кошачий иммунодефицит, калицивирусная инфекция у кошек, вирусный перитонит кошек (FIP), коронавирусные и парвовирусные энтериты собак, лямблиоз собак и кошек, герпетическая и другие инфекции.
Вирусы вызывают тяжелые изменения в организме, нередко приводящие к смертельному исходу. Источником вирусов являются не только больные животные, но и животные-вирусоносители, выделяющие инфект с калом, мочой, истечениями из глаз, носа, содержимым гнойничков и т.д.
Передача вирусов происходит как при непосредственном контакте с больным животным и/или вирусоносителем, так и через воздух при совместном содержании больных и здоровых животных, через подстилки, клетки, посуду и т.д. Распространению вируса способствуют такие факторы, как скученное содержание животных (особенно на выставках), несоблюдение элементарных гигиенических мероприятий, склонность кошек и собак к бродяжничеству, а также стрессовые факторы (длительная транспортировка, неправильное питание, переохлаждение).
При подозрении на вирусные инфекции кошек и собак выявляют следующие симптомы (симптомы могут быть в комплексе, но могут быть и по отдельности), первое – это повышение температуры, рвота, понос, отказ от еды, угнетенное состояние; необходимо незамедлительно обратиться в ветеринарную клинику к врачу, для обследования, постановки диагноза и назначения лечения.
Лечение вирусных заболеваний весьма трудоемко.
Терапия вирусных заболеваний должна быть направлена на восстановление защитных барьеров слизистых оболочек, борьбу с вирусами, коррекцию иммунитета (стимуляция естественной резистентности, защита от вторичных инфекций), ликвидацию или ослабление проявлений заболевания (симптоматическая терапия), а также на замещение нарушенных физиологических функций организма (заместительная терапия).
Кроме того, при вирусных заболеваниях важна правильная диета, сбалансированное содержание витаминов, макро- и микроэлементов. Это не только важный компонент терапии, но и способ освобождения организма от накопившихся во время болезни шлаков и токсинов, что особенно важно после периода анорексии или голодной диеты.
К незаразным заболеваниям кишечника относятся, те болезни, которые вызваны возрастными и/или функциональными нарушениями в системах различных органов, нарушении в питании, несбалансированные рационы или однотипное питание, отравление лекарственными средствами, бытовыми химикатами, комнатными растениями./GettyImages-117451692-56a503b05f9b58b7d0da8ee3.jpg)
Первые симптомы заболевания могут быть схожи с симптомами вирусных инфекций, поэтому для дифференциации и постановки диагноза большинство врачей применяют экспресс-тесты на наличие вирусных инфекций. Они основаны на принципе иммунохромотографии.
Принцип действия теста состоит в том, что при погружении тест полоски в биологическую жидкость (или другой жидкий образец), она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии.
Вместе с ней движутся нанесенные на нижнюю часть тест-полоски меченые специфические антитела, которые, связываются с анализируемым веществом. Такие тесты дают 98% точности.
При первых проявлениях заболевании рекомендуется незамедлительно обратиться на прием, ведь при длительном течении болезни (2-4дня) для многих животных наступают необратимые процессы в организме, которые могут привести к летальному исходу.
Дорогие владельцы будьте бдительны и внимательны к своим питомцам.
Бактериальные инфекции пищеварительной системы — симптомы, причины, лечение
Бактериальные инфекции органов пищеварения — это болезни, поражающие органы пищеварения в результате попадания в организм инфекционных бактериальных организмов. Инфекционные бактерии, известные как
Инфекционные бактерии, известные как
кишечная палочка (
E coli )
, сальмонелла и
Shigella — одна из наиболее частых причин бактериальных инфекций пищеварительного тракта. Каждая из этих инфекций вызывает тошноту с рвотой или без нее, диарею и другие желудочно-кишечные симптомы.Они также могут вызывать кровавый понос, известный как дизентерия.
Бактериальные инфекции пищеварительного тракта — распространенное заболевание пищевого происхождения в Соединенных Штатах, которое распространяется среди людей через зараженную пищу и воду. Чаще всего люди заражаются инфицированными бактериями в результате употребления неочищенной загрязненной воды или употребления в пищу сырых, зараженных продуктов или недоваренного мяса, птицы или яиц. Как только человек инфицирован, бактерии живут в кишечнике и передаются со стулом инфицированного человека.Животные и насекомые также могут быть инфицированы и распространять болезнь среди людей.
Признаки и симптомы бактериальных инфекций пищеварительного тракта могут длиться от пяти до семи дней или дольше. Течение болезни у разных людей разное. У некоторых людей, инфицированных бактериальными инфекциями пищеварительного тракта, симптомы легкие, у других может быть тяжелая диарея с рвотой или без нее, что может представлять риск обезвоживания. К счастью, бактериальную инфекцию можно успешно вылечить с помощью антибиотиков, жидкости и нутритивной поддержки.
Течение болезни у разных людей разное. У некоторых людей, инфицированных бактериальными инфекциями пищеварительного тракта, симптомы легкие, у других может быть тяжелая диарея с рвотой или без нее, что может представлять риск обезвоживания. К счастью, бактериальную инфекцию можно успешно вылечить с помощью антибиотиков, жидкости и нутритивной поддержки.
При отсутствии лечения бактериальные инфекции пищеварительного тракта могут привести к серьезному обезвоживанию. Сильное обезвоживание и дисбаланс электролитов могут привести к шоку или коме и могут быть опасны для жизни.
Немедленно обратитесь за медицинской помощью (позвоните 911). , если у вас или у кого-то из ваших близких наблюдаются симптомы сильного обезвоживания, такие как спутанность сознания, летаргия, потеря сознания, холодная кожа или снижение выработки мочи.
Немедленно обратитесь за медицинской помощью. Если у вас развилась диарея и рвота, и вы считаете, что могли подвергнуться воздействию зараженной пищи или воды.
Бактериальная инфекция H. pylori: симптомы, диагностика, лечение, профилактика
Helicobacter pylori ( H. pylori ) — это тип бактерий. Эти микробы могут проникнуть в ваше тело и жить в пищеварительном тракте. Через много лет они могут вызвать язвы, называемые язвами, на слизистой оболочке желудка или в верхней части тонкой кишки. У некоторых людей инфекция может привести к раку желудка.
Заражение H. pylori является обычным явлением.Около двух третей населения мира находится в организме. У большинства людей он не вызывает язвы или каких-либо других симптомов. Если у вас есть проблемы, существуют лекарства, которые могут убить микробы и помочь заживлению ран.
По мере того, как все больше людей в мире получает доступ к чистой воде и санитарии, все меньше людей заражаются бактериями . Имея хорошие привычки в отношении здоровья, вы можете защитить себя и своих детей от H. pylori .
Как H. pylori вызывает заболевание
На протяжении десятилетий врачи считали, что язвы у людей возникают в результате стресса, острой пищи, курения или других привычек образа жизни. Но когда в 1982 году ученые обнаружили H. pylori , они обнаружили, что микробы являются причиной большинства язв желудка .
Но когда в 1982 году ученые обнаружили H. pylori , они обнаружили, что микробы являются причиной большинства язв желудка .
Продолжение
После того, как H. pylori попадает в ваше тело, он атакует слизистую оболочку желудка, которая обычно защищает вас от кислоты, которую ваше тело использует для переваривания пищи. Как только бактерии нанесут достаточно вреда, кислота может проникнуть через слизистую оболочку, что приведет к язвам. Они могут кровоточить, вызывать инфекции или препятствовать прохождению пищи через пищеварительный тракт.
Вы можете получить H. pylori из еды, воды или посуды. Это чаще встречается в странах или сообществах, где отсутствует чистая вода или хорошая канализация. Вы также можете заразить бактерии при контакте со слюной или другими биологическими жидкостями инфицированных людей.
Многие люди заражаются H. pylori в детстве, но могут заразиться и взрослые. Микробы живут в организме годами до появления симптомов, но у большинства людей язвы никогда не появятся. Врачи не знают, почему только у некоторых людей появляются язвы после инфекции.
Врачи не знают, почему только у некоторых людей появляются язвы после инфекции.
Симптомы
Если у вас язва, вы можете почувствовать тупую или жгучую боль в животе. Это может приходить и уходить, но вы, вероятно, почувствуете это больше всего, когда у вас пустой желудок, например, между приемами пищи или посреди ночи. Это может длиться от нескольких минут до нескольких часов. Вы можете почувствовать себя лучше после еды, питья молока или приема антацидов.
Продолжение
К другим признакам язвы относятся:
Язвы могут кровоточить в желудок или кишечник, что может быть опасно для вашего здоровья.Немедленно обратитесь за медицинской помощью, если у вас есть какие-либо из этих симптомов:
Это нечасто, но инфекция H. pylori может вызвать рак желудка. Поначалу болезнь имеет несколько симптомов, например изжогу. Со временем вы можете заметить:
- Боль или опухоль в животе
- Тошнота
- Отсутствие чувства голода
- Чувство сытости после небольшого количества еды
- Рвота
- Беспричинная потеря веса
Диагноз
Если у вас нет симптомов язвы, врач, вероятно, не проверит вас на H. pylori . Но если они у вас есть сейчас или были в прошлом, лучше пройти обследование. Лекарства, такие как нестероидные противовоспалительные препараты (НПВП), также могут повредить слизистую оболочку желудка, поэтому важно выяснить, что вызывает ваши симптомы, чтобы вы могли получить правильное лечение.
pylori . Но если они у вас есть сейчас или были в прошлом, лучше пройти обследование. Лекарства, такие как нестероидные противовоспалительные препараты (НПВП), также могут повредить слизистую оболочку желудка, поэтому важно выяснить, что вызывает ваши симптомы, чтобы вы могли получить правильное лечение.
Продолжение
Для начала ваш врач спросит вас о вашей истории болезни, симптомах и лекарствах, которые вы принимаете. Затем вам проведут медицинский осмотр, в том числе надавят на живот, чтобы проверить, нет ли отека, болезненности или боли.Вы также можете иметь:
- Анализы крови и стула, , которые могут помочь найти инфекцию.
- Дыхательный тест на мочевину. Вы выпьете особую жидкость, которая содержит вещество, называемое мочевиной. Затем вы вдохнете в сумку, которую врач отправит в лабораторию для тестирования. Если у вас H. pylori , бактерии превратят мочевину в вашем организме в углекислый газ, а лабораторные тесты покажут, что в вашем дыхании уровень газа выше нормы.

Чтобы более внимательно изучить ваши язвы, ваш врач может использовать:
- Эндоскопия верхних отделов желудочно-кишечного тракта. В больнице врач с помощью трубки с маленькой камерой, называемой эндоскопом, будет смотреть вниз по горлу, в желудок и верхнюю часть тонкой кишки. Эту процедуру также можно использовать для сбора образца, который будет исследован на наличие бактерий. Вы можете спать или бодрствовать во время процедуры, но вы получите лекарство, чтобы вам было комфортнее.
- Тесты верхнего GI . В больнице вы выпьете жидкость, содержащую вещество, называемое барием, и ваш врач сделает вам рентгеновский снимок.Жидкость покрывает ваше горло и желудок, выделяя их на изображении.
- Компьютерная томография (КТ). Это мощный рентгеновский снимок, который делает подробные снимки внутренней части вашего тела.
Если у вас H. pylori , ваш врач может также проверить вас на рак желудка. Сюда входят:
- Физический осмотр
- Анализы крови для проверки на анемию, когда в вашем организме недостаточно эритроцитов.
 Это может произойти, если у вас кровоточащая опухоль.
Это может произойти, если у вас кровоточащая опухоль. - Анализ кала на скрытую кровь, который проверяет ваш стул на наличие крови, невидимой невооруженным глазом.
- Эндоскопия.
- Биопсия, когда врач берет небольшой кусочек ткани вашего желудка, чтобы найти признаки рака. Ваш врач может сделать это во время эндоскопии.
- Тесты, которые делают подробные снимки внутренних органов вашего тела, такие как компьютерная томография или магнитно-резонансная томография (МРТ)
Лечение H. pylori
Если у вас есть язвы, вызванные H.pylori , вам понадобится лечение, чтобы убить микробы, вылечить слизистую оболочку желудка и предотвратить повторное появление язв . Обычно для выздоровления требуется 1-2 недели лечения.
Ваш врач, вероятно, посоветует вам принимать несколько различных типов лекарств. Возможные варианты:
- Антибиотики для уничтожения бактерий в организме, такие как амоксициллин, кларитромицин (биаксин), метронидазол (флагил), тетрациклин (сумицин) или тинидазол (тиндамакс).
 Скорее всего, вы возьмете как минимум двоих из этой группы.
Скорее всего, вы возьмете как минимум двоих из этой группы. - Лекарства, которые уменьшают количество кислоты в желудке, блокируя крошечные насосы, которые ее производят. Они включают декслансопразол (Dexilant), эзомепразол (Nexium), лансопразол (Prevacid), омепразол (Prilosec), пантопразол (Protonix) или рабепразол (Aciphex).
- Субсалицилат висмута, который также может помочь убить H. pylori вместе с вашими антибиотиками.
- Лекарства, блокирующие химический гистамин, который заставляет ваш желудок вырабатывать больше кислоты. Это циметидин (Тагамет), фамотидин (Флюксид, Пепцид), низатидин (Аксид) или ранитидин (Зантак).
Ваше лечение может означать, что вы будете принимать 14 или более таблеток в день в течение нескольких недель, что кажется большим количеством лекарства. Но действительно важно принимать все, что прописывает врач, и следовать его инструкциям. Если вы не принимаете антибиотики правильно, бактерии в вашем организме могут стать к ним устойчивыми, что затрудняет лечение инфекций. Если ваши лекарства беспокоят вас, поговорите со своим врачом о вариантах лечения и о том, как вы можете справиться с побочными эффектами.
Если ваши лекарства беспокоят вас, поговорите со своим врачом о вариантах лечения и о том, как вы можете справиться с побочными эффектами.
Примерно через 1-2 недели после окончания лечения врач может снова проверить ваше дыхание или стул, чтобы убедиться, что инфекция исчезла.
Профилактика
Вы можете защитить себя от заражения H. pylori , выполнив те же действия, что и другие микробы:
- Мойте руки после посещения туалета и перед приготовлением или приемом пищи. Учите детей делать то же самое.
- Избегайте нечистой пищи и воды.
- Не ешьте плохо приготовленные продукты.
- Избегайте еды, которую подают люди, которые не мыли руки.
Хотя стресс и острая пища не вызывают язв, они могут помешать их быстрому заживлению или усугубить боль.Поговорите со своим врачом о том, как справиться со стрессом, улучшить диету и, если вы курите, как вам помочь бросить курить.
Чего мне ожидать после инфекции H.
 pylori?
pylori?
Большинство язв, вызванных H. pylori , заживают через несколько недель лечения. Если вы принимали один, вам следует избегать приема НПВП от боли, поскольку эти препараты могут повредить слизистую оболочку желудка. Если вам нужно обезболивающее, попросите врача порекомендовать его.
Где я могу найти информацию или поддержку?
Вы можете найти информацию о H.pylori и язвы от Американского колледжа гастроэнтерологии. Чтобы получить информацию о раке желудка, а также о группах поддержки в Интернете и на местном уровне, посетите Американское онкологическое общество.
Бактериальный гастроэнтерит Лекарства: антибиотики
Guandalini S, Pensabene L, Zikri MA, et al. Lactobacillus GG, вводимый в растворе для пероральной регидратации детям с острой диареей: многоцентровое европейское исследование. J Педиатр Гастроэнтерол Нутр . 2000 30 января (1): 54-60.[Медлайн].
Дугган С., Нурко С. «Питание кишечника»: научная основа непрерывного энтерального питания при острой диарее. J Педиатр .1997 декабрь 131 (6): 801-8. [Медлайн].
Salminen S, Isolauri E, Onnela T. Флора кишечника в нормальном и неупорядоченном состоянии. Химиотерапия . 1995. 41 прил. 1: 5-15. [Медлайн].
Марки MI. Инфекционная диарея: введение и комментарий. Педиатр Энн . 1994 23 октября (10): 526-7. [Медлайн].
Хамер Д.Х., Горбач С.Л. Инфекционная диарея и бактериальное пищевое отравление. Feldman M, Scharschmidt BF, Sleisenger MH, ред. Болезнь желудочно-кишечного тракта и печени Слайзингера и Фордтрана . 6-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1998. 1594-1632.
Xu F, Gonzalez-Escalona N, Haendiges J, et al. Vibrio parahaemolyticus типа 631, новый патоген пищевого происхождения в Северной Америке. Дж. Клин Микробиол . 2016 14 декабря. [Medline].
Cadle RM, Mansouri MD, Logan N, Kudva DR, Musher DM. Связь ингибиторов протонной помпы с исходами колита Clostridium difficile. Am J Health Syst Pharm . 2007 15 ноября. 64 (22): 2359-63. [Медлайн].
64 (22): 2359-63. [Медлайн].
Wei L, Ratnayake L, Phillips G, et al. Лекарства для подавления кислоты и бактериальный гастроэнтерит: популяционное когортное исследование. Br J Clin Pharmacol .2017 5 января. 27 (1): 40-51. [Медлайн].
Штеффен Р., Коллард Ф., Торнипорт Н. и др. Эпидемиология, этиология и влияние диареи путешественников на Ямайке. ЯМА . 1999, 3 марта. 281 (9): 811-7. [Медлайн]. [Полный текст].
Streit JM, Jones RN, Toleman MA, Stratchounski LS, Fritsche TR. Распространенность и чувствительность к противомикробным препаратам среди возбудителей гастроэнтерита, выявленных в Европе и Латинской Америке, и изолятов сальмонелл, выделенных после инфекций кровотока в Северной Америке и Латинской Америке: отчет программы SENTRY Antimicrobial Surveillance Programme (2003). Int J Антимикробные агенты . 2006 май. 27 (5): 367-75. [Медлайн].
2006 май. 27 (5): 367-75. [Медлайн].
Показатели жизненно важных функций: предотвращение инфекций, вызванных Clostridium difficile. MMWR Morb Mortal Wkly Rep . 2012 9 марта. 61: 157-62. [Медлайн].
Всемирная организация здравоохранения. Холера: информационный бюллетень № 107. Ноябрь 2008 г. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs107/en/. Доступ: 19 февраля 2009 г.
May FJ, Polkinghorne BG, Fearnley EJ.Эпидемиология вспышек пищевого гастроэнтерита, опосредованного бактериальным токсином, в Австралии, 2001–2013 гг. Commun Dis Intell Q Rep . 2016 24 декабря. 40 (4): E460-E469. [Медлайн].
Ли Л.А., Гербер А.Р., Лонсуэй Д.Р. и др. Yersinia enterocolitica O: 3 инфекции у младенцев и детей, связанные с домашним приготовлением детенышей. N Engl J Med . 1990, апрель 5. 322 (14): 984-7. [Медлайн].
N Engl J Med . 1990, апрель 5. 322 (14): 984-7. [Медлайн].
Центры по контролю и профилактике заболеваний.Yersinia enterocolitica. 25 октября 2005 г. Доступно по адресу http://www.cdc.gov/ncidod/dbmd/diseaseinfo/yersinia_g.htm. Доступ: 18 февраля 2009 г.
Центры по контролю и профилактике заболеваний (CDC). Смертность от гастроэнтерита увеличилась вдвое. Доступно по адресу http://www.cdc.gov/media/releases/2012/p0314_gastroenteritis.html.
Гарсия Родригес Л.А., Руигомес А., Панес Дж. Острый гастроэнтерит сопровождается повышенным риском воспалительного заболевания кишечника. Гастроэнтерология . 2006 май. 130 (6): 1588-94. [Медлайн].
Calbo E, Freixas N, Xercavins M, et al. Нозокомиальная вспышка пищевого происхождения Klebsiella pneumoniae, продуцирующая SHV1 и CTX-M-15: эпидемиология и меры борьбы. Clin Infect Dis . 2011 Март 52 (6): 743-9. [Медлайн].
Clin Infect Dis . 2011 Март 52 (6): 743-9. [Медлайн].
Бисвас Дж. С., Аль-Али А., Раджпут П., Смит Д., Гольденберг С. Д.. Параллельное исследование диагностической точности трех молекулярных панелей для выявления бактериального гастроэнтерита. Eur J Clin Microbiol Infect Dis . 2014 ноябрь 33 (11): 2075-81. [Медлайн].
Хамфрис RM, Линскотт AJ. Лабораторная диагностика бактериального гастроэнтерита. Clin Microbiol Ред. . 2015 28 января (1): 3-31. [Медлайн].
Cody SH, Abbott SL, Marfin AA, et al. Две вспышки инфекции Salmonella serotype typhimurium DT104 с множественной лекарственной устойчивостью, связанной с сыром из сырого молока, в Северной Калифорнии. ЯМА . 1999 19 мая.281 (19): 1805-10. [Медлайн]. [Полный текст].
Guandalini S, Dincer AP. Управление питанием при диарейных заболеваниях. Baillieres Clin Гастроэнтерол . 1998 12 декабря (4): 697-717. [Медлайн].
Салливан ПБ.Питание при острой диарее. Питание . 1998, 14 октября (10): 758-62. [Медлайн].
Ruiz-Palacios GM, Perez-Schael I, Velazquez FR, et al., Для группы исследования вакцины против ротавируса человека. Безопасность и эффективность аттенуированной вакцины против тяжелого ротавирусного гастроэнтерита. N Engl J Med . 2006, 5 января. 354 (1): 11-22. [Медлайн]. [Полный текст].
DuPont HL, Комитет параметров практики Американского колледжа гастроэнтерологии. Рекомендации по острой инфекционной диарее у взрослых. Ам Дж. Гастроэнтерол . 1997 ноябрь 92 (11): 1962-75. [Медлайн].
Гарсия Родригес Л.А., Руигомес А., Панес Дж. Использование препаратов, подавляющих кислотность, и риск бактериального гастроэнтерита. Клин Гастроэнтерол Гепатол . 2007 декабрь 5 (12): 1418-23. [Медлайн].
Gibreel A, Taylor DE. Устойчивость к макролидам у Campylobacter jejuni и Campylobacter coli. J Антимикробный Chemother . 2006 августа 58 (2): 243-55. [Медлайн]. [Полный текст].
Kaur S, Vaishnavi C, Prasad KK, Ray P, Kochhar R. Сравнительная роль антибиотика и ингибитора протонной помпы в экспериментальной инфекции Clostridium difficile у мышей. Микробиол Иммунол .2007. 51 (12): 1209-14. [Медлайн]. [Полный текст].
Mines D, Stahmer S, Shepherd SM. Отравления: пища, рыба, моллюски. Emerg Med Clin North Am . 1997 15 февраля (1): 157-77. [Медлайн].
Натаро Дж. П., Штайнер Т., Геррант Р.Л. Энтероагрегантная кишечная палочка. Emerg Infect Dis . 1998 апр-июн. 4 (2): 251-61. [Медлайн].
Патерсон DL. Устойчивость к грамотрицательным бактериям: Enterobacteriaceae. Am J Med . 2006 июн. 119 (6 приложение 1): S20-8; обсуждение С62-70. [Медлайн].
Трахтман Х., Кристен Э. Патогенез, лечение и терапевтические испытания при гемолитико-уремическом синдроме. Curr Opin Pediatr . 1999 г., 11 (2): 162-8.[Медлайн].
Wong CS, Jelacic S, Habeeb RL, Watkins SL, Tarr PI. Риск гемолитико-уремического синдрома после лечения антибиотиками инфекций, вызванных Escherichia coli O157: H7. N Engl J Med . 2000, 29 июня. 342 (26): 1930-6. [Медлайн]. [Полный текст].
Campylobacter (кампилобактериоз). Центры по контролю и профилактике заболеваний (CDC). Доступно по адресу https://www.cdc.gov/campylobacter/technical.html. Доступ: 15 февраля 2018 г.
Cuypers WL, Jacobs J, Wong V, Klemm EJ, Deborggraeve S, Van Puyvelde S. Устойчивость к фторхинолонам у сальмонелл: выводы с помощью полногеномного секвенирования. Микроб Геном . 2018 5 июля. [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA обновляет предупреждения для фторхинолоновых антибиотиков о рисках для психического здоровья и побочных реакциях на низкий уровень сахара в крови. Доступно на https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm612995.htm. 10 июля 2018 г .; Доступ: 18 июля 2018 г.
Frellick M. FDA: Более строгие предупреждения о фторхинолонах для психического здоровья и гипогликемии. Доступно на https://www.medscape.com/viewarticle/899142. 10 июля 2018 г .; Доступ: 18 июля 2018 г.
Кальдераро А., Мартинелли М., Буттрини М. и др. Вклад панели FilmArray (R) Gastrointestinal Panel в лабораторную диагностику гастроэнтерита в когорте детей: двухлетнее проспективное исследование. Int J Med Microbiol . 2018 июл.308 (5): 514-21. [Медлайн].
Гольденберг Дж. З., Яп С., Литвин Л. и др. Пробиотики для профилактики диареи, связанной с Clostridium difficile, у взрослых и детей. Кокрановская база данных Syst Rev . 2017 19 декабря. 12: CD006095. [Медлайн].
[Рекомендации] Беренджер Б., Чуй Л., Реймер А.Р. и др. Для Канадской сети лабораторий общественного здравоохранения. Заявление о позиции Канадской сети лабораторий общественного здравоохранения: Диагностика гастроэнтерита, не основанная на культуре, и значение для исследований в области общественного здравоохранения. Can Commun Dis Rep . 2017 декабрь 7. 43 (12): 279-81. [Медлайн].
Lee H, Ku HJ, Lee DH и др. Характеристика и геномное исследование нового бактериофага HY01, инфицирующего Escherichia coli O157: H7 и Shigella flexneri: потенциал в качестве агента биоконтроля в пище. PLoS One . 2016. 11 (12): e0168985. [Медлайн].
Пробиотики и желудочно-кишечные инфекции
Желудочно-кишечные инфекции являются основной причиной заболеваемости и смертности
во всем мире, особенно в развивающихся странах. Использование пробиотиков для предотвращения и
лечить различные диарейные заболевания приобрело популярность в последние годы. Примеры, где
пробиотики положительно повлияли на гастроэнтерит.Однако в целом
эффективность этих методов лечения и механизмы, с помощью которых пробиотики улучшают состояние желудочно-кишечного тракта.
инфекции в основном неизвестны. Мы обсудим возможные механизмы, с помощью которых пробиотики могут
благотворное влияние за счет усиления профилактики или
лечение диарейных заболеваний.
1. Введение
Внутри микробиоты индивидуальные
бактерии, содержащие важные гены, могут принести пользу хозяину по-разному.В качестве
можно рассматривать огромное сообщество комменсальных микробов, подмножества этих
организмы могут иметь важные физиологические преимущества для хозяина в контексте
питания человека и хозяина: взаимодействия микробов. Пробиотики могут стимулировать
иммунитет, регулируют иммунные сигнальные пути, продуцируют антипатогенные факторы,
или побудить хозяина продуцировать антипатогенные факторы. Пробиотики могут производить
секретируемые факторы, которые стимулируют или подавляют цитокины и клеточно-опосредованные
иммунитет.Эти факторы также могут влиять на ключевые иммунные сигнальные пути.
такие как каскады киназ и MAP. Пробиотики могут производить факторы, которые
подавляют патогены и другие комменсальные бактерии, эффективно позволяя им
микробы, чтобы эффективно конкурировать за питательные вещества в сложных сообществах. Микробы
продуцирующие антипатогенные факторы могут представлять собой источники новых классов
противомикробные соединения, и эти факторы могут регулироваться мастером
регуляторные гены в определенных классах бактерий. Микробы также могут регулировать
Микробы также могут регулировать
сигнальные пути в иммунных клетках, которые приводят к выработке
антимикробные факторы клетками млекопитающих, эффективно приводящие к ремоделированию
кишечных сообществ и профилактика или лечение инфекций.
Желудочно-кишечный тракт
инфекции являются основной причиной заболеваемости и смертности во всем мире. Исследования
проведенное в 2006 г., показало, что во всем мире тяжелая диарея и обезвоживание
несут ответственность каждый год за смерть 1575000 детей в возрасте до
пять.Это составляет 15% из 10,5 миллионов смертей детей в год в
эта возрастная группа [1]. Согласно недавним
по оценкам, острый гастроэнтерит вызывает до 770 000 госпитализаций на
год в США [2]. Кишечные патогены включают:
вирусы (ротавирусы, норовирусы) и бактерии, такие как различные штаммы
патогенный Escherichia coli ,
toxigenic Clostridium difficile , Campylobacter jejuni и Vibrio cholerae .Эти
патогены производят различные типы токсинов, которые могут вызывать тяжелые или
опасное для жизни обезвоживание и диарея. Несмотря на медицинские достижения в
Несмотря на медицинские достижения в
диагностика и лечение, процент и количество госпитализированных педиатрических
пациенты младше 5 лет с тяжелой ротавирусной инфекцией значительно
увеличилась, если сравнивать недавний период времени (2001–2003 гг.) с более ранним
период времени (1993–1995) [3]. Помимо типичного
картина острого гастроэнтерита, инфекционные агенты, такие как энтеропатогенные E.coli (EPEC) может вызывать стойкие,
хроническая диарея у детей продолжительностью более 1 недели [4]. Такие стойкие инфекции могут увеличить риск обезвоживания.
и длительные заболевания. Важно отметить, что относительный вклад EPEC и
другие бактериальные возбудители болезней остаются в некоторой степени спорными. Недавний
исследование показало, что повышенный относительный риск желудочно-кишечных заболеваний у
детей можно было продемонстрировать только на кишечные вирусы [5].
Недавние исследования выявили
хронические заболевания, связанные с гастроэнтеритом.Понос в раннем детстве
предрасполагает детей к длительным нарушениям здоровья, включая нарушение физической формы,
задержка роста, нарушение познавательной способности и успеваемости [6].
Наряду с этими данными, новое исследование недоедания матери и ребенка
сообщается в The Lancet в январе
2008 г. связывает плохое питание с повышенным риском кишечных инфекций в
дети. Кроме того, синдром раздраженного кишечника (СРК), дорогостоящий и сложный
для лечения состояния, которым страдает 20% населения США [7], требует медицинских затрат до
30 миллиардов долларов в год, не считая затрат на лекарства, отпускаемые по рецепту и без рецепта [8].СРК вызывается
эпизод острого гастроэнтерита в 30% всех случаев в предыдущих исследованиях [9]. Следовательно, предотвращение или
лечение острого гастроэнтерита до развития отдаленных последствий
резко сократить количество госпитализаций, количество лет жизни с поправкой на инвалидность и то и другое
прямые и косвенные медицинские расходы.
Точная диагностика острой
гастроэнтерит — постоянная проблема даже в сложных академических медицинских учреждениях.
центры. В популяции педиатрических пациентов, превышающей 4700 детей, менее
50% образцов стула, которые прошли полную микробиологическую оценку, дали
специфический диагноз [10]. Кишечные вирусы представляют собой преобладающие этиологические агенты острого гастроэнтерита.
Кишечные вирусы представляют собой преобладающие этиологические агенты острого гастроэнтерита.
у детей младше 3 лет, и бактерии вызвали большинство случаев
острого гастроэнтерита у детей старше 3 лет [10]. Диагностические проблемы
с энтеросолюбильными вирусами включают относительную нехватку молекулярных или
тесты на вирусный антиген и невозможность легко культивировать большинство кишечных вирусов.
Бактериальные патогены может быть трудно идентифицировать (например, большинство штаммов
болезнетворные E.coli ) из-за отсутствия специальных анализов
для этих инфекций. Относительная нечувствительность анализов на токсины в стуле
для обнаружения токсигенных C.
difficile не позволяет поставить точный диагноз. В условиях детской больницы,
Комбинированный токсин-антиген показал чувствительность ниже 40% в педиатрической практике.
пациенты (J. Versalovic, неопубликованные данные). Внедрение новых молекулярных
анализы для определения генов токсинов непосредственно в кале с помощью ПЦР в реальном времени
заметно улучшили способность диагностировать диарею, ассоциированную с антимикробными препаратами, и
колит, вызванный токсигенным C. difficile [11]. Кроме того,
difficile [11]. Кроме того,
примерно 15–25% случаев диареи, связанной с антимикробными препаратами, вызваны
автор: C. difficile . Распространенность
диарея, связанная с антимикробными препаратами, и желудочно-кишечные заболевания подчеркивают
важность альтернатив антибиотическим стратегиям лечения. Более того,
антибиотики имеют ограниченное применение для лечения гастроэнтерита у
Общее. Противомикробные препараты обычно не рекомендуются в качестве профилактики.
стратегии из-за проблем устойчивости к антибиотикам и
антимикробное заболевание.Таким образом, вместо подавления бактериального
популяций, принимающих антибиотики, можно ли использовать пробиотики для ремоделирования или изменения микробной
сообщества к здоровому состоянию [12]?
2. Пробиотики
2.1. Необходимость в механических деталях действия пробиотиков
Использование
пробиотиков для профилактики и лечения широкого спектра заболеваний.
пользу в последнее десятилетие. Отчасти это связано с необходимостью поиска альтернатив
традиционные методы лечения, такие как антибиотики, а также отсутствие хороших
лечение заболеваний желудочно-кишечного тракта. Хотя есть все больше сообщений об эффективности
Хотя есть все больше сообщений об эффективности
пробиотиков при лечении таких заболеваний, как поучит [13, 14],
диарея [15–17],
и синдром раздраженного кишечника [18], научная основа для
использование пробиотиков только начинает изучаться. Мы сосредоточимся на
потенциальные применения пробиотиков в лечении диарейных заболеваний. Несколько
примеры покажут, как пробиотики могут быть выбраны и использованы против
возбудители гастроэнтерита.
Концепция использования пробиотиков
микроорганизмов для профилактики и лечения различных заболеваний человека.
более 100 лет [19].
С ростом числа патогенов с множественной лекарственной устойчивостью и
признание роли микробиоты человека в здоровье и болезнях,
В последнее время наблюдается рост интереса к пробиотикам. Этот
Этот феномен проявляется в количестве пробиотических продуктов, продаваемых на рынке.
потребителям, а также увеличение количества проводимых научных исследований
в пробиотиках.Хотя многие механизмы, благодаря которым пробиотики приносят пользу,
человеческие существа остаются неясными, пробиотические бактерии используются больше
обычно для лечения конкретных заболеваний.
Несколько определений того, что
составляет «пробиотик» в литературе. За это
обзор, мы используем определение, полученное в 2001 г.
Организация (ФАО) и Всемирная организация здравоохранения (ВОЗ) — «Пробиотики
живые микроорганизмы, которые при введении в достаточном количестве приносят здоровье
выгода для хозяина.»[20].
Это определение в настоящее время принято Международным
Научная ассоциация пробиотиков и пребиотиков (ISAPP)
(http://www.isapp.net/).
2.2. Антипатогенная активность
Возможно
самый важный научный вопрос относительно использования пробиотиков в
медицина — это определение механизмов воздействия пробиотиков на человека.
здоровье. Было задействовано несколько механизмов, но большинство из них не были задействованы.
экспериментально доказано (рисунок 1).Здесь мы обсуждаем возможные механизмы, которые
актуален для лечения диарейных заболеваний. Выделим исследования
примеры, которые поддерживают эти предполагаемые механизмы, когда это возможно.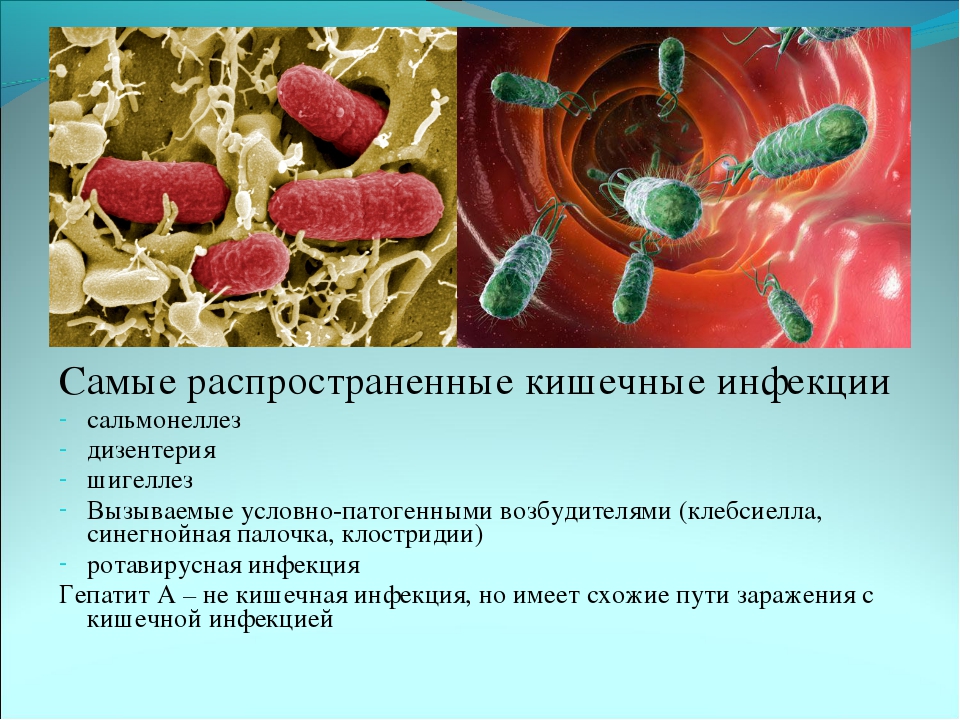
2.3. Стимуляция противомикробной защиты хозяина
Было показано, что многие пробиотики
производят антипатогенные соединения от небольших молекул до биоактивных
антимикробные пептиды. Большинство этих исследований были сосредоточены на in vitro
восприимчивость патогенов к продуктам, выделяемым пробиотическими бактериями.В большинстве
случаях способность противомикробного соединения, секретируемого пробиотиком
Организм для подавления роста патогена in vivo не было продемонстрировано.
По идее, противомикробное соединение, вырабатываемое организмом, должно быть
производиться на достаточно высоком уровне и в нужном месте в кишечнике
тракт, чтобы оказать сильное действие на возбудителя in vivo.
Элегантное доказательство принципа
прямое действие противомикробного препарата, продуцируемого пробиотиками, против патогена было
недавно сообщил Corr et al.кто продемонстрировал, что производство бактериоцина
Abp118 по Lactobacillus salivarius был
Достаточно для защиты мышей от болезней путем инфицирования Listeria monocytogenes [21].
Чтобы доказать, что действие бактериоцина непосредственно отвечает за
защиты мышей, они создали л.
salivarius , который был неспособен продуцировать Abp118, и показал, что этот
мутант был неспособен защитить от L.
monocytogenes инфекция.Примечательно, что они смогли экспрессировать ген, который
придает иммунитет к бактериоцину Abp118 в пределах L. monocytogenes и показывает, что этот штамм теперь устойчив к
пробиотический эффект L. salivarius в
мышь. Это исследование предоставило четкие доказательства того, что производные пробиотиков
бактериоцин может действовать непосредственно на патогене in vivo.
2.4. Исключение патогенов с помощью косвенных механизмов
В дополнение к
производство антимикробных соединений, которые действуют непосредственно на патогены, пробиотики
может стимулировать пути антимикробной защиты хозяина.Кишечный тракт имеет
ряд механизмов противодействия воздействию патогенов, включая
производство дефенсинов [22].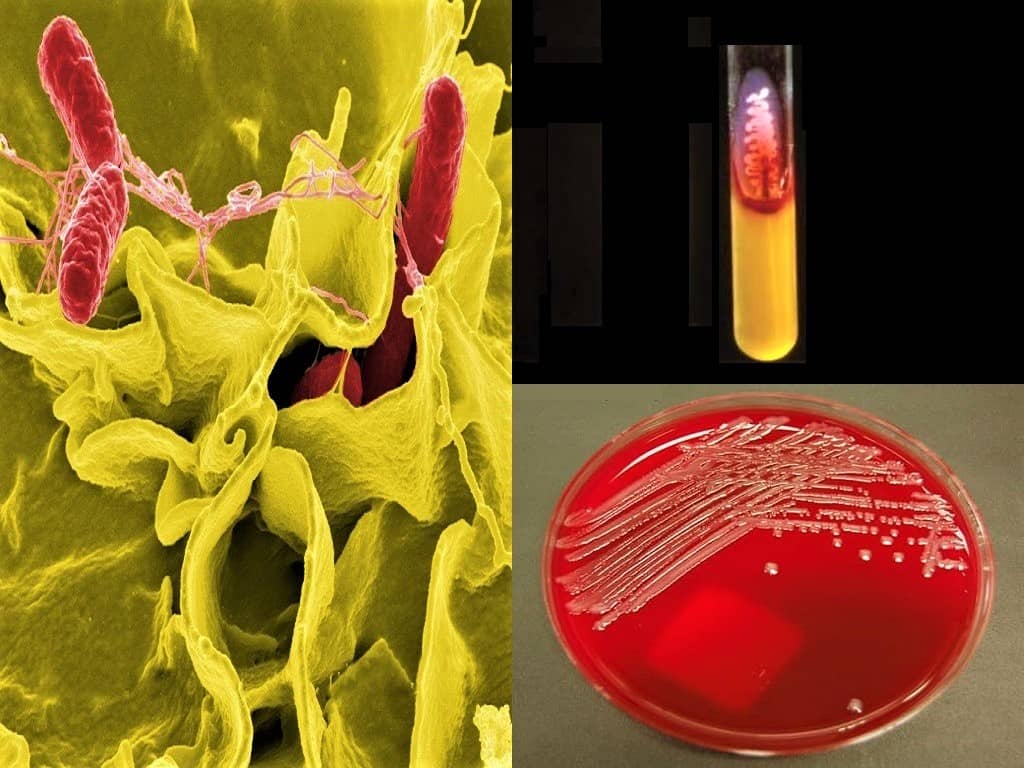
Дефенсины — это катионные антимикробные пептиды, которые производятся в ряде
типы клеток, включая клетки Панета в криптах тонкой кишки и
кишечные эпителиальные клетки. Был отмечен дефицит продукции альфа-дефенсина.
коррелирует с болезнью Крона подвздошной кишки [23, 24]. Ткань
образцы от пациентов с болезнью Крона показали более низкий уровень
продукция альфа-дефенсина и экстракты из этих образцов показали снижение
способность подавлять рост бактерий in vitro.Более того, некоторые патогенные
бактерии разработали механизмы, препятствующие производству или механизму
действие дефензинов (см. обзор [25]).
Пробиотики могут стимулировать
активность дефенсина, по крайней мере, через два механизма. Во-первых, пробиотики могут стимулировать
синтез экспрессии дефенсина. Это было продемонстрировано на примере бета-тестирования человека.
дефенсин 2 (hBD-2), экспрессия которого повышается за счет присутствия нескольких
пробиотические бактерии через фактор транскрипции [26, 27]. В
В
подразумевается, что пробиотические штаммы с этой способностью могут усилить
защита кишечника за счет повышения уровня дефенсина. Этот эффект также наблюдается
с некоторыми патогенными бактериями и, следовательно, не является специфическим свойством
пробиотические бактерии. Во-вторых, многие дефенсины производятся в форме пропептида.
которые должны активироваться под действием протеаз. Один хорошо охарактеризованный пример
активация мышиного дефенсина криптдина (альфа-дефенсина,
продуцируется клетками Панета) под действием матриксной металлопротеиназы 7 (ММП-7) [28].мышей
дефектные по MMP-7, более подвержены гибели Salmonella . Имеющиеся данные указывают на то, что бактерии могут стимулировать
продукция ММП-7 в кишечнике [29]. Таким образом,
одним из механизмов, в котором пробиотики могут участвовать в активации дефенсинов, является
за счет стимуляции выработки ММП в кишечном тракте. В качестве альтернативы,
пробиотики могут продуцировать протеазы, которые сами активируют дефенсины в
просвет кишечника. Хотя пока нет доказательств в поддержку этого механизма,
Хотя пока нет доказательств в поддержку этого механизма,
подмножество лактобацилл и стрептококков кодируют MMP-подобные белки в своих
геномы (R.Бриттон, неопубликованное наблюдение). Эти MMP не встречаются ни в одном
другие бактерии, и поэтому будет интересно определить, какое влияние они
влияют на функцию клетки-хозяина.
2,5. Иммуномодуляция
Вместо прямого подавления роста или
жизнеспособность патогена, пробиотики могут конкурировать за экологическую нишу или,
в противном случае создать условия, неблагоприятные для распространения возбудителя.
в кишечном тракте. Есть много возможных механизмов того, как возбудитель
исключение может иметь место.Во-первых, было продемонстрировано, что несколько пробиотиков
изменить способность патогенов прилипать к эпителиальным клеткам толстой кишки или вторгаться в них
in vitro, например, см. [30, 31]. Во-вторых, пробиотики могут изолировать жизненно важные
питательные вещества от вторгшихся патогенов и ухудшают их способность к колонизации. В третьих,
В третьих,
пробиотики могут изменять программу экспрессии генов патогенов таким образом, как
ингибировать выражение функций вирулентности [32].
Наконец, пробиотики могут создать неблагоприятную среду для патогена.
колонизация путем изменения pH, слоя слизи и других факторов в локальном
окружение.Важно отметить, что хотя многие из этих возможных
эффекты были продемонстрированы в
vitro способность пробиотиков исключать патогены in vivo остается
быть доказанным.
2.6. Повышение барьерной функции кишечника
Пробиотики могут оказывать штамм-зависимое действие на иммунную систему. Разные
штаммы, представляющие различные виды Lactobacillus , продемонстрировали противоположные эффекты в отношении провоспалительного
продукция цитокинов дендритными клетками костного мозга мышей [33].Определенные штаммы пробиотиков нейтрализовали иммуностимулирующее действие других
штаммы, так что пробиотики могут давать аддитивные или антагонистические
полученные результаты. Интересно, что в этом исследовании противовоспалительный цитокин IL-10 был
Интересно, что в этом исследовании противовоспалительный цитокин IL-10 был
сохраняется на аналогичных уровнях [31].
Различные штаммы пробиотиков Lactobacillus
одного и того же вида могут также давать противоположные эффекты по отношению к
иммуномодуляция. Lactobacillus, происходящие из грудного молока человека
reuteri либо стимулировали ключевой провоспалительный цитокин человека
фактор некроза опухоли (TNF) или подавление его продукции миелоидом человека
клетки [34].Неудивительно, что механизмы действия могут быть связаны с противоположными эффектами.
о ключевых сигнальных путях в клетках млекопитающих. Штаммы пробиотиков, такие как Lactobacillus rhamnosus GG (LGG), могут
активировать и преобразователь сигнала, и активатор транскрипции (STAT)
сигнальные пути в макрофагах человека [35]. В
Напротив, пробиотические штаммы Lactobacillus могут подавлять
передача сигналов [36, 37] или передача сигналов, опосредованная MAP-киназой / c-Jun [34].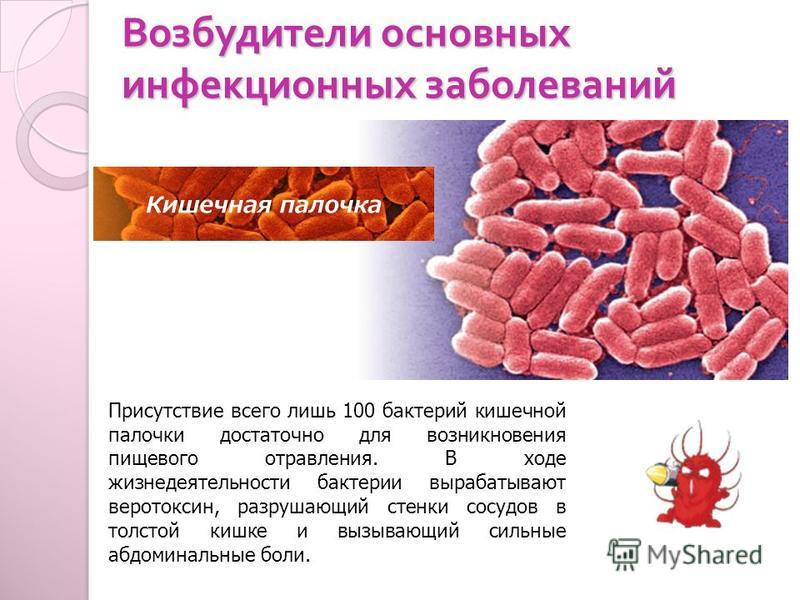
Стимуляция ключевых сигнальных путей и усиление провоспалительного
выработка цитокинов может иметь важное значение для «подготовки» иммунной системы к защите
против желудочно-кишечных инфекций.И наоборот, подавление иммунной
передача сигналов может быть важным механизмом, способствующим гомеостазу и толерантности к
микробные сообщества со многими потенциальными антигенами, и эти иммуносупрессивные
функции могут способствовать заживлению или разрешению инфекций.
2.7. Почему важно понимание механизмов?
Нарушение
функция эпителиального барьера и потеря образования плотных стыков в
кишечный эпителий может способствовать патофизиологии и развитию диарейных симптомов
наблюдается при заражении определенными возбудителями [38, 39].Утрата
плотные соединения могут привести к увеличению межклеточного транспорта, что может привести к
потеря жидкости и проникновение патогенов в подслизистую основу. Патогены могут выделять
факторы, такие как энтеротоксины, которые могут способствовать чрезмерному апоптозу или некрозу
эпителиальных клеток кишечника, тем самым нарушая кишечный барьер.
Кишечные патогены также могут вызывать очаговые поражения на поверхности слизистой оболочки из-за:
прямая адгезия с кишечными эпителиальными клетками (например, EPEC). В отличие,
Сообщалось, что пробиотики способствуют образованию плотных стыков и
барьерная функция кишечника [40, 41].Несмотря на то что
механизмы обеспечения целостности барьера не совсем понятны,
пробиотики могут противодействовать разрушению кишечного эпителиального барьера
несмотря на наличие болезнетворных микроорганизмов. Пробиотики также могут подавлять токсины.
производство или вмешательство в способность определенных патогенов прилипать
непосредственно на поверхность кишечника. В результате патогены могут иметь
снижение способности нарушать барьерную функцию кишечника.
2,8. Важные соображения по использованию пробиотиков: выбор штамма и физиология микробов
Важное
проблемой в области пробиотиков является идентификация генов и
механизмы, ответственные за полезные функции, выполняемые этими микробами. Успешное выявление механистических деталей функционирования пробиотиков
Успешное выявление механистических деталей функционирования пробиотиков
будет иметь как минимум три важных преимущества. Во-первых, понимание механизмов
действие обеспечит научную основу для положительных эффектов, обеспечиваемых
специфические микробы. Эти прорывные исследования помогут продвинуть пробиотики
от статуса диетических добавок к терапевтическим средствам. Во-вторых, понимание
механизмы пробиоза и генные продукты, продуцируемые пробиотиками, позволят
для выявления более сильнодействующих пробиотиков или развития
биоинженерная терапия.Например, противовоспалительный цитокин IL-10
был постулирован как потенциальное терапевтическое средство для лечения воспалительного
заболевание кишечника. Чтобы проверить эту гипотезу, был разработан штамм Lactococcus lactis , сконструированный для производства и секреции IL-10.
сконструированы и продемонстрированы для уменьшения колита на мышиной модели [42].
Ранние клинические испытания у пациентов с воспалительными заболеваниями кишечника указывают на некоторые
облегчение симптомов при лечении штаммом, чрезмерно продуцирующим ИЛ-10. В третьих,
В третьих,
идентификация продуктов генов, ответственных за улучшение
болезнь позволит исследователям, промышленности и клиницистам следить за производством
этих продуктов в качестве важных биомаркеров при приготовлении пробиотиков. В качестве
обсуждается ниже, физиологическое состояние микробов может иметь решающее значение для
функции пробиотиков. Таким образом, будет важно иметь возможность следить за
производство важных биоактивных молекул при культивировании и переработке
пробиотики для животных и людей.
2.9. Пробиотики и диарея
Пробиотики
считаются живыми или жизнеспособными микроорганизмами по определению. В отличие от
небольшие молекулы, которые являются стабильными объектами, пробиотики — это динамические микроорганизмы
и изменит паттерны экспрессии генов при воздействии различных
условия окружающей среды. Эта реальность имеет два важных значения для тех, кто
которые решили использовать эти организмы для борьбы с болезнями человека или животных. Первый,
пробиоз — это специфическое для штамма явление. Поскольку определение вида бактерий
Поскольку определение вида бактерий
сложно в наш век полного секвенирования генома, ясно, что пробиотики
эффекты, наблюдаемые in vitro и in vivo,
штамм специфический. Например, модуляция продукции TNF штаммами Lactobacillus reuteri идентифицированных штаммов
которые были иммуностимулирующими, иммунонейтральными и иммуносупрессивными в отношении TNF
производство [34, 43].
Эти результаты подчеркивают штаммоспецифический характер пробиотических эффектов.
вызвано бактериями.Таким образом, для исследовательских групп и промышленности важно
будьте осторожны с обработкой и отслеживанием деформации, чтобы включить правильные
штаммы проверяются до введения в клинических испытаниях.
Второй ключевой момент заключается в том, что
физиология пробиотического штамма является важным фактором. Быть живым
микроорганизмы, белки и вторичные метаболиты, которые производятся
будет меняться в зависимости от фазы роста. Эта функция вызывает ряд
важные вопросы для стабильности и эффективности пробиотических штаммов. Первый,
Первый,
пробиотики подвергаются многочисленным воздействиям окружающей среды во время производства
и после проглатывания хозяином. В частности, пробиотики, используемые для лечения
кишечные заболевания или чей механизм действия, как предполагается, проявляется в
Кишечный тракт должен выдерживать как кислотный, так и желчный стресс во время
транзитом через кишечник. Физиологическое состояние микроба является важным
характеристика, которая определяет, будут ли клетки восприимчивы к разным
типы экологического стресса [44, 45].За
Например, экспоненциально растущие клетки л.
reuteri гораздо более восприимчивы к уничтожению желчными солями, чем клетки в
стационарная фаза [45].
Таким образом, важно рассматривать физиологическое состояние клеток с точки зрения
адаптации к стрессу не только для выживания в хозяине, но и во время
производство. Во-вторых, экспрессия биоактивных молекул, которые чаще всего
ответственный за пользу для здоровья, оказываемую пробиотиками, часто зависит от фазы роста. Например, наши группы исследовали производство
Например, наши группы исследовали производство
иммуномодулирующие соединения и противомикробные средства штаммами L. reuteri . В обоих случаях эти
соединения более выражены при входе и во время стационарного
фаза (неопубликованное наблюдение).
3. Пробиотики и профилактика и лечение гастроэнтерита — примеры
Пробиотик, полученный из комменсала
бактерии используются для лечения целого ряда заболеваний пищеварительной системы,
в том числе колит, ассоциированный с антибиотиками, Helicobacter
pylori гастрит и диарея путешественника [46].Составы пробиотиков могут включать отдельные штаммы или комбинации
штаммы. L. reuteri происходит из
желудочно-кишечного тракта человека, широко присутствует у млекопитающих и никогда не был
показано, что вызывает заболевание. В
испытания на людях, обработка пробиотиками L.
reuteri у маленьких детей с ротавирусным гастроэнтеритом снижал
продолжительность заболевания и способствовала выздоровлению пациента [15, 16], в то время как в другом исследовании это предотвращало
диарея у младенцев [17]. Несмотря на многообещающие данные клинических испытаний, первичный молекулярный
Несмотря на многообещающие данные клинических испытаний, первичный молекулярный
Механизмы, лежащие в основе антипатогенных свойств L. reuteri , остаются неизвестными.
Пробиотики могут быть эффективны при
профилактика или лечение инфекционного гастроэнтерита. В контексте
профилактика заболеваний, несколько исследований с различными пробиотическими штаммами
документально подтверждено, что эти бактерии могут снизить частоту возникновения острой диареи на 15–75%.
в зависимости от исследования [17, 47–50].Несмотря на то что
относительное влияние на заболеваемость варьируется в зависимости от конкретных
пробиотический штамм и популяция пациентов, стабильная польза от болезни
профилактика была продемонстрирована в многочисленных клинических исследованиях. В одной болезни
профилактическое исследование [49],
добавление Bifidobacterium
lactis значительно снизил заболеваемость острой диареей и ротавирусом
линька у младенцев. Исследования, в которых изучалась потенциальная польза пробиотиков для:
предотвращение диареи, связанной с антимикробными препаратами, дало неоднозначные результаты [51–54]. Один
Один
профилактическое исследование сообщило о снижении числа случаев заболевания, связанного с противомикробными препаратами.
диарея у младенцев на 48% [52].
Пробиотики также могут быть включены в
схемы лечения инфекционного гастроэнтерита. Несколько метаанализов
многочисленные клинические испытания с различными пробиотиками документально подтвердили снижение
Течение гастроэнтерита составляло от 17 до 30 часов [49, 50, 55]. Проверено
с другой стороны, метаанализ пробиотиков, используемых в клинических испытаниях
при гастроэнтерите отмечалось значительное снижение частоты продолжительной диареи.
более 3 дней (длительный понос).Частота продолжительной диареи
уменьшилось на 30% или 60%, соответственно, в зависимости от исследования [50, 56] (резюмировано
в [55]). Пробиотический агент LGG внес свой вклад
к значительному сокращению ротавирусной диареи к 3 дням лечения, когда
назначают детям в составе пероральной регидратационной терапии [57].
Кокрановские сборники последних данных большой серии испытаний пробиотиков
База данных систематических обзоров (http://www. cochrane.org/) дала многообещающие выводы.По состоянию на 2008 г.
cochrane.org/) дала многообещающие выводы.По состоянию на 2008 г.
пробиотики, по-видимому, эффективны для предотвращения острого гастроэнтерита у
детям и может сократить продолжительность острого заболевания. Кроме того, пробиотики
многообещающие средства для профилактики и лечения диареи, связанной с антимикробными препаратами,
хотя анализы намерения лечить не продемонстрировали положительных результатов.
3.1.
Clostridium difficile и диарея, связанная с антибиотиками
В дальнейшем мы
выделить некоторые возможные механизмы, с помощью которых пробиотики могут использоваться для
улучшить гастроэнтерит.Поскольку ряд инфекционных агентов вызывают
диарея, колит и гастроэнтерит, мы остановимся только на нескольких примерах
с идеей, что многие из обсуждаемых механизмов могут быть распространены на другие
бактериальные или вирусные причины диареи.
3.1.1. Возможная роль пробиотиков в лечении CDAD
An
примерно 500 000–3 000 000 случаев Clostridium
difficile- -ассоциированная диарея (CDAD) возникает ежегодно с сопутствующим здоровьем
затраты на уход превышают 1 миллиард долларов в год [58–60]. CDAD возникает в основном у пациентов, перенесших
CDAD возникает в основном у пациентов, перенесших
антибактериальная терапия в медицинских учреждениях, что указывает на изменения в
кишечная микробиота важна для инициации CDAD. В небольшом, но
при увеличении числа случаев будут возникать более серьезные осложнения, в том числе:
псевдомембранозный колит и токсический мегаколон. Более того, появление резистентных к метронидазолу
штаммы C. difficile имеют
снижает эффективность метронидазола, ванкомицина и
Цецит, вызванный метронидазолом, усиливает потребность в новых методах лечения
лечение и профилактика CDAD [61, 62].
Примерно
У 10–40% пациентов, получавших лечение от начального приступа CDAD, наблюдается рецидив
заболевание, часто с множественными эпизодами [63]. Такие рецидивы часто невосприимчивы к существующим
терапии, включая терапию антибиотиками. Пациенты с рецидивирующим CDAD имели
заметное снижение разнообразия организмов в их фекальной микробиоте, в то время как
пациенты, у которых не было рецидива заболевания, имели нормальную микробиоту [64]. Таким образом, методы лечения, восстанавливающие нормальную микробиоту или
Таким образом, методы лечения, восстанавливающие нормальную микробиоту или
подавить C.difficile рост, в то время как
возможность повторного заселения кишечника благоприятной микробиотой может быть
важно для лечения инфекций и поддержания здоровья кишечника.
3.1.2. Ликвидация
C. difficile посредством производства противомикробных соединений
Пробиотические организмы использовались для лечения рецидивирующих C. difficile в прошлом и в некоторых случаях.
случаи показали умеренный эффект в облегчении рецидивов заболевания [63]. Это приложение было несколько спорным и на
на этот раз не рекомендуется использовать пробиотики для облегчения CDAD [65].Однако протестированные организмы специально не
изолированы для лечения CDAD и, следовательно, не могли быть
соответствующие штаммы, которые следует использовать для предотвращения рецидива CDAD. В дальнейшем мы
обрисовать потенциальные механизмы, в которых тщательно отобранные или спроектированные
пробиотики можно использовать для лечения C. difficile и искоренения этого патогена.
difficile и искоренения этого патогена.
3.1.3. Конкурентное исключение
C. difficile с использованием пробиотиков
CDAD в настоящее время лечится с помощью
противомикробных средств, эффективных против C.difficile , чаще всего ванкомицин или метранидазол. Потому что эти
лекарства являются антибиотиками широкого спектра действия, они, вероятно, играют роль в рецидивирующих
болезнь, подавляя нормальную кишечную микробиоту. Использование противомикробных препаратов
соединения, которые нацелены на C. difficile , в то время как
разрешение на восстановление постоянных организмов было бы одним из возможных механизмов
предотвратить повторный CDAD.
3.1.4. Пробиотики и
C. difficile Прорастание спор
Как упоминалось выше, CDAD обычно
инфекция, полученная в больнице или другом учреждении здравоохранения.
Следовательно, a
пробиотик, который может исключить C.
difficile можно вводить до поступления в больницу.
К сожалению, мало что известно о том, как и где C. difficile колонизирует кишечник. Как только эта информация
Известно, что могут быть разработаны стратегии блокирования колонизации пробиотиками.
Тем не менее, многообещающий пробиотик
описан подход с использованием нетоксигенного препарата C. difficile .Используя модель хомяка инфекции C. difficile , Gerding et al. продемонстрировал защитный
Эффект от заселения хомяка штаммами C. difficile , которые не способны продуцировать токсин до заражения
с вирулентным штаммом, продуцирующим токсин [66].
Колонизация кишечного тракта нетоксигенным штаммом оказалась
требуется для защиты. В настоящее время этот пробиотический подход находится под
исследование для использования на людях (http: //www.viropharma.com /).
3.2. Энтерогеморрагический
E. coli
A вероятно
усложняет устранение C. difficile из кишечника способность организма развиваться.
стрессоустойчивые споры. Идентификация пробиотических штаммов, которые могут
Идентификация пробиотических штаммов, которые могут
предотвратить образование спор или их прорастание в кишечнике
трактат открывает многообещающие возможности для борьбы с CDAD. Последние работы по споре
прорастание обеспечило анализы in vitro, в которых ингибирующая активность
пробиотиков можно тестировать [67].
Для прорастания спор в лаборатории необходимо наличие
желчные кислоты, при этом наибольшую активность проявляют таурохолат и холат [67].
Таким образом, желчные кислоты могут играть роль в передаче сигнала C. difficile о том, что споры находятся в правильном месте кишечника, чтобы
прорастают. Зорг и Соненшейн недавно предложили механизм, с помощью которого
уменьшение кишечной микробиоты может привести к появлению эффективных спор
всхожесть и разрастание С.difficile [67].
Они обнаружили, что дезоксихолат желчной кислоты (DOC) способен вызывать споры.
прорастание, но этот последующий рост тормозился из-за токсического воздействия
DOC по вегетативной C. difficile . Их
difficile . Их
работа предлагает модель, в которой снижение концентрации DOC в
кишечник из-за нарушения нормальной микробиоты удаляет этот ключевой
ингибитор роста C. difficile . DOC
вторичная желчная кислота, образующаяся при дегидроксилировании холата ферментом
-дегидроксилаза, активность, которая вырабатывается членами кишечника
микробиота.Пока неясно, снижает ли терапия антибиотиками
уровень DOC в кишечнике, можно предположить, что обеспечение
пробиотические бактерии, способные продуцировать -дегидроксилазу, могут предотвращать кишечные
разрастается C. difficile , в то время как
восстанавливается нормальная микробиота.
3.2.1. Секвестрация и удаление токсинов
Энтерогеморрагические Инфекции, вызванные E. coli (EHEC), вызывают спорадические
вспышки геморрагического колита во всем мире (100 000 случаев в год
в США) [68].Большинство инфекций приводят к развитию кровавой диареи, но в некоторых случаях.
(5-10%) пациентов с EHEC (в основном дети) разовьются опасные для жизни
состояние гемолитико-уремического синдрома (ГУС) [69, 70].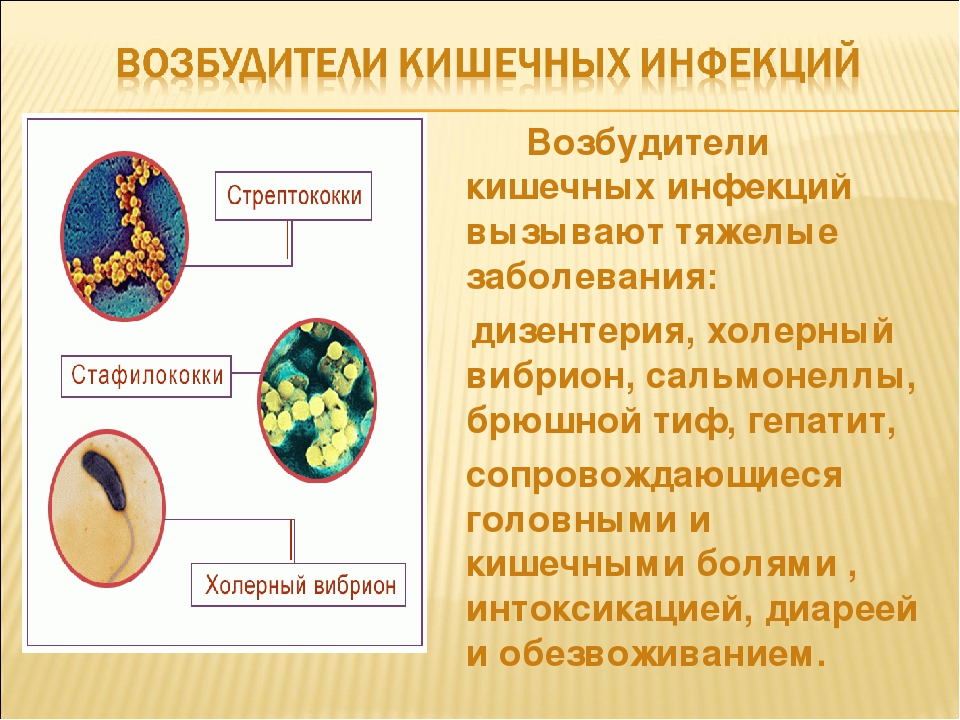
ГУС — основная причина почечной недостаточности у детей. EHEC, что, вероятно,
произошел от штамма EPEC [71],
также вызывает прикрепление и стирание поражений на эпителиальных клетках хозяина и
снижает барьерную функцию кишечного эпителия. Кроме того, штаммы EHEC являются
характеризуются экспрессией генов токсина шига (Stx), и, таким образом, они могут
быть обозначенным как продуцирующий шига-токсин E.coli (STEC). В настоящее время проводится только поддерживающая терапия инфекции EHEC.
доступны, так как терапия антибиотиками может увеличить риск развития ГУС,
и поэтому необходимо разработать новые методы лечения. Одна многообещающая альтернатива
терапевтическим может быть использование пробиотиков для лечения инфекций EHEC.
3.2.2. Ингибирование продукции токсинов с помощью EHEC — Идентификация штаммов, которые подавляют литические функции лямбда.
Шига-токсины:
белки, инактивирующие рибосомы, которые ингибируют синтез белка, удаляя
специфический остаток аденина из 28S рРНК большой субъединицы рибосомы [72]. Токсин шига необходим для развития ГУС, и недавние исследования
Токсин шига необходим для развития ГУС, и недавние исследования
указали, что штаммы EHEC, мутировавшие в отношении продукции токсина шига, не вызывают
болезнь на модели стерильных мышей [73].
Действительно, инъекции токсина Шига с ЛПС непосредственно мышам достаточно для
вызывают HUS-подобное заболевание в почках мышей [74].
Таким образом, токсин шига является важным медиатором ГУС и терапии, направленной на
нейтрализация его активности, как ожидается, уменьшит или устранит это опасное для жизни
осложнение, хотя текущие попытки нейтрализации токсина шига были
неудачный [75].
Как возможный механизм лечения
Болезнь EHEC и снижение заболеваемости HUS, Paton et al. имеют
сгенерировал «дизайнерские пробиотики», в которых рецептор олигосахаридов (Gb 3 ) для Stx экспрессируется на клеточной поверхности
штамм E. coli [76–78]. Этот
Было показано, что пробиотический штамм способен нейтрализовать Stx in vitro. Как
доказательство концепции, мыши, которых заражали штаммом STEC, были защищены
путем введения пробиотика, экспрессирующего рецептор Gb 3 [79]. Защитный эффект наблюдался даже тогда, когда штаммы были убиты формалином.
Защитный эффект наблюдался даже тогда, когда штаммы были убиты формалином.
перед использованием, подтверждая гипотезу о том, что секвестрация и удаление токсинов
был механизмом защиты мышей. Подобные результаты были
полученные с использованием рецепторов, экспрессирующих бактерии, для токсинов, продуцируемых другими
возбудители диарейных болезней, включая энтеротоксигенные E. coli (наиболее частая причина диареи путешественников) и Vibrio cholerae .
3.2.3. Ингибирование прилипания патогенов и усиление барьерных функций кишечника
Гены Stx переносятся на лямбдоидных профагах и обычно
расположен в области вируса с поздней транскрипцией, рядом с литическими генами [80].Поскольку механизм секреции токсина не был идентифицирован, расположение Stx
рядом с литическими генами предполагает
что активация фага и лизис клеток ответственны за продукцию Stx и
релиз. Это генетическое сопоставление предполагает, что терапевтические средства, подавляющие
литическое решение лямбда in vivo значительно уменьшит или устранит осложнения
вызвано системным высвобождением Stx.
3.3. Ротавирус
Ключ
взаимодействие EHEC, как и EPEC, с кишечным эпителием
образование прикрепляющихся и стирающихся высыпаний на поверхности эпителия [81].Это взаимодействие вызывается факторами, секретируемыми непосредственно из бактерии.
в клетку-хозяин, где происходит перераспределение актинового цитоскелета.
Инфекция EHEC и EPEC также вызывает потерю образования плотных соединений и
снижение кишечного эпителиального барьера за счет перестройки
ключевые белки плотных контактов, включая окклюдин [82, 83].
Терапии, которые нарушили бы это взаимодействие EHEC / EPEC с
кишечного эпителия или подавления потери барьерной функции должно улучшаться
болезнь.
Пробиотики показали некоторый успех
ингибирование адгезии, образование поражений A / E и усиление барьерной функции в
ответ на инфекцию EHEC in vitro.
Джонсон-Генри и др. протестировали способность Lactobacillus
rhamnosus GG для предотвращения потери целостности барьера и образования A / E
поражения, вызванные EHEC-инфекцией клеточной культуры in vitro [40].
Они обнаружили, что предварительная обработка эпителиальных клеток кишечника in vitro с помощью LGG
было достаточно, чтобы уменьшить количество поражений A / E и предотвратить потерю
барьерная функция, измеряемая по трансэпителиальному сопротивлению, локализация
белки плотных контактов и анализы проницаемости барьера.Главное, живой LGG
был необходим для этих эффектов, поскольку убитые нагреванием бактерии не были эффективны в
предотвращение воздействия EHEC на эпителиальные клетки.
Кишечные вирусы, включая норовирусы
и ротавирус представляют собой основные причины гастроэнтерита, особенно у молодых
дети. Ротавирусная инфекция приводит к развитию острого гастроэнтерита с
сопутствующие обезвоживание и рвота, главным образом, у детей в возрасте 3–24 месяцев.
Ротавирус человека в первую очередь поражает эпителиальные клетки кишечника дистального отдела тонкого кишечника.
кишечник, что приводит к опосредованному энтеротоксинами повреждению кишечного барьера
функция.Недавние исследования показывают, что пробиотики могут сократить продолжительность и
облегчить течение болезни, вызванной ротавирусной инфекцией ([84];
Г. Прейдис и Дж. Версалович, неопубликованные данные). Пробиотики продвигают кишечник
Прейдис и Дж. Версалович, неопубликованные данные). Пробиотики продвигают кишечник
выработка иммуноглобулина и, по-видимому, снижает тяжесть кишечной
поражения, вызванные ротавирусной инфекцией на мышиной модели. Эти выводы и связанные с ними
исследования показывают, что пробиотики могут уменьшить тяжесть и продолжительность
желудочно-кишечных инфекций по механизмам, не зависящим от прямого возбудителя
антагонизм.Пробиотики также могут способствовать заживлению и гомеостазу, регулируя
производство цитокинов и облегчение функции кишечного барьера.
Пробиотики могут
стратегия профилактики и лечения желудочно-кишечных инфекций.
Конкретные бактерии, происходящие из микробных сообществ человека, могут иметь ключевые
особенности, которые делают эти микробы основными кандидатами на пробиотики.
терапии. Эти полезные микробы могут по-разному влиять на хозяина.
такие как предотвращение распространения и функции патогенов.Пробиотики также могут
стимулировать иммунную функцию хозяина и целостность слизистого барьера. Работая
Работая
через различные механизмы пробиоза пробиотики могут оказывать воздействие на
различные этапы процесса. Пробиотики могут предотвратить заболевание
при профилактическом применении. Пробиотики также могут подавлять или уменьшать
тяжесть или продолжительность заболевания в контексте лечения. Как наши знания
достижений микробиома человека, рационального выбора пробиотиков на основе
известные механизмы действия и механизмы заболевания облегчат
оптимизация стратегий терапевтической микробиологии.В конечном итоге мы ожидаем, что
пробиотики помогут продвинуть стабильные, разнообразные и полезные микробные
сообщества, которые укрепляют здоровье человека и предотвращают болезни.
Благодарности
Исследования в лаборатории Бриттона поддержаны грантом от
Фонд Гербера, Центр микробных исследований Университета штата Мичиган
Патогенез, Центр возобновляемых органических
Ресурсы и Отдел микробиологических исследований в штате Мичиган по контракту
Национальным институтом здоровья (NIH N01-AI-30058). J. Versalovic поддерживается за счет средств NIH (NIDDK R01 DK065075; NCCAM R21 AT003482; NCCAM R01 AT004326; NIDDK P30 DK56338, который финансирует Центр болезней органов пищеварения Техасского медицинского центра), Управления военно-морских исследований и перспективных исследовательских проектов Министерства обороны США. Агентство (DARPA).
J. Versalovic поддерживается за счет средств NIH (NIDDK R01 DK065075; NCCAM R21 AT003482; NCCAM R01 AT004326; NIDDK P30 DK56338, который финансирует Центр болезней органов пищеварения Техасского медицинского центра), Управления военно-морских исследований и перспективных исследовательских проектов Министерства обороны США. Агентство (DARPA).
Кишечные бактерии и СРК
Бактерии присутствуют в нормальном кишечнике (кишечнике), особенно в нижних отделах кишечника. Они достигают концентрации в несколько миллиардов в толстой кишке (толстом кишечнике / кишечнике).
Эти «нормальные» бактерии выполняют важные жизненные функции, в том числе:
- Защита от заражения болезнетворными бактериями
- Помогая иммунной системе кишечника развиваться
- Производство различных веществ, имеющих важную пищевую ценность
- Вместе нормальные кишечные бактерии часто называют кишечной флорой (или микробиотой). Ряд факторов может нарушить взаимовыгодные отношения между флорой и организмом.
 Когда это происходит, могут прижиться бактерии, вызывающие заболевание.
Когда это происходит, могут прижиться бактерии, вызывающие заболевание.
Какова роль кишечной микробиоты?
Было сделано много интересных разработок и открытий о связи между нашим кишечником (пищеварительной системой) и нашим мозгом и о том, как это влияет на наше здоровье, а также о роли микробов в этой связи.
Важно знать, что функциональные расстройства желудочно-кишечного тракта, такие как СРК, не являются психологическими заболеваниями; но мы также должны понимать, что мозг играет важную роль.Мозг постоянно общается с микроорганизмами внутри каждого из нас.
Эти микробы поддерживают с нами отношения сотрудничества, не только участвуя в пищеварении, но и взаимодействуя с нашими собственными клетками, кишечником и мозгом. Кишечные микробы могут помочь поддерживать баланс между мозгом и кишечником.
Подробнее о микробиоте кишечника
Играют ли бактерии роль в СРК?
В настоящее время имеются доказательства, подтверждающие идею о том, что нарушения в бактериях, населяющих кишечник, могут иметь значение, по крайней мере, у некоторых людей с синдромом раздраженного кишечника (СРК).
Эти данные наблюдений или исследований можно резюмировать следующим образом:
- Использование антибиотиков, которые, как известно, нарушают флору, может предрасполагать людей к СРК
- У некоторых людей СРК может развиться внезапно после эпизода желудочной или кишечной инфекции (гастроэнтерита), вызванной бактериями (состояние, называемое постинфекционным СРК или ИП-СРК)
- У некоторых пациентов с СРК в стенке кишечника может присутствовать очень низкий уровень воспаления, которое могло быть результатом ненормального взаимодействия с бактериями в кишечнике
- Избыточный бактериальный рост в тонком кишечнике (СИБР) может быть связан с СРК
- Изменение бактерий в кишечнике с помощью антибиотиков или пробиотиков может улучшить симптомы СРК
- При PI-IBS у некоторых людей, которые ранее были здоровыми, после эпизода гастроэнтерита развиваются симптомы типа IBS, в то время как у большинства других полностью выздоравливают.
 PI-IBS представляет собой четкую связь между воздействием бактериальной инфекции (например, из-за зараженной пищи или воды) и IBS у тех, кто кажется особенно подверженным риску.
PI-IBS представляет собой четкую связь между воздействием бактериальной инфекции (например, из-за зараженной пищи или воды) и IBS у тех, кто кажется особенно подверженным риску.
Подробнее о PI-IBS
В ряде исследований сообщается о роли воспаления внутренней оболочки (слизистой оболочки) кишечника при СРК. Это легкое воспаление, которое гораздо реже, чем при истинных воспалительных заболеваниях кишечника, язвенном колите и болезни Крона. Интересно, что это было обнаружено среди пациентов, у которых не было никаких оснований предполагать, что их СРК начался с инфекции.Что внезапно вызывает это воспаление, не ясно. Возможно, им управляют тонкие изменения в бактериальной популяции в кишечнике.
Некоторые люди с СРК могут быть генетически предрасположены к усиленной воспалительной реакции на нормальные бактерии. Хотя эта теория СРК находится в зачаточном состоянии, уже есть некоторые свидетельства распространения воспалительного процесса за пределы стенки кишечника. Это может объяснить некоторые из симптомов, таких как усталость и фибромиалгия, которые могут возникать у людей, страдающих СРК.
Это может объяснить некоторые из симптомов, таких как усталость и фибромиалгия, которые могут возникать у людей, страдающих СРК.
В течение некоторого времени различные исследования предполагали наличие изменений в типе кишечной флоры у людей с СРК. Эти изменения во флоре могут привести к увеличению количества определенных видов бактерий, которые сами производят больше газа и других продуктов своего метаболизма. Это может способствовать появлению таких симптомов, как газы, вздутие живота и диарея.
Есть ли роль антибиотиков в лечении СРК?
Обычно бактерии практически отсутствуют в кислой среде желудка и немногочисленны в верхних отделах кишечника.Они значительно увеличиваются в нижних отделах тонкой кишки, а затем резко переходят в толстую кишку.
Недавно было высказано предположение, что в тонком кишечнике некоторых пациентов с СРК увеличивается количество бактерий, а также типы бактерий, обычно встречающиеся только в толстой кишке. Это состояние называется избыточным бактериальным ростом тонкой кишки (СИБР). Курс антибиотиков может улучшить симптомы, но эксперты расходятся во мнениях о том, играет ли СИБР роль в СРК.
Курс антибиотиков может улучшить симптомы, но эксперты расходятся во мнениях о том, играет ли СИБР роль в СРК.
Остается вопрос, почему по крайней мере некоторые люди с СРК реагируют на курс антибиотиков. Об этом совсем недавно сообщалось в исследованиях пациентов с СРК, получавших антибиотик рифаксимин.
Другим объяснением этих реакций может быть подавление определенных видов бактерий в толстой кишке, особенно тех бактерий, которые склонны выделять газ и другие вещества в процессе ферментации. У группы пациентов с вздутием живота и метеоризмом, у которых не было доказательств SIBO, было описано улучшение симптомов, связанных с газами, при терапии антибиотиками.Антибиотики явно помогают некоторым пациентам с СРК, хотя то, как это происходит, может быть более сложным, чем первоначально предполагалось.
К длительному курсу антибиотикотерапии следует подходить с осторожностью, независимо от профиля безопасности данного антибиотика. Это важный вопрос, так как СРК часто бывает хроническим и рецидивирующим заболеванием.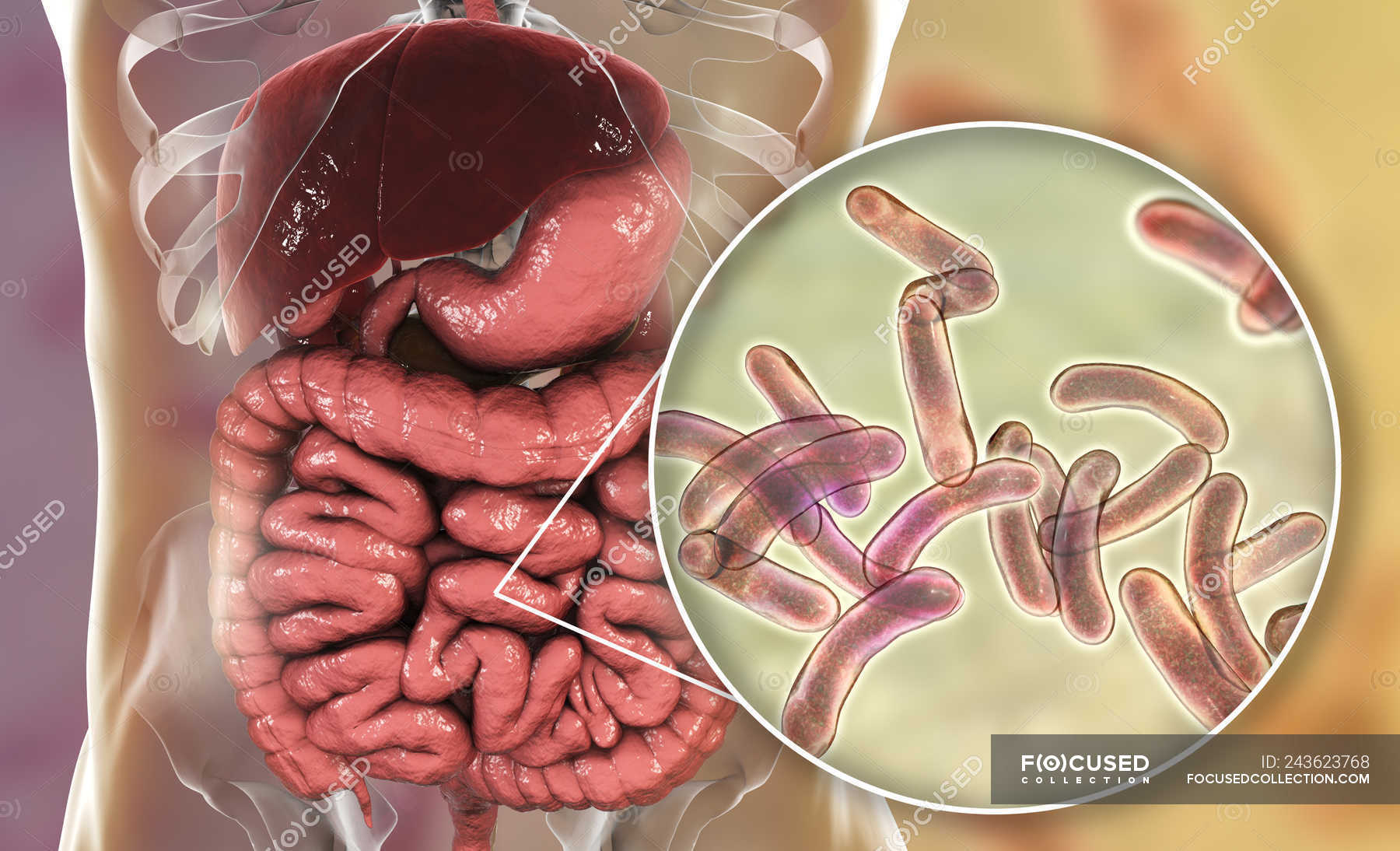 У некоторых людей наблюдается относительно продолжительное улучшение после однократного курса антибиотиков, у других — нет. Необходимы результаты дальнейших долгосрочных исследований относительно использования антибиотиков.
У некоторых людей наблюдается относительно продолжительное улучшение после однократного курса антибиотиков, у других — нет. Необходимы результаты дальнейших долгосрочных исследований относительно использования антибиотиков.
Есть ли роль пробиотиков в лечении СРК?
- Учитывая их профиль безопасности, эффективные пробиотики на первый взгляд кажутся более привлекательными как средство воздействия на кишечную флору при СРК. Эффективны ли пробиотики при СРК? Было проведено несколько исследований различных пробиотиков при СРК. Лишь недавно они стали качественными, необходимыми для того, чтобы делать твердые выводы. Были некоторые ранние доказательства, хотя и непоследовательные, об улучшении симптомов, связанных с «газами».
- Совсем недавно были получены некоторые доказательства пользы некоторых комбинаций пробиотиков. Лучшее доказательство относится к конкретному организму, Bifidobacterium infantis 35624. Исследования показали, что этот штамм превосходит плацебо в облегчении основных симптомов СРК (боль / дискомфорт в животе, затрудненная дефекация и вздутие живота / вздутие живота).

Узнайте больше о роли антибиотиков и пробиотиков в лечении СРК
Сводка
Многие недавние открытия добавляют к растущему количеству доказательств того, что СРК может быть, по крайней мере частично, результатом дисфункционального взаимодействия между нашей кишечной флорой и нами самими.Это приводит к слабому воспалению стенки кишечника, которое может распространиться на другие части тела.
Некоторые исследователи предполагают, что избыточный бактериальный рост в тонком кишечнике является частым фактором, вызывающим симптомы СРК. Другие данные указывают на более тонкие изменения флоры толстой кишки. Обе гипотезы остаются неподтвержденными.
Тем не менее, краткосрочная терапия антибиотиками или пробиотиками, похоже, действительно уменьшает симптомы у некоторых людей с СРК.Независимо от того, возникают ли эти эффекты из-за изменений количества или типа бактерий в толстой и / или тонкой кишке, очевидно, что манипуляции с кишечными бактериями заслуживают дальнейшего внимания.
Эта статья вам помогла?
IFFGD — некоммерческая образовательная и исследовательская организация. Наша миссия — информировать, помогать и поддерживать людей, страдающих желудочно-кишечными расстройствами.
Наш оригинальный контент создан специально для читателей IFFGD в ответ на ваши вопросы и проблемы.
Если вы нашли эту статью полезной, рассмотрите возможность поддержки IFFGD небольшим пожертвованием, не облагаемым налогом.
Симптомы и методы лечения SIBO | Избыточный бактериальный рост в тонком кишечнике
Что такое избыточный бактериальный рост в тонком кишечнике (СИБР)?
Есть ли у вас неприятные симптомы, такие как вздутие живота или боль в животе после еды? Боретесь с газами, запором или диареей? У вас может быть состояние, известное как избыточный бактериальный рост тонкого кишечника, или обычно известное как SIBO.В этом состоянии бактерии, которые обычно должны находиться в толстой кишке, неправильно перемещаются в тонкий кишечник, где могут вызвать множество неприятных пищеварительных симптомов.
Вкратце, тонкий кишечник — это место, где пища дополнительно переваривается ферментами и кислотой после получения ее из желудка. В толстой кишке, которая анатомически следует за последней частью тонкой кишки, есть бактерии, которые помогают переваривать и усваивать питательные вещества. Теперь, если эти бактерии попадают в тонкий кишечник, где они не должны находиться, бактерии питаются пищей, которую вы пытаетесь переваривать, что приводит к неприятным симптомам, таким как газы, боль и вздутие живота.Это не хорошо!
К сожалению, многие практикующие врачи не знают о СИБР, что приводит к неправильному лечению и практически не улучшает ваши симптомы. Просто чтобы дать вам представление, многие пациенты, у которых диагностирован синдром раздраженного кишечника (СРК), действительно могут иметь SIBO. Это может оставить вас разочарованным, безнадежным и думать, что вы должны справляться с этими симптомами навсегда, что не соответствует действительности! В Natural Balance мы понимаем, что появление этих симптомов может оказать огромное негативное влияние на вашу повседневную жизнь и помешать вам жить полноценной жизнью. Мы здесь, чтобы заверить вас в том, что у SIBO есть надежда и есть успешные методы лечения.
Мы здесь, чтобы заверить вас в том, что у SIBO есть надежда и есть успешные методы лечения.
Как мы тестируем на SIBO?
Комплексный анализ стула — этот тест проверяет баланс бактерий в кишечном микробиоме. Он предоставляет информацию о чрезмерном росте бактерий, дрожжей, яйцеклеток и паразитов.
Дыхательный тест на водород / метан — Этот неинвазивный тест обычно проводится после 12 часов голодания и требует приема точного количества сахара и измерения вашего дыхания каждые 15 минут в течение 3 часов.Если в тонком кишечнике присутствуют бактерии, они в конечном итоге ферментируют сахар, производя водород, метан или и то, и другое, которые всасываются в кровоток и выдыхаются (что измеряется).
Анализ мочи на содержание органических кислот — Этот тест оценивает один образец мочи на предмет наличия побочных продуктов дрожжей и бактерий. Если он выходит за пределы допустимого диапазона, это может указывать на чрезмерный рост дрожжей или бактерий.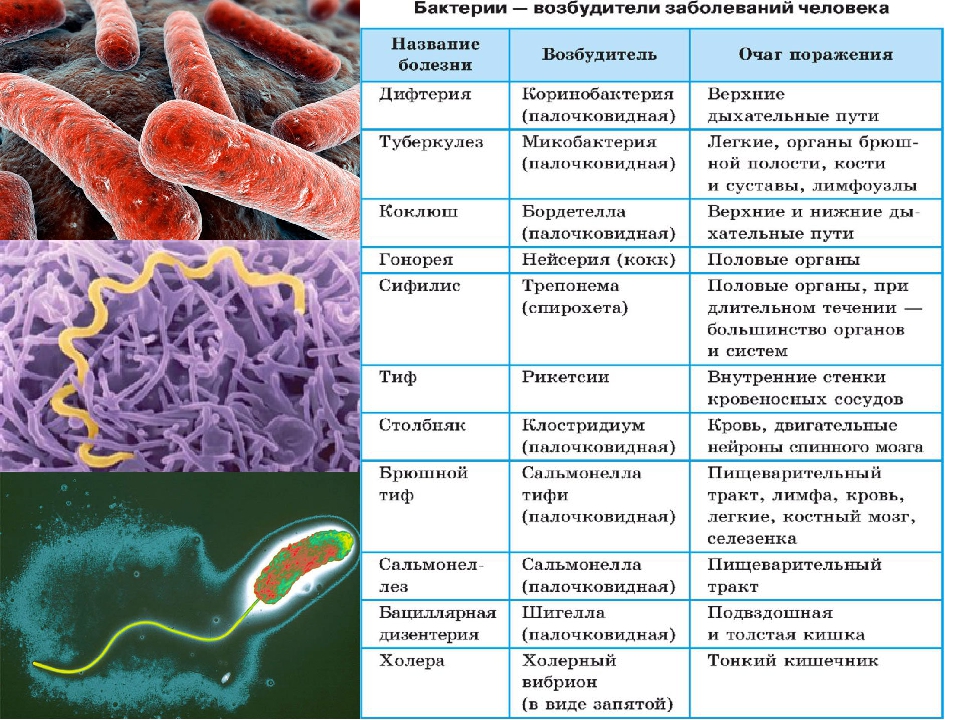
Как лечится СИБР?
Лечение SIBO — это многоэтапный процесс.Во-первых, от пациента требуется уменьшить количество продуктов, которые питают вредные бактерии, включая обработанный сахар, алкоголь и определенные углеводы. Затем мы убиваем вредные бактерии, используя ферменты биопленки и естественные средства уничтожения, которые могут включать различные травы и специи, такие как куркума, чеснок, орегано и имбирь. При необходимости мы используем антибиотики, поскольку они являются очень эффективным способом избавления от вредных бактерий из тонкого кишечника. Основные используемые антибиотики — Ксифаксан и Неомицин. Как только мы эффективно уничтожим вредные бактерии, мы хотим восстановить здоровье вашего кишечника и слизистой оболочки кишечника с помощью множества пробиотиков и целебных агентов.
Ремоделирование кишечника после инфекции, подобной SIBO, — непростая задача и может занять до нескольких месяцев. Процесс может быть трудным, но вам нужно сделать это только один раз, и вы хотите сделать это правильно. Наша клиника унаследовала множество пациентов, которые ранее выполняли некоторую работу со своим кишечником, но неэффективно. К сожалению, в результате остаются бактерии, у которых развилась устойчивость к антибиотикам и определенным естественным средствам уничтожения. Но не теряйте надежды, если это случилось с вами. Мы используем наши расширенные тесты функциональной медицины для оценки и формулирования других подходящих препаратов и антибиотиков при создании вашего индивидуального плана.
Наша клиника унаследовала множество пациентов, которые ранее выполняли некоторую работу со своим кишечником, но неэффективно. К сожалению, в результате остаются бактерии, у которых развилась устойчивость к антибиотикам и определенным естественным средствам уничтожения. Но не теряйте надежды, если это случилось с вами. Мы используем наши расширенные тесты функциональной медицины для оценки и формулирования других подходящих препаратов и антибиотиков при создании вашего индивидуального плана.
Симптомы SIBO
- Тошнота
- Вздутие живота
- Газ
- Боль в животе
- Спазмы в животе
- Диарея
- Запор (реже)
- Стул с неприятным запахом
- Рвота
- отрыжка
- Усталость
- Похудание
- Сыпь
- Розацеа
- Подавленное настроение
- Боль в суставах
- Угри
- Аллергия
- Чувствительность к продуктам питания, особенно к глютену, молочным продуктам и фруктозе
Какие факторы риска ищет наша клиника?
- Предыдущая операция, вызвавшая структурные изменения в кишечнике
- Использование антацидов
- Грыжа
- Неисправен илеоцекальный клапан
- Препараты, подавляющие иммунитет
- Напряжение
- Целиакия
- Старение
- Хронический панкреатит
- Диабет
- Диеты с высоким содержанием сахара, алкоголя, полуфабрикатов и углеводов
- Проблемы с моторикой желудочно-кишечного тракта (например, при диабетическом гастропарезе)
Если не лечить, СИБР может привести к таким заболеваниям, как:
- Депрессия из-за неправильного усвоения аминокислот, витаминов и минералов (все они необходимы для выработки нейромедиаторов)
- Дефицит железа
- Синдром хронической усталости
- Дырявый кишечник
- Аутоиммунные проблемы, такие как боли в суставах и сыпь
- Недоедание
- Анемия
- Потеря памяти
Если вы думаете, что у вас проблемы с SIBO, не стесняйтесь обращаться в наш офис, и мы будем рады назначить вам встречу. Мы помогли многим пациентам успешно восстановить здоровье их кишечника и надеемся на сотрудничество с вами. Мы заботимся о том, чтобы вы нашли первопричину своих симптомов, чтобы вы могли наслаждаться достойной жизнью!
Мы помогли многим пациентам успешно восстановить здоровье их кишечника и надеемся на сотрудничество с вами. Мы заботимся о том, чтобы вы нашли первопричину своих симптомов, чтобы вы могли наслаждаться достойной жизнью!
Пробиотиков: роль в лечении кишечных инфекций и воспалений?
Воспаление и инфекция часто сопровождаются дисбалансом микрофлоры кишечника. Затем может возникнуть сильная воспалительная реакция микрофлоры бактерий, что приведет к сохранению воспаления и дисфункции кишечного барьера.Пробиотические бактерии могут противодействовать воспалительному процессу, стабилизируя микробную среду кишечника и барьер проницаемости кишечника, а также усиливая деградацию энтеральных антигенов и изменяя их иммуногенность. Другим объяснением стабилизирующего действия кишечника может быть улучшение иммунологического барьера кишечника, в частности, кишечных IgA-ответов. Эффекты пробиотиков также могут быть опосредованы контролем баланса между про- и противовоспалительными цитокинами. Таким образом, изменение кишечной флоры для увеличения преобладания специфических непатогенных бактерий и, таким образом, для изменения кишечной среды можно рассматривать как альтернативу для достижения профилактических или терапевтических эффектов при кишечных инфекционных и воспалительных состояниях.
Таким образом, изменение кишечной флоры для увеличения преобладания специфических непатогенных бактерий и, таким образом, для изменения кишечной среды можно рассматривать как альтернативу для достижения профилактических или терапевтических эффектов при кишечных инфекционных и воспалительных состояниях.
ПРОБИОТИКА
Пробиотики — это живые микробные пищевые добавки или компоненты бактерий, которые, как было доказано, оказывают благотворное влияние на здоровье человека. 1 Ранее пробиотики отбирались в основном для обеспечения штаммов хороших условий обработки пищевых продуктов. Этот отбор был пересмотрен, чтобы включить здоровую микрофлору кишечника или слизистых оболочек человека в качестве основного источника новых штаммов, с дополнительным акцентом на выживаемость в кишечнике, стабильность кислоты и желчи и временную колонизацию поверхностей слизистой оболочки в кишечном тракте.Наиболее часто используемые роды, отвечающие этим критериям, — это лактобациллы и бифидобактерии.
Применение пробиотиков было дополнено концепцией пребиотиков (таблица 1). Наиболее часто используемые пребиотики — это углеводные субстраты, способные стимулировать компоненты нормальной микрофлоры кишечника, что может принести пользу здоровью хозяина. Однако пребиотики также могут быть неабсорбируемыми субстратами, которые стимулируют рост пробиотиков. Когда они применяются вместе, понятие определяется как синбиотик (таблица 1).
НОРМАЛЬНАЯ МИКРОФЛОРА ЖИВОТНОГО ЧЕЛОВЕКА — ИСТОЧНИК ПРОБИОТИКОВ
Нормальная микрофлора кишечника 2 — метаболически активный, но еще не изученный орган защиты хозяина. Установление нормальной флоры обеспечивает хозяину наиболее существенную антигенную нагрузку с сильным стимулирующим эффектом для созревания лимфоидной ткани, ассоциированной с кишечником. 3– 6 Хотя бактерии распространены по всему кишечнику, основная концентрация микробов и метаболическая активность обнаруживаются в толстом кишечнике. 1, 3 На основе данных культур было показано, что во рту обитает сложная микрофлора, состоящая из факультативных и строгих анаэробов, включая стрептококки, бактероиды, лактобациллы и дрожжи. Верхний отдел кишечника (желудок, двенадцатиперстная кишка, тощая кишка) имеет разреженную микрофлору с содержанием до 10 5 колониеобразующих единиц / мл. Начиная с подвздошной кишки, концентрация бактерий постепенно увеличивается, достигая 10 11 до 10 12 колониеобразующих единиц / г в толстой кишке.Было подсчитано, что существует не менее 500 различных видов микробов, хотя на количественной основе в нормальной микрофлоре человека, вероятно, преобладают 10-20 родов, например, Bacteroides , Lactobacillus , Clostridium , Fusobacterium , Bifidobacterium , Eubacterium , Peptococcus , Peptostreptococcus , Escherichia и Veillonella .
1, 3 На основе данных культур было показано, что во рту обитает сложная микрофлора, состоящая из факультативных и строгих анаэробов, включая стрептококки, бактероиды, лактобациллы и дрожжи. Верхний отдел кишечника (желудок, двенадцатиперстная кишка, тощая кишка) имеет разреженную микрофлору с содержанием до 10 5 колониеобразующих единиц / мл. Начиная с подвздошной кишки, концентрация бактерий постепенно увеличивается, достигая 10 11 до 10 12 колониеобразующих единиц / г в толстой кишке.Было подсчитано, что существует не менее 500 различных видов микробов, хотя на количественной основе в нормальной микрофлоре человека, вероятно, преобладают 10-20 родов, например, Bacteroides , Lactobacillus , Clostridium , Fusobacterium , Bifidobacterium , Eubacterium , Peptococcus , Peptostreptococcus , Escherichia и Veillonella .
Микробная колонизация начинается сразу после рождения. 3 Материнская микрофлора влагалища и кишечника является источником бактерий, колонизирующих кишечник новорожденного. Колонизация также определяется контактом с окружающей средой. На этом этапе преобладающими штаммами являются факультативные анаэробы, такие как энтеробактерии, колиформные бактерии и лактобациллы.
3 Материнская микрофлора влагалища и кишечника является источником бактерий, колонизирующих кишечник новорожденного. Колонизация также определяется контактом с окружающей средой. На этом этапе преобладающими штаммами являются факультативные анаэробы, такие как энтеробактерии, колиформные бактерии и лактобациллы.
Диета может оказывать большое влияние на состав и активность микрофлоры кишечника. Считается, что у младенцев естественное преобладание бифидобактерий наблюдается у тех, кто находится на грудном вскармливании, в то время как у младенцев, вскармливаемых смесью, профиль более сложен и похож на микрофлору взрослых, с энтеробактериями, лактобактериями, бактероидами, клостридиями, бифидобактериями и стрептококками. 7 После отъема состав микрофлоры постепенно изменяется, напоминая состав взрослой особи.
Местные бактерии иногда классифицируются как потенциально вредные или полезные для здоровья; большинство из них, однако, являются частью комменсальной флоры. Штаммы с полезными свойствами включают, в основном, бифидобактерии и лактобациллы. Наиболее распространенными пробиотиками (таблица 1) являются бифидобактерии и лактобациллы, и некоторые из них обладают мощными противовоспалительными свойствами. 8 Более того, этим же родам приписываются другие полезные аспекты, такие как стимуляция иммунного ответа и конкурентное исключение патогенов, посредством чего стимулируется неспецифическая резистентность хозяина к микробным патогенам.
Штаммы с полезными свойствами включают, в основном, бифидобактерии и лактобациллы. Наиболее распространенными пробиотиками (таблица 1) являются бифидобактерии и лактобациллы, и некоторые из них обладают мощными противовоспалительными свойствами. 8 Более того, этим же родам приписываются другие полезные аспекты, такие как стимуляция иммунного ответа и конкурентное исключение патогенов, посредством чего стимулируется неспецифическая резистентность хозяина к микробным патогенам.
ОБОСНОВАНИЕ ТЕРАПЕВТИЧЕСКОЙ МОДУЛЯЦИИ МИКРОЭКОЛОГИИ КИШЕЧНИКА ПРИ ВОСПАЛЕНИИ И ИНФЕКЦИИ КИШЕЧНИКА
Желудочно-кишечный барьер контролирует транспорт антигена в кишечнике. Целостность защиты слизистой оболочки кишечника зависит от ряда факторов как в просвете кишечника, так и в слизистой оболочке.Обычно эти факторы ограничивают колонизацию патогенами, устраняют чужеродные антигены, проникшие через слизистую оболочку, и регулируют антигенспецифические иммунные ответы. 9 Чтобы установить инфекцию или воспаление, антиген должен обойти этот впечатляющий набор защит кишечника.
9 Чтобы установить инфекцию или воспаление, антиген должен обойти этот впечатляющий набор защит кишечника.
Большинство встречающихся антигенов уже обработаны, когда они контактируют с поверхностью слизистой оболочки. Протеазы кишечных бактерий разрушают антигенную структуру, что является важным шагом на пути к невосприимчивости к диетическим антигенам.Регуляторные события кишечного иммунного ответа происходят в различных лимфоидных компартментах кишечника: брыжеечных лимфатических узлах, пейеровских бляшках, изолированных лимфатических фолликулах и изолированных Т-лимфоцитах в эпителии и собственной пластинке, а также в секреторных участках. Секреторные антитела IgA в кишечнике являются частью общей иммунной системы слизистых оболочек, которая включает дыхательные пути, слезные, слюнные и молочные железы. Следовательно, иммунный ответ, инициированный в лимфоидной ткани кишечника, может влиять на иммунные ответы на других поверхностях слизистой оболочки.
Оральная толерантность состоит из иммунологической гипореактивности к антигенам, встречающимся при кишечном пути, что является признаком регуляции иммунной системы кишечника. 10 Считается, что механизмы пероральной толерантности относятся не только к диетическим антигенам, но и к резидентной микрофлоре. 11 Толерантность опосредуется подавлением ответа лимфоцитов и клональной делецией и / или анергией на периферии. Были идентифицированы две специфические популяции регуляторных лимфоцитов: регуляторные Т-лимфоциты и Т-хелперные клетки 3.Они функционируют за счет продукции подавляющих цитокинов, включая интерлейкин 10 и трансформирующий фактор роста β соответственно. Было высказано предположение, что одним из основных механизмов, с помощью которого ассоциированная с кишечником лимфоидная ткань поддерживает гомеостаз, является регулирование местных цитокинов. Этот гомеостаз позволяет поддерживать толерантность к массивному воздействию антигенов, встречающемуся при кишечном пути: пероральная толерантность к диетическим антигенам и здоровые взаимодействия между резидентной микрофлорой кишечника и эпителием.Гомеостаз требует эффективных барьерных функций кишечника и целостности эпителия.
10 Считается, что механизмы пероральной толерантности относятся не только к диетическим антигенам, но и к резидентной микрофлоре. 11 Толерантность опосредуется подавлением ответа лимфоцитов и клональной делецией и / или анергией на периферии. Были идентифицированы две специфические популяции регуляторных лимфоцитов: регуляторные Т-лимфоциты и Т-хелперные клетки 3.Они функционируют за счет продукции подавляющих цитокинов, включая интерлейкин 10 и трансформирующий фактор роста β соответственно. Было высказано предположение, что одним из основных механизмов, с помощью которого ассоциированная с кишечником лимфоидная ткань поддерживает гомеостаз, является регулирование местных цитокинов. Этот гомеостаз позволяет поддерживать толерантность к массивному воздействию антигенов, встречающемуся при кишечном пути: пероральная толерантность к диетическим антигенам и здоровые взаимодействия между резидентной микрофлорой кишечника и эпителием.Гомеостаз требует эффективных барьерных функций кишечника и целостности эпителия.
Демонстрация того, что в отсутствие кишечной микрофлоры транспорт антигена увеличивается, указывает на то, что кишечная микрофлора является важным компонентом защитного барьера кишечника. 8 Начальное развитие состава кишечной микрофлоры считается ключевым фактором в развитии нормальных барьерных функций кишечника. 12 Воздействуя на развитие лимфоидной ткани кишечника в раннем возрасте, микрофлора кишечника управляет регуляцией системной и местной иммунной реактивности, включая гипореактивность к антигенам, полученным из микроорганизмов и пищи.Экспериментальные животные, лишенные интерлейкина 10 или трансформирующего фактора роста β, вызывают воспалительную реакцию слизистой оболочки на резидентную микрофлору кишечника. 13 Эти наблюдения отражают сложные взаимодействия между микрофлорой и слизистой оболочкой кишечника.
Роль кишечной микрофлоры в индукции оральной толерантности была исследована на стерильных мышах. 5 Было замечено, что в отличие от контрольных мышей, стерильные животные сохраняли свою тенденцию к системному иммунному ответу, например выработке антител IgE, при пероральном введении антигена. Отмена оральной толерантности была результатом отсутствия кишечной флоры. Аберрантный ответ IgE можно исправить путем восстановления микрофлоры на неонатальной стадии, но не в более позднем возрасте. Недавние исследования развития микрофлоры у младенцев, рожденных естественным путем, и младенцев, рожденных путем кесарева сечения, показали значительные различия в культивируемой микрофлоре. 14 Колонизация была связана с созреванием гуморальных иммунных механизмов, в частности циркулирующих клеток, секретирующих IgA и IgM, 6 , что отражает зависимость регуляции иммунного ответа слизистой оболочки от нормальной микрофлоры кишечника.
Отмена оральной толерантности была результатом отсутствия кишечной флоры. Аберрантный ответ IgE можно исправить путем восстановления микрофлоры на неонатальной стадии, но не в более позднем возрасте. Недавние исследования развития микрофлоры у младенцев, рожденных естественным путем, и младенцев, рожденных путем кесарева сечения, показали значительные различия в культивируемой микрофлоре. 14 Колонизация была связана с созреванием гуморальных иммунных механизмов, в частности циркулирующих клеток, секретирующих IgA и IgM, 6 , что отражает зависимость регуляции иммунного ответа слизистой оболочки от нормальной микрофлоры кишечника.
При некоторых воспалительных состояниях кишечника нарушается взаимодействие здорового хозяина и микроба, и воспаление сопровождается дисбалансом микрофлоры кишечника, поэтому иммунный ответ может быть вызван резидентными бактериями. Ротавирусная диарея связана с повышенной концентрацией фекальной уреазы, медиатора воспаления, который предрасполагает слизистую оболочку кишечника к пагубным воздействиям, вызванным аммиаком, и к чрезмерному росту бактерий, продуцирующих уреазу. 15 Duchmann и соавторы 11 показали, что здоровые люди толерантны к своей собственной микрофлоре и что такая толерантность отменяется у пациентов с воспалительным заболеванием кишечника.Об изменении микрофлоры кишечника сообщается у пациентов с ревматоидным артритом 16 и аллергическим заболеванием, 17, 18 , что подразумевает, что нормальная микрофлора кишечника представляет собой экосистему, отвечающую на воспаление в кишечнике и других частях человеческого тела.
15 Duchmann и соавторы 11 показали, что здоровые люди толерантны к своей собственной микрофлоре и что такая толерантность отменяется у пациентов с воспалительным заболеванием кишечника.Об изменении микрофлоры кишечника сообщается у пациентов с ревматоидным артритом 16 и аллергическим заболеванием, 17, 18 , что подразумевает, что нормальная микрофлора кишечника представляет собой экосистему, отвечающую на воспаление в кишечнике и других частях человеческого тела.
Предварительные данные исследований на людях указывают на зависимость от микрофлоры кишечника и нерегулируемого иммунного ответа на их антигенные структуры для развития воспалительных состояний кишечника, от аллергии до аутоиммунных и воспалительных заболеваний. 19 Нормализация свойств несбалансированной местной микрофлоры специфическими штаммами здоровой микрофлоры кишечника составляет основу пробиотической терапии (рис. 1). Пероральное введение пробиотиков может остановить порочный круг воспаления (рис.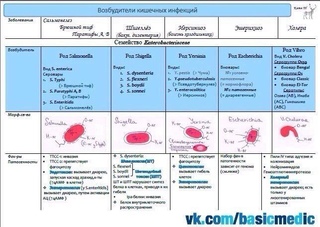 2). Эффективность пробиотиков проявляется в нормализации повышенной кишечной проницаемости и изменения микроэкологии кишечника, улучшении функций иммунологического барьера кишечника и облегчении воспалительной реакции кишечника.Целями пробиотической терапии являются клинические состояния, сопровождающиеся нарушением барьерной функции слизистой оболочки, особенно инфекционные и воспалительные заболевания.
2). Эффективность пробиотиков проявляется в нормализации повышенной кишечной проницаемости и изменения микроэкологии кишечника, улучшении функций иммунологического барьера кишечника и облегчении воспалительной реакции кишечника.Целями пробиотической терапии являются клинические состояния, сопровождающиеся нарушением барьерной функции слизистой оболочки, особенно инфекционные и воспалительные заболевания.
Рисунок 1
Эволюция микрофлоры кишечника и обоснование пробиотической терапии. Различные внутренние и внешние проблемы нарушают нормальный баланс здоровой микрофлоры кишечника. Их действие можно обратить вспять с помощью определенных штаммов здоровой микрофлоры кишечника.Нормализация свойств несбалансированной аборигенной микрофлоры специфическими штаммами здоровой микрофлоры кишечника составляет основу пробиотической терапии.
Рисунок 2
Воспаление кишечной микрофлоры. Воспаление может привести к тому, что состав и функция сбалансированной нормальной микрофлоры станут аберрантными и иммуногенными, что приведет к сохранению воспаления и дисфункции кишечного барьера. Пробиотические бактерии могут противодействовать воспалительному процессу, усиливая деградацию энтеральных антигенов, уменьшая секрецию медиаторов воспаления и способствуя нормализации местной флоры и исключению патогенов.
Воспаление может привести к тому, что состав и функция сбалансированной нормальной микрофлоры станут аберрантными и иммуногенными, что приведет к сохранению воспаления и дисфункции кишечного барьера. Пробиотические бактерии могут противодействовать воспалительному процессу, усиливая деградацию энтеральных антигенов, уменьшая секрецию медиаторов воспаления и способствуя нормализации местной флоры и исключению патогенов.
КЛИНИЧЕСКИЕ ДЕМОНСТРАЦИИ ПРОФИЛАКТИЧЕСКИХ И ТЕРАПЕВТИЧЕСКИХ ДЕЙСТВИЙ ПРОБИОТИКОВ
Потенциальные последствия нормальной микрофлоры кишечника для здоровья должны быть продемонстрированы хорошо контролируемыми клиническими исследованиями и исследованиями питания на людях. К настоящему времени в нескольких клинических исследованиях изучалось использование пробиотиков, в основном лактобацилл и бифидобактерий, в качестве пищевых добавок для профилактики и лечения различных инфекционных и воспалительных состояний желудочно-кишечного тракта.
Острый гастроэнтерит
Наиболее изученным заболеванием желудочно-кишечного тракта, которое лечат пробиотиками, является острая детская диарея. У пациентов, госпитализированных с острой ротавирусной диареей, штамм Lactobacillus GG (ATCC 53103) в виде ферментированного молока или лиофилизированного порошка значительно сократил продолжительность диареи по сравнению с группой плацебо, получавшей пастеризованный йогурт. 20 С тех пор результат был подтвержден в исследованиях, проведенных в аналогичной популяции 21 , а также в различных популяциях. 22 Эффект объясняется стабилизацией местной микрофлоры, 15 сокращением продолжительности выделения ротавируса, 23 и снижением повышенной проницаемости кишечника, вызванной ротавирусной инфекцией, 24 вместе со значительным увеличением IgA секретирующие клетки на ротавирус. 21, 25
В многоцентровом исследовании, проведенном рабочей группой Европейского общества детской гастроэнтерологии, гепатологии и питания, была проверена клиническая эффективность пробиотиков в случаях острой диареи, вызванной ротавирусом или другими патогенами. 26 При ротавирусной диарее наблюдалось значительное сокращение продолжительности диареи, в то время как при неспецифической или бактериальной диарее явного эффекта не обнаружено. Исследование показало безопасность введения пробиотика в растворе для пероральной регидратации и предотвращение развития ротавирусной диареи в сторону затяжного течения.
26 При ротавирусной диарее наблюдалось значительное сокращение продолжительности диареи, в то время как при неспецифической или бактериальной диарее явного эффекта не обнаружено. Исследование показало безопасность введения пробиотика в растворе для пероральной регидратации и предотвращение развития ротавирусной диареи в сторону затяжного течения.
Пробиотики также доказали свою эффективность в профилактике острой детской диареи. Сааведра и его коллеги 27 провели двойное слепое плацебо-контролируемое исследование с участием госпитализированных младенцев, которые были рандомизированы для получения стандартной детской смеси или той же смеси с добавлением Bifidobacterium bifidum (позже переименованного в Bifidobacterium lactis ) и Streptococcus thermophilus.В течение 17 месяцев наблюдения у 31% пациентов, получавших стандартную детскую смесь, но только у 7% пациентов, получавших смесь с пробиотиками, развился понос; Распространенность выделения ротавируса была значительно ниже у тех, кто получал смесь с пробиотиками. Добавление пробиотиков привело к значительному снижению заболеваемости диареей у недоедающих перуанских детей, находящихся под наблюдением в течение 15 месяцев. 28 Однако эффект был ограничен детьми, не находящимися на грудном вскармливании.Совсем недавно группа под руководством Шаевской оценила эффективность перорального введения Lactobacillus GG в профилактике нозокомиальной диареи у маленьких детей. 29 Восемьдесят один ребенок в возрасте от 1 до 36 месяцев, которые были госпитализированы по причинам, отличным от диареи, были включены в рандомизированное двойное слепое исследование для получения пробиотиков или плацебо на время их пребывания в больнице. Lactobacillus GG снижает частоту внутрибольничной диареи по сравнению с плацебо (6.7% против 33,3%; относительный риск 0,2, 95% доверительный интервал от 0,06 до 0,6). Распространенность ротавирусной инфекции была одинаковой в группах пробиотиков и плацебо. Однако использование пробиотиков по сравнению с плацебо значительно снижает риск ротавирусного гастроэнтерита, что позволяет предположить, что пробиотики снижают риск внутрибольничной диареи у младенцев.
Добавление пробиотиков привело к значительному снижению заболеваемости диареей у недоедающих перуанских детей, находящихся под наблюдением в течение 15 месяцев. 28 Однако эффект был ограничен детьми, не находящимися на грудном вскармливании.Совсем недавно группа под руководством Шаевской оценила эффективность перорального введения Lactobacillus GG в профилактике нозокомиальной диареи у маленьких детей. 29 Восемьдесят один ребенок в возрасте от 1 до 36 месяцев, которые были госпитализированы по причинам, отличным от диареи, были включены в рандомизированное двойное слепое исследование для получения пробиотиков или плацебо на время их пребывания в больнице. Lactobacillus GG снижает частоту внутрибольничной диареи по сравнению с плацебо (6.7% против 33,3%; относительный риск 0,2, 95% доверительный интервал от 0,06 до 0,6). Распространенность ротавирусной инфекции была одинаковой в группах пробиотиков и плацебо. Однако использование пробиотиков по сравнению с плацебо значительно снижает риск ротавирусного гастроэнтерита, что позволяет предположить, что пробиотики снижают риск внутрибольничной диареи у младенцев.
Воспалительное заболевание кишечника
Проглатывание пробиотических бактерий может стабилизировать иммунологический барьер в слизистой оболочке кишечника за счет снижения выработки местных провоспалительных цитокинов (рис. 2).Предварительные отчеты показали клиническую пользу в обращении вспять некоторых иммунологических нарушений, характерных для болезни Крона. 30 Однако большинство доказательств роли аберрантной микрофлоры кишечника в воспалительном заболевании кишечника получено на экспериментальных животных моделях. У трансгенных мышей с целевой делецией Т-клеточного рецептора (TCR α) спонтанно развивается колит в ответ на кишечную микрофлору. 31 Если организованная лимфоидная ткань, ассоциированная с кишечником, удаляется у мышей путем аппендэктомии в неонатальном возрасте, но не позднее, развивается толерантность к микрофлоре кишечника, и у мышей не развивается колит, что указывает на то, что первоначальный образец колонизации может определять последующие иммунологические процессы.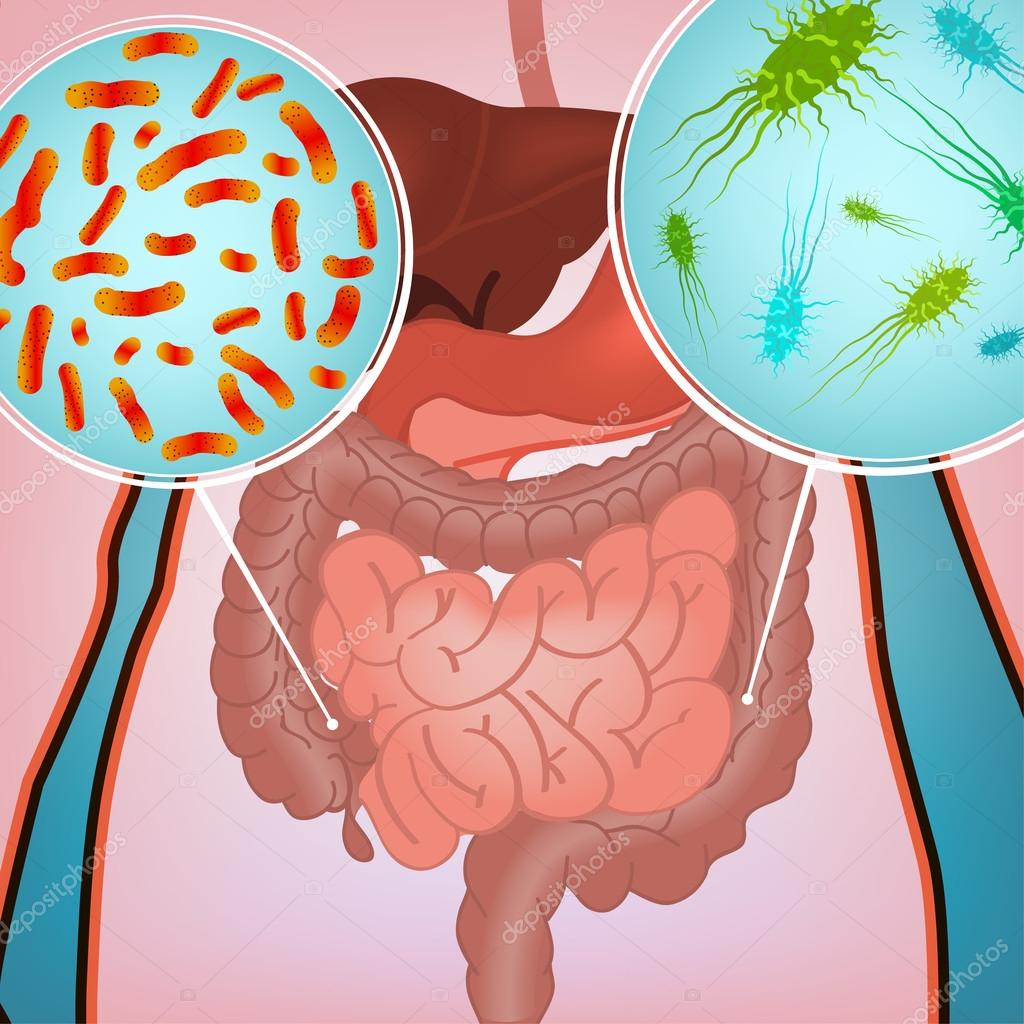 Многочисленные экспериментальные исследования действительно показали, что отсутствие или неадекватность сигналов созревания от микрофлоры кишечника приводит к уменьшению площади поверхности кишечника, изменению структуры ферментов слизистой оболочки, дефектам неиммунологического барьера кишечника, снижению способности к воспалительным реакциям, дефектам слизистой оболочки. Система IgA и отмена оральной толерантности. 1, 4– 6, 32, 33 Ограниченная доступность контролируемых данных по воспалительным заболеваниям человека требует дополнительных исследований влияния конкретных пробиотических штаммов на отдельные формы воспалительного заболевания кишечника и его осложнения.
Многочисленные экспериментальные исследования действительно показали, что отсутствие или неадекватность сигналов созревания от микрофлоры кишечника приводит к уменьшению площади поверхности кишечника, изменению структуры ферментов слизистой оболочки, дефектам неиммунологического барьера кишечника, снижению способности к воспалительным реакциям, дефектам слизистой оболочки. Система IgA и отмена оральной толерантности. 1, 4– 6, 32, 33 Ограниченная доступность контролируемых данных по воспалительным заболеваниям человека требует дополнительных исследований влияния конкретных пробиотических штаммов на отдельные формы воспалительного заболевания кишечника и его осложнения.
Аллергическая болезнь
Распространенность атопических заболеваний в западных обществах постоянно растет. Гигиеническая гипотеза аллергии предполагает, что быстрое увеличение атопии связано с уменьшением воздействия микробов в раннем возрасте. 34 Самый ранний и самый массовый источник такого воздействия связан с установлением микрофлоры кишечника. Регуляторная роль пробиотиков при аллергических заболеваниях человека была впервые подчеркнута при демонстрации подавляющего действия на пролиферацию лимфоцитов и интерлейкинов 4 поколения in vitro. 35, 36 Впоследствии было показано, что иммуновоспалительные ответы на пищевые антигены у аллергиков ослабляются пробиотиками, что частично связано с усилением продукции противовоспалительных цитокинов интерлейкина 10 37 и трансформирующего фактора роста β, 38 и частично для контроля аллергического воспаления в кишечнике. 39
34 Самый ранний и самый массовый источник такого воздействия связан с установлением микрофлоры кишечника. Регуляторная роль пробиотиков при аллергических заболеваниях человека была впервые подчеркнута при демонстрации подавляющего действия на пролиферацию лимфоцитов и интерлейкинов 4 поколения in vitro. 35, 36 Впоследствии было показано, что иммуновоспалительные ответы на пищевые антигены у аллергиков ослабляются пробиотиками, что частично связано с усилением продукции противовоспалительных цитокинов интерлейкина 10 37 и трансформирующего фактора роста β, 38 и частично для контроля аллергического воспаления в кишечнике. 39
В одном проспективном исследовании микрофлора кишечника 76 младенцев с высоким риском атопического заболевания была проанализирована в возрасте 3 недель и 3 месяцев с помощью обычного культивирования бактерий и двух независимых методов культивирования, газожидкостной хроматографии жирных кислот бактериальных клеток и количественной флуоресценции в гибридизация бактериальных клеток на месте./eColi87296113-56a9c2705f9b58b7d0febf6f.jpg) 40 Положительная кожная реакция на укол в 12 месяцев наблюдалась у 22/76 (29%) детей. В возрасте 3 недель профиль жирных кислот бактериальных клеток в образцах фекалий значительно отличался у младенцев с развивающейся и не развивающейся атопией (p = 0,005). При флуоресценции было обнаружено, что у атопиков гидридизации in situ больше клостридий и, как правило, меньше бифидобактерий в стуле, чем у неатопиков. Таким образом, было показано, что различия в микрофлоре кишечника новорожденных предшествуют развитию атопии, что свидетельствует о решающей роли баланса местных кишечных бактерий для созревания иммунитета человека к неатопическому типу.
40 Положительная кожная реакция на укол в 12 месяцев наблюдалась у 22/76 (29%) детей. В возрасте 3 недель профиль жирных кислот бактериальных клеток в образцах фекалий значительно отличался у младенцев с развивающейся и не развивающейся атопией (p = 0,005). При флуоресценции было обнаружено, что у атопиков гидридизации in situ больше клостридий и, как правило, меньше бифидобактерий в стуле, чем у неатопиков. Таким образом, было показано, что различия в микрофлоре кишечника новорожденных предшествуют развитию атопии, что свидетельствует о решающей роли баланса местных кишечных бактерий для созревания иммунитета человека к неатопическому типу.
Значительное улучшение клинического течения атопической экземы наблюдалось у младенцев, получавших диету с пробиотиками, и параллельно значительно снизились маркеры системного 38 и кишечного 39 аллергического воспаления. Аналогичные результаты были получены у взрослых с гиперчувствительностью к молоку. 41 У этих субъектов провокация молока в сочетании с пробиотическим штаммом предотвращала иммуновоспалительный ответ, характерный для ответа без пробиотиков.
41 У этих субъектов провокация молока в сочетании с пробиотическим штаммом предотвращала иммуновоспалительный ответ, характерный для ответа без пробиотиков.
Профилактический потенциал пробиотиков при атопическом заболевании недавно был продемонстрирован в двойном слепом плацебо-контролируемом исследовании. 42 Пробиотики, вводимые до и после родов в течение шести месяцев детям с высоким риском атопических заболеваний, позволили снизить распространенность атопической экземы вдвое по сравнению с таковой у младенцев, получавших плацебо.
ПРОБИОТИЧЕСКАЯ ТЕРАПИЯ: ТРЕБОВАНИЯ ДЛЯ СПЕЦИАЛЬНЫХ ШТАММОВ
Роль диеты для здоровья и благополучия изменилась по мере развития науки о питании.В настоящее время исследовательский интерес направлен на улучшение определенных физиологических функций, помимо влияния пищи на питание, включая возможность снижения риска заболеваний. Это также центр исследований пробиотиков. Будущие пробиотики будут иметь более тщательно проясненные механизмы либо для контроля конкретных физиологических процессов в развитии болезни в группах риска, либо для диетического управления конкретными заболеваниями. Пробиотические функциональные пищевые продукты можно определить как продукты, содержащие определенные пробиотические микробы с научно доказанной клинической эффективностью для конечного продукта, предназначенного для использования человеком.Разработка пробиотических функциональных пищевых продуктов требует новых критериев для штаммов, соответствующих конкретным показаниям.
Пробиотические функциональные пищевые продукты можно определить как продукты, содержащие определенные пробиотические микробы с научно доказанной клинической эффективностью для конечного продукта, предназначенного для использования человеком.Разработка пробиотических функциональных пищевых продуктов требует новых критериев для штаммов, соответствующих конкретным показаниям.
Предпосылки для действия пробиотиков включают выживание и адгезию к определенным областям желудочно-кишечного тракта и конкурентное исключение патогенов или вредных антигенов. Эти процессы могут зависеть, во-первых, от конкретных характеристик штамма, а во-вторых, от возраста и иммунологического состояния хозяина. Некоторые штаммы пробиотиков лучше прикрепляются к тонкой кишке, а некоторые специфически связываются с различными частями толстой кишки. 43 Вероятно, что штаммы также по-разному прилипают к здоровой и поврежденной слизистой оболочке. 44 Более того, было показано, что даже близкородственные пробиотики обладают различными свойствами in vitro, 45 , возможно, также объясняет различия в клинических эффектах. 21 Однако недавно было показано, что штаммы с более низкой общей связывающей способностью in vitro могут по-прежнему обеспечивать высокое конкурентное исключение патогенов или вредных бактерий, 46 , что указывает на необходимость дальнейшей характеристики адгезионных свойств для разработки методологий доклинического отбора кандидатов пробиотические штаммы.
21 Однако недавно было показано, что штаммы с более низкой общей связывающей способностью in vitro могут по-прежнему обеспечивать высокое конкурентное исключение патогенов или вредных бактерий, 46 , что указывает на необходимость дальнейшей характеристики адгезионных свойств для разработки методологий доклинического отбора кандидатов пробиотические штаммы.
Пополнение пробиотиками может также происходить за счет использования генетически модифицированных бактерий, проявляющих улучшенные или дополнительные функциональные свойства. К ним относятся пробиотики, созданные для производства противовоспалительных цитокинов. Сообщения об эффектах Lactococcus lactis , созданного для выработки интерлейкина 10 локально в слизистой оболочке кишечника мышей, указывают на большой потенциал для будущих терапевтических применений. 47 Другими методами модификации пробиотиков являются воздействие на микроорганизм сублетального стресса, такого как кислотные условия или тепло, с целью улучшения выживаемости в желудочно-кишечном тракте и повышения устойчивости к стрессу и, таким образом, повышения конкурентоспособности организма в отношении патогенов.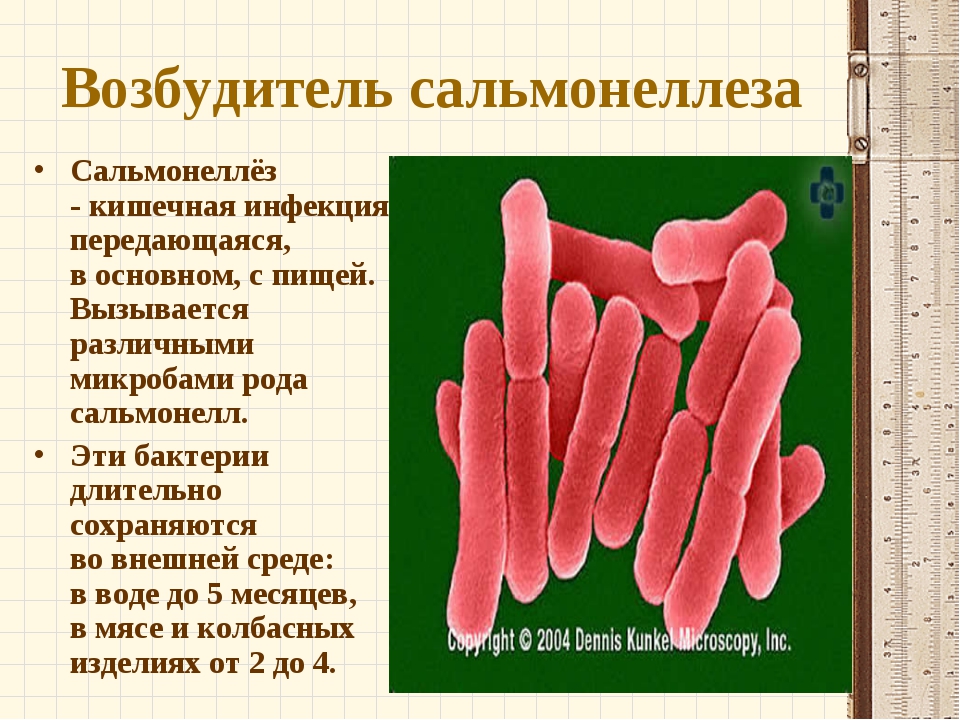 в кишечной среде. 48– 50 Инактивация также может иметь потенциал для модификации пробиотиков. Использование инактивированных вместо жизнеспособных микроорганизмов имело бы свои преимущества с точки зрения безопасности, более длительного срока хранения и меньшего взаимодействия с другими компонентами пищевого продукта. В целом инактивированные пробиотики клинически изучены в меньшей степени, чем их жизнеспособные аналоги. Было показано, что при лечении ротавирусной диареи инактивированные пробиотики столь же эффективны, как и активный в сокращении продолжительности эпизодов диареи, но их способность стимулировать иммунную защиту хозяина была слабее. 21 То же самое, по-видимому, применимо к бактериальным инфекциям, как показали исследования, в которых мышей подвергались воздействию Salmonella typhimurium 51 ; только жизнеспособные пробиотики стимулировали антигенспецифический иммунный ответ. Однако в некоторых случаях, таких как связывание кишечных токсинов, нежизнеспособные пробиотики могут быть даже более эффективными, чем жизнеспособные.
в кишечной среде. 48– 50 Инактивация также может иметь потенциал для модификации пробиотиков. Использование инактивированных вместо жизнеспособных микроорганизмов имело бы свои преимущества с точки зрения безопасности, более длительного срока хранения и меньшего взаимодействия с другими компонентами пищевого продукта. В целом инактивированные пробиотики клинически изучены в меньшей степени, чем их жизнеспособные аналоги. Было показано, что при лечении ротавирусной диареи инактивированные пробиотики столь же эффективны, как и активный в сокращении продолжительности эпизодов диареи, но их способность стимулировать иммунную защиту хозяина была слабее. 21 То же самое, по-видимому, применимо к бактериальным инфекциям, как показали исследования, в которых мышей подвергались воздействию Salmonella typhimurium 51 ; только жизнеспособные пробиотики стимулировали антигенспецифический иммунный ответ. Однако в некоторых случаях, таких как связывание кишечных токсинов, нежизнеспособные пробиотики могут быть даже более эффективными, чем жизнеспособные. 52
52
АСПЕКТЫ БЕЗОПАСНОСТИ ПРОБИОТИЧЕСКОЙ ТЕРАПИИ
Модификация микрофлоры кишечника представляет собой относительно новый метод лечения желудочно-кишечных заболеваний.Пробиотическая терапия с продемонстрированным эффектом для здоровья — это новый подход. Проглатывание большого количества жизнеспособных бактерий требует гарантии безопасности. Используемые в настоящее время пробиотики были признаны безопасными для использования в ферментированных пищевых продуктах, но в целом оценка безопасности микробных пищевых добавок недостаточно развита. 23
Некоторые исследования предполагают, что кишечник является источником заболевания, вызываемого бактериями, обычно проживающими в просвете кишечника, но иногда перемещающимися через эпителий кишечника. 54 Поскольку для использования пробиотиков было выбрано все больше адгезивных штаммов, способность выживать в условиях желудка и прилипать к кишечному эпителию может повлечь за собой риск транслокации. 55 Транслокация может усиливаться дисфункцией кишечного барьера, вызванной воспалением. Однако эффективные пробиотики могут обладать свойствами, которые противодействуют повреждению эпителия и, следовательно, снижают риск транслокации. Концепция транслокации подразумевает особые требования безопасности для микробов, используемых в оральной бактериотерапии.Среди них происхождение штамма, его видовые характеристики и стабильность. Допустимое происхождение — нормальная здоровая микрофлора кишечника человека.
55 Транслокация может усиливаться дисфункцией кишечного барьера, вызванной воспалением. Однако эффективные пробиотики могут обладать свойствами, которые противодействуют повреждению эпителия и, следовательно, снижают риск транслокации. Концепция транслокации подразумевает особые требования безопасности для микробов, используемых в оральной бактериотерапии.Среди них происхождение штамма, его видовые характеристики и стабильность. Допустимое происхождение — нормальная здоровая микрофлора кишечника человека.
Пробиотики были выбраны из представителей нормальной здоровой микрофлоры кишечника, большинство из которых принадлежит к Lactobacillus или Bifidobacterium , но недавно были введены новые пробиотические микробы из других видов и родов. Бифидобактерии и молочнокислые бактерии редко вызывают заболевание в результате транслокации, и их показатели безопасности в ферментированном молоке, овощах и злаках превосходны.Их естественное присутствие на всех поверхностях слизистой оболочки человека также свидетельствует об их безопасности.
Генетически модифицированные микроорганизмы в настоящее время не используются и не планируются для использования в пищевых продуктах. Однако быстрое развитие в этой области может изменить цели их применения. Самая важная проблема безопасности — это содержание маркеров устойчивости к антибиотикам в генетических компонентах модифицированных организмов. Процедуры отбора были разработаны, чтобы гарантировать отсутствие таких маркеров специально для лактококков. 52 В случае новых пробиотиков было предложено использование инактивированных бактерий, отчасти потому, что их потребление кажется более безопасным, чем использование жизнеспособных бактерий. Однако информации о влиянии методов инактивации на структуру и состав клеточной стенки мало. Например, методы термообработки могут вызвать ряд изменений в структурах клеточной стенки чувствительных пробиотиков, таким образом влияя, например, на иммуногенность и адгезионные свойства этих агентов.Такие заботы ограничиваются термической обработкой; пагубные эффекты также можно ожидать, например, в ответ на лиофилизацию и другие технологические обработки.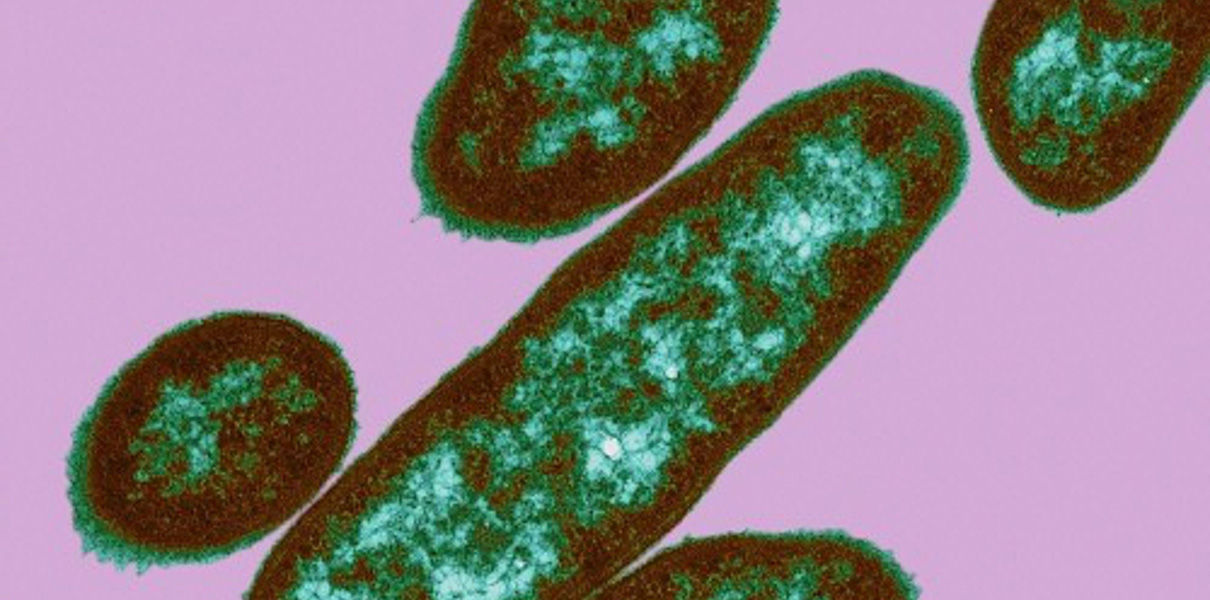
Взятые вместе, влияние и долгосрочное воздействие традиционных и новых пробиотиков на резидентную микрофлору кишечника и их метаболическую активность следует охарактеризовать в четко определенных надзорных исследованиях. Они должны включать характеристику конкретных иммуномодулирующих свойств штаммов для разработки конкретных клинических применений в определенных целевых популяциях.
ВЫВОДЫ
Пробиотики — это живые микробные пищевые добавки или компоненты бактерий, которые, как было доказано, оказывают благотворное влияние на здоровье человека. Недавние исследования расширили определение пробиотиков, поскольку было показано, что генетически модифицированные микробы и нежизнеспособные микробы могут в равной степени обладать таким потенциалом. Однако нормализация свойств несбалансированной аборигенной микрофлоры специфическими штаммами здоровой микрофлоры кишечника составляет основу пробиотической терапии.Было показано, что пероральное введение пробиотиков усиливает различные линии защиты кишечника: иммунную изоляцию, иммунную элиминацию и иммунную регуляцию.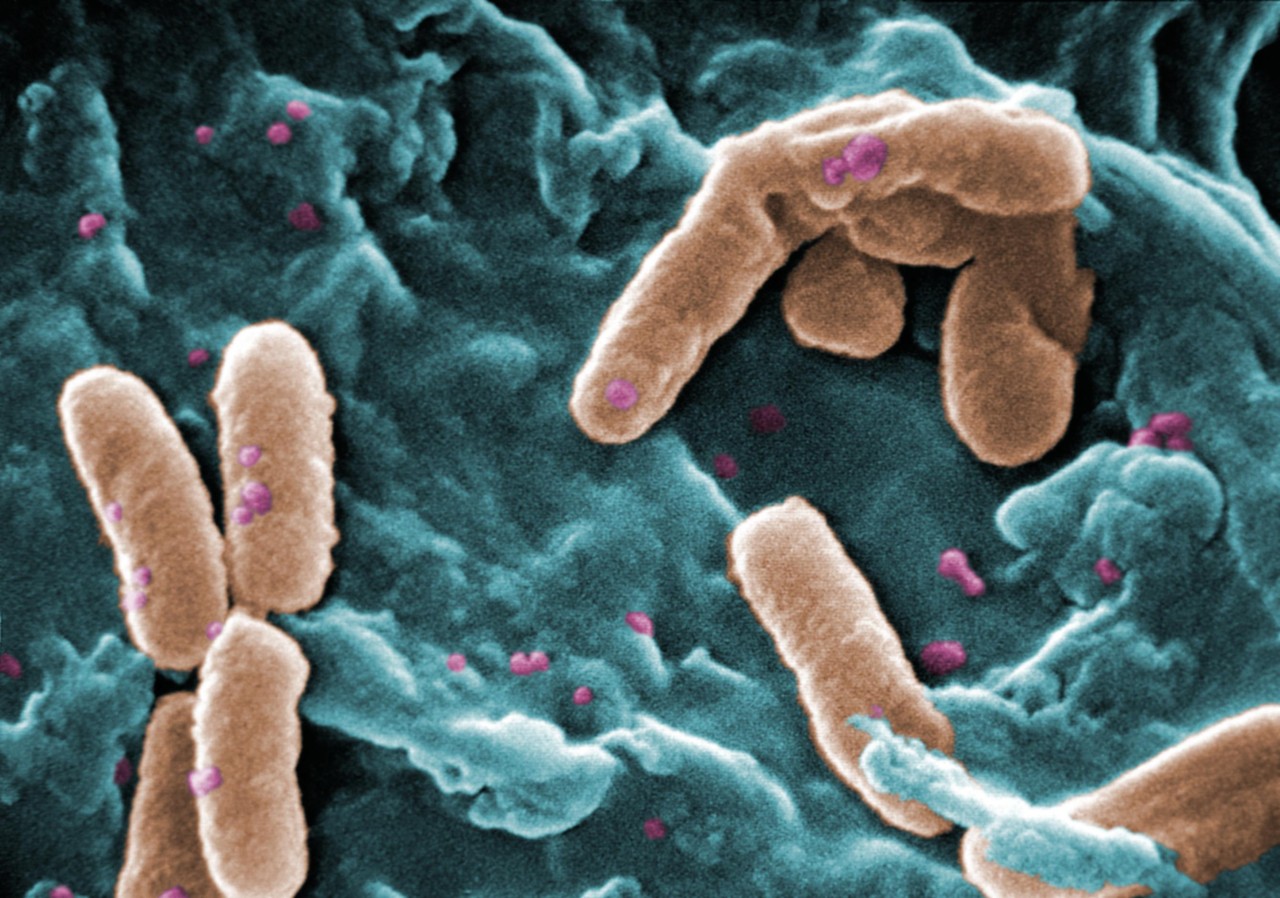 Пробиотики также стимулируют неспецифическую резистентность хозяина к микробным патогенам и тем самым способствуют их искоренению. Применение пробиотиков в настоящее время заключается в снижении риска заболеваний, связанных с дисфункцией кишечного барьера. Пробиотические свойства штаммов различаются; различные бактерии или их модификации / компоненты обладают определенными участками прикрепления, иммунологическими эффектами и различными эффектами в здоровой и воспаленной среде слизистой оболочки.В будущем такие специфические свойства пробиотиков могут быть использованы при разработке профилактических и терапевтических вмешательств для конкретных заболеваний.
Пробиотики также стимулируют неспецифическую резистентность хозяина к микробным патогенам и тем самым способствуют их искоренению. Применение пробиотиков в настоящее время заключается в снижении риска заболеваний, связанных с дисфункцией кишечного барьера. Пробиотические свойства штаммов различаются; различные бактерии или их модификации / компоненты обладают определенными участками прикрепления, иммунологическими эффектами и различными эффектами в здоровой и воспаленной среде слизистой оболочки.В будущем такие специфические свойства пробиотиков могут быть использованы при разработке профилактических и терапевтических вмешательств для конкретных заболеваний.
ССЫЛКИ
- ↵
Salminen S , Bouley C, Boutron-Ruault MC, и др. . Физиология и функции желудочно-кишечного тракта — цели для развития функционального питания. Br J Nutr1998; 80 (добавлено): 147–71.
- ↵
Берг РД .
 Аборигенная микрофлора желудочно-кишечного тракта. Тенденции Microbiol 1996; 4: 430–5.
Аборигенная микрофлора желудочно-кишечного тракта. Тенденции Microbiol 1996; 4: 430–5. - ↵
Бенно Ю. , Мицуока Т. Развитие микрофлоры кишечника у человека и животных. Бифидобактерии Microfi1986; 5: 13–25.
- ↵
Cebra JJ . Влияние микробиоты на развитие иммунной системы кишечника. Am J Clin Nutr1999; 69 (добавлено): 1046–51.
- ↵
Судо N , Савамура С., Танака К., и др. .Необходимость кишечной бактериальной флоры для развития системы продукции IgE, полностью восприимчивой к индукции оральной толерантности. J Immunol1997; 159: 1739–45.
- ↵
Grönlund MM , Arvilommi H, Kero P, et al . Важность кишечной колонизации в созревании гуморального иммунитета в раннем младенчестве: проспективное последующее исследование здоровых младенцев в возрасте 0–6 месяцев.
 Arch Dis Child Fetal Neonatal Ed2000; 83: F186–92.
Arch Dis Child Fetal Neonatal Ed2000; 83: F186–92. - ↵
Harmsen HJ , Wildeboer-Veloo AC, Raangs GC, и др. . Анализ развития кишечной флоры у детей, находящихся на грудном и искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr2000; 30: 61–7.
- ↵
Isolauri E , Sütas Y, Kankaanpää P, et al . Пробиотики: влияние на иммунитет. Am J Clin Nutr, 2001; 73: S444–50.
- ↵
Sanderson IR , Walker WA. Поглощение и транспорт макромолекул кишечником: возможная роль в клинических расстройствах (обновленная информация). Гастроэнтерология 1993; 104: 622–39.
- ↵
Weiner HL , van Rees EP. Переносимость слизистой оболочки. Immunol Lett1999; 69: 3–4.

- ↵
Duchmann R , Kaiser I, Hermann E, и др. .Существует толерантность к резидентной кишечной флоре, но она нарушается при активном воспалительном заболевании кишечника (ВЗК). Clin Exp Immunol1995; 102: 448–55.
- ↵
Hooper LV , Wong MH, Thelin A, и др. . Молекулярный анализ комменсальных взаимоотношений между хозяином и микробом в кишечнике. Science2001; 291: 881–4.
- ↵
Groux H , Powrie F. Регуляторные Т-клетки и воспалительное заболевание кишечника.Immunol Today1999; 20: 442–6.
- ↵
Grönlund MM , Lehtonen OP, Eerola E, et al . Фекальная микрофлора здоровых детей, рожденных разными способами родоразрешения: стойкие изменения микрофлоры кишечника после кесарева сечения.
 J Pediatr Gastroenterol Nutr, 1999; 28: 19-25.
J Pediatr Gastroenterol Nutr, 1999; 28: 19-25. - ↵
Isolauri E , Kaila M, Mykkänen H, et al . Пероральная бактериотерапия вирусного гастроэнтерита.Dig Dis Sci1994; 39: 2595–600.
- ↵
Малин М. , Верронен П., Миккянен Х., и др. . Повышенная активность бактериальной уреазы в фекалиях при ювенильном хроническом артрите: свидетельства изменения микрофлоры кишечника? Br J Rheumatol 1996; 35: 689–94.
- ↵
Apostolou E , Pelto L, Kirjavainen PV, et al . Различия в бактериальной флоре кишечника здоровых взрослых и взрослых с гиперчувствительностью к молоку, измеренные с помощью флуоресцентной гибридизации in situ.FEMS Immunol Med Microbiol2001; 30: 217–21.
- ↵
Björkstén B , Naaber P, Sepp E, et al .
 Микрофлора кишечника у детей 2-летнего возраста из Эстонии и Швеции с аллергией. Clin Exp Allergy 1999; 29: 342–6.
Микрофлора кишечника у детей 2-летнего возраста из Эстонии и Швеции с аллергией. Clin Exp Allergy 1999; 29: 342–6. - ↵
Isolauri E . Пробиотики при болезнях человека. Am J Clin Nutr, 2001; 73: 11425–65.
- ↵
Isolauri E , Juntunen M, Rautanen T, et al .Штамм Lactobacillus человека (Lactobacillus GG) способствует выздоровлению детей от острой диареи. Педиатрия, 1991; 88: 90–7.
- ↵
Majamaa H , Isolauri E, Saxelin M, и др. . Молочнокислые бактерии в лечении острого ротавирусного гастроэнтерита. J Pediatr Gastroenterol Nutr, 1995; 20: 333–9.
- ↵
Pant AR , Graham SM, Allen SJ, и др. .Lactobacillus GG и острая диарея у детей раннего возраста в тропиках. J Trop Pediatr 1996; 42: 162–5.

- ↵
Guarino A , Canani RB, Spagnuolo MI, и др. . Пероральная бактериальная терапия сокращает продолжительность симптомов и выведение вирусов у детей с легкой диареей. J Pediatr Gastroenterol Nutr, 1997; 25: 516–19.
- ↵
Isolauri E , Kaila M, Arvola T, et al .Диета при ротавирусном энтерите влияет на проницаемость тощей кишки для макромолекул у крыс-сосунов. Педиатр Res1993; 33: 548–53.
- ↵
Kaila M , Isolauri E, Soppi E, и др. . Усиление ответа циркулирующих клеток, секретирующих антитела, при диарее человека с помощью штамма лактобацилл человека. Педиатр Res1992; 32: 141–4.
- ↵
Guandalini S , Pensabene L, Zikri MA, и др. .Lactobacillus GG, вводимый в растворе для пероральной регидратации детям с острой диареей: многоцентровое европейское исследование.
 J Pediatr Gastroenterol Nutr2000; 30: 54–60.
J Pediatr Gastroenterol Nutr2000; 30: 54–60. - ↵
Saavedra JM , Bauman NA, Oung I, et al . Кормление младенцев в больнице Bifidobacterium bifidum и Streptococcus thermophilus для профилактики диареи и выделения ротавируса. Lancet1994; 344: 1046–9.
- ↵
Оберхельман Р.А. , Гилман Р.Х., Шин П., и др. .Плацебо-контролируемое испытание Lactobacillus GG для предотвращения диареи у недоедающих перуанских детей. J Pediatr1999; 134: 15–20.
- ↵
Szajewska H , Kotowska M, Mrukowicz JZ, et al . Эффективность Lactobacillus GG в профилактике нозокомиальной диареи у младенцев. Журнал Педиатр, 2001; 138: 361–5.
- ↵
Малин М , Суомалайнен Х., Сакселин М, и др. .Стимулирование иммунного ответа IgA у пациентов с болезнью Крона с помощью пероральной бактериотерапии Lactobacillus GG.
 Энн Нутр Метаб 1996; 40: 137–45.
Энн Нутр Метаб 1996; 40: 137–45. - ↵
Mombaerts P , Mizoguchi E, Grusby MJ, и др. . Спонтанное развитие воспалительного заболевания кишечника у мышей с мутантными Т-клеточными рецепторами. Cell1993; 75: 275–82.
- ↵
Brandtzaeg P . Развитие иммунной системы слизистых оболочек человека.В: Bindels JG, Goedhart AC, Visser HKA, eds. Последние разработки в области детского питания . Великобритания: Kluwer Academic Publishers, 1996: 349–76.
- ↵
Гаскинс HR . Иммунологические аспекты взаимодействия хозяина / микробиоты в кишечном эпителии. В: Mackie RI, White BA, Isaacson RE, eds. Желудочно-кишечная микробиология . Нью-Йорк: International Thomson Publishing; 1997: 537–87.
- ↵
Страчан Д.П. .Сенная лихорадка, гигиена и размер домочадца.
 BMJ1989; 299: 1259–60.
BMJ1989; 299: 1259–60. - ↵
Sütas Y , Soppi E, Korhonen H, et al . Подавление пролиферации лимфоцитов in vitro с помощью бычьих казеинов, гидролизованных ферментами, производными Lactobacillus GG. J. Allergy Clin Immunol. 1996; 98: 216–24.
- ↵
Sütas Y , Hurme M, Isolauri E. Подавление продукции IL-4, индуцированной антителами против CD3, бычьими казеинами, гидролизованными ферментами, производными Lactobacillus GG.Scand J Immunol1996; 43: 687–9.
- ↵
Pessi T , Sütas Y, Hurme M, и др. . Поколение интерлейкина-10 у детей с атопией после перорального приема Lactobacillus rhamnosus GG. Clin Exp Allergy 2000; 30: 1804-8.
- ↵
Isolauri E , Arvola T, Sütas Y, et al . Пробиотики в лечении атопической экземы.
 Clin Exp Allergy 2000; 30: 1605–10.
Clin Exp Allergy 2000; 30: 1605–10. - ↵
Majamaa H , Isolauri E.Пробиотики: новый подход к лечению пищевой аллергии. J. Allergy Clin Immunol. 1997; 99: 179–86.
- ↵
Каллиомяки М. , Кирьявайнен П., Эерола Э, и др. . Отчетливые закономерности микрофлоры кишечника новорожденных у младенцев, у которых атопия развивалась и не развивалась. J Allergy Clin Immunol, 2001; 107: 129–34.
- ↵
Pelto L , Isolauri E, Lilius EM, et al .Пробиотические бактерии подавляют вызванную молоком воспалительную реакцию у субъектов с гиперчувствительностью к молоку, но обладают иммуностимулирующим эффектом у здоровых субъектов. Clin Exp Allergy 1998; 28: 1474–9.
- ↵
Каллиомяки М. , Салминен С., Керо П.
 , и др. . Пробиотики в первичной профилактике атопического заболевания: рандомизированное плацебо-контролируемое исследование. Lancet2001; 357: 1076–9.
, и др. . Пробиотики в первичной профилактике атопического заболевания: рандомизированное плацебо-контролируемое исследование. Lancet2001; 357: 1076–9. - ↵
Цзинь Л. , Маркварт Р., Чжао Х.Штамм Enterococcus faecium (18C23) подавляет адгезию энтеротоксигенной Escerichia coli K88 к слизи тонкого кишечника свиней. Appl Environ Microbiol2000; 66: 4200–4.
- ↵
Мао Y , Нобаек С., Касрави Б., и др. . Влияние штаммов Lactobacillus и овсяных отрубей на вызванный метотрексатом энтероколит у крыс. Гастроэнтерология 1996; 111: 334–44.
- ↵
Ouwehand AC , Kirjavainen PV, Grönlund MM, et al .Адгезия пробиотических микроорганизмов к кишечной слизи. Int Dairy J1999; 9: 623–30.
- ↵
Ли Ю.К.
 , Лим CY, Teng WL, и др. . Качественный подход к изучению адгезии молочнокислых бактерий на клетках кишечника и их конкуренции с энтеробактериями. Appl Environ Microbiol2000; 66: 3692–7.
, Лим CY, Teng WL, и др. . Качественный подход к изучению адгезии молочнокислых бактерий на клетках кишечника и их конкуренции с энтеробактериями. Appl Environ Microbiol2000; 66: 3692–7. - ↵
Steidler L , Hans W, Schotte L, и др. .Лечение мышиного колита Lactococcus lactis, секретирующим интерлейкин-10. Science2000; 289: 1352–5.
- ↵
Hartke A , Bouché S, Giard JC, и др. . Реакция молочнокислого стресса на Lactococcus lactis subsp. lactis. Curr Microbiol 1996; 33: 194–9.
Hartke A , Bouché S, Gansel X, и др. . Устойчивость к стрессу, вызванная голоданием, у Lactococcus lactis subsp.lactis IL1403. Appl Environ Microbiol1994; 60: 3474–8.
- ↵
Kets EPW , Teunissen PJM, de Bont JAM.
 Влияние совместимых растворенных веществ на выживаемость молочнокислых бактерий, подвергнутых сушке. Appl Environ Microbiol 1996; 62: 259–61.
Влияние совместимых растворенных веществ на выживаемость молочнокислых бактерий, подвергнутых сушке. Appl Environ Microbiol 1996; 62: 259–61. - ↵
Perdigón G , Alvarez S, Gobbato N, et al . Сравнительный эффект адъювантной способности Lactobacillus casei и липополисахарида на секреторный антительный ответ кишечника и устойчивость к инфекции сальмонеллы у мышей.Food Agric Immunol, 1995; 7: 283–94.
- ↵
Эль-Незами Н , Канкаанпяя П., Салминен С., и др. . Физико-химические изменения повышают способность молочных штаммов молочнокислых бактерий удалять афлатоксин из загрязненной среды. J. Food Protect, 1998; 61: 466–8.
Salminen S , фон Райт А., Морелли Л., и др. . Демонстрация безопасности пробиотиков — обзор.Int J Food Microbiol 1998; 44: 93–106.


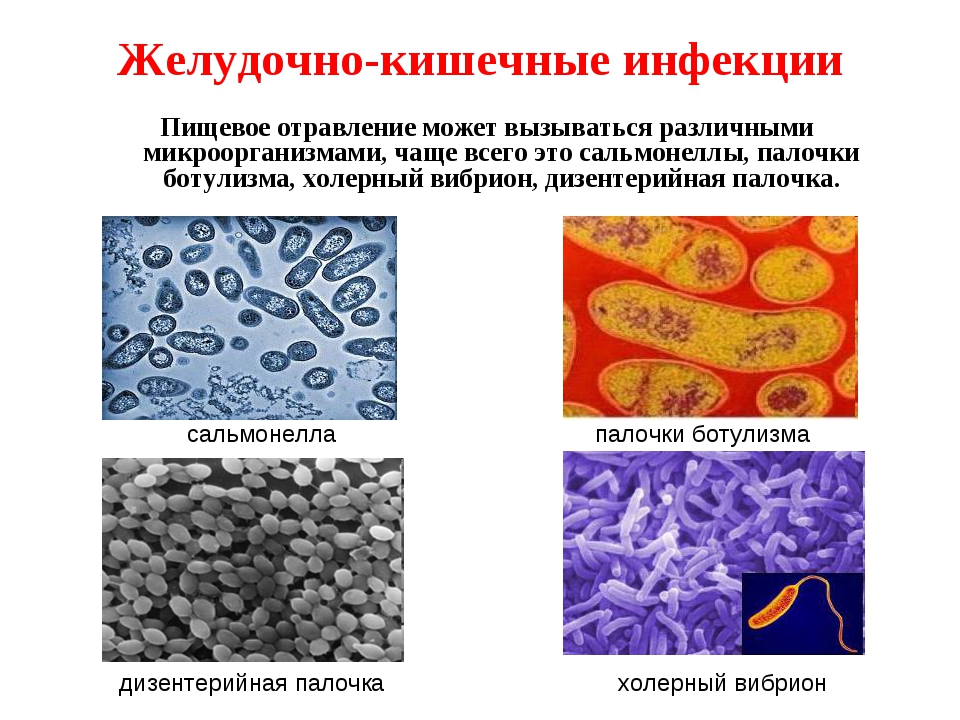 Появление примеси крови в стуле служит поводом для немедленного обращения к врачу.
Появление примеси крови в стуле служит поводом для немедленного обращения к врачу.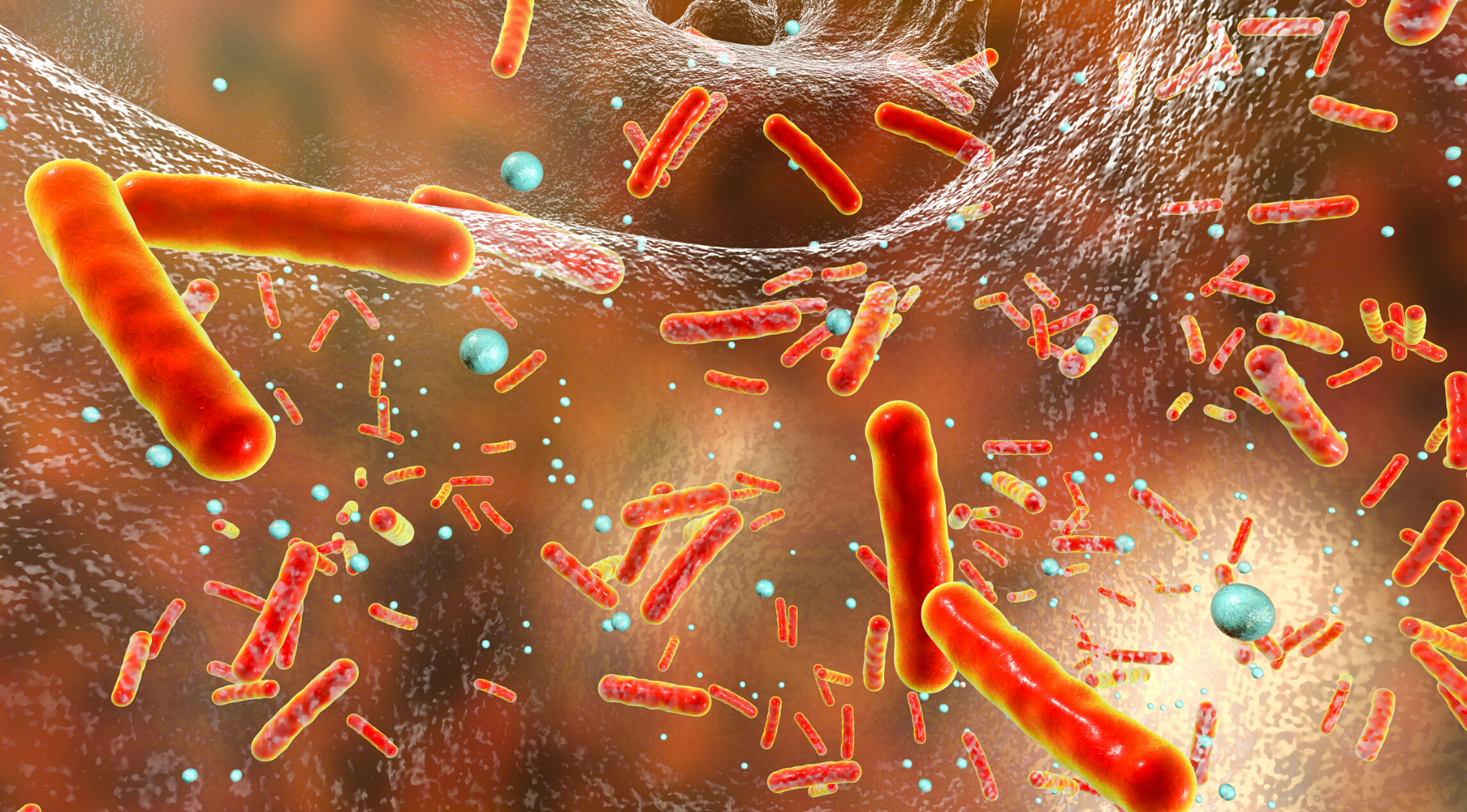


 Это может произойти, если у вас кровоточащая опухоль.
Это может произойти, если у вас кровоточащая опухоль. Скорее всего, вы возьмете как минимум двоих из этой группы.
Скорее всего, вы возьмете как минимум двоих из этой группы. Когда это происходит, могут прижиться бактерии, вызывающие заболевание.
Когда это происходит, могут прижиться бактерии, вызывающие заболевание. PI-IBS представляет собой четкую связь между воздействием бактериальной инфекции (например, из-за зараженной пищи или воды) и IBS у тех, кто кажется особенно подверженным риску.
PI-IBS представляет собой четкую связь между воздействием бактериальной инфекции (например, из-за зараженной пищи или воды) и IBS у тех, кто кажется особенно подверженным риску.
 Аборигенная микрофлора желудочно-кишечного тракта. Тенденции Microbiol 1996; 4: 430–5.
Аборигенная микрофлора желудочно-кишечного тракта. Тенденции Microbiol 1996; 4: 430–5.  Arch Dis Child Fetal Neonatal Ed2000; 83: F186–92.
Arch Dis Child Fetal Neonatal Ed2000; 83: F186–92.
 J Pediatr Gastroenterol Nutr, 1999; 28: 19-25.
J Pediatr Gastroenterol Nutr, 1999; 28: 19-25.  Микрофлора кишечника у детей 2-летнего возраста из Эстонии и Швеции с аллергией. Clin Exp Allergy 1999; 29: 342–6.
Микрофлора кишечника у детей 2-летнего возраста из Эстонии и Швеции с аллергией. Clin Exp Allergy 1999; 29: 342–6. 
 J Pediatr Gastroenterol Nutr2000; 30: 54–60.
J Pediatr Gastroenterol Nutr2000; 30: 54–60.  Энн Нутр Метаб 1996; 40: 137–45.
Энн Нутр Метаб 1996; 40: 137–45.  BMJ1989; 299: 1259–60.
BMJ1989; 299: 1259–60.  Clin Exp Allergy 2000; 30: 1605–10.
Clin Exp Allergy 2000; 30: 1605–10.  , и др. . Пробиотики в первичной профилактике атопического заболевания: рандомизированное плацебо-контролируемое исследование. Lancet2001; 357: 1076–9.
, и др. . Пробиотики в первичной профилактике атопического заболевания: рандомизированное плацебо-контролируемое исследование. Lancet2001; 357: 1076–9.  , Лим CY, Teng WL, и др. . Качественный подход к изучению адгезии молочнокислых бактерий на клетках кишечника и их конкуренции с энтеробактериями. Appl Environ Microbiol2000; 66: 3692–7.
, Лим CY, Teng WL, и др. . Качественный подход к изучению адгезии молочнокислых бактерий на клетках кишечника и их конкуренции с энтеробактериями. Appl Environ Microbiol2000; 66: 3692–7.  Влияние совместимых растворенных веществ на выживаемость молочнокислых бактерий, подвергнутых сушке. Appl Environ Microbiol 1996; 62: 259–61.
Влияние совместимых растворенных веществ на выживаемость молочнокислых бактерий, подвергнутых сушке. Appl Environ Microbiol 1996; 62: 259–61.