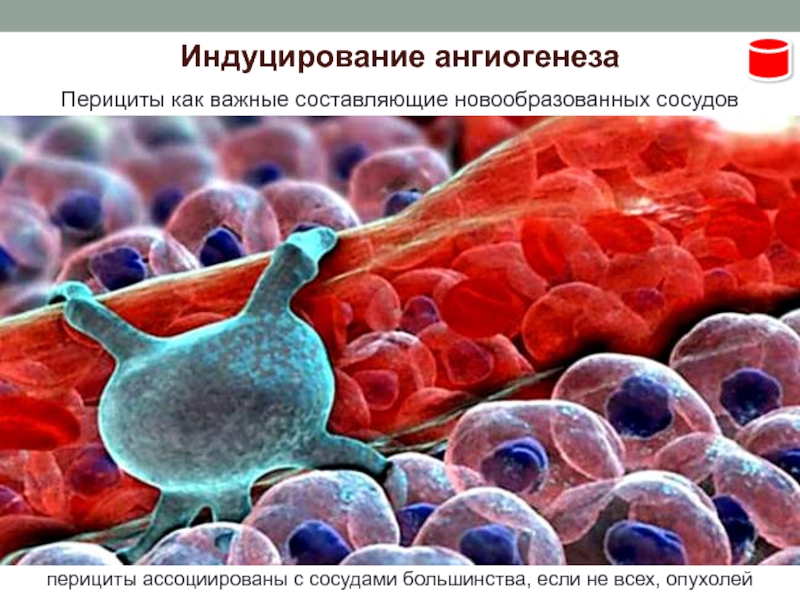
09.07.2001 Человеческие эмбрионы как источник ″биологических запчастей″ | Научные открытия и технические новинки из Германии | DW
Никакая другая тематика, связанная с биологией и генетикой, не вызывала в Германии за последние годы столь сильного общественного резонанса, как проблемы, касающиеся исследования и использования в научных целях человеческих эмбрионов.
По мнению экспертов, медицинская целесообразность вступила тут в острый конфликт с этическими принципами. Немецкие законодатели — в отличие от своих коллег в ряде других развитых странах — пока не готовы дать зелёный свет развитию этого направления исследований, хотя и признают его важность. В последние недели и дни дискуссия резко обострилась: предметом дебатов стал вопрос об импорте в Германию так называемых эмбриональных стволовых клеток человека. Репортаж Виталия Волкова:
Сегодня немецкие специалисты в области генетики, молекулярной биологии и репродуктивной медицины, ограниченные в своих исследованиях более жёсткими, чем в большинстве других стран, законами, с нетерпением ждут решения чрезвычайно важного, но весьма щекотливого вопроса: можно ли будет в ФРГ работать с эмбриональными стволовыми клетками, завезёнными из-за границы. Хотя формально немецкий закон о защите эмбрионов не запрещает импорт таких клеток, на практике намерение двух ведущих биологов Боннского университета — Оливера Брюстле и Отмара Вистлера — завезти их из Израиля вызвало небывалую по накалу общественно-политическую дискуссию. В итоге жарких парламентских дебатов Бундестаг образовал специальную комиссию по вопросам этики в науке — в придачу к уже существующему Национальному совету по тем же вопросам. Но к немалому разочарованию боннских — да и не только боннских — биологов, решение о том, этичен ли импорт эмбриональных стволовых клеток, отложен до конца года, и совершенно ясно, что ни о каких изменениях в законе о защите эмбрионов до очередных парламентских выборов в Германии не может быть и речи.
Но что же такое эмбриональные стволовые клетки? Это клетки эмбриона, не достигшие в своём развитии стадии так называемой дифференцировки, то есть специализации, и следовательно, способные под воздействием тех или иных факторов превратиться в клетки различных тканей и органов более чем 2-х сотен типов. Собственно говоря, именно благодаря этому свойству из эмбриона, поначалу состоящего из одинаковых клеток, и формируется организм с самыми разными типами клеток. Понятно, что биологи проявляют большой интерес к исследованию свойств эмбриональных стволовых клеток, поскольку в случае успеха эти клетки откроют совершенно новые возможности перед медициной. Руди Баллинг, член Научного общества биотехнологических исследований, говорит:
Собственно говоря, именно благодаря этому свойству из эмбриона, поначалу состоящего из одинаковых клеток, и формируется организм с самыми разными типами клеток. Понятно, что биологи проявляют большой интерес к исследованию свойств эмбриональных стволовых клеток, поскольку в случае успеха эти клетки откроют совершенно новые возможности перед медициной. Руди Баллинг, член Научного общества биотехнологических исследований, говорит:
- «Самое главное будет состоять в том, что мы сможем приступить к внедрению новых технологий в хирургии и обеспечить регенерацию тех или иных органов. Если в результате заболевания выйдут из строя какие-то группы клеток, пусть даже узкоспециализированных — ну, скажем, вследствие вирусной инфекция погибнут вырабатывающие инсулин бета-клетки поджелудочной железы, — то мы сможем их заменить. Мы внедрим стволовые клетки в повреждённый орган, и он снова сможет выполнять свою утраченную было функцию.»
Сам процесс культивирования эмбриональных стволовых клеток, на первый взгляд, не так уж сложен: он состоит в извлечении стволовой клетки из эмбриона и размножении её в специальной питательной среде. Полученные таким образом клеточные культуры — они именуются «клеточными линиями» — призваны обеспечивать экспериментальным материалом исследовательские лаборатории в разных странах мира. Однако опыт свидетельствует о том, что выращивание эмбриональных стволовых клеток — дело исключительно тонкое. Не случайно во всём мире существует лишь 3 научных центра, овладевших этим высоким искусством. И один из этих центров — Европейская лаборатория молекулярной биологии в Гейдельберге. Так что исследования в области эмбриональных стволовых клеток вполне успешно ведутся и в Германии — только объектом изучения здесь являются не человеческие, а мышиные эмбрионы. Созданием клеточных линий на базе мышиных эмбрионов гейдельбергские специалисты занимаются уже многие годы. В стенах лаборатории осуществляется весь производственный цикл, включая изготовление уникальных инструментов, необходимых для «выуживания» подходящих клеток из эмбрионов. Научная сотрудница лаборатории Кристина Винтерстен говорит:
Научная сотрудница лаборатории Кристина Винтерстен говорит:
- «Прежде всего, для создания «клеточной линии» необходимо располагать очень хорошей лабораторной базой — а это требует больших затрат денег, времени и труда. Однако ко всему этому нужно ещё и везение, потому что лишь из очень немногих эмбрионов удаётся получить стволовые клетки, пригодные для создания линии.»
На практике отобрать необходимые для создания «клеточной линии» эмбрионы в стадии так называемой «бластоцисты» совсем не просто — одни кандидаты ещё не дозрели, другие перезрели — всё это определяется методом проб и ошибок, сказать заранее, из какого эмбриона удастся получить хорошую стволовую клетку, учёные не могут. Затем кандидатов помещают в специальную питательную среду. Там им надлежит расти и делиться, но так, чтобы при этом ни в коем случае не вступить в стадию дифференцировки. Кристина Винтерстен поясняет:
- «Они растут маленькими колониями, плотность которых должна поддерживаться на оптимальном уровне. Слишком большая плотность колонии приводит к дифференцировке, а слишком маленькая — к тому, что клетки просто перестают расти и делиться. Для нас это означает, что мы дважды в день проверяем колонию, как минимум раз в день меняем питательную среду и раз в два дня «перебираем», «пассажируем» линию.»
Каждая колония состоит примерно из двух сотен клеток. Время от времени несколько колоний сливают вместе и снова разъединяют, и результатом такого многократного и регулярного «пассажирования» теоретически должно стать образование клеточной линии, способной годами производить всё новые и новые стволовые клетки. Однако на практике после определённого количества таких «пассажей» клетки по неизвестной причине теряют «плюрипотентность», то есть лишаются способности к дифференцировке. Поэтому для поддержания производства требуется постоянно создавать свежие клеточные линии. Но ни большой опыт, ни строгое соблюдение технологии не могут гарантировать успех. Кристина Винтерстен приводит такие цифры:
- «Вот моя последняя работа: я начала примерно с сотни эмбрионов, и на их основе мне удалось заложить 9 линий — на первый взгляд, немного, но это ещё очень хорошо, — и лишь про одну из этих линий я могу сказать, что она обладает потенциалом для производства полноценных стволовых клеток.
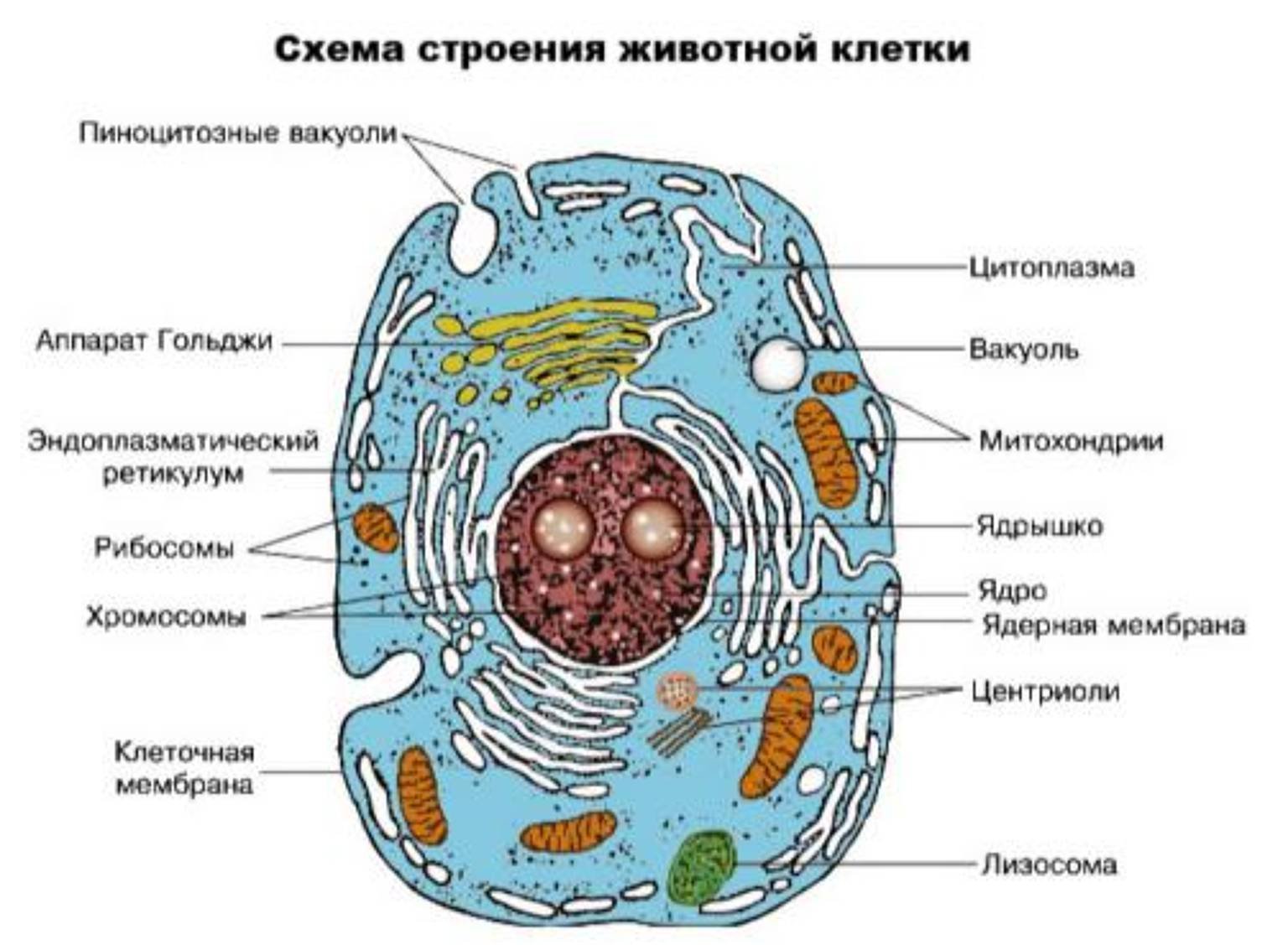 Это значит, что в них при размножении будет сохраняться полный набор хромосом. Не говоря уже о способности к дифференцировке и образованию специфических клеток различных тканей.»
Это значит, что в них при размножении будет сохраняться полный набор хромосом. Не говоря уже о способности к дифференцировке и образованию специфических клеток различных тканей.»Однако как на самом деле поведут себя стволовые клетки, предсказать невозможно. Так что культивированная по всем правилам искусства клеточная линия вполне может оказаться непригодной для лабораторных экспериментов. Матиас Трайер, коллега Кристины Винтерстен, поясняет:
- «Исследования мышиных стволовых клеток насчитывают уже около 20-ти лет, и можно сказать, что на сегодняшний день мы знаем о них немало. Мы научились управлять их дифференцировкой настолько, что уже можем in vitro, в пробирке, получать нервные клетки и клетки мышечной ткани. На днях появилось сообщение, что кому-то удалось вне организма вырастить клетки поджелудочной железы. Однако мы по-прежнему знаем крайне мало о молекулярных механизмах, лежащих в основе этих процессов, и потребуется ещё множество исследований и экспериментов, чтобы можно было говорить о надёжном и хорошо управляемом производстве стволовых клеток.»
Таким образом, с точки зрения Матиаса Трайера, оптимизм тех, кто намерен в самом ближайшем будущем начать получать — уже из человеческих эмбриональных стволовых клеток — сырьё для медицинских целей, ничем не оправдан. Более того, если производство клеточных линий на базе мышиных эмбрионов идёт более или менее успешно — в Гейдельберге для дальнейших экспериментов заготовлены и помещены на длительное хранение в жидкий азот более 5-ти миллионов мышиных стволовых клеток, — то аналогичные попытки культивировать стволовые клеточные линии на базе кроличьих эмбрионов положительных результатов не дали. Так что гейдельбергский биолог знает, о чём говорит. С человеческими стволовыми клетками дело обстоит несколько иначе: на сегодняшний день в мире уже имеется одиннадцать стабильных клеточных линий, культивированных на базе человеческих эмбрионов. И хотя их использование представляется с научной точки зрения преждевременным, а с этической — весьма спорным, многих учёных, а тем более предпринимателей, это не останавливает. Они не скрывают, что если в Германии решение вопроса о правомерности импорта человеческих эмбриональных стволовых клеток будет и дальше откладываться, им придётся перенести свои исследования за границу, в те страны, где это не связано с правовыми проблемами. Типичным примером может послужить молодая фирма «Кардион» в Дюссельдорфе. Уже через полгода, к зиме, она твёрдо намерена начать работы с человеческими стволовыми клетками — для того, чтобы с их помощью лечить такие недуги, как инфаркт миокарда и диабет.
Они не скрывают, что если в Германии решение вопроса о правомерности импорта человеческих эмбриональных стволовых клеток будет и дальше откладываться, им придётся перенести свои исследования за границу, в те страны, где это не связано с правовыми проблемами. Типичным примером может послужить молодая фирма «Кардион» в Дюссельдорфе. Уже через полгода, к зиме, она твёрдо намерена начать работы с человеческими стволовыми клетками — для того, чтобы с их помощью лечить такие недуги, как инфаркт миокарда и диабет.
Правда, пока исследователи экспериментируют с мышиными стволовыми клетками — теми самыми, что выращиваются в Гейдельберге. Если в питательную среду, в которой они находятся, добавить определённый фактор роста, то он будет воспринят клетками как сигнал к началу дифференцировки. То есть в клетках активизируются гены, инициирующие их трансформацию в клетки какого-то определённого типа. Это позволяет как бы «ремонтировать» любые поражённые болезнью органы — по крайней мере, теоретически. Впрочем, некоторые приёмы специалисты «Кардиона» успешно испытали и на практике. Они искусственно вызывали у лабораторных мышей инфаркт миокарда, а затем вводили им в сердце эмбриональные стволовые клетки. После такой инъекции ткань сердечной мышцы восстанавливалась, инфаркт полностью излечивался. Это дало основание управляющему делами фирмы «Кардион» Михаэлю Рулю говорить о революционных достижениях:
- «Революция состоит в том, что этот способ впервые позволяет обеспечить реальную терапию, добиться полного выздоровления пациента, победить болезнь навсегда, устранив саму причину недуга. Иными словами, использование стволовых клеток — огромный шаг вперёд, прорыв в медицине.»
Когда же дело дойдёт до экспериментов с человеческими эмбриональными стволовыми клетками, работы придётся перенести за границу: лишь там есть необходимые «Кардиону» клеточные линии, а кроме того, там эти исследования не вызывают столь жарких дискуссий. К шумихе в Германии Михаэль Руль относится с недоумением:
- «Весь наш бизнес, нашу деятельность по созданию промышленной технологии на базе стволовых клеток, мы можем осуществлять, не выходя за рамки действующих законов.
 Для наших работ нам достаточно уже имеющихся за рубежом «клеточных линий». Ни одна яйцеклетка не должна быть специально оплодотворена и израсходована в ходе наших исследований!»
Для наших работ нам достаточно уже имеющихся за рубежом «клеточных линий». Ни одна яйцеклетка не должна быть специально оплодотворена и израсходована в ходе наших исследований!»Но пока в Германии кипят страсти, иностранные партнёры — от греха подальше — и сами не рвутся заключать контракты на поставку «эмбрионального сырья» в Германию. Тем более что по результатам опросов общественного мнения две трети немцев негативно относятся к идее в той или иной форме использовать человеческие эмбрионы в качестве материала для научных экспериментов. По этой причине «Кардион» прорабатывает и запасной вариант: исследует стволовые клетки взрослого человека. Дело в том, что стволовые клетки имеются также в органах и тканях взрослых людей. По многим важным для науки и медицины свойствам они сходны с эмбриональными клетками, но имеют по сравнению с ними и ряд недостатков — растут медленнее, обладают меньшей плюрипотентностью, то есть способностью к дифференцировке, а кроме того, их труднее найти: например, в костном мозге, наиболее часто используемом сегодня для добычи взрослых стволовых клеток, одна такая клетка приходится на 10 тысяч обычных, уже специализированных! Однако Михаэля Руля всё это не останавливает. Он руководствуется соображениями коммерческой целесообразности:
- «Мы фокусируем наше внимание на двух типах стволовых клеток — на взрослых и на эмбриональных. И это обеспечивает нам совершенно особое положение среди фирм, работающих в этой области.»
Научный руководитель фирмы «Кардион», Манфред Рюдигер, дополняет своего коллегу. Он объясняет, почему учёные «Кардиона» предпочитают искать взрослые стволовые клетки не в костном мозге, как это далают специалисты других фирм и исследовательских центров, а в стенках кишечника:
- «Мы работаем со взрослыми стволовыми клетками, изъятыми из стенок кишечника, поскольку кишечник — это тот орган, который в наибольшей степени нуждается в регенерации. Кишечник постоянно подвергается весьма значительным механическим нагрузкам и поэтому должен иметь возможность быстро восстанавливать свою слизистую оболочку.
 Природа это предусмотрела и снабдила стенки кишечника стволовыми клетками, которые на протяжении всей жизни делятся и регенерируют ткань.»
Природа это предусмотрела и снабдила стенки кишечника стволовыми клетками, которые на протяжении всей жизни делятся и регенерируют ткань.»Манфред Рюдигер уверен, что его фирма успешно справится не только с инфарктом миокарда, но и с такой широко распространённой болезнью, как диабет. Путь решения проблемы — тот же: создание технологии, позволяющей трансформировать стволовые клетки в бета-клетки поджелудочной железы.
- «Тогда мы сможем трансплантировать пациентам новые клетки, производящие инсулин. И эти клетки будут сами регистрировать содержание сахара в крови, как это делают нормальные клетки поджелудочной железы. Так что диабетики, нуждающиеся сегодня в регулярных инъекциях инсулина, будут избавлены от этого — вживлённые в их организм стволовые клетки возьмут на себя снабжение инсулином.»
Специалисты фирмы «Кардион» рассчитывают начать клинические испытания препарата против диабета лет через 5. Это значит, что готовое лекарство появится на рынке не раньше чем через 10 лет. А вот будет ли это немецкий или, скажем, американский медикамент, зависит от того, получат ли учёные в Германии право работать с эмбриональными стволовыми клетками.
Это был репортаж Виталия Волкова. О некоторых других аспектах получения и применения эмбриональных стволовых клеток, о проблемах терапевтического клонирования и преимплантационной диагностики мы расскажем в следующей выпуске радиожурнала «Наука и техника» ровно через неделю.
Долю человеческих клеток в химере с мышью подняли до четырех процентов
Jian Feng
Американским биологам удалось создать химерные зародыши человека и мыши, в которых доля человеческих клеток составила до четырех процентов. В предыдущих экспериментах клетки человека встраивались в такие зародыши плохо, и их не всегда удавалось обнаружить. Прогресс стал возможен благодаря специальной обработке эмбриональных стволовых клеток человека: исследователи «затормозили» их развитие, синхронизировав их состояние с эмбриональными клетками мыши. В результате человеческие клетки проникли в самые разные органы, от печени до сетчатки. Работа опубликована в журнале Science Advances.
В предыдущих экспериментах клетки человека встраивались в такие зародыши плохо, и их не всегда удавалось обнаружить. Прогресс стал возможен благодаря специальной обработке эмбриональных стволовых клеток человека: исследователи «затормозили» их развитие, синхронизировав их состояние с эмбриональными клетками мыши. В результате человеческие клетки проникли в самые разные органы, от печени до сетчатки. Работа опубликована в журнале Science Advances.
Химерные зародыши из разных видов млекопитающих — это не только инструмент для изучения эмбрионального развития, но и перспективная биотехнология. Ученые неоднократно предлагали использовать животных как инкубаторы для выращивания человеческих органов. Такие химерные зародыши уже создавали не только для лабораторных организмов — например, мышей и крыс, — но и с участием человеческих клеток.
Так, несколько лет назад были получены химеры человек-свинья, а летом 2019 года испанские ученые заявили о том, что создали в Китае химеру человек-обезьяна. Правда, все эти зародыши уничтожают на ранних стадиях развития, чтобы избежать этических разногласий. И только летом 2019 года японские ученые получили разрешение на то, чтобы не только вводить клетки человека в эмбрион мыши, но также подсаживать химеру в матку беременных мышей.
Проблема состоит вот в чем: на той стадии развития, когда возможно создание химеры, клетки человека и мыши находятся в разных состояниях. Зародыш мыши в этот момент состоит из наивных эмбриональных стволовых клеток (ЭСК) — они способны дать начало всем зародышевым, а также некоторым внезародышевым тканям. Клетки человека на этой же стадии называют примированными ЭСК — из них внезародышевые ткани не получатся, поскольку они уже начали дифференцировку.
Сейчас известно несколько способов перевести ЭСК человека из примированного состояния в наивное — это, например, химические ингибиторы или экспрессия определенных генов (мы также рассказывали об одном механическом способе). Но во всех этих случаях эффективность встраивания в постимплантационный зародыш невысока: в химерах человек-свинья удалось заметить лишь отдельные клетки человека, а в химерах человек-мышь их практически не удается разглядеть.
Цзянь Фэн (Jiang Feng) из Нью-Йоркского государственного университета в Баффало и его коллеги предложили еще один способ решения проблемы. Дело в том, что наивность мышиных ЭСК может быть связана с диапаузой — состоянием, при котором развитие эмбрионов тормозится на время, пока мать вынашивает или выкармливает предыдущее поколение детенышей. Известно также, что диапаузу у мышиных эмбрионов можно вызвать, если заблокировать белковый комплекс mTOR, который подстегивает клеточный обмен веществ. Поэтому Фэн с коллегами предположил, что можно обработать человеческие ЭСК блокаторами mTOR и тем самым синхронизировать их с клетками в зародыше мыши.
Для начала исследователи проверили, что выбранный ими метод работает. Они разработали протокол с участием распространенного блокатора mTOR — рапамицина, а также альтернативного блокатора — Torin1. Полученные колонии наивных ЭСК экспрессировали все необходимые маркеры и образовывали опухоли (тератомы) при введении в организм мыши, то есть удовлетворяли критериям эмбриональных клеток. При этом их функциональные свойства изменились: например, они стали лучше делиться. В то время как исходная культура примированных ЭСК увеличилась в 10 раз за 6 дней, культура наивных ЭСК — почти в 1000 раз. Изменения затронули также экспрессию генов и уровень метилирования ДНК.
Затем авторы работы ввели наивные ЭСК человека, экспрессирующие зеленый флуоресцентный белок, в мышиные морулы — эмбрионы первых дней развития, которые представляют собой просто группу одинаковых клеток. Из химерных морул развились бластоцисты — клеточные шары с рыхлой массой внутри — причем человеческие клетки светились как во внешнем слое, так и во внутреннем. Далее эти бластоцисты подсадили мышам и полученные эмбрионы забирали на анализ вплоть до 17-го дня развития (отсчет с момента оплодотворения). Исследователей интересовало, в какие ткани смогут встроиться клетки человека. В итоге они были обнаружены как в печени (производное внутреннего зародышевого листка, энтодермы), так и в сетчатке (производное внешнего листка, эктодермы), и даже в сердце и костном мозге (производные среднего листка, мезодермы).
Срез химерного зародыша с разной окраской. Зеленый — клетки человека, синими стрелками отмечены места интеграции этих клеток в органы зародыша. 1 — сердце, 2 — сетчатка глаза.
Hu et al. / Sci Adv, 2020
Подсчитав долю общей ДНК человека в химерном зародыше, авторы работы обнаружили, что от 0,14 до 4,06 процентов клеток (в зависимости от конкретного зародыша) были человеческими. По сравнению с предыдущими работами, в которых эти клетки с трудом удавалось обнаружить, здесь можно говорить о стабильном встраивании клеток человека в мышиный зародыш после имплантации.
Чтобы избежать этических споров, исследователи проверили: клетки человека не попали в зачатки половых органов мышей (это одно из строгих ограничений на создание таких химер). Что же касается нервной системы, авторы работы отмечают: хоть отдельные клетки там и были обнаружены, в таком скромном количестве и на таких ранних стадиях они не могли внести существенный вклад в формирование мышиного мозга. Тем не менее, их исследование демонстрирует, что принципиальные трудности в создании химерных зародышей — не столько этические, сколько технические, однако их, в отличие от этических, постепенно удается преодолеть.
Ранее мы рассказывали о том, что ученым удалось получить полноценный зародыш мыши из одной соматической клетки. Зародыши человека, тем временем, удалось культивировать in vitro до стадии более двух недель. А у ранних человеческих эмбрионов обнаружили первые признаки старения.
Полина Лосева
Ученые смогли вырастить из свиного жира кость нижней челюсти.
 Говорят: так можно создавать и человеческие кости | Громадское телевидение
Говорят: так можно создавать и человеческие кости | Громадское телевидение
Об этом говорится в научном исследовании в издании Science Translational Medicine.
Нижняя челюсть — единственная подвижная кость черепа — играет важную роль в нашей жизни. Благодаря височно-нижнечелюстному суставу мы можем говорить и пережевывать пищу. В то же время нижнюю челюсть почти невозможно заменить: она очень сложная по строению кость, а еще должна выдерживать значительное давление.
Операций по замене нижнечелюстной кости могут потребовать люди с врожденными пороками или те, кто повредил челюсть в результате травм. Можно взять кость с другой части тела, но те часто не имеют подходящей формы. Можно использовать металлические протезы. Но, во-первых, часто они вызывают аллергическую реакцию, а во-вторых, не учитывают рост остальных костей.
Группа американских исследователей обратила внимание на один из способов воспроизведения костей — их выращивания из стволовых клеток. На это их натолкнула публикация десятилетней давности, в которой описывался процесс выращивания косточки височно-нижнечелюстного сустава из стволовых клеток, полученных из человеческого жира.
Для своего исследования ученые взяли стволовые клетки, полученные из свиного жира, а за «леса» человеческой челюсти взяли коровьи кости. Из части клеток они вырастили кость нижней челюсти, а из части — хрящевые клетки, необходимые для сустава, соединяющего челюсть со скулами.
Выращенные челюсти исследователи пересадили подопытным свиньям — животные нормально ими пользовались почти сразу после пересадки. Через шесть месяцев свиней усыпили и проверили, насколько пересаженные челюсти у них прижились. Выяснилось, что «леса» из коровьих костей рассосались, оставив после себя выращенную челюсть.
Теперь авторы исследования готовятся к проведению испытаний на людях. В них примут участие шесть пациентов с открытым прикусом. С помощью выращенных из стволовых клеток костей их челюсти удлинят, чтобы убрать врожденный дефект прикуса.
В состав вакцин входят клетки абортированных человеческих эмбрионов
Проверка фейков в рамках партнерства с Facebook
В этом видео утверждается, что в состав вакцин входят абортированные клетки человеческого эмбриона. Автор уверяет, что в вакцине присутствует чужеродная ДНК и хромосомы «нездорового генома», которые вызывают различные виды рака.
Это неправда: в состав вакцин не входят клетки абортированных человеческих плодов. Однако некоторые вирусы, входящие в состав вакцин, выращивают в клетках-потомках тканей, собранных из абортированных человеческих плодов много десятилетий назад.
Ученые подсчитали, что вакцины, изготовленные благодаря одному из видов линий клеток эмбрионов (WI-38), и их производные предотвратили почти 11 млн смертей и 4,5 млрд случаев заболеваний.
Вакцины от ветряной оспы, краснухи, гепатита А и один препарат вакцины против бешенства делают, выращивая вирусы в фибробластах эмбриона плода. Фибробласты — это клетки, необходимые для содержания кожи и других соединительных тканей вместе. Впервые эти клетки для изготовления вакцин получили в результате планового прерывания двух беременностей в начале 1960-х. Эти же эмбриональные клетки, полученные десятилетия назад, продолжают расти в лабораториях, и их по сей день используют для изготовления вакцин. Новые дополнительные источники клеток плода не нужны.
В видео автор утверждает, что «каждому ребенку вводится нездоровый генетический код с патологиями и болезнями, которые способствуют возникновению рака». Этот вывод она делает на основе доклада итальянской ассоциации Corvelva:
«Итальянская организация Corvelva провела полное секвенирование генома клеточной линии MRC-5, какие именно используется в некоторых вакцинах <…> В вакцине присутствует полный геном (ДНК) всех хромосом какого-то определенного индивида <…> В нем найдено более 560 генов, которые связаны с различными формами рака».
Так называемое исследование итальянской группы Corvelva — это доклад, который не содержит базового описания хода исследования, и оно никогда не было опубликовано в авторитетном научном журнале. К тому же организация «Corvelva» — это не научная организация, а ассоциация с четкой антивакцинаторской позицией. Они не предоставляют информацию о том, как собирали образцы и как они пришли к выводу, что эти гены происходят от раковых клеток.
На самом деле после выращивания вируса в клетках эмбриона его очищают, чтобы удалить реагенты для роста и остатки клеток. Во время этого процесса очистки клеточная ДНК оставшуюся также разрушается. В конечном препарате вакцины остатки ДНК минимальны (триллионные части грамма) и являются сильно фрагментированными. Поскольку ДНК фрагментирована, она не может создать целый белок, который способен повредить. Кроме этого, ДНК вакцины не может встраиваться в человеческую ДНК, чтобы вызвать какие-либо изменения в организме.
Происхождение подобных фейков прослеживает также из цитирования текстов бывшей американской исследовательницы Терезы Дейшер. Она написала открытое письмо, в котором связала заболевание аутизмом с использованием в вакцинах ДНК абортированных эмбрионов. Этот текст не прошел процесса научного рецензирования, а другие ученые раскритиковали его за ряд нарушений. Об этом мы писали ранее здесь.
VoxUkraine — уникальный контент, который стоит прочесть. Подписывайтесь на нашу e-mail рассылку, читайте нас в Facebook и Twitter, смотрите актуальные видео на YouTube.
Мы верим, что у слов есть сила, а идеи имеют определяющее влияние. VoxUkraine объединяет лучших экономистов и помогает им донести идеи до десятков тысяч соотечественников. Контент VoxUkraine бесплатный (и всегда будет бесплатным), мы не продаем рекламу, не занимаемся лоббизмом. Чтобы проводить больше исследований, создавать новые влиятельные проекты и публиковать много качественных статей нам нужны умные люди и деньги. Люди есть! Поддержать VoxUkraine. Вместе мы сделаем больше.
Люди есть! Поддержать VoxUkraine. Вместе мы сделаем больше.
Поддержать Вокс
Внимание
Авторы не работают, не консультируют, не владеют акциями и не получают финансирования от компании или организации, которая бы имела пользу от этой статьи, а также никоим образом с ними не связаны
ОЦЕНКА ФУНКЦИОНАЛЬНЫХ СВОЙСТВ ЧЕЛОВЕЧЕСКИХ ЭНДОТЕЛИАЛЬНЫХ И ГЛАДКОМЫШЕЧНЫХ КЛЕТОК ПОСЛЕ ЗАСЕЛЕНИЯ НА ПОВЕРХНОСТИ ИЗ ЕСТЕСТВЕННЫХ И СИНТЕТИЧЕСКИХ МАТЕРИАЛОВ | Саая
1. Parizek M, Kasalkova N, Bacakova L, Slepicka P, Lisa V, Blazkova M, Svorcik V. Improved Adhesion, Growth and Maturation of Vascular Smooth Muscle Cells on Poly-ethylene Grafted with Bioactive Molecules and Carbon Particles. International Journal of Molecular Sciences. 2009; 10 (10): 4352–4374.
2. T.D. VU and T. KOFIDIS, National University of Singapore, Singapore DOI: 10.1533/9780857096715.2.127 © 2014 Woodhead Publishing Limited.
3. Weinberg CB, Bell E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 1986; 231: 397–400.
4. Nicolas L’Heureux, Lucie Germain, Raymond Labb~, Francois A. Auger. Qulbec, Canada: In vitro construction of a human blood vessel from cultured vascular cells: A morphologic study. J. Vasc. Surg. 1993; 17: 499–509.
5. Matsuda T, Miwa H. A hybrid vascular model biomimicking the hierarchic structure of arterial wall: Neointimal stability and neoarterial regeneration process under arterial circulation. J. Thorac. Cardiovasc. Surg. 1995; 110: 988–997.
6. Kaushal S, Amiel GE, Guleserian KJ, Shapira OM, Perry T, Sutherland FW et al. Functional small-diameter neovessels created using endothelial progenitor cells expanded ex vivo. Nat Med. 2001; 7: 1035–1040.
Functional small-diameter neovessels created using endothelial progenitor cells expanded ex vivo. Nat Med. 2001; 7: 1035–1040.
7. Quint C, Kondo Y, Manson RJ, Lawson JH, Dardik A, Niklason LE. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc. Natl. Acad. Sci. USA. 2011; 108: 9214–9219.
8. Tara S, Rocco KA, Hibino N, Sugiura T, Kurobe H, Breuer CK, Shinoka T. Vessel bioengineering. Circ. J. 2014 Jan; 78 (1): 12–19.
9. Wu H, Fan J, Chu CC, Wu J. Electrospinning of small diameter 3-D nanofi brous tubular scaffolds with controllable nanofi ber orientations for vascular grafts. J. Mater. Sci. Mater. Med. 2010; 21: 3207–3215.
10. Pektok E, Nottelet B, Tille JC, Gurny R, Kalangos A, Moeller M et al. Degradation and healing characteristics of small-diameter poly (epsilon-caprolactone) vascular grafts in the rat systemic arterial circulation. Circulation. 2008; 118: 2563–2570.
11. Roha JD, Sawh-Martineza R, Brennana MP, Jaya SM, Devineb L, Raoa DA et al. Tissue-engineered vascular grafts transform into mature blood vessels via an infl ammation-mediated process of vascular remodeling. January 26, 2010 PNAS | March 9, 2010 | vol. 107 | no. 10 | 4669–4674.
12. Su Y, Su Q, Liu W, Jin G, Mo X, Ramakrishna S. Dualdrug encapsulation and release from core-shell nanofi — bers. J. Biomater. Sci. Polym. Ed. 2011 March 18, doi: 10.1163/092050611X564137.
13. Захарова ИС, Живень МК, Саая ШБ, Карпенко АА, Шевченко АИ, Струнов АА и др. Разработка клеточных технологий для создания клеточно-наполненных сосудистых трансплантатов. Патология кровообращения и кардиохирургия. 2015; 19 (4–2): 43–54. Zakharova IS, Zhiven’ MK, Saaya ShB, Karpenko AA, Shevchenko AI, Strunov AA i dr. Razrabotka kletochyh tehnologiy dlya sozdaniya kletochno-napolnennyh sosudistyh transplantatov. Patologiya krovoobrashenia i kardiohirurgia. 2015; 19 (4–2): 43–54.
Разработка клеточных технологий для создания клеточно-наполненных сосудистых трансплантатов. Патология кровообращения и кардиохирургия. 2015; 19 (4–2): 43–54. Zakharova IS, Zhiven’ MK, Saaya ShB, Karpenko AA, Shevchenko AI, Strunov AA i dr. Razrabotka kletochyh tehnologiy dlya sozdaniya kletochno-napolnennyh sosudistyh transplantatov. Patologiya krovoobrashenia i kardiohirurgia. 2015; 19 (4–2): 43–54.
14. Сергеевичев ДС, Васильева МБ, Субботовская АИ, Юношев АС, Сильвестров ВВ, Новрузов РБ, Карась- ков АМ. Bлияние детергентной и ферментной децеллюляризации на биомеханические свойства аортального аллографта. Вестник НГУ. Серия: Биология, клиническая медицина. 2012; 10 (4). Sergeevichev DS, Vasilieva MB, Subbotovskaya AI, Yunoshev AS, Silvestrov VV, Novruzov RB, Karaskov AM. Vliyaniye detergentnoy I fermentnoy detsellulyarizatsii na biomehanicheskie svoystva aortalnogo allografta. Vestnik NGU. Seriya: Biologiya, klinicheskaya meditsina. 2012; 10 (4).
15. Попова ИВ, Степанова АО, Сергеевичев ДС, Акулов АЕ, Захарова ИС, Покушалов ЕА, Лактионов ПП, Карпенко АА. Сравнительное исследование трех типов протезов, изготовленных методом электроспиннинга в эксперименте in vitro и in vivo. Патология кровообращения и кардиохирургия. 2015; 19 (4): 63– 71. Popova IV, Stepanova AO, Sergeevichev DS, Akulov AE, Zakharova IS, Pokushalov ЕA, Laktionov PP, Karpenko AA. Sravnitelnoe issledovanie treh tipov protezov, izgotovlennih metodom electrospininga v eksperimente in vitro i in vivo. Patologiya krovoobrascheniya i kardiohirurgia. 2015; 19 (4): 63–71.
16. Cynthia S. Wong, Melissa Sgarioto, Amal A. Owida, William Yang, Franklin L. Rosenfeldt, Yos S. Morsi. Polyethyleneterephthalate Provides Superior Retention of Endothelial Cells During Shear Stress Compared to Polytetrafl uoroethylene and Pericardium. Heart, Lung and Circulation . 2006; 15: 371–377.
Heart, Lung and Circulation . 2006; 15: 371–377.
17. Eybl E, Grimm M, Grabenwoger M, Bock P, Muller MM, Wolner E. Endothelial cell lining of bioprosthetic heart valve materials. J. Thorac. Cardiovasc. Surg. 1992; 104 (3): 763–9.
18. Simon P, Kasimir MT, Seebacher G, Weigel G, Ullrich R, Salzer-Muhar U et al. Early failure of the tissue engineered porcine heart valve SYNERGRAFT in pediatric patients. Eur. J. Cardiothorac. Surg. 2003; 23: 1002–1006.
19. Kannan RY, Salacinski HJ, Sales K, Butler P, Seifalian AM. The roles of tissue engineering and vascularisation in the development of micro-vascular networks: A review. Biomaterials. 2005; 26 (14): 1857–1875.
20. Rotmans JI, Heyligers JM, Verhagen HJ, Velema E, Nagtegaal MM, de Kleijn DP et al. In vivo cell seeding with anti-CD34 antibodies successfully accelerates endothelialization but stimulates intimal hyperplasia in porcine arteriovenous expanded polytetrafl uoroethylene grafts. Circulation. 2005; 112 (1): 12–18.
21. Mirenghi L, Ramires PA, Pentassuglia RE, Rotolo P, Romito A. Growth of human endothelial cells on plasmatreated polyethyleneterephthalate surfaces. J. Mater. Sci. Mater. Med. 2000; 11 (5): 327–331.
22. Thompson MM, Budd JS, Eady SL, Allen KE, James M, James RF et al. Effect of seeding time and density on endothelial cell attachment to damaged vascular surfaces. Br. J. Surg. 1993; 80 (3): 359–362.
23. Miyata T, Conte MS, Trudell LA, Mason D, Whittemore AD, Birinyi LK. Delayed exposure to pulsatile shear stress improves retention of human saphenous vein endothelial cells on seeded ePTFE grafts. J. Surg. Res. 1991; 50 (5): 485–493.
Delayed exposure to pulsatile shear stress improves retention of human saphenous vein endothelial cells on seeded ePTFE grafts. J. Surg. Res. 1991; 50 (5): 485–493.
Человеческий эмбрион собрали из лабораторных клеток
Искусственный псевдозародыш, готовый прикрепиться к матке, может стать удачной моделью для изучения патологий эмбрионального развития.
Сразу две исследовательские группы, в Юго-западном медицинском центре Университета Техаса и в Университете Монаша, сообщили в Nature, что им удалось лабораторными методами создать полноценный человеческий эмбрион на стадии бластоцисты. Так называют одну из самых ранних стадий развития – на этапе бластоцисты эмбрион ещё не внедрился в стенку матки, но уже готов это сделать.
Человеческий бластоид – псевдозародыш, соответствующий стадии бластоцисты. Синим окрашены ядра клеток. (Фото: UT Southwestern)
‹
›
Что такое бластоциста? После оплодотворения яйцеклетка млекопитающих первые несколько дней делится, пока из неё не получится что-то вроде пузырька. В этом пузырьке есть клетки трёх типов. Те, что окружают его по периметру, образуют так называемый трофобласт, или трофэктодерму. Клетки трофобласта потом сформируют плаценту. Большая часть объёма внутри пузырька – просто полость, которая так и называется – полость бластоцисты. Но в одном месте изнутри на стенке пузырька образуется клеточная масса, которая опять же так и называется – внутренняя клеточная масса. Она состоит из эпибласта и гипобласта. Клетки гипобласта потом дадут зародышевый мешок, который помогает эмбриону питаться и дышать на самых ранних этапах развития, и хорион – ещё одну зародышевую оболочку, которая будет участвовать в формировании плаценты. А вот само тело эмбриона начнёт развиваться из клеток эпибласта.
По мере развития молекулярной и клеточной биологии исследователи стали пытаться смоделировать бластоцисту в лабораторных условиях. В этом есть смысл не только с точки зрения фундаментальных знаний о том, как развивается зародыш, но и из практических соображений: многие патологии развития и неудачные беременности начинаются с проблем на стадии бластоцисты. Несколько лет назад лабораторную бластоцисту удалось собрать из мышиных стволовых клеток – полученную клеточную структуру назвали бластоид, чтобы отличать от натуральной бластоцисты. И вот сейчас то же самое получилось с клетками человека.
В этом есть смысл не только с точки зрения фундаментальных знаний о том, как развивается зародыш, но и из практических соображений: многие патологии развития и неудачные беременности начинаются с проблем на стадии бластоцисты. Несколько лет назад лабораторную бластоцисту удалось собрать из мышиных стволовых клеток – полученную клеточную структуру назвали бластоид, чтобы отличать от натуральной бластоцисты. И вот сейчас то же самое получилось с клетками человека.
Главная проблема была в том, чтобы найти стволовые клетки, похожие на клетки бластоцисты. Исследователи из Техасского университета брали их из двух источников. Во-первых, это были настоящие клетки человеческой бластоцисты. Когда-то человеческую бластоцисту взяли для научных исследований, разобрали на клетки, и с тех пор их сохраняют для экспериментов. (Клетки зародыша потенциально бессмертны, если их правильно содержать.)
Во-вторых, зародышевые клетки можно получить из обычных клеток взрослого человека – это будут так называемые индуцированные плюрипотентные стволовые клетки. Индуцированные – потому что их создают, обрабатывая обычные клетки специальными молекулярными сигналами. В результате, например, клетки кожи теряют специализацию и впадают в глубокое эмбриональное детство, когда они могли бесконечно делиться. Зародышевые клетки способны превратиться в любые другие, поэтому их называют плюрипотентными. Мы много раз писали про такие стволовые клетки; по свойствам они не отличаются или почти не отличаются от настоящих зародышевых клеток.
Исследователи выращивали клетки в специальном сосуде, который позволял им образовать трёхмерную структуру. То есть если бы стволовые клетки захотели создать бластоцисту (бластоид), им бы ничто не помешало. Разумеется, в питательную среду им добавляли молекулярные факторы, которые должны были склонить делящиеся клетки к тому, чтобы сформировать пузырёк с трофобластом, эпибластом и гипобластом.
Другая группа исследователей, в Университете Монаша, тоже работали со специализированными клетками взрослых людей. Но эти клетки не обращали в индуцированные стволовые, а добивались того, чтобы среди них сразу появились бластоцистные клетки трёх видов. То есть первая исследовательская команда «обнуляла» генетическую активность зрелых клеток до самого-самого начального зародышевого состояния, а потом запускала в них программу зародышевого развития – и делящиеся клетки уже сами превращались в клетки трофобласта, эпибласта и гипобласта. А вторая команда сразу пыталась получить клетки трофобласта, эпибласта и гипобласта, которые объединялись в псевдозародыш-бластоид. В первом случае бластоцисту выращивали, во втором – собирали из клеточного конструктора (точнее, детали конструктора сами находили себя и соединялись в нужную структуру).
И в том, и в другом случае всё сработало более-менее успешно: человеческие бластоиды формировались на 6–8 день выращивания клеточной культуры и с 20-процентным успехом. Размером и структурой они были как настоящие, состояли примерно из такого же числа клеток. Активность генов в искусственной бластоцисте тоже была такая же, как у настоящей, готовой имплантироваться в матку. Собственно, когда для полученных бластоидов имитировали условия имплантации, они были на это готовы: они прикреплялись к клеточной культуре, которая изображала стенку матки, и начинали развиваться дальше. У них появлялись зародышевые органы вплоть до того, что некоторые псевдоэмбрионы готовили свои клетки, чтобы создать плаценту.
То есть в принципе клеточные структуры, полученные подобным образом, вполне могут служить моделью для изучения человеческого зародыша в тот момент, когда он готовится укорениться в матке. Хотя портал Nature пишет о неизбежных этических вопросах, которые всегда возникают при слове «эмбрион», эти вопросы, очевидно, будут не столь остры, чем если бы речь шла о настоящем эмбрионе, полученном при слиянии яйцеклетки и сперматозоида. Правда, прежде чем на человеческих бластоидах начнут что-то изучать, нужно скорректировать методы, с помощью которых их получают.
Правда, прежде чем на человеческих бластоидах начнут что-то изучать, нужно скорректировать методы, с помощью которых их получают.
Пока что псевдоэмбрионы, полученные так, как описано выше, развиваются с разной скоростью, и даже разные типы клеток в пределах одного и того же бластоида тоже могут развиваться с немного разной скоростью – хотя в настоящих зародышах всё строго синхронизировано. Наконец, в бластоидах оставалась группа клеток, которая не относится ни к трофобласту, ни к эпибласту, ни к гипобласту, и исследователям ещё предстоит понять, что это за клетки и как от них избавиться.
Озонотерапия
Это новый, перспективный и эффективный вид лечения. Он основан на разностороннем действии, которое медицинский озон оказывает на кровь и на организм в целом.
Озон – это газ с нестойкой, высокоактивной молекулой с большой проникающей способностью. Озон распадается с образованием атомарного кислорода, который окисляет микроорганизмы, токсины, шлаки, стимулирует обмен веществ, улучшает питание тканей.
Озон оказывает на организм следующее действие:
- Антимикробное:
разрушение бактерий, вирусов и других внутриклеточных паразитов (хламидии, уреаплазмы), грибов.Озон окисляет стенку и гены микроба, причем делает это внутриклеточно. По эффективности озон здесь сравним с антибиотиками, с той только разницей, что ДЕЙСТВУЕТ ЛУЧШЕ. Все антибиотики помимо торможения размножения микробов и вирусов, снижают защитные силы организма. Озон же, наоборот, стимулирует размножение иммунных клеток и вызывает гибель микроорганизмов. - Антигипоксическое действие.
Вводимый в кровь медицинский озон в жидкой среде (физраствор) насыщает организм кислородом, устраняя кислородное голодание (гипоксию), задерживая старение и рубцевание клеток и тканей. Он стимулирует обновление клеточных мембран и размножение клеток. Этим проявляется «омолаживающий» эффект озона на организм.
- Стимуляция обмена веществ.
Усиление кислородного обмена (тканевого дыхания) в организме за счет введения озона приводит к усилению выработки энергии, белка (основного «строительного материала»), гормонов, биологически активных веществ и других регуляторов и стимуляторов жизнедеятельности. Этим повышается иммунный, энергетический статус организма, проводится профилактика болезней на молекулярном и клеточном уровне. - Антитоксическое действие.
При введении озона в кровь циркулирующие в ней шлаки (холестерин, билирубин и другие недоокисленные продукты обмена веществ, которые оказывают токсическое действие) окисляются им и быстрее выводятся из организма. Задерживается развитие атеросклеротических бляшек в артериях мозга, сердца, конечностей. Мембраны клеток крови становятся мягкими, эластичными, повышается транспорт кровью кислорода и улучшение отдачи его в ткани. - Противоопухолевоедействие.
Уникальность действия озона на раковую клетку (и ткань) заключается в том, что озон приводит к саморазрушению опухолевой клетки, за счет торможения ее порочного «бескислородного» обмена веществ. Озон избирательно вызывает гибель раковых клеток, так как здоровые клетки имеют свою антиоксидантную систему защиты, а больные раком – нет. Применение озона в онкологии сулит большие клинические перспективы. - Противовоспалительное действие.
Проникая внутрь клетки человеческого организма озон связывается с полиненасыщенными жирными кислотами и образует высокоактивные вещества-озониды, которые окисляют простагландины — биологически активные вещества участвующие в воспалительных реакциях, тем самым способствуют исчезновению воспаления.
ПОКАЗАНИЯ:
- Хирургия
абсцессы (гнойники), раневая инфекция, сепсис, перитонит, пролежни, длительнонезаживающие раны, трофические язвы, хронический остеомиелит, тромбофлебит, атеросклероз сосудов нижних конечностей, кардиохирургические вмешательства.
- Терапия, аллергология, эндокринология
хронический гастрит, колит, язвенная болезнь желудка и 12-перстной кишки, хронический гепатит, цирроз печени, артриты и артрозы, ишемическая болезнь сердца, аллергические заболевания, болезни верхних дыхательных путей, сахарный диабет. - Венерические болезни
заболевания, передаваемые преимущественно половым путем ( ЗППП ) и их осложнения. - Дерматология
фурункулез, пиодермия, герпес, грибковые поражения, псориаз, экзема, красный плоский лишай, угревая болезнь. - Акушерство и гинекология
воспалительные заболевания придатков матки, бесплодие, невынашивание беременности, токсикозы беременных, профилактика внутриутробного инфицирования плода, фетоплацентарная недостаточность, анемия беременных. - Невропатология
нарушения мозгового кровообращения, заболевания периферической нервной системы, мигрень. - Инфекционные болезни
вирусные гепатиты, герпесвирусная инфекция, токсоплазмоз, цитомегаловирус. - Стоматология
стоматит, парадонтоз, пульпит, гингивит.
ПРОТИВОПОКАЗАНИЯ:
- Аллергия к озону. Повышенная кровоточивость
- Гипертиреоз, тиреотоксикоз (повышение функции щитовидной железы).
- Судороги, эпилепсия.
- Острый инфаркт миокарда.
- Алкоголь в крови.
Хосе Поло: Псевдоэмбрионы человека, созданные из клеток кожи, представляют собой этическое минное поле | USA
Биохимик Хосе Поло позирует с изображениями своих человеческих псевдоэмбрионов. Universidad Monash
Группе ученых во главе с аргентинским биохимиком Хосе Поло удалось создать человеческие псевдоэмбрионы, не используя яйцеклетки или сперму, а перепрограммировав клетки кожи, чтобы они вернулись в нормальное состояние. эмбриональное состояние. Этот медицинский скачок на меняющихся рубежах биоэтики потребует от человечества решения насущного вопроса: какой юридический статус получит эти скопления человеческих клеток, известные как бластоиды?
Поло из Университета Монаша в Мельбурне предпочитает дистанцировать свою работу от термина «искусственный эмбрион»: «Мы не хотим порождать ложные ожидания или заставлять людей думать, что через год у нас будет целая армия клонов. .Технология еще не достигла этого ».
.Технология еще не достигла этого ».
Биохимик описывает, что происходит в первые дни после оплодотворения, когда яйцеклетка и сперматозоид объединяются, чтобы сформировать единую всемогущую клетку, с инструкцией по превращению себя в человека, состоящего из 37 миллиардов клеток. В первый день эмбрион состоит всего из двух клеток. На второй становится четыре. На третьем восемь. Примерно на шестой день он формирует структуру размером чуть более 0,1 миллиметра, состоящую примерно из 200 клеток: бластоцисту.
Эти модели эмбрионов до сих пор не могли создать полноценный организм, но кто знает, можно ли этого достичь за 10 или 15 лет
Испанский биолог Марта Шахбази из Кембриджского университета
«Это похоже на футбол, который внутри теннисный мяч, — говорит Поло. «Мяч, когда он имплантируется в матку, генерирует плаценту. А теннисный мяч — это то, что родит ребенка ».
Команда Поло взяла клетки кожи и вернула их в состояние, аналогичное состоянию клеток в естественной бластоцисте, которые способны давать начало множеству других специализированных клеток, включая клетки крови, печени, мышц и мозга.При контакте эти перепрограммированные клетки взаимодействуют и через шесть дней образуют человеческий псевдоэмбрион, структуру размером с песчинку, которую команда называет индуцированным бластоидом или iBlastoid. Один единственный эксперимент может произвести тысячи.
В лабораторных условиях исследователям удалось вырастить псевдоэмбрионы, эквивалентные 11-дневной естественной бластоцисте. Международный консенсус, основанный на исследованиях избыточных человеческих эмбрионов из клиник по лечению бесплодия, устанавливает красную черту через 14 дней — момент, когда эмбрион больше не может делиться, чтобы потенциально произвести близнецов, и текущую точку отсечения для изучения человеческих эмбрионов.По данным Polo, на 14-й день в игру вступает концепция индивидуума, хотя в действительности до 75% успешных оплодотворений теряется в первые две недели беременности.
Модели человеческих эмбрионов, известные как iBlastoids, созданные в лаборатории командой Хосе Поло. Universidad Monash
Человеческие псевдоэмбрионы открывают черный ящик эмбрионального развития, который труднодоступен из-за очевидных этических ограничений, и позволяет исследователям исследовать причины бесплодия и врожденных заболеваний.«IBlastoids могут служить моделью в течение первых двух недель, и поэтому мы можем изучить, какие мутации или какие токсины вызывают сбой процесса», — говорит Поло, чье революционное исследование было опубликовано 17 марта в журнале Nature .
Другая группа под руководством китайского молекулярного биолога Цзюнь Ву объявила в параллельной статье в Nature , что им удалось создать псевдоэмбрионы из эмбриональных стволовых клеток, полученных из природных бластоцист, благодаря оптимизации протоколов культивирования в лаборатории.
По словам испанского биолога Марты Шахбази из Кембриджского университета, это первый случай создания полных моделей человеческого эмбриона. Шахбази считает, что это может быть первым шагом «революции», которая наконец откроет секреты человеческого развития. «Это не эмбрионы, это следует прояснить. Это просто модели, которые могут помочь нам изучить конкретные механизмы, которые мы не можем изучить на эмбрионе », — отмечает она. В 2016 году команде Шахбази удалось вырастить человеческие эмбрионы вне матки в лабораторных условиях в течение более длительного периода времени, чем кому-либо удавалось к тому моменту: 13 дней.
Человеческие псевдоэмбрионы позволяют исследователям исследовать причины бесплодия и врожденных заболеваний
Человеческие псевдоэмбрионы, произведенные как Поло, так и командами Ву, не функционируют, то есть они дегенерируют с течением времени . Эквиваленты, имплантированные в матку самок крыс, также нежизнеспособны. Все данные свидетельствуют о том, что псевдоэмбрионы неспособны производить детей любого рода. Шахбази считает, что «нет никаких этических проблем» в изучении этих структур за пределами красной линии в 14 дней.«Нет закона, который устанавливает пределы для этого типа расследования, потому что это что-то очень новое, но, конечно же, на него будут наложены ограничения. Эти модели эмбрионов до сих пор не могли создать полноценный организм, но кто знает, можно ли этого достичь в течение 10 или 15 лет ».
В прошлом году группе, возглавляемой испанским биологом Альфонсо Мартинесом Ариасом, удалось создать структуры, похожие на человеческий эмбрион, продолжительностью от 18 до 21 дня из клеток, выращенных в лаборатории, но без семян для того, что будет мозгом или тканями, которые образуют плаценту.Мартинес Ариас, в то время работавший в Кембриджском университете, является одним из ведущих деятелей в этой области, который в 2018 году сформировал фронт, призывающий к дебатам об этических аспектах исследований с использованием моделей человеческих эмбрионов.
Мартинес Ариас считает, что эти два новых исследования являются «шагом вперед, но не огромным прорывом», потому что обе модели по-прежнему демонстрируют функциональные и структурные отличия от реальных эмбрионов, а также содержат чужеродные клетки, которых там не должно быть. «Конечная цель — заменить эти структуры зародышем на ранней стадии, чтобы избежать этической проблемы зависимости от эмбрионов.Вы не можете просто помочь себе с человеческими эмбрионами, как если бы вы покупаете апельсины «.
Сейчас в Университете Помпеу Фабра в Барселоне Мартинес Ариас считает, что усовершенствованные модели эмбрионов, которые появятся в будущем, должны регулироваться в соответствии с теми же этическими принципами, что и настоящие эмбрионы. Однако он выступает за удаление 14-дневной красной линии в каждом конкретном случае, если для этого есть хорошее научное обоснование. «Это нужно делать с осторожностью. Если каждому дадут полную свободу действий, я думаю, это приведет к тому, что вместо серьезных исследований будет проводиться множество сомнительных научных исследований, вызывающих критику », — говорит он.
Если мы способны взять клетку кожи и создать эмбрион, мы не собираемся защищать клетки кожи, как если бы они были жизнеспособными эмбрионами
Мария Касадо, основательница Обсерватории по биоэтике и законодательству
Исследования человека модели эмбрионов продолжают развиваться. Ву из Техасского университета в 2019 году сотрудничал с испанцем Хуаном Карлосом Изписуа над созданием искусственных эмбрионов крысы с использованием одной ушной клетки. Две другие ведущие лаборатории, лаборатории Магдалены Зерницкой-Гетцин в Польше и Ян Ю в Китае, также представили в последние недели предварительные результаты своей работы с моделями человеческих эмбрионов.
Мария Касадо, основательница Обсерватории по биоэтике и праву при Университете Барселоны, поддержала использование избыточных эмбрионов из центров фертильности для исследования в 2000 году. По ее мнению, ключ кроется в идее градуализма. «Придаем ли мы такое же значение человеку, жизнеспособному плоду, эмбриону in vitro, зародышевой клетке и клетке кожи? Уровни защиты должны быть постепенными; нельзя искать решений по принципу «все или ничего» «. Юрист считает, что противоречия в этой области следует «разрядить» в пользу исследований, которые принесут пользу здоровью человека.«Если мы сможем взять клетку кожи и создать эмбрион, мы не будем защищать клетки кожи, как если бы они были жизнеспособными эмбрионами», — заявляет она.
Касадо также выступает за пересмотр нынешней этической границы 14 дней: «Мы не можем пытаться регулировать вещи раз и навсегда, как если бы это было записано в Священном Писании».
Английская версия Роба Трейна.
Нейробиологи обнаруживают спутанные клетки «зомби» в человеческом мозгу после смерти
Можно подумать, что когда человек мертв, его тело будет делать что-то; без кровообращения и воздуха внутренние системы быстро истощатся.Но из-за странной причуды биологии существуют такие вещи, как живые мертвецы — по крайней мере, живые клетки внутри выгоревшего и обсыпанного пылью тела.
Некоторые клетки человеческого мозга действительно увеличивают свою активность после того, как мы умираем. Эти «зомби» клетки увеличивают экспрессию своих генов и отважно продолжают пытаться выполнять свои жизненно важные задачи, как если бы кто-то забыл сказать им, что они теперь избыточны.
невролог Джеффри Леб из Университета Иллинойса и его коллеги наблюдали, как эти клетки упорно проросших новые щупальца и возились с делами в течение нескольких часов после смерти.
«Большинство исследований предполагают, что все в мозге останавливается, когда перестает биться сердце, но это не так», — сказал Лоеб. «Наши результаты будут необходимы для интерпретации исследований тканей человеческого мозга. Просто мы не оценили эти изменения до сих пор».
Большая часть информации, которая у нас есть о расстройствах мозга, таких как аутизм, болезнь Альцгеймера и шизофрения, получена в результате экспериментов, проводимых на тканях мозга после смерти; этот подход имеет решающее значение при поиске лечения, поскольку модели на животных для исследований мозга часто не верны нам.
Обычно эта работа проводится на тканях людей, умерших более 12 часов назад. Сравнивая экспрессию генов в свежих тканях мозга (удаленных в ходе операции по поводу эпилепсии у 20 пациентов) с вышеупомянутыми образцами мозга умерших людей, Лоеб и его команда обнаружили поразительные различия, которые не зависели от возраста или заболевания.
Они использовали данные об экспрессии генов, которые они позже подтвердили, исследуя гистологию ткани мозга, чтобы понять, что клеточно-специфическая активность изменяется с течением времени после смерти при комнатной температуре.
В то время как активность большинства генов оставалась стабильной в течение 24 часов, задокументированных командой, нейронные клетки и их активность генов быстро истощались. Однако наиболее примечательно то, что глиальные клетки увеличили экспрессию и процессы генов.
Клетки оживают после смерти человеческого мозга. (Д-р Джеффри Лоэб / UIC)
Поначалу это удивительно, но на самом деле это имеет большой смысл, учитывая, что глиальные клетки, такие как микроглия и астроциты, питающиеся отходами, вступают в действие, когда что-то идет не так.А умирать так же «неправильно», как и все живые существа.
«То, что глиальные клетки увеличиваются после смерти, неудивительно, учитывая, что они воспалительные, и их работа заключается в очистке после травм головного мозга, таких как кислородное голодание или инсульт», — сказал Леб.
Затем команда продемонстрировала, что РНК, экспрессируемая генами, сама по себе не изменяется в течение 24 часов после смерти, поэтому любые изменения в ее количестве действительно должны быть связаны с продолжением биологических процессов.
«Полная экспрессия генов в свежевыделенных образцах человеческого мозга позволяет получить беспрецедентное представление о геномной сложности человеческого мозга из-за сохранения стольких различных транскриптов, которые больше не присутствуют в посмертных тканях», — написали исследователи в своей статье. бумага.
Это имеет огромное значение как для прошлых, так и для настоящих исследований с использованием ткани мозга для понимания заболеваний, которые связаны с иммунными реакциями, таких как эти «зомби» глиальные клетки, которые набухают, когда они безуспешно пожирают окружающие кусочки умирающего мозга.
Однако через 24 часа эти клетки также умерли, и их уже нельзя было отличить от разрушающейся ткани, которая их окружала.
«Исследователям необходимо принять во внимание эти генетические и клеточные изменения и максимально сократить посмертный интервал, чтобы уменьшить масштабы этих изменений», — пояснил Лоеб.
«Хорошая новость из наших открытий заключается в том, что теперь мы знаем, какие гены и типы клеток стабильны, какие деградируют, а какие со временем увеличиваются, чтобы можно было лучше понять результаты посмертных исследований мозга».
Даже после смерти мы, биологические существа, никогда не бываем полностью статичными.
Это исследование было опубликовано в Scientific Reports .
Как клетки человека координируют начало репликации ДНК
Комплекс распознавания происхождения (ORC) — это группа белков, которые необходимо полностью собрать на первом этапе репликации ДНК.Один компонент ORC, ORC1 (видимый на этом изображении в виде ярко-зеленых точек), выделяется в капельки в ядре клетки и позволяет ненадолго перемещаться и собираться с другими белками в нужный момент клеточного цикла. Предоставлено: Манзар Хоссейн / лаборатория Стилмана / CSHL, 2021 г.
Cold Spring Harbor Laboratory (CSHL) Президент и главный исполнительный директор Брюс Стилман занимается анализом репликации ДНК, критического этапа деления клеток, с 1980-х годов. Его лаборатория изучает, как комплексы распознавания происхождения — ORC — координируют дупликацию ДНК.Они обнаружили, как наши клетки собирают и разбирают ORC во время цикла клеточного деления. Один белок ORC разделяется на маленькие жидкие капельки, разделяя их до тех пор, пока не наступит нужный момент для привлечения других белков и начала репликации ДНК.
ORC распознает, где инициировать репликацию во многих местах вдоль длинных линейных участков ДНК в хромосомах наших клеток. Полностью собранные ORC привлекают другие белки для создания точных копий хромосом.Этот механизм необходим для точного наследования ДНК без ошибок, которые могут привести к таким заболеваниям, как рак.
Ученые изучили структуру ORC у нескольких видов. Стилман объясняет:
«Мы ранее изучали это на пекарских дрожжах, но оказалось, что человеческие клетки действуют иначе».
В отличие от одноклеточных дрожжей, у человека есть множество клеток, которые делятся в разное время. Исследователи обнаружили, что один человеческий белок ORC, ORC1, имеет определенные области, которых не хватает дрожжевому ORC1.Когда ORC связывается с ДНК, ORC1 рекрутирует CDC6, белок, который собирает другие белки репликации ДНК. Некоторые из специфичных для человека участков ORC1 и CDC6 связываются с другими белками, которые регулируют репликацию ДНК. Манзар Хоссейн, исследователь лаборатории Стиллмана, говорит:
«Мы обнаружили, что ORC1 и CDC6 взаимодействуют очень косвенно. Мы обнаружили очень короткий период времени, который позволяет им взаимодействовать».
ДНК-связанный ORC1 изолируется в жидкие капли, которые на короткое время меняют форму, а затем вводит CDC6.Кухулика Бхалла, постдок из лаборатории Стилмана, объясняет:
«Итак, если вы можете представить себе лавовую лампу, как будто у вас есть жидкость, но внутри нее другая цветная жидкость. И им все же удавалось оставаться разделенными».
На протяжении большей части цикла деления клетки количество ORC1 и CDC6 колеблется в клетке. Стилман объясняет, что «как высокие, так и низкие количества ORC1 приводят к серьезным последствиям для жизнеспособности клеток. Таким образом, вы должны иметь только правильное количество» каждого белка на протяжении всего клеточного цикла.Стилман и его коллеги показали, что CDC6 задействует другие регуляторные белки, которые контролируют активность и уровни ORC1 как в пространстве, так и во времени. Они опубликовали свои результаты в Molecular Cell .
Делить или нет — петля клеточной обратной связи позволяет новым клеткам принимать судьбоносное решение.
Дополнительная информация:
Manzar Hossain et al., Множественные короткие белковые связывающие мотивы в ORC1 и CDC6 контролируют инициацию репликации ДНК, Molecular Cell (2021).DOI: 10.1016 / j.molcel.2021.03.003
Предоставлено
Лаборатория Колд-Спринг-Харбор
Ссылка :
Как клетки человека координируют начало репликации ДНК (2021, 23 марта)
получено 26 марта 2021 г.
с https: // физ.org / news / 2021-03-human-cells-dna-replication.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Измененные клетки кожи человека, имитирующие раннюю стадию развития эмбриона
Донна Лу
Структуры iBlastoid выглядят как настоящие бластоцисты человека
Университет Монаша
Живые структуры, моделирующие раннее эмбриональное развитие человека, были созданы полностью из клеток кожи.Модели означает, что это должно быть возможным изучение бесплодию, раннему выкидышу и раннего эмбрионального развития без спорного использования реальных эмбрионов человека — хотя модели могут поднять этические вопросы самостоятельно.
Ранее единственным способом изучения раннего развития человеческих эмбрионов были бластоцисты, полученные в результате процедур ЭКО. Бластоцисты представляют собой шарообразную раннюю стадию эмбрионального развития, которая формируется через пять дней после оплодотворения и может продолжать формировать эмбрионы.Но их использование в науке вызывает споры из-за их способности превратиться в живую человеческую личность.
Объявление
Теперь, перепрограммировав фибробласты, клетки соединительной ткани, взятые из образцов кожи, Хосе Поло из Университета Монаша в Мельбурне, Австралия, и его коллеги создали структуры, похожие на бластоцисты человека.
«Это первый случай, когда на людях мы создаем эмбриональную структуру без яйца», — говорит Джейсон Лимниос из Университета Бонда в Голд-Косте, Австралия, который не принимал участия в исследовании. «Это большое дело».
Структуры, которые команда назвала iBlastoids, могут быть использованы для моделирования первых двух недель эмбрионального развития.
iBlastoids структурно и генетически очень похожи на настоящие человеческие бластоцисты, но не идентичны. Например, у iBlastoids отсутствует блестящая оболочка, мембрана, которая окружает бластоцисту до того, как она имплантируется в матку.«Это то, что мы никогда не сможем смоделировать», — говорит Поло.
«Прямо сейчас вы не можете вживить это женщине и забеременеть», — говорит Лимниос. «Он не вырастет в плод или ребенка, потому что в нем отсутствуют некоторые из наиболее важных структурных частей».
Команда использовала технику, называемую ядерным перепрограммированием, для создания iBlastoids. Они взяли фибробласты у взрослых доноров и, изменив гены, экспрессируемые в клетках, изменили их свойства.
При помещении в трехмерный каркас, известный как внеклеточный матрикс, клетки спонтанно организовываются в сферические структуры, содержащие отдельные слои клеток, которые содержат бластоцисты человека.
iBlastoids могут давать начало плюрипотентным стволовым клеткам — клеткам, которые способны самообновляться и дифференцироваться в разные типы клеток тела. Они могут помочь в продвижении исследований бесплодия, позволяя ученым изучать, что происходит, когда эмбрионы подвергаются воздействию токсинов или вирусов на раннем этапе развития. По словам Лимниоса, все это теперь можно было сделать без использования настоящих человеческих эмбрионов.
Однако любые новые открытия, сделанные с использованием iBlastoids, могут потребовать подтверждения с использованием настоящих человеческих бластоцист, говорит Поло, хотя их использование может позволить проводить исследования в более широком масштабе, чем это возможно сейчас.
«Вы можете использовать 1000 или 10 000 iBlastoids, чтобы что-то обнаружить, а затем вы можете пойти и проверить это открытие на трех бластоцистах», — говорит он.
Разработка моделей, подобных эмбрионам, поднимает этические и юридические вопросы. Во многих странах человеческие эмбрионы нельзя по закону культивировать в лаборатории дольше 14 дней, хотя есть планы рассмотреть возможность изменения правила. По словам Поло, теперь необходимо будет обсудить, следует ли расширить этот предел для iBlastoids, учитывая, что они не являются настоящими человеческими эмбрионами.
«Закон должен догнать науку», — говорит Лимниос. «До этого времени все будут уважать действующие законы и обращаться с этими iBlastoids как с эмбрионами».
Ссылка на журнал: Nature , DOI: 10.1038 / s41586-021-03372-y
исследователей воссоздают ключевую стадию человеческого эмбриона в лаборатории | Наука
Этот лабораторный клубок человеческих клеток имеет много общего с 5-дневными человеческими эмбрионами.
ЮГО-ЗАПАДНЫЙ МЕДИЦИНСКИЙ ЦЕНТР УНИВЕРСИТЕТА ТЕХАСА
Автор: Митч Лесли,
Человеческий эмбрион на стадии бластоцисты меньше кончика шариковой ручки и может содержать менее 100 клеток, но эта точка пути развития давно озадачивала и раздражала биологов и врачей. Например, на этой стадии происходит много выкидышей, и бластоциста также может расщепляться с образованием близнецов.Теперь несколько исследовательских групп нашли способы имитировать бластоцисты, заставляя выращенные в лаборатории человеческие клетки формировать кластеры, очень похожие на настоящие.
Подвиг, описанный в двух статьях Nature на этой неделе и двух недавних препринтах, может позволить исследователям ответить на важные вопросы о фертильности человека, например, почему экстракорпоральное оплодотворение (ЭКО) часто терпит неудачу. Более того, эрзац-бластоцисты «станут окнами в эту стадию развития человека», — говорит биолог по стволовым клеткам Арье Вармфлэш из Университета Райса, не имеющий отношения к работе.«Они позволят нам изучить это так, как мы не могли делать раньше».
Когда-то все мы были бластоцистами. Эта фаза, которая у человека начинается примерно через 5 дней после оплодотворения и длится всего пару дней, является переломным моментом. «Бластоциста — это первая стадия, на которой у нас развиваются специализированные типы клеток», — говорит биолог развития Джанет Россант из Детской больницы и Университета Торонто. Этап также инициирует другое важное событие: имплантацию, при которой бластоциста прижимается к слизистой оболочке матки и начинает взаимодействовать с клетками матери, создавая плаценту.
Но ответить на такие вопросы, как какие гены контролируют развитие бластоцисты и почему имплантация так часто оказывается безуспешной, было затруднено. Единственным источником человеческих бластоцист являются донорские эмбрионы, изначально созданные для лечения ЭКО, которых мало и которые несут огромный этический багаж. В Соединенных Штатах, например, исследователи не могут использовать финансирование Национального института здоровья для изучения этих бластоцист. В поисках альтернативы несколько групп ученых заставили стволовые клетки мыши формировать скопления, похожие на бластоцисты, получившие название бластоидов, но они не полностью воспроизводят то, что происходит в человеческом эмбрионе.
Для создания человеческого бластоида клеточный биолог Джун Ву из Юго-западного медицинского центра Техасского университета и его коллеги первоначально использовали эмбриональные стволовые (ES) клетки, которые можно выделить из человеческих бластоцист и дать начало всем типам клеток в нашем организме. Ранее исследователи обнаружили, что при определенных условиях культивирования клетки могут образовывать каждый из трех типов клеток бластоцисты. Ву и его команда пошли еще дальше и показали, что когда они стимулировали культивированные человеческие ES-клетки двумя молекулярными смесями, клетки собирались в мертвые кольца для бластоцист.
Поскольку ES-клетки происходят из бластоцист человека, они имеют много общих этических и практических ограничений. Но при правильном молекулярном воздействии исследователи могут преобразовывать зрелые клетки, такие как фибробласты кожи, в индуцированные плюрипотентные стволовые (iPS) клетки, которые обладают такими же способностями генерирования тканей, как ES-клетки, но не требуют разрушения эмбрионов. Подталкивание человеческих iPS-клеток с помощью тех же двух молекулярных смесей также приводит к образованию кластеров бластоцистоподобных клеток, сообщает команда Ву в Nature .
Связанное содержание
Вторая группа, опубликованная в журнале Nature , возглавляемая биологом по стволовым клеткам Хосе Поло из Университета Монаша в Австралии, случайно столкнулась с другим рецептом создания человеческих бластоидов, изучая, как клетки кожи превращаются в клетки iPS. Группа заметила, что промежуточные клетки, которые не полностью преобразовались в iPS-клетки, могут порождать все три типа клеток бластоцисты. На стандартных планшетах для культивирования клетки не могли полностью раскрыть свой потенциал.Но в более просторных помещениях они сходились в сферы, очень похожие на бластоцисты. В препринтах, опубликованных на прошлой неделе, две независимые группы, возглавляемые биологами-разработчиками Магдаленой Зерницкой-Гетц из Калифорнийского технологического института и Ян Ю из Третьей больницы Пекинского университета, сообщили также о создании бластоцистоподобных кластеров из «расширенных» стволовых клеток человека.
Группы
Поло и Ву продемонстрировали, что их бластоиды повторяют многие характеристики бластоцист человека. Например, они содержали примерно одинаковое количество клеток и включали многие из одних и тех же генов.И, по крайней мере, в чашке для культивирования бластоиды воссоздают некоторые ранние этапы имплантации.
Создание кластеров было неэффективным, а те, которые сформировались, показали несколько ключевых отличий от бластоцист, полученных при ЭКО. «Мы многое не понимаем», — говорит Сьюзан Фишер из Калифорнийского университета в Сан-Франциско, биолог по репродукции и развитию. Тем не менее, она подчеркивает: «В качестве первого шага это очень увлекательно, и можно многому научиться».
Хотя новые методы неэффективны, Поло отмечает, что они все еще могут производить бластоиды в больших количествах.Это могло бы позволить исследователям использовать бластоиды для проверки того, нарушают ли определенные химические вещества эмбриональное развитие, отслеживать, как мутации приводят к врожденным дефектам, и улучшать ЭКО.
Бластоиды — это не эмбрионы, предупреждает Ву, а «совокупность клеток, которая проходит ранние стадии эмбриогенеза». Он добавляет, что человеческий бластоид не может развиться в плод. Широко признанное руководство по исследованиям, закрепленное в законе в некоторых странах, запрещает выращивание бластоцист более 14 дней — и все четыре группы соблюдали этот предел со своими бластоидами.Новые рекомендации Международного общества исследования стволовых клеток, которые должны быть опубликованы в мае, могут предоставить дополнительные рекомендации по работе с эмбриоподобными структурами, такими как бластоиды.
Но реакция публики на эти новые творения неопределенная, говорит Фишер. «Это тестовый пример того, как ученые и непрофессионалы относятся к совокупности клеток».
Человек-Свинья Гибридный Созданный в лаборатории-вот факты
В замечательном-если, вероятно, противоречивой-подвиг, ученые объявили сегодня, что они создали первые успешные гибриды человека и животного.Проект доказывает, что человеческие клетки могут быть введены в нечеловеческий организм, выжить и даже расти внутри животного-хозяина, в данном случае свиней.
Этот биомедицинский прогресс долгое время был мечтой и затруднением для ученых, надеющихся решить острую нехватку донорских органов.
Каждые десять минут человек добавляется в национальный список ожидания трансплантации органов. И каждый день 22 человека из этого списка умирают без нужного органа. Что, если вместо того, чтобы полагаться на щедрого донора, вы могли бы вырастить особый орган внутри животного?
Человеческая кровь фильтруется через легкие свиньи в лаборатории Ларса Бурдорфа в Медицинской школе Университета Мэриленда.Тысячи людей умирают каждый год из-за отсутствия трансплантируемых человеческих органов. Ученые экспериментируют с техникой под названием CRISPR, чтобы избавить органы свиньи от вирусов, наносящих вред человеку.
Теперь это на один шаг ближе к реальности, сообщает международная группа исследователей под руководством Института Солка в журнале Cell . Команда создала так называемую химеру: организм, содержащий клетки двух разных видов. (Подробнее о революции ДНК читайте в журнале National Geographic .)
В прошлом химеры человека и животного были недоступны. Такие эксперименты в настоящее время не имеют права на государственное финансирование в Соединенных Штатах (до сих пор команда Солка полагалась на частных доноров для проекта химеры). Общественное мнение также препятствовало созданию организмов, которые отчасти являются людьми, а отчасти животными.
Но для ведущего автора исследования Джун Ву из Института Солка нам нужно только взглянуть на мифические химеры — такие как гибриды человека и птицы, которых мы знаем как ангелов, — для другой точки зрения.
«В древних цивилизациях химеры ассоциировались с Богом», — говорит он, и наши предки считали, что «химерная форма может охранять людей». В каком-то смысле это то, на что команда надеется, когда-нибудь сделают гибриды человека и животных.
Создание химеры
Есть два способа сделать химеру. Первый — ввести органы одного животного в другое — рискованное дело, потому что иммунная система хозяина может вызвать отторжение органа.
Другой метод — начать на эмбриональном уровне, ввести клетки одного животного в эмбрион другого и дать им возможность срастись в гибрид.
Звучит странно, но это гениальный способ в конечном итоге решить ряд неприятных биологических проблем с органами, выращенными в лаборатории.
Когда ученые открыли стволовые клетки, главные клетки, которые могут производить любые ткани тела, они, казалось, содержали бесконечные научные перспективы. Но убедить эти клетки превратиться в нужные ткани и органы сложно.
Клетки должны выжить в чашках Петри. Ученые должны использовать каркасы, чтобы убедиться, что органы вырастают в нужную форму.И часто пациенты должны пройти болезненные и инвазивные процедуры для сбора тканей, необходимых для запуска процесса.
Сначала Хуан Карлос Изписуа Бельмонте, профессор лаборатории экспрессии генов Института Солка, думал, что концепция использования эмбриона-хозяина для выращивания органов казалась достаточно простой. Однако Бельмонте и более 40 сотрудников потребовалось четыре года, чтобы придумать, как создать химеру человека и животного.
Для этого команда использовала предыдущие химерные исследования, проведенные на мышах и крысах.
Эта годовалая химера произошла от мыши, которой инъецировали крысиные стволовые клетки.
Фотография любезно предоставлена Хуаном Карлосом Изписуа Бельмонте
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Другие ученые уже выяснили, как вырастить ткань поджелудочной железы крысы внутри мыши. В среду эта команда объявила, что поджелудочные железы мышей, выращенные внутри крыс, успешно лечили диабет, когда больным мышам пересаживали части здоровых органов.
Группа под руководством Солка продвинула эту концепцию еще на один шаг, использовав инструмент редактирования генома под названием CRISPR для взлома бластоцист мыши — предшественников эмбрионов. Там они удалили гены, которые нужны мышам для выращивания определенных органов. Когда они ввели крысиные стволовые клетки, способные производить эти органы, эти клетки процветали.
Получившиеся мыши смогли дожить до взрослого состояния. Некоторые даже вырастили химерный желчный пузырь из клеток мыши и крысы, хотя у крыс нет этого конкретного органа.
Риск отторжения
Затем команда взяла стволовые клетки у крыс и ввела их в бластоцисты свиней. Эта версия провалилась — неудивительно, поскольку у крыс и свиней резко различаются сроки беременности и эволюционные предки.
Но свиньи очень похожи на людей. Хотя им требуется меньше времени для вынашивания беременности, их органы очень похожи на наши.
Не то, чтобы это сходство облегчало задачу. Команда обнаружила, что для того, чтобы ввести человеческие клетки в свиней, не убивая их, им нужно было выбрать правильный момент.
«Мы попробовали три разных типа человеческих клеток, по сути, представляющих три разных периода» в процессе развития, — объясняет Цзюнь Ву, ученый из Института Солка и первый автор статьи. Путем проб и ошибок они узнали, что наивные плюрипотентные клетки — стволовые клетки с неограниченным потенциалом — не выживают так же хорошо, как те, которые развились немного дальше.
Когда эти самые подходящие человеческие клетки были введены в эмбрионы свиньи, эмбрионы выжили. Затем их поместили во взрослых свиней, которые несли эмбрионы от трех до четырех недель, прежде чем они были извлечены и проанализированы.
Всего команда создала 186 химерных эмбрионов на поздних стадиях, которые выжили, говорит Ву, и «по нашим оценкам, [каждый имел] примерно одну из 100 000 человеческих клеток».
Изображение бластоцисты свиньи, которой вводят человеческие клетки.
Фотография любезно предоставлена Хуаном Карлосом Изписуа Бельмонте
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Это низкий процент — и в долгосрочной перспективе это может стать проблемой для метода, — говорит Ке Ченг, эксперт по стволовым клеткам из Университета Северной Каролины в Чапел-Хилл и Университета штата Северная Каролина.
Человеческая ткань, по-видимому, замедляет рост эмбриона, отмечает Ченг, и органы, выращенные из таких эмбрионов, которые развиваются сейчас, вероятно, будут отвергнуты людьми, поскольку они будут содержать очень много ткани свиньи.
Следующий большой шаг, говорит Ченг, — это выяснить, можно ли увеличить количество человеческих клеток, которые могут переносить эмбрионы. Текущий метод — это начало, но все еще не ясно, можно ли преодолеть это препятствие.
Бельмонте соглашается, отмечая, что могут потребоваться годы, чтобы использовать этот процесс для создания функционирующих органов человека.Эту технику можно было бы использовать гораздо раньше как способ изучения развития человеческого эмбриона и понимания болезней. И эта информация в реальном времени может быть столь же ценной, как и возможность вырастить орган.
Даже на этой ранней стадии Ченг называет эту работу прорывом: «Есть и другие шаги, которые нужно предпринять, — признает он. «Но это интригует. Очень интригующе ».
Примечание редактора: Эта статья была обновлена, чтобы уточнить формирование желчного пузыря у химерных мышей.
Клетки человека
Клетки человека состоят из множества разных частей. У каждой части есть цель, и если вы хотите понять здоровье человека и биологию; все начинается с твердого понимания клетки.
Клетки разделены на отсеки. Эти отсеки известны как органеллы, и в каждом из них содержится
специфические функции. Существуют также структурные волокна и мембраны, указанные ниже:
Плазменная мембрана
Это внешний слой клетки.Он придает клетке форму и удерживает жидкость внутри клетки. Он полупроницаемый, что означает, что он позволяет определенным вещам проходить внутрь и наружу клетки. Сама мембрана представляет собой бислой фосфолипидов.
Ядро
Это часть клетки, которая содержит генетический материал, хромосомы и хроматин, которые связаны с воспроизводством клетки. Внутри ядра находится суборганелла, известная как ядрышко, которая производит и собирает рибосомы.
Цитоплазма
Это жидкость на водной основе внутри клетки, которая содержит соли и другие ионы и молекулы, взвешенные в растворе. В цитоплазме вы найдете волокна, белки, органеллы и везикулы.
Цитоскелет
Сеть белковых нитей в цитоплазме, которая обеспечивает структурную основу клетки и отвечает за движения клеток. Включает микротрубочки, микрофиламенты и промежуточные волокна.
Аппарат Гольджи
По сути, это большая складывающаяся мембрана. Он служит перерабатывающим заводом в пределах
клетка, в первую очередь работающая с белками и липидами. Он также упаковывает макромолекулы для транспортировки в другие области клетки или для секреции.
Лизосомы
Эти органеллы содержат мощные ферменты, известные как гидолазы, которые расщепляют молекулы пищи, старые или нежелательные органеллы и даже вторгаются в патогены.
Рибосомы
Рибосомы — это крошечные, примерно сферические структуры, прикрепленные к шероховатой эндоплазматической сети. Они участвуют в синтезе белков.
Центриоль
Центриоли — это бочкообразные органеллы, состоящие из триплетов микротрубочек. Находясь парами, они образуют центросомы, которые важны для деления клеток.
Митохондрия
Митохондрии (множественное число от митохондрий = митохондрии) связаны с дыханием клетки.Дыхание производит энергию для клетки. Это электростанции клетки.
Эндоплазматическая сеть
Еще одна мембранная органелла, связанная с ядерной мембраной. Выполняет множество функций, наиболее важными из которых являются синтез и сворачивание белка. Некоторые белки поступают в Гольджи для дальнейшей модификации и окончательной упаковки.
Пероксисомы
Эти органеллы содержат перекиси, которые переваривают липиды и некоторые другие продукты.
Микровилли
Находящиеся на клетках, которые функционируют для поглощения, это небольшие расширения клетки, которые служат для увеличения общей площади поверхности клеток.