Опухоль из клеток Лейдига — Leydig cell tumour
Лейдига опухолевых клеток , а также опухоли клеток Лейдиги (США написание), (яички) опухоли интерстициальных клеток и (яички) опухолевые клетки интерстициальных (США написание), является членом секс корда-стромальных опухоли группы яичников и яичек рака . Он возникает из клеток Лейдига . Хотя опухоль может возникнуть в любом возрасте, чаще всего она возникает у молодых людей.
Опухоли Сертоли-Лейдига представляет собой сочетание опухоли клеток Лейдига и опухоли клеток Сертоли из клеток Сертоли .
Презентация
Большинство опухолей из клеток Лейдига обнаруживается у мужчин, обычно в возрасте 5–10 лет или в среднем зрелом возрасте (30–60 лет). У детей обычно преждевременное половое созревание .
Из-за избытка тестостерона, секретируемого опухолью, у одной трети пациентов женского пола в недавнем анамнезе наблюдается прогрессирующая маскулинизация . Маскулинизации предшествуют ановуляция , олигоменорея , аменорея и дефеминизация . Дополнительные признаки включают акне и гирсутизм , снижение голоса, клиторомегалию , выпадение височных волос и увеличение мускулатуры. Уровень тестостерона в сыворотке высокий.
Дополнительные признаки включают акне и гирсутизм , снижение голоса, клиторомегалию , выпадение височных волос и увеличение мускулатуры. Уровень тестостерона в сыворотке высокий.
У мужчин опухоль яичек является наиболее частым признаком. Остальные симптомы зависят от возраста и типа опухоли. Если опухоль секретирует андрогены, опухоль обычно протекает бессимптомно, но может вызвать преждевременное половое созревание у мальчиков предпубертатного возраста. Если опухоль выделяет эстрогены, это может вызвать феминизацию у мальчиков. У взрослых это вызывает ряд проблем, включая гинекомастию , эректильную дисфункцию, бесплодие, женское распределение волос, гонадогенитальную атрофию и потерю либидо.
Причина
Исследования на животных предполагают возможную связь с C8 (C8HF15O2, перфтороктановая кислота ).
Диагностика
Наличие опухоли яичников плюс гормональные нарушения предполагает опухоль из клеток Лейдига, гранулезно-клеточную опухоль или текому . Однако гормональные нарушения при опухолях Лейдига присутствуют только в 2/3 случаев. Опухоли из клеток Лейдига яичек могут быть обнаружены сонографически, ультразвуковое исследование может быть назначено в случае пальпации шишки в мошонке, однако также возможна случайная идентификация этих повреждений.
Опухоли из клеток Лейдига яичек могут быть обнаружены сонографически, ультразвуковое исследование может быть назначено в случае пальпации шишки в мошонке, однако также возможна случайная идентификация этих повреждений.
Окончательный диагноз ставится с помощью гистологии , как часть отчета о патологии, сделанного во время или после операции. Кристаллы Рейнке классически обнаруживаются в этих опухолях и помогают подтвердить диагноз, хотя они встречаются менее чем в половине всех опухолей из клеток Лейдига. Иммуногистохимические маркеры опухолей из клеток Лейдига включают ингибин-альфа , кальретинин и мелан-A .
лечение
Обычный режим химиотерапии имеет ограниченную эффективность при опухолях этого типа, хотя иматиниб показал некоторые перспективы. В настоящее время лучевая терапия не играет роли.
Обычное лечение — хирургическое вмешательство. Операция для женщин обычно представляет собой одностороннюю сальпингоофорэктомию с сохранением фертильности. При злокачественных опухолях операция может быть радикальной и обычно сопровождается адъювантной химиотерапией, иногда лучевой терапией. Во всех случаях за начальным лечением следует наблюдение. Поскольку во многих случаях опухоль из клеток Лейдига не производит повышенных опухолевых маркеров , основное внимание уделяется повторному физическому обследованию и визуализации.
Во всех случаях за начальным лечением следует наблюдение. Поскольку во многих случаях опухоль из клеток Лейдига не производит повышенных опухолевых маркеров , основное внимание уделяется повторному физическому обследованию и визуализации.
У мужчин обычно выполняется радикальная паховая орхиэктомия. Однако операция по сохранению яичек может использоваться для поддержания фертильности у детей и молодых людей. Этот подход включает паховый или мошоночный разрез и ультразвуковое наблюдение, если опухоль не пальпируется. Это может быть сделано, потому что опухоль обычно одноочаговая, не связана с предраковыми поражениями и вряд ли вернется в норму.
Прогноз , как правило , хорошо , как опухоль , как правило, растет медленно и обычно доброкачественное : 10% являются злокачественными . Для злокачественных опухолей с недифференцированной гистологией прогноз неблагоприятный.
Дополнительные изображения
Смотрите также
Ссылки
внешние ссылки
}}
<img src=»https://en. wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Синтез тестостерона в организме мужчины
Андрогены в мужском организме по своему происхождению подразделяются на надпочечниковые и тестикулярные (табл. 1).
Таблица 1 – Источники андрогенов у мужчин
| Тестикулы (95-98%) | Надпочечники (3-5%) |
|---|---|
| Тестостерон Дегидроэпиандростерон (ДГЭА) Андростерон | Дегидроэпиандростерон (ДГЭА) Дигидроэпиандростерон-сульфат (ДГЭА-С) Андростендион |
Синтез андрогенов надпочечниками
Современные средства для самообороны — это внушительный список предметов, разных по принципам действия. Наибольшей популярностью пользуются те, на которые не нужна лицензия или разрешение на покупку и использование. В интернет магазине Tesakov.com, Вы можете купить средства самозащиты без лицензии.
Надпочечниковые андрогены способны превращаться в тестостерон.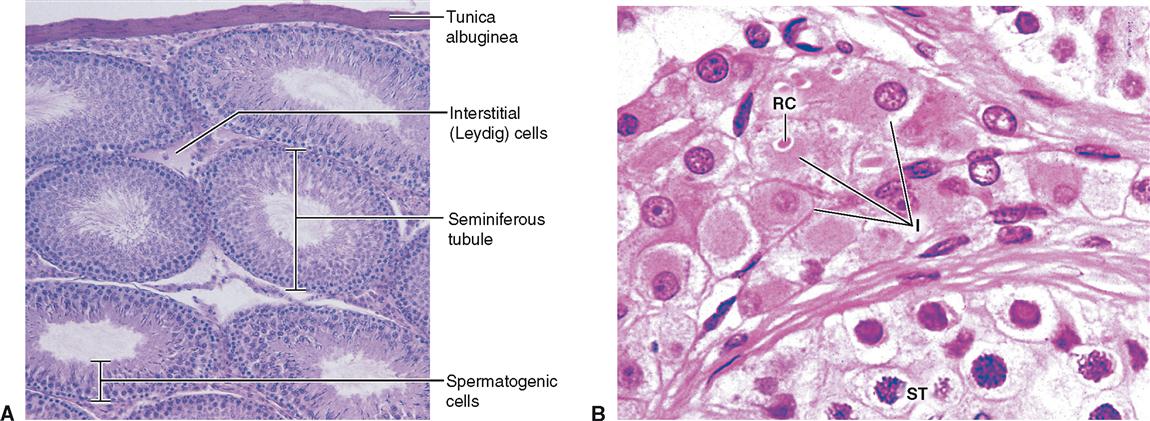 Однако их вклад в общий гормональный фон мужчины не столь значителен, как андрогенные эффекты тестостерона, секретируемого тестикулами.
Однако их вклад в общий гормональный фон мужчины не столь значителен, как андрогенные эффекты тестостерона, секретируемого тестикулами.
Впервые секреция надпочечниковых андрогенов возрастает в возрасте 7-8 лет и продолжает увеличиваться до середины полового созревания. Ведущая роль в активации секреции надпочечниковых андрогенов отводится адренокортикотропному гормону (АКТГ, кортикотропин), вырабатывающегося клетками передней доли гипофиза.
Синтез тестостерона в яичках
Яички взрослого мужчины синтезируют тестостерон (от 5 до 12 мг/сут), а также более слабые андрогены. В яичках также синтезируется небольшое кол-во дигидротестостерона (ДГТ) и эстрогена.
Тестостерон синтезируется из холестерина в клетках Лейдига. Контроль уровня секреции андрогенов происходит за счет обратной связи и контролируется гипоталамо-гипофизарной системой.
Гипоталамо-гипофизарная система и андрогены
В запуске секреции тестостерона яичками участвуют следующие гормоны:
ГнРГ секретируется в гипоталамусе, и ответственен за контроль импульсивной секреции гонадотропинов.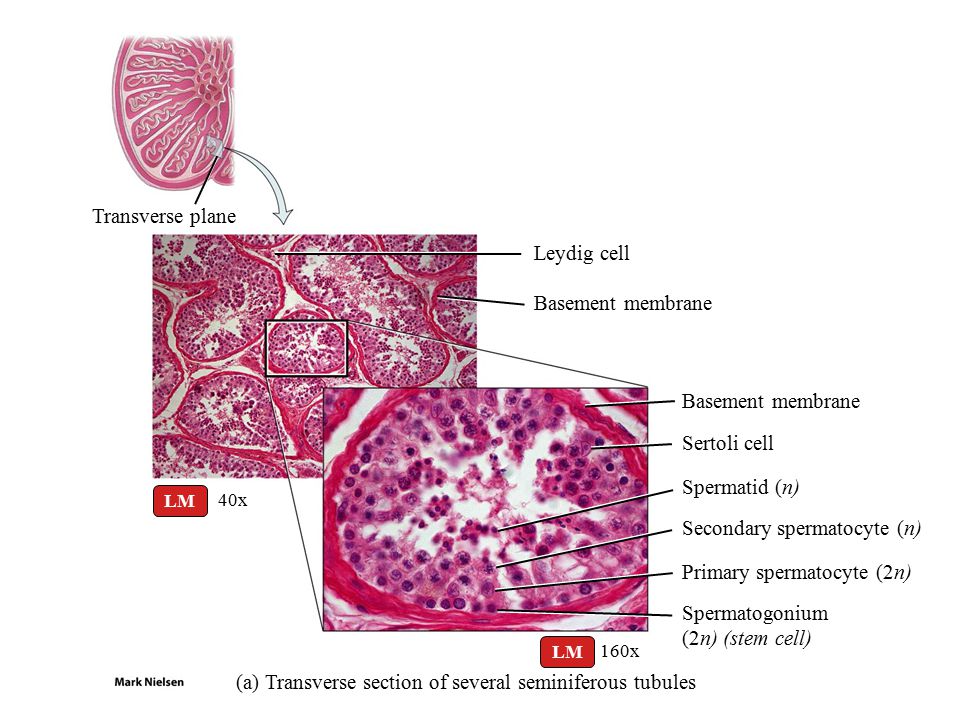 Гонадотропины – ЛГ и ФСГ, в свою очередь стимулируют выработку андрогенов и сперматогенез яичками. ЛГ ответственен за регулировку синтеза половых гормонов клетками Лейдига, а ФСГ индуцирует процессы созревания сперматозоидов, а также усиливает стимуляцию клеток Лейдига по отношению к ЛГ, посредствам увеличения ЛГ-рецепторов на мембранах клеток.
Гонадотропины – ЛГ и ФСГ, в свою очередь стимулируют выработку андрогенов и сперматогенез яичками. ЛГ ответственен за регулировку синтеза половых гормонов клетками Лейдига, а ФСГ индуцирует процессы созревания сперматозоидов, а также усиливает стимуляцию клеток Лейдига по отношению к ЛГ, посредствам увеличения ЛГ-рецепторов на мембранах клеток.
Интенсивность выделения гонадотропинов по принципу отрицательной обратной связи зависит от уровня тестостерона и ингибина. Известно, что тестостерон подавляет секрецию ЛГ, а ингибин является ингибитором секреции ФСГ. Это объясняет, почему одним из побочных эффектов заместительной терапии гормональными препаратами у мужчин, а также применение данных препаратов в бодибилдинге, является подавление секреции собственного тестостерона, и при длительном применении вызывает уменьшение яичек в размере, ввиду временного угнетения их функций.
Существует предположение, что в механизме ингибирующего влияния тестостерона на ЛГ участвует не сам тестостерон, а другие стероиды, в которые он трансформируется, например ДГТ и эстрадиол – наиболее активный женский половой гормон. Доказано, что ингибирующее свойство эстрадиола на ЛГ, превосходит ингибирующее свойство тестостерона на ЛГ. Такое положение определяет снижение половых гормонов при ожирении мужчин, связанное с повышенной ароматизацией андрогенов в эстрогены (см. подробнее об ожирении и тестостероне). Ингибирующее свойство эстрогенов по отношению к ФСГ проявляется еще в большей степени, чем к ЛГ.
Доказано, что ингибирующее свойство эстрадиола на ЛГ, превосходит ингибирующее свойство тестостерона на ЛГ. Такое положение определяет снижение половых гормонов при ожирении мужчин, связанное с повышенной ароматизацией андрогенов в эстрогены (см. подробнее об ожирении и тестостероне). Ингибирующее свойство эстрогенов по отношению к ФСГ проявляется еще в большей степени, чем к ЛГ.
Для поддержания стероидогенной активности в клетках Лейдига в присутствие ЛГ необходим еще один гормон гипофиза – пролактин. Он ответственен за увеличение число рецепторов ЛГ. Однако это касается только нормального его уровня – при повышенном уровне пролактина угнетается секреторная функция клеток Лейдига. Постоянно повышенный пролактин в плазме крови рассматривается как гиперпролактинемия у мужчин.
Поскольку секреция гонадотропинов имеет импульсивный характер, с наибольшим пиком в утренние часы, то и максимальный уровень тестостерона приходится на 6:00-8:00 часов утра, постепенно снижаясь в течение дня и достигая своего минимума к 20:00-22:00 часам.
- Борода не растет? Или она не такая густая и шикарная, как хотелось бы? Не все еще потеряно.
- Косметика и аксессуары для правильного ухода за бородой и усами. Зайдите сейчас!
Клетки Лейдига Википедия
Клетка Лейдига — гормонопродуцирующие клетки млекопитающих, расположенные между семенными канальцами в семенниках, в них производится тестостерон и другие соединения андрогенного ряда, также в них образуется небольшое количество женских половых гормонов эстрогенов и прогестинов.
Эти клеточные элементы расположены в межуточной (интерстициальной) ткани яичек между извитыми канальцами поодиночке или в виде скоплений различной численности вблизи кровеносных капилляров. КЛ весьма крупные, их размер достигает 20 мкм и более. Ядра КЛ обычно округло-овальной формы, светлые, с 1—2, иногда больше, ядрышками. Цитоплазма ацидофильная, зернистая, содержит многочисленные органеллы, среди которых преобладают митохондрии и гладкий эндоплазматический ретикулум, что свидетельствует о высокой синтезирующей способности данных клеточных элементов.
Выделяют 3 различных морфофункциональных типа КЛ в зависимости от их величины: малые, средние и большие. Согласно литературным данным, КЛ малых размеров являются малоактивными в отношении стероидогенеза и представляют собой инволюционирующие формы; напротив, КЛ среднего и большого размера активно продуцируют тестостерон. Этот андрогенный гормон необходим для нормального течения сперматогенеза, регулирует развитие и функцию добавочных желез половой системы, обеспечивает развитие вторичных половых признаков, определяет сексуальную активность и половое поведение. Регуляция синтеза тестостерона КЛ находится под контролем гипоталамо-гипофизарной системы.
Гонадолиберин, секретируемый в пульсовом режиме в портальную систему гипофиза, стимулирует в нём синтез гонадотропных гормонов, одним из которых является лютеинизирующий гормон (ЛГ), стимулирующий эндокринную функции яичка за счёт прямого действия на КЛ, — чем больше ЛГ в крови, тем интенсивнее продукция тестостерона. Напротив, повышение сывороточного уровня последнего приводит к угнетению секреции ЛГ (обратная связь). Большинство научных исследований, посвященных тестикулярным интерстициальным эндокриноцитам, носит экспериментальный характер. При этом часто использовались разнообразные морфометрические методы, позволяющие с разных сторон объективно осветить те или иные изменения различных тканевых и клеточных структур, в частности, КЛ.
Большинство научных исследований, посвященных тестикулярным интерстициальным эндокриноцитам, носит экспериментальный характер. При этом часто использовались разнообразные морфометрические методы, позволяющие с разных сторон объективно осветить те или иные изменения различных тканевых и клеточных структур, в частности, КЛ.
К настоящему времени достаточно подробно изучена возрастная функциональная морфология семенников. Однако разработка этой проблемы у человека дала противоречивые результаты. Вместе с тем, особенности функциональной морфологии КЛ, ассоциированные с возрастом, применительно к относительно здоровым мужчинам могут служить так называемой «условной нормой» (УН) и быть полезными при изучении эндокринной части семенников в условиях патологии. Число КЛ достигает максимума к 20 годам жизни человека и мало изменяется до 60 лет, составляя 4 % объёма зрелого яичка. После 60 лет их число постепенно снижается на половину.
См. также
Литература
- Розен.
 Б.Б Основы эндокринологии 1994.— М.: Изд-во МГУ, 1994.— С.21
Б.Б Основы эндокринологии 1994.— М.: Изд-во МГУ, 1994.— С.21 - Современная медицина: актуальные вопросы. / Сб. ст. по материалам XXIХ междунар. науч.-практ. конф. № 3 (29). Новосибирск: Изд. «СибАК», 2014. — С. 27
Кости помогут вылечить мужское бесплодие « Российская Фармацевтика
В Колумбийском университете решают проблему мужского бесплодия через «костный гормон»
Источник: Science Photo
Гормон, выделяемый клетками костной ткани, может влиять на мужскую фертильность – способность к оплодотворению, предполагают ученые из Колумбийского университета. В частности, исследователи показали, что «костный гормон» остеокальцин приводит к повышению уровня тестостерона у самцов мышей и, как следствие, к увеличению их репродуктивных способностей. Специалисты надеются, что их открытие позволит найти наиболее действенный метод борьбы с мужским бесплодием.
Исследователи из медицинского центра Колумбийского университета США решили проверить, есть ли обратная связь между клетками костной ткани и половыми гормонами, то есть способны ли остеобласты как-то влиять на уровень половых гормонов в крови. «Мы подумали, что остеокальцин как-то может повлиять на уровень гормонов. Причем изначально мы считали, что в большей степени он будет воздействовать на женские половые гормоны», – цитирует слова руководителя исследования Джерарда Карсенти (Gerard Karsenty) Nature News.
«Мы подумали, что остеокальцин как-то может повлиять на уровень гормонов. Причем изначально мы считали, что в большей степени он будет воздействовать на женские половые гормоны», – цитирует слова руководителя исследования Джерарда Карсенти (Gerard Karsenty) Nature News.
Роль половых гормонов в развитии костной ткани
Известно, что половые гормоны влияют на развитие костной ткани. В частности, женские половые гормоны прогестагены и мужские андрогены стимулирует деление и развитие остеобластов – «молодых» клеток костей. Особую роль на развитие костей половые гормоны играют в пубертатном периоде, когда особенности формирования скелета напрямую зависят от преобладания женских или мужских половых гормонов.
В предварительном эксперименте ученым удалось показать, что лишение способности клеток костной ткани мышей вырабатывать остеокальцин приводит к снижению уровня тестостерона в их крови. При этом на репродуктивность самок мышей подобное «лишение» не оказывало никакого влияния. Таким образом, самцы гораздо больше подвержены влиянию «костного гормона».
Таким образом, самцы гораздо больше подвержены влиянию «костного гормона».
Остеобласты, молодые костные клетки, в процессе созревания превращаются в остеоциты. На рисунке — остеоцит. Источник: Science Photo
Остеобласты
— молодые остеобразующие клетки костей, способные синтезировать межклеточное вещество – так называемый матрикс. По мере накопления этого вещества остеобласты «затвердевают» в нем и становятся остеоцитами – зрелыми клетками костной ткани. Остеобласты также высвобождает особый белок – остеокальцин, который является своеобразным «маркером» формирования кости.
Остеобласты, выделяя белок остеокальцин, способны воздействовать на выработку тестостерона. Источник: Science Photo
Убедившись, что остеокальцин оказывает влияние именно на тестостерон, специалисты провели еще несколько серий экспериментов. Так, в одном из них они выращивали гормонопродуцирующие клетки Лейдига в присутствии остеобластов и других клеток.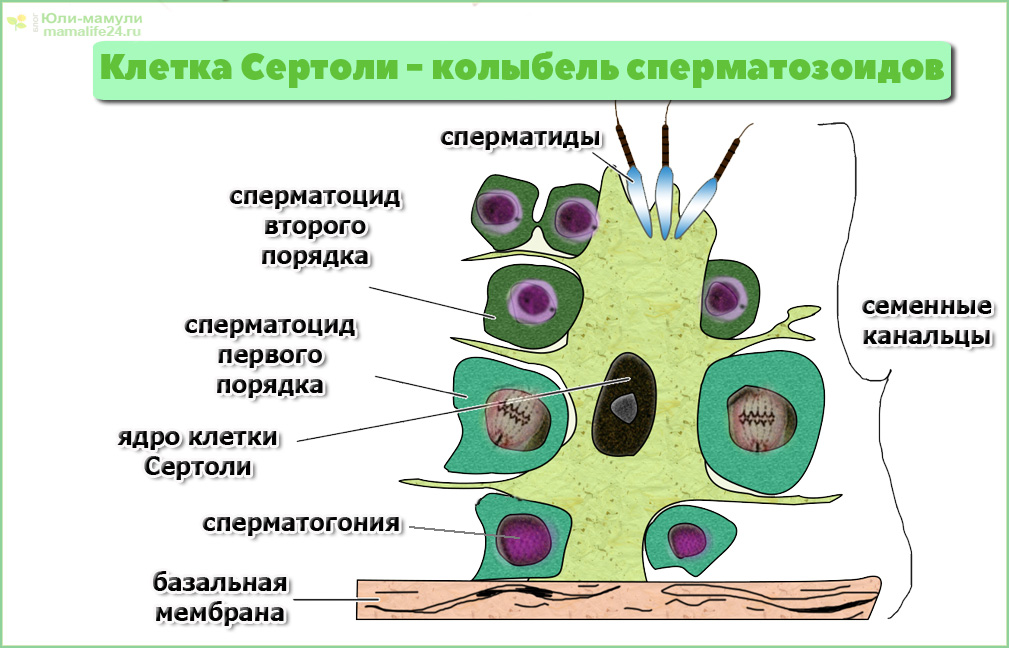 В итоге оказалось, что костные клетки, в отличие от других, в несколько раз повышают продуктивность и активность клеток Лейдига. Подобные данные позволили ученым утвердиться во мнении относительно того, что костные клетки действительно могут влиять на выработку половых гормонов. Однако, с другой стороны, мог существовать и еще один вариант: гормон, влияющий на концентрацию тестостерона в крови, мог быть вовсе и не костным гормоном, а вырабатываться в тех же самых семенниках.
В итоге оказалось, что костные клетки, в отличие от других, в несколько раз повышают продуктивность и активность клеток Лейдига. Подобные данные позволили ученым утвердиться во мнении относительно того, что костные клетки действительно могут влиять на выработку половых гормонов. Однако, с другой стороны, мог существовать и еще один вариант: гормон, влияющий на концентрацию тестостерона в крови, мог быть вовсе и не костным гормоном, а вырабатываться в тех же самых семенниках.
Клетки Лейдига
— гормонопродуцирующие клетки млекопитающих, расположенные между семенными канальцами в семенниках. Именно в этих клетках производится тестостерон. Также в них образуется небольшое количество женских половых гормонов эстрогенов и прогестинов.
Клетки Лейдига производят тестостерон. Источник: Science Photo
Чтобы исключить вариант вариант выработки гормона половыми железами, исследователи поставили еще один эксперимент, в котором «нокаутировали» («выключили») ген остеокальцина, и посмотрели, как подобное «выпадение» гена повлияет на уровень тестостерона.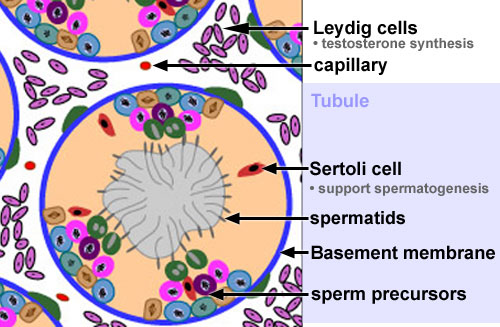 Для этого клетки Лейдига инкубировали с нормальными и генетическими модифицированными, то есть содержащими «выключенный» ген остеокальцина и, соответственно, не способными его синтезировать, костными клетками. В итоге оказалось, что «клетки-инвалиды» не оказывали никакого влияния на синтез тестостерона. А вот полноценные остеобласты, напротив, в несколько раз «повысили» уровень мужского гормона. Интересно также, что, когда к клеткам Лейдига, находившимся вместе с видоизмененными остеобластами, добавили очищенный остеокальцин, это также повлияло на выработку тестостерона.
Для этого клетки Лейдига инкубировали с нормальными и генетическими модифицированными, то есть содержащими «выключенный» ген остеокальцина и, соответственно, не способными его синтезировать, костными клетками. В итоге оказалось, что «клетки-инвалиды» не оказывали никакого влияния на синтез тестостерона. А вот полноценные остеобласты, напротив, в несколько раз «повысили» уровень мужского гормона. Интересно также, что, когда к клеткам Лейдига, находившимся вместе с видоизмененными остеобластами, добавили очищенный остеокальцин, это также повлияло на выработку тестостерона.
Генный нокаут
Один из методов генной инженерии, позволяющих искусственно инактивировать один из генов.
Как показали ученые, ключевую роль в запуске механизма высвобождения дополнительных порций тестостерона играет также рецептор остеокальцина – GPRC6A. При взаимодействии белка остеокальцина с рецептором на поверхности клетки Лейдига происходит активация пути, по которому идет синтез тестостерона. Исследователи предполагают, что лекарства, используемые при лечении костных заболеваний, могут затрагивать эти пути, и, как следствие, влиять на мужские репродуктивные способности.
Исследователи предполагают, что лекарства, используемые при лечении костных заболеваний, могут затрагивать эти пути, и, как следствие, влиять на мужские репродуктивные способности.
Схема действия остеокальцина на клетки семенников — клетки Лейдига. Источник: Журнал Cell
Кстати, ранее этими же исследователями было показано, что костная ткань может быть задействована и в выработке инсулина. «Все этого указывает на то, что остеокальцин может являться универсальным гормоном. Он, конечно, не влиял на продолжительность жизни мышей, но качество их жизни значительно улучшал», – говорит Джерард Карсенти.
Ученые заявляют, что полученные ими результаты помогут разработать наиболее действенные методы борьбы и с мужским бесплодием у человека.
Юлия Синяева
gzt.ru
Синдромы с парциальным поражением яичек — Гипогонадизм как самостоятельное заболевание — Гипогонадизм — Нарушения полового развития у мальчиков
Гипергонадотропный гипогонадизм чаще сопровождается первичной тотальной недостаточностью яичек. Однако изредка преимущественно страдает один морфологический компонент семенников. Различают первичный гипогонадизм с поражением клеток Лейдига, гипогонадизм с преимущественным нарушением функции канальцев и первичную аплазию зародышевого эпителия (синдром дель Кастильо).
Однако изредка преимущественно страдает один морфологический компонент семенников. Различают первичный гипогонадизм с поражением клеток Лейдига, гипогонадизм с преимущественным нарушением функции канальцев и первичную аплазию зародышевого эпителия (синдром дель Кастильо).
Первичная недостаточность клеток Лейдига
Первичная недостаточность клеток Лейдига развивается вследствие повреждения интерстициальной ткани яичек различными вредными агентами: проникающая радиация (в том числе и рентгеновские лучи; в этом заключается опасность рентгенологического исследования тазовой области без специальной защиты яичек!), инфекция, препараты с тератогенными свойствами и др.
По-видимому, в отдельных случаях бывает генетически обусловленное недоразвитие или отсутствие закладки интерстициальных клеток. У больных резко снижена продукция тестостерона, что приводит к повышению уровня ЛГ в крови Секреция ФСГ остается в пределах нормы, так как канальцы либо не повреждены, либо их функция снижена меньше, чем клеток Лейдига.
Из-за отсутствия достаточной секреции тестостерона полноценный сперматогенез становится невозможным. Фертильность больных низкая.
Клинически отмечаются все признаки гипогонадизма. Яички небольших размеров, умеренно плотные, половой член и мошонка недоразвиты, вторичные половые признаки отсутствуют. С возрастом постепенно формируются типичные евнухоидные пропорции тела. Введение ХГ в течение 3 дней не повышает уровень тестостерона в крови и экскрецию 17-КС. Дифференциальный диагноз с другими формами гипогонадизма основывается также на определении содержания в крови гонадотропных гормонов (высокий уровень ЛГ и нормальный ФСГ).
Первичная недостаточность канальцев
Первичная недостаточность канальцев по гистологическим изменениям в семенниках напоминает синдром Клайнфелтера.
Однако в связи с нормальным кариотипом и приобретенным характером заболевания у большинства больных эту форму гипогонадизма называют ложным синдромом Клайнфелтера.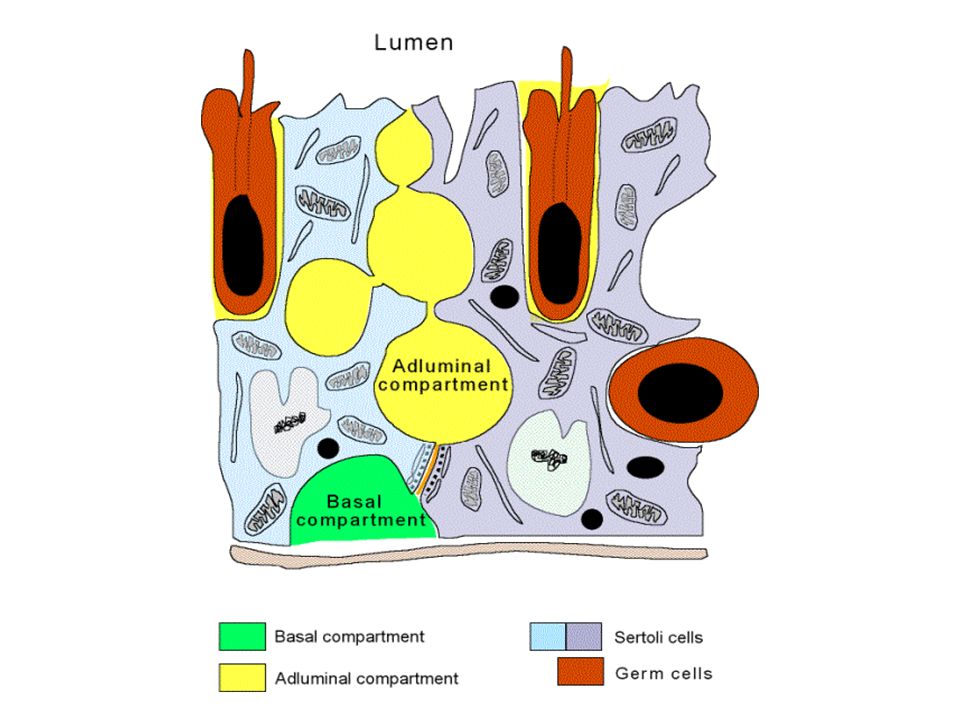 Прогрессирующий гиалиноз семенных канальцев возможен при длительном лечении препаратами ХГ [Уилкинс Л., 1963], поэтому ХГ назначают лишь по строгим показаниям.
Прогрессирующий гиалиноз семенных канальцев возможен при длительном лечении препаратами ХГ [Уилкинс Л., 1963], поэтому ХГ назначают лишь по строгим показаниям.
Смотрите раздел – Лечение гипогонадизма и коррекция задержки полового развития
Другой причиной ложного синдрома Клайнфелтера может стать перенесенный орхит. Чаще истинную причину заболевания установить не удается. Содержание тестостерона в крови у этих больных снижено, однако меньше, чем при первичном поражении клеток Лейдига. Продукция гонадотропинов повышена, особенно ФСГ. Проба с ХГ обычно выявляет андрогенные резервы яичек, которые, однако, ниже, чем у больных с гипогонадотропным гипогонадизмом.
Клиническая картина характеризуется симптомами, напоминающими истинный синдром Клайнфелтера. Больные высокого роста, евнухоидного телосложения. Половой член небольших размеров, яички маленькие, плотные. У двух наблюдаемых нами больных гинекомастии не было. Н. Т. Старкова (1973) приводит описание больного, у которого биопсия яичек подтвердила гиалиноз канальцев, с выраженной гипекомастией.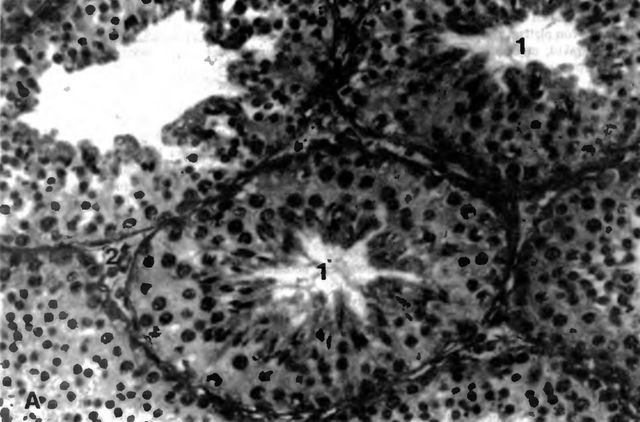 Вторичные половые признаки развиты недостаточно, оволосение лобка по женскому типу.
Вторичные половые признаки развиты недостаточно, оволосение лобка по женскому типу.
Интеллект у всех больных нормальный. Дифференцировать ложный синдром Клайнфелтера с истинным легко определением кариотипа, но отличить от других форм гипогонадизма можно только после биопсии гонад. Тем не менее характерные гипофизарно-гонадные взаимоотношения у этих больных (см. выше) заставляют подумать о ложном синдроме Клайнфелтера раньше.
Первичная герминативная аплазия
Первичная герминативная аплазия впервые описана del Castillo с соавт. в 1947 г. Синдром характеризуется отсутствием половых клеток. При гистологическом исследовании в семенных канальцах находят только клетки Сертоли без зародышевого эпителия (другое название заболевания — «синдром только клеток Сертоли»). Интерстиций яичек развит нормально. Причины заболевания остаются неясными. Авторы, описавшие синдром, связывают его происхождение с воздействием радиации. Типичная гистологическая картина иногда обнаруживается при запущенных формах крипторхизма [Тетер, 1968], а также тяжелых травмах и заболеваниях нервной системы.
Однако, по-видимому, синдром следует считать врожденным заболеванием с ранней артофией герминативных клеток. Гипофизарно-гонадные взаимоотношения у этих больных могут быть близкими к нормальным.
Нормальное содержание гонадотропных гормонов в крови при синдроме дель Кастильо дало основание некоторым авторам считать его разновидностью нормогонадотропного гипогонадизма [Лайбер Б., Ольбрих Г., 1974]. Половое развитие больных происходит в обычные сроки, маскулинные признаки вполне достаточные.
В дальнейшем отмечаются азооспермия и бесплодие. У части больных возможны незначительные клинические проявления евнухоидизма.
«Нарушения полового развития у мальчиков»,
П.М.Скородок, О.Н.Савченко
Популярные статьи раздела
Опухоли из клеток Сертоли и Лейдига — Студопедия. Нет
Нет
Сертоли — стромально-клеточные опухоли (андробластома). Андробластома относится к гормонально-активным маскулинизирующим опухолям и составляет около 1,5-2% новообразований яичников. Это маскулинизирующая гормонопродуцирующая опухоль, содержащая клетки Сертоли — Лейдига (хилюсные и стромальные клетки). Термин «адренобластома» не отражает сопутствующую маскулинизацию. Образующиеся в избытке андрогены угнетают функцию гипофиза и в организме снижается выработка эстрогенов. Опухоль преимущественно доброкачественная, злокачественные варианты составляют 0,2% злокачественных поражений яичников. Андробластома встречается у пациенток до 20 лет и у девочек, в этих наблюдениях нередко отмечается изосексуальное преждевременное половое созревание. Диаметр образования от 5 до 20 см. Капсула часто четко выражена, строение нередко дольчатое, на разрезе опухоль солидная, желтоватого, оранжевого или оранжево-серого цвета. Сохранившийся другой яичник всегда атрофичен, фиброзно изменен, как у женщин в постменопаузе.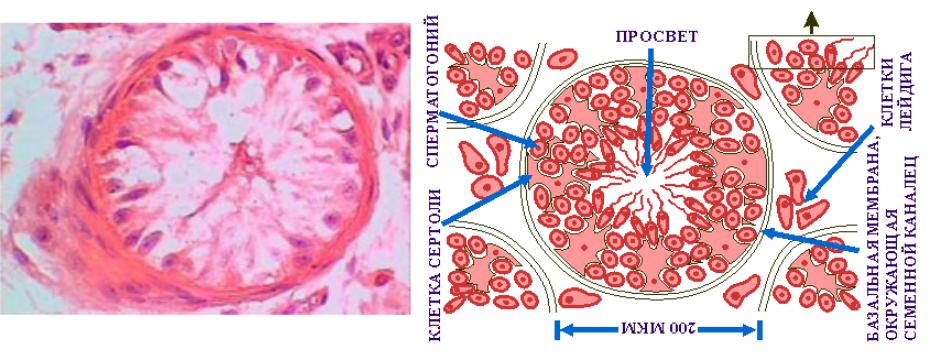 Основное клиническое проявление опухоли — вирилизация. На фоне общего здоровья возникает аменорея, отмечается бесплодие, уменьшаются молочные железы (дефеминизация), позднее появляются признаки маскулинизации — грубеет голос, развивается оволосение по мужскому типу (гирсутизм), повышается либидо, уменьшается подкожная жировая клетчатка, возникает гипертрофия клитора, контуры тела и лица приобретают мужские черты. Симптомы заболевания обычно развиваются постепенно. Клинические проявления в основном зависят от возраста. В репродуктивном периоде пациентка обращается к врачу, как правило, по поводу аменореи и бесплодия. В период климактерия и постменопаузы в большинстве случаев клинические признаки считают возрастными явлениями и лишь при развитии маскулинизации пациентки обращаются к врачу. Опухоль развивается медленно, поэтому более раннее обращение к врачу обычно связано с болями внизу живота (при осложнениях). Диагноз устанавливают на основании клинической картины и данных двуручного влагалищно-абдоминального исследования, а также УЗИ с ЦДК.
Основное клиническое проявление опухоли — вирилизация. На фоне общего здоровья возникает аменорея, отмечается бесплодие, уменьшаются молочные железы (дефеминизация), позднее появляются признаки маскулинизации — грубеет голос, развивается оволосение по мужскому типу (гирсутизм), повышается либидо, уменьшается подкожная жировая клетчатка, возникает гипертрофия клитора, контуры тела и лица приобретают мужские черты. Симптомы заболевания обычно развиваются постепенно. Клинические проявления в основном зависят от возраста. В репродуктивном периоде пациентка обращается к врачу, как правило, по поводу аменореи и бесплодия. В период климактерия и постменопаузы в большинстве случаев клинические признаки считают возрастными явлениями и лишь при развитии маскулинизации пациентки обращаются к врачу. Опухоль развивается медленно, поэтому более раннее обращение к врачу обычно связано с болями внизу живота (при осложнениях). Диагноз устанавливают на основании клинической картины и данных двуручного влагалищно-абдоминального исследования, а также УЗИ с ЦДК. При гинекологическом исследовании опухоль определяется сбоку от матки, она односторонняя, подвижная, безболезненная, диаметром от 5 до 20 см, овальной формы, плотной консистенции, с гладкой поверхностью. При УЗИ андробластома имеет сходные признаки с гранулезо- и тека-клеточными опухолями.
При гинекологическом исследовании опухоль определяется сбоку от матки, она односторонняя, подвижная, безболезненная, диаметром от 5 до 20 см, овальной формы, плотной консистенции, с гладкой поверхностью. При УЗИ андробластома имеет сходные признаки с гранулезо- и тека-клеточными опухолями.
Выделяют солидный, кистозный и кистозно-солидный типы. Эхографическая картина показывает неоднородное внутреннее строение с множественными гиперэхогенными участками и гипоэхогенными включениями. Допплерография не имеет определенного значения в дифференциальной диагностике, но иногда помогает найти опухоль.
Лечение вирилизирующих опухолей яичника оперативное, как лапаротомическим, так и лапароскопическим доступом. Объем и доступ оперативного лечения зависят от возраста больной, величины и характера объемного образования, сопутствующей генитальной и экстрагенитальной патологии. При андробластоме у девочек и пациенток репродуктивного возраста достаточно удалить придатки матки пораженной стороны.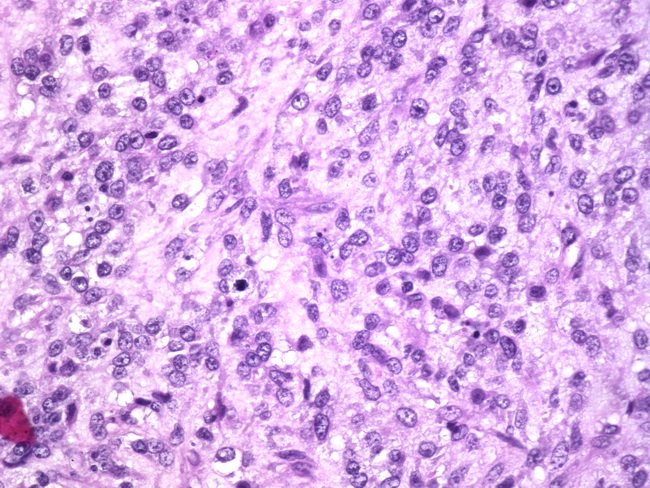 У больных в постменопаузе выполняют надвлагалищную ампутацию матки с придатками. После удаления опухоли функции организма женщины восстанавливаются в такой же последовательности, в какой развивались симптомы заболевания. Облик женщины меняется очень быстро, восстанавливаются менструальная и репродуктивная функции, но огрубение голоса, гипертрофия клитора и гирсутизм могут сохраниться на всю жизнь. При подозрении на злокачественную опухоль показаны пангистерэктомия и удаление сальника. Прогноз при доброкачественной опухоли благоприятный.
У больных в постменопаузе выполняют надвлагалищную ампутацию матки с придатками. После удаления опухоли функции организма женщины восстанавливаются в такой же последовательности, в какой развивались симптомы заболевания. Облик женщины меняется очень быстро, восстанавливаются менструальная и репродуктивная функции, но огрубение голоса, гипертрофия клитора и гирсутизм могут сохраниться на всю жизнь. При подозрении на злокачественную опухоль показаны пангистерэктомия и удаление сальника. Прогноз при доброкачественной опухоли благоприятный.
Герминогенные опухоли
опухоль яичник андробластома герминогенный
Герминогенные новообразования возникают из первичных половых клеток эмбриональных гонад и их производных, из 3 зародышевых листков — эктодермы, мезодермы и эндодермы.
Дисгерминома (семинома яичника) — злокачественная опухоль яичника, в связи с выраженным сходством с соответствующей тестикулярной опухолью.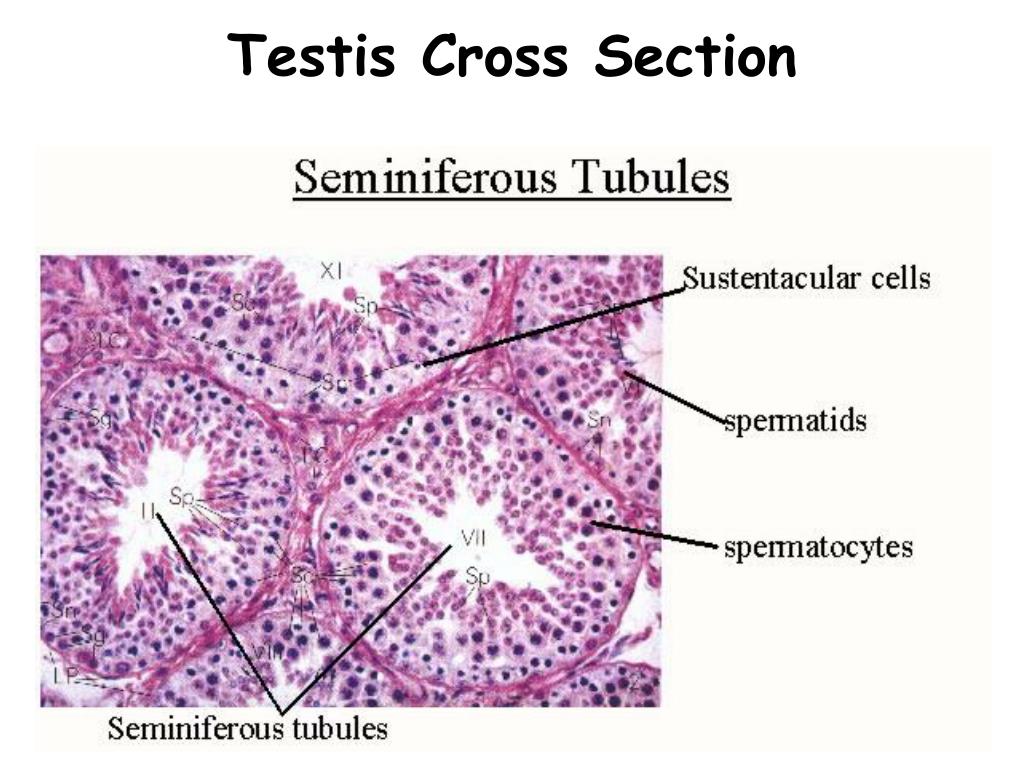 Дисгерминомы составляют около 1-2% опухолей яичников, наиболее часто выявляются в возрасте от 10 до 30 лет, примерно в 5% случаев до 10 лет и очень редко после 50 лет. Дисгерминома составляет около 3% среди злокачественных опухолей. Дисгерминома представляет собой самую частую злокачественную опухоль при беременности. Состоит из клеток, морфологически сходных с примордиальными фолликулами. Считают, что дисгерминомы происходят из первичных герминогенных элементов. В норме к моменту рождения все половые клетки находятся в составе примордиальных фолликулов, половые клетки, не образующие фолликулов, погибают. Если этого не происходит, то половые клетки приобретают способность к бесконтрольной пролиферации и дают начало опухоли. Дисгерминома возникает у подростков и молодых женщин при общем и генитальном инфантилизме с поздним менархе. Часто наблюдаются аномалии наружных половых органов. Опухоль, как правило, односторонняя. Двусторонняя дисгерминома нередко сочетается с гонадобластомой. Типичная дисгерминома представлена солидной опухолью округлой или овоидной формы с гладкой белесоватой фиброзной капсулой.
Дисгерминомы составляют около 1-2% опухолей яичников, наиболее часто выявляются в возрасте от 10 до 30 лет, примерно в 5% случаев до 10 лет и очень редко после 50 лет. Дисгерминома составляет около 3% среди злокачественных опухолей. Дисгерминома представляет собой самую частую злокачественную опухоль при беременности. Состоит из клеток, морфологически сходных с примордиальными фолликулами. Считают, что дисгерминомы происходят из первичных герминогенных элементов. В норме к моменту рождения все половые клетки находятся в составе примордиальных фолликулов, половые клетки, не образующие фолликулов, погибают. Если этого не происходит, то половые клетки приобретают способность к бесконтрольной пролиферации и дают начало опухоли. Дисгерминома возникает у подростков и молодых женщин при общем и генитальном инфантилизме с поздним менархе. Часто наблюдаются аномалии наружных половых органов. Опухоль, как правило, односторонняя. Двусторонняя дисгерминома нередко сочетается с гонадобластомой. Типичная дисгерминома представлена солидной опухолью округлой или овоидной формы с гладкой белесоватой фиброзной капсулой.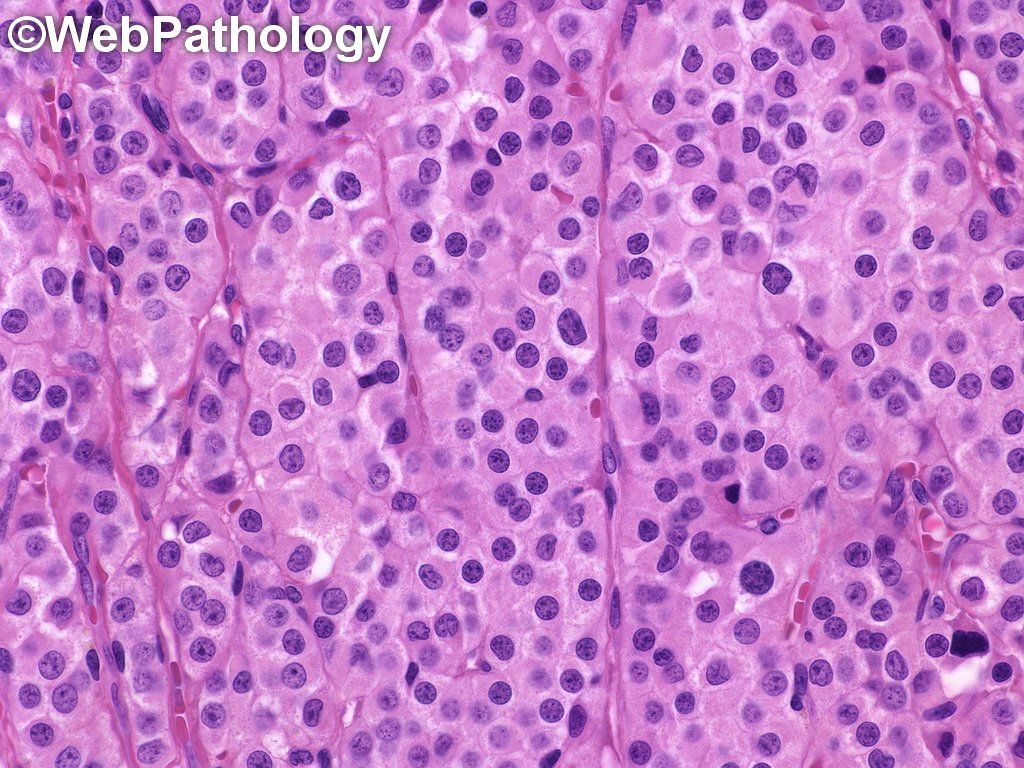 Опухоль может достигать значительных размеров, полностью замещая ткань яичника, дисгерминома при небольших узлах имеет различную консистенцию. На разрезе ткань опухоли желтоватая, бледно-бурая с розовым оттенком. Большие опухоли обычно пестрые из-за кровоизлияний и очагов некроза различной давности. Клинические проявления не имеют специфических признаков. Гормональная активность дисгерминоме не свойственна. Жалобы больных неспецифические, иногда появляются тупые тянущие боли внизу живота, общее недомогание, дизурические явления, слабость, сонливость, утомляемость, нередко нарушен менструальный цикл: длительная аменорея может сменяться маточными кровотечениями. Дисгерминома склонна к быстрому росту, метастатическому распространению и прорастанию в соседние органы. Метастазирование обычно происходит лимфогенным путем с поражением лимфатических узлов общей подвздошной артерии, дистальной части брюшной аорты и надключичных лимфатических узлов. Гематогенные метастазы встречаются в терминальной стадии заболевания, чаще в печени, легких, костях.
Опухоль может достигать значительных размеров, полностью замещая ткань яичника, дисгерминома при небольших узлах имеет различную консистенцию. На разрезе ткань опухоли желтоватая, бледно-бурая с розовым оттенком. Большие опухоли обычно пестрые из-за кровоизлияний и очагов некроза различной давности. Клинические проявления не имеют специфических признаков. Гормональная активность дисгерминоме не свойственна. Жалобы больных неспецифические, иногда появляются тупые тянущие боли внизу живота, общее недомогание, дизурические явления, слабость, сонливость, утомляемость, нередко нарушен менструальный цикл: длительная аменорея может сменяться маточными кровотечениями. Дисгерминома склонна к быстрому росту, метастатическому распространению и прорастанию в соседние органы. Метастазирование обычно происходит лимфогенным путем с поражением лимфатических узлов общей подвздошной артерии, дистальной части брюшной аорты и надключичных лимфатических узлов. Гематогенные метастазы встречаются в терминальной стадии заболевания, чаще в печени, легких, костях.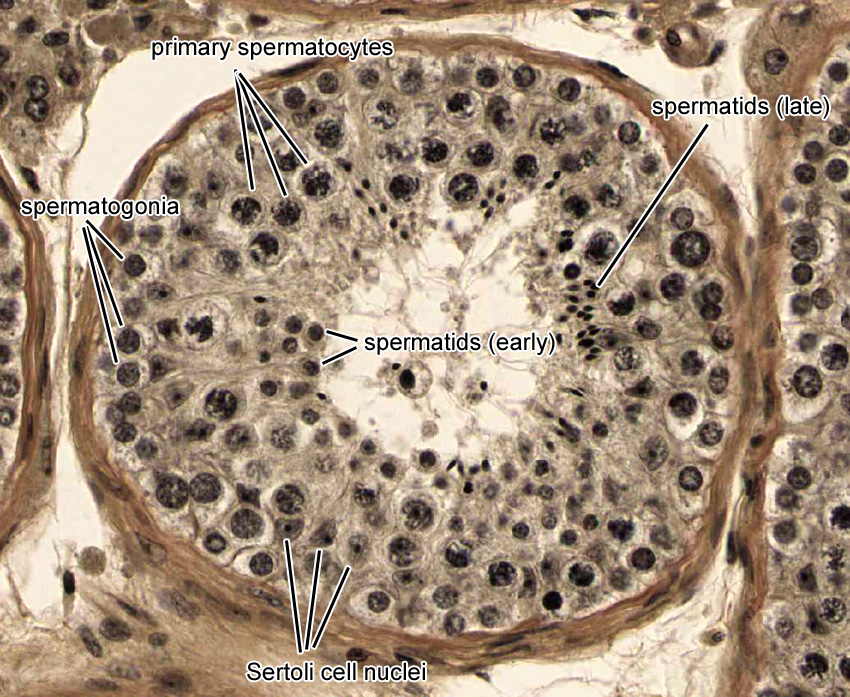 Проявления метастазов дисгерминомы сходны с картиной первичной опухоли. Диагноз устанавливается на основании клинического течения заболевания, данных двуручного гинекологического исследования, УЗИ с ЦДК и морфологического исследования удаленного макропрепарата. При гинекологическом исследовании опухоль располагается обычно позади матки, чаще односторонняя, округлая, с нечеткими контурами, плотная, бугристая, величиной от 5 до 15 см(чаще достигает больших размеров), в начальной стадии подвижная, безболезненная. Большую помощь оказывает УЗИ с ЦДК. На эхограммах опухоль имеет эхопозитивное средней эхогенности, часто дольчатое строение. Внутри новообразования нередки участки дегенеративных изменений, контуры неровные, форма неправильная. При допплерометрическом исследовании определяются множественные участки васкуляризации как по периферии, так и в центральных структурах опухоли: с низким индексом резистентности (ИР ниже 0,4).
Проявления метастазов дисгерминомы сходны с картиной первичной опухоли. Диагноз устанавливается на основании клинического течения заболевания, данных двуручного гинекологического исследования, УЗИ с ЦДК и морфологического исследования удаленного макропрепарата. При гинекологическом исследовании опухоль располагается обычно позади матки, чаще односторонняя, округлая, с нечеткими контурами, плотная, бугристая, величиной от 5 до 15 см(чаще достигает больших размеров), в начальной стадии подвижная, безболезненная. Большую помощь оказывает УЗИ с ЦДК. На эхограммах опухоль имеет эхопозитивное средней эхогенности, часто дольчатое строение. Внутри новообразования нередки участки дегенеративных изменений, контуры неровные, форма неправильная. При допплерометрическом исследовании определяются множественные участки васкуляризации как по периферии, так и в центральных структурах опухоли: с низким индексом резистентности (ИР ниже 0,4).
Лечение дисгерминомы только хирургическое с последующей лучевой терапией.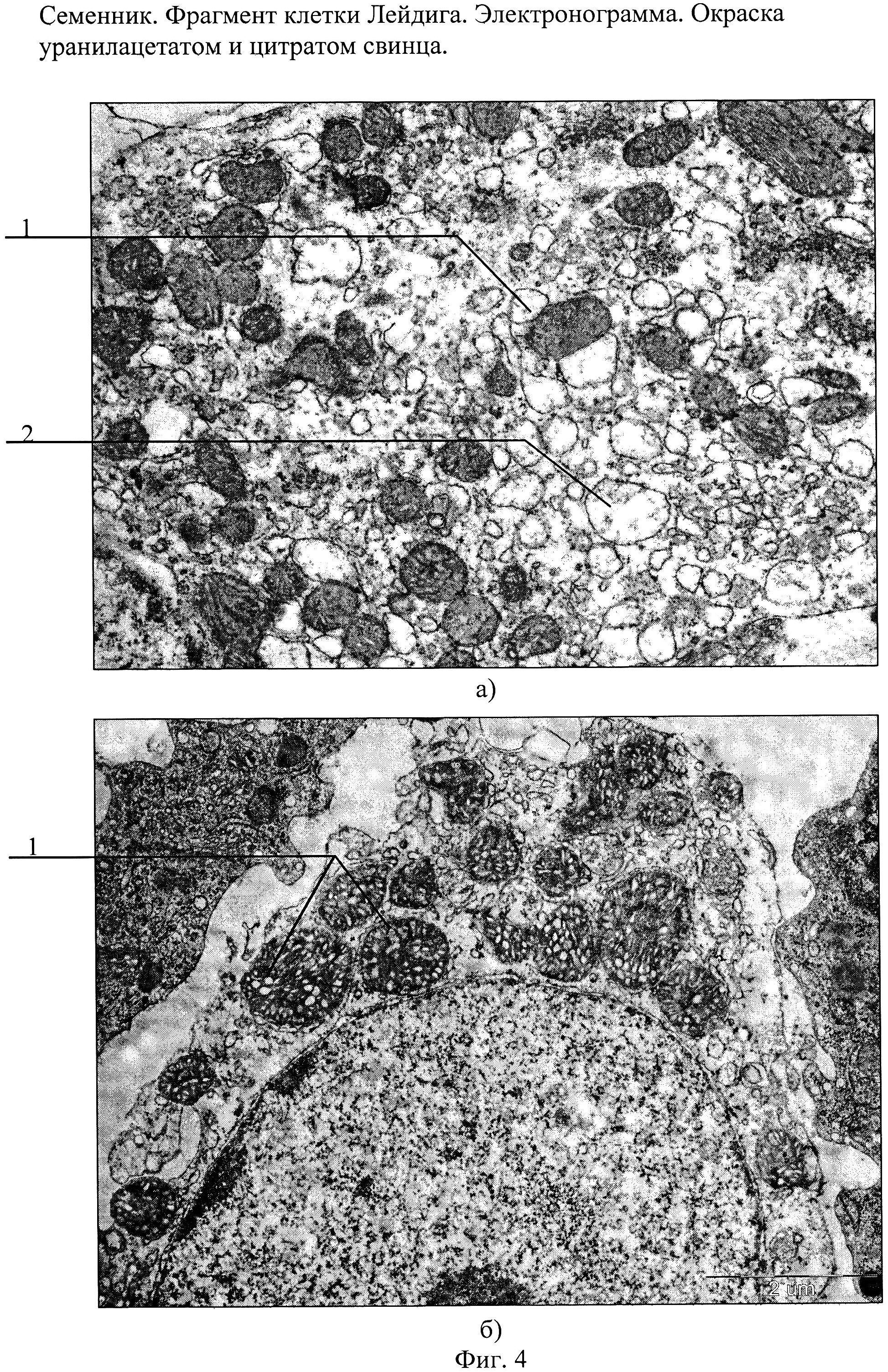 Целесообразно использовать лапаротомический доступ. При односторонней опухоли, без признаков распространения за пределы пораженного яичника у молодых женщин, планирующих иметь в дальнейшем детей, можно ограничиться удалением придатков матки пораженной стороны. У пациенток перименопаузального возраста выполняют экстирпацию матки с придатками, удаляют сальник. Во время операции нельзя нарушать целостность капсулы, поскольку это значительно ухудшает прогноз. При распространении опухоли за пределы яичника показана более радикальная операция — удаление матки с придатками и сальника с последующей рентгенотерапией. Увеличенные лимфатические узлы подлежат удалению, а их область — рентгенотерапии. Как первичная опухоль, так и метастатические узлы хорошо поддаются рентгенотерапии. Чистые формы дисгермином высоко чувствительны к лучевой терапии, что и определяет относительно благоприятный прогноз заболевания.
Целесообразно использовать лапаротомический доступ. При односторонней опухоли, без признаков распространения за пределы пораженного яичника у молодых женщин, планирующих иметь в дальнейшем детей, можно ограничиться удалением придатков матки пораженной стороны. У пациенток перименопаузального возраста выполняют экстирпацию матки с придатками, удаляют сальник. Во время операции нельзя нарушать целостность капсулы, поскольку это значительно ухудшает прогноз. При распространении опухоли за пределы яичника показана более радикальная операция — удаление матки с придатками и сальника с последующей рентгенотерапией. Увеличенные лимфатические узлы подлежат удалению, а их область — рентгенотерапии. Как первичная опухоль, так и метастатические узлы хорошо поддаются рентгенотерапии. Чистые формы дисгермином высоко чувствительны к лучевой терапии, что и определяет относительно благоприятный прогноз заболевания.
При правильном лечении возможно полное выздоровление. В настоящее время 5-летняя выживаемость больных с односторонней инкапсулированной дисгерминомой без метастазов достигает90%. В прогностическом плане неблагоприятны метастазы и прорастание за пределы яичника, большие размеры и двусторонняя локализация дисгерминомы.
В прогностическом плане неблагоприятны метастазы и прорастание за пределы яичника, большие размеры и двусторонняя локализация дисгерминомы.
Зрелая тератома относится к герминогенным опухолям. В зависимости от дифференцировки тканей тератомы делят на зрелые (дермоидная киста) и незрелые (тератобластома).
Зрелая тератома подразделяется на солидную (без кист) и кистозные (дермоидная киста). Выделяют и монодермальные (высокоспециализированные) тератомы — струму яичника и
Карциноид яичника, их строение идентично обычной ткани щитовидной железы и кишечным карциноидам. Зрелая кистозная тератома является одной из наиболее распространенных опухолей в детском и юношеском возрасте, опухоль может встречаться даже у новорожденных, что косвенно свидетельствует о ее тератогенном происхождении. Зрелая тератома встречается в репродуктивном возрасте, в постменопаузальном периоде (как случайная находка). Зрелая тератома состоит из хорошо дифференцированных производных всех трех зародышевых листков с преобладанием эктодермальных элементов.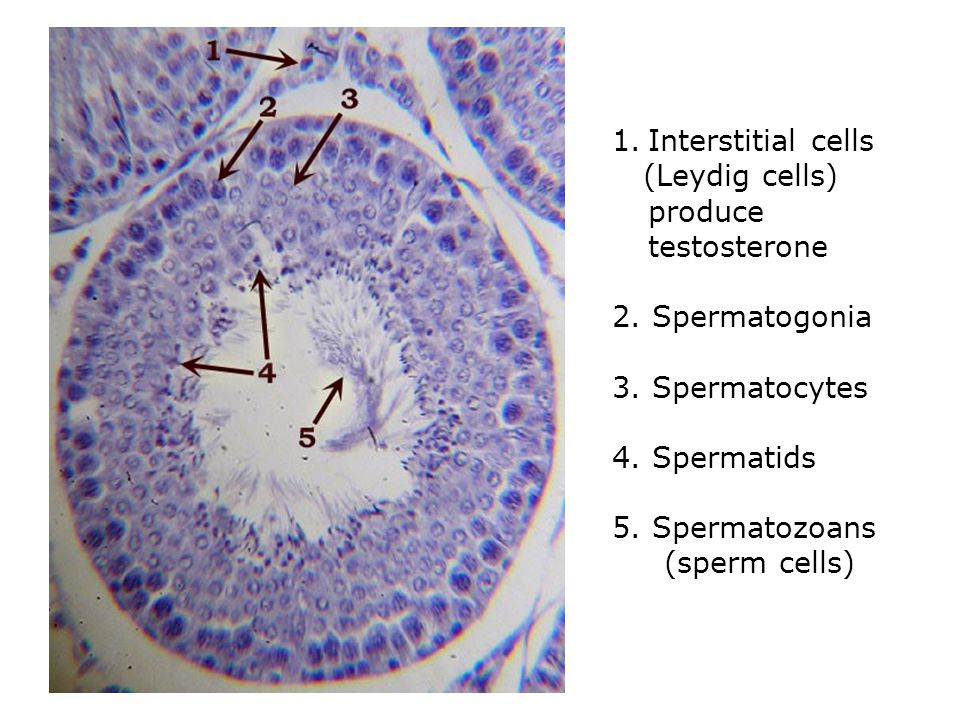 Этим определяется термин «дермоидная киста». Опухоль является однокамерной кистой (редко наблюдается многокамерное строение), всегда доброкачественная и лишь изредка проявляет признаки малигнизации. В структуру дермоидных кист включен так называемый дермоидный бугорок. Капсула дермоидной кисты плотная, фиброзная, различной толщины, поверхность гладкая, блестящая. Тератома на разрезе напоминает мешок, содержащий густую массу, состоящую из сала и волос, а нередко встречаются и хорошо сформированные зубы. Внутренняя поверхность стенки выстлана цилиндрическим или кубическим эпителием. При микроскопическом исследовании определяются ткани эктодермального происхождения — кожа, элементы невральной ткани — глия, нейроциты, ганглии. Мезодермальные производные представлены костной, хрящевой, гладкомышечной, фиброзной и жировой тканью. Производные эндодермы встречаются реже и обычно включают бронхиальный и гастроинтестинальный эпителий, ткань щитовидной и слюнной желез. Объектом особо тщательного гистологического исследования должен быть дермоидный бугорок с целью исключения малигнизации.
Этим определяется термин «дермоидная киста». Опухоль является однокамерной кистой (редко наблюдается многокамерное строение), всегда доброкачественная и лишь изредка проявляет признаки малигнизации. В структуру дермоидных кист включен так называемый дермоидный бугорок. Капсула дермоидной кисты плотная, фиброзная, различной толщины, поверхность гладкая, блестящая. Тератома на разрезе напоминает мешок, содержащий густую массу, состоящую из сала и волос, а нередко встречаются и хорошо сформированные зубы. Внутренняя поверхность стенки выстлана цилиндрическим или кубическим эпителием. При микроскопическом исследовании определяются ткани эктодермального происхождения — кожа, элементы невральной ткани — глия, нейроциты, ганглии. Мезодермальные производные представлены костной, хрящевой, гладкомышечной, фиброзной и жировой тканью. Производные эндодермы встречаются реже и обычно включают бронхиальный и гастроинтестинальный эпителий, ткань щитовидной и слюнной желез. Объектом особо тщательного гистологического исследования должен быть дермоидный бугорок с целью исключения малигнизации. Симптоматика дермоидных кист мало отличается от симптоматики доброкачественных опухолей яичников. Дермоидная киста не обладает гормональной активностью, редко обусловливает жалобы. Болевой синдром отмечается в небольшом числе наблюдений. Общее состояние женщины, как правило, не страдает. Иногда появляются дизурические явления, чувство тяжести внизу живота. В ряде случаев происходит перекрут ножки дермоидной кисты, возникает симптоматика «острого живота», требующая экстренного оперативного вмешательства. Относительно редким аутоиммунным осложнением зрелых тератом яичника является анемия. Ее развитие связывают с кроветворной тканью в структуре опухоли, вырабатывающей антигенно-измененные эритроциты. В подобных случаях после удаления опухоли наступает полное выздоровление. Дермоидная киста нередко сочетается с другими опухолями и опухолевидными образованиями яичников. Чрезвычайно редко при зрелой тератоме возникает злокачественный процесс, в основном плоскоклеточный рак.
Симптоматика дермоидных кист мало отличается от симптоматики доброкачественных опухолей яичников. Дермоидная киста не обладает гормональной активностью, редко обусловливает жалобы. Болевой синдром отмечается в небольшом числе наблюдений. Общее состояние женщины, как правило, не страдает. Иногда появляются дизурические явления, чувство тяжести внизу живота. В ряде случаев происходит перекрут ножки дермоидной кисты, возникает симптоматика «острого живота», требующая экстренного оперативного вмешательства. Относительно редким аутоиммунным осложнением зрелых тератом яичника является анемия. Ее развитие связывают с кроветворной тканью в структуре опухоли, вырабатывающей антигенно-измененные эритроциты. В подобных случаях после удаления опухоли наступает полное выздоровление. Дермоидная киста нередко сочетается с другими опухолями и опухолевидными образованиями яичников. Чрезвычайно редко при зрелой тератоме возникает злокачественный процесс, в основном плоскоклеточный рак.
Зрелая солидная тератома — относительно редкая опухоль яичников, встречается в основном у детей и молодых женщин.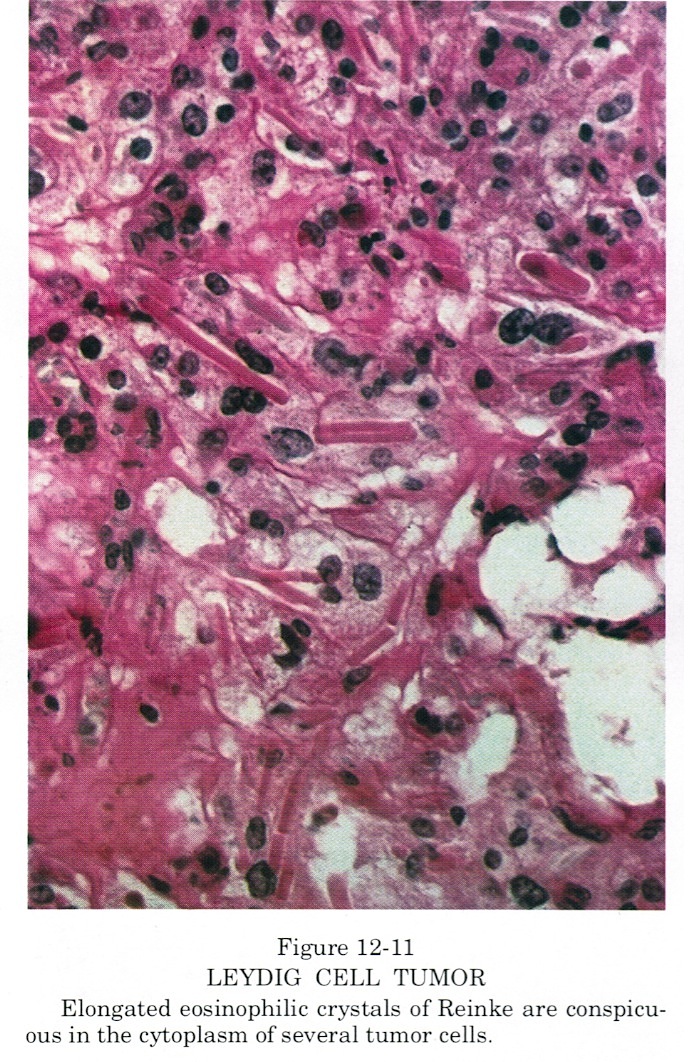 Большинство зрелых тератом содержит опухолевые элементы незрелых тканей, и по этому признаку их относят к злокачественным опухолям. Солидные тератомы целиком состоят из зрелых тканей, они доброкачественные и имеют благоприятный прогноз. Дифференцировать опухоль позволяет только широкое гистологическое исследование. Диагноз устанавливают на основании клинического течения заболевания, двуручного гинекологического исследования, применения УЗИ с ЦДК, лапароскопии.
Большинство зрелых тератом содержит опухолевые элементы незрелых тканей, и по этому признаку их относят к злокачественным опухолям. Солидные тератомы целиком состоят из зрелых тканей, они доброкачественные и имеют благоприятный прогноз. Дифференцировать опухоль позволяет только широкое гистологическое исследование. Диагноз устанавливают на основании клинического течения заболевания, двуручного гинекологического исследования, применения УЗИ с ЦДК, лапароскопии.
При гинекологическом исследовании опухоль располагается в основном кпереди от матки, округлой формы, с гладкой поверхностью, имеет длинную ножку, подвижная, безболезненная, плотной консистенции. Диаметр зрелой тератомы составляет от 5 до 15 см. Дермоидная киста с включением костных тканей — единственная опухоль, которую можно определить на обзорном рентгеновском снимке брюшной полости. Эхография способствует уточнению диагноза зрелых тератом (выраженный акустический полиморфизм). Зрелые тератомы имеют гипоэхогенное строение с солитарным эхогенным включением, с четкими контурами. Непосредственно за эхогенным включением располагается акустическая тень. Зрелые тератомы могут иметь нетипичное внутреннее строение. Внутри опухоли визуализируются множественные небольшие гиперэхогенные включения. В ряде случаев опухоль имеет плотное внутреннее строение, иногда полностью однородное, хотя внутри опухоли нередко визуализируются небольшие гиперэхогенные штриховые включения, реже тонкие длинные линейные включения. В ряде случаев за мелкоштриховыми включениями визуализируется слабый эффект усиления — «хвост кометы». Возможно кистозно-солидное строение с плотным компонентом с высокой эхогенностью, круглой или овальной формы, с ровными контурами. Полиморфизм внутреннего строения опухоли нередко создает сложности в трактовке эхографических картин При ЦДК в зрелых тератомах практически всегда отсутствует васкуляризация, кровоток может визуализироваться в прилегающей к опухоли ткани яичника, ИР находится в пределах обычных значений — 0,4. В качестве дополнительного метода в диагностике зрелых тератом после применения УЗИ возможно использовать РКТ.
Непосредственно за эхогенным включением располагается акустическая тень. Зрелые тератомы могут иметь нетипичное внутреннее строение. Внутри опухоли визуализируются множественные небольшие гиперэхогенные включения. В ряде случаев опухоль имеет плотное внутреннее строение, иногда полностью однородное, хотя внутри опухоли нередко визуализируются небольшие гиперэхогенные штриховые включения, реже тонкие длинные линейные включения. В ряде случаев за мелкоштриховыми включениями визуализируется слабый эффект усиления — «хвост кометы». Возможно кистозно-солидное строение с плотным компонентом с высокой эхогенностью, круглой или овальной формы, с ровными контурами. Полиморфизм внутреннего строения опухоли нередко создает сложности в трактовке эхографических картин При ЦДК в зрелых тератомах практически всегда отсутствует васкуляризация, кровоток может визуализироваться в прилегающей к опухоли ткани яичника, ИР находится в пределах обычных значений — 0,4. В качестве дополнительного метода в диагностике зрелых тератом после применения УЗИ возможно использовать РКТ. При лапароскопии дермоидная киста имеет неравномерный желтовато-белесоватый цвет, при пальпации манипулятором консистенция плотная. Определенное дифференциально-диагностическое значение имеет расположение кисты в переднем своде, в отличие от опухолей других видов, обычно располагающихся в маточно-прямокишечном пространстве. Ножка дермоидной кисты обычно длинная, тонкая, на капсуле могут быть мелкие кровоизлияния. Лечение зрелых тератом хирургическое. Объем и доступ оперативного вмешательства зависят от величины объемного образования, возраста пациентки и сопутствующей генитальной и экстрагенитальной патологии. У молодых женщин и девочек следует по возможности ограничиться частичной резекцией яичника в пределах здоровой ткани (кистэктомия). Предпочтительно использовать лапароскопический доступ с применением эвакуирующего мешочка. У пациенток перименопаузального возраста показана надвлагалищная ампутация матки с придатками с обеих сторон. Допустимо удаление придатков матки с пораженной стороны, если матка не изменена.
При лапароскопии дермоидная киста имеет неравномерный желтовато-белесоватый цвет, при пальпации манипулятором консистенция плотная. Определенное дифференциально-диагностическое значение имеет расположение кисты в переднем своде, в отличие от опухолей других видов, обычно располагающихся в маточно-прямокишечном пространстве. Ножка дермоидной кисты обычно длинная, тонкая, на капсуле могут быть мелкие кровоизлияния. Лечение зрелых тератом хирургическое. Объем и доступ оперативного вмешательства зависят от величины объемного образования, возраста пациентки и сопутствующей генитальной и экстрагенитальной патологии. У молодых женщин и девочек следует по возможности ограничиться частичной резекцией яичника в пределах здоровой ткани (кистэктомия). Предпочтительно использовать лапароскопический доступ с применением эвакуирующего мешочка. У пациенток перименопаузального возраста показана надвлагалищная ампутация матки с придатками с обеих сторон. Допустимо удаление придатков матки с пораженной стороны, если матка не изменена. Прогноз благоприятный.
Прогноз благоприятный.
Тератобластома (незрелая тератома) относится к злокачественным новообразованиям яичника. Опухоль чрезвычайно незрелая, дифференцировка низкая. Незрелая тератома встречается гораздо реже, чем зрелая. Опухоль имеет тенденцию к быстрому росту и может достигать значительных размеров. При микроскопическом исследовании определяется в сочетании производных всех трех зародышевых слоев. Поверхность разреза обычно пестрая, от бледно-серого до темно-бурого цвета. При осмотре определяются кости, хрящи. волосы, опухоль содержит жировые массы. Опухоль обычно располагается сбоку от матки, односторонняя, неправильной формы, неравномерно мягкой, местами плотной консистенции в зависимости от преобладающего типа тканей и некротических изменений, больших размеров, с бугристой поверхностью, малоподвижная, чувствительная при пальпации. При прорастании капсулы имплантируется в брюшину, дает метастазы в забрюшинные лимфатические узлы, легкие, печень, головной мозг. Метастазы незрелой тератомы, как и основная опухоль, обычно состоят из различных тканевых элементов с наиболее незрелыми структурами.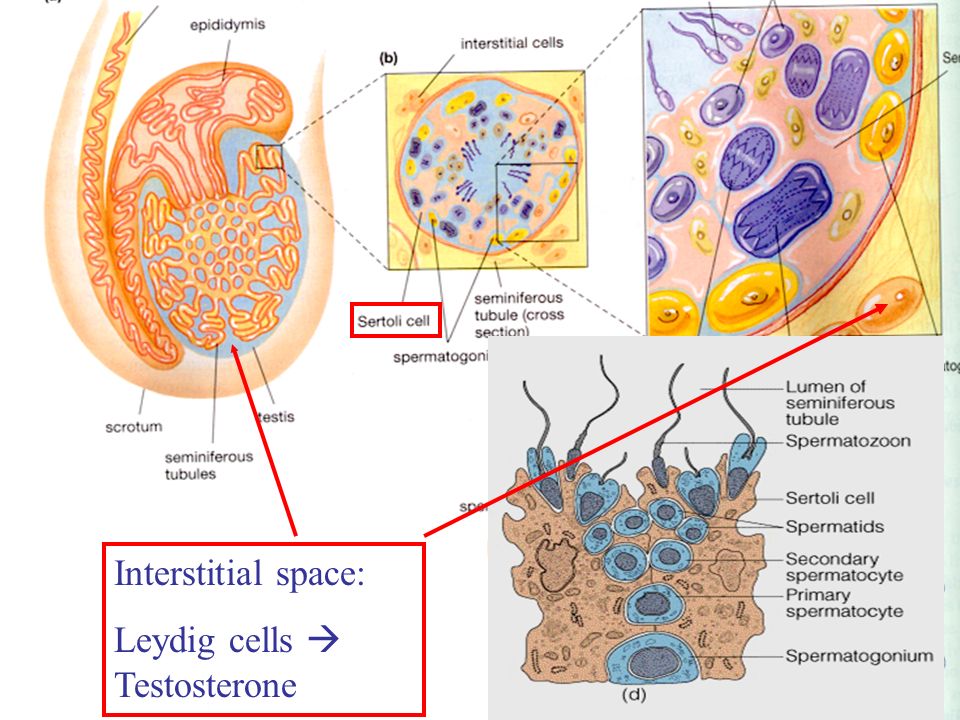
Больные жалуются на боли внизу живота, общую слабость, вялость, повышенную утомляемость, снижение трудоспособности. Менструальная функция чаще не нарушена. В анамнезе крови отмечаются изменения, присущие злокачественным опухолям. При быстром росте клиническая картина из-за интоксикации, распада и метастазирования опухоли схожа с общесоматическим заболеванием. Это часто приводит к неадекватному лечению. К моменту распознавания опухоль уже бывает запущенной. Применение эхографии с ЦДК может способствовать уточнению диагностики. Эхографические картины отражают смешанное, кистозно-солидное строение незрелой тератомы с неровными нечеткими контурами. Подобно всем злокачественным вариантам опухолей незрелая тератома имеет хаотическое внутреннее строение с выраженной неоваскуляризацией. При ЦДК визуализируется выраженная мозаичная картина с турбулентным кровотоком и преимущественно центрально расположенными и артериовенозными шунтами. Максимальная систолическая скорость кровотока понижает индексы периферического сопротивления (ИР ниже 0,4). Лечение хирургическое. Допустимы надвлагалищная ампутация матки с придатками и удаление сальника. Незрелые тератомы малочувствительны к лучевой терапии, но иногда реагируют на комбинированную химиотерапию. Прогноз неблагоприятный.
Лечение хирургическое. Допустимы надвлагалищная ампутация матки с придатками и удаление сальника. Незрелые тератомы малочувствительны к лучевой терапии, но иногда реагируют на комбинированную химиотерапию. Прогноз неблагоприятный.
Ячейка Лейдига
Анатомия инфобокса
Имя = PAGENAME
Latin =
GraySubject = 258
GrayPage = 1243
Caption = Гистологический срез паренхимы яичка кабана. 1 Просвет извитой части семенных канальцев, 2 сперматида, 3 сперматоцита, 4 сперматогонии, 5 клеток Сертоли, 6 миофибробластов, 7 клеток Лейдига, 8 капилляров
Caption2 = Поперечное сечение семенных канальцев. Стрелками указано расположение ячеек Лейдига.
System =
MeshName = Leydig + cells
MeshNumber =
DorlandsPre = c_18
DorlandsSuf = 12224005
Клетки Лейдига , также известные как интерстициальных клеток Leydig , находятся рядом с семенными канальцами в семенных канальцах.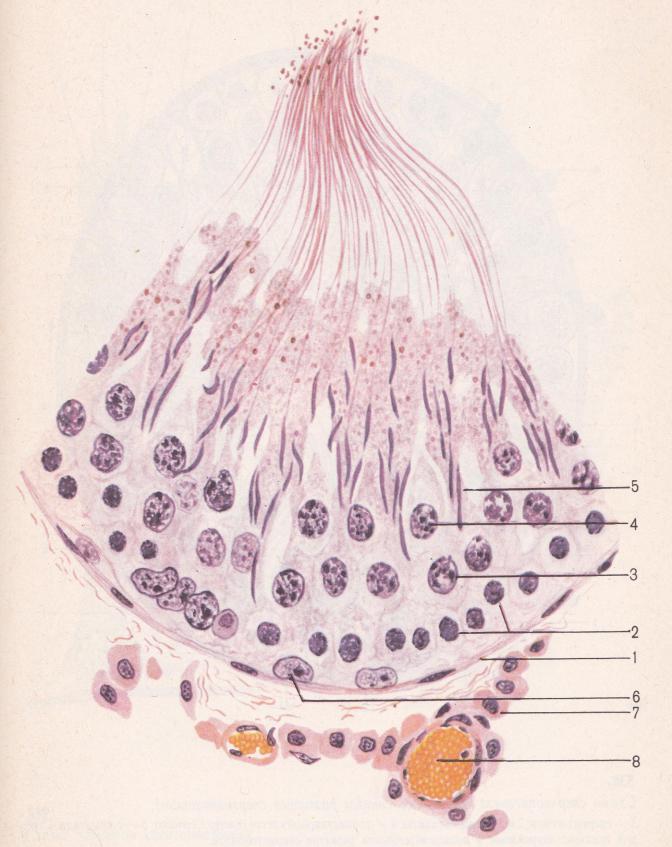 Они могут секретировать тестостерон и часто тесно связаны с нервами. Клетки Лейдига имеют круглые везикулярные ядра и гранулярную эозинофильную цитоплазму.
Они могут секретировать тестостерон и часто тесно связаны с нервами. Клетки Лейдига имеют круглые везикулярные ядра и гранулярную эозинофильную цитоплазму.
Номенклатура
Клетки Лейдига названы в честь немецкого анатома Франца Лейдига, который открыл их в 1850 году.[ WhoNamedIt | Syndd | 625 ]
Функции
Клетки Лейдига выделяют класс гормонов, называемых андрогенами (19-углеродные стероиды). Они секретируют тестостерон, андростендион и дегидроэпиандростерон (ДГЭА) при стимуляции лютеинизирующим гормоном гипофиза (ЛГ). ЛГ увеличивает активность холестериндесмолазы (фермент, связанный с превращением холестерина в прегненолон), что приводит к секреции синтеза тестостерона клетками Лейдига.
Фолликулостимулирующий гормон (ФСГ) увеличивает ответ клеток Лейдига на ЛГ за счет увеличения количества рецепторов ЛГ, экспрессируемых на клетках Лейдига.
Ультраструктура
Клетки Лейдига представляют собой многоугольные эозинофильные клетки с круглым везикулярным ядром и содержат липидные капли. Они содержат обильный гладкий эндоплазматический ретикулум, который объясняет их эозинофилию. Часто встречаются пигмент липофусцин и стержневидные кристаллические структуры (кристаллы Рейнке). cite journal | author = Al-Agha O, Axiotis C | title = Углубленное изучение опухоли яичка из клеток Лейдига | journal = Arch Pathol Lab Med | volume = 131 | issue = 2 | pages = 311–7 | год = 2007 | pmid = 17284120 ] цитировать в Интернете | автор = Рамнани, Дхарам М | title = Опухоль клеток Лейдига: кристаллоиды Рейнке | url = http: //www.webpathology.com/image.cfm? n = 3 & Case = 38 | date = 25.01.2005 | accessdate = 2007-03-28 ]
Они содержат обильный гладкий эндоплазматический ретикулум, который объясняет их эозинофилию. Часто встречаются пигмент липофусцин и стержневидные кристаллические структуры (кристаллы Рейнке). cite journal | author = Al-Agha O, Axiotis C | title = Углубленное изучение опухоли яичка из клеток Лейдига | journal = Arch Pathol Lab Med | volume = 131 | issue = 2 | pages = 311–7 | год = 2007 | pmid = 17284120 ] цитировать в Интернете | автор = Рамнани, Дхарам М | title = Опухоль клеток Лейдига: кристаллоиды Рейнке | url = http: //www.webpathology.com/image.cfm? n = 3 & Case = 38 | date = 25.01.2005 | accessdate = 2007-03-28 ]
Развитие
Клетки Лейдига образуются на 16-й и 20-й неделе беременности и остаются в состоянии покоя до полового созревания.jedikkemoeder
= Дополнительно
ха-ха
Ссылки
ee также
* Клетка Сертоли
* Клеточная опухоль Сертоли-Лейдига
Внешние ссылки
* BUHistaology | http://www2.ufp.pt/~pedros/qfisio/reproduction.htm Репродуктивная физиология ]
* [ http://www.umassmed.edu/faculty/graphics/700/Leefig1.jpgDiagram at umassmed .edu ]
Фонд Викимедиа.
2010.
Ячейка Лейдига — это … Что такое ячейка Лейдига?
Клетка Лейдига — Информационное окно Анатомия Имя = PAGENAME Latin = GraySubject = 258 GrayPage = 1243 Caption = Гистологический срез паренхимы яичка кабана. 1 просвет извитой части семенных канальцев, 2 сперматиды, 3 сперматоцита, 4…… Википедия
Клетка Лейдига — Клетка Лейдига lī dig также Клетка Лейдига dig (z) в клетке интерстициальной ткани яичка, которая обычно используется.считается главным источником андрогенов яичек и особенно. тестостерон также называют клеткой Лейдига, интерстициальной клеткой Лейдига Лея · dig lī… Медицинский словарь
клетка Лейдига — существительное клетка в семенниках, которая секретирует гормон тестостерон • Синхронизация: ↑ клетка Лейдига • Гиперонимы: ↑ клетка * * * / luy dig /, Anat. любые интерстициальные клетки яичек, вырабатывающие андрогены. А также камера Лейдига. [1900 05; им. Ф. фон… Полезный английский словарь
Ячейка Лейдига — / luy dig /, Анат.любые интерстициальные клетки яичек, вырабатывающие андрогены. А также камера Лейдига. [1900 05; имени Ф. фон Лейдига (1821 1908), немецкого физиолога] * * *… Universalium
клетка Лейдига — интерстициальная клетка в яичке, вырабатывающая мужские половые гормоны (анатомия)… Современный английский словарь
Клетка Лейдига — Интерстициальные клетки семенников млекопитающих, участвующие в синтезе тестостерона… Словарь по молекулярной биологии
Опухоль из клеток Лейдига — 1.самая распространенная негерминальная опухоль яичка, происходящая из клеток Лейдига яичка; такие опухоли редко бывают злокачественными. Называется также интерстициальной ячейкой t. 2. прикорневой т … Медицинский словарь
Опухоль из клеток Сертоли-Лейдига — Информационное окно DiseaseDisorder Имя = Опухоль из клеток Сертоли-Лейдига ICD10 = ICD9 = ICD9 | 183.0, ICD9 | 256.1 ICDO = 8631/0 Информационное окно DiseaseDisorder Имя = Arrhenoblastoma ICD10 = ICD930 клетка опухоль ICD10 = ICD930 , также известная как арренобластома или…… Википедия
Опухоль из клеток Сертоли-Лейдига — андробластома (деф.2)… Медицинский словарь
Клеточная опухоль Сертоли-Лейдига яичника — Редкий тип опухоли яичника, при котором опухолевые клетки секретируют мужской половой гормон. Это может вызвать вирилизацию (появление мужских физических характеристик у женщин). Также называется андробластома и арренобластома … Английский словарь терминов по раку
ячейка Лейдига — ячейка Лея · Dig līd ig n LEYDIG CELL… Медицинский словарь
Обзор антител
— маркеры клеток Лейдига
Маркеры клеток Лейдига
Ячейки Лейдига , также известные как межстраничные
клетки Лейдига, находятся рядом с семенными канальцами в
яички.Клетки Лейдига могут синтезировать тестостерон и часто
тесно связаны с нервами. Клетки Лейдига имеют круглые везикулярные ядра.
и гранулированная эозинофильная цитоплазма. Клетки Лейдига названы в честь
Иоганнес Лейдиг, открывший их в 1850 году.
3-бета-HSD (3-гидроксистероид
дегидрогеназа, 3b-HSD)
Маркерный ген клеток Лейдига.
PMID: 9369931
один из ключевых ферментов, участвующих в
стероидогенный путь клеток Лейдига.PMID: 79473533beta-HSD реактивность
был расположен на субклеточных уровнях с помощью феррицианида
метод. Специфическая, отчетливая локализация продукта реакции в
Форма выделений ферроцианида меди наблюдалась на
мембраны гладкой эндоплазматической сети не только в
клетки Лейдига фетального типа и фибробластоподобные предшественники
клетки Лейдига взрослого типа, но также локально в эндотелиальном
клетки интерстициальных кровеносных капилляров.PMID: 9725769Эти данные показывают очень раннюю иммуноэкспрессию.
3beta-HSD, который был обнаружен за день до зарегистрированного
начало производства стероидов фетальными клетками Лейдига.PMID: 9475409
локализуется на трубчатых или пластинчатых кристах
и внутренние мембраны митохондрий, и на мембранах
гладкая эндоплазматическая сеть в переходной клетке, а также
в камере Лейдига.PMID: 6584387Иммуногистохимические исследования показали, что
Опухоль из клеток Лейдига содержала тестостерон, эстрогены и 17
бета-гидроксистероид дегидрогеназа (HSD) в цитоплазме. Этот
это первое сообщение об опухоли из клеток Лейдига, в которой
продемонстрирована локализация 17 бета-HSD
иммуногистохимически.PMID: 2707954
7-дегидрохолестерин
редуктаза (7-DHCR)
11 бета-гидроксистероид
дегидрогеназа
11betaHSD типа I является преобладающей оксидазой в
Клетки Лейдига in vivo.PMID: 10714825а
маркер созревания клеток Лейдига у крыс.PMID: 2080241
Кальретинин
а
ценный маркер нормальных и неопластических клеток Лейдига
яички.PMID: 12051635,
PMID: 12409718,
PMID: 10886732
клеток Лейдига во всех оцененных биопсиях
экспрессировал кальретинин и служил встроенным контролем для
иммунореактивность.PMID: 15950053В нормальном семеннике собаки кальретинин
экспрессия была ограничена клетками Лейдига и Сертоли
яички. В опухолевых тканях экспрессия кальретинина была обнаружена в
все исследованные опухоли (интерстициальные клеточные опухоли, семинома,
и опухоли из клеток Сертоли), с цитоплазматической и ядерной
структура клеточного распределения.PMID: 15924929
В нормальных тканях особенно сильный
экспрессия была обнаружена в клетках Лейдига семенников, нейронах
мозг, тека-лютеин и внутренние клетки яичника,
и мезотелий.PMID: 14608532В постпубертатных яичках кальретинин был
экспрессируется в клетках Лейдига, но не в половых клетках или в большинстве
семенники и клетки Сертоли. Выражение кальретинина в норме
Клетки Лейдига, клетки внутренней теки, компонент клеток Лейдига
Опухоли из клеток Сертоли-Лейдига и опухоли из клеток ворот позволяют предположить, что
функциональная связь с производством андрогенов.PMID: 11603218
Cyp17 и Cyp11a1
Эстераза
полезный фермент-маркер для клеток Лейдига из
зрелых крыс и может помочь в исследованиях, касающихся
развитие этих клеток.PMID: 3457892,PMID: 7172178
Ингибин-альфа
маркер клеток Лейдига.
PMID: 12409718,
PMID: 10886732
нормальных клеток Лейдига секретируют ингибин
альфа-субъединицы, в то время как опухоли из клеток Лейдига также могут секретировать
биоактивный ингибин. Ни нормальные клетки Лейдига, ни клетки Лейдига
опухоли продуцируют активин.PMID: 1547906
Клетки Лейдига экспрессируют мРНК для
альфа-субъединица ингибина и продуцирует ингибин, который
биологически и иммунологически активны, вызывая
переоценка наших концепций производства тестикулярного ингибина.PMID: 2511047
IGF-1 (инсулиноподобный фактор роста-1)
INSL3 (инсулиноподобный
фактор 3)
экспрессируется исключительно в пренатальном и
послеродовые клетки Лейдига
все чаще используется
как специфический маркер
ячейки Лейдига
дифференциация и функция.PMID: 8020942
гормон, вырабатываемый клетками Лейдига яичек.
на протяжении всей жизни.PMID: 16467267
— главный новый продукт клеток Лейдига в
все виды млекопитающих, изученные на данный момент.PMID: 16006031постпубертатный клеточный маркер Лейдига.
PMID: 15151926
высоко экспрессируется у плода и взрослого типа
Клетки Лейдига всех изученных видов.PMID: 12559415
Ley I-L (инсулиноподобный ген Лейдига)
член семейства генов, связанных с инсулином,
специфически экспрессируется в пре- и постнатальных клетках Лейдига
в яичках и в постнатальных теках яичников.PMID: 9605933
LRH-1 (гомолог рецептора печени-1)
Лютеинизирующий гормон
(ЛГ) рецептор
Мелан-А
маркер клеток Лейдига.
PMID: 12409718
Антиген Melan-A / MART-1 также экспрессируется в
Клетки Лейдига, ткань надпочечников и опухоли, секретирующие стероиды.PMID: 12966351
- Окрашивание ядер
также часто наблюдалось в
нормальные клетки Лейдига и их опухоли.PMID: 11478605
Нестин
выражается в популяции нормальных и
гиперпластические клетки Лейдига и в клетках Сертоли в присутствии
внутриканальцевой неоплазии зародышевых клеток.PMID: 15127288
— маркер предшественников клеток Лейдига.
PMID: 15569711
Нейрон-специфическая энолаза (NSE)
Использование пероксидазы и антипероксидазы
иммуноцитохимический метод, нейрон-специфическая енолаза (NSE) -подобная
иммунореактивность (NSE-LI) выявлена в клетках Лейдига взрослых
семенники человека на световом микроскопическом уровне.PMID: 1772141
P450arom (ароматаза цитохрома P450)
активность ароматазы была измерена в
незрелые и зрелые клетки Лейдига крыс, а также клетки Сертоли
клеток, тогда как у свиней, барана и человека ароматаза в основном
присутствует в клетках Лейдига.PMID: 10442293
PBR (Бензодиазепиновый рецептор периферического типа)
— холестерин с высоким сродством 18 кДа и лекарственное средство
лиганд-связывающий белок, участвующий во многих клеточных функциях,
включая стероидогенез, окислительные процессы, клеточные
пролиферация и апоптоз.МРНК PBR также наблюдалась в
стероидсинтезирующие опухолевые клетки Лейдига мыши МА-10.PMID: 14630713,
PMID: 12388644
играет решающую роль в возрастном снижении
в производстве тестостерона в клетках Лейдига крысы Brown Norway.PMID: 12002446
— белок Mr 18000, преимущественно локализованный в
митохондрии, опосредует транспорт холестерина через
митохондриальные мембраны в стероидогенных клетках.PMID: 10029072белок внешней митохондриальной мембраны
участвует в регуляции транспорта холестерина из
внешняя по отношению к внутренней митохондриальной мембране, скорость, определяющая
шаг в биосинтезе стероидов.PMID: 9832438
PBR 18 кДа может играть более важную роль
в стероидогенезе, чем в пролиферации в этой клетке Лейдига
линия.PMID: 9488670
Релаксиноподобный фактор
(RLF)
новый маркер для Лейдига
созревание клеток.PMID: 10330103а
высокоспецифичный и конститутивный новый маркер для клеток Лейдига в
яички человека.PMID: 9239733
, также известный как инсулиноподобная клетка Лейдига
фактор (Ley-I-L), является новым членом группы инсулин-IGF-релаксин
семейство гормонов и факторов роста, которое недавно было
показано, что он сильно экспрессируется в клетках Лейдига яичек, и
является полезным маркером для клеток Лейдига у человека.
яичников и может быть диагностическим дополнением при гиперплазии и
опухоли, происходящие оттуда.PMID: 10202675новый член инсулиноподобного фактора роста
семейство, является надежным маркером нормальных клеток Лейдига в
постпубертатные яички человека.PMID: 10519633
SCC (боковая цепь P450
фермент расщепления)
Вещество П (СП)
Иммунореактивность (-LI), подобная субстанции P (SP)
было обнаружено, что они присутствуют как у плода, так и у взрослого поколения
Клетки Лейдига у хомяков и морских свинок, в то время как нейрон-специфические
енолаза (NSE) -LI была обнаружена в клетках Лейдига 3 видов
на всех этапах изучен.PMID: 1725082
STAR (стероидогенный острый регуляторный белок)
Стероидогенный фактор-1 (SF-1, Nr5a1 и Ad4bp)
единственный известный фактор транскрипции
регулируют промотор Insl3 мыши в клетках Лейдига.PMID: 16467267
бесхозный ядерный рецептор, необходимый для
развитие надпочечников и гонад и эндокринная регуляция.PMID: 16467257
орфанный ядерный рецептор, который важен
для экспрессии генов, участвующих в половой дифференциации,
развитие яичек и надпочечников, синтез гормонов и
регулирование.PMID: 12390883регулируется как базально, так и стимулируется цАМФ
транскрипция в надпочечниках и клетках Лейдига мыши.PMID: 10098601
играет ключевую роль в регуляции экспрессии
крысиного гена P450c17 в яичках Лейдига и в
клетки коры надпочечников.PMID: 9178749
Тромбоспондин 2
(TSP2)
Другие маркеры клеток Лейдига
Четыре маркера взрослой клетки Лейдига
дифференцировки, которые были измерены в этом исследовании (3βHSD VI,
ПГД-синтетаза, EST и 17βHSD III).PMC 151561Изменения
в экспрессии гена клеток Лейдига во время развития у мышей:
Эти пять генов
(3бета-гидроксистероид дегидрогеназа (3beta-HSD) VI,
17beta-hydroxysteroid dehydrogenase (17beta-HSD) III, сосудистый
молекула клеточной адгезии 1, эстроген сульфотрансфераза и
простагландин D (PGD) -синтетаза) экспрессируется у взрослых мышей
Популяция клеток Лейдига, но не в популяции плода.PMID: 11906915
Предупреждение : file_get_contents (http: // files.differencebetween.com/wp-content/uploads/2017/10/difference-between-leydig-cells-and-sertoli-cells-1.pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в /home/diffbw/webapps/diffbw_wp/awsfiles.php в строке 20
Предупреждение : file_get_contents (http://files.differencebetween.com/wp-content/uploads/2017/10/difference-between -leydig-cells-and-sertoli-cells-1.pdf): не удалось открыть поток: HTTP-запрос не прошел! HTTP / 1.1 403 Запрещено
в / home / diffbw / webapps / diffbw_wp / awsfiles.php в строке 20
Предупреждение : file_get_contents (http://files.differencebetween.com/wp-content/uploads/2017/10/difference-between-leydig-cells-and-sertoli-cells-1 .pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в /home/diffbw/webapps/diffbw_wp/awsfiles.php в строке 20
Предупреждение : file_get_contents (http://files.differencebetween.com/wp-content/uploads/2017/10/difference- между клетками Лейдига и клетками Сертоли-1.pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в /home/diffbw/webapps/diffbw_wp/awsfiles.php в строке 20
Предупреждение : file_get_contents (http://files.differencebetween.com/wp-content/uploads/2017/10/difference- between-leydig-cells-and-sertoli-cells-1.pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в /home/diffbw/webapps/diffbw_wp/awsfiles.php в строке 20
Предупреждение : file_get_contents (http: // files.differencebetween.com/wp-content/uploads/2017/10/difference-between-leydig-cells-and-sertoli-cells-1.pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в /home/diffbw/webapps/diffbw_wp/awsfiles.php в строке 20
Предупреждение : file_get_contents (http://files.differencebetween.com/wp-content/uploads/2017/10/difference- between-leydig-cells-and-sertoli-cells-1.pdf): не удалось открыть поток: сбой HTTP-запроса! HTTP / 1.1 403 Запрещено
в / home / diffbw / webapps / diffbw_wp / awsfiles.php on line 20
Клетки Лейдига — Большая химическая энциклопедия
Лютеинизирующий гормон / усеченная клетка Лейдига TM5 Конститутивно (77-79) … [Стр.112]
Метирапон полезен для тестирования эндокринной функции a клетки островков поджелудочной железы P клетки островков поджелудочной железы Нейрогипофиз Гипофизарно-надпочечниковая ось Клетки Лейдига семенников … [Стр.231]
Стимулирующий клетки интерстициальный гормон гипофиза контролирует выработку гонадных гормонов.В семенниках клетки Лейдига стимулируются к выработке тестостерона и эстрона, в женском организме фолликулы стимулируются к выработке прогестерона (см. Также раздел 11). [Pg.350]
Tfelt-Hansen, J., Ferreira, A., Yano, S., Kanuparthi, D., Romero, JR, Brown, EM и Chattopadhyay, N., 2005, активация рецептора, чувствительного к кальцию, вызывает производство оксида азота в раковых клетках H-500 Leydig. Am J Physiol Endocrinol Metab 288, E1206-13. [Pg.426]
Сообщалось о снижении подвижности сперматозоидов и повышенной активности кислой фосфатазы в результате перорального введения 0.05 мг / кг свинца с питьевой водой самцам крыс в течение 20-30 дней в исследовании, проведенном в бывшем СССР (Красовский и др., 1979). Сообщалось о дистрофических изменениях клеток Лейдига в тканях гонад крыс, подвергшихся воздействию таких низких доз, как 0,005 мг свинца / кг / день. Слабые стороны исследования включают отсутствие данных о линии и количестве использованных крыс, а также тот факт, что уровни PbB не сообщались. [Pg.200]
Neaves, W. B., Johnson, L., Porter, J. C., Parker, C. R. и Petty, C. S. (1984). Число клеток Лейдига, суточная выработка спермы и уровни гонадотропинов в сыворотке у стареющих мужчин.Журнал клинической эндокринологии и метаболизма 59, 756-763. [Pg.188]
Piper WN, Ruangwises S, Bestervelt LL, et al. 1991. Производство тестостерона клетками Лейдига и активность P45017 (17-гидроксилазы и C17-201yase) после воздействия in vitro на … [Pg.671]
Данные о токсичности HFC-134a показывают, что он нетоксичен в большинстве случаев. Большинство описанных изменений происходило при высоких концентрациях, которые также вызывают наркоз. Нет данных о генетической токсичности HFC-134a.Сообщается, что первичный эффект — это индукция гиперплазии клеток Лейдига и аденом у самцов крыс, подвергшихся воздействию 50 000 частей на миллион в течение 6 часов в день, 5 дней в неделю в течение 2-летнего периода (Collins et al., 1995, Hext и Parr-Dobrzanski, 1993). NOAEL, равный 10 000 ppm из этих данных, был основой RfC EPA. [Стр.188]
T. H. Fong, S.M. Ван, Х.С. Lin, Иммуноцитохимическая демонстрация липидной капель-специфической капсулы в культивируемых клетках Лейдига золотых хомяков, J. CeU. Biochem., 1996, 63, 366-373. [Стр.311]
Ингибин А также является чувствительным маркером дифференцировки клеток Сертоли (> 90% положительных результатов). Опухоль из клеток Сертоли, включая ее крупноклеточный кальцифицирующий вариант, окрашивается с различной степенью положительности с антителами к виментину, цитокератину, S-100, синаптофизину, хромогранину и нейрон-специфической энолазе. Иммунореактивность цитокератина в опухолях из клеток Сертоли обычно выше, чем в опухолях из клеток Лейдига. Иммунореактивность к FLAP не наблюдается в опухолях из клеток Сертоли. [Pg.647]
Gagnon S, Tetu B, Silva EG, et al.Частота продукции альфа-фетопротеина опухолями из клеток Сертоли-Лейдига яичника Иммуногистохимическое исследование восьми случаев. Мод Pathol. 1989 2 63-67. [Pg.756]
Мураками М., Хосокава С., Ямада Т., Харакава М., Ито М., Кояма Ю., Кимма Дж., Йошитаке А., Ямада Х (1995) Видоспецифический механизм опухолевого генеза клеток Лейдига крыс под действием процимидона. Toxicol Appl Pharmacol 131 244-252 Clegg ED, Cook JC, Chapin RE, Foster PM, Daston GP (1997) Гиперплазия клеток Лейдига и механизмы образования аденомы и актуальность для человека.Reprod Toxicol 11 107-121 … [Pg.396]
Prentice DE, Siegel RA, Donatsch P, Qureshi S, Ettlin RA (1992) Мезулергин индуцировал опухоли из клеток Лейдига, синдром, затрагивающий гипофизарно-тестикулярную ось крысы . Arch Toxicol 15 197-204 … [Pg.396]
Рамнат, Х. И., Петерсон, С., Майкл, А. Э., Стокко, Д. М., и Кук, Б. А. (1997). Модуляция стероидогенеза хлорид-ионами в опухолевых клетках Лейдига мыши MA-10 роль кальция, синтеза белка и стероидогенного острого регулирующего белка.Эндокринология 138, 2308-2314. [Pg.410]
Berg, A.M., A.B. Кикман, Э. Мяо, А. Кокран, С. Уилсон и WH. Орм-Джонсон (1990). Влияние ингибиторов цитохрома P-45017a на продукцию стероидов в клетках Лейдига мышей и микросомах семенников мышей и свиней. Биохимия 29, 2193-2201. [Стр.320]
L.S. Джефферсон и др. (1981). Гипофизарно-тестикулярная ось у самцов крыс, страдающих стрептозотоциновым диабетом. Доказательства гонадотрофности, дисфункции клеток Сертоли и клеток Лейдига. Int. Дж. Андрол. 4, 265-80.[Pg.374]
Эти клетки возникают из интерстициальной мезенхимальной ткани между канальцами в течение восьмой недели эмбрионального развития человека. Они расположены в соединительной ткани между семенными канальцами. Клетки Лейдига — это эндокринные клетки в яичках, которые производят тестостерон из холестерина через серию ферментативных путей и стероидных промежуточных продуктов под контролем люктинизирующего гормона (ЛГ) из гипофиза. Эффекты тестостерона можно разделить на следующие категории… [Pg.449]
Агенезия клеток Лейдига — RightDiagnosis.com
Введение: агенез клеток Лейдига
Описание агенеза клеток Лейдига
Агенезия клеток Лейдига (заболевание):
Состояние, возникшее в результате пониженного или отсутствующего функционирования … подробнее »
См. Также:
Гипоплазия клеток Лейдига, тип I:
»Введение: Гипоплазия клеток Лейдига, тип I
»Симптомы гипоплазии клеток Лейдига I типа.
»Причины гипоплазии клеток Лейдига I типа.
Агенез клеток Лейдига: Связанные темы
Эти темы о медицинских состояниях или симптомах могут иметь отношение к
Медицинская информация по агенезу клеток Лейдига:
Агенез клеток Лейдига как болезнь
Агенез клеток Лейдига. : Другое название гипоплазии клеток Лейдига, тип I (или тесная ассоциация с медицинским состоянием).
»Введение: Гипоплазия клеток Лейдига, тип I
»Симптомы гипоплазии клеток Лейдига I типа.
»Причины гипоплазии клеток Лейдига I типа.
Агенез клеток Лейдига: связанные заболевания
Агенез клеток Лейдига : Агенез клеток Лейдига указан как тип (или связанный с) следующих заболеваний в нашей базе данных:
Причины агенеза клеток Лейдига
Некоторые из причин агенеза клеток Лейдига включены в список ниже:
- Генетическое заболевание передается по аутосомно-рецессивному типу
Подробнее о причинах агенеза клеток Лейдига (гипоплазия клеток Лейдига, тип I)
Симптомы агенеза клеток Лейдига (гипоплазия клеток Лейдига, тип I)
Некоторые из симптомов агенеза клеток Лейдига включают:
- Недоразвитые клетки Лейдига
- Очень низкий уровень тестостерона в сыворотке
- Высокий уровень лейтеинизирующего гормона
- Маленький пенис
- Гипоспадия
См.

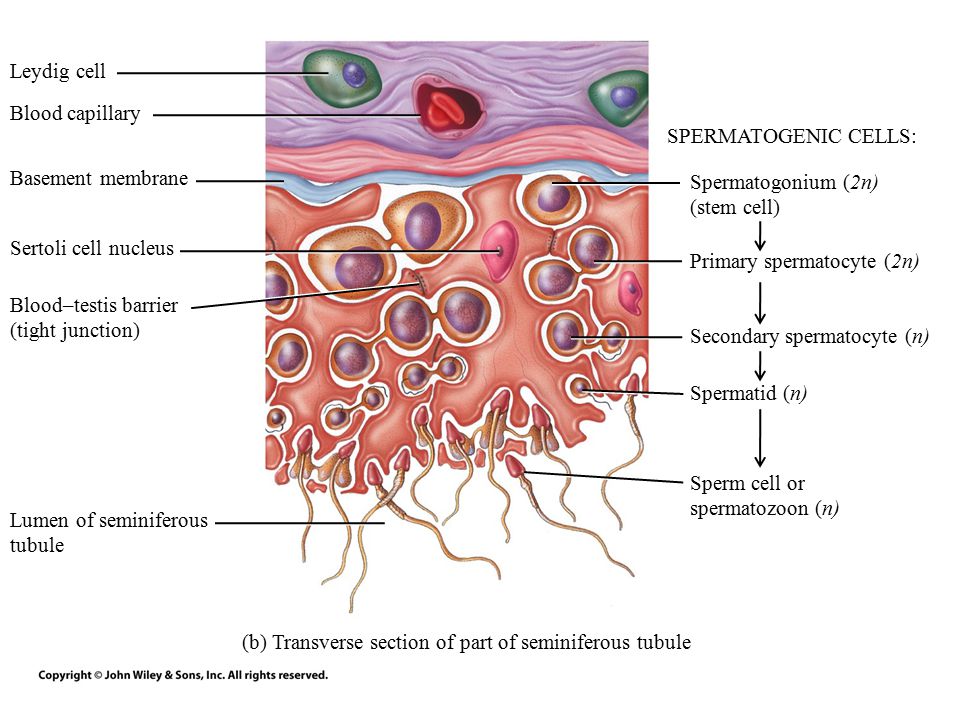 Б.Б Основы эндокринологии 1994.— М.: Изд-во МГУ, 1994.— С.21
Б.Б Основы эндокринологии 1994.— М.: Изд-во МГУ, 1994.— С.21 Нет
Нет