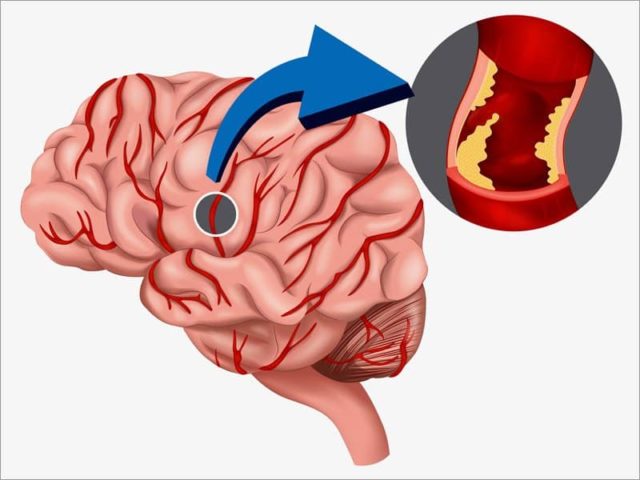
Абдоминальная ишемия — Инновационный сосудистый центр
Абдоминальная ишемия (мезентериальный тромбоз, острая ишемия кишечника, недостаточность кровообращения кишки) возникает, когда кровоток через артерии, которые снабжают кровью кишечник, замедляется или останавливается. Такое состояние имеет много потенциальных причин, в том числе закупорка артерии тромбом или сужение артерии из-за развития холестериновых бляшек. Закупорки также могут возникать в венах, но они менее распространены.
Независимо от причины, снижение кровотока в желудочно-кишечный тракт оставляет ткани без достаточного количества кислорода, что вызывает нарушение функции клеток и их гибель. Если повреждения кишечной стенки достаточно серьезные, то развивается гангрена кишечника с последующим его разрывом (перфорация) с исходом в каловый перитонит и смерть.
Спасти человека с мезентериальным тромбозом можно только при своевременной правильной диагностике, с последующим удалением тромба и оценкой жизнеспособности кишки.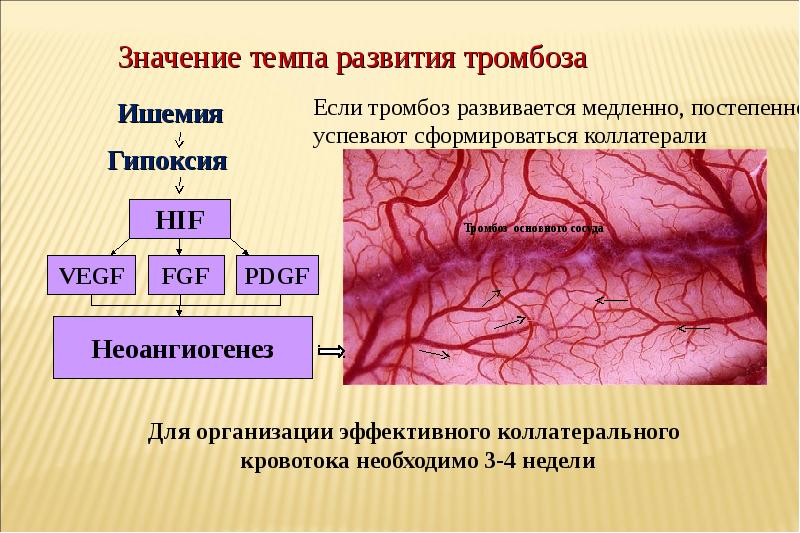 При обычном симптоматическом лечении летальность достигает 99%, при операции по удалению кишки — 80%, при своевременном удалении тромба и контролем за кишкой — 25%.
При обычном симптоматическом лечении летальность достигает 99%, при операции по удалению кишки — 80%, при своевременном удалении тромба и контролем за кишкой — 25%.
Подход к лечению в Инновационном сосудистом центре
Своевременная диагностика мезентериальной ишемии позволяет провести адекватное лечение и сохранить человеку жизнь. В нашей клинике при подозрении на мезентериальную ишемии экстренно выполняется ангиография и удаление тромба из артерий кишечника. Только такое лечение дает пациенту шанс остаться в живых. Если прошло достаточно много времени от начала заболевания, то выполняется восстановление кровообращения и лапароскопия, которая позволяет определить необходимость в удалении омертвевших участков кишки. Без лечения погибают все пациенты. С лечением удается спасти больше половины.
Причины острой ишемии кишечника
- Атеросклероз артерий кишечника может привести к их тромбозу с последующим развитием мезентериальной ишемии. При наличии признаков ишемической болезни сердца, атеросклеротических поражений артерий ног у пациента можно подразумевать системный атеросклероз и соответственно иметь ввиду риск абдоминальной ишемии.

- Высокое или низкое артериальное давление повышает риск развития мезентериального тромбоза и ишемии кишечника
- Сердечная недостаточность и мерцательная аритмия повышают риск эмболии артерий кишечника (перенос тромба из сердца в артерии) и развития острой кишечной ишемии.
- Повышенная свертываемость крови при тромбофилиях, серповидно-клеточной анемии и антифосфолипидном синдроме.
- Употребление кокаина и метамфетамина может вызывать спазм кишечных сосудов и ишемию кишечника.
Клинические формы мезентериального тромбоза
- Тромбоз сосудов толстой кишки (ишемический колит)
Этот наиболее распространенный вариант ишемии кишечника возникает при уменьшении притока крови к толстой кишке. Чаще всего наблюдается у людей старше 60 лет, хотя может развиться в любом возрасте. Признаками и симптомами ишемии толстой кишки являются кровотечения из заднего прохода и внезапно появившиеся спастические боли в животе.
- Острая ишемия тонкой кишки
Этот тип ишемии кишечника, как правило связан с блокированием кровотока в верхней брыжеечной артерии. Он отличается резким началом. Беспокоят сильные боли в животе, тошнота, рвота. Состояние прогрессивно ухудшается и в ближайшие дни наступает гибель пациента.
Он отличается резким началом. Беспокоят сильные боли в животе, тошнота, рвота. Состояние прогрессивно ухудшается и в ближайшие дни наступает гибель пациента.
- Хроническая недостаточность кровоснабжения кишечника
Хроническая абдоминальная (мезентериальная) ишемия иногда называется кишечной стенокардией (брюшная жаба). Развивается в результате развития атеросклеротических бляшек в артериях кишечника. Процесс этот развивается медленно, жалобы носят характер расстройств пищеварения, спазмов в кишечнике. Потенциально опасным осложнением хронической мезентериальной ишемии является развитие тромбов в пораженных артериях, которые блокируют кровоток и вызывают острую абдоминальную ишемию.
- Венозная абдоминальная ишемия
Развивается при тромбозе брыжеечных вен на фоне различных заболеваний органов брюшной полости. При закупорке кишечных вен кровь застаивается в кишечнике, вызывая отеки кишки и кровоточивость слизистой оболочки. Полный блок венозного оттока приводит к гибели участков кишки с развитием перитонита.
Осложнения мезентериального тромбоза
- Гангрена кишки. Если приток крови в кишечник полностью блокирован, то развивается его гибель.
- Перфорация. Омертвевший участок кишки может разорваться. В результате этого содержимое кишечника изливается в брюшную полость, вызывая инфекционный процесс в брюшине (перитонит).
- Рубцовые изменения в стенке кишки. Иногда эти грозные осложнения не развиваются, но поврежденная стенка кишки замещается рубцом, вызывающим сужение кишечной трубки и развитие кишечной непроходимости.
Прогноз при мезентериальной ишемии
Большинство пациентов погибает в течение 2-5 суток с момента начала заболевания, если кровообращение в кишечнике не было восстановлено в ближайшие 6 часов.
При венозном мезентериальном тромбозе возможно постепенное выздоровление, с частичным рубцеванием кишки и развитием хронических энтериитов и колитов. Однако летальность так же высока.
При сегментарном (частичном) мезентериальном тромбозе пациент может выжить, если кишка припаяется к другим органам и не наступит ее перфорация с перитонитом, однако вероятность такого исхода очень небольшая. В последующем у больного может развиться кишечная непроходимость из-за рубцевания погибшей кишки.
В последующем у больного может развиться кишечная непроходимость из-за рубцевания погибшей кишки.
При своевременном восстановлении кишечного кровотока с помощью методов эндоваскулярной хирургии (тромбэктомия, тромболизис, ангиопластика) — вероятность выздоровления повышается до 75%. Однако даже успешное восстановление кровотока требует обязательного наблюдения за состоянием кишечника. Необходимо в течение первых суток выполнить диагностическую лапароскопию, которую можно повторить и в следующие сутки.
При гибели участков кишки необходимо выполнить их удаление во время лапаротомии (открытая операция через живот). Иногда приходится удалять большие по протяженности участки кишки, но это необходимо, так как мертвые и сомнительно-жизнеспособные участки кишки могут распадаться с истечением кишечного содержимого в брюшную полость и развитием гнойного перитонита.
После резекции больших участков кишки может развиться синдром мальабсорбции (нарушения всасывания пищи), что приводит к значительному похуданию пациента, частым поносам и другим кишечным расстройствам.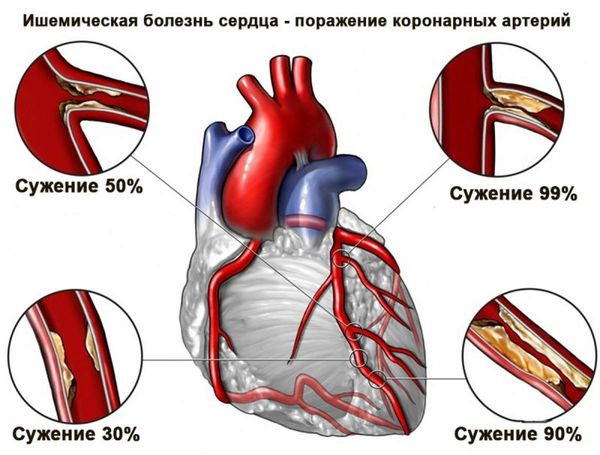 Поэтому наиболее важным в лечении мезентериального тромбоза является восстановление кровообращения в кишечнике, с целью уменьшить размеры его омертвения.
Поэтому наиболее важным в лечении мезентериального тромбоза является восстановление кровообращения в кишечнике, с целью уменьшить размеры его омертвения.
🚑 Где и как лечат ишемическую болезнь сердца?
Что такое ишемия?
В переводе термин «ишемия» означает «задержка крови». Это не отдельная болезнь, а целое патологическое состояние, возникающее из-за недостаточного запитывания кровью какой-либо часть органа или его всего. Все ткани и органы нашего тела требуют питательных веществ, которые приносит ток крови, если же наблюдается нехватка питания, то наступают ишемические изменения. Крайне чувствительны к ним сердце и головной мозг.
Причины возникновения ишемии
Причинами появления и развития ишемии могут быть:
•Спазм артерии. Такая ишемия называется нейрогенной;
•Тромб, который перекрывает сосуд. Это обтурационная ишемия;
•Атеросклеороз;
•Сильный стресс;
•Отравление различными ядами;
•Закупорка сосудов;
•Утолщение стенок сосудов;
•Механическое сдавливание сосуда.
Установление причины возникновения непосредственно влияет на способ лечения.
Классификация заболевания
Ишемия может быть острой и хронической. Острая возникает в связи с неожиданным прекращением или замедлением тока крови. И может быть:
•Абсолютной;
•Субкомпенсированной;
•Компенсированной.
Первая – самая тяжелая, ведет к значительным нарушениям работы тканей и органов.
При хронической ишемии происходят медленные и незаметные нарушения кровотока, причем проявляться они могут в различных органах, чаще всего – в головном мозге, приводя к гипертонической болезни, атеросклерозу и болезням сердца.
Симптомы ишемии
В зависимости от того, в каком именно органе наблюдается недостаток питания, симптоматика будет отличаться.
Ишемия головного мозга характеризуется следующими признаками:
•Нарушается память;
•Снижается уровень концентрации внимания;
•Нарушается координация движений;
•Шум в ушах;
•Нарушение зрения;
•Несвязная речь;
•Онемение лица;
•Ощущается нехватка воздуха.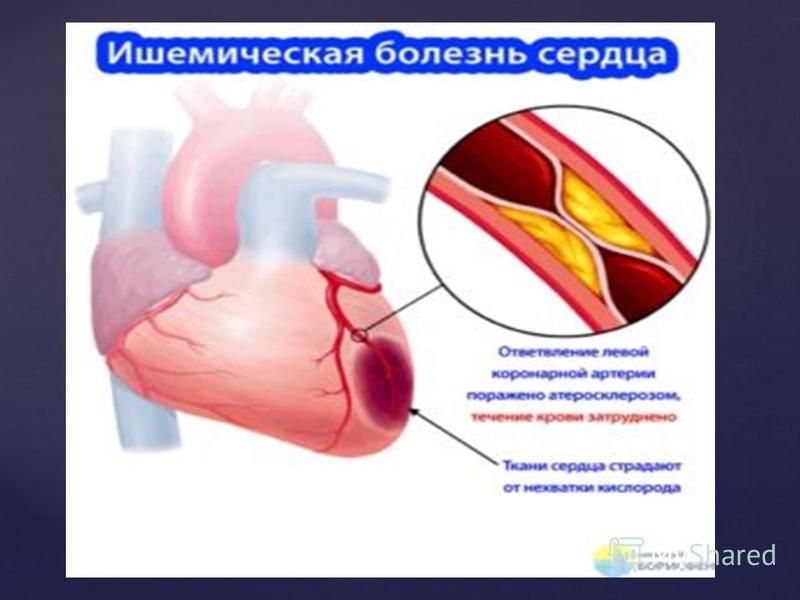
Возникают такие симптомы внезапно и очень схожи с прединсультными.
Ишемия кишечника дает сильнейший болевой синдром, усиливается перистальтика, появляются тошнота, рвота, в кале – кровь.
Ишемия ног – довольно частая патология. Симптоматика – постоянная непрекращающаяся боль, язвы на ногах, переходящие в некроз и гангрену.
Ишемия сердца дает о себе знать стенокардией, то есть у человека болит за грудиной, не хватает кислорода, артериальное давление низкое, изжога, боль отдает в левую руку, ощущение страха смерти. Очень опасное состояние, может привести к летальному исходу.
Встречается и безболевая ишемия, выявить которую можно исключительно при аппаратной диагностике, например, ЭКГ или Холтеровском мониторинге. Последний состоит в том, что на человека надевают датчики и дают физическую нагрузку – крутить педали велотренажера или бежать по дорожке поднятой под определенным углом. Также за пациентом наблюдают целые сутки. Расшифровывая полученные данные, врач обнаруживает сбои в питании сосудов сердца.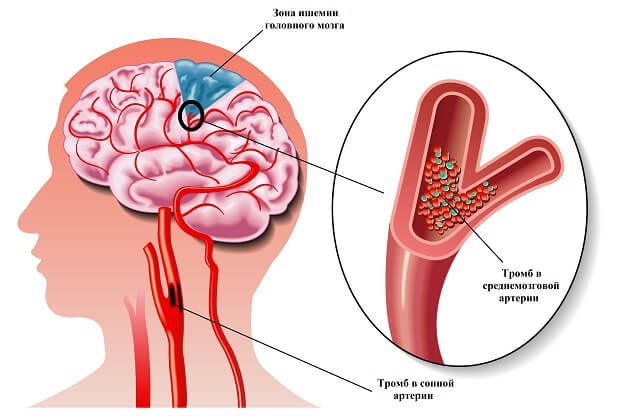
Что такое коллатеральное кровообращение и какова его роль при ишемии
Оказывается, в нашем организме заложена масса интересных восстановительных возможностей. Одна из них – коллатеральное кровообращение. Когда тало определяет, что какой-то орган или его часть имеют ишемизированные ткани, открываются коллатеральные сосуды, которые перебирают на себя функцию кровоснабжения поврежденных органов. Ученые выяснили, что этот процесс запускается, когда «голодные» клетки раздражают нервные окончания и заставляют вступать в дело коллатерали. В зависимости от того, насколько эффективно действуют эти спасители жизни и здоровья человека, принято рассматривать 3 степени кровоснабжения.
•При первой общее количество коллатералей вполне достаточно, чтобы полностью заменить нерабочий сосуд;
•Относительно достаточная вторая степень характеризуется тем, что коллатералей не совсем хватает для качественной замены основного сосуда. Будут наблюдаться сбои дыхания, кислородная недостаточность;
•Третья степень – абсолютно недостаточная. При этом вспомогательные сосуды не справляются с дублирующими функциями, и возникает инфаркт миокарда и ишемический инсульт.
При этом вспомогательные сосуды не справляются с дублирующими функциями, и возникает инфаркт миокарда и ишемический инсульт.
Как диагностируют ишемию?
Поскольку ишемия – патология давно известная и хорошо изученная, то в арсенале докторов есть стандартная схема диагностики. В нее входят:
•Анализ крови;
•Электрокардиограма;
•Ультразвуковая кардиография;
•Компьютерная томография;
•Коронарная ангиография.
Как лечат ишемическую болезнь
Показаниями к лечению может быть исключительно результаты диагностики. Привлекаются методики:
•Медикаментозные;
•Физиотерапевтические;
•Хирургические.
Прежде всего, предпринимают меры, направленные на восстановление кровообращения. Для этого предписывают спазмолитики, тромболитики и препараты, снижающие вязкость крови. Затем необходимо расширить артерию и исключить появление бляшек. В первые 6 часов делают тромболизис, то есть ликвидируют тромб, который перекрыл сосуд. Также следует предпринять меры, чтобы коллатеральная сеть развилась как можно быстрее.
Также следует предпринять меры, чтобы коллатеральная сеть развилась как можно быстрее.
Эти мероприятия предпринимают при одновременном контроле за уровнем сахара в крови, холестерина и артериального давления. Исключение стрессовых ситуаций з жизни пациента способствуют более быстрому выздоровлению.
Если терапевтические меры не дают ожидаемого эффекта, прибегают к хирургическому вмешательству. Оно может состоять в коронарной ангиопластике, шунтировании или стентировании.
Шунтирование предполагает вживление искусственного сосуда, по которому пускаю кровоток в обход поврежденного.
При ангиопластике в сосуд вводят балонный катетер, устраняющий последствия ишемии.
Стентирование – это установка каркаса, который держит стенки сосуда и не дает им спадаться, следующий этап развития ангиопластики.
этиология, механизмы возникновения, основные проявления, последствия. Микроциркуляция при ишемии. Значение шунтирования и коллатерального кровообращения в исходе ишемии.
Ишемия. Нарушение
периферического кровообращения, в
основе которого лежит ограничение или
полное прекращение притока артериальной
крови, называется ишемией. Ишемия
характеризуется следующими признаками:
побледнением ишемизированного участка
органа, снижением температуры, нарушением
чувствительности в виде парестезии
(ощущение онемения, покалывания, «ползания
мурашек»), болевым синдромом, уменьшением
скорости кровотока и объема органа,
понижением артериального давления на
участке артерии, расположенном ниже
препятствия, понижением напряжения
кислорода в ишемизированном участке
органа или ткани, уменьшением образования
межтканевой жидкости и снижением тургора
ткани, нарушением функции органа или
ткани> дистрофическими изменениями.
Причиной ишемии могут быть различные
факторы: сдавление артерии, обтурация
ее просвета, действие на нервно-мышечный
аппарат артериальной стенки. В соответствии
В соответствии
с этим различают компрессионный,
обтурационный и, ангиоспастический
типы ишемии. Компрессионная
ишемия
возникает от сдавления приводящей
артерии лигатурой, рубцом, опухолью,
инородным телом и др. Обтурационная
ишемия
является следствием частичного сужения
или полного закрытия просвета артерии
тромбом или эмболом. Продуктивно-инфильтративные
и воспалительные изменения стенки
артерии, возникающие при атеросклерозе,
облитерирующем эндартериите, узелковом
периартериите, также приводят к
ограничению местного кровотока по типу
обтурационной ишемии. Ангиоспастическая
ишемия
возникает вследствие раздражения
сосудосуживающего аппарата сосудов и
их рефлекторного спазма, вызванного
эмоциональным воздействием (страх,
боль, гнев), физическими факторами
(холод, травма, механическое раздражение),
химическими агентами, биологическими
раздражителями (токсины бактерий) и т.
д. В условиях патологии ангиоспазм
характеризуется относительной
продолжительностью и значительной
выраженностью, что может быть причиной
резкого замедления кровотока, вплоть
до полной остановки его. Чаще всего
Чаще всего
ангиоспазм развивается в артериях
относительно крупного диаметра внутри
органа по типу сосудистых безусловных
рефлексов с соответствующих
интерорецепторов. Эти рефлексы
характеризуются значительной инертностью
и автономностью. Примером такого типа
сосудистых реакций может служить спазм
венечных артерий сердца при раздражении
рецепторов внутренних органов (кишок,
желчных путей, мочеточников, мочевого
пузыря, легких, матки), рефлекторный
спазм сосудов парного органа (почки,
конечности) при раздражении противоположно
расположенного. Ангиоспастическая
ишемия может также иметь условно-рефлекторный
характер. Наконец, прямое раздражение
расположенного в подкорковой области
сосудодвигательного центра токсическими
веществами, содержащимися в омывающей
его крови, механическое раздражение
подкорковых образований, регулирующих
сосудистый тонус (при опухолевом процессе
в головном мозге, кровоизлияниях в мозг,
при повышении внутричерепного давления),
наличие патологического, в частности
воспалительного процесса в области
промежуточного мозга также часто
приводят к выраженным ангиоспастическим
явлениям. Таким образом, развитие
Таким образом, развитие
ангиоспазма достигается прежде всего
вследствие активации нейрогенных
α-адренэргических, Н1-гистаминэргических,
серотонинэргических, дофаминэргических
механизмов. Источником биогенных
немедиаторной природы аминов являются
надпочечники (катехоламины) и клетки
диффузной нейроэндокринной системы
(АРUD
— система захвата предшественников
аминов и их декарбоксилирования),
разбросанные по разным органам и тканям,
обладающие способностью вырабатывать
серотонин, гистамин и дофамин. В рыхлой
соединительной ткани источником
гистамина, кроме того, являются тканевые
базофилы, в крови — базофилы (гистамин)
и тромбоциты (гистамин, серотонин). В
развитии ангиоспазма определенную роль
играют простагландины (ГОТ и тромбоксан
А2).
Последний образуется в тромбоцитах,
его выделение особенно резко возрастает
при их адгезии и агрегации на поврежденной
стенке сосудов. Наконец, ангиоспастическим
действием обладают вазоактивные пептиды
— вазопрессин и ангиотензин II.
Непосредственный механизм активации
сократительных белков гладкомышечмых
клеток для такого широкого по происхождению
и химической природе спектра биологически
активных веществ до конца не установлен.
Посредником служат специфические
рецепторы гладкомышечных клеток.
Применительно к катехоламинам это, в
частности, α-адренорецепторы. При их
возбуждении, по-видимому, прежде всего
изменяются электрические свойства
мембраны гладко-мышечных клеток
вследствие повышения проницаемости
клеточной мембраны для ионов Na,
Са2+,
К? С1. Во время потенциала действия,
вызванного норадреналином, особая роль
принадлежит ионам Са2+,
которые поступают через клеточную
мембрану из межклеточной жидкости и,
кроме того, освобождаются из
саркоплазматического ретикулума.
Следствием этого является активация
сократительных белков гладкомышечных
клеток и развитие их сокращения. Большую
роль в возникновении ангиоспастической
ишемии играет изменение чувствительности
мышечных элементов стенки сосудов по
отношению к норадреналину и вазоактивным
пептидам. Например, ионы натрия,
Например, ионы натрия,
накапливаясь в мышечных волокнах сосуда,
повышают его чувствительность к
прессорным веществам — катехоламинам,
вазопрессину и ангиотензину. В последнее
время установлено участие эндотелия в
нормальном функционировании механизма
сокращения — расслабления гладких мышц
сосудов. Повреждение эндотелия лишает
его способности выделять фактор
релаксации, вследствие чего усиливаются
спастические реакции. Последние могут
возникать даже на ацетилхолин и
брадикинин, которые в норме вызывают
расширение сосудов. Характер обменных,
функциональных и структурных изменений
в ишемизированном участке ткани или
органа определяется степенью кислородного
голодания, тяжесть которого зависит от
скорости развития и типа ишемии, ее
продолжительности, локализации, характера
коллатерального кровообращения,
функционального состояния органа или
ткани. Ишемия, возникающая на участке
полной обтурации или компрессии артерий,
при прочих равных условиях вызывает
более тяжелые изменения, чем при спазме.
Быстро развивающаяся ишемия, как и
длительная, протекает более тяжело по
сравнению с медленно развивающейся или
непродолжительной. Особенно большое
значение в развитии ишемии имеет
внезапная обтурация артерий, так как
при этом может присоединиться рефлекторный
спазм системы разветвлений данной
артерии. Ишемия жизненно важных органов
(мозг, сердце) имеет более тяжелые
последствия, чем ишемия почек, селезенки,
легких, а ишемия последних — более
тяжелые по сравнению с ишемией скелетной,
мышечной, костной или хрящевой ткани.
Указанные органы характеризуются
высоким уровнем энергетического обмена,
в то же время их коллатеральные сосуды
функционально абсолютно или относительно
не способны компенсировать нарушение
кровообращения. Наконец, большое значение
в развитии ишемии имеет предшествующее
функциональное состояние органа или
ткани. Затруднение притока артериальной
крови в условиях повышенной функциональной
активности органа или ткани более
опасно, чем в состоянии покоя. Особенно
велика роль несоответствия функции
органа и его кровоснабжения при наличии
органических изменений в артериях.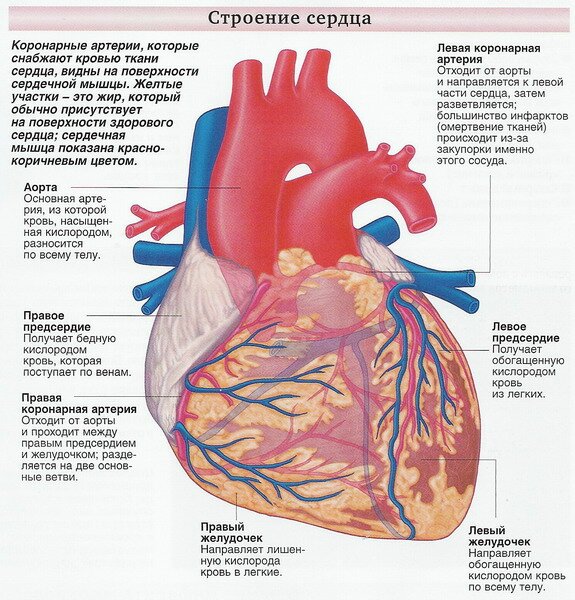 Это
Это
связано с тем, что органические изменения
сосудистой стенки, с одной стороны,
ограничивают ее способность к расширению
при повышенной нагрузке, а с другой,
делают ее более чувствительной к
различным спазматическим влияниям.
Кроме того, возможность усиления
коллатерального кровообращения в
склеротически измененных сосудах также
весьма ограничена.
Принципы лечения повреждений сосудов конечностей
При оказании помоoи раненым с повреждениями сосудов последовательно решаются следующие основные задачи:
- спасение жизни раненого при кровотечении и кровопотере,
- сохранение жизнеспособности конечности,
- лечение осложнений и постедствий повреждений сосудов.
Своевременно и правильно выполненная временная остановка кровотечения вместе с быстрым восполнением кровопотери лежат в основе спасения жизни раненых с сосудистой травмой.
Возможность сохранения конечности при повреждении сосудов определяется глубиной артериальной ишемии. Классификация острой ишемии, прогноз и лечебная тактика при ранении артерий конечностей по В. А. Корнилову приведены в табл. 1.
Классификация острой ишемии, прогноз и лечебная тактика при ранении артерий конечностей по В. А. Корнилову приведены в табл. 1.
Таблица 1.
Классификация ишемии конечности при ранении артерии, прогнозирование ее исходов и лечебная тактика
| Степень ишемии | Главные клинические признаки | Прогноз | Лечение |
| Компенсированная (за счет коллатералей)
Некомпенсированная Необратимая | Сохранены активные движения, тактильная и болевая чувствительность
Утрата активных движений, тактильной и болевой чувствительности Пассивные движения невозможны — острая ишемическая контактура конечности | Угрозы гангрены нет
Конечность омертвеет в пределах ближайших 6-8 часов Сохранение конечности невозможно | Показания к срочному восстановлению артерии нет, перевязка сосуда безопасна
Показано неотложное восстановление артерии Показана ампутация, восстановление артерии может привести к гибели раненого от интоксикации |
Наличие достаточного коллатерального кровотока в конечности с поврежденной магистральной артерией проявляется сохранением активных движений в дистальных суставах, тактильной и болевой чувствительности (компенсированная ишемия). При компенсированной ишемии угроза развития ишемического некроза отсутствует. Если завершить операцию перевязкой поврежденной артерии, может развиться хроническая ишемия, устраняемая реконструктивной операцией в отдаленном периоде.
При компенсированной ишемии угроза развития ишемического некроза отсутствует. Если завершить операцию перевязкой поврежденной артерии, может развиться хроническая ишемия, устраняемая реконструктивной операцией в отдаленном периоде.
В ситуации, когда уровня сохраненного коллатерального кровотока не хватает для обеспечения жизнедеятельности тканей, уже через 30–40 минут после ранения развивается картина некомпенсированной ишемии (утрата активных движений, тактильной и болевой чувствительности). Если не восстановить кровоток по магистральной аргерии, то через 6–8 часов неизбежно разовьется ишемическая контрактура поперечно-полосатых мышц конечности (необратимая ишемия). Попытка сохранить конечность восстановлением артерии при необратимой ишемии ведет к смертельно опасному эндотоксикозу за счет вымывания из длительно ишемизированных мышц ионов калия, миоглобина, полипептидов, агрессивных свободных радикалов и др. (феномен ишемии-реперфузии).
Наиболее часто необратимая ишемия вследствие «анатомической недостаточности» имеющихся коллатералей развивается при ранениях подколенной артерии (до 80%), общей подвздошной артерии (50%), бедренной артерии в нижней трети (30%), подключичной артерии в начальном отделе (25%). Ранения других артерий протекают более благоприятно, хотя их повреждения при обширных разрушениях мягких тканей, сопровождающихся нарушением коллатерального кровотока, также могут приводить к гангрене конечности.
Операции по поводу повреждений сосудов целесообразно проводить под общим обезболиванием. Учитывая возможность интраоперационного кровотечения, необходимо располагать запасом консервированной крови, подготовленной для переливания. Ангиотравматологические операции выполняются в три этапа. Сначала осуществляется выделение зоны повреждения сосудов и обеспечивается временный гемостаз атравматическими зажимами. Затем с учетом характера повреждения сосудистой стенки, степени артериальной ишемии и других факторов производится окончательный гемостаз путем восстановления или перевязки сосуда (либо временное внутрисосудистое протезирование). Заключительным этапом операции является первичная хирургическая обработка ран (при наличии соответствующих показаний).
Реконструктивные вмешательства на поврежденных сосудах осуществимы не во всех лечебных учреждениях, что объясняется их сложностью и недостатком хирургов, подготовленных по ангиотравматологии. Кроме того, для проведения сосудистых операций необходимы специальные инструменты и атравматический шовный материал.
Технически восстановление поврежденной магистральной артерии осуществляется наложением бокового или циркулярного шва, выполнением аутовенозной пластики, в редких случаях — вшиванием, аутовенозной заплаты. Боковой шов целесообразно накладывать при поперечных ранах, составляющих не более половины окружности сосуда, и при продольных ранах длиной не более 1 -1,5 см. В остальных случаях артерию даже при неполном повреждении целесообразно пересечь и восстановить циркулярным швом. При наличии сосудосшивающего аппарата (АСЦ-8) может применяться механический циркулярный шов.
Наложить циркулярный сосудистый шов удается при дефектах стенки артерии не более 2~3 см длиной, при этом надо дополнительно мобилизовать сосуд, согнуть конечность в суставе. В случае более обширных дефектов производится аутовенозная пластика артерий с использованием отрезка большой подкожной вены неповрежденной нижней конечности (при этом периферический конец вены подшивается к центральному концу артерии, чтобы венозные клапаны не препятствовали току крови).
По современным представлениям, все поврежденные магистральные артерии целесообразно восстанавливать. Перевязку артерии как метод окончательной остановки кровотечения разрешается производить только у раненых с компенсированной ишемией и в случаях отсутствия хирургов, владеющих техникой сосудистого шва, или сложной медико-тактической обстановки.
У раненых с некомпенсированной ишемией конечности, в случае невозможности окончательного восстановления сосуда, следует производить временное внутрисосудистое протезирование артерий как метод двухэтапного восстановления артерий. При компенсированной ишемии временное протезирование сосуда противопоказано из-за угрозы ухудшения кровообращения при тромбозе протеза.
Для временного протезирования используются стандартные или импровизированные (например, от систем для переливания крови) трубки, которые вводятся в просвет поврежденной артерии и таким образом временно восстанавливают кровоток в ишемизированной конечности (рис. 1). Применение временного протезирования артерий предполагает срочную эвакуацию раненого в специализированное лечебное учреждение или вызов к раненому специалиста-ангиохирурга для окончательного восстановления сосуда.
Рис. 1. Методика временного протезирования поврежденной артерии
Показанием к обязательному восстановлению поврежденных магистральных вен (наложением бокового или циркулярного шва) являются признаки венозной гипертензии, что чаще бывает при ранениях крупных вен нижних конечностей — подвздошных, бедренных.
При операциях на фоне угрожающей ишемии и в ряде других случаев ранений кровеносных сосудов производится широкое подкожное рассечение всех фасциальных футляров ишемизированного сегмента конечности с помощью длинных ножниц (профилактическая фасциотомия). Разрезы зашивают редкими кожными швами для устранения ворот инфекции. Профилактическая фасциотомия при восстановлении артерий конечностей производится по следующим показаниям: некомпенсированная ишемия конечности; длительное (1,5–2 часа) пребывание на конечности кровоостанавливающего жгута; сопутствующее ранение магистральной вены; обширное повреждение мягких тканей и.значительный отек конечности, тяжелое состояние раненого с предшествовавшим длительным периодом артериальной гипотонии. Наиболее часто применяется фасциотомия голени ввиду особенностей строения, костно-фасацальных футляров.
Эвакуация раненых после операций на сосудах возможна через 6–12 часов после вмешательства при условии стабилизации общего состояния и восполнения кровопотери. С 3-х по 10-е сутки эвакуация наземным транспортом опасна ввиду возможности развития вторичного кровотечения. Перед эвакуацией всем раненым, независимо от характера вмешательства на сосудах конечностей, производится транспортная иммобилизация, и накладываются провизорные жгуты (наличие сопровождающего обязательно).
Гуманенко Е.К.
Военно-полевая хирургия
Опубликовал Константин Моканов
этиология, механизмы возникновения, основные проявления, последствия. Микроциркуляция при ишемии. Значение шунтирования и коллатерального кровообращения в исходе ишемии — КиберПедия
Ишемия — нарушение периферического кровообращения, в основе которого лежит ограничение или полное прекращение притока артериальной крови, называется ишемией. Ишемия характеризуется следующими признаками: побледнением ишемизированного участка органа, снижением температуры, нарушением чувствительности в виде парестезии (ощущение онемения, покалывания, «ползания мурашек»), болевым синдромом, уменьшением скорости кровотока и объема органа, понижением артериального давления на участке артерии, расположенном ниже препятствия, понижением напряжения кислорода в ишемизированном участке органа или ткани, уменьшением образования межтканевой жидкости и снижением тургора ткани, нарушением функции органа или ткани, дистрофическими изменениями. Причиной ишемии могут быть различные факторы: сдавление артерии, обтурация ее просвета, действие на нервно-мышечный аппарат артериальной стенки. В соответствии с этим различают компрессионный, обтурационный и, ангиоспастический типы ишемии. Компрессионная ишемия возникает от сдавления приводящей артерии лигатурой, рубцом, опухолью, инородным телом и др. Обтурационная ишемия является следствием частичного сужения или полного закрытия просвета артерии тромбом или эмболом. Продуктивно-инфильтративные и воспалительные изменения стенки артерии, возникающие при атеросклерозе, облитерирующем эндартериите, узелковом периартериите, также приводят к ограничению местного кровотока по типу обтурационной ишемии. Ангиоспастическая ишемия возникает вследствие раздражения сосудосуживающего аппарата сосудов и их рефлекторного спазма, вызванного эмоциональным воздействием (страх, боль, гнев), физическими факторами (холод, травма, механическое раздражение), химическими агентами, биологическими раздражителями (токсины бактерий) и т. д. В условиях патологии ангиоспазм характеризуется относительной продолжительностью и значительной выраженностью, что может быть причиной резкого замедления кровотока, вплоть до полной остановки его. Чаще всего ангиоспазм развивается в артериях относительно крупного диаметра внутри органа по типу сосудистых безусловных рефлексов с соответствующих интерорецепторов. Эти рефлексы характеризуются значительной инертностью и автономностью. Примером такого типа сосудистых реакций может служить спазм венечных артерий сердца при раздражении рецепторов внутренних органов (кишок, желчных путей, мочеточников, мочевого пузыря, легких, матки), рефлекторный спазм сосудов парного органа (почки, конечности) при раздражении противоположно располо-женного. Ангиоспастическая ишемия может также иметь условно-рефлекторный характер. Наконец, прямое раздражение расположенного в подкорковой области сосудодвигательного центра токсическими веществами, содержащимися в омывающей его крови, механическое раздражение подкорковых образований, регулирующих сосудистый тонус (при опухолевом процессе в головном мозге, кровоизлияниях в мозг, при повышении внутричерепного давления), наличие патологического, в частности воспалительного процесса в области промежуточного мозга также часто приводят к выраженным ангиоспастическим явлениям. Таким образом, развитие ангиоспазма достигается прежде всего вследствие активации нейрогенных α-адренэргических, Н1-гистаминэргических, серотонинэргических, дофа-минэргических механизмов. Источником биогенных немедиаторной природы аминов являются надпочечники (катехоламины) и клетки диффузной нейроэндокринной системы (АРUD — система захвата предшественников аминов и их декарбоксилирования), разбросанные по разным органам и тканям, обладающие способностью вырабатывать серотонин, гистамин и дофамин. В рыхлой соединительной ткани источником гистамина, кроме того, являются тканевые базофилы, в крови — базофилы (гистамин) и тромбоциты (гистамин, серотонин). В развитии ангиоспазма определенную роль играют простагландины (ГОТ и тромбоксан А2). Последний образуется в тромбоцитах, его выделение особенно резко возрастает при их адгезии и агрегации на поврежденной стенке сосудов. Наконец, ангиоспастическим действием обладают вазоактивные пептиды — вазопрессин и ангиотензин II. Непосредственный механизм активации сократительных белков гладкомышечмых клеток для такого широкого по происхождению и химической природе спектра биологически активных веществ до конца не установлен. Посредником служат специфические рецепторы гладкомышечных клеток. Применительно к катехоламинам это, в частности, α-адренорецепторы. При их возбуждении, по-видимому, прежде всего изменяются электрические свойства мембраны гладко-мышечных клеток вследствие повышения проницаемости клеточной мембраны для ионов Na, Са2+, К,С1. Во время потенциала действия, вызванного норадреналином, особая роль принадлежит ионам Са2+, которые поступают через клеточную мембрану из межклеточной жидкости и, кроме того, освобождаются из саркоплазматического ретикулума. Следствием этого является активация сократительных белков гладкомышечных клеток и развитие их сокращения. Большую роль в возникновении ангиоспастической ишемии играет изменение чувствительности мышечных элементов стенки сосудов по отношению к норадреналину и вазоактивным пептидам. Например, ионы натрия, накапливаясь в мышечных клнтках сосуда, повышают его чувствительность к прессорным веществам — катехоламинам, вазо-прессину и ангиотензину. В последнее время установлено участие эндотелия в нормальном функционировании механизма сокращения — расслабления гладких мышц сосудов. Повреждение эндотелия лишает его способности выделять фактор релаксации, вследствие чего усиливаются спастические реакции. Последние могут возникать даже на ацетилхолин и брадикинин, которые в норме вызывают расширение сосудов. Характер обменных, функциональных и структурных изменений в ишемизированном участке ткани или органа определяется степенью кислородного голодания, тяжесть которого зависит от скорости развития и типа ишемии, ее продолжительности, локализации, характера коллатерального кровообращения, функционального состояния органа или ткани. Ишемия, возникающая на участке полной обтурации или компрессии артерий, при прочих равных условиях вызывает более тяжелые изменения, чем при спазме. Быстро развивающаяся ишемия, как и длительная, протекает более тяжело по сравнению с медленно развивающейся или непродолжительной. Особенно большое значение в развитии ишемии имеет внезапная обтурация артерий, так как при этом может присоединиться рефлекторный спазм системы разветвлений данной артерии. Ишемия жизненно важных органов (мозг, сердце) имеет более тяжелые последствия, чем ишемия почек, селезенки, легких, а ишемия последних — более тяжелые по сравнению с ишемией скелетной, мышечной, костной или хрящевой ткани. Указанные органы характеризуются высоким уровнем энергетического обмена, в то же время их коллатеральные сосуды функционально абсолютно или относительно не способны компенсировать нарушение кровообращения. Наконец, большое значение в развитии ишемии имеет предшествующее функциональное состояние органа или ткани. Затруднение притока артериальной крови в условиях повышенной функциональной активности органа или ткани более опасно, чем в состоянии покоя. Особенно велика роль несоответствия функции органа и его кровоснабжения при наличии органических изменений в артериях. Это связано с тем, что органические изменения сосудистой стенки, с одной стороны, ограничивают ее способность к расширению при повышенной нагрузке, а с другой, делают ее более чувствительной к различным спазматическим влияниям. Кроме того, возможность усиления коллатерального кровообращения в склеротически измененных сосудах также весьма ограничена.
4.4. Тромбоз: причины и механизмы тромбообразования, проявления, исходы и значение тромбоза для организма
Тромбоз— это процесс прижизненного образования на внутренней поверхности стенки сосудов сгустков крови, состоящих из ее элементов. Сгустки крови могут быть пристеночными (частично уменьшают просвет сосудов) и закупоривающими. Первая разновидность тромбов чаще всего возникает в сердце и стволах магистральных сосудов, вторая — в мелких артериях и венах. В зависимости от того, какие компоненты преобладают в структуре тромба, различают белые, красные и смешанные тромбы. В первом случае тромб образуют тромбоциты, лейкоциты, а также небольшое количество белков плазмы; во втором — эритроциты, скрепленные нитями фибрина; смешанные тромбы представляют собой чередующиеся белые и красные слои. Еще с прошлого столетия сформировалось четкое представление об основных факторах тромбообразования в виде триады Вирхова. 1. Повреждение сосудистой стенки, возникающее под действием физических (механическая травма, электрический ток), химических (NaCl, FeCl3, HgCl2, AgNO3) и биологических (эндотоксины микроорганизмов) факторов, в результате нарушения ее питания и метаболизма. Указанными нарушениями, кроме того, сопровождаются атеросклероз, гипертоническая болезнь, аллергические процессы. Пристеночный тромб образуется прежде всего на участке повреждения стенки сосуда. Это объясняется, с одной стороны, тем, что из поврежденной внутренней оболочки сосуда выделяются факторы свертывания крови, активирующие процесс тромбообразования, а с другой, локальным угнетением процесса фибринолиза, уменьшением образования в эндотелии кровеносных сосудов ПП2 (простациклин) и его эндоперекисей, оказывающих в норме выраженное антиагрегационное действие на тромбоциты. В условиях повреждения эндотелия увеличивается его способность к синтезу фактора активации тромбоцитов — ФАТ). С его участием связывают агрегацию и дегрануляцию тромбоцитов, высвобождение из них вазоактивных аминов (гистамин, серотонин), АТФ, активацию фосфолипазы А, и усиление биосинтеза тромбоксана А2. 2. Нарушение активности свертывающей и противосвертывающей системы крови и сосудистой стенки. Повышение активности свертывающей системы крови вследствие повышения в ней концентрации прокоагулянтов (тромбин, тромбопластин), как и понижение активности противосвертывающей (уменьшение содержания в крови антикоагулянтов или увеличение активности их ингибиторов), в том числе фибринолитической, как правило, приводит к внутрисосудистому свертыванию крови (ВССК) и тромбозу. ВССК обусловлено быстрым и значительным поступлением в сосудистое русло факторов свертывания крови в частности тканевого тромбопластина, что наблюдается при преждевременной отслойке плаценты, эмболии околоплодными водами, травматическом шоке, остром массивном гемолизе эритроцитов. В эксперименте ВССК можно воспроизвести путем введения в систему общей циркуляции крови собак или кроликов активного тромбина или тромбопластина. ВССК может быть генерализованным (диссеминированным — ДВС-синдром) и локальным. Это процесс обратимый, особенно при своевременной терапии антикоагулянтами. Переход ВССК в тромбоз происходит под влиянием факторов свертывания сосудистой стенки и тромбоцитов при их повреждении. В связи с усиленным потреблением факторов свертывания крови и тромбоцитов в процессе ДВС, вторичной активацией противосвертывающей системы и фибринолиза во вторую фазу ДВС развивается тромбогеморрагический или гиперкоагуля-ционный синдром.
3. Замедление кровотока и его нарушения (завихрения в области аневризмы). Этот фактор, вероятно, имеет меньшее значение, однако он позволяет объяснить, почему в венах тромбы образуются в пять раз чаще, чем в артериях, в венах нижних конечностей — в 3 раза чаще, чем в венах верхних конечностей, а также высокую частоту тромбообразования при декомпенсации кровообращения, пребывании на длительном постельном режиме. Развитие некроза (инфаркта, гангрены) в бассейне тромбированного, лишенного коллатералей сосуда — конечный этап тромбоза. Особенно велика роль тромбоза венечных артерий в развитии инфаркта миокарда. Исходом тромбоза могут быть асептическое (ферментативное, аутолитическое) расплав-ление, организация (рассасывание с замещением соединительной тканью), реканализация, септическое (гнойное) расплавление. Послед-нее особенно опасно, так как способствует септикопиемии и образова-нию множественных абсцессов в различных органах.
Ишемия миокарда — Основные симптомы и методы лечения ишемии, советы врачей
Заболевания сердечно-сосудистой системы – первая причина смертности населения планеты в настоящее время.
Более 50% людей погибают из-за проблем с сосудами и сердечной недостаточности.
Вопросом, что такое ишемия сердца, ежедневно задаётся не один человек. Словосочетание «ишемия миокарда» подразумевает под собой недостаточное снабжение сердечной мышцы кислородом.
Ишемия на ЭКГ проявляется характерным набором симптомов и патологических изменений, которые невозможно перепутать с другим заболеванием.
Этиология и патогенез ишемии миокарда
Основная причина возникновения заболевания – снижение питания миокарда артериальной кровью, богатой кислородом.
Патологические процессы, вызывающие ишемию миокарда:
- атеросклеротическое сужение сердечных артерий из-за образования бляшек в строме сосуда. Каждая бляшка состоит из липопротеинов низкой и очень низкой плотности, а также тромбоцитов. При разрыве бляшки формируется острое ишемическое повреждение миокарда, иначе именуемое инфарктом;
- воспалительные изменения сосудистой стенки: васкулиты, артерииты, системные заболевания соединительной ткани ведут к нарушению проницаемости сосудов;
- вирусные и бактериальные агенты, размножающиеся в интиме сосудов;
- токсическое поражение коронарных сосудов, вызывающее их спазм. Может формироваться вследствие избыточного употребления алкоголя, никотина, отравления тяжелыми металлами и солями ртути;
- стрессовая ситуация, вызывающая массивный выброс адреналина в кровь, ведет к сужению сосудистого просвета.
- гормонозависимые опухоли различных органов и тканей.
Вследствие нарушения питания сердечной мышцы развивается спазм сосудов, нарушение окисления свободных жирных кислот, накопление недоокисленных продуктов распада белков, активируется перекисное окисление липидов.
Эти изменения приводят к нарушению питания митохондрий – основных источников продукции энергии в клетках.
Из-за дисфункции митохондрий не функционируют ионные каналы в сердечной ткани, и развивается дисбаланс ионов, что ведёт к нарушению сократительной функции сердца.
Виды ишемии миокарда
В зависимости от расположения участка сердца, который не получает кровь, ишемия всего миокарда делится на субэпикардиальную и субэндокардиальную формы.
Субэпикардиальная ишемия миокарда локализуется непосредственно под наружным слоем сердечной мышцы – под эпикардом. Зона повреждения имеет достаточную величину и протяжённость от эпикарда до эндокарда, задевая все слои передней и задней стенки.
При субэндокардиальной ишемии повреждается внутренняя часть сердечной мышцы – эндокард. Эндокард содержит большое количество мелких капилляров и кровеносных сосудов, обеспечивающих питание сердца, поэтому его повреждение переносится особенно тяжело.
Клиническая картина заболевания
Типичная ишемия всего миокарда складывается из следующих проявлений: давящая, жгучая боль за грудиной с иррадиацией в челюсть, лопатку или плечо; ощущение нехватки воздуха и одышка, слабость, холодный пот и бледность кожных покровов.
Боль сопровождается страхом смерти и проходит в течение 15-20 минут после приема нитроглицерина.
При брюшной форме заболевание начинается с тошноты и рвоты, возможно появление диареи и болей в животе.
Через несколько минут к этим неприятным ощущениям добавляется боль в груди, учащённое дыхание и сердцебиение. Симптомы проходят через несколько минут после приёма нитросодержащих лекарственных препаратов.
Если заболевание манифестирует в форме астматического приступа, существует высокая вероятность перепутать ишемию миокарда с приступом удушья. При астматической форме изначально развивается резкая нехватка воздуха, сопровождающаяся болью в грудной клетке, нарушением потоотделения и бледностью кожи.
Через некоторое время неприятные ощущения в груди проходят, и остаётся лишь нарушение дыхания. Самая тяжёлая форма для диагностики – без болевая ишемия миокарда. Она протекает практически бессимптомно для пациента, оставляя некротические изменения в поражённых сосудах.
Для без болевой формы наиболее характерно появление инфаркта миокарда в финале заболевания.
Цереброваскулярная форма протекает по типу острого нарушения мозгового кровообращения и характеризуется потерей сознания, нарушениями спинномозговых рефлексов, утратой способности к чтению и письму на короткий промежуток времени.
После окончания приступа пациента могут беспокоить следующие симптомы: головокружения, головная боль, тошнота и слабость.
Периферическая форма ишемии начинается с болей в руках или ногах, постепенно переходящих на область сердца.
Конечности становятся холодными и бледными, мокрыми на ощупь. Учащается пульс, частота дыхательных движений постепенно увеличивается. Симптомы поражения сердечно-сосудистой системы добавляются через несколько часов.
Диагностические мероприятия
Для диагностики данного заболевания используется множество достоверных лабораторных и инструментальных методик. В большинстве больниц используется первичный врачебный осмотр и опрос пациента, которые позволяют заподозрить ишемические изменения в сердце, выявить специфические симптомы и симптоматические комплексы.
При прослушивании грудной клетки больного можно выявить нарушения ритма и проводимости, свидетельствующие о протекающем в организме патологическом процессе.
Для подтверждения диагноза используют следующие лабораторные методы:
- общий анализ мочи и крови с определением количества тромбоцитов позволяют судить о нарушениях в системе кроветворения и патологии костного мозга;
- биохимические анализы предоставляют сведения об основных маркёрах некроза миокарда: тропонинах, миоглобине, фракции креатинфосфокиназы. Также нужно измерить основные показатели печени и пронаблюдать их в динамике;
- коагулограмма и гемостазиограмма используются для определения времени свертывания крови и диагностики нарушений в системе свёртывания крови.
Из инструментальных методов наибольшее распространение получило электрокардиографическое исследование сердца. ЭКГ снимается в момент приступа, с участием нагрузочных проб (фармакологические пробы, холодовая и тепловая пробы, стресс-тест, чрез пищеводная стимуляция желудочков, велоэргометрия), а также большой информативностью обладает суточное ЭКГ-мониторирование, иначе называемое Холтеровским.
Ишемия миокарда на ЭКГ проявляется подъемом сегмента ST выше изолинии.
Рентгенографическое исследование грудной клетки в обеих проекциях позволяет выявить увеличение размера желудочков, что свидетельствует о функциональной перегрузке тех или иных отделов сердца. Также можно увидеть изменения со стороны аорты: этот сосуд наиболее подвержен изменениям.
На фонокардиографии можно увидеть изменение тонов сердца, появление патологических шумов, обозначающих нарушение ритма и проводимости, а также свидетельствующих о пороках сердца.
Эхокардиограмма сердца или УЗИ позволяют увидеть размеры полостей сердца, толщинку стенок, определить место и характер расположения некроза, патологические изменения миокарда.
Является высокочувствительным методом исследования, который позволяет минимизировать риск постановки неправильного диагноза при этих исходных данных.
Лечение ишемии миокарда
Ишемическая болезнь сердца – тяжелое мультифакториальное заболевание, которое требует комплексного подхода к лечению и профилактике дальнейших осложнений. Первым и самым важным этапом должно стать изменение образа жизни и отказ от вредных привычек.
Необходимо строго соблюдать режим труда и отдыха, избегать ненужных стрессовых ситуаций, а также регулярно применять дозированные физические нагрузки с целью оздоровления организма в целом.
Ходьба быстрым шагом до нескольких километров в день, занятия в спортивном зале или на спортивной площадке, посещение бассейна или лечебной гимнастики снижают риск повторения эпизода ишемии практически вдвое.
Изменение привычного питания является важным этапом на пути к здоровому сердцу.
Прежде всего, следует отказаться от жирной и жареной пищи с большим количеством соли и специй, избегать фастфуда, газированных и алкогольных напитков, пакетированных соков и консервантов. Следует добавить в ежедневный рацион овощи и фрукты, свежие ягоды и зелень, употреблять больше круп.
Сливочное масло необходимо заменить растительным, майонез – нежирной сметаной, а вместо сахара использовать мёд. Правильное питание снизит риск развития сердечно-сосуд
Анатомия коллатерального кровообращения спинного мозга — Грипп
Травма спинного мозга остается серьезным осложнением
лечение обширных аневризм торакоабдоминальной аорты
(TAAA), будь то открытая операция или эндоваскулярная
стратегии. Хотя частота и характер возникновения
травм спинного мозга в последние годы меняются,
сохраняется угроза возможной параплегии или парапареза
удерживать пациентов от плановых операций
предотвратить разрыв обширного TAAA.Лучшее понимание
анатомии и физиологии кровообращения спинного мозга
в последние годы привели к снижению риска
послеоперационная ишемия спинного мозга; дальнейшее понимание должно
скоро позволит нам сделать послеоперационную параплегию и
парапарез — очень редкое осложнение лечения ТААА.
Ряд клинических и экспериментальных данных
заставили нас усомниться в традиционном представлении о том, что позвоночник
перфузия пуповины зависит главным образом от одного
видная ветвь от нисходящей аорты с
характерная конфигурация шпильки, так называемая артерия
Адамкевича (1).Мы предложили вместо этого существование
разветвленной коллатеральной сети, поддерживающей спинной
перфузия пуповины. Эта залоговая сеть включает в себя все
сегментарные артерии (СА), как межреберные, так и поясничные: они
направляют ветви к передней спинномозговой артерии (ASA), основной
артерия внутри позвоночного канала. Помимо нескольких SA
входов, ASA также потенциально получает питание от обширных
эпидуральной артериальной сети и плотным массивом мелких
сосуды, снабжающие параспинальную мускулатуру.Все эти
сосуды соединены между собой и имеют большие анастомозы
подключичными артериями краниально и подчревной
артерии каудально. Эта обширная залоговая сеть позволяет
компенсаторный поток в спинной мозг, когда некоторые из
прямые входы в ASA нарушаются во время ремонта
TAAA.
Наблюдение, что травма спинного мозга чаще встречается
часто в TAAA большой степени — тип II в
Классификация Кроуфорда — документально подтверждена более чем
20 лет назад (2).Совсем недавно мы и другие отметили, что
когда такие обширные резекции выполняются в два этапа
а не во время одной процедуры, риск спинномозговой
травма пуповины резко снижается, Рисунок 1 (3,4). Несмотря на то что
в нашем ретроспективном исследовании двухэтапные процедуры были
продиктовано различными обстоятельствами эволюции
болезнь каждого пациента, мы рассудили, что защита
из-за травмы спинного мозга, в результате которой каждый случай вероятен
отражала аналогичную физиологическую адаптацию побочным
сеть к потере входа SA.Мы провели
серия исследований, которые начали проливать свет на этот процесс
за счет чего полное восстановление перфузии спинного мозга после
обычно достигается обширная жертва СА, и для объяснения
механизмы случайного возникновения спинного мозга
Травма после обширной резекции TAAA.
Рисунок 1 Масштабы жертвоприношения сегментарной артерии в серии клинических операций по восстановлению торакоабдоминальной аневризмы. Каждый пациент представлен
один столбик, указывающий на степень резекции аневризмы.Пациентам с ремонтом в два этапа указывается объем первого ремонта.
желтым. Среди одноэтапных ремонтов операции, выполняемые с использованием гипотермической остановки кровообращения, отличаются от тех, которые выполняются с использованием левой
шунтирование сердца. Пациенты, перенесшие параплегию или парапарез, обозначены звездочками. Этот рисунок изменен из ссылки (3)
Первая серия опытов на свиньях в отношении
кровообращение спинного мозга продемонстрировало, что подключичная
и срединные крестцовые артерии (эквивалент гипогастральной
артерии человека) являются важными компонентами
залоговая сеть.Если подключичная артерия или срединная
крестцовые артерии удаляются как входы в коллатеральные
сети, меньшим количеством SA можно пожертвовать во время моделирования TAAA
резекция без ишемии спинного мозга [под моторным
вызванные потенциалы (MEP)], как показано на Рисунок 2 . В родном
свинья, может быть до 13 пар межреберных и поясничных артерий.
принесены в жертву без какого-либо воздействия, но меньшее количество может быть устранено
без потери MEP, если ранее была подключичная артерия
жертвоприношения, и еще меньше — после жертвоприношения срединной крестцовой артерии (5).
Рисунок 2 Показаны исследования при различных обстоятельствах среднего числа сегментарных артерий — межреберных или поясничных, — которые можно было бы последовательно пережать, не вызывая ишемического изменения в двигательных вызванных потенциальных сигналах у молодых свиней. В ранее не затронутом контроле можно безопасно пережать большее количество сегментарных артерий, чем после пережатия подключичной артерии или после пережатия средней крестцовой артерии. Этот рисунок изменен из ссылки (5)
Важность общей степени жертвенности СА как
основной предиктор риска последующей параплегии
подтверждено в двух клинических исследованиях.В первоначальном исследовании на
время, когда мало интраоперационных мероприятий по укреплению позвоночника
защита пуповины была обычным делом, параплегия наблюдалась очень редко
наблюдается, если во время резекции TAAA было забито менее 11 сегментарных артерий, Рисунок 3 (6). До настоящего времени
день, на основе 609 пациентов, самый высокий риск параплегии
возникает, когда приносится в жертву более 13 SA. когда
вовлечено от 8 до 12 СА, риск поражения спинного мозга
травмы зависят от их местоположения, с наибольшим
уязвимость, возникающая с нижнегрудным и поясничным SA
жертвоприношение ( Рисунок 4 ) (7).
Рисунок 3 Сравнение заболеваемости параплегией до (в
138 пациентов) и после (у 95 пациентов) различных добавок для увеличения
Обычно применялась защита спинного мозга. меньше случаев
параплегия наблюдалась при использовании вспомогательных средств, но в обоих случаях
групп, повреждение спинного мозга зависело от количества сегментарных
артерии принесены в жертву. Когда было менее 11 сегментарных артерий
приносят в жертву в присутствии добавок для защиты спинного мозга,
травм спинного мозга не произошло.Эта цифра изменена из
ссылка (6)
Рисунок 4 Предлагаемая схема классификации риска параплегии, основанная на протяженности и расположении резекции сегментарной артерии (СА) во время восстановления грудной и торакоабдоминальной аневризмы. Для ограниченных резекций, особенно в верхних грудных сегментах, риск довольно низок, но он резко возрастает, когда жертвуют более 8 СА, особенно в нижнегрудной и поясничной областях. На диаграммах представлена степень резекции аневризм в каждой группе.Частота ишемического повреждения спинного мозга составила 1,2% в группе A, 3,7% в группе B, 15% в группе C и 12% в группе D. Этот показатель модифицирован из справочного материала (7).
Измерение давления в коллатеральной сети — по
средство катетера в культе разделенной СА — позволяет
оценка динамического отклика циркуляции
в жертву SA. Давление в залоговой сети 60-80%.
среднего артериального давления (САД) на исходном уровне и падает после
обширное жертвоприношение SA, достигшее своего надира примерно через 5 часов,
во время пробуждения от наркоза.Постепенное восстановление
побочное давление в сети начинается в течение первых 24 часов.
В экспериментах, показанных на рис. 5 , вернитесь к исходному уровню.
давление неизменно наблюдалось между 72 и 120 часами после
полное жертвоприношение SA, даже у свиней, которые показали функциональные
свидетельство травмы спинного мозга (8).
Рисунок 5 Когда давление контролируется в культе сегментарной артерии (СА) после умерщвления всех СА, давление коллатеральной сети (CNP) сначала падает, достигает своего минимального значения примерно через 5 часов после умерщвления СА и надежно восстанавливается между 72 от часов до 5 дней даже у свиней, у которых впоследствии появляются признаки функционального повреждения спинного мозга (8)
Интраоперационное клиническое измерение коллатералей
сетевое давление также было возможно у нескольких пациентов,
Рисунок 6 (9).Эти клинические записи показывают, что, как в
свинья, базовое давление в боковой сети меньше
исходная карта. Перфузионное давление в коллатеральной сети падает после умерщвления СА и остается довольно низким.
до тех пор, пока пульсирующая перфузия не восстановится после отмены
искусственного кровообращения. В частности, перфузионное давление
в залоговой сети остается довольно низким, несмотря на то, что
обычно считается эффективным частичным обходным анастомозом левых отделов сердца.
Самое низкое давление, продемонстрированное у нескольких пациентов
давление на боковую сеть которых отслеживалось для
Через 24 часа после операции, как у свиньи, во время
согревание и пробуждение от анестезии, несколько часов
после завершения SA жертвоприношение.Это может объяснить недавний
клиническая тенденция к преобладанию отсроченных, скорее,
чем немедленная параплегия.
Рисунок 6 Интраоперационное давление коллатеральной сети, которое, как считается, примерно эквивалентно давлению перфузии спинного мозга (SCPP), также можно контролировать клинически у пациентов, перенесших резекцию аневризм грудной и торакоабдоминальной аорты. Как и у свиней, SCPP изначально ниже среднего MAP на исходном уровне и падает при умерщвлении сегментарной артерии (SA); SCPP очень низкий при отсутствии пульсирующей перфузии, включая интервал обходного анастомоза левых отделов сердца.Частичное выздоровление наблюдается в течение первых 72 часов после операции (не показано) (9). CPB = искусственное кровообращение; DHAC = глубокая гипотермическая остановка кровообращения; DP = дистальная перфузия; LBCA = остановка кровообращения в нижней части тела; SCP = избирательная церебральная перфузия
Задокументировать и, возможно, объяснить эти физиологические
наблюдения, мы провели серию анатомических исследований
залоговой сети (10). В начальных исследованиях
смесь метилметакрилата вводили в физиологический
давление в кровообращение молоди свиней в аборигенной
состояние, а впоследствии и у других свиней после принесения в жертву всех
межреберные и поясничные СА.Переваривание окружающих
ткань раскрыла слепок обширной сети взаимосвязанных
мелкие артерии и артериолы, окружающие спинной мозг:
Матрица сосудов соединяет относительно скромный спинной мозг
контур перфузии с гораздо более обширной сетью
сосуды, снабжающие параспинальные мышцы, На рисунках 7 и 8
соединительные сосуды в позвоночном канале, которые
обеспечить преемственность между спинномозговой и экстраспинальной
цепей, а также наличие как продольных, так и поперечных
взаимосвязи.По этой картинке можно представить
как потерю нескольких SA можно компенсировать потоком через
альтернативные маршруты в этой богатой анастомотической сети.
Рисунок 7 Перфузия спинного мозга зависит от сосудистой
сеть, которая также обеспечивает приток параспинальных мышц, чьи
требует, чтобы приток к спинному мозгу уменьшился. С этой точки зрения аорта
видно, как выделяются парные сегментарные артерии, которые проходят вокруг
тело позвонка для питания параспинальных мышц и, по средней линии,
малая передняя спинномозговая артерия
Рисунок 8 На этом продольном разрезе скребка после инъекции
метилметакрилат, ASA, с его множественными соединениями
с обширной сосудистой сетью параспинальных мышц, прилегающих к
спинной мозг
Идеализированная реконструкция деталей
структура перфузионной сети спинного мозга может быть
видно на Рисунок 9 (10).Есть несколько входов в
ASA из аорты через SA, а также соединения с
разветвленная эпидуральная сеть сосудов, в которых
сегментарные эпидуральные аркады, которые питаются ASA
периодически через радикуломедуллярные артерии (АРМА).
Рис. 9 Схематическая реконструкция кровоснабжения спинного мозга. Множественные входы в переднюю спинномозговую артерию и богатые
матрица продольных и латеральных взаимосвязей между спинномозговой и эпидуральной системами показаны
Анатомические исследования изменений кровообращения после
обширное жертвоприношение SA у свиньи выявило увеличение
ASA в течение 24 часов и более обширное расширение
различных компонентов спинномозгового кровообращения
5 дней (11).Усовершенствование техники инъекции позволяет
визуализация коллатеральной сети на месте с помощью КТ
сканирование с использованием рентгеноконтрастной вязкой смеси бария и латекса вместо акрила, чтобы очертить даже небольшие сосуды внутри
залоговая сеть (12). На рис. 10 лигированные SA являются
видно, заполнены ретроградно к рентгеноконтрастным зажимам: плотность
коллатеральная сосудистая сеть через 5 дней после умерщвления СА явно
больше, чем на прилагаемом изображении от местной свиньи
с неповрежденными СА.Эти исследования вместе взятые подтверждают
расширение и распространение залоговой сети
в течение 5 дней в ответ на жертву СА. Наличие
большее количество судов и увеличенная вместимость внутри
залоговая сеть объясняет надежный возврат
стабильное побочное давление в сети через 5 дней после обширной СА
жертва.
Рис. 10 Компьютерная томография сагиттального среза молоди свиньи, введенной смесью бария и латекса, показывает нормальное распределение сосудов в
коллатеральная сеть, окружающая спинной мозг, а затем увеличенное количество и плотность этих сосудов у свиньи через 120 часов после
обрыв всех сегментарных артерий
Более интригующе, чем расширение и распространение
сосудов представляет собой серию наблюдений, сделанных путем сканирования
электронная микроскопия исходного метилметакрилата
слепки.Эти изображения показывают постепенную переориентацию
пролиферирующие сосуды после обширного жертвоприношения СА: от
случайная ориентационная характеристика родного состояния на
конфигурация с сосудами, более параллельными позвоночнику
ось, Рисунок 11 (11). Мы предполагаем, что эта переориентация
облегчает поток от краниальных и каудальных входов в
срединно-грудной отдел кровообращения спинного мозга, который
область, наиболее серьезно лишенная прямого кровоснабжения
в результате жертвы СА.Мы ожидаем, что в дальнейшем
усовершенствования методов визуализации в конечном итоге позволят
оценка и мониторинг кровообращения спинного мозга в
пациенты до и после умерщвления СА.
Рисунок 11 Показано изменение ориентации мелких артериальных сосудов параостистых мышц в течение 5 дней после полного умерщвления всех межреберных и поясничных сегментарных артерий (SA) у свиньи. Микрофотография, полученная с помощью сканирующего электронного микроскопа (вверху), иллюстрирует более параллельную ориентацию сосудов после умерщвления SA, которая, очевидно, отличается от случайного расположения у нативной свиньи (ниже).График отражает количественную оценку этих изменений ориентации сосудов. Этот рисунок изменен из ссылки (11).
Механизмы, провоцирующие анатомические изменения
которые возникают в сети залога после обширных
Жертва SA еще предстоит выяснить. Вполне вероятно, что там
является вазодилатацией причиной раннего увеличения ASA,
вероятно, в ответ на легкую ишемию. Последующие
распространение мелких сосудов, по-видимому, связано с генерацией
новых сосудов — ангиогенез — а также трансформация
из меньших артериальных каналов в более крупные с помощью
артериогенеза.Ясно, что понимание того, как это
процесс стимулируется и контролируется может допускать манипуляции
для увеличения ответа до аневризмы
процедуры, и, таким образом, уменьшить вероятность последующего
ишемия спинного мозга с нарушением функции.
Тем временем знание анатомии и физиологии
кровообращения спинного мозга может помочь
временной ход поэтапных вмешательств, а также продолжительность и
характер мероприятий по улучшению защиты спинного мозга.В
уязвимость спинного мозга во время первых
через несколько дней после обширного жертвоприношения SA — до наблюдаемых
произошла адаптация в залоговой сети —
требует бдительности, чтобы избежать гиповолемии, гипертермии,
высокое венозное давление и другие угрозы, которые могут расстроить
временно неустойчивый баланс между кровью спинного мозга
спрос и предложение, которые преобладают после жертвы SA. однажды
анатомическая адаптация к пониженному сегментарному кровоснабжению, система снова вполне
надежный, и угроза послеоперационной параплегии уменьшается.
Благодарности
Описанная работа стала возможной благодаря поддержке
грант № RO1HL45636 от Национального фонда сердца, легких и
Институт крови НИЗ.
Раскрытие информации: Авторы заявляют об отсутствии конфликта интересов.
Список литературы
- Adamkiewicz A. Die Blutgefasse des Menschlichen
Рукенмаркес. Кракау, 1881. - Svennson LG, Crawford ES, Hess KR, et al.Опыт
со 1509 пациентами, перенесшими торакоабдоминальный отдел аорты
операции. J. Vasc Surg 1993; 17: 357-68; обсуждение 368-70. - Etz CD, Zoli S, Mueller CS и др. Поэтапный ремонт
значительно снижает частоту параплегии после обширных
Пластика аневризмы торакоабдоминальной аорты. J Thorac
Cardiovasc Surg 2010; 139: 1464-72. - Coselli JS, LeMaire CC, Miller ZC и др. Смертность и
параплегия после пластики торакоабдоминальной аневризмы: риск
факторный анализ.Энн Торак Сург 2000; 69: 409-14. - Strauch JT, Spielvogel D, Lauten A, et al. Важность
экстрасегментарных сосудов для кровоснабжения спинного мозга
в хронической модели свиней. Eur J Cardiothorac Surg
2003; 24: 817-24. - Грипп РБ, Эргин М.А., Галла Дж. Д. и др. Ищу
артерия Адамкевича: поиски минимизации параплегии
после операций по поводу аневризм нисходящего грудного отдела
и торакоабдоминальная аорта. J Thorac Cardiovasc Surg
1996; 112: 1202-13. - Zoli S, Roder F, Etz CD и др. Прогнозирование риска
параплегия после грудной и торакоабдоминальной аневризмы
ремонт. Ann Thorac Surg 2010; 90: 1237-44; обсуждение 1245. - Etz CD, Zoli S, Bischoff MS и др. Измерение
побочное давление в сети для минимизации риска параплегии
при резекции торакоабдоминальной аневризмы. J Thorac
Cardiovasc Surg 2010; 140: S125-30; обсуждение S142-S146. - Etz CD, Di Luozzo G, Zoli S, et al. Прямой спинной мозг
мониторинг перфузионного давления в обширном дистальном отделе аорты
лечение аневризмы.Энн Торак Сург 2009; 87: 1764-4. - Etz CD, Кари Ф.А., Мюллер С.С. и др. Залоговая сеть
концепция: переоценка анатомии спинного мозга
перфузия. J Thorac Cardiovasc Surg 2011; 141: 1020-8. - Etz CD, Кари Ф.А., Мюллер С.С. и др. Залог
сетевая концепция: ремоделирование артериального коллатераля
сеть после экспериментального жертвоприношения сегментарной артерии. J
Торакальная кардиоваскулярная хирургия 2011; 141: 1029-36. - Geisbuesch S, Schray D, Bischoff MS и др.Изображение
ремоделирование сосудов после имитации торакоабдоминального
лечение аневризмы. J Thorac Cardiovasc Surg 2012. [Epub
впереди печати].
% PDF-1.4
%
196 0 объект
>
endobj
xref
196 190
0000000016 00000 н.
0000005011 00000 н.
0000005253 00000 н.
0000005305 00000 н.
0000005347 00000 н.
0000005383 00000 п.
0000005434 00000 н.
0000005786 00000 н.
0000006442 00000 н.
0000006565 00000 н.
0000006688 00000 н.
0000006811 00000 н.
0000006934 00000 п.
0000007057 00000 н.
0000007180 00000 н.
0000007303 00000 н.
0000007426 00000 н.
0000007549 00000 н.
0000007671 00000 н.
0000007794 00000 н.
0000007917 00000 п.
0000008039 00000 п.
0000008162 00000 п.
0000008283 00000 н.
0000008406 00000 н.
0000008529 00000 н.
0000008652 00000 п.
0000008775 00000 н.
0000008889 00000 н.
0000009000 00000 н.
0000009097 00000 н.
0000009194 00000 н.
0000009291 00000 п.
0000009388 00000 п.
0000009484 00000 н.
0000009580 00000 н.
0000009676 00000 н.
0000009769 00000 н.
0000009864 00000 н.
0000009960 00000 н.
0000010056 00000 п.
0000010152 00000 п.
0000010248 00000 п.
0000010343 00000 п.
0000010439 00000 п.
0000010535 00000 п.
0000010631 00000 п.
0000010726 00000 п.
0000010822 00000 п.
0000010917 00000 п.
0000011011 00000 п.
0000011106 00000 п.
0000011611 00000 п.
0000012052 00000 п.
0000012737 00000 п.
0000012847 00000 п.
0000012955 00000 п.
0000013212 00000 п.
0000013720 00000 п.
0000014346 00000 п.
0000014603 00000 п.
0000015111 00000 п.
0000015195 00000 п.
0000015452 00000 п.
0000017863 00000 п.
0000018558 00000 п.
0000018973 00000 п.
0000019619 00000 п.
0000019877 00000 п.
0000019964 00000 п.
0000020402 00000 п.
0000020657 00000 п.
0000021129 00000 п.
0000021372 00000 п.
0000021693 00000 п.
0000021792 00000 п.
0000021906 00000 п.
0000025082 00000 п.
0000025420 00000 п.
0000029600 00000 н.
0000036506 00000 п.
0000038633 00000 п.
0000041567 00000 п.
0000042512 00000 п.
0000042554 00000 п.
0000042608 00000 п.
0000042650 00000 п.
0000042704 00000 п.
0000042746 00000 н.
0000042800 00000 п.
0000042842 00000 п.
0000042896 00000 п.
0000042938 00000 п.
0000042992 00000 п.
0000043034 00000 п.
0000043088 00000 п.
0000043130 00000 н.
0000043184 00000 п.
0000043226 00000 п.
0000043280 00000 п.
0000043322 00000 п.
0000043376 00000 п.
0000043418 00000 п.
0000043472 00000 п.
0000043514 00000 п.
0000043568 00000 п.
0000043610 00000 п.
0000043664 00000 п.
0000043706 00000 п.
0000043760 00000 п.
0000043802 00000 п.
0000043856 00000 п.
0000043898 00000 п.
0000043952 00000 п.
0000043994 00000 п.
0000044048 00000 п.
0000044090 00000 п.
0000044144 00000 п.
0000044186 00000 п.
0000044240 00000 п.
0000044282 00000 п.
0000044336 00000 п.
0000044378 00000 п.
0000044432 00000 п.
0000044481 00000 п.
0000044513 00000 п.
0000045339 00000 п.
0000045411 00000 п.
0000045582 00000 п.
0000045724 00000 п.
0000045779 00000 п.
0000045857 00000 п.
0000045912 00000 п.
0000046000 00000 н.
0000046055 00000 п.
0000046209 00000 н.
0000046320 00000 н.
0000046375 00000 п.
0000046457 00000 п.
0000046588 00000 п.
0000046682 00000 п.
0000046737 00000 п.
0000046845 00000 п.
0000046997 00000 н.
0000047110 00000 п.
0000047165 00000 п.
0000047254 00000 п.
0000047309 00000 п.
0000047406 00000 п.
0000047461 00000 п.
0000047609 00000 п. RciD> TAD / s} Ԍ: q}
Хроническая критическая ишемия конечностей: диагностика, лечение и прогноз
JAMIE D.САНТИЛЛИ, доктор медицины, и СТИВЕН М. САНТИЛЛИ, доктор медицины, доктор философии, Школа медицины Университета Миннесоты, Миннеаполис, Миннесота
Am Fam Physician. , 1 апреля 1999; 59 (7): 1899-1908.
Хроническая критическая ишемия конечностей проявляется болью в покое, длительно незаживающими ранами и гангреной. Ишемическая боль в покое обычно описывается как жгучая боль в своде стопы или дистальном отделе стопы, которая возникает, когда пациент лежит, но уменьшается, когда пациент возвращается в положение, в котором стопы зависимы.Объективные гемодинамические параметры, которые подтверждают диагноз критической ишемии конечностей, включают лодыжечно-плечевой индекс 0,4 или меньше, систолическое давление в голеностопном суставе 50 мм рт. Ст. Или меньше или систолическое давление в пальце ноги 30 мм рт. Вмешательство может включать консервативную терапию, реваскуляризацию или ампутацию. Прогрессирующая гангрена, быстро увеличивающиеся раны или постоянная ишемическая боль в покое могут указывать на угрозу конечности и указывать на необходимость реваскуляризации у пациентов без чрезмерных операционных рисков.Шунтирующие трансплантаты обычно требуются из-за многоуровневого и дистального характера сужения артерии при критической ишемии конечностей. Пациенты с диабетом чаще, чем другие пациенты, имеют заболевание дистальных отделов, которое менее поддается шунтированию. По сравнению с ампутацией, реваскуляризация более рентабельна и связана с более высокой периоперационной заболеваемостью и смертностью. Сохранение конечностей должно быть целью большинства пациентов с критической ишемией конечностей.
Атеросклероз лежит в основе большинства заболеваний периферических артерий.Суженные сосуды, которые не могут обеспечить достаточный приток крови к работающим мышцам ног, могут вызвать хромоту, которая возникает при физической нагрузке и облегчается в покое. (Обзор диагностики и лечения хромоты см. В статье Сантилли и др. В мартовском выпуске журнала American Family Physician за 1996 год.1) По мере увеличения сужения сосудов может развиться критическая ишемия конечностей, когда кровоток не прекращается. удовлетворять метаболические потребности тканей в состоянии покоя. Хотя критическая ишемия конечностей может быть следствием острого состояния, такого как эмбол или тромбоз, в большинстве случаев это прогрессирующий результат хронического состояния, чаще всего атеросклероза.
Хроническая критическая ишемия конечностей определяется не только клиническими проявлениями, но и объективным измерением нарушения кровотока. Критерии постановки диагноза включают либо один из следующих (1) периодических болей в стопах в состоянии покоя более двух недель, которые требуют регулярного приема анальгетиков и связаны с систолическим давлением в голеностопном суставе 50 мм рт. Ст. Или менее, либо систолическим давлением в пальце ноги 30. мм рт. ст. или меньше, или (2) незаживающая рана или гангрена стопы или пальцев ног с аналогичными гемодинамическими измерениями.2 Гемодинамические параметры могут быть менее надежными у пациентов с диабетом, поскольку кальцификация артериальной стенки может ухудшить сжатие манжетой для измерения кровяного давления и привести к измерению систолического давления, превышающему фактические уровни.
Факторы риска
Хроническая критическая ишемия конечностей является конечным результатом окклюзионной болезни артерий, чаще всего атеросклероза. В дополнение к атеросклерозу в сочетании с гипертонией, гиперхолестеринемией, курением сигарет и диабетом, в 3,4 раза менее частыми причинами хронической критической ишемии конечностей являются болезнь Бюргера или облитерирующий тромбангиит, а также некоторые формы артериита.5
Диабет является особенно важным фактором риска, поскольку он часто ассоциируется с тяжелым заболеванием периферических артерий. Атеросклероз развивается у больных сахарным диабетом в более молодом возрасте и быстро прогрессирует. Кроме того, у больных диабетом атеросклероз поражает более дистальные сосуды; глубокая кишка бедра, подколенная и большеберцовая артерии часто поражаются, а аорта и подвздошные артерии сужаются минимально. Эти дистальные поражения менее поддаются реваскуляризации.Атеросклероз в дистальных отделах артерий в сочетании с диабетической нейропатией способствует более высокому уровню потери конечностей у пациентов с диабетом по сравнению с пациентами без диабета. уменьшают приток крови к тканям. 7,8 Критическая ишемия тканей клинически проявляется в виде боли в состоянии покоя, незаживающих ран (из-за повышенных метаболических требований для заживления ран) или некроза тканей (гангрены).
Ишемическая боль в покое классически описывается как жгучая боль в подушечке стопы и пальцах ног, которая усиливается ночью, когда пациент лежит в постели. Боль усиливается в положении лежа из-за потери гравитационного притока к стопе. Ишемическая боль в состоянии покоя локализуется в стопе, где ткань находится дальше всего от сердца и дистальнее артериальной окклюзии.1 Пациентам с ишемической болью в состоянии покоя часто необходимо свесить ноги через край кровати или спать в кресле для восстановления силы тяжести. усиление кровотока и облегчение боли.У пациентов, которые для комфорта держат ноги в зависимом положении, часто наблюдаются значительные отеки стоп и лодыжек.
Длительно незаживающие раны обычно обнаруживаются в местах травм стопы, вызванных неправильной подгонкой обуви или травмой. Рана обычно считается незаживающей, если она не реагирует на 4–12-недельные испытания консервативной терапии, такой как регулярная смена повязок, предотвращение травм, лечение инфекции и обработка некротической ткани.
Гангрена обычно находится на пальцах ног.Он развивается, когда кровоснабжение настолько низкое, что возникает спонтанный некроз в тканях с наиболее плохой перфузией.
Диагноз
Боль в состоянии покоя иногда бывает трудно распознать у пациентов с другими хроническими болями в ногах, например, вызванными периферической невропатией. Маркировка раны как незаживающей также может быть субъективной оценкой. Однако ряд физических данных и объективных параметров гемодинамики можно использовать для подтверждения диагноза хронической критической ишемии конечностей.Типичные физические признаки включают отсутствие или ослабление пульса на педалях, блестящую гладкую кожу ступней и ног и мышечную атрофию икр.
Объективное измерение кровотока легко достигается с помощью ручного доплеровского зонда и манжеты для измерения кровяного давления.1 Манжета накачивается до тех пор, пока пульс, расположенный дистальнее манжеты, больше не перестанет слышать допплер. Затем из манжеты медленно спускается воздух, пока снова не будет обнаружен пульс. Это измерение регистрируется как систолическое давление. Как упоминалось ранее, систолическое давление в голеностопном суставе 50 мм рт.ст. или меньше или систолическое давление в пальце ноги 30 мм рт.ст. или меньше предполагает наличие критической ишемии конечности.
Еще одним широко используемым параметром является лодыжечно-плечевой индекс, который представляет собой отношение систолического давления на тыльной стороне стопы или задней большеберцовой артерии к систолическому давлению в плечевой артерии. Пациенты с хромотой обычно имеют лодыжечно-плечевой индекс от 0,5 до 0,8, в то время как пациенты с критической ишемией конечностей обычно имеют лодыжечно-плечевой индекс 0,4 или меньше. 9,10
Сосудистые лаборатории также используют доплеровские датчики для измерения формы волны пульсового объема. на сегментарных участках артерий ног.Изменение формы волны Доплера с трехфазной на двухфазную и затем на монофазную, а затем стенотические формы волны могут определить места артериальной блокады.
Дифференциальный диагноз
Ишемическую боль в покое можно спутать с ночными судорогами, артритом или диабетической невропатией. Ночные судороги возникают в икроножных мышцах; они обычно пробуждают пациента ото сна и облегчаются массажем мышц, ходьбой или применением спазмолитиков. Пациенты с артритом плюсневых костей могут испытывать боль в стопе.Эта боль часто возникает ночью, и ее можно облегчить, стоя. Отличительной особенностью артритной боли является то, что она обычно возникает периодически и через определенные промежутки времени, тогда как ишемическая боль в состоянии покоя постоянно возникает после определенного периода лежания.