Мазок на флору из ЛОР-органов в Санкт-Петербурге
directions
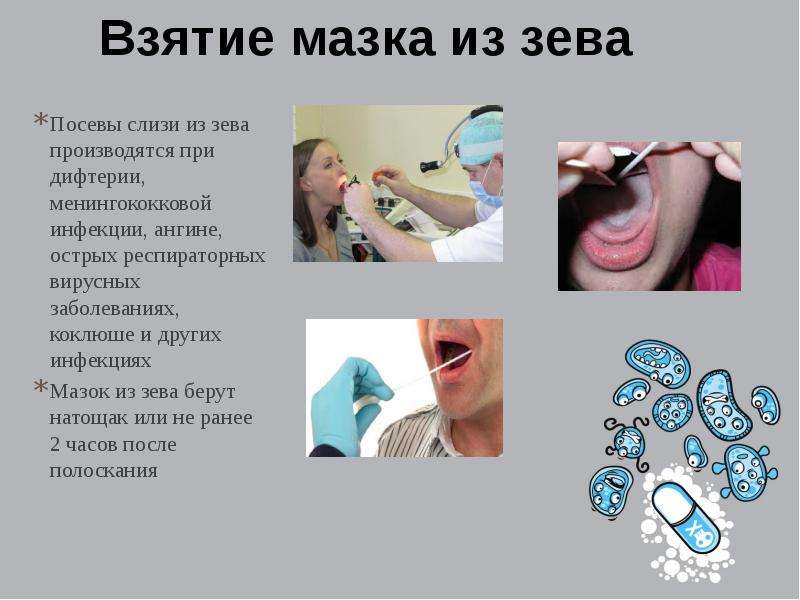
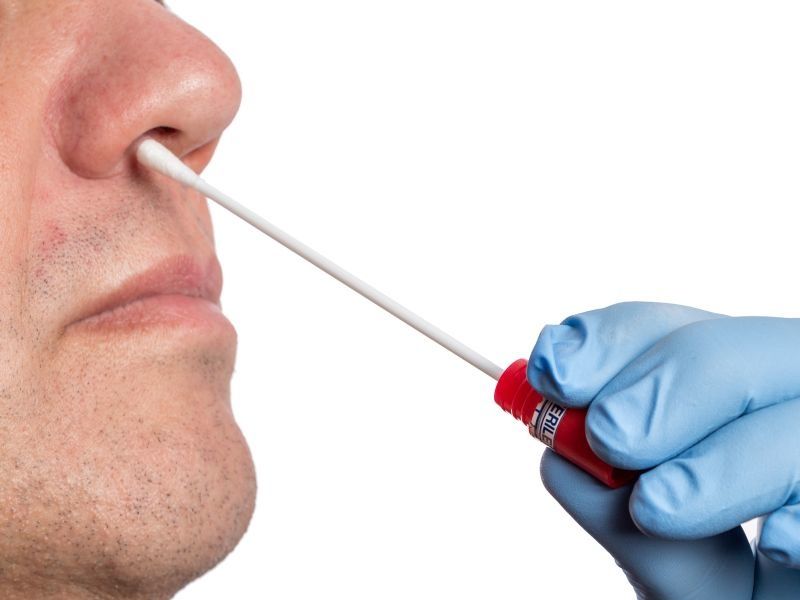
Мазок на флору из ЛОР-органов проводится при воспалительных патологиях носа, зева, уха и рецидивирующих инфекциях. В результате исследования мазка можно выявить патогенные микроорганизмы и дрожжевые грибки в слизистых оболочках придаточных пазух носа, зева, гортани, наружных слуховых проходов. После выяснения того, какие микроорганизмы вызвали заболевание, и определения чувствительности микробов к антибиотикам, назначаются определенные лекарства, которые устранят инфекцию.
Врачи-специалисты
Врач-оториноларинголог
Врач-оториноларинголог
Врач-оториноларинголог, Врач-профпатолог
Врач-оториноларинголог
Врач-оториноларинголог
В настоящее время на сайте ведутся работы по изменению прайс-листа, актуальную информацию уточняйте по тел: 640-55-25 или оставьте заявку, с Вами свяжется оператор.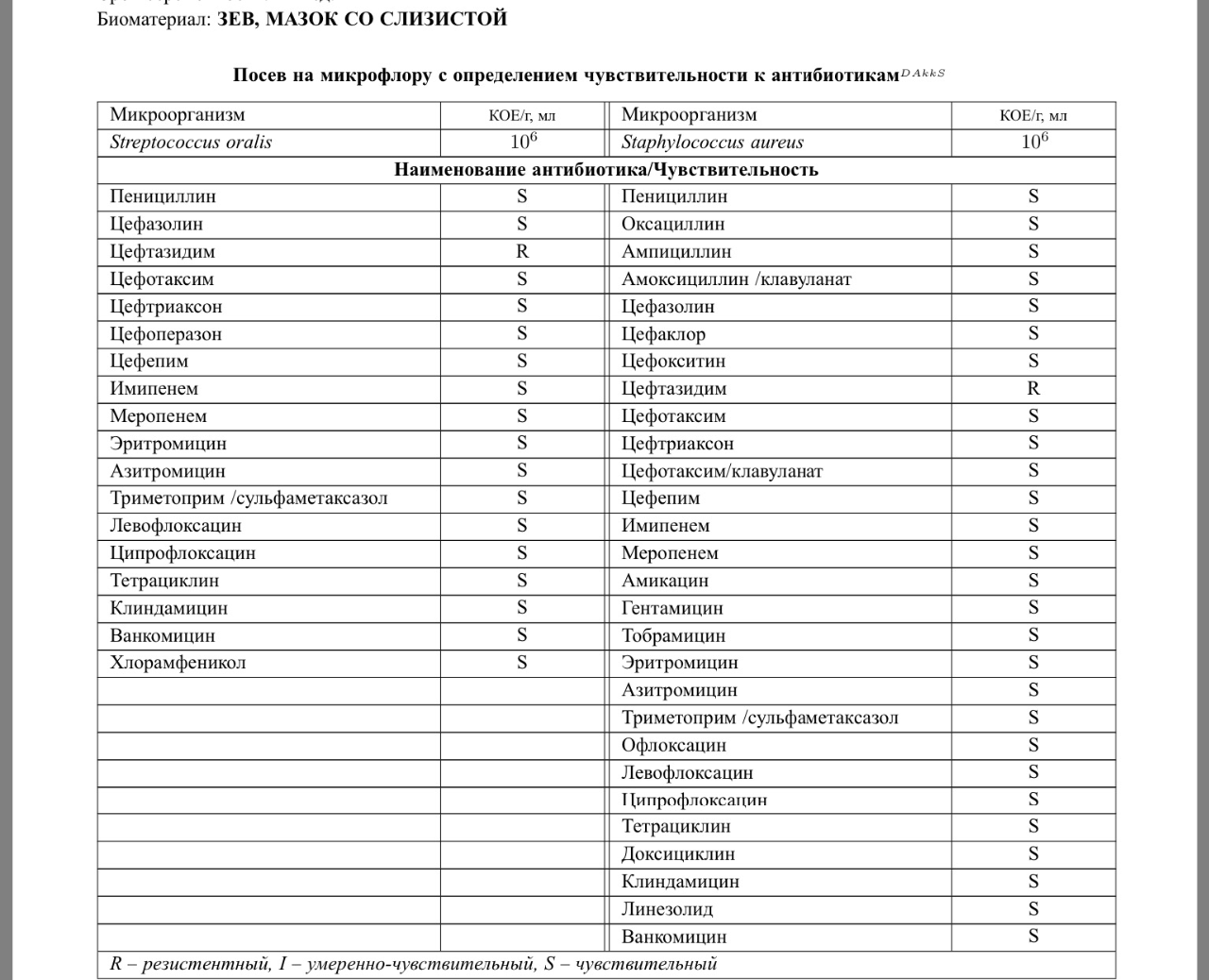
Цены на услуги
-
Получение мазков со слизистой оболочки ротоглотки
300a
-
Получение мазков со слизистой оболочки носоглотки
300a
-
Получение мазков из верхних дыхательных путей
360a
Информация и цены, представленные на сайте, являются справочными и не являются публичной офертой.
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
Мазок из ЛОР-органов берется при прохождении профкомиссий для работы, связанной с пищевой промышленностью, детьми, тяжелобольными людьми, чтобы предотвратить риск инфицирования золотистым стафилококком. Показанием для взятия мазка из ЛОР-органов является обследование беременных женщин непосредственно перед госпитализацией в роддом, позволяющее выявить микроорганизмы, которые могут осложнить течение беременности или вызвать инфекционное заболевание. У детей мазок производится перед поступлением в дошкольные коллективы, а также при хроническом тонзиллите, аденоидите, всех видах синусита. Мазок из ЛОР-органов также берется у людей, которые контактировали с больными инфекционными заболеваниями, в целях предупреждения заражения.
Показанием для взятия мазка из ЛОР-органов является обследование беременных женщин непосредственно перед госпитализацией в роддом, позволяющее выявить микроорганизмы, которые могут осложнить течение беременности или вызвать инфекционное заболевание. У детей мазок производится перед поступлением в дошкольные коллективы, а также при хроническом тонзиллите, аденоидите, всех видах синусита. Мазок из ЛОР-органов также берется у людей, которые контактировали с больными инфекционными заболеваниями, в целях предупреждения заражения.
Мазок берется стерильной палочкой со слизистой носа, глотки или наружного слухового прохода, наносится на предметное стекло и отправляется в лабораторию на исследование. Посев готовится около 10 дней, пока все микроорганизмы не вырастут на специальной питательной среде.
Взятие мазка производится и у взрослых, и у детей и дает возможность выявить и вылечить острый или хронический тонзиллит, дифтерию, гайморит, отит и др. заболевания.
832,1003,1298,1300,1274,871
Антон Иванов
21.12.2020
17:50
medi-center.ru
Огромная благодарность неврологу Соловьёву Даниилу Петровичу! Настоящий доктор, побольше бы таких докторов!
Стало плохо во время забора крови. Девушка-лаборант очень быстро и правильно отреагировала, привела в чувство, подбодрила. Приятно, когда к тебе относятся внимательно)
Жданова Анна Михайловна
25.11.2020
14:32
medi-center.ru
Хочу выразить огромную благодарность врачу терапевту Дерешовскому Александру Сергеевичу.
На 28 неделе беременности не обошла стороной и нас эта зараза под названием COVID-19. В день вызова врача пришёл Александр Сергеевич, посмотрел, послушал, взял мазки на ковид, назначил грамотное лечение. И самое главное всегда со мной был на связи, и утром , и днём, и вечером.
Зараза отступила.
Спасибо Вам, Александр Сергеевич, за Ваш труд в столь не простое для всех время.
Здоровья Вам и Вашим близким!????
Носовец Влада Витальевна
16.09.2020
09:42
medi-center.ru
Хотела бы порекомендовать и выразить благодарность Врачу хирургу Джораеву Агамурату ( охтинская аллея 18) за его профессионализм, чуткий подход к пациентам, всегда боялась хирургов, но после лечения у этого врача все перевернулось. Агамурат, если вы это читаете спасибо Вам большое.
Добры день всем, хочу выразить благодарность врачу-неврологу Братановой Ирине Валерьевне. На прием пришел с параличом лицевого нерва, левая сторона лица была практически парализована. Как оказалось, иглорефлексотерапия вполне успешно лечит такие болезни, спустя пару сеансов были заметны изменения в лучшую сторону, а на 8-9-м все пришло в норму, считаю это не только своей заслугой, но и врача :). Цены на ИРТ по району кстати довольно умеренные, а клиника на ул.Поликарпова 6 произвела хорошее впечатление.
Хочу выразить большую благодарность клинике на аллее Поликарпова 6к2, всегда вежливые, доброжелательные девушки на ресепшн. Помогли удобно состыковать время приёма врачей. А также отдельно поблагодарить замечательнейшего доктора Гиндрюк Василия Васильевича за профессионализм, заботу и внимание! Наблюдаться у него одно удовольствие!!!
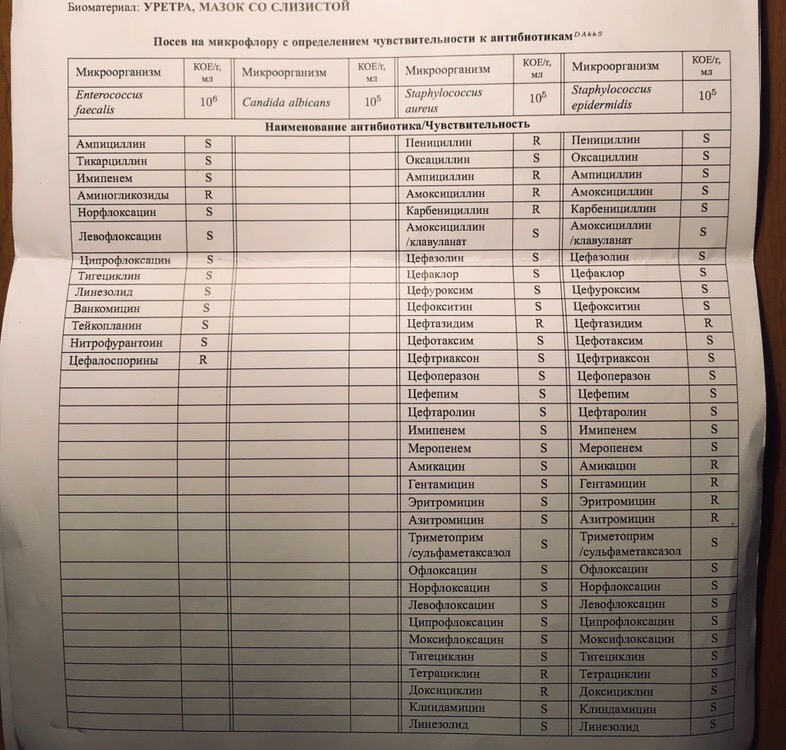
Зачем делается посев из зева и носа с определением чувствительности к антибиотикам?
Забор биоматериала из горла (зева), носа и пазух носа позволяет определить какие именно микробы и бактерии заселяют слизистую.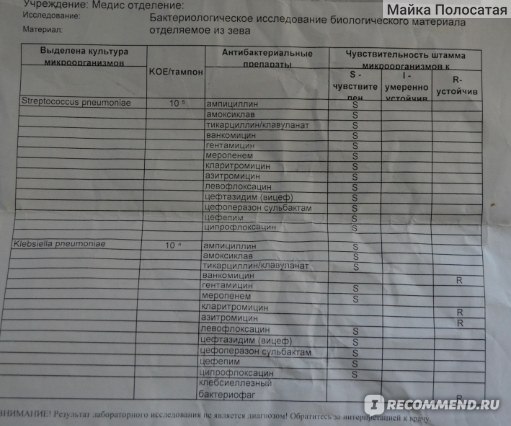 Данный анализ незаменим в ряде случаев. Во-первых, конечно же, для установления причин серьезных заболеваний ЛОР-органов. Мазок делается при заболеваниях, обусловленных бактериальной инфекцией. Это синусит, ринит, тонзиллит, эпиглотит и фарингит. Во-вторых, очень часто бактерии, развивающиеся в горле и носу, способны вызвать серьезные заболевания в других органах. Так, мазок из носа и горла — это обязательный анализ, назначаемый людям, у которых часто развиваются фурункулы. Их вызывают штаммы золотистого стафилококка, способного заселять слизистую горла и носа и распространяться из этих областей на кожу.
Данный анализ незаменим в ряде случаев. Во-первых, конечно же, для установления причин серьезных заболеваний ЛОР-органов. Мазок делается при заболеваниях, обусловленных бактериальной инфекцией. Это синусит, ринит, тонзиллит, эпиглотит и фарингит. Во-вторых, очень часто бактерии, развивающиеся в горле и носу, способны вызвать серьезные заболевания в других органах. Так, мазок из носа и горла — это обязательный анализ, назначаемый людям, у которых часто развиваются фурункулы. Их вызывают штаммы золотистого стафилококка, способного заселять слизистую горла и носа и распространяться из этих областей на кожу.
Еще одна важная задача мазка из горла и носа — определить чувствительность возбудителей инфекционных заболеваний к антибиотикам. К сожалению, все больше бактерий приобретают высокую резистентность (сопротивляемость) к антибиотикам, что делает стандартные схемы лечения неэффективными.
Посев же дает возможность понять:
- насколько в данном конкретном случае эффективны старые препараты;
- определить эффективность новых лекарств;
- в целом контролировать ситуацию с распространением проблемы антибактериальной резистентности.
Существует два основных подхода к назначению антибактериальной терапии – эмпирический и этиотропный. Рассмотрим плюсы и минусы обоих методов.
При эмпирическом назначении препаратов врач учитывает общую эпидемиологическую информацию об устойчивости бактерий на данной территории, природную чувствительность возбудителя, а также данные о его резистентности. Этот метод позволяет оперативно начать противомикробную терапию.
При этиотропном назначении терапия проводится лишь после анализов — идентификации возбудителя и определения его чувствительности к антибиотикам. То есть лечение начинается не столь оперативно как при эмпирическом назначении, зато существенно повышается его эффективность.
Сама процедура не требует особой подготовки. Забор биоматериала производится натощак. Либо же через 2 часа после последнего приема пищи. За два дня перед процедурой запрещено пользоваться противомикробными спреями, мазями для носа, средствами для полоскания. Миндалины запрещено обрабатывать раствором Люголя. Более того, для того, чтобы повысить результативность процедуры, не рекомендуют предварительно даже чистить зубы и полоскать рот.
Либо же через 2 часа после последнего приема пищи. За два дня перед процедурой запрещено пользоваться противомикробными спреями, мазями для носа, средствами для полоскания. Миндалины запрещено обрабатывать раствором Люголя. Более того, для того, чтобы повысить результативность процедуры, не рекомендуют предварительно даже чистить зубы и полоскать рот.
При взятии мазка из зева важно следить, чтобы стерильный тампон, которым проводят забор, не коснулся языка и губ. Для этого необходимо широко раскрыть рот, а специалист, производящий забор, прижмет язык шпателем. Мазок берется только из глотки, с обеих миндалин. Если на миндалинах присутствуют видимые налеты, то соскоб берется в первую очередь с воспаленной области.
В Запорожье посев из зева и носа с определением чувствительности к антибиотикам проводят в медицинском центре «Юнимед». На базе филиалов центра (Ореховское шоссе, 10 и проспект Маяковского, 11) работают пункты забора биоматериалов. Лаборатории, с которыми сотрудничает центр, располагают самым современным оборудованием, что позволяет исключить влияние внешних условий и человеческого фактора на процесс исследования, а значит и максимизировать точность результатов анализов.
Консультации по телефонам: +38 (061) 220-10-72, +38 (066) 181-34-34, +38 (097) 181-34-34
Профилактика ЛОР заболеваний у часто болеющих пациентов
Профилактика ЛОР заболеваний у часто болеющих пациентов
Климат Санкт-Петербурга и плохая экологическая обстановка большого города создает благоприятный фон для развития заболеваний ЛОР органов. Гаймориты, риниты, фарингиты, ларингиты, отиты — часто встречающиеся проблемы у детей и взрослых.
ЛОР отделение Медицинского центра «XXI век» проводит диагностику, лечение и профилактику различных заболеваний ЛОР органов. Проводится выявление причин частой заболеваемости и подбор консервативной терапии (при выявлении очагов хронической инфекции – их санация).
Проведенные в рамках программ физиотерапевтические процедуры и санация очагов инфекции повышают защитные функции слизистой, улучшают работоспособность всех ЛОР органов, что способствует значительному снижению заболеваемости ОРВИ.
Специалистами нашего ЛОР отделения разработаны программы для часто болеющих пациентов. Каждая программа составляется индивидуально, диагностика, виды и количество процедур назначаются врачом в зависимости от характера проблемы, причин и тяжести состояния. Ниже приведены медицинские услуги, являющиеся основными составляющими этих программ:
Консультация отоларинголога.
Консультация зав.отделением, к.м.н, ведущего специалиста.
Мазок (посев) на флору и чувствительность к антибиотикам из зева (в рамках амбулаторного приема. Посев на флору и чувствительность к антибиотикам (готовится не менее 7 дней) позволяет выделить патогенные микроорганизмы и назначить специфическое лечение.
УЗИ пазух носа.
Клинический анализ крови. Анализ крови на скрытые инфекции (вирус Эпштейн-Барра, герпес, циталомегавирус, хламидии, микоплазму).
Риноцитограмма.
Физиотерапия – в зависимости от причин и индивидуальных особенностей могут быть назначены: промывания миндалин, промывания с аппаратом Тонзиллор, КУФ, лазеротерапия, фонофорез, перемещения по Проетцу. Обычно курс лечения составляет от 5 до 10 процедур.
Повторная консультация по результатам лечения, с рекомендациями и подбором медикаментозного, иммуностимулирующего и профилактического лечения. Консультация зав. отделением, к.м.н, ведущего специалиста.
По показаниям может быть назначена рентгенография или компьютерная томография придаточных пазух носа.
вернуться назад
Взятие мазка из зева, носа, уха в клинике Ланцетъ
Мазок и соскоб слизистой – это лабораторное исследование, которое позволяется определить состав микрофлоры слизистой определенного органа. В практике отоларинголога взятие мазка и соскоба со слизистой проводят из нескольких мест: зев, нос, уши. Мазок или соскоб берутся для дальнейшего изучения материала под микроскопом или для посева на питательную среду. Процедура является абсолютно безболезненной, но при этом позволяет врачу поставить точный диагноз.
В практике отоларинголога взятие мазка и соскоба со слизистой проводят из нескольких мест: зев, нос, уши. Мазок или соскоб берутся для дальнейшего изучения материала под микроскопом или для посева на питательную среду. Процедура является абсолютно безболезненной, но при этом позволяет врачу поставить точный диагноз.
В клинике Ланцет диагностические процедуры выполняют на самом современном оборудовании, а команда врачей с высшей категорией поможет установить верный диагноз и назначить необходимое лечение.
Хронические воспалительные поражения верхних дыхательных путей.
Острая ангина.
Хронический и постоянно рецидивирующий тонзиллит.
Гнойные риниты, синуситы.
Воспалительные заболевания ушей (отит).
Подозрение на онкологическое образование.
Противопоказаний у данной процедуры нет, она может быть выполнена ребенку с первых дней жизни или беременной женщине на любом сроке.
Перед проведением процедуры пациент должен пройти несложную подготовку. За 2-3 часа до исследования желательно отказаться от приема пищи, питья воды, нельзя использовать антисептические спреи и другие лекарственные препараты. Стоит отметить, что наиболее информативны мазки со слизистой в том случае, если еще не началась антибактериальная терапия, в противном случае результаты могут быть ложноотрицательными. Если врач хочет провести контрольное обследование после курса лечения, то взятие мазка необходимо проводить не ранее, чем через трое суток от последнего принятия антибактериального препарата.
Для проведения исследования пациента усаживают на стул. Для взятия мазка из зева просят широко раскрыть рот; из носа – наклонить голову назад; из ушей – поворачивают голову пациента в бок и немного потянув за ушную раковину по направлению к макушке, выпрямляют наружный слуховой проход. Взятие мазка проводят при помощи стерильного ватного тампона, намотанного на длинную ручку. Сразу же после взятия мазка ватный тампон помещают в транспортную среду, в которой и будут осуществлять передачу материала в лабораторию. Чем быстрее будет осуществлена эта передача, тем достовернее получатся результаты исследования.
Взятие мазка проводят при помощи стерильного ватного тампона, намотанного на длинную ручку. Сразу же после взятия мазка ватный тампон помещают в транспортную среду, в которой и будут осуществлять передачу материала в лабораторию. Чем быстрее будет осуществлена эта передача, тем достовернее получатся результаты исследования.
В дальнейшем мазок или соскоб будет тщательным образом исследован под микроскопом (для определения клеточного состава слизистых), а также произведут посев на питательные среды, что поможет точно установить патологический микроорганизм, который вызвал заболевание и его чувствительность к основным группам антибиотиков. Этот метод диагностики является залогом рациональной терапии, которая поможет побороть болезнь при минимальном воздействии на весь организм в целом.
В диагностическом центре Ланцет работают специалисты с высшей категорией, а также в наличии имеется передовое оборудование, которое применяется для диагностики и лечения наших пациентов. Данное сочетание является залогом успешного выздоровления.
Мазок из зева и носа на флору в ОН КЛИНИК Рязань, цена
Одним из наиболее распространенных видов лабораторного исследования является мазок из зева и носа на флору. Именно таким образом можно выявить возбудителей различных заболеваний, которые сопровождаются воспалением слизистой этих органов. Различают несколько разновидностей такого исследования:
- если пациент часто болеет насморком или страдает от постоянно рецидивирующих болезней горла, то доктор направляет его сдать мазок на флору из зева и носа;
- если врач подозревает у пациента коклюш или дифтерию, то забор мазка производится с поверхности миндалин, а также с задней стенки зева.
Для чего же нужно это исследование? Оно не только позволяет выявить конкретную разновидность болезнетворных микроорганизмов, атакующих нос и горло пациента, но еще и необходимо для того, чтобы определить их чувствительность к антибиотикам.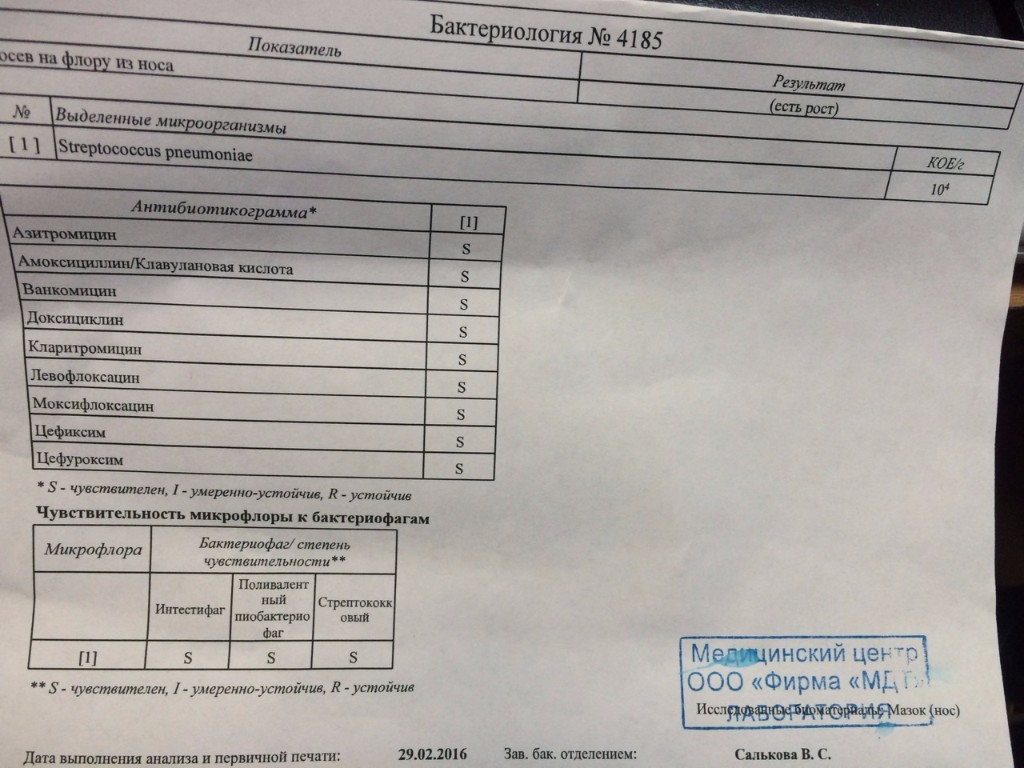 В конечном итоге это позволяет назначить максимально эффективное лечение болезни и предотвратить ее рецидивирование.
В конечном итоге это позволяет назначить максимально эффективное лечение болезни и предотвратить ее рецидивирование.
В каких случаях пациента могут направить сдать мазок из зева и носа на флору?
Врач-терапевт или отоларинголог может назначить данное исследование следующим пациентам:
- тем, у кого подозревают наличие дифтерии – в этом случае забор анализа производится ежедневно на протяжении трех дней;
- пациентам, страдающим от ангины, при которой в горле появляется налет. У них мазок из зева на флору берут однократно;
- людям, имевшим непосредственный контакт с инфекционным больным;
- тем, у кого на фоне инфекции развивается мононуклеоз, назначается однократный забор мазка из зева на флору;
- лицам с диагностированным туберкулезом, а также выявленным поражением ЦНС;
- детям – перед их поступлением в дошкольное или общеобразовательное учреждение.
Технология забора мазка из зева и носа на флору
Мазок берут при помощи валика из стерильной марли, который накручивают на стерильную же металлическую палочку. Для того, чтобы обеспечить максимальную достоверность его результатов, в день забора анализов не рекомендуется завтракать и чистить зубы. За неделю до даты забора биоматериала необходимо прекратить прием антибиотикосодержащих фармпрепаратов.
После того, как мазок получен, его содержимое наносят на квадрат из стерильного стекла. Немного подсушенный биоматериал направляют для исследования в лабораторию.
В «ОН КЛИНИК в Рязани» есть собственная лаборатория. Это делает возможным сдать все необходимые анализы централизованно в одном месте в течение одного-двух дней. Быстрые и точные результаты исследований – то, что нужно для того, чтобы назначить эффективное лечение выявленного заболевания и незамедлительно его начать!
Полученный в результате забора мазка из зева и носа на флору материал обычно отправляется на такие исследования, как:
- антигенный экспресс-тест, который делается в течение получаса и позволяет выявить стрептококк группы А;
- бакпосев, который необходим для того, чтобы определить возбудителя заболевания, а также помогает определить чувствительность болезнетворных микроорганизмов к антибиотикам;
- ПЦР-диагностика – необходима для определения вида составляющих микрофлору носа и глотки микроорганизмов путем исследования их ДНК.

Вас интересует цена мазка из зева в Рязани в нашей частной клинике? Позвоните нам и запишитесь на прием!
Посев на флору | Сдать бак-посев на флору в лаборатории KDLmed в Пятигорске
Существует универсальный анализ — посев на флору, благодаря которому удается определить главные характеристики аэробных организмов, находящихся в питательных средах. Таким же путем можно выявить восприимчивость к антибактериальным препаратам.
В проведении исследований используется любой биологический материал, с помощью которого находят неспецифические инфекционные болезни, возбудителей хронических инфекционных состояний, после чего происходит назначение соответствующих средств для осуществления эффективной терапии.
Исследование зева и носа
• Пневмококки.
• Стрептококки.
• Стафилококки.
• Гемолитические стрептококки.
Поражение слизистой оболочки перечисленными выше микроорганизмами приводит к возникновению синусита, ринита, фарингита и прочих болезней. Своевременно проведенный анализ на флору и чувствительность дает возможность идентифицировать возбудителя и диагностировать заболевание, после чего назначить адекватное лечение на основании полученных результатов. В итоге удается избежать перехода острого состояния в хроническую форму. Есть бактерии, которые должны поддерживать нормальную микрофлору. Их не нужно лечить препаратами. А отсутствие требуемого количества организмов называется дисбактериозом.
Урогенитальные мазки
Частым лабораторным исследованием является посев на флору из влагалища, шейки матки и мочеиспускательного канала. В данном случае тоже можно говорить о присутствии микроорганизмов, составляющих нормальную микрофлору. Материал помещается на стекло, а также окрашивается особыми составами, позволяющими различить бактерии под микроскопом. При обнаружении патогенных организмов определяется восприимчивость к противомикробным препаратам. Посредством проведения исследования удается выявить такие показатели:
• состав флоры;
• число эритроцитов и лейкоцитов;
• присутствие лактобацилл;
• наличие гонококков, трихомонад, грибов.
Основания для сдачи урогенитальных мазков
Среди них в первую очередь отмечаются болевые ощущения внизу живота, наличие зуда и нестандартных выделений. Также назначение на мазок дается во время профилактического осмотра у гинеколога, при планировании беременности. Не лишним будет провести обследование после смены полового партнера. Исследование осуществляется по окончании продолжительного лечения гормональными составами, антибиотиками и цитостатиками, оказывающими воздействие на микроорганизмы, которые должны присутствовать в норме.
Правильное проведение исследования
• Не принимать препараты, воздействующие на слизистую оболочку.
• Если речь идет о вагинальном мазке, не следует иметь половых контактов за день-два до процедуры.
• Забор материала проводит врач с помощью одноразовых инструментов.
• Процесс является безболезненным.
• Выполнение исследования проводится 4-5 дней.
Мы предлагаем посетить нашу клинико-диагностическую лабораторию. В итоге вы получите адекватные результаты в сжатые сроки. У нас вам удастся воспользоваться профессиональными услугами лучших специалистов, которые определят возбудителя заболевания и предоставят сведения об эффективной антимикробной терапии. Врач сможет оценить рациональность лечения. Позвоните сотрудникам в единый контактный центр по номеру 8 (800) 200-40-26 за дополнительной информацией.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ / ТРЕБУЕТСЯ КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА / ЛИЦЕНЗИЯ ЛО-26-01-004308 от 19.12.2017 г.
Микробиологические исследования в Екатеринбурге — НоваМед
Микробиологические исследования в МК НоваМед
Микробиологические исследования — золотое правило диагностики многих заболеваний, в большей степени инфекционных. Они занимают много времени, поскольку выращивание определенных микрочастиц (микробов, бактерий) в соответствующей среде и их изучение занимает время. Однако в нашей клинике вы получите результаты за срок от 1 до 9 дней, не считая дня сдачи материала.
Микробиологические анализы в Екатеринбурге
Наши специалисты проводят высокоточное микробиологическое исследование, посев осуществляется в стерильных условиях. Результаты дают бесценную информацию для врача, который сможет точно поставить диагноз и назначить лечение. Для лаборатории необходимы:
Это базовые материалы для изучения.
Наши лаборатории оборудованы по современным технологиям, поэтому мы гарантируем высокоточные микробиологические исследования. Специалист может определить вид возбудителя заболевания, его спецификацию и степень чувствительности к тем или иным медикаментам.
Для чего стоит сдать микробиологические анализы
Чтобы определить в пробах исследуемого материала наличие, вид, характеристики патогенных организмов и обозначить эффективную программу терапии.
Какие микробиологические анализы необходимо сдать для получения результата?
Чаще всего это общеклинический анализ крови пациента. Способ оценить качество и количество элементов крови (сыворотки) и дать общую оценку состояния всего организма, а по отдельности – работы его органов и систем. Это один из важнейших методов диагностики, способствующих точной оценке патологических состояний.
Общий клинический анализ мочи — очень информативный для врача метод, который покажет, есть ли воспалительные или инфекционные процессы в организме, наличие скрытых или явных заболеваний. Чаще всего информирует о работе мочевыделительной системы: почек, мочевого пузыря и т.д.
Микробиологические анализы сдавать лучше натощак, в день перед сдачей биоматериалов воздержаться от курения, алкоголя, тонизирующих напитков.
Клинические проявления заболеваний, причины которых становятся более ясными после исследований, могут потребовать дополнительных методов лабораторной диагностики. Поэтому мы рекомендуем сразу же посетить узких специалистов нашей клиники: уролога, андролога, гинеколога и вместе с ними определить самую эффективную программу диагностирования. Каждый организм уникален и требует индивидуального профессионального подхода.
Каждый организм уникален и требует индивидуального профессионального подхода.
Иногда могут понадобиться дополнительные комплексные обследования, которые дадут более четкую картину происходящего в организме: УЗИ, биохимические, генетические исследования. Все это можно сделать в наших лабораториях. Чтобы записаться на прием, достаточно просто позвонить. Мы поможем вам сориентироваться в программе диагностики и проконсультируем.
Сравнительное исследование доклинических и клинических студентов-медиков
Предпосылки . Верхние дыхательные пути — одно из самых частых мест микробной колонизации. Колонизированные люди подвержены риску инфекций и могут быть источником передачи патогенов. Студенты-медики часто подвергаются воздействию различных инфекционных агентов и с большей вероятностью могут быть ими колонизированы. Это исследование было направлено на определение распространенности и сравнение скорости колонизации носовых и глоточных бактериальных патогенов среди студентов-медиков, обучающихся доклиническим и клиническим наукам. Методы . Это поперечное исследование было проведено среди 100 доклинических и 100 студентов-медиков, изучающих клинические науки. Выделение, идентификация и тестирование изолятов на чувствительность к антибиотикам проводили стандартными микробиологическими методами. Результаты . Колонизация носа S. aureus и MRSA составила 35% (70/200) и 19,5% (39/200) соответственно. Колонизация носа S. aureus и MRSA была значительно выше среди студентов клинических наук по сравнению со студентами доклинических наук.Колонизация глотки Haemophilus influenzae была значительно выше среди студентов клинических наук по сравнению со студентами доклинических наук. Колонизация глотки бета-гемолитическими стрептококками (не группа A) была выше среди студентов доклинических наук, чем студентов клинических наук. Заключение . Колонизация носа S. aureus и MRSA была выше среди студентов-клинических студентов. Колонизация глотки потенциальными бактериальными патогенами была выше среди студентов клинических наук, чем студентов доклинических курсов.Периодический скрининг MRSA и потенциальных патогенов горла у студентов клинических наук может снизить частоту нозокомиальной передачи патогенов.
Колонизация глотки потенциальными бактериальными патогенами была выше среди студентов клинических наук, чем студентов доклинических курсов.Периодический скрининг MRSA и потенциальных патогенов горла у студентов клинических наук может снизить частоту нозокомиальной передачи патогенов.
1. Введение
Инфекции дыхательных путей являются одной из важных причин заболеваемости и смертности во всем мире [1]. Верхние дыхательные пути, постоянно подвергающиеся воздействию окружающей среды, подвержены колонизации различными микробными агентами. Бактериальные патогены, такие как Streptococcus pneumoniae , Streptococcus pyogenes , Haemophilus influenzae , Neisseria meningitidis и Staphylococcus aureus , часто колонизируют верхние дыхательные пути человека.Эти патогены легко передаются от колонизированных / инфицированных людей здоровому населению через респираторные капли или ротоглоточные выделения. Бессимптомная колонизация потенциальными патогенами, такими как Streptococcus pneumoniae , Streptococcus pyogenes , Haemophilus influenzae и Neisseria meningitidis , может привести к инвазивным инфекциям и серьезным осложнениям. Частота носителей этих патогенов варьируется в зависимости от социально-экономического статуса, условий окружающей среды, возраста и антимикробной терапии населения [2].Повышение устойчивости к противомикробным препаратам и появление организмов с множественной лекарственной устойчивостью (МЛУ) затрудняет лечение инвазивных инфекций [3].
Передача респираторных патогенов в медицинских учреждениях определяется взаимодействием с пациентами и микробной нагрузкой в больничной среде. Качество окружающей среды в медицинских учреждениях и концентрация переносимых по воздуху микробов зависят от микробов, изгнанных пациентами и медицинскими работниками. При отсутствии надлежащей вентиляции микробы могут сохраняться в больничной среде в течение разного времени.Это увеличивает риск для пассажиров, пациентов и студентов-медиков, которые проводят долгие часы в больничной среде. Лица, оказывающие помощь пациентам, и студенты-медики, изучающие клинические науки, имеют больше шансов быть переносчиками патогенных бактерий и могут быть потенциальным источником внутрибольничных инфекций [4–7].
Лица, оказывающие помощь пациентам, и студенты-медики, изучающие клинические науки, имеют больше шансов быть переносчиками патогенных бактерий и могут быть потенциальным источником внутрибольничных инфекций [4–7].
Это исследование было запланировано для определения носовой и глоточной колонизации бактериальными патогенами среди студентов-медиков и для сравнения разницы в уровнях колонизации среди доклинических и клинических студентов-медиков.Мы предположили, что воздействие больничной среды увеличило бы бактериальную колонизацию носа и глотки среди студентов, изучающих клинические науки, по сравнению со студентами доклинических дисциплин, которые не подвергались такому воздействию больничной среды. Точно так же ожидается более высокая картина устойчивости к антибиотикам среди изолятов студентов-клинических студентов по сравнению с учащимися доклинических исследований.
2. Материалы и методы
2.1. Дизайн и субъекты исследования
Это проспективное поперечное исследование проводилось в течение пяти месяцев с мая по сентябрь 2017 года.Перед началом исследования было получено одобрение Институционального этического комитета (IRC) Колледжа медицинских наук Манипала (MCOMS), Покхара, Непал. Все участники были включены после получения письменного информированного согласия. Обследуемая популяция составила 200 студентов-медиков. Общая доступная популяция исследования в одном пакете доклинических наук (подмножество A) составляла 100 студентов. Таким образом, была включена вся популяция одной партии. Равное количество студентов, изучающих клинические науки (подмножество B), было взято для сравнительного исследования после консультации со статистиком.Блок фундаментальных и клинических наук разделен расстоянием 3,5 км. Учащиеся из обеих подгрупп не живут в одном месте или не живут в столовой, и общаются очень редко.
2.1.1. Критерии включения
Студенты клинических наук с минимум двухлетним пребыванием в больнице (интерны) были включены в подгруппу B.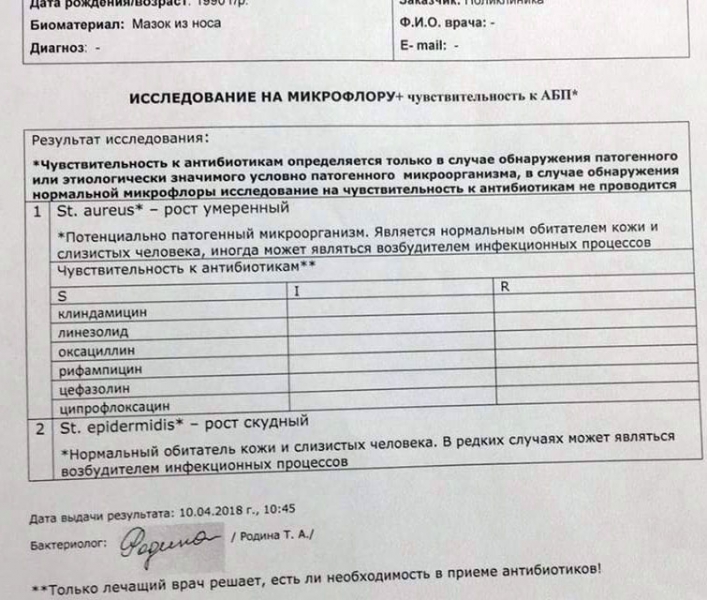 Студенты доклинических наук, не госпитализированные в течение последних шести месяцев, были включены в подгруппу A.
Студенты доклинических наук, не госпитализированные в течение последних шести месяцев, были включены в подгруппу A.
2.1.2. Критерии исключения
Студенты клинических наук, находящиеся в длительном отпуске (> 2 месяцев), и студенты доклинических факультетов с историей госпитализации в течение последних шести месяцев были исключены из исследования.
Демографические данные, включая возраст, пол, национальность, пребывание в больнице, недавнее воздействие антибиотиков, респираторные заболевания, курение, жевание табака / гутка и т. Д., Были собраны с помощью структурированного вопросника. Данные родственных изолятов из лаборатории клинической микробиологии учебного госпиталя Манипал были собраны для определения распространенности респираторных патогенов среди пациентов для анализа в течение периода исследования.
2.2. Сбор образцов
Был взят один образец из передней носовой полости и один из задней стенки глотки (200 мазков из носа и 200 мазков из глотки) от 200 участников (100 из подгруппы A и 100 из подгруппы B).Образцы были получены путем протирания обоих передних носовых ходов первым тампоном и протирания задней части ротоглотки вторым тампоном.
2.3. Выделение и идентификация бактериальных изолятов
Образцы сразу же инокулировали на чашки с 5% агаром с овечьей кровью и шоколадным агаром (Hi Media, Мумбаи, Индия) в месте сбора. Засеянные чашки немедленно отправляли в лабораторию и инкубировали при 37 ° C в сосуде для свечей с повышенным парциальным давлением CO 2 .Идентификацию изолятов проводили стандартными микробиологическими методами, такими как морфология колоний, окраска по Граму, тест на каталазу, тест на коагулазу, чувствительность к оптохинам, чувствительность к бацитрацину и тест на спутниковость [8].
2.4. Тест на чувствительность к антибиотикам
Тестирование изолятов на чувствительность к антибиотикам проводили на агаре Мюллера – Хинтона (HI Media, Мумбаи, Индия) методом дисковой диффузии Кирби – Бауэра [9]. Метициллин-устойчивый Staphylococcus aureus (MRSA) был исследован методом дисковой диффузии цефокситина (30 µ г) [9].
Метициллин-устойчивый Staphylococcus aureus (MRSA) был исследован методом дисковой диффузии цефокситина (30 µ г) [9].
2,5. Статистический анализ
Корреляция между переменными определялась с помощью критерия хи-квадрат с использованием SPSS 11.5. Значение ≤ 0,05 считалось значимым.
3. Результаты
Всего в этом исследовании приняли участие 200 студентов-медиков (MBBS), включая 100 студентов из подгруппы A (первый год) и 100 из подгруппы B (стажеры). Возраст участников подгруппы A составлял 18-25 лет, а подгруппы B — от 22 до 30 лет. Демографические данные студентов представлены в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Бактериологический профиль культур носовых и глоточных мазков подгруппы A и подгруппы B показан в таблице 2.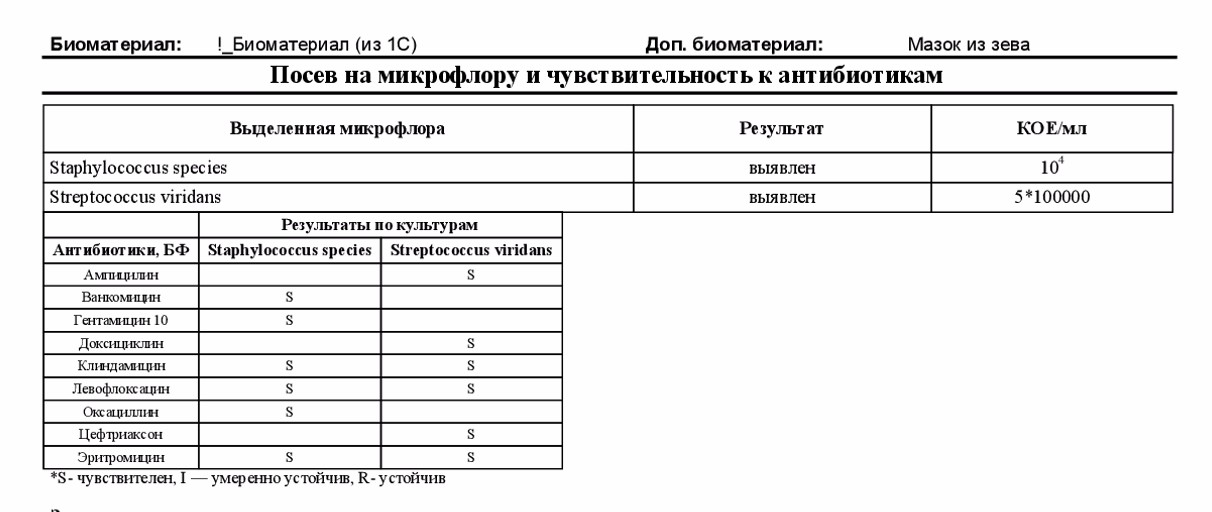 Общая носовая колонизация S. aureus и MRSA составила 35% (70/200) и 19,5% (39/200) соответственно. Скорость носовой колонизации S. aureus и MRSA была значительно выше (значения 0,003 и 0,001) среди подгруппы B по сравнению с подгруппой A (таблица 2). Изоляты из глотки (подгруппа A и подгруппа B) были Haemophilus influenzae (12,5%), бета-гемолитическими стрептококками не группы A (5,5%), S. aureus (5,5%), Streptococcus pneumoniae (4%). ) и Haemophilus parainfluenzae (3.5%). Колонизация глотки Haemophilus influenzae была обнаружена значительно выше ( p , значение 0,005) среди подгруппы B по сравнению с подгруппой A (таблица 2). Среди участников 7,5% (15/200) были колонизированы S. aureus в полости носа вместе с другими потенциальными патогенами в глотке ( Haemophilus influenzae , бета-гемолитические стрептококки и Streptococcus pneumoniae ).
Общая носовая колонизация S. aureus и MRSA составила 35% (70/200) и 19,5% (39/200) соответственно. Скорость носовой колонизации S. aureus и MRSA была значительно выше (значения 0,003 и 0,001) среди подгруппы B по сравнению с подгруппой A (таблица 2). Изоляты из глотки (подгруппа A и подгруппа B) были Haemophilus influenzae (12,5%), бета-гемолитическими стрептококками не группы A (5,5%), S. aureus (5,5%), Streptococcus pneumoniae (4%). ) и Haemophilus parainfluenzae (3.5%). Колонизация глотки Haemophilus influenzae была обнаружена значительно выше ( p , значение 0,005) среди подгруппы B по сравнению с подгруппой A (таблица 2). Среди участников 7,5% (15/200) были колонизированы S. aureus в полости носа вместе с другими потенциальными патогенами в глотке ( Haemophilus influenzae , бета-гемолитические стрептококки и Streptococcus pneumoniae ).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Из 100 носовых мазков, взятых из подгруппы A, S.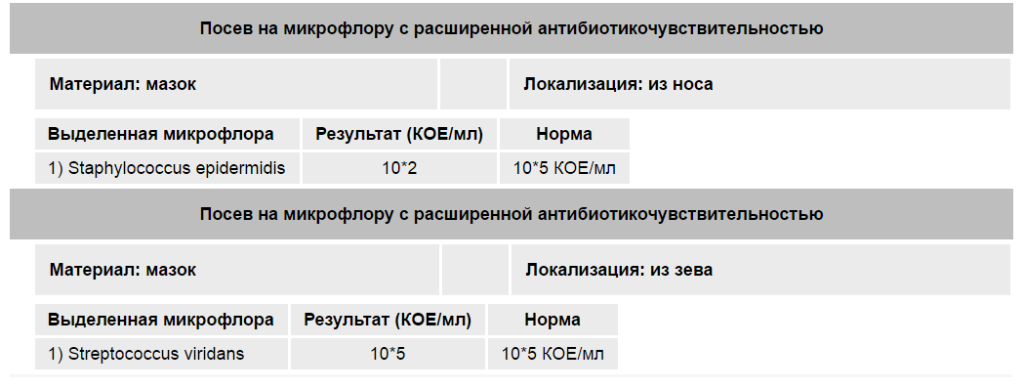 aureus был изолирован от 25 (25%) участников, из которых 10 (40%) были MRSA. Частота носительства S. aureus составила 28,8% (17/59) и 19,5% (8/41) среди участников мужского и женского пола, соответственно, что было статистически незначимым (значение 0,291). Точно так же частота носительства MRSA составила 13,5% (8/59) и 4,9% (2/41) среди участников мужского и женского пола, соответственно. Эта разница была статистически незначимой (значение 0,155). Другая бактериальная флора, выделенная из мазков из носа, включает видов Staphylococcus epidermidis , Micrococcus видов, видов Enterococcus и аэробных спороносителей.
aureus был изолирован от 25 (25%) участников, из которых 10 (40%) были MRSA. Частота носительства S. aureus составила 28,8% (17/59) и 19,5% (8/41) среди участников мужского и женского пола, соответственно, что было статистически незначимым (значение 0,291). Точно так же частота носительства MRSA составила 13,5% (8/59) и 4,9% (2/41) среди участников мужского и женского пола, соответственно. Эта разница была статистически незначимой (значение 0,155). Другая бактериальная флора, выделенная из мазков из носа, включает видов Staphylococcus epidermidis , Micrococcus видов, видов Enterococcus и аэробных спороносителей.
Бактериологическая культура образцов из носа и глотки среди подгруппы B показала аналогичные бактериальные изоляты, как в подгруппе A, но относительно более высокую скорость колонизации (таблица 2). Колонизация носа S. aureus среди подгруппы B составила 45% (45/100) с 29% (29/100) MRSA. Частота носительства S. aureus среди мужчин и женщин составила 41% (25/61) и 41% (16/39) соответственно. Аналогичным образом, уровень колонизации назального MRSA среди участников составлял 26,2% (16/61) у мужчин и 33 человек.3% (13/39) у женщин. Паттерн устойчивости к антибиотикам изолятов S. aureus из подмножества A и подмножества B представлен в таблице 3. Не наблюдалось значительных различий в паттерне устойчивости к антибиотикам изолятов S. aureus из подмножества A и подмножества B. Характер устойчивости к антибиотикам глоточных изолятов представлен в Таблице 4.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Четыре изолята бета-гемолитических стрептококков (45.4%) имели промежуточную чувствительность к пенициллину. AZM: азитромицин, CIP: ципрофлоксацин, CTR: цефтриаксон, COT: котримоксазол, C: хлорамфеникол, E: эритромицин, P: пенициллин. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Большинство студентов с носовым носительством S. aureus не принимали антибиотики в течение последних двух недель (95,8%), не были госпитализированы в течение последних шести месяцев (98,6%), не принимали в анамнезе антибиотики. респираторные инфекции (92,9%) и отсутствие в анамнезе курения / употребления табака (95,7%). Аналогичным образом, большинство студентов с глоточным носительством потенциальных бактериальных патогенов не имели в анамнезе использования антибиотиков, госпитализации, респираторных инфекций и курения / употребления табака.
Аналогичным образом, большинство студентов с глоточным носительством потенциальных бактериальных патогенов не имели в анамнезе использования антибиотиков, госпитализации, респираторных инфекций и курения / употребления табака.
4. Обсуждение
Бремя нозокомиальных инфекций значительно выше в развивающихся странах [10]. Медицинские работники считаются важными резервуарами для передачи внутрибольничных патогенов. Еще одним потенциальным источником инфекций могут быть студенты-медики, особенно те, кто занимается лечением пациентов. Полость носа и глотка человека являются благоприятными анатомическими участками для колонизации микробными агентами. Поэтому важно проверять медицинских работников и студентов-медиков на предмет колонизации бактериальными патогенами.
В нашем исследовании частота носительства S. aureus через нос среди студентов клинических наук (подгруппа B) составила 45%, что значительно выше, чем у студентов доклинических наук (подгруппа A) (25%). Результаты нашего исследования сопоставимы с другими исследованиями со скоростью колонизации около 40% [11, 12]. В аналогичном исследовании, проведенном среди студентов доклинических наук из Непала, сообщалось о 15% носительства S. aureus через нос [13]. Однако аналогичные исследования, проведенные в других странах, показали, что уровень колонизации колеблется от 19% до 25% [14–16].Частота носительства MRSA среди подгруппы B в нашем исследовании составила 29%, что значительно выше, чем подгруппы A (10%). Уровень колонизации MRSA, сообщенный в 2016 году Ansari et al. из Непала было ниже (4%), чем наши данные [13]. О более низких показателях колонизации MRSA от 0% до 9,4% сообщалось из других стран [14, 15, 17, 18]. Более высокие показатели колонизации S. aureus среди студентов-медиков, изучающих клинические науки, можно объяснить длительным воздействием больничной среды и регулярным взаимодействием с пациентами.Однако Сяфина и др. сообщили о более высокой колонизации S.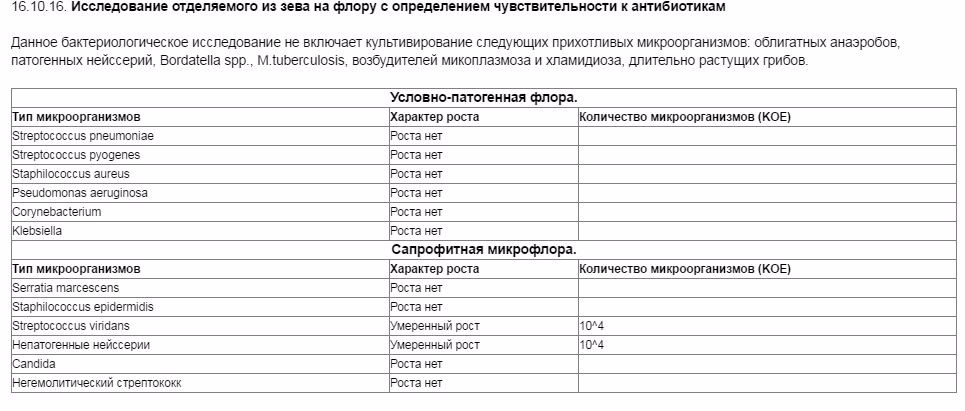 aureus среди доклинических студентов по сравнению с клиническими студентами [19]. Патогены, такие как MRSA, выживают в течение длительного времени благодаря своей стабильности в больничной среде. Это увеличивает риск передачи и колонизации. Уровень колонизации MRSA среди медицинских работников в конкретных условиях зависит от местной распространенности MRSA и методов инфекционного контроля. В нашем исследовании высокий процент колонизации MRSA среди студентов-клиник может быть связан с высокой распространенностью MRSA (34.75%) среди клинических изолятов больницы Manipal Teaching Hospital [20]. Высокая распространенность MRSA среди пациентов в медицинских учреждениях увеличивает риск колонизации среди медицинских работников из-за частого взаимодействия. С другой стороны, студенты доклинических курсов находятся вдали от воздействия окружающей среды в больнице и имеют более низкий уровень колонизации S. aureus и MRSA.
aureus среди доклинических студентов по сравнению с клиническими студентами [19]. Патогены, такие как MRSA, выживают в течение длительного времени благодаря своей стабильности в больничной среде. Это увеличивает риск передачи и колонизации. Уровень колонизации MRSA среди медицинских работников в конкретных условиях зависит от местной распространенности MRSA и методов инфекционного контроля. В нашем исследовании высокий процент колонизации MRSA среди студентов-клиник может быть связан с высокой распространенностью MRSA (34.75%) среди клинических изолятов больницы Manipal Teaching Hospital [20]. Высокая распространенность MRSA среди пациентов в медицинских учреждениях увеличивает риск колонизации среди медицинских работников из-за частого взаимодействия. С другой стороны, студенты доклинических курсов находятся вдали от воздействия окружающей среды в больнице и имеют более низкий уровень колонизации S. aureus и MRSA.
Частота носительства S. aureus и MRSA среди студентов мужского пола была выше по сравнению с женщинами, что сопоставимо с другими отчетами [15, 21, 22].Пожилой возраст рассматривается как возможный фактор колонизации S. aureus . Студент-клинический студент старшей возрастной группы больше колонизирован S. aureus по сравнению с доклиническим студентом младшего возраста.
Антибиограммы S. aureus , выделенного из подгруппы B, показали более высокую, но статистически незначимую картину устойчивости по сравнению с подгруппой A (таблица 2). Это может быть связано с тем фактом, что больничные штаммы более устойчивы к обычно используемым антибиотикам по сравнению с общественными [23, 24].Структура устойчивости изолятов к антибиотикам может измениться с течением времени из-за изменений в схеме назначения антибиотиков. Сообщалось о повышенной устойчивости к противомикробным препаратам в изолятах лечебных учреждений третичного уровня, возможно, из-за повышенного избирательного давления, вызванного широким применением противомикробных препаратов, высокой плотностью пациентов и медицинских работников, неадекватной вентиляцией и неадекватной политикой инфекционного контроля. Изолятов S. aureus в нашем исследовании было обнаружено, что они более устойчивы к обычно используемым антибиотикам по сравнению с отчетом Okamo et al.[15].
Изолятов S. aureus в нашем исследовании было обнаружено, что они более устойчивы к обычно используемым антибиотикам по сравнению с отчетом Okamo et al.[15].
Колонизация верхних дыхательных путей бактериальными патогенами увеличивает риск инвазивных инфекций и передачи восприимчивому хозяину. Микробная колонизация — сложный процесс, который включает колонизацию, устранение и реколонизацию [25]. Общая скорость колонизации глотки бактериальными патогенами была выше среди подгруппы B по сравнению с подгруппой A, но не была статистически значимой, за исключением случая H. influenza e. Более высокие показатели колонизации глотки среди подгруппы B могут быть связаны с длительным (> 2 лет) воздействием окружающей среды в больнице и взаимодействием с различными пациентами.Уровень колонизации глотки бета-гемолитическими стрептококками был выше среди подгруппы А, но статистически незначим. Предыдущее исследование, проведенное в том же учреждении, показало, что уровень колонизации Streptococcus pneumoniae и / или Haemophilus среди медицинских работников составляет 65%, что выше наших результатов [26]. Ряд факторов может быть связан с микробной колонизацией носа и глотки. Общие факторы риска включают молодой возраст, зиму, перенаселенность, низкий социально-экономический статус и курение.Низкий уровень колонизации глотки в нашем исследовании может быть связан с тем, что большинство участников были некурящими, принадлежащими к группам со средним и высоким доходом, и образцы были собраны летом. Данные клинической лаборатории больницы Manipal Teaching Hospital за соответствующие месяцы выявили низкий уровень выделения вышеуказанных организмов из клинических образцов. Более низкая распространенность этих патогенов среди пациентов может быть связана с более низким уровнем глоточного носительства среди студентов.Скорость носовой колонизации S. aureus была выше по сравнению с потенциальными патогенами, выделенными из глотки. Такие патогены, как Streptococcus pneumoniae , Streptococcus pyogenes и Haemophilus influenzae , являются деликатными и инактивируются вскоре после выделения и воздействия дезинфицирующих средств. Время выживания этих организмов в условиях больницы короче по сравнению с MRSA, что отражает их плохую передачу и низкие показатели колонизации.
Время выживания этих организмов в условиях больницы короче по сравнению с MRSA, что отражает их плохую передачу и низкие показатели колонизации.
Общая картина устойчивости к антибиотикам глоточных изолятов (подгруппа A и подгруппа B) показала, что большинство изолятов Haemophilus были чувствительны к обычно используемым антибиотикам. Среди изолятов Streptococcus pneumoniae 37,5% (3/8) были устойчивы к пенициллину, что указывает на возрастающую устойчивость. Из 11 бета-гемолитических стрептококков 45,4% (4/11) показали промежуточную чувствительность к пенициллину. Это открытие может вызывать тревогу в связи с появлением в будущем устойчивых к пенициллину штаммов.Результаты нашего исследования сопоставимы с исследованием из Индии [27].
Скрининг колонизации носа и глотки среди медицинских работников и студентов-медиков может помочь предсказать передачу потенциальных патогенов. Риск передачи и распространения бактериальных патогенов из одного отделения / отделения в другое больше у студентов клинических наук, поскольку они проходят периодическую программу ротационной подготовки в различных отделениях / отделениях. Клиницисты и другие медицинские работники работают в одном конкретном отделении и с меньшей вероятностью распространят патогены из одного отделения в другое.Данные скрининга могут быть важны для сведения к минимуму передачи инфекции среди пациентов с высоким риском, таких как новорожденные, ожоговые пациенты, послеоперационные пациенты и пациенты интенсивной терапии. В связи с вышеизложенным, исследование больницы на предмет распространенности MRSA и других потенциальных патогенов в различных отделениях поможет разрешить ситуацию. На основании имеющихся данных отделения больницы можно разделить на отделения (зоны) высокого риска, отделения умеренного риска и отделения низкого риска. Программа повышения осведомленности / ориентации может потребоваться после завершения доклинического научного исследования в отношении стандартных методов минимизации передачи и предотвращения внутрибольничных инфекций. Регулярная программа скрининга и ограничение числа колонизированных медицинских работников и студентов-медиков, особенно в отделениях высокого риска, должны строго выполняться, чтобы уменьшить передачу внутрибольничных патогенов.
Регулярная программа скрининга и ограничение числа колонизированных медицинских работников и студентов-медиков, особенно в отделениях высокого риска, должны строго выполняться, чтобы уменьшить передачу внутрибольничных патогенов.
Сила нашего исследования заключается в охвате назальной и глоточной колонизации бактериальными патогенами среди студентов-медиков, поскольку в большинстве предыдущих исследований были ограниченные данные о носовой колонизации только S. aureus / MRSA. Колонизация носа и глотки среди студентов-медиков может быть потенциальным источником клонального распространения MRSA в больнице.Это было подробно подчеркнуто в нашем исследовании.
Это исследование имело некоторые ограничения. Исследование проводилось в осенне-летний сезон; следовательно, сезонные изменения в скорости колонизации не могли быть изучены. Молекулярный анализ потенциальных патогенов не проводился. Передача патогенов от студентов-медиков к пациентам, медицинским работникам и наоборот не была включена в это исследование. Исследование проводилось среди студентов одного медицинского колледжа Западного Непала, и результаты исследования не могут быть распространены на студентов других медицинских колледжей.
5. Заключение
Студенты-медики клинических наук имеют более высокие показатели колонизации S. aureus и MRSA. Более высокая колонизация, возможно, связана с длительным воздействием окружающей среды в больнице и взаимодействием с пациентами. Колонизация глотки потенциальными патогенами была выше среди студентов клинических наук. Более высокие показатели колонизации носа и глотки среди студентов-медиков могут представлять угрозу для передачи потенциальных патогенов среди пациентов и медицинских работников.Осведомленность студентов-медиков об их роли в передаче болезнетворных микроорганизмов и важности универсальных мер предосторожности и гигиены рук может помочь в сокращении внутрибольничных инфекций.
Доступность данных
Данные, использованные для подтверждения результатов этого исследования, можно получить у соответствующего автора по запросу.
Конфликт интересов
У авторов нет конфликта интересов.
Вклад авторов
Дхарм Радж Бхатта как главный исследователь разработал исследование, собрал и обработал образцы, проанализировал данные и составил рукопись.Депендра Хамал, Раджани Шрестха, Ранджана Параджули, Ниша Барал и Супрам Хосуру Субраманья внесли свой вклад в сбор образцов, обработку и анализ данных. Ниранджан Наяк и Шишир Гокхале внесли свой вклад в формулировку целей и доработку рукописи. Все авторы прочитали и приняли рукопись.
Благодарности
Авторы выражают благодарность всему персоналу отделения микробиологии учебной больницы Манипал, Покхара, Непал, за их помощь и поддержку. Авторы выражают благодарность студентам доклинических и клинических наук за участие в исследовании.
Определение микробиомов носа и ротоглотки в многоцентровом популяционном исследовании — результаты предварительного теста 1 Национальной когорты Германии
Популяция исследования
Исследование было интегрировано в предварительный тест 1 фазы GNC, который проводился в 2011 году и направлена на проверку возможности различных аспектов набора, оценки и экзаменов в исследовательском центре и последующего наблюдения 12,13,14 . Все исследовательские центры собрали случайные выборки населения из регистрационных бюро соответствующих жителей.Вкратце, приглашения были разосланы по почте и включали описание целей и процедур проверки исследования и копию письма-одобрения от уполномоченного по защите данных. Письмо с напоминанием было отправлено, если через четыре недели не было ответа. С физическими лицами дополнительно связывались по телефону, если номер телефона имелся. Из 17 центров, участвовавших в предварительном тесте 1, возможность получения мазков из носа и ротоглотки была проверена в шести и четырех исследовательских центрах, соответственно.Три из этих исследовательских центров также изучали возможность получения самостоятельно взятых мазков из носа в домашних условиях. На рис. 1 показано географическое расположение шести исследовательских центров и тип мазков, проводимых в каждом центре. Все участники предварительного тестирования 1 и, следовательно, представленного технико-экономического обоснования, также приняли участие в базовом личном интервью для получения общепринятых демографических, социально-экономических и медицинских данных, антропометрических измерений (рост и вес), измерения частоты сердечных сокращений и артериального давления. , сбор других биопроб и других технико-экономических обоснований.
На рис. 1 показано географическое расположение шести исследовательских центров и тип мазков, проводимых в каждом центре. Все участники предварительного тестирования 1 и, следовательно, представленного технико-экономического обоснования, также приняли участие в базовом личном интервью для получения общепринятых демографических, социально-экономических и медицинских данных, антропометрических измерений (рост и вес), измерения частоты сердечных сокращений и артериального давления. , сбор других биопроб и других технико-экономических обоснований.
мазок из носа и ротоглотки
Обучение исследовательского персонала
Местные исследовательские группы состояли из 2-4 человек (врачей и медсестер) и были обучены и сертифицированы на месте координатором представленного исследования, имеющим лицензию. врач и имеет обширный личный опыт получения мазков из носа и глотки в соответствии с принятыми на международном уровне Стандартными операционными процедурами (СОП). Учебные занятия состояли из трех частей: (а) презентация в PowerPoint (обзор целей исследования, соответствующей анатомии, техники взятия проб и сохранения образцов), (б) демонстрация и практическое обучение, и (в) сертификация (каждый стажер прошел для демонстрации трех правильно выполненных тампонов).
Процедура взятия мазка
В исследовательском центре сертифицированный персонал объяснил участнику цели исследования, а затем взял у него / нее по одному переднему мазку из носа из каждой ноздри и по одному мазку из ротоглотки. Для мазка из носа мазок вводили в ноздрю на глубину 1–1,5 см и трижды вращали на слизистой оболочке носа при постоянном давлении. Эту процедуру повторили для другой ноздри. Затем оба тампона помещали в одну пробирку для хранения объемом 1,5 мл (Micro tube, Sarstedt, no.72.694.005), содержащий 1 мл стабилизирующего реагента RNAlater® (QIAGEN, Остин, Техас, США). Кроме того, исследователи проводили мазок из ротоглотки по миндалинам (или «областям миндалин», если миндалины были атрофированы или были удалены) и фарингопалатиновой дуге с обеих сторон. Доля этих анатомических структур, которая была успешно взята тампоном, была записана в протоколе биопроба и использовалась в качестве показателя полноты процедуры мазка из глотки. После завершения процедуры тампона кончик тампона отрезали и поместили в 1.Пробирка для хранения 5 мл, содержащая 1 мл RNAlater ® . После сбора мазки помещали на сухой лед и к концу дня переносили в хранилище -80 ° C.
Доля этих анатомических структур, которая была успешно взята тампоном, была записана в протоколе биопроба и использовалась в качестве показателя полноты процедуры мазка из глотки. После завершения процедуры тампона кончик тампона отрезали и поместили в 1.Пробирка для хранения 5 мл, содержащая 1 мл RNAlater ® . После сбора мазки помещали на сухой лед и к концу дня переносили в хранилище -80 ° C.
Наконец, в трех исследовательских центрах (рис. 1) участников проинструктировали, как самостоятельно собирать мазки из носа. Четыре недели спустя участникам был отправлен набор для мазков, содержащий два мазка из носа, транспортную пробирку, содержащую 2 мл RNAlater, небольшую бутылку с 2 мл NaCl, анкету, инструкции по самостоятельному сбору мазка из носа и перчатки.Их попросили самостоятельно взять по одному мазку из носа из каждой ноздри, заполнить анкету и отправить все по почте в лабораторию в течение 24 часов. Процедура взятия мазка в домашних условиях описывалась аналогично тому, как это делалось в исследовательском центре. Короче говоря, мазок из носа нужно было ввести в ноздрю на глубину ок. 1,5 см, трижды повернули на слизистой оболочке носа при постоянном давлении и поместили в RNAlater. Участникам было поручено хранить тампоны в холодильнике на ночь, если они были собраны за день до отправки.Тампоны были доставлены при температуре окружающей среды и помещены при -80 ° C по прибытии в исследовательский центр.
Типы тампонов
Сравнивались следующие четыре типа тампонов: тампон 1 — нейлоновый тампон с ворсом (№ 502CS01, Hain Lifescience), тампон 2 — вискозный тампон (№ 30MW112, Check Diagnostics GmbH), тампон 3 — тампон с полиуретановым наконечником (№ 30MW940 / 125, Check Diagnostics GmbH) и тампон с 4-мя кончиком из альгината кальция (№ 25-806 1 Па, Check Diagnostics GmbH). Участники исследования были рандомизированы блочной рандомизацией по одному из четырех типов мазков.У данного участника мазки одного и того же типа использовались для мазков из носа и ротоглотки, а также для самостоятельного мазка из носа.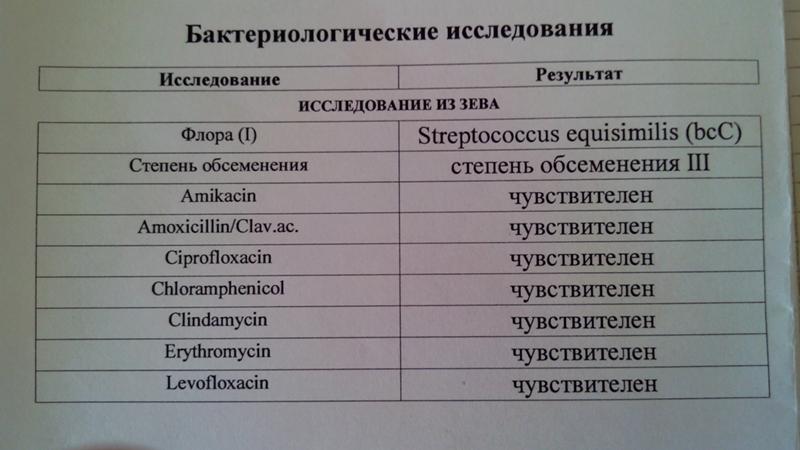
Принятие
После завершения процедуры взятия мазка участникам было предложено заполнить отдельные вопросники приема мазков из носа и ротоглотки в исследовательском центре и самостоятельного мазка из носа дома. Принятие оценивалось с помощью вопросов по пятибалльной шкале Лайкерта. Участники оценили каждый пункт на 1 (категорическое несогласие), 2 (несогласие), 3 (ни согласие, ни несогласие), 4 (согласие) или 5 (полное согласие).Некоторые вопросы были перефразированы, чтобы уменьшить предвзятость ответа.
Лабораторный анализ
Из 1807 собранных мазков для анализа микробиома была отобрана подвыборка 313 мазков (195 носовых и 118 ротоглоточных мазков, полученных от 258 участников), так как это количество было сочтено достаточно большим для достижения основных целей: исследование (таблица 3, дополнительная таблица 3). Чтобы избежать любой возможной систематической ошибки, вызванной включением нескольких мазков от одного и того же участника, только 258 мазков (148 образцов из передних носовых ходов и 110 образцов ротоглотки, см. Таблицу 3 и дополнительную Таблицу 3) были проанализированы для сравнения типов мазков или самостоятельных мазков с мазками.мазок обученным персоналом. Отдельные мазки были взяты из каждой ноздри, но только один из двух мазков был взят для анализа случайным образом, в результате чего была получена случайная смесь мазков из левой или правой ноздри для последующих анализов.
Таблица 3 Обзор мазков, включенных в анализ микробиома.
Тампоны помещали в пробирки, содержащие 500 мкл свободной от нуклеаз H 2 O и 100 мг стеклянных шариков (промытые кислотой, ≤ 106 мкм, Sigma-Aldrich). Клетки лизировали в приборе FastPrep ® -24 в течение 30 секунд при настройке интенсивности 6.Экстракцию ДНК проводили с использованием InstaGene Matrix (Biorad) в соответствии с инструкциями производителя. Библиотеки ампликонов были созданы из области V1 – V2 гена 16 S рРНК с использованием праймеров 27 F и 338R 6 в 20-цикловой реакции ПЦР, как описано ранее 8 . Ампликоны экстрагировали из агарозных гелей с помощью набора QIAquick Gel Extraction Kit от Qiagen в соответствии с протоколом производителя. Перед секвенированием концентрацию очищенных продуктов ПЦР количественно определяли с помощью набора дцДНК Quant-iT PicoGreen (Invitrogen), и образцы объединяли в равных концентрациях.Секвенирование 2 × 250 п.н. выполняли на секвенсоре Illumina MiSeq (Illumina, Hayward, Californa, USA). Необработанные последовательности были объединены 15 и впоследствии выровнены с использованием MOTHUR (алгоритм gotoh с эталонной базой данных SILVA) до предварительной кластеризации, что позволило получить два несовпадения. Всего было проанализировано 14,5 миллионов последовательностей для 313 образцов (46 399 ± 28 247 последовательностей на образец). Для последующего анализа рассматривались только филотипы со средней численностью не менее 0,001% от общего числа сообществ и длиной последовательности> 200 п.н.Всем филотипам была присвоена таксономическая принадлежность на основе наивной байесовской классификации (классификатор RDP) 16 . Затем филотипы были вручную проанализированы по базе данных RDP с использованием функции Seqmatch, а также по базе данных NCBI для определения дискриминирующей способности каждой последовательности. Последовательности, не происходящие от 16S рДНК, были удалены, в результате чего осталось 13,2 миллиона последовательностей. Минимальное количество считываний на образец составляло 8850. Название вида было присвоено филотипу, когда только 16 фрагментов гена S рРНК ранее описанных изолятов этого вида показали ≤2 несовпадения с соответствующей репрезентативной считанной последовательностью.Точно так же название рода было присвоено филотипу, когда только 16 фрагментов гена S рРНК ранее описанных изолятов, принадлежащих к этому роду, и 16 фрагментов гена S рРНК, происходящих от некультивируемых представителей этого рода, показали ≤ 2 несовпадений. Затем определяли относительную численность бактериальных типов или филотипов путем суммирования всех последовательностей и расчета относительной доли каждого типа / филотипа во всем микробном сообществе.
Ампликоны экстрагировали из агарозных гелей с помощью набора QIAquick Gel Extraction Kit от Qiagen в соответствии с протоколом производителя. Перед секвенированием концентрацию очищенных продуктов ПЦР количественно определяли с помощью набора дцДНК Quant-iT PicoGreen (Invitrogen), и образцы объединяли в равных концентрациях.Секвенирование 2 × 250 п.н. выполняли на секвенсоре Illumina MiSeq (Illumina, Hayward, Californa, USA). Необработанные последовательности были объединены 15 и впоследствии выровнены с использованием MOTHUR (алгоритм gotoh с эталонной базой данных SILVA) до предварительной кластеризации, что позволило получить два несовпадения. Всего было проанализировано 14,5 миллионов последовательностей для 313 образцов (46 399 ± 28 247 последовательностей на образец). Для последующего анализа рассматривались только филотипы со средней численностью не менее 0,001% от общего числа сообществ и длиной последовательности> 200 п.н.Всем филотипам была присвоена таксономическая принадлежность на основе наивной байесовской классификации (классификатор RDP) 16 . Затем филотипы были вручную проанализированы по базе данных RDP с использованием функции Seqmatch, а также по базе данных NCBI для определения дискриминирующей способности каждой последовательности. Последовательности, не происходящие от 16S рДНК, были удалены, в результате чего осталось 13,2 миллиона последовательностей. Минимальное количество считываний на образец составляло 8850. Название вида было присвоено филотипу, когда только 16 фрагментов гена S рРНК ранее описанных изолятов этого вида показали ≤2 несовпадения с соответствующей репрезентативной считанной последовательностью.Точно так же название рода было присвоено филотипу, когда только 16 фрагментов гена S рРНК ранее описанных изолятов, принадлежащих к этому роду, и 16 фрагментов гена S рРНК, происходящих от некультивируемых представителей этого рода, показали ≤ 2 несовпадений. Затем определяли относительную численность бактериальных типов или филотипов путем суммирования всех последовательностей и расчета относительной доли каждого типа / филотипа во всем микробном сообществе.
Статистический анализ
Все анализы проводились на основе стандартизованных данных о численности.Матрицы сходства образцов рассчитывались на основе алгоритма Брея-Кертиса 17 . Структуры бактериальных сообществ априори определенных групп были визуализированы путем ординации с использованием nMDS с 50 случайными перезапусками. Значительные различия между заранее заданными группами выборок были оценены с использованием анализа сходства (ANOSIM) (9999 перестановок) с сопутствующей статистикой R, измеряющей степень разделения между группами 18 и / или перестановочным многомерным анализом дисперсии (PERMANOVA), что позволяет для типа III (частичные) суммы квадратов с фиксированной суммой эффектов равной нулю для смешанных членов и точных p-значений, сгенерированных с использованием неограниченной перестановки необработанных данных 19 .Группы образцов считались значительно различающимися, если значение p было <0,05. Степень внутригрупповой вариации для образцов из одного и того же места обитания была рассчитана путем применения многомерного дисперсионного анализа, где низкий индекс дисперсии указывает на низкую внутригрупповую неоднородность. Богатство, разнообразие и однородность филотипов были изучены путем расчета общих филотипов (S), индекса разнообразия Симпсона (1-D), индекса разнообразия Шеннона (H ') и индекса равномерности Пиелу (J') на подвыборочных данных с использованием функции redufy_even_depth ( rngseed = TRUE) из пакета R «phyloseq» 20 .
Обилие представляющих интерес видов и одномерные индексы разнообразия сравнивались между априори группами выборок с использованием либо t-критерия, либо дисперсионного анализа (ANOVA). Данные о численности видов и индексы разнообразия были подвергнуты тесту на нормальность с использованием как омнибуса Д’Агостино и Пирсона, так и алгоритмов Шапиро-Уилка (Prism 6, Graphpad Software Inc.). Поскольку большая часть численности PT в большинстве групп давала оценки, указывающие на ненормальное распределение, тест Крускала-Уоллиса с апостериорным критерием множественного сравнения Данна использовался, когда сравнивались несколько групп, тогда как тест Манна-Уитни использовался, когда сравнивали только 2 группы. Для множественных сравнений применялась поправка Бенджамини-Хохберга 21 . Группы образцов считались значимо разными, если значение p было <0,05. Был проведен многомерный анализ и рассчитаны индексы разнообразия с использованием PRIMER (v7.0.6; PRIMER-E; Plymouth Marine Laboratory, UK) 18 , тогда как одномерный анализ и тесты нормальности были выполнены в Prism 6 (Graphpad Software, Inc.).
Для множественных сравнений применялась поправка Бенджамини-Хохберга 21 . Группы образцов считались значимо разными, если значение p было <0,05. Был проведен многомерный анализ и рассчитаны индексы разнообразия с использованием PRIMER (v7.0.6; PRIMER-E; Plymouth Marine Laboratory, UK) 18 , тогда как одномерный анализ и тесты нормальности были выполнены в Prism 6 (Graphpad Software, Inc.).
Одобрение этики
Все процедуры, выполняемые в исследованиях с участием людей, соответствовали этическим стандартам институционального и / или национального исследовательского комитета, а также Хельсинкской декларации 1964 года и ее более поздним поправкам или сопоставимым этическим стандартам.Исследование было одобрено ответственными комитетами по этике Федеральных земель Германии в Аугсбурге, Бремене, Эссене, Фрайбурге, Гамбурге и Гейдельберге. Информированное согласие было получено от всех отдельных участников, включенных в исследование.
Собранная самостоятельно слюна и мазки из глубокого носа одинаково эффективны для диагностики COVID-19, результаты исследования — ScienceDaily
Собранные самостоятельно слюна и мазки из глубокого носа, собранные медицинскими работниками, одинаково эффективны для обнаружения SARS-CoV-2, вирус, вызывающий COVID-19, согласно новому исследованию, проведенному ARUP Laboratories и University of Utah (U of U) Health.
Исследование, опубликованное в журнале Journal of Clinical Microbiology , представляет собой одно из крупнейших на сегодняшний день проспективных сравнений типов образцов, сказал Хулио Дельгадо, доктор медицинских наук, главный врач ARUP. Другие исследования, в том числе исследование Йельской школы общественного здравоохранения, пришли к аналогичным выводам, но с заметно меньшим количеством пациентов и образцов.
Исследователи также обнаружили, что образцы, собранные самостоятельно с передней части носа, менее эффективны, чем глубокие носовые мазки для обнаружения вирусов.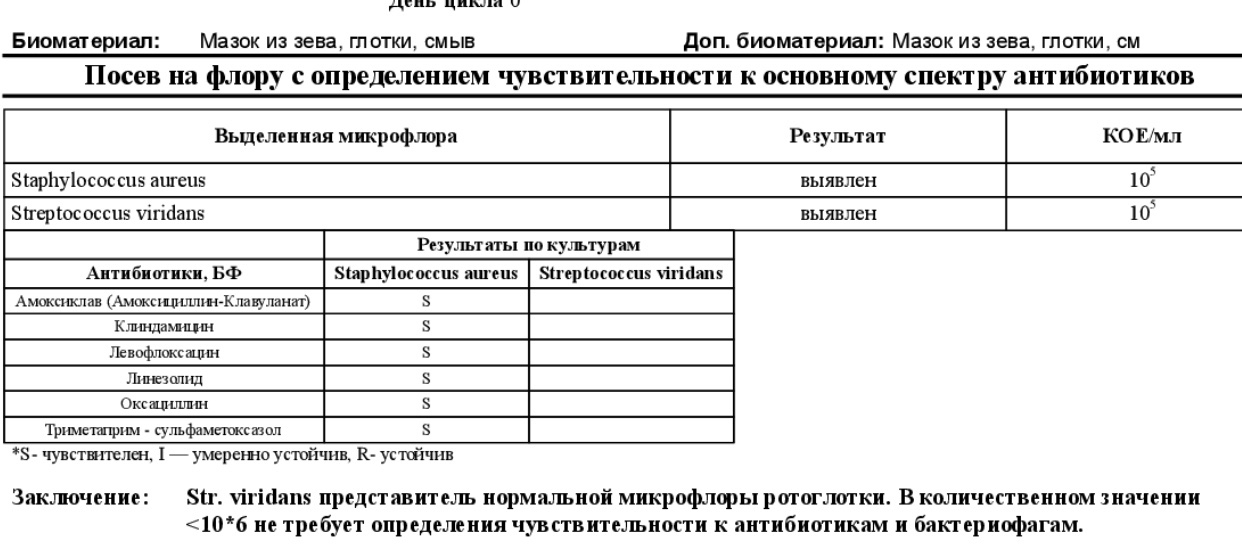 Это открытие побудило к последующему исследованию, которое еще не было опубликовано, в котором исследователи узнали, что они могут повысить чувствительность теста мазка из носа до 98%, объединив мазок из переднего носа и мазок, взятый из задней части глотки.
Это открытие побудило к последующему исследованию, которое еще не было опубликовано, в котором исследователи узнали, что они могут повысить чувствительность теста мазка из носа до 98%, объединив мазок из переднего носа и мазок, взятый из задней части глотки.
Результаты имеют важное значение для пациентов и медицинских работников. Процесс сбора слюны и передних носовых образцов менее инвазивен, чем глубокий носовой или носоглоточный мазок. Кроме того, оба типа образцов можно собирать самостоятельно, что снижает риск заражения для медицинских работников, собирающих образцы из носоглотки, — сказала Кимберли Хэнсон, доктор медицинских наук, магистр здравоохранения, руководитель отдела клинической микробиологии в ARUP и основной автор исследования.
«Самостоятельный сбор слюны и мазков из носа может решить многие проблемы с ресурсами и безопасностью, связанные с диагностическим тестированием SARS-CoV-2», — сказал Дельгадо.
ARUP и U of U Health планируют начать предлагать тестирование слюны в некоторых клинических учреждениях U of U Health в начале сентября. Они уже используют мазки из переднего носа в сочетании с мазками из горла, чтобы проверить некоторых бессимптомных людей.
По словам Дельгадо, тестирование
COVID-19 на этих альтернативах носоглоточным мазкам со временем будет увеличиваться.«С самого начала пандемии COVID-19 ARUP работает над созданием потенциала для высококачественного тестирования COVID-19», — сказал он. «Наша цель — сделать это тестирование доступным для больниц и систем здравоохранения по всей стране».
Хэнсон и ее коллеги проанализировали более 1100 образцов, взятых у 368 добровольцев в центре здоровья Университета штата Калифорния в Редвуде с конца мая по июнь. Добровольцы самостоятельно собрали слюну, которую они сплюнули в пробирку и взяли с передней части обеих ноздрей, чтобы получить образцы для тестирования.Исследователи сравнили результаты тестов этих типов образцов с результатами тестов, взятых поставщиками медицинских услуг из носоглотки у добровольцев. Противоречивые результаты по образцам, собранным у одного и того же пациента, привели к повторному тестированию с использованием платформы на основе второй полимеразной цепной реакции (ПЦР).
Противоречивые результаты по образцам, собранным у одного и того же пациента, привели к повторному тестированию с использованием платформы на основе второй полимеразной цепной реакции (ПЦР).
Исследование показало, что SARS-CoV-2 был обнаружен как минимум в двух типах образцов у 90% пациентов, у которых был положительный результат теста на вирус.
В качестве самостоятельной альтернативы мазкам из носоглотки слюна оказалась отличным вариантом, сказал Хэнсон.Показатели положительности образцов слюны были почти такими же, как и для образцов из носоглотки.
Исследование показало, что взятые самостоятельно мазки из носа, если их использовать отдельно, могут пропустить почти 15% инфекций, что побудило исследователей провести дальнейшее исследование, комбинируя их с мазками из ротоглотки или горла.
«Исследование является примером того, как ARUP и U of U Health продолжают изучать новые методы обслуживания пациентов и общества, а также обеспечивать безопасность медицинских работников», — сказал Ричард Орланди, доктор медицины, главный врач по амбулаторному здоровью U of U Health. .«Мы ценим исследователей ARUP, а также сотрудников и пациентов нашего испытательного центра Redwood, которые участвовали в этом открытии», — сказал он. «Этот захватывающий прогресс отражает новаторский дух ARUP и U of U Health, а также преимущества нашего партнерства».
История Источник:
Материалы предоставлены Университетом здравоохранения штата Юта . Примечание. Содержимое можно редактировать по стилю и длине.
Progress с 01.04.14 по 01.04.15 Результаты Воздействия Публикации
|
Нарушение микрофлоры глотки антибиотиками способствует гиперчувствительности дыхательных путей после респираторно-синцитиальной вирусной инфекции
Аннотация
Фон
Регуляторные Т-клетки (Treg-клетки), которые необходимы для регуляции иммунного ответа на инфекцию респираторно-синцитиального вируса (RSV), стимулируются глоточным комменсальным пневмококком.Влияние нарушения микрофлоры глотки антибиотиками на чувствительность дыхательных путей и относительные иммунные ответы после инфицирования RSV не выяснено.
Методы
Самок мышей BALB / c (в возрасте 3 недель) инфицировали RSV, а затем лечили пероральными антибиотиками или пероральной бидистиллированной водой (ddH 2 O) через 1 день после инфицирования (pi). Изменения микрофлоры глотки анализировали после лечения антибиотиками в течение 7 и 14 дней. Через 8 дней после инъекции и 15 дней после инъекции воспалительные клетки в жидкости бронхоальвеолярного лаважа (BALF) были исследованы в сочетании с тестами на гистопатологию легких, гиперчувствительность дыхательных путей (AHR), ответы Treg-клеток легких и селезенки. Экспрессию мРНК Foxp3 в легких, IL-10 и TGF-β1 в ЖБАЛ и гомогенате легких исследовали через 15 дней после введения. Пробу овальбумином (OVA) использовали для индукции AHR после инфицирования RSV.
Экспрессию мРНК Foxp3 в легких, IL-10 и TGF-β1 в ЖБАЛ и гомогенате легких исследовали через 15 дней после введения. Пробу овальбумином (OVA) использовали для индукции AHR после инфицирования RSV.
Результаты
Преобладающий комменсал глотки, Streptococcus , был устранен лечением антибиотиками в течение 7 дней. Такое же изменение наблюдалось и после лечения антибиотиками в течение 14 дней. После инфицирования RSV AHR усиливался обработкой антибиотиком через 15 дней после инъекции. Обнаружено синхронное снижение количества легочных Treg-клеток, мРНК Foxp3 и TGF-β1.Аналогичные результаты наблюдались при заражении OVA.
Выводы
После инфицирования RSV лечение антибиотиками привело к исчезновению комменсальных бактерий из глотки, таких как Streptococcus , которые, следовательно, могут индуцировать AHR и уменьшать количество Treg-клеток в легких.
Образец цитирования: Ni K, Li S, Xia Q, Zang N, Deng Y, Xie X и др. (2012) Нарушение микрофлоры глотки антибиотиками способствует гиперчувствительности дыхательных путей после респираторно-синцитиальной вирусной инфекции.PLoS ONE 7 (7):
e41104.
https://doi.org/10.1371/journal.pone.0041104
Редактор: Стефания Энн Кормье, Центр медицинских наук Университета штата Луизиана, Соединенные Штаты Америки
Поступила: 14 декабря 2011 г .; Одобрена: 20 июня 2012 г .; Опубликовано: 26 июля 2012 г.
Авторские права: © 2012 Ni et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Национальным фондом естественных наук Китая (номера грантов: NSFC 30972698, NSFC 81170010) (http://isis.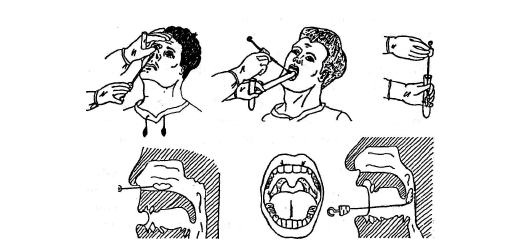 nsfc.gov.cn/portal/index.asp). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
nsfc.gov.cn/portal/index.asp). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Респираторно-синцитиальный вирус (RSV) является одним из наиболее распространенных патогенов, вызывающих инфекции нижних дыхательных путей у младенцев и детей раннего возраста.Это вызывает бронхиолит и связано с повторяющимся хрипом в более позднем детстве [1]. Однако точный фактор, который связывает инфекцию RSV и повторяющиеся хрипы, неясен. Использование антибиотиков, приводящее к изменению бактериальной колонизации дыхательных путей у новорожденных, связано с более поздним повторным свистящим дыханием [2], [3]. Во всем мире лечение антибиотиками часто применяется у пациентов с RSV-инфекцией [4]. Однако лечение антибиотиками рекомендуется только в том случае, если имеется серьезное подозрение или доказательство наличия бактериальной инфекции после инфицирования RSV [5], [6] и частота сочетанной инфекции RSV и бактерий невысока [7], [8].Предполагается, что злоупотребление антибиотиками является связующим звеном между инфекцией RSV и повторяющимся хрипом.
Свистящее дыхание связано с различиями в бактериальной колонизации носоглотки [3]. У детей с хрипом бактериальная колонизация дыхательных путей содержит меньше доминирующих бактерий и больше недоминантных бактерий, чем у здоровых детей [9]. Микрофлора глотки влияет на иммунные реакции в окружающей лимфоидной ткани. Сообщалось о более высокой доле Treg-клеток среди аденоидных мононуклеарных клеток детей с положительной культурой комменсального пневмококка из глотки [10].Цельноклеточный антиген пневмококка индуцирует пролиферацию аденоидных IL-10-продуцирующих Treg-клеток [10]. Клетки Treg играют важную роль в модулировании иммунного ответа на инфекцию RSV. Повышенное количество Treg-клеток в периферической крови или легких после инфицирования RSV было обнаружено у людей и мышей [11] — [13]. Ингибирующее действие Treg-клеток на CD8 + T-клетки может уравновешивать клиренс RSV и патологические процессы и, таким образом, способствовать выздоровлению [12] — [15].
Ингибирующее действие Treg-клеток на CD8 + T-клетки может уравновешивать клиренс RSV и патологические процессы и, таким образом, способствовать выздоровлению [12] — [15].
Нарушение комменсальной микрофлоры, вызванное лечением антибиотиками, снижает количество легочных Treg-клеток и вызывает более тяжелое воспаление дыхательных путей в ответ на провокацию аэроаллергеном овальбумином (OVA) [16].Неясно, связывает ли этот эффект инфекцию RSV и более позднее свистящее дыхание. В этом исследовании микрофлора глотки была нарушена с использованием антибиотиков широкого спектра действия цефоперазон, чтобы подтвердить его влияние на вызванное RSV воспаление дыхательных путей, гиперреактивность дыхательных путей (AHR) и изучить задействованные механизмы. Предыдущие исследования показали, что после инфицирования RSV сенсибилизация OVA через дыхательные пути увеличивает чувствительность дыхательных путей к метахолину [17]. Таким образом, провокация OVA была введена для изучения влияния нарушенной микрофлоры глотки на чувствительность дыхательных путей, вызванную воздействием как патогена, так и аллергена.Наше исследование впервые показывает, что после инфицирования RSV в раннем возрасте нарушение микрофлоры глотки антибиотиками может способствовать одновременному увеличению AHR и снижению Treg-клеток легких.
Материалы и методы
Модель животных и Заявление об этике
Самок мышей BALB / c (10 ± 2 г, возраст 3 недели) содержали в определенных условиях, свободных от патогенов, в индивидуальных вентилируемых клетках в Центре лабораторных животных Медицинского университета Чунцина. Животные получали корм и стерильную воду ad libitum .Протоколы лечения были следующими: (1) пероральное лечение цефоперазоном ad libitum после инфицирования RSV: содержало группу RSV + 7d-антибиотиков и группу RSV + 14d-антибиотиков; (2) пероральное лечение цефоперазоном ad libitum после имитации инфекции: включает группу 7d-антибиотиков и группу 14d-антибиотиков; (3) пероральная обработка ddH 2 O ad libitum после инфицирования RSV: содержала группы RSV, испытанные при 8 днях после инъекции и 15 днях после инфицирования; (4) пероральная обработка ddH 2 O ad libitum после имитации инфекции: содержала фиктивные группы, испытанные при 8 днях после инъекции и 15 днях после инфицирования.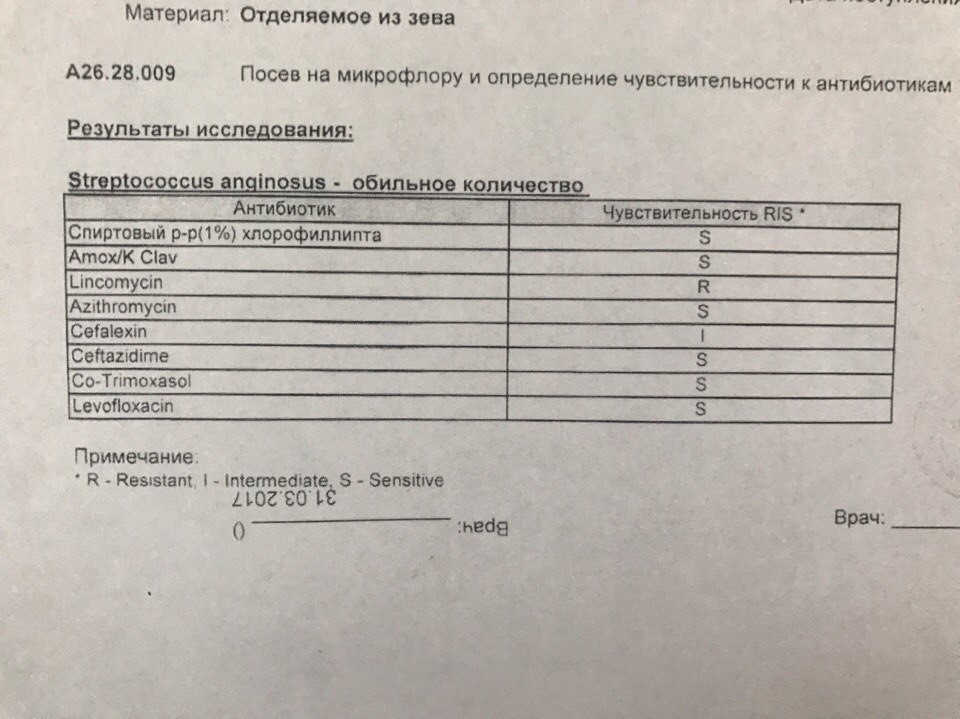 Изменения микрофлоры глотки тестировали с помощью полимеразной цепной реакции (ПЦР) при 8 днях после инъекции и 15 днях после инъекции. Воспаление дыхательных путей, AHR, ответы Treg-клеток легких и селезенки анализировались параллельно. Для амплификации AHR после инфицирования RSV вводили 1% (1 г / 100 мл PBS) аэрозольное заражение OVA в течение 30 мин / день от 8 дней до 14 дней после инфицирования, и проводили идентичные тесты при 15 днях после инфицирования. Проба PBS использовалась в качестве контроля. Все животные проходили лечение в строгом соответствии с руководящими принципами по использованию и уходу за лабораторными животными Китайского CDC и Правилами для медицинских лабораторных животных (1998 г.) Министерства здравоохранения Китая в соответствии с протоколами, утвержденными Национальным институтом по контролю за инфекционными заболеваниями. и профилактика.Все действия с животными были одобрены Этническим комитетом Медицинского университета Чунцина.
Изменения микрофлоры глотки тестировали с помощью полимеразной цепной реакции (ПЦР) при 8 днях после инъекции и 15 днях после инъекции. Воспаление дыхательных путей, AHR, ответы Treg-клеток легких и селезенки анализировались параллельно. Для амплификации AHR после инфицирования RSV вводили 1% (1 г / 100 мл PBS) аэрозольное заражение OVA в течение 30 мин / день от 8 дней до 14 дней после инфицирования, и проводили идентичные тесты при 15 днях после инфицирования. Проба PBS использовалась в качестве контроля. Все животные проходили лечение в строгом соответствии с руководящими принципами по использованию и уходу за лабораторными животными Китайского CDC и Правилами для медицинских лабораторных животных (1998 г.) Министерства здравоохранения Китая в соответствии с протоколами, утвержденными Национальным институтом по контролю за инфекционными заболеваниями. и профилактика.Все действия с животными были одобрены Этническим комитетом Медицинского университета Чунцина.
Вирус
Клетки Hep-2 культивировали в среде DMEM с 10% фетальной бычьей сывороткой (FBS). Штамм RSV A2 выращивали в клетках Hep-2 на среде DMEM с добавлением 2% FBS. Вирус очищали следующим образом: после сбора клеток и супернатанта проводили повторное замораживание и оттаивание для полного высвобождения вируса, а затем центрифугировали при 4 ° C. Супернатант собирали в виде вирусной суспензии и замораживали при -80 ° C.Его отрегулировали так, чтобы он содержал 3-5 × 10 7 БОЕ RSV / мл по оценке с помощью анализа налета.
Заражение мышей
Мышей инфицировали под анестезией путем интраназальной инокуляции RSV (10 6 БОЕ в 100 мкл суспензии вируса). Контрольных мышей ложно инфицировали средой DMEM с 2% FBS, которую центрифугировали в тех же условиях, что и суспензия вируса. Эффективность инфекции подтверждена тестом на чуму и ПЦР в образце цельного легкого [18], [19]. Через 4 дня после рождения мышей умерщвляли.Легкие удаляли и разделяли либо (а) гомогенизировали и культивировали в клетках Hep-2, с последующим исследованием инфекции, показывающим наличие синцитиальных поражений; или (b) использовали для извлечения РНК (реагент Bioteke RNzol, Пекин, Китай) и обратно транскрибировали в кДНК (набор реагентов Takara PrimeScript RT, Далянь, Китай). Праймеры гена белка G RSV были: P1: 5′-TGGGACACTCTTAATCAT-3 ‘и P2: 5′-TGATTCCAAGCTGAGG AT-3’. Продукты ПЦР секвенировали для подтверждения инфекции RSV.
Праймеры гена белка G RSV были: P1: 5′-TGGGACACTCTTAATCAT-3 ‘и P2: 5′-TGATTCCAAGCTGAGG AT-3’. Продукты ПЦР секвенировали для подтверждения инфекции RSV.
Лечение антибиотиками и идентификация глоточных бактерий
Как сообщалось ранее [20], Цефоперазон (0.5 мг / мл; Sigma-Aldrich, Сент-Луис, Миссури, США) вводили перорально мышам ad libitum в питьевой воде. На 8 и 15 дней после эксперимента некоторых мышей умерщвляли случайным образом. Мазки из горла культивировали с использованием колумбийского кровяного агара в инкубаторе с 5% CO 2 в течение 20 часов. Затем все колонии в агаре были собраны и очищены. Тотальную ДНК экстрагировали с помощью DNeasy Kit (QIAGEN, Hilden, Германия). ПЦР консервативной области V3 гена 16s рРНК всех бактерий и специфической области Streptococcus и E coli выполняли для подтверждения индуцированного антибиотиком разрушения микрофлоры глотки.Использовали следующие праймеры: V3 F: 5′-CCTACGGGAGGCAGCAG-3 ‘, R: 5′-ATTACCGC GGCTGCTGG-3’; Streptococcus F: 5′-GTACAGTTGCTTCAGGACGTATC-3 ‘, R: 5′-ACGTTCGATTTCATCACGTTG-3’; E. coli . F: 5′-CAATTTTCGTGTCCCCTTC G-3 ‘, R: 5′-GTTAAT GATAGTGTGTCGAAAC-3’ [21]. Все продукты были проверены путем секвенирования. Подсчет бактериальных колоний глотки проводили следующим образом: мышь умерщвляли, ткань слизистой оболочки глотки удаляли и измельчали в PBS в дозе 100 мг: 1 мл. 10 мкл гомогената ткани слизистой оболочки глотки диспергировали на колумбийском кровяном агаре в инкубаторе с 5% CO 2 в течение 20 часов.Подсчитывали все бактериальные колонии, растущие на Колумбийском кровяном агаре.
Анализ жидкости бронхоальвеолярного лаважа и гомогената легких
Для анализа жидкости бронхоальвеолярного лаважа (BALF) мышь умерщвляли и ее дыхательные пути промывали шесть раз 0,5 мл PBS, затем BALF центрифугировали. Супернатант собирали и хранили при -80 ° C для тестирования IL-10 и TGF-β1 с использованием наборов ELISA (Beijing 4A Biotech Co. , Ltd. China), тогда как клетки внизу классифицировали в соответствии со стандартными морфологическими критериями в 100 клеток с помощью световой микроскопии после окрашивания по Райту-Гимзе.Для анализа гомогената легких мышь умерщвляли, ее легкое удаляли и взвешивали. Всю легочную ткань измельчали в PBS в концентрации 100 мг: 1 мл, а затем центрифугировали гомогенат. Супернатант собирали и хранили при -80 ° C для тестирования IL-10 и TGF-β1 с использованием наборов для ELISA (Beijing 4A Biotech Co., Ltd., Китай).
, Ltd. China), тогда как клетки внизу классифицировали в соответствии со стандартными морфологическими критериями в 100 клеток с помощью световой микроскопии после окрашивания по Райту-Гимзе.Для анализа гомогената легких мышь умерщвляли, ее легкое удаляли и взвешивали. Всю легочную ткань измельчали в PBS в концентрации 100 мг: 1 мл, а затем центрифугировали гомогенат. Супернатант собирали и хранили при -80 ° C для тестирования IL-10 и TGF-β1 с использованием наборов для ELISA (Beijing 4A Biotech Co., Ltd., Китай).
Обнаружение реактивности дыхательных путей
Измерение функции легких проводилось с помощью плетизмографии всего тела (EMKA Technologies, Париж, Франция). AHR выражали как усиленную паузу (Penh) при каждой концентрации метахолина (Sigma-Aldrich, St.Луис, Миссури, США), используя PBS в качестве исходного уровня.
Анализ проточной цитометрии
Для тестирования Treg-клеток легкое и селезенку измельчали отдельно в PBS. Коллагеназа А использовалась только для переваривания легочной ткани. Все клетки пропускали через сито 45 мкм и центрифугировали при 450 g в течение 10 мин при комнатной температуре. Клетки на дне собирали и промывали, а суспензию отдельных клеток отправляли на анализ проточной цитометрии. Моноклональные антитела против CD4-FITC мыши (Clone GK1.5, BD Biosciences, Гейдельберг, Германия), против CD25-PE мыши (Clone PC61.5, eBioscience, SanDiego, USA) и антимышиный Foxp3-PE-Cy5 (Clone FJK-16s, eBioscience, SanDiego, USA) использовали для мечения Treg-клеток. Для внутриклеточного окрашивания Foxp3 использовали фиксацию / пермеабилизацию Foxp3 (eBioscience, SanDiego, США) и 10-кратную пермеабилизацию (eBioscience, SanDiego, США). Для предотвращения неспецифического связывания mAb все образцы предварительно инкубировали с очищенным крысиным IgG: моноклональным антителом против CD16 / CD32 мыши (Clone 2.4G2, BD Biosciences, Гейдельберг, Германия). Клеточные фенотипы измеряли с помощью проточного цитометра BD FacsCaliber, а анализ выполняли с помощью программного обеспечения BD CellQuest.
В реальном времени — Полимеразная цепная реакция
РНК из тканей легких была извлечена и обратно транскрибирована в кДНК. Foxp3 и β-актин количественно определяли с помощью ПЦР в реальном времени (BIO-RAD, Hercules, США). SYBR Green RealMasterMix (TIANGEN, Пекин, Китай), а также следующие праймеры использовали в качестве флуоресценции: Foxp3: F: 5′-AGCTGGAGCTGGAAAAGGA-3 ‘и R: 5′-GCTACGATGCAGCAAGAGC-3′; β-актин F: 5’-TGGCATTGTTACCA ACTGGGAC-3 ‘и R: 5′-TCACGGTTGGCCTTAGGGTTC-3’. Обе мишени запускались в трех экземплярах.
Рисунок 1. Исследование микрофлоры глотки.
(A) ПЦР-амплификация специфической области Streptococcus . 1, маркер; 2, положительный контроль, стрептококк NCTC7466; 3, отрицательный контроль; 4, отсутствие инфекции RSV; оральный ддх3О в течение 7 дней; 5. После заражения RSV пероральный ddh3O в течение 7 дней; 6, отсутствие инфекции RSV, пероральные антибиотики в течение 7 дней; 7. После заражения RSV пероральные антибиотики в течение 7 дней; 8, маркер. Продукт ПЦР, 197 бит / с. (B) ПЦР-амплификация специфической области E.coli . 1, маркер; 2, положительный контроль, E. coli ATCC25922; 3, отрицательный контроль; 4, отсутствие инфекции RSV, пероральный ddh3O в течение 7 дней; 5. После заражения RSV пероральный ddh3O в течение 7 дней; 6, отсутствие инфекции RSV, пероральные антибиотики в течение 7 дней; 7. После заражения RSV пероральные антибиотики в течение 7 дней; 8, маркер. Продукт ПЦР, 450 бит / с.
https://doi.org/10.1371/journal.pone.0041104.g001
Статистический анализ
Graphpad Prism 5.0 с использованием двустороннего дисперсионного анализа с пост-тестами Бонферрони использовали для анализа AHR и анализа воспалительных клеток.Остальные данные сравнивали с помощью критерия Краскала-Уоллиса. Все экспериментальные результаты были выражены как среднее значение ± SEM, и P <0,05 считалось статистически значимым.
Рисунок 2. Воспаление дыхательных путей, анализ гиперчувствительности и гистопатологический анализ.
Воспаление дыхательных путей, анализ гиперчувствительности и гистопатологический анализ.
(A) Подсчет и классификация воспалительных клеток в ЖБАЛ через 8 дней после инъекции. (B) Подсчет и классификация воспалительных клеток в ЖБАЛ через 15 дней после инъекции. (C) Подсчет и классификация воспалительных клеток в ЖБАЛ через 15 дней после инъекции.Было введено воздействие OVA. (D) Анализ гиперреактивности дыхательных путей через 8 дней после инъекции. (E) Анализ гиперреактивности дыхательных путей через 15 дней после инъекции. (F) Анализ гиперреактивности дыхательных путей через 15 дней после инъекции. Было введено воздействие OVA. (H) Гистопатологический анализ (H&E, 100 × и 200 ×) легкого через 8 дней после инъекции. Проникающие воспалительные клетки отмечены стрелкой. (G) Гистопатологический анализ (H&E, 100 × и 200 ×) легкого через 15 дней после инъекции. Проникающие воспалительные клетки отмечены стрелкой. Данные (N = 5-6) представлены как среднее ± SEM трех независимых экспериментов.Обратите внимание, что некоторые группы данных представлены дважды на разных панелях для лучшей интерпретации. * P <0,05, ** P <0,01, *** P <0,001.
https://doi.org/10.1371/journal.pone.0041104.g002
Рис. 3. Анализ проточной цитометрии ответа Treg-клеток и анализ экспрессии мРНК Foxp3 с помощью ПЦР в реальном времени.
(A) Процент легочных Treg-клеток через 8 дней после инъекции. (B) Процент Treg-клеток селезенки через 8 дней после инъекции.(C) Процент легочных Treg-клеток через 15 дней после инъекции. (D) Процент Treg-клеток селезенки через 15 дней после инъекции. (E) Процент легочных Treg-клеток через 15 дней после инъекции. Было введено воздействие OVA. (F) Процент Treg-клеток селезенки через 15 дней после инъекции. Было введено воздействие OVA. (G) Относительная экспрессия мРНК Foxp3 в легких через 15 дней после инъекции. Группу, получавшую имитацию, использовали в качестве стандарта. (H) Относительная экспрессия мРНК Foxp3 в легких через 15 дней после введения OVA. Группу, получавшую имитацию, использовали в качестве стандарта. Данные (N = 5-6) FCM представлены как среднее ± SEM трех независимых экспериментов.Обратите внимание, что некоторые группы данных представлены дважды на разных панелях для лучшей интерпретации. Данные каждой группы в анализе экспрессии мРНК основаны на N = 7-8. * P <0,05, ** P <0,01, *** P <0,001.
Группу, получавшую имитацию, использовали в качестве стандарта. Данные (N = 5-6) FCM представлены как среднее ± SEM трех независимых экспериментов.Обратите внимание, что некоторые группы данных представлены дважды на разных панелях для лучшей интерпретации. Данные каждой группы в анализе экспрессии мРНК основаны на N = 7-8. * P <0,05, ** P <0,01, *** P <0,001.
https://doi.org/10.1371/journal.pone.0041104.g003
Рисунок 4. ELISA-анализ IL-10 и TGF-β1 в ЖБАЛ.
(A) Экспрессия IL-10 в ЖБАЛ. (B) Экспрессия TGF-β1 в ЖБАЛ. (C) Экспрессия IL-10 в гомогенате.(D) Экспрессия TGF-β1 в гомогенате. Данные (N = 7-9) представлены как среднее ± SEM двух независимых экспериментов. * P <0,05, ** P <0,01, *** P <0,001.
https://doi.org/10.1371/journal.pone.0041104.g004
Результаты
Инфекция RSV у мышей
Мышей, инфицированных RSV, умерщвляли через 4 дня после инъекции. Титры RSV в легких анализировали с помощью анализа бляшек как 60,68 ± 11,71 БОЕ / мл легочного гомогената. Инфекция RSV также была подтверждена с помощью ПЦР и секвенирования.
Цефоперазон нарушает микрофлору глотки у мышей
Без лечения преобладающей глоточной комменсальной бактерией был Streptococcus, , как описано ранее [22]. После обработки цефоперазоном в течение 7 дней, Streptococcus в слизистой оболочке глотки мышей исчезли (фиг. 1A), тогда как некоторые устойчивые E coli были обнаружены (фиг. 1B). Количество бактериальных колоний после лечения цефоперазоном (3,00 ± 0,58 × 10 3 КОЕ / г ткани слизистой оболочки глотки) было заметно меньше количества (127.30 ± 5,13 × 10 3 КОЕ / г ткани слизистой оболочки глотки) в имитационной группе. Инфекция RSV не повлияла на преобладающую микрофлору согласно ПЦР-анализу (рис. 1A, 1B). Через 15 дней после инъекции было обнаружено такое же изменение микрофлоры глотки (данные не показаны).
Нарушение микрофлоры глотки антибиотиками способствует развитию AHR после инфицирования RSV
Подсчет воспалительных клеток в ЖБАЛ, гистологический анализ и тесты AHR были выполнены при 8 днях после инъекции и 15 днях после инъекции (рис. 2A – H). Инфекция RSV вызвала очевидное увеличение воспалительных клеток в ЖБАЛ через 8 дней после инъекции, но не через 15 дней (рис.2А, 2Б). Обнаружены достоверные различия в подгруппах этих воспалительных клеток. В норме в ЖБАЛ преобладали макрофаги (рис. 2А, 2Б). Повышенное количество лимфоцитов наблюдалось в ЖБАЛ через 8 дней после инъекции и 15 дней после инъекции, тогда как количество макрофагов не увеличивалось сильно и даже уменьшалось через 15 дней после инъекции (фиг. 2A, 2B). Сама по себе инфекция RSV не вызывала явной AHR в эти моменты времени (рис. 2D, 2E). Гистопатологический анализ показал, что после инфицирования RSV большее количество воспалительных клеток инфильтрировалось вокруг бронхов через 8 дней после инъекции (рис.2G) и 15 дней после инъекции (рис. 2H), хотя это повреждение было уменьшено на 15 дней после инъекции по сравнению с 8 днями после инъекции. Лечение антибиотиками после инфицирования RSV также привело к накоплению воспалительных клеток в дыхательных путях, опять же преимущественно лимфоцитов, через 8 дней после инфицирования (фиг. 2A) и 15 дней после инфицирования (фиг. 2B). Лечение антибиотиками после инфицирования RSV индуцировало AHR в ответ на провокацию метахолином в высоких концентрациях через 15 дней после инъекции, но не через 8 дней после инъекции (фиг. 2D, 2E). Гистопатологическое повреждение в группе, получавшей RSV плюс антибиотик, не показало значительных отличий от таковой в группах с RSV-инфекцией в эти моменты времени (рис.2G, 2H). Само по себе лечение антибиотиками явно не влияло на количество воспалительных клеток в ЖБАЛ, гистопатологическое повреждение или AHR по сравнению с имитационной группой (рис. 2A – H). В ответ на провокацию OVA не наблюдалось тенденций к ухудшению количества воспалительных клеток в тестах BALF или AHR (рис.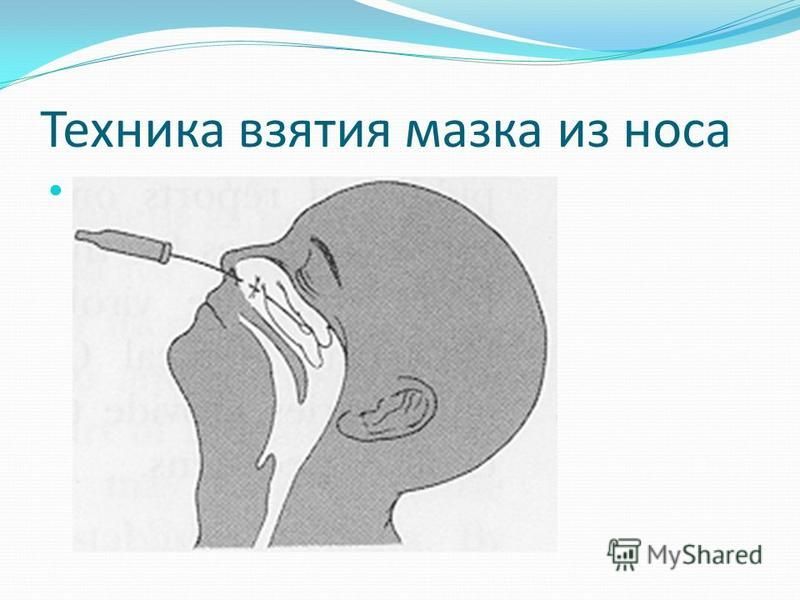 2C, 2F), хотя большая инфильтрация воспалительных клеток была обнаружена вокруг бронхов (рис. 2H).
2C, 2F), хотя большая инфильтрация воспалительных клеток была обнаружена вокруг бронхов (рис. 2H).
Нарушение микрофлоры глотки антибиотиками приводит к снижению легочных Treg-клеток и экспрессии мРНК Foxp3 после заражения RSV
Чтобы исследовать изменения в Treg-клетках, их процентное содержание было протестировано синхронно в легких и селезенке.Через 8 дней после инъекции не было обнаружено явных различий между всеми группами. Инфекция RSV увеличивала количество CD4 + CD25 + клеток в легких и CD4 + Foxp3 + клеток селезенки (фиг. 3A, 3B). Одно только лечение антибиотиками уменьшало количество CD4 + Foxp3 + клеток в легких (фиг. 3A). После инфицирования RSV лечение антибиотиками уменьшало количество CD4 + Foxp3 + клеток в селезенке, но не в легких (фиг. 3A, 3B) по сравнению с таковой при инфицировании только RSV. Через 15 дней после инъекции в легких наблюдались явные изменения. После инфицирования RSV количество клеток CD4 + CD25 + Foxp3 + увеличивалось в легких, хотя, что интересно, увеличение количества клеток CD4 + CD25 + Foxp3 + ингибировалось в группе, получавшей инфекцию RSV плюс лечение антибиотиками (рис.3С). Одно только лечение антибиотиками также ингибировало легочные CD4 + CD25 + Foxp3 + клетки, хотя этот эффект не достиг уровня статистической значимости. Различия в селезенке не были очевидны (рис. 3D). В ответ на провокацию OVA это явление ингибирования антибиотиком также наблюдалось в легких и селезенке (фиг. 3E, 3F). Сходные тенденции наблюдались также при анализе экспрессии мРНК Foxp3 в легких (рис. 3G, 3H).
Нарушение микрофлоры глотки антибиотиками снижает уровень TGF-β1 в гомогенате легких после инфицирования RSV
IL-10 и TGF-β1 в ЖБАЛ и гомогенате легких тестировали через 15 дней после введения.В BALF инфекция RSV увеличивала экспрессию IL-10. В отличие от изменения легочных Treg-клеток, лечение антибиотиками после инфицирования RSV привело к увеличению экспрессии IL-10 в BALF (фиг. 4A). Никаких явных изменений в экспрессии TGF-β1 не наблюдалось среди различных групп (фиг.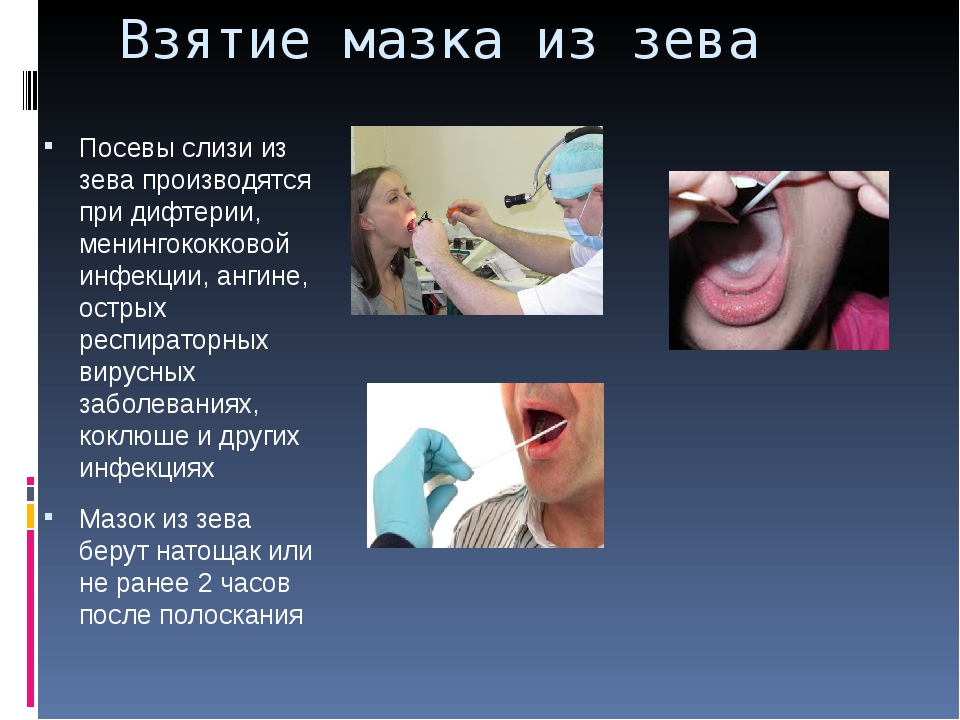 4B) в BALF. В гомогенате легких как лечение только антибиотиками, так и инфекция RSV плюс лечение антибиотиками могут повышать уровень IL-10 (рис. 4C), тогда как лечение антибиотиками после инфицирования RSV снижает уровень TGF-β1 по сравнению с группой, инфицированной только RSV (рис.4D).
4B) в BALF. В гомогенате легких как лечение только антибиотиками, так и инфекция RSV плюс лечение антибиотиками могут повышать уровень IL-10 (рис. 4C), тогда как лечение антибиотиками после инфицирования RSV снижает уровень TGF-β1 по сравнению с группой, инфицированной только RSV (рис.4D).
Обсуждение
RSV — наиболее распространенный патоген, связанный с риском хрипов у младенцев и детей раннего возраста. Stein RT, et al. обнаружили, что бронхиолит, вызванный RSV в раннем возрасте, связан с повышенным риском хрипов позже [23]. Другое исследование показывает, что дети, госпитализированные по поводу бронхиолита в младенчестве, имеют более частые эпизоды свистящего дыхания и повторные посещения по поводу астмы в возрасте семи лет по сравнению с контрольной группой того же возраста [24]. Однако не у всех младенцев с бронхиолитом в дальнейшем разовьются повторяющиеся хрипы.Триггерные факторы сложны и до конца не изучены. Результаты наших исследований показали, что нарушение микрофлоры глотки из-за чрезмерного использования антибиотиков широкого спектра действия после инфицирования RSV в раннем возрасте может вызвать AHR. Насколько нам известно, это первое исследование, посвященное влиянию микрофлоры глотки на воспаление дыхательных путей и последующую AHR после инфицирования RSV.
Во-первых, мы продемонстрировали нарушение микрофлоры глотки после приема пероральных антибиотиков.В нормальных условиях преобладающей глоточной бактерией был Streptococcus , что соответствовало предыдущим исследованиям [22]. Можно предположить, что быстрый рост преобладающего Streptococcus в ограниченном пространстве конкурентно подавлял рост недоминантной E coli. Следовательно, Streptococcus был положительным, тогда как E coli был отрицательным в группах, не получавших антибиотики. После лечения антибиотиками был выведен Streptococcus , в то время как устойчивые к антибиотикам E coli остались. Это сняло ограничение по пространству для роста E coli . Следовательно, Streptococcus был отрицательным, тогда как E coli был положительным в группах, получавших антибиотики.
Это сняло ограничение по пространству для роста E coli . Следовательно, Streptococcus был отрицательным, тогда как E coli был положительным в группах, получавших антибиотики.
Во-вторых, мы продемонстрировали нарушение микрофлоры глотки антибиотиками, вызванное AHR после инфицирования RSV. В нашем исследовании инфекция RSV вызвала большее накопление воспалительных клеток в ЖБАЛ и инфильтрацию вокруг бронхов через 8 дней после инъекции. Кроме того, после периода острого воспаления воспаление уменьшилось относительно через 15 дней после инъекции.Однако в эти моменты времени AHR не был обнаружен. В разных исследованиях время сохранения AHR после инфицирования RSV варьируется. [25], [26]. Пик AHR может быть обнаружен в течение первых 6 дней после инфицирования RSV, после чего этот эффект быстро снижается. В этом исследовании тесты AHR проводились при 8 и 15 днях после пика, которые выходили за пределы этого пикового периода. Это считается причиной отсутствия AHR в нашей модели инфекции RSV. Фактически, мы обнаружили, что пик AHR появился на 4 днях пи, уменьшился на 6 дней пи и вернулся к нормальному уровню через 8 дней пи (данные не показаны).Однако, когда микрофлора глотки была нарушена лечением антибиотиками в течение 14 дней после инфицирования, AHR значительно индуцировалась через 15 дней после инфицирования, что указывает на влияние микрофлоры глотки на чувствительность дыхательных путей.
Сообщалось о взаимосвязи между бактериальной колонизацией у новорожденных и повторяющимся хрипом в более позднем детстве. Проспективное исследование астмы в когорте детей в Копенгагене показывает, что новорожденные, колонизированные определенными бактериями в гипофарингеальной области, подвергаются повышенному риску рецидивов хрипов и астмы в раннем возрасте [3].Бактериальные колонии в дыхательных путях различаются у детей с повторяющимся хрипом и здоровых детей [9]. Появляется все больше свидетельств того, что нарушение микрофлоры, вызванное антибиотиками, сопровождающееся повторным заражением аллергеном, нарушает иммунный баланс дыхательных путей и усугубляет воспаление дыхательных путей [16], [20].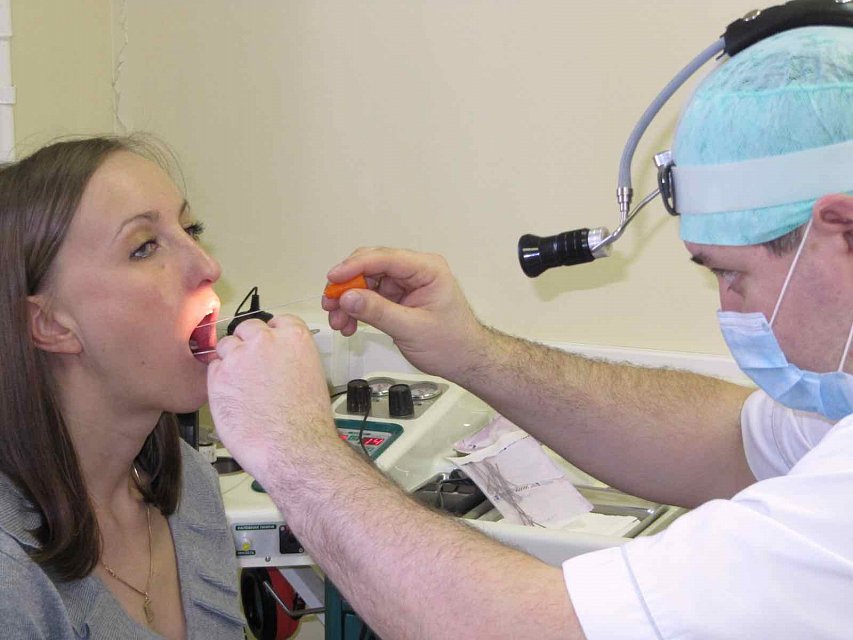 В этих исследованиях все воспаление дыхательных путей и AHR были вызваны аллергеном. Наше исследование впервые продемонстрировало влияние комменсальной микрофлоры глотки на патоген-индуцированное воспаление дыхательных путей и AHR.
В этих исследованиях все воспаление дыхательных путей и AHR были вызваны аллергеном. Наше исследование впервые продемонстрировало влияние комменсальной микрофлоры глотки на патоген-индуцированное воспаление дыхательных путей и AHR.
В-третьих, мы наблюдали, что нарушение микрофлоры глотки антибиотиками приводит к снижению экспрессии Treg-клеток и мРНК Foxp3 в легких после инфицирования RSV. Поиск молекулярного маркера, специфичного для Treg-клеток, показал, что большинство, если не все, из этих клеток конститутивно экспрессируют молекулу CD25, а истощение CD25 + CD4 + Т-клеток спонтанно вызывает аутоиммунное заболевание [27]. Недавние усилия показали, что природные Treg-клетки специфически экспрессируют фактор транскрипции Foxp3 и что мутации гена Foxp3 вызывают множество иммунологических заболеваний у людей [28].В нашем исследовании были проанализированы частоты CD4 + CD25 + Foxp3 +, CD4 + Foxp3 + и CD4 + CD25 + клеток. Инфекция RSV индуцирует Treg-клетки, о чем широко сообщалось в исследованиях на людях и животных [11] — [13]. В нашем исследовании после инфицирования RSV количество легочных Treg-клеток значительно увеличилось через 15 дней после инъекции. Легочные Treg-клетки не были полностью активированы в течение раннего адаптивного иммунного периода при 8 сутках после инъекции, что могло бы объяснить отсутствие увеличения при 8 сутках после инъекции. Ингибирующий эффект лечения антибиотиками в течение 14 дней на легочные Treg-клетки был подтвержден с помощью проточной цитометрии и теста экспрессии мРНК Foxp3.Более того, в группе, получавшей только антибиотик, ингибирующий эффект был преимущественно сосредоточен на CD4 + Foxp3 + клетках. Наши результаты согласуются с предыдущими исследованиями, которые показывают более низкую относительную экспрессию гена Foxp3 у стерильных мышей [29] и высокую частоту аденоидных Treg-клеток у детей с положительной культурой носоглоточного пневмококка, что указывает на роль комменсальной микрофлоры глотки. поддержание иммунного гомеостаза за счет пролиферации Treg-клеток [10].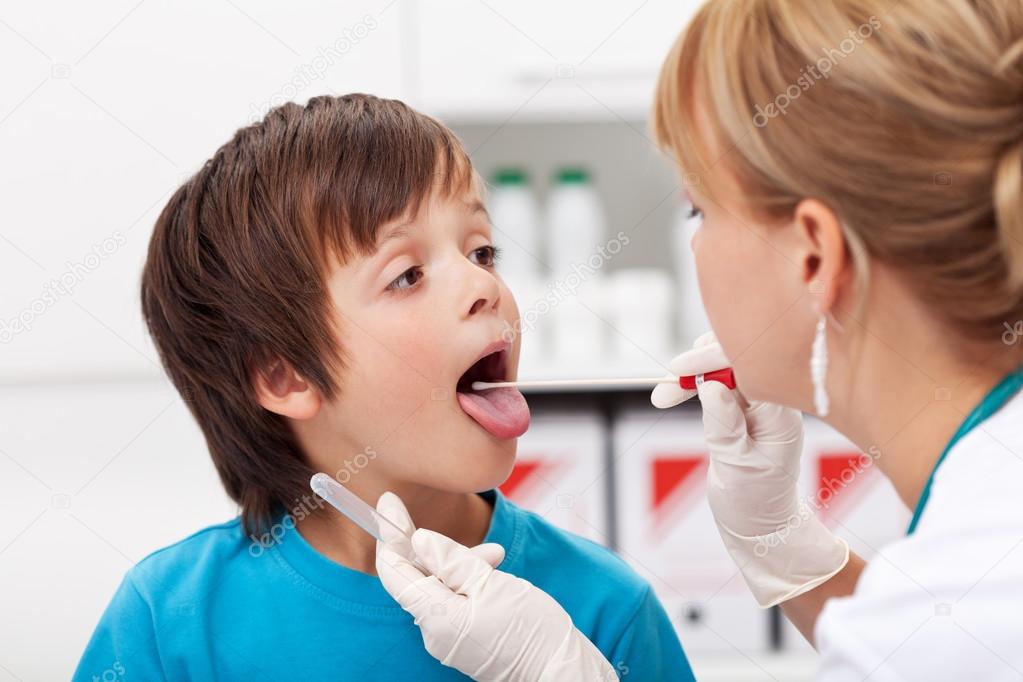 Эти исследования предоставляют четкие доказательства влияния комменсальной колонизации на иммунную толерантность, опосредованную Treg-клетками.Комменсальная микрофлора способствует пролиферации Treg-клеток [10], [30], [31]. В нашем исследовании лечение антибиотиками значительно уменьшило комменсальную микрофлору глотки, поэтому запретило стимуляцию пролиферации Treg-клеток. Ответ Treg-клеток селезенки отличался от легочного, что указывало на то, что влияние нарушения микрофлоры глотки ограничивалось в пределах местных тканей.
Эти исследования предоставляют четкие доказательства влияния комменсальной колонизации на иммунную толерантность, опосредованную Treg-клетками.Комменсальная микрофлора способствует пролиферации Treg-клеток [10], [30], [31]. В нашем исследовании лечение антибиотиками значительно уменьшило комменсальную микрофлору глотки, поэтому запретило стимуляцию пролиферации Treg-клеток. Ответ Treg-клеток селезенки отличался от легочного, что указывало на то, что влияние нарушения микрофлоры глотки ограничивалось в пределах местных тканей.
Что наиболее интересно в нашем исследовании, направление изменения легочных Treg-клеток контрастировало с направлением изменения AHR.Этот вывод согласуется с предыдущим исследованием, показывающим, что противодействие ответа Treg-клеток по сравнению с изменениями AHR, вызванными аллергеном [32]. Более того, ослабление AHR, опосредованное Treg-клетками дыхательных путей, было подтверждено адаптивным переносом Treg-клеток мышам [33]. Иными словами, в нашем исследовании AHR была вызвана инфекцией патогена.
Наконец, исследовали уровень IL-10 и TGF-β1 в ЖБАЛ и гомогенате легких. IL-10 и TGF-β1 считаются эффекторными цитокинами периферических Treg-клеток.Treg-клетки, коэкспрессирующие TGF-β1 и IL-10, способствуют подавлению индуцированной аллергеном AHR [33]. В нашем исследовании повышение уровня ИЛ-10 в ЖБАЛ и гомогенате легких наблюдалось в группе лечения РСВ-инфекции плюс антибиотики через 15 дней после инъекции, что, по-видимому, противоречило изменению легочных Treg-клеток. Фактически, IL-10 также продуцируется клетками Th3 [34]. IL-10, происходящий из Treg-клеток в ЖБАЛ и гомогенате легких, вряд ли может быть протестирован с помощью ELISA, поэтому требуется другой точный метод. С другой стороны, снижение TGF-β1 в гомогенате легких наблюдалось в группе с инфекцией RSV плюс лечение антибиотиками через 15 дней после инъекции, что происходило параллельно со снижением количества легочных Treg-клеток.TGF-β1 может продуцироваться лимфоцитами, макрофагами и дендритными клетками [35].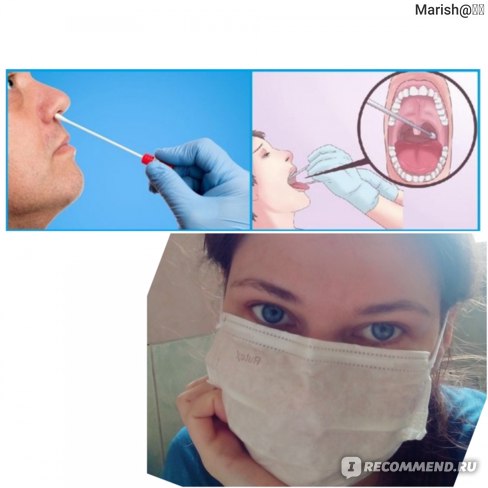 Исследования TGF-β1 и AHR показывают, что повышенная AHR связана со сниженной экспрессией TGF-β1 и Foxp3 в легких [36], а TGF-β1 подавляет гиперчувствительность дыхательных путей при аллергическом заболевании дыхательных путей [37]. TGF-β1 также подавляет AHR, индуцированную вирусом парагриппа [38]. Наше исследование также обнаружило более высокую AHR, когда лечение 14d-антибиотиком уменьшало легочный TGF-β1 после инфекции RSV. TGF-β1 в BALF не показал никаких изменений. По нашему мнению, низкий уровень TGF-β1 в ЖБАЛ (всего около 60 пг / мл) может скрывать различия между каждой группой.
Исследования TGF-β1 и AHR показывают, что повышенная AHR связана со сниженной экспрессией TGF-β1 и Foxp3 в легких [36], а TGF-β1 подавляет гиперчувствительность дыхательных путей при аллергическом заболевании дыхательных путей [37]. TGF-β1 также подавляет AHR, индуцированную вирусом парагриппа [38]. Наше исследование также обнаружило более высокую AHR, когда лечение 14d-антибиотиком уменьшало легочный TGF-β1 после инфекции RSV. TGF-β1 в BALF не показал никаких изменений. По нашему мнению, низкий уровень TGF-β1 в ЖБАЛ (всего около 60 пг / мл) может скрывать различия между каждой группой.
В заключение, наше исследование показало, что лечение антибиотиками нарушает микрофлору глотки и устраняет ее способность стимулировать пролиферацию и активность Treg-клеток, впоследствии способствуя AHR в ответ на инфекцию RSV. Лимфоидные ткани, расположенные в слизистой оболочке, и лимфоидная ткань, связанная со слизистой оболочкой (MALT), являются первыми местами, контактирующими с комменсальной флорой [39]. Типичный MALT в дыхательных путях содержит ассоциированные с носом лимфоидные ткани (NALT) и лимфоидные ткани, ассоциированные с бронхами (BALT), оба из которых составляют клеточную композицию, ожидаемую в иммунно-индуктивном участке, и обладают способностью реагировать на антигены дыхательных путей [ 40].Это может обеспечить иммуноиндуктивный сайт для окружающей микрофлоры. Лечение антибиотиками после инфицирования RSV нарушит микрофлору глотки, потенциально повлияет на местный иммунный ответ и тем самым приведет к AHR. Поэтому после инфицирования RSV следует осторожное применение антибиотиков.
Благодарности
Мы хотели бы поблагодарить сотрудников Центра лабораторных животных Медицинского университета Чунцина за их помощь в кормлении животных. Мы также ценим техническую помощь заместителя главного техника Синь Ли в проточной цитометрии.
Вклад авторов
Задумал и спроектировал эксперименты: EL KN NZ YD XX ZL ZF. Проведены эксперименты: KN NZ QX.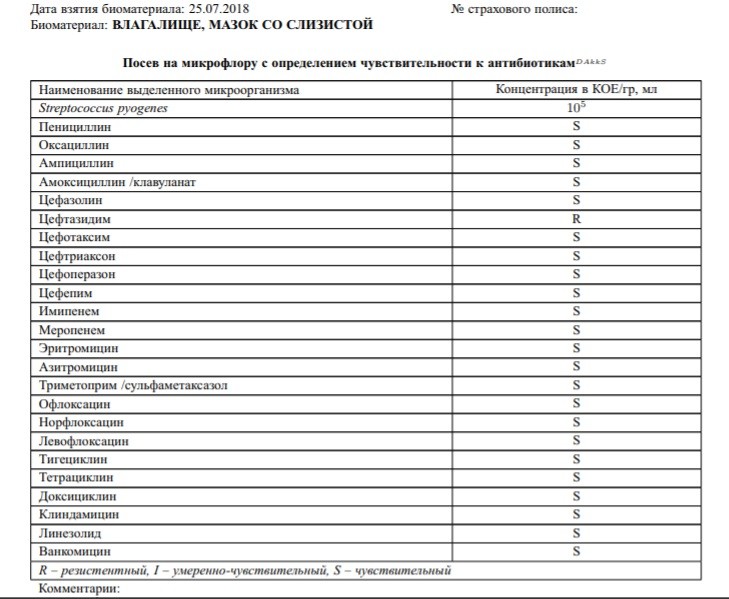 Проанализированы данные: KN NZ SL. Предоставленные реагенты / материалы / инструменты анализа: LW YL. Написал статью: КН ЭЛ. Получено разрешение на использование клеточной линии: Hep-2: LW.
Проанализированы данные: KN NZ SL. Предоставленные реагенты / материалы / инструменты анализа: LW YL. Написал статью: КН ЭЛ. Получено разрешение на использование клеточной линии: Hep-2: LW.
Список литературы
- 1.
Хендерсон Дж., Хиллиард Т.Н., Шериф А., Сталкер Д., Аль-Шаммари Н. и др. (2005) Госпитализация по поводу бронхиолита, вызванного RSV, в возрасте до 12 месяцев и последующей астмы, атопии и хрипов: продольное когортное исследование при рождении.Pediatr Allergy Immunol. 16: 386–392. - 2.
Penders J, Kummeling I, Thijs C (2011) Использование антибиотиков младенцами и риск одышки и астмы — систематический обзор и метаанализ. Eur Respir J. - 3.
Бисгаард Х., Хермансен М.Н., Бухвальд Ф., Лоланд Л., Халькьяер Л.Б. и др. (2007) Детская астма после бактериальной колонизации дыхательных путей у новорожденных. N Engl J Med 357: 1487–1495. - 4.
Spurling GK, Fonseka K, Doust J, Del Mar C (2007) Антибиотики при бронхиолите у детей.Кокрановская база данных Syst Rev. CD005189 p. - 5.
(2006) Диагностика и лечение бронхиолита. Педиатрия 118: 1774–1793. - 6.
Steiner RW (2004) Лечение острого бронхиолита, связанного с RSV. Am Fam Physician 69: 325–330. - 7.
Antonow JA, Hansen K, McKinstry CA, Byington CL (1998) Оценка сепсиса у госпитализированных младенцев с бронхиолитом. Pediatr Infect Dis J 17: 231–236. - 8.
Samson L, Cooke C, Macdonald N (1999) Анализ использования и неправильного использования антибиотиков у детей, госпитализированных с инфекцией RSV.Педиатр по детскому здоровью 4: 195–199. - 9.
Нагаяма Ю., Цубаки Т., Накаяма С., Савада К., Тагучи К. и др. (2007) Бактериальная колонизация респираторных секретов у младенцев и детей с острым и рецидивирующим хрипом. Pediatr Allergy Immunol 18: 110–117. - 10.
Zhang Q, Leong SC, McNamara PS, Mubarak A, Malley R, et al. (2011) Характеристика регуляторных Т-клеток в ассоциированной носовой лимфоидной ткани у детей: взаимосвязь с пневмококковой колонизацией.PLoS Pathog 7: e1002175.
(2011) Характеристика регуляторных Т-клеток в ассоциированной носовой лимфоидной ткани у детей: взаимосвязь с пневмококковой колонизацией.PLoS Pathog 7: e1002175. - 11.
Куси М.Г., Марторелли Б., Ди Дженова Г., Терроси С., Кампочча Г. и др. (2010) Возрастные изменения опосредованного Т-клетками иммунного ответа и эффекторной памяти на респираторно-синцитиальный вирус (RSV) у здоровых субъектов. Иммунное старение 7:14. - 12.
Fulton RB, Meyerholz DK, Varga SM (2010) Foxp3 + CD4-регуляторные Т-клетки ограничивают легочную иммунопатологию, модулируя ответ Т-лимфоцитов CD8 во время респираторно-синцитиальной вирусной инфекции.J Immunol 185: 2382–2392. - 13.
Ли Д.К., Харкер Дж. А., Трегонинг Дж. С., Атабани С.Ф., Йоханссон С. и др. (2010) Природные регуляторные Т-клетки CD25 + имеют решающее значение для ограничения врожденного и адаптивного иммунитета и лечения заболеваний, вызванных респираторно-синцитиальной вирусной инфекцией. J Virol 84: 8790–8798. - 14.
Peebles RS Jr, Graham BS (2005) Патогенез респираторно-синцитиальной вирусной инфекции на мышиной модели. Proc Am Thorac Soc 2: 110–115. - 15.Ruckwardt TJ, Bonaparte KL, Nason MC, Graham BS (2009) Регуляторные Т-клетки способствуют раннему притоку CD8 + Т-клеток в легкие мышей, инфицированных респираторным синцитиальным вирусом, и уменьшают диспропорции иммунодоминирования. J Virol 83: 3019–3028.
- 16.
Sun DQ, Yang XQ, Wang LJ, Li X, Liu EM и др. (2010) [Влияние атомизации овальбумина на субпопуляции Т-лимфоцитов мышей BALB / c с нарушением микрофлоры кишечника]. Си Бао Ю Фен Цзы Миан И Сюэ За Чжи 26: 473–476. - 17.Schwarze J, Hamelmann E, Bradley KL, Takeda K, Gelfand EW (1997) Респираторно-синцитиальная вирусная инфекция приводит к гиперчувствительности дыхательных путей и повышенной сенсибилизации дыхательных путей к аллергену. Дж. Клин Инвест 100: 226–233.
- 18.
Чавес-Буэно С. , Мехиас А., Гомес А.М., Олсен К.Д., Риос А.М. и др. (2005) Острое и хроническое заболевание дыхательных путей, вызванное респираторно-синцитиальным вирусом, не зависит от генетического фона: экспериментальная модель на мышах. Virol J 2: 46.
, Мехиас А., Гомес А.М., Олсен К.Д., Риос А.М. и др. (2005) Острое и хроническое заболевание дыхательных путей, вызванное респираторно-синцитиальным вирусом, не зависит от генетического фона: экспериментальная модель на мышах. Virol J 2: 46. - 19.Schwarze J, Makela M, Cieslewicz G, Dakhama A, Lahn M и др. (1999) Перенос усиливающего эффекта респираторно-синцитиальной вирусной инфекции на последующую аллергическую сенсибилизацию дыхательных путей Т-лимфоцитами. J Immunol 163: 5729–5734.
- 20.
Noverr MC, Falkowski NR, McDonald RA, McKenzie AN, Huffnagle GB (2005) Развитие аллергического заболевания дыхательных путей у мышей после терапии антибиотиками и увеличение грибковой микробиоты: роль генетики хозяина, антигена и интерлейкина-13.Заражение иммунной 73: 30–38. - 21.
Yu Z, Morrison M (2004) Сравнение различных гипервариабельных областей генов rrs для использования в фингерпринтинге микробных сообществ с помощью ПЦР-денатурирующего градиентного гель-электрофореза. Appl Environ Microbiol 70: 4800–4806. - 22.
Cangemi de Gutierrez R, Miguel de Nader O, Ruiz Holgado AP, Nader-Macias ME (1999) Вариации микробной флоры в дыхательных путях мышей. Mem Inst Oswaldo Cruz 94: 701–707. - 23.Stein RT, Sherrill D, Morgan WJ, Holberg CJ, Halonen M, et al. (1999) Респираторно-синцитиальный вирус в раннем возрасте и риск возникновения хрипов и аллергии к 13 годам. Ланцет 354: 541–545.
- 24.
Fjaerli HO, Farstad T, Rod G, Ufert GK, Gulbrandsen P и др. (2005) Острый бронхиолит в младенчестве как фактор риска хрипов и снижения легочной функции на семь лет в округе Акерсхус, Норвегия. BMC Pediatr 5: 31. - 25.
Estripeaut D, Torres JP, Somers CS, Tagliabue C, Khokhar S и др.(2008) Персистенция респираторно-синцитиального вируса в легких коррелирует с гиперреактивностью дыхательных путей на мышиной модели. J Infect Dis 198: 1435–1443. - 26.
Джафри Х. С., Чавес-Буэно С., Мехиас А., Гомес А.М., Риос А.М. и др. (2004) Респираторно-синцитиальный вирус вызывает пневмонию, цитокиновый ответ, обструкцию дыхательных путей и хронические воспалительные инфильтраты, связанные с длительной гиперреактивностью дыхательных путей у мышей. J Infect Dis 189: 1856–1865.
С., Чавес-Буэно С., Мехиас А., Гомес А.М., Риос А.М. и др. (2004) Респираторно-синцитиальный вирус вызывает пневмонию, цитокиновый ответ, обструкцию дыхательных путей и хронические воспалительные инфильтраты, связанные с длительной гиперреактивностью дыхательных путей у мышей. J Infect Dis 189: 1856–1865. - 27.
Сакагути С. (2011) Регуляторные Т-клетки: история и перспективы.Методы Мол Биол 707: 3–17. - 28.
Сакагути С., Крыло К., Мияра М. (2007) Регуляторные Т-клетки — краткая история и перспектива. Eur J Immunol 37: S116–123. - 29.
Ostman S, Rask C, Wold AE, Hultkrantz S, Telemo E (2006) Нарушение функции регуляторных Т-клеток у мышей без микробов. Eur J Immunol 36: 2336–2346. - 30.
Бассет С., Тиам Ф., Мартино С.Д., Холтон Дж., Клементс Дж. Д. и др. (2010) Холероподобные энтеротоксины и регуляторные Т-клетки.Токсины (Базель) 2: 1774–1795. - 31.
Scerbo MJ, Bibolini MJ, Roth GA, Monferran CG (2012) Пептид синапсина, слитый с субъединицей B термолабильного токсина E. coli, индуцирует регуляторные Т-клетки и модулирует баланс цитокинов при экспериментальном аутоиммунном энцефаломиелите. J Neuroimmunol 242: 16-25. - 32.
Burchell JT, Wikstrom ME, Stumbles PA, Sly PD, Turner DJ (2009) Ослабление индуцированной аллергеном гиперреактивности дыхательных путей опосредуется регуляторными Т-клетками дыхательных путей.Am J Physiol Lung Cell Mol Physiol 296: L307–319. - 33.
Прессер К., Швинге Д., Вегманн М., Хубер С., Шмитт С. и др. (2008) Совместная экспрессия TGF-beta1 и IL-10 позволяет регуляторным Т-клеткам полностью подавлять гиперреактивность дыхательных путей. J Immunol 181: 7751–7758. - 34.
Дель Прете Дж., Де Карли М., Альмеригогна Ф., Джудизи М.Г., Бьяджиотти Р. и др. (1993) Человеческий IL-10 продуцируется как хелперными клонами Т-клеток 1-го (Th2), так и 2-го типа (Th3) и ингибирует их антиген-специфическую пролиферацию и продукцию цитокинов. J Immunol 150: 353–360.
J Immunol 150: 353–360. - 35.
Letterio JJ, Roberts AB (1998) Регулирование иммунных ответов с помощью TGF-бета. Анну Рев Иммунол 16: 137–161. - 36.
Гордон Э.Д., Сидху С.С., Ван З.Э., Вудрафф П.Г., Юань С. и др. (2012) Защитная роль периостина и TGF-бета при IgE-опосредованной аллергии и гиперчувствительности дыхательных путей. Clin Exp Allergy 42: 144–155. - 37.
Алькорн Дж. Ф., Ринальди Л. М., Яффе Е. Ф., Ван Лун М., Бейтс Дж. Х. и др. (2007) Трансформирующий фактор роста бета1 подавляет гиперчувствительность дыхательных путей при аллергическом заболевании дыхательных путей.Am J Respir Crit Care Med 176: 974–982. - 38.
Uhl EW, Castleman WL, Sorkness RL, Busse WW, Lemanske RF Jr и др. (1996) Персистирование, вызванное вирусом парагриппа, воспаления, фиброза и дисфункции дыхательных путей, связанное с экспрессией TGF-бета 1, у коричневых норвежских крыс. Am J Respir Crit Care Med 154: 1834–1842. - 39.
O’Flaherty S, Saulnier DM, Pot B, Versalovic J (2010) Как пробиотики и пребиотики могут влиять на иммунитет слизистой оболочки? Кишечные микробы 1: 293–300. - 40.
Bienenstock J, McDermott MR (2005) Лимфоидные ткани, связанные с бронхом и носом. Immunol Rev 206: 22–31.
Общие сведения о различных типах тестов на COVID-19
За последние шесть месяцев мировые ученые и эксперты открыли и опробовали уникальные методы выявления коронавируса. По мере того, как наука развивается и становится широко распространенной, вам может быть трудно следовать последним тестам и методикам.Вы не одиноки.
Мы попросили Брайана Мочона, доктора философии, клинического микробиолога и системного медицинского директора в Sonora Quest Laboratories / Laboratory Sciences из Аризоны по тестированию на инфекционные заболевания, поделиться своим мнением об уникальных стратегиях сбора образцов, связанных с тестированием на COVID-19. Он перечислил три способа поставить диагноз — мазки из зева, мазки из носа и мазки из носоглотки. Доктор Мочон также обсудил другие альтернативные методы сбора, такие как использование слюны и объединение образцов пациентов.
Он перечислил три способа поставить диагноз — мазки из зева, мазки из носа и мазки из носоглотки. Доктор Мочон также обсудил другие альтернативные методы сбора, такие как использование слюны и объединение образцов пациентов.
Взятие мазка
Вы, наверное, слышали, как несколько друзей рассказывали о своем опыте получения мазка из носа. Некоторые друзья могут говорить о некотором дискомфорте, в то время как другие пренебрежительно говорят, что в этом нет ничего страшного. Они оба говорят правду. «Эти образцы могут быть собраны с разной глубины носа», — сказал д-р Мочон. «Некоторые мазки предназначены для сбора образцов из носовых стенок ноздри, в то время как другие берутся из более глубоких слоев носовой полости (т. Е. Из носоглотки).Образцы также можно брать из задней стенки глотки, иначе известной как ротоглоточный (ОП) мазок. Все мазки ищут одно и то же — респираторные выделения и инфицированные клетки ».
Так почему же не все просто выбирают наиболее удобный метод? Доктор Мочон объяснил, что «образцы, взятые из более глубоких слоев носоглотки, показали более высокую вирусную концентрацию или титр. Другими словами, у вас больше шансов получить более точный диагноз при взятии образцов с помощью мазков из носоглотки (NP), чем с помощью мазков из носа или горла.По этой причине мазок из носоглотки стал стандартом для надежного тестирования.
«Конечно, есть еще место для сбора образцов из носа или горла», — сказал д-р Мочон. «Очевидно, что они более удобны, но они также могут быть более безопасным методом для пациентов с заболеваниями носа, такими как хронические носовые кровотечения и носовые полипы. Если вы страдаете одним из этих состояний, вам следует поговорить со своим врачом о том, какой тип образца лучше всего соответствует вашим потребностям, но, по возможности, образцы из носоглотки должны быть основным методом сбора.”
Назальный мазок
Фото: cdc.gov
Носоглоточный мазок
Фото: cdc.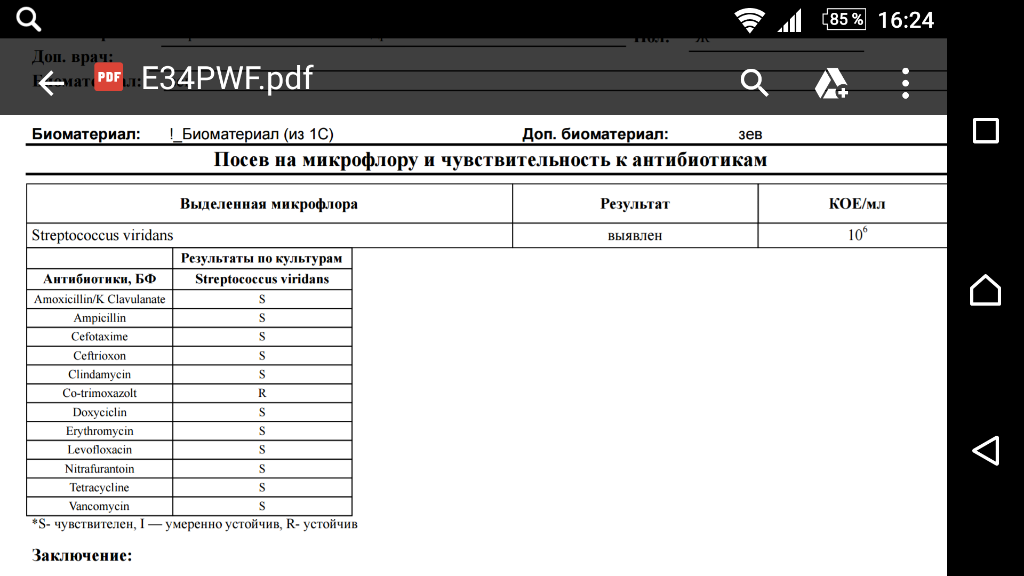 gov
gov
Мазок из горла (ротоглотки)
Фото: cdc.gov
Исследование образца в лаборатории
После взятия тампона его помещают в жидкость, называемую транспортной средой, и отправляют в лабораторию для обработки и тестирования.Фактически, вы можете быть удивлены, узнав, что лаборатория обрабатывает все мазки (носовые, NP и горловые) совершенно одинаково. Это связано с тем, что мазки, используемые в процессе сбора, ищут одно и то же — вирус в респираторном секрете и инфицированных клетках. После того, как тампон помещается в транспортную среду, он предназначен для высвобождения вируса и инфицированных клеток в жидкость. Затем с этой жидкостью проводятся тесты.
Слюна
Доктор Мочон с энтузиазмом отзывался об этом типе образцов.«Некоторые ранние данные из различных лабораторий по всей стране показали, что слюна может быть столь же надежной, как мазок NP». Далее он сказал, что если будет доказано, что слюна является надежным и точным типом образца, это приведет к более комфортным условиям для пациента и уменьшит потребность в мазках как части сбора. Это очень многообещающе как для пациентов, так и для медицинских работников ».
Доктор Мочон объяснил, что более глубокие мазки NP иногда могут вызывать чихание или рвотные движения, которые затем могут привести к аэрозолизации вируса.Медицинские работники носят маски и другое защитное снаряжение, чтобы обезопасить себя при работе с тампоном NP. Это не проблема со слюной, поскольку пациент просто плюнет в трубку или чашку.
Объединение
В этом методе образцы от нескольких пациентов объединяются и тестируются. Если отрицательно, то предполагается, что все отрицательные. В случае положительного результата лаборатория повторно протестирует каждого пациента индивидуально. Обоснование этого метода заключается в том, чтобы увеличить возможности лаборатории и сэкономить на реагентах для тестирования, которые также были ограничены из-за размера и размаха пандемии COVID-19.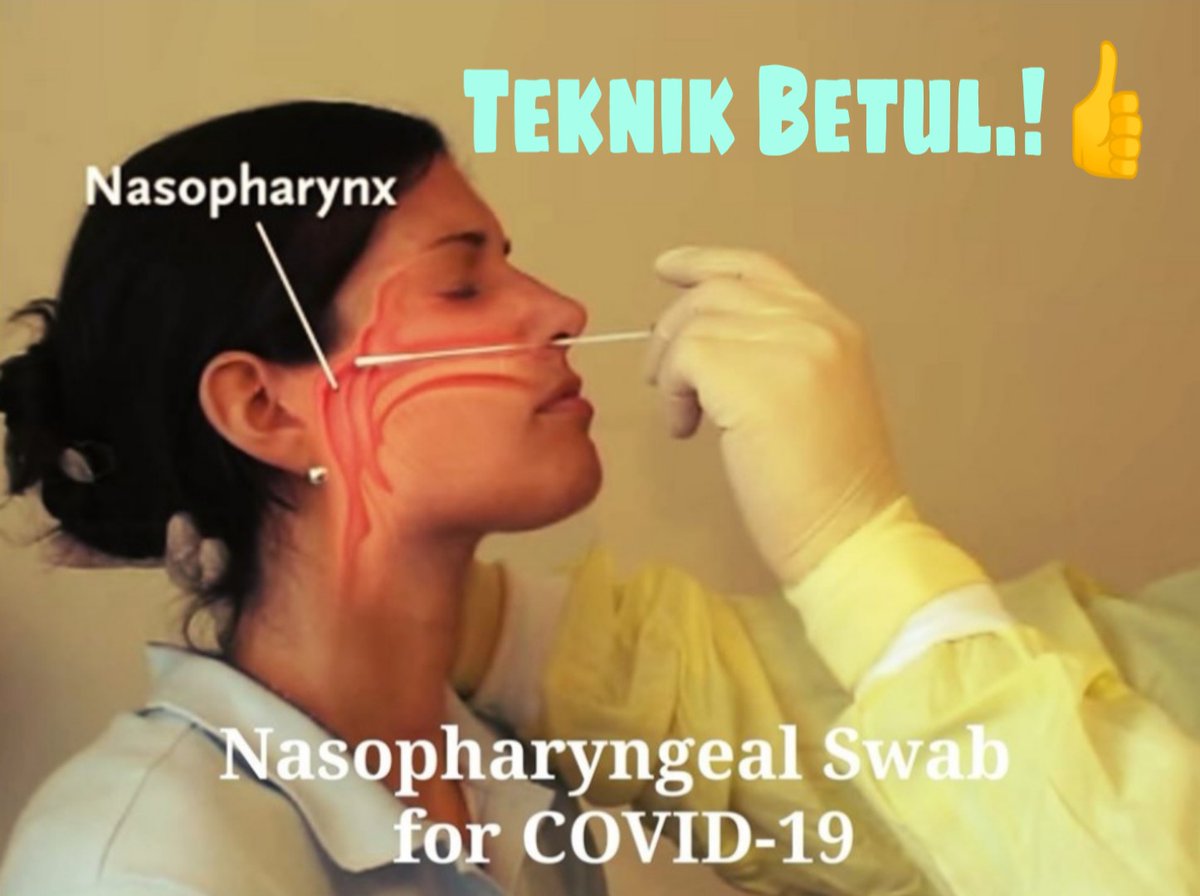 Этот метод можно использовать только в том случае, если распространенность вируса ниже 5-6%.
Этот метод можно использовать только в том случае, если распространенность вируса ниже 5-6%.
Следует ли мне пройти тестирование?
Эти тесты становятся все более доступными, но они по-прежнему предназначены в первую очередь для людей с симптомами. Если у вас нет симптомов, возможно, вы захотите узнать больше о тесте на антитела. Если у вас наблюдаются симптомы, связанные с COVID-19, посетите нашу программу проверки симптомов на сайте bannerhealth.com, чтобы получить информацию о следующих шагах.
Присоединиться к разговору
Временное руководство по клиническим образцам на COVID-19
Сводка последних изменений
По состоянию на 26 февраля 2021 г.
- Добавлено новое руководство по отбору образцов из капиллярных пальцев.
Просмотреть предыдущие обновления
Ключевые моменты
- Тип образца, взятого при тестировании на текущую или прошлую инфекцию SARS-CoV-2, зависит от выполняемого теста и инструкций его производителя. Некоторые из перечисленных ниже типов образцов не подходят для всех испытаний.
- Для первоначального диагностического тестирования на текущие инфекции SARS-CoV-2 CDC рекомендует собрать и протестировать образец из верхних дыхательных путей.
- Это руководство предназначено для медицинских работников или сотрудников департаментов здравоохранения, которые собирают образцы у других в медицинских учреждениях или по месту оказания медицинской помощи.Руководство по самостоятельному сбору образцов можно найти здесь.
В CDC есть рекомендации о том, кого следует тестировать, но решение о том, кого следует тестировать, принимается отделами здравоохранения STLT и / или поставщиками медицинских услуг. Провайдер должен проводить тестирование на наличие других патогенов, как указано, как часть первоначальной оценки, но не должно откладывать тестирование на SARS-CoV-2, вирус, вызывающий COVID-19.
Безопасный сбор и обращение с образцами
Для медицинских работников, собирающих образцы или работающих в пределах 6 футов от пациентов с подозрением на заражение SARS-CoV-2, необходимо поддерживать надлежащий инфекционный контроль и использовать рекомендованные средства индивидуальной защиты (СИЗ), в том числе респиратор N95 или более высокого уровня (или маску для лица). если респиратор отсутствует), защитные очки, перчатки и халат.
Для медицинских работников, которые работают с образцами, но не принимают непосредственного участия в сборе образцов (например, работают с образцами, взятыми самостоятельно) и не работают в пределах 6 футов от пациента, соблюдайте стандартные меры предосторожности. Медицинские работники должны постоянно носить средство контроля источника (лицевую маску) во время нахождения в медицинском учреждении.
Медицинские работники могут свести к минимуму использование СИЗ, если пациенты собирают собственные образцы, сохраняя расстояние не менее 6 футов.
Сбор респираторных образцов
Образцы дыхательных путей следует собирать сразу после принятия решения о проверке кого-либо, независимо от времени появления симптомов.В приведенном ниже руководстве рассматриваются варианты сбора образцов.
Правильный сбор образцов — важнейший этап лабораторной диагностики инфекционных заболеваний. Образец, взятый неправильно, может привести к ложным или неубедительным результатам теста. Следующие ниже инструкции по сбору образцов соответствуют стандартным рекомендуемым процедурам.
Для первоначального диагностического тестирования на текущие инфекции SARS-CoV-2 CDC рекомендует собрать и протестировать образец из верхних дыхательных путей.Свяжитесь с испытательной лабораторией, чтобы подтвердить принятые типы образцов, и следуйте инструкциям производителя по сбору образцов. Для взятия образцов из верхних дыхательных путей следует использовать стерильные тампоны. Это важно как для обеспечения безопасности пациента, так и для сохранения целостности образца.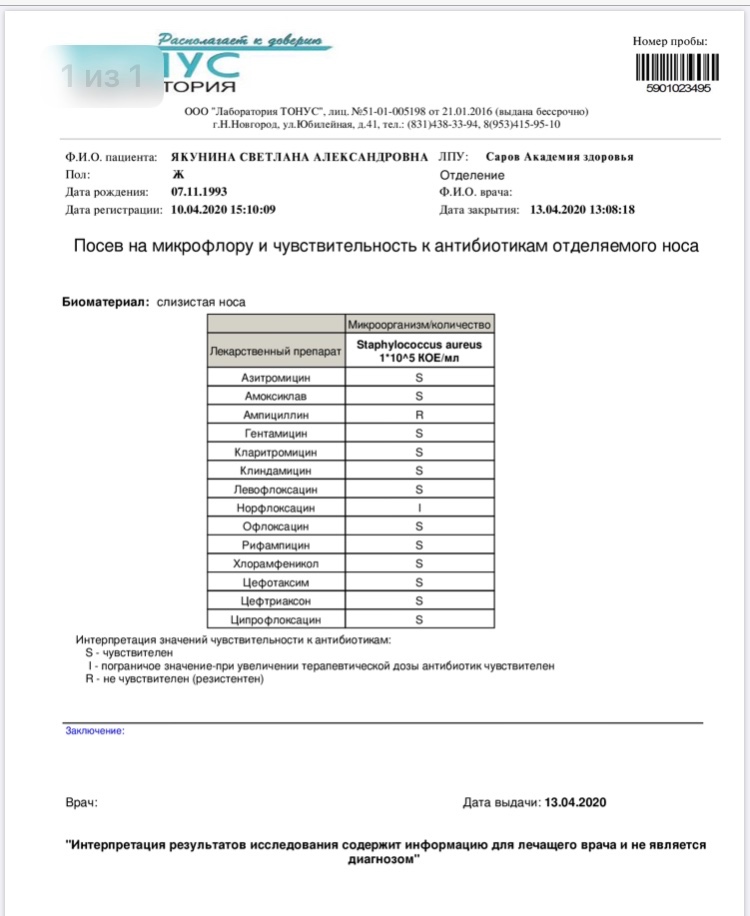 Обратите внимание, что образцы из носоглотки и ротоглотки не подходят для самостоятельного сбора.
Обратите внимание, что образцы из носоглотки и ротоглотки не подходят для самостоятельного сбора.
Также возможно исследование образцов из нижних дыхательных путей. У пациентов, у которых появляется продуктивный кашель, можно собрать мокроту и проверить ее на SARS-CoV-2, если таковая имеется.Однако отведение мокроты не рекомендуется из-за возможности образования аэрозоля во время процедуры. При определенных клинических обстоятельствах (например, для тех, кто получает инвазивную механическую вентиляцию легких), аспират из нижних дыхательных путей или образец бронхоальвеолярного лаважа можно собрать и протестировать как образец из нижних дыхательных путей.
А. Верхние дыхательные пути
Сбор образцов из носоглотки (NP) / Сбор образцов из ротоглотки (OP) (горло) (выполняется только обученным медицинским работником)
Используйте только тампоны из синтетического волокна с тонкими пластиковыми стержнями или стержнями из проволоки, предназначенные для отбора проб слизистой оболочки носоглотки.Не используйте тампоны из альгината кальция или тампоны с деревянными стержнями, так как они могут содержать вещества, инактивирующие некоторые вирусы и препятствующие молекулярным тестам. CDC рекомендует собирать только образец NP, хотя образец OP является приемлемым типом образца. Если собраны как образцы NP, так и OP, объедините их в одну пробирку, чтобы максимизировать чувствительность теста и ограничить использование ресурсов тестирования.
Инструкции по забору образца NP (выполняются обученным медицинским работником):
- Наклоните голову пациента назад на 70 градусов.
- Осторожно и медленно введите тампон minitip с гибким стержнем (проволочным или пластмассовым) через ноздрю параллельно нёбу (не вверх) до тех пор, пока не возникнет сопротивление или расстояние не будет равно расстоянию от уха до ноздри пациента, указывая на то, что контакт с носоглоткой.

- Осторожно потрите и раскатайте тампон.
- Оставьте тампон на несколько секунд для впитывания секрета.
- Медленно удалите тампон, вращая его. Образцы можно собирать с обеих сторон с помощью одного и того же тампона, но нет необходимости собирать образцы с обеих сторон, если minitip пропитан жидкостью из первого сбора.
- Если искривленная перегородка или закупорка затрудняют получение образца из одной ноздри, используйте тот же тампон для получения образца из другой ноздри.
- Поместите тампон кончиком вперед в предусмотренную транспортировочную трубку.
Для визуального руководства см. Инфографический значок в формате pdf «Этапы сбора образцов из носоглотки» [13 МБ, 2 стр.].
Инструкции по забору образца OP (выполняется обученным медицинским работником):
- Вставьте тампон в заднюю часть глотки и миндалины.
- Протрите тампоном обе столбы миндалин и заднюю часть ротоглотки, избегая касания языка, зубов и десен.
- Поместите тампон кончиком вперед в предусмотренную транспортировочную трубку.
Образец из средней носовой раковины (NMT) (выполняется медицинским работником или пациентом после изучения и соблюдения инструкций по сбору):
- Используйте конический тампон.
- Наклоните голову пациента назад на 70 градусов.
- Осторожно вращая тампон, введите тампон на расстояние менее одного дюйма (около 2 см) в ноздрю параллельно нёбу (не вверх) до тех пор, пока не почувствуете сопротивление носовых раковин.
- Поверните тампон несколько раз против стенки носа и повторите процедуру для другой ноздри, используя тот же тампон.
- Поместите тампон кончиком вперед в предусмотренную транспортировочную трубку.
Визуальные руководства
Образец из переднего носа (выполняется медицинским работником или пациентом после изучения и соблюдения инструкций по сбору):
- Вставьте весь наконечник входящего в комплект тампона (обычно от ½ до ¾ дюйма или от 1 до 1,5 см) внутрь ноздри.

- Твердо возьмите образец стенки носа, вращая тампон по круговой траектории относительно стенки носа не менее 4 раз.
- Возьмите образец примерно за 15 секунд. Обязательно соберите любой носовой дренаж, который может присутствовать на тампоне.
- Повторите процедуру для другой ноздри, используя тот же тампон.
- Поместите тампон кончиком вперед в предусмотренную транспортировочную трубку.
Для наглядного руководства см. Инфографику «Как собрать образец мазка из переднего носа для тестирования на COVID-19».значок в формате pdf [133 KB, 2 стр.]
Промывание / аспирация носоглотки или промывание / аспирация носа (выполняется квалифицированным медицинским работником)
- Присоедините катетер к отсасывающему аппарату.
- Наклоните голову пациента назад на 70 градусов.
- Закапать 1–1,5 мл небактериостатического физиологического раствора (pH 7,0) в одну ноздрю.
- Вставьте трубку в ноздрю параллельно нёбу (не вверх). Катетер должен достигать глубины, равной расстоянию от ноздрей до наружного отверстия уха.
- Начните осторожное отсасывание / аспирацию и извлеките катетер, осторожно его вращая.
- Поместите образец в стерильную пробирку со средой для транспортировки вирусов.
Дополнительное наглядное руководство см. В разделах «Назофарингеальный / назальный аспират» или «Назофарингеальный / назальный промывание» в коллекции образцов гриппа infographic.pdf icon
Слюна (полученная пациентом под наблюдением или без):
Соберите 1–5 мл слюны в стерильный герметичный контейнер с завинчивающейся крышкой.Никаких консервантов не требуется. Следуйте дополнительным инструкциям поставщика медицинских услуг или производителя.
Б. Нижние дыхательные пути
Бронхоальвеолярный лаваж, аспират трахеи, плевральная жидкость, биопсия легких (обычно выполняется врачом в условиях больницы)
- Соберите 2–3 мл в стерильную герметичную чашку для сбора мокроты с завинчивающейся крышкой или стерильный сухой контейнер.

- В связи с возросшими техническими навыками и потребностями в оборудовании сбор других образцов, кроме мокроты, из нижних дыхательных путей может быть ограничен пациентами с более тяжелым заболеванием, включая людей, госпитализированных и / или со смертельным исходом.
Мокрота (собранная под руководством квалифицированного медицинского работника)
- Для пациентов, у которых появляется продуктивный кашель, можно собрать и исследовать мокроту, если она доступна для SARS-CoV-2. Однако отведение мокроты не рекомендуется. Объясните пациенту разницу между мокротой (глубокий кашель) и выделениями из ротовой полости (слюна / слюна). Попросите пациента прополоскать рот водой, а затем отхаркивать мокроту от глубокого кашля непосредственно в стерильную герметичную емкость для сбора с завинчивающейся крышкой или стерильный сухой контейнер.
Примечание. Это процедура с образованием аэрозолей, которая может привести к более высоким концентрациям инфекционных респираторных аэрозолей. Процедуры, вызывающие образование аэрозолей, потенциально подвергают медицинских и других лиц повышенному риску воздействия патогенов и инфекции. Медицинские работники должны поддерживать надлежащий инфекционный контроль, включая стандартные меры предосторожности, и при сборе образцов носить респиратор N95 или аналогичный или более высокого уровня, средства защиты глаз, перчатки и халат.
Правильное обращение с стерильными тампонами, расфасованными в массовом порядке, для сбора образцов из верхних дыхательных путей
Стерильные тампоны для взятия образцов из верхних дыхательных путей могут быть упакованы одним из двух способов:
- В индивидуальной упаковке (предпочтительно, если возможно)
- Массовая упаковка
Когда нет в наличии тампонов в индивидуальной упаковке, для взятия образцов можно использовать тампоны в большой упаковке; тем не менее, следует проявлять осторожность, чтобы избежать заражения SARS-CoV-2 каких-либо тампонов в упакованном навалом контейнере.
- Перед взаимодействием с пациентами и в чистом комплекте защитных перчаток разложите отдельные тампоны из контейнера для сыпучих материалов в отдельные стерильные одноразовые пластиковые пакеты.
- Если тампоны, расфасованные без упаковки, нельзя упаковать по отдельности:
- Используйте только свежие чистые перчатки для извлечения одного нового тампона из контейнера для массовых грузов.
- Закройте контейнер тампона для сыпучих материалов после каждого извлечения тампона и оставляйте его закрытым, когда он не используется, чтобы избежать случайного загрязнения.
- Храните открытые упаковки в закрытом герметичном контейнере, чтобы свести к минимуму загрязнение.
- Держите все использованные тампоны подальше от контейнера для тампонов, чтобы избежать загрязнения.
- Как и в случае со всеми тампонами, берите тампон только за дистальный конец тампона, используя только руки в перчатках.
- Когда пациенты самостоятельно собирают мазки под клиническим наблюдением:
- Передавайте мазок пациенту только в чистых защитных перчатках.
- Затем пациент может самостоятельно взять мазок и поместить тампон в транспортную среду или стерильное транспортное средство и закрыть.
- Если пациенту требуется помощь, вы можете помочь пациенту поместить тампон в транспортный носитель или транспортное средство и запечатать его.
Хранение и транспортировка респираторных образцов
Храните респираторные образцы при 2–8 ° C в течение 72 часов после сбора. Если ожидается задержка тестирования или доставки, храните образцы при -70 ° C или ниже.
Упакуйте и отправьте образцы, культуры или изоляты пациентов с подозрением на SARS-CoV-2 как биологическое вещество UN 3373, Категория B, в соответствии с действующей редакцией Правил перевозки опасных грузов Международной ассоциации воздушного транспорта (IATA), значок на внешней стороне и символ U. S. Департамент транспорта (DOT) Безопасная транспортировка инфекционных веществpdf iconeexternal icon. Персонал должен быть обучен упаковывать и отправлять в соответствии с правилами и способом, который соответствует их функциональным обязанностям.
S. Департамент транспорта (DOT) Безопасная транспортировка инфекционных веществpdf iconeexternal icon. Персонал должен быть обучен упаковывать и отправлять в соответствии с правилами и способом, который соответствует их функциональным обязанностям.
Дополнительную информацию об упаковке, отправке и транспортировке образцов можно найти во Временных рекомендациях по лабораторной биобезопасности при обращении и обработке образцов, связанных с коронавирусным заболеванием 2019 (COVID-19).
Доставка образцов в CDC
При необходимости и при предварительном одобрении образцы могут быть отправлены в CDC, если результаты повторных испытаний остаются неубедительными или получены другие необычные результаты.Пожалуйста, свяжитесь с CDC по адресу [email protected] перед отправкой образцов для подтверждения.
Дополнительную информацию, включая форму отправки образцов и адрес доставки, можно найти в разделе «Отправка образцов в CDC».
Сбор образцов капилляров из пальца
Образцы крови используются для тестов на антитела (или серологических), а для некоторых тестов, разрешенных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, которые используются в местах оказания медицинской помощи, образцы собираются путем прокалывания кожи устройством для укола пальца.
Любой, кто выполняет процедуры укола пальцем, должен ознакомиться со следующими рекомендациями, чтобы убедиться, что они не подвергают людей, находящихся под их опекой, риску заражения. Устройства для пальцев никогда не должны использоваться более чем одним человеком из-за риска передачи других инфекционных заболеваний, передающихся через кровь.
Эти рекомендации применимы не только к медицинским учреждениям, но также и к любым учреждениям, где проводятся процедуры пальца.
Инструкция по взятию пробы капиллярной крови из пальца:
- Вымойте руки теплой мыльной водой и тщательно вытрите руки или выполните гигиену рук, используя дезинфицирующее средство для рук на спиртовой основе.

- Наденьте перчатки для взятия пробы крови из пальца.
- Удерживайте руку испытуемого в нижнем положении и помассируйте руку, чтобы улучшить приток крови к пальцам.
- Используйте средний или безымянный палец для сбора образцов. Найдите место укола — оно должно быть немного смещено от центра (с боковой стороны) на мясистой части кончика пальца.
- Очистите место прокола салфеткой из 70% изопропилового спирта и дайте ему высохнуть на воздухе.
- Используйте устройство для сбора, предоставленное производителем, или одноразовый одноразовый ланцет, который убирается при проколе, для выполнения укола пальцем. Следуйте инструкциям производителя при использовании его устройства для сбора.
- Прижмите устройство для сбора пальцев или ланцет к боковой поверхности подушечки пальца и активируйте, чтобы выполнить прокол. При использовании ланцета сделайте один прокол одним плавным движением.
- Осторожно сожмите основание пальца, чтобы в месте прокола образовалась капля крови.Избегайте многократного или слишком сильного сжатия пальца. Вытрите первую каплю крови и следуйте инструкциям производителя, чтобы заполнить капиллярную пробирку для забора крови, или нанесите вторую каплю крови на тестовое устройство.
- Утилизируйте использованные устройства для сбора пальцев и ланцеты сразу же в месте использования в одобренном контейнере для острых предметов. Никогда не используйте ланцеты повторно.
- Сильно надавите на место прокола чистой марлей в течение пяти-десяти секунд после сбора образца, чтобы убедиться, что кровотечение остановилось.При необходимости нанесите на место самоклеящуюся полоску из латекса.
- Правильно снимите перчатки и утилизируйте их в соответствующие емкости. Меняйте перчатки между контактами с каждым испытуемым. Перед тем, как прикасаться к чистым поверхностям, смените перчатки, которые касались потенциально загрязненных кровью предметов или ран от пальцев.
- Тщательно вымойте и высушите руки или выполните гигиену рук сразу после снятия перчаток и перед тем, как прикасаться к медицинским принадлежностям, предназначенным для использования другими людьми.



 4%)
4%) Изменения / проблемы:
Изменения / проблемы: В частности, были проведены научные клинические исследования, в которых сравнивались четыре различных диагностических метода для выявления болезнетворных организмов, связанных с пневмонией у крупного рогатого скота. Информация из этого проекта предоставит руководство по выбору между более легкими и простыми методами диагностики для обнаружения патогенов BRD по сравнению с другими методами, которые требуют больше времени и усилий, в зависимости от способности этих тестов обнаруживать вероятные причины пневмонии у крупного рогатого скота.Имея научные данные, подтверждающие использование диагностических методов для выявления вероятных причин пневмонии у молочных телят, ветеринары могут стратегически применять эти диагностические методы для предоставления информации, необходимой для разработки улучшенных программ лечения и профилактики пневмонии у молочных телят. Основная цель проекта: способствовать быстрой идентификации и последующему лечению респираторных заболеваний крупного рогатого скота (BRD) путем разработки, проверки и руководства применением новых или улучшенных диагностических инструментов.Четыре различных диагностических инструмента или метода отбора проб были научно подтверждены путем применения каждого из четырех методов к каждому теленку, у которого были клинические признаки, соответствующие критериям, необходимым для включения в исследование. В общей сложности 100 молочных телят с клиническим диагнозом BRD были использованы для научного сравнения лабораторных результатов по четырем методам отбора проб. Результаты этого проекта предоставили научное доказательство того, что методы отбора проб мазков из носа (NS) и глотки (PRS) очень хорошо согласуются с методами отбора проб бронхоавеолярного лаважа (BAL) и транстрахеального смыва (TTW), что потребовало больших клинических навыков и усилий для сбора образцов. диагностический образец для выявления патогенов, которые могут быть причиной BRD у молочных телят.Хотя специалисты по внутренней ветеринарии считают TTW предпочтительным эталоном для получения образцов наилучшего качества для выявления патогенов BRD, этот метод отбора образцов является инвазивным и требует стерильной хирургической подготовки и местной анестезии участка над трахеей, где используется большая игла.
В частности, были проведены научные клинические исследования, в которых сравнивались четыре различных диагностических метода для выявления болезнетворных организмов, связанных с пневмонией у крупного рогатого скота. Информация из этого проекта предоставит руководство по выбору между более легкими и простыми методами диагностики для обнаружения патогенов BRD по сравнению с другими методами, которые требуют больше времени и усилий, в зависимости от способности этих тестов обнаруживать вероятные причины пневмонии у крупного рогатого скота.Имея научные данные, подтверждающие использование диагностических методов для выявления вероятных причин пневмонии у молочных телят, ветеринары могут стратегически применять эти диагностические методы для предоставления информации, необходимой для разработки улучшенных программ лечения и профилактики пневмонии у молочных телят. Основная цель проекта: способствовать быстрой идентификации и последующему лечению респираторных заболеваний крупного рогатого скота (BRD) путем разработки, проверки и руководства применением новых или улучшенных диагностических инструментов.Четыре различных диагностических инструмента или метода отбора проб были научно подтверждены путем применения каждого из четырех методов к каждому теленку, у которого были клинические признаки, соответствующие критериям, необходимым для включения в исследование. В общей сложности 100 молочных телят с клиническим диагнозом BRD были использованы для научного сравнения лабораторных результатов по четырем методам отбора проб. Результаты этого проекта предоставили научное доказательство того, что методы отбора проб мазков из носа (NS) и глотки (PRS) очень хорошо согласуются с методами отбора проб бронхоавеолярного лаважа (BAL) и транстрахеального смыва (TTW), что потребовало больших клинических навыков и усилий для сбора образцов. диагностический образец для выявления патогенов, которые могут быть причиной BRD у молочных телят.Хотя специалисты по внутренней ветеринарии считают TTW предпочтительным эталоном для получения образцов наилучшего качества для выявления патогенов BRD, этот метод отбора образцов является инвазивным и требует стерильной хирургической подготовки и местной анестезии участка над трахеей, где используется большая игла. вводится и вводится небольшое использование для получения диагностического образца. Метод отбора проб БАЛ требует навыков, необходимых для введения трубки для лаважа через носовую полость и продолжения в трахею и далее до тех пор, пока уровень бронхов в легких не будет соответствовать диаметру трубки для лаважа.При использовании как TTW, так и BAL необходимо ввести стерильный физиологический раствор, а затем создать отсос с помощью шприца, прикрепленного к трубке, чтобы извлечь часть введенной жидкости, которая становится диагностическим образцом для лабораторного анализа. При использовании методов мазков для получения диагностических образцов используются одноразовые стерильные мазки (NS) или защищенные стерильные мазки (PRS). Методы отбора проб с использованием мазков относительно просты и легки в выполнении, в то время как TTW и BAL требуют определенной степени клинических ветеринарных навыков.Для основных бактериальных причин пневмонии у молочных телят, PRS и BAL показали безвозвратное совпадение от 0,89 до 0,92 по сравнению с эталонным стандартным методом (TTW), основанным на статистике Каппа. (Метод мазка из носа был немного ниже — 0,86). Процент положительного согласия этих трех методов по сравнению с TTW варьировался от 89% до 97%. Для обнаружения вирусных патогенов несогласованность между различными методами (NS, PRS и BAL) по сравнению с TTW была от умеренной до хорошей, но не такой большой, как полученная для бактериальных патогенов.Однако были случаи для ряда телят (от 2 до 9, в зависимости от вирусного патогена), когда эти альтернативные методы давали положительные лабораторные результаты, когда лабораторные результаты TTW были отрицательными. Процент положительного согласия этих трех методов обнаружения вирусных патогенов по сравнению с TTW варьировался от 57% до 93%. Для обнаружения респираторно-синцитиального вируса крупного рогатого скота (BRSV) имелись количественные, но незначительные преимущества для BAL перед методами мазков и PRS перед NS.Для коронавируса крупного рогатого скота метод PRS обнаружил наибольшее количество телят с этим вирусом, и все три метода идентифицировали всех телят с этим вирусом, когда TTW был положительным.
вводится и вводится небольшое использование для получения диагностического образца. Метод отбора проб БАЛ требует навыков, необходимых для введения трубки для лаважа через носовую полость и продолжения в трахею и далее до тех пор, пока уровень бронхов в легких не будет соответствовать диаметру трубки для лаважа.При использовании как TTW, так и BAL необходимо ввести стерильный физиологический раствор, а затем создать отсос с помощью шприца, прикрепленного к трубке, чтобы извлечь часть введенной жидкости, которая становится диагностическим образцом для лабораторного анализа. При использовании методов мазков для получения диагностических образцов используются одноразовые стерильные мазки (NS) или защищенные стерильные мазки (PRS). Методы отбора проб с использованием мазков относительно просты и легки в выполнении, в то время как TTW и BAL требуют определенной степени клинических ветеринарных навыков.Для основных бактериальных причин пневмонии у молочных телят, PRS и BAL показали безвозвратное совпадение от 0,89 до 0,92 по сравнению с эталонным стандартным методом (TTW), основанным на статистике Каппа. (Метод мазка из носа был немного ниже — 0,86). Процент положительного согласия этих трех методов по сравнению с TTW варьировался от 89% до 97%. Для обнаружения вирусных патогенов несогласованность между различными методами (NS, PRS и BAL) по сравнению с TTW была от умеренной до хорошей, но не такой большой, как полученная для бактериальных патогенов.Однако были случаи для ряда телят (от 2 до 9, в зависимости от вирусного патогена), когда эти альтернативные методы давали положительные лабораторные результаты, когда лабораторные результаты TTW были отрицательными. Процент положительного согласия этих трех методов обнаружения вирусных патогенов по сравнению с TTW варьировался от 57% до 93%. Для обнаружения респираторно-синцитиального вируса крупного рогатого скота (BRSV) имелись количественные, но незначительные преимущества для BAL перед методами мазков и PRS перед NS.Для коронавируса крупного рогатого скота метод PRS обнаружил наибольшее количество телят с этим вирусом, и все три метода идентифицировали всех телят с этим вирусом, когда TTW был положительным. Основная цель проекта: облегчить перевод результатов исследований в практическое применение путем разработки и интеграции образовательных программ BRD для ветеринарных и производственных организаций, ориентированных на здоровье и управление КРС. Результаты этого проекта были рецензированы, приняты и опубликованы в качестве научного исследования Американской ассоциации практикующих врачей (AABP) для их 48-й ежегодной конференции.Основываясь на результатах и результатах этого проекта, которые использовались в образовательных программах для AABP, ожидается, что ветеринарные клиницисты и практикующие врачи будут применять эти научные данные для выбора и реализации этих более простых, легких и менее инвазивных диагностических подходов для выявления связанных с патогенами патогенов. с BRD у молочных телят. Ожидается, что по мере реализации этих изменений в подходах к диагностическому тестированию BRD будут улучшены профилактика, контроль и лечение заболеваний BRD.
Основная цель проекта: облегчить перевод результатов исследований в практическое применение путем разработки и интеграции образовательных программ BRD для ветеринарных и производственных организаций, ориентированных на здоровье и управление КРС. Результаты этого проекта были рецензированы, приняты и опубликованы в качестве научного исследования Американской ассоциации практикующих врачей (AABP) для их 48-й ежегодной конференции.Основываясь на результатах и результатах этого проекта, которые использовались в образовательных программах для AABP, ожидается, что ветеринарные клиницисты и практикующие врачи будут применять эти научные данные для выбора и реализации этих более простых, легких и менее инвазивных диагностических подходов для выявления связанных с патогенами патогенов. с BRD у молочных телят. Ожидается, что по мере реализации этих изменений в подходах к диагностическому тестированию BRD будут улучшены профилактика, контроль и лечение заболеваний BRD.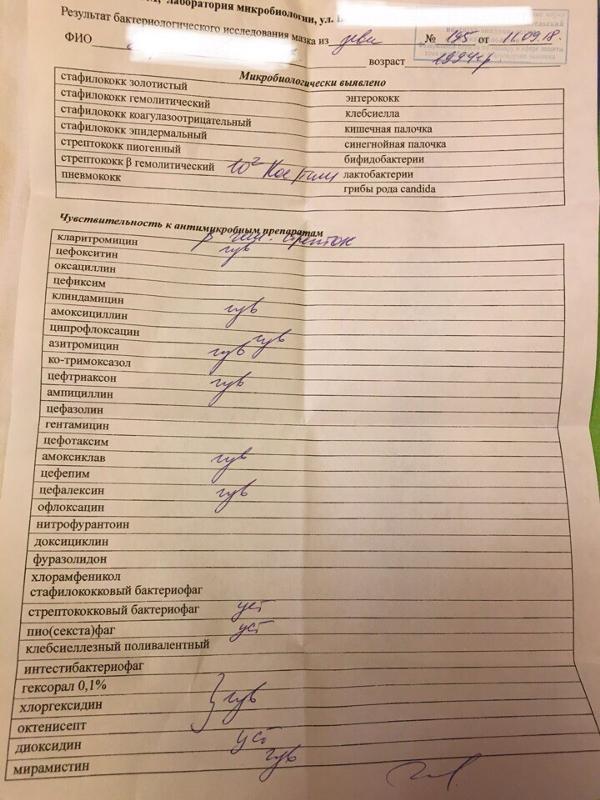 TTW позволяет избежать заражения из носоглотки, но процедура инвазивная и требует технических навыков. BAL и TTW напрямую отбирают образцы из нижних дыхательных путей, но BAL, NS и NPS могут быть загрязнены флорой носоглотки. По сравнению с NS, NPS обеспечивает защищенный образец глоточного кармана, который может быть более репрезентативным для патогенов BRD. Целью этого исследования было сравнить соответствие результатов, полученных с помощью NS, NPS или BAL, с результатами, полученными с помощью TTW для изоляции патогенов BRD у молочных телят с острой недифференцированной BRD.Материалы и методы:
TTW позволяет избежать заражения из носоглотки, но процедура инвазивная и требует технических навыков. BAL и TTW напрямую отбирают образцы из нижних дыхательных путей, но BAL, NS и NPS могут быть загрязнены флорой носоглотки. По сравнению с NS, NPS обеспечивает защищенный образец глоточного кармана, который может быть более репрезентативным для патогенов BRD. Целью этого исследования было сравнить соответствие результатов, полученных с помощью NS, NPS или BAL, с результатами, полученными с помощью TTW для изоляции патогенов BRD у молочных телят с острой недифференцированной BRD.Материалы и методы:
 (2011) Характеристика регуляторных Т-клеток в ассоциированной носовой лимфоидной ткани у детей: взаимосвязь с пневмококковой колонизацией.PLoS Pathog 7: e1002175.
(2011) Характеристика регуляторных Т-клеток в ассоциированной носовой лимфоидной ткани у детей: взаимосвязь с пневмококковой колонизацией.PLoS Pathog 7: e1002175. , Мехиас А., Гомес А.М., Олсен К.Д., Риос А.М. и др. (2005) Острое и хроническое заболевание дыхательных путей, вызванное респираторно-синцитиальным вирусом, не зависит от генетического фона: экспериментальная модель на мышах. Virol J 2: 46.
, Мехиас А., Гомес А.М., Олсен К.Д., Риос А.М. и др. (2005) Острое и хроническое заболевание дыхательных путей, вызванное респираторно-синцитиальным вирусом, не зависит от генетического фона: экспериментальная модель на мышах. Virol J 2: 46.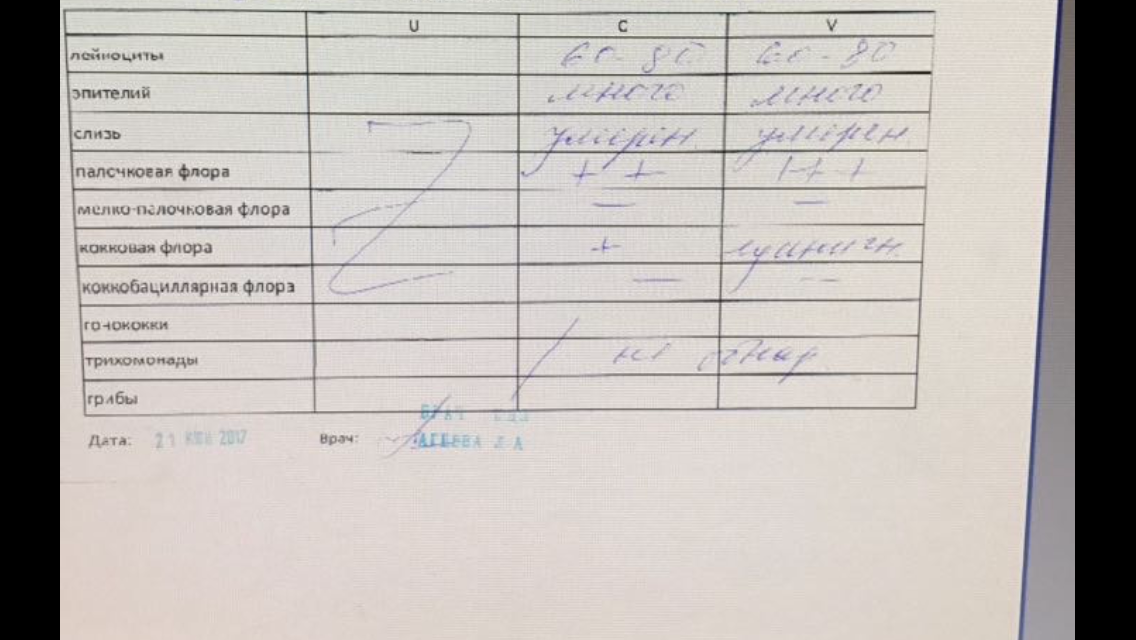 С., Чавес-Буэно С., Мехиас А., Гомес А.М., Риос А.М. и др. (2004) Респираторно-синцитиальный вирус вызывает пневмонию, цитокиновый ответ, обструкцию дыхательных путей и хронические воспалительные инфильтраты, связанные с длительной гиперреактивностью дыхательных путей у мышей. J Infect Dis 189: 1856–1865.
С., Чавес-Буэно С., Мехиас А., Гомес А.М., Риос А.М. и др. (2004) Респираторно-синцитиальный вирус вызывает пневмонию, цитокиновый ответ, обструкцию дыхательных путей и хронические воспалительные инфильтраты, связанные с длительной гиперреактивностью дыхательных путей у мышей. J Infect Dis 189: 1856–1865. J Immunol 150: 353–360.
J Immunol 150: 353–360.