Ингибиторы альфа-глюкозидазы для профилактики или замедления развития диабета 2-го типа и связанных с ним осложнений у людей, подверженных повышенному риску заболевания диабетом 2-го типа
Вопрос обзора
Могут ли ингибиторы альфа-глюкозидазы предотвращать или замедлять развитие сахарного диабета 2 типа и связанные с ним осложнения у людей, подверженных повышенному риску развития сахарного диабета 2 типа?
Актуальность
Люди с умеренно повышенным уровнем глюкозы часто подвергаются повышенному риску развития диабета 2-го типа. Поэтому для профилактики диабета 2-го типа этим людям часто рекомендуют увеличить физические нагрузки и снизить потребление калорий. Ингибиторы альфа-глюкозидазы (акарбоза, миглитол, воглибоза) используются для снижения уровня глюкозы крови у больных сахарным диабетом 2-го типа. В настоящее время неизвестно, следует ли назначать ингибиторы альфа-глюкозидазы лицам с умеренно повышенным уровнем глюкозы крови. Мы хотели выяснить, могут ли ингибиторы альфа-глюкозидазы предотвращать или замедлять развитие сахарного диабета 2 типа у людей с умеренно повышенным уровнем глюкозы.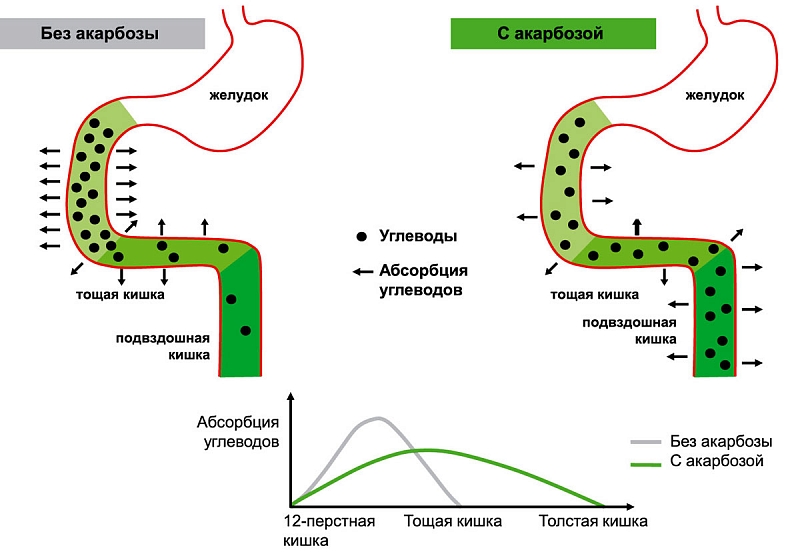 Мы провели поиск в медицинской литературе на предмет рандомизированных контролируемых испытаний (клинические испытания, в которых людей в случайном порядке определяют в одну из двух или более групп лечения), длительностью не менее одного года, в которых исследовали ингибиторы альфа-глюкозидазы у участников с уровнем глюкозы выше нормы, но ниже диагностических критериев для сахарного диабета 2 типа.
Мы провели поиск в медицинской литературе на предмет рандомизированных контролируемых испытаний (клинические испытания, в которых людей в случайном порядке определяют в одну из двух или более групп лечения), длительностью не менее одного года, в которых исследовали ингибиторы альфа-глюкозидазы у участников с уровнем глюкозы выше нормы, но ниже диагностических критериев для сахарного диабета 2 типа.
Характеристика исследований
Мы обнаружили 10 рандомизированных контролируемых испытаний, представляющих 11 814 участников, в 8 из них исследовали акарбозу, а в 2 исследовали воглибозу. Продолжительность испытаний варьировала от одного года до шести лет.
Эти доказательства актуальны на декабрь 2017 года.
Основные результаты
При сравнении акарбозы с плацебо (вещество, которое, как считается, не оказывает терапевтического эффекта) у 670 из 4014 участников (17%), получавших акарбозу, развился сахарный диабет второго типа, по сравнению с 812 из 3994 участников (20%), получавших плацебо. Большинство данных для этого сравнения были получены в ходе испытаний, в которых приняли участие люди с заболеваниями сердца. При сравнении акарбозы с отсутствием вмешательства, у семи из 75 участников (9%), получавших акарбозу, развился диабет второго типа, по сравнению с 18 из 65 участников (28%) в группе отсутствия вмешательства. Лечение акарбозой не уменьшало или не увеличивало риск смерти от любой причины, смерти от сердечных заболеваний, серьезных побочных эффектов, инсультов или сердечной недостаточности. По сравнению с плацебо, акарбоза снижала риск возникновения инфарктов миокарда (у одного из 742 участников (0,1%), получавших акарбозу, был инфаркт миокарда по сравнению с 15 из 744 участников (2%), получавших плацебо). Лечение акарбозой показало повышенный риск возникновения несерьезных побочных эффектов (в основном желудочно-кишечных событий) по сравнению с плацебо: У 751 из 775 человек (97%), получавших акарбозу, были несерьезные побочные эффекты по сравнению с 723 из 775 человек (93%), получавших плацебо.
Большинство данных для этого сравнения были получены в ходе испытаний, в которых приняли участие люди с заболеваниями сердца. При сравнении акарбозы с отсутствием вмешательства, у семи из 75 участников (9%), получавших акарбозу, развился диабет второго типа, по сравнению с 18 из 65 участников (28%) в группе отсутствия вмешательства. Лечение акарбозой не уменьшало или не увеличивало риск смерти от любой причины, смерти от сердечных заболеваний, серьезных побочных эффектов, инсультов или сердечной недостаточности. По сравнению с плацебо, акарбоза снижала риск возникновения инфарктов миокарда (у одного из 742 участников (0,1%), получавших акарбозу, был инфаркт миокарда по сравнению с 15 из 744 участников (2%), получавших плацебо). Лечение акарбозой показало повышенный риск возникновения несерьезных побочных эффектов (в основном желудочно-кишечных событий) по сравнению с плацебо: У 751 из 775 человек (97%), получавших акарбозу, были несерьезные побочные эффекты по сравнению с 723 из 775 человек (93%), получавших плацебо.
В одном испытании сравнили воглибозу с плацебо, а в другом сравнили воглибозу с диетой и физическими упражнениями. При сравнении воглибозы с плацебо у 50 из 897 участников (5,6%), получавших воглибозу, развился сахарный диабет второго типа, по сравнению со 106 из 881 участников (12%), получавших плацебо.
В одном испытании с 90 участниками сравнивали акарбозу с диетой и физическими упражнениями, а в другом испытании с 98 участниками сравнивали акарбозу с метформином. Для этих сравнений не было значимых различий в каких-либо исходах.
Ни в одном из испытаний не сообщали об ампутации нижних конечностей, слепоте или тяжелой потере зрения, заболевании почек, качестве жизни, связанном со здоровьем, времени прогрессирования до сахарного диабета 2 типа или о социально-экономических последствиях (таких как отсутствие на работе или затраты).
Качество доказательств
По большинству наших исходов мы не уверены или очень не уверены, насколько достоверны результаты наших сравнений. Причинами этой неопределенности являются систематические ошибки в некоторых из включенных испытаний, малое число испытаний в целом по каждому исходу, неточность результатов и пропущенные данные в одном включенном испытании.
Причинами этой неопределенности являются систематические ошибки в некоторых из включенных испытаний, малое число испытаний в целом по каждому исходу, неточность результатов и пропущенные данные в одном включенном испытании.
Osnovnye rezul’taty programmy APREL’ | Chazova
От имени исследователей программы АПРЕЛЬ — Метаболический синдром (МС) в последние годы привлекает к себе повышенное внимание медицинской общественности. Это обусловлено не только широким распространением данного симптомокомплекса в популяции, но и тем, что у пациентов с МС риск развития сердечно-сосудистых осложнений в 2–10 раз выше, чем у лиц без метаболических нарушений. Основную роль в развитии сердечно-сосудистых осложнений у больных с МС играют артериальная гипертония (АГ), дислипидемия и гипергликемия. При этом особое значение в последнее время придается повышенному уровню глюкозы после еды, так называемой постпрандиальной гипергликемии. В целом ряде исследований было показано, что именно постпрандиальная гипергликемия является самостоятельным фактором риска развития ишемической болезни сердца и мозгового инсульта. Одним из наиболее эффективных и безопасных лекарственных средств, способных влиять на постпрандиальную гипергликемию, является акарбоза. Механизм действия препарата заключается в обратимой блокаде a-глюкозидаз (сахараза, глюкоамилаза, мальтаза) в верхнем отделе тонкой кишки. Это приводит к нарушению ферментативного расщепления поли- и олигосахаридов и всасыванию моносахаридов, вследствие чего предотвращается развитие постпрандиальной гипергликемии и снижается уровень инсулина. Результаты научного исследования, проводимого в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у пациентов с АГ, нарушенной толерантностью к глюкозе (НТГ) и ожирением, продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на обмен липидов, а также снижать избыточную массу тела и повышенный уровень артериального давления (АД).
В целом ряде исследований было показано, что именно постпрандиальная гипергликемия является самостоятельным фактором риска развития ишемической болезни сердца и мозгового инсульта. Одним из наиболее эффективных и безопасных лекарственных средств, способных влиять на постпрандиальную гипергликемию, является акарбоза. Механизм действия препарата заключается в обратимой блокаде a-глюкозидаз (сахараза, глюкоамилаза, мальтаза) в верхнем отделе тонкой кишки. Это приводит к нарушению ферментативного расщепления поли- и олигосахаридов и всасыванию моносахаридов, вследствие чего предотвращается развитие постпрандиальной гипергликемии и снижается уровень инсулина. Результаты научного исследования, проводимого в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у пациентов с АГ, нарушенной толерантностью к глюкозе (НТГ) и ожирением, продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на обмен липидов, а также снижать избыточную массу тела и повышенный уровень артериального давления (АД). Результаты научных работ и крупных международных исследований по изучению влияния терапии акарбозой на развитие сердечно-сосудистых заболеваний и СД типа 2 у больных с НТГ послужили основанием для проведения Российской многоцентровой программы АПРЕЛЬ (Многоцентровая рандомизированная программа по изучению эффективности применения Акарбозы у Пациентов с наРушенной толЕрантностью к глюкозе и артериаЛЬной гипертонией). Целью этой программы являлась оценка эффективности применения ингибитора a-глюкозидаз акарбозы в дозах 150 и 300 мг в сутки и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного, липидного обмена и массу тела.АПРЕЛЬ является открытой рандомизированной, выполненной на параллельных группах, многоцентровой программой.Она проводилась в России в 17 исследовательских центрах 10 городов – Москве, Санкт-Петербурге, Волгограде, Екатеринбурге, Краснодаре, Новосибирске, Томске, Тюмени, Уфе и Челябинске.
Результаты научных работ и крупных международных исследований по изучению влияния терапии акарбозой на развитие сердечно-сосудистых заболеваний и СД типа 2 у больных с НТГ послужили основанием для проведения Российской многоцентровой программы АПРЕЛЬ (Многоцентровая рандомизированная программа по изучению эффективности применения Акарбозы у Пациентов с наРушенной толЕрантностью к глюкозе и артериаЛЬной гипертонией). Целью этой программы являлась оценка эффективности применения ингибитора a-глюкозидаз акарбозы в дозах 150 и 300 мг в сутки и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного, липидного обмена и массу тела.АПРЕЛЬ является открытой рандомизированной, выполненной на параллельных группах, многоцентровой программой.Она проводилась в России в 17 исследовательских центрах 10 городов – Москве, Санкт-Петербурге, Волгограде, Екатеринбурге, Краснодаре, Новосибирске, Томске, Тюмени, Уфе и Челябинске.
Метаболический синдром (МС) в последние годы привлекает к себе повышенное внимание медицинской общественности. Это обусловлено не только широким распространением данного симптомокомплекса в популяции, но и тем, что у пациентов с МС риск развития сердечно-сосудистых осложнений в 2–10 раз выше, чем у лиц без метаболических нарушений [1, 2]. Основную роль в развитии сердечно-сосудистых осложнений у больных с МС играют артериальная гипертония (АГ), дислипидемия и гипергликемия. При этом особое значение в последнее время придается повышенному уровню глюкозы после еды, так называемой постпрандиальной гипергликемии. В целом ряде исследований было показано, что именно постпрандиальная гипергликемия является самостоятельным фактором риска развития ишемической болезни сердца и мозгового инсульта. Например, в исследовании DECODE [3], в котором использовались данные ряда крупномасштабных проспективных исследований, проводившихся в Европе, было показано, что повышенный уровень глюкозы через 2 ч после сахарной нагрузки ассоциируется с высоким уровнем сердечно-сосудистой смертности независимо от показателей глюкозы в плазме крови натощак.
Это обусловлено не только широким распространением данного симптомокомплекса в популяции, но и тем, что у пациентов с МС риск развития сердечно-сосудистых осложнений в 2–10 раз выше, чем у лиц без метаболических нарушений [1, 2]. Основную роль в развитии сердечно-сосудистых осложнений у больных с МС играют артериальная гипертония (АГ), дислипидемия и гипергликемия. При этом особое значение в последнее время придается повышенному уровню глюкозы после еды, так называемой постпрандиальной гипергликемии. В целом ряде исследований было показано, что именно постпрандиальная гипергликемия является самостоятельным фактором риска развития ишемической болезни сердца и мозгового инсульта. Например, в исследовании DECODE [3], в котором использовались данные ряда крупномасштабных проспективных исследований, проводившихся в Европе, было показано, что повышенный уровень глюкозы через 2 ч после сахарной нагрузки ассоциируется с высоким уровнем сердечно-сосудистой смертности независимо от показателей глюкозы в плазме крови натощак. В исследовании Pacific and Indian Ocean [4] установлено, что изолированная постпрандиальная гипергликемия удваивает риск смерти, а в исследовании Fungata Diabetes [5] выявлено, что гипергликемия после еды, а не определяемая натощак, является независимым фактором риска сердечно-сосудистых заболеваний. Одним из наиболее эффективных и безопасных лекарственных средств, способных влиять на постпрандиальную гипергликемию, является акарбоза. Механизм действия препарата заключается в обратимой блокаде a-глюкозидаз (сахараза, глюкоамилаза, мальтаза) в верхнем отделе тонкой кишки. Это приводит к нарушению ферментативного расщепления поли- и олигосахаридов и всасыванию моносахаридов, вследствие чего предотвращается развитие постпрандиальной гипергликемии и снижается уровень инсулина [ 6 ]. Результаты научного исследования, проводимого в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у пациентов с АГ, нарушенной толерантностью к глюкозе (НТГ) и ожирением [7], продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на обмен липидов, а также снижать избыточную массу тела и повышенный уровень артериального давления (АД).
В исследовании Pacific and Indian Ocean [4] установлено, что изолированная постпрандиальная гипергликемия удваивает риск смерти, а в исследовании Fungata Diabetes [5] выявлено, что гипергликемия после еды, а не определяемая натощак, является независимым фактором риска сердечно-сосудистых заболеваний. Одним из наиболее эффективных и безопасных лекарственных средств, способных влиять на постпрандиальную гипергликемию, является акарбоза. Механизм действия препарата заключается в обратимой блокаде a-глюкозидаз (сахараза, глюкоамилаза, мальтаза) в верхнем отделе тонкой кишки. Это приводит к нарушению ферментативного расщепления поли- и олигосахаридов и всасыванию моносахаридов, вследствие чего предотвращается развитие постпрандиальной гипергликемии и снижается уровень инсулина [ 6 ]. Результаты научного исследования, проводимого в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у пациентов с АГ, нарушенной толерантностью к глюкозе (НТГ) и ожирением [7], продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на обмен липидов, а также снижать избыточную массу тела и повышенный уровень артериального давления (АД). Эффективность применения акарбозы для предотвращения развития сахарного диабета (СД) типа 2 и снижения риска сердечно-сосудистых осложнений у пациентов с НГТ показана также в крупном международном исследовании Stop – NIDDM (Stop – Noninsulin – Dependent Diabetes Mellitus trial) [8, 9]. Относительный риск развития СД типа 2 на фоне лечения акарбозой в течение около 3 лет снизился на 25%, новые случаи АГ на фоне активной терапии возникали на 34% реже, инфаркт миокарда – на 91%, любое зафиксированное сердечно-сосудистое осложнение – на 49%. Результаты научных работ и крупных международных исследований по изучению влияния терапии акарбозой на развитие сердечно-сосудистых заболеваний и СД типа 2 у больных с НТГ послужили основанием для проведения Российской многоцентровой программы АПРЕЛЬ (Многоцентровая рандомизированная программа по изучению эффективности применения Акарбозы у Пациентов с наРушенной толЕрантностью к глюкозе и артериаЛЬной гипертонией). Целью этой программы являлась оценка эффективности применения ингибитора a-глюкозидаз акарбозы в дозах 150 и 300 мг в сутки и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного, липидного обмена и массу тела.
Эффективность применения акарбозы для предотвращения развития сахарного диабета (СД) типа 2 и снижения риска сердечно-сосудистых осложнений у пациентов с НГТ показана также в крупном международном исследовании Stop – NIDDM (Stop – Noninsulin – Dependent Diabetes Mellitus trial) [8, 9]. Относительный риск развития СД типа 2 на фоне лечения акарбозой в течение около 3 лет снизился на 25%, новые случаи АГ на фоне активной терапии возникали на 34% реже, инфаркт миокарда – на 91%, любое зафиксированное сердечно-сосудистое осложнение – на 49%. Результаты научных работ и крупных международных исследований по изучению влияния терапии акарбозой на развитие сердечно-сосудистых заболеваний и СД типа 2 у больных с НТГ послужили основанием для проведения Российской многоцентровой программы АПРЕЛЬ (Многоцентровая рандомизированная программа по изучению эффективности применения Акарбозы у Пациентов с наРушенной толЕрантностью к глюкозе и артериаЛЬной гипертонией). Целью этой программы являлась оценка эффективности применения ингибитора a-глюкозидаз акарбозы в дозах 150 и 300 мг в сутки и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного, липидного обмена и массу тела.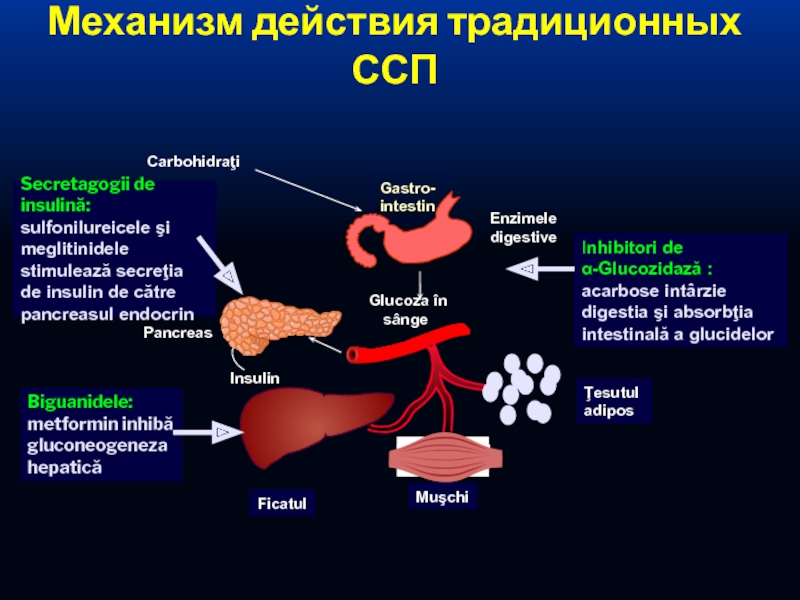 Методы Дизайн исследования АПРЕЛЬ является открытой рандомизированной, выполненной на параллельных группах, многоцентровой программой. Она проводилась в России в 17 исследовательских центрах 10 городов – Москве, Санкт-Петербурге, Волгограде, Екатеринбурге, Краснодаре, Новосибирске, Томске, Тюмени, Уфе и Челябинске. Подходящими для исследования считались пациенты независимо от пола в возрасте от 18 до 60 лет включительно, имеющие индекс массы тела (ИМТ) более 25 кг/м2, НТГ (уровень глюкозы в плазме крови, определяемый натощак, ниже 7 ммоль/л, через 2 ч после приема 75 г глюкозы 7,8 и выше и ниже 11,1 ммоль/л) и «мягкую» АГ (систолическое АД [САД] в положении сидя 140 мм рт. ст. и выше и ниже 160 мм рт. ст. и/или диастолическое АД [ДАД] в положении сидя 90 мм рт. ст. и выше и ниже 100 мм рт. ст.). В исследование не включали лиц с тяжелыми сердечно-сосудистыми заболеваниями, такими как острый инфаркт миокарда, стенокардия III–IV функциональных классов, нестабильная стенокардия, сердечная недостаточность, нарушение мозгового кровообращения; при наличии СД типа 1 и 2, вторичных АГ, хронической почечной недостаточности, наличии заболеваний и при приеме лекарств, нарушающих кишечную проходимость и/или абсорбцию, тяжелых нарушениях функции печени, онкологических заболеваниях, во время беременности и периода лактации.
Методы Дизайн исследования АПРЕЛЬ является открытой рандомизированной, выполненной на параллельных группах, многоцентровой программой. Она проводилась в России в 17 исследовательских центрах 10 городов – Москве, Санкт-Петербурге, Волгограде, Екатеринбурге, Краснодаре, Новосибирске, Томске, Тюмени, Уфе и Челябинске. Подходящими для исследования считались пациенты независимо от пола в возрасте от 18 до 60 лет включительно, имеющие индекс массы тела (ИМТ) более 25 кг/м2, НТГ (уровень глюкозы в плазме крови, определяемый натощак, ниже 7 ммоль/л, через 2 ч после приема 75 г глюкозы 7,8 и выше и ниже 11,1 ммоль/л) и «мягкую» АГ (систолическое АД [САД] в положении сидя 140 мм рт. ст. и выше и ниже 160 мм рт. ст. и/или диастолическое АД [ДАД] в положении сидя 90 мм рт. ст. и выше и ниже 100 мм рт. ст.). В исследование не включали лиц с тяжелыми сердечно-сосудистыми заболеваниями, такими как острый инфаркт миокарда, стенокардия III–IV функциональных классов, нестабильная стенокардия, сердечная недостаточность, нарушение мозгового кровообращения; при наличии СД типа 1 и 2, вторичных АГ, хронической почечной недостаточности, наличии заболеваний и при приеме лекарств, нарушающих кишечную проходимость и/или абсорбцию, тяжелых нарушениях функции печени, онкологических заболеваниях, во время беременности и периода лактации. Непереносимость акарбозы, а также использование больным любых медикаментозных препаратов и биологически активных добавок для уменьшения массы тела в течение 3 мес перед включением в программу также являлись причиной отказа от включения в программу. Пациентов, удовлетворяющих критериям включения и не имеющих критериев исключения, рандомизировали «методом конвертов» на 3 группы: принимающих акарбозу в дозе 150 и 300 мг в сутки и «контрольную», в которой препарат не принимали. Всем больным проводили немедикаментозную терапию, направленную на уменьшение массы тела. Рекомендовались гипокалорийная диета со сниженным содержанием углеводов и жиров, которая рассчитывалась индивидуально для каждого больного. Дефицит составлял 500–600 килокалорий в день. Также проводили беседы по повышению физической активности. Перед началом исследования и во время всего периода наблюдения пациенты могли принимать любую антигипертензивную терапию, но без ее изменения. В программу могли быть включены пациенты, не принимающие антигипертензивные препараты.
Непереносимость акарбозы, а также использование больным любых медикаментозных препаратов и биологически активных добавок для уменьшения массы тела в течение 3 мес перед включением в программу также являлись причиной отказа от включения в программу. Пациентов, удовлетворяющих критериям включения и не имеющих критериев исключения, рандомизировали «методом конвертов» на 3 группы: принимающих акарбозу в дозе 150 и 300 мг в сутки и «контрольную», в которой препарат не принимали. Всем больным проводили немедикаментозную терапию, направленную на уменьшение массы тела. Рекомендовались гипокалорийная диета со сниженным содержанием углеводов и жиров, которая рассчитывалась индивидуально для каждого больного. Дефицит составлял 500–600 килокалорий в день. Также проводили беседы по повышению физической активности. Перед началом исследования и во время всего периода наблюдения пациенты могли принимать любую антигипертензивную терапию, но без ее изменения. В программу могли быть включены пациенты, не принимающие антигипертензивные препараты.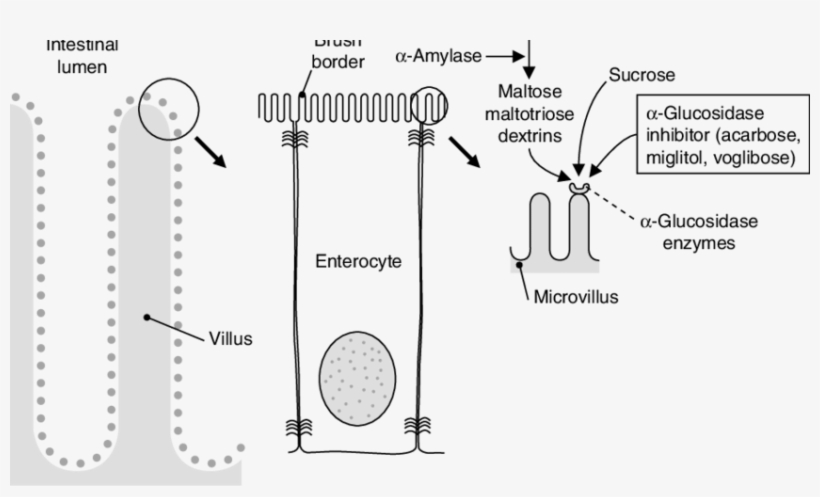 На первом визите у включенных в программу больных проводили сбор анамнеза, физикальное исследование с определением роста, массы тела, объема талии (ОТ) и бедер (ОБ), измерением АД и частоты сердечных сокращений (ЧСС), регистрировали ЭКГ в 12 стандартных отведениях, осуществляли забор крови для общего и биохимического анализов. Последний включал определение уровня общего холестерина (ХС), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП) (факультативно), глюкозы в плазме крови натощак, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), мочевой кислоты (факультативно). Проводили пероральный тест толерантности к глюкозе. Все пациенты заполняли опросники и получали рекомендации по рациональному питанию и повышению физической активности. Индивидуально рассчитывали допустимый суточный калораж пищи. Лицам, включенным в группы активного лечения, выдавали препарат и рекомендации для пациента » Вам назначен Глюкобай». Акарбозу (глюкобай, фирма «Bayer») назначали непосредственно перед едой или в начале приема пищи.
На первом визите у включенных в программу больных проводили сбор анамнеза, физикальное исследование с определением роста, массы тела, объема талии (ОТ) и бедер (ОБ), измерением АД и частоты сердечных сокращений (ЧСС), регистрировали ЭКГ в 12 стандартных отведениях, осуществляли забор крови для общего и биохимического анализов. Последний включал определение уровня общего холестерина (ХС), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП) (факультативно), глюкозы в плазме крови натощак, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), мочевой кислоты (факультативно). Проводили пероральный тест толерантности к глюкозе. Все пациенты заполняли опросники и получали рекомендации по рациональному питанию и повышению физической активности. Индивидуально рассчитывали допустимый суточный калораж пищи. Лицам, включенным в группы активного лечения, выдавали препарат и рекомендации для пациента » Вам назначен Глюкобай». Акарбозу (глюкобай, фирма «Bayer») назначали непосредственно перед едой или в начале приема пищи. В течение 1-й недели доза препарата составляла 50 мг 1 раз в день (во время ужина), на 2-й неделе дозу удваивали, акарбозу принимали во время завтрака и ужина, начиная с 3-й недели лекарство назначали по 50 мг 3 раза в день перед приемом пищи. Лица, рандомизированные в группу приема акарбозы в дозе 150 мг в сутки, продолжали принимать препарат в этой дозе до окончания исследования, а тем, кто находился в группе лечения препаратом в дозе 300 мг с 5-й недели дозу увеличивали до 200 мг в сутки, с 6-й – до 250 мг и 7-й – до 300 мг в сутки, после чего подобранную дозу препарата назначали до конца периода лечения – 24 нед (рис. 1). При наличии у больного на активном лечении метеоризма или диареи рекомендовалось без уменьшения дозы продолжать прием препарата в течение 2–3 нед, скорректировав при этом диету за счет уменьшения приема углеводов. При сохранении побочных эффектов можно было уменьшить дозу принимаемого лекарства. Рис. 1. Схема титрования дозы глюкобая. Таблица 1. Характеристика пациентов Показатель Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) Мужчины/женщины 27/59 36/89 50/58 Возраст, лет 53,0±1,2 51,3±1,0 50,8±0,9 Длительность АГ, годы 10,1±0,9 10,4±0,7 9,8±0,8 Глюкоза натощак, моль/л 6,1±0,7 6,0±0,8 6,1 ±0,8 Глюкоза постпрандиальная, ммоль/л 8,6±0,1 8,9±0,1 9,0±0,1 Общий ХС, ммоль/л 6,3 ±1,2 6,0±1,2 6,2 ±1,1 ХС ЛПВП, ммоль/л 1,3 ±0,4 1,3 ±0,4 1,3±0,5 ХС ЛПНП, ммоль/л 4,3±1,2 4,0±1,2 4,2±1,2 ТГ, ммоль/л 1,9±0,9 1,9±1,1 2,0±1,0 САД, мм рт.
В течение 1-й недели доза препарата составляла 50 мг 1 раз в день (во время ужина), на 2-й неделе дозу удваивали, акарбозу принимали во время завтрака и ужина, начиная с 3-й недели лекарство назначали по 50 мг 3 раза в день перед приемом пищи. Лица, рандомизированные в группу приема акарбозы в дозе 150 мг в сутки, продолжали принимать препарат в этой дозе до окончания исследования, а тем, кто находился в группе лечения препаратом в дозе 300 мг с 5-й недели дозу увеличивали до 200 мг в сутки, с 6-й – до 250 мг и 7-й – до 300 мг в сутки, после чего подобранную дозу препарата назначали до конца периода лечения – 24 нед (рис. 1). При наличии у больного на активном лечении метеоризма или диареи рекомендовалось без уменьшения дозы продолжать прием препарата в течение 2–3 нед, скорректировав при этом диету за счет уменьшения приема углеводов. При сохранении побочных эффектов можно было уменьшить дозу принимаемого лекарства. Рис. 1. Схема титрования дозы глюкобая. Таблица 1. Характеристика пациентов Показатель Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) Мужчины/женщины 27/59 36/89 50/58 Возраст, лет 53,0±1,2 51,3±1,0 50,8±0,9 Длительность АГ, годы 10,1±0,9 10,4±0,7 9,8±0,8 Глюкоза натощак, моль/л 6,1±0,7 6,0±0,8 6,1 ±0,8 Глюкоза постпрандиальная, ммоль/л 8,6±0,1 8,9±0,1 9,0±0,1 Общий ХС, ммоль/л 6,3 ±1,2 6,0±1,2 6,2 ±1,1 ХС ЛПВП, ммоль/л 1,3 ±0,4 1,3 ±0,4 1,3±0,5 ХС ЛПНП, ммоль/л 4,3±1,2 4,0±1,2 4,2±1,2 ТГ, ммоль/л 1,9±0,9 1,9±1,1 2,0±1,0 САД, мм рт. ст. 144,2±11,5 147,! ±12,2 147,1±10,8 ДАД, мм рт. ст. 89,0±7,4 90,0±8,2 92,0±7,4 Масса тела, кг 90,0±1,5 91,1±1,2 96,1±1,5 ОТ, см 104,1±1,5 104,0±1,0 108,5±1,1 Рис. 2. Динамика массы тела на фоне терапии. Рис. 3. Динамика ОТ на фоне терапии. Таблица 2. Достижение пациентами целевых уровней глюкозы натощак (<5,5 ммоль/л) и постпрандиальной (<7,5 ммоль/л) Показатель Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) абс. % абс. % абс. % Глюкоза натощак 9 6,8 65 49,7 63 54,2 Глюкоза постпрандиальная 29 22 97 73,5 79 65,5 Таблица 3. Достижение целевых уровней АД (<140/90 мм рт.ст.) Число пациентов Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) САД ДАД САД ДАД САД ДАД абс. 59 75 110 117 93 100 % 44 57 83 89 80 81 Таблица 4. Динамика показателей липидного обмена Показатель, ммоль/л Контроль Акарбоза 150 мг Акарбоза 300 мг Общий ХС -0,4±0,05 -0,4±0,03 -0,5±0,02 ХС ЛПВП 0,2±0,07 0,2±0,01 0,2±0,08 ХС ЛПНП -0,5±0,07 -0,5±0,04 -0,6±0,02 ТГ -0,1±0,01 -0,1±0,02 -0,2±0,01 Таблица 5.
ст. 144,2±11,5 147,! ±12,2 147,1±10,8 ДАД, мм рт. ст. 89,0±7,4 90,0±8,2 92,0±7,4 Масса тела, кг 90,0±1,5 91,1±1,2 96,1±1,5 ОТ, см 104,1±1,5 104,0±1,0 108,5±1,1 Рис. 2. Динамика массы тела на фоне терапии. Рис. 3. Динамика ОТ на фоне терапии. Таблица 2. Достижение пациентами целевых уровней глюкозы натощак (<5,5 ммоль/л) и постпрандиальной (<7,5 ммоль/л) Показатель Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) абс. % абс. % абс. % Глюкоза натощак 9 6,8 65 49,7 63 54,2 Глюкоза постпрандиальная 29 22 97 73,5 79 65,5 Таблица 3. Достижение целевых уровней АД (<140/90 мм рт.ст.) Число пациентов Контроль (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) САД ДАД САД ДАД САД ДАД абс. 59 75 110 117 93 100 % 44 57 83 89 80 81 Таблица 4. Динамика показателей липидного обмена Показатель, ммоль/л Контроль Акарбоза 150 мг Акарбоза 300 мг Общий ХС -0,4±0,05 -0,4±0,03 -0,5±0,02 ХС ЛПВП 0,2±0,07 0,2±0,01 0,2±0,08 ХС ЛПНП -0,5±0,07 -0,5±0,04 -0,6±0,02 ТГ -0,1±0,01 -0,1±0,02 -0,2±0,01 Таблица 5. Нежелательные явления Нежелательное явление Диета (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) абс. % абс. % абс. % Метеоризм — — 20 5,2 22 5,8 Диарея — — 6 1,5 11 2,9 Боли в животе — — 5 1,3 5 1,3 Изжога — — 1 0,3 — Фиброзно-кистозная мастопатия (операция) — — 1 0,3 — ОРВИ 2 0,5 — — Обострение хронического бронхита 1 0,3 — — Гипертонический криз 1 0,3 — — Пояснично-крестцовый радикулит 1 0,3 — — Мерцание предсердий 2 0,5 — — ИБС (госпитализация) 2 0,5 — — СД типа 2 2 0,5 2 0,5 2 0,5 За период наблюдения предусматривалось проведение нескольких контрольных визитов пациентов – во время периода активного наблюдения – на 12 и 24-й неделях от начала программы и после окончания выдачи акарбозы – на 28-й неделе от включения пациента в данное исследование. Кроме того, больным, получавшим акарбозу, был запланирован дополнительный визит через 4 нед от начала активного лечения. На каждом визите проводили расспрос пациента с выявлением нежелательных эффектов терапии, физикальное исследование, определялись массу тела, ОТ, ОБ, регистрировали АД и ЧСС.
Нежелательные явления Нежелательное явление Диета (n=86) Акарбоза 150 мг (n=125) Акарбоза 300 мг (n=108) абс. % абс. % абс. % Метеоризм — — 20 5,2 22 5,8 Диарея — — 6 1,5 11 2,9 Боли в животе — — 5 1,3 5 1,3 Изжога — — 1 0,3 — Фиброзно-кистозная мастопатия (операция) — — 1 0,3 — ОРВИ 2 0,5 — — Обострение хронического бронхита 1 0,3 — — Гипертонический криз 1 0,3 — — Пояснично-крестцовый радикулит 1 0,3 — — Мерцание предсердий 2 0,5 — — ИБС (госпитализация) 2 0,5 — — СД типа 2 2 0,5 2 0,5 2 0,5 За период наблюдения предусматривалось проведение нескольких контрольных визитов пациентов – во время периода активного наблюдения – на 12 и 24-й неделях от начала программы и после окончания выдачи акарбозы – на 28-й неделе от включения пациента в данное исследование. Кроме того, больным, получавшим акарбозу, был запланирован дополнительный визит через 4 нед от начала активного лечения. На каждом визите проводили расспрос пациента с выявлением нежелательных эффектов терапии, физикальное исследование, определялись массу тела, ОТ, ОБ, регистрировали АД и ЧСС. Кроме того, на визите через 24 и 28 нед от начала включения в программу проводили пероральный тест толерантности к глюкозе. Повторно проводили забор крови для общего и биохимического анализа, общий анализ мочи и регистрацию ЭКГ в 12 стандартных отведениях на визите через 24 нед от начала терапии. Критериями эффективности проводимой терапии были число и процент пациентов, достигших целевого уровня АД (<140/90 мм рт. ст.), снижение ДАД и САД (в процентах), число и процент лиц, достигших целевого уровня глюкозы натощак (<6,1 ммоль/л) и через 2 ч после приема 75 г глюкозы (<7,8 ммоль/л), динамика показателей липидного спектра, ИМТ, соотношения ОТ/ОБ. Безопасность оценивали на основании регистрации нежелательных явлений, данных физикального осмотра уровня АД и ЧСС, изменений ЭКГ в 12 стандартных отведениях, биохимическим показателям. Инструментальные и биохимические исследования АД измеряли по методу Короткова в положении сидя утром в одно и то же время перед приемом антигипертензивных препаратов.
Кроме того, на визите через 24 и 28 нед от начала включения в программу проводили пероральный тест толерантности к глюкозе. Повторно проводили забор крови для общего и биохимического анализа, общий анализ мочи и регистрацию ЭКГ в 12 стандартных отведениях на визите через 24 нед от начала терапии. Критериями эффективности проводимой терапии были число и процент пациентов, достигших целевого уровня АД (<140/90 мм рт. ст.), снижение ДАД и САД (в процентах), число и процент лиц, достигших целевого уровня глюкозы натощак (<6,1 ммоль/л) и через 2 ч после приема 75 г глюкозы (<7,8 ммоль/л), динамика показателей липидного спектра, ИМТ, соотношения ОТ/ОБ. Безопасность оценивали на основании регистрации нежелательных явлений, данных физикального осмотра уровня АД и ЧСС, изменений ЭКГ в 12 стандартных отведениях, биохимическим показателям. Инструментальные и биохимические исследования АД измеряли по методу Короткова в положении сидя утром в одно и то же время перед приемом антигипертензивных препаратов. Учитывали данные двух измерений, проводившихся с интервалом 3–5 мин. Если различие ДАД не превышало 5 мм рт. ст., то производили третье измерение АД и среднюю величину заносили в индивидуальную карту больного. Если различия в уровне ДАД при первых двух измерениях составляло более 5 мм рт. ст., то измерения повторяли после не менее чем 15-минутного отдыха пациента. Общий, биохимический анализ крови и общий анализ мочи проводили локальными лабораториями по стандартным методикам. Статистическая обработка Сравнение групп пациентов (организованных по разным группирующим признакам) проводили с использованием статистических непараметрических критериев, не зависящих от характера распределения – точного метода Фишера и критерия c2. Параллельно вычислен также традиционно используемый в биомедицинских исследованиях t-критерий Стьюдента для нормально распределенных переменных. Результаты Первый пациент был включен в программу АПРЕЛЬ в ноябре 2003 г., завершилась она в июне 2004 г. В программу вошли 383 пациента, из которых проанализированы 380 человек: 245 (64%) женщин и 135 (36%) мужчин, средний возраст составил 48±6,8 года.
Учитывали данные двух измерений, проводившихся с интервалом 3–5 мин. Если различие ДАД не превышало 5 мм рт. ст., то производили третье измерение АД и среднюю величину заносили в индивидуальную карту больного. Если различия в уровне ДАД при первых двух измерениях составляло более 5 мм рт. ст., то измерения повторяли после не менее чем 15-минутного отдыха пациента. Общий, биохимический анализ крови и общий анализ мочи проводили локальными лабораториями по стандартным методикам. Статистическая обработка Сравнение групп пациентов (организованных по разным группирующим признакам) проводили с использованием статистических непараметрических критериев, не зависящих от характера распределения – точного метода Фишера и критерия c2. Параллельно вычислен также традиционно используемый в биомедицинских исследованиях t-критерий Стьюдента для нормально распределенных переменных. Результаты Первый пациент был включен в программу АПРЕЛЬ в ноябре 2003 г., завершилась она в июне 2004 г. В программу вошли 383 пациента, из которых проанализированы 380 человек: 245 (64%) женщин и 135 (36%) мужчин, средний возраст составил 48±6,8 года.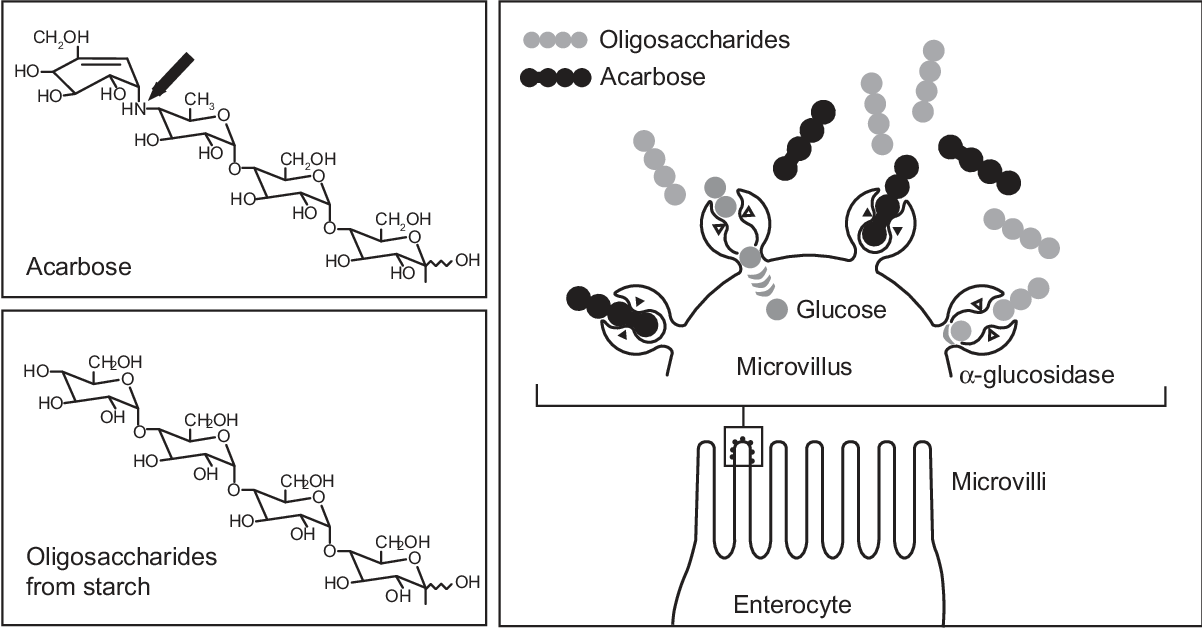 В группу контроля вошли 132 человека, в группу приема акарбозы в дозе 150 мг – 132 человека и в группу приема акарбозы в дозе 300 мг – 116 человек. У всех пациентов согласно критериям включения была избыточная масса тела или ожирение, мягкая АГ и НТГ, по данным перорального глюкозотолерантного теста. ИМТ в среднем составил 33,7±0,17 кг/м2. В подавляющем большинстве случаев у пациентов определялся абдоминальный тип ожирения; ОТ составляла 106,9±11,3 см; давность ожирения – 16±5,4 года; длительность АГ – 10,3±7,3 года. Антигипертензивную терапию принимали 52% пациентов, 22% из них в виде монотерапии, 57% лечились двумя препаратами, 19% – тремя и 2% – получали четыре препарата и более. Так, 80% пациентов принимали b-блокаторы, 45% – ингибиторы АПФ, 25% – диуретики, 16% – антагонисты кальция, 1% – агонисты имидазолиновых рецепторов. Пациенты продолжали принимать исходную антигипертензивную терапию в неизмененном виде на протяжении всего исследования, что являлось обязательным условием протокола.
В группу контроля вошли 132 человека, в группу приема акарбозы в дозе 150 мг – 132 человека и в группу приема акарбозы в дозе 300 мг – 116 человек. У всех пациентов согласно критериям включения была избыточная масса тела или ожирение, мягкая АГ и НТГ, по данным перорального глюкозотолерантного теста. ИМТ в среднем составил 33,7±0,17 кг/м2. В подавляющем большинстве случаев у пациентов определялся абдоминальный тип ожирения; ОТ составляла 106,9±11,3 см; давность ожирения – 16±5,4 года; длительность АГ – 10,3±7,3 года. Антигипертензивную терапию принимали 52% пациентов, 22% из них в виде монотерапии, 57% лечились двумя препаратами, 19% – тремя и 2% – получали четыре препарата и более. Так, 80% пациентов принимали b-блокаторы, 45% – ингибиторы АПФ, 25% – диуретики, 16% – антагонисты кальция, 1% – агонисты имидазолиновых рецепторов. Пациенты продолжали принимать исходную антигипертензивную терапию в неизмененном виде на протяжении всего исследования, что являлось обязательным условием протокола. Уровень САД в группах активного лечения был достоверно выше, чем в группе контроля (табл. 1). У 83% пациентов была отягощена наследственность по АГ, у 75% – по ожирению и у 31% – по СД типа 2. Курили 22% включенных в исследование, причем мужчины в 2 раза чаще, чем женщины. В результате проводимого лечения достоверно снизилась масса тела и уменьшились показатели, характеризующие выраженность абдоминального типа ожирения, – ОТ во всех трех группах, при этом в группах активного лечения эти показатели уменьшились достоверно больше (рис. 2, 3). Масса тела у лиц, принимавших акарбозу в дозах как 150, так и 300 мг в сутки, снизилась в значительно большей степени, чем в контрольной группе, где использовались лишь немедикаментозные методы лечения (-9,3±1,5 кг, p<0,05; -10,2±1,3 кг, p<0,05; -4±1,07 кг, p<0,05 соответственно. ОТ уменьшилась соответственно на 8,1±0,9 см, 9,2±1,2 см и 7,3±1,4 см (p<0,05). На фоне терапии акарбозой в дозах 150 мг и 300 мг в сутки достоверно снизился уровень глюкозы крови, определяемый натощак (-0,2±0,01 ммоль/л и -0,6±0,03 ммоль/л, p<0,5 соответственно) и более выражено через 2 ч после нагрузки глюкозой (-1,7±0,6 ммоль/л и -1,8±0,4 ммоль/л, p<0,05 соответственно).
Уровень САД в группах активного лечения был достоверно выше, чем в группе контроля (табл. 1). У 83% пациентов была отягощена наследственность по АГ, у 75% – по ожирению и у 31% – по СД типа 2. Курили 22% включенных в исследование, причем мужчины в 2 раза чаще, чем женщины. В результате проводимого лечения достоверно снизилась масса тела и уменьшились показатели, характеризующие выраженность абдоминального типа ожирения, – ОТ во всех трех группах, при этом в группах активного лечения эти показатели уменьшились достоверно больше (рис. 2, 3). Масса тела у лиц, принимавших акарбозу в дозах как 150, так и 300 мг в сутки, снизилась в значительно большей степени, чем в контрольной группе, где использовались лишь немедикаментозные методы лечения (-9,3±1,5 кг, p<0,05; -10,2±1,3 кг, p<0,05; -4±1,07 кг, p<0,05 соответственно. ОТ уменьшилась соответственно на 8,1±0,9 см, 9,2±1,2 см и 7,3±1,4 см (p<0,05). На фоне терапии акарбозой в дозах 150 мг и 300 мг в сутки достоверно снизился уровень глюкозы крови, определяемый натощак (-0,2±0,01 ммоль/л и -0,6±0,03 ммоль/л, p<0,5 соответственно) и более выражено через 2 ч после нагрузки глюкозой (-1,7±0,6 ммоль/л и -1,8±0,4 ммоль/л, p<0,05 соответственно).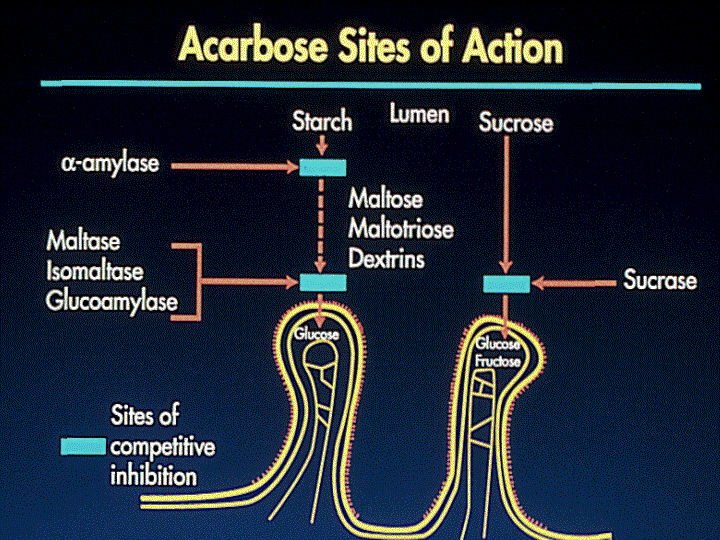 Как видно, существенного отличия в динамике этих показателей у лиц, получавших разные дозы препарата, не наблюдали. В контрольной группе отмечена сходная динамика уровня глюкозы, определяемой как натощак, так и через 2 ч после нагрузки глюкозой (-0,6±0,03 ммоль/л, p<0,05 и -2,0±1,3 ммоль/л, p<0,5 соответственно). Целевого уровня глюкозы натощак и после нагрузки с глюкозой достигли подавляющее большинство пациентов, принимавших акарбозу, в то время как в контрольной группе достижение целевых уровней данного показателя отмечено у относительно небольшого числа пациентов (табл. 2). При этом число пациентов, достигших целевых уровней глюкозы в плазме крови, было практически одинаковым в группах больных, принимавших разные дозы препарата. Уровень как САД, так и ДАД в группах, принимавших акарбозу в дозах 150 и 300 мг, снизился достоверно ниже по сравнению с группой контроля: САД -14,2±1,6 мм рт. ст.; -12,3±0,6 мм рт. ст. и -7,3±1,1 мм рт. ст. (p<0,05) соответственно и ДАД -8,4±0,3 мм рт.
Как видно, существенного отличия в динамике этих показателей у лиц, получавших разные дозы препарата, не наблюдали. В контрольной группе отмечена сходная динамика уровня глюкозы, определяемой как натощак, так и через 2 ч после нагрузки глюкозой (-0,6±0,03 ммоль/л, p<0,05 и -2,0±1,3 ммоль/л, p<0,5 соответственно). Целевого уровня глюкозы натощак и после нагрузки с глюкозой достигли подавляющее большинство пациентов, принимавших акарбозу, в то время как в контрольной группе достижение целевых уровней данного показателя отмечено у относительно небольшого числа пациентов (табл. 2). При этом число пациентов, достигших целевых уровней глюкозы в плазме крови, было практически одинаковым в группах больных, принимавших разные дозы препарата. Уровень как САД, так и ДАД в группах, принимавших акарбозу в дозах 150 и 300 мг, снизился достоверно ниже по сравнению с группой контроля: САД -14,2±1,6 мм рт. ст.; -12,3±0,6 мм рт. ст. и -7,3±1,1 мм рт. ст. (p<0,05) соответственно и ДАД -8,4±0,3 мм рт. ст., -7,8±0,5 мм рт. ст. и -6,0±1,3 мм рт. ст. (p<0,05) соответственно. Анализ эффективности влияния акарбозы на уровень АД показал, что более 80% в каждой из групп, принимающих акарбозу, достигли целевых значений САД и ДАД в отличие от группы контроля, в которой значительно меньше пациентов достигли целевого АД (табл. 3). Уровень ХС снизился достоверно и равнозначно во всех исследуемых группах. Значимое снижение уровня ТГ также было отмечено во всех трех исследуемых группах, а ХС ЛПНП – лишь в группе лиц, принимавших 300 мг акарбозы в сутки. В то же время достоверно значимое повышение уровня ХС ЛПВП отмечено лишь у пациентов, принимавших 150 мг акарбозы в сутки (табл. 4). Нежелательные явления, связанные с приемом акарбозы, такие как метеоризм, диарея, боли в области живота, отмечены у 53 пациентов, у одного была кожная сыпь в виде крапивницы (табл. 5). Появление нежелательных явлений послужило основанием для снижения дозы акарбозы с 300 до 150 мг в сутки только у 9 (7,8%) пациентов.
ст., -7,8±0,5 мм рт. ст. и -6,0±1,3 мм рт. ст. (p<0,05) соответственно. Анализ эффективности влияния акарбозы на уровень АД показал, что более 80% в каждой из групп, принимающих акарбозу, достигли целевых значений САД и ДАД в отличие от группы контроля, в которой значительно меньше пациентов достигли целевого АД (табл. 3). Уровень ХС снизился достоверно и равнозначно во всех исследуемых группах. Значимое снижение уровня ТГ также было отмечено во всех трех исследуемых группах, а ХС ЛПНП – лишь в группе лиц, принимавших 300 мг акарбозы в сутки. В то же время достоверно значимое повышение уровня ХС ЛПВП отмечено лишь у пациентов, принимавших 150 мг акарбозы в сутки (табл. 4). Нежелательные явления, связанные с приемом акарбозы, такие как метеоризм, диарея, боли в области живота, отмечены у 53 пациентов, у одного была кожная сыпь в виде крапивницы (табл. 5). Появление нежелательных явлений послужило основанием для снижения дозы акарбозы с 300 до 150 мг в сутки только у 9 (7,8%) пациентов.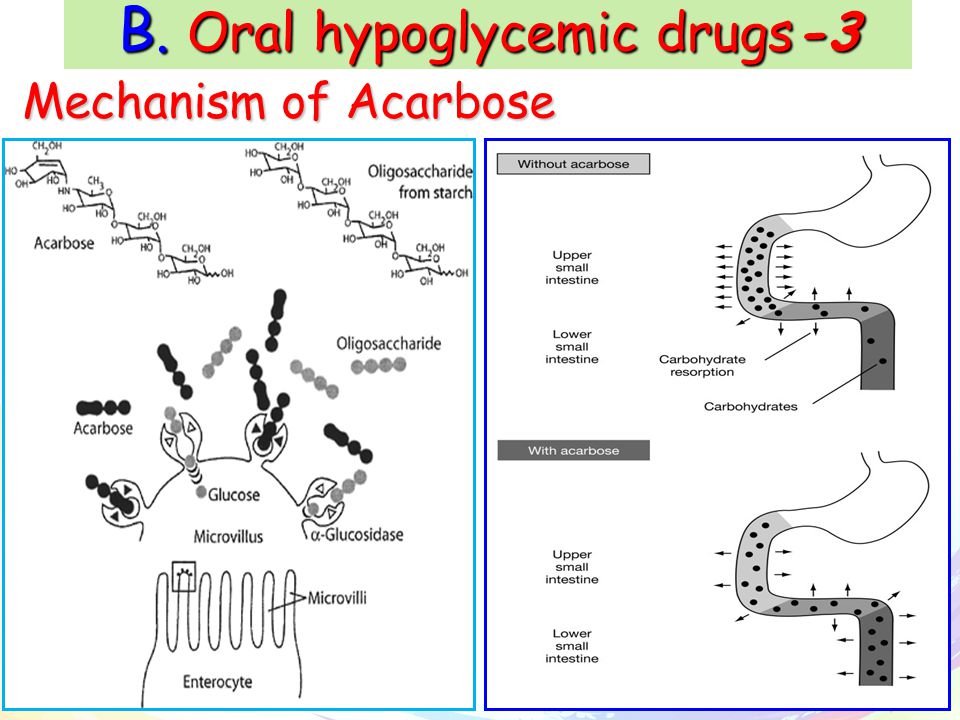 Из-за метеоризма из группы активной терапии досрочно вышли из программы 14 (5,6%) человек, из них 5 принимали 150 мг акарбозы и 9 – 300 мг. В контрольной группе досрочно выбыли из исследования по разным причинам, в том числе из-за нежелания соблюдать диетические рекомендации, 7 (5,3%) человек. К окончанию программы СД типа 2 был диагностирован у 2 больных, получавших 150 мг акарбозы, 2 находившихся на приеме 300 мг препарата и 2 из группы контроля. Обсуждение В программе АПРЕЛЬ принимали участие пациенты, у которых присутствовали основные симптомы, определяющие понятие МС: абдоминальное ожирение, НТГ, АГ, гипертриглицеридемия и гиперхолестеринемия. Терапия акарбозой привела к снижению массы тела, выраженности абдоминального ожирения, снижению постпрандиального уровня глюкозы и ее уровня натощак, улучшению показателей липидного обмена, что сопровождалось достоверным снижением как САД, так и ДАД. Снижение массы тела и АД у лиц, принимавших акарбозу, было значительно большим (почти в 2 раза), чем у лиц контрольной группы.
Из-за метеоризма из группы активной терапии досрочно вышли из программы 14 (5,6%) человек, из них 5 принимали 150 мг акарбозы и 9 – 300 мг. В контрольной группе досрочно выбыли из исследования по разным причинам, в том числе из-за нежелания соблюдать диетические рекомендации, 7 (5,3%) человек. К окончанию программы СД типа 2 был диагностирован у 2 больных, получавших 150 мг акарбозы, 2 находившихся на приеме 300 мг препарата и 2 из группы контроля. Обсуждение В программе АПРЕЛЬ принимали участие пациенты, у которых присутствовали основные симптомы, определяющие понятие МС: абдоминальное ожирение, НТГ, АГ, гипертриглицеридемия и гиперхолестеринемия. Терапия акарбозой привела к снижению массы тела, выраженности абдоминального ожирения, снижению постпрандиального уровня глюкозы и ее уровня натощак, улучшению показателей липидного обмена, что сопровождалось достоверным снижением как САД, так и ДАД. Снижение массы тела и АД у лиц, принимавших акарбозу, было значительно большим (почти в 2 раза), чем у лиц контрольной группы.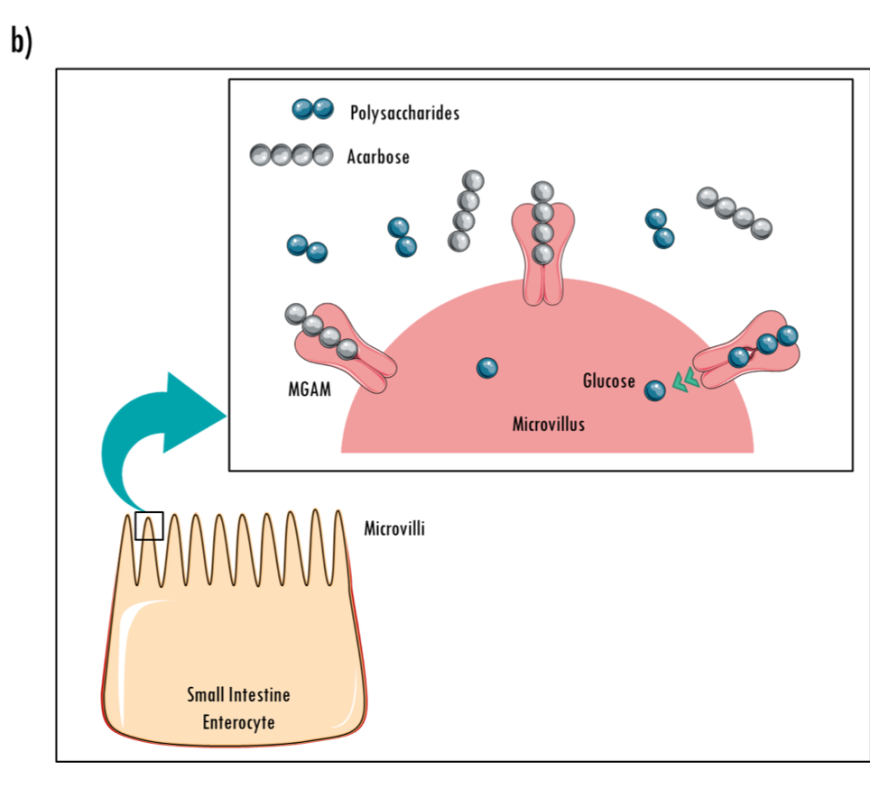 В группах пациентов, принимавших акарбозу, отмечено более значимое улучшение показателей липидного обмена в виде достоверного повышения ХС ЛПВП, снижения ХС ЛПНП и ТГ в сравнении с контрольной группой. Возможно, эти позитивные эффекты обусловлены не только уменьшением выраженности абдоминального ожирения, но и в значительной степени снижением уровня глюкозы натощак и после пероральной нагрузки глюкозой. Гипергликемия, особенно постпрандиальная, является важным фактором в развитии не только дислипидемии, но и атеросклероза. Повышенное содержание глюкозы в крови приводит к образованию модифицированных гликозилированных липопротеидов [10], которые обладают замедленной способностью удаляться из кровотока, в результате чего они захватываются макрофагами с образованием пенистых клеток, что является ключевым моментом в патогенезе атеросклероза. У пациентов с инсулинорезистентностью была выявлена прямая корреляция между уровнем глюкозы в крови и ТГ [11]. В основе патогенеза дислипидемии при МС лежит инсулинорезистентность.
В группах пациентов, принимавших акарбозу, отмечено более значимое улучшение показателей липидного обмена в виде достоверного повышения ХС ЛПВП, снижения ХС ЛПНП и ТГ в сравнении с контрольной группой. Возможно, эти позитивные эффекты обусловлены не только уменьшением выраженности абдоминального ожирения, но и в значительной степени снижением уровня глюкозы натощак и после пероральной нагрузки глюкозой. Гипергликемия, особенно постпрандиальная, является важным фактором в развитии не только дислипидемии, но и атеросклероза. Повышенное содержание глюкозы в крови приводит к образованию модифицированных гликозилированных липопротеидов [10], которые обладают замедленной способностью удаляться из кровотока, в результате чего они захватываются макрофагами с образованием пенистых клеток, что является ключевым моментом в патогенезе атеросклероза. У пациентов с инсулинорезистентностью была выявлена прямая корреляция между уровнем глюкозы в крови и ТГ [11]. В основе патогенеза дислипидемии при МС лежит инсулинорезистентность. Резистентность к инсулину приводит к усилению липолиза и высвобождению большого количества свободных или неэстерифицированных жирных кислот из жировой ткани в портальную вену, что в сочетании с повышенным содержанием глюкозы в крови дает дополнительный субстрат для синтеза ТГ в печени [12]. Результаты исследования Stop-NIDDM, продемонстрировавшего значительное снижение риска сердечно-сосудистых осложнений, также подтверждают важное значение коррекции постпрандиальной гипергликемии для снижения риска развития атеросклероза и его последствий. Существенной разницы в динамике всех изучаемых показателей между группами лиц, получавших акарбозу 150 мг и 300 мг, не отмечалось. При этом не было достоверной разницы в динамике средних показателей уровня глюкозы в плазме крови между всеми группами, что, вероятно, связано с непродолжительным сроком наблюдения за пациентами. Однако целевых значений как уровня глюкозы натощак, так и через 2 ч после нагрузки глюкозой, достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля.
Резистентность к инсулину приводит к усилению липолиза и высвобождению большого количества свободных или неэстерифицированных жирных кислот из жировой ткани в портальную вену, что в сочетании с повышенным содержанием глюкозы в крови дает дополнительный субстрат для синтеза ТГ в печени [12]. Результаты исследования Stop-NIDDM, продемонстрировавшего значительное снижение риска сердечно-сосудистых осложнений, также подтверждают важное значение коррекции постпрандиальной гипергликемии для снижения риска развития атеросклероза и его последствий. Существенной разницы в динамике всех изучаемых показателей между группами лиц, получавших акарбозу 150 мг и 300 мг, не отмечалось. При этом не было достоверной разницы в динамике средних показателей уровня глюкозы в плазме крови между всеми группами, что, вероятно, связано с непродолжительным сроком наблюдения за пациентами. Однако целевых значений как уровня глюкозы натощак, так и через 2 ч после нагрузки глюкозой, достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля. Способность акарбозы снижать постпрандиальный уровень гликемии, не вызывая при этом стимуляции эндогенного инсулина, приводит не только к потере массы тела, но и к снижению риска развития гипогликемических состояний, которые могут быть обусловлены гиперинсулинемией. Снижение массы тела на фоне приема акарбозы, возможно, способствовало снижению уровня АД и улучшению показателей липидного обмена. Многочисленными исследованиями было доказано, что снижение массы тела приводит к значительному снижению уровня АД. Снижение АД также может быть обусловлено улучшением углеводного обмена, что приводит к повышению чувствительности периферических тканей к инсулину и снижению повышенной активации симпатической нервной системы. Таким образом, результаты Российского исследования АПРЕЛЬ продемонстрировали позитивное влияние препарата Акарбоза (глюкобай) на основные факторы сердечно-сосудистого риска: избыточную массу тела, постпрандиальную гипергликемию, дислипидемию и АГ. Акарбоза обладает уникальным механизмом действия, препятствуя всасыванию углеводов на уровне тонкой кишки, что определяет ее безопасность у больных с МС, т.
Способность акарбозы снижать постпрандиальный уровень гликемии, не вызывая при этом стимуляции эндогенного инсулина, приводит не только к потере массы тела, но и к снижению риска развития гипогликемических состояний, которые могут быть обусловлены гиперинсулинемией. Снижение массы тела на фоне приема акарбозы, возможно, способствовало снижению уровня АД и улучшению показателей липидного обмена. Многочисленными исследованиями было доказано, что снижение массы тела приводит к значительному снижению уровня АД. Снижение АД также может быть обусловлено улучшением углеводного обмена, что приводит к повышению чувствительности периферических тканей к инсулину и снижению повышенной активации симпатической нервной системы. Таким образом, результаты Российского исследования АПРЕЛЬ продемонстрировали позитивное влияние препарата Акарбоза (глюкобай) на основные факторы сердечно-сосудистого риска: избыточную массу тела, постпрандиальную гипергликемию, дислипидемию и АГ. Акарбоза обладает уникальным механизмом действия, препятствуя всасыванию углеводов на уровне тонкой кишки, что определяет ее безопасность у больных с МС, т. е. у больных со множественными сердечно-сосудистыми факторами риска. Все это позволяет рекомендовать акарбозу для лечения этой категории больных. Соисследователи: Аметов А.С., Архипов М.В., Батурин А.К., Волкова Э.Г., Глезер М.Г., Горностаев В.В., Закирова А.Н., Ивлева А.Я., Карпов Р.С., Комиссаренко И.А., Кошельская О.А., Кривозубов Е.Ф., Лазебник Л.Б., Медведева И.В., Мезенцева Н.Г., Недогода С.В., Соколова Л.А., Спиропулос Н.А., Фурсов А.Н., Ратова Л.Г., Шестакова М.В.
е. у больных со множественными сердечно-сосудистыми факторами риска. Все это позволяет рекомендовать акарбозу для лечения этой категории больных. Соисследователи: Аметов А.С., Архипов М.В., Батурин А.К., Волкова Э.Г., Глезер М.Г., Горностаев В.В., Закирова А.Н., Ивлева А.Я., Карпов Р.С., Комиссаренко И.А., Кошельская О.А., Кривозубов Е.Ф., Лазебник Л.Б., Медведева И.В., Мезенцева Н.Г., Недогода С.В., Соколова Л.А., Спиропулос Н.А., Фурсов А.Н., Ратова Л.Г., Шестакова М.В.
- Mikhail N, Golub M, Tuck M. Obesity and hypertension. Prog Cardiovasc Dis 1999; 42 (1): 39–58.
- Kannel W.B, Mc Gee D.L. Diabetes and cardiovascular risk factors: the Framingham Study. Circulation 1979; 59: 8–13.
- DECODE Study Group on behalf of the European Diabetes Epidemiology Group. Is fasting glucose sufficient to define diabetes? Epidemiological data from 20 European Studies.
 Diabetologia 1999; 42: 654–74.
Diabetologia 1999; 42: 654–74. - Collins V.R, Dowse G, Zimmet P. Evidence against asscociation between parity and NIDDM from five population groups. Diabetes Care 1991; 14: 975–81.
- Tominaga M, Egushi H, Manaka H et al. Imparied glucose tolerance is a risk factor for cardiovascular disease, but not impaired fasting glucose. The Funagata Diabetes Study. Diabetes Care 1999; 22: 920–4.
- Rosak C et al. The effect of the timing and and the administration of acarbose on postprandial hyperglycaemia. Diab Med 1995; 12: 979–84.
- Chazova I, Mychka V. Treatment of patients with arterial hypertension and impaired glucose tolerance: results from «APREL» study. Fifteenth European meeting on Hypertension, Milan, Italy, June 17–21, 2005; S121.
- Jean-Louis Chiasson. Acarbose for prevention of type 2 diabetes mellitus: the Stop-NIDDM randomized trial. Lancet 2002; 358: 2072–7.

- Jean-Louis Chiasson. Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance. JAMA 2003; 290: 486–94.
- Steiner G. Altering triglyceride concentration changes insulin — glucose relationships in hypertriglyceridemic patients. Double — blind study with gemfibrozil with implications for atherosclerosis. Diabetes Care 1991; 14: 1077–81.
- Mamo J, Szeto L, Steiner G. Glycation of very low density lipoprotein from rat plasma impairs its catabolism. Diabetologia 1990; 33: 339–43.
- Howard B.V. Lipoprotein metabolism in diabetes mellitus. J Lipid Res 1987; 28: 613–28.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
ФАРМАТЕКА » Двойное профилактическое действие акарбозы – ингибитора альфа-глюкозидазы
Двойное профилактическое действие акарбозы — ингибитора альфа-глюкозидазы
В обзоре рассмотрены различные аспекты комплексного терапевтического действия акарбозы — препарата, ингибирующего альфа-гликозидазу в проксимальном отделе кишечника. За счет этого эффекта акарбоза уменьшает образование глюкозы в кишечнике, снижает постпрандиальную гипергликемию. Показано, что акарбоза оказывает благоприятное влияние на инсулиночувствительность и инсулинорезистентность, позитивно влияет на липидный обмен. Многоуровневый механизм действия препарата позволяет использовать его у пациентов с сахарным диабетом 2 типа, метаболическим синдромом, ожирением и атеросклеротическими заболеваниями. Результаты клинических исследований свидетельствуют о способности акарбозы предупреждать развитие сахарного диабета и сердечно-сосудистых заболеваний у лиц с нарушенной толерантностью к глюкозе.
За счет этого эффекта акарбоза уменьшает образование глюкозы в кишечнике, снижает постпрандиальную гипергликемию. Показано, что акарбоза оказывает благоприятное влияние на инсулиночувствительность и инсулинорезистентность, позитивно влияет на липидный обмен. Многоуровневый механизм действия препарата позволяет использовать его у пациентов с сахарным диабетом 2 типа, метаболическим синдромом, ожирением и атеросклеротическими заболеваниями. Результаты клинических исследований свидетельствуют о способности акарбозы предупреждать развитие сахарного диабета и сердечно-сосудистых заболеваний у лиц с нарушенной толерантностью к глюкозе.
Акарбоза (Глюкобай, Bayer) является первым и практически единственным представителем оригинального класса противодиабетических средств, действие которых не направлено непосредственно на островковый аппарат поджелудочной железы. Акарбоза ингибирует в проксимальном отделе тонкого кишечника фермент альфа-глюкозидазу, который выделяется клетками щеточной каймы. Связываясь конкуретно, обратимо и дозозависимо с альфа-глюкозидазой, акарбоза предупреждает расщепление сложных пищевых углеводов и дисахаридов, таких как крахмал, декстрин, сукроза. Этот эффект начинается в первые 10–15 минут после приема пищи и продолжается в течение 4–6 часов. При поступлении в пищеварительный тракт продуктов, содержащих сахариды, в норме половина глюкозы абсорбируется в течение первого часа, а остальная ее часть – в течение второго. Под воздействием акарбозы всасывание глюкозы в первые 2 часа снижается до минимума. Примерно 2/3 ее усваивается через 2–4 часа. Иначе говоря, принятая в самом начале еды акарбоза постоянно следует за пищевыми сахаридами в реальном масштабе времени, предупреждая проникновение моносахаридов в кровоток через слизистую кишечника в течение 1–2 часов от момента приема пищи. Вследствие этого предупреждаются высокие пики гипергликемии и ранней фазы гиперинсулинемии.
Связываясь конкуретно, обратимо и дозозависимо с альфа-глюкозидазой, акарбоза предупреждает расщепление сложных пищевых углеводов и дисахаридов, таких как крахмал, декстрин, сукроза. Этот эффект начинается в первые 10–15 минут после приема пищи и продолжается в течение 4–6 часов. При поступлении в пищеварительный тракт продуктов, содержащих сахариды, в норме половина глюкозы абсорбируется в течение первого часа, а остальная ее часть – в течение второго. Под воздействием акарбозы всасывание глюкозы в первые 2 часа снижается до минимума. Примерно 2/3 ее усваивается через 2–4 часа. Иначе говоря, принятая в самом начале еды акарбоза постоянно следует за пищевыми сахаридами в реальном масштабе времени, предупреждая проникновение моносахаридов в кровоток через слизистую кишечника в течение 1–2 часов от момента приема пищи. Вследствие этого предупреждаются высокие пики гипергликемии и ранней фазы гиперинсулинемии.
Ввиду обратимости связывания акарбозы с альфа-глюкозидазой лечение ею может продолжаться неопределенно долго без снижения эффективности препарата. Более того, акарбоза может применяться в комбинации с другими антидиабетическими средствами (инъекции инсулина, препараты сульфанилмочевины, бигуаниды).
Более того, акарбоза может применяться в комбинации с другими антидиабетическими средствами (инъекции инсулина, препараты сульфанилмочевины, бигуаниды).
Сродство акарбозы с кишечными энзимами постепенно уменьшается в следующей последовательности: альфа-глюкозидаза > сукраза > мальтаза > декстраназа. Установлено, что акарбоза ингибирует также панкреатическую альфа-амилазу.
Продолжительное лечение акарбозой сопровождается увеличением микробной массы в толстой кишке. В этом отношении особенно выделяются лактобактерии [14, 15]. Данный процесс сопровождается микробной ферментацией углеводов со снижением рН фекальных масс. В определенной степени это напоминает эффект, достигаемый с помощью лактулозы, уменьшающей при гепатоэнцефалическом синдроме явления энцефалопатии. Поэтому акарбоза может быть использована при лечении цирроза печени у больных сахарным диабетом (СД). Кроме того, под влиянием акарбозы происходит снижение уровня альфа-гидроксибутирата (признанный канцероген), предотвращение гипераммонемии и снижение рН в кишечнике. Как известно, при СД риск развития рака толстой кишки на 30 % выше, чем в популяции. Биохимические изменения в кишечнике, развивающиеся под влиянием акарбозы, способствуют значительному снижению риска развития этой злокачественной опухоли.
Как известно, при СД риск развития рака толстой кишки на 30 % выше, чем в популяции. Биохимические изменения в кишечнике, развивающиеся под влиянием акарбозы, способствуют значительному снижению риска развития этой злокачественной опухоли.
Однако все эти патологические состояния не являются основным показанием для применения акарбозы. Важнейшее свойство акарбозы – способность предотвращать постпрандиальную (послепищевую) гипергликемию позволяет предупреждать прогрессию нарушенной толерантности к глюкозе (НТГ) в СД 2 типа, а у больных с уже развившемся СД – надежно контролировать уровень глюкозы.
В основном акарбоза применяется при СД 2 типа и НТГ, существует положительный опыт ее использования при СД 2 типа, требующем инсулинотерапии. Она с успехом применялась и при комбинированном лечении больных СД 1 типа диетой и инсулином. Объективным критерием гипогликемической эффективности и профилактической активности акарбозы являются существенное снижение концентрации гликированного гемоглобина (HbA1c) и уровня постпрандиальной гликемии. Профилактическая эффективность этого препарата подтверждается его способностью достоверно снижать частоту перехода НТГ в СД 2 типа, а также уменьшением под его влиянием риска развития ИБС и сердечно-сосудистой заболеваемости по данным проспективных, многоцентровых, клинических исследований.
Профилактическая эффективность этого препарата подтверждается его способностью достоверно снижать частоту перехода НТГ в СД 2 типа, а также уменьшением под его влиянием риска развития ИБС и сердечно-сосудистой заболеваемости по данным проспективных, многоцентровых, клинических исследований.
Влияние акарбозы на гликемию
Был проведен мета-анализ результатов 13 рандомизированных исследований с применением акарбозы у больных СД 2 типа. Длительность наблюдения за пациентами колебалась в пределах от 3 месяцев до 2 лет. Во всех без исключения исследованиях наблюдалось достоверное снижение уровня глюкозы натощак (в среднем на 1,3 ± 0,3 ммоль/л), ее постпрандиального уровня (в среднем на 2,9 ± 0,8 ммоль/л) и уменьшение концентрации HbА1c (в среднем на 0,9 ± 0,25 %) [9].
В крупном многоцентровом исследовании, в которое были включены 2139 больных СД 2 типа, у которых контроль гликемии при применении диеты и/или препаратов сульфанилмочевины оказался малоэффективным, лечение акарбозой привело к снижению уровня постпрандиальной гликемии (через 1 час после приема глюкозы) на 2,58 ммоль/л, а уровень НbА1c снизился за период лечения на 0,7 %. Особенно эффективной терапия оказалась у лиц с давностью заболевания менее одного года [1].
Особенно эффективной терапия оказалась у лиц с давностью заболевания менее одного года [1].
Добавление акарбозы к инсулинотерапии, метформину и сульфанилмочевине у больных СД 2 типа обеспечивало дополнительное абсолютное снижение уровня HbА1с на 0,5–0,8 %. Этот эффект сохранялся при наблюдении за больными в течение 3 лет [11].
Влияние акарбозы на инсулинорезистентность и чувствительность к инсулину
Одним из основных механизмов развития СД 2 типа является недостаточная секреция инсулина в начальную фазу пищевой гипергликемии (вслед за приемом пищи). При недостаточном инсулинообразовании пищевая гипергликемия посредством механизма обратной биологической связи стимулирует гиперинсулинемию, которая сопровождается снижением числа рецепторов к инсулину. Гипергликемия, оказывающая токсический эффект на поджелудочную железу, усиливает пострецепторный дефект на уровне периферических тканей (мышцы, печень, жировая клетчатка), т. е. воздействует на основной механизм инсулинорезистентности. В результате сочетанного нарушения быстрой фазы секреции инсулина и клеточной инсулинорезистентности развивается патологически высокая и продолжительная гипергликемия. Площадь под такой кривой значительно превышает площадь под нормальной гликемической кривой.
В результате сочетанного нарушения быстрой фазы секреции инсулина и клеточной инсулинорезистентности развивается патологически высокая и продолжительная гипергликемия. Площадь под такой кривой значительно превышает площадь под нормальной гликемической кривой.
Meneilly и соавт. (2000) при лечении акарбозой больных инсулинозависимым СД с умеренно повышенной массой тела наблюдали возрастание чувствительности тканей к инсулину на 30 % по отношению к исходному значению [13]. Вместе с тем установлено, что акарбоза более эффективна у лиц с инсулинорезистентностью и пациентов с СД 2 типа небольшой давности (и соответственно более показана при этих состояниях).
Акарбоза и глюкагон-подобный пептид 1
Основная роль в позитивном влиянии акарбозы на метаболизм глюкозы принадлежит недавно открытому гормону ГПП-1 (глюкагон-подобный пептид-1). В отличие от глюкагона, синтезируемого альфа-клетками поджелудочной железы, он синтезируется в кишечнике.
ГПП-1 оказывает множество эффектов, синергичных по отношению к стимулированной глюкозой секреции инсулина бета-клетками поджелудочной железы. В ряде работ показано, что ГПП-1 способен предотвращать закономерное ослабление функции бета-клеток, связанное с возрастом, и улучшать ее у больных СД 2 типа [6].
В ряде работ показано, что ГПП-1 способен предотвращать закономерное ослабление функции бета-клеток, связанное с возрастом, и улучшать ее у больных СД 2 типа [6].
При использовании аналога ГПП-1 с пролонгированным действием – эксендина-4 – в экспериментах на крысах установлено, что указанное воздействие на функцию бета-клеток достигается путем: 1) усиления генной регуляции их глюкозочувствительности, 2) повышения дифференциации и неогенеза этих клеток.
Введение экзогенного ГПП-1 уменьшает концентрацию глюкозы крови натощак у здоровых и больных СД (Nattan и соавт., 1994) путем стимуляции секреции инсулина и его синтеза в соответствии с уровнем глюкозы (Fehman и соавт., 1992), а также с помощью подавления секреции глюкагона (Komatsu и соавт., 1989).
При введении ГПП-1 в течение 1 часа общее количество секретируемого инсулина возросло с 10,33 до 25,18 мг/мг белка/час (вдвое против исходного уровня). Это было связано как с усилением секреции инсулина единичной бета-клеткой, так и с увеличением клеточного ответа бета-клеток на глюкозу (иначе говоря, произошло и увеличение числа секретирующих клеток, и усиление секреции инсулина каждой бета-клеткой).
При максимальной стимуляции глюкозой в сочетании с введением ГПП-1 наблюдалось возрастание секреции инсулина единичной бета-клеткой в 1,3 раза. Стимуляция функции бета-клеток с помощью калия (20 ммоль) способствовало деполяризации их мембран и усилению секреции инсулина даже в отсутствие добавочной глюкозы. Установлено, что увеличение внутриклеточного Са2+ может быть начальным этапом действия ГПП-1. При введении ГПП-1 в сочетании с глюкозой и деполяризацией клеток не отмечено дополнительного увеличения числа секретирующих бета-клеток, но обнаружено возрастание относительного количества (в 1,6 раза) секреции инсулина на 1 клетку [6].
Продолжительное лечение эксендином-4 крыс с генетически обусловленным СД достоверно повышало толерантность к глюкозе и снижало концентрацию НbА1с (через 13 недель применения). Через 56 дней у животных основной группы содержание висцерального и подкожного жира достоверно снижалось, несмотря на высокий уровень лептина, играющего важную роль в развитии ожирения [6].
У добровольцев (здоровые и больные СД 2 типа) в течение нескольких минут от начала введения эксендина-4 повышался уровень инсулина, который и через 3 часа после окончания введения в 2 раза превышал исходный, даже в отсутствие введения глюкозы. Все это происходило на фоне снижения уровня глюкагона (в 2 раза по сравнению с исходным).
Влияние акарбозы на липиды и липопротеиды
Данные о влиянии акарбозы на холестерин липопротеидов низкой плотности, Апо А1 и В, противоречивы. Имеются сведения как об отсутствии влияния на их уровень, так и о разнонаправленных сдвигах в концентрациях указанных субстанций [8].
Общепризнанно, что акарбоза существенно влияет на уровень триглицеридов крови. При любом виде СД, метаболическом синдроме и даже при изолированной НТГ отмечается та или иная степень гипертриглицеридемии. Особенно часто гипертриглицеридемия, высокий уровень липопротеидов очень низкой плотности (ЛПОНП), состоящих в основном из триглицеридов и свободных жирных кислот (СЖК), наблюдаются при сочетании СД или НТГ с ожирением.
Пищевые углеводы являются предшественниками липогенеза, а инсулин, как известно, играет центральную роль в пищевом метаболизме жиров, в т. ч. за счет ингибирования синтеза эндогенных триглицеридов. Индуцированное акарбозой ослабление инсулинорезистентности становится основным стимулом к снижению синтеза триглицеридов.
При падении концентрации инсулина в крови СЖК высвобождаются из адипоцитов в системный кровоток и связываются гепатоцитами. Далее они этерифицируются с образованием триацилглицерина, запасы которого либо используются печенью в качестве источника энергии, либо для образования ЛПОНП и триглицеридов. Положительно воздействуя на регуляцию обмена глюкозы, акарбоза, хотя и косвенно, но достаточно эффективно влияет на уровень ЛПОНП и тиреотропного гормона. В исследовании Mulaguarnera и соавт. (1999) 30 человек с гипертриглицеридемией без СД получали в течение 16 недель акарбозу в дозе 100 мг/сут. За указанный срок уровень триглицеридов у них снизился с 5,8 до 3,6 ммоль/л [10]. Примерно такой же результат наблюдался у больных семейной гипертриглицеридемией при лечении акарбозой в течение 2 месяцев в дозе 100 мг/сут.
Примерно такой же результат наблюдался у больных семейной гипертриглицеридемией при лечении акарбозой в течение 2 месяцев в дозе 100 мг/сут.
Maruhama и соавт. (1995) наблюдали достоверное снижение уровня триглицеридов при 3-месячной терапии акарбозой (300 мг/сут) у пациентов с ожирением и гипертриглицеридемией [12]. Наиболее впечатляющими оказались результаты мета-анализа 7 длительных исследований с акарбозой [7], в котором также было продемонстрировано достоверное снижение уровня триглицеридемии, а также общего холестерина и его фракций.
В связи с тем, что акарбоза не влияет на адсорбцию жиров в кишечнике, ее гипотриглицеридемический эффект зависит от того, насколько в печени снижается захват свободных жирных кислот для образования ЛПОНП.
Другие клинические эффекты акарбозы
Установлено достоверное снижение систолического АД (в среднем на 5,2 ± 2,4 мм рт. ст.) у больных инсулинозависимым СД с мягкой артериальной гипертензией, лечившихся акарбозой [8].
В крупном проспективном исследовании The STOP-NIDDM в группе пациентов с НТГ, получавших акарбозу, риск развития артериальной гипертензии снижался на 38 % (p = 0,004; рис. 1). В группе акарбозы в течение почти всего периода наблюдения отмечалось постепенное снижение среднего систолического и диастолического артериального давления по сравнению с исходным уровнем. В группе плацебо артериальное давление, напротив, имело тенденцию к повышению (рис. 2) [5].
1). В группе акарбозы в течение почти всего периода наблюдения отмечалось постепенное снижение среднего систолического и диастолического артериального давления по сравнению с исходным уровнем. В группе плацебо артериальное давление, напротив, имело тенденцию к повышению (рис. 2) [5].
У больных СД лечение акарбозой позволяет снизить риск тромбогенных нарушений гемостаза, обусловленных приемом жирной пищи. Об этом свидетельствуют результаты исследования Ceriello и соавт. (1996), наблюдавших достоверное снижение фрагментов I и II протромбина у больных СД 2 типа через 2 часа после приема богатой углеводами и жирами пищи со 100 мг акарбозы [3]. Аналогичным образом снижался уровень D-даймера.
Поскольку местом приложения действия акарбозы является тонкий кишечник, этот препарат оказывает ряд положительных эффектов, опосредованных на уровне желудочно-кишечного тракта. В частности, прием акарбозы ассоциируется с усилением высвобождения желудочного ингибирующего полипептида в позднем (60–240 минут) постпрандиальном периоде. Это, с одной стороны, замедляет опорожнение желудка и сохраняет чувство насыщения (не без влияния на соответствующие центры головного мозга, управляющие этим чувством), а с другой – активирует бета-клетки, повышает их чувствительность к глюкозе, усиливает инсулиновый ответ на нагрузку глюкозой.
Это, с одной стороны, замедляет опорожнение желудка и сохраняет чувство насыщения (не без влияния на соответствующие центры головного мозга, управляющие этим чувством), а с другой – активирует бета-клетки, повышает их чувствительность к глюкозе, усиливает инсулиновый ответ на нагрузку глюкозой.
Отмечаемое всеми исследователями снижение массы тела больных под влиянием лечения акарбозой, вероятнее всего, обусловлено именно этим эффектом [8].
Интегративная роль акарбозы в профилактике сахарного диабета, атеросклероза, метаболического синдрома
Рассмотренные выше терапевтические эффекты акарбозы – нормализация уровня глюкозы натощак и после углеводной нагрузки, благоприятное влияние на инсулиночувствительность и инсулинорезистентность, существенное снижение уровней триглицеридов и ЛПОНП, гипотензивное действие при мягкой артериальной гипертензии, позитивное воздействие на некоторые показатели гемокоагуляции, снижение массы тела – позволяют рассматривать этот препарат как эффективное средство лечения и профилактики не только CД 2, но и метаболического синдрома, ожирения, атеросклеротических заболеваний и их осложнений.
В недавно закончившемся крупном международном многоцентровом исследовании STOP-NIDDM оценивалась способность акарбозы предупреждать у лиц с НТГ развитие СД и сердечно-сосудистых осложнений [4, 5]. В STOP-NIDDM участвовали 1429 пациентов с НТГ и другими факторами риска (артериальная гипертензия, ожирение, нарушения липидного обмена). Было установлено, что у лиц с НТГ лечение акарбозой на 25 % уменьшало риск развития СД 2 типа (p
Особенно обнадеживающими оказались результаты превентивного применения акарбозы в целях предупреждения сердечно-сосудистых заболеваний. За 3,3 года наблюдения у лиц с НТГ и другими факторами риска удалось снизить комбинированный риск развития сердечно-сосудистых заболеваний на 49 % (p = 0,03), причем риск инфаркта миокарда уменьшился более чем на 90 % (р = 0,0002), а частота новых случаев артериальной гипертензии – на 34 % (p
Полученные данные являются принципиально новыми и крайне важными: они расширяют представления о патогенезе атеросклероза и атеросклеротических осложнений, позволяют по-новому взглянуть на проблему профилактики СД и сердечно-сосудистых заболеваний у лиц с латентным фактором риска, к числу которых относится НТГ.
Pervye rezul’taty Rossiyskoy programmy po izucheniyu effektivnosti primeneniya akarbozy u patsientov s narushennoy tolerantnost’yu k glyukoze i arterial’noy gipertoniey (APREL’) | Chazova
От имени исследователей — Соисследователи: Аметов А.С., Архипов М.В., Батурин А.К., Волкова Э.Г., Глезер М.Г., Горностаев В.В., Закирова А.Н., Ивлева А.Я., Карпов Р.С., Комиссаренко И.А., Кошельская О.А., Кривозубов Е.Ф., Лазебник Л.Б., Медведева И.В., Мезенцева Н.Г., Недогода С.В., Ратова Л.Г., Соколова Л.А., Спиропулос Н.А., Фурсов А.Н., Чорбинская С.А.,Шестакова М.В. — Проведение программы АПРЕЛЬ было инициировано отделом системных гипертензий НИИ кардиологии им. А.Л.Мясникова РК НПК МЗ и СР РФ под руководством проф. И.Е. Чазовой. Программа стартовала в ноябре 2003 г. и завершилась в июле 2004 г. Она проводилась в Москве и ряде регионов России: Центральном, Северо-Западном, Южном, Поволжье, Уральском, Западной Сибири и республике Башкортостан. В программе принимали участие 17 исследовательских центров из 10 городов России: Москвы, Санкт-Петербурга, Волгограда, Екатеринбурга, Краснодара, Новосибирска, Томска, Тюмени, Уфы, Челябинска. Основанием для проведения программы АПРЕЛЬ послужила широкая распространенность метаболического синдрома (МС), основными проявлениями которого являются абдоминальное ожирение, нарушения углеводного, липидного обмена и артериальная гипертония (АГ).результаты Российского исследования АПРЕЛЬ продемонстрировали, что акарбоза (глюкобай) позитивно воздействует на основные факторы сердечно-сосудистого риска – избыточную массу тела, постпрандиальную гипергликемию и АГ. Снижение массы тела, уровня постпрандиальной гликемии и АД на фоне монотерапии акарбозой суммарно снижает степень риска развития сердечно-сосудистых осложнений, что ранее доказано результатами исследования STOP-NIDDM.Акарбоза обладает уникальным механизмом периферического действия, т.е. способностью препятствовать всасыванию углеводов на уровне тонкой кишки.
В программе принимали участие 17 исследовательских центров из 10 городов России: Москвы, Санкт-Петербурга, Волгограда, Екатеринбурга, Краснодара, Новосибирска, Томска, Тюмени, Уфы, Челябинска. Основанием для проведения программы АПРЕЛЬ послужила широкая распространенность метаболического синдрома (МС), основными проявлениями которого являются абдоминальное ожирение, нарушения углеводного, липидного обмена и артериальная гипертония (АГ).результаты Российского исследования АПРЕЛЬ продемонстрировали, что акарбоза (глюкобай) позитивно воздействует на основные факторы сердечно-сосудистого риска – избыточную массу тела, постпрандиальную гипергликемию и АГ. Снижение массы тела, уровня постпрандиальной гликемии и АД на фоне монотерапии акарбозой суммарно снижает степень риска развития сердечно-сосудистых осложнений, что ранее доказано результатами исследования STOP-NIDDM.Акарбоза обладает уникальным механизмом периферического действия, т.е. способностью препятствовать всасыванию углеводов на уровне тонкой кишки. Периферическое действие акарбозы и отсутствие системного действия определяет ее безопасность для больных МС, т.е. больных с множественными сердечно-сосудистыми факторами риска.Благодаря своей безопасности, способности снижать АД и постпрандиальный уровень глюкозы, не вызывая при этом гиперинсулинемию, а также эффективно уменьшать массу тела, акарбоза может применяться в качестве монотерапии у больных с ожирением, мягкой АГ и нарушениями углеводного обмена.
Периферическое действие акарбозы и отсутствие системного действия определяет ее безопасность для больных МС, т.е. больных с множественными сердечно-сосудистыми факторами риска.Благодаря своей безопасности, способности снижать АД и постпрандиальный уровень глюкозы, не вызывая при этом гиперинсулинемию, а также эффективно уменьшать массу тела, акарбоза может применяться в качестве монотерапии у больных с ожирением, мягкой АГ и нарушениями углеводного обмена.
Проведение программы АПРЕЛЬ было инициировано отделом системных гипертензий НИИ кардиологии им. А.Л.Мясникова РК НПК МЗ и СР РФ под руководством проф. И.Е. Чазовой. Программа стартовала в ноябре 2003 г. и завершилась в июле 2004 г. Она проводилась в Москве и ряде регионов России: Центральном, Северо-Западном, Южном, Поволжье, Уральском, Западной Сибири и республике Башкортостан. В программе принимали участие 17 исследовательских центров из 10 городов России: Москвы, Санкт-Петербурга, Волгограда, Екатеринбурга, Краснодара, Новосибирска, Томска, Тюмени, Уфы, Челябинска. Обоснование программы Основанием для проведения программы АПРЕЛЬ послужила широкая распространенность метаболического синдрома (МС), основными проявлениями которого являются абдоминальное ожирение, нарушения углеводного, липидного обмена и артериальная гипертония (АГ). Как доказано многочисленными крупными многоцентровыми исследованиями, у этой категории больных имеется повышенный риск развития сердечно-сосудистых осложнений и сахарного диабета (СД) типа 2 [1–3]. Особое значение придается постпрандиальному уровню глюкозы в плазме крови (глюкоза в плазме крови после приема пищи) как самостоятельному фактору риска развития сердечно-сосудистых осложнений, мозговых инсультов и преждевременной смерти. Результаты крупных международных исследований DECODE и UKPDS показали, что риск сердечно-сосудистых осложнений и преждевременной смерти значительно повышен при высоком уровне именно постпрандиальной глюкозы в плазме крови, чем ассоциированный с уровнем глюкозы плазмы в крови натощак [4, 5].
В программе принимали участие 17 исследовательских центров из 10 городов России: Москвы, Санкт-Петербурга, Волгограда, Екатеринбурга, Краснодара, Новосибирска, Томска, Тюмени, Уфы, Челябинска. Обоснование программы Основанием для проведения программы АПРЕЛЬ послужила широкая распространенность метаболического синдрома (МС), основными проявлениями которого являются абдоминальное ожирение, нарушения углеводного, липидного обмена и артериальная гипертония (АГ). Как доказано многочисленными крупными многоцентровыми исследованиями, у этой категории больных имеется повышенный риск развития сердечно-сосудистых осложнений и сахарного диабета (СД) типа 2 [1–3]. Особое значение придается постпрандиальному уровню глюкозы в плазме крови (глюкоза в плазме крови после приема пищи) как самостоятельному фактору риска развития сердечно-сосудистых осложнений, мозговых инсультов и преждевременной смерти. Результаты крупных международных исследований DECODE и UKPDS показали, что риск сердечно-сосудистых осложнений и преждевременной смерти значительно повышен при высоком уровне именно постпрандиальной глюкозы в плазме крови, чем ассоциированный с уровнем глюкозы плазмы в крови натощак [4, 5]. Особенно высок этот риск у женщин. Терапевтические подходы к лечению АГ у данной категории больных имеют свои особенности. Влияя только на один из компонентов МС, можно добиться заметного улучшения других нарушений. Например, уменьшение массы тела может привести к снижению артериального давления (АД) и нормализации метаболических нарушений [6]. Грамотно подобранная антигипертензивная терапия также может способствовать не только хорошему гипотензивному эффекту, но и улучшению показателей углеводного и липидного обмена. Одним из самых безопасных препаратов, влияющих на постпрандиальный уровень глюкозы и инсулинорезистентность (ИР), является акарбоза (глюкобай), представитель класса ингибиторов альфа-глюкозидаз. Механизм действия акарбозы – обратимая блокада альфа-глюкозидазы, ключевого фермента расщепления поли- и олигосахаридов, благодаря чему снижается возможность образования глюкозы в кишечнике и ее всасывания, вследствие чего предотвращается чрезмерный подъем постпрандиальной гликемии без стимуляции секреции инсулина [7].
Особенно высок этот риск у женщин. Терапевтические подходы к лечению АГ у данной категории больных имеют свои особенности. Влияя только на один из компонентов МС, можно добиться заметного улучшения других нарушений. Например, уменьшение массы тела может привести к снижению артериального давления (АД) и нормализации метаболических нарушений [6]. Грамотно подобранная антигипертензивная терапия также может способствовать не только хорошему гипотензивному эффекту, но и улучшению показателей углеводного и липидного обмена. Одним из самых безопасных препаратов, влияющих на постпрандиальный уровень глюкозы и инсулинорезистентность (ИР), является акарбоза (глюкобай), представитель класса ингибиторов альфа-глюкозидаз. Механизм действия акарбозы – обратимая блокада альфа-глюкозидазы, ключевого фермента расщепления поли- и олигосахаридов, благодаря чему снижается возможность образования глюкозы в кишечнике и ее всасывания, вследствие чего предотвращается чрезмерный подъем постпрандиальной гликемии без стимуляции секреции инсулина [7]. Последнее делает акарбозу безопасным препаратом, так как при его использовании отсутствует опасность развития гипогликемических состояний. Эффективность применения акарбозы для предотвращения развития СД типа 2 у пациентов с нарушенной толерантностью к глюкозе (НТГ) была продемонстрирована в крупных клинических исследованиях [8, 9]. В 2002 г. было завершено крупное международное исследование STOP-NIDDM, наглядно продемонстрировавшее высокую эффективность акарбозы в предотвращении СД типа 2 у больных с НТГ. Главным итогом исследования STOP-NIDDM явилось то, что у больных, находившихся на активном лечении акарбозой, относительный риск развития СД типа 2 был на 36% меньше, чем в группе плацебо [10]. При этом уменьшение относительного риска развития СД типа 2 при применении акарбозы было достигнуто вне зависимости от пола, возраста и массы тела: у более молодых пациентов (моложе 55 лет) – на 21%, в более старших возрастных группах (старше 55 лет) – на 30%, у мужчин – на 23% и у женщин – на 29%, при индексе массы тела (ИМТ) более 30 кг/м2 – на 23%, при ИМТ<30 кг/м2 – на 30%.
Последнее делает акарбозу безопасным препаратом, так как при его использовании отсутствует опасность развития гипогликемических состояний. Эффективность применения акарбозы для предотвращения развития СД типа 2 у пациентов с нарушенной толерантностью к глюкозе (НТГ) была продемонстрирована в крупных клинических исследованиях [8, 9]. В 2002 г. было завершено крупное международное исследование STOP-NIDDM, наглядно продемонстрировавшее высокую эффективность акарбозы в предотвращении СД типа 2 у больных с НТГ. Главным итогом исследования STOP-NIDDM явилось то, что у больных, находившихся на активном лечении акарбозой, относительный риск развития СД типа 2 был на 36% меньше, чем в группе плацебо [10]. При этом уменьшение относительного риска развития СД типа 2 при применении акарбозы было достигнуто вне зависимости от пола, возраста и массы тела: у более молодых пациентов (моложе 55 лет) – на 21%, в более старших возрастных группах (старше 55 лет) – на 30%, у мужчин – на 23% и у женщин – на 29%, при индексе массы тела (ИМТ) более 30 кг/м2 – на 23%, при ИМТ<30 кг/м2 – на 30%. Важным результатом исследования явилось то, что впервые были получены данные о возможности акарбозы предотвращать развитие сердечно-сосудистых заболеваний у лиц с нарушениями углеводного обмена. Относительный риск развития новых случаев АГ на фоне активного лечения снизился на 34%, инфаркта миокарда – на 91%, а любого зафиксированного сердечно-сосудистого события – на 49%. Предпосылкой к проведению программы АПРЕЛЬ явились результаты научного исследования, проводимого ранее в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у больных с АГ, НТГ и ожирением, которые продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на уровень АД у данной категории больных [11]. Цель программы состояла в сравнительной оценке эффективности ингибитора a-глюкозидазы акарбозы (глюкобай) в дозах 150 и 300 мг/сут и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного и липидного обмена и массу тела у пациентов с НТГ и АГ.
Важным результатом исследования явилось то, что впервые были получены данные о возможности акарбозы предотвращать развитие сердечно-сосудистых заболеваний у лиц с нарушениями углеводного обмена. Относительный риск развития новых случаев АГ на фоне активного лечения снизился на 34%, инфаркта миокарда – на 91%, а любого зафиксированного сердечно-сосудистого события – на 49%. Предпосылкой к проведению программы АПРЕЛЬ явились результаты научного исследования, проводимого ранее в отделе системных гипертензий НИИ кардиологии им. А.Л.Мясникова у больных с АГ, НТГ и ожирением, которые продемонстрировали способность акарбозы позитивно влиять не только на углеводный обмен, но и на уровень АД у данной категории больных [11]. Цель программы состояла в сравнительной оценке эффективности ингибитора a-глюкозидазы акарбозы (глюкобай) в дозах 150 и 300 мг/сут и немедикаментозных мероприятий по изменению образа жизни и стереотипов питания на течение АГ, показатели углеводного и липидного обмена и массу тела у пациентов с НТГ и АГ. Дизайн программы представлял собой открытую рандомизированную двойную многоцентровую программу на параллельных группах пациентов с избыточной массой тела, НТГ и АГ. После предварительного скрининга пациенты были рандомизированы «методом конвертов» на 3 равные по численности группы: принимающих акарбозу в дозе 150, 300 мг в сутки и группу контроля. Все пациенты должны были выполнять немедикаментозные мероприятия, направленные на снижение массы тела. Предшествующая антигипертензивная терапия не могла меняться на протяжении всего исследования (рис. 1). Общая продолжительность участия каждого пациента в исследовании составляла 24 нед. По условиям протокола все пациенты проходили полное обследование с проведением дополнительного клинико-лабораторного и инструментального осмотра на 1 и 4-м (заключительном) визите. Обязательным являлось заполнение специального опросника о качестве жизни и пищевых привычек (1-й и 4-й визиты). Также обязательным являлись и 2 промежуточных визита с проведением осмотра, измерения АД, частоты сердечных сокращений (ЧСС), измерения массы тела и окружности талии и определения глюкозы в плазме крови натощак и через 2 ч после нагрузки 75 мг глюкозы.
Дизайн программы представлял собой открытую рандомизированную двойную многоцентровую программу на параллельных группах пациентов с избыточной массой тела, НТГ и АГ. После предварительного скрининга пациенты были рандомизированы «методом конвертов» на 3 равные по численности группы: принимающих акарбозу в дозе 150, 300 мг в сутки и группу контроля. Все пациенты должны были выполнять немедикаментозные мероприятия, направленные на снижение массы тела. Предшествующая антигипертензивная терапия не могла меняться на протяжении всего исследования (рис. 1). Общая продолжительность участия каждого пациента в исследовании составляла 24 нед. По условиям протокола все пациенты проходили полное обследование с проведением дополнительного клинико-лабораторного и инструментального осмотра на 1 и 4-м (заключительном) визите. Обязательным являлось заполнение специального опросника о качестве жизни и пищевых привычек (1-й и 4-й визиты). Также обязательным являлись и 2 промежуточных визита с проведением осмотра, измерения АД, частоты сердечных сокращений (ЧСС), измерения массы тела и окружности талии и определения глюкозы в плазме крови натощак и через 2 ч после нагрузки 75 мг глюкозы. На всех 4 визитах врач проводил беседы с пациентом, оценивал дневник питания и фиксировал любые побочные явления. Немедикаментозные мероприятия включали в себя гипокалорийную диету со сниженным содержанием углеводов, жиров и повышение физической активности. Гипокалорийную диету с дефицитом в 500–600 Ккал рассчитывали индивидуально для каждого больного. На первом визите больным выдавали методические рекомендации по изменению образа жизни и питания. Критерии включения В программу планировалось включить 408 человек из разных регионов России. Подходящими для исследования считали пациентов обоих полов в возрасте от 18 до 60 лет включительно, имеющих ИМТ>25 кг/м2, НТГ (согласно определению уровень глюкозы в плазме крови натощак ниже 7 ммоль/л, уровень глюкозы в плазме крови после перорального приема 75 г глюкозы 7,8 и выше и ниже 11,1 ммоль/л), и мягкую АГ [согласно определению систолическое АД (САД) в положении сидя 140 мм рт. ст. и выше и ниже 160 мм рт. ст. и/или диастолическое АД (ДАД) в положении сидя 90 мм рт.
На всех 4 визитах врач проводил беседы с пациентом, оценивал дневник питания и фиксировал любые побочные явления. Немедикаментозные мероприятия включали в себя гипокалорийную диету со сниженным содержанием углеводов, жиров и повышение физической активности. Гипокалорийную диету с дефицитом в 500–600 Ккал рассчитывали индивидуально для каждого больного. На первом визите больным выдавали методические рекомендации по изменению образа жизни и питания. Критерии включения В программу планировалось включить 408 человек из разных регионов России. Подходящими для исследования считали пациентов обоих полов в возрасте от 18 до 60 лет включительно, имеющих ИМТ>25 кг/м2, НТГ (согласно определению уровень глюкозы в плазме крови натощак ниже 7 ммоль/л, уровень глюкозы в плазме крови после перорального приема 75 г глюкозы 7,8 и выше и ниже 11,1 ммоль/л), и мягкую АГ [согласно определению систолическое АД (САД) в положении сидя 140 мм рт. ст. и выше и ниже 160 мм рт. ст. и/или диастолическое АД (ДАД) в положении сидя 90 мм рт. ст. и выше и ниже 100 мм рт. ст.]. Пациенты могли принимать любую антигипертензивную терапию. В программу могли быть включены пациенты, не принимающие антигипертензивную терапию. В момент рандомизации уровень САД должен был быть 130 мм рт. ст. и выше, а ДАД 85 мм рт. ст. и выше. Критериями исключения являлись: непереносимость акарбозы, участие в любом другом исследовании в течение 30 дней перед отбором, тяжелые сердечно-сосудистые заболевания, включающие острый инфаркт миокарда, стенокардию III–IV функционального класса, нестабильную стенокардию, сердечную недостаточность, нарушение мозгового кровообращения, клинически значимые изменения ЭКГ, требующие немедленной терапии, заболевания или лекарства, нарушающие кишечную проходимость и/или абсорбцию, а также статины. В программу не включали больных, имеющих СД типа 1 или типа 2, вторичные АГ: реноваскулярная, феохромоцитому, болезнь Иценко–Кушинга, тиреотоксикоз, хроническую почечную недостаточность, тяжелые нарушения функции печени (превышение уровня трансаминаз в 2 раза и более нормы), беременность и период лактации, онкологические заболевания, использование больным любых медикаментозных препаратов и биологически активных добавок для уменьшения массы тела в течение 3 мес перед отбором.
ст. и выше и ниже 100 мм рт. ст.]. Пациенты могли принимать любую антигипертензивную терапию. В программу могли быть включены пациенты, не принимающие антигипертензивную терапию. В момент рандомизации уровень САД должен был быть 130 мм рт. ст. и выше, а ДАД 85 мм рт. ст. и выше. Критериями исключения являлись: непереносимость акарбозы, участие в любом другом исследовании в течение 30 дней перед отбором, тяжелые сердечно-сосудистые заболевания, включающие острый инфаркт миокарда, стенокардию III–IV функционального класса, нестабильную стенокардию, сердечную недостаточность, нарушение мозгового кровообращения, клинически значимые изменения ЭКГ, требующие немедленной терапии, заболевания или лекарства, нарушающие кишечную проходимость и/или абсорбцию, а также статины. В программу не включали больных, имеющих СД типа 1 или типа 2, вторичные АГ: реноваскулярная, феохромоцитому, болезнь Иценко–Кушинга, тиреотоксикоз, хроническую почечную недостаточность, тяжелые нарушения функции печени (превышение уровня трансаминаз в 2 раза и более нормы), беременность и период лактации, онкологические заболевания, использование больным любых медикаментозных препаратов и биологически активных добавок для уменьшения массы тела в течение 3 мес перед отбором. Дозировка и способ применения препарата: пациенты, рандомизированные в группу активного лечения (принимающие акарбозу), начинали принимать препарат по 50 мг 1 раз в день до еды (во время ужина) в течение 1-й недели, со 2-й недели – по 50 мг 2 раза (завтрак и ужин) и с 3-й недели – по 50 мг 3 раза в сутки перед едой до окончания программы. Пациентам, рандомизированным на прием 300 мг акарбозы, дозу препарата с 5-й недели постепенно увеличивали до 300 мг в сутки (100 мг 3 раза в день) и сохраняли ее до окончания исследования при хорошей переносимости лечения. Статистическая обработка: в настоящей работе проведено сравнение групп пациентов (организованных по разным группирующим признакам) с использованием статистических непараметрических критериев, не зависящих от характера распределения – точного метода Фишера и критерия хи-квадрат (параллельно вычислен также традиционно используемый в биомедицинских исследованиях t-критерий Стьюдента для нормально распределенных переменных). Критериями эффективности являлись: число и процент пациентов, достигших целевого уровня АД (<140/90 мм рт.
Дозировка и способ применения препарата: пациенты, рандомизированные в группу активного лечения (принимающие акарбозу), начинали принимать препарат по 50 мг 1 раз в день до еды (во время ужина) в течение 1-й недели, со 2-й недели – по 50 мг 2 раза (завтрак и ужин) и с 3-й недели – по 50 мг 3 раза в сутки перед едой до окончания программы. Пациентам, рандомизированным на прием 300 мг акарбозы, дозу препарата с 5-й недели постепенно увеличивали до 300 мг в сутки (100 мг 3 раза в день) и сохраняли ее до окончания исследования при хорошей переносимости лечения. Статистическая обработка: в настоящей работе проведено сравнение групп пациентов (организованных по разным группирующим признакам) с использованием статистических непараметрических критериев, не зависящих от характера распределения – точного метода Фишера и критерия хи-квадрат (параллельно вычислен также традиционно используемый в биомедицинских исследованиях t-критерий Стьюдента для нормально распределенных переменных). Критериями эффективности являлись: число и процент пациентов, достигших целевого уровня АД (<140/90 мм рт. ст.), число и процент лиц, достигших целевого уровня глюкозы натощак и через 2 ч после приема 75 г глюкозы на дозе акарбозы 150 мг, дозе акарбозы 300 мг и в группе контроля, снижение диастолического АД в положении сидя (в %), снижение систолического АД в положении сидя (в %), динамика показателей липидного спектра, динамика ИМТ и отношения окружность бедер (ОБ)/окружность талии (ОТ). Безопасность лечения оценивали согласно регистрации нежелательных явлений, АД и пульса, ЭКГ в 12 отведениях, результатам физикального обследования, показателям гликемии, протеинурии, АСТ и АЛТ. Результаты исследования В программу были включены 383 пациента, из которых в анализ вошли 380 человек: 245 (64%) женщин и 135 (36%) мужчин, их возраст в среднем составлял 48±6,8 года. В группу контроля вошли 132 человека, в группу приема акарбозы в дозе 150 мг – 132 человека и в группу приема акарбозы в дозе 300 мг – 116 человек. У всех пациентов согласно критериям включения были избыточная масса тела или ожирение, мягкая или умеренная форма АГ и НТГ по пероральному глюкозотолерантному тесту.
ст.), число и процент лиц, достигших целевого уровня глюкозы натощак и через 2 ч после приема 75 г глюкозы на дозе акарбозы 150 мг, дозе акарбозы 300 мг и в группе контроля, снижение диастолического АД в положении сидя (в %), снижение систолического АД в положении сидя (в %), динамика показателей липидного спектра, динамика ИМТ и отношения окружность бедер (ОБ)/окружность талии (ОТ). Безопасность лечения оценивали согласно регистрации нежелательных явлений, АД и пульса, ЭКГ в 12 отведениях, результатам физикального обследования, показателям гликемии, протеинурии, АСТ и АЛТ. Результаты исследования В программу были включены 383 пациента, из которых в анализ вошли 380 человек: 245 (64%) женщин и 135 (36%) мужчин, их возраст в среднем составлял 48±6,8 года. В группу контроля вошли 132 человека, в группу приема акарбозы в дозе 150 мг – 132 человека и в группу приема акарбозы в дозе 300 мг – 116 человек. У всех пациентов согласно критериям включения были избыточная масса тела или ожирение, мягкая или умеренная форма АГ и НТГ по пероральному глюкозотолерантному тесту. ИМТ в среднем составлял 33,76±0,17 кг/м2. В подавляющем большинстве случаев у пациентов определялся абдоминальный тип ожирения, ОТ в среднем составляла 106,9±11,3 см. Давность ожирения в среднем составляла 16±5,4 года. По показателям, отражающим абдоминальный тип ожирения и ИМТ, пациенты контрольной группы и групп активного лечения достоверно не различались (табл. 1). Таблица 1. Сравнительная характеристика групп пациентов при первом осмотре Показатель Диета (n=132) А-150 (n=132) А-300 (n=116) ИМТ, кг/м2 32,0±4,3 33,0±5,2 33,0±5,4 ОТ/ОБ 0,94±0,12 0,93±0,09 0,95±0,1 САД, мм рт. ст. 144,2±11,5 147,0±12,2* 147,0±10,8* ДАД, мм рт. ст. 89,0±7,3 90,0±8,2 92,0±7,4 Глюкоза натощак, ммоль/л 6,1±0,7 6,0±0,8 6,1±0,8 Глюкоза постпрандиальная, ммоль/л 8,7±0,9 8,9±0,9 9,0±1 *p<0,05 по сравнению с группой контроля. Таблица 2. Достижение целевых уровней глюкозы Достижение целевых уровней глюкозы в плазме крови Диета А-150 А-300 Натощак 9 (6,8%) 65 (49,7%) 63 (54,2%) Постпрандиальный 29 (22%) 97 (73,5%) 79 (65,5%) Таблица 3.
ИМТ в среднем составлял 33,76±0,17 кг/м2. В подавляющем большинстве случаев у пациентов определялся абдоминальный тип ожирения, ОТ в среднем составляла 106,9±11,3 см. Давность ожирения в среднем составляла 16±5,4 года. По показателям, отражающим абдоминальный тип ожирения и ИМТ, пациенты контрольной группы и групп активного лечения достоверно не различались (табл. 1). Таблица 1. Сравнительная характеристика групп пациентов при первом осмотре Показатель Диета (n=132) А-150 (n=132) А-300 (n=116) ИМТ, кг/м2 32,0±4,3 33,0±5,2 33,0±5,4 ОТ/ОБ 0,94±0,12 0,93±0,09 0,95±0,1 САД, мм рт. ст. 144,2±11,5 147,0±12,2* 147,0±10,8* ДАД, мм рт. ст. 89,0±7,3 90,0±8,2 92,0±7,4 Глюкоза натощак, ммоль/л 6,1±0,7 6,0±0,8 6,1±0,8 Глюкоза постпрандиальная, ммоль/л 8,7±0,9 8,9±0,9 9,0±1 *p<0,05 по сравнению с группой контроля. Таблица 2. Достижение целевых уровней глюкозы Достижение целевых уровней глюкозы в плазме крови Диета А-150 А-300 Натощак 9 (6,8%) 65 (49,7%) 63 (54,2%) Постпрандиальный 29 (22%) 97 (73,5%) 79 (65,5%) Таблица 3. Достижение целевых значений АД Достижение целевых уровней глюкозы в плазме крови Диета А-150 А-300 САД ДАД САД ДАД САД ДАД Число больных 59 75 110 117 93 100 % от подгруппы 44% 57% 83% 89% 80% 81% Таблица 4. Частота нежелательных явлений Нежелательное явление Диета Акарбоза 150 Акарбоза 300 Метеоризм 0 20 (5,2%) 22 (5,8%) Диарея 0 6 (1,5%) 11 (2,9%) Боль в животе 0 5 (1,3%) 5 (1,3%) Аллергическая сыпь 0 1 (0,3%) 0 Изжога 0 1 (0,3%) 0 Переход в СД типа 2 2 (0,5%) 2 (0,5%) 2 (0,5%) Ишемическая болезнь сердца (госпитализация) 2 (0,5%) 0 0 Мерцание предсердий 2 (0,5%) 0 0 Гипертонический криз 1 (0,3%) 0 0 Обострение хронического бронхита 1 (0,3%) 0 0 Острые респираторные вирусные инфекции 2 (0,5%) 0 0 Фиброзно-кистозная мастопатия 0 1 (0,5%) 0 Пояснично-крестцовый радикулит 0 1 (0,5%) 0 Рис. 1. Дизайн исследования. Рис. 2. Динамика массы тела на фоне терапии. Рис. 3. Динамика длины ОТ на фоне терапии. Рис. 4. Динамика уровня глюкозы в плазме крови на фоне терапии. Рис. 5. Динамика липидов на фоне терапии.
Достижение целевых значений АД Достижение целевых уровней глюкозы в плазме крови Диета А-150 А-300 САД ДАД САД ДАД САД ДАД Число больных 59 75 110 117 93 100 % от подгруппы 44% 57% 83% 89% 80% 81% Таблица 4. Частота нежелательных явлений Нежелательное явление Диета Акарбоза 150 Акарбоза 300 Метеоризм 0 20 (5,2%) 22 (5,8%) Диарея 0 6 (1,5%) 11 (2,9%) Боль в животе 0 5 (1,3%) 5 (1,3%) Аллергическая сыпь 0 1 (0,3%) 0 Изжога 0 1 (0,3%) 0 Переход в СД типа 2 2 (0,5%) 2 (0,5%) 2 (0,5%) Ишемическая болезнь сердца (госпитализация) 2 (0,5%) 0 0 Мерцание предсердий 2 (0,5%) 0 0 Гипертонический криз 1 (0,3%) 0 0 Обострение хронического бронхита 1 (0,3%) 0 0 Острые респираторные вирусные инфекции 2 (0,5%) 0 0 Фиброзно-кистозная мастопатия 0 1 (0,5%) 0 Пояснично-крестцовый радикулит 0 1 (0,5%) 0 Рис. 1. Дизайн исследования. Рис. 2. Динамика массы тела на фоне терапии. Рис. 3. Динамика длины ОТ на фоне терапии. Рис. 4. Динамика уровня глюкозы в плазме крови на фоне терапии. Рис. 5. Динамика липидов на фоне терапии. Рис. 6. Динамика САД и ДАД на фоне терапии. Длительность АГ в среднем составляла 10,3±7,34 года. Антигипертензивную терапию принимали 52% пациентов, 22% из них в виде монотерапии, 57% – двумя препаратами, 19% – тремя и 2% – четырьмя и более; 80% пациентов принимали бета-адреноблокаторы, 45% – ингибиторы ангиотензинпревращающего фермента, 25% – диуретики, 16% – блокаторы кальциевых каналов, 1% – агонисты имидазолиновых рецепторов и 5,7% – адельфан. Пациенты продолжали принимать исходную антигипертензивную терапию в неизменном виде на протяжении всего исследования, что являлось обязательным условием протокола исследования. Уровень САД в группах активного лечения был достоверно выше, чем в группе контроля (см. табл. 1). У 83% пациентов была отягощена наследственность по АГ, 75% – по ожирению и 31% – по СД типа 2. Табакокурение отмечено у 22% пациентов, среди мужчин в 2 раза чаще, чем среди женщин. В результате проводимого лечения достоверно снизились масса тела и показатели абдоминального ожирения во всех трех группах пациентов, при этом в группах активного лечения эти показатели уменьшились достоверно больше, чем в контрольной группе (рис.
Рис. 6. Динамика САД и ДАД на фоне терапии. Длительность АГ в среднем составляла 10,3±7,34 года. Антигипертензивную терапию принимали 52% пациентов, 22% из них в виде монотерапии, 57% – двумя препаратами, 19% – тремя и 2% – четырьмя и более; 80% пациентов принимали бета-адреноблокаторы, 45% – ингибиторы ангиотензинпревращающего фермента, 25% – диуретики, 16% – блокаторы кальциевых каналов, 1% – агонисты имидазолиновых рецепторов и 5,7% – адельфан. Пациенты продолжали принимать исходную антигипертензивную терапию в неизменном виде на протяжении всего исследования, что являлось обязательным условием протокола исследования. Уровень САД в группах активного лечения был достоверно выше, чем в группе контроля (см. табл. 1). У 83% пациентов была отягощена наследственность по АГ, 75% – по ожирению и 31% – по СД типа 2. Табакокурение отмечено у 22% пациентов, среди мужчин в 2 раза чаще, чем среди женщин. В результате проводимого лечения достоверно снизились масса тела и показатели абдоминального ожирения во всех трех группах пациентов, при этом в группах активного лечения эти показатели уменьшились достоверно больше, чем в контрольной группе (рис. 2, 3). Масса тела у лиц, принимавших акарбозу 150 мг и 300 мг в сутки, снизилась в 2 раза больше по сравнению с лицами контрольной группы, к которым применялись только немедикаментозные мероприятия (D=-9,3±1,5 кг, р<0,05; D=-10,2±1,3 кг, р<0,05 и D=-4±1,07 кг, р<0,05 соответственно). На фоне терапии акарбозой в дозах 150 мг и 300 мг в сутки достоверно снизился уровень глюкозы в крови натощак (D=-0,2±0,01 ммоль/л, D=-0,6±0,03 ммоль/л, р<0,5 соответственно) и более выраженно через 2 ч после нагрузки глюкозой (D=-1,7±0,6 ммоль/л, р<0,05 и D=-1,8±0,4 ммоль/л, р<0,05 соответственно). Существенной разницы между этими группами терапии не отмечено (рис. 4), как и между группами активной терапии акарбозой, и группой контроля (D=-0,6±0,03 ммоль/л, р<0,5 и D=-2,0±1,3 ммоль/л, р<0,05 соответственно). Уровень общего холестерина (ХС) снизился достоверно и равнозначно во всех исследуемых группах (группа акарбозы 150 мг – D=-0,4±0,03 ммоль/л, р<0,05, группа акарбозы 300 мг – D=-0,5±0,02 ммоль/л, р<0,05 и группа контроля –D=-0,4±0,05 ммоль/л, р<0,05), что продемонстрировано на рис.
2, 3). Масса тела у лиц, принимавших акарбозу 150 мг и 300 мг в сутки, снизилась в 2 раза больше по сравнению с лицами контрольной группы, к которым применялись только немедикаментозные мероприятия (D=-9,3±1,5 кг, р<0,05; D=-10,2±1,3 кг, р<0,05 и D=-4±1,07 кг, р<0,05 соответственно). На фоне терапии акарбозой в дозах 150 мг и 300 мг в сутки достоверно снизился уровень глюкозы в крови натощак (D=-0,2±0,01 ммоль/л, D=-0,6±0,03 ммоль/л, р<0,5 соответственно) и более выраженно через 2 ч после нагрузки глюкозой (D=-1,7±0,6 ммоль/л, р<0,05 и D=-1,8±0,4 ммоль/л, р<0,05 соответственно). Существенной разницы между этими группами терапии не отмечено (рис. 4), как и между группами активной терапии акарбозой, и группой контроля (D=-0,6±0,03 ммоль/л, р<0,5 и D=-2,0±1,3 ммоль/л, р<0,05 соответственно). Уровень общего холестерина (ХС) снизился достоверно и равнозначно во всех исследуемых группах (группа акарбозы 150 мг – D=-0,4±0,03 ммоль/л, р<0,05, группа акарбозы 300 мг – D=-0,5±0,02 ммоль/л, р<0,05 и группа контроля –D=-0,4±0,05 ммоль/л, р<0,05), что продемонстрировано на рис.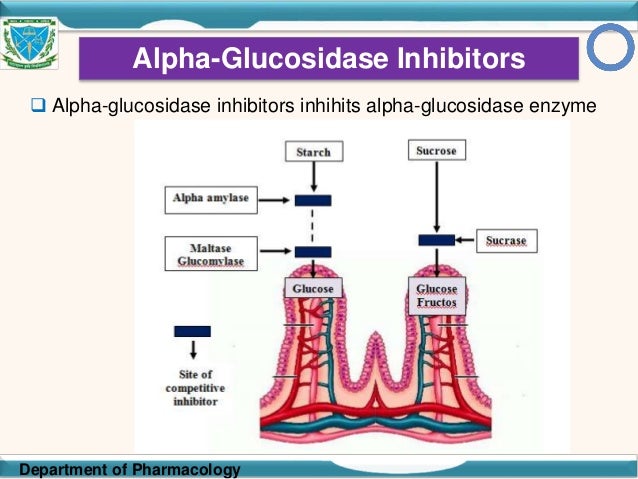 5. Значимое снижение уровня триглицеридов было отмечено во всех трех исследуемых группах (см. рис. 5), а ХС липопротеидов низкой плотности (ХС ЛПНП) лишь в группе лиц, принимавших 300 мг акарбозы в сутки (D= -0,5±0,01 ммоль/л, р<0,05; D=-0,5±0,02 ммоль/л, р<0,05 соответственно), в отличие от принимавших 150 мг акарбозы и группы контроля. Достоверное повышение уровня ХС липопротеидов высокой плотности (ХС ЛПВП) отмечено только в группе пациентов, принимавших 150 мг акарбозы в сутки (D=-0,2±0,01 ммоль/л, р<0,05). В группах пациентов, принимавших акарбозу 150 мг и 300 мг в сутки, уровень САД и ДАД снизился достоверно ниже по сравнению с группой контроля (рис. 6): САД (D= -14,2±1,6 мм рт. ст., р<0,05; D=-12,3±0,6 мм рт. ст., р<0,05; D= -7,3±1,1 мм рт. ст., р<0,05 соответственно, достоверность разницы между группами – р<0,05), ДАД (D=-8,4±0,3 мм рт. ст., р<0,05 и D=-7,8±0,5 мм рт. ст., р<0,05; D=-6,0±1,3 мм рт. ст. соответственно, достоверность разницы между группами – р<0,05).
5. Значимое снижение уровня триглицеридов было отмечено во всех трех исследуемых группах (см. рис. 5), а ХС липопротеидов низкой плотности (ХС ЛПНП) лишь в группе лиц, принимавших 300 мг акарбозы в сутки (D= -0,5±0,01 ммоль/л, р<0,05; D=-0,5±0,02 ммоль/л, р<0,05 соответственно), в отличие от принимавших 150 мг акарбозы и группы контроля. Достоверное повышение уровня ХС липопротеидов высокой плотности (ХС ЛПВП) отмечено только в группе пациентов, принимавших 150 мг акарбозы в сутки (D=-0,2±0,01 ммоль/л, р<0,05). В группах пациентов, принимавших акарбозу 150 мг и 300 мг в сутки, уровень САД и ДАД снизился достоверно ниже по сравнению с группой контроля (рис. 6): САД (D= -14,2±1,6 мм рт. ст., р<0,05; D=-12,3±0,6 мм рт. ст., р<0,05; D= -7,3±1,1 мм рт. ст., р<0,05 соответственно, достоверность разницы между группами – р<0,05), ДАД (D=-8,4±0,3 мм рт. ст., р<0,05 и D=-7,8±0,5 мм рт. ст., р<0,05; D=-6,0±1,3 мм рт. ст. соответственно, достоверность разницы между группами – р<0,05). Целевого уровня глюкозы в крови натощак и после нагрузки – критерий эффективности – достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля (табл. 2). Причем число пациентов, достигших целевых уровней глюкозы в плазме крови, было практически равным в обеих группах больных, принимающих как 150 мг, так и 300 мг акарбозы. Анализ эффективности влияния акарбозы на АД показал, что более 80% пациентов в каждой из групп, принимающих акарбозу, достигли целевого уровня САД и ДАД в отличие от группы контроля, в которой значительно меньшее число пациентов достигли целевого уровня АД (табл. 3). Нежелательные явления, связанные с приемом акарбозы, в виде метеоризма, диареи и боли в области живота отмечены у 53 пациентов, у 1 – кожная сыпь в виде крапивницы (табл. 4). Появление нежелательных явлений послужило основанием для снижения дозы акарбозы в 300 мг до 150 мг в сутки только у 9 (7,8%) пациентов. По причине метеоризма из группы активной терапии досрочно вышли из программы 14 (5,6%) человек.
Целевого уровня глюкозы в крови натощак и после нагрузки – критерий эффективности – достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля (табл. 2). Причем число пациентов, достигших целевых уровней глюкозы в плазме крови, было практически равным в обеих группах больных, принимающих как 150 мг, так и 300 мг акарбозы. Анализ эффективности влияния акарбозы на АД показал, что более 80% пациентов в каждой из групп, принимающих акарбозу, достигли целевого уровня САД и ДАД в отличие от группы контроля, в которой значительно меньшее число пациентов достигли целевого уровня АД (табл. 3). Нежелательные явления, связанные с приемом акарбозы, в виде метеоризма, диареи и боли в области живота отмечены у 53 пациентов, у 1 – кожная сыпь в виде крапивницы (табл. 4). Появление нежелательных явлений послужило основанием для снижения дозы акарбозы в 300 мг до 150 мг в сутки только у 9 (7,8%) пациентов. По причине метеоризма из группы активной терапии досрочно вышли из программы 14 (5,6%) человек. Из них 5 человек принимали 150 мг акарбозы и 9 человек – 300 мг акарбозы. В контрольной группе досрочно выбыли из программы по разным причинам, в том числе и с нежеланием соблюдать диету, 7 (5,3%) человек. К окончанию программы СД типа 2 был диагностирован у 2 человек, получавших 150 мг акарбозы, у 2, получавших 300 мг, и у 2 из группы контроля. Обсуждение В нашей работе принимали участие пациенты, у которых присутствовали основные симптомы, определяющие понятие МС: абдоминальное ожирение, НТГ, АГ, гипертриглицеридемия и гиперхолестеринемия. Терапия акарбозой привела к снижению массы тела, выраженности абдоминального ожирения, снижению постпрандиального уровня глюкозы и ее уровня натощак, что сопровождалось достоверным снижением как САД, так и ДАД. Снижение массы тела и АД у лиц, принимавших акарбозу, было значительно большим (почти в 2 раза), чем у лиц контрольной группы. Кроме того, положительная динамика показателей липидного обмена – ХС ЛПНП, ХС ЛПВП и триглицеридов – была достоверно выраженнее на фоне приема акарбозы по сравнению с только диетическими мероприятиями.
Из них 5 человек принимали 150 мг акарбозы и 9 человек – 300 мг акарбозы. В контрольной группе досрочно выбыли из программы по разным причинам, в том числе и с нежеланием соблюдать диету, 7 (5,3%) человек. К окончанию программы СД типа 2 был диагностирован у 2 человек, получавших 150 мг акарбозы, у 2, получавших 300 мг, и у 2 из группы контроля. Обсуждение В нашей работе принимали участие пациенты, у которых присутствовали основные симптомы, определяющие понятие МС: абдоминальное ожирение, НТГ, АГ, гипертриглицеридемия и гиперхолестеринемия. Терапия акарбозой привела к снижению массы тела, выраженности абдоминального ожирения, снижению постпрандиального уровня глюкозы и ее уровня натощак, что сопровождалось достоверным снижением как САД, так и ДАД. Снижение массы тела и АД у лиц, принимавших акарбозу, было значительно большим (почти в 2 раза), чем у лиц контрольной группы. Кроме того, положительная динамика показателей липидного обмена – ХС ЛПНП, ХС ЛПВП и триглицеридов – была достоверно выраженнее на фоне приема акарбозы по сравнению с только диетическими мероприятиями. Существенной разницы в динамике всех изучаемых показателей между группами лиц, получавших акарбозу 150 мг и 300 мг, не отмечено. При этом не отмечено достоверной разницы в динамике средних показателей глюкозы в плазме крови между всеми группами, что, вероятно, связано с непродолжительным сроком наблюдения за пациентами. Однако целевых значений как уровня глюкозы натощак, так и через 2 ч после перорального глюкозотолерантного теста, достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля. Способность акарбозы снижать постпрандиальный уровень гипергликемии, не вызывая при этом стимуляции эндогенного инсулина, приводит не только к потере массы тела, но и к снижению риска развития гипогликемических состояний. Ведь известно, что гиперинсулинемия способствует повышению массы тела и создает угрозу развития гипогликемии. Снижение массы тела на фоне приема акарбозы, возможно, способствовало снижению уровня АД и улучшению показателей липидного обмена. Результатами многочисленных исследований было доказано, что снижение массы тела приводит к значительному снижению уровня АД.
Существенной разницы в динамике всех изучаемых показателей между группами лиц, получавших акарбозу 150 мг и 300 мг, не отмечено. При этом не отмечено достоверной разницы в динамике средних показателей глюкозы в плазме крови между всеми группами, что, вероятно, связано с непродолжительным сроком наблюдения за пациентами. Однако целевых значений как уровня глюкозы натощак, так и через 2 ч после перорального глюкозотолерантного теста, достигли подавляющее большинство пациентов, принимающих акарбозу, в отличие от группы контроля. Способность акарбозы снижать постпрандиальный уровень гипергликемии, не вызывая при этом стимуляции эндогенного инсулина, приводит не только к потере массы тела, но и к снижению риска развития гипогликемических состояний. Ведь известно, что гиперинсулинемия способствует повышению массы тела и создает угрозу развития гипогликемии. Снижение массы тела на фоне приема акарбозы, возможно, способствовало снижению уровня АД и улучшению показателей липидного обмена. Результатами многочисленных исследований было доказано, что снижение массы тела приводит к значительному снижению уровня АД. Снижение АД также может быть обусловлено улучшением углеводного обмена, что привело к повышению чувствительности периферических тканей к инсулину и к снижению повышенной активации симпатической нервной системы. Таким образом, результаты Российского исследования АПРЕЛЬ продемонстрировали, что акарбоза (глюкобай) позитивно воздействует на основные факторы сердечно-сосудистого риска – избыточную массу тела, постпрандиальную гипергликемию и АГ. Снижение массы тела, уровня постпрандиальной гликемии и АД на фоне монотерапии акарбозой суммарно снижает степень риска развития сердечно-сосудистых осложнений, что ранее доказано результатами исследования STOP-NIDDM [10]. Акарбоза обладает уникальным механизмом периферического действия, т.е. способностью препятствовать всасыванию углеводов на уровне тонкой кишки [12]. Периферическое действие акарбозы и отсутствие системного действия определяет ее безопасность для больных МС, т.е. больных с множественными сердечно-сосудистыми факторами риска. Благодаря своей безопасности, способности снижать АД и постпрандиальный уровень глюкозы, не вызывая при этом гиперинсулинемию, а также эффективно уменьшать массу тела, акарбоза может применяться в качестве монотерапии у больных с ожирением, мягкой АГ и нарушениями углеводного обмена.
Снижение АД также может быть обусловлено улучшением углеводного обмена, что привело к повышению чувствительности периферических тканей к инсулину и к снижению повышенной активации симпатической нервной системы. Таким образом, результаты Российского исследования АПРЕЛЬ продемонстрировали, что акарбоза (глюкобай) позитивно воздействует на основные факторы сердечно-сосудистого риска – избыточную массу тела, постпрандиальную гипергликемию и АГ. Снижение массы тела, уровня постпрандиальной гликемии и АД на фоне монотерапии акарбозой суммарно снижает степень риска развития сердечно-сосудистых осложнений, что ранее доказано результатами исследования STOP-NIDDM [10]. Акарбоза обладает уникальным механизмом периферического действия, т.е. способностью препятствовать всасыванию углеводов на уровне тонкой кишки [12]. Периферическое действие акарбозы и отсутствие системного действия определяет ее безопасность для больных МС, т.е. больных с множественными сердечно-сосудистыми факторами риска. Благодаря своей безопасности, способности снижать АД и постпрандиальный уровень глюкозы, не вызывая при этом гиперинсулинемию, а также эффективно уменьшать массу тела, акарбоза может применяться в качестве монотерапии у больных с ожирением, мягкой АГ и нарушениями углеводного обмена.
- Mikhail N, Golub M, Tuck M. Obesity and hypertension. Prog Cardiovasc Dis 1999; 42 (1): 39–58.
- Kannel W.B, Mc Gee D.L. Diabetes and cardiovascular risk factors: the Framingham Study. Circulation 1979; 59: 8–13.
- Stamler J. Epidemic obesity in the United States. Arch Intern Med 1998; 150: 1040–4.
- DECODE Study Group on behalf of the European Diabetes Epidemiology Group. Is fasting glucose sufficient to define diabetes? Epidemiological data from 20 European Studies. Diabetologia 1999; 42: 654–74.
- UK Prospective Diabetes Study (UKPDS) Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ 1998; 317: 703–13.
- Мычка В.Б., Творогова М.Г.,Чазова И.Е.Терапия ксеникалом больных артериальной гипертонией и метаболическим сндромом.
 Артериал. гипертензия. 8 (1):
Артериал. гипертензия. 8 (1): - Rosak C at al. The effect of the timing and and the administration of acarbose on postprandial hyperglycaemia. Diab Med 1995; 12: 979–84.
- Willms B, Ruge D. Comparison of acarbose and metformin in patient with type 2 diabetes mellitus insufficiently controlled with diet and sulphonylureas: a randomized, placebo — controlled study. Diab Med 1999; 16: 755–61.
- Mc Kay S.V et al. Acarbose decreases glucose entry rate and increase glucose oxidation, a U13C-glucose study. Diabetes 1999; 48 (suppl. V): A 110.
- Chiasson J et al. The STOP-NIDDM trial. An international study on efficacy of an a — glucosidase inhibitor to prevent type 2 diabetes in a population with IGT. Diabetes Care, 1998, 21, 1720-1725
- Мычка В.Б., Богиева Р.М., Мамырбаева К.М., Чазова И.Е. Терапия акарбозой как профилактика множественных сердечно — сосудистых факторов риска метаболического синдрома.
 Артериал. гипертензия. 2003; 9 (2):
Артериал. гипертензия. 2003; 9 (2): - Malaguarnera Y, Giugno I, Ruello P et al. Acarbose is an effective adjunct to dietary therapy in the treatment of hypertriglyceridemias. Br J Clin Pharmac 1999; 48: 605–9.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
Акарбоза(глюкобай)
Показания к применению
В качестве средств заместительной
терапии
Острая
и хроническая надпочечниковая
недостаточность.
В качестве противовоспалительных
средств
Диффузные болезни
соединительной ткани (коллагенозы)
Гепатит
Гломерулонефрит
Кожные
воспалительно-аллергически
заболевания(дерматиты, экзема,
нейродермит)
Ревматоидный
артрит
В
офтальмологии (ириты, кератиты)
В
стоматологии (аллергические и
воспалительные заболевания слизистой
полости рта,
пульпы
зуба, пародонта).
В
качестве противоаллергических средств.
Бронхиальная
астма (атопическая)
Сенная лихорадка
Отёк Квинке
Анафилаксия и
др. аллергические реакции
Шоковые состояния
различного генеза.
В качестве иммунодепрессантов
В
транспланталогии
Острые лейкозы
и лимфолейкозы
Осложнения
терапии глюкокортикоидами:
Синдром
отмены
В результате
гипотрофии или атрофии собственных
желез (как неработающих), поскольку
гормон в избытке
вводится извне) развивается острая
надпочечниковая недостаточность
вплоть до шока
и обостряются болезни по поводу которых
принимался препарат.
«Стероидный
диабет»
В связи с
влиянием на углеводный и жировой
обмен.
Синдром
Кушинга
Обеднение
жировых депо конечностей и отложение
жира на лице, шее, плечах, груди.
Снижение
иммунитета
В результате
выявляются скрытые инфекции
Остеопороз
Развивается
при длительном лечении, может привести
к патологическим переломам
Задержка
натрия и воды, потеря калия,
гипохлоремический алкалоз, увеличение
ОЦК, АД, отеки
Другие
— более редкие — эффекты
Психическая
гиперактивность, атрофия кожи и
подкожных тканей, повышение
внутриглазного
давления, миопатии, задержка роста у
детей
Таблетированные препараты в лечении сахарного диабета II типа
Таблетированные препараты в лечении сахарного диабета II типа
Сахарный диабет (СД) – группа обменных заболеваний, характеризующихся гипергликемией, возникающих в результате нарушения секреции инсулина, его действия или обоих факторов. На сегодняшний день заболеваемость СД катастрофически растет во всех без исключения странах мира, приобретая масштабы всемирной эпидемии. В 2000 г . в мире насчитывалось более 160 млн больных, и предполагается, что к 2010 г . их число превысит 215 млн. В России в 2001 г . было более 2 млн больных СД, из них около 1, 775 млн страдали СД II типа.
На сегодняшний день заболеваемость СД катастрофически растет во всех без исключения странах мира, приобретая масштабы всемирной эпидемии. В 2000 г . в мире насчитывалось более 160 млн больных, и предполагается, что к 2010 г . их число превысит 215 млн. В России в 2001 г . было более 2 млн больных СД, из них около 1, 775 млн страдали СД II типа.
В основе СД II типа лежит как наличие резистентности к инсулину, так и нарушение его секреции. СД II типа (прежде всего инсулинорезистентность) является составной частью так называемого метаболического синдрома, представляющего собой висцеральное ожирение, дислипидемию (повышение ТГ, хс-ЛПНП, снижение хс-ЛПВП), артериальную гипертензию. Метаболический синдром и СД II типа, как одно из его проявлений, являются ведущими причинами смертности в развитых странах Европы и Северной Америки. Более того, в 90-е гг. прошлого века смертность от СД II типа неуклонно возрастала. Одной из особенностей СД II типа является длительное малосимптомное течение. На ранних стадиях заболевания гипергликемия способствует как развитию выраженных нарушений секреции инсулина, так и быстрому прогрессированию атеросклероза и поражению нервной системы. Отсутствие клинических симптомов умеренного (до 7-10 ммоль/л и выше) повышения гликемии приводит к низкой обращаемости пациентов в медицинские учреждения, создает иллюзию видимого благополучия. Все это приводит к тому, что на момент выявления СД II типа (обычно случайному) у пациентов уже присутствуют осложнения заболевания в виде нарушения зрения (ретинопатия), почек (микро-, макропротеинурия), поражения сосудов сердца, мозга, нижних конечностей. Вышеуказанные осложнения являются основной причиной смерти и высокой инвалидизации больных СД II типа.
На ранних стадиях заболевания гипергликемия способствует как развитию выраженных нарушений секреции инсулина, так и быстрому прогрессированию атеросклероза и поражению нервной системы. Отсутствие клинических симптомов умеренного (до 7-10 ммоль/л и выше) повышения гликемии приводит к низкой обращаемости пациентов в медицинские учреждения, создает иллюзию видимого благополучия. Все это приводит к тому, что на момент выявления СД II типа (обычно случайному) у пациентов уже присутствуют осложнения заболевания в виде нарушения зрения (ретинопатия), почек (микро-, макропротеинурия), поражения сосудов сердца, мозга, нижних конечностей. Вышеуказанные осложнения являются основной причиной смерти и высокой инвалидизации больных СД II типа.
В настоящее время патогенез осложнений СД 2 типа определен в рамках международных многоцентровых проспективных клинических исследований (DECODE, UKPDS, Helsinki Policemen Study, Kumamoto Study и др.) и на лабораторных моделях. В основе развития осложнений СД лежат инсулинорезистентность, компенсаторная гиперинсулинемия и гипергликемия, в первую очередь развивающаяся после приема пищи. Развитие СД II типа претерпевает ряд последовательных этапов, финалом которых является стойкое снижение секреции инсулина (рис.). В этой связи одной из основных задач терапии СД II типа является поддержание не только нормогликемии, но и сохранение резервных возможностей бета-клеток поджелудочной железы (ПЖ). Поскольку нарушения углеводного обмена не являются единственными проявлениями СД, а гипергликемия и инсулинорезистентность приводят к нарушению всех видов обмена веществ, компенсация СД осуществляется в нескольких направлениях.
Развитие СД II типа претерпевает ряд последовательных этапов, финалом которых является стойкое снижение секреции инсулина (рис.). В этой связи одной из основных задач терапии СД II типа является поддержание не только нормогликемии, но и сохранение резервных возможностей бета-клеток поджелудочной железы (ПЖ). Поскольку нарушения углеводного обмена не являются единственными проявлениями СД, а гипергликемия и инсулинорезистентность приводят к нарушению всех видов обмена веществ, компенсация СД осуществляется в нескольких направлениях.
Первоочередной и важнейшей задачей лечения СД II типа является нормализация гликемии. Крупнейшее проспективное клиническое исследование UKPDS (United Kingdom Prospective Diabetes Study) убедительно показало, что нормализация (снижение) гликемии предупреждает или задерживает развитие всех осложнений СД II типа. Снижение уровня HbA1c на 1% приводит к уменьшению общей смертности на 21, сердечно-сосудистой заболеваемости на 14, нарушений микроциркуляторного русла на 37%. Вместе с этим риск смерти при СД II типа уменьшается на 42 и 63% при снижении HbA1c на 2 и 3% соответственно. Другое крупнейшее исследование – DECODE (Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe) показало, что наличие гликемии после еды на уровне 11 моль/л (10,0 ммоль/л в цельной венозной крови) увеличивает риск сердечно-сосудистой смертности в 2 и более раза вне зависимости от уровня гликемии натощак.
Вместе с этим риск смерти при СД II типа уменьшается на 42 и 63% при снижении HbA1c на 2 и 3% соответственно. Другое крупнейшее исследование – DECODE (Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe) показало, что наличие гликемии после еды на уровне 11 моль/л (10,0 ммоль/л в цельной венозной крови) увеличивает риск сердечно-сосудистой смертности в 2 и более раза вне зависимости от уровня гликемии натощак.
На сегодняшний день в арсенале врача есть все возможности воздействия на механизмы развития гипергликемии при СД II типа.
Питание и физическая нагрузка являются важными компонентами в лечении. Роль диеты и увеличения физической нагрузки доказали свою эффективность в профилактике СД II типа. По данным DPP (Diabetes Prevention Program), активное изменение образа жизни у лиц с нарушением толерантности к глюкозе (НТГ) привело к снижению развития СД II типа на 58%. Вместе с этим на более поздних стадиях СД II типа модификация образа жизни не приводит к полному устранению гипергликемии. Так, в вышеуказанном исследовании UKPDS лишь 6% пациентов на диетотерапии смогли достичь приемлемых показателей HbA1c (7%) за 8-летний период наблюдения. Более того, имеющиеся сегодня эпидемиологические, клинические и лабораторные наблюдения показывают, что достижение целевых показателей гликемии при СД II типа должно начинаться максимально быстро с момента выявления СД II типа. В подавляющем большинстве случаев для этого требуется медикаментозная терапия.
Так, в вышеуказанном исследовании UKPDS лишь 6% пациентов на диетотерапии смогли достичь приемлемых показателей HbA1c (7%) за 8-летний период наблюдения. Более того, имеющиеся сегодня эпидемиологические, клинические и лабораторные наблюдения показывают, что достижение целевых показателей гликемии при СД II типа должно начинаться максимально быстро с момента выявления СД II типа. В подавляющем большинстве случаев для этого требуется медикаментозная терапия.
Вся сахароснижающая терапия при СД II типа условно может быть разделена на четыре группы:
- Препараты, оказывающие выраженное действие на устранение инулинорезистентности (метформин, тиазолидиндионы (глитазоны).
- Препараты, преимущественно оказывающие прямое действие на бета-клетки ПЖ (секретогоги), что приводит к усилению секреции инсулина. Препараты данной группы обычно используются для нормализации уровня глюкозы после еды.
- Препараты, уменьшающие поступление углеводов из кишечника в кровь (акарбоза, гуаровая смола и отчасти метформин).
 Препараты этой группы оказывают действие на гликемию после еды, однако в отличие от секретогогов не вызывают увеличения секреции инсулина.
Препараты этой группы оказывают действие на гликемию после еды, однако в отличие от секретогогов не вызывают увеличения секреции инсулина. - Инсулин и инсулиноподобные препараты (аналоги).
Препараты, устраняющие инсулинорезистентность
Наиболее известным, давно использующимся в клинической практике представителем данной группы является метформин, относящийся к группе бигуанидов. В последние несколько лет в арсенале врача появилась новая группа препаратов – тиазолидиндионы.
Бигуаниды. После прекращения использования в клинических целях буформина и фенформина метформин остался единственным препаратом данной группы в лечении СД II типа. Безопасность метформина в сравнении с другими бигуанидами объясняется иной химической структурой, снижающей блокирование переноса электронов через мембраны клеток и уменьшающей риск развития лактатацидоза.
Метформин используется в лечении СД II типа с 1957 г . , в настоящее время накоплен колоссальный клинический опыт и научный материал, связанный с его применением. Основное действие метформина можно определить как антигипергликемическое, а не сахароснижающее. В настоящее время доказано, что препарат снижает продукцию глюкозы клетками печени, увеличивает утилизацию глюкозы периферическими тканями (прежде всего мышцами) и уменьшает гликемию после приема пищи за счет активации анаэробного гликолиза в тонком кишечнике и замедления кишечной абсорбции.
, в настоящее время накоплен колоссальный клинический опыт и научный материал, связанный с его применением. Основное действие метформина можно определить как антигипергликемическое, а не сахароснижающее. В настоящее время доказано, что препарат снижает продукцию глюкозы клетками печени, увеличивает утилизацию глюкозы периферическими тканями (прежде всего мышцами) и уменьшает гликемию после приема пищи за счет активации анаэробного гликолиза в тонком кишечнике и замедления кишечной абсорбции.
Препарат не влияет на бета-клетки ПЖ, не усиливает секрецию инсулина, следовательно, не вызывает гипогликемии.
Одним из важнейших механизмов развития гипергликемии при СД II типа является повышение продукции глюкозы печенью в ночные и ранние утренние часы, что приводит к повышению уровня глюкозы в крови натощак. Метформин эффективно устраняет этот дефект.
До появления глитазонов бигуаниды являлись основными препаратами, воздействующими на инсулинорезистентность. Основу инсулинорезистентности при СД II типа составляют нарушения механизмов пострецепторного действия инсулина, т.е. уменьшается чувствительность различных органов и тканей к воздействию инсулина. Метформин оказывает влияние на этот процесс, что в свою очередь приводит к снижению периферической инсулинорезистентности, нормализации метаболизма и поглощению глюкозы мышцами, печенью и жировой тканью, предотвращает развитие гипергликемии и поздних осложнений СД II типа.
Основу инсулинорезистентности при СД II типа составляют нарушения механизмов пострецепторного действия инсулина, т.е. уменьшается чувствительность различных органов и тканей к воздействию инсулина. Метформин оказывает влияние на этот процесс, что в свою очередь приводит к снижению периферической инсулинорезистентности, нормализации метаболизма и поглощению глюкозы мышцами, печенью и жировой тканью, предотвращает развитие гипергликемии и поздних осложнений СД II типа.
К другим благоприятным эффектам относят снижение всасывания углеводов в кишечнике, снижение аппетита на фоне приема метформина, что способствует уменьшению массы тела у пациентов с диабетом и ожирением.
Метформин активно влияет на процесс метаболизма жиров, он снижает уровень ТГ (до 30-45%), СЖК (на 10-17%), замедляет процессы липолиза.
Клинические и метаболические действия метформина нашли выраженное подтверждение в период проведения UKPDS и других исследований (табл. 1).
Более того, проводимое исследование DPP по профилактике СД II типа выявило снижение развития заболевания на 31% в группе лиц, получавших метформин в дозе 850 мг/сутки.
Метформин является препаратом выбора при СД II типа у лиц с избыточной массой тела или абдоминальным ожирением. Лечение препаратом начинают с приема 500 мг в ужин или на ночь, максимальная доза может составлять 2,5-3 г/сутки (в несколько приемов). В исследовании UKPDS, проводимом на оригинальном препарате метформина – глюкофаже, было достоверно доказано, что наибольшая эффективность препарата по предотвращению развития осложнений СД II типа достигается на среднесуточной дозе в 2500 мг. В настоящий момент на рынке появляется глюкофаж в дозировке 1000 мг. Это поможет врачам оптимизировать лечение, а пациентам – упростить прием препарата.
В связи с накоплением лактата на фоне приема метформина препарат не рекомендуют назначать при тяжелой сердечно-сосудистой патологии, у лиц с гипоксией любой этиологии и при нарушениях функции печени. Следование этим рекомендациям привело к тому, что в последние годы случаи фатального лактатацидоза не отмечались. Частота лактатацидоза при приеме метформина составляет в среднем 0,03 случая на 1 тыс. пациенто-лет. Все случаи лактатацидоза за последние 10 лет при терапии метформином связаны с нарушением правил приема препарата. Следует помнить, что у пожилых пациентов возможно уменьшение терапевтической дозы препарата в связи со снижением функции почек.
пациенто-лет. Все случаи лактатацидоза за последние 10 лет при терапии метформином связаны с нарушением правил приема препарата. Следует помнить, что у пожилых пациентов возможно уменьшение терапевтической дозы препарата в связи со снижением функции почек.
Итак, метформин является препаратом выбора для нормализации гликемии натощак. При отсутствии его эффективности или наличии противопоказаний (гипоксия любой этиологии, болезни печени, беременность) для поддержания гликемии натощак назначаются инсулины средней продолжительности действия на ночь в дозе 0,1-0,15 ЕД/кг с последующей коррекцией. Монотерапию метформином можно с хорошей эффективностью использовать и при незначительном (до 7,5-9,0 ммоль/л) превышении постпрандиальной (2-часовой) гликемии у пациентов при диетотерапии. При больших значениях гликемии целевые показатели, как правило, не достигаются и целесообразно использование препаратов, повышающих секрецию инсулина (секретогогов).
Тиазолидиндионы (глитазоны) – группа препаратов, представляющих собой агонисты гамма-рецепторов, активируемых пролифератором пероксисом (PPAR-гамма). Действие глитазонов основано на активации метаболизма глюкозы и липидов преимущественно в мышечной и жировой ткани, что приводит к повышению активности эндогенного инсулина, т.е. устранению инсулинорезистентности (сенситайзеры инсулина). Препараты данной группы являются наиболее активными в отношении коррекции дислипидемии при СД II типа за счет действия в печени и жировой ткани. На сегодняшний день за счет вышеуказанных свойств глитазоны являются одними из наиболее многообещающих препаратов в лечении СД II типа. Вместе с тем данная группа препаратов имеет очень незначительный период клинических наблюдений (с 1998 г. в США и с 2000 г . в Европе), пока нет ни одного крупномасштабного долговременного законченного проспективного клинического исследования в рамках доказательной медицины, подтвердившего длительный клинический и хороший прогностический эффект. Подавляющее большинство препаратов данной группы используется в странах Северной Америки, их распространенность в Европе не достигает 5% от общего числа.
Действие глитазонов основано на активации метаболизма глюкозы и липидов преимущественно в мышечной и жировой ткани, что приводит к повышению активности эндогенного инсулина, т.е. устранению инсулинорезистентности (сенситайзеры инсулина). Препараты данной группы являются наиболее активными в отношении коррекции дислипидемии при СД II типа за счет действия в печени и жировой ткани. На сегодняшний день за счет вышеуказанных свойств глитазоны являются одними из наиболее многообещающих препаратов в лечении СД II типа. Вместе с тем данная группа препаратов имеет очень незначительный период клинических наблюдений (с 1998 г. в США и с 2000 г . в Европе), пока нет ни одного крупномасштабного долговременного законченного проспективного клинического исследования в рамках доказательной медицины, подтвердившего длительный клинический и хороший прогностический эффект. Подавляющее большинство препаратов данной группы используется в странах Северной Америки, их распространенность в Европе не достигает 5% от общего числа.
В России зарегистрированы оба основных представителя данной группы – розиглитазон и пиоглитазон. Оба препарата принимаются, как правило, в первой половине дня однократно (розиглитазон может применяться дважды в день). Препараты практически не выводятся через почки, в связи с чем могут назначаться при нарушенной почечной функции, фармакокинетика стабильна и не требует коррекции дозы у пожилых. Противопоказанием к назначению являются повышенные (в 2,5 и более раз) печеночные трансаминазы.
Препараты, стимулирующие секрецию инсулина
В данную группу препаратов входят производные сульфонилмочевины и глиниды.
Глиниды – группа препаратов, вошедшая в практическое здравоохранение с середины 90-х гг. В нашей стране зарегистрировано два препарата – репаглинид (производное бензоевой кислоты) и натеглинид (производное D-фенилаланина). По своим фармакокинетическим свойствам оба препарата сходны, их отличает быстрое и обратимое взаимодействие с рецептором сульфонилмочевины. Это приводит к быстрому и недлительному эффекту, имитирующему первую фазу секреции инсулина при приеме пищи. Особенности фармакокинетики требуют назначения препаратов данной группы перед основными приемами пищи за 5-10 мин. При приеме препарата во время еды снижается скорость его всасывания, что проявляется более слабым гипогликемизирующим эффектом.
Это приводит к быстрому и недлительному эффекту, имитирующему первую фазу секреции инсулина при приеме пищи. Особенности фармакокинетики требуют назначения препаратов данной группы перед основными приемами пищи за 5-10 мин. При приеме препарата во время еды снижается скорость его всасывания, что проявляется более слабым гипогликемизирующим эффектом.
Производные сульфонилмочевины применяются в лечении СД II типа с конца 50-х гг., в настоящее время используются препараты 2-го поколения.
Препараты, входящие в данную группу, имеют разную аффинность к рецептору, различное время действия. После клонирования АТФ-зависимых К+-каналов в середине 90-х гг. прошлого века активно обсуждается вопрос о селективности ряда препаратов данной группы в отношении бета-клеток ПЖ. Время взаимодействия с рецептором, селективность определяют их фармакокинетику.
По основным свойствам препараты можно разделить на следующие группы: имеющие суточный спектр действия (глимепирид, гликлазид МВ), низкие риск гипогликемии и кардиотоксический эффект (гликлазид, глимепирид), максимальный гипогликемизирующий эффект (глибенкламид, глимепирид), а также препараты, применение которых возможно при хронической почечной недостаточности (гликвидон, гликлазид).
Различные представители этой группы анализировались с позиций доказательной медицины в рамках крупномасштабных проспективных исследований. Из всех препаратов наибольший опыт накоплен в отношении глибенкламида (табл. 2).
Назначение секретогогов при СД II типа имеет основной целью нормализацию усвоения постабсорбционной глюкозы. В подавляющем большинстве случаев при СД II типа на фоне диетотерапии и применения секретогогов возможно достижение гликемии после еды до 7,5-8,0 ммоль/л. При отсутствии достижения целевых показателей гликемии после еды к лечению можно добавить метформин, тиазолидиндионы или акарбозу. При неэффективности комбинации целесообразно добавление инсулинотерапии.
Больные СД II типа вынуждены получать большое количество медикаметов для достижения целевых показателей лечения, профилактики или лечения поздних осложнений. Прием большого количества лекарственных препаратов приводит к низкой комплаентности больных. Пациенты неохотно выполняют рекомендации, пропускают прием препаратов. Одной из тенденций в лечении таких больных является внедрение на рынок комбинированных препаратов, позволяющих воздействовать на разные звенья патогенеза, например сочетание глибенкламида с метформином. Использование комбинированных препаратов позволяет воздействовать как на гликемию натощак, так и на прандиальную. Интересным представляется тот факт, что комбинированная терапия глибенкламидом и метформином в одном препарате достоверно улучшала эффективность лечения не только по сравнению с монотерапией, но и с раздельным приемом этих препаратов в эквивалентных дозах.
Одной из тенденций в лечении таких больных является внедрение на рынок комбинированных препаратов, позволяющих воздействовать на разные звенья патогенеза, например сочетание глибенкламида с метформином. Использование комбинированных препаратов позволяет воздействовать как на гликемию натощак, так и на прандиальную. Интересным представляется тот факт, что комбинированная терапия глибенкламидом и метформином в одном препарате достоверно улучшала эффективность лечения не только по сравнению с монотерапией, но и с раздельным приемом этих препаратов в эквивалентных дозах.
Блокаторы альфа-глюкозидазы
Представителем данной группы препаратов в России является акарбоза. Препарат конкурентно ингибирует альфа-глюкозидазу, замедляет всасывание углеводов и снижает уровень гликемии после еды. Доля назначений, приходящихся на акарбозу, в лечении СД II типа и ее эффективность относительно невелики в сравнении с секретогогами. Вместе с тем препарат показал хорошую эффективность в профилактике развития СД II типа у лиц с НТГ. Назначение акарбозы пациентам с НТГ за 3 года снизило риск развития СД II типа на 25%, также почти у 1/3 пациентов нормализовалась толератность к углеводам (STOP-NIDDM Trial).
Назначение акарбозы пациентам с НТГ за 3 года снизило риск развития СД II типа на 25%, также почти у 1/3 пациентов нормализовалась толератность к углеводам (STOP-NIDDM Trial).
Суммируя вышеизложенное, следует отметить, что в арсенале практического врача сегодня есть все возможности эффективно воздействовать на гипергликемию при СД II типа; лечение следует начинать максимально быстро для достижения целевых показателей как по углеводному обмену (HbA1c-гликемия), так и АД и липидному спектру. Только комбинированное воздействие на механизмы развития осложнений СД II типа позволит улучшить прогноз пациентов, снизить смертность и осложнения.
применений, дозировка, побочные эффекты, взаимодействия, предупреждение
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Акарбоза — сложный олигосахарид, задерживающий
переваривание проглоченных углеводов, что приводит к меньшему увеличению
концентрация глюкозы в крови после еды. Как следствие глюкозы плазмы
Как следствие глюкозы плазмы
снижение, PRECOSE снижает уровень гликозилированного гемоглобина у пациентов с
сахарный диабет 2 типа. Системное неферментативное гликозилирование белков, как
отражается уровнями гликозилированного гемоглобина, является функцией средней крови
концентрация глюкозы с течением времени.
Механизм действия
В отличие от сульфонилмочевины, PRECOSE не усиливает секрецию инсулина. Антигипергликемическое действие акарбозы является результатом
конкурентное, обратимое ингибирование альфа-амилазы поджелудочной железы и
мембраносвязанные кишечные ферменты альфа-глюкозидгидролазы. Панкреатический
альфа-амилаза гидролизует сложные крахмалы до олигосахаридов в просвете
тонкий кишечник, в то время как мембраносвязанные кишечные альфа-глюкозидазы
гидролизуют олигосахариды, трисахариды и дисахариды до глюкозы и
другие моносахариды в щеточной кайме тонкой кишки.У диабетиков
У пациентов это ингибирование фермента приводит к задержке всасывания глюкозы и
снижение постпрандиальной гипергликемии.
Поскольку его механизм действия различен, эффект
PRECOSE для улучшения гликемического контроля является добавкой к сульфонилмочевине,
инсулин или метформин при использовании в комбинации. Кроме того, PRECOSE уменьшает
инсулинотропные и увеличивающие вес эффекты сульфонилмочевины.
Акарбоза не обладает ингибирующей активностью в отношении лактазы и
следовательно, не ожидается, что это вызовет непереносимость лактозы.
Фармакокинетика
Поглощение
В исследовании с участием 6 здоровых мужчин, менее 2% пероральной дозы
акарбоза абсорбировалась как активное лекарственное средство, в то время как примерно 35% от общего количества
радиоактивность от пероральной дозы, меченной 14 C, была поглощена. Средний
51% пероральной дозы выводится с фекалиями в виде неабсорбированного лекарственного препарата.
радиоактивность в течение 96 часов после приема внутрь. Поскольку акарбоза действует локально
в желудочно-кишечном тракте эта низкая системная биодоступность родительского
соединение является терапевтически желательным. После перорального приема здоровых
После перорального приема здоровых
добровольцы с 14 C-меченной акарбозой, пиковые концентрации в плазме
радиоактивность была достигнута через 14-24 часов после дозирования, в то время как пик в плазме
концентрации активного лекарственного средства были достигнуты примерно через 1 час. В
отсроченное поглощение радиоактивности, связанной с акарбозой, отражает поглощение
метаболиты, которые могут быть образованы кишечными бактериями или кишечными
ферментативный гидролиз.
Метаболизм
Акарбоза метаболизируется исключительно в
желудочно-кишечного тракта, в основном кишечными бактериями, но также и
пищеварительные ферменты.Часть этих метаболитов (примерно 34%
доза) абсорбировалась и впоследствии выводилась с мочой. Не менее 13
метаболиты были выделены хроматографически из образцов мочи. В
основные метаболиты были идентифицированы как производные 4-метилпирогаллола (которые
конъюгаты сульфата, метила и глюкуронида). Один метаболит (образуется при расщеплении
молекулы глюкозы из акарбозы) также имеет ингибитор альфа-глюкозидазы
Мероприятия. Этот метаболит вместе с исходным соединением выделяется из
Этот метаболит вместе с исходным соединением выделяется из
моча составляет менее 2% от общей введенной дозы.
Экскреция
Доля акарбозы, которая абсорбируется в виде интактного лекарственного средства, составляет
практически полностью выводится почками. Когда акарбоза вводилась внутривенно,
89% дозы было выделено с мочой в виде активного препарата в течение 48 часов. В
напротив, менее 2% пероральной дозы выводилось с мочой в виде активного
(то есть исходное соединение и активный метаболит) лекарственное средство. Это соответствует
низкая биодоступность исходного препарата. Период полувыведения из плазмы
Активность акарбозы у здоровых добровольцев составляет примерно 2 часа.Как следствие,
Накопление препарата не происходит при приеме внутрь три раза в день (t.i.d.).
Особые группы населения
Средняя стационарная площадь под кривой (AUC) и максимальная
концентрация акарбозы у пожилых людей была примерно в 1,5 раза выше
по сравнению с молодыми волонтерами; однако эти различия не были статистически
существенный. Пациенты с тяжелой почечной недостаточностью (Clcr <25 мл / мин / 1,73 м²)
достигла примерно в 5 раз более высоких пиковых концентраций акарбозы в плазме крови и 6
в разы больше AUC, чем у добровольцев с нормальной функцией почек.Нет исследований
фармакокинетические параметры акарбозы в зависимости от расы. В
Контролируемые в США клинические исследования PRECOSE у пациентов с диабетом 2 типа
mellitus, снижение уровня гликозилированного гемоглобина было аналогичным в
Кавказцы (n = 478) и афроамериканцы (n = 167) с тенденцией к лучшему
ответ на латиноамериканском языке (n = 132).
Пациенты с тяжелой почечной недостаточностью (Clcr <25 мл / мин / 1,73 м²)
достигла примерно в 5 раз более высоких пиковых концентраций акарбозы в плазме крови и 6
в разы больше AUC, чем у добровольцев с нормальной функцией почек.Нет исследований
фармакокинетические параметры акарбозы в зависимости от расы. В
Контролируемые в США клинические исследования PRECOSE у пациентов с диабетом 2 типа
mellitus, снижение уровня гликозилированного гемоглобина было аналогичным в
Кавказцы (n = 478) и афроамериканцы (n = 167) с тенденцией к лучшему
ответ на латиноамериканском языке (n = 132).
Лекарственные взаимодействия
Исследования на здоровых добровольцах показали, что PRECOSE не имеет
влияние на фармакокинетику или фармакодинамику нифедипина,
пропранолол или ранитидин.PRECOSE не препятствовал абсорбции или
Распределение глибурида сульфонилмочевины у больных сахарным диабетом. PRECOSE может
влияют на биодоступность дигоксина и могут потребовать корректировки дозы дигоксина путем
16% (90% доверительный интервал: 8-23%), снижение средней Cmax дигоксина на 26% (90%
доверительный интервал: 16–34%) и снижает средние минимальные концентрации
дигоксина на 9% (доверительный интервал 90%: уменьшение с 19% до увеличения на 2%). (См. МЕРЫ ПРЕДОСТОРОЖНОСТИ: ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ .)
(См. МЕРЫ ПРЕДОСТОРОЖНОСТИ: ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ .)
Количество метформина, абсорбированного при приеме PRECOSE, составляло
биоэквивалентен количеству, абсорбированному при приеме плацебо, на что указывает
значения AUC в плазме. Однако пиковый уровень метформина в плазме был снижен на
примерно 20% при приеме PRECOSE из-за небольшой задержки всасывания
метформина. Практически отсутствует клинически значимое взаимодействие между
PRECOSE и метформин.
Клинические испытания
Клинический опыт исследований по подбору доз при типе 2
Только пациенты с сахарным диабетом, получающие диетическое лечение
Результаты шести контролируемых исследований монотерапии с фиксированными дозами
PRECOSE в лечении сахарного диабета 2 типа, с участием 769
Пациенты, получавшие PRECOSE, были объединены и получили средневзвешенное значение
отличие от плацебо в среднем изменении по сравнению с исходным уровнем гликозилированного
гемоглобин (HbA1c) был рассчитан для каждого уровня дозы, как показано ниже:
Таблица 1
| Среднее изменение HbA1c за вычетом плацебо в исследованиях монотерапии фиксированной дозой | |||
| Доза PRECOSE * | N | Изменение HbA1c% | p-значение |
25 мг т. я бы. я бы. | 110 | -0,44 | 0,0307 |
| 50 мг три раза в день | 131 | -0,77 | 0,0001 |
| 100 мг три раза в день | 244 | -0,74 | 0,0001 |
| 200 мг 3 раза в день ** | 231 | -0,86 | 0,0001 |
| 300 мг т.внутр. ** | 53 | -1 | 0,0001 |
| * PRECOSE был статистически значительно отличается от плацебо при всех дозах. Хотя не было статистически значимые различия между средними результатами для диапазона доз от 50 до 300 мг три раза в день, некоторые пациенты могут получить пользу от увеличения дозировки от 50 до 100 мг три раза в день | |||
Хотя в исследованиях использовался
максимальная доза 200 или 300 мг т. i.d., максимальная рекомендуемая доза для пациентов
i.d., максимальная рекомендуемая доза для пациентов
<60 кг - 50 мг три раза в день; максимальная рекомендуемая доза для пациентов> 60
кг составляет 100 мг 3 раза в день.
Результаты этих шести фиксированных доз,
исследования монотерапии также были объединены, чтобы получить средневзвешенное значение
разница по сравнению с плацебо в среднем изменении по сравнению с исходным уровнем для одного часа после приема пищи
уровни глюкозы в плазме, как показано на следующем рисунке:
Рисунок 1
* PRECOSE было статистически значимо
отличается от плацебо при всех дозах в отношении воздействия на один час
постпрандиальная глюкоза плазмы.
** 300 мг три раза в день. ПРЕДУПРЕЖДЕНИЕ
режим был лучше, чем более низкие дозы, но не было статистически
значимые различия от 50 до 200 мг три раза в день.
Клинический опыт при типе 2
Пациенты с сахарным диабетом, получающие монотерапию или в комбинации с
Сульфонилмочевины, метформин или инсулин
PRECOSE изучался как монотерапия
и в качестве комбинированной терапии с лечением сульфонилмочевиной, метформином или инсулином.
Влияние лечения на уровень HbA1c и уровень глюкозы через час после приема пищи
суммированы для четырех плацебо-контролируемых двойных слепых рандомизированных исследований.
проводились в США в таблицах 2 и 3 соответственно.В
Различия в лечении за вычетом плацебо, которые суммированы ниже, были
статистически значимыми для обеих переменных во всех этих исследованиях.
Исследование 1 (n = 109) с участием пациентов
на фоне лечения только диетой. Средний эффект от добавления
ПРЕКОСОМ к диетической терапии было изменение HbA1c на -0,78% и улучшение на
уровень глюкозы через час после приема пищи -74,4 мг / дл.
В исследовании 2 (n = 137) среднее значение
Эффект от добавления PRECOSE к максимальной терапии сульфонилмочевиной изменился
в HbA1c -0.54%, и улучшение уровня глюкозы в крови через час после приема пищи.
-33,5 мг / дл.
В исследовании 3 (n = 147) среднее значение
Эффект от добавления PRECOSE к максимальной терапии метформином заключался в изменении
HbA1c составляет -0,65%, а повышение уровня глюкозы в крови через час после приема пищи -34,3.
мг / дл.
Исследование 4 (n = 145) показало, что
Добавление PRECOSE к пациентам на фоне лечения инсулином привело к
среднее изменение HbA1c -0,69% и улучшение через час после приема пищи
глюкоза -36.0 мг / дл.
Годовое исследование PRECOSE as
монотерапия или в сочетании с лечением сульфонилмочевиной, метформином или инсулином
было проведено в Канаде, в котором 316 пациентов были включены в первичную
анализ эффективности (рисунок 2). В диете группы сульфонилмочевины и метформина,
среднее снижение HbA1c, вызванное добавлением PRECOSE, составило
статистически значимо через шесть месяцев, и этот эффект был устойчивым через один
год. У пациентов, получавших PRECOSE и получавших инсулин, статистически наблюдалось
значительное снижение HbA1c через шесть месяцев и тенденция к снижению через шесть месяцев.
один год.
Таблица 2: Влияние прекозы на HbA1c
| Исследование | Лечение | HbA1c (%) a | p-значение | ||
| Среднее значение исходного уровня | Среднее изменение относительно исходного уровня b | Разница в лечении | |||
| 1 | Диета Плацебо Плюс | 8,67 | 0. 33 33 | – | – |
| PRECOSE 100 мг три раза в день Плюс Диета | 8,69 | -0,45 | -0,78 | 0,0001 | |
| 2 | Плацебо Плюс SFU c | 9,56 | 0,24 | – | – |
| PRECOSE 50–300 d мг т.я бы. Плюс SFU c | 9,64 | -0,3 | -0,54 | 0,0096 | |
| 3 | Плацебо плюс метформин e | 8,17 | +0,08 г | – | – |
| PRECOSE 50–100 мг три раза в день Плюс Метформин е | 8,46 | -0,57 г | -0. 65 65 | 0,0001 | |
| 4 | Плацебо плюс инсулин f | 8,69 | 0,11 | – | – |
| PRECOSE 50–100 мг три раза в день Плюс инсулин f | 8,77 | -0,58 | -0,69 | 0,0001 | |
| a HbA1c Нормальный диапазон: 4–6% b После четырех месяцев лечения в исследовании 1 и шести месяцев в исследованиях 2, 3 и 4 c SFU, сульфонилмочевина, максимальная доза d Хотя в исследованиях использовалась максимальная доза до 300 мг t.я бы., максимальная рекомендуемая доза для пациентов ≤ 60 кг — 50 мг три раза в день; максимальная рекомендуемая доза для пациентов> 60 кг составляет 100 мг 3 раза в день e Метформин дозируется по 2000 мг / день или 2500 мг / день f Средняя доза инсулина 61 ЕД / день г Результаты приведены в соответствие с общим исходным уровнем 8,33% | |||||
Таблица 3: Влияние прекозы на уровень глюкозы после приема пищи
| Исследование | Лечение | Глюкоза через час после приема пищи (мг / дл) | p-значение | ||
| Среднее значение исходного уровня | Среднее изменение по сравнению с исходным уровнем a | Разница в лечении | |||
| 1 | Диета Плацебо Плюс | 297. 1 1 | 31,8 | – | – |
| PRECOSE 100 мг три раза в день Плюс Диета | 299,1 | -42,6 | -74,4 | 0,0001 | |
| 2 | Плацебо Плюс SFU b | 308,6 | 6,2 | – | – |
| PRECOSE 50–300 c мг т.я бы. Плюс SFU b | 311,1 | -27,3 | -33,5 | 0,0017 | |
| 3 | Плацебо плюс метформин d | 263,9 | +3,3 из | – | – |
| PRECOSE 50–100 мг три раза в день Плюс Метформин d | 283 | -31. 0 ж 0 ж | -34,3 | 0,0001 | |
| 4 | Плацебо плюс инсулин e | 279,2 | 8 | – | – |
| PRECOSE 50–100 мг три раза в день Плюс инсулин e | 277,8 | -28 | -36 | 0,0178 | |
| a После четырех месяцев лечения в исследовании 1 и шести месяцев лечения в Исследования 2, 3 и 4 b SFU, сульфонилмочевина, максимальная доза c Хотя в исследованиях использовалась максимальная доза до 300 мг t.я бы., максимальная рекомендуемая доза для пациентов ≤ 60 кг — 50 мг три раза в день; максимальная рекомендуемая доза для пациентов> 60 кг составляет 100 мг 3 раза в день d Метформин дозируется 2000 мг / день или 2500 мг / день e Средняя доза инсулина 61 ЕД / день f Результаты приведены в соответствие с общим исходным уровнем 273 мг / дл | |||||
Рисунок 2
Рисунок 2: Влияние PRECOSE (III) и плацебо (III) на среднее изменение уровней HbA1c по сравнению с исходным уровнем
в течение годичного исследования у пациентов с сахарным диабетом 2 типа при использовании
в сочетании с: (A) только диетой; (B) сульфонилмочевина; (C) метформин; или (D)
инсулин. Были проверены различия в лечении через 6 и 12 месяцев: * p <0,01; #
р = 0,077.
Были проверены различия в лечении через 6 и 12 месяцев: * p <0,01; #
р = 0,077.
Механизм действия акарбозы: конкурентное ингибирование кишечника …
Предпосылки: Ингибиторы акарбозы и дипептидилпептидазы-4 (DPP-4is) имеют несколько общих черт в отношении их эффективности. Оценка гипогликемических эффектов и эффектов потери веса, а также их переносимости при их оптимальных дозировках может обеспечить лучшее лечение взрослых диабетиков 2 типа.Методы. Мы провели систематический обзор и сетевой метаанализ (NMA) рандомизированных контролируемых испытаний, которые были идентифицированы из баз данных EMBASE, MEDLINE, Кокрановского центрального реестра контролируемых исследований, Web of Science, индекса цитирования материалов конференций, ClinicalTrials.gov, Китайская национальная инфраструктура знаний, Ван Фанг и СиноМед. Испытания с 300 мг / сут акарбозы или рекомендованными дозами DPP-4 были наиболее оптимальными для нашего NMA. Были использованы средние различия (MD) и относительный риск (RR), полученные из подходящих исследований. Результаты. Среди 15 411 потенциальных исследований 13 парных испытаний и 48 исследований монотерапии были включены в метаанализ и NMA, соответственно. DPP-4 имел больший эффект снижения глюкозы, но более слабый эффект потери веса, чем акарбоза, в парном метаанализе (p <0,05). Тем не менее, NMA с 11 877 участниками показало, что при их оптимальных дозах акарбоза и DPP-4 имели сходные глюкозоснижающие эффекты на глюкозу через 2 часа после приема пищи (MD 0,96 ммоль / л, 95% вероятный интервал -0.56–2,54), HbA1c (0,05%, –0,25–0,33), снижение уровня глюкозы в плазме натощак (–0,27 ммоль / л, –0,76–0,24) и достижение целевой цели HbA1c <7,0% (ОР 1,33, 0,51–3,64). Акарбоза превосходила DPP-4is в отношении потери веса (MD -1,23 кг, -2,08 до -0,33). У акарбозы было больше побочных эффектов абстиненции, желудочно-кишечных и общих нежелательных явлений, чем у DPP-4 (p <0,05), но различия исчезли после более длительного лечения (p> 0,05). Выводы: Акарбоза и DPP-4 имеют сходные эффекты снижения глюкозы, но Эффекты акарбозы для похудания лучше.
Результаты. Среди 15 411 потенциальных исследований 13 парных испытаний и 48 исследований монотерапии были включены в метаанализ и NMA, соответственно. DPP-4 имел больший эффект снижения глюкозы, но более слабый эффект потери веса, чем акарбоза, в парном метаанализе (p <0,05). Тем не менее, NMA с 11 877 участниками показало, что при их оптимальных дозах акарбоза и DPP-4 имели сходные глюкозоснижающие эффекты на глюкозу через 2 часа после приема пищи (MD 0,96 ммоль / л, 95% вероятный интервал -0.56–2,54), HbA1c (0,05%, –0,25–0,33), снижение уровня глюкозы в плазме натощак (–0,27 ммоль / л, –0,76–0,24) и достижение целевой цели HbA1c <7,0% (ОР 1,33, 0,51–3,64). Акарбоза превосходила DPP-4is в отношении потери веса (MD -1,23 кг, -2,08 до -0,33). У акарбозы было больше побочных эффектов абстиненции, желудочно-кишечных и общих нежелательных явлений, чем у DPP-4 (p <0,05), но различия исчезли после более длительного лечения (p> 0,05). Выводы: Акарбоза и DPP-4 имеют сходные эффекты снижения глюкозы, но Эффекты акарбозы для похудания лучше. Следовательно, при использовании наиболее оптимальных дозировок диабетикам с избыточным весом / ожирением 2 типа лечение акарбозой может принести больше пользы, чем DPP-4.
Следовательно, при использовании наиболее оптимальных дозировок диабетикам с избыточным весом / ожирением 2 типа лечение акарбозой может принести больше пользы, чем DPP-4.
Дозирование прекозы (акарбозы), показания, взаимодействия, побочные эффекты и др.
Противопоказания
Подтвержденная гиперчувствительность к акарбозе
Диабетический кетоацидоз, цирроз, воспалительное заболевание кишечника, язвы толстой кишки, частичная кишечная непроходимость или предрасположенность к кишечной непроходимости, известное выраженное нарушение всасывания GI
Состояния, которые могут ухудшиться в результате увеличения газообразования Желудочно-кишечный тракт
Предостережения
Не существует клинических исследований, устанавливающих убедительные доказательства снижения макроваскулярного риска с помощью акарбозы или любого другого антидиабетического препарата
Когда пациенты с диабетом подвергаются стрессу, например лихорадке, травме, инфекции или хирургическому вмешательству, временная потеря контроля уровня глюкозы в крови может произойти; в такое время может потребоваться временная терапия инсулином.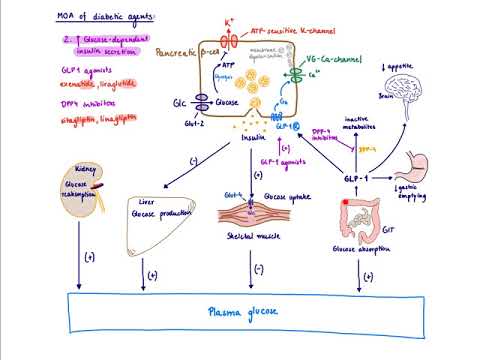
Мониторинг гликемического контроля с помощью анализа 1,5-AG не рекомендуется; измерения 1,5-AG ненадежны при оценке гликемического контроля у пациентов, принимающих акарбозу; использовать альтернативные методы для мониторинга гликемического контроля
Гипогликемия
- В соответствии с механизмом действия препарат не должен вызывать гипогликемию при введении отдельно, натощак или после приема пищи
- Агенты сульфонилмочевины или инсулин могут вызывать гипогликемию; поскольку при назначении в сочетании с лечением сульфонилмочевиной или комбинацией инсулина вызывает дальнейшее снижение уровня глюкозы в крови, это может увеличить вероятность гипогликемии
- Гипогликемия не возникает у пациентов, получающих только метформин при обычных обстоятельствах применения; Повышенная частота гипогликемии, не наблюдаемая при добавлении акарбозы к терапии метформином
- Пероральная глюкоза (декстроза), абсорбция которой не ингибируется акарбозой, должна использоваться вместо сахарозы (тростникового сахара) при лечении легкой и умеренной гипогликемии
- Сахароза, чья абсорбция гидролиз до глюкозы и фруктозы тормозится акарбозой, не подходит для быстрой коррекции гипогликемии; тяжелая гипогликемия может потребовать внутривенной инфузии глюкозы или инъекции глюкагона.

Повышение уровня трансаминазы в сыворотке
- Повышение уровня сывороточных трансаминаз (АСТ и / или АЛТ) выше верхнего предела нормы (ВГН), вызванное лечением; хотя различия между видами лечения были статистически значимыми, повышение было бессимптомным, обратимым, более частым у женщин и, в целом, не было связано с другими признаками дисфункции печени;
- Сообщено о 62 случаях повышения уровня сывороточных трансаминаз> 500 МЕ / л (29 из которых были связаны с желтухой); в большинстве случаев нарушения функции печени улучшаются или исчезают после прекращения терапии; зарегистрированы случаи фульминантного гепатита со смертельным исходом; связь с акарбозой неясна
Акарбоза Перорально: использование, побочные эффекты, взаимодействия, изображения, предупреждения и дозировка
Диарея, газы или дискомфорт / боль в животе могут возникать, когда ваше тело приспосабливается к этому лекарству в течение первых нескольких недель.Эти побочные эффекты обычно уменьшаются со временем. Если какой-либо из этих эффектов продолжается или ухудшается, немедленно сообщите об этом своему врачу или фармацевту.
Если какой-либо из этих эффектов продолжается или ухудшается, немедленно сообщите об этом своему врачу или фармацевту.
Помните, что ваш врач прописал это лекарство, потому что он или она посчитали, что польза для вас больше, чем риск побочных эффектов. Многие люди, принимающие это лекарство, не имеют серьезных побочных эффектов.
Немедленно сообщите своему врачу, если у вас есть какие-либо серьезные побочные эффекты, в том числе: признаки проблем с печенью (например, тошнота / непрекращающаяся рвота, потеря аппетита, боли в животе / животе, пожелтение глаз / кожи, темная моча) .
Акарбоза обычно не вызывает низкого уровня сахара в крови (гипогликемии). Низкий уровень сахара в крови может возникнуть, если этот препарат назначают вместе с другими лекарствами от диабета, или если вы не потребляете достаточно калорий из пищи, или если вы выполняете необычно тяжелые упражнения. Поговорите со своим врачом или фармацевтом о том, нужно ли снизить дозу других лекарств от диабета.
Симптомы низкого уровня сахара в крови включают внезапное потоотделение, дрожь, учащенное сердцебиение, голод, помутнение зрения, головокружение или покалывание в руках / ногах.Не используйте столовый сахар и не пейте не диетическую газировку, чтобы облегчить эти симптомы, потому что акарбоза замедляет расщепление столового сахара. Носите с собой таблетки или гель глюкозы для лечения низкого уровня сахара в крови. Если у вас нет этих надежных форм глюкозы, съешьте немного меда или выпейте стакан апельсинового сока, чтобы быстро поднять уровень сахара в крови. Немедленно сообщите врачу о реакции и использовании этого продукта. Чтобы предотвратить низкий уровень сахара в крови, ешьте регулярно и не пропускайте приемы пищи. Посоветуйтесь со своим врачом или фармацевтом, чтобы узнать, что вам делать, если вы пропустите прием пищи.
Симптомы высокого уровня сахара в крови (гипергликемия) включают жажду, учащенное мочеиспускание, спутанность сознания, сонливость, приливы крови, учащенное дыхание и фруктовый запах изо рта. Если возникают эти симптомы, немедленно сообщите об этом своему врачу. Возможно, вам потребуется увеличить дозировку или вам могут потребоваться другие лекарства.
Если возникают эти симптомы, немедленно сообщите об этом своему врачу. Возможно, вам потребуется увеличить дозировку или вам могут потребоваться другие лекарства.
Этот препарат в редких случаях может вызывать серьезные кишечные заболевания (пневматоз цистоидес кишечника). Немедленно сообщите своему врачу, если у вас появятся: непрекращающийся понос, запор, кровь / слизь в стуле.
Очень серьезные аллергические реакции на этот препарат возникают редко. Однако немедленно обратитесь за медицинской помощью, если вы заметили какие-либо симптомы серьезной аллергической реакции, включая: сыпь, зуд / отек (особенно лица / языка / горла), сильное головокружение, затрудненное дыхание.
Это не полный список возможных побочных эффектов. Если вы заметили другие эффекты, не перечисленные выше, обратитесь к врачу или фармацевту.
В США —
Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов.Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088 или на сайте www. fda.gov/medwatch.
fda.gov/medwatch.
В Канаде — Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов. Вы можете сообщить о побочных эффектах в Министерство здравоохранения Канады по телефону 1-866-234-2345.
Побочные эффекты акарбозы и механизм действия
Введение
Акарбоза — это общее название таких препаратов, как прекоза, которые прописываются, чтобы помочь диабетикам 2 типа контролировать уровень сахара в крови. Ингибиторы акарбозы или альфа-глюкозидазы действуют, блокируя ферменты, переваривающие углеводы в тонком кишечнике.Углеводы в нашем организме расщепляются на сахара. Когда действуют ингибиторы альфа-глюкозидазы, скорость расщепления углеводов до сахара снижается. В результате скорость, с которой сахар попадает в кровоток, замедляется. Это приводит к снижению уровня сахара в крови. Диабетикам, принимающим этот препарат, приходится иметь дело с побочными эффектами акарбозы. К ним относятся проблемы с пищеварением из-за механизма действия акарбозы .
Механизм действия
Акарбоза замедляет действие двух ферментов, задача которых — переваривать сложные углеводы в простые сахара.Это ингибирование носит временный характер, и хотя эти ферменты все еще продолжают переваривать углеводы, скорость, с которой они это делают, значительно снижается.
Как следует использовать акарбозу?
Акарбоза — это таблетка, которую обычно принимают три раза в день. Очень важно принимать каждую дозу с первым укусом каждого основного приема пищи. Тщательно следуйте инструкциям на этикетке с рецептом. Если вы чего-то не понимаете, спросите своего лечащего врача или фармацевта. Принимайте акарбозу точно в соответствии с указаниями. Не принимайте больше или меньше и не принимайте чаще, чем предписано.Продолжайте принимать акарбозу, даже если чувствуете себя хорошо. Не прекращайте принимать акарбозу, не посоветовавшись со своим врачом.
Наиболее рекомендуемые торговые марки акарбозы включают
Глисет, Прекоза, Эуглит, Миньяр, Элитокс, Глюкарб, Дискарб и Дисорб
Побочные эффекты, которые могут проявиться сразу после начала приема акарбозы
Проблемы с пищеварением
Наиболее частыми побочными эффектами акарбозы являются метеоризм, ощущение вздутия живота, боли в животе и диарея. Эти препараты задерживают сложные углеводы в кишечнике, предотвращая их быстрое расщепление. Это заставляет пищу дольше оставаться в пищеварительной системе. Бактерии ферментируют эту пищу и в качестве побочного продукта выделяют газ. Это приводит к метеоризму и вздутию живота.
Эти препараты задерживают сложные углеводы в кишечнике, предотвращая их быстрое расщепление. Это заставляет пищу дольше оставаться в пищеварительной системе. Бактерии ферментируют эту пищу и в качестве побочного продукта выделяют газ. Это приводит к метеоризму и вздутию живота.
Что вы можете сделать?
Ваш врач может справиться с этими побочными эффектами, начав с меньшей дозы и постепенно увеличивая дозировку.
Следует ли использовать акарбозу в течение длительного времени?
Хотя обычная доза акарбозы переносится хорошо, краткосрочные побочные эффекты могут вызвать смущение и дискомфорт.Акарбоза не исследовалась на предмет истощения питательных веществ при более длительном применении.
Просто помните: исследования показывают, что если вы придерживаетесь правильной диеты, вы можете существенно изменить уровень сахара в крови. Прерывистое голодание, начинающееся с простого 12-часового голодания между обедом и завтраком, также может значительно улучшить чувствительность к инсулину. Умеренные упражнения могут помочь вам не только похудеть, но и лучше справиться с сахаром в крови.
Умеренные упражнения могут помочь вам не только похудеть, но и лучше справиться с сахаром в крови.
Прием акарбозы: какие особые меры предосторожности мне следует соблюдать?
Перед приемом акарбозы,
Сообщите своему врачу и фармацевту, если у вас аллергия на акарбозу или другие препараты.
Сообщите своему врачу о других рецептурных и безрецептурных лекарствах, которые вы принимаете, особенно о
.
- Другие лекарства от диабета
- Дигоксин (ланоксин)
- Диуретики («водные пилюли»)
- Эстрогены
- Изониазид
- Лекарства от повышенного давления или простуды
- Оральные контрацептивы
- Ферменты поджелудочной железы
- Фенитоин (дилантин)
- Стероиды
- Лекарства для щитовидной железы
- Витамины
Сообщите своему врачу, если у вас есть или когда-либо были кетоацидоз, цирроз или кишечные заболевания, такие как воспалительное заболевание кишечника или непроходимость кишечника.
Сообщите своему врачу, если вы беременны, планируете забеременеть или кормите грудью. Если вы забеременели во время приема акарбозы, обратитесь к врачу.
Что мне делать, если я забыл о дозе акарбозы?
Примите пропущенную дозу, как только вспомните. Если вы планируете в ближайшее время перекусить, примите дозу вместе с перекусом. Если почти пришло время для следующей дозы, пропустите пропущенную дозу и продолжите свой обычный график дозирования. Не принимайте двойную дозу, чтобы восполнить пропущенную.
Что мне следует знать о хранении и утилизации акарбозы?
Храните лекарство при температуре от 20 до 25 ° C (от 68 до 77 ° F). Беречь от влаги. Хранить контейнер плотно закрытым. Храните лекарство в недоступном для детей и домашних животных месте. Не давайте это лекарство никому только потому, что у него есть симптомы, похожие на вас. Они могут страдать от совершенно не связанного с ними заболевания или расстройства. Отнесите ненужные лекарства или лекарства с истекшим сроком годности к фармацевту, который избавит вас от них.
Особенности питания при приеме акарбозы
Прием только антидиабетических препаратов никогда не может быть единственным способом борьбы с диабетом.Исследования меняют взгляд врачей на правильную диету для диабетиков, поэтому убедитесь, что вы правильно питаетесь в соответствии с этими принципами.
Если вы собираетесь употреблять алкоголь, как диабетик знайте свои пределы. В сети много дезинформации о том, что диабетикам следует и не следует делать, поэтому имейте это в виду.
Взаимодействие с другими препаратами: Акарбоза
- Некоторые лекарства могут повышать уровень сахара в крови, и вам следует соблюдать осторожность, принимая их вместе с лекарствами, такими как акарбоза, которые используются для снижения уровня сахара в крови.К таким лекарствам относятся тиазидные диуретики и петлевые диуретики, кортикостероиды, фенотиазины, препараты щитовидной железы, эстрогены (конъюгированные), прогестины, гормональные контрацептивы, фенитоин, ниацин, симпатомиметики, блокаторы кальциевых каналов и изониазид.

- Если вы принимаете кишечные адсорбенты, включая активированный уголь и препараты пищеварительных ферментов (амилазу, панкреатин) для лечения проблем с пищеварением, имейте в виду, что они могут снизить эффективность акарбозы.
- Акарбоза, когда ее принимают вместе с сульфонилмочевиной, оказывает большее влияние на снижение уровня сахара в крови.
- Acarbse может снизить всасывание дигоксина, который вы принимаете при сердечных заболеваниях. Вам может потребоваться изменить дозировку после консультации с вашим лечащим врачом.
Кому не следует принимать акарбозу?
Не принимайте акарбозу, если:
- У вас аллергия (гиперчувствительность) на акарбозу.
- У вас аллергия на любой другой ингредиент таблеток.
- Вы беременны, можете забеременеть или кормите грудью.
- У вас воспаление кишечника или язва желудка (такие состояния, как язвенный колит или болезнь Крона).
- У вас есть или вы подвержены непроходимости кишечника (кишечника).

- Вы не можете правильно переваривать пищу из-за проблем с кишечником.
- У вас большая грыжа или другое заболевание, при котором выделяется большое количество газа, что может ухудшить ваше состояние.
- У вас заболевание печени.
- У вас тяжелая болезнь почек.
Что входит в состав акарбозы?
Действующее вещество — акарбоза (каждая таблетка содержит 50 или 100 мг акарбозы). Другие ингредиенты: микрокристаллическая целлюлоза, кукурузный крахмал, натрийкроскармеллоза, безводный коллоидный диоксид кремния и стеарат магния.
Диабет обратимый. Это то послание, которое доктора медицины передают нам сегодня.
Пищевые добавки, которые помогают контролировать уровень сахара в крови, могут помочь вам снизить нагрузку на лекарства, отпускаемые по рецепту.При использовании пищевых добавок для лечения диабета всегда консультируйтесь со своим врачом. Некоторые добавки могут быстро снизить уровень сахара в крови, поэтому следует проявлять особую осторожность при использовании их вместе с лекарствами, отпускаемыми по рецепту
Global Health: Сахарный диабет: Лекарства: Ингибиторы альфа-глюкозидазы: Акарбоза
Каждая молекула фермента мальтаза-глюкоамилаза (MGAM) состоит из 1867 остатков и содержит две гомологичные каталитические субъединицы. N-концевой домен (остатки 1-868) называется NtMGAM, а C-концевой домен (остатки 955-1867) называется CtMGAM.Обе субъединицы осуществляют одну и ту же каталитическую реакцию — гидролиз α- (1,4) связанных единиц глюкозы в линейных олигосахаридных субстратах с получением мономеров глюкозы. Однако они различаются по своей особой специфичности для мальтоолигосахаридов различной длины (Sim et al ., 2008).
N-концевой домен (остатки 1-868) называется NtMGAM, а C-концевой домен (остатки 955-1867) называется CtMGAM.Обе субъединицы осуществляют одну и ту же каталитическую реакцию — гидролиз α- (1,4) связанных единиц глюкозы в линейных олигосахаридных субстратах с получением мономеров глюкозы. Однако они различаются по своей особой специфичности для мальтоолигосахаридов различной длины (Sim et al ., 2008).
Оба домена NtMGAM и CtMGAM состоят из пяти основных субдоменов:
- домен типа P-трилистник
- N-концевой β-сэндвич-домен
- каталитический (β / α) 8 бочкообразный домен с двумя вставленными петлями
- проксимальный C-концевой домен
- дистальный C-концевой домен
Третичные структуры NtMGAM и CtMGAM обнаруживают аналогичную складку (Рисунок 2), однако последний имеет вставку из 21 остатка (показана голубым цветом, Рисунки 2b и 3b) и дает ему больший карман для связывания для связывания более длинных субстратов, чем NtMGAM.
Рис. 2. Ленточная диаграмма, представляющая MGAM в комплексе с акарбозой, с отдельными структурными субдоменами, выделенными разными цветами (а) NtMGAM (PDB ID 2qmj; Sim et al., 2008). (б) CtMGAM (PDB ID 3top; Ren et al., 2011). CtMGAM имеет 21 дополнительный остаток в каталитическом домене, выделенный голубой лентой . Акарбоза представлена в виде мяча и клюшки с цветовой кодировкой в зависимости от типа атома (C: зеленый; N: синий; O: красный).
Акарбоза — субстратоподобный ингибитор HPA, MGAM и SI. Он имеет тетрасахаридоподобную структуру с акарвиозиновой группой, α-связанной с мальтозой. Первые два кольца невосстанавливающего конца акарбозы (также известного как акарвозин) занимают сахарные субсайты -1 и +1 активного центра, а N-связанная связь занимает каталитический центр. Расщепление субстрата происходит между подсайтами -1 и +1. Активный сайт крупным планом показывает акарбоз в виде фигурки (рис. 3).
3).
Рисунок 3. Крупным планом активный сайт (a) NtMGAM (PDB ID 2qmj; Sim et al., 2008). (б) CtMGAM (PDB ID 3top; Ren et al., 2011). Акарбоза показана в виде фигурки, обозначенной цветом в зависимости от типа атома (C: зеленый; N: синий; O: красный). Подсайты -1, +1 сахара показаны в дугах розовый и синий соответственно.
Тщательное изучение структуры показывает, что акарбоза связывается с NtMGAM посредством обширных взаимодействий водородных связей, представленных синими линиями на рисунке 4a с остатками активного сайта Asp203, Thr205, Asp327, Arg526, Asp542 и His600 и окружающими молекулами воды.Два кольца от восстанавливающего конца акарбозы минимально взаимодействуют с остатками активного сайта. Подобная сеть водородных связей наблюдается (рис. 4b) между остатками акарбозы и активного сайта CtMGAM (Asp1157, Asp1279, Arg1510, Asp1526 и His1584). Разница между акарбозой и тетрасахаридным субстратом, связанным с α- (1,4), заключается в наличии атома азота вместо атома кислорода. Каталитический нуклеофил Asp (Asp443 в NtMGAM / Asp1420 в CtMGAM) не взаимодействует с акарбозой, тогда как тот же остаток образует ковалентный интермедиат с олигосахаридными субстратами и играет главную роль в гидролизе линейных олигосахаридов до мономеров.Кислотно-основной остаток Asp542 (в NtMGAM) и Asp1526 (в CtMGAM) образует несколько водородных связей с молекулой лекарства. Эти структурные исследования показали, что акарбоза действует, блокируя активные центры HPA, MGAM и SI, предотвращая связывание олигосахаридных субстратов и задерживая переваривание углеводов.
Разница между акарбозой и тетрасахаридным субстратом, связанным с α- (1,4), заключается в наличии атома азота вместо атома кислорода. Каталитический нуклеофил Asp (Asp443 в NtMGAM / Asp1420 в CtMGAM) не взаимодействует с акарбозой, тогда как тот же остаток образует ковалентный интермедиат с олигосахаридными субстратами и играет главную роль в гидролизе линейных олигосахаридов до мономеров.Кислотно-основной остаток Asp542 (в NtMGAM) и Asp1526 (в CtMGAM) образует несколько водородных связей с молекулой лекарства. Эти структурные исследования показали, что акарбоза действует, блокируя активные центры HPA, MGAM и SI, предотвращая связывание олигосахаридных субстратов и задерживая переваривание углеводов.
Рис. 4. (a) Взаимодействие водородных связей ( синие линии) между акарбозой (рисунок карандашом) и остатками фермента в (a) NtMGAM (PDB ID 2qmj; Sim et al., 2008) ; (б) CtMGAM ( PDB ID 3top; Ren et al. , 2011). T Каталитический нуклеофил Asp помечен как красный и кислотно-основной остаток Asp синий и показан в виде шариков и палочек, в то время как остатки других ферментов показаны в виде фигур. Кольцо акарвозина занимает субсайт фермента , где связываются сахара -1 и +1 субстрата.
, 2011). T Каталитический нуклеофил Asp помечен как красный и кислотно-основной остаток Asp синий и показан в виде шариков и палочек, в то время как остатки других ферментов показаны в виде фигур. Кольцо акарвозина занимает субсайт фермента , где связываются сахара -1 и +1 субстрата.
PDB-101: Здоровье в мире: Сахарный диабет: Лекарства: Ингибиторы альфа-глюкозидазы: альфа-глюкозидаза
Ферменты глюкозидазы катализируют гидролиз крахмала до простых сахаров.У людей эти ферменты способствуют перевариванию пищевых углеводов и крахмалов с образованием глюкозы для всасывания в кишечнике, что, в свою очередь, приводит к повышению уровня глюкозы в крови. Подавление функции этих ферментов у пациентов с диабетом 2 типа может уменьшить гипергликемию.
Глюкозидазы названы на основе их субстратов, типов гидролизуемых связей и точного механизма действия. Альфа-амилазы (например, альфа-амилазы слюны и поджелудочной железы) действуют на длинноцепочечные углеводы, в то время как альфа-глюкозидазы (например,(например, мальтаза, глюкоамилаза и сахароза изомальтаза) действуют на более короткие цепи крахмала и дисахариды с образованием глюкозы. Последние ферменты являются молекулярными мишенями следующих антидиабетических препаратов, одобренных USFDA:
Последние ферменты являются молекулярными мишенями следующих антидиабетических препаратов, одобренных USFDA:
Эти препараты задерживают переваривание углеводов и снижают уровень глюкозы в крови в краткосрочной перспективе, что приводит к улучшению уровня HbA1c у пациентов с диабетом 2 типа.
Углеводы и крахмалы, такие как зерновые, картофель, макаронные изделия и хлеб, состоят из полимеров глюкозы (или глюканов).Структурно они состоят из двух различных компонентов (рис. 1): амилозы или длинных линейных цепей α- (1,4) связанных глюканов; и амилопектин, сильно разветвленные глюканы с α- (1,4) и α- (1,6) гликозидными связями (Williams, 2017).
Рисунок 1. Структура амилозы и амилопектина (адаптировано из Bowen, 2006). Единицы глюкозы показаны зелеными шестиугольниками.
1. Функция
В пищеварительной системе человека множественные глюкозидазы (ферменты, переваривающие углеводы) координируют распад диетических крахмалов и других полисахаридов с высвобождением глюкозы (рис. 2).Здесь обсуждаются два основных класса ферментов, переваривающих углеводы:
2).Здесь обсуждаются два основных класса ферментов, переваривающих углеводы:
- Альфа-амилазы:
i. Альфа-амилаза слюны начинает действовать во рту, расщепляя эндо-α- (1,4) связи в молекулах крахмала с образованием более коротких олигомеров.
ii. Альфа-амилаза поджелудочной железы (HPA) действует на продукты переваривания альфа-амилазы в слюне в кишечнике, дополнительно гидролизуя эндо-α- (1,4) гликозидные связи и образуя гораздо более мелкие олигосахариды, такие как мальтоза (дисахарид), мальтотриоза (трисахарид) и α-лимитный декстрин (смесь полимеров D-глюкозных единиц, связанных α- (1,4) и α- (1,6) гликозидными связями) (Bowen, 2006). - Альфа-глюкозидазы: продукты гидролиза амилазы не могут абсорбироваться кишечником, поэтому они далее расщепляются на более простые сахара или моносахариды (например, глюкозу, галактозу и фруктозу) небольшими мембраносвязанными кишечными ферментами, такими как
i. Мальтаза-глюкоамилаза (MGAM) расщепляет невосстанавливающие α- (1,4) гликозидные связи с высвобождением α-D-глюкозы.
ii. Сахараза-изомальтаза (SI) также может расщеплять α- (1,4) гликозидные связи с высвобождением α-D-глюкозы.Кроме того, N-концевой домен сахароза-изомальтазы (NtSI) расщепляет α- (1,6) связь амилопектина, в то время как C-концевой домен сахаразы-изомальтазы (CtSI) способен расщеплять α- (1 , 2) связывание сахарозы (также известной как обычный столовый сахар).
Рисунок 2. Переваривание крахмала альфа-амилазами и альфа-глюкозидазами. Единицы глюкозы представлены на рисунке 1.
Конечным продуктом переваривания крахмала альфа-глюкозидазами, такими как MGAM, является глюкоза.Акарбоза — хорошо известный натуральный продукт, ингибирующий альфа-амилазы и альфа-глюкозидазы. Связывание акарбозы с альфа-глюкозидазами предотвращает расщепление пищевого крахмала и олигосахаридов (рис. 3), что приводит к снижению образования моносахаридов и снижению уровня глюкозы в крови после приема пищи.
Фигура 3: Схема, показывающая a ) Заключительные стадии гидролиза крахмала, катализируемые MGAM; б) Связывание акарбозы с альфа-глюкозидазой (MGAM), конкурентное ингибирование фермента. Источник: адаптировано из (Bischoff, 1991).
Источник: адаптировано из (Bischoff, 1991).
2. Структура
Структуры как альфа-амилаз, так и альфа-глюкозидаз характеризуются бочкой, состоящей из 8 β-цепей и α-спиралей. В то время как первый класс ферментов имеет остатки Asp и Glu в активном центре и принадлежит к семейству гликозидгидролаз 13 (Gh23), последний имеет только остатки Asp в активном центре и принадлежит к семейству гликозидгидролаз 31 (Gh41). Здесь мы описываем структуры трех из этих ферментов.
- Альфа-амилаза поджелудочной железы человека (HPA)
- Мальтаза-глюкоамилаза (MGAM)
- Сахараза-изомальтаза (SI)
A. Поджелудочная железа человека Альфа-амилаза
Альфа-амилаза поджелудочной железы человека (HPA) — это мономерный кальций- и хлоридсвязывающий белок (Brayer et al. , 1995). Поскольку последовательность и структура альфа-амилазы слюны аналогична таковой у амилазы поджелудочной железы, она не обсуждается отдельно. Белок HPA из 496 аминокислот состоит из трех доменов (рис. 4):
Белок HPA из 496 аминокислот состоит из трех доменов (рис. 4):
Домен A (оранжевого и красного цвета) является самым большим из трех доменов и насчитывает
- центральный восьмицепочечный параллельный β / a-ствол (оранжевый и красный; остатки 1-99 и 169-404)
- активный сайт (Asp197, Glu233 и Asp 300)
- сайт связывания хлорида (остатки Arg195, Asn298 и Arg337)
Домен B (окрашен в небесно-голубой цвет; остатки 100-168) является наименьшим из трех доменов и расположен на протяженной петле между третьей β-цепью и α-спиралью центрального β-цилиндра домена A.Состоит из
- сайт связывания кальция (остатки Asn100, Arg158 и Asp167; His201 из домена A)
Домен C (окрашен в розовый цвет; остатки 405-496) находится на C-конце, и его функция полностью не изучена. Состоит из
- антипараллельная β-структура и связана с доменом A
Рисунок 4. Топология альфа-амилазы поджелудочной железы человека. Домен A (оранжевый) , состоящий из 8 β-листов / α-спирального домена, который образует цилиндр (остатки 1-99 и 169-404) . β-листы (оранжевый) помечены от β1 до β8, каждая последующая α-спираль (красный оранжевый). Домен B (голубой) прерывает домен A между β3 и его соответствующей α-спиралью (остатки 100-168). Домен C (розовый) представляет собой небольшой структурно независимый антипараллельный бета-ствол (остатки 405-496). Взято из Levine, 2011.
Домен A (оранжевый) , состоящий из 8 β-листов / α-спирального домена, который образует цилиндр (остатки 1-99 и 169-404) . β-листы (оранжевый) помечены от β1 до β8, каждая последующая α-спираль (красный оранжевый). Домен B (голубой) прерывает домен A между β3 и его соответствующей α-спиралью (остатки 100-168). Домен C (розовый) представляет собой небольшой структурно независимый антипараллельный бета-ствол (остатки 405-496). Взято из Levine, 2011.
Трехмерная структура (PDB ID 5td4, Zhang et al., 2016), а доменная организация HPA показана на рисунке 5. Три домена имеют цветовую кодировку оранжевого, синего и розового цветов, как описано выше. Белок, использованный для определения структуры, имел точечную мутацию Asp300Asn. Примечание: Asn300 был изменен на Asp, чтобы представить белок дикого типа на рисунках ниже.
Рисунок 5. Ленточная диаграмма альфа-амилазы поджелудочной железы человека (HPA) и ее субдоменов в комплексе с октаозным субстратом, с отдельными структурными субдоменами, выделенными разными цветами (PDB ID 5td4; Zhang et al., 2016). Остатки активного центра показаны в виде шариков и палочек; субстрат октаозы показан в виде фигурки с цветовой кодировкой по типу атома (C: зеленый; O: красный).
И кальций, и хлорид играют важную функциональную роль. Кальций необходим для каталитической активности (Vallee et al. , 1959). Ион взаимодействует с Asn100, Arg158, Asp167, His201 и тремя молекулами воды (рис. 6а). Было высказано предположение, что сайт связывания кальция обеспечивает структурную целостность и организацию для домена B (Qian et al., 1994). Фермент также связывает хлорид-ион в домене A, чуть ниже активного сайта (рис. 6b), где он координируется Arg195, Asn298 и Arg337. Ион хлорида одновременно служит аллостерическим активатором катализа и модулирует оптимум pH для гидролитической активности (Brayer et al. , 1995). Отсутствие связанного хлорид-иона делает фермент неактивным (Maurus et al ., 2008).
, 1995). Отсутствие связанного хлорид-иона делает фермент неактивным (Maurus et al ., 2008).
| Рисунок 6а.Лента представляет сайт связывания иона кальция в альфа-амилазе поджелудочной железы человека (HPA) (PDB ID 5td4; Zhang et al., 2016). | Рисунок 6б. Лента представляет сайт связывания хлорид-иона в альфа-амилазе поджелудочной железы человека (HPA) (PDB ID 5td4; Zhang et al., 2016). |
Активная площадка
Активный сайт HPA представляет собой глубокий C-образный карман, образованный щелью между доменами A и B.Этот сайт содержит три кислых аминокислоты (Asp197, Glu233 и Asp300), которые вместе расщепляют α- (1,4) связи в цепях крахмала из 3 или более единиц D-глюкозы с образованием более коротких олигосахаридов с α- (1,4 ) и α- (1,6) связи (рис. 7а). Исследования по картированию субстрата выявили по крайней мере 5 участков связывания сахара на этом ферменте. Расщепление субстрата каталитическим нуклеофилом (Asp197) происходит между -1 и +1 субсайтами. На рис. 7b показан активный сайт HPA с помеченными подсайтами.
| Рисунок 7а. Крупным планом активный центр HPA с каталитическими остатками Asp197 (нуклеофил), Glu233 (кислота / основание) и Asp300 показан в оранжевом . (PDB ID 5td4; Zhang et al., 2016). Подложка из октаозы показана в виде фигурки с цветовой кодировкой в зависимости от типа атома (C: зеленый; O: красный). | Рисунок 7b. Поверхностное представление активного сайта из HPA (PDB ID 5td4; Zhang et al., 2016). Подложка из октаозы показана в виде фигурки с цветовой кодировкой в зависимости от типа атома (C: зеленый; O: красный). Подсайты сахара –2, 1, +1, +2 показаны фиолетовыми, розовыми, синими и коричневыми дугами соответственно. Расщепление субстрата происходит между подсайтами -1 и +1. |
Альфа-амилазы катализируют гидролиз углеводов, разрушая α- (1,4) глюкозидные связи в полисахаридах, таких как крахмал, в двухстадийной реакции. На первой стадии образуется ковалентный промежуточный гликозил-фермент, которому помогают две боковые цепи, содержащие карбоновые кислоты, известные как каталитический нуклеофил (Asp197) и кислотно-основной катализатор (Glu233).Структура ковалентного гликозильного промежуточного фермента HPA (фиг. 8, PDB ID 3ij7) показывает каталитический нуклеофил Asp197, ковалентно связанный с субстратом. Было высказано предположение, что третий каталитический остаток (Asp300) стабилизирует конформацию связанных субстратов. На втором этапе промежуточный гликозил-фермент гидролизуется с высвобождением мономерной глюкозы. Продаваемые в настоящее время противодиабетические препараты акарбоза и миглитол обратимо связываются с активным сайтом альфа-амилазы поджелудочной железы и ингибируют гидролиз крахмала.
Рисунок 8. Увеличенный вид активного сайта промежуточного комплекса ковалентный гликозил-HPA с консервативными остатками Asp197 (нуклеофил), Glu233 (кислота / основание) и Asp300, показанным на оранжевый Клюшка и шарик . (PDB ID 3ij7; Zhang et al., 2009). Подложка показана в виде фигурки, обозначенной цветом в зависимости от типа атома (C: морской зеленый; O: красный; F: зеленый). Asp197 ковалентно связан с субстратом.
B. Мальтаза-глюкоамилаза
Мальтозоглюкоамилаза (MGAM) прикреплена к эпителиальным клеткам щеточной каймы тонкой кишки и состоит из цитозольного домена, трансмембранного домена (TMD), O-гликозилированного линкера (O-линкера) и двух гомологичных каталитических субъединиц. — амино- и карбоксиконцевые домены (NtMGAM и CtMGAM) (рис. 9а).
Рисунок 9. Линейное схематическое представление структурных доменов NtMGAM и CtMGAM. Источник: адаптировано из (Sim et al., 2008, Ren et al., 2011).
NtMGAM состоит из 868 остатков, а CtMGAM состоит из 913 остатков и на 40% идентичны. Каждый каталитический домен, в свою очередь, состоит из пяти основных структурных доменов, показанных на рисунках 9b и 9c и перечисленных в таблице 1
| Домен | NtMGAM (Sim и др. ., 2008) | CtMGAM (Рен и др. ., 2011) |
| Трилистник Type-P domain | остатки 1-51 | Остатки 955-1002 |
| N-концевой β-сэндвич-домен | остатки 52-269 | Остатки 1003-1221 |
| Бочкообразная область каталитического 8 (β / α) | остатка 270-651 с двумя вставленными петлями, выступающими между β3 и α3 и между β4 и α4, соответственно | Остатки 1222-1633, с двумя вставленными петлями, выступающими между β3 и α3 и между β4 и α4, соответственно |
| Проксимальный С-концевой домен | остатки 652-730 | Остатки 1634-1712 |
| Дистальный С-концевой домен | остатки 731-868 | Остатки 1713-1867 |
Таблица 1: Субдомены N-концевых и C-концевых MGAM
Первым субдоменом в доменах NtMGAM и CtMGAM является домен типа P типа трилистник, и его функция в настоящее время неизвестна.За ним следует N-концевой домен, состоящий из антипараллельного β-сэндвича; каталитический домен, состоящий из 8 (β / α) -бочкового домена, двух вставленных петель; и, наконец, проксимальный и дистальный С-концевые домены, оба состоят из β-сэндвичей. Сравнивается доменная организация NtMGAM (PDB ID 2qmj, Рисунок 10a) и CtMGAM (PDB ID 3top, Рисунок 10b). CtMGAM кристаллизуется как димер, но только мономер показан на фиг. 10b для сравнения с мономером NtMGAM. Оба мономера имеют молекулярную массу около 100 кДа.
Рисунок 10. Ленточное представление MGAM в комплексе с акарбозой — (а) NtMGAM (PDB ID 2qmj; Sim et al., 2008). (б) CtMGAM (PDB ID 3top; Ren et al., 2011). Отдельные структурные подобласти выделены разными цветами. Остатки активного сайта показаны в виде фигурок. CtMGAM имеет 21 дополнительный остаток в каталитическом домене, выделенном голубой лентой. Акарбоза представлена в виде шара и палки, обозначенных цветом в зависимости от типа атома (C: зеленый; N: синий; O: красный).
Активный сайт
Оба домена NtMGAM и CtMGAM осуществляют одну и ту же каталитическую реакцию, но отличаются своей специфичностью для связывания олигосахаридов различной длины (Sim et al. , 2008). Активный сайт NtMGAM имеет неглубокий карман для связывания субстрата только с двумя подсайтами сахара (-1 и +1 подсайты, где связь между сахарами в -1 и +1 разорвана). Наличие 21 дополнительного остатка в активном сайте CtMGAM (синяя лента на фиг. 11b) позволяет связывать более длинные субстраты.Следовательно, NtMGAM предпочтительно связывает и расщепляет более короткие субстраты, тогда как CtMGAM может расщеплять более длинные субстраты. Выравнивание последовательностей с другими членами семейства Gh41 позволило идентифицировать Asp443 в NtMGAM и Asp1420 в CtMGAM как каталитические нуклеофилы. Роль общего кислотно-основного катализатора играет Asp542 в NtMAGAM и Asp1526 в CtMGAM. Оба каталитических домена MGAM имеют сигнатурную последовательность WIDMNE (Ernst et al ., 2006), окружающую каталитический нуклеофил (рис. 11 и 12).В настоящее время нет трехмерных структур MGAM, связанных с субстратами, поэтому здесь показаны структуры NtMGAM и CtMGAM, связанные с акарбозой. Выводы из этих анализов объясняют, почему все продаваемые в настоящее время антидиабетические препараты, нацеленные на MGAM, блокируют связывание субстрата, занимая -1 субсайт.
Рис. 11. Увеличенный вид домена каталитического цилиндра с остатками каталитической сигнатуры WIDMNE показан в оранжевый . По сравнению с NtMGAM, CtMGAM имеет дополнительный 21 остаток в этой области, показанной синей лентой. Каталитический нуклеофил Asp помечен красным, а кислотно-основной остаток Asp — синим. (a) NtMGAM (PDB ID 2qmj; Sim et al., 2008). (б) CtMGAM (PDB ID 3top; Ren et al., 2011)
Рис. 12. Поверхностное представление активного сайта. (a) NtMGAM (PDB ID 2qmj; Sim et al., 2008).(б) CtMGAM (PDB ID 3top; Ren et al., 2011). Акарбоза показана в виде фигурки, обозначенной цветом в зависимости от типа атома (C: зеленый; N: синий; O: красный). Подсайты сахара -1, +1 показаны фиолетовыми и синими дугами соответственно.
C. Сахараза-изомальтаза
Сукраза-изомальтаза (SI) — это гидролаза, обнаруженная в просвете кишечника, где она катализирует конечную стадию переваривания пищевых углеводов. Фермент выполняет две функции — сахарозу или гидролиз сахарозы и изомальтазу или гидролиз мальтозы (Witmer and Martínez del Rio, 2001).Конечными продуктами гидролиза SI являются простые сахара глюкоза и фруктоза. Эти моносахариды всасываются микроворсинками в эпителиальные клетки кишечника.
Фермент SI имеет цитозольный домен, трансмембранный домен (TMD), O-гликозилированный линкер (O-linker) и две гомологичные каталитические субъединицы, изомальтазу (NtSI) и сукразу (CtSI) (рис. 13, вверху). Два каталитических домена имеют 40% идентичность последовательностей, и оба способны расщеплять α- (1,4) связанные олигосахариды. NtSI обладает дополнительной активностью по расщеплению олигосахаридов, связанных с α- (1,6), в то время как CtSI обладает дополнительной активностью по расщеплению олигосахаридов, связанных с α (1,2).Обе каталитические единицы SI состоят из пяти основных структурных доменов (Jones et al. , 2011).
Рисунок 13 . Linear s — химическое представление доменной организации SI и его гидролитической активности. Источник: адаптировано из (Jones et al. , 2011).
Состав подобласти NtSI (рисунок 13, внизу) включает:
- домен типа P типа трилистника (остатки 29-80)
- N-концевой домен (остатки 81-296)
- каталитический (β / α) 8-цилиндровый домен (остатки 297-681) с двумя вариабельными вставками 1 и 2 (остатки 395-445 и 476-521 соответственно)
- проксимальный C-концевой домен (остатки 682-759)
- дистальный C-концевой домен (остатки 760-898)
Сворачивание NtSI аналогично третичной организации NtMGAM.Первый субдомен в домене NtSI представляет собой домен типа P типа трилистник, и его функция в настоящее время неизвестна. За ним следует N-концевой домен, состоящий из серии антипараллельных β-бочек; каталитический домен, состоящий из (β / α) 8 -бочкового домена; две вставленные петли; и, наконец, проксимальный и дистальный С-концевые домены, оба состоят из β-сэндвичей. Доменная организация NtSI (PDB ID 3lpo) имеет цветовую кодировку, как показано в кристаллической структуре NtSI PDB ID 3lpp; Sim и др. ., 2010, показано на фиг. 14. NtSI состоит из 898 остатков с молекулярной массой около ~ 100 кДа. Он кристаллизуется как тетрамер, но здесь для ясности показан только мономер.
Рисунок 14. Ленточное представление NtSI и его субдоменов в комплексе с коталанолом, при этом индивидуальные структурные субдомены выделены разными цветами (PDB ID 3lpp; Sim et al., 2010). Остатки активного сайта показаны в виде фигурок. Коталанол представлен в виде мяча и клюшки с цветовой кодировкой по типу атома (C: зеленый; N: синий; O: красный; S: желтый) .
Активный сайт
Активный сайт NtSI состоит из неглубокого кармана связывания субстрата только с двумя сахарными субсайтами (-1 и +1 субсайты). Невосстанавливающий конец субстрата закапывается в субплощадке -1. Расщепление субстрата каталитическим нуклеофилом (Asp) происходит между -1 и +1 субсайтами. Эти структурные детали активных сайтов дают представление о том, как домены SI развили свои сайты связывания с субстратом, чтобы приспособиться к различным связям сахара и крахмала.Все продаваемые в настоящее время антидиабетические препараты, нацеленные на MGAM и SI, блокируют связывание субстрата, занимая -1-субсайт, тем самым предотвращая доступ олигосахаридов к активному сайту. SI принадлежит к ферменту гликозидгидролаза семейства 31 (Gh41) (Jones et al. , 2011) и имеет последовательность каталитической сигнатуры WIDMNE (Ernst et al. , 2006), окружающую каталитический нуклеофил (Рисунки 15 и 16). ). Выравнивание последовательностей с другими членами семейства Gh41 позволило идентифицировать Asp472 в NtSI как каталитический нуклеофил, тогда как Asp571 играет роль кислотно-основного остатка.В настоящее время не существует трехмерных структур SI, связанных с субстратами. В следующем разделе описывается комплекс NtSI с субстратоподобным ингибитором, коталанолом. Коталанол показан в виде зеленой фигурки.
Рис. 15. Увеличенный вид домена каталитического цилиндра NtSI с остатками каталитической сигнатуры WIDMNE, показанными на рисунке оранжевый . Каталитический нуклеофил Asp помечен красным, а кислотно-основной остаток Asp — синим (PDB ID 3lpp; Sim et al., 2010). Коталанол показан в виде фигурки, обозначенной цветом в зависимости от типа атома (C: зеленый; N: синий; O: красный; S: желтый).
Рис. 16. Поверхностное представление активного сайта из NtSI (PDB ID 3lpp; Sim et al., 2010). Коталанол показан в виде фигурки, обозначенной цветом в зависимости от типа атома (C: зеленый; N: синий; O: красный; S: желтый). Подсайты сахара -1, +1 показаны фиолетовыми и синими дугами соответственно.
3. Фармакологические последствия
Альфа-амилазы и альфа-глюкозидазы — ключевые ферменты в пути переваривания углеводов, приводящие к высвобождению мономерных молекул глюкозы, которые всасываются в кровь.Это приводит к повышению уровня глюкозы в крови после приема пищи. Подавление действия таких ферментов может значительно снизить уровень глюкозы после приема пищи при диабете 2 типа. HPA и другие глюкозидазы в пути переваривания крахмала представляют собой привлекательные мишени для лечения высокого уровня глюкозы в крови при диабете 2 типа.
4. Сравнение целей
Ферменты альфа-глюкозидазы, мальтозоглюкоамилазы (MGAM) и сахаразы-изомальтазы (SI) работают одновременно, катализируя последнюю стадию распада крахмала на простые молекулы сахара (Sim et al., 2008). Интересно, что как ферменты MGAM, так и SI имеют дублированные каталитические домены (фиг. 17) — N-концевые (NtMGAM, NtSI) и C-концевые (CtMGAM и CtSI). Секвенирование гена MGAM человека показало, что MGAM и SI имеют тесную эволюционную взаимосвязь (~ 40-60% сходства аминокислотной последовательности), что позволяет предположить, что эти два фермента эволюционировали путем дублирования уже тандемно дублированного гена (Sim et al 2008 г.). Две N-концевые каталитические единицы, NtMGAM и NtSI, имеют 60% идентичности последовательностей, как и две С-концевые каталитические единицы, CtMGAM и CtSI.С другой стороны, идентичность последовательностей между двумя каталитическими единицами каждого отдельного белка (NtMGAM против CtMGAM и NtSI против CtSI) составляет 40% (фиг. 17).
Рисунок 17: Схематическое изображение белковой организации MGAM и SI и их гидролитической активности. Источник: адаптировано из (Jones, et al. 2011).
Все четыре каталитических домена принадлежат к семейству гликозидгидролаз 31 (Gh41) (Jones et al. , 2011) и имеют характерную последовательность каталитической сигнатуры WIDMNE (Ernst et al., 2006). Эти домены демонстрируют перекрывающиеся субстратные активности и специфичности. И MGAM, и SI обладают активностью против α- (1,4) связанных олигосахаридов. NtSI обладает дополнительной активностью против олигосахаридов, связанных с α- (1,6), тогда как CtSI обладает дополнительной активностью против олигосахаридов, связанных с α- (1,2). На рис. 17 представлена гидролитическая активность этих ферментов. Было высказано предположение, что избыточная каталитическая активность, связанная с α- (1,4), обусловлена соотношением α- (1,4) и α- (1,6) гликозидных связей в крахмале 19: 1.
Исследование структур HPA, MGAM и SI позволяет предположить, что каталитический механизм всех этих ферментов схож. Они осуществляют катализ в два этапа — на первом этапе образуется ковалентный гликозил-ферментный промежуточный продукт, которому помогают две боковые цепи, содержащие карбоновые кислоты, известные как каталитический нуклеофил и кислотно-основной катализатор. На втором этапе происходит гидролиз промежуточного гликозил-фермента с высвобождением мономерной глюкозы. Схематическое изображение реакции, катализируемой HPA, MGAM и SI с целью разрыва связей α- (1,4) в олигоглюканах, показано на Фигуре 18 (Bras et al., 2018).
Рис. 18. Упрощенное представление реакции, катализируемой HPA (адаптировано из Bras et al. 2018)
Сводка характерных особенностей обсуждаемых здесь глюкозидаз представлена в таблице 2:
| Альфа-амилаза | Альфа-глюкозидаза | ||||
| Название фермента | Альфа-амилаза слюны | Панкреатическая альфа-амилаза (HPA) | MGAM, N- и C-концевые домены | N-концевой домен SI | C-концевой домен SI |
| Присутствует в | устье | кишечник | кишечник | кишечник | кишечник |
| Подложка | длинные крахмальные цепи, содержащие три или более α- (1,4) связанных звена D-глюкозы | более короткие цепи крахмала, содержащие α- (1,4) связи | более короткие цепи крахмала, содержащие как α- (1,4), так и α- (1,6) связи | более короткие цепи крахмала, содержащие как α- (1,4), так и α- (1,2) связи | |
| Раскол | эндо α- (1,4) связи в крахмальных цепях из 3 или более единиц D-глюкозы | Концевые невосстанавливающие α- (1,4) связи в крахмале | как α- (1,4), так и α- (1,6) связи в крахмале | и α- (1,4), и α- (1,2) связи в крахмале | |
| Продукты | более короткие цепочки из крахмала | линейных α- (1,4) и разветвленных α- (1,6) полимерных сахаров, таких как мальтоза, мальтотриоза, олигомеры глюкозы, α-предельный декстрин | глюкоза | глюкоза | глюкоза и фруктоза |
| Семейство ферментов | Семейство гликозидгидролаз 13 | Семейство гликозидгидролаз 31 | |||
| Каталитический нуклеофил | аспартат | Аспартат | |||
| Каталитический донор протонов | Глутамат | Аспартат | |||
Таблица 2: Сводная таблица альфа-амилаз и альфа-глюкозидаз человека, участвующих в переваривании углеводов
.

 Diabetologia 1999; 42: 654–74.
Diabetologia 1999; 42: 654–74.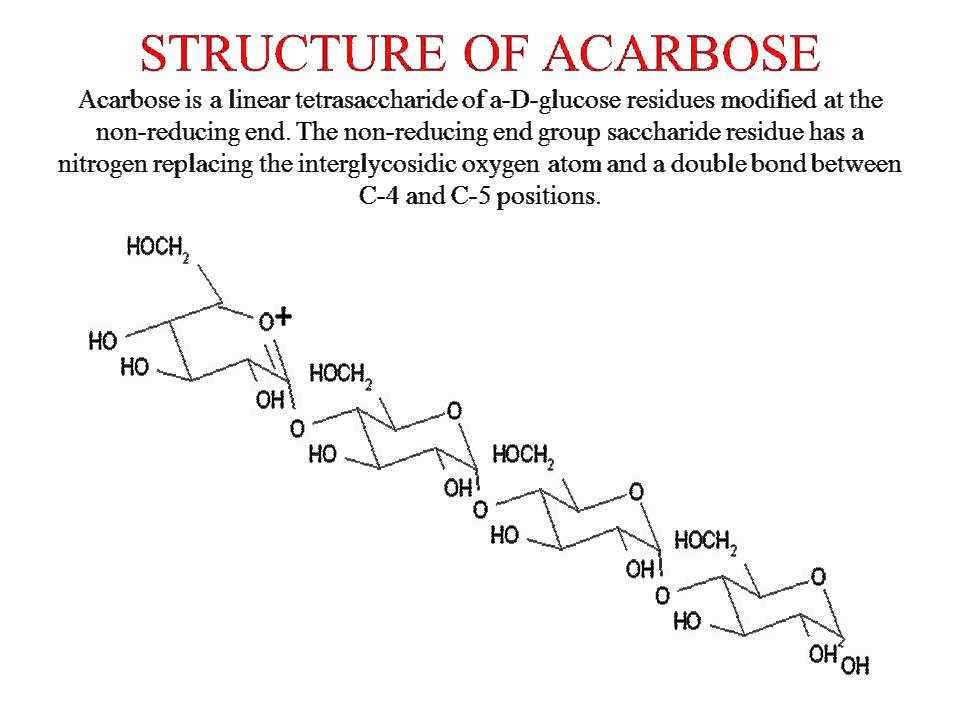
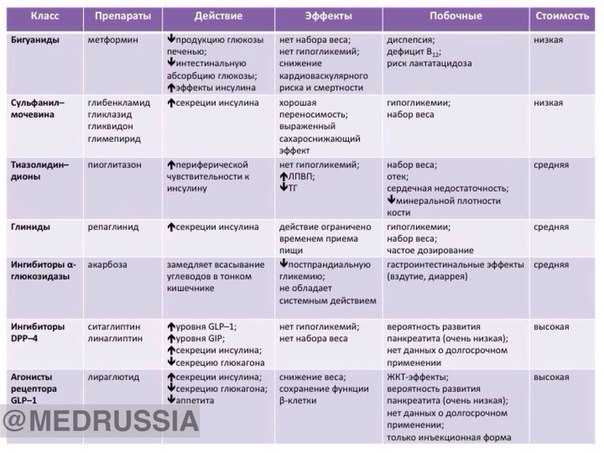 Артериал. гипертензия. 8 (1):
Артериал. гипертензия. 8 (1): Артериал. гипертензия. 2003; 9 (2):
Артериал. гипертензия. 2003; 9 (2): Препараты этой группы оказывают действие на гликемию после еды, однако в отличие от секретогогов не вызывают увеличения секреции инсулина.
Препараты этой группы оказывают действие на гликемию после еды, однако в отличие от секретогогов не вызывают увеличения секреции инсулина.