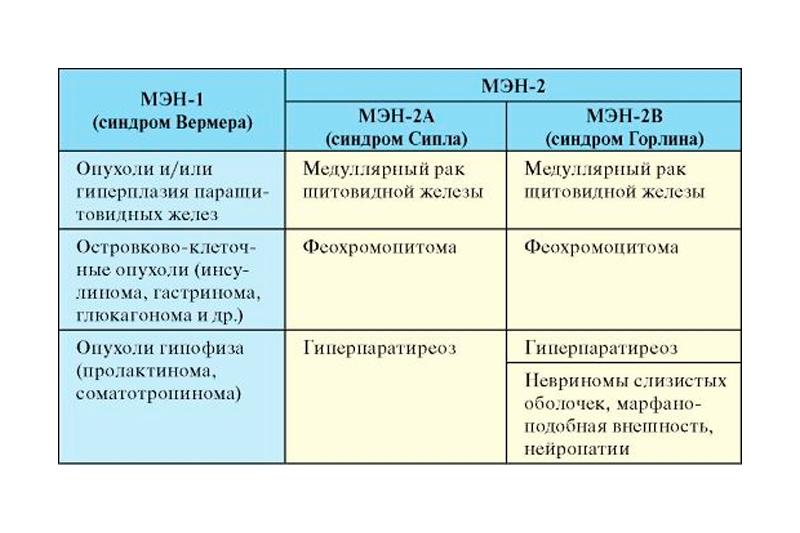
Синдром множественных эндокринных неоплазий 2-го типа
МЭН-2А (синдром Сиппла) — аутосомно-доминантно наследуемое сочетание медуллярного рака щитовидной железы, феохромоцитомы и гиперпаратиреоза. При синдроме МЭН-2В к указанным компонентам добавляются невриномы слизистых оболочек, патология мышц и скелета (марфаноподобная внешность) и нейропатии (табл. 1).
Таблица 1
Синдром МЭН-2
|
Этиология и патогенез
|
Аутосомно-доминантное наследование мутации RET-протоонкогена на хромосоме 10р11.2
|
|
Эпидемиология
|
Распространенность 1 — 10 случаев на 100 тысяч населения
|
|
Основные клинические проявления
|
Медуллярный рак щитовидной железы, феохромоцитома, гиперпаратиреоз. При МЭН-2В, кроме того, невриномы слизистых оболочек, марфаноподобная внешность
|
|
Диагностика
|
Как при спорадических опухолях, семейный и генетический скрининг
|
|
Дифференциальная диагностика
|
Как при спорадических опухолях
|
|
Лечение
|
Начинается с удаления феохромоцитомы; в остальном — как при спорадических опухолях
|
|
Прогноз
|
Определяется медуллярным раком щитовидной железы и феохромоиигомой; наихудший при МЭН-2В
|
Этиология и патогенез
Развитие синдрома МЭН-2 связано с мутациями RET-протоонкогена, который локализован на хромосоме 10 (регион 10р11.2) и кодирует поверхностный мембранный гликопротеид, относящийся к семейству рецептора тирозинкиназы. Мутации RET-протоонкогена выявлены у 90% пациентов с синдромом МЭН-2. Тип мутации в значительной степени взаимосвязан с различными вариантами фенотипа синдрома МЭН-2. При МЭН-2А и семейной форме медуллярного рака щитовидной железы (МРЩЖ) выявляются миссенс-мутации, приводящие к замене аминокислот в экзонах экстрацеллюлярного домена кодируемого белка. При МЭН-2В практически всегда выявляется мутация в 918-м кодоне 16-го экзона. Мутации RET-протоонкогена приводят к его активации, что в свою очередь обусловливает активацию клеточного роста, которая может закончиться опухолевой трансформацией.
Эпидемиология
Является редкой эндокринной патологией’ распространенность 1—10 случаев на 100 тысяч населения.
Клинические проявления
1. Медуллярный рак щитовидной железы (МРЩЖ) — опухоль парафолликулярных клеток щитовидной железы, основным продуктом секреции которой является кальцитонин. Клиническая картина МРЩЖ бедна, и симптоматика либо вообще отсутствует, либо (в 1/3 случаев) в поздних стадиях проявляется диареей и/или карциноидным синдромом, поскольку МРЩЖ обладает способностью к продукции вазоактивных пептидов (простагландины, серотонин, гистамин). Очень редко МРЩЖ продуцирует АКТГ с развитием синдрома Кушинга. Чаще всего диагноз МРЩЖ устанавливается при обследовании по поводу узлового зоба.
2. Феохромоцитома выявляется у половины больных, чаще уже после манифестации МРЩЖ. В типичном случае опухоль двусторонняя (70 %). Частота экстраадреналовых и злокачественных вариантов ниже, чем при спорадических феохромоцитомах.
3. Первичный гиперпаратиреоз.
4. При синдроме МЭН-2В, кроме того, развивается патология опорно-двигательного аппарата (марфаноидная внешность, искривления позвоночника и грудной клетки, конская стопа, вывихи головок бедер, арахнодактилия), невриномы слизистых оболочек (видны на губах, щеках, языке, но могут поражать весь ЖКТ; представляют собой бело-розовые безболезненные узелки размером 1—3 мм), удлиненное лицо с чертами прогнатизма, значительное утолщение губ.
Диагностика
1. Диагностика отдельных компонентов МЭН-2, которая строится на принципах, описанных для отдельных заболеваний.
2. Семейный скрининг:
- пентагастриновый тест (или тест с глюконатом кальция), определение уровня метанефринов и кальция проводится ежегодно родственникам первой и второй степени родства в возрасте от 6 до 50 лет;
- генетический скрининг с целью ранней диагностики МРЩЖ: По наличию или отсутствию мутации RET-протоонкогена пациенты подразделяются на 3 группы:
— обнаружение мутации RET-протоонкогена в лейкоцитах периферической крови указывает на то, что в данном случае МРЩЖ имеет место в рамках МЭН-2 или является семейным;
— отсутствие мутации RET-протоонкогена в периферических лейкоцитах и ее наличие в самой опухоли свидетельствует о соматической мутации и, таким образом, о спорадической форме МРЩЖ;
— отсутствие мутации в самой опухоли и лейкоцитах не позволяет сделать никакого заключения.
Родственники больных 1-й группы имеют наибольший потенциальный риск, и в этой ситуации ставится вопрос о профилактической экстирпации щитовидной железы. При отсутствии у пациентов 2-й группы признаков феохромоцитомы и гиперпаратиреоза нет необходимости в обследовании родственников. Обследование родственников больных 3-й группы обязательно.
Дифференциальная диагностика
Строится на принципах, описанных для спорадических опухолей.
Лечение
Лечение при синдроме начинается с удаления феохромоцитомы. При любом варианте МРЩЖ обязательна экстирпация щитовидной железы с систематическим удалением шейных лимфатических узлов и клетчатки. При радикально проведенной операции необходимо пожизненное наблюдение за пациентом, включающее определение уровня кальцитонина и проведение пентагастринового теста или теста с глюконатом кальция.
Прогноз
Прогноз при синдроме МЭН-2 значительно хуже, чем при других вариантах МЭН, поскольку он определяется такими заболеваниями, как медуллярный рак щитовидной железы и феохромоцитома. Пятилетняя выживаемость при МРЩЖ колеблется от 40 до 80 %. Наихудший прогноз при МРЩЖ в рамках МЭН-2В.
Дедов И.И., Мельниченко Г.А., Фадеев В.Ф.
Эндокринология
Опубликовал Константин Моканов
Синдром множественной эндокринной неоплазии типа II (МЭН 2): причины, симптомы, лечение, признаки
Главным признаком МЭН 2 является сочетание МРЩЖ и феохромоцитомы. Выделяют два основных клинических варианта МЭН 2.
Клинические варианты множественных эндокринных неоплазий 2-го типа
| Вариант | Характеристика |
|---|---|
|
МЭН 2А (синдром Сиппла):
— МЭН 2А с кожным амилоидозом;
— МЭН 2А с болезнью Гиршпрунга
|
МРЩЖ.
Феохромоцитома.
Первичный гиперпаратиреоз.
То же + зудящий дерматоз спины.
То же + мегаколон
|
| МЭН 2Б (синдром Горлина) |
МРЩЖ.
Феохромоцитома.
Ганглионейроматоз слизистых оболочек.
Марфаноидная внешность
|
Распространенность синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Заболевание диагностируется с частотой 1:30 000, поражает мужчин и женщин одинаково. Синдром МЭН 2Б встречается в 15 раз реже, чем МЭН 2А.
Причина синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Причиной всех вариантов МЭН 2 является врожденная активирующая мутация гена, кодирующего гликопротеид семейства тирозинкиназы, получившего наименование ret. RET-протоонкоген расположен на длинном плече 10-й хромосомы. Мутация конкретного кодона RET-протоонкогена с высокой достоверностью определяет клиническую картину заболевания, что коренным образом отличает его от МЭН 1.
МРЩЖ выявляется у 90% больных с впервые выявленным МЭН 2 и в большинстве случаев определяет его прогноз. Как и при спорадических формах, он развивается из парафолликулярных или С-клеток, но очень часто проявляется уже в детском и даже младенческом возрасте (при МЭН 2В) и часто бывает мультифокальным. Заболевание в течение нескольких лет может протекать латентно и выявляться случайно в виде пальпируемого узла в ЩЖ, но к этому сроку многие пациенты уже имеют метастазы. Опухоль выделяет в кровь большое количество кальцитонина, что позволяет легко ее диагностировать. В сомнительных случаях используется проба со стимуляцией пентагастрином. Высокий уровень кальцитонина, как правило, не имеет клинических проявлений. Вопрос о тактике лечения МРЩЖ неразрывно связан с генетическим тестированием (см. ниже).
Феохромоцитома диагностируется у 50% больных МЭН 2. По сравнению со спорадическими хромаффинными опухолями, ее характеризует возникновение в более раннем возрасте, высокая вероятность двустороннего или множественного поражения и меньшая выраженность клинической картины. При выявлении одновременно феохромоцитомы и МРЩЖ операция по поводу феохромоцитомы должна быть выполнена в первую очередь.
Первичный гиперпаратиреоз развивается у 20—30% больных МЭН 2А, протекает более доброкачественно, чем у больных МЭН 1, преобладают бессимптомные или стертые формы. При диагностике и лечении применяются те же подходы, что и у пациентов с МЭН 1. Если в ходе операции по поводу МРЩЖ у больного без клинических и лабораторных признаков гиперпаратиреоза обнаруживается одна или несколько аденом паращитовидных желез, они также должны удаляться.
Лечение и наблюдение синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Основным фактором, определяющим прогноз больных МЭН 2, является МРЩЖ, и единственным радикальным методом его лечения является тиреоидэктомия с центральной лимфодиссекцией, так как пациенты с клиническими или лабораторными признаками заболевания зачастую уже имеют метастазы. Хирургическая тактика определяется результатами генетического исследования. К рентгеновскому и другим видам облучения данная опухоль малочувствительна. В настоящее время появилась возможность эффективной таргетной химиотерапии нерезектабельных и метастатических форм МРЩЖ препаратом вандетаниб (капрелса), однако эффективность лечения требует дальнейшего изучения.
Генетическому скринингу должны подвергаться все пациенты с клиническим подозрением на МЭН 2, прямые родственники больных с генетически подтвержденным МЭН 2 и больные со спорадическими МРЩЖ или феохромоцитомой.
В зависимости от типа выявленной мутации, у ребенка тиреоидэктомия с удалением центральных лимфоузлов шеи может выполняться в течение первых 6 мес жизни, а желательно — даже через месяц после рождения. В более благоприятных случаях показано ее выполнение до возраста 5 или 10 лет. Взрослым пациентам без отдаленных метастазов тотальная тиреоидэктомия должна выполняться в кратчайшие сроки. Радикальность операции контролируется с помощью пентагастринового теста, при положительном результате возможно эффективное повторное вмешательство.
Ежегодный биохимический скрининг на предмет МРЩЖ показан всем больным МЭН 2 как до, так и после хирургического лечения. Скрининг феохромоцитомы должен начинаться сразу после тиреоидэктомии и включает ежегодные лабораторные исследования и КТ надпочечников каждые 3—5 лет.
Прогноз синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Пятилетняя выживаемость при МЭН 2 колеблется от 40 до 80%.
Помимо классических синдромов МЭН, множественные новообразования из эндокринных желез наблюдаются при некоторых редких наследственных заболеваниях (болезнь Ван Хиппеля—Линдау, комплекс Карнея, синдром Пейц—Йегерса).
Синдром множественной эндокринной неоплазии типа II (МЭН 2): причины, симптомы, лечение, признаки
Этот синдром разделяют на два подтипа: МЭН 2А (синдром Сиппла) и МЭН 2Б. Оба этих синдрома включают МРЩЖ и феохромоцитому, но МЭН 2А — еще и гиперпаратиреоз, тогда как для МЭН 2Б характерен ряд дополнительных соматических проявлений, но не гиперпаратиреоз. Пенетрантность МЭН 2 превышает 80%.
При обоих синдромах МЭН 2 МРЩЖ возникает чаще и раньше других признаков. Вероятность его развития на протяжении жизни больного составляет 80-100%. Предраковые изменения проявляются гиперплазией парафолликулярных клеток щитовидной железы, продуцирующих кальцитонин. Опухоль характеризуется мультицентрическим ростом и обычно локализуется в верхней трети долей щитовидной железы (где С-клеток много и в норме).
Почти четверть всех МРЩЖ имеет наследственную природу. Примерно 45% таких случаев приходится на МЭН ПА, 50% — на изолированную семейную форму МРЩЖ и 5% — на МЭН ПБ. У больных с МЭН 2Б МРЩЖ обычно возникает раньше (часто до 5-летнего возраста) и прогрессирует быстрее, чем в других случаях.
Биохимические проявления (и диагноз) зависят в основном от продукции кальцитонина гиперплазированными С-клетками, которые реагируют на инфузию пентагастрина или кальция резким выбросом этого гормона. Злокачественную природу опухоли подтверждает иммуногистохимическое окрашивание плохо дифференцированной ткани на кальцитонин. Отличительной особенностью таких опухолей являются также внеклеточные отложения амилоида. Это вещество окрашивается антителами к кальцитонину, что свидетельствует о присутствии в нем агрегатов гормона, выделяемого опухолевыми клетками. МРЩЖ постепенно распространяется по всему органу, проникая в регионарные лимфоузлы и метастазируя в печень, легкие и кости.
Примерно у 50% больных с МЭН 2 развиваются феохромоцитомы. Обычно они локализуются в надпочечниках, часто бывают двусторонними, но редко — злокачественными. Они проявляются типичными клиническими симптомами и признаками (артериальной гипертонией, головной болью, сердцебиениями, потливостью) и диагностируются по повышенному уровню катехоламинов и их метаболитов в плазме или моче. Объемные образования в надпочечниках обнаруживают с помощью лучевых методов. Как и в случае МРЩЖ, развитию феохромоцитомы при МЭН 2 предшествует гиперплазия мозгового вещества надпочечников. Однако, в отличие от гиперплазии С-клеток щитовидной железы, предопухолевую стадию патологии надпочечников трудно диагностировать с помощью биохимических исследований.
Гиперпаратиреоз при МЭН 2 (как и при МЭН I) обусловлен гиперплазией околощитовидных желез. Он встречается примерно у 25% больных с МЭН 2А и гораздо реже — при МЭН 2Б. По своему течению он сходен со спорадическим гиперпаратиреозом (т.е. менее агрессивен, чем при МЭН I) и успешно лечится хирургически.
МЭН 2 характеризуется и другими фенотипическими особенностями, в частности папулезным амилоидозом кожи (зудящими и сливающимися эритематозными высыпаниями), который часто предшествует развитию МРЩЖ. Амилоид в этих папулах образуется из кератина, а не из кальцитонина. Патогенез этих кожных поражений неизвестен, но они чаще наблюдаются при определенных мутациях гена MEN2 [особенно приводящих к замене цистеина (Цис634) в белковом продукте на тирозин (Тир)]. Второй вариант МЭН 2А, изолированный семейный МРЩЖ, ассоциируется с болезнью Гиршспрунга (врожденным мегаколоном), которая наиболее часто обнаруживается при мутациях гена RET, приводящих к заменам Цис в позициях 609, 615 и 620. Ганглионевромы кишечника, невромы слизистых, марфоноидная внешность и утолщение нервов роговицы при МЭН 2Б связаны, по-видимому, с исходным генетическим дефектом. Поражения кишечника могут нарушать перистальтику, приводя к периодическим тяжелым запорам и поносам.
Причины и патогенез синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Патогенез синдромов МЭН 2 изучен достаточно подробно. Анализ сцепления позволил локализовать дефектные гены при МЭН 2А, МЭН 2Б и изолированном семейном МРЩЖ в перицентромерной области хромосомы 10. В дальнейшем выяснилось, что дефектный ген близок или идентичен протоонкогену RET. Белок RET содержит один трансмембранный домен, обладает тирозинкиназной активностью и является частью рецептора нейротропного фактора глиального происхождения (GDNF). Этот рецептор (GDNFRα-1) представляет собой мембранный белок (соединенный с гликозилфосфатидилинозитолом), лигандами которого, кроме GDNF, являются также неуртурин, персефин и артемин. Наиболее отличительная особенность его структуры заключается в присутствии большого числа остатков Цис во внеклеточной части RET непосредственно перед трансмембранным сегментом. Принято считать, что в норме этот участок ингибирует внутриклеточный тирозинкиназный домен RET. Внеклеточная часть RET содержит также кадхериноподобный домен. RET синтезируется в различных клетках, происходящих из нервного гребня, и, по-видимому, играет важную роль в процессе развития. У мышей нокаут гена RET обусловливает отсутствие межмышечных ганглиев в подслизистом слое тонкой и толстой кишки, а также различные аномалии мочеполового тракта.
Мутации гена RET у больных с МЭН 2А приводят к заменам остатков Цис, сконцентрированных во внеклеточной примембранной части RET и кодируемых последовательностями 10-го и 11-го экзонов. Одни из таких дефектов являются миссенс-мутациями, тогда как другие — небольшими делециями или вставками, но во всех случаях они затрагивают те или иные вышеупомянутые остатки Цис. На долю этих дефектов приходится более 97% всех мутаций гена RET, ассоциированных с МЭН 2А. Чаще всего (в 84% случаев) происходит замена Цис634 на аргинин (Apr), фенилаланин (Фен), серии (Сер), глицин (Гли), тирозин (Тир) или триптофан (Трп). Замена Цис634 на Apr ассоциирована с развитием гиперпаратиреоза, а на любую другую из перечисленных аминокислот — с развитием феохромоцитомы. На долю замены Цис634 на Apr приходится 64% всех изменений данного кодона. Интересно, что вставка из четырех аминокислот между Цис634 и Apr635 обусловливает МРЩЖ и высокую частоту гиперпаратиреоза, но не феохромоцитомы.
Парадоксально, что у больных с изолированным семейным МРЩЖ имеются многие из тех же мутаций, которые характерны для МЭН 2А. По-видимому, при этом заболевании какие-то факторы ограничивают сферу действия мутаций RET только парафолликулярными клетками щитовидной железы. Помимо замены Цис634 на Apr, при изолированном семейном МРЩЖ обнаруживаются и другие мутации, более специфичные для этого заболевания. Замена Цис634 обладает большим трансформирующим клетки потенциалом, чем замены других аминокислот. Действительно, в 60% случаев изолированного семейного МРЩЖ мутации RET не затрагивают Цис и ассоциированы с поздней трансформацией С-клеток щитовидной железы. Однако другие клинические проявления (размеры опухоли, двусторонность поражения и частота метастазов в лимфоузлы) при мутациях, затрагивающих и не затрагивающих Цис, одинаковы.
В отличие от МЭН 2А и изолированного семейного МРЩЖ, при МЭН 2Б мутации, затрагивающие Цис, отсутствуют. Более чем в 95% случаев МЭН ПБ находят замену Мет918 на треонин (Тре). У некоторых больных обнаружены иные дефекты — замены Ала883 на Фен и Сер922 на Тир, а также моно-аллельные замены Вал804 на Мет и Сер904 на Цис. Примерно в 50% случаев МЭН 2Б развивается вследствие мутаций de novo. По каким-то причинам эти мутации обнаруживаются почти исключительно в отцовском аллеле гена.
В 30-40% случаев спорадического МРЩЖ и около 10% случаев спорадической феохромоцитомы находят соматические мутации, идентичные зародышевым мутациям при МЭН ПА и изолированном семейном МРЩЖ, а также типичную для МЭН 2Б замену Мет918. Такие мутации практически никогда не встречаются при спорадическом гиперпаратиреозе. Замена Мет918 в белке RET ассоциируется с особенно неблагоприятным клиническим исходом спорадического МРЩЖ.
Обнаружено тесное сцепление локуса RET с болезнью Гиршспрунга, характеризующейся нарушением развития межмышечных ганглиев задней кишки. В тяжелых случаях это приводит к мегаколону (фенотип, сходный с таковым у мышей с нокаутом гена RET). У больных из семей с болезнью Гиршспрунга находят множество мутаций, нарушающих строение как внутри-, так и внеклеточного домена RET. Некоторые из них (например, делеций) препятствуют экспрессии гена. Наряду с данными, полученными на мышах с нокаутом RET, это позволяет считать болезнь Гиршспрунга следствием полного выпадения его функции («нулевым фенотипом»). Интересно, что у некоторых больных имеются проявления как МЭН 2, так и болезни Гиршспрунга. Обнаруживаемые в этих случаях мутации RET обусловливают замены Цис на Apr в позициях 609, 618 или 620. Это не только способствует димеризации RET и повышению его тирозинкиназной активности, но, по-видимому, нарушает и его транспорт в клеточную мембрану. Можно предположить, что преобладание того или иного механизма в разных клетках приводит либо к активации (как при МЭН 2), либо к супрессии RET (как при болезни Гиршспрунга).
При МЭН 2А активность RET возрастает, вероятно, вследствие устранения ингибирующего влияния цистеинов его внеклеточного домена, что способствует димеризации RET, аутофосфорилированию и тем самым повышает его тирозинкиназную активность. При МЭН 2Б изменяется, по-видимому, субстратная специфичность тирозинкиназы RET, что и определяет данный фенотип. Кроме обычных субстратов (сходных с субстратами эпидермального фактора роста), она фосфорилирует и те белки, которые в норме фосфорилируются цитоплазматическими тирозинкиназами семейства Src и Аb и участвуют в сигнальных путях регуляции клеточного роста. Таким образом, одного лишь изменения субстратной специфичности тирозинкиназы мутантного RET при МЭН 2Б достаточно для усиления митогенного стимула. Кроме того, RET при МЭН 2Б активнее, чем при МЭН ПА, фосфорилирует Тир1062, который служит местом связывания (докингсайтом) многих эффекторных белков, включая She и фосфатидилинозитол-3-киназу. Это означает, что RET при МЭН 2Б сильнее активирует последующие звенья сигнальных путей в клетке, чем при МЭН ПА и изолированном семейном МРЩЖ.
Обследование синдрома множественной эндокринной неоплазии типа II (МЭН 2)
Для выявления конкретных мутаций гена RET при МЭН 2А, МЭН 2Б и изолированном семейном МРЩЖ используют полимеразную цепную реакцию (ПЦР). В основе 95% случаев МЭН 2 лежат известные мутации этого гена (например, для МЭН 2А наиболее характерна мутация, ведущая к замене Цис634 на Apr). У больных с отсутствием любых известных мутаций можно проводить анализ гаплотипа (при наличии информативных генетических маркеров и других больных в данной семье).
Поскольку семейный МРЩЖ часто проявляется как спорадический, и почти 6% больных со спорадическим МРЩЖ являются носителями зародышевых мутаций RET, генетический анализ следует, вероятно, проводить у всех больных с этой опухолью. Согласно имеющимся данным, у 40% носителей таких мутаций МРЩЖ не проявляется клинически до 70-летнего возраста. Исходя из этого некоторые авторы предлагали ежегодно обследовать этих больных и проводить тиреоидэктомию только при появлении клинических или биохимических (проба с пентагастрином) признаков МРЩЖ. Исключение могли бы составлять больные с МЭН 2Б или особенно агрессивными формами изолированного семейного МРЩЖ (которым профилактическая тиреоидэктомия показана независимо от появления симптомов или биохимических признаков заболевания).
Однако большинство авторов рекомендуют выполнять тиреоидэктомию у всех носителей мутаций RET, ассоциированных с МЭН 2. Эта точка зрения учитывает высокую общую пенетрантность МРЩЖ, которая (включая клинические и доклинические стадии болезни) близка к 100%, чувствительность и специфичность генетического анализа (с использованием ПЦР), трудности длительного наблюдения за больными и частых повторных биохимических исследований, а также возможность ложноотрицательных и ложноположительных результатов пробы с пентагастрином. В пользу такого подхода свидетельствует ряд клинических данных, согласно которым в удаленной ткани щитовидной железы у больных с генетическим дефектом, но нормальными результатами пробы с пентагстрином, обнаруживается гиперплазия С-клеток и ранние стадии МРЩЖ. Все это говорит о несостоятельности возражений против ранней операции, позволяющей надежно предотвратить развитие МРЩЖ.
Лечение синдрома множественной эндокринной неоплазии типа II (МЭН 2)
При наследственном МРЩЖ необходима тотальная тиреоидэктомия с иссечением лимфоузлов, поскольку менее радикальный подход (вследствие мультицентрического роста опухоли) грозит рецидивом заболевания. Полноту операции проверяют, определяя базальный и стимулированный уровень кальцитонина в сыворотке. Большинство клиницистов считают, что операцию нужно проводить сразу же после выявления у больного генетического дефекта. При МЭН 2Б тиреоидэктомию обычно проводят до 6-месячного, а при МЭН 2А — до 5-летнего возраста. У больных с МЭН 2Б, оперированных на первом году жизни, в удаленной ткани очень часто находят микроскопические очаги МРЩЖ, а иногда и его метастазы. Перед операцией на шее всех больных необходимо проверять на наличие феохромоцитомы. При метастазах МРЩЖ операция имеет целью не излечение больного, а лишь уменьшение массы опухолевой ткани. Локализацию очагов рака выясняют с помощью МРТ или селективной катетеризации вен с последующим определением кальцитонина в пробах крови. Лучевая и химиотерапия малоэффективны, и к этим видам лечения прибегают в основном лишь при запущенных стадиях болезни.
Лечение феохромоцитомы при МЭН 2 не отличается от такового у больных со спорадическими опухолями. Перед хирургической резекцией опухоли используют α- (а иногда и β-) блока-торы для купирования артериальной гипертонии, а также нормализуют внутрисосудистый объем. Учитывая частое поражение обоих надпочечников в таких случаях, некоторые авторы рекомендуют сразу проводить двустороннюю адреналэктомию. Однако двусторонние феохромоцитомы встречаются далеко не у всех больных; кроме того, эти опухоли редко бывают злокачественными. Поэтому большинство считает оправданным удаление при первой операции только увеличенного надпочечника с последующим пристальным наблюдением за больным, чтобы не пропустить развития опухоли во второй железе. Такой подход избавляет многих больных от постоянной надпочечниковой недостаточности, сопряженной с опасностью для жизни.
причины, симптомы, диагностика и лечение
Синдром множественных эндокринных неоплазий — это группа патологий наследственного характера, при которой развиваются новообразования или гиперпластические изменения эндокринных желез. Совокупность клинических проявлений эндокринных изменений зависит от типа данного синдрома: при МЭН 1 поражаются поджелудочная железа, паращитовидные железы и передняя доля гипофиза; в случае развития МЭН 2А типа — надпочечники и щитовидная железа; при 2В типе МЭН — надпочечники, щитовидная железа, паращитовидные железы и слизистые оболочки. Подразделение типажей является достаточно условным, поскольку они часто пересекаются. Неоплазии могут проявляться
Содержание статьи:
Множественные эндокринные неоплазии 1 типа
Характеристика МЭН 1 типа
Совокупность патологических процессов, поражающих переднюю долю гипофиза, паращитовидные железы и поджелудочную железу носят название синдрома Вермера, исходя из имени автора, который впервые описал данное заболевание в 1954г. Чаще всего развивается гиперпаратиреоз — у 90% больных, функционально активные аденомы поджелудочной железы — у 80% случаев и аденомы гипофиза — в 65% случаев. Выделяют спорадические и наследственные формы МЭН 1. Поражения щитовидной железы могут быть в виде коллоидного зоба, аденомы, тиреоидного рака, хронического лимфоцитарного тиреоидита или тиреотоксикоза. Патологические изменения надпочечников обычно представлены аденомами или гиперплазией. Реже встречаются полипы желудка, липомы, опухоли яичек, рак легкого.
Причины МЭН 1 типа
Основная масса случаев развития МЭН 1 типа — это генетически детерминированные патологии, имеющие аутосомно-доминантный тип наследования. Ученые считают, что МЭН 1 типа имеет прямую взаимосвязь с наследованием локуса IIqI3 на XI хромосоме. Для наследственной формы свойственны мутации как в соматических, так и в герминативных клетках, для спорадической — исключительно в соматических. Существует вероятность развития неоплазий нейроэктодермальных клеток, что дает возможность предположения наличия патогенетической связи родственных эктопических гормональных синдромов с МЭН-синдромами.
Очень часто при множественных эндокринных неоплазиях 1 типа нет одновременного проявления всех признаков.
Симптомы МЭН 1 типа
Первым из симптомов множественных эндокринных неоплазий является гиперпаратиреоз, который, как правило, проявляет первые признаки в возрасте около 25-30 лет. На раннем этапе пациенты ощущают тошноту, снижение аппетита, запоры, снижение веса, в некоторых случаях — почечные колики, спровоцированные отложением мелких конкрементов и солей. По мере нарастания симптомов отмечается мышечная слабость проксимальных отделов конечностей, ухудшение памяти, болевые ощущения в костях, полидипсия, полиурия и депрессивные состояния. Иногда при гиперпаратиреозе, развившемся на фоне МЭН 1, возникают судороги и коматозные состояния.
По сравнению с первичным гипапаратериозом, гипапаратериоз при МЭН 1, имеет достаточно мягкое течение. В редких случаях развивается ободковый кератит, кальцификация ушных раковин, хондрокальциноз и др. Множественным эндокринным неоплазиям 1 типа достаточно свойственно явление компрессионных переломов позвонков и остеопороза.
Виды аденом гипофиза при МЭН 1
При МЭН 1 типа аденомы гипофиза могут быть представлены такими видами: соматотропиномами, пролактиномами, кортикотропиномами. Пролактиномы могут стать причиной гиперпролактинемического гипогонадизма, клиническим проявлением которого является галакторея, дисменорея, женское бесплодие и гинекомастии у мужчин. Кортикотропиномы провоцируют развитие болезни Иценко-Кушинга, иногда могут стать причиной гипопитуитаризма. Наличие соматотропиномы приводит к развитию акромегалии, миастении, снижению памяти и часто сопровождается он головными болями.
Среди множественных эндокринных неоплазий 1 типа, поражающих поджелудочную железу, чаще всего встречаются випомы, гастриномы и инсулиномы, реже — соматостатиномы и глюкагономы и др.
Часто инсулиномы имеют множественный характер. Злокачественные инсулиномы встречаются в 3-6% случаев. Клиническим признаком инсулиномы является развитие гипогликемического синдрома. После инсулиномы второй по частоте опухолью поджелудочной железы при синдроме МЭН 1, выступает гастринома. Гастриномы проявляются развитием синдрома Золлингера-Эллисона. Випома относится к числу гормонально-активных опухолей АПУД-системы, которая производит гиперсекрецию вазоактивного интестинального полипептида и вызывает интермиттирующую или постоянную диарею, гипотонию, стеаторею, обезвоживание и кожные высыпания.
Диагностика МЭН 1 типа
Диагноз МЭН 1 типа считается достоверным при наличии не менее 2-х составляющих данного синдрома.
Лабораторная диагностика может выявить гипофосфатемию, увеличение количественного показателя ионизированного кальция, повышение уровня инсулина, гастрина, СТГ, пролактина, паратиреоидного гормона и др. Топическая диагностика новообразований эндокринных желез подразумевает выполнение ЯМР-томографии паращитовидных желез, УЗИ, селективную артериографию, сцинтиографию, МРТ головного мозга, рентгенографию или КТ турецкого седла, ультрасонографию и УЗИ поджелудочной железы.
С целью оценки степени вторичных поражений органов средостения, при МЭН 1 типа применяется забор биологических образцов крови для проведения биохимического анализа, в процессе которого определяются такие показатели: креатинин, мочевина, электролиты, щелочная фосфатаза, глюкоза, остаточный азот и др. Показано также проведение проб мочи по Сулковичу и Зимницкому. К числу диагностических мероприятий при МЭН 1 также относится экскреторная урография, УЗИ почек, ЭКГ, денситометрия, фиброгастродуоденоскопия, рентгенография трубчатых костей, пальцев рук и др.
Лечение МЭН 1 типа
Тактика лечения при множественных эндокринных неоплазиях 1 типа заключается в поэтапном удалении неоплазий. В первую очередь производится паратиреодиэктомия — удаление околощитовидных желез, затем приступают к удалению поджелудочной железы (резекция головки поджелудочной железы, энуклеация, панкреатодуаденальная резекция, дистальная резекция и др.). Если опухоли имеют злокачественный характер, пациенту проводят послеоперационную химиотерапию.
Аденома гипофиза при МЭН 1 типа лечится при помощи хирургического метода, химио- или лучевой терапии.
Множественные эндокринные неоплазии 2А и 2В типов
Характеристика МЭН 2А и 2В типов
Симптомокомплекс множественных эндокринных неоплазий 2А типа подразумевает наличие феохромоцитомы, гиперпаратиреоза медуллярной карциномы щитовидной железы. Впервые данная патология была описана Дж. Сипплом в 1959 году, поэтому в некоторых источниках встречается второе название этого синдрома — синдром Сипла.
При МЭН 2В типа (синдром Горлина), помимо перечисленных выше составляющих, присутствуют нейропатии и патология опорно-двигательного аппарата и невриномы слизистых оболочек.
Причины МЭН 2А и 2В типов
Этиологическим фактором развития синдромов множественных эндокринных неоплазий 2 типов является аутосомно-доминантное наследование мутации RET-протоонкогена в области 10р11.2 в Х хромосоме. У пациентов с МЭН 2А типа процесс мутации происходит в кодонах 768 и 804 в экзоне 11 и в кодонах 609, 618, 620, 634 в экзоне 10. При МЭН 2В типа изменения происходят в 918 кодоне 11 экзона. Процесс мутации RET-протоонкогена провоцирует его активацию, что становится причиной неконтролируемого клеточного роста и неопластической трансформации.
Частота развития множественных эндокринных неоплазий 2 типа составляет 1-10 случаев на 100 тыс. человек.
Симптомы МЭН 2А и 2В типов
Среди ранних симптомов множественных эндокринных неоплазий 2А типа первое место занимает рак щитовидной железы, который исходит из парафолликулярных клеток и секретирует кальцитонин. Спектр симптомов небольшой, треть пациентов могут жаловаться на диарею и иметь карциноидный синдром, связанный с выработкой опухолью вазоактивных пептидов (серотонина, гистамина, простагландинов).
В некоторых случаях карцинома щитовидной железы вырабатывает АКТГ, что является предрасполагающим фактором к развитию синдрома Иценко-Кушинга. В основном медуллярный рак щитовидной железы диагностируется в процессе обследования больных по поводу узлового зоба. Медуллярная карцинома щитовидной железы одинаково часто встречается и у мужчин, и у женщин (соотношение 1:1). Возрастная категория пациентов колеблется в пределах 30-40 лет.
По мере прогрессирования карциномы развивается раковая кахексия, печеночная желтуха, возможны легочные кровотечения. В случае отсутствия терапевтических мероприятий III и IV стадии происходит быстрый летальный исход.
У половины пациентов с МЭН 2А типа выявляется феохромоцитома и, как правило, уже после поражения опухолью щитовидной железы. В большинстве случаев феохромоцитома развивается в совокупности с транзиторной, умеренной или постоянной артериальной гипертензией, гипергидрозом, общей слабостью, полиурией, гиперсаливацией. В случае кризового течения феохромоцитомы — высокий риск развития острой сердечной недостаточности, фибрилляции желудочков, гемморагического инсульта, отека легких. Возможны гипертонические кризы, в процессе которых происходит молниеносное повышение артериального давления, которое может достичь цифр 220/150 и выше. Такие приступы завершаются внезапно, как и начались.
Снижение аппетита, тошнота, почечные колики и боли в эпигастральной области при МЭН 2А типа могут свидетельствовать о наличии гиперпаратиреоза.
Течение МЭН 2А типа может сочетаться с болезнью Гиршпрунга и первичным амилоидозом кожи.
В случае развития синдрома множественных эндокринных неоплазий 2В типа к феохромоцитоме, гиперпаратиреозу и медуллярной карциноме щитовидной железы присоединяется развитие множественных неврином слизистых оболочек и патологии опорно-двигательного аппарата.
У больных с синдромом множественных эндокринных неоплазий 2В типа развивается марфаноподобная внешность, также у них часто встречается воронкообразная деформация грудной клетки, конская стопа, искривление позвоночника, вывихи бедренных костей и арахнодактилия. Невриномы в большинстве случаев локализируются на слизистых ЖКТ, губ, щек и на языке. Они представлены в виде безболезненных бело-розовых узелков величиной 1-3 см. Расстройства пищеварительной системы могут провялятся в качестве запоров, диареи, мегаколона.
Диагностика МЭН 2А и 2В типов
На протяжении периода диагностики пациенту выполняют ряд исследований, среди которых сцинтиография, УЗИ щитовидной железы и надпочечников, определение уровня гормонов (АКТГ, кальцитонина, тиреоглобулина, паратгормона, катехоламинов) и кальция в крови. Генетические исследования дают возможность диагностировать мутацию RET-протоонкогена.
Лечение МЭН 2А и 2В типов
Терапевтические мероприятия, направленные на устранения синдрома множественных эндокринных неоплазий 2 типа подразумевают поэтапное удаление феохромоцитомы — одностороннее или двухстороннее удаление надпочечников. В случае двухсторонней адреналэктомии, с целью профилактики хронической надпочечниковой недостаточности, необходима постоянная заместительная минерало- и глюкокортикоидная терапия.
На следующем этапе производится тиреоидэктомия, при необходимости с лимфодиссекцией. После данного оперативного вмешательства, для профилактики послеоперационного гипотиреоза, рекомендовано применение тироксина. При наличии неоперабельной карциномы щитовидной железы самым корректным способом лечения является химиотерапия.
Хирургическое лечение гиперпаратиреоза при МЭН 2 типа может подразумевать субтотальную паратиреоидэктомию, а иногда тотальный вариант удаления околощитовидных желез в комплексе с аутотрансплантацией тиреоидной ткани в мышцу предплечья.
Неотъемлемой частью диагностики являются дифференциальные анализы. Они особенно актуальны в процессе определения МЭН 2А типа, при медуллярной карциноме необходимо исключить сходство со спорадическими вариантами болезни. Верифицировать диагноз поможет тщательное генетическое обследование.
Прогноз при синдроме множественных эндокринных неоплазий
Наблюдение пациентов в динамике и генетический скрининг больных с синдромом множественных эндокринных неоплазий 1 типа дают возможность выполнить диагностику и контроль за течением данного синдрома, что качественно увеличивает шансы на выздоровление при данной патологии. Множественные злокачественные новообразования поджелудочной железы подразумевают гораздо меньшие шансы на успех.
Множественные эндокринные неоплазии 2 типа также имеют неблагоприятный прогноз, который во многом зависит от наличия метастаз феохромоцитомы и рака щитовидной железы и от операбельности больного.
Немаловажную роль играет субъективное отношение пациента к своему здоровью, а также уровень компетентности и внимательности специалистов. Если больной тщательно и своевременно выполняет рекомендации доктора, это безусловно положительно скажется на его здоровье.
Синдром множественной эндокринной неоплазии второго типа — ДНК-диагностика
МЭН2А и МЭН2Б (Multiple Endocrine Neoplasia Types 2A and 2B – OMIM number: 171400) – семейные раковые синдромы, наследуемые по аутосомно-доминантному типу. Встречаются с частотой около 1: 30 000. Для больных с этими синдромами характерно наличие семейного медуллярного рака щитовидной железы (МРЩЖ) (92-100 %). Кроме того, эти заболевания объединяет тот факт, что они ассоциированы со специфическими мутациями протоонкогена RET (10q11.2), кодирующего тирозиновую протеинкиназу рецепторного типа. Мутации превращают нормальный ген RET в доминантный трансформирующий онкоген. Отличие синдромов – в спектре поражаемых органов, а также в степени их агрессивности. Для больных с МЭН2А помимо МРЩЖ характерно наличие феохромоцитомы (встречается ~ в 50 % случаев) и гиперплазии/аденомы паращитовидных желез (обнаруживают у 20-30 % больных). Наряду с медуллярной карциномой феохромоцитомы также выявляют примерно у 50 % пациентов с синдромом МЭН2Б. Однако гиперплазия паращитовидных желез при этом заболевании встречается крайне редко. Для больных с МЭН2Б характерны сопутствующие аномалии: пороки развития скелета и зрения, множественные невриномы слизистых оболочек, а также ганглионевриномы желудочно-кишечного тракта, мегаколон и другие. МЭН2Б представляет наиболее агрессивную форму заболевания. Для него характерен ранний (дошкольный) возраст возникновения МРЩЖ с ранним метастазированием в регионарные лимфатические узлы. При синдроме МЭН2А МРЩЖ чаще формируется в раннем школьном возрасте, а риск развития МРЩЖ составляет 100 %.
ДНК-диагностика МЭН2А облегчается высокой кластеризацией мутаций в гене RET, ассоциированных с этим синдромом: более чем у 98 % семей с МЭН2А были идентифицированы миссенс- мутации в одном из 5-ти цистеиновых кодонов: 609, 611, 618, 620 (10-й экзон) или 634 (11-й экзон). Более редкие мутации у больных МЭН2А находят в экзонах 13 и 14 гена RET. При МЭН2Б более чем у 94 % семей выявляют одну и ту же герминальную мутацию в кодоне 918 (16-й экзон). В редких случаях находят мутацию в экзоне 15 (к.883). Исходя из этих данных при молекулярной диагностике синдрома МЭН2А необходим сиквенс 10-го и 11-го экзонов гена RET. А в случае отсутствия мутаций в этих экзонах исследуют последовательности экзонов 13 и 14. При МЭН2Б мутацию Met 918Thr выявляют методом рестрикционного анализа. При отсутствии этой мутации необходимо проверить экзон 15.
Результаты ДНК-диагностики МЭН2 и СМРЩЖ используют для подтверждения клинического диагноза, для прогноза развития феохромоцитомы и гиперплазии паращитовидных желез, для выбора тактики лечения конкретного больного, одним из путей которого является тиреоидэктомия на доклинической стадии рака, поскольку у 90 % детей со специфическими RET мутациями рано или поздно развивается МРЩЖ.
Публикации по теме раздела
Множественной эндокринной неоплазии второго типа (МЭН2А и МЭН2Б) синдром
Синдром множественной эндокринной неоплазии типа I (МЭН 1): причины, симптомы, лечение, признаки
Синдром МЭН 1, или синдром Вермера, характеризуется сочетанием опухоли или гиперплазии ПЩЖ, опухоли из островковых клеток ПЖ и аденомы передней доли гипофиза. Кроме этих основных новообразований, у больных МЭН 1 часто выявляются аденомы коры надпочечников, карциноидные опухоли, липомы, ангиофибромы и коллагеномы. Относительная частота выявления той или иной опухоли увеличивается с возрастом, ниже приведены цифры для пациентов в возрасте 40 лет.
Распространенность синдрома множественной эндокринной неоплазии типа I (МЭН 1)
МЭН 1 встречается чаще других заболеваний своей группы. Его распространенность в популяции достигает 1:30 000 и не имеет половых и этнических различий.
Частота выявления опухолей при множественных эндокринных неоплазиях 1-го типа
| Новообразование | Частота, % |
|---|---|
| Аденома паращитовидной железы | 90 |
| Гастринома | 40 |
| Инсулинома | 10 |
| ППома | 20 |
| Глюкагонома, ВИПома, соматостатинома | 2 |
| Карциноид (вилочковой железы, бронхов, кишечный) | 2 |
| Энтерохромаффиноподобная опухоль (карциноид) желудка | 10 |
| Пролактинома | 20 |
| Соматотропинома | 5 |
| Кортикотропинома | 2 |
| Тиреотропинома | <1 |
| Клинически неактивная аденома гипофиза | 5 |
| Аденома коры надпочечников | 25 |
| Феохромоцитома | <1 |
| Эпендимома | 1 |
| Липома | 30 |
| Ангиофиброма лица | 85 |
| Коллагенома лица | 70 |
Причины синдрома множественной эндокринной неоплазии типа I (МЭН 1)
Заболевание обусловлено мутацией гена, который кодирует специфический белок менин. Он локализуется в клеточном ядре и выполняет функцию супрессора опухолевого роста. Описано более 300 мутаций, приводящих к отсутствию или синтезу неактивного менина. Инициация заболевания проходит в 2 этапа. Сама мутация («первый толчок») изначально присутствует во всех клетках организма, но не проявляет себя до тех пор, пока сохранна вторая аллель гена. В последующем постнатально в одной из клеток происходит утрата части или всей 11 -й хромосомы с неповрежденной аллелью, и клетка приобретает потенциал к опухолевому росту («второй толчок»). Таким образом, сама мутация является рецессивной, но заболевание наследуется аутосомно-доминантно и может манифестировать в любом возрасте.
Симптомы, диагностика и лечение синдрома множественной эндокринной неоплазии типа I (МЭН 1)
Клиническая картина, диагностика и лечение отдельных опухолей при МЭН 1 в общих чертах сходны с таковыми при изолированных поражениях соответствующих эндокринных желез, ниже охарактеризованы только их специфические признаки.
Первичный гиперпаратиреоз является самым частым проявлением МЭН 1, обычно манифестирует в 20—30-летнем возрасте и к 50 годам обнаруживается практически у всех больных. Наиболее часто выявляется аденома трех или всех четырех П ЩЖ.
Диагностика первичного гиперпаратиреоза при МЭН 1 базируется на клинической картине и лабораторных данных (кальций, ПТГ). Традиционная визуализация (УЗИ, томография) менее эффективна, большей информативностью обладает сцинтиграфия с Тс99m_ метоксиизобугилизонитрилом. В связи с тем, что злокачественные опухоли редки, профилактическая паратиреоидэктомия не практикуется. Оперативное лечение производится после выявления гиперпаратиреоза и должно состоять из субтотальной паратиреоидэктомии с оставлением участка одной, наиболее интактной железы. Возможна тотальная паратиреоидэктомия с аутотрансплантацией ткани железы под кожу предплечья (для удобства последующего наблюдения). Операция на ПЩЖ при МЭН 1 обычно дополняется максимально возможной резекцией тимуса как наиболее частой локализации карциноида.
Опухоли из клеток островков Лангерганса развиваются примерно у 2/3 пациентов с МЭН 1, показана корреляция частоты их малигнизации и метастазирования с возрастом пациентов. Другой неблагоприятной особенностью этих новообразований при МЭН 1 являются их малые размеры, мультифокальный рост и локализация не только в любой части ПЖ, но и в подслизистой оболочке двенадцатиперстной кишки, что определяет недостаточную эффективность УЗИ, КТ и МРТ для их своевременного выявления. Клетки опухолей могут выделять хромогранин А и В, инсулин, проинсулин, глюкагон, гастрин, соматостатин, серотонин, кальцитонин, панкреатический полипептид, вазоактивный интестинальный полипептид, соматолиберин, нейротензин, высокое содержание которых в крови, наряду с клинической картиной, лежит в основе диагностики соответствующей опухоли.
Для визуализации наиболее эффективны ПЭТ-КТ3 и сцинтиграфия с меченым октреотидом. Возможности хирургического лечения ограничены. Абсолютным показанием к операции считается только инсулинома, в неоперабельных случаях используют консервативное лечение диазоксидом или стрептозоцином. Опухоли другой природы следует по возможности также лечить консервативно.
Аденомы передней доли гипофиза выявляются с частотой от 10 до 60%. Как и при изолированных формах, преобладают микроаденомы, секретирующие пролактин.
Аденомы коры надпочечников при МЭН 1 встречаются достаточно часто (20—40%), в большинстве случаев бывают двусторонними и не-функционирующими. Хирургическому лечению подлежат только гормонально активные или быстрорастущие опухоли.
Липомы, как кожные, так и висцеральные, выявляются примерно у 1/3 пациентов с МЭН 1. Они всегда инкапсулированные, обычно множественные, способны достигать значительных размеров и часто вызывают косметические проблемы. Рецидивов после удаления таких липом обычно не наблюдается.
Множественные ангиофибромы и коллагеномы лица встречаются у больных МЭН 1 очень часто и могут быть полезны для доклинического выявления носителей гена этого заболевания.
Все больные, имеющие на момент осмотра или в анамнезе сочетание двух и более характерных для МЭН 1 новообразований, а также родственники больных с установленным или предполагаемым диагнозом МЭН 1 первой степени родства, должны подвергаться генетическому обследованию. Важен сам факт выявления генетической предрасположенности, корреляции между наличием конкретной мутации и течением заболевания нет.
Все носители врожденной мутации МЭН 1 нуждаются в пожизненном скрининге для своевременного выявления и лечения заболевания или его рецидивов.
Программа скрининга у больных и носителей мутации множественных эндокринных неоплазий 1 -го типа
| Опухоль | Возраст начала (лет) | Лабораторные исследования (ежегодно) | Визуализация (1 раз в 3 года) |
|---|---|---|---|
| Аденомы ПЩЖ | 8 | Ионизированный кальций, ПТГ | — |
| Гастринома | 20 | Гастрин, желудочная секреция, стимуляция секретином | — |
| Инсулинома | 5 | Глюкоза натощак, инсулин | — |
| Другие энтеропанкреатические опухоли | 20 | Хромогранин А, глюкагон, проинсулин | КТ, МРТ, сцинтиграфия с меченым октреотидом |
| Аденомы гипофиза | 5 | Пролактин, ИФР-1 | МРТ |
| Карциноид | 20 | — | КТ, МРТ |
В случаях, когда генетическое исследование не выявило мутации или не может быть выполнено, но имеются косвенные признаки семейного характера заболевания, всем больным и их родственникам первой степени родства рекомендуется проходить скрининговое обследование 1 раз в 3 года с определением уровней кальция, ПТГ и пролактина сыворотки крови.
Прогноз синдрома множественной эндокринной неоплазии типа I (МЭН 1)
Прогноз пациентов с МЭН 1 может быть различным и при условии адекватного лечения эндокринных нарушений (гиперпаратиреоз, синдром Золлингера-Эдисона, инсулинома) определяется возрастом появления и степенью злокачественности развивающихся новообразований.
Синдром дупликации MECP2 — Genetics Home Reference
El Chehadeh S, Touraine R, Prieur F, Reardon W, Bienvenu T, Chantot-Bastaraud S, Doco-Fenzy M, Landais E, Philippe C, Marle N, Callier P, Mosca -Boidron AL, Mugneret F, Le Meur N, Goldenberg A, Guerrot AM, Chambon P, Satre V, Coutton C, Jouk PS, Devillard F, Dieterich K, Afenjar A, Burglen L, Moutard ML, Addor MC, Lebon S, Мартине Д., Алессандри Дж. Л., Доре Б., Миге М., Девис Д., Согье-Вебер П., Друнат С., Арал Б., Кремер В., Рондо С., Табет А. С., Тевенон Дж., Товен-Робине С., Перретон Н., Дес Портес В. Фэвр Л.Дупликация Xq28, включая MECP2, у шести незарегистрированных пораженных женщин: что мы можем узнать для диагностики и генетического консультирования? Clin Genet. 2016, 19 октября. Doi: 10.1111 / cge.12898. [Epub перед печатью]
Gonzales ML, LaSalle JM. Роль MeCP2 в развитии мозга и нарушениях нервного развития. Curr Psychiatry Rep.2010 Апрель; 12 (2): 127-34. DOI: 10.1007 / s11920-010-0097-7. Обзор.
Lombardi LM, Baker SA, Zoghbi HY. Расстройства MECP2: от клиники к мышам и обратно.J Clin Invest. 2015 3 августа; 125 (8): 2914-23. DOI: 10,1172 / JCI78167. Обзор.
Lugtenberg D, Kleefstra T, Oudakker AR, Nillesen WM, Yntema HG, Tzschach A, Raynaud M, Rating D, Journel H, Chelly J, Goizet C, Lacombe D, Pedespan JM, Echenne B, Tariverdian G, O ‘Рурк Д., Кинг, доктор медицины, Грин А., ван Когеленберг М., Ван Эш, Г. Гец, Дж. Хамель, Б. К., ван Боховен Н., де Брауэр А. П.. Структурные вариации дупликаций Xq28: MECP2 у 1% пациентов с необъяснимым XLMR и у 2% пациентов мужского пола с тяжелой энцефалопатией.Eur J Hum Genet. 2009 Апрель; 17 (4): 444-53. DOI: 10.1038 / ejhg.2008.208. Epub 2008 5 ноября. Опечатка в: Eur J Hum Genet. 2009 Май; 17 (5): 697.
Ramocki MB, Peters SU, Tavyev YJ, Zhang F, Carvalho CM, Schaaf CP, Richman R, Fang P, Glaze DG, Lupski JR, Zoghbi HY. Аутизм и другие нейропсихиатрические симптомы распространены у людей с синдромом дупликации MeCP2. Энн Нейрол. 2009 декабрь; 66 (6): 771-82. DOI: 10.1002 / ana.21715.
Yi Z, Pan H, Li L, Wu H, Wang S, Ma Y, Qi Y.Дупликация хромосомы Xq28, охватывающая MECP2: Клинический и молекулярный анализ 16 новых пациентов из 10 семей в Китае. Eur J Med Genet. 2016 июн; 59 (6-7): 347-53. DOI: 10.1016 / j.ejmg.2016.05.004.
.
SATB2-ассоциированный синдром — Genetics Home Reference
Bengani H, Handley M, Alvi M, Ibitoye R, Lees M, Lynch SA, Lam W, Fannemel M, Nordgren A, Malmgren H, Kvarnung M, Mehta S, McKee S , Уайтфорд М., Стюарт Ф., Коннелл Ф., Клейтон-Смит Дж., Мансур С., Мохаммед С., Фрайер А., Мортон Дж; Консорциум UK10K, Грозева Д., Асам Т., Мур Д., Сифрим А., Макрей Дж., Хёрлс М.Э., Ферт Х.В., Раймонд Флорида, Кини Ю., Неллекер С., Исследование Ddd, ФитцПатрик ДР. Клинические и молекулярные последствия связанных с заболеванием мутаций de novo в SATB2.Genet Med. 2017 2 февраля. Doi: 10.1038 / gim.2016.211. [Epub впереди печати]
Британова О., Акопов С., Лукьянов С., Грусс П., Тарабыкин В. Новый фактор транскрипции Satb2 взаимодействует с элементами ДНК области прикрепления матрикса тканеспецифическим образом и демонстрирует клеточно-зависимую экспрессию в развивающейся ЦНС мыши. Eur J Neurosci. 2005 Февраль; 21 (3): 658-68.
Britanova O, Depew MJ, Schwark M, Thomas BL, Miletich I, Sharpe P, Tarabykin V. Фенокопия гаплонедостаточности Satb2 вызывает делеции 2q32-q33, тогда как потеря предполагает фундаментальную роль в координации развития челюстей.Am J Hum Genet. 2006 Октябрь; 79 (4): 668-78.
Britanova O, de Juan Romero C, Cheung A, Kwan KY, Schwark M, Gyorgy A, Vogel T, Akopov S, Mitkovski M, Agoston D, Sestan N, Molnár Z, Tarabykin V. Satb2 — постмитотический детерминант для спецификации нейронов верхнего слоя в неокортексе. Neuron. 2008 7 февраля; 57 (3): 378-92. DOI: 10.1016 / j.neuron.2007.12.028.
Добрева Г., Чахрур М., Даутценберг М., Чиривелла Л., Канцлер Б., Фариньяс И., Карсенти Г., Гросседль Р. SATB2 — это многофункциональный детерминант формирования черепно-лицевого паттерна и дифференциации остеобластов.Cell. 2 июня 2006 г .; 125 (5): 971-86.
Зарате Ю.А., Рыбный Ж.Л. SATB2-ассоциированный синдром: механизмы, фенотип и практические рекомендации. Am J Med Genet A. 2017 февраль; 173 (2): 327-337. DOI: 10.1002 / ajmg.a.38022. Обзор.
Zarate YA, Kalsner L, Basinger A, Jones JR, Li C, Szybowska M, Xu ZL, Vergano S, Caffrey AR, Gonzalez CV, Dubbs H, Zackai E, Millan F, Telegrafi A, Baskin B, Person Р, Фиш Дж. Л., Эверман Д.Б. Генотип и фенотип еще у 12 человек с синдромом, ассоциированным с SATB2.Clin Genet. 31 января 2017 г. doi: 10.1111 / cge.12982. [Epub перед печатью]
.
Синдром анофтальмии SOX2 — Genetics Home Reference
Бакрания П., Робинсон Д. О., Баньян Д. Д., Солт А, Мартин А., Кролла Дж. А., Вятт А., Филдер А., Эйнсворт Дж., Мур А., Рид С., Уддин Дж., Лоуз Д., Паскуэль-Сальседо Д., Аюсо С., Аллен Л., Коллин Дж. Р., Рагге Н.К. Синдром анофтальмии SOX2: 12 новых случаев, демонстрирующих более широкий фенотип и высокую частоту крупных делеций генов. Br J Ophthalmol. 2007 ноябрь; 91 (11): 1471-6. Epub 2007 23 мая.
Кельберман Д., де Кастро С.К., Хуанг С., Кролла Дж. А., Палмер Р., Грегори Дж. В., Тейлор Д., Кавалло Л., Файенца М. Ф., Фишетто Р., Акерманн Дж. К., Мартинес-Барбера Дж. П., Рицзоти К. , Ловелл-Бэдж R, Робинсон IC, Геррелли Д., Даттани МТ.SOX2 играет важную роль в гипофизе, переднем мозге и глазах во время эмбрионального развития человека. J Clin Endocrinol Metab. 2008 Май; 93 (5): 1865-73. DOI: 10.1210 / jc.2007-2337. Epub 2008, 19 февраля.
Шнайдер А., Бардакджан Т.М., Чжоу Дж., Хьюз Н., Кипр Р., Дорсенвиль Д., Херани Ф., Катовиц Дж., Шимменти Л.А., Хаммел М., Фицпатрик Д.Р., Янг Т.Л. Семейный рецидив синдрома анофтальмии SOX2: фенотипически нормальная мать с двумя пораженными дочерьми. Am J Med Genet A. 1 ноября 2008 г .; 146A (21): 2794-8.DOI: 10.1002 / ajmg.a.32384.
Циафери В., Кельберман Д., Даттани МТ. Роль SOX2 при гипогонадотропном гипогонадизме. Sex Dev. 2008; 2 (4-5): 194-9. DOI: 10,1159 / 000152035. Epub 2008 5 ноября. Обзор.
Verma AS, Фитцпатрик DR. Анофтальм и микрофтальм. Orphanet J Rare Dis. 2007 26 ноября; 2:47. Обзор.
Уильямсон К.А., ФитцПатрик ДР. Заболевания глаз, связанные с SOX2. 2006 г. 23 февраля [обновлено 31 июля 2014 г.]. В: Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJH, Bird TD, Ledbetter N, Mefford HC, Smith RJH, Stephens K, редакторы.GeneReviews® [Интернет]. Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл; 1993-2017. Доступно по адресу http://www.ncbi.nlm.nih.gov/books/NBK1300/
Williamson KA, Hever AM, Rainger J, Rogers RC, Magee A, Fiedler Z, Keng W.T., Sharkey FH, McGill N , Хилл С.Дж., Шнайдер А., Мессина М., Тернпенни П.Д., Фантес Я.А., ван Хейнинген В., ФитцПатрик ДР. Мутации в SOX2 вызывают анофтальмогенитальный пищеводно-генитальный синдром (AEG). Hum Mol Genet. 2006 1 мая; 15 (9): 1413-22. Epub 2006 16 марта. Ошибка в: Hum Mol Genet.2006 15 июня; 15 (12): 2030.
Zhou J, Kherani F, Bardakjian TM, Katowitz J, Hughes N, Schimmenti LA, Schneider A, Young TL. Выявление новых мутаций и вариантов последовательностей в генах SOX2 и CHX10 у пациентов с анофтальмией / микрофтальмией. Mol Vis. 24 марта 2008 г .; 14: 583-92.
.
Синдром Мабри — Genetics Home Reference
Hansen L, Tawamie H, Murakami Y, Mang Y, ur Rehman S, Buchert R, Schaffer S, Muhammad S, Bak M, Nöthen MM, Bennett EP, Maeda Y, Aigner M, Reis A, Kinoshita T, Tommerup N, Baig SM, Abou Jamra R. Гипоморфные мутации в PGAP2, кодирующие белок ремоделирования GPI-якоря, вызывают аутосомно-рецессивную интеллектуальную инвалидность. Am J Hum Genet. 2013 4 апреля; 92 (4): 575-83. DOI: 10.1016 / j.ajhg.2013.03.008.
Horn D, Krawitz P, Mannhardt A, Korenke GC, Meinecke P.Синдром гиперфосфатазии-умственной отсталости из-за мутации PIGV: расширенный клинический спектр. Am J Med Genet A. 2011 август; 155A (8): 1917-22. DOI: 10.1002 / ajmg.a.34102. Epub 2011 7 июля.
Хорн Д., Шоттманн Г., Майнеке П. Гиперфосфатазия с умственной отсталостью, брахителефалангией и выраженным лицевым гештальтом: определение узнаваемого синдрома. Eur J Med Genet. 2010 март-апрель; 53 (2): 85-8. DOI: 10.1016 / j.ejmg.2010.01.002. Epub 2010 18 января.
Krawitz PM, Murakami Y, Hecht J, Krüger U, Holder SE, Mortier GR, Delle Chiaie B, De Baere E, Thompson MD, Roscioli T, Kielbasa S, Kinoshita T, Mundlos S, Робинсон П.Н., Хорн Д.Мутации в PIGO, входящем в путь синтеза якоря GPI, вызывают гиперфосфатазию с умственной отсталостью. Am J Hum Genet. 2012 13 июля; 91 (1): 146-51. DOI: 10.1016 / j.ajhg.2012.05.004. Epub 2012 7 июня.
Krawitz PM, Murakami Y, Rieß A, Hietala M, Krüger U, Zhu N, Kinoshita T, Mundlos S, Hecht J, Robinson PN, Horn D. Мутации PGAP2, влияющие на GPI-якорь -синтезирующие пути, вызывают гиперфосфатазию с синдромом умственной отсталости. Am J Hum Genet. 2013 4 апреля; 92 (4): 584-9.DOI: 10.1016 / j.ajhg.2013.03.011.
Krawitz PM, Schweiger MR, Rödelsperger C, Marcelis C, Kölsch U, Meisel C, Stephani F, Kinoshita T, Murakami Y, Bauer S, Isau M, Fischer A, Dahl A, Kerick M, Hecht J, Köhler S, Jäger M, Grünhagen J, de Condor BJ, Doelken S, Brunner HG, Meinecke P, Passarge E, Thompson MD, Cole DE, Horn D, Roscioli T, Mundlos S, Robinson PN. Идентификационная фильтрация данных последовательности экзома по происхождению выявляет мутации PIGV при синдроме умственной отсталости гиперфосфатазии.Нат Жене. Октябрь 2010; 42 (10): 827-9. DOI: 10,1038 / нг.653. Epub 2010 29 августа.
Murakami Y, Kanzawa N, Saito K, Krawitz PM, Mundlos S, Robinson PN, Karadimitris A, Maeda Y, Kinoshita T. Механизм высвобождения щелочной фосфатазы, вызванный гипергликозилфосфатидилинозитовой недостаточностью у пациентов с дефицитом гликозилфосфатидилинозитола синдром умственной отсталости. J Biol Chem. 2012 24 февраля; 287 (9): 6318-25. DOI: 10.1074 / jbc.M111.331090. Epub 2012 6 января.
Томпсон М.М., Незарати М.М., Гиллессен-Кесбах Г., Мейнеке П., Мендоза-Лондоно Р., Морнет Е., Брун-Хит I, Скуарчони С.П., Легеаи-Маллет Л., Мюнних А., Коул Д.Гиперфосфатазия с судорогами, неврологическим дефицитом и характерными чертами лица: пять новых пациентов с синдромом Мабри. Am J Med Genet A. Июль 2010; 152A (7): 1661-9. DOI: 10.1002 / ajmg.a.33438. Ошибка в: Am J Med Genet A. 2011 May; 155A (5): 1215. Мендоса, Роберто [исправлено на Мендоса-Лондоно, Роберто].
Thompson MD, Roscioli T, Marcelis C, Nezarati MM, Stolte-Dijkstra I, Sharom FJ, Lu P, Phillips JA, Sweeney E, Robinson PN, Krawitz P, Yntema HG, Andrade DM, Brunner HG, Cole DE ,Фенотипическая изменчивость при гиперфосфатазии с судорогами и неврологическим дефицитом (синдром Мабри). Am J Med Genet A. 2012 Mar; 158A (3): 553-8. DOI: 10.1002 / ajmg.a.35202. Epub 2012 7 февраля.
.
