10. Специальные методы операционных исследований
Помимо
ревизии брюшной полости, для уточнения
диагноза
непроходимости желчных путей с целью
выбора метода
операции необходимы специальные
диагностические методы.
В-современных условиях для этого в
основном используют
операционную рентгеноманометрию желчных
путей и холангиоскопию. Кроме того,
приходится производить
диагностическую холедохотомию и
зондирование желчных
протоков и иногда дуоденотомию для
осмотра фатерова
сосочка.
РЕНТГЕНОМАНОМЕТРИЧЕСКОЕ
ИССЛЕДОВАНИЕ ЖЕЛЧНЫХ ПУТЕЙ
Рентгеноманометрическое
исследование желчных путей заключается
в проведении манометрии, дебитометрии
и их
контрастного рентгенологического
исследования по
Рис.
20. Различные
способы интубации желчных путей, а
—пункция троакаром желчного пузыря; б
— введение канюли через пузырный проток
до удаления желчного пузыря; в — введение
канюли в культю пузырного протока
после холецистэктомии; г — введение
канюли в общий желчный проток; д —
исследование через наружный дренаж
общего желчного протока.
ходу
операции. С помощью манометрии и
дебитометрии удается установить
функциональное состояние и тонус
запирательного
аппарата желчных путей, а с помощью
холангиографии — их анатомические
изменения.
В
зависимости от характера патологического
процесса
и уровня блокады желчных путей
рентгеноманометри-ческое исследование
проводят через желчный пузырь, пузырный
проток, гепатикохоледох или внутрипеченоч-ные
желчные протоки (рис. 20). Интубация
желчного пузыря
обычно необходима при раковой обтурации
терминальных отделов общего желчного
протока, чтобы установить,
есть ли сообщение пузыря с печеночными
протоками
для внутреннего отведения желчи из
печени.
Исследование через пузырный
проток обычно применяют
после
холецистэктомии, когда следует выявить
состояние
магистральных
желчных протоков. При невозможности
использования
желчного пузыря и пузырного протока
обычно
приходится прибегать к непосредственной
инту-
бации
гепатикохоледоха. Наконец, при
Наконец, при
непроходимости
желчных
путей в воротах печени производят
интубацию
внутрипеченочных желчных
протоков. :
Интубацию
желчного пузыря обычно производят
специальными троакарами, применяемыми
для его пункции. Интубацию
пузырного протока и гепатикохоледоха
удобнее всего осуществлять
металлическими канюлями или полиэтиленовыми
катетерами, которые затем фиксируют
лигатурами во избежание подтекания
желчи. Пункции внутрипеченочных
протоков удобнее всего делать обычными
инъекционными иглами.
Операционная манометрия
Манометрия
желчных путей в качестве метода
операционной
диагностики заключается в определении
величины
давления в желчных путях после введения
в них жидкости. При этом жидкость в
кишечник поступает под определенным
давлением, зависящим от тонуса желчных
путей и запирательного аппарата фатерова
сосочка. Вначале
происходит наполнение жидкостью желчных
путей и
повышение в них давления. Повышенное
давление, преодолев
резистентность сфинктера Одди, вызывает
эвакуацию
жидкости в кишечник. Затем величина
Затем величина
давления снижается и стабилизируется
на уровне прекращения опорожнения
желчных путей. В соответствии с этим
основными
манометрическими показателями принято
считать: 1) исходное давление —
давление до введения жидкости в
желчные пути; 2) давление наполнения —
давление
во время поступления жидкости в желчные
пути; 3)
давление прохождения —давление, при
котором начинается эвакуация жидкости
из желчных путей; 4) остаточное
давление-—давление, при котором
заканчивается
поступление жидкости из желчных путей.
В
нормальных условиях показатели давления
соответствуют
определенным величинам, не изменяясь
при повторных
исследованиях; напротив, при патологическомсостоянии
желчных путей • манометрические
показатели резко
меняются, что указывает на нарушение
желче-выделения
Рис. 21. Аппарат
для деби-тохолангиоманометрии
желчных
путей (В. В. Виноградов, 1969).
а
— стойка аппарата и кронштейн
для крепления к операционному
столу; б -— водный манометр
со шкалой; в — колба для
перфузии физиологического раствора;
г — цилиндр шприца для
дебитомет’^ии; д — система соединительных
трубок; е — нивелир. .
.
В
настоящее время имеется несколько
способов проведения холангиоманометрии.
Они различаются по принципиальным
особенностям техники и применяемой
аппаратуре.
Сюда могут быть отнесены рентгеноманометрия
по
методу, предложенному Caroli
(1939—1949), холан-гиоманометрия
по методу, разработанному Mallet-Guy
(4942—1947),
и кинезиметрия, которую применил РоШе-их
(1956). В условиях практической работы
наиболее простым
и удобным оказался метод манометрии по
Мал-ле-Ги.
При этом способе учитывают лишь один
показатель—
величину остаточного давления после
его стабилизации
по окончании перфузии жидкости в желчные
пути.
Для определения давления используют
специальный
аппарат типа барографа-анероида с
воздушной передачей,
записывая показатели давления на
кимографе в
сантиметрах водного столба после
введения в желчные
пути физиологического раствора шприцем
под произвольным
давлением. Регистрируемые показатели
давления
имеют вид характерных кривых, которые
сохраняют
идентичный вид при повторных исследованиях,
а давление после стабилизации всегда
устанавливается
на одном и том же уровне. Величина
Величина
последнего для
желчного пузыря составляет в норме
180—-220
мм
вод. ст., а при исследовании желчных
протоков
— около il20
мм вод. ст. При патологическом состоянии
желчных путей отмечают повышение или
снижение .
этих показателей, изменение формы кривых
и величины давления
после его стабилизации.
Для
упрощения метода Малле-Ги, требующего
специальной
аппаратуры, нами предложен и применяется
более
упрощенный способ (В. В. Виноградов, Э.
В. Гриш-кевич, Ю. Ф. Пауткин, 1964). С этой
целью используем стеклянный
водный манометр (рис. 21),
который с помощью
тройника соединен с колбой и системой
для введения
жидкости в желчные пути. Манометр
смонтирован на
подвижном штативе, который Можно
стерилизовать-, и
прикреплять к операционному столу. Во
время исследования
в манометре создают давление 400 мм вод.
ст. и
затем производят из него перфузию
жидкости в течение
30 с, определяя величину остаточного
давления до 5
раз. В норме величина давления в общем
желчном про-
токе
соответствует показателям от 100—110 до
150—
160
мм вод. ст., причем при повторных
ст., причем при повторных
исследованиях цифры
остаточного давления оказываются
одинаковыми. Для Получения точных данных
необходимо соблюдать определенные
технические условия проведения
манометрии
во избежание искажения показателей
давления и диагностических
ошибок: 1) правильно производить интубацию
желчных путей; 2) использовать манометр,
соединительные трубки и интубационные
канюли достаточного
диаметра; 3) следить за полной ‘герметизацией
системы
и отсутствием в ней иузырьков воздуха;
4) применять
для перфузии только теплый изотонический
раствор
хлорида натрия; 5) устанавливать нулевое
деление манометра
на уровне интубации желчных путей.
Одновременно необходимо учитывать,
что некоторые фармакологические
вещества, используемые для наркоза
(морфин,
пантопон, ганглиоблокирующие препараты
и др.), могут
вызывать нарушение тонуса желчных путей
и извращать
показатели давления.
Операционная
дебитометрия
Для
определения функционального состояния
желчных путей может быть использована
дебитометрия. Этот метод
Этот метод
основан на определении количества
жидкости, проходящей
при перфузии через желчные пути в единицу
времени.
Нами
для дебитометрии был использован метод,,
предложенный
Besangan
(1965). Из шприца емкостью-100
мл производят перфузию жидкости в
желчные пути, помещая
шприц на определенном уровне. При этом
в норме
величина дебита жидкости составляет
на уровне 150
мм вод. ст. от 5 до 8 мл/мин, на уровне 200
мм вод.
ст. — от 10 до 12 мл/мин и на уровне 300 мм
вод.
ст. — 20—25 мл/мин.
В
патологических условиях отмечается
изменение показателей
расхода жидкости, который резко
уменьшается
при обтурации желчных путей и увеличивается
при недостаточности
их сфинктерного аппарата.
Ряд
исследователей (В. М. Ситенко, 1968; Л. Б.
Ду-берман,
1970) считают преимуществом дебитометрии
перед
манометрией большую простоту этого
метода и более
точное отражение гидродинамических
изменений при патологических
состояниях желчных путей. Однако, как
Однако, как
свидетельствуют
наши исследования у 300 больных, которым
одновременно были проведены манометрия
и дебитометрия,
манометрические показатели более точно
отражали
изменения желчных путей, хотя в ряде
случаев
с помощью дебитометрии выявлялись
изменения сфинктерного
аппарата фатерова сосочка, которые
нельзя
было определить при манометрии. В связи
с этим мы считаем
наиболее целесообразным одновременное
использование
общих методов, которые наиболее точно
отразят
имеющиеся изменения со стороны желчных
протоков
и особенно фатерова сосочка (В. В.
Виноградов, В.
Н. Корнеев, 1971).
Данные
манометрии и дебитометрии существенно
облегчают диагностику непроходимости
желчных путей, свидетельствуя о нарушении
желчевыведения, хотя, естественно,
с помощью этих данных невозможно
определить
причину непроходимости последних. Для
этого нужно использовать другие
методы операционного исследования.
Роль их особенно важна в тех случаях,
когда отсутствует
органическое препятствие оттоку желчи
и
желчная
гипертензия носит динамический характер,
что требует
также ее устранения для’ восстановления
нормального тока желчи.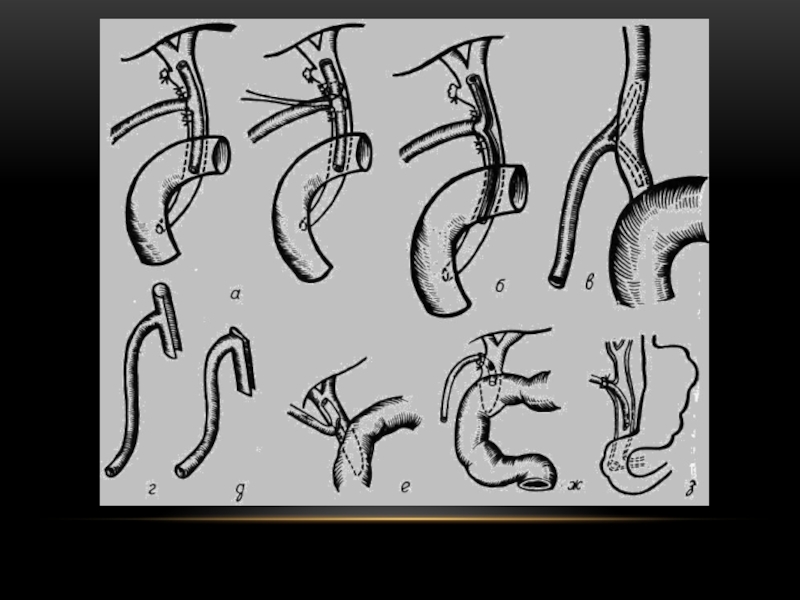
Операционная
холангиография
Метод
операционной холангиографии предложен
аргентинским
хирургом Mirizzi
в 1931 г. В настоящее время он
стал основным методом интраоперационного
исследования
желчных путей, значительно расширив
возможности
распознавания различных патологических
состояний
их.
Техника
операционной холангиографии состоит
во введении
по ходу операции контрастного вещества
в желчные
пути с их последующим рентгенологическим
исследованием.
В настоящее время обычно используют
серийную
операционную холангиографию, делая
после введения
контрастного вещества несколько
рентгеновских снимков.
Это позволяет определить не только
анатомическое
состояние желчных путей, но и их
функциональную
способность (В. В. Виноградов, 1964; Mirizzi,
1948; Mallet-Guy,
1957, и др.).
В
качестве контрастных веществ для
операционной холангиографии могут быть
использованы йодированные масляные
препараты, например йодолипол или
различные
водорастворимые органические йодсодержащие
вещества:
кардиотраст (диодон), триомбрин (уротраст),
гипак
и др. Масляные контрастные вещества не
Масляные контрастные вещества не
смешиваются
с желчью, вытесняя последнюю, делают
более четким изображение желчных путей
и не влияют на их тонус.
Одйако значительная вязкость масляных
контрастных
веществ затрудняет определение
эвакуаторной способности
желчных протоков, а попадание пузырьков
воздуха
нередко вызывает артефакты на
рентгенограммах. Водорастворимые
контрастные вещества, смешиваясь
с желчью, дают менее четкую рентгенологическую
картину,
но зато лучше выявляют ее детали и
позволяют определять
быстроту эвакуации контрастного
вещества. Следует
всегда иметь в виду, что эти препараты
могут оказывать
раздражающее действие на желчные пути,
что может
вести ,к артефактам. Во избежание
последних они Должны иметь концентрацию
не выше 30% и быть щелочной
или нейтральной реакции. Количество
контраст-
ного
вещества для операционной холангиографии
обычно
составляет около 20 мл, но резко увеличив
вается,
достигая более 100 мл в условиях
механической
желтухи или значительного расширения
желчных, путей.
Техническое
оснащение для выполнения операционной
холангиографии предусматривает
рентгеноопераци-онный
стол или специальный туннель для
помещения кассеты
с рентгеновской пленкой. Мы используем
передвижную
стандартную рентгеновскую-установку
РУ-780 и
получаем высококачественные снимки
при следующем
техническом режиме: напряжение 75 кВ,
сила тока
20 мА, экспозиция от 3 до 6 с при фокусном
расстоянии
40—50 см. Стандартный размер снимка 30X40
ом.
Во
время операционной холангиографии для
получения
качественных снимков необходимо: 1)
полностью освободить
операционное поле от металлических
инструментов
и других рентгеноконтрастных предметов;
2) вводить
контрастное вещество без пузырьков
воздуха; 3)
выключить на время снимка дыхательные
движения больного;
4) положение кассеты с пленкой должно
соответствовать проекции желчных
путей; 5) подобрать правильный
режим снимка. Первый снимок делаем с
некоторой
гиперпрессией в момент окончания
введения контрастного вещества для
получения картины всех желчных путей.
Через 3 мин производим второй снимок, с
помощью которого
определяем степень эвакуации контрастного
вещества из желчных путей и их
функциональную способность.
В
настоящее время для операционной
холангиографии
все шире применяется рентгенотелевидение
с электронно-оптическими
усилителями. Этот метод дает возможность
визуально наблюдать в динамике
рентгено-контрастное
изображение желчных путей в незатемнен-ном
помещении на экране телевизора, которое
может быть
заснято с помощью фото- или киносъемки,
либо на | видеомагнитофон.
Несмотря на эти преимущества
рент-генотелевидения,
его диагностическая ценность ниже
обычных
методов исследования вследствие меньшей
четкости
выявляемых деталей рентгенологической
картины. Кроме того, современная
рентгенотелевизионная аппаратура
сложна в эксплуатации и дорога (В. В.
Виноградов,
1971).
Диагностическое
значение рентгеноманометрического
исследования
желчных путей
В
настоящее время не вызывает сомнений,
что деби-тометрия,
манометрия и холангиография значительно
облегчают
операционную диагностику различных
заболеваний
желчных путей. Прежде всего это
Прежде всего это
подтверждают результаты
хирургического лечения, которые гораздо»
лучше,
когда оно проводится под
рентгеноманометриче-ским
контролем. В связи с последним следует
настаивать на
систематическом применении его при
всех операциях на
желчных путях. Отрицание отдельными
авторами: правильности этого положения
чаще всего объясняется’ недостаточным
опытом подобных интраоперационных-исследований.
Приводимые ими данные обычно хуже
результатов
операционных статистик, когда
рентгеномано-метрическое
исследование является правилом, а не
исключением
(В. В. Виноградов, 1964; Arianoff,
1947; Mallet-Guy,
1953; Hess,
1955, и др.).
При
непроходимости желчных путей с помощью
ма-нометрии
обычно устанавливают желчную гипертензию,
указывающую
на блокаду желчевыделения, и определяют
ее степень. Однако это еще не дает
возможности уточнить
причину нарушения оттока желчи, хотя
часта выявляет
ее механический или динамический
характер. Остаточное
давление в условиях непроходимости
желчных
путей может оставаться на одном уровне
при повторных
определениях. В некоторых случаях оно
В некоторых случаях оно
прогрессивно растет по мере переполнения
желчных путей жидкостью.
Иногда вначале нормальное давление,
затем повышается,
постепенно стабилизируясь на высоком
уровне.
Наконец, в отдельных случаях, если
имеющееся препятствие
в желчных путях не вызывает нарушения
оттока
желчи, давление оказывается нормальным.
По существу
аналогичная картина наблюдается при
дебитоме-трии,
когда удается выявить более или менее
выраженное
уменьшение количества перфузируемой
жидкости. Практически
это имеет значение, если дебит,
определяемый
при давлении в 300 мм вод ст., снижается
ниже 15
мл/мин. Изменения показателей манометрии
и деби-тометрии
желчных путей при их непроходимости
представлены
в табл. 18.
При
изменении показателей манометрии и
дебитометрии важная
роль в уточнении характера патологического
процесса
принадлежит рентгеноконтрастному
исследованию,
С его помощью можно определить локализацию
об-турации
желчных протоков, установить ее причину
(конкременты,
панкреатит, стеноз фатерова сосочка,
рубцо-вое
сужение гепатикохоледоха, опухоли) или,
напротив, только
их динамический характер (рис. 22).
22).
Отдельными
рентгенологическими признаками
органической
непроходимости желчных путей могут
быть полное
или частичное нарушение пассажа
контрастного вещества
по желчному протоку, его супрастенотическое
расширение,
видимые тени конкрементов, деформация
стенок
желчных протоков, их сужение или полная
закупорка
с присущими абтурации опухолью
признаками.
Следует
иметь в виду, что динамические нарушения,
вызывающие желчную гипертензию
функционального
характера, по данным манометрии и
дебитометрии, одновременно
сопровождаются рентгенологической
картиной,
свидетельствующей об отсутствии
органических признаков
поражения.
Таким
образом, при непроходимости желчных
путей сочетанное
проведение манометрии, дебитометрии и
хо-лангиографии
дают возможность: 1) определить блокаду
оттока
желчи в различных участках гепатобилиарной
системы, 2) установить причину непроходимости
желчных
путей, ее локализацию и степень обтурации.
или, на-лротив,
свидетельствовать о динамическом
характере на-
Рис.
22. Операционная холангиограмма после
холецистэктомии Определяется
умеренное расширение желчных протоков,
сужение’ терминального
отдела холедоха в области фатерова
сосочка, деформация
его в интрапанкреатической части и
рефлюкс в панкреатический-
рушения
желчевыведения, 3) контролировать
восстановление
проходимости желчных путей после
операции.
При
проведении рентгеноманометрического
исследования
не следует, однако, полностью исключать
возможность
диагностических ошибок из-за неправильной
интерпретации полученных данных или
возникновения артефактов,
что создает ложное впечатление о
патологи-
Рис. 23. Проведение
холангиоско-
пии.
ческом
процессе желчных путей. Возможными
источни- ками
ошибок могут быть технические
погрешности в проведении исследования,
раздражающее действие упот- |ребляемых
для перфузии веществ, а также извращение
нормального
тонуса желчных протоков от применения
:
лекарственных
препаратов во время наркоза. Непра-
Непра-
вильная
интерпретация рентгенологической
картины может
быть вызвана попаданием воздуха в
желчные пути, неправильным
положением интубационной канюли,
подтеканием
контрастного вещества, сдавленней или
наложением друг на друга отдельных
участков желчных путей. Неуверенность
в точности полученных при
рентге-номанометрическом
исследовании данных обычно ведет к
повторному исследованию или использованию
других диагностических
методов.
ХОЛАНГИОСКОПИЯ
Для
уточнения диагноза при поражении желчных
путей значительные
перспективы открывает эндоскопическое
исследование
— холангиоскопия.
Идея
эндоскопического исследования желчных
протоков
принадлежит Bakes
(1923). Mclver
(1941) предложил
для этого специальный прибор, но он не
получил распространения.
Wildegans
(1953) разработал современную
конструкцию холедохоскопа, что позволило
применять холангиоскопию в клинической
практике. Холе-дохоскои
представляет собой металлический тубус
диаметром
7—8 мм, изогнутый на конце. В него
В него
вмонтированы
оптическая система, источник света и
канал для промывания
жидкостью желчных путей. Конец холедо*
хоскопа
вводят в общий желчный или в общий
печеночный
проток после холедохотомии или через
культю расширенного
пузырного тфотока. В ‘последнее время
появились
усовершенствованные фиброхоледохоскопы
меньшего
диаметра, которые более удобны для
осмотра желчных
путей и имеют мощное освещение для
фото-или
киносъем’ки (рис. 23).
Как
показывают исследования (В. Р. Пурмалис,
1970;
Wildegans,
1960; Griessmann,
1961; Schein,
1964; Risharol,
1960, и собственные наблюдения), при
холедо-хоскопии
легко осмотреть общий печеночный проток
и
внутрипеченочные
протоки, а также общий желчный проток
и фатеров сосочек (рис. 24). Это позволяет
увидеть
в них конкременты, замазкообразную
массу, явления
холангита, стриктуры желчных протоков,
новообразования
и патологические изменения фатерова
сосочка.
Большое
диагностическое значение холангиоскопия
имеет для обнаружения мелких конкрементов
и микролитов,
которые не определяются при операционной
хо-лангиографии или другими методами.
Холангиоскопия значительно
повышает возможности распознавания и
уточнения
форм холангита. Наконец, с помощью
эндоскопического
исследования можно более точно установить
некоторые изменения фатерова сосочка,
особенно при
отечных формах папиллита и рубцовых
деформациях
сосочка.
По
нашим данным, включающим 150 наблюдений,
фиброхолангиоскопия
— весьма перспективный метод операционного
исследования желчных путей, необходимо
дальнейшее его клиническое изучение и
накопление опыта.
Рис.
24. Картина различных участков желчных
путей пои холангио-скопии
(норма).
ОПЕРАЦИОННАЯ
РЕВИЗИЯ ЖЕЛЧНЫХ ПУТЕЙ
Несмотря
на возможности, которые открывают
специальные
методы исследования, в ряде случаев
решающее
значение все же остается за осмотром,
пальпацией, а
также зондированием желчных путей.
Диагностическая
холедохотомия не потеряла своего
значения в качестве заключительного
метода исследования
желчных протоков при их непроходимости,
особенно
в сомнительных случаях для окончательного
подтверждения или отрицания
патологического состояния гепатикохоледоха
и фатерова сосочка. С такой принципиальной
С такой принципиальной
возможностью всегда следует считаться
и было бы
неправильно ориентироваться на отказ
от холедохо-томии
или противопоставлять ее другим методам
исследования.
Это в полной мере относится к пробной.
дуоде-нотомии
‘при подозрении на поражение фатерова
сосочка, особенно
на возможность его новообразования.
Операционную
ревизию желчных протоков следует,
конечно,
проводить по соответствующим показаниям,
в связи
с чем технику этих вмешательств подробно
приводим
ниже.
Тест по лечебному делу с ответами по теме ‘Заболевания желчных путей и печени’
Тест по лечебному делу с ответами по теме ‘Заболевания желчных путей и печени’ — Gee Test
наверх
 Биохимия11. Фармакология12. Военная и экстремальная медицина13. Судебная медицина14. Гигиена и основы экологии человека15. Общественное здоровье и здравоохранение16. Биомедицинская этика17. Философия18. Правоведение19. Пульмонология20. Гастроэнтерология и гепатология21. Нефрология22. Гематология23. Эндокринология24. Пропедевтика внутренних болезней25. Ревматические болезни26. Поликлиническая терапия и медико-социальная экспертиза27. Фтизиопульмонология28. Нервные болезни29. Психиатрия, наркология и медицинская психология30. Лучевая диагностика и лучевая терапия31. Педиатрия32. Дерматовенерология33. История Военно-медицинской академии 34. Профессиональные болезни35. Военно-полевая терапия36. Инфекционные болезни37. Клиническая фармакология38. История отечества, культурология, политология, социология и экономика39. История медицины40. Гистология, цитология и эмбриология41. Кардиология42. Анестезиология и реаниматология43. Заболевания щитовидной железы44. Заболевания молочной железы45. Заболевания сердца и сосудов46.
Биохимия11. Фармакология12. Военная и экстремальная медицина13. Судебная медицина14. Гигиена и основы экологии человека15. Общественное здоровье и здравоохранение16. Биомедицинская этика17. Философия18. Правоведение19. Пульмонология20. Гастроэнтерология и гепатология21. Нефрология22. Гематология23. Эндокринология24. Пропедевтика внутренних болезней25. Ревматические болезни26. Поликлиническая терапия и медико-социальная экспертиза27. Фтизиопульмонология28. Нервные болезни29. Психиатрия, наркология и медицинская психология30. Лучевая диагностика и лучевая терапия31. Педиатрия32. Дерматовенерология33. История Военно-медицинской академии 34. Профессиональные болезни35. Военно-полевая терапия36. Инфекционные болезни37. Клиническая фармакология38. История отечества, культурология, политология, социология и экономика39. История медицины40. Гистология, цитология и эмбриология41. Кардиология42. Анестезиология и реаниматология43. Заболевания щитовидной железы44. Заболевания молочной железы45. Заболевания сердца и сосудов46. Общая хирургия47. Заболевания легких и плевры48. Грыжи диафрагмы и брюшной стенки49. Заболевания пищевода50. Заболевания желудка и двенадцатиперстной кишки51. Заболевания кишечника52. Заболевания прямой кишки53. Заболевания желчных путей и печени54. Заболевания поджелудочной железы55. Амбулаторная хирургия56. Стоматология и челюстно-лицевая хирургия57. Травматология и ортопедия58. Урология59. Военно-полевая хирургия60. Детская хирургия61. Оториноларингология62. Офтальмология63. Оперативная хирургия и топографическая анатомия64. Акушерство65. Гинекология
Общая хирургия47. Заболевания легких и плевры48. Грыжи диафрагмы и брюшной стенки49. Заболевания пищевода50. Заболевания желудка и двенадцатиперстной кишки51. Заболевания кишечника52. Заболевания прямой кишки53. Заболевания желчных путей и печени54. Заболевания поджелудочной железы55. Амбулаторная хирургия56. Стоматология и челюстно-лицевая хирургия57. Травматология и ортопедия58. Урология59. Военно-полевая хирургия60. Детская хирургия61. Оториноларингология62. Офтальмология63. Оперативная хирургия и топографическая анатомия64. Акушерство65. Гинекология
- 1. растворение конкрементов литолитическими препаратами;
- 2. микрохолецистостомия;
- 3. дистанционная волновая литотрипсия;
- 4. холецистэктомия;
- 5. комплексная консервативная терапия.
- 1. эмпиема желчного пузыря;
- 2. рак головки поджелудочной железы;
- 3. водянка желчного пузыря;
- 4. острый перфоративный холецистит;
- 5. эхинококкоз печени.
- 1.
 выраженный диспепсический синдром;
выраженный диспепсический синдром; - 2. длительный анамнез;
- 3. сопутствующие изменения печени;
- 4. наличие эпизодов рецидивирующего панкреатита;
- 5. наличие конкрементов в желчном пузыре.
- 1. экстренная холецистэктомия;
- 2. срочная холецистэктомия;
- 3. срочная микрохолецистостомия под контролем УЗИ или ла¬пароскопии как окончательный этап;
- 4. дистанционная литотрипсия;
- 5. срочная микрохолецистостомия под контролем УЗИ или ла¬пароскопии с последующей отсроченной холецистэктомией.
- 1. рубцовые стриктуры внепеченочных желчных путей;
- 2. холедохолитиаз;
- 3. рак головки поджелудочной железы;
- 4. эхинококкоз печени;
- 5. метастазы в печень опухолей различной локализации.
- 1. острый деструктивный панкреатит;
- 2. острый деструктивный холецистопанкреатит;
- 3. динамическая непроходимость кишечника;
- 4. желчнокаменная кишечная непроходимость;
- 5.
 острый гнойный холангит.
острый гнойный холангит.
- 1. увеличенный безболезненный желчный пузырь в сочетании с желтухой;
- 2. увеличение печени, асцит, расширение вен передней брюш¬ной стенки;
- 3. желтуха, пальпируемый болезненный желчный пузырь, мест¬ные перитонеальные явления;
- 4. отсутствие стула, схваткообразные боли, появление пальпи¬руемого образования брюшной полости;
- 5. выраженная желтуха, увеличенная бугристая печень, кахексия.
- 1. комплексная консервативная терапия в условиях реанимаци¬онного отделения;
- 2. терапия в сочетании с эндоскопической декомпрессией тон¬кой кишки;
- 3. срочное хирургическое вмешательство: холецистэктомия с разделением билиодигестивного свища, энтеротомия, удале¬ние конкремента;
- 4. срочное хирургическое вмешательство: энтеротомия, удале¬ние желчного конкремента;
- 5. паранефральная блокада в сочетании с сифонной клизмой.
- 1. нагноение послеоперационной раны;
- 2.
 острый послеоперационный панкреатит;
острый послеоперационный панкреатит; - 3. интраоперационная травма желчных протоков;
- 4. рубцовая стриктура холедоха;
- 5. внутрибрюшное кровотечение.
- 1. отказаться от хирургического лечения, проводить консерва¬тивную терапию;
- 2. холецистэктомия под интубационным наркозом;
- 3. холецистэктомия под перидуральной анестезией;
- 4. хирургическая холецистостомия;
- 5. дистанционная волновая литотрипсия.
- 1. внутривенная инфузионная холангиография;
- 2. эндоскопическая ретроградная холангиопанкреатография;
- 3. чрескожная чреспеченочная холангиография;
- 4. УЗИ;
- 5. пероральная холецистохолангиография.
- 1. инфаркт миокарда;
- 2. тромбоэмболия легочной артерии;
- 3. острый послеоперационный панкреатит;
- 4. динамическая кишечная непроходимость;
- 5. внутрибрюшное кровотечение.
- 1. эндоскопическая папиллосфинктеротомия;
- 2.
 комплексная консервативная терапия;
комплексная консервативная терапия; - 3. трансдуоденальная папиллосфинктеропластика;
- 4. холедохотомия с наружным дренированием холедоха;
- 5. экстракорпоральная литотрипсия.
- 1. холецистостомия под контролем УЗИ;
- 2. панкреатодуоденальная резекция в один этап;
- 3. наложение билиодигестивного анастомоза;
- 4. декомпрессия желчных путей, после разрешения желтухи -панкреатодуоденальная резекция;
- 5. симптоматическая консервативная терапия.
- 1. перфорация 12-перстной кишки;
- 2. острый холангит;
- 3. желудочно-кишечное кровотечение;
- 4. острый панкреатит;
- 5. непроходимость кишечника.
- 1. пероральная холецистохолангиография;
- 2. лапароскопия;
- 3. обзорный рентгеновский снимок брюшной полости;
- 4. УЗИ;
- 5. эндоскопическая ретроградная холангиопанкреатография.
- 1. а, б, в;
- 2. а, б, г;
- 3. в, г, д;
- 4.
 б, д;
б, д; - 5. б, в, д.
- 1. острый деструктивный панкреатит;
- 2. подпеченочный абсцесс;
- 3. перфорация желчного пузыря, перитонит;
- 4. желчнокаменная непроходимость кишечника;
- 5. тромбоз мезентериальных сосудов.
- 1. острый панкреатит;
- 2. перфорация 12-перстной кишки;
- 3. холангит;
- 4. кровотечение из области вмешательства;
- 5. острая кишечная непроходимость.
- 1. трансдуоденальная папиллосфинктеропластика;
- 2. супрадуоденальная холедоходуоденостомия;
- 3. эндоскопическая папилосфинктеротомия;
- 4. гепатикоеюностомия;
- 5. операция Микулича.
- 1. пальпация желчного протока;
- 2. трансиллюминация;
- 3. зондирование протоков;
- 4. фиброхолангиоскопия;
- 5. ревизия корзинкой Дормиа.
- 1. механическая желтуха вследствие холедохолитиаза;
- 2. цирроз печени;
- 3. инфекционный гепатит;
- 4.
 синдром Жильбера;
синдром Жильбера; - 5. гемохроматоз.
- 1. повторная лапаротомия с целью извлечения конкремента;
- 2. проведение литолитической терапии через дренаж;
- 3. дистанционная волновая литотрипсия;
- 4. эндоскопическая папиллосфинктеротомия;
- 5. чрескожное чреспеченочное эндобилиарное вмешательство.
- 1. эндоскопическая папиллосфинктеротомия;
- 2. гепатикоеюностомия;
- 3. эндоскопическое проведение назобилиарного дренажа выше стриктуры;
- 4. холедоходуоденостомия;
- 5. чрескожная чреспеченочная гепатикостомия.
- 1. показатели СОЭ;
- 2. уровень активности щелочной фосфатазы;
- 3. активность панкреатических ферментов;
- 4. показатели опухолевого маркера СА-19-9;
- 5. результаты копрологического исследования.
- 1. экстренная операция — повторное дренирование протока;
- 2. лапароскопия с диагностической и лечебной целью;
- 3.
 наблюдение за больным, УЗИ-контроль;
наблюдение за больным, УЗИ-контроль; - 4. попытаться ввести дренаж вслепую;
- 5. фистулография.
- 1. внутрипеченочное расположение желчного пузыря;
- 2. пожилой и старческий возраст больных;
- 3. перфоративный холецистит с развитием перитонита;
- 4. отсутствие конкрементов в желчном пузыре;
- 5. развитие эмпиемы желчного пузыря.
- 1. наружное дренирование желчных протоков;
- 2. холецистостомия;
- 3. десимпатизация печеночной артерии;
- 4. ничего не предпринимать, рану ушить;
- 5. холецистэктомия, дренирование брюшной полости.
- 1. лапароскопия;
- 2. эндоскопическая ретроградная холангиография;
- 3. чрескожная чреспеченочная холангиография;
- 4. спленопортография;
- 5. селективная ангиография ветвей чревного ствола.
- 1. холецистэктомия в срочном порядке;
- 2. консервативная терапия;
- 3. микрохолецистостомия под контролем УЗИ;
- 4.
 наложение хирургической холецистостомы;
наложение хирургической холецистостомы; - 5. дистанционная волновая литотрипсия.
- 1. холецистолитотомия с сохранением желчного пузыря;
- 2. лапароскопическая холецистэктомия;
- 3. микрохолецистостомия и санация желчного пузыря под кон¬тролем УЗИ;
- 4. холецистэктомия традиционным хирургическим доступом;
- 5. дистанционная волновая литотрипсия.
- 1. экстренная холецистэктомия;
- 2. консервативная терапия, динамическое наблюдение;
- 3. экстренная лапароскопия;
- 4. эндоскопическая ретроградная холангиография;
- 5. микрохолецистостомия под контролем УЗИ.
- 1. конкремента в области шейки желчного пузыря;
- 2. увеличения головки поджелудочной железы;
- 3. конкремента в проксимальной части холедоха;
- 4. папиллита;
- 5. стеноза дуоденального соска.
- 1. затампонировать участок кровотечения гемостатической губкой;
- 2. пережать пальцами гепато-дуоденальную связку, осушить рану, отдифференцировать источник кровотечения, прошить или перевязать;
- 3.
 затампонировать кровоточащий участок на 5-10 минут;
затампонировать кровоточащий участок на 5-10 минут; - 4. использовать для остановки кровотечения препарат желпластан;
- 5. применить лазерную коагуляцию.
- 1. перфорация желчного пузыря с развитием перитонита;
- 2. обтурация камнем пузырного протока;
- 3. острый папиллит;
- 4. холедохолитиаз;
- 5. ущемленный камень дуоденального сосочка.
- 1. эндоскопическую папиллосфинктеротомию;
- 2. лапаротомию, дуоденотомию, извлечение конкремента;
- 3. микрохолецистостомию под контролем УЗИ;
- 4. лапаротомию, дренирование по Керру;
- 5. хирургическую холецистостомию.
- 1. микрохолецистостомия под контролем УЗИ;
- 2. холецистоэнтероанастомоз;
- 3. эндоскопическая папиллосфинктеротомия, установка стента в общий желчный проток;
- 4. холедоходуоденостомия;
- 5. хирургическая холецистостомия.
- 1. холецистэктомия, холедохолитотомия, дренирование прото¬ка по Керру;
- 2.
 эндоскопическая установка назобилиарного зонда для разре¬шения желтухи;
эндоскопическая установка назобилиарного зонда для разре¬шения желтухи; - 3. холецистэктомия, холедохолитотомия, холедоходуоденостомия;
- 4. микрохолецистостомия под контролем УЗИ;
- 5. дистанционная литотрипсия.
- 1. сочетании холецистита с дивертикулом двенадцатиперстной кишки;
- 2. первом приступе острого холецистита;
- 3. наличии местного перитонита;
- 4. декомпенсации сопутствующих заболеваний;
- 5. возрасте больного старше 65 лет.
- 1. ограничиться пробной лапаротомией;
- 2. наложить холецистоэнтероанастомоз;
- 3. наложить холецистостому;
- 4. произвести транспеченочное наружное дренирование желч¬ных протоков;
- 5. наложить гепатикостому.
- 1. холедохолитиаз;
- 2. стеноз БДС;
- 3. стриктура холедоха;
- 4. язва 12-перстной кишки;
- 5. хроническая дуоденальная непроходимость.
- 1. луковица;
- 2. нисходящий отдел;
- 3.
 нижняя горизонтальная ветвь;
нижняя горизонтальная ветвь; - 4. в области большого дуоденального соска;
- 5. область связки Трейца.
- 1. экстренная операция;
- 2. чрескожная чреспеченочная холангиография;
- 3. УЗИ;
- 4. сцинтиграфия печени;
- 5. реогепатография.
- 1. УЗИ;
- 2. сцинтиграфия печени;
- 3. внутривенная холеграфия;
- 4. ЭРХПГ;
- 5. спленопортография.
- 1. резидуальный холедохолитиаз;
- 2. папиллостеноз;
- 3. хронический гепатит;
- 4. язвенная болезнь двенадцатиперстной кишки;
- 5. дискинезия желчных путей.
- 1. стеноз большого дуоденального соска;
- 2. вклиненный в БДС камень;
- 3. рубцовая стриктура холедоха;
- 4. хронический панкреатит;
- 5. острый гепатит.
- 1. цирроз печени;
- 2. сдавление холедоха индуративно измененной головкой под¬желудочной железы;
- 3. холедохолитиаз;
- 4.
 хронический гепатит;
хронический гепатит; - 5. папиллостеноз.
- 1. лапаротомию, холедохолитотомию с глухим швом стенки желчного протока;
- 2. лапаротомию, трансдуоденальную папиллосфинктеропластику;
- 3. продолжить консервативную терапию с использованием ме¬тодов экстракорпоральной детоксикации;
- 4. лапаротомию, холедохолитотомию с дренированием холедоха по Керру;
- 5. применить форсированный диурез.
- 1. рак большого дуоденального соска;
- 2. персистирующий гепатит;
- 3. холедохолитиаз;
- 4. перихоледохеальный лимфаденит;
- 5. хронический панкреатит.
- 1. острый холангит;
- 2. тромбоэмболия ветвей легочной артерии;
- 3. тромбоз воротной вены;
- 4. гемобилия;
- 5. внутрибрюшное кровотечение.
- 1. исследование билирубина крови, мочи, кала;
- 2. исследование ферментов крови;
- 3. лапароскопия с биопсией печени;
- 4. ЭРХПГ;
- 5.
 фистулография.052 Основные рентгенологические признаки ХДН: а) замедленная эвакуация бария по 12-перстной кишке до 1-3 мин; б) расши¬рение диаметра 12-перстной кишке; в) ускорение эвакуации бария; г) увеличение ретрогастрального пространства; д) от-теснение желудка извне; е) дефект наполнения; ж) маятнико-образные движения бария в 12-перстной кишке. Выберите правильную комбинацию ответов:
фистулография.052 Основные рентгенологические признаки ХДН: а) замедленная эвакуация бария по 12-перстной кишке до 1-3 мин; б) расши¬рение диаметра 12-перстной кишке; в) ускорение эвакуации бария; г) увеличение ретрогастрального пространства; д) от-теснение желудка извне; е) дефект наполнения; ж) маятнико-образные движения бария в 12-перстной кишке. Выберите правильную комбинацию ответов: - 6. а, б, в;
- 7. а, б, ж;
- 8. в, г, д;
- 9. д, е, ж;
- 10. б, д, ж.
- 1. гастрит;
- 2. хроническая дуоденальная непроходимость;
- 3. язвенная болезнь 12-перстной кишки;
- 4. стеноз БДС;
- 5. панкреатит.
- 1. эндоскопическая папиллосфинктеротомия с удалением кам¬ней корзинкой Дормиа;
- 2. холедохотомия;
- 3. холедоходуоденоанастомоз;
- 4. камнедробление;
- 5. холедохоэнтеростомия.
- 1. холедохолитиаз;
- 2. стеноз дистальной части холедоха;
- 3. рубцовая стриктура холедоха;
- 4.
 хроническая дуоденальная непроходимость;
хроническая дуоденальная непроходимость; - 5. гепатит.
- 1. лапароскопию;
- 2. каваграфию;
- 3. сцинтиграфию печени;
- 4. УЗИ с диагностичекой пункцией;
- 5. аортографию.
- 1. первичный рак печени;
- 2. рак головки поджелудочной железы с обтурацией общего желчного протока;
- 3. острый калькулезный холецистит;
- 4. гнойный холангит;
- 5. вирусный гепатит.
- 1. эхинококкоз;
- 2. альвеококкоз;
- 3. амебиаз;
- 4. описторхоз;
- 5. аскаридоз.
- 1. эхинококкоз печени;
- 2. абсцесс печени;
- 3. гемангиома печени;
- 4. непаразитарная киста печени;
- 5. метастатическое поражение печени.
- 1. повторить УЗИ через 4-6 месяцев;
- 2. незамедлительное дообследование для уточнения диагноза и характера образования;
- 3. экстренная госпитализация в хирургический стационар и операция;
- 4.
 амбулаторное наблюдение за больным;
амбулаторное наблюдение за больным; - 5. срочное проведение ЭГДС.
- 1. симптоматическая терапия;
- 2. наблюдение онколога;
- 3. госпитализация в хирургический стационар;
- 4. компьютерная томография через 6 месяцев;
- 5. амбулаторное проведение целиакографии.
- 1. выяснение уровня С-реактивного протеина, ЯМР;
- 2. АЛТ, ACT, сцинтиграфия печени;
- 3. обзорная рентгенография брюшной полости, аортография;
- 4. ЭГДС, спленопортография;
- 5. выявление уровня α-фетопротеина, УЗИ, пункционная био¬псия печени, лапароскопия.
- 1. а, в, д;
- 2. б, г, д, е;
- 3. в, д, ж, з;
- 4. а, в;
- 5. в, е, и, к.
- 1. серомукоид;
- 2. α-фетопротеин;
- 3. С-реактивный протеин;
- 4. коэффициент Ритиса;
- 5. подобных тестов не существует.
- 1. атрезия воротной вены;
- 2. хронический индуративный панкреатит;
- 3.
 пилефлебит;
пилефлебит; - 4. болезнь Бадда-Хиари;
- 5. метастатическое поражение лимфатических узлов гепатодуо-денальной связки.
- 1. о надпеченочном блоке;
- 2. о внутрипеченочном блоке;
- 3. о подпеченочном блоке;
- 4. о смешанном блоке;
- 5. о гиперспленизме.
- 1. болезнь Киари;
- 2. цирроз печени;
- 3. пилефлебит;
- 4. атрезия ветвей портальной вены;
- 5. хронический индуративный панкреатит.
- 1. синдроме Мирриззи;
- 2. циррозе печени;
- 3. вирусном гепатите;
- 4. метастатическом поражении печени;
- 5. болезни Кароли.
- 1. ЭГДС;
- 2. лапароскопия;
- 3. УЗИ печени;
- 4. спленопортография;
- 5. эндоскопическая ретроградная панкреатография.
- 1. язвенная болезнь желудка;
- 2. синдром Меллори-Вейсса;
- 3. эрозивный гастродуоденит;
- 4. варикозное расширение вен пищевода;
- 5.
 синдром Делафуа.
синдром Делафуа.
1. Анатомия человека2. Патологическая анатомия3. Нормальная физиология4. Патофизиология5. Биология6. Микробиология7. Общая и клиническая иммунология8. Медицинская и биологическая физика9. Общая и биоорганическая химия10. Биохимия11. Фармакология12. Военная и экстремальная медицина13. Судебная медицина14. Гигиена и основы экологии человека15. Общественное здоровье и здравоохранение16. Биомедицинская этика17. Философия18. Правоведение19. Пульмонология20. Гастроэнтерология и гепатология21. Нефрология22. Гематология23. Эндокринология24. Пропедевтика внутренних болезней25. Ревматические болезни26. Поликлиническая терапия и медико-социальная экспертиза27. Фтизиопульмонология28. Нервные болезни29. Психиатрия, наркология и медицинская психология30. Лучевая диагностика и лучевая терапия31. Педиатрия32. Дерматовенерология33. История Военно-медицинской академии 34. Профессиональные болезни35. Военно-полевая терапия36. Инфекционные болезни37. Клиническая фармакология38. История отечества, культурология, политология, социология и экономика39. История медицины40. Гистология, цитология и эмбриология41. Кардиология42. Анестезиология и реаниматология43. Заболевания щитовидной железы44. Заболевания молочной железы45. Заболевания сердца и сосудов46. Общая хирургия47. Заболевания легких и плевры48. Грыжи диафрагмы и брюшной стенки49. Заболевания пищевода50. Заболевания желудка и двенадцатиперстной кишки51. Заболевания кишечника52. Заболевания прямой кишки53. Заболевания желчных путей и печени54. Заболевания поджелудочной железы55. Амбулаторная хирургия56. Стоматология и челюстно-лицевая хирургия57. Травматология и ортопедия58. Урология59. Военно-полевая хирургия60. Детская хирургия61. Оториноларингология62. Офтальмология63. Оперативная хирургия и топографическая анатомия64. Акушерство65. Гинекология
История медицины40. Гистология, цитология и эмбриология41. Кардиология42. Анестезиология и реаниматология43. Заболевания щитовидной железы44. Заболевания молочной железы45. Заболевания сердца и сосудов46. Общая хирургия47. Заболевания легких и плевры48. Грыжи диафрагмы и брюшной стенки49. Заболевания пищевода50. Заболевания желудка и двенадцатиперстной кишки51. Заболевания кишечника52. Заболевания прямой кишки53. Заболевания желчных путей и печени54. Заболевания поджелудочной железы55. Амбулаторная хирургия56. Стоматология и челюстно-лицевая хирургия57. Травматология и ортопедия58. Урология59. Военно-полевая хирургия60. Детская хирургия61. Оториноларингология62. Офтальмология63. Оперативная хирургия и топографическая анатомия64. Акушерство65. Гинекология
Справочник заболеваний
Хирургическая тактика при этих осложнениях может меняться коренным образом в сторону расширения объема оперативного вмешательства. Что потребует выполнения санации желчных протоков эндоскопическим путем, либо проведения полостной открытой операции, с возможным наружным дренированием желчных протоков на длительное время.
«Золотой стандарт»
Холецистэктомия — операция по удалению желчного пузыря. При холецистэктомии патологически измененный желчный пузырь удаляют полностью вместе с конкрементами путем хирургического вмешательства.
По данным зарубежной и отечественной литературы, у 90–95% больных холецистэктомия полностью излечивает симптомы, которые наблюдались до операции.
Лапароскопическая холецистэктомия является «золотым стандартом» в лечении хронического калькулезного холецистита и зачастую при лечении острого холецистита. Ее выполняют с помощью специального инструментария через 3–4 прокола в брюшной стенке диаметром 5–10 мм. В эти проколы вводят специальные трубки (троакары), в брюшную полость с помощью инсуффлятора (насоса) вводят углекислый газ — накладывают карбоксиперитонеум. Введенный газ создает пространство для работы инструментов. Через троакары с помощью видеокамеры и специальных зажимов и электродов выделяют анатомические элементы желчного пузыря — пузырную артерию и пузырный проток, накладывают на них специальные металлические скобки (клипсы) и пересекают. Современные видеосистемы предоставляют отличное качество изображения и визуализации структур, намного превосходящие таковые при открытых операциях. Желчный пузырь отделяют от печени и удаляют через один из проколов брюшной стенки.
Современные видеосистемы предоставляют отличное качество изображения и визуализации структур, намного превосходящие таковые при открытых операциях. Желчный пузырь отделяют от печени и удаляют через один из проколов брюшной стенки.
Преимуществами лапароскопической холецистэктомии является малотравматичность, что сказывается на отсутствии болевого синдрома в послеоперационной ране, быстрый период восстановления после операции, снижение сроков пребывания в стационаре (1–2 дня), быстрое восстановление сил и возвращение к повседневной деятельности и работе.
К сожалению, в 1–5% случаев выполнить холецистэктомию из лапароскопического доступа невозможно. Чаще всего это обусловлено анатомическими аномалиями желчных путей, выраженным воспалительным или спаечным процессом, развитием интраоперационных осложнений. В таких случаях выполняют переход на открытую операцию (конверсия).
Открытую холецистэктомию выполняют из верхней срединной лапаротомии или косых подреберных разрезов типа доступов Кохера и Федорова, которые обеспечивают широкий доступ к желчному пузырю, желчным протокам и другим органам брюшной полости. При таких доступах выполнимы все методы интраоперационной ревизии внепеченочных желчных протоков, включая измерение их ширины, зондирование протоков, интраоперационную холангиографию, интраоперационное ультразвуковое исследование, интраоперационное эндоскопическое исследование желчных протоков.
При таких доступах выполнимы все методы интраоперационной ревизии внепеченочных желчных протоков, включая измерение их ширины, зондирование протоков, интраоперационную холангиографию, интраоперационное ультразвуковое исследование, интраоперационное эндоскопическое исследование желчных протоков.
Это должен знать каждый
Многие задаются вопросом: как можно жить без желчного пузыря? Здоровый желчный пузырь действительно необходимый орган, который принимает участие в пищеварении. Во время поступления пищи из желудка в двенадцатиперстную кишку происходит сокращение желчного пузыря и из него желчь попадает в кишечник, где участвует в пищеварении. Однако патологически измененный желчный пузырь нормально не функционирует, а, наоборот, вызывает больше проблем: болевой синдром, поддержание хронического резервуара инфекции, нарушение функции как печени, так и поджелудочной железы. Поэтому холецистэктомия, выполненная по показаниям, улучшает состояние пациента и не отражается на функции пищеварения.
Общий риск летальности вследствие холецистэктомии варьирует в пределах 0,14–0,15%, зависит от возраста, физического состояния пациентов и формы желчнокаменной болезни.
Послеоперационный период
В первый месяц после операции происходит восстановление функций и общего состояния организма. Тщательное соблюдение врачебных рекомендаций является залогом полноценного восстановления здоровья. Основными направлениями реабилитации являются соблюдение режима физической нагрузки, диета, медикаментозное лечение и уход за ранами.
Людям с удаленным желчным пузырем в первый месяц необходимо соблюдение диеты на время, пока организм адаптируется к изменениям функционирования желчной системы. В этот период возможны (но не обязательны) послабления стула или его учащение до 2–3 раз в сутки. Через 4–6 месяцев после операции человек может вести обычный образ жизни, практически без ограничений. Однако у отдельных пациентов, у которых заболевание протекало длительное время и с осложнениями, часть симптомов не удается устранить холецистэктомией, и они требуют дальнейшего лечения.
Медикаментозное лечение
После лапароскопической холецистэктомии обычно требуется минимальное медикаментозное лечение. Болевой синдром после операции обычно выражен незначительно, но у некоторых пациентов требуется применение анальгетиков в течение 2–3 дней. Обычно это нестероидные противовоспалительные препараты, например кеторол. У некоторых пациентов возможно применение спазмолитиков в течение 7–10 дней. Прием препаратов урсодезоксихолевой кислоты (Урсосан) позволяет улучшить текучесть желчи и снизить риски формирования микроконкрементов в желчных путях. Прием медикаментозных препаратов должен выполняться строго по указанию лечащего врача в индивидуальной дозировке.
Уход за послеоперационными ранами
В стационаре на послеоперационные раны, располагающиеся в местах введения инструментов, будут наложены специальные наклейки. Душ можно принимать, начиная с 48 часов после оперативного вмешательства. Попадание воды на швы не является противопоказанным, однако не следует мыть раны с гелями или мылом и тереть мочалкой. После принятия душа следует смазать раны 5% раствором йода. Раны можно вести открытым методом, без повязок. Прием ванн или купание в бассейнах и водоемах запрещается до снятия швов и в течение 5 дней после снятия швов.
После принятия душа следует смазать раны 5% раствором йода. Раны можно вести открытым методом, без повязок. Прием ванн или купание в бассейнах и водоемах запрещается до снятия швов и в течение 5 дней после снятия швов.
Швы после лапароскопической холецистэктомии снимают на 7–8-е сутки после операции. Это амбулаторная процедура, снятие швов проводит доктор или перевязочная медицинская сестра, процедура является безболезненной.
Диета
Соблюдение диеты требуется в срок до 1 месяца после лапароскопической холецистэктомии. Рекомендовано исключение алкоголя, легкоусваиваемых углеводов, жирной, острой, жареной, пряной пищи, регулярное питание 4–6 раз в день. Вводить новые продукты в рацион следует постепенно, через 1 месяц после операции возможно снятие диетических ограничений по рекомендации гастроэнтеролога.
Возможные осложнения холецистэктомии
Любая операция может сопровождаться нежелательными эффектами и осложнениями. После любой технологии холецистэктомии возможны осложнения.
Это могут быть подкожные кровоизлияния, которые проходят самостоятельно в течение 7–10 дней. Специального лечения не требуют. Частота раневой инфекции составляет 1–2%, нагноение ран – редкое осложнение, однако оно может потребовать хирургического вмешательства под местной анестезией с последующими перевязками и применением антибиотиков. У 0,3% больных возможно развитие грыж в местах проколов. Данное осложнение чаще всего связано с особенностями соединительной ткани пациента и может потребовать хирургической коррекции в отдаленном периоде. Очень редко возможны осложнения со стороны брюшной полости, которые могут потребовать повторных вмешательств либо малоинвазивных пункций под контролем ультразвука. Частота таких осложнений не превышает 0,001%. Это могут быть внутрибрюшные кровотечения, гематомы, гнойные осложнения в брюшной полости.
Повреждения желчных протоков являются одними из наиболее тяжелых осложнений при всех видах холецистэктомии, в том числе и лапароскопической. В традиционной открытой хирургии частота тяжелых повреждений желчных протоков составляла 1 на 1500 операций. В первые годы освоения лапароскопической технологии частота этого осложнения выросла в 3 раза — до 1 на 500 операций, однако с ростом опыта хирургов и развитием лапароскопической технологии стабилизировалась на уровне 1 на 1000 операций. Известный российский специалист по этой проблеме Эдуард Израилевич Гальперин в 2004 году писал: «Ни длительность заболевания, ни характер операции (неотложная или плановая), ни диаметр протока и даже профессиональный стаж хирурга не влияют на возможность повреждения протоков…» Возникновение такого осложнения может потребовать повторного оперативного вмешательства и длительного периода реабилитации.
В традиционной открытой хирургии частота тяжелых повреждений желчных протоков составляла 1 на 1500 операций. В первые годы освоения лапароскопической технологии частота этого осложнения выросла в 3 раза — до 1 на 500 операций, однако с ростом опыта хирургов и развитием лапароскопической технологии стабилизировалась на уровне 1 на 1000 операций. Известный российский специалист по этой проблеме Эдуард Израилевич Гальперин в 2004 году писал: «Ни длительность заболевания, ни характер операции (неотложная или плановая), ни диаметр протока и даже профессиональный стаж хирурга не влияют на возможность повреждения протоков…» Возникновение такого осложнения может потребовать повторного оперативного вмешательства и длительного периода реабилитации.
Венозный тромбоз и тромбоэмболия легочной артерии являются опасными для жизни осложнениями любого оперативного вмешательства. Именно поэтому большое внимание уделяют профилактике этих осложнений. В зависимости от определенной лечащим врачом у вас степени риска будут назначены профилактические мероприятия: эластическая компрессия нижних конечностей и введение низкомолекулярных гепаринов.
Любое оперативное вмешательство несет определенный риск осложнений, однако отказ от операции или затягивание с ее выполнением также имеет риск развития тяжелых заболеваний или осложнений. Выполнение холецистэктомии в плановом порядке, при незапущенных формах болезни несет гораздо меньший риск нежелательных отклонений от нормального течения операции и послеоперационного периода. Большое значение также имеет и ответственность пациента за строгое соблюдение режима и рекомендаций врачей.
Реабилитация после холецистэктомии
Большинство пациентов после оперативного лечения полностью избавляются от симптомов, которые их беспокоили, и через 1 месяц после операции возвращаются к обычной жизни. Если холецистэктомия выполнена вовремя, до возникновения сопутствующей патологии со стороны других органов пищеварительной системы, пациент может питаться без ограничений (что не отменяет необходимости правильного здорового питания), не ограничивать себя в физических нагрузках, не принимать специальных препаратов.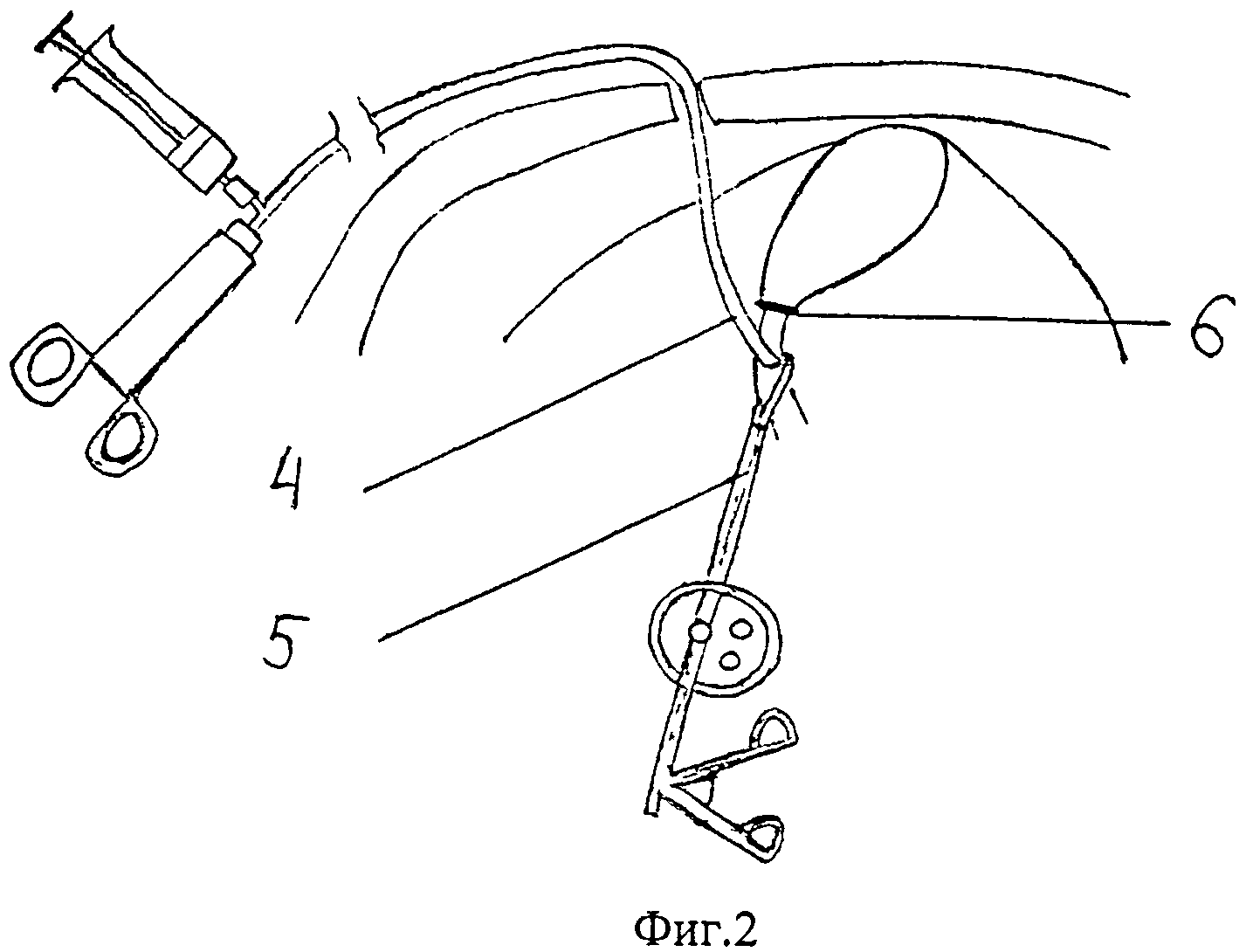
Мы всегда рады помочь!
В нашем отделении выполняется весь спектр диагностических процедур и операций по лечению ЖКБ, а также других заболеваний печени и поджелудочной железы. Обращайтесь к нам, мы вам поможем!
Хирургия печени и поджелудочной железы
ЭВОЛЮЦИЯ ПРОБЛЕМЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ МЕХАНИЧЕСКОЙ ЖЕЛТУХИ НА ЗАПАДНОМ УРАЛЕ | Палатова
1. етшев П. С. Механическая желтуха: причины и диагностические подходы (лекция) /Анналы хирургической гепатологии, 2011, том 16, № 3, с. 50-57
2. Гальперин Э. И. Диагностика и лечение больных механической желтухой/Советская медицина, 1972, № 8. С. 46-51
3. Гальперин Э. И., Момунова О. Н. Классификация тяжести механической желтухи/Хирургия, 2014, № 1, с. 5-9
4. Котельникова Л. П. Состояние печени и желчных путей в оценке хирургической тактики при желчнокаменной болезни /автореф. Докт дисс., Пермь, 1995
Котельникова Л. П. Состояние печени и желчных путей в оценке хирургической тактики при желчнокаменной болезни /автореф. Докт дисс., Пермь, 1995
5. Майстренко Н. А. Стукалов В. В., Прядко А. С. и др. Диагностика и лечение синдрома механической желтухи доброкачественного генеза /Анналы хирургической гепатологии, 2011, том 16, № 3, с. 26-34
6. Мансурова И. Д. Биохимия печени больных гепатитами и циррозом/Автореф. Дисс. Докт., Душанбе, 1966.
7. Натальский А. А. Современные принципы диагностики и лечения синдрома механической желтухи /автореф. Докт. Дисс., Рязань, 2015
8. Палатова Л. Ф. Хирургические заболевания желчных путей, сопровождающиеся желтухой, их взаимосвязь с патологией печени /автореф. Докт. Дисс., Пермь, 1977.
9. Савельев В. С., Кириенко А. И. Клиническая хирургия. / Национальное руководство, том 2, 2008.
10. Семендяева М. Е. Холангиолитический гепатит / Советская медицина, 1961, № 5, с. 52-60
11. Смирнов Е. В. К хирургическому лечению обтурационной желтухи/Советская медицина, 1972, № 8, с. 62-66
12. Тер-Григорова Е.Н., Тер-Григоров В. С. Врожденный вирусный гепатит / М. Медицина, 1967
13. Шерлок Ш. Заболевания печени и желчных путей/ Ш. Шерлок, Дж. Дули, М. Гэотар-Медицина, 1999.
УЛЬТРАЗВУКОВЫЕ ПРИЗНАКИ ЖЕЛЧНОГО ПУЗЫРЯ У БОЛЬНЫХ ОСТРЫМ ХОЛЕЦИСТИТОМ И ОБСТРУКЦИЕЙ ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ В СЛУЧАЯХ ВИЗУАЛИЗАЦИИ В ЕГО СТЕНКЕ ВЕНОЗНО-АРТЕРИАЛЬНОГО ТИПА КРОВОТОКА | Верзакова
1. Трофимова Е.Ю., Шаврина Н.В., Титова О.Н., Клыпа Д.С. Ультразвуковая диагностика отрыва желчного пузыря у пациента с закрытой травмой живота // Ультразвуковая и функциональная диагностика. 2012. № 6. С. 77–80. [Trofimova E.Yu., Shavrina N.V., Titova O.N., Klypa D.S. Ul’trazvukovaya diagnostika otryva zhelchnogo puzyrya u pacienta s zakrytoj travmoj zhivota. Ul’trazvukovaya i funkcional’naya diagnostika, 2012, No. 6, рр. 77–80 (In Russ.)].
2. Андреев А.В., Дурлештер В.М., Токаренко Е.В., Левешко А.И., Шепелев А.А. Ультразвуковая диагностика ятрогенных повреждений желчных протоков // Медицинская визуализация. 2014. № 1. С. 37–45. [Andreev A.V., Durleshter V.M., Tokarenko E.V., Leveshko A.I., SHepelev A.A. Ul’trazvukovaya diagnostika yatrogennyh povrezhdenij zhelchnyh protokov. Medicinskaya vizualizaciya, 2014, No. 1, рр. 37–45 (In Russ.)].
3. Рязанцев А.А., Митьков В.В. Трехмерная эхография как дополнительная методика в изучении вариантов анатомического строения желчевыводящих путей // Ультразвуковая и функциональная диагностика. 2010. № 1. С. 105–117. [Ryazancev A.A., Mit’kov V.V. Trekhmernaya ehkhografiya kak dopolnitel’naya metodika v izuchenii variantov anatomicheskogo stroeniya zhelchevyvodyashchih putej. Ul’trazvukovaya i funkcional’naya diagnostika, 2010, No. 1, рр. 105–117 (In Russ.)].
4. Брюховецкий Ю.А. Ультразвуковое исследование желчевыводящей системы // Практическое руководство по ультразвуковой диагностике. Общая ультразвуковая диагностика / под ред. В.В.Митькова. М.: Видар, 2003. С. 133–194. [Bryuhoveckij Yu.A. Ul’trazvukovoe issledovanie zhelchevyvodyashchej sistemy. Prakticheskoe rukovodstvo po ul’trazvukovoj diagnostike. Obshchaya ul’trazvukovaya diagnostika / pod red. V.V. Mit’kova. Moscow: Vidar, 2003, рр. 133–194 (In Russ.)].
5. Лапкин К.В., Иванов В.А., Омар Хассан, Морозова С.В. Ультразвуковая томография в диагностике форм острого холецистита // Визуализация в клинике. 1995. № 6. С. 19–22. [Lapkin K.V., Ivanov V.A., Omar Hassan, Morozova S.V. Ul’trazvukovaya tomografiya v diagnostike form ostrogo holecistita. Vizualizaciya v klinike, 1995, No. 6, рр. 19–22 (In Russ.)].
6. Тимербулатов В.М., Верзакова И.В. Ультразвуковая диагностика острого холецистита и его осложнений // Анналы хирургической гепатологии. 2008. Т. 13, № 1. С. 76–82. [Timerbulatov V.M., Verzakova I.V. Ul’trazvukovaya diagnostika ostrogo holecistita i ego oslozhnenij. Annaly hirurgicheskoj gepatologii, 2008, Vol. 13, No. 1, рр. 76–82 (In Russ.)].
7. Митьков В.В., Митькова М.Д., Мумладзе Р.Б. Возможности допплеровских методик исследования в диагностике воспалительных заболеваний желчного пузыря // Ультразвуковая диагностика. 2000. № 1. С. 5–14. [Mit’kov V.V., Mit’kova M.D., Mumladze R.B. Vozmozhnosti dopplerovskih metodik issledovaniya v diagnostike vospalitel’nyh zabolevanij zhelchnogo puzyrya. Ul’trazvukovaya diagnostika. 2000, No. 1, рр. 5–14 (In Russ.)].
8. Paulson E.K., Kliewer M.A., Hertzberg B.S. Diagnosis of cholecystitis with color Doppler sonography: significance of arterial flow in thickened gallbladder wall. AJR., 1994, Vol. 162, рр. 1105–1108.
9. Jeffrey R.B., Nino-Murcia M., Ralls P.W. et al. Color Doppler sonography of the cystic artery: comparison of normal controls and patients with acute cholecystitis. J. Ultrasound Med., 1995, Vol. 14, рр. 33–36.
10. Warren B.L. Small vessel occlusion in acute acalculous cholecystitis. Surgery, 1992, Vol. 111, рр. 163–168.
11. Митьков В.В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов. М.: Издательский дом Видар-М, 2000. 152 с. [Mit’kov V.V. Dopplerografiya v diagnostike zabolevanij pecheni, zhelchnogo puzyrya, podzheludochnoj zhelezy i ih sosudov. Moscow: Izdatel’skij dom Vidar-M, 2000, 152 р. (In Russ.)].
12. Верзакова И.В., Тимербулатов М.В., Усатова О.С., Макарьева М.Л. Состояние гемодинамики по результатам дуплексного сканирования в висцеральных ветвях брюшной аорты при остром калькулезном холецистите, осложненным механической желтухой // Медицинский вестник Башкортостана. 2006. № 1. С. 27–28. [Verzakova I.V., Timerbulatov M.V., Usatova O.S., Makar’eva M.L. Sostoyanie gemodinamiki po rezul’tatam dupleksnogo skanirovaniya v visceral’nyh vetvyah bryushnoj aorty pri ostrom kal’kuleznom holecistite, oslozhnennym mekhanicheskoj zheltuhoj. Medicinskij vestnik Bashkortostana, 2006, No. 1, рр. 27–28 (In Russ.)].
13. Рязанцев А.А. Возможности ультразвуковой визуализации билиодигестивных анастомозов // Ультразвуковая и функциональная диагностика. 2010. № 6. С. 12–25. [Ryazancev A.A. Vozmozhnosti ul’trazvukovoj vizualizacii biliodigestivnyh anastomozov. Ul’trazvukovaya i funkcional’naya diagnostika, 2010, No. 6, рр. 12–25 (In Russ.)].
14. Гончарова Т.П., Рязанцев А.А., Наумович Е.Г. Ультразвуковая визуализация стриктуры билиодигестивных анастомозов // Ультразвуковая и функциональная диагностика. 2013. № 6. С. 14–26. [Goncharova T.P., Ryazancev A.A., Naumovich E.G. Ul’trazvukovaya vizualizaciya striktury biliodigestivnyh anastomozov. Ul’trazvukovaya i funkcional’naya diagnostika, 2013, No. 6, рр. 14–26 (In Russ.)].
15. Lee H.J., Choi B.I., Han J.K. et al. Three-dimensional ultrasonography using the minimum transparent mode in obstructive biliary diseases: early experience. J. Ultrasound Med., 2002, Vol. 21, No. 4, рр. 443–453.
16. Национальные рекомендации «Острый холецистит» / Приняты на XII Съезде хирургов России «Актуальные вопросы хирургии». Ростов-на-Дону, 7–9 октября 2015 г. С. 6–7. [Nacional’nye rekomendacii «Ostryj holecistit» / Prinyaty na XII S’ezde hirurgov Rossii «Aktual’nye voprosy hirurgii». Rostov-na-Donu, 7–9 oktyabrya 2015 g, рр. 6–7 (In Russ.)].
17. Schiller V.L., Turner R.R., Sarti D.A. Color Doppler imaging of the gallbladder wall in acute cholecystitis: sonographic-patho-logic correlation. Abdom. Imaging, 1996, Vol. 21. P. 233–237.
18. Куликов В.П. Основы ультразвукового исследования сосудов М.: Издательский дом Видар-М, 2015. 392 с. [Kulikov V.P. Osnovy ul’trazvukovogo issledovaniya sosudov. Moscow: Izdatel’skij dom Vidar-M, 2015. 392 р. (In Russ.)].
19. Лысенко М.В., Савостьянов В.В., Кузин В.В., Ефименко Н.А., Сухоруков А.Л., 2003. Способ определения центрального венозного давления. Патент на изобретение. Заявка: 2002113693/14, 27.05.2002. Опубликовано: 20.10.2003. [Lysenko M.V., Savost’yanov V.V., Kuzin V.V., Efimenko N.A., Suhorukov A.L., 2003. Sposob opredeleniya central’nogo venoznogo davleniya. Patent na izobretenie. Zayavka: 2002113693/14, 27.05.2002. Opublikovano: 20.10.2003 (In Russ.)].
20. Верзакова О.В., Верзакова И.В. Способ интраоперационного измерения внутрипузырного давления в полости желчного пузыря // Сборник научных трудов по итогам научно-практической конференции «Информационные технологии в медицине и фармакологии», 10 августа 2015 г., г. Ростов-на-Дону. С. 28–31. [Verzakova O.V., Verzakova I.V. Sposob intraoperacionnogo izmereniya vnutripuzyrnogo davleniya v polosti zhelchnogo puzyrya. Sbornik nauchnyh trudov po itogam nauchno-prakticheskoj krnferencii «Informacionnye tekhnologii v medicine i farmakologii», 10 avgusta 2015 g. Rostov-na-Donu, 2015, рр. 28–31 (In Russ.)].
| Выпуск | Название | |
| Том 21, № 1 (2016) | РЕЦИДИВИРУЮЩАЯ МЕХАНИЧЕСКАЯ ЖЕЛТУХА ПРИ КИСТОЗНОЙ ДИЛАТАЦИИ ВНУТРИПЕЧЕНОЧНЫХ ЖЕЛЧНЫХ ПРОТОКОВ | Аннотация PDF (Rus) |
| М. Х. Татаршаов, В. С. Боташева, В. Р. Борлаков, З. Б. Каракотова, А. М. Махожев | ||
| «… трудности дооперационной и интраоперационной диагностики, а также нестандартный выбор оперативного …» | ||
| Том 20, № 3 (2015) | Лечение осложнений чреспеченочных эндобилиарных вмешательств при механической желтухе, обусловленной периампулярными опухолями | Аннотация PDF (Rus) |
| Ш. И. Каримов, М. Ш. Хакимов, А. А. Адылходжаев, С. У. Рахманов, В. Р. Хасанов | ||
| «… периампулярными опухолями с механической желтухой применением минимально инвазивных методов. Материал и методы …» | ||
| Том 22, № 1 (2017) | АТОМНО-СИЛОВАЯ МИКРОСКОПИЯ ЭРИТРОЦИТА ПРИ РАЗНОЙ СТЕПЕНИ ТЯЖЕСТИ МЕХАНИЧЕСКОЙ ЖЕЛТУХИ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) | Аннотация PDF (Rus) |
| Р. А. Пахомова, Ю. С. Винник, Л. В. Кочетова, Е. А. Воронова, Ю. С. Нагорнов | ||
| «… механической желтухи. Материал и методы. Механическую желтуху моделировали на 48 минипигах, морфофункциональные …» | ||
| Том 20, № 1 (2015) | Микробиологическая диагностика и выбор антимикробной терапии инфекции желчевыводящих путей | Аннотация PDF (Rus) |
| В. Г. Фирсова, В. В. Паршиков, И. В. Чеботарь, А. В. Лазарева, А. Г. Погорелов | ||
| «… поджелудочной железы, осложненной механической желтухой, оперирован двухэтапно. Выполнена холецистостомия под …» | ||
| Том 23, № 3 (2018) | Антеградное желчеотведение: анализ осложнений и способы их профилактики | Аннотация PDF (Rus) |
| Ю. В. Кулезнева, О. В. Мелехина, Л. И. Курмансеитова, М. Г. Ефанов, В. В. Цвиркун, А. Ю. Огнева, А. Б. Мусатов, И. В. Патрушев | ||
| «… дренирование желчных протоков выполнено 974 больным механической желтухой различного генеза. При дистальном …» | ||
| Том 21, № 4 (2016) | Хирургическое лечение альвеококкоза, осложненного механической желтухой | Аннотация PDF (Rus) |
| Н. В. Мерзликин, Б. И. Альперович, В. Ф. Цхай, Н. А. Бражникова, В. Г. Навасардян, В. Г. Зайцев | ||
| «… механической желтухой при альвеококкозе печени. Материал и методы. Оперировано 39 пациентов с механической …» | ||
| Том 20, № 4 (2015) | ЛЕЧЕНИЕ БОЛЬНЫХ МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ | Аннотация PDF (Rus) |
| А. Н. Айдемиров, Н. Г. Шахназарян, А. З. Вафин, А. М. Шахназарян | ||
| «… Цель. Улучшение результатов лечения больных механической желтухой различного генеза на основе …» | ||
| Том 24, № 2 (2019) | Антеградное билиарное стентирование в лечении механической желтухи | Аннотация PDF (Rus) |
| А. В. Андреев, В. М. Дурлештер, А. И. Левешко, С. А. Габриэль, Е. В. Токаренко | ||
| «… саморасширяющимися металлическими стентами при механической желтухе опухолевого генеза. Материал и методы …» | ||
| Том 20, № 4 (2015) | РЕТРОГРАДНЫЕ ЭНДОСКОПИЧЕСКИЕ ВМЕШАТЕЛЬСТВА В ЛЕЧЕНИИ БОЛЬНЫХ МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ | Аннотация PDF (Rus) |
| С. А. Габриэль, В. М. Дурлештер, А. Я. Гучетль, А. В. Андреев, В. Ю. Дынько, В. В. Гольфанд | ||
| «… пациентов с механической желтухой различной этиологии. Материал и методы. Анализировали эффективность …» | ||
| Том 24, № 1 (2019) | Формирование билиодигестивных анастомозов при механической желтухе опухолевого генеза под контролем эндо-УЗИ | Аннотация PDF (Rus) |
| М. Н. Рудакова, К. Ю. Рябов, А. Г. Жевелюк, М. М. Трандофилов, А. В. Прохоров, А. Ю. Попов | ||
| «… -УЗИ при механической желтухе опухолевого генеза в условиях измененной анатомии верхних отделов …» | ||
| Том 23, № 3 (2018) | Антеградные вмешательства при механической желтухе, обусловленной сочетанием нескольких этиологических факторов | Аннотация PDF (Rus) |
| А. В. Мамошин, Ю. В. Иванов, А. Л. Альянов, В. Ф. Мурадян, Д. С. Сумин | ||
| «… заболеваний, является механическая желтуха, которая существенно ухудшает клиническое течение заболевания …» | ||
| Том 24, № 1 (2019) | Ретроградное эндопротезирование желчных протоков при доброкачественных заболеваниях органов гепатопанкреатодуоденальной зоны | Аннотация PDF (Rus) |
| А. Е. Котовский, К. Г. Глебов, Т. Г. Дюжева, Т. А. Сюмарева, Б. М. Магомедова | ||
| «… восстановление оттока желчи при механической желтухе, уменьшение давления во внутри- и внепеченочных желчных …» | ||
| Том 24, № 2 (2019) | Механическая желтуха опухолевого генеза: подходы к миниинвазивной декомпрессии | Аннотация PDF (Rus) |
| Б. Л. Дуберман, Д. В. Мизгирёв, А. М. Эпштейн, В. Н. Поздеев, А. В. Тарабукин | ||
| «… В статье приведен обзор современных подходов к хирургическому лечению механической желтухи …» | ||
| Том 21, № 3 (2016) | Синдром Мириззи – вариабельность течения с двойным блоком желчеоттока | Аннотация PDF (Rus) |
| Ф. Г. Назыров, А. В. Девятов, У. Р. Салимов | ||
| Том 20, № 4 (2015) | ЭНДОСКОПИЧЕСКИЕ ТРАНСПАПИЛЛЯРНЫЕ МЕТОДЫ ЛЕЧЕНИЯ ХОЛЕДОХОЛИТИАЗА | Аннотация PDF (Rus) |
| М. В. Хрусталева, М. А. Дехтяр, Г. К. Ягубян | ||
| Том 25, № 1 (2020) | Успешное эндоскопическое лечение при холедохолитиазе с применением дистанционной литотрипсии и баллонной дилатации | Аннотация PDF (Rus) |
| В. Б. Ринчинов, А. Н. Плеханов, Б. Г. Гармаев | ||
| Том 20, № 3 (2015) | Эндоскопическое билиарное стентирование при опухолевой механической желтухе | Аннотация PDF (Rus) |
| А. С. Маады, О. Э. Карпов, Ю. М. Стойко, П. С. Ветшев, С. В. Бруслик, А. Л. Левчук | ||
| «… диагностики и лечения неоперабельных пациентов с опухолевой механической желтухой, а также частоту ранних и …» | ||
| Том 24, № 2 (2019) | Сочетанное применение миниинвазивных технологий в лечении механической желтухи | Аннотация PDF (Rus) |
| О. Э. Карпов, П. С. Ветшев, С. В. Бруслик, А. С. Маады, А. Л. Левчук, Т. И. Свиридова | ||
| Том 20, № 3 (2015) | Роль и место миниинвазивных дренирующих вмешательств в лечении заболеваний органов гепатопанкреатодуоденальной зоны у больных пожилого и старческого возраста | Аннотация PDF (Rus) |
| М. Ю. Кабанов, Д. М. Яковлева, К. В. Семенцов, Т. Л. Горшенин, С. М. Рыбаков, Т. Е. Аксенова, И. А. Яковлева, А. В. Краденов | ||
| «… билиарного тракта являются эффективными методами при механической желтухе у пациентов пожилого и старческого …» | ||
| Том 24, № 4 (2019) | Спорные вопросы билиарной декомпрессии при механической желтухе опухолевого генеза | Аннотация PDF (Rus) |
| Ю. В. Кулезнева, О. В. Мелехина, М. Г. Ефанов, Р. Б. Алиханов, А. Б. Мусатов, А. Ю. Огнева, В. В. Цвиркун | ||
| «… резектабельном процессе определяют по тяжести механической желтухи, холангиту, срокам предстоящей операции, а при …» | ||
| Том 22, № 2 (2017) | АНТЕГРАДНЫЕ ОПЕРАЦИИ ЖЕЛЧЕОТВЕДЕНИЯ ПРИ МЕХАНИЧЕСКОЙ ЖЕЛТУХЕ | Аннотация PDF (Rus) |
| О. И. Кит, Е. Н. Колесников, С. С. Мезенцев, А. В. Снежко | ||
| «… механической желтухе. Материал и методы. Антеградная операция желчеотведения выполнена 1271 больному: 977 …» | ||
| Том 24, № 2 (2019) | Возможности лечебных ретроградных миниинвазивных технологий при синдроме механической желтухи | Аннотация PDF (Rus) |
| М. И. Быков, В. А. Порханов, С. Л. Гобаева, В. В. Щава | ||
| «… пациентов с механической желтухой различной этиологии. Наглядно показаны современные тенденции развития …» | ||
| Том 20, № 1 (2015) | Билиарный папилломатоз как причина стриктуры конфлюенса желчных протоков | Аннотация PDF (Rus) |
| И. В. Погребняков, О. Н. Сергеева, В. А. Черкасов, В. О. Панов, О. В. Чистякова, Б. И. Долгушин | ||
| «… стриктуры внепеченочных желчных протоков и механической желтухи. Подробно освещены дифференциальная …» | ||
| Том 25, № 1 (2020) | Применение антеградного и комбинации антеградного и ретроградного методов хирургического лечения холангиолитиаза, осложненного механической желтухой | Аннотация PDF (Rus) |
| Э. Н. Праздников, Д. Р. Зинатулин, В. П. Шевченко, Р. Х. Умяров, М. А. Редькина, М. С. Хоптяр | ||
| «… холангиолитиазом и механической желтухой, применением антеградных технологий. Материал и методы. Анализировали …» | ||
| Том 20, № 3 (2015) | Ультразвуковая абляция (HIFU) в лечении нерезектабельных опухолей поджелудочной железы | Аннотация PDF (Rus) |
| О. Э. Карпов, П. С. Ветшев, С. В. Бруслик, Т. И. Свиридова, А. Л. Левчук, В. О. Саржевский, В. В. Судиловская | ||
| «… ,5 ± 1,5 см. В 50% наблюдений нерезектабельную опухоль поджелудочной железы осложняла механическая …» | ||
| Том 24, № 4 (2019) | Эндо-УЗИ в дифференциальной диагностике новообразований гепатопанкреатодуоденальной зоны | Аннотация PDF (Rus) |
| Ю. А. Пархисенко, А. И. Жданов, А. К. Воронцов, А. В. Филипцов, В. В. Поддубный, А. В. Трофимов | ||
| «… позволяет уточнить диагноз у больных с синдромом механической желтухи. Эти показатели служат объективным …» | ||
| 1 — 26 из 26 результатов | ||
Лапароскопическая холецистэктомия Текст научной статьи по специальности «Клиническая медицина»
УДК 616.381.366-089.87-072.1
Л.Е. СЛАВИН
Казанская государственная медицинская академия
Лапароскопическая холецистэктомия
I Славин Лев Ефимович
доктор медицинских наук,
профессор кафедры эндоскопии, общей и эндоскопической хирургии 420000, г. Казань, Сибирский тракт, д. 23, кв. 65, тел.: 8-917-391-53-45
В лекции представлена история развития лапароскопической холецистэктомии, обсуждены показания, противопоказания к выполнению данной операции. Особое внимание уделено безопасной технике и профилактике интраоперационных осложнений.
Ключевые слова: лапароскопическая холецистэктомия, показания, техника, осложнения.
L.E. SLAVIN
Kazan State Medical Academy
Laparoscopic cholecystectomy
In the lecture provides the history of laparoscopic cholecystectomy, discussed indications, contraindications to perform this operation. Particular attention is paid to safety technique and prevention of intraoperative complications.
Keywords: laparoscopic cholecystectomy, indications, technique, complications.
Современная история лечения ЖКБ насчитывает немногим более 100 лет с момента, когда в 1882 году Лангенбух выполнил первую холецистэктомию. Прогресс в лечении этого заболевания до начала семидесятых годов нашего столетия в основном был связан с общим развитием медицины — открытием антибиотиков, разработкой принципов общей анестезии, развитием лучевых методов диагностики. Однако в последние десятилетия начался новый этап в лечении холелитиаза. Особый интерес к этой проблеме связан с чрезвычайно высоким ростом заболеваемости ЖКБ в развитых странах (каждое послевоенное десятилетие этот показатель удваивается). На сегодняшний день желчекаменной болезнью страдает 10-12% населения в странах Запада и 3-4% азиатского населения. Двадцать миллионов американцев имеют конкременты в желчном пузыре, хирурги в этой стране ежегодно выполняют 600 000 холецистэктомий. Ежегодные медицинские затраты составляют 1 млрд долларов, и это без потери зарплаты, производительности труда и стоимости лечения послеоперационных осложнений. С другой стороны, технический прогресс и успехи фундаментальных наук нашли свое приложение в клинической медицине, что привело к пересмотру стратегии и тактики лечения ЖКБ.
Основные изменения коснулись не только лечебной, но и диагностической программ. Если до семидесятых годов в распоряжении врача были только рентгенография как метод диагностики и открытая операция как метод лечения, то за последние 20-25 лет были разработаны УЗИ, КТ и прямые способы контрастирования желчных путей. В лечении, кроме «открытой» операции, стали использовать лапароскопические
вмешательства. Появились такие методы консервативного лечения, как медикаментозное растворение и экстракорпоральная литотрипсия. Возник вопрос — какой метод диагностики и лечения следует избрать для конкретного больного?
До недавнего времени «золотым стандартом» в лечении ЖКБ была «открытая» холецистэктомия (ОХЭ), с результатами которой и сравнивали другие методы лечения. Летальность при плановых ОХЭ не превышала 0,5%. Количество осложнений в зависимости от характера заболевания и общего состояния пациента составляло 5-15%. Большинство из них не были опасны для жизни. Внедрение в практику оперативной лапароскопии произвело переворот во взглядах на хирургическое лечение ЖКБ. Показательны данные Американского института здоровья, где произведено сравнение различных способов лечения ЖКБ (табл. 1.)
Показания к лапароскопической холецистэктомии:
1. Хронический калькулезный холецистит,
2. Холестероз желчного пузыря,
3. Полипоз желчного пузыря,
4. Острый холецистит.
В период внедрения показания к этой операции были весьма ограничены. В последующем, по мере накопления опыта, показания к ЛХЭ стали шире и в настоящее время практически приближаются к таковым в «открытой» хирургии. Лапароскопическим доступом выполняют не только изолированную ЛХЭ, но и интраоперационную холангиографию, холедохотомию с эксплорацией ОЖП, наложение билиодигестивных анастомозов.
Таблица 1
Сравнение различных способов лечения ЖКБ
ОХЭ ЛХЭ
Возможность применения, % 98 90-95
Эффективность, % 100 100
Результаты
— летальность, % <1 <1
— осложнения, % 4-8 2-5
— повреждения ВЖП 0,1-0,2 0,2-0,6
— рецидив, % 0 0
Сроки лечения
— в стационаре 3-7 1-2
— амбулаторно 20-40 7-14
Дискомфорт выраженный слабый
ОХЭ — открытая холецистэктомия,
ЛХЭ — лапароскопическая холецистэктомия. Противопоказания к лапароскопической холецистэктомии Абсолютные противопоказания включают:
1. Общие противопоказания к проведению лапароскопической операции.
2. Рак желчного пузыря.
3. Плотный инфильтрат в зоне «шейки» желчного пузыря.
4. Поздние сроки беременности.
Относительные противопоказания:
1. Холедохолитиаз, механическая желтуха, холангит.
2. Острый панкреатит.
3. Синдром Мириззи.
4. Склероатрофический желчный пузырь.
5. Цирроз печени.
6. Острый холецистит на сроках более 72 часов от начала заболевания.
7. Перенесенные операции на органах верхнего этажа брюшной полости.
8. Псевдотуморозный панкреатит.
9. Язвенная болезнь.
10. Ожирение Ш-1У степени.
Вопрос об относительных противопоказаниях в каждом случае следует рассматривать индивидуально, в зависимости от уровня подготовки хирурга и оснащенности его операционной.
Дооперационное обследование
Проводят для уточнения характера основного заболевания, выявления его осложнений и сопутствующей патологии со стороны других органов. При анализе полученных результатов могут быть выявлены противопоказания к ЛХЭ как со стороны гепатобилиарной системы, так и общего характера, связанные с непереносимостью интубационного наркоза или ПП.
1. УЗИ — основной метод диагностики ЖКБ [5, 6]. Позволяет определить:
— наличие конкрементов в желчном пузыре и их размеры;
— наличие конкрементов в общем желчном протоке или косвенные признаки холедохолитиаза;
— степень воспалительно-инфильтративных изменений и толщину стенки желчного пузыря;
— диаметр общего печеночного, общего желчного и пузырного протоков;
— расположение и размеры желчного пузыря;
— наличие спаечного процесса в подпеченочном пространстве.
2. Биохимические анализы. Важны для диагностики сопутствующего гепатита и желтухи. Определяют уровень билирубина (прямую и непрямую фракции), АЛТ, АСТ и ЩФ.
3. Ретроградная холангиопанкреатикография (РХПГ) — прямое трансдуоденальное эндоскопическое контрастирование желчевыводящих путей. РХПГ выполняют при подозрении на холедохолитиаз, для выяснения характера механической желтухи и для изучения анатомии протоков перед операцией. Показания к РХПГ должны быть строго аргументированы, так как это инвазивная процедура, частота осложнений при которой достигает 3%, а летальность — 0,1-0,2%. Основные осложнения: панкреонекроз, перфорация двенадцатиперстной кишки, кровотечение в просвет ЖКТ.
4. Обследование сердечно-сосудистой, дыхательной и выделительной систем для исключения противопоказаний к операции. При необходимости проводят предоперационную подготовку и коррекцию выявленных нарушений.
Доступ
Типичную ЛХЭ выполняют из 4 доступов. Технические особенности, например, гепатомегалия или внутрипеченочное расположение желчного пузыря, могут потребовать введения дополнительного, пятого троакара для отведения печени. Разработана косметическая модификация ЛХЭ из трех доступов для технически простых случаев [8].
По одной из вышеописанных методик накладывают ПП. Первый троакар для лапароскопа вводят параумбиликаль-но по белой линии живота ниже пупка. У крупных и высоких пациентов удобнее ввести лапароскоп выше пупка. Последовательно осматривают брюшную полость. Все последующие инструменты вводят в брюшную полость строго под контролем видеомонитора.
Второй инструментальный троакар вводят в эпигастральной области как можно ближе к мечевидному отростку, чтобы угол между лапароскопом и троакаром приближался к 90°. Брюшную стенку пунктируют в косом направлении под углом в 45° так, чтобы стилет троакара появился в поле зрения правее круглой связки печени.
Третий и четвертый вспомогательные троакары вводят соответственно по среднеключичной линии на 4-5 см ниже реберной дуги и по передней подмышечной линии на уровне пупка. Важно, чтобы эти инструменты не находились на одной вертикальной линии.
Пятый троакар вводят при необходимости дополнительного отведения печени ретрактором. Брюшную стенку прокалывают в левом подреберье.
Осматривают печень и желчный пузырь. Уточняют диагноз и тактику.
Этапы операции
Тракция. Цель этого этапа — приподнять желчный пузырь, обнажить ворота печени и зону треугольника Кало для последующей препаровки.
На дно желчного пузыря накладывают мягкий анатомический зажим, введенный через доступ 4. Если из-за рубцового процесса или припаявшегося сальника дно желчного пузыря не визуализируется, выполняют препаровку тканей 1_-образным электродом или диссектором, введенным через доступ 2. Спайки между печенью и диафрагмой должны быть пересечены, так как затрудняют создание экспозиции. Зажимом дно желчного пузыря приподнимают, выполняя тракцию в цефалическом направлении и несколько латерально. Освобождают от спаек об-
ласть тела желчного пузыря. На карман Гартмана накладывают второй зажим, введенный через доступ 3. В процессе операции этот инструмент находится в левой руке хирурга. Последующая тракция возможна в двух вариантах — французском (А) и американском (Б):
А) В первом случае выполняют тракцию латерально, вниз и по направлению к передней брюшной стенке. Этот вариант расправляет треугольник Кало и открывает его обзору.
Б) Во втором случае выполняют тракцию вверх и латерально. При этом треугольник Кало сморщивается. Пузырный проток приближается к ОПП и становится непосредственным продолжением ОЖП. Именно такой вариант тракции — одна из причин высокого уровня повреждений ВЖП (до 1 %) в США в период освоения ЛХЭ.
Прицельному осмотру зоны «шейки» желчного пузыря может препятствовать нависающая увеличенная квадратная доля печени. Изменение положения тела и тракция, как правило, позволеют исправить ситуацию. При неэффективности этого приема через дополнительный 5 мм прокол в левом подреберье вводят ретрактор и приподнимают квадратную долю вверх. У полных пациентов осмотр и препаровка «шейки» желчного пузыря может быть затруднена из-за выраженной паравези-кальной клетчатки и увеличенных размеров большого сальника. Облегчить визуализацию ворот печени помогают ретрактор и лапароскоп со скошенной оптикой.
Рассечение брюшины. Мобилизацию начинают с рассечения брюшины 1_-образным электродом по переходной складке на уровне средней трети медиальной поверхности желчного пузыря. Далее 11-образный разрез продолжают над карманом Гартмана с переходом на латеральную стенку органа. Для сохранения принципа безопасности очень важно рассечь брюшину скорее дистально — в зоне кармана Гартмана, чем проксимально — над пузырным протоком или элементами гепатодуо-денальной связки. Рассекают только брюшину, без подлежащей клетчатки, захватывая и приподнимая ее электрохирургическим крючком. Ошибочный уровень рассечения брюшины нередко бывает первым звеном в цепи ошибок, приводящих в конечном счете к повреждению ВЖП [9].
Препаровка треугольника Кало. Тупо, при помощи диссектора, тупфера или «пяточки» электрохирургического крючка рассеченную брюшину вместе с подлежащей жировой клетчаткой смещают проксимально, по направлению к гепатодуоде-нальной связке. Обнажают пузырный проток и артерию. Разделение тканей производят крючком или диссектором строго вдоль стенки желчного пузыря, не углубляясь в сторону ОПП. Пузырный проток и артерию очищают от спаек и жировой клетчатки, подготавливая к клипированию и пересечению.
Техника «хобот слона». Выделение элементов «шейки» желчного пузыря — один из наиболее ответственных моментов операции. В настоящее время наиболее безопасной признана техника «хобот слона», которая восстанавливает естественные топографические взаимоотношения между пузырным и общим желчным протоков в условиях тракции. Основной ее принцип состоит в том, что медиальную стенку желчного пузыря выделяют на протяжении 1/3 по всей окружности, не пересекая пузырный проток. Это чрезвычайно важно, так как именно здесь может проходить интимно спаянный с медиальной стенкой пузыря ОПП или правая ветвь печеночной артерии. Такую ситуацию часто наблюдают при склероатрофическом желчном пузыре или при его остром воспалении. Два правила, выработанные еще в начале ХХ века, следует строго соблюдать при выделении органа:
Ни одно трубчатое образование, идущее к желчному пузырю, не должно быть пересечено до полного прояснения анатомии этой зоны.
Необходимо убедиться, что после выполнения обратимой мобилизации лишь два трубчатых образования — артерия и проток — подходят к желчному пузырю.
Пересечение артерии. Сосуд предварительно клипируют или коагулируют диссектором в 3-4 местах на протяжении, затем пересекают его около стенки желчного пузыря. В половине случаев ствол пузырной артерии не визуализируется, а терминальные веточки сосуда коагулируют при выделении медиальной стенки органа.
После пересечения артерии, проксимальная часть желчного пузыря вместе с пузырным протоком внешне напоминает хобот слона.
Пересечение пузырного протока. Выделяют пузырный проток по всему периметру. Размер клипсы (5 или 8 мм) выбирают в зависимости от диаметра протока. Первой накладывают дистальную клипсу как можно ближе к шейке пузыря. Затем накладывают две проксимальных клипсы. В момент клипиро-вания в поле зрения должны находиться пузырный проток и обе бранши аппликатора. Пузырный проток пересекают ножницами без коагуляции, оставляя 2 клипсы на проксимальной культе. Обращают внимание на то, что пересеченная структура имеет один просвет.
Холангиография. Основной метод интраоперационной диагностики холедохолитиаза при ЛХЭ. Различные хирургические школы придерживаются селективного (выборочного) и рутинного (обязательного) использования интраоперационной холангиографии (ИХ). Рутинное применение ИХ поддерживают не более 50% хирургов. Отказ от обязательного применения интраоперационной холангиографии объясняют следующими факторами:
а) облучение пациента и персонала операционной,
б) значительное (10-20%) количество ложноположительных результатов,
в) возможное повреждение магистральных протоков при выполнении интраоперационной холангиографии «любой ценой»,
г) высокая стоимость исследования.
Показания для селективного использования холангио-графии:
1. Широкий пузырный проток (более 5 мм).
2. Наличие мелких конкрементов в желчном пузыре и особенно в пузырном протоке.
3. Интраоперационная визуализация расширенного желчного протока, то есть когда имеется расхождение между данными дооперационного УЗИ и интраоперационной находкой. Для интраоперационного измерения диаметра пузырного и общего желчного протоков разработаны специальные инструменты.
4. Неясная анатомия в зоне треугольника Кало.
5. Невозможность при наличии соответствующих показаний дооперационного выполнения РХПГ или ЧЧХГ.
Селективные показания для выполнения интраоперацион-ной холангиографии имеют место у 13-20% пациентов. При рутинном использовании интраоперационной холангиогрфии частота резидуального холедохолитиаза достигает 1% [10].
Проблема холедохолитиаза
Частота холедохолитиаза при ЖКБ составляет около 10%. Нераспознанный и неизлеченный холедохолитиаз — одна из основных причин неудач в хирургии ЖКБ. Диагностику холе-дохолитиаза осуществляют до, во время и после ЛХЭ. Оптимальна дооперационная диагностика, что позволяет заранее выбрать адекватную и наименее опасную тактику лечения. Четыре основных фактора позволяют заподозрить холедохо-литиаз: холангит, расширение ВЖП по данным УЗИ более 8 мм,
повышение уровня трансаминаз и прямого билирубина. При сочетании всех четырех факторов вероятность холедохолитиаза достигает 99%. При их отсутствии частота холедохолитиаза равна 7% [15, 39].
Диагностика холедохолитиаза.
Дооперационная диагностика
Диагноз базируется на стандартных обязательных исследованиях, которые включают:
1. Клиническое обследование — наличие при поступлении или в анамнезе желтухи и холангита, приступа желчекаменного панкреатита. Если проявления первых двух осложнений ЖКБ достаточно ясны, то дифференциальная диагностика различных форм панкреатита сложна. К главным факторам, свидетельствующим о билиарном характере панкреатита, помимо наличия конкрементов в желчном пузыре, относят:
а) повышение уровня щелочной фосфатазы свыше 300 ед/л,
б) возраст свыше 50 лет,
в) женский пол,
г) уровень аланинаминотрансферазы свыше 100 ед/л.
Простой подсчет показывает, что при полном отсутствии или
наличии только одного из перечисленных факторов в 90% всех случаев приступ панкреатита не связан с миграцией конкрементов и, наоборот, при наличии 3 и более признаков в 87% случаев речь идет о желчекаменном панкреатите [16].
2. Биохимические критерии. Для диагностики значимо повышение уровня билирубина (главным образом за счет прямой фракции) более чем в два раза.
3. Данные УЗИ. Холедохолитиаз при обычном исследовании обнаруживают не более чем у 30% пациентов, имеющих конкременты в желчных протоках. Косвенный фактор, свидетельствующий в пользу наличия конкрементов в протоке, — расширение гепатикохоледоха свыше 8 мм. УЗИ следует проводить не ранее, чем за 7 дней до операции, поскольку со временем картина может измениться. Для получения более точной информации сонографию желательно проводить в динамике, то есть 2-3 раза до операции. Необходим постоянный контакт между хирургом и оператором УЗИ с целью сравнения данных сонографии и интраоперационных находок.
Возможно более детальное исследование протоковой системы при использовании трансдуоденального эндоскопического датчика УЗИ. Техника этого исследования состоит в следующем: положение пациента на левом боку. После стандартной для ФГДС подготовки, в двенадцатиперстную кишку до уровня большого дуоденального соска вводят эндоскоп, сопряженный с секторным ультразвуковым датчиком, работающим на частоте 7,5 или 12 мГц. Для обеспечения акустического соединения используют баллончик с жидкостью. Во время исследования датчик постепенно вытягивают в луковицу двенадцатиперстной кишки. Небольшие изменения положения датчика позволяют изучить проксимальную часть общего желчного протока и общий печеночный проток. Принципиальное значение имеет появление акустической тени в зоне действия датчика.
Показания для трансдуоденального УЗИ аналогичны показаниям для РХПГ Особое значение исследование приобретает в случаях, когда не удается канюлировать БДС, пациент не переносит контрастный препарат, или в анамнезе у него недавно перенесенный приступ острого панкреатита (РХПГ может вызвать обострение процесса).
Противопоказания к выполнению трансдуоденального УЗИ: исследование не показано, если дистальная часть общего желчного протока хорошо визуализируется при обычном трансабдоминальном УЗИ. В некоторых случаях проведение трансдуоденального УЗИ невозможно — при наличии стенози-
рующей язвы двенадцатиперстной кишки или при сдавлении кишки извне. Необходимо учитывать тот факт, что глубина проникновения при использовании датчика, работающего на частоте 7,5 мГц, не превышает б см. По точности диагностики холедохолитиаза трансдуоденальное УЗИ сравнимо с прямыми методами контрастирования ВЖП (РХПГ, ЧЧХГ) [18]. По данным Ю.Г Старкова и соавт., метод позволил выявить холедохолитиаз, недиагносцированный до операции, у 5% больных. Точность диагностики холедохолитиаза по данным интраоперационного УЗИ в этой ситуации составила 1GG%, тогда как информативность интраоперационной холангиографии — лишь 57% [19].
4. Внутривенная холангиография. Это исследование малоинформативно в диагностике холедохолитиаза. Тем не менее его можно использовать при наличии гепацитотропного контраста (билископин) и рентгеновского аппарата, позволяющего получать томограммы на уровне гепатикохоледоха [2G].
б. РХПГ относят к прямым методам контрастирования желчных путей. Контрастный препарат вводят ретроградно после эндоскопической катетеризации БДС. Точность этого исследования в отношении выявления холедохолитиаза близка к 1GG%. Однако вмешательства на БДС сопровождаются осложнениями, частота которых достигает 2-З% и летальностью в доли процента. К ним относят: острый панкреатит, кровотечение и перфорацию двенадцатиперстной кишки. Поэтому в большинстве клиник РХПГ перед ЛХЭ применяют селективно.
Показания для РХПГ:
а) желтуха или холангит при поступлении или в анамнезе;
б) повышение уровня печеночных проб в два и более раз;
в) желчекаменный панкреатит;
г) расширение гепатикохоледоха свыше 8 мм.
Выполнение РХПГ возможно у 8G-9G% пациентов. Трудности
при выполнении этой процедуры связаны с анатомическими аномалиями расположения БДС и наличием парафатериаль-ных дивертикулов [21].
6. Чрескожная чреспеченочная холангиография.
ЧЧХ также относят к прямым методам контрастирования желчных путей и выполняют по тем же показаниям, что и РХПГ. С целью диагностики холедохолитиаза ЧЧХ обычно применяют в случаях, когда РХПГ невыполнима. Эта процедура эффективна при расширении ВЖП и наличии желчной гипертензии. С 19б9 года для выполнения этого исследования применяют иглу Хиба. Под контролем рентгенотелевизионной установки иглу вводят в девятом межреберье по средне-подмышечной линии по направлению к воротам печени на глубину 12-15 см. При легком подтягивании иглы и одновременном введении контрастного вещества следят на экране за появлением изображения печеночных желчных ходов. Частота осложнений составляет G,9-4,9% [22]. Они включают:
1) желчеистечение в брюшную полость;
2) холангит;
3) подкапсульную гематому;
4) поддиафрагмальный абсцесс.
ЧЧХ уступает РХПГ по своей эффективности, поскольку извлечение конкрементов из протоков чреспеченочным доступом сложнее [23].
Интраоперационная диагностика холедохолитиаза
Как и при открытой холецистэктомии, основной способ ин-траоперационной диагностики холедохолитиаза при ЛХЭ — рентгенологическое исследование желчных путей. В эндохирургии значимость интраоперационной холангиографии возрастает из-за невозможности мануальной пальпации ВЖП. Холангиография во время ЛХЭ может быть успешно выполнена у 7G-95% пациентов.
Начиная с 1991 года, для интраоперационной диагностики холедохолитиаза стали применять интраоперационное УЗИ. Это исследование требует специального датчика, который вводят через 10 мм троакар. Преимущество интраоперационного УЗИ: — отсутствие вредного действия радиации на пациента и персонал. Главные недостатки — необходимость специального дорогостоящего оборудования и невозможность диагностировать конкременты в терминальном отделе общего желчного протока [24].
Эффективный метод не только диагностики, но и лечения холедохолитиаза — лапароскопическая холедохоскопия.
Послеоперационная диагностика холедохолитиаза
Частота резидуального холедохолитиаза составляет 1-2%. Клинические признаки холедохолитиаза могут проявиться на различных сроках после ЛХЭ. В раннем послеоперационном периоде при нарушении желчеоттока возможно желчеистече-ние из ложа пузыря в брюшную полость.
На более поздних сроках превалируют симптомы желчной гипертензии: распирающие боли в правом подреберье, желтуха, сопровождающая приступы, холангит. Для диагностики холедохолитиаза используют РХПГ и ЧЧХГ.
Лечебная тактика при холедохолитиазе
1. Эндоскопическая папиллосфинктеротомия. Оптимальным способом коррекции холедохолитиаза считают доопера-ционную ЭПСТ с извлечением конкрементов из протоков [25]. Лучше выполнять процедуру не ранее, чем за 24 часа до операции. Это снижает до минимума вероятность миграции новых конкрементов из желчного пузыря.
Однако выполнение РХПГ возможно не у всех пациентов. Противопоказаниями служат: наличие парафатериальных дивертикулов, анатомические аномалии расположения БДС. Относительное противопоказание — хронический панкреатит. Нередко после выполнения РХПГ выясняется, что произвести ЭПСТ и извлечь конкременты не представляется возможным. Основными препятствиями служат тубулярный стеноз терминальной части общего желчного протока и крупные (более
1 см в диаметре) конкременты. В этой ситуации, при наличии соответствующего оборудования и опыта, показана лапароскопическая холедолитотомия или освобождение протоков чрезкожно-чрезпеченочным доступом.
К сожалению, ЭПСТ имеет свои недостатки. Анализ отдаленных результатов показал, что через 4-5 лет возрастает число больных с атрофией слизистой оболочки желудка, уменьшается диаметр папиллотомного отверстия. Явления холангита отмечены не только у больных с рестенозом большого дуоденального сосочка, но и при полном рассечении сфинктера Одди вследствие развития дуодено-билиарного рефлюкса [26].
2. Лапароскопическая холедохотолитотомия.
Для выполнения этого приема необходимы:
а) операционный холедохоскоп с набором инструментов для извлечения камней;
б) дренажи для лапароскопического дренирования желчных путей;
в) специалист, владеющий техникой эндохирургического шва.
Оперативная техника
Существует два варианта эксплорации и ревизии холедо-ха — через пузырный проток или путем холедохотомии. Преимущество доступа через пузырный проток — в сохранении целостности общего желчного протока. Однако этот способ требует применения баллонной дилятации пузырного протока для введения инструментов. Второе преимущество — отсут-
ствие необходимости в ушивании холедохотомического отверстия. После эксплорации холедоха конкременты извлекают с помощью корзинки Дормиа или катетера Фолея.
Процесс контролируют либо рентгенологически, либо визуально через гибкий холедохоскоп. В некоторых случаях возможно «проталкивание» конкрементов в двенадцатиперстную кишку. Завершают операцию дренированием общего желчного протока через пузырный проток или через холедохотомиче-ское отверстие по Керу. Герметичность проверяют введением физиологического раствора и контрольной холангиографией. Подпеченочное пространство дренируют отдельной трубкой.
Основное преимущество лапароскопической холедохоли-тотомии перед РХПГ и ЭПСТ — сохранение сфинктерного аппарата БДС. Для снижения травматичности процедуры предложено интраоперационное применение экстракорпоральной литотрипсии с целью измельчения конкрементов перед экстракцией [27, 28].
При отсутствии контроля за полнотой лапароскопической холедохолитотомии возможно эндохирургическое наложение холедоходуоденоанастомоза (ХДА)
3. Переход к «открытой» операции и ревизия ВЖП Основное показание для открытой эксплорации холедо-ха — невозможность по тем или иным причинам выполнения эндоскопической или лапароскопической холедохолитотомии при доказанном холедохолитиазе.
После разрешения принципиальных интраоперационных задач желчный пузырь электрохирургически выделяется из ложа, проводится контроль гемостаза, санация подпеченоч-ного пространства. Желчный пузырь извлекается через один из 10 мм доступов. В большинстве случаев брюшная полость дренируется на сутки трубкой.
Таблица 2
Результаты ЛХЭ в ведущих странах Европы и США в 1992 г.
Страна Выполнено ЛХЭ Переход к открытой операции % Повреждения ВЖП % Леталь- ность
Англия и Уэлс 3319 5,2 G,33 G,17
Бельгия 3244 б,5 G,5G G,G9
Франция 2955 4,8 G,6G G,G3
Шотландия 1б55 14,G G,7G G,5G
Швейцария 91G 8,1 G,5G G
США 776G4 3-8 G,59 G,G4
Переход к лапаротомии
Необходимость в конверсии по ходу ЛХЭ возникает в 3-7% случаев (табл. 2). В частности, по данным 1_мпдз1оп Е.Н., Реде Р.У., уровень конверсий в США составляет 6,1% [25]. Показаниями служат:
— неясная анатомия в зоне треугольника Кало;
— невозможность идентифицировать элементы ворот печени из-за выраженных инфильтративных или рубцовосклеротических изменений;
— интраоперационные осложнения: ранение ВЖП и кровотечение, которое невозможно остановить без риска повреждения элементов гепатодуоденалной связки;
— выявление по ходу лапароскопии заболеваний, не диа-гносцированных до операции. Чаще это опухолевый процесс с локализацией в ободочной кишке. По ходу ЛХЭ рак ободочной кишки обнаруживают в 0,5% случаев [12].
Переход к лапаротомии не является поражением хирурга, признаком его слабости и некомпетентности. Лапаротомия —
это почетное отступление, позволяющее предотвратить тяжелые, иногда фатальные осложнения.
По мнению J. Hunter, необходимо установить предел времени для пробной мобилизации желчного пузыря. За 30 минут от начала его выделения пузырный проток должен быть четко определен и подготовлен к клипированию. Лапароскопическая операция не может быть в несколько раз продолжительнее «открытой». Чревосечение должно быть выполнено до того, как хирург затратит слишком много сил и времени на лапароскопическую мобилизацию, когда переход к лапаротомии становится эмоционально невозможен [27].
Снижение порога перехода к лапаротомии — один из основных факторов профилактики осложнений в эндохирургии. Группа французских хирургов выполнила более 2000 ЛХЭ без единого повреждения ВЖП. Они добились этого, расширив показания к чревосечению на этапе освоения метода: на первые 100 ЛХЭ лапаротомия выполнена в 22 случаях, на вторую сотню — у 12, на третью — у 6 пациентов. Далее частота конверсии установилась на уровне 1-2%.
Послеоперационное ведение
Эндоскопическая хирургия изменила принципы ведения больных после операции. Отсутствие болей в животе и мышцах брюшной стенки позволяет не ограничивать физическую активность пациента уже в первые сутки после операции. Наркотические аналгетики не назначают. Полноценная экскурсия диафрагмы предотвращает гипостатическую пневмонию. Перистальтика восстанавливается через несколько часов, самое позднее — через сутки после операции. Тошнота и рвота — редкое явление. В отличие от традиционной абдоминальной хирургии, напряжение мышц передней брюшной стенки отсутствует, незначительная локальная болезненность имеет место лишь в местах введения троакаров. Дефанс и вздутие живота настолько нетипичны для лапароскопических операций, что их появление всегда свидетельствует о послеоперационном осложнении (кровотечение, желчеистечение, повреждение кишечника и др.). Антибиотики назначают только при остром воспалении желчного пузыря или при дегерметизации органа в процессе ЛХЭ. Инфузионную терапию назначают только по показаниям. Кормление начинают со вторых суток. Длительность нахождения в стационаре составляет 1-7 дней, что зависит от особенностей заболевания и характера операции. Как правило, через 1-2 недели после вмешательства пациент может вернуться к привычному образу жизни, включая легкий физический труд и занятия спортом.
ЛИТЕРАТУРА
1. Gilliland T.M., Traverso L.W. Modern Standards for Comparison of Cholecystectomy with Alternative Treatments for Symptomatic Cholelithiasis with Emphasis on Long Term Relief of Symptoms. Surgery Gynecology and Obstetrics 1990; 170: 39-44.
2 Zacks S.L., Sandler R.S., Rutledge R., Brown R.S. A population-based cohort study comparing laparoscopic cholecystectomy and open cholecystectomy. Am J Gastroenterol 2002; 97: 334-340.
3. Kratzer W., Mason R.A., Kachele V. Prevalence of gallstones in sonographic surveys worldwide. J Clin Ultrasound 1999; 27:1-7.
4. Fahlke J., Ridwelski K., Manger T., Grote R., Lippert H. Diagnostic workup before laparoscopic cholecystectomy-which diagnostic tools should be used? Hepatogastroenterology 2001; 48: 59-65.
5. Lee C.L., Wu C.H., Chen T.K. et al: Prospective study of abdominal ultrasonography before laparoscopic cholecystectomy. J Clin Gastroenterol 1993; 16/2: 113-116.
6. Gai H., Thiele H. Sonographische Selektionskriterien fur die laparoskopische Cholecystektomie. Chirurg 1992; 63: 426-431.
7. Феденко В.В., Евдошенко В.В., Матвеев Н.Л., Владыкин Л.А. Косметическая модификация ЛХЭ для технически простых случаев. Эндоскопическая хирургия 1995; 2-3: 21-23.
8. Федоров И.В., Славин Л.Е. Повреждения желчных протоков при лапароскопической холецистэктомии. Казань, 1995. 72 с.
9. Ciair D.G. Brooks D.C. Laparoscopic choiangiography. The case for a seiective approach. Surg Ciin North Am 1994; 74/4: 9б1-9бб.
1G. Phiiiips EH, Carroii BJ, Pearistein AR et. ai. Laparoscopic choiedochoscopy and extraction of common biie duct stones. Worid J. Surg. 1993; 17: 22-28.
12. Trondsen E., Edwin B., Reiertsen O., Faerden A.E., Fagertun H., Rosseiand A.R. Prediction of common biie duct stones prior to choiecystectomy: a prospective vaiidation of a discriminant anaiysis function. Arch Surg 1998; 133(2): 1б2-1бб.
13. Edmundowicz S.A., Aiiperti G., Middieton W.D. Preiiminary experience using endoscopic uitrasonography in the diagnosis of choiedochoiithiasis. Endoscopy 1992; 24: 774-778.
14. Старков Ю.Г., Стрекаловский В.П., Вишневский В.А. и др. Интраоперационное ультразвуковое исследование при лапароскопических вмешательствах. Анналы хирургической гепатологии 1997; 2: 94-1G2.
15. Saiky B., Bauer J. Intravenous choiangiography, ERCP, and seiective operative choiangiography in the performans of iaparoscopic choiecystectomy; Surg Endosc. 1994; 8: 289-291.
16. Bouiay J., Scheiienberg R., Brady P.G. Roie of ERCP and therapeutic biiiary endoscopy in asssociation with iaparoscopic choiecistectomy. Am. J. Gastroenteroi. 1992; 77: 7: 837-842.
17. Гальперин Э.И, Волкова Н.В. Заболевания желчных путей после холецистэктомиию. М.: Медицина, 1988. 2б5 с.
18. Ward E.M., LeRoy A.J., Bender C.E. et ai. Imaging of compiications of iaparoscopic choiecistectomy Abdom Imaging 1993; 18: 15G-155.
19. Ascher S.M., Evans S.R.T., Zeman R.K. Laparoscopic choiecystectomy: intraoperative uitrasound of the extrahepatic biiiary tree and the naturai history of postoperative transabdominai uitrasound findings. Seminars in Uitrasound, CT, and MRI, 1993, 14/5 331-337).
2G. Андреев А.Л., Рыбин Е.П., Учваткин В.Г., и др. Сравнительная оценка результатов одноэтапной и двухэтапной тактики лечения холедохолитиаза у 15G пациентов. Тезисы международной конференции «Применение сшивающих аппаратов в лапароскопической и торакоскопической хирургии»; 1997; Санкт-Петербург.
21. Котовский А.Е., Поздеев И.В., Тупикин Л.В. Отдаленные результаты эндоскопической папиллосфинктеротомии. Анналы хирургической гепатологии 1997; 2: 132-135.
22. Carroii B., Phiiiips E. Laparoscopic removai of common duct stones. Gastrointestinai Endoscopy Ciinics North America 1993; 3/2: 239-248.
23. Phiiiips E., Carroi B., Pearistein R. et ai. Laparoscopic choiecystectomy and extraction of common biir duct stones. Worid J Surg. 1993;17: 22-28.
24. Ebner S., Rechner J., Beiier S., Erhart K., Riegier F.M., Szinicz G. Laparoscopic man agement of common biie duct stones. Surg Endosc 2GG4; 18(5): 7б2-7б5.
25. Livingston E.H., Rege R.V. A nationwide study of conversion from iaparoscopic to open choiecystectomy. Am J Surg 2GG4; 188: 2G5-211
26. Junger W., Junger WG, Hutter J., Miiier K, Moritz E. Deiay diagnosis of maiignant tumors missed at iaparoscopic choiecystectomy. Surg. Endosc. 1997; 11: 1G: 1G1G-1G13.
27. Hunter J.G. Commentary. Techniques of iaparoscopic choiecystectomy: The difficuit operation. Surg Ciin N Am 1994; 74/4: 777-78G
28. Randoux O., Desrousseaux B., Atat I., Sarkis P., Corman N., Ampe J. Les Laparotomies de Conversions au Cours des Choiecystectomies par Laparoscopie. J Chir 1992; 129/12: 519-522.
Обзор клинических исследований: интраоперационная холангиография
Этот документ был рассмотрен и одобрен Советом управляющих Общества американских желудочно-кишечных и эндоскопических хирургов (SAGES) в мае 2017 года.
Авторы
William W. Hope, MD
Robert Fanelli, MD
Danielle S. Walsh, MD
Ray Price, MD
Димитриос Стефанидис, MD, PhD
Уильям С. Ричардсон, MD
Преамбула
Следующий обзорный обзор интраоперационной холангиограммы предназначен для врачей, которые занимаются лечением и лечением патологии желчного пузыря / желчевыводящих путей и выполняют лапароскопическую холецистэктомию.Он предназначен для критического обзора техники интраоперационной холангиографии, альтернатив интраоперационной визуализации желчных протоков и имеющихся доказательств, подтверждающих их безопасность и эффективность. В зависимости от уровня доказательности могут быть даны или не даны рекомендации по их использованию в клинической практике.
Заявление об ограничении ответственности
Руководства по клинической практике и обзорные обзоры предназначены для указания предпочтительных подходов к медицинским проблемам, установленных экспертами в данной области.Эти рекомендации будут основаны на существующих данных или на едином мнении экспертов, когда данных мало или нет. Обзоры в центре внимания применимы ко всем врачам, которые решают клиническую проблему (проблемы) без учета специальной подготовки или интересов, и предназначены для предоставления рекомендаций, основанных на конкретной теме; в рамках определенного объема обзора они указывают предпочтительные, но не обязательно единственно приемлемые подходы из-за сложности среды здравоохранения.Руководства и рекомендации призваны быть гибкими. Учитывая широкий спектр специфики любой медицинской проблемы, хирург всегда должен выбирать курс, наиболее подходящий для конкретного пациента и переменных, существующих на момент принятия решения.
Руководства, обзорные обзоры и рекомендации разработаны под эгидой Общества американских желудочно-кишечных эндоскопических хирургов и его различных комитетов и одобрены Советом управляющих. Каждый клинический обзор в центре внимания систематически исследовался, анализировался и исправлялся комитетом по рекомендациям и, при необходимости, анализировался соответствующей многопрофильной группой.Поэтому рекомендации считаются действительными на момент производства на основе имеющихся данных.
Обзор литературы
Систематический поиск литературы был выполнен в MEDLINE в августе 2014 года. Стратегия поиска была ограничена статьями для взрослых на английском языке и показана на Рисунке 1. Второй поиск был проведен в мае 2015 года и ограничен статьями на английском языке для детей.
Поиск литературы выявил релевантные статьи. Тезисы были рассмотрены 4 членами комитета (WWH, MZ, WO, DW) и разделены на следующие категории:
- Рандомизированные исследования, метаанализы и систематические обзоры
- Проспективные исследования
- Ретроспективные исследования
- Сообщения о случаях болезни
- Обзорные статьи
Рандомизированные контролируемые испытания, метаанализы и систематические обзоры были выбраны для дальнейшего обзора наряду с проспективными и ретроспективными исследованиями, когда не хватало доказательств более высокого уровня.Исследования с меньшими выборками рассматривались при отсутствии дополнительных доказательств. Также были включены самые последние обзоры. Все отчеты о случаях, старые обзоры и небольшие исследования были исключены при наличии доказательств более высокого уровня. Дубликаты публикаций или популяции пациентов рассматривались только один раз. Когда доступные доказательства из исследований уровня I считались адекватными, исследования с более низким уровнем доказательств не рассматривались. Также были включены более новые релевантные статьи, опубликованные после даты первоначального поиска литературы во время составления данного руководства.В соответствии с этими критериями исключения для обзора были отобраны 66 статей для взрослых и 37 статей по педиатрии.
Рецензенты оценили уровень доказательности и провели поиск в библиографии каждой статьи на предмет дополнительных статей, которые могли быть пропущены во время первоначального поиска. Были получены дополнительные релевантные статьи (n = 12), которые были включены в обзор для выставления оценок. В обзор было включено 115 оцененных статей, относящихся к данному руководству. Чтобы облегчить обзор несколькими рецензентами, эти статьи были разделены на следующие темы и распространены среди рецензентов:
- История холангиографии
- Показания к интраоперационной холангиографии
- Возможность интраоперационной холангиографии для уменьшения повреждений желчных протоков
- Методы и оборудование, необходимые для интраоперационной холангиографии и применения глюкагона
- Исходы, связанные с интраоперационной холангиографией
- Альтернативные интраоперационные методы оценки желчного дерева
- Рекомендации, включенные в это руководство, были разработаны на основе оценок всех статей рецензентами.
Уровни доказательности / определения
Качество доказательств и сила рекомендации по каждому руководству оценивались в соответствии с системой GRADE. Здесь используется четырехуровневая система для обозначения качества доказательств (очень низкое (+), низкое (+ +), умеренное (+ + +) или высокое (+ + + +)) и двухуровневая система для оценки силы. рекомендации (слабой или сильной)
Введение
Заявление о фокусировке
Целью данного обзора клинических исследований является критический обзор литературы и описание техники интраоперационной холангиографии и альтернативных методов интраоперационной оценки желчевыводящих путей.
История интраоперационной холангиограммы
История интраоперационной холангиографии (хорошо задокументированная MacFadyen [1] ) восходит к 1918 году, когда Райху приписывают первый отчет об описании анатомии желчного дерева с использованием висмута и петролатума для идентификации желчного свища [2] . Дальнейшие успехи были достигнуты в 1920-х и 30-х годах с Тенни и Паттерсоном [3] , которые определили стриктуру и свищ желчного протока у пациента, перенесшего холецистэктомию, и у Гинзбурга и Бенджамина [4] , которые вводили раствор липиодола в желчные пути. свищ для выявления камней общих желчных протоков.
В 1932 году Мириззи сообщил о первой серии маршрутизации IOC с использованием липиодола во время холецистэктомии [5] и продвинул понимание хирургии желчевыводящих путей, подчеркнув важность IOC, очертив анатомию и функцию сфинктера Одди, а также рекомендации выхода Т-образных трубок после исследования общего желчного протока [1] . Двадцать лет спустя Свенсон и Фишер сообщили о первом применении МОК четырем младенцам с подозрением на атрезию желчных путей.В то время как на начальной холецистохолангиограмме использовался раствор метиленового синего, вводимый непосредственно в желчный пузырь с последующим поиском его в двенадцатиперстной кишке и проксимальных отделах печеночных протоков, впоследствии был введен «Диодраст» и был получен простой снимок брюшной полости, подтверждающий диагноз атрезии желчных путей. у 3 из 4 пациентов [6] .
Первоначальные IOC были выполнены со статическими пленками, и процедура требовала в среднем 20-30 минут для получения 3-4 изображений и часто приходилось повторять [1] .Улучшения в IOC пришли параллельно с улучшением возможностей визуализации. В 1957 году Лакнер и Фолькель [7] сообщили о мобильном усилителе изображения, за которым последовали Стефанини [8] , Грейс и Пекар [9] и Уитакер и др. [10] сообщает об использовании этого вместе с телевизионной рентгеноскопией для IOC. Улучшения в камерах и телевизионных мониторах позволили получить изображения более высокого качества, и появилась интраоперационная флюорохангиография (IOFC) более высокой четкости.Berci et al. сообщили о серии пациентов в 1978 г., когда они использовали мобильный усилитель с C-образной рукояткой и IOFC для получения изображений, которые стали текущим стандартом для IOC [11] .
Какие показания для IOC?
Основными целями IOC являются выявление камней желчных протоков, уточнение анатомии желчных протоков и предотвращение повреждений желчных протоков. [1] . Холангиография также является основным инструментом в оценке желтухи новорожденных, позволяя отличить атрезию желчных протоков, гипоплазию желчных протоков и холестаз от других причин, а также сделать возможной терапевтическую ирригацию уплотненной желчи из системы протоков.Показания к IOC во время лапароскопической холецистэктомии могут включать желтуху или желтуху в анамнезе, панкреатит в анамнезе, особенно связанный с желчнокаменным панкреатитом, повышенные функциональные пробы печени, общий желчный проток диаметром более 5-7 мм, пузырный проток диаметром более 3 мм. , множественные мелкие камни желчного пузыря, неясная анатомия, камни общего желчного протока, визуализированные на предоперационном ультразвуковом исследовании, возможное повреждение или утечка желчного протока и короткий пузырный проток [1, 12] .
Предотвращает ли плановое выполнение ИОК травмы общих желчных протоков?
Вопрос о том, следует ли проводить IOC в плановом порядке или выборочно, остается предметом споров.В руководстве SAGES по клиническому применению лапароскопической хирургии желчных путей [13] рекомендовано, что IOC может снизить риск повреждения желчных протоков при регулярном использовании и может обеспечить доступ к желчевыводящим путям для терапевтического вмешательства (уровень доказательности II, рекомендация степени B ). В этом руководстве содержится призыв к разработке надежных алгоритмов, которые помогут хирургам проводить селективную холангиографию [13] . В более поздних рекомендациях Европейской ассоциации эндоскопической хирургии (EAES) относительно профилактики и лечения повреждений желчных протоков во время лапароскопической холецистэктомии авторы отметили, что рутинное использование МОК остается спорным и что рутинное использование МОК не может быть рекомендовано на основании доступная литература [14] .Это руководство, однако, указывает на то, что IOC позволяет на ранней стадии идентифицировать повреждения желчных протоков, если они правильно интерпретируются [14] . Этот вопрос был рассмотрен в двух недавних систематических обзорах.
Первое исследование оценило восемь рандомизированных контролируемых исследований и не обнаружило какой-либо пользы МОК для предотвращения повреждений желчных протоков. [15] . В этом исследовании они отметили, что качество доказательств уровня 1 было от умеренного до плохого, и что ни одно из исследований не имело недостаточной мощности ни по отдельности, ни в комбинации, чтобы продемонстрировать пользу IOC [12] .Во втором системном обзоре оценивались статьи, касающиеся повреждений желчных протоков, и сообщалось о защитном эффекте IOC при повреждениях желчных протоков во время холецистэктомии, однако были рассмотрены доказательства, которые не соответствовали уровню 1 [16] . Общенациональный когортный анализ пациентов Medicare, перенесших холецистэктомию в период с 1992 по 1999 год, показал, что риск повреждения желчных протоков повышался, когда IOC не использовался после учета факторов опыта пациента и хирурга, и предположил, что рутинное использование IOC может снизить частоту распространенных Повреждения желчных протоков [17] .Другое исследование оценивало значение IOC во время лапароскопической холецистэктомии с использованием данных по заявкам Texas Medicare за 2000-2009 гг. И не сообщило об отсутствии статистически значимой связи между IOC и повреждением общего желчного протока, когда вмешивающиеся факторы контролировались для [18, 19] .
В двух исследованиях оценивали влияние холангиограммы на раннее выявление повреждений желчных протоков. Данные шведского национального регистра по хирургии желчных камней сообщили о снижении частоты повреждения общего желчного протока на 29% при использовании IOC, а также о снижении риска смерти на 62% [20] .Данные одного учебного центра с большим объемом информации показали, что рутинное использование IOC во время лапароскопической холецистэктомии было связано с низкой частотой повреждений желчных протоков и что IOC облегчил обнаружение и восстановление этих повреждений при той же хирургической процедуре [21] .
В педиатрической литературе нет рандомизированных проспективных исследований для оценки полезности ИОК для предотвращения повреждения желчных протоков. Тем не менее, наиболее надежные рекомендации получены из большого ретроспективного когортного исследования педиатрических пациентов, в котором не было выявлено преимуществ IOC в предотвращении повреждений желчных протоков в этой популяции [19, 22] .Используя базу данных о выписках пациентов Калифорнии для поиска детей младше 18 лет, перенесших холецистэктомию, Келли-Куон и др. Определили когорту из 6931 ребенка. ИОК была проведена у 30% детей, а общая частота повреждения желчных протоков составила 0,36%. Примечательно, что частота травм увеличивалась с возрастом и не была ниже в центрах с более высоким использованием IOC или больших хирургических объемов [19] . Наблюдалась тенденция к увеличению вероятности повреждения желчного протока в больницах с тенденцией к обычному использованию IOC (отношение шансов 12.92, 99% ДИ 1,31-127,15). Авторы приходят к выводу, что независимо от хирургов, выполняющих плановую IOC, эффективность IOC в этой популяции может быть маркером более сложной процедуры аберрантной хирургической анатомии, и они выступают за дополнительные исследования показаний для IOC для тех, кто использует это выборочно.
Рекомендация
Хирурги должны широко использовать IOC, быть знакомыми с его показаниями и легко владеть техникой и интерпретацией изображений холангиограммы.Хотя IOC может снизить риск повреждения желчных протоков, его повседневное использование остается спорным; необходимы дополнительные доказательства высокого качества, прежде чем можно будет рекомендовать плановую IOC
Качество доказательств: +++, слабое
Какая техника для IOC является лучшей?
Описано несколько методов IOC, которые развивались с течением времени на основе имеющихся технологий. Не было доказано, что какая-либо конкретная техника лучше, и сообщалось обо всех методах, позволяющих дать адекватную оценку желчного дерева.Большинство экспертов согласны с тем, что критическое мнение о безопасности должно быть получено в первую очередь во время лапароскопической холецистэктомии, когда это возможно, до выполнения IOC [23] .
Для оценки желчного дерева во время лапароскопической холецистэктомии были предложены два основных метода рентгеноскопии. [1] .
Интраоперационная холангиография начинается с критического обзора безопасности [23] и определения анатомии. Зажим помещается на пузырный проток и воронкообразное соединение, чтобы предотвратить поток желчи из желчного пузыря или контраст в желчный пузырь во время IOC.Затем делается небольшой разрез на передней поверхности пузырного протока сразу под зажимом, что подтверждается наличием желчи. В правом верхнем квадранте делается небольшой колотый разрез, и игла или направляющий тубус вводится чрескожно в брюшную полость под углом к кистозной дуктотомии. В это время катетер для холангиограммы по выбору хирурга может быть продвинут в пузырный протоковый канал и закреплен зажимом, баллоном, устройством для удержания пузырного протока или зонтичным механизмом.
После того, как холангиоискатель закреплен на месте, мобильный флюороскоп с С-образной дугой накрывается стерильной салфеткой и помещается в правом верхнем квадранте пациента.Кровать, которая должна быть расположена и способна вместить С-дугу, может быть отрегулирована так, чтобы пациент находился в положении Тренделенбурга и немного вправо, что может облегчить установку С-дуги. После обсуждения с анестезиологом можно провести респирацию, чтобы получить удовлетворительное изображение. Затем через холангиограмму вводят разбавленный краситель и получают рентгеноскопические изображения. Несмотря на меньшую нагрузку, чем реальная методика IOC, правильная идентификация холангиограммы имеет первостепенное значение для предотвращения повреждения желчных протоков и выявления камней в общих желчных протоках.Во время IOC необходимо визуализировать правильную анатомию желчевыводящих путей, наполнение двенадцатиперстной кишки без признаков дефектов наполнения общего желчного протока и наполнение правого и левого печеночных протоков.
Альтернативным рентгеноскопическим методом исследования желчного дерева является холецистохолангиография, при которой катетер вводится непосредственно в желчный пузырь и растягивается красителем, который затем попадает в пузырный проток. Чаще используется в детской и младенческой популяции, где пузырный проток может быть очень маленьким и его труднее канюлировать. Порт 5 мм [25] для холецистостомии, чрескожной пункции желчного пузыря с фиксацией к брюшной стенке или без нее [26, 27] , а также использование специальных зажимов для фиксации желчного пузыря и облегчения холецистохолангиографии [28] .
Было проведено одно рандомизированное контролируемое исследование, в котором оценивались два метода IOC. В этом исследовании 59 пациентов были рандомизированы в IOC с использованием зажимного устройства, которое помогает ввести 5-миллиметровый катетер в пузырный проток, или зажимного устройства, которое помещается через правый срединно-подреберный порт и зажимает через шейку желчного пузыря калибром 19. игла, которую можно ввести в желчный пузырь [29] . Они сообщили об отсутствии преимуществ одного катетера над другим и о том, что оба зажима способствовали IOC всего за 10 минут, и что предпочтения хирурга должны определять, какую технику канюляции им следует использовать. [29] .
Сообщалось о нескольких предлагаемых методах, помогающих при МОК в сложных случаях, но они не были тщательно протестированы. В случаях, когда пузырный проток может быть заблокирован камнями, фиброзом или извилистыми клапанами Хейстера, можно использовать такие приемы, как доение камней из проксимального отдела пузырного протока или использование проводника для облегчения введения катетера. [1, 30 ] . Для пациентов с короткими, утолщенными или расширенными пузырными протоками, которые не поддаются установке зажима и контролю холангиокатетера, в качестве альтернативного метода фиксации кистозного протока сообщалось о методе использования петли сосуда для окружения катетера и пузырного протока проток для снижения риска утечки культи пузырного протока [31] .
Рекомендация
Нет никаких свидетельств того, что один из доступных методов IOC превосходит другой. Поэтому хирурги должны использовать наиболее удобную и знакомую им технику, принимая во внимание анатомию пациента.
Качество доказательств: +, слабое
Есть ли польза от использования Глюкагона во время МОК?
Использование глюкагона было рекомендовано как полезное дополнение к МОК и широко применяется. В литературе имеются различные сообщения о влиянии глюкагона на сфинктер Одди, а также о клиническом значении его использования для холангиографии, по которому нет единого мнения.
В нескольких исследованиях сообщалось о благотворном влиянии глюкагона на расслабление сфинктера Одди и улучшении визуализации холангиографии с его использованием [32-40] , в то время как в других не сообщалось об заметных преимуществах его использования [41-43] . В одном исследовании оценивалось использование 1 или 2 мг глюкагона внутривенно и сообщалось, что доза 1 мг так же эффективна, как 2 мг во время холангиографии. [36] . Сторонники использования глюкагона ссылаются на простоту использования и относительно низкую частоту побочных эффектов.Был отмечен только один серьезный побочный эффект у 60-летнего мужчины с неожиданной феохромоцитомой, у которого был интраоперационный сердечный криз, поскольку глюкагон также может спровоцировать выброс катехоламинов [44] . Они рекомендовали, чтобы при введении глюкагона был доступен соответствующий фармакологический антагонист катехоламинов, чтобы предотвратить этот потенциальный побочный эффект [44] . Для клинического использования наиболее ценная роль глюкагона связана с случаями, когда общий желчный проток не выходит в двенадцатиперстную кишку, когда вы пытаетесь промыть мелкие камни или когда вы собираетесь выполнить чрескистозное исследование общего желчного протока.
Хотя есть небольшие серии, описывающие использование глюкагона у педиатрических пациентов, перенесших ИОК, все они относятся к пациентам, у которых ИОК был положительным на наличие камня и предпринималась попытка лапароскопического исследования общего желчного протока. [30, 45] . Имеется сообщение об одном случае, когда глюкагон и N-ацетилцистеин использовались для промывания желчного дерева у двухмесячного ребенка с обструкцией без осложнений и с успешным удалением камней и уплотненной желчи [46] .
Рекомендация:
Глюкагон может быть полезен во время IOC, чтобы позволить мелким камням или контрасту пройти в двенадцатиперстную кишку, расслабляя сфинктер Одди. Учитывая его низкий профиль побочных эффектов, простоту использования и возможное улучшение визуализации во время введения глюкагона IOC, хирурги должны учитывать его при показаниях во время IOC.
Оценка: +, слабый
Какое оборудование необходимо для выполнения IOC?
Техника IOC развивалась с момента ее первого описания с большим количеством достижений, чтобы сделать процедуру более простой, воспроизводимой и эффективной.
IOC может выполняться с ограниченным оборудованием, и существует несколько различных катетеров, которые хирург может выбрать в зависимости от своих предпочтений и опыта. Многие современные катетеры и канюли IOC имеют комплект со всем необходимым оборудованием, но могут включать в себя некоторые или все из следующего: катетер или канюлю, шприц, иглу / оболочку интродьюсера и трехходовой кран. Поскольку комплекты часто бывают дорогостоящими, холангиографию также можно выполнить довольно дешево с использованием мочеточникового катетера 3 French и многоразового зажимного инструмента для холангиограммы.В зависимости от используемого катетера может потребоваться дополнительное оборудование, такое как приспособление для наложения зажимов, в тех случаях, когда катетер необходимо закрепить в пузырном протоке — поскольку большинство хирургов используют приспособление для наложения зажимов во время лапароскопической холецистэктомии, это часто уже доступно. Краситель также необходим для выполнения IOC, и тип красителя будет варьироваться в зависимости от институциональных протоколов. Физиологический раствор также полезен для промывания протока до и после введения красителя. В случае небольшого или извилистого пузырного протока может оказаться полезным выбор гидрофильных проводов.Мобильные С-дуги / рентгеноскопия теперь распространены в большинстве операционных и значительно облегчают IOC. Необходимы стерильные чехлы для С-дуги. Как упоминалось ранее, в некоторых случаях может использоваться глюкагон, который вводится анестезиологами. Поскольку IOC предполагает радиационное облучение, хирурги и персонал операционной должны иметь защиту от использования свинцовых фартуков и средств защиты шеи или свинцовых защитных экранов.
Как упоминалось ранее, нет доступной литературы, демонстрирующей превосходство одного метода или оборудования над другим [29] , и, следовательно, методы и оборудование следует оставить на усмотрение хирурга.
Рекомендация:
Инструменты, необходимые для ИОК, включают мобильную С-дугу или другие возможности рентгеноскопии, рентгеноконтрастный краситель и катетер или канюлю для холангиограммы по выбору хирурга. Следует регулярно использовать радиационную защиту в виде фартуков / защиты шеи или щитов, за которыми могут стоять хирурги / персонал. При отсутствии четких доказательств превосходства конкретного оборудования или техники IOC выбор оборудования и техники остается на усмотрение хирурга.
Оценка: +, слабый
Какова чувствительность и специфичность IOC для выявления патологии желчных протоков?
Холангиография может быть простой методикой, но не во всех случаях может быть осуществлена по разным причинам, связанным с анатомией. Сообщаемые показатели успешной холангиографии как для педиатрических, так и для взрослых пациентов колеблются от 82% до 97%, при этом в большинстве исследований указывается, что показатели успеха превышают 90% [15, 21, 29, 30, 47-59] .
Чувствительность IOC для обнаружения камней CBD составляет от 75% до 100%, а специфичность — от 76.2–100%, при этом в большинстве отчетов указывается чувствительность и специфичность более 90%. Положительная прогностическая ценность IOC колеблется от 94,5% до 100%, а отрицательная прогностическая ценность — от 91,4% до 100%. Сообщается, что точность IOC составляет от 92,2% до 99% при обнаружении камней [50, 54, 59-65] .
В популяции младенцев, где ИОК проводится для выяснения этиологии персистирующей неонатологии, вероятность успеха значительно ниже и напрямую коррелирует с размером и внешним видом желчного пузыря.Если желчный пузырь явно сильно атретичен, как при атрезии желчных путей, некоторые авторы больше не настаивают на попытках холангиограммы и приступают к процедуре Касаи напрямую со 100% точностью [25, 26] , хотя одна когорта сообщила, что показатель успешности IOC составил 86 % в этом же населении [66] . У младенцев с желчным пузырем нормального размера все ретроспективные серии случаев от четырех разных авторов сообщают о 100% чувствительности и специфичности для оценки проходимости желчных протоков [12, 25, 26, 66] .
Рекомендация:
IOC обладает высокой чувствительностью, специфичностью, положительной и отрицательной прогностической ценностью и точностью для обнаружения камней CBD и патологии желчных путей новорожденных. Хирурги должны свободно использовать эту технику по показаниям и ознакомиться с ее интерпретацией.
Класс: ++, Сильный
Сколько времени нужно на выполнение IOC?
Одним из аргументов против рутинного использования МОК было то, что он продлевает продолжительность лапароскопической холецистэктомии.Отчеты о сроках проведения IOC различаются в зависимости от техники, опыта выполнения процедуры и условий (в больнице или нет). Сообщаемая продолжительность лапароскопической ИОК колеблется от 4,3 до 18 минут [15, 26, 29, 54, 55, 57, 58, 62, 63, 67, 68] ; более длительная процедура связана с ограниченным доступом к рентгеноскопии, неадекватными хирургическими навыками и нечастым использованием процедуры [69] .
Рекомендация:
IOC при лапароскопической холецистэктомии минимально увеличивает продолжительность процедуры в опытных руках.Однако ограниченное использование МОК и незнание процедуры хирургами и персоналом операционной может значительно продлить процедуру, указывая на необходимость ее более частого использования.
Оценка: ++, слабая
Альтернативы интраоперационной оценке желчного дерева
Существуют ли другие оперативные методы, которые можно использовать вместо IOC для оценки CBD / анатомии?
Сообщалось о двух основных интраоперационных методах, альтернативных интраоперационной холангиограмме для оценки билиарного дерева, включая лапароскопическую ультрасонографию и инфракрасную флуоресцентную холангиографию.
Лапароскопическое УЗИ
Лапароскопическая ультразвуковая оценка желчного дерева появилась как альтернатива IOC и пытается устранить некоторые из потенциальных недостатков IOC, включая радиационное воздействие, время операции и частоту отказов. Были описаны различные методы лапароскопической ультразвуковой оценки билиарного дерева, но они традиционно выполняются с использованием тех же лапароскопических портов, что и стандартная 4-портовая холецистэктомия. Затем через эпигастральный или пупочный порт вводится гибкий ультразвуковой прибор.Дно желчного пузыря отводится к головке, и ультразвуковой зонд помещается над общим желчным протоком, где можно визуализировать соединение правого и левого печеночных протоков, а также соединение пузырного протока. Затем ультразвуковой зонд может проследовать по общему желчному протоку до двенадцатиперстной кишки для оценки камней в общем желчном протоке и других соответствующих анатомических особенностей.
Лапароскопический ультразвук был принят многими хирургами в качестве альтернативы интраоперационной холангиограмме, и многочисленные исследования с различными методологиями сообщили о безопасности и эффективности этого метода.На сегодняшний день многие исследования проводились с небольшими размерами выборок, что ограничивало сравнения МОК. Недавний метаанализ сравнил лапароскопическое УЗИ с ИОК, чтобы оценить, является ли это сопоставимым методом интраоперационной визуализации [70] . Первичным результатом было наличие или отсутствие камней в общем желчном протоке; исследования были исключены по следующим причинам: отсутствие сравнения с IOC на той же популяции пациентов, открытые случаи, УЗИ, проведенное новичками (менее 20 случаев), отсутствие проспективного сбора данных, и если они не предоставили достаточно данных для чувствительности, специфичности, истинно положительный, истинно отрицательный, ложноположительный и ложноотрицательный [70] .На основании 11 исследований, которые соответствовали критериям включения, объединенная чувствительность для выявления камней общего желчного протока для ИОК составила 0,87 (95% ДИ 0,77-0,93), а совокупная специфичность 0,99 (95% ДИ 0,98-0,99), в то время как лапароскопическое ультразвуковое исследование имело объединенную чувствительность 0,87 (95% ДИ 0,80–0,92) и специфичность 1,00 (95% ДИ 0,99–1,00) [70] . Этот хорошо проведенный мета-анализ показывает, что лапароскопическое ультразвуковое исследование является точным средством интраоперационной оценки камней в общем желчном протоке по сравнению с IOC [70] .Важно отметить, что это исследование не оценивало лапароскопическое ультразвуковое исследование как инструмент для правильного определения анатомии желчевыводящих путей или предотвращения повреждений общих желчных протоков, и на сегодняшний день нет убедительных данных по этой теме. В одном многоцентровом обзоре использования лапароскопического ультразвука у 1381 пациента, у которого не было повреждений основных желчных протоков, сделан вывод о том, что этот метод может помочь предотвратить повреждения желчных протоков [71] .
Сообщалось о некоторых потенциальных преимуществах лапароскопического ультразвука, включая сокращение времени, а также возможность снижения затрат [72, 73] .Зарегистрированное время для лапароскопического УЗИ в среднем составляло от 6,6 до 11,6 минут по сравнению со средним временем для интраоперационной холангиограммы в диапазоне от 10,9 до 17,9 минут, причем все исследования отражали более короткое время с использованием лапароскопического УЗИ [54, 62, 63, 67, 68, 74] . Лапароскопический ультразвук также применялся в педиатрической популяции и показывает многообещающие возможности для выявления микролитиаза при нормальном IOC [75] .
Рекомендация:
Лапароскопическое ультразвуковое исследование — это реальная альтернатива интраоперационному методу по сравнению с интраоперационной холангиограммой для выявления камней в общих желчных протоках.Лапароскопическое ультразвуковое исследование может иметь некоторые преимущества перед интраоперационной холангиограммой, в том числе сокращение времени на выполнение техники.
Оценка: +++, Крепкий
Флуоресцентная холангиография в ближнем инфракрасном диапазоне
Флуоресцентная холангиография была впервые описана в 2009 году и включает предоперационную внутривенную инъекцию индоцианинового зеленого (ICG) и основана на концепции, согласно которой ICG выводится исключительно с желчью и что связанный с белком ICG излучает свет с максимальной длиной волны 830 нм, когда освещается ближним инфракрасным светом [76-79] [62-65] .
Сообщалось о различных устройствах и методах для флуоресцентной холангиографии, но все они основаны на введении ICG внутри желчных путей или внутривенно и использовании специализированной системы камер, которая использует ближний инфракрасный свет, чтобы позволить хирургу видеть флуоресцентные ICG и оценить анатомию желчевыводящих путей. В этой связи обзор флуоресцентной холангиографии будет ограничен ее использованием во время лапароскопической холецистэктомии. Сообщается, что структуры, которые можно идентифицировать во время лапароскопической флуоресцентной холангиографии перед рассечением треугольника Калота, включают пузырный проток, общий печеночный проток, общий желчный проток и место соединения пузырного протока с общим печеночным протоком.Сообщаемая частота визуализации этих структур колеблется от 71,4 до 100% для пузырного протока, 33,3-100% для общего печеночного протока, 25-100% для соединения пузырного протока / общего печеночного протока и 50-100% для общей желчи. воздуховод [76, 77, 80-86] . Нет данных о его применении в педиатрии.
Одно исследование рассматривало идентификацию желчного дерева как до, так и после рассечения треугольника Кало с помощью ICG и обнаружило, что флуоресцентная визуализация визуализировала пузырный проток, CD-CHD, CHD и CBD у 69.От 6% до 95,1% пациентов [87] . Это было в 2-3 раза больше в идентификации анатомии желчных протоков по сравнению с отсутствием диссекции [87] . Острое воспаление и толщина тканей (> 5-10 мм), покрывающих треугольник и портальный гепатит, были ограничивающими факторами [87] . Однако оказалось, что ИМТ не является статистически значимой переменной. У пациентов, у которых IOC не был успешным, флуоресцентная визуализация была успешной в 80% случаев при идентификации анатомии внепеченочных желчных протоков [87] (Narula et.al).
Недавно появились сообщения об использовании флуоресцентной холангиографии во время роботизированной традиционной и одноцентровой холецистэктомии. Несколько авторов сообщили о сериях случаев от 44 до 184, сообщая о безопасности и эффективности этой технологии во время роботизированной холецистэктомии [83, 85, 86] .
Использование флуоресцентной холангиографии для обнаружения желчных камней ограничено. Об обнаружении смоделированных камней общего желчного протока на мышиной модели с использованием флуоресценции сообщалось [88] .Osayi et al. осмотрел 82 пациента и обнаружил, что флуоресцентная визуализация не позволяет выявить холедохолитиаз и отстой; следовательно, IOC остается золотым стандартом в этом контексте [87] .
В одном исследовании оценивалась стоимость и время операции флуоресцентной холангиографии с интраоперационной холангиограммой n у 45 пациентов по сравнению с контрольной историей [89] . Они сообщили о более низкой индивидуальной медианной стоимости на пациента (13,97 ± 4,3 против 778,43 ± 0,4 доллара США, p = 0,00001) и более коротком времени процедуры (0.71 ± 0,26 против 7,15 ± — 3,76 минут, p <0,0001) для флуоресцентной холангиографии по сравнению с интраоперационной холангиограммой [89] .
Рекомендация:
Флуоресцентная холангиография — это новая развивающаяся методика, которая осуществима и безопасна для использования во время лапароскопической холецистэктомии. Диапазоны идентификации различных анатомических структур различаются, и технология не оценивалась при различных патологиях желчевыводящих путей. В настоящее время недостаточно доказательств для использования флуоресцентной холангиографии для оценки камней в общих желчных протоках, уменьшения повреждений желчных протоков или для оценки эффективности по сравнению с интраоперационной холангиографией, и ее роль для использования еще не определена.Флуоресцентная холангиография может выполняться с меньшими затратами времени и средств, чем обычные интраоперационные холангиограммы.
Оценка: +, слабый
Раскрытие информации
У доктора Хоуп гонорар за консультацию / исследование для Барда / Давола и Гора. Доктор Фанелли является владельцем Allurion Technologies, Respiratory Motion, Mozaic Medical. Он получает гонорары от Cook, Inc. Он является членом правления SAGES, а также активным членом комитета ASGE. Он является директором Американского совета хирургии.Он является консультантом Boston Scientific Corporation. Доктору Уолшу нечего раскрывать. Доктору Прайсу нечего раскрывать. Доктор Стефанидис получает гонорары за преподавание для У.Л. Гора и Давола. Доктору Ричардсону нечего раскрывать.
Артикул:
- MacFadyen, B.V., Интраоперационная холангиография: прошлое, настоящее и будущее. Surg Endosc, 2006. 20 Приложение 2: с. S436-40.
- Райх А., Случайная инъекция в желчные протоки вазелином и висмутовой пастой. JAMA, 1918 год.71: стр. 1555.
- Тенни К. и С. Паттерсон, Инъекция в желчные протоки висмутовой пастой. JAMA, 1922. 78: с. 171.
- Гинзбург, Л. и Э. В. Бенджамин, Исследования липиодола послеоперационных желчных свищей. Ann Surg, 1930. 91 (2): p. 233-41.
- Mirizzi, P.L., La Cholangiografia Durante las Operaciones de las Vias Biliares. Bol Soc Cir Buenos Aires, 1932. 16: p. 1133.
- Свенсон, О. и Дж. Х. Фишер, Использование холангиограммы во время исследования атрезии желчных путей.N Engl J Med, 1952. 247 (7): p. 247-8.
- Lackner, J. and L. Volkel, Die Technik der Intraoperative Cholangiographie unter Verwendung desRoentgen-Bildverstaerkers. Рентгенбл, 1957. 10: с. 119.
- Стефанини, П., La Roentgentscopia Televisiva Intraoperatoria delle Vie Biliari. Gaz Intern Med E Chir, 1963. 48: с. 1435.
- Грейс, Р.Х. и В.Г. Пекар, Значение оперативной холангиографии с использованием усилителя изображения и телевизионного монитора. Br J Surg, 1968. 55 (12): p.933-8.
- Whitaker, P.H., E.G. Паркинсон и Дж. Хьюз, Телевизионная рентгеноскопия для оперативной холангиографии. Разбор 150 дел. Clin Radiol, 1968. 19 (4): p. 368-78.
- Berci, G., et al., Оперативная рентгеноскопия и холангиография. Использование современной радиологической техники во время операции. Am J Surg, 1978. 135 (1): p. 32-5.
- Tang, S.T., et al., Оценка холангиографии с применением лапароскопии в диагностике длительной желтухи у младенцев. J Laparoendosc Adv Surg Tech A, 2009.19 (6): с. 827-30.
- Overby, D.W., et al., Руководство SAGES по клиническому применению лапароскопической хирургии желчных путей. Surg Endosc, 2010. 24 (10): с. 2368-86.
- Eikermann, M., et al., Профилактика и лечение повреждений желчных протоков во время лапароскопической холецистэктомии: руководящие принципы клинической практики Европейской ассоциации эндоскопической хирургии (EAES). Surg Endosc, 2012. 26 (11): с. 3003-39.
- Ford, J.A., et al., Систематический обзор интраоперационной холангиографии при холецистэктомии.Br J Surg, 2012. 99 (2): с. 160-7.
- Buddingh, K.T., et al., Интраоперационная оценка анатомии желчных протоков для предотвращения повреждения желчных протоков: обзор текущих и будущих вмешательств по безопасности пациентов. Surg Endosc, 2011. 25 (8): с. 2449-61.
- Flum, D.R., et al., Повреждение желчных протоков во время холецистэктомии и выживаемость у получателей медицинской помощи. JAMA, 2003. 290 (16): с. 2168-73.
- Sheffield, K.M., et al., Связь между холецистэктомией с интраоперационной холангиографией и без нее и риском повреждения общего протока.JAMA, 2013. 310 (8): с. 812-20.
- Kelley-Quon, L.I., et al., Осложнения детской холецистэктомии: влияние госпитального опыта и использования холангиографии. J Am Coll Surg, 2014. 218 (1): с. 73-81.
- Tornqvist, B., et al., Влияние запланированной интраоперационной холангиографии и раннего выявления повреждения желчных протоков на выживаемость после холецистэктомии: популяционное когортное исследование. BMJ, 2012. 345: с. e6457.
- Альварес, Ф.А. и др., Влияние рутинной интраоперационной холангиографии во время лапароскопической холецистэктомии на повреждение желчных протоков.Br J Surg, 2014. 101 (6): с. 677-84.
- Раваль, М.В., Т.Б. Лаутц и М. Браун. Повреждения желчных протоков во время детской лапароскопической холецистэктомии: национальная перспектива. J Laparoendosc Adv Surg Tech A, 2011. 21 (2): с. 113-8.
- Страсберг, С.М., М. Хертл, Н.Дж. Сопер, Анализ проблемы повреждения желчевыводящих путей во время лапароскопической холецистэктомии. J Am Coll Surg, 1995. 180 (1): p. 101-25.
- Селим, М.И., А.М. Аль-Хашеми, С.С. Мешреф, Мини-лапароскопическая холецистэктомия у детей до 10 лет с серповидно-клеточной анемией.ANZ J Surg, 2005. 75 (7): p. 562-5.
- Окадзаки Т. и др. Диагностическая холангиография с применением лапароскопии у младенцев с длительной желтухой. Pediatr Surg Int., 2006. 22 (2): с. 140-3.
- Hay, S.A. и др., Желтуха новорожденных: роль лапароскопии. J Pediatr Surg, 2000. 35 (12): с. 1706-9.
- Houben, C.H., et al., Заедание желчного пузыря при лапароскопической холецистохолангиографии: простой метод. Pediatr Surg Int, 2013. 29 (9): с. 953-5.
- Холкомб, Г.W., 3rd, et al., Лапароскопическая холецистэктомия у младенцев и детей: модификации и анализ затрат. J Pediatr Surg, 1994. 29 (7): с. 900-4.
- Buddingh, K.T., et al., Техника канюляции Кумара и Олсена для интраоперационной холангиографии: рандомизированное исследование. Surg Endosc, 2013. 27 (3): с. 957-63.
- Hill, S.J. и др., Ведение педиатрических пациентов с холедохолитиазом в эпоху передовых малоинвазивных методов. J. Laparoendosc Adv Surg Tech A, 2014. 24 (1): p.38-42.
- Файек С.А., К. Варга и К. Ли, Надежный метод обработки «трудного» пузырного протока для получения хорошей холангиограммы во время лапароскопической холецистэктомии. Surg Endosc, 2007. 21 (6): с. 1020-2.
- Ponce, J., et al., Влияние внутривенного введения глюкагона и глюкагон- (1-21) -пептида на двигательную активность сфинктера Одди у людей. Dig Dis Sci, 1989. 34 (1): с. 61-4.
- Махмуд, С. и др., Радиологическое лечение оставшихся камней желчных протоков после недавней операции с использованием глюкагонов.Surg Endosc, 2001. 15 (11): с. 1359-60.
- Джонс, Р. М. и др., Обращение спазма билиарного сфинктера с помощью низких доз глюкагона во время оперативной холангиографии. Anaesth Intensive Care, 1983. 11 (2): p. 174-5.
- Табак С.А. и др., Улучшение холангиографии глюкагоном. Предварительный отчет. Arch Surg, 1983. 118 (1): с. 84-5.
- Эванс, А.Ф. и Г.Х. Уайтхаус, Дальнейший опыт холангиографии с усилением глюкагона. Clin Radiol, 1980. 31 (6): p. 663-5.
- Джарретт, Л.Н. и Г.Д. Белл, Эффект внутривенного введения глюкагона на желчную секрецию холангиографического агента у человека. Clin Radiol, 1980. 31 (6): p. 657-61.
- Bordley, J.t. и J.E. Olson, Использование глюкагона в оперативной холангиографии. Surg Gynecol Obstet, 1979. 149 (4): с. 583-4.
- Эванс, А.Ф. и Г.Х. Белый дом, Влияние глюкагона на инфузионную холангиографию. Clin Radiol, 1979. 30 (5): с. 499-506.
- Кэннон, П. и Д. Легге, Глюкагон как гипотонический агент в холангиографии.Clin Radiol, 1979. 30 (1): p. 49-52.
- Билиотти Д. и др. Влияние глюкагона на сфинктер двигательной активности Одди. Пищеварение, 1989. 43 (4): с. 185-9.
- Cofer, J.B., et al., Влияние внутривенного глюкагона на интраоперационную холангиографию. South Med J, 1988. 81 (4): p. 455-6.
- Джарретт, Л.Н. и др., Глюкагон и инфузионная холангиография. Br J Radiol, 1982. 55 (652): p. 269-71.
- Schorr, R.T. и С. Роджерс, Интраоперационный сердечно-сосудистый криз, вызванный глюкагоном.Arch Surg, 1987. 122 (7): с. 833-4.
- Short, S.S. и др., Лапароскопическое исследование общего желчного протока у детей связано со снижением стоимости и продолжительности пребывания в стационаре: результаты двухцентрового анализа. Журнал Педиатр Хирургия, 2013. 48 (1): с. 215-20.
- Berrani, H., et al., Ассоциация N-ацетилцистеина и глюкагона во время чрескожной холангиографии при лечении синдрома уплотненной желчи. Арх Педиатр, 2015. 22 (3): с. 300-2.
- Pietrabissa, A., et al., Сравнительная оценка контактной ультрасонографии и транскистозной холангиографии во время лапароскопической холецистэктомии: проспективное исследование.Arch Surg, 1995. 130 (10): с. 1110-4.
- Rawlings, A., et al., Лапароскопическая холецистэктомия с одним разрезом: начальный опыт критического взгляда на безопасность диссекции и рутинной интраоперационной холангиографии. J Am Coll Surg, 2010. 211 (1): с. 1-7.
- Hublet, A., et al., Лапароскопическая ультрасонография как хорошая альтернатива интраоперационной холангиографии (IOC) во время лапароскопической холецистэктомии: результаты проспективного исследования. Acta Chir Belg, 2009. 109 (3): с. 312-6.
- Ли, Дж.W., et al., Интраоперационная холангиография в сочетании с лапароскопической ультрасонографией для выявления скрытого холедохолитиаза. Med Sci Monit, 2009. 15 (9): с. MT126-30.
- Людвиг К., Дж. Бернхардт и Д. Лоренц, Значение и последствия рутинной интраоперационной холангиографии во время холецистэктомии. Surg Laparosc Endosc Percutan Tech, 2002. 12 (3): с. 154-9.
- Кимура Т. и др. Лапароскопическое ультразвуковое исследование и оперативная холангиография предотвращают образование остаточных камней в общем желчном протоке при лапароскопической холецистэктомии.Surg Laparosc Endosc Percutan Tech, 1999. 9 (2): с. 124-8.
- Csendes, A., et al., Распространенность камней в общем желчном протоке в соответствии с возрастающим числом факторов риска. Проспективное исследование с использованием рутинной интраоперационной холангиографии в 477 случаях. Гепатогастроэнтерология, 1998. 45 (23): с. 1415-21.
- Birth, M., et al., Проспективное рандомизированное сравнение лапароскопической ультрасонографии с использованием ультразвукового зонда с гибким наконечником и интраоперационной динамической холангиографии во время лапароскопической холецистэктомии.Surg Endosc, 1998. 12 (1): с. 30-6.
- Hope, W.W., et al., Обучение холангиографии в хирургической ординатуре. J Surg Educ, 2013. 70 (2): с. 243-7.
- Gyorgy, L., et al., Оценка периоперационной холангиографии при тысяче лапароскопических холецистэктомий. Magy Seb, 2006. 59 (2): p. 91-6.
- Wenner, D.E., et al., Фактическое время, необходимое для динамической флюороскопической интраоперационной холангиографии. JSLS, 2005. 9 (2): с. 174-7.
- Collins, C., et al., Проспективное исследование камней в общем желчном протоке у пациентов, перенесших лапароскопическую холецистэктомию: пересмотр естественного течения холедохолитиаза.Ann Surg, 2004. 239 (1): p. 28-33.
- Waldhausen, J.H., D.D. Graham, D. Tapper, Обычная интраоперационная холангиография во время лапароскопической холецистэктомии сводит к минимуму ненужную эндоскопическую ретроградную холангиопанкреатографию у детей. Журнал Педиатр Хирургия, 2001. 36 (6): с. 881-4.
- Videhult, P., G. Sandblom, and I.C. Расмуссен, Насколько надежна интраоперационная холангиография как метод выявления камней в общем желчном протоке? : Проспективное популяционное исследование с участием 1171 пациента.Surg Endosc, 2009. 23 (2): с. 304-12.
- Сингх, Г. и др., Роль селективной интраоперационной холангиографии во время холецистэктомии. Aust N Z J Surg, 2000. 70 (2): p. 106-9.
- Кателин, Дж., Н. Ризк и Дж. Шампо, Сравнение лапароскопического ультразвука и холангиографии при оценке желчных протоков во время лапароскопической холецистэктомии. Eur J Ultrasound, 1999. 10 (1): p. 1-9.
- Томпсон, Д.М., и др., Сравнение лапароскопического ультразвука с цифровой флюорохолангиографией для выявления холедохолитиаза во время лапароскопической холецистэктомии.Surg Endosc, 1998. 12 (7): с. 929-32.
- Ротлин М.А. и др., Лапароскопическая ультрасонография во время холецистэктомии. Br J Surg, 1996. 83 (11): 1512-6.
- Barteau, J.A., et al., Сравнение интраоперационного ультразвука и холангиографии при оценке общего желчного протока во время лапароскопической холецистэктомии. Surg Endosc, 1995. 9 (5): с. 490-6.
- Huang, L., et al., Лапароскопическая холецистохолангиография для диагностики длительной желтухи у младенцев, опыт 144 случая.Pediatr Surg Int., 2010. 26 (7): с. 711-5.
- Кателин, Дж. М. и др., Оценка билиарного дерева во время лапароскопической холецистэктомии: лапароскопическое ультразвуковое исследование в сравнении с интраоперационной холангиографией: проспективное исследование 150 случаев. Surg Laparosc Endosc, 1998. 8 (2): с. 85-91.
- Стигманн, Г.В. и др., Лапароскопическая ультрасонография в сравнении со статической или динамической холангиографией при лапароскопической холецистэктомии. Перспективное многоцентровое исследование. Surg Endosc, 1995. 9 (12): с.1269-73.
- Massarweh, N.N., et al., Знания, поведение и мнения хирургов относительно интраоперационной холангиографии. J Am Coll Surg, 2008. 207 (6): с. 821-30.
- Азиз О. и др. Лапароскопическая ультрасонография в сравнении с интраоперационной холангиограммой для выявления камней общего желчного протока во время лапароскопической холецистэктомии: метаанализ диагностической точности. Int J Surg, 2014. 12 (7): с. 712-9.
- Machi, J., et al., Обычное использование лапароскопического ультразвука уменьшает повреждение желчных протоков: многоцентровое исследование.Surg Endosc, 2009. 23 (2): с. 384-8.
- Biffl, W.L., et al., Обычное интраоперационное лапароскопическое ультразвуковое исследование с селективной холангиографией снижает количество осложнений со стороны желчных протоков во время лапароскопической холецистэктомии. J Am Coll Surg, 2001. 193 (3): с. 272-80.
- Falcone, R.A., Jr., et al., Проспективное сравнение лапароскопического ультразвука и интраоперационной холангиограммы во время лапароскопической холецистэктомии. Surg Endosc, 1999. 13 (8): с. 784-8.
- Кателин, Дж. М. и Дж. Шампо, Лапароскопическое ультразвуковое исследование в абдоминальной хирургии.Acta Chir Belg, 1998. 98 (2): p. 55-61.
- Нефф, Л.П. и др., Микролитиаз, Эндоскопическое УЗИ и дети: не только маленькие желчные камни у маленьких взрослых. Журнал Педиатр Хирургия, 2011. 46 (3): с. 462-6.
- Ishizawa, T., Y. Bandai и N. Kokudo, Флуоресцентная холангиография с использованием индоцианинового зеленого для лапароскопической холецистэктомии: начальный опыт. Arch Surg, 2009. 144 (4): с. 381-2.
- Ishizawa, T. и др., Интраоперационная флуоресцентная холангиография с использованием индоцианинового зеленого: дорожная карта желчных путей для безопасной хирургии.J Am Coll Surg, 2009. 208 (1): с. е1-4.
- Ландсман М.Л. и др., Светопоглощающие свойства, стабильность и спектральная стабилизация индоцианинового зеленого. J. Appl Physiol, 1976. 40 (4): p. 575-83.
- Mordon, S., et al., Индоцианин зеленый: физико-химические факторы, влияющие на его флуоресценцию in vivo. Microvasc Res, 1998. 55 (2): p. 146-52.
- Ishizawa, T., et al., Флуоресцентная холангиография, освещающая желчное дерево во время лапароскопической холецистэктомии. Br J Surg, 2010.97 (9): с. 1369-77.
- Aoki, T. и др., Интраоперационная флуоресцентная визуализация с использованием индоцианинового зеленого для картирования печени и холангиографии. J. Hepatobilial Pancreat Sci, 2010. 17 (5): p. 590-4.
- Kaneko, J., et al., Техника повторной инъекции индоцианина зеленого для использования в флуоресцентной ангиографии одновременно с холангиографией во время лапароскопической холецистэктомии. Surg Laparosc Endosc Percutan Tech, 2012. 22 (4): с. 341-4.
- Buchs, N.C., et al., Интраоперационная флуоресцентная холангиография с использованием индоцианинового зеленого во время роботизированной одноцентровой холецистэктомии.Int J Med Robot, 2012. 8 (4): с. 436-40.
- Schols, R.M., et al., Флуоресцентная холангиография во время лапароскопической холецистэктомии: технико-экономическое обоснование раннего определения границ желчных путей. Surg Endosc, 2013. 27 (5): с. 1530-6.
- Spinoglio, G., et al., Флуоресцентная холангиография в ближнем инфракрасном диапазоне (NIR) в режиме реального времени при одноцентровой роботизированной холецистэктомии (SSRC): проспективное исследование, проводимое одним учреждением. Surg Endosc, 2013. 27 (6): с. 2156-62.
- Daskalaki, D., et al., Флуоресцентная холангиография индоцианинового зеленого (ICG) во время роботизированной холецистэктомии: результаты 184 последовательных случаев в одном учреждении.Surg Innov, 2014. 21 (6): с. 615-21.
- Osayi, S.N., et al., Флуоресцентная холангиография в ближнем инфракрасном диапазоне облегчает идентификацию анатомии желчных протоков во время лапароскопической холецистэктомии. Surg Endosc, 2015. 29 (2): с. 368-75.
- Фигейредо, Дж. Л. и др., Интраоперационная флуоресцентная холангиография в ближнем инфракрасном диапазоне (NIRFC) на мышиных моделях повреждения желчных протоков. World J Surg, 2010. 34 (2): с. 336-43.
- Dip, F.D., et al., Анализ затрат и эффективность сравнения рутинного использования интраоперационной флуоресцентной холангиографии с флюороскопической холангиограммой у пациентов, перенесших лапароскопическую холецистэктомию.Surg Endosc, 2014. 28 (6): с. 1838-43 гг.
© 2021 Общество американских желудочно-кишечных и эндоскопических хирургов. Все права защищены. Пожалуйста, не размещайте этот документ на своем веб-сайте.
Пероперационная холангиография — обзор
Интраоперационная холангиография
IOC чаще всего используется во время плановой холецистэктомии для оценки ретинированных камней и для уточнения анатомии желчных протоков (см. Главы 34, 35 и 43). Напротив, ИОК редко помогает при оценке желчных опухолей и редко требуется при резекции печени.Техника ИОК через пузырный проток описана в гл. 35. Впервые введенная Mirizzi (1948), IOC впоследствии была рекомендована как рутинная процедура для всех холецистэктомий (Amott et al, 2005; Mills et al, 1985; Wenner et al, 2005). Однако такая политика рутинного применения подвергалась сомнению во многих сообщениях (Metcalfe et al, 2004; Nugent et al, 2005; Olsen, 1997).
При оценке желчного протока на предмет наличия ретенционных камней необходимо учитывать множество факторов.Во-первых, большинство камней в желчном дереве подозреваются на основании клинических данных и выявляются до операции (Sarli et al, 2003a, 2003b), а доля пациентов с тихим холедохолитиазом невысока. Анализ нескольких серий, включающих более 4000 случаев, выявил 4% случаев появления неожиданных камней в желчном протоке (Metcalfe et al, 2004). При анализе 5179 пациентов, перенесших лапароскопическую холецистэктомию без IOC, только у 0,6% развились симптомы, связанные с остаточными камнями в желчном протоке.Заболеваемость непредвиденным холедохолитиазом низка, а вероятность того, что такие камни станут клинически значимыми, еще ниже. Другое соображение заключается в том, что могут быть ложноположительные результаты в диапазоне от 0% до 4% (0,8% в исследовании Metcalfe et al [2004]), что приводит к дополнительным ненужным процедурам. Используя свои результаты, Metcalfe и соавторы (2004) подсчитали, что для обнаружения одного общего камня желчных протоков, который в конечном итоге станет симптоматическим у пациента без предоперационного предположения о холедохолитиазе, необходимо провести 167 исследований IOC; кроме того, потребуется 8 ненужных исследований желчных протоков или эндоскопические ретроградные холангиопанкреатографические исследования для ложноположительных результатов и для камней, которые остались бы бессимптомными.
Литература поддерживает избирательный подход к оценке непредвиденного холедохолитиаза. Сарли и его коллеги (2003a, 2003b) сообщили о низкой частоте ретинированных камней, используя предоперационный алгоритм, основанный на клинических симптомах и биохимических тестах, подход, который значительно сократил количество выполненных исследований IOC. Также существуют разногласия относительно роли МОК в снижении частоты повреждения желчевыводящих путей. Несколько исследований показали, что рутинная ИОК снижает частоту или тяжесть повреждений желчевыводящих путей, связанных с лапароскопической холецистэктомией (см. Гл.43). Тем не менее, проясняет ли IOC анатомию желчевыводящих путей, чтобы предотвратить или минимизировать травму, зависит от времени исследования (т.е.до того, как травма произойдет) и требует правильной интерпретации результатов (Olsen, 1997). В своем обзоре лапароскопической холецистэктомии с ИОК ( n = 6024 пациентов) и без ИОК ( n = 3268 пациентов) Меткалф и его коллеги (2004) обнаружили небольшую разницу в частоте серьезных травм (0,02% против 0,09%). ; P =.13) и нет разницы в количестве легких травм (0,28% против 0,18%; P = 0,025). Напротив, вероятность немедленного распознавания травмы была значительно выше, если бы IOC была выполнена ( P = 0,01). Интраоперационное распознавание и коррекция повреждения желчевыводящих путей снижает заболеваемость пациентов (см. Гл. 43). Однако, по оценке Меткалфа и его коллег (2004), для выявления одной травмы во время операции необходимо выполнить 821 холангиограмму. Оправдана ли выборочная политика МОК, остается предметом споров, и усилия по выявлению пациентов с высоким риском травм, вероятно, будут полезны в этом отношении.
Плановая интраоперационная холангиография при лапароскопической холецистэктомии
Цели: В настоящем исследовании анализируется ценность интраоперационной холангиографии (IOC), выполненной у всех пациентов в течение 22 лет хирургической деятельности в трех разных учреждениях, и, в результате постоянного научного внимания к этому вопросу, мы разработали набор критериев. которые анализируются и обсуждаются.
Материалы и методы : Мы изучили пациентов, перенесших лапароскопическую холецистэктомию в трех больницах с января 1995 года по декабрь 2017 года.Группа пациентов проанализирована, во всех случаях проведено ИОК.
Результаты : у нас были положительные результаты по камням общего желчного протока (CBDS), не подозреваемые более чем в 10%, открытие, которое изменило хирургическое лечение пациента после IOC. Эта процедура заняла в среднем 10 минут, и не было никаких осложнений, вызванных МОК.
Выводы : Интраоперационная холангиография, выполняемая в плановом порядке, представляет собой важный инструмент в диагностике нежелательных камней в общем желчном протоке (CBDS) во время LC.Такое отношение предотвратило дальнейшее хирургическое лечение всех пациентов с бессимптомным билиарным калькулезом.
Бессимптомные камни общего желчного протока (CBD) даже сегодня представляют серьезную проблему для хирурга, несмотря на прогресс, достигнутый как в эндоскопии, так и в лапароскопии. Чуть более 10 лет назад у 10% пациентов с симптоматическим калькулезом и у 15% пациентов с острым холециститом были камни в общем желчном протоке. При лапароскопической процедуре пациенты имели преимущество более быстрого и быстрого подхода к холецистэктомии с последующим уменьшением холедохолитиаза.Даже когда все процедуры выполнимы, одни методы предпочтительнее других. Если пациенту была проведена холецистэктомия, единодушно мнение, что холедохалитиаз необходимо лечить эндоскопически с помощью эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) с эндоскопической сфинктеротомией (ЭС), сохраняющей операцию в случае неудачи (5-10%) [1]. Если желчный пузырь находится «на месте», лечение является спорным, т.е. ERCP с последующей лапароскопической холецистэктомией (LC). Другая возможность — выполнить холецистэктомию и удалить камни CBD с помощью лапароскопии или отказаться от камней с последующей ERCP после LC.Многие хирурги соглашаются с этими вариантами в соответствии со своим личным опытом, а также с различными протоколами, которым необходимо следовать. Наша личная склонность — лечить CBDS за один раз, используя все возможные хирургические стратегии, которыми мы располагаем, и это наше отношение также подтверждается положительными результатами, полученными за эти годы.
С января 1995 года по декабрь 2017 года мы собрали данные о 8918 пациентах, перенесших LC по поводу симптоматического литиаза в трех разных учреждениях.Рутинная интраоперационная холангиография (IOC) была успешно выполнена у 8806 пациентов (98,8%). У остальных 112 пациентов (1,2%) неудача была вызвана техническими трудностями. Предоперационное подозрение на CBDS было основано на истории болезни пациента, возможном появлении желтухи или панкреатита с учетом высоких значений в крови билирубина (> 1,0 мг / дл), щелочного фосфата (> 147 Ед / дл), амилазы (> 115 Ед / дл) или ультразвуковая документация CBDS или его диаметр более 7 мм.Если ни один из этих элементов отсутствует, мы рассматриваем процедуру IOC. Общие желчные камни были обнаружены у 1631 пациента (18,5%) с предоперационным диагнозом 1458 случаев (89,3%) и 173 случая (10,6%), обнаруженных во время ЦП на периоперационной холангиографии. ЭРХПГ с ЭС была успешно проведена у 1221 пациента (83,7%), которым был поставлен предоперационный диагноз CBDS. Остальные 237 пациентов (16,2%), добавленные к пациентам с интраоперационным диагнозом CBDS, прошли хирургическое лечение, как показано в таблице 1.Оперативная холангиография была предпринята у всех пациентов с использованием катетера 4-Fr, а холедохоскопия была выполнена с использованием фиброскопа размера 7-FR, введенного через пузырный проток или холедохотомию, чтобы подтвердить полное очищение желчных протоков. Пациенты наблюдались через 6-12-24 месяцев и не обнаружили резидуальных или рецидивов камней. Сообщалось о послеоперационных осложнениях в двух случаях билиомы после удаления Т-образной трубки, и этим пациентам была проведена консервативная терапия. Смертности не обнаружено.
Таблица 1 . Демографическая таблица пациентов, перенесших лапароскопическую холецистэктомию с IOC (1995 — 2018)
Всего оперированных больных (8918) | Возрастной диапазон (14 — 92) | Мужчины 3711 (41,7%) | Женщины 5207 (58,3%) |
Выпущено МОК 8806 (98,8%) | Отказ 112 (1,2%) | ||
Холедохалитиаз | 1631 (18.5%) | ||
Предоперационная диагностика | 1458 (89,3%) | ||
Внутриоперационная диагностика | 173 (10,6%) |
Камни желчных путей — наиболее частая причина боли в животе и наиболее частое осложнение, связанное с камнями в желчном пузыре.Сообщается, что желчная колика или заболевание желчевыводящих путей обнаруживается примерно у 7–15% взрослых пациентов с болью в животе [2]. Заболеваемость камнями в желчном пузыре увеличивается с возрастом и достигает 30% к 70 годам [3]. Примерно 80% желчных камней имеют бессимптомное проявление, и у большинства пациентов симптомы отсутствуют в течение десятилетий. От 8% до 10% людей с бессимптомными желчными камнями развиваются симптомы в течение 5 лет и только 5% требуют хирургического вмешательства [4]. Из этих данных легко понять, что лечение желчного пузыря и желчных протоков может быть различным, особенно если диагноз ставится во время LC.
Следовательно, мы считаем, что холецистэктомию нельзя считать завершенной, если в желчном протоке остались камни. По этой причине мы выбираем рутинную IOC, которая, по нашему опыту, позволила диагностировать CBDS у 295 пациентов, которым потребовалась бы дополнительная эндоскопическая или хирургическая операция. Действительно, распространенность бессимптомной CBDS колеблется от 5,2% до 12% [5], и сообщалось, что более чем у половины пациентов с сохраненными бессимптомными камнями протоков со временем развиваются симптомы, а у 25% — серьезные осложнения [6].
После того, как камни диагностируются в желчных протоках во время LC, мы сталкиваемся с дилеммой, другими словами: удалить камни лапароскопическим способом, преобразовать их в открытую операцию, отказаться от камней, ожидая их спонтанного выхода из холедоха, прежде чем выполнять операцию. ЭРХПГ с ЭС впоследствии или для одновременного проведения лапаро-эндоскопического «рандеву». Эти различные подходы основаны не только на способностях хирурга и эндоскописта, но и на имеющихся инструментах.Все это влияет на разный процент успешности, заболеваемости и смертности [7].
В эпоху открытой холецистэктомии холедохолитиаз диагностировали при пероперационной холангиографии, и камни удалялись с помощью CBDE, как естественное продолжение оперативной процедуры. Несмотря на то, что LC считается оптимальным подходом, так как послеоперационная заболеваемость и смертность, а также продолжительность пребывания в больнице ниже, чем при стандартной холецистэктомии [8], «этот новый способ хирургического вмешательства» изменил подход к холедохолитиазу, так как лапароскопическое исследование желчных протоков, в частности при бессимптомных камнях.
Если, с одной стороны, понятно, что тот, кто выполняет 100 лапароскопических холецистэктомий или меньше в год, вряд ли будет развивать или поддерживать навыки, необходимые для лапароскопического исследования общего желчного протока, с другой стороны, мы считаем, что CBDS следует лечить в больнице. В то же время холецистэктомия как по стоимости, так и по эффективности и безопасности. Даже если многие хирурги без уважительных причин отказались от рутинной оперативной холангиографии, ее преимущества неоспоримы.
Действительно, доступно лишь несколько рандомизированных исследований, сравнивающих предоперационную ЭРХПГ с последующей ЦП с одностадийной ЦП и ДЦБДЭ [9,10], и такое же сомнение сохраняется в отношении метода исследования чрезкистозного (ТК) желчного протока и трансколедохального (ТД). ) [11] и для закрытия холедохотомии (Т-образная трубка против билиарного стента против первичного закрытия) [12]. Исходя из наших положительных результатов, мы заявляем, что рутинное использование IOC вначале не влияет на время операции, и это было задокументировано другими авторами [13].Во-вторых, это лечение позволило иногда диагностировать холедокальные камни с процентным значением выше, чем указано в литературе.
Еще одно большое преимущество, которое мы получили при системном использовании Т-образной трубки для закрытия общего желчного протока, поскольку это не привело к образованию свищей, стриктуры желчных протоков или другим осложнениям при последующем наблюдении, за исключением двух билиом, леченных консервативно. Кроме того, наличие Т-образной трубки позволило провести холангиографию с целью контроля просвета желчных протоков.Многие хирурги не разделяют этого отношения и предпочитают первичное закрытие или билиарный стент общего желчного протока, но осложнения, описанные в литературе [14], никогда не убедили нас принять эти методы. В систематическом обзоре Cocrhane, проведенном Мартином [15], сделан вывод о том, что одностадийное лечение в форме LCBDE с использованием метода TC является процедурой выбора для интраоперационно обнаруженных камней CBD. Другой вариант для LCBDE — его неудача, поэтому разумно перейти на открытую операцию.
Хирургическое соглашение еще не достигло какого-либо консенсуса для адекватного лечения холедохолитиаза, и до сих пор последовательное лечение в форме предоперационной ЭРХПГ с последующим ЦП считается оптимальным лечением.Неопределенно всегда существовал для лечения недооцененной CBS. Длительный период обучения лапароскопической процедуре привел нас к тому, что мы предпочли LCBDE рутинно и решали проблему лечения холелитиаза с холедохолитиазом за один этап.
- Петелин Дж. (1991) Лапароскопический доступ к патологии общего протока. Surg Lap Endos 1: 33-41. [Crossref]
- Caddy GR, Tham TC (2006) Желчнокаменная болезнь. Симптомы, диагностика и эндоскопическое лечение камней общего желчного протока. Best Practices Clin Gastroenterol 20: 1085-1101. [Crossref]
- Kelly K, Weber S (2006) Холецистит. В: Jamagin WR, Belghiti J, Buchler MW et al., Eds. Хирургия печени, желчевыводящих путей и поджелудочной железы 487-493.
- Halldestam I, Enell EL, Kullman E, Borch K (2004) Развитие симптомов и осложнений у людей с бессимптомными желчными камнями. Br J Surg 91: 734-738. [Crossref]
- Rosseland AR, Glomsaker TB (2000) Бессимптомные камни в общем желчном протоке .Eur J Gastroenterol Hepatol 12: 1171-1173. [Crossref]
- Johnson AG, Hosking SW (1987) Оценка лечения камней желчных протоков. Br J Surg 74: 555-560. [Crossref]
- Lacitignola S, Minardi M (2008) Лечение камней общего желчного протока: десятилетний опыт работы в центре третичной медицинской помощи. JSLS 12: 62-65. [Crossref]
- Amaral PC, Azaro Filho EM, Galvão-Neto MP, Fortes MF, Souza EL, et al.(1988) Видеолапаро-холецистэктомия: казуистика 1000 случаев. J Soc Laparoendosc Surg 2: 141-145. [Crossref]
- Роджерс С.Дж., Виолончель Дж. П., Хорн Дж. К., Сиперштейн А. Э., Шектер В. П. и др. (2010) Проспективное рандомизированное исследование LC + LCBDE по сравнению с ERCP + LC при каменной болезни общего желчного протока. Arch Surg 145: 28-33. [Crossref]
- Cuschieri A, Lezoche E, Morino M, Croce E, Lacy A, et al. (1999) E.A.E.S. многоцентровое проспективное рандомизированное исследование, сравнивающее двухэтапное и одноэтапное ведение пациентов с желчнокаменной болезнью и протоковыми камнями. Surg Endosc 13: 952-957. [Crossref]
- Honjun H, Yong J, Baoqiang W (2015) Лапароскопическая холедохотомия с исследованием общего желчного протока или транскистозный доступ? Surg Laparosc Endosc Percutan Tech 25: 218-222. [Crossref]
- Yi HJ, Hong J, Min SH, Lee HK (2015) Долгосрочный результат первичного закрытия после лапароскопического исследования общего желчного протока в сочетании с холедохоскопией. Surg Laparosc Endosc Percutan Tech 25: 250-253.[Crossref]
- Vindal A, Chander J, Lal P, Mahendra B (2015) Сравнение интраоперационной холангиографии и холедохоскопии для очистки протоков при лапароскопическом исследовании CBD: проспективное рандомизированное исследование . Surg Endosc 29: 1030-1038. [Crossref]
- Abellan Marcillo I, Qurashi K, Abrisqueta Carrion J, Martinez Isla A (2014) Лапароскопическое исследование общего желчного протока. Уроки, извлеченные из 200 случаев. Cir Esp 92: 341-347.[Crossref]
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Есть много причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Обзор текущих и будущих мероприятий по обеспечению безопасности пациентов
40. Пьячентини Ф., Перри С., Пьетранджели Ф., Нарди М-младший, Далла Торре А,
Никита А, Лотти Р., Кастальдо П., Габбриелли Ф, Кастилья Д., Ситон Г.
(2003) Интраоперационная холангиография при лапароскопической хо-
лецистэктомии: выборочная или рутинная? Г Чир 24: 123–128
41.Картикесалингам А., Маркар С.Р., Вираккоди Р., Уолш С.Р.,
Кэрролл Н., Праседом Р.К. (2009) Облучение во время лапароскопической холецистэктомии
с обычной интраоперационной ангиографией хол-
. Surg Endosc 23: 1845–1848
42. Моллой М., Бауэр Р.Х., Хассельгрен П.О., Далтон Б.Дж. (1999) Ангиография Chol-
во время лапароскопической холецистэктомии — совокупный
анализ кривой институционального обучения. Ж Гастроинтест
Сургут 3: 185–188
43.Flum DR, Flowers C, Veenstra DL (2003) Анализ экономической эффективности
интраоперационной холангиографии в профилактике
повреждений желчных протоков во время лапароскопической холецистэктомии. J Am Coll
Surg 196: 385–393
44. Machi J, Tateishi T, Oishi AJ, Furumoto NL, Oishi RH, Uchida
S, Sigel B (1999) Лапароскопическая ультрасонография в сравнении с операционным
холангиомиография во время лапароскопической холангиографии : обзор
литературы и сравнение с открытой интраоперационной ультрасонографией
.J Am Coll Surg 188: 360–367
45. Catheline J, Rizk N, Champault G (1999) Сравнение лапароскопического ультразвукового исследования
с холангиографией при оценке
желчного дерева во время лапароскопической холецистэктомии. Eur J
Ультразвук 10: 1–9
46. Bif fl WL, Moore EE, Offner PJ, Franciose RJ, Burch JM
(2001) Рутинное интраоперационное лапароскопическое УЗИ
с селективной холангиографией уменьшает количество осложнений желчных протоков
во время 9000 холецистэктомия.J Am Coll Surg 193:
272–280
47. Catheline JM, Turner R, Paries J (2002) Лапароскопическая ультрасонография
является дополнением к холангиографии для выявления
холедохолитиаза при лапароскопической холецистэктомии. Br J Surg
89: 1235–1239
48. Hakamada K, Narumi S, Toyoki Y, Nara M, Oohashi M, Miura
T, Jin H, Yoshihara S, Sugai M, Sasaki M (2008) Интраоперационная
УЗИ как учебное пособие по лапароскопической билиарной хирургии
геры.World J Gastroenterol 14: 2370–2376
49. Kimura T., Umehara Y, Yoshida M, Sakuramachi S, Kawabe A,
Suzuki K (1999) Лапароскопическое УЗИ и оперативное
холангиография предотвращает остаточные камни общего желчного протока
в
лапароскопическая холецистэктомия. Surg Laparosc Endosc Percutan
Tech 9: 124–128
50. Machi J, Oishi AJ, Tajiri T., Murayama KM, Furumoto NL, Oishi
RH (2007) Обычное лапароскопическое ультразвуковое исследование может значительно снизить потребность в
. интраоперационная холангиография
при холецистэктомии.Surg Endosc 21: 270–274
51. Machi J, Johnson JO, Deziel DJ, Soper NJ, Berber E, Siperstein
A, Hata M, Patel A, Singh K, Arregui ME (2009) Обычное использование
лапароскопического ультразвука уменьшает повреждение желчных протоков: исследование мульти-
центра. Surg Endosc 23: 384–388
52. Ондерс Р.П., Хэллоуэлл П.Т. (2005) Эпоха ультразвукового исследования
во время лапароскопической холецистэктомии. Am J Surg 189: 348–351
53. Perry KA, Myers JA, Deziel DJ (2008) Лапароскопическое ультразвуковое исследование
как основной метод визуализации желчных протоков при холецисто-
тэктомии.Surg Endosc 22: 208–213
54. Tranter SE, Thompson MH (2001) Возможности лапароскопической
ультрасонографии в качестве альтернативы оперативной холангиографии в
обнаружении камней желчных протоков. Br J Surg 88: 65–69
55. Tranter SE, Thompson MH (2003) Проспективное слепое контролируемое исследование
, сравнивающее лапароскопическое ультразвуковое исследование желчного протока соединения
с оперативной холангиографией. Surg Endosc
17: 216–219
56.Birth M, Carroll BJ, Delinikolas K, Eichler M, Weiser H (1996)
Распознавание лапароскопических повреждений желчных протоков с помощью интраоперационной
ультрасонографии. Surg Endosc 10: 794–797
57. Birth M, Roblick U, Brugmans F, Weiser HF, Bruch HP (1999)
Лапароскопическое ультразвуковое исследование надежно визуализирует повреждение желчного протока.
ries — слепое рандомизированное исследование на свиньях. Langenbecks Arch Surg
384: 360–365
58. Wills VL, Jorgensen JO, Hunt DR (2000) Рандомизированное контролируемое испытание
с участием троллей
, сравнивающее холецистохолангиографию с кистозной холангиографией протока
во время лапароскопической холектомии.Aust
N Z J Surg 70: 573–577
59. Daoud M, McCallum MJ (1999) Простой и эффективный метод
холангиографии при лапароскопической холецистэктомии: лапароскопическая
холецистохолангиография. Aust N Z J Surg 69: 138–140
60. Glattli A, Metzger A, Klaiber C, Seiler C, Maddern GJ, Baer HU
(1994) Холецистохолангиография против холангиографии пузырного протока —
phy во время лапароскопической холецистомии. Перспективное контролируемое исследование
.Surg Endosc 8: 299–301
61. Fox AD, Baigrie RJ, Cobb RA, Dowling BL (1996) Пероперационная
холангиография через желчный пузырь (холецистохолангиография —
) во время лапароскопической холецистэктомии. Surg Laparosc
Endosc 6: 22–25
62. Коксал Э. (2001) Холецистохолангиография при лапароскопической
холецистэктомии. Surg Today 31: 877–880
63. Moont M (1995) Холецистохолангиография. Surg Endosc
9: 544–546
64.Young C, Moont M (1998) Рутинная холецистохолангиография:
— жизнеспособная альтернатива лапароскопической холецистэктомии. Aust N
Z J Surg 68: 425–427
65. Holzman MD, Sharp K, Holcomb GW, Frexes-Steed M, Richards
WO (1994) Альтернативный метод лапароскопической холангиографии
. Surg Endosc 8: 927–930
66. Кумар С.С. (1992) Лапароскопическая холангиография: новый метод
и устройство. J Laparoendosc Surg 2: 247–254
67.Pertsemlidis D (2009) Флуоресцентный индоцианин зеленый для визуализации
желчных протоков во время лапароскопической холецистэктомии. Arch Surg
144: 978
68. Сари Ю.С., Тунали В., Томаоглу К., Карагоз Б., Гунейи А., Карагоз I
(2005) Можно ли предотвратить повреждение желчных протоков? «Новая техника в лапароскопической холецистэктомии
» ». BMC Surg 5:14
69. Сюй Ф., Сюй К.Г., Сюй Д.З. (2004) Новый метод предотвращения повреждения желчного протока
при лапароскопической холецистэктомии.World J Gastroen-
terol 10: 2916–2918
70. Лю Дж.Дж., Алемозаффар М., Макхон Б., Дханани Н., Гейдж Ф., Пинто
PA, Горбач А.М., Эльстер Э. (2008) Оценка
в реальном времени
Инфракрасная интраоперационная холангиография на модели свиньи. Surg
Endosc 22: 2659–2664
71. Ishizawa T., Tamura S, Masuda K, Aoki T., Hasegawa K,
Imamura H, Beck Y, Kokudo N (2009) Интраоперационная флуоресцентная
холангиография с использованием карта желчных путей для безопасной операции
.J Am Coll Surg 208: e1 – e4
72. Tanaka E, Choi HS, Humblet V, Ohnishi S, Laurence RG,
Frangioni JV (2008) Интраоперационная оценка
внепеченочных желчных протоков у крыс и свиньи, использующие невидимый инфракрасный люминесцентный свет ближнего диапазона
. Хирургия 144: 39–48
73. Мицухаси Н., Кимура Ф, Симидзу Х, Имамаки М., Йошидомэ Х,
Оцука М., Като А, Йошитоми Х, Нодзава С., Фурукава К.,
Такеучи Д., Такаяшики Т. Suda K, Igarashi T, Miyazaki M
(2008) Полезность интраоперационной флюоресцентной визуализации для
оценки местной анатомии в гепатобилиарной хирургии.J Hepatobilation
Pancreat Surg 15: 508–514
74. Ishizawa T., Bandai Y, Kokudo N (2009) Флуоресцентная холангиография
с использованием индоцианинового зеленого для лапароскопической холецистической операции. Arch Surg 144: 381–382
75. Аоки Т., Мураками М., Ясуда Д., Симидзу Й, Кусано Т., Мацуда
К, Ниия Т., Като Х, Мурай Н., Оцука К., Кусано М., Като Т.
(2010) Интраоперационная флуоресцентная визуализация с использованием индоцианина
зеленого цвета для картирования печени и холангиографии.J Гепатобилиарная
Панкреатическая хирургия 17 (5): 590–594
2460 Эндоскопическая хирургия (2011) 25: 2449–2461
123
Научные публикации в Интернете
Введение
Открытая или лапароскопическая безопасная холецистэктомия — сложная задача для хирурга. Хотя предоперационная диагностика калькулезных заболеваний желчных путей не представляет проблем, во время операции желчные камни часто пропускаются, поэтому задержанные камни в желчных каналах являются постоянной проблемой при лечении камней желчных путей.Потребность в дополнительных диагностических методах для улучшения результатов хирургии желчного пузыря давно признана для устранения или сведения к минимуму возможности пропущенных камней в желчных каналах, последствия которых ставят хирурга в неловкое положение и разочаровывают его пациента. В 1936 году Лэхи пришел к выводу, что до 1926 года он оставил камень в общем желчном протоке у каждого десятого пациента, подвергшегося холецистэктомии 1 . Стремясь снизить этот высокий уровень заболеваемости, он увеличил холедохотомию до 44% (в серии из 200 случаев) с обнаружением камней в 18% из них.Поскольку осложнения после холедохотомии могут быть значительными 2 , для хирурга как с клинической, так и с экономической точки зрения важно попытаться свести их к минимуму путем надлежащего осмотра пациентов. Раньше холедохотомия выполнялась исключительно по традиционным показаниям либо из-за истории болезни, лабораторных исследований или оперативных данных, основными критериями были: 1. недавняя или рецидивирующая желтуха, 2. острый или хронический панкреатит в анамнезе, 3. история болезни. перемежающийся озноб или лихорадка у больных желчнокаменной болезнью; 4.предоперационные рентгенологические данные о камнях в желчных протоках, 5. лабораторные исследования повышенного уровня билирубина в сыворотке крови, аспартаттрансаминазы (AST), щелочной фосфатазы (ALP) и гамма-глутамилтранспептидазы (GGT), 6. оперативные данные о расширении пузырного протока, расширенном CBD или пальпируемые камни в протоке, 7. наличие множества мелких камней в желчном пузыре, 8. мутная желчь, аспирированная из протока, и 9. рецидивирующие симптомы после операции на желчных путях. Эти традиционные показания привели к большому количеству ненужных холедохотомий, что увеличило заболеваемость и даже смертность пациентов с желчнокаменными заболеваниями.Кроме того, не предусмотрены меры для лечения неожиданных камней в общем желчном протоке (присутствуют в 5-7% случаев 3 ), которые обычно не обнаруживаются во время операции. Чтобы преодолеть эти трудности в лечении заболеваний желчных путей, существует множество методов, доступных как для предоперационного, так и для оперативного обнаружения камней желчных путей и других заболеваний. Интраоперационная холангиография — это метод, который чаще всего используется для определения наличия камней / заболеваний желчных протоков. Его точность приближается к другим доступным модальностям 4 , но он прост, доступен и очень экономичен.Это быстрее и легко повторяется и добавляет всего несколько дополнительных минут к оперативной процедуре. Для его выполнения не требуется специальной подготовки, и его можно выполнять с высокой степенью точности после того, как хирург ознакомится с ним. Он оказался ценным инструментом в хирургическом лечении желчных путей с момента его введения Мирризи в 1931 г. 5 . Методика подразумевает рентгенологическое помутнение желчных протоков путем введения контрастного красителя. Он предоставляет хирургу неоценимую анатомическую и патологическую информацию о желчных путях.Многие хирурги теперь используют результаты интраоперационной холангиограммы, чтобы решить, следует ли исследовать проток или определить местонахождение камней перед исследованием. Ненужное обследование общего желчного протока при маргинальных показаниях можно предотвратить с помощью точной и точной рентгенографии желчных путей. Регулярное использование интраоперационной холангиограммы должно улучшить конечный результат операции на желчных путях и исключить большинство непродуктивных или ненужных холедохотомий, выполняемых в сочетании с холецистэктомией по поводу доброкачественного заболевания.Считается, что рутинная чрескстозная холангиография снижает частоту повреждения желчных протоков за счет выявления аномалий протоков примерно у 14% пациентов. 3 . Предоставляется дорожная карта системы протоков, которая помогает предотвратить и идентифицировать повреждение общего желчного протока. Это обеспечивает безопасную визуализацию скрытых или хирургически опасных зон. Также информация, полученная с помощью интраоперационной холангиограммы, может предотвратить повторную операцию по поводу операционной травмы или пропущенных камней. Оперативная транскистозная холангиография протоков очень эффективна при обнаружении неожиданных камней (5-7%) в общем желчном протоке, которые обычно пропускаются во время операции и не обнаруживаются ни одним предоперационным тестированием.Интраоперационная холангиограмма также может быть использована для определения любых связей с билиарным деревом при различных патологиях печени, например, полостях эхинококковой кисты 6 , полостях абсцесса и т. Д., Которые затем можно лечить одновременно. Помимо выявления задержанных камней и аномальных желчных протоков, интраоперационная холангиография также полезна для диагностики других патологий желчных путей, таких как дивертикулы, стриктуры, паразиты, например аскариды, клонорхи и т. Д., А также новообразования, которые могут вызывать внутреннюю или внешнюю облитерацию.Хотя процедура связана с частотой ложных срабатываний в диапазоне от 0 до 5% 6 , это можно значительно уменьшить с помощью опыта хирурга и рутинного использования процедуры. Точность интраоперационной холангиографии была значительно увеличена за счет улучшений в визуализации, предлагаемых новым рентгеноскопическим оборудованием с С-образной дугой и улучшением изображения. Использование усилителя изображения и рентгеноскопии снижает количество необходимого излучения и обещает большую безопасность для пациента и операционной бригады. 7 .
Пациенты и методы
Это проспективное исследование включало 485 последовательных пациентов с желчнокаменной болезнью с клиническими показаниями к исследованию общего желчного протока и без них, которые обратились в отделение общей хирургии Государственного медицинского колледжа, Сринагар, в течение пяти лет с 1 st июня 2006 г. по 31 st май 2011, независимо от возраста и пола. Все эти пациенты были подвергнуты подробному анамнезу, клиническому обследованию и обследованию.Всем обследованным пациентам была проведена интраоперационная холангиограмма. В каждом альтернативном случае выполнялась лапароскопическая и открытая холецистэктомия с исследованием общего желчного протока или без него. В нашем методе мы использовали полуразбавленный 75% уровень Уровидео (йодсодержащий краситель с меглумином и натриевыми солями диатризойной кислоты), одноразовый шприц объемом 20 мл, 8-дюймовую полиэтиленовую трубку, прикрепленную к шприцу с одного конца, и металлическую канюлю на одном конце. другой конец и портативное рентгеноскопическое оборудование с С-образной дугой и функцией улучшения изображения.Холангиографию выполняли при наклоне пациента на 20 ° вправо с помощью стандартной методики через катетер пузырного протока до любых манипуляций с CBD, независимо от каких-либо оперативных результатов. Пациентам, которым была сделана лапароскопическая холецистэктомия, с помощью иглы 14-G над правым верхним квадрантом был создан пятый небольшой порт, игла была удалена после проникновения в брюшную стенку, оставив оболочку на месте. Катетер 5-French был продвинут через оболочку и проведен через отверстие, сделанное в пузырном протоке.Затем пузырный проток и катетер плотно зажимали гемоклипсом. Первоначальная пленка была получена после введения 4 мл контрастного красителя, а вторая пленка была получена после введения 8 мл контрастного вещества. Особое внимание было уделено тому, чтобы избежать попадания пузырьков воздуха, так как они дают ложноположительный результат. Катетер оставался на месте, если холангиограммы не были доступны для интерпретации. Наличие дефекта наполнения или невозможность проникновения красителя в двенадцатиперстную кишку считалось показанием для исследования CBD.Используя портативное рентгеноскопическое оборудование с С-образной дугой, мы наблюдали за продвижением красителя в желчные протоки под прямым зрением с рентгеноскопического экрана. Расширение желчных протоков за счет закупорки злокачественных / доброкачественных образований потребляет больше краски, чтобы полностью рассмотреть желчное дерево. Собранные данные были сведены в таблицу и измерено значение p.
Рисунок 1
Таблица 1
Рисунок 2
Таблица 2
Рисунок 3
Таблица 3
Рисунок 4
Таблица 4
Рисунок 5
Таблица 5
Рисунок 6
Рисунок 1.ИОК с контрастом свободно идущим дистально
Рисунок 7
Рисунок 2. IOC, показывающий внутрипеченочное и внепеченочное билиарное дерево
Рисунок 8
Рис. 3. IOC, показывающий дефект наполнения на конечном конце левого печеночного протока
Рисунок 9
Рис. 4. IOC показывает расширенный CBD с дефектом наполнения ниже места слияния
Рисунок 10
Рисунок 5.Лапароскопический нормальный ИОК Рисунок 6. Послеоперационная холангиограмма с нормальной Т-трубкой
Результаты
Нормальное холагиографическое исследование (рисунки 1, 2 и 5) наблюдалось в 385 случаях, в то время как аномальные холангиограммы были получены у 100 пациентов, у которых проводилось исследование CBD; камни (рис. 3 и 4) были обнаружены только у 85 пациентов, а остальные 15 пациентов дали ложноположительные результаты (таблицы I, II, III и IV). У пациентов с показаниями к исследованию КБД с точки зрения расширенного пузырного протока, расширенного КБД, холедохолитиаза или предшествующего желчнокаменного панкреатита аномальные холангиограммы были получены у 16 из 28 пациентов (57.14%) и камни были извлечены у 14 пациентов (50%). У этих пациентов интраоперационная холангиография помогла нам избавить 12 из 28 пациентов (42,86%) от ненужного исследования КБД, в то время как у пациентов без признаков исследования общего желчного протока интраоперационная холангиография может выявить камни (рис. 3 и 4) в общем желчном протоке. желчный проток только у 15 из 345 (4,34%) пациентов с очень значимым значением p (p
Обсуждение
В течение многих лет хирурги осознавали, что лечение связанного литиаза общего желчного протока во время холецистэктомии может быть потенциальным источником трудностей.Исторически сложилось так, что исследование общего желчного протока давало не только лучшую гарантию его очищения, но и лучшую надежду на то, что повторной операции по поводу задержанных камней можно было избежать, а исследование общего желчного протока проводилось только в тех случаях, когда это было указано клиническими или лабораторными параметрами. Однако с появлением интраоперационной холангиографии Мирризи в 1931 году концепция изменилась, и многие из предшествующих показаний для исследования общего желчного протока стали вместо этого показаниями для интраоперационной холангиографии.Однако быстрое развитие и широкое распространение лапароскопической холецистэктомии привело к возобновлению споров вокруг рутинной или селективной интраоперационной холангиографии. Он оказался ценным инструментом для обнаружения неожиданных или скрытых камней в обычных желчных протоках при холецистэктомии у пациентов, не имеющих клинических / ультразвуковых показаний, требующих исследования общего желчного протока. В противном случае эти камни были бы упущены из-за отказа от холедохотомии из-за отсутствия вышеуказанных показаний для исследования общего желчного протока.Этот неожиданный уровень обнаружения камней по-разному оценивается разными авторами в своих исследованиях. Schulenburg 6 (1969) и Kakos et al. 2 (1972) в своих исследованиях показали, что обычные холангиограммы выявляют 4,2% и 4% неожиданных камней с частотой ложноположительных 4,2% и 5% и ложноотрицательными показателями 4,2% и 1% соответственно. Wayne et al. 8 (1976) в серии из 354 пациентов обнаружили неожиданные камни у 3,67% с ложноположительной холангиограммой у 0.85%. В исследовании 74 пациентов Thurston 9 (1974) обнаружил неожиданные камни CBD у 7,7% с частотой ложноотрицательных результатов 1,4%. Shively EH et al. 10 (1990) обнаружил неожиданную частоту положительных камней в 5% у 484 пациентов, перенесших пероперационную холангиографию, и общую частоту ложноположительных холангиограмм в 3%. В нашем исследовании 485 пациентов мы обнаружили неожиданные камни у 4,34%, а общий уровень ложноположительных и ложноотрицательных результатов холангиографии составил 3,1% и 0% соответственно.Наши результаты неожиданного обнаружения камней аналогичны тем, которые наблюдали Шуленбург 6 , Крэнли и др. 11 и Какос и др. 2 . Они не согласуются с данными Терстона 9 , который обнаружил более высокий процент неожиданных камней (7,7%) у 74 пациентов. Это изменение может быть связано с отбором пациентов и большей продолжительностью исследования в их случае (7 лет). Частота ложных срабатываний, наблюдаемая в настоящем исследовании, аналогична той, которую наблюдали Shively et al. 10 (1990). Наши результаты по количеству ложноположительных результатов ниже по сравнению с Schulenburg и Kakos et al. 2 , а наши ложноположительные результаты выше по сравнению с Wayne et al. 8 Хотя Gerber et al. 12 (1982) не одобряют рутинную холангиографию в своем исследовании, они обнаружили 0% ложных отрицательных результатов холангиограммы у своих 24 пациентов. В настоящем исследовании у нас также была частота ложноотрицательных холангиограмм 0%. Faris et al. 13 (1975) и Стюарт и др. 14 (1998) также получили аналогичные результаты в своем исследовании. Старк и др. 15 (1980) обнаружили в своих исследованиях уровень ложноотрицательных результатов в 0,2%. Шуленбург 6 (1969), Kakos et al. 2 (1972), Mullen JT et al. 16 (1976) и Skillings et al. 17 (1979) обнаружил ложноотрицательные результаты в 4,2%, 1,4%, 2,13% и 5,4%, соответственно, в своих индивидуальных исследованиях, что выше по сравнению с нашими результатами; несоответствие может быть связано с техникой, примененной в процедуре.Kakos et al. 2 (1972) получили высокий выход камня в пределах 71-90% при исследовании каналов с положительными холангиограммами. Это согласуется с нашим исследованием положительного исследования протока у 85% (17 из 20 пациентов). Маккормик и др. 18 (1974) получил положительный результат исследования протока 77,7%, результаты ниже, чем у нас, разница может быть связана с меньшим количеством пациентов в их случае. Faris et al. 13 (1975) получил положительный коэффициент разведки канала 71.5% в их серии из 400 пациентов. Расхождение с нашими результатами может быть связано с тем, что исследование проводилось в течение более длительного периода (1957-1972 гг.) И данные были получены от разных оперировавших хирургов. Наши результаты также согласуются с Levine et al. 19 (1983), у 166 пациентов с положительной холангиограммой частота исследования протока составила 84%. Старк и др. 15 (1980) получил положительную доходность 63,8% от разведки каналов. Skillings et al. 17 (1979) также получил положительную доходность 62.16%. Оба исследования были основаны на обзоре записей пациентов, перенесших холецистэктомию с интраоперационной холангиографией. Flowers et al. 20 (1992) получили истинно положительный выход 75% при исследовании протоков в своем исследовании. Результаты, полученные другими авторами, могут отличаться от нашего исследования из-за ретроспективного характера их исследований. Наши результаты действительно согласуются с Richardson et al. 21 (1999), получившие 85% истинно положительных холангиограмм. Также почти аналогичные результаты были получены Hammarstrorm et al. 22 (1998), которые получили 88% результатов исследования протока в исследовании 279 пациентов. Принимая во внимание расширенные желчные протоки, особенно кистозный или общий желчный проток или и то, и другое, извлечение камней из таких протоков в настоящем исследовании было различным в зависимости от того, рассматривались ли эти параметры по отдельности или в комбинации. Мы получили выход камней 60% у пациентов с расширенными кистами, а также с расширенными общими желчными протоками, но 50% только при учете только расширенного общего желчного протока без параметра пузырного протока.Wu Sc et al. 23 (2005) описал 53,1% положительных результатов исследования у пациентов с расширенными общими желчными протоками (обнаруженными при УЗИ брюшной полости) при интраоперационной холангиографии. Эти результаты соответствуют 50% положительным результатам разведки таких каналов в настоящем исследовании. Cranley et al. 11 (1980) подтвердили, что у 57,6% пациентов с расширенным общим желчным протоком частота исследования камней составляет 57,6%. Это почти аналогично нашим результатам 50% в настоящем исследовании.Тейлор и др. 24 (1983) также получили аналогичные результаты 58,13% у пациентов с расширенным общим желчным протоком при холангиографии. Ливингстон и др. 25 (2005) прибегали к селективной холангиографии у пациентов с ультразвуковыми доказательствами дилатации общего желчного протока и выявляли камни у 30,15% этих пациентов. Он не обнаружил никакой связи с камнями общего желчного протока у пациентов с желчнокаменным панкреатитом. В нашем исследовании с частотой накопления камней в расширенных протоках 50% мы не смогли удалить камни из протоков у 25 пациентов с желчнокаменным панкреатитом в анамнезе, возможно потому, что большинство мелких камней, ответственных за панкреатит, могли пройти спонтанно и, следовательно, не были обнаружены при интраоперационной холангиографии.Mullen et al. 16 (1976), однако, выявили камни у 10% пациентов с анамнезом, свидетельствующим о желчнокаменном панкреатите. У пациентов с холедохолитиазом, подтвержденным ультразвуковым исследованием, и пальпируемыми камнями в общем желчном протоке, холангиограмма была ненормальной у всех 5 пациентов, а частота извлечения камней составила 100% у этих пациентов в настоящем исследовании. Шивели и др. 10 (1990) также получили 100% удаление камня у таких пациентов в своем исследовании. Интраоперационная холангиография зарекомендовала себя как ценный инструмент в предотвращении травм за счет правильной идентификации анатомии и выявления любых связанных врожденных или приобретенных аномалий.В нашем исследовании холангиография помогла нам правильно определить анатомию треугольника Кало при возникновении трудностей. У двух пациентов имелась связь (приобретенная) между желчным пузырем и общим желчным протоком (синдром Мириззи). У этого пациента желчный пузырь был фиброзирован и сморщен с большим искажением. У обоих пациентов удалось избежать повреждения близлежащих структур за счет своевременного проведения интраоперационной холангиографии. Schulenburg et al. 6 (1969) описал аномалии кистозного, печеночного и общего желчных протоков у 20.9% из 1000 пациентов, выполнив интраоперационную холангиографию, смогли выявить эти аномалии и, таким образом, избежать повреждений желчных протоков. Интраоперационная холангиография проводится не только для поиска камней, но и для предотвращения или выявления повреждений желчных протоков путем ее своевременного применения. В настоящем исследовании во время интраоперационной холангиографии у наших пациентов не было обнаружено повреждений желчевыводящих путей. Это согласуется с данными Campenhout et al. 26 (1993), у которых также не было повреждений желчных путей ни у одного из 107 пациентов, обсуждаемых в исследовании.Ciulla et al. 5 (2007) в своем исследовании интраоперационной холангиографии (ИОК) у 169 пациентов выявили уровень травм 0,5% и пришли к выводу, что правильно выполненная ИОК может минимизировать степень травм за счет их своевременного выявления. Moosa et al. 27 (1992) в своем исследовании лапароскопической холецистэктомии сообщили о шести пациентах с повреждениями общего желчного протока (1%). Преимущества хорошей и тщательной процедуры IOC должны заключаться в том, чтобы избежать ненужных исследований протока у тех пациентов, у которых есть клинические / биохимические или радиологические показания для такого исследования, и увеличить положительный результат от таких исследований.Это будет большим подспорьем для снижения заболеваемости, связанной с такой ненужной процедурой у этих пациентов. Интраоперационная холангиография должна четко идентифицировать тех пациентов, у которых процедура холедохотомии неизбежна. Шивели и др. № 10 (1990) предотвратил ненужное исследование протоков у 12% пациентов с клиническими / лабораторными / радиологическими показаниями для такого исследования. Точно так же Schulenburg 6 (1969) в исследовании с участием 1000 пациентов также предотвратил ненужные исследования протоков у 55% на основе интраоперационной холангиографии.Гербер и др. 12 (1982) также смогли предотвратить такую непродуктивную холедохотомию у 38,70% своих пациентов с помощью IOC. Kakos et al. 2 , Thurston et al. 9 и Stark et al. 15 (1972) наблюдали значительное снижение непродуктивных холедохотомий. В нашем исследовании мы смогли спасти 42,86% наших пациентов от ненужных холедохотомий, у которых в противном случае были клинические или сонографические показания для исследования протоков. Дополнительное оперативное время, необходимое для получения адекватного исследования, и связанные с этим затраты, вызвали другие аргументы за или против рутинного использования оперативной холангиографии.Поскольку получение этого исследования является технической процедурой, ограничивающим фактором временной эффективности его использования является знакомство с методикой. Для своевременного и точного результата требуется высококвалифицированный опыт команды, в которую входят хирург, его или ее помощники, техник по скрабам, анестезиолог и радиолог. В то время как дополнительное время, затрачиваемое на интраоперационную холангиографию, по измерениям различных авторов, варьируется от 10 до 33 минут, в нашем исследовании 485 пациентов, которым выполнялась обычная ИОК, мы обнаружили, что дополнительное время, затрачиваемое на процедуру, составляет от 5 до 30 минут .Первоначально время, затраченное на процедуру, было больше, но после знакомства с процедурой оно сократилось в среднем до 13,35 минут. В этом отношении наше исследование соответствует Hermann et al. 28 (1965), Flowers et al. 20 (1992) и Wayne et al. 8 (1976). Buddingh et al. 29 (2011) пришли к выводу в своем исследовании, что внедрение рутинной политики IOC сопровождалось меньшим количеством повреждений крупных желчных протоков и более высокими показателями интраоперационного лечения камней общего желчного протока.
Заключение
Таким образом, в нашем исследовании мы пришли к выводу, что интраоперационная холангиография является очень полезным дополнением к арсеналу билиарных хирургов и ее применение только в отдельных случаях, когда есть показания для ее использования для решения дилеммы оперирующего хирурга в виде предоперационный статус, аномальная анатомия желчных путей или сложная холецистэктомия из-за плотных спаек, чтобы получить четкую карту протоковой системы, а также свести к минимуму количество ненужных пред- и послеоперационных эндоскопических ретроградных холангиопанкреатографий.Следовательно, интраоперационная холангиография помогает предотвратить повреждение билиарного дерева, потому что «унция профилактики стоит фунта лечения».
Список литературы
1. Partington PF, Sachs MD: Рутинное использование оперативной холангиографии. Surg Gynecol Obstet; 1948; 87: 299-307.
2. Какос Г.С., Томпкинс Р.К., Turnipseed W и др.: Оперативная холангиография во время рутинной холецистэктомии. Обзор 3012 дел. Arch Surg; 1972; 104: 484-88.
3. Берчи Дж., Шор Дж. М., Хэмлин Дж. А. и др.: Аномалии желчных протоков. В: Berci G, Hamlin JA (ред.): Оперативная билиарная радиология. Уильямс и Уилкинс, Балтимор; 1981: 109-141.
4. Макфадден Д.В., Нигам А. Холедохолитиаз и холангит. В: Зиннер MJ, Эшли SW (ред.): Абдоминальные операции Maingot, 11-е изд. Макгроу Хилл, Нью-Йорк; 2007: 865-887.
5. Ciulla A, Agnello G, Tomasello G и др .: Интраоперационная холангиография во время видеолапароскопической холецистэктомии. Какова его роль? Результаты нерандомизированного исследования. Энн Итал Чир; 2007; 78 (2): 85-9.
6. Шуленбург ЦАР: Оперативная холангиография: 1000 случаев. Хирургия; 1969; 65 (5): 723-739.
7. Берчи Дж., Шор Дж. М., Хэмлин Дж. А. и др.: Оперативная рентгеноскопия и холангиография. Использование современных радиологических методов во время операции. Am J Surg; 1978; 135: 32-5.
8. Уэйн Р., Цегельски М., Блейхер Дж и др.: Оперативная холангиография при неосложненной хирургии желчевыводящих путей. Обзор 354 холангиографических исследований у пациентов без признаков патологии общего протока. Am J Surg; 1976; 131: 324-27.
9. Терстон О.Г .: Внезапная оперативная холангиография. Arch Surg; 1974; 108: 512-15.
10. Shively EH, Wieman TJ, Adams AL и др .: Оперативная холангиография. Am Surg; 1990; 159: 380-385.
11. Крэнли Б., Логан Х .: Исследование общего желчного протока — актуальность клинической картины и важность пероперационной холангиографии. Br J Surg; 1980; 67: 869-872.
12. Гербер А., Апт МК: Дело против рутинной оперативной холангиографии. Am J Surg; 1982; 143: 734-36.
13.Фарис И., Томсон Дж. П.С., Гранди Д. Д. и др.: Оперативная холангиография: переоценка, основанная на обзоре 400 холангиограмм. Br J Surg; 1975; 62: 966-972.
14. Стюарт С.А., Симпсон ТИГ, Элворд Л.А. и др .: Рутинная интраоперационная лапароскопическая холангиография. Am J Surg; 1998; 176: 632-37.
15. Старк М.Э., Лоури К.В.: Рутинная оперативная холангиография с холецистэктомией. Surg Gynecol Obstet; 1980; 151: 657-58.
16. Mullen JT, Carr RE, Rupnik EJ и др .: 1000 холецистэктомий, экстрадуктальная пальпация и оперативная холангиография.Am J Surg; 1976; 131: 672-75.
17. Skillings JC, Williams JS, Hinsha JR: Экономическая эффективность оперативной холангиографии. Am J Surg; 1979; 137: 26-31.
18. McCormick JSC, Bremner DN, Thomson JWW и др .: Оперативная холангиограмма: ее интерпретация, точность и ценность в сочетании с холецистэктомией. Энн Сург; 1974; 180: 902-906.
19. Левин С.Б., Лернер Х.Д., Лейфер Э.Д .: Интраоперационная холангиография. Обзор показаний и анализ половозрастных групп. Энн Сург; 1983; 198: 692-7.
20. Флауэрс Дж. Л., Цукер К. А., Грэм С. М. и др.: Лапароскопическая холангиография. Результаты и показания. Энн Сург; 1992; 215: 209-216.
21. Ричардсон Н.Г., Макинтош Н.А., Сарре Р.Г.: Чрескожная трансхолекистозная холангиография при лапароскопической холецистэктомии. ANZ J Surg; 1999; 69: 501-504.
22. Hammarstrom LE, Ranstam J: Факторы, позволяющие прогнозировать образование камней желчных протоков у пациентов с острым калькулезным холециститом. Dig Surg; 1998; 15: 323-327.
23. Wu SC, Chen FC, Lo CJ: Селективная интраоперационная холангиография и одноэтапное лечение камней общего желчного протока при лапароскопической холецистэктомии.World J Surg; 2005; 29: 1402-1408.
24. Тейлор Т.В., Торранс Б., Риммер С. и др .: Оперативная холангиография: есть ли статистическая альтернатива? Am J Surg; 1983; 145: 640-643.
25. Ливингстон Э. Х., Миллер Дж., Коан Б. и др.: Показания к селективной интраоперационной холангиографии. J Gastrointest Surg; 2005; 9: 1371-7.
26. Campenhout IV, Prosmanne O, Gagner M и др.: Рутинная оперативная холангиография во время лапароскопической холецистэктомии: возможность и ценность у 107 пациентов. AJR; 1993; 160: 1209-1211.
27. Моосса А.Р., Истер Д.В., Зонненберг Е.В. и др.: Лапароскопические повреждения желчного протока. Повод для беспокойства. Энн Сург; 1992; 215: 203-208.
28. Hermann RE, Hoerr SO: значение рутинного использования оперативной холангиографии. Surg Gynecol Obstet; 1965; 121: 1015-20.
29. Buddingh KT, Weersma RK, Savenije RAJ и др .: Более низкая частота повреждений основных желчных протоков и усиление интраоперационного лечения камней общего желчного протока после выполнения рутинной интраоперационной холангиографии.J Am Coll Surg; 2011; 213: 267-274.
Цель, процедура, преимущества и риск
Ваша печень вырабатывает желчь — химическое вещество, которое помогает вам переваривать пищу. Водопроводная система протоков, которая проходит между печенью, желчным пузырем и тонкой кишкой, — это то, как движется желчь. Некоторые из них попадают прямо в ваш тонкий кишечник. Остальное сохраняется в желчном пузыре.
Интраоперационная холангиограмма — это особый вид рентгеновского снимка, который показывает желчные протоки. Используется во время операции.На обычном рентгеновском снимке вы получаете одно изображение. Но холангиограмма показывает вашему врачу видео в реальном времени ваших желчных протоков, чтобы он мог видеть, что происходит в режиме реального времени.
Как это может помочь
Обычно холангиограмма используется, когда у вас есть желчные камни и вам необходимо удалить желчный пузырь. Ваш врач сделает несколько небольших разрезов на вашем теле (это называется лапароскопической операцией). Затем они вставят крошечную видеокамеру в один из разрезов, чтобы помочь ему с операцией.
Во время этой операции интраоперационная холангиограмма может помочь вашему врачу выполнить следующие действия:
Проверить наличие камней желчных протоков .Камни из желчного пузыря иногда попадают в желчные протоки. Они не всегда вызывают симптомы, но могут привести к серьезным проблемам, например к инфекции.
Обеспечьте безопасность общего желчного протока. У вас много протоков, органов и других частей, плотно упакованных в этой части вашего тела. Иногда ваш врач не может сказать, на что он смотрит. Так что есть шанс, что они могут повредить один из ваших самых больших протоков, общий желчный проток.
Когда вам может понадобиться один
У вас больше шансов получить его во время операции, если у вас есть:
- Желтуха или панкреатит в анамнезе
- Функция печени выше нормальной
- Несколько небольших желчных камней
- Более широкий- чем обычно общий желчный проток или пузырный проток
- Камни желчного протока или результаты лабораторных исследований, которые говорят вашему врачу, что они могут быть у вас
Как это делается
Когда пришло время сделать визуализацию во время операции, ваш врач позвонит:
- Наденьте зажим на пузырный проток, который проходит прямо в желчный пузырь.Это мешает чему-либо втекать или вытекать.
- Затем введите тонкую трубку в пузырный проток.
- Введите в трубку контрастный краситель, который помогает выделить желчные протоки.
- Сделайте рентгеновские снимки в реальном времени с помощью флюороскопа.
Возможные риски
К основным из них относятся:
Аллергическая реакция : краситель, используемый для визуализации, может вызвать проблемы. Расскажите своему врачу о любых прошлых реакциях на контрастные красители, йод, латекс или лекарства.
Неправильные результаты : Ваш врач может назвать их ложноположительными. Может показаться, что у вас камни желчных протоков, но на самом деле это не так. Тогда вы можете получить ненужную помощь, которая может вызвать проблемы.
Продолжение
Травма : есть вероятность, что процесс может повредить желчные протоки или близлежащие части тела.
Радиация : Поговорите со своим врачом о том, сколько радиации вы получите во время процедуры.

 выраженный диспепсический синдром;
выраженный диспепсический синдром;/49/5.png) острый гнойный холангит.
острый гнойный холангит. острый послеоперационный панкреатит;
острый послеоперационный панкреатит; комплексная консервативная терапия;
комплексная консервативная терапия; б, д;
б, д; синдром Жильбера;
синдром Жильбера; наблюдение за больным, УЗИ-контроль;
наблюдение за больным, УЗИ-контроль; наложение хирургической холецистостомы;
наложение хирургической холецистостомы; затампонировать кровоточащий участок на 5-10 минут;
затампонировать кровоточащий участок на 5-10 минут; эндоскопическая установка назобилиарного зонда для разре¬шения желтухи;
эндоскопическая установка назобилиарного зонда для разре¬шения желтухи; нижняя горизонтальная ветвь;
нижняя горизонтальная ветвь;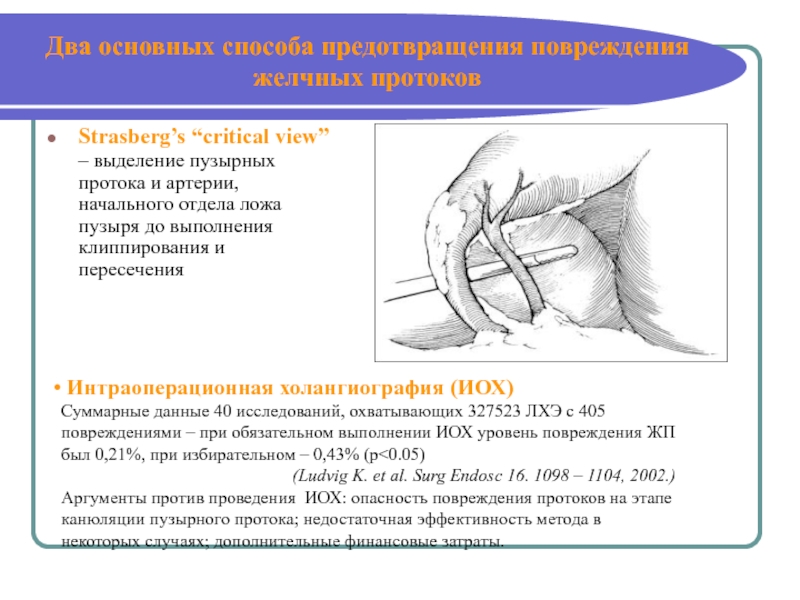 хронический гепатит;
хронический гепатит; фистулография.052 Основные рентгенологические признаки ХДН: а) замедленная эвакуация бария по 12-перстной кишке до 1-3 мин; б) расши¬рение диаметра 12-перстной кишке; в) ускорение эвакуации бария; г) увеличение ретрогастрального пространства; д) от-теснение желудка извне; е) дефект наполнения; ж) маятнико-образные движения бария в 12-перстной кишке. Выберите правильную комбинацию ответов:
фистулография.052 Основные рентгенологические признаки ХДН: а) замедленная эвакуация бария по 12-перстной кишке до 1-3 мин; б) расши¬рение диаметра 12-перстной кишке; в) ускорение эвакуации бария; г) увеличение ретрогастрального пространства; д) от-теснение желудка извне; е) дефект наполнения; ж) маятнико-образные движения бария в 12-перстной кишке. Выберите правильную комбинацию ответов: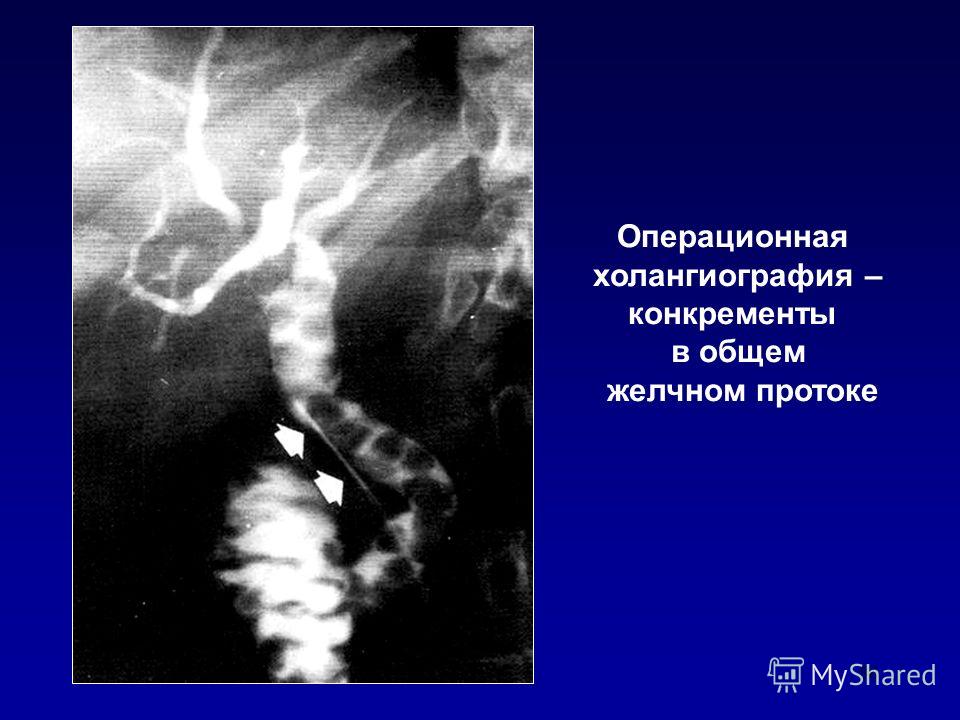 хроническая дуоденальная непроходимость;
хроническая дуоденальная непроходимость; амбулаторное наблюдение за больным;
амбулаторное наблюдение за больным; пилефлебит;
пилефлебит; синдром Делафуа.
синдром Делафуа.