Микробиологическое исследование мокроты | Компетентно о здоровье на iLive
Микробиологическое исследование является важнейшим звеном диагностического поиска и верификации возбудителя пневмонии. Оно предполагает не только выделение возбудителя, но и изучение его свойств, в том числе чувствительность к различным медикаментозным препаратам, обладающим бактерицидным и бактериостатическим действием.
С этой целью используют метод посева мокроты на различные питательные среды. В образце мокроты, доставленной в лабораторию, отбирают гнойные комочки и тщательно промывают их в чашке Петри с изотопическим раствором натрия хлорида, что в известной степени позволяет освободить их от микрофлоры верхних дыхательных путей. Посев гнойных комочков мокроты производят па различные питательные среды, состав которых описывается в специальных руководствах по микробиологии. Среды с посевами инкубируют при 37,5°С в течение 24 ч. Из выросших колоний выделяют чистые культуры, идентифицируют их известными микробиологическими методами и определяют чувствительность к антибиотикам.
Для количественного определения содержания микроорганизмов мокроту гомогенизируют, смешивают с питательным бульоном и из смеси готовят последовательные десятикратные разведения, которые засевают на чашки Петри с кровяным агаром. Через 24 ч инкубации при 37,5°С учитывают результаты, подсчитывая однотипные по внешнему виду колонии и учитывая степень разведения материала. Из колоний готовят мазки и микроскопируют их.
Интерпретация результатов
Трактовка результатов микробиологического исследования мокроты достаточно сложна, что объясняется рядом факторов. Выше уже упоминалось о постоянном обсеменении бронхиального содержимого микрофлорой верхних дыхательных путей и ротовой полости и частом присутствии в нормальном трахеобронхиальном содержимом здоровых людей большинства наиболее типичных возбудителей респираторных заболеваний (пневмококков, стрептококков, стафилококков и др.). В связи с этим выделение в мокроте в ходе микробиологических исследований ассоциации различных микроорганизмов, большая часть из которых в данном конкретном случае являются условно-патогенными, чрезвычайно затрудняет установление возбудителя заболевания. Поэтому для интерпретации результатов микробиологического исследования мокроты следует учитывать количественное преобладание того или иного вида бактерий (больше 106-107 м.к./мл), появление определенных микроорганизмов в фазе обострения и исчезновение их в период ремиссии. При этом очень важно учитывать клиническую картину заболевания.
Поэтому для интерпретации результатов микробиологического исследования мокроты следует учитывать количественное преобладание того или иного вида бактерий (больше 106-107 м.к./мл), появление определенных микроорганизмов в фазе обострения и исчезновение их в период ремиссии. При этом очень важно учитывать клиническую картину заболевания.
Основные и возможные возбудители различных клинических форм пневмоний
Клиническая форма пневмонии | Основные возбудители | Возможные возбудители |
Крупозная | Пневмококки | Стрептококки, клебсиеплы |
Постгриппозная | Стафилококки, пневмококки, клебсиеллы | Гемофильная палочка, стрептококки |
Абсцедирующая | Стафилококки, бактероиды, смешанная флора | Клебсиеллы, синегнойная палочка |
Аспирационная | Бактероиды, анаэробные стрептококки | Стафилококки, пневмококки |
Послеоперационная | Стафилококки | Пневмококки, клебсиеллы |
Интерстициальная | Микоплазмы | Возбудители орнитоза, пситтакоза |
Вторичная пневмония у госпитальных больных без предшествующей антибактериальной терапии | Стафилококки, пневмококки, клебсиеллы, бактероиды | Кишечная палочка, серрации и др. |
Вторичная пневмония, развившаяся на фоне антибактериальной терапии | Факультативно-патогенные микроорганизмы | Pseudomonas, Serratia, Klebsiella, Staphylococcus, Proteus и др. |
У больных хроническим бронхитом | Пневмококки, гемофильная палочка | Стафилококки, стрептококки |
У больных алкоголизмом | Пневмококки, гемофильная палочка, клебсиеллы | Кишечная палочка, простейшие |
При синдроме приобретенной иммунологической недостаточности | Пневмоцисты, грибы | Цитомегаловирусы |
У больных, уход за которыми осуществляют посторонние | Пневмококки, стафилококки, гемофильная папочка | Клебсиеллы, кишечная палочка |
Оценивая количественно результаты исследования микробной обсемененности у больных пневмонией, следует помнить о чрезвычайно высокой чувствительности этого показателя к назначению антибиотиков.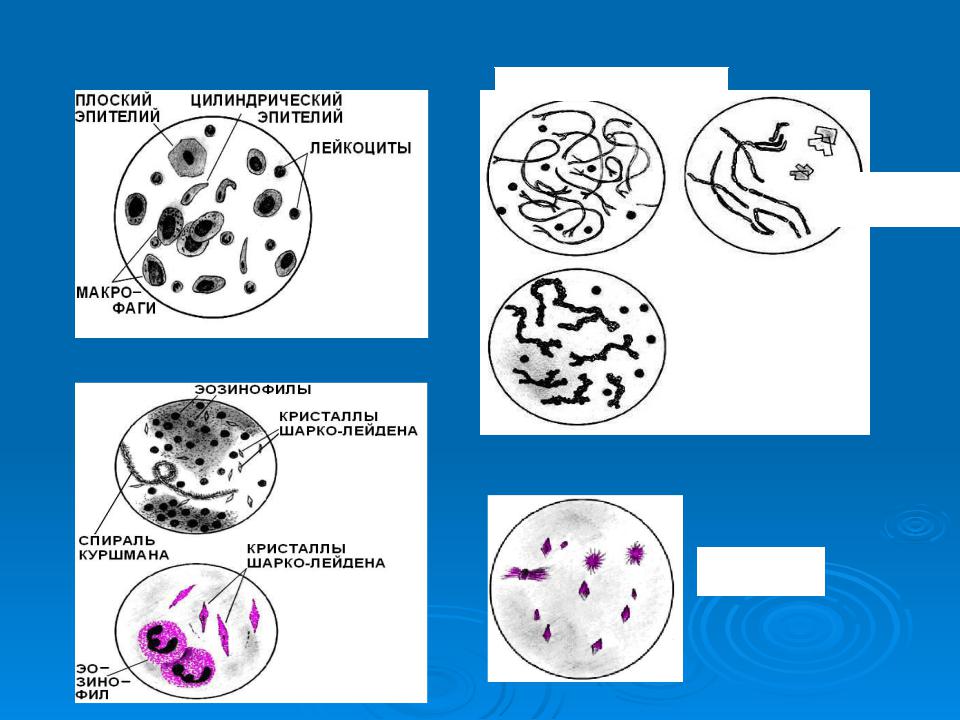 Даже кратковременное лечение антибактериальными препаратами может приводить к резкому снижению микробной обсемененности, что не позволяет адекватно оценить результаты исследования мокроты. Поэтому целесообразно осуществлять забор мокроты до назначения лечения антибиотиками.
Даже кратковременное лечение антибактериальными препаратами может приводить к резкому снижению микробной обсемененности, что не позволяет адекватно оценить результаты исследования мокроты. Поэтому целесообразно осуществлять забор мокроты до назначения лечения антибиотиками.
Следует также отметить, что для культивирования внутриклеточных возбудителей пневмоний (микоплазмы, легионеллы, хламидии, риккетсии) используют специальные селективные питательные среды. Рутинное микробиологическое исследование с использованием обычных питательных сред (агар-агар) никогда не дает положительных результатов. Поэтому выбор конкретных методов микробиологического исследования должен проходить с участием лечащего врача, который обязан информировать врача-лаборанта об имеющихся у него подозрениях относительно возможной роли внутриклеточных возбудителей в возникновении пневмонии у данного пациента.
Следует добавить, что п реальной клинической практике даже технически совершенное микробиологическое исследование мокроты позволяет выявить возбудителя заболевания не чаще, чем в 40-60% случаев заболевания. Поэтому для верификации возбудителя могут быть использованы другие современные методы исследования. Информативность бактериологического исследования может быть существенно повышена при использовании в качестве исследуемого биологического материала не мокроты, а трахеобронхиального аспирата, жидкости, полученной при бронхоальвеолярном лаваже (ЖВАЛ), бронхоскопии и т.п.
Поэтому для верификации возбудителя могут быть использованы другие современные методы исследования. Информативность бактериологического исследования может быть существенно повышена при использовании в качестве исследуемого биологического материала не мокроты, а трахеобронхиального аспирата, жидкости, полученной при бронхоальвеолярном лаваже (ЖВАЛ), бронхоскопии и т.п.
Кроме того, для выявления возбудителей пневмонии может быть использован метод иммунофлюоресценции различных биологических материалов (материал бронхоскопии, кровь, плевральное содержимое и.т.п.), методы ПЦР-диагностики, исследование уровня специфических антител в сыворотке крови. К сожалению, до сих нор эти способы диагностики не нашли широкого клинического применения и пока используются лишь в крупных специализированных центрах и лабораториях.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Макроскопическое исследование мокроты | Компетентно о здоровье на iLive
Макроскопическое исследование мокроты у больных пневмониями имеет важное диагностическое значение, нередко помогая установить характер патологического процесса и возможные осложнения (например, кровотечение или нагноение).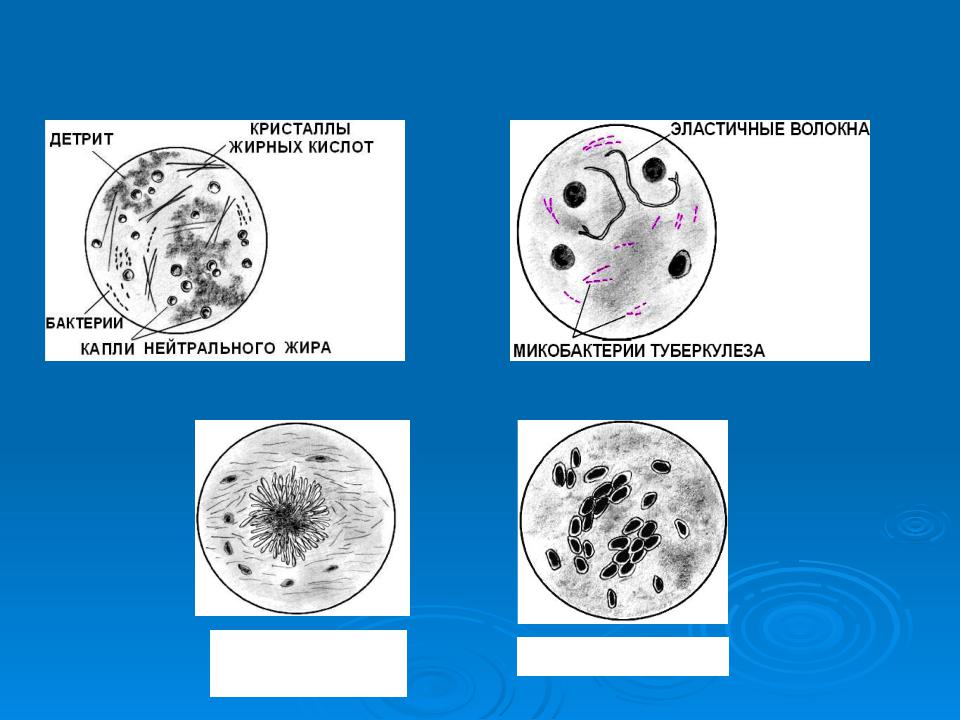
Количество мокроты при заболеваниях органов дыхания может варьировать в широких пределах (от 10 до 500 мл и более в сутки) и определяется в основном двумя факторами:
- характером и степенью активности патологического процесса в легких и
- возможностью беспрепятственного откашливания образовавшейся мокроты.
Относительно небольшое количество мокроты (не более 50-100 мл в сутки) характерно для большинства больных пневмониями и другими воспалительными заболеваниями легких (острый трахеит, острый и хронический бронхит и др.).
Значительное увеличение количества мокроты (более 150-200 мл в сутки), как правило, наблюдается при заболеваниях, сопровождающихся образованием полости, сообщающейся с бронхом (абсцесс легкого, туберкулезная каверна, бронхоэктазы), или распадом ткани (гангрена, распадающийся рак легкого и др.). Необходимо заметить в этой связи, что иногда у этих больных количество мокроты может уменьшиться из-за нарушения дренирования воспалительного очага.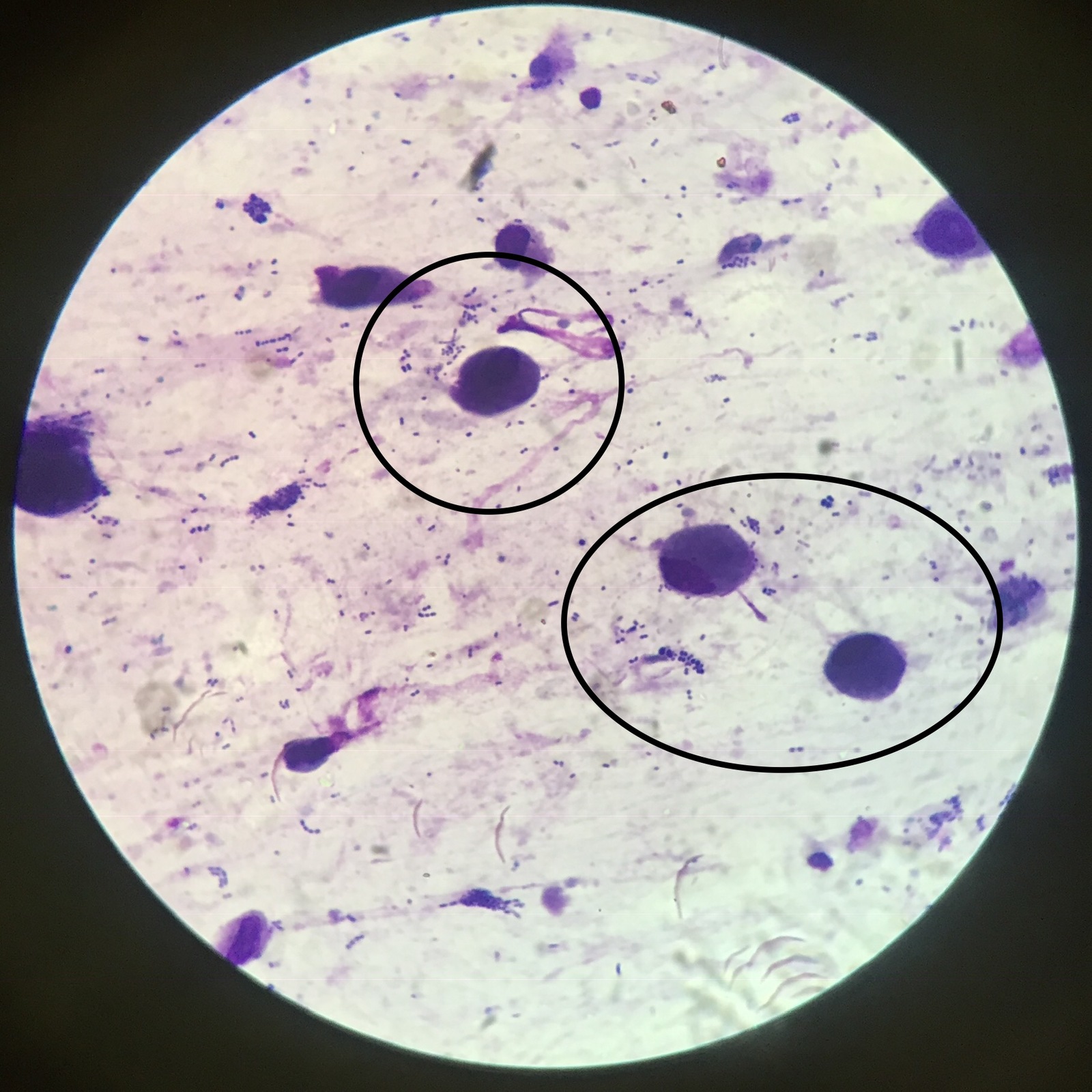
У тяжелых больных пневмонией и пациентов старческого возраста нередко наблюдается подавление кашлевого рефлекса, в связи с чем мокрота выделяется в небольшом количестве или отсутствует совсем.
Цвет мокроты зависит от состава патологического трахеобронхиального секрета и наличия различных примесей (например, примесей крови).
Основные причины изменения цвета мокроты при пневмониях и других заболеваниях легких
Цвет и характер мокроты | Характер патологического процесса |
Бесцветная, прозрачная (слизистая мокрота) | Многие острые заболевания легких, трахеи и бронхов (особенно в начальной стадии), сопровождающиеся преимущественно катаральным воспалением. Часто — хронические заболевания в стадии ремиссии |
Желтоватый оттенок (слизисто-гнойная) | Наличие умеренного количества гноя в мокроте. Характерно для большинства острых и хронических заболеваний легких на определенной стадии развития воспаления |
Зеленоватый оттенок (слизисто-гнойная или гнойная) | Застой гнойной мокроты, сопровождающийся распадом нейтрофильных лейкоцитов и выделением фермента вердопероксидазы, превращения железопорфириновой группы которой обуславливают зеленоватый оттенок мокроты |
Желтый (канареечный) цвет мокроты | Присутствие в мокроте большого количества эозинофилов (например, при эозинофильной пневмонии) |
Ржавый цвет | Проникновение эритроцитов в просвет альвеол путем диапедеза и освобождение из распадающихся эритроцитов гематина (наиболее характерно для крупозной пневмонии) |
Розоватый цвет серозной мокроты | Примесь малоизмененных эритроцитов в серозной мокроте при альвеолярном отеке легкого |
Другие оттенки красного цвета (алый, коричневый и др. | Признаки более значительных примесей крови (кровохарканье, легочное кровотечение) |
Черноватый или сероватый цвет | Примеси угольной пыли в мокроте |
Следует иметь в виду, что появление в мокроте примесей крови, независимо от характера основного патологического процесса (катаральное, гнойное или фибринозное воспаление, опухоль и т.п.), существенно изменяет цвет мокроты (см. ниже).
Запах мокроты. Обычно мокрота серозного и слизистого характера запаха не имеет. Зловонный гнилостный запах свежевыделенной мокроты свидетельствует:
- о гнилостном распаде легочной ткани при абсцедировании легкого, гангрене легкого, распадающемся раке легкого;
- о разложении белков мокроты (в том числе белков крови) при длительном нахождении ее в полостях (абсцесс легкого, реже — бронхоэктазы) преимущественно под действием анаэробной флоры.
Характер мокроты. В зависимости от консистенции, цвета, прозрачности, запаха и других физических признаков, выявляемых при макроскопическом исследовании, различают четыре основных вида мокроты:
- Слизистая мокрота — бесцветная, вязкая, без запаха.
 Она встречается в начальных стадиях воспаления или при стихании его активности.
Она встречается в начальных стадиях воспаления или при стихании его активности. - Серозная мокрота также бесцветная, жидкая, пенистая, без запаха. Она появляется, как правило, при альвеолярном отеке легкого, когда в результате повышения давления в системе малого круга кровообращения или увеличении проницаемости сосудистой стенки при воспалении увеличивается транссудация в просвет дыхательных пуки плазмы крови, богатой белком. Вследствие активных дыхательных движений (удушье, одышка) плазма вспенивается и выделяется в виде пенистой жидкости, иногда диффузно окрашенной в розовый цвет, что свидетельствует о значительном увеличении проницаемости сосудистой стенки и кровотечении по типу per diapidesum.
- Слизисто-гнойная мокрота — вязкая, желтоватого или зеленоватого цвета — обычно встречается при многих заболеваниях органов дыхания, в том числе при пневмониях. В некоторых случаях слизисто-гнойная мокрота может иметь нерезко выраженный неприятный запах.

- Гнойная мокрота жидкой или полужидкой консистенции, зеленоватого или желтоватого цвета, часто с неприятным зловонным запахом. Она встречается при острых или хронических нагноительных процессах в легких и бронхах, при распаде легочной ткани (абсцесс и гангрена легкого, бронхоэктазы, распадающийся рак легкого и др.). При отстаивании гнойной мокроты обычно образуются два или три слоя. Гнойная мокрота при некоторых заболеваниях легких (абсцесс, гангрена легкого, бронхоэктазы, гнойный бронхит) при стоянии в течение нескольких часов разделяется на два или три слоя.
Двухслойная мокрота чаще встречается при абсцессе легкого. Верхний слой се состоит из серозной пенистой жидкости, а нижний — из зеленовато-желтого непрозрачного гноя.
Трехслойная мокрота наиболее характерна для гангрены легкого, хотя иногда она может появляться у больных с бронхоэктазами и даже гнилостным бронхитом. Верхний слой такой мокроты состоит из пенистой бесцветной слизи, содержащей большое количество пузырьков воздуха, средний — из мутноватой слизисто-серозной жидкости желтовато-зеленоватого цвета, нижний — из желтого или зеленоватого непрозрачного гноя.
Кровохарканье. Примесь крови в мокроте имеет очень важное диагностическое значение, нередко указывая на развитие серьезных осложнений. В зависимости от степени и характера повреждения легочной ткани и дыхательных путей примесь крови в мокроте (кровохарканье — haematoptoe) может быть различной: 1) прожилки крови, 2) сгустки крови, 3) «ржавая» мокрота, 4) диффузно окрашенная розовая мокрота и т.п. Если при откашливании выделяется чистая алая кровь без примеси слизи или гноя, говорят о возникновении легочного кровотечения (haematomesis). Кровохарканье (haematoptoe) представляет собой выделение мокроты с кровью. При легочном кровотечении (haematomesis) во время откашливания у больного выделяется чистая алая кровь (туберкулез, рак легкого, бронхоэктазы, травматические повреждения и т.д.).
При пневмониях, особенно при крупозном воспалении легких, также возможно выделение крови с мокротой в виде «ржавой» мокроты, прожилок или сгустков крови. Кровохарканье и легочное кровотечение может встречаться и при других заболеваниях органов дыхания. Следует все же иметь в виду, что в реальной клинической практике примесь крови в мокроте нередко может иметь другие характеристики. Например, вопреки распространенному мнению, «ржавая» мокрота может встречаться не только при крупозном воспалении легкого (типичные случаи), но и при очаговой и гриппозной пневмонии, при туберкулезе легкого с творожистым распадом, застое в легком, отеке легкого и т.п. С другой стороны, при крупозной пневмонии иногда в мокроте могут появляться прожилки или лаже сгустки крови или, наоборот, она не имеет примесей крови и носит характер слизистой или слизисто-гнойной.
Следует все же иметь в виду, что в реальной клинической практике примесь крови в мокроте нередко может иметь другие характеристики. Например, вопреки распространенному мнению, «ржавая» мокрота может встречаться не только при крупозном воспалении легкого (типичные случаи), но и при очаговой и гриппозной пневмонии, при туберкулезе легкого с творожистым распадом, застое в легком, отеке легкого и т.п. С другой стороны, при крупозной пневмонии иногда в мокроте могут появляться прожилки или лаже сгустки крови или, наоборот, она не имеет примесей крови и носит характер слизистой или слизисто-гнойной.
Основные причины кровохарканья и наиболее типичный вид мокроты
Основные причины | Характер примеси крови |
Бронхоэктазы, хронический гнойный бронхит | Чаще в виде прожилок или сгустков крови в мокроте гнойного или слизисто-гнойного характера |
Крупозная пневмония | «Ржавая» мокрота |
Абсцесс, гангрена легкого | Гнойно-кровянистая, полужидкая, спивкообразной консистенции обильная мокрота коричневого или красного цвета с резким гнилостным запахом |
Рак легкого | Кровянистая, иногда желеобразная мокрота (типа «малинового желе») |
Туберкулез легкого | Прожилки или сгустки крови в слизисто-гнойной мокроте; при формировании каверны возможно появление обильной кровянистой мокроты коричневого или красного цвета |
Инфаркт легкого | Сгустки крови или мокрота, диффузно окрашенная в коричневый цвет |
Альвеолярный отек легкого | Диффузно окрашенная розовая пенистая серозная мокрота |
Стафилококковая или вирусная очаговая пневмония | Прожилки или сгустки крови в слизисто-гнойной мокроте, ииогда «ржавая» мокрота |
Актиномикоз легкого | Прожилки или сгустки крови в слизисто-гнойной или гнойной мокроте |
Следует помнить, что почти при всех приведенных в таблице заболеваниях возможно развитие массивного легочного кровотечения.
[1], [2], [3], [4], [5], [6], [7], [8]
бактериологический анализ, метод сбора, расшифровка, норма лейкоцитов
Мокротой называют биологический материал, который выделяется при воспалении, локализованном в области легких и трахеи. Она возникает при заболеваниях органов дыхания и сбоях в работе сердечно-сосудистой системы. Микроскопическое исследование мокроты – это вид диагностики, который необходим для выявления точной причины недомогания и подбора эффективной терапевтической схемы.
Посредством данного диагностического метода можно найти и идентифицировать пагубные микроорганизмы. Таким образом также определяют их резистентность к медикаментам, относящимся к антибиотикам. С помощью микроскопического исследования изучают необработанные (нативные) препараты (крошковатые и гнойные комочки, нити). Чтобы отделить их, используют чашку Петри, покровные стекла и другие приспособления.
Показания к назначению
Весомым поводом к проведению диагностики становится возникновение следующих патологических изменений:
- катаральные явления;
- сибирская язва;
- очаги воспаления в легких и бронхах;
- обострение обструктивного бронхита;
- гной в области дыхательных органов;
- силикоз;
- коклюш;
- туберкулез;
- хронический тонзиллит и бронхит;
- легочная гангрена;
- опухоль в области легких.

Преимущества микроскопического обследования
Клинический анализ мокроты отличается от остальных диагностических способов многофункциональностью. Точную причину недомогания определяют, ориентируясь на следующие параметры:
- Объем. При разных заболеваниях количество секрета может сильно разниться. Если объем не превышает 1 литра в день, фиксируют начало приступа астмы, воспаление и застойные процессы, локализованные в дыхательной системе. Количество образовавшейся мокроты при дальнейшем прогрессировании заболевания постепенно увеличивается. Чем ее больше, тем хуже состояние пациента.
- Характер (консистенция). Мокрота возникает при таких патологиях, как астма, эхинококкоз, пневмония, начальные стадии онкологии. Кровь появляется при наличии отека легких, астме сердечного типа.
- Окраска. Мокрота может иметь белый, зеленоватый, ярко-желтый, сероватый, черноватый, выраженный красный или коричневатый оттенок.
- Запах.
 При наличии патологических процессов секрет отдает гнилью.
При наличии патологических процессов секрет отдает гнилью. - Наличие примесей. Они присутствуют в составе, если в анамнезе присутствует злокачественная опухоль ЖКТ. Также специалист может обнаружить в мокроте гниль, гной, фрагменты новообразований, яйца глистов, фибрин или рисовые тельца.
Среди преимуществ микроскопического обследования выделяют его экономичность, доступность и высокую результативность. Многие элементы можно исследовать только после окрашивания.
Подготовка к обследованию
Чтобы получить достаточное количество мокроты, пациенту придется принять отхаркивающий состав и выпить побольше согревающих напитков. Перед тем как идти на процедуру, необходимо провести санацию ротовой полости. Секрет обычно собирают утром натощак. Биологический материал помещают в стерильный контейнер. Слизи должно быть не менее 5 мл.
Микроскопическое исследование проводят через несколько часов после окончания первого этапа.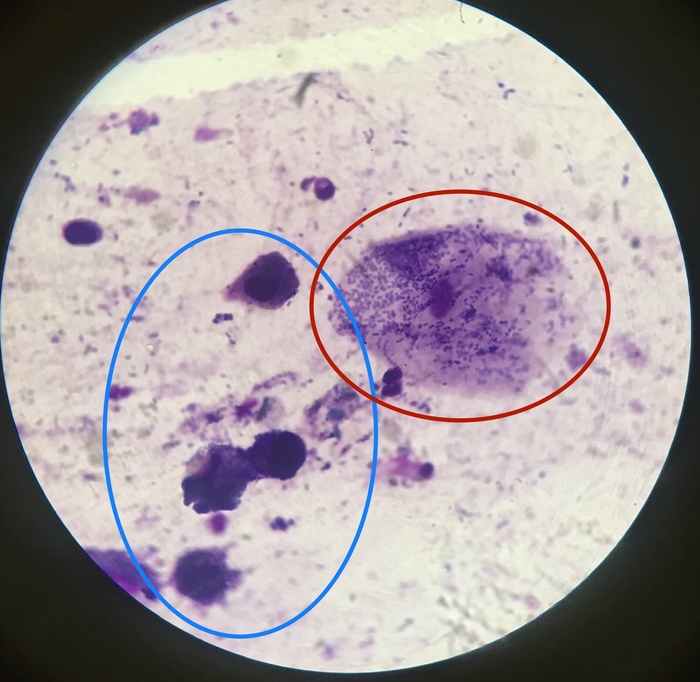 До начала клинического анализа содержимое следует держать в холодильнике. Сбор выделений бронхов и трахей пациент должен провести в полном соответствии с правилами, указанными доктором. Расшифровку должен осуществлять специалист. Он учитывает нормальные показатели, указанные в таблице. Процесс происходит по стандартному алгоритму.
До начала клинического анализа содержимое следует держать в холодильнике. Сбор выделений бронхов и трахей пациент должен провести в полном соответствии с правилами, указанными доктором. Расшифровку должен осуществлять специалист. Он учитывает нормальные показатели, указанные в таблице. Процесс происходит по стандартному алгоритму.
Какие показатели рассматриваются
При микроскопическом исследования в составе мокроты могут присутствовать такие элементы, как:
- Спирали Куршмана – они представляют собой плотные тяжи слизи, которые характеризуются разными параметрами. Компонент состоит из нити осевой формы и мантии, содержащей в себе белые кровяные тельца. Спирали возникают при спазме бронхов.
- Лейкоциты – это зернистые клетки, обладающие серым цветом и круглой формой. Они образуются, если в анамнезе присутствуют воспалительные заболевания в дыхательной системе.
- Красные кровяные тельца – желтоватые диски, характеризующиеся гомогенной структурой.
 Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения.
Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения. - Макрофаги альвеолярного типа – клетки, которые больше, чем лейкоциты. С помощью фагоцитоза происходит очищение органов дыхательной системы от пагубных ингредиентов.
- Эпителиальные клетки цилиндрического типа – их распознают по бокаловидной или клиновидной форме.
- Клетки онкологических опухолей – характеризуются большим размером, неправильной формой и наличием крупных ядер.
- Эластичные волокна – их выявляют при распаде функциональной ткани, образующих дыхательную систему. Данные компоненты обладают двухконтурной структурой, отсутствием оттенка, одинаковой толщиной. Существуют и другие специфические признаки. К примеру, раздвоение на концах волоконцев.
- Эпителий плоского типа – клетки многоугольной формы, которые не имеют значения при изучении всех остальных разновидностей.
- Кристаллы Шарко-Лейдена – элементы, величина которых находится в широких пределах.
 Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Благодаря микроскопическому исследованию мокроты также фиксируют наличие яиц гельминтов, токсинов, болезнетворных бактерий, макрофагов протоплазмы, эозинофилов и грибков. Последние предварительно окрашивают.
Лейкоциты являются неотъемлемой частью мокроты. Их уровень повышается из-за нагноительных и воспалительных процессов. Показатели, полученные после исследования микроскопической картины мокроты, позволяют определить зону бактериологического заражения. Техника проведения микроскопического анализа характеризуется специфичностью.
У человека объем секрета, выделяемого на протяжении 24 часов, не должен быть больше 100 мл. Уровень белых кровяных телец при этом находится в норме. При исследовании мазок на микобактерии свидетельствует об их отсутствии. Микроскопический метод часто объединяют с общими и биохимическими анализами.
бактериологический анализ, метод сбора, расшифровка, норма лейкоцитов
Мокротой называют биологический материал, который выделяется при воспалении, локализованном в области легких и трахеи. Она возникает при заболеваниях органов дыхания и сбоях в работе сердечно-сосудистой системы. Микроскопическое исследование мокроты – это вид диагностики, который необходим для выявления точной причины недомогания и подбора эффективной терапевтической схемы.
Посредством данного диагностического метода можно найти и идентифицировать пагубные микроорганизмы. Таким образом также определяют их резистентность к медикаментам, относящимся к антибиотикам. С помощью микроскопического исследования изучают необработанные (нативные) препараты (крошковатые и гнойные комочки, нити). Чтобы отделить их, используют чашку Петри, покровные стекла и другие приспособления.
Показания к назначению
Весомым поводом к проведению диагностики становится возникновение следующих патологических изменений:
- катаральные явления;
- сибирская язва;
- очаги воспаления в легких и бронхах;
- обострение обструктивного бронхита;
- гной в области дыхательных органов;
- силикоз;
- коклюш;
- туберкулез;
- хронический тонзиллит и бронхит;
- легочная гангрена;
- опухоль в области легких.

Преимущества микроскопического обследования
Клинический анализ мокроты отличается от остальных диагностических способов многофункциональностью. Точную причину недомогания определяют, ориентируясь на следующие параметры:
- Объем. При разных заболеваниях количество секрета может сильно разниться. Если объем не превышает 1 литра в день, фиксируют начало приступа астмы, воспаление и застойные процессы, локализованные в дыхательной системе. Количество образовавшейся мокроты при дальнейшем прогрессировании заболевания постепенно увеличивается. Чем ее больше, тем хуже состояние пациента.
- Характер (консистенция). Мокрота возникает при таких патологиях, как астма, эхинококкоз, пневмония, начальные стадии онкологии. Кровь появляется при наличии отека легких, астме сердечного типа.
- Окраска. Мокрота может иметь белый, зеленоватый, ярко-желтый, сероватый, черноватый, выраженный красный или коричневатый оттенок.
- Запах.
 При наличии патологических процессов секрет отдает гнилью.
При наличии патологических процессов секрет отдает гнилью. - Наличие примесей. Они присутствуют в составе, если в анамнезе присутствует злокачественная опухоль ЖКТ. Также специалист может обнаружить в мокроте гниль, гной, фрагменты новообразований, яйца глистов, фибрин или рисовые тельца.
Среди преимуществ микроскопического обследования выделяют его экономичность, доступность и высокую результативность. Многие элементы можно исследовать только после окрашивания.
Подготовка к обследованию
Чтобы получить достаточное количество мокроты, пациенту придется принять отхаркивающий состав и выпить побольше согревающих напитков. Перед тем как идти на процедуру, необходимо провести санацию ротовой полости. Секрет обычно собирают утром натощак. Биологический материал помещают в стерильный контейнер. Слизи должно быть не менее 5 мл.
Микроскопическое исследование проводят через несколько часов после окончания первого этапа. До начала клинического анализа содержимое следует держать в холодильнике. Сбор выделений бронхов и трахей пациент должен провести в полном соответствии с правилами, указанными доктором. Расшифровку должен осуществлять специалист. Он учитывает нормальные показатели, указанные в таблице. Процесс происходит по стандартному алгоритму.
До начала клинического анализа содержимое следует держать в холодильнике. Сбор выделений бронхов и трахей пациент должен провести в полном соответствии с правилами, указанными доктором. Расшифровку должен осуществлять специалист. Он учитывает нормальные показатели, указанные в таблице. Процесс происходит по стандартному алгоритму.
Какие показатели рассматриваются
При микроскопическом исследования в составе мокроты могут присутствовать такие элементы, как:
- Спирали Куршмана – они представляют собой плотные тяжи слизи, которые характеризуются разными параметрами. Компонент состоит из нити осевой формы и мантии, содержащей в себе белые кровяные тельца. Спирали возникают при спазме бронхов.
- Лейкоциты – это зернистые клетки, обладающие серым цветом и круглой формой. Они образуются, если в анамнезе присутствуют воспалительные заболевания в дыхательной системе.
- Красные кровяные тельца – желтоватые диски, характеризующиеся гомогенной структурой.
 Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения.
Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения. - Макрофаги альвеолярного типа – клетки, которые больше, чем лейкоциты. С помощью фагоцитоза происходит очищение органов дыхательной системы от пагубных ингредиентов.
- Эпителиальные клетки цилиндрического типа – их распознают по бокаловидной или клиновидной форме.
- Клетки онкологических опухолей – характеризуются большим размером, неправильной формой и наличием крупных ядер.
- Эластичные волокна – их выявляют при распаде функциональной ткани, образующих дыхательную систему. Данные компоненты обладают двухконтурной структурой, отсутствием оттенка, одинаковой толщиной. Существуют и другие специфические признаки. К примеру, раздвоение на концах волоконцев.
- Эпителий плоского типа – клетки многоугольной формы, которые не имеют значения при изучении всех остальных разновидностей.
- Кристаллы Шарко-Лейдена – элементы, величина которых находится в широких пределах.
 Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Благодаря микроскопическому исследованию мокроты также фиксируют наличие яиц гельминтов, токсинов, болезнетворных бактерий, макрофагов протоплазмы, эозинофилов и грибков. Последние предварительно окрашивают.
Лейкоциты являются неотъемлемой частью мокроты. Их уровень повышается из-за нагноительных и воспалительных процессов. Показатели, полученные после исследования микроскопической картины мокроты, позволяют опре
Анализы на туберкулез | EUROLAB
Мокроты больного — это смесь секрета желез слизистой оболочки трахеи и бронхов, серозного выпота из патологически измененных сосудов, иногда частиц казеозных масс, некротической грануляционной и легочной ткани, а также примеси солей. Мокроты выделяется при многих заболеваниях легких и бронхов.
В туберкулезных учреждениях больные собирают мокроту в индивидуальные контейнеры, на четверть емкости заполнены раствором хлорамина, где оно частично дезинфицируется. Контейнеры градуированные, и это дает возможность определять суточное количество мокроты.
Контейнеры градуированные, и это дает возможность определять суточное количество мокроты.
Макроскопически у больных туберкулезом легких мокрота имеет слизистый или слизисто-гнойный характер, без запаха, гомогенная, не образует слоев. Количество мокроты может быть разной. В начале заболевания туберкулезом легких мокрота не выделяется, затем оно может выделяться утром отдельными плевками, позже его количество может достигать 100-200 мл.
После макроскопического проводят бактериоскопическое, бактериологическое и биологическое исследование мокроты.
Бактериоскопический метод
Бактериоскопический метод охватывает прямую бактериоскопию мазков из патологического материала, окрашенных по Цилю-Нильсену, бактериоскопию методом флотации, люминесцентную микроскопию, фазовоконтрастного микроскопию.
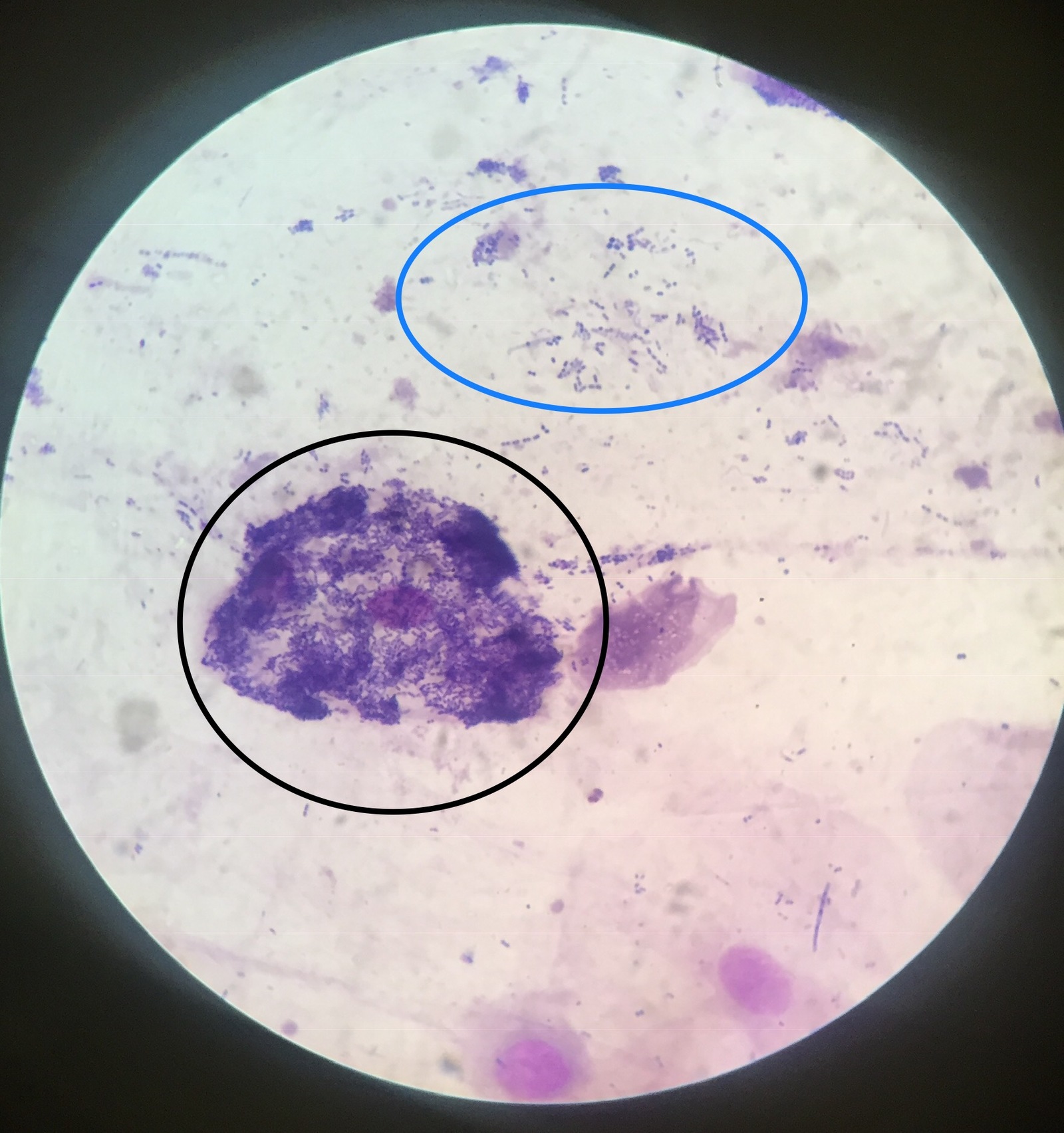
Бактериоскопическое исследование мокроты начинается с приготовления мазка. Для этого мокроты смешивают с раствором натрия гидроксида и центрифугируют для получения осадка. Осадок стеклянными палочками переносят на предметное стекло. Вторым предметным стеклом его равномерно размещают: накрывают покровным стеклом. Препарат изучают под микроскопом. В нем можно увидит лейкоциты, эластичные волокна, а при специальной окраске — атипичные клетки и различные бактерии.
Осадок стеклянными палочками переносят на предметное стекло. Вторым предметным стеклом его равномерно размещают: накрывают покровным стеклом. Препарат изучают под микроскопом. В нем можно увидит лейкоциты, эластичные волокна, а при специальной окраске — атипичные клетки и различные бактерии.
Микобактерии окрашиваются по Граму положительно. Для выявления МБТ готовят мазок мокроты высушивают его, фиксируют над пламенем спиртовки, после чего окрашивают по Цилю-Нильсену. Окраска производится сначала карболовым раствором фуксина. Микобактерии туберкулеза плохо воспринимают окраску, поэтому раствор фуксина наносят на препарат в большом количестве, подогревают над пламенем спиртовки до появления пара. Затем краску сливают, препарат промывают в воде и обесцвечивают в 5% растворе серной кислоты или в смеси этилового спирта с раствором соляной кислоты. При этом все бактерии и морфологические элементы мокроты, кроме микобактерий туберкулеза, бесцветные. Мазок промывают проточной водой, а затем наносят метиленовый синий на 1-2 мин. После этого раствор краски сливают, мазок промывают и высушивают. Препарат изучают через иммерсионной систему микроскопа, для чего на препарат наносят каплю иммерсионного масла, чтоб создать одинаковую среду между линзой объектива и препаратом. Микобактерии туберкулеза под микроскопом видно окрашенными в красный цвет.
После этого раствор краски сливают, мазок промывают и высушивают. Препарат изучают через иммерсионной систему микроскопа, для чего на препарат наносят каплю иммерсионного масла, чтоб создать одинаковую среду между линзой объектива и препаратом. Микобактерии туберкулеза под микроскопом видно окрашенными в красный цвет.
Метод окраски по Цилю-Нильсену позволяет выявить микобактерии туберкулеза в тех случаях, когда в 1см3 мокроты содержится около 5000 — 10000 МБТ при условии, если просмотрено 300 полей зрения. При небольшом количестве МБТ в мокроте бактериоскопический метод неэффективен.
Исследование мокроты следует проводить в течение трех дней подряд, а при отрицательном результате — применить метод флотации.
Метод флотации
Он основан на том, что при встряхивании двух жидкостей с различным удельным весом легче жидкость всплывает на поверхность одновременно с микобактериями туберкулеза, находящихся в суспензии. Суть методики заключается в том, что готовят водную суспензию с углеводородами (ксилол, бензол) и МБТ.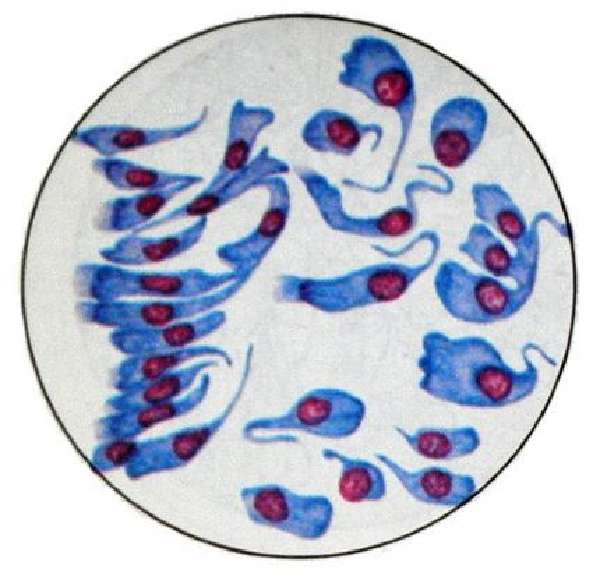 На поверхность воды утечет сливкообразная пена с МБТ, которую отсасывают пипеткой и наносят на предметное стекло. Слой пены на предметном стекле высушивают и наносят новый слой пены из колбы. Так наслаивают пену 5-6 раз, после чего мазок фиксируют и окрашивают по Цилю-Нильсену.
На поверхность воды утечет сливкообразная пена с МБТ, которую отсасывают пипеткой и наносят на предметное стекло. Слой пены на предметном стекле высушивают и наносят новый слой пены из колбы. Так наслаивают пену 5-6 раз, после чего мазок фиксируют и окрашивают по Цилю-Нильсену.
Люминесцентная микроскопия
Эффективным методом выявления микобактерий туберкулеза является люминесцентная микроскопия. Суть метода заключается в способности микобактерий туберкулеза, окрашенные специальными красителями (аурамин, родамин), светиться при облучении ультрафиолетовыми лучами. Преимуществом метода люминесцентной микроскопии является возможность проведения исследований при меньших увеличениях микроскопа, обеспечивает просмотр в короткий срок большего количества полей зрения, чем при обычной микроскопии. Возможность выявления микобактерий туберкулеза увеличивается на 10-15% по сравнению с обычной бактериоскопии и на 8% — по сравнению с методом флотации.
Используют люминесцентный микроскоп под малым увеличением. На темном фоне видны золотисто-желтые микобактерии туберкулеза.
На темном фоне видны золотисто-желтые микобактерии туберкулеза.
Фазово-контрастная микроскопия
Это единственный микроскопический метод исследования, позволяющий наблюдать микобактерии и их биологически измененные формы в живом состоянии. Для проведения такого исследования применяют специальное фазовоконтрастное устройство.
При цитологическом исследовании мокроты у больных туберкулезом легких оказывается незначительное количество нейтрофилов в стадии значительной дегенерации на фоне казеозного детрита, скопления мононуклеаров, гигантских клеток Пирогова-Лангханса, иногда эозинофилы.
В случаях, когда мокроты нет или она выделяется в очень малом количестве, больному назначают отхаркивающее микстуру или раздражающие ингаляции. Кроме того, в случаях, когда нет мокроты, исследуют смыв из бронхов.
Исследование смыва из бронхов
Оно проводится врачом. Для этого больному натощак смазывают корень языка, заднюю стенку глотки и надгортанник 1% раствором дикаина. Затем гортанным шприцем вливают в трахею 5-10 мл изотонического раствора натрия хлорида. У больного сразу возникает сильный кашель и введен изотонический раствор натрия хлорида выкашливается на чашку Петри. Также смыв из бронхов (БАС — бронхоальвеолярный смыв) получают с помощью БАЛ — бронхо-альвеолярного лаважа, который проводят при бронхоскопии. БАЗ исследуют методом флотации или методом посева. Исследование смыва из бронхов позволяет дополнительно выявлять МБТ в 5-10% случаев.
Затем гортанным шприцем вливают в трахею 5-10 мл изотонического раствора натрия хлорида. У больного сразу возникает сильный кашель и введен изотонический раствор натрия хлорида выкашливается на чашку Петри. Также смыв из бронхов (БАС — бронхоальвеолярный смыв) получают с помощью БАЛ — бронхо-альвеолярного лаважа, который проводят при бронхоскопии. БАЗ исследуют методом флотации или методом посева. Исследование смыва из бронхов позволяет дополнительно выявлять МБТ в 5-10% случаев.
Исследование мочи, кала, цереброспинальной и плевральной жидкости на МБТ
В клинической практике МБТ нередко приходится проявлять в моче, кале, цереброспинальной и плевральной жидкости. Исследование мочи на МБТ проводят в тех случаях, когда в ходе исследования осадка в каждом поле зрения оказывается не менее 15 лейкоцитов.
Для выявления МБТ мочу многократно центрифугируют, наслаивая каждый раз новые порции с осадка мочи на предметное стекло. Мазок окрашивают по методу Диля-Нильсена. Выявление микобактерий туберкулеза в моче свидетельствует о наличии туберкулеза почек.
Выявление микобактерий туберкулеза в моче свидетельствует о наличии туберкулеза почек.
Для исследования мочи по методу флотации дают ей постоять, затем 20-30 мл осадка обрабатывают, как обычно, без подогрева на водяной бане. Отсутствие МБТ в гнойной мочи и это не исключает наличия туберкулеза почек. В таких случаях нужно или делать ее посев на питательные среды, или применять биологический метод исследования.
Исследование кала на МБТ следует проводить в случаях подозрения на туберкулез кишок. При этом надо помнить, что у больных, выделяющих МБТ и частично заглатывают мокроту, МБТ можно выявить при исследовании кала и за непораженных кишок, поскольку микобактерии туберкулеза устойчивы и не всегда погибают под воздействием пищеварительных соков. В кале больных туберкулезом кишок часто оказывается слизь, кровь и примеси гноя.
Обнаружение МБТ в цереброспинальной жидкости нередко имеет решающее значение в диагностике туберкулезного менингита. Однако бактериоскопическим методом выявить МБТ удается только в 10-20% больных туберкулезный менингит.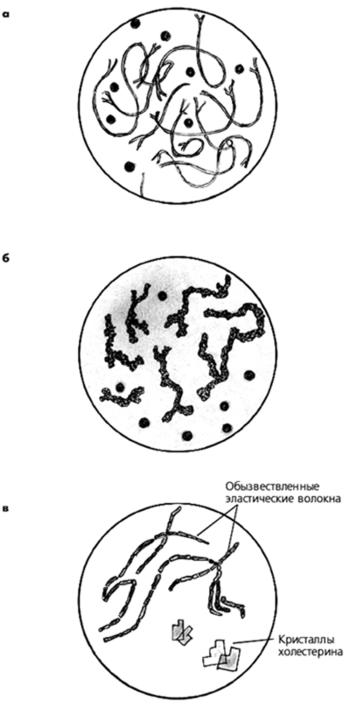 Исследование проводится по следующей методике. Пробирку с цереброспинальной жидкостью ставят на 8-10 часов в прохладном месте. Если в ней образуется нежная фибринная пленка (она состоит из клеток и МБТ), ее наносят на предметное стекло и готовят препарат по методу Циля-Нильсена. В случаях, когда пленка не образуется, препарат готовят из осадка после центрифугирования.
Исследование проводится по следующей методике. Пробирку с цереброспинальной жидкостью ставят на 8-10 часов в прохладном месте. Если в ней образуется нежная фибринная пленка (она состоит из клеток и МБТ), ее наносят на предметное стекло и готовят препарат по методу Циля-Нильсена. В случаях, когда пленка не образуется, препарат готовят из осадка после центрифугирования.
Для выявления МБТ в плевральном экссудате, пунктатах и выделении из свищей готовят препарат так же, как и при исследовании мокроты.
Бактериологическое исследование состоит из посева материала на питательные среды и дифференциации культуры МБТ от кислотоустойчивых сапрофитов. Этим методом можно обнаружить микобактерии туберкулеза, когда в 1 мл материала находится 20-100 микробных клеток. Пробирки со средой помещают в термостат при температуре 37 ° С. Первые колонии микобактерий могут появиться на 18-30-й день, а иногда — через 2-3 месяца. Бактериологическое исследование проводят одновременно с бактериоскопическим трижды.
Посев исследуемого материала производится на специальные среды после предварительной обработки. Чаще всего используют такие среды: Левенштейна-Йенсена, Финна-2, Миддлбрука, Огава и др., которые содержат вещества, задерживающие рост посторонних микроорганизмов. Предварительная обработка патологического материала заключается в уничтожении сопроводительной бактериальной флоры. Посев материала из бронхов, а также посев мочи делают из центрифугата или осадка. При этом мочу, если она не загрязнена, можно не обрабатывать.
Предварительная обработка биологического материала
Для подготовки к посеву мокроты, плеврального экссудата, цереброспинальной жидкости существует несколько методов предварительной обработки.
Метод Мазура заключается в обработке патологического материала 3-4 мл 2% раствором серной кислоты в стерильной пробирке. Пробирку встряхивают в течение 3 мин., после чего материал стерильной платиновой петлей наносят на яичные среды.
Метод Петрова: мокроты обрабатывается 4% раствором гидроксида натрия в течение 15 мин.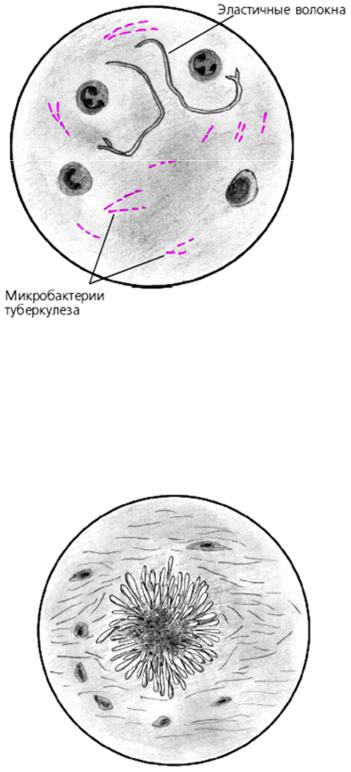 , А затем центрифугируется.
, А затем центрифугируется.
Биологический метод
Это привитие патологического материала животным. Гвинейским свинкам или белым мышам в паховой участок или в брюшную полость вводят исследуемый материал в дозе 2-3 мл. Для этого его сначала обрабатывают 3 8% раствором соляной кислоты, хорошо отмывают (иначе на месте введения может возникнуть некроз тканей, возможна даже смерть животного от воздействия кислоты).
Незагрязненную мочу и СМЖ можно прививать без предварительной обработки. При наличии в патологическом материале вирулентных штаммов МБТ животного заболевают туберкулезом и погибают через 1-2 месяца после заражения. Если МБТ масс ослабленную вирулентность, животное погибает позже или может совсем не погибнуть. В таких случаях животное забивают, и диагноз устанавливают после вскрытия, макро- и микроскопического выявления туберкулезных бугорков. Диагноз можно поставить на основании прижизненного исследования увеличенного регионариого лимфатического узла или инфильтрата, возникший на месте инокуляции патологического материала.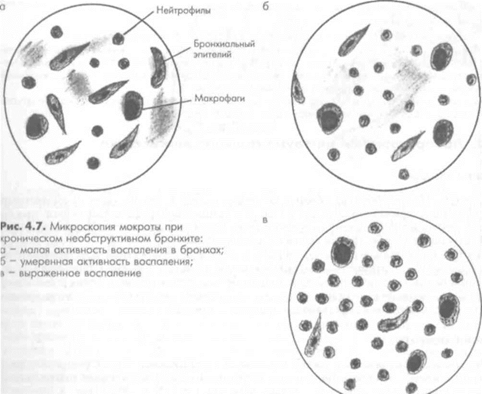
В последние годы для дифференциации микобактерий используют метод газожидкостной хроматографии, основанный на высокой способности различных соединений (аминокислот, нуклеиновых кислот, жиров, углеводов и т. д.). При этом не исключается этап культивирования возбудителя на питательных средах, что можно отнести к недостаткам метода.
Ускоренные методы поиска микобактерий
К ускоренным методам обнаружения микобактерий принадлежат выявления МБТ с помощью индикаторной пробирки ВВL МОИТ. Рост микобактерий туберкулеза происходит в течение 4-10 суток. Пробирки ВВL МОИТ содержат бульон и флуоресцентное соединение, реагирует на кислород, растворенный в бульоне. Исходная концентрация кислорода не дает яркого свечения. При поглощении кислорода культурой МБТ наблюдается яркая флуоресценция на дне пробирки. Такой результат считают положительным. Если флуоресценции нет или она незначительна — результат отрицательный. Показания пробирок учитывают ежедневно, начиная со второго дня инкубации.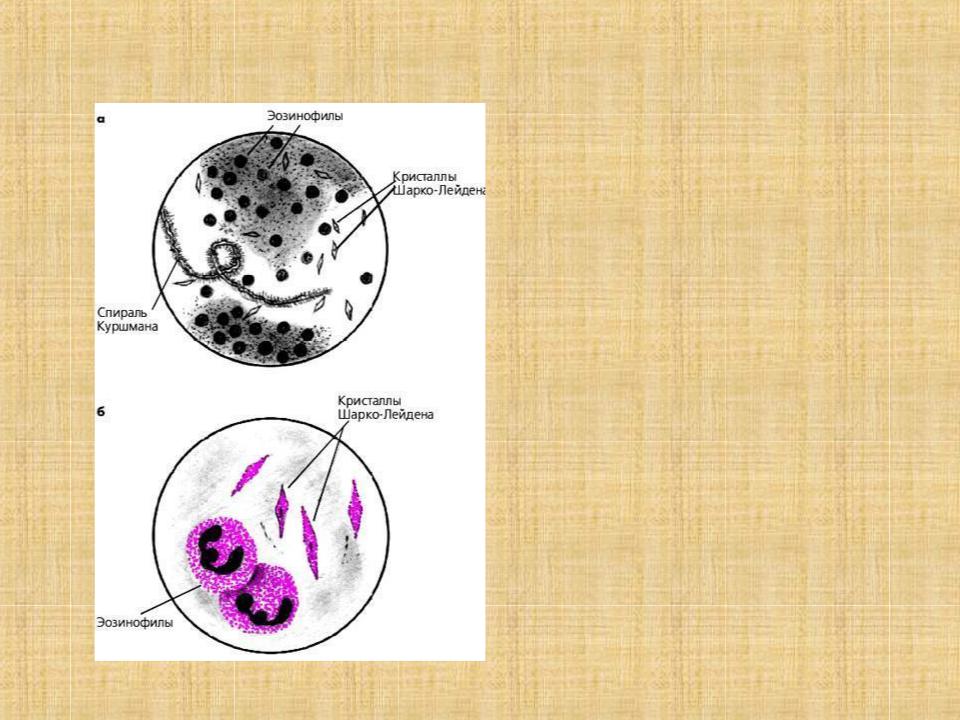
В последнее время для диагностики туберкулеза используют иммуноферментные и молекулярно-генетические методы.
Молекулярно-генетические методы
Появились методы идентификации МБТ с помощью моноклональных антител, полученных способом гибридомной технологии. Сейчас существует более 100 моноклональных антител к эпитопам основных антигенов МБТ. Применение этих антител в иммуноферментном анализе дает возможность очень быстро дифференцировать вид возбудителя, но пока метол используется в научных разработках для идентификации возбудителя туберкулеза, который чаще всего встречается.
Среди молекулярно-генетических методов диагностики туберкулеза чаще всего применяется метод ДНК-зондов и полимеразной цепной реакции (ПЦР). В основе этих методов лежит принцип комплементарности нуклеотидных оснований в построении двуспиральной молекулы ДНК. При проведении ДНК-зондирования в случае наличия в пробе исследуемого специфического участка ДНК микобактерий образуется гибрид (двухцепной фрагмент) ДНК исследуемого и ДНК-зонда.
В основе приципа ПЦР лежит многократное увеличение фрагмента ДНК. Для амплификации (многократного удвоения гена бактерий) требуется наличие двух праймеров (затравок) — небольшого одноцепочечного фрагмента ДНК, что соединяется с комплементарной участком одной из цепей матричной ДНК. В дальнейшем происходит достройка этой цепи ДНК-полимеразой. Увеличение количества (в 106 раз) фрагмента амплифицируемого оказывается электрофорезом в агаровом геле. Учет результатов реакций осуществляется под пластинами трансиллюминатора в ультрафиолетовом свете,
ДНК-зондирование позволяет проводить определение микобактерий в диагностическом материале в течение 2-4 суток, а ПЦР — за 4-6 ч. с максимально высокой чувствительностью методов — 10-100-1000 клеток в пробе исследуемого.
польза, способы проведения и возможные риски процедуры
Микроскопическое исследование мокроты является основным методом диагностики туберкулеза легких в странах с низким и средним доходом, где, по статистике, происходит почти 95% случаев туберкулеза и 98% смертей от туберкулеза в мире.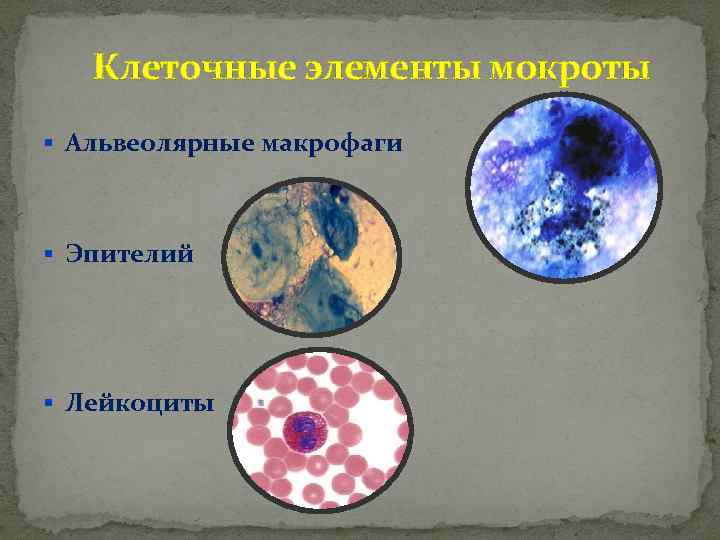
Что такое микроскопия мокроты
Микроскопия мокроты — это простой, быстрый и недорогой метод, который очень помогает врачам при постановке диагноза и назначении правильных препаратов в районах с высокой распространенностью туберкулеза. Он также выявляет наиболее инфекционных пациентов. Следовательно, данный метод является неотъемлемой частью глобальной стратегии борьбы с туберкулезом.
Тем не менее, микроскопия мокроты имеет существенные ограничения по эффективности.
Чувствительность значительно снижается, когда бактериальная нагрузка составляет менее 10 000 организмов / мл в образце мокроты. Она также не слишком эффективна при внелегочном туберкулезе, педиатрическом туберкулезе и у пациентов, инфицированных ВИЧ и туберкулезом одновременно.
Врач может назначить микроскопию мокроты, если считает, что у пациента есть микобактериальная инфекция, грибок или паразит. Микобактерии представляют собой микроорганизмы (их почти 100 известных видов). Наиболее распространенным типом является микробактерия Mycobacterium tuberculosis, которая вызывает туберкулез.
Общие симптомы туберкулеза включают:
- кашель с кровью или слизью;
- отсутствие аппетита;
- потерю веса;
- усталость;
- лихорадку;
- озноб;
- ночную потливость.
Другим довольно распространенным типом этих бактерий является Mycobacterium leprae, которая вызывает проказу. За исключением двух микроорганизмов, вызывающих туберкулез и проказу, большинство микобактерий существуют в воде и почве во всем мире. Они называются нетуберкулезными микобактериями (НТМ). НТМ можно найти в водопроводной воде, воде в бассейнах и грунтовой почве. Их жесткая, восковая клеточная стенка делает их устойчивыми к антибактериальным средствам.
Хотя НТМ и чрезвычайно широко распространены, большинство людей не болеют по их вине. Однако люди с проблемами иммунитета, такими как СПИД, уязвимы к инфекции. У некоторых людей может быть инфекция без каких-либо симптомов. У других людей есть инфекции, которые вызывают симптомы, похожие на туберкулез.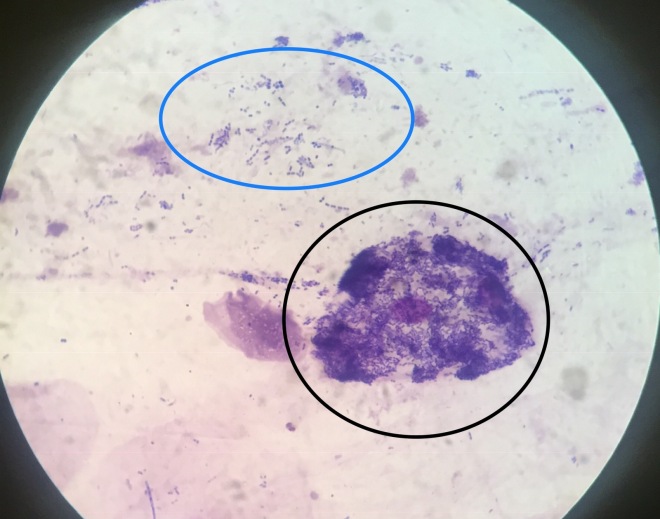 Микроскопия мокроты поможет врачу выяснить, действительно ли у пациента туберкулез или же заболевание вызвано другой микробактерией.
Микроскопия мокроты поможет врачу выяснить, действительно ли у пациента туберкулез или же заболевание вызвано другой микробактерией.
Подготовка к сбору
В ночь перед анализом нужно выпить много жидкости, например, воду или чай.
Это поможет организму произвести больше мокроты.
Сбор утренней мокроты делает тест более точным. Утром в мокроте появляется больше бактерий.
Нельзя есть, пить и курить перед сбором образца мокроты.
Процесс сбора материала
Мокроту собирает либо пациент, либо врач. Если у пациента есть проблемы с откашливанием мокроты, ему может помочь паровая ингаляция.
Для сбора материала для микроскопии мокроты врач даст пациенту стерильную емкость. Не нужно открывать ее до полной готовности собрать пробу.
Чтобы собрать образец мокроты, пациенту нужно сделать следующее:
- почистить зубы и промыть рот, не используя антисептическую жидкость для полоскания рта;
- сделать пару длинных глубоких вдохов;
- начать кашлять, пока не появится мокрота;
- выплюнуть мокроту в чашку для образца;
- продолжать откашливать мокроту, пока чашка не будет заполнена до маркера, что составляет приблизительно 1 чайную ложку;
- закрыть емкость крышкой;
- написать свое имя, дату рождения и дату сбора мокроты на этикетке емкости;
- отнести образец в поликлинику или частную лабораторию.

Образец для микроскопии мокроты может быть охлажден в течение 24 часов, если это необходимо. Не нужно замораживать его и не надо хранить при комнатной температуре. Если пациент не может откашлять мокроту, можно попробовать принять горячий душ или подышать над картошкой. Мокрота должна поступать из глубины легких, чтобы тест был точным. Если пациент все еще не может откашлять мокроту, врач сделает бронхоскопию для сбора мокроты непосредственно из легких.
Бронхоскопия — простая процедура, которая занимает от 30 до 60 минут.
- Врач распылит местный анестетик в нос и горло пациента, чтобы обезболить их.
- Пациенту может быть дано успокоительное средство, чтобы помочь ему расслабиться. Что касается общей анестезии, то она обычно не требуется для бронхоскопии.
- Бронхоскоп — мягкая, маленькая трубка с увеличительным стеклом на конце — будет введена через нос или рот в легкие пациента.
- С помощью бронхоскопа врач может видеть легкие и взять небольшой образец мокроты.

- Для безопасности нужно, чтобы кто-то отвез пациента домой после данной процедуры.
Не существует рисков, связанных с самостоятельным сбором пробы мокроты. Редкие риски бронхоскопии включают:
- аллергические реакции на седативные средства;
- инфекцию;
- бронхиальное кровотечение;
- спазмы — внезапное сжатие мышц в бронхиолах;
- нерегулярный сердечный ритм;
- пневмоторакс.
Микроскопическое исследование
При проведении микроскопии мокроты медицинский работник окрашивает специальным красителем клетки образца, а затем промывает их в кислотном растворе.
Затем клетки исследуют под микроскопом. Если клетки в мазке сохраняют краситель, это означает, что в них присутствуют микобактерии.
Микобактерии обычно имеют кислотоустойчивые свойства и удерживаются на красителе при промывании в кислотном растворе.
Также может быть проведен тест на культуру.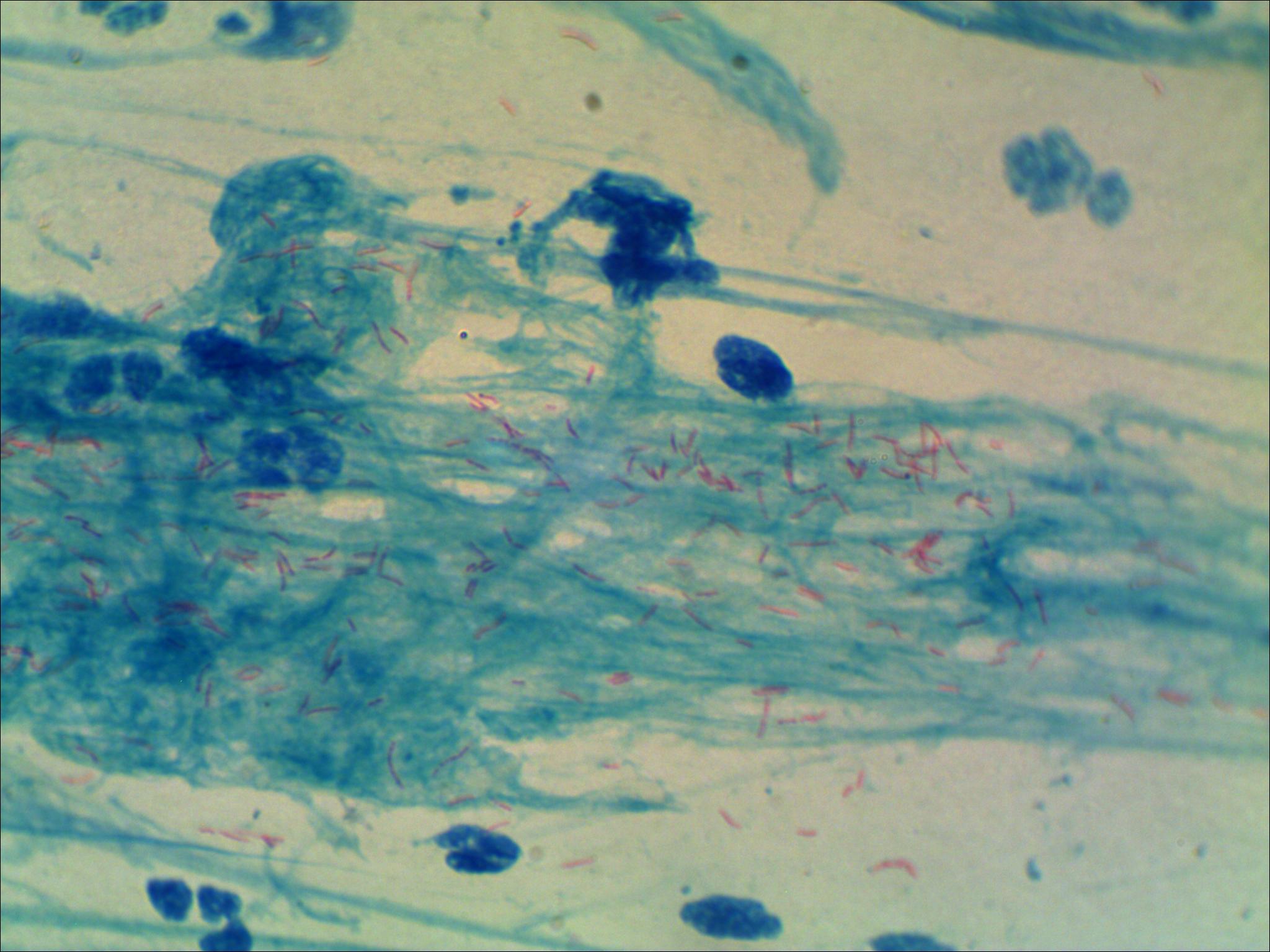 Образец мокроты помещают в культуральную среду, содержащую питательные вещества. Образцу дают возможность расти при комнатной температуре в течение нескольких дней. Это позволяет увидеть большее количество бактериальных клеток, чтобы подтвердить результаты анализа.
Образец мокроты помещают в культуральную среду, содержащую питательные вещества. Образцу дают возможность расти при комнатной температуре в течение нескольких дней. Это позволяет увидеть большее количество бактериальных клеток, чтобы подтвердить результаты анализа.
Микроскопия мокроты позволяет обнаружить в образце слизь, клетки, бактерии, грибы волокнистые и кристаллические структуры и паразитов.
В образце мокроты могут присутствовать следующие элементы:
Клетки
- Альвеолярные макрофаги — при хронических процессах в бронхолегочной системе. Если они содержат пигмент гемосидерин, который состоит из оксида железа, значит есть застой в малом круге кровообращения или же об инфаркт легкого или кровоизлияние в него.
- Макрофаги, содержащие липидные капли — при воспалительно-дегенеративном процессе в бронхиолах и бронхах.
- Множество лимфоцитов — при коклюше или туберкулезе.

- Наличие лейкоцитов нормально для любого образца мокроты.
- Эритроциты в норме могут присутствовать в единичных количествах. Если в мокроте есть свежая кровь, то в ней будут неизмененные эритроциты, а если кровь долго находилась в дыхательных путях и отошла вместе с мокротой, то анализ выявит выщелоченные эритроциты.
- Жировые моноциты (макрофаги) — при абсцессе, актиномикозе или эхинококкозе лёгких (одна из стадий развития ленточного глиста).
- Плоский эпителий — при попадании в образец слюны. Хотя и мокрота и слюна — это нативные (естественные) жидкости организма, но мокрота из глубины легких — это не то же самое, что слюна. Мокрота — это слизь, и она обычно достаточно плотная по консистенции, особенно когда в легких есть инфекция.
- Цилиндрические клетки мерцательного эпителия — при опухоли в легких, бронхите, бронхиальной астме или трахеите.
- Эозинофилы — при раке легкого, астме, туберкулезной инфекции, инфаркте легкого, эозинофильной пневмонии и легочных глистных инвазиях.
- Клетки злокачественных новообразований — при легочной опухоли.
Волокна
- При кавернозном туберкулезе и других легочных патологиях в исследуемом образце выявляют коралловидные волокна.
- Эластические волокна характерны для туберкулеза, абсцесса, новообразований в легких и гельминтоза под названием «эхинококкоз».
- Обызвествлённые (пропитанные кальциевыми солями) эластические волокна появляются при распаде петрификатов — следов туберкула.
Спирали и кристаллы
A Быстрый и точный диагностический скрининговый анализ для обнаружения микобактерий, включая Mycobacterium tuberculosis, непосредственно из мокроты без экстракции
Мы сообщаем о новом подходе, использующем скрининговый анализ ПЦР в реальном времени, нацеленный на тандемно повторяющийся элемент размером 53 п.н., присутствующий в различных локусах в пределах Mycobacterium tuberculosis (Mtb) геном. Положительные образцы были идентифицированы в диапазоне дискриминационной кривой плавления 90–94 ° C, при этом результаты были получены менее чем за час непосредственно из очищенных образцов мокроты без экстракции.Панель из 89 мокроты с положительным мазком была использована для аналитической валидации анализа со 100% соответствием, с чувствительностью, соответствующей культуре. Перекрестная реактивность была обнаружена в узком диапазоне микобактерий, отличных от туберкулеза (MOTT) (пять мокроты, три in silico ), с самой высокой чувствительностью в комплексе M. avium (MAC). В течение года была проведена прямая оценка теста с платформой GeneXpert с 104 последовательными образцами в Royal Free Hospital, Великобритания.Анализ рабочих характеристик приемника (ROC) данных показал, что оба теста примерно равны по чувствительности, при этом площадь под кривой составляет 0,85 и 0,80 для GeneXpert и нашего анализа, соответственно, что указывает на то, что этот тест будет экономически эффективным методом. до тестирования GeneXpert.
1. Введение
Mycobacterium tuberculosis ( Mtb ), этиологический агент туберкулеза (ТБ), является второй по значимости причиной смерти от инфекционных заболеваний во всем мире, при этом латентная инфекция поражает до одной трети населения мира. [1].Быстрая диагностика имеет важное значение для начала лечения и активного участия пациента в процессе лечения.
Чтобы обнаружить кислотоустойчивые бациллы (КУБ) в мокроте, включая Mtb , с помощью окрашивания по Цилю Нильсену, необходимо более 5000 организмов на мл мокроты для визуализации бацилл с помощью световой микроскопии [2]. Таким образом, тесту мазка часто недостает чувствительности и специфичности для обнаружения Mtb , а у пациентов с активным туберкулезом легких только около 45% инфекций выявляются при микроскопии мокроты [3].Культура Mtb остается золотым стандартом как для диагностики, так и для тестирования лекарственной чувствительности и может обнаруживать всего одну бактерию на мл мокроты [4]; однако этому методу препятствует как длительное время инкубации (до нескольких недель для диагностики в твердой культуре), так и то, что его сложно реализовать в полевых условиях [2]. Крайне важно, чтобы были разработаны новые диагностические методы, желательно с техникой по месту оказания помощи (POC), которую можно было бы легко перенести в места с ограниченными ресурсами.Тест должен быть быстрым, простым, специфическим и высокочувствительным методом для обнаружения Mtb в мокроте и респираторных образцах на таких низких уровнях, как одна копия генома Mtb .
Современные молекулярные методологии обнаружения и генотипирования Mtb включают амплификацию мобильного элемента IS 6110 , присутствующего в Mtb и других членах комплекса TB (MTBC) [5]. Число копий IS 6110 в геноме Mtb зависит от штамма: присутствует до 25 копий и в среднем примерно 15 копий.Некоторые штаммы Mtb обладают единственной копией или полностью лишены IS 6110 , что потенциально снижает чувствительность анализа [6].
Сообщалось об одновременном обнаружении, а также дифференцировке штаммов Mtb с использованием метода, называемого «спейсерное олигонуклеотидное типирование» или «сполиготипирование», основанное на амплификации полиморфных «спейсерных» областей внутри локуса прямого повтора (DR), присутствующего исключительно в штаммах MTBC. [7]. Штаммы различаются в зависимости от наличия или отсутствия определенных спейсерных областей.В отличие от IS 6110 , сполиготипирование позволяет различать M. bovis и Mtb [8].
Были разработаны наборы для выявления туберкулеза на основе амплификации, например система Roche COBAS AMPLICOR MTBC и система BD ProbeTec ET (BD Biosciences), но они обладают меньшей чувствительностью по сравнению с тестами на основе культуры [9, 10].
Совсем недавно тест GeneXpert от Cepheid [11, 12] быстро стал наиболее распространенным молекулярным тестом для диагностики туберкулеза и одновременного определения устойчивости к рифампицину, на что указывают мутации в гене rpo B и используются в качестве суррогата множественной лекарственной устойчивости.Несмотря на то, что тесты и оборудование чувствительны, специфичны и просты в использовании, они дороги, а платформа GeneXpert требует стабильного источника питания, что ограничивает ее ценность в бедных ресурсных странах, которые в нем больше всего нуждаются. Менее дорогой тест имел бы явные преимущества.
Самым последним молекулярным маркером, широко применяемым для дифференциации штаммов Mtb , является тандемный повтор с переменным числом (VNTR), также называемый микобактериальной вкрапленной повторяющейся единицей (MIRU) [13, 14].Описанный здесь новый анализ (далее именуемый « Mtb detect») нацелен на некоторые из этих тандемно повторяющихся ДНК. В геномной ДНК из узкого круга микобактерий, включая MTBC с высоким числом копий (30+ копий), М., наблюдаются различные числа копий показанной последовательности из 53 п.н. (обычно от трех до 13 копий в каждом локусе, рисунок 1). avium (MAC, прогнозируемые 12–14 копий), а также с единичным или малым числом копий (прогнозируемые 1–5 копий) у трех других видов микобактерий ( M.marinum, M. ulcerans, и M. leprae) . Здесь мы описываем разработку и оценку анализа (обнаружение Mtb ), который позволяет обнаруживать отдельные молекулы этого часто повторяющегося элемента ДНК напрямую и недорого из обеззараженной мокроты без экстракции для использования в качестве недорогого скрининга перед тестированием GeneXpert. Это изобретение описано в находящейся на рассмотрении международной заявке на патент, опубликованной как WO 2009/125228.
2. Материалы и методы
2.1. Mtb Разработка теста обнаружения
2.1.1. Штаммы для разработки тестов
Два штамма Mtb , h47Rv и собственная культура, обозначенная 5480, из клинического изолята, собранного в Великобритании в 2010 году, были использованы в качестве положительных контролей для разработки анализа. Их выращивали на склонах Левенштейна-Йенсена и идентифицировали фенотипическими и биохимическими тестами [15]. ДНК экстрагировали с помощью мини-набора QIAamp DNA (Qiagen, UK) в соответствии с рекомендациями производителя.
2.1.2. Образцы мокроты для разработки тестов
Семьдесят шесть образцов мокроты с положительным мазком, из которых четыре были подтверждены посевом как MOTT, включая M. chelonae, M. fortuitum, M. intracellulare, и M. abscessus, были получены из Королевский госпиталь Лондона, Великобритания . Образцы были инактивированы кипячением в 1 М NaOH в течение 10 минут после разжижения дитиотреитола (Sputasol, Oxoid, UK). Еще одна панель из семи инактивированных образцов мокроты, содержащих Mtb с концентрацией> 90 бацилл на поле микроскопии, и еще шесть образцов мокроты, содержащих MOTT, включая M.malmoense и M. chelonae были получены из региональной микобактериологической лаборатории, Ньюкасл, Великобритания. Обеззараженные образцы мокроты инактивировали нагреванием путем кипячения при 105 ° C в течение 10 мин. Образцы хранили при -20 ° C.
2.1.3. Результаты кислотно-быстрой микроскопии мазка
Все расчеты количества клеток основаны на добавлении 10 мкл л мокроты и 300 полей на предметное стекло. Результат <10 указывает на экстраполированное количество бактерий на образец 1–9 на всем слайде, 1+ указывает на ≥10 бактерий на всем слайде, но менее 2 на поле, 2+ указывает на 2-3 бактерии на поле и 3 + указывает ≥3 бактерий на поле.
2.2. Амплификация
Были сконструированы и синтезированы следующие праймеры, нацеленные на повторяющийся элемент длиной 53 п.н. (Рисунок 1): Mtb detect For: 5 ‘GGC GCC GCT CCT CCT CAT CGC T 3’ и Mtb detect Rev: 5 ‘CGC CGG CGA CGA TGC AGA GC 3 ‘, используемый для амплификации на блочных платформах реального времени и in silico следующим образом.
2.2.1. Блочная амплификация
ПЦР состояли из 25 мкл л 2x ReadyMix (Sigma, Великобритания), 5 пмоль каждого праймера, приблизительно 50 нг матричной ДНК или 1 мкл л инактивированной мокроты и воды, свободной от нуклеаз, для полной реакции. объем 50 мк л.Параметры цикла ПЦР на термоциклере Applied Biosystems 9700 были следующими: 95 ° C в течение 12 минут, 45 циклов при 94 ° C в течение 30 секунд, 64 ° C в течение 1 минуты и 72 ° C в течение 2 минут.
2.2.2. Амплификация ПЦР в реальном времени
Реакционные смеси для ПЦР состояли из 10 мкл л 2x Lightcycler 480 (LC480) SYBR green I Mastermix (Roche, Applied Science UK), содержащих ДНК-полимеразу FastStart Taq, реакционный буфер, смесь dNTP (с dUTP вместо dTTP), краситель SYBR Green I и MgCl 2 вместе с 0.5 мкМ мкМ каждый праймер, 1 мкл мкл матричной ДНК и вода, не содержащая нуклеаз, до 20 мкл л. Параметры цикла ПЦР на Roche LC480 были следующими: 40 ° C Урацил-ДНК N-гликозилаза ( UNG) активацию проводили в течение 10 мин путем добавления 0,25 ед. Фермента к каждой реакции для переваривания любой dUTP-содержащей ДНК, присутствующей перед циклом, чтобы предотвратить перенос ранее амплифицированных образцов. После этого следовала денатурация при 95 ° C в течение 12 минут, 45 циклов при 95 ° C в течение 10 секунд и 72 ° C в течение 1 секунды.Скорость нарастания составляла 4,4 и 1,0 ° C / с соответственно. Непосредственно следовал протокол кривой плавления: 99 ° C в течение 10 секунд, 55 ° C в течение 20 секунд и, наконец, повторный нагрев до 99 ° C с 5 сборами данных на ° C. Скорость нарастания составляла 4,4 и 2,2 ° C / с соответственно.
Образцы, предположительно содержащие ингибиторы (положительные при микроскопии мазка, отрицательные при блочной ПЦР), перед амплификацией разбавляли в соотношении 1:50 водой, свободной от нуклеаз.
2.2.3. In Silico Amplification
Программное обеспечение « in silico Simulation of Molecular Biology Experiments» использовалось для оценки специфичности анализа обнаружения Mtb с использованием программного обеспечения « in silico PCR Amplification», расположенного по адресу http: // insilico.ehu.es/PCR/index.php?mo=Mycobacterium. Были представлены последовательности прямого и обратного праймеров и определены критерии поиска, допускающие наличие двух несовпадений (ни одного на 3′-конце). Анализ был проведен против всех доступных полных геномов микобактерий ().
2.3. Анализ
2.3.1. Анализ на основе блоков
ПЦР-продуктов определяли размер с помощью электрофореза в агарозном геле.
2.3.2. Анализ в реальном времени
Кривые амплификации анализировали методом абсолютного количественного определения / 2-го производного максимума, полученного из программного обеспечения LC480 (Roche, UK).Анализ кривой плавления автоматически выполнялся с использованием метода отрицательной первой производной (-dF / dT) в программном обеспечении LC480.
2.4. Расщепление рестрикционной эндонуклеазой
Сгенерированные на основе блоков продукты ПЦР были подтверждены как основанные на повторах рестрикционным расщеплением с Hha I в соответствии с инструкциями производителя (New England Biolabs, Великобритания) и визуализированы на агарозном геле.
2,5. Клиническая оценка и анализ
Сто четыре последовательных клинических образца различного типа (см. Таблицу 1) были обеззаражены в соответствии с общепринятой практикой.Вкратце, образцы обеззараживали равным объемом 4% NaOH, а затем нейтрализовали с последующим разжижением дитиотреитолом (Sputasol, Oxoid, UK) и центрифугированием. Добавляли десять миллилитров стерильной воды и снова центрифугировали. Окрашивание отложений аурамином проводили с последующей микроскопией. Этот осадок (приблизительно 2,5 мл) также использовали как для ПЦР, так и для инкубации в BD MGIT (Becton Dickinson). Пятьсот микролитров объединяли с 1,5 мл реагента для образцов GeneXpert и инкубировали в течение 15 минут в соответствии с инструкциями производителя (Cepheid, США).Затем один микролитр этой смеси использовали в качестве матрицы для анализа обнаружения Mtb и амплифицировали, как описано выше. Оставшуюся смесь загружали в картридж инструмента и обрабатывали в соответствии с инструкциями производителя.
Диагностическая точность ПЦР и теста GeneXpert сравнивалась с использованием анализа сводной кривой характеристики оператора приемника (ROC) с культурой и клинического решения рассматривать каждого пациента как золотой стандарт в двух отдельных анализах.Все анализы проводились в статистической программе Stata. 3. РезультатыПоиски BLAST с использованием настроек по умолчанию с набором праймеров для обнаружения Mtb выявили идентичность с MTBC, M. avium комплекс (MAC), M. ulcerans , M. marinum, и M . leprae . 3.1. Разработка теста: MTBCВ общей сложности 79 образцов мокроты MTBC с положительным мазком на AFB были подвергнуты блочному анализу обнаружения Mtb и проанализированы электрофорезом в агарозном геле.Исходные концентрации образцов определялись с помощью стандартной микроскопии мазков, а общее количество бактерий экстраполировалось из использованных объемов образцов. Все отрицательные контрольные реакции ПЦР образовывали отдельный димер праймера из 38 пар оснований (фиг. 2). Образцы с исходным шаблоном низкого уровня (<20 молекул / мкл л) визуализировались в виде отдельных полос (рис. 2). Образцы с более высокой концентрацией шаблона (от ~ 2 × 10 2 до 2 × 10 7 молекул / мкл л) дали мазок размером от 200 до 12 т.п.н. (Рисунок 2).
Пятьдесят восемь образцов MTBC дали положительные результаты и 21 отрицательный результат с помощью блочной ПЦР и гель-электрофореза. Предполагалось, что образцы, которые не удалось амплифицировать, содержат эндогенные ингибиторы ПЦР, и впоследствии были проанализированы с использованием платформы реального времени для повышения чувствительности обнаружения. Двадцать одна проба мокроты MTBC с положительным мазком, отрицательная блочным методом, была перенесена на платформу реального времени. Двадцать из 21 мокроты дали положительный результат на системе LC480, судя по температуре плавления 90–94 ° C.Отрицательные контроли образовывали димеры праймеров с температурой плавления 86 ° C; низко положительные образцы сформировали оба продукта (Рисунок 3).
Все девять образцов, классифицированных как слабоположительные (<10 бацилл / слайд), дали положительные результаты с помощью анализа Mtb detect в реальном времени (после разбавления 1:50 для уменьшения эффекта эндогенных ингибиторов ПЦР). Основываясь на экстраполяции результатов микроскопии на количество бактерий в исходном образце мокроты, анализ в реальном времени был рассчитан примерно в 2–50 раз более чувствительным, чем микроскопия мазка, и показал более низкую, чем чувствительность отдельных клеток. 3.2. Разработка тестаДесять образцов мокроты содержали MOTT. Чтобы эмпирически проверить специфичность обнаружения Mtb для MTBC, эти образцы были подвергнуты анализу в реальном времени. Перекрестная реактивность была показана со штаммом M. avium complex (MAC) и с M. chelonae, M. abscessus, M. fortuitum, и M. intracellulare . Рестрикционное переваривание использовали для характеристики наблюдаемого высокомолекулярного мазка. Hha I с участком разрезания GCGC отщеплял ампликон с повторением 44 п.н., теоретически давая продукты расщепления длиной 3, 20 и 21 п.о., и его использовали для дискриминации продукта димера праймера, который давал продукты расщепления 3 и 35 п.н. (данные не показано). Все ампликоны были полностью расщеплены, что наблюдалось по исчезновению мазка и фрагмента размером 44 п.н., что указывает на то, что продукт с высокой молекулярной массой состоит исключительно из конкатемеров повторяющегося элемента. Специфичность детектирующего анализа Mtb была протестирована in silico с 43 доступными секвенированными геномами микобактерий.Наибольшее количество повторов, идентифицированных анализом, было для видов MTBC (30+ копий), за исключением некоторой перекрестной реактивности с MAC (12–14 копий), M. ulcerans (четыре копии), M. marinum (пять экземпляров) и M. leprae (три экземпляра). 3.3. Прямая клиническая оценкаВ таблице 1 показаны результаты непосредственной оценки с помощью GeneXpert для 26/104 образцов, дающие положительный результат по крайней мере в одном из четырех тестов (мазок, посев, GeneXpert или Mtb ). обнаружить ПЦР).Остальные 78/104 были отрицательными по всем четырем тестам. ROC-анализ данных с использованием бактериальной культуры в качестве золотого стандарта показал, что площадь под кривой для GeneXpert составляла 0,85 (95% доверительный интервал 0,75–0,95) по сравнению с площадью под кривой для ПЦР 0,80 (95% доверительный интервал 0,69–0,91). ,. Рисунок 4 (а) предполагает, что эти два теста примерно эквивалентны. Используя клиническое решение о лечении в качестве золотого стандарта, площадь под кривой для GeneXpert составила 0,83 (95% доверительный интервал 0.75–0,92) по сравнению с площадями под кривой для ПЦР 0,74 (95% доверительный интервал 0,64–0,83) (рисунок 4 (b)). Во время оценки перекрестной реактивности не наблюдалось с MOTT ( M. kansasii и M. chelonae ). Mtb detect, как и тест GeneXpert, был способен обнаруживать образцы с отрицательным мазком. Наибольшее количество дней до положительного результата культивирования в жидкой культуре (MGIT), когда образец был отрицательным по мазку, и как GeneXpert, так и новый анализ были положительными, составляло 23 дня. Общая положительная прогностическая ценность по сравнению с клиническим лечением составила 100% и 88% для GeneXpert и нашего анализа, а отрицательная прогностическая ценность составила 80% и 83%. 4. ОбсуждениеСуществует очевидная потребность в диагностических тестах POC на туберкулез в условиях ограниченных ресурсов. Несмотря на свою чувствительность, культура микобактерий для диагностики Mtb не является специфической, и для подтверждения идентификации Mtb требуется дополнительное время, а также тестирование, часто после нескольких недель культивирования. Для культурных учреждений требуется специальный персонал со специальной подготовкой и высокоразвитой инфраструктурой, что делает их непригодными для использования в условиях POC.Микроскопия мазка мокроты в настоящее время является наиболее широко используемым диагностическим тестом на туберкулез и, вероятно, самым быстрым, но имеет несколько ограничений, которые не позволяют использовать ее в POC. Микроскопии мазка не хватает чувствительности и специфичности, а также требуется сложная лабораторная инфраструктура, недоступная в условиях POC. Идеальный молекулярный тест POC должен быть таким же чувствительным, как культура, воспроизводимым, быстрым, надежным и простым, с низким риском биобезопасности и контаминации, и не должен требовать специального, потенциально дорогостоящего оборудования, такого как центрифуги.Многие ДНК-мишени в геноме Mtb были в центре внимания при разработке ПЦР для быстрых анализов POC. Хотя он и не считается таким чувствительным, как культура, наиболее широко используемый диагностический ПЦР-тест для Mtb нацелен на элемент IS 6110 , который присутствует в нескольких копиях (до 25 копий) в геноме [16]. Штаммы с низким числом копий или без них приведут к потере или значительному снижению чувствительности анализа. Для решения этой проблемы был разработан простой анализ ПЦР в реальном времени, нацеленный на тандемно повторяющийся элемент, присутствующий в нескольких копиях (примерно 20–30) во всех линиях Mtb [17].Использование инкубации с урацил-N ДНК-гликозилазой в начале dUTP-содержащей ПЦР гарантирует, что ранее амплифицированные продукты не могли действовать как матрица и перекрестно контаминировать. Во время аналитической валидации девять слабо положительных образцов мазка (1–9 бацилл на слайд) были положительными при блочном анализе, а при анализе с использованием ПЦР в реальном времени требовалось разведение перед положительным результатом. Вероятно, это связано с Таблица 1 | Услуги по фронтальной микроскопии мокроты: возможность оптимизировать выявление случаев туберкулеза на основе мазка в странах с высокой распространенностьюТаблица 1 Дополнительный результат серийных мазков, собранных в виде пятен-утренних пятен или
СТАНДАРТНОЕ РУКОВОДСТВО ДЛЯ ЛАБОРАТОРНЫХ ТЕХНИЧЕСКИХ МИКРОСКОПИЙ МИКРОСКОПИИ МЯТКИ МЫРКИ1 СТАНДАРТНОЕ РУКОВОДСТВО ДЛЯ ЛАБОРАТОРНЫХ ТЕХНИКОВ ПО МИКРОСКОПИИ МЫРКИ МЫРКИ 2-е издание НАЦИОНАЛЬНАЯ СПРАВОЧНАЯ ЛАБОРАТОРИЯ ПО ТУБЕРКУЛЕЗУ ОТДЕЛЕНИЕ ЛАБОРАТОРИИ ОБЩЕСТВЕННОГО ЗДОРОВЬЯ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ П.О. Box No. 667, Thimphu, Bhutan. Тел .:, Факс: Веб-сайт: 2 ПРЕДИСЛОВИЕ Основная цель Национальной справочной лаборатории по туберкулезу (NTRL), Лаборатории общественного здравоохранения (PHL) при Министерстве здравоохранения — координировать работу больничных лабораторий в Бутане в рамках сети Национальной схемы внешнего обеспечения качества (NEQAS) по туберкулезу ( ТБ) Микроскопия в области обеспечения качества (ОК) микроскопии мазка мокроты, посева и тестирования лекарственной чувствительности, надзора за лекарственно-устойчивым или множественно-лекарственным туберкулезом и биобезопасности в туберкулезной лаборатории.Это 2-е издание Стандартного руководства для лаборантов по микроскопии мазка мокроты является одним из значительных усилий по улучшению контроля качества микроскопии мокроты в лабораториях больниц, выполняющих микроскопию мазка мокроты на туберкулез. Это соответствует рекомендации, сделанной Объединенной группой внешнего обзора Глобального фонда по лекарственным средствам, SEARO ВОЗ и Наднациональной референс-лабораторией по туберкулезу, Таиланд, проведенной 9 18 июня. Ключевые изменения в настоящем издании включают формулировку реагентов. для окрашивания Ziehl Neelson (ZN) с увеличением концентрации первичного красителя (Carbol Fuchsin) от 0.От 3% до 1% и снижение концентрации метиленового синего с 0,3% до 0,1% в качестве противокрасителя. Он также включает важные аспекты оценки образцов для слепой повторной проверки слайдов на основе выборки для обеспечения качества партии (LQAS) и более подробную информацию о биобезопасности в лаборатории, выполняющей микроскопию мазков на туберкулез. Спасибо всем профессионалам NTRL, PHL за их поддержку в составлении конкретных технических аспектов и заполнении Стандартного руководства для лаборантов по микроскопии мазка мокроты.Надеемся, что это пересмотренное руководство окажется полезным для всех лаборантов и поможет улучшить диагностику туберкулеза за счет гарантированного качества лабораторных услуг по микроскопии мазка мокроты на кислотоустойчивые бациллы (КУБ). Предложения и рекомендации приветствуются от всех пользователей, чтобы можно было внести изменения в следующие выпуски для улучшения версии. (Д-р ДОРДЖИ Вангчук) ГЕНЕРАЛЬНЫЙ ДИРЕКТОР Департамента общественного здравоохранения 1 3 БЛАГОДАРНОСТИ Компания PHL очень признательна Всемирной организации здравоохранения (ВОЗ) за их техническую и финансовую помощь.Их постоянная поддержка и сотрудничество были неоценимы при внесении поправок в Стандартное руководство для лаборантов по микроскопии мазка мокроты и публикации этого руководства. Искренняя благодарность членам PHL за их ценные усилия по пересмотру и обновлению этого Стандартного руководства, а также Объединенной группе внешнего обзора за их рекомендацию пересмотреть Стандартное руководство для лаборантов по микроскопии мазка мокроты. NTRL, PHL, в частности, благодарит следующих членов рабочей группы за рецензирование и доработку этого руководства: 1.Г-н Сонам Вангчук, микробиолог, руководитель лаборатории общественного здравоохранения 2. Г-н Бинай Тхапа, микробиолог, лаборатория общественного здравоохранения 3. Г-н Черинг Доржи, медицинский технолог, лаборатория общественного здравоохранения 4. Г-жа Сангай Зангмо, медицинский технолог, лаборатория общественного здравоохранения 5. Г-н Келзанг Пуншо, медицинский технолог, лаборатория общественного здравоохранения. Это 2-е издание было обсуждено и окончательно доработано членами рабочей группы 26 сентября, редактор: Карчунг Черинг [медицинский технолог], ответственный, Национальная справочная лаборатория по туберкулезу. Лаборатория Департамента здравоохранения Минздрава П.О. Ящик № 667 Тхимпху, Бутан. Тел: Факс: Веб-сайт: 2 4 Аббревиатуры NTRL PHL MDR TB LQAS AFB WHO DOTS NTCP PTB MOTT IUATLD IQC EQA QI Национальная справочная лаборатория по туберкулезу Лаборатория общественного здравоохранения Партия туберкулеза с множественной лекарственной устойчивостью Система обеспечения качества Acid Fast Bacilli Всемирная организация здравоохранения Лечение под непосредственным наблюдением Краткосрочная национальная программа борьбы с туберкулезом Легочный туберкулез Mycobacterium, отличные от Tubercle Международный союз борьбы с туберкулезом и легочными заболеваниями Внутренний контроль качества Внешняя оценка качества Повышение качества 3 5 Содержание Стр.ПРЕДИСЛОВИЕ … 1 БЛАГОДАРНОСТИ … 2 Сокращения … 3 Оглавление … 4 ГЛАВА 1 Общие сведения Роль микроскопии мазка мокроты в стратегии DOTS Микроскопия мазка мокроты Основное оборудование и реагенты Сбор образцов Процедуры подготовки мазка Метод окрашивания по Зильху Нильсену Состав реагентов для окрашивания Ziehl Neelsen Процедуры окрашивания Ziehl Neelsen Процедуры микроскопического исследования Морфологические характеристики кислотоустойчивых бацилл Регистрация и сообщение результатов Причины ошибок при микроскопии Последствия ложноположительных и ложноотрицательных мазков Хранение окрашенных слайдов для обеспечения качества ГЛАВА 2 ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА Обоснование Действия по обеспечению качества включают элементы / компоненты обеспечения качества 6 Методы ВОК Оценка на месте Тестирование панели Подготовка слайдов панели Характеристика слайдов панелей Отправка слайдов слепым методом перепроверка ГЛАВА 3 МЕРЫ ПРЕДОСТОРОЖНОСТИ В ЛАБОРАТОРИИ ТБ МИКРОСКОПИИ Передача бацилл ТБ Образование аэрозолей: распространение капель Относительный риск заражения от заражения ТБ Опасности Опасности при вдыхании a.Сбор образцов мокроты b. Работа с бактериологическими петлями c. Подготовка мазка и фиксация тепла Лабораторная гигиена Дезинфицирующие средства Средства индивидуальной защиты Лабораторные аварии Приложение для удаления отходов Форма запроса / отчета лаборатории: Приложение 7 Рабочий лист для приготовления реагента ZN: Приложение Основное оборудование и материалы для лаборатории, выполняющей микроскопию Циль-Нильсена Приложение Классификация ошибок: Приложение-слайд-форма для обеспечения качества: Приложение-лист результатов мазка для контроля качества Приложение-бланк обратной проверки слепой повторной проверки Приложение-результат тестирования панели Форма отчета: Таблица тестирования панели приложения: Запись тестирования панели приложения и форма обратной связи Ссылки 8 Общие сведения ГЛАВА-1 Туберкулез — одна из основных проблем общественного здравоохранения во всем мире.Почти треть мирового населения, то есть два миллиарда человек, инфицированы Mycobacterium tuberculosis и, таким образом, подвержены риску развития этого заболевания. Каждый год более девяти миллионов человек заболевают активным туберкулезом и около двух миллионов умирают. Более 90% случаев туберкулеза и случаев смерти в мире происходит в развивающихся странах, где 75% случаев приходится на наиболее экономически продуктивную возрастную группу (15-54 года). Хотя Бутан является одной из стран с низким бременем туберкулеза в Регионе Юго-Восточной Азии, туберкулез остается одной из основных проблем общественного здравоохранения в Бутане.Общее количество новых случаев туберкулеза, выявляемых ежегодно, составляет от 1000 до 1100, из которых примерно 35% составляют новые пациенты с положительным мазком. Туберкулез поражает людей всех возрастных групп и в основном экономически продуктивных возрастных групп от 15 до 34 лет. В 2008 году ежегодная заболеваемость всеми случаями ТБ оценивалась в 165 случаев на 100 000 населения (Global TB Control Report 2009). С момента введения краткосрочного курса лечения под непосредственным наблюдением (DOTS) в 1994 г. и охвата DOTS в 1997 г. частота регистрации случаев снизилась с 211 на 100 000 населения в 2000 году до 168 на 100 000 в 2009 году (когорта NTCP отчет, МЗ).По данным ВОЗ, предполагаемая частота положительных результатов мазка мокроты в Бутане составляет 80 на 100 000 населения. Уровень регистрации случаев в 2009 году составил 63 случая на 100 000 населения. Бутан уже достиг цели — 85% (90,96% в 2008 г.) успешного лечения среди выявленных новых случаев с положительным мазком. Стратегия ВОЗ по борьбе с туберкулезом (ДОТС) основана на сети лабораторий, которые проводят микроскопию мазка мокроты на КУБ. И диагностика, и мониторинг лечения являются ключевыми компонентами DOTS.Создание сети хорошо функционирующих периферийных лабораторий в системе здравоохранения, легко доступных для населения, является одним из главных приоритетов программы борьбы с туберкулезом в Бутане. Если лабораторный диагноз окажется недостоверным, это повлияет на все другие виды деятельности. Однако качество лабораторных услуг часто не считается приоритетом Национальной программы борьбы с туберкулезом (NTCP). Ошибки при микроскопии могут привести к невозможности выявления людей с заразным туберкулезом, которые затем продолжают распространять инфекцию в обществе, или к ненужному лечению в случаях, когда это не заболевание.Ошибки при считывании результатов контрольных мазков могут привести к тому, что пациенты будут переведены на длительное лечение, повторное лечение или преждевременное прекращение лечения. Следовательно, необходимы качественные лабораторные услуги по микроскопии мазка мокроты на КУБ. Доступность и качество микроскопии мазка на КУБ зависят от национальной справочной лаборатории, которая поддерживает и контролирует работу отдельных лабораторий. Это руководство предназначено для руководства лабораторным персоналом в обеспечении гарантированного качества и надежных лабораторных услуг в области микроскопии мазков на КУБ.В этом руководстве содержится информация о безопасности в лаборатории, микроскопии мазка мокроты и программе обеспечения качества. 7 9 1. Роль микроскопии мазка мокроты в стратегии DOTS 1. Диагностика туберкулеза 1.1 Подтверждающий диагноз туберкулеза легких (ЛТБ) 1.2 Выявление случаев ЛТБ a. Расставьте по приоритетам и распределите случаи по стандартным схемам лечения b.Помощь в прогнозировании: положительный мазок на ТБ (инфекционные случаи) Мазок-отрицательный ТБ (и отрицательный мазок мазка на ТБ с положительной культурой) 2. Мониторинг и оценка химиотерапии 2.1 В конце интенсивной фазы стандартного короткого курса химиотерапии (от 2-го или 3-го месяца до проверьте процесс DOTS и результат лечения). 2.2 По окончании лечения следить за успешностью лечения. 3. Эпидемиология и эпиднадзор 3.1. Для отчетности по эпиднадзору / уведомления о случаях ТБ с положительным результатом мазка мокроты в индексе проблемы ТБ.3.2 В качестве скринингового теста на инфекционную форму ЛТБ для профилактики туберкулеза в медицинских учреждениях. 2. Микроскопия мазка мокроты Самым важным методом диагностики туберкулеза является прямое микроскопическое исследование окрашенного соответствующим образом мазка мокроты на наличие КУБ. Прямая микроскопия проста и недорога и позволяет выявлять большинство инфекционных форм туберкулеза легких. В настоящее время нет другого диагностического инструмента, который можно было бы реализовать по доступной цене. Прямая микроскопия на туберкулез также проводится для оценки реакции на лечение и установления излечения или неудачи в конце лечения.Минимальное количество кислотоустойчивых бацилл, необходимое для получения положительного результата мазка, оценивается в 000 на миллилитр мокроты (Таблица 1). При концентрации ниже 1000 AFB на мл мокроты вероятность обнаружения бациллов в мазке составляет менее 10%. Таблица 1: Количество кислотоустойчивых бацилл, обнаруженных в мазках, концентрации культивируемых бацилл в образцах мокроты и вероятность положительного результата Количество наблюдаемых бацилл Расчетная концентрация бацилл на мл мокроты Вероятность положительного результата 0 из 100 или более полей Менее 1000 Менее 10% 1–2 на 300 полей 5 000–10 000 50% 1–9 на 100 полей Приблизительно 30 000 80% 1–9 на 10 полей Приблизительно 50 000 90% 1–9 на поле Приблизительно 100,% 10 или более на поле О 500,% Источник: David HL.Бактериология микобактериозов. Министерство здравоохранения и социального обеспечения США, Служба общественного здравоохранения, Центр инфекционных заболеваний, Атланта, США, 10 Чувствительность можно дополнительно улучшить, исследуя более одного образца от пациента, так как многие исследования показали, что исследование двух образцов в среднем выявляет более 90% случаев, а добавление третьего образца увеличивается примерно до 95 -98%.Поэтому для скрининга подозреваемых на туберкулез легких настоятельно рекомендуется использовать три образца мокроты. Однако отрицательный результат мазка не исключает диагноз туберкулеза, поскольку у некоторых пациентов имеется меньшее количество бацилл, которые не могут быть обнаружены с помощью прямой микроскопии. Образец или мазок низкого качества также могут дать отрицательный результат. Чувствительность мазка низкая при внелегочном туберкулезе и при заболеваниях, вызванных Mycobacterium, кроме туберкулезных бактерий (MOTT). Также практически невозможно различить разные виды микобактерий под микроскопом.2.1 Основное оборудование и реагенты для приготовления мазка Контейнер для мокроты емкостью 50 мл для сбора мокроты Проволочная петля с внутренним диаметром 3 мм или палочка-аппликатор для распределения мокроты по предметному стеклу Новое стеклянное предметное стекло (без смазки и царапин на предметном стекле) Алмазный маркер / маркировочный карандаш для ввода идентификационного номера на предметное стекло Щипцы для удержания предметного стекла с мазком Горелка Бунзена или спиртовая лампа для стерилизации проволочной петли, фиксация размазанного предметного стекла и пламя во время окрашивания Металлический мусорный бак / банка с дезинфицирующим средством для удаления инфицированного материала Спиртово-песочная колба Удалите и продезинфицируйте излишки мокроты на проволочной петле Для окрашивания и окрашивания Balance Staining Rack для удерживания размазанных слайдов для окрашивания 1% карболового фуксина для окрашивания кислотоустойчивых бацилл 9 11 25% серная кислота для обесцвечивания окрашенных мазков 0.1% метиленовый синий для предотвращения окрашивания обесцвеченного материала в мазке Вода для ополаскивания / промывки окрашивающего раствора Слайд-штатив, чтобы поместить окрашенные слайды для сушки на воздухе Для микроскопического исследования Микроскоп Иммерсионное масло для объектива 100X Салфетка для впитывания иммерсионного масла на окрашенных слайдах перед хранением. Коробка для слайдов для хранения окрашенных слайдов для обеспечения качества (повторная проверка вслепую) 70% этанол для чистки линз (частое использование не рекомендуется) Чистая, сухая ткань линз для очистки линз микроскопов Для регистрации и отчетности Лабораторный журнал ТБ Форма запроса / отчета лаборатории Красная ручка для напишите положительный результат 2.2 Сбор образцов Для лабораторной диагностики туберкулеза необходимо собрать три образца следующим образом: Один точечный образец, когда пациент впервые посещает медицинское учреждение, Один образец раннего утра (желательно на следующий день) Один образец образца, когда образец раннего утра сдается для экспертиза 10 12 Контейнеры Важным условием для безопасного сбора и транспортировки образцов удовлетворительного качества является использование подходящего контейнера.Следующие технические характеристики рекомендуются для облегчения выбора подходящего контейнера для сбора образца мокроты: с широким горлом, чтобы пациент мог легко откашливаться внутри контейнера, не загрязняя его снаружи. Емкость примерно 50 мл. Изготовлен из прозрачного материала для облегчения наблюдения за объемом образца и качество без вскрытия контейнера с завинчивающейся крышкой для обеспечения водонепроницаемости и снижения риска утечки во время транспортировки Легко маркируется, чтобы обеспечить постоянную идентификацию Жесткий, чтобы избежать поломки во время транспортировки Методика сбора Хорошо объясните причины сбора мокроты и дайте четкие инструкции по методику сбора у пациента, чтобы получить образец мокроты хорошего качества.Поручите пациентам собирать образцы на открытом воздухе вдали от других людей, а не в замкнутых пространствах, таких как туалеты, поскольку воздух разбавляет аэрозоли, образующиеся во время кашля, для получения образца мокроты, а ультрафиолетовые лучи от прямого солнечного света дезактивируют бациллы ТБ содержится в аэрозолях. Попросите пациента получить образец мокроты рано утром перед едой и прополоскать рот перед сбором мокроты, чтобы удалить любые остатки пищи, поскольку частицы пищи в мазках затрудняют их исследование.При первом посещении лечебного учреждения пациенту выдают контейнер. Его / ее следует проинструктировать, с демонстрацией фактическими действиями, глубоко вдохнуть 2–3 раза Кашель глубоко из груди во время выдоха Откройте контейнер и выплюните мокроту в контейнер Избегайте слюны или выделений из носа Закройте контейнер Попросите пациента аналогичным образом соберите образец ранним утром и принесите его в лабораторию. Во время второго посещения собирается третий образец (пятно). Критерии хорошего качества мокроты. Образец мокроты должен быть густым, гнойным и / или окрашенным кровью.Достаточное количество не менее 3-5 мл. Не содержит частиц пищи или других остатков. При поступлении в лабораторию образцам присваивается уникальный серийный номер лаборатории, а данные о пациенте, включая имя, адрес, возраст / пол, контактный номер, вносятся в журнал туберкулезной лаборатории. 11 13 Образцы мокроты необходимо обработать как можно скорее; однако при неизбежных обстоятельствах образец следует охладить или хранить в прохладном месте, чтобы предотвратить рост нежелательных микроорганизмов.Транспортировка мокроты Образцы мокроты, собранные в медицинском учреждении, где нет службы микроскопии, следует отправить вместе с формой запроса в ближайшую лабораторию, где они будут исследованы. Для микроскопии туберкулеза рекомендуется транспортировка термостатированного мазка. Пометьте слайды и приготовьте три мазка из трех разных образцов мокроты от подозреваемого на туберкулез и зафиксируйте все мазки нагреванием перед транспортировкой. 2.3 Процедуры подготовки мазка Мазок следует готовить управляемыми партиями (максимум 12 на партию).Маркировка мазков должна производиться на стенде для поступающих образцов с помощью перманентного маркера, например. алмазный маркер. Не прикасайтесь к поверхности слайдов. Максимальный шанс найти бациллы находится в твердых или влажных плотных частицах мокроты, и результаты прямого исследования мазка в значительной степени зависят от выбора этих частиц. Рекомендуемый размер мазка мокроты — 1 см х 2 см. Блок-схема подготовки мазка. Пометьте новое чистое предметное стекло без царапин на одном конце лабораторным серийным номером.Обозначьте матовые слайды карандашом, а не матовые слайды алмазным карандашом. Для приготовления мазка используйте слизисто-гнойный, непрозрачный, сероватый или желтоватый участок. Перенесите соответствующую часть образца на предметное стекло с помощью аппликатора или проволочной петли. 12 14 Нанесите образец на площадь от 1 см x 2 см до 2 см x 3 см. Сделайте его достаточно тонким, чтобы его можно было прочитать.Используйте новое предметное стекло для каждого образца. Дайте мазкам высохнуть на воздухе в течение 15 минут. Не используйте тепло для сушки. Пропустите слайд через пламя три или четыре раза мазком вверх. Не перегревайте. Дайте остыть перед окрашиванием. Поместите аппликатор в дезинфицирующее средство и используйте новый для каждого образца. Удалите частицы прилипшей мокроты с проволочной петли, перемещая ее вверх и вниз через бутылку со спиртом, содержащим 70% спирта. Перед повторным использованием тщательно обожгите проволочную петлю. 13 15 3.Техника окрашивания Zielh Neelsen AFB противостоит обесцвечиванию под действием слабой кислоты и сохраняет первичное окрашивание. Контркрашивание используется для окрашивания других материалов и фона, что дает контрастный фон для легкой видимости кислотостойких бацилл. После окрашивания мазка методом Циля Нильсена AFB становится красным на синем фоне. 3.1 Состав реагентов для окрашивания по Цилю Нильсену (См. Приложение II для рабочего листа для приготовления реагента ZN) 1% Карбол фуксин Базовый фуксин Абсолютный спирт: 10 г: 100 мл Растворенный основной фуксин в этаноле… Раствор 1 Кристаллы фенола Дистиллированная вода: 50 г: 900 мл Растворенные кристаллы фенола в дистиллированной воде … Раствор 2 Взвешивают 10 г основного красителя фуксина на весах и переносят их в коническую колбу на 250 мл. Добавьте 100 мл абсолютного спирта и растворите краситель, поместив его на водяную баню при 60 ° C. Избегайте прямого нагрева (раствор 1). Взвешивают 50 г кристаллов фенола на весах и переносят в коническую колбу на 1000 мл. Добавьте 500 мл дистиллированной воды и растворите кристаллы фенола. Может потребоваться легкое тепло.(раствор 2) Смешайте раствор 1 и раствор 2 и перенесите содержимое в мерный цилиндр на 1000 мл. Добавьте дистиллированную воду, чтобы довести конечный объем до 1000 мл. Вылейте раствор через фильтровальную бумагу (ватман № 1) и храните отфильтрованный раствор в бутылке янтарного цвета. Наклейте на бутылку название реагента (1% Carbol Fuchsin), а также дату приготовления и срок годности. Его можно хранить при комнатной температуре в течение шести месяцев. 25% серная кислота (h3SO4) Конц. h3SO4 Дистиллированная вода: 250 мл: 750 мл Возьмите 750 мл дистиллированной воды в колбу. Осторожно добавьте в воду концентрированную серную кислоту (не добавляйте воду к кислоте).Эта смесь будет нагреваться, поэтому всегда ставьте колбу в таз с холодной водой, разбавляя кислоту. Осторожно перемешайте и храните в бутылке янтарного цвета. Промаркируйте его названием реагента (25% серная кислота), датой приготовления и сроком годности. Его можно хранить при комнатной температуре двенадцать месяцев. 14 16 0,1% Метиленовый синий Хлорид метиленового синего Дистиллированная вода: 1 г: 1000 мл Взвешивают 1 г метиленового синего и переносят в колбу на 1 л.Добавьте 1000 мл дистиллированной воды. Хорошо взболтать и растворить. Вылейте раствор через фильтровальную бумагу (ватман № 1) и храните отфильтрованный раствор в бутылке янтарного цвета. Наклейте на бутылку название реагента (0,1% метиленовый синий), а также дату приготовления и срок годности. Его можно хранить при комнатной температуре в течение шести месяцев. Процедуры окрашивания по Цилю Нильсену 1. Поместите пронумерованные слайды на штатив для окрашивания размазанной стороной вверх (по отдельности или партиями максимум из 12 слайдов). Следите за тем, чтобы между слайдами оставался зазор в толщину пальцев, чтобы предотвратить перенос материала с одного мазка на другой и стекание раствора со слайдов.2. Залейте всю поверхность предметного стекла 1% раствором фуксина Carbol Ziehl-Neelsen. 15 17 3. Медленно нагрейте каждую заслонку до появления пара. Продолжайте готовить на пару в течение 5 минут, используя периодический нагрев. (Ни в коем случае раствор красителя не должен кипеть или высыхать во время окрашивания.) 4. Промойте каждое предметное стекло по отдельности в слабом потоке воды, пока все свободные пятна не будут смыты.Слейте лишнюю воду для полоскания, наклонив задвижку. 5. Залейте предметное стекло обесцвечивающим раствором (25% серная кислота) на 3 минуты. (Если предметное стекло недостаточно обесцвечивается через 3 минуты, обесцвечивайте еще 1 минуту.) 16 18 6. Тщательно промойте предметное стекло водой. Слейте лишнюю воду с горки. Протрите заднюю часть предметного стекла ватой, смоченной средством для обесцвечивания, чтобы очистить засохшие пятна.7. Снова промойте предметное стекло водой и слейте излишки воды с предметного стекла, наклонив предметное стекло. 8. Залейте предметное стекло 0,1% метиленовым синим и контркрашивающим средством на 60 секунд. 17 19 9. Тщательно промойте предметное стекло водой и слейте излишки пятен с предметного стекла, поместив предметное стекло под легкую струю проточной воды. 10. Поставьте промытое предметное стекло на держатель предметного стекла и дайте мазку высохнуть на воздухе.(Не нагревайте и не используйте промокательную бумагу для сушки мазка. Не помещайте предметное стекло под прямыми солнечными лучами, чтобы высушить мазок.) 4. Процедуры микроскопического исследования Чтобы добиться высокого качества исследования мазка, необходимы хороший микроскоп и удобная рабочая зона. Считывание мазков должно быть систематическим и стандартизированным, чтобы гарантировать, что исследуется репрезентативный участок мазка. Чтобы гарантировать, что область покрыта только один раз, мазок должен быть исследован упорядоченным образом, и рекомендуется следующая процедура: 18 20 Сфокусируйте окрашенное предметное стекло под линзой объектива с малым увеличением (5x или 10x) и наблюдайте за качеством окрашивания и равномерностью мазка.Выберите поле, в котором мазок распределен равномерно и будут видны лейкоциты и слизь. Нанесите каплю иммерсионного масла на окрашенный мазок и сфокусируйте его с помощью 100-кратного объектива. Не трогайте мазок пипеткой. Это может привести к загрязнению аппликатора, в результате чего AFB может распространиться от одного слайда к другому, что приведет к ложноположительным результатам. Всегда исследуйте мазки, окрашенные ZN, с помощью 100-кратного объектива под масляной иммерсией. Включайте заведомо положительный и отрицательный слайды каждый день.Положительный контроль обеспечивает окрашивающую способность растворов и процедуры окрашивания. Отрицательный контроль подтверждает, что кислотоустойчивые загрязнители не присутствуют в пятнах или других растворах. Проведите серию систематических обследований мазка по всей длине. После исследования микроскопического поля переместите предметное стекло в продольном направлении, чтобы можно было исследовать соседнее поле справа. Тщательно исследуйте каждое поле. 19 21 Прежде чем мазок будет признан отрицательным, изучите как минимум 100 полей.Для опытных микроскопистов это займет около пяти минут. В мазке размером 2,0 x 1,0 см количество микроскопических полей на одной длине предметного стекла соответствует примерно 100. Если мазок умеренно или сильно положителен, можно исследовать меньшее количество полей и можно даже сделать отчет о положительном результате. хотя весь мазок не исследован. Перед исследованием следующего слайда протрите иммерсионную линзу куском ткани для линз. При использовании микроскопа можно увидеть неожиданные объекты.Если эти объекты перемещаются только при перемещении предметного стекла, это могут быть материалы, иногда обнаруживаемые в образце или объекте, осажденные пятна, загрязнения из пятен или загрязнения в иммерсионном масле. Артефакты, которые перемещаются только при повороте окуляра, находятся в окуляре или на его линзах. Артефакты также могут быть вызваны материалом на конденсоре, линзах, зеркале или источнике света. Храните все предметные стекла для контроля качества в соответствии с установленными процедурами. Морфологические характеристики кислотоустойчивых бацилл. КУБ составляет приблизительно 1-4 м в длину и m толщиной, которые обычно выглядят как тонкие палочковидные бациллы, но они также могут выглядеть изогнутыми или изогнутыми.При окрашивании карбол-фуксином КУБ выглядят как тонкие красные стержни, слегка изогнутые, более или менее зернистые, изолированные, попарно или группами, четко выделяющиеся на синем фоне. Отдельные бактерии могут отображать сильно окрашенные участки, называемые шариками, а участки чередования пятен могут иметь полосатый вид. Все виды микобактерий невозможно дифференцировать с помощью микроскопии. Некоторые микобактерии, отличные от M. tuberculosis, могут иметь плеоморфный вид — от длинных стержней до кокковидных форм с более равномерным распределением окрашивающих свойств.Быстрорастущие микобактерии могут различаться по своей способности удерживать кислотоустойчивые пятна. 20 22 5. Запись и сообщение результатов. В первую очередь необходимо провести микроскопическое наблюдение, а затем, если в мазке присутствуют КУБ; приблизительное среднее количество этих бацилл на микроскопическое поле. Рекомендуется придерживаться единой схемы чтения, наблюдая до 100 полезных полей. Полезным микроскопическим полем считается поле, в котором наблюдаются клеточные элементы бронхиального происхождения (лейкоциты, слизистые волокна и реснитчатые клетки).Поля, в которых нет таких элементов, не должны включаться в чтение. Отчетность Полученные результаты должны быть правильно занесены или расшифрованы в лабораторном журнале. Все результаты сообщаются как можно раньше или предпочтительно в течение 24 часов. Положительные результаты отмечены красным. Количество обнаруженных КУБ является показателем степени заразности пациента, а также тяжести туберкулеза. Поэтому результаты должны быть количественно оценены. Для мазков, окрашенных по Цилю-Нильсену, рекомендуется следующий полуколичественный метод отчетности: Таблица 2: Классификация мазков с КУБ в соответствии с рекомендациями ВОЗ и IUATLD Число полей кислотоустойчивых бацилл (КУБ) Отчет Нет КУБ в 100 иммерсионных полях Отрицательный 1- 9 AFB В 100 иммерсионных полях Положительный скудный Записать точное число от 10 до 99 AFB В 100 иммерсионных полях 1+ от 1 до 10 AFB На поле (изучить 50 полей) 2+ Более 10 AFB На поле (изучить 20 полей) 3+ 21 23 6.Причины ошибок при микроскопии, связанные с образцом Неадекватный объем образца и / или плохое качество. Небрежность в маркировке тары. Маркировка должна производиться на корпусе емкости, а не на ее крышке. Связано с приготовлением мазка Недостаточная или плохо освещенная рабочая поверхность. Перемешивание слайдов. Готовить слишком много слайдов одновременно. Рекомендуется максимум 12 штук на партию. Повторное использование ранее положительных слайдов. От них следует отказаться. Загрязнение образцов из-за неосторожного использования петель / деревянных аппликаторов.Связано с окрашиванием Использование поцарапанных предметных стекол, на которых отложения пятна могут выглядеть как бациллы. Использование нефильтрованного фуксина, который может содержать кристаллы. Небрежность при нагревании фуксина, позволяя ему высохнуть и кристаллизоваться на мазке. Неадекватное обесцвечивание мазка, которое может оставлять красное пятно на сапрофитных палочках, которые затем оказываются кислотоупорными. Связано с микроскопическим исследованием. Невозможность проверить слайды и изменить их нумерацию, если номер не виден во время окрашивания. Это может привести к заменам.Несоблюдение правил очистки иммерсионных линз тканью линз после каждого обследования, особенно после того, как мазок оказался положительным. Перенос бактерий из положительного мазка из-за прикосновения к мазку капельницы с иммерсионным маслом. Капле масла следует дать возможность упасть без какого-либо контакта между капельницей и предметным стеклом. Ошибочная запись результатов. 22 24 Таблица 3: Руководство по поиску и устранению неисправностей при микроскопии Проблема Возможные причины Решение Поле тусклое Темные тени в поле, которые перемещаются при перемещении окуляра Изображение нечеткое Изображение из-за низкой мощности нечеткое Возможно слишком низкий уровень конденсатора Конденсатор Возможно закрыта диафрагма. Возможно, окуляр загрязнен.Окуляр или объектив могут быть заражены грибком. Поверхность окуляра может поцарапаться. Смазанная часть слайда может быть перевернута. В масле может быть пузырек воздуха. Масло может быть плохого качества. На линзе может быть грязь. На линзе может быть масло. На верхней поверхности линзы может быть пыль. линза Возможно, линза сломана. Поднимите конденсор. Откройте диафрагму. Очистите окуляр. Возможно, потребуется очистка окуляра или объектива. Возможно, потребуется новый окуляр. Переверните слайд. Переместите линзу 100x из стороны в сторону. Используйте только иммерсионное масло хорошего качества.Очистите линзу. Очистите линзу. Очистите линзу. Может потребоваться новая линза. 7. Последствия ложноположительных и ложноотрицательных мазков. Ложноположительные результаты. Пациенты начинают лечение без необходимости. Лекарства от туберкулеза тратятся. При контрольных обследованиях интенсивная фаза лечения продолжается дольше, чем необходимо. Пациенты могут потерять доверие к программе. Ложноотрицательные результаты Пациенты с туберкулезом не получают лечения, что приводит к страданиям, распространению туберкулеза и смерти.Интенсивная фаза лечения не продлевается на необходимый срок, что приводит к неадекватному лечению. Пациенты могут потерять доверие к программе. 23 25 8. Хранение окрашенных слайдов для обеспечения качества Лаборатория должна хранить все исследованные слайды таким образом, чтобы можно было легко извлечь каждый слайд, идентифицированный для повторной проверки. Инструкции для периферийного персонала лаборатории по хранению исследуемых слайдов включают: Удалите иммерсионное масло со слайдов, повернув их лицом к мазку на папиросной бумаге, прежде чем поместить их в ящики для хранения.Храните слайды в ящике для слайдов так, чтобы они не касались друг друга (слайды не должны складываться или прижиматься друг к другу). Не записывайте на слайде результат исследования мазка. Промаркируйте слайды в соответствии с лабораторным журналом, чтобы убедиться, что правильный слайд соответствует результату. Храните слайды последовательно по серийному номеру лаборатории независимо от положительности в коробках для слайдов в том же порядке, в котором они указаны в лабораторном журнале (положительные и отрицательные слайды не должны храниться отдельно в разных коробках).Чтобы поддерживать согласованность с лабораторным журналом, оставьте два пустых поля после первого слайда пациента, чтобы можно было добавить второй и третий слайды после их прочтения. Всегда храните слайды в закрытых коробках вдали от прямых солнечных лучей. 24 26 ГЛАВА-2 ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА Обоснование: Убедитесь, что представленные результаты точны. Выявите любые методы, которые являются потенциальными источниками ошибок. Убедитесь, что приняты соответствующие корректирующие действия. Действия по обеспечению качества включают: Проверка образцов, представленных для тестирования, Регулярная проверка реагентов. используется в процедурах тестирования (включая даты истечения срока годности) Включение стандартов (или образцов с известной положительной реакцией) в обычные тестовые прогоны Периодический обзор и обновление руководств по процедурам Регулярное обслуживание и калибровка оборудования Сбор и анализ данных Регулярные встречи с клиентами лаборатории Элементы / Компоненты обеспечения качества Внутренний контроль качества (IQC) Внешняя оценка качества (EQA) Улучшение качества (QI) Внутренний контроль качества (IQC) Эффективный и систематический мониторинг выполнения лабораторных работ, технических процедур, оборудования и расходных материалов, включая качество пятен в то туберкулезная лаборатория.Обеспечивает точную, надежную и воспроизводимую лабораторную информацию и служит механизмом, с помощью которого туберкулезные лаборатории могут подтверждать компетентность своих диагностических служб. Внешняя оценка качества Процесс выявления лабораторий, у которых проблемы, приводящие к плохой работе указанной справочной лаборатории. Оценить общие лабораторные показатели при микроскопии мокроты. 25 27 Улучшение качества Процесс, с помощью которого компоненты туберкулезной лабораторной службы постоянно анализируются для повышения их надежности, эффективности и использования.Методы ВОК Тестирование панели оценки на месте Слепая перепроверка 1. Оценка на месте Оценка на месте является важным компонентом значимой программы ВОК, чтобы: охватить административные, а также технические аспекты Проверить, соблюдает ли лаборатория руководящие принципы по контролю качества. ошибки, обнаруженные в недавнем раунде слепой перепроверки (в некоторых случаях визит необходимо специально спланировать для этой цели, например, высокая частота ложноположительных результатов, обнаруженных в раундах слепой перепроверки или панельного тестирования) Действия по оценке на месте включают: процедура сбора мокроты.Наблюдение и оценка процедур подготовки, окрашивания и чтения мазков. Обеспечение того, чтобы слайды с положительным и отрицательным контролем использовались со всеми новыми / полученными партиями красителей, а также с каждой партией мазков ежедневно. Повторная проверка нескольких положительных и отрицательных мазков для оценки качества мазка и пятен, а также результатов. Предоставление предложений по корректирующим действиям или выполнение корректирующих действий по мере необходимости после анализа результатов слепой перепроверки и панельного тестирования. Обучение на месте.26 28 2. Панельное тестирование Панельное тестирование проводится для улучшения и поддержания квалификации в исследовании мазков на КУБ во всех периферийных лабораториях, которые предоставляют услуги микроскопии мокроты. Подготовка панельного предметного стекла. Образец мокроты, использованный для изготовления панельного предметного стекла, не старше 2 дней. Подготовленные слайды бывают негативных и позитивных разных марок. Характеристика слайдов панелей Каждый набор панелей состоит из 10 известных мазков; пять окрашенных ZN и пять неокрашенных.Как окрашенные, так и неокрашенные, состоят из отрицательных и положительных слайдов разных классов с кодовыми номерами. Отгрузка панельных слайдов Панельные слайды упаковываются в слайд-боксы и отправляются в районы. Лабораториям дается срок в один месяц для сообщения результатов в PHL с даты получения слайдов панели. Инструкции для испытательных лабораторий. Стандартизированная форма для отчета и записи результатов панели предоставляется техническим специалистам в периферийных лабораториях. Слайды панелей должны рассматриваться индивидуально, а не в составе группы.Время для чтения слайдов панели. На слайды следует тратить столько же времени, сколько и на обычные слайды, и, если возможно, супервизоры должны контролировать время, затрачиваемое на считывание мазков панели. Оценка результатов панельного теста. Он оценивает квалификацию лаборанта в области микроскопии туберкулеза, используя лучшие мазки, и, таким образом, лучшие результаты оцениваются с использованием стандартного метода. Обратная связь Референс-лаборатория должна предоставлять обратную связь периферийной лаборатории, включая оценку точности результатов.27 29 3. Повторная проверка вслепую Это процесс, при котором случайный выбор слайдов (репрезентативных от общего числа проверенных слайдов) выполняется с использованием системы обеспечения качества партии (LQAS) из рутинной рабочей нагрузки в периферийной лаборатории и повторно исследуется в NTRL. Размер выборки: Метод выборки для обеспечения качества партии (LQAS) используется для определения размера выборки для слепой перепроверки и зависит от: общего количества негативных слайдов, обрабатываемых каждый год, и производительности (чувствительности) по сравнению с показателем положительности слайдов (SPR). Контроллеры. Учитывая SPR и общее количество исследованных отрицательных слайдов, количество слайдов, которые необходимо слепить, определяется статистически, при этом минимальная чувствительность контроллеров составляет 75%, а приемлемое число равно нулю.Используя статистическую таблицу № 3, справочная лаборатория должна перепроверять 105 слепых слайдов ежегодно для каждой районной лаборатории, что составляет слайды в квартал в год. Таблица 3: Ежегодный размер выборки на основе ежегодно проверяемых отрицательных результатов LAQS Число приемлемости Коэффициент положительности слайдов (SPR) 2,5% 5,0% 7,5% 10,0% 13,0% 15,0% 18,0% Всего требуется выборка 100 d = d = d = d = d = d = d = d = d = d = d = d = 30 Оценка слепых результатов повторной проверки слайдов: Таблица 4: Отчеты, сведенные в таблицу и проанализированные с использованием следующего руководства Результат результата контрольной лаборатории (PHL) Отрицательный лабораторный 1-9 AFB / 100 F Отрицательно Правильно LFN HFN HFN HFN 1-9 AFB / 100 F LFP Правильно Правильно QE QE 1+ HFP Правильно Правильно Правильно 2+ HFP QE Правильно Правильно Правильно 3+ HFP QE QE Правильно Правильно Исправлено Нет ошибок QE Ошибка количественного определения Незначительная ошибка LFN Низкий Ложноотрицательная малая ошибка LFP Низкая Ложноположительная малая ошибка HFN Высокая Ложноотрицательная основная ошибка HFP Высокая Ложно-положительная обратная связь по основной ошибке Справочная лаборатория должна предоставить обратную связь в испытательную лабораторию, включая оценку точности результатов, а также предложения по своему усмотрению Единые объяснения ошибок.29 31 ГЛАВА-3 МЕРЫ ПРЕДОСТОРОЖНОСТИ В ЛАБОРАТОРИИ ТБ МИКРОСКОПИИ Наиболее важным фактором в предотвращении лабораторной инфекции является хорошая техника со стороны отдельного работника. Специализированное оборудование может способствовать хорошей лабораторной практике, но НЕ заменяет его. M. tuberculosis включен в группу риска III по классификации риска ВОЗ, который может инфицировать лабораторных работников воздушно-капельным путем. Количество микобактерий туберкулеза, необходимое для инициации инфекции, составляет всего 10 микобактерий.Аэрозоли могут производиться в туберкулезной лаборатории при работе с протекающими образцами, открытии контейнеров для образцов и приготовлении мазков. Когда аэрозольный материал высыхает, образуются ядра капель, создающие инфекционные частицы, которые могут оставаться в воздухе в течение длительных периодов времени. При соблюдении осторожности и соответствующих методов обработка мокроты представляет для техника минимальный риск инфицирования. Передача бацилл ТБ Бациллы туберкулеза почти всегда передаются от пациентов с активным заболеванием легких.Пациент выделяет микобактерии туберкулеза небольшими каплями респираторного секрета. Эти выделения быстро испаряются, оставляя ядра капель диаметром менее 5 мкм. Ядра капель такого размера, содержащие 1 3 бациллы, могут оставаться в воздухе в течение длительного времени во взвешенном состоянии и после вдыхания способны проникать глубоко в легкие, вызывая инфекцию. Более крупные частицы не остаются в воздухе так долго и не так эффективно передают туберкулез. Риск заражения зависит от (1) заразности источника, (2) окружающей среды (например.g., перенаселенность и недостаточная вентиляция способствуют передаче ядер капель), (3) продолжительность и интенсивность воздействия и (4) восприимчивость реципиента. Образование аэрозоля: распространение капель Кашель Пение Чихание Разговор 30 32 Относительный риск от контакта с инфекционным туберкулезом Врачи, медперсонал в противотуберкулезном отделении Сбор образцов Подготовка мазка мокроты Процедурные риски Опасности при вдыхании Большинство инфекций в туберкулезной лаборатории возникают из-за потенциально инфекционных аэрозолей туберкулезная палочка.Многие микробиологические методы образуют аэрозоли, например, когда лопаются пузырьки, или когда жидкости выплескиваются через небольшие отверстия или попадают на поверхности. Следующие микробиологические процессы образуют аэрозоли: a. Сбор образцов мокроты Практики, при которых образуются аэрозоли: кашель, не закрывая рот, стояние перед подозреваемыми пациентами, когда они кашляют. Сбор образцов в закрытых помещениях. При неосторожном отвинчивании крышки образуются аэрозоли, так как во время сбора между краем контейнера и крышкой часто присутствует пленка жидкости.Меры предосторожности для снижения этих рисков включают: Инструктаж пациента прикрывать рот во время кашля. Стоять позади пациента, пока пациент кашляет. Сбор образцов на открытом воздухе. Осторожно открывать контейнеры для мокроты, содержащие образцы. Работа с бактериологическими петлями. Способы образования аэрозолей: Нагревание проволоки при погружении в образец. Прямое пламя вызывает очень опасное разбрызгивание. Меры предосторожности для снижения этих рисков включают: Соответствующее охлаждение петли после стерилизации и перед введением в образец.Перед сжиганием удалите мокроту, приставшую к проволочным петлям, в песочно-спиртовой банке. c. Подготовка мазка и термофиксация Способы, при которых образуются аэрозоли: Энергичное размазание. Тепловая фиксация мазка перед сушкой на воздухе. Меры предосторожности для снижения этих рисков включают в себя: Мягкое движение рук при смазывании. Полная сушка мазка на воздухе перед термофиксацией. Гигиена лаборатории Доступ в лабораторию разрешается только уполномоченному персоналу. Запретить есть, пить, курить или наносить макияж в лаборатории. Не разрешать облизывать этикетки или сосать карандаши. Мыть руки подходящим мылом при входе в лабораторию, после работы с потенциально загрязненными контейнерами для образцов, после любой бактериологической процедуры и перед тем, как покинуть лабораторию. все поверхности и оборудование в лаборатории как потенциально заразные и регулярно очищаются перед началом и после окончания работы с использованием 5% фенола или 70% спирта.Полы нельзя подметать, их следует протирать дезинфицирующим средством, чтобы предотвратить образование пыли. Дезинфицирующие средства Растворы дезинфицирующих средств следует готовить свежими каждый день и не следует хранить в разбавленном виде, поскольку их активность снизится. Разливы дезинфицирующего средства на поверхности Приготовьте фенол 5% каждые 2 дня Спирт 70% об. / Об. X Еженедельно Гипохлорит 5% * X Каждые 2 дня * Коррозийное воздействие на металл 5% Фенол После дезинфекции рабочей зоны и лабораторных материалов оставьте на несколько минут перед началом работы. 32 34 5% Гипохлорит. После дезинфекции рабочей зоны и лабораторных материалов оставить на несколько минут перед началом работы.70% спирт (этанол) При загрязнении рук промойте 70% этанолом, а затем тщательно промойте водой с мылом. Все вышеперечисленные дезинфицирующие средства токсичны, и их чрезмерное воздействие может привести к респираторной недостаточности, кожной сыпи или конъюнктивиту. Однако при обычном использовании и в соответствии с инструкциями производителя они безопасны и эффективны. Средства индивидуальной защиты Маски Использование масок не обязательно. Только специальные маски, такие как респиратор N95 с идеальной посадкой, действительно эффективны.Перчатки Перчатки тоже не нужны, так как заражение через кожу встречается редко. Если они используются, их следует часто менять; в противном случае они будут служить только для распространения заражения. Фартук Фартук следует носить каждый раз, когда техник выполняет работу в лаборатории. Такой же фартук нельзя носить за пределами лаборатории. Несчастные случаи в лаборатории Пролитие внутрь шкафа биологической безопасности: убедитесь, что внутри шкафа находятся абсорбирующие материалы (марля / хлопок), 5% фенол и 70% спирт. В случае утечки внутри BSC, немедленно дезактивируйте BSC, используя процедуру, описанную ниже: Надевайте двойную пару перчаток во время процедуры дезактивации.Немедленно расстелите пропитанную 5% фенолом марлю / вату, чтобы покрыть разлив, в то время как шкаф биологической безопасности продолжает работать. Подождите минут. Используя марлю / вату, вытрите пятно от краев к центру. Снова протрите область марлей / ватой, смоченной 70% спиртом. Выбросьте использованную марлю / вату и перчатки в пакет для биологических отходов для автоклавирования. Вымойте руки с мылом после дезинфекции 33 35 Разливы на оборудовании, лабораторных столах, стенах, полах, одежде и т. Д.: Немедленно указать всему персоналу, работающему в лаборатории, и выполнить эвакуацию в течение 1 часа, чтобы обеспечить рассеивание аэрозолей, образующихся при разливе. Покиньте зараженную лабораторию, закройте двери лаборатории и вывесите предупреждающие знаки, чтобы никто не мог войти в лабораторию. Тщательно вымойте руки и другие явно загрязненные участки водой с мылом. Если личная одежда загрязнена, снимите всю верхнюю одежду и поместите ее в автоклав или контейнер для автоклавирования. Наденьте чистую одежду.Наденьте маску N95, свежий лабораторный халат и две пары перчаток и войдите снова. По возвращении в лабораторию накройте место разлива марлей / ватой, смоченной 5% -ным раствором фенола (не наливайте дезактивирующий раствор непосредственно на разлив, чтобы избежать дополнительного выброса аэрозолей). Дать постоять 20 минут, затем протереть марлей / ватой. Снова протрите область марлей / ватой, смоченной 70% спиртом. Выбросьте использованную марлю / хлопок и перчатки в пакет для автоклава и автоклав. Снова вымойте руки и другие загрязненные участки водой с мылом.Удаление отходов Ни один инфицированный материал не должен покидать лабораторию, если он не упакован надлежащим образом для транспортировки. Все образцы, загрязненные контейнеры, палочки для аппликаторов, пипетки и другие лабораторные принадлежности перед утилизацией или повторным использованием следует стерилизовать автоклавированием при 121 ° C и весе 15 фунтов в течение 20 минут. Все клинические материалы должны рассматриваться как инфекционные, и с ними необходимо обращаться с точно такими же мерами предосторожности, указанными на этикетках с предупреждениями об опасности. 34 36 Лабораторная форма запроса / отчета: Приложение 1 НАЦИОНАЛЬНАЯ СПРАВОЧНАЯ ЛАБОРАТОРИЯ ТБ ЛАБОРАТОРИЯ ОБЩЕСТВЕННОГО ЗДРАВООХРАНЕНИЯ THIMPHU: БУТАНСКАЯ ЛАБОРАТОРНАЯ ФОРМА ДЛЯ ОБСЛЕДОВАНИЯ AFB Название больницы: Дата: Имя пациента: Возраст: Пол М / Ж: Полный адрес: Пациент с ТБ Нет.: Классификация заболевания: Легочные внелегочные, Место проведения: Образец: Причина исследования: Диагноз Последующее лечение химиотерапии Дата взятия образца: РЕЗУЛЬТАТЫ (заполняется в лаборатории) Лаборатория. Серийный номер: a) Внешний вид мокроты Слизисто-гнойный окрашенный кровью Образец слюны 1 Образец 2 Образец 3 b) Дата микроскопии Результаты образца * Положительные (оценка) Скудные * Напишите КУБ в столбце результатов не замечено или положительно и отметьте галочкой соответствующую градацию. Дата: Проверено (Подпись): 35 37 Рабочий лист для подготовки реагента ZN: Приготовление реагента [Ziehl Neelsen Staining-1] Приложение 2 Название реагента: Номер партии: Дата приготовления: Общее приготовленное количество: Срок годности: Подготовил: 1% Carbol fuchsin Ингредиенты Поставщик / номер по каталогу Номер партии Добавленное количество Техник / Технолог Дата Базовый фуксин 1 г Абсолютный этанол 10 мл Кристаллический фенол 5 г Дистиллированная вода до 100 мл Инструкции по приготовлению 1% Carbol фуксина: 1.С помощью цифровых весов взвесьте 1 г основного фуксина в стерильной колбе объемом 100 мл. 2. Добавьте 10 мл абсолютного спирта и растворите краситель, поместив его на водяную баню при 60 ° C. Избегайте прямого нагрева (раствор 1). 3. С помощью цифровых весов взвесьте на весах 5 г кристаллов фенола и перенесите их в колбу Эрленмейера на 100 мл. 4. Добавьте 50 мл дистиллированной воды и растворите кристаллы фенола. Может потребоваться легкое тепло. (раствор 2) 5. Смешайте раствор 1 и раствор 2 и перенесите содержимое в мерный цилиндр 6 на 100 мл.Добавьте дистиллированную воду, чтобы довести конечный объем до 100 мл. 7. Вылейте раствор через фильтровальную бумагу (ватман № 1) и храните отфильтрованный раствор в бутылке янтарного цвета. 8. Наклейте на бутылку название реагента (1% Carbol Fuchsin), номер партии, дату приготовления, срок годности и температуру хранения. 9. Закройте крышки и храните при комнатной температуре. [Примечание: храните реагент до 6 месяцев с даты приготовления. Иногда фильтруйте фуксин Carbol, если образуется осадок.] 36 38 Приготовление реагента [Ziehl Neelsen Staining-2] Название реагента: Номер партии: Дата приготовления: Общее количество приготовленного: Срок годности: Приготовлено: 25% серной кислоты Ингредиенты Концентрация.H 2 SO 4 Номер поставщика / по каталогу Номер партии Добавленное количество Техник / Технолог 25 мл Дата Дистиллированная вода 75 мл Инструкции по приготовлению 25% серной кислоты: 1. С помощью мерного цилиндра на 100 мл отмерьте 75 мл дистиллированной воды в конической колбе на 500 мл. и погрузили колбу в таз с холодной водой. 2. С помощью мерного цилиндра на 50 мл отмерьте 25 мл конц. Серной кислоты и осторожно добавить в воду концентрированную серную кислоту. Эта смесь будет нагреваться, поэтому всегда ставьте колбу в таз с холодной водой, разбавляя кислоту.3. Осторожно перемешайте и храните в стеклянных бутылках янтарного цвета с крышками. 4. Наклейте на бутылку название реагента (25% серная кислота), номер партии, дату приготовления, срок годности и температуру хранения. 5. Закройте крышки и храните при комнатной температуре. Приготовленную кислоту можно хранить до 12 месяцев со дня приготовления. [Примечание: всегда добавляйте кислоту в воду. Никогда не добавляйте воду в кислоту.] 37 39 Подготовка реагента [Ziehl Neelsen Staining-3] Название реагента: Номер партии: Дата приготовления: Общее приготовленное количество: Срок годности: Подготовлено: 0.1% Метиленовый синий Ингредиенты Метиленовый синий Номер поставщика / каталожный номер Номер партии Добавленное количество Техник / Технолог 0,1 г Дата Дистиллированная вода 100 мл Инструкции по приготовлению 0,1% метиленового синего: 1. С помощью цифровых весов взвесьте 0,1 г метиленового синего в стерильной емкости. Колбу на 500 мл и растворите ее в 100 мл дистиллированной воды. 2. Для перемешивания используйте стержень для перемешивания или вихревой раствор. 3. Вылейте раствор через фильтровальную бумагу (ватман № 1) и храните отфильтрованный раствор в стеклянных флаконах янтарного цвета с крышками.4. Наклейте на бутылку название реагента (0,1% метиленовый синий), номер партии, дату приготовления, срок годности и температуру хранения. 5. Закройте крышки и храните при комнатной температуре. [Примечание. Храните реагент до 6 месяцев с даты приготовления.] Контроль качества Окрашивайте положительный контроль и отрицательное контрольное стекло с помощью новой партии окрашивающего реагента и наблюдайте за качеством реагента. Качество мазка хорошее = прошло успешно, Качество мазка плохое = не прошло. Выполняется: Дата окрашивания: Качество окрашивания [хорошее / плохое] Окончательные результаты (цвет мазка AFB Качество окрашивания счетчика хорошее или плохое) окрашивание Положительный контроль Отрицательный контроль прошел / не прошел и дата 38 Frontiers | Ультраструктурный анализ клеточной оболочки и накопления липидных включений в клинических изолятах Mycobacterium tuberculosis из мокроты, окислительного стресса и дефицита железа
Введение: Микобактерии обладают несколькими уникальными клеточными характеристиками, такими как множественные слои клеточной оболочки, удлинение на полюсах клеток, асимметричное деление клеток и накопление внутрицитоплазматических липидных включений, что способствует их выживанию в условиях стресса.Однако понимание этих характеристик в клинических изолятах Mycobacterium tuberculosis ( M. tuberculosis ) и при стрессе хозяина ограничено. Ранее мы сообщали о влиянии стресса хозяина на распределение длины клеток в большом наборе клинических изолятов M. tuberculosis ( n = 158). Здесь мы исследуем влияние стресса хозяина на ультраструктуру клеток нескольких клинических изолятов M. tuberculosis ( n = 8) из этого исследования.Целью данного исследования является более глубокое понимание влияния стресса хозяина на клеточную адаптацию клинических изолятов M. tuberculosis . Методы: Мы отобрали несколько изолятов M. tuberculosis ( n = 8) для анализа ультраструктуры клеток ex vivo в мокроте и в условиях стресса in vitro с помощью просвечивающей электронной микроскопии. Клеточные адаптации M. tuberculosis в мокроте коррелировали с ультраструктурой чувствительных и устойчивых к антибиотикам изолятов в жидкой культуре в условиях окислительного стресса, дефицита железа и воздействия изониазида. Результаты: В мокроте, M. tuberculosis, накопленных внутрицитоплазматических липидных включений. В жидкой культуре клинический M. tuberculosis выявил изолят, чтобы изолировать вариацию степени внутрицитоплазматических липидных включений, которые отсутствовали в лабораторном штамме h47Rv. Окислительный стресс, дефицит железа и воздействие изониазида увеличивают накопление липидных включений и уменьшают толщину электронно-прозрачного слоя оболочки клетки в М.tuberculosis клеток. Кроме того, в железодефицитных клетках наблюдались внутрицитоплазматические компартменты. Заключение: Наш ультраструктурный анализ выявил значительное влияние стресса хозяина на клеточные адаптации клинических изолятов M. tuberculosis . Эти адаптации могут способствовать выживанию M. tuberculosis в условиях стресса хозяина и антибиотика. Различия в клеточных адаптациях среди клинических изолятов M. tuberculosis могут коррелировать с их способностью сохраняться у больных туберкулезом во время лечения антибиотиками.Эти наблюдения указывают на необходимость дальнейшего анализа этих клеточных адаптаций в большом наборе клинических изолятов M. tuberculosis . Это поможет определить значение этих клеточных адаптаций в лечении туберкулеза. ВведениеMycobacterium tuberculosis ( M. tuberculosis ) вызывает туберкулез (ТБ) и является серьезной проблемой общественного здравоохранения (Всемирная организация здравоохранения [ВОЗ], 2015). Способность М.tuberculosis , чтобы выжить в условиях стресса хозяина и антибиотиков, отчасти объясняет, почему M. tuberculosis является успешным патогеном для человека. Следовательно, клеточный a PPT — Модуль AFB MICROSCOPY PowerPoint Presentation, скачать бесплатноModuleAFB MICROSCOPY Обзор содержимого • Сбор образцов мокроты • Качество образцов мокроты • Обработка образцов мокроты • Обработка образцов мокроты образцы • Мазок и окрашивание мокроты • Исследование мазка • Регистрация и отчетность Сбор образцов мокроты • Соберите 1-3 образца мокроты для диагностических целей в соответствии с политикой НПТ • Соблюдайте политику НПТ для объявления или исключения случая положительного мазка мокроты • Соблюдайте политику НПТ в отношении контрольных мазков Инструкции для пациентов • Дайте пациентам четкие инструкции о том, как собирать мокроту: • Важность исследования мокроты для диагностики туберкулеза • Потребность в настоящей мокроте, а не слюне • Как сделать производить качественную мокроту • Как открывать и закрывать емкость • Как избежать заражения вне контейнера Характеристики хорошего образца мокроты • 3-5 мл • Обычно густой и слизистый, но может быть жидким с частями гнойного материала • Цвет варьируется от непрозрачного белого до зеленого, от красноватого до коричневого в крови присутствует • Прозрачная слюна не подходит; но исследуйте слюну, если невозможно получить лучший образец, особенно для последующих обследований • Образец, содержащий в основном кровь, не должен исследоваться; Пациент должен обратиться к врачу для немедленного лечения. Обработка образцов мокроты • Обработайте образцы как можно скорее в интересах пациентов • Однако для микроскопии время между сбором и окрашиванием не имеет большого значения • Для хранения холодильника не требуется образцы • После приготовления фиксированного мазка дальнейшая обработка может подождать Сбор и транспортировка мокроты • Варианты, если в медицинском учреждении, в котором находится пациент, не проводится микроскопия мазка мазка • Направляют пациентов в ближайшее отделение микроскопии • Получите образцы взяты назначенным лицом или отправлены на общественном транспорте в центр микроскопии • Поручите взятию образцов, подготовке и фиксации мазков и доставке в центр микроскопии назначенному лицу Регистрация образцов мокроты • Зарегистрируйте все образцы для микроскопии КУБ в ТБ Лабораторный журнал • Одна линия для диагностических мазков каждый пациент • Одна строка для каждого последующего наблюдения • Один или несколько результатов могут быть зарегистрированы в одной строке • Пометьте емкости для мокроты сбоку, а не на крышке, серийным номером лаборатории и номером столбца или кодом для диагностических мазков • Этикетка слайды с серийным номером лаборатории и кодом столбца Размывание мокроты (1) • Выберите новые, чистые, обезжиренные, царапины, слайды без отпечатков пальцев • Используйте карандаш в случае матового слайда и алмазный карандаш в случае незамороженных слайдов для записи серийного номера • Убедитесь, что номер на слайде такой же, как и на контейнере для мокроты Размывание мокроты (2) • Выберите и соберите желтоватые (или беловатые) частицы с помощью палочки-аппликатора, e.грамм. бамбук или проволочная петля • Приготовьте слайд овальной формы в центре слайда, 2 (длина) на 1 (ширина) см или 3 на 2 см. • Раздавите толстые частицы с помощью палочки / проволочной петли, распределите так, чтобы долгое время для получения ровных мазков Размывание мокроты (3) • Поместите использованную палочку в контейнер для отходов; используйте новую палочку для каждого образца. • Обмакните проволочную петлю в бутыль со спиртом и песком; перемещайте петлю вверх и вниз, чтобы удалить лишнюю мокроту; нагрейте на огне до докрасна • Высушите мазок на воздухе при комнатной температуре • Если мазок полностью высох, проведите слайд 2-3 раза над пламенем, удерживая слайд вверх Мазок Окрашивание красителем ZIehl-Neelsen (1) • Хорошо окрашенный мазок ZN показывает сильный красный AFB на слабом синем фоне • На фоне не должно быть много красного цвета и красных артефактов • Предлагаемый метод заключается в использовании 1% карбол фуксина (сильный красный) и 0.1% метиленовый синий (слабый синий) как противокрасочное пятно • Обесцвечивание 3% -ной соляной кислотой в спирте или 20-25% -ной серной кислотой в воде • должно быть полным • может быть повторено, чтобы гарантировать полное отсутствие красного цвета на фоне ZN Окрашивание мазка Окрашивание мазка красителем Циль-Нильсена (2) ШАГИ: • Расположите слайды в последовательном порядке на окрашивающем мостике, размазанной стороной вверх, избегайте соприкосновения слайдов друг с другом • Покрывающие слайды полностью раствором карбол фуксина (через фильтровальную бумагу) • Слегка нагреть до пара • Оставить на 10-15 минут • Промыть водой и слить • Залить обесцвечивающим раствором, 3-5 мин, промыть водой, процедить.При необходимости повторите, промойте и слейте воду • Нанесите раствор метиленового синего на 1, максимум 2 минуты • Промойте водой и слейте воду • Высушите на воздухе на штативе для предметных стекол Окрашивание мазков аурамином (1) ШАГИ • Уложите слайды в последовательный заказ на окрашивающий мостик, слайд стороной вверх, избегайте соприкосновения слайдов друг с другом • Нанесите фильтрованный раствор аурамина, оставьте минимум на 15, макс. 30 минут • Смойте водой и слейте воду • Нанесите обесцвечивающий раствор, 1-3 минуты, промойте водой и слейте воду, повторите, если необходимо, промойте водой и слейте воду • Нанесите пятно на макс.1 минута • Промойте водой и слейте воду • Высушите на воздухе на держателе предметных стекол Окрашивание мазка аурамином (2) • AFB демонстрирует желтую или зеленую флуоресценцию на более или менее темном фоне, в зависимости от используемой лампы и фильтров. • Обесцвечивающий раствор должен содержать спирт; кислота обычно 0,5% HCl • Обычное контркрашивание — 0,5% перманганат калия • Храните окрашенные слайды в темноте, если исследование не может быть проведено сразу после окрашивания Мазок, окрашенный аурамином (1) Мазок, окрашенный аурамином (2) Исследование мазков ZN • Изучите 1 размер мазка (2 см) или 100 полей с помощью светлопольного микроскопа, увеличение 1000x • Объявите мазок отрицательным, если AFB не обнаружены • Если < Обнаружено 10 AFB, подсчитайте количество AFB • Если обнаружено> = 10 AFB, оцените мазок 1+, 2+ или 3+ • Для высоких положительных результатов может быть достаточно исследования 20-30 полей Исследование Мазки, окрашенные аурамином • Изучите 1 мазок длины (2 см) с помощью FM • лучше всего использовать объектив с 20-кратным увеличением: длина 1 составляет 30 полей с этим объективом, но в 3 раза больше площади, видимой через объектив 100-кратного увеличения • если используется объектив с 40-кратным увеличением , одна длина 40-50 ф полей или в 2 раза больше площади, видимой через объектив 100X • При необходимости подтвердите AFB, типичную форму изогнутого стержня, переключив объектив на более высокое увеличение (40X при растрировании с помощью 20X) Оценка мазков, окрашенных аурамином • Изучите длина, если не видно или мало AFB • объявляется отрицательным, если не видны вообще • если меньше 30 AFB обнаружено при использовании объектива 20x или меньше 20 AFB при использовании объектива 40x, результат скудный.Сообщите точное количество AFB на длину • если AFB на длину составляет от 30 до 299 при использовании объектива 20X или от 20 до 199 при использовании объектива 40X, оцените мазок как 1+ • Изучите около 10 полей, если видно много AFB • если есть в среднем более 100 AFB на поле с объективом 20X или более 50 с помощью 40X, оцените мазок как 3+ • если на поле видно от 10 до 100 AFB с объективом 20X или от 5 до 50 с объективом 40X, оцените как 2+ Регистрация и отчетность • Запишите результаты мазка в лабораторный регистр туберкулеза • Запишите результаты мазка в бланк запроса на исследование мокроты • Отправьте заполненный бланк запроса на исследование мокроты лицу, запрашивающему исследование мокроты Оценка мазков ZN Оценка мазков в FM с использованием объектива 20X Оценка мазков в FM с использованием объектива 40X Лабораторный регистр прибор для микроскопии мазка мокроты Форма запроса и отчета для исследования мазка мокроты Ключевые сообщения • Образцы хорошего качества, их мазки, окрашивание и считывание — все это необходимо для правильного диагноза туберкулеза и методы флуорохромов подходят, но флуоресценция лучше при большой рабочей нагрузке и / или небольшом количестве AFB • Шкалы оценки для количественного определения AFB в мазках различаются в зависимости от системы увеличения и, следовательно, используемой цели • Специальная форма запроса и лабораторный журнал всегда должны использоваться для записи и представления результатов исследования мазка DSSM apibrėžimas: Tiesiogiai skreplių tepinėlio mikroskopijaKą reiškia DSSM? DSSM reiškia Tiesiogiai skreplių tepinėlio mikroskopija.Jei lankotės mūsų ne angliškoje versijoje ir norite matyti Tiesiogiai skrepli tepinėlio mikroskopija anglišką versiją, slinkite žemyn į apačią ir pamatysite Tiesiogiai skrepli rešemskopija angles. Atminkite, kad DSSM santrumpa yra plačiai naudojamas pramonės šakų, pavyzdžiui, bankininkystės, skaičiavimo, švietimo, finansų, vyriausybini ir sveikatos. Будьте DSSM, Tiesiogiai skreplių tepinėlio mikroskopija gali būti trumpinys kitų akronimų. DSSM = Tiesiogiai skreplių tepinėlio mikroskopijaIeškote bendro DSSM apibrėžimo? DSSM reiškia Tiesiogiai skreplių tepinėlio mikroskopija.Mes didžiuojamės, kad sąrašas akronimas DSSM didžiausių duomenų bazėje santrumpos ir akronimų. Šis paveikslėlis rodo vieną iš DSSM apibrėžimų anglų kalba: Tiesiogiai skreplių tepinėlio mikroskopija. Jūs galite atsisiųsti vaizdo failą spausdinti arba siųsti jį savo draugams elektroniniu paštu, Facebook, Twitter, arba TikTok. Reikšmė DSSM anglų kalbaKaip minėta pirmiau, DSSM naudojama kaip teksto žinutės akronimas atstovauti Tiesiogiai skreplių tepinėlio mikroskopija.Šis puslapis yra apie DSSM akronimas ir jo reikšmės kaip Tiesiogiai skreplių tepinėlio mikroskopija. Atkreipkite dėmesį, kad Tiesiogiai skreplių tepinėlio mikroskopija nėra vienintelė prasmė DSSM. Ten gali būti daugiau nei vienas apibrėžimas DSSM, todėl patikrinkite, ar tai mūsų žodyne visoms DSSM reikšmių po vieną. Apibrėžimas anglų kalba: Прямая микроскопия мазка мокротыKitos DSSM reikšmėsБудьте Tiesiogiai skreplių tepinėlio mikroskopija, DSSM turi kitų reikšmių.Jie yra išvardyti kairėje apačioje. Prašome slinkite žemyn ir spustelėkite, kad pamatytumėte kiekvieną iš j. Visoms DSSM reikšmėmis spustelėkite «daugiau». Jei lankotės mūsų angliškoje versijoje ir norite matyti Tiesiogiai skreplių tepinėlio mikroskopija apibrėžimus kitomis kalbomis, spustelėkite kalbos meniu dešinėje apačioje. Jūs pamatysite Tiesiogiai skreplių tepinėlio mikroskopija reikšmes daugeliu kitų kalbų, pavyzdžiui, arabų, danų, olandų, hindi, Japonija, korėjiečių, graikų, iriealči, vietnamt. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 )
) Она встречается в начальных стадиях воспаления или при стихании его активности.
Она встречается в начальных стадиях воспаления или при стихании его активности.

 При наличии патологических процессов секрет отдает гнилью.
При наличии патологических процессов секрет отдает гнилью.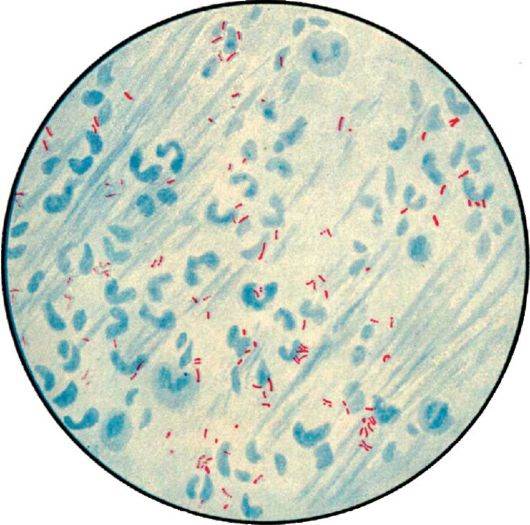 Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения.
Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения. Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
 При наличии патологических процессов секрет отдает гнилью.
При наличии патологических процессов секрет отдает гнилью.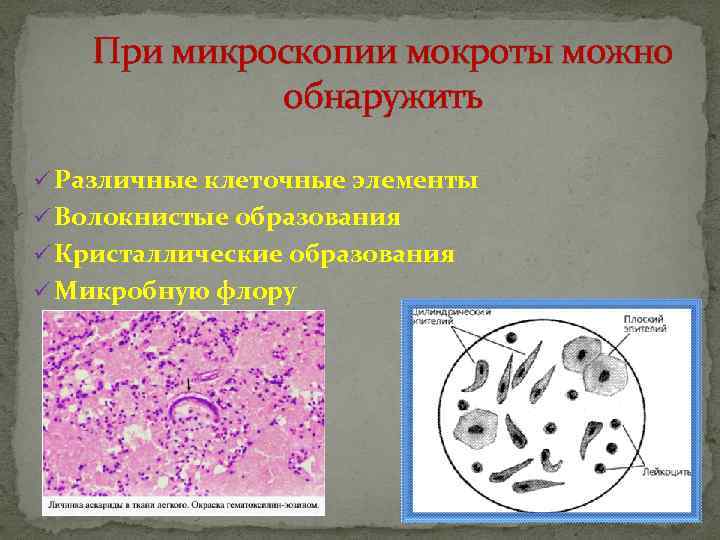 Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения.
Они возникают при инфаркте легкого, пневмонии, разрушении функциональной ткани, застойных явлениях, локализующихся в малом круге кровообращения. Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.
Они образуются после распада эозинофилов. Данные компоненты мокроты отличаются от белых кровяных телец зернистостью и блестящей поверхностью. Их довольно легко расшифровать.