Миокардит
В кардиологии медицинского центра IMMA работают лучшие специалисты отрасли. Индивидуальный подход к каждому пациенту обеспечивает достоверный сбор клинической картины опасного заболевания сердца – миокардита. В своей работе кардиологи руководствуются научно-обоснованной лечебной практикой, принципами доказательной медицины и рекомендациями ВОЗ РФ. Что в совокупности дает высокую эффективность и положительный прогноз терапии. Использование современного оборудования для диагностических мероприятий позволяет с высокой точностью определить наличие или отсутствие миокардита.
В наших клиниках вы можете:
- Получить консультацию врача — кардиолога;
- Снять ЭКГ и получить профессиональную расшифровку результатов;
- Пройти процедуру СМАД;
- Пройти холтеровское мониторирование;
- Воспользоваться другими услугами наших клиник.
Для уточнения подробностей и по любым вопросам обращайтесь по номеру, указанному на сайте
Миокардит — основное определение
Воспаление сердечной мышцы, не связанное с нарушением циркуляции крови в коронарных артериях, называется миокардитом.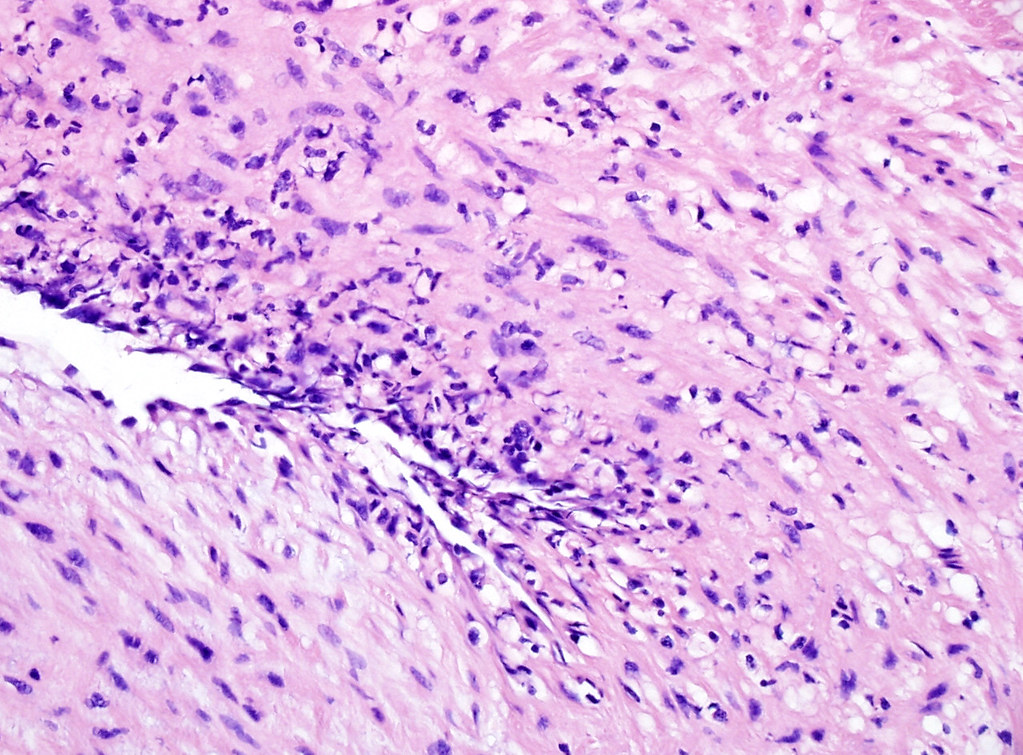 Болезнь поражает средний слой мышечной ткани – миокард. Возбудителями служат специфические инфекции и вирусные патологии. В некоторых случаях спровоцировать воспаление могут аллергические, аутоиммунные заболевания и острая интоксикация. По данным Всемирной организации здравоохранения миокардит диагностируется в 10% случаев от числа всех сердечных болезней.
Болезнь поражает средний слой мышечной ткани – миокард. Возбудителями служат специфические инфекции и вирусные патологии. В некоторых случаях спровоцировать воспаление могут аллергические, аутоиммунные заболевания и острая интоксикация. По данным Всемирной организации здравоохранения миокардит диагностируется в 10% случаев от числа всех сердечных болезней.
Главная опасность патологии заключается в отсутствии возрастного порога. Миокардит может развиваться как у детей, так и у пожилых людей. Несмотря на то, что прогноз для большинства случаев положительный, заболевание крайне непредсказуемо. Без своевременной диагностики и лечения, может наступить внезапное нарушение ритма сердца – аритмия, которая становится причиной крайне тяжелых последствий, вплоть до летального исхода.
Виды миокардита в зависимости от причин
В основу классификации заболевания по МКБ положен причинно-следственный фактор, который вызывает миокардит. В зависимости от провокаторов, заболевание принимает следующие формы:
- Инфекционный миокардит
Инфекционные заболевания различного происхождения, в тяжелом проявлении, дают осложнения на миокард – развивается воспаление.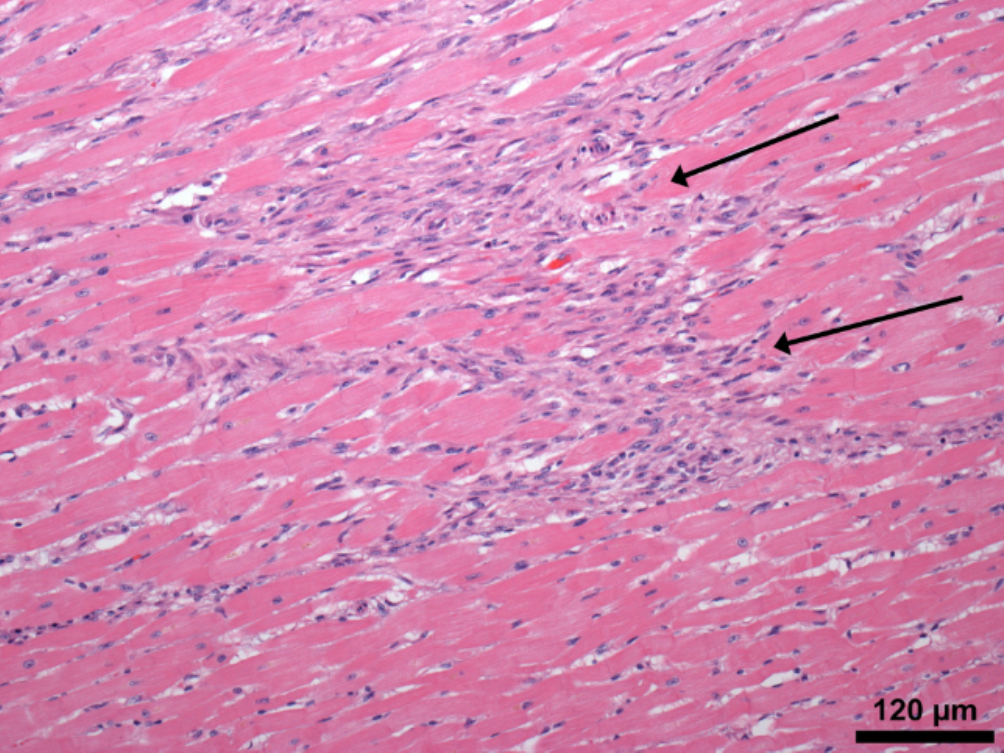 Причиной могут выступать всевозможные вирусы герпеса, гриппа, гепатита. Бактериальные заболевания. Грибковые патологии Candida и Aspergillus. Паразитирующие организмы. Дифтерийная палочка, хламидии, стрептококк.
Причиной могут выступать всевозможные вирусы герпеса, гриппа, гепатита. Бактериальные заболевания. Грибковые патологии Candida и Aspergillus. Паразитирующие организмы. Дифтерийная палочка, хламидии, стрептококк.
- Ревматический миокардит
Является производной инфекционного миокардита. Развивается на фоне угнетенной иммунной системы. Главная причина – гемолитический стрептококк, вызывающий патологии на слизистых оболочках.
- Аллергический миокардит
Заболевание формируется на фоне аллергической реакции. При этом факторы могут быть самыми разными. Ожоги, провоцирующие выброс большого количества отравляющих веществ в кровь. Пересадка органов, трансплантация, ведущие к отторжению имплантатов и поражению миокарда. Аллергия на лекарственные препараты, в результате которой препараты вызывают воспаление сердечной мышцы.
- Токсический миокардит
Алкогольное отравление, почечная недостаточность, в результате которой повышается уровень мочевой кислоты, тяжелые пары металлов могут вызвать воспалительные процессы в миокарде.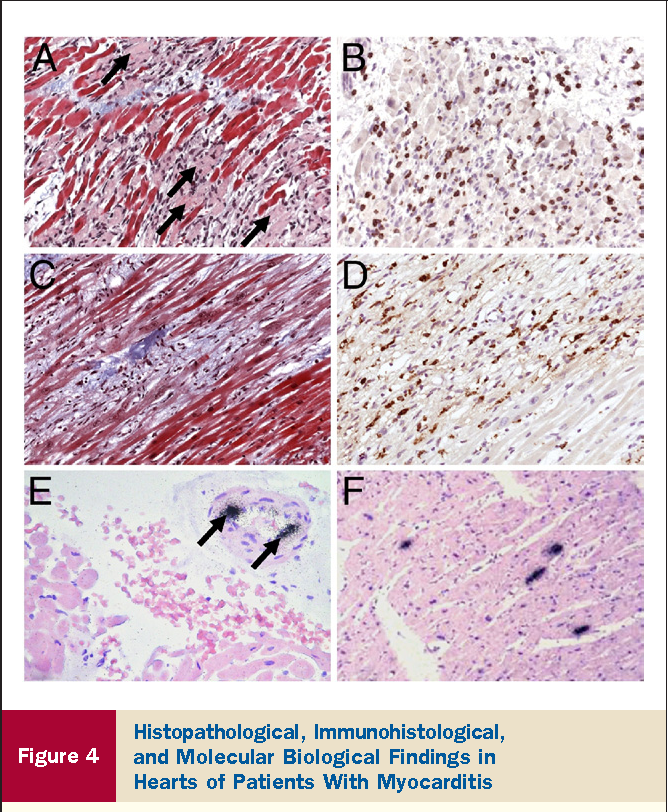
- Симптоматический миокардит
Последствием хронических заболеваний может стать миокардит. Как правило, это аутоиммунные болезни – красная волчанка, ревматоидный артрит, склеродермия, оказывающие крайне негативное влияние на все внутренние органы, включая сердце.
- Идиопатический миокардит
Заболевание с невыясненной этиологией. Характеризуется частичным поражением миокарда и тяжелой формой течения. Чаще всего становится причиной наступления смерти. Это связано с невозможностью в настоящее время установить причины развития.
Исходя из классификации заболевания, большинство существующих инфекций может стать причиной воспалительного процесса в сердечной мышце. Поэтому даже банальная, на первый взгляд, простуда может дать толчок воспалительному процессу в миокарде. Профилактический осмотр после перенесенных вирусных заболеваний — лучшее средство для предупреждения миокардита.
Важно! Своевременно обнаруженная и до конца пролеченная инфекция сводит к минимальному риску получение осложнения на сердечную мышцу.
Симптоматика
Признаки миокардита обширны и полностью зависят от формы, течения и степени развития патологии. Развитие заболевания разделяется на несколько групп:
- По форме течения: острый, хронический и стремительный.
- По локализации: очаговый и диффузный.
- По степени тяжести: легкий, средний и тяжелый.
При любом виде миокардита пациенты имеют несколько схожих симптомов: хроническая усталость, общая слабость, болевой синдром в груди и под левой лопаткой, повышенное потоотделение, одышка.
Расширенная группа признаков указывает на наличие определенного вида миокардита:
• Незначительная симптоматика свойственна инфекционно-аллергическому миокардиту. Больной испытывает незначительную слабость, воспринимаемую, скорее, как последствия усталости, чем как симптом опасного заболевания. Принимая витамины и аспирин человек даже не задумывается о том, что в организме идут опасные воспалительные процессы.
• Идиопатический или ревматический миокардит проявляется острой, жгучей болью в области сердца и левой руки. Клиническая картина сходна с ИБС — вялость, ограничение двигательной функции, постоянная нехватка воздуха, в некоторых случаях — ночная лихорадка.
• Диффузная локализация воспалительного процесса, поражающего весь миокард характеризуется острой сердечной недостаточностью и характерными ей симптомами. Появляются отеки, синяки под глазами, конечности немеют и приобретают синеватый оттенок.
• Бактериальный миокардит характеризуется нарушение работы кровеносной системы. Велика вероятность образования тромбов в главных сердечных артериях. Проявляется изменением цвета кожных покровов, одышкой, даже в период покоя и постоянной ноющей болью за грудиной.
Тяжесть патологии полностью отражается на внешнем виде больного. На начальных стадиях воспалительного процесса видимых изменений не наблюдается. Больной может пожаловаться лечащему врачу на общую слабость. По мере усугубления болезни у пациента наблюдается синюшность губ, конечности приобретают бледный цвет, возникает отечность под глазами. В тяжелой форме отчетливо просматриваются раздутые вены на шее и руках, мучительный сухой кашель, одышка, мешающие осуществлять привычные действия.
По мере усугубления болезни у пациента наблюдается синюшность губ, конечности приобретают бледный цвет, возникает отечность под глазами. В тяжелой форме отчетливо просматриваются раздутые вены на шее и руках, мучительный сухой кашель, одышка, мешающие осуществлять привычные действия.
Важно! При появлении любых перечисленных признаков следует немедленно обратиться за медицинской помощью. Особенно важно это сделать после перенесенных инфекционных заболеваний.
Лечение
Основное внимание в консервативном лечении миокардита уделяется этиотропной терапии – ликвидации причин и осложнений. На первых этапах происходит госпитализация, назначение строгой диеты, исключение вредных привычек и снятие воспаления.
Стандартная схема терапевтических мероприятий выглядит следующим образом:
- Строгий постельный режим в стационаре, не менее четырех недель;
- Ограничение физической активности;
- Поддерживающая комплексная терапия;
- Прием противовоспалительных препаратов широкой группы – НПВС;
- Лечение антибиотиками, при специфических вирусных патологиях;
- Назначение гормональных препаратов — глюкокортикостероидов (ГКС).
 Применяется в тяжелых случаях, для подавления гормона кортизона, ответственного за развитие воспалительных процессов;
Применяется в тяжелых случаях, для подавления гормона кортизона, ответственного за развитие воспалительных процессов; - Иммуномодуляция. Поддержание и восстановление защитной функции организма;
- Корректировка обменных процессов. Для обогащения кислородом и питательными элементами сердечной мышцы;
- Профилактический витаминный курс.
Соблюдение основных стандартов лечения является залогом успешного лечения. Поэтому самолечение сердечных болей – категорически противопоказано. Это может привести к непоправимым осложнениям, самым легким из которых станет инфаркт миокарда. От пациента требуется только внимательное отношение к собственному здоровью – прислушиваться к первым тревожным звоночкам организма и своевременно проходить осмотр. Только кардиолог может поставить правильный диагноз и назначить лечение, после полного сбора анамнеза.
Осложнения
Последствиями запущенного миокардита являются негативные процессы в сердечной мышце.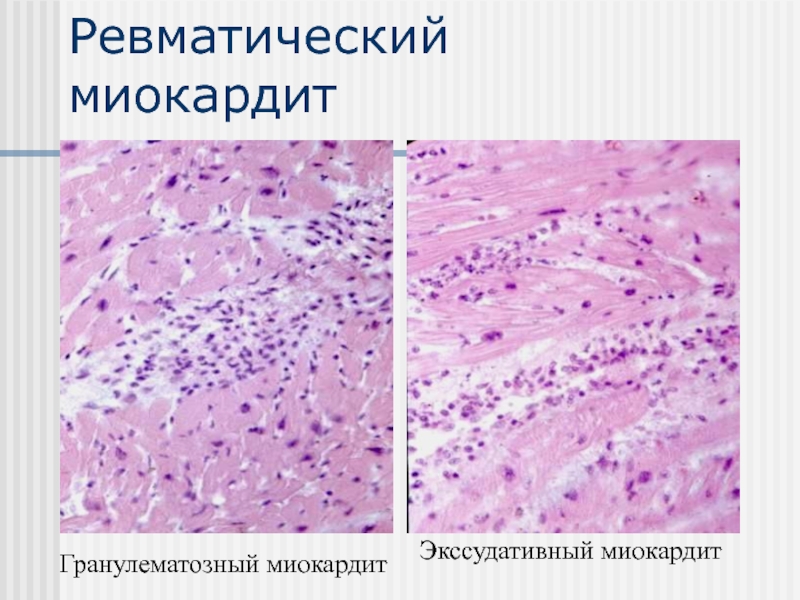 В зависимости от течения и формы заболевания в миокарде могут появиться необратимые изменения, которые приводят к нарушению нормального функционала сердечной мышцы – перекачивание крови. В крайних случаях, поражения настолько серьезные, что приводят к остановке сердца и наступлению внезапной смерти.
В зависимости от течения и формы заболевания в миокарде могут появиться необратимые изменения, которые приводят к нарушению нормального функционала сердечной мышцы – перекачивание крови. В крайних случаях, поражения настолько серьезные, что приводят к остановке сердца и наступлению внезапной смерти.
Длительное течение миокардита приводит к аномальному увеличению сердечной мышцы. Процесс необратим, поэтому в таких случаях больному показана многолетняя терапия и полный пересмотр образа жизни.
Самыми тяжелыми последствиями считается гигантоклеточный миокардит. Большинство больных с таким диагнозом нуждаются в трансплантации сердца. В противном случае, кардиологи дают неблагоприятный для жизни прогноз. По данным ВОЗ примерно 90% больных умирают в течение 4-5 лет, если не проведена операция по пересадке сердца.
Воспалительный процесс в миокарде способствует рубцеванию мышечной ткани, что в свою очередь полностью нарушает сердечный ритм и кровоснабжение. Это приводит к развитию сердечной недостаточности и, как правило, заканчивается ИБС.
Но в большинстве случаев, нормальный функционал сердца восстанавливается, хотя и требует длительного профилактического лечения и пожизненного наблюдения у кардиолога.
Кто входит в группу риска
Наиболее распространенная причина возникновения миокардита – вирусные патологии различного происхождения. Поэтому в группу риска входит каждый человек, кто перенес герпес, гепатит В, С, краснуху, ветряную оспу, корь, дифтерию и, даже, грипп. Так как большинству людей диагностировалось какое-либо вирусное заболевание, профилактический осмотр обязан пройти каждый, с целью исключить наличие воспалительных процессов в сердце. Это впоследствии может сохранить жизнь.
Риск развития миокардита возрастает пропорционально наличию инфекционных патологий. Прислушаться к своему сердцу, рекомендовано всем, кто перенес или является носителем заболеваний, вызванных следующими возбудителями:
- Бактерии, провоцирующие развитие туберкулёза, хламидиоза, стафилококка.
- Грибковые рода аспергиллус фумигатус и кандида.
 Вызывают такие распространенные заболевания, как тонзиллит, ларингит, отит, конъюнктивит, кандидоз и т.д.
Вызывают такие распространенные заболевания, как тонзиллит, ларингит, отит, конъюнктивит, кандидоз и т.д. - Паразитирующие черви – аскариды, эхинококки, трихинеллы, лямблии, токсокарозы.
- Сахарный диабет в любой степени.
- Заболевания щитовидной железы.
- Аутоиммунные патологии – ревматоидный артрит, красная волчанка, васкулит.
В группу риска входят люди, чья профессиональная деятельность связана с работой на предприятиях с вредными условиями труда, где существует вероятность отравления тяжелыми металлами. Приём некоторых лекарственных препаратов может спровоцировать воспаление миокарда. Например, противоаллергические цефалоспорины или антидепрессанты крайне негативно отражаются на сердечной деятельности. Социальные факторы играют немаловажную роль для миокарда. Злоупотребление алкогольными напитками, курение и другие, опасные и вредные, пристрастия способствуют развитию миокардита.
Консультация и осмотр у кардиолога
Медицинские клиники IMMA располагают современным оборудованием и собственными лабораториями для точного определения миокардита на начальных стадиях. Полный спектр исследований включает первичный осмотр квалифицированным кардиологом, уточняющие анализы, диагностические мероприятия с использованием современных технологий. Диагностика и лечение миокардита у детей и взрослых проходит в оборудованных клиниках, обученным опытным персоналом, под руководством ведущих кардиологов.
Полный спектр исследований включает первичный осмотр квалифицированным кардиологом, уточняющие анализы, диагностические мероприятия с использованием современных технологий. Диагностика и лечение миокардита у детей и взрослых проходит в оборудованных клиниках, обученным опытным персоналом, под руководством ведущих кардиологов.
Для записи на прием воспользуйтесь контактами, указанными на сайте. Профессиональный персонал клиники окажет всевозможную информационную поддержку.
Миокардит
«Подожди – и плохое само по себе исчезнет» Закон Хелрагна
ЭТИОЛОГИЯ МИОКАРДИТА
Инфекционный миокардит
• Вирусы: парвовирус B19, человеческого герпеса-6, Коксаки A и B, аденовирусы, эховирусы, гриппа A и B, гепатита C, ВИЧ-1, цитомегаловирус, Эпштейн-Барра, SARS-CoV-2.
• Бактерии: Staphylococcus, Streptococcus, Pneumococcus, Meningococcus, Gonococcus, Salmonella, Corynebacterium diphtheriae, Haemophilus influenzae, Mycobacterium (tuberculosis), Mycoplasma pneumoniae, Brucella.
• Спирохеты: Borrelia (болезнь Лайма), Leptospira.
• Грибы: Aspergillus, Actinomyces, Blastomyces, Candida, Coccidioides, Cryptococcus, Histoplasma, Mucormycoses, Nocardia, Sporothrix.
• Простейшие: Trypanosome cruzii (болезнь Чагаса), Toxoplasma gondii, Entamoeba, Leishmania.
• Рикетсии: Coxiella burnetii, R. rickettsii, R. tsutsugamuschi.
• Гельминты: Trichinella spiralis, Echinococcus granulosus, Taenia solium.
Иммунно-опосредованный миокардит
• Аллергены: вакцины, лекарства (амитриптилин, изониозид, колхицин, метилдопа, пенициллины, сульфонамиды, тетрациклин, тиазиды, фуросемид).
• Аутоантигены: лимофцитарный, гигантоклеточный, ассоциированный с иммунными заболеваниями (ревматоидный артрит, воспалительные болезни кишечника, системная красная волчанка, слеродермия, полимиозит, диабет 1 типа, тиреотоксикоз, ревматическая лихорадка).
• Аллоантигены: реакция отторжения трансплантанта.
Токсический миокардит
• Лекарства: антрациклины, циклофосфамид, литий, интерлейкин-2, клозапин.
• Тяжелые металлы: медь, железо, свинец.
• Физические агенты: радиация, электрический шок.
• Разные агенты: укусы животных (змей, скорпиона, насекомых), фосфор, мышьяк, феохромоцитома.
Вирусы в миокарде при изолированной диастолической дисфункции левого желудочка
Tschope C, et al. Circulation. 2005;111:879–86.
МОРФОЛОГИЧЕСКАЯ ДИАГНОСТИКА МИОКАРДИТА
• Клеточный тип: лимфоцитарный, эозинофильный, нейтрофильный, гигантоклеточный, грануломатозный, смешанный.
• Активность: легкий, умеренный, выраженный.
• Локализация: фокусный, сливной, диффузный, репаративный.
Эпидемиология миокардита
Shah Z, et al. Am J Card. 2019;1:131–6.
КЛИНИКА МИОКАРДИТА
• Острые боли в грудной клетке: перикардит, псевдоишемические.
• Сердечная недостаточность: одышка в покое/нагрузке, утомляемость, симптомы лево- и правожелудочковой недостаточности.
• Сердцебиение, перебои, предобморок, обморок.
• Кардиогенный шок.
• Внезапная сердечная смерть.
ЭКГ при гигантоклеточном миокардите
Voors A, 2013.
ДИАГНОСТИКА
• Коронарная ангиография: исключение обструктивной коронарной болезни.
• Сердечные биомаркеры: тропонины T/I, мозговой натриуретический пептид.
• Сердечные аутоантитела: повышаются при ДКМП, ОКС, у здоровых.
• Эхокардиография: дилатационная кардиомиопатия с быстрой динамикой, локальные нарушения сократимости, перикардит, внутрисердечные тромбы.
• ЭКГ, холтеровское мониторирование: АВ блокада 1–3 степени, блокады ножек пучка Гиса, нарушение внутрижелудочкового проведения, аномальный Q, изменения ST-T, экстрасистолия, тахиаритмии.
• Магнитро-резонансная томография: локальное или глобальное усиление интенсивности сигнала на Т2-взвешенных изображениях (отек), повышение отношения раннего гадолиниевого усиления миокарда и скелетных мышц (≥4) в гадолиний усиленных Т1-взвешенных изображениях (отек, гиперемия), локальное повреждение с неишемическим типом распределения в инвертированных гадолиний усиленных Т1-взвешенных изображениях (позднее гадолиниевое усиление).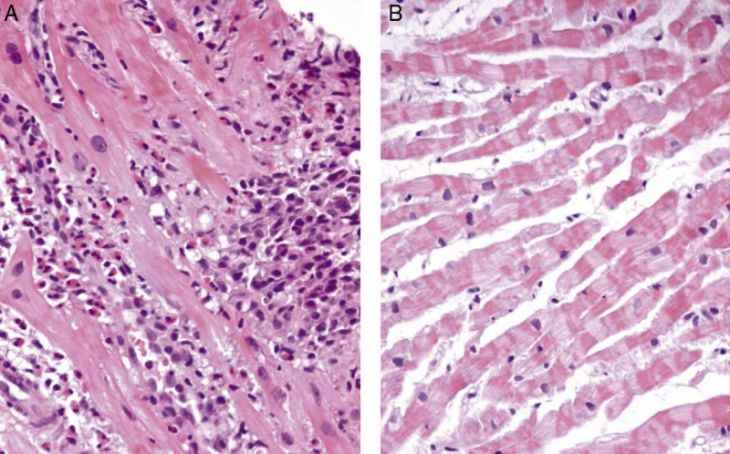
• Эндомиокардиальная биопсия (иммуногистохимия): воспалительный инфильтрат, некроз миокарда, вирусы, исключение дилатационной кардиомиопатии и болезней накопления.
Магнитно-резонансная томография
Слева направо: норма, острый миокардит, хронический миокардит, ДКМП. Lurz P, et al, 2016.
Характеристика отека миокарда при магнитно-резонансной томографии
• Инфаркт миокарда: трансмуральный отек соответствующий коронарным артериям.
• Острый миокардит: отек субэпипикардиально, боковая стенка, некоронарное распределение.
• Эозинофильный миокардит: отек неоднородный или диффузный.
• Саркоидоз: отек субэпипикардиально, мезокардиально или субэндокардиально, эффект кортикостероидов.
• Гипертрофическая кардиомиопатия: отек неоднородный, может быть связан с ишемией миокарда.
• Кардиомиопатия Такоцубо: нет рубцов, циркулярный отек верхушки и средней части миокарда, нет отложенного усиления.
Морфология
Лимфоцитарный воспалительный инфильтрат при вирусном миокардите.
ПРИЗНАКИ ВИРУСНОЙ ИНФЕКЦИИ
• Клиника миокардита в течение 1–4 нед после респираторной или гастроинтестинальной инфекции.
• Признаки инфекции вирусом Коксаки А (бессимптомная, мелкопузырчатая сыпь горла, конечностей, геморрагический конъюнктивит), Коксаки В (боли в горле, гастроинтестинальные симптомы, плевродиния — схваткообразная боль межреберных мышц), парвовирус В19 (сыпь на шеках и конечностях, симметричный полиартрит кистей рук).
• Серологические тесты: гепатит С, ВИЧ. Высокая частота антител к кардиотропным вирусам в популяции при отсутствии миокардита ограничивает тестирование (ESC).
• Воспалительный синдром: лихорадка, повышение СОЭ, С-реактивный белок.
• Эндомиокардиальная биопсия: полимеразная цепная реакция.
Вирусная инфекция у внезапно умерших
Andreoletti L, et al.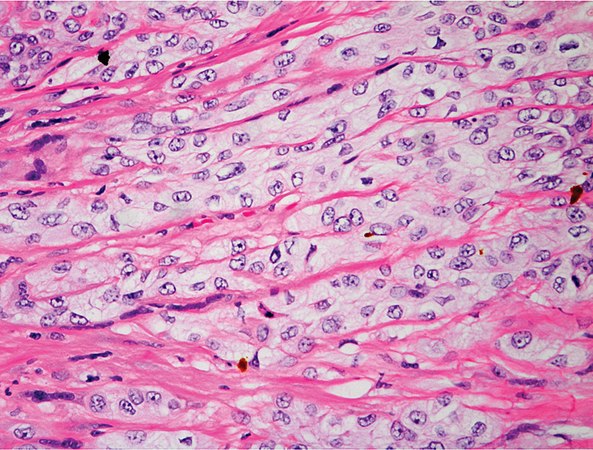 J Am Coll Cardiol. 2007;50:2207–14.
J Am Coll Cardiol. 2007;50:2207–14.
КЛАССИФИКАЦИЯ МИОКАРДИТОВ
• Этиология: вирусы, бактерии, лекарства…
• Морфология: лимфоцитарный, эозинофильный, гигантоклеточный, гранулематозный (саркоидоз).
• Течение: фульминантный, острый (до 1 мес), хронический.
• Клиника: аритмии, дилатационная кардиомиопатия, сердечная недостаточность, кардиогенный шок.
ФОРМУЛИРОВКА ДИАГНОЗА
□ Острый миокардит, фибрилляция предсердий, сердечная недостаточность. [I40.9]
□ Острый вирусный миокардит, АВ блокада 2 степени, тип II, СН. [I40.0]
□ Хронический миокардит, сердечная недостаточность со сниженной ФВЛЖ, III ФК. [I40.1]
□ Коронавирусная инфекция CОVID-19, двусторонняя пневмония, миокардит, фибрилляция предсердий. [U07.2]
Прогноз остро возникшей кардиомиопатии
Ammirati E, et al. Circulation. 2018;138:1088–99.
ЛЕЧЕНИЕ
• Ограничить физические нагрузки в период острой фазы, на ≥6 мес у спортсменов.
• Исключить повреждающие факторы: алкоголь, другие лекарства.
• Лечение сердечной недостаточности: ИАПФ/БРА, бета-блокаторы, диуретики, дигоксин, трансплантация сердца.
• Аритмии: контроль ЧСС, временная кардиостимуляция.
• Боли в груди (перикардит, миоперикардит): аспирин 1500–3000 мг/сут, ибупрофен 1200–2400 мг/сут.
• Кортикостероиды: эозинофильный, гигантоклеточный, саркоидоз, ассоциированный с системными заболеваниями соединительной ткани, вирус-негативный миокардиты.
• Препараты с недоказанным эффектом при вирусном миокардите: противовируные, иммуноглобулин, кортикостероиды, цитостатики.
Неревматические миокардиты (часть 1) | «Гострі та невідкладні стани у практиці лікаря»
В последние годы в широкой клинической практике стали использоваться методы сцинтиграфической визуализации воспалительного поражения сердечной мышцы с помощью радиофармпрепаратов (РФП), тропных к воспалительному процессу [16]. Этот метод позволяет определить наличие лейкоцитарной инфильтрации в мышце сердца и выраженность перфузионных нарушений.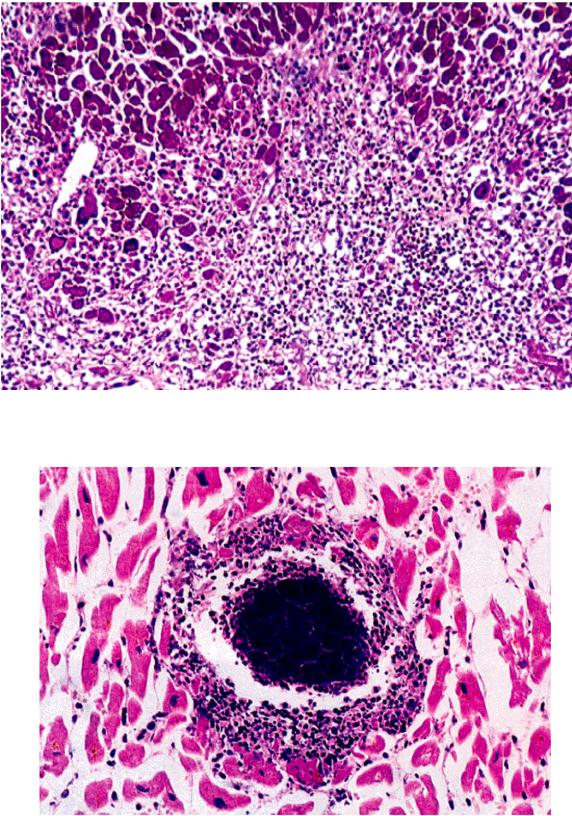 Для верификации воспаления используют РФП, которые избирательно накапливаются в зоне воспаления: цитрат галлия-67 (
Для верификации воспаления используют РФП, которые избирательно накапливаются в зоне воспаления: цитрат галлия-67 (
Ga), аутолейкоциты, меченные технецием-99 или индием-111-оксимом [12].
С точки зрения ядерно-физических, радиационно-гигиенических требований и удобства применения наибольшее распространение в клинической практике получила методика мечения лейкоцитов с помощью 99технеция-гексаметилпропиленаминоксима (99Тс-ГМПАО). Планарная сцинтиграфия тела с использованием 99Тс-ГМПАО позволяет визуально определить места скопления меченых лейкоцитов, что расценивается как очаги воспаления и нагноения. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) грудной клетки с 99Тс-ГМПАО-аутолейкоцитами позволяет получать качественные многопроекционные изображения миокарда с толщиной каждого томографического скана до 0,8 см, и в результате по серии срезов можно визуально оценить выраженность и протяженность лейкоцитарной инфильтрации в миокарде. Повторная ОФЭКТ с кардиотропным РФП – 99Tc-тетрафосмином позволяет изучить перфузию миокарда и сделать вывод о наличии и выраженности кардиосклероза. Таким образом, проведение радиоизотопной диагностики в комплексе из двух исследований (определение воспалительной инфильтрации и перфузии миокарда) позволяет визуализировать скрытые экстракардиальные очаги воспаления и нагноения, оценить выраженность воспалительного поражения миокарда и наличие миокардитического кардиосклероза [16].
Повторная ОФЭКТ с кардиотропным РФП – 99Tc-тетрафосмином позволяет изучить перфузию миокарда и сделать вывод о наличии и выраженности кардиосклероза. Таким образом, проведение радиоизотопной диагностики в комплексе из двух исследований (определение воспалительной инфильтрации и перфузии миокарда) позволяет визуализировать скрытые экстракардиальные очаги воспаления и нагноения, оценить выраженность воспалительного поражения миокарда и наличие миокардитического кардиосклероза [16].
При повреждении или гибели кардиомиоцитов на их поверхности экспонируется миозин, с которым связываются антимиозиновые антитела (к тяжелым цепям миозина), меченные изотопом индия-111 (111In). В отличие от галлия-67, который позволяет оценить распространенность воспалительной инфильтрации, меченные 111In антитела к миозину отражают выраженность и локализацию некрозов миокарда. После введения таких антител проводится сцинтиграфия. Для миокардита характерно умеренное диффузное распределение радиофармпрепарата по миокарду, для инфаркта миокарда — интенсивное локальное накопление. Согласно результатам биопсии миокарда чувствительность сцинтиграфии с антимиозиновыми антителами (111In) в диагностике миокардита составляет 83%, специфичность — 53%, предсказательная ценность отрицательного результата — 92%. Margari и соавторы показали, что положительные результаты сцинтиграфии с антимиозиновыми антителами в сочетании с отсутствием дилатации левого желудочка (конечно-
Согласно результатам биопсии миокарда чувствительность сцинтиграфии с антимиозиновыми антителами (111In) в диагностике миокардита составляет 83%, специфичность — 53%, предсказательная ценность отрицательного результата — 92%. Margari и соавторы показали, что положительные результаты сцинтиграфии с антимиозиновыми антителами в сочетании с отсутствием дилатации левого желудочка (конечно-
диастолический размер Эндомиокардиальная биопсия
В соответствии с рекомендациями ВОЗ/ВФК диагноз миокардита устанавливается на основании гистологических, иммунологических и иммуногистохимических данных. Таким образом, морфологическое исследование биоптатов миокарда является золотым стандартом диагностики миокардитов [1, 4, 7].
Впервые успешная прижизненная биопсия миокарда через сосудистый доступ описана Sakakibara и Konno в 1962 году. Для диагностики миокардитов результаты морфологического исследования миокарда стали использоваться с 1980 года (Mason и соавт.) [22]. В 1986 году группой ведущих американских морфологов были разработаны так называемые Даллаские критерии миокардита — первая попытка стандартизации морфологического диагноза. Строгим диагностическим критерием активного миокардита признавалось наличие воспалительной клеточной инфильтрации миокарда с некрозом и/или дегенерацией кардиомиоцитов (рис. 4). Пограничный миокардит определялся как воспалительная инфильтрация при отсутствии признаков повреждения кардиомиоцитов (рис. 5). При повторных биопсиях заключение формулировалось следующим образом: продолжающийся (персистирующий) миокардит, разрешающийся (заживающий) миокардит или разрешившийся (заживший) миокардит. Указывался тип инфильтрата (наиболее частый — лимфоцитарный, эозинофильный, нейтрофильный, гранулематозный, смешано-клеточный), его выраженность (слабая, умеренная, тяжелая инфильтрация), распространенность (инфильтрация очаговая, сливная, диффузная) [4, 7, 9, 13, 15].
Строгим диагностическим критерием активного миокардита признавалось наличие воспалительной клеточной инфильтрации миокарда с некрозом и/или дегенерацией кардиомиоцитов (рис. 4). Пограничный миокардит определялся как воспалительная инфильтрация при отсутствии признаков повреждения кардиомиоцитов (рис. 5). При повторных биопсиях заключение формулировалось следующим образом: продолжающийся (персистирующий) миокардит, разрешающийся (заживающий) миокардит или разрешившийся (заживший) миокардит. Указывался тип инфильтрата (наиболее частый — лимфоцитарный, эозинофильный, нейтрофильный, гранулематозный, смешано-клеточный), его выраженность (слабая, умеренная, тяжелая инфильтрация), распространенность (инфильтрация очаговая, сливная, диффузная) [4, 7, 9, 13, 15].
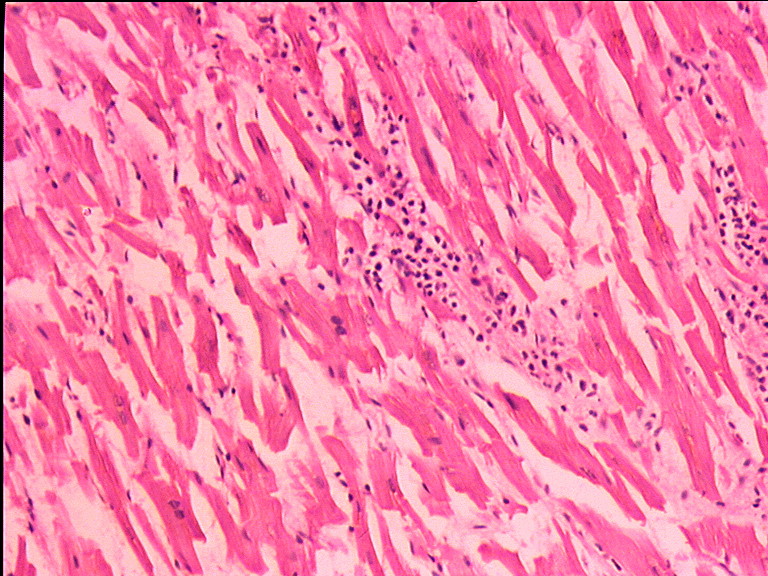
При анализе биоптатов, соответствующих Далласким критериям миокардита (112 больных), в 55% случаев определялся активный лимфоцитарный миокардит, пограничный — в 23%, гранулематозный — в 10%, гигантоклеточный (наличие многоядерных гигантских клеток — рис. 6) — в 6% и эозинофильный (при миокардите, связанном с аллергической реакцией или с периферической эозинофилией) — в 6% (Magnani и соавт.) [4].
6) — в 6% и эозинофильный (при миокардите, связанном с аллергической реакцией или с периферической эозинофилией) — в 6% (Magnani и соавт.) [4].
Однако эндомиокардиальная биопсия не дает полной гарантии постановки диагноза, поскольку при очаговом процессе высока вероятность забора неизмененного участка миокарда и получения ложноотрицательного результата. Особенно это вероятно в случаях очагового миокардита или на поздних стадиях течения заболевания. Обычно берется 5 биоптатов, чувствительность метода в диагностике миокардита при этом составляет 43%, увеличение количества биоптатов до 17 повышает чувствительность до 80%. В нескольких исследованиях показано, что чувствительность возрастает также при выполнении эндомиокардиальной биопсии из обоих желудочков. Однако в клинической практике как увеличение количества биоптатов, так и осуществление дополнительных доступов повышает риск осложнений, который в подавляющем большинстве случаев не оправдывается возможной пользой для пациента. Кроме того, показано, что оценка биоптатов довольно субъективна, воспроизводимость результатов при исследовании разными морфологами не стопроцентна. В связи с этим многие авторы считают, что использование Далласких критериев в настоящее время неприемлемо [4, 6, 7, 15, 16].
Кроме того, показано, что оценка биоптатов довольно субъективна, воспроизводимость результатов при исследовании разными морфологами не стопроцентна. В связи с этим многие авторы считают, что использование Далласких критериев в настоящее время неприемлемо [4, 6, 7, 15, 16].
В 1997 году на конференции Всемирной федерации кардиологов в Марбурге был принят Консенсус по определению воспалительной кардиомиопатии (миокардита). Марбургские критерии основаны на синтезе рекомендаций двух международных экспертных групп — по гистопатологии/иммуногистохимии и по молекулярной диагностике инфекционных кардиомиопатий. Миокардит определяется по наличию воспалительной инфильтрации в миокарде. Термин «острый» миокардит соответствует «активному» по Даллаской классификации, «хронический» — «пограничному» и «заживающему» миокардиту. Понятие «воспалительный инфильтрат» необходимо конкретизировать по преобладающему типу клеток: лимфоцитарный, эозинофильный, нейтрофильный, гигантоклеточный, гранулематозный или смешанный. Указывается распространенность воспалительной инфильтрации (очаговая, сливная, диффузная). Для оценки фиброза разработаны критерии: отсутствие фиброза —
Указывается распространенность воспалительной инфильтрации (очаговая, сливная, диффузная). Для оценки фиброза разработаны критерии: отсутствие фиброза —
0-я степень, начальный фиброз — 1-я степень, умеренный фиброз — 2-я степень, выраженный фиброз — 3-я степень.
Для постановки диагноза миокардита по Марбургским критериям необходимо наличие минимум 14 лейкоцитов на площади 1 мм2: преимущественно Т-лимфоцитов (CD45ro) и до 4 макрофагов. При наличии фокальных скоплений Т-лимфоцитов диагноз миокардита может быть поставлен на основании состава инфильтрата, даже если пороговое количество в 14 лейкоцитов/мм2 не достигается.
Количественно инфильтрат должен быть подсчитан иммуногистохимическим методом. В настоящее время доступен широкий спектр моно- и поликлональных антител к антигенам различных клеток, что позволяет идентифицировать участвующие в воспалении клетки и выяснить активность иммунологических реакций. В исследовании ESETCID иммуногистохимически определяли CD45ro, CD2, CD3, CD4, CD8, CD79a, CD68, также возможно использование anti-CD20, anti-HLA, антител к перфорину (выявление цитотоксических перфорин-позитивных Т-лимфоцитов), к молекулам межклеточной адгезии (anti-ICAM-1) и др. (рис. 7) [2, 15, 23].
(рис. 7) [2, 15, 23].
Окончание читать здесь
Аутоиммунный полигландулярный синдром взрослых: современные представления о предикторах развития поражения миокарда и диагностике компонентов заболевания | Паневин
Введение
Аутоиммунный полигландулярный синдром (АПС) характеризуется поражением двух и более эндокринных желез, приводящим чаще всего к развитию их гормональной недостаточности. Помимо поражения органов эндокринной системы в состав АПС может входить аутоиммунное поражение неэндокринных органов. По механизму развития выделяют два типа данного синдрома.
АПС 1-го типа является моногенным заболеванием, в основе его – дефект аутоиммунного гена-регулятора (AIRE), который расположен в длинном плече 21-й хромосомы. В подавляющем большинстве случаев данное заболевание развивается в детском возрасте, характеризуется первичной хронической надпочечниковой недостаточностью (1-ХНН), гипопаратиреозом, кандидозом кожи и слизистых оболочек. В некоторых случаях данной триаде сопутствуют сахарный диабет 1-го типа (СД 1), аутоиммунное поражение щитовидной железы, первичное бесплодие, а также аутоиммунное поражение неэндокринных органов (пернициозная анемия, первичный билиарный цирроз, целиакия, алопеция).
В некоторых случаях данной триаде сопутствуют сахарный диабет 1-го типа (СД 1), аутоиммунное поражение щитовидной железы, первичное бесплодие, а также аутоиммунное поражение неэндокринных органов (пернициозная анемия, первичный билиарный цирроз, целиакия, алопеция).
АПС 2-го типа является полигенным заболеванием, в его основе – генетическая предрасположенность к аутоиммунному поражению ткани в результате наличия специфических генов системы HLA (DR3, DR4, B8, DQA1 и др.). Классический АПС 2-го типа характеризуется наличием 1-ХНН и аутоиммунного поражения щитовидной железы – болезни Грейвса (БГ) или гипотиреоза в исходе аутоиммунного тиреоидита (АИТ). Данное сочетание принято называть синдромом Шмидта, сочетание 1-ХНН с поражением щитовидной железы и СД 1 – синдромом Карпентера.
Зарубежные исследователи (Betterle) модифицировали данную классификацию, добавив АПС 3-го и 4-го типов, которые по своему патогенезу идентичны АПС 2-го типа, однако характеризуются сочетаниями аутоиммунных поражений, отличных от АПС 2-го типа.
АПС 3-го типа характеризуется любым сочетанием аутоиммунных поражений, исключая 1-ХНН и гипопаратиреоз. Выделяют 4 подтипа АПС 3-го типа (табл. 1). АПС 4-го типа включает 1-ХНН в сочетании с различными второстепенными компонентами АПС.
Таблица 1. Классификация АПС 3-го типа
Основой большей части аутоиммунных эндокринных заболеваний является лимфоидная и макрофагальная инфильтрация органа-мишени в результате нарушения Т-клеточного иммунитета, дефекта регуляторных Т-лимфоцитов, модулирующих иммунный ответ посредством регуляции функции Т-эффекторных клеток (Т-хелперов и цитотоксических лимфоцитов). Высокая активность Т-киллеров и Т-хелперов приводит к развитию деструкции ткани, атрофии органа и недостаточной продукции вырабатываемого гормона. Помимо этого В-лимфоциты продуцируют аутоантитела к структурным компонентам эндокринных желез, чаще всего к ферментам, участвующим в синтезе гормонов [1] (табл. 2).
Таблица 2. Спектр аутоантигенов компонентов АПС
Зачастую у пациентов с одним аутоиммунным заболеванием другие составляющие АПС проявляются после некоторого латентного периода. В связи с тем что развитию клинической картины заболевания предшествует длительная фаза скрытых изменений на клеточном уровне, наиболее целесообразным является скрининг на наличие циркулирующих антител (АТ), характерных для других компонентов АПС: определение АТ к тиреопероксидазе (TПO), тиреоглобулину (ТГ), АТ к GAD IСА, АТ к тирозинфосфатазе, АТ к глиадину, париетальным клеткам желудка – в момент выявления одного из компонентов АПС, далее каждые 2–3 года [2].
В связи с тем что развитию клинической картины заболевания предшествует длительная фаза скрытых изменений на клеточном уровне, наиболее целесообразным является скрининг на наличие циркулирующих антител (АТ), характерных для других компонентов АПС: определение АТ к тиреопероксидазе (TПO), тиреоглобулину (ТГ), АТ к GAD IСА, АТ к тирозинфосфатазе, АТ к глиадину, париетальным клеткам желудка – в момент выявления одного из компонентов АПС, далее каждые 2–3 года [2].
Некоторые авторы помимо манифестной формы выделяют неполную (латентную) форму АПС, которая включает в себя субклиническую и потенциальную [3]. Субклиническая форма характеризуется наличием одного аутоиммунного заболевания в сочетании с одним и более серологическими маркерами других основных компонентов АПС при наличии субклинического нарушения функции второго органа-мишени. Потенциальная форма АПС – это наличие одного эндокринного аутоиммунного заболевания при выявленных антителах к другим органам, не сопровождающееся нарушением их функции.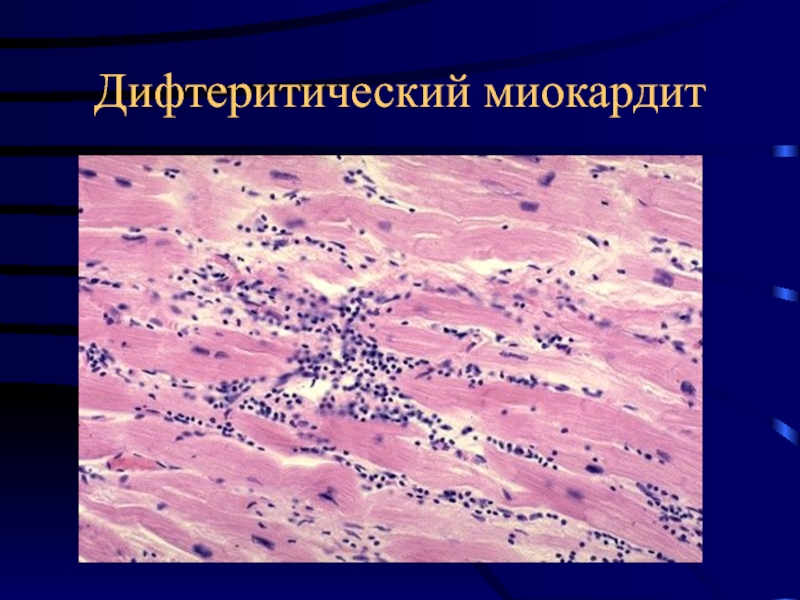 Распространенность латентных форм существенно выше манифестных [4].
Распространенность латентных форм существенно выше манифестных [4].
Наиболее хорошо изучено на сегодняшний день поражение миокарда при заболеваниях щитовидной железы, особенно при БГ и в меньшей степени при хронической надпочечниковой недостаточности и СД 1. Изменения миокарда при БГ могут быть связаны с аутоиммунным миокардитом, хотя механизмы, лежащие в основе развития данного состояния, требуют уточнения. Учитывая, что БГ может сочетаться с эндокринной офтальмопатией (ЭОП), претибиальной микседемой, развитие которых обусловлено действием АТ к рецептору тиреотропного гормона в тканях, можно предположить, что кардиомиопатия при диффузном токсическом зобе (ДТЗ) может иметь аутоиммунную составляющую, а не быть следствием действия только тиреоидных гормонов. Описаны случаи идиопатической кардиомиопатии, при которых определяются АТ к структурным компонентам миокарда, в том числе к β1-адренорецепторам. Кардиомиопатия, связанная с аутоиммунным поражением щитовидной железы, может быть более распространена, чем диагностируется, из-за того что она может протекать в легкой и субклинической форме [5–7].
Состояние миокарда при атоиммунной эндокринной патологии
Хотя поражение сердечно-сосудистой системы не выделено в составе АПС, в некоторых клинических случаях описывается развитие поражения миокарда с развитием сердечной недостаточности при отсутствии предшествующего клинически проявляющегося поражения сердца [8].
Поражение миокарда при БГ является наиболее распространенным в связи с токсическим действием избытка тиреоидных гормонов на миокард. Однако в связи с иммунной природой поражения ЩЖ при БГ ранее высказывались предположения о вкладе аутоиммунных механизмов и в развитие поражения сердца. В качестве аргумента приводились сообщения об обнаружении при биопсии миокарда дегенеративных изменений, лимфоцитарной инфильтрации, накопления мукополисахаридов с последующим формированием фиброза у пациентов с БГ. Схожие изменения имели место у пациентов с сопутствующей ЭОП и претибиальной микседемой при посмертном гистологическом исследовании указанных органов-мишеней [9].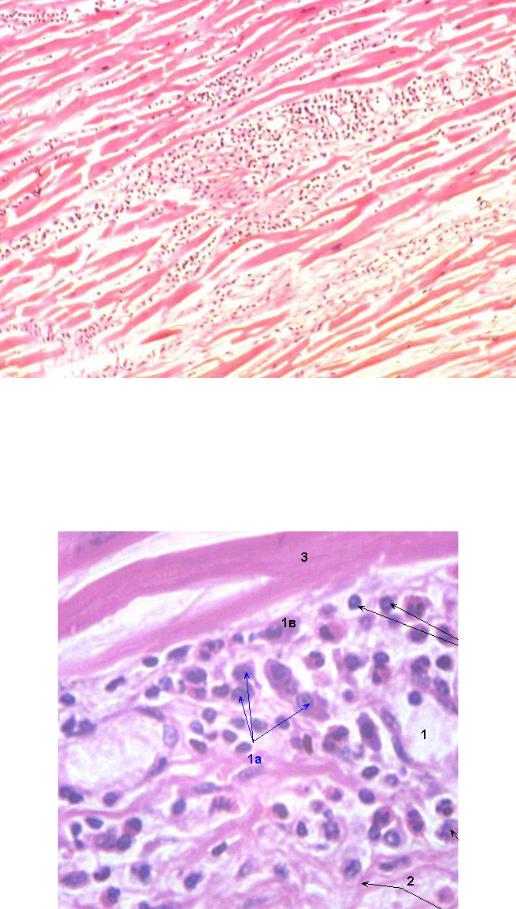
При изучении распространенности миксоматозной дегенерации клапанного аппарата сердца у пациентов с аутоиммунными заболеваниями щитовидной железы и многоузловым токсическим зобом выявлена более частая встречаемость этого состояния при БГ (35%) и тиреоидите Хашимото (25%) в сравнении с многоузловым токсическим зобом (7,5%) [10–12].
В проспективных исследованиях обнаружена повышенная частота развития легочной гипертензии (более чем в 2 раза) у пациентов с БГ, чем у пациентов с тиреотоксикозом неаутоиммунного генеза [13–15].
Отмечалось наличие легочной гипертензии у пациентов с другими аутоиммунными заболеваниями (склеродермия, системная красная волчанка, диффузные заболевания соединительной ткани) так же, как и у пациентов с аутоиммунными заболеваниями щитовидной железы, сопровождающимися нарушениями ее функции (гипертиреоз, гипотиреоз) [16].
A.W. Nathan в 1983 г. установил, что миокардиодистрофия при БГ связана, помимо воздействия на миокард катехоламинов, с присутствием аутоантител к кардиомиоцитам, обладающих стимулирующим действием на миокард, способствуя входному току кальция в его клетки [17].
Однако V. Fatourechi и W.D. Edwards при проведении биопсии миокарда правого желудочка у пациентов с БГ показали, что лимфоидная инфильтрация ткани, характерная для миокардита, была выявлена лишь у 18% обследованных пациентов [18].
Описаны случаи развития кардиомиопатии Такоцубо (ТКМП) и гигантоклеточного миокардита на фоне АПС, в клинической картине которых доминировала надпочечниковая недостаточность.
Кардиомиопатия Такоцубо – преходящее снижение сократимости миокарда апикальной части левого желудочка. Были предложены различные причины, провоцирующие ее развитие: эмоциональный стресс, тяжелые физические нагрузки, хирургические вмешательства, медикаменты, общая анестезия, тиреотоксикоз, синдром множественной эндокринной неоплазии, гипогликемические состояния, преходящая гипотензия [19].
Большое внимание к проблеме ТКМП в последние годы стали проявлять в связи с тем, что у людей, перенесших тиреотоксикоз, даже при радикальном излечении выявлено повышение смертности по сравнению с остальной популяцией именно от сердечно-сосудистых причин [20]. Наиболее вероятной причиной повышения смертности является именно ТКМП, формирование которой происходит в период тиреотоксикоза.
Наиболее вероятной причиной повышения смертности является именно ТКМП, формирование которой происходит в период тиреотоксикоза.
Обращает на себя внимание относительно высокий процент сопутствующих аутоиммунных заболеваний у больных миокардитом: у 19% больных гигантоклеточным миокардитом и у 11% всех больных с морфологически доказанным миокардитом, что подчеркивает роль нарушений аутореактивности в патогенезе воспалительных заболеваний миокарда [21].
Более чем в 20% случаев гигантоклеточный миокардит может сочетаться с другими аутоиммунными заболеваниями: имеется несколько сообщений о сочетании с болезнью Крона (Cooper et al., 1995, 1997), неспецифическим язвенным колитом (Cooper et al., 1997; Ariza et al., 1995; McKeon, 1986), миозитом орбитальных мышц и скелетной мускулатуры (Leib et al., 1994; Klein et al., 1998), аутоиммунным тиреоидитом (Benish and Josephson, 1973; Davies et al., 1975) и артеритом Такаясу (Kennedy et al., 1971; Roberts, 1966). Единичные случаи сочетания с ревматоидным артритом, тотальной алопецией.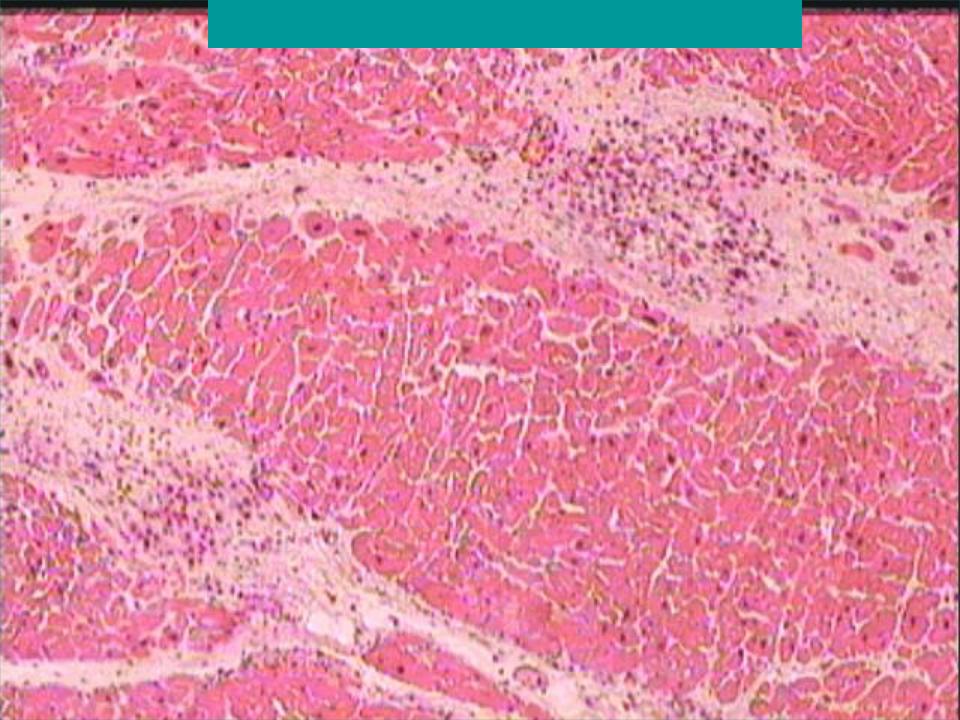
Верификация аутоиммунного поражения сердца при СД 1 затруднена из-за развития с течением времени при неудовлетворительном контроле гликемии автономной сердечно-сосудистой полинейропатии.
Описан случай острого дебюта идиопатического СД 1 в сочетании с фульминантным вирусным миокардитом [22].
Также возможно сочетание рассеянного склероза с СД 1, АИТ и идиопатической дилатационной кардиомиопатией (ДКМП). Указанное сочетание нашло подтверждение в экспериментах на животных путем индуцирования нарушения иммунной регуляции T-клеточного звена [23].
Приводится описание развития миокардита у пациентов с СД 1 после перенесенного инфаркта, который в данном случае являлся триггером аутоиммунного воспаления в результате компонентов миокарда и выработки к ним антител, в частности к альфа-миозину [24].
Истинную распространенность легких форм миокардита трудно установить, поскольку заболевание может протекать без какой-либо клинической симптоматики [25]. Отсутствие точных данных о частоте встречаемости миокардита связано с недостаточной чувствительностью диагностических методов и относительно недавним применением эндомиокардиальной биопсии (ЭМБ) с полимеразной цепной реакцией и иммуногистохимическим анализом препаратов сердечной мышцы [26].
В основе патогенетических механизмов миокардита лежит комплекс факторов – активация процессов апоптоза, а также реакций первичного и вторичного иммунного ответа, ремоделирование сократительного аппарата сердечной мышцы [27]. Эти процессы, как правило, проходят три последовательные фазы [28]. В начальной фазе происходит повреждение миокарда через активацию первичного иммунного ответа [29]. Макрофаги и натуральные киллеры усугубляют повреждение сердечной мышцы, уничтожая пораженные кардиомиоциты, а также поддерживают активное воспаление в миокарде, продуцируя провоспалительные цитокины [30]. Вторая фаза миокардита характеризуется активацией реакций вторичного (специфического) иммунитета с выработкой специфичных антимиокардиальных иммуноглобулинов классов G, M и A плазматичеcкими клетками и пролиферацией клонов антигенспецифичных Т-лимфоцитов [31]. Кроме того, происходит стимуляция хемотаксиса лейкоцитов, что сопровождается их миграцией в очаг воспаления и адгезией к эндотелиоцитам, нарушением микроциркуляции и выраженным повреждением сократительного аппарата сердца. Основными провоспалительными цитокинами, которые вырабатываются иммунными клетками в очаге воспаления в этой фазе заболевания, являются: γ-интерферон, фактор некроза опухоли α (ФНО-α), интерлейкин (ИЛ) 1, ИЛ-2, ИЛ-6, ИЛ-17А, ИЛ-23 [32]. В случае длительного воспалительного процесса в сердечной мышце происходит переход заболевания в третью, хроническую фазу, в которой основным патологическим процессом является ремоделирование сердечной мышцы с прогрессирующей ее дилатацией и развитием хронической сердечной недостаточности [33]. При этом нарушаются энергообразующая функция миокардиоцитов (окислительное фосфорилирование, гликолиз), внутриклеточный метаболизм (синтез белковых структур), сократительная функция миофибрилл [34].
Основными провоспалительными цитокинами, которые вырабатываются иммунными клетками в очаге воспаления в этой фазе заболевания, являются: γ-интерферон, фактор некроза опухоли α (ФНО-α), интерлейкин (ИЛ) 1, ИЛ-2, ИЛ-6, ИЛ-17А, ИЛ-23 [32]. В случае длительного воспалительного процесса в сердечной мышце происходит переход заболевания в третью, хроническую фазу, в которой основным патологическим процессом является ремоделирование сердечной мышцы с прогрессирующей ее дилатацией и развитием хронической сердечной недостаточности [33]. При этом нарушаются энергообразующая функция миокардиоцитов (окислительное фосфорилирование, гликолиз), внутриклеточный метаболизм (синтез белковых структур), сократительная функция миофибрилл [34].
Признаки воспаления в миокарде при гистологическом исследовании могут не выявляться, однако глубокие структурно-функциональные изменения сократительного аппарата сердца с развитием фиброза, как правило, необратимы. Впоследствии может происходить трансформация заболевания в ДКМП [35].
По данным аутопсий, проведенных 27 пациентам с БГ, зафиксированы умеренный отек, инфильтрация миокарда и незначительный интерстициальный и периваскулярный фиброз, отмечалась гипертрофия кардиомиоцитов; у одного пациента был диагностирован лимфоцитарный миокардит, еще у одного – пограничный миокардит. Кроме того, сообщалось о двух случаях с тяжелым лимфоцитарным миокардитом [36].
Возможности лабораторной диагностики
Для лабораторной диагностики миокардита используются как в экспериментальных работах, так и на практике АТ к следующим антигенным структурам сердца: сарколемме, в частности β1-адренорецепторам и холинергическим рецепторам; антимитохондриальные антитела; антисаркоплазматические антитела, АТ, повреждающие транспортный белок Са2+-АТФазу; антимикросомальные антитела; антитела к миофибриллам – актину и тяжелой цепи миозина; антитела к структурам межклеточного пространства – ламинину, виментину, десмину, фибронектину, коллагену [37].
У пациентов с ДКМП также обнаруживаются антитела к структурным компонентам миокарда: адренорецепторам, мускариновым рецепторам, ламинину, виментину, десмину, кератину, актину, тяжелым цепям миозина и митохондриальным белкам. Одна из ключевых ролей в развитии кардиомиопатии отводится антителам к адренорецепторам миокарда, которые обнаруживаются у 30–40% больных ДКМП [38].
Одна из ключевых ролей в развитии кардиомиопатии отводится антителам к адренорецепторам миокарда, которые обнаруживаются у 30–40% больных ДКМП [38].
Аутоиммунная теория развития ДКМП подтверждается обнаружением циркулирующих антител к миокарду не только у больных, но и у их родственников. Возможность использования антител к миокарду в качестве ранних маркеров заболевания остается предметом для дискуссии [39].
Наличие органоспецифичных антител (IgG) к миозину и другим, менее известным антигенам при миокардите и ДКМП имеет место не менее чем у 1/3 пациентов [40]. В большинстве случаев у пациентов с наличием указанных антител в крови в последующем данные маркеры не определяются. Это может означать, что антимиокардиальные антитела являются ранним маркером поражения миокарда. Отсутствие антител в крови у оставшейся части пациентов свидетельствует о преобладании у них клеточных механизмов аутоиммунных реакций или неиммуноопосредованном поражении миокарда [41].
Для диагностики аутоиммунного поражения сердца в рамках АПС рекомендуется использовать лабораторные и инструментальные методы исследования, применяемые для диагностики миокардита и ДКМП.
Увеличение СОЭ и лейкоцитоз крайне редко встречаются у пациентов с миокардитом. Наиболее информативный маркер острого воспаления – С-реактивный белок. Несмотря на высокую специфичность метода определения активности МВ-изоформы креатинкиназы (100%) для диагностики повреждений миокарда при воспалительных заболеваниях сердца, чувствительность его не превышает 6% [42].
Дополнительную информацию о степени тяжести миокардита можно получить при исследовании цитокинового профиля: уровня ИЛ-10, ФНО-α, неоптерина.
В клинической практике возможно широкое использование определения антител к миокарду методом непрямой иммунофлюоресценции, а также с помощью стандартизованных иммуноферментных тест-систем ELISA, полученных методом хроматографии [43].
Возможности инструментальной диагностики
На ЭКГ могут регистрироваться нарушения реполяризации диффузного характера по типу уплощения или инверсии зубца Т. Вовлечение в процесс перикарда может сопровождаться изменением сегмента ST.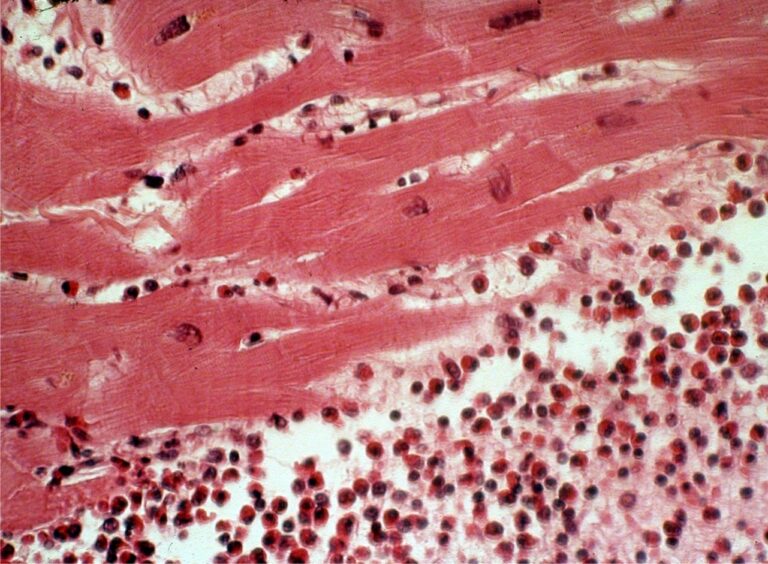 У 31% больных активным миокардитом встречаются инфарктоподобные варианты течения заболевания, при которых наряду с развитием интенсивного болевого синдрома в прекардиальной области регистрируются элевация сегмента ST в двух и более отведениях (54%) или его депрессия (27%), а также низковольтажный патологический зубец Q (18–27%) [44]. Чувствительность ЭКГ-методов в диагностике миокардита не превышает 47% [45].
У 31% больных активным миокардитом встречаются инфарктоподобные варианты течения заболевания, при которых наряду с развитием интенсивного болевого синдрома в прекардиальной области регистрируются элевация сегмента ST в двух и более отведениях (54%) или его депрессия (27%), а также низковольтажный патологический зубец Q (18–27%) [44]. Чувствительность ЭКГ-методов в диагностике миокардита не превышает 47% [45].
МРТ – наиболее информативный для диагностики воспалительных заболеваний миокарда метод, так как идеально передает мозаичность состава ткани в условиях воспаления [46]. Кино-МРТ позволяет выявить функциональные изменения в миокарде, и эти данные носят неспецифичный характер и фактически дублируют эхокардиографические показатели. Дополнительную и порой решающую информацию в диагностике миокардитов обеспечивает МРТ с контрастным усилением, в качестве которого используются вещества, содержащие тяжелый парамагнитный металл гадолиний. Наиболее распространенным является метод позднего контрастного усиления (late gadolinium enhancement, LGE), при котором МРТ проводится через 15–20 мин после введения контрастного вещества. Нормальный миокард достаточно быстро накапливает контрастное вещество и быстро его выводит. Отсутствие выведения контрастного вещества в отсроченную фазу отражает наличие необратимых процессов в миокарде, таких как некроз кардиомиоцитов и фиброз. Для миокардита наиболее характерно поражение боковой, передней и нижней стенок левого желудочка. Кроме того, повреждение миокарда при воспалительных заболеваниях, как правило, располагается субэпикардиально, реже трансмурально или интрамурально [21].
Нормальный миокард достаточно быстро накапливает контрастное вещество и быстро его выводит. Отсутствие выведения контрастного вещества в отсроченную фазу отражает наличие необратимых процессов в миокарде, таких как некроз кардиомиоцитов и фиброз. Для миокардита наиболее характерно поражение боковой, передней и нижней стенок левого желудочка. Кроме того, повреждение миокарда при воспалительных заболеваниях, как правило, располагается субэпикардиально, реже трансмурально или интрамурально [21].
Эндомиокардиальная биопсия показана в случае персистирующей или прогрессирующей дисфункции миокарда, ишемический генез которой исключен после проведения коронарной ангиографии [6]. Однако следует помнить, что миокардит может развиваться и у пациентов с исходным поражением коронарных артерий. ЭМБ выполняется под местной анестезией с помощью гибких биотомов из стандартных доступов: правожелудочковая – через v. jugularis и v. femoralis, а левожелудочковая – через a. femoralis, под контролем флуороскопии, эхокардиографии, а также МРТ или компьютерной томографии.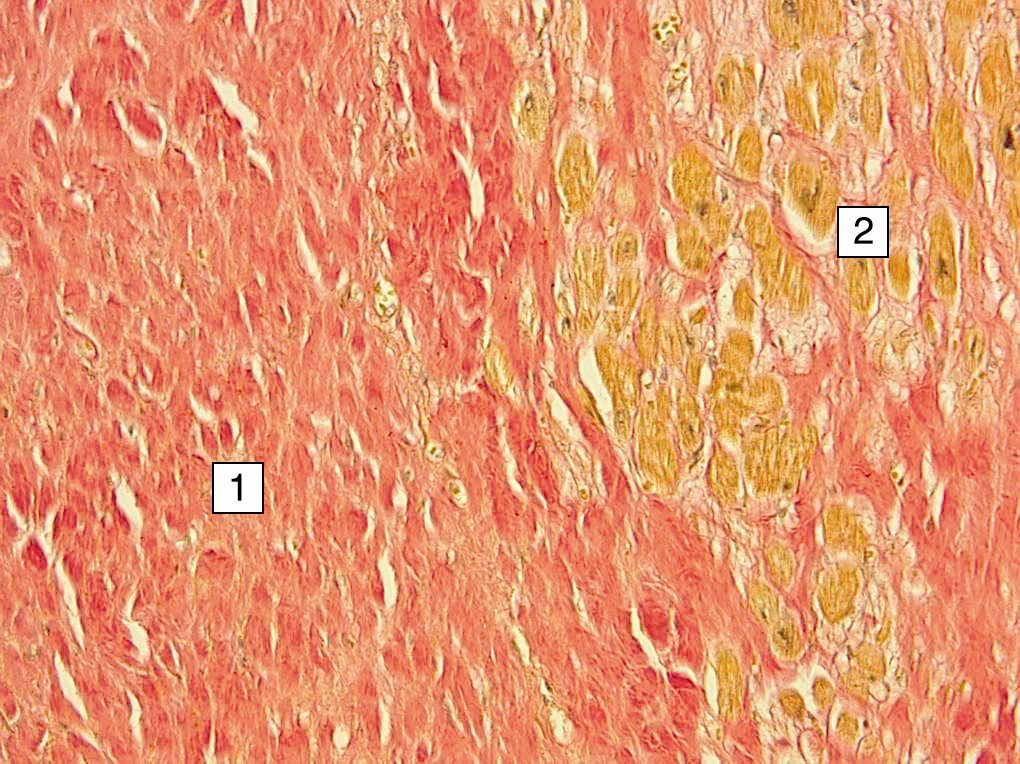 Из одного региона получают более 1 биоптата (оптимально 5–10) размером 2–3 мм. ЭМБ в случае, если она выполняется в специализированных центрах, относительно безопасная процедура [21].
Из одного региона получают более 1 биоптата (оптимально 5–10) размером 2–3 мм. ЭМБ в случае, если она выполняется в специализированных центрах, относительно безопасная процедура [21].
Заключение
Хотя пациенты с АПС имеют относительно молодой возраст, в связи с потенциально возможным аутоиммунным поражением миокарда необходимо учитывать у них высокий риск развития поражения сердечно-сосудистой системы. Таким образом, вопрос о необходимости проведения лабораторно-инструментальных исследований у больных АПС при отсутствии клинических признаков поражения миокарда остается открытым и нуждается в подробном изучении.
Дополнительная информация
Источники финансирования. Поисково-аналитическая работа выполнена в рамках гранта Российского научного фонда № 17-75-30035 “Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация”.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящих рекомендаций, о которых необходимо сообщить.
Участие авторов. Все авторы внесли существенный вклад в проведение работы и подготовку статьи, прочли и одобрили финальную версию текста перед публикацией.
1. Van den Driessche A, Eenkhoorn V, Van Gaal L, De Block C. Type 1 diabetes and autoimmune polyglandular syndrome: a clinical review. Neth J Med. 2009;67(11):376-387.
2. Kahaly GJ. Polyglandular autoimmune syndromes. Eur J Endocrinol. 2009;161(1):11-20. doi: 10.1530/EJE-09-0044.
3. Betterle C, Zanchetta R. Update on autoimmune polyendocrine syndromes (APS). Acta Biomed. 2003;74(1):9-33.
Acta Biomed. 2003;74(1):9-33.
4. Ларина А.А., Трошина Е.А., Иванова О.В. Аутоиммунные полигландулярные синдромы взрослых: генетические и иммунологические критерии диагностики. // Проблемы эндокринологии. – 2014. – Т. 60. – № 3. – С. 43-52. [Larina AA, Troshina EA, Ivanova OV. Autoimmune polyglandular syndromes in the adults: the genetic and immunological diagnostic criteria. Problems of endocrinology. 2014;60(3):43-52. (In Russ.)] doi: 10.14341/probl201460343-52.
5. Drvota V, Janson A, Norman C, et al. Evidence for the presence of functional thyrotropin receptor in cardiac muscle. Biochem Biophys Res Commun. 1995;211(2):426-431. doi: 10.1006/bbrc.1995.1831.
6. Cooper DS. Antithyroid drugs. N Engl J Med. 1984;311(21): 1353-1362. doi: 10.1056/nejm198411223112106.
doi: 10.1056/nejm198411223112106.
7. Jahns R, Boivin V, Hein L, et al. Direct evidence for a beta1-adrenergic receptor-directed autoimmune attack as a cause of idiopathic dilated cardiomyopathy. J Clin Invest. 2004;113(10): 1419-1429. doi: 10.1172/JCI20149.
8. Sezai A, Hata M, Minami K. Hypertrophic obstructive cardiomyopathy with Schmidt’s syndrome: report of a case. Thorac Cardiovasc Surg. 2010;58(5):314-316. doi: 10.1055/s-0029-1185884.
9. Шульгина В.Ю., Фадеев В.В., Мельниченко Г.А. Поражения миокарда при тиреотоксикозе: особенности течения, исходы, отдаленный прогноз. // Клиническая и экспериментальная тиреоидология. – 2006. – Т. 2. – № 4. – С. 21-30. [Shul’gina VY, Fadeev VV, Mel’nichenko GA. Myocardial lesion in hyperthyroidism: natural history, outcomes, prognosis. Clinical and experimental thyroidology. 2006;2(4):21-30. (In Russ.)] doi: 10.14341/ket20062421-30.
Clinical and experimental thyroidology. 2006;2(4):21-30. (In Russ.)] doi: 10.14341/ket20062421-30.
10. Nishimura RA, McGoon MD, Shub C, et al. Echocardiographically documented mitral-valve prolapse. Long-term follow-up of 237 patients. N Engl J Med. 1985;313(21):1305-1309. doi: 10.1056/NEJM198511213132101.
11. Kahaly G, Mohr-kahaly S, Beyer J, Meyer J. Prevalence of myxomatous mitral valve prolapse in patients with lymphocytic thyroiditis. Am J Cardiol. 1995;76(17):1309-1310. doi: 10.1016/s0002-9149(99)80363-4.
12. Channick BJ, Adlin EV, Marks AD, et al. Hyperthyroidism and mitral-valve prolapse. N Engl J Med. 1981;305(9):497-500. doi: 10.1056/NEJM198108273050906.
13. Ma RC, Cheng AY, So WY, et al. Thyrotoxicosis and pulmonary hypertension. Am J Med. 2005;118(8):927-928. doi: 10.1016/j.amjmed.2005.03.038.
Ma RC, Cheng AY, So WY, et al. Thyrotoxicosis and pulmonary hypertension. Am J Med. 2005;118(8):927-928. doi: 10.1016/j.amjmed.2005.03.038.
14. Siu CW, Zhang XH, Yung C, et al. Hemodynamic changes in hyperthyroidism-related pulmonary hypertension: a prospective echocardiographic study. J Clin Endocrinol Metab. 2007;92(5): 1736-1742. doi: 10.1210/jc.2006-1877.
15. Marvisi M, Brianti M, Marani G, et al. Hyperthyroidism and pulmonary hypertension. Respir Med. 2002;96(4):215-220. doi: 10.1053/rmed.2001.1260.
16. Li JH, Safford RE, Aduen JF, et al. Pulmonary hypertension and thyroid disease. Chest. 2007;132(3):793-797. doi: 10.1378/chest.07-0366.
17. Nathan AW, Longmore DB, Havard CW, Dandona P. The effects of plasma from patients with Graves’ disease on foetal mouse hearts in organ culture. Br J Exp Pathol. 1983;64(5):474-478.
Nathan AW, Longmore DB, Havard CW, Dandona P. The effects of plasma from patients with Graves’ disease on foetal mouse hearts in organ culture. Br J Exp Pathol. 1983;64(5):474-478.
18. Fatourechi V, Edwards WD. Graves’ disease and low-output cardiac dysfunction: implications for autoimmune disease in endomyocardial biopsy tissue from eleven patients. Thyroid. 2000; 10(7):601-605. doi: 10.1089/thy.2000.10.601.
19. Ohwada R, Hotta M, Kimura H, et al. Ampulla cardiomyopathy after hypoglycemia in three young female patients with anorexia nervosa. Intern Med. 2005;44(3):228-233. doi: 10.2169/internalmedicine.44.228.
20. Vanderpump M. Cardiovascular and cancer mortality after radioiodine treatment of hyperthyroidism. J Clin Endocrinol Metab.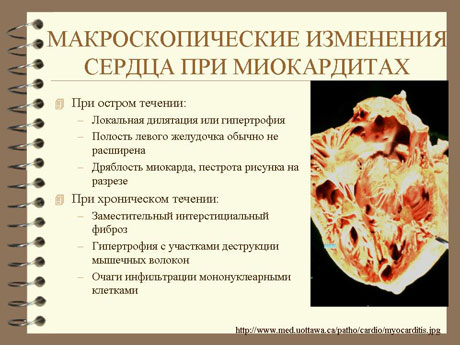 2007;92(6):2033-2035. doi: 10.1210/jc.2007-0837.
2007;92(6):2033-2035. doi: 10.1210/jc.2007-0837.
21. Моисеева О.М., Митрофанова Л.Б., Пахомов А.В., и др. Спорные вопросы диагностики миокардитов. // Сердце: журнал для практикующих врачей. – 2010. – Т. 9. – №4. – С. 234-241. [Moiseeva OM, Mitrofanova LB, Pakhomov AV, et al. Spornye voprosy diagnostiki miokarditov. Serdtse. 2010; 9(4):234-241. (In Russ.)]
22. Deretzi G, Kountouras J, Zavos C, et al. Multiple sclerosis, idiopathic dilated cardiomyopathy, and insulin-dependent diabetes mellitus: a common mechanism of irregular immune regulation. Neurologist. 2011;17(3):172-175. doi: 10.1097/NRL.0b013e3182173552.
23. Gottumukkala RV, Lv H, Cornivelli L, et al. Myocardial infarction triggers chronic cardiac autoimmunity in type 1 diabetes. Sci Transl Med. 2012;4(138):138ra180. doi: 10.1126/scitranslmed.3003551.
Sci Transl Med. 2012;4(138):138ra180. doi: 10.1126/scitranslmed.3003551.
24. Дерюгин М.В., Бойцов С.А. Хронические миокардиты. – СПб: ЭЛБИ-СПб; 2005. [Deryugin MV, Boytsov SA. Khronicheskie miokardity. Saint-Petersburg: ELBI-SPb; 2005. (In Russ.)]
25. Pankuweit S, Maisch B. Das Herz bei viralen Infektionen. Internist (Berl). 2010;51(7):836-843. doi: 10.1007/s00108-009-2559-8.
26. Badorff C, Knowlton KU. Dystrophin disruption in enterovirus-induced myocarditis and dilated cardiomyopathy: from bench to bedside. Med Microbiol Immunol. 2004;193(2-3):121-126. doi: 10.1007/s00430-003-0189-7.
27. Rose NR. Myocarditis: infection versus autoimmunity.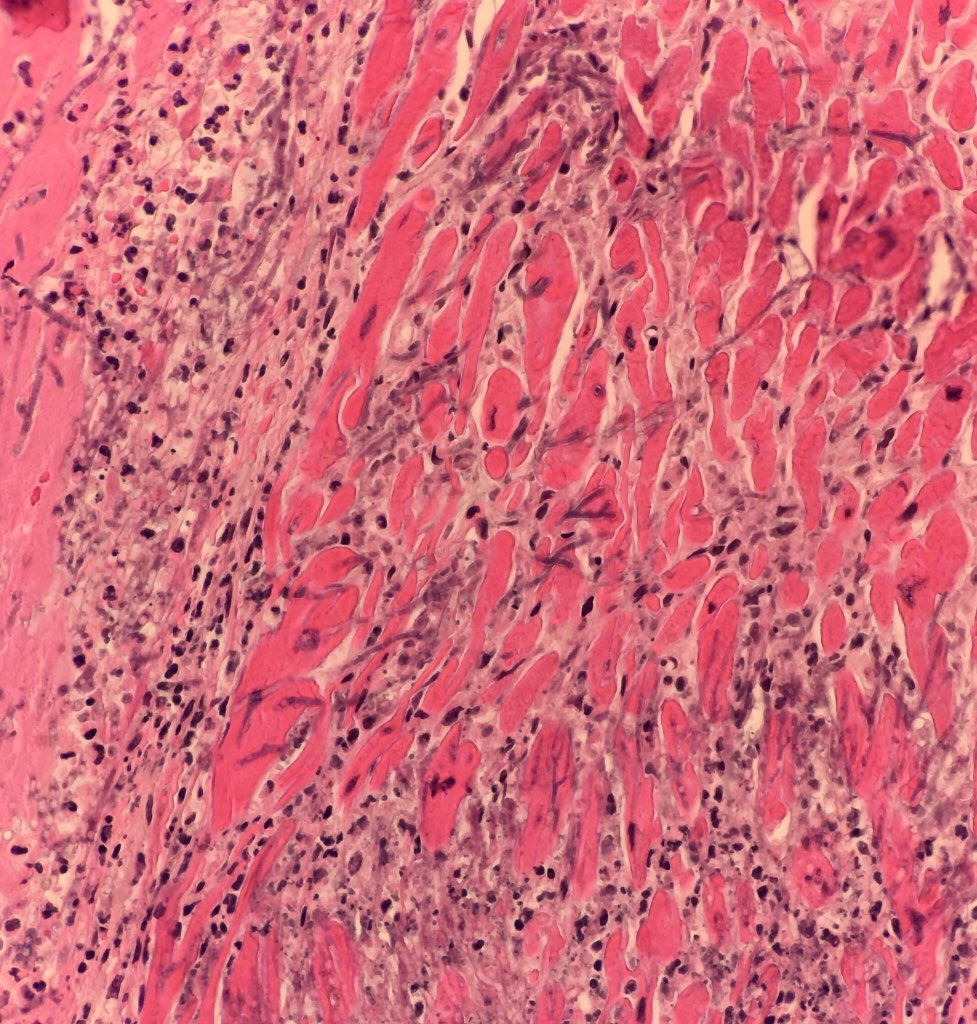 J Clin Immunol. 2009;29(6):730-737. doi: 10.1007/s10875-009-9339-z.
J Clin Immunol. 2009;29(6):730-737. doi: 10.1007/s10875-009-9339-z.
28. Kawai C. From myocarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation. 1999;99(8):1091-1100. doi: 10.1161/01.cir.99.8.1091.
29. Cooper LT. Myocarditis from bench to bedside. New Jersey: Humana Press Totowa; 2003.
30. Поляков В.П., Николаевский Е.Н., Пичко А.Г. Некоронарогенные и инфекционные заболевания сердца. – Самара; 2010. [Polyakov VP, Nikolaevskiy EN, Pichko AG. Nekoronarogennye i infektsionnye zabolevaniya serdtsa. Samara; 2010. (In Russ.)]
31. Aukrust P, Gullestad L, Ueland T, et al. Inflammatory and anti-inflammatory cytokines in chronic heart failure: Potential therapeutic implications.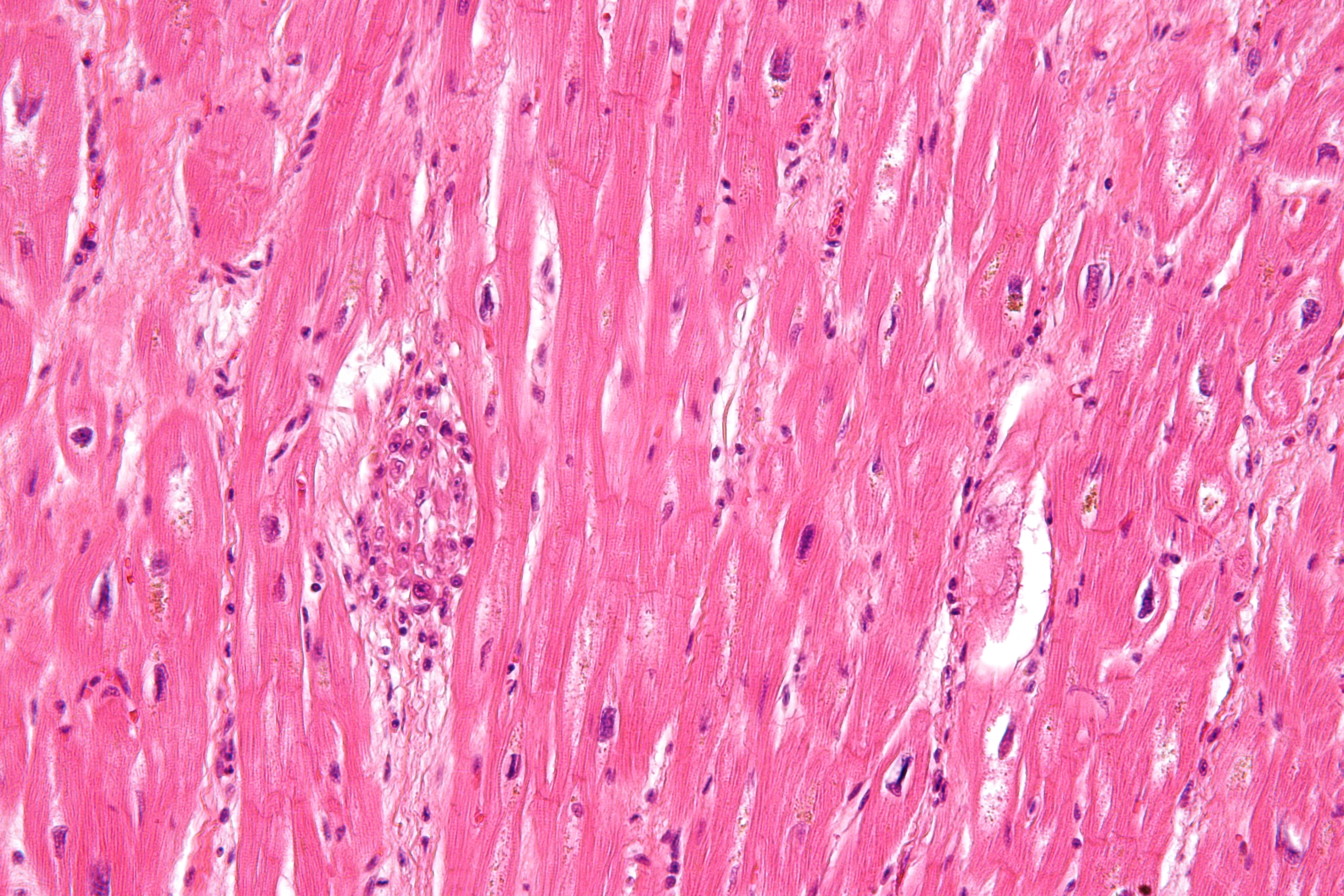 Ann Med. 2009;37(2):74-85. doi: 10.1080/07853890510007232.
Ann Med. 2009;37(2):74-85. doi: 10.1080/07853890510007232.
32. Mahrholdt H, Wagner A, Deluigi CC, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-1590. doi: 10.1161/CIRCULATIONAHA.105.606509.
33. Dillmann WH. Biochemical basis of thyroid hormone action in the heart. Am J Med. 1990;88(6):626-630. doi: 10.1016/0002-9343(90)90530-q.
34. Caforio AL, Tona F, Bottaro S, et al. Clinical implications of anti-heart autoantibodies in myocarditis and dilated cardiomyopathy. Autoimmunity. 2008;41(1):35-45. doi: 10.1080/08916930701619235.
35. Shirani J, Barron MM, Pierre-Louis M-LY, Roberts WC. Congestive heart failure, dilated cardiac ventricles, and sudden death in hyperthyroidism. Am J Cardiol. 1993;72(3):365-368. doi: 10.1016/0002-9149(93)90691-5.
Congestive heart failure, dilated cardiac ventricles, and sudden death in hyperthyroidism. Am J Cardiol. 1993;72(3):365-368. doi: 10.1016/0002-9149(93)90691-5.
36. Коваленко В.Н., Несукай Е.Г., Чернюк С.В. Миокардит: современный взгляд на этиологию и патогенез заболевания. // Украинский кардиологический журнал. – 2012. – №2. – С. 84-91. [Kovalenko VN, Nesukai YG, Cherniuk SV. Myocarditis: a contemporary look on the etiology and pathogenesis of the disease. Ukrainskiy kardiologicheskiy zhurnal. 2012;(2):84-91. (In Russ.)]
37. Magnusson Y, Wallukat G, Waagstein F, et al. Autoimmunity in idiopathic dilated cardiomyopathy. Characterization of antibodies against the beta 1-adrenoceptor with positive chronotropic effect. Circulation. 1994;89(6):2760-2767. doi: 10.1161/01.cir.89.6.2760.
38. Neumann DA, Lynne Burek C, Baughman KL, et al. Circulating heart-reactive antibodies in patients with myocarditis or cardiomyopathy. J Am Coll Cardiol. 1990;16(4):839-846. doi: 10.1016/s0735-1097(10)80331-6.
Neumann DA, Lynne Burek C, Baughman KL, et al. Circulating heart-reactive antibodies in patients with myocarditis or cardiomyopathy. J Am Coll Cardiol. 1990;16(4):839-846. doi: 10.1016/s0735-1097(10)80331-6.
39. Caforio ALP, Mahon NJ, Tona F, McKenna WJ. Circulating cardiac autoantibodies in dilated cardiomyopathy and myocarditis: pathogenetic and clinical significance. Eur J Heart Fail. 2002; 4(4):411-417. doi: 10.1016/s1388-9842(02)00010-7.
40. Latif N, Baker CS, Dunn MJ, et al. Frequency and specificity of antiheart antibodies in patients with dilated cardiomyopathy detected using SDS-PAGE and western blotting. J Am Coll Cardiol. 1993;22(5):1378-1384. doi: 10.1016/0735-1097(93)90546-d.
41. Caforio AL, Goldman JH, Baig MK, et al. Cardiac autoantibodies in dilated cardiomyopathy become undetectable with disease progression. Heart. 1997;77(1):62-67. doi: 10.1136/hrt.77.1.62.
Cardiac autoantibodies in dilated cardiomyopathy become undetectable with disease progression. Heart. 1997;77(1):62-67. doi: 10.1136/hrt.77.1.62.
42. Greaves K, Oxford JS, Price CP, et al. The prevalence of myocarditis and skeletal muscle injury during acute viral infection in adults. Arch Intern Med. 2003;163(2):165. doi: 10.1001/archinte.163.2.165.
43. Полетаев А.Б. Новые подходы в раннем выявлении патологических изменений в организме человека (иммунохимический скрининг как основа стратегии перехода от лечебной к превентивной медицине): методическое руководство для врачей. – М.: МИЦ Иммункулус; 2011. [Poletaev AB. Novye podkhody v rannem vyyavlenii patologicheskikh izmeneniy v organizme cheloveka (immunokhimicheskiy skrining kak osnova strategii perekhoda ot lechebnoy k preventivnoy meditsine): metodicheskoe rukovodstvo dlya vrachey.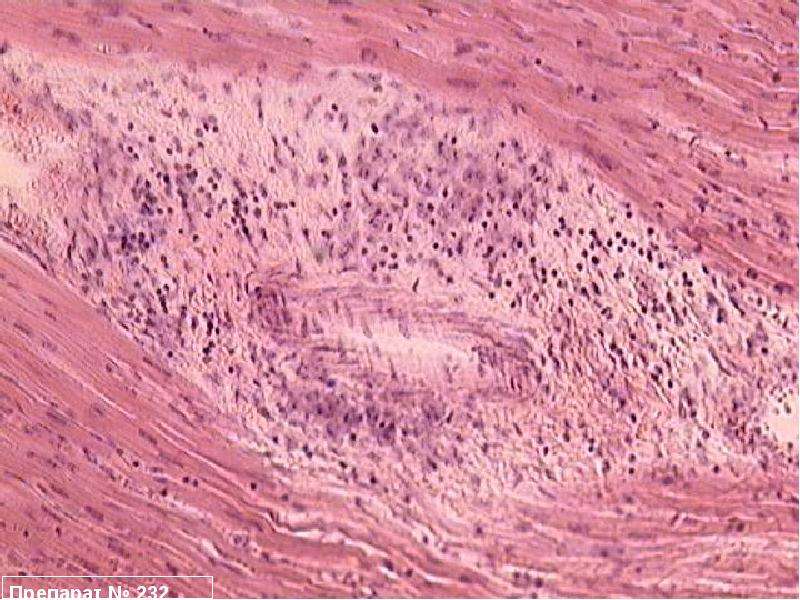 Moscow: MITs Immunkulus; 2011. (In Russ.)]
Moscow: MITs Immunkulus; 2011. (In Russ.)]
44. Cooper LT, Jr. Myocarditis. N Engl J Med. 2009;360(15): 1526-1538. doi: 10.1056/NEJMra0800028.
45. Morgera T, Di Lenarda A, Dreas L, et al. Electrocardiography of myocarditis revisited: Clinical and prognostic significance of electrocardiographic changes. Am Heart J. 1992;124(2):455-467. doi: 10.1016/0002-8703(92)90613-z.
46. Hundley WG, Bluemke DA, Finn JP, et al. ACCF/ACR/AHA/NASCI/SCMR 2010 expert consensus document on cardiovascular magnetic resonance: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol. 2010;55(23):2614-2662. doi: 10.1016/j.jacc.2009.11.011.
Новое положение AHA по лечению фульминантного миокардита
Американская ассоциация сердца (AHA) опубликовала новое научное положение по лечению фульминантного миокардита (ФМ), сосредоточив внимание на своевременной диагностике и терапии этого редкого, но потенциально смертельного заболевания.
Фульминантный миокардит – это тяжелое, быстро прогрессирующее воспаление сердца, часто вызванное вирусной инфекцией, возникает внезапно и связано с высоким риском смерти от кардиогенного шока, аритмий и полиорганной недостаточности.
«Это первое научное положение по этой теме», — сказал Лесли Купер, доктор медицинских наук, заместитель председателя группы по научным положениям AHA. «Его основной посыл заключается в том, чтобы врачи скорой помощи и стационара распознали кардиогенный шок на ранней стадии и направили пациентов к узким специалистам или в центры, которые имеют возможность использовать механическую поддержку кровообращения или выполнить трансплантацию», — сказал он.
Научное положение было опубликовано 6 января в журнале Circulation. В этой статье мы приведем основные разделы.
Полностью поддается лечению
Авторы определяют ФМ как «внезапное и тяжелое воспаление миокарда, приводящее к некрозу миоцитов, отеку и кардиогенному шоку».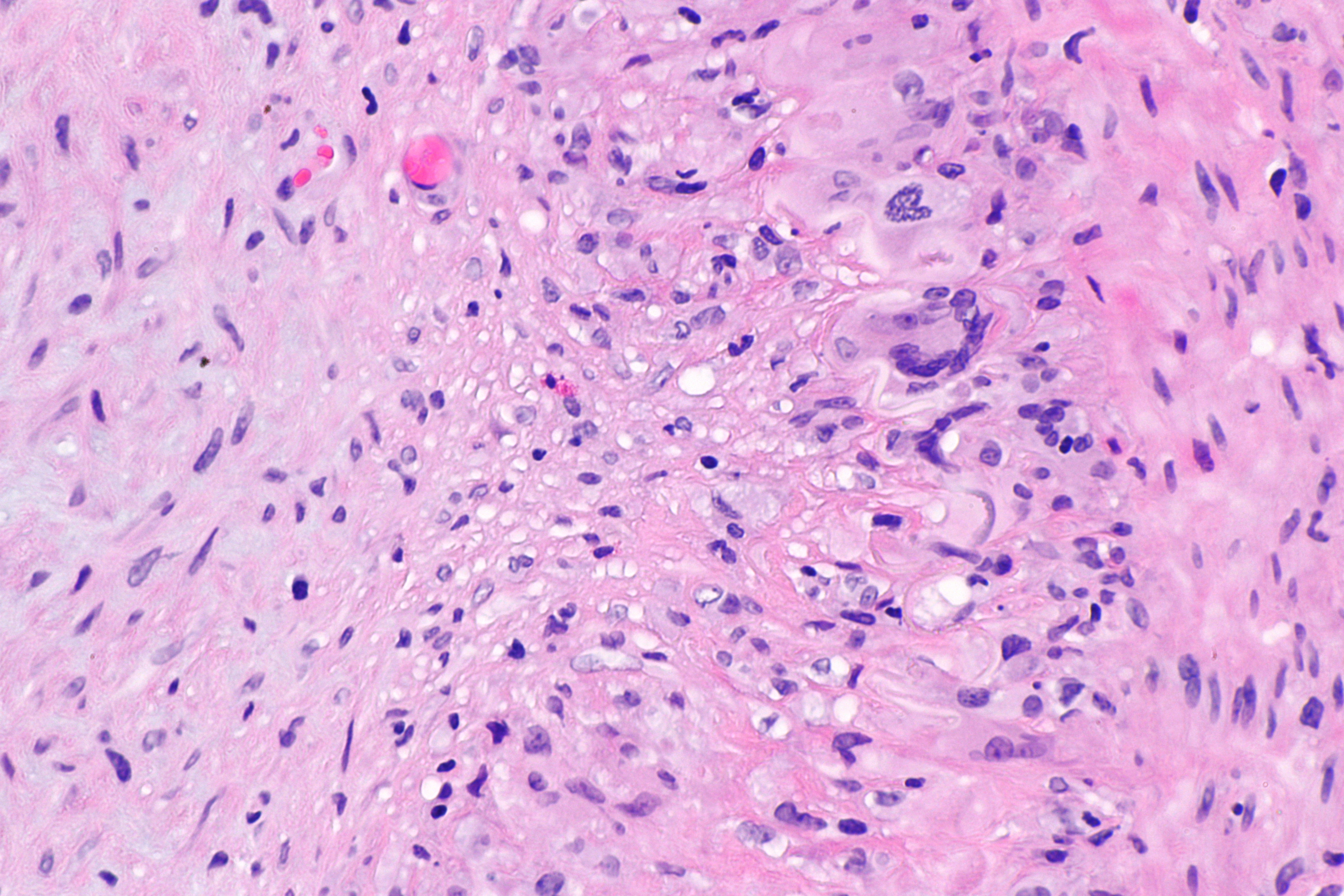
«ФМ чаще поражает молодых, средний возраст составляет около 40 лет, вызывается вирусом, и, хотя ФМ является одной из наименее распространенных причин миокардита, но является чрезвычайно важным, потому что имеет тяжелое течение». Тем не менее, добавил он, «это заболевание полностью излечимо».
Состояния, которые могут привести к ФМ, включают лимфоцитарный миокардит (который может быть вызван воспалительной кардиомиопатией, связанной с аутоиммунными, токсическими или инфекционными причинами) и гигантоклеточный миокардит. Кроме того, миокардит может быть вызван острым некротизирующим эозинофильным миокардитом, обычно связанным с определенными лекарственными средствами (такими как адалимумаб, амоксициллин, карбамазепин, клозапин, спиронолактон и тетрациклин). Авторы отмечают, что к этому списку можно отнести и некоторые новые методы лечения рака. «Важно помнить, что миллионы людей получают эти препараты, и осознавать, что они могут вызвать ФМ», — подчеркнул Купер.
Высокая настороженность
Хотя исторически ФМ диагностировался методом исключения или на аутопсии, современные диагностические технологии позволяют выявлять его на ранней стадии, когда пациент еще жив и может получить эффективную терапию, а современные технологии сделали доступным целый ряд инструментов для лечения этого состояния.
Клинические признаки варьируют в широких пределах. Общее состояние может быть связано или не связано с системными проявлениями инфекции или системным воспалением.
Авторы перечисляют такие симптомы как одышка, боль в груди, нарушение ритма и проводимости сердца, а также быстро развивающийся кардиогенный или смешанный (кардиогенный и распределительный) шок.
Красные флаги, предполагающие наличие ФМ включают в себя:
- Наличие «явных сердечно-сосудистых заболеваний», таких как острый коронарный синдром или острая сердечная недостаточность de novo у молодого пациента
- Наличие в анамнезе признаков или симптомов недавней вирусной инфекции мочевыводящих путей или энтеровирусной инфекции, сопровождающейся сердечно-сосудистыми симптомами у молодых пациентов без типичных сердечно-сосудистых факторов риска
- Наличие шока, электрической нестабильности или быстро развивающихся нарушений проводимости
- Правосторонняя сердечная недостаточность
- Нарушение кровообращения
Авторы отмечают, что на ранних этапах может быть сложно отличить сепсис и кардиогенный шок, вызванные миокардитом у пациентов с лихорадкой, но подчеркивают, что «высокая настороженность оправдана».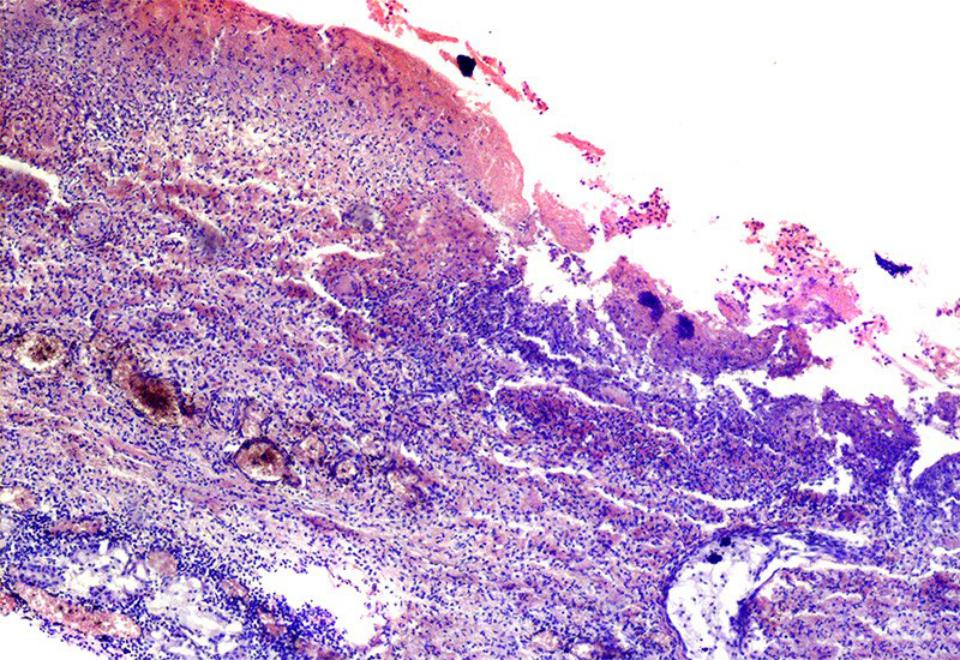
Гемодинамически стабильным пациентам с подозрением на ранний ФМ необходимо провести несколько исследований:
- ЭКГ
- Рентген грудной клетки
- Общий анализ крови с лейкоцитарной формулой
- Базовый биохимический анализ крови, включая функциональные пробы печени
- Натрийуретический пептид
- Газы артериальной или венозной крови
- Посев крови (у пациентов с лихорадкой)
- Сердечный тропонин
Также могут проводиться эхокардиография, МРТ сердца, в том числе с контрастированием.
Лечение
ФМ с кардиогенным шоком или при остановке сердца следует лечить по соответствующим рекомендациям.
Учреждения, не располагающие передовыми возможностями по лечению ФМ и не обладающие экспертными знаниями по ведению миокардитов, должны рассмотреть возможность перевода пациентов в специализированный центр, который может обеспечить механическую поддержку кровообращения и трансплантацию.
Рекомендации по первичному лечению ФМ:
- Избегайте внутривенного введения жидкости пациентам с гипотензией, поскольку это может ухудшить симптомы и гемодинамику в случае острой сердечной недостаточности или кардиогенного шока. Было установлено, что вазопрессорная терапия норэпинефрином превосходит дофамин в случае острого инфаркта миокарда, но эффект применения при ФМ неизвестен.
- Используйте раннюю инвазивную стратегию, чтобы исключить нарушение эпикардиального кровообращения и оценить гемодинамику.
- Эндомиокардиальная биопсия может сократить период гипоперфузии органов и головного мозга и уменьшить время до специфической диагностики причины ФМ, необходимой для специфического лечения.
В положении подробно описывается тактика по проведению и оценке биопсии.
В идеале лечение должна проводить мультидисциплинарная команда.
Гемодинамическая поддержка необходима для стабилизации, а дыхательная поддержка часто необходима для поддержания адекватной перфузии тканей и органов.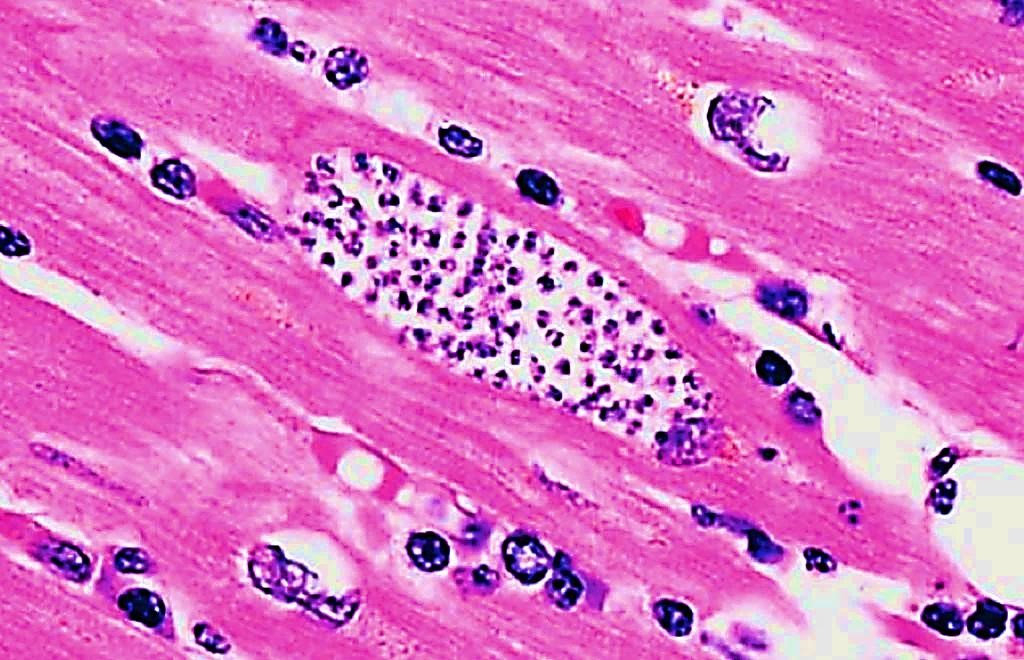 Для этого могут потребоваться механические устройства поддержки кровообращения или экстракорпоральное жизнеобеспечение. Могут использоваться и чрескожно имплантируемые бивентрикулярные устройства.
Для этого могут потребоваться механические устройства поддержки кровообращения или экстракорпоральное жизнеобеспечение. Могут использоваться и чрескожно имплантируемые бивентрикулярные устройства.
Ссылка на положение: https://www.ahajournals.org/doi/10.1161/CIR.0000000000000745
Ссылка на обзор: https://www.medscape.com/viewarticle/923721#vp_1
Миокардит — причины, диагностика и лечение
Что такое миокардит?
Сердце состоит из трех слоев: наружного соединительнотканного, среднего мышечного и внутреннего эндотелиального. Миокардит — это воспалительное заболевание среднего слоя стенки сердца, т.е. сердечной мышцы. Мужчины болеют миокардитом чаще, чем женщины, но обычно переносят его легче. Дети младшего возраста страдают в основном вирусным миокардитом; нередко он имеет молниеносное течение.
Причины миокардита
Существует множество возбудителей, которые вызывают заболевание.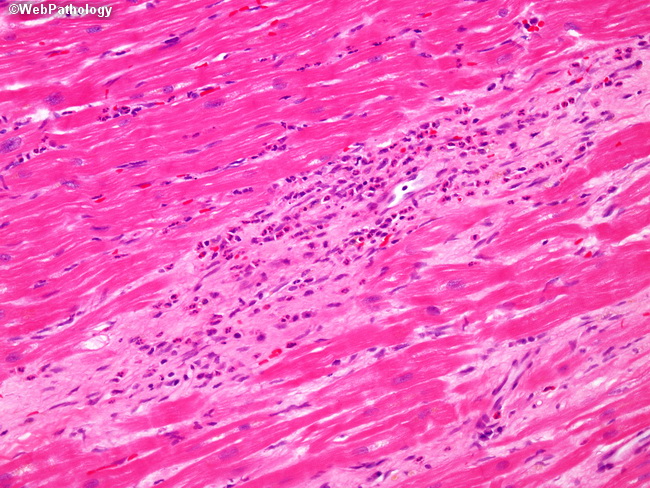
Чаще всего это вирусы:
- вирус Коксаки В
- аденовирус
- парвовирус В19
- вирус простого герпеса
- вирус гриппа А.
Потенциальными возбудителями также считают:
- эховирус (обычно поражает желудочно-кишечный тракт)
- вирус Эпштейна-Барр
- ВИЧ
- вирус краснухи.
Заболевание могут вызвать бактерии:
- стафилококки
- стрептококки
- дифтерийные палочки
- бактерии, вызывающие болезнь Лайма, — боррелии;
паразиты:
- токсоплазмы
- трипаносомы, в том числе вызывающие болезнь Шагаса, — она распространена в Центральной и Южной Америке;
грибы:
- кандиды
- аспергиллы
- гистоплазмы.
Другими причинами миокардита могут быть:
- лекарства или наркотики, которые могут вызвать аллергическую или токсическую реакцию. Это пенициллин и сульфаниламиды, некоторые противосудорожные средства, кокаин.

- химические вещества (окись углерода).
- ожоговая болезнь
- трансплантация органов
- ревматологические заболевания — системная красная волчанка, гранулематоз Вегенера, артериит Такаясу, гигантоклеточный артериит.
Иногда причина миокардита остается неясной.
Классификация
Заболевание разделяют по причинам — инфекционный и неинфекционный миокардит.
По обширности поражения:
- диффузный
- очаговый.
По течению:
- острый
- хронический
- молниеносный.
Код миокардита по МКБ-10
I01.2 — Острый ревматический миокардит
I40 — Инфекционный миокардит
I40.1 — Изолированный миокардит
I41.0 — Миокардит при бактериальных болезнях, классифицированных в других рубриках
I41.1 — Миокардит при вирусных болезнях, классифицированных в других рубриках
I41.2 — Миокардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках
I41. 8 — Миокардит при других болезнях, классифицированных в других рубриках
8 — Миокардит при других болезнях, классифицированных в других рубриках
I51.4 — Миокардит неуточненный
Симптомы и признаки миокардита
В легких случаях миокардит никак себя не проявляет. Пациента могут беспокоить общие признаки вирусной или бактериальной инфекции — слабость, плохое самочувствие, боль в горле, насморк. В более серьезных случаях могут быть следующие симптомы:
- боль в груди
- учащение или нарушения ритма сердца
- одышка при незначительной физической активности или в покое
- отеки лодыжек, стоп
- быстрая утомляемость, усталость
- головная боль
- чувство ломоты в теле, боль в суставах.
Симптомы миокардита у детей
У детей до 2 лет признаки болезни могут стертыми. Обычно обращают на себя внимание:
- беспокойство ребенка или его вялость
- плохой набор веса
- отказ от еды
- повышение температуры
- бледность рук и ног
- потеря сознания
- холодные на ощупь руки и ноги — это признак нарушения кровообращения
- учащение дыхания и/или частоты сердечных сокращений
- нарушения ритма сердца, при этом пульс становится неритмичным.

У детей старше 2 лет симптомы более явные. Ребенок может пожаловаться на:
- боль в груди
- кашель
- сильную усталость
- отечность век, ступней.
Диагностика
Обследование начинают с расспроса пациента и оценки его состояния. Врач осматривает цвет кожи, определяет наличие отеков, прослушивает тоны сердца, оценивает частоту и ритмичность пульса, измеряет температуру. Затем выполняют инструментальное обследование:
- Электрокардиография (ЭКГ). Позволяет определить аритмии, выявить нарушения сократимости миокарда. Только на основании ЭКГ поставить диагноз нельзя, так как нет изменений, характерных только для миокардита.
- Рентгенография грудной клетки. На снимке можно определить размер и форму сердца, выявить скопление жидкости в плевральных синусах, что укажет на сердечную недостаточность.
- Магнитно-резонансная томография (МРТ). Фиксирует размер сердца, его форму и структуру, изменения в двигательной активности мышцы.

- Эхокардиография. Позволяет создавать движущиеся изображения бьющегося сердца. Во время ЭхоКГ можно определить толщину миокарда, выявить расширение камер сердца, снижение насосной функции, жидкость в околосердечной сумке, узнать, есть ли проблемы с клапанами.
- Общий анализ крови. По результатам общего анализа крови можно оценить СОЭ и уровень лейкоцитов — “клеток воспаления”.
- Биохимический анализ поможет определить уровни ферментов, указывающих на повреждение мышц — креатинфосфокиназы, тропонина. Кроме того, в крови можно обнаружить антитела к бактериальным агентам, а методом ПЦР — выявить вирусы.
- Биопсия сердца. Это самый точный способ диагностики, но из-за сложности используется редко.
- Профилирование мини-РНК. Этот новый метод позволяет дифференцировать молниеносную форму миокардита от острой.
Лечение миокардита
В легких случаях терапия не нужна и миокардит проходит самостоятельно. В более тяжелых случаях необходима поддержка сердечной функции до того, как воспаление полностью стихнет. Для снижения нагрузки на сердце пациента госпитализируют либо дают рекомендации по ограничению физической активности.
Для снижения нагрузки на сердце пациента госпитализируют либо дают рекомендации по ограничению физической активности.
Препараты и аппараты для лечения миокардита
- Антибиотики в случае бактериальной инфекции
- Нестероидные противовоспалительные средства
- Антиаритмические препараты
- Антикоагулянты, влияющие на свертываемость крови — чтобы избежать появления тромбов.
Если насосная функция сердца нарушена, то врач рекомендует лекарства, которые уменьшают нагрузку на сердце и устраняют избыток жидкости. Это могут быть:
- Ингибиторы ангиотензин-превращающего фермента — эналаприл, лизиноприл, рамиприл.
- Блокаторы рецепторов ангиотензина II — лозаратан, валсартан.
- Бета-блокаторы — метопролол, бисопролол, карведилол. Эти препараты назначают при сердечной недостаточности и нерегулярном или учащенном сердечном ритме.
- Диуретики (мочегонные), например, фуросемид.
В тяжелых случаях нужна аппаратная поддержка. Применяют:
Применяют:
- Внутриаортальную баллонную контрпульсацию. Это нагнетание крови специальным насосом в аорту, что уменьшает нагрузку на сердце.
- Экстракорпоральную мембранную оксигенацию — насыщение крови кислородом и удаление углекислого газа вне организма, с помощью аппарата.
- Вентрикулярные насосы. Это устройства, которые механически перекачивают кровь из нижних камер сердца в большой круг кровообращения. Вспомогательные насосы нужны при выраженной сердечной недостаточности для того, чтобы дать сердцу восстановиться или для поддержки жизнедеятельности в ожидании трансплантации.
Реабилитация
Важной частью восстановления считают снижение нагрузки на сердце за счет регулирования двигательной активности. Не стоит усердствовать с физическими нагрузками сразу после выздоровления. Иногда лучше в течение нескольких месяцев ограничивать физические упражнения, в том числе ходьбу. О режиме активности и о том, когда можно вернуться к обычной деятельности, нужно посоветоваться с лечащим врачом.
Также важно регулярно посещать врача после выздоровления. Обычно перед визитом нужно выполнить ЭхоКГ, ЭКГ, сдать общий анализ крови.
Если миокардит имеет затяжное течение или есть выраженная сердечная недостаточность, важно придерживаться диеты с ограничением соли, жидкости, алкоголя и курения.
Осложнения
- Сердечная недостаточность. Она возникает из-за снижения насосной функции сердца. При крайней степени сердечной недостаточности показана пересадка сердца.
- Инфаркт миокарда или инсульт. Они обусловлены тромбами, которые блокируют сосуды сердца или мозга.
- Нарушения ритма сердца.
- Внезапная смерть. Поврежденный миокард провоцирует развитие аритмий, которые могут вызвать внезапную остановку сердца.
Прогноз
В большинстве пациенты полностью выздоравливают. При системных заболеваниях прогноз более серьезен и зависит от течения основной болезни. Новорожденные имеют более высокий риск осложнений. В редких случаях необходима пересадка сердца.
Профилактика миокардитов
Специфических методов, защищающих от болезни, нет. Однако снизить риск миокардита можно следующими способами:
- Избегать скоплений людей в период эпидемии гриппа или ОРВИ.
- Регулярно мыть руки с мылом. Это поможет не заболеть инфекционными болезнями.
- Избегать рискованного поведения, т.е. практиковать защищенный секс, не использовать наркотики.
- Беречь себя от клещей. В этом поможет одежда с длинными рукавами, использование репеллентов с ДЭТА.
- Плановая вакцинация. Краснуха и грипп — это болезни, которые могут вызывать миокардит.
Источники
- Myocarditis, Mayo Clinic, Overview http://www.mayoclinic.org/diseases-conditions/myocarditis/basics/definition/CON-20027303?p=1
https://medlineplus.gov/ency/article/007307.htm - Myocarditis — pediatric, MedlinePlus, updated 02. 2019, authors: Neil K. Kaneshiro, MD, MHA, Clinical Professor of Pediatrics, University of Washington School of Medicine, Seattle, WA https://medlineplus.
 gov/ency/article/007307.htm
gov/ency/article/007307.htm - Что мы знаем о миокардитах? РМЖб Медицинское обозрение №12 от 21.07. 2016, авторы: Игнатова Ю.С, Кашталап В.В, Барбараш О.Л http://www.rmj.ru/articles/kardiologiya/ChtomyznaemomiokarditahProblemnyyobzornaosnoveotkrytyhdannyh74191417/
Миокардит | mgzt.ru
Миокардит характеризуется большим количеством симптомов — от легкой одышки и боли в груди, которая может разрешиться самостоятельно, до кардиогенного шока и смерти. Дилатационная кардиомиопатия с хронической сердечной недостаточностью — наиболее частое следствие миокардита. Чаще всего миокардит является результатом вирусной инфекции, реже — других патогенов, токсических или реакций гиперчувствительности, гигантоклеточного миокардита или саркоидоза. Прогноз и лечение зависят от причины. Клинические и гемодинамические данные определяют показания для направления к специалисту для решения вопроса об эндомиокардиальной биопсии.
Даллаские стандартные критерии для диагноза миокардита требуют, чтобы воспалительная клеточная инфильтрация с ассоциацией с некрозом миоцитов или без нее имела место при определенной окраске биоптата ткани сердца. Эти критерии ограничены вариабельностью интерпретации, недостаточной прогностической ценностью, низкой чувствительностью и являются причиной ошибок. Эти недостатки привели к альтернативным критериям, которые основаны на специфической окраске клеток иммунопероксидазой для выявления поверхностных антигенов -анти-CD3, анти-CD4, анти-CD68 и антиген человеческих лейкоцитов. Эти критерии более чувствительны и имеют большую прогностическую ценность.
Эти критерии ограничены вариабельностью интерпретации, недостаточной прогностической ценностью, низкой чувствительностью и являются причиной ошибок. Эти недостатки привели к альтернативным критериям, которые основаны на специфической окраске клеток иммунопероксидазой для выявления поверхностных антигенов -анти-CD3, анти-CD4, анти-CD68 и антиген человеческих лейкоцитов. Эти критерии более чувствительны и имеют большую прогностическую ценность.
Предварительные исследования дают основание полагать, что не-инвазивное МР-сканирование сердца может стать альтернативным для диагноза миокардита без связанной с риском биопсии сердца. Выявленный участок миокардита соответствует участку аномального сигнала при МР-сканировании сердца.
Клинико-патологические критерии могут помочь отличить фуль-минантный лимфоцитарный миокардит от острого лимфоцитарно-го миокардита и обосновать прогностически полезную информацию, которая улучшит чисто пато-логоанатомическую классификацию болезни. На основе этих кли-нико-патологических критериев фульминантный лимфоцитарный миокардит, который начинается с вирусной продромы в пределах 2 недель до появления первых симптомов и гемодинамических нарушений, но, как правило, имеет хороший прогноз, можно дифференцировать от острого лимфоцитарного миокардита, который обычно неотличим по клинике и гемодинамическим отклонениям, но более часто приводит к смерти или требует трансплантации. При применении этих критериев необходимо помнить два обстоятельства. Первое, хотя больные фульминатным лимфоцитарным миокардитом часто выздоравливают, они еще являются больными и требуют лечения (внутривенное введение инотропных препаратов или механическая поддержка кровообращения). Второе, так как обе формы миокардита довольно редки, прогностические данные относительно трансплантации сердца и сроков выживания ограничены всего несколькими пациентами.
При применении этих критериев необходимо помнить два обстоятельства. Первое, хотя больные фульминатным лимфоцитарным миокардитом часто выздоравливают, они еще являются больными и требуют лечения (внутривенное введение инотропных препаратов или механическая поддержка кровообращения). Второе, так как обе формы миокардита довольно редки, прогностические данные относительно трансплантации сердца и сроков выживания ограничены всего несколькими пациентами.
Острый миокардит часто сначала диагностируется как неишемическая дилатационная кардиомиопатия у больных с симптомами, которые присутствуют в течение нескольких недель или месяцев. Однако клинические симптомы колеблются от субклинического заболевания до внезапной смерти при впервые начавшейся пердсердной или желудочковой аритмии, полной сердечной блокады или острых симптомов, напоминающих инфаркт миокарда. Сердечные симптомы весьма вариабельны: утомляемость, снижение толерантности к физической нагрузке, болезненное сердцебиение, боли в области сердца и синкопа. Боли в сердце при миокардите могут быть вызваны перикардитом или, нечасто, спазмом коронарных сосудов.
Боли в сердце при миокардите могут быть вызваны перикардитом или, нечасто, спазмом коронарных сосудов.
Хотя симптомы вирусной продромы с лихорадкой, миалгией и респираторными или гастроинтестинальными симптомами присущи и миокрадиту, симптомы последнего еще более разнообразны. Так, из 3055 больных с острым миокардитом, которые обследовались по программе European Study of the Epidemiology and Treatment of Inflammatory Heart Disease, 72% имели одышку, 32% — боли в области сердца, 18% — аритмию. В большинстве исследований указывается на преобладание болезни у мужчин. Клинические проявления миокардита у детей отличаются от таковых у взрослых. Они чаще дают фульминантное течение. Из-за столь широкого спектра клинических проявлений врачи должны допускать возможность миокардита при наличии у больного многих сердечных симптомов.
У большинства больных с миокардитом, у которых имеет место острая дилатационная кардиоми-опатия, болезнь относительно нетяжелая, разрешается с кратковременными остаточными явлениями. Но определенные клинические признаки указывают на возможность высокого риска: сыпь, лихорадка, эозинофилия, которая может быть связана с лекарственной терапией или гиперсенситивным миокардитом. О гигантокле-точном миокардите следует думать у больных с острой дилата-ционной кардиомиопатией, ассоциированной с тимомой, аутоиммунными нарушениями, желудочковой тахикардией или блокадой сердца высокой степени. Необычная причина миокардита — саркоидоз — может быть заподозрена у больных с хронической сердечной недостаточностью, дилатационной кардиомиопатией или возникшей желудочковой аритмией или сердечной блокадой 2-3-й степени или у тех, у кого нет эффекта от стандартной терапии.
Но определенные клинические признаки указывают на возможность высокого риска: сыпь, лихорадка, эозинофилия, которая может быть связана с лекарственной терапией или гиперсенситивным миокардитом. О гигантокле-точном миокардите следует думать у больных с острой дилата-ционной кардиомиопатией, ассоциированной с тимомой, аутоиммунными нарушениями, желудочковой тахикардией или блокадой сердца высокой степени. Необычная причина миокардита — саркоидоз — может быть заподозрена у больных с хронической сердечной недостаточностью, дилатационной кардиомиопатией или возникшей желудочковой аритмией или сердечной блокадой 2-3-й степени или у тех, у кого нет эффекта от стандартной терапии.
Истинная частота миокардита в популяции неизвестна. Эндомио-кардиальная биопсия используется редко из-за определенного риска и недостаточно широко принятых и чувствительных гистологических стандартов. Сероэпидеми-ологические данные трудно интерпретировать из-за гетерогенного эффекта энтеровирусов, который может быть причиной анамнестических антител к другим Коксаки-вирусам типа В. Однако наблюдение, что вирусный геном более часто определяется в сердечной ткани больных хронической дила-тационной кардиомиопатией, чем в ткани больных с клапанной или ишемической кардиомиаопатией, подтверждает концепцию, что вирусный миокардит приводит к настоящей болезни. Более того, миокардит — важная причина внезапной смерти, так же как и детская кардиомиопатия. Недавно проведенное длительное наблюдение детского миокардита показало, что наибольшая тяжесть болезни уже не будет у ребенка спустя 6-12 лет после того, как был установлен диагноз, тогда как дети при хронической дилатационной кардиомиопатии умирают или им требуется трансплантация сердца.
Однако наблюдение, что вирусный геном более часто определяется в сердечной ткани больных хронической дила-тационной кардиомиопатией, чем в ткани больных с клапанной или ишемической кардиомиаопатией, подтверждает концепцию, что вирусный миокардит приводит к настоящей болезни. Более того, миокардит — важная причина внезапной смерти, так же как и детская кардиомиопатия. Недавно проведенное длительное наблюдение детского миокардита показало, что наибольшая тяжесть болезни уже не будет у ребенка спустя 6-12 лет после того, как был установлен диагноз, тогда как дети при хронической дилатационной кардиомиопатии умирают или им требуется трансплантация сердца.
Вирусы и поствирусные миокардиты остаются наиболее важной причиной острой и хронической дилатационной кардиомиопатии. Сероэпидемиологические и молекулярные исследования выявили связь Коксаки-вирусной инфекции типа В с вспышкой миокардитов в 50-90-е годы. Согласно сообщениям из США и Германии, спектр вирусов, которые были определены в эндомиокардиальных биоптатах, простирались от Коксаки-вирусов типа В во второй половине 1990-х годов и в последующие 5 лет до паровируса В19 и других вирусов.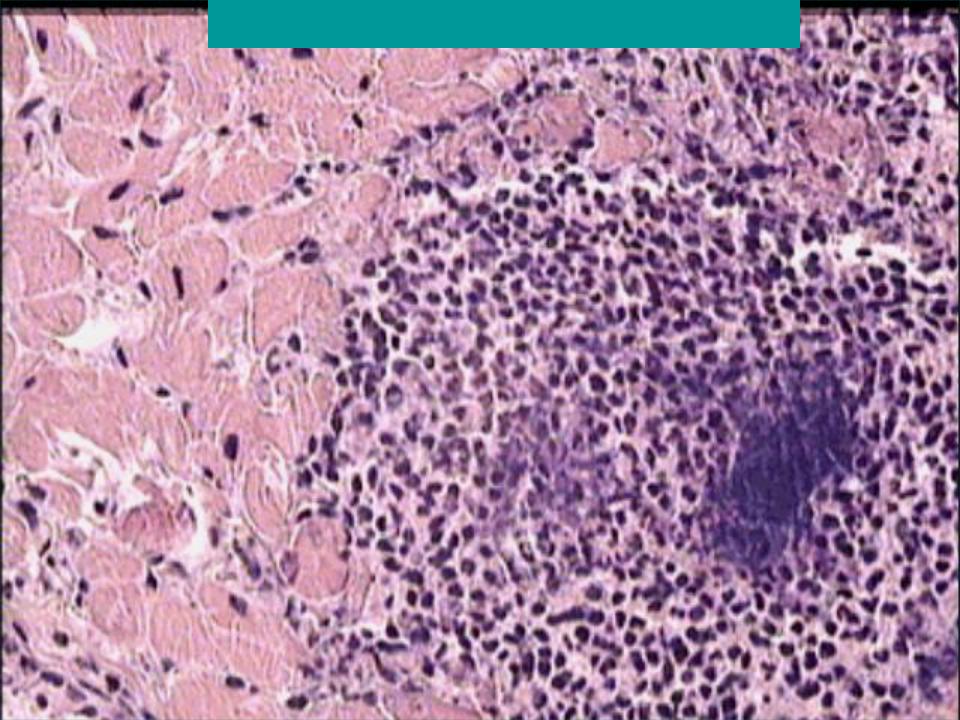 В Японии вирус гепатита С был также связан с миокардитами и дилатационной кардиомиопатией. Многие другие вирусы менее часто, но тоже ассоциированы с миокардитом. Это вирус Эпстайна — Барр, цитомегаловирус, вирус человеческого герпеса 6. Большое число наблюдений связи миокардита с вирусной инфекцией привело к попыткам антивирусной терапии
В Японии вирус гепатита С был также связан с миокардитами и дилатационной кардиомиопатией. Многие другие вирусы менее часто, но тоже ассоциированы с миокардитом. Это вирус Эпстайна — Барр, цитомегаловирус, вирус человеческого герпеса 6. Большое число наблюдений связи миокардита с вирусной инфекцией привело к попыткам антивирусной терапии
больных с вирусассоциированной кардиомиопатией.
Помимо вирусов, определена роль других инфекций как причины миокардита. Болезнь может стать результатом инфицирования Borrelia burgdorferi (болезнь Лайма). Больные болезнью Лайма часто коинфицированы эрлихией (ehrlichia) и бабесией (babesia). Лаймовский миокрадит следует заподозрить у больных с указанием на путешествия в анамнезе в регионы, где эта болезнь эндемична, или подвергшихся укусу клеща, особенно если в клинической картине присутствует нарушение атриовентрикулярной проводимости. В сельских районах Центральной и Южной Африки инфекция Trypanosoma cruzi может протекать как острый миокардит или хроническая кардиомиопатия, иногда вместе с блоком правой ветви или левым передним фасцикулярным блоком. В этих случаях ЭКГ или контрастная вентрикулография может выявить апикальную аневризму левого желудочка, региональное нарушение движения стенки или диффузную кардиомиопатию. Региональное нарушение движения стенки или дефект перфузии, которая не распространяется на коронарную артерию, может также наблюдаться при неинфекционных состояниях, таких как саркоидоз сердца и аритмогенная кардиомиопатия правого желудочка или дисплазия.
В этих случаях ЭКГ или контрастная вентрикулография может выявить апикальную аневризму левого желудочка, региональное нарушение движения стенки или диффузную кардиомиопатию. Региональное нарушение движения стенки или дефект перфузии, которая не распространяется на коронарную артерию, может также наблюдаться при неинфекционных состояниях, таких как саркоидоз сердца и аритмогенная кардиомиопатия правого желудочка или дисплазия.
Миокардиты наиболее часто являются патологоанатомической находкой на аутопсии больных с ВИЧ-инфекцией (50% и более).
Кардиомиопатия у этих больных может быть вызвана ингибированием сердечной сократимости ВИЧ гликопротеином 120, коинфекцией или антивирусной терапией.
Лекарственные реакции гиперчувствительности и системный гиперэозинофильный синдром могут быть причиной специфического миокардита, который часто отвечает на прекращение приема причинного агента или лечение основного заболевания, хотя часто требуется адьювантная терапия кортикостероидами. Многочисленные лекарства, включая антиконвульсанты, антибиотики и антипсихотические средства, могут стать причиной гиперчувствительного миокардита. Эозинофильный миокардит характеризуется предшествующей эозинофильной инфильтрацией миокарда и может ассоциироваться с системными заболеваниями, такими как гиперэозинофиль-ный синдром, синдром Чарга — Страуса, Лефлеровский эндомиокардиальный фиброз, рак, паразитарные, гельминтные или протозойные инфекции. Сообщалось, что эозинофильный миокардит развивался после вакцинации от некоторых болезней, включая ветряную оспу. Клинически он характеризуется застойной сердечной недостаточностью, эндокардиаль-ным и клапанным фиброзом и эндокардиальным тромбозом. Редким заболеванием является некротизирующий эозинофильный миокардит, которому свойственны острое начало и высокая летальность.
Многочисленные лекарства, включая антиконвульсанты, антибиотики и антипсихотические средства, могут стать причиной гиперчувствительного миокардита. Эозинофильный миокардит характеризуется предшествующей эозинофильной инфильтрацией миокарда и может ассоциироваться с системными заболеваниями, такими как гиперэозинофиль-ный синдром, синдром Чарга — Страуса, Лефлеровский эндомиокардиальный фиброз, рак, паразитарные, гельминтные или протозойные инфекции. Сообщалось, что эозинофильный миокардит развивался после вакцинации от некоторых болезней, включая ветряную оспу. Клинически он характеризуется застойной сердечной недостаточностью, эндокардиаль-ным и клапанным фиброзом и эндокардиальным тромбозом. Редким заболеванием является некротизирующий эозинофильный миокардит, которому свойственны острое начало и высокая летальность.
Два идиопатических и гистологически сходных заболевания — гигантоклеточный миокардит и сердечный саркоидоз — довольно редкая, но важная причина кардиомиопатии. Первый из них представляет собой острое заболевание с высоким риском смерти или необходимостью трансплантации сердца и считается аутоиммунным по своей природе из-за ассоциации с аутоиммунными нарушениями, тимомой и лекарственной гиперчувствительностью. Гигантоклеточный миокардит иногда отличается от гораздо более частого поствирусного миокардита наличием желудочковой тахикардии, блокадой сердца и плохим прогнозом вопреки оптимальному лечению. Больные с типичной хронической дилатационной кардиомиопатией и возникшей желудочковой аритмией или блокадой 2-й или 3-й степени или не отвечающие на оптимальную терапию с большой долей вероятности имеют сердечный сар-коидоз или грануломатозный миокардит.
Гигантоклеточный миокардит иногда отличается от гораздо более частого поствирусного миокардита наличием желудочковой тахикардии, блокадой сердца и плохим прогнозом вопреки оптимальному лечению. Больные с типичной хронической дилатационной кардиомиопатией и возникшей желудочковой аритмией или блокадой 2-й или 3-й степени или не отвечающие на оптимальную терапию с большой долей вероятности имеют сердечный сар-коидоз или грануломатозный миокардит.
Миокардит может сочетаться с другими кардиомиопатиями и быть осложнением других болезней. Например, прогноз при амилоидозе сердца значительно ухудшается, если имеет место гистологически подтвержденный миокардит. Высокий процент больных с аритмогенной кардиомиопатией правого желудочка или дисплазией имеет ассоциированный миокардит, часть этих случаев вызвана вирусной инфекцией.
Биомаркеры поражения сердца повышаются незначительно у больных с острым миокардитом, но могут помочь подтвердить диагноз. Тропонин-1 имеет высокую специфичность (80%), но ограниченную чувствительность (34%) в диагностике болезни. Клинические и экспериментальные исследования показали, что повышенный уровень сердечного тропонина-1 отмечается при остром миокардите чаще, чем повышенный уровень креатининкиназы МВ. Незначительное число серологических и визуальных биомаркеров было ассоциировано с плохим прогнозом. Например, относительно высокий уровень сывороточного Fas лиганда и интерлейкина-10 может предсказать повышенный риск смерти, хотя эти анализы не являются широко доступными.
Клинические и экспериментальные исследования показали, что повышенный уровень сердечного тропонина-1 отмечается при остром миокардите чаще, чем повышенный уровень креатининкиназы МВ. Незначительное число серологических и визуальных биомаркеров было ассоциировано с плохим прогнозом. Например, относительно высокий уровень сывороточного Fas лиганда и интерлейкина-10 может предсказать повышенный риск смерти, хотя эти анализы не являются широко доступными.
При остром миокардите ЭКГ может выявить синусовую тахикардию с неспецифическим ST-сегментом и патологической Т-волной. Иногда изменения на ЭКГ наводят на мысль об инфаркте миокарда — повышение ST-сегмента, депрессия ST-сегмента и патологические Q-волны. Перикардит нечасто сопутствует миокардиту клинически и часто проявляется в виде перикар-дитоподобных изменений на ЭКГ. Чувствительность ЭКГ низкая (47%). Наличие Q-волн или блокады левой ветви ассоциируется с высоким риском смерти или трансплантацией сердца.
ЭхоКГ показана для исключения других причин сердечной недостаточности, так как не выявляет специфических признаков острого миокардита. МР-сканирование сердца применяется всё чаще как диагностический тест при подозрении на острый миокардит и может быть использовано для определения места эндомиокардиальной биопсии.
МР-сканирование сердца применяется всё чаще как диагностический тест при подозрении на острый миокардит и может быть использовано для определения места эндомиокардиальной биопсии.
Эндомиокардиальную биопсию следует применять у пациентов с необъяснимой появившейся сердечной недостаточностью менее чем в течение 2 недель при нормальном или дилатированном левом желудочке и гемодинамичес-ких нарушениях при подозрении на фульминантный миокардит. Биопсию также следует применить у пациентов с необъяснимой сердечной недостаточностью в течение 2 недель — 3 месяцев в ассоциации с дилатацией левого желудочка и желудочковой аритмией, или блокадой седрца Mobitz типа II, или блокадой 2-й или 3-й степени и у пациентов, у которых не получен эффект от обычной терапии в течение 1-2 недель, для исключения гигантоклеточного миокардита.
Больных миокардитом с дилатационной кардиомиопатией следует лечить согласно современным рекомендациям Американской ассоциации болезней сердца и ряда других учреждений.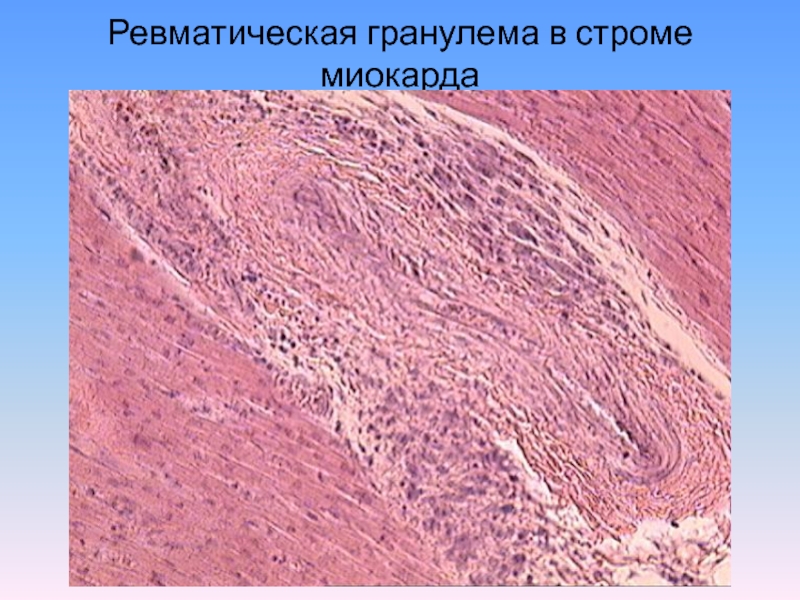 У большинства пациентов наблюдается улучшение при применении стандартной терапии сердечной недостаточности, которая включает ингибиторы АПФ или блокаторы рецепторов ангиотензина. Назначают бета-блокаторы (метопролол и карведилол) и диуретики по показаниям. У больных, у которых состояние ухудшается, несмотря на оптимальную терапию, показана механическая поддержка кровообращения или экстракорпоральная оксигенация как «мост» к трансплантации или выздоровлению. Общая частота выживания после трансплантации по поводу миокардита такая же, как при сердечной недостаточности, вызванной другими причинами. Больным, выздоровевшим от острого миокардита, следует воздержаться от физических нагрузок в течение нескольких месяцев от начала болезни. Применение картеолола (carteolol), неселективного бета-блокатора, улучшает гистопатологические результаты и уменьшает утолщение стенки миокарда при Коксаки-В-вирусном миокардите. Применение НПВП повышает летальность.
У большинства пациентов наблюдается улучшение при применении стандартной терапии сердечной недостаточности, которая включает ингибиторы АПФ или блокаторы рецепторов ангиотензина. Назначают бета-блокаторы (метопролол и карведилол) и диуретики по показаниям. У больных, у которых состояние ухудшается, несмотря на оптимальную терапию, показана механическая поддержка кровообращения или экстракорпоральная оксигенация как «мост» к трансплантации или выздоровлению. Общая частота выживания после трансплантации по поводу миокардита такая же, как при сердечной недостаточности, вызванной другими причинами. Больным, выздоровевшим от острого миокардита, следует воздержаться от физических нагрузок в течение нескольких месяцев от начала болезни. Применение картеолола (carteolol), неселективного бета-блокатора, улучшает гистопатологические результаты и уменьшает утолщение стенки миокарда при Коксаки-В-вирусном миокардите. Применение НПВП повышает летальность.
При миокардите с артимиями также проводится терапия поддержки, так как аритмия обычно разрешается после острой фазы болезни, которая может длиться несколько недель. При остром миокардите временный водитель ритма может потребоваться при бра-дикардии или полной блокаде сердца. При стойкой желудочковой аритмии может потребоваться амиодарон и, возможно, кардиовертер-дефибриллятор даже при наличии еще не купированного острого воспаления.
При остром миокардите временный водитель ритма может потребоваться при бра-дикардии или полной блокаде сердца. При стойкой желудочковой аритмии может потребоваться амиодарон и, возможно, кардиовертер-дефибриллятор даже при наличии еще не купированного острого воспаления.
Применение противовирусных препаратов пока ограничено исследованиями в эксперименте и на очень небольшом числе больных. Поскольку у большинства больных острый миокардит был диагностирован после вирусной инфекции, маловероятно, что противовирусная терапия может оказаться полезной. При персистенции вируса и хронической стойкой дилатационной кардиомиопатии применение интерферона оказалось успешным. Освобождение от вируса было достигнуто у всех больных после противовирусной терапии и сопровождалось улучшением функции левого желудочка. Применение иммуносупрессоров не оправдало надежд.
Рудольф АРТАМОНОВ,
профессор.
По материалам
New England Journal of Medicine.
Гигантоклеточный миокардит — Фонд миокардита
О гигантоклеточном миокардите
Если вы попросите обычного человека определить гигантоклеточный миокардит, велика вероятность, что он не сможет это сделать. То же самое и с большинством врачей. В то время как более распространенный вирусный миокардит считается редким заболеванием, гигантоклеточный миокардит встречается еще реже, ежегодно поражая лишь небольшую часть людей. И хотя это состояние может быть необычным, оно может иметь серьезные последствия.
То же самое и с большинством врачей. В то время как более распространенный вирусный миокардит считается редким заболеванием, гигантоклеточный миокардит встречается еще реже, ежегодно поражая лишь небольшую часть людей. И хотя это состояние может быть необычным, оно может иметь серьезные последствия.
Вот почему Фонд миокардита повысил осведомленность об этой болезни и почти двадцать лет искал лекарство. Здесь мы предоставим простой обзор, чтобы помочь пациентам, их близким и врачам понять гигантоклеточный миокардит.
Что такое гигантоклеточный миокардит?
Гигантоклеточный миокардит в сердце эксплантата пациента. Воспаление сердца окрашивается в фиолетовый цвет.
Первый случай гигантоклеточного миокардита был описан медицинскими работниками в 1905 году.Однако наше понимание болезни все еще развивается. С 1905 по 1987 год все случаи гигантоклеточного миокардита были описаны при вскрытии, при этом выживаемость обычно составляла менее 3 месяцев с момента появления первых симптомов.
В целом гигантоклеточный миокардит — это заболевание с быстрым смертельным исходом, которое может реагировать на некоторые иммунодепрессанты или трансплантацию сердца. Теперь мы знаем, что при ранней диагностике с помощью биопсии сердца и своевременном иммуносупрессивном лечении девяносто процентов пациентов с гигантоклеточным миокардитом выживают как минимум один год.
Благодаря постоянным исследованиям и кропотливым усилиям Фонда миокардита и исследователей миокардита по всему миру, медицинское сообщество теперь имеет больше информации о гигантоклеточном миокардите, чем когда-либо прежде. Хотя это может произойти у людей с аутоиммунными заболеваниями, предстоит еще много работы, чтобы понять это очень редкое и смертельное заболевание.
Что вызывает гигантоклеточный миокардит?
Причина гигантоклеточного миокардита неизвестна, но наблюдения в тканях человека и экспериментальные данные на модели крысы Льюиса предполагают, что заболевание опосредуется Т-лимфоцитами.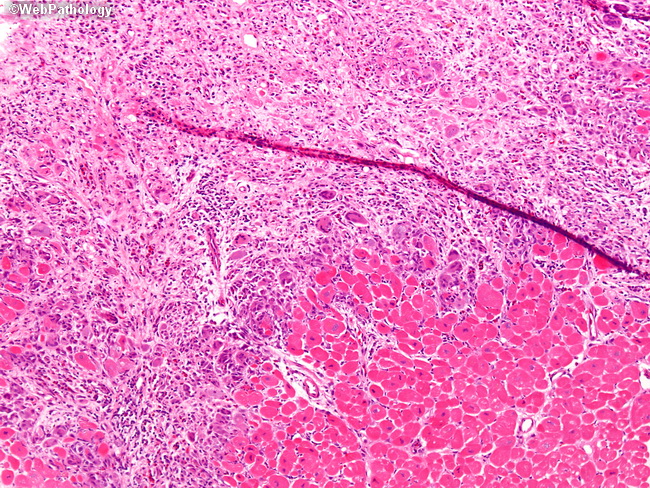
Если причина гигантоклеточного миокардита неизвестна, как его можно вызвать у крыс?
Экспериментальный гигантоклеточный миокардит у крыс Lewis может быть вызван аутоиммунизацией миозином.
Гигантоклеточный миокардит — новое явление?
№ Гигантоклеточный миокардит впервые был описан в 1905 году.
Почему никто не слышал о гигантоклеточном миокардите?
Гигантоклеточный миокардит — очень редкое заболевание. Поэтому многие врачи не знакомы с гигантоклеточным миокардитом.
Как диагностируют и лечат гигантоклеточный миокардит?
Гигантоклеточный миокардит можно подтвердить и диагностировать только с помощью биопсии сердца. Во время этой процедуры катетер вводится в один из крупных кровеносных сосудов в шее или паху. Затем внутрь катетера помещается инструмент, называемый биоптомом, который используется для удаления небольшого кусочка ткани. Это опасная процедура, особенно для тех, кто уже получил бы такую компенсацию с точки зрения сердечной деятельности. Очень важно, чтобы ваши результаты были рассмотрены опытным кардиологом для подтверждения диагноза.
Очень важно, чтобы ваши результаты были рассмотрены опытным кардиологом для подтверждения диагноза.
После постановки диагноза ваш врач назначит иммунодепрессанты и кортикостероиды. Эти лекарства помогают уменьшить воспаление и предотвратить осложнения, включая сердечную недостаточность и аритмию. Хотя многим пациентам в конечном итоге может потребоваться трансплантация, лекарства могут отсрочить необходимость процедуры на месяцы или даже годы.
Можно ли спутать результаты биопсии с другим заболеванием?
Гигантоклеточный миокардит можно спутать с сердечным саркоидозом.Поэтому все подозреваемые случаи должны быть рассмотрены опытным кардиологом.
Как выполняется эндомиокардиальная биопсия?
Тонкая трубка, называемая катетером, вводится в вену или артерию, обычно в паху или шее. Катетер направляется с помощью рентгеновского снимка или эхокардиограммы (сонограммы сердца) и помещается внутрь сердца. Затем в катетер вводится инструмент, называемый биоптомом, который используется для удаления небольшого участка сердца изнутри.
Какие методы лечения гигантоклеточного миокардита?
Одним из методов лечения является назначение пациенту различных иммунодепрессантов в сочетании со стероидами.Другой вариант — пересадка сердца.
Цель иммуносупрессивной терапии — отсрочить трансплантацию сердца. Необходимость пересадки может отложиться на месяцы или даже годы. Поскольку каждый случай уникален, нет типичного времени.
Какова ожидаемая продолжительность жизни пациента после трансплантации гигантоклеточного миокардита?
Посттрансплантационная выживаемость составляет примерно 71% через пять лет, несмотря на 25% -ную инфильтрацию гигантских клеток в сердце донора. Чтобы подтвердить эти результаты, в настоящее время проводится рандомизированное исследование иммуносупрессии, включая муромонаб-CD3, циклоспорин и стероиды.
Что происходит после трансплантации?
Быстрое лечение может дать положительные результаты и снизить уровень смертности или необходимость в трансплантации сердца.
Во многих случаях трансплантат исключает наличие гигантоклеточного миокардита. Тем не менее, у некоторого процента тех, кто получит трансплантат, в новом сердце будет наблюдаться рост гигантских клеток.
Завершаются дополнительные исследования для определения риска роста гигантских клеток в сердцах реципиентов трансплантата.Хотя необходимы дополнительные исследования, ученые считают, что рост этих клеток может быть менее серьезным из-за иммунодепрессантов, которые пациенты принимают, чтобы помочь своему телу принять донорское сердце. А поскольку регулярная биопсия проводится для предотвращения отторжения трансплантата, постоянный мониторинг помогает выявить чрезмерный рост клеток по мере его возникновения.
Почему гигантоклеточный миокардит у пациента с трансплантатом не так серьезен?
Точная причина неизвестна. Но болезнь может быть менее агрессивной, поскольку пациенты принимают иммуносупрессивные препараты, чтобы предотвратить отторжение донорского сердца.
Какой вид лечения гигантоклеточного миокардита используется у пациента после трансплантации?
Лечение в некоторой степени зависит от клинических проявлений, но может включать стероиды в течение 2-3 месяцев.
Как выявляется гигантоклеточный миокардит у пациента с трансплантатом?
Диагноз ставится на основании биопсии сердца, которая обычно проводится у пациента после трансплантации для выявления отторжения донорского сердца.
Если гигантоклеточный миокардит возникает у пациента после трансплантации, сколько времени обычно требуется, чтобы появиться?
Диапазон времени до рецидива широк: от 3 недель до 9 лет после трансплантации, в среднем около года.
Поиск лекарства продолжается
Современные пациенты и медицинские работники имеют больше, чем когда-либо, информации о гигантоклеточном миокардите. Тем не менее, предстоит сделать еще много открытий, и Фонд миокардита оказывает поддержку исследователям и врачам в поисках лекарства. Если вам или вашему близкому был поставлен диагноз гигантоклеточного миокардита, наша обширная исследовательская библиотека и часто задаваемые вопросы могут помочь найти ответы на некоторые из них.Чтобы узнать больше, свяжитесь с нами сегодня или сделайте пожертвование, чтобы внести свой вклад в нашу миссию.
Если вам или вашему близкому был поставлен диагноз гигантоклеточного миокардита, наша обширная исследовательская библиотека и часто задаваемые вопросы могут помочь найти ответы на некоторые из них.Чтобы узнать больше, свяжитесь с нами сегодня или сделайте пожертвование, чтобы внести свой вклад в нашу миссию.
Узнайте больше о миокардите или просмотрите ответы на часто задаваемые вопросы о миокардите, статьи об исследованиях миокардита и фотографии исследований миокардита.
Как диагностируют и лечат гигантоклеточный миокардит (ГКМ)?
Shim SH, Kim DS, Cho W, Nam JH. Вирус Коксаки B3 регулирует инфильтрацию Т-клеток в сердце за счет активации антигена-1, связанной с функцией лимфоцитов, по оси cAMP / Rap1. Дж. Gen Virol .2014 Сентябрь 95: 2010-8. [Медлайн].
Фридрих М.Г., Зехтем У., Шульц-Менгер Дж. И др., Для Международной группы консенсуса по сердечно-сосудистому магнитному резонансу при миокардите. Сердечно-сосудистый магнитный резонанс при миокардите: технический документ JACC. Джам Колл Кардиол . 2009 28 апреля, 53 (17): 1475-87. [Медлайн].
Сердечно-сосудистый магнитный резонанс при миокардите: технический документ JACC. Джам Колл Кардиол . 2009 28 апреля, 53 (17): 1475-87. [Медлайн].
Karatolios K, Pankuweit S, Maisch B. Диагностика и лечение миокардита: роль эндомиокардиальной биопсии. Варианты лечения Curr Cardiovasc Med .2007 декабрь 9 (6): 473-81. [Медлайн].
Cooper LT, Baughman KL, Feldman AM и др. Роль эндомиокардиальной биопсии в лечении сердечно-сосудистых заболеваний: научное заявление Американской кардиологической ассоциации, Американского колледжа кардиологов и Европейского общества кардиологов, одобренное Американским обществом сердечной недостаточности и Ассоциацией сердечной недостаточности Европейского общества кардиологии. Евро Сердце J . 2007 декабря 28 (24): 3076-93.[Медлайн].
Мейсон Дж. У. , О’Коннелл Дж. Б., Херсковиц А. и др. Клиническое испытание иммуносупрессивной терапии миокардита. Исследователи по лечению миокардита. N Английский язык J Med . 1995 г. 3 августа. 333 (5): 269-75. [Медлайн].
, О’Коннелл Дж. Б., Херсковиц А. и др. Клиническое испытание иммуносупрессивной терапии миокардита. Исследователи по лечению миокардита. N Английский язык J Med . 1995 г. 3 августа. 333 (5): 269-75. [Медлайн].
Макнамара Д.М., Голубков Р., Старлинг Р.К. и др. Контролируемое испытание внутривенного иммуноглобулина при недавно развившейся дилатационной кардиомиопатии. Тираж . 2001 8 мая. 103 (18): 2254-9. [Медлайн].
Hia CP, Yip WC, Tai BC, Quek SC. Иммуносупрессивная терапия при остром миокардите: систематический обзор за 18 лет. Арка Дис Детский . 2004 июнь 89 (6): 580-4. [Медлайн].
Canter CE, Simpson KE. Диагностика и лечение миокардита у детей в современную эпоху. Тираж . 2014 7 января. 129 (1): 115-28. [Медлайн].
Thavendiranathan P, Poulin F, Lim KD, Plana JC, Woo A, Marwick TH. Использование визуализации деформации миокарда с помощью эхокардиографии для раннего выявления кардиотоксичности у пациентов во время и после химиотерапии рака: систематический обзор. Джам Колл Кардиол . 2014 июл 1. 63 (25 пт A): 2751-68. [Медлайн].
Мендес Л.А., Дек GW, Пикард М.Х., Паласиос И.Ф., Ньюэлл Дж., Давидофф Р.Дисфункция правого желудочка: независимый предиктор неблагоприятного исхода у пациентов с миокардитом. Am Heart J . 1994 августа 128 (2): 301-7. [Медлайн].
Shields RC, Tazelaar HD, Berry GJ, Cooper LT Jr.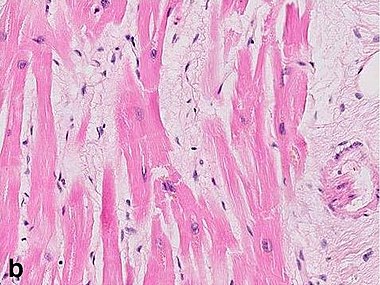 Роль эндомиокардиальной биопсии правого желудочка при идиопатическом гигантоклеточном миокардите. J Card Fail . 2002 Апрель 8 (2): 74-8. [Медлайн].
Роль эндомиокардиальной биопсии правого желудочка при идиопатическом гигантоклеточном миокардите. J Card Fail . 2002 Апрель 8 (2): 74-8. [Медлайн].
Янси К.В., Джессап М., Бозкурт Б. и др., Для членов писательского комитета Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям.Руководство ACCF / AHA по лечению сердечной недостаточности, 2013 г.: отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации о практических рекомендациях. Тираж . 2013 15 октября 128 (16): e240-327. [Медлайн].
Veia A, Cavallino C, Bacchini S и др. Идиопатический гигантоклеточный миокардит: современное состояние. WJCD . 2014 май. 4 (6): 316-24. [Полный текст].
Cooper LT Jr, Берри Г. Дж., Шабетаи Р.Идиопатический гигантоклеточный миокардит — естественное течение и лечение. Исследователи группы по исследованию многоцентрового гигантоклеточного миокардита. N Английский язык J Med . 1997, 26 июня. 336 (26): 1860-6. [Медлайн].
Дж., Шабетаи Р.Идиопатический гигантоклеточный миокардит — естественное течение и лечение. Исследователи группы по исследованию многоцентрового гигантоклеточного миокардита. N Английский язык J Med . 1997, 26 июня. 336 (26): 1860-6. [Медлайн].
Hufnagel G, Pankuweit S, Richter A, Schonian U, Maisch B. Европейское исследование эпидемиологии и лечения сердечных воспалительных заболеваний (ESETCID). Первые эпидемиологические результаты. Герц . 2000 Май. 25 (3): 279-85. [Медлайн].
Drazner MH.Прогрессирование гипертонической болезни сердца. Тираж . 2011 25 января. 123 (3): 327-34. [Медлайн].
Эчуффо-Чеугуи Дж. Б., Эркоу С., Батлер Дж., Янси К. В., Фонаров Г. К.. Оценка риска прогрессирования от бессимптомной дисфункции левого желудочка до явной сердечной недостаточности: систематический обзор и метаанализ.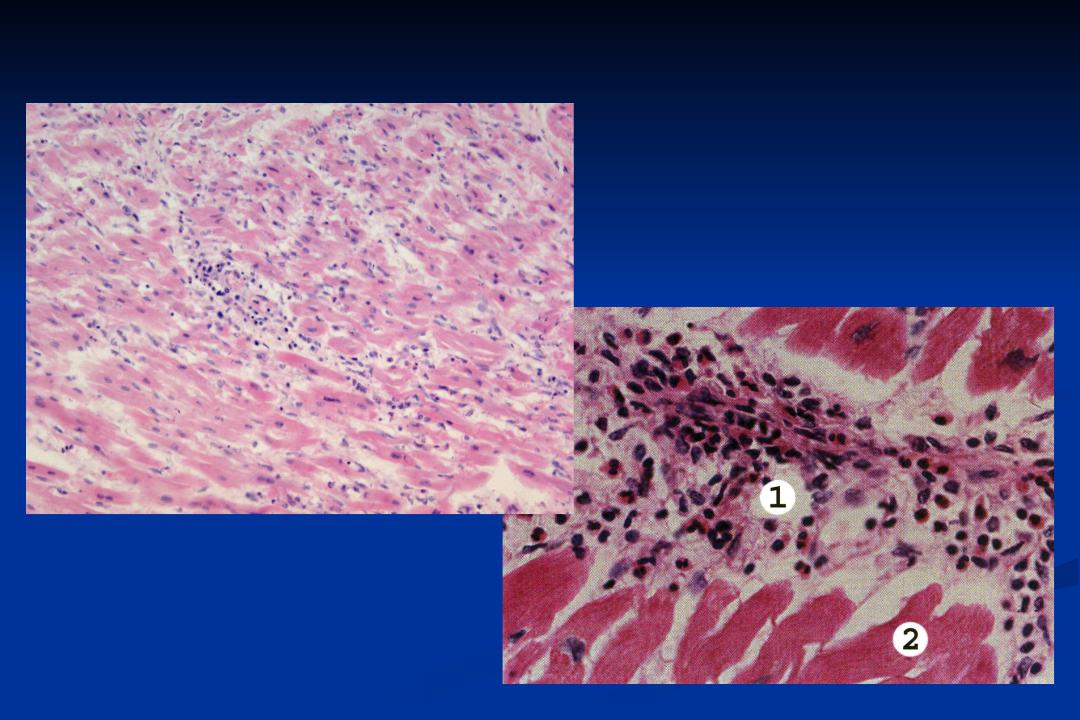 JACC Heart Fail . 2016 4 (4): 237-48. [Медлайн].
JACC Heart Fail . 2016 4 (4): 237-48. [Медлайн].
Zile MR, Baicu CF, Ikonomidis JS, et al. Жесткость миокарда у пациентов с сердечной недостаточностью и сохраненной фракцией выброса: вклад коллагена и тайтина. Тираж . 2015, 7 апреля. 131 (14): 1247-59. [Медлайн].
Шапиро Б.П., Ован Т.Э., Мохаммед С. и др. Передача сигналов минералокортикоидами при переходе к сердечной недостаточности с нормальной фракцией выброса. Гипертония . 2008 Февраль 51 (2): 289-95. [Медлайн].
Ахмед С.Х., Кларк Л.Л., Пеннингтон В.Р. и др. Матричные металлопротеиназы / тканевые ингибиторы металлопротеиназ: взаимосвязь между изменениями протеолитических детерминант состава матрикса и структурными, функциональными и клиническими проявлениями гипертонической болезни сердца. Тираж . 2006 г. 2 мая. 113 (17): 2089-96. [Медлайн].
113 (17): 2089-96. [Медлайн].
Hsu RC, Burak J, Tiwari S, Chakraborti C, Sander GE. Кардиомиопатия Шагаса в Новом Орлеане и на юго-востоке США. Охснер Дж. . Осень 2016 г. 16 (3): 304-8. [Медлайн].
Вирани С.С., Хан А.Н., Мендоса С.Е., Феррейра А.С., де Марчена Э. Кардиомиопатия Такоцубо или синдром разбитого сердца. Tex Heart Inst J . 2007. 34 (1): 76-9. [Медлайн].
Барбаро Г.Сердечно-сосудистые проявления ВИЧ-инфекции. Тираж . 2002, 10 сентября. 106 (11): 1420-5. [Медлайн].
Барбаро Дж., Ди Лоренцо Дж., Сольдини М. и др. Интенсивность миокардиальной экспрессии индуцибельной синтазы оксида азота влияет на клиническое течение кардиомиопатии, связанной с вирусом иммунодефицита человека. Gruppo Italiano per lo Studio Cardiologico dei pazienti affetti da AIDS (GISCA).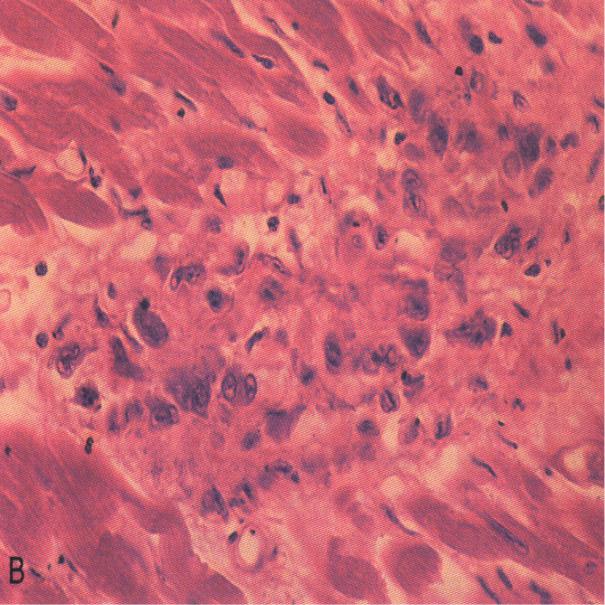 Тираж . 1999 31 августа, 100 (9): 933-9. [Медлайн].
Тираж . 1999 31 августа, 100 (9): 933-9. [Медлайн].
Mehta PA, Dubrey SW.Сердечная недостаточность с высоким выбросом. QJM . 2009 апр. 102 (4): 235-41. [Медлайн].
Гуццо-Мерелло Г., Кобо-Маркос М., Гальего-Дельгадо М., Гарсия-Павиа П. Алкогольная кардиомиопатия. Мир Дж. Кардиол . 2014 26 августа. 6 (8): 771-81. [Медлайн].
Паван Д., Николози Г.Л., Лестуцци С., Бурелли С., Зардо Ф., Зануттини Д. Нормализация переменных функции левого желудочка у пациентов с алкогольной кардиомиопатией после прекращения чрезмерного употребления алкоголя: эхокардиографическое исследование. Евро Сердце J . 1987 май. 8 (5): 535-40. [Медлайн].
Mouhaffel AH, Madu EC, Satmary WA, Fraker TD Jr. Сердечно-сосудистые осложнения кокаина.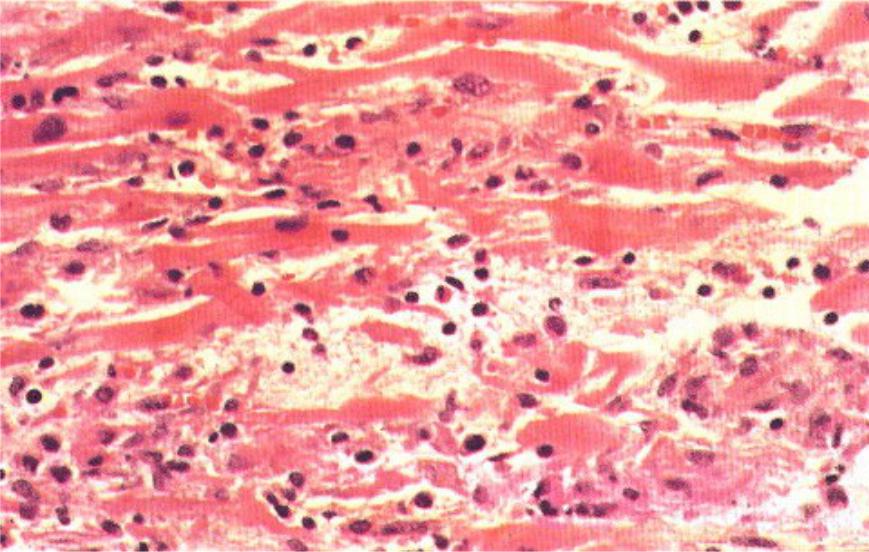 Сундук . 1995 Май. 107 (5): 1426-34. [Медлайн].
Сундук . 1995 Май. 107 (5): 1426-34. [Медлайн].
Купер С.Дж., Саид С., Алхатиб Х. и др. Дилатационная кардиомиопатия, вторичная по отношению к хроническому злоупотреблению кокаином: отчет о болезни. BMC Res Примечания . 2013 17 декабря, 6: 536. [Медлайн].
Хаммель М., Унтервальд EM.Рецептор дофамина D1: предполагаемая нейрохимическая и поведенческая связь с действием кокаина. Дж. Клеточная Физиология . 2002 апр. 191 (1): 17-27. [Медлайн].
Restrepo CS, Rojas CA, Martinez S, et al. Сердечно-сосудистые осложнения кокаина: результаты визуализации. Эмерг Радиол . 2009 16 января (1): 11-9. [Медлайн].
Vasica G, Tennant CC. Употребление кокаина и сердечно-сосудистые осложнения. Med J Aust . 2002 Сен 2. 177 (5): 260-2.[Медлайн].
177 (5): 260-2.[Медлайн].
Lange RA, Cigarroa RG, Flores ED, et al. Усиление кокаин-индуцированной вазоконстрикции коронарных артерий за счет бета-адренергической блокады. Энн Интерн Мед. 15 июня 1990 г. 112 (12): 897-903. [Медлайн].
Варгас Р., Гиллис Р.А., Рамвелл П.В. Пропранолол способствует спазму коронарной артерии свиньи, вызванному кокаином. Дж Фармакол Эксп Тер . 1991 Май. 257 (2): 644-6. [Медлайн].
Guinn MM, Bedford JA, Wilson MC.Антагонизм внутривенной летальности кокаина у нечеловеческих приматов. Клин Токсикол . 1980 июн.16 (4): 499-508. [Медлайн].
Hilfiker-Kleiner D, Haghikia A, Nonhoff J, Bauersachs J. Перипартальная кардиомиопатия: текущее лечение и перспективы на будущее. Евро Сердце J . 2015 7 мая.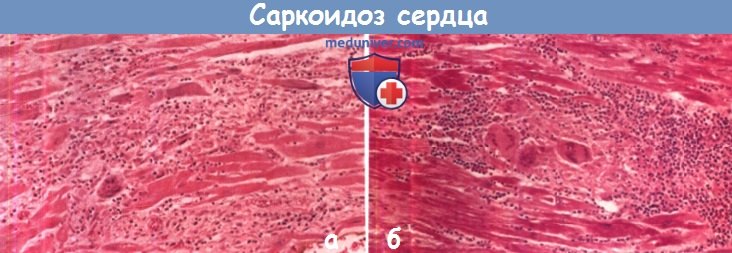 36 (18): 1090-7. [Медлайн].
36 (18): 1090-7. [Медлайн].
Chung E, Leinwand LA. Беременность как модель сердечного стресса. Cardiovasc Res . 2014 15 марта. 101 (4): 561-70.[Медлайн].
Haghikia A, Podewski E, Libhaber E, et al. Фенотипирование и результаты современного лечения в немецкой когорте пациентов с перинатальной кардиомиопатией. Базовый Рес Кардиол . 2013 Июль 108 (4): 366. [Медлайн].
Форстер О., Хилфикер-Кляйнер Д., Ансари А.А. и др. Изменение уровня IFN-гамма, oxLDL и пролактина в сыворотке коррелирует с клиническим улучшением у пациентов с кардиомиопатией в период родов. евро J Сердечная недостаточность .2008 Сентябрь 10 (9): 861-8. [Медлайн].
Слива К., Фетт Дж., Элькаям У. Перипартальная кардиомиопатия. Ланцет . 19 августа 2006 г. 368 (9536): 687-93. [Медлайн].
368 (9536): 687-93. [Медлайн].
Слива К., Скудицки Д., Кэнди Г., Бергеманн А., Хопли М., Сарели П. Добавление пентоксифиллина к традиционной терапии улучшает исход у пациентов с кардиомиопатией в послеродовом периоде. евро J Сердечная недостаточность . 2002 июн. 4 (3): 305-9. [Медлайн].
Слива К., Блаувет Л., Тибазарва К. и др.Оценка бромокриптина в лечении острой тяжелой перипартальной кардиомиопатии: пилотное исследование, подтверждающее правильность концепции. Тираж . 2010 апр. 6. 121 (13): 1465-73. [Медлайн].
Сьюард Дж. Б., Касакланг-Верзоса Г. Инфильтративные сердечно-сосудистые заболевания: похожие кардиомиопатии. Джам Колл Кардиол . 2010, 27 апреля. 55 (17): 1769-79. [Медлайн].
Кляйн А.Л., Хатле Л.К., Бурстоу Д. Д. и др. Допплеровская характеристика диастолической функции левого желудочка при сердечном амилоидозе. Джам Колл Кардиол . 1989 Apr, 13 (5): 1017-26. [Медлайн].
Д. и др. Допплеровская характеристика диастолической функции левого желудочка при сердечном амилоидозе. Джам Колл Кардиол . 1989 Apr, 13 (5): 1017-26. [Медлайн].
Falk RH. Диагностика и лечение сердечных амилоидозов. Тираж . 2005 27 сентября. 112 (13): 2047-60. [Медлайн].
Фальк Р. Х., Александр К. М., Ляо Р., Дорбала С. А.Л. (легкая цепь) кардиальный амилоидоз: обзор диагностики и терапии. Джам Колл Кардиол . 2016 20 сентября. 68 (12): 1323-41. [Медлайн].
О Дж. К., Сьюард Дж. Б., Таджик А. Дж. Руководство Echo . 3-е изд. Филадельфия, Пенсильвания: Lippincott Williams & Wilkins; 2006.
Гольдман М.Э., Кантор Р., Шварц М.Ф., Бейкер М., Десник Р.Дж. Эхокардиографические аномалии и тяжесть заболевания при болезни Фабри. Джам Колл Кардиол . 1986 Май. 7 (5): 1157-61. [Медлайн].
Джам Колл Кардиол . 1986 Май. 7 (5): 1157-61. [Медлайн].
Pieroni M, Chimenti C, De Cobelli F и др. Кардиомиопатия при болезни Фабри: эхокардиографическое определение компартментализации эндомиокардиальных гликосфинголипидов. Джам Колл Кардиол . 18 апреля 2006 г. 47 (8): 1663-71. [Медлайн].
Оммен С.Р., Нисимура Р.А., Эдвардс В.Д. Болезнь Фабри: имитация обструктивной гипертрофической кардиомиопатии ?. Сердце . 2003 августа 89 (8): 929-30. [Медлайн].
Коунас С., Деметреску С., Пантазис А.А. и др. Бинарный вид эндокарда — плохой отличительный признак болезни Андерсона-Фабри от семейной гипертрофической кардиомиопатии. Джам Колл Кардиол .2008 27 мая. 51 (21): 2058-61. [Медлайн].
Vohringer M, Mahrholdt H, Yilmaz A, Sechtem U. Значение позднего увеличения гадолиния в сердечно-сосудистой магнитно-резонансной томографии (CMR). Герц . 2007 марта 32 (2): 129-37. [Медлайн].
Значение позднего увеличения гадолиния в сердечно-сосудистой магнитно-резонансной томографии (CMR). Герц . 2007 марта 32 (2): 129-37. [Медлайн].
De Cobelli F, Esposito A, Belloni E, et al. МРТ сердца с отсроченным усилением для дифференциации болезни Фабри от симметричной гипертрофической кардиомиопатии. AJR Ам Дж. Рентгенол .2009 Март 192 (3): W97-102. [Медлайн].
Smedema JP, Snoep G, van Kroonenburgh MP, et al. Оценка точности сердечно-сосудистого магнитного резонанса с усилением гадолиния в диагностике сердечного саркоидоза. Джам Колл Кардиол . 2005 17 мая. 45 (10): 1683-90. [Медлайн].
Уэмура А., Моримото С., Хирамицу С., Като Ю., Ито Т., Хисида Х. Гистологическая диагностика сердечного саркоидоза: оценка биопсии эндомиокарда. Am Heart J . 1999, август 138 (2, часть 1): 299-302. [Медлайн].
[Медлайн].
Чиу Ч.З., Накатани С., Чжан Г. и др. Предотвращение ремоделирования левого желудочка с помощью длительной терапии кортикостероидами у пациентов с саркоидозом сердца. Ам Дж. Кардиол . 2005 г. 1. 95 (1): 143-6. [Медлайн].
Smedema JP, Snoep G, van Kroonenburgh MP, et al. Поражение сердца у пациентов с легочным саркоидозом оценивалось в двух университетских медицинских центрах в Нидерландах. Сундук . 2005 июл.128 (1): 30-5. [Медлайн].
Сехри В., Санал С., Делорензо Л.Дж., Ароноу В.С., Магуайр Г.П. Сердечный саркоидоз: подробный обзор. Арк Мед Науки . 2011 7 августа (4): 546-54. [Медлайн].
Grant SC, Леви RD, Venning MC, Ward C, Brooks NH. Гранулематоз Вегенера и сердце. Br Сердце J . 1994, январь 71 (1): 82-6. [Медлайн].
[Медлайн].
Hoffman GS, Kerr GS, Leavitt RY, et al.Гранулематоз Вегенера: анализ 158 больных. Энн Интерн Мед. 1992 15 марта. 116 (6): 488-98. [Медлайн].
Oliveira GH, Seward JB, Tsang TS, Specks U. Эхокардиографические данные у пациентов с гранулематозом Вегенера. Майо Клин Proc . 2005 ноябрь 80 (11): 1435-40. [Медлайн].
Гуджа П., Розинг Д. Р., Триподи Д. Д., Шизукуда Ю. Кардиомиопатия с перегрузкой железом: лучшее понимание возрастающего расстройства. Джам Колл Кардиол .2010 21 сентября. 56 (13): 1001-12. [Медлайн].
Дерево JC. Сердечное железо при различных заболеваниях, зависимых от переливания крови. Кровь Ред. . 2008 г., 22 декабря, приложение 2: S14-21. [Медлайн].
Шмитт Б., Голуб Р.М., Грин Р.Скрининг пациентов первичного звена на наследственный гемохроматоз с насыщением трансферрина и уровнем ферритина в сыворотке: систематический обзор для Американского колледжа врачей. Энн Интерн Мед. 2005 г., 4 октября. 143 (7): 522-36. [Медлайн].
Qaseem A, Aronson M, Fitterman N, et al, для Подкомитета по оценке клинической эффективности Американского колледжа врачей. Скрининг наследственного гемохроматоза: руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. 2005 Октябрь 4. 143 (7): 517-21. [Медлайн].
McKee PA, Castelli WP, McNamara PM, Kannel WB. Естественная история застойной сердечной недостаточности: исследование Фрамингема. N Английский язык J Med . 1971, 23 декабря. 285 (26): 1441-6. [Медлайн].
Естественная история застойной сердечной недостаточности: исследование Фрамингема. N Английский язык J Med . 1971, 23 декабря. 285 (26): 1441-6. [Медлайн].
Костанцо М.Р., Августин С., Бурж Р. и др. Отбор и лечение кандидатов на трансплантацию сердца. Заявление для медицинских работников Комитета по сердечной недостаточности и трансплантации сердца Совета по клинической кардиологии Американской кардиологической ассоциации. Тираж . 1995 15 декабря. 92 (12): 3593-612. [Медлайн].
Манчини Д.М., Эйзен Х., Куссмаул В., Малл Р., Эдмундс Л. Х. мл., Уилсон-мл. Значение пикового потребления кислорода при физической нагрузке для оптимального времени трансплантации сердца у амбулаторных пациентов с сердечной недостаточностью. Тираж . 1991, март, 83 (3): 778-86. [Медлайн].
Ликофф MJ, Чендлер SL, Кей HR.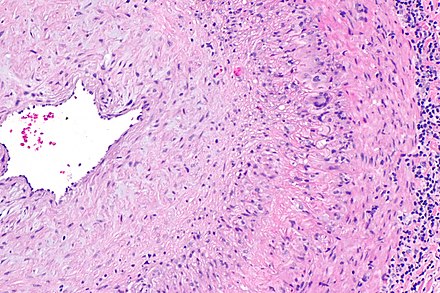 Клинические детерминанты смертности при хронической застойной сердечной недостаточности, вторичной по отношению к идиопатической дилатационной или ишемической кардиомиопатии. Ам Дж. Кардиол . 1987 г. 1. 59 (6): 634-8. [Медлайн].
Клинические детерминанты смертности при хронической застойной сердечной недостаточности, вторичной по отношению к идиопатической дилатационной или ишемической кардиомиопатии. Ам Дж. Кардиол . 1987 г. 1. 59 (6): 634-8. [Медлайн].
Стелкен А.М., Юнис Л.Т., Дженнисон С.Х. и др. Прогностическая ценность кардиопульмональных нагрузочных тестов с использованием процента достижения прогнозируемого пикового потребления кислорода для пациентов с ишемической и дилатационной кардиомиопатией. Джам Колл Кардиол . 1996, 27 февраля (2): 345-52. [Медлайн].
Albouaini K, Egred M, Alahmar A, Wright DJ. Сердечно-легочная физическая нагрузка и ее применение. Постградская медицина J . 2007 ноябрь 83 (985): 675-82. [Медлайн].
Опасич С., Пинна Г.Д., Боббио М. и др. Пиковое потребление кислорода при хронической сердечной недостаточности при физической нагрузке: к эффективному использованию у отдельных пациентов. Джам Колл Кардиол . 1998 15 марта. 31 (4): 766-75. [Медлайн].
Джам Колл Кардиол . 1998 15 марта. 31 (4): 766-75. [Медлайн].
Corra U, Mezzani A, Bosimini E, Giannuzzi P. Сердечно-легочные нагрузки и прогноз при хронической сердечной недостаточности: алгоритм прогнозирования для конкретного пациента. Сундук . 2004 Сентябрь 126 (3): 942-50. [Медлайн].
La Vecchia L, Mezzena G, Zanolla L, et al. Сердечный тропонин I как диагностический и прогностический маркер тяжелой сердечной недостаточности. J Пересадка легкого сердца . 2000 июля 19 (7): 644-52. [Медлайн].
Peacock WF, Emerman CE, Doleh M, Civic K, Butt S. Ретроспективный обзор: частота ИМ без подъема сегмента ST у пациентов отделения неотложной помощи с декомпенсированной сердечной недостаточностью. Застойная сердечная недостаточность . 2003 ноябрь-декабрь. 9 (6): 303-8. [Медлайн].
Ван С.С., Фитцджеральд Дж. М., Шульцер М., Мак Э., Аяс Н. Т.. У этого пациента с одышкой в отделении неотложной помощи застойная сердечная недостаточность? ЯМА . 2005 Октябрь 19, 294 (15): 1944-56. [Медлайн].
Цутамото Т., Вада А., Маеда К. и др. Ослабление компенсации эндогенной сердечной натрийуретической пептидной системы при хронической сердечной недостаточности: прогностическая роль концентрации натрийуретического пептида в плазме мозга у пациентов с хронической симптоматической дисфункцией левого желудочка. Тираж . 1997 15 июля. 96 (2): 509-16. [Медлайн].
МакМюррей Дж. Дж., Пакер М., Десаи А.С. и др. Для исследователей и комитетов PARADIGM-HF. Ингибирование ангиотензин-неприлизина по сравнению с эналаприлом при сердечной недостаточности. N Английский язык J Med . 2014 11 сентября. 371 (11): 993-1004. [Медлайн].
371 (11): 993-1004. [Медлайн].
Sachdeva A, Horwich TB, Fonarow GC. Сравнение эффективности каждого из пяти предикторов смертности и срочной трансплантации у пациентов с тяжелой сердечной недостаточностью. Ам Дж. Кардиол . 2010 сен 15. 106 (6): 830-5. [Медлайн].
Francone M. Роль магнитного резонанса сердца в оценке дилатационной кардиомиопатии: диагностический вклад и прогностическое значение. ISRN Радиол . 2014. 2014: 365404. [Медлайн]. [Полный текст].
Лессик Дж., Мутлак Д., Рисплер С. и др. Сравнение мультидетекторной компьютерной томографии и эхокардиографии для оценки регионарной функции левого желудочка. Ам Дж. Кардиол . 2005 октября 1. 96 (7): 1011-5. [Медлайн].
Abunassar JG, Yam Y, Chen L, D’Mello N, Chow BJ. Полезность шкалы Агатстона = 0 для исключения ишемической кардиомиопатии у пациентов с сердечной недостаточностью. Ам Дж. Кардиол . 2011 г. 1 февраля. 107 (3): 428-32. [Медлайн].
Полезность шкалы Агатстона = 0 для исключения ишемической кардиомиопатии у пациентов с сердечной недостаточностью. Ам Дж. Кардиол . 2011 г. 1 февраля. 107 (3): 428-32. [Медлайн].
Левин А, Хехт HS. КТ-ангиография сердца при застойной сердечной недостаточности. Дж. Nucl Med . 2015 Июнь 56, приложение 4: 46S-51S. [Медлайн].
Бхатти С., Хаким А., Юсуф М.А., Аль-Халиди Х.Р., Мазур В., Шизукуда Ю.Диагностическая эффективность компьютерной томографической ангиографии для дифференциации ишемической и неишемической кардиомиопатии. Дж Нукл Кардиол . 2011 Май. 18 (3): 407-20. [Медлайн].
[Рекомендации] Хант С.А., Абрахам В.Т., Чин М.Х. и др. Для Фонда Американского колледжа кардиологов, Американской кардиологической ассоциации. 2009 г. Целенаправленное обновление, включенное в Руководство ACC / AHA 2005 г. по диагностике и лечению сердечной недостаточности у взрослых Отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации о практических рекомендациях, разработанных в сотрудничестве с Международным обществом сердца и легких Трансплантация. Джам Колл Кардиол . 14 апреля 2009 г. 53 (15): e1-e90. [Медлайн].
по диагностике и лечению сердечной недостаточности у взрослых Отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации о практических рекомендациях, разработанных в сотрудничестве с Международным обществом сердца и легких Трансплантация. Джам Колл Кардиол . 14 апреля 2009 г. 53 (15): e1-e90. [Медлайн].
[Рекомендации] Янси К.В., Джессап М., Бозкурт Б. и др. ACC / AHA / HFSA 2016 сосредоточили внимание на обновленной информации о новой фармакологической терапии сердечной недостаточности: обновленное руководство ACCF / AHA по лечению сердечной недостаточности 2013 года: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по клиническим практическим рекомендациям и Американское общество сердечной недостаточности. Джам Колл Кардиол .2016 27 сентября. 68 (13): 1476-88. [Медлайн].
Teerlink JR.Ивабрадин при сердечной недостаточности — СМЕНЫ парадигмы… пока. Ланцет . 2010 11 сентября. 376 (9744): 847-9. [Медлайн].
van Veldhuisen DJ, Genth-Zotz S, Brouwer J, et al. Ингибирование АПФ в высоких и низких дозах при хронической сердечной недостаточности: двойное слепое плацебо-контролируемое исследование имидаприла. Джам Колл Кардиол . 1998 Декабрь 32 (7): 1811-8. [Медлайн].
Следователи СОЛВД. Влияние эналаприла на выживаемость у пациентов со сниженной фракцией выброса левого желудочка и застойной сердечной недостаточностью. N Английский язык J Med . 1 августа 1991 г. 325 (5): 293-302. [Медлайн].
Пакер М., Пул-Уилсон П.А., Армстронг П.В. и др. Сравнительные эффекты низких и высоких доз ингибитора ангиотензинпревращающего фермента, лизиноприла, на заболеваемость и смертность при хронической сердечной недостаточности.Исследовательская группа ATLAS. Тираж . 1999, 7 декабря. 100 (23): 2312-8. [Медлайн].
Пул-Уилсон П.А., Сведберг К., Клеланд Дж. Г. и др., Для европейских исследователей исследования карведилола или метопролола.Сравнение карведилола и метопролола по клиническим исходам у пациентов с хронической сердечной недостаточностью в Европейском исследовании карведилола или метопролола (COMET): рандомизированное контролируемое исследование. Ланцет . 2003 июл 5. 362 (9377): 7-13. [Медлайн].
Flather MD, Shibata MC, Coats AJ, et al, для SENIORS Investigators. Рандомизированное исследование для определения влияния небиволола на смертность и госпитализацию сердечно-сосудистых заболеваний у пожилых пациентов с сердечной недостаточностью (SENIORS). Евро Сердце J . 2005 26 февраля (3): 215-25. [Медлайн].
Евро Сердце J . 2005 26 февраля (3): 215-25. [Медлайн].
Waagstein F, Bristow MR, Swedberg K и др. Благоприятные эффекты метопролола при идиопатической дилатационной кардиомиопатии. Метопролол в группе исследования дилатационной кардиомиопатии (MDC). Ланцет . 1993, 11 декабря. 342 (8885): 1441-6. [Медлайн].
Пакер М., Бристоу М.Р., Кон Дж. Н. и др. Влияние карведилола на заболеваемость и смертность пациентов с хронической сердечной недостаточностью.Группа исследования сердечной недостаточности карведилола в США. N Английский язык J Med . 1996 г. 23 мая. 334 (21): 1349-55. [Медлайн].
Исследовательская группа MERIT-HF. Эффект метопролола CR / XL при хронической сердечной недостаточности: рандомизированное исследование метопролола CR / XL при застойной сердечной недостаточности (MERIT-HF). Ланцет . 1999, 12 июня. 353 (9169): 2001-7. [Медлайн].
Ланцет . 1999, 12 июня. 353 (9169): 2001-7. [Медлайн].
Хьялмарсон А., Гольдштейн С., Фагерберг Б. и др. Влияние метопролола с контролируемым высвобождением на общую смертность, госпитализацию и благополучие пациентов с сердечной недостаточностью: рандомизированное исследование метопролола CR / XL при застойной сердечной недостаточности (MERIT-HF).Исследовательская группа MERIT-HF. ЯМА . 2000 марта 8. 283 (10): 1295-302. [Медлайн].
Следователи и комитеты CIBIS-II. Исследование сердечной недостаточности бисопролола II (CIBIS-II): рандомизированное исследование. Ланцет . 1999, 2 января. 353 (9146): 9-13. [Медлайн].
Packer M, Fowler MB, Roecker EB, et al, для группы исследования проспективной рандомизированной кумулятивной выживаемости карведилола (COPERNICUS). Влияние карведилола на заболеваемость пациентов с тяжелой хронической сердечной недостаточностью: результаты проспективного рандомизированного исследования совокупной выживаемости карведилола (COPERNICUS).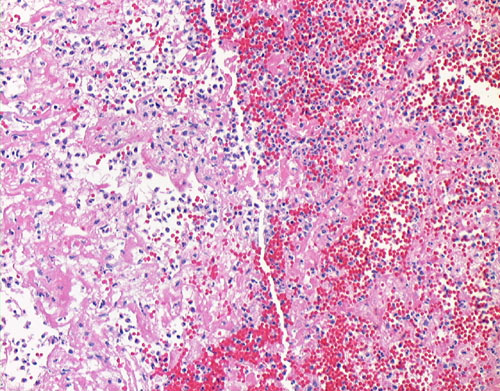 Тираж . 2002, 22 октября. 106 (17): 2194-9. [Медлайн].
Тираж . 2002, 22 октября. 106 (17): 2194-9. [Медлайн].
Питт Б., Сигал Р., Мартинес Ф.А., Мурерс Г. и др. Рандомизированное исследование лозартана по сравнению с каптоприлом у пациентов старше 65 лет с сердечной недостаточностью (Оценка лозартана в исследовании пожилых людей, ELITE). Ланцет . 1997 15 марта. 349 (9054): 747-52. [Медлайн].
Питт Б., Пул-Уилсон П., Сигал Р. и др. Эффекты лозартана по сравнению с каптоприлом на смертность у пациентов с симптоматической сердечной недостаточностью: обоснование, дизайн и исходные характеристики пациентов в исследовании выживания при сердечной недостаточности с лозартаном — ELITE II. J Card Fail . 1999 июн. 5 (2): 146-54. [Медлайн].
МакМюррей Дж. Дж., Остергрен Дж., Сведберг К. и др. Для исследователей и комитетов CHARM. Эффекты кандесартана у пациентов с хронической сердечной недостаточностью и сниженной систолической функцией левого желудочка, принимающих ингибиторы ангиотензинпревращающего фермента: испытание с добавлением CHARM. Ланцет . 2003, 6 сентября. 362 (9386): 767-71. [Медлайн].
Ланцет . 2003, 6 сентября. 362 (9386): 767-71. [Медлайн].
Granger CB, McMurray JJ, Yusuf S, et al, для следователей и комитетов CHARM.Эффекты кандесартана у пациентов с хронической сердечной недостаточностью и сниженной систолической функцией левого желудочка, не переносящей ингибиторы ангиотензин-превращающего фермента: исследование CHARM-Alternative. Ланцет . 2003 сентябрь 6. 362 (9386): 772-6. [Медлайн].
Питт Б., Заннад Ф., Ремме В.Дж. и др. Влияние спиронолактона на заболеваемость и смертность у пациентов с тяжелой сердечной недостаточностью. Исследователи рандомизированного оценочного исследования альдактона. N Английский язык J Med .1999, 2 сентября. 341 (10): 709-17. [Медлайн].
Питт Б., Ремме В., Заннад Ф. и др., Для исследователей исследования эффективности и выживаемости после острого инфаркта миокарда, сердечной недостаточности и выживаемости. Эплеренон, селективный блокатор альдостерона, у пациентов с дисфункцией левого желудочка после инфаркта миокарда. N Английский язык J Med . 2003 г., апрель 3. 348 (14): 1309-21. [Медлайн]. [Полный текст].
Эплеренон, селективный блокатор альдостерона, у пациентов с дисфункцией левого желудочка после инфаркта миокарда. N Английский язык J Med . 2003 г., апрель 3. 348 (14): 1309-21. [Медлайн]. [Полный текст].
Zannad F, McMurray JJ, Krum H, et al, для исследовательской группы EMPHASIS-HF.Эплеренон у пациентов с систолической сердечной недостаточностью и легкими симптомами. N Английский язык J Med . 2011, 6 января, 364 (1): 11-21. [Медлайн].
Jaeschke R, Oxman AD, Guyatt GH. В какой степени пациенты с застойной сердечной недостаточностью с синусовым ритмом получают пользу от терапии дигоксином? Систематический обзор и метаанализ. Ам Дж. Мед. . 1990 Март 88 (3): 279-86. [Медлайн].
Rich MW, McSherry F, Williford WO, Yusuf S. Влияние возраста на смертность, госпитализации и реакцию на дигоксин у пациентов с сердечной недостаточностью: исследование DIG.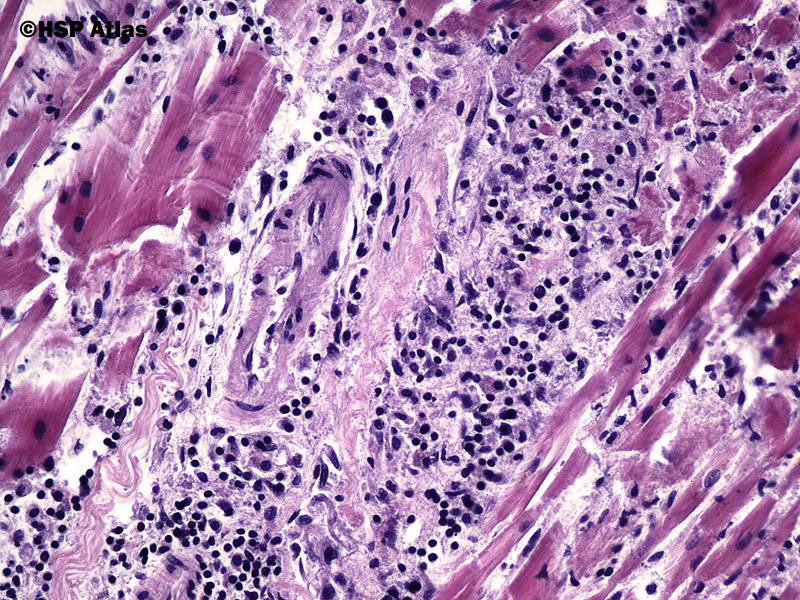 Джам Колл Кардиол . 2001 сен. 38 (3): 806-13. [Медлайн].
Джам Колл Кардиол . 2001 сен. 38 (3): 806-13. [Медлайн].
Кон Дж., Арчибальд Д. Г., Зиеше С. и др. Влияние сосудорасширяющей терапии на смертность при хронической застойной сердечной недостаточности. Результаты совместного исследования администрации ветеранов. N Английский язык J Med . 1986, 12 июня. 314 (24): 1547-52. [Медлайн].
Тейлор А.Л., Зиеше С., Янси С. и др., Для исследователей-афроамериканцев по исследованию сердечной недостаточности. Комбинация изосорбида динитрата и гидралазина у чернокожих с сердечной недостаточностью. N Английский язык J Med . 2004 г. 11 ноября. 351 (20): 2049-57. [Медлайн].
Публикационный комитет для исследователей VMAC (расширение сосудов в лечении острой ХСН). Внутривенное введение несиритида в сравнении с нитроглицерином для лечения декомпенсированной застойной сердечной недостаточности: рандомизированное контролируемое исследование.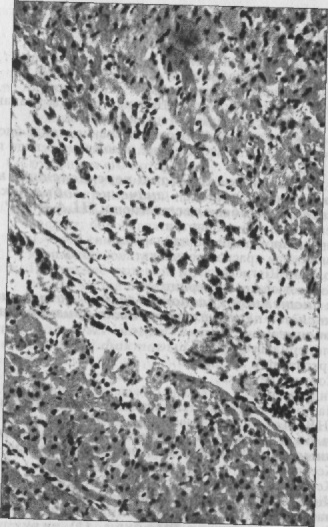 ЯМА . 2002 27 марта. 287 (12): 1531-40. [Медлайн].
ЯМА . 2002 27 марта. 287 (12): 1531-40. [Медлайн].
Burger AJ, Horton DP, LeJemtel T и др., Для проспективной рандомизированной оценки сердечной эктопии с помощью добутамина или терапии Natrecor.Влияние несиритида (натрийуретический пептид B-типа) и добутамина на желудочковые аритмии при лечении пациентов с острой декомпенсированной застойной сердечной недостаточностью: исследование PRECEDENT. Am Heart J . 2002 декабрь 144 (6): 1102-8. [Медлайн].
О’Коннор С.М., Старлинг Р.С., Эрнандес А.Ф. и др. Эффект несиритида у пациентов с острой декомпенсированной сердечной недостаточностью. N Английский язык J Med . 2011 июл 7. 365 (1): 32-43. [Медлайн].
Пакер М., Карвер Дж. Р., Родехеффер Р. Дж. И др.Влияние перорального милринона на смертность при тяжелой хронической сердечной недостаточности. Исследовательская группа PROMISE Study. N Английский язык J Med . 1991 21 ноября. 325 (21): 1468-75. [Медлайн].
Исследовательская группа PROMISE Study. N Английский язык J Med . 1991 21 ноября. 325 (21): 1468-75. [Медлайн].
Ксамотерол в группе исследования тяжелой сердечной недостаточности. Ксамотерол при тяжелой сердечной недостаточности. Ланцет . 1990, 7 июля. 336 (8706): 1-6. [Медлайн].
Мэсси Б.М., Коллинз Дж. Ф., Аммон С.Е. и др., Для исследователей судебного процесса WATCH. Рандомизированное исследование варфарина, аспирина и клопидогреля у пациентов с хронической сердечной недостаточностью: исследование варфарина и антитромбоцитарной терапии при хронической сердечной недостаточности (WATCH). Тираж . 2009 31 марта, 119 (12): 1616-24. [Медлайн].
Homma S, Thompson JL, Pullicino PM, et al, для исследователей WARCEF. Варфарин и аспирин у пациентов с сердечной недостаточностью и синусовым ритмом.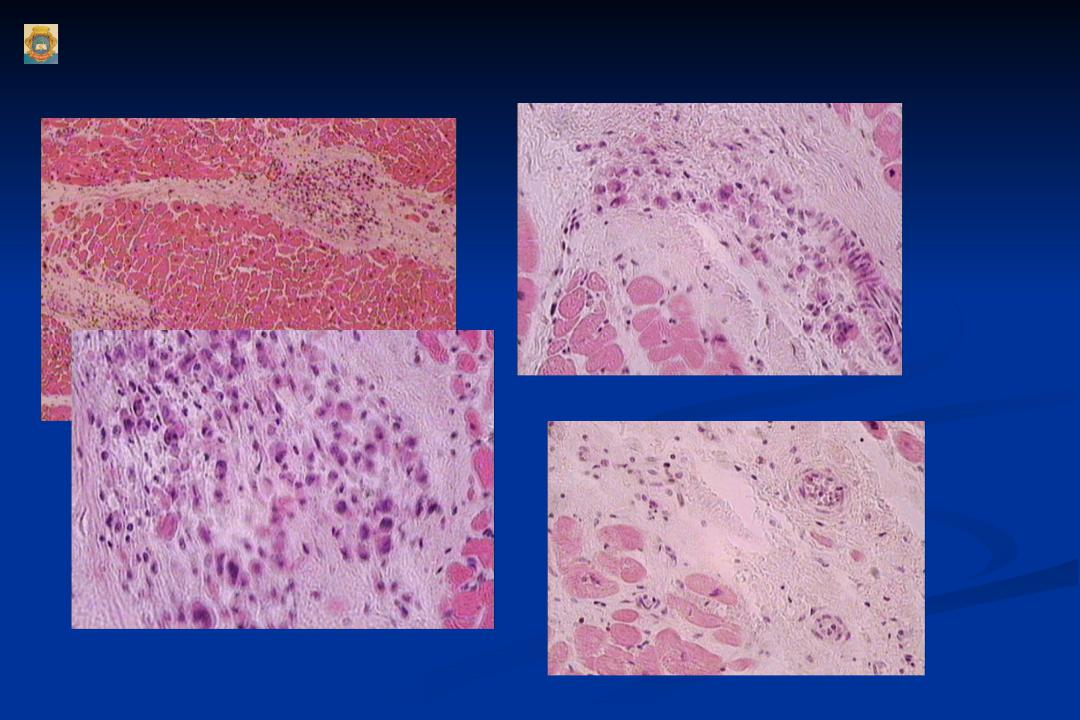 N Английский язык J Med . 2012 17 мая. 366 (20): 1859-69. [Медлайн].
N Английский язык J Med . 2012 17 мая. 366 (20): 1859-69. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Допуск на премаркет (PMA): Thoretec Heartmate XVE LVAS. Доступно по адресу http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMA/pma.cfm? ID = 332296. 4 апреля 2003 г .; Дата обращения: 17 ноября 2016 г.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Thoratec HeartMate II LVAS — P060040 / S005 [обновлено 5 марта 2014 г.]. Доступно по адресу http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/DeviceApprovalsandClearances/Recently-ApprovedDevices/ucm201473.htm. 20 января 2010 г .; Дата обращения: 17 ноября 2016 г.
Центры услуг Medicare и Medicaid. Памятка для решения вспомогательных устройств для желудочков в качестве целевой терапии (CAG-00119R2). Доступно по адресу https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=243&ver=9. Дата обращения: 17 ноября 2016 г.
Доступно по адресу https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=243&ver=9. Дата обращения: 17 ноября 2016 г.
Pagani FD, Miller LW, Russell SD и др., Для исследователей HeartMate II. Расширенная механическая поддержка кровообращения с роторным вспомогательным устройством левого желудочка с непрерывным потоком. Джам Колл Кардиол . 2009 21 июля. 54 (4): 312-21. [Медлайн].
Slaughter MS, Роджерс Дж. Г., Милан, Калифорния, и другие, для исследователей HeartMate II.Сердечная недостаточность на поздних стадиях лечится с помощью вспомогательного аппарата для левого желудочка с непрерывным потоком. N Английский язык J Med . 2009 декабрь 3. 361 (23): 2241-51. [Медлайн].
Heller SR, для группы сотрудничества ADVANCE. Резюме исследования ADVANCE. Уход за диабетом . 2009, ноябрь 32, приложение 2: S357-61. [Медлайн].
2009, ноябрь 32, приложение 2: S357-61. [Медлайн].
Slaughter MS, Pagani FD, McGee EC и др., Для HeartWare Bridge to Transplant ADVANCE Trial Investigators. Система помощи желудочков HeartWare для моста к трансплантату: объединенные результаты испытания моста к трансплантату и протокола непрерывного доступа. J Пересадка легкого сердца . 2013 июл.32 (7): 675-83. [Медлайн].
Bristow MR, Saxon LA, Boehmer J, et al., Для сравнения медицинской терапии, Pacing, et al. Сердечная ресинхронизирующая терапия с имплантируемым дефибриллятором или без него при запущенной хронической сердечной недостаточности. N Английский язык J Med . 2004 20 мая. 350 (21): 2140-50. [Медлайн].
Ван Боммель Р.Дж., Моллема С.А. и др. Нарушение функции почек связано с отсутствием ответа на эхокардиографию и плохим прогнозом после сердечной ресинхронизирующей терапии. Джам Колл Кардиол . 2011 г. 1. 57 (5): 549-55. [Медлайн].
Джам Колл Кардиол . 2011 г. 1. 57 (5): 549-55. [Медлайн].
Мосс А.Дж., Холл В.Дж., Кэнном Д.С. и др. Для исследователей испытаний MADIT-CRT. Сердечная ресинхронизирующая терапия для профилактики сердечной недостаточности. N Английский язык J Med . 2009 Октябрь 1. 361 (14): 1329-38. [Медлайн].
Зареба В., Пиотрович К., МакНитт С., Мосс А.Дж., для следователей МАДИТ II. Эффективность имплантируемого кардиовертера-дефибриллятора у пациентов с сердечной недостаточностью и дисфункцией левого желудочка (из популяции MADIT II). Ам Дж. Кардиол . 2005 15 июня. 95 (12): 1487-91. [Медлайн].
Freudenberger RS, Hellkamp AS, Halperin JL, et al, для исследователей SCD-HeFT. Риск тромбоэмболии при сердечной недостаточности: анализ исследования внезапной сердечной смерти при сердечной недостаточности (SCD-HeFT).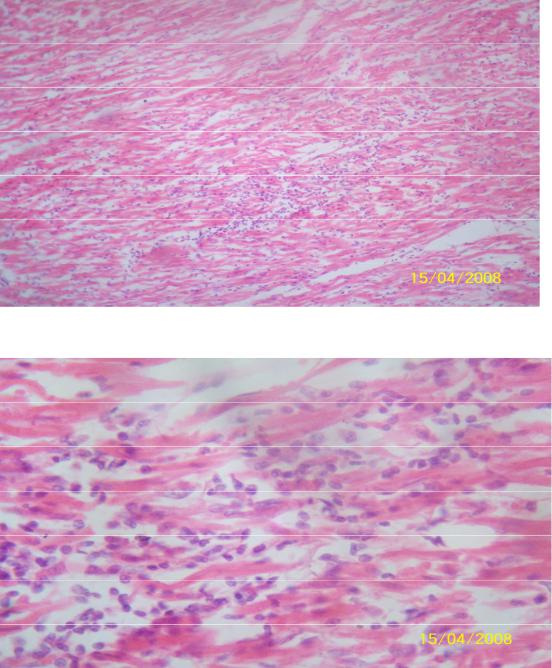 Тираж . 2007 г. 22 мая. 115 (20): 2637-41. [Медлайн].
Тираж . 2007 г. 22 мая. 115 (20): 2637-41. [Медлайн].
Кобер Л., Тьюн Дж. Дж., Нильсен и др. Для DANISH Investigators. Имплантация дефибриллятора пациентам с неишемической систолической сердечной недостаточностью. N Английский язык J Med . 2016 29 сентября. 375 (13): 1221-30. [Медлайн].
Гоэль К., Леннон Р.Дж., Тилбери Р.Т., Сквайрс Р.В., Томас Р.Дж. Влияние кардиологической реабилитации на смертность и сердечно-сосудистые события после чрескожного коронарного вмешательства в сообществе. Тираж . 2011 31 мая. 123 (21): 2344-52. [Медлайн].
Тейлор Р.С., Унал Б., Кричли Дж. А., Кейпвелл С. Снижение смертности у пациентов, получающих кардиологическую реабилитацию на основе физических упражнений: насколько можно отнести к улучшению факторов риска сердечно-сосудистых заболеваний ?. Eur J Cardiovasc Предыдущий Rehabil . 2006 июн.13 (3): 369-74. [Медлайн].
Eur J Cardiovasc Предыдущий Rehabil . 2006 июн.13 (3): 369-74. [Медлайн].
Suaya JA, Stason WB, Ades PA, Normand SL, Shepard DS. Кардиологическая реабилитация и выживаемость у пожилых пациентов с коронарной болезнью. Джам Колл Кардиол . 2009, 30 июня. 54 (1): 25-33. [Медлайн].
Jolliffe JA, Rees K, Taylor RS, Thompson D, Oldridge N, Ebrahim S. Реабилитация на основе физических упражнений при ишемической болезни сердца. Кокрановская база данных Syst Rev .2001. CD001800. [Медлайн].
Стивенс МБ. Кардиологическая реабилитация. Ам Фам Врач . 2009 г. 1. 80 (9): 955-9; раздаточный материал 960. [Medline].
Тейлор Р.С., Браун А., Эбрахим С. и др. Реабилитация на основе физических упражнений для пациентов с ишемической болезнью сердца: систематический обзор и метаанализ рандомизированных контролируемых исследований. Ам Дж. Мед. . 2004 15 мая. 116 (10): 682-92. [Медлайн].
Ам Дж. Мед. . 2004 15 мая. 116 (10): 682-92. [Медлайн].
Гринберг Б., Батлер Дж., Фелкер Г.М. и др.Повышение уровня кальция путем чрескожного введения генной терапии у пациентов с сердечными заболеваниями (CUPID 2): рандомизированное, многонациональное, двойное слепое, плацебо-контролируемое исследование фазы 2b. Ланцет . 2016 19 марта. 387 (10024): 1178-86. [Медлайн].
Siminiak T, Fiszer D, Jerzykowska O, et al. Чрескожная транскоронарно-венозная трансплантация аутологичных скелетных миобластов в лечении постинфарктного нарушения сократимости миокарда: исследование ПОЗНАН. Евро Сердце J . 2005, 26 июня (12): 1188-95. [Медлайн].
Menasche P, Alfieri O, Janssens S, et al. Исследование аутологичной трансплантации миобластов при ишемической кардиомиопатии (MAGIC): первое рандомизированное плацебо-контролируемое исследование трансплантации миобластов.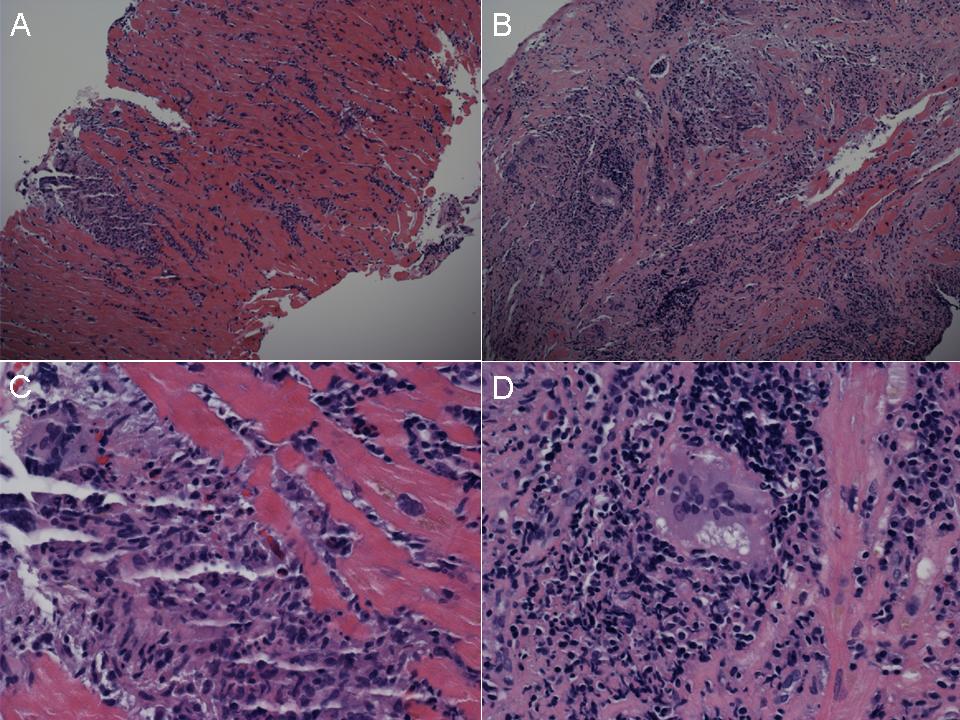 Тираж . 2008, 4 марта. 117 (9): 1189-200. [Медлайн].
Тираж . 2008, 4 марта. 117 (9): 1189-200. [Медлайн].
Диб Н., Маккарти П., Кэмпбелл А. и др. Возможность и безопасность аутологичной трансплантации миобластов у пациентов с ишемической кардиомиопатией. Пересадка клеток . 2005. 14 (1): 11-9. [Медлайн].
Каспи О., Хубер И., Кехат И. и др. Трансплантация кардиомиоцитов, полученных из эмбриональных стволовых клеток человека, улучшает работу миокарда в инфаркте сердца крысы. Джам Колл Кардиол . 2007 6 ноября. 50 (19): 1884-93. [Медлайн].
Пател А.Н., Дженовезе Дж. Терапия стволовыми клетками для лечения сердечной недостаточности. Curr Opin Cardiol . 2007 сентября, 22 (5): 464-70. [Медлайн].
Генри Т.Д., Траверс Дж. Х., Хэммон Б.Л. и др. Безопасность и эффективность ixmyelocel-T: расширенная аутологичная многоклеточная терапия при дилатационной кардиомиопатии. Circ Res . 2014 26 сентября. 115 (8): 730-7. [Медлайн].
Circ Res . 2014 26 сентября. 115 (8): 730-7. [Медлайн].
Perin EC, Dohmann HF, Borojevic R, et al. Трансэндокардиальная трансплантация аутологичных клеток костного мозга при тяжелой хронической ишемической сердечной недостаточности. Тираж . 2003 13 мая. 107 (18): 2294-302. [Медлайн].
Абрахам В.Т., Адамсон П.Б., Бурж Р.К. и др. Для исследовательской группы CHAMPION. Беспроводной мониторинг гемодинамики легочной артерии при хронической сердечной недостаточности: рандомизированное контролируемое исследование. Ланцет . 19 февраля 2011 г. 377 (9766): 658-66. [Медлайн].
[Рекомендации] Пониковски П., Вурс А.А., Анкер С.Д. и др. Для авторов / членов рабочей группы. Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности от 2016 г .: Целевая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского общества кардиологов (ESC), разработанная при особом участии Ассоциации сердечной недостаточности (HFA). ) ESC. Евро Сердце J . 2016 14 июля. 37 (27): 2129-200. [Медлайн].
Jaiswal A, Nguyen VQ, Le Jemtel TH, Ferdinand KC. Новая роль ингибиторов фосфодиэстеразы в лечении терминальной стадии сердечной недостаточности. Мир Дж. Кардиол . 2016 26 июля. 8 (7): 401-12. [Медлайн].
Буско М. Генетический тест помогает выявить семейную кардиомиопатию. Heartwire от Medscape. 22 октября 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/812935.Доступ: 2 ноября 2013 г.
Тадрос Р., Чами Н., Бодуан М. и др. Новые мутации при семейной дилатационной кардиомиопатии идентифицированы с помощью секвенирования всего экзома [аннотация 696]. Представлено на: Canadian Cardiovascular Congress (CCC) 2013; 19 октября 2013 г .; Монреаль, Квебек. Банка Кардиол . Октябрь 2013. 29 (10) Suppl: S364.
Ямада Т., Хирашики А., Окумура Т. и др. Прогностическое влияние комбинированного позднего повышения гадолиния на сердечно-сосудистый магнитный резонанс и пиковое потребление кислорода у амбулаторных пациентов с неишемической дилатационной кардиомиопатией. J Card Fail . 2014 20 ноября (11): 825-32. [Медлайн].
Гулати А., Исмаил Т.Ф., Джаббур А. и др. Клиническая ценность и прогностическая ценность оценки объема левого предсердия с помощью сердечно-сосудистого магнитного резонанса при неишемической дилатационной кардиомиопатии. евро J Сердечная недостаточность . 2013 июн.15 (6): 660-70. [Медлайн].
Felker GM, Lee KL, Bull DA и др., Для сети клинических исследований сердечной недостаточности NHLBI. Диуретические стратегии у пациентов с острой декомпенсированной сердечной недостаточностью. N Английский язык J Med . 2011 г., 3 марта. 364 (9): 797-805. [Медлайн].
Бейкер Д.В., Райт РФ. Управление сердечной недостаточностью. IV. Антикоагулянтная терапия для пациентов с сердечной недостаточностью из-за систолической дисфункции левого желудочка. ЯМА . 1994 23-30 ноября. 272 (20): 1614-8. [Медлайн].
Moss AJ, Hall WJ, Cannom DS и др. Повышение выживаемости с имплантированным дефибриллятором у пациентов с ишемической болезнью сердца с высоким риском желудочковой аритмии.Исследователи по испытаниям многоцентровой автоматической имплантации дефибриллятора. N Английский язык J Med . 1996 26 декабря. 335 (26): 1933-40. [Медлайн].
Мосс А.Дж. Имплантируемый кардиовертер-дефибриллятор: наибольшая польза от самых тяжелых пациентов. Тираж . 2000, 11 апреля. 101 (14): 1638-40. [Медлайн].
Suma H. Частичная левовентрикулэктомия. Циркуляр J . 2009 июн.73, доп. A: A19-22. [Медлайн].
Матса Л.С., Сагурти С.Р., Анантапур В., Налла С., Наллари П.Ген эндотелина 1 как модификатор дилатационной кардиомиопатии. Ген . 2014 Сен 15. 548 (2): 256-62. [Медлайн].
Динов Б., Фидлер Л., Шонбауэр Р. и др. Результаты катетерной аблации желудочковой тахикардии при дилатационной неишемической кардиомиопатии по сравнению с ишемической кардиомиопатией: результаты исследования проспективного кардиологического центра Лейпцига (HELP-VT). Тираж . 2014 18 февраля. 129 (7): 728-36. [Медлайн].
Рой Д., Таладжич М., Наттель С. и др., Для исследователей фибрилляции предсердий и застойной сердечной недостаточности.Контроль ритма по сравнению с контролем частоты при фибрилляции предсердий и сердечной недостаточности. N Английский язык J Med . 19 июня 2008 г. 358 (25): 2667-77. [Медлайн].
Porcari A, De Angelis G, Romani S и др. Современные стратегии диагностики дилатационной кардиомиопатии: сравнение методов визуализации. Эксперт Rev Cardiovasc Ther . 2018 20 ноября. 1-11. [Медлайн].
Camino M, Morales MD. Бета 1 антитела к рецепторам адренорецепторов у детей с дилатационной кардиомиопатией. Передняя Biosci (Элитный Эд) . 1 января 2019 г. 11: 102-8. [Медлайн].
Гигантоклеточный миокардит: история Джексона
Джексон всегда был здоров — и всегда участвовал в спортивных состязаниях. Двумя его фаворитами были футбол и хоккей. В ноябре 2016 года он вернулся домой в Уоллингфорд, штат Пенсильвания, с футбольного турнира в Северной Каролине. Он подумал, что простудился, потому что сначала его симптомы были легкими, просто насморк и сухой кашель.
Но через шесть дней его симптомы ухудшились.Он чувствовал сильную усталость, у него болел живот, стало трудно дышать. Родители отвезли его в Детскую больницу Филадельфии (CHOP) неотложной помощи, Брендивайн-Вэлли, в Глен-Миллс, штат Пенсильвания.
Изначально врачи заподозрили, что у Джексона пневмония, и прописали ему антибиотики для борьбы с инфекцией, стероиды для открытия легких и отдых.
Но менее чем через 24 часа состояние Джексона быстро ухудшилось. «Все его тело просто отключалось», — говорит его мать Кира.Когда его родители снова обратились в службу неотложной помощи CHOP, персонал приказал семье отвезти Джексона в отделение неотложной помощи CHOP.
В отделении неотложной помощи команда заподозрила, что Джексон страдает сердечным заболеванием, и перевела подростка в отделение интенсивной терапии сердца (CICU) для более детального обследования. Были проконсультированы с Мэтью О’Коннором, доктором медицины, медицинским директором программы по сердечной недостаточности и трансплантации, и его командой.
«Здоровье Джексона быстро ухудшалось, — говорит Кира.Он страдал от респираторной недостаточности, сердечной недостаточности и сердечной недостаточности.
Редкое и опасное для жизни заболевание
Доктор О’Коннор и команда знали, что у них мало времени. Было крайне важно как можно быстрее определить причину состояния Джексона.
Джексон был помещен на экстракорпоральную мембранную оксигенацию (ЭКМО), которая поддерживала его сердце и легкие и сохраняла ему жизнь, пока врачи работали, чтобы определить, что вызывает симптомы Джексона, и лечить основную проблему.
В течение 24 часов после прибытия в CICU и после биопсии сердца медицинская группа Джексона смогла диагностировать его состояние: чрезвычайно редкую и часто смертельную форму гигантоклеточного миокардита.
«Тот факт, что команда CHOP даже знала, что нужно делать биопсию — они поймали ее рано, и это спасло ему жизнь», — говорит Кира.
Гигантоклеточный миокардит — редкое аутоиммунное заболевание, которое поражает сердечную мышцу (миокард) и вызывает тяжелое воспаление. Расстройство быстро прогрессирует, может привести к сердечной недостаточности, и многим диагностированным в конечном итоге потребуется пересадка сердца.Причина гигантоклеточного миокардита в настоящее время неизвестна.
Доктор О’Коннор и медицинская бригада работали быстро. Джексону дали лекарство, чтобы уменьшить сильное воспаление в его сердце, и он оставался на ЭКМО в критическом состоянии в течение двух недель, пока его сердце не стало достаточно сильным, чтобы биться самостоятельно. Когда Джексон выздоровел достаточно, чтобы его отменили ЭКМО, его команда внимательно наблюдала за ним и при необходимости скорректировала его лекарства.
Медленное восстановление
Первые недели выздоровления были для Джексона непростыми.До внезапной болезни он был заядлым спортсменом. Однако впоследствии ему потребовалась интенсивная терапия, чтобы заново освоить основные задачи, такие как ходьба и питание.
«Мы не смогли бы пережить это трудное время без вспомогательного персонала CHOP. Медсестры, терапевты были просто великолепны в его повседневной заботе ».
Через месяц Джексон перебрался из реанимации и получил разрешение вернуться домой. В первые месяцы после инцидента Джексон каждые две недели возвращался в больницу для наблюдения.Со временем проверки стали ежемесячными, так как его сила росла. Теперь, два года спустя, встречи с Джексоном увеличились до одного раза в шесть-восемь недель. Хотя его сердечная функция не совсем нормальная, она продолжает неуклонно улучшаться.
Состояние Джексона лечится с помощью комбинации лекарств, улучшающих работу сердца и подавляющих иммунную систему. Точные дозировки контролируются и корректируются по мере необходимости.
«Его выздоровление будет продолжаться», — говорит Кира. «У нас были некоторые неудачи и проблемы, но мы движемся в правильном направлении.”
Джексону также был имплантирован дефибриллятор по рекомендации Молли Шаха, MBBS, медицинского директора Программы электрофизиологии и сердечного ритма. Дефибриллятор был имплантирован из-за того, что у Джексона в анамнезе были желудочковые аритмии во время его пребывания в больнице. Это устройство поможет сердцу Джексона вернуться к нормальному ритму, если это повторится снова.
Принятие перемен и движение вперед
Джексону сейчас 15 лет, и во многих смыслах он типичный подросток.Хотя ему не разрешили заниматься контактными видами спорта, его медицинская бригада работала с ним, чтобы спорт по-прежнему играл важную роль в его жизни. По состоянию здоровья он получил разрешение на игру в гольф и продемонстрировал прирожденный талант к этому виду спорта.
«Гольф был очень терапевтическим для Джексона — и он неплохо справляется с этим и подает большие надежды», — говорит Кира.
Помимо участия в турнирах по гольфу, Джексон также любит играть в сенсорный футбол и баскетбол со своими друзьями. Он также работает рефери по хоккею с шайбой, чтобы оставаться вовлеченным в игру.
«Доктор. О’Коннор был прекрасен в клиническом плане, но также был очень хорош в оказании эмоциональной поддержки », — говорит Кира.
«Джексон может заниматься как можно большим количеством занятий, что позволяет ему быть обычным подростком».
Джексон сохраняет дальновидность и взгляды на свою жизнь. Он не позволит, чтобы страх его здоровья определял его. Как объясняет его отец, Дэйв, «он очень хорошо умел двигаться дальше и сохранять позитивный настрой».
Джексон говорит: «Я смотрю на это как на далекое воспоминание.Сейчас моя главная цель — сосредоточиться на колледже; и я определенно хочу сыграть в гольф первого дивизиона ».
Семья Джексона благодарна за лечение и уход, которые Джексон продолжает получать в CHOP, и они понимают важность исследований для будущих достижений.
«Мы надеемся, что случай Джексона поможет проложить дорогу другим пациентам», — говорит Кира. «Будь то какие-то методы лечения или наш опыт».
На данный момент Джексон вернулся в школу и занимается тем, что любит.Что касается спорта, жизни и будущего, у Джексона есть одна последовательная мысль: он занимается этим, чтобы выиграть.
Гигантоклеточный миокардит: краткий обзор | Архив патологии и лабораторной медицины
В образцах EMB, полученных для световой микроскопии, серийные срезы залитой парафином ткани последовательно пронумерованы. Во многих учреждениях принято окрашивать каждую вторую или третью секцию гематоксилин-эозином и оставлять промежуточные секции для особых пятен, как указано. 24,30 Окрашивание эластическим трихромом Массона или пентахромом Мовата обычно рекомендуется для выявления интерстициального фиброза, беспорядка миоцитов и некроза. Окрашивание железа у мужчин и женщин в постменопаузе обычно выполняется, чтобы исключить потенциально излечимую болезнь накопления железа. 24,30 Окрашивание конго красным может быть назначено для исключения сердечного амилоидоза, особенно у пациентов старше 50 лет. 30 Если виден воспалительный инфильтрат, рекомендуется иммуногистохимическое окрашивание на Т-лимфоциты (например, CD3) и макрофаги (например, CD68), чтобы лучше охарактеризовать степень и природу инфильтрата. 23 При обнаружении гранулематозного воспаления показаны специальные окраски микроорганизмов, такие как метенамин серебра Гомори или Циля – Нильсена. 4,30
В дополнение к исследованию под световым микроскопом предлагается приобрести образцы ЭМБ для обнаружения вирусных геномов. 23 Хотя залитую парафином ткань можно использовать для анализов на основе ПЦР, чувствительность и воспроизводимость обнаружения вирусного генома являются субоптимальными.Предпочтительно мгновенное замораживание ткани в жидком азоте и хранение при -80 ° C или хранение ткани при комнатной температуре в растворе для стабилизации ткани РНК. 23,24,30 После мгновенного замораживания следует избегать отправки ткани на стандартную гистологическую обработку из-за возможного артефакта кристаллов льда. 24,30 При подозрении на миокардит, инфильтративных заболеваниях и приеме кардиотоксических препаратов (например, антрациклина) в некоторых случаях может оказаться полезным сохранение некоторого количества образца в 2–4% глутаровом альдегиде при комнатной температуре для исследования с помощью просвечивающей электронной микроскопии. 24,30 В случаях вскрытия или эксплантации сердца важно тщательно отбирать пробы сердца, так как миокардит может быть очаговым процессом. При расследовании случаев внезапной сердечной смерти Ассоциация европейской сердечно-сосудистой патологии рекомендует предоставлять поперечные срезы свободной стенки левого желудочка (передняя, боковая и задняя), межжелудочковой перегородки (передняя и задняя), свободной стенки правого желудочка (передняя, боковая и задняя). и задний), и оба предсердия для гистологического исследования. 31
Гигантоклеточный миокардит. Отчет о болезни
ВВЕДЕНИЕ
Гигантоклеточный миокардит (ГКМ) — редкое и серьезное заболевание, вероятно, аутоиммунного происхождения, гистологически характеризующееся наличием гигантских многоядерных клеток наряду с обширными воспалительными инфильтратами с большими участками некроза1. До 1997 г. было зарегистрировано лишь 80 единичных случаев. опубликовано и 2 ограниченных серии.2 В Испании на дату опубликовано только 3 случая. достигаются путем анатомического исследования эксплантированного сердца.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент 50 лет без значительного анамнеза. За несколько часов до госпитализации пациент обратился к врачу с жалобами на одышку без лихорадки или симптомов, связанных с инфекционным процессом; ему прописали лечение антибиотиками и бронходилататор. В ночь поступления в больницу у него была непереносимость пролежней. На следующее утро он отправился в отделение неотложной помощи из-за предсинкопального приступа. Клинические и рентгенологические исследования выявили острый отек легких.Была выполнена ЭКГ (рис. 1), которая показала блокаду правой ветви, переднюю геми-блокаду правой ветви и АВ-блокаду 1-й степени. Отмечено возникновение полной перемежающейся АВ-блокады, не потребовавшей электростимуляции. Пациент был переведен в отделение интенсивной терапии и лечился диуретиками, внутривенно инотропными препаратами (добутамином) и вазодилататорами. Электрокардиограмма показала нерасширенный левый желудочек (диастолический диаметр 46 мм) с сильно сниженной фракцией выброса (25%).Катетеризация с коронарной ангиографией не выявила серьезного заболевания сердца, а вентрикулография показала 22% фракцию выброса с тяжелой переднебоковой и диафрагмальной гипокинезией и небольшой антеробазальной и апикальной гипокинезией (рис. 2). Серия ферментных тестов была нормальной, за исключением небольшого увеличения тропонина T.
Рис. 1. ЭКГ: синусоидальная тахикардия с АВ-блокадой 1-й степени, полной блокадой правой ветви и передней геми-блокадой левой ветви.
Рис. 2. Вентрикулография в правой передней косой проекции в систолу и диастолу. Фракция выброса сильно снижена с сокращением верхушки и исходной переднебоковой области. Края очерчены для большей ясности.
Состояние пациента настолько улучшилось, что его снова положили на пол через 10 дней после поступления, но в последующие дни его состояние ухудшилось, и он был повторно госпитализирован в ОИТН с острым отеком легких и кардиогенным шоком.Была проведена правосторонняя катетеризация и выявлено повышенное давление наполнения (легочное капиллярное давление 27 мм рт. Ст., Среднее давление в правом предсердии 16 мм рт. Ст.) И серьезное снижение сердечного выброса (3,1 л / м, сердечный индекс 1,68 л / м / м²), несмотря на лечение. с добутамином и диуретиками. Состояние пациента не улучшалось, а постепенно ухудшалось, и его перевели в нашу больницу для трансплантации сердца.
Пациент был госпитализирован в наш центр через 28 дней после появления симптомов.Был установлен интрааортальный баллон, что улучшило его клинические параметры, достигло отрицательного водного баланса и стабилизации гемодинамики. Физикальное обследование при поступлении показало, что сердце пациента хорошо перфузировано, но мутно, с артериальным давлением 100/75 мм рт. Ст. При перфузии добутамином. Аритмичный артериальный пульс при экстрасистолии 96 уд / мин. Было замечено повышение центрального венозного давления, а также скачок в третьем и четвертом тонах сердца слева. Шумов не обнаружено.Гепатомегалия в 6 см от реберной границы, отеков нет.
На ЭКГ: ритм синусовый с атриовентрикулярной блокадой I степени, полной блокадой правой ветви и пониженным вольтажом. Рентген грудной клетки показал острый отек легких. На эхокардиограмме левый желудочек был расширен и фракция выброса
Пациент был внесен в список срочной трансплантации на третий день после поступления, и трансплантат был выполнен в тот же день. Послеоперационное течение прошло без осложнений.Получил индукционную иммунодепрессорную терапию антимиоцитным гамма-глобулином. Поддерживающая терапия состояла из тройной терапии циклоспорином, микрофенолятмофетилом и преднизоном. У пациента был умеренный (степень 3А) эпизод отторжения, выявленный при биопсии на второй неделе после трансплантации; это лечили стероидным шоком с полным разрешением биопсией на четвертой неделе без повторного появления гигантских клеток ни в одной из последующих биопсий. По данным этого отчета (через 6 месяцев после трансплантации), пациент ведет нормальный образ жизни, без одышки или других симптомов, с нормальной функцией трансплантата при последующих эхокардиографических исследованиях.
Анализ крови отрицательный. Методика полимеразной цепной реакции не выявила вирусных геномов в проанализированных образцах миокарда.
Анатомо-патологическое макроскопическое исследование эксплантированного сердца (рис. 3) выявило небольшую дилатацию обоих желудочков с замещением нормальной мышечной ткани базальной трети перегородки, передней и боковой стенок левого желудочка и в меньшей степени — задняя стенка левого желудочка; желудочки были покрыты рубцами и имели серовато-коричневый цвет, а апикальная треть сердца сохранилась практически полностью.Макроскопические изменения незначительно повлияли на переднюю поверхность правого желудочка. Гистологическое исследование (рис. 4) выявило интенсивный воспалительный инфильтрат лимфоцитов и плазматических клеток с некоторыми эозинофилами и большим количеством многоядерных гигантских клеток. Были участки серпигинозного некроза и значительного замещения мышечной ткани фиброзной тканью в ранее отмеченных областях. Для выявления кислото-спиртоустойчивых бацилл использовали специальные настойки, которые оказались отрицательными. Серийные срезы коронарных артерий показали поражения в средней нисходящей передней артерии без признаков нестабильности и, как считается, не были причиной отмеченных анатомических аномалий.
Рис. 3. Анатомический кусок эксплантированного сердца в базальной средней (A) и апикальной (B) областях. Можно видеть, что мышечная ткань заменена рубцовой тканью на больших участках обоих желудочков, особенно в перегородке, а также на передней и боковой стенках левого желудочка; тем не менее, мышца сохраняется в большинстве апикальных частей, что соответствует данным вентрикулографии.
Рис. 4. Гистологическое исследование (настойка гематоксилин-эозина), при котором можно наблюдать воспалительный инфильтрат, состоящий в основном из лимфоцитов и гистоцитов, которые можно увидеть в многоядерных гигантских клетках.
ОБСУЖДЕНИЕ
ГКМ — редкое заболевание. Cooper2 сообщил о наиболее обширной серии: 63 пациента из 36 больниц, указав в библиографии примерно 90 случаев, опубликованных до 1997 г. на английском языке.
В Испании Ruiz et al3 в 1993 году опубликовали случай женщины с ГКМ, сопровождающейся тимомой, миастенией, хроническим лимфоцитарным тиреоидитом, гигантоклеточным миозитом и гранулематозной инфильтрацией лимфатических узлов легочных волокон. В 1994 г. Ariza et al4 сообщили о смертельном случае ГКМ у 46-летней женщины с язвенным колитом в анамнезе.Fernández et al5 в 1999 году описали новый случай 57-летнего мужчины, у которого первоначально был апикальный инфаркт миокарда, с развитием рефрактерной сердечной недостаточности и которому в конце концов потребовалась трансплантация сердца. Нашим случаем был 50-летний пациент с сердечной недостаточностью и атриовентрикулярной блокадой, которому потребовалась трансплантация сердца из-за прогрессирования внутриаортального баллона до кардиогенного шока.
GCM связан с другими аутоиммунными процессами примерно в 20% случаев.2,7 В многоцентровом исследовании сердечная недостаточность была наиболее частой формой проявления 2 и составляла 75% случаев. Желудочковая тахикардия составляла 14% случаев с такими симптомами, как сердцебиение, обмороки или внезапная смерть. Острый инфаркт миокарда имел место в 6% случаев, а полная атриовентрикулярная блокада — в 5%. Нередко появление более одного основного проявления в течении болезни. В серии Stanford 7 из 5 случаев развилась прогрессирующая сердечная недостаточность и желудочковая тахикардия.В бостонской серии 6 желудочковая тахикардия присутствовала в 90% случаев. Клинический диагноз следует сильно подозревать перед лицом пациента с сердечными симптомами, которые недавно появились и быстро прогрессируют с признаками интенсивной желудочковой дисфункции при отсутствии другой возможной этиологии; эндомиокардиальная биопсия является окончательной диагностической процедурой. Часто диагноз ставится на основании исследования эксплантированного сердца.
GCM имеет плохой прогноз.В многоцентровом исследовании 89% пациентов умерли или потребовалась трансплантация сердца в среднем в течение 5,5 месяцев. В исследовании Davidoff et al6 было отмечено 17% снижение фракции выброса в течение среднего периода наблюдения в 2 года, в отличие от 8% улучшения в группе с лимфоцитарным миокардитом.
В настоящее время различные исследователи отдают предпочтение лечению иммунодепрессантами. В многоцентровом исследовании средняя выживаемость нелеченых пациентов составила 3 месяца.2 Наибольшая выживаемость, 12,6 месяца, была получена в группе пациентов, получавших циклоспорин в сочетании с другим иммунодепрессантом. Авторы указали на сложность оценки этих результатов, поскольку, учитывая обычно смертельное течение этих пациентов, только те, кто выжил в течение некоторого времени без лечения, будут иметь возможность получить лечение, что создает предвзятость при отборе выживших. После упомянутого исследования были опубликованы анекдотические случаи как реакции, так и неэффективности комбинированного лечения иммунодепрессорами.8,9
Пересадка сердца, когда это возможно, является основной альтернативной терапией. Так было с нашим пациентом и с 34 из 63 пациентов, о которых сообщалось в многоцентровом исследовании, с выживаемостью 74% после среднего периода наблюдения в 3,7 года2. GCM может повторяться в трансплантатах пересаженных пациентов; 10 это произошла у 9 из 34 пациентов с трансплантатом в многоцентровом исследовании в период от 3 недель до 9 лет после трансплантации.
Для переписки: д-р Х. Фернандес-Яньес.
Никасио Гальего, 19, 6Д. 28010. Мадрид. Испания.
Эл. Почта: [email protected].
Гигантоклеточный миокардит: обзор случая | Междисциплинарный журнал сердечно-сосудистых заболеваний
GCM — это воспалительное заболевание миокарда с недостаточной диагностикой во всем мире. Часто его диагностируют после смерти или трансплантации сердца (5, 6).
Хотя GCM известен как редкое заболевание миокарда, сообщалось о его заболеваемости от 0,2% до 5% при миокардите, вызванном EMB (7, 8).
GCM обычно встречается у людей молодого и среднего возраста (1, 9).
В нашей серии средний возраст пациентов составляет 44,3 года, все из которых женщины. Эти характеристики согласуются с предыдущими исследованиями (3, 6, 10).
Основным клиническим проявлением ГКМ является прогрессирующая сердечная недостаточность (64–75%). Другими клиническими проявлениями являются атриовентрикулярная блокада высокой степени (5–31%), желудочковая аритмия (VT-VF) (14–32%), острые коронароподобные синдромы (6–19%) (1, 6, 9, 11 ).
Примерно 20% случаев GCM имеют аутоиммунные нарушения, такие как коллагеновая сосудистая болезнь, тиреоидит или воспалительное заболевание кишечника (12).
В наших случаях общими симптомами были ЖТ (встречалась у трех пациентов), ХГВ (второй случай), сердечная недостаточность (второй случай).
Клинический диагноз ГКМ, особенно у женщин среднего возраста, следует подозревать при подходе к пациенту с желудочковой аритмией и АВ-блокадой высокой степени даже без значительной дисфункции ЛЖ. Важность дифференциальной диагностики GCM, особенно с AVB, — это сердечный саркоидоз (13, 14).
Имеются ограниченные данные об использовании неинвазивных методов визуализации, таких как МРТ сердца и ядерная визуализация (15).CMR была проведена в двух из наших случаев, которые, помимо отека миокарда, в первом случае CMR показали толстый слой увеличения позднего гадолиния миокарда (LGE), который распространялся от субэпикардиального до интрамурального LV. У третьего пациента был LGE (субэндокард) в нижнебоковой области ЛЖ.
Недавний отчет сравнил CMR с гистологией в GCM, в которой CMR, кодируемый штаммом, показал неоднородное распределение LGE, влияющее на все слои миокарда (15).
Таблица 1 иллюстрирует диагностическую важность общих методов визуализации при специфическом миокардите (15).
Таблица 1.
Кадходян и др. (15)
| Модальность визуализации | CMR | Эхокардиография | Ядерная визуализация (18F-FDG PET) | ||||
|---|---|---|---|---|---|---|---|
| Кардиосаркоидоз | + | + | ++ | + | + | + | + |
| Эозинофильный миокардит | ++ | ++ | — | ||||
| 12 |
Хотя неинвазивная визуализация не может дать однозначного различия между воспалительной кардиомиопатией, но они являются (особенно CMR) стандартными справочными материалами для начальной и дополнительной оценки характеристик и функции миокардиальной ткани (16).
EMB и гистологическое исследование — золотой стандарт диагностики ГКМ (17). Гигантские клетки — основная характеристика GCM (12). Классический гистопатологический взгляд на GCM — диффузный некроз миоцитов с инфильтрацией воспалительных клеток, включая эозинофилы, лимфоциты, многоядерные гигантские клетки, плазматические клетки и нейтрофилы (9, 12, 18, 19).
Основным дифференциальным диагнозом GCM в гистопатологии являются другие поражения миокарда, содержащие гигантские клетки, включая саркоидоз, инфекционный гранулематозный миокардит, гигантоклеточный артериит и артериит Такаясу (4, 20).
Гистопатология миокарда в третьем случае выявила гигантские клетки с телом астероида, но ее изображения и клинические особенности не указывали на сердечный саркоидоз (CS). Патологические характерные особенности CS, позволяющие отличить его от GCM, включают ненекротические гранулемы с гигантскими клетками и внутрицитоплазматическими включениями, такими как Schaumann и астероидные тела (21).
Тем не менее, для представления CS был рассмотрен третий случай. Наш второй случай показал массивный некроз миокарда и серьезную инфильтрацию воспалительных клеток.При должном внимании к ее очень плохому прогнозу можно рассмотреть взаимосвязь между патологическим взглядом миокарда и клиническим прогнозом.
Одновременное присутствие генома парвовируса B19 и GCM может указывать на запускающий эффект заражения парвовирусом B19 на гигантоклеточный миокардит (22).
Нет достаточного управления данными и последующей GCM (23). Кандолин и др. сообщили, что 26 пациентов с диагнозом ГКМ биопсии лечились комбинированной иммуносупрессией, которая включала стероид (все пациенты), циклоспорин, микофенолятмофетил, муромонаб, гамма-глобулин и метотрексат.В этом отчете описывается, что две трети пациентов частично вылечились от тяжелой клинической сердечной недостаточности, но сохраняли предрасположенность к желудочковой аритмии (6).
Пять пациентов (общая смертность) умерли от желудочковой аритмии. Двадцать пять пациентов получали бета-адреноблокаторы (6).
В нескольких других сообщениях описана эффективность иммуносупрессивной терапии, такой как стероид, муромонаб, циклоспорин, антитимоцитарный глобулин (АТГ) и микофенолятмофетил, которые могут быть эффективны при относительной клинической ремиссии ГКМ (9, 11, 24, 25).
В нашем первом случае лечение стероидами и ММФ привело к частичной ремиссии желудочковой аритмии.
Во втором случае функции правого желудочка и левого желудочка относительно восстановились с помощью стероидного импульса и MMF.
У третьего пациента улучшилось состояние миокарда и желудочковая аритмия. Конечно, ей сделали абляцию аритмии. Однако очевидно, что иммунодепрессанты могут частично контролировать сердечную недостаточность и аритмию (7).
Для комбинаций лекарственных препаратов необходимы дальнейшие исследования, в особенности клинические.
Препараты против сердечной недостаточности (ангиотензинпревращающий фермент или блокаторы рецепторов ангиотензина и B-блокаторы) использовались для наших пациентов в соответствии с рекомендациями (26).
Специальных рекомендаций по повторной биопсии в GCM для диагностики и последующего наблюдения за лечением и оценки прогноза не существует (2), но, учитывая результаты повторной биопсии в третьем случае, рекомендуется провести дальнейшие исследования для повторной биопсии. и биопсия левого желудочка у пациентов с GCM.
3.1. Вывод
Особенно важно учитывать гигантоклеточный миокардит при тахиаритмии и брадиаритмии неизвестного происхождения, особенно у пациентов молодого и среднего возраста. В целом иммунодепрессанты могут помочь контролировать ГКМ, но необходимы клинические испытания.
Острый фульминантный гигантоклеточный миокардит, проявляющийся синкопальными явлениями, успешно вылеченный ортотопической трансплантацией сердца
Ссылка на статью:
Дэвид Ф. Миранда, Моси К.Беннетт и Питер Зимбва ( 2017 ) Острый фульминантный гигантоклеточный миокардит, проявляющийся синкопальными явлениями, успешно лечится с помощью ортотопической трансплантации сердца. Журнал Фонда Института сердца Миннеаполиса: январь 2017 г., Vol. 1, № 1. С. 72-75.
История болезни
Дэвид Ф. Миранда, MD * †, Моси К. Беннетт, MD, PhD *, и Питер Зимбва, MD, PhD, MSc, MRCP, DTM & H †
* Minneapolis Heart Institute, Abbott Northwestern Больница, Миннеаполис, Миннесота;
† Отделение кардиологии, Департамент медицины, Медицинский центр округа Хеннепин, Миннеаполис, Миннесота
Адрес для корреспонденции:
Питер Зимбва, доктор медицины, доктор медицинских наук, MSC, MRCP, DTM & H
800 East 28th Street
Abbott Northwestern Hospital
Миннеаполис, Миннесота 55407
Электронная почта: zimbwap @ gmail.com
РЕФЕРАТ
Миокардит является основной причиной терминальной сердечной недостаточности и является причиной до 10% случаев идиопатической дилатационной кардиомиопатии. Гигантоклеточный миокардит — это особенно быстро развивающееся заболевание, которое плохо поддается иммуносупрессивной терапии. Окончательное лечение — трансплантация сердца .
Ключевые слова: трансплантация сердца, гигантоклеточный миокардит, иммуносупрессия, мультимодальная визуализация, отторжение трансплантации сердца
ВВЕДЕНИЕ
Гигантоклеточный миокардит — редкая форма миокардита неизвестного происхождения, гистологически характеризующаяся диффузным миокардитом. многоядерные гигантские клетки без саркоидоза. 1 Пациенты часто обращаются с быстро прогрессирующей клинической сердечной недостаточностью и желудочковыми аритмиями. 2 В целом, средняя выживаемость пациентов с гигантоклеточным миокардитом составляет 5,5 месяцев с момента появления симптомов. Из-за быстрого прогрессирования болезни некоторые умирают в ожидании пересадки сердца. В регистре 34 пациентов, перенесших трансплантацию сердца, у 9 был рецидив гигантоклеточного миокардита в трансплантированном сердце, и 1 умер. 3,4 Исход пациента можно улучшить с помощью раннего распознавания и последующего вмешательства с помощью иммуносупрессивной терапии и расширенной терапии сердечной недостаточности.
ПРЕЗЕНТАЦИЯ СЛУЧАЯ
56-летний мужчина поступил в отделение неотложной помощи с несколькими пресинкопальными эпизодами. У него были эти эпизоды, связанные с сердцебиением, в течение 2 недель. Первоначальная электрокардиограмма показала атриовентрикулярную (АВ) блокаду первой степени с морфологией правой ножки пучка Гиса и депрессию ST с реципрокной элевацией ST в aVR, относящуюся к глобальной ишемии ( Рисунок 1 ). Его артериальное давление было 127/68, а частота сердечных сокращений — 86 ударов в минуту.Его сердечно-сосудистое обследование было ничем не примечательным. Исходные лабораторные значения были следующими: гемоглобин 15 г / дл, тромбоциты 206 000 / куб. М, натрий 136 ммоль / л, калий 4,2 ммоль / л и креатинин 0,89 мг / дл. Исходный тропонин I составил 3,887 нг / мл. Коронарная ангиограмма не показала обструктивной болезни коронарной артерии. Эхокардиограмма, выполненная за 6 дней до обращения, не показала аномалий движения стенки с нормальной фракцией выброса. Магнитно-резонансное изображение сердца (МРТ) показало обширное поглощение гадолиния в частях эпикарда и эндокарда левого желудочка, правого желудочка и межжелудочковой перегородки (, рис. 2, ) и было подозрительным на миокардит.Обширные вирусные серологические исследования острого миокардита не выявили особенностей. Эндомиокардиальная биопсия не показала явных признаков воспаления или инфильтративного заболевания. Затем у него были прогрессирующие нарушения проводимости с частыми паузами (до 6 секунд) и АВ-блокада типа Мобитц II.
| РИСУНОК 1 Результаты электрокардиограммы. |
| РИСУНОК 2 МРТ сердца показала обширный миокардит, включая левый желудочек, правый желудочек и межжелудочковую перегородку. |
Через две недели после выписки у него была устойчивая мономорфная желудочковая тахикардия. Повторная эндомиокардиальная биопсия показала гигантоклеточный миокардит (, рис. 3, ). В это время он начал принимать преднизон и циклоспорин. Он был внесен в список United Network for Organ Sharing (UNOS) со статусом 2 для трансплантации сердца, а для первичной профилактики был установлен двухкамерный имплантируемый кардиовертер-дефибриллятор. Впоследствии он был повторно доставлен в больницу с прогрессирующей утомляемостью и продолжающимся учащенным сердцебиением.Несмотря на агрессивную антиаритмическую и иммунодепрессивную терапию, у него были стойкие нарастание и уменьшение фракции выброса и аритмии. Ему был повышен статус UNOS 1Ae, и через 74 дня после его первого обращения ему была сделана ортотропная трансплантация сердца. Патологическое исследование эксплантированного сердца выявило остаточный лимфоцитарный миокардит с очаговыми, а также умеренными редкими гигантскими клетками (, рис. 4, ). Произошла интерстициальная замена с фиброзом, а также лимфоцитарными инфильтратами ( Рисунок 5 ).Клинически он чувствует себя очень хорошо через три года после трансплантации, может заниматься спортом и живет нормальной жизнью.
| РИСУНОК 3 A, B. Примеры гигантских клеток в эндомиокарде. C. Показывает очаг воспаления с гигантской клеткой на периферии. D. Доказательства активного воспаления, проникающего в нормальные клетки миокарда. |
| РИСУНОК 4 Эксплантированная патология сердца с остаточным лимфоцитарным миокардитом с очаговыми, а также с редкими гигантскими клетками легкой степени. |
| РИСУНОК 5 Интерстициальное замещение при фиброзе эндомиокарда. |
ОБСУЖДЕНИЕ
Гигантоклеточный миокардит патологически характеризуется смешанным воспалительным клеточным инфильтратом с некротическими миоцитами, многоядерными гигантскими клетками с гистиоцитами, окруженными эозинофилами, лимфоцитами и случайными плазматическими клетками. Гигантоклеточный миокардит может быть аутоиммунным заболеванием, зависящим от CD-4-положительных лимфоцитов. 5 Важно интерпретировать образцы биопсии или образцы эксплантированного сердца с полным знанием истории болезни пациента. Часто бывает необходимо исследовать несколько уровней биопсии эндомиокарда, чтобы обнаружить гранулемы, которые могут быть очаговыми. Возможно, поэтому его первоначальная биопсия была отрицательной.
Лечение пациентов с гигантоклеточным миокардитом никогда не изучалось методом рандомизированного контроля. Первый зарегистрированный случай успешного лечения агрессивной иммуносупрессией был в 1987 году. 6 С этого времени несколько пациентов с гигантоклеточным миокардитом отреагировали на иммуносупрессию, но Реестр гигантоклеточного миокардита показал наибольший успех при трансплантации сердца, выполненной более чем у 50% пациентов. 2 Также были зарегистрированы случаи рецидива в пересаженных сердцах.
В настоящее время трансплантация сердца является золотым стандартом терапии со средней выживаемостью более 10 лет для пациентов с терминальной сердечной недостаточностью. 7 Многие достижения в области иммуносупрессии, профилактики инфекций и хирургических методов превратили трансплантацию сердца в рутинное лечение. 8
В заключение, пациенты с гигантоклеточным миокардитом часто имеют острую сердечную недостаточность, аритмию и нарушения проводимости. Несмотря на первоначальную относительную гемодинамическую стабильность, у нашего пациента был ранний рецидив трудноизлечимых симптоматических аритмий, резистентных к обычной терапии. Он разработал четкие показания для трансплантации сердца с прекрасным результатом. 9
ССЫЛКИ
| 1 | Уилсон М.С., Барт РФ, Бейкер ПБ, Унверферт Д.В., Колибаш А.Дж.Гигантоклеточный миокардит. Ам Дж. Мед. . 1985. 79: 647–652. [Crossref] [Google Scholar] |
| 2 | Cooper LT, Berry GL, Shabetai R; Исследователи группы по исследованию многоцентрового гигантоклеточного миокардита. Идиопатический гигантоклеточный миокардит — естественное течение и исход. N Английский язык J Med . 1997; 336: 1860–1866. [Crossref] [Google Scholar] |
| 3 | Мейсон Дж. У., О’Коннелл Дж. Б., Херсковиц А. и др. Клиническое испытание иммуносупрессивной терапии миокардита.Исследователи по лечению миокардита. N Английский язык J Med . 1995; 333: 269–275. [Crossref] [Google Scholar] |
| 4 | Davidoff R, Palacious I, Southern J, Fallon JT, Newell J, Dec GW. Гигантоклеточный и лимфоцитарный миокардит: сравнение их клинических характеристик и отдаленных результатов. Тираж . 1991; 83: 953–961. [Crossref] [Google Scholar] |
| 5 | Дэвис MJ, Pomerance A, Teare RD. Идиопатический гигантоклеточный миокардит — отличительное клинико-патологическое заболевание. Br Сердце J . 1975. 37: 192–195. [Crossref] [Google Scholar] |
| 6 | Костанза-Нордин М. Р., Сильвер М. А., О’Коннелл Дж. Б., Сканлон П. Дж., Робинсон Дж. А.. Гигантоклеточный миокардит: резкое улучшение гемодинамики и гистологии после иммуносупрессивной терапии. |

 Применяется в тяжелых случаях, для подавления гормона кортизона, ответственного за развитие воспалительных процессов;
Применяется в тяжелых случаях, для подавления гормона кортизона, ответственного за развитие воспалительных процессов;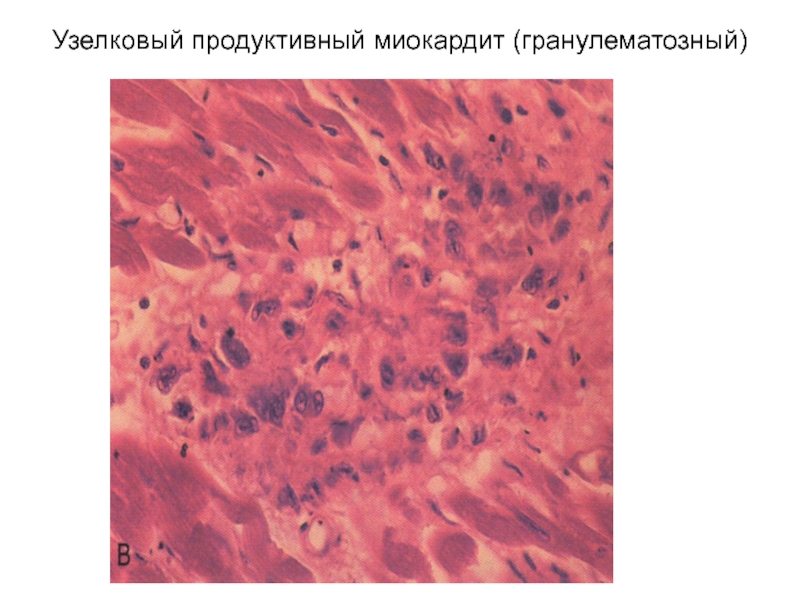 Вызывают такие распространенные заболевания, как тонзиллит, ларингит, отит, конъюнктивит, кандидоз и т.д.
Вызывают такие распространенные заболевания, как тонзиллит, ларингит, отит, конъюнктивит, кандидоз и т.д.

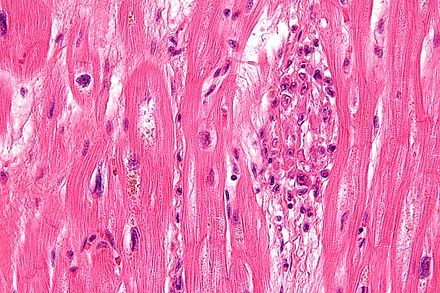
 gov/ency/article/007307.htm
gov/ency/article/007307.htm