Genes & Cells
Г.Л. Менткевич, А.А. Исаев, А.В. Приходько, И.В. Потапов, Р.В. Деев
О современном статусе и перспективах развития клинически значимых клеточных технологий:
Главное не мешать!
В материале приведена беседа врачей-разработчиков, администраторов и клиницистов, посвященная внедрению в практику здравоохранения банкирования клеток пуповинной крови и пупочного канатика. Приведены данные о проводимых в мире клинических исследованиях по оценке безопасности и эффективности применения клеток пуповинной крови.
Ключевые слова: пуповинная кровь, кроветворение, РУСКОРД, Гемабанк.
G.L. Mentkevich, A.A. Isaev, A.V. Prikhodko, I. V. Potapov, R.V. Deev
On the current status and prospects for the development of clinically significant cell technologies
The material contains a conversation between doctors-developers, administrators, and clinicians on the introduction of banking of umbilical cord blood and umbilical cord cells into healthcare practice. The data on clinical studies conducted in the world to assess the safety and effectiveness of the use of umbilical cord blood cells are presented.
The data on clinical studies conducted in the world to assess the safety and effectiveness of the use of umbilical cord blood cells are presented.
Keywords: umbilical cord blood, hematopoiesis, RUSCORD, Gemabank.
Р.В. Деев. Глубокоуважаемые коллеги, сегодня мы обсуждаем значимый для нашего здравоохранения вопрос – проблему разработки и внедрения биомедицинских трансплантационных технологий; в частности – статус в мире и России по сохранению гемопоэтических клеток и их применению в рамках канонических гематологических и негематологических показаний.
Первый мой вопрос заведующему лабораторией Гемабанка – кандидату медицинских наук Ивану Викторовичу Потапову. Иван Викторович, как на Ваш взгляд поменялись представления о возможностях клеточной трансплантологии за прошедшие 20 лет текущего века? Какое место в ней занимало и занимает банкирование и применение клеточных технологий?
И.В. Потапов. В начале текущего века клеточная трансплантология была широко представлена трансплантациями кроветворных стволовых клеток в лечении онкогематологических заболеваний. При этом на уровне фундаментальных исследований активно изучались свойства эмбриональных стволовых клеток, прогениторных региональных стволовых клеток (в т.ч. фетальных), а также произошел некоторый «ренессанс» в вопросах изучения свойств мезенхимальных стволовых (стромальных) клеток.
При этом на уровне фундаментальных исследований активно изучались свойства эмбриональных стволовых клеток, прогениторных региональных стволовых клеток (в т.ч. фетальных), а также произошел некоторый «ренессанс» в вопросах изучения свойств мезенхимальных стволовых (стромальных) клеток.
Актульные для того периода представления о будущей роли этих клеток были оптимистичными и даже идеалистическими. Представлялось, что стволовые и прогениторные клетки из разных источников после трансплантации могут восстановить популяцию специализированных клеток (например, кардиомиоцитов, нейронов, гепатоцитов и т.д.) и кардинально изменить исходы таких тяжелых заболеваний как инфаркт миокарда, инсульт, цирроз печени.
В начале нулевых годов стартовало множество исследований по изучению безопасности и эффективности применения т.н. мононуклеарных клеток костного мозга для лечения различных форм ишемической болезни сердца. Вскоре стало понятно, что такой подход (достаточно простой с технологической точки зрения) не приносит значимых результатов. В частности, исследователи осознали, что идея о заместительной функции стволовых и прогениторных клеток в лечении болезней внутренних органов несостоятельна. Трансплантированные клетки, ауто- или аллогенные, не могли повлиять на репаративную регенерацию органов в достаточной степени, чтобы заместить рубцовую ткань, восстановить кровоснабжение и иннервацию, то есть de novo восстановить нормальную структуру органа после повреждения.
В частности, исследователи осознали, что идея о заместительной функции стволовых и прогениторных клеток в лечении болезней внутренних органов несостоятельна. Трансплантированные клетки, ауто- или аллогенные, не могли повлиять на репаративную регенерацию органов в достаточной степени, чтобы заместить рубцовую ткань, восстановить кровоснабжение и иннервацию, то есть de novo восстановить нормальную структуру органа после повреждения.
Поэтому первым следствием такого «отрезвления» стала смена концепции заместительного эффекта клеточной терапии на регуляторную. В настоящее время основная масса ученых придерживается мнения, что клеточные популяции, привносимые в пораженный орган с терапевтической целью, оказывают паракринный эффект, выделяя различные регуляторные молекулы белковой природы, например, цитокины, а также микровезикулы. При этом они могут стимулировать региональные прогениторные клетки, ангиогенез, влиять на работу макрофагов и аутоиммунные процессы.
Вторым следствием стало то, что сравнительно простые технологии с использованием клеток, полученных в результате минимального набора лабораторных манипуляций не всегда и не везде применимы. Чтобы получить больший эффект от трансплантации с клетками нужно работать: наращивать целевые популяции, модифицировать in vitro, использовать достижения из смежных областей (генной и тканевой инженерии).
Чтобы получить больший эффект от трансплантации с клетками нужно работать: наращивать целевые популяции, модифицировать in vitro, использовать достижения из смежных областей (генной и тканевой инженерии).
Что касается идеи банкирования, то, на мой взгляд, она не претерпела кардинальных изменений. Клеточные биобанки использовались и используются в онкогематологии для заготовки аутоклеток перед химиотерапией, банки пуповинной крови работают как источники донорского биоматериала. Идеология персональных банков пуповинной крови также кардинально не поменялась и по-прежнему продвигает идею сохранения клеток «нулевого дня» для использования в отдаленном будущем, а также для лечения некоторых болезней в педиатрии. В целом видно, что идея биобанкирования утрачивает романтический оттенок, приобретает более реалистичные и прагматические черты; становится рутинной.
А.В. Приходько. Я бы хотел дополнить исторический экскурс Ивана Викторовича нашим собственным опытом. Вы знаете, на этапе создания Гемабанка, в 2003 году, хотелось качественно реализовать у нас актуальные на тот момент медицинские услуги, перенять опыт западных коллег, и сделать банкирование доступным на всей территории России. Фактически, здесь мы были первопроходцами. Хочу отметить, что начинать что-то новое всегда нелегко, но у нас была сильная команда, и нас вдохновлял опыт банкирования за рубежом. На этой задаче мы и сосредоточились в первый год существования Гемабанка. Мы продвигались сразу в трех направлениях.
Фактически, здесь мы были первопроходцами. Хочу отметить, что начинать что-то новое всегда нелегко, но у нас была сильная команда, и нас вдохновлял опыт банкирования за рубежом. На этой задаче мы и сосредоточились в первый год существования Гемабанка. Мы продвигались сразу в трех направлениях.
Первое направление — это обучение персонала роддомов забору пуповинной крови, чему, разумеется, предшествовали решения административных вопросов. Вторым направлением было создание информационно-просветительских программ, как во врачебных кругах, так и среди будущих родителей. Третий вектор — это обеспечение логистики для оперативной доставки биоматериала из роддомов из разных уголков России в столицу, т.к. лаборатория и криохранилище находятся здесь.
После того, как этот — первый этап работы был отлажен, мы начали подготовку ко второму, более сложному, на мой взгляд, этапу. Основной задачей на тот момент было актуализировать банкирование и клиническое применение гемопоэтических стволовых клеток пуповинной крови (ГСК ПК) в нашей стране. Мы не случайно открыли Гемабанк на базе Онкоцентра им. Н.Н. Блохина[1], т.к. это профильное учреждение занимается лечением онкологических и онкогематологических заболеваний с использованием гемопоэтических стволовых клеток костного мозга. Именно в этом учреждении была разработана уникальная методика по выделению, криоконсервации и хранению гемопоэтических стволовых клеток костного мозга. Эта же методика была успешно адаптирована и для пуповинной крови.
Мы не случайно открыли Гемабанк на базе Онкоцентра им. Н.Н. Блохина[1], т.к. это профильное учреждение занимается лечением онкологических и онкогематологических заболеваний с использованием гемопоэтических стволовых клеток костного мозга. Именно в этом учреждении была разработана уникальная методика по выделению, криоконсервации и хранению гемопоэтических стволовых клеток костного мозга. Эта же методика была успешно адаптирована и для пуповинной крови.
Э. Глюкман (Париж, Франция), А.В. Приходько (Москва), А.А. Исаев (Москва), 2011
На тот момент богатый опыт выделения, криоконсервации и применения этого биоматериала был только у зарубежных коллег. Поэтому мы решили привлечь мировых лидеров, трансплантологов с большим опытом к обмену знаниями. Так зародилась идея проведения международных симпозиумов в Москве и нам удалось организовать и проводить его в течение нескольких лет. На один из таких симпозиумов была приглашена доктор, трансфузиолог, Элиан Глюкман, которая впервые в 1988 году провела трансплантацию ГСК ПК для лечения пациента с анемией Фанкони. Именно после этого случая начали создаваться донорские и персональные банки пуповинной крови в США, Европе и Азии.
Именно после этого случая начали создаваться донорские и персональные банки пуповинной крови в США, Европе и Азии.
В России Гемабанк был и остается первым и единственным банком по сей день, чьи образцы были использованы клиентами для проведения родственных аллогенных трансплантаций. Так, в 2005 году Гемабанк выдал первый образец для проведения родственной аллогенной трансплантации для лечения нейробластомы 4 стадии. Трансплантация была проведена Г.Л. Менткевичем в Онкоцентре им. Н.Н. Блохина. У пациента после трансплантации в течение 5 лет наблюдалась устойчивая ремиссия. Этот случай стал началом эры клинического применения ГСК ПК из частного банка пуповинной крови, и уже ни у кого не возникало сомнения, что мы переходим на новый, третий этап развития компании – применение ГСК ПК в практической медицине России.
Позднее была выполнена череда аллогенных трансплантаций для лечения пациентов с анемии Фанкони, лейкозов, синдрома Швахмана-Даймонда и др.
Р.В.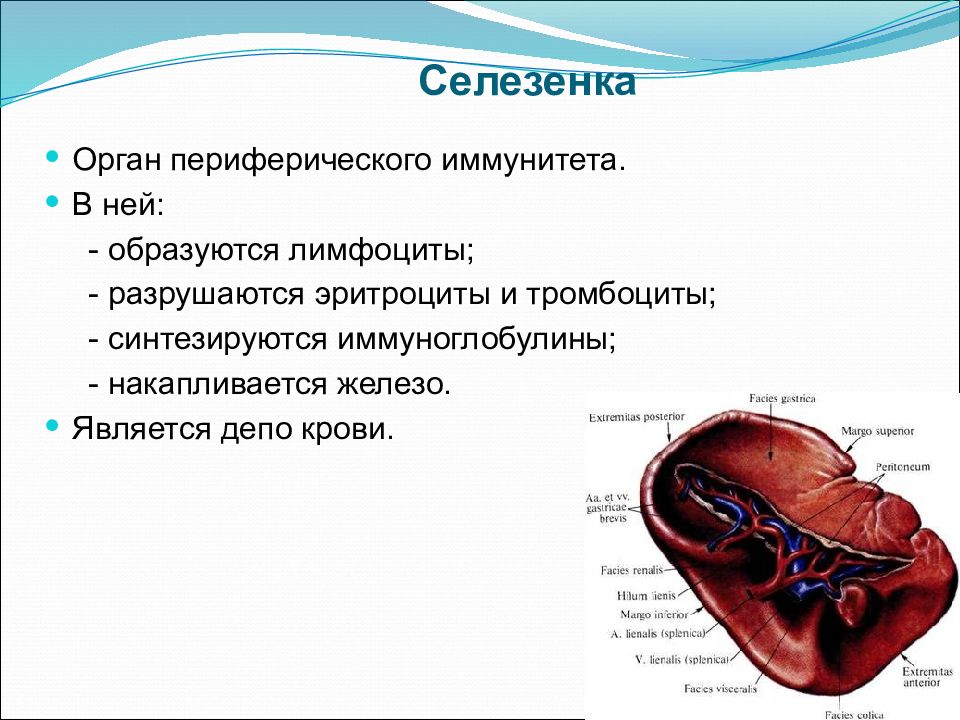 Деев. Георгий Людомирович, согласны ли Вы с тем, что взгляды на клиническое применение гемопоэтических клеток из различных источников в клинической практике изменились?
Деев. Георгий Людомирович, согласны ли Вы с тем, что взгляды на клиническое применение гемопоэтических клеток из различных источников в клинической практике изменились?
Г.Л. Менткевич. Конечно. За более чем 50-летний период использования гемопоэтических стволовых клеток в терапевтических целях взгляды на сферы их применения существенно расширились. Меняются как показания, так и технологии их применения. Совершенствуются методы деплеции и селекции нужных популяций иммунокомпетентных клеток, проводятся исследования для придания селектированным клеткам желательных свойств (например, для усиления эффекта трансплантат против опухоли или уменьшения эффекта трансплантат-против-хозяина). Наиболее репрезентативные и достоверные исследования относятся к области проведения относительно стандартных методик традиционной трансплантации кроветворных клеток, в основном, при злокачественных заболеваниях крови. Вместе с тем развиваются подходы в изучении возможности применения клеточных технологий в области персонифицированной иммунотерапии злокачественных заболеваний, такие как адоптивная иммунотерапия дендритными вакцинами, использование цитотоксических лимфоцитов как аутогенных, так и аллогенных (например, при злокачественных опухолях центральной нервной системы). Особый интерес представляют наработки по возможному использованию клеток пуповинной крови и материала, который можно получать из пуповинно-плацентарного комплекса. Стволовые клетки, получаемые из этого источника, находят меньшее применение в стандартной трансплантационной практике, однако имеют ряд преимуществ при использовании в регенеративной медицине. Подкупает также способ их получения, при котором не требуется никаких манипуляций с донором или будущим пациентом, если данная процедура осуществляется в целях индивидуального сохранения.
Особый интерес представляют наработки по возможному использованию клеток пуповинной крови и материала, который можно получать из пуповинно-плацентарного комплекса. Стволовые клетки, получаемые из этого источника, находят меньшее применение в стандартной трансплантационной практике, однако имеют ряд преимуществ при использовании в регенеративной медицине. Подкупает также способ их получения, при котором не требуется никаких манипуляций с донором или будущим пациентом, если данная процедура осуществляется в целях индивидуального сохранения.
Р.В. Деев. Иван Викторович, скажите пожалуйста, все же, каковы научно-обоснованные аппликации для клеточных технологий на сегодняшний день; что Вы прогнозируете на ближайшие 10-20 лет? Что может пересадка клеток дать практической онкологии? Антиэйджингу?
Нынешние горизонты клеточных технологий не показывают революционных сдвигов в практической медицине. Но, безусловно, они способны многое ей дать. Особенно если использовать их в сочетании с современными достижениями в создании генетических модификаций клеток (генетическое редактирование, перепрограммирование клеток перед трансплантацией), тканевой инженерии (создание 2d и 3d конструкций с живыми клетками), широким внедрением генодиагностики.
Особенно если использовать их в сочетании с современными достижениями в создании генетических модификаций клеток (генетическое редактирование, перепрограммирование клеток перед трансплантацией), тканевой инженерии (создание 2d и 3d конструкций с живыми клетками), широким внедрением генодиагностики.
Что касается онкологии, то, как мне видится, методы воздействия на опухоль в виде химио- или лучевой терапии уже подходят к своему потолку, и фокус внимания онкологов сместился на методы активации противоопухолевого иммунитета. А это направление как раз развивается в плоскости клеточных технологий.
Продление жизни – спекулятивная тема. Существует гипотеза о том, что кроветворные или мезенхимальные стволовые (стромальные) клетки, сохраненные в момент рождения, могут через 50 и более лет хранения на фоне успехов медицины будущего положительно повлиять на здоровье постаревшего владельца такого «вклада». Однако доказать или опровергнуть такую гипотезу сейчас нельзя, ведь первый образец пуповинной крови был сохранен в 1992 году, то есть самые «старые» 30-летние вкладчики сейчас не нуждаются в продлении жизни.
Безусловно, персональный банк пуповинной крови не может жить только мечтами о будущем, это как минимум непрактично. Гемабанк сотрудничает со всеми клиническими центрами нашей страны, проводящими трансплантации в детской онкогематологии, к настоящему моменту нами выдано, а клиницистами трансплантировано по показаниям 6 образцов. Также образцы пуповинной крови востребованы для экспериментального лечения ДЦП. Для этих целей выдано 30 образцов.
Поскольку медицина развиваетсяинтенсивно, и в последние 15 лет появилось множество клинических исследований с использованием клеток пуповинной крови в лечении болезней внутренних органов неопухолевой природы, востребованность образцов будет медленно, но верно расти.
Еще одна услуга Гемабанка – выделение и хранение мезенхимальных (стромальных) клеток пупочного канатика. Клинические исследования в мире с использованием этого биоматериала начались сравнительно недавно и пока не дают сформулировать окончательных выводов о востребованности этого клеточного материала со стороны практического здравоохранения.
Я думаю, что Гемабанку, чтобы оставаться в тренде современных биотехнологий и активно формировать их, необходимо развивать лабораторную базу, проводить больший объем собственных фундаментальных исследований.
Р.В. Деев. Александр Викторович, а как Вы видите драйверы развития гемабанков?
А.В. Приходько. Вы знаете, согласно данным международной статистики в настоящее время в мире, в частных и в донорских банках суммарно сохранено более 7 млн образцов пуповинной крови. При этом мировой запас пуповинной крови ежегодно увеличивается более чем на 600 000 образцов. В пуповинной крови содержится большое количество кроветворных стволовых клеток, которые успешно применяются в практическом здравоохранении для лечения более 100 различных заболеваний. Это известные факты.
Практика их клинического применения насчитывает более 30 лет. В мире действуют более 200 банков пуповинной крови. 10 мировых лидеров банкирования хранят свыше 4 млн образцов пуповинной крови, а также ткани и клеток пупочного канатика. Наибольший опыт хранения пуповинной крови накоплен США и Китаем. Они же проводят самое большое количество трансплантаций и клинических исследований по применению стволовых клеток пуповинной крови и пупочного канатика для лечения детского церебрального паралича (ДЦП), аутизма, болезни Альцгеймера, диабета, заболеваний сердца, печени, болезни Паркинсона и др.
Наибольший опыт хранения пуповинной крови накоплен США и Китаем. Они же проводят самое большое количество трансплантаций и клинических исследований по применению стволовых клеток пуповинной крови и пупочного канатика для лечения детского церебрального паралича (ДЦП), аутизма, болезни Альцгеймера, диабета, заболеваний сердца, печени, болезни Паркинсона и др.
В зависимости от стран пуповинную кровь сохраняют около 0,5-10% всех рожающих. Однако, например, в Сингапуре эта величина достигает 30%. Эксперты связывают такую большую разницу в отношении государства, а именно в некоторых странах предусмотрена выплата государственного пособия на рождение ребенка, часть из которого можно использовать для оплаты услуг биострахования, а также с широким распространением в стране комбинированной модели персонального и донорского хранения пуповинной крови.
Во всемирной поисковой системе доноров костного мозга в настоящее время зарегистрировано более 30 млн доноров, из них 700 000 приходятся на донорские образцы пуповинной крови.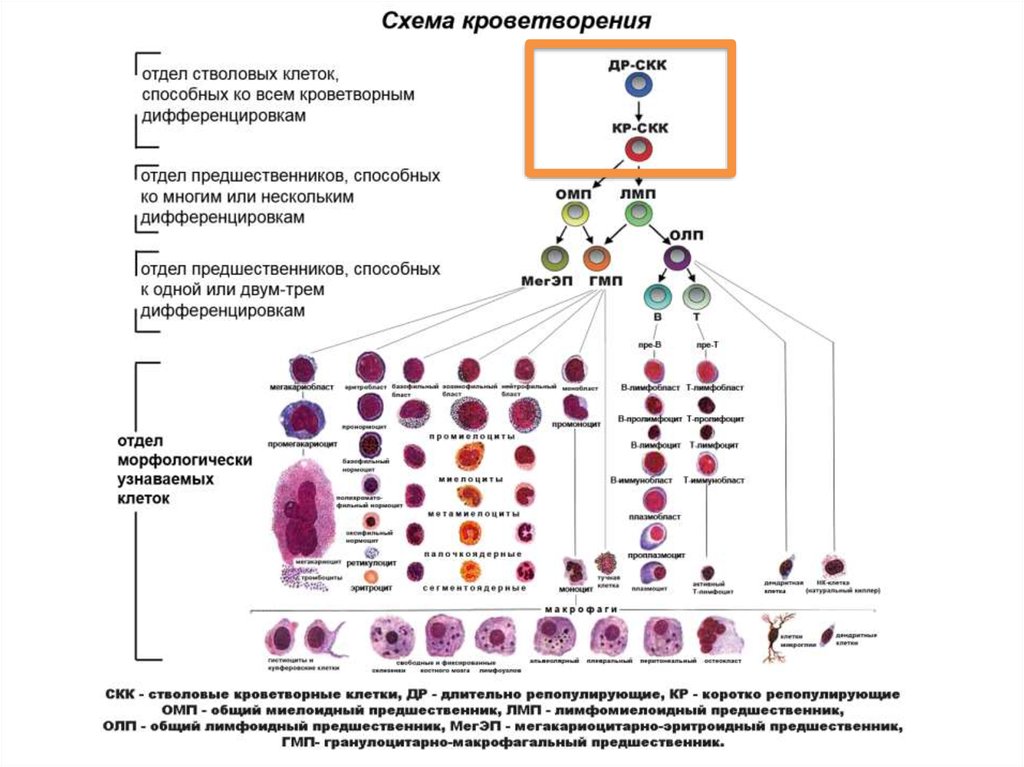 В систему входят 75 регистров из 53 стран мира, а также 53 банка пуповинной крови из 36 стран, в том числе и из России.
В систему входят 75 регистров из 53 стран мира, а также 53 банка пуповинной крови из 36 стран, в том числе и из России.
В РФ на сегодня работает 10 банков персонального и донорского хранения пуповинной крови. Суммарно в них сохранены более 100 000 образцов пуповинной крови. При этом, около 17 000 образцов сохранено в донорских банках (10 000 в Самарском центре «Династия», 5000 — в донорском банке стволовых клеток в Москве), 74 000 – в банках персонального хранения, из них более 32 000 образцов — в Гемабанке.
Безусловно, Россия использует мировой опыт и двигается за лидерами в области клеточных технологий. Успех США и Китая основан на колоссальных инвестициях, направленных на клинические исследования. Так, в этих странах сконцентрирован наибольший процент исследований, проводимых в мире. При появлении глобальных проблем, например таких, какой недавно стал COVID-19, первым отреагировал Китай. На данный момент там проведено несколько успешных клинических исследований по применению стволовых клеток пуповинной крови и пупочного канатика для профилактики и лечения осложнений коронавирусной инфекции. Важна поддержка государства в отношении ускоренного процесса утверждения протоколов клинических исследований. Гибкость и сплоченность работы частного и государственного секторов в данных вопросах, позволяет странам быстро реагировать на возникшую проблему. В этом плане мы менее динамичны по сравнению с США и Китаем.
Важна поддержка государства в отношении ускоренного процесса утверждения протоколов клинических исследований. Гибкость и сплоченность работы частного и государственного секторов в данных вопросах, позволяет странам быстро реагировать на возникшую проблему. В этом плане мы менее динамичны по сравнению с США и Китаем.
Н.П. Бочков (Москва), А.Г. Румянцев (Москва), А.В. Приходько (Москва), О.В. Тюмина (Самара)
Для ускорения процессов утверждения различных протоколов для исследований и применения пуповинной крови в России в 2019 году была зарегистрирована ассоциация специалистов и организаций в области заготовки, хранения и применения клеток пуповинной крови и клеточных технологий РУСКОРД. В настоящее время ассоциация РУСКОРД объединяет два донорских банка пуповинной крови и банки персонального хранения, в том числе “Гемабанк” (Россия), “МЦ Династия” (Самара), “Покровский банк стволовых клеток” (Санкт-Петербург), Уфимский банк стволовых клеток, Банк пуповинной крови (Владивосток) и “Био-Банкинг Солюшнс” (Москва).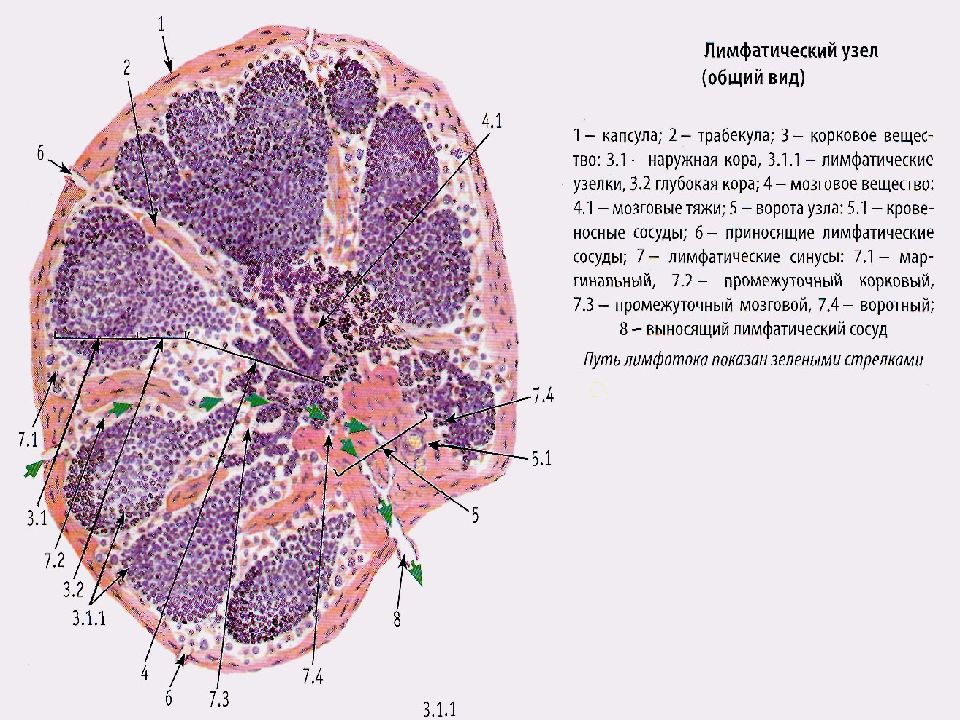 Ассоциация создана с целью регулирования деятельности участников отрасли, а также для поддержки и активного развития научных исследований в области клеточных технологий в регенеративной медицине и развития международного сотрудничества с ведущими мировыми исследовательскими университетами.
Ассоциация создана с целью регулирования деятельности участников отрасли, а также для поддержки и активного развития научных исследований в области клеточных технологий в регенеративной медицине и развития международного сотрудничества с ведущими мировыми исследовательскими университетами.
Р.В. Деев. Мне кажется, что самое время спросить Артура Александровича о том, как общемировые тенденции способствуют разработкам и их внедрению в России. 18-летний опыт работы Вашего коллектива наверняка позволит Вам охарактеризовать особенности внедрения новых разработок в области клеточных и (даже) генных технологий в нашей стране?
А.А. Исаев. Внедрение «первых в классе» препаратов и инновационных медицинских технологий имеет хорошие перспективы при условии здравоохранения с большим бюджетом. Именно это стимулирует инвесторов вкладывать в новые разработки значительные средства. Наиболее благодатная почва для развития биотехнологий — экономики с большим рынком и высокой стоимостью услуг. Сегодня в этом лидируют опять же — США, а также Европа и Япония. Имеется статистика, согласно которой 60% «первых в классе» препаратов разрабатывается и внедряется в США, около 20% — в странах ЕС, 13% — в Японии. Несколько развивающихся стран, включая Россию, Бразилию, Индию составляют около 1% рынка «первых в классе» препаратов. В последующем новые разработки выходят и на другие рынки. Если препарат появился в США и получил там рынок, дальше он будет развиваться в Европе, Азии, России и далее по миру.
Сегодня в этом лидируют опять же — США, а также Европа и Япония. Имеется статистика, согласно которой 60% «первых в классе» препаратов разрабатывается и внедряется в США, около 20% — в странах ЕС, 13% — в Японии. Несколько развивающихся стран, включая Россию, Бразилию, Индию составляют около 1% рынка «первых в классе» препаратов. В последующем новые разработки выходят и на другие рынки. Если препарат появился в США и получил там рынок, дальше он будет развиваться в Европе, Азии, России и далее по миру.
Важно отметить, что в странах с невысокими расходами на здравоохранение перспектива внедрения новых разработок снижена. В нашу страну 99% новых препаратов и технологий приходит после регистрации и появления на других рынках.
Что касается принятия врачебным сообществом новых препаратов и технологий, то здесь играют большую роль клинические рекомендации. Врачебное сообщество формирует рекомендации по лечению того или иного заболевания. Когда препарат или технология включаются в эти рекомендации, то его могут использовать все врачи. Лечение с использованием препаратов, включенных в клинические рекомендации, финансирует государственное здравоохранение. Важно учитывать, что в нашей стране доля государственного здравоохранения составляет 96% и только 4% — это вложенные в систему частные деньги. Главные специалисты Минздрава, формирующие рекомендации, с одной стороны находятся под давлением потребностей пациентов, которые требуют использования новых препаратов. А с другой стороны – под давлением финансовых возможностей системы. Люди, возглавляющие врачебное сообщество, действуют с оглядкой на бюджеты. Поэтому многие препараты и методы лечения в стандарты лечения не включаются по причине низкого бюджета здравоохранения. А если новый препарат, услуга или технология не заложены в статьи расходов ОМС, то они будут недоступны большинству пациентов.
Лечение с использованием препаратов, включенных в клинические рекомендации, финансирует государственное здравоохранение. Важно учитывать, что в нашей стране доля государственного здравоохранения составляет 96% и только 4% — это вложенные в систему частные деньги. Главные специалисты Минздрава, формирующие рекомендации, с одной стороны находятся под давлением потребностей пациентов, которые требуют использования новых препаратов. А с другой стороны – под давлением финансовых возможностей системы. Люди, возглавляющие врачебное сообщество, действуют с оглядкой на бюджеты. Поэтому многие препараты и методы лечения в стандарты лечения не включаются по причине низкого бюджета здравоохранения. А если новый препарат, услуга или технология не заложены в статьи расходов ОМС, то они будут недоступны большинству пациентов.
Сложности внедрения и доступа новых услуг и продуктов идущие к рынку в нашей стране приводят к тому, что средства, идущие на финансирование разработок, являются в основном государственными. Государство финансирует разработки через различные грантовые механизмы. Вместе с тем, многие частные компании и разработчики мало конкурентны в получении этих денег. Большинство грантов уходит в государственные институты и научные центры, у которых в свою очередь нет предпринимательского опыта, активности и мотивации для внедрения новых разработок в практику здравоохранения.
Государство финансирует разработки через различные грантовые механизмы. Вместе с тем, многие частные компании и разработчики мало конкурентны в получении этих денег. Большинство грантов уходит в государственные институты и научные центры, у которых в свою очередь нет предпринимательского опыта, активности и мотивации для внедрения новых разработок в практику здравоохранения.
Государственное финансирование очень неэффективно выбирает и ведет процесс разработок. Зачастую деньги вкладываются в разработки, не имеющие реальных перспектив в здравоохранении.
Например, инновационный препарат Неоваскулген (первый геннотерапевтический препарат в России и третий в мире) разрабатывался за несколько лет до того, как в 2007 году мы, в Институте Стволовых Клеток Человека, стали активно заниматься этим направлением и его внедрением в практическое здравоохранение. В 2011 году препарат получил регистрационное удостоверение и только с 2020 года началось его активное внедрение в практику и достаточно массовое использование.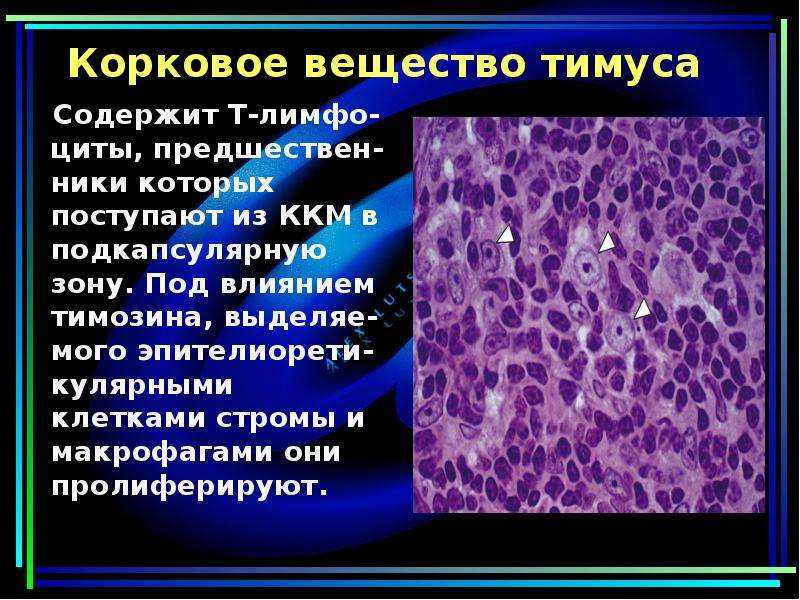
Во всем мире время разработки и внедрения инновационного препарата занимает около 12-15 лет. Но если этот путь проходится в России, то доступ к рынку занимает больше времен, чем за рубежом.
Р.В. Деев. Частные биотехнологические компании ведь могут оперировать и средствами частных инвестиций.
А.А. Исаев. Что касается развития в России инвестиционных механизмов и поддержки со стороны государства инновационных направлений, том числе биотехнологий, то многие из этих механизмов работают и мы ими пользуемся.
Для развития медицинского направления созданы специальные условия. Медицинская деятельность в нашей стране не облагается налогом на прибыль, и это существенный элемент поддержки. Медицинские услуги также не облагаются налогом на добавленную стоимость. Это благодатная почва для развития частного здравоохранения. Есть хорошие инструменты для разработчиков в виде статуса резидента Сколково, различных инновационных центров, технопарков и территорий особых зон, которые дают различные преференции и снижают нагрузки, связанные с налогами, платежами в фонды.
Мы используем разные механизмы. Например, Гемабанк для финансирования части развития, провел IPO — первичное публичное размещение ценных бумаг на Московской бирже. Сегодня Гемабанк акционерная компания, имеющая свои котировки на рынке и выплачивающая дивиденды. Фондовый рынок — это инструмент для привлечения ресурсов. На нем Гемабанк не только разместил акции, а также участвует в облигационной истории. Мы пользуемся широким спектром инструментов на фондовом рынке. И с точки зрения размещения ценных бумаг Институты Развития также оказывают поддержку. Так на Московской бирже создан специальный сектор — Рынок инноваций и инвестиций. Созданы инструменты субсидирования размещения. Пока этот механизм не является общепринятой практикой для инновационных компаний, но я уверен, что в последующем рынок капитала станет в России более востребованным источником финансирования.
Р.В. Деев. Георгий Людомирович, как этот процесс – развития биотеха и внедрения новых технологий выглядит на взгляд врача-клинициста? Как Вы видите происходящее?
Г. Л. Менткевич. Мы видим, что внедрение новых технологий и препаратов в последние годы происходит под жестким контролем разрешающих органов. Фармакологические компании тратят миллионы долларов и десятки лет на внедрение новых препаратов. Специфика развития фармакологического бизнеса на современном этапе, как правило, имеет ту особенность, что новые фармакологические средства направлены на глубинное взаимодействие с генетическим материалом клетки хозяина, отдаленные последствия которого не всегда возможно прогнозировать. Безусловно, перед нами стоят множественные медицинские проблемы, которые теоретически и практически могут быть решены с применением клеточного материала. Но при этом не следует забывать, что только собственные, не манипулированные клетки по всей видимости не несут существенного риска перестройки генетического репертуара пациента. В ситуациях с аллогенной трансплантацией стволовых клеток при неизлечимых заболеваниях мы поставлены перед жесткой дилеммой спасения жизни пациента.
Л. Менткевич. Мы видим, что внедрение новых технологий и препаратов в последние годы происходит под жестким контролем разрешающих органов. Фармакологические компании тратят миллионы долларов и десятки лет на внедрение новых препаратов. Специфика развития фармакологического бизнеса на современном этапе, как правило, имеет ту особенность, что новые фармакологические средства направлены на глубинное взаимодействие с генетическим материалом клетки хозяина, отдаленные последствия которого не всегда возможно прогнозировать. Безусловно, перед нами стоят множественные медицинские проблемы, которые теоретически и практически могут быть решены с применением клеточного материала. Но при этом не следует забывать, что только собственные, не манипулированные клетки по всей видимости не несут существенного риска перестройки генетического репертуара пациента. В ситуациях с аллогенной трансплантацией стволовых клеток при неизлечимых заболеваниях мы поставлены перед жесткой дилеммой спасения жизни пациента. В случаях же использования аллогенного материала пуповинно-плацентарного комплекса безусловно можно предполагать взаимодействие фрагментов генетического материала донора с геномом пациента с неизвестными отдаленными последствиями. В первую очередь, с моей точки зрения, это касается системного введения аллогенного материала с регенеративной целью. Необходимо также рассматривать и возможные краткосрочные негативные эффекты. Хорошо известная способность мезенхимальных (стромальных) клеток подавлять реализацию эффекта «трансплантат против опухоли» свидетельствует о наличии иммуносупрессивного потенциала, который вряд ли носит специфический характер. В этом аспекте банкирование своих собственных клеток пуповинной крови, возможно пуповинно-плацентарного комплекса, представляется на сегодняшний день наиболее перспективным фундаментом дальнейшего применения клеточных технологий.
В случаях же использования аллогенного материала пуповинно-плацентарного комплекса безусловно можно предполагать взаимодействие фрагментов генетического материала донора с геномом пациента с неизвестными отдаленными последствиями. В первую очередь, с моей точки зрения, это касается системного введения аллогенного материала с регенеративной целью. Необходимо также рассматривать и возможные краткосрочные негативные эффекты. Хорошо известная способность мезенхимальных (стромальных) клеток подавлять реализацию эффекта «трансплантат против опухоли» свидетельствует о наличии иммуносупрессивного потенциала, который вряд ли носит специфический характер. В этом аспекте банкирование своих собственных клеток пуповинной крови, возможно пуповинно-плацентарного комплекса, представляется на сегодняшний день наиболее перспективным фундаментом дальнейшего применения клеточных технологий.
Р.В. Деев. В этом контексте, Иван Викторович, какие перспективы применения – трансплантации сохраненных клеток вы видите, или, быть может, сами развиваете в Гемабанке?
И.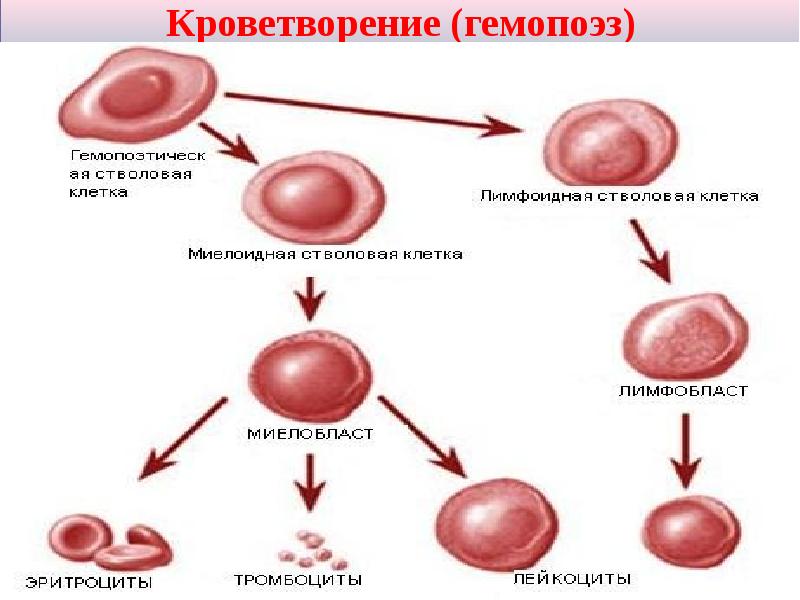 В. Потапов. Конечно помимо лабораторных возможностей мы активно сотрудничаем с клиницистами, и с каждым коллективом у нас своя история взаимодействия: каждый случай трансплантации по-своему уникален. Однако есть и то, что их все объединяет.
В. Потапов. Конечно помимо лабораторных возможностей мы активно сотрудничаем с клиницистами, и с каждым коллективом у нас своя история взаимодействия: каждый случай трансплантации по-своему уникален. Однако есть и то, что их все объединяет.
Во-первых, со стороны клиники всегда происходит тщательная подготовка, которая касается и оценки соотношения риск/польза, и подготовке реципиента, и тактики ведения в посттрансплантационный период и многих других аспектов. Во-вторых, Гемабанк свою часть работы касательно обработки, хранения и транспортировки образцов всегда выполняет максимально качественно, с применением как российских, так и лучших практик зарубежных стандартов. Это вместе создает фундамент, который минимизирует риски, связанные с лечением. Образцы, сохраненные в Гемабанке, принимались на лечение не только в нашей стране, но и в США, Ю. Корее, Германии, Грузии. Это означает, что клиницисты доверяют нам.
С точки зрения медицинской науки эффективность и безопасность должны оцениваться в рамках клинических исследований, с группами контроля, рандомизацией и др. правилами, Гемабанк на данный момент не имел возможности организации таких исследований в силу специфики своей работы, ведь неизвестно, когда и кому и при каком заболевании может понадобиться образец. Но в целом, все трансплантации, и в частности, качество предоставленных образцов, были оценены клиницистами положительно.
правилами, Гемабанк на данный момент не имел возможности организации таких исследований в силу специфики своей работы, ведь неизвестно, когда и кому и при каком заболевании может понадобиться образец. Но в целом, все трансплантации, и в частности, качество предоставленных образцов, были оценены клиницистами положительно.
А.В. Приходько. Дополню Ивана Викторовича. Важно, что Гемабанк стремится занять такую же лидерскую активную позицию на территории России, как мировые лидеры банкирования в США и в Китае. Это невозможно без обеспечения качества всего цикла нашей работы, а значит – образцов, сохраненных у нас. Как мы только что сказали, по количеству образцов, по их качеству, т.е. соответствию международным стандартам, Гемабанк лидирует на российском рынке персонального банкирования.
Говоря о локальном преимуществе, хочется отметить прежде всего широкий спектр услуг, предоставляемый Гемабанком. В частности, мы единственный банк в РФ с лицензией на сохранение стволовых клеток пуповинно-плацентарного комплекса, которые подтвердили свою безопасность и эффективность в более 100 клинических исследованиях, проведенных в Европе и в Азии. Еще одним из преимуществ является территория охвата и предоставление доступа к услугам для всех наших граждан. Наше неоспоримое преимущество в том, что Гемабанк имеет опыт применения образцов своих клиентов, как в России, так и за рубежом, для лечения лейкоза, лимфом, анемии Фанкони, синдрома Швахмана-Даймонда и других крайне тяжелых заболеваний. Наши клиенты уверены в том, что их образцы сохранены с наибольшим возможным объемом клеточности биоматериала и жизнеспособны, т.к. выделением и криоконсервацией клеток занимаются не рядовые лаборанты, а высококвалифицированные дипломированные специалисты. Также они уверены в том, что биоматериал можно использовать для лечения и мы помогаем на всех этапах, даже если клиент выбирает зарубежную клинику, не говоря уже об отечественных центрах трансплантации, с которыми у Гемабанка большой опыт сотрудничества и ряда успешных трансплантаций.
Еще одним из преимуществ является территория охвата и предоставление доступа к услугам для всех наших граждан. Наше неоспоримое преимущество в том, что Гемабанк имеет опыт применения образцов своих клиентов, как в России, так и за рубежом, для лечения лейкоза, лимфом, анемии Фанкони, синдрома Швахмана-Даймонда и других крайне тяжелых заболеваний. Наши клиенты уверены в том, что их образцы сохранены с наибольшим возможным объемом клеточности биоматериала и жизнеспособны, т.к. выделением и криоконсервацией клеток занимаются не рядовые лаборанты, а высококвалифицированные дипломированные специалисты. Также они уверены в том, что биоматериал можно использовать для лечения и мы помогаем на всех этапах, даже если клиент выбирает зарубежную клинику, не говоря уже об отечественных центрах трансплантации, с которыми у Гемабанка большой опыт сотрудничества и ряда успешных трансплантаций.
Подчеркиваю, что Гемабанк сохраняет свои лидерские позиции уже на протяжении 18 лет. Этому безусловно способствует ориентир на международный опыт и стандарты, а также постоянный контроль за качеством оказания услуг на всех этапах, содействие клиентам, когда необходимо применить стволовые клетки пуповинной крови для лечения.
Р.В. Деев. Артур Александрович, чуть-чуть расширим тему беседы. Что на Ваш взгляд объединяет гематологию и генетику? Почему Ваш бизнес в сфере биомедицины начавшись как саппорт гематологии, продолжил услугами в области генетики, репродуктологии, научными исследованиями в это сфере?
А.А. Исаев. Я не рассматриваю гематологию в контексте развития здравоохранения как нечто отдельное. Это часть здравоохранения и идеи использования принципов регенеративной медицины в гематологии были реализованы раньше, чем во многих других областях. В том числе идеи, связанные с генной терапией.
Гематология достаточно развитая область, благодаря знаниям о том, как регенерирует кроветворная ткань, какие генетические изменения приводят к тем или иным заболеваниям крови. Кроветворная ткань и стволовые клетки стали и способом лечения в регенеративной медицине и объектом лечения с помощью генной терапии. Регенеративная медицина тесно связана с генетикой. Изначально мы в ИСКЧ в большей степени были сфокусированы на регенеративной медицине, на том, что клетки человека могут обновляться, дифференцироваться, восстанавливать различные ткани и органы. Свойство «стволовости» клеток (воспроизводить себя и дифференцироваться) лежит в основе регенеративной медицины. Мы были сфокусированы на том, как можно это использовать, как применить клеточные технологии для лечения тех или иных заболеваний. Максимальных успехов в этом направлении достигли именно гематология и иммунология. Определенные успехи есть и в других направлениях. Еще стало понятно, что клетками кроветворной ткани костного мозга и пуповинной крови можно лечить, с точки зрения заместительной терапии, не только гематологические и онкологические заболевания, но и заболевания, связанные с изменением генетики клетки.
Изначально мы в ИСКЧ в большей степени были сфокусированы на регенеративной медицине, на том, что клетки человека могут обновляться, дифференцироваться, восстанавливать различные ткани и органы. Свойство «стволовости» клеток (воспроизводить себя и дифференцироваться) лежит в основе регенеративной медицины. Мы были сфокусированы на том, как можно это использовать, как применить клеточные технологии для лечения тех или иных заболеваний. Максимальных успехов в этом направлении достигли именно гематология и иммунология. Определенные успехи есть и в других направлениях. Еще стало понятно, что клетками кроветворной ткани костного мозга и пуповинной крови можно лечить, с точки зрения заместительной терапии, не только гематологические и онкологические заболевания, но и заболевания, связанные с изменением генетики клетки.
Какое-то время мы шли по этому пути. Потом стало понятно, что клеточная терапия имеет свои возможности и сложности. Например, связанные с недешевой экономикой методов клеточной терапии, их разработкой и внедрением.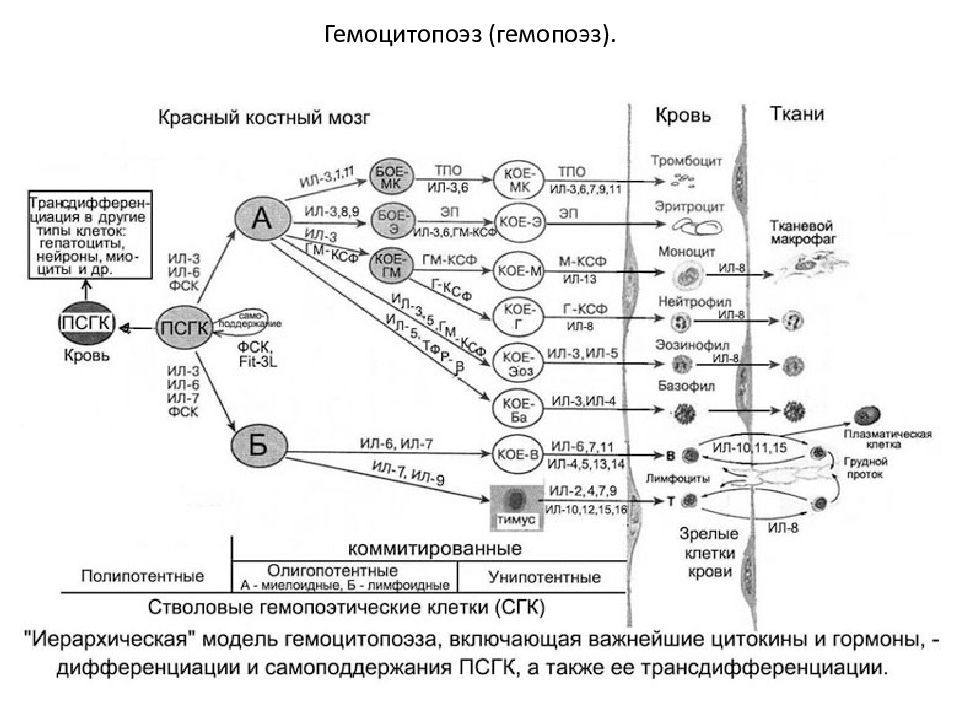 Часто мы – человечество, научная общественности, недостаточно понимаем механизмы доставки клеток в таргетные регионы организма. С другой стороны стали более понятны идеи, связанные с генной терапией. Ведь с помощью генетики и генной терапии мы можем поменять паттерн того, как развивается клетка. Именно поэтому мы начали развивать направление генной терапии, которое очень сильно конкурирует с клеточной по производственной эффективности, по затратам. И здесь геннотерапевтические препараты могут сильно выигрывать в плане себестоимости и цены.
Часто мы – человечество, научная общественности, недостаточно понимаем механизмы доставки клеток в таргетные регионы организма. С другой стороны стали более понятны идеи, связанные с генной терапией. Ведь с помощью генетики и генной терапии мы можем поменять паттерн того, как развивается клетка. Именно поэтому мы начали развивать направление генной терапии, которое очень сильно конкурирует с клеточной по производственной эффективности, по затратам. И здесь геннотерапевтические препараты могут сильно выигрывать в плане себестоимости и цены.
А.В. Приходько (Москва), О.Ю. Верлинский (Чикаго, США), Б.В. Афанасьев (Санкт-Петербург), А. Цандер (Гамбург, Германия), 2012
Мы столкнулись с тем, что геннотерапевтические разработки — очень долгий процесс. Часто мы лечим заболевания, когда генетический дефект привел к уже сформировавшимся проблемам. Так возникла еще одна концепция, которая сегодня стала частью развития всего холдинга ИСКЧ, Гемабанка и ряда других наших проектов. Идея связана с тем, что данные о генетике мы можем получить с момента появления первой клетки нашего организма. Сразу после слияния сперматозоида и яйцеклетки. И даже до их слияния мы можем получить информацию о генетике половых клеток.
Согласно принципам медицины «4П», первая П — это профилактика. Мы можем выяснить риски развития заболеваний и их предотвратить. Так у нас возникла идея, что генетические скрининги и профилактика дают колоссально большую пользу и эффекты, даже превосходящие лечение. Мы стали активно развивать генетическую диагностику. Именно сочетание методов регенеративной медицины, генетической диагностики и генной терапии позволило нам реализовать такой уникальный план лечения, такие как трансплантация стволовых кроветворных клеток пуповинной крови девочке с генетическим заболеванием — синдромом Швахмана-Даймонда. Это заболевание со временем может привести к лейкозу. На самом деле, лечение можно провести таким образом, что родители смогут родить еще одного здорового ребенка. Затем, собрав его пуповинную кровь, использовать ее для лечения больной сестры с целью восстановления ее кроветворной системы клетками, свободными от генетической поломки, приводящей к заболеванию.
На таких ярких примерах мы уже показали, как с помощью сочетания методов клетчоной трансплантации и генетики можно профилактировать и лечить наследственные заболевания. Понимание взаимосвязанности регенеративной медицины и генетики позволяет создать сильные и эффективные инструменты для предупреждения и терапии целого ряда тяжелых заболеваний.
А.А. Исаев
Р.В. Деев. Как Вы считаете, какова репутация у Ваших компании и коллективов – среди врачей, пациентов, клиентов, инвесторов и бизнес-партнеров? Насколько это понятие (репутация) значимо для Вас, какой смысл Вы в него вкладываете?
А.А. Исаев. Я думаю, что о нашей репутации лучше скажут коллеги, с которыми мы работали. Но то, что мы слышим и чего добиваемся — это профессиональное, ответственное и честное отношение к тому, что делаем. Это непросто. Иногда на пути велики соблазны попробовать внедрять технологии с низкой эффективностью, потому что на них уже потрачено немало времени. Или использовать какие-то «неприличные» инструменты взаимодействия с профессиональным сообществом.
Мы развиваем технологии, для которых видим реальную возможность применения. Процент эффективности разных технологий может варьировать, но с каждым шагом мы стараемся довести их до практического здравоохранения. Это касается и Гемабанка, который имеет приличное количество случаев использования сохраненных образцов пуповинной крови, и других проектов, развитие которых в том числе спонсировал Гемабанк: генная терапия, тканеинженерные генные матриксы, генетическая диагностика. Мы стараемся быть профессиональными. В основе нашей работы лежат принципы доказательной медицины и честности по отношению к пациентам и врачам. Именно за честность и профессионализм наши компании Гемабанк, Репробанк, Генетико и другие, ценят коллеги. Мы привыкли отвечать за качество своей работы, ее эффективность и обоснованность.
Р.В. Деев. Это достаточно оптимистично. Давайте спросим у клинициста, есть ли основания к оптимизму? Реализуются ли все наши мечты по лечению сложных пациентов в ближайшем будущем?
Г.Л. Менткевич. Мечты? Это громко сказано. Чисто с профессиональной точки зрения мне хотелось бы, чтобы исследования в области применения клеточных технологий (а они на самом деле этого заслуживают) проводились в клиниках с соблюдением критериев доказательной медицины и не носили сенсационного характера, могли быть проверены и качественно задокументированы. Для России, клеточные технологии могли бы быть важным направлением в плане развития прикладной медицинской науки. Для этого нужно не так уж много: главное не мешать.
Р.В. Деев. Уважаемые коллеги, благодарю всех за беседу!
[1] ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Артериальная гипертония
Предупредить развитие гипертонии — значит вовремя остановиться и осознать, какие именно факторы вашей жизни могут влиять на развитие опасной патологии. Сохранить качество жизни можно, лишь тщательно следя за образом этой самой жизни. Контроль за артериальным давлением — одна из важнейших задач, стоящих перед каждым, кто хочет дожить до здоровой старости. Рассмотрим основные правила профилактики гипертонии.
Измеряйте давление так часто, как можете. Очень важно регулярно измерять артериальное давление. Вы можете делать это сами дома с помощью автоматического аппарата, но делать это нужно правильно. Перед приобретением аппарата измерьте окружность плеча, то есть бицепса. Выбирайте аппарат с манжетой, подходящей вам по размеру. Успокойтесь. Не пейте чай, кофе или другие напитки, содержащие кофеин, не занимайтесь никакой физической нагрузкой за 30 минут до измерения. Сядьте правильно. Обопритесь спиной на спинку стула. Аппарат должен находиться на уровне сердца. Согнутые в локтях руки спокойно лежат на столе. Не перекрещивайте ноги или руки. Во время измерений нельзя разговаривать, смотреть телевизор, слушать радио, принимать пищу. Нижний край манжеты должен находиться на 2 см выше локтевого сгиба. Сделайте несколько измерений. Измерьте артериальное давление 2–3 раза и запишите среднее арифметическое этих измерений. Измеряйте артериальное давление в одно и то же время. Это важно, так как артериальное давление изменяется в течение дня. Рекомендуется это делать утром и вечером. Записывайте все ваши показатели.
Контролируйте собственный вес
Во всем мире растет число людей с ожирением. А ожирение неизбежно ведет к гипертонии. Хороший способ следить за весом — проверять его по таблице «Индекс массы тела». Чтобы подсчитать ваш индекс массы тела, разделите ваш вес в килограммах на показатель роста в метрах, возведенный в квадрат. Индекс массы тела = кг/м2. Нормой будет индекс 18,5–24,9. При показателях 25–29,9 ваш вес уже можно считать избыточным, а индекс выше 30 говорит об ожирении. Другой способ определения ожирения — измерение окружности талии. Окружность талии измеряют в положении стоя, без верхней одежды. Мерную ленту надо держать горизонтально. Окружность талии у мужчин больше 102 см, а у женщин больше 88 см считается симптомом ожирения.
Бросайте курить. Существует несколько способов отказа от курения. Какой подойдет именно вам — решайте. Сам: собрался, решил, бросил. Дешево и сердито. Но не всегда и не для всех применимо. Спорт: очень полезное занятие и приятная альтернатива курению. Способен предупредить тягу к курению, депрессивные состояния, нервозность, стрессовые ситуации, прибавку в весе, а посему помогает избежать рецидивов курения и повысить самооценку. С помощью врача: врач порекомендует, расскажет, поможет и поддержит. Индивидуально или в группе: психологическая поддержка, индивидуальная или групповая, помогает в отказе от курения. Часто в сочетании с лекарствами. Гипноз: возможно, помогает, хотя нет убедительных данных. Лекарства: есть такие, но лучше, чтобы их рекомендовал и назначил врач.
Некоторые лекарственные препараты в виде пластырей, ингаляторов и жевательных резинок содержат никотин и призваны частично восполнять его запасы в организме уже бывшего курильщика, чтобы тот не сильно переживал синдром отмены любимых сигарет. Другие лекарства ведут себя как никотин и также призваны снижать тягу к курению. Альтернативная медицина: иглорефлексотерапия, электромагнитные волны, электропунктура. Все это хорошо, все работает, помогает преодолеть синдром отмены, а порой и предупредить его.
Выбирайте здоровую пищу. Питаться здоровой пищей — всегда хорошая идея. Ешьте 3 раза в день и следите за размером порций. Постарайтесь обойтись без готовых полуфабрикатов и точек фастфуда. А кроме того… При покупке продуктов обращайте внимание на вес продукта, его калорийность и химический состав, содержание белков, жиров, углеводов, указанных на этикетке. По возможности разнообразьте свой рацион. Это будет способствовать большей его сбалансированности. Откажитесь от длительного применения односторонних несбалансированных рационов и диет; вегетарианство возможно только после консультации с врачом. Измените пропорции продуктов в своей тарелке в сторону увеличения рыбы, овощей и зелени, цельнозерновых продуктов и уменьшения жареных гарниров, сладких напитков, соусов и жира. Ограничивайте количество потребляемого сахара, кондитерских изделий.
Откажитесь от колбас, сосисок, копченостей, гамбургеров, хот-догов, паштетов, чипсов и других высокожировых высококалорийных продуктов. Замените мясо рыбой (2 раза в неделю), птицей, бобовыми (фасоль, чечевица, горох). Порции мяса или птицы должны быть небольшими (90–100 г в готовом виде), а красное мясо (говядину, баранину, свинину) лучше готовить не более 2–3 раз в неделю. Предпочтение нужно отдавать нежирным сортам мяса. Желательно готовить пищу на пару, отваривать, запекать; сведите к минимуму количество масел, сахара, поваренной соли. При заправке салатов лучше использовать растительные масла: кукурузное, подсолнечное, оливковое, соевое до двух столовых ложек в день, а не майонез и сметану. Выбирайте молочные продукты с низким содержанием жира: молоко, йогурты, кефир до 1–2,5%, творог 0–9%. Предпочтите цельнозерновой хлеб, можно ржаной или с отрубями.
Живите активнее. Ваше тело рождено для движения. Значит, будьте активны. Ходьба, прогулки, велосипед, волейбол, танцы… Все, что душе угодно! Попытайтесь ходить пешком на работу, пройти 2–3 остановки или 30–40 минут пешком ежедневно. Танцуйте и занимайтесь спортом при любой удобной возможности.
Сдать анализы в Ставрополе — цены на анализы в медицинской лаборатории АрхиМед
1. Панель №1 IgE или IgG4 (Молоко коровье, Молоко козье, Молоко овечье, Сыр, Творог, Сметана, Йогурт, Кефир)
2. Панель №2 IgE или IgG4 (Пшеничная мука, Рожаная мука, Рис, Гречка, Овес, Перловка, Пшено, Ячменная крупа)
3. Панель №3 IgE или IgG4 (Фасоль (бобы), Горох, Чечевица (смесь), Кукурузная мука, Дрожжи пекарские, Белок куриного яйца, Желток куриного яйца, Яйцо перепелиное)
4. Панель №4 IgE или IgG4 (Говядина, Телятина, Свинина, Баранина , Курица, Индейка, Утка, Гусь)
5. Панель №5 IgE или IgG4 (Треска, Хек, Морской окунь, Камбала, Семга, Форель, Сельдь, Палтус)
6. Панель №6 IgE или IgG4 (Сазан, Карп, Щука, Судак, Кефаль, Ледяная рыба, Пикша, Осетр)
7. Панель №7 IgE или IgG4 (Кролик, Конина, Креветки, Крабы, Кальмары, Мидии, Морской гребешок, Морская капуста)
8. Панель №8 IgE или IgG4 (Морская соль, Сахар, Фруктоза,Соль поваренная, Тростниковый сахар, Красный острый перец, Черный перец, Соль с пониженным содержанием натрия)
9. Панель №9 IgE или IgG4 (Базилик, Петрушка, Кинза, Укроп, Лук зеленый, Лук порей, Лук репчатый, Чеснок)
10. Панель №10 IgE или IgG4 (Картофель, Морковь, Свекла, Помидор, Перец сладкий, Огурец, Кабачок, Баклажан)
11. Панель №11 IgE или IgG4 (Капуста белокочанная, Капуста красная, Капуста брюссельская, Брокколи, Капуста цветная, Капуста китайская, Капуста кольраби, Морская капуста (водоросли))
12. Панель №12 IgE или IgG4 (Редис, Редька (смесь), Тыква, Шпинат, Сельдерей, Авокадо, Оливки/маслины, Шампиньоны)
13. Панель №13 IgE или IgG4 (Апельсин, Грейпфрут, Мандарин, Лимон, Лайм, Помело, Яблоко, Груша)
14. Панель №14 IgE или IgG4 (Абрикос, Персик, Слива, Инжир, Финики, Арбуз, Дыня, Айва)
15. Панель №15 IgE или IgG4 (Ананас, Манго, Киви, Банан, Хурма, Гранат, Виноград зеленый, Виноград красный)
16. Панель №16 IgE или IgG4 (Вишня, Малина садовая, Клубника, Клюква, Смородина красная, Смородина черная, Крыжовник, Черника)
17. Панель №17 IgE или IgG4 (Арахис, Миндаль, Фундук, Грецкий орех, Фисташки, Кедровый орех, Кешью, Подсолнечник)
18. Панель №18 IgE или IgG4 (Кофе, Чай черный, Чай зеленый, Каркадэ, Мед (смесь), Шоколад, Соя, Клейковина)
19. Панель №19 IgE или IgG4 (Камамбер, Моцарелла, Сыр «Дор Блю», Козий сыр, Овечья брынза, Сыр «Ольтермани», Ряженка, Яйца цесарки)
20. Панель №20 IgE или IgG4 (Оленина, Мясо лося, Мясо кабана, Перепелка, Белые грибы, Опята, Лисички, Грибы вешанка)
21. Панель №21 IgE или IgG4 (Морской язык, Тунец, Рыба меч, Севрюга, Стерлядь, Муксун, Угорь, Хариус)
22. Панель №22 IgE или IgG4 (Окунь речной, Сом, Лещ, Кета, Лосось, Горбуша, Скумбрия, Навага)
23. Панель №23 IgE или IgG4 (Форель речная, Рыба сиг, Дорада, Икра красная, Раки, Лангуст, Устрицы, Осьминог)
24. Панель №24 IgE или IgG4 (Желатин, Розмарин, Лавровый лист, Гвоздика, Тмин, Ваниль, Корица, Имбирь)
25. Панель №25 IgE или IgG4 (Салан корн,Салат рукола, Салат латук, Салат «Айсберг», Щавель, Спаржа, Тархун, Хрен)
26. Панель №26 IgE или IgG4 (Цукини, Зеленая фасоль, Белая фасоль, Дайкон, Фенхель, Артишок, Топинамбур, Батат)
27. Панель №27 IgE или IgG4 (Земляника, Брусника, Голубика, Ежевика, Черешня, Папайя, Маракуйя, Мангостин)
28. Панель №28 IgE или IgG4 (Бразильский орех, Кокос, Льняное семя, Кунжутное семя, Мак, Горчица, Фезалис, Маслины)
29. Панель №29 IgE или IgG4 (Цвет липы, Шиповник, Бессмертник, Зверобой, Ромашка, Мят, Жасмин, Матэ)
30. Панель №30 IgE или IgG4 (Тилапия, Ставрида, Барабулька, Сибас, Толстолобик, Хамса, мойва, Сардины)
31. Панель №31 IgE или IgG4 (Кари, Шафран, Тимьян, Цикорий, Облепиха, Кизил, Фейхоа, Лист малины)
32. Панель №32 IgE или IgG4 (Вино белое, красное, розовое, коньяк, виски, водка, пиво, пивные дрожжи)
33. Панель №33 IgE или IgG4 (Джин, Ром, Сакэ, Текила, можжевельник, тясячелистник, пангасиус, Рыба талисман)
34. Панель №34 IgE или IgG4 (Капуста романсу, Патиссон, Репа, Гриб шиитаке, Барбарис, Кумкват, Нектарин, Нут)
35. Панель №35 IgE (S.Pyogenus, St.Pneumonia, S.Aureus, E.Coli, Proteus Vulgaris, Kleb.Pneumonia, Br.Cataralis)
36. Панель №36 IgE (Alternaria tenuis, Mucor mucedo, Aspergillus fumigatus, Cladosporium herbarum, Pennicillium notabum, Botrytis cinerea, Candida albicans, Fisarium moniliforme)
37. Панель №37 IgE (Дуб, Клен, Ясень, Береза, Тополь, Лещина, Ольха, Липа)
38. Панель №38 IgE (Амброзия, Одуванчик, Мятлик, Тимофеевка, Ежа, Овсяница, Полынь, Райграс)
39. Панель №39 IgE (Кошка(эпителий), Собака(эпителий), Шерсть овцы, Таракан рыжий (Bl or.),Клещ D.pteronyssinus,Клещ D.Farina,Клещ T.Putrescentia,Клещ Acarus siro)
40. Панель №40 IgE (Мышь(эпителий), Крыса(эпителий), Хомяк(эпителий), Морская свинка(эпителий), Кролик(эпителий), Лошадь(эпителий), Перо волнистого попугая, Табак)
Правила подготовки к сдаче анализа
- специальной подготовки не требуется.
Отделение общей хирургии №1 — Рязанская областная клиническая больница ГБУ РО «ОКБ»
Опухоли печени – новообразования злокачественного и доброкачественного характера, исходящие из паренхимы, желчных протоков или сосудов печени. Наиболее частыми проявлениями опухолей печения служат тошнота, похудение, потеря аппетита, гепатомегалия, желтуха, асцит. Диагностика опухолей печени включает проведение УЗИ, исследование печеночных проб, КТ, биопсию печени. Лечение опухолей печени хирургическое и заключается в резекции пораженного участка органа.
В гепатологии принято различать первичные доброкачественные опухоли печени, первичные и вторичные (метастатические) злокачественные новообразования (рак печени). Знание вида и происхождения опухоли печени позволяет проводить дифференцированное лечение. Доброкачественные опухоли печени встречаются сравнительно редко. Обычно они протекают бессимптомно и выявляются случайно. Чаще в гастроэнтерологии приходится сталкиваться с первичным раком печени или вторичным метастатическим поражением органа. Метастазы в печени нередко обнаруживаются у пациентов с первичным раком желудка, легких, толстой кишки, раком молочной железы.
Классификация доброкачественных опухолей печени
Среди доброкачественных опухолей печени в клинической практике встречаются аденомы (гепатоаденомы, аденомы желчного протока, билиарные цистаденомы, папилломатоз). Они происходят из эпителиальных и соединительнотканных элементов печени или желчных протоков. К опухолям печени мезодермального происхождения относятся гемангиомы, лимфангиомы. Редко встречаются гамартомы, липомы, фибромы печени. Иногда к опухолям печени причисляют непаразитарные кисты.
Аденомы печени представляют собой одиночные или множественные круглые образования сероватого или темно-красного цвета различного размера. Они располагаются под капсулой печени или в толще паренхимы. Считается, что развитие аденом печени у женщин может быть связано с длительным использованием пероральной контрацепции. Некоторые виды доброкачественных опухолей печени (трабекулярные аденомы, цистаденомы) склонны к перерождению в гепатоцеллюлярный рак.
Сосудистые образования (ангиомы) встречаются среди доброкачественных опухолей печени наиболее часто. Они имеют пещеристое губчатое строение и исходят из венозной сети печени. Среди сосудистых опухолей печени различают кавернозные гемангиомы и каверномы. Существует мнение, что сосудистые образования печени являются не истинными опухолями, а врожденной васкулярной аномалией.
Гемангиома печени
Узловатая гиперплазия печени развивается вследствие локальных циркуляторных и билиарных нарушений в отдельных зонах печени. Макроскопически данная опухоль печени может иметь темно-красный или розовый цвет, мелкобугристую поверхность, различную величину. Консистенция узловатой гиперплазии печени плотная, микроскопически обнаруживаются явления локального цирроза. Не исключается перерождение узловатой гиперплазии в злокачественную опухоль печени.
Происхождение непаразитарных кист печени может быть врожденным, травматическим, воспалительным.
Симптомы доброкачественных опухолей печени
Большая часть доброкачественных опухолей печени не имеет четко выраженной клинической симптоматики. В отличие от злокачественных опухолей печени доброкачественные образования растут медленно и длительно не приводят к нарушению общего самочувствия.
Гемангиомы печени больших размеров могут вызывать боли и тяжесть в эпигастрии, тошноту, отрыжку воздухом. Опасность гемангиомы печени заключается в высокой вероятности разрыва опухоли с развитием кровотечения в брюшную полость и гемобилии (кровотечения в желчные протоки), перекрутом ножки опухоли. Крупные кисты печени вызывают тяжесть и давление в подреберье и эпигастрии. Осложнениями кист печени могут являться разрыв, нагноение, желтуха, кровоизлияние в полость опухоли.
Аденомы печени при достижении значительных размеров могут вызывать боли в животе, а также пальпироваться в виде опухолевидного образования в правом подреберье. В осложненных случаях может произойти разрыв аденомы с развитием гемоперитонеума. Узловатая гиперплазия печени обычно не имеет выраженных симптомов. При пальпации печени может отмечаться гепатомегалия. Спонтанные разрывы данной опухоли печени наблюдаются редко.
Диагностика и лечение доброкачественных опухолей печени
С целью диагностики доброкачественных опухолей печени используются УЗИ печени, гепатосцинтиграфия, КТ, гепатоангиография, диагностическая лапароскопия с прицельной биопсией печени и морфологическим исследованием биоптата. При аденомах или узловатой гиперплазии возможно проведение чрескожной биопсии печени.
Ввиду вероятности малигнизации и осложненного течения доброкачественных опухолей печени основная тактика их лечения – хирургическая, предполагающая резекцию печени в границах здоровых тканей. Объем резекции определяется локализацией и размерами опухоли печени и может включать краевую резекцию (в т. ч. лапароскопическую), сегментэктомию, лобэктомию или гемигепатэктомию.
При кисте печени может производиться иссечение кисты, эндоскопическое или открытое дренирование, наложение цистодуоденоанастомоза, марсупиализация.
Классификация и причины злокачественных опухолей печени
Злокачественные опухоли печени могут быть первичными, т. е. исходить непосредственно из структур печени, или вторичными, связанными с разрастанием метастазов, занесенных из других органов. Вторичные опухоли печени встречаются в 20 раз чаще, чем первичные, что связано с фильтрацией через печень крови, идущей от различных органов и гематогенным заносом опухолевых клеток.
Первичные злокачественные опухоли печени – явление относительно редкое. Встречается преимущественно у лиц мужского пола старше 50 лет. По происхождению выделяют следующие формы первичных злокачественных опухолей печени:
— гепатоцеллюлярная карцинома (печеночно-клеточный рак, гепатома), исходящая из клеток печеночной паренхимы;
— холангиокарцинома, исходящая из эпителиальных клеток желчных протоков;
— ангиосаркома, произрастающая из эндотелия сосудов;
— гепатобластома – опухоль печени, встречающаяся у детей.
Среди причин образования первичных злокачественных опухолей печени первенство принадлежит хроническим вирусным гепатитам В и С. Вероятность развития гепатоцеллюлярного рака у пациентов с гепатитом увеличивается в 200 раз. Среди других факторов, связанных с риском развития злокачественных опухолей печени, выделяют цирроз печени, паразитарные поражения (шистосомоз, описторхоз), гемохроматоз, сифилис, алкоголизм, канцерогенное воздействие различных химических соединений (тетрахлористого углерода, нитрозаминов, органических хлорсодержащих пестицидов), алиментарные причины (пищевой микотоксин – афлатоксин).
Метастазы в печень
Симптомы злокачественных опухолей печени
К начальным клиническим проявлениям злокачественных опухолей печени относятся недомогание и общая слабость, диспепсия (ухудшения аппетита, тошнота, рвота), тяжесть и ноющая боль в подреберье справа, субфебрилитет, похудание.
С увеличением размеров опухоли печень выступает из-под края реберной дуги, приобретает бугристость и деревянистую плотность. В поздних стадиях развивается анемия, желтуха, асцит; нарастает эндогенная интоксикация, печеночная недостаточность. Если опухолевые клетки обладают гормональной активностью, то возникают эндокринные нарушения (синдром Кушинга). При сдавлении растущей опухолью печени нижней полой вены, появляются отеки нижних конечностей. При эрозии сосудов возможно развитие внутрибрюшного кровотечения; в случае варикозного расширения вен пищевода и желудка может развиться желудочно-кишечное кровотечение.
Диагностика и лечение злокачественных опухолей печени
Типичными для всех злокачественных опухолей печени являются сдвиги в биохимических показателях, характеризующих функционирование органа: снижение альбуминов, увеличение фибриногена, рост активности трансаминаз, повышение мочевины, остаточного азота и креатинина. В связи с этим при подозрении на злокачественную опухоль печени необходимо исследовать печеночные пробы и коагулограмму.
Для более точной диагностики прибегают к проведению ультразвукового сканирования, компьютерной томографии, МРТ печени, ангиографии печени. С целью гистологической верификации образования проводится пункционная биопсия печени или диагностическая лапароскопия.
При признаках метастатического поражения печени необходимо установление локализации первичной опухоли, для чего может потребоваться выполнение рентгенографии желудка, ЭГДС, маммографии, УЗИ молочных желез, колоноскопии, ирригоскопии, рентгенографии легких и т. д.
Полное излечение злокачественных опухолей печени возможно только при их радикальном удалении. Как правило, при опухолях печени производится резекция доли печени или гемигепатэктомия. При холангиокарциномах прибегают к удалению протока и наложению соустий (гепатикоеюноанастомоза, гепатикодуоденоанастомоза).
При единичных опухолевых узлах печени возможно выполнение их деструкции с помощью радиочастотной абляции, химиоабляции, криоабляции. Методом выбора при злокачественных опухолях печени является химиотерапия (системная, внутрисосудистая).
Прогноз при опухолях печени
Неосложненные доброкачественные опухоли печени в прогностическом плане благоприятны.
Злокачественные опухоли печени характеризуются бурным течением и без лечения приводят к гибели пациента в течение 1 года. При операбельных злокачественных опухолях печени продолжительность жизни в среднем составляет около 3-х лет; 5-летняя выживаемость – менее 20%.
Сотрудниками хирургического отделения №1 выполняется весь спектр хирургических вмешательств при очаговых поражениях печени: анатомические сегментарные и секторальные резекции печени, гемигепатэктомии, эхинококкэктомии с перицистэктомией. Наше отделение – региональный лидер во внедрении резекционных вмешательств на печени из лапароскопического доступа.
Эхинококк печени
Гомеостатическое и патогенное экстрамедуллярное кроветворение
J Blood Med. 2010; 1: 13–19.
Лаборатория иммунологии и кроветворения отделения сравнительной патобиологии; Онкологический центр Purdue, Университет Пердью, Вест-Лафайет, Индиана, США
Для корреспонденции: Чанг Х. Ким, Департамент сравнительной патобиологии, 725 Harrison Street, Университет Пердью, Вест-Лафайет, IN 47907, США, тел. + 1765 494 0976, факс +1 765 494 9830, электронная почта ude.eudrup@mikhc Авторские права © 2010 Ким, издатель и лицензиат Dove Medical Press Ltd.
Это статья в открытом доступе, разрешающая неограниченное некоммерческое использование при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Экстрамедуллярный гематопоэз (ЭГ) определяется как гематопоэз, происходящий в органах вне костного мозга; это происходит при различных состояниях, включая развитие плода, нормальные иммунные реакции и патологические обстоятельства. Во время внутриутробного развития, до образования зрелого костного мозга, ЭГ происходит в желточном мешке, печени и селезенке плода.ГЭ также возникает во время активных иммунных ответов на патогены. Чаще всего этот ответ возникает в селезенке и печени на продукцию антигенпрезентирующих клеток и фагоцитов. ГЭ также возникает, когда костный мозг становится пригодным для стволовых клеток и клеток-предшественников при определенных патологических состояниях, включая миелофиброз, когда клетки костного мозга заменяются коллагеновыми волокнами соединительной ткани. Таким образом, EH происходит либо активно, либо пассивно в ответ на разнообразные изменения в кроветворной среде.В этой статье рассматриваются ключевые особенности и регуляторы основных типов EH.
Ключевые слова: миелопоэз, цитокины, миелоидные супрессорные клетки, Т-клетки, инфекция, дендритные клетки, FoxP3, миелофиброз
Введение
Экстрамедуллярный гемопоэз (EH) относится к кроветворению, происходящему не в костном мозге, а в других органах. Классическим примером ГЭ является усиление эктопического эритропоэза в печени или селезенке при гипоксии из-за повышенной выработки эритропоэтина. 1 EH можно разделить на активные и пассивные категории. Нормальный гемопоэз, который происходит в желточном мешке плода, печени и селезенке, является примером активной EH; он запрограммирован как важный процесс для обычного развития плода. Другой пример активной EH — это та, которая возникает в селезенке и печени во время иммунных реакций после инфекции. Напротив, EH также возникает в результате нарушения кроветворения костного мозга в периферических органах, таких как печень и селезенка, и это считается пассивной формой EH.Как активные, так и пассивные EH продуцируют клетки крови, такие как антигенпрезентирующие клетки, гранулоциты, NK-клетки, эритроциты и / или тромбоциты, для роста или выживания хозяина. Неадекватный EH приводит к недостаточному производству или созреванию клеток крови, в то время как чрезмерный EH приводит к воспалительным заболеваниям (). В этой статье будут рассмотрены ключевые аспекты основных типов EH.
Основные формы экстрамедуллярного кроветворения. Экстрамедуллярный гемопоэз возникает на ранних этапах внутриутробного развития плода, а также играет важную роль во взрослой жизни.Кроветворение происходит в печени и селезенке плода. Гемопоэтические стволовые клетки и клетки-предшественники в печени плода мигрируют в костный мозг, и после рождения костный мозг становится основным местом кроветворения. Гематопоэтические стволовые клетки и клетки-предшественники в костном мозге эмигрируют на периферию, такую как печень и селезенка. При инфицировании и возникающих в результате иммунных ответах различные гематопоэтические факторы, включая лиганды TLR и цитокины, способствуют экстрамедуллярному гематопоэзу в печени и селезенке. Основная роль этого экстрамедуллярного кроветворения заключается в производстве функционально зрелых антигенпрезентирующих клеток и фагоцитов.Чрезмерный и длительный экстрамедуллярный кроветворение на периферии возникает при наличии аутоиммунных заболеваний и хронической инфекции. В этих ситуациях экстрамедуллярный гемопоэз вреден для хозяина. Когда возникает злокачественное заболевание, такое как первичный миелофиброз, костный мозг становится непригодным для поддержания кроветворения, и экстрамедуллярный кроветворение значительно увеличивается.
Факторы, необходимые для кроветворения
Кроветворение — это сложный процесс, регулируемый множеством факторов.Гемопоэз происходит в специализированных участках ткани (например, «гематопоэтических нишах»), способствующих поддержанию и дифференцировке стволовых клеток и клеток-предшественников. Например, гемопоэтические стволовые клетки, которые находятся в состоянии покоя и самообновляются, присутствуют в нише стволовых клеток костного мозга, в которой мало кислорода и что способствует сохранению их идентичности стволовым клеткам. 2 Ниша стволовых клеток костного мозга состоит из различных клеток и их продуктов, которые положительно и отрицательно регулируют этот процесс. 3 , 4 Ключевые регуляторные клетки включают остеобласты, ретикулярные клетки, экспрессирующие хемокиновый лиганд 12 (CXCL12), и клетки эндотелия сосудов. 5 — 8 Кроме того, сигналы от симпатической нервной системы и остеокластов регулируют выход гемопоэтических стволовых клеток из костного мозга посредством регуляции критического фактора самонаведения и удержания стволовых клеток, называемого CXCL12. 9 , 10 Требование специализированной ниши является ограничивающим фактором для EH на периферии.Как следствие, ЭГ обычно ограничивается на периферии в определенное время и при определенных условиях.
Ряд молекулярных путей, включая Wnt, кальций-чувствительные рецепторы, ангиопоэтин 1, Tie-2 и компоненты внеклеточного матрикса, вовлечены в процесс тонкого контроля ниши стволовых клеток. 6 , 7 , 11 — 13 Считается, что эти пути, хотя и не полностью изучены, участвуют не только в поддержании ниши стволовых клеток, но также в обновлении и дифференцировке кроветворных клеток. стволовые клетки в нише.Различные клетки продуцируют гемопоэтические цитокины, такие как фактор стволовых клеток (SCF), лиганды notch, костные морфогенные белки, трансформирующий фактор роста β, тромбопоэтин (TPO), факторы роста фибробластов и инсулиноподобный фактор роста 2, которые поддерживают и регулируют примитивный гемопоэтический стволовые клетки. 14 Другие цитокины, такие как гранулоцитарный колониестимулирующий фактор (G-CSF), интерлейкин-3 (IL-3), IL-7, эритропоэтин (EPO), гранулоцитарный макрофаг (GM) -CSF и макрофаг (M) — ЦСЖ играет важную роль в дифференцировке гемопоэтических стволовых клеток и клеток-предшественников в коммитированные клеточные линии. 15
В дополнение к вышеупомянутым клеткам и факторам, гемопоэз можно регулировать рядом других средств, таких как лиганды Toll-подобных рецепторов, метаболические / физиологические продукты, различные медиаторы воспаления и гормоны. 2 , 16 — 18 Многие цитокины, продуцируемые при воспалении, действуют как миелопоэтические факторы, 19 определенные лиганды Toll-подобных рецепторов способствуют миелопоэзу, 20 и гипоксия является хорошо известным индуктором эритропоэз. 21 Кроме того, паратироидный гормон (ПТГ) и инсулиноподобные факторы роста (IGF) контролируют нишу гемопоэтических стволовых клеток; ПТГ может увеличивать количество стволовых клеток костного мозга и клеток-предшественников, а IGF может регулировать выживание и рост гемопоэтических стволовых клеток и клеток-предшественников. 18 Многие из типов клеток, продуцируемых в костном мозге, такие как моноциты и В-клетки, требуют дальнейшего созревания на периферии, чтобы стать полностью функциональными иммунными клетками. Моноциты будут мигрировать в различные участки ткани, чтобы стать макрофагами или дендритными клетками, а В-клетки должны активироваться на периферии, чтобы стать клетками памяти и плазматическими клетками.Наивные Т-клетки образуются в тимусе из предшественников, которые возникли в костном мозге, и они подвергаются дальнейшей дифференцировке в ответ на антигены, предлагаемые антигенпрезентирующими клетками. Таким образом, термин «экстрамедуллярный гематопоэз» относится к широкому диапазону гематопоэтических активностей от ранних стадий клональной детерминации до поздних стадий созревания гематопоэтических клеток.
Ранняя ГЭ во время внутриутробного развития
Костный мозг становится функциональным участком кроветворения у плода с 4–5 месяцев беременности у человека.У мышей кроветворение костного мозга несколько задерживается и становится активным после рождения. Развивающийся плод нуждается в кроветворных клетках для снабжения кислородом и по другим менее очевидным причинам. Следовательно, ткани, не связанные с костным мозгом, служат участками кроветворения до того, как костный мозг возьмет на себя роль основного участка кроветворения. У ранних эмбрионов желточный мешок служит основным местом кроветворения. 22 , 23 В середине беременности клетки желточного мешка колонизируют пуповину, область аорты, гонад и мезонефрос (AGM), а затем и эмбриональную печень.Желточный мешок сначала производит гемопоэтические стволовые клетки и эритроциты, но позже производит также и миелоидные клетки. 24 В этом отношении желточный мешок является важным местом, в котором находятся примитивные эритробласты и практически все определяющие HPC. На более позднем этапе эмбрионального развития некоторые из этих клеток засевают печень плода. 25 Как уже упоминалось, следующим участком кроветворной ткани после желточного мешка является AGM, а позже печень плода становится основным участком кроветворения. В конечном итоге костный мозг становится основным местом кроветворения.После рождения количество колониеобразующих гематопоэтических предшественников в селезенке увеличивается, достигая пика у мышей в возрасте двух недель. 26 Фактически, селезенка остается кроветворным органом у мышей на протяжении всей их жизни, хотя и на низком уровне.
Считается, что печень перестает действовать как место кроветворения после рождения. Однако печень поддерживает низкие уровни гемопоэтических стволовых клеток, эритропоэза и миелопоэза во взрослой жизни. 27 Более того, печень считается местом созревания нетрадиционных Т-клеток, включая NKT-клетки, CD8αα-Т-клетки, CD4 – CD8 – дважды отрицательные Т-клетки и γδ Т-клетки.
Индуцированная EH возникает во время инфекции и иммунных ответов
После рождения у млекопитающих и грызунов происходит экстрамедуллярное кроветворение, когда иммунные ответы возникают на периферии (). Печень и селезенка являются основными участками экстрамедуллярного кроветворения. Другие органы, такие как легкие, почки и брюшная полость, также могут стать участками кроветворения в болезненных состояниях.
Повышенный экстрамедуллярный гемопоэз в селезенке и печени мышей с дефицитом FAS (CD95) дает полезное представление о причине EH. 28 У FAS-дефицитных мышей гемопоэтические клетки устойчивы к апоптозу, что позволяет этим клеткам расти в органах, которые обычно не способствуют росту и дифференцировке гемопоэтических стволовых клеток и клеток-предшественников. Кроме того, иммунные клетки у этих мышей значительно разрастаются, производя большие объемы цитокинов, которые могут подпитывать рост гемопоэтических клеток-предшественников на периферии. Другим примером индуцированной EH является повышенный миелопоэз, обнаруживаемый во многих органах мышей с отсутствующим налетом FoxP3.Мыши Scurfy демонстрируют увеличенное количество миелоидных клеток CD11b + в селезенке и печени, что согласуется с повышенной экспрессией GM-CSF и IL-3. 29 У мышей с налетом Т-клетки, продуцирующие GM-CSF и IL-3, чрезмерно активируются в отсутствие Т-клеток FoxP3 + , вызывая чрезмерное количество EH в селезенке и печени. Напротив, перенос функциональных Т-клеток FoxP3 + новорожденным мышам с налетом полностью подавляет EH и воспалительные заболевания, связанные с налетом. 30 Важной функцией Т-клеток FoxP3 + является подавление дифференцировки наивных Т-клеток в гематопоэтические цитокин-продуцирующие эффекторные Т-клетки (). 30 FoxP3 + Т-клетки функционируют в основном в Т-эллиптической зоне селезенки, а не в красной пульпе, где возникает ЭН.
Регуляция экстрамедуллярного кроветворения при иммунных ответах. Проиллюстрирован пример механизма регуляции EH. В селезенке EH, примером которой является созревание миелоидных предшественников в зрелые нейтрофилы и дендритные клетки, конститутивно встречается на низких уровнях.Во время инфекции и воспаления этот процесс значительно усиливается из-за активированных Т-клеток, продуцирующих гемопоэтические цитокины, такие как GM-CSF и IL-3. Важным негативным регулятором EH является регуляторная Т-клетка FoxP3 + . FoxP3 + регуляторные Т-клетки подавляют дифференцировку наивных Т-клеток в гематопоэтические цитокин-продуцирующие эффекторные Т-клетки в ответ на антигены, передаваемые антигенпрезентирующими клетками. Поскольку известно, что регуляторные Т-клетки FoxP3 + могут подавлять больше, чем Т-клетки, существует вероятность того, что регуляторные Т-клетки FoxP3 + подавляют EH посредством регуляции дополнительных типов клеток-мишеней.
NK-клетки, по-видимому, играют отрицательную роль в регуляции EH в селезенке. Истощение NK-клеток антителом против NK1.1 у постнатальных мышей увеличивало количество миелоидных клеток-предшественников в 3–10 раз в селезенке. 31 Это исследование, однако, не определило, было ли увеличение результатом мобилизации клеток из костного мозга или продуктом EH в селезенке. In vitro , NK-клетки могут, наоборот, уменьшать количество клеток-предшественников. 32 , 33 Хотя механизм еще предстоит определить, NK-клетки, возможно, могут регулировать кроветворение с помощью растворимых ингибиторных факторов или посредством своей активности по уничтожению клеток.
Токсин-1 синдрома токсического шока (TSST-1) является суперантигеном, продуцируемым большинством штаммов Staphylococcus aureus . Суперрантигены могут конъюгировать молекулы MHC II антигенпрезентирующих клеток и определенные β-цепи рецепторов Т-клеток для поликлональной активации Т-клеток. Т-клетки являются хорошим источником гемопоэтических факторов, таких как GM-CSF, IL-3 и онкостатин М. 30 , 34 , 35 В этом отношении TSST-1 может индуцировать продукцию гемопоэтических факторы. 36 Staphylococcus , энтеротоксин B (SEB) — еще один суперантиген, продуцируемый Staphylococcus aureus . SEB может активировать наивные Т-клетки и индуцировать их дифференцировку в эффекторные Т-клетки, которые продуцируют GM-CSF и IL-3. 30
Микробные компоненты, такие как лиганды TLR, могут влиять на кроветворение как в костном мозге, так и в селезенке. Лиганды TLR, такие как липополисахариды (LPS, лиганд TLR2) и Pam3CSK4 (лиганд TLR4), могут напрямую активировать гематопоэтические клетки-предшественники через свои рецепторы. 37 Следовательно, дифференцировка предшественников в миелоидные клетки, такие как макрофаги и дендритные клетки, значительно усиливается in vitro, в то время как миелоидные клетки в костном мозге и селезенке увеличиваются после инъекции LPS in vivo . Интересно, что лиганды TLR могут превращать даже лимфоидные предшественники в миелоидные клетки. Таким образом, лиганды TLR являются эффективными регуляторами внемедуллярного кроветворения. 37 Это говорит о том, что инфекция может значительно повлиять на кроветворение в костном мозге и периферических органах, таких как селезенка.
Функция лигандов TLR в регуляции кроветворения предполагает, что инфекция является важным элементом возникновения EH. В качестве примера было определено, что большая инфекция Leishmania увеличивает количество колониеобразующих единичных клеток или миелоидных клеток-предшественников в селезенке. 38 Интересно, что ответ у мышей BALB / c был больше, чем у мышей C57BL / 6. Это могло быть связано с меньшей способностью мышей BALB / c избавляться от инфекции внутриклеточными патогенами. Одним из механизмов повышенной миелопоэтической активности, по-видимому, является продукция GM-CSF и TNF-α, 39 , которые могут синергетически поддерживать рост и созревание миелоидных предшественников.
Инфекция Plasmodium berghei (т.е. малярия) позволила лучше понять кинетику гемопоэтического сдвига от костного мозга к селезенке. 40 Инфекция Plasmodium berghei увеличила количество КОЕ-ГМ в костном мозге в течение первой недели инфекции, за которым последовал рост КОЕ-ГМ в периферической крови и, наконец, в селезенке примерно в конце периода инфицирования. вторая неделя. Количество предшественников костного мозга нормализовалось в течение двух недель, но количество предшественников в селезенке оставалось повышенным в течение более длительного периода времени.Неясно, как последовательно регулируется кроветворение в костном мозге и селезенке.
EH при инфекции будет генерировать достаточное количество зрелых миелоидных клеток, чтобы помочь избавиться от патогенов, однако усиленный миелопоэз без надлежащего созревания миелоидных предшественников может индуцировать CD11b + GR-1 + миелоидных супрессорных клеток. 41 , 42 Миелоидные клетки-супрессоры появляются в селезенке и других органах, пораженных инфекцией и раком.Эти клетки очень неоднородны и считаются нормальными составляющими миелопоэза. 41 Таким образом, неполная EH может в конечном итоге препятствовать иммунным ответам на патогены.
EH в результате хронического миелопролиферативного синдрома
Экстрамедуллярное кроветворение возникает, если костный мозг больше не функционирует. Первичный миелофиброз — это форма филадельфийского хронического миелопролиферативного синдрома. 43 При первичном миелофиброзе происходит смещение и мобилизация стволовых клеток и клеток-предшественников.Как следствие, гемопоэтические стволовые клетки и клетки-предшественники занимают печень и селезенку как альтернативные участки кроветворения. В то же время ниша стволовых клеток костного мозга изменяется так, что больше не поддерживает нормальный гемопоэз. 44 — 46 Таким образом, при первичном миелофиброзе место кроветворения изменяется с костного мозга на селезенку и печень. Первичный миелофиброз и связанный с ним филадельфийский хронический миелопролиферативный синдром связаны с точечной мутацией тирозинкиназы JAK2 (JAK2V617F). 47 — 50 Считается, что эта мутация делает гемопоэтические стволовые клетки и клетки-предшественники более чувствительными к факторам роста, изменяет нишу стволовых клеток костного мозга и заставляет клетки мобилизоваться в селезенку и печень. Другой примечательной особенностью первичного миелофиброза является высокая продукция воспалительных цитокинов, таких как SDF-1, HGF, IL-6, IL-8, SCF и VEGF. Аналогичным образом увеличивается количество факторов, способствующих фиброзу и ангиогенезу (bFGF, TGF-β, PF4, VEGF и т. Д.). 51 — 53 Эти молекулы продуцируются в основном гемопоэтическими клетками и вносят свой вклад в регуляторные гуморальные изменения, происходящие в медуллярных нишах и нишах селезенки. Помимо мутации JAK2, активирующие мутации, влияющие на рецептор тромбопоэтина MPL (MPLW515L и MPLW515K), были обнаружены у небольшого числа пациентов с филадельфийско-негативным хроническим миелопролиферативным синдромом. 54 , 55 EH, особенно EH при миелофиброзе, никогда не может полностью заменить костный гематопоэз в производстве необходимых клеток крови.
Заключение
Хотя костный мозг является основным участком кроветворения, это может происходить во многих других тканях как во время внутриутробного развития, так и после рождения. Экстрамедуллярный гемопоэз может происходить до тех пор, пока существуют соответствующие поддерживающие клетки, аккомодация гемопоэтических клеток-предшественников и местная продукция растворимых и связанных с клетками гемопоэтических факторов, которые поддерживают и индуцируют дифференцировку стволовых и клеток-предшественников. Экстрамедуллярное кроветворение происходит при нескольких состояниях, как активно, так и пассивно.Он играет важную роль во время развития плода, а именно выживания плода до образования функциональной кроветворной ниши костного мозга. В качестве нормальной реакции на инфекцию и воспаление в селезенке и печени происходит миелопоэз с образованием фагоцитарных и антигенпредставляющих клеток. При злокачественных заболеваниях, таких как различные формы миелофиброза, кроветворная ниша костного мозга становится пригодной для обитания, а кроветворные стволовые клетки и клетки-предшественники перемещаются на периферию. EH не может полностью вытеснить кроветворение костного мозга с точки зрения производства необходимых кроветворных клеток, скорее, он необходим для созревания кроветворных клеток, которые продуцируются как незрелые клетки в костном мозге.В то время как запрограммированный экстрамедуллярный гематопоэз необходим для дополнения кроветворной активности в костном мозге, чрезмерный и связанный с заболеванием экстрамедуллярный гематопоэз может возникать и опосредовать хроническое воспаление. Требуются дополнительные исследования, чтобы найти полезные стратегии контроля нежелательного экстрамедуллярного кроветворения и хронического воспаления.
Благодарности
Я благодарю Джихо Ли из лаборатории иммунологии и гематопоэза за то, что поделился своими идеями. Эта работа была частично поддержана грантами от NIH (R01AI074745, 1R56AI080769 и R01DK076616), Американского фонда Крона и колита и Американской кардиологической ассоциации для CHK.
Сноски
Раскрытие информации
Автор сообщает об отсутствии конфликта интересов в этой работе.
Ссылки
1. Боззини CE, Баррио Рендо ME, Devoto FC, Эппер CE. Исследования медуллярного и экстрамедуллярного эритропоэза у взрослых мышей. Am J Physiol. 1970. 219 (3): 724–728. [PubMed] [Google Scholar] 2. Элиассон П., Йонссон Дж. Ниша гемопоэтических стволовых клеток: мало кислорода, но приятно находиться. J. Cell Physiol. 2010. 222 (1): 17–22. [PubMed] [Google Scholar] 3.Гарретт Р.В., Эмерсон С.Г. Кость и кровеносные сосуды: твердая и мягкая ниши кроветворных стволовых клеток. Стволовая клетка клетки. 2009. 4 (6): 503–506. [PubMed] [Google Scholar] 4. Raaijmakers MH, Scadden DT. Развитие представлений о нише микроокружения для гемопоэтических стволовых клеток. Curr Opin Hematol. 2008. 15 (4): 301–306. [PubMed] [Google Scholar] 5. Кальви Л. М., Адамс Г. Б., Вейбрехт К. В. и др. Остеобластические клетки регулируют нишу гемопоэтических стволовых клеток. Природа. 2003. 425 (6960): 841–846. [PubMed] [Google Scholar] 6.Сугияма Т., Кохара Х., Нода М., Нагасава Т. Поддержание пула гемопоэтических стволовых клеток с помощью передачи сигналов хемокина CXCL12-CXCR4 в нишах стромальных клеток костного мозга. Иммунитет. 2006; 25 (6): 977–988. [PubMed] [Google Scholar] 7. Чжан Дж., Ню Ц., Е Л. и др. Идентификация ниши гемопоэтических стволовых клеток и контроль размера ниши. Природа. 2003. 425 (6960): 836–841. [PubMed] [Google Scholar] 8. Киль MJ, Йилмаз, Огайо, Ивашита Т., Йилмаз, Огайо, Терхорст С., Моррисон С.Дж. Рецепторы семейства SLAM различают гемопоэтические стволовые клетки и клетки-предшественники и выявляют эндотелиальные ниши для стволовых клеток.Клетка. 2005. 121 (7): 1109–1121. [PubMed] [Google Scholar] 9. Катаяма Ю., Баттиста М., Као В.М. и др. Сигналы симпатической нервной системы регулируют выход гемопоэтических стволовых клеток из костного мозга. Клетка. 2006. 124 (2): 407–421. [PubMed] [Google Scholar] 10. Коллет О., Дар А., Шивтиель С. и др. Остеокласты разрушают компоненты эндоста и способствуют мобилизации гематопоэтических клеток-предшественников. Nat Med. 2006. 12 (6): 657–664. [PubMed] [Google Scholar] 11. Араи Ф., Хирао А., Омура М. и др. Передача сигналов Tie2 / ангиопоэтин-1 регулирует покой гемопоэтических стволовых клеток в нише костного мозга.Клетка. 2004. 118 (2): 149–161. [PubMed] [Google Scholar] 12. Нильссон С.К., Джонстон Х.М., Уитти Г.А. и др. Остеопонтин, ключевой компонент ниши гемопоэтических стволовых клеток и регулятор примитивных гемопоэтических клеток-предшественников. Кровь. 2005. 106 (4): 1232–1239. [PubMed] [Google Scholar] 13. Stier S, Ko Y, Forkert R, et al. Остеопонтин — это компонент ниши гемопоэтических стволовых клеток, который негативно регулирует размер пула стволовых клеток. J Exp Med. 2005. 201 (11): 1781–1791. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15.Брончуд MH, Декстер TM. Клиническое использование гемопоэтических факторов роста. Blood Rev.1989; 3 (1): 66–70. [PubMed] [Google Scholar] 16. МакГеттрик А.Ф., О’Нил, Лос-Анджелес. Толл-подобные рецепторы: ключевые активаторы лейкоцитов и регулятор кроветворения. Br J Haematol. 2007. 139 (2): 185–193. [PubMed] [Google Scholar] 17. Sioud M, Floisand Y, Forfang L, Lund-Johansen F. Передача сигналов через toll-подобный рецептор 7/8 индуцирует дифференцировку клеток-предшественников CD34 + костного мозга человека вдоль миелоидной линии. J Mol Biol.2006. 364 (5): 945–954. [PubMed] [Google Scholar] 18. Гарретт Р.В., Эмерсон С.Г. Роль паратиреоидного гормона и инсулиноподобных факторов роста в кроветворных нишах: физиология и фармакология. Mol Cell Endocrinol. 2008. 288 (1–2): 6–10. [PubMed] [Google Scholar] 19. Ватанабе С., Накаяма Н., Йокота Т., Араи К., Миядзима А. Колониестимулирующие факторы и сеть рецепторов цитокинов. Curr Opin Biotechnol. 1991. 2 (2): 227–237. [PubMed] [Google Scholar] 20. Певзнер-Фишер М., Морад В., Коэн-Сфади М. и др. Toll-подобные рецепторы и их лиганды контролируют функции мезенхимальных стволовых клеток.Кровь. 2007. 109 (4): 1422–1432. [PubMed] [Google Scholar] 21. Адамсон JW. Эритропоэтин: исследования регуляции эритропоэза in vitro и in vivo. Soc Gen Physiol Ser. 1988. 43: 57–65. [PubMed] [Google Scholar] 22. Палис Дж., Йодер М.С. Желточный мешок кроветворения: первые клетки крови мыши и человека. Exp Hematol. 2001. 29 (8): 927–936. [PubMed] [Google Scholar] 23. Тавассоли М. Эмбриональное и внутриутробное кроветворение: обзор. Клетки крови. 1991. 17 (2): 269–281. 282–286. обсуждение. [PubMed] [Google Scholar] 24.Самохвалов И.М., Самохвалова Н.И., Нисикава С. Трассировка клеток показывает вклад желточного мешка в кроветворение взрослых. Природа. 2007. 446 (7139): 1056–1061. [PubMed] [Google Scholar] 25. Люкс СТ, Йошимото М, МакГрат К., Конвей С.Дж., Палис Дж., Йодер М.С. Все примитивные и дефинитивные гематопоэтические клетки-предшественники, появляющиеся до E10 у эмбриона мыши, являются продуктами желточного мешка. Кровь. 2008. 111 (7): 3435–3438. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вольбер FM, Леонард Э., Майкл С., Оршелл-Трейкофф CM, Йодер М.С., Сроур Э.Ф.Роль селезенки и печени в развитии кроветворной системы мышей. Exp Hematol. 2002. 30 (9): 1010–1019. [PubMed] [Google Scholar] 27. Голден-Мейсон Л., О’Фаррелли К. Имея все это? Стволовые клетки, кроветворение и лимфопоэз в печени взрослого человека. Immunol Cell Biol. 2002. 80 (1): 45–51. [PubMed] [Google Scholar] 28. Шнайдер Э., Моро Г., Арнульд А. и др. Повышенный фетальный и внемедуллярный гемопоэз у мышей C57BL / 6-lpr / lpr с дефицитом Fas. Кровь. 1999. 94 (8): 2613–2621. [PubMed] [Google Scholar] 29.Кларк LB, Appleby MW, Brunkow ME, Wilkinson JE, Ziegler SF, Ramsdell F. Клеточная и молекулярная характеристика мутанта мышей scurfy. J Immunol. 1999. 162 (5): 2546–2554. [PubMed] [Google Scholar] 30. Ли Дж.Х., Ван Ц., Ким Ч. FoxP3 + регуляторные Т-клетки сдерживают экстрамедуллярный миелопоэз селезенки посредством подавления гемопоэтических цитокин-продуцирующих Т-клеток. J Immunol. 2009. 183 (10): 6377–6386. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Ханссон М., Петерссон М., Ку ГК, Вигзелл Х., Кисслинг Р.Функция естественных клеток-киллеров in vivo в качестве регуляторов миелоидных клеток-предшественников в селезенке. Eur J Immunol. 1988. 18 (3): 485–488. [PubMed] [Google Scholar] 32. Холмберг Л.А., Миллер Б.А., Олт К.А. Влияние естественных клеток-киллеров на развитие сингенных гемопоэтических предшественников. J Immunol. 1984. 133 (6): 2933–2939. [PubMed] [Google Scholar] 33. Degliantoni G, Perussia B, Mangoni L, Trinchieri G. Ингибирование образования колоний в костном мозге естественными клетками-киллерами человека и активностью ингибирования колоний, полученных из естественных клеток-киллеров.J Exp Med. 1985. 161 (5): 1152–1168. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Мосманн Т.Р., Червински Х., Бонд М.В., Гедлин М.А., Коффман Р.Л. Два типа клона мышиных хелперов Т-лимфоцитов. I. Определение в соответствии с профилями активности лимфокинов и секретируемых белков. J Immunol. 1986. 136 (7): 2348–2357. [PubMed] [Google Scholar] 35. Broxmeyer HE, Bruns HA, Zhang S, et al. Клетки Th2 регулируют гомеостаз гемопоэтических клеток-предшественников за счет продукции онкостатина М. Иммунитет. 2002. 16 (6): 815–825. [PubMed] [Google Scholar] 36.Галелли А., Андерсон С., Шарлот Б., Алуф Дж. Э. Индукция мышиного гемопоэтического фактора роста токсином-1 синдрома токсического шока. J Immunol. 1989. 142 (8): 2855–2863. [PubMed] [Google Scholar] 37. Нагаи Ю., Гарретт К.П., Охта С. и др. Toll-подобные рецепторы на гематопоэтических клетках-предшественниках стимулируют восполнение запасов врожденной иммунной системы. Иммунитет. 2006. 24 (6): 801–812. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Миркович А.М., Галелли А., Эллисон А.С., Модаббер Ф.З. Усиление миелопоэза во время основной инфекции Leishmania у мышей: создание «безопасных мишеней», возможный способ уклониться от эффекторного иммунного механизма.Clin Exp Immunol. 1986; 64 (1): 1–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Cotterell SE, Engwerda CR, Kaye PM. Инфекция Leishmania donovani стромальных макрофагов костного мозга избирательно усиливает миелопоэз за счет механизма, включающего GM-CSF и TNF-альфа. Кровь. 2000. 95 (5): 1642–1651. [PubMed] [Google Scholar] 40. Mungyer G, Poels LG, Иерусалим C, Иерусалим R. Plasmodium berghei: влияние на гранулопоэз и производство макрофагов у мышей BALB / c. Exp Parasitol. 1983; 56 (2): 266–276. [PubMed] [Google Scholar] 41.Остранд-Розенберг С., Синха П. Миелоидные клетки-супрессоры: связь воспаления и рака. J Immunol. 2009. 182 (8): 4499–4506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Габрилович Д.И., Нагарадж С. Миелоидные клетки-супрессоры как регуляторы иммунной системы. Nat Rev Immunol. 2009. 9 (3): 162–174. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Абдель-Вахаб О.И., Левин Р.Л. Первичный миелофиброз: обновленная информация об определении, патогенезе и лечении. Annu Rev Med. 2009. 60: 233–245. [PubMed] [Google Scholar] 44.Тиле Дж., Стейнберг Т., Хёппнер Б. и др. Гисто- и иммуноморфометрия мегакариопоэза при хроническом миелолейкозе с миелофиброзом и так называемым первичным (идиопатическим) остео-миелофиброзом / склерозом. Anal Cell Pathol. 1990. 2 (4): 215–227. [PubMed] [Google Scholar] 45. Тиле Дж, Ромпчик В., Вагнер С., Фишер Р. Сосудистая архитектура и тип коллагена IV при первичном миелофиброзе и истинная полицитемия: иммуноморфометрическое исследование трепанобиопсии костного мозга. Br J Haematol. 1992. 80 (2): 227–234.[PubMed] [Google Scholar] 46. Перейра А., Сервантес Ф., Бругес Р., Розман С. Гистопатология костного мозга при первичном миелофиброзе: клинические и гематологические корреляции и прогностическая оценка. Eur J Haematol. 1990. 44 (2): 95–99. [PubMed] [Google Scholar] 47. Верниг Г., Меркер Т., Окабе Р., Левин Р.Л., Ли Б.Х., Гиллиланд Д.Г. Экспрессия Jak2V617F вызывает заболевание, подобное истинной полицитемии, с ассоциированным миелофиброзом на мышиной модели трансплантата костного мозга. Кровь. 2006. 107 (11): 4274–4281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48.Левин Р.Л., Уодли М., Коулс Дж. И др. Активирующая мутация тирозинкиназы JAK2 при истинной полицитемии, эссенциальной тромбоцитемии и миелоидной метаплазии с миелофиброзом. Раковая клетка. 2005. 7 (4): 387–397. [PubMed] [Google Scholar] 49. Левин Р.Л., Белисл С., Уодли М. и др. Анализ клональности на основе X-инактивации и количественная оценка JAK2V617F выявляют сильную связь между клональностью и JAK2V617F в PV, но не с ET / MMM, и идентифицируют подмножество JAK2V617F-отрицательных пациентов с ET и MMM с клональным гематопоэзом.Кровь. 2006. 107 (10): 4139–4141. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Лаку С, Пизани Д.Ф., Туллиез М., Гачелин Ф.М., Вайнченкер В., Виллеваль Ж.Л. Экспрессия JAK2V617F в мышиных гемопоэтических клетках приводит к MPD, имитирующей человеческий PV с вторичным миелофиброзом. Кровь. 2006. 108 (5): 1652–1660. [PubMed] [Google Scholar] 51. Le Bousse-Kerdiles MC, Martyre MC. Двойное участие фиброгенных цитокинов в патогенезе фиброза и миелопролиферации при миелоидной метаплазии с миелофиброзом. Ann Hematol.1999. 78 (10): 437–444. [PubMed] [Google Scholar] 52. Lataillade JJ, Pierre-Louis O, Hasselbalch HC, et al. Вовлекает ли первичный миелофиброз дефектную нишу стволовых клеток? От концепции к доказательствам. Кровь. 2008. 112 (8): 3026–3035. [PubMed] [Google Scholar] 53. Эмади С., Клей Д., Дестерке С. и др. IL-8 и его рецепторы CXCR1 и CXCR2 участвуют в контроле мегакариоцитарной пролиферации, дифференцировки и плоидности при миелоидной метаплазии с миелофиброзом. Кровь. 2005. 105 (2): 464–473. [PubMed] [Google Scholar] 54.Пикман Ю., Ли Б. Х., Меркер Т. и др. MPLW515L — это новая соматическая активирующая мутация при миелофиброзе с миелоидной метаплазией. PLoS Med. 2006; 3 (7): e270. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Парданани А.Д., Левин Р.Л., Лашо Т. и др. Мутации MPL515 при миелопролиферативных и других миелоидных нарушениях: исследование с участием 1182 пациентов. Кровь. 2006. 108 (10): 3472–3476. [PubMed] [Google Scholar]
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови.Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови. Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : Они поддерживают иммунную систему. Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они способствуют свертыванию крови.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией. Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит главным образом в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Белые кровяные тельца имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз — это производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждом этапе процесса клетки-предшественники становятся более организованными:
Эритроциты и тромбоциты
- Эритроциты : клетки CMP изменяются пять раз, прежде чем окончательно превратиться в эритроциты, также известные как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых следует своим путем в процессе кроветворения.Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Роль селезенки и печени в развитии кроветворной системы мышей
Цель:
Считается, что гемопоэтические стволовые клетки (HSC) и колониеобразующие клетки-предшественники (CFC) мигрируют из печени в костный мозг (BM) примерно во время рождения, где они остаются на протяжении всей жизни животного.Хотя у мышей селезенка также является кроветворным органом, ни происхождение, ни вклад HSC селезенки в гемопоэтический гомеостаз не оценивали по сравнению с HSC BM. Чтобы исследовать эти проблемы, мы количественно измерили активность CFC и HSC в селезенке, костном мозге, периферической крови и печени мышей в онтогенезе.
Методы:
CFC оценивали по образованию клоногенных колоний, а HSC — по способности к долгосрочному восстановлению.
Полученные результаты:
С возрастом ХФУ постепенно увеличивались в BM и уменьшались в печени. Повышенная распространенность ХФУ в крови плода и детеныша произошла на 12 день (d) после полового акта (ПК) и в период от 16 дней до 4 дней после родов, что соответствует времени, когда гемопоэтические клетки мигрируют из желточного мешка и / или аорты-гонад. mesonephros (AGM) в печень плода и из печени новорожденного в BM, соответственно.В селезенке ХФУ показали два пика активности через 2 и 14-15 дней после родов. HSC селезенки также колебались в течение этого периода времени. Неонатальная спленэктомия не изменила частоты CFC или HSC в BM, но CFC увеличилась в печени спленэктомированных мышей.
Выводы:
Эти данные демонстрируют, что печень может действовать как место экстрамедуллярного кроветворения у новорожденных, особенно в отсутствие селезенки, и подразумевают, что селезенка, костный мозг и печень совместно вносят вклад в гемопоэтический гомеостаз.
Кроветворение — обзор | Темы ScienceDirect
Введение
Гематопоэз — это продолжающийся всю жизнь процесс непрерывного образования и обновления клеток крови для удовлетворения повседневных потребностей, а также в ответ на повышенный спрос, например, травмы или инфекции. В среднем взрослые люди производят приблизительно один триллион клеток крови каждый день, включая 200 миллиардов эритроцитов (красных кровяных телец (эритроцитов)) и 70 миллиардов нейтрофилов.Поддержание кроветворения регулируется как стохастическими, так и инструктивными механизмами. В этой статье будет представлен краткий обзор основных результатов, которые способствовали пониманию способности к производству крови в течение всей жизни, с акцентом на основополагающие открытия, определяющие систему кроветворения.
Гемопоэтические стволовые клетки (HSC) находятся на вершине гемопоэза и определяются двумя фундаментальными характеристиками: способностью к самообновлению, делением, которое приводит к двум HSC, и способностью к мультипотентной дифференцировке во все зрелые линии крови. , то есть эритроциты, тромбоциты, лимфоциты, моноциты / макрофаги и гранулоциты.Ключевые исследования в начале 1950-х годов показали, что кроветворение у облученных животных можно восстановить с помощью клеток селезенки и / или костного мозга (КМ). Позже было показано, что аллогенные кожные трансплантаты переносятся смертельно облученными мышами, получившими гемопоэтический трансплантат, что привело к концепции химеризма, то есть восстановления хозяина донорскими клетками. В 1960-х Till, McCulloch и его коллеги опубликовали революционные исследования, показывающие, что отдельные клоногенные клетки в BM могут самообновляться и восстанавливать кроветворение, постулируя существование in vivo HSC.Они показали, что селезенка смертельно облученных мышей, которым вводили гемопоэтические клетки, образовывали макроскопические узелки пропорционально количеству введенных клеток ВМ, и предположили, что эти колонии селезенки (колониеобразующие единицы — селезенка (КОЕ-С)) произошли от одной клетки , что они позже продемонстрировали анализом хромосомных маркеров. Эти исследования также заложили основу для клинической трансплантации кроветворения.
Первоначально считалось, что анализ CFU-S предназначен для измерения HSC, и он до сих пор используется в качестве суррогатного анализа HSC.Однако единственной истинной мерой функции HSC является способность полностью повторно заселить смертельно облученного хозяина. Хотя «присутствие» HSC может быть определено путем мониторинга выживаемости смертельно облученных реципиентов трансплантата, этот строгий метод «выживаемости» не позволяет количественно оценить количество или функцию HSC или сравнить трансплантаты HSC. Для решения этой проблемы были разработаны анализы долгосрочной репопуляции, которые оценивают и количественно определяют клетки с долгосрочным репопуляцией (LTRC), синоним HSC, которые позволяют сравнивать трансплантаты.В стандартном формате донорский трансплантат HSC смешивают с конкурирующим трансплантатом BM от конгенной мыши дикого типа, и смесь трансплантируют смертельно облученному реципиенту. Маркеры, отличные для донорского трансплантата и конкурирующего трансплантата, используются для различения продукции крови из каждого источника клеток, что позволяет сравнить их способность к репопуляции. В анализе используются мышь C57Bl / 6 (CD45.2) и мышь B6.SJL-PtrcAPep3B / BoyJ (BOYJ) (CD45.1), которые различаются только по антигену CD45, и их можно различить с помощью специфических моноклональных антител, что позволяет оценка химеризма у животных-реципиентов.
Хотя тесты конгенной конкурентной репопуляции подходят для HSC мышей, они не позволяют анализировать HSC человека. Вместо этого человеческие гемопоэтические клетки анализировали у мышей с ослабленным иммунитетом, а HSC анализировали в модели, аналогичной конкурентному анализу репопуляции, путем трансплантации сублетально облученным иммунодефицитным мышам, что позволяет оценить химеризм и продукцию нескольких линий человеческих клеток крови. Приживление человеческого HSC in utero эмбриону овцы также используют в качестве экспериментальной модели кроветворения человека.
Кроветворение — обзор | Темы ScienceDirect
Введение
Гематопоэз — это продолжающийся всю жизнь процесс непрерывного образования и обновления клеток крови для удовлетворения повседневных потребностей, а также в ответ на повышенный спрос, например, травмы или инфекции. В среднем взрослые люди производят приблизительно один триллион клеток крови каждый день, включая 200 миллиардов эритроцитов (красных кровяных телец (эритроцитов)) и 70 миллиардов нейтрофилов. Поддержание кроветворения регулируется как стохастическими, так и инструктивными механизмами.В этой статье будет представлен краткий обзор основных результатов, которые способствовали пониманию способности к производству крови в течение всей жизни, с акцентом на основополагающие открытия, определяющие систему кроветворения.
Гемопоэтические стволовые клетки (HSC) находятся на вершине гемопоэза и определяются двумя фундаментальными характеристиками: способностью к самообновлению, делением, которое приводит к двум HSC, и способностью к мультипотентной дифференцировке во все зрелые линии крови. , то есть эритроциты, тромбоциты, лимфоциты, моноциты / макрофаги и гранулоциты.Ключевые исследования в начале 1950-х годов показали, что кроветворение у облученных животных можно восстановить с помощью клеток селезенки и / или костного мозга (КМ). Позже было показано, что аллогенные кожные трансплантаты переносятся смертельно облученными мышами, получившими гемопоэтический трансплантат, что привело к концепции химеризма, то есть восстановления хозяина донорскими клетками. В 1960-х Till, McCulloch и его коллеги опубликовали революционные исследования, показывающие, что отдельные клоногенные клетки в BM могут самообновляться и восстанавливать кроветворение, постулируя существование in vivo HSC.Они показали, что селезенка смертельно облученных мышей, которым вводили гемопоэтические клетки, образовывали макроскопические узелки пропорционально количеству введенных клеток ВМ, и предположили, что эти колонии селезенки (колониеобразующие единицы — селезенка (КОЕ-С)) произошли от одной клетки , что они позже продемонстрировали анализом хромосомных маркеров. Эти исследования также заложили основу для клинической трансплантации кроветворения.
Первоначально считалось, что анализ CFU-S предназначен для измерения HSC, и он до сих пор используется в качестве суррогатного анализа HSC.Однако единственной истинной мерой функции HSC является способность полностью повторно заселить смертельно облученного хозяина. Хотя «присутствие» HSC может быть определено путем мониторинга выживаемости смертельно облученных реципиентов трансплантата, этот строгий метод «выживаемости» не позволяет количественно оценить количество или функцию HSC или сравнить трансплантаты HSC. Для решения этой проблемы были разработаны анализы долгосрочной репопуляции, которые оценивают и количественно определяют клетки с долгосрочным репопуляцией (LTRC), синоним HSC, которые позволяют сравнивать трансплантаты.В стандартном формате донорский трансплантат HSC смешивают с конкурирующим трансплантатом BM от конгенной мыши дикого типа, и смесь трансплантируют смертельно облученному реципиенту. Маркеры, отличные для донорского трансплантата и конкурирующего трансплантата, используются для различения продукции крови из каждого источника клеток, что позволяет сравнить их способность к репопуляции. В анализе используются мышь C57Bl / 6 (CD45.2) и мышь B6.SJL-PtrcAPep3B / BoyJ (BOYJ) (CD45.1), которые различаются только по антигену CD45, и их можно различить с помощью специфических моноклональных антител, что позволяет оценка химеризма у животных-реципиентов.
Хотя тесты конгенной конкурентной репопуляции подходят для HSC мышей, они не позволяют анализировать HSC человека. Вместо этого человеческие гемопоэтические клетки анализировали у мышей с ослабленным иммунитетом, а HSC анализировали в модели, аналогичной конкурентному анализу репопуляции, путем трансплантации сублетально облученным иммунодефицитным мышам, что позволяет оценить химеризм и продукцию нескольких линий человеческих клеток крови. Приживление человеческого HSC in utero эмбриону овцы также используют в качестве экспериментальной модели кроветворения человека.
Что делает селезенка?
Хотя у большинства людей есть селезенки, мы не часто задумываемся о том, как они функционируют как органы нашего тела. Возможно, вы слышали, как люди используют фразу «отдушина селезенки» — не относящаяся к самой части тела, а как способ описать высвобождение гнева или разочарования. Слово «селезенка» стало использоваться метафорически как синоним слова «гнев». Это потому, что в средние века селезенка считалась буквальным физическим источником вспыльчивости.Люди думали, что «выпустить воздух» из селезенки уберет излишний гнев. К счастью, с тех пор мы многое узнали о назначении селезенки в нашем организме.
Где селезенка?
Ваша селезенка расположена в верхнем левом углу живота — сразу за животом и под диафрагмой. Она мягкая и пурпурная, по форме похожа на очень маленькую гладкую округлую лапу ловца с зазубринами на ее верхнем переднем крае.
Размер и вес могут сильно различаться, но селезенка среднего здорового взрослого человека составляет около пяти дюймов в длину, три дюйма в ширину и полтора дюйма в толщину.Типичная селезенка весит около шести унций, когда вы здоровы. При некоторых инфекциях или других состояниях ваша селезенка может увеличиваться. Когда это происходит, ваша селезенка может увеличиться в весе примерно до четырех фунтов.
Это потому, что ваша селезенка является сосудистым органом; он содержит множество сосудов, которые переносят и циркулируют жидкости в вашем теле. Он очень тесно взаимодействует с вашей кровью и лимфой и может быть затронут инфекциями, злокачественными новообразованиями, болезнями печени, паразитами и другими состояниями.
Для чего нужна селезенка?
Как вы видели, ваша селезенка часто находится на «передней линии» вашего тела; Фактически, ваша селезенка — это очень загруженный орган, особенно с учетом ее небольшого размера.
Основная функция вашей селезенки — действовать как фильтр для вашей крови. Он распознает и удаляет старые, деформированные или поврежденные эритроциты. Когда кровь попадает в селезенку, она выполняет «контроль качества»; ваши эритроциты должны пройти через лабиринт узких проходов. Здоровые клетки крови просто проходят через селезенку и продолжают циркулировать по кровотоку. Клетки крови, которые не могут пройти тест, будут разрушены в селезенке макрофагами. Макрофаги — это большие белые кровяные тельца, которые специализируются на разрушении этих нездоровых красных кровяных телец.
Всегда экономично, ваша селезенка сохраняет все полезные компоненты из старых клеток, например, железо. Он хранит железо в форме ферритина или билирубина и в конечном итоге возвращает железо в костный мозг, где вырабатывается гемоглобин. Гемоглобин — это важный белок в вашей крови, который переносит кислород из легких во все части вашего тела, которые в нем нуждаются.
Еще одна полезная функция селезенки — запасание крови. Кровеносные сосуды в селезенке человека могут становиться шире или уже, в зависимости от потребностей вашего тела.Когда сосуды расширяются, ваша селезенка может вместить до чашки резервной крови. Если по какой-либо причине вам понадобится дополнительная кровь — например, если травма приводит к потере крови, ваша селезенка может отреагировать, выпуская эту резервную кровь обратно в вашу систему.
Ваша селезенка также играет важную роль в вашей иммунной системе, которая помогает вашему организму бороться с инфекцией. Подобно тому, как она обнаруживает неисправные эритроциты, ваша селезенка может улавливать любые нежелательные микроорганизмы (например, бактерии или вирусы) в вашей крови.
Когда в вашем кровотоке обнаруживается один из этих захватчиков, ваша селезенка вместе с лимфатическими узлами переходит в действие и создает армию защитных клеток, называемых лимфоцитами. Лимфоциты — это тип лейкоцитов, вырабатывающих антитела, особые белки, которые ослабляют или убивают бактерии, вирусы и другие организмы, вызывающие инфекцию. Антитела и лейкоциты также предотвращают распространение инфекций по организму, задерживая микробы и уничтожая их.
Могу ли я жить без селезенки?
Как вы видели, ваша селезенка — очень полезный орган, но не жизненно важный.Иногда селезенку необходимо удалить хирургическим путем. Это может быть из-за травмы селезенки или ее удаления в процессе трансплантации других органов.
Другие части вашего тела, такие как лимфатические узлы и печень, могут вмешаться и взять на себя многие функции вашей селезенки. Поскольку селезенка так важна для вашей иммунной системы, люди без селезенки более уязвимы для инфекций. Вот почему ваш врач может посоветовать вам принять дополнительные меры предосторожности, такие как вакцинация, после удаления селезенки.Вам также будут прописаны пероральные антибиотики для ежедневного приема; это еще один способ предотвратить заражение. Тем не менее, нередко оставаться без селезенки, и многие люди могут жить полноценной жизнью без нее.
Узнайте больше о печени и ее функциях.
Свяжитесь с нами
Чтобы записаться на прием или сделать направление в Центр детской трансплантации Hillman при детской больнице UPMC в Питтсбурге, свяжитесь с нашими координаторами по трансплантации:
Ян Блайс
Телефон: 412-692-8184
Электронная почта: Джоанна[email protected]
Renee Brown-Bakewell
Телефон: 412-692-6310
Электронная почта: [email protected]
Время работы: с 8:30 до 17:00.
Факс: 412-692-6116
Экстренные направления принимаются круглосуточно по телефону 877-640-6746.
| 11 | 2,0 × 10 5 | nd | nd |
| 12 | 5.0 × 10 5 | 1,98 ± 1,48 (n = 9) | 7,18 ± 7,39 (n = 9) |
| 10,0 × 10 5 | 2,37 ± 1,49 (n = 8) | 11,53 ± 11,10 (n = 8) | |
| 15,0 × 10 5 | 4,79 ± 2,60 (n = 9) | 17,60 ± 7,08 (n = 9) | |
| 13 | 0,8 × 10 5 | 0,35 ± 0,20 (n = 5) | 0,86 ± 0,59 (n = 5) |
| 1.0 × 10 5 | 0,32 ± 0,25 (n = 5) | 1,36 ± 1,16 (n = 5) | |
| 2,0 × 10 5 | 0,77 ± 0,38 (n = 5) | 2,48 ± 1,51 (n = 5) | |
| 14 | 1,0 × 10 5 | 0,30 ± 0,18 (n = 5) | 1,44 ± 1,22 (n = 5) |
| 1,5 × 10 5 | 0,50 ± 0,10 (n = 5) | 1,60 ± 1,78 (n = 5) | |
| 2.0 × 10 5 | 0,64 ± 0,10 (n = 8) | 2,32 ± 1,05 (n = 8) | |
| 15 | 1,0 × 10 5 | 0,31 ± 0,30 (n = 9) | 1,20 ± 1,15 (n = 9) |
| 2,0 × 10 5 | 0,78 ± 0,42 (n = 7) | 2,95 ± 2,31 (n = 7) | |
| 3,0 × 10 5 | 1,10 ± 0,67 (n = 9) | 3,35 ± 1,95 (n = 9) | |
| 16 | 1.0 × 10 5 | 0,31 ± 0,19 (n = 5) | 1,40 ± 1,11 (n = 5) |
| 2,5 × 10 5 | 1,10 ± 0,75 (n = 5) | 3,29 ± 1,39 (n = 5) | |
| 5,0 × 10 5 | 1,53 ± 0,54 (n = 5) | 6,72 ± 2,78 (n = 5) | |
| 17 | 1,0 × 10 5 | 0,33 ± 0,16 (n = 8) | 1,15 ± 0,96 (n = 8) |
| 2.0 × 10 5 | 0,66 ± 0,47 (n = 6) | 2,13 ± 1,65 (n = 6) | |
| 3,0 × 10 5 | 1,63 ± 1,62 (n = 8) | 4,39 ± 2,94 (n = 8) | |
| 18 | 1,0 × 10 5 | 0,48 ± 0,28 (n = 5) | 1,31 ± 0,78 (n = 5) |
| 2,5 × 10 5 | 1,32 ± 0,65 (n = 5) | 2,39 ± 0,90 (n = 5) | |
| 5. |
