Наследственный гемохроматоз, I тип (ген HFE) (Hemochromatosis Type 1 (Gene HFE))
Исследуемый материал
Цельная кровь (с ЭДТА)
Метод определения
MLPA
Выдаётся описание результатов врачом-генетиком!
Данное исследование предназначено для выявления наиболее частых мутаций в гене, ответственном за развитие наследственного гемохроматоза 1 типа. Исследование имеет диагностическое значение, позволяющее определить наследственную природу избыточного накопления железа в организме.
Гемохроматоз представляет собой системное заболевание, характеризующееся прогрессирующим накоплением запасов железа в организме и его отложением в различных органах и тканях. В литературе также можно встретить другие названия заболевания: бронзовый диабет, пигментный цирроз печени, семейный гемохроматоз, гемохроматозный синдром, болезнь перегрузки железом, синдром Труазье-Ано-Шоффара, болезнь фон Реклингхаузен-Аппельбаума.
В свою очередь, гемохроматоз можно подразделить на 2 категории: первичный (наследственный) и вторичный гемохроматоз. Причиной первичного гемохроматоза (НГХ) служат генетические нарушения, в то время как вторичный может быть вызван чрезмерным употреблением пищи богатой железом (красное мясо) или добавок, способствующих его повышенному усвоению (витаминные комплексы, содержащие в своём составе большое количество железа, продукты, богатые аскорбиновой кислотой). Среди причин вторичного гемохроматоза следует назвать также такие патологические состояния, как хронические гемолитические анемии (ß-талассемия) и эритробластопении, разнообразные хронические заболевания печени (вирусные гепатиты В и С, алкогольная болезнь печени и др.), кожная порфирия (porphyria cutanea tarda), увеличивающие содержание железа в организме.
Симптомы и признаки заболевания включают в себя гиперпигментацию кожи, диабет, гепатомегалию (классическая триада), нарушение со стороны деятельности сердца, артропатию и гипогонадизм. Ранние жалобы чаще всего сводятся к слабости, апатии, похуданию, изменению окраски кожи, болям в животе, утрате либидо и явлениям, характерным для начала диабета. Наиболее чёткими объективными признаками полностью развившегося заболевания служат гепатомегалия, гиперпигментация кожи, телеангиэктазии, спленомегалия, артропатия, нарушения сердечного ритма, застойная сердечная недостаточность, выпадение волос на теле, атрофия яичек и желтуха.
Ранние жалобы чаще всего сводятся к слабости, апатии, похуданию, изменению окраски кожи, болям в животе, утрате либидо и явлениям, характерным для начала диабета. Наиболее чёткими объективными признаками полностью развившегося заболевания служат гепатомегалия, гиперпигментация кожи, телеангиэктазии, спленомегалия, артропатия, нарушения сердечного ритма, застойная сердечная недостаточность, выпадение волос на теле, атрофия яичек и желтуха.
Особенность гемохроматоза, затрудняющая своевременную диагностику и лечение, заключается в том, что, как правило, клинические признаки заболевания проявляют себя не сразу, а только лишь, когда количество накопленного железа в организме намного превышает допустимые нормы. Последнее сопровождается грубыми нарушениями со стороны работы внутренних органов и систем.
Для выявления состояния перегрузки организма железом используется целый ряд биохимических маркёров: уровень железа в сыворотке крови, общая железосвязывающая способность сыворотки (ОЖСС), трансферрин, насыщение трансферрина (НТЖ), сывороточный ферритин и др. Наиболее важными показателями обмена железа являются два из них: уровень ферритина и насыщение транферрина. Последний рассчитывается по формуле: НТЖ=(железо сыворотки крови/ОЖСС)х100%. НТЖ точнее отражает запасы железа в организме, так как уровень железа сыворотки и ОЖСС сами по себе обладают большими индивидуальными колебаниями и зависят от множества факторов. Именно повышение уровня ферритина и насыщения трансферрина является первым признаком заболевания.
В настоящее время выделяют 5 типов НГХ: классический (1-й тип), ювенильный (2-й тип), гемохроматоз 3-го, 4-го типов и неонатальный гемохроматоз.
Наследственный гемохроматоз 1-го типа (классический) признан одним из наиболее частых аутосомно-рецессивных заболеваний Европы. Развитие классического гемохроматоза связывают с нарушением работы гена HFE, локализованного на 6-ой хромосоме (6p21.3) и имеющего в своём составе 7 экзонов. На сегодняшний день в результате многочисленных исследований семей больных НГХ уже обнаружено более 25-ти отдельных мутаций в структуре HFE. По данным Fedder и его коллег, более 80% пациентов являются носителями одной из двух самых распространённых мутаций C282Y и H63D этого гена. Частота носительства указанных мутации крайне распространена в ряде северных стран Европы, достигая для C282Y 10-13 % в Британии, Норвегии и Швеции. Ряд отечественных работ показал, что российская частота основных мутаций гена HFE сходна по своим показателям с частотой мутаций в Греции, Италии, Испании и США, где частота аллеля 282Y составляет в среднем 0,02-0,04.
По данным Fedder и его коллег, более 80% пациентов являются носителями одной из двух самых распространённых мутаций C282Y и H63D этого гена. Частота носительства указанных мутации крайне распространена в ряде северных стран Европы, достигая для C282Y 10-13 % в Британии, Норвегии и Швеции. Ряд отечественных работ показал, что российская частота основных мутаций гена HFE сходна по своим показателям с частотой мутаций в Греции, Италии, Испании и США, где частота аллеля 282Y составляет в среднем 0,02-0,04.
Как правило, клиническая картина заболевания начинает проявляться в возрасте старше 45 лет. Однако, как показано в работе Литвиновой М.М., повышение уровня ферритина и насыщения трансферрина, отражающие процесс чрезмерного накопление железа в организме, у пациентов, гомозиготных по мутации C282Y, можно выявить уже в подростковом возрасте. Ранняя постановка диагноза, своевременное начало адекватного лечения даёт возможность предотвратить такие грозные осложнения гемохроматоза, как цирроз печени, гипогонадизм, сахарный диабет, сердечную недостаточность и многие другие.
нарушения процессов обмена железа, Уровень железа
Что такое наследственный гемохроматоз?
Наследственный гемохроматоз (HH) является врожденным заболеванием. У страдающих им имеются нарушения процессов обмена железа. Симптомы можно легко предотвратить, если болезнь диагностирована правильно и в срок. В противном случае, при отсутствии лечения, они грозят серьезными повреждениями разных органов.
Человеческий организм необходимое количество железа всасывает из пищи, и когда он достигает достаточного уровня, всасывание железа ограничивается в результате саморегулирования. В свою очередь, под влиянием НН организм накапливает избыток железа, поскольку этот механизм регулирования нарушен.
Со временем избыток железа накапливается в клетках печени, сердца, поджелудочной железы, суставов и т.д., что может привести к тяжелым заболеваниям этих органов. Например, циррозу печени, раку печени, сахарному диабету, болезням сердца и т.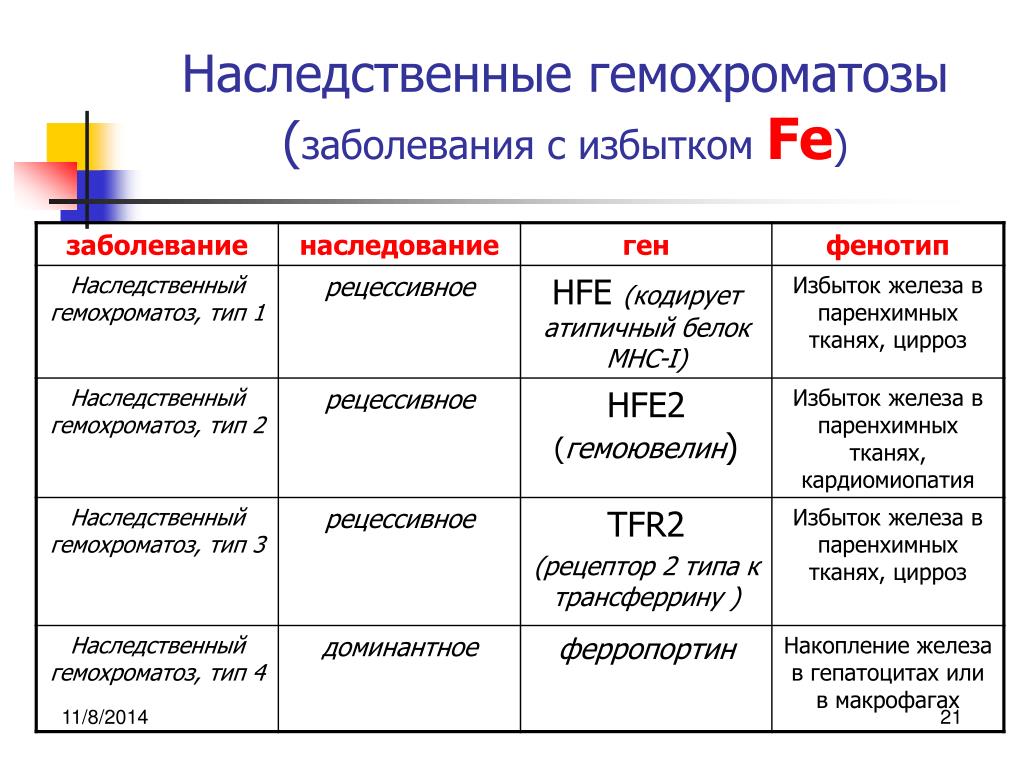 д.
д.
Молекулярная диагностика гена HFE помогают обнаружить до 90% случаев заболевания. Этот метод не дает ответов на симптоматические вопросы о том, накапливается ли и в каком избыточном количестве железо, а также о степени тяжести возможных повреждений тканей.
Главной целью анализа является выявление заболевания, чтобы можно было своевременно начать терапию, что позволит избежать тяжелых повреждений суставов, печени, сердца и других органов.
Описание анализа
В 1996 году был обнаружен ген HFE, отвечающий за вероятность наследственного гемохроматоза. Наиболее распространенной причиной гемохроматоза являются мутации G(845)А и С(187)G. Если ребенок наследует от родителей обе копии дефектного гена, то это означает, что в течение жизни у него будет развиваться гемохроматоз. В свою очередь, люди, которые наследуют только один измененный ген, сами гемохроматозом не болеют, но могут передавать этот ген своим детям.
Таким образом, если оба родителя являются только носителями гемохроматоза, то у каждого из их детей вероятность получить две копии измененных генов составляет 25%. В разных популяциях частота заболеваемости гемохроматозом составляет в среднем 0,3% жителей.
Лечение гемохроматоза
Гемохроматоз является одним из генетических заболеваний, при котором существует простая и эффективная терапия. Уровень железа поддерживается в норме с помощью безболезненной и относительно недорогой процедуры – регулярного кровопускания. Первоначально она нужна пациентам чаще, пока не будет достигнут нормальный уровень железа в крови. При длительном наблюдении у врача процедуры сдачи крови назначают только в случае необходимости для поддержания нормального уровня железа.
Конфиденциальность и этические принципы
Результаты анализа являются строго конфиденциальными. Они будут отправлены только назначившему тест лечащему врачу или пациенту. По результатам анализа ДНК пациент может проконсультироваться со своим врачом.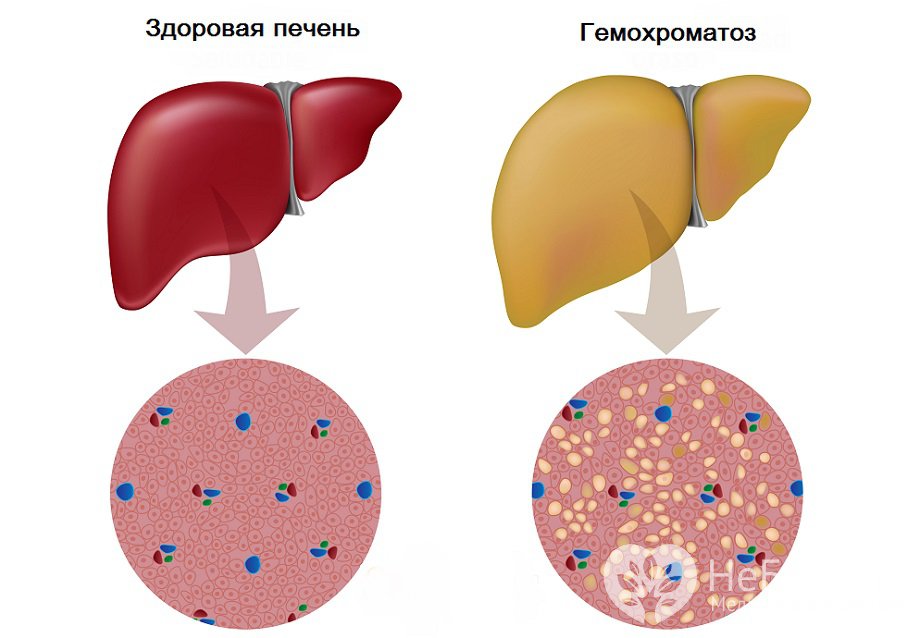 С образцом конкретного пациента будет проведен только назначенный тест, для других целей он не будет использоваться ни при каких обстоятельствах.
С образцом конкретного пациента будет проведен только назначенный тест, для других целей он не будет использоваться ни при каких обстоятельствах.
Для посещения нашей лаборатории и сдачи образцов для выполнения какого-либо анализа, просьба звонить по тел. +371 26267833 или писать на эл. почту [email protected] с указанием интересующего вас анализа; имени, фамилии и года рождения человека, которому необходим анализ; желаемых даты и времени посещения лаборатории; номера контактного телефона.
Лишнее железо в организме связали с дополнительным риском развития возрастных заболеваний. То, что раньше считали типичным проявлением старости, может оказаться генетической, но легко излечимой болезнью — Наука
Мутации, ответственные за наследственный гемохроматоз, носит в своем геноме примерно каждый десятый человек северноевропейского происхождения и, по некоторым оценкам, каждый третий североамериканец. Они затрагивают ген HFE, который регулирует выработку гепцидина — белка, тормозящего всасывание железа в кишечнике. Гомозигот, то есть тех, у кого обе копии гена содержат мутацию, гораздо меньше — примерно 1 человек из 150. Однако все эти люди рискуют развитием гемохроматоза, то есть избыточного поглощения железа.
Мы привыкли думать о железе как о безусловно полезном микроэлементе, необходимом для кроветворения. Вероятно, предкам человека было выгодно всасывать максимум железа из пищи, так как мясо им попадалось не всегда. Однако в больших количествах железо может оказаться вредным, умножая количество свободных радикалов в тканях и мешая клеткам бороться с окислительным стрессом. В последнее время растет количество исследований, связывающих повышенный уровень железа в крови с риском развития множества заболеваний, среди которых инсульт, сердечная недостаточность, диабет и даже рак.
Среди гомозигот по мутации гемохроматоз диагностируют у каждого второго мужчины и у каждой четвертой женщины. Группа британских и американских ученых подсчитала дополнительные риски, которые возникают у таких пациентов. Они проанализировали истории болезней почти трех тысяч людей с мутацией в обоих копиях генов, средний возраст которых был 63 года. Оказалось, что у 15% мужчин и 10% женщин развивались дополнительные заболевания, а среди людей без мутаций в гене HFE таких было 5 и 3% соответственно. Эти заболевания включали в себя хронические боли, диабет, мышечную слабость и хрупкость суставов. Гомозиготы по мутации в два раза чаще страдали атритом, и в четыре — болезнями печени, в том числе раком.
Они проанализировали истории болезней почти трех тысяч людей с мутацией в обоих копиях генов, средний возраст которых был 63 года. Оказалось, что у 15% мужчин и 10% женщин развивались дополнительные заболевания, а среди людей без мутаций в гене HFE таких было 5 и 3% соответственно. Эти заболевания включали в себя хронические боли, диабет, мышечную слабость и хрупкость суставов. Гомозиготы по мутации в два раза чаще страдали атритом, и в четыре — болезнями печени, в том числе раком.
Таким образом, многие болезни, которые мы привыкли связывать со старостью и считать неотвратимыми, могут быть всего лишь следствием гемохроматоза. А значит, их можно предотвратить с помощью генетического тестирования и профилактики.
На данный момент известен один эффективный и простой метод, позволяющий справиться с гетерохроматозом, — это регулярное кровопускание. Именно поэтому, кстати, у женщин реже, чем у мужчин, развивается это заболевание: они теряют кровь естественным путем при менструациях.
Полина Лосева
Анализы в KDL. Гемохроматоз, определение мутаций
Гемохроматоз – генетическое заболевание, связанное с нарушением обмена железа. Дефект гена HFE приводит к повышенному усвоению железа из пищи, в итоге его токсичные соединения начинают скапливаться в организме. Постепенно развиваются различные патологии. На ранних стадиях гемохроматоз протекает бессимптомно, затем могут наблюдаться общая слабость, болезненность суставов, бронзовый цвет кожи, сонливость, импотенция. Запущенный гемохроматоз способен привести к развитию сахарного диабета, остеопороза, нарушений работы сердца, цирроза и рака печени, недостаточности половых желез.
При гемохроматозе повышаются уровни ферритина и трансферрина в крови. Однако на основе только этих данных диагноз ставить нельзя, поскольку ферритин и трансферрин могут быть повышены и по другим причинам. Дальнейшая диагностика включает проведение генетического анализа с помощью метода ПЦР, который выявляет мутацию в гене HFE, приводящую к развитию гемохроматоза. Эта мутация встречается часто, особенно у мужчин (частота заболеваемости в 24 раза выше, чем у женщин). Радикального лечения гемохроматоза, как и других генетических заболеваний, не существует, однако эффективным поддерживающим средством является флеботомическая терапия – лечебное кровопускание. Регулярное применение кровопускательных процедур позволяет снизить запасы железа в организме, выводить его излишки из печени и других уязвимых органов и стимулирует производство эритроцитов.
Эта мутация встречается часто, особенно у мужчин (частота заболеваемости в 24 раза выше, чем у женщин). Радикального лечения гемохроматоза, как и других генетических заболеваний, не существует, однако эффективным поддерживающим средством является флеботомическая терапия – лечебное кровопускание. Регулярное применение кровопускательных процедур позволяет снизить запасы железа в организме, выводить его излишки из печени и других уязвимых органов и стимулирует производство эритроцитов.
В каких случаях обычно назначают исследование?
Тест используется для диагностики наследственного гемохроматоза и при наличии симптомов избытка железа, таких как:
- повышение ферритина и трансферрина в крови;
- высокий уровень гемоглобина;
- «бронзовый» цвет кожи;
- увеличение печени и фиброзные изменения в ней;
- нарушения со стороны сердца;
- сахарный диабет.
Также анализ необходимо сдать всем, у кого в семье фиксировались случаи гемохроматоза.
Что именно определяется в процессе анализа?
Происходит определение наличия мутации в гене HFE (в локусах 187 C>G (H63D) и 845 G>A (C282Y)) в образце крови пациента с помощью метода ПЦР.
Что означают результаты теста?
По результатам исследования выдается заключение врача-генетика с комментариями и пояснениями. Окончательный диагноз ставит лечащий врач пациента.
Сроки выполнения теста.
Обычно результат анализа можно получить спустя 10 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. С подробной информацией можно ознакомиться в соответствующем разделе статьи.
Hemochromatosis — modern condition of the problem | Voloshina
The iron overload syndrome can be associated with various acquired states and hereditary factors.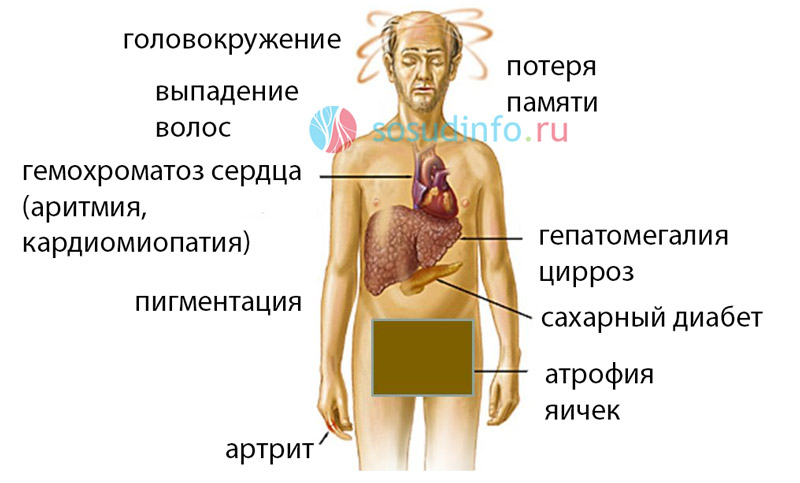 Hereditary hemochromatosis is the most common genetic disorder. Without therapeutic intervention the disease can lead to the development of life-threatening complications such as cirrhosis, hepatocellular carcinoma. The article presents data on pathogenesis, diagnosis and treatment of hereditary hemochromatosis. Own clinical observation is given.
Hereditary hemochromatosis is the most common genetic disorder. Without therapeutic intervention the disease can lead to the development of life-threatening complications such as cirrhosis, hepatocellular carcinoma. The article presents data on pathogenesis, diagnosis and treatment of hereditary hemochromatosis. Own clinical observation is given.
Гемохроматоз — заболевание, связанное с накоплением в организме высоких патологических уровней железа, что приводит к функциональным нарушениям некоторых органов. Обычно абсорбция железа жестко регулируется, вследствие чего организм не способен выделять избыток железа. Избыток железа накапливается в клетках в виде гемосидерина. Это в конечном итоге приводит к гибели клеток и замене этих клеток фиброзной тканью, что ведет к нарушению структуры и функции органов. При гемохроматозе возможно поражение печени, поджелудочной железы, сердца, щитовидной железы, суставов, кожи, гонад, гипофиза. Перегрузка железом, вызывающая гемохроматоз, может происходить тремя способами: массивное пероральное потребление железа, повышенная абсорбция железа при нормальном потреблении железа, а также чрезмерное производство или массовое, частое переливание эритроцитов. При наследственном гемохроматозе избыток железа обычно депонируется в паренхиматозных клетках, тогда как при трансфузионном гемохроматозе оно преимущественно депонируется в ретикулоэндотелиальных клетках [1-3]. Наследственный гемохроматоз включает в себя группу генетических нарушений, характеризующихся повышенной абсорбцией железа. Преобладающим механизмом в большинстве типов наследственного гемохроматоза является эффект гепсидина, который играет ключевую роль в гомеостазе железа [4-6]. Гепсидин синтезируется главным образом в гепатоцитах и контролирует концентрацию железа в плазме путем связывания с ферропортином (также называемым SLC40A1), единственным известным трансмембранным транспортером железа из тканей доноров железа. Ферропортин экспортирует железо из двенадцатиперстной кишки, из макрофагов и гепатоцитов. В плазме железо связывается с трасферрином, таким образом, насыщенность железа трансферрином в среднем составляет 35% (среднее утреннее значение). Гепсидин ингибирует освобождение железа из макрофагов (из старых эритроцитов и ферритина), гепатоцитов и энтероцитов двенадцатиперстной кишки путем связывания с ферропортином. А при отсутствии ферропортина выход железа из энтероцитов, гепатоцитов и макрофагов блокирован. Таким образом, гепсидин снижает уровень всасывания железа в кишечнике, снижает уровень освобождаемого железа из гепатоцитов и макрофагов, что приводит к низкому уровню железа в плазме и повышению в тканях. Причиной наследственного гемохроматоза является мутация в гене HFE. Впервые дефект в гене HFE описан в 1996 г., который представляет собой мутацию, приводящую к замене тирозина на цистеин в положении аминокислоты 282 (С282Y) [7]. Мутация в гене HFE вызывает повышенную абсорбцию железа, несмотря на нормальное потребление железа. Белок HFE регулирует производство гепсидина. Пациенты с наследственным гемохроматозом гомозиготы C282Y составляют от 80 до 85% [1, 8]. Существуют еще две мутации: одна — связанная с заменой аспартата гистидином в положении 63 (H63D), и вторая — замещающая цистеин серином в положении 65 (S65C). Эти мутации не связаны с синдромом перегрузки железом, если только C282Y не является составной частью гетерозиготы C282Y/H63D или C282Y/S65C. Таким образом, HFE-ассоциированная форма наследственного гемохроматоза может быть верифицирована при бессимптомном течении заболевания. Соответственно, генетический диагноз может быть применен у пациентов, у которых гемохроматоз еще не проявился фенотипически. Эта группа пациентов с генетической предрасположенностью к гемохроматозу. У гетерозигот повышенный риск развития диабета по сравнению с общей популяцией, механизм развития при этом неизвестен [9-11]. Ранее считалось, что у всех пациентов с дефектом гена HFE со временем проявится клиника гемохроматоза.
Ферропортин экспортирует железо из двенадцатиперстной кишки, из макрофагов и гепатоцитов. В плазме железо связывается с трасферрином, таким образом, насыщенность железа трансферрином в среднем составляет 35% (среднее утреннее значение). Гепсидин ингибирует освобождение железа из макрофагов (из старых эритроцитов и ферритина), гепатоцитов и энтероцитов двенадцатиперстной кишки путем связывания с ферропортином. А при отсутствии ферропортина выход железа из энтероцитов, гепатоцитов и макрофагов блокирован. Таким образом, гепсидин снижает уровень всасывания железа в кишечнике, снижает уровень освобождаемого железа из гепатоцитов и макрофагов, что приводит к низкому уровню железа в плазме и повышению в тканях. Причиной наследственного гемохроматоза является мутация в гене HFE. Впервые дефект в гене HFE описан в 1996 г., который представляет собой мутацию, приводящую к замене тирозина на цистеин в положении аминокислоты 282 (С282Y) [7]. Мутация в гене HFE вызывает повышенную абсорбцию железа, несмотря на нормальное потребление железа. Белок HFE регулирует производство гепсидина. Пациенты с наследственным гемохроматозом гомозиготы C282Y составляют от 80 до 85% [1, 8]. Существуют еще две мутации: одна — связанная с заменой аспартата гистидином в положении 63 (H63D), и вторая — замещающая цистеин серином в положении 65 (S65C). Эти мутации не связаны с синдромом перегрузки железом, если только C282Y не является составной частью гетерозиготы C282Y/H63D или C282Y/S65C. Таким образом, HFE-ассоциированная форма наследственного гемохроматоза может быть верифицирована при бессимптомном течении заболевания. Соответственно, генетический диагноз может быть применен у пациентов, у которых гемохроматоз еще не проявился фенотипически. Эта группа пациентов с генетической предрасположенностью к гемохроматозу. У гетерозигот повышенный риск развития диабета по сравнению с общей популяцией, механизм развития при этом неизвестен [9-11]. Ранее считалось, что у всех пациентов с дефектом гена HFE со временем проявится клиника гемохроматоза. Однако в настоящее время выяснено, что фенотипическая экспрессия встречается лишь у приблизительно 70% гомозигот C282Y и у менее 10% из них развивается тяжелая перегрузка железом с повреждением внутренних органов [12, 13]. В таблице представлена классификация синдромов перегрузки железом в зависимости от причины его возникновения. В зависимости от причины развития заболевания пациентов с синдром перегрузки железом можно подразделить на 4 группы: пациенты с наследственным гемохроматозом, пациенты с вторичным гемохроматозом, вызванным различными причинами, и небольшая группа пациентов, которая выделяется как «разное». Причиной вторичного гемохроматоза является эритропоэтический гемохроматоз. Наиболее часто это происходит в результате основного заболевания крови, при котором эритроциты имеют сокращенную продолжительность жизни. Эта группа заболеваний включает в себя железодефицитную анемию, талассемию, сидеробластическую анемию, хроническую гемолитическую анемию, апластическую анемию, пиридоксин-чувствительную анемию, недостаточность пируваткиназы. Синдром перегрузки железом может возникнуть у пациентов, которые получают длительные и множественные переливания эритроцитарной массы. Как видно из таблицы, другие достаточно редкие заболевания, такие как, например, порфирия, также могут вызвать синдром перегрузки железом. Наконец, чрезмерное потребление железа может вызвать гемохроматоз. Известный исторический факт: употребление пива, приготовленного в стальных барабанах, явилось причиной синдрома перегрузки железом. Также передозировка препаратами железа может стать причиной синдрома перегрузки железом. Надо помнить, что многие безрецептурные пищевые добавки содержат железо в достаточно большой дозировке, поэтому недопустимо их бесконтрольное применение. Симптомы заболевания зависят от органа, который более всего поражен, однако почти все пациенты жалуются на значительную слабость и быструю утомляемость. Никаких специфических симптомов гемохроматоза не существует. Чаще всего диагноз ставится на стадии заболевания, когда уже пострадали несколько систем.
Однако в настоящее время выяснено, что фенотипическая экспрессия встречается лишь у приблизительно 70% гомозигот C282Y и у менее 10% из них развивается тяжелая перегрузка железом с повреждением внутренних органов [12, 13]. В таблице представлена классификация синдромов перегрузки железом в зависимости от причины его возникновения. В зависимости от причины развития заболевания пациентов с синдром перегрузки железом можно подразделить на 4 группы: пациенты с наследственным гемохроматозом, пациенты с вторичным гемохроматозом, вызванным различными причинами, и небольшая группа пациентов, которая выделяется как «разное». Причиной вторичного гемохроматоза является эритропоэтический гемохроматоз. Наиболее часто это происходит в результате основного заболевания крови, при котором эритроциты имеют сокращенную продолжительность жизни. Эта группа заболеваний включает в себя железодефицитную анемию, талассемию, сидеробластическую анемию, хроническую гемолитическую анемию, апластическую анемию, пиридоксин-чувствительную анемию, недостаточность пируваткиназы. Синдром перегрузки железом может возникнуть у пациентов, которые получают длительные и множественные переливания эритроцитарной массы. Как видно из таблицы, другие достаточно редкие заболевания, такие как, например, порфирия, также могут вызвать синдром перегрузки железом. Наконец, чрезмерное потребление железа может вызвать гемохроматоз. Известный исторический факт: употребление пива, приготовленного в стальных барабанах, явилось причиной синдрома перегрузки железом. Также передозировка препаратами железа может стать причиной синдрома перегрузки железом. Надо помнить, что многие безрецептурные пищевые добавки содержат железо в достаточно большой дозировке, поэтому недопустимо их бесконтрольное применение. Симптомы заболевания зависят от органа, который более всего поражен, однако почти все пациенты жалуются на значительную слабость и быструю утомляемость. Никаких специфических симптомов гемохроматоза не существует. Чаще всего диагноз ставится на стадии заболевания, когда уже пострадали несколько систем. От первых симптомов заболевания до верификации диагноза проходит обычно не менее десяти лет. У женщин с гемохроматозом симптомы заболевания проявляются в более позднем возрасте, чем у мужчин, из-за менструальной кровопотери, потери «материнского железа» во время беременности и антиоксидантным эффектом эстрогена, и заболевание до наступления климактерического периода клинически ничем себя не проявляет [14]. Приблизительно у 50% у пациентов с симптомами наследственного гемохроматоза наблюдается сахарный диабет, риск его возникновения значительно возрастает у гетерозигот. Цирроз печени присутствует у 70% пациентов с гемохроматозом. В этой группе пациентов заметно повышается частота гепатоцеллюлярной карциномы, которая является основной причиной смерти. Поражение суставов при гемохроматозе проявляется в виде артралгии (обычно второго и третьего метакарпофангеанских суставов). Деформации суставов при гемохроматозе обычно не наступает, хотя возможны дегенеративные изменения суставов. У этих пациентов, как правило, в синовиальной жидкости можно найти кристаллы пирофосфата кальция. Для полиартрита при гемохроматозе характерно, что даже после нормализации запасов железа он может по-прежнему прогрессировать. Отложение железа в волокнах сердечной мышцы и клетках проводящей системы сердца может привести к нарушению ритма сердца и/или дилятационной кардиомиопатии, с развитием в дальнейшем сердечной недостаточности. В некоторых случаях происходит полная компенсация левожелудочковой недостаточности после нормализации уровня железа в организме [9 — 12]. При гемохроматозе возможно развитие гипогонадизма и соответственно импотенции, обусловленного гипоталамической и/или гипофизарной недостаточностью, приводящей к нарушению высвобождения гормона гонадотропина. В случаях превышения запасов железа в пять раз и более возникает гиперпигментация кожи, которая является результатом осаждения железа и меланина. Перегрузка железом макрофагов может привести к нарушению фагоцитоза и снижению иммунитета, что приводит к увеличению риска инфицирования от Listeria, Yersinia enterocolitica и Vibrio vulnificus.
От первых симптомов заболевания до верификации диагноза проходит обычно не менее десяти лет. У женщин с гемохроматозом симптомы заболевания проявляются в более позднем возрасте, чем у мужчин, из-за менструальной кровопотери, потери «материнского железа» во время беременности и антиоксидантным эффектом эстрогена, и заболевание до наступления климактерического периода клинически ничем себя не проявляет [14]. Приблизительно у 50% у пациентов с симптомами наследственного гемохроматоза наблюдается сахарный диабет, риск его возникновения значительно возрастает у гетерозигот. Цирроз печени присутствует у 70% пациентов с гемохроматозом. В этой группе пациентов заметно повышается частота гепатоцеллюлярной карциномы, которая является основной причиной смерти. Поражение суставов при гемохроматозе проявляется в виде артралгии (обычно второго и третьего метакарпофангеанских суставов). Деформации суставов при гемохроматозе обычно не наступает, хотя возможны дегенеративные изменения суставов. У этих пациентов, как правило, в синовиальной жидкости можно найти кристаллы пирофосфата кальция. Для полиартрита при гемохроматозе характерно, что даже после нормализации запасов железа он может по-прежнему прогрессировать. Отложение железа в волокнах сердечной мышцы и клетках проводящей системы сердца может привести к нарушению ритма сердца и/или дилятационной кардиомиопатии, с развитием в дальнейшем сердечной недостаточности. В некоторых случаях происходит полная компенсация левожелудочковой недостаточности после нормализации уровня железа в организме [9 — 12]. При гемохроматозе возможно развитие гипогонадизма и соответственно импотенции, обусловленного гипоталамической и/или гипофизарной недостаточностью, приводящей к нарушению высвобождения гормона гонадотропина. В случаях превышения запасов железа в пять раз и более возникает гиперпигментация кожи, которая является результатом осаждения железа и меланина. Перегрузка железом макрофагов может привести к нарушению фагоцитоза и снижению иммунитета, что приводит к увеличению риска инфицирования от Listeria, Yersinia enterocolitica и Vibrio vulnificus. Отложение железа в щитовидной железе обычно вызывает гипотиреоз. Для развернутой стадии гемохроматоза характерно наличие цирроза печени, сахарного диабета и пигментации кожи (так называемый бронзовый диабет). У пациентов, злоупотребляющих алкоголем и инфицированных гепатитом вируса В и/или С, патология печени и поджелудочной железы, связанная с гемохроматозом, протекает значительно тяжелее [1-3]. На схеме представлены диагностические мероприятия при подозрении на гемохроматоз. Известно, что только около 70% гомозигот C282Y имеют повышенный уровень ферритина, который соответствует увеличению запасов железа, и лишь у небольшого процента этих пациентов имеются клинические проявления заболевания. Безусловно, все пациенты с симптомами, которые могут наблюдаться при гемохроматозе, должны проходить дальнейшее обследование для исключения заболевания. Особое внимание необходимо уделять пациентам с немотивированной слабостью, артралгией, болевым синдромом в правом верхнем квадранте живота, импотенцией, снижением либидо, синдромом сердечной недостаточности, пигментацией кожи, наличием диабета. Кроме того, у всех пациентов с гепатомегалией, цитолитическим синдромом, при цирротической стадии заболевания необходимо кроме всех возможных этиологических причин заболевания помнить о возможности гемохроматоза. Безусловно, наследственный гемохроматоз должен быть исключен у больных, имеющих родственников I степени родства страдающих гемохроматозом. Исследование должно начинаться с измерения насыщения сывороточного трансферрина или концентрации ферритина в сыворотке крови. Следует отметить, что определение трансферрина в случаях эритропоэтического гемохроматоза не столь эффективно для верификации синдрома перегрузки железом. Специфичность ферритина во многом зависит от наличия воспалительных заболеваний. Если уровень ферритина выше 200 мкг/л у женщин или 300 мкг/л у мужчин или насыщение трансферрина более 40% у женщин или 50% у мужчин, необходимо провести дальнейшее тестирование для исключения гемохроматоза [1, 2, 10, 11].
Отложение железа в щитовидной железе обычно вызывает гипотиреоз. Для развернутой стадии гемохроматоза характерно наличие цирроза печени, сахарного диабета и пигментации кожи (так называемый бронзовый диабет). У пациентов, злоупотребляющих алкоголем и инфицированных гепатитом вируса В и/или С, патология печени и поджелудочной железы, связанная с гемохроматозом, протекает значительно тяжелее [1-3]. На схеме представлены диагностические мероприятия при подозрении на гемохроматоз. Известно, что только около 70% гомозигот C282Y имеют повышенный уровень ферритина, который соответствует увеличению запасов железа, и лишь у небольшого процента этих пациентов имеются клинические проявления заболевания. Безусловно, все пациенты с симптомами, которые могут наблюдаться при гемохроматозе, должны проходить дальнейшее обследование для исключения заболевания. Особое внимание необходимо уделять пациентам с немотивированной слабостью, артралгией, болевым синдромом в правом верхнем квадранте живота, импотенцией, снижением либидо, синдромом сердечной недостаточности, пигментацией кожи, наличием диабета. Кроме того, у всех пациентов с гепатомегалией, цитолитическим синдромом, при цирротической стадии заболевания необходимо кроме всех возможных этиологических причин заболевания помнить о возможности гемохроматоза. Безусловно, наследственный гемохроматоз должен быть исключен у больных, имеющих родственников I степени родства страдающих гемохроматозом. Исследование должно начинаться с измерения насыщения сывороточного трансферрина или концентрации ферритина в сыворотке крови. Следует отметить, что определение трансферрина в случаях эритропоэтического гемохроматоза не столь эффективно для верификации синдрома перегрузки железом. Специфичность ферритина во многом зависит от наличия воспалительных заболеваний. Если уровень ферритина выше 200 мкг/л у женщин или 300 мкг/л у мужчин или насыщение трансферрина более 40% у женщин или 50% у мужчин, необходимо провести дальнейшее тестирование для исключения гемохроматоза [1, 2, 10, 11]. Согласно рекомендациям Американской ассоциации по изучению болезней печени 2011 г. (AASLD 2011) в случае, если у пациентов сывороточный трансферрин <45% и нормальный уровень ферритина, то диагностический поиск должен быть прекращен, данных за гемохроматоз нет. В тех случаях, когда сывороточный трансферрин ≥45% и/или увеличен уровень ферритина в сыворотке крови, то продолжается диагностический поиск [3]. Следующим шагом диагностических мероприятий является генетическое исследование — определение HFE генотипа. При выявлении гомозиготы (С288Y/C288Y) диагноз наследственного гемохроматоза подтвержден. Эта форма в основном присутствует в популяциях североевропейского происхождения, где один из 200-300 человек гомозиготы [15]. Хотя распространенность гомозиготности для мутации C282Y высока, пенетрация болезни относительно низкая. По мнению различных авторов, в среднем у 1-33% гомозигот развиваются клинические проявления заболевания, связанные с перегрузкой железом [15-18]. Затем для верификации диагноза и определения тактики ведения пациента необходимо оценить уровень активности аминотрансфераз и концентрации ферритина в сыворотке крови (<1000 мг/л и/или >1000 мг/л), и в зависимости от этих показателей принимается решение о терапевтической тактике и необходимости проведения пункционной биопсии печени (см. схему). У пациентов при сочетании гетерозигот C288Y/H63D, а также C288Y гетерозигот или не C288Y — необходимо тщательное исключение других заболеваний печени или крови (при необходимости проведение пункционной биопсии печени) и затем принимается решение о лечебных кровопусканиях. Нет достоверных доказательств того, что те или иные диеты влияют на возникновение или прогрессирование гемохроматоза. Однако некоторые авторы считают, что больным наследственным гемохроматозом показана диета с исключением чая и цитрусовых, которые, по их мнению, способствуют накоплению железа [19]. Безусловно, больным гемохроматозом должен быть строго запрещен алкоголь, который является основным гепатотоксичным веществом.
Согласно рекомендациям Американской ассоциации по изучению болезней печени 2011 г. (AASLD 2011) в случае, если у пациентов сывороточный трансферрин <45% и нормальный уровень ферритина, то диагностический поиск должен быть прекращен, данных за гемохроматоз нет. В тех случаях, когда сывороточный трансферрин ≥45% и/или увеличен уровень ферритина в сыворотке крови, то продолжается диагностический поиск [3]. Следующим шагом диагностических мероприятий является генетическое исследование — определение HFE генотипа. При выявлении гомозиготы (С288Y/C288Y) диагноз наследственного гемохроматоза подтвержден. Эта форма в основном присутствует в популяциях североевропейского происхождения, где один из 200-300 человек гомозиготы [15]. Хотя распространенность гомозиготности для мутации C282Y высока, пенетрация болезни относительно низкая. По мнению различных авторов, в среднем у 1-33% гомозигот развиваются клинические проявления заболевания, связанные с перегрузкой железом [15-18]. Затем для верификации диагноза и определения тактики ведения пациента необходимо оценить уровень активности аминотрансфераз и концентрации ферритина в сыворотке крови (<1000 мг/л и/или >1000 мг/л), и в зависимости от этих показателей принимается решение о терапевтической тактике и необходимости проведения пункционной биопсии печени (см. схему). У пациентов при сочетании гетерозигот C288Y/H63D, а также C288Y гетерозигот или не C288Y — необходимо тщательное исключение других заболеваний печени или крови (при необходимости проведение пункционной биопсии печени) и затем принимается решение о лечебных кровопусканиях. Нет достоверных доказательств того, что те или иные диеты влияют на возникновение или прогрессирование гемохроматоза. Однако некоторые авторы считают, что больным наследственным гемохроматозом показана диета с исключением чая и цитрусовых, которые, по их мнению, способствуют накоплению железа [19]. Безусловно, больным гемохроматозом должен быть строго запрещен алкоголь, который является основным гепатотоксичным веществом. Кроме того, было доказано, что этанол снижает синтез гепсидина [20, 21]. Терапией выбора при первичном гемохроматозе является кровопускание. Уменьшая количество эритроцитов, которые являются основным мобилизатором железа в организме, тем самым уменьшается и сводится к минимуму токсическое действие железа. Пациентам может потребоваться 50-100 кровопусканий в год по 500 мл каждый, чтобы снизить уровень железа до нормы. Как только уровень железа нормализуется, требуется пожизненное, но менее частое кровопускание, обычно 3-4 раза в год. Цель кровопускания состоит в поддержании уровня ферритина на значениях 50-100 мкг/л. В случаях значительного снижения гемоглобина после проведения кровопускания, целесообразно совместное лечение с эритропоэтином. Если гемохроматоз обнаружен на ранней стадии заболевания, лечение кровопусканием может предотвратить дисфункцию пораженных органов и тем самым увеличить продолжительность жизни больного. Тем не менее, пациенты редко живут более двух лет после постановки диагноза, в случаях поздней диагностики на стадии развернутых клинических проявлений [22, 23]. Согласно Европейской ассоциации по изучению печени (EASL 2010) показанием к лечебному кровопусканию является повышенный уровень ферритина в сыворотке крови. Рекомендовано проведение лечебного кровопускания объемом 400-500 мл 1 раз в неделю или 1 раз в 2 недели до достижения уровня ферритина <300 мкг/л. Затем проводится пожизненное поддерживающее кровопускание, уровень ферритина рекомендован <50 мкг/л [1]. Гадлайн Американской ассоциации по изучению болезней печени 2011 г. (AASLD 2011) рекомендует начинать терапию при повышенном уровне ферритина у пациентов с наличием или без клинических признаков заболевания. Рекомендовано проведение кровопусканий по 500 мл 1 или 2 раза в неделю до достижения целевого уровня ферритина 50-100 мкг/л, и затем данный уровень ферритина необходимо поддерживать пожизненно [3]. Альтернативными методами лечения являются хелатирующие препараты, которые рекомендованы в тех случаях, когда кровопускания по тем или иным причинам невозможны и обычно не рекомендованы при наследственном гемохроматозе.
Кроме того, было доказано, что этанол снижает синтез гепсидина [20, 21]. Терапией выбора при первичном гемохроматозе является кровопускание. Уменьшая количество эритроцитов, которые являются основным мобилизатором железа в организме, тем самым уменьшается и сводится к минимуму токсическое действие железа. Пациентам может потребоваться 50-100 кровопусканий в год по 500 мл каждый, чтобы снизить уровень железа до нормы. Как только уровень железа нормализуется, требуется пожизненное, но менее частое кровопускание, обычно 3-4 раза в год. Цель кровопускания состоит в поддержании уровня ферритина на значениях 50-100 мкг/л. В случаях значительного снижения гемоглобина после проведения кровопускания, целесообразно совместное лечение с эритропоэтином. Если гемохроматоз обнаружен на ранней стадии заболевания, лечение кровопусканием может предотвратить дисфункцию пораженных органов и тем самым увеличить продолжительность жизни больного. Тем не менее, пациенты редко живут более двух лет после постановки диагноза, в случаях поздней диагностики на стадии развернутых клинических проявлений [22, 23]. Согласно Европейской ассоциации по изучению печени (EASL 2010) показанием к лечебному кровопусканию является повышенный уровень ферритина в сыворотке крови. Рекомендовано проведение лечебного кровопускания объемом 400-500 мл 1 раз в неделю или 1 раз в 2 недели до достижения уровня ферритина <300 мкг/л. Затем проводится пожизненное поддерживающее кровопускание, уровень ферритина рекомендован <50 мкг/л [1]. Гадлайн Американской ассоциации по изучению болезней печени 2011 г. (AASLD 2011) рекомендует начинать терапию при повышенном уровне ферритина у пациентов с наличием или без клинических признаков заболевания. Рекомендовано проведение кровопусканий по 500 мл 1 или 2 раза в неделю до достижения целевого уровня ферритина 50-100 мкг/л, и затем данный уровень ферритина необходимо поддерживать пожизненно [3]. Альтернативными методами лечения являются хелатирующие препараты, которые рекомендованы в тех случаях, когда кровопускания по тем или иным причинам невозможны и обычно не рекомендованы при наследственном гемохроматозе. Безусловно, целевая концентрация ферритина ниже 50-100 мкг/л ассоциирована с высоким риском развития анемии и требует использования хелатирующих препаратов. Deferasirox — новый хелатирующий препарат, показавший свою эффективность при наследственном гемохроматозе, однако высокая цена и гепато- и нефротоксичность значительно снижают спектр его применения [24]. Еще одним методом терапии гемохроматоза является эритроцитоферез, однако он не получил широкого распространения из-за высокой стоимости и меньшей эффективности в сравнении с кровопусканием [23]. В некоторых работах продемонстрировано, что 80% пациентов предпочли эритроцитоферез вместо флеботомии. Уменьшение количества процедур кровопускания с помощью эритроцитофереза также может оказать положительное влияние на соблюдение продолжительного поддерживающего лечения [25]. В настоящее время разрабатываются такие методы терапии, как мини-гепсидин, агонист BMP6 и антагонист TMPRSS6, которые, возможно, будут доступны по стоимости терапии, не будут иметь серьезных побочных эффектов и будут использоваться для терапии наследственного гемохроматоза. В заключение приводим собственное клиническое наблюдение. Больная К., 1958 г. р., обратилась за консультацией в 2015 г. по поводу немотивированной слабости, повышенной утомляемости, которые беспокоят пациентку на протяжении около 10 лет. С 2007 г. (с 49 лет) при многократном амбулаторном и стационарном обследовании выявлен цитолитический синдром с повышением аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) от 2 до 4 норм. Другие биохимические показатели крови: билирубин, креатинфосфокиназа (КФК), холестерин, липопротеиды высокой плотности (ЛПВП), щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП), сахар крови и др. всегда были в норме. Пациентке проводилось обследование — исключены вирусный гепатит В, С, D — HBsAg, anti-HCV, HBV-ДНК и HCV-РНК многократно отрицательные. Маркеры аутоиммунных заболеваний печени ANA, AMA-M2 , LKM-1, LC-1, SLA/LP и пр. не выявлены также при многократном обследовании.
Безусловно, целевая концентрация ферритина ниже 50-100 мкг/л ассоциирована с высоким риском развития анемии и требует использования хелатирующих препаратов. Deferasirox — новый хелатирующий препарат, показавший свою эффективность при наследственном гемохроматозе, однако высокая цена и гепато- и нефротоксичность значительно снижают спектр его применения [24]. Еще одним методом терапии гемохроматоза является эритроцитоферез, однако он не получил широкого распространения из-за высокой стоимости и меньшей эффективности в сравнении с кровопусканием [23]. В некоторых работах продемонстрировано, что 80% пациентов предпочли эритроцитоферез вместо флеботомии. Уменьшение количества процедур кровопускания с помощью эритроцитофереза также может оказать положительное влияние на соблюдение продолжительного поддерживающего лечения [25]. В настоящее время разрабатываются такие методы терапии, как мини-гепсидин, агонист BMP6 и антагонист TMPRSS6, которые, возможно, будут доступны по стоимости терапии, не будут иметь серьезных побочных эффектов и будут использоваться для терапии наследственного гемохроматоза. В заключение приводим собственное клиническое наблюдение. Больная К., 1958 г. р., обратилась за консультацией в 2015 г. по поводу немотивированной слабости, повышенной утомляемости, которые беспокоят пациентку на протяжении около 10 лет. С 2007 г. (с 49 лет) при многократном амбулаторном и стационарном обследовании выявлен цитолитический синдром с повышением аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) от 2 до 4 норм. Другие биохимические показатели крови: билирубин, креатинфосфокиназа (КФК), холестерин, липопротеиды высокой плотности (ЛПВП), щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП), сахар крови и др. всегда были в норме. Пациентке проводилось обследование — исключены вирусный гепатит В, С, D — HBsAg, anti-HCV, HBV-ДНК и HCV-РНК многократно отрицательные. Маркеры аутоиммунных заболеваний печени ANA, AMA-M2 , LKM-1, LC-1, SLA/LP и пр. не выявлены также при многократном обследовании. Циркулирующие иммунные комплексы (ЦИК) не найдены. Общий белок, уровень гамма-глобулинов всегда находились в норме. Пациентка никогда не злоупотребляла и не злоупотребляет алкоголем. Лекарственные препараты и биологически активные добавки не принимала. При многократных ультразвуковых исследованиях (УЗИ) органической патологии не выявлено. Так, при УЗИ органов брюшной полости от 22.04.2015: печень — контуры ровные, четкие. Эхоструктура усилена незначительно, гомогенная, признаков холангита нет. Размеры в норме — кранио-каудальный (ККР) размер левой доли — 8,7 см, косой вертикальный размер (КВР) правой доли- 13,1 см. Воротная вена 1,2 см, не расширена. Брюшной отдел аорты 1,6-1,7 см, не расширен. Со стороны билиарного тракта и желчного пузыря изменений не найдено. Поджелудочная железа — контуры ровные. Эхоструктура усилена незначительно, размеры головки 2,3 см, хвоста 1,3 см. Почки, селезенка без изменений. Заключение: незначительные диффузные изменения паренхимы печени и поджелудочной железы. 30.04.2015 проведена магниторезонансная томография (МР-томография) органов брюшной полости и забрюшинного пространства в аксиальной, сагиттальной и фронтальной плоскостях с шагом сканирования 4-5 мм. Заключение: гепатомегалия на фоне выраженных диффузных дистрофических изменений паренхимы печени преимущественно по типу фиброзно-склеротических, нельзя исключить болезни накопления. Умеренные дистрофические изменения паренхимы поджелудочной железы. Проведена фиброэластометрия печени — фиброз 1-й степени (FibroScan, Metavir 6,6 кПа). При осмотре состояние удовлетворительное, сознание ясное, положение активное. Пациентка правильного телосложения, нормального питания (индекс массы тела — ИМТ — 25 кг/м2). Периферических отеков нет. Кожные покровы темного цвета, периферические лимфатические узлы не пальпируются. Со стороны дыхательной, сердечно-сосудистой, мочеполовой и других систем патологии не выявлено. Живот мягкий, при пальпации безболезненный. Печень по краю реберного края, эластической консистенции, безболезненная при пальпации.
Циркулирующие иммунные комплексы (ЦИК) не найдены. Общий белок, уровень гамма-глобулинов всегда находились в норме. Пациентка никогда не злоупотребляла и не злоупотребляет алкоголем. Лекарственные препараты и биологически активные добавки не принимала. При многократных ультразвуковых исследованиях (УЗИ) органической патологии не выявлено. Так, при УЗИ органов брюшной полости от 22.04.2015: печень — контуры ровные, четкие. Эхоструктура усилена незначительно, гомогенная, признаков холангита нет. Размеры в норме — кранио-каудальный (ККР) размер левой доли — 8,7 см, косой вертикальный размер (КВР) правой доли- 13,1 см. Воротная вена 1,2 см, не расширена. Брюшной отдел аорты 1,6-1,7 см, не расширен. Со стороны билиарного тракта и желчного пузыря изменений не найдено. Поджелудочная железа — контуры ровные. Эхоструктура усилена незначительно, размеры головки 2,3 см, хвоста 1,3 см. Почки, селезенка без изменений. Заключение: незначительные диффузные изменения паренхимы печени и поджелудочной железы. 30.04.2015 проведена магниторезонансная томография (МР-томография) органов брюшной полости и забрюшинного пространства в аксиальной, сагиттальной и фронтальной плоскостях с шагом сканирования 4-5 мм. Заключение: гепатомегалия на фоне выраженных диффузных дистрофических изменений паренхимы печени преимущественно по типу фиброзно-склеротических, нельзя исключить болезни накопления. Умеренные дистрофические изменения паренхимы поджелудочной железы. Проведена фиброэластометрия печени — фиброз 1-й степени (FibroScan, Metavir 6,6 кПа). При осмотре состояние удовлетворительное, сознание ясное, положение активное. Пациентка правильного телосложения, нормального питания (индекс массы тела — ИМТ — 25 кг/м2). Периферических отеков нет. Кожные покровы темного цвета, периферические лимфатические узлы не пальпируются. Со стороны дыхательной, сердечно-сосудистой, мочеполовой и других систем патологии не выявлено. Живот мягкий, при пальпации безболезненный. Печень по краю реберного края, эластической консистенции, безболезненная при пальпации.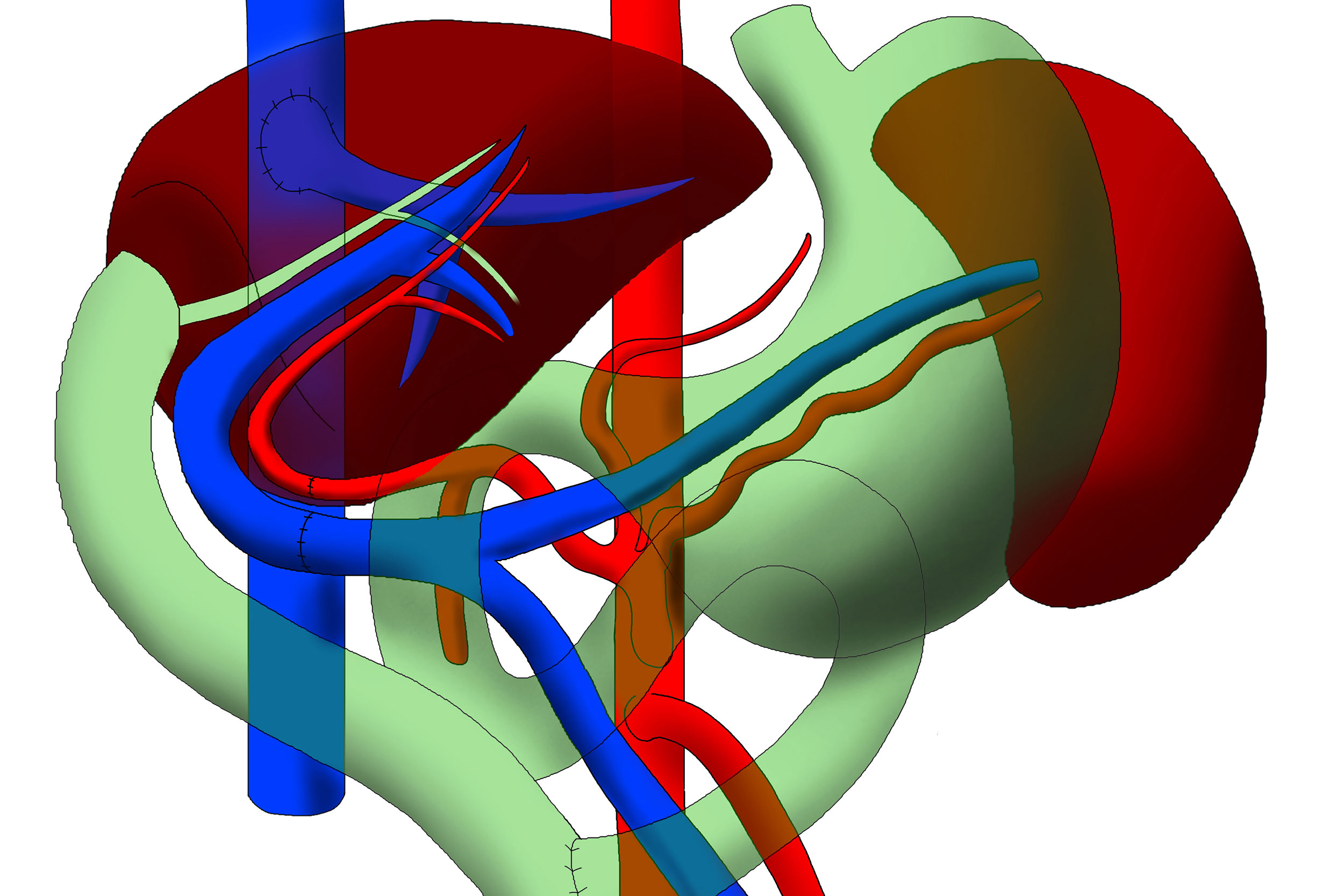 Селезенка не пальпируется. Дополнительно из анамнеза выяснено: из перенесенных заболеваний в детстве отмечает корь, скарлатину и ветряную оспу. В раннем школьном возрасте произведена тонзиллэктомия по поводу хронического тонзиллита. В 1988 г., в 30-летнем возрасте, перенесла клещевой энцефалит, без последствий. Менструальный период с 12 лет, менструации обильные по 6-7 дней. Менопауза с 48 лет, с 2006 г. Беременностей 6, 2 нормальных родов, 2 раза прерывала беременность в медицинском учреждении. Одно самопроизвольное прерывание беременности с обильным кровотечением. До 2005 г. пациентка была добровольным донором крови, всего 8-9 эпизодов сдачи крови. Данные обследования — АЛТ 56 ЕД/л (1,8 норм), АСТ 48 ЕД/л (1,5 нормы), панкреатическая амилаза, общий билирубин, ГГТП, ЩФ, общий белок, триглицериды, холестерин, сахар крови, холестерин ЛПВП и холестерин липопротеидов низкой плотности (ЛПНП) в норме. Железо сыворотки крови 44,5 мкмоль/л (норма 8,95-30,43 мкмоль/л), латентная железосвязывающая способность <7,3 мкмоль/л (норма 20 — 62 мкмоль/л), трансферрин 1,86 г/л (норма 2,5-3,8 г/л), % насыщения трансферрина 95,2 % (норма 15-50 %), ферритин 1444 мкг/л (норма 10-120 мкг/л). Больная проконсультирована эндокринологом — сахарный диабет не обнаружен. Учитывая повышение сывороточного трансферрина >45% и значительное увеличение ферритина в сыворотке крови до 1444 мкг/л, диагноз гемохроматоза бесспорный. Произведен анализ образцов ДНК на выявление мутаций в гене HFE — обнаружена мутация С282Y (c.845 G > A) в гомозиготном состоянии с.845А / с.845 А. Таким образом, диагноз у больной К. — наследственный гемохроматоз, гомозиготная мутация в гене HFE (С288Y / C288Y) с преимущественным поражением печени, фиброз 1-й степени (FibroScan, Metavir 6,6 кПа). Позднее проявление и диагностика заболевания в возрасте 58 лет в 2015 г. обусловлены длительной компенсацией заболевания ввиду массовых кровопотерь за счет менструальной крови, донорства крови, кровопотерь во время прерывания беременности и родов.
Селезенка не пальпируется. Дополнительно из анамнеза выяснено: из перенесенных заболеваний в детстве отмечает корь, скарлатину и ветряную оспу. В раннем школьном возрасте произведена тонзиллэктомия по поводу хронического тонзиллита. В 1988 г., в 30-летнем возрасте, перенесла клещевой энцефалит, без последствий. Менструальный период с 12 лет, менструации обильные по 6-7 дней. Менопауза с 48 лет, с 2006 г. Беременностей 6, 2 нормальных родов, 2 раза прерывала беременность в медицинском учреждении. Одно самопроизвольное прерывание беременности с обильным кровотечением. До 2005 г. пациентка была добровольным донором крови, всего 8-9 эпизодов сдачи крови. Данные обследования — АЛТ 56 ЕД/л (1,8 норм), АСТ 48 ЕД/л (1,5 нормы), панкреатическая амилаза, общий билирубин, ГГТП, ЩФ, общий белок, триглицериды, холестерин, сахар крови, холестерин ЛПВП и холестерин липопротеидов низкой плотности (ЛПНП) в норме. Железо сыворотки крови 44,5 мкмоль/л (норма 8,95-30,43 мкмоль/л), латентная железосвязывающая способность <7,3 мкмоль/л (норма 20 — 62 мкмоль/л), трансферрин 1,86 г/л (норма 2,5-3,8 г/л), % насыщения трансферрина 95,2 % (норма 15-50 %), ферритин 1444 мкг/л (норма 10-120 мкг/л). Больная проконсультирована эндокринологом — сахарный диабет не обнаружен. Учитывая повышение сывороточного трансферрина >45% и значительное увеличение ферритина в сыворотке крови до 1444 мкг/л, диагноз гемохроматоза бесспорный. Произведен анализ образцов ДНК на выявление мутаций в гене HFE — обнаружена мутация С282Y (c.845 G > A) в гомозиготном состоянии с.845А / с.845 А. Таким образом, диагноз у больной К. — наследственный гемохроматоз, гомозиготная мутация в гене HFE (С288Y / C288Y) с преимущественным поражением печени, фиброз 1-й степени (FibroScan, Metavir 6,6 кПа). Позднее проявление и диагностика заболевания в возрасте 58 лет в 2015 г. обусловлены длительной компенсацией заболевания ввиду массовых кровопотерь за счет менструальной крови, донорства крови, кровопотерь во время прерывания беременности и родов. Обращает внимание, что от появления первых признаков заболевания до верификации диагноза прошло 8 лет! Больной с конца 2015 г. назначена терапия — кровопускание по 500 мл 1 раз в неделю. Кровопускания пациентка переносила хорошо, отмечала значительное улучшение в состоянии уже после первой процедуры. Проводился контроль общего анализа крови и ферритина крови, уровень которого постепенно снижался. Всего было проведено более 100 кровопусканий за 2 года, однако до настоящего времени целевой уровень трансферрина (100 мкг/л) достичь не удалось из-за того, что пациентка периодически пропускает процедуры, объясняя хорошим самочувствием. В настоящее время пациентка продолжает терапию, удалось ее убедить о необходимости пожизненной терапии. Таким образом, необходимо помнить, что при наличии цитолитического синдрома у пациентов в диагностический поиск должен быть включен наследственный гемохроматоз. Терапией выбора при наследственном гемохроматозе в настоящее время остается кровопускание. Вовремя начатая адекватная терапия позволяет избежать развития цирротической стадии заболевания и тем самым увеличить продолжительность жизни больных. Авторы заявляют об отсутствии конфликта интересов.
Обращает внимание, что от появления первых признаков заболевания до верификации диагноза прошло 8 лет! Больной с конца 2015 г. назначена терапия — кровопускание по 500 мл 1 раз в неделю. Кровопускания пациентка переносила хорошо, отмечала значительное улучшение в состоянии уже после первой процедуры. Проводился контроль общего анализа крови и ферритина крови, уровень которого постепенно снижался. Всего было проведено более 100 кровопусканий за 2 года, однако до настоящего времени целевой уровень трансферрина (100 мкг/л) достичь не удалось из-за того, что пациентка периодически пропускает процедуры, объясняя хорошим самочувствием. В настоящее время пациентка продолжает терапию, удалось ее убедить о необходимости пожизненной терапии. Таким образом, необходимо помнить, что при наличии цитолитического синдрома у пациентов в диагностический поиск должен быть включен наследственный гемохроматоз. Терапией выбора при наследственном гемохроматозе в настоящее время остается кровопускание. Вовремя начатая адекватная терапия позволяет избежать развития цирротической стадии заболевания и тем самым увеличить продолжительность жизни больных. Авторы заявляют об отсутствии конфликта интересов.
N B Voloshina
Novosibirsk State Medical University FGBOU in the NSMU of the Ministry of Health of Russia
M F Osipenko
Novosibirsk State Medical University FGBOU in the NSMU of the Ministry of Health of Russia
N V Litvinova
Novosibirsk State Medical University FGBOU in the NSMU of the Ministry of Health of Russia
Email: [email protected]
A N Voloshin
Novosibirsk City Clinical Hospital 2
- EASL clinical practice guidelines for HFE hemochromatosis. Journal of Hepatology. 2010; 53: 3-22. https://doi.org/10.1016/j.
 jhep.2010.03.001
jhep.2010.03.001 - Adams P, Brissot P, Powell L.W. EASL International consensus conference on haemochromatosis. Journal of Hepatology. 2000;33:487-496. https://doi.org/10.1016/s0168-8278(01)80874-6
- Bacon В.R, Adams P.C, Kowdley K.V, Powell L.W, Tavill A.S. Diagnosis and management of management of hemochromatosis: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatolog. 2011; 54: 328-343. https://doi.org/10.1002/hep.24330
- Nemeth E, Ganz T. The role of hepcidin in iron metabolism. Acta Haematologica. 2009; 122: 78-86. https://doi.org/10.1159/000243791
- Nemeth E. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004; 306: 2090-2093. https://doi.org/10.1126/science.1104742
- Ganz T. Iron homeostasis: fitting the puzzle pieces together. Cell Metabolism. 2008; 7 (4): 288-290. https://doi.org/10.1016/j.cmet.2008.03.008
- Feder J.N, Gnirke A, Thomas W, Tsuchihashi Z, Ruddy D.A, Basava A et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nature Genetics. 1996;13:399-408. https://doi.org/ 10.1038/ng0896-399
- Bardou-Jacquet E, de Tayrac M, Mosser J, Deugnier Y. GNPAT variant associated with severe iron overload in HFE hemochromatosis. Hepatology. 2015; 62 (6): 1917-1918. https://doi.org/10.1002/hep.27854
- Adams P.C, Barton J.C, Mc Laren G.D, Acton R.T, Speechley M, Mc Laren C.E et al. Screening for iron overload: lessons from the Hemochromatosis and IRon Overload Screening (HEIRS) Study. Canadian Journal of Gastroenterolgy. 2009; 23 (11): 769-772. https://doi.org/10.1155/2009/ 839308
- Adams P.C, Reboussin D.M, Barton J.C, Mc Laren C.E, Eckfeldt J.H, Mc Laren G.D et al. Hemochromatosis and iron — overload screening in a racially diverse population.
 New England Journal of Medicine. 2005; 352(17): 1769-1778. https://doi.org/10.1056/nejmoa041534
New England Journal of Medicine. 2005; 352(17): 1769-1778. https://doi.org/10.1056/nejmoa041534 - Philippe M.A. Role of iron in hepatic fibrosis: one piece in the puzzle. World J Gastroenterol. 2007; 13 (35):4746. https://doi.org/10.3748/ wjg.v13.i35.4746
- Allen K.J et al. Iron — overload — related disease in HFE hereditary hemo — chromatosis. New England Journal of Medicine. 2008; 358 (21): 2293-2295. https://doi.org/10.1056/nejmc080330
- Asberg A, Hveem K, Thorstensen K. Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of 65,238 persons. Scand J Gastroenterol. 2001;36(10):1108-1115. https://doi.org/10.1080/003655201750422747
- Warne C.D, Zaloumis S.G, Bertalli N.A, Delatycki M.B et al. HFE p.C282Y homozygosity predisposes to rapid serum ferritin rise after menopause: A genotype — stratified cohort study of hemochromatosis in Australian women. J Gastroenterol Hepatol. 2017; 32 (4): 797-802. https://doi.org/10.1111/jgh.13621
- Powell L.W, Seckington R.C, Deugnier Y. Haemochromatosis. Lancet. 2016; 388(10045): 706-716. https://doi.org/10.1016/s0140-6736(15) 01315-x
- Wood M.J, Crawford D.H.G, Wockner L.F, Powell L.W, Ramm G.A. Serum ferritin concentration predicts hepatic fibrosis better than hepatic iron concentration in human HFE-Haemochromatosis. Liver International. 2017; 37(9): 1382-1388. https://doi.org/10.1111/liv.13395
- Allen K.J, Gurrin L.C, Constantine C.C et al. Iron — overload — disease in HFE hereditary hemochromatosis. New England Journal of Medicine. 2008; 358 (21): 2293-2295. https://doi.org/10.1056/nejmc080330
- Allen K.J et al. HFE C282Y homozygotes with serum ferritin concentrations below 1000 lg/l are et low risk of hemochromatosis. Hepatology. 2010; 52 (3): 925-933. https://doi.org/10.1002/hep.23786
- Moretti D, van Doorn G.
 M, Swinkels D.W, Melse-Boonstra A. Relevance of dietary iron intake and bioavailability in the management of HFE hemochromatosis: a systematic review. American Journal of Clinical Nutricion. 2013; 98 (2): 468-479. https://doi.org/10.3945/ ajcn.112.048264
M, Swinkels D.W, Melse-Boonstra A. Relevance of dietary iron intake and bioavailability in the management of HFE hemochromatosis: a systematic review. American Journal of Clinical Nutricion. 2013; 98 (2): 468-479. https://doi.org/10.3945/ ajcn.112.048264 - Harrison-Findik D.D, Schafer D, Klein E et al. Alcohol metabolism — mediated oxidative stress down — regulates hepcidin transcription and leads to increased duodenal iron transporter expression. Journal of Biological Chemistry. 2006; 281 (32): 22974-22982. https://doi.org/10.1074/ jbc.m602098200
- Harrison-Findik D.D, Klein E, Crist C, Evans J, Timchenko N, Gollan J. Iron — mediated regulation of liver hepcidin expression in rats and mice is abolished by alcohol. Hepatology. 2007;46(6):1979-1985. https://doi.org/10.1002/hep.21895
- Delatycki M.B, Gurrin L.C, Ong S.Y et al. Reduced mortality due to phlebotomy in moderately iron — loaded HFE haemochromatosis? The need for clinical trials. Journal of Hepatology. 2015;63(1):282-283. https://doi.org/10.1016/j.jhep.2015.03.028
- Stefashyna O, Stern M, Infanti L, Holbro A et al. Pattern of care of blood donors with early — uncomplicated hereditary haemochromatosis in a Swiss blood donation centre. Vox Sanguinis. 2013;106(2):111-117. https://doi.org/10.1111/vox.12078
- Phatak P, Brissot P, Wurster M et al. A phase 1/2, dose — escalation trial of deferasirox for the treatment of iron overload in HFE-related hereditary hemochromatosis. Hepatology. 2010;52(5):1671-1779. https://doi.org/ 10.1002/hep.23879
- Rombout-Sestrienkova E, van Kraaij M.G.J, Koek G.H. How we manage patients with hereditary haemochromatosis. British Journal of Haematology. 2016; 175(5): 759-770. https://doi.org/10.1111/bjh.14376
Views
Abstract — 550
PDF (Russian) — 55
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.

Страница статьи : Клиническая медицина
Лопаткина Т.Н. Наследственный гемохроматоз. В кн.: Руководство по гастроэнтерологии / Под ред. Ф.И. Комарова, С.И. Рапопорта. М.: 2010: 583-7.
Циммерман Я.С., Циммерман И.Я. Классификации гастроэнтерологических заболеваний и клинических синдромов. 4е изд. Пермь; 2014: 133-5.
Leiber B., Olbrich G. Die klinischen Syndrome. München; Berlin; Wien; 1963.
Подымова С.Д. Болезни печени: Руководство для врачей. 4е изд. М.; 2005: 556-66.
Berk J.E., Priest R.J. Hemochromatosi.s In: Bockus H.L. Gastroenterology. 2-nd Ed. Philadelphia; London; 1966; Vol. 3: 403-19.
Баев А.А., Павлов Ч.С., Маевская М.В. и др. Последние достижения в диагностике наследственного гемохроматоза. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2003; (6): 4-10.
Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Пер. с англ. М.; 1999.
Ференци П. Гемохроматоз и болезнь Вильсона. Российский журнал гастроэнтерологии, гепатологтт и колопроктологии. 2001; (4): 64-5.
Vierling J.M. Epidemiology and clinical course of liver disease: Identification of candidates for hepatic transplantation. Hepatology.1984; 4: 845-945.
Майер К.-П. Гепатит и последствия гепатита: Пер. с нем. М.; 1999: 261-73.
Kuntz E., Kuntz H.-D. Diseases of Liver and Biliary System. 10th Ed. Oxford; London; 1997.
Feder J.N. A novel MHS class I-line gene is mutated in patients with hereditary hemochromatosis. Nat. Genet. 1996; 13: 399-408.
Gross C.N. Co-trafficking in HFE, a nonclassical maior histocompatibility complex class-1 protein with the transferrin receptor implies a role in intracellular iron regulation. J. Biol. Chem. 1998; 273: 22068-74.
Parkkila S. Association of the transferrin receptor in human placenta with HFE the protein defective in hereditary hemochromatosis. Proc. Natl. Acad. Sci. USA. 1997; 94(24): 13198-202.
Waheed A. Association of HFE-protein with transferrin receptor in crypt enterocites of human duodenum. Peoc. Natl. Acad. Sсi. USA. 1999; 96(4): 1579-84.
Peoc. Natl. Acad. Sсi. USA. 1999; 96(4): 1579-84.
Simon M. The genetic of hemochromatosis. J. Hepatol. 1988; 6: 116-8.
Roetto A., Totaro A. New mutations inactivating transferrin receptor-2 in hemochromatosis type 3. Blood. 2001; 97(9): 2555-60.
Simon M. Idiopathic hemochromatosis demonstration of recessive transmission and early detection by family HLA typing. N. Engl. J. Med. 1977; 297: 1017-21.
Ивашкин В.Т. (ред.). Болезни печени и желчевыводящих путей. М.; 2002.
Heilmeyer L., Begemann H. Blut-und Blutkrankheiten: Handbuch der inneren Medizin. Berlin; Gottingen Heilderberg; 1951.
Pipemo A., Fargion S., Alba R.D. et al. Liver damage in Italien patients with hereditary hemochromatosis in highly influenced by hepatitis B and C virus infection. J. Hepatol. 1992; 16: 364-8.
Bacon B.R. Diagnosis and management of hemochromatosis. Gastroenterology. 1997; 113: 995- 9.
Thaler H. Leberkrankheiten: Histologie, Klinik. Berlin; Heilderberg; New-York: Springer Verlag; 1982.
Edwards C.Q., Kurshner J.P. Screening for primaren hemochromatosis. N. Engl, J. Med. 1993; 387: 1616-20.
Gollan J.L. Diagnosis of hemochromatosis. Gastroenterology. 1983; 84: 418-31.
Lin E., Adams P.C. Biochemical liver profile in hemochromatosis. A curvey of 100 patients. J. Clin. Gastroenterol. 1991; 13: 316-20.
Stemmel W., Nideray C., Strohmejer G. Diagnose der primaren hemochromatose. Dtsch. Med. Wschr. 1993; 118: 227-9.
Crawford D.N. G., Halliday J.W., Ferris R.A., Powell L.W. Diagnosis of hemochromatosis in young subjects: Predictive accuracy of biochemical screening tests. Gastroenterology. 1984; 87: 628-33.
Stemmel W., Nideray C., Strohmeyer G. Therapie der hemochromatose. Dtsch. Med. Wschr. 1993; 118: 267-9.
Crawford D.N.G., Halliday J.W. Current concepts in rational therapy for hemochromatosis. Drugs. 1991; 41: 875-82.
Генотипирование HFE при гемохроматозе | Медицинский центр ЛМД
Описание
Синонимы (rus): Исследование на наследственный гемохроматоз
Синонимы (eng): Hemochromatosis genotyping
Биоматериал: Венозная кровь
Показатель(и): Мутации C282Y,H63D и S65С в гене HFE
Метод(и): Полимеразная цепная реакция
Тип контейнера и особенности преаналитики: Пробирка для гематологических исследований с EDTA, 2 мл (фиолетовая крышечка)
Первичный гемохроматоз – это системное заболевание, характеризующееся избыточным высасыванием железа (Fe) в кишечнике с его последующим отложением в органах и тканях. Наиболее часто поражаются печень, сердечная мышца, поджелудочная железа, селезенка и кожа, но подвернуться изменениям может любая система органов. Перегрузка органов железом может приводить к таким состояниям как сахарный диабет, цирроз печени, хроническая сердечная недостаточность, артропатии, эректильная дисфункция и другие. Заболевание является генетическим с аутосомно-рецессивным наследованием, самой распространенной причиной гемохроматоза являются изменения в гене HFE (гемохроматоз 1 типа). Наиболее часто встречаемые мутации в этом гене — C282Y, H63D и S65C. Около 80% случаев первичного гемохроматоза приходится на гомозиготный вариант мутации C282Y или одновременное наличие C282Y и H63D мутаций в гетерозиготном состоянии.
Наиболее часто поражаются печень, сердечная мышца, поджелудочная железа, селезенка и кожа, но подвернуться изменениям может любая система органов. Перегрузка органов железом может приводить к таким состояниям как сахарный диабет, цирроз печени, хроническая сердечная недостаточность, артропатии, эректильная дисфункция и другие. Заболевание является генетическим с аутосомно-рецессивным наследованием, самой распространенной причиной гемохроматоза являются изменения в гене HFE (гемохроматоз 1 типа). Наиболее часто встречаемые мутации в этом гене — C282Y, H63D и S65C. Около 80% случаев первичного гемохроматоза приходится на гомозиготный вариант мутации C282Y или одновременное наличие C282Y и H63D мутаций в гетерозиготном состоянии.
Необходимо учитывать, что только у небольшого числа лиц с мутациями в гене HFE развивается клиническая картина гемохроматоза и повреждения внутренних органов. Генотипирование HFE является вспомогательным исследованием для установления этиологии гемохроматоза и должно сопровождаться другими лабораторными исследованиями метаболизма железа – уровень железа, ферритина, процент насыщения трансферрина.
Когда назначается
Диагностика гемохроматоза 1 типа. Дифференциальная диагностика поражения печени. Дифференциальная диагностика системного нарушения работы органов.
Подготовка к анализу
Специальной подготовки не требуется. Исследование проводится натощак (не принимать пищу 3 часа до исследования, можно пить воду).
Интерпретация
Причинами положительного результата теста может быть:
1. Наследственный гемохроматоз 1 типа;
2. Вариант нормы при отсутствии изменений метаболизма железа и характерной симптоматики. Отсутствие изменений в гене HFE практически исключает вероятность наследственного гемохроматоза.
Список литературы
- Kowdley KV, Brown KE, Ahn J, Sundaram V. ACG Clinical Guideline: Hereditary Hemochromatosis. Am J Gastroenterol. 2019 Aug;114(8):1202-1218.
- European Association For The Study Of The Liver.
 EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol. 2010 Jul;53(1):3-22.
EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol. 2010 Jul;53(1):3-22. - Porto G, Brissot P, Swinkels DW, Zoller H, Kamarainen O, Patton S, Alonso I, Morris M, Keeney S. EMQN best practice guidelines for the molecular genetic diagnosis of hereditary hemochromatosis (HH). Eur J Hum Genet. 2016 Apr;24(4):479-95.
- Bacon BR, Adams PC, Kowdley KV, Powell LW, Tavill AS; American Association for the Study of Liver Diseases. Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011 Jul;54(1):328-43.
Наследственный гемохроматоз: MedlinePlus Genetics
Наследственный гемохроматоз — это заболевание, при котором организм усваивает слишком много железа из пищи. Избыток железа накапливается в тканях и органах организма, особенно в коже, сердце, печени, поджелудочной железе и суставах. Поскольку люди не могут увеличить выведение железа, избыток железа может перегрузить и в конечном итоге повредить ткани и органы. По этой причине наследственный гемохроматоз также называют нарушением перегрузки железом.
Ранние симптомы наследственного гемохроматоза могут включать крайнюю усталость (утомляемость), боли в суставах, боли в животе, потерю веса и потерю полового влечения.По мере ухудшения состояния у пораженных людей может развиться артрит, заболевание печени (цирроз) или рак печени, диабет, сердечные аномалии или изменение цвета кожи. На появление и тяжесть симптомов могут влиять факторы окружающей среды и образа жизни, такие как количество железа в рационе, употребление алкоголя и инфекции.
Существует четыре типа наследственного гемохроматоза, которые классифицируются в зависимости от возраста начала и других факторов, таких как генетическая причина и способ наследования.
Тип 1, наиболее частая форма заболевания, и тип 4 (также называемый болезнью ферропортина) начинаются во взрослом возрасте. У мужчин с гемохроматозом 1 или 4 типа симптомы обычно развиваются в возрасте от 40 до 60 лет, а у женщин симптомы обычно появляются после менопаузы.
Гемохроматоз 2 типа известен как заболевание с юношеским началом, поскольку симптомы часто проявляются в детстве. К 20 годам накопление железа вызывает снижение или отсутствие секреции половых гормонов. У пораженных женщин менструация обычно начинается нормально, но через несколько лет менструация прекращается.У мужчин может наблюдаться задержка полового созревания или симптомы, связанные с нехваткой половых гормонов. Если гемохроматоз 2-го типа не лечить, потенциально смертельное заболевание сердца становится очевидным к 30 годам.
Начало гемохроматоза 3-го типа обычно является промежуточным между типом 1 и 2 с симптомами, обычно начинающимися до 30 лет.
Наследственный гемохроматоз и сахарный диабет: последствия для клинической практики
Nemeth, E. et al . Гепсидин регулирует отток клеточного железа, связываясь с ферропортином и индуцируя его интернализацию. Наука 306 , 2090–2093 (2004).
CAS
Статья
Google ученый
Адамс, П. К. и Бартон, Дж. К. Гемохроматоз. Ланцет 370 , 1855–1860 (2007).
CAS
Статья
Google ученый
Пьетранджело А. Гемохроматоз: эндокринное заболевание печени. Гепатология 46 , 1291–1301 (2007).
CAS
Статья
Google ученый
Уздечка, К. Р. и др. . Нарушение регуляции гепсидина в HFE -ассоциированном гемохроматозе и печени как регуляторе гомеостаза железа в организме. Ланцет 361 , 669–673 (2003).
CAS
Статья
Google ученый
Моррисон, Э. Д. и др. . Уровень ферритина в сыворотке указывает на прогрессирующий фиброз печени у U.С. больные фенотипическим гемохроматозом. Ann. Междунар. Med. 138 , 627–633 (2003).
CAS
Статья
Google ученый
Mura, C. , Raguenes, O. & Férec, C. Анализ мутаций HFE у 711 пробандов гемохроматоза: доказательства участия S65C в легкой форме гемохроматоза. Кровь 93 , 2502–2505 (1999).
, Raguenes, O. & Férec, C. Анализ мутаций HFE у 711 пробандов гемохроматоза: доказательства участия S65C в легкой форме гемохроматоза. Кровь 93 , 2502–2505 (1999).
CAS
PubMed
Google ученый
Папаниколау, Г. и др. . Мутации в HFE2 вызывают перегрузку железом при ювенильном гемохроматозе, сцепленном с хромосомой 1q. Nat. Genet. 36 , 77–82 (2004).
CAS
Статья
Google ученый
Ли, П. Л., Бейтлер, Э., Рао, С. В. и Бартон, Дж. С. Генетические аномалии и ювенильный гемохроматоз: мутации гена HJV , кодирующего гемоявелин. Кровь 103 , 4669–4671 (2004).
CAS
Статья
Google ученый
Roetto, A. et al. . Мутантный антимикробный пептид гепсидин связан с тяжелым ювенильным гемохроматозом. Nat. Genet. 33 , 21–22 (2003).
CAS
Статья
Google ученый
Камашелла, К. и др. . Ген TFR2 мутирован при картировании нового типа гемохроматоза на 7q22. Nat. Genet. 25 , 14–15 (2000).
CAS
Статья
Google ученый
Njajou, O.T. и др. . Мутация в SLC11A3 связана с аутосомно-доминантным гемохроматозом. Nat. Genet. 28 , 213–214 (2001).
CAS
Статья
Google ученый
Андерсен, Р. В., Тибьярг-Хансен, А., Appleyard, M., Birgens, H. & Nordestgaard, B.G. Мутации гемохроматоза в общей популяции: скорость прогрессирования перегрузки железом. Кровь 103 , 2914–2919 (2004).
CAS
Статья
Google ученый
Асберг, А. и др. . Скрининг на гемохроматоз: высокая распространенность и низкая заболеваемость среди неотобранной популяции в 65 238 человек. Сканд. J. Gastroenterol. 36 , 1108–1115 (2001).
Скрининг на гемохроматоз: высокая распространенность и низкая заболеваемость среди неотобранной популяции в 65 238 человек. Сканд. J. Gastroenterol. 36 , 1108–1115 (2001).
CAS
Статья
Google ученый
Олиник, Дж. К. и др. . Популяционное исследование клинической экспрессии гена гемохроматоза. N. Engl. J. Med. 341 , 718–724 (1999).
CAS
Статья
Google ученый
Deugnier, Y. et al. . Гендерно-специфическая фенотипическая экспрессия и стратегии скрининга при C282Y-сцепленном гемохроматозе: исследование с участием 9396 французов. руб. J. Haematol. 118 , 1170–1178 (2002).
CAS
Статья
Google ученый
Бейтлер, Э., Фелитти, В. Дж., Козиол, Дж. А., Хо, Н. Дж. И Гелбарт, Т. Пенетранс 845G — & gt; Мутация наследственного гемохроматоза A (C282Y) HFE в США. Lancet 359 , 211–218 (2002).
Артикул
Google ученый
Аллен, К.J. и др. . Заболевание, связанное с перегрузкой железом, при наследственном гемохроматозе HFE . N. Engl. J. Med. 358 , 221–230 (2008).
CAS
Статья
Google ученый
Гордеук В.Р. и др. . Концентрация ферритина в сыворотке и запасы железа в организме у многоцентрового многоэтнического населения первичной медико-санитарной помощи. Am. J. Hematol. 83 , 618–626 (2008).
CAS
Статья
Google ученый
Гуррин, Л.С. и др. . Естественная история показателей сывороточного железа для гомозиготности HFE C282Y, связанной с наследственным гемохроматозом. Гастроэнтерология 135 , 1945–1952 (2008).
CAS
Статья
Google ученый
Гуррин, Л. К. и др. . HFE Гетерозиготные соединения C282Y / h363D имеют низкий риск заболеваний, связанных с гемохроматозом. Гепатология 50 , 94–101 (2009).
CAS
Статья
Google ученый
Niederau, C. и др. . Выживаемость и причины смерти пациентов с циррозом и без цирроза с первичным гемохроматозом. N. Engl. J. Med. 313 , 1256–1262 (1985).
CAS
Статья
Google ученый
Уитлок, Э. П., Гарлитц, Б. А., Харрис, Э. Л., Бейл, Т. Л., Смит, П.R. Скрининг наследственного гемохроматоза: систематический обзор для Целевой группы профилактических служб США. Ann. Междунар. Med. 145 , 209–223 (2006).
Артикул
Google ученый
Пауэлл, Л. В. и др. . Скрининг на гемохроматоз у бессимптомных субъектов с семейным анамнезом или без него. Arch. Междунар. Med. 166 , 294–301 (2006).
Артикул
Google ученый
Олиник, Ю.К., Хаган, С. Е., Каллен, Д. Дж., Бейлби, Дж. И Уиттолл, Д. Э. Эволюция нелеченого наследственного гемохроматоза в популяции Басселтона: 17-летнее исследование. Mayo Clin. Proc. 79 , 309–313 (2004).
Артикул
Google ученый
Уильямс, Р., Смит, П. М., Спайсер, Э. Дж., Барри, М. и Шерлок, С. Венесекционная терапия при идиопатическом гемохроматозе. Анализ 40 пролеченных и 18 нелеченных пациентов. Q. J. Med. 38 , 1–16 (1969).
CAS
PubMed
Google ученый
Адамс, П. К., Кертес, А. Э. и Вальберг, Л. С. Клинические проявления гемохроматоза: меняющаяся картина. Am. J. Med. 90 , 445–449 (1991).
Am. J. Med. 90 , 445–449 (1991).
CAS
Статья
Google ученый
Бэкон, Б. Р. и Садик, С. А. Наследственный гемохроматоз: проявление и диагностика в 1990-е годы. Am. J. Gastroenterol. 92 , 784–789 (1997).
CAS
PubMed
Google ученый
Булай, З. Дж. и др. . Заболевания у родственников больных гемохроматозом. N. Engl. J. Med. 343 , 1529–1535 (2000).
CAS
Статья
Google ученый
Свинкелс, Д. В., Йорна, А.T. & Raymakers, R.A. Краткое изложение голландского многопрофильного руководства по диагностике и лечению наследственного гемохроматоза. Neth. J. Med. 65 , 452–455 (2007).
CAS
PubMed
Google ученый
Олиник, Дж. К., Ган, Э. и Тан, Т. Прогнозирование перегрузки железом при гиперферритинемии. Clin. Гастроэнтерол. Гепатол. 7 , 359–362 (2009).
CAS
Статья
Google ученый
Сен-Пьер, Т.Г., Кларк, П. Р. и Чуа-Анусорн, В. Измерение и картирование концентраций железа в печени с помощью магнитно-резонансной томографии. Ann. NY Acad. Sci. 1054 , 379–385 (2005).
Артикул
Google ученый
Burke, W., Reyes, M. & Imperatore, G. Наследственный гемохроматоз: реалистичный подход к профилактике болезни, вызванной перегрузкой железом, у населения. Best Prac. & Res. Clin. Haematol. 15 , 315–328 (2002).
Артикул
Google ученый
Брэдли, Л. А., Хаддоу, Дж. Э. и Паломаки, Г. Е. Популяционный скрининг на гемохроматоз: объединяющий анализ опубликованных интервенционных исследований.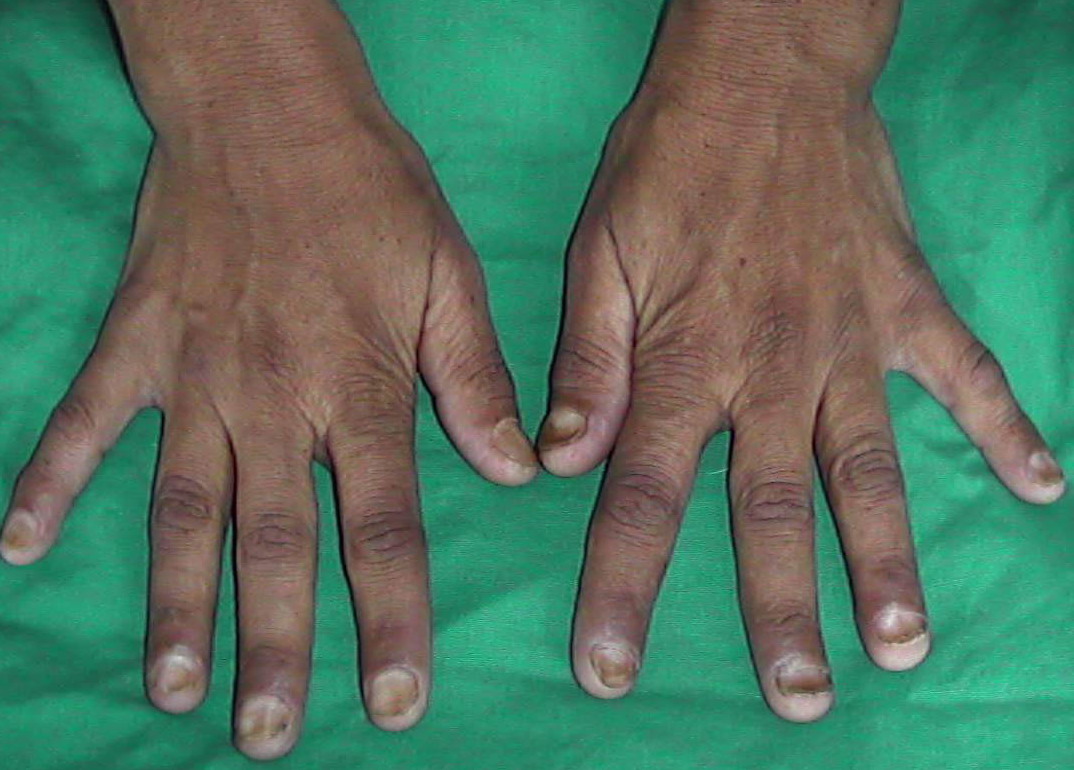 J. Med. Экран. 3 , 178–184 (1996).
J. Med. Экран. 3 , 178–184 (1996).
CAS
Статья
Google ученый
Целевая группа по профилактическим услугам США. Скрининг на гемохроматоз: изложение рекомендаций. Ann. Междунар. Med. 145 , 204–208 (2006).
Фатак П. Д., Бонковский Х. Л. и Каудли К. В. Наследственный гемохроматоз: время для целевого обследования. Ann. Междунар. Med. 149 , 270–272 (2008).
Артикул
Google ученый
Кадет, Э. и др. . Целенаправленный подход значительно увеличивает частоту выявления пациентов с недиагностированным гемохроматозом. J. Intern. Med. 253 , 217–224 (2003).
CAS
Статья
Google ученый
Тавилл А.С. Диагностика и лечение гемохроматоза. Гепатология 33 , 1321–1328 (2001).
CAS
Статья
Google ученый
Ворвуд, М. Унаследованная нагрузка железа: генетическое тестирование в диагностике и лечении. Анализ крови 19 , 69–88 (2005).
CAS
Статья
Google ученый
Нидерау, К. и др. . Долгосрочная выживаемость пациентов с наследственным гемохроматозом. Гастроэнтерология 110 , 1107–1119 (1996).
CAS
Статья
Google ученый
Fargion, S. и др. . Факторы выживаемости и прогностические факторы у 212 итальянских пациентов с генетическим гемохроматозом. Гепатология 15 , 655–659 (1992).
CAS
Статья
Google ученый
Адамс П. К., Спичли М. и Кертес А. Э. Анализ долгосрочной выживаемости при наследственном гемохроматозе. Гастроэнтерология 101 , 368–372 (1991).
CAS
Статья
Google ученый
Макклейн, Д. А. и др. .Высокая распространенность аномального гомеостаза глюкозы, вызванного снижением секреции инсулина, у лиц с наследственным гемохроматозом. Диабетология 49 , 1661–1669 (2006).
CAS
Статья
Google ученый
Даймок, И. В., Кассар, Дж., Пайк, Д. А., Окли, В. Г. и Уильямс, Р. Наблюдения за патогенезом, осложнениями и лечением диабета в 115 случаях гемохроматоза. Am.J. Med. 52 , 203–210 (1972).
CAS
Статья
Google ученый
О’Салливан, Э. П., Макдермотт, Дж. Х., Мерфи, М. С., Сен, С. и Уолш, К. Х. Снижение распространенности сахарного диабета при наследственном гемохроматозе — результат более раннего диагноза. Diabetes Res. Clin. Практика 81 , 316–320 (2008).
CAS
Статья
Google ученый
Дэвис, Т.М. и др. . Распространенность, характеристики и прогностическое значение мутаций гена HFE при диабете 2 типа: исследование диабета Фримантла. Уход за диабетом 31 , 1795–1801 (2008).
Артикул
Google ученый
Эллервик К., и др. . Распространенность наследственного гемохроматоза при сахарном диабете 1 типа с поздним началом: ретроспективное исследование. Ланцет 358 , 1405–1409 (2001).
CAS
Статья
Google ученый
Салонен, Дж. Т., Туомайнен, Т. П. и Контула, К. Роль мутации C282Y в гене гемохроматоза в развитии диабета 2 типа у здоровых мужчин: проспективное когортное исследование. BMJ 320 , 1706–1707 (2000).
CAS
Статья
Google ученый
Холсолл, Д. Дж., Макфарлейн, И., Луан, Дж., Cox, T. M. & Wareham, N.J. Типичный сахарный диабет 2 типа и мутации гена HFE : популяционное исследование случай-контроль. Гум. Мол. Genet. 12 , 1361–1365 (2003).
Дж., Макфарлейн, И., Луан, Дж., Cox, T. M. & Wareham, N.J. Типичный сахарный диабет 2 типа и мутации гена HFE : популяционное исследование случай-контроль. Гум. Мол. Genet. 12 , 1361–1365 (2003).
CAS
Статья
Google ученый
Кавалло-Перин, П. и др. . Инсулинорезистентность и гиперинсулинемия при гомозиготной бета-талассемии. Метаболизм 44 , 281–286 (1995).
CAS
Статья
Google ученый
Меркель, П.А. и др. . Инсулинорезистентность и гиперинсулинемия у пациентов с большой талассемией, леченных гипертрансфузией. N. Engl. J. Med. 318 , 809–814 (1988).
CAS
Статья
Google ученый
Дмоховски, К., Файнгуд, Д. Т., Франкомб, В., Тайлер, Б. и Зинман, Б. Факторы, определяющие толерантность к глюкозе у пациентов с большой талассемией. J. Clin. Эндокринол. Метаб. 77 , 478–483 (1993).
CAS
PubMed
Google ученый
Храмиак, И. М., Файнгуд, Д. Т. и Адамс, П. С. Факторы, влияющие на толерантность к глюкозе при наследственном гемохроматозе. Clin. Вкладывать деньги. Med. 20 , 110–118 (1997).
CAS
PubMed
Google ученый
Кукси, Р. К. и др. . Окислительный стресс, апоптоз бета-клеток и снижение секреторной способности инсулина на мышиных моделях гемохроматоза. Эндокринология 145 , 5305–5312 (2004).
CAS
Статья
Google ученый
Cighetti, G. и др. . Окислительный статус и малоновый диальдегид у пациентов с бета-талассемией. Eur. J. Clin. Вкладывать деньги. 32 (Приложение 1), 55–60 (2002).
CAS
Статья
Google ученый
Гаттеридж, Дж. М., Роули, Д. А., Гриффитс, Э. и Холливелл, Б. Комплексы с низким молекулярным весом и радикальные реакции кислорода при идиопатическом гемохроматозе. Clin. Sci. (Лондон) 68 , 463–467 (1985).
М., Роули, Д. А., Гриффитс, Э. и Холливелл, Б. Комплексы с низким молекулярным весом и радикальные реакции кислорода при идиопатическом гемохроматозе. Clin. Sci. (Лондон) 68 , 463–467 (1985).
CAS
Статья
Google ученый
Джоуихан, Х.А. и др. . Железо-опосредованное ингибирование митохондриального поглощения марганца опосредует митохондриальную дисфункцию на мышиной модели гемохроматоза. Мол.Med. 14 , 98–108 (2008).
CAS
Статья
Google ученый
Абрахам Д., Роджерс Дж., Голт П., Кушнер Дж. П. и Макклейн Д. А. Повышение секреторной способности инсулина, но снижение чувствительности к инсулину после коррекции перегрузки железом с помощью флеботомии при наследственном гемохроматозе. Диабетология 49 , 2546–2551 (2006).
CAS
Статья
Google ученый
Наследственный гемохроматоз — с доктором.Сид Барритт
Что такое наследственный гемохроматоз? Доктор Сид Барритт обсуждает эту болезнь с доктором Роном Фальком. Это генетическое заболевание заставляет излишки железа откладываться в разных частях тела. Они говорят о симптомах и способах обследования, а также о лечении наследственного гемохроматоза. Доктор Барритт — адъюнкт-профессор медицины в отделении гастроэнтерологии и гепатологии.
«Одна из проблем с наследственным гемохроматозом заключается в том, что это группа пациентов, которым часто требуется флеботомия или забор крови для снижения уровня железа.”
— Доктор Сид Барритт
Рон Фальк, MD: Здравствуйте и добро пожаловать в кабинет кафедры медицинского факультета Университета Северной Каролины. Это наша серия, в которой мы обсуждаем различные генетические заболевания с врачами, которые лечат пациентов с этими состояниями. Сегодня мы поговорим о наследственном гемохроматозе.
Мы приветствуем доктора Сида Барритта, доцента медицины нашего отделения гастроэнтерологии и гепатологии. Доктор Баррит специализируется на заболеваниях печени, в частности, на неалкогольной жировой болезни печени.Он принимает пациентов с гемохроматозом, поражающим печень, и это будет в центре нашего сегодняшнего обсуждения. Добро пожаловать, доктор Барритт.
Сид Барритт, MD: Спасибо.
Чрезмерное отложение железа
Falk: Что такое наследственный гемохроматоз? Что означают эти слова?
Barritt: Наследственный гемохроматоз — это генетическое заболевание, которое предрасполагает к чрезмерному отложению железа в организме. Организм начинает эффективно усваивать железо, но без эффективного способа избавления от лишнего железа железо будет откладываться в твердых органах, особенно в печени.
Falk: Итак, откуда вообще берется железо?
Barritt: Железо попадает в организм с пищей — диетическое железо: мясо, листовые зеленые овощи и тому подобное.
Falk: Железо можно потерять. Женщины теряют железо во время менструации. Как еще можно потерять железо?
Barritt: Ну вот и все. Кровопотеря — это единственный способ потерять железо. Кровопотеря, потеря крови со стороны желудочно-кишечного тракта, менструальный цикл — это основной способ утилизации железа в организме.Железо также образует красные кровяные тельца, но организм вырабатывает лишь определенное количество красных кровяных телец, а остальное избыточное железо откладывается в другом месте.
Falk: Таким образом, цель состоит в том, чтобы проглотить достаточное количество железа и сделать его таким, чтобы у вас было достаточно нормальных красных кровяных телец, доставляющих кислород в организм, а дополнительное железо перерабатывается печенью и избавляется от него. при нормальных обстоятельствах.
Barritt: В нормальных условиях да.В нормальных условиях организм будет усваивать только определенное количество железа, но в ситуации наследственного гемохроматоза организм, возможно, стал слишком эффективно усваивать железо. Итак, мы извлечем дополнительное железо из нашего обычного рациона, и тогда организм не будет иметь ничего общего с дополнительным железом, которое оно усвоило, и оно откладывается в печени, сердце, поджелудочной железе и других местах.
Итак, мы извлечем дополнительное железо из нашего обычного рациона, и тогда организм не будет иметь ничего общего с дополнительным железом, которое оно усвоило, и оно откладывается в печени, сердце, поджелудочной железе и других местах.
Falk: Каким образом кишечник усваивает больше железа при наследственном гемохроматозе ?
Barritt: Происходит множество генетических мутаций.Наиболее распространенной является наследственная мутация гемохроматоза HFE. Происходит то, что благодаря этой мутации организм будет поглощать больше железа, откладывать это железо в энтероциты или клетки в слизистой оболочке кишечника, и в конечном итоге эти запасы железа передаются в другие области тела, особенно в печень, в некоторых случаях сердце и поджелудочная железа тоже.
Симптомы гемохроматоза
Falk: С какими симптомами на самом деле сталкиваются пациенты с гемохроматозом?
Barritt: Многие пациенты с гемохроматозом фактически бессимптомны в течение длительного периода времени.
Falk: Другими словами, они не знают, что у них это есть.
Barritt: Они вообще не знают, что у них это есть. Симптоматическая перегрузка железом у пациентов может проявляться в зависимости от того, какие органы поражены больше всего. В некоторых ситуациях пациенты будут жаловаться на усталость, особенно если в сердце имеется избыточная перегрузка железом, вызывающая сердечную недостаточность в некоторой степени. Если у пациентов наблюдается избыточная перегрузка железом в суставах, у них может быть артрит.Избыточная перегрузка печени железом может в конечном итоге привести к образованию рубцовой ткани в печени и даже к циррозу печени. Симптомы цирроза печени широки и разнообразны и могут быть такими же легкими, как усталость, но в конечном итоге приводят к симптомам терминальной стадии заболевания печени, таким как вздутие живота, отек ног, желтуха и т. Д.
Falk: И цель — избежать этого любой ценой.
Barritt: Цель состоит в том, чтобы выявить это задолго до появления симптомов и лечить.
Falk: Есть ли изменения кожи?
Barritt: Исторически гемохроматоз был известен как «бронзовый диабет».
Железо может откладываться в самых разных местах — как мы уже упоминали ранее, в печени, сердце, поджелудочной железе. Отложение железа в поджелудочной железе может привести к дисфункции поджелудочной железы и диабету. Еще одно место, где может откладываться железо, — это кожа. Пациенты приобретают оттенок от загара до бронзового цвета кожи, что приводит к этому явлению бронзирования.Вначале «бронзовый диабет» был тем, как изначально распознавали гемохроматоз.
Наследование и тестирование гемохроматоза
Falk: Как передается гемохроматоз? Каков образец наследования?
Barritt: Тип наследования является аутосомно-рецессивным, что означает, что два родителя должны быть носителями мутации, а генетические нарушения, которые наследуются по аутосомно-рецессивному типу, означают, что два родителя-носителя имеют шанс 25%. передать одному из своих потомков оба аномальных гена, поэтому они рискуют заболеть.
Falk: Как это проверить?
Barritt: Мы можем проверить это, сначала поискав излишки железа. Поскольку это заболевание встречается относительно редко, мы не проводим тестирование генетики у всех, но обычно из-за симптомов или других стандартных тестов, которые проводятся на уровне первичной медико-санитарной помощи, у пациента могут быть проверены запасы железа.
Основной проводимый тест — ферритин. Ферритин — это мера запасов железа в организме. Это также сочетается с тестом на процентное насыщение, который является мерой того, насколько эффективно организм усваивает железо.Таким образом, если ферритин повышен, а процент насыщения железом повышен, можно провести дальнейшее тестирование для выявления наследственного гемохроматоза.
Falk: Железо, которое в периодической таблице сокращенно обозначается как «Fe» — вы можете заказать, как клиницист, железо, которое, если вы смотрите на результат теста, могло бы сказать «Fe» или «утюг. »
»
Barritt: Сыворотка железа.
Falk: Это будет один тест. Это не то, на что вы смотрите — вы смотрите на то, насколько хорошо это железо связано.
Барритт: Верно.
Falk: Что бы вы там искали, если ищете в MyChart этот номер?
Barritt: Существует панель железа, которую можно отправить, которая включает в себя уровень железа в сыворотке и нечто, называемое общей связывающей способностью железа, часто сокращенно TIBC. Отсюда процент насыщения — сколько железа на самом деле связано в крови. Обычно это меньше пятидесяти процентов. В нормальных условиях организм может усвоить только около пятидесяти процентов железа, поступающего с пищей, а во многих случаях даже меньше.В условиях наследственного гемохроматоза этот процент насыщения становится выше.
Falk: Куда это идет?
Barritt: Может доходить до ста процентов, но диагностические критерии выше пятидесяти процентов. Очень часто у людей с наследственным гемохроматозом мы наблюдаем процентное насыщение в семьдесят, восемьдесят, девяносто, девяносто девять процентов.
Falk: А ферритин, что это должно быть?
Barritt: Ферритин имеет нормальный диапазон от пятидесяти до ста пятидесяти.В зависимости от лаборатории верхний предел может быть в пределах двух сотен. Мы диагностируем чрезмерный ферритин, когда это значение превышает триста. У многих пациентов с наследственным гемохроматозом этот уровень может исчисляться тысячами.
Falk: Итак, если вы смотрите в лаборатории и видите кого-то с процентным насыщением более пятидесяти процентов, и вы видите кого-то с ферритином, который находится в сотнях или тысячах, это наводка на то, что есть проблема.
Barritt: Это отличный намек на то, что существует проблема, и отличная отправная точка для диагностики наследственного гемохроматоза.
Falk: Что происходит потом?
Barritt: Отсюда мы проводим генетическое тестирование. Наиболее частая причина наследственного гемохроматоза — мутации в гене HFE. Мы можем отправить тестирование на самые распространенные генетические мутации, которые предрасполагают людей к чрезмерной перегрузке железом. Это мутации в гене HFE.Двумя наиболее распространенными из них, которые мы можем проверить в США, являются мутация C282Y и мутация H63D. Эти буквы и цифры означают замену одной аминокислоты на другую аминокислоту в определенном локусе белка, который кодирует ген.
Наиболее частая причина наследственного гемохроматоза — мутации в гене HFE. Мы можем отправить тестирование на самые распространенные генетические мутации, которые предрасполагают людей к чрезмерной перегрузке железом. Это мутации в гене HFE.Двумя наиболее распространенными из них, которые мы можем проверить в США, являются мутация C282Y и мутация H63D. Эти буквы и цифры означают замену одной аминокислоты на другую аминокислоту в определенном локусе белка, который кодирует ген.
Это самая распространенная генетическая мутация в кавказской популяции. Примерно каждый десятый человек является носителем этой мутации HFE, но только примерно один из двухсот имеет две копии мутации, которая подвергает их риску симптоматического заболевания, но поскольку наследственный гемохроматоз, возможно, немного сложнее, чем мы полностью понимаем. На этом этапе только около десяти процентов людей с обеими копиями аномального гена будут проявлять симптоматическую клиническую перегрузку железом.
Falk: Если бы вы знали, что у вашего родителя гемохроматоз, хотели бы вы, как ребенок этого родителя, пройти генетическое тестирование?
Барритт: Да. Я думаю, это разумный поступок. Одна из проблем современной медицины состоит в том, что мы получаем много информации и не знаем, как ее использовать.
Если бы ко мне подошел молодой взрослый и сказал: «Я знаю, что оба моих родителей являются носителями», или «Я знаю, что у одного из моих родителей наследственный гемохроматоз» , мы могли бы проверить генотип этого пациента, но просто потому, что у них есть генетическая предрасположенность, не обязательно означает, что у них разовьется симптоматическое заболевание.В этой ситуации следует проверить запасы железа, посмотреть, какой у них ферритин, узнать, каков процент их насыщения, и, если оба значения нормальные или низкие, будет уместным подход с осторожным ожиданием.
Причины биопсии печени
Falk: Сейчас иногда делают биопсию печени.
Barritt: Верно.
Falk: По каким причинам вы это сделали?
Barritt: Есть две причины для биопсии печени.Показания к биопсии печени — любой человек с ферритином выше тысячи или любой человек с наследственным гемохроматозом старше пятидесяти лет. Мы знаем, что любой из этих двух факторов риска предрасполагает пациентов к увеличению рубцовой ткани в печени, если не к циррозу печени. Если мы сможем идентифицировать цирроз печени, мы будем лечить этих пациентов несколько иначе, используя различные профилактические методы лечения его осложнений.
Falk: Что бы это было?
Barritt: Ну, сначала мы хотим исключить то, что называется варикозом, поэтому, если у кого-то есть цирроз печени, у него есть риск кровотечения из аномальных кровеносных сосудов в желудке и пищеводе.Мы можем провести тестирование, чтобы найти это. Но что еще более важно в ситуации наследственного гемохроматоза, эти пациенты подвержены риску рака печени. Мы бы начали проверять механизмы выявления рака печени, чтобы выявить его на ранней стадии, пока он еще поддается лечению.
Falk: Также полезно сказать пациенту : «Погодите. У вас появляются рубцы в печени, и вы защищаете ее от других потенциальных токсинов ».
Barritt: А именно алкоголь в этой ситуации.Опять же, существует взаимосвязь между алкоголем и перегрузкой железом, которую мы не полностью понимаем. Как я упоминал ранее, только около десяти процентов пациентов с генетической предрасположенностью к перегрузке железом действительно развивают симптоматическое заболевание. Когда мы добавляем в смесь алкоголь, у таких пациентов гораздо больше шансов заболеть тяжелым заболеванием и циррозом печени.
Falk: Потому что алкогольная болезнь печени довольно распространена.
Barritt: Алкогольная болезнь печени является очень распространенным явлением, вероятно, наиболее распространенным заболеванием печени из всех существующих.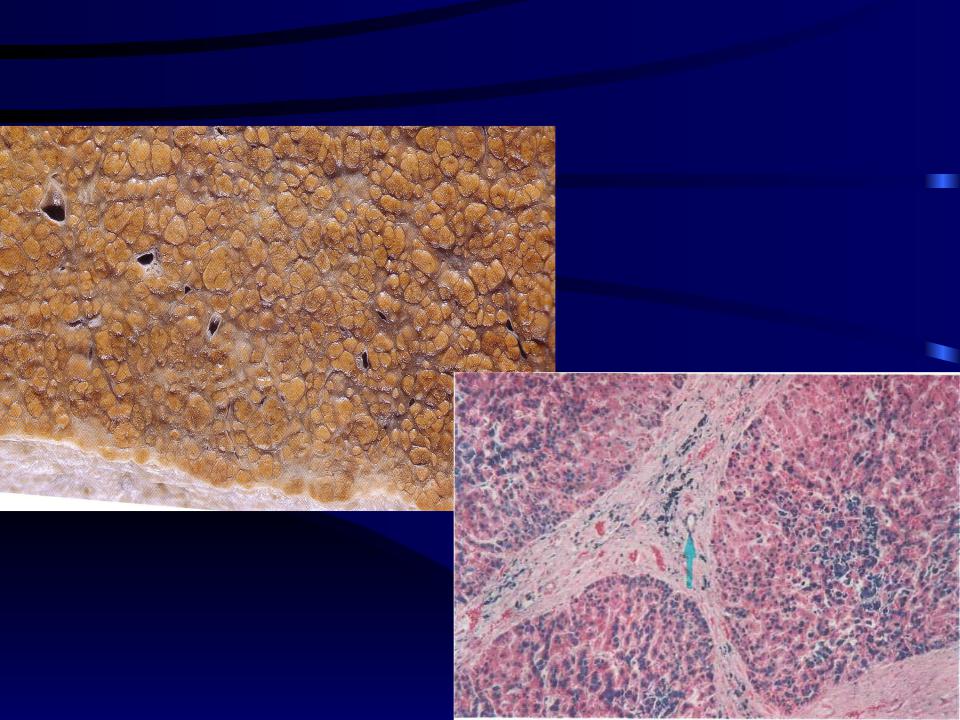 Я бы не сказал, что это самое распространенное заболевание печени, которое мы наблюдаем, потому что многие люди, страдающие расстройствами, связанными с употреблением алкоголя, не обращаются к врачу. Опять же, если мы говорим об общей генетической предрасположенности и общей социальной проблеме, когда эти два аспекта пересекаются, мы довольно часто видим их вместе.
Я бы не сказал, что это самое распространенное заболевание печени, которое мы наблюдаем, потому что многие люди, страдающие расстройствами, связанными с употреблением алкоголя, не обращаются к врачу. Опять же, если мы говорим об общей генетической предрасположенности и общей социальной проблеме, когда эти два аспекта пересекаются, мы довольно часто видим их вместе.
Falk: Полагаю, ожирение печени является дополнительным фактором риска?
Barritt: Жировая печень является дополнительным фактором риска цирроза печени, но я не могу сказать, что жирная печень предрасполагает кого-либо к наследственному гемохроматозу.Это две общие проблемы.
Falk: Но существует ли такая же взаимосвязь, как с алкогольной болезнью печени?
Barritt: Жирная печень — относительно новое явление, поскольку она становится очень распространенным диагнозом, связанным с печенью. Железо может быть частью гипотезы о двойном ударе, которая вызывает развитие жировой болезни печени. Мы можем наблюдать то, что называется вторичной перегрузкой железом при жировой болезни печени, просто из-за хронического воспаления, происходящего в печени, пациенты могут получать дополнительное количество железа в печени, не имея к этому генетической предрасположенности.Но всякий раз, когда у вас есть несколько поражений печени — будь то жировая болезнь печени, алкоголь или железо, все эти различные проблемы могут способствовать развитию рубцовой ткани и предрасполагать кого-то к циррозу.
Falk: Другими словами, если у кого-то есть жировая болезнь печени из-за ожирения, например, наличие железа при биопсии печени не обязательно указывает на наследственный гемохроматоз.
Barritt: Верно.Это отдельный вопрос. При любом хроническом заболевании печени мы видим то, что мы называем вторичной перегрузкой железом. Большая часть того, как мы проводим различие между первичным процессом перегрузки, таким как наследственный гемохроматоз, и вторичной перегрузкой железом, — это то, где мы видим железо. Итак, в процессе первичной перегрузки железом, таком как наследственный гемохроматоз, железо откладывается в гепатоцитах, нормальных клетках печени. При вторичной перегрузке железом мы видим отложение железа в других клетках печени — лейкоцитах, называемых макрофагами, в других местах в печени, что помогает нам различать первичную и вторичную перегрузку железом.
Итак, в процессе первичной перегрузки железом, таком как наследственный гемохроматоз, железо откладывается в гепатоцитах, нормальных клетках печени. При вторичной перегрузке железом мы видим отложение железа в других клетках печени — лейкоцитах, называемых макрофагами, в других местах в печени, что помогает нам различать первичную и вторичную перегрузку железом.
Лечение наследственного гемохроматоза
Falk: Что же такое лечение наследственного гемохроматоза?
Barritt: На самом деле лечение довольно простое: это флеботомия. Если организм теряет кровь —
Falk: Как древние кровотечения.
Barritt: Справа. Мы не пользуемся пиявками, банками или чем-то в этом роде, но мы отправляем людей в лабораторию для сдачи крови. Одна из проблем, связанных с наследственным гемохроматозом, заключается в том, что это группа пациентов, которым часто требуется флеботомия или забор крови для снижения уровня железа.Казалось бы, это большое население, которое может пойти сдавать кровь из альтруистических соображений. Жизнь никогда не бывает такой простой, поэтому этих пациентов часто исключают из сдачи крови, потому что некоторые из их печеночных ферментов могут быть ненормальными, и это часто первые скрининговые тесты, которые банки крови и другие места используют для исключения доноров — чтобы исключить другую печень. -связанные проблемы, такие как вирусный гепатит.
Falk: Если вы делаете повторяющиеся флеботомии, как это заставляет чувствовать себя пациент?
Barritt: Может помочь пациенту чувствовать себя нормально.Большинство симптомов наследственного гемохроматоза можно обратить вспять с истощением запасов железа при флеботомии, особенно если мы начнем это раньше, до того, как у пациента появятся чрезмерные симптомы. Один из прискорбных симптомов, который бывает сложно обратить вспять, — это артрит, который сопровождается тяжелыми случаями перегрузки железом. Итак, когда я обсуждаю терапию с пациентом, я хочу убедиться, что у меня реалистичные ожидания. Мы можем обратить вспять воспаление в печени. Мы можем вылечить диабет, но вылечить артрит зачастую гораздо труднее.
Мы можем обратить вспять воспаление в печени. Мы можем вылечить диабет, но вылечить артрит зачастую гораздо труднее.
Falk: То, что я собираю, — это раннее выявление, защита печени от алкоголя, ведение здорового образа жизни, попытки убедиться, что человеку делают флеботомию или регулярно удаляют кровь, — все это часть этого терапевтического лечения. строить планы.
Барритт: Совершенно верно. Я люблю говорить пациентам, что хорошо для сердца, хорошо для печени. Итак, поддержание здорового веса. Употребляйте алкоголь в умеренных количествах, если вообще употребляете. И доведение их железа до нормального уровня — все это куски долгосрочного успеха.Если мы сможем должным образом истощить пациента по железу, то гемохроматоз станет своего рода «второстепенным диагнозом», так сказать. Пациенты могут рассчитывать на нормальную продолжительность жизни, если болезнь выявляется на ранней стадии и отсутствуют долгосрочные изменения в печени, сердце, поджелудочной железе и так далее.
Другие формы перегрузки железом
Falk: Существуют ли другие формы перегрузки железа?
Barritt: Да, есть и другие формы перегрузки железом. В широком смысле любая наследственная перегрузка железом называется гемохроматозом.Самая распространенная форма наследственного гемохроматоза — это гемохроматоз HFE, о котором мы говорили.
Существуют и другие мутации, влияющие на метаболизм железа, которые могут вызывать перегрузку железом, и это могут быть мутации рецептора трансферрина. Это обычно проявляется немного раньше и может затронуть мужчин и женщин, это может повлиять на любую расу, и у этих пациентов развивается болезнь в возрасте от тридцати до сорока лет, тогда как при гемохроматозе HFE пациенты обычно старше пятидесяти и в постменопаузе, когда они развиваются. болезнь.
Есть ювенильная мутация, при которой у детей может развиться перегрузка железом. Здесь мы в основном видим сердечные проявления, а не печеночные проявления.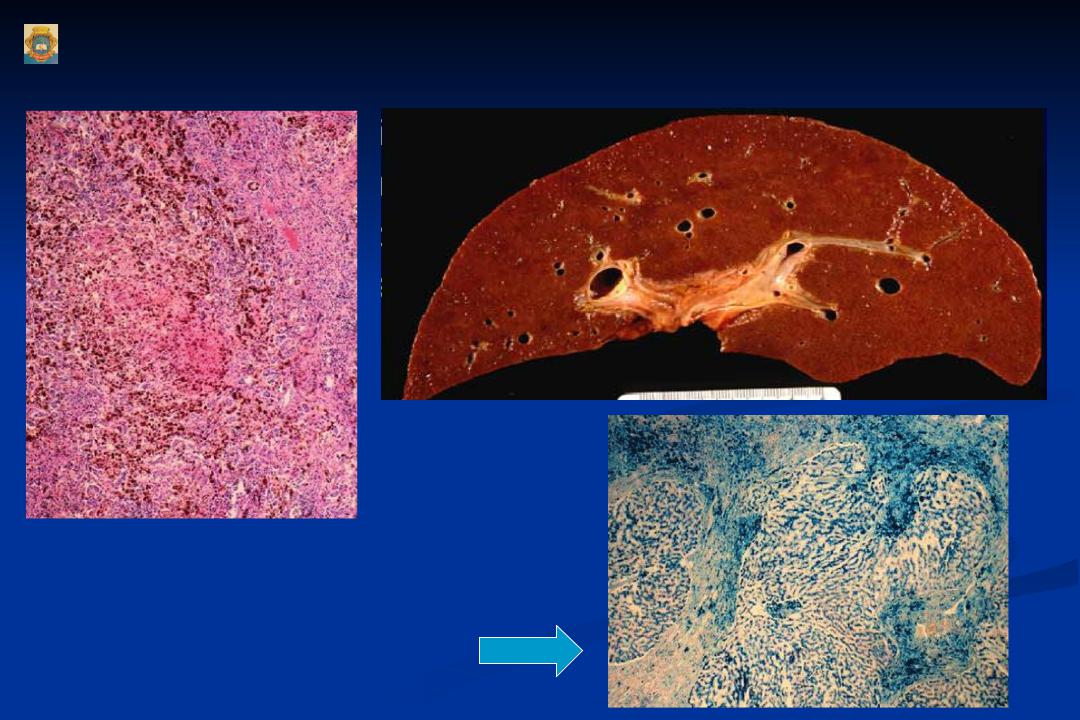
В рецепторе ферропортина есть мутация, которая может влиять на мужчин и женщин любого происхождения или расы и проявляется в возрасте от десяти до восьмидесяти лет, и на это в основном влияет увеличение количества железа в рационе. Одно из наиболее распространенных проявлений, которые мы видим в мутации рецептора ферропортина, — это то, что называется перегрузкой африканским железом, когда традиционное пиво варится в наполненных железом бочках.Пациенты получают там чрезмерное потребление железа, и если у них есть мутация, у них может развиться симптоматическая перегрузка железом в этой мутации.
Falk: Итак, терапия заключалась бы в том, чтобы не пить пиво из железной бочки.
Barritt: Верно, поэтому избегайте чрезмерного употребления железа в рационе во всех его формах.
Дополнительная информация о гемохроматозе
Falk: Где бы кто-нибудь узнал больше о гемохроматозе, если бы зашел в сеть? Какое надежное место для посещения?
Barritt: Гемохроматоз.org — разумное место для посещения. В целом я предостерегаю от слишком большого количества исследований в Интернете, потому что Интернет — это действительно переменный ресурс: одни хорошие, другие плохие, а некоторые безразличные. Hemochromatosis.org кажется разумным. Вероятно, лучший источник — ваш лечащий врач. Начиная с этого места, и если есть опасения по поводу симптоматической перегрузки железом, обратитесь к специалисту, будь то гастроэнтеролог, специалист по печени или гематолог.
Falk: Большое спасибо, доктор.Барритт, за то, что был у нас сегодня.
Barritt: Спасибо, что пригласили меня.
Falk: Большое спасибо нашим слушателям за настройку. В следующий раз мы поговорим с доктором Маниш Саха о тромботической микроангиопатии. Вы можете подписаться на Chair’s Corner в iTunes, SoundCloud или поставить отметку «Нравится» на FaceBook. Большое спасибо за внимание.
Посетите эти сайты для получения дополнительной информации:
Наследственный гемохроматоз: патогенез, диагностика и лечение
В конце 1800-х годов гемохроматоз считался странной аутоптической находкой. Более чем через столетие это было окончательно признано наследственным мультиорганным заболеванием, связанным с полиморфизмом, распространенным среди белых людей: 845G → А изменение в HFE , которое приводит к образованию C282Y в продукте гена. Гемохроматоз в настоящее время является четко выраженным синдромом, характеризующимся нормальным эритропоэзом, управляемым железом, и токсическим накоплением железа в паренхиматозных клетках печени, сердца и эндокринных желез. Это может быть вызвано мутациями, затрагивающими любой из белков, ограничивающих поступление железа в кровь.У мышей делеция гормона железа гепсидина и любого из 8 генов, которые регулируют его биологию, включая Hfe, рецептор трансферрина 2 ( Tfr2 ) и гемодувелин ( Hjv ) (все они определяют накопление железа который корректирует гепсидин) или ферропортин ( Fpn ) (экспортер клеточного железа, подавляемый гепсидином), вызывают перегрузку железом, но не заболевание органов. У людей потеря TfR2, HJV и самого гепсидина или мутации FPN приводят к полномасштабному гемохроматозу.В отличие от этих редких случаев, у белых людей гомозиготы по полиморфизму C282Y в HFE многочисленны, но они предрасположены только к гемохроматозу; Полное заболевание органа развивается у меньшинства, когда эти люди злоупотребляют алкоголем или из-за других неустановленных модифицирующих факторов. Тестирование гена HFE может использоваться для диагностики гемохроматоза, но по-прежнему требуется анализ гистологии печени и клинических признаков для выявления пациентов с редкими формами заболевания, не относящимися к HFE. Роль гепсидина в патогенезе гемохроматоза показывает его сходство с эндокринными заболеваниями, такими как диабет, и указывает на новые подходы к диагностике и лечению этого распространенного нарушения метаболизма железа.
Более чем через столетие это было окончательно признано наследственным мультиорганным заболеванием, связанным с полиморфизмом, распространенным среди белых людей: 845G → А изменение в HFE , которое приводит к образованию C282Y в продукте гена. Гемохроматоз в настоящее время является четко выраженным синдромом, характеризующимся нормальным эритропоэзом, управляемым железом, и токсическим накоплением железа в паренхиматозных клетках печени, сердца и эндокринных желез. Это может быть вызвано мутациями, затрагивающими любой из белков, ограничивающих поступление железа в кровь.У мышей делеция гормона железа гепсидина и любого из 8 генов, которые регулируют его биологию, включая Hfe, рецептор трансферрина 2 ( Tfr2 ) и гемодувелин ( Hjv ) (все они определяют накопление железа который корректирует гепсидин) или ферропортин ( Fpn ) (экспортер клеточного железа, подавляемый гепсидином), вызывают перегрузку железом, но не заболевание органов. У людей потеря TfR2, HJV и самого гепсидина или мутации FPN приводят к полномасштабному гемохроматозу.В отличие от этих редких случаев, у белых людей гомозиготы по полиморфизму C282Y в HFE многочисленны, но они предрасположены только к гемохроматозу; Полное заболевание органа развивается у меньшинства, когда эти люди злоупотребляют алкоголем или из-за других неустановленных модифицирующих факторов. Тестирование гена HFE может использоваться для диагностики гемохроматоза, но по-прежнему требуется анализ гистологии печени и клинических признаков для выявления пациентов с редкими формами заболевания, не относящимися к HFE. Роль гепсидина в патогенезе гемохроматоза показывает его сходство с эндокринными заболеваниями, такими как диабет, и указывает на новые подходы к диагностике и лечению этого распространенного нарушения метаболизма железа.
Ключевые слова
Метаболизм железа
Наследственные заболевания
Микроэлементы
Гепцидин
HFE
Сокращения, используемые в этой статье
BMP
статьи о молекулах костной ткани, полные 0 (см. Руководство по морфогенному белку
)
текст
Авторские права © 2010 AGA Institute. Опубликовано Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Наследственный гемохроматоз (HH) — Американский колледж гастроэнтерологии
Анализы крови могут определить, не слишком ли велико количество железа, хранящегося в организме.Обычно выполняются тесты на насыщение трансферрина и ферритин.
Тест на насыщение трансферрина определяет, сколько железа содержится в белке, переносящем железо в крови. Насыщение трансферрина натощак на уровне 45 процентов или выше, по крайней мере, в двух случаях, считается признаком перегрузки железом, и для подтверждения этого состояния необходимо провести дополнительные тесты.
Тест на ферритин сыворотки действует как косвенный показатель накопления железа в организме. Уровень ферритина в сыворотке считается нормальным для мужчин и женщин в постменопаузе, если он составляет от 20 до 300 мкг / л.Для женщин в пременопаузе нормальный диапазон составляет от 20 до 200 мкг / л. У людей с прогрессирующим ГГ уровень ферритина в сыворотке может достигать 15000 мкг / л. Однако состояния, отличные от HH, могут вызывать высокий уровень ферритина в сыворотке, включая заболевание печени, инфекцию, рак, болезнь сердца, СПИД, метаболические нарушения и воспалительные состояния, такие как артрит.
Если любой из этих тестов показывает уровень железа в организме выше нормы, врачи могут назначить тест под названием « HFE анализ мутаций» для выявления мутаций гена HFE, который подтвердит диагноз.Тест « HFE анализ мутаций» определяет мутации, идентифицированные в гене HFE. Они называются C282Y и H63D. Когда у пациентов есть две копии C282Y (по одной от каждого родителя), у них есть HH. Если у них есть только одна копия C282Y, они являются носителем. Большинство пациентов с одной или двумя копиями мутации H63D не имеют признаков перегрузки железом. Если мутации нет, ГГ не является причиной накопления железа, и врач будет искать другие причины.
Поскольку HH легко обнаруживается с помощью тестов на уровень железа в крови и путем поиска мутаций в гене гемохроматоза (HFE), все больше врачей ставят диагноз людям с этим заболеванием до того, как у них появятся симптомы.
Врачи иногда проводят биопсию печени у пациентов, чтобы определить степень поражения печени и отличить ДГ от других заболеваний печени. Биопсия печени — единственный тест, который может определить наличие цирроза печени, который является единственным осложнением, влияющим на продолжительность жизни человека с ГГ, поскольку увеличивает риск рака печени. Биопсию печени следует рекомендовать всем с ГГ, у которых уровень ферритина превышает 1000 мкг / л и / или результаты тестов функции печени отклоняются от нормы.
За пределами этих двух состояний (ферритин> 1000 мкг / л или повышенные показатели печеночных тестов) вероятность цирроза настолько мала, что обычно не оправдывает риск процедуры (вероятность незначительных осложнений, таких как преходящая боль / низкое кровяное давление, составляет 2%. и вероятность кровотечения <0,1%). Биопсия печени также может дать более четкое представление о количестве железа, которое хранится в печени, что известно как концентрация железа в печени. Биопсия печени также используется в случаях явной перегрузки железом при отрицательном результате генетического теста и отсутствии другого семейного анамнеза ГГ.
Лечение простое, недорогое и безопасное. Первый шаг — избавить организм от лишнего железа. Этот процесс называется флеботомией, что означает удаление крови так же, как она берется у доноров в банках крови. В зависимости от тяжести перегрузки железом один или два раза в неделю берется пол-литра крови в течение от нескольких месяцев до года, а иногда и дольше. Кровопускание одной единицы крови обычно снижает уровень ферритина примерно на 30 мкг / л. Уровень ферритина в крови периодически проверяется для контроля уровня железа.Цель состоит в том, чтобы довести уровень ферритина в крови до нижнего предела нормы и удерживать его на этом уровне. Это означает снижение содержания ферритина до менее 50 мкг / л.
Когда уровень железа возвращается к норме, начинается поддерживающая терапия, которая включает удаление поллитра крови каждые 2–4 месяца на всю жизнь. Некоторым людям может потребоваться более частая флеботомия. Многие пациенты, которым проводят поддерживающую флеботомию, делают это как доноры крови. Ежегодный анализ крови на ферритин поможет определить, как часто следует удалять кровь.Также необходимо регулярное наблюдение у специалиста, который интересуется гемохроматозом или расстройством, связанным с перегрузкой железом. Это может быть гематолог или гастроэнтеролог / гепатолог.
Если лечение начинается до того, как органы будут повреждены, можно предотвратить сопутствующие заболевания, такие как заболевания печени, сердца, артрит и диабет. Перспективы людей, у которых на момент постановки диагноза уже были эти состояния, зависят от степени поражения органа. Например, лечение HH может остановить прогрессирование заболевания печени на ранних стадиях, что приводит к нормальной продолжительности жизни.Однако, если развился цирроз или рубцевание печени, риск развития рака печени увеличивается, даже если запасы железа уменьшаются до нормального уровня. Люди с диабетом, возникшим в результате повреждения поджелудочной железы, обычно видят улучшение, если не обращение вспять, в зависимости от того, сколько повреждений произошло. Лечение не может вылечить состояния, связанные с установленным ДГ, но поможет улучшить большинство из них. Основное исключение — артрит, который обычно не проходит даже после удаления избытка железа.
Людям с HH не следует принимать добавки с железом или витамином C. А тем, у кого есть повреждение печени, не следует употреблять алкогольные напитки, потому что они могут еще больше повредить печень, или есть сырые морепродукты из-за риска серьезной инфекции.
Скрининг на ДГ — тестирование людей, у которых нет симптомов, — не является рутинной частью медицинского обслуживания или обследований. Однако братьям и сестрам пациентов с ГП следует сдать кровь на анализ, чтобы узнать, есть ли у них заболевание или являются ли они носителями.Родственникам первой степени родства пациентов с этим заболеванием следует предложить пройти обследование. Тестирование должно включать анализ насыщения трансферрина, ферритина и мутации HFE (генный тест). При рассмотрении вопроса о тестировании детей пациента может быть проще сначала проверить другого родителя, и если он / она не обнаруживает каких-либо мутаций HFE , тогда дети могут быть только носителями. Однако, если у другого родителя есть генная мутация, детям следует предложить генетическое тестирование. Каждый раз, когда проводится генетическое тестирование, должен быть доступен сертифицированный генетический консультант и должно быть получено информированное согласие.
Врачи должны посоветовать пациентам пройти обследование их близких родственников и рассмотреть возможность обследования людей с заболеваниями суставов, тяжелой и продолжающейся усталостью, сердечными заболеваниями, повышенными ферментами печени, импотенцией и диабетом, поскольку эти состояния могут быть результатом ГГ.
Поскольку генетический дефект является обычным явлением, а раннее выявление и лечение настолько эффективны, некоторые исследователи, а также образовательные и пропагандистские группы предположили, что широкомасштабный скрининг на ДГ будет рентабельным и его следует проводить.Тем не менее, существуют опасения по поводу возможной генетической дискриминации, которая может возникнуть при идентификации человека, у которого никогда не будет прогрессирования болезни.
Автор (ы) и дата (ы) публикации
Брюс Р. Бэкон, доктор медицины, FACG, и Судханшу Гогиа, доктор медицины, Медицинский факультет Университета Сент-Луиса, Сент-Луис, Миссури — Опубликовано в феврале 2011 г.
Вернуться к началу
Наследственный гемохроматоз — Консультант по терапии рака
Как я могу быть уверен, что у пациента наследственный гемохроматоз?
Термин «гемохроматоз» относится к повреждению тканей в результате перегрузки железом.Совсем недавно был введен термин «болезнь, вызванная перегрузкой железом», для обозначения болезни, которая возникает из-за перегрузки железом. Гемохроматоз может быть результатом первичных (наследственные или генетические нарушения) или вторичных (экзогенное введение железа или продуктов крови или гематологические нарушения) причин. Наследственный гемохроматоз (ГГ) присутствует, когда наследственное нарушение метаболизма железа приводит к перегрузке железом, повреждению тканей и заболеванию.
Наиболее частой причиной гемохроматоза среди населения североевропейского происхождения является HH.Большинство случаев HH является результатом наследственных мутаций в белках, участвующих в чувствительности к железу и регуляции гомеостаза железа (типы 1–3 HH). Такие мутации приводят к нарушению выработки ключевого гормона, регулирующего железо, гепсидина. Гепсидин играет центральную роль в гемостазе железа, координируя абсорбцию, мобилизацию и хранение железа для удовлетворения потребностей в железе для эритропоэза и других железозависимых процессов. Гепсидин экспрессируется преимущественно в гепатоцитах и секретируется в кровоток.Он связывается с ферропортином, экспортирующим железо, белком (FPN), который высоко экспрессируется на макрофагах и базолатеральной поверхности энтероцитов, вызывая интернализацию и деградацию FPN, тем самым подавляя экспорт железа (Рисунок 1). Экспрессия гепсидина регулируется статусом железа, эритропоэзом, воспалением и гипоксией. Избыток железа и воспаление вызывают экспрессию гена гепсидина (HAMP) и выработку белка, что снижает абсорбцию железа из кишечника и высвобождение железа из костного мозга.Эритропоэз и гипоксия подавляют выработку гепсидина, способствуя абсорбции и высвобождению железа. В настоящее время различают четыре типа ДГ.
Тип 1. ГГФ, связанный с ГП, является аутосомно-рецессивным наследственным заболеванием и является наиболее частой причиной ГГ, на которую приходится примерно 90% случаев. Чаще всего миссенс-мутация приводит к замене тирозина на цистеин в аминокислоте 282, что приводит к мутации C282Y в продукте гена HFE. Примерно 1 из 7 человек является гетерозиготным, тогда как 1 из 200 человек в популяциях североевропейского происхождения гомозиготен по мутации C282Y.Только гомозиготность по C282Y увеличивает риск перегрузки железом. Развитие болезни, связанной с перегрузкой железом, происходит примерно у 30% мужчин и 1% женщин, гомозиготных по C282Y к 7-му десятилетию жизни.
Другая мутация, H63D, встречается чаще, чем C282Y (1 из 3 гетерозиготен, а 1 из 36 гомозиготен по H63D), но она не увеличивает риск развития болезни, связанной с перегрузкой железом. Сложная гетерозиготность по C282Y и H63D затрагивает примерно 1 из каждых 42 человек в популяциях североевропейского происхождения.Он перерастает в клинически значимое заболевание, вызывающее перегрузку железом, примерно в 1% случаев, обычно на фоне других сопутствующих факторов заболевания печени, таких как чрезмерное употребление алкоголя.
HFE-родственный HH характеризуется нарушением чувствительности к железу и неадекватно низкой продукцией гепсидина по сравнению с железным статусом гомозиготных индивидуумов.
Тип 2. ГГ, связанный с ювенильным гемохроматозом, является чрезвычайно редким аутосомно-рецессивным заболеванием, которое приводит к тяжелой перегрузке железом во 2-м и 3-м десятилетиях жизни.Мутации в генах геможувелина или гепсидина лежат в основе причины этого заболевания. Он характеризуется нарушением чувствительности к железу и низким уровнем выработки гепсидина.
Тип 3: ГГ, связанная с рецептором трансферина 2 (TFR2), является чрезвычайно редким аутосомно-рецессивным заболеванием, которым страдают взрослые люди итальянского, португальского, французского или японского происхождения. Он характеризуется нарушением чувствительности к железу и низким уровнем выработки гепсидина.
Тип 4: Мутации ферропортина являются причиной чрезвычайно редкой формы ГГ у взрослых, которая наследуется по аутосомно-доминантному типу.О нем сообщалось в популяциях французов, жителей Соломоновых островов, африканцев, афроамериканцев, испанцев или индейцев. Это вызвано мутациями в гене FPN либо с усилением, либо с потерей функции.
В дальнейшем в данной публикации мы обсуждаем только ДГ, связанные с HFE.
Какие признаки и симптомы наследственного гемохроматоза обычно обнаруживаются?
Хотя гомозиготность C282Y присутствует при рождении, она демонстрирует высокую вариабельность с точки зрения развития биохимических или клинических проявлений перегрузки железом.Повышенное насыщение сывороточного трансферрина и уровни ферритина развиваются по крайней мере у половины пораженных взрослых. По крайней мере, 50% гомозигот по C282Y остаются бессимптомными в течение длительного времени и даже в зрелом возрасте. У многих никогда не разовьются симптомы или признаки болезни. У тех, у кого развивается болезнь, связанная с перегрузкой железом, симптомы и признаки развиваются в основном в среднем возрасте, когда нагрузка железом достигает критического уровня (обычно около 10-20 г железа в организме).
Пациенты, которым грозит самый высокий риск развития болезни, связанной с перегрузкой железом, — это пациенты, у которых уровень насыщения трансферрина и ферритина составляет не менее 95% и 1000 мкг / л соответственно.Женщины рождаются позже мужчин, так как они защищены от потери или использования железа во время менструации или беременности. Существует множество других генетических факторов и факторов окружающей среды, которые изменяют клиническую и биохимическую экспрессию гомозиготности C282Y. Сопутствующее наличие других процессов повреждения печени также может способствовать развитию повреждения печени. Употребление в пищу железа, фруктов и алкоголя может изменять степень накопления железа независимо от статуса HFE.
Симптомы и признаки часто неспецифичны и часто присутствуют в течение длительного времени до постановки диагноза (Рисунок 2; Таблица I).Общие симптомы включают летаргию, утомляемость, артралгию и потерю либидо. Кроме того, могут возникать специфические симптомы, связанные с вовлечением органов в перегрузку железом.
n
n
Обычно поражаются суставы, печень, гипофиз, кожа, поджелудочная железа и, реже, сердце. Двусторонний артрит 2-го и 3-го пястно-фаланговых суставов или крупных суставов нижних конечностей поражает до 25% людей с ГГ, связанных с HFE, и чаще встречается у людей с более значительной перегрузкой железом.Это одно из самых изнурительных проявлений болезни, связанной с перегрузкой железом. Хроническое заболевание печени (цирроз и гепатоцеллюлярная карцинома), гипогонадотропный гондадизм, пигментация кожи, сахарный диабет и сердечная недостаточность могут возникать в порядке убывания вероятности.
Многие из этих клинических проявлений напрямую связаны с чрезмерным всасыванием железа, которое приводит к повреждению клеток из-за образования оксирадикалов и перекисного окисления липидов. Было высказано предположение, что повреждение гепатоцеллюлярных лизосом и митохондрий способствует локальному повреждению гепатоцитов, некрозу и апоптозу.Вторичные регенеративные реакции печени, клетки-предшественники печени и фиброгенные реакции на это повреждение приводят к фиброзу, циррозу и, в конечном итоге, гепатоцеллюлярной карциноме.
Список признаков, признаков и симптомов в виде таблицы или диаграммы
См. Разделы выше, в которых описаны характерные особенности и менее распространенные клинические проявления ГГ.
Дифференциальный диагноз наследственного гемохроматоза
Дифференциальные диагнозы включают:
1. Хронические заболевания печени, такие как
Аутоиммунный гепатит, первичный билиарный цирроз, первичный склерозирующий холангит, аутоиммунная холангиопатия: диагностировано серологически и биопсией печени
Вирусный гепатит B, C: идентифицирован серологически, вирусологически и при биопсии печени
Хронический лекарственный гепатит: анамнез, серология, + биопсия печени
Алкогольная и неалкогольная жировая болезнь печени: анамнез, физический осмотр, исключение других причин заболевания печени, биопсия печени
2.Вторичные причины повышенного уровня ферритина в сыворотке, например
пациентов с почечной недостаточностью, находящихся на гемодиализе или получающих лечение эритропоэтином и железом (около 40% таких пациентов)
ожирение и неалкогольная жировая болезнь печени (30-50% таких лиц)
хронических вирусных гепатита (30-50% таких лиц).
Из этих групп только пациенты с хроническим заболеванием почек могут иметь значительную перегрузку железом.Гиперферритинемия при других болезненных состояниях обычно не указывает на значительную перегрузку железом.
3. Вторичные синдромы перегрузки железом, такие как анемии, вызванные нагрузкой железом, парентеральная перегрузка железом и т. Д.
4. Причины артрита: обычно определяются по анамнезу, физическому осмотру, серологии и визуализации
5. Другие причины сахарного диабета
6. Другие причины импотенции: различаются по анамнезу (и обследованию с исключением), различным эндокринопатиям и местным причинам
7 Другие причины пигментации кожи: определяются анамнезом, физическим осмотром и биохимией сыворотки (например,g., тестирование на болезнь Аддисона)
Как я могу подтвердить диагноз?
Какие тесты следует заказывать в первую очередь?
Исследование HH зависит от клинической ситуации. Клиницистам обычно предлагаются два распространенных диагностических сценария: (1) лица, поступающие на обследование на основании семейного анамнеза ГГ или перегрузки железом, или (2) клинические симптомы или признаки, которые повышают вероятность ГГ.
Для тех, кто обращается для оценки семейного анамнеза, первоначальное тестирование должно включать измерение насыщения трансферрина в сыворотке и уровня ферритина.Лица североевропейского происхождения также должны пройти тестирование гена HFE на общую мутацию C282Y. Эти тесты дополняют друг друга: нормальные исследования железа исключают наличие перегрузки железом в то время, в то время как тестирование гена HFE выявляет любую предрасположенность к развитию болезни, связанной с перегрузкой железом. За гомозиготными C282Y-индивидами с нормальным уровнем ферритина следует периодически (по крайней мере, каждые 2 года) оценивать эволюцию биохимической экспрессии, которая предшествует наиболее значительным клиническим последствиям заболевания.Почти все гомозиготы C282Y, у которых разовьется болезнь перегрузки железом, сделают это к 65 годам.
Пациенты с клиническими проявлениями сначала должны быть обследованы с помощью измерения насыщения трансферрина и уровня ферритина. Если любой из них повышен, показано генетическое тестирование на гомозиготность C282Y. Если гомозиготность C282Y подтверждена, то требуется дальнейшая оценка для доказательства болезни, связанной с перегрузкой железом, как показано на рисунке 3.
n
Какие тесты следует использовать для подтверждения первоначальных тестов?
Оценка уровня риска болезни, связанной с перегрузкой железом, необходима у всех гомозигот по C282Y с повышенными уровнями ферритина в сыворотке.Лица моложе 45 лет, не имеющие других сопутствующих факторов риска для печени и имеющие уровень ферритина в сыворотке ниже 1000 мкг / л, могут безопасно перейти на терапию флеботомией, семейный скрининг и консультации относительно риска злокачественных новообразований. Те, кто старше 45 лет и имеют уровни ферритина в сыворотке выше 1000 мкг / л или обладают другими факторами риска заболеваний печени, должны быть дополнительно обследованы с прямой оценкой оценки концентрации железа в печени с помощью биопсии печени, FerriScan (измерение R2 MRI печени концентрация железа) или количественная флеботомия, которая обеспечивает ретроспективную оценку нагрузки железом в организме.
Биопсия печени является золотым стандартом диагностики фиброза и цирроза печени, а также количественного определения концентрации железа в печени. R2 MRI стал точным, неинвазивным и быстрым методом измерения содержания железа в печени и возможного выявления фиброза. МРТ обеспечивает высокую степень чувствительности и специфичности для измерения концентрации железа в печени с площадью под кривой рабочих характеристик приемника более 0,98. Продукт концентрации железа в печени и возраста является чувствительной и специфической мерой для выявления субъектов с риском фиброза высокой степени.Есть надежда, что в будущем другие неинвазивные методы оценки фиброза (например, FibroScan) окажутся полезными для оценки и лечения болезни печени, вызывающей перегрузку железом, осложняющей ГГ.
Алгоритм диагностики см. На рис. 3.
Какие еще заболевания, состояния или осложнения мне следует искать у пациентов с наследственным гемохроматозом?
Каковы основные факторы риска для пациентов с этим заболеванием?
У 30% мужчин и 1% женщин, гомозиготных по C282Y, развивается болезнь перегрузки железом в возрасте 65 лет при отсутствии других факторов риска заболевания печени.Развитие заболевания печени может быть ускорено такими факторами риска, как чрезмерное употребление алкоголя, хронический вирусный гепатит и, возможно, неалкогольный стеатогепатит.
Запасы железа у разных пациентов могут различаться в десять раз, и эта вариабельность, вероятно, определяется генетическими факторами, а также факторами окружающей среды, такими как потребление железа и фруктов с пищей, потребление алкоголя, кровопотеря и сдача крови. Генетические факторы становятся важными детерминантами статуса железа у ДГ. Недавнее исследование активности дуоденальной цитохрома B редуктазы у пациентов с HH показало, что общие полиморфизмы, которые влияют на активность фермента, составляют до 11% вариабельности экспрессии перегрузки железом у гомозиготных по C282Y людей.
Пациенты, у которых концентрация железа в печени превышает 90 мкмоль / г и ферритин 1000 мкг / л, наиболее склонны к развитию болезни, связанной с перегрузкой железом. Примерно 5% гомозиготных субъектов по C282Y подвержены риску цирроза печени. После развития цирроза, независимо от лечения флеботомией, гомозиготные по C282Y субъекты сохраняют примерно 100-кратный повышенный риск гепатоцеллюлярной карциномы по сравнению с популяцией соответствующего возраста и пола.
Какие заболевания могут возникнуть при наследственном гемохроматозе?
Общая выживаемость гомозиготных C282Y аналогична выживаемости в общей популяции при отсутствии болезни, связанной с перегрузкой железом.
Заболевание, связанное с перегрузкой железом, является основным клиническим проявлением перегрузки железом у ДГ. Он включает артрит, заболевание печени (включая цирроз и гепатоцеллюлярную карциному) или любое другое клиническое состояние, которое нельзя отнести к другой причине в условиях перегрузки железом и гомозиготности C282Y. Другие хорошо задокументированные осложнения ГГ включают повышенную восприимчивость к инфекционным заболеваниям, таким как сальмонелла, листерия и инфекция иерсины. Гомозиготные по C282Y люди имеют в два-три раза повышенный риск рака кишечника и рака груди по сравнению с населением в целом.
Какие осложнения наследственного гемохроматоза встречаются чаще всего?
Основными опасными для жизни осложнениями ГГ являются развитие цирроза, гепатоцеллюлярной карциномы, терминальной стадии заболевания печени и их осложнений. Дилатационная кардиомиопатия — редкое осложнение ДГ. Декомпенсированное заболевание печени, вызванное ГГ, поддается лечению с помощью ортотопической трансплантации печени подходящим кандидатам. Однако пациенты с HH, перенесшие ортотопическую трансплантацию печени, имеют более низкие показатели выживаемости по сравнению с пациентами, перенесшими трансплантацию по другим причинам заболевания печени.Другие серьезные осложнения включают артрит, гипопитуитаризм, сахарный диабет, импотенцию и позднюю кожную порфирию.
Как правильно лечить пациента с наследственным гемокроматозом?
Поскольку организм имеет ограниченную способность выводить железо, лечение перегрузки железом зависит от методов лечения, которые напрямую уменьшают запасы железа: кровопускания или хелатирующей терапии. По возможности следует также учитывать сопутствующие гепатотоксические сопутствующие факторы. Основным методом лечения большинства пациентов с C282Y с перегрузкой железом является удаление железа из организма путем флеботомии.Каждая взятая единица крови содержит примерно 250 мг железа. Если пациенты не переносят флеботомию по медицинским причинам (например, анемия, сердечная недостаточность) или по другим причинам, можно использовать хелатирующие агенты. Исторически это основывалось на парентеральном применении десфериоксамина. Однако недавно представленная пероральная терапия деферасироксом представляет собой более переносимую альтернативу.
Какая начальная терапия является наиболее эффективной?
Наиболее эффективным начальным лечением наследственного гемохроматоза является флеботомия.
Перечень обычных начальных терапевтических вариантов, включая рекомендации по применению, а также ожидаемый результат терапии.
Флеботомия остается основным методом лечения с тех пор, как она была впервые описана в 1940-х годах Дэвисом и Эроусмитом. Это безопасный и эффективный способ удалить железо у большинства пациентов с ДГ. Количество еженедельных венесекций, необходимых для возврата уровня ферритина в сыворотке к низкому нормальному диапазону, позволяет напрямую измерить степень перегрузки железом у индивидуума.
Целью терапии является возвращение и поддержание уровня ферритина в сыворотке крови на низком нормальном уровне от 50 до 100 мкг / л. Частота венесекции может быть адаптирована к способности человека справиться с кровопотерей. Первоначально терапия проводится один раз в неделю. Частота проведения флеботомии снижается по мере того, как уровень ферритина снижается до нормального. При достижении нормального уровня ферритина субъект возвращается к поддерживающему графику флеботомии, который обычно проводится от 3 до 4 раз в год.
Из-за высокой вариабельности повторного накопления железа требования к поддерживающей флеботомии также сильно различаются. Многие страны теперь принимают кровь от терапевтических доноров для переливания крови.
Перечень подмножества терапий второй линии, включая рекомендации по выбору и использованию этих методов лечения спасения
Наиболее полезной терапией второй линии после кровопускания является пероральное хелатирование железа с использованием деферасирокса. Эта терапия предлагает значительные клинические преимущества по сравнению с предыдущим подкожным введением десфериоксамина.
Деферасирокс принимают в таблетках для приема внутрь в дозе от 20 до 30 мг / кг массы тела. Обычно он хорошо переносится и имеет меньшие побочные эффекты по сравнению с десфериоксамином.
Десфериоксамин используется гораздо реже, но при необходимости его можно вводить в виде подкожной инфузии в дозе 25–50 мг / кг / день в течение 10–12 часов.
Список их, включая любые рекомендации по мониторингу побочных эффектов.
Деферасирокс вводится в виде таблеток для перорального применения и обычно хорошо переносится.Общие побочные эффекты включают тошноту, рвоту, диарею и боли в животе. Сообщалось о дозозависимом повышении креатинина в сыворотке. Иногда отмечается повышение уровня сывороточной трансаминазы; поэтому следует ежемесячно контролировать биохимическую функцию почек и печени. Побочные эффекты десфериоксамина включают гиперчувствительность и анурию. Осторожность требуется пациентам с почечной недостаточностью.
Как мне наблюдать за пациентом с наследственным гемохроматозом?
Мониторинг субъектов с HH основан на мониторинге (1) нагрузки железом и (2) повреждения органа.
Мониторинг нагрузки железом лучше всего проводить с помощью серийных измерений уровня ферритина в сыворотке. Низкий нормальный уровень ферритина в сыворотке крови является конечной точкой успешной начальной терапии. Поддерживающая флеботомия должна поддерживать уровень ферритина на низком уровне нормы. У гомозигот C282Y с риском заболевания печени или других заболеваний, связанных с перегрузкой железом, при первоначальном диагнозе следует учитывать неинвазивное количественное определение концентрации железа в печени и повреждение печени или более инвазивные тесты, такие как биопсия печени, для определения фиброзного или цирротического состояния печени.
У пациентов с циррозом печени вопросы лечения включают скрининг на гепатоцеллюлярную карциному, наблюдение за варикозными расширениями, лечение асцита или других осложнений декомпенсированной терминальной стадии болезни печени. Выявление терминальной стадии заболевания печени и декомпенсации требует заблаговременного рассмотрения возможности ортотопической трансплантации печени.
Всех субъектов с гомозиготностью C282Y следует проконсультировать относительно риска колоректального рака (у мужчин и женщин) и рака груди (только у женщин).Неизвестно, связан ли риск злокачественного новообразования со статусом генетической мутации или статусом железа у человека.
Осложнения, возникающие в результате повреждения внепеченочных органов, вызванного перегрузкой железом, лечатся в зависимости от пораженного основного органа.
Установленное повреждение органа-мишени может не быть полностью обратимым с помощью терапии флеботомией, но могут произойти некоторые улучшения. Особенности, которые, скорее всего, улучшатся при терапии, включают в себя вялость, утомляемость, пигментацию кожи и непереносимость глюкозы.Открытый сахарный диабет, требующий лечения, обычно не купируется терапией флеботомией, хотя дозы инсулина могут быть уменьшены после терапии флеботомией.
Фиброз печени обратим, но цирроз, вероятно, не обратим. После того, как артрит установлен, артрит редко улучшается, даже когда восстанавливается нормальный статус железа. Гипогонадотропный гипогонадизм может уменьшить тяжесть при терапии, но часто требует дополнительных гормональных добавок (таблица 1).
Какие доказательства?
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Наследственный гемохроматоз типа 1 и ген HFE
Как генетика HFE влияет на тяжесть заболевания при гемохроматозе
Вам может быть интересно, почему все это имеет значение.
Серьезность заболевания и вероятность того, что кто-то с этими генами испытает симптомы и возникнут проблемы, зависят от того, какой тип генной мутации присутствует.
Наиболее распространенной и наиболее тяжелой формой является , гомозиготная по C282Y. Это когда у кого-то есть две копии самой сильной генетической мутации, C282Y.
Второй по степени серьезности сценарий — составной гетерогиготный . Это когда у вас есть одна копия C282Y и одна копия H63D.
Окончательный сценарий — гетерозиготный либо по C282Y, либо по H63D. Это означает, что у вас есть только одна копия только одного из генов. Часто (но не всегда) это наименее серьезное проявление состояния.
В итоге:
- Гомозиготный -> 2 копии C282Y. Скорее всего, будет тяжелым.
- Соединение Гетерозиготное -> 1 копия C282Y + 1 копия H63D. Второй, скорее всего, будет тяжелым.
- Гетерозиготный -> 1 копия C282Y (или 1 копия H63D). Наименее вероятно, будет серьезным.
Кто наследует гемохроматоз?
Судя по цифрам, 1 из 200 человек североевропейского происхождения имеет две генетические мутации гена HFE .
Эта статистика включает людей, гомозиготных по двум копиям гена C282Y, а также тех, кто является сложной гетерозиготной (C282Y + H63D).
Кроме того, цифры говорят нам, что 1 из 9 человек североевропейского происхождения является носителем одного гена HFE .
Это означает, что наличие одного гена гемохроматоза — очень распространенное явление!
Один ген гемохроматоза может по-прежнему вызывать симптомы
Когда в генетическом профиле человека присутствуют две мутации гена C282Y HFE (как описано выше), его здоровье подвергается риску из-за перегрузки железом.
Без сомнения, самые тяжелые случаи гемохроматоза являются результатом этой генетики.
Но важно не упускать из виду влияние, которое одна-единственная мутация гена гемохроматоза может оказать на наше здоровье.
Даже одна измененная копия C282Y или H63D может привести к некоторой степени перегрузки железом у некоторых людей. Этот сценарий абсолютно может быть основной причиной проблем со здоровьем, симптомов, болезней или болезней для многих людей.
Многие врачи, компании по лабораторным исследованиям, книги и другие веб-сайты склонны преуменьшать потенциальные последствия для здоровья наличия только одного гена гемохроматоза.
Вы можете прочитать или услышать, что один вариант гена не является «клинически значимым».
Однако при этом игнорируются истории и симптомы людей, здоровье которых было подорвано из-за умеренного уровня перегрузки железом.
Многие люди со всего мира написали мне и рассказали мне о своих проблемах со здоровьем из-за высокого содержания железа, хотя у них есть только одна мутация гена.
Фактически, это мой опыт с моей собственной историей гемохроматоза.
Точно так же я слышал множество историй от людей, которые не понимали своих потенциальных рисков для здоровья или последствий хранения слишком большого количества железа.Я видел бесчисленное количество случаев, когда людям говорили, что с их здоровьем все в порядке или что «все в их голове».
Возможно, хуже всего, когда врач говорит человеку, что у него есть ген гемохроматоза, но что ему не нужно ничего с этим делать, потому что у него только одна мутация.
Я даже слышал истории о том, что людей отговаривали сдавать кровь, даже один раз, даже при повышенном уровне ферритина.
Дело в том, что вы можете проявлять симптомы избытка железа только с одним геном, а в некоторых случаях вообще без каких-либо генных мутаций!
Интересный обзор Американского журнала эпидемиологии показал, что 78% людей с диагнозом наследственный гемохроматоз гомозиготны по C282Y.
Это оставляет 22% людей с диагнозом наследственный гемохроматоз с чем-то другим, кроме двух копий C282Y.
В этом отчете пациенты с другими сочетаниями генетики (включая 7%, у которых не было ни C282Y, ни H63D!) Все еще имели симптомы перегрузки железом и были клинически диагностированы практикующим врачом.
В этом обзоре:
- 5% оказались составными гетерозиготами (C282Y / H63D)
- 1,5% были гомозиготными по мутации H63D (то есть у них было две копии H63D, но не было копий C282Y)
- 3.6% были гетерозиготами C282Y (то есть у них была только одна копия C282Y)
- 5,2% были гетерозиготами H63D (то есть у них была только одна копия H63D и не было копий C282Y)
- 7% не имели мутаций ни C282Y, ни H63D
Это означает, что пациенты с нетрадиционной генетикой могут испытывать симптомы и лабораторные исследования, указывающие на перегрузку железом, даже если у них нет классически определенной генетики наличия двух копий C282Y.
Однако, как указано выше, многие врачи считают, что для диагностики гемохроматоза необходимы две копии C282Y, в результате чего многие пациенты с атипичной генетикой страдают, но без диагностики, поддержки или вариантов лечения.
Лечение наследственного гемохроматоза
К счастью для людей с наследственным гемохроматозом, которые хотели бы «что-то с этим поделать», мы здесь, чтобы помочь!
Если вы знаете, что у вас перегрузка железом, зачем ждать, чтобы увидеть, появятся ли у вас клинически значимые симптомы?
Если гемохроматоз выявлен на ранней стадии и эффективные методы лечения, такие как терапевтическая флеботомия, хорошо переносятся, тогда вы сможете предотвратить симптомы и осложнения.

 jhep.2010.03.001
jhep.2010.03.001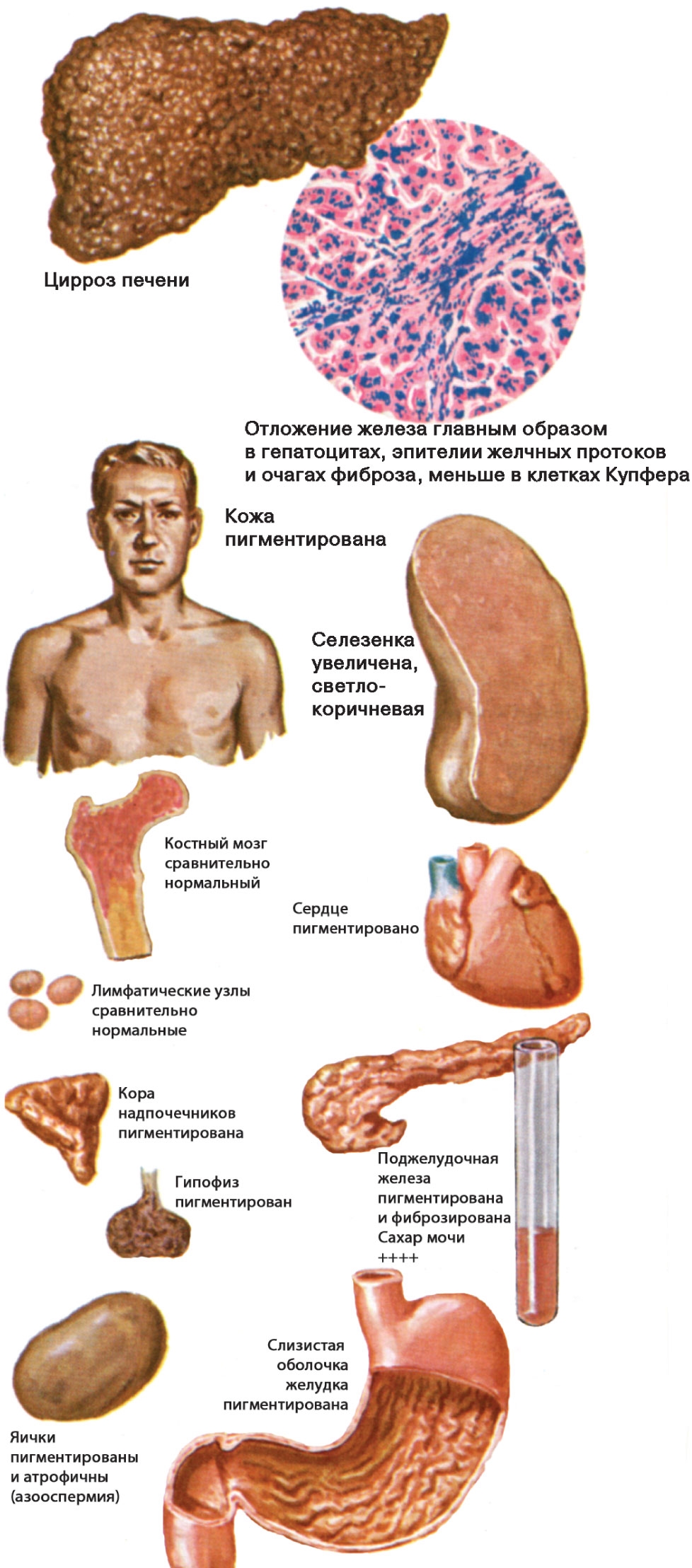 New England Journal of Medicine. 2005; 352(17): 1769-1778. https://doi.org/10.1056/nejmoa041534
New England Journal of Medicine. 2005; 352(17): 1769-1778. https://doi.org/10.1056/nejmoa041534 M, Swinkels D.W, Melse-Boonstra A. Relevance of dietary iron intake and bioavailability in the management of HFE hemochromatosis: a systematic review. American Journal of Clinical Nutricion. 2013; 98 (2): 468-479. https://doi.org/10.3945/ ajcn.112.048264
M, Swinkels D.W, Melse-Boonstra A. Relevance of dietary iron intake and bioavailability in the management of HFE hemochromatosis: a systematic review. American Journal of Clinical Nutricion. 2013; 98 (2): 468-479. https://doi.org/10.3945/ ajcn.112.048264
 EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol. 2010 Jul;53(1):3-22.
EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol. 2010 Jul;53(1):3-22.