МКБ-10 код P70.4 | Другие неонатальные гипогликемии
ICD-10
ICD-10 is the 10th revision of the International Statistical Classification of Diseases and Related Health Problems (ICD), a medical classification list by the World Health Organization (WHO).
It contains codes for diseases, signs and symptoms, abnormal findings, complaints, social circumstances, and external causes of injury or diseases.
ATC
The Anatomical Therapeutic Chemical (ATC) Classification System is used for the classification of active ingredients of drugs according to the organ or system on which they act and their therapeutic, pharmacological and chemical properties.
It is controlled by the World Health Organization Collaborating Centre for Drug Statistics Methodology (WHOCC).
DDD
The defined daily dose (DDD) is a statistical measure of drug consumption, defined by the World Health Organization (WHO).
It is used to standardize the comparison of drug usage between different drugs or between different health care environments.
Гипогликемия и ее последствия
Определение 1
Гипогликемия (от греч.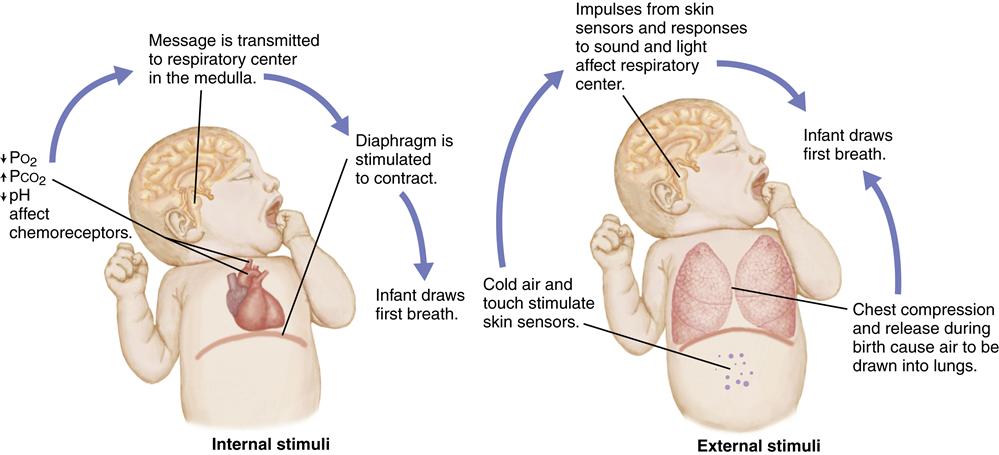 Hypo — «снижение», glykos — «сладкий», haima — «кровь») — это снижение уровня глюкозы до уровня 2,8-2,2 ммоль / л независимо от наличия симптомов, сопровождающееся характерной клинической симптоматикой. Резкое снижение гликемии приводит к активации симпатической нервной системы и дисфункции центральной нервной системы (ЦНС).
Hypo — «снижение», glykos — «сладкий», haima — «кровь») — это снижение уровня глюкозы до уровня 2,8-2,2 ммоль / л независимо от наличия симптомов, сопровождающееся характерной клинической симптоматикой. Резкое снижение гликемии приводит к активации симпатической нервной системы и дисфункции центральной нервной системы (ЦНС).
Гипогликемию наблюдают как у здоровых людей (например, во время усиленных физических нагрузок), так и у пациентов с заболеваниями желез внутренней секреции (в первую очередь при сахарном диабете) и печени. Необходимо заметить, что больные сахарным диабетом могут не испытывать гипогликемии при значениях глюкозы в крови 4-5,0 ммоль / л.
Гипогликемия в период новорожденности
Неонатальная гипогликемия проявляется сразу же после рождения или в первые 12-72 часа жизни в 1,5-3 из тысячи новорожденных.
Случается чаще у детей, родившихся с массой тела менее 2,5 кг, недоношенных, с внутриутробной задержкой развития, с нарушением акта сосания и глотания, гемолитической болезнью, болезнью гиалиновых мембран, при наличии гипотрофии и врожденной патологии углеводного обмена. Транзиторную гипогликемию обнаруживают у 80-90% детей, родившихся от матерей, больных сахарным диабетом, или которые имели диабет беременных. У 10-20% детей из групп высокого риска развивается стойкая тяжелая гипогликемия.
Транзиторную гипогликемию обнаруживают у 80-90% детей, родившихся от матерей, больных сахарным диабетом, или которые имели диабет беременных. У 10-20% детей из групп высокого риска развивается стойкая тяжелая гипогликемия.
Замечание 1
Неонатальная гипогликемия в дальнейшем может стать причиной значительного отставания в психомоторном развитии ребенка. Повторные эпизоды гипогликемии приводят к органическому поражению ЦНС (пирамидные, экстрапирамидные и мозжечковые нарушения).
Непосредственными причинами гипогликемии у новорожденных является:
- гиперинсулинемия,
- наследственный дефект ферментов метаболизма углеводов (например, глюкозо-6-фосфатазы),
- дефицит источников глюкозы (например, гликогена)
- дефицит контринсулярных гормонов.
Недиагностированная и нелеченная гипогликемия приводит к необратимым поражениям нервной системы, эпилептических припадков, психической отсталости, особенно это касается тяжелых, длительных и частых гипогликемии.
Ранними признаками гипогликемии в периоде новорожденности является мышечная гипотония, тремор, цианоз, нарушение дыхания, судороги, сонливость, апноэ, фасцикуляции, снижение температуры тела.
Гипогликемия у детей
У детей старшего возраста, кроме гиперинсулинемии и врожденных нарушений обмена углеводов, причиной гипогликемии могут стать:
- приобретенное эндокринное заболевание (соматотропного недостаточность, адреногенитальный синдром, надпочечная недостаточность, гипотиреоз и др.),
- потребление алкоголя,
- потребление анаболических стероидов,
- введение инсулина и сахароснижающих препаратов (у ребенка, который не болеет сахарным диабетом).
Клинически в этом возрасте гипогликемия проявляется слабостью, сонливостью, чувством голода, потливостью, раздражительностью, тремором, тахикардией, болями в области сердца и головной болью, тошнотой и рвотой (усиление секреции адреналина), головокружением, нарушением сознания, дизартрией, афазией, судорогами, потерей сознания и развитием коматозного состояния. Важно оценить регулярность появления симптомов гипогликемии и их связь с длиной интервалов между кормлениями.
Важно оценить регулярность появления симптомов гипогликемии и их связь с длиной интервалов между кормлениями.
В возрасте от 18 месяцев до 6 лет случается гипогликемия голодания — неспособность поддерживать нормальную гликемию при голодании. Гипогликемия голодания возникает в маленьких и худых детей, в случае больших перерывов между приемами пищи, по недостаточного питания при тяжелых инфекционных болезнях, желудочно-кишечных нарушениях, она может сопровождать судороги и потеря сознания. У мальчиков это заболевание встречается в 10-20 раз чаще, чем у девочек.
Гипогликемия при сахарном диабете
В основе возникновения гипогликемии при сахарном диабете лежит избыток инсулина в организме в соответствии с поступления углеводов с пищей или из печени, а также при ускоренной утилизации углеводов (физическая нагрузка). Ведущими факторами развития гипогликемии при сахарном диабете является передозировка инсулина (назначение слишком высокой дозы инсулина, введение инсулина с концентрацией 100 ЕД / мл шприцом для инсулина с концентрацией 40 ЕД / мл), повышение активности инсулина (ускорение всасывания, высвобождение инсулина из комплекса с анти инсулиновых антителами, почечная недостаточность, период «медового месяца»), повышение чувствительности к инсулину (дефицит контр инсулярной гормонов, потеря массы тела, физическая активность), несоответствие поступления углеводов организм (рвота, диарея, диета, изменения качества, количества и времени приема пищи), другие факторы (употребление алкоголя, салицилатов, сульфамидных препаратов). Наличие у больного автономной нейропатии также является фактором риска тяжелых гипогликемии.
Наличие у больного автономной нейропатии также является фактором риска тяжелых гипогликемии.
Различают симптоматическую и бессимптомную (скрытую) гипогликемию. Клинические симптомы гипогликемии обусловлены повышением тонуса симпато-адреналовой системы и повышением продукции контринсулиновых гормонов, а также нарушением питания нервной ткани. В условиях недостаточного поступления глюкозы к мозгу развивается углеводное и кислородное голодание.
Симптомы гипогликемии делятся на:
вегетативные — активация симпатической и парасимпатической нервной системы:
- потливость,
- тахикардия,
- тремор,
- чувство голода;
нейрогликопеничные — гипоксия головного мозга:
- озабоченность,
- раздражительность,
- изменения поведения;
общие:
- головная боль,
- тошнота.
В зависимости от выраженности симптомов выделяют легкую степень гипогликемии (больной может сам справиться со своим состоянием) — возникает чувство голода, дрожь, раздражительность, потливость, сердцебиение, бледность кожи. При средней степени гипогликемии (больной нуждается в помощи посторонних лиц) присоединяются нейрогликопеничные и нейрогенные симптомы — головная боль, неадекватное поведение, часто с признаками агреси и возбуждения, капризность, нарушение речи и зрения, тахикардия, расширение зрачков. Наблюдают слабость, «ватные» колени, чувство страха, онемение губ, кончика носа, боль в животе, рвота, бред, галлюцинации и др.
При средней степени гипогликемии (больной нуждается в помощи посторонних лиц) присоединяются нейрогликопеничные и нейрогенные симптомы — головная боль, неадекватное поведение, часто с признаками агреси и возбуждения, капризность, нарушение речи и зрения, тахикардия, расширение зрачков. Наблюдают слабость, «ватные» колени, чувство страха, онемение губ, кончика носа, боль в животе, рвота, бред, галлюцинации и др.
Замечание 2
Тяжелая степень гипогликемии требует неотложной помощи, характеризуется полной дезориентацией больного, судорогами, нарушением глотания, развитием гипогликемической комы. Частые и тяжелые гипогликемии вызывают поражение головного мозга, задержку интеллектуального развития.
| Краткое содержание | Неонатальная гипогликемия, понимаемая как снижение уровня глюкозы в плазме, может привести к долгосрочному неврологические повреждения. | Подробное описание | Неонатальная гипогликемия, понимаемая как снижение уровня глюкозы в плазме, может привести к долгосрочному неврологические повреждения.Гипогликемия — одно из наиболее частых метаболических изменений новорожденных. Около 30% всех новорожденных подвержены риску гипогликемии. в основном рискуют дети от диабетических матерей, рожденные недоношенными, поздно недоношенными (34-36,6 нед. гестационный возраст), родившиеся в срок (37-42 нед. гестационного возраста) с низкой массой тела для гестационный возраст (SGA, 90о процентиля). 50% этих младенцев страдают гипогликемией в первые 48 лет. до сих пор спорные сегодня, чтобы назначить пороговое значение, ниже которого можно определить состояние неонатальной гипогликемии. В 2011 году Американская академия педиатрии предоставила практическое руководство по скринингу и последующему ведению неонатальной гипогликемии у младенцев из группы риска. Пациентам с риском заболеваемости показан тщательный мониторинг уровня глюкозы в крови новорожденных. В 2013 году Харрис и др. Провели исследование, чтобы оценить частоту неудач при лечении гипогликемия в выборке из 242 новорожденных, отнесенных в соотношении 1: 1 к случайной или контрольной группе. Пациентов лечили 40% декстрозой в геле с концентрацией 200 мг / кг, в то время как контрольной группе с раствором плацебо. Новорожденных обеих групп поощряли кормить, но если кормление было недостаточным, вводили грудное молоко или молочную смесь через шприц. Уровень глюкозы в крови определялся через 30 минут после введения геля, но если гипогликемия была стойкий, вводили до 6 доз геля в течение 48 часов жизни. Исследователи не обнаружили побочных эффектов, связанных с введением геля, и группа младенцев, получавших гель, показали повышение уровня глюкозы в крови на 7,2 мг / дл по сравнению с группа плацебо.Hegarty et al провели клиническое исследование, в котором рандомизировано 416 новорожденных. и назначен на один из 4 видов лечения: глюкоза 40% в геле однократно (200 мг / кг) или двойная доза (400 мг / кг) через 1 час после рождения или с последующим 3 дополнительными дозами декстрозы (200 мг / кг) в первые 12 часов. | Вмешательство | Тип вмешательства: Пищевая добавка Название вмешательства: Прием раствора плацебо (0,5 мл / кг) Описание: 43 новорожденных с риском гипогликемии, которым будет вводиться раствор плацебо (0,5 мл / кг) Этикетка Arm Group: Плацебо (0,5 мл / кг) Другое имя: Плацебо Тип вмешательства: Пищевая добавка Название вмешательства: Введение раствора плацебо (1 мл / кг) Описание: 43 новорожденных с риском гипогликемии, которым будет назначен раствор плацебо (1 мл / кг) Этикетка Arm Group: Плацебо (1 мл / кг) Другое имя: Плацебо Тип вмешательства: Пищевая добавка Название вмешательства: Введение 40% глюкозы в геле (0,5 мл / кг) Описание: 43 новорожденных с риском гипогликемии, которым будет вводиться 40% раствор декстрозы в геле (0,5 мл / кг) Этикетка Arm Group: Дестрогель (0,5 мл / кг) Тип вмешательства: Пищевая добавка Название вмешательства: Введение 40% глюкозы в геле 1 мл / кг) Описание: 43 новорожденных с риском гипогликемии, которым будет назначен 40% раствор декстрозы в геле (1 мл / кг). Этикетка Arm Group: Дестрогель (1 мл / кг) |
|---|
№AN16GLU, Глюкоза: показатели, норма — узнать цены на анализы для животных в Москве
ОПИСАНИЕ
Глюкоза — основной энергетический субстрат практически для всех клеток организма. Уровень глюкозы является одним из наиболее важных лабораторных показателей. Глюкоза попадает в кровь, в первую очередь, в результате расщепления углеводов пищи и всасывания глюкозы из кишечника. У животных с однокамерным желудком увеличение концентрации глюкозы в крови наблюдается в течение 2–4 часов после еды. Вторым источником глюкозы является ее синтез в печени в процессе глюконеогенеза (синтеза из неуглеводных компонентов, в основном из аминокислот и глицерина) у животных с однокамерным желудком, и гликогенолиза (расщепления гликогена до глюкозы). В проксимальных почечных канальцах также происходит глюконеогенез — это третий источник глюкозы, который в различных физиологических состояниях может оказать значительное влияние на ее метаболизм.
Концентрация глюкозы в крови зависит от времени последнего приема пищи (имеет значение только у животных с однокамерным желудком), гормональных влияний и использования глюкозы периферическими тканями (в основном скелетной мускулатурой).
Гормональная регуляция уровня глюкозы в крови осуществляется путем влияния на печеночное производство глюкозы и ее периферическое использование. Наиболее важным гормоном при этом является инсулин, который вырабатывается β-клетками островков Лангерганса поджелудочной железы. Инсулин снижает уровень глюкозы в крови, облегчает ее проникновение в миоциты, адипоциты и гепатоциты, подавляет глюконеогенез в печени, способствует синтезу и хранению гликогена в печени. Другие гормоны и биологически активные вещества, такие как глюкагон, катехоламины, глюкокортикоиды и гормон роста (соматотропин, СТГ), оказывают контринсулярное действие, вызывая повышение уровня глюкозы в крови. Глюкагон, вырабатываемый α-клетками островков Лангерганса поджелудочной железы, стимулирует гликогенолиз и глюконеогенез и ингибирует синтез гликогена в печени. Глюкокортикоиды способствуют глюконеогенезу, но также обуславливают состояние инсулинорезистентности, подавляя активность белков-переносчиков (транспортеров) глюкозы на мембранах клеток-мишеней. Соматотропин также вызывает периферическую инсулинорезистентность, снижая поглощение глюкозы клетками и увеличивая синтез глюкозы в печени. Катехоламины изменяют уровень глюкозы в крови с помощью различных механизмов, в том числе способствуя усилению глюконеогенеза и гликогенолиза в печени, ингибируя секрецию инсулина, стимулируя высвобождение соматотропина.
Основной причиной гипергликемии является сахарный диабет (СД), который развивается в результате нехватки инсулина или дефекта действия инсулина (инсулинорезистентности). СД часто возникает вследствие заболеваний поджелудочной железы (например, иммуноопосредованным разрушением панкреатических β-клеток или панкреатита). Кроме того, различные эндокринные заболевания могут вызывать вторичный СД, в том числе гиперадренокортицизм (избыток кортизола), акромегалию (избыток СТГ), феохромоцитому (избыток катехоламинов) и глюкагоному. При гепатокожном синдроме, который наблюдается у некоторых собак с циррозом или другими патологиями печени, имеет место многофакторная гипергликемия. Также необходимо дифференцировать СД от гипергликемии, вызванной действием катехоламинов и кортизола при стрессе (особенно у кошек). У собак причиной СД обычно является инсулиновая недостаточность вследствие панкреатического разрушения β-клеток. В диэструсе у сук, когда повышается концентрация прогестерона в крови, возникает гипергликемия под влиянием прогестерон-стимулируемой секреции молочными железами соматотропного гормона. СД более подвержена порода вольфшпиц (кеесхонд). У кошек СД часто возникает вследствие сочетанного нарушения секреции инсулина и дефекта инсулиновых рецепторов.
У кошек гипергликемия развивается на фоне действия гормонов, таких как глюкагон, тироксин, гестагены и эстрогены. При стрессе или волнении животных во время взятия образцов крови отмечается кратковременная гипергликемия в результате секреции катехоламинов и стимуляции глюконеогенеза.
Гипогликемия может развиться вследствие повышенного потребления глюкозы тканями (например, при эндотоксемии, физической перегрузке), сокращения количества поступающей глюкозы (например, при голодании, печеночной недостаточности) или в обоих случаях (гипоадренокортицизм). В редких случаях причиной гипогликемии могут быть неопластические процессы. Стойкая гипогликемия отмечается при новообразовании β-клеток по причине высокого потребления глюкозы. Другие опухоли, такие как лейомиома или лейомиосаркома, также могут быть причиной гипогликемии, которая связана либо с секрецией инсулиноподобного вещества, либо с чрезмерным потреблением глюкозы опухолевыми клетками. Новообразования печени вызывают гипогликемию в результате уменьшения функциональной массы органа. Болезни накопления гликогена редко являются причиной гипогликемии у животных. Гликогеноз III типа характерен для породы немецкая овчарка.
Новорожденные или молодые животные, а также собаки миниатюрных пород, склонны к развитию гипогликемии, возможно, в результате недостаточного глюконеогенеза, связанного со скоростью метаболизма.
ПРЕАНАЛИТИКА
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 3 дня при температуре хранения +2°С…+8°С; сохраняет стабильность 1 неделю при замораживании -17С…-23С.
В образцах, взятых после приема пищи, уровень глюкозы может быть завышен (постпрандиальная гипергликемия).
Выраженные гемолиз и липемия могут вызвать умеренное увеличение значения глюкозы в исследуемой пробе.
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения лаборатории VET UNION: ммоль/л.
Референсные значения:
Собаки: 0–6 мес. — 2,86–12 ммоль/л; 6–12 мес. — 4,2–6,6 ммоль/л; старше одного года — 4,3–6,6 ммоль/л.
Кошки: 0–6 мес. — 3–12 ммоль/л; 6–12 мес. — 3,8–9,8 ммоль/л; старше одного года — 3,2–7,9 ммоль/л.
Хорьки: 5,1–11,4 ммоль/л — альбиносы; 3,4–7,3 ммоль/л — темные.
Лошадь: 3–7 ммоль/л.
МРС: 2,7–4,4 ммоль/л.
КРС:2,1 -4,1 ммоль/л.
Кролик: 4,1–8,3 ммоль/л.
Крыса:2,7–7,4 ммоль/л.
Морская свинка: 3,3–6,9 ммоль/л.
Мышь:3,4 -7,0 ммоль/л.
Песчанка:2,7–7,4 ммоль/л.
Хомяк: 2,0–10,9 ммоль/л.
Шиншилла: 6,0 -10,7 ммоль/л.
Тукан:12,2 — 19,4 ммоль/л.
Тигр:4,15 — 14,03 ммоль/л.
Леопард: 3,2 -8,8 ммоль/л.
Истинный уровень глюкозы в крови ниже 2 ммоль/л требует немедленного вмешательства, поскольку может вызвать состояние комы. С другой стороны, уровень глюкозы выше 56 ммоль/л может привести к развитию гипергликемической комы.
Бета-адреноблокаторы, антигистаминные препараты, этанол, производные сульфонилмочевины, салицилаты и анаболические стероиды могут снизить уровень глюкозы в крови. Гипогликемия возможна у животных с сахарным диабетом, которым недавно был введен инсулин, а также при использовании производных сульфонилмочевины, таких как глипизид. У животных, получающих парентеральное питание, а также при назначении некоторых препаратов (например, кортикостероидов, агонистов центральных α2-адренорецепторов, фуросемида, тиазидных диуретиков, ацетазоламида, производных фенотиазинов, мегестрол ацетата и гепарина) может развиться гипергликемия.
Повышенный уровень гематокрита снижает значение глюкозы в цельной крови, и наоборот. Выраженный лейкоцитоз и бактериальная контаминация образца ускоряют потребление глюкозы. Гипогликемия у животных на фоне нейтропении или при лейкограмме воспаления с наличием токсических нейтрофилов свидетельствует о развитие сепсиса.
Повышение уровня:
Сахарный диабет.
Дефицит инсулина (иммуноопосредованная деструкция β-клеток, панкреатит).
Инсулинорезистентность (гиперадренокортицизм, акромегалия, феохромоцитома, глюкагонома).
Беспокойство или страх.
Гипертиреоидизм.
Гепатокожный синдром.
Лекарственная терапия.
Понижение уровня:
Сепсис.
Болезни накопления гликогена.
Паранеопластический синдром, новообразования β-клеток панкреатических островков (инсулинома).
Лейомиосаркома.
Печеночная недостаточность.
Гипоадренокортицизм.
Физическая нагрузка (у охотничьих пород собак).
Ювинильная и неонатальная гипогликемия, в частности, у миниатюрных пород собак.
Поздние сроки беременности.
Гипопитуитаризм.
Голодание или мальабсорбция.
причины и симптомы понижения сахара в крови
|
Статья подготовлена Михаилом Астаховым, врач анестезиолог-реаниматолог, высшей категории. Специально для сайта medprostor.by |
Гипогликемия — понижение сахара в крови. Симптомы развиваются постепенно, в течение 20-60 минут. Встречается преимущественно у лиц, страдающих сахарным диабетом I типа (инсулинозависимый) при нарушении правил заместительной терапии. Иногда возникает у беременных женщин или новорожденных детей. Минимальным приемлемым показателем глюкозы крови считается 3,3 ммоль/л. При декомпенсированном СД симптомы падения сахара в крови у человека возникают уже при 4,5 ммоль/л. В самых тяжелых случаях явления гипогликемии могут отмечаться при 6-7 ммоль/л.
Клинические признаки понижения уровня глюкозы
Падение сахара в крови, независимо от причин, имеет симптомы:
-
снижение интеллектуальных способностей; -
дезориентация, рассеянность; -
эйфория; -
сонливость; -
вялость; -
туман, мушки перед глазами; -
резкое, неудержимое чувство голода.
При осмотре пациента обнаруживается потливость, скачок артериального давления, тахикардия, бледность кожи. При возникновении гипогликемической комы — нарушение дыхания, сознания, сердечного ритма.
Причины снижения сахара в крови
Наиболее распространенная причина понижения глюкозы в крови — отсутствие приема пищи после инъекции инсулина у пациентов, страдающим сахарным диабетом. На долю подобных случаев приходится около 90% всех эпизодов диагностированной гипогликемии. Гормон, попадая в кровоток, способствует расщеплению и усвоению углеводов тканями. При этом их плазменный уровень критически снижается. Признаки патологии возникают при резком падении уровня сахаров с высоких цифр до низких или нормальных для здорового человека показателей (например, с 18-19 до 5-6 ммоль/л у диабетиков).
К числу других возможных причин резкого падения сахара в крови у пациентов с СД относится:
- Введение чрезмерной дозы инсулина. Происходит при неверном подборе дозировок врачом или ошибках при наборе препарата в шприц. Встречается преимущественно у людей, недавно начавших курс заместительной терапии. Тяжесть патологии напрямую зависит от того, на сколько была превышена необходимая доза лекарства.
- Повышенная физическая активность. Во время выполнения физической работы организм тратить энергию, которая восполняется за счет расщепления углеводов. Если была введена доза инсулина, после чего человек начал заниматься спортом или работать, может развиться гипогликемия легкой или средней степени.
- Прием алкоголя. Регулярное потребление спиртных напитков приводит к нарушению обмена углеводов в печени. Орган оказывается неспособен синтезировать глюкозу из протеинов и осуществлять поддержание ее необходимого уровня во внутренней среде. Это одна из частых причин низкого сахара в крови у мужчин.
Гипогликемия у новорожденных
Причины снижения сахара в крови у детей начального периода жизни:
-
синдром новорожденного от матери, страдающей классическим или гестационным диабетом; -
СД новорожденных; -
ятрогенная неонатальная гипогликемия; -
другие преходящие и неуточненные нарушения углеводного обмена.
Подобные нарушения обусловлены особенностями выработки и потребления сахаров организмом ребенка. Потребление глюкозы в раннем постнатальном периоде составляет около 7 г/кг веса в сутки. Недостаточное ее поступление провоцирует активизацию процессов гликогенолиза и глюкогеногенеза, что в дальнейшем может иметь непредсказуемые последствия.
Гипогликемия у здорового человека
Порой сахар в крови падает у беременных. Это обусловлено гормональной перестройкой организма, при которой возникает гиперпродукция инсулина поджелудочной железой. Кроме того, причиной низкого сахара в крови у женщины может быть недостаточность питания. Плод потребляет достаточно большое количество глюкозы. Если расход не компенсируется за счет пищи, концентрация сахаров во внутренней среде снижается.
У людей без сахарного диабета причиной гипогликемии становится инсулинома — гормонопродуцирующая опухоль поджелудочной железы. При этом концентрация инсулина в организме увеличивается, содержание сахаров снижается. Иногда падение уровня глюкозы возникает при экстремальном голодании, когда организм оказывается неспособен компенсировать недостаток углеводов за счет внутренних резервов.
Краткие выводы
- Причин снижения уровня сахара в крови множества (от сонливости и вялости, до эйфории и растерянности).
- У тех кто страдает сахарным диабетом это может быть вызвано как чрезмерной физ. нагрузкой, неверно введенной дозой инсулина так и приемом алкоголя.
- У новорожденных это может быть связанно как с сахарным диабетом так и с ятрогенной неонатальной гипогликемией.
- У здоровых людей это может быть в основном связанно с голоданием и опухолью поджелудочной железы.
Возможности применения современных устройств для мониторинга гликемии во время беременности | Ушанова Ф.О., Демидова Т.Ю.
Введение
Ведение женщин с нарушениями углеводного обмена во время беременности все еще остается непростой задачей для врачей, связанной с высокими требованиями к управлению заболеванием. Даже незначительное отклонение от целевых значений во время беременности несет в себе определенные риски. С одной стороны, сахарный диабет (СД) ассоциирован с разнообразной акушерской патологией и нарушениями нормального внутриутробного развития плода, с другой — беременность осложняет течение СД, повышая риск развития и прогрессирования диабетических осложнений, что требует постоянного тщательного мониторинга за состоянием беременной [1].
Согласно данным Международной диабетической ассоциации на сегодняшний день более 463 млн человек в возрасте 20–79 лет, а это около 9,3% взрослых, страдают СД. Кроме того, около 1,1 млн детей и подростков в возрасте до 20 лет больны СД 1 типа. По оценкам экспертов, к 2030 г. в мире будет насчитываться 578 млн взрослых с СД, а к 2045 г. — 700 млн [2]. В Российской Федерации в Государственном регистре больных СД на 1 января 2019 г. зарегистрировано 4,58 млн человек (3,12% населения РФ) [3]. При этом до 30–40% всех заболевших СД, в т. ч. СД 2 типа, составляют люди репродуктивного возраста. Эти данные позволяют утверждать, что все больше женщин репродуктивного возраста страдают нарушениями углеводного обмена, это требует особого внимания к тщательному планированию и ведению беременности с целью снижения риска неблагоприятных исходов для матери и плода.
Беременность может быть осложнена различными видами нарушений углеводного обмена:
прегестационный СД — существовавший у женщины до наступления беременности: СД 1 типа,
СД 2 типа и другие типы СД;
манифестный СД (1 типа, 2 типа или другие типы), выявленный впервые во время беременности;
гестационный СД (ГСД) — нарушение углеводного обмена, развивающееся во время беременности, характеризующееся менее выраженной гипергликемией, не соответствующей критериям манифестного СД.
Гипергликемия во время беременности может привести к различным осложнениям у матери и плода, наиболее значимыми из которых являются самопроизвольное прерывание беременности, преэклампсия, преждевременные роды, рождение крупного плода, родовой травматизм, неонатальная гипогликемия и др. Наиболее эффективным методом минимизирования рисков, связанных с СД, являются оптимизация контроля уровня глюкозы в крови и достижение компенсации СД до наступления и во время беременности [1]. При этом управление гликемией во время беременности может быть серьезной проблемой для врачей и пациенток в связи со специфическими особенностями углеводного обмена, изменением чувствительности к инсулину и лабильностью гликемии. Эффективность лечения напрямую зависит от активного, грамотного самоконтроля, осуществляемого самой больной в домашних условиях, в связи с чем все пациентки с СД и ГСД нуждаются в обучении. Им необходимо овладеть такими навыками, как самоконтроль за уровнем гликемии, кетонурии с ведением подробного дневника, коррекция дозы инсулина в зависимости от уровня гликемии и потребляемой пищи, профилактика и лечение гипогликемических и кетоацидотических состояний, соблюдение принципов рационального питания и выполнение программы физических нагрузок.
Самоконтроль во время беременности
К традиционным параметрам самоконтроля при СД относятся: контроль гликемии с помощью глюкометра, анализ крови и/или мочи на определение уровня кетонов.
Целевыми показателями гликемии для беременных женщин с манифестными формами СД являются [1]:
глюкоза плазмы натощак / перед едой / на ночь / ночью — <5,3 ммоль/л;
глюкоза плазмы через 1 ч после еды — <7,8 ммоль/л или через 2 ч после еды — <6,7 ммоль/л;
НbА1c — <6%.
При ГСД целями гликемического контроля являются следующие показатели:
глюкоза плазмы натощак / перед едой / на ночь / ночью — <5,1 ммоль/л;
глюкоза плазмы через 1 ч после еды — <7,0 ммоль/л.
Во время беременности при любом типе СД частота измерений гликемии очень важна. В этот период изменяются углеводные коэффициенты, чувствительность к инсулину, дозы инсулина требуют частой коррекции, в связи с чем пациенткам рекомендуется вести подробный дневник самоконтроля. Частота самоконтроля гликемии во время беременности на фоне инсулинотерапии должна составлять не менее 7–8 раз в сутки, зачастую требуется дополнительный контроль при плохом самочувствии, риске гипогликемии или на этапе титрации дозы инсулина. Кроме того, во время беременности необходимо проводить контроль уровня гликированного гемоглобина (HbA1c) 1 раз в 2–3 мес. При нормальной беременности продолжительность существования эритроцитов уменьшается, соответственно, сокращается время, в течение которого эритроцит подвергается процессу гликирования, что может сопровождаться занижением уровня HbA1c [4]. Данный факт подтверждает важность именно динамического ежедневного контроля гликемии. В то же время такой частый самоконтроль может нарушать привычный образ жизни и, соответственно, снижать приверженность беременных женщин выполнению рекомендаций. Кроме того, нередко можно столкнуться с проблемой косвенных признаков гипергликемии, таких как наличие диабетической фетопатии по данным УЗИ плода, при целевых показателях гликемии по данным дневника самоконтроля, что может свидетельствовать о скрытых эпизодах гипергликемии, не зафиксированных во время измерений.
Значение гликемической вариабельности
В последние годы все больше внимания при обсуждении развития диабетических осложнений уделяется концепции контроля углеводного обмена, основанной на оценке гликемической варибельности (ГВ). Многочисленные исследования позволяют сделать вывод о том, что хаотичные измерения содержания глюкозы с помощью глюкометра в дневное время, а также оценка уровня HbA1с не дают возможности оценить амплитуду колебаний гликемии в течение суток и не отражают такие важные параметры гликемического профиля, как время нахождения в состоянии гипо- или гипергликемии и ГВ. При одном и том же уровне HbA1с разница в диапазоне колебаний гликемии в течение дня является ведущим фактором, влияющим на развитие неблагоприятных последствий. По данным некоторых исследований, выраженная ГВ является даже более значимым фактором риска прогрессирования диабетических осложнений, чем хроническая гипергликемия [5]. При манифестном СД вклад ГВ в развитие осложнений не вызывает сомнений, значимость же данного параметра при ГСД остается не до конца изученной. Исследования, в которых проводилось сравнение ГВ у женщин с ГСД и беременных женщин без нарушений углеводного обмена, показали неоднозначные результаты. В некоторых исследованиях было подтверждено, что колебания уровня глюкозы в крови у беременных с ГСД выше, чем у здоровых беременных [6–8]. Так, R. Mazze et al. выявили значимое повышение вариабельности уровня глюкозы в группе беременных с ГСД по сравнению с беременными с нормальной гликемией [6]. Аналогичные результаты получены в исследовании Su et al. и других работах [7]. Таким образом, ГВ как компонент гликемических нарушений оказывает большее влияние, чем хроническая гипергликемия, на развитие диабетических осложнений [8].
Для оценки ГВ может быть использован комплекс показателей и индексов, рассчитываемых на основании данных непрерывного мониторинга гликемии (НМГ), который обеспечивает более полное представление о гликемических экскурсиях, включая продолжительность и частоту колебаний. Одним из основных параметров оценки вариабельности гликемии является MAGE (Mean Average of Glucose Excursions — средняя амплитуда колебаний глюкозы, превышающих по модулю одно стандартное отклонение (SD)). Известно, что MAGE коррелирует с другими показателями ГВ, прежде всего с различными вариантами расчета показателя SD: суточного, межсуточного, прандиального, ночного, которые стали входить в протоколы рутинного НМГ. McDonnell et al. [9] в качестве нового индекса для оценки вариабельности уровня глюкозы в крови, обеспечивающего более точное измерение внутрисуточной изменчивости глюкозы, предложили индекс длительного повышения гликемии (CONGA, continuous overlapping net glycemic action). Высокое значение CONGA указывает на нестабильный контроль уровня глюкозы в крови, а низкое значение соответствует стабильному контролю. Поскольку большинство индексов зависят в основном от высокого уровня глюкозы в крови, низкие значения уровня гликемии часто выпадают из фокуса внимания, на основании чего в 2006 г. Kovatchev et al. [10] предложили использовать среднесуточный диапазон риска (ADRR, average daily risk range) в качестве нового индикатора для оценки ГВ, который одинаково чувствителен к гипо- и гипергликемии и может быть легко определен с помощью самоконтроля. Значение ADRR — это гликемические данные, преобразованные в соответствующее значение риска возникновения гипер- и гипогликемии. Значение данного показателя является основой для разделения пациентов по категориям риска лабильности гликемии: низкий риск — 0–19, средний — 20–40, высокий — 40 и более. В рекомендациях Американской диабетической ассоциации 2020 г. предлагается новый индикатор — время в целевом диапазоне (TIR, time in range) — который относится к временному или процентному содержанию глюкозы в крови в пределах целевого диапазона в течение 24 ч. Целью TIR-контроля является обеспечение стабильного «гомеостаза глюкозы». Целевой показатель TIR, т. е. время нахождения гликемии в целевом диапазоне, должен быть больше 70%. TIR менее данного значения отражает наличие колебаний уровня глюкозы, требующее вмешательств со стороны врача или пациента [11].
Таким образом, получить более подробную информацию о гликемической кривой, особенно при лабильном течении СД или трудностях в оценке степени компенсации ГСД, беременным женщинам помогут современные устройства для НМГ.
Возможности НМГ во время беременности
НМГ помимо простого увеличения количества измерений глюкозы обеспечивает детальную информацию о характере и тенденциях к изменению ее уровня, колебаниях гликемии, позволяет идентифицировать периоды скрытых ночных гипогликемий, постпрандиальных гипер-гликемий. Анализ данных НМГ помогает более качественно корректировать инсулинотерапию или принимать решение о ее инициации, вносить изменения в план питания и физической активности.
Данные о влиянии НМГ на здоровье матери и новорожденных были получены в исследовании CONCEPTT [12]. В его рамках оценивались результаты использования НМГ в группе беременных и группе планирующих беременность. В CONCEPTT были включены 215 беременных с СД 1 типа, находящихся на инсулинотерапии, из различных медицинских центров. 108 участниц измеряли уровень глюкозы крови с помощью устройства для НМГ и глюкометра (использовался для калибровки показателей устройства суточного мониторинга), а 107 — только с помощью глюкометра (контрольная группа). По результатам исследования было выявлено, что беременные с НМГ дольше имели целевые значения глюкозы крови, чем контрольная группа (68% времени в целевом диапазоне у беременных с НМГ против 61% времени в контрольной группе), и менее продолжительно испытывали состояние гипергликемии (27% и 32% времени соответственно). При этом число и общая продолжительность эпизодов гипогликемии были сходными. В группе НМГ было выявлено лучшее достижение целевых значений HbA1c — до 66%, в то время как в контрольной группе этот показатель составил 40%. Обращают на себя внимание результаты, связанные с новорожденными: в среднем в группе НМГ в 2 раза снизились частота рождения детей с большой для гестационного возраста массой тела и ростом, частота реанимационных мероприятий длительностью более 24 ч, а также продолжительность пребывания новорожденного в роддоме. Отмечается, что среди пользователей НМГ чаще регистрировались нежелательные эффекты в виде раздражения кожи, вероятно, из-за приклеиваемого сенсора: 48% против 40% в контрольной группе.
В фундаментальном исследовании последствий гипер-гликемии у беременных женщин с ГСД HAPO (Hyperglycemia and adverse pregnancy outcomes) [13] в 2008 г. была выявлена корреляция между повышением уровня глюкозы в плазме и каждым из 5 вторичных исходов: преждевременными родами, дистоцией плечиков или родовым травматизмом, интенсивной неонатальной помощью, гипербилирубинемией и преэклампсией. В данном исследовании было выявлено, что параметр MAGE может являться маркером прогнозирования преэклампсии, макросомии, неонатальной гипогликемии и комбинированного неонатального исхода. Еще один параметр оценки гликемической кривой — среднесуточный уровень глюкозы крови (MBG, mean of daily continuous 24 h blood glucose) продемонстрировал ассоциацию с развитием таких неонатальных осложнений, как макросомия, дефицит массы тела плода, частота респираторного дистресс-синдрома плода. Результаты исследования также демонстрируют, что использование устройств для НМГ в дополнение к традиционным методам управления гликемией может снизить риск неблагоприятных последствий для матери и плода при ГСД за счет улучшения ГВ.
Улучшение гликемического контроля и исходов беременности при СД 1 типа и СД 2 типа благодаря использованию НМГ также подтверждено в исследовании Murphy et al. [14]. В нем использование устройств для НМГ было ассоциировано со снижением риска преэклампсии, частоты кесарева сечения, уменьшением массы тела плода и нео-натальных осложнений. В то же время по результатам некоторых исследований [15, 16], сравнивавших эффективность систем НМГ с самоконтролем гликемии с помощью глюкометра у беременных с ГСД, значимых различий выявлено не было. Такие первичные исходы, как частота кесарева сечения, перинатальной смертности или макросомии, а также неонатальной гипогликемии, не продемонстрировали значимых различий в группах применения традиционного самоконтроля и НМГ. Выраженная разница в группах была получена в показателях гестационной прибавки массы тела, значения которой были ниже в группе применения НМГ, и более частом назначении инсулинотерапии в данной группе. Схожие результаты, не продемонстрировавшие значимое положительное влияние НМГ в отношении исходов беременности, получены в исследовании GlucoMOMS [17], включавшем 300 женщин с СД 1 типа и СД 2 типа на сроке до 16 нед. и ГСД на сроке до 30 нед. В данном исследовании проводилась сравнительная оценка исходов беременности, в частности частоты макросомии, у женщин, проводивших контроль с помощью глюкометра 5–7 раз в сутки, и у женщин, которым проводился НМГ в «слепом» режиме, а затем врачом корректировалась терапия. Частота макросомии составила 31,0% в группе НМГ и 28,4% в группе стандартного лечения. Уровни HbA1c были одинаковыми в группах лечения. Таким образом, ретроспективный анализ использования НМГ предоставлял подробную информацию о колебаниях гликемии, но не был ассоциирован со снижением риска макросомии.
Флеш-мониторинг гликемии во время беременности
На сегодняшний день возможности мониторинга гликемии значительно расширены. НМГ может проводиться в «слепом» режиме (профессиональный), в режиме реального времени (постоянный) и путем периодического сканирования (флеш-мониторинг). Устройства для флеш-мониторинга отображают уровень глюкозы в интерстициальной жидкости, аналогично устройствам для НМГ, считывают информацию в течение 14 дней. В отличие от приборов для НМГ, не требуетcя калибровка глюкометром благодаря технологии, позволяющей проводить заводскую калибровку, что исключает необходимость проколов пальцев для измерения уровня глюкозы в крови. При флеш-мониторинге данные об уровне глюкозы могут быть получены только по запросу, не отображаясь в постоянном режиме. Помимо уровня гликемии в настоящий момент времени на экране отображаются тренды в виде стрелки и график гликемии за предыдущие 8 ч [18]. Частое измерение концентрации глюкозы способствует тому, что пациентки реже находятся в состояниях гипо- и гипергликемии и улучшают свой средний уровень глюкозы благодаря коррекции терапии.
В настоящее время данные о влиянии флеш-мониторинга на течение СД и его осложнений в период беременности немногочисленны. Одна из работ была посвящена оценке приемлемости и точности данных, полученных при использовании флеш-мониторинга гликемии, по сравнению с применением глюкометра у беременных с СД. Это проспективное многоцентровое исследование, включавшее 74 беременных с СД 1 типа, СД 2 типа и ГСД, находившихся на инсулинотерапии, диетотерапии или терапии метформином. Датчики для мониторинга гликемии использовались в течение 14 дней, при этом значения глюкозы сравнивались со значениями, полученными с помощью глюкометра (измерения проводились не реже 4 раз в сутки). В результате исследования была продемонстрирована клиническая точность результатов сенсора при сравнении с данными глюкометра — около 88,1%, общая средняя относительная разница составила 11,8%. На результаты не повлияли тип СД, срок беременности, возраст или индекс массы тела. Не было зарегистрировано непредвиденных нежелательных явлений, связанных с применением устройства. Таким образом, в ходе данного исследования было продемонстрировано удовлетворительное соответствие между значениями сенсора и уровнями глюкозы в капиллярной крови, что подтверждает приемлемость флеш-мониторинга гликемии в ведении беременных женщин с нарушениями углеводного обмена. На точность системы не повлияли характеристики пациенток, что указывает на безопасность системы для использования беременными женщинами с СД. При этом удобство использования НМГ у беременных обусловлено отсутствием необходимости прокалывания пальцев (в т. ч. для калибровки, как при использовании НМГ), что способствовало более частому самоконтролю и, соответственно, улучшению показателей гликемии [19]. В другом исследовании [20], посвященном сравнению эффективности флеш-мониторинга и стандартного самоконтроля с помощью глюкометра, подтверждается большая эффективность первого метода. Продемонстрировано положительное влияние данного метода самоконтроля на продолжительность гипогликемии (<3,9 ммоль/л) — время снизилось на 38%, без изменения общей суточной дозы инсулина [20]. Несомненно, необходимы дальнейшие исследования, направленные на оценку эффективности флеш-мониторинга гликемии в отношении улучшения гликемического контроля и исходов беременности для матери и плода.
Недостатки применения НМГ во время беременности
НМГ очень полезен в качестве дополнительного инструмента контроля углеводного обмена во время беременности, но некоторые факторы могут ограничивать использование данных устройств [21–23]. Дискомфорт может быть связан с необходимостью ношения сенсора, что наиболее заметно проявляется с увеличением срока беременности и, соответственно, размеров живота. Устройства для флеш-мониторинга, в которых сенсор устанавливается на заднюю поверхность плеча, лишены этого недостатка. Также к ограничениям использования таких устройств относится необходимость привлечения медработников к анализу полученных данных, недостаточная их осведомленность и необходимость обучения. Кроме того, поводом для отказа от традиционных глюкометров могут быть технические проблемы и неточность данных, получаемых с помощью устройств НМГ, необходимость калибровки (не для всех устройств), хотя с каждым годом производителями обеспечивается все более высокая информативность и чувствительность сенсоров. Следует также помнить, что беременность сопровождается физиологическим изменением состава интерстициальной жидкости, что также может повлиять на точность датчика, хотя данный фактор не получил подтверждения в одном из исследований [24]. Еще одним пунктом, ограничивающим применение НМГ в клинической практике, несомненно, является высокая стоимость данных устройств [25]. В завершение стоит отметить, что возможности, безопасность и точность устройств для НМГ совершенствуются, многие недостатки в новых устройствах нивелируются, что делает использование НМГ в рутинной практике более полезным и доступным.
Удаленный мониторинг гликемии во время беременности
В некоторых странах в последние годы в клинической практике достаточно широко применяется удаленный мониторинг глюкозы с помощью специальных программ. Использование удаленного мониторинга уровня глюкозы дает возможность просмотра данных глюкометра, НМГ или флеш-мониторинга гликемии в виде суточных графиков и других отчетов врачом с помощью специального программного обеспечения (например, CareLink и CareLink Pro для продуктов Medtronic [26–29], Studio, Share и Clarity для продуктов Dexcom [30], Tidepool Blip [31] и Diasend [32]). Программное обеспечение и онлайн-программы могут использоваться как для удаленного контроля в режиме реального времени, так и для ретроспективного мониторинга данных об уровне глюкозы у пациенток с СД [33–35]. В некоторых исследованиях проводилась оценка возможности и эффективности дистанционного мониторинга данных глюкометра, на основании которого проводилась коррекция терапии беременных женщин с ГСД и СД 1 типа [36–39]. На научной сессии Американской диабетической ассоциации в 2016 г. были также представлены данные анализа дистанционного мониторинга показателей НМГ у беременных с СД 1 типа. По результатам наблюдения отмечена тенденция к улучшению контроля уровня глюкозы и снижению риска гипогликемий [40].
На сегодняшний день в нашей стране возможность использования программ для дистанционного мониторинга отсутствует. Проводятся исследования, направленные на оценку эффективности и целесообразности такого способа управления гликемией. Возможно, в недалеком будущем с помощью удаленного мониторинга взаимодействие врача и пациентки на этапах подбора и коррекции терапии, особенно актуальное в период беременности, будет совершенствоваться.
Заключение
На сегодняшний день данные об эффективности и целесообразности применения современных технологий мониторинга гликемии в профилактике различных диабетических осложнений во время беременности противоречивы. Для улучшения понимания того, что внедрение современных устройств НМГ в широкую клиническую практику при беременности необходимо, продолжаются различные исследования, затрагивающие не только манифестные формы нарушений углеводного обмена, но и ГСД. И если в первом случае преимущества НМГ очевидны, то в отношении пограничных изменений, характерных для ГСД, необходимо дальнейшее изучение вопроса приемлемости и обоснованности данных методов контроля гликемии. Накопленная информация о возможностях НМГ может стать основой для расширения применения таких устройств в рутинной практике и улучшения качества ведения больных с различными формами нарушения углеводного обмена во время беременности.
Сведения об авторах:
Ушанова Фатима Омариевна — ассистент кафедры эндокринологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5512-6899.
Демидова Татьяна Юльевна — д.м.н., профессор, заведующая кафедрой эндокринологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6385-540X.
Контактная информация: Ушанова Фатима Омариевна, e-mail: [email protected]. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.08.2020, поступила после рецензирования 03.09.2020, принята в печать 16.09.2020.
About the authors:
Fatima O. Ushanova — assistant of the Department of Endocrinology of the Medical Faculty, Pirogov Russian National Research Medical University, 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-5512-6899.
Tat’yana Yu. Demidova — Doct. of Sci. (Med.), Professor, Head of the Department of Endocrinology of Medical Faculty, Pirogov Russian National Research Medical University, 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-6385-540X.
Contact information: Fatima O. Ushanova, e-mail: [email protected]. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.08.2020, revised 03.09.2020, accepted 16.09.2020.
.
Раздел для практикующего врача, назначающего лечение, наглядно демонстрирующий применение новейших научных разработок в области медицины. Статьи носят рекомендательный характер, сочетая в себе практическую информацию и научные обзоры.
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Журнал «Медицинский совет» №2, 2018
DOI: http://dx.doi.org/10.21518/2079-701X-2018-2-233-237
А.В. Дегтярева1,2, д.м.н., А.А. Пучкова1, к.м.н., А.В. Болмасова1, к.м.н., М.А. Меликян3, к.м.н.
1 Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
2 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
3 Эндокринологический научный центр Минздрава России, Москва
Синдром моносомии 18р- – крайне редкое заболевание (1:50000 новорожденных, родившихся живыми). Врожденный гипопитуитаризм является одним из проявлений данного синдрома в 13% случаев. Редкость данной патологии обуславливает трудности ранней диагностики врожденного гипопитуитаризма в силу недостаточной осведомленности среди педиатров и неонатологов. В данной статье представлен клинический случай врожденного гипопитуитаризма у девочки с синдромом моносомии 18р-, который проявлялся после рождения симптомами холестаза и гипогликемией.
A.V. Degtyareva1,2, MD, А.А. Puchkova1, PhD in medicine, A.V. Bolmasova1, PhD in medicine, M.A. Melikyan3
1 Kulakov Scientific Center for Obstetrics, Gynaecology and Perinatology of the Ministry of Health, Moscow
2 Sechenov First Moscow State Medical University of the Ministry of Health of Russia
3 Endocrinology Research Center of the Ministry of Health of Russia, Moscow
Cholestasis, hypoglycemia and unusual phenotype as the manifestations of congenital hypopituitarism as part of monosomy 18P- syndrome
The monosomy 18p-syndrome refers to an extremely rare disorder (1:50,000 live-born infants). Congenital hypopituitarism is one of the manifestations of this syndrome in 13% of cases. The rarity of this pathology causes difficulties in the early detection of congenital hypopituitarism due to lack of awareness among paediatricians and neonatologists. The article presents a clinical case of congenital hypopituitarism in a girl with monosomy 18p-syndrome, which manifested itself after birth in the form of cholestasis and hypoglycaemia.
Загрузить файл
Список литературы
1. de Grouchy J, Lamy M, Thieffry S, Arthuis M, Salmon CH: Dysmorphie complexe avec oligophrenie: deletion des bras courts d’un chromosome 17-18. C R Acad Sci, 1963, 258: 1028.
2. de Grouchy J. The 18p, 18q and 18 syndromes. Birth defects Orig Art Ser, 1969, V: 74-87.
3. Nusbaum C, Zody MC, Borowsky ML, Kamal M, Chinappa D Kodira, Todd D. Taylor et al. DNA sequence and analysis of human chromosome 18. Nature, 2005, 437: 551-555.
4. Sebold C, Soileau B, Heard P, Carter E, O’Donnell L, Hale DE, et al. Whole arm deletions of 18p: Medical and developmental effects. Am J Med Genet Part A, 2015, 167A: 313-323.
5. Turleau С. Monosomy 18p. Review Orphanet Journal of Rare Diseases, 2008, 3: 4.
6. Козлова С.И., Демикова Н.С. Наследственные синдромы и медико-генетическое консультирование. КМК, Авторская академия, Москва 2007.
7. Hasi-Zogai M, Sebold C, Heard P, Carter E, Soileau B, Hill A, et al. A Review of 18p Deletions. American Journal of Medical Genetics Part C (Seminars in Medical Genetics), 2015, 169C: 251-264.
8. Дегтярева А.В, Мухина Ю.Г, Дегтярев Д.Н. Синдром холестаза у новорожденных детей. Пособие для врачей. М: 4ТЕ АРТ, 2011. 36 с.
9. Mauvais F-X, Gonzales E, davit-Spraul A, Jacquemin E, Brauner R. Cholestasis Reveals Severe Cortisol Deficiency in Neonatal Pituitary Stalk Interruption Syndrome. PLOS ONE, 2016, February 1. DOI: 10.1371/journal.pone.0147750.
10. Braslavsky D, Keselman A, Galoppo M, Lezama C, Chiesa A, Galoppo C et. Al. Neonatal cholestasis in congenital pituitary hormone deficiency and isolated hypocortisolism: characterization of liver dysfunction and follow-up. Arq Bras Endocrinol Metab, 2011, 55/8.
11. Lammoglia J, Eyzaguirre F, Unanue N, Román R, Codner E., Cassorla F. et al. Hipopituitarismo congénito: experiencia en 23 casos. Rev Méd Chile, 2008, 136(8): 996-1006.
12. De León D, Stanely C, Sperling M. Hypoglycemia in Neonates and Infants. En: Sperling M. Pediatric Endocrinology. 3 ed. Filadelfia: Saunders. 2008: 710-5.
13. Дегтярева А.В., Пучкова А.А, Мухина Ю.Г, Лукина Л.И, Кыштымов М.В. Урсодезоксихолевая кислота в комплексной терапии неонатального холестаза. Вестник педиатрической фармакологии и нутрициологии, 2006, 3(2): 27-31.
Гипогликемия новорожденных | Американская академия педиатрии
- Джейн Э. Макгоуэн, доктор медицины *
- * Доцент педиатрии, MCP
Университет Ганемана и больница Святого Христофора
для детей, Филадельфия, Пенсильвания.
ЦЕЛИ
После прочтения этой статьи читатели должны иметь возможность:
Описать наиболее частую причину затяжных неонатальных заболеваний.
гипогликемия.Перечислите признаки гипогликемии.
Опишите состояние, которое было задействовано как механизм
гипогликемическая травма головного мозга.
Пример из практики
Доношенный младенец мужского пола родился после
протекающая без осложнений беременность
28-летняя беременная I женщина, которая
не имел признаков гипергликемии
и никаких хронических заболеваний. Младенец
имел баллы по шкале Апгар 7 и 9 на
1 и 5 минут соответственно. Его
параметры роста были в
нормальный диапазон, при весе на 60-м
процентиль, окружность головы на
50-й процентиль и длина на
50-й процентиль.Ребенка забрали
к колодцу детскую, осмотрели
и купались, а потом отнесли в
мать для кормления около 2 часов
возраста. Он выглядел слегка нервным
в то время и было не очень
заинтересованы в уходе или очень осведомлены.
Концентрация глюкозы в крови
1,39 ммоль / л (25 мг / дл) было
полученные с помощью One Touch ®
инструмент. Ребенка кормили 25 мл
5% раствор декстрозы в воде. Кровь
полученная концентрация глюкозы
1 час спустя 2,22 ммоль / л.
(40 мг / дл), и ребенок, которого кормили грудью в течение
около 5 минут на каждую грудь с
очевидное удовлетворение.Дрожь и «
отсутствие интереса ».
Обычный режим работы в яслях был
последовал, без комментариев в диаграмме
медперсоналом о
кормление или поведение младенца до тех пор, пока
второй день жизни, когда он снова
казался нервным и суетливым. Глюкоза
концентрация в то время была
1,11 ммоль / л (20 мг / дл). Младенец
кормили грудью или из бутылочки (обычное
Домашняя формула 20 ккал / унция)
чередование каждые 2 часа и клинические признаки
улучшенный. One Touch ® глюкоза
концентрации, полученные в течение следующих
24 часа были переменными, но в целом
концентрация увеличилась, с
перед выпиской, предрандиальная стоимость
2.78 ммоль / л (50 мг / дл).
Семья не вернулась в
больничная клиника на следующий день, но сделал
обратитесь к своему лечащему врачу на
пятый день жизни в это время
младенец вел себя голодным, был отмечен
быть «очень активным» и взвешенным
На 113,4 г больше веса при рождении. В
2 недели жизни, отметили родители
младенец быть очень суетливым и
нервничать и испытывать приступы пристального взгляда.
В местном отделении неотложной помощи он
было отмечено, что похудел,
казался сонным, но суетливым, когда
возбудился, и начал
тонико-клонические подергивания всех
конечности.«Глюкоза
концентрация »была менее 0,55 ммоль / л.
(10 мг / дл). Младенец лечился
с внутривенным введением глюкозы, и
очевидный приступ разрешился. Над
следующие несколько недель младенец
вернулся в аварийную ситуацию
отдел несколько раз с похожими
эпизоды.
При окончательном осмотре
врач-терапевт, младенец
набрала 283,5 г и появилась «
пухлый. «Офисная глюкоза»
концентрация »составляла 1,94 ммоль / л (35
мг / дл). Младенец был направлен в
детский эндокринолог, отметивший
что вес младенца был
приближается к 90-му процентилю,
была определенная гепатомегалия,
и младенец выглядел «апатичным».”
В больнице несколько сывороток
концентрации глюкозы были измерены
менее 2,22 ммоль / л (40
мг / дл), с инсулином в плазме
все концентрации более 144 пмоль / л
(20 мкЕд / мл).
Младенец лечился
диазоксид с ограниченным успехом
в течение следующих 3 месяцев.
Разработка продолжалась, но была «медленной». Он
лечился в местной неотложной помощи
отдел трижды для
тонико-клонические судороги, требующие
внутривенное введение глюкозы для коррекции тяжелой
гипогликемия. В 5-месячном возрасте
младенец прошел промежуточный итог
панкреатэктомия.Во время выздоровления у него был
тяжелый, продолжительный приступ и был
был в шоке, требуя двух
туры реанимации. Эшерихия
coli был диагностирован менингит и
лечится успешно.
В возрасте 1 года младенец
показал небольшой прогресс в развитии
с 6-месячного возраста. Через 5 лет
возраст, он выставлялся крайне бедным
рост, был сахарный диабет,
потребовалось лечение инсулином, и
требуемый фермент поджелудочной железы
замена кормлением для лечения
мальабсорбционная диарея.Он был почти
полностью глухой и пометил
отставание в развитии. Его родители
обратился за помощью к адвокату, утверждая, что
лечащие врачи в родах
больнице не удалось диагностировать «
гиперинсулинизм », которое затем привело
к несвоевременной диагностике и лечению,
с последующим тяжелым неврологическим
повреждать.
Вопросы для рассмотрения (не стесняйтесь
отправьте свои ответы на эти
вопросы и любые ваши собственные вопросы
на рассмотрение «экспертов» и
обсудить об этом случае):
Какой вероятный диагноз
для гипогликемии этого младенца?Какие диагностические тесты могут
были сделаны в роддоме
определить, есть ли у младенца
временный или постоянный
гипогликемия?Что можно было сделать
до выписки из родов
больница, чтобы предоставить доказательства
способность младенца поддерживать нормальный
концентрация глюкозы в крови с
нормальный график кормления?Что сделала панкреатическая
патологическое обследование, вероятно, покажет
на момент подведения итогов
панкреатэктомия?Как бы вы оценили
клинический результат в отношении
первичный диагноз и его
осложнения по сравнению с менингитом E coli
и шок?
Уильям У.Хэй, младший, доктор медицины, соредактор
Введение
Глюкоза является основным источником
энергия для работы органов. Несмотря на то что
все органы могут использовать глюкозу,
человеческий мозг использует это почти
исключительно как субстрат для энергии
метаболизм. Потому что церебральный
запасы гликогена ограничены, техническое обслуживание
адекватной доставки глюкозы в
мозг является важным физиологическим
функция. Высота
соотношение массы тела и мозга у новорожденного
приводит к пропорционально более высокому
потребность в глюкозе по сравнению с
емкость для производства глюкозы
чем то, что встречается у взрослого,
с учетом использования церебральной глюкозы
на целых 90% общей глюкозы
потребление.Хотя альтернативный
топливо, такое как лактат и кетон
тела, можно использовать как подложку
для производства энергии
противодействие незрелому новорожденному
ответ ограничивает доступность
эти молекулы. Таким образом, новорожденные
чрезвычайно восприимчив к любому
состояние, которое ухудшает положение
нормального гомеостаза глюкозы
при переходе с внутриутробного
к самостоятельной внематочной жизни.
Гомеостаз глюкозы в утробе матери
Глюкоза является одним из основных
субстраты для метаболизма плода.Под
нормальные условия (т.е. нормальные
материнский уровень глюкозы), практически все
глюкоза, используемая плодом,
поступает из материнского кровообращения
через облегченное распространение через
плацента. Это приводит к зарождению плода.
концентрация глюкозы в крови
примерно 70% материнских
ценить. Хотя ферменты
необходим как для глюконеогенеза, так и для
гликогенолиз присутствуют в
человеческий плод к концу первого
триместр, несколько исследований
продемонстрировал отсутствие значительных
производство глюкозы у плода
если не будет устойчивого снижения
в пуповинном поглощении глюкозы.Глюкоза
коэффициент использования у плода
оценивается от 4 до 6 мг / кг на
минута. Примерно от 60% до 70%
утилизации глюкозы плода
объясняется окислением
глюкоза углерода до CO 2 , с
остаток доступен для синтеза
гликоген и другие макромолекулы.
У человеческого плода окисление
глюкоза составляет примерно
80% потребления кислорода плодом,
демонстрируя, что глюкоза — это
основной субстрат для оксидативного
метаболизм.
Скорость, с которой плод использует
глюкоза в первую очередь является функцией
концентрация глюкозы, хотя
изменения концентрации инсулина
может иметь скромное влияние, поскольку
Что ж.Исследования показали, что
уровни инсулина поджелудочной железы плода
секреция коррелирует с изменениями в
концентрация глюкозы у плода, но
панкреатический ответ притупляется
по сравнению с новорожденным или взрослым.
Секреция инсулина в ответ на развитие плода.
гипергликемия увеличивает глюкозу
скорости утилизации и окисления, но это
мало влияет на метаболизм плода
скорость или скорость кислорода
потребление, предполагая, что окисление
другие субстраты уменьшаются под
эти условия. Уменьшено
окисление субстратов, таких как амино
кислоты и лактат приводят к увеличению
наличие этих субстратов для
срастание тканей и может учитывать
часть для повышенного соматического
рост, связанный с плодом
гиперинсулинемия.
В моделях на животных, введение
глюкагона не имеет
прямое влияние на глюкозу плода
метаболизм. Однако соотношение
инсулин в глюкагон у плода
циркуляция играет решающую роль в
регулирование баланса между глюкозой
потребление и хранение энергии.
Высокое соотношение инсулин: глюкагон у
кровообращение плода приводит к
активация синтеза гликогена и
подавление гликогенолиза за счет
регулирующий деятельность печени
ферменты, используемые для этих процессов.Преобладание инсулина поддерживает
гликогенсинтаза в активной форме
и гликогенфосфорилаза в его
неактивная форма через цАМФ-зависимую
эффекты на специфические протеинкиназы
и фосфорилазы, таким образом усиливая
синтез гликогена и минимизация
гликогенолиз. У большинства видов
включая человека, печеночный гликоген
запасы накапливаются медленно во время
ранние и средние сроки беременности, с быстрым
увеличение содержания гликогена в печени
происходящие в течение последних 30%
жизнь плода. Заметное увеличение
синтез гликогена во время этого
период связан с увеличением
в циркулирующих концентрациях обоих
инсулин и кортизол.Поскольку
повышение уровня кортизола кажется
необходимо для максимальной активации
гликогенсинтаза, надпочечники плода
дисфункция может ограничивать гликоген в печени
накопление на поздних сроках беременности.
В условиях, связанных с
снижение уровня глюкозы у плода
концентрации и повышенный глюкагон
секреция, например, хроническая гипогликемия
или гипоксемия, гликоген
фосфорилаза активируется, а синтаза
преобразован в неактивную форму,
тем самым подавляя гликоген
синтез и стимуляция
гликогенолиз с последующим истощением
запасы гликогена плода.Высота
соотношение инсулин: глюкагон также подавляет
липолиз, что позволяет
энергия должна храниться в виде
подкожно-жировая клетчатка. Таким образом, плод
гормональная и метаболическая среда
налаживает поставку готового субстрата
которые можно использовать во время
метаболический переход от плода к
новорожденный.
Гомеостаз глюкозы у новорожденного
Относительная зависимость плода
на постоянный приток материнских
глюкоза требует значительных
изменения в регуляции глюкозы
метаболизм при рождении после
резкое прерывание пуповины
доставка глюкозы.Хотя точный
триггер неизвестен, количество
физиологические изменения снабжают
новорожденный для поддержания уровня глюкозы
гомеостаз. Повысился
концентрация катехоламинов немедленно
следующие роды стимулируют
секреция глюкагона с последующим
снижение инсулина: глюкагон
соотношение. Гликогенсинтаза — это
инактивирована и гликогенфосфорилаза
активируется, что приводит к стимуляции
гликогенолиз и ингибирование
синтез гликогена. Высвобождение глюкозы
из гликогена обеспечивает быстрое
доступный источник глюкозы для
новорожденный в первые несколько часов
послеродовой.Однако это было
по оценкам, доношенные младенцы имеют только
достаточное количество печеночного гликогена для поддержания
запас глюкозы примерно на
10 часов. Следовательно, другие
механизмы необходимы для поддержания
гомеостаз глюкозы. Высота
соотношение глюкагон: инсулин также в послеродовом периоде
индуцирует синтез ферментов
требуется для глюконеогенеза. С
сочетание выпуска
жирные кислоты, стимулируемые высоким
концентрации катехоламинов, которые
приводит к заметному увеличению
наличие и доступность глицерина
свободных аминокислот в
кровообращение, младенец становится способным к
значительный глюконеогенез от 4 до
6 часов жизни.Однако фермент
занятия не достигают взрослого уровня
до 1–2-недельного возраста.
Показатели использования базальной глюкозы в
новорожденному от 4 до 6 мг / кг
в минуту, почти вдвое больше
удельные веса у взрослых. Вовремя
первые несколько часов жизни, уровень глюкозы в крови
концентрации падают от плода
ценность, которая отражает материнскую
концентрация глюкозы в крови, как
низкий 1,7 ммоль / л (30 мг / дл)
до того, как младенец достигнет
метаболический переход к самостоятельному
производство глюкозы и устанавливает
послеродовой гомеостаз глюкозы.До того как
экзогенная подача субстрата
обеспечивается либо энтеральным кормлением
или введение внутривенного
жидкости, вывод глюкозы в печени служит
самый значительный источник
глюкоза для удовлетворения метаболических потребностей. К
поддерживать нормальный уровень печеночного
производство глюкозы, младенец должен
иметь адекватные запасы гликогена
и глюконеогенные предшественники
(например, жирные кислоты, глицерин, амино
кислоты и лактат), соответствующие
концентрации печеночных ферментов
необходим для глюконеогенеза и
гликогенолиз и в норме
функционирующая эндокринная система.Отсутствие
любого из этих требований приводит
к нарушению гомеостаза глюкозы,
чаще всего приводит к
неонатальная гипогликемия.
Заболеваемость, диагноз и клиническая картина
ЗАБОЛЕВАЕМОСТЬ
Оценки заболеваемости
гипогликемия у новорожденного зависит
как по определению
состояние и методы, с помощью которых
концентрация глюкозы в крови
измеряется. Общая заболеваемость
оценивается от 1 до 5 на 1000
живорождений, но это выше в группе риска
населения.Например, 8%
большие для гестационного возраста младенцы
(в первую очередь младенцы от матерей с диабетом [
IDMs]) и 15% недоношенных детей.
и младенцы с внутриутробным
задержка роста (ЗВУР)
сообщается как имеющий
гипогликемия; заболеваемость в целом
популяция младенцев «высокого риска» может быть
до 30%.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Концентрация глюкозы в крови
при котором диагностируется неонатальный
гипогликемия должна быть
были весьма противоречивыми.
Гипогликемия у доношенных детей наблюдалась.
определяется как значение глюкозы в крови
менее 2.0 ммоль / л (<35 мг / дл)
или как значение глюкозы в плазме
менее 2,2 ммоль / л (<40 мг / дл).
Однако недавний обзор
педиатры в Великобритании
продемонстрировал отсутствие консенсуса в отношении
уровень глюкозы в крови, который они
считается «гипогликемией». Они процитировали
концентрации в диапазоне от
От 1 ммоль / л (20 мг / дл) до 4 ммоль / л
(70 мг / дл) как нижний предел
нормальный. Далее, определения
гипогликемия основана прежде всего на
популяционные исследования крови или
концентрация глюкозы в плазме
в течение первых 48-72 часов жизни,
с гипогликемией, определяемой как
уровень глюкозы в крови более чем
2 стандартных отклонения ниже
Средняя численность населения.Такие определения имеют
только ограниченный физиологический
значимость.
Физиологически гипогликемия
присутствует, когда доставка глюкозы
неадекватно для удовлетворения потребности в глюкозе
и может произойти в диапазоне
концентрации глюкозы в зависимости от
статус младенца. Например,
2-часовой здоровый младенец, у которого
уровень глюкозы в крови 1,7 ммоль / л
(30 мг / дл) может не демонстрировать
нарушение функции органа, но
находящийся в стрессовом состоянии младенец может продемонстрировать
физиологическая гипогликемия в крови
концентрация глюкозы 2.8 ммоль / л
(50 мг / дл), если уровень глюкозы
доставка в определенные органы (например,
мозг) меньше, чем скорость
утилизация глюкозы. На сегодняшний день исследований нет
установили абсолютную кровь
концентрация глюкозы, при которой
краткосрочный или долгосрочный орган
неизменно возникает дисфункция, хотя
исследования на животных показывают, что
концентрации менее 1 ммоль / л (<20
мг / дл), если выдерживается в течение нескольких
часов, может быть связано с
неизбежная травма головного мозга. Без конкретных
доказательства в поддержку абсолютного
пороговое значение, без единой крови
значение глюкозы можно использовать для определения
физиологическая гипогликемия.
Определение «нормальной» крови
концентрации глюкозы для данного
популяция новорожденных также
зависит от практики кормления в
это население. Например,
среднее значение для нормальной крови
концентрация глюкозы у доношенных детей
определено на основании исследований 30 лет
назад был значительно ниже, чем
ценности, определенные в прошлом
10 лет. Это не из-за
изменение физиологии новорожденных, но
потому что педиатры больше не
следовать практике удержания
кормления от здоровых новорожденных для
длительный период после родов.Вместо того, чтобы отражать «нормальный»
неонатальный гомеостаз глюкозы, эти
ранние ценности продемонстрировали эффект
вмешательства медицинских
практикующих в нормальном переходе к
послеродовой метаболизм. По аналогии,
ранние данные, которые продемонстрировали более низкие
значения глюкозы в крови в популяциях
недоношенных детей по сравнению с
доношенные младенцы были интерпретированы
ошибочно означать, что низкий вес при рождении
младенцы лучше переносили гипогликемию
чем новорожденные с нормальным весом. В
Фактически, эти данные отражают отказ
производство глюкозы в печени в
недоношенные дети в ответ на
недостаточное поступление экзогенного субстрата.В то время стандартное кормление
практика не была установлена для
это население, и надежный
внутривенное (в / в) питание не было
имеется в наличии. Наконец, время, когда
концентрация глюкозы в крови
измеряется влияет на рассматриваемое значение «
нормальный»; глюкоза в крови
концентрации увеличиваются в течение первых 24 до
48 часов жизни при здоровом сроке
младенцы, вероятно, в результате обоих
увеличивающийся объем энтерального
кормление и начало
глюконеогенез. Таким образом, значение, которое было бы
считается «низко нормальным» через 3 часа
жизни можно было бы назвать «
гипогликемический »в 18 часов.
Проведение точной диагностики
гипогликемия дополнительно осложняется
ограничения методов, используемых для
измерить уровень глюкозы в крови
концентрации быстро. Хотя «золото
стандарт »остается гексокиназой
метод, используемый многими диагностическими
лабораторий, такой подход
непрактичен в качестве инструмента скрининга из-за
время, необходимое для обработки
образец и выполнить анализ.
Кроме того, если образец не
быстро доставлен в лабораторию
и быстро обрабатывается, глюкоза
метаболизируется красной кровью
ячеек, тем самым ложно уменьшая
концентрация глюкозы.Размещение
образец в пробирке, содержащей
гликолитический ингибитор, такой как натрий
фторид может предотвратить эту проблему,
но такие трубки либо нелегко
есть в наличии или просто не используется.
Большинство питомников используют глюкозу
оксидазный / пероксидазный хромогеновый тест
полоски для скрининга новорожденных из группы высокого риска
при низком уровне глюкозы в крови
концентрации. Капля крови попала на
пропитанная реагентом бумажная полоска для
указанное время вызовет
изменение цвета, которое коррелирует с
концентрация глюкозы в крови. В
фактическая концентрация глюкозы в крови
можно оценить путем сравнения
со стандартной диаграммой или определенным
точнее, «читая»
цвет полосы с коэффициентом отражения
колориметр, который был откалиброван
с помощью стандартного раствора.Несмотря на то что
использование колориметра отражательной способности для
читать тест-полоски улучшается
точность, сравнение нескольких исследований
различными методами установлено, что
корреляция между «настоящей» кровью
значения глюкозы и полученные значения
использование тест-полосок остается высоким
Переменная. Это особенно актуально при низких
концентрация глюкозы в крови.
Результаты тест-полоски реагента также
подвержены изменениям в
метод, используемый для получения образца (например,
вариабельность количества крови
нанесенный на полоску или загрязнение
образца по остаточному изопропилу
спирт на коже).Это было
оценил, что скрининг с
полоски с реагентами обнаруживают
примерно 85% случаев
гипогликемия, хотя частота ложноположительных результатов
может достигать 25%. Таким образом, чтобы
обеспечить точное обнаружение низких
концентрация глюкозы в крови, а
подтверждающий образец должен быть отправлен в
центральная лаборатория, если тест-полоска
значение соответствует
гипогликемия или если результат тест-полоски
нормальный диапазон, но клинический
находки вызывают подозрение
гипогликемия.
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
Хотя гипогликемия часто бывает
классифицируется как «симптоматический» или «
бессимптомно », эти термины фактически
отражать наличие или отсутствие
физические признаки, сопровождающие низкий
концентрация глюкозы в крови.А
различные признаки могут быть замечены в случаях
тяжелая или длительная гипогликемия
и у младенцев, у которых есть
от легкой до умеренной гипогликемии и
в противном случае физиологически напряженный.
Большинство результатов неспецифические и
в результате нарушений в одном или
больше аспектов центральной нервной
системная функция. К ним относятся
аномальные дыхательные паттерны, такие как
тахипноэ, апноэ или респираторный
бедствие; сердечно-сосудистые признаки, такие как
тахикардия или брадикардия; и
неврологические находки, в том числе
нервозность, вялость, слабое сосание,
нестабильность температуры и судороги.Много
этих признаков могут быть следствием других
общие неонатальные расстройства,
включая сепсис, гипокальциемию и
внутричерепное кровоизлияние. Гипогликемия
всегда следует учитывать в
младенец с одним или несколькими из
эти признаки из-за отсутствия лечения
гипогликемия может иметь серьезные
последствия, и лечение быстрое,
относительно легко и имеет ограниченную сторону
последствия. Однако с учетом нынешнего
стандарты ухода за новорожденными, в большинстве случаев
гипогликемии у новорожденного
диагностирован во время планового скрининга
младенцев, находящихся в группе риска
но которые выглядят физиологически
нормально на момент оценки.
Этиология
Недоношенность и ЗВУР
Причины неонатального
гипогликемию можно разделить на следующие категории:
связанные нарушения в одном или
больше процессов, необходимых для
нормальное производство глюкозы в печени
что может привести к кратковременному или
длительные эпизоды гипогликемии
(Таблица 1⇓
).
Запасы гликогена в печени
ограничены у обоих недоношенных детей,
кто не пережил период
быстрого накопления гликогена
на поздних сроках беременности и
младенцы с малым к гестационному возрасту (SGA), которые
не имели адекватного субстрата
запас для синтеза гликогена,
что подвергает этих новорожденных риску
при гипогликемии.ЗВУР из-за
плацентарная недостаточность с
сохранение нормального размера головы ставит
добавлен спрос на младенцев
уже низкие запасы гликогена, потому что
увеличения соотношения между мозгом и телом
соотношение. Доношенные младенцы и младенцы
многоплодная беременность также может быть
риск из-за наличия
относительная плацентарная недостаточность. В
дополнение к пониженному гликогену
доступность, исследования недоношенных и ЗВУР
младенцы обнаружили измененные модели
секреции инсулина, субстрата
метаболизм и гормональные реакции на
изменения уровня глюкозы в крови
концентрация по сравнению с
доношенных детей, соответствующих гестационному возрасту (AGA).
Таблица 1.
Этиология неонатальной гипогликемии
Младенцы, перенесшие
перинатальный стресс из-за асфиксии или
переохлаждение или повышенное
работа дыхания за счет дыхательной
бедствие может иметь «нормальный»
запасы гликогена, но количество
доступный гликоген может быть недостаточным для
удовлетворить их возросшие требования из-за
к более высокому, чем обычно, уровню
утилизация глюкозы. Гипогликемия может
возникают у этих младенцев, когда они становятся доступными
гликоген был использован для удовлетворения
начальные послеродовые метаболические потребности,
особенно если был
период гипоксемии с сопутствующим
быстрое потребление глюкозы через
анаэробный метаболизм.
Это необычно для неадекватных
уровни глюконеогенных предшественников
быть ограничивающим фактором в печеночной
выработка глюкозы у новорожденного
потому что появляются даже недоношенные дети
иметь достаточное количество жирных кислот,
глицерин, аминокислоты, лактат и
пируват доступен. Тем не мение,
глюконеогенные ферменты индуцируются больше
медленно у недоношенных детей. Дальше,
производство кетоновых тел
относительно уменьшился в ответ на
гипогликемия. Доношенные младенцы могут
имеют увеличенное высвобождение кетона
тела, когда глюкоза в крови
уменьшается, но концентрация
кетоны плохо коррелируют с
степень гипогликемии.Как результат,
вклад глюконеогенеза
к производству глюкозы в печени может
быть ограниченным у некоторых новорожденных.
IDMS
Несколько групп младенцев находятся в
повышенный риск гипогликемии из-за
к изменениям печеночного фермента
функции, нарушающие гликогенолиз,
глюконеогенез или и то, и другое. Печеночный
функция может быть затронута
количество эндокринных и метаболических
нарушения, наиболее частое из которых
гиперинсулинизм. IDM могут иметь
повышенная секреция поджелудочной железы
инсулин из-за воздействия
повышенная материнская глюкоза
концентрации в утробе матери.Плацентарная глюкоза
транспорт увеличивается, что приводит к
гипергликемия плода, что, в свою очередь,
стимулирует секрецию инсулина
поджелудочная железа плода. IDM также имеют
повышенный инсулин поджелудочной железы
секреция в ответ на данную глюкозу
нагрузка по сравнению с nonIDM. Другой
индуцированные диабетом изменения в
материнский метаболизм, такой как
изменения аминокислот в сыворотке крови, может
играют роль в метаболизме
изменения, обнаруженные в IDM.
После родов повышенная кровь
концентрации глюкозы больше не
присутствует, но гиперинсулинемия
сохраняется, таким образом поддерживая высокий
Постнатально соотношение инсулин: глюкагон.В результате гликогенолиз и
липолиз подавляются,
глюконеогенные ферменты не индуцируются, и
остается производство глюкозы в печени
на низких уровнях перед лицом
снижение концентрации глюкозы в крови.
Инсулин также увеличивает периферическое
утилизация глюкозы инсулино-чувствительными
ткани, такие как скелетные мышцы,
способствуя быстрому истощению
доступная глюкоза. Комбинированные эффекты
повышенного использования глюкозы и
подавленное производство глюкозы в печени
привести к гипогликемии, которая может
сохраняться от 24 до 72 часов до
Нормализуются паттерны секреции инсулина.
ЭРИТРОБЛАСТОЗ ПЛОДА И ТОКОЛИТИЧЕСКИЕ АГЕНТЫ БЕТА-АГОНИСТА
Хотя диабет матери является
наиболее частая причина
гиперинсулинизм у новорожденного, послеродовой инсулин
секреция может быть ненормальной из-за
несколько других расстройств. Младенцы, которые
есть эритробластоз плода
повышенный уровень инсулина и
увеличение количества панкреатических
бета-клетки. Механизм этого
развитие неясно, но одно
возможно, что глутатион высвободился
из гемолизированных эритроцитов инактивирует
инсулин в кровообращении, который
вызывает большую секрецию инсулина и
активирует бета-клетки.Обмен
переливание крови может усугубить
проблема из-за переливания крови
обычно сохраняется с
комбинация декстрозы и других агентов.
Во время обмена младенец
получает значительную нагрузку глюкозой,
с последующим завышенным инсулином
ответ от гиперпластического
поджелудочная железа. В конце обмена
скорость введения декстрозы
возвращается к исходному уровню, но уровень инсулина
остаются на возвышении, что ведет к дальнейшим
гипогликемия.
Использование токолитика бета-агониста
такие агенты, как тербуталин, также
связаны с гиперинсулинемией в
новорожденный, особенно если возбудитель
использовался более 2 недель и
был прекращен менее чем за 1 неделю
до доставки.Больные младенцы
также, похоже, уменьшили
запасы гликогена, что еще больше усугубляет
гиперинсулинемия и ее последствия
по снижению глюкозы
концентрации.
ГИПЕРИНСУЛИНИЗМ
Гипогликемия, которая сохраняется дольше
более 5-7 дней не является обычным явлением и
чаще всего из-за
гиперинсулинизм. Некоторые младенцы с ЗВУР
или перинатальная асфиксия демонстрируют
гиперинсулинемия, которая может сохраняться
целых 4 недели, но такие
случаи относительно редки, и
лежащий в основе механизм неясен.Несколько видов врожденных
были описаны гиперинсулинизм и
считаются наиболее распространенными
причина сохраняющейся гипогликемии
после первой недели жизни.
Аутосомно-рецессивная форма
врожденный гиперинсулинизм был
связано с дефектом сульфонилмочевины
рецептор или K + -ATP канал. А
одиночная мутация на коротком плече
хромосома 11 была описана
в еврейском населении ашкенази,
но случаи в других этнических группах
были связаны с рядом
других мутаций в том же
область, край.Аутосомно-доминантная форма
гиперинсулинемии также
описано. Мутация (ы)
отвечает за аутосомно-доминантную форму
гиперинсулинизма еще не было
выявлено, но расстройство отличается
от аутосомно-рецессивной формы
в том, что это, похоже, не приводит
от аномального рецептора сульфонилмочевины
функция. Синдром врожденного
гиперинсулинемия и бессимптомное течение
гипераммониемия, связанная с
мутации в глутамате
также был описан ген дегидрогеназы.
Синдром Беквита-Вейдемана
связанные с гиперплазией
несколько органов, включая поджелудочную железу,
с последующим повышением инсулина
секреция.Редко гиперинсулинемия.
может возникнуть в результате локализации островковой клетки
аденомы в ином
нормальная поджелудочная железа.
ВНУТРЕННИЕ ОШИБКИ МЕТАБОЛИЗМА
Врожденные нарушения обмена веществ могут
влияют либо на доступность
глюконеогенные предшественники или
функция ферментов, необходимых для
производство печеночной глюкозы.
Метаболические нарушения, которые могут проявляться
гипогликемия включает некоторые формы
болезни накопления гликогена,
галактоземия, дефекты окисления жирных кислот,
дефицит карнитина, некоторые из
аминоацидемии, наследственная фруктоза
непереносимость (дефицит фруктозо-1,6-дифос-фатазы) и дефекты
другие глюконеогенные ферменты.Наконец, эндокринные расстройства, такие как
гипопитуитаризм и надпочечниковая недостаточность
также может привести к гипогликемии
из-за отсутствия
соответствующий гормональный ответ на
гипогликемия и последующая неспособность
активировать выработку глюкозы в печени.
Однако эти условия очень
редко и следует рассматривать после
исключение более распространенной этиологии.
ОПРЕДЕЛЕНИЕ ЭТИОЛОГИИ
Получение тщательного перинатального анамнеза
это первый шаг в определении
этиология гипогликемии в
новорожденный.Наличие риска
факторов, таких как ненормальные результаты на
материнский тест на толерантность к глюкозе,
материнский прием лекарств
связанные с неонатальным
гипогликемия или недоношенность вызывает
диагностика относительно проста. Рост
параметры должны быть нанесены на
установить, является ли ребенок SGA, AGA,
или LGA. Следует заподозрить сепсис
сильно у доношенного ребенка, у которого
гипогликемия, но без других явных признаков
факторы риска. Если гипогликемия сохраняется
более 1 недели
возможности гиперинсулинемии, другие
эндокринные нарушения и врожденные ошибки
метаболизм следует исследовать,
особенно если гипогликемия
устойчив к стандартному лечению.
К сожалению, часто бывает сложно
документировать гиперинсулинемию
потому что уровень инсулина должен быть
нарисованный во время эпизодов
гипогликемия, чтобы продемонстрировать наличие
несоответствующей секреции инсулина.
Уровни связывающего белка для
инсулиноподобный фактор роста 1
(IGFBP-1) уменьшаются в присутствии
гиперинсулинемия, вызывающая
измерение сывороточного уровня IGFBP-1
полезно для подтверждения диагноза
гиперинсулинемия. Сыворотка и моча
тесты на специфические метаболические и
эндокринные расстройства, такие как сыворотка
аминокислотные профили и
измерение кортизола и роста
уровни гормонов, также может быть необходимо
для выяснения этиологии неонатальных
гипогликемия.
Менеджмент
Цели лечения младенцев, которые
гипогликемия должна нормализоваться
концентрации глюкозы в крови как
как можно быстрее и избегать
дальнейшие эпизоды гипогликемии
обеспечение адекватного субстрата до тех пор, пока
нормальный гомеостаз глюкозы может быть
учредил. Метод, выбранный для
достижение этой цели является функцией
как клинический статус младенца
и предполагаемую этиологию
гипогликемия.
ЭНТЕРАЛЬНОЕ КОРМЛЕНИЕ
Доношенные дети, у которых есть
бессимптомная легкая гипогликемия, начальная
попытка энтерального питания может быть
успешно в достижении целевой крови
значения глюкозы.Хотя подсказка
повышение уровня глюкозы в крови
концентрации могут быть достигнуты после
кормление 5% декстрозой и
водный раствор, декстроза
метаболизируется быстро, и
гипогликемия может повториться раньше нормы
кормления могут быть установлены. Использование
стандартная детская смесь обеспечит
не только углеводы в виде
лактоза, а также белок и жир,
которые метаболизируются медленнее
и, следовательно, обеспечит
постоянная подача субстрата. Потребление жиров
также снижает клеточную глюкозу
усваивает и стимулирует
глюконеогенез, дополнительно способствуя
восстановление нормального гомеостаза глюкозы.Подсчитано, что уровень глюкозы в крови
концентрации должны увеличиваться на
примерно 1,67 ммоль / л (30
мг / дл) в течение первого часа после
подача от 30 до 60 мл стандарта
детская смесь.
Внутривенная терапия
Младенцы с уровнем глюкозы в крови
концентрации нормализуются после
энтеральное питание следует продолжать
иметь концентрацию глюкозы в крови
проверяется перед каждым кормлением на предмет
От 12 до 24 часов. Если после приема пищи
концентрация в норме, но
значение перед следующим кормлением
снова в гипогликемическом диапазоне,
следует рассмотреть возможность энтерального питания
неудача, а младенец —
кандидат на внутривенную терапию.Подсказка
обеспечение внутривенным введением глюкозы в эти
обстоятельства позволят избежать повторных эпизодов
препрандиальной гипогликемии. Этот
может быть важным, потому что последующее наблюдение
исследования младенцев, у которых есть
рецидивирующая гипогликемия указывает на то, что
множественные эпизоды низкого уровня глюкозы в крови
концентрации с большей вероятностью будут
связанные с неблагоприятными
результаты развития нервной системы, чем один
эпизод.
Внутривенная терапия должна быть первой
метод лечения, используемый в
симптоматические младенцы, младенцы, неспособные
переносят энтеральное питание, а те
у кого нарушение глюкозы
гомеостаз тяжелый или ожидаемый
длиться более нескольких часов.В
последняя категория включает недоношенных
младенцы, младенцы с ЗВУР,
младенцы женщин, у которых плохо
контролируемый диабет и младенцы, которые
имеют основную этиологию
гипогликемия, такая как сепсис, известная или
подозреваемые врожденные ошибки
метаболизм или эндокринные дефекты, или
эритробластоз.
Введение начального болюса
200 мг / кг 10% декстрозы и
вода (2 мл / кг D 10 W) должна быть
с последующим непрерывным вливанием
декстроза рассчитана на доставку от 5 до
8 мг / кг глюкозы в минуту (т. Е.
скорость, эквивалентная глюкозе
коэффициент использования здорового младенца).Значок «
мини-болюс ».
показано, что возвращает глюкозу в крови
концентрация в норме быстрее
чем постоянный настой в одиночку. Значок «
мини-болюс »также рассчитана
чтобы избежать превышения желаемого
концентрация глюкозы. Ограничивая
количество глюкозы в виде
болюс, можно избежать
вызывая ятрогенную гипергликемию, которая
может стимулировать избыток инсулина
секреция и вызвать отскок
гипогликемия. Уровень глюкозы в крови
следует проверить концентрацию
примерно через 30 минут после
болюс, затем каждые 1-2 часа до
стабильно и в пределах нормы.Если
последующее значение попадает в
гипогликемический диапазон, болюс должен быть
повторяется и скорость инфузии
увеличился с 10% до 15%. Это не так
необычно для младенцев, у которых есть
кратковременный или продолжительный
гиперинсулинемия требует от 12 до
15 мг / кг в минуту глюкозы внутривенно
для поддержания нормогликемии. В таком
случаях может потребоваться разместить
катетер пупочной вены или
периферический центральный венозный катетер
(так называемая линия PIC), чтобы
введение растворов IV с
концентрация декстрозы выше, чем
12.5%.
Если нет опасений по поводу
перегрузка жидкостью или способность
переносят энтеральное питание, младенцы
требуется внутривенная терапия гипогликемии
должно быть разрешено продолжить
кормления. Есть несколько преимуществ
к этой практике. Во-первых, это позволит
более легкий переход от парентерального
к энтеральному источнику углеводов
однократно концентрация глюкозы в крови
стабилизировались. Во-вторых, предоставление
немного углеводов в виде галактозы (один
сахаров, входящих в состав лактозы)
может быть полезен в IDM и других
младенцы, страдающие гиперинсулинемией;
исследования показали, что
инсулиновый ответ поджелудочной железы на галактозу
меньше, чем ответ на
эквивалентное количество глюкозы.Когда
нормальная концентрация глюкозы в крови
было установлено, и требование
для внутривенного введения глюкоза стабильна в течение
От 12 до 24 часов, младенец может быть
отлучен от этой терапии
измерение уровня глюкозы в крови на препрандиальном уровне
концентрации и уменьшение
скорость инфузии от 10% до 20% каждый
время глюкозы в крови больше
от 2,8 до 3,4 ммоль / л (от> 50 до
60 мг / дл). Неспособность терпеть
отлучение от внутривенного введения глюкозы указывает на
наличие распространенного расстройства,
например, метаболический дефект или
идиопатическая гиперинсулинемия, и следует
подскажите дальнейшую оценку.
ДРУГИЕ АГЕНТЫ
Было использовано несколько других агентов
для лечения рефрактерной гипогликемии,
чаще всего встречается в одном из
гиперинсулинемические состояния (Таблица 2⇓
).
Кортикостероиды (гидрокортизон, от 5 до
15 мг / кг в день в два-три раза
разделенные дозы или преднизон,
2 мг / кг в день) связаны
со снижением периферической глюкозы
утилизация и увеличение крови
концентрации глюкозы, но у них есть
множество других метаболических эффектов
это необходимо учитывать.
Прием кортикостероидов в качестве дополнения
к глюкозе внутривенно может быть полезно, когда
потребность в глюкозе больше
чем 15 мг / кг в минуту.
Таблица 2.
Дополнительные методы лечения гипогликемии
Глюкагон вызывает быстрое
повышение уровня глюкозы в крови у младенцев, которые
имеют адекватные запасы гликогена, но
это всего лишь временный эффект, и
опекуны должны быть готовы к
управлять гипогликемией, когда она повторяется.
Недоношенные и младенцы, которые
есть ЗВУР имеют ограниченный гликоген
магазины и вряд ли испытают
повышение уровня глюкозы в крови
концентрация после введения
глюкагон. Начальная доза
30 мкг / кг может вызвать реакцию
у некоторых младенцев, но у тех, у кого
гиперинсулинемия может потребовать
В 10 раз более высокая доза для преодоления
эффекты инсулина с высоким уровнем циркуляции
уровни и стимулируют гликогенолиз.Введение глюкагона наиболее
полезно тем младенцам, у которых есть
тяжелая гипогликемия как
временная мера до стабильного внутривенного доступа
можно получить (например, ожидая
прибытие транспортной бригады).
Несколько других агентов могут быть
ценно для лечения младенцев в
кому диагноз
гиперинсулинемия подтверждена и кто остается
стойкое гипогликемическое заболевание, несмотря на
введение глюкозы в / в
От 15 до 20 мг / кг в минуту.
Диазоксид в дозе 5 мг / кг каждые
8 часов угнетает поджелудочную
секреция инсулина.Соматостатин или его
аналог октреотида пролонгированного действия также
подавляет высвобождение инсулина, а также
гормон роста и глюкагон
секреция и используется чаще всего
до операции у младенцев, нуждающихся в
панкреатэктомия по поводу рефрактерной
гипогликемия и гиперинсулинемия.
Итого (95%) или почти завершено
панкреатэктомия может потребоваться для
управлять случаями гиперинсулинемии
из-за генных мутаций или островковой клетки
аденомы. Однако гипогликемия
рецидивирует до 33% хирургически
леченных пациентов, и от 40% до 60%
в более позднем возрасте заболевают сахарным диабетом.
Последствия гипогликемии
ГИПОГЛИКЕМИЧЕСКАЯ ТРАВМА МОЗГА
Хотя гипогликемия
связаны с рядом физиологических
изменения, самые глубокие последствия
видны в мозгу, где глюкоза
является основным субстратом для энергии
обмен веществ и местная энергия
магазины и поставка альтернативных
субстраты ограничены. Суровый
гипогликемия у новорожденного — это
связано с селективным некрозом нейронов
в нескольких областях мозга, в том числе
поверхностная кора, зубчатая извилина,
гиппокамп и хвостатая скорлупа.Исходные события в
гипогликемической энцефалопатии до сих пор нет
полностью понял, но мозг
травма, похоже, возникла в результате
количество запущенных процессов
когда концентрация глюкозы в крови
уменьшение (Рисунок⇓
).
Умеренный
снижение уровня глюкозы в крови
концентрация связана с
компенсаторное увеличение мозгового кровотока
которые, как предполагалось, представляют
средство поддержания доставки
церебральная глюкоза. Недоношенными
новорожденные, такие изменения церебрального
кровоток может предрасполагать к
внутрижелудочковое кровоизлияние и может
мало влияют на нейроны
поставка глюкозы из-за передачи
глюкоза через гематоэнцефалический барьер
зависит от активности
переносчики глюкозы в сосуды
эндотелий и клеточные мембраны.Уровни переносчика глюкозы
уменьшилась у плода и новорожденного
по сравнению с младенцами старшего возраста и
может ограничивать скорость церебрального
поглощение глюкозы.
Рисунок 1.
Предлагаемый механизм патогенеза гипогликемического поражения головного мозга у новорожденного.
АТФ = аденозин-5′-трифосфат; PCr = фосфокреатин. Используется с разрешения Ross Products
Подразделение, Abbott Laboratories Inc., Колумбус, Огайо, 43216. Из Semin Neonat Nutr Metab . 1997;
4, подразделение Ross Products, Abbott Laboratories Inc.
Если поступление глюкозы в мозг
не поддерживается, может быть
снижение церебральной электрической
активность, разрушение мембраны с
высвобождение свободных жирных кислот и
измененный метаболизм аминокислот,
включая увеличение производства
глутамат. Глутамат, который является одним
возбуждающей аминокислоты
нейротрансмиттеры найдены только в
центральная нервная система, считается
играть важную роль в
патофизиология гипогликемического поражения головного мозга.
Гипогликемия связана с
повышенная концентрация глутамата
в синаптической щели, скорее всего, из-за
к комбинации увеличенного
высвобождение глутамата из пресинаптического
нейроны и снижение аденозина
5′-трифофат (АТФ) -зависимый
поглощение глутамата глиальными клетками.Глутамат связывается с постсинаптическими рецепторами,
запускающий выпуск второго
мессенджеры через метаботропный глутамат
рецепторы и изменения в
трансмембранные потоки ионов через ионотропные
рецепторы глутамата. Хотя там
несколько типов ионотропных
рецепторы, N -метил-D-аспартат
(NMDA) рецептор глутамата,
который связан с ионом
канал, по которому натрий и
кальций в клетку и калий
вне клетки преобладает в
незрелый мозг. У всех видов
изучено, включая человека, количество
функциональных рецепторов NMDA
увеличивается в процессе развития мозга,
впоследствии уменьшается до взрослого
уровни.
Увеличенное количество NMDA
рецепторы у позднего плода и раннего
периоды новорожденных, скорее всего, отражают
роль рецептора как одного из
первичные медиаторы долгосрочных
потенцирование, процесс, который
связаны с синаптогенезом и
формирование памяти. NMDA
рецепторная активность также
может быть вовлечен в
регулирование процесса
апоптоза, или
запрограммированная гибель клеток,
через изменения в
цитоплазматический и ядерный
концентрации кальция.
У человеческого плода
третий триместр плода
развитие и ранние
неонатальный период
характеризуется активным
формирование и
модификация синаптического
связи и
ветвление дендритов
связана с
увеличенный NMDA
рецепторы.Таким образом,
нормальный уровень NMDA
рецепторная активность
критически важен для
развитие незрелых
мозг. Однако избыток
активация NMDA
рецепторы глутамата
увеличивает цитоплазматический
концентрации
натрия и кальция до уровней, которые
превышают возможности нейронов
гомеостатические механизмы, тем самым
изменение трансмембранного иона
градиенты. В частности, гипогликемия
увеличивает чувствительность NMDA
рецепторы активации глутаматом,
что может привести к снижению
порог глутамат-индуцированного
эксайтотоксичность.Во время гипогликемии
энергозависимые механизмы восстановления
нормальные трансмембранные градиенты
натрий и кальций не могут работать
из-за истощения АТФ и
фосфокреатин, связанный с
гипогликемия. Избыток кальция
приток активирует клеточный
фосфолипазы и протеазы, альтеры
митохондриальный метаболизм, триггеры бесплатно
радикальное образование, изменяет закономерности
синаптической передачи и
в конечном итоге может привести к выборочному
нейрональный некроз.
Появляется все больше свидетельств того, что
специфические изменения митохондрий
функция может играть важную роль
в ранних событиях, ведущих к
гипогликемическая энцефалопатия.Уменьшено
потоки субстрата через
цикл трикарбоновых кислот приводит к
снижение доступности сокращения
эквиваленты в митохондриях. Как
результат неполное сокращение
молекулярного кислорода внутри
митохондрии и повышенное образование
свободные радикалы кислорода, которые повреждают
обе митохондриальные мембраны и
митохондриальная ДНК. Фрагментация
митохондриальной ДНК вмешивается
с синтезом транспорта электронов
цепные ферменты, такие как субъединицы
цитохромоксидаза и
никотинамид аденин динуклеотид
(НАДН) -дегидрогеназа, являющаяся
кодируется митохондриальной
геном.Таким образом, способность клетки
для восстановления уровня АТФ нарушается.
Местное истощение высокоэнергетических
фосфаты, а также изменения
митохондриальные мембраны приводят к
снижение секвестрации кальция
митохондриями как цитоплазматическая
кальций. Митохондриальная дисфункция
также может вносить непосредственный вклад в
нейрональный некроз, инициируя
процесс апоптоза. Недавние исследования
указали, что выпуск
цитохром с из митохондрий
требуется для активации ферментов, которые
вызвать апоптоз и это
цитохром с выделяется как окислительный
фосфорилирование не удается.
Гипогликемия также могла
усугубляют черепно-мозговую травму в периоды
церебральная гипоксия в незрелом мозге.
Как и при гипогликемии, церебральная
гипоксия связана с истощением
высокоэнергетических фосфатов, повышенный
внеклеточный глутамат
концентрации, активация ионотропных
рецепторы глутамата и повышенное
внутриклеточный натрий и кальций. В
кроме того, анаэробный гликолиз во время
гипоксия ускоряет истощение
глюкоза в головном мозге. Таким образом
сочетание гипогликемии и гипоксии
можно ожидать, что действовать
синергетически вызывает повреждение нейронов.Хотя гипогликемия
быть нейропротекторным во время церебральных
ишемия у взрослых, исследования у незрелых
животные продемонстрировали, что
сопутствующая гипогликемия
обостряет гипоксически-ишемическое повреждение головного мозга,
возможно за счет ускорения истощения
высокоэнергетические фосфаты.
Гипогликемия также устраняет гипоксию.
расширение сосудов головного мозга, таким образом
нарушение компенсаторных механизмов
это могло бы иначе улучшить кислород
доставка в мозг в периоды
гипоксемия. Хотя дальше
необходимо расследование, эти результаты
указать, что поддержание
нормогликемия особенно критична у младенцев в
риск эпизодов гипоксемии, например
как те, у кого есть значительные
респираторный дистресс.
КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ
Физиологические нарушения
связанные с острой гипогликемией в
новорожденный результат реакции на стресс,
с выделением катехоламинов и
глюкагон и последующий липолиз
и гликогенолиз в попытке
увеличить доступность субстрата для
нормальные обменные процессы. Таким образом,
даже при бессимптомной гипогликемии,
есть значительные краткосрочные
воздействие на младенца, которое может привести
в истощении эндогенных
субстрат, оставляя младенца неподготовленным
для обработки последующих физиологических
стресс.У доношенных детей короткий период
повышенной симпатической активности
и измененный метаболизм в печени
обычно переносится хорошо. Однако в
недоношенный ребенок или ребенок с SGA,
добавлен физиологический стресс, связанный
с низким уровнем глюкозы в крови
концентрация может быть достаточной для осаждения
кардиореспираторная нестабильность и
осложнять неотложную помощь
существенно. Быстро, быстро
нормализация низкого уровня глюкозы в крови
концентрации необходимы для минимизации
гормональный и метаболический
расстройства. Если нормальный уровень глюкозы в крови
концентрация может быть достигнута в
своевременно, острые последствия
единичный эпизод гипогликемии может
быть минимизированным.
Долгосрочные последствия неонатального
гипогликемия остается спорным вопросом.
Повторные эпизоды симптоматического
гипогликемия, наблюдаемая у младенцев
которые страдают стойким гиперинсулинизмом,
были связаны с выборочными
нейрональный некроз и длительный
нарушение когнитивных и двигательных функций
функция. В ранних исследованиях также сообщалось
плохие результаты развития нервной системы
в IDM. Однако более свежие данные
предположить, что только гипогликемия
не влияет на долгосрочные результаты в
IDM; скорее, неблагоприятные исходы
были связаны с наличием
врожденные аномалии.
Доступно очень мало данных
относительно долгосрочного результата в
подавляющее большинство гипогликемических
младенцы с бессимптомным течением
гипогликемия, обнаруживаемая на
плановый скрининг и лечится
быстро. Исследования у нормальных взрослых
показали, что когнитивная функция
нарушается во время легкой
инсулино-индуцированная гипогликемия (кровь
значения глюкозы <3,4 ммоль / л [<60 мг / дл]). Взрослые диабетики, которые
иметь в анамнезе повторяющиеся эпизоды
гипогликемии
имеют стойкие когнитивные дефициты, так как
а также легкая атрофия коры головного мозга,
находки, которые не наблюдались в
диабетики, которые не испытали
значительная гипогликемия.
Большинство исследований у новорожденных,
хотя неизбежно ограничен
объем, не смогли продемонстрировать
любые долгосрочные последствия в перспективе
младенцы, пережившие краткое
эпизоды гипогликемии. Изменения
в стволе мозга слуховые вызванные
ответы (BAER) были зарегистрированы в
несколько младенцев (от 1 до 5 дней) во время
эпизоды гипогликемии
неуточненной этиологии. Аномальный
BAER были обнаружены в крови
концентрации глюкозы в диапазоне от
От 0,7 до 2,5 ммоль / л (от 12 до 45 мг / дл),
и в двух младенцах они остались
ненормально в течение нескольких часов после
была введена глюкоза.Однако длительного наблюдения не проводилось.
сообщил об этих младенцах. Второй
исследование, в котором проанализированы факторы
влияющие на исход в возрасте 18 месяцев в
когорта недоношенных детей, обнаруженная
что те, у кого был хотя бы один
уровень глюкозы в крови меньше чем
2,6 ммоль / л (46 мг / дл) на 5 или
больше дней было значительно меньше
баллы по стандартизированным тестам
умственное и двигательное развитие и
в три раза выше заболеваемость
церебральный паралич, чем у тех, у кого было меньше
эпизоды гипогликемии или те
кто испытал одиночный
эпизод более тяжелой гипогликемии.Различия остались значительными
когда другие факторы риска, такие как
масса тела при рождении и внутрижелудочковые
кровоизлияния были учтены. Таким образом, там
это свидетельство того, что
легкая или умеренная гипогликемия может повлиять на
исход, по крайней мере, у младенцев из группы высокого риска.
Заключение
Нарушение гомеостаза глюкозы
которые приводят к гипогликемии,
распространен среди новорожденных. Осознание
факторы риска, которые предрасполагают младенцев к
гипогликемия позволяет проводить скрининг
тех, кто находится в группе риска, так что клинически
неопределяемая гипогликемия может быть
лечить быстро, тем самым предотвращая
развитие тяжелых или
симптоматическая гипогликемия, которая
связанные с неблагоприятными исходами.Однако ведение пациентов с высоким риском
младенцев осложняется отсутствием
консенсус по глюкозе в крови
значение, которое представляет собой гипогликемию
а также неточности в
методы, используемые для измерения уровня глюкозы в крови
значения. Еще одна нерешенная проблема:
бессимптомная гипогликемия
связан с постоянными эффектами
на функции мозга у новорожденного.
Никакие убедительные исследования не демонстрируют
отдаленные последствия бессимптомного
гипогликемия у доношенных детей, но это
вероятно, что гипогликемия
способствует ненормальному
исход нервного развития у младенцев, у которых
другие факторы риска черепно-мозговой травмы,
такие как недоношенность или
гипоксически-ишемическое повреждение головного мозга.В этих
младенцы, поддерживающие уровень глюкозы в крови
концентрации значительно выше
порог гипогликемии может
улучшить неврологический исход.
Необходимы дальнейшие исследования, чтобы
определить последствия
гипогликемия у доношенных детей.
ПРЕДЛАГАЕМЫЕ ЧТЕНИЯ
Эйнсли-Грин А. Глюкоза, мозг и педиатрия
эндокринолог.
Horm Res. 1996; 46: 8-25Калхан С., Балобан Ф.Метаболические и эндокринные нарушения, часть первая:
нарушения углеводного обмена. В: Fanaroff AA, Martin RJ, eds.
Неонатально-перинатальная медицина: болезни плода и
Новорожденный . 6th 1997 Mosby-Year Book Inc., Сент-Луис, МоСтэнли, Калифорния. Гиперинсулинизм у младенцев и детей.
Педиатрическая клиника North Am . 1997; 44: 363-374Уильямс AF. Гипогликемия у новорожденных: обзор .Публикации ВОЗ № 5778, 1997 г.
- Авторское право © 1999 Американская академия педиатрии
Гипогликемия новорожденных — Педиатрия — Руководства Merck Professional Edition
Внутривенно декстроза (для профилактики и лечения)
Новорожденные, относящиеся к большинству групп высокого риска, проходят профилактическое лечение.Например, новорожденных от женщин с диабетом, которые принимали инсулин, часто начинают при рождении с в / в вливания 10% D / W или перорального приема глюкозы, как и тем, кто болеет, очень недоношен или страдает респираторной недостаточностью. Других новорожденных из группы риска, которые не болеют, следует начинать с раннего и частого кормления смесями, чтобы обеспечить их углеводами.
Любой новорожденный, у которого уровень глюкозы падает до ≤ 50 мг / дл (≤ 2,75 ммоль / л), должен незамедлительно начать лечение с энтерального питания или с внутривенной инфузией до 12.5% D / W, 2 мл / кг за 10 мин; При необходимости можно вводить более высокие концентрации декстрозы через центральный катетер. Затем инфузию следует продолжить со скоростью, обеспечивающей от 4 до 8 мг / кг / мин глюкозы (т. Е. 10% D / W примерно от 2,5 до 5 мл / кг / ч). Для корректировки скорости инфузии необходимо контролировать уровень глюкозы в сыворотке. Как только состояние новорожденного улучшится, энтеральное питание может постепенно заменить внутривенное вливание, в то время как концентрация глюкозы продолжает контролироваться. Внутривенное введение декстрозы всегда должно быть постепенным, поскольку внезапное прекращение приема может вызвать гипогликемию.
Если начало внутривенной инфузии новорожденному с гипогликемией затруднено, глюкагон от 100 до 300 мкг / кг внутримышечно (максимум 1 мг) обычно быстро повышает уровень глюкозы в сыворотке, и этот эффект длится от 2 до 3 часов, за исключением новорожденных с истощенным гликогеном. магазины. Гипогликемию, резистентную к высоким дозам инфузии глюкозы, можно лечить гидрокортизоном 12,5 мг / м 2 каждые 6 часов. Если гипогликемия не поддается лечению, следует рассмотреть другие причины (например, сепсис) и, возможно, эндокринную оценку стойкого гиперинсулинизма и нарушений дефектного глюконеогенеза или гликогенолиза.
Гипогликемия новорожденных после контролируемого диетой и лечением инсулином гестационного диабета
Реферат
ЦЕЛЬ Оценить риск гипогликемии новорожденных после контролируемого диетой и лечением инсулином гестационного диабета (ГСД) и его связи с массой тела при рождении .
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ В проспективное когортное исследование были включены доношенные новорожденные, родившиеся после ГСД с января 2013 г. по декабрь 2015 г. в Университетском медицинском центре Утрехта (Утрехт, Нидерланды).Обычный скрининг уровня глюкозы в крови новорожденных проводился через 1, 3, 6, 12 и 24 часа после рождения. Основными критериями исхода были неонатальная гипогликемия, определяемая как уровень глюкозы в крови ≤36 мг / дл (тяжелая форма) и ≤47 мг / дл (легкая).
РЕЗУЛЬТАТЫ Всего было включено 506 новорожденных, родившихся после беременностей, осложненных ГСД, леченных инсулином (22,5%) или без инсулина (77,5%). Частота легкой и тяжелой гипогликемии была сходной в группах, получавших инсулин, и контролируемых диетой (33 vs.35%, P = 0,66; и 20 против 21%, P = 0,79). Вес при рождении> 90 процентиля наблюдался у 17,2% всех младенцев. Хотя дети с массой тела при рождении> 90-го центиля имели самый высокий риск гипогликемии, подавляющее большинство гипогликемии (78,6%) было обнаружено у детей с массой тела при рождении <90-го центиля. Более 95% всех гипогликемий произошло в течение 12 часов после рождения.
ВЫВОДЫ Рутинный скрининг на неонатальную гипогликемию после беременностей, осложненных ГСД, выявляет высокую частоту как легкой, так и тяжелой гипогликемии как при ГСД, контролируемом диетой, так и при лечении инсулином, а также во всем диапазоне центилей массы тела при рождении.Мы предлагаем рутинный скрининг уровня глюкозы в крови на неонатальную гипогликемию в течение первых 12 часов жизни у всех новорожденных после ГСД, независимо от использования инсулина матерью или веса при рождении.
Введение
Заболеваемость невыявленным диабетом во время беременности и гестационным сахарным диабетом (ГСД) растет, в настоящее время осложняя до 10–25% всех беременностей во всем мире (1,2). Одной из основных проблем у младенцев, рожденных после беременности, осложненной диабетом, является гипогликемия. Поскольку глюкоза свободно проходит через плаценту, гипергликемия матери, связанная с GDM, приводит к повышению уровня глюкозы у плода, вызывая избыточную продукцию инсулина плода (гиперинсулинизм) (3,4).После рождения, когда у матери прекращается поступление глюкозы, повышенный уровень неонатального инсулина сохраняется и может привести к гипогликемии и угнетению механизмов метаболической компенсации. Своевременное распознавание и лечение неонатальной гипогликемии важно из-за возможности неблагоприятного исхода для нервного развития. Младенцы, подвергшиеся гипогликемии, показывают отклонения на МРТ черепа и имеют риск задержки развития в более старшем возрасте, даже в случае легкой преходящей гипогликемии. Было продемонстрировано, что лечение снижает риск неблагоприятных исходов (5–7).Хотя клиническая значимость очевидна, существуют разногласия относительно определения, скрининга и лечения неонатальной гипогликемии. Общепринятый порог составляет 47 мг / дл для легкой гипогликемии и 36 мг / дл для тяжелой гипогликемии, и клинические руководства рекомендуют послеродовой скрининг глюкозы у младенцев из группы риска (8). Тем не менее, руководства различаются относительно того, какие младенцы относятся к группе высокого риска (8–11). Помимо ранее существовавшего материнского диабета, факторы риска неонатальной гипогликемии велики для гестационного возраста (LGA), малы для гестационного возраста (SGA) и недоношенности.Что касается ГСД, некоторые руководящие принципы рекомендуют проводить скрининг всех младенцев от матерей с ГСД (8,9,12), тогда как другие советуют проводить скрининг только тех младенцев, рожденных от матерей с ГСД, получавших лечение инсулином (10,11). Чтобы улучшить лечение и спланировать надежные исследования эффектов лечения, необходимы отчеты о частоте неонатальной гипогликемии, основанные на протоколе систематического скрининга. Мы оценили частоту неонатальной гипогликемии у доношенных детей, рожденных от матерей с инсулиновым и не леченным инсулином ГСД, определяемую стандартизированными измерениями глюкозы в первые 24 часа жизни.
Дизайн и методы исследования
Место проведения и исследуемая группа
Мы провели проспективное когортное исследование с участием всех младенцев от женщин с диагнозом ГСД с января 2013 года по декабрь 2015 года в Университетском медицинском центре Утрехта в Нидерландах. Критериями исключения были недоношенность (срок беременности <37,0 недель), мертворождение или серьезный врожденный порок развития. Недоношенные дети, которые уже были четко признаны склонными к гипогликемии и, таким образом, регулярно проходят скрининг в клинической практике, были исключены из исследования.Это исследование было одобрено этическим комитетом Медицинского центра Утрехтского университета (номер файла 16–627 / C).
Процедуры и измерения
Диагностика и лечение GDM
В соответствии с национальными голландскими руководящими принципами, женщины либо подвергались скринингу на основе наличия определенных факторов риска (предыдущий GDM, предыдущий ребенок с массой тела при рождении> 95-го центиля, ИМТ матери> 30 , синдром поликистозных яичников у матери, член семьи первой степени родства с диабетом или предшествующая необъяснимая гибель плода) на 24–28 неделе беременности или протестированы на основании клинических данных, предполагающих GDM (i.е., гидрамнион или рост плода> 90-го центиля) (13). Использовали 75-граммовый пероральный тест на толерантность к глюкозе (OGTT), и GDM диагностировали в случае уровня глюкозы в плазме крови натощак> 126 мг / дл или уровня глюкозы в плазме крови через 2 часа> 141 мг / дл. Женщин с ГСД обучали самоконтролю за уровнем глюкозы в крови, они получали лечебное питание и интенсивно наблюдались в амбулаторной клинике командой, состоящей из гинеколога, эндокринолога, диетолога и медсестры, специализирующейся на диабете.Целевой уровень глюкозы в крови составлял 96–126 мг / дл (натощак и через 1,5 ч после еды). В случае недостаточного гликемического контроля было начато лечение инсулином. Гликемический контроль оценивался по последнему четырехточечному профилю глюкозы в крови до родов как для натощак, так и для средних значений глюкозы после приема пищи. В целом, среднее количество дней до родов, в течение которых измеряли профиль глюкозы в крови, составляло 15 дней (диапазон 9-25 дней).
Неонатальная помощь
Все новорожденные были госпитализированы на срок не менее 24 часов после рождения.Уровни глюкозы в крови измеряли с помощью пяточной палочки через 1, 3, 6, 12 и 24 часа после рождения перед кормлением. Мы использовали тестирование в месте оказания медицинской помощи с помощью метода глюкозооксидазы (i-STAT; Abbott Laboratories, Princeton, NJ). В случае появления клинических симптомов проводились дополнительные измерения уровня глюкозы в крови. Концентрации глюкозы в крови, а также дата и время измерения были извлечены из электронных карт пациентов. Материнские характеристики, такие как возраст, ИМТ, лечение GDM, результаты OGTT, роды и характеристики новорожденных, такие как пол, гестационный возраст при рождении и вес при рождении, также были получены из электронных карт пациентов.
Легкая неонатальная гипогликемия определялась как уровень глюкозы ≤47 мг / дл, а тяжелая гипогликемия — как ≤36 мг / дл в соответствии с консенсусным документом о рабочих порогах, подготовленным Cornblath et al. (14). Показания уровня глюкозы не были слепыми, и последующее лечение следовало за любой гипогликемией. В качестве начального лечения вводили дополнительное количество грудного молока или смеси, а в случае стойкой гипогликемии внутривенно вводили. лечение глюкозой проводилось для поддержания уровня глюкозы в крови предпочтительно> 54 мг / дл.Через 1 час после вмешательства повторно измеряли уровень глюкозы, чтобы проверить, исчезла ли гипогликемия.
Центили массы при рождении были рассчитаны на основе кривых голландского населения, скорректированных с учетом гестационного возраста, пола и количества детей (15). SGA определяли как массу тела при рождении <10-го центиля, LGA определяли как массу при рождении> 90-го центиля и соответствовали гестационному возрасту (AGA) как массу при рождении между 10-м и 90-м центилем.
Статистический анализ
Анализы проводились с использованием SPSS версии 21.0 (SPSS Inc., Чикаго, Иллинойс). Базовые характеристики сравнивались с использованием критериев χ 2 для дискретных переменных или однофакторного дисперсионного анализа для непрерывных переменных или непараметрического тестирования в случае непараметрического распределения, и при необходимости выполнялись апостериорные тесты Бонферрони. Результаты представлены в виде среднего значения ± стандартное отклонение, медианы (межквартильный размах) или числа (в процентах), где это необходимо. Значение P <0,05 определяется как порог статистической значимости. Кривая распространенности была построена для выявления неонатальной гипогликемии с течением времени, при этом у новорожденных, по данным цензурированных наблюдений, гипогликемия не развивалась.
Результаты
В общей сложности 2145 женщин прошли скрининг на ГСД в нашей больнице в период исследования, в результате чего было выявлено 583 женщины с ГСД. Двенадцать женщин вынашивали близнецов, в результате чего после беременности с ГСД родилось 595 новорожденных. Два случая были исключены из-за мертворождения, 62 — из-за преждевременных родов и 16 — из-за серьезных врожденных пороков развития. Девять пациентов были потеряны для последующего наблюдения (перевод в другую больницу или отказ следовать протоколу). Таким образом, в исследование были включены 506 новорожденных, из которых 392 (77.5%) родились после беременностей с ГСД без лечения инсулином и 114 (22,5%) после ГСД, леченного инсулином. Профиль исследования показан на рис. 1.
Рисунок 1
Профиль исследования. GA — срок беременности; гипо, гипогликемия.
Частота легкой гипогликемии была сходной между группами, не получавшими инсулин, и группами, получавшими инсулин (33 против 35%; P = 0,66) (рис. 1). Кроме того, частота тяжелой гипогликемии была сопоставимой в обеих группах (20% против 21%; P = 0,79).
В таблице 1 приведены характеристики матери и новорожденного для младенцев, не страдающих гипогликемией легкой или тяжелой степени.В целом было выполнено 2769 измерений уровня глюкозы в крови, в среднем 5 на новорожденного. Общая частота легкой и тяжелой гипогликемии составила 33,4 и 20,2% соответственно. Материнские характеристики, включая возраст, этническую принадлежность, ИМТ и первородство, не различались между группами. Средние значения OGTT и гестационный возраст на момент постановки диагноза GDM также были схожими. Поступление в неонатальное отделение было отмечено у 24,5, 10,1 и 11,5% групп с тяжелой, легкой и отсутствующей гипогликемией, соответственно.В отделение интенсивной терапии новорожденных III уровня не было госпитализировано ни одного из детей с тяжелой формой заболевания, 0,6% детей с легкой степенью тяжести и 2,6% детей без гипогликемии. Причинами госпитализации в ОРИТ были проблемы с дыханием ( n = 3), перинатальная асфиксия ( n = 3) и прием лекарств матери ( n = 1). Двое младенцев без гипогликемии получали глюкозу внутривенно. Оба случая касались младенцев с массой тела при рождении намного ниже 2,3-го процентиля и недостаточным пероральным приемом пищи. Ни у одного из младенцев не развились судороги.Из всех новорожденных с гипогликемией у 65,3% не было второго эпизода после вмешательства, а среднее общее количество эпизодов гипогликемии, измеренное на одного ребенка с гипогликемией, составило 1,58.
Таблица 1
Характеристики пациента
Масса тела при рождении
Распределение неонатальной гипогликемии среди децилей массы тела при рождении визуализировано на рис. 2. Легкая гипогликемия наблюдалась у 41,4% всех детей с LGA, а тяжелая гипогликемия — у 25,3%. Младенцы LGA имели значительно более высокий риск гипогликемии (отношение шансов 1.93 [95% ДИ 1,19–3,14]) по сравнению с младенцами AGA. Однако как легкая, так и тяжелая гипогликемия наблюдались во всем диапазоне центилей массы тела при рождении. Из всех младенцев с легкой гипогликемией 72,2% были AGA, и 71,6% всех младенцев, страдающих тяжелой гипогликемией, были AGA (Таблица 1).
Рисунок 2
Младенцы без гипогликемии (гипогликемии (гипогликемии) в легкой или тяжелой форме на процентиль массы тела при рождении (числа в столбцах указывают процентную долю в пределах дециля массы тела при рождении).
Временной график
Кривая распространенности была построена для времени до первой обнаруженной неонатальной гипогликемии; новорожденные, у которых не развилась гипогликемия, подвергались цензуре.Индивидуально представлены тяжелая и легкая гипогликемия (рис. 3). Большинство гипогликемических событий произошло в течение первых нескольких часов после рождения. При первом измерении уровня глюкозы в крови через 1 час после рождения уже выявлено 66,3% случаев легкой и 81,4% тяжелых случаев гипогликемии. Через 6 часов вновь выявленная тяжелая гипогликемия была ограничена, и кривые показывают, что плато достигается примерно через 12 часов после рождения. Через 12 часов наблюдения было выявлено 96,5% всех первых случаев легкой гипогликемии и 98% всех первых случаев тяжелой гипогликемии.После этого произошло шесть новых случаев легкой гипогликемии и два новых случая тяжелой гипогликемии.
Рисунок 3
Кривая распространенности, представляющая совокупное выявление легкой и тяжелой гипогликемии во времени. Ось y представляет совокупное обнаружение новых случаев гипогликемии.
Выводы
В этом большом проспективном когортном исследовании мы обнаружили схожую и высокую частоту легкой и тяжелой неонатальной гипогликемии у младенцев, рожденных после беременностей с инсулиновым и не леченным инсулином ГСД.У младенцев, рожденных с LGA, был самый высокий риск неонатальной гипогликемии, но, тем не менее, 72% всех неонатальных гипогликемий приходилось на детей с AGA.
Клинические руководства различаются по вопросу о том, следует ли проводить скрининг новорожденных от беременностей GDM на неонатальную гипогликемию, особенно при AGA или в случаях, когда у матерей контролируется диета. Мы демонстрируем, что риски гипогликемии для всех младенцев с GDM сопоставимы с младенцами с обычными факторами риска, такими как SGA, LGA, недоношенность и ранее существовавший материнский диабет.Отчеты о заболеваемости неонатальной гипогликемией в связи с различными факторами риска широко варьируются в зависимости от определений, методов скрининга и конкретных групп пациентов. Однако в двух крупных проспективных когортных исследованиях в настоящее время рекомендованы определения и мониторинг уровня глюкозы в крови. Харрис и др. (16) исследовали частоту неонатальной гипогликемии у 514 детей с высоким риском (поздние недоношенные, SGA, LGA и младенец от матери с диабетом). Концентрация глюкозы в крови измерялась через 1 час после рождения, каждые 3-4 часа в первые 24 часа и каждые 3-8 часов в следующие 24 часа.Легкая и тяжелая гипогликемия определялась аналогично нашему протоколу. Они сообщили о гипогликемии у 51% новорожденных и тяжелой гипогликемии у 19%, без разницы между различными группами риска (16). McKinlay et al. (5) также применили сопоставимый подход интенсивного скрининга в своем проспективном когортном исследовании, в котором участвовали 404 поздних недоношенных и доношенных новорожденных с высоким риском. Были использованы аналогичные определения; легкая гипогликемия была зарегистрирована у 53% младенцев, а тяжелая гипогликемия — у 16% (5). К сожалению, в обоих исследованиях не уточняется материнский диабет.Наши результаты соответствуют их количеству, подтверждая, что младенцы от матерей с ГСД в равной степени подвержены гипогликемии, как и новорожденные, рекомендованные в настоящее время для рутинного скрининга.
У нашего исследования есть несколько сильных сторон. Это большое проспективное когортное исследование. Мы развернули стандартизированную стратегию скрининга и применили часто используемые пороговые значения для гипогликемии. Кроме того, у нас было только 1,5% потерь для последующего наблюдения, что минимизировало систематическую ошибку отбора. Среднее количество измерений глюкозы составило пять на каждого младенца, что свидетельствует о хорошем соблюдении протокола.Ограничением нашего исследования является то, что оно не позволяет определить оптимальный уровень глюкозы в крови для лечения или предотвращения осложнений и отсутствия здоровой контрольной группы. Кроме того, невозможно было рассчитать точное потребление глюкозы младенцами.
Остается спорным вопрос о том, следует ли считать неонатальную гипогликемию физиологическим феноменом, учитывая относительно высокую частоту гипогликемии после рождения у здоровых младенцев. В целом заболеваемость оценивается в 5–15% (14).У здоровых новорожденных первые несколько часов характеризуются резким снижением уровня глюкозы в крови до ~ 50 мг / дл с повышением через 3 часа до плато ~ 70 мг / дл (17). Это увеличение объясняется несколькими механизмами. Противорегулирующие гормоны, такие как глюкагон, катехоламины и глюкокортикоиды, управляют глюконеогенезом, а также для мозга новорожденных становятся доступными альтернативные виды топлива. Поэтому из-за гиперинсулинизма младенцы от матерей с диабетом склонны к более глубокому и продолжительному снижению уровня глюкозы в крови.Следовательно, это ключ к дифференциации физиологического биохимического низкого уровня глюкозы от гипогликемии с нарушенной метаболической адаптацией, как в случае с новорожденными, рожденными после GDM (18,19).
Исследования с применением монитора непрерывного действия глюкозы (CGM) могут дать больше информации о нормальных и патофизиологических профилях глюкозы в крови у новорожденных. Исследования с недоношенными новорожденными в отделении интенсивной терапии показывают, что использование CGM выявляет больше эпизодов гипогликемии, чем повторные измерения уровня глюкозы в крови (20).Однако в настоящее время CGM еще не может быть подходящим инструментом для скрининга младенцев, рожденных от матерей с GDM, в повседневной практике из-за ограниченной точности, особенно в гипогликемическом диапазоне, а также из-за сложного и дорогостоящего характера метода (21).
Клиническая значимость неонатальной гипогликемии хорошо известна. С помощью ранней черепной МРТ исследование 35 доношенных новорожденных с тяжелой неонатальной гипогликемией (средний уровень глюкозы 18 мг / дл) показало аномалии белого вещества у 94%, корковые аномалии у 51% и нарушения в 18 месяцев у 65% (6).Кроме того, было показано, что более легкая преходящая неонатальная гипогликемия приводит к неврологическим нарушениям. Kerstjens et al. (7) сообщают о значительно более высоком риске задержки развития у 832 умеренно недоношенных новорожденных, подвергшихся гипогликемии (определяемой как уровень глюкозы в плазме <30 мг / дл хотя бы один раз в течение первых 72 часов после рождения) по сравнению с теми, у кого была эугликемия (шансы соотношение 2,42 [95% ДИ 1,23–4,77]). В 10-летнем возрасте дети, перенесшие преходящую неонатальную гипогликемию (определяемую как уровни глюкозы <35, <40 и <45 мг / дл), имели более низкие результаты тестов успеваемости (22).Кроме того, McKinlay et al. (5) недавно показали, что стандартизированный мониторинг уровня глюкозы в крови с последующим лечением гипогликемии (определяемой как уровень глюкозы в крови <47 мг / дл) у новорожденных с высоким риском (34% исследуемой популяции были младенцами, рожденными от матерей с ГСД) предотвращает повреждение нервной системы ( 5). Более того, они продемонстрировали связь между неонатальной гипогликемией и повышенным риском низкой управляющей функции (относительный риск 2,32 [95% ДИ 1,17–4,59]) и зрительной моторной функции (относительный риск 3.67 [95% ДИ 1,15–11,69]) в возрасте 4,5 лет. Была использована большая проспективная когорта из 614 новорожденных с риском гипогликемии, которые были обследованы и пролечены в случае низкого уровня глюкозы в крови. В группе наибольшего риска оказались дети, подвергшиеся тяжелой, рецидивирующей или клинически невыявленной гипогликемии (23).
Принимая во внимание потенциальную тяжесть пагубных последствий неонатальной гипогликемии в свете относительно простой процедуры скрининга и лечения, скрининг представляется оправданным, при этом необходимо провести обследование пяти новорожденных от беременностей, осложненных ГСД, с целью выявления одного новорожденного с тяжелой формой ГСД. гипогликемия.Скрининг в течение первых 12 часов после рождения выявил 98% всех новорожденных с тяжелой гипогликемией и 96,5% всех новорожденных с легкой гипогликемией.
Однако современные методы скрининга требуют госпитализации, часто являются болезненными, и не все устройства на месте оказания медицинской помощи обладают хорошей точностью для определения низкого уровня глюкозы в крови (24,25). Чтобы облегчить и стимулировать рутинный скрининг, необходима дальнейшая разработка точного, неинвазивного и, желательно, метода оказания медицинской помощи.
Резюме
Регулярный скрининг на неонатальную гипогликемию после беременностей, осложненных ГСД, выявляет высокую частоту как легкой (32,6%), так и тяжелой (21%) гипогликемии как для ГСД, контролируемого диетой, так и для лечения инсулином, и во всем диапазоне родов. весовые центили. Новорожденные беременных с ГСД так же склонны к гипогликемии, как и другие признанные категории младенцев из группы высокого риска. Мы предлагаем рутинный скрининг крови на неонатальную гипогликемию в течение первых 12 часов жизни у всех новорожденных после беременности с GDM, независимо от использования инсулина матерью или веса при рождении.
Информация о товаре
Двойственность интересов. J.H.D. получил гранты от Abbott, Dexcom, Medtronic и Sensonics и личные гонорары от Roche Diabetes Care и Sensonics. О других потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Вклад авторов. D.N.V. и L.d.W. способствовал сбору, исследованию и обработке данных; провели статистический анализ и интерпретацию результатов; и написал рукопись.D.N.V., F.G. и M.L.-d.R. способствовал дизайну исследования. B.B.v.R., J.H.D., M.P.H., A.F., F.G. и M.L.-d.R. участвовал в интерпретации результатов, рецензировал и редактировал рукопись. D.N.V. является гарантом этой работы и, как таковой, имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность выполненного анализа.
- Получено 8 января 2018 г.
- Принято 19 марта 2018 г.
- © 2018 Американской диабетической ассоциацией.
Гипогликемия новорожденных — WikEM
Эта страница предназначена для гипогликемии новорожденных . См. Гипогликемию для взрослых пациентов или неонатальную гипогликемию (педиатры).
Фон
- 3 рождения на 1000 с гипогликемией
Риски
- СД матери (гиперинсулин)
- Премия (не может накапливать гликоген)
- Больные дети (истощенный гликоген)
- Младенцы с задержкой роста (истощенный гликоген)
- Macrosomic kids
Клинические особенности
Дифференциальная диагностика
Гипогликемия новорожденных
- Пониженная доступность субстрата
- Задержка внутриутробного развития
- Болезнь накопления гликогена
- Врожденные нарушения обмена веществ (e.г., непереносимость фруктозы)
- Недоношенность
- Длительное голодание без глюкозы внутривенно
- Гиперинсулинемия:
- Другие эндокринные аномалии:
- Повышенная утилизация глюкозы:
- Прочие условия:
Стойкая неонатальная гипогликемия
- Слишком много инсулина:
- Идиопатия, асфиксия, резус диагнозы, Беквит-Вейдерман, несиодобластоз (аутосомно-рецессивный гиперинсулинизм)
- Недостаточно антиинсулина:
- Врожденные нарушения обмена веществ
- Болезнь накопления гликогена, ошибки жирового окисления
Оценка
- Уровень глюкозы в крови
- глюкоза в крови <40 мг / дл (у недоношенных детей повторные уровни ниже <50)
Нормальное падение уровня глюкозы происходит через 2-4 часа жизни
Менеджмент
Таблица декстрозы для детской гипогликемии
| Категория | Возраст | Глюкоза | Лечение | Начальный болюс для внутривенного введения | Поддерживающая доза |
| Неонатальный | <2 мес. | <40 | D10W | 2.5-5 мл / кг | 6 мл / кг / ч |
| Педиатрическая | 2мес-8лет | <60 | D25W | 2 мл / кг | D10W:
|
| Взрослый | > 8 лет | <70 | D50W | 50 мл (1 ампер) OR 1 мл / кг |
- Рассмотрите возможность разбавления болюса D25 или D50 с помощью NS 1: 1, так как эти концентрации могут склерозировать вены
- Проверьте еще раз через 5 минут после приема и повторите дозу, если она низкая.
- Рассмотреть возможность в / м / ск глюкагона, если внутривенный доступ недоступен
Общее лечение
- Глюкометр показывает 20-40 мг / дл, ребенок доношен и может кормить:
- Забор крови для определения уровня глюкозы в крови.
- Подайте 5 мл / кг D5W.
- Повторите измерение уровня глюкозы в крови или глюкометра через 20 мин после кормления.
- Показания глюкометра:
- <20 мг / дл или
- <40 мг / дл и NPO или недоношенные или
- <40 мг / дл после кормления или
- <40 мг / дл и симптоматический
- Забор крови для статического измерения глюкозы.
- Введите болюсное введение 2–3 мл / кг D10W внутривенно.
- Начните непрерывную инфузию D10W со скоростью 4-6 мг / кг / мин.
- Если ребенок от матери, страдающей диабетом, начните D10W с 8-10 мг / кг / мин (100-125 см3 / кг / день).
- Повторите определение уровня глюкозы в крови через 20 минут и продолжайте лечение до тех пор, пока уровень сахара в крови не станет> 40 мг / дл.
- При стойкой гипогликемии, несмотря на указанные выше меры:
- Увеличивайте скорость инфузии глюкозы ступенчато с шагом 2 мг / кг / мин * до 12-15 мг / кг / мин глюкозы.С осторожностью используйте увеличенный объем у младенцев, у которых перегрузка объемом является проблемой. Максимальная концентрация глюкозы в периферическом IV — D12,5.
- Если младенцу требуется внутривенная концентрация декстрозы> 12,5%, вставьте центральный венозный катетер.
- Не используйте болюсы D25W или D50W внутривенно или болюсы большого внутривенного объема, так как это вызывает рикошетную гипогликемию у младенцев с гиперинсулинемией. Кроме того, введение D25W или D50W может вызвать опасное повышение осмолярности плазмы.
- Если гипогликемия не контролируется с помощью вышеуказанных мер:
- Получить консультацию эндокринолога для проведения дальнейшей диагностической оценки и ведения.
- В ожидании консультации отправить кровь (при низком уровне сахара в крови) для определения концентрации глюкозы, кортизола в плазме, гормона роста и инсулина
- Дальнейшее лечение может включать глюкокортикоиды, диазоксид, соматостатин или панкреатэктомию.
Рассчитать скорость введения глюкозы
Используйте любую из следующих формул:
- (% глюкозы x мл / кг / сут) / 144 = скорость инфузии глюкозы (мг / кг / мин)
- (% глюкозы x мл / ч) / (6 x масса тела в кг) = скорость инфузии глюкозы (мг / кг / мин)
Стойкая гипогликемия
- Контрольный инсулин, c-пептид, GH, кортизол, бета-гидроксибутират, UA
- Увеличить объем на 30 куб. См / кг / день
- Повысьте уровень глюкозы до 12.5%
Если продолжается более 3 дней: обратитесь к эндокринологу или раньше
Расположение
- Допустить
- Внутривенное вливание декстрозы при отлучении: когда уровень глюкозы в крови стабилен в течение 12-24 часов, начните уменьшать в / в вливание на 1-2 мл / час каждые 3-4 часа, если уровень глюкозы в крови остается> 60 мг / дл.
См. Также
Список литературы
Новые подходы к лечению неонатальной гипогликемии | Материнское здоровье, неонатология и перинатология
Boardman JP, Wusthoff CJ, Cowan FM. Гипогликемия и неонатальная черепно-мозговая травма. Arch Dis Child Educ Pract. Ed. 2013; 98: 2–6.
Артикул
PubMed
Google ученый
Hawdon JM. Определение неонатальной гипогликемии: время переосмыслить? Arch Dis Child Fetal Neonatal Ed. 2013; 98: F382–3.
Артикул
PubMed
Google ученый
Rozance PJ, Hay WW.Гипогликемия у новорожденных: особенности, связанные с неблагоприятными исходами. Biol Neonate. 2006; 90: 74–86.
CAS
Статья
PubMed
Google ученый
Адамкин ДХ. Послеродовой гомеостаз глюкозы у недоношенных и доношенных детей. Педиатрия. 2011; 127: 575–9.
Артикул
PubMed
Google ученый
Адамкин ДХ. Неонатальная гипогликемия. Curr Opin Pediatr.2016; 28: 150–5.
Артикул
PubMed
Google ученый
Адамкин Д.Х., Полин Р. Гипогликемия новорожденных: 60 — это новые 40? Вопросы остаются прежними. J Perinatol. 2016; 36: 10–2.
CAS
Статья
PubMed
Google ученый
Стэнли Калифорния, Розанс П.Дж., Торнтон П.С., Де Леон Д.Д., Харрис Д., Хеймонд М.В., Хуссейн К., Левицкий Л.Л., Мурад М.Х., Симмонс Р.А., Сперлинг М.А., Вайнштейн Д.А., Уайт Н.Х., Вольфсдорф Д.И.Переоценка «переходной неонатальной гипогликемии»: механизм и значение для лечения. J Pediatr. 2015; 166: 1520–5.
Артикул
PubMed
Google ученый
Торнтон П.С., Стэнли, Калифорния, Де Леон Д.Д., Харрис Д., Хеймонд М.В., Хуссейн К., Левицкий Л.Л., Мурад М.Х., Розанс П.Дж., Симмонс Р.А., Сперлинг М.А., Вайнштейн Д.А., Уайт Н.Х., Вольфсдорф Д.И. Рекомендации Детского эндокринного общества по оценке и лечению стойкой гипогликемии у новорожденных, младенцев и детей.J Pediatr. 2015; 167: 238–45.
Артикул
PubMed
Google ученый
Hay Jr WW, Raju TN, Higgins RD, Kalhan SC, Devaskar SU. Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья ребенка и человеческого развития Юнис Кеннеди Шрайвер. J Pediatr. 2009; 155: 612–7.
Артикул
PubMed
Google ученый
Arcangeli T, Thilaganathan B, Hooper R, Khan KS, Bhide A. Задержка нервного развития у маленьких детей в срок: систематический обзор. Ультразвуковой акушерский гинеколь. 2012; 40: 267–75.
CAS
Статья
PubMed
Google ученый
Brand PL, Molenaar NL, Kaaijk C, Wierenga WS. Нейроразвитие исходов гипогликемии у здоровых, крупных для гестационного возраста, доношенных новорожденных. Arch Dis Child. 2005; 90: 78–81.
CAS
Статья
PubMed
PubMed Central
Google ученый
Stenninger E, Flink R, Eriksson B, Sahlen C. Долгосрочная неврологическая дисфункция и неонатальная гипогликемия после диабетической беременности. Arch Dis Child Fetal Neonatal Ed. 1998; 79: F174–9.
CAS
Статья
PubMed
PubMed Central
Google ученый
фон Бекерат А.К., Коллманн М., Ротки-Фаст С., Карпф Э., Ланг У., Кларич П. Перинатальные осложнения и отдаленные исходы неврологического развития младенцев с задержкой внутриутробного развития.Am J Obstet Gynecol. 2013; 208: 130–6.
Google ученый
Комитет по плодам и новорожденным Американской академии педиатрии. Регулярная оценка артериального давления, гематокрита и глюкозы у новорожденных. Педиатрия. 1993; 92: 474–6.
Google ученый
Barry JS, Rozance PJ, Brown LD, Anthony RV, Thornburg KL, Hay WW Jr. Повышенная чувствительность миокарда плода к инсулино-стимулированному метаболизму глюкозы во время задержки роста плода овцы.Exp Biol Med (Maywood). 2016. [Epub перед печатью].
Леос Р.А., Андерсон М.Дж., Чен Х, Пагмир Дж., Андерсон К.А., Лаймсанд ЮЗ. Хроническое воздействие повышенного уровня норэпинефрина подавляет секрецию инсулина у плодов овцы с плацентарной недостаточностью и задержкой внутриутробного развития. Am J Physiol Endocrinol Metab. 2010; 298: E770–8.
CAS
Статья
PubMed
PubMed Central
Google ученый
Limesand SW, Rozance PJ, Zerbe GO, Hutton JC, Hay Jr WW.Ослабленное высвобождение и хранение инсулина в островках поджелудочной железы эмбриона овцы с ограничением внутриутробного развития. Эндокринология. 2006; 147: 1488–97.
CAS
Статья
PubMed
Google ученый
Limesand SW, Розанс П.Дж., Смит Д., Хэй мл. WW. Повышенная чувствительность к инсулину и поддержание показателей утилизации глюкозы у плодов овец с плацентарной недостаточностью и задержкой внутриутробного развития. Am J Physiol Endocrinol Metab.2007; 293: E1716–25.
CAS
Статья
PubMed
Google ученый
Macko AR, Yates DT, Chen X, Green AS, Kelly AC, Brown LD, Limesand SW. Повышенный уровень норадреналина в плазме подавляет секрецию инсулина, но адренергическая блокада выявляет повышенную чувствительность бета-клеток в модели плацентарной недостаточности у овец на 0,7 гестации. J Dev Orig Health Dis. 2013; 4: 402–10.
CAS
Статья
PubMed
Google ученый
Thorn SR, Brown LD, Rozance PJ, Hay Jr WW, Friedman JE. Повышенное производство глюкозы в печени у плодов овцы с задержкой внутриутробного развития не подавляется инсулином. Сахарный диабет. 2013; 62: 65–73.
CAS
Статья
PubMed
PubMed Central
Google ученый
Браун Л.Д., Розанс П.Дж., Торн С.Р., Фридман Дж.Э., Хэй мл. WW. Острое добавление аминокислот увеличивает чистый прирост белка у плода овец с ЗВУР.Am J Physiol Endocrinol Metab. 2012; 303: E352–64.
CAS
Статья
PubMed
PubMed Central
Google ученый
Коричневый LD. Эндокринная регуляция роста скелетных мышц плода: влияние на здоровье метаболизма в будущем. J Endocrinol. 2014; 221: R13–29.
CAS
Статья
PubMed
PubMed Central
Google ученый
Браун Л.Д., Розанс П.Дж., Брюс Дж.Л., Фридман Дж.Э., Хэй-младший В.В., Весоловски С.Р.Ограниченная способность к окислению глюкозы у плодов овцы с задержкой внутриутробного развития. Am J Physiol Regul Integr Comp Physiol. 2015; 309: R920–8.
CAS
Статья
PubMed
Google ученый
Limesand SW, Jensen J, Hutton JC, Hay Jr WW. Снижение репликации бета-клеток способствует снижению массы бета-клеток у плодов овцы с ограничением внутриутробного роста. Am J Physiol Regul Integr Comp Physiol. 2005; 288: R1297–305.
CAS
Статья
PubMed
Google ученый
Limesand SW, Rozance PJ, Macko AR, Anderson MJ, Kelly AC, Hay Jr WW. Снижение концентрации инсулина и массы бета-клеток предшествует ограничению роста плодов овец с плацентарной недостаточностью. Am J Physiol Endocrinol Metab. 2013; 304: E516–23.
CAS
Статья
PubMed
PubMed Central
Google ученый
Rozance PJ, Hay WW Jr. Фактор роста гепатоцитов островков поджелудочной железы и фактор роста эндотелия сосудов А сигнализация у плодов с ограниченным ростом. Mol Cell Endocrinol. 2016. [Epub перед печатью].
Thorn SR, Regnault TRH, Brown LD, Rozance PJ, Keng J, Roper M, Wilkening RB, Hay WW, Jr., Friedman JE. Ограничение внутриутробного развития увеличивает глюконеогенную способность печени плода и снижает инициацию трансляции рибонуклеиновой кислоты-мессенджера и чувствительность к питательным веществам в печени и скелетных мышцах плода.Эндокринология. 2009; 150: 3021–30.
CAS
Статья
PubMed
PubMed Central
Google ученый
Wesolowski SR, Hay WW Jr. Роль плацентарной недостаточности и ограничения внутриутробного развития на активацию продукции глюкозы в печени плода. Mol Cell Endocrinol. 2015. [Epub перед печатью].
Yates DT, Green AS, Limesand SW. Катехоламины опосредуют множественные адаптации плода во время плацентарной недостаточности, которые способствуют задержке внутриутробного развития: уроки гипертермической овцы.J Беременность. 2011; 2011: 740408.
CAS
Статья
PubMed
PubMed Central
Google ученый
Ятс Д.Т., Кларк Д.С., Макко А.Р., Андерсон М.Дж., Шелтон Л.А., Ниаринг М., Аллен Р.Э., Роадс Р.П., Лаймсэнд ЮЗ. Миобласты из плодов овцы с ограниченным внутриутробным ростом обнаруживают внутренние недостатки пролиферации, которые вносят вклад в более мелкие миофибриллы полусухожильной мышцы. J Physiol. 2014; 592: 3113–25.
CAS
Статья
PubMed
PubMed Central
Google ученый
Whipple AO, Франц В.К. Аденома островковых клеток при гиперинсулинизме: обзор. Ann Surg. 1935; 101: 1299–335.
CAS
Статья
PubMed
PubMed Central
Google ученый
Харрис Д.Л., Уэстон П.Дж., Сигнал М, Чейз Дж. Г., Хардинг Дж. Гель с декстрозой при неонатальной гипогликемии (исследование Sugar Babies): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет. 2013; 382: 2077–83.
CAS
Статья
PubMed
Google ученый
Alexandrou G, Skiold B, Karlen J, Tessma MK, Norman M, Aden U, Vanpee M. Ранняя гипергликемия является фактором риска смерти и уменьшения белого вещества у недоношенных детей. Педиатрия. 2010; 125: e584–91.
Артикул
PubMed
Google ученый
McKinlay CJ, Alsweiler JM, Ansell JM, Anstice NS, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Jiang Y, Paudel N, Signal M, Thompson B, Wouldes TA, Yu TY, Harding JE . Неонатальная гликемия и исходы неврологического развития через 2 года.N Engl J Med. 2015; 373: 1507–18.
CAS
Статья
PubMed
PubMed Central
Google ученый
Лилиен Л.Д., Пилдес Р.С., Сринивасан Г., Воора С., Йе ТФ. Лечение гипогликемии новорожденных миниболусом и внутривенной инфузией глюкозы. J Pediatr. 1980; 97: 295–8.
CAS
Статья
PubMed
Google ученый
Харрис Д.Л., Альсвейлер Дж. М., Анселл Дж. М., Гэмбл Г. Д., Томпсон Б., Вулдес Т. А., Ю. Т. Ю., Хардинг Дж. Э.Результат через 2 года после лечения неонатальной гипогликемией гелем декстрозы: наблюдение в рандомизированном исследовании. J Pediatr. 2016; 170: 54–9.
CAS
Статья
PubMed
Google ученый
Сринивасан Г., Пилдес Р.С., Каттаманчи Г., Воора С., Лилиен Л.Д. Показатели глюкозы в плазме у здоровых новорожденных: новый взгляд. J Pediatr. 1986; 109: 114–7.
CAS
Статья
PubMed
Google ученый
Ву ХК, Толоса Л., Эль-Метвалли Д., Вискарди РМ. Мониторинг уровня глюкозы у новорожденных: необходимость в точных и неинвазивных методах. Arch Dis Child Fetal Neonatal Ed. 2014; 99: F153–7.
Артикул
PubMed
Google ученый
Беннетт С., Фаган Е., Чахарбахши Е., Замфирова И., Фликер Дж. Реализация протокола с использованием геля глюкозы для лечения гипогликемии новорожденных. Nurs Womens Health. 2016; 20: 64–74.
Артикул
PubMed
Google ученый
Stewart CE, Sage EL, Reynolds P. Поддержка «Baby Friendly»: инициатива по улучшению качества лечения переходной неонатальной гипогликемии. Arch Dis Child Fetal Neonatal Ed. 2015. [Epub перед печатью].
Beardsall K, Vanhaesebrouck S, Ogilvy-Stuart AL, Vanhole C, Palmer CR, van Weissenbruch M, Midgley P, Thompson M, Thio M, Cornette L, Ossuetta I, Iglesias I, Theyskens C, de Jong М., Ахлувалия Дж. С., де Зегер Ф., Дангер ДБ. Ранняя инсулинотерапия у младенцев с очень низкой массой тела при рождении.N Engl J Med. 2008; 359: 1873–84.
CAS
Статья
PubMed
Google ученый
Харрис Д.Л., Баттин М.Р., Уэстон П.Дж., Хардинг Дж. Непрерывный мониторинг уровня глюкозы у новорожденных с риском гипогликемии. J Pediatr. 2010. 157: 198–202.
Артикул
PubMed
Google ученый
Hay Jr WW, Rozance PJ. Непрерывный мониторинг глюкозы для диагностики и лечения неонатальной гипогликемии.J Pediatr. 2010; 157: 180–2.
Артикул
PubMed
PubMed Central
Google ученый
Харрис Д.Л., Уэстон П.Дж., Хардинг Дж. Заболеваемость неонатальной гипогликемией у детей, относящихся к группе риска. J Pediatr. 2012; 161: 787–91.
CAS
Статья
PubMed
Google ученый
Rozance PJ, Hay Jr WW. Гипогликемия новорожденных — ответы, но больше вопросов.J Pediatr. 2012; 161: 775–6.
Артикул
PubMed
PubMed Central
Google ученый
Boluyt N, van Kempen A, Offringa M. Нейроразвитие после неонатальной гипогликемии: систематический обзор и дизайн оптимального будущего исследования. Педиатрия. 2006; 117: 2231–43.
Артикул
PubMed
Google ученый
Рекомендации по неонатальной гипогликемии | baby gooroo
Немногие новорожденные вызывают большие споры, чем неонатальная гипогликемия (низкий уровень сахара в крови), особенно когда она возникает у младенцев, находящихся на грудном вскармливании.Продолжающиеся дебаты подогреваются тем фактом, что эксперты расходятся во мнениях не только о том, как управлять неонатальной гипогликемией (НГ), но и о том, как ее определять.
Что такое неонатальная гипогликемия?
Глюкоза (сахар) в крови является источником энергии для организма. Когда уровень глюкозы в крови низкий, возникает состояние, известное как гипогликемия, и организм не может нормально функционировать. Почти у всех новорожденных после рождения наблюдается гипогликемия. Уровни глюкозы в крови обычно падают в течение первых 1-2 часов, опускаясь до 30 мг / дл (миллиграммов на драмлитр), а затем повышаются в течение следующих 12 часов (при условии, что младенцы получают достаточное питание), достигая уровня 45 мг / дл. или больше.Эти изменения часто происходят без какого-либо медицинского вмешательства.
Хотя нет никаких доказательств того, что несколько часов низкого уровня сахара в крови у бессимптомных младенцев (без симптомов) вредны, многие поставщики медицинских услуг обычно проверяют новорожденных на гипогликемию, в том числе тех, у которых нет признаков низкого уровня сахара в крови. все. Симптомы могут включать:
- Дрожь
- Раздражительность
- Цианоз (сине-серое изменение цвета кожи)
- Судороги
- Высокий крик
- Плохие привычки при кормлении
- Слабость
- Слабость
- Закатывание глаз
Слабость
Неонатальная гипогликемия может вызвать неврологические повреждения у новорожденных, если ее не лечить.Тем не менее, рутинный скрининг широко критиковался как дорогостоящий, инвазивный и ненадежный. Более того, это увеличивает риск ненужных добавок у младенцев, находящихся на грудном вскармливании.
Скрининг неонатальной гипогликемии
Американская академия педиатрии (AAP) рекомендует ограничить скрининг на неонатальную гипогликемию младенцами из группы риска (т. Е. Младенцами, рожденными от матерей с диабетом или гестационным диабетом; крупными или малые для гестационного возраста; поздние недоношенные дети, рожденные в возрасте от 34 до 37 недель) и младенцы, перенесшие родовую травму.AAP также рекомендует, чтобы частота и продолжительность скрининга основывались на уровне риска младенца. Другими словами, медицинская необходимость (а не политика или распорядок) должна определять необходимость скрининга и лечения NH.
Краткое изложение рекомендаций:
- Здоровые доношенных детей , рожденные от матерей с нормальной беременностью, родами и родами, не нуждаются в рутинном скрининге на неонатальную гипогликемию.
- К младенцам, подверженным риску неонатальной гипогликемии, относятся дети, рожденные от матерей с диабетом (включая гестационный диабет), дети, большие или малые для гестационного возраста, и поздно недоношенные дети (рожденные между 34–37 неделями).
- Уровень глюкозы в крови, при котором рекомендуется лечение бессимптомных младенцев, неясен.
- Уровень глюкозы в крови всего 30 мг / дл в первые 1-2 часа после рождения у бессимптомных младенцев может не быть вредным.
- Уровень глюкозы в крови обычно повышается до 45 мг / дл к 12 часам после рождения.
- Крупные и маленькие для гестационного возраста дети считаются группой риска по неонатальной гипогликемии на срок до 10 дней.
- Лабораторные исследования — самый точный метод измерения уровня глюкозы в крови.
- Прикроватные тест-полоски (по сравнению с лабораторным тестом) являются ненадежным средством измерения уровня сахара в крови и могут давать результаты, которые различаются на 10–20 мг / дл.
- Младенцам с симптомами (показывающими уровень глюкозы в крови менее 20–25 мг / дл) следует немедленно пройти лабораторный анализ на уровень глюкозы в крови и ввести глюкозу внутривенно, если уровни ниже 40 мг / дл.
- Ведение бессимптомных детей из группы риска зависит от возраста.
Можно ли кормить детей с гипогликемией исключительно грудью?
Исключительное грудное вскармливание лучше всего подходит для всех ребенка, включая детей с повышенным риском гипогликемии.Если у ребенка симптомы (проявляются признаки гипогликемии) или уровень глюкозы в крови ниже 20-25 мг / дл, ребенку следует вводить жидкости внутривенно (в / в) до тех пор, пока уровень глюкозы в крови не станет нормальным (более 45 мг / дл). dL), и ребенок может эффективно кормить грудью. Матери младенцев, которые не могут кормить грудью, даже если они временно, могут защитить свое молоко, сцеживая вручную или сцеживая грудь каждые 2–3 часа или примерно 8–12 раз в день, пока их дети не смогут возобновить грудное вскармливание. .Матери следует поощрять к тому, чтобы практиковать уход кожа к коже, что можно делать даже тогда, когда их ребенок получает внутривенные вливания. (Прочтите это, чтобы узнать обо всех преимуществах косметического ухода.)
Многие младенцы испытывают неонатальную гипогликемию и в большинстве своем кормят исключительно грудью. Если ваш ребенок не может кормить грудью и ему необходимо кормить грудью в течение короткого времени, вы можете сцеживать молоко вручную, сцеживать молоко и кормить его своим ребенком или кормить ребенка донорским молоком или детской смесью. Лечащий врач вашего ребенка может помочь вам решить, какой вариант лучше всего подходит вам и вашему ребенку.
Причины и симптомы гипогликемии новорожденных
Глюкоза, или сахар в крови, имеет решающее значение для развития мозга, поскольку является основным источником энергии для мозга . Неонатальная гипогликемия — это состояние, при котором уровень сахара в крови ребенка падает до опасно низкого уровня в течение нескольких дней после рождения. Эти низкие уровни глюкозы могут нарушить процесс роста и привести к гибели клеток мозга. Неонатальная гипогликемия является одной из наиболее частых неонатальных метаболических проблем , и легко поддается лечению .Когда ребенок переходит к жизни вне утробы матери, уровень глюкозы в крови естественным образом падает в течение первых двух часов после родов (2). Однако у младенца с неонатальной гипогликемией (НГ) наблюдается более резкое и продолжительное падение уровня сахара в крови, чем у здорового младенца. В утробе матери плод обычно может получать стабильный уровень глюкозы от матери через плаценту. После рождения младенец получает глюкозу из грудного молока или смеси, а также вырабатывает ее в печени. Стабильный уровень глюкозы важен для функционирования органов у новорожденного ребенка, а мозг использует глюкозу почти исключительно для энергетического обмена и развития (3).
Перейти к:
NH — одна из наиболее частых проблем метаболизма у младенцев, а тяжелая форма NH — одна из основных причин неонатального повреждения головного мозга. Неонатальную гипогликемию распознать несложно, и обычно ее очень легко лечить. Однако необработанный NH может привести к серьезным последствиям, потому что развивающаяся ткань мозга младенца зависит от постоянного поступления глюкозы в качестве основного источника топлива. Когда мозг ребенка не получает достаточного количества глюкозы, клетки мозга начинают умирать, и это может привести к необратимому повреждению мозга (3).
Факторы риска неонатальной гипогликемии
Некоторые медицинские состояния, которые могут вызвать NH, перечислены ниже (это не полный список) (3)::
- Младенцы, необычно маленькие или большие для гестационного возраста (см. Наши страницы, посвященные ограничению внутриутробного развития [IUGR] и макросомии)
- Недоношенные дети: могут иметь плохие запасы питательных веществ и незрелую гормональную систему, что может увеличить их риск
- Младенцы, рожденные от матерей с диабетом
- Младенцы, перенесшие асфиксию (ГИЭ) или стресс в утробе матери
- Младенцы с низким уровнем гормонов щитовидной железы (гипотиреоз)
- Младенцы с некоторыми редкими генетическими нарушениями
Причины неонатальной гипогликемии
Причины неонатальной гипогликемии включают следующие (2):
- Избыток инсулина в крови ребенка: Инсулин — это гормон, снижающий количество глюкозы в крови.Когда у ребенка избыток инсулина, одно состояние называется стойкой гиперинсулинемической гипогликемией младенчества (PHHI).
- Гипоксическая ишемическая энцефалопатия (ГИЭ)
- Ограниченное хранение гликогена : Прежде чем глюкоза расщепляется до простой формы, она хранится в форме гликогена. Снижение запасов гликогена может произойти в результате недоношенности или ограничения внутриутробного развития (ЗВУР) и может вызвать гипогликемию.
- Повышенное потребление глюкозы : Ребенку может потребоваться использовать больше глюкозы, чем обычно, из-за следующих заболеваний:
- Гипертермия (высокая температура тела в результате инфекции, приема лекарств или травмы головы)
- Полицитемия (аномально высокая масса эритроцитов, которая может быть вызвана кислородным голоданием)
- Сепсис (бактериальная инфекция в кровотоке)
- Дефицит гормона роста
- Пониженный гликогенолиз : Это пониженное расщепление гликогена на глюкозу.
- Снижение глюконеогенеза : Это снижение выработки глюкозы, вызванное проблемами метаболического пути.
- Истощение запасов гликогена : Это может быть вызвано следующими причинами:
- Асфиксия-перинатальный стресс (ребенок лишен кислорода во время родов так долго, что происходит повреждение, как правило, головного мозга).
- Голод
Отдаленные эффекты неонатальной гипогликемии
Если неонатальная гипогликемия остается недиагностированной и / или не лечится слишком долго, существует вероятность долгосрочной травмы.Некоторые из этих травм включают (2):
Признаки и симптомы неонатальной гипогликемии
В некоторых случаях у младенцев с низким уровнем сахара в крови могут даже не проявляться симптомы. После рождения ребенка обычно проводят анализы крови, чтобы проверить уровень сахара в крови. Если признаки и симптомы появляются, они могут включать следующее (3):
- Кожа синеватого цвета ( цианоз ) или кожа бледная
- Проблемы с дыханием , такие как учащенное дыхание ( тахипноэ, ), паузы в дыхании ( апноэ, ) или хрюкающий звук
- Раздражительность или вялость
- Свободные или вялые мышцы ( гипотония )
- Рвота или плохое кормление
- Слабый или высокий крик
- Тремор, дрожь, потливость или судороги
Преходящая и стойкая неонатальная гипогликемия
Существует два разных типа неонатальной гипогликемии: преходящая (краткосрочная) и стойкая (долгосрочная).Младенцы с преходящим амнезиаком обычно имеют дефицит запасов гликогена при рождении. Это часто встречается у детей, рожденных недоношенными, маленьких для гестационного возраста или перенесших асфиксию при родах. Младенцы с преходящим НГ также могут испытывать гиперинсулинизм, который чаще всего встречается у детей, рожденных от матерей с диабетом (2).
Неонатальная гипогликемия также может возникнуть, если прервать внутривенное вливание глюкозы; например, если пупочный катетер установлен неправильно или у ребенка сепсис.Если у ребенка НГ из-за ошибки приема лекарства, это халатность врача.
Диагностика и лечение гипогликемии новорожденных
Когда у ребенка проявляются клинические признаки низкого уровня глюкозы в крови или если известно, что у ребенка есть риск неонатальной гипогликемии, необходимо немедленно провести анализ уровня глюкозы в крови. Этот тест следует проводить в течение нескольких минут после появления любых симптомов, отправив часть крови ребенка в лабораторию для анализа. Если у ребенка низкий уровень сахара в крови, то его концентрацию глюкозы следует повторно проверять каждые три-шесть часов в течение первых 24-48 часов жизни (2).Поскольку при неправильном лечении NH может привести к травме головного мозга, важно использовать агрессивную терапию, которая включает парентеральное введение глюкозы (декстрозы) для повышения уровня глюкозы в крови у детей с симптомами (1). Декстроза обычно вводится через капельницу, и ее уровни контролируются и регулируются до тех пор, пока уровень глюкозы в крови у ребенка не достигнет приемлемой концентрации. При необходимости лечение будет продолжаться от нескольких часов или дней до недели или до тех пор, пока ребенок не сможет поддерживать нормальный уровень глюкозы.Младенцам, родившимся рано, с инфекцией или родившимся с низким весом, возможно, потребуется более длительное лечение.
Общие методы лечения гипогликемии новорожденных
Если внутривенное введение декстрозы невозможно для ребенка с NH, можно использовать глюкагон в качестве лечения и вводить подкожно или внутримышечно (1). Глюкагон можно использовать для лечения младенцев, которые страдают тяжелой гипогликемией и могут не иметь доступной для них декстрозы. Младенцы, перенесшие NH и не получающие декстрозу или глюкагон, должны получать питание в течение первого часа жизни.Эти кормления следует проводить с интервалом в два-три часа, а концентрацию глюкозы в крови следует часто контролировать в течение 20-30 минут после кормления. Младенцам, находящимся на грудном вскармливании, может потребоваться дополнительная смесь до тех пор, пока мать не сможет вырабатывать достаточно грудного молока (1).
Юридическая помощь при неонатальной гипогликемии | доверенные поверенные США по родовым травмам
Ранняя диагностика и лечение неонатальной гипогликемии имеют решающее значение; Серьезность проблем, которые могут возникнуть, если не лечить неонатальную гипогликемию, подчеркивает этот момент.Тестирование на гипогликемию простое, и если у ребенка были какие-либо факторы риска гипогликемии и он не был проверен должным образом, медицинский персонал проявил халатность. Медицинский персонал также действовал небрежно, если у ребенка была гипогликемия, и это состояние не лечилось или не лечилось должным образом. Если ребенок получил повреждение мозга или травму в результате этих халатных действий, это считается врачебной халатностью.
Чтобы начать бесплатное рассмотрение обращения, свяжитесь с нашей командой любым из следующих способов.
Бесплатный обзор корпуса | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатно): 866-738-1783
Нажмите кнопку Live Chat в вашем браузере
Заполните нашу онлайн-форму для связи
Источники:
- Розанс, П.J., MD. (нет данных). Лечение и исход неонатальной гипогликемии. Получено с https://www.uptodate.com/contents/management-and-outcome-of-neonatal-hypoglycemia?search=неонатальная гипогликемия & source = search_result & selectedTitle = 2 ~ 54 & usage_type = default & display_rank = 2
- Rozance, P.J., MD.

 Дела были обработанные 40% декстрозой в геле с концентрацией 200 мг / кг, в то время как контроли с раствор плацебо. Новорожденных обеих групп поощряли к кормлению, но если кормление было недостаточный, вводили грудное молоко или молочную смесь через шприц. Обрабатывали группа показала частоту неудач в обращении более низкой гипогликемии по сравнению с контрольной группой (14% против 24%, ОР = 0,57 (0,33-0,98), р = 0,04). Hegarty et al провели клиническое испытание, в котором 416 новорожденные были рандомизированы и распределены по одному из 4 типов лечения: глюкоза 40% в геле в однократная (200 мг / кг) или двойная (400 мг / кг) через 1 час после рождения или с последующими 3 дополнительные дозы декстрозы (200 мг / кг) в первые 12 часов. Уровень глюкозы в крови измерялся при 2 часа с момента рождения, затем каждые 2-4 часа в течение первых 12 часов жизни. Заболеваемость гипогликемия была ниже в группе лечения, чем в контрольной группе, получавшей плацебо. раствор (41% против 52%, RR = 0,79 (0,64-0,98), p = 0,03).
Дела были обработанные 40% декстрозой в геле с концентрацией 200 мг / кг, в то время как контроли с раствор плацебо. Новорожденных обеих групп поощряли к кормлению, но если кормление было недостаточный, вводили грудное молоко или молочную смесь через шприц. Обрабатывали группа показала частоту неудач в обращении более низкой гипогликемии по сравнению с контрольной группой (14% против 24%, ОР = 0,57 (0,33-0,98), р = 0,04). Hegarty et al провели клиническое испытание, в котором 416 новорожденные были рандомизированы и распределены по одному из 4 типов лечения: глюкоза 40% в геле в однократная (200 мг / кг) или двойная (400 мг / кг) через 1 час после рождения или с последующими 3 дополнительные дозы декстрозы (200 мг / кг) в первые 12 часов. Уровень глюкозы в крови измерялся при 2 часа с момента рождения, затем каждые 2-4 часа в течение первых 12 часов жизни. Заболеваемость гипогликемия была ниже в группе лечения, чем в контрольной группе, получавшей плацебо. раствор (41% против 52%, RR = 0,79 (0,64-0,98), p = 0,03). Группа новорожденных, получавших лечение однократное введение геля в концентрации 200 мг / кг показало большее снижение частота гипогликемии по сравнению с другими видами лечения (38% против 56%, ОР = 0,66 (0,47-0,99), р = 0,04)
Группа новорожденных, получавших лечение однократное введение геля в концентрации 200 мг / кг показало большее снижение частота гипогликемии по сравнению с другими видами лечения (38% против 56%, ОР = 0,66 (0,47-0,99), р = 0,04) Выбранный порог составлял 45 мг / дл, но они также заявили, что немногие исследования показали, что бессимптомное состояние гипогликемии, продолжающееся в течение нескольких часов, связано с с длительным неврологическим повреждением.Исследования, показывающие взаимосвязь между плазмой крови концентрация сахара и долгосрочные неврологические нежелательные явления также зависели от вариативное определение гипогликемии, длительность гипогликемии, отсутствие исследований случай-контроль и размер выборки. Другой выбранный порог для диагностики гипогликемии составил 47 мг / дл, однако без строгих научных доказательств. Впоследствии в 2015 и 2017 годах два научные данные показали, что поддержание уровня сахара в крови выше 47 мг / дл в первые 48 часов жизни у младенцев с риском гипогликемии и при последующем наблюдении не ассоциировались с увеличение частоты нейросенсорных изменений в возрасте 2 и 4,5 лет жизни соответственно. Кроме того, в этих документах устанавливались условия суровых гипогликемия при уровне глюкозы в плазме
Выбранный порог составлял 45 мг / дл, но они также заявили, что немногие исследования показали, что бессимптомное состояние гипогликемии, продолжающееся в течение нескольких часов, связано с с длительным неврологическим повреждением.Исследования, показывающие взаимосвязь между плазмой крови концентрация сахара и долгосрочные неврологические нежелательные явления также зависели от вариативное определение гипогликемии, длительность гипогликемии, отсутствие исследований случай-контроль и размер выборки. Другой выбранный порог для диагностики гипогликемии составил 47 мг / дл, однако без строгих научных доказательств. Впоследствии в 2015 и 2017 годах два научные данные показали, что поддержание уровня сахара в крови выше 47 мг / дл в первые 48 часов жизни у младенцев с риском гипогликемии и при последующем наблюдении не ассоциировались с увеличение частоты нейросенсорных изменений в возрасте 2 и 4,5 лет жизни соответственно. Кроме того, в этих документах устанавливались условия суровых гипогликемия при уровне глюкозы в плазме гипогликемию.Гликемический мониторинг у новорожденных из группы риска следует начинать не ранее два часа жизни, фактически видно, что при рождении значения глюкозы в крови новорожденных очень низкие, потому что они обусловлены метаболической активностью плода в внутриутробная фаза, а позже эти значения снова увеличиваются, пока не достигнут значений, аналогичных взрослый в течение 48-72 часов.Мониторинг проводится с помощью глюкометра, капиллярного EGA или крови забор проб проводится у пациентов, подверженных риску болезненного стресса. В последние годы проводятся различные исследования группы оценивали возможность достижения немедикаментозной профилактики гипогликемия.В частности, группа Хегарти разработала протокол, в котором используется гель декстрозы на 40% в категориях риска, которые могут снизить количество случаев гипогликемии и вследствие болезненных процедур. Температура тела и состояние обмена веществ и / или респираторный ацидоз — один из основных факторов, влияющих на уровень сахара в крови в первые 48 часов жизни.
гипогликемию.Гликемический мониторинг у новорожденных из группы риска следует начинать не ранее два часа жизни, фактически видно, что при рождении значения глюкозы в крови новорожденных очень низкие, потому что они обусловлены метаболической активностью плода в внутриутробная фаза, а позже эти значения снова увеличиваются, пока не достигнут значений, аналогичных взрослый в течение 48-72 часов.Мониторинг проводится с помощью глюкометра, капиллярного EGA или крови забор проб проводится у пациентов, подверженных риску болезненного стресса. В последние годы проводятся различные исследования группы оценивали возможность достижения немедикаментозной профилактики гипогликемия.В частности, группа Хегарти разработала протокол, в котором используется гель декстрозы на 40% в категориях риска, которые могут снизить количество случаев гипогликемии и вследствие болезненных процедур. Температура тела и состояние обмена веществ и / или респираторный ацидоз — один из основных факторов, влияющих на уровень сахара в крови в первые 48 часов жизни. В настоящее время не существует стратегий предотвращения гипогликемии. лечение, в случае бессимптомной гипогликемии, — это раннее введение молока в формула, а в случае симптоматической гипогликемии вливание 10% глюкозы внутривенно предвиденное или раннее кормление грудным молоком или смесью. употребление молока, приготовленного в первые часы жизни, снижает грудное вскармливание.В тяжелых случаях при гликемии
В настоящее время не существует стратегий предотвращения гипогликемии. лечение, в случае бессимптомной гипогликемии, — это раннее введение молока в формула, а в случае симптоматической гипогликемии вливание 10% глюкозы внутривенно предвиденное или раннее кормление грудным молоком или смесью. употребление молока, приготовленного в первые часы жизни, снижает грудное вскармливание.В тяжелых случаях при гликемии группа показала частоту неудач в обращении более низкой гипогликемии по сравнению с контрольной группой (14% против 24%, RR = 0,57 (0,33-0,98), p = 0,04). В 2016 г. Вестон и др. литературы с целью оценки эффективности 40% декстрозы в геле для предотвращения гипогликемии и в снижении долгосрочного ущерба, связанного с развитием нервной системы. Были включены испытания с участием 312 младенцев. Было обнаружено, что введение геля снижение разлучения матери и ребенка (ОР = 0,54, 95% ДИ = 0,31-0,93) и вероятность исключительно грудное вскармливание после выписки увеличилось (ОР 1,10, 95% ДИ с 1,01 до 1,18).
группа показала частоту неудач в обращении более низкой гипогликемии по сравнению с контрольной группой (14% против 24%, RR = 0,57 (0,33-0,98), p = 0,04). В 2016 г. Вестон и др. литературы с целью оценки эффективности 40% декстрозы в геле для предотвращения гипогликемии и в снижении долгосрочного ущерба, связанного с развитием нервной системы. Были включены испытания с участием 312 младенцев. Было обнаружено, что введение геля снижение разлучения матери и ребенка (ОР = 0,54, 95% ДИ = 0,31-0,93) и вероятность исключительно грудное вскармливание после выписки увеличилось (ОР 1,10, 95% ДИ с 1,01 до 1,18). Уровень глюкозы в крови измеряли через 2 часа после рождения, затем каждые 2-4 часа в течение первых 12 часов жизни. Частота гипогликемии была ниже в леченных, чем в контрольной группе, получавших раствор плацебо (41% против 52%, RR = 0,79 (0,64-0,98), р = 0,03). Группа новорожденных, получавших однократное введение геля при концентрация 200 мг / кг показала большее снижение частоты гипогликемии по сравнению с другими видами лечения (38% против 56%, ОР = 0,66 (0,47-0,99), p = 0,04). Лечение 40% декстрозой в геле также привело к снижению количества госпитализаций в ОИТН из-за гипогликемия по сравнению с контрольной группой (2% против 13%, RR = 0,12 (0,02-0,90), p = 0,04) и к количеству новорожденных, получавших молоко в смеси (средняя разница = -6,00 (-11,58-0,41), p = 0,036). Научные доказательства безопасности: отсутствие побочных эффектов, связанных с использованием Во всех проведенных исследованиях было зарегистрировано 40% декстрозы в геле. опубликовано Оклендским университетом, Новая Зеландия, утверждает, что использование декстрозы в геле не изменяет частоту неврологической инвалидности в 2 года правильного возраста, более того, такие события, как судорожный кризис или смерть, не были описаны после введение этого геля.
Уровень глюкозы в крови измеряли через 2 часа после рождения, затем каждые 2-4 часа в течение первых 12 часов жизни. Частота гипогликемии была ниже в леченных, чем в контрольной группе, получавших раствор плацебо (41% против 52%, RR = 0,79 (0,64-0,98), р = 0,03). Группа новорожденных, получавших однократное введение геля при концентрация 200 мг / кг показала большее снижение частоты гипогликемии по сравнению с другими видами лечения (38% против 56%, ОР = 0,66 (0,47-0,99), p = 0,04). Лечение 40% декстрозой в геле также привело к снижению количества госпитализаций в ОИТН из-за гипогликемия по сравнению с контрольной группой (2% против 13%, RR = 0,12 (0,02-0,90), p = 0,04) и к количеству новорожденных, получавших молоко в смеси (средняя разница = -6,00 (-11,58-0,41), p = 0,036). Научные доказательства безопасности: отсутствие побочных эффектов, связанных с использованием Во всех проведенных исследованиях было зарегистрировано 40% декстрозы в геле. опубликовано Оклендским университетом, Новая Зеландия, утверждает, что использование декстрозы в геле не изменяет частоту неврологической инвалидности в 2 года правильного возраста, более того, такие события, как судорожный кризис или смерть, не были описаны после введение этого геля. Кроме того, из анализа литературы различными научные поисковые системы, включая Pubmed, Scholar и другие, с использованием в качестве ключевых слов: новорожденный, гипогликемия и гель декстрозы, до момента написания этого синопсиса никаких работ не проводилось обнаружено, что касается побочных эффектов при использовании геля декстрозы. .
Кроме того, из анализа литературы различными научные поисковые системы, включая Pubmed, Scholar и другие, с использованием в качестве ключевых слов: новорожденный, гипогликемия и гель декстрозы, до момента написания этого синопсиса никаких работ не проводилось обнаружено, что касается побочных эффектов при использовании геля декстрозы. .