Хронический гепатит С — причины, симптомы и лечение — Медкомпас
Хронический гепатит С
Вирусным гепатитом С называется инфекционно-воспалительный процесс, характеризующийся поражением печени.
Гепатит С относится к парентеральным инфекциям, которые приводят к поражению печени. В последнее время количество случаев заражениям этим заболеванием неуклонно растет.
Симптомы болезни
Длительное время вирусный гепатит С может протекать бессимптомно. Затем развивается яркий дебют заболевания, который связан с развитием либо цирроза печени, либо рака.
В зависимости от выраженности клинических проявлений принято выделять три основные стадии инфекционного процесса. К ним относятся следующие:
- Острая
- Латентная
- Фаза реактивации.
В некоторых случаях при сильном иммунном ответе может произойти полное удаление вируса из организма человека. Клинически это проявляется выздоровлением пациента.
Основными клиническими проявлениями вирусного гепатита С являются:
- Желтуха, то есть появление желтушного окрашивания кожи и слизистых оболочек
- Немотивированная слабость
- Боли в правом подреберье
- Снижение аппетита
- Снижение массы тела и т.д.
Причины болезни
Гепатит С развивается в результате инфицирования одноименным вирусом. Он является РНК содержащим и имеет микроскопические размеры.
Основными путями передачи этой инфекции являются:
- Парентеральный, то есть через кровь (медицинские инструменты, переливание крови и т.д.)
- Вертикальный (от инфицированной матери плоду)
- Половой.
Диагностика
Диагностический поиск в отношении вирусного гепатита С включает в себя следующие исследования:
- Проведение полимеразной цепной реакции, определяющей ДНК вируса
- Серологические исследования, которые выявляют антитела различных классов к этому типу вируса
- Биохимическое исследование крови, которое позволяет оценить сохранность функции печени (повышение ферментов печени (АЛТ и АСТ) и билирубина)
- Ультразвуковое исследование печени
- Определение онкомаркеров для исключения рака печени
- Биопсия печеночной паренхимы для последующего гистологического исследования, позволяющего изучить строение печени.

При проведении серологических исследований следует учитывать, что имеется стадия окна. Она характеризуется тем, что в крови уже циркулирует вирус, а антитела к нему еще не вырабатываются, поэтому они не могут быть определены. В связи с этим обязательно проведение повторного серологического исследования через полгода в случае подозрения на вирусный гепатит С.
Осложнения
Отсутствие лечения гепатита С способно привести к следующим осложнениям:
- Печеночная недостаточность
- Асцит
- Рак печени
- Внутрибрюшное кровотечение
- Печеночная энцефалопатия и т.д.
Лечение болезни
Вирусный гепатит С представляет сложную терапевтическую задачу. Это связано с несовершенством предлагаемых лекарственных препаратов. Были сообщения в литературе о применении противовирусных препаратов, однако это лечение очень дорогое и не всегда эффективное. Поэтому гепатит С современная гепатология предлагает лечить по следующим направлениям:
- Интерфероны как основное средство, которое приводит к повышению противовирусного иммунитета, подавляя активность вирусов гепатита С;
- Коррекция нарушенной функции печени (симптоматическая терапия).
Основным критерием, который определяет необходимость назначения альфа-интерферонов, является лабораторно доказанная активность вирусных частиц. Интерферонотерапия позволяет добиться следующих положительных эффектов:
- Снижение репликативной активности вируса
- Уменьшение риска злокачественного онкологического процесса печени
- Нормализация или улучшение функции печени
- Профилактика цирроза печени.
Гепатит B / Заболевания / Клиника ЭКСПЕРТ
Лечение
Во всем мире основная цель лечения хронического гепатита В — улучшение качества и продолжительности жизни за счет предупреждения развития цирроза печени, печеночной недостаточности и рака печени вследствие устойчивого подавления репликации (размножения) вируса.
Хронический гепатит В – инфекция, требующая в большинстве случаев пожизненного лечения!
В течение последнего десятилетия число препаратов, зарегистрированных для лечения гепатита В, выросло с 1 (интерферон) до 7, в число которых вошли 5 таблетированных (пероральных) аналогов нуклеозидов (нуклеотидов) и 2 интерферона — стандартный и пегилированный интерферон-α.
Сравнительная характеристика терапии интерфероном и аналогами нуклеозидов.
| Терапия | ИФН-α | Аналоги нуклеоз(т)идов |
Путь введения | Подкожный | Пероральный (в таблетках) |
| Продолжительность терапии | Ограниченная (12мес) | От нескольких лет до пожизненной |
| Противовирусная активность | Средняя | Сильная, зависит от препарата |
| Исчезновение HBsAg (один из параметров оценки эффективности терапии) | 1-3% через 1 год | 0-1% через 1 год, варьирует в зависимости от препарата |
| Устойчивость | Нет | 0-25% через 1 год |
| Побочные эффекты | Частые | Редкие |
Выбор лекарственного средства для начала терапии HBV осуществляется только врачом и основывается на противовирусной активности и риске развития устойчивости к препарату.
Если вирус не вызывает активного воспаления в печени, вы можете не нуждаться в лечении. Но очень важно проходить регулярное обследование — осложнения болезни легче лечить, когда они обнаружены на ранней стадии.
Ваш врач будет рекомендовать регулярно сдавать анализы крови, чтобы проверить, насколько хорошо ваша печень работает.
Все пациенты, получающие противовирусную терапию, и, по крайней мере, в течение 24 недель после ее завершения так же должны находиться под чутким наблюдением своего врача для оценки ответа на терапию, переносимости препаратов и приверженности лечению, а также выявления обострения гепатита (обусловленного реактивацией вируса), что потребует немедленного возобновления лечения.
Пациенты, получающие ИФН-α, должны более часто проходить клинический осмотр.
Наблюдая за любыми изменениями в печени, вы и ваш лечащий врач сможете оставаться на шаг впереди вируса.
Лечение гепатита С в Москве
Рассказывает Татьяна Полунина,
гастроэнтеролог, гепатолог, профессор, д.м.н.
В настоящее время отмечается рост заболеваемости гепатитом С, который передается при контакте с зараженной кровью. В более чем 85% случаев инфекция имеет хроническое течение с риском формирования цирроза печени, выявляющегося, как правило, через 20 и более лет после заражения. Трансформация в цирроз при естественном течении инфекционного процесса происходит постепенно без выраженных симптомов, а лечение поздних стадий заболевания сопряжено со значительными трудностями и не всегда бывает успешным. Для больных хроническим гепатитом С риск развития рака печени через 20 лет после инфицирования составляет 1-5%.
Главной особенностью гепатита С является генетическая изменчивость и способность к мутациям. Высокая мутационная активность вируса приводит к тому, что в организме человека может насчитываться около четырех десятков подвидов вируса гепатита С в рамках одного генотипа, поэтому иммунная система не в состоянии контролировать выработку нужных антител, т.к. пока вырабатываются антитела на один подвид вируса, появляются новые подвиды с иными антигенными свойствами. Скрытый период заболевания составляет около 50 дней, при этом симптомы гепатита С могут даже не проявиться: нередко пациенты узнают об инфекции только тогда, когда начинается цирроз печени.
В целом гепатит С — бессимптомное заболевание, которое зачастую диагностируется случайно. Но между тем можно выделить неспецифичные симптомы гепатита С, наличие которых не указывает на заболевание. К ним относятся астения, утомляемость и слабость. В любом случае необходимо периодически проводить анализ на гепатит, ведь выявленное на ранней стадии заболевание лечится легче и быстрее.
В любом случае необходимо периодически проводить анализ на гепатит, ведь выявленное на ранней стадии заболевание лечится легче и быстрее.
Токсический гепатит и хронический гепатит C
Разграничение отдельных стадий гепатита С имеет важное значение из-за необходимости определения показаний к интерферонотерапии:
- Острая фаза инфекции: протекает бессимптомно, больные не подозревают о наличии инфекции и являются источником заражения;
- Прогрессирование в хронический гепатит: у 85% заболевших после острой фазы развивается хронический гепатит С, который может протекать сначала скрыто (латентная фаза), а затем начать прогрессировать (фаза реактивации), когда уже выявляются клинико-лабораторные признаки обострения заболевания.
- Трансформация в цирроз печени — тяжелое заболевание, на фоне которого возможно развитие осложнений и рака печени, приводящих к летальному исходу.
Диагностика гепатита С
Для выявления вируса и подтверждения диагноза проводится ряд тестов. В настоящее время для обнаружения вируса используется лабораторная и клиническая диагностика. После диагностики назначается курс лечения, от правильности выбора которого повышается шанс выздоровления. Отметим, что метод и длительность лечения, а также дозировка препаратов подбираются индивидуально для каждого пациента, благодаря чему эффективность терапии составляет 50-80%. Но, чтобы «попасть» в вышеуказанный процентный диапазон, нужны усилия не только врача, но и самого пациента.
Эффективным считается лечение, при котором РНК вируса гепатита С не обнаруживается через 12 недель после приема лекарств. В таком случае есть смысл продолжить проведение противовирусной терапии (ПВТ) в течение 24-48 недель в зависимости от генотипа вируса.
В последние 20 лет лечение гепатита С ознаменовалось значительными успехами в связи с внедрением в клиническую практику пегилированных (пролонгированных) интерферонов и ингибиторов репликации вирусов, что позволяет не только предотвратить развитие таких грозных осложнений, как цирроз и рак печени, но и у многих пациентов полностью элиминировать (устранить) возбудитель, приводя к выздоровлению.
Лабораторная диагностика гепатита
Лабораторная диагностика основана на выявлении специфических маркеров инфицирования вирусом (РНК вируса гепатита С, анти-IgM/G).
По результатам назначаются дополнительные анализы на гепатит, после чего определяются с курсом лечения:
- при нормальных показателях биохимического спектра пациент находится под наблюдением лечащего врача;
- при превышении двух норм показателей биохимического спектра сыворотки крови: АСТ, АЛТ, ЩФ и общего билирубина — проводят иммунно-ферментный анализ крови на анти-HCV;
- при положительном результате иммунно-ферментного анализа, а также в случае выявления РНК вируса и определения генотипа и уровня виремии используется полимеразно-цепная реакция, цель которой — подбор эффективной противовирусной терапии;
- при повышенных показателях печеночных проб, положительном результате иммунно-ферментного анализа и полимеразно-цепной реакции проводят клиническую диагностику, подбор противовирусной терапии и осуществляют контроль эффективности лечения;
- при превышении нормы показателей печеночных проб и отрицательного результата иммунно-ферментного анализа, в случае превышения нормы в показателях печеночных проб, отрицательного результата полимеразно-цепной реакции и положительного результата иммунно-ферментного анализа осуществляют наблюдение пациента один раз в три месяца.
Клиническая диагностика гепатита С
Диагноз «Острый гепатит С» ставится на основании клинических, вирусологических и биохимических данных, имеющих четкую связь с парентеральными манипуляциями за первые месяцы до его развития: хирургическими операциями, переливанием крови, первой инъекцией наркотических средств и т.п.
К сожалению, у большинства больных отсутствуют признаки острого гепатита, и обнаружение РНК вируса не позволяет отличить острый гепатит от хронического. В данном случае диагностика должна основываться на наличии соответствующих данных эпидемического анамнеза за 1-4 месяца до впервые выявленных признаков гепатита С, которыми являются антитела к вирусу гепатита С и уровнями ферментемии.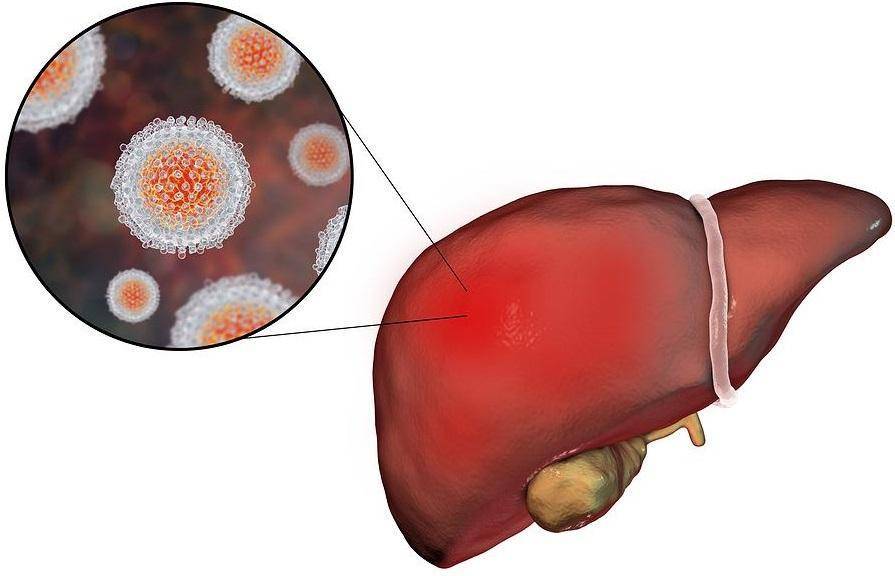
Критериями для постановки диагноза являются увеличение печени и селезенки, а также наличие гиперферментемии и антител к вирусу гепатита С в крови в течение 6 месяцев. Точный характер поражения печени — стадию фиброза и степень некрозо-воспалительных изменений — позволяет определить биопсия печени, которая на сегодняшний день является наиболее точным и информативным методом диагностики хронического гепатита С. Процедура проводится в течение нескольких секунд и абсолютно безопасна для пациента.
Наличие или отсутствие РНК вируса гепатита не является диагностическим критерием хронического гепатита С, а только определяет фазу процесса (активный, неактивный).
Токсический гепатит: лечение
Токсическим гепатитом называют поражение печени, вызванное каким-либо токсическим агентом: лекарственными средствами, пестицидами, продуктами бытовой химии, профессиональными вредностями и др.
В настоящее время выделяют два типа токсического гепатита. К первому типу относится предсказуемое поражение печени, которое связано со случайным употреблением токсического вещества любого происхождения. Ко второму типу относят непредсказуемые поражения печени, к которым относят поражения медикаментозного происхождения.
Лечение токсического гепатита проводят согласно общим принципам лечения печеночной недостаточности и только под контролем врача. С целью удаления и подавления образования токсических веществ в организме назначается диета с ограничением белка в суточном рационе до 50 г и регулярное промывание кишечника. С целью дезинтоксикации проводят процедуры, направленные на восстановление и поддержание кислотно-щелочного равновесия, электролитного баланса и устранение метаболических нарушений. К данным процедурам относится внутривенный ввод раствора глюкозы, аскорбиновой кислоты, хлорида калия и других растворов.
Курс лечения токсического гепатита назначается индивидуально в зависимости от степени интоксикации и поражения печении. Критерием эффективного лечения является нормализация общего состояния пациента, в том числе и биохимических показателей функционального состояния печени.
Продолжительность лечения составляет от 2 недель до нескольких месяцев в зависимости от тяжести заболевания.
Хронический гепатит: лечение
Заражение гепатитом С приводит к хроническому заболеванию печени и может спровоцировать цирроз или рак печени, если вовремя не начать лечение.
Для оптимального подбора курса лечения хронического гепатита С необходим индивидуальный подход и наличие информации:
- об анамнезе и течении заболевания;
- о факторах, влияющих на прогрессирование болезни;
- результатов постоянного контроля проводимого лечения;
- о контроле за побочными эффектами для их коррекции и предупреждения.
В настоящее время лечение больных хроническим гепатитом С основывается на интерферонотерапии или комбинированной терапии. Продолжительность лечения зависит от течения и стадии гепатита и может длиться до 12 месяцев.
Специалисты Гепатологического центра ЕМС проводят лечение гепатита С, разрабатывая метод терапии в зависимости от множества факторов. В случае наличия сопутствующих заболеваний и развития побочных эффектов в ходе терапии, лечение гепатита С проводится совместно со специалистами согласно профилю заболевания пациента и характера имеющихся побочных эффектов (эндокринологом, невропатологом, психотерапевтом, кардиологом и др.). В большинстве случаев лечение гепатита в Гепатологическом центре осуществляется в амбулаторно-поликлинических условиях, при этом применяется комбинированная терапия с применением препаратов интерферона и нуклеозидных аналогов.
Татьяна Полунина
Гепатит С — причины появления, симптомы заболевания, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гепатит С: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Гепатит С – это вирусное инфекционное заболевание, которое вызывает воспаление печени, зачастую приводя к ее серьезным повреждениям. Вирус гепатита С распространяется через зараженную кровь.
До недавнего времени лечение гепатита С требовало еженедельных инъекций и приема пероральных препаратов, которые многие люди, инфицированные вирусом, не могли использовать из-за других проблем со здоровьем или серьезных побочных эффектов.
Сегодня ситуация изменилась – разработаны лекарства нового поколения, и с их помощью хронический гепатит С поддается терапии.
Тем не менее около половины людей с гепатитом С не подозревают о том, что инфицированы, поскольку часто болезнь протекает бессимптомно.
Поэтому скрининг гепатита С необходимо проходить регулярно, особенно при наличии факторов риска заражения.
Причины появления гепатита С
Заболевание обычно распространяется, когда кровь человека, зараженного вирусом гепатита С, попадает в организм незараженного. Особенно часто это происходит в среде наркоманов.
В группе риска находятся люди, которым часто переливают кровь, и длительное время находящиеся на гемодиализе.
Заражению подвержены новорожденные дети, если их мать больна гепатитом С.
Кроме того, существуют редкие, но все же возможные ситуации инфицирования вирусом:
- Совместное использование предметов личной гигиены, которые могли соприкасаться с кровью больного человека (бритвы, ножницы или зубные щетки).
- Половой контакт с человеком, зараженным вирусом гепатита С.
- Татуировки или пирсинг, выполненные в ненадлежащих санитарных условиях.
Вирус гепатита С не передается при совместном использовании столовых приборов, кормлении грудью, объятиях, поцелуях, при держании за руку, кашле или чихании, через укусы насекомых. Также он не распространяется через еду или воду.
Также он не распространяется через еду или воду.
Классификация заболевания
В зависимости от длительности заболевания:
- Острый гепатит С – это ранняя стадия, когда гепатит длится менее шести месяцев.
- Хронический гепатит С – это долгосрочный тип, когда заболевание длится больше шести месяцев.
До 85% случаев острого гепатита в конечном итоге переходят в хроническую форму заболевания.
Гепатит различают по активности патологического процесса:
- Минимальная активность (печеночные трансаминазы (АЛТ и АСТ) в биохимическом анализе крови повышены не более, чем на 3 нормы)).
- Умеренная активность (3–10 норм печеночных трансаминаз).
- Высокая активность (> 10 норм).
По степени фиброза, то есть замещения нормальной ткани печени соединительной в ходе воспалительного процесса:
- F0 – нет фиброза.
- F1 – портальный фиброз без септ (соединительнотканных перегородок).
- F2 – портальный фиброз с единичными септами.
- F3 – многочисленные септы без цирроза.
- F4 – цирроз (полное замещение нормальной ткани печени на фиброзную. Приводит к тяжелым нарушениям функции клеток печени, а также значительно замедляет продвижение крови и желчи по печени).
Симптомы гепатита С
Хронический вирусный гепатит С, как правило, в течение многих лет является «тихой» инфекцией, пока не повредит печень настолько, что появятся признаки и симптомы тяжелого заболевания.
В течение первых 6 месяцев от начала заболевания человек может даже не подозревать, что болен, ощущая лишь необъяснимую усталость, плохой аппетит, тяжесть в правом подреберье, регулярную головную боль и головокружение.
В этот же период может меняться цвет кала (от светлого вплоть до белого) и мочи (от темно-желтой до коричневой). Некоторые пациенты говорят, что у них болят суставы.
Некоторые пациенты говорят, что у них болят суставы.
По мере прогрессирования заболевания к первоначальным симптомам присоединяются спонтанные кровотечения (носовые, маточные, кровотечения из десен), желтушность кожных покровов, склонность к образованию гематом, зуд, накопление свободной жидкости в брюшной полости (асцит), отеки ног. Кроме того, пациенты начинают терять вес, снижается память, появляются проблемы со зрением, на коже формируются сосудистые звездочки.
У мужчин может отмечаться гинекомастия (увеличение грудных желез), снижение либидо, уменьшение размера яичек.
Симптомы острого гепатита С включают желтуху, усталость, тошноту, жар и мышечные боли. Они появляются через 1-3 месяца после инфицирования вирусом и продолжаются от двух недель до трех месяцев.
Острая инфекция гепатита С не всегда переходит в хроническую фазу. У некоторых людей вирус уходит после острой фазы в процесс, известный как спонтанный вирусный клиренс (излечение). В исследованиях пациентов с диагнозом «острый гепатит С» частота спонтанного вирусного клиренса варьировалась от 15 до 25%.
Диагностика гепатита С
Диагноз ставится на основании жалоб больного и анамнеза. При подозрении на вирусный гепатит С врач обязательно выясняет, были ли в течение жизни переливания крови, хирургические манипуляции, не употреблял ли пациент инъекционные наркотики, делал ли татуировки и пирсинг, имели ли место незащищенные половые контакты.
Для уточнения диагноза могут понадобиться следующие обследования:
- Клинический анализ крови с развернутой лейкоцитарной формулой.
Особые случаи лечения гепатита «C»
1.Сопутствующая инфекция гепатита «B»
Отмечены осложнения лечения препаратами прямого действия при наличии гепатита В, что выражается в обострении процесса со всеми ярко выраженными проявлениями обострения вирусного гепатита В (желтуха, значительное повышение печеночных ферментов в крови, температура).
Поэтому до начала терапии необходимо провести исследование маркеров гепатита В: HBsAg, anti-HBcor, anti-HBs.
При выявлении HBsAg обязательно обследование на ДНК вируса гепатита В, на антитела к гепатиту D — anti-HDV и РНК HDV методом ПЦР.
В ходе противовирусного лечения хронического гепатита С у пациентов с anti-HBcor+, а также в периоде наблюдения после завершения терапии, следует проводить контроль ДНК HBV и при необходимости назначать противовирусное лечение хронического гепатита В.
2. Степень фиброза и лечение пациентов с циррозом печени
Опасность вирусного заболевания печени обусловлена тем, что активный вирус при размножении разрушает печень необратимо и при этом вместо разрушенной печени формируются участки повышенной плотности, состоящие из соединительной ткани. Оставшаяся здоровая часть печени компенсирует функции уже разрушенной ее части и обеспечивает, таким образом, жизнедеятельность пациента, часто без всяких симптомов и даже отклонений в биохимическом анализе крови.
Однако, при длительном процессе разрушения может сложиться ситуация, при которой оставшаяся здоровая часть печени не достаточна для компенсации – эта стадия заболевания называется цирроз, а при далеко зашедшем процессе его нельзя вылечить, так как при назначении ПППД возможно обострение цирроза, которое невозможно остановить.
Поэтому важнейшим вопросом при назначении противовирусной терапии является оценка степени поражения печени (степени фиброза). Из всех существующих в настоящее время методом оценки фиброза наиболее информативным признана эластометрия на аппарате фиброскан. В результате измерения таким образом плотности печени мы получаем ее значение в килопаскалях кПа (физические единицы измерения плотности). Начиная с 12,5 кПа мы ставим 4-ю, последнюю стадию, которая может ассоциироваться с циррозом.
Основное и самое опасное последствие уплотнения печени – это вызванное им повышение давления в портальной вене – портальная гипертензия, которая возникает из-за увеличения сопротивления кровотоку и может закончиться разрывом сосуда и несовместимым с жизнью кровотечением.
Портальная гипертензия чаще всего проходит бессимптомно и первым клиническим проявлением является увеличение селезенки и в связи с этим снижение уровня тромбоцитов. Клиническое значение портальной гипертензии заключается в угрозе кровотечения из расширенных вен пищевода и желудка, развития асцита (жидкость в брюшной полости), бактериального перитонитом и энцефалопатии.
Измерение плотности печеночной ткани на аппарате Фиброскан точно определяет степень ее фиброза, повышение которой и вызывает портальную гипертензию. Пороговый уровень плотности, ассоциирующийся с циррозом и портальной гипертензией, является 25 кПа.
Поскольку плотность печеночной ткани связана с портальной гипертензией, то сочетание уровня тромбоцитов и выраженности фиброза в килопаскалях, дает нам предварительную информацию для выбора тактики лечения и возможности назначения ПППД. Плотность меньше или равная 20 кПа и количество тромбоцитов больше 150, позволяют считать процесс компенсированным и назначать противовирусную терапию с учетом рекомендаций по лечению цирроза класса А.
Клиническая декомпенсация является противопоказанием для назначения ПППД. Для принятия решения о назначении терапии значимыми являются следующие показатели, характеризующие угрозу кровотечений: индекс LSPS, включающий плотность печеночной ткани по данным эластометрии, размеры селезенки и уровень тромбоцитов. Пороговым является значение больше 6,5 и плотность печеночной ткани больше 21 кПа.
В зависимости от прогностических показателей, в том числе плотности печеночной ткани, могут быть назначены разные схемы лечения ПППД, обязательно с учетом противопоказаний и сопутствующих заболеваний. В схему лечения как правило добавляется рибавирин и длительность терапии может быть увеличена до 24 недель.
При наблюдении пациентов с циррозом печени класса В обязательно наблюдение у опытного гепатолога или в специализированном гепатологическом центре. До начала противовирусного лечения крайне важно исключить наличие гепато-целлюларной карциномы (ГКЦ). При наличии ГЦК сначала проводится лечение рака печени, а затем вирусного гепатита С. В ряде случаев противовирусная терапия ПППД может быть назначена совместно с химиотерапией.
До начала противовирусного лечения крайне важно исключить наличие гепато-целлюларной карциномы (ГКЦ). При наличии ГЦК сначала проводится лечение рака печени, а затем вирусного гепатита С. В ряде случаев противовирусная терапия ПППД может быть назначена совместно с химиотерапией.
Обострение хронического гепатита в на фоне беременности. Клиническое наблюдение Текст научной статьи по специальности «Клиническая медицина»
КЛИНИЧЕСКИМ СЛУЧАИ
Обострение хронического гепатита В на фоне беременности. Клиническое наблюдение
Климова Е.А.1, Знойко О.О.1, Рензина Е.И.1, Блохина Н.П.2, Нурмухаметова Е.А.2, Ревазян Н.Р.2, Марьяновская Т.В.2
1 ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
2 ГБУЗ «Клиническая инфекционная больница № 1» Департамента здравоохранения г. Москвы
Выявление беременных с хроническим гепатитом В (ХГВ) путем их обязательного скрининга очень важно, поскольку позволяет не только своевременно выявить признаки возможного обострения ХГВ, но и провести мероприятия, направленные на снижение риска инфицирования новорожденных, способствуя таким образом сокращению глобального бремени ХГВ-инфекции. Беременность может быть причиной ХГВ, сопровождающегося высоким уровнем активности аланинаминотрансферазы, желтухой и печеночной декомпенсацией, хотя развитие печеночной недостаточности с летальным исходом встречаются нечасто. Тяжелое течение обострения ХГВ на фоне беременности требует проведения противовирусной терапии, направленной как на улучшение исхода болезни для матери, так и на предотвращение вертикальной передачи вируса гепатита В новорожденному, поскольку обострение ХГВ сопровождается, как правило, высоким уровнем виремии, являющейся значимым фактором риска инфицирования новорожденного. Противовирусное лечение проводится с использованием аналогов нуклеот(з)идов, при выборе которых, помимо оценки потенциальной угрозы для плода, необходимо оценивать профиль резистентности противовирусных препаратов.
Противовирусное лечение проводится с использованием аналогов нуклеот(з)идов, при выборе которых, помимо оценки потенциальной угрозы для плода, необходимо оценивать профиль резистентности противовирусных препаратов.
Ключевые слова:
беременность, хронический гепатит В, обострение, противовирусная терапия
Инфекционные болезни: новости, мнения, обучение. 2017. № 3. С. 92-98.
Статья поступила в редакцию: 19.12.2016. Принята в печать: 06.04.2017.
Exacerbation of chronic hepatitis B in the background of pregnancy. Clinical case
Klimova E.A.1, Znoyko O.O.1, 1 A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Renzina E.I.1, Blokhina N.P.2, of the Ministry of Healthcare of the Russian Federation
Nurmukhametova E.A.2, 2 Infectious Clinical Hospital # 1, Moscow Revazyan N.R.2, Maryanovskaya T. V.2
Identification of pregnant women with chronic HBV-infection by their compulsory screening is very important, as it allows not only quickly identify the signs of a possible exacerbation of chronic hepatitis B, but also to take measures aimed at reducing the risk of neonatal infection, thus contributing to reducing the global bur-
den of HBV-infection. Pregnancy can cause exacerbations of chronic hepatitis B, accompanied by a high level of activity of ALT, jaundice and hepatic decompensation, although the development of hepatic failure with a fatal outcome are rare. Severe acute exacerbations of chronic hepatitis B in the background of pregnancy requires antiviral therapy aimed both at improving disease outcomes for both mother and the prevention of vertical transmission of hepatitis B virus in a newborn, as aggravation of chronic hepatitis B is accompanied, as a rule, a high level of viremia, which is a significant risk factor infection of the newborn. Antiviral treatment is carried out using analogues nucleotides, the choice of which, in addition to assessing the potential risk to the fetus, it is necessary to assess the resistance profile of antiviral drugs.
Antiviral treatment is carried out using analogues nucleotides, the choice of which, in addition to assessing the potential risk to the fetus, it is necessary to assess the resistance profile of antiviral drugs.
Keywords:
pregnancy, chronic hepatitis B, exacerbations, antiviral therapy
Infectious Diseases: News, Opinions, Training. 2017; (3): 92-8.
Received: 19.12.2016. Accepted: 06.04.2017.
Вирусный гепатит В, несмотря на существование высокоэффективной вакцины, применяемой в мире уже более 30 лет, продолжает оставаться глобальной проблемой общественного здравоохранения. По оценкам Всемирной организации здравоохранения, более 2 млрд человек в какой-то момент их жизни были инфицированы вирусом гепатита В (ВГВ), около 350 млн людей по всему миру страдают хронической ВГВ-инфекцией, причем половина из них приобрели инфекцию в перинатальном или неонатальном периоде, особенно в тех странах, где вирусный гепатит В имеет высокую распространенность [1-3]. В связи с этим становится ясно, что проблема хронического гепатита В (ХГВ) во время беременности имеет особую значимость, поскольку эффективная профилактика вертикальной передачи вируса гепатита В является важным подходом в деле сокращения глобального бремени ВГВ-инфекции [4]. Ведение беременности, протекающей на фоне ХГВ, требует учета многих проблем: необходимо оценивать тяжесть заболевания печени, вирусологический статус беременной, возможное воздействие ВГВ-инфекции на здоровье беременной и плода, влияние беременности на репликацию ВГВ и течение хронического гепатита, возможные эффекты, оказываемые противовирусным лечением, риск перинатальной передачи инфекции. Тестирование на HBsAg в нашей стране рекомендуется для каждой беременной, независимо от результатов предыдущих исследований или вакцинации [5]. Выявление HBsAg является основанием для тщательного мониторинга течения как ХГВ, так и беременности. Имеющиеся данные о влиянии беременности на течение хронической ВГВ-инфекции ограничены и зачастую противоречивы. Как правило, в отсутствие цирроза печени хроническая инфекция ВГВ на фоне беременности протекает мягко, не вызывая существенного нарушения функции печени [6-8]. Вместе с тем беременность может быть фактором риска развития обострения ХГВ [10] даже при его бессимптомном течении, вплоть до развития тяжелой печеночной недостаточности, требующей трансплантации печени [11, 12].
Выявление HBsAg является основанием для тщательного мониторинга течения как ХГВ, так и беременности. Имеющиеся данные о влиянии беременности на течение хронической ВГВ-инфекции ограничены и зачастую противоречивы. Как правило, в отсутствие цирроза печени хроническая инфекция ВГВ на фоне беременности протекает мягко, не вызывая существенного нарушения функции печени [6-8]. Вместе с тем беременность может быть фактором риска развития обострения ХГВ [10] даже при его бессимптомном течении, вплоть до развития тяжелой печеночной недостаточности, требующей трансплантации печени [11, 12].
Ниже приведено описание случая обострения хронического НВеАд-положительного гепатита В, возникшего на фоне беременности.
Клинический случай
Больная К., 23 лет, поступила в инфекционную больницу с диагнозом: беременность 20-21 нед, головное предлежа-ние плода, ХГВ, HBeAg-положительный. Анемия беременных легкой степени.
Известно, что ХГВ у пациентки диагностирован 8 лет назад, когда при диспансеризации был обнаружен HBsAg. Эпидемиологический анамнез не выявил факторов риска инфицирования ВГВ (гемотрансфузий не получала, психоактивные вещества не употребляла). При амбулаторном наблюдении периодически регистрировалось повышение активности аланинаминотрансферазы (АЛТ) до 1-1,5 нормы, в крови обнаружены HBsAg и HBeAg, при ультразвуковом исследовании (УЗИ) органов брюшной полости патологии не выявлено. Пациентка периодически принимала курсы гепа-топротекторов (силимар, фосфоглив и др.). Противовирусной терапии не получала.
Настоящая беременность первая. За 4 дня до госпитализации появились диспептические явления — изжога, тошнота, повторная рвота (1-2 раза в сутки), плохой аппетит. При биохимическом исследовании крови обнаружено повышение уровня активности АЛТ до 109 МЕ/л, показатели аспар-татаминотрансферазы (АСТ) — без отклонений от нормы. В последующие дни наросла слабость, появились темная моча и желтушность склер. Больная направлена в инфекционный стационар с подозрением на обострение ХГВ. При поступлении состояние средней тяжести. Предъявляет жалобы на слабость, сниженный аппетит и тошноту. Сознание ясное, ориентирована в месте и времени, контактна. Сон не нарушен. Головокружения нет. Кожа чистая, сыпи нет. Кровоточивости носа, десен нет. Незначительно выражена желтушность кожи и склер. Периферические лимфатические узлы не увеличены. Отеков нет. В легких везикулярное дыхание, хрипов нет. Тоны сердца приглушены, ритм правильный, частота сердечных сокращений — 80 в минуту, артериальное давление (АД) — 125/75 мм рт.ст. Живот участвует в акте дыхания, мягкий, при пальпации безболезненный во всех отделах, симптомов раздражения брюшины нет. Асцита нет. Печень увеличена, пальпируется на 2 см ниже края реберной дуги, край эластической консистенции. Селезенка не увеличена.
В последующие дни наросла слабость, появились темная моча и желтушность склер. Больная направлена в инфекционный стационар с подозрением на обострение ХГВ. При поступлении состояние средней тяжести. Предъявляет жалобы на слабость, сниженный аппетит и тошноту. Сознание ясное, ориентирована в месте и времени, контактна. Сон не нарушен. Головокружения нет. Кожа чистая, сыпи нет. Кровоточивости носа, десен нет. Незначительно выражена желтушность кожи и склер. Периферические лимфатические узлы не увеличены. Отеков нет. В легких везикулярное дыхание, хрипов нет. Тоны сердца приглушены, ритм правильный, частота сердечных сокращений — 80 в минуту, артериальное давление (АД) — 125/75 мм рт.ст. Живот участвует в акте дыхания, мягкий, при пальпации безболезненный во всех отделах, симптомов раздражения брюшины нет. Асцита нет. Печень увеличена, пальпируется на 2 см ниже края реберной дуги, край эластической консистенции. Селезенка не увеличена.
Физиологические отправления в норме. Биохимические показатели крови: билирубин 93 мкмоль/л, АЛТ 1160 МЕ/л, АСТ 1280 МЕ/л. В сыворотке крови обнаружены HBsAg, НВеАд, анти-HBcIgG, слабоположительный анти-HBcIgM.
Была назначена дезинтоксикационная терапия, проводилась профилактика самопроизвольного прерывания беременности. В течение следующей недели самочувствие больной постепенно ухудшалось, полностью пропал аппетит, усилилась слабость, появились инверсия сна, чувство «провалов», головокружение, дискомфорт в правом подреберье, сохранялась тошнота и рвота 1-3 раза в день. Желтуха наросла и стала яркой, ухудшились биохимические показатели крови: билирубин 329 мкмоль/л, АЛТ 2665 МЕ/л, АСТ 2192 МЕ/л, протромбиновый индекс (ПТИ) снизился до 57%. В сыворотке крови обнаружена ДНК ВГВ в концентрации >1010 МЕ/мл.
Проводили дифференциальный диагноз с острыми вирусными гепатитами другой этиологии. Повторные исследования маркеров дельта-инфекции, вирусных гепатитов А, С и Е (анти-дельта IgM, анти-дельта IgG, РНК ВГД, анти-ВГА1дМ, анти-ВГС, РНК ВГС, анти-ВГЕ IgM,) дали отрицательный результат. При определении маркеров герпетической и ВИЧ-инфекции получен отрицательный результат. Уровень ауто-антител и церулоплазмина в пределах нормы.
Повторные исследования маркеров дельта-инфекции, вирусных гепатитов А, С и Е (анти-дельта IgM, анти-дельта IgG, РНК ВГД, анти-ВГА1дМ, анти-ВГС, РНК ВГС, анти-ВГЕ IgM,) дали отрицательный результат. При определении маркеров герпетической и ВИЧ-инфекции получен отрицательный результат. Уровень ауто-антител и церулоплазмина в пределах нормы.
УЗИ органов брюшной полости выявило умеренное увеличение печени без признаков портальной гипертензии. Было диагностировано обострение хронического HBеAg-позитивного гепатита В, тяжелое течение, угроза развития дистрофии печени у пациентки с беременностью 21-22 нед, в связи с чем решено начать противовирусную терапию с использованием телбивудина 600 мг внутрь 1 раз в сутки.
На фоне проводимой противовирусной терапии состояние больной улучшилось, уменьшились симптомы печеночно-клеточной недостаточности, улучшились биохимические показатели, через 2 дня от начала приема телбивудина уровень билирубина снизился до 308 мкмоль/л, АЛТ 1668 МЕ/л, АСТ 1314 МЕ/л, уровень ПТИ повысился до 76%.
Через 2 нед от начала терапии концентрация ДНК ВГВ снизилась почти вдвое — до 106 МЕ/мл. В последующие дни состояние пациентки прогрессивно улучшалось, исчезла желтуха, нормализовались уровни активности АЛТ и АСТ. Течение беременности без отклонений от нормы.
Выписана через 1,5 мес в удовлетворительном состоянии с незначительной гипербилирубинемией (32 мкмоль/л) при нормальных показателях АЛТ и АСТ, уровень ДНК ВГВ -105 МЕ/мл. Было рекомендовано продолжить дальнейший прием телбивудина в той же дозе.
Срочные роды в срок. Родилась здоровая доношенная девочка массой 3500 г и длиной 51 см, по шкале Апгар 8-9 баллов. С целью профилактики вертикальной передачи ВГВ в первые часы жизни была проведена пассивно-активная иммунизация против ХГВ-инфекции с использованием гипериммунного иммуноглобулина и вакцины против гепатита В. Дальнейшее наблюдение за ребенком в течение 2 лет жизни показало отсутствие инфицирования ВГВ. Указанная противовирусная терапия телбивудином проводилась пациентке в течение 24 нед. С целью определения дальнейшей тактики противовирусной терапии в соответствии с «дорожной кар-
той», сопровождающей лечение ХГВ аналогами нуклеот(з)и-дов, было выполнено обследование на наличие ДНК ВГВ, которая вновь была обнаружена в крови (уровень ДНК ВГВ -<750 МЕ/мл), продолжал определяться НВеАд при нормальном уровне активности АЛТ и АСТ. В связи с тем что на фоне противовирусной терапии телбивудином в течение 24 нед не удалось добиться авиремии, было рекомендовано продолжить противовирусную терапию с использованием энтекавира по 0,5 г внутрь 1 раз в день с контролем уровня ДНК ВГВ, клинического анализа крови и биохимических показателей.
При приеме в течение 5 лет энтекавира сохранялись нормальные биохимические показатели, достигнута авире-мия, однако сероконверсии не произошло, продолжал выявляться НВеАд, уровень а-фетопротеина не отклонен от нормальных показателей, показатели эластометрии — 4 кПа, что соответствует F0 по шкале METAVIR.
Обсуждение
В целом беременность оказывает незначительное влияние на течение ХГВ [13], однако в некоторых случаях на фоне беременности регистрируется обострение воспалительного процесса в печени, причины которого до конца не ясны. Течение ХГВ-инфекции определяется динамическим взаимодействием ВГВ и иммунной системы хозяина. Выраженность репликации вируса и интенсивность иммунного ответа обусловливают естественное течение гепатита и степень повреждения печени. Описаны случаи реактивации ХГВ на фоне химиотерапии, при которой применяются иммуносупрессивные препараты и стероиды [14, 15]. Полагают, что при беременности увеличивается продукция кортикостероидов, повышаются уровни эстрогенов и прогестерона. Эти изменения гормонального статуса могут вызвать иммуносупрессивный эффект, приводящий к повышению уровня ДНК ВГВ [16, 17]. Нет четкого определения обострения ХГВ, но принято считать, что оно характеризуется внезапным увеличением уровня АЛТ более чем в 5-10 раз выше верхней границы нормы или более чем в 3 раза от базового уровня, а также повторным появлением в сыворотке крови ДНК ВГВ у пациентов с ХГВ-инфекцией в прошлом [17, 18].
Тяжесть обострения ХГВ может варьировать от мягкого, бессимптомного повышения уровня активности АЛТ на поздних сроках беременности или в послеродовом периоде [19], вплоть до молниеносного гепатита. Так, Y.-B. Yang и соавт. сообщают о беременной, у которой тяжелое обострение ХГВ осложнилось развитием массивного послеродового кровотечения, гепаторенального синдрома, печеночной энцефалопатии, спонтанного бактериального перитонита и инфекции желчных путей [12].
Тяжелое поражение печени, обусловленное ХГВ-инфекцией, на фоне беременности может произойти не только у пациенток с диагностированной ХГВ-инфекцией и протекающей бессимптомно, но и в тех случаях, когда заболевание прежде было нераспознанным. В частности сообщается о развитии молниеносной печеночной недостаточности при сроке беременности 27 нед у пациентки с отсутствием данных о наличии ХГВ в анамнезе, потребовав-
Таблица 1. Классификация лекарственных препаратов по категориям в зависимости от степени риска развития тератогенного эффекта [33]
Категория безопасности Степень риска для плода
А Контролируемые клинические исследования у беременных не показывают риска аномалий для плода или он кажется маловероятным
Животная модель не показала риска для плода, но у беременных клинические контролируемые иссле-В дования не проводили; либо на животной модели выявлялся побочный эффект, что не было подтверждено в клинических контролируемых исследованиях на людях
С Животные модели показали побочные эффекты у плода (тератогенные или эмбриоцидальные и др.), нет данных клинических контролируемых исследований у женщин; либо данные исследований на женщинах, а также животной модели недоступны. Препараты могут назначаться только в случае преобладания положительных эффектов для плода в сравнении с потенциальным риском
Существует очевидный риск для плода, но положительные эффекты для беременных его превышай ют (например, препарат необходим в жизнеугрожающей ситуации или при серьезном заболевании у женщины, когда более безопасные для плода препараты не могут применяться либо неэффективны)
Х Исследования на животных моделях или людях показали патологическое влияние на плод либо подтвержденный риск для плода; риск использования препарата у беременных превышает любые возможные положительные эффекты. Препарат противопоказан беременным и планирующим беременность женщинам
шей выполнения ортотопической трансплантации печени. В крови были выявлены маркеры НВ-вирусной инфекции, при морфологическом исследовании на фоне субмассивного некроза печеночной ткани в правой доле печени обнаружена гепатоцеллюлярная карцинома [11]. Не удается прогнозировать с высокой степенью достоверности обострение ХГВ во время беременности, опираясь на уровень ДНК ВГВ, АЛТ, статус по НВеАд или учитывая другие клинико-лабора-торные показатели. Старший возраст был единственным предиктором более высокого риска обнаруженной тенденции неблагоприятных клинических исходов как для плода (преждевременные роды, самопроизвольное прерывание беременности), так и для матери (гестационный сахарный диабет, преэклампсия, печеночная недостаточность) [20, 21]. Обострение ХГВ происходит часто после родов, что может быть связано с реактивацией иммунной системы. В послеродовом периоде у 25% женщин, страдающих ХГВ, выявляют обострение воспалительного процесса в печени, которое протекает, как правило, бессимптомно. Послеродовая реактивация ХГВ может быть ассоциирована с сероконверсией (клиренсом НВеАд, развитием НВеАЬ-позитивного гепатита, снижением уровня ДНК ВГВ и нормализации уровня активности АЛТ) у 12,5-17% больных [22]. При этом у пациенток с НВеАд-положительным ХГВ риск возникновения обострения в послеродовом периоде в 2,5 раза выше, чем при отсутствии НВеАд [23]. Это требует тщательного мониторинга за состоянием родильницы, страдающей ХГВ.
Тяжело протекающее обострение ХГВ и угроза развития печеночной недостаточности являются показанием к проведению противовирусной терапии, что улучшает исход болезни матери [24] и предотвращает вертикальную передачу ВГВ новорожденному. Известно, что иммунопрофилактика новорожденным, рожденным от матерей с высоким уровнем ДНК ВГВ, не всегда способна защитить от инфицирования ВГВ [25], при наличии НВеАд от 8 до 30% матерей с высоким уровнем ДНК ВГВ передают вирус ребенку [26, 27]. Противовирусная терапия, проведенная в течение послед-
Таблица 2. Противовирусные препараты, разрешенные для лечения гепатита В в зависимости от категории безопасности
| Лекарственный препарат | Категория безопасности |
ИФН альфа-2Ь Ш С
Пег-ИФН альфа-2а С
Энтекавир С
Ламивудин С
Телбивудин « В
Тенофовир В
него триместра беременности, может снизить риск передачи инфекции от матери к плоду за счет снижения уровня ВГВ ДНК к моменту родов, так какв подавляющем большинстве случаев инфицирование новорожденного происходит ин-транатально, во время родов [28, 29].
Противовирусная терапия с использованием мощных нуклеот(з)идных аналогов в условиях тяжелого обострения ХВГ, повышающая шансы на выживаемость этих пациентов, должны быть начата как можно раньше. Использование этих препаратов является оправданным, несмотря на ограниченный опыт их применения [24, 28, 30].
Основной проблемой для плода является риск воздействия потенциально тератогенных препаратов во время раннего эмбриогенеза [31, 32]. Лекарственные препараты в соответствии с возможным тератогенным эффектом в организме человека или животных классифицированы на 5 категорий — А, В, С, D и X (табл. 1).
Интерфероны противопоказаны во время беременности. Только два разрешенных препарата для лечения ХГВ относят к категории В — телбивудин и тенофовир, остальные — к категории С (табл. 2).
Телбивудин и тенофовир имеют лучший, чем другие противовирусные препараты, применяемые для лечения ХГВ, профиль безопасности для плода и могут быть использованы для лечения этого заболевания у беременных. Следует также учитывать, что телбивудин, являясь мощным противо-
вирусным агентом, имеет низкий генетический барьер резистентности, тогда как тенофовир обладает не только мощным противовирусным действие, но и высоким генетическим барьером резистентности [34, 35]. При использовании телбивудина для лечения ХГВ необходимо, наряду с другими лабораторными показателями, мониторировать в положенные сроки уровень вирусной нагрузки, для того чтобы при необходимости своевременно изменить тактику противовирусной терапии и свести к минимуму возможное формирование резистентных штаммов ВГВ.
Таким образом, беременность может быть потенциальной причиной обострения ХГВ-инфекции, для своевременной
диагностики которой требуется тщательное наблюдение пациентки на протяжении всей беременности и в послеродовом периоде. Обострения ХГВ на фоне беременности в некоторых случаях могут приводить к тяжелым нарушениям функции печени, сопровождаясь очень высоким уровнем активности АЛТ, желтухой и печеночной декомпенсацией. Противовирусная терапия с использованием нуклеот(з)идных аналогов в условиях тяжелого обострения ХВГ повышает шансы на выживаемость этих пациенток, а также на поздних стадиях беременности является наиболее эффективным методом снижения риска передачи ВГВ от матерей с высоким уровнем виремии новорожденным.
СВЕДЕНИЯ ОБ АВТОРАХ
Климова Елена Анатольевна — доктор медицинских наук, профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России E-mail: [email protected]
Знойко Ольга Олеговна — доктор медицинских наук, профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России E-mail: [email protected]
Рензина Екатерина Ильинична — аспирант кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России E-mail: [email protected]
Блохина Наталья Петровна — доктор медицинских наук, профессор, заведующая консультативно-диагностическим отделением Центра по лечению хронических вирусных гепатитов ГБУЗ «Инфекционная клиническая больница № 1» Департамента здравоохранения г. Москвы E-mail: [email protected]
Нурмухаметова Елена Андреевна — кандидат медицинских наук, руководитель Центра по лечению хронических вирусных гепатитов ГБУЗ «Инфекционная клиническая больница № 1» Департамента здравоохранения г. Москвы E-mail: [email protected]
Ревазян Наира Рубеновна — врач акушерского отделения ГБУЗ «Инфекционная клиническая больница №1» Департамента здравоохранения г. Москвы
Марьяновская Татьяна Валерьевна — кандидат медицинских наук, врач Центра по лечению хронических вирусных гепатитов ГБУЗ «Инфекционная клиническая больница № 1» Департамента здравоохранения г. Москвы
ЛИТЕРАТУРА
1. Alter M.J. Epidemiology of hepatitis B in Europe and worldwide // J. Hepatol. 2003. Vol. 39, suppl. 1. P. S64-S69.
2. Шахгильдян И.В., Михайлов М.И., Онищенко Г.Г. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика). М.: ГОУ ВУНМЦ Минздрава России, 2003. 383 с.
3. Ющук Н.Д., Климова Е.А., Знойко О.О., Кареткина Г.Н. и др. Вирусные гепатиты: клиника, диагностика, лечение. М., 2015. 150 с.
4. Абдурахманов Д.Т. Хронический гепатит В и D. М. : ГЭОТАР-Медиа, 2010. 288 с.
5. Рекомендации по диагностике и лечению взрослых больных гепатитами В и С / под ред. В.Т. Ивашкина, Н.Д. Ющука. М. : ГЭОТАР-Медиа, 2015. 143 с.
6. Jonas M.M. Hepatitis B and pregnancy: an underestimated issue // Liver Int. 2009. Vol. 29, suppl. 1. P. 133-139. doi: 10.1111/j.1478-3231.2008.01933.x.
7. Piratvisuth T. Optimal management of HBV infection during pregnancy // Liver Int. 2013. Vol. 33, suppl. 1. P. 188-194.
8. Borgia G., Carleo M.A., Gentile I. Hepatitis B in pregnancy // World J. Gastroenterol. 2012. Vol. 18, N 34. P. 4677-4683.
9. Sarin S.K., Kumar M., Shrivastava S., Sinha S. et al. Influence of chronic HBV infection on pregnancy: a human model of maternofetal virus host interactions // Gastroenterology. 2011. Vol. 141. P. 1522-1525.
10. Rawal B.K., Pandas S., Watkins R.P., Ghosh P. et al. Symptomatic reactivation of hepatitis B in pregnancy // Lancet. 1991. Vol. 337. P. 364.
11. Singhal A., Kanagala R., Jalil S., Wright H.I. et al. Chronic HBV with pregnancy: reactivation flare causing fulminant hepatic failure // Ann. Hepatol. 2011. Vol. 10, N 2. P. 233-236.
12. Yang Y.-B., Li X.-M., Shi Z.-J., Ma L. Pregnant woman with fulminant hepatic failure caused by hepatitis B virus infection: a case report // World J. Gastroenterol. 2004. Vol. 10. P. 2305-2306.
13. Westbrook R.H. et al. Pregnancy and liver disease // J. Hepatol. 2016. Vol. 64, N 4. P. 933-945.
14. Xunrong L., Yan A.W., Liang R., Lau G.K. Hepatitis B virus (HBV) reactivation after cytotoxic or immunosuppressive therapy- pathogenesis and management // Rev. Med. Virol. 2001. Vol. 11. P. 287-299.
15. Lubel J.S., Testro A.G., Angus P.W. Hepatitis B virus reactivation following immunosuppressive therapy: guidelines for prevention and management // Int. Med. J. 2007. Vol. 37. P. 705-712.
16. Lin H.H., Chen P.J., Chen D.S. et al. Postpartum subsidence of hepatitis B viral replication in HBeAg-positive carrier mothers // J. Med. Virol. 1989. Vol. 29. P. 1-6.
17. Lok A.S., Lai C.L., Wu P.C. et al. Spontaneous hepatitis B e antigen to antibody seroconversion and reversion in Chinese patients with chronic hepatitis B virus infection // Gastroenterology. 1987. Vol. 92. P. 1839-1846.
18. Lok A.S., Ward J.W., Perrillo R.P., McMahon B.J. et al. Reactivation of hepatitis B during immunosuppressive therapy: potentially fatal yet preventable // Ann. Intern. Med. 2012. Vol. 156. P. 743-745.
19. Kumar M., Singh T., Sinha S. Chronic hepatitis B virus infection and pregnancy // J. Clin. Exp. Hepatol. 2012. Vol. 2, N 4. P. 366-381. doi:10.1016/j.jceh.2012.09.001.
20. Nguyen G., Garcia R.T., Nguyen N., Trinh H. et al. Clinical course of hepatitis B virus infection during pregnancy // Aliment. Pharmacol. Ther. 2009. Vol. 29, N 7. P. 755-764. doi: 10.1111/j.1365-2036.2009.03932.x.
21. ter Borg M.J., Leemans W.F., de Man R.A., Janssen H.L. Exacerbation of chronic hepatitis B infection after delivery // J. Viral Hepat. 2008. Vol. 15, N 1. P. 37-41.
22. Lin H.H., Wu W.Y., Kao J.H., Chen D.S. Hepatitis B post-partum e antigen clearance in hepatitis B carrier mothers: Correlation with viral characteristics // J. Gastroenterol. Hepatol. 2006. Vol. 21, N 3. P. 605-609.
23. Giles M., Visvanathan K., Lewin S., Bowden S. et al. Clinical and virological predictors of hepatic flares in pregnant women with chronic hepatitis B // Gut. 2015. Vol. 64, N 11. P. 1810-1815. doi: 10.1136/ gutjnl-2014-308211.
24. Philips C.A., Sarin S.K. Potent antiviral therapy improves survival in acute on chronic liver failure due to hepatitis B virus reactivation // World J. Gastroenterol. 2014. Vol. 20, N 43. P. 16 037-16 052. doi:10.3748/ wjg.v20.i43.16037.
REFERENCES
1. Alter M.J. Epidemiology of hepatitis B in Europe and worldwide. J Hepatol. 2003; 39, suppl. 1: S64-9.
2. Shakhgildyan I.V., Mikhaylov M.I., Onishchenko G.G. Parenteral viral hepatitis (epidemiology, diagnosis, prevention). Moscow : All-Russian Educational Scientific and Methodological Center for Continuing Medical and Pharmaceutical Education; 2003: 383 p. (in Russian)
3. Yushchuk N.D., Klimova E.A., Znoyko O.O., Karetkina G.N., et al. Viral hepatitis: clinic, diagnosis, treatment. Moscow; 2015: 150 p. (in Russian)
4. Abdurakhmanov D.T. Chronic hepatitis B and D. Moscow: GEOTAR-Media; 2010: 288 p. (in Russian)
5. Ivashkin V.T., Yushchuk N.D., eds. Recommendations for diagnosis and treatment of adult patients with hepatitis B and C. Moscow: GEOTAR-Media; 2015: 143 p. (in Russian)
6. Jonas M.M. Hepatitis B and pregnancy: an underestimated issue. Liver Int. 2009; 29, suppl. 1: 133-9. doi: 10.1111/j.1478-3231.2008.01933.x.
7. Piratvisuth T. Optimal management of HBV infection during pregnancy. Liver Int. 2013; 33, suppl. 1: 188-94.
8. Borgia G., Carleo M.A., Gentile I. Hepatitis B in pregnancy. World J Gastroenterol. 2012; 18 (34): 4677-83.
25. Sellier P., Maylin S., Amarsy R., Mazeron M.-C. et al. Untreated highly viraemic pregnant women from Asia or sub-Saharan Africa often transmit hepatitis B virus despite serovaccination to newborns // Liver Int. 2015. Vol. 35, N 2. P. 409-416.
26. Pan C., Han G.R., Zhao W. et al. A prospective open-label study to evaluate the efficacy, safety and tolerability of telbivudine in HBeAg chronic hepatitis B pregnant women // Hepatology. 2010. Vol. 52. P. S4.
27. Han G.-R., Cao M.-K., Zhao W. et al. A prospective open-label study for the efficacy and safety of telbuvidine in pregnancy for the prevention of perinatal transmission of hepatitis B virus to the infant // J. Hepatol. 2011. Vol. 55. P. 1215-1221.
28. Zhang L.J., Wang L. Blocking intrauterine infection by telbivudine in pregnant chronic hepatitis B patients // Zhonghua Gan Zang Bing Za Zhi. 2009. Vol. 17. P. 561-563.
29. Wong V., Chan H. Severe acute exacerbation of chronic hepatitis B: A unique presentation of a common disease // J. Gasrtoenterol. Hepatol.
2009. Vol. 24. P. 1179-1186.
30. Dionne-Odom J., Tita A.T.N., Silverman N.S. Hepatitis B in pregnancy screening, treatment, and prevention of vertical transmission // Am. J. Obstet. Gynecol. 2016. Vol. 214, N 1. P. 6-14.
31. Jindal A., Kumar M., Sarin S.K. Management of acute hepatitis B and reactivation of hepatitis B // Liver Int. 2013. Vol. 33, suppl. 1. P. 164-175. doi: 10.1111/liv.12081.
32. Bzowej N.H. Hepatitis B therapy in pregnancy // Curr. Hepat. Rep.
2010. Vol. 9. P. 197-204.
33. FDA. URL: http://www.fda.gov/fdac/features/2001/301_preg. html. (date of access October 20, 2008)
34. Dunkelberg J.C., Berkley E.M., Thiel K.W., Leslie K.K. Hepatitis B and C in pregnancy: a review and recommendations for care // J. Perinatol. 2014. Vol. 34, N 12. P. 882-891. doi: 10.1038/jp.2014.167.
35. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection // J. Hepatol. 2012. Vol. 57. P. 167-185.
9. Sarin S.K., Kumar M., Shrivastava S., Sinha S., et al. Influence of chronic HBV infection on pregnancy: a human model of maternofetal virus host interactions. Gastroenterology. 2011; 141: 1522-5.
10. Rawal B.K., Paridas S., Watkins R.P., Ghosh P., et al. Symptomatic reactivation of hepatitis B in pregnancy. Lancet. 1991; 337: 364.
11. Singhal A., Kanagala R., Jalil S., Wright H.I., et al. Chronic HBV with pregnancy: reactivation flare causing fulminant hepatic failure. Ann Hepatol. 2011; 10 (2): 233-6.
12. Yang Y.-B., Li X.-M., Shi Z.-J., Ma L. Pregnant woman with fulminant hepatic failure caused by hepatitis B virus infection: a case report. World J Gastroenterol. 2004; 10: 2305-6.
13. Westbrook R.H., et al. Pregnancy and liver disease. J Hepatol. 2016; 64 (4): 933-45.
14. Xunrong L., Yan A.W., Liang R., Lau G.K. Hepatitis B virus (HBV) reactivation after cytotoxic or immunosuppressive therapy- pathogenesis and management. Rev Med Virol. 2001; 11: 287-99.
15. Lubel J.S., Testro A.G., Angus P.W. Hepatitis B virus reactivation following immunosuppressive therapy: guidelines for prevention and management. Int Med J. 2007; 37: 705-712.
16. Lin H.H., Chen P.J., Chen D.S., et al. Postpartum subsidence of hepatitis B viral replication in HBeAg-positive carrier mothers. J Med Virol. 1989; 29: 1-6.
17. Lok A.S., Lai C.L., Wu P.C., et al. Spontaneous hepatitis B e antigen to antibody seroconversion and reversion in Chinese patients with chronic hepatitis B virus infection. Gastroenterology. 1987; 92: 1839-46.
18. Lok A.S., Ward J.W., PerriLLo R.P., McMahon B.J., et al. Reactivation of hepatitis B during immunosuppressive therapy: potentially fatal yet preventable. Ann Intern Med. 2012; 156: 743-5.
19. Kumar M., Singh T., Sinha S. Chronic hepatitis B virus infection and pregnancy. J CLin Exp HepatoL. 2012; 2 (4): 366-81. doi:10.1016/j. jceh.2012.09.001.
20. Nguyen G., Garcia R.T., Nguyen N., Trinh H., et aL. CLinicaL course of hepatitis B virus infection during pregnancy. ALiment PharmacoL Ther. 2009; 29 (7): 755-64. doi: 10.1111/j.1365-2036.2009.03932.x.
21. ter Borg M.J., Leemans W.F., de Man R.A., Janssen H.L. Exacerbation of chronic hepatitis B infection after deLivery. J ViraL Hepat. 2008; 15 (1): 37-41.
22. Lin H.H., Wu W.Y., Kao J.H., Chen D.S. Hepatitis B post-partum e antigen cLearance in hepatitis B carrier mothers: CorreLation with viraL characteristics. J GastroenteroL HepatoL. 2006; 21 (3): 605-9.
23. GiLes M., Visvanathan K., Lewin S., Bowden S., et aL. CLinicaL and vi-roLogicaL predictors of hepatic fLares in pregnant women with chronic hepatitis B. Gut. 2015; 64 (11): 1810-5. doi: 10.1136/gutjnL-2014-308211.
24. PhiLips C.A., Sarin S.K. Potent antiviraL therapy improves survivaL in acute on chronic Liver faiLure due to hepatitis B virus reactivation. WorLd J GastroenteroL. 2014; 20 (43): 16 037-52. doi:10.3748/wjg.v20. i43.16037.
25. SeLLier P., MayLin S., Amarsy R., Mazeron M.-C., et aL. Untreated highLy viraemic pregnant women from Asia or sub-Saharan Africa often
transmit hepatitis B virus despite serovaccination to newborns. Liver Int. 2015; 35 (2): 409-16.
26. Pan C., Han G.R., Zhao W., et aL. A prospective open-LabeL study to evaLuate the efficacy, safety and toLerabiLity of teLbivudine in HBeAg chronic hepatitis B pregnant women. HepatoLogy. 2010; 52: S4.
27. Han G.-R., Cao M.-K., Zhao W., et aL. A prospective open-LabeL study for the efficacy and safety of teLbuvidine in pregnancy for the prevention of perinataL transmission of hepatitis B virus to the infant. J HepatoL. 2011; 55: 1215-21.
28. Zhang L.J., Wang L. BLocking intrauterine infection by teLbivudine in pregnant chronic hepatitis B patients. Zhonghua Gan Zang Bing Za Zhi. 2009; 17: 561-3.
29. Wong V., Chan H. Severe acute exacerbation of chronic hepatitis B: A unique presentation of a common disease. J GasrtoenteroL HepatoL. 2009; 24: 1179-86.
30. Dionne-Odom J., Tita A.T.N., SiLverman N.S. Hepatitis B in pregnancy screening, treatment, and prevention of verticaL transmission. Am J Obstet GynecoL. 2016; 214 (1): 6-14.
31. JindaL A., Kumar M., Sarin S.K. Management of acute hepatitis B and reactivation of hepatitis B. Liver Int. 2013; 33, suppL. 1: 164-75. doi: 10.1111/Liv.12081.
32. Bzowej N.H. Hepatitis B therapy in pregnancy. Curr Hepat Rep. 2010; 9: 197-204.
33. FDA. URL: http://www.fda.gov/fdac/features/2001/301_preg. htmL. (date of access October 20, 2008)
34. DunkeLberg J.C., BerkLey E.M., ThieL K.W., LesLie K.K. Hepatitis B and C in pregnancy: a review and recommendations for care. J PerinatoL. 2014; 34 (12): 882-91. doi: 10.1038/jp.2014.167.
35. EASL CLinicaL Practice GuideLines: Management of chronic hepatitis B virus infection. J HepatoL. 2012; 57: 167-85.
Вылечить гепатит С: украинка «подпольно искала сама» лекарства и выздоровела
- Анастасия Дзюбак, Кропивницкий
- для BBC News Украина
Автор фото, Getty Images
Підпис до фото,
Американка Терри Аддаббо благодаря новым лекарствам вылечилась от гепатита С. Эти же препараты помогли выздороветь и нашей героине
По оценкам Минздрава, сейчас вирусным гепатитом C в Украине инфицировано около 5% населения. Это полтора миллиона человек, большинство из которых не знает о своей болезни.
Светлана (имя изменено по просьбе героини) также узнала о своей болезни случайно. Далее был путь самостоятельного поиска лечения.
О диагнозе узнала случайно
12 лет назад женщина попала в больницу с болью в ногах.
«Начало крутить ноги. Пришлось отказаться от каблуков. С этим и обратилась к врачу. Диагностировали реактивный артрит — это фактически реакция организма на определенный раздражитель. Начали искать причину и обнаружили гепатит С, который очень редко дает такую симптоматику».
Обычно болезнь может длиться бессимптомно 10-15 лет, за что и получила название «ласковый убийца».
На тот момент о заболевании Светлана знала мало.
«Несмотря на то, что работала в организации, которая помогает людям с ВИЧ, регулярно проходила экспресс-тест на эту инфекцию, на гепатиты внимания как-то не обращала», — говорит Светлана.
По ее словам, она точно знает, что причиной ее болезни стала татуировка.
Автор фото, Getty Images
Підпис до фото,
Вирус гепатита С
«Лет 15 назад хороших тату-салонов не было, а те, что были — очень дорогие. Мы с братом делали тату «на дому» у его знакомых, каким-то кустарным аппаратом. Перед процедурой держали иглы в спирте», — вспоминает женщина.
Сомнения о том, откуда болезнь, исчезли после того, как брат также сдал анализ, и у него обнаружили гепатит того же генотипа.
Без надежд на государство
К тому времени уже существовала государственная программа лечения гепатитов, однако согласно протоколам в очередь могли стать только пациенты с фиброзом 3-4 степени — фактически с началом разрушения печени.
То есть, если начать лечение в это время, то после выздоровления от гепатита надо браться за восстановление печени.
«У меня не было фиброза вообще. Мне сказали, что у меня латентная форма болезни и я могу быть свободна», — говорит Светлана.
С болезнью прожила десять лет: все это время искала, как можно получить лечение, а не только поддерживающую терапию.
К тому же, в то время государство закупало для лечения пациентов интерферон и рибовирин. Эти лекарства давали лишь 50% шанс на выздоровление, а кроме того, имели серьезные побочные эффекты и возможность рецидива.
«Тогда узнала о препаратах софосбувир и даклатасвир, которые тогда только появились. Они дают 96% гарантии на выздоровление. Цена на лекарства была заоблачная — более 10 000 долларов курс», — говорит женщина. На тот момент она, мать-одиночка, понимала, что позволить себе это лекарство не может.
К тому же, сертифицированным был только один из двух нужных препаратов: даже если каким-то образом за счет государства ты получишь один, то другой приходилось как-то докупать самому.
Автор фото, Getty Images
Підпис до фото,
Препарат софосбувир, который помогает в лечении, но стоит очень дорого
Спасительные дженерики
Два года назад Светлана таки прошла курс лечения и выздоровела, приобретя дженерики — непатентованные лекарственные препараты, воспроизводящие оригинальные препараты.
Такие лекарства производят в Индии и Египте. Курс лечения ими стоил около 500 долларов и позволял выздороветь за три месяца употребления таблеток дома.
В Украине они были не были сертифицированы, то есть фактически — нелегальны.
«В нашей стране можно купить все, что угодно. Я находила и в интернете, и в аптеках. Иногда продают просто с рук, привезенный из Египта. Даже врачи дают телефоны дистрибьюторов, которые продадут препараты», — признается женщина.
После лечения Светлана сдала анализ ПЦР (полимерно-цепная реакция, которая определяет присутствие вируса в плазме крови), который подтвердил, что она выздоровела.
«Анализ подтвердил, что выздоровела. Однако, если сдавать сейчас эспресс-тест, он покажет положительный результат, ведь в крови остались антитела. Это нормально», — говорит Светлана.
Экспресс-тест на гепатиты можно пройти в медицинских учреждениях или легко приобрести в любой аптеке: его стоимость составляет от 40 до 120 гривен, а от некоторых разновидностей гепатита даже можно сделать прививку.
А несколько лет назад Украина перешла на новые международные протоколы и стала лечить гепатит теми препаратами, которые Светлана не могла себе позволить несколько лет назад, и их аналогами.
Последнюю партию препарата, а это более 7 000 курсов для лечения от гепатита С, по данным Центра общественного здоровья Минздрава, отправили в регионы в этом июле.
Чтобы получить лечение за счет государства, необходимо обратиться с заявлением на имя руководителя областного департамента здравоохранения или главного врача медучреждения.
Однако, как и несколько лет назад, существует очередь, и предпочтние отдают пациентам с серьезными поражениями печени и другими заболеваниями, влияющими на более быстрое прогрессирование гепатита, например, ВИЧ. Среди «льготных» категорий — дети и участники АТО.
Острые обострения хронического гепатита С: клинико-патологическое и прогностическое исследование
Предпосылки / методы:
Для изучения заболеваемости, предрасполагающих факторов, клинико-патологических характеристик и последствий острых обострений при хроническом гепатите С была проведена последовательная серия из 194 подтвержденных биопсией, анти-ВГС-положительных и поверхностных антиген-отрицательных пациентов с гепатитом В и изучена на предмет событий. острых обострений, стойкого биохимического разрешения и развития цирроза.
Полученные результаты:
В течение среднего периода 6,2 +/- 3,5 (1,0–14,0) года у 78 пациентов (40,2%) был зарегистрирован 151 эпизод обострения. Расчетная годовая частота обострений составила 11,9%. Пятьдесят пять процентов обострений протекали бессимптомно. Гистологическое исследование острых обострений показало легкую или умеренную лобулярную воспалительную активность без перекрывающего некроза печени у всех и перипортально по частям у 23 (42.6%). Клинико-патологические особенности обострений у пациентов с хроническим гепатитом C были менее тяжелыми, чем у пациентов с хроническим гепатитом B. Путь заражения, пол, возраст, способ клинической картины и исходная гистология не влияли на возникновение острых обострений. Только пациенты с аланинаминотрансферазой> или = 300 Ед / л при поступлении имели тенденцию к более частому развитию обострений (p <0,001, отношение шансов = 3,6, 95% доверительный интервал: 1,9-6,5). Острые обострения сами по себе не влияли на последующее развитие цирроза или устойчивое биохимическое разрешение.Цирроз чаще развивался у пациентов с хроническим активным гепатитом в начале исследования (p <0,001, отношение шансов = 6,5, 95% доверительный интервал: 2,6–16,0). По сравнению с исходным уровнем РНК ВГС, РНК ВГС увеличивалась в 61% обострений, но генотип оставался неизменным в 75%.
Выводы:
Эти результаты позволяют предположить, что обострения также часто возникают у пациентов с хроническим гепатитом С.Клинически они протекают безболезненно, гистологически менее серьезны и вряд ли последуют стойкой ремиссии или развитию цирроза.
Как лечить вирусную инфекцию гепатита С у пациентов с гематологическими злокачественными новообразованиями | Кровь
Этот случай поднимает 2 вопроса: (1) влияние цирроза на распоряжение химиотерапевтическими препаратами и (2) риск печеночной недостаточности из-за лечения рака или препаратов, используемых в поддерживающей терапии.
Дозирование лекарств (включая химиотерапию) у пациентов с циррозом — неточная наука, отчасти из-за сложности распределения лекарств в печени, которая зависит от печеночной перфузии, экстракции, метаболизма, экскреции и различий в связывании с белками отдельных лекарств. . 49,50 Ни один метод не позволяет оценить фармакокинетику и фармакодинамику лекарственного средства у отдельного пациента с нарушением функции печени.Коррекция дозы часто необходима у пациентов с холестатическим поражением печени, 51,52 , но коррекция обычно не требуется у пациентов с хронической инфекцией ВГС, за исключением некоторых схем миелоаблативного кондиционирования с высокими дозами для HCT, для которых существует риск Синдром фатальной синусоидальной обструкции почти в 10 раз чаще встречается у пациентов с хронической инфекцией ВГС, чем у пациентов без инфекции ВГС. 53-55 Наиболее точным методом корректировки дозы является терапевтический мониторинг лекарственного средства, при котором доза персонализируется в режиме реального времени в соответствии с клиренсом лекарственного средства индивидуальным пациентом для достижения целевого воздействия в плазме. 56-58 У пациентов, для которых планируется ГСТ, широко используется терапевтический мониторинг бусульфана (BU), чтобы избежать отторжения трансплантата и рецидива некоторых злокачественных заболеваний (слабое воздействие) и токсических эффектов (сильное воздействие). 59,60 Для лекарств с непредсказуемой фармакокинетикой (например, CY 61 и мелфалан 62 ) терапевтический мониторинг лекарственных средств является единственным логическим подходом к дозированию не только для пациентов с циррозом, но и для пациентов с нормальной функцией печени.Однако клиническое использование терапевтического мониторинга лекарственных средств по большей части ограничено специализированными центрами. Поэтому большинство пациентов с циррозом или холестазом должны полагаться на другие методы коррекции дозы.
Другой метод корректировки дозы включает сортировку пациентов с циррозом печени по классам A, B или C по Чайлду-Туркотта-Пью (http://www.hepatitisc.uw.edu/page/clinical-calculators/ctp). Для многих химиотерапевтических препаратов фармакокинетическую информацию для пациентов с циррозом печени класса A или B по Чайлд-Тюркотт-Пью можно получить у производителя лекарственного средства; такая информация основана на рекомендациях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейского агентства по лекарственным средствам по определению фармакокинетики исследуемых препаратов у пациентов с нарушением функции печени. 63,64 Для пациентов с циррозом класса A или B часто рекомендуется снижение дозы от 50% до 75%, в зависимости от того, является ли рассматриваемый препарат препаратом с высокой степенью экстракции печени (экстракция зависит от перфузии печени) или низкой. препарат для экстракции печени (экстракция зависит от метаболизма и элиминации гепатоцитов). 49 Для лекарств с высокой экстракцией необходимо снижение дозы. Для препаратов с низкой экстракцией степень связывания с белками влияет на корректировку дозы, при этом для препаратов с высокой степенью связывания снижение дозы не требуется.Дозу препаратов с низким связыванием белков снижают параллельно с предполагаемым снижением функционального резерва печени (на основе класса Чайлда-Тюркотта-Пью). Были опубликованы рекомендации по корректировке дозы химиотерапии, основанные на результатах сывороточных тестов печени, в основном на уровне сывороточного билирубина. 51,52,64 Основными целями корректировки дозы являются предотвращение системных побочных эффектов от токсичных концентраций в плазме и обеспечение адекватных концентраций лекарственного средства, когда ожидается слабое воздействие.
Если бы пациенту в этом случае назначили HCT, вопросы были бы следующими: какой режим кондиционирования мог бы выдержать этот пациент с циррозом? Следует ли попробовать терапию ПППД перед трансплантацией? Противопоказан ли микофенолятмофетил для профилактики РТПХ?
Высокие дозы миелоаблативных схем, содержащих токсины синусоидальных эндотелиальных клеток (CY, этопозид, тиотепа, мелфалан, гемтузумаб озогамицин и общее облучение тела> 12 Гр), в значительной степени отказались от пациентов с хроническим гепатитом (инфекция ВГС, неалкогольный стеатогепатит или алкогольный гепатит). ) в пользу менее токсичных для печени схем. 53,54 Если есть необходимость использовать схему на основе CY у пациента с циррозом, доза должна составлять от 90 мг / кг до 100 мг / кг (вместо 120 мг / кг), если возможно, с корректировкой дозы. и либо отделены во времени от BU, либо приводятся первыми по порядку (например, CY / целевая BU). 61,65,66 Режимы пониженной интенсивности могут избежать синусоидального повреждения, но пациенты с циррозом по-прежнему подвержены риску печеночной недостаточности из-за РТПХ, инфекционного холестаза, гипоксического гепатита, инфильтрации опухоли и лекарственного поражения печени в результате приема лекарств. поддерживающая терапия, включая лечение травами. 54,67-70 Асцитную жидкость следует слить перед введением гидрофильных препаратов, таких как флударабин и метотрексат, 54 и, если используется микофенолят мофетил, следует скорректировать дозу, если уровень сывороточного альбумина низкий. 71 Поддерживающая терапия должна включать урсодиол для профилактики холестатического поражения печени, антибиотики для предотвращения бактериальной транслокации во время нейтропении, а также внимание к воротному давлению и гепаторенальному синдрому.
Лекарственное поражение печени в результате приема противоопухолевых препаратов было рассмотрено в другом месте. 64,68,72 ВГС является фактором риска лекарственного поражения печени от некоторых лекарств, и есть сообщения о случаях повышения вирусных титров и более тяжелой инфекции ВГС после восстановления иммунитета после иммуносупрессивной химиотерапии. 30,73,74 Пациенты с циррозом будут подвергаться большему риску обострения воспаления печени, связанного с ВГС, чем люди без цирроза. Лечение пациентов с циррозом, инфицированных HCV, с помощью ПППД может быть успешным для достижения УВО, но, вероятно, его следует отложить до тех пор, пока не станет ясно течение гематологического злокачественного новообразования.
Спонтанное обострение против суперинфекции гепатотропными вирусами
29 Итальянская ассоциация по изучению печени; Итальянское общество
инфекционных тропических болезней; Итальянское общество по изучению
болезней, передаваемых половым путем. Практическое руководство по лечению гепатита C
: рекомендации совещания экспертов AISF /
SIMIT / SIMAST. Dig Liver Dis 2010;
42: 81-91 [PMID: 19748329 DOI: 10.1016 / j.dld.2009.08.001]
30 Fried MW, Shiffman ML, Reddy KR, Smith C, Marinos G,
Gonçales FL, Häussinger D, Diago M, Carosi G, Dhumeaux
D, Craxi A, Лин А., Хоффман Дж., Ю. Дж. Пегинтерферон альфа-2а
плюс рибавирин для лечения хронической инфекции вируса гепатита С. N Engl J
Med 2002; 347: 975-982 [PMID: 12324553]
31 Джентиле I, Виола C, Борджиа F, Кастальдо Дж., Борджиа Г. Телапре-
vir: многообещающий ингибитор протеазы для лечения инфекции вируса гепа-
titis C. .Curr Med Chem 2009; 16: 1115-1121
[PMID: 19275615]
32 Coppola N, Pisaturo M, Tonziello G, Sagnelli C, Sagnelli
E, Angelillo IF. Эффективность пегилированного интерферона α-2a и
α-2b у пациентов с хроническим гепатитом C генотипа 1: анализ мета-
. BMC Infect Dis 2012; 12: 357 [PMID: 23245594 DOI:
10.1186 / 1471-2334-12-357]
33 Hadziyannis SJ, Sette H, Morgan TR, Balan V, Diago M,
Marcellin P, Ramadori G, Bodenheimer H, Bernstein D,
Rizzetto M, Zeuzem S, Pockros PJ, Lin A, Ackrill AM.
Комбинированная терапия пегинтерфероном-альфа2а и рибавирином при хроническом гепатите С
: рандомизированное исследование продолжительности лечения
и дозы рибавирина. Энн Интерн Мед 2004; 140: 346-355
[PMID: 14996676]
34 Юноси З.М., Степанова М., Генри Л., Гейн Э., Якобсон И.М.,
Лавиц Э., Нельсон Д., Гербер Л., Надер Ф., Хант С. Эффекты
Лечение на основе софосбувира с интерфероном и без него,
по исходам и продуктивности пациентов с хроническим гепатитом
атитом С.Клин Гастроэнтерол Гепатол 2013; Epub перед печатью
[PMID: 24316172 DOI: 10.1016 / j.cgh.2013.11.032]
35 Ассела Т. Софосбувир для лечения вируса гепатита С.
Expert Opin Pharmacother 2014; 15: 121-130 [PMID: 24289735
DOI: 10.1517 / 14656566.2014.857656]
36 Джентиле I, Борджиа F, Коппола N, Буономо АР, Castaldo G,
Борджиа Г. Даклатасвир: первое из нового класс препаратов, направленных против вируса гепатита С NS5A.Curr Med Chem 2014;
21: 1391-1404 [PMID: 24372205]
37 Джентиле I, Борджиа Ф, Заппуло Э, Буономо А.Р., Спера AM,
Кастальдо Г., Борджиа Г. Эффективность и безопасность софосбувира в
Лечение хронического гепатита C: Начало новой эры
. Rev Последние клинические испытания, 2013 г .; Epub перед печатью [PMID:
23859195]
38 Джентиле I, Борджиа F, Буономо А.Р., Кастальдо Дж., Борджиа Г. A
Новый многообещающий терапевтический вариант против вируса гепатита С:
пероральный нуклеотидный ингибитор полимеразы NS5B софосбувир .
Curr Med Chem 2013; 20: 3733-3742 [PMID: 23848533 DOI:
10.2174 / 092986731132099
]
39 Sheen IS, Liaw YF, Lin DY, Chu CM. Острые обострения
при хроническом гепатите С: клинико-патологическое и прогностическое исследование
. J Hepatol 1996; 24: 525-531 [PMID: 8773906]
40 Hiraga N, Suzuki F, Akuta N, Suzuki Y, Sezaki H, Hosaka
T, Someya T, Kobayashi M, Saitoh S, Arase Y, Ikeda K, Ko-
bayashi M, Matsuda M, Watabiki S, Satoh J, Kumada H.
Клинические и вирусологические характеристики нелеченых пациентов
с хроническим гепатитом С, у которых развивается сывороточный аланин амино
Обострение нотрансферазы. J Med Virol 2005; 75: 240-248 [PMID:
15602722 DOI: 10.1002 / jmv.20263]
41 Rumi MG, De Filippi F, La Vecchia C, Donato MF, Gallus
S, Del Ninno E, Colombo M. Гепатит C реактивация у пациентов с хронической инфекцией с генотипами 1b и 2c:
пациентов: ретроспективное когортное исследование
с участием 206 нелеченных пациентов.Gut 2005;
54: 402-406 [PMID: 15710990 DOI: 10.1136 / gut.2004.048009]
42 Sagnelli E, Coppola N, Marrocco C, Coviello G, Battaglia
M, Messina V, Rossi G, Sagnelli C, Scolastici C. , Filippini P.
Диагностика острого гепатита, связанного с вирусом гепатита С, с помощью риального определения титров IgM к вирусу гепатита С. J Hepatol 2005; 42:
646-651 [PMID: 15826712 DOI: 10.1016 / j.jhep.2004.12.027]
43 Sagnelli E, Pisaturo M, Stanzione M, Messina V, Alessio L,
Sagnelli C, Starace M, Pasquale G, Коппола Н.Клинические до
Отправка, исходы и ответ на терапию среди пациентов
с обострением хронического гепатита С. Clin Gastro-
энтерол Hepatol 2013; 11: 1174-1180.e11 [PMID: 235
DOI:
10.1016 / j.cgh.2013.03.025]
44 Coppola N, Pisapia R, Marrocco C, Martini S, Vatiero LM,
Messina V, Tonziello G , Sagnelli C, Filippini P, Piccinino F,
Sagnelli E. Индекс авидности IgG к HCV при остром гепатите C.
J Clin Virol 2007; 40: 110-115 [PMID: 17720621 DOI: 10.1016 /
j.jcv.2007.07.005]
45 Coppola N, Pisapia R, Tonziello G, Masiello A, Martini S,
Pisaturo M, Messina V, Sagnelli C, Macera M, Signoriello
G, Sagnelli E. Улучшение этиологического диагноза
острого гепатита C: диагностический протокол, основанный на титре анти-
HCV-IgM и индексе авидности IgG. J Clin Virol 2009; 46:
222-229 [PMID: 19758839 DOI: 10.1016 / j.jcv.2009.08.009]
46 Sagnelli E, Tonziello G, Pisaturo M, Sagnelli C, Coppola N.
Клиническое применение авидности антител и иммуноглобулов
Тестирование
lin M при острой инфекции HCV. Антивир Тер 2012; 17:
1453-1458 [PMID: 23322703 DOI: 10.3851 / IMP2471]
47 Tsuji K, Yamasaki K, Yamanishi M, Kawakami M, Shira-
hama S.
Безуспешных носителей РНК вируса гепатита С: 10-летнее наблюдение —
исследование.J Gastroenterol Hepatol 2001; 16: 536-540 [PMID:
11350550 DOI: 10.1046 / j.1440-1746.2001.02474.x]
48 Coppola N, Vatiero LM, Sagnelli E. Генотип 2 ВГС как фактор риска
фактор реактивации хронической Инфекция ВГС. Gut 2005; 54:
1207 [PMID: 16009701 DOI: 10.1136 / gut.2005.070649]
49 Sagnelli E, Pisaturo M, Sagnelli C, Coppola N. Лечение на основе ритуксимаба-
, репликация HCV и обострения печени. Clin
Dev Immunol 2012; 2012: 945950 [PMID: 22
6 DOI:
10.1155/2012/945950]
50 Coppola N, Pisaturo M, Guastaerro S, Tonziello G, Sica A,
Iodice V, Sagnelli C, Ferrara MG, Sagnelli E. Повышенная вирусная нагрузка hepa-
titis C и реактивация заболевания печени при ВГС
РНК-положительных пациентов с онкогематологическим заболеванием без
, проходящих химиотерапию. Dig Liver Dis 2012; 44: 49-54 [PMID:
21885355 DOI: 10.1016 / j.dld.2011.07.016]
51 Энниши Д., Маэда Y, Ниицу Н., Кодзима М., Идзуцу К., Такиза-
ва Дж, Кусумото С. , Okamoto M, Yokoyama M, Takamatsu Y,
Sunami K, Miyata A, Murayama K, Sakai A, Matsumoto M,
Shinagawa K, Takaki A, Matsuo K, Kinoshita T, Tanimoto M.
Печеночная токсичность и прогноз у инфицированных вирусом гепатита С
пациентов с диффузной крупноклеточной В-клеточной лимфомой, получавших
схем химиотерапии, содержащих ритуксимаб: многоцентровый анализ в Японии
. Кровь 2010; 116: 5119-5125 [PMID:
20823454 DOI: 10.1182 / blood-2010-06-289231]
52 Marignani M, Mangone M, Cox MC, Angeletti S, Veggia B,
Ferrari A, di Fonzo M, Begini P, Gigante E, Laverde G, Aloe-
Spiriti A, Monarca B, Delle Fave G.ВГС-положительный статус
и обострения гепатита у пациентов с В-клеточной неходжкинской лимфомой
, получавших схемы, содержащие ритуксимаб. Dig
Liver Dis 2011; 43: 139-142 [PMID: 20554488 DOI: 10.1016 /
j.dld.2010.05.010]
53 Pitini V, Sturniolo G, Arrigo C, Leonardi S, Pino S, Altavilla
G. Генотип 2 HCV как фактор риска реактивации у пациентов с В-клеточной лимфомой, проходящих химиотерапию комбинацией ритуксимаба
.Br J Haematol 2010; 150: 116-118 [PMID:
20230413 DOI: 10.1111 / j.1365-2141.2010.08154.x]
54 Thurairajah PH, Thorburn D, Hubscher S, White A, Lai WK,
O’Donnell K, Мутимер Д. Заболеваемость и характеристика повышений уровня трансаминаз в сыворотке крови на
пегилированного интерферона и
рибавирина у пациентов с хроническим гепатитом С. Алимент
Pharmacol Ther 2007; 25: 1293-1300 [PMID: 17509097]
55 Caroleo B, Gallelli L, Staltari O, De Sarro G, Guadagnino V.
Повышение уровня трансаминаз в сыворотке при лечении пегилированным интерфероном
Лечение хронического гепатита ВГС, вероятно, вызванного полиэтиленгликолем
. Intervirology 2008; 51: 407-409 [PMID:
19258719 DOI: 10.1159 / 000205266]
6713 14 июня 2014 г.
|
Том 20
|
Выпуск 22
|
WJG
|
www.wjgnet.com
Sagnelli E
et al
.Нарушения со стороны печени при хроническом гепатите С
Тяжелая реактивация гепатита С как раннее осложнение трансплантации гемопоэтических клеток
Инфекция, вызванная вирусом гепатита С (ВГС), является наиболее распространенной инфекцией, передающейся через кровь, в Соединенных Штатах, от которой, по оценкам, страдают 2,7–3,9 миллиона человек. 1 По оценкам, распространенность ВГС-инфекции среди онкологических больных достигает 30%. 2, 3 У онкологических больных с хронической инфекцией ВГС, получающих химиотерапию, обострение и реактивация инфекции ВГС признаются причинами дисфункции печени. 4, 5, 6 Обострение инфекции ВГС определяется как трехкратное или большее повышение уровня аланинаминотрансферазы (АЛТ) у пациента без других причин дисфункции печени, таких как злокачественная инфильтрация, некоторые лекарства, системные инфекции, поражающие печень, получение переливания крови в течение 1 месяца после повышения уровня АЛТ или РТПХ печени. 5 Реактивация инфекции ВГС определяется как повышение уровня РНК ВГС не менее чем на 1 log 10 МЕ / мл от исходного уровня, поскольку уровни РНК ВГС у хронически инфицированных пациентов могут колебаться примерно на 0,5 log 10 МЕ / мл. 4, 5
Раковые больные с хронической инфекцией ВГС, перенесшие трансплантацию гемопоэтических клеток (НСТ), имеют высокий риск ускоренного прогрессирования фиброза печени — прогрессирование может быть в два раза быстрее, чем у пациентов, инфицированных ВГС, не подвергающихся НСТ, — и смерти из-за инфекционных причин и РТПХ. 7, 8 Имеющаяся в настоящее время информация свидетельствует о том, что по сравнению с реактивацией вируса гепатита В реактивация ВГС редко вызывает значительную заболеваемость и смертность, связанные с печенью. 4, 5, 9, 10 Однако мало что известно о естественном течении или исходах обострения и реактивации HCV у реципиентов HCT. В недавно опубликованном руководстве рабочей группы по лечению хронической инфекции HCV у кандидатов на HCT рекомендуется по возможности завершить противовирусное лечение до HCT. 11 Тем не менее, у пациентов, которые не могут отложить HCT из-за риска рецидива рака, откладывание противовирусной терапии до 6 месяцев после HCT является наиболее распространенным подходом.На этом этапе большинство пациентов завершают иммуносупрессивную терапию, которая может вызывать токсические эффекты, перекрывающиеся с эффектами противовирусных препаратов и лекарственными взаимодействиями с противовирусными препаратами. 11 Немедленное противовирусное лечение после HCT рекомендуется только пациентам, у которых развивается фиброзирующий холестатический гепатит или декомпенсированный цирроз печени, а также пациентам с лимфопролиферативными расстройствами, связанными с HCV. 11 Не установлено, требует ли реактивация HCV во время HCT срочного противовирусного лечения. 11
Здесь мы описываем то, что, насколько нам известно, является первым зарегистрированным случаем обострения и реактивации HCV, осложняющего ранний период HCT (<30 дней после HCT) и требующего срочной терапии, направленной на HCV. У 25-летнего мужчины с хронической инфекцией ВГС (генотип 2) и первичной В-клеточной лимфомой средостения II стадии рецидив заболевания произошел через 6 месяцев после 6 курсов ритуксимаба, циклофосфамида, доксорубицина, VCR и преднизолона. Затем он получил ритуксимаб, ифосфамид, карбоплатин и этопозид, которые вызвали CR после 3 циклов.Затем он был госпитализирован по поводу аутологичного HCT с режимом кондиционирования, состоящим из гемцитабина, бусульфана, мелфалана и вориностата. Он достиг приживления на 9 день. Исходно, до кондиционирования, вирусная нагрузка HCV составляла 696 000 МЕ / мл (5,8 log 10 МЕ / мл) (количественная ПЦР на РНК HCV, версия 2.0; Roche Molecular Systems, Inc., Pleasanton , Калифорния, США) (рис. 1), и у него не было признаков цирроза на основании визуализации брюшной полости и неинвазивного анализа сывороточного фиброза с помощью FIBRO Spect II (Prometheus Laboratories, Сан-Диего, Калифорния).Хотя эпиднадзорное тестирование перитрансплантата на вирусную нагрузку на ВГС не рекомендуется, 11 такое тестирование было выполнено через 1 день после начала кондиционирующей терапии и показало увеличение вирусной нагрузки> 2 log до 7,9 log 10 МЕ / мл. Это сопровождалось повышением уровня ALT в течение 1 недели после начала режима кондиционирования и 2 дней после HCT. Уровень билирубина также достиг пика в этот период до 8,3 мг / дл. Уровни АЛТ и билирубина нормализовались через 9 дней после ГСТ, но быстро снова повысились после выписки из больницы и прогрессировали, включая лихорадку, озноб, тошноту и рвоту.Пациент был повторно госпитализирован для исследования повышения уровня ферментов печени и симптомов. Во время этой госпитализации вирусная нагрузка HCV увеличилась до> 100000000 МЕ / мл (> 8 log 10 МЕ / мл). Другие причины острого гепатита были исключены, включая ВПГ, вирус гепатита А, вирус гепатита В, вирус гепатита Е, ЦМВ, аденовирус, бактериальные и грибковые инфекции и лекарства. Сонография печени показала увеличенную печень, мягкую грубую эхотекстуру и нормальные воротные и печеночные вены. Биопсия печени была исключена из-за тромбоцитопении.
Рисунок 1
Изменения уровней аланинаминотрансферазы и вирусной нагрузки гепатита С у реципиента аутологичного трансплантата гемопоэтических стволовых клеток с первичной средостенной B-клеточной лимфомой.
Из-за постоянно повышенного уровня АЛТ было принято решение начать противовирусную терапию HCV через 20 дней после HCT. Это решение также было основано на опасениях по поводу надвигающейся печеночной недостаточности и возможного развития фиброзирующего холестатического гепатита, 12 , а также на желании снизить риск рецидива лимфомы у пациента в будущем. 5 Пациент получил комбинацию противовирусных препаратов прямого действия (ПППД) софосбувира (400 мг перорально в день) и даклатасвира (60 мг перорально в день) в течение 12-недельного курса. Несмотря на инфекцию HCV генотипа 2, прием рибавирина был исключен из-за анемии (надир гемоглобина при трансплантации 7,9 г / дл). После 3 дней терапии уровень АЛТ резко снизился, вирусная нагрузка HCV снизилась более чем на 2 log, а симптомы улучшились. Биопсия печени в конечном итоге была выполнена через 4 недели после начала терапии ПППД из-за постоянно повышенного уровня конъюгированного билирубина и выявила хроническое воспаление воротной вены (степень 2), повреждение желчных протоков и умеренный холестаз.Противовирусная терапия ВГС закончилась через 12 недель, после чего вирусная нагрузка ВГС была неопределяемой, а повышение АЛТ и гипербилирубинемия полностью исчезли. Вирусная нагрузка остается неопределяемой на 4-й неделе без противовирусных препаратов.
Лечение ВГС может положительно повлиять на вирусологические, печеночные и онкологические исходы больных раком. 5, 13 Сообщается, что у онкологических больных с нелеченым гепатитом С, получающих химиотерапию, частота острой реактивации ВГС составляет 11%, и реактивация чаще встречается у пациентов с гематологическими злокачественными новообразованиями, чем у пациентов с солидными опухолями. 4 Во время обострения нарушение функции печени может вызвать прекращение химиотерапии или прерывание запланированного курса лечения. 4, 10 Хроническая инфекция ВГС связана с патогенезом В-клеточной неходжкинской лимфомы, и лечение ВГС рекомендуется в качестве начальной терапии у отдельных пациентов с определенными типами лимфомы, такими как лимфома маргинальной зоны селезенки. 14 У реципиентов HCV с хронической инфекцией HCV у пациентов, получавших лечение HCV до или после HCT, частота рецидивов неходжкинской лимфомы, ассоциированной с HCV, была ниже, чем у пациентов, которые не получали такую терапию (20 против 86%, P = 0.015). Реципиенты HCT, получавшие лечение от инфекции HCV, также имели более высокие показатели 5-летней выживаемости (75 против 39%, P = 0,02), чем те, кто не лечился от инфекции HCV. 5 Кроме того, пациенты с HCV-инфицированным раком, которые не получают лечения от HCV, имеют более высокий риск прогрессирования цирроза и портальной гипертензии, что может затруднить онкологическое лечение из-за нарушения метаболизма и клиренса химиотерапевтических препаратов. 13
Все кандидаты и получатели HCT должны пройти обследование на предмет лечения HCV; однако надлежащие сроки лечения ВГС не установлены. 11 ПППД безопасны и хорошо переносятся кандидатами на ГСТ, и они могут быть более эффективными для лечения ВГС, чем схемы, содержащие интерферон. 5 Межлекарственные взаимодействия и исходы лечения ВГС у пациентов, получающих химиотерапию новыми ПППД, недостаточно изучены и требуют дальнейшего изучения.
По нашему опыту, у большинства пациентов с обострением или реактивацией ВГС показатели функции печени нормализуются с возвращением к исходным уровням виремии после прекращения химиотерапии. 4, 5, 6 У пациента, описанного здесь, тяжелая и устойчивая реактивация HCV вызвала раннее (<30 дней после HCT) противовирусное лечение для предотвращения дальнейшего повреждения печени и улучшения общего результата. Тяжелое обострение или реактивация HCV в раннем пост-HCT периоде следует добавить к показаниям для срочного лечения HCV.
Ссылки
- 1
Smith BD, Morgan RL, Becket GA, Falck-Ytter Y, Holtzman D, Teo CG et al .Рекомендации по выявлению хронической инфекции вируса гепатита С у лиц 1945-1965 годов рождения. MMWR Recomm Rep 2012; 61 : 1–18.
PubMed
Google Scholar
- 2
Silvestri F, Pipan C, Barillari G, Zaja F, Fanin R, Infanti L et al . Распространенность инфекции вирусом гепатита С у пациентов с лимфопролиферативными заболеваниями. Blood 1996; 87 : 4296–4301.
CAS
PubMedGoogle Scholar
- 3
Bianco E, Marcucci F, Mele A. Распространенность инфекции вирусом гепатита С при лимфопролиферативных заболеваниях, отличных от В-клеточной неходжкинской лимфомы, и при миелопролиферативных заболеваниях: итальянское многоцентровое исследование «случай-контроль». Haematologica 2004; 89 : 70–76.
PubMed
Google Scholar
- 4
Mahale P, Kontoyiannis DP, Chemaly RF, Jiang Y, Hwang JP, Davila M et al .Острое обострение и реактивация хронической инфекции вируса гепатита С у онкологических больных. J Hepatol 2012; 57 : 1177–1185.
Артикул
Google Scholar
- 5
Kyvernitakis A, Mahale P, Popat UR, Jiang Y, Hosry J, Champlin RE et al . Инфекция вирусом гепатита С у пациентов, перенесших трансплантацию гемопоэтических клеток в эпоху противовирусных препаратов прямого действия. Пересадка костного мозга Biol 2016; 22 : 717–722.
Артикул
Google Scholar
- 6
Mahale P, Thomas SK, Kyvernitakis A, Torres HA. Ведение множественной миеломы, осложненной реактивацией вируса гепатита С: роль новой противовирусной терапии. Открытый форум Infect Dis 2015; 3 : ofv211.
Артикул
Google Scholar
- 7
Peffault de Latour R, Levy V, Asselah T., Marcellin P, Scieux C, Adès L et al .Отдаленный исход инфекции гепатита С после трансплантации костного мозга. Кровь 2004; 103 : 1618–1624.
CAS
СтатьяGoogle Scholar
- 8
Ramos CA, Saliba RM, de Padua L, Khorshid O, Shpall EJ, Giralt S et al . Влияние серопозитивности вируса гепатита С на выживаемость после аллогенной трансплантации гемопоэтических стволовых клеток при гематологических злокачественных новообразованиях. Haematologica 2009; 94 : 249–257.
Артикул
Google Scholar
- 9
Kohrt HE, Ouyang DL, Keeffe EB. Систематический обзор: профилактика ламивудином реактивации хронического гепатита B, вызванной химиотерапией. Aliment Pharmacol Ther 2006; 24 : 1003–1016.
CAS
СтатьяGoogle Scholar
- 10
Ануп П., Уотерспун А., Матутес Э. Тяжелая дисфункция печени в результате реактивации вируса гепатита С после лечения хроническим лимфолейкозом алемтузумабом. Br J Haematol 2010; 148 : 484–486.
Артикул
Google Scholar
- 11
Торрес Х.А., Чонг П.П., де Лима М., Фридман М.С., Гиралт С., Хаммонд С.П. и др. . Инфекция вируса гепатита С среди доноров и реципиентов трансплантата гемопоэтических клеток: рекомендации Рабочей группы Американского общества по трансплантации крови и костного мозга. Пересадка костного мозга Biol 2015; 21 : 1870–1882.
Артикул
Google Scholar
- 12
Эванс А.Т., Леб К.Р., Шульман Х.М., Хассан С., Цю В.С., Хоккенбери Д.М. и др. . Фиброзирующий холестатический гепатит С после трансплантации гемопоэтических клеток: сообщение о 3 летальных случаях. Am J Surg Pathol 2015; 39 : 212–220.
Артикул
Google Scholar
- 13
Torres HA, Mahale P, Blechacz B, Miller E, Kaseb A, Herlong HF et al .Влияние инфекции вирусом гепатита С на больных раком: обращение к безнадзорному населению. J Natl Compr Canc Netw 2015; 13 : 41–50.
Артикул
Google Scholar
- 14
Национальная комплексная онкологическая сеть. Лимфома краевой зоны селезенки (версия 4.2014) http://www.nccn.org/about/nhl.pdf. По состоянию на 18 марта 2016 г.
Ссылки для скачивания
Благодарности
Мы благодарим г-жуСтефани Деминг из отдела научных публикаций онкологического центра доктора медицины Андерсона Техасского университета за помощь в редактировании.
Вклад авторов
Дизайн исследования: NTO, HAT. Лечение и наблюдение за пациентами: NTO, EA-H, YLN, BB, PA, HAT. Сбор и анализ данных: NTO, HAT. Предоставление экспертных заключений: NTO, EA-H, YLN, BB, PA, HAT. Написание рукописи: NTO, HAT.
Информация об авторе
Принадлежность
Департамент медицины, Отдел инфекционных заболеваний, Медицинский колледж Бейлора, Хьюстон, Техас, США
NT Оливер
Департамент трансплантации стволовых клеток и клеточной терапии Университета им. Техасский онкологический центр Андерсона, Хьюстон, Техас, США
YL Nieto & P Anderlini
Отделение гастроэнтерологии, гепатологии и питания, Онкологический центр Андерсона Университета Техаса, Хьюстон, Техас, США
B Blechacz
Департамент инфекционных заболеваний, инфекционного контроля и здоровья сотрудников, Онкологический центр им. М.Д. Андерсона Техасского университета, Хьюстон, Техас, США
E Ariza-Heredia & HA Torres
Автор, ответственный за переписку
Х. А. Торрес.
Декларации этики
Конкурирующие интересы
HAT является или был главным исследователем грантов на исследования от Gilead Sciences, Merck & Co., Inc. и Vertex Pharmaceuticals, при этом все средства выплачивались онкологическому центру Андерсона при Техасском университете. HAT является или был оплачиваемым научным консультантом Gilead Sciences, Janssen Pharmaceuticals, Inc., Merck & Co., Inc., Vertex Pharmaceuticals, Genentech, Novartis, Astellas Pharma, Pfizer Inc.и Theravance Biopharma, Inc .; Условиями этих соглашений управляет онкологический центр MD Anderson Cancer Center в соответствии с его политикой в отношении конфликта интересов.
Об этой статье
Цитируйте эту статью
Оливер Н., Ньето Ю., Блехач Б. et al. Тяжелая реактивация гепатита С как раннее осложнение трансплантации гемопоэтических клеток.
Пересадка костного мозга 52, 138–140 (2017).https://doi.org/10.1038/bmt.2016.196
Ссылка для скачивания
Дополнительная литература
Влияние двойной системы молекулярной адсорбции плазмы на функцию печени, электролиты, воспаление и иммунитет у пациентов с тяжелым хроническим гепатитом
- Гао Чен
- , Mengzheng Wu
- , Bibo Wu
- , Feifei Liu
- , Jianying Liu
- и Li Liu
Журнал клинического лабораторного анализа
(2019)Реактивация вируса гепатита С у пациентов, получающих лечение от рака: проспективное обсервационное исследование
- Гаррис А.Торрес
- , Джефф Хосри
- , Параг Махале
- , Минас П. Экономидес
- , Ин Цзян
- и Анна С. Лок
Гепатология
(2018)Онкологическое бремя инфекции вирусом гепатита С: клиническая перспектива
- Гаррис А.Торрес
- , Терри Линн Шигл
- , Нассим Хаммуди
- , Джеймс Т. Линк
- , Фелипе Саманьего
- , Ахмед Касеб
- и Винсент Малле
CA: Онкологический журнал для клиницистов
(2017)
Лечение множественной миеломы, осложненной реактивацией вируса гепатита С: роль новой противовирусной терапии | Открытый форум по инфекционным болезням
Аннотация
Сообщалось о реактивации хронической инфекции вируса гепатита С (ВГС) у онкологических больных, получающих химиотерапию.В этом исследовании мы сообщаем о первом, насколько нам известно, случае обострения и реактивации хронической инфекции ВГС, вызванной талидомидом, что осложняет лечение множественной миеломы. Противовирусная терапия на основе софосбувира помогла добиться выведения вируса и нормализации ферментов печени, что открыло доступ к будущим потенциально спасающим жизнь химиотерапевтическим агентам.
Острое обострение (определяется как повышение уровня сывороточной аланинаминотрансферазы [АЛТ] в ≥3 раза выше верхнего предела нормы) и реактивация инфекции, вызванной вирусом хронического гепатита С (ВГС) (определяется как повышение уровня РНК ВГС на ≥1 log 10 МЕ / мл от исходного уровня) сообщалось у онкологических больных, получающих химиотерапию [1].Эти состояния могут привести к снижению дозы или прекращению химиотерапии и помешать лечению рака [1]. В этом исследовании мы сообщаем о первом случае, насколько нам известно, вызванной талидомидом реактивации ВГС, осложняющей лечение множественной миеломы.
ДЕЛО
74-летней белой женщине был поставлен диагноз множественной миеломы II стадии (Международная система стадий) и хроническая инфекция ВГС генотипа 2b в июне 2006 года, и ей начали принимать талидомид (100 мг в день) и дексаметазон (пульс 40 мг).Уровни аланинаминотрансферазы и РНК HCV увеличились в течение 28 дней после начала химиотерапии (таблица 1, рисунок 1). Уровни аланинаминотрансферазы нормализовались через 61 день после пика. Талидомид был отменен через 116 дней, и пациенту была проведена аутологичная трансплантация гемопоэтических клеток (HCT) с мелфаланом в качестве кондиционирующего режима. Парапротеин сыворотки, проверяемый ежемесячно, исчез через 5-6 месяцев после HCT.
Таблица 1. Лабораторные характеристики
пациента с реактивацией ВГС после лечения талидомидом
| Лабораторные параметры . | Нормальные значения . | Эпизод 1 . | Эпизод 2 . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходный уровень: до начала применения талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | Исходный уровень: до начала приема талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | ||||||
| Значения . | дней после инициации . | Значения . | дней после инициации . | ||||||||
| РНК ВГС | 0 log 10 МЕ / мл | 5,58 | 7,7 | 28 | 1175 | 3,97 | 6,83 | 86 | 140 | 21 | 91 | 88 | 241 | 121 | 92 |
| AST | 15–46 IU / L | 21 | 107 | 83 | 292 | 92 | 426 | ||||
| Общий билирубин | 0–1.0 г / дл | 0,6 | 0,7 | 130 | 3 | 0,3 | 1,0 | 61 | 29 | ||
| Общее количество лейкоцитов a | 4–11 (µL × 1000 клеток) | 7,1 | 2,6 | 21 | 63 | 4,8 | 3,9 | 90 | 27 | ||
| ALC a | 1–4,8 (× 1000 ячеек / µL7) | 1–4,8 (× 1000 ячеек / µL7) .5 | 127 | 2 | 1,67 | 1,33 | 90 | — | |||
| Лабораторные параметры . | Нормальные значения . | Эпизод 1 . | Эпизод 2 . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходный уровень: до начала применения талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | Исходный уровень: до начала приема талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | ||||||
| Значения . | дней после инициации . | Значения . | дней после инициации . | ||||||||
| РНК ВГС | 0 log 10 МЕ / мл | 5,58 | 7,7 | 28 | 1175 | 3,97 | 6,83 | 86 | 140 | 21 | 91 | 88 | 241 | 121 | 92 |
| AST | 15–46 IU / L | 21 | 107 | 83 | 292 | 92 | 426 | ||||
| Общий билирубин | 0–1.0 г / дл | 0,6 | 0,7 | 130 | 3 | 0,3 | 1,0 | 61 | 29 | ||
| Общее количество лейкоцитов a | 4–11 (µL × 1000 клеток) | 7,1 | 2,6 | 21 | 63 | 4,8 | 3,9 | 90 | 27 | ||
| ALC a | 1–4,8 (× 1000 ячеек / µL7) | 1–4,8 (× 1000 ячеек / µL7) .5 | 127 | 2 | 1,67 | 1,33 | 90 | — | |||
Таблица 1.
Лабораторные характеристики пациента с реактивацией ВГС после лечения талидомидом
| Нормальные значения . | Эпизод 1 . | Эпизод 2 . | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходный уровень: до начала применения талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | Исходный уровень: до начала приема талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | ||||||
| Значения . | дней после инициации . | Значения . | дней после инициации . | ||||||||
| РНК ВГС | 0 log 10 МЕ / мл | 5,58 | 7,7 | 28 | 1175 | 3,97 | 6,83 | 86 | 140 | 21 | 91 | 88 | 241 | 121 | 92 |
| AST | 15–46 IU / L | 21 | 107 | 83 | 292 | 92 | 426 | ||||
| Общий билирубин | 0–1.0 г / дл | 0,6 | 0,7 | 130 | 3 | 0,3 | 1,0 | 61 | 29 | ||
| Общее количество лейкоцитов a | 4–11 (µL × 1000 клеток) | 7,1 | 2,6 | 21 | 63 | 4,8 | 3,9 | 90 | 27 | ||
| ALC a | 1–4,8 (× 1000 ячеек / µL7) | 1–4,8 (× 1000 ячеек / µL7) .5 | 127 | 2 | 1,67 | 1,33 | 90 | — | |||
| Лабораторные параметры . | Нормальные значения . | Эпизод 1 . | Эпизод 2 . | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходный уровень: до начала применения талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | Исходный уровень: до начала приема талидомида . | Пик / Надир a после начала применения талидомида . | Время возврата к исходному уровню (дни) . | ||||||
| Значения . | дней после инициации . | Значения . | дней после инициации . | ||||||||
| РНК ВГС | 0 log 10 МЕ / мл | 5,58 | 7,7 | 28 | 1175 | 3,97 | 6,83 | 86 | 140 | 21 | 91 | 88 | 241 | 121 | 92 |
| AST | 15–46 IU / L | 21 | 107 | 83 | 292 | 92 | 426 | ||||
| Общий билирубин | 0–1.0 г / дл | 0,6 | 0,7 | 130 | 3 | 0,3 | 1,0 | 61 | 29 | ||
| Общее количество лейкоцитов a | 4–11 (µL × 1000 клеток) | 7,1 | 2,6 | 21 | 63 | 4,8 | 3,9 | 90 | 27 | ||
| ALC a | 1–4,8 (× 1000 ячеек / µL7) | 1–4,8 (× 1000 ячеек / µL7) .5 | 127 | 2 | 1,67 | 1,33 | 90 | — | |||
Рисунок 1.
Изменения уровней аланинаминотрансферазы (АЛТ) и вирусной нагрузки вируса гепатита С (ВГС) у пациента, получающего лечение талидомидом. Сокращения: Декса, дексаметазон; МЕ, международные единицы; Рибавирин, рибавирин; SCT, трансплантация стволовых клеток; Соф, софосбувир; TDM, талидомид.
Рисунок 1.
Изменения уровней аланинаминотрансферазы (АЛТ) и вирусной нагрузки вируса гепатита С (ВГС) у пациента, получающего лечение талидомидом.Сокращения: Декса, дексаметазон; МЕ, международные единицы; Рибавирин, рибавирин; SCT, трансплантация стволовых клеток; Соф, софосбувир; TDM, талидомид.
Миелома оставалась в стадии ремиссии до октября 2012 года, когда был обнаружен рецидив. Талидомид был возобновлен с 50 мг на ночь и увеличен до 100 мг на ночь через 28 дней. Через четыре месяца после начала приема талидомида было отмечено обострение и реактивация ВГС (таблица 1, рисунок 1). Талидомид был отменен через 92 дня; АЛТ и РНК ВГС существенно снизились и достигли уровня, близкого к уровню преталидомида.Тесты на ядро антитела гепатита B, поверхностный антиген и антитело к вирусу иммунодефицита человека 1/2 были отрицательными, с генотипом CC IL28B. Ультразвук печени показал нормальную эхогенность, отсутствие признаков цирроза или очаговых поражений печени, что исключает поражение печени миеломой [2]. Портальные и печеночные вены были проходимыми с нормальным направленным потоком, что свидетельствует об отсутствии тромбоэмболии, вызванной талидомидом. Для предотвращения дальнейших эпизодов обострения и реактивации ВГС, что позволило получить доступ к другим химиотерапевтическим средствам, пациенту была начата безинтерфероновая комбинированная терапия софосбувиром и рибавирином в зависимости от веса в течение 12 недель.Она достигла стойкого вирусологического ответа (неопределяемая РНК HCV через 24 недели после завершения лечения) [3]. РНК вируса гепатита С стала неопределяемой, а уровни АЛТ нормализовались без дополнительных пиков АЛТ во время или после лечения ВГС. Через 34 месяца после отмены талидомида множественная миелома достигла почти полной ремиссии, и в настоящее время пациент находится под онкологическим наблюдением.
ОБСУЖДЕНИЕ
Талидомид — иммуномодулирующее средство, одобренное для лечения множественной миеломы и узловатой лепрозной эритемы [4].Он также использовался для лечения хронической реакции «трансплантат против хозяина» после HCT, афтозного стоматита, связанного с синдромом приобретенного иммунодефицита, макроглобулинемии Вальденстрема и системного амилоидоза легких цепей [4].
Талидомид подавляет секрецию фактора некроза опухоли-α, ключевого цитокина, который способствует иммунному ответу на вирусные инфекции [5]. В прошлом наблюдалась реактивация инфекции вирусом гепатита В после терапии талидомидом амилоидоза легкой цепи почек [6]. Некоторые, но не все авторы задокументировали гепатотоксические эффекты после введения талидомида, но только об одном случае было зарегистрировано у пациента с хронической инфекцией ВГС [7].К сожалению, в этом случае не был указан уровень РНК ВГС до начала приема талидомида. У нашего пациента реактивация HCV произошла дважды после введения талидомида, что осложнило лечение множественной миеломы. Реактивация вируса гепатита С была связана с несколькими химиотерапевтическими агентами, такими как алемтузумаб, блеомицин, бусульфан, цисплатин, циклофосфамид, циклоспорин, цитарабин, дакарбазин, доксорубицин, этопозид, гемцитабин, метотрексат, 1, но не винкристастин, [8] винкристастин, [8] ].Большинство этих препаратов применялось в комбинации с кортикостероидами [1]. Кортикостероиды воздействуют на ВГС либо напрямую, усиливая репликацию РНК ВГС, либо косвенно, подавляя иммунный ответ, опосредованный ВГС [9]. Это может быть причиной первого эпизода реактивации РНК HCV, наблюдаемого у этого пациента. Противовоспалительный эффект дексаметазона также может быть причиной снижения уровня АЛТ до того, как талидомид был отменен в первый раз. Однако мы наблюдали, что реактивация HCV происходила даже при введении талидомида в качестве монотерапии.В исследовании in vitro индуцированное талидомидом ингибирование активации киназы IκB и передачи сигналов ядерного фактора-κB привело к усиленной репликации РНК HCV [10], и наши клинические наблюдения подтверждают этот вывод. Следовательно, следует рассмотреть возможность применения талидомида наряду с другими агентами, которые, как было установлено, связаны с реактивацией HCV.
Одобренная в настоящее время противовирусная терапия прямого действия (ПППД) с использованием схем, содержащих софосбувир, значительно улучшила показатели устойчивого вирусологического ответа и сократила продолжительность лечения [3].У нашего пациента инфекция ВГС была устранена, а уровни АЛТ нормализованы с помощью 12-недельного курса софосбувира и рибавирина, что позволило получить доступ к широкому спектру вариантов лечения рака в будущем.
Последние руководящие принципы рекомендуют всем кандидатам на HCV-инфицированные HCT проходить оценку на предмет противовирусной терапии перед началом схем кондиционирования, и их следует лечить до HCT, когда это возможно [11]. После HCT некоторые эксперты рекомендуют подождать 6 месяцев, прежде чем начинать противовирусное лечение ПППД, чтобы снизить дозу иммунодепрессантов [11].Лечение на основе противовирусных препаратов прямого действия после HCT у HCV-инфицированных пациентов с гематологическими злокачественными новообразованиями, таких как пациенты с неходжкинской лимфомой, кажется безопасным и эффективным и, как было показано, улучшает печеночные и онкологические исходы [12]. Предварительные данные свидетельствуют о том, что одновременное применение ПППД вместе с выбранными химиотерапевтическими агентами безопасно и может использоваться с осторожностью в определенных случаях [13]. Однако необходимо учитывать лекарственные взаимодействия и перекрывающуюся токсичность.
ВЫВОДЫ
В заключение следует отметить, что обострение и реактивация ВГС могут осложнить лечение рака и возникать у пациентов, получающих талидомид. Гематоонкологи должны повысить осведомленность об этом состоянии. Следует контролировать уровни аланинаминотрансферазы и РНК ВГС у пациентов, инфицированных вирусом гепатита С, получающих талидомид, и может потребоваться снижение дозы или прекращение приема талидомида.
Благодарность
Мы благодарим Стефани Деминг (онкологический центр Андерсона Университета Техаса) за помощь в редактировании.
Возможный конфликт интересов. HAT является консультантом Gilead Sciences, Janssen Pharmaceuticals, Inc., Merck & Co., Inc., Vertex Pharmaceuticals, Novartis, Genentech, Astellas, Pfizer и Theravance, Inc., и получил исследовательские гранты от Gilead Sciences, Merck. & Co., Inc. и Vertex Pharmaceuticals. Все авторы подали форму ICMJE для раскрытия информации о потенциальном конфликте интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1
Махале
-П
,
Kontoyiannis
DP
,
Chemaly
RF
et al. .
Острое обострение и реактивация хронической инфекции вируса гепатита С у онкологических больных
.
J Hepatol
2012
;
57
:
1177
—
85
,2
Бхандари
MS
,
Mazumder
A
,
Vesole
DH
.
Поражение печени при множественной миеломе
.
Clin лимфома миелома
2007
;
7
:
538
—
40
.3
AASLD / IDSA HCV Guidance Panel
.
Руководство по гепатиту С: рекомендации AASLD-IDSA по тестированию, ведению и лечению взрослых, инфицированных вирусом гепатита С
.
Гепатология
2015
;
62
:
932
—
54
,4
Мэтьюз
SJ
,
Маккой
С
.
Талидомид: обзор одобренных и исследовательских применений
.
Clin Ther
2003
;
25
:
342
—
95
,5
Загон
LG
,
Каплан
G
.
Иммуномодуляция талидомидом и аналогами талидомида
.
Ann Rheum Dis
1999
;
58
(
Дополнение 1
):
I107
—
13
.6
Григг
AP
,
Sasadeusz
J
.
Реактивация гепатита В после талидомида
.
Intern Med J
2008
;
38
:
301
—
2
,7
Фаулер
R
,
Имри
К
.
Гепатит, связанный с талидомидом: история болезни
.
Am J Hematol
2001
;
66
:
300
—
2
,8
Торрес
HA
,
Давила
М
.
Реактивация вируса гепатита В и вируса гепатита С у онкологических больных
.
Нат Рев Клин Онкол
2012
;
9
:
156
—
66
.9
Генри
SD
,
Metselaar
HJ
,
Van Dijck
J
et al. .
Влияние стероидов на репликацию вируса гепатита С in vivo и in vitro
.
Ann N Y Acad Sci
2007
;
1110
:
439
—
47
.10
Ранс
E
,
Таннер
JE
,
Альфиери
C
.
Ингибирование киназы IkappaB талидомидом увеличивает репликацию РНК вируса гепатита С
.
J Viral Hepat
2012
;
19
:
e73
—
80
.11
Торрес
HA
,
Chong
PP
,
De Lima
M
et al. .
Инфекция вирусом гепатита С среди доноров и реципиентов трансплантата гемопоэтических клеток: рекомендации Рабочей группы Американского общества по трансплантации крови и костного мозга
.
Пересадка костного мозга Biol
2015
;
21
:
1870
—
82
.12
Kyvernitakis
А
,
Mahale
P
,
Popat
UR
et al. .
Инфекция вирусом гепатита С у пациентов, перенесших трансплантацию гемопоэтических клеток в эпоху противовирусных препаратов прямого действия
.
Пересадка костного мозга Biol
2015
; .13
Махале
-П
,
Kyvernitakis
A
,
Kantarjian
H
et al. .
Одновременное применение химиотерапии и противовирусных препаратов у онкологических больных, инфицированных вирусом гепатита С
.
Гепатология
2015
;
62
:
114A
:.
Заметки автора
© Автор 2015.Опубликовано Oxford University Press от имени Американского общества инфекционистов.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivs (http://creativecommons.org/licenses/by-nc-nd/4.0/), которая разрешает некоммерческое воспроизведение и распространение. работы на любом носителе при условии, что оригинальная работа не была изменена или преобразована каким-либо образом, и что произведение правильно процитировано. По вопросам коммерческого повторного использования обращайтесь в журналы[email protected].
Есть ли общая иммунологическая связь?
Инфекции, вызванные вирусом гепатита С (ВГС), могут оказать важное влияние на состояние здоровья полости рта пациентов, способствуя таким заболеваниям, как пародонтоз и рак полости рта. Был проведен обзор существующей научной литературы, написанной на английском языке, с целью выявления оральных и пародонтальных проявлений инфекции ВГС и ее влияния на жидкости полости рта. Инфекция ВГС может определять прямые внепеченочные проявления на уровне полости рта и пародонта, включая красный плоский лишай полости рта, сиаладенит, подобный Шегрену, и рак полости рта.Изменения, вызванные инфекцией в иммунной системе, диете и образе жизни субъектов, могут способствовать развитию заболеваний полости рта, таких как заболевания пародонта. Важные изменения происходят также в составе слюны и десневой жидкости инфицированных пациентов. Пациенты, инфицированные ВГС, нуждаются в тщательном наблюдении с точки зрения здоровья полости рта, поскольку заражение вирусом может привести к оральным осложнениям. Клеточные и молекулярные особенности десневой жидкости пациентов, инфицированных ВГС, могут дать ответ на некоторые вопросы, касающиеся ее влияния на поражение пародонта, и относится ли это к возможной двунаправленной взаимосвязи с корректировкой биомаркеров печени, вызванной воспалительным статусом пациентов с пародонтом.
1. Введение
Несмотря на значительные усилия, предпринятые в последние годы для повышения осведомленности о возможностях передачи и лечения, вирус гепатита С (ВГС) остается важной проблемой глобального здравоохранения. Нелеченная вирусная инфекция приводит к хроническому воспалению печени. Хронический гепатит имеет такие осложнения, как цирроз печени и гепатоцеллюлярная карцинома, которые являются фатальными для пациента [1, 2]. Более того, патологические события, которые вызывает инфекция ВГС, распространяются за пределы печени, ряд внепеченочных проявлений, включая криоглобулинемию, злокачественную лимфому, синдром Шегрена или красный плоский лишай полости рта, уже обсуждался в литературе [3–7].
Текущие данные ВОЗ (Всемирная организация здравоохранения) показывают, что в 2015 году более 70 миллионов человек были инфицированы ВГС, что привело к глобальной распространенности около 1%. Инфекция ВГС поражает все регионы мира с существенными различиями между странами. По данным ВОЗ, самая высокая распространенность инфекции ВГС отмечена в регионах Восточного Средиземноморья и Европы. По оценкам, в 2015 году во всем мире произошло 1,75 миллиона новых случаев инфицирования ВГС [8]. Инфекцию трудно диагностировать на ранних стадиях, поскольку она не проявляет явных клинических признаков и может быть точно определена только с помощью серологического теста.Этот аспект можно улучшить с помощью более тщательного анализа внепеченочных проявлений, которые выражаются почти у 75% инфицированных пациентов [9]. Считается, что вирус может находиться во внепеченочных тканях, что делает его более подверженным передаче и труднее лечить [10]. Следовательно, развитие осложнений вирусной инфекции, таких как гепатоцеллюлярная карцинома, может иметь критическое влияние на иммунную систему пациента [11], что еще больше затрудняет борьбу с защитными физиологическими механизмами.
Влияние инфекции ВГС на здоровье полости рта с течением времени получило разные мнения, варьирующиеся от клинических данных до метаанализа и более широкого подхода к этому вопросу [12]. Ухудшение здоровья полости рта у инфицированных пациентов может быть результатом нарушения функции печени, поврежденной иммунной системы или низкого желания инфицированных пациентов обращаться за стоматологической помощью [13, 14]. В нескольких исследованиях рассматривается значение инфекции ВГС для ротовой полости, подчеркиваются как стоматологические патологические изменения, так и другие внепеченочные проявления (EHM) с оральными последствиями [15], в то время как другие показывают влияние гепатита A, B и C на жидкости полости рта , выявление возможного носительства вирусов гепатита в цельной слюне и десневой жидкости [16].Более свежий обзор Han et al. указывает на синергию между заболеваниями пародонта и печени, помимо вирусного гепатита, указывая на возможное совместное воздействие, которое может оказывать воспаление пародонта и печени [17]. В данной обзорной статье основное внимание уделяется двунаправленной взаимосвязи воспаления пародонта и инфекции ВГС с точки зрения клинических проявлений, молекулярной экспрессии биомаркеров в жидкостях полости рта и ее значению для практикующих врачей, как пародонтологов, так и гепатологов, с последующим интересом к вопросу о наличии воспаления пародонта может повысить риск передачи вируса гепатита С через жидкости полости рта, особенно через десневую щель (GCF).
2. Инфекция ВГС: влияние на здоровье полости рта и состояние пародонта
2.1. Инфекция ВГС и статус пародонта
Coates et al. изучили проблемы со здоровьем полости рта у лиц, инфицированных ВГС, в исследовании 87 пациентов в возрасте от 35 до 44 лет [13]. Патологические изменения зубов, выраженные с помощью индекса DMFT (Decayed, Missing, Filled Teeth index), были в три раза важнее для пациентов с ВГС, чем для контрольной группы для зубов с кариозными поражениями.У пациентов с ВГС также наблюдалось большее количество отсутствующих зубов, но было меньше зубных пломб, чем в контрольной группе [13].
Состояние пародонта пациентов оценивалось с использованием индекса CPITN (Периодонтальный индекс потребности в лечении в сообществе), регистрирующего повышенное кровоточивость десен у инфицированных пациентов и более глубокие пародонтальные карманы для возрастных групп от 25–34 до 35–44 лет. Несмотря на то, что результаты не были статистически значимыми для ряда субъектов, у инфицированных субъектов отмечалась тенденция к нарушению статуса пародонта.Авторы утверждают, что особенности диеты и другие социальные особенности, такие как отсутствие надлежащего стоматологического и пародонтологического лечения, могут быть причиной этой тенденции [13].
Возможный патологический механизм, который может пролить свет на влияние хронического гепатита С на статус пародонта, может быть связан с инсулинорезистентностью (ИР) и развитием хронического воспалительного процесса в печени.
Инсулинорезистентность — это патологическое состояние, при котором клетки не реагируют нормально на инсулин, что тесно связано с диабетом и ожирением.Заболевания пародонта были связаны с метаболическим синдромом (включая инсулинорезистентность) [18], а также была подтверждена связь между инфекцией ВГС и инсулинорезистентностью [19]. Было высказано предположение, что, учитывая связь между хроническим воспалением печени и инсулинорезистентностью [19], воспалительная реакция пародонта могла быть изменена у пациентов с ВГС с фиброзом печени и ожирением [20]. Серфати и др. предположили, что в обострение ИР при хроническом ВГС вовлечены несколько механизмов, среди которых метаболический синдром и хронические воспалительные процессы.Эти патологические пути повышают продукцию провоспалительных цитокинов (в основном TNF-альфа, адипонектина и IL-6) [19]. Эти цитокины участвуют либо в запуске и прогрессировании заболевания пародонта, либо во взаимосвязи между заболеванием пародонта и ИР [21].
Печень контролирует многие аспекты физиологии иммунной системы от производства защитных клеток до контроля неспецифической иммунной активности организма, ведущей к хроническому воспалительному состоянию. В результате нарушение функции печени, вызванное хроническим воспалением, сдвигает все защитные способности организма.Такие изменения могут интересовать характеристики нейтрофильных клеток (более низкая адгезия, подвижность и фагоцитарная способность) и активность системы комплемента, которая усиливает защитную реакцию антитело-клетка [22]. Сотрудничество между нейтрофильными клетками и системой комплемента чрезвычайно важно для нормальной активности защитных механизмов против патогенных бактерий пародонта [23].
Заболевание пародонта возникает, когда экологический баланс полости рта нарушается и пародонтальные бактериальные патогены начинают вызывать воспалительную реакцию.В дальнейшем воспаление переходит в хроническую форму и вызывает растворение тканей пародонта. На патологический механизм заболевания может влиять нарушение иммунной системы пациента. Это не только вызывает изменение видов бактерий в полости рта, но также вызывает неадекватную воспалительную реакцию [24]. Это может относиться к пациентам, страдающим лейкемией или раком, или к тем, кто проходит курс химиотерапии, а также к пациентам с нарушением функции печени, вызванным циррозом печени [25].
Сочетание внутренних факторов, таких как резистентность к инсулину, иммунологическая дисфункция, хронический воспалительный статус, и внешних факторов, включая отсутствие надлежащего ухода за зубами, может привести к тому, что пациенты, инфицированные ВГС, столкнутся с риском развития заболеваний пародонта. В этом аспекте не только пациенты, инфицированные ВГС, не решаются решать свои стоматологические проблемы, но и их план лечения и возможности также могут быть ограничены из-за нежелания некоторых стоматологов лечить их из-за риска распространения инфекции [26].
2.2. ЭМ с оральными последствиями и заболеваниями пародонта
В то время как стоматологические и пародонтальные проблемы кажутся косвенным следствием вирусной инфекции, другие состояния здоровья полости рта, такие как плоский лишай полости рта, сиаладенит, подобный Шегрену, и плоскоклеточная карцинома полости рта, являются прямым следствием вирусной инфекции. вызванный иммунным дефицитом, вызванным вирусом, что считается внепеченочным проявлением (EHM) инфекции [15, 27, 28]. Однако биологический механизм, посредством которого инфекция ВГС может вызвать оральные внепеченочные проявления, еще полностью не выяснен.
Красный плоский лишай — это кожное заболевание, которое проявляется воспалительными поражениями. Красный плоский лишай также может поражать слизистую оболочку полости рта, особенно внутреннюю выстилку щек, в данном случае это красный плоский лишай (OLP). В отличие от локализации заболевания на коже, где оно часто исчезает самопроизвольно, особые местные условия в полости рта предотвращают это и могут даже вызвать поражение, чтобы развить потенциал злокачественности [29]. Обзоры метаанализов связи между OLP и инфекцией HCV доказали наличие прочной связи между ними [30].Эти результаты имеют важное клиническое значение, поскольку двунаправленная связь между двумя состояниями представляет интерес для пациентов с диагнозом того или иного состояния, чтобы их направили к обоим специалистам. Исследование, проведенное Азизи и Резаи, показало, что если поражение OLP расположено на десне, оно вызывает форму десквамативного гингивита, что отрицательно сказывается на статусе пародонта [31]. Клинически это приводит к ухудшению изучаемых показателей для пациентов с OLP по сравнению с контролем, таких как индекс зубного налета, индекс десны, глубина зондирования, кровотечение при зондировании и потеря прикрепления [31].Негативное влияние поражений OLP на статус пародонта также подтверждается исследованием Lopez-Jornet и Camacho-Alonso, которое выявило повышенные средние значения CPITN для пациентов с OLP по сравнению со здоровой контрольной группой [32].
Синдром Шегрена — хроническое аутоиммунное заболевание, поражающее секреторные железы тела, такие как слезные и слюнные железы. Нарушение функции этих желез приводит к сухости глаз и рта, что отрицательно сказывается на качестве жизни пациента.Поскольку приток слюны в рот уменьшается или даже отсутствует на более поздних стадиях заболевания, вся ротовая полость подвержена различным патологическим явлениям, как описано Фоксом [33]. Зубы больше не защищены от бактерий компонентами слюны, и зубной налет больше не удаляется потоком слюны. Это вызывает прогрессирование кариеса зубов и сдвиг слизистой оболочки полости рта, которая становится более хрупкой и уязвимой для травм и инфекций. Поскольку слюнные железы пытаются компенсировать недостаток выработки слюны, они увеличиваются в размерах и искажают внешний вид пациента.Несмотря на то, что патологические пути синдрома Шегрена не полностью описаны, возможная аутоиммунная природа заболевания может быть тесно связана с вирусной инфекцией. Несмотря на негативное влияние пониженного слюноотделения на полость рта, прямая связь между синдромом Шегрена и пародонтозом пока не доказана. Исследование Kuru et al. не обнаружили существенных различий между состоянием пародонта таких пациентов и здоровых людей с точки зрения клинических и бактериальных элементов, таких как микробиологический анализ образца зубного налета и характеристик поражений пародонта [34].Другое исследование Boutsi et al. указали, что у пациентов с синдромом Шегрена без других сопутствующих заболеваний состояние пародонта существенно не отличалось, и они демонстрировали даже лучшую гигиену полости рта, чем контрольные субъекты [35].
Плоскоклеточная карцинома полости рта, наиболее частый тип рака полости рта, является еще одним внепеченочным проявлением инфекции ВГС. Наряду с поведенческими элементами, такими как употребление табака и алкоголя, вирусная инфекция считается важным фактором риска развития рака полости рта, который часто возникает из-за предраковых или потенциальных злокачественных поражений слизистой оболочки полости рта, таких как лейкоплазия, эритроплазия и красный плоский лишай.Тем не менее, у пациентов, инфицированных ВГС, сообщалось о развитии рака полости рта даже при отсутствии таких предраковых поражений [36]. Систематический обзор Джаведа и Варнакуласурия предполагает, что заболевания пародонта могут повышать риск рака полости рта [37]. Но даже при небольшом увеличении важность еще более возрастает, если во внимание принимаются другие взаимные факторы риска для обоих состояний, такие как потребление табака и алкоголя. Кроме того, результаты исследования Narayan et al.показали, что плоскоклеточный рак полости рта и состояние пародонта прямо пропорциональны как в клиническом, так и в микробиологическом аспектах [38]. Однако необходимы дальнейшие исследования, изучающие статус пародонта у пациентов с ВГС с оральными ЭГ, поскольку сложность этого предмета требует тщательного анализа различными медицинскими специалистами.
3. Передача инфекции ВГС: пародонтоз и жидкости полости рта
3.1. Слюна
Инфекция ВГС происходит при контакте с вирусными молекулами РНК инфицированных пациентов.Эти молекулы переносятся кровью пациента и могут быть обнаружены либо внутри продуктов крови (например, при переливании крови от непроверенных доноров), либо на различных объектах после контакта с инфицированной кровью (например, иглы шприцев), которые используются разными людьми вместе (как в случае наркозависимых). С распространением вируса бороться еще труднее, поскольку он также может передаваться через незащищенные половые контакты, когда один из партнеров инфицирован, но не знает об этом факте, поскольку болезнь не проявляет клинической активности на первых стадиях.Вирус также может передаваться через плохо стерилизованные иглы, используемые для татуажа и пирсинга [8].
Вирус обладает сильным лимфотропизмом и может быть обнаружен внутри мононуклеарных клеток крови. Следовательно, его можно проследить в жидкостях, содержащих такие клетки, например в слюне [39–43]. Кроме того, несмотря на основной парентеральный путь передачи, инфекция ВГС также регистрировалась у пациентов, которые не подвергались воздействию игл, переливаний крови или инфицированных партнеров, что может свидетельствовать о существовании возможных альтернативных векторов передачи [44].Таким образом, в некоторых исследованиях проверялась возможность присутствия молекул инфекционной вирусной РНК в других жидкостях организма, кроме крови [16, 45], при этом преобладание таких молекул в слюне оказалось непостоянным [46, 47].
Caldeira et al. провели исследование, в котором они зарегистрировали 36,8% положительных образцов слюны на РНК ВГС в отсутствие серологических антител к ВГС и 23,5% положительных образцов слюны на РНК ВГС вместе с существующими серологическими антителами против ВГС, все образцы взяты от инфицированных пациентов [48].Тем не менее, из-за того, что HCV требует, чтобы клетка-хозяин реплицировалась внутри (нацеленная как на гепатоциты, так и на клетки периферической крови), скорость идентификации вирусной РНК в слюне варьировалась в значительной степени, так как вариабельность присутствия вирусных молекул в периферических клетках крови. клетки крови, обнаруженные в слюне, могут иметь важное значение для результатов обнаружения [49–53]. Процесс репликации вирусной РНК требует создания промежуточной РНК с отрицательной цепью. В то время как некоторые исследования не обнаружили трансов такой РНК с отрицательной цепью в образцах слюны [54], этот тип РНК был обнаружен в образцах ткани слюнных желез инфицированных пациентов, также страдающих сиаладенитом [55].
Биологические механизмы, которые позволяют вирусу существовать в слюне, пока неясны. Несмотря на то, что вирус в основном считается гепатотропным, есть научные результаты, предполагающие, что его репликация также может происходить внутри периферических мононуклеарных клеток крови, обнаруженных в подчелюстных слюнных железах. Этот факт подтверждается участием вируса в развитии таких состояний, как сиаладенит и синдром Шегрена [56]. Arrieta et al. провели исследование in situ эпителиальных клеток слюнных желез, происходящих от пациентов, инфицированных ВГС и страдающих сиаладенитом или синдромом Шегрена.Результаты исследования показали, что распространенность HCV-инфицированных клеток в слюне составляет от 25% до 48,8% [55].
Вероятность того, что слюна является переносчиком инфекций ВГС, также обсуждалась в нескольких тематических исследованиях, касающихся как клинических отчетов пациентов, которые ранее были укушены инфицированными ВГС, так и экспериментальных исследований [57, 58]. Однако исследования с использованием метода полимеразной цепной реакции (ПЦР) и попытки обнаружить копии вирусной РНК в образцах слюны не доказали инфекционный потенциал этих вирусных копий, поскольку распространенность вирусной РНК сильно различается [59, 60].
Противоречивые результаты исследований, направленных на обнаружение вирусной РНК в слюне инфицированных ВГС пациентов, можно объяснить происхождением вируса как десневой щелевой жидкости, точнее, мононуклеарных клеток крови, обнаруженных в этой жидкости. Следовательно, статус пародонта можно рассматривать как фактор, способствующий присутствию ВГС в слюне [61]. В то время как уровни аспартаттрансаминазы (AST) в слюне были зарегистрированы значительно более высокими уровнями в образцах от пациентов с хроническим заболеванием пародонта, а значения AST коррелируют со степенью повреждения тканей пародонта [62], молекулы вирусной РНК были обнаружены в образцах слюны HCV. пациенты независимо от состояния пародонта [63].
3.2. Гингивальная Crevicular Fluid
Также изучалась способность антигенов и антител HCV присутствовать в GCF. GCF — это особая жидкость для полости рта, поскольку, несмотря на то, что он происходит из внутренней среды (из сыворотки), он секретируется во внешнем пространстве тела (десневой борозде) и дальше в открытую полость рта. Таким образом, его особенности в составе (маркеры воспаления) и поведении (увеличение кровотока во время воспаления) делают GCF достойным исследованием предмета изучения двунаправленных связей между заболеваниями пародонта и инфекцией ВГС.Жидкость содержит компоненты бактериального налета, воспалительные клетки иммунной системы, следы соединительной ткани и другие сывороточные факторы [64].
Вирусная РНК и антитела против HCV были обнаружены в образцах GCF, собранных у пациентов, инфицированных HCV [65–67]. Вирусные молекулы способны переходить в слюну, что делает GCF источником заражения слюны пациентов, инфицированных HCV.
Воспаление пародонта в форме гингивита или пародонтита вызывает усиление оттока десневой десневой жидкости и более частое кровотечение из десен.В результате вирус может легче мигрировать из кровотока в жидкость десневой щели и дальше в слюну, поскольку он переносится периферическими мононуклеарными клетками крови [68]. Одно исследование показало, что распространенность РНК HCV в GCF пациентов, инфицированных HCV, составляет 59% [67]. Результаты другого исследования показали, что уровень распространенности антител к HCV в десневой жидкости инфицированных пациентов составляет 83,72% после использования теста быстрого обнаружения [69]. Судзуки и др. показали, что более высокие концентрации РНК HCV были обнаружены в GCF, а не в слюне у 77% инфицированных пациентов, включенных в исследование, в то время как в 78% случаев вирусный генетический материал был обнаружен в GCF, даже если он отсутствовал. в слюне инфицированных больных [68].Теория о том, что источником РНК и антител ВГС в полости рта на самом деле является жидкость десневой щели, также подтверждается исследованиями Монтебуноли и Дольчи [65]. Тем не менее, эффективность передачи вируса через пероральные жидкости может зависеть от вирусной нагрузки, а это означает, что необходимы дальнейшие количественные исследования для оценки потенциального риска непарентеральных путей заражения ВГС.
Судя по текущим научным данным, лучший ответ на вопрос о присутствии молекул РНК HCV в десневой жидкости относится к инфицированным лейкоцитам [70], которые содержат штаммы вирусов и переносятся из кровотока в десневую жидкость. в основном в случае воспаления десен.Таким образом, предмет все еще требует дальнейших исследований, которые должны сосредоточиться на особенностях компонентов, как клеточных, так и молекулярных, десневой жидкости пациентов, инфицированных ВГС.
3.3. Последствия присутствия вирусной РНК в жидкостях ротовой полости
На обнаружение молекул РНК вируса гепатита C в жидкостях человеческого тела, кроме крови, влияют методы отбора проб и анализа. Тестирование образцов слюны на антигены или антитела выявило аналогичную или даже более высокую специфичность по сравнению с тестированием сыворотки, как предполагают исследования, оценивающие эффективность стандартных инструментов диагностики инфекции ВГС и более поздних, таких как наборы для перорального обнаружения РНК ВГС для слюны, в то время как также предлагает способы улучшения этого менее инвазивного метода [66, 71].Наиболее частые методы исследования включают использование теста ELISA (иммуноферментный анализ) для обнаружения антител к HCV в сыворотке [72]. Напротив, слюну легче отбирать, что может облегчить и улучшить скрининг возможных инфицированных пациентов, тем самым оказав влияние на клинические, экономические и эпидемиологические факторы, влияющие на проблему инфекции ВГС [71]. Однако, даже если с точки зрения специфичности две жидкости сопоставимы, с точки зрения чувствительности, тесты, используемые на сыворотке крови, являются более подходящими, поскольку в слюне концентрация антител ниже.Этот спад может быть улучшен путем корректировки протокола, например увеличения количества образцов, уменьшения разведения и увеличения времени инкубации [66]. Де Кок и др. показали, что модифицированный метод ELISA может быть использован в качестве инструмента для проведения эпидемиологических исследований для обнаружения антител против HCV в жидкостях полости рта, поскольку он демонстрирует удовлетворительную степень специфичности [73].
Существуют исследования [74, 75], в которых утверждается, что чувствительность 80–87% и специфичность 100% для обнаружения антител к HCV в пероральных жидкостях по сравнению со 100% для сыворотки крови.Хотя нет значительной корреляции между вирусной нагрузкой и уровнями ВГС в слюне, пациенты с низким уровнем ВГС в сыворотке указали на незначительную концентрацию вирусной РНК в слюне. Тем не менее, Hermida et al. выявили значительную корреляцию между сывороточной виремией и концентрацией вирусной РНК в слюне [76]. Это может иметь важное значение для лиц, осуществляющих уход, предполагая необходимость дальнейших эпидемиологических исследований [65]. Однако эти данные все еще противоречивы, поскольку некоторые авторы обнаружили, что присутствие вирусной РНК в слюне не зависит от сывороточной вирусемии или наличия других состояний полости рта [77].
Участие ВГС как такового в дисфункции слюнной железы все еще остается под вопросом [78, 79], но связь инфекции гепатита С с синдромом Шегрена признана причиной гипофункции слюны, а снижение скорости слюноотделения потенциально является причиной большинство стоматологических и оральных заболеваний у пациентов, инфицированных ВГС, а также инсулинорезистентность, которая проявляется у этих пациентов, что приводит к их склонности к развитию пародонтоза. Ведение пациентов, инфицированных ВГС, представляет собой серьезную проблему из-за патологических особенностей, которые имеют эти пациенты, а также из-за влияния инфекции на планирование лечения и прогноз.
4. Заболевания пародонта: влияние на инфекцию ВГС
Функцию печени в основном оценивают с помощью серологического тестирования двух ферментов — аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ), уровни которых повышаются при печеночной недостаточности и воспалении. Уровни AST слюны были зарегистрированы значительно более высокими уровнями в образцах от пациентов с хроническими заболеваниями пародонта, как показано в исследовании Kudva et al., И, более того, значения AST слюны коррелируют со степенью повреждения тканей пародонта [62].
GCF представляет собой серозный транссудат или воспалительный экссудат, в зависимости от состояния тканей пародонта, и его можно легко получить из десневой борозды, окружающей каждый зуб. Различные компоненты GCF, такие как цитокины и металлопротеиназы (MMP), такие как IL-1, IL-6, IL-12, TNF-alpha, VEGF и MMP9, могут рассматриваться как маркеры воспаления пародонта, их идентификация в GCF используется. для изучения общих путей между заболеваниями пародонта и другими состояниями, такими как диабет 1 и 2 типа, болезни сердца и ревматоидный артрит [80–82], поскольку присутствие некоторых из этих биомаркеров было обнаружено в сыворотке и эпителии десен пародонта. -поврежденные пациенты с некоторыми сопутствующими заболеваниями [82–85].
Научные данные подтверждают необходимость исследований по оценке различных провоспалительных компонентов GCF у пациентов с инфекцией HCV или с инфекцией HCV и заболеваниями пародонта. Однако есть исследования, в которых обнаруживается высокий уровень некоторых из этих маркеров, таких как интерлейкины IL-1, IL-6 и интерферон IFN-гамма, в сыворотке пациентов, инфицированных HCV, а также в сыворотке и GCF пациентов с пародонтальной инфекцией [86 –88]. Необходимы дальнейшие исследования, чтобы оценить связь между другими воспалительными маркерами, обнаруженными в десневой жидкости, и инфекцией ВГС [20] и, таким образом, выяснить, будет ли у пациентов, инфицированных ВГС, более высокий риск развития травмы пародонта или у пациентов с пародонтальным нарушением Гепатит типа C может иметь более высокую экспрессию других биомаркеров, специфичных для печени, наряду с некоторыми представлениями о лежащем в основе механизме.
Было показано, что уровни AST в GCF у пациентов с заболеваниями пародонта повышены и коррелируют с активностью заболеваний пародонта [89, 90], что указывает на тенденцию к снижению после лечения пародонта и связанное с этим улучшение клинических параметров [91]. Более того, у пациентов с неалкогольной жировой болезнью печени (НАЖБП) наблюдается значительное улучшение биомаркеров печени (выраженное в виде активности АЛТ и АСТ) после эффективной пародонтальной терапии. Таким образом, воспаление пародонта определяется по Р . gingivalis у пациентов с НАЖБП может быть фактором риска обострения НАЖБП, и пародонтальное лечение может быть полезным при ведении пациентов с НАЖБП [92]. Механизмы, которые считаются ответственными за участие пародонтита в различных заболеваниях печени, были связаны с бактериальными агентами, провоспалительными медиаторами и окислительным стрессом. Вместе с цитокинами и хемокинами другие молекулы, такие как белки теплового шока (HSP), могут вырабатываться в результате агрессии пародонтальных бактерий и, следовательно, вызывать воспаление печени [17].Вместе с патологическим механизмом, предложенным в разделе 2.1 этой обзорной статьи (вовлечение ИР), исследование TNF-альфа и других провоспалительных цитокинов могло бы дать исчерпывающее объяснение возможной связи хронической инфекции гепатита С и заболеваний пародонта. Как в пародонтологии, так и в гепатологии необходимо всестороннее понимание двунаправленного патологического механизма, который объединяет эти два состояния, чтобы обеспечить правильные протоколы диагностики и лечения.
5. Заключение
Инфекция ВГС различными способами вызывает ухудшение состояния полости рта инфицированных пациентов. Считается ли, что некоторые авторы связаны с внепеченочными проявлениями инфекции, или вызваны системными последствиями (нарушение работы иммунной системы), или вызваны поведением пациентов (плохая гигиена полости рта и диета), нарушение пародонта у пациентов, инфицированных ВГС. объясняет серьезное снижение качества жизни и благосостояния. Более того, молекулы вирусной РНК и антитела были обнаружены в слюне и десневой жидкости пациентов, что вызывает дополнительные вопросы о передаче и обнаружении заболевания.
Изучение общей иммунологической связи между вирусным гепатитом типа C и здоровьем пародонта может быть предметом дальнейших исследований, не только в том, что касается клинических параметров, но также путем идентификации конкретных маркеров в GCF, изучения слияния патологических механизмов , возможно, связанное с ИР и хроническим воспалительным процессом. Это может привести к лучшему пониманию того, являются ли эти отношения двунаправленными и неявно ли связаны с лежащими в основе механизмами, которые вызывают прогрессирование их патологий.Эта двунаправленная связь между заболеваниями пародонта и инфекцией ВГС имеет далеко идущие последствия как для пациентов, так и для практикующих врачей, будь то пародонтологи или гепатологи.
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов.
Обострение гепатита С, вызванное субклиническим гипоадренализмом интерфероном-альфа2бета: отчет о клиническом случае | Cases Journal
Доказано, что гепатит С связан со многими аутоиммунными эндокринопатиями, особенно с щитовидной железой, а также с гипоталамусом, гипофизом и почечными органами [2, 3].Это первый случай исследования проблемы субклинического ИИ и влияния на нее лечения интерфероном. При наличии положительного АСА было весьма вероятно, что ИИ является результатом инфекции ВГС и его иммуномодулирующего действия на ткань надпочечников, поскольку большинство альтернативных причин не очевидны.
Интересно, что у пациента был обнаружен субклинический ИИ, диагноз которого подтверждался неспособностью стимулировать адекватное повышение кортизола после 60 минут стимуляции косинтропином, хотя исходные уровни были удовлетворительными на всем протяжении.У здоровых субъектов должно наблюдаться абсолютное увеличение на 300 нмоль / л или более на 60-минутном образце [4]. Было предложено другое определение не отвечающих на лечение — увеличение менее чем на 20% по сравнению с исходным значением [5], непосредственно относящееся к этому пациенту. Кроме того, повышенные уровни АКТГ и ренина и пониженное соотношение альдостерон / ренин окончательно указывают на недостаточность коры надпочечников. Были описаны различные стадии прогрессирующей надпочечниковой недостаточности, но этот случай явно не вписывается ни в одну из предписанных категорий [6].Согласно этому предложению, наша пациентка принадлежит к категории «Симптоматическое состояние при стрессе» , в которой она соответствовала всем критериям, за исключением того, что ее исходный уровень кортизола был нормальным, а не более 83 нмоль / л.
Во время терапии ИФН и рибавирином наблюдалось устойчивое и постепенное снижение исходных уровней кортизола в слюне и сыворотке до введения АСТ. Уровни АКТГ в сыворотке крови немного повысились на протяжении всего курса лечения и вернулись к уровню до лечения после. Отсутствие повышения уровня кортизола через 60 минут наблюдается как в слюне, так и в сыворотке крови на протяжении 48 недель лечения.Во время терапии также наблюдалось значительное снижение уровня кортизола (дополнительный файл 1). Через 12 месяцев после окончания терапии IFN исходные уровни кортизола вернулись к уровням до лечения.
Продольный 24-часовой профиль кортизола в слюне на протяжении всего курса лечения является полезным и показательным. Нормальный физиологический суточный график был утрачен с удалением второго пика кортизола в конце дня. Хотя первый утренний пик сохранился, он был значительно ослаблен до среднего значения 6.2 нмоль / л с последующим постепенным снижением до неопределяемого надира в полночь. Эффект и влияние IFN на 24-часовой профиль слюны также соответствовали тому, что наблюдали в сыворотке. Наблюдалась явная разница в концентрациях кортизола в слюне во время терапии по сравнению с уровнями до и после. После завершения терапии функция надпочечников восстановилась и вернулась к уровню до лечения, то есть к субклиническому гипоадренализму, при котором второй дневной пик кортизола был потерян (дополнительный файл 1, рисунок 1).В этом случае уровни кортизола в слюне, по-видимому, являются дополнительным полезным инструментом для оценки оси HPA. В AST он удовлетворительно сравнивается с сывороточным кортизолом при обнаружении AI. Хотя ИИ лучше всего оценивается по динамике кортизола в сыворотке крови, этот отчет убедительно свидетельствует о том, что динамика концентрации в слюне является надежным и надежным инструментом в диагностике ИИ. Это дополнительно удобно для пациентов, особенно в амбулаторных условиях. Однако этот анализ не является широко доступным и широко доступным.Отсутствие суточных колебаний концентрации слюны также требует подтверждения, но это также указывает на AI. Наша частота тестирования могла не выявить второй дневной пик, который может произойти где-то между 15:00 и 18:00 часами. Частые отборы проб могут быть более показательными, но с риском несоблюдения. Абсолютная концентрация кортизола в утренней слюне менее 3,8 нмоль / л является хорошим индикатором (надвигающейся) надпочечниковой недостаточности [7, 8]. Этот уровень неуклонно снижался после терапии IFN, указывая на продолжающееся снижение резерва надпочечников, где он максимально стимулируется АКТГ, на что указывает неспособность АКТГ повышаться дальше с прогрессирующим гипоадренализмом.
Рисунок 1
Круглосуточные профили кортизола в слюне до, во время и после Пациент прошел комбинированную терапию интерфероном-α2β и рибавирином. Существует значительная разница между группами, получавшими IFN, и группами, не получавшими IFN.
Титры ACA достигли пика на 48 -й неделе. После этого он вернулся к титру до лечения, параллельно профилям кортизола.
Патогенез заболевания надпочечников, ассоциированного с ВГС, остается неизвестным, и молекулярная основа этого заболевания не определена.Нормальная компьютерная томография исключила анатомические причины, такие как кровотечение, диссеминированная карцинома или, в редких случаях, антифосфолипидный синдром [9]. Считается, что при аутоиммунном заболевании надпочечников на клетках коры надпочечников должен присутствовать антиген, чтобы стимулировать иммунный ответ. Этот ответ включает как Т-, так и В-клетки, хотя основной детерминант находится в первых. Иммунная система часто стимулируется инфекцией HCV, которая дополнительно усиливается терапией IFN. Это отражается в положительном, но низком титре АСА на исходном уровне, достигающем пика в надире функции надпочечников.Это наблюдение согласуется с предыдущим сообщением [10], хотя наш случай дополнительно детализирует влияние повышения титра АСА на метаболизм кортизола. Возможно, что IFN напрямую подавляет синтетическую функцию клеток надпочечников, а колеблющаяся динамика кортизола до и во время лечения представляет собой баланс между ингибирующим эффектом IFN и трофическим эффектом ACTH. Альтернативно, IFN может действовать, стимулируя Т-клетки к разрушению большего количества клеток коры надпочечников. Уровень АКТГ был почти на пике перед лечением и, следовательно, не смог адекватно подняться, чтобы противостоять адреналитическому эффекту IFN.В другом отчете о клиническом случае предполагалось увеличение потребления кортизола при собственно ИИ [11]. Кроме того, неизвестна естественная история адреналита, включая его обратимость, влияние терапии IFN и реакцию на добавку глюкокортикоидов. Обратимый аутоиммунный адреналит, леченный высокими дозами глюкокортикоидов, связанный с болезнью Грейвса, был описан ранее, но он явно отличался от нашего случая [12]. Титры ACA параллельны динамике уровней кортизола, достигая пика в надире функции надпочечников, хотя абсолютный титр невелик.Тем не менее, это наблюдение дает убедительные доказательства иммунопатогенеза этого состояния.
Хотя сущность субклинического ИИ была хорошо описана [13], управление ею остается спорным. В аутоиммунной ситуации de novo ее развитие зависит от ряда факторов, таких как титры АСА, степень недостаточности надпочечников, возраст и пол пациента [14, 15]. При наличии инфекции гепатита С прогресс неизвестен, хотя можно предположить, что риск выше из-за наличия антител к АСА и последующей терапии интерфероном.Спорный вопрос об истинном «субклиническом» состоянии этого состояния при наличии витилиго. Однако у пациента не было других симптомов, связанных с надпочечниками, хотя, по общему признанию, при лечении ВГС и ИФН клинические симптомы надпочечниковой недостаточности может быть очень трудно выявить.
Заманчиво было лечить этого пациента заместительной терапией гидрокортизоном, учитывая биохимические результаты и трудности в разделении симптомов надпочечниковой недостаточности и побочных эффектов, связанных с лечением.Последнее очень затрудняло определение активного компонента симптоматики из-за недостаточности надпочечников. Сообщалось, что лечение супрафизиологическими кортикостероидами полностью изменило состояние при аналогичном клиническом сценарии, но при отсутствии инфекции ВГС [12].

