Что нужно знать о правилах гигиены детей до года
Кожа ребенка отличается по своей структуре от кожи взрослого, она является первой линией защиты ребенка от вредных воздействий. В связи с этим любое повреждение кожи может быть опасным для малыша, важно обеспечить правильный уход за кожей младенца1.
Купание младенца
Рекомендации по купанию младенца включают в себя следующие положения2:
- Ванна должна находиться в безопасном месте
- Ребенка можно купать до отпадения пуповинного остатка — это не причиняет вреда здоровому ребенку
- Ванна и игрушки для купания должны быть чистыми
- Мочалка может быть использована только для обливания кожи для поддержания тепла
- Температура воды для купания должна составлять 37–37,5 °С
- Ребенка нельзя оставлять одного в ванне
- Температура воздуха в помещении должна составлять 21–24 °С
- Запрещается купание ребенка детьми младшего возраста без присутствия взрослых
- Длительность купания должна составлять 5–10 минут
- Частота купания не менее 2–3 раз в неделю
Увлажнение кожи и профилактика опрелостей у младенца может заключаться в применении смягчающих средств, например, масел2.
Уход за кожей младенца после купания
После купания рекомендуется покрывать ребенка мягкой тканью, не надевая на него одежду сразу. Это предотвращает значительное падение температуры тела ребенка после купания и дает возможность коже малыша контактировать с кожей родителя2.
С целью снижения риска развития пеленочного дерматита необходимо, чтобы область подгузника была сухой и чистой. Чрезмерная влажность увеличивает трение, повышает проницаемость кожи, стимулирует рост микроорганизмов и провоцирует опрелости у новорождённых.
Уход за пупочной ранкой
После рождения ребенка пуповину отсекают, остается так называемый пуповинный остаток. Пуповинный остаток высыхает, мумифицируется и отпадает в 1-ю неделю жизни ребенка, после отпадения пуповинного остатка образуется пупочная ранка, которая требует должного ухода. Необходимо, чтобы пупочная ранка была чистой и сухой3.
Пуповинный остаток высыхает, мумифицируется и отпадает в 1-ю неделю жизни ребенка, после отпадения пуповинного остатка образуется пупочная ранка, которая требует должного ухода. Необходимо, чтобы пупочная ранка была чистой и сухой3.
Различные микроорганизмы могут быть причиной развития инфекционных заболеваний пупочной ранки, или омфалитов4.
В зависимости от проявлений омфалита различают:
- Катаральный омфалит («мокнущий пупок») — характеризуется наличием серозного или серозно-гнойного отделяемого из пупочной ранки и замедлением восстановления эпителия4.
- Гнойный (флегмонозный) омфалит — возникает в результате распространения воспалительного процесса на кожу и подкожную клетчатку около пупка, отделяемое из пупочной ранки гнойного характера4.
- Некротический омфалит — встречается редко, кожа вокруг пупка становится багрово-синюшной4.
В зависимости от типа омфалита, для лечения инфекций пупочной ранки специалист может назначить местную обработку пупочной ранки растворами или порошками, хирургическую обработку ранки, а также системную антибактериальную терапию4.
Для обработки пупочной ранки может применяться антисептик местного действия МестаМидин-Сенс®. Его можно применять в неразбавленном виде у детей всех возрастов5.
Уход при инфекционных заболеваниях кожи
Стрептодермия у детей (их также называют пиодермиями) — гнойные воспалительные заболевания кожи, они могут быть вызваны разнообразными возбудителями (стафилококки, стрептококки, пневмококки, кишечная палочка и др.) В зависимости от возбудителя, проявления пиодермий могут быть разными6. Чтобы правильно определить тип пиодермии и начать лечение, необходимо проконсультироваться со специалистом.
Лечение пиодермии может включать в себя применение антибиотиков, санации гнойных очагов, повышение неспецифической резистентности организма, дезинтоксикацию. Важным является рациональный уход за кожей малыша. Необходимо избегать трения, перегревания, возможна обработка антисептиком6. А чтобы предотвратить мацерацию, можно использовать крем от опрелостей для новорождённых.
Важным является рациональный уход за кожей малыша. Необходимо избегать трения, перегревания, возможна обработка антисептиком6. А чтобы предотвратить мацерацию, можно использовать крем от опрелостей для новорождённых.
Антисептиком, разрешенным для применения у детей любого возраста, может стать МестаМидин-Сенс®5. Как применять его у новорождённых , а также при грудном вскармливании, вы можете узнать в инструкции. Препарат не имеет возрастных ограничений. Перед использованием проконсультируйтесь с врачом.
Список литературы:
1. Кешишян Е. С., Сахарова Е. C., Афанасьева Н. В. Консультирование по уходу за кожей детей первых лет жизни //Медицинский совет. – 2018. – №. 17.
2. Захарова И. Н., Касьянова А. Н., Мачнева Е. Б. Уход за кожей детей раннего возраста. Новые инновационные подходы //Медицинский совет. – 2018. – №. 2.
3. Муреева Е. Н. и др. ПРАВИЛА СЕСТРИНСКОГО УХОДА ЗА НОВОРОЖДЕННЫМ. – 2018.
4. Соколова Н. Справочник педиатра. – Litres, 2019.
5. Согласно инструкции по медицинскому применению препарата МестаМидин-Сенс®.
6. Неонатология. Национальное руководство. Под ред. акад. РАМН Володина Н.Н. М: ГЭОТАР-Медиа; 2007.
Не нарушить качество жизни ребенка
В Санкт-Петербурге состоялась IV Общероссийская конференция с международным участием «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству». В рамках секционного заседания заместитель главного врача по родовспоможению и детству ГБУЗ МО «Мытищинская городская клиническая больница», проф. Нина Ивановна Захарова рассказала о принципах ухода за новорожденными.
Неонатология как раздел медицины развивается семимильными шагами, за счет решения проблем на самом раннем этапе развития детей удается улучшить качество их жизни, в целом снизить младенческую смертность, поэтому и ориентироваться стоит на рекомендации именно неонатологов, уверена Нина Захарова. «Я бы поставила ранний неонатальный период на третье место по значимости в формировании системы здоровья жизни человека на протяжении всей его жизни. На первое место – генетический код родителей, на второе – особенности внутриутробного развития. Технологии адаптации ребенка не должны нарушаться, потому что как ребенок адаптируется в раннем неонатальном периоде, так он и пойдет дальше по жизни», – подчеркнула она.
«Я бы поставила ранний неонатальный период на третье место по значимости в формировании системы здоровья жизни человека на протяжении всей его жизни. На первое место – генетический код родителей, на второе – особенности внутриутробного развития. Технологии адаптации ребенка не должны нарушаться, потому что как ребенок адаптируется в раннем неонатальном периоде, так он и пойдет дальше по жизни», – подчеркнула она.
Профессор рассказала об основных принципах ухода за новорожденными с учетом международных рекомендаций и личного опыта.
Необходимо пережимать пуповину не ранее конца первой минуты жизни новорожденного. Таким образом ребенок получает дополнительные защитные иммунобиологические факторы, которые попадают из плаценты во время родовой деятельности.
Не нужно обрабатывать рот и нос новорожденному. Таким образом повреждается очень важный биологический слой слизистой. Естественная защита ребенка должна оставаться такой, какая она есть, а для проведения манипуляции (отсасывание слизи изо рта и носа) нужны медицинские показания.
Необходим как можно более тесный и длительныйконтакт «кожа к коже» мамы и ребенка. Н.И. Захарова отметила, что в ее лечебном учреждении на партнерские роды приглашаются и отцы. В случае если женщина не может взять ребенка сразу после рождения и положить на живот, это может сделать папа. Она добавила, что круглосуточное совместное пребывание мамы и ребенка необходимо на всех этапах. Все манипуляции и процедуры ребенку проводятся в палате в присутствии мамы, она должна на них согласиться, а медперсонал объяснить ей, насколько они важны.
Н.И. Захарова подчеркнула, что хотелось бы, чтобы родовспомогательные учреждения забыли о том, что сыровидную смазку нужно снимать в родильном зале. Сыровидная смазка – это естественная антибактериальная защита, увлажнение, элемент предупреждения трения при прохождении ребенка через родовые пути.
Рекомендуется использовать свободное пеленание или не стесняющую свободу новорожденного одежду (распашонку, шапочку, носочки и др.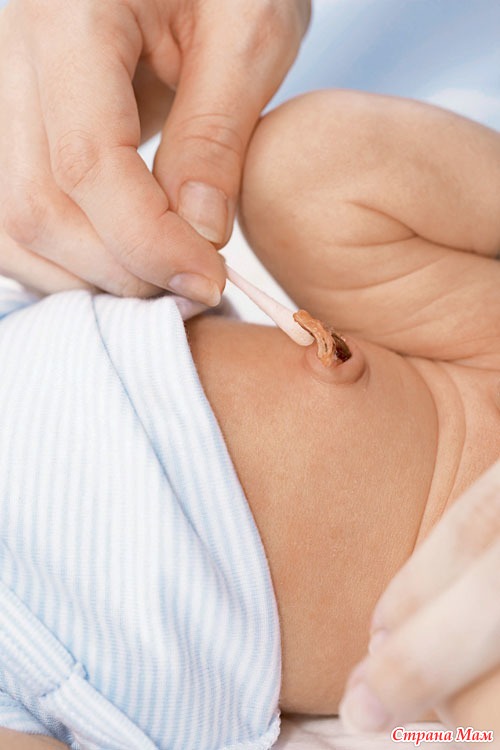 ). Стеснять движения – это нарушать развитие ребенка, его дыхательную функцию.
). Стеснять движения – это нарушать развитие ребенка, его дыхательную функцию.
Н.И. Захарова напомнила также, что отсутствуют данные о необходимости ежедневной обработки глаз, ее эффективности и целесообразности. Несмотря на то, что в СанПин остался вопрос о профилактике гонобленнореи, нужно учитывать микробиом и не нарушать своими действиями эту естественную защитную среду слезы и кожи.
Важна и ранняя выписка из стационара. «Пребывание любого человека в стационаре к третьему дню приводит к колонизации его госпитальной флорой. А нам важно, чтобы ребенок ушел с флорой мамы и папы и не нарушенным госпитальными инфекциями микробиомом», – сказала профессор.
Обработка пуповинного остатка – также остается темой для дискуссий. В отличие от педиатров, которые по-прежнему настаивают на закапывании перекиси водорода или обработке зеленкой, неонатологи рекомендуют после рождения пуповинный остаток ничем не обрабатывать, содержать в чистоте и сухости, он отпадет естественным путем. Этот биологический кусочек связи с мамой не должен подвергаться каким-то профилактическим дезинфицирующим обработкам.
Один из самых сложных вопросов в уходе за новорожденными – что делать при загрязнении пуповинного остатка. В ранних рекомендациях ВОЗ говорилось, что он должен обрабатываться стерильной водой и стерильной салфеткой, но, отметила Захарова, «вся анатомия заживления (мумифицирования) пуповинного остатка и пупочной ранки говорит о том, что при загрязнении пуповинного остатка мы омываем пуповину с мылом, высушиваем обычным полотенцем или пеленкой и оставляем ее открытой, не закрывая подгузником». Подгузники последнего поколения не нужно подворачивать, они оставляют пуповинный остаток сухим. В разработанном Европейской ассоциацией дерматологов стандарте уделяется особое внимание выбору подгузников.
Поскольку желудочно-кишечный тракт – это самый большой резервуар микроорганизмов, то дефекты ухода за кожей новорожденного выражаются прежде всего в опрелостях, пеленочном дерматите. При выборе подгузника важны несколько факторов: наличие слоев, которые предупреждают соприкосновение кожи ребенка с мокрым слоем, имеют высокие впитывающие свойства и пропускают испарения. «Применение подгузников эффективно у детей с проблемной кожей», – отметила Нина Ивановна.
При выборе подгузника важны несколько факторов: наличие слоев, которые предупреждают соприкосновение кожи ребенка с мокрым слоем, имеют высокие впитывающие свойства и пропускают испарения. «Применение подгузников эффективно у детей с проблемной кожей», – отметила Нина Ивановна.
Нельзя обрабатывать пуповинный остаток зеленкой или перекисью, потому что как только мы начинаем в биологически живой пуповинный остаток закапывать какие-то противовоспалительные средства, моментально в нем начинает размножаться, убивая собственный биом, госпитальная флора. То же самое и с пупочной ранкой. Обрабатывать ее не следует. А вот купать ребенка можно и нужно даже при не отпавшем пуповинном остатке и после проведения вакцинации БЦЖ, потому что нигде не написано, что после вакцинации мы должны сделать суточный отвод от водных процедур. Купание проводится обычной проточной водой комфортной температуры. Воду для этих целей не кипятят.
Профессор Захарова подчеркнула, что ребенок не нуждается в ежедневном умывании, вытирании, очищении, потому что все локусы тела содержат свой микробиом, который нарушать нельзя. Нужно проводить обычные гигиенические мероприятия при необходимости и учитывать немаловажный момент, а именно четко следить за отсутствием в косметических средствах потенциально опасных ингредиентов, красителей, внимательно читать надписи на упаковке. Состояние кожи – это показатель здоровья ребенка. И оно требует особого внимания даже у детей доношенных.
«Рекомендации неонатологов по уходу за кожей, питанию должны более широко внедряться в практику педиатров. Я призываю работать вместе и следовать международным рекомендациям, которые не нарушают качество жизни ребенка», – резюмировала Н.И. Захарова.
Источник: Анна Шарафанович, журналист
Блог Farla :: Обработка пупка у новорожденных
У молодых родителей, особенно, если малыш в семье первый, куча вопросов относительно ухода за ребеночком. Пожалуй, больше всего мамочек беспокоит обработка пупочной ранки крохи. Ведь в обычной жизни с необходимостью проводить подобные процедуры мы не сталкиваемся, поэтому опыта в этом вопросе – никакого. Однако пупок новорожденного необходимо тщательно обрабатывать. Важно следить за состоянием пупочной ранки: не мокнет, не кровоточит ли она? Нет ли покраснения и припухлости? Сегодня поговорим обо всём, что касается ухода за пупочной ранкой новорожденного.
Пожалуй, больше всего мамочек беспокоит обработка пупочной ранки крохи. Ведь в обычной жизни с необходимостью проводить подобные процедуры мы не сталкиваемся, поэтому опыта в этом вопросе – никакого. Однако пупок новорожденного необходимо тщательно обрабатывать. Важно следить за состоянием пупочной ранки: не мокнет, не кровоточит ли она? Нет ли покраснения и припухлости? Сегодня поговорим обо всём, что касается ухода за пупочной ранкой новорожденного.
Почему за пупком новорожденного нужно тщательно ухаживать?
Пуповина 9 месяцев соединяла организм малыша с организмом матери. Через нее ребеночку поступало все необходимо для роста и развития: кислород, полезные вещества. И вот, после появления крохи на свет, эта пуповина сначала пережимается, затем перерезается. Естественно, на теле крохи остается ранка – кровоточащее место. Его необходимо обрабатывать как любую другую ранку. Даже еще тщательнее, ведь речь идет о совсем маленьком человечке. У него еще даже не сформирован окончательно иммунитет, чтобы организм мог в полную силу противостоять инфекциям. Нужно следить, чтобы пупочная ранка всегда была сухой и чистой. Тогда вероятность попадания в нее болезнетворных бактерий будет стремиться к нулю.
Обычно уже через 3-4 недели отпадает необходимость дополнительного ухода за пупочной ранкой, она подсыхает и затягивается.
Можно ли купать малыша, пока у него не зажила пупочная ранка?
На этот вопрос специалисты дают самые разные ответы. Большинство врачей рекомендуют до заживления пупочной ранки купать малыша только в кипяченой воде. Некоторые советуют добавлять в воду марганцовку.
Что понадобится для обработки пупочной ранки у новорожденного?
Все необходимое вы, наверняка, уже купили. Средства ухода за пупочной ранкой есть в любом наборе аптечки для мамы и малыша:
- перекись водорода;
- зеленка или перманганат калия;
- ватные палочки;
- пипетка (если горлышко у флакона с перекисью водорода не имеет наконечника, через который удобно капать жидкость).

Процесс обработки
Обрабатывают пупок один раз в день, обычно после вечернего купания. Последовательность действий следующая:
- Малыша насухо вытирают, укладывают на пеленальный столик.
- Берем чистую и сухую ватную палочку, промакиваем ей пупочную ранку, чтобы там не осталось воды.
- Слегка раздвигая кожу живота вокруг пупочной ранки, капаем прямо на ранку 1-2 капли перекиси водорода. Это вещество при попадании на кровоточащие участки не щиплет кожу малыша. Не нужно волноваться: крохе не больно. Перекись шипит и пузырится. Так и должно быть, значит, препарат действует.
- Когда перекись перестанет шипеть, снова промакиваем пупочную ранку ватной палочкой. Если внутри есть кровяные корочки, отделяем их. Специально отдирать их не нужно. Убираем только те корочки, которые легко отделяются сами.
- При помощи ватной палочки (другой) смазываем ранку зеленкой. Вместо зеленки можно использовать перманганат калия. Он лучше подсушивает, однако требует более осторожного применения. Не нужно, чтобы раствор попадал на кожу вокруг пупка. Это может вызвать сухость и шелушение.
- После процедуры лучше не одевать малыша сразу же, а дать его коже подышать в течение нескольких минут.
Нужно ли заклеивать пупочную ранку пластырем, заматывать бинтом?
При нормальном процессе заживления ранки, делать этого ни в коем случае нельзя. Кожица малыша для скорейшего заживления должна «дышать». Под повязкой могут завестись микробы, способные вызвать воспаление.
Особенности ухода за пупком с прищепкой
Как известно, в роддоме пуповина малыша обрезается не полностью, остается небольшой «хвостик», на который накладывается специальная прищепка. Окончательно «хвостик» отпадает на 3-4-й день после родов. Поскольку выписывают маму с малышом домой обычно позже – на 5-е сутки, то мамочка этой особенности пупка своего крохи может и не увидеть. Другое дело, если вас с малышом по какой-то причине выписали из роддома раньше. Тогда необходимо следить за состоянием пупка с учетом некоторых особенностей. Они совсем небольшие. Уход за пупком с прищепкой не сильно отличается от обработки пупочной ранки без зажима. Единственное дополнительное действие: снять прищепку перед обработкой ранки и соответственно надеть ее обратно, когда со всеми манипуляциями будет покончено. Кроме того, потребуется протереть зажим перекисью водорода. Делать это необходимо со всех сторон. После обработки прищепку насухо вытирают кусочком ваты. Чтобы не дать бактериям не единого шанса, прищепку дополнительно можно протереть спиртовым раствором (70-процентным).
Тогда необходимо следить за состоянием пупка с учетом некоторых особенностей. Они совсем небольшие. Уход за пупком с прищепкой не сильно отличается от обработки пупочной ранки без зажима. Единственное дополнительное действие: снять прищепку перед обработкой ранки и соответственно надеть ее обратно, когда со всеми манипуляциями будет покончено. Кроме того, потребуется протереть зажим перекисью водорода. Делать это необходимо со всех сторон. После обработки прищепку насухо вытирают кусочком ваты. Чтобы не дать бактериям не единого шанса, прищепку дополнительно можно протереть спиртовым раствором (70-процентным).
Что делать, если часть пуповины с прищепкой не отпала на 4-й день?
Не нужно волноваться: в некоторых случаях это может произойти на несколько дней позже. Главное – не стараться отделять остаток пуповины самостоятельно. Это может навредить малышу.
В каких случаях необходимо бить тревогу?
Если пупочная ранка в первые дни слегка кровит, отделяются корочки, это нормально. Любая ранка на теле человека будет вести себя примерно так же. Однако нужно внимательно следить за ее состоянием, чтобы не пропустить тревожных симптомов:
- малышу уже две недели или больше, а ранка не подсыхает;
- ранка мокнет, гноится;
- от ранки чувствуется неприятный запах гниения;
- кожа вокруг ранки покраснела;
- кожа вокруг ранки горячая;
В этих случаях необходимо как можно скорее сообщить о проблеме доктору.
Что должна знать мама об уходе за новорожденным
В родильном доме врач-неонатолог, детская медсестра разъясняют маме основы ухода за новорожденным, рассказывают о пользе свободного пеленания, преимуществе грудного вскармливания. Медсестра учит как нужно подмывать и умывать малыша, обучает выполнению термометрии, уходу за пуповинным остатком и пупочной ранкой.
До и после ухода за ребенком женщина должна тщательно вымыть руки.
Уход за пуповинным остатком
Пуповинный остаток сначала высыхает, и мумифицируется при воздействии воздуха, а затем отпадает в течение первой недели жизни.
Согласно международным рекомендациям, для ухода за пуповинным остатком не требуется создания стерильных условий.
Не рекомендуется обрабатывать пуповинный остаток какими – либо антисептиками ( растворы анилиновых красителей, спирт, раствор калия перманганата и т. п. ), достаточно содержать его сухим и чистым, предохранять от загрязнения мочой, калом а также от травмирования при тугом пеленании или использовании одноразовых подгузников с тугой фиксацией. Доказано, что местное использование антисептиков не только не уменьшает частоту инфекций, но и способствует задержке отпадения пуповинного остатка. В случае загрязнения пуповинный остаток и кожу вокруг пупочного кольца можно промыть водой, и осушить чистой ватой или марлей. Пуповинный остаток должен отпасть самостоятельно. Не рекомендуется пользоваться повязками и дополнительным подвязыванием пуповины для ускорения процесса мумификации. В родильном доме практикуется ранняя выписка (на 3 – 5 сутки после родов ), в том числе до отпадения пуповины.
Уход за кожей новорожденного
При уходе за здоровой кожей новорожденного следует избегать любых действий, которые могут нарушить эпидермальный барьер ( воздействие повышенной влажности, трение, раздражающие вещества, травмы ) Снижению бактерицидных свойств кожи способствуют обезжиривание ( спиртом, эфиром ), охлаждение, раздражение кожи мочой и калом. Рекомендуется купать ребенка в теплой воде, не добавляя никаких дезинфицирующих средств; ежедневное использование шампуней, пены для ванны и других моющих средств не показано.
Многие присыпки содержат частицы, вызывающие раздражение кожи, а также отдушки, провоцирующие аллергические реакции. Не содержащие тальк присыпки можно использовать для обработки шейных, подмышечных и паховых складок при пеленочной сыпи вследствие нерационального использования подгузников. Необходимо избегать широкого использования вазелина ( растительного масла ), задерживающего влагу и являющегося активным аллергеном.
При неправильном уходе за кожей возникает пеленочный дерматит, который представляет раздражение кожи в области, контактирующей с подгузником. Основная причина развития пеленочного дерматита – дефекты ухода ( редкая смена подгузников, тугое пеленание). Пеленочный дерматит не представляет серьезной угрозы для здоровья ребенка, но
раздражение кожи очень болезненно, вызывает страдание и беспокойство ребенка, что отражается на его самочувствии.
Независимо от типа подгузников ( одноразовые или многоразовые ), необходимо соблюдать правила ухода за ребенком:
— менять подгузник при его наполнении;
— сразу менять подгузник, если был стул;
— использовать “дышащие” подгузники;
— организовывать как можно чаще воздушные ванны в течение дня.
Уход за кожей при использовании одноразовых и многоразовых подгузников отличается.
При использовании одноразовых подгузников кожа должна быть сухой; не рекомендуется применять жирные мази, кремы, создающие эффект компресса, что провоцирует развитие дерматита. Если на кожу нанесены мазь или крем, перед надеванием подгузника избыток средств необходимо удалить салфеткой. Рекомендуется использовать для ухода за кожей новорожденного крем на водной основе, лосьоны, молочко.
При использовании многоразовых подгузников можно применять кремы и мази, так как создание прослойки между кожей и подгузником уменьшает риск раздражения.
Уход за глазами
Для профилактики инфекционных заболеваний глаз в родильном зале во время первичного туалета новорожденного проводится 3-х кратное закапывание 20% раствора альбуцида. В дальнейшем ежедневная обработка глаз не требуется. При необходимости мама умывает ребенка теплой проточной водой со своей руки.
Уход за пуповинным остатком
Пуповина — это особый орган, который соединяет плод с плацентой. Иначе говоря, это важная ниточка, которая связывает вас с малышом! Задача её заключается в транспорте к ребенку крови, насыщенной кислородом и питательными веществами, и уносить ту, что содержит продукты обмена и углекислый газ.
Как только малыш появляется на свет, необходимость в пуповине отпадает, поскольку он начинает дышать самостоятельно, её перерезают и накладывают скобку.
После наложения скобки, пуповинный остаток начинает подсыхать, уменьшается в размерах и темнеть, затем отпадает, и образуется пупочная ранка.
Пупочная ранка – «входные ворота» для инфекции, поэтому при неправильном или ненадлежащем уходе возможно возникновение воспалительных процессов в ней (омфалит).
Как же все- таки правильно ухаживать за пуповинным остатком????
Теперь кратко и по пунктам:
ВОЗ рекомендует, так называемое, «сухое ведение» пуповинного остатка:
1) Не требуется применения каких-либо антисептиков и других лекарственных веществ, если нет показаний для этого (так как при обработке антисептиками вместе с патогенной флорой уничтожается и нормальная флора, заселяющая кожу).
2) Пуповинный остаток не нужно накрывать повязками, подгузниками, а следует держать его открытым (накрывается только одеждой).
3)Одежда ребенка должна быть чистой, сухой, меняться по мере загрязнения, но не реже 1 раз в сутки.
4) Пуповинный остаток следует поддерживать сухим и чистым. В случае загрязнения пупочного остатка (моча, испражнения) необходимо сразу промыть его теплой водой и просушить чистой пеленкой или салфеткой.
5) Стараться как можно меньше травмировать одноразовыми подгузниками или резинкой от штанишек.
ВАЖНО!
Наличие пуповинного остатка не является противопоказанием для купания ребенка. Было доказано, что у детей, которых родители купают с не отпавшим пуповинным остатком, отпадение его происходит раньше, а инфекционные осложнения, связанные с ним, возникают намного реже, чем у тех детей, которых не купают до отпадения пуповинного остатка.
СЛУЧАИ, КОГДА НЕОБХОДИМО ОБРАТИТЬСЯ К ВРАЧУ
- Пупочная ранка и кожа вокруг нее покраснела, отекла и напряжена.
- Гнойные выделения из пупочной ранки.
- Неприятный запах из ранки.
- При правильном уходе за пупочной ранкой она долго не заживает.

- При любых необычных выделениях из пупочной ранки.
- Важно помнить, что срок отпадения пупочной ранки от 5 до 15 дней.
Гигиенические процедуры – не только обязательный ритуал, необходимый для здоровья ребенка, но и незабываемые минуты счастья, которые мама разделяет со своим малышом!
Пуповина — незначительная инфекция пуповины или пупка
Определение
- Пупок (пупок) с мутными выделениями или даже небольшим количеством высохшего гноя на поверхности
- Пупок также называют пупком или пупком
- Отрезок пуповины, который остается на ребенке, называется пуповиной
Позвоните или перезвоните, если
- Появляется красная полоса или покраснение вокруг пупка
- Возникла лихорадка
- Мутные выделения не прошли через 3 дня использования этого совета по уходу
- Ваш ребенок начинает выглядеть или вести себя ненормально
- Вы думаете Ваш ребенок должен быть на виду
Об этой теме
Причина
- Мутные выделения обычно возникают из-за инфекции на поверхности кожи.
- Это может быть вызвано нормальными кожными бактериями.
- Может даже присутствовать небольшое количество гноя.
Омфалит: серьезное осложнение
- Определение. Бактериальная инфекция культи пуповины с распространением на кожу вокруг нее. Это неотложная медицинская помощь.
- Как часто. 1 из 200 новорожденных.
- Симптомы. Покраснение распространяется вокруг пупка. Эта область может быть болезненной, опухшей и иметь неприятный запах.
Консультации после ухода
Обзор:
- Из пупка в течение нескольких дней после отпадания пуповины будет сочиться секрет.
- Нормальные выделения представляют собой прозрачную слизь с кровянистым оттенком.

- Мутные выделения — это обычно легкая инфекция.
- Это могут быть нормальные кожные бактерии.
- Может присутствовать небольшое количество гноя.
- Вот несколько советов по уходу, которые могут помочь.
Очистите пупок:
- Очистите пупок (пупок) 2 раза в день.
- Используйте влажный ватный тампон или ткань.
- Удалите засохшие выделения или гной.
- Делайте это осторожно, чтобы предотвратить кровотечение.
- Осторожно: Не используйте медицинский спирт. Причина: может помешать заживлению.
Мазь с антибиотиком:
- При наличии гноя используйте мазь с антибиотиком, например, Полиспорин.
- Рецепт не требуется.
- Нанесите небольшое количество на пупок.
- Делайте это 2 раза в день после того, как промыли пораженный участок теплой водой.
- Делайте это в течение 2 дней. После этого используйте мазь с антибиотиком, только если вы видите больше гноя.
Купание:
- Не используйте ванну, пока шнур не отвалится.Также должен хорошо зажить пупок.
Подгузники:
- Держите пупок сухим, чтобы ускорить заживление.
- Для обеспечения контакта с воздухом держите подгузник в сложенном состоянии. Держите его под шнуром и пупком.
Чего ожидать:
- При лечении мутные выделения и гной должны исчезнуть через 2–3 дня.
- Пупок должен высохнуть и зажить через 7 дней.
Автор : Barton Schmitt MD, FAAP . |
врачей используют пуповинные клетки для улучшения заживления ран
Криоконсервированные пуповины открывают новые возможности в заживлении ран.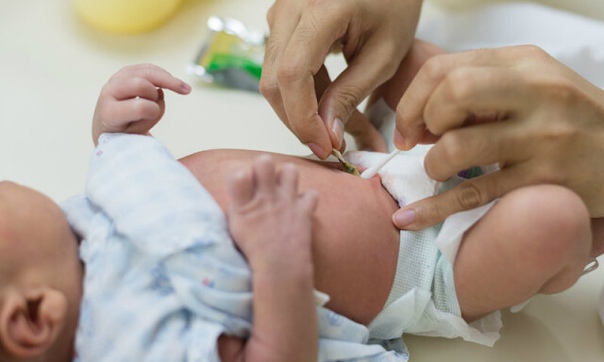
В последние годы в медицинском сообществе появилась растущая тенденция: банки шнуров. Здесь врачи хранят криоконсервированную пуповину (cUC), взятую у ребенка сразу после рождения.Эти объекты, которые могут быть частными или предлагать общественные услуги, используют cUC для различных целей. Стволовые клетки в пуповинах могут помочь регенерировать ткань, укрепить иммунную систему и лечить или даже предотвращать ряд заболеваний. Теперь группа ученых из Техаса использовала cUC для улучшения заживления ран .
Переосмысление способов заживления ран
В рамках нового исследования в недавнем выпуске журнала Wounds исследователи из системы здравоохранения ветеранов Центрального Техаса использовали cUC для лечения ряда давних хронических ран .В рамках исследования врачи клиники в Темпле, штат Техас, набрали в общей сложности 57 пациентов с 64 отдельными ранами. В процессе лечения команда под руководством ортопеда Марка Кутюра полностью обработала каждую рану перед тем, как вставить CUC и закрепить ее влажной марлей.
Для многих пациентов этот процесс повторялся еженедельно. После завершения цикла лечения команда из Техаса обнаружила довольно многообещающие результаты: 51 рана — или почти 80 процентов от общего числа — зажила чуть менее чем за четыре недели.Что касается того, почему cUC так эффективен, это может быть связано с богатой гликозаминогликанами внешней подкладкой пуповины. Это химическое соединение обладает несколькими важными качествами, в том числе эффективным противовоспалительным и предотвращающим образование рубцов.
Не только это, но и в сопроводительном пресс-релизе Couture объяснил, что cUC может быть менее затратным. Согласно другому исследованию, опубликованному в журнале Wounds, при нынешних методах лечения стоимость лечения хронических ран составляет более 50 миллиардов долларов в год.
Некоторые врачи уже начали использовать CUC для лечения ран. В интервью WIVB, филиалу CBS компании Buffalo, д-р Эндрю Райс из отдела фут-хирургов округа Фэрфилд подробно рассказал, как он лечил язвы диабетической стопы пациента с помощью cUC. Используя шнур, доктор Райс смогла сократить курс лечения раны для одного пациента с шести месяцев до пяти недель. Райс добавил, что, по его мнению, использование пуповинных клеток на ранах также может помочь гарантировать, что эти области не станут поврежденными или уязвимыми после первого заживления.
В интервью WIVB, филиалу CBS компании Buffalo, д-р Эндрю Райс из отдела фут-хирургов округа Фэрфилд подробно рассказал, как он лечил язвы диабетической стопы пациента с помощью cUC. Используя шнур, доктор Райс смогла сократить курс лечения раны для одного пациента с шести месяцев до пяти недель. Райс добавил, что, по его мнению, использование пуповинных клеток на ранах также может помочь гарантировать, что эти области не станут поврежденными или уязвимыми после первого заживления.
Для всех ваших специализированных продуктов для ухода за ранами обращайтесь в Advanced Tissue. Мы доставляем как на дом, так и в учреждения длительного ухода.
Рассмотрение подходов, Медикаментозная терапия, Хирургическая терапия
Автор
Роберт К. Минкес, доктор медицины, доктор медицины Медицинский директор педиатрической хирургической службы Детской больницы Голизано на юго-западе Флориды; Группа врачей Ли
Роберт К. Минкес, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж хирургов, Американская медицинская ассоциация, Американская педиатрическая хирургическая ассоциация, Phi Beta Kappa
Раскрытие информации: не раскрывать.
Соавтор (ы)
Стивен М. Мегисон, доктор медицины Профессор хирургии Юго-Западного медицинского центра Техасского университета; Медицинский директор травматологической службы, Детский медицинский центр, Даллас
Стивен М. Мегисон, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации хирургии травм, Американской ассоциации педиатрической хирургии, Американского общества травматологии, Общества. of Critical Care Medicine
Раскрытие информации: нечего раскрывать.
Ли Эрн Чен, доктор медицины Медицинский директор хирургических служб, Baylor Health Care System; Директор по исследованию результатов хирургических вмешательств, Департамент хирургии, Медицинский центр Университета Бэйлора
Ли Эрн Чен, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии, Американский колледж хирургов, Американская медицинская ассоциация, Американская педиатрия. Хирургическая ассоциация
Раскрытие информации: Ничего не раскрывать.
Марк В. Мацциотти, доктор медицины Доцент кафедры хирургии и педиатрии, Медицинский колледж Бейлора, Детская больница Техаса
Марк В. Мацциотти, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии, American Medical Ассоциация, Американский колледж хирургов, Американская педиатрическая хирургическая ассоциация, Phi Beta Kappa
Раскрытие: Ничего не разглашать.
Юджин С. Ким, доктор медицины, FACS, FAAP Профессор хирургии и педиатрии, отделение детской хирургии, отделение гематологии, онкологии, трансплантации крови и костного мозга, Медицинская школа Кека, Университет Южной Калифорнии; Лечащий детский хирург, Детская больница Лос-Анджелеса
Юджин С. Ким, доктор медицины, FACS, FAAP является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация исследований рака, Американский колледж хирургов, Американская медицинская ассоциация, Американская педиатрическая больница. Хирургическая ассоциация, Американская хирургическая ассоциация, Ассоциация академической хирургии, Группа детской онкологии, Общество лапароэндоскопических хирургов, Общество университетских хирургов, Техасская медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Дебора Ф. Биллмайр, доктор медицины Доцент кафедры хирургии, Медицинский центр Университета Индианы
Дебора Ф. Биллмир, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии, Американский колледж хирургов, США Педиатрическая хирургическая ассоциация, Phi Beta Kappa, Общество интенсивной терапии
Раскрытие информации: Ничего не разглашать.
Главный редактор
Юджин С. Ким, доктор медицины, FACS, FAAP Профессор хирургии и педиатрии, отделение детской хирургии, отделение гематологии, онкологии, трансплантации крови и костного мозга, Медицинская школа Кека, Университет Южной Калифорнии; Лечащий детский хирург, Детская больница Лос-Анджелеса
Юджин С. Ким, доктор медицины, FACS, FAAP является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация исследований рака, Американский колледж хирургов, Американская медицинская ассоциация, Американская педиатрическая больница. Хирургическая ассоциация, Американская хирургическая ассоциация, Ассоциация академической хирургии, Группа детской онкологии, Общество лапароэндоскопических хирургов, Общество университетских хирургов, Техасская медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Роберт Келли, доктор медицины
Роберт Келли, доктор медицины является членом следующих медицинских обществ: Американская академия педиатрии, Американский колледж хирургов, Американская медицинская ассоциация, Американская педиатрическая хирургическая ассоциация, Американское общество абдоминальных хирургов, Медицинское общество Вирджиния, Медицинская академия Норфолка, Южная медицинская ассоциация
Раскрытие информации: нечего раскрывать.
Благодарности
Роберт С. Блосс, доктор медицины Клинический адъюнкт-профессор хирургии и педиатрии, Медицинская школа Техасского университета; Клинический доцент кафедры хирургии медицинского колледжа Бейлора; Консультант, Хьюстонские детские хирурги
Роберт С. Блосс, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американского колледжа хирургов, Американской медицинской ассоциации, Американской педиатрической хирургической ассоциации, Юго-западного хирургического конгресса и Техасского педиатрического общества
Раскрытие: Ничего не нужно раскрывать.
Омфалит — обзор | Темы ScienceDirect
Омфалит
Омфалит или пупочный сепсис — это бактериальная инфекция культи пуповины и окружающих тканей. Широкое распространение асептического ухода за пуповиной значительно сократило его частоту. 26, 27 Факторы риска развития омфалита включают низкий вес при рождении (<2500 г), предшествующую пупочную катетеризацию и преждевременный разрыв или длительный разрыв околоплодных вод. 28
Бактериальная инфекция через открытую рану пуповины или окружающей ткани является обычной причиной, хотя может возникнуть первичная бактериемия с засеиванием культи пуповины. Большинство инфекций являются полимикробными. Основными микроорганизмами, вызывающими омфалит, являются Staphylococcus aureus, стрептококк группы A, Escherichia coli , Kliebsiella pneumoniae , Proteus mirabilis, и анаэробы, такие как Bactero14141. 29–31
Первоначальные результаты включают гнойные выделения из культи пуповины, за которыми следует околопупочная эритема, отек, уплотнение и болезненность (рис. 39-9). В конце инфекции у новорожденных проявляются признаки сепсиса, включая летаргию, раздражительность, переохлаждение или гипертермию. Если инфекцию не лечить, она может прогрессировать до поверхностного абсцесса, некротического фасциита, мионекроза, тромбоза воротной вены, перитонита, потрошения кишечника, абсцесса печени, эндокардита, сепсиса и смерти. 32–34 Раздражающий дерматит, вызванный лечением пупка, может имитировать омфалит.
Если инфекцию не лечить, она может прогрессировать до поверхностного абсцесса, некротического фасциита, мионекроза, тромбоза воротной вены, перитонита, потрошения кишечника, абсцесса печени, эндокардита, сепсиса и смерти. 32–34 Раздражающий дерматит, вызванный лечением пупка, может имитировать омфалит.
Омфалит лечится антибиотиками, направленными на более распространенные возбудители. Они могут включать нафциллин и цефотаксим. Метронидазол может быть добавлен для анаэробной защиты, особенно при подозрении на некротический фасциит или мионекроз. При осложнениях может потребоваться хирургическая очистка. 35–37 Омфалит — потенциально опасная для жизни инфекция.
Эффективность мезенхимальных стволовых клеток, полученных из пуповинной крови и желе Уортона, для безрубцового заживления ран
Этика
Это исследование было одобрено комитетом по этике клинических исследований Высшей школы биомедицинских наук Университета Нагасаки (12053003).Ткани плаценты и пуповины были взяты у здоровых доноров, перенесших плановое кесарево сечение после доношенной беременности; все доноры дали информированное согласие.
Все эксперименты на животных были одобрены Комитетом по этике экспериментов на животных (1206070993-2) Университета Нагасаки (Нагасаки, Япония). Эксперименты проводились в соответствии с институциональными и национальными рекомендациями.
Ex vivo Расширение UCB-MSC
Пуповинную кровь собирали из доставленных плацент с использованием стерильных игл 18G и шприцев на 50 мл, содержащих 1000 единиц гепарина.Собранные образцы крови хранили на льду и разбавляли фосфатно-солевым буфером Дульбекко (D-PBS), содержащим 2 мМ EDTA. Мононуклеарные клетки выделяли центрифугированием в градиенте плотности с использованием раствора Ficoll-Hypaque-Plus (GE Healthcare). Свежевыделенные мононуклеарные клетки суспендировали в модифицированной по Дульбекко средне-низкой глюкозе Игла (DMEM-LG) (Wako), содержащей 10% фетальной бычьей сыворотки (Hyclone Laboratories, Inc. ) и 1% пенициллин / стрептомицин (Life Technologies), а затем засевали в Т75. — или флаконы для культивирования клеток Т25 плотностью 8.0–10 × 10 5 клеток / см 2 . Клетки инкубировали при 37 ° C в 5% CO 2 и среду меняли каждые 3-4 дня. Мы продолжали культивирование в течение приблизительно 1 недели после того, как фибробластоподобные клетки появились на дне колб. Затем эти фибробластоподобные клетки собирали, используя 0,25% трипсин-ЭДТА, и повторно высевали для дальнейшего размножения ex vivo . 2 клетки -го пассажа или 3 -го пассажа использовали для экспериментов, за исключением анализа роста клеток.
) и 1% пенициллин / стрептомицин (Life Technologies), а затем засевали в Т75. — или флаконы для культивирования клеток Т25 плотностью 8.0–10 × 10 5 клеток / см 2 . Клетки инкубировали при 37 ° C в 5% CO 2 и среду меняли каждые 3-4 дня. Мы продолжали культивирование в течение приблизительно 1 недели после того, как фибробластоподобные клетки появились на дне колб. Затем эти фибробластоподобные клетки собирали, используя 0,25% трипсин-ЭДТА, и повторно высевали для дальнейшего размножения ex vivo . 2 клетки -го пассажа или 3 -го пассажа использовали для экспериментов, за исключением анализа роста клеток.
Ex vivo Расширение WJ-MSC
Ткань пуповины собирали и хранили в сбалансированном солевом растворе Хэнка (Life Technologies) при 4 ° C. После удаления пупочной артерии и вен желеобразную ткань Уортона разрезали на мелкие кусочки (1-2 мм) и поместили в чашки для культивирования диаметром 6 или 10 см, покрытые 10 мкг / мл человеческого фибронектина. В чашки добавляли небольшое количество среды DMEM-LG, содержащей 10% FBS и пенициллин / стрептомицин, и клетки инкубировали в 5% CO 2 при 37 ° C.После инкубации в течение ночи в чашки добавляли еще среду. Фибробластоподобные клетки выросли из тканей примерно через 5 дней инкубации со сменой среды каждые 3-4 дня. Клетки собирали, используя 0,25% трипсин-ЭДТА, и повторно высевали для дальнейшего размножения ex vivo . Мы использовали 2 клетки -го пассажа для экспериментов, исключая анализ роста клеток.
Анализ роста клеток
UCB-MSC и WJ-MSC первого пассажа высевали в 6-луночные планшеты с плотностью 3.0 × 10 3 клеток / см 2 и культивировали в течение 1 недели. Клетки собирали в виде суспензии отдельных клеток, и общее количество клеток подсчитывали с помощью NucleoCounter ® NC-100 TM .
Проточная цитометрия
Чтобы охарактеризовать UCB-MSC и WJ-MSC, 2 клетки пассажа и трипсинизировали для получения суспензии единичных клеток, а затем окрашивали моноклональными антителами мыши против CD34-FITC (4h21), CD44-PE ( IM7), CD45-PE (HI30), CD73-FITC (AD2), CD90-FITC (eBio5E10) и CD105-PE (SN6) (eBioscience).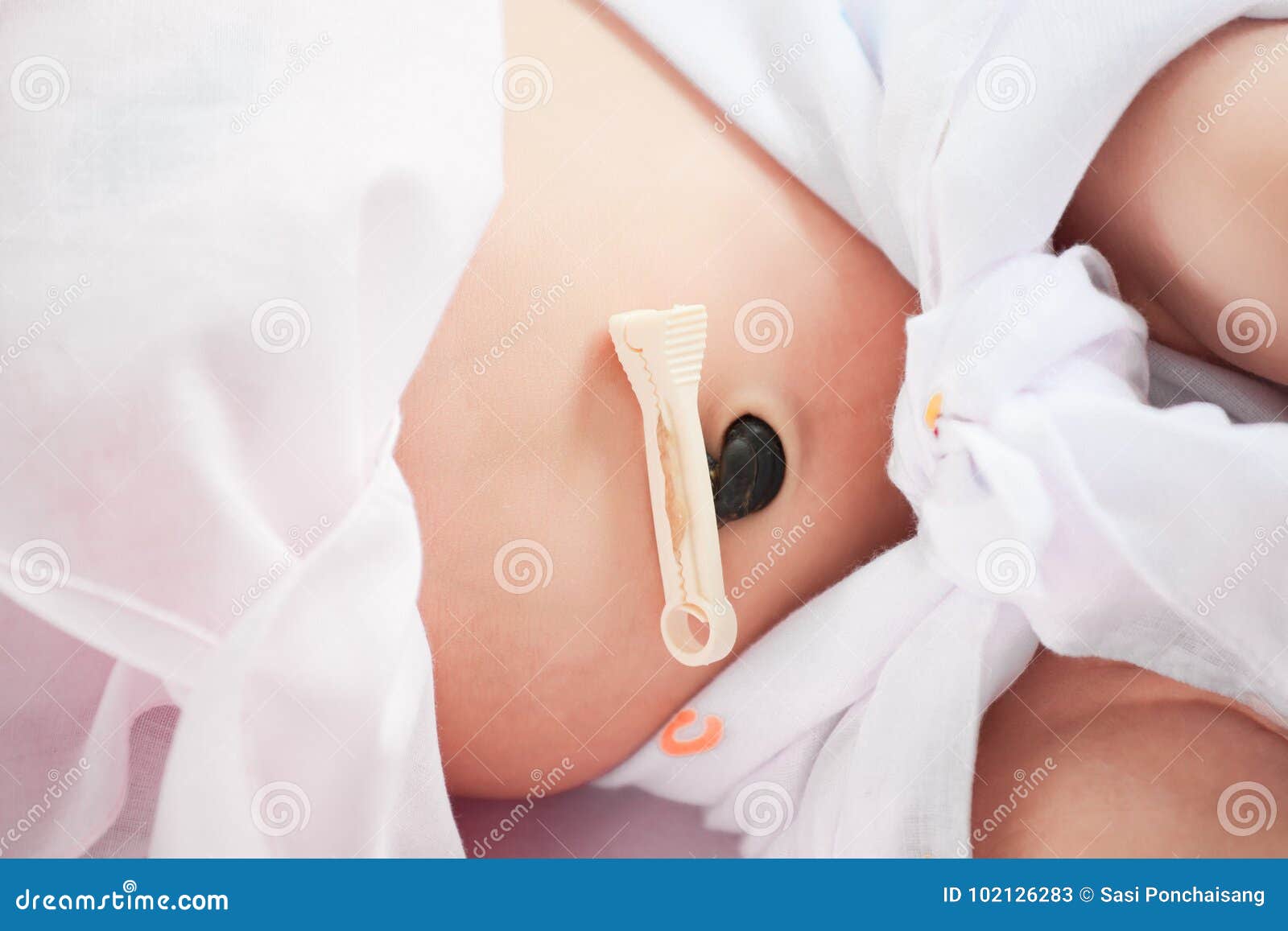 Соответствующие изотипические контроли использовали в качестве отрицательных контролей. После двукратной промывки PBS был проведен количественный анализ проточной цитометрии с использованием прибора LSRFortessa TM (Becton Dickinson). Мы проанализировали полученные данные с помощью программы Cell Quest (Becton Dickinson).
Соответствующие изотипические контроли использовали в качестве отрицательных контролей. После двукратной промывки PBS был проведен количественный анализ проточной цитометрии с использованием прибора LSRFortessa TM (Becton Dickinson). Мы проанализировали полученные данные с помощью программы Cell Quest (Becton Dickinson).
RT
2 Profiler PCR array
Общую РНК выделяли из UCB-MSC и WJ-MSC с использованием RNeasy Mini Kit (Qiagen). После генерации кДНК с использованием набора RT 2 First Strand Kit (SABiosciences), RT 2 Profiler PCR array для определения фиброза человека выполняли в соответствии с инструкциями производителя (SABiosciences).Всего в массив было включено 84 ключевых гена, участвующих в ремоделировании тканей во время восстановления и заживления ран. Было проведено три отдельных эксперимента, и данные были проанализированы с помощью программы анализа на базе Интернета (SABiosciences, http://pcrdataanalysis.sabiosciences.com/pcr/arrayanalysis.php).
Мышиная модель заживления ран и имплантация клеток
Шестинедельных мышей BALB / cSlc (nu-nu) были приобретены у Japan SLC. Четыре дефекта кожи на всю толщину были созданы в дорсальной коже с помощью биопсийных штампов диаметром 5 мм (Kai Industries).Затем мышей случайным образом разделили на 3 группы и получили подкожные инъекции в 4 точки вокруг каждой раны: общее количество 1,0 × 10 5 UCB-MSC в 50 мкл среды (группа UCB-MSC), 1,0 × 10 5 WJ-MSC (группа WJ-MSC) или только 50 мкл среды (контрольная группа). Раны регистрировали с помощью цифровой камеры (Lumix DMC-GF3, Panasonic) через 0, 1, 3, 5, 7, 10 и 14 дней после лечения, а площади ран измеряли с помощью программного обеспечения Photoshop CS6 Extended (системы Adobe).Ткани раны собирали с нормальными краями кожи 1 мм в разные моменты времени для следующих анализов.
Количественная полимеразная цепная реакция в реальном времени (ОТ-ПЦР)
Для измерения уровней экспрессии мРНК нескольких генов, связанных с заживлением ран, мы собирали ткани кожной раны для анализа с помощью ОТ-ПЦР через 3 или 7 дней после лечения.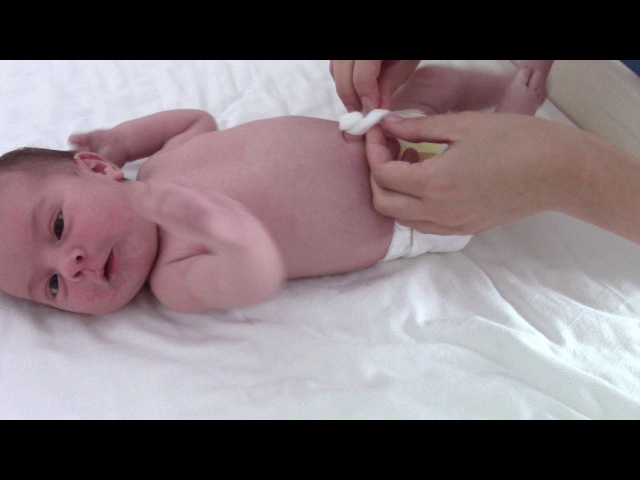 Вкратце, раневые ткани гомогенизировали с использованием Multi-beads shocker ® (Yasui Kikai), а очистку РНК проводили с использованием ISOGEN2 (Nippon Gene) в соответствии с протоколом производителя.Набор ReverTra Ace ® q-PRC RT с устройством для удаления геномной ДНК (TOYOBO) использовали для получения кДНК из очищенной тотальной РНК. ОТ-ПЦР выполняли с использованием смеси для кПЦР THUNDERBIRD SYBR (TOYOBO) и системы обнаружения ПЦР в реальном времени CFX96 Touch (Bio Rad). Последовательности праймеров, использованные для количественной оценки уровней экспрессии генов, перечислены в дополнительной таблице 1.
Вкратце, раневые ткани гомогенизировали с использованием Multi-beads shocker ® (Yasui Kikai), а очистку РНК проводили с использованием ISOGEN2 (Nippon Gene) в соответствии с протоколом производителя.Набор ReverTra Ace ® q-PRC RT с устройством для удаления геномной ДНК (TOYOBO) использовали для получения кДНК из очищенной тотальной РНК. ОТ-ПЦР выполняли с использованием смеси для кПЦР THUNDERBIRD SYBR (TOYOBO) и системы обнаружения ПЦР в реальном времени CFX96 Touch (Bio Rad). Последовательности праймеров, использованные для количественной оценки уровней экспрессии генов, перечислены в дополнительной таблице 1.
Гистологическая оценка
Для гистологического анализа мышей умерщвляли через 3, 7 и 14 дней после обработки. Собранные раневые ткани фиксировали в 4% параформальдегиде для заливки парафином.Срезы (толщиной 6 мкм) использовали для различных методов окрашивания: окрашивания гематоксилин-эозином (HE), окрашивания трихромом Массона, окрашивания Picrosirius red 26 и иммуногистохимического (IHC) окрашивания на CD31 (ab28364, Abcam) и F4 / 80 (CI : A3-1, Abcam). Для ИГХ срезы депарафинизировали, инкубировали в течение 20 минут с 3% перекисью водорода для блокирования активности эндогенной пероксидазы, инкубировали с Blocking One Histo (Nacalai Tesque) при комнатной температуре, а затем инкубировали с первичными антителами при 4 ° C в течение ночи.Все срезы визуализировали с использованием Histofine Simplestaining mouseMAX-PO (кролик или крыса) (Nichirei Biosciences, Inc.) и таблеток 3,3′-диаминобензидина (Sigma-Aldrich). Окрашенные срезы просматривали под микроскопом (Olympus IX83, Olympus), а цифровые изображения получали с помощью камеры DP80 с использованием программного обеспечения cellSens (Olympus). Срезы, окрашенные пикросириусом красным, наблюдали с помощью поляризованного микроскопа. Окрашенные НЕ срезы использовали для оценки реэпителизации и грануляции ран. Изображения были оптимизированы глобально и собраны в фигуры с помощью Adobe Photoshop.
Вестерн-блоттинг
Для измерения уровней белков CD31 и F4 / 80 мышей умерщвляли и через 7 дней после обработки собирали ткани раны. Вкратце, собранные раневые ткани гомогенизировали с использованием Multi-beads shocker ® и добавляли к реагенту T-PER (Thermo Fisher Scientific), состоящему из ингибиторов протеиназы и дефосфорилирования (Thermo Fisher Scientific). Полные лизаты белка получали после удаления дебриса фильтрованием через фильтры 0,22 мкм (Millipore).Общий белок (10 мкг) отделяли с использованием геля mini-Protean TGX Stain-Free TM (BioRad) и затем переносили на мембраны PVDF с использованием системы переноса Trans-Blot ® Turbo TM (BioRad). После блокирования блокирующим реагентом PVDF Can Get Signal ® (TOYOBO) в течение 1 часа при комнатной температуре мембраны инкубировали с первичными антителами против CD31, F4 / 80 или тубулина (Sigma-Aldrich) при 4 ° C в течение ночи. с последующим введением соответствующих вторичных антител, конъюгированных с пероксидазой хрена, при комнатной температуре в течение 1 часа.Экспрессию визуализировали с помощью хемилюминесценции с помощью цифрового люминесцентного анализатора изображений (LAS-4000, GE Healthcare).
Статистический анализ
Существенные различия определяли с использованием критерия Стьюдента t , при этом p <0,05 считали статистически значимым. Все данные были представлены в виде средних значений ± SEM.
Проблемы с пуповиной
ОБЗОР: Что необходимо знать каждому практикующему специалисту
Вы уверены, что у вашего пациента омфалит? Каковы типичные признаки этого заболевания?
Дренаж из культи пуповины у новорожденного может указывать на серьезную инфекцию.Бактерии колонизируют культю пуповины вскоре после рождения; во время некроза тканей стимулируется рост бактерий, а сосуды служат воротами для прямого попадания бактерий в кровоток.
Хотя омфалит редко встречается в развитых странах, он встречается примерно у 0,7% доношенных новорожденных, а уровень смертности достигает 15%. Омфалит может прогрессировать до некротического фасциита, смертность от которого достигает 85%. Раннее распознавание и лечение могут предотвратить развитие некротического фасциита и улучшить исход.Симптомы следует отличать от других состояний, при которых возникает дренаж из пуповины.
Локализованные симптомы омфалита включают (см. Рисунок 1):
1. Эритема околопупочной области кожи
2. Нежность
3. Введение
4. Гнойное отделяемое
5. Кровотечение из пуповины
Какое другое заболевание / состояние имеет некоторые из этих симптомов?
Патент урахуса с дренажом из пупка.В этом состоянии урахус не может превратиться в фиброзный канатик, позволяя мочевому пузырю дренировать пупок. Дренаж мочой негнойный. Открытый урахус не вызывает уплотнения, болезненности или кровотечения. Кожа может казаться эритематозной и раздраженной из-за контакта с мочой. Может возникнуть инфекция мочевыводящих путей; системные симптомы в остальном редки.
Устойчивый омфаломезентериальный проток также имеет дренаж из пупка. При полной проходимости терминальный отдел подвздошной кишки сообщается с пупком; дренаж содержит кишечные выделения и не является гнойным.Окружающие ткани не чувствительны и не уплотнены. Это состояние связано с кишечной непроходимостью и дивертикулом Меккеля. Ректальное кровотечение является обычным явлением.
Избыточная грануляционная ткань может сохраняться в основании пупка после отделения пуповины; это также может привести к дренированию культи пуповины. Дренаж серозно-кровавый негнойный. Нет связанной болезненности, эритемы или уплотнения.
Что послужило причиной развития этой болезни в это время?
Пуповина содержит две пупочные артерии, пупочную вену, остаток омфаломезентериального (желточного) протока, рудиментарный аллантоис и студенистую оболочку желе Уортона. При рождении пуповина имеет голубовато-белый оттенок. Вскоре после рождения желе Уортона обезвоживается, и пуповина начинает мумифицироваться и чернеть. Этот процесс приводит в конечном итоге к отделению спинного мозга от места прикрепления к брюшной полости и, как полагают, включает автолиз из-за опосредованной лейкоцитами активности лизосомных ферментов. Небольшое количество гнойного материала у основания пуповины может быть нормальным явлением во время этого процесса.
При рождении пуповина имеет голубовато-белый оттенок. Вскоре после рождения желе Уортона обезвоживается, и пуповина начинает мумифицироваться и чернеть. Этот процесс приводит в конечном итоге к отделению спинного мозга от места прикрепления к брюшной полости и, как полагают, включает автолиз из-за опосредованной лейкоцитами активности лизосомных ферментов. Небольшое количество гнойного материала у основания пуповины может быть нормальным явлением во время этого процесса.
Расставание обычно происходит в течение первых трех недель.Время зависит от ряда факторов, в том числе от режима ухода за пуповиной. Сразу после рождения пупок заселяется кожной флорой.
Начало омфалита обычно составляет 5-7 дней после рождения. Первоначально кожа у основания пуповины становится эритематозной, теплой и нежной, напоминающей целлюлит. По мере развития инфекции выделения становятся гнойными и зловонными. При отсутствии лечения бактерии распространяются на подкожную клетчатку, и живот становится чрезвычайно чувствительным при пальпации.Крепитус может быть оценен по достоинству. Кожа становится синюшной и фиолетовой, и младенец заболевает системно, включая жар и вялость. Это признаки некротического фасциита. Некротический фасциит требует неотложной хирургической и медицинской помощи.
Какие лабораторные исследования следует запросить для подтверждения диагноза? Как следует интерпретировать результаты?
Физические признаки эритемы, уплотнения, болезненности и гнойных выделений в пупке являются патогномоничными для омфалита.При подозрении следует провести полное обследование на сепсис, включая посев на поверхность, общий анализ крови, С-реактивный белок, посев крови, общий анализ мочи, посев мочи и люмбальную пункцию.
Могут ли быть полезны визуализирующие исследования? Если да, то какие?
При развитии некротического фасциита рентгенограмма может показать подкожный воздух. Компьютерная томография (КТ) может показать скопление жидкости и воздуха между подкожно-жировой клетчаткой и мышцами.
Компьютерная томография (КТ) может показать скопление жидкости и воздуха между подкожно-жировой клетчаткой и мышцами.
Если вы можете подтвердить, что у пациента омфалит, какое лечение следует начать?
Незамедлительное лечение при подозрении на омфалит является обязательным.Омфалит — это полимикробная инфекция; некоторые из наиболее вероятных возбудителей инфекции включают Staphylococcus aureus, Escherichia coli и виды стрептококков. Следовательно, лечение направлено против грамположительных и грамотрицательных организмов. Большинство экспертов также включают лечение анаэробов (антистафилококковые пенициллины и аминогликозиды или цефалоспорины третьего поколения и клиндамицин или метронидазол). Рассмотрите возможность применения ванкомицина, если распространенность метициллин-устойчивого золотистого стафилококка (MRSA) высока.Если у пациента некротический фасциит, необходимо проконсультироваться с хирургом; необходима обработка раны. Подозрение на некротический фасциит — неотложная помощь.
Какие побочные эффекты связаны с каждым вариантом лечения?
Каковы возможные исходы омфалита?
Наиболее частое осложнение омфалита — сепсис. Дополнительные осложнения включают септический тромбофлебит, абсцесс печени, тромбоз воротной вены, перитонит, приводящий к внутрибрюшному абсцессу, спонтанное потрошение тонкой кишки, приводящее к гангрене кишечника, и некротический фасциит.
Некротический фасциит у новорожденных вызывает септический шок. Сообщается, что смертность от некротического фасциита достигает 85%. Лечение включает быструю хирургическую обработку нежизнеспособных тканей, применение антибиотиков широкого спектра действия и поддерживающую терапию. Даже после хирургического вмешательства смертность остается чрезвычайно высокой.
Что вызывает это заболевание и как часто оно встречается?
Заболеваемость омфалитом колеблется от 0,7% до 7%; развивающиеся страны имеют самый высокий уровень заболеваемости.
Сопутствующий коэффициент смертности от омфалита составляет 7-15%; если омфалит прогрессирует до некротического фасциита, смертность может достигать 85%.
Факторы риска включают нестерильные роды, домашние роды, продолжительные роды, длительный разрыв плодных оболочек, катетеризацию пуповины, недоношенность, низкий вес при рождении и неасептический уход за пуповиной. Также считается, что аномалии иммунной системы повышают риск развития омфалита у младенца. (Например, дефекты адгезии лейкоцитов задерживают отделение пуповины, что позволяет патогенным бактериям размножаться.)
Пупок подвергается полимикробной колонизации после рождения. Бактерии размножаются в омертвевших тканях культи пуповины; эта инфекция предотвращает облитерацию пупочных сосудов, что позволяет микроорганизмам напрямую попадать в кровь, что может привести к сепсису.
Как эти патогены / гены / воздействия вызывают болезнь?
Другие клинические проявления, которые могут помочь в диагностике и лечении
Какие осложнения вы можете ожидать от болезни или лечения болезни?
Осложнения включают септический тромбофлебит, абсцесс печени, тромбоз воротной вены, перитонит с внутрибрюшным абсцессом, спонтанное потрошение тонкой кишки, приводящее к гангрене кишечника, мионекроз мускулатуры брюшной стенки и некротический фасциит.
Доступны ли дополнительные лабораторные исследования; даже те, которые не широко доступны?
Как можно предотвратить омфалит?
По данным Американской академии педиатрии, ни один режим лечения пуповины не был более эффективным, чем любой другой, для предотвращения инфекции.
В развитых странах культи следует оставить сушиться после рождения. Актуальные антибиотики и алкоголь больше не рекомендуются, поскольку они могут продлить отделение пуповины. Кроме того, их эффективность в предотвращении инфекции не обнаружена.
Кроме того, их эффективность в предотвращении инфекции не обнаружена.
Поскольку некротическая ткань в высыхающей культе пуповины обеспечивает богатую среду для роста бактерий, она легко колонизируется после рождения. Патогенные бактерии могут инфицировать и попадать в кровоток через пупочные сосуды. В развивающихся странах гигиенический уход за пуповиной уменьшает колонизацию, столбняк, инфекции и сепсис.
Какие доказательства?
Уход за шнуром:
Зупан, Дж., Гарнер, П., Омари, А.А. «Актуальный уход за пуповиной при рождении». Кокрановская база данных Syst Rev. 2004. В этом метаанализе 10 исследований, проведенных в развитых странах, сравнивались методы ухода за пуповиной. Не было значительных различий в смертности или частоте омфалита между любыми схемами ухода за пуповиной (уход за пуповиной, антисептические средства местного действия, включая хлоргексидин, тройной краситель, спирт или сульфадиазин серебра).
Mullany, LC, Darmstadt, GL, Khatry, SK. «Местное нанесение хлоргексидина на пуповину для профилактики омфалита и неонатальной смертности на юге Непала: кластерное рандомизированное исследование на уровне сообщества». Ланцет. т. 367. 2006. pp. 910-8. Чтобы определить, как уход за пуповиной влияет на исходы в развивающихся странах, где асептические методы могут быть менее доступны, в этом кластерно-рандомизированном исследовании на уровне сообществ был назначен один из трех режимов ухода за пуповиной в 413 различных общинах Непала. Было показано, что местный уход за пупком антисептиками значительно снижает риск омфалита и неонатальной смертности.
• Хлоргексидин по сравнению с лечением сухим пуповиной снизил частоту тяжелого омфалита (0.2 против 1,1 процента) и смертности (72 против 98 смертей на 1000 живорождений; ОР 0,76, 95% от 0,55 до 1,04).
• Младенцы, получившие раннюю помощь пуповины (<24 часов жизни), имели более низкий уровень смертности по сравнению с группой в целом. У младенцев, получивших раннее лечение пуповины, хлоргексидин снизил уровень смертности по сравнению с лечением сухим пуповиной (14 против 21 смерти на 1000 живорождений; ОР 0,66, 95%, 0,46–0,95).
У младенцев, получивших раннее лечение пуповины, хлоргексидин снизил уровень смертности по сравнению с лечением сухим пуповиной (14 против 21 смерти на 1000 живорождений; ОР 0,66, 95%, 0,46–0,95).
• Не было различий в частоте омфалита или смертности при уходе за пуповиной с мылом / водой и при помощи сухого пуповины.
«Столбняк новорожденных — Монтана, 1998 г.». MMWR Morb Mortal Wkly Rep. vol. 47. 1998. pp. 928-30. Неправильный уход за пуповиной может привести к инфекциям пуповины. Например, столбняк новорожденных был описан как осложнение неправильного применения коровьего навоза или бентонитовой глины.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
Трансплантация мезенхимальных стволовых клеток пуповины человека способствует заживлению кожных ран у сильно обожженных крыс
Аннотация
Фон
Тяжелые ожоги — частая травма, приводящая к смертельному исходу. Ключевым этапом тяжелой ожоговой терапии является как можно более раннее заживление ран, и отчеты показывают, что терапия мезенхимальными стволовыми клетками (МСК) способствует облегчению заживления ран.В этом исследовании мы исследовали влияние МСК пуповины человека (hUC-МСК) на заживление ран на крысиной модели тяжелого ожога и его потенциальный механизм.
Методы
взрослых крыс-самцов линии Wistar были случайным образом разделены на hUC-MSC с имитацией, ожогом и ожоговой трансплантацией. Меченные GFP hUC-MSC или PBS внутривенно вводили соответствующим группам. Скорость закрытия раны оценивалась Image Pro Plus. GFP-меченные hUC-MSC отслеживали с помощью in vivo, биолюминесцентной визуализации (BLI), а специфическую для человека экспрессию ДНК в ранах детектировали с помощью ПЦР. Воспалительные клетки, нейтрофилы, макрофаги, капилляры и коллаген I / III типов в ранах оценивали гистохимическим окрашиванием. Кровоток в ране оценивали с помощью лазерного доплеровского измерителя кровотока. Уровни провоспалительных и противовоспалительных факторов, VEGF, коллагена I / III типов в ранах анализировали с помощью ELISA.
Воспалительные клетки, нейтрофилы, макрофаги, капилляры и коллаген I / III типов в ранах оценивали гистохимическим окрашиванием. Кровоток в ране оценивали с помощью лазерного доплеровского измерителя кровотока. Уровни провоспалительных и противовоспалительных факторов, VEGF, коллагена I / III типов в ранах анализировали с помощью ELISA.
Результаты
Мы обнаружили, что заживление ран было значительно ускорено в группе терапии hUC-MSC. HUC-MSC мигрировали в рану и заметно снижали количество инфильтрированных воспалительных клеток и уровни IL-1, IL-6, TNF-α и повышали уровни IL-10 и TSG-6 в ранах.Кроме того, неоваскуляризация и уровни VEGF в ранах в группе терапии hUC-MSC были заметно выше, чем в других контрольных группах. Соотношение типов коллагена I и III в группе терапии hUC-MSC было заметно выше, чем в группе ожогов в указанное время после трансплантации.
Заключение
Исследование предполагает, что трансплантация hUC-MSC может эффективно улучшить заживление ран на модели крыс с тяжелыми ожогами. Более того, эти данные могут стать теоретической основой для дальнейшего клинического применения hUC-MSC в ожоговых областях.
Образец цитирования: Liu L, Yu Y, Hou Y, Chai J, Duan H, Chu W, et al. (2014) Трансплантация мезенхимальных стволовых клеток пуповины человека способствует заживлению кожных ран у сильно обожженных крыс. PLoS ONE 9 (2):
e88348.
https://doi.org/10.1371/journal.pone.0088348
Редактор: Димас Тадеу Ковас, Университет Сан-Паулу — USP, Бразилия
Поступила: 29 сентября 2013 г .; Принята к печати: 6 января 2014 г .; Опубликован: 20 февраля 2014 г.
Авторские права: © 2014 Liu et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Национальным фондом естественных наук Китая (81372052), Общим финансовым грантом Китайского фонда постдокторантуры (2013M532200) и Первой дочерней больницей Китайского фонда научных исследований больниц общего профиля. (QN201207).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Тяжелые ожоги — одно из самых опасных хирургических вмешательств. Ключевым этапом спасения тяжелых ожоговых пациентов является как можно более раннее прикрытие ран [1]. Однако аутогенные источники кожи серьезно дефицитны, а источники ксеногенной кожи были ограничены после выполнения Регламента трансплантации человеческих органов.Между тем, использование ксеногенной свиной кожи обычно подвержено реакциям отторжения антигена и риску инфицирования. Кроме того, биоинженерные заменители кожи все еще находятся на стадии экспериментов. Следовательно, необходимы новые и эффективные методы лечения для ускорения заживления ран у пациентов с тяжелыми ожогами.
Мезенхимальные стволовые клетки (МСК) происходят из стромы, которую можно выделить из нескольких тканей человека, таких как костный мозг, жировая ткань, скелетные мышцы, синовиальная оболочка, десна, амниотическая жидкость, пуповинная кровь и пуповина [2], [2] 3].МСК участвуют в регенерации многих поврежденных тканей, таких как легкие, почки и спинной мозг [4], [5], [6], [7], [8]. По сравнению с другими исходными МСК, преимущества МСК пуповины человека (hUC-МСК) заключаются в коротком времени амплификации, высокой скорости пролиферации, более низкой иммуногенности, более высокой безопасности, численности и удобстве [3], [9], [10]. Сообщалось, что hUC-МСК способствуют функциональному восстановлению пациентов с лучевыми ожогами [11]. Однако мало что известно о hUC-MSC при лечении тяжелых термических ожогов.
Однако мало что известно о hUC-MSC при лечении тяжелых термических ожогов.
Предыдущее исследование показывает, что МСК рекрутируются в раны и вносят вклад в заживление ран за счет трансдифференцировки во множественные типы кожных клеток [12]. Однако недавние исследования показали, что паракринная передача сигналов МСК является основным механизмом, определяющим положительные эффекты МСК в ответ на повреждение [13], [14]. Таким образом, цель настоящего исследования — оценить влияние hUC-MSC на заживление ран при тяжелых ожогах и его возможные механизмы.
Материалы и методы
Уход за животными
Все исследования проводились в соответствии с процедурами, соответствующими Международным руководящим принципам биомедицинских исследований с участием животных, выпущенным Советом международных организаций медицинских наук (CIOMS.) и были одобрены институциональным комитетом по уходу за животными и их использованию в Первой дочерней больнице больницы общего профиля PLA. Шестинедельных крыс-самцов линии Вистар (180–220 г) анестезировали внутрибрюшинным введением 300 мг / кг авертина (20 мг / мл) (2,2,2-трибромэтанол, Sigma, США) [15]. В конце эксперимента всех крыс умерщвляли передозировкой 10% хлоралгидрата.
Животная модель тяжелого ожога
126 взрослых крыс-самцов линии Wistar были случайным образом разделены на 3 группы (n = 42): имитация, ожоговая трансплантация и ожоговая трансплантация hUC-MSC.Каждая группа была разделена поровну на семь подгрупп по шесть крыс в соответствии с периодом эвтаназии через 0, 1, 2, 3, 6, 8, 11 недель после трансплантации клеток. Была подготовлена модель 30% TBSA и ожога на всю толщину; после анестезии крыс путем внутрибрюшинной инъекции авертина (300 мг / кг) волосы на спине были полностью удалены, сначала машинкой для стрижки, а затем нанесением депиляционного крема Veet. Затем заднюю часть этих крыс помещали в горячую воду (94 ° C) на 12 с, что вызывало 30% TBSA с ожогом на всю толщину [15]. Для предотвращения шока была сделана немедленная инъекция сбалансированного солевого раствора (40 мг / кг). Затем рану на спине обрабатывали 1% -ной настойкой йода и держали в сухом состоянии, чтобы предотвратить инфекцию. Крыс в имитационной группе помещали в воду при 37 ° C на 12 с, и другие процессы были такими же, как те, что применялись к обожженным крысам. Раны оставляли открытыми, и животных умерщвляли в определенные моменты времени после трансплантации.
Для предотвращения шока была сделана немедленная инъекция сбалансированного солевого раствора (40 мг / кг). Затем рану на спине обрабатывали 1% -ной настойкой йода и держали в сухом состоянии, чтобы предотвратить инфекцию. Крыс в имитационной группе помещали в воду при 37 ° C на 12 с, и другие процессы были такими же, как те, что применялись к обожженным крысам. Раны оставляли открытыми, и животных умерщвляли в определенные моменты времени после трансплантации.
Выделение, культивирование и маркировка hUC-MSC
hUC-МСК были выделены из 3 доношенных здоровых плодов, рожденных посредством кесарева сечения (срок беременности 39-40 недель), размноженных in vitro и охарактеризованных, как описано ранее [16].hUC-МСК из пассажей 3-8 использовали для всех экспериментов. За два дня до трансплантации hUC-MSC метили зеленым флуоресцентным белком (GFP) с использованием лентивирусной стратегии. Положительную долю GFP-меченных hUC-MSC оценивали с помощью проточной цитометрии [17].
Внутривенная инъекция меченных GFP hUC-MSC
Взрослых крыс-самцов случайным образом разделили на 3 группы. Крысам в группе hUC-MSC с трансплантированным ожогом вводили 5 × 10 6 GFP-меченных hUC-MSC в хвостовую вену на 3 день после ожога.Крысы из других групп одновременно получали инъекцию PBS в хвостовую вену. Все крысы в каждой группе прошли клиническую оценку.
Сбор и обнаружение образцов
На 0, 1, 2, 3, 6, 8 и 11 неделях после трансплантации hUC-MSC вся рана с краем 0,5 см была осторожно удалена, промыта в PBS. Затем каждый образец раны был разделен на две части по наименее заживающей части. Один кусок раны хранили в жидком азоте для будущего молекулярного детекции или анализа ELISA, а другой кусок фиксировали в 4% параформальдегиде для гистологического исследования.
Захват изображений и анализ
GFP-меченные hUC-MSC применяли к сильно обожженным крысам для определения характера миграции hUC-MSC in vivo с использованием биолюминесцентной визуализации (BLI, Caliper Life Sciences Inc. , Массачусетс, США). Для оценки развития тяжелых ожоговых ран были получены изображения ран, а время заживления и скорость заживления ран были оценены в определенные моменты времени после трансплантации. Остаточная площадь раны (<1%) считалась полным заживлением раны.Площадь раны измеряли фотографически каждую неделю после трансплантации hUC-MSC, и скорость закрытия раны рассчитывалась следующим образом: Скорость закрытия раны (%) = [(исходная площадь раны - площадь раны в определенные моменты времени) / исходная площадь раны] × 100%. Количественные измерения площади раны оценивали с помощью программного обеспечения для анализа изображений Image Pro Plus 5.1 (Media Cybernetics, Silver Spring, MD).
, Массачусетс, США). Для оценки развития тяжелых ожоговых ран были получены изображения ран, а время заживления и скорость заживления ран были оценены в определенные моменты времени после трансплантации. Остаточная площадь раны (<1%) считалась полным заживлением раны.Площадь раны измеряли фотографически каждую неделю после трансплантации hUC-MSC, и скорость закрытия раны рассчитывалась следующим образом: Скорость закрытия раны (%) = [(исходная площадь раны - площадь раны в определенные моменты времени) / исходная площадь раны] × 100%. Количественные измерения площади раны оценивали с помощью программного обеспечения для анализа изображений Image Pro Plus 5.1 (Media Cybernetics, Silver Spring, MD).
Анализ ДНК человека
Кожные раны крыс в 3 группах в определенные моменты времени после инъекции hUC-MSC собирали, промывали PBS и переваривали с использованием протеиназы K.Затем ДНК каждого образца экстрагировали путем очистки фенол / хлороформ и осаждения изопропанолом. Присутствие специфической ДНК человека было обнаружено с помощью ПЦР-амплификации фрагмента длиной 479 п.н. очень повторяющейся последовательности α-сателлитной ДНК центромерной области хромосомы 17 человека с праймерами, модифицированными в соответствии с Беккером (5′-GGG ATA ATT TCA GCT GAC TAA ACA G-3 ‘; 5′-AAA CGT CCA CTT GCA GTT CTA G-3’) [18]. 40 циклов включали денатурацию в течение 30 с при 95 ° C, отжиг в течение 30 с при 58 ° C и удлинение в течение 40 с при 72 ° C.Продукт ПЦР детектировали с помощью агарозного геля.
Гистологические анализы
После фиксации 4% параформальдегидом в течение 24 часов при комнатной температуре образцы заливали парафином и делали срезы в плоскости, перпендикулярной разрезу. Были приготовлены срезы толщиной пять микрометров, депарафинизированы в диметилбензоле и регидратированы. Препаративные срезы окрашивали H&E в соответствии со стандартными процедурами. Другие срезы инкубировали со специфическими антителами (моноклональные мышиные антитела против крысиного c-ANCA, ED-1, CD31, vWF, коллагена типа I или коллагена типа III; Santa Cruz Biotechnology, Санта-Крус, Калифорния) с последующей инкубацией с соответствующими вторичными антитело и комплекс PAP (пероксидаза-антипероксидаза) и воздействие с использованием DAB (3,3′-диаминобензидина). Воспалительные клетки, c-ANCA + и ED-1 + клетки, капилляры и коллаген типов I и III в ранах подсчитывались в 5 случайно выбранных полях каждого слайда опытным и независимым ученым-клеточником слепым методом.
Воспалительные клетки, c-ANCA + и ED-1 + клетки, капилляры и коллаген типов I и III в ранах подсчитывались в 5 случайно выбранных полях каждого слайда опытным и независимым ученым-клеточником слепым методом.
Лазерная допплерография кровотока (ЛДФ)
Изменения микроциркуляции в кожных ранах в определенные моменты времени после трансплантации оценивали с помощью LDF (Periflux 5000; зонд 404, Perimed, Швеция) [19]. ЛДФ измеряли в соответствии с инструкциями в буклете со спецификациями продукта, предоставленными компанией.Вкратце, для скрепления зонда и кожи / раны крысы использовали специальную двустороннюю липкую ленту, и компьютер считывал значение BPU (единицы перфузии крови). Комнатную температуру поддерживали на уровне 23,6 ° C ± 1 ° C, а влажность составляла 46% ± 2%.
Иммуноферментный анализ (ELISA)
Уровни IL-1, IL-6, TNF-α, IL-10, TSG-6, VEGF, коллагена типов I и III в сильно обожженной ране определяли с помощью наборов ELISA (R&D Systems, Миннеаполис, Миннесота). Образцы раны были разрезаны на мелкие кусочки, и экстракция коллагена типов I и III из тканей раны была проведена с использованием стандартного метода, описанного ранее [20].Другие образцы гомогенизировали в ступке, лизировали в 500 мл буфера для экстракции и центрифугировали при 10 000 об / мин в течение 10 мин. Супернатанты всех образцов детектировали с помощью считывающего устройства для микропланшетов с множественным детектированием, используя сэндвич-набор для ELISA с двумя антителами в соответствии с протоколами производителя. Концентрации IL-1, IL-6, TNF-α, IL-10, TSG-6, VEGF, коллагена I и III типов были нормализованы к общему содержанию белка.
Статистический анализ
Все данные выражены в виде среднего значения ± стандартное отклонение (± s) и были проанализированы с помощью SPSS 16.0 (SPSS Inc., Чикаго, Иллинойс, США). Данные были проанализированы с использованием независимого t-критерия Стьюдента для сравнения между 2 группами и знакового рангового критерия Вилкоксона для денситометрических данных. Когда присутствовало более 2 групп, применяли тест ANOVA (факторный дизайн) с использованием программного обеспечения Prism (GraphPad Software, La Jolla, CA, USA). Различия считались статистически значимыми при P <0,05.
Когда присутствовало более 2 групп, применяли тест ANOVA (факторный дизайн) с использованием программного обеспечения Prism (GraphPad Software, La Jolla, CA, USA). Различия считались статистически значимыми при P <0,05.
Результаты
hUC-MSCs Инъекционные раны, стимулированные для выздоровления, после тяжелых ожогов
Полное заживление кожных ран, т.е.е., с хорошей эпителизацией и остаточной площадью раны <1%, у крыс с тяжелым ожогом оценивали путем общего наблюдения. Время восстановления кожных ран в группе с трансплантированными ожогами hUC-MSC было значительно короче, чем в группе ожоговых. На 2-й неделе после трансплантации клеток струпы в группе hUC-MSC с трансплантированными ожогами были полностью десквамированы, а раны без тяжелой инфекции были чистыми. Однако струпы в ожоговой группе оставались плотно прилегающими к ранам, а гнойная секреция под струпами привела к частичному растворению струпов и серьезному инфицированию ран, что привело к замедленному заживлению ран у сильно обожженных крыс.На 11-й неделе после трансплантации hUC-MSC раневой эпителий 5 из 6 крыс восстановился в группе hUC-MSC, тогда как все 6 крыс в группе ожоговой группы показали отсутствие заживления одновременно (рис. 1A). Время заживления ран в ожоговой трансплантированной hUC-MSC и ожоговой группах составило 74 ± 4 дня и 93 ± 3 дня соответственно. Время заживления ран в группе с пересаженными ожогами hUC-MSC было значительно короче, чем в группе ожоговых (** P <0,01; рис. 1B), а скорость заживления ран в группе с пересаженными ожогами hUC-MSC была значительно выше, чем в ожоговой группе на 2, 3, 6 и 8 неделях после трансплантации (* P <0.05, ** P <0,01; Рис. 1С).
Рис. 1. Инъекция hUC-MSC способствовала заживлению ран после тяжелого ожога.
(A) Типичные изображения кожных ран в разные моменты времени после трансплантации hUC-MSC. (B) Статистический анализ времени заживления ран был представлен на гистограмме. Время заживления ран в группе с пересаженными ожогами hUC-MSC было значительно короче, чем в группе ожоговых. (C) Статистический анализ скорости заживления ран через 2, 3, 6 и 8 недель после трансплантации был представлен на гистограмме.Скорость заживления ран в группе с пересаженными ожогами hUC-MSC была значительно выше, чем в группе ожоговой в то же время. Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 по сравнению с ожоговой группой, соответственно.
(C) Статистический анализ скорости заживления ран через 2, 3, 6 и 8 недель после трансплантации был представлен на гистограмме.Скорость заживления ран в группе с пересаженными ожогами hUC-MSC была значительно выше, чем в группе ожоговой в то же время. Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 по сравнению с ожоговой группой, соответственно.
https://doi.org/10.1371/journal.pone.0088348.g001
Мечение и миграция hUC-MSC
hUC-MSC из пассажей 3-8 имели однородную форму веретена и находились в своем логарифмическом цикле умножения.HUC-MSC метили зеленым флуоресцентным белком (GFP) с использованием стратегии лентивирусного вектора. Наши пилотные данные демонстрируют, что эта стратегия очень эффективна в производстве инфекционных вирусных частиц, экспрессирующих GFP (95,2% ± 3,5%) в привитых hUC-MSC (рис. 2А).
Рисунок 2. hUC-МСК культивировали, метили и отслеживали in vivo у крыс с тяжелыми ожогами.
(A) P3 hUC-MSC наблюдали с помощью светлопольной микроскопии с использованием инвертированного микроскопа. GFP-меченые hUC-MSC наблюдали с помощью инвертированной флуоресцентной микроскопии, а положительные уровни GFP-меченных клеток оценивали с помощью проточной цитометрии.Увеличение 100 раз. (B) GFP-меченные hUC-MSC мигрировали в кожные раны крыс с тяжелыми ожогами в разные моменты времени после трансплантации клеток. (C) ДНК человека в кожных ранах крыс с тяжелыми ожогами анализировали с помощью ОТ-ПЦР.
https://doi.org/10.1371/journal.pone.0088348.g002
Для оценки динамического перемещения и самонаведения hUC-MSC в ответ на тяжелые ожоговые раны in vivo , 5 × 10 6 GFP-меченый hUC-MSC трансплантировали крысам с тяжелыми ожогами, и последовательную визуализацию BLI проводили через 1-3 недели после трансплантации hUC-MSC.На 1-й неделе после трансплантации мы наблюдали, что hUC-MSC мигрировали в тяжелые ожоговые раны, и эти GFP-меченные hUC-MSC в основном концентрировались на краю раны и в основании раны на 2-й и 3-й неделе после трансплантации hUC-MSC. (Рис. 2B).
(Рис. 2B).
Не было продукта ПЦР специфической ДНК человека в ранах группы с тяжелым ожогом, но сигналы ПЦР специфической ДНК человека были представлены в ранах группы hUC-MSC с трансплантированными тяжелыми ожогами на 1-й, 2-й, 3-й неделях ( Рис. 2С).
Противовоспалительный эффект hUC-МСК в ране
Окрашивание
H&E срезов кожной раны показало, что первичные инфильтрирующие клетки в сильно обожженной ране были воспалительными клетками.Общее количество воспалительных клеток в группе с трансплантированными ожогами hUC-MSC было заметно ниже, чем в группе ожоговых, и количество воспалительных клеток в группе с ожогом выше, чем в группе имитации, а в группе с ожогом наблюдался абсцесс. Количество инфильтрирующих нейтрофилов (c-ANCA + ) и макрофагов (ED-1 + ) в кожных ранах в группе подвергнутых ожоговой трансплантации hUC-MSC было значительно ниже, чем в группе ожоговых, и положительные показатели c- ANCA и ED-1 в ожоговой группе были заметно выше, чем в фиктивной (рис.3А). Результаты количественного анализа представлены на соответствующей гистограмме (рис. 3Б).
Рисунок 3. Обнаружен противовоспалительный эффект hUC-MSC на кожные раны крыс с тяжелыми ожогами (A) Инфильтрацию воспалительных клеток в ранах оценивали по окрашиванию H&E.
Положительное окрашивание на нейтрофилы (c-ANCA) и макрофаги (ED-1) исследовали с помощью иммуногистохимии. (B) Количественный анализ положительного окрашивания нейтрофилов (c-ANCA) и макрофагов (ED-1) показан на соответствующей гистограмме.(C, D, E) Провоспалительные цитокины IL-1, IL-6 и TNF-α в ранах оценивали с помощью набора для ELISA. Уровни IL-1, IL-6 и TNF-α в группе с трансплантированными ожогами hUC-MSC были значительно ниже, чем в группе ожоговых, а их уровни в группе ожогов были значительно выше, чем в группе фиктивных. (F, G) Противовоспалительные цитокины IL-10 и TSG-6 в ранах оценивали с помощью набора для ELISA. Уровни IL-10 и TSG-6 в группе hUC-MSC с трансплантированными ожогами были значительно выше, чем в других контрольных группах. Значения представлены как среднее ± стандартное отклонение (n = 6), двойная звездочка (**) означает p <0,01.
Значения представлены как среднее ± стандартное отклонение (n = 6), двойная звездочка (**) означает p <0,01.
https://doi.org/10.1371/journal.pone.0088348.g003
Кроме того, мы оценили уровни основных провоспалительных факторов (IL-1, IL-6 и TNF-α) и противовоспалительных цитокинов ( IL-10 и TSG-6) в кожных ранах в 3 группах на 2 неделе после трансплантации. Мы обнаружили, что уровни IL-1, IL-6 и TNF-α в группе с трансплантированными ожогами hUC-MSC были значительно ниже, чем в группе ожоговых, а уровни этих цитокинов в группе ожоговых были значительно выше, чем в группе с ожоговыми клетками. в фиктивной группе (рис.3C, 3D, 3E). Однако уровни противовоспалительных цитокинов, таких как IL-10 и TSG-6, были значительно выше, чем в двух других группах (фиг. 3F, 3G).
Влияние hUC-MSC на неоваскуляризацию раны
На 3-й неделе после трансплантации hUC-MSC неоваскуляризация раны произошла как в ожоговой, так и в ожоговой трансплантированной группе hUC-MSC. Неоваскуляризацию количественно оценивали путем подсчета микрососудов. По сравнению с ожоговой группой, группа hUC-MSC с пересаженной ожогом содержала больше микрососудов (рис.4А). Результаты количественного анализа представлены на соответствующей гистограмме (рис. 4Б).
Фиг.4. Влияние hUC-MSC на неоваскуляризацию раны на 3-й неделе после трансплантации клеток.
(A) Образцы ран в группах hUC-MSC с имитацией, ожогом и пересаженными ожогами были окрашены на маркеры сосудистых эндотелиальных клеток CD31 и vWF с использованием иммуногистохимии. (B) Количественный анализ микрососудов показан на соответствующей гистограмме. (C) Уровень VEGF в ранах оценивали с помощью набора для ELISA.Уровень VEGF в группе с трансплантированными ожогами hUC-MSC был значительно выше, чем в других контрольных группах. (D) Микроциркуляцию кожной раны оценивали с помощью лазерного допплеровского измерителя кровотока. Микроциркуляция кожной раны в группе ожоговой трансплантации hUC-MSC была заметно выше, чем в группе ожоговой на 1, 2, 3, 6 и 8 неделях после трансплантации. Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 соответственно.
Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 соответственно.
https://doi.org/10.1371/journal.pone.0088348.g004
Мы дополнительно исследовали уровень VEGF в кожных ранах, чтобы определить возможное влияние hUC-MSC на ангиогенез раны. Уровни VEGF в группах hUC-MSC с трансплантированными ожогами были значительно выше, чем в других контрольных группах (фиг. 4C), что указывает на то, что hUC-MSC приводили к усилению ангиогенеза раны.
Микроциркуляцию кожной раны оценивали с помощью лазерного допплеровского измерителя кровотока (ЛДФ).Микроциркуляция кожной раны в группе с трансплантированными ожогами hUC-MSC была заметно выше, чем в группе ожоговых через 1, 2, 3, 6 и 8 недель после трансплантации (рис. 4D).
Все результаты предполагают, что hUC-MSC способствовали неоваскуляризации тяжелых ожоговых ран.
Модификация накопления коллагена типов I и III в ране
Коллаген I и III типов являются основными типами коллагена здоровой кожи, а соотношение коллагена I и III типов определяет ход заживления ран.Обработка сильно обожженных ран с помощью hUC-МСК изменила накопление коллагена типов I и III на 3-й неделе после трансплантации (рис. 5А). Результаты количественного анализа представлены на соответствующей гистограмме (рис. 5Б). Результат elisa также показал аналогичный результат. По сравнению с ранами в группе с тяжелым ожогом соотношение коллагена типов I и III в группе с трансплантированными ожоговыми клетками hUC-MSC значительно повышалось на 1, 2, 3, 6, 8 и 11 неделях после трансплантации (фиг. 5C).
Рисунок 5.Модификация накопления коллагена I и III типов в ране.
(A) Обработка сильно обожженных ран с помощью hUC-MSC изменяет накопление коллагена типов I и III на 3-й неделе после трансплантации. (B) Количественный анализ соотношения типов коллагена I и III показан на соответствующей гистограмме. (C) Уровни коллагена типов I и III в ранах в различные моменты времени после трансплантации оценивали с помощью набора для ELISA. По сравнению с ранами в группе с сильным ожогом, hUC-MSC значительно повышали соотношение коллагена типов I и III в ране на 1, 2, 3, 6, 8 и 11 неделях после трансплантации.Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 соответственно.
По сравнению с ранами в группе с сильным ожогом, hUC-MSC значительно повышали соотношение коллагена типов I и III в ране на 1, 2, 3, 6, 8 и 11 неделях после трансплантации.Значения представлены как среднее ± стандартное отклонение (n = 6), звездочка (*) и двойная звездочка (**) означают P <0,05 и p <0,01 соответственно.
https://doi.org/10.1371/journal.pone.0088348.g005
Обсуждение
Необходимо быстрое и соответствующее лечение тяжелых ожогов, особенно в острой фазе. В последнее время МСК стали перспективным методом лечения радиационно-индуцированных ожогов [1]. Учитывая терапевтическую эффективность МСК при радиационно-индуцированных ожогах, существует большой интерес к потенциальному использованию МСК для лечения термических ожогов и тяжелых ожогов.В этом исследовании мы обнаружили, что большое количество меченных GFP hUC-MSC мигрировало в рану через кровообращение. Раны, обработанные hUC-MSC, показали более быстрое закрытие ран, предположительно из-за того, что hUC-MSC снижали воспалительную реакцию, способствовали ангиогенезу и модифицировали накопление коллагена в локально обожженной коже в различные моменты времени после трансплантации паракринными цитокинами.
В настоящем исследовании hUC-MSC мигрировали в рану и располагались на краю раны и в основании раны.Но механизм, ответственный за нахождение hUC-MSC в раны, не совсем понятен, он, вероятно, включает сложное взаимодействие молекул адгезии, хемокинов и протеаз внеклеточного матрикса [21]. Одно исследование продемонстрировало, что внутрикожная инъекция хемокина SLC / CCL21 на краю раны увеличивает набор МСК, вводимых внутривенно, и значительно ускоряет закрытие раны [22].
Некоторые исследования подтвердили, что процесс заживления ран может быть нарушен инфекцией, некрозом и повышенным уровнем воспалительных факторов.Даже постоянное воспаление в ране создавало каскад, который сохранял длительное состояние [23], [24], [25]. Наши результаты показали, что hUC-МСК заметно ослабляли воспаление на локально обожженной коже за счет уменьшения инфильтрации нейтрофилов и макрофагов, а также продукции провоспалительных цитокинов. Между тем, введение hUC-MSC явно увеличивало продукцию противовоспалительных цитокинов, стимулированных IL-10 и TNF-α, гена / белка 6 (TSG-6), которые были основными участниками противовоспалительного цитокинового профиля hUC-MSC.
Между тем, введение hUC-MSC явно увеличивало продукцию противовоспалительных цитокинов, стимулированных IL-10 и TNF-α, гена / белка 6 (TSG-6), которые были основными участниками противовоспалительного цитокинового профиля hUC-MSC.
Кровоснабжение — ключ к заживлению ран. Несколько исследований продемонстрировали, что некоторые паракринные факторы питания, секретируемые МСК, такие как VEGF, основной фактор роста фибробластов (FGF2) и фактор роста гепатоцитов (HGF), способствовали неоваскуляризации поврежденных тканей [26], [27]. Несколько исследований также выявили способность МСК улучшать кровоснабжение тканей, способствуя прорастанию эндотелиальных клеток за счет секреции растворимого фактора [28]. Наше исследование также показало, что hUC-MSC повышают уровень VEGF в тяжелых ожоговых ранах и способствуют ангиогенезу раны.Кроме того, мы предположили, что hUC-MSC ускоряют заживление сильно обгоревшей раны паракринным VEGF, увеличивая ангиогенез раны.
Коллаген как структурно и функционально важная молекула, которая создает каркас в соединительной ткани, также участвует на каждой стадии заживления ран [29]. Коллаген I и III типов — это основные типы коллагена для здоровой кожи. Кроме того, соотношение коллагена I и III типов в ранах, в основном, определяет процесс заживления ран [29].Наши результаты показали, что hUC-МСК могут изменять накопление коллагена I и III типов и повышать соотношение коллагена I и III типов в сильно обожженной ране. Предыдущее исследование также показало, что МСК способствуют заживлению ран за счет секреции коллагена I типа и изменения экспрессии генов в дермальных фибробластах [30].
Трансплантация
hUC-MSC ускорила закрытие ран после тяжелых ожогов, стимулируя миграцию hUC-MSC, модулируя воспалительную среду, способствуя образованию хорошо васкуляризованного грануляционного матрикса и коллагенового каркаса.Таким образом, эти данные могут обеспечить теоретическую основу для дальнейшего клинического применения hUC-MSC у пациентов с тяжелыми ожогами.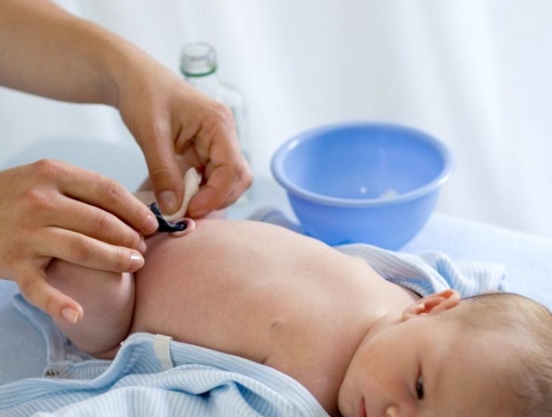
Вклад авторов
Задумал и разработал эксперименты: LYL YHY YSH JKC. Проведены эксперименты: LYL YHY YSH. Проанализированы данные: LYL YHY YSH. Предоставленные реагенты / материалы / инструменты для анализа: HJD WLC HJZ QH JDD. Написал статью: LYL YHY YSH JKC.
Ссылки
- 1.
Леклерк Т., Тепеньер С., Джалт П., Бей Э., Пельтцер Дж. И др.(2011) Клеточная терапия ожогов. Cell Prolif 44: 48–54. - 2.
Суздальцева Ю.Г., Бурунова В.В., Вахрушев И.В., Чеглаков И.Б., Ярыгин К.Н. (2008) Сравнение иммунологических свойств культивированных мезенхимальных клеток человека из различных источников in vitro. Булл Эксп Биол Мед 145: 228–231. - 3.
Troyer DL, Weiss ML (2008) Клетки, полученные из желе Уортона, представляют собой примитивную популяцию стромальных клеток. Стволовые клетки 26: 591–599. - 4.
Li J, Li D, Liu X, Tang S, Wei F (2012) Мезенхимальные стволовые клетки пуповины человека уменьшают системное воспаление и ослабляют LPS-индуцированное острое повреждение легких у крыс.Дж. Инфламм (Лондон) 9: 33. - 5.
Бернардо М.Э., Пальяра Д., Локателли Ф. (2012) Терапия мезенхимальными стромальными клетками: революция в регенеративной медицине? Пересадка костного мозга 47: 164–171. - 6.
Салем HK, Thiemermann C (2010) Мезенхимальные стромальные клетки: текущее понимание и клинический статус. Стволовые клетки 28: 585–596. - 7.
Oh JY, Kim MK, Shin MS, Lee HJ, Ko JH и др. (2008) Противовоспалительная и антиангиогенная роль мезенхимальных стволовых клеток в заживлении ран роговицы после химического повреждения.Стволовые клетки 26: 1047–1055. - 8.
Lau K, Paus R, Tiede S, Day P, Bayat A (2009) Изучение роли стволовых клеток в заживлении кожных ран. Exp Dermatol 18: 921–933. - 9.
Фонг С.Ю., Ричардс М., Манаси Н., Бисвас А., Бонгсо А. (2007) Сравнительное поведение роста и характеристика стволовых клеток из человеческого желе Уортона. Reprod Biomed Online 15: 708–718.
Reprod Biomed Online 15: 708–718. - 10.
Бакш Д., Яо Р., Туан Р. С. (2007) Сравнение потенциала пролиферативной и мультилинейной дифференцировки мезенхимальных стволовых клеток человека, полученных из пуповины и костного мозга.Стволовые клетки 25: 1384–1392. - 11.
Maxson S, Lopez EA, Yoo D, Danilkovitch-Miagkova A, Leroux MA (2012) Краткий обзор: роль мезенхимальных стволовых клеток в заживлении ран. Стволовые клетки Transl Med 1: 142–149. - 12.
Сасаки М., Абэ Р., Фудзита Ю., Андо С., Инокума Д. и др. (2008) Мезенхимальные стволовые клетки привлекаются к поврежденной коже и способствуют заживлению ран за счет трансдифференцировки в несколько типов клеток кожи. J Immunol 180: 2581–2587. - 13.
Hocking AM, Gibran NS (2010) Мезенхимальные стволовые клетки: паракринная передача сигналов и дифференцировка во время заживления кожных ран.Exp Cell Res 316: 2213–2219. - 14.
Gnecchi M, Zhang Z, Ni A, Dzau VJ (2008) Паракринные механизмы в передаче сигналов и терапии взрослых стволовых клеток. Circ Res 103: 1204–1219. - 15.
Чу В.Л., Чай Дж.К., Фэн Ю.К., Ма Л., Чжу Г.Й. и др. (2012) [Экспрессия белков, ассоциированных со стрессом эндоплазматического ретикулума, в печени сильно обожженных крыс]. Чжунхуа И Сюэ За Чжи 92: 853–856. - 16.
Han Y, Chai J, Sun T, Li D, Tao R (2011) Дифференциация мезенхимальных стволовых клеток пуповины человека в дермальные фибробласты in vitro.Biochem Biophys Res Commun 413: 561–565. - 17.
Бай З.М., Дэн XD, Ли Дж.Д., Ли Д.Х., Цао Х. и др. (2013) Артериально трансплантированные мезенхимальные стволовые клетки в модели обратимой односторонней обструкции мочеточника у мышей: визуализация биолюминесценции in vivo и влияние на фиброз почек. Чин Мед Ж. (англ.) 126: 1890–1894. - 18.
Ли Дж., Мяо С., Го В., Цзя Л., Чжоу Дж. И др. (2008) Обогащение предполагаемых эпидермальных стволовых клеток человека на основе размера клеток и адгезии коллагена IV типа. Cell Res 18: 360–371.
Cell Res 18: 360–371. - 19.
Yuhua S, Ligen L, Jiake C, Tongzhu S (2012) Влияние полоксамера 188 на углубление глубоких ожоговых ран второй степени на ранней стадии. Бернс 38: 95–101. - 20.
Янь Х., Пэн К.Дж., Ван К.Л., Гу З.Й., Лу YQ и др. (2013) Влияние геля полифенола кожуры граната на заживление кожных ран у крыс с аллоксан-индуцированным диабетом. Чин Мед Ж. (англ.) 126: 1700–1706. - 21.
Карп Дж. М., Ленг Тео Г. С. (2009) Направление мезенхимальных стволовых клеток: дьявол кроется в деталях.Стволовая клетка клетки 4: 206–216. - 22.
Чжоу Ю.Л., Чжан Х.Ф., Ли XL, Ди Р.М., Яо В.М. и др. (2010) Повышенный уровень фактора 1, полученного из стромальных клеток, усиливает возвращение мезенхимальных стволовых клеток костного мозга при дилатационной кардиомиопатии у крыс. Chin Med J (англ.) 123: 3282–3287. - 23.
Choi H, Lee RH, Bazhanov N, Oh JY, Prockop DJ (2011) Противовоспалительный белок TSG-6, секретируемый активированными МСК, ослабляет вызванный зимозаном перитонит мышей за счет уменьшения передачи сигналов TLR2 / NF-kappaB в резидентных макрофагах.Кровь 118: 330–338. - 24.
Chen K, Wang D, Du WT, Han ZB, Ren H и др. (2010) hUC-МСК мезенхимальных стволовых клеток пуповины человека проявляют иммуносупрессивную активность посредством PGE2-зависимого механизма. Clin Immunol 135: 448–458. - 25.
Краснодембская А, Сонг Й, Фанг Х, Гупта Н, Сериков В и др. (2010) Антибактериальный эффект мезенхимальных стволовых клеток человека частично опосредован секрецией антимикробного пептида LL-37. Стволовые клетки 28: 2229–2238. - 26.
Wang M, Crisostomo PR, Herring C, Meldrum KK, Meldrum DR (2006) Клетки-предшественники человека из костного мозга или жировой ткани продуцируют VEGF, HGF и IGF-I в ответ на TNF с помощью p38 MAPK-зависимого механизма. Am J Physiol Regul Integr Comp Physiol 291: R880–884. - 27.
Ван И, Ван М.


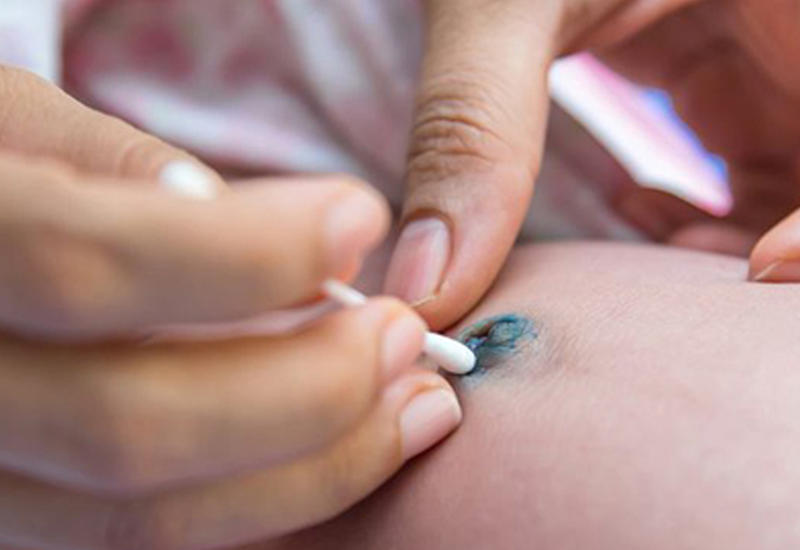
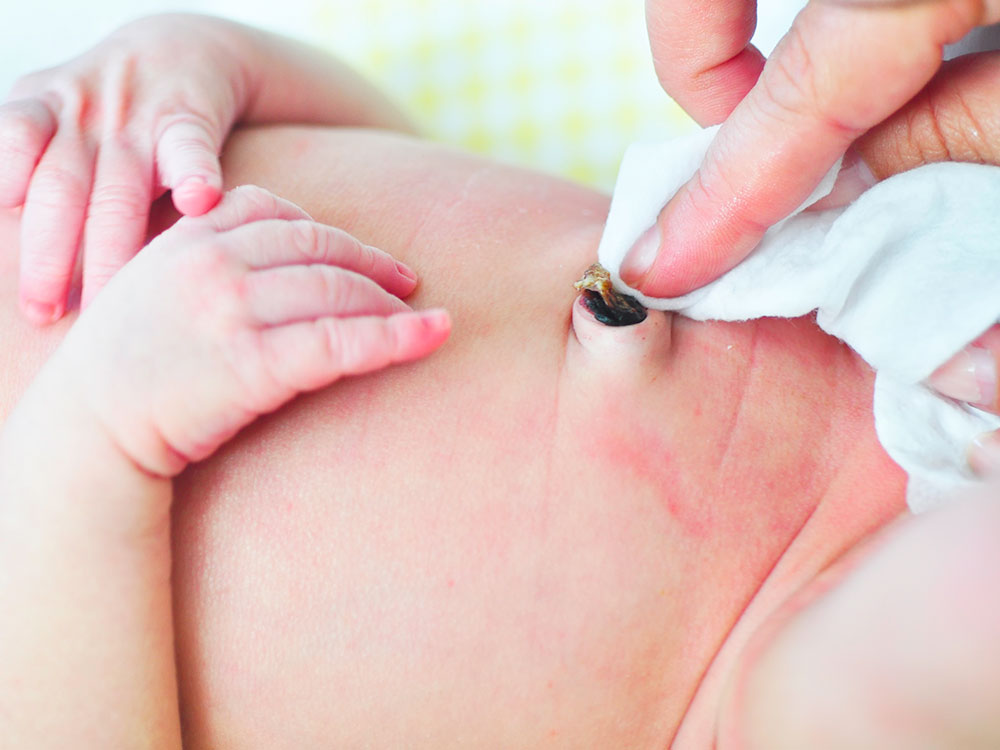
 Reprod Biomed Online 15: 708–718.
Reprod Biomed Online 15: 708–718. Cell Res 18: 360–371.
Cell Res 18: 360–371.