симптомы, первые признаки у женщин и мужчин, сколько живут?
Кишечник человека можно условно разделить на три части:
- Тонкая кишка состоит из двенадцатиперстной (начинается от желудка), тощей и подвздошной.
- Толстая кишка состоит из слепой, восходящей, поперечной и нисходящей ободочной, сигмовидной кишки.
- Прямая кишка — конечный отдел кишечника, который служит для накопления и выведения каловых масс.
Когда говорят «рак кишечника», как правило, имеют в виду опухоли толстой и прямой кишки — так называемый колоректальный рак. В данной статье речь пойдет о раке толстой кишки. О злокачественных опухолях прямой кишки на сайте есть отдельная статья.
Некоторые цифры и факты:
- Рак кишечника — одно из самых распространенных онкологических заболеваний во многих странах.
- Чаще всего (в 94% случаев) заболевание диагностируется у людей старше 50 лет.
 До 59% случаев диагностируются у людей старше 70 лет.
До 59% случаев диагностируются у людей старше 70 лет. - Раком называют злокачественные опухоли, которые развиваются из слизистой оболочки. В кишечнике им чаще всего предшествуют полипы.
- В течение жизни колоректальным раком заболеет примерно каждый 14-й мужчина и каждая 19-я женщина.
- В настоящее время рак кишечника достаточно хорошо поддается лечению. Если опухоль диагностирована на ранней стадии, высоки шансы на наступление ремиссии.
Типы и классификация рака толстой кишки
Большинство злокачественных опухолей толстой кишки (примерно в 96% случаев) представлено аденокарциномами. Они происходят из железистых клеток слизистой оболочки, которые продуцируют слизь. В зависимости от микроскопического строения, аденокарциномы делятся на муцинозные и перстневидно-клеточные.
Выделяют 5 стадий колоректального рака:
- Стадия 0: опухоль находится в верхних слоях слизистой оболочки. Это так называемый рак на месте (in situ).

- Стадия I: опухоль врастает глубже в стенку кишки, но не прорастает ее насквозь.
- Стадия II: опухоль проросла сквозь толщу стенки кишки, но не распространилась на близлежащие (регионарные) лимфоузлы.
- Стадия III: опухолевые клетки распространились в регионарные лимфоузлы.
- Стадия IV: опухоль, которая метастазировала. При колоректальном раке метастазы чаще всего обнаруживают в печени, брюшине, яичниках, легких.
Причины, факторы риска колоректального рака
Невозможно назвать точную однозначную причину, из-за которой в клетке возникла мутация, и она начала бесконтрольно размножаться. Но известны многочисленные факторы риска, которые повышают вероятность развития рака кишечника:
- Возраст. Риски заболеть наиболее высоки после 70 лет. Среди людей младше 50 лет заболевание встречается очень редко.

- Отягощенный семейный анализ. Вероятность заболеть выше среди людей, у которых есть близкие родственники с диагностированным раком кишечника.
- Некоторые наследственные состояния. Например, семейный аденоматозный полипоз ответственен примерно за 1% случаев колоректального рака. У человека, страдающего от этого состояния и не получающего лечения, к 40 годам практически наверняка разовьется злокачественная опухоль.
- Доброкачественные полипы. В большинстве случаев злокачественные опухоли в кишке развиваются именно из полипов, которые обнаруживаются к 60 годам у каждого третьего человека. Не каждый полип трансформируется в рак, это достаточно сложный, длительный процесс.
- Хроническое воспаление в кишке. Болезнь Крона и неспецифический язвенный колит повышают риски примерно на 70%.
- Некоторые заболевания. По неизвестным причинам сахарный диабет, желчнокаменная болезнь, акромегалия повышают риск колоректального рака.

- Избыточная масса тела. Примерно в 13% случаев в развитии рака кишечника определенную роль сыграли лишние килограммы.
- Нездоровое питание. Рацион многих современных людей содержит большое количество мяса, полуфабрикатов, очень мало овощей, фруктов, бобовых, злаков. Это повышает риск некоторых онкологических и других заболеваний.
- Вредные привычки. Люди, которые курят и часто употребляют алкоголь, чаще страдают раком кишечника.
Симптомы рака кишечника
Как и всякое онкологическое заболевание, рак кишечника коварен. Он долгое время растет «молча», не вызывая каких-либо симптомов. Но, даже когда симптомы появляются, по ним невозможно однозначно диагностировать злокачественную опухоль, потому что они сильно напоминают проявления других заболеваний пищеварительной системы:
- Боль, периодические болезненные спазмы в животе.
- Изменение характера стула, появление в нем примесей крови, слизи.

- Частые запоры, диарея.
- Повышенное газообразование, вздутие живота.
- Снижение аппетита.
- Потеря веса без видимой причины.
Для того чтобы не «пропустить» заболевание, важно внимательно относиться к своему самочувствию. Нужно обращать внимание на любые необычные, сохраняющиеся в течение длительного времени симптомы. Всегда лучше лишний раз посетить врача и провериться.
Методы диагностики
При подозрении на рак кишечника в первую очередь назначают колоноскопию. Во время процедуры в толстый кишечник вводят через задний проход специальный инструмент в виде тонкой длинной гибкой трубки — колоноскоп. На конце колоноскопа находится миниатюрная видеокамера и источник света. Увеличенное изображение транслируется на экран аппарата, таким образом, врач имеет возможность осмотреть слизистую оболочку кишки изнутри.
Колоноскопия помогает обнаружить любые патологические образования на слизистой толстого кишечника: злокачественные опухоли, полипы, язвы, участки воспаления.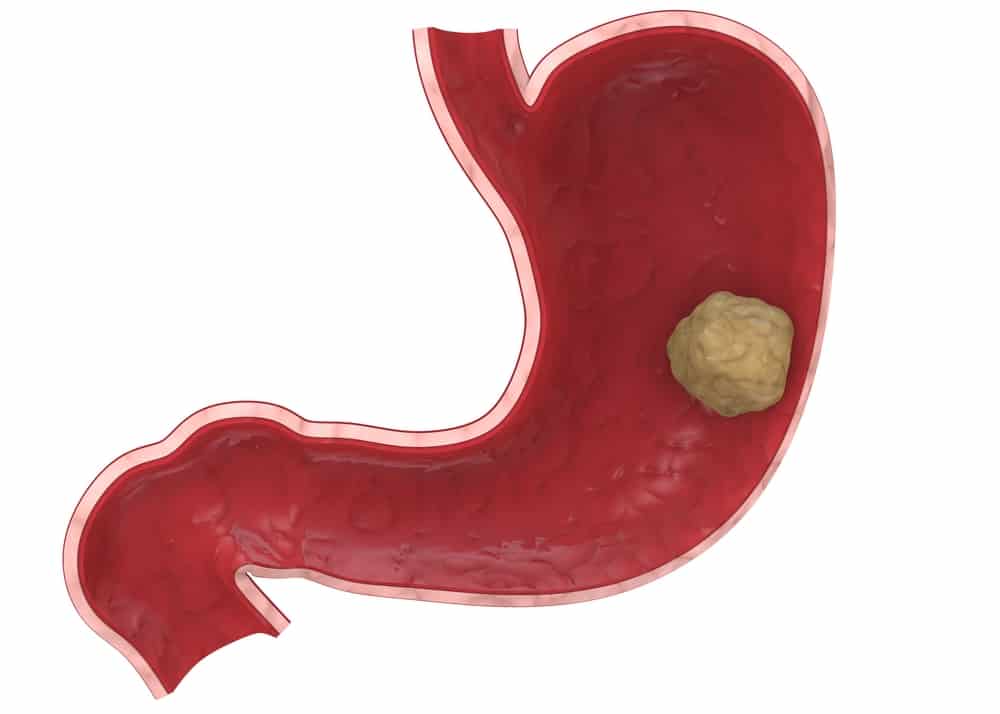 Во время исследования можно получить фрагмент ткани и отправить его на анализ в лабораторию.
Во время исследования можно получить фрагмент ткани и отправить его на анализ в лабораторию.
После того как во время колоноскопии обнаружена злокачественная опухоль, зачастую необходимо уточнить некоторые подробности. Врачу нужно выяснить, насколько сильно новообразование проросло за пределы кишки, распространилось ли оно в регионарные лимфоузлы, есть ли отдаленные метастазы. Для этого используют дополнительные методы диагностики: КТ, МРТ, ПЭТ, рентгенографию костей и грудной клетки, УЗИ органов брюшной полости.
Общий анализ крови помогает выявить анемию. Кишечное кровотечение диагностируют с помощью анализа кала на скрытую кровь. При раке кишки в крови могут повышаться уровни некоторых онкомаркеров, но в целях диагностики злокачественной опухоли такое исследование неинформативно. Уровни онкомаркеров проверяют в динамике, чтобы оценить эффективность лечения.
Что такое скрининг? Насколько он эффективен при раке кишечника?
Так как на ранних стадиях рак кишечника не имеет симптомов, зачастую диагноз устанавливают слишком поздно, когда опухоль уже успела распространиться в организме. Из-за этого ухудшается прогноз. В ранней диагностике помогает скрининг — исследования, которые регулярно проводят у всех людей из группы риска.
Из-за этого ухудшается прогноз. В ранней диагностике помогает скрининг — исследования, которые регулярно проводят у всех людей из группы риска.
Основной метод скрининга при колоректальном раке — колоноскопия. Ее рекомендуется проходить раз в 10 лет всем людям старше 50 лет. Если у человека есть дополнительные факторы риска, например, болезнь Крона, семейный аденоматозный полипоз, врач порекомендует начинать скрининг в более раннем возрасте.
Методы лечения рака кишечника
Лечением пациента, у которого диагностирован колоректальный рак, занимается команда врачей-специалистов. В нее могут входить: онколог, онколог-хирург, химиотерапевт, врач лучевой диагностики, гастроэнтеролог, психоонколог. Выбор лечебной тактики осуществляется с учетом некоторых факторов:
- Стадия и тип рака.
- Расположение опухоли в кишечнике.
- Возраст, состояние здоровья пациента.
- Сопутствующие заболевания, осложнения, к которым привела опухоль.
Хирургическое лечение рака кишечника
Хирургия — основной, наиболее радикальный метод лечения рака кишки. Если опухоль «поймана» на ранней стадии, ее можно удалить с участком окружающей ткани. Образец отправляют в лабораторию, где патологоанатомы изучают под микроскопом внешний вид клеток, край резекции. Если край резекции содержит опухолевые клетки, либо обнаружено, что клетки слабо дифференцированы, практически совсем утратили черты нормальных, врач может назначить повторную операцию. Удаляют часть кишки, которая может содержать опухолевые клетки, это помогает предотвратить рецидив.
Если опухоль «поймана» на ранней стадии, ее можно удалить с участком окружающей ткани. Образец отправляют в лабораторию, где патологоанатомы изучают под микроскопом внешний вид клеток, край резекции. Если край резекции содержит опухолевые клетки, либо обнаружено, что клетки слабо дифференцированы, практически совсем утратили черты нормальных, врач может назначить повторную операцию. Удаляют часть кишки, которая может содержать опухолевые клетки, это помогает предотвратить рецидив.
Зачастую приходится выполнять резекцию (колэктомию) — удалять часть кишечника, содержащую опухоль. Оставшиеся части кишки соединяют — накладывают анастомоз. Иногда наложить анастомоз сразу не удается. В таких случаях выполняют колостомию или илеостомию: на поверхность кожи выводят, соответственно, конец ободочной или подвздошной кишки. Через сформированное отверстие будут временно отходить каловые массы. Спустя некоторые время проводят повторную операцию: колостому или илеостому закрывают, концы кишки соединяют.
В случаях, когда радикальная операция невозможна, и опухоль перекрывает просвет кишечника, прибегают к паллиативным вмешательствам. Их цель — обеспечить нормальное прохождение каловых масс и улучшить состояние пациента:
- Стентирование кишечника. В просвет кишки устанавливают стент — полый цилиндрический каркас с сетчатой стенкой.
- Постоянная колостома. Если нижний отдел толстой кишки заблокирован опухолью, на поверхность кожи выводят колостому для отхождения стула.
Химиотерапия при раке толстой кишки
Химиотерапия при колоректальном раке бывает разных видов:
- Адъювантная: после хирургического лечения, с целью предотвращения рецидива.
- Неоадъювантная: назначается до хирургического вмешательства. Помогает сократить размеры опухоли, упростить ее удаление, перевести неоперабельный рак в операбельный, снизить риск рецидива после операции.
- Паллиативная: назначается в качестве самостоятельного, основного метода лечения, на поздних стадиях, когда радикальное хирургическое лечение невозможно.
 Такая химиотерапия помогает улучшить состояние больного, уменьшить симптомы, повысить продолжительность жизни.
Такая химиотерапия помогает улучшить состояние больного, уменьшить симптомы, повысить продолжительность жизни.
При раке толстого кишечника применяются такие химиопрепараты, как капецитабин, 5-фторурацил, оксалиплатин, иринотекан. Как правило, лечение проводят комбинацией 2–3 препаратов.
Таргетная терапия
В последние десятилетия стало многое известно о процессах, которые происходят в злокачественных опухолях на молекулярном уровне. Ученые идентифицировали многие гены, мутации в которых ответственны за возникновение рака. Известны молекулы, благодаря которым раковые клетки выживают и бесконтрольно размножаются. Созданы препараты, которые могут заблокировать эти молекулы — они называются таргетными препаратами.
При раке толстого кишечника эффективны три группы таргетных препаратов:
- Блокаторы VEGF — вещества, которое раковые клетки вырабатывают, чтобы стимулировать рост кровеносных сосудов и обеспечить себя кислородом, питательными веществами.
 К этой группе относятся препараты: бевацизумаб, рамуцирумаб, зив-афлиберцепт.
К этой группе относятся препараты: бевацизумаб, рамуцирумаб, зив-афлиберцепт. - Блокаторы EGFR — белка-рецептора, который в большом количестве представлен на поверхности раковых клеток и при активации стимулирует их рост. К этой группе препаратов относятся: цетуксимаб, панитумумаб.
- Ингибиторы киназ — сигнальных белков-ферментов. К этой группе относится регорафениб.
Таргетные препараты применяют при колоректальном раке на поздних стадиях.
Иммунотерапия
Иммунотерапия — еще одно современное направление в лечении злокачественных опухолей. Она использует ресурсы иммунной системы для борьбы с раковыми клетками.
В норме иммунная система постоянно вынуждена себя сдерживать: если иммунные клетки будут вести себя слишком агрессивно, могут развиться серьезные аутоиммунные состояния. В качестве «педали тормоза» иммунитет использует особые молекулы — контрольные точки. Раковые клетки умеют использовать контрольные точки себе на пользу.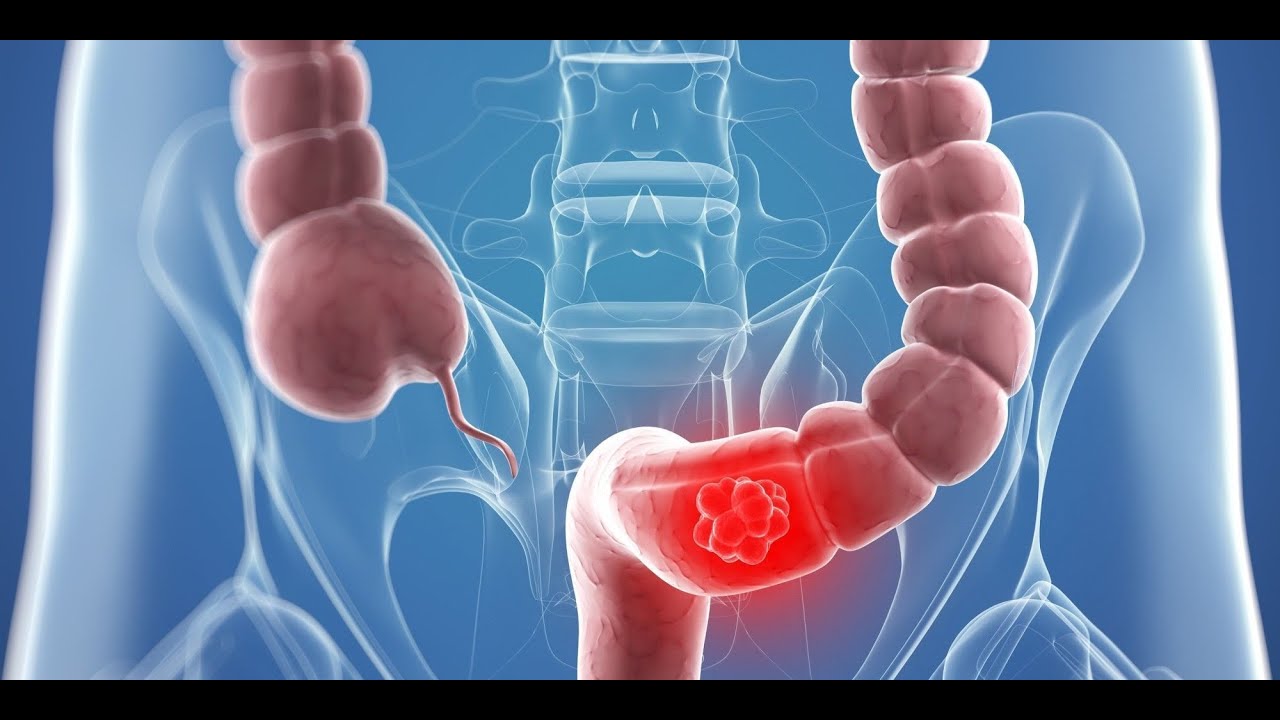 Они блокируют активацию иммунных клеток и, таким образом, защищают себя от их агрессии.
Они блокируют активацию иммунных клеток и, таким образом, защищают себя от их агрессии.
В настоящее время существует особый класс иммунопрепаратов — ингибиторы контрольных точек. Они вновь активируют иммунитет, в результате чего тот атакует опухолевую ткань.
При раке кишечника применяют препараты из группы ингибиторов контрольных точек: ниволумаб (Опдиво) и пембролизумаб (Кейтруда).
Лучевая терапия при раке толстой кишки
Лучевую терапию, как и химиотерапию, при раке толстой кишки применяют до, после операции, в паллиативных целях на поздних стадиях. Кроме того, облучение опухоли можно проводить прямо во время хирургического вмешательства.
Иногда лучевую терапию назначают в сочетании с химиотерапией — это так называемая химиолучевая терапия. Она отличается высокой эффективностью, но сопровождается более серьезными побочными эффектами.
Прогноз выживаемости после лечения рака толстой кишки
Прогноз для онкологических больных оценивают по пятилетней выживаемости — показателю, который обозначает количество пациентов, оставшихся в живых в течение 5 лет. Этот показатель зависит от стадии, при раке толстой кишки он составляет:
Этот показатель зависит от стадии, при раке толстой кишки он составляет:
- На стадии I — 92–95%.
- На стадии II — 63–87%.
- На стадии III — 53–69%.
- На стадии IV — 11%.
Гастроинтестинальная стромальная опухоль ЖКТ — центр лечения онкологии СМ-Клиники
Виды и причины
Как и в случае с другими видами онкологических новообразований, эффективность лечения гастроинтестинальных стромальных опухолей напрямую зависит от ранней диагностики. При этом ГИСО длительное время протекает бессимптомно. Чтобы выявить заболевание вовремя врачи «СМ-Клиника» рекомендуют регулярно проходить профилактическое обследование, особенно по достижении зрелого возраста.
Обычно гастроинтестинальные стромальные опухоли обнаруживаются в желудке (около двух третей всех случаев), реже в кишечнике (примерно 20 %), ещё реже — в пищеводе. ГИСО склонны к метастазированию — вредоносные клетки распространяются через кровь, поражая печень, лёгкие, кости.
Причина возникновения гастроинтестинальных стромальных опухолей ЖКТ — мутации в гене KIT или PDGFRA. Это нарушение приводит к аномальному росту клеток, из которых состоит новообразование.
Симптомы
Клиническая картина заболевания проявляется по мере роста опухоли. При значительных размерах новообразования наблюдаются следующие симптомы:
- плохой аппетит;
- затруднённое глотание;
- потеря веса;
- вздутие живота;
- кровь в кале;
- тошнота, рвота;
- слабость.
Диагностика и лечение
В медицинском центре «СМ-Клиника» диагностика гастроинтестинальных стромальных опухолей ЖКТ осуществляется с помощью инструментальных и лабораторных методик, среди которых:
- биопсия;
- КТ с контрастом;
- эндоскопия;
- УЗИ.
Лечение гастроинтестинальных стромальных опухолей ЖКТ носит комплексных характер, сочетая хирургическое удаление опухоли и таргетную терапию.
Тактика лечения разрабатывается с учетом рекомендаций и международных протоколов. Разработка методики борьбы с ГИСО учитывает особенности новообразования, стадию болезни, состояние здоровья и возраст пациента.
Узнайте подробности о лечении гастроинтестинальных стромальных опухолей ЖКТ и пройдите диагностику в медицинском центре «СМ-Клиника». Оставьте заявку или запишитесь на приём по телефону, указанному на сайте.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Гастроинтестинальные стромальные опухоли (ГИСО). От теории к практике. Лекция для врачей
Лекция для врачей «Гастроинтестинальные стромальные опухоли (ГИСО). От теории к практике». Лекцию для врачей проводит врач-хирург, УЗИ-диагност А. С. Гаевская.
Гастроинтестинальная стромальная опухоль – злокачественная мезенхимальная опухоль, исходящая, предположительно, из клеток Кахала.
ГИСО являются редкими опухолями. Средний показатель заболеваемости в мире составляет 1.0 — 1,5 случая на 100 тысяч человек в год.
Эти опухоли встречаются в любом отделе желудочно-кишечного тракта, наиболее частая локализация в желудке (60-70%), в тонком кишечнике (25-35%).
Клинический пример ГИСО желудка.
Женщина 60 лет. При диспансерном УЗИ ОБП случайно обнаружена небольшая опухоль желудка.
Сканограмма антрального отдела желудка и опухоли (продольный срез).
Сканограмма антрального отдела желудка с опухолью (поперечный срез)
В режиме ЦДК опухоль имеет активный кровоток
Пациентка была прооперирована. Диагноз верифицирован.
Метастазы не обнаружены.
Клинический случай ГИСО тонкого кишечника (мужчина 80 лет)
Мужчина 80 лет. Жалобы на боли и появление опухоли в правой подвздошной области. При УЗИ выявлена крупная опухоль кишечника с зонами некроза и скудным кровотоком.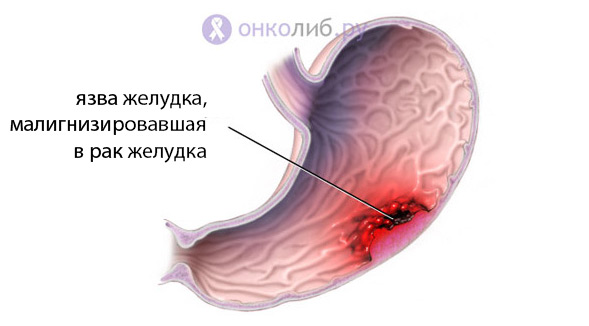 Морфологическая верификация после удаления опухоли – ГИСО подвздошной кишки без метастазов.
Морфологическая верификация после удаления опухоли – ГИСО подвздошной кишки без метастазов.
Клинический случай ГИСО тонкого кишечника (мужчина 75 лет)
Мужчина 75 лет, запоры, при УЗИ ОБП выявлена небольшая опухоль
тощей кишки, по результатам гистологического анализа – ГИСО тощей кишки.
В режиме энергетического допплера опухоль аваскулярна.
Гастроинтестинальные стромальные опухоли (ГИСО) (дополнительный материал)
В последние 20 лет выделен особый тип стромальных опухолей ЖКТ, имеющих веретеноклеточное строение и своеобразное клиническое течение. Эти опухоли получили название гастроинтестинальных стромальных опухолей (ГИСО — gastrointestinal stromal tumors — GIST). Хотя ГИСО составляют всего около 1 % новообразований ЖКТ, они являются самыми частыми мезенхимальными опухолями этой локализации. Несмотря на относительно низкую заболеваемость ГИСО, вопросы их диагностики и лечения остаются актуальными в современной онкологии.
Независимо от размеров и гистологических параметров все ГИСО являются потенциально злокачественными, так как их биологическое поведение зачастую непредсказуемо. В последние годы в диагностике, лечении ГИСО произошли существенные изменения. Применение в лечении пациентов с такими распространенными формами ГИСО, как метастатические или неоперабельные, таргетного препарата иматиниб (гливек) привело к значительному улучшению прогноза.
До 80-х годов ХХ века предполагалось, что большинство веретеноклеточных опухолей ЖКТ возникают из гладкой мускулатуры, и это определяло их первичный диагноз — лейомиобластома, лейомиома, лейомиосаркома. Впоследствии их гистогенез был уточнен при использовании электронной микроскопии и иммуногистохимических методов исследования, позволивших установить сочетание гладкомышечной и невральной направленности дифференцировки опухолевых клеток. Эти клетки являются аналогами возбудимых интерстициальных клеток Кахаля (ИКК) (interstitial cells of Cajal) ЖКТ. ИКК обладают электрической активностью (рacemaker) и объединяют гладкомышечные клетки с периферической нервной системой, участвуя в регуляции перистальтики стенки ЖКТ. В 1983 г. Mazur и Clark для обозначения опухолей, клетки которых обладают свойствами интерстициальных клеток Кахаля, предложили термин «стромальная опухоль». Более полное понимание гистогенеза стромальных опухолей ЖКТ стало возможно в 1998 г. в связи с открытием сверхэкспрессии онкобелка KIT (CD117) в большинстве составляющих ГИСО клеток. Онкобелок KIT — трансмембранный рецептор тирозинкиназы, определяющий дифференцировку примитивных мезенхимальных клеток в ИКК. Его экспрессия оказалась очень специфичной для ИКК. Клеточная пролиферация, адгезия, дифференцировка и туморогенез в ГИСО в большинстве случаев связаны с активацией онкогена с-KIT. В экспериментах при внесении мутированного с-KIT в геном мыши у последней развивались ГИСО.
ИКК обладают электрической активностью (рacemaker) и объединяют гладкомышечные клетки с периферической нервной системой, участвуя в регуляции перистальтики стенки ЖКТ. В 1983 г. Mazur и Clark для обозначения опухолей, клетки которых обладают свойствами интерстициальных клеток Кахаля, предложили термин «стромальная опухоль». Более полное понимание гистогенеза стромальных опухолей ЖКТ стало возможно в 1998 г. в связи с открытием сверхэкспрессии онкобелка KIT (CD117) в большинстве составляющих ГИСО клеток. Онкобелок KIT — трансмембранный рецептор тирозинкиназы, определяющий дифференцировку примитивных мезенхимальных клеток в ИКК. Его экспрессия оказалась очень специфичной для ИКК. Клеточная пролиферация, адгезия, дифференцировка и туморогенез в ГИСО в большинстве случаев связаны с активацией онкогена с-KIT. В экспериментах при внесении мутированного с-KIT в геном мыши у последней развивались ГИСО.
Молекулярными событиями, приводящими к развитию опухоли, являются активирующие опухолеродные мутации генов, экспрессирующих онкобелки KIT и PDGFRa (рецептор фактора роста тромбоцитов-α), относящиеся к группе тирозинкиназ. Большинство ГИСО несут в себе ЮТ-мутации, но около 30% имеют активационные мутации в гене, кодирующем выработку PDGFRa, что определяет двоякий механизм запуска туморогенеза в ГИСО: посредством гиперэкспрессии KIT и (или) PDGFRa. Однако в механизмах опухолевой прогрессии ГИСО участвуют и другие, пока не идентифицированные молекулярные и цитогенетические мутации.
Большинство ГИСО несут в себе ЮТ-мутации, но около 30% имеют активационные мутации в гене, кодирующем выработку PDGFRa, что определяет двоякий механизм запуска туморогенеза в ГИСО: посредством гиперэкспрессии KIT и (или) PDGFRa. Однако в механизмах опухолевой прогрессии ГИСО участвуют и другие, пока не идентифицированные молекулярные и цитогенетические мутации.
ЭПИДЕМИОЛОГИЯ
Частота заболеваемости ГИСО составляет 15-20 случаев на 1 млн в год. ГИСО встречается у пациентов в достаточно широком возрастном диапазоне (возрастная медиана — 55-65 лет), однако пик заболеваемости приходится на 6-ю декаду жизни, а менее 10 % опухолей развиваются в возрасте до 40 лет. ГИСО несколько чаще преобладают у мужчин.
Наиболее частая локализация опухолей — желудок (60-70 %), далее следуют тонкая кишка (20-30 %), прямая или ободочная кишка (5 %) пищевод (<5 %). Сообщается о первичных ГИСО сальника и брыжейки кишечника. Очень редко эктопические ГИСО могут обнаруживаться и вне ЖКТ, например у мужчин в предстательной железе. Опухоль ЖКТ может доходить до малого таза и диагностироваться при гинекологическом или ректальном осмотре.
Опухоль ЖКТ может доходить до малого таза и диагностироваться при гинекологическом или ректальном осмотре.
Симптомы гастроинтестинальных стромальных опухолей
Патогномоничные симптомы отсутствуют, клиническая картина определяется расположением новообразования. Возможны затруднения глотания, чувство преждевременного насыщения, вздутие или боли в животе. У 20% больных гастроинтестинальная стромальная опухоль на начальных стадиях протекает бессимптомно. Из-за неспецифичности и неяркой выраженности проявлений пациенты обращаются к врачу в среднем через 4-6 месяцев после появления первых признаков болезни. Нередко такие неоплазии становятся случайной находкой при проведении КТ, эзофагогастродуоденоскопии и других исследований. Иногда гастроинтестинальные стромальные опухоли обнаруживают во время хирургического вмешательства по поводу другого заболевания.
При прогрессировании онкологического процесса более чем у половины больных наблюдаются желудочно-кишечные кровотечения, сопровождающиеся меленой или кровавой рвотой. У многих пациентов развивается постгеморрагическая анемия. Высокая вероятность кровотечений при ГИСО объясняется частым изъязвлением новообразования. У 10-30% больных гастроинтестинальными стромальными опухолями отмечаются признаки кишечной непроходимости. На поздних стадиях выявляются снижение массы тела, потеря аппетита, слабость и увеличение живота, обусловленное асцитом и/или растущим новообразованием. При пальпации живота определяется опухолевидное образование. При метастазировании в печень возможно увеличение органа и желтуха той или иной степени выраженности.
У многих пациентов развивается постгеморрагическая анемия. Высокая вероятность кровотечений при ГИСО объясняется частым изъязвлением новообразования. У 10-30% больных гастроинтестинальными стромальными опухолями отмечаются признаки кишечной непроходимости. На поздних стадиях выявляются снижение массы тела, потеря аппетита, слабость и увеличение живота, обусловленное асцитом и/или растущим новообразованием. При пальпации живота определяется опухолевидное образование. При метастазировании в печень возможно увеличение органа и желтуха той или иной степени выраженности.
Диагностика гастроинтестинальных стромальных опухолей
Диагноз выставляют с учетом клинических симптомов, данных внешнего осмотра и объективных исследований. Пациентам назначают рентгенографию органов брюшной полости, УЗИ и контрастную КТ органов брюшной полости. При низко расположенных опухолях больных направляют на МРТ. При поражении желудка осуществляют гастроскопию, при поражении толстого кишечника – колоноскопию. При подозрении на метастазирование гастроинтестинальной стромальной опухоли проводят рентгенографию грудной клетки, КТ грудной клетки, рентгенографию позвоночника, сцинтиграфию костей скелета и другие исследования.
При возможности используют ПЭТ-КТ, позволяющую точно определять распространенность гастроинтестинальной стромальной опухоли и выявлять небольшие метастазы, не обнаруживаемые при помощи других методик. Окончательный диагноз устанавливают на основании гистологического и иммунохимического исследования образца ткани, взятого при проведении эндоскопического исследования. Дифференциальную диагностику осуществляют с другими новообразованиями ЖКТ.
КЛИНИЧЕСКИЕ И МОРФОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ
На момент диагностики размеры первичной опухоли могут быть диаметром от 1 до 35 см и более, что определяет достаточно широкий спектр клинических симптомов. При ГИСО могут наблюдаться местные симптомы, обусловленные особенностями локализации опухоли. К таким симптомам относятся: чувство быстрого насыщения, вздутие живота, желудочно-кишечные кровотечения или повышенная утомляемость вследствие анемии. У некоторых пациентов могут отмечаться тошнота, рвота, боли, потеря массы тела, а иногда при пальпации можно обнаружить опухоль. Могут быть и кожные проявления — сыпь, которая проходит, как только удаляют опухоль. Однако чаще течение асимптоматичное или неспецифическое.
Достаточно часто ГИСО желудка выявляется как случайная находка при эндоскопии, лапароскопии или КТ, диспансерном обследовании, хирургическом вмешательстве по поводу другого заболевания или на аутопсии. По разным данным, случайное выявление ГИСО желудка отмечается в 17,7 % случаев.
Согласно M. Miettinen и соавт. (2005), проанализировавших более 1700 случаев с ГИСО желудка, у 54,4 % больных были выявлены симптомы желудочно-кишечного кровотечения, постгеморрагическая анемия или мелена, что определялось глубоким изъязвлением опухоли. Реже (16,8 %) отмечались боли в верхнем этаже брюшной полости, тогда как симптомы острого живота выявлялись лишь в 1,7 % случаев. Средняя продолжительность симптоматики до установления диагноза составляла 4-6 мес.
Для ГИСО ЖКТ характерна триада Carney (1977) в виде сочетания экстраадренальной параганглиомы, хондром легких и самой ГИСО.
Опухоль в основном поражает подслизистую оболочку, распространяясь в стенку ЖКТ. Возможно изъязвление слизистой оболочки. Крупные опухоли обычно выбухают в просвет или в сторону серозной оболочки (рис. 20.1). Ткань опухоли в основном рыхлая, мягкая, редко — саркоматозного вида, на разрезе светло-коричневого, серого или розоватого цвета. Границы мелких опухолей отчетливые. Опухоли крупных размеров зачастую обладают инфильтрирующим ростом. В преобладающем большинстве крупных опухолей наблюдаются центральный некроз и кистозные полости с кровоизлияниями.
Такие опухоли ошибочно могут быть приняты за кисту поджелудочной железы и забрюшиннуюкисту.
Большинство ГИСО имеют достаточно характерную гистологическую картину. Поражения состоят из веретенообразных и эпителиоидных клеток, в связи с чем выделяются веретеноклеточный и эпителиоидный типы (рис. 20.2 и 20.3). Веретенообразную форму клеток имеютоколо 70 % ГИСО, эпителиоидную морфологию — 20 %. В остальных случаях опухоль представлена смесью из веретенообразных и эпителиоидных клеток.
В большинстве опухолей преобладают веретенообразные клетки, образующие завитки или короткие пучки. Ядра клеток овальные, мономорфные, часто имеют везикулярный хроматин. Цитоплазма относительно бледная, с неясными контурами. Напротив, эпителиоподобные опухолевые клетки — полигонально-округлые, диаметром 15-25 мкм, с более отчетливыми клеточными границами и светлой слабоэозинофильной или оптически пустой светлой цитоплазмой. Ядра без атипии, светлые, овально-округлой формы, иногда располагаются эксцентрично. Клетки опухоли разделены на дольки.
Рис. 20.1. Гастроинтестинальная стромальная опухоль желудка
Рис. 20.2. Веретеноклеточный Рис. 20.3. Интенсивная экспресковый тип. Микропрепаратсия антигена c-kit (CD 117).
Иммуногистохимический микропрепарат тонкими прослойками соединительной ткани, придающими им гнездную архитектуру. Данный тип опухолей ранее называли лейомиобластомой.
В большинстве ГИСО наблюдается незначительный ядерный полиморфизм и очень редко определяются явно атипичные клетки. В последнем случае необходим дифференциальный диагноз с лейомиосаркомой.
В ГИСО могут встречаться ослизнение, параганглио- и карциноидоподобные структуры. В небольшом количестве опухолей могут выявляться отчетливые ядерные палисады, встречающиеся в опухолях оболочек периферических нервов. Однако указанные морфологические особенности не имеют какого-либо прогностического значения. К проявлениям патоморфоза опухоли после лечения иманитибом (гливеком) относятся: очаги некроза, кровоизлияния и миксоидная дегенерация. По материалу небольшого фрагмента ткани затруднительно установить правильный диагноз, поскольку опухоль может иметь различную гистологическую структуру, а картина — изменяться на фоне терапии.
Учитывая достаточно широкий спектр морфологических характеристик, ГИСО следует дифференцировать с мезенхимальными, нейроэндокринными, нейрогенными опухолями брюшной полости: истинными лейомиосаркомами и лейомиомами, гломусной опухолью, шванномами (опухоли оболочек периферических нервов), злокачественной меланомой, фиброматозом. От лейомиомы ГИСО отличаются большей клеточностью. Гломусная опухоль ЖКТ обладает позитивностью к виментину и негативна к гладкомышечным маркерам, для шванномы характерны ослизнение, тонкие, веретенообразные клетки (так называемое тонкое веретено).
Иммуногистохимическая диагностика
Более 95 % ГИСО экспрессируют KIT, что позволяет на сегодняшний день рассматривать его как универсальный маркер данного типа опухоли. Для точного диагноза и принятия терапевтического решения необходимо иммуногистохимическое исследование для выявления экспрессии онкобелка KIT (CD117). Окраска на CD117 при ГИСО может быть очаговой и (или) диффузной. В большинстве случаев определяется четкое окрашивание клеточной мембраны и (или) цитоплазмы. Окрашенные структуры в клетке могут иметь точечно-глыбчатую структуру (dot-like). Характер окраски на CD117 может варьировать в самой опухоли, а также изменяться после терапии.
Следует отметить, что кроме ИКК в норме в ЖКТ CD117/KIT всегда экспрессируют тучные клетки, что может служить положительным контролем при иммуногистохимическом исследовании. Кроме ГИСО, СD117 могут экспрессировать тучно-клеточные лейкозы, глиобластомы, мелкоклеточный рак легких. Примечательно, что меланомы глаза, также экспрессируя СD117, метастазируют в печень, минуя легкие, и также лечатся гливеком.
Для диагностики ГИСО применяются и другие иммуногистохимические маркеры, которые, однако, по специфичности уступают CD117. Дополнительные маркеры включают: CD34 — антиген гемопоэтических клеток-предшественников и эндотелия сосудов (чувствительность 60-80 %), гладкомышечный актин (чувствительность — 35 %), S-100 (чувствительность — 10 %) и десмин (чувствительность — 5 %). Для стандартной диагностики ГИСО общепринятым является применение KIT (CD117), CD34 и десмина; последний маркер используется для дифференциальной диагностики c лейомиосаркомами. Следует отметить, что ГИСО желудка всегда экспрессируют CD34, в тонкой кишке этот антиген, как правило, не экспрессируется. При эпителиоидно-клеточном варианте CD117 окрашивается слабо.
Некоторые опухоли, не относящиеся к ГИСО, при технологических дефектах в процессе иммуногистохимической обработки антигена, бывают ложноположительными к CD117. С другой стороны, позитивность к KIT может наблюдаться в метастатической меланоме и сосудистых опухолях. Поэтому всегда при интерпретации иммуногистохимических результатов следует учитывать клиническую картину и морфологические данные.
В 4-5 % случаях опухоли, имеющие клинические и морфологические признаки ГИСО, не дают положительной окраски при реакции с антителами к CD117. Эти опухоли, не экспрессирующие в достаточном для выявления количестве KIT, несут в себе активационные мутации PDGFRa. Поэтому, если все основные характеристики опухоли соответствуют ГИСО, в некоторых случаях диагноз может быть установлен и при негативной реакции на KIT. При наличии опухоли с типичными морфологическими признаками ГИСО, но KIT-отрицательной для подтверждения диагноза в ряде случаев может потребоваться молекулярно-биологическое исследование для определения KIT PDGFRa-мутаций.
Ошибки при диагностике GIST составляют около 6 %. ГИСО ошибочно может диагностироваться как меланома, светлоклеточная саркома, лейомиосаркома, рак, крупноклеточная лимфома, карциноидная и гломическая опухоли, интрадоминальный (тонкокишечный) десмоид, саркома без определенного гистогенеза.
ПРОГНОЗ
Термин «доброкачественная опухоль» при ГИСО неприменим, так как все опухоли независимо от размеров и локализации считаются потенциально злокачественными. Применить универсальные морфологические критерии злокачественности как признаки тканевой, клеточной и ядерной атипии, присущие для злокачественных опухолей другого гистогенеза, при ГИСО не представляется возможным. Безусловно, опухоли при наличии диагностированных метастазов, независимо от гистологическй картины, являются злокачественными и всегда имеют плохой прогноз.
Метастазируют ГИСО в основном гематогенно, и очень редко — лимфогенно. Метастазы наблюдаются главным образом в печени, редко — в лимфатических узлах и почти никогда не выявляются в легких. У некоторых пациентов с распространенной стадией обнаруживают обширные брюшинные отсевы в виде множественных мелких узелков диаметром до 0,5 см с характерной полостью в центре с геморрагическим содержимым.
Более чем у 30 % пациентов к моменту диагностики имеются признаки распространенности в виде интраабдоминальных метастазов и (или) метастазов в печень и опухолевой инфильтрации окружающих органов. В настоящее время критерии клинического стадирования ГИСО еще не разработаны. На практике целесообразно выделение локализованной формы — при отсутствии метастазов и распространенной — при наличии метастазов в печени и диссеминации брюшины.
После проведения проспективных молекулярных исследований с включением в исследуемые группы желудочных и нежелудочных ГИСО, а также анализа результатов лечения первичных и рецидивных опухолей были выделены статистически значимые критерии прогноза течения заболевания. Вероятность метастазирования повышается по мере увеличения размеров опухоли и митотической активности, определяемой при светооптической микроскопии
с окраской гематоксилином и эозином. Дополнительное прогностическое значение имеет определение индекса пролиферативной активности, выявляемого с помощью антител Ki-67. Решающим критерием злокачественности является более 5 митозов в 50 полях зрения в большом поле зрения микроскопа (х400), что коррелирует с внутрибрюшным распространением опухоли и (или) метастазами в печени. Эта корреляция усиливается при увеличении размеров опухоли. Критическими следует считать размеры опухоли >10 см. К сожалению, даже митотические неактивные и относительно мелкие опухоли могут рецидивировать и метастазировать.
К дополнительным гистологическим признакам, которые ассоциируются с агрессивным поведением, относятся инвазия слизистой оболочки, высокая клеточность в опухоли, выраженная атипия клеток и ядер, очаги некрозов и эпителиоидная морфология.
На основании ретроспективного анализа 1765 случаев (Miettinen M. et al., 2005) с учетом размеров опухоли и митотического индекса (табл. 20.1) для определения риска рецидива ГИСО были выделены 4 группы новообразований: очень низкого, низкого, среднего и высокого риска рецидива или степени агрессивности. Опухоли больших размеров с высоким митотическим индексом ассоциируются с максимальным риском, хотя опухоли диаметром >10 см с любым митотическим индексом или опухоли с 10 митозами и более в 50 полях зрения при большом увеличении вне зависимости от размера относят к группе высокого риска.
Таблица 20.1. Прогноз желудочных ГИСО
|
Риск прогрессирования
|
Размер опухоли, см
|
Число митозов на 50 полей зрения,х400
|
|
Очень низкий
|
<2
|
<5
|
|
Низкий
|
2-5 <5
|
<5 6-10
|
|
Средний
|
5-10 >5
|
<5 >5
|
|
Высокий
|
>10 Любой
|
Любой >10
|
Первичная локализация опухоли, пол пациента, гистологический вариант, интенсивность экспрессии CD117 не влияют на уровень общей выживаемости. Значение анатомической локализации продолжает обсуждаться, но считается, что тонкокишечные ГИСО характеризуются более агрессивным поведением, чем желудочные опухоли.
ДИАГНОСТИКА
Диагностика первичной ГИСО желудка зависит от ее размеров и клинической симптоматики. Стандартным методом для диагностики отдаленных метастазов и определения резектабельности опухолей больших размеров и мониторинга при лечении является КТ органов брюшной полости. КТ с контрастированием позволяет охарактеризовать распространенность и наличие метастазов. Для получения качественного контрастного изображения применяют пероральные или внутривенные контрастные препараты.
На КТ ГИСО выглядит как плотное образование, с повышенной контрастностью, хотя крупные опухоли при наличии некрозов, кровоизлияний или участков распада могут иметь менее гомогенную структуру. ГИСО — хорошо васкуляризированная опухоль с четкими границами, часто — с экзофитным ростом в пределах подслизистого слоя, что может приводить к смещению других органов. Однако ГИСО, несмотря на большие размеры, редко приводят к обструкции ЖКТ.
При диагностике ГИСО обязательно проводят эндоскопическое исследование верхних отделов ЖКТ, часто — в сочетании с эндоскопическим УЗИ. При больших опухолях с изъязвлением слизистой оболочки желудка выполняют гастробиопсию, позволяющую получить достаточное количество материала для морфологического исследования. При подслизистых образованиях оптимальным является эндоскопическое УЗИ (УЗ-эндоскопия), позволяющее определить точные размеры опухоли и идентифицировать слои ЖКТ, обнаружить кистозные полости, а также установить вовлеченность окружающих структур или лимфатических узлов.
Эхоэндоскопически ГИСО обычно определяется как гипоэхогенные массы, которые возникают в мышечном слое или мышечной пластинке слизистой оболочки. Критериями агрессивного течения ГИСО, по данным эндоскопического УЗИ, являются:
• размеры опухоли >4 см;
• нечеткие внешние контуры опухоли;
• эхогенные включения;
• кистозные полости в опухоли.
Под контролем эндоскопического УЗИ выполняется тонкоигольная биопсия, рассматриваемая как ведущий метод в уточнении диагноза перед хирургической резекцией; она позволяет получить диагностический материал более чем в 75 % случаев.
Ткань ГИСО очень нежная и легко кровоточит при травматизации. Поэтому при подозрении на «стромальную опухоль», если возможно полное ее удаление по данным первичного обследования, проводить биопсию до операции не рекомендуется вследствие высокого риска диссеминации клеток. Исключение — эндоскопическая биопсия, которая не сопряжена с риском интраабдоминального распространения опухоли. Отметим, что зачастую материала предоперационной биопсии бывает недостаточно для дооперационной диагностики. Поэтому хирургическое удаление первичной опухоли рекомендуется выполнять у всех пациентов, способных перенести операцию.
С целью дифференциальной диагностики под контролем эндоскопического УЗИ также может выполняться подслизистая резекция небольших узлов, подозрительных на ГИСО. Однако при полученном ранее морфологическом подтверждении ГИСО эндоскопическая резекция противопоказана, поскольку связана с возможным вовлечением мышечного слоя стенки органа и с высокой вероятностью наличия остаточной опухоли по линии резекции.
Окончательное заключение о злокачественности процесса возможно лишь на основании морфологического исследования полностью удаленного препарата. Производится светооптическая микроскопия с оценкой гистологической структуры опухоли. Но при этом следует заметить, что морфологическое строение опухоли может измениться после терапии. Для исключения других опухолей и подтверждения диагноза обязательно осуществляют иммуногистохимическое исследование. При этом выявление экспрессии онкобелка с-KIT в ГИСО имеет не только диагностическое, но и очень важное терапевтическое значение, так как позволяет обоснованно назначить таргетную терапию.
Для стадирования гастроинтестинальных стромальных опухолей используется TNM классификация с последующей группировкой по стадиям (7-е издание 2010 г.)
Примечание: основными прогностическими факторами являются: митотический индекс, размер и локализация опухоли. В основу стадирования включены размер опухоли и митотический индекс. Митотический индекс для ГИСО определяют как количество митозов в 50 полях зрения при большом увеличении микроскопа (общая площадь 5 мм2), используя объектив 40х. (табл. 1 и 2)
Символ Т содержит следующие градации:
ТХ — первичная опухоль не может быть оценена
Т0 — отсутствие данных о первичной опухоли
Т1 — опухоль не более 2 см
Т2 — опухоль более 2 см, но не более 5 см в наибольшем измерении
Т3 — опухоль более 5 см, но не более 10 см в наибольшем измерении
Т4 — опухоль более 10 см. в наибольшем измерении
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах
NX — региональные лимфоузлы не могут быть оценены*
N0 — нет метастазов в региональных лимфатических узлах
N1 — есть метастазы в региональных лимфатических узлах
- При ГИСО метастазы в регионарные лимфоузлы встречаются редко, поэтому в тех случаях, когда статус лимфоузлов не может быть оценен клинически и морфологически, рассматривают как N0 вместо Nx или pNx.
- Стадирование ГИСО также зависит и от митотического индекса опухоли. Митотический индекс для ГИСО определяют по количеству митозов в 50 полях зрения (на общей площади 5 мм2) при большом увеличении микроскопа, используя объектив 40х.
Символ М характеризует наличие или отсутствие отдаленных метастазов
М0 — нет отдаленных метастазов М1 — есть отдаленные метастазы
Митотический индекс*
Низкий митотический индекс — не более 5 митозов в 50 полях зрения
Высокий митотический индекс — более 5 митозов в 50 полях зрения
Из-за более благоприятного прогноза при локализации опухоли в желудке все ГИСО разделены на две группы: желудочные и внежелудочные опухоли, и распределение по стадиям проводится отдельно для стромальных опухолей желудка и остальных локализаций
Группировка по стадиям представлена в таблице 1 и 2:
Таблица 1. Распределение по стадиям ГИСО желудка*
|
Стадия IA
|
T1,T2
|
N0
|
M0
|
Митотический индекс
|
|
Стадия IB
|
Т3
|
N0
|
M0
|
Низкий
|
|
Стадия II
|
T1,T2
|
N0
|
M0
|
Низкий
|
|
T4
|
N0
|
M0
|
Высокий
| |
|
Стадия IIIA
|
Т3
|
N0
|
M0
|
Низкий
|
|
Стадия IIIB
|
Т4
|
N0
|
M0
|
Высокий
|
|
Стадия IV
|
Любая Т
|
N1
|
M0
|
Высокий
|
|
Любая Т
|
Любая N
|
М1
|
Любой
| |
|
Любой
|
Таблица 2. Распределение по стадиям ГИСО внежелудочной локализации**
|
Стадия I
|
T1,T2
|
N0
|
M0
|
Митотический индекс
|
|
Стадия II
|
T3
|
N0
|
M0
|
Низкий
|
|
Стадия IIIA
|
Т1
|
N0
|
M0
|
Низкий
|
|
Т4
|
N0
|
M0
|
Высокий
| |
|
Стадия IIIB
|
T2,T3,T4
|
N0
|
M0
|
Низкий
|
|
Стадия IV
|
Любая Т
|
N1
|
M0
|
Высокий
|
|
Любая Т
|
Любая N
|
М1
|
Любой
| |
|
Любой
| ||||
|
* Критерии стадирования опухолей желудка можно применить для первичных ГИСО сальника.
| ||||
** Критерии стадирования опухолей тонкой кишки можно применить для первичных ГИСО остальных внежелудочных локализаций.
Однако в данной классификации не учитываются такие значимые прогностические факторы, как наличие опухолевых клеток по линии резекции и разрыв капсулы опухоли. Эти критерии необходимо учитывать как крайне неблагоприятные факторы прогноза, в основном для решения вопроса об использовании адъювантной терапии иматинибом.
В связи с этим клиницистами, помимо установления стадии, у пациентов с локализованным и местно-распространенным процессом используется различные схемы оценки риска прогрессирования заболевания. Оптимальной для решения вопроса о применении адъювантной терапии иматинибом является схема, предложенная H. Joensuu в 2008г или Miettinen M. и Lasota J. в 2006. Риск прогрессирования по классификации H. Joensuu определяется характеристиками 4 основных прогностических факторов ГИСО: размера опухоли, митотического индекса, локализации и наличия разрыва капсулы опухоли [10, 11].
Таблица №3. Риск прогрессирования заболевания ( H. Joensuu, 2008)
|
Риск
|
Размер опухоли, см
|
Митотический индекс
|
Локализация опухоли
|
|
Очень низкий
|
<2
|
<5
|
Любая
|
|
Низкий
|
2.1-5.0
|
<5
|
Любая
|
|
Промежуточный
|
2.1-5.0
|
>5
|
Желудок
|
|
<5.0
|
6-10
|
Любая
| |
|
5.1-10.0
|
<5
|
Желудок
| |
|
Высокий
|
Любой
|
Любой
|
Разрыв опухоли
|
|
>10
|
Любой
|
Любая
| |
|
Любой
|
>10
|
Любая
| |
|
>5
|
>5
|
Любая
| |
|
2.1-5.0
|
>5
|
Вне желудка
| |
|
5.1-10.0
|
<5
|
Вне желудка
|
Таблица №4. Риск прогрессирования болезни после хирургического лечения у больных с резектабельными ГИСО (по Miettinen, 2006)
|
Параметры опухоли
|
Риск прогрессирования болезни
| ||||
|
Размер опухоли
|
Митотический
индекс
|
Опухоли желудка
|
Опухоли тонкой кишки
|
Опухоли
12-ПК
|
Опухоли прямой кишки
|
|
<2см
|
<5 в 50 ПЗ
|
0% (нет риска)
|
0% (нет риска)
|
0% (нет)
|
0% (нет)
|
|
>2<5
|
<5 в 50 ПЗ
|
1,9%
|
4,3%
|
8,3%
|
8,5%
|
|
(очень низкий)
|
(низкий)
|
(низкий)
|
(низкий)
| ||
|
>5<10
|
<5 в 50 ПЗ
|
3,6%
|
24%
|
34%
|
57%
|
|
(низкий)
|
(промежуточный)
|
(высокий)
|
(высокий)
| ||
|
>10см
|
<5 в 50 ПЗ
|
12%
|
52%
| ||
|
(промежуточный)
|
(высокий)
| ||||
|
<2см
|
>5 в 50 ПЗ
|
0%
|
50%
|
a
|
54%
|
|
(нет)
|
(высокий)
|
(высокий)
| |||
|
>2<5
|
>5 в 50 ПЗ
|
16%
|
73%
|
50%
|
52%
|
|
(промежуточный)
|
(высокий)
|
(высокий)
|
(высокий)
| ||
|
>5<10
|
>5 в 50 ПЗ
|
55%
|
85%
|
86%
|
71%
|
|
(высокий)
|
(высокий)
|
(высокий)
|
(высокий)
| ||
|
>10см
|
>5 в 50 ПЗ
|
86%
|
90%
| ||
|
(высокий)
|
(высокий)
| ||||
а) риск не известен, тем не менее, опухоли тонкой кишки характеризуются плохим прогнозом
б) разрыв опухоли является фактором высокого риска и требует назначения адъювантной терапии
ЛЕЧЕНИЕ
В качестве терапии 1-й линии у пациентов с локализованной ГИСО применяется оперативное лечение. Однако даже при условии полной резекции опухоли медиана выживаемости после хирургического лечения составляет 5 лет.
Целью радикального оперативного вмешательства при первичных ГИСО является полное удаление опухоли в пределах здоровых тканей. ГИСО необходимо удалять аккуратно, без повреждения псевдокапсулы. При травматизации опухоли возможны кровотечение и (или) интраоперационная диссеминация опухолевых клеток. Такая диссеминация определяет крайне высокий риск интраперитонеального рецидива заболевания. Так, по данным исследователей M.D. Anderson Cancer Center (1992), после полного удаления ГИСО желудка, осложнившегося вскрытием псевдокапсулы, отмечается статистически значимое ухудшение выживаемости по сравнению с показателем у пациентов, у которых вмешательство прошло без осложнений.
Вовлечение окружающих структур при ГИСО желудка встречается крайне редко. В случае их вовлечения или если опухоль спаяна с окружающими органами, чтобы избежать вскрытия псевдокапсулы, выполняют моноблочную комбинированную резекцию всего конгломерата в пределах здоровых тканей. При этом непораженные ткани не удаляют.
В отличие от аденокарциномы желудка метастазы в регионарные лимфатические узлы при ГИСО встречаются редко. Поэтому лимфодиссекция рутинно не выполняется, за исключением случаев с явным вовлечением лимфатических узлов.
Некоторые исследователи предлагают выполнять парциальные резекции желудка, однако размер опухоли и ее локализация зачастую требуют более расширенного вмешательства, вплоть до гастрэктомии.
Большинство рецидивов ГИСО после операции происходит в течение первых двух лет. При этом сроки выживаемости не зависят от наличия или отсутствия опухолевых клеток по линии резекции. Даже при полной резекции в пределах здоровых тканей и отсутствии опухолевых клеток по линии резекции главной проблемой остается наличие резидуальной опухоли, поскольку при ГИСО, особенно крупных размеров, в брюшной полости сохраняется некоторое количество опухолевых клеток.
При ретроспективно диагностированных ГИСО, например после вылущивания «лейомиом», необходима радикальная повторная операция; при этом удаляется большой сальник.
В последнее время в лечении ГИСО все шире применяются лапароскопические технологии. Однако эндохирургическое иссечение
из мини-доступа выполняют при размера
Опухоли желудка: виды, симптомы и лечение
Рак желудка ежегодно уносит около 800 000 человеческих жизней по всему миру и занимает второе место в шкале смертности от онкологии. Цифра угнетающая, но узнав, какое количество больных с данной патологией, становится страшно – почти миллион человек, причем мужчины, по показаниям медицинской статистики, болеют чаще, чем женщины.
Как защитить себя от этого страшного заболевания? Прежде чем ответить на этот вопрос, следует знать общую картину патологии, ее виды, факторы вызывающие болезнь.
Доброкачественные и злокачественные новообразования
Опухоль желудка представляет собой появление образований на стенках органа. Они могут быть доброкачественными и злокачественными.
Доброкачественная опухоль в желудке делится на несколько видов:
- Эпителиальный тип – возникает из клеток эпителия и представляет собой полип, который со временем может переродиться в злокачественную опухоль.
- Неэпителиальный тип – образуется из подлежащих тканей. Данный тип опухоли разделен на виды:
- Липома – перерождение жировых клеток.
- Фиброма – опухоль зародилась в соединительных тканях.
- Лейомимома – доброкачественное образование гладкой мускулатуры.
- Гемангиома – новообразование проросло на сосудах.
- Фибромиома – данный вид представляет собой смешанную из мышечной и соединительной ткани опухоль.
Злокачественные новообразования развивается из слизистой ткани органа, и имеют несколько форм роста, классификация которых осуществляется по TNM.
Экзофитный вид – образование прорастает в просвет желудка. Данный тип опухоли имеет подвиды:
- блюдцевидный – представляет собой изъязвленный вид опухоли, края которой приподняты и имеют четкое очертание;
- полиповидный – образование относится к редким видам данного заболевания, без изъязвлений и от здоровой ткани хорошо отделена.
- бляшковидный тип опухоли.
Эндофитный вид – злокачественное образование прорастает в стенки органа. Данный тип раковой опухоли имеет следующие подвиды роста:
- инфильтративно-язвенный вид;
- диффузно-фиброзный.
- Смешанный вид.
Такая классификация учитывает наличие метастаз в лимфоузлах и отдаленное метастазирование, а также особенности первичного образования.
Какая именно опухоль желудка у пациента врачом определяется не только по форме роста, используется еще гистологическая классификация.
Гистологическое определение
Злокачественное образование состоит из шести основных гистологических видов:
- железистый рак или аденокарцинома;
- коллоидный или слизистый рак;
- скирр или фиброзный;
- солидный рак;
- плоскоклеточный рак;
- мелкоклеточная онкология.
Важно! Самым распространенным видом рака желудка считают аденокарциному, а плоскоклеточный рак относят к редким видам данной патологии.
Классификация железистого рака выявляет несколько разновидностей, а именно:
- Папиллярная аденома – данная опухоль характеризуется образованием пальцеподобных эпителиальных наростов с фиброзной основой.
- Тубулярная карцинома – образование состоит из трубчатых структур, которые проросли в фиброзной строме.
- Муцинозная или слизистая аденокарцинома – при таком новообразовании большая часть опухоли содержит в себе внеклеточный муцин в большом количестве. Атипичные клетки располагаются беспорядочно или в виде цепочки и окружены слизью.
- Перстневидноклеточная аденокарцинома – атипичные клетки данной опухоли содержат муцин в цитоплазме. Он сдавливает ядра перерожденных клеток, оттесняя их к периферии, что и придало клеткам вид перстня.
Классификация клеток аденокарциномы по степени их деления определяет три вида:
- Низкодифференцированные аденокарциномы, которые состоят из раздельных клеток и структур.
- Высокодифференцированные аденомы состоят из железистых структур, схожих с неопухолевыми железами желудка.
- Умеренно дифференцированные карциномы представляют собой нечто среднее между первым и вторым видом.
Кроме желудочных видов рака, перечисленных выше, существует еще один – нейроэндокринный рак. Данный вид опухоли относится к гетерогенной. Источником для возникновения образования служат перерожденные нейроэндокринные клетки, которые располагаются по всему организму человека.
Нейроэндокринные новообразования имеют следующие разновидности:
- инсулинома;
- випома;
- соматостатинома;
- глюганома;
- гастринома.
Карциноидная опухоль отличается от других тем, что может передаваться по наследству.
Виды
Коллоидный или слизистый рак желудка отличается прорастанием образования между слоями мышечной оболочки или проникает опухоль в подслизистую желудка.
Образование состоит из слизистой массы, расположенной пластами. При данном виде онкологии желудок слегка увеличивается в объеме, стенки органа, из-за того, что они пропитались слизью становятся более утолщенными.
Фиброзный вид рака желудка характеризуется значительным развитием соединительной ткани, атипичные клетки которой имеют небольшие размеры, напоминающие по виду кубы. В связи с тем, что количество перерожденных клеток может быть незначительным, природу образования можно выявить только при изучении регионального метастазирования. В случае язвенного распада данного образования может открыться кровотечение из желудка.
Солидный или мозговой рак – при такой разновидности опухоли ткань сильно анаплазирована и перенасыщена мелкими атипичными клетками полигональной формы Соединительнотканной стромы, как правило, в такой опухоли практически отсутствуют.
Мелкоклеточный рак желудка относится к редкой форме онкологии. Злокачественное образование состоит из мелких клеток имеющих схожесть с лимфоцитами. Эти клетки образуют большие пласты. Во многих клетках содержатся гастрин, серотанин. Клиническая картина мелкоклеточного рака желудка имеет много общего с мелкоклеточной опухолью легкого.
Плоскоклеточный рак желудка относится к редким заболеваниям. Зарождается он железистом эпителии желудка.
Довольно часто встречается смешанная фора рака желудка. А также некоторые образования при прогрессировании могут перейти из одного в другое состояние. К примеру, аденокарцинома может переродиться в коллоидный или солидный рак, а солидный — в фиброзный.
Важно! Чаще всего опухоль желудка дислоцируется в антральном и пилорическом отделах данного органа — 70% всех случаев. Далее идет малая кривизна тела желудка — 15% случаев. Третье место занимает кардия – 10%. Реже всего новообразование локализуется на передней или задней стенках желудка – 5% случаев.
Как определить наличие болезни? Признаки опухоли желудка напрямую связаны с видом опухоли и местом ее локализации.
Симптомы
В зависимости от вида, стадии болезни различаются и симптомы опухоли в желудке. На ранней стадии болезнь проявляется признаками, схожими с другими патологиями:
- язва желудка и двенадцатиперстной кишки;
- гастрит;
- поллипоз желудка.
Начальные симптомы опухоль желудка имеет неспецифические:
- ощущение тяжести в животе;
- изжога;
- тошнота и рвота;
- болевой синдром верхнего отдела желудка;
- ощущение полного желудка.
Помимо этих признаков в медицине есть «синдром малых симптомов», к ним относятся следующие:
- аппетит снижается или полностью исчезает;
- отказ от любимых блюд, а также мяса, рыбы;
- распирание в эпигастральной зоне живота;
- отсутствие удовольствия от принятой еды;
- рвота в виде «кофейной гущи»;
- жидкий стул черного цвета.
К общим признакам относят:
- апатия, депрессия;
- снижение массы тела без видимых причин;
- вялость;
- повышенная утомляемость, слабость;
- анемия.
При запущенной стадии болезни появляется высокая температура.
Диагностика
При выявлении любого, выше перечисленного симптома необходимо немедленно обратиться к врачу. Специалист поможет, выявит или опровергнуть наличие опухоли желудка. Для этого он назначит диагностику.
На первом месте в диагностике находится сбор анамнеза. На данном этапе врач выявляет жалобы, факторы риска.
Далее специалист переходит к обследованию. В него входит следующее:
- Осмотр. При его помощи выявляются внешние признаки заболевания – потеря веса, изменение цвета лица.
- Пальпация помогает определить наличие опухоли в брюшной полости. Также проводят прощупывание лимфатических узлов. Это необходимо для нахождения метастаз.
- Перкуссия или простукивание. Знающий специалист, используя данный метод, может определить границы образования.
- Аускультация или прослушивание помогает выявить кишечный шум и уровень работы желудка и кишечника.
Но перечисленные методы обследования эффективны только на поздних этапах диагностирования. Собрав анамнез и проведя визуальное обследование, врач назначит инструментальную диагностику при помощи следующих методов:
- Рентгенология.
- Эндоскопия.
- Флуоресцентный.
- Ультразвуковое исследование.
- Компьютерная томография.
- Магнитно-резонансная томография.
- Лапароскопия.
- Использование онкомаркеров.
Проведенное исследование пациента с использованием данных методик дает больше возможности для вынесения точного диагноза и назначения лечения.
Лечение
Лечение опухоли желудка напрямую зависит от степени заболевания, места расположения опухоли и общего состояния больного. Всего существует два метода борьбы с данной патологией:
- Радикальный — подразумевает хирургическое и другое удаление новообразования или метастазов.
- Паллиативный – данное лечение направленно на удаление симптомов заболевания и облегчение жизни пациента.
Радикальная терапия:
Хирургическое вмешательство. Такой метод лечения направлен на иссечение опухоли и имеющихся метастазов из организма при помощи хирургической операции. В зависимости от прогрессирования новообразования будет определяться и тактика операции. Но радикальными бывают не все хирургические вмешательства. В некоторых случаях врачи используют паллиативную терапию.
Химиотерапия. Данный метод используют, как самостоятельный вид терапии, так и в комплексе. Для него используют специальные химические препараты, способные подавлять жизнедеятельность атипичных клеток. Но идеальных комбинаций химиотерапевтических медикаментов не существует, по этой причине больной, прошедший химиотерапию страдает от побочного эффекта.
Лучевая терапия относится к быстропрогрессирующим видам лечения. Использование правильно подобранной лучевой терапии дает больше положительных результатов, чем негативных. Многие медицинские работники относятся скептически к данному методу, но такое отношение ничем не оправдано. Современный подход снизил до минимума лучевую нагрузку на организм больного.
Главная задача использование лучевой терапии при онкологии желудка – это доставка больших доз радиоактивного излучения к основной опухоли и метастазам не затрагивая соседние здоровые ткани. Может быть использована для лечения неоперабельных больных.
Так же для лечения опухолей применяют интрооперационное лучевое лечение. Такой метод лечения подразумевает облучение основы опухоли, с целью уничтожения мелких метастаз и атипичных клеток, которые могли остаться, после хирургического вмешательства.
Лучевое облучение, как и другие перечисленные выше методы лечения сама по себе представляет только паллиативную терапию. Правильное использование комплексной терапии, состоящей из хирургического вмешательства, химиотерапии лучевой терапии намного улучшает прогноз пациента на выздоровление и продолжительность жизни.
В случае если желудочный рак затронул другие органы, то проводят комбинированную операцию с удалением не только пораженного органа, но и части кишечника, поджелудочной железы, селезенки, печени, что по показаниям медицинской статистики продлевает и улучшает качество жизни таких больных.
Важно! Своевременное выявление болезни позволит провести эффективное лечение, предупредив тем самым нежелательные последствия данного заболевания.
Доброкачественные опухоли желудка – лечение и операция
Доброкачественная опухоль желудка – это новообразование, которое не имеет признаков злокачественного процесса. В некоторых случаях остается небольшой риск перерождения при отсутствии соответствующего лечения. Доброкачественные новообразования желудка составляют до 5% от числа всех опухолевых заболеваний желудка, могут развиваться из эпителия, нервной ткани, жировых структур или сосудистых. Рост может быть быстрый или замедленный. По направлению роста выделяют опухоли, движущиеся в сторону просвета желудка, в сторону органов брюшной полости и новообразования, которые разрастаются внутри стенки. По локализации они с одинаковой частотой возникают в теле желудка, антральном отделе или в других местах.
В ЦЭЛТ вы можете получить консультацию хирурга.
- Первичная консультация — 2 700
- Повторная консультация — 1 800
Записаться на прием
Разновидности и особенности желудочных опухолей
По происхождению все новообразования, локализованные в области желудка, разделяют на две большие группы: эпителиальные и неэпителиальные.
Среди первой группы встречаются аденомы и полипы (одиночные или группами). Разница в том, что полипы – это выросты в просвет органа, они обычно округлой формы и имеют широкое основание, могут располагаться на ножке. Развитие полипов ассоциировано с возрастными изменениями – чаще встречаются в возрасте после 40 лет, болезнь поражает мужчин чаще, чем женщин. Гистологически полип представляет собой разросшиеся железистые и эпителиальные ткани с соединительнотканными элементами и развитой сетью сосудов.
Аденомы – это истинные доброкачественные новообразования, состоящие преимущественно из железистой ткани. В отличие от полипов, аденома может чаще перерождаться. Но встречаются реже, чем полипы.
Неэпителиальные опухоли встречаются редко. Они формируются в стенке желудка и могут состоять из самых разных тканей.
К неэпителиальным новообразованиям относят:
- Миому – формируется из мышечной ткани.
- Невриному – формируется из клеток, составляющих миелиновую оболочку нервных волокон.
- Фиброму – развивается из соединительной ткани.
- Липому – состоит из жировой ткани.
- Лимфангиомы – клетки опухоли происходят из стенок лимфатических сосудов.
- Гемангиомы – из клеток, выстилающих кровеносные или лимфатические сосуды.
- и другие варианты, в том числе опухоли смешанной природы.
В отличие от полипов, которые чаще встречаются у мужчин, опухоли неэпителиальной природы чаще диагностируют у женщин. У всех подобных новообразований есть отличительные особенности: как правило, они имеют четкий контур, гладкую поверхность, округлую форму. Могут разрастаться до значительных размеров.
Особо выделяют неэпителиальную опухоль лейомиому – она встречается с более высокой частотой, чем другие новообразования из этой группы. Эта опухоль может вызывать желудочные кровотечения или потенцировать образование язв за счет прорастания в слизистую оболочку желудка. Все неэпителиальные новообразования отличаются достаточно высоким риском онкологического перерождения – малигнизации.
Симптомы
Симптомы опухоли желудка, как правило, слабо выражены. Если новообразование не растет, то практически не проявляется и никак не наблюдается. Очень часто доброкачественные опухоли определяют по косвенным признакам или выявляют случайно при эндоскопическом обследовании.
Клиническая картина включает в себя:
- Проявления, характерные для гастрита, но без достаточных диагностических признаков для постановки диагноза гастрит.
- Кровоизлияние в желудок.
- Снижение аппетита, утомляемость, колебания веса – общие нарушения, которые можно ассоциировать с болезнями пищеварительной системы.
- Диспепсия.
- При частых кровоизлияниях – анемия.
При абсолютно спокойном течении могут наблюдаться боли тупого и ноющего характера, локализованные, как правило, в эпигастрии. Боль нередко возникает после приема пищи. Достаточно часто больные ассоциируют эти симптомы с гастритом.
При опухолях достаточно большого размера могут наблюдаться более выраженные проявления. Появляется тяжесть, возникают приступы тошноты, появляется частая отрыжка. В рвотных массах и стуле больные обнаруживают примеси крови. В лабораторных анализах определяют пониженный гемоглобин. Пациенты испытывают слабость и головокружения. Вне зависимости от сохранности нормального аппетита начинается потеря веса. Всего различают более сотни видов доброкачественных новообразований – с разным течением и клинической картиной. Выраженность симптомов зависит от локализации, размера и скорости роста опухоли. Классической клинической картиной, позволяющей заподозрить опухоль, считается кровотечение, сопровождаемое общими нарушениями работы ЖКТ.
Причины
На сегодняшний день все причины образования доброкачественных опухолей желудка неизвестны. Поэтому правильно говорить о факторах риска – факторах, которые провоцируют патологические процессы, приводящие к появлению новообразований. В их числе наличие других заболеваний ЖКТ.
Наиболее актуальная теория гласит, что полипы появляются в результате нарушений естественной регенерации слизистой желудка. Поэтому полипы часто развиваются на фоне гастрита. Аденомы чаще сопровождаются атрофическим гастритом. При этом отмечено, что более 70% всех новообразований развивается в нижней трети желудка – то есть в зоне с пониженной концентрацией соляной кислоты.
Причиной развития неэпителиальной опухоли могут быть эмбриональные нарушения или наличие хронических заболеваний. Так как конкретных причин выявить не удается, не существует и специфической профилактики доброкачественных опухолей. Нельзя забывать и о наследственной предрасположенности – пациентам, чьи родственники имели новообразования желудка, необходимо даже при отсутствии каких-либо симптомов заболевания желудка выполнять эндоскопическое исследование. В любом случае, при подозрении на наличие полипа или полиповидного образования желудка следует обратиться к хирургу.
Наши врачи
Главный хирург ЦЭЛТ, заслуженный врач РФ, главный специалист ДЗ г. Москвы по эндохирургии и эндоскопии, членкор РАН, заведующий кафедрой факультетской хирургии № 1 ГБОУ БПО МГМСУ, доктор медицинских наук, врач высшей категории, профессор
Стаж 41 год
Записаться на прием
Врач-хирург, заведующий хирургической службой ЦЭЛТ, кандидат медицинских наук, врач высшей категории
Стаж 31 год
Записаться на прием
Диагностика
Диагностика опухолей желудка состоит из трех основных этапов: сбор анамнеза, осмотр, рентгенографическое и эндоскопическое исследование. Также назначают анализ крови, который позволяет выявить снижение уровня гемоглобина, то есть анемию, характерную для опухолей, вызывающих кровотечение. Доброкачественность новообразования определяют по таким признакам: размер, наличие перистальтики (при инструментальном исследовании), форма. Нечеткие контуры, быстрый рост и отсутствие перистальтики свидетельствуют о том, что полип малигнизируется.
Для уточнения диагноза используют ЭГДС – эзофагогастродуоденоскопию, которая позволяет визуально оценить состояние слизистой и в режиме реального времени увидеть форму и размер опухолей, локализованных на слизистой. Этот метод позволяет оценить риск малигнизации – визуально невозможно отличить злокачественную опухоль ранней стадии от доброкачественной, требуется биопсия. При подозрении на онкологию при проведении ФГДС берут пробу для гистологического исследования в лаборатории – биопсия позволяет точно определить характер новообразования.
Так как неэпителиальные опухоли бывают самые разнообразные, то нередко поставить окончательный диагноз удается только после операции.
Исследование опухолей, расположенных вне слизистой, возможно теми же средствами: на рентгенографии видны контуры, а эндоскопическое исследование в сочетании с ультразвуковым метолом (эндо-УЗИ) позволяет определить зоны сдавливания, которые появляются при росте опухолей внутри стенок желудка или в сторону внутренних органов.
Лечение
Лечение доброкачественной опухоли желудка бывает только хирургическое. Консервативные методы неэффективны. Операцию могут отложить при небольшом размере опухоли и отсутствии опасности озлокачествления. Но в большинстве случаев показано хирургическое удаление – с помощью современных технологий операция безопасна. Раннее удаление особенно важно провести в случае, когда не удается достоверно определить характер опухоли – злокачественные новообразования необходимо убрать на ранней стадии.
Существует несколько методов удаления доброкачественной опухоли, которые применяются в настоящее время:
- Эндоскопическая электроэксцизия – так называется малоинвазивная операция, которая подразумевает электрокоагуляцию через эндоскопический доступ. Таким способом удаляют полипы.
- Энуклеация – позволяет снизить кровопотерю, выполняется через эндоскопический или лапароскопический доступ (в зависимости от локализации образования).
- Лапароскопическая резекция желудка – операция с доступом через проколы передней брюшной стенки и разрез стенки желудка, при которой часть желудка удаляют, а затем восстанавливают непрерывный пищеварительный тракт с помощью аппаратного шва.
- Гастрэктомия – полное удаление желудка. Практически не применяют при доброкачественных опухолях.
Эндоскопическая операция показана при обнаружении полипов, которые видны при диагностике и расположены одиночно. Если полип небольшой, достаточно коагуляции. Для новообразований размером более 5 мм применяют электроэксцизию – полип затягивают за ножку, а затем удаляют электрокоагулятором. При полипах более крупного размера проводят подслизистую резекцию образования (через эндоскоп).
Резекцию желудка проводят при множественных полипах или при высоком риске озлокачествления. Гастрэктомию проводят при некоторых случаях диффузного полипоза.
В клинике ЦЭЛТ можно пройти обследование и начать лечение – современные технологии на страже крепкого здоровья.
Наши услуги
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7 (495) 788 33 88
симптомы, классификация, признаки на ранней стадии
В желудке человека могут появляться новообразования различной этиологии. Опухоли доброкачественного типа встречаются редко – в 5% случаев. Они не представляют опасности и хорошо поддаются лечению. Остальные 95% опухолей проявляются как злокачественные. Иными словами, раковые. По статистике в России рак желудка занимает второе место среди онкологических патологий.
Этиология
Раковая опухоль желудка – это образование, вырастающее на слизистой органа из слоя клеток эпителия. Статистика говорит о диагностировании злокачественной патологии желудка чаще у мужчин – минимум в два раза. Группу риска составляют люди старше 45 лет. У детей рак желудка встречается крайне редко. Вероятной причиной врачи считают генетическую предрасположенность.
Болезнь сложно обнаружить на ранних этапах развития. Начальные стадии по симптоматике похожи на другие патологии ЖКТ, к примеру, гастрит. Поэтому смертность от рака желудка в России занимает второе место в списке онкопатологий. За прошедший год из зарегистрированных случаев заболеваний раком 70% диагнозов выявлены уже на последней стадии.
Говоря о доброкачественных опухолях, статистика половой предрасположенности к заболеванию почти аналогичная раковым – у мужчин новообразования появляются чаще, чем у женщин.
Вероятность заболеть увеличивается с возрастом – к 40 годам риск возникновения патологии высок. Прогрессирующая стадия болезни диагностируется в основном у лиц старше 50 лет.
Опухоли доброкачественного типа, как недавно выяснили учёные, возникают не без помощи хеликобактерной бактерии. Она способна спровоцировать рост раковых клеток, а вдобавок привести к доброкачественному новообразованию. Лечение инфекции привело к тому, что количество образований доброкачественного характера заметно снизилось.
Факторы риска
Несмотря на уровень современной медицины, причины возникновения в организме человека рака не сформулированы. Учёные знают, что клетки ДНК внезапно подвергаются мутации. Они растут, делятся, образуя на тканях наросты. С ростом агрессивных клеток образование становится злокачественным. Патология развивается быстро, либо опухоль растёт продолжительное время и больной месяцами не догадывается о происходящем в организме. Процесс возникновения раковых клеток вроде бы понятен. Но какие причины заставляют гены мутировать, неясно.
Исследования сходятся в одном – присутствуют факторы риска, запускающие механизм развития онкологии:
- Воздействие на слизистую желудка бактерии Хеликобактер Пилори. Она выделяет токсические вещества. Токсины агрессивно влияют на клетки органа, разрушая их. Образуется кислая желудочная среда, в результате слизистая видоизменяется. Возникает язвенная болезнь. Появление язв, эрозийных участков может привести к образованию доброкачественной опухоли. Атрофическое состояние стенок слизистой провоцирует развитие условий для роста раковых клеток. Запущенный процесс приводит к появлению злокачественного образования.
- Развитие гастрита атрофического типа. Для болезни характерно воспаление слизистой. При запущенной форме видоизмененные клетки приобретают онкологический характер.
- Отсутствие сбалансированного правильного питания. Наличие в рационе большого количества соленых, копченых, маринованных продуктов и консервантов, наряду с недостатком свежих овощей и фруктов, приводит к нарушению нормальной работы ЖКТ. Постепенно это может вызвать рост онкологической опухоли. Кроме этого, негативным образом на желудок воздействует переедание. Это становится причиной избыточного веса. Как следствие, рак часто диагностируется у больных ожирением.
- Приём антибиотиков, нестероидных препаратов отрицательно влияет на слизистую желудка, может спровоцировать злокачественное образование.
- Недостаток витамина В12, как следствие, анемия в тяжёлой форме.
- Хирургические операции на органах ЖКТ, повреждения органа во время вмешательства.
- Болезнь Менетрие – вид доброкачественной опухоли, когда слизистая оболочка органа растёт, на ней появляются кисты и других образований. Заболевание считают предраковой стадией.
- Жизнь в районах с плохой экологией, а также работа с химическими и токсическими веществами.
- Ослабление иммунитета организма.
- Зависимость от сигарет. Выявлено,
Что такое стромальные опухоли желудочно-кишечного тракта?
Рак начинается, когда клетки тела начинают бесконтрольно расти. Клетки практически в любой части тела могут стать раком, а затем распространиться на другие части тела. Чтобы узнать больше о раке, о том, как он возникает и распространяется, см. Что такое рак?
Опухоли стромы желудочно-кишечного тракта (ГИСО) — это редкие виды рака, которые возникают в особых клетках стенки желудочно-кишечного тракта (ЖКТ), также известного как пищеварительный тракт.Чтобы понять GIST, нужно кое-что узнать о структуре и функциях желудочно-кишечного тракта .
Как работает желудочно-кишечный тракт
Желудочно-кишечный тракт перерабатывает пищу для получения энергии и избавляет организм от твердых отходов. После того, как пища пережевана и проглочена, она проходит через пищевод — трубку, по которой пища проходит через горло и грудь к желудку. Пищевод соединяется с желудком сразу под диафрагмой (тонкая мышечная полоса под легкими).
Желудок — похожий на мешочек орган, который помогает процессу пищеварения, смешивая пищу с желудочным соком.Затем пища и желудочный сок попадают в тонкий кишечник. Тонкий кишечник, длина которого составляет около 20 футов, продолжает расщеплять пищу и всасывает большую часть питательных веществ в кровоток.
Тонкая кишка соединяется с толстой кишкой, первой частью которой является толстая кишка, мышечная трубка длиной около 5 футов. Ободочная кишка поглощает воду и минеральные вещества из оставшейся пищи. Отходы, оставшиеся после этого процесса (кал), попадают в прямую кишку, где они хранятся до тех пор, пока не выйдут из организма через задний проход.
Опухоли стромы желудочно-кишечного тракта
Желудочно-кишечные стромальные опухоли (GIST) начинаются в очень ранних формах специальных клеток в стенке желудочно-кишечного тракта, называемых интерстициальными клетками Cajal (ICC).
ICC иногда называют «кардиостимуляторами» желудочно-кишечного тракта, потому что они сигнализируют мышцам желудочно-кишечного тракта о сокращении для перемещения пищи и жидкости.
Более половины GIST начинаются в желудке. Большинство других начинаются в тонком кишечнике, но GIST могут начинаться где угодно по ходу желудочно-кишечного тракта.Небольшое количество GIST начинается за пределами желудочно-кишечного тракта в близлежащих областях, таких как сальник (фартук (фартук, нависающий над органами в брюшной полости) или брюшина (тонкая оболочка над органами и стенками внутри брюшной полости). ).
Некоторые GIST кажутся гораздо более вероятными, чем другие
врастать в другие области или распространяться на другие части тела.
Врачи смотрят на определенные факторы, чтобы определить вероятность быстрого роста и распространения GIST, например:
Другие виды рака желудочно-кишечного тракта
GIST отличаются от других, более распространенных типов рака желудочно-кишечного тракта, которые развиваются из других типов клеток.
Рак может возникать в любом месте желудочно-кишечного тракта — от пищевода до заднего прохода. Большинство видов рака, которые начинаются в желудочно-кишечном тракте, в том числе большинство видов рака пищевода, рака желудка и рака толстой и прямой кишки, начинаются в клетках железы, выстилающих почти весь желудочно-кишечный тракт. Раковые образования, которые развиваются в этих клетках, называются аденокарциномами .
Рак может также начаться в плоскоклеточных клетках, которые представляют собой плоские клетки, выстилающие некоторые части желудочно-кишечного тракта, такие как верхняя часть пищевода и конец заднего прохода.Раковые образования, начинающиеся в этих клетках, называются плоскоклеточными карциномами .
В желудочно-кишечном тракте также есть нейроэндокринные клетки. Эти клетки имеют некоторые общие черты с нервными клетками, но также имеют другие общие черты с гормон-продуцирующими (эндокринными) клетками. Раковые образования, которые развиваются из этих клеток, называются нейроэндокринными опухолями (НЭО) . Эти виды рака в желудочно-кишечном тракте встречаются редко. Карциноидные опухоли являются примером нейроэндокринной опухоли, обнаруженной в желудочно-кишечном тракте.
Другие редкие типы рака желудочно-кишечного тракта включают различные типы сарком мягких тканей, такие как:
- Лейомиосаркомы: Рак гладкомышечных клеток
- Ангиосаркомы: Рак клеток кровеносных сосудов
- Злокачественные опухоли оболочек периферических нервов (MPNST): злокачественных опухолей клеток, которые поддерживают и защищают нервы
GIST отличаются от этих других типов рака желудочно-кишечного тракта.Они начинаются в разных типах клеток, нуждаются в разных видах лечения и имеют разный прогноз (перспективы). Вот почему врачам необходимо выяснить, есть ли у человека с опухолью в желудочно-кишечном тракте GIST, какой-либо другой тип рака или незлокачественное заболевание.
Признаки и симптомы стромальных опухолей желудочно-кишечного тракта
Большинство стромальных опухолей желудочно-кишечного тракта (ГИСО) развиваются в стенках желудка или тонкой кишки. Эти опухоли часто прорастают в пустое пространство внутри желудочно-кишечного тракта, поэтому они могут не вызывать симптомы сразу, если только они не находятся в определенном месте или не достигают определенного размера.
Небольшие опухоли могут не вызывать никаких симптомов и могут быть обнаружены случайно, когда врач исследует другую проблему. Эти небольшие опухоли часто растут медленно.
Симптомы, связанные с кровопотерей
ГИСО — это хрупкие опухоли, которые легко кровоточат. Фактически, они часто обнаруживаются, потому что вызывают кровотечение в желудочно-кишечном тракте . Признаки и симптомы этого кровотечения зависят от того, как быстро оно возникает и где находится опухоль.
- Острое кровотечение в пищевод или желудок может вызвать у человека рвоту кровью .Когда кровь вырывается вверх, она может частично перевариваться и выглядеть как кофейная гуща.
- При быстром кровотечении в желудок или тонкий кишечник испражнения (стул) становятся черными и дегтеобразными. .
- Острое кровотечение в толстую кишку может сделать стул красным с видимой кровью .
- Если кровотечение медленное, оно часто не вызывает у человека рвоты или изменения стула. Однако со временем медленное кровотечение может привести к снижению количества эритроцитов (анемии), из-за чего человек может чувствовать себя усталым и слабым .
Кровотечение из желудочно-кишечного тракта может быть очень серьезным. Если у вас есть какие-либо из этих признаков или симптомов, немедленно обратитесь к врачу.
Другие возможные симптомы GIST
Другие симптомы GIST могут включать:
- Боль в животе
- Образование или опухоль в брюшной полости
- Тошнота и рвота
- Чувство сытости после небольшого количества еды
- Потеря аппетита
- Похудание
- Проблемы с глотанием (при опухолях пищевода)
Некоторые опухоли становятся достаточно большими, чтобы блокировать прохождение пищи через желудок или кишечник.Это называется препятствием , и оно может вызвать сильную боль в животе и рвоту.
Поскольку ГИСО часто хрупкие, они иногда могут разорваться, что может привести к отверстию (перфорация , ) в стенке желудочно-кишечного тракта. Это также может привести к сильной боли в животе. В этих ситуациях может потребоваться экстренная операция.
Хотя многие из возможных симптомов GIST (например, боль в животе и тошнота) могут быть вызваны другими причинами, кроме рака, если у вас есть эти симптомы, особенно если они длятся более нескольких дней, важно обратиться к врачу.
Типичные варианты лечения стромальных опухолей желудочно-кишечного тракта
Лечение стромальных опухолей желудочно-кишечного тракта (ГИСО) в основном зависит от таких факторов, как:
- Если опухоль может быть резецирована (удалена) хирургическим путем, в зависимости от размера опухоли, где она находится и насколько далеко она распространилась
- Насколько быстро растет опухоль (скорость ее митоза)
- Если опухолевые клетки имеют определенные генные мутации
- Риск возврата опухоли после лечения
Другие факторы, такие как возраст человека и общее состояние здоровья, также могут иметь значение.
Локализованные опухоли меньшего размера (операбельные)
Большинство мелких GIST нуждаются в лечении. Но некоторые очень маленькие опухоли (менее 2 сантиметров в диаметре), не вызывающие никаких симптомов, могут никогда не вырасти настолько, чтобы вызвать какие-либо проблемы. Один из вариантов такой опухоли — просто внимательно наблюдать за ней, проверяя ее с помощью эндоскопии через определенные промежутки времени, например, один или два раза в год. Пока он не растет, дальнейшее лечение может не потребоваться.
Хирургия является основным методом лечения большинства других небольших опухолей.Необходимость дальнейшего лечения после операции зависит от риска возвращения GIST.
Небольшие опухоли, которые не растут быстро, обычно имеют низкий риск рецидива, поэтому зачастую дальнейшее лечение не требуется.
Риск возврата GIST после операции выше, если:
- Опухоль больше
- Не завелась в желудке
- Раковые клетки быстро делятся (имеют высокую скорость митоза)
Если врач считает, что рак имеет средний или высокий риск рецидива на основании этих факторов, обычно рекомендуется адъювантное лечение целевым препаратом иматиниб (гливек) в течение как минимум года после операции.При опухолях, вероятность рецидива которых высока, многие врачи рекомендуют иматиниб не менее 3 лет.
Врач, вероятно, проверит опухолевые клетки на наличие определенных изменений в генах KIT и PDGFRA перед назначением иматиниба. Это связано с тем, что иматиниб вряд ли поможет при опухолях, в которых отсутствует одно из этих генетических изменений.
Локализованные, более крупные (малооперабельные) опухоли
Опухоли, которые больше или находятся в местах, которые затрудняют их полное удаление (резекцию), могут потребовать более обширного хирургического вмешательства, которое может вызвать проблемы со здоровьем как в краткосрочной перспективе, так и в дальнейшем.По этой причине операция обычно не является первым лечением.
Лечение целевым препаратом иматиниб (Гливек) обычно проводится сначала, чтобы попытаться уменьшить опухоль. Но перед началом лечения важно убедиться, что опухоль действительно GIST, поэтому требуется биопсия. В рамках тестирования образца биопсии опухолевые клетки обычно проверяются на наличие определенных изменений в генах KIT и PDGFRA . Это связано с тем, что иматиниб вряд ли поможет при опухолях, в которых отсутствует одно из этих генетических изменений.Если иматиниб назначается, его продолжают как минимум до тех пор, пока опухоль не перестанет сокращаться.
Если опухоль достаточно уменьшится в размерах, может быть проведена операция, если врач считает, что сможет удалить ее безопасно. Иматиниб, вероятно, будет продолжен после операции, чтобы снизить вероятность рецидива рака.
Если опухоль не уменьшилась в размерах, чтобы сделать операцию возможной, иматиниб часто продолжают применять до тех пор, пока кажется, что это помогает. Если он больше не работает, иногда может быть полезно повышение дозы.Если нет или если побочные эффекты слишком серьезны, можно попробовать другой целевой препарат, сунитиниб (Сутент). Если сунитиниб больше не работает, некоторым людям может помочь регорафениб (стиварга). Если этот препарат больше не работает, может помочь рипретиниб (Qinlock).
Опухоли, которые нельзя удалить или распространились на отдаленные участки (неоперабельные опухоли)
Варианты лечения неоперабельных ГИСО зависят от того, почему они неоперабельны, и, если они распространились, насколько обширно распространение.
Операция обычно не является первым лечением этих опухолей, поэтому перед началом лечения важно подтвердить, что опухоль на самом деле является GIST, с помощью биопсии.
Таргетный препарат иматиниб (Гливек) обычно является предпочтительным первым препаратом для лечения наиболее продвинутых ГИСО. (Вместо этого можно использовать целевой препарат авапритиниб (Айвакит), если раковые клетки имеют определенные изменения в гене PDGFRA .) В рамках тестирования биопсийного образца опухолевые клетки могут быть проверены на наличие определенных изменений в KIT. и PDGFRA гены.Это может дать представление о том, насколько вероятно, что иматиниб (или авапритиниб) будет полезным.
Если используется иматиниб, его продолжают до тех пор, пока опухоль не растет (и побочные эффекты допустимы). Если опухоль снова начнет расти, она может отреагировать на увеличение дозы иматиниба. Если нет или если побочные эффекты иматиниба слишком серьезны, может быть полезным переход на сунитиниб (сутент). Если сунитиниб больше не работает, некоторым людям может помочь регорафениб (стиварга). Если регорафениб больше не помогает, можно использовать рипретиниб (Qinlock).
Если опухоль достаточно уменьшится в результате таргетной терапии, для некоторых людей может быть возможным хирургическое вмешательство. За этим может последовать более целенаправленная терапия, если она все еще эффективна.
Если рак распространился только на 1 или 2 участка брюшной полости (например, на печень), врач может посоветовать удалить основную опухоль, а также попытаться удалить эти другие опухоли. Если это так, обязательно поговорите со своим врачом о целях лечения (будь то попытка вылечить рак, помочь вам жить дольше или предотвратить или уменьшить симптомы), а также о его возможных преимущества и риски.
Другие варианты лечения рака, распространившегося на печень, включают абляцию и эмболизацию, чтобы попытаться уничтожить эти опухоли.
Раковые опухоли, которые больше не реагируют на указанные выше таргетные препараты, трудно поддаются лечению. Некоторые врачи могут порекомендовать попробовать другие целевые препараты, такие как сорафениб (Нексавар), дазатиниб (Спрайсел), нилотиниб (Тасигна) или пазопаниб (Вотриент), хотя пока не ясно, насколько полезны эти препараты.
Стандартные химиотерапевтические препараты обычно не очень эффективны.Некоторым людям может быть полезно принять участие в клинических испытаниях нового метода лечения.
Рецидивирующие опухоли
Когда рак возвращается после лечения, это называется рецидивом. Если рак возвращается (рецидивирует) в месте возникновения или рядом с ним, это называется локальным рецидивом . Если он рецидивирует на других участках (например, в легких или печени), это называется удаленным рецидивом . Варианты лечения рецидивирующих GIST зависят от локализации и степени рецидива.
При большинстве рецидивов лечение целевым препаратом иматиниб (Гливек) часто является первым вариантом уменьшения размеров опухолей, если он все еще эффективен и пациент может переносить его прием. Если начальная доза иматиниба не работает, дозу можно увеличить. Другой вариант — попробовать другие препараты таргетного действия, такие как сунитиниб (Сутент), регорафениб (Стиварга) или рипретиниб (Цинлок).
Если рак возвращается в виде одной или нескольких четко определенных опухолей, удаление или уничтожение опухоли может быть вариантом.Врачи до сих пор не уверены, помогает ли удаление GIST, которые возвращаются после лечения, людям жить дольше, поэтому важно обсудить риски и преимущества этого лечения со своим врачом и семьей.
Лучевая терапия также может помочь в лечении таких симптомов, как боль, особенно при опухолях костей.
Если указанные выше таргетные препараты больше не помогают, некоторые врачи могут порекомендовать попробовать другие таргетные препараты, такие как сорафениб (Нексавар), дазатиниб (Спрайцел), нилотиниб (Тасигна) или пазопаниб (Вотриент), хотя пока не ясно, как полезны эти препараты.
Поскольку эти виды рака часто трудно поддаются лечению, вы можете также рассмотреть возможность участия в клинических испытаниях новых методов лечения.
стромальных опухолей желудочно-кишечного тракта | Abdominal Key
Современное управление ГИСО — это многопрофильная задача. Пациентов следует лечить в центре, предлагающем опыт в хирургическом и медицинском лечении заболеваний, с доступными междисциплинарными конференциями по раку для обсуждения нюансов клинико-патологического и иммуногистохимического профиля опухоли и его влияния на определение последовательности комбинированного лечения.
Ведение желудочных ГИСО менее 2 см в диаметре является спорным, поскольку их естественное течение неизвестно с уверенностью, но считается благоприятным. Два исследования показали, что субсантиметровые желудочные GIST (microGIST) относительно распространены, обнаруживаются в 22,5% аутопсий у взрослых старше 50 лет в Германии и у 35% пациентов, перенесших гастрэктомию по поводу рака желудка в Японии. 93,94 Несмотря на относительную частоту, некоторые из этих новообразований, по-видимому, становятся клинически значимыми.До тех пор, пока не будут получены дополнительные данные, наиболее подходящее лечение таких небольших опухолей остается неопределенным.
В итальянском исследовании, сравнивавшем 170 ГИСО размером ≤2 см с 101> 2 см, частота митозов, наблюдаемых в отдельных опухолях, увеличилась с 20% в ГИСО <6 мм до 75% в ГИСО размером 1,7–2,0 см до 100% в GIST размером> 2 см. 95 Из 170 малых ГИСО 135 подверглись мутационному анализу. Основные результаты по сравнению с более крупными GIST заключались в том, что 74% малых GIST имели мутации KIT или PDGFRA с избытком случаев дикого типа, мутации KIT экзона 11 были менее распространены, и наблюдались новые мутации, которые не были обнаружены. сообщается в клинически значимых ГИСО> 2 см. 95
Опухоли желудка, стратифицированные как имеющие низкий риск на основании клинических, патологических и молекулярных особенностей, могут рассматриваться только для активного наблюдения. Решение только о наблюдении должно включать междисциплинарное обсуждение рисков и преимуществ, предоставляемых пациенту и документированных в медицинской карте. Также следует проанализировать клинические и радиологические параметры, требующие перехода к более агрессивному лечению.
Если ведется активный надзор, текущие рекомендации Национальной комплексной онкологической сети (NCCN) рекомендуют эндоскопию с эзофагогастродуоденоскопией (EGD) +/- EUS каждые 6–12 месяцев.Наличие роста поражения до> 2 см, неровные границы вне просвета, изъязвление, гетерогенные эхогенные очаги, наличие кистозных пространств и / или развитие симптомов должны побудить к пересмотру стратегии лечения. 96 Руководства Европейского общества медицинской онкологии (ESMO) рекомендуют ежегодное наблюдение с EUS для предполагаемых GIST размером <2 см, также может быть предложено EUS-FNA. 97 Если диагноз GIST подтвержден, следует предложить операцию. Если пациент не предпочитает хирургическое вмешательство, наблюдение следует продолжить, хотя оптимальная политика наблюдения, основанная на фактических данных, отсутствует. 97
Японские руководящие принципы были разработаны на основе обширного популяционного эндоскопического наблюдения за раком желудка и разграничения результатов EGD и EUS. Подслизистые опухоли желудка <2 см без злокачественных новообразований на EGD в виде изъязвлений, неровных краев или быстрого роста могут сопровождаться наблюдением EGD один или два раза в год. 98,99 Рост опухоли или наличие злокачественных новообразований на EGD требует хирургического вмешательства или дальнейшего обследования, включая КТ, EUS или EUS-FNA.Злокачественные новообразования на EUS (неоднородная паренхима или неровные края) или подтверждение GIST с помощью EUS-FNA являются показаниями к операции. Пациентам с подслизистыми поражениями без подтверждения диагноза GIST и без злокачественных новообразований на EUS может быть предложено хирургическое вмешательство или постоянное наблюдение.
Хирургия остается стандартом лечения и единственным потенциально лечебным вариантом для пациентов с первичными операбельными локализованными GIST. Всем пациентам с ГИСО ≥2 см, симптоматическими опухолями и всеми ГИСО не желудочного происхождения следует рассмотреть возможность хирургической резекции и адъювантного лечения.Преобладают онкологические принципы безопасной хирургической практики, и основной целью операции является резекция всей опухоли с макро- и микроскопически отрицательными краями (R0). С опухолями следует обращаться «без прикосновения», поскольку разрыв или нарушение псевдокапсулы опухоли во время операции связано с повышенным риском рецидива и кровотечения. Формальная лимфаденэктомия требуется редко, за исключением педиатрической популяции, где метастазы в лимфатические узлы могут быть более распространенными. 100,101
Объем хирургической резекции зависит от размера опухоли по отношению к анатомическому расположению и способности безопасно восстановить целостность желудочно-кишечного тракта.Сохранение сфинктера и органа является предпочтительным, хотя к местнораспространенным ГИСО следует подходить с резекцией единым блоком соседних органов, чтобы при необходимости минимизировать возможное нарушение опухоли. В таких случаях хирургической резекции часто предшествует медикаментозная терапия для уменьшения размеров опухоли и сведения к минимуму степени резекции, как описано ниже. Операция обычно представляет собой клиновидную или сегментарную резекцию пораженного желудка или кишечника без широких границ, необходимых для соответствующей аденокарциномы.В серии из 140 пациентов с ГИСО желудка клиновидная резекция была выполнена у 68%, частичная гастрэктомия — у 28% и полная гастрэктомия — только у 4%. 102 Иногда может потребоваться более обширная резекция (полная резекция желудка при большом проксимальном GIST желудка, панкреатодуоденэктомия при периампулярном GIST или абдоминоперинеальная резекция при низком GIST прямой кишки).
Независимо от того, планируется ли открытая или лапароскопическая резекция, к ГИСО обращаются аналогичным образом с использованием предоперационной визуализации в качестве ориентира.Сначала тщательно исследуют брюшную полость, чтобы определить пораженные органы и удалить любые ранее не обнаруженные перитонеальные метастатические отложения. Хотя первичные GIST могут демонстрировать воспалительные спайки с окружающими структурами, они, как правило, не проникают в другие органы за пределами места происхождения, несмотря на зловещий вид на КТ. Назогастральная аспирация, предоперационная татуировка и интраоперационная ФГДС могут рассматриваться как вспомогательные средства, помогающие в точной локализации GIST и достижении резекции R0.
Хотя сообщалось об эндоскопической резекции ГИСО малого желудка, это не рекомендуется. 103 В отличие от ранних аденокарцином желудка, ограниченных слизистой оболочкой и поддающихся эндоскопической резекции слизистой оболочки, ГИСО затрагивают собственную мышечную мышцу. Таким образом, эндоскопическая резекция рискует оставить положительный глубокий край и из-за глубины поражения может привести к перфорации желудочно-кишечного тракта. О таких эндоскопических резекциях сообщалось по большей части для небольших ГИСО, группы опухолей, для которых операция может даже не быть показана. 104 Следовательно, к таким методам следует подходить с большой осторожностью, и они не рекомендуются какими-либо основными международными руководящими принципами.
Лапароскопическая резекция первичных ГИСО с помощью лапароскопии продолжает развиваться и может быть рассмотрена, если будут соблюдены стандартные онкологические принципы (рис. 33-7). Два ранних исследования подтвердили безопасность и возможность лапароскопического доступа. 105,106 Недавний метаанализ Koh et al. поддерживает лапароскопическую резекцию как безопасный и осуществимый подход, не имеющий различий в положительности границ, безрецидивной выживаемости (RFS) или общей выживаемости (OS) по сравнению с открытыми резекциями.Кроме того, лапароскопические резекции часто сокращали время пребывания в больнице и снижали интраоперационную кровопотерю. 107 Однако решения о техническом оперативном подходе должны уравновешивать периоперационные факторы с онкологической безопасностью. В предоперационный процесс принятия решения следует включать оценку сопутствующей патологии пациента, анатомического расположения опухоли, опыта хирурга и способности перейти на открытый доступ. Когда выполняются лапароскопические и вспомогательные доступы, следует рассмотреть возможность модифицированной литотомии или расщепления ног для улучшения визуализации и манипуляции с органами.Кроме того, угловая камера и вращающийся лапароскопический степлер могут помочь в безопасной резекции и удалении опухоли.
Рисунок 33-7
Лапароскопическое изображение желудочного GIST вдоль большой кривизны желудка (стрелки), изолированного между тракционными швами ( A ) и желудка, частично разделенного с помощью линейного степлера ( B ).
Желудочно-кишечная стромальная опухоль | саркома мягких тканей
ГИСО — это редкий тип саркомы, обнаруживаемый в пищеварительной системе, чаще всего в стенке желудка.Саркома мягких тканей — это разновидность рака.
Кто получает GIST
GIST чаще всего встречается у пожилых людей.
Люди с генетическим заболеванием, называемым нейрофиброматозом (НФ), имеют повышенный риск развития ГИСО.
GIST у детей встречается редко.
Симптомы
Люди с ранней стадией GIST часто не имеют никаких симптомов. Таким образом, ГИСО на ранней стадии может быть обнаружен, когда люди проходят тесты на другие заболевания. Большинство GIST диагностируются на более поздних стадиях заболевания.Симптомы расширенного GIST, вероятно, включают:
- боль или дискомфорт в животе (животе)
- чувство полноты
- тошнота
- кровь в стуле или рвота
- чувство сильной усталости
- низкое количество эритроцитов (анемия)
Другое медицинское эти симптомы могут быть вызваны другими заболеваниями, помимо рака. Если у вас есть эти симптомы, вам следует обратиться к врачу. GIST встречается редко, поэтому с большей вероятностью они будут вызваны чем-то менее серьезным, но всегда лучше проверить.
Лечение
Ваше лечение зависит от размера и расположения рака, а также от вашего общего состояния здоровья. Ваш специалист обсудит это с вами.
Хирургия
Хирургия обычно является основным методом лечения GIST. Ваш хирург стремится удалить как можно большую часть рака с границей здоровой ткани (чистой границей) вокруг нее. Наличие границы здоровой ткани без каких-либо раковых клеток важно, поскольку это снижает риск рецидива рака.
Операция может вылечить ГИСО меньшего размера.Но, возможно, хирург не сможет полностью удалить ГИСО большего размера.
GIST может иногда распространяться на другие части тела. Это распространение называется вторичным или метастазами. В некоторых ситуациях хирург может удалить эти вторичные образования.
GIST в желудке означает, что вашему хирургу может потребоваться удалить весь желудок или его часть. Также может потребоваться удаление селезенки. Операция на желудке — сложная операция, и впоследствии потребуется некоторое время, чтобы скорректировать режим питания.Вам, вероятно, придется часто есть небольшими порциями (примерно два раза в час) в течение довольно долгого времени после операции.
Целенаправленные противораковые препараты
Раковые клетки имеют изменения в генах (ДНК), которые отличают их от нормальных клеток. Эти изменения означают, что они ведут себя иначе. Раковые клетки могут расти быстрее нормальных клеток и иногда распространяться. Таргетные противораковые препараты действуют, «нацеливая» те различия, которые есть у раковой клетки.
Тип направленного противоракового препарата, используемый для GIST, называется ингибитором тирозинкиназы (TKI).Они блокируют химические мессенджеры (ферменты), называемые тирозинкиназами. Тирозинкиназы помогают посылать в клетки сигналы роста, поэтому их блокирование останавливает рост и деление клеток.
Примеры TKI, используемых для лечения GIST, включают:
- иматиниб (Гливек)
- сунитиниб (Сутент)
- регорафениб (Стиварга)
Иматиниб (Гливек)
Возможно, вам назначили иматиниб для лечения ГИСО, который нельзя полностью удалить хирургическим путем или который распространился до операции.
Некоторые люди с ГИСО имеют более высокий риск рецидива рака после операции. Это называется GIST высокого риска. Иматиниб может помочь снизить вероятность возврата ГИСО. Поэтому в этой ситуации ваш врач может порекомендовать вам принимать иматиниб в течение 3 лет после операции.
Вам также может быть назначен иматиниб для уменьшения ГИСО перед операцией, чтобы хирург мог легко его удалить. Иногда хирург может полностью удалить ГИСО после лечения иматинибом.
Анализ белка на иматиниб
Вашему врачу нужен образец вашего ГИСО для проведения тестирования на белок. Этот образец может быть взят из того, когда вам делали биопсию для диагностики GIST или операцию по удалению GIST. Клетки проверяются, чтобы увидеть, есть ли на их поверхности рецептор под названием CD117.
Этот белок CD117 производится геном под названием c-kit. Ошибка в этом гене заставляет ген c-kit производить слишком много белка CD117. Большинство GIST имеют мутации гена c-kit.
Если клетки GIST положительны по CD117, иматиниб, вероятно, будет работать очень хорошо. Но это может работать даже для GIST, которые отрицательны по CD117.
Сунитиниб (Сутент)
Ваш врач может порекомендовать вам сунитиниб (Сутент) в одной из следующих ситуаций:
- иматиниб перестал работать
- У вас наблюдались серьезные побочные эффекты при лечении иматинибом
У вас должен быть GIST, который нельзя полностью удалить или который распространился.
Регорафениб (Стиварга)
Регорафениб (Стиварга) используется для лечения расширенного ГИСО. Ваш врач может порекомендовать регорафениб, если вы проходили лечение иматинибом и сунитинибом и этими препаратами:
- не работали
- или вызывает серьезные побочные эффекты
Расширенный GIST означает, что вам нельзя делать операцию по удалению GIST, или он распространился. Чтобы принимать это лекарство, вы должны быть в хорошей физической форме.
Как справиться
Справиться с диагнозом редкого рака может быть особенно сложно, как практически, так и эмоционально.Если вы будете хорошо информированы о своем раке и его лечении, вам будет легче принимать решения и справляться с происходящим.
Разговор с другими людьми
Разговор с другими людьми, у которых есть то же самое, также может помочь.
Наш дискуссионный форум Cancer Chat — это место для всех, кто страдает раком. Вы можете поделиться своим опытом, историями и информацией с другими людьми, которые знают, что вы переживаете.
Некоторые организации по лечению саркомы предлагают информацию и поддержку, особенно GIST Support UK.Это организация людей с GIST и их семей
Что такое GIST?
Желудочно-кишечный тракт означает, что они запускаются в пищеварительной системе (желудочно-кишечном тракте). Стромальный означает, что они развиваются из тканей, которые поддерживают соединительные ткани, контролируя движения кишечника. Опухоль означает образование в теле, которое может быть раком, а может и не быть.
Некоторые GIST ведут себя не злокачественно (доброкачественно). Как правило, опухоль, которая ведет себя доброкачественно, имеет тенденцию к относительно медленному росту и с меньшей вероятностью вернется.
Опухоль, которая ведет себя злокачественно (злокачественно), растет быстрее и с большей вероятностью вернется или распространится.
Чем больше GIST, тем больше вероятность того, что он будет вести себя как рак. И если ее не лечить, доброкачественная опухоль может начать действовать как рак. Большинство этих опухолей возникают в стромальной ткани желудка. Но они могут начаться в любом месте пищеварительной системы, например в кишечнике или пищеводе (пищеводе). Очень редко они развиваются вне желудочно-кишечного тракта.
Стромальная опухоль желудочно-кишечного тракта — GIST: виды лечения
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете о различных типах лечения, которые врачи используют для людей с GIST. Используйте меню для просмотра других страниц.
В этом разделе объясняются типы лечения, являющиеся стандартом лечения GIST. «Стандарт лечения» означает лучшие известные методы лечения. При принятии решения о плане лечения вам рекомендуется рассмотреть возможность проведения клинических испытаний. Клиническое исследование — это исследование, в котором проверяется новый подход к лечению.Врачи хотят узнать, является ли новое лечение безопасным, эффективным и, возможно, лучше, чем стандартное лечение. В клинических испытаниях можно проверить новое лекарство, новую комбинацию стандартных методов лечения или новые дозы стандартных лекарств или других методов лечения. Клинические испытания — это один из вариантов лечения и ухода на всех стадиях рака. Ваш врач может помочь вам рассмотреть все варианты лечения. Узнайте больше о клинических испытаниях в разделах «О клинических испытаниях» и «Последние исследования» этого руководства.
Обзор лечения
В области лечения рака разные врачи часто работают вместе, чтобы создать общий план лечения пациента, который сочетает в себе различные виды лечения. Это называется мультидисциплинарной командой. Для людей с ГИСО важно, чтобы их план лечения составляла медицинская бригада, специализирующаяся на саркомах, поскольку было показано, что это увеличивает шансы человека на выживание. Бригады по лечению рака включают множество других специалистов в области здравоохранения, таких как фельдшеры, практикующие медсестры, медсестры-онкологи, социальные работники, фармацевты, консультанты, диетологи и другие.
Описание распространенных видов лечения, используемых для GIST, приведено ниже. Ваш план лечения также включает лечение симптомов и побочных эффектов, что является важной частью лечения рака.
Варианты лечения и рекомендации зависят от нескольких факторов, включая тип и стадию опухоли, возможные побочные эффекты, предпочтения пациента и общее состояние здоровья пациента. Врач рассмотрит множество факторов, чтобы выбрать лучшее лечение, в том числе лечение опухоли:
Размер
Количество делящихся клеток
Генетический макияж
Основное местонахождение
Распространено ли уже
Произошел ли разрыв опухоли самостоятельно или в результате хирургического вмешательства
Найдите время, чтобы узнать обо всех вариантах лечения, и обязательно задавайте вопросы о том, что неясно.Поговорите со своим врачом о целях каждого лечения и о том, чего вы можете ожидать от лечения. Такие разговоры называются «совместным принятием решений». Совместное принятие решений — это когда вы и ваши врачи вместе выбираете методы лечения, которые соответствуют целям вашего лечения. Совместное принятие решений особенно важно для GIST, потому что существуют разные варианты лечения. Узнайте больше о принятии решений о лечении.
Хирургия
Операция — это удаление опухоли и некоторых окружающих здоровых тканей во время операции.Хирург-онколог — это врач, специализирующийся на хирургическом лечении рака.
Для людей с локализованным GIST хирургическое вмешательство является стандартным лечением, и его следует проводить по возможности. Если GIST не может быть полностью удален хирургическим путем, например, если он распространился где-то еще, его часто невозможно вылечить. Тем не менее, операция может быть рассмотрена, если количество заболеваний ограничено.
Перед операцией поговорите со своим лечащим врачом о возможных побочных эффектах конкретной операции, которая вам предстоит.Узнайте больше об основах хирургии рака.
Лечение с использованием лекарств
Системная терапия — это использование лекарств для уничтожения опухолевых клеток. Этот тип лекарства вводится через кровоток, чтобы достичь опухолевых клеток по всему телу. Системные методы лечения обычно назначаются онкологом, врачом, который специализируется на лечении рака с помощью лекарств.
Обычные способы проведения системной терапии включают внутривенную (IV) трубку, вводимую в вену с помощью иглы, или в таблетку или капсулу, которые проглатываются (перорально).
Таргетная терапия — это тип системной терапии, применяемой при ГИСО. Ниже более подробно обсуждаются различные целевые методы лечения. Человек может одновременно получать 1 тип системной терапии или комбинацию системных терапий. Их также можно назначать как часть плана лечения, который включает хирургическое вмешательство и / или лучевую терапию.
Лекарства, используемые для лечения рака, постоянно проходят экспертизу. Часто лучший способ узнать о прописанных вам лекарствах, их назначении и потенциальных побочных эффектах или взаимодействии с другими лекарствами — поговорить с врачом.Также важно сообщить своему врачу, принимаете ли вы какие-либо другие лекарства или добавки, отпускаемые по рецепту или без рецепта. Травы, добавки и другие лекарства могут взаимодействовать с лекарствами от рака. Узнайте больше о своих рецептах с помощью доступных для поиска баз данных лекарств.
Таргетная терапия
Таргетная терапия — это лечение, направленное на специфические гены, белки рака или тканевую среду, которая способствует росту и выживанию рака. Этот вид лечения блокирует рост и распространение раковых клеток и ограничивает повреждение здоровых клеток.
Не все опухоли имеют одинаковые мишени. Поскольку некоторые из этих генетических изменений в опухоли могут означать, что описанные ниже препараты могут не работать должным образом, ваш врач может провести тесты для определения генов, белков и других факторов в вашей опухоли. Это помогает врачам лучше подбирать каждому пациенту наиболее эффективное лечение, когда это возможно. Кроме того, продолжаются научные исследования, чтобы узнать больше о конкретных молекулярных мишенях и новых методах лечения, направленных на них.
Ингибиторы тирозинкиназы (TKI) — это препараты, нацеленные на определенные белки, называемые киназами, которые способствуют росту и выживанию опухоли.TKI часто используются для лечения GIST.
Лекарства, описанные в этом разделе, перечислены в том порядке, в котором они были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Порядок их использования может зависеть от факторов, рассмотренных выше. Узнайте больше об основах целевого лечения.
Поговорите со своим врачом о возможных побочных эффектах каждого лекарства и о том, как с ними бороться.
Иматиниб (Гливек). Это была первая таргетная терапия, одобренная FDA для GIST.Часто это первое лекарство, используемое для лечения GIST. С тех пор, как этот препарат стал доступным, прогноз для пациентов с ГИСО значительно улучшился.
Проводятся исследования, чтобы выяснить, как долго следует назначать иматиниб после операции, чтобы помочь отсрочить или предотвратить рецидив, и иматиниб является единственным лекарством, одобренным для этого использования. Если ГИСО распространился на другие части тела, иматиниб принимают всю оставшуюся жизнь пациента, чтобы помочь контролировать опухоль.
Обычная доза иматиниба составляет 400 миллиграммов (мг) в день.Для некоторых пациентов доза может быть увеличена до 800 мг в день, особенно для тех, у кого есть генетическая мутация экзона 9 в гене KIT .
Иматиниб имеет некоторые общие побочные эффекты, с которыми часто успешно справляются. Дозу можно скорректировать, чтобы уменьшить побочные эффекты, или в план лечения можно добавить другие лекарства, чтобы справиться с побочными эффектами. Наиболее частыми побочными эффектами иматиниба являются накопление жидкости, сыпь, тошнота, диарея, усталость и незначительные мышечные боли. К серьезным, но относительно редким побочным эффектам относятся кровотечение и воспаление печени.Со многими из этих побочных эффектов можно справиться с помощью медицинской бригады. Кроме того, некоторые побочные эффекты со временем проходят. Люди с серьезными побочными эффектами могут принимать более низкую дозу иматиниба и при этом получать от этого пользу. Если вы хотите прекратить лечение из-за побочных эффектов, сначала поговорите со своим лечащим врачом, чтобы узнать, лучший ли это вариант.
Сунитиниб (Сутент). Сунитиниб — это TKI, который разными способами замедляет рост опухоли. Сунитиниб также блокирует как KIT , так и процесс образования новых кровеносных сосудов, который называется ангиогенезом.Сунитиниб используется для лечения ГИСО, который продолжает расти даже после лечения иматинибом. Сунитиниб также можно использовать, когда побочные эффекты иматиниба слишком серьезны.
Побочные эффекты сунитиниба включают усталость, диарею, тошноту и рвоту, изжогу, изменение вкуса, высокое кровяное давление, низкие показатели крови и изменение цвета кожи.
Регорафениб (Стиварга). Регорафениб — это TKI, который действует множеством различных способов для замедления роста опухоли, включая блокирование молекулы KIT и блокирование роста кровеносных сосудов в опухоли.Он был одобрен в 2013 году для людей с ГИСО на поздних стадиях, которые нельзя удалить хирургическим путем, и когда иматиниб и сунитиниб не работали или вызывали серьезные побочные эффекты.
Побочные эффекты регорафениба включают усталость, тошноту, синдром рук и ног, высокое кровяное давление, диарею и воспаление печени.
Ларотректиниб (Витракви). Небольшой процент сарком, менее 1%, имеет мутацию в гене тирозинкиназы нейротрофического рецептора ( NTRK ).Ларотректиниб (Витракви) — ингибитор NTRK, который в настоящее время одобрен для лечения любого рака, имеющего специфическую мутацию в гене NTRK . Эти мутации NTRK не обнаруживаются в наиболее распространенных типах GIST, включая мутации с KIT , PDGFR , SDH и RAF .
Наиболее частые побочные эффекты включают усталость, тошноту, головокружение, рвоту, повышение ферментов печени, кашель, запор и диарею.
Авапритиниб (Айвакит). Авапритиниб — это TKI, который также нацелен на опухоли со специфической мутацией в гене рецептора тромбоцитарного фактора роста альфа ( PDFGRA ) экзона 18 . Он одобрен FDA для лечения метастатических GIST, которые имеют мутацию в экзоне PDGFRA 18 , которая не может быть удалена хирургическим путем.
Типичными побочными эффектами авапритиниба были отек, тошнота, усталость, проблемы с вниманием, памятью или мышлением, рвота, потеря аппетита, диарея, изменение цвета волос, усиленное выделение слез из глаз, боль в животе, запор, сыпь. и головокружение.
Рипретиниб (Qinlock). Рипретиниб — это TKI, одобренный для лечения расширенного GIST после 3 или более предшествующих курсов лечения с TKI, включая иматиниб, не остановивших рост и распространение опухоли.
Общие побочные эффекты рипретиниба включают выпадение волос, усталость, тошноту, боль в животе, запор, мышечную боль, диарею, потерю аппетита, синдром рук и ног и рвоту. Также существует риск серьезных побочных эффектов, включая рак кожи, высокое кровяное давление и проблемы с сердцем.
Химиотерапия
Химиотерапия — это использование лекарств для уничтожения раковых клеток, обычно путем предотвращения роста, деления и образования новых клеток. Однако стандартная химиотерапия неэффективна для лечения GIST и не должна использоваться.
Лучевая терапия
Лучевая терапия — это использование высокоэнергетических рентгеновских лучей или других частиц для уничтожения раковых клеток. Врач, специализирующийся на лучевой терапии для лечения рака, называется онкологом-радиологом.Наиболее распространенный вид лучевой терапии называется дистанционной лучевой терапией, то есть облучение от аппарата, расположенного вне тела. Когда лучевая терапия проводится с использованием имплантатов, она называется внутренней лучевой терапией или брахитерапией.
Схема или расписание лучевой терапии обычно состоит из определенного количества процедур, проводимых в течение определенного периода времени.
Лучевая терапия не часто используется для лечения людей с ГИСО. Однако его можно использовать в качестве паллиативного лечения для облегчения боли, такой как боль в костях, или для остановки кровотечения.Лучевая терапия может повредить как здоровые, так и опухолевые клетки. Побочные эффекты лучевой терапии включают усталость, легкие кожные реакции, расстройство желудка и жидкий стул.
Большинство побочных эффектов проходят вскоре после окончания лечения. Узнайте больше об основах лучевой терапии.
Физические, эмоциональные и социальные последствия рака
Опухоль и ее лечение вызывают физические симптомы и побочные эффекты, а также эмоциональные, социальные и финансовые последствия.Управление всеми этими эффектами называется паллиативной или поддерживающей терапией. Это важная часть вашего ухода, которая включается в лечение, направленное на замедление, остановку или устранение рака.
Паллиативная помощь направлена на улучшение вашего самочувствия во время лечения путем устранения симптомов и поддержки пациентов и их семей с другими, немедицинскими потребностями. Любой человек, независимо от возраста, типа и стадии рака, может получить такую помощь. И часто он работает лучше всего, когда его начинают сразу после диагноза рака.Люди, которые получают паллиативную помощь наряду с лечением рака, часто имеют менее тяжелые симптомы, лучшее качество жизни и сообщают, что более удовлетворены лечением.
Паллиативные методы лечения широко варьируются и часто включают прием лекарств, изменения питания, техники релаксации, эмоциональную и духовную поддержку и другие методы лечения. Вы также можете получить паллиативное лечение, подобное тому, которое предназначено для избавления от опухоли, например лекарственную терапию, хирургическое вмешательство или лучевую терапию.
Перед началом лечения поговорите со своим врачом о целях каждого лечения в плане лечения. Вам также следует поговорить о возможных побочных эффектах конкретного плана лечения и вариантах паллиативной помощи.
Во время лечения ваша медицинская бригада может попросить вас ответить на вопросы о ваших симптомах и побочных эффектах и описать каждую проблему. Обязательно сообщите медицинскому персоналу, если у вас возникла проблема. Это помогает медицинскому персоналу как можно быстрее устранять любые симптомы и побочные эффекты.Это также может помочь предотвратить более серьезные проблемы в будущем.
Узнайте больше о важности отслеживания побочных эффектов в другой части этого руководства. Узнайте больше о паллиативной помощи в отдельном разделе этого сайта.
Лечение по стадиям GIST
Для каждого этапа GIST могут быть рекомендованы разные методы лечения. Ваш врач порекомендует вам конкретный план лечения в зависимости от стадии опухоли и других факторов. Подробное описание каждого типа лечения представлено ранее на этой странице.Клинические испытания также могут быть вариантом лечения для каждой стадии.
Локализованный GIST
Локализованный GIST — это опухоль, которая осталась в той части тела, где она возникла. ГИСО меньшего размера можно полностью удалить хирургическим путем. Для некоторых это может быть единственное необходимое лечение.
Если опухоль большая или распространилась на близлежащие органы, ее можно сначала лечить иматинибом (см. «Таргетная терапия» выше). Цель этого подхода — уменьшить опухоль, чтобы ее было легче удалить хирургическим путем.Это называется «неоадъювантная терапия». В конечном итоге хирург попытается удалить всю опухоль, чтобы снизить риск того, что опухоль вернется или заблокирует желудочно-кишечный тракт.
Чтобы удалить опухоль целиком, хирургу, возможно, придется удалить части близлежащих органов, в зависимости от расположения опухоли. Удаление лимфатических узлов обычно не требуется, поскольку ГИСО не часто распространяются на лимфатические узлы. Лимфатические узлы — это крошечные органы в форме бобов, которые помогают бороться с инфекцией. Опухоль, которую невозможно удалить хирургическим путем, называется «неоперабельной».«Врач порекомендует таргетную терапию при неоперабельном локализованном GIST.
GIST имеет способность возвращаться после хирургического удаления и может распространяться на другие органы. Некоторые GIST имеют более высокий риск возврата или распространения, чем другие. После операции по поводу локализованного GIST люди с высоким риском рецидива часто получают иматиниб в течение не менее 3 лет, чтобы предотвратить или отсрочить его повторное появление. Этот вид лечения после операции называется «адъювантной терапией».
Метастатический GIST
Если ГИСО распространился на другую часть тела, откуда он начался, врачи называют это метастатическим.Если это произойдет, рекомендуется поговорить с врачами, имеющими опыт лечения. У врачей могут быть разные мнения о лучшем стандартном плане лечения. Клинические испытания также могут быть вариантом. Узнайте больше о том, как получить второе мнение перед началом лечения, чтобы вам было комфортно с выбранным планом лечения. Во многих случаях люди с метастатическим GIST могут жить нормальной жизнью в течение многих лет, получая лечение только таблетками и регулярными посещениями больницы. Узнайте больше о жизни с хроническим раком.
В зависимости от предыдущего лечения, ваш план лечения может включать хирургическое вмешательство, более высокую дозу TKI или лечение в рамках клинических испытаний. Ваш врач может продолжать рекомендовать иматиниб, регорафениб или сунитиниб, даже если они не работают должным образом. Они также могут порекомендовать вернуться к одному из этих препаратов (обычно иматинибу) после того, как другие были испытаны и / или после того, как они перестали работать. В общем, некоторое лечение с помощью таргетной терапии GIST лучше, чем полное отсутствие лечения.Паллиативная помощь также будет иметь важное значение для облегчения симптомов и побочных эффектов.
Для большинства людей диагностика метастатического ГИСО является очень сложной и сложной задачей. Вам и вашей семье рекомендуется поговорить о своих чувствах с врачами, медсестрами, социальными работниками или другими членами медицинской бригады. Также может быть полезно поговорить с другими пациентами, в том числе через группу поддержки.
Ремиссия и вероятность рецидива
Ремиссия — это когда опухоль не обнаруживается в организме и отсутствуют симптомы.Это также называется «отсутствие признаков болезни» или NED.
Ремиссия может быть временной или постоянной. Эта неопределенность заставляет многих беспокоиться о том, что опухоль вернется. Хотя многие ремиссии носят постоянный характер, важно обсудить с врачом возможность возврата опухоли. Понимание риска рецидива и вариантов лечения может помочь вам почувствовать себя более подготовленным, если опухоль все же вернется. Узнайте больше о том, как справиться со страхом повторения.
Если опухоль возвращается после первоначального лечения, это называется рецидивирующей опухолью.Он может вернуться в том же месте (так называемый местный рецидив), поблизости (региональный рецидив) или в другом месте (отдаленный рецидив).
Когда это произойдет, снова начнется новый цикл тестирования, чтобы узнать как можно больше о повторении. После того, как это обследование будет выполнено, вы и ваш врач обсудите варианты лечения. Часто план лечения включает описанные выше процедуры, такие как хирургическое вмешательство и таргетная терапия. Однако их можно использовать в другой комбинации или давать с разной скоростью.Ваш врач может предложить клинические испытания, в которых изучаются новые способы лечения этого типа рецидивирующей опухоли. Какой бы план лечения вы ни выбрали, паллиативная помощь будет иметь важное значение для облегчения симптомов и побочных эффектов.
Люди с рецидивирующим или метастатическим GIST часто испытывают такие эмоции, как недоверие или страх. Вам предлагается поговорить с медицинским персоналом об этих чувствах и спросить об услугах поддержки, которые помогут вам справиться с этим. Узнайте больше о том, как справиться с повторением.
Если лечение не работает
Восстановление из GIST не всегда возможно.Если рост опухоли невозможно контролировать, возможно, вы никогда не оправитесь от болезни. Это состояние называется терминальным.
Этот диагноз вызывает стресс, и многим людям трудно обсуждать запущенный рак. Тем не менее, важно вести открытые и честные беседы с медицинскими работниками, чтобы выразить свои чувства, предпочтения и опасения. Медицинская бригада имеет особые навыки, опыт и знания, чтобы поддерживать пациентов и их семьи, и всегда готова помочь. Чрезвычайно важно обеспечить человеку физический комфорт, отсутствие боли и эмоциональную поддержку.
Люди, которые, как ожидается, будут жить менее 6 месяцев, могут захотеть обратиться в хоспис. Уход в хосписе призван обеспечить максимально возможное качество жизни людям, находящимся на грани конца жизни. Вам и вашей семье рекомендуется обсудить с медицинским персоналом варианты ухода в хосписе, которые включают уход на дому, специальный центр хосписа или другие медицинские учреждения. Медсестринский уход и специальное оборудование могут сделать пребывание дома приемлемым для многих семей. Узнайте больше о расширенном планировании ухода.

 До 59% случаев диагностируются у людей старше 70 лет.
До 59% случаев диагностируются у людей старше 70 лет.


 Такая химиотерапия помогает улучшить состояние больного, уменьшить симптомы, повысить продолжительность жизни.
Такая химиотерапия помогает улучшить состояние больного, уменьшить симптомы, повысить продолжительность жизни. К этой группе относятся препараты: бевацизумаб, рамуцирумаб, зив-афлиберцепт.
К этой группе относятся препараты: бевацизумаб, рамуцирумаб, зив-афлиберцепт.