Внезапная сердечная смерть у больных ишемической болезнью сердца: от механизмов к клинической практике | Голухова
1. Gillum R.F. Geographic variation in sudden coronary death. Am Heart J. 1990; 119 (2 Pt 1): 380-389.
2. Голухова Е.З. Внезапная сердечная смерть. Меняют ли результаты рандомизированных исследований наши представления о возможных предикторах и путях профилактики? Креативная кардиология 2008; 1: 7-24
3. Бойцов С.А., Никулина Н.Н., Якушин С.С. и др. Внезапная сердечная смерть у больных ишемической болезнью сердца: по результатам Российского многоцентрового эпидемиологического исследования заболеваемости, смертности, качества диагностики и лечения острых форм ИБС (РЕЗОНАНС). Российский кардиологический журнал 2011; 2: 59-64. DOI: 10. 15829/1560-4071-2011-2-59-64
15829/1560-4071-2011-2-59-64
4. Fishman G.I., Chugh S.S., DiMarco J.P. et al. Sudden cardiac death prediction and prevention: report from a National Heart, Lung, and Blood Institute and Heart Rhythm Society Workshop. Circulation 2010; 122: 2335-2348.
5. Goldberger J.J., Cain M.E., Hohnloser S.H. et al. American Heart Association / American College of Cardiology Foundation/Heart Rhythm Society Scientific Statement on Noninvasive Risk Stratification Techniques for Identifying Patients at Risk for Sudden Cardiac Death. J. Am Coll Cardiol 2008; 52: 1179-1199.
6. Santini M., Lawalle C., Ricci R.P. Primary and secondary prevention of SCD: who should get an ICD? Heart 2007; 93: 1478-1483.
7. Moss A.J., Hall W.J., Cannom D.S. et al. Multicenter Automatic Defibrillator Implantation Trial Investigators. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. N. Engl J. Med 1996; 335: 1933-1940.
Moss A.J., Hall W.J., Cannom D.S. et al. Multicenter Automatic Defibrillator Implantation Trial Investigators. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. N. Engl J. Med 1996; 335: 1933-1940.
8. Moss A.J., Zareba W., Hall W.J. et al. Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N. Engl J. Med 2002; 346: 877-883.
9. Nieminen T., Lehtima T., Viik J. et al. T-wave alternans predicts mortality in a population undergoing a clinically indicated exercise test. Eur Heart J. 2007; 28: 2332-2337.
10. Bardy G.H., Lee K.L., Mark D.B. et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N. Engl J. Med 2005; 352: 225-237.
Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N. Engl J. Med 2005; 352: 225-237.
11. Rubart M., Zipes D.P. Mechanisms of sudden cardiac death. J. Clin Invest 2005; 115: 2305-2315.
12. Myerburg R.J., Interian A., Simmons J., Castellanos A. Sudden cardiac death. In: Zipes DP, ed. Cardiac Electrophysiology: from Cell to Bedside. 4th ed. Philadelphia: WB Saunders; 2004: 720-731.
13. George A.L. Jr. Molecular and genetic basis of sudden cardiac death. J. Clin Invest 2013; 123: 75-83. doi: 10.1172/JCI62928
14. Shmidt A., Azevedo C.F., Cheng A. et al. Infarct tissue heterogeneity by magnetic resonance imaging identifies enhanced cardiac arrhythmia susceptibility in patients with left ventricular dysfunction. Circulation 2007; 115: 2006-2014.
Circulation 2007; 115: 2006-2014.
15. Nguyen T.P., Qu Z., Weiss J.N. Cardiac Fibrosis and Arrhythmogenesis: The Road to Repair is Paved with Perils. J. Mol Cell Cardiol 2014; 70: 83-91.
16. Caron K.M., James L.R., Kim H.S. et al. Cardiac hypertrophy and sudden death in mice with a genetically clamped renin transgene. Proc Nat Acad Sci USA 2004; 101: 3106-3111.
17. Donoghue M., Wakimoto H., Maguire C.T. et al. Heart block, ventricular tachycardia, and sudden death in ACE2 transgenic mice with downregulated connexins. J. Mol Cell Cardiol 2003; 35: 1043-1053.
18. Pitt B., Zannand F., Remme W. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. New Engl J. Med 1999; 341: 709-717.
New Engl J. Med 1999; 341: 709-717.
19. Сокольская М.А. Антагонисты альдостерона в профилактике внезапной сердечной смерти. Анналы аритмологии 2006; 4: 49-56
20. Tikhomirova V.E., Kryukova O.V., Serov R.A. et al. Phenotyping of Angiotensin-Converting Enzyme in the Human Heart. JACC 20 15; 6 (10S).
21. Zipes D.P., Rubart M. Neural modulation of cardiac arrhythmias and sudden cardiac death. Heart Rhythm 2006; 3: 108-113.
22. Ревишвили А.Ш., Ардашев А.В., Бойцов С.А. и др. Клинические рекомендации по проведению электрофизио-логических исследований, катетерной аблации и применению имплантируемых антиаритмических устройств. М.: МАКС Пресс; 2013. 596 с.
23. Tracy C.M., Epstein A.E., Darbar D. et al. 2012 ACCF/AHA/HRS Focused Update incorporated into the ACCF/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: A Report of the American College of Cardiology Foundation / American Heart Association Task Force on Practice Guidelines and Heart Rhythm Society. J. Am Coll Cardiol 2013; 61: e6-e75.
Tracy C.M., Epstein A.E., Darbar D. et al. 2012 ACCF/AHA/HRS Focused Update incorporated into the ACCF/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: A Report of the American College of Cardiology Foundation / American Heart Association Task Force on Practice Guidelines and Heart Rhythm Society. J. Am Coll Cardiol 2013; 61: e6-e75.
24. Priori S.G., Blomstrom-Lundqvist C., Mazzanti A. et al. ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death Eur Heart J. 2015; 36: 2793-2867 doi: 10.1093/eurheartj/ehv316.
25. Hohnloser S.H., Kuck K.H., Dorian P., et al. for the DINAMIT Investigators. Prophylactic Use of an Implantable Cardioverter -Defibrillator after Acute Myocardial Infarction. N. Engl J. Med 2004; 351: 2481-2488.
26. Bigger J.T.Jr., Whang W., Rottman J.N. et al. Mechanisms of death in the CABG Patch trial: a randomized trial of implantable cardiac defibrillator prophylaxis in patients at high risk of death after coronary artery bypass graft surgery. Circulation 1999; 99: 1416-1421.
Bigger J.T.Jr., Whang W., Rottman J.N. et al. Mechanisms of death in the CABG Patch trial: a randomized trial of implantable cardiac defibrillator prophylaxis in patients at high risk of death after coronary artery bypass graft surgery. Circulation 1999; 99: 1416-1421.
27. Gorgels A.P., Gijsbers C., de Vreede-Swagemakers J. et al. Out-ofhospital cardiac arrest — the relevance ofheart failure. The Maastricht Circulatory Arrest Registry. Eur Heart J. 2003; 24: 1204-1209.
28. Groh W.J. Lessons from a population: the limitations of left ventricular ejection fraction as the major determinant for primary prevention implantable cardioverter-defibrillators. J. Am Coll Cardiol 2006; 47: 1167-1168.
29. Stecker E.C., Vickers C., Waltz J. et al. Population-based analysis of sudden cardiac death with and without left ventricular systolic dysfunction: two-year findings from the Oregon Sudden Unexpected Death Study. J. Am Coll Cardiol 2006; 47: 1161-1166.
J. Am Coll Cardiol 2006; 47: 1161-1166.
30. Pillarisetti J., Emert M., Biria M. et al. Under-Utilization of Implantable Cardioverter Defibrillators in Patients with Heart Failure — The Current State of Sudden Cardiac Death Prophylaxis. Indian Pacing Electrophysiol J. 2015; 15: 20-29.
31. Shah B., Hernandez A.F., Liang L. Get With The Guidelines Steering Committee. Hospital variation and characteristics of implantable cardioverter-defibrillator use in patients with heart failure: data from the GWTG-HF (Get With The Guidelines-Heart Failure) registry. J. Am Coll Cardiol 2009; 53: 416-22.
32. Costantini O., Hohnloser S.H., Kirk M.M. et al. The ABCD (Alternans Before Cardioverter Defibrillator) Trial: strategies using T-wave alternans to improve efficiency of sudden cardiac death prevention. J. Am Coll Cardiol 2009; 53: 471-479.
J. Am Coll Cardiol 2009; 53: 471-479.
33. Громова О.И., Александрова С.А., Макаренко В.Н., Голухова Е.З. Современные предикторы жизнеугрожающих аритмий. Креативная кардиология 2012; 2: 30-46
34. Goldberger J.J., Cain M.E., Hohnloser S.H. et al. American Heart Association / American College of Cardiology Foundation/Heart Rhythm Society Scientific Statement on Noninvasive Risk Stratification Techniques for Identifying Patients at Risk for Sudden Cardiac Death. J. Am Coll Cardiol 2008; 52: 1179-1199.
35. Scott P.A., Barry J., Roberts P.R., Morgan J.M. Brain natriuretic peptide for the prediction of sudden cardiac death and ventricular arrhythmias: a meta-analysis. Eur J. Heart Fail 2009; 11: 958-966.
36. Голухова Е.З., Громова О.И., Мерзляков В.Ю. и др. Турбулентность ритма сердца и мозговой натрийуретический пептид как предикторы жизнеугрожающих аритмий у больных ишемической болезнью сердца. Креативная кардиология 2013; 2: 62-77
Голухова Е.З., Громова О.И., Мерзляков В.Ю. и др. Турбулентность ритма сердца и мозговой натрийуретический пептид как предикторы жизнеугрожающих аритмий у больных ишемической болезнью сердца. Креативная кардиология 2013; 2: 62-77
37. Kanoupakis E.M., Manios E.G., Kallergis E.M. et al. Serum Markers of Collagen Turnover Predict Future Shocks in Implantable Cardioverter-Defibrillator Recipients With Dilated Cardiomyopathy on Optimal Treatment. J. Am Coll Cardiol 2010; 55: 2753-2759.
38. Marcus G.M. Can Serologic Markers of Fibrosis Reveal an Arrhythmogenic Ventricular Substrate in Nonischemic Dilated Cardiomyopathy? J. Am Coll Cardiol 2010; 55. № 24. Editorial comment.
39. Catalano O., Moro G., Perotti M. et al. Late gadolinium enhancement by cardiovascular magnetic resonance is complementary to left ventricle ejection fraction in predicting prognosis of patients with stable coronary artery disease. J. Cardiovasc Magn Reson 2012; 14: 29. doi: 10.1186/1532-429X-14-29.
J. Cardiovasc Magn Reson 2012; 14: 29. doi: 10.1186/1532-429X-14-29.
Внезапная ненасильственная смерть молодых людей (ретроспективный анализ) Текст научной статьи по специальности «Прочие медицинские науки»
Научный обзор
Scientific Review
МЕДИЦИНА
НЕОТЛОЖНЫХ состояний
®
УДК 616.342-002-036.11-009/212
ГОРАЕЕВА М.В.1, ВЕЛЕСЛАВОВА O.E.1, БАТУРОВА М.А.1, РЫЛОВ А.Ю.2, ЛАВРЕНТЮКГ.П.2, ПЛАТОНОВ П.Г.3, ШУБИК Ю.В.1
Северо-западный центр диагностики и лечения аритмий при СПбГМА им. И.И. Мечникова, Россия Санкт-Петербургское бюро судебно-медицинской экспертизы, Россия 3Лундский университет, Швеция
ВНЕЗАПНАЯ НЕНАСИЛЬСТВЕННАЯ СМЕРТЬ МОЛОДЫХ ЛЮДЕЙ
(ретроспективный анализ)
Резюме. С целью оценки причин внезапной ненасильственной смерти молодых людей в возрасте от 14 до 35лет, умерших в 2009 году в Санкт-Петербурге, произведен анализ 538 протоколов судебно-медицинских аутопсий.
С целью оценки причин внезапной ненасильственной смерти молодых людей в возрасте от 14 до 35лет, умерших в 2009 году в Санкт-Петербурге, произведен анализ 538 протоколов судебно-медицинских аутопсий.
В 152 случаях внезапная смерть была вызвана острым отравлением алкоголем, наркотиками или неизвестным веществом, она была сочтена насильственной, эти протоколы были исключены из дальнейшего анализа. Из оставшихся 386 случаев экстракардиальной причина внезапной смерти была у 95 человек (24,6 %), чаще всего это были пневмонии — 27, туберкулез легких — 21, онкологические заболевания — 11. В 291 случае (75,4 %) причиной внезапной смерти была кардиальная патология, причем в 272 случаях диагноз был сформулирован как «кардиомиопатия», из них в 57(20,95 %) случаяхречь шла об алкогольной кардиомиопатии, в 95 случаях (34,9 %) — о токсической и в 108 случаях (39,7 %) диагноз был сформулирован как «кардиомиопатия неуточненная, острая миокардиальная недостаточность». Гипертрофическая кардиомиопатия была диагностирована у 7 умерших, дилатационная — у 5. В 15 случаях диагноз был сформулирован как «ишемическая болезнь сердца, острая коронарная недостаточность», в 3 случаях выявлен активный миокардит, в 1 — врожденный порок сердца. Таким образом, причиной внезапной смерти молодых людей более чем в четверти случаев является передозировка наркотиков и/или алкогольная интоксикация. В подавляющем большинстве случаев (93,5 %) причина внезапной смерти формулируется как «кардиомиопатия» (неуточненная, токсическая или алкогольная). Очевидное несовпадение выявленных причин внезапной смерти и современных литературных данных обусловлено, видимо, методологическими особенностями патологоанатомической экспертизы. Ключевые слова: молодые люди, внезапная смерть, внезапная сердечная смерть, алкоголь, наркотики, судебно-медицинская экспертиза, аутопсия, кардиомиопатия, каналопатия.
Гипертрофическая кардиомиопатия была диагностирована у 7 умерших, дилатационная — у 5. В 15 случаях диагноз был сформулирован как «ишемическая болезнь сердца, острая коронарная недостаточность», в 3 случаях выявлен активный миокардит, в 1 — врожденный порок сердца. Таким образом, причиной внезапной смерти молодых людей более чем в четверти случаев является передозировка наркотиков и/или алкогольная интоксикация. В подавляющем большинстве случаев (93,5 %) причина внезапной смерти формулируется как «кардиомиопатия» (неуточненная, токсическая или алкогольная). Очевидное несовпадение выявленных причин внезапной смерти и современных литературных данных обусловлено, видимо, методологическими особенностями патологоанатомической экспертизы. Ключевые слова: молодые люди, внезапная смерть, внезапная сердечная смерть, алкоголь, наркотики, судебно-медицинская экспертиза, аутопсия, кардиомиопатия, каналопатия.
Внезапная смерть (ВС) может оказаться трагическим исходом различных заболеваний. Статистические данные, характеризующие распространенность ВС, существенно различаются в разных исследованиях и в разных странах. Во многом это объясняется разногласиями в трактовке самого понятия ВС. Всемирная организация здравоохранения определяет ее как засвидетельствованную ненасильственную смерть, происходящую мгновенно или в течение 1 часа после начала острых симптомов. Если же у события не было свидетелей, ВС определена временным интервалом не более 24 часов от того момента, когда человека в последний раз видели живым. Необходимо отметить, что острая алкогольная интоксикация, острое отравление наркотическими средствами или смерть от других токсических веществ рассматриваются как насильственная смерть и исключены из понятия ВС.
Статистические данные, характеризующие распространенность ВС, существенно различаются в разных исследованиях и в разных странах. Во многом это объясняется разногласиями в трактовке самого понятия ВС. Всемирная организация здравоохранения определяет ее как засвидетельствованную ненасильственную смерть, происходящую мгновенно или в течение 1 часа после начала острых симптомов. Если же у события не было свидетелей, ВС определена временным интервалом не более 24 часов от того момента, когда человека в последний раз видели живым. Необходимо отметить, что острая алкогольная интоксикация, острое отравление наркотическими средствами или смерть от других токсических веществ рассматриваются как насильственная смерть и исключены из понятия ВС.
ВС, обусловленную патологическими изменениями со стороны сердца или коронарных артерий, принято называть внезапной сердечной
смертью (ВСС) [1, 2]. В тех случаях, когда не выявлена никакая иная причина и не обнаружено структурных или гистологических изменений миокарда или сосудов сердца, причина смерти описывается как аутопсия-отрицательная и трактуется как синдром внезапной аритмической смерти, или sudden arrhythmic death syndrome (SADS) [3, 4]. Ограничение по времени в 1 час повышает вероятность аритмического механизма смерти [5, 6]. Аутопсия-отрицательную необъяснимую смерть во сне чаще называют синдромом внезапной необъяснимой смерти, или sudden unexplained death syndrome (SUNDS) [7-9].
Ограничение по времени в 1 час повышает вероятность аритмического механизма смерти [5, 6]. Аутопсия-отрицательную необъяснимую смерть во сне чаще называют синдромом внезапной необъяснимой смерти, или sudden unexplained death syndrome (SUNDS) [7-9].
ВСС является самой частой причиной ВС. Во всем мире она составляет 50 % и более от всей сер-
© Гордеева М.В., Велеславова О.Е., Батурова М.А., Рылов А.Ю., Лаврентюк Г.П., Платонов П.Г., Шубик Ю.В., 2014 © «Медицина неотложных состояний», 2014 © Заславский А.Ю., 2014
дечной летальности [10—12]. Пики ВСС приходятся на возраст от рождения до 6 месяцев (синдром внезапной детской смерти) и далее от 45 до 75 лет, в подавляющем большинстве случаев от ишеми-ческой болезни сердца (до 80 % от всех аутопсий) [13, 14].
Распространенность ВСС, отмечаемая в странах Запада, колеблется в пределах от 0,36 до 1,28 случая на 1000 населения в год. Именно такой (от 36 до 127 случаев на 100 000 населения) она считается и по данным Европейского общества кардиологов [14-16]. В США от ВСС умирают от 250 000 до 500 000 человек ежегодно, что составляет 15 % от всей летальности [13, 14, 17]. В Австралии и Новой Зеландии ежегодно умирает внезапно до 50 000 человек [18], в Великобритании, по данным официальной статистики, от ВСС погибают 1,34 на 100 000 человек в год. При этом примерно в одном из каждых 20 случаев ВСС патологоанатомы не находят ни морфологических, ни гистологических изменений со стороны сердца и сосудов [19].
Именно такой (от 36 до 127 случаев на 100 000 населения) она считается и по данным Европейского общества кардиологов [14-16]. В США от ВСС умирают от 250 000 до 500 000 человек ежегодно, что составляет 15 % от всей летальности [13, 14, 17]. В Австралии и Новой Зеландии ежегодно умирает внезапно до 50 000 человек [18], в Великобритании, по данным официальной статистики, от ВСС погибают 1,34 на 100 000 человек в год. При этом примерно в одном из каждых 20 случаев ВСС патологоанатомы не находят ни морфологических, ни гистологических изменений со стороны сердца и сосудов [19].
ВС в молодом возрасте (менее 35 лет, исключая детей) является достаточно редким событием и составляет лишь 1-2 % всех случаев смерти [8, 20]. Статистические данные по причинам ВС в молодом возрасте неодинаковы в различных странах. Так, в одной из голландских работ сообщается о том, что структурные изменения сердца отсутствовали у 29 % умерших внезапно молодых людей в возрасте от 15 до 35 лет. В 25 % случаев причиной смерти был инфаркт миокарда, в 12 % — миокардит, в 6 % — гипертрофическая кардиомиопатия (ГКМП) [21]. В Австралии аутопсия-отрицательная внезапная аритмическая смерть составила 21 %, атеросклероз коронарных артерий как причина ВСС — 18 %, дилатационная кардиомиопатия (ДКМП) — 12 %, ГКМП — 11 %, миокардит — 11 % [18]. В США наиболее распространенной причиной ВСС молодых называют ГКМП [22], в то время как в Италии лидирует аритмогенная кардиомиопатия/дисплазия правого желудочка (АКДПЖ) [8, 15, 23-26].
В 25 % случаев причиной смерти был инфаркт миокарда, в 12 % — миокардит, в 6 % — гипертрофическая кардиомиопатия (ГКМП) [21]. В Австралии аутопсия-отрицательная внезапная аритмическая смерть составила 21 %, атеросклероз коронарных артерий как причина ВСС — 18 %, дилатационная кардиомиопатия (ДКМП) — 12 %, ГКМП — 11 %, миокардит — 11 % [18]. В США наиболее распространенной причиной ВСС молодых называют ГКМП [22], в то время как в Италии лидирует аритмогенная кардиомиопатия/дисплазия правого желудочка (АКДПЖ) [8, 15, 23-26].
В совсем недавно опубликованное масштабное южнокорейское исследование было включено 10 867 солдат. Методами обследования были стандартная электрокардиография (ЭКГ) покоя, холтеровское мониторирование, тредмил-тест, эхокардиография, а также, по показаниям, провокационная проба с флекаинидом. Выявлено 5,95 % случаев гипертрофии левого желудочка без признаков ГКМП по данным эхокардиографии, у 0,90 % обнаружены специфические ЭКГ-паттерны синдрома Бругада (из них положительный провокационный тест с флекаинидом только у одного), в 0,17 % выявлен синдром преждевременного возбуждения желудочков, в 0,5 % регистрировалась эпсилон-волна, характерная для АКДПЖ (ни в одном случае диагноз не был подтвержден с помощью эхокардиографии), в 0,02 % выявлен удлиненный интервал QT (без желудочковых аритмий в ходе холтеровского мониторирования и тред-
мил-теста). По результатам работы авторы сделали небесспорный вывод о том, что основной причиной ВСС у молодых азиатских мужчин является синдром Бругада [27].
По результатам работы авторы сделали небесспорный вывод о том, что основной причиной ВСС у молодых азиатских мужчин является синдром Бругада [27].
Традиционно широко освещается в литературе проблема ВС в целом и ВСС в частности у спортсменов. По многочисленным данным, ВСС среди молодых профессиональных спортсменов в настоящее время составляет примерно 0,4—0,6 на 100 000 [15, 23, 25, 26, 28, 29]. В Великобритании примерно 80 % всех нетравматических случаев ВС у молодых профессиональных спортсменов были связаны с сердечно-сосудистой патологией, из них ГКМП составила 40-50 % [22].
В крупном американском исследовании, проведенном в Миннеаполисе, проанализированы причины ВС 1866 спортсменов, представляющих 38 различных видов спорта, за 1980-2006 г. Большинство смертей произошло во время или в ранние сроки после физических упражнений. Только 11 % жертв были женщины. Общая смертность в этой группе составила 0,61 на 100 000. Большинство случаев ВС (56 %) были обусловлены сердечно-сосудистыми заболеваниями. Наиболее распространенной причиной была ГКМП (36 %). Тупая травма грудной клетки (commotion cordis) была причиной 22 % случаев ВС [30].
Большинство случаев ВС (56 %) были обусловлены сердечно-сосудистыми заболеваниями. Наиболее распространенной причиной была ГКМП (36 %). Тупая травма грудной клетки (commotion cordis) была причиной 22 % случаев ВС [30].
Принято считать, что риск ВСС напрямую связан с тяжелой физической нагрузкой [11, 31]. Однако сравнительно недавно опубликованное Орегонское исследование свидетельствует о том, что ВСС часто ассоциирована с бытовыми нагрузками, с так называемой «световой активностью». Весьма часто ВСС происходит во время сна. ВСС во время сексуальной активности случается только у мужчин [32].
Имеются различия в частоте возникновения ВСС среди мужчин и женщин, а также среди различных этнических групп. Около 75 % случаев ВСС происходят с мужчинами [4, 16, 33-36]. Они имеют на 50 % более высокий стандартизированный по возрасту уровень ВСС по сравнению с женщинами [12]. У афроамериканцев ВСС встречается чаще, чем у белых, латиноамериканцев и азиатов [13].
Несмотря на продемонстрированные весьма существенные различия в определении причин ВСС у молодых людей по данным разных авторов, для всех очевидно, о каких именно заболеваниях идет речь.
Принято считать, что в большинстве случаев причиной ВСС являются генетически детерминированные заболевания сердца со структурными изменениями (ГКМП, ДКМП, АКДПЖ, некомпактный миокард и др.) или без таковых: так называемые первичные электрические заболевания сердца, или каналопатии (синдром удлиненного QT-интервала, синдром короткого QT-интервала, синдром Бругада, катехоламинер-гическая полиморфная желудочковая тахикардия и др.) [5, 7, 37, 38].
С сожалением приходится констатировать, что Россия лидирует среди индустриально развитых стран как по показателям общей смертности, так и по показателям смертности от сердечно-сосудистых заболеваний [39]. По-видимому, и показатель ВСС также является высоким, однако точными статистическими данными мы не располагаем. Часто называемая цифра в 400 000 случаев ВСС в год [1] является скорее экстраполяцией американских и европейских данных. Мы также не смогли обнаружить в доступной литературе российских статистических данных о ВС молодых людей.
По-видимому, и показатель ВСС также является высоким, однако точными статистическими данными мы не располагаем. Часто называемая цифра в 400 000 случаев ВСС в год [1] является скорее экстраполяцией американских и европейских данных. Мы также не смогли обнаружить в доступной литературе российских статистических данных о ВС молодых людей.
Целью настоящего ретроспективного исследования явилась оценка причин внезапной ненасильственной смерти молодых людей в возрасте от 14 до 35 лет, умерших в 2009 году в Санкт-Петербурге, по данным протоколов судебно-медицинских аутопсий и сопутствующей документации.
Материал и методы исследования
В 2009 г. Санкт-Петербургским бюро судебно-медицинской экспертизы было проведено 21 773 аутопсии. Из них 10 440 аутопсий было выполнено на базе 1-го городского судебно-медицинского морга. Молодых людей в возрасте от 14 до 35 лет, умерших внезапно, без явных признаков насилия, оказалось 538 из 10 440 (5,15 %). Именно эти 538 протоколов вскрытий (в том числе данные органо-метрии и морфометрии сердца, гистологические и токсикологические исследования) были подвергнуты настоящему ретроспективному анализу. Кроме того, изучались протоколы полиции, в том числе протоколы опроса свидетелей и/или родственников.
Именно эти 538 протоколов вскрытий (в том числе данные органо-метрии и морфометрии сердца, гистологические и токсикологические исследования) были подвергнуты настоящему ретроспективному анализу. Кроме того, изучались протоколы полиции, в том числе протоколы опроса свидетелей и/или родственников.
Полученные результаты
У всех умерших было проведено токсикологическое исследование, результаты которого представлены в табл. 1. Как можно видеть, 152 случая ВС из 538 (28,2 %) были вызваны острым отравлением алкоголем и/или наркотиками, в некоторых случаях — отравлением неизвестным веществом. Отравлений наркотиками оказалось 96 (средний возраст в группе 25,7 ± 9,3 года), мужчин — 83. В подавляющем большинстве наркотические вещества были представлены синтетическими производными опиума (более 80 %). Чаще всего это был морфин, реже — метадон и героин. Имелись случаи сочетания опиатов с седативными и/или снотворными средствами.
Острая алкогольная интоксикация (содержание алкоголя в крови более 6 %о) была констатирована у 19 умерших (средний возраст 29,3 ± 5,7 года), из них мужчин — 17. Смертельное сочетание алкоголя и наркотиков (этанол и опиаты) было обнаружено у 12 человек (средний возраст 28,9 ± 5,9 года), из них мужчин — 10. Наконец, причина ВС была определена как «отравление неизвестным веществом» у 25 человек (средний возраст 24,1 ± 9,9 года), из них мужчин — 20. Такая неопределен-
ность обусловлена ростом количества вновь синтезируемых наркотиков и затруднениями при их идентификации.
Во всех этих 152 случаях ВС была сочтена насильственной, они были исключены из дальнейшего анализа. Таким образом, из общего числа (10 440) проведенных судебно-медицинских аутопсий внезапно умерших ненасильственной смертью в возрасте от 14 до 35 лет оказалось 386 (3,7 %). Экстракардиальной причина ВС была у 95 человек из 386 (24,6 %). Причины внесердеч-ной смерти представлены в табл. 2. Как видно из табл. 2, чаще всего это была легочная патология (пневмония — 27, туберкулез легких — 21, тромбоэмболии ветвей легочной артерии — 4). Весьма часто встречались онкологические заболевания, несколько реже — инсульты и патология печени и поджелудочной железы. Последняя, весьма вероятно, связана со злоупотреблением алкоголем.
Экстракардиальной причина ВС была у 95 человек из 386 (24,6 %). Причины внесердеч-ной смерти представлены в табл. 2. Как видно из табл. 2, чаще всего это была легочная патология (пневмония — 27, туберкулез легких — 21, тромбоэмболии ветвей легочной артерии — 4). Весьма часто встречались онкологические заболевания, несколько реже — инсульты и патология печени и поджелудочной железы. Последняя, весьма вероятно, связана со злоупотреблением алкоголем.
В 291 случае (75,4 %) причиной ВС была кар-диальная патология, характер которой отражает табл. 3. Как следует из табл. 3, из всей кардиальной патологии как причины ВСС судебно-медицин -ский диагноз основного заболевания был сформулирован как «кардиомиопатия» в целом в 272 случаях из 291 (93,5 %). Из них в 57 (20,95 %) речь шла об алкогольной кардиомиопатии. В числе этих 57 умерших было 43 мужчины в возрасте 29,9 ± 5,1 года и 14 женщин в возрасте 28,6 ± 6,4 года. Диагноз устанавливался в соответствии с данными ка-тамнеза (длительное злоупотребление алкоголем) и/или на основании наличия в крови более 2,5 % алкоголя, что соответствует сильному алкогольному опьянению. При аутопсии структурные изменения сердца присутствовали не всегда. Из имеющейся патологии чаще выявлялись умеренные увеличение массы сердца, гипертрофия миокарда и дилатация полостей сердца. Определялось повышенное субэпикардиальное накопление жировой клетчатки. Гистологически алкогольная кардио-миопатия характеризовалась сочетанием атрофии с гипертрофией мышечных волокон, дистонией интрамуральных артерий, причудливыми контурами сосудов, мелкокапельной жировой дистрофией кардиомиоцитов, липоматозом стромы миокарда. Дополнительными признаками хронической алкогольной интоксикации являлись изменения со стороны печени: чаще жировой гепатоз, реже алкогольный гепатит и (редко в этой возрастной категории) цирроз печени, а также склероз и липоматоз поджелудочной железы, склероз мягких мозговых оболочек, наличие старых периваску-лярных кровоизлияний в ткани головного мозга (результат эпизодов резкого венозного полнокровия головного мозга при алкогольных эксцессах).
При аутопсии структурные изменения сердца присутствовали не всегда. Из имеющейся патологии чаще выявлялись умеренные увеличение массы сердца, гипертрофия миокарда и дилатация полостей сердца. Определялось повышенное субэпикардиальное накопление жировой клетчатки. Гистологически алкогольная кардио-миопатия характеризовалась сочетанием атрофии с гипертрофией мышечных волокон, дистонией интрамуральных артерий, причудливыми контурами сосудов, мелкокапельной жировой дистрофией кардиомиоцитов, липоматозом стромы миокарда. Дополнительными признаками хронической алкогольной интоксикации являлись изменения со стороны печени: чаще жировой гепатоз, реже алкогольный гепатит и (редко в этой возрастной категории) цирроз печени, а также склероз и липоматоз поджелудочной железы, склероз мягких мозговых оболочек, наличие старых периваску-лярных кровоизлияний в ткани головного мозга (результат эпизодов резкого венозного полнокровия головного мозга при алкогольных эксцессах).
В 95 случаях (34,9 %) в судебно-медицинских заключениях кардиомиопатия трактовалась как «токсическая». Следует отметить, что в Международной классификации болезней такая нозологическая форма отсутствует. Из числа этих 95 умерших было 85 мужчин в возрасте 26,4 ± 8,4 года
Следует отметить, что в Международной классификации болезней такая нозологическая форма отсутствует. Из числа этих 95 умерших было 85 мужчин в возрасте 26,4 ± 8,4 года
и 10 женщин в возрасте 24,1 ± 9,9 года. В их крови или моче либо не было обнаружено алкоголя и/или наркотиков, либо их количество было незначительным. Характерными для токсической кардиомиопатии, помимо других очевидных причин смерти, были дряблый, тусклый, глинистого вида миокард, неспецифические изменения по данным гистологического исследования, некоторые дополнительные признаки токсического воздействия (увеличение селезенки и/или жировой гепатоз). Немаловажное влияние на заключение судебно-медицинского эксперта оказывало наличие следов внутривенных инъекций и постинъек-ционых рубцов в проекции подкожных вен.
Диагноз был сформулирован как «кардиомио-патия неуточненная, острая миокардиальная недостаточность» в 108 случаях (39,7 %). Из них мужчин было 95 (возраст 24,1 ± 9,9 года), женщин — 13 (возраст 26,1 ± 8,5 года). В этой группе умерших макро- и микроскопические структурные изменения сердца отсутствовали либо были незначительными. Как правило, отсутствовал алкогольный анамнез или анамнез употребления наркотиков. По весьма скудным данным, представленным полицией со слов родственников умерших и/или очевидцев события, в большинстве случаев смерть наступала мгновенно либо во сне.
Из них мужчин было 95 (возраст 24,1 ± 9,9 года), женщин — 13 (возраст 26,1 ± 8,5 года). В этой группе умерших макро- и микроскопические структурные изменения сердца отсутствовали либо были незначительными. Как правило, отсутствовал алкогольный анамнез или анамнез употребления наркотиков. По весьма скудным данным, представленным полицией со слов родственников умерших и/или очевидцев события, в большинстве случаев смерть наступала мгновенно либо во сне.
ГКМП была диагностирована у 7 умерших (2,6 %) — все мужчины, средний возраст 26,9 ± 8,2 года. Диагноз устанавливался на основании наличия асимметричной гипертрофии межжелудочко-
вой перегородки. В части случаев он подтверждался патогномоничной гистологической картиной: дискомплексацией мышечных волокон, дезорганизацией кардиомиоцитов.
ДКМП была выявлена у 5 умерших (1,8 %) — 3 мужчин (27, 28 и 35 лет) и 2 женщин (28 и 35 лет). Этому диагнозу соответствовали дилатация всех камер сердца и некоторое увеличение его массы (свыше 400 г) в отсутствие гипертрофии миокарда.
Этому диагнозу соответствовали дилатация всех камер сердца и некоторое увеличение его массы (свыше 400 г) в отсутствие гипертрофии миокарда.
По результатам 15 судебно-медицинских аутопсий (5,15 %) диагноз был сформулирован как «ишемическая болезнь сердца, острая коронарная недостаточность». В числе этих 15 было 14 мужчин в возрасте 29,5 ± 5,5 года и 1 женщина 34 лет, страдающая ожирением. Диагноз устанавливался на основании наличия значимых атеросклеротиче-ских изменений коронарных артерий и гистологической картины, соответствующей проявлениям острой ишемии (повышенная эозинофилия, расстройства кровообращения в сосудах микроцир-куляторного русла с неравномерным кровенаполнением капилляров, отек стромы миокарда, спазм и плазматическое пропитывание интимы мелких интрамуральных артерий). Реже определялся морфологический субстрат острого коронарного синдрома в эпикардиальных артериях (атеротромбоз с признаками нестабильности атеросклеротической бляшки).
Активный миокардит диагностирован лишь у 3 человек, из них 2 мужчин (23 и 29 лет) и 1 женщина 20 лет. Проявлением острого миокардита счита-
Таблица 1. Результаты токсикологических исследований
Причина смерти К-во случаев
Острое отравление наркотиками 96
Острая алкогольная интоксикация 19
Отравление алкоголем и наркотиками 12
Отравление неизвестным веществом 25
Всего 152
Таблица 2. Экстракардиальные причины внезапной смерти молодых людей в возрасте 14-35 лет
Внесердечная причина смерти К-во случаев
Пневмония 27
Туберкулез 21
Онкологические заболевания 11
Острое нарушение мозгового кровообращения 7
Острый панкреатит 6
Цирроз печени 5
Кровотечения из желудочно-кишечного тракта 4
Тромбоэмболии ветвей легочной артерии 4
Острая респираторная вирусная инфекция 4
Разрыв аорты 3
Эпилепсия 3
Гипогликемия 1
Гнойный плеврит 1
Всего 95
лось наличие лимфоцитарной инфильтрации. В 1 случае (мужчина 20 лет) был выявлен врожденный порок сердца: сочетание дефектов межпредсерд-ной и межжелудочковой перегородки.
В 1 случае (мужчина 20 лет) был выявлен врожденный порок сердца: сочетание дефектов межпредсерд-ной и межжелудочковой перегородки.
Обсуждение полученных результатов
Очевидно, что основной причиной ВСС людей старшего и среднего возраста являются сердечно-сосудистые заболевания [1, 4, 19, 40—42]. В то же время в России, к сожалению, практически не существует работ, характеризующих структуру ВС в целом и ВСС у молодых людей. Такие исследования представляются чрезвычайно важными, в частности, в связи с тем, что многие из заболеваний сердечно-сосудистой системы, являющиеся причиной смерти в молодом возрасте, являются генетически детерминированными, наследуемыми.
Сама по себе внезапность смерти молодого человека влечет за собой необходимость исключения ее насильственного характера. Следствием этого является то, что ВС и ВСС молодых людей являются объектом исследования судебно-медицинского эксперта, а не патологоанатома. Уже один только этот факт может привести к существенным расхождениям в оценке причин ВСС. Это обусловлено различиями в профессиональной подготовке, в методологии, но самое главное — в задачах аутопсии. Можно полагать, что главной задачей судебно-медицинского эксперта — и совершенно обоснованно — является исключение насильственного характера ВС. Как известно, насильственной, в частности, считается ВС вследствие острого отравления наркотиками и острой алкогольной интоксикации.
Уже один только этот факт может привести к существенным расхождениям в оценке причин ВСС. Это обусловлено различиями в профессиональной подготовке, в методологии, но самое главное — в задачах аутопсии. Можно полагать, что главной задачей судебно-медицинского эксперта — и совершенно обоснованно — является исключение насильственного характера ВС. Как известно, насильственной, в частности, считается ВС вследствие острого отравления наркотиками и острой алкогольной интоксикации.
В представленном ретроспективном исследовании с острым отравлением наркотиками была связана каждая пятая ВС молодых людей. Если к этому добавить острую алкогольную интоксикацию и некоторое число имевших место отравлений неизвестным веществом, то таких умерших оказалось более четверти от всех включенных в выборку. Весьма примечательным выглядит и соотношение между умершими от острого отравления наркотиками и умершими от острой алкогольной интоксикации: примерно 5 : 1.
Однако общее число умерших, ВС которых связана с алкоголем и/или наркотиками, может ока-
заться еще большим, если вспомнить о том, что еще для 57 умерших причиной ВС указана алкогольная кардиомиопатия: 209 из 538, то есть 38,9 %. Здесь необходимо вспомнить о том, что мы пока говорим о ВС, а не о ВСС. В связи с этим представляют интерес иные, некардиологические причины ВС. Вполне обоснованным выглядит предположение о том, что такие из них, как острый панкреатит и цирроз печени [43, 44], а также, возможно, туберкулез легких [45], пневмония [46—48] и некоторые другие, могут ассоциироваться со злоупотреблением алкоголем и наркотиками. Очевидно, таким образом, что решение проблемы снижения ВС и ВСС у молодых людей не может быть реализовано в отрыве от решения проблемы алкоголизма и наркозависимости [49, 50].
Переходя к обсуждению причин ВСС, необходимо начать с того, что лишь небольшое число аутопсий (5,15 %) позволило выявить в данной возрастной категории ишемическую болезнь сердца, что вполне соответствует литературным данным [42, 51, 52]. Единичными были установленные диагнозы активного миокардита, что данным других авторов не соответствует [53—55]. Почти полное отсутствие выявленных врожденных пороков сердца можно объяснить тем, что исследовались аутопсии умерших не младше 14 лет.
Единичными были установленные диагнозы активного миокардита, что данным других авторов не соответствует [53—55]. Почти полное отсутствие выявленных врожденных пороков сердца можно объяснить тем, что исследовались аутопсии умерших не младше 14 лет.
В подавляющем же большинстве случаев ВСС (93,5 %) судебно-медицинский диагноз формулировался как «кардиомиопатия». При этом не возникает никаких вопросов при выявлении ГКМП и, пожалуй, ДКМП, но они составляют соответственно лишь 2,6 и 1,8 % от всех причин ВСС. Это несколько меньше, чем в доступной литературе [38, 56, 57].
Менее очевидной выглядит формулировка диагноза «алкогольная кардиомиопатия» (20,95 % случаев), но в этом случае диагноз хотя бы подтвержден, помимо неспецифических макро- и микроскопических изменений миокарда, данными катамнеза и/или содержанием алкоголя в крови, соответствующим тяжелой степени алкогольного опьянения [43, 58—60]. Что же касается таких формулировок диагноза, как «кардиомиопатия неуточненная, острая миокардиальная недостаточность» (39,7 % случаев) и «токсическая кардиомиопатия» (34,9 %), то они не могут не вызывать
Что же касается таких формулировок диагноза, как «кардиомиопатия неуточненная, острая миокардиальная недостаточность» (39,7 % случаев) и «токсическая кардиомиопатия» (34,9 %), то они не могут не вызывать
Судебно-медицинскии диагноз К-во случаев
Кардиомиопатия неуточненная, острая миокардиальная недостаточность 108
Токсическая кардиомиопатия 95
Алкогольная кардиомиопатия 57
Ишемическая болезнь сердца, острая коронарная недостаточность 15
ГКМП 7
ДКМП 5
Активный миокардит 3
Врожденный порок сердца 1
Всего 291
Таблица 3. Кардиальные причины внезапной сердечной смерти молодых людей в возрасте 14-35 лет
Кардиальные причины внезапной сердечной смерти молодых людей в возрасте 14-35 лет
некоторых сомнений, так как выявляемые при этом макро- и микроскопические неспецифические изменения, как правило, минимальны или вовсе отсутствуют.
Обоснованность этих сомнений подтверждается также тем, что при анализе такой объемной выборки (более 10 000 аутопсий) ни в одном случае не возникло предположения о наличии у умершего такой патологии, как, например, миокардитический кардиосклероз, АКДПЖ, некомпактный миокард, аномалии развития коронарных артерий. Весьма удивительным представляется также тот факт, что ни в одном из заключений по результатам аутопсии не отражено полное отсутствие макро- и микроскопических изменений, за исключением, скажем, признаков фибрилляции желудочков. Между тем среди такого большого количества умерших молодых людей не могло не оказаться субъектов с генетически детерминированными первичными электрическими заболеваниями сердца: синдромом удлиненного QT-интервала, синдромом Бру-гада и др. [43, 58—60]. Трудно предположить, что все они без исключения страдали хроническим алкоголизмом или наркозависимостью.
[43, 58—60]. Трудно предположить, что все они без исключения страдали хроническим алкоголизмом или наркозависимостью.
Анализ протоколов аутопсий позволяет предположить, что между судебно-медицинскими и патологоанатомическими аутопсиями существуют, как уже упоминалось выше, методологические различия. Так, сложилось впечатление, что морфометрия сердца в некоторых случаях могла проводиться без должной тщательности. Гистологические исследования, возможно, не имели специфической направленности, так как участки взятого миокарда нередко не маркировались, количество взятых участков сердца было ограниченным и не охватывало все структуры сердца. Правый желудочек сердца практически не подвергался ни должному морфологическому, ни какому-либо вообще гистологическому анализу. Все это не позволяло судебно-медицинскому эксперту ориентироваться на гистологическое заключение в верификации диагноза. Коронарные артерии не всегда вскрывались вдоль, в результате чего судить о возможном их аномальном расположении не представлялось возможным. Не всегда подвергались тщательному исследованию межпредсердная перегородка и клапаны сердца.
Не всегда подвергались тщательному исследованию межпредсердная перегородка и клапаны сердца.
ВСС в молодом возрасте неожиданна, часто необъяснима и всегда является трагедией для всей семьи. Ни в коем случае не умаляя пагубное влияние алкоголя или наркотиков на миокард, следует все же учитывать, что их употребление, а также использование многих лекарственных средств могут служить дополнительным пусковым фактором наряду с уже имеющимся генетически обусловленным анатомическим аритмическим субстратом. Учитывая то, что, по всеобщему мнению, превалирующей причиной ВСС у молодых людей являются генетически детерминированные заболевания сердца, в том числе наследуемые по аутосомно-до-минантному типу, для семьи умершего крайне важ-
но установить точную причину его смерти [61, 62]. Поэтому наряду с данными аутопсии для постановки диагноза совершенно необходим тщательно собранный катамнез заболевания [37]. Однако судебно-медицинские эксперты, к сожалению, владеют весьма скудной информацией о катамнезе в целом и обстоятельствах смерти в частности. Протоколы полиции ориентированы в первую очередь на исключение насильственной причины смерти, поэтому описывается только место, где она произошла, а также положение тела. В лучшем случае может присутствовать информация о приверженности умершего к наркотикам и/или алкоголю. Практика опроса свидетелей и родственников об обстоятельствах смерти, предшествующих симптомах, наследственности и т.п. фактически отсутствует. Между тем с точки зрения кардиолога важной может оказаться информация из любого источника [37], например от членов семьи, близких друзей, участкового терапевта и т.д. Необходимо владеть информацией о профессии, спортивной активности, вредных привычках умершего [8, 15, 23—26]. Крайне важны сведения об обстоятельствах смерти: дате, временном интервале (мгновенная или менее 1 часа), месте смерти (дома, на работе, на отдыхе), ее обстоятельствах (в покое, во время сна, во время бытовой или тяжелой нагрузки, во время эмоционального стресса, купания и т.
Однако судебно-медицинские эксперты, к сожалению, владеют весьма скудной информацией о катамнезе в целом и обстоятельствах смерти в частности. Протоколы полиции ориентированы в первую очередь на исключение насильственной причины смерти, поэтому описывается только место, где она произошла, а также положение тела. В лучшем случае может присутствовать информация о приверженности умершего к наркотикам и/или алкоголю. Практика опроса свидетелей и родственников об обстоятельствах смерти, предшествующих симптомах, наследственности и т.п. фактически отсутствует. Между тем с точки зрения кардиолога важной может оказаться информация из любого источника [37], например от членов семьи, близких друзей, участкового терапевта и т.д. Необходимо владеть информацией о профессии, спортивной активности, вредных привычках умершего [8, 15, 23—26]. Крайне важны сведения об обстоятельствах смерти: дате, временном интервале (мгновенная или менее 1 часа), месте смерти (дома, на работе, на отдыхе), ее обстоятельствах (в покое, во время сна, во время бытовой или тяжелой нагрузки, во время эмоционального стресса, купания и т. д.), наличии предшествующих симптомов [1, 63]. Важным может оказаться выявление подозрительных обстоятельств смерти (угарный газ, побои, дорожное происшествие и т.д.) [18]. В ходе расспроса родственников должно сложиться впечатление об общем состоянии здоровья умершего, возможных значимых заболеваниях (особенно важны наличие синкопальных состояний, нарушений ритма сердца, болей в области сердца, субфебрилитета, артериальной гипертензии, недавних инфекционных болезней, эпилепсии, бронхиальной астмы и т.д.). Требуется уточнить, употреблял ли умерший лекарственные средства (какие, как долго и в каких дозировках). Крайне важно собрать сведения о наследственности: преждевременная ВС в семье, аритмии, обмороки или другие возможные проявления заболеваний сердца у родственников [8, 15, 18, 23—26]. Собранная именно таким образом информация позволит заподозрить генетически детерминированное заболевание сердца и оптимизировать процедуру аутопсии за счет более тщательной макро- и микроскопии. Это поможет выявить такие наследуемые заболевания, как АКДПЖ, ГКМП, некомпактный миокард и др.
д.), наличии предшествующих симптомов [1, 63]. Важным может оказаться выявление подозрительных обстоятельств смерти (угарный газ, побои, дорожное происшествие и т.д.) [18]. В ходе расспроса родственников должно сложиться впечатление об общем состоянии здоровья умершего, возможных значимых заболеваниях (особенно важны наличие синкопальных состояний, нарушений ритма сердца, болей в области сердца, субфебрилитета, артериальной гипертензии, недавних инфекционных болезней, эпилепсии, бронхиальной астмы и т.д.). Требуется уточнить, употреблял ли умерший лекарственные средства (какие, как долго и в каких дозировках). Крайне важно собрать сведения о наследственности: преждевременная ВС в семье, аритмии, обмороки или другие возможные проявления заболеваний сердца у родственников [8, 15, 18, 23—26]. Собранная именно таким образом информация позволит заподозрить генетически детерминированное заболевание сердца и оптимизировать процедуру аутопсии за счет более тщательной макро- и микроскопии. Это поможет выявить такие наследуемые заболевания, как АКДПЖ, ГКМП, некомпактный миокард и др.
Впрочем, отсутствие структурных изменений сердца также является крайне важным диагностическим критерием [5, 7—9, 63]. Как уже отмечалось ранее, в нашем исследовании в группах с диагнозами «кардиомиопатия, острая миокардиальная недостаточность» и «токсическая кардиомиопатия» встречалось немало протоколов аутопсий, в которых не были описаны сколь-нибудь значимые макро- и микроскопические изменения сердца. В
таких случаях во всем мире причина смерти описывается как аутопсия-отрицательная и трактуется как синдром внезапной аритмической смерти. Принято считать, что основной причиной такой ВСС являются жизнеопасные желудочковые нарушения ритма сердца, обусловленные наличием ряда заболеваний, не связанных со структурными изменениями сердца и объединенных терминами «каналопатии» или «первичные электрические заболевания сердца» [5, 7—9]. В основе этих заболеваний лежат мутации генов, кодирующих белки ионных каналов, экспрессирующихся в миокарде, а также их модуляторов [62]. Безусловно, для верификации этих заболеваний необходимо генетическое тестирование, недоступное в настоящее время в качестве рутинного [25, 61, 64]. Однако выделение данной категории умерших, а также тех, причиной смерти которых явились генетически детерминированные органические заболевания сердца (АКДПЖ, ГКМП, некомпактный миокард и др.), может и должно помочь практическим кардиологам сосредоточить свои усилия на обследовании ближайших родственников про-бандов и предпринять профилактические (а возможно, и лечебные) меры для снижения среди них риска ВСС.
Безусловно, для верификации этих заболеваний необходимо генетическое тестирование, недоступное в настоящее время в качестве рутинного [25, 61, 64]. Однако выделение данной категории умерших, а также тех, причиной смерти которых явились генетически детерминированные органические заболевания сердца (АКДПЖ, ГКМП, некомпактный миокард и др.), может и должно помочь практическим кардиологам сосредоточить свои усилия на обследовании ближайших родственников про-бандов и предпринять профилактические (а возможно, и лечебные) меры для снижения среди них риска ВСС.
Хорошо известно, к сожалению, что ВСС может быть первым и единственным проявлением болезни сердца. Очевидно также, что ни одна страна мира не может себе позволить чрезвычайно дорогое скрининговое обследование своего молодого населения для исключения таких заболеваний [64]. Возможно, компромиссный, но в то же время достаточно эффективный способ решения проблемы — создание инновационного направления, заключающегося в тесном сотрудничестве судебно-медицинской службы и практической кардиологии.
Выводы
1. Непосредственной причиной внезапной смерти молодых людей в возрасте 14—35 лет более чем в четверти случаев является передозировка наркотиков и/или алкогольная интоксикация. При этом общее число умерших, внезапная смерть которых прямо или косвенно связана с алкоголем и/или наркотиками (алкогольная кардиомиопа-тия, острый панкреатит, цирроз печени, туберкулез легких и др.), является существенно большим.
2. В подавляющем большинстве случаев (93,5 %) по результатам судебно-медицинской аутопсии причина внезапной сердечной смерти молодых людей формулируется как кардиомио-патия, чаще всего неуточненная, токсическая или алкогольная. Именно эти диагнозы, по всей видимости, вобрали в себя почти полностью отсутствующие в выборке генетически детерминированные структурные заболевания сердца, а также аутопсия-отрицательные смерти.
3. Очевидное несовпадение причин внезапной сердечной смерти у молодых людей по данным су-
дебно-медицинских аутопсий и по современным литературным данным, основанным на результатах патологоанатомических аутопсий, обусловлено, видимо, методологическими различиями и разницей в задачах судебно-медицинской и пато-логоанатомической экспертизы.
4. Представляется целесообразным проведение работы, в рамках которой одни и те же случаи внезапной сердечной смерти молодых людей будут подвергнуты последовательно судебно-медицинской и патологоанатомической экспертизе с последующим сравнением результатов.
Список литературы
1. Бокерия Л.А., Ревишвили А.Ш., Неминущий Н.М. Внезапная сердечная смерть. — М.: ГЭОТАР-Медиа, 2011. — 272 с.
— 272 с.
2. Pratt C.M., Greenway P.S., Schoenfeld M.H. et al. Exploration of the precision of classifying sudden cardiac death. Implications for the interpretation of clinical trials // Circulation. — 1996. — Vol. 93. — P. 519-524.
3. Bayes de Luna A., Coumel P., Leclercq J.F. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases // Am. Heart J. — 1989. — Vol. 117. — P. 151-159.
4. Byrne R., Constant O, Smyth Y. et al. Multiple source surveillance incidence and aetiology of out-of-hospitalsudden cardiac death in a rural population in the West of Ireland // Eur. Heart J. — 2008. — Vol. 29. — P. 1418-1423.
5. Huikuri H.V., Castellanos A., Myerburg R.J. Sudden death due to cardiac arrhythmias // N. Engl. J. Med. — 2001. — Vol. 345. — P. 1473-1482.
— Vol. 345. — P. 1473-1482.
6. Turakhia M, TsengZ.H. Sudden Cardiac death:Epidemiology, mechanisms and therapy // Curr. Probl. Cardiol. — 2007. — Vol. 32. — P. 501-546.
7. Chugh S.S., Kelly K.L., Titus J.L. Sudden cardiac death with apparently normal heart // Circulation. — 2000. — Vol. 102. — P. 649-654.
8. Corrado D., Basso C., Thiene G. Sudden cardiac death in young people with apparently normal heart // Cardiovasc. Res. —
2001. — Vol. 50. — P. 399-408.
9. Morentin B, Suarez-Mier M.P., Aguilera B. Sudden unexplained death among persons 1 to 35 years old // Forensic Sci. Int. — 2003. — Vol. 135. — P. 213-217.
10. Engdahl J., Holmberg M., Karlson B.W. et al. The epidemiology of out-of-hospital «sudden» cardiac arrest // Resuscitation. —
—
2002. — Vol. 52. — P. 235-245.
11. Lopera G., Curtis A.B. Risk stratification for sudden cardiac death: current approaches and predictive value // Curr. Cardiol. Rev. — 2009. — Vol. 5. — P. 56-64.
12. Zipes D.P., Wellens H.J. Sudden cardiac death // Circulation. — 1998. — Vol. 98. — P. 2334-2351.
13. State-specific mortality from sudden cardiac death — United States, 1999 // MMWR Morb. Mortal. Wkly Rep. — 2002. — Vol. 51. — P. 123-126.
14. Zheng Z.J., Croft J.B., Giles W.H. et al. Sudden cardiac death in the United States, 1989 to 1998 // Circulation. — 2001. — Vol. 104. — P. 2158-2163.
15. Corrado D., Migliore F, Basso C., Thiene G. Exercise and the risk of sudden cardiac death // Herz. — 2006. — Vol. 31. — P. 553558.
— 2006. — Vol. 31. — P. 553558.
16. Muller-Nordhorn J., Binting S., Roll S., Willich S.N. An update on regional variation in cardiovascular mortality within Europe // Eur. Heart J. — 2008. — Vol. 29. — P. 1316-1326.
17. Myerburg R.J., Kessler K.M., Castellanos A. Sudden cardiac death. Structure, function, and time-dependence of risk // Circulation. — 1992. — Vol. 85. — P. I2-10.
18. PuranikR., Chow C.R., Duflou J.A. et al. Sudden death in the young//Heart Rhythm. — 2005. — Vol. 2, № 12. — P. 1277-1282.
19. Bowker T.J., Wood D.A., Davies M.J. et al. Sudden unexpected cardiac or unexplained death in England: a national survey// Q. J. Med. — 2003. — Vol. 96. — P. 269-279.
20. Chugh S.S., Jui J., Gunson K. et al. Current burden of sudden cardiac death: multiple source surveillance versus retrospective death certificate-based review in a large U. S. community // J. Am. Coll. Cardiol. — 2004. — Vol. 44. — P. 1268-1275.
S. community // J. Am. Coll. Cardiol. — 2004. — Vol. 44. — P. 1268-1275.
21. Vreede-Swagemakers J.J., Gorgels A.P., Dubois-Arbouw W.I. Out-of-hospital cardiac arrest in the 1990s: a population-based study in the Maastricht area on incidence, characteristics and survival // J. Am. Coll. Cardiol. — 1997. — Vol. 30. — P. 1500-1505.
22. Sharma S., Whyte G., McKenna W.J. Sudden death from cardiovascular disease in young athletes: fact or fiction //Br. J. Sports Med. — 1997. — Vol. 31. — P. 269-276.
23. Corrado D., Basso C., Rizzoli G. et al. Does sports activity enhance the risk of sudden death in adolescents and young adults?// J. Am. Coll. Cardiol. — 2003. — Vol. 42. — P. 1959-1963.
24. Corrado D., Basso C, Thiene G. Assay: sudden death in young athletes//Lancet. — 2005. — Vol. 45. — P. S47-S48.
45. — P. S47-S48.
25. Corrado D., Schmied C., Basso C. et al. Risk of sports: do we need a pre-participation screening for competitive and leisure athletes?//Eur. Heart J. — 2011. — Vol. 32. — P. 934-944.
26. Corrado D., Thiene G, Nava A. et al. Sudden death in young competitive athletes: clinico-pathologic correlations in 22 cases //Am. J. Med. — 1990. — Vol. 89. — P. 588-596.
27. Uhm J.S., Hwang I.U., Oh Y.S. et al. Prevalence of Electrocardiographic Findings Suggestive of Sudden Cardiac Death Risk in 10,867Apparently Healthy Young Korean Men // Pac. Clin. Electrophysiol. — 2011. — Vol. 36. — P. 717-723.
28. Криворученко Е.В., Красницкая О.В. Внезапная смерть в спорте// Физич. восп. студ. — 2011. — № 1. — C. 81-84.
29. Germann C.A., Perron A.D. Sudden Cardiac Death in Athletes: a guide for emergency physicians // Am. J. Emerg. Med. -2005. — Vol. 23. — P. 504-509.
Germann C.A., Perron A.D. Sudden Cardiac Death in Athletes: a guide for emergency physicians // Am. J. Emerg. Med. -2005. — Vol. 23. — P. 504-509.
30. Maron B.J., Doerer J.J., Haas T.S. et al. Sudden death in young competitive athletes. Analysis of 1866 deaths in the United States, 1980-2006// Circulation. — 2009. — Vol. 19. — P. 10851092.
31. Maron B.J, Shirani J., Poliac L.C. et al. Sudden death in young competitive athletes. Clinical, demographic, and pathological profiles// JAMA. — 1996. — Vol. 276. — P. 199-204.
32. Reddy P.R., Reinier K., Singh T. et al. Physical activity as a trigger of sudden cardiac arrest: the Oregon sudden unexpected death study// Int. J. Cardiol. — 2009. — Vol. 131. — P. 345-349.
33. Зайратьянц О.В, Кактурский Л..B. Причины смерти населения Москвы // Актуальные вопросы морфогенеза в норме и патологии. Сб. научных трудов НИИ морфологии человека РАМН. — М, 2002. — С. 21-24.
Сб. научных трудов НИИ морфологии человека РАМН. — М, 2002. — С. 21-24.
34. Кактурский Л.В. Внезапная сердечная смерть (клиническая морфология). — М.: Медицина для всех, 2000. — 127с.
35. Filippi A., Sessa E, Mazzaglia G. et al. Out of hospital sudden cardiac death in Italy: a population-based case-control study // Cardiovasc. Med. (Hagerstown). — 2008. — Vol. 9. — P. 595-600.
36. Moore M.J., Glover B.M., McCann C.J. et al. Demographic and temporal trends in out of hospital sudden cardiac death in Belfast//Heart. — 2006. — Vol. 92. — P. 311-315.
37. Bos J.M., Maron B.J., Ackerman M.J. et al. Role of family history of sudden death in risk stratification and prevention of sudden death with implantable defibrillators in hypertrophic cardiomyopathy// Am. J. Cardiol. — 2010. — Vol. 106. — P. 1481-1486.
106. — P. 1481-1486.
38. Christiaans I., van Engelen K., van Langen I.M. et al. Risk stratificationforsudden cardiac death in hypertrophic cardiomyopathy: systematic review of clinical risk markers // Europace. — 2010. -Vol. 12. — P. 313-321.
39. Россия в цифрах. Краткий статистический сборник. -М.: Госкомстат России. — 1995. — 108 с.
40. Вишневский А.Г, Школьников В.М. Смертность в России: главные группы риска и приоритеты действия. — М.: Московский Центр Карнеги. — 1997. — Вып. 19. — С. 8-16.
41. Милле Ф, Школьников В., Эртриш В., Вилен Ж. Современные тенденции смертности по причинам смерти в России, 1965-1994. — М.: Центр демографии и экологии человека, 1996. — 140 с.
42. Kannel W.B., Thomas H.E. Sudden coronary death: the Framingham Study // Ann. NY Acad. Sci. — 1982. — Vol. 382. -P. 3-21.
NY Acad. Sci. — 1982. — Vol. 382. -P. 3-21.
43. Барбараш О.Л., Фомина Н.В., Алтарев С.С. Неблагоприятное влияние периода новогодних праздников на показатели общей и кардиоваскулярной смертности // Кардиология. -2010. — № 11. — С. 35-39.
44. Дей К. Алкогольная патология печени // Наркология. —
2002. — № 4. — С. 21-23.
45. Данциг И.И., Смирнов Ю.Н., Гиршов Б.Д. Летальные исходы у лиц, злоупотребляющих алкоголем // Пробл. туберкулеза. — 2001. — № 2. — С. 49-52.
46. Апатова О.И., Шелепин А.А. Внебольничные пневмонии с присоединением внутрибольничной инфекции у лиц с хронической алкогольной интоксикацией // Новости науки и техн. Сер. мед. вып. Алкогольная болезнь/ВИНИТИ. — 2004. — № 5. — С. 1-2.
47. Белков С.А., Новоженов В.Г., Гордеев М.Н. Пневмонии у больных хроническим алкоголизмом. — М.: Изд-во Института психотерапии, 2001. — 64 с.
Белков С.А., Новоженов В.Г., Гордеев М.Н. Пневмонии у больных хроническим алкоголизмом. — М.: Изд-во Института психотерапии, 2001. — 64 с.
48. Гордеев М.Н. Особенности течения пневмоний у больных хроническим алкоголизмом // Мед. помощь. — 2002. — № 2. -С. 17-19.
49. Европейский план действия по борьбе с потреблением алкоголя на 2000-2005 гг. // Вопр. наркологии. — 2001. — № 3. -С. 1-7.
50. Школьников В.М., Червяков В.В. Политика по контролю кризисной смертности в России в переходный период. Программа развития ООН/Россия / Институт международных исследований семьи. — М., 2000. — Проект NoRUS/98/G51. — 193 с.
51. Morentin B., Audicana C. Population-based study of out-of-hospital sudden cardiovascular death: incidence and causes of death in middle-aged adults // Rev. Esp. Cardiol. — 2011. — Vol. 64. -P. 28-34.
— 2011. — Vol. 64. -P. 28-34.
52. Nabel E.G. Cardiovascular disease // N. Engl. J. Med. —
2003. — Vol. 349. — P. 60-72.
53. Daisley H., Jones-Le Cointe A., Hutchinson G., Simmons V. Fatal cardiac toxicity temporally related to poly-drug abuse // Vet. Hum. Toxicol. — 1998. — Vol. 40. — P. 21-22.
54. Gruszecki A.C., McGwin G., Robinson C.A., Davis G.G. The relationship of drug abuse to unexplained sudden death // Arch. Pathol. Lab. Med. — 2008. — Vol. 132. — P. 1903-1906.
55. Gruszecki A.C., McGwin G., Robinson C.A., Davis G.G. Unexplained sudden death and the likelihood of drug abuse // J. Forensic Sci. — 2005. — Vol. 50. — P. 419-422.
56. Colan S.D., Lipshultz S.E., Lowe A. M. et al. Epidemiology and cause-specific outcome of hypertrophic cardiomyopathy in children: findings from the Pediatric Cardiomyopathy Registry. // Circulation. — 2007. — Vol. 115. — P. 773-781.
M. et al. Epidemiology and cause-specific outcome of hypertrophic cardiomyopathy in children: findings from the Pediatric Cardiomyopathy Registry. // Circulation. — 2007. — Vol. 115. — P. 773-781.
57. Elliott P.M., Poloniecki J., Dickie S. et al. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients // J. Am. Coll. Cardiol. — 2000. — Vol. 36. — P. 2212-2218.
58. Арлеевский И.П., Галлеев А.А., Мухаметшина Г.А., Ами-нова Ф.И. Случай острой алкогольной миокардиодистрофии с инфарктоподобными изменениями электрокардиограммы // Рос. кардиол. журн. — 2000. — № 5. — С. 47-48.
59. Liberthson R..R.. Sudden death from cardiac causes in children and young adults//N. Engl. J. Med. — 1996. — Vol. 334. — P. 1039-1044.
60. Кактурский Л.В., Рыбакова М.Г., Кузнецова И. А. Внезапная сердечная смерть (морфологическая диагностика). Пособие для врачей. — СПб.: ГПАБ. — 2008. — Вып. 100. — 80с.
А. Внезапная сердечная смерть (морфологическая диагностика). Пособие для врачей. — СПб.: ГПАБ. — 2008. — Вып. 100. — 80с.
61. Tester D.J, Ackerman M.J. The role of molecular autopsy in unexplained sudden cardiac death // Curr. Opin. Cardiol. — 2006. -Vol. 21. — P. 166-172.
62. Tester D.J, Spoon D.B., Valdivia H.H. et al. Targeted mutational analysis of the RyR2-encoded cardiac ryanodine receptor in sudden unexplained death: a molecular autopsy of 49 medical examiner/coroner’s cases//Mayo Clin. Proc. — 2004. — Vol. 79. -P. 1380-1384.
63. Valdes-Dapena M. Are some crib deaths sudden cardiac deaths?// J. Am. Coll. Cardiol. — 1985. — Vol. 5. — P. 113B-117B.
64. Wheeler M.T., Heidenreich P.A., Froelicher V.F. et al. Cost-Effectiveness of Preparticipation Screening for Prevention of Sudden Cardiac Death in Young Athletes // Ann. зроблено аналiз 538 протоколiв судово-медичних аутопсш.
зроблено аналiз 538 протоколiв судово-медичних аутопсш.
У 152 випадках раптова смерть була викликана гострим отруенням алкоголем, наркотиками або невщомою речо-виною, вона була визнана насильницькою, цi протоколи були виключенi з подальшого аналiзу. З решти 386 випад-кiв екстракардiальною причина раптово! смертi була в 95 ошб (24,6 %), найчастiше це були пневмонп — 27, туберку-льоз легешв — 21, онкологiчнi захворювання — 11. У 291 випадку (75,4 %) причиною раптово! смерт була кардiаль-на патолог1я, причому в 272 випадках дiагноз був сформу-льований як «кардюмюпатая», з них в 57 (20,95 %) випадках йшлося про алкогольну кардюмюпатш, в 95 випадках (34,9 %) — про токсичну i в 108 випадках (39,7 %) дiагноз був сформульований як «кардюмюпаля неуточнена, го-стра мiокардiальна недостатшсть». Гiпертрофiчна кардю-мiопатiя була дiагностована в 7 померлих, дилатацiйна — у 5. У 15 випадках дiагноз був сформульований як «iшемiчна хвороба серця, гостра коронарна недостатшсть», в 3 випадках виявлений активний мiокардит, в 1 — вроджена вада серця. , кардiомiопатiя, каналопаля.
, кардiомiопатiя, каналопаля.
Gordeyeva M.V.1, Veleslavova O.Ye.1, Baturova M.A.1, RylovA.Yu.2, Lavrentyuk G.P.2, PlatonovP.G.3, Shubik Yu.V.1 North-Western Center for Diagnosis and Treatment of Arrhythmias at Saint-Petersburg State Medical Academy named after I.I. Mechnikov
2Saint Petersburg Bureau of Forensic Medical Examination, Saint Petersburg, Russia 3Lund University, Lund, Sweden
SUDDEN NON-VIOLENT DEATH IN YOUNG ADULTS (RETROSPECTIVE ANALYSIS)
Summary. To assess causes of sudden non-violent death in young adults aged 14—35 years deceased in Saint Petersburgin 2009, an analysis of 538 reports of medicolegal autopsies was made.
In 152 cases, when the sudden death was caused by acute poisoning with alcohol, narcotics, or unknown compounds, it was considered violent, and the corresponding reports were excluded from further analysis. Extracardiac causes of sudden death were revealed in 95 of 386 remaining cases (24.6 %), most often pneumonia — in 27, pulmonary tuberculosis — in 21, and oncological diseases — in 11 cases were documented. In 291 patients (75.4 %), sudden death was caused by cardiac diseases. In 272 cases, cardiomyopathy was diagnosed, including alcoholic cardiomyopathy in 57 cases (20.95 %), toxic cardiomyopathy in 95 cases (34.9 %), and cardiomyopathy of undetermined origin, acute myocardial insufficiency in 108 cases (39.7 %). Hypertrophic cardiomyopathy was detected in 7 subjects and dilated cardiomyopathy, in 5 subjects. In 15 cases, ischemic heart disease, acute coronary insufficiency was documented; acute myocarditis was revealed in 3 cases, and congenital valvular disease, in 1 case. Thus, drug overdose and/or alcoholic intoxication are causes of sudden death of young adults in more than one fourth of cases. In overwhelming majority of cases (93.5 %), the cause of sudden death is documented as cardiomyopathy (undetermined, toxic, or alcoholic).
Extracardiac causes of sudden death were revealed in 95 of 386 remaining cases (24.6 %), most often pneumonia — in 27, pulmonary tuberculosis — in 21, and oncological diseases — in 11 cases were documented. In 291 patients (75.4 %), sudden death was caused by cardiac diseases. In 272 cases, cardiomyopathy was diagnosed, including alcoholic cardiomyopathy in 57 cases (20.95 %), toxic cardiomyopathy in 95 cases (34.9 %), and cardiomyopathy of undetermined origin, acute myocardial insufficiency in 108 cases (39.7 %). Hypertrophic cardiomyopathy was detected in 7 subjects and dilated cardiomyopathy, in 5 subjects. In 15 cases, ischemic heart disease, acute coronary insufficiency was documented; acute myocarditis was revealed in 3 cases, and congenital valvular disease, in 1 case. Thus, drug overdose and/or alcoholic intoxication are causes of sudden death of young adults in more than one fourth of cases. In overwhelming majority of cases (93.5 %), the cause of sudden death is documented as cardiomyopathy (undetermined, toxic, or alcoholic). An obvious divergence of causes of sudden death revealed by the authors and up-to-date literature data seem to be conditioned methodological peculiar features of autopsy.
An obvious divergence of causes of sudden death revealed by the authors and up-to-date literature data seem to be conditioned methodological peculiar features of autopsy.
Key words: young adults, sudden death, sudden cardiac death, alcohol, narcotics, forensic medical examination, autopsy, cardiomyopathy, canalopathy.
МИОКАРДИАЛЬНЫЙ ЦИТОПРОТЕКТОР ТРИМЕТАЗИДИН МВ – ПРЕПАРАТ, ПОВЫШАЮЩИЙ ЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ И ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | Трухан
1. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Журнал Сердечная Недостаточность, 2013, 7(81): 379-472.
2. Мареев В.Ю., Агеев Ф. Т., Арутюнов Г.П. и др. Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность, 2010, 11(57): 1-62.
Т., Арутюнов Г.П. и др. Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность, 2010, 11(57): 1-62.
3. Демографический ежегодник России. 2013. URL: http://www.gks.ru/bgd/regl/B13_16/Main.htm
4. Трухан Д.И., Тарасова Л.В. Оптимизация лекарственной терапии ишемической болезни сердца и артериальной гипертензии: выбор ингибитора ангиотензинпревращающего фермента. Системные гипертензии. 2014. 1: 73-7.
5. Бубнова М.Г., Аронов Д.М., Оганов Р.Г., от имени исследователей – Рудоманов О.Г., Путылина А.С. Клиническая характеристика и общие подходы к лечению пациентов со стабильной стенокардией в реальной клинической практике. Российское исследование «ПЕРСПЕКТИВА» (ч. I). Кардиоваскулярная терапия и профилактика, 2010, 6: 47-56.
6. Аронов Д.М., Арутюнов Г.П., Беленков Ю.Н. и др. Согласованное мнение экспертов о целесообразности использования миокардиального цитопротектора триметазидина (Предуктала МВ) в комплексной терапии больных с хроническими формами ишемической болезни сердца. Cardioсоматика, 2012, 2: 58-60.
7. Трухан Д.И. Миокардиальный цитопротектор триметазидин МВ как важный компонент комплексной терапии ишемической болезни сердца и хронической сердечной недостаточности. Consilium Medicum, 2014, 10: 86-92.
8. Трухан Д.И. Терапевтические возможности миокардиального цитопротектора триметазидина МВ в лечении ишемической болезни сердца. Cardioсоматика, 2014, 3-4: 41-47.
9. Detry JM, Sellier P, Pennaforte S et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidine European Multi center Study Group. Br. J. Clin. Pharmacol., 1994, 37(2): 279-88.
Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidine European Multi center Study Group. Br. J. Clin. Pharmacol., 1994, 37(2): 279-88.
10. Kuzmicic J, Parra V, Verdejo HE et al. Trimetazidine prevents palmitate-induced mitochondrial fission and dysfunction in cultured cardiomyocytes. Biochem Pharmacol, 2014 Oct 1, 91(3): 323-36.
11. Loiacono F, Alberti L, Lauretta L et al. Metabolic therapy for heart failure. Recenti Prog Med, 2014 Jul-Aug, 105(7-8): 288-94.
12. Belardinelli R, Lacalaprice F, Faccenda E, Volpe L. Clinical benefits a metabolic approach in the cardiac rehabilitation of patients with coronary artery disease. Am J Cardiol, 2006, 98(supp.): 25-33.
13. Gao D, Ning N, Niu X et al. Trimetazidine: a meta-analysis of randomized controlled trials in heart failure. Heart, 2011, 97: 278-86.
Gao D, Ning N, Niu X et al. Trimetazidine: a meta-analysis of randomized controlled trials in heart failure. Heart, 2011, 97: 278-86.
14. Grajek S, Michalak M. The effect of trimetazidine added to pharmacological treatment on all-cause mortality in patients with systolic heart failure. Cardiology, 2015, 131(1): 22-9.
15. Терещенко С.Н., Акимова О.С., Демидова И.В. и др. Цитопротектор триметазидин в комплексной терапии тяжелой постинфарктной хронической сердечной недостаточности. Кардиология, 1999, 9: 48–52.
16. Маколкин В.И. Ишемическая дисфункция миокарда и пути ее коррекции. Форум. Ишемическая болезнь сердца, 2000, 2: 2-4.
17. Di Napoli P, Taccardi AA, Barsotti A. Long-term cardioprotectiveaction of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy. Heart, 2005, 91: 161–5.
Heart, 2005, 91: 161–5.
18. Васюк Ю.А., Школьник Е.Л., Куликов К.Г. и др. Влияние терапии Предукталом МВ на течение ХСН у больных стабильной стенокардией напряжения, перенесших острый инфаркт миокарда. Результаты исследования ПРИМА. Сердечная недостаточность, 2009, 10(1): 34-6.
19. Мареев В.Ю. Предуктал MB в амбулаторном лечении больных с сердечной недостаточностью ишемической этиологии: исследование ПРЕАМБУЛА. Электронный ресурс. URL:http://www. healtheconomics.m/index.php.
20. Lopatin YM et al. ESC Congress. Munich 27 Aug 2012. Abstract 2052.
21. Fragasso G, Rosano G, Baek SH et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: results from an international multicentre retrospective cohort study. Int J Cardiol, 2013 Mar 10, 163(3): 320-5.
Int J Cardiol, 2013 Mar 10, 163(3): 320-5.
22. El-Kady T, El-Sabban K, Gabaly M et al. Effects of trimetazidine on myocardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy: a 24-month study. Am. J. Cardiovasc. Drugs, 2005, 5(4): 271–8.
23. Sellier P, Broustet JP. Assessment of antiischemic and antianginal effect at trough plasma concentration and safety of trimetazidine MR 35 mg in patients with stable angina pectoris: a multicenter, double-blind, placebo-controlled study. Am J Cardiovasc Drugs, 2003, 3: 361–9.
24. Passeron J. Clinical efficacy of trimetazidine in stable angina pectoris. Presse Med, 1986, 15: 1775–8.
25. Detry JM, Seller P, Pennaforte S et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidin European Multicenter Study Group. Br J Clin Pharmacol, 1994, 37(2): 279–88.
Detry JM, Seller P, Pennaforte S et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidin European Multicenter Study Group. Br J Clin Pharmacol, 1994, 37(2): 279–88.
26. Dalla-Volta S, Maraglino G, Della-Valentina P et al. Comparison of trimetazidine with nifedipine in effort angina: a double-blind, crossover study. Cardiovasc Drugs Ther, 1990, 4: 853–60.
27. Iyengar S, Rosano G. Effects of antianginal drugs in stable angina in predicted mortality risk after surviving a myocardial infarction (METRO). Am J Cardiovasc Drugs, 2009, 9(5): 293–7.
28. Kim JS, Kim CH, Chun KJ et al. Effects of trimetazidine in patients with acute myocardial infarction: data from the Korean Acute Myocardial Infarction Registry. Clin Res Cardiol, 2013 Dec, 102(12): 915-22.
Clin Res Cardiol, 2013 Dec, 102(12): 915-22.
29. Трухан Д.И., Викторова И.А. Внутренние болезни: Кардиология. Ревматология. М.: ООО «Медицинское информационное агентство», 2013. 376 с.
30. Тарасова Л.В., Трухан Д.И. Роль врача первого контакта в профилактике, диагностике и лечении ишемической болезни сердца. Справочник поликлинического врача, 2013, 12: 8-12.
31. Chazov EI, Lepakchin VK, Zharova EA et al. Trimetazidine in Angina Combination Therapy – the TACT study: trimetazidine versus conventional treatment in patients with stable angina pectoris in a randomized, placebo-controlled, multicenter study. Am J Ther, 2005, 12(1): 35–42.
32. Szwed H, Sadowski Z, Elikowski W et al. Combination treatment in stable effort angina using trimetazidine and metoprolol: results of a randomized, double-blind, multicentre study (TRIMPOL II).TRIMetazidin in POLand. Eur Heart J, 2001, 22(24): 2267–74.
Combination treatment in stable effort angina using trimetazidine and metoprolol: results of a randomized, double-blind, multicentre study (TRIMPOL II).TRIMetazidin in POLand. Eur Heart J, 2001, 22(24): 2267–74.
33. Маколкин В.И., Осадчий К.К. Эффективность и переносимость триметазидина при лечении стабильной стенокардии напряжения в течение 8 недель (российское исследование ТРИУМФ). Кардиология, 2003, 6: 18-22.
34. Оганов Р.Г., Глезер М.Г., Деев А.Д. (От имени исследователей). Результаты Российского исследования «ПАРАЛЛЕЛЬ»: Программа выявления пациентов с неэффективной терапией бетаблокаторами и сравнительной оценки эффективности добавления к терапии Предуктала МВ или изосорбида динитрата при стабильной стенокардии. Кардиология, 2007, 3: 4–13.
35. Michaelides AP, Spiropoulos K, Dimopoulos R et al. Antianginal efficacy of the combination of the trimetazidine – propranolol compared with isosorbide dinitrate – propranolol in patients with stable angina. Clin Drug Invest. 1997, 13: 8–14.
Antianginal efficacy of the combination of the trimetazidine – propranolol compared with isosorbide dinitrate – propranolol in patients with stable angina. Clin Drug Invest. 1997, 13: 8–14.
36. McClellan KJ, Plosker GL. Trimetazidine. A review of its use in stable angina pectoris and other coronary conditions. Drug, 1999, 58(1): 143–57.
37. Алмазов В.А., Шляхто Е.В., Нифонтов Е.М. и др. Антиишемическая эффективность триметазидина у больных со стабильной стенокардией. Кардиология, 2000, 6: 40–2.
38. Nesukay E. Assessment of the most effective combination of antianginal medications in the treatment of patients with stable anginapectoris. WCC-12-ABS-1257.
39. Бубнова М.Г., Аронов Д. М., Оганов Р.Г. и др. Новые возможности триметазидина МВ в лечении ишемической болезни сердца в условиях реальной клинической практики. Результаты Российского многоцентрового рандомизированного исследования «ПЕРСПЕКТИВА» (ч. II). Кардиоваскулярная терапия и профилактика, 2011, 10(6): 70–80.
М., Оганов Р.Г. и др. Новые возможности триметазидина МВ в лечении ишемической болезни сердца в условиях реальной клинической практики. Результаты Российского многоцентрового рандомизированного исследования «ПЕРСПЕКТИВА» (ч. II). Кардиоваскулярная терапия и профилактика, 2011, 10(6): 70–80.
40. Marzilli M. Cardioprotective effects of trimetazidine: a review. Curr Med Res Opin, 2003, 19(7): 661-72.
41. Marzilli M, Klein WW. Efficacy and tolerability of trimetazidine in stable angina: a meta-analysis of randomized, double-blind, controlled trials. Coron Artery Dis, 2003 Apr, 14(2): 171-9.
42. Stanley WC, Marzilli M. Metabolic therapy in the treatment of ischaemic heart disease: the pharmacology of trimetazidine. Fundam Clin Pharmacol, 2003 Apr, 17(2): 133-45.
43. Peng S, Zhao M, Wan J et al. The efficacy of trimetazidine on stable angina pectoris: A metaanalysis of randomized clinical trials. Int J Cardiol., 2014 Oct 24, 177(3): 780-5.
44. Задионченко В.С., Шехян Г.Г., Ялымов А.А. и др. Доказанная эффективность и дополнительные благоприятные возможности триметазидина в терапии пациентов с ишемической болезнью сердца. Справочник поликлинического врача, 2013, 2: 29-35.
45. Fi Z, Kovács G, Szentes V.Role of trimetazidine in the treatment of diabetic microangiopathy in ischaemic heart disease. Orv Hetil, 2015 May 10, 156(19): 765-8.
46. Szwed H, Sadowski Z, Pachocki R et al. The antiischemic effects and tolerability of trimetazidine in coronary diabetic patients.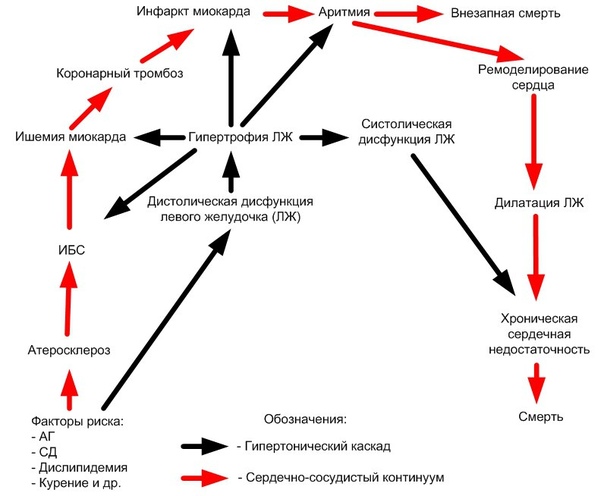 A substudy from TRIMPOL-1. Cardiovasc Drugs Ther, 1999, 13(3): 217–22.
A substudy from TRIMPOL-1. Cardiovasc Drugs Ther, 1999, 13(3): 217–22.
47. Федоткина Ю.А., Панченко Е.П. и др. Антиишемическая эффективность триметазидина у больных ишемической болезнью сердца и нарушениями углеводного обмена. Кардиология, 2002, 2: 28–33.
48. Stanley WC. Rationale for a metabolic approch in diabetic coronary patients. Coron Artery Dis, 2005, 16(supp. 1): 11–5.
49. Monti LD, Setola E, Fragasso G et al. Metabolic and endothelial effects of trimetazidine on forearm skeletal muscle in patients with type 2 diabetes and ischemic cardiomyopathy. Am J Physiol Endocrinol Metab, 2006 Jan, 290(1): 54-9.
50. Петрий В.В., Микова Н.В., Маколкин В.И. Коррекция триметазидином МВ эпизодов преходящей ишемии миокарда у больных ишемической болезнью сердца в сочетании с сахарным диабетом 2-го типа. Кардиология, 2007, 7: 22–5.
Кардиология, 2007, 7: 22–5.
51. Stadnik M, Handzlik-Orlik G, Sarnecki K et al.Clinical aspects of the use of trimetazidine in the prevention and treatment of myocardial diseases. Przegl Lek, 2013, 70(9): 730-4.
52. Xu X, Zhang W, Zhou Y et al. Effect of trimetazidine on recurrent angina pectoris and left ventricular structure in elderly multivessel coronary heart disease patients with diabetes mellitus after drug-eluting stent implantation: a single-centre, prospective, randomized, doubleblind study at 2-year follow-up. Clin Drug Investig, 2014 Apr, 34(4): 251-8.
53. Трухан Д.И., Филимонов С.Н. Клиника, диагностика и лечение основных заболеваний сердечно-сосудистой системы. Новокузнецк: ООО «Полиграфист». 2014. 235 с.
54. Харьков Е.И., Давыдов Е.Л., Гринштейн Ю.И., Кусаев В.В. Особенности фармакотерапии в пожилом и старческом возрасте (Сообщение I). Сибирский медицинский журнал (Иркутск), 2010, 5: 131-4.
Харьков Е.И., Давыдов Е.Л., Гринштейн Ю.И., Кусаев В.В. Особенности фармакотерапии в пожилом и старческом возрасте (Сообщение I). Сибирский медицинский журнал (Иркутск), 2010, 5: 131-4.
55. Сыркин А.Л., Лепахин В.К., Фитилев С.Б. и др. Триметазидин при стабильной стенокардии напряжения у больных старше 65 лет. Исследование TRIMER (Trimetazidine in Elderly People). Кардиология, 2002, 6: 24–31.
56. Гуревич М.А. Медикаментозное лечение пожилого пациента, перенесшего инфаркт миокарда Consilium Medicum, 2003, 12. URL: http://old.conmed.ru/magazines/cm/medicum/article/14302.
57. Национальные рекомендации по диагностике и лечению стабильной стенокардии.
58. Кардиоваскулярная терапия и профилактика.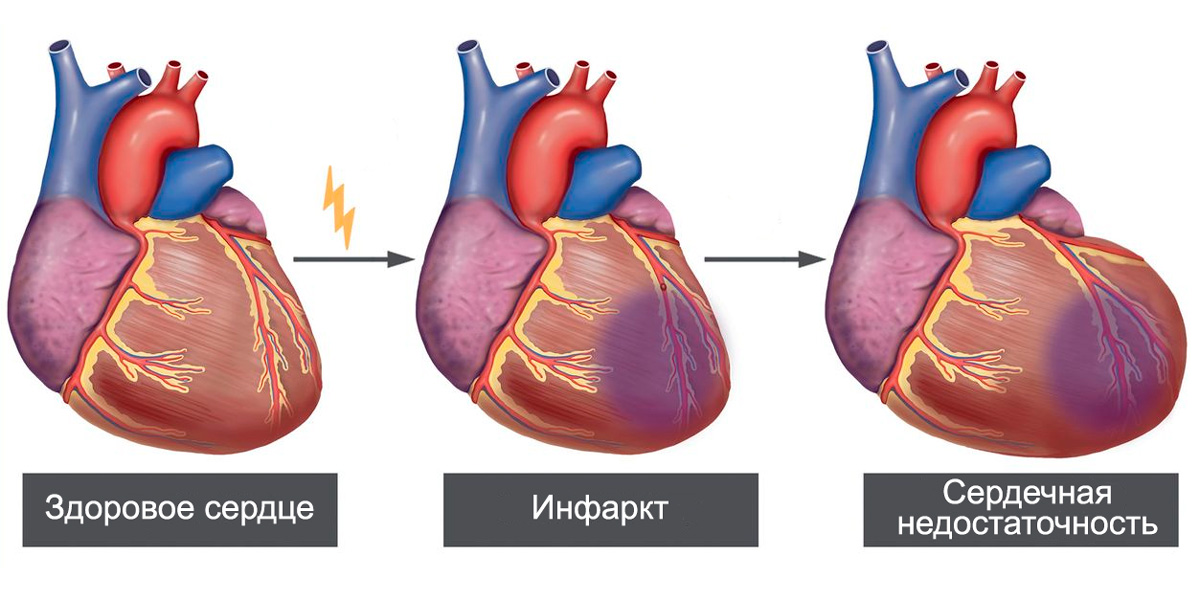 Приложение 4, 2008, 7(6): 33 с.
Приложение 4, 2008, 7(6): 33 с.
59. Fihn SD, Gardin JM, Abrams J et al. 2012 ACCF/AHA/ACP/ AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease. Circulation, 2012 Dec 18, 126(25): 354-471.
60. Montalescot G, Sechtem U, Achenbach S et al. 2013 ESC guidelines on the management of stable coronary artery disease. Eur Heart J, 2013 Oct, 34(38): 2949-3003.
61. Steg PG, Grollier G, Gallay P et al. (on behalf of the LIST Study Group). A randomized doubleblind trial of intravenous trimetazidine as adjunctive therapy to primary angioplasty for acute myocardial infarction. Int J Cardiol, 2001, 77: 263-73.
62. Bonello L, Sbragia P, Amabile N et al. Protective effect of an acute oral loading dose of trimetazidine on myocardial injury following percutaneous coronary intervention. Heart, 2007, 93(6): 703–7.
Protective effect of an acute oral loading dose of trimetazidine on myocardial injury following percutaneous coronary intervention. Heart, 2007, 93(6): 703–7.
63. Fabiani JN, Ponzio O, Emerit I et al. Cardioprotective effects of trimetazidine during coronary artery graft surgery. J Cardiovasc Surg, 1992, 33: 486-91.
64. Гордеев И.Г., Люсов В.А., Ильина Е.Е. и др. Нарушения сократимости миокарда левого желудочка у больных после коронарного шунтирования и методы ее коррекции. Кардиология, 2007, 2: 22–4.
65. Lin X, Ma A, Zhang W et al. Cardioprotective effects of atorvastatin plus trimetazidine in percutaneous coronary intervention. Pak J Med Sci, 2013 Apr, 29(2): 545-8.
66. Chen J, Zhou S, Jin J. Chronic treatment with trimetazidine after discharge reduces the incidence of restenosis in patients who received coronary stent implantation: A 1-year prospective follow-up study. Int J Cardiol, 2014 Jul 1, 174(3): 634-9.
Chen J, Zhou S, Jin J. Chronic treatment with trimetazidine after discharge reduces the incidence of restenosis in patients who received coronary stent implantation: A 1-year prospective follow-up study. Int J Cardiol, 2014 Jul 1, 174(3): 634-9.
67. Лопатин Ю.М., Дронова Е.Н. Клинико-фармако экономическая оценка длительного применения Предуктала модифицированного высвобождения у больных ишемической болезнью сердца, подвергнутых чрескожным коронарным вмешательствам. Сердце: журнал для практикующих врачей, 2011, 10(1): 67–72.
68. Labrou A, Giannoglou G, Ziotas D et al. Trimetazidine administration minimizes myocardial damage and improves left ventricular function after percutaneous coronary intervention. Am J Cardiovasc Drugs, 2007, 7: 143–50.
69. Tunerir В, Colak О, Alatas О et al. Measurement of troponin T to detect cardioprotective effect of trimetazidine during coronary artery bypass grafting. Ann Thorac Surg, 1999, 68: 2173–6.
Measurement of troponin T to detect cardioprotective effect of trimetazidine during coronary artery bypass grafting. Ann Thorac Surg, 1999, 68: 2173–6.
70. Zhang Y, Ma XJ, Shi DZ. Effect of Trimetazidine in Patients Undergoing Percutaneous Coronary Intervention: A Meta-Analysis. PLoS One, 2015 Sep 14, 10(9): e0137775.
71. Sentürk T, Cavun S, Avcı B et al. Effective inhibition of cardiomyocyte apoptosis through the combination of trimetazidine and N-acetylcysteine in a rat model of myocardial ischemia and reperfusion injury. Atherosclerosis, 2014 Dec, 237(2): 760-6.
72. Yang Q, Yang K, Li AY. Trimetazidine protects against hypoxia-reperfusion-induced cardiomyocyte apoptosis by increasing microRNA-21 expression. Int J Clin Exp Pathol, 2015 Apr 1, 8(4): 3735-41.
73. Liu YC, Li L, Su Q et al. Trimetazidine pretreatment inhibits myocardial apoptosis and improves cardiac function in a Swine model of coronary microembolization. Cardiology, 2015, 130(2): 130-6.
74. Давыдов С.И., Титова В.В., Гордеева М.А. и др. Роль триметазидина МВ в оптимизации терапии острого коронарного синдрома с позиции влияния на дисфункцию эндотелия и системное воспаление. Российский кардиологический журнал, 2013, 6: 54-61.
75. Аронов Д.М. Значение триметазидина при реабилитации кардиологических больных. Consilium medicum, 2008, 5: 105-9.
76. Szkodzinski J, Danikiewicz A, Hudzik B et al. Effect of trimetazidine on serum interleukin-6 and C-reactive protein concentrations in patients with stable coronary artery disease. J Biol Regul Homeost Agents, 2015 Jan-Mar, 29(1): 63-72.
J Biol Regul Homeost Agents, 2015 Jan-Mar, 29(1): 63-72.
77. Tanoglu A, Yamanel L, Inal V et al. Appreciation of trimetazidine treatment in experimental sepsis rat model. Bratisl Lek Listy, 2015, 116(2): 124-7.
78. Ромащенко О.В., Клочкова Г.Н., Муханова Е.И., Гайворонская И.В. Плейотропные эффекты триметазидина. Российский кардиологический журнал, 2013, 4: 83-7.
79. Mahfoudh-Boussaid A, Hadj Ayed Tka K, Zaouali MA. et al. Effects of trimetazidine on the Akt/ eNOS signaling pathway and oxidative stress in an in vivo rat model of renal ischemia-reperfusion. Ren Fail, 2014 Oct, 36(9): 1436-42.
80. Onbasili AO, Yeniceriglu Y, Agaoglu P et al. Trimetazidine in the prevention of contrastinduced nephropathy after coronary procedures. Heart, 2007, 93: 696–702.
Heart, 2007, 93: 696–702.
81. Shehata M. Impact of Trimetazidine on Incidence of Myocardial Injury and ContrastInduced Nephropathy in Diabetic Patients With Renal Dysfunction Undergoing Elective Percutaneous Coronary Intervention. Am J Cardiol, 2014 May 16. pii: S0002-9149(14).
82. Zhang R, Wei J, Yin H, Zhu Y. Effect of trimetazidine on renal function in patients with shock. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2014 Apr, 26(4): 219-22.
83. Liu W, Ming Q, Shen J et al. Trimetazidine Prevention of Contrast-Induced Nephropathy in Coronary Angiography. Am J Med Sci, 2015 Nov, 350(5): 398-402.
84. Hassanzadeh G, Hosseini A, Pasbakhsh P et al. Trimetazidine prevents oxidative changes induced in a rat model of sporadic type of Alzheimer’s disease. Acta Med Iran, 2015, 53(1): 17-24.
Acta Med Iran, 2015, 53(1): 17-24.
85. Трухан Д.И. Оригиналы и генерики: перезагрузка в свете экономического кризиса. Справочник поликлинического врача, 2012, 4: 32-6.
86. Трухан Д.И., Тарасова Л.В. Рациональная фармакотерапия и лекарственная безопасность в кардиологии. Справочник поликлинического врача, 2013, 5: 21-6.
87. Трухан Д.И. Выбор лекарственного препарата с позиций рациональной фармакотерапии. Consilium Medicum, 2013, 11: 45-9.
88. Трухан Д.И., Трухан В.Д. Мировой фармацевтический рынок: сохранение парадигмы классического маркетинга. Омский научный вестник, 2010, 1: 16-21.
89. Дрейд Д. Депренорм MВ – новый кардиоцитопротектор для лечения ИБС. Новая аптека, 2007, 12: 44-5.
Депренорм MВ – новый кардиоцитопротектор для лечения ИБС. Новая аптека, 2007, 12: 44-5.
90. Шостак Н.А., Смоленская О.Г., Панов А.В. и др. Оптимизация лечения ишемической болезни сердца с помощью цитопротекторов (опыт использования триметазидина мв на основании многоцентрового исследования). Клиницист, 2007, 6: 51-6.
91. Шостак Н.А., Смоленская О.Г., Панов А.В. и др. Возможности терапевтической кардиоцитопротекции в комплексной терапии ИБС. Российский кардиологический журнал, 2009, 6: 25-8.
92. Трухан Д.И. Рациональная фармакотерапия в кардиологии сквозь призму коморбидности и лекарственной безопасности. Справочник поликлинического врача, 2015, 1: 26-31.
93. Трухан Д.И., Поздняков Ю. М. Выбор диуретика для лечения артериальной гипертензии с позиций рациональной фармакотерапии. Справочник поликлинического врача, 2015, 10: 4-9.
М. Выбор диуретика для лечения артериальной гипертензии с позиций рациональной фармакотерапии. Справочник поликлинического врача, 2015, 10: 4-9.
94. Мирошниченко И.И., Птицина С.Н., Бобров В.И. и др. Фармакокинетический анализ нового кардиотропного препарата протекор и восстановленных отечественных антиангинальных препаратов депренорм и депренорм МВ. Психофармакология и биологическая наркология, 2007, S-2(М-Я): 1909-10.
95. Раменская Г.В., Шлыков В.С., Деханова О.А. Сравнительная оценка высвобождения in vitro таблетированных лекарственных форм триметазидина пролонгированного действия. Химико-фармацевтический журнал, 2009, 12: 36-8.
96. Сизова Ж.М. Взаимозаменяемость миокардиальных цитопротекторов в лечении больных с ишемической болезнью сердца. Трудные вопросы – простые решения. Рациональная фармакотерапия в кардиологии, 2013, 2: 183-7.
Рациональная фармакотерапия в кардиологии, 2013, 2: 183-7.
97. Cohen SM. Concept Analysis of Adherence in the Context of Cardiovascular Risk Reduction. Nursing Forum, 2009, 44(1): 25–36.
98. Гиляревский С.Р., Голшмид М.В., Кузьмина И.М.. Соотношение эффективности и безопасности применения статинов с целью первичной и вторичной профилактики: мифы и реальность. Системные гипертензии, 2015, 2: 96-102.
99. Трухан Д.И. Коррекция нарушений липидного обмена у пациентов с метаболическим синдромом: фокус на розувастатин. Справочник поликлинического врача, 2015, 11-12: 4-8.
100. Шилов А.М. Место препаратов с метаболической направленностью в условиях первичного звена здравоохранения при профилактике и лечении ишемических синдромов. Медицинский Совет, 2015, 12: 60-5.
Медицинский Совет, 2015, 12: 60-5.
101. Симаков А.А., Панина М.И. новые возможности лечения больных с ишемической болезнью сердца и стабильной стенокардией. Медицинский Совет, 2016, 19: 6-11.
102. Сизова Ж.М., Владимиров С.К. Современные возможности миокардиальной цитопротекции в лечении больных ишемической болезнью сердца. Медицинский Совет, 2016, 13: 38-43.
103. Трухан Д.И., Филимонов С.Н. Болезни сердечно-сосудистой системы: клиника, диагностика и лечение. СПб: СпецЛит. 2016. 319 с.
Виды сердечной недостаточности
Классификация
видов сердечной недостаточности основана
на критериях происхождения (миокардиальная
и перегрузочная), скорости развития
(острая и хроническая), преимущественного
поражения отдела сердца (левожелудочковая
и правожелудочковая), преимущественной
недостаточности фазы сердечного цикла
(систолическая и диастолическая) и
первичности поражения (кардиогенная и
некардиогенная). Выделенные на основе
Выделенные на основе
этих критериев виды сердечной
недостаточности перечислены на рис.
22–24.
Рис.
22–24. Виды сердечной недостаточности.
По
происхождению
По этому критерию
выделены миокардиальная, перегрузочная
и смешанные формы сердечной недостаточности.
• Миокардиальная
форма развивается преимущественно в
результате непосредственного повреждения
миокарда.
• Перегрузочная
форма сердечной недостаточности
возникает преимущественно в результате
перегрузки сердца (увеличения пред- или
постнагрузки).
• Смешанная
форма сердечной недостаточности —
результат сочетания прямого повреждения
миокарда и его перегрузки.
По
скорости
развития
По быстроте развития
симптомов сердечной недостаточности
выделены острая и хроническая формы.
• Острая
(развивается за минуты и часы). Является
Является
результатом инфаркта миокарда, острой
недостаточности митрального и аортального
клапанов, разрыва стенок левого желудочка.
• Хроническая
(формируется постепенно, в течение
недель, месяцев, годами). Является
следствием артериальной гипертензии,
хронической дыхательной недостаточности,
длительной анемии, пороков сердца.
Течение хронической сердечной
недостаточности может осложнять острая
сердечная недостаточность.
По
первичности
механизма
развития
По снижению
сократительной функции миокарда или
уменьшению притока венозной крови к
сердцу выделены первичная (кардиогенная)
и вторичная (некардиогенная) формы
сердечной недостаточности.
• Первичная
(кардиогенная). Развивается в результате
преимущественного снижения сократительной
функции сердца при близкой к нормальной
величине притока венозной крови к нему.
Наиболее часто наблюдается при ИБС
(может сопровождаться инфарктом миокарда,
кардиосклерозом, дистрофией миокарда),
миокардитах (например, при воспалительных
поражениях мышцы сердца или выраженных
и длительных эндотоксинемиях),
кардиомиопатиях.
• Вторичная
(некардиогенная). Возникает вследствие
первичного преимущественного уменьшения
венозного притока к сердцу при близкой
к нормальной величине сократительной
функции миокарда. Наиболее часто
встречается при острой массивной
кровопотере, нарушении диастолического
расслабления сердца и заполнения его
камер кровью (например, при сдавлении
сердца жидкостью, накапливающейся в
полости перикарда — кровью, экссудатом),
эпизодах пароксизмальной тахикардии
(что приводит к снижению сердечного
выброса и возврату венозной крови к
сердцу), коллапсе (например, вазодилатационном
или гиповолемическом).
По
преимущественно
поражённому
отделу
сердца
В зависимости от
преимущественного поражения левого
или правого отделов сердца различают
левожелудочковую и правожелудочковую
сердечную недостаточность.
• Левожелудочковая
сердечная недостаточность. Может быть
вызвана перегрузкой левого желудочка
(например, при стенозе устья аорты) или
снижением его сократительной функции
(например, при инфаркте миокарда), т. е.
е.
состояниями, приводящими к уменьшению
выброса крови в большой круг кровообращения,
перерастяжению левого предсердия и
застою крови в малом круге кровообращения.
• Правожелудочковая
сердечная недостаточность. Возникает
при механической перегрузке правого
желудочка (например, при сужении отверстия
клапана лёгочной артерии) или высоком
давлении в лёгочной артерии (при лёгочной
гипертензии), т.е. состояниях,
сопровождающихся уменьшением выброса
крови в малый круг кровообращения,
перерастяжением правого предсердия и
застоем крови в большом круге
кровообращения.
• Тотальная.
При этой форме выражена и левожелудочковая
и правожелудочковая сердечная
недостаточность.
По
преимущественной
недостаточности
фазы
сердечного
цикла
В зависимости от
вида нарушения функций миокарда левого
желудочка (снижение силы и скорости его
сокращения или нарушение скорости
расслабления) левожелудочковую сердечную
недостаточность подразделяют на
систолическую и диастолическую.
• Диастолическая
сердечная недостаточность — нарушение
расслабления и наполнения левого
желудочка. Обусловлена его гипертрофией,
фиброзом или инфильтрацией и приводит
к увеличению конечного диастолического
давления и развитию сердечной
недостаточности.
• Систолическая
сердечная недостаточность (хроническая)
осложняет течение ряда заболеваний.
При ней нарушается насосная (нагнетающая)
функция сердца, что приводит к уменьшению
сердечного выброса.
СЛУЧАЙ ОСТРОГО ИНФАРКТА МИОКАРДА ПРИ ВРОЖДЕННОЙ СОСУДИСТОЙ АНОМАЛИИ СЕРДЦА – МИОКАРДИАЛЬНОМ МОСТИКЕ | Мустафин
1. Bokerija, LA, Bokerija OL, Mozhina AA, Tetvadze IV. Miokardial’nye myshechnye mostiki. Jembriologija, anatomija, patofiziologija: Literaturnyj obzor. Chast’ I. Bjulleten’ NCSSH imeni A.N. Bakuleva RAMN. 2010;11(1):62-71.
2. Medushevskaja JuA. Osobennosti stroenija i gemodinamiki vetvej venechnyh arterij, raspolozhennyh pod myshechnymi mostikami. Vesennie anatomicheskie chtenija: sbornik statej nauch.-prakt. konf., posvjashhennoj pamjati docenta D. D. Smirnova. Grodno. 2017:115-118.
Medushevskaja JuA. Osobennosti stroenija i gemodinamiki vetvej venechnyh arterij, raspolozhennyh pod myshechnymi mostikami. Vesennie anatomicheskie chtenija: sbornik statej nauch.-prakt. konf., posvjashhennoj pamjati docenta D. D. Smirnova. Grodno. 2017:115-118.
3. Belov JuV, Bogopol’skaja OM. Miokardial’nyj mostik — vrozhdennaja anomalija koronarnogo rusla. Kardiologija. 2004;12:89–94.
4. Starodubov OD, Efremova OA. Miokardial’nye myshechnye mostiki: patofiziologicheskie osobennosti i kliniko-morfologicheskie priznaki. Nauchnye vedomosti Belgorodskogo gosudarstvennogo universiteta. Medicina. Farmacija. 2016:15-21.
5. Shheglova EV, Chotchaeva ZH, Andrejuk VA, Gol’tjapin DB. Miokardial’nye mosty kak prichina ishemii miokarda. Vestnik molodogo uchenogo. 2013;2:42-45.
2013;2:42-45.
6. Ishikawa Y. Anatomic properties of myocardial bridge predisposing to myocardial infarction. Circulation 2009;120:376-383.
7. Bokerija LA, Berishvili II. Hirurgicheskaja anatomija venechnyh arterij. 2013:297.
8. Ferreira AG. Myocardial bridges: morphological and functional aspects. Br. Heart J. 1991;66: 364-367.
9. Loukas M. Myocardial bridges: a review. Clin. Anat. 2011;24:675-683.
10. Peralta MR. Puentes Miocárdicas. Papel de la microcirculación, reserva coronaria y daño endotelial sistólico. Arch. Inst. Cardiol. Méx . 1998;68:506-530.
Острый инфаркт миокарда: причины, симптомы и лечение
Что такое острый инфаркт миокарда?
Острый инфаркт миокарда — это медицинское название сердечного приступа. Сердечный приступ — это опасное для жизни состояние, которое возникает, когда приток крови к сердечной мышце резко прекращается, вызывая повреждение тканей. Обычно это результат закупорки одной или нескольких коронарных артерий. Закупорка может развиться из-за накопления зубного налета, вещества, в основном состоящего из жира, холестерина и продуктов клеточных отходов.
Сердечный приступ — это опасное для жизни состояние, которое возникает, когда приток крови к сердечной мышце резко прекращается, вызывая повреждение тканей. Обычно это результат закупорки одной или нескольких коронарных артерий. Закупорка может развиться из-за накопления зубного налета, вещества, в основном состоящего из жира, холестерина и продуктов клеточных отходов.
Немедленно позвоните в службу 911, если вы думаете, что у вас или кого-то из ваших знакомых может быть сердечный приступ.
Хотя классическими симптомами сердечного приступа являются боль в груди и одышка, симптомы могут быть самыми разными. К наиболее распространенным симптомам сердечного приступа относятся:
. Важно отметить, что не все люди, у которых случаются сердечные приступы, испытывают одинаковые симптомы или одинаковую тяжесть симптомов. Боль в груди является наиболее частым симптомом как среди женщин, так и среди мужчин.Однако женщины чаще, чем мужчины:
Фактически, некоторые женщины, перенесшие сердечный приступ, сообщают, что их симптомы напоминают симптомы гриппа.
Сердце — главный орган сердечно-сосудистой системы, в которую также входят различные типы кровеносных сосудов. Некоторые из наиболее важных сосудов — это артерии. Они несут богатую кислородом кровь к вашему телу и всем вашим органам. Коронарные артерии направляют богатую кислородом кровь именно к сердечной мышце. Когда эти артерии блокируются или сужаются из-за накопления зубного налета, кровоток к сердцу может значительно уменьшиться или полностью прекратиться.Это может вызвать сердечный приступ. Несколько факторов могут привести к закупорке коронарных артерий.
Плохой холестерин
Плохой холестерин, также называемый липопротеинами низкой плотности (ЛПНП), является одной из основных причин закупорки артерий. Холестерин — это бесцветное вещество, которое содержится в еде, которую вы едите. Ваше тело тоже делает это естественно. Не весь холестерин вреден, но холестерин ЛПНП может прилипать к стенкам артерий и образовывать зубной налет. Зубной налет — это твердое вещество, которое блокирует кровоток в артериях. Тромбоциты, которые способствуют свертыванию крови, могут прилипать к бляшке и со временем накапливаться.
Тромбоциты, которые способствуют свертыванию крови, могут прилипать к бляшке и со временем накапливаться.
Насыщенные жиры
Насыщенные жиры также могут способствовать образованию бляшек в коронарных артериях. Насыщенные жиры содержатся в основном в мясных и молочных продуктах, включая говядину, масло и сыр. Эти жиры могут привести к закупорке артерий, увеличивая количество плохого холестерина в вашей системе крови и уменьшая количество хорошего холестерина.
Транс-жиры
Другой тип жира, способствующий закупорке артерий, — это трансжиры или гидрогенизированные жиры.Транс-жиры обычно производятся искусственно, и их можно найти во множестве обработанных пищевых продуктов. Трансжиры обычно указываются на этикетках пищевых продуктов как гидрогенизированное масло или частично гидрогенизированное масло.
Определенные факторы могут увеличить риск сердечного приступа.
Высокое кровяное давление
Вы подвергаетесь большему риску сердечного приступа, если у вас высокое кровяное давление. Нормальное артериальное давление ниже 120/80 мм рт. Ст. (Миллиметры ртутного столба) в зависимости от вашего возраста. По мере увеличения числа увеличивается и ваш риск развития проблем с сердцем.Высокое кровяное давление повреждает артерии и ускоряет образование зубного налета.
Нормальное артериальное давление ниже 120/80 мм рт. Ст. (Миллиметры ртутного столба) в зависимости от вашего возраста. По мере увеличения числа увеличивается и ваш риск развития проблем с сердцем.Высокое кровяное давление повреждает артерии и ускоряет образование зубного налета.
Высокий уровень холестерина
Высокий уровень холестерина в крови повышает риск острого инфаркта миокарда. Вы можете снизить уровень холестерина, изменив свой рацион или приняв определенные лекарства, называемые статинами.
Высокий уровень триглицеридов
Высокий уровень триглицеридов также увеличивает риск сердечного приступа. Триглицериды — это тип жира, который закупоривает артерии.Триглицериды из пищи, которую вы едите, проходят через вашу кровь, пока не откладываются в вашем теле, обычно в жировых клетках. Однако некоторые триглицериды могут оставаться в ваших артериях и способствовать образованию зубного налета.
Диабет и повышенный уровень сахара в крови
Диабет — это состояние, при котором уровень сахара или глюкозы в крови повышается. Высокий уровень сахара в крови может повредить кровеносные сосуды и в конечном итоге привести к ишемической болезни сердца. Это серьезное заболевание, которое у некоторых людей может вызвать сердечные приступы.
Высокий уровень сахара в крови может повредить кровеносные сосуды и в конечном итоге привести к ишемической болезни сердца. Это серьезное заболевание, которое у некоторых людей может вызвать сердечные приступы.
Ожирение
Ваши шансы на сердечный приступ выше, если у вас очень избыточный вес. Ожирение связано с различными состояниями, которые увеличивают риск сердечного приступа, в том числе:
- диабет
- высокое кровяное давление
- высокий уровень холестерина
- высокий уровень триглицеридов
курение
курение табачных изделий увеличивает риск сердечного приступа . Это также может привести к другим сердечно-сосудистым состояниям и заболеваниям.
Возраст
Риск сердечного приступа увеличивается с возрастом. Мужчины подвержены более высокому риску сердечного приступа после 45 лет, а женщины — более высокому риску сердечного приступа после 55 лет.
Семейный анамнез
У вас больше шансов получить сердечный приступ, если у вас есть семья история ранних пороков сердца.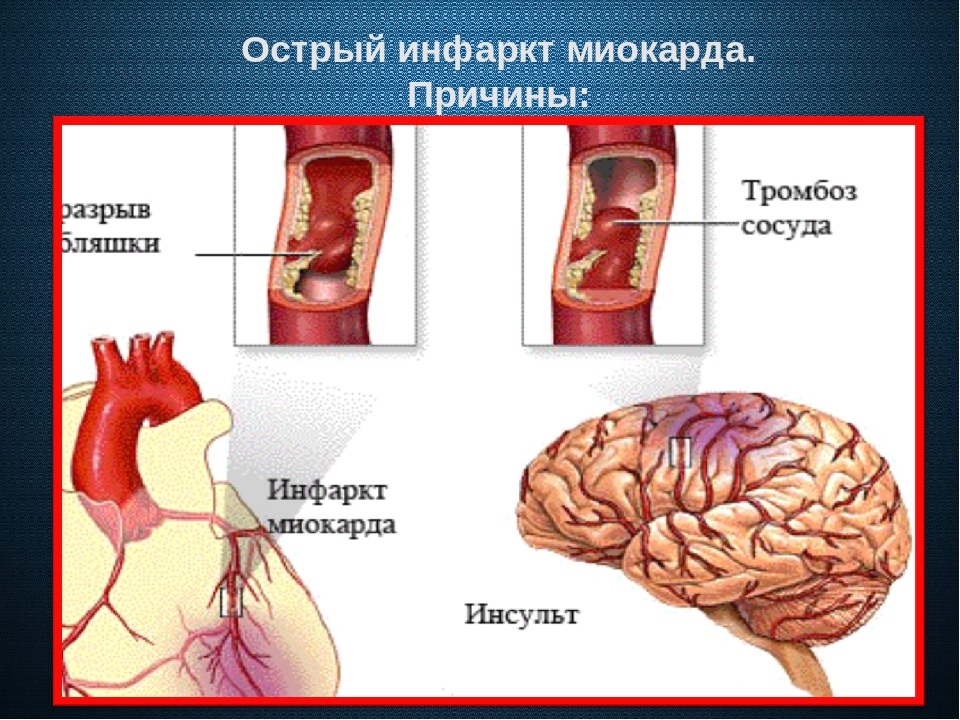 Ваш риск особенно высок, если у вас есть члены семьи мужского пола, у которых болезнь сердца развилась до 55 лет, или если у вас есть члены семьи женского пола, у которых болезнь сердца развилась до 65 лет.
Ваш риск особенно высок, если у вас есть члены семьи мужского пола, у которых болезнь сердца развилась до 55 лет, или если у вас есть члены семьи женского пола, у которых болезнь сердца развилась до 65 лет.
Другие факторы, которые могут увеличить риск сердечного приступа, включают:
Чтобы определить, был ли у вас сердечный приступ, врач послушает ваше сердце, чтобы проверить, нет ли нарушений в вашем сердцебиении. Они также могут измерить ваше кровяное давление. Ваш врач также проведет ряд различных тестов, если подозревает, что у вас был сердечный приступ. Электрокардиограмма (ЭКГ) может быть сделана для измерения электрической активности вашего сердца. Анализы крови также можно использовать для проверки белков, связанных с повреждением сердца, таких как тропонин.
Другие диагностические тесты включают:
- стресс-тест, чтобы увидеть, как ваше сердце реагирует на определенные ситуации, например, упражнения
- ангиограмму с коронарной катетеризацией для поиска областей закупорки в ваших артериях
- эхокардиограмму для определения областей сердца, которые не работают должным образом
Сердечные приступы требуют немедленного лечения, поэтому большинство процедур начинается в отделении неотложной помощи. Минимально инвазивная процедура, называемая ангиопластикой, может использоваться, чтобы разблокировать артерии, кровоснабжающие сердце.Во время ангиопластики ваш хирург вставит длинную тонкую трубку, называемую катетером, через вашу артерию, чтобы добраться до закупорки. Затем они надувают небольшой баллон, прикрепленный к катетеру, чтобы снова открыть артерию, позволяя возобновить кровоток. Ваш хирург может также поместить небольшую сетчатую трубку, называемую стентом, на место закупорки. Стент может предотвратить повторное закрытие артерии.
Минимально инвазивная процедура, называемая ангиопластикой, может использоваться, чтобы разблокировать артерии, кровоснабжающие сердце.Во время ангиопластики ваш хирург вставит длинную тонкую трубку, называемую катетером, через вашу артерию, чтобы добраться до закупорки. Затем они надувают небольшой баллон, прикрепленный к катетеру, чтобы снова открыть артерию, позволяя возобновить кровоток. Ваш хирург может также поместить небольшую сетчатую трубку, называемую стентом, на место закупорки. Стент может предотвратить повторное закрытие артерии.
В некоторых случаях ваш врач может также захотеть провести аортокоронарное шунтирование (АКШ). Во время этой процедуры ваш хирург перенаправит ваши вены и артерии, чтобы кровь могла обойти закупорку.АКШ иногда делают сразу после сердечного приступа. Однако в большинстве случаев это делается через несколько дней после инцидента, чтобы у вашего сердца было время для восстановления.
Для лечения сердечного приступа также можно использовать ряд различных лекарств:
- Разжижители крови, такие как аспирин, часто используются для разрушения тромбов и улучшения кровотока через суженные артерии.

- Тромболитики часто используются для растворения сгустков.
- Антитромбоцитарные препараты, такие как клопидогрель, можно использовать для предотвращения образования новых и роста существующих сгустков.
- Нитроглицерин можно использовать для расширения кровеносных сосудов.
- Бета-адреноблокаторы снижают артериальное давление и расслабляют сердечную мышцу. Это поможет снизить серьезность повреждения сердца.
- Ингибиторы АПФ также можно использовать для снижения артериального давления и уменьшения нагрузки на сердце.
- Можно использовать обезболивающие, чтобы уменьшить дискомфорт, который вы можете испытывать.
Ваши шансы на выздоровление после сердечного приступа зависят от того, насколько сильно повреждено ваше сердце и как быстро вы получите неотложную помощь.Чем раньше вы получите лечение, тем больше у вас шансов выжить. Однако, если ваша сердечная мышца серьезно повреждена, ваше сердце может быть не в состоянии перекачивать достаточное количество крови по всему телу. Это может привести к сердечной недостаточности.
Это может привести к сердечной недостаточности.
Повреждение сердца также увеличивает риск развития нарушений сердечного ритма или аритмий. Ваш риск повторного сердечного приступа также будет выше.
Многие люди, перенесшие сердечные приступы, испытывают тревогу и депрессию.Во время выздоровления важно поговорить со своим врачом о том, что вас беспокоит. Также может быть полезно присоединиться к группе поддержки или поговорить с консультантом о том, через что вы проходите.
Большинство людей могут вернуться к своей обычной деятельности после сердечного приступа. Однако вам нужно будет вернуться к любой интенсивной физической активности. Ваш врач поможет вам разработать конкретный план выздоровления. От вас могут потребовать принимать лекарства или пройти программу кардиологической реабилитации. Этот тип программы может помочь вам постепенно восстановить силы, научить вас изменять здоровый образ жизни и направить вас в процессе лечения.
Есть много способов предотвратить сердечный приступ, даже если он был у вас раньше.
Один из способов снизить риск — придерживаться здоровой для сердца диеты. Эта диета должна в основном состоять из:
Вам также следует сократить количество следующих продуктов в своем рационе:
- сахар
- насыщенные жиры
- транс-жиры
- холестерин
Это особенно важно для людей с диабетом, высокий артериальное давление и высокий уровень холестерина.
Выполнение упражнений несколько раз в неделю также улучшит здоровье сердечно-сосудистой системы. Если у вас недавно случился сердечный приступ, вам следует поговорить со своим врачом, прежде чем начинать новый план упражнений.
Также важно бросить курить, если вы курите. Отказ от курения значительно снизит риск сердечного приступа и улучшит здоровье сердца и легких. Вам также следует избегать пассивного курения.
Острая коронарная недостаточность (угрожающий инфаркт миокарда и инфаркт миокарда): Хирургическое лечение методом трансплантата подкожной вены
Реферат
Развитие прямой хирургии коронарной артерии методом трансплантата подкожной вены впервые дает метод, который сразу же увеличивает снабжение миокарда кислородом. В результате площадь инфаркта миокарда больше не зависит только от потребления кислорода.
В результате площадь инфаркта миокарда больше не зависит только от потребления кислорода.
С апреля 1968 г. по май 1971 г. 29 пациентам была проведена экстренная операция; 18 операций выполнено больным с инфарктом миокарда, 11 — с острым инфарктом миокарда. Девятнадцати пациентам перед обострением была проведена коронарноангиография; 9 изучались во время острого эпизода. Пациенты с надвигающимся инфарктом миокарда были прооперированы в течение 24 часов после острого приступа.Девять пациентов с острым инфарктом были прооперированы в течение 4–5 часов, 1 — в течение 8 часов и 1 — в течение 10 часов. Три пациента умерли после операции; 2 в группе с угрожающим инфарктом миокарда и 1 в группе с острым инфарктом. Двенадцати пациентам было проведено повторное киноангиографическое обследование. Все трансплантаты, кроме 1, были открытыми. В группе с надвигающимся инфарктом миокарда послеоперационная левая вентрикулография показала хорошую функцию левого желудочка. В группе острого инфаркта миокарда у 4 пациентов наблюдалась хорошая функция левого желудочка. У 1 желудочек без изменений, у 2 — нарушение сокращения.
У 1 желудочек без изменений, у 2 — нарушение сокращения.
Несмотря на то, что настоящий клинический опыт ограничен, можно сделать определенные выводы: (1) Экстренная коронарная киноангиография может быть выполнена с минимальным риском. (2) Пациенты с угрозой инфаркта миокарда могут быть прооперированы с низким уровнем смертности и минимальными осложнениями. Эти пациенты — идеальные кандидаты. Операция может предотвратить инфаркт миокарда. (3) Когда операции выполняются в течение 6 часов после острого инфаркта миокарда, большая часть сердечной мышцы может быть сохранена.(4) У пациентов с острым инфарктом миокарда и кардиогенным шоком вспомогательное механическое кровообращение является обязательным в качестве первого шага. Увеличение кровоснабжения, насыщенного кислородом, должно улучшить перфузию миокарда.
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст
Авторские права © 1971 Опубликовано Elsevier Inc.
Рекомендуемые статьи
Цитирование статей
Стратегии снижения риска внезапной сердечной смерти при остром инфаркте миокарда
Внезапная сердечная смерть (ВСС) остается серьезной проблемой общественного здравоохранения, от которой ежегодно страдают около 300 000 человек в США. 1 ВСС, определяемая как смерть, наступающая в течение одного часа после появления симптомов, связана с ишемической болезнью сердца в 80% случаев. Примерно одна треть случаев является результатом острой окклюзии эпикардиальной коронарной артерии. 2 Около 50% смертности от острого инфаркта миокарда (ОИМ) является результатом внезапной смерти. Хотя недавние тенденции продемонстрировали заметное улучшение показателей смертности пациентов, поступивших с ОИМ, 3 прогноз пациентов, страдающих от остановки сердца вне больницы, остается мрачным, и только 4% из них были выписаны живыми. 4 Таким образом, выявление пациентов с риском внезапной сердечной смерти во время инфаркта миокарда является обязательным условием для реализации стратегии снижения риска задолго до события. Однако в большинстве случаев ВСС отсутствует явная болезнь сердца, что затрудняет попытки заранее выявить таких пациентов. Действительно, большинство случаев ВСС можно классифицировать как относящиеся к группе низкого риска ишемической болезни сердца, основываясь только на классическом профиле факторов риска, особенно во время острого случая ИМ, что предотвращает снижение смертности.
1 ВСС, определяемая как смерть, наступающая в течение одного часа после появления симптомов, связана с ишемической болезнью сердца в 80% случаев. Примерно одна треть случаев является результатом острой окклюзии эпикардиальной коронарной артерии. 2 Около 50% смертности от острого инфаркта миокарда (ОИМ) является результатом внезапной смерти. Хотя недавние тенденции продемонстрировали заметное улучшение показателей смертности пациентов, поступивших с ОИМ, 3 прогноз пациентов, страдающих от остановки сердца вне больницы, остается мрачным, и только 4% из них были выписаны живыми. 4 Таким образом, выявление пациентов с риском внезапной сердечной смерти во время инфаркта миокарда является обязательным условием для реализации стратегии снижения риска задолго до события. Однако в большинстве случаев ВСС отсутствует явная болезнь сердца, что затрудняет попытки заранее выявить таких пациентов. Действительно, большинство случаев ВСС можно классифицировать как относящиеся к группе низкого риска ишемической болезни сердца, основываясь только на классическом профиле факторов риска, особенно во время острого случая ИМ, что предотвращает снижение смертности. В этой статье основное внимание уделяется факторам риска ВСС, особенно во время ОИМ, с практической целью вмешательства для снижения риска.
В этой статье основное внимание уделяется факторам риска ВСС, особенно во время ОИМ, с практической целью вмешательства для снижения риска.
Патогенез
Патологические исследования выявили две доминирующие формы коронарной окклюзии при ВСС. Большинство случаев возникает в результате разрыва атеросклеротической бляшки тонкой фиброзной капсулы с вторичным тромбозом. Другие случаи вызваны эрозией зубного налета без разрушения фиброзного колпачка. Эрозия зубного налета чаще всего наблюдается у курящих женщин в пременопаузе и не связана с уровнем холестерина. 5 Большинство случаев ВСС является результатом желудочковых тахиаритмий, перерождающихся в фибрилляцию желудочков (ФЖ). 6 Острая тромботическая окклюзия вызовет истощение аденозинтрифосфата (АТФ) с последующим открытием каналов АТФ калия (КАТФ) и неоднородностью в продолжительности потенциала действия и распространении, особенно вокруг пограничной зоны области инфаркта, открывая путь для повторного заражения. входные цепи. 7 Трансмуральная дисперсия реполяризации может усугубляться ограниченным резервом реполяризации у пациентов с мутациями в генах ионных каналов, что объясняет повышенный риск ВСС при ОИМ у субъектов с удлиненными интервалами QT.
входные цепи. 7 Трансмуральная дисперсия реполяризации может усугубляться ограниченным резервом реполяризации у пациентов с мутациями в генах ионных каналов, что объясняет повышенный риск ВСС при ОИМ у субъектов с удлиненными интервалами QT.
Следовательно, снижение риска ВСС должно быть нацелено на провоцирующую бляшку, механизмы развития желудочковых аритмий и быструю дефибрилляцию летальных аритмий.
Клиническая эпидемиология
Эпидемиологические исследования и вскрытия жертв ВСС при ОИМ показывают, что несколько профилей факторов риска коронарной болезни могут предрасполагать субъектов к внезапной смерти. Гендерные различия особенно заметны: у мужчин преобладает SCD, MI и SD во время MI.Напротив, большинство ВСС у женщин не коронарные. 8 Возраст является важным фактором, поскольку частота внезапной сердечной болезни в результате острой коронарной окклюзии увеличивается после 40 лет. В более молодых возрастных группах следует учитывать злоупотребление кокаином. Курение сигарет является провокатором острого тромбоза 9 и коронарного спазма 10 и, как было установлено в нескольких исследованиях, является фактором риска внезапной сердечной смерти. 2,11–13 Отказ от курения быстро снижает риск ВСС даже при вторичной профилактике. 2,13 Содействие отказу от курения является важным элементом снижения риска.
Курение сигарет является провокатором острого тромбоза 9 и коронарного спазма 10 и, как было установлено в нескольких исследованиях, является фактором риска внезапной сердечной смерти. 2,11–13 Отказ от курения быстро снижает риск ВСС даже при вторичной профилактике. 2,13 Содействие отказу от курения является важным элементом снижения риска.
Гиперхолестеринемия, коварный фактор риска, менее склонна к провоцированию ФЖ, возможно, из-за прекондиционирования миокарда. 11,14 История фибрилляции предсердий связана в двух исследованиях с SCD. 15,16
Продромальные симптомы
Хотя последнее событие может быть определено как внезапное, многие жертвы ВСС имели незамеченные симптомы задолго до своей смерти.До 50% страдают стенокардией в предшествующем году 11,14 и у большинства из них наблюдаются такие симптомы, как стенокардия, одышка и тошнота. В одной серии половина жертв принимали обезболивающие менее чем за 12 часов до смерти. 2 Таким образом, обучение населения в целом обращению с этими симптомами, особенно в группах высокого риска, может позволить пациентам и членам их семей принять важные профилактические меры.
2 Таким образом, обучение населения в целом обращению с этими симптомами, особенно в группах высокого риска, может позволить пациентам и членам их семей принять важные профилактические меры.
Электрокардиограмма в стратификации риска
Электрокардиограмма (ЭКГ) в 12 отведениях обеспечивает важную стратификацию риска ВСС; при не связанных с ишемией расстройствах внезапной смерти, таких как удлиненный интервал QT, бругада и аритмогенная дисплазия правого желудочка, ЭКГ является центральным элементом диагностики.В целом на ЭКГ в 12 отведениях отсутствуют маркеры, достаточно чувствительные и специфичные для стратификации риска ишемической болезни сердца. 17
Необходимо оценить ЭКГ-признаки гипертрофии левого желудочка. 11 Скорректированный интервал QT (интервал QTc) более 440 мсек имеет относительный риск (RR) равный двум для ВСС. 18 Во время инфаркта сумма элеваций ST предсказывает неблагоприятный исход. 14
Несколько исследований показали, что окклюзия правой коронарной артерии более подвержена аритмии, чем окклюзия артерий левой системы, но это открытие противоречиво. 11,19 Многочисленные исследования показали, что коллатеральный кровоток является защитным, поэтому реваскуляризация для восстановления коронарного кровотока должна быть превентивной стратегией, даже если разорванная бляшка закроет другую артерию.
11,19 Многочисленные исследования показали, что коллатеральный кровоток является защитным, поэтому реваскуляризация для восстановления коронарного кровотока должна быть превентивной стратегией, даже если разорванная бляшка закроет другую артерию.
Фармакологические вмешательства
Несколько исследований показывают, что лечение статинами снижает частоту внезапной сердечной болезни и соответствующие методы лечения с помощью имплантируемого кардиовертера-дефибриллятора (ИКД) у пациентов с ишемической болезнью сердца. 20 Хотя доказано, что бета-блокаторы и ингибиторы ангиотензинпревращающего фермента (АПФ) снижают смертность у пациентов, перенесших инфаркт миокарда или с сердечной недостаточностью, их роль в первичной профилактике ВСС при ОИМ остается неясной.
Генетические факторы
Теоретически генетические исследования имеют большой потенциал в качестве инструментов скрининга. Давно известно, что семейный анамнез ВСС является предиктором ВСС у потомков, братьев и сестер.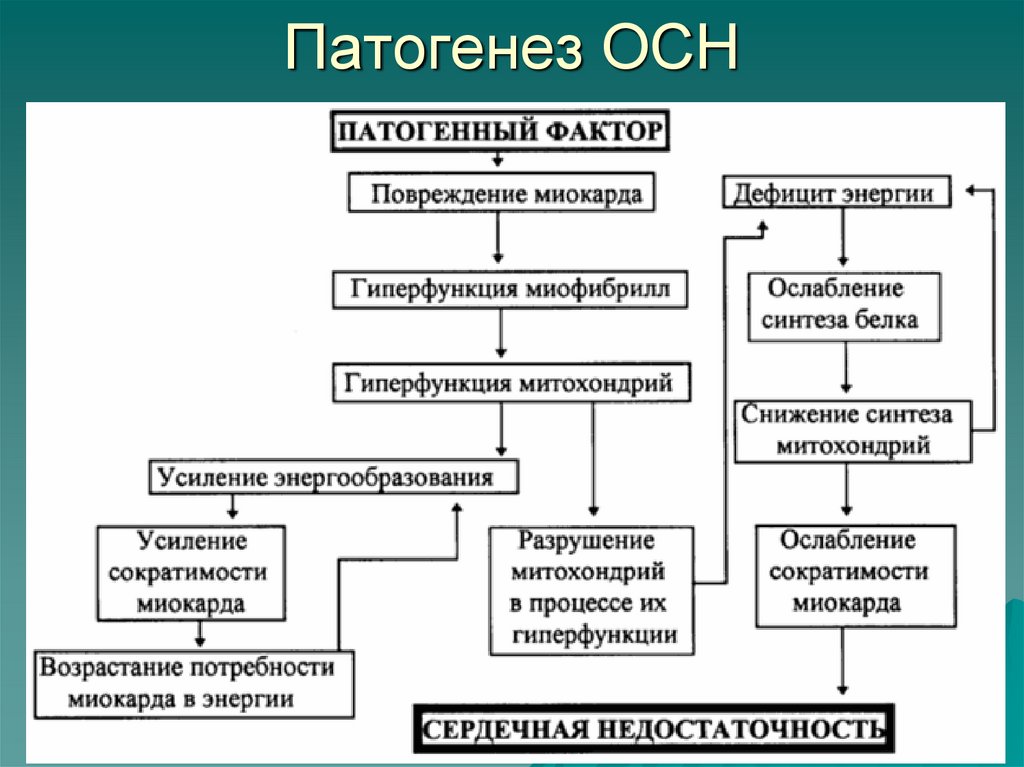 Парижское проспективное исследование показало, что ОР составил 1,8 для пациентов с одним из родителей, перенесших ВСС, и 9,4, если страдали оба родителя. 21 В исследовании «Генетика аритмии в Нидерландах» (AGNES) Dekker et al. обнаружили, что присутствие одного родственника первой степени родства с ВСС повлекло за собой ОР 2.72 для SCD. 15 Известно, что некоторые моногенные расстройства подвергают пациентов особенно высокому риску внезапной смерти при проявлении ОИМ. У пациентов с синдромом удлиненного интервала QT, страдающих ОИМ, может развиться рефрактерная torsades des pointes в результате дальнейшего удлинения сегмента QT 22,23 (см. Рисунок 1 ).
Парижское проспективное исследование показало, что ОР составил 1,8 для пациентов с одним из родителей, перенесших ВСС, и 9,4, если страдали оба родителя. 21 В исследовании «Генетика аритмии в Нидерландах» (AGNES) Dekker et al. обнаружили, что присутствие одного родственника первой степени родства с ВСС повлекло за собой ОР 2.72 для SCD. 15 Известно, что некоторые моногенные расстройства подвергают пациентов особенно высокому риску внезапной смерти при проявлении ОИМ. У пациентов с синдромом удлиненного интервала QT, страдающих ОИМ, может развиться рефрактерная torsades des pointes в результате дальнейшего удлинения сегмента QT 22,23 (см. Рисунок 1 ).
Множественные исследования выявили мутации, вызывающие даже умеренное увеличение интервала QT при ВСС. В одной конкретной этнической группе, афроамериканцы, общий полиморфизм в SCN5A, Y1102, увеличивает восприимчивость к SCD с RR, равным восьми. 24 Недавние полногеномные ассоциативные исследования выявили, что несколько аллелей связаны с внезапной смертью при ОИМ.
Первый, обнаруженный на хромосоме 21q21, находится в месте, близком к гену вирусного рецептора, который, как известно, участвует в патогенезе миокардита. 25 Другое исследование обнаружило другой полиморфизм вблизи гена SCN10A, гена, который изменяет интервал PR. 26 Несмотря на статистическую значимость этих результатов, абсолютный риск остается небольшим, что исключает использование рутинного геномного секвенирования для стратификации риска сегодня.
Использование автоматических внешних дефибрилляторов
Доказано, что использование автоматических внешних дефибрилляторов (AED) в общественных местах вдвое увеличивает выживаемость пациентов с ВСС вне больниц. 27 Обучение неспециалистов основам жизнеобеспечения и развертывание АВП в общественных местах повысит выживаемость в случаях ВСС с начальным ритмом фибрилляции желудочков до 56%. 28 Эти исследования показывают, что для достижения положительных результатов дефибрилляция должна быть развернута в течение трех минут после ареста при свидетелях. Своевременное вмешательство зависит от немедленной доступности АВД и минимально обученного персонала, способного с ним работать. При отсутствии таких предпосылок, например, при использовании домашних ПЭП, польза для выживания не реализуется.
Своевременное вмешательство зависит от немедленной доступности АВД и минимально обученного персонала, способного с ним работать. При отсутствии таких предпосылок, например, при использовании домашних ПЭП, польза для выживания не реализуется.
В заключение, сегодня ни один фактор риска не имеет достаточной силы, чтобы оправдать вмешательство в одиночку. Было предложено несколько алгоритмов оценки риска, основанных на оценке множества факторов; ни одно из них не было подтверждено проспективно. Пациентам с высоким риском следует рассмотреть возможность модификации факторов риска и медикаментозной терапии и, возможно, реваскуляризации.Эта оценка динамична и должна периодически пересматриваться.
Осложнений острого инфаркта миокарда (ОИМ). Пациент
Мулласари А.С., Баладжи П., Кхандо Т.; Лечение осложнений при остром инфаркте миокарда. J Assoc Physitors Индия. 2011 Dec59 Suppl: 43-8.
Адам В. Грассо, Сорин Дж. Бренер; Осложнения острого инфаркта миокарда, Центр непрерывного образования, Клиника Кливленда
Неппер-Кристенсен Л. , Лонборг Дж., Хофстен Д.Е. и др .; Преимущество реперфузии с первичным чрескожным коронарным вмешательством при продолжительности симптомов более 12 часов у пациентов с инфарктом миокарда с подъемом сегмента ST.Circ Cardiovasc Interv. 11 сентября 2018 (9): e006842. DOI: 10.1161 / CIRCINTERVENTIONS.118.006842.
, Лонборг Дж., Хофстен Д.Е. и др .; Преимущество реперфузии с первичным чрескожным коронарным вмешательством при продолжительности симптомов более 12 часов у пациентов с инфарктом миокарда с подъемом сегмента ST.Circ Cardiovasc Interv. 11 сентября 2018 (9): e006842. DOI: 10.1161 / CIRCINTERVENTIONS.118.006842.
Хот УН, Джиа Дж., Молитерно Д.Д. и др .; Прогностическое значение физического обследования сердечной недостаточности при острых коронарных синдромах без подъема сегмента ST: непреходящая ценность классификации Киллипа. ДЖАМА. 2003 октябрь 22290 (16): 2174-81.
Сердечные аритмии при ишемической болезни сердца; Шотландская межвузовская сеть рекомендаций — SIGN (2018)
Wehrens XH, Doevendans PA; Разрыв сердца, осложняющий инфаркт миокарда.Int J Cardiol. 2004 июн 95 (2-3): 285-92.
Isoda S, Osako M, Kimura T. и др .; Хирургическое лечение постинфарктных дефектов межжелудочковой перегородки — обновление 2013. Ann Thorac Cardiovasc Surg. 2013, апрель 1919 г. (2): 95-102. Epub 2013 11 апреля.
2013, апрель 1919 г. (2): 95-102. Epub 2013 11 апреля.
Ям Н, Au TW, Cheng LC; Постинфарктный дефект межжелудочковой перегородки: хирургические результаты за последнее десятилетие. Asian Cardiovasc Thorac Ann. 2013 Октябрь 21 (5): 539-45. DOI: 10.1177 / 0218492312462041. Epub 2013 9 июля.
Крихбаум С.Д., Бёдер Н.Ф., Геде Л. и др .; Восстановление створки митрального клапана с помощью новой системы PASCAL: первые реальные данные из опыта работы нескольких центров в Германии.Clin Res Cardiol. 2020 Май 109 (5): 549-559. DOI: 10.1007 / s00392-019-01538-3. Epub 2019 26 августа.
Boyd JH; Ишемическая митральная регургитация. Цирк J. 201377 (8): 1952-6. Epub 2013 19 июля.
Анзай Т; Постинфарктное воспаление и ремоделирование левого желудочка: палка о двух концах. Цирк J. 201377 (3): 580-7. Epub 2013 29 января.
Кханна С., Бхат А., Мардини М. и др .; Аневризма левого желудочка: редкое осложнение острого инфаркта миокарда в современную эпоху. Отчеты Oxf Med. 2020 сен 22 2020 (9): omaa080. DOI: 10.1093 / omcr / omaa080. eCollection 2020 сентябрь
Отчеты Oxf Med. 2020 сен 22 2020 (9): omaa080. DOI: 10.1093 / omcr / omaa080. eCollection 2020 сентябрь
Ондрус Т., Кановский Дж., Новотный Т. и др .; Инфаркт миокарда правого желудочка: от патофизиологии к прогнозу. Exp Clin Cardiol. 2013 Зима 18 (1): 27-30.
Чоккалингам А., Теджвани Л., Аггарвал К. и др .; Динамическая обструкция выводного тракта левого желудочка при остром инфаркте миокарда с шоком: причина, следствие и совпадение. Тираж. 2007 июл 31116 (5): e110-3.
Арсенос П., Гацулис К., Дилаверис П. и др .; Аритмическая внезапная сердечная смерть: субстрат, механизмы и текущие стратегии стратификации риска для пациента, перенесшего инфаркт миокарда. Hellenic J Cardiol. 2013 июль-август 54 (4): 301-15.
Ошеров А.Б., Боровик-Раз М, Аронсон Д. и др .; Заболеваемость ранним тромбом левого желудочка после острого инфаркта миокарда передней стенки в эпоху первичного коронарного вмешательства. Am Heart J. 2009 июнь 157 (6): 1074-80. DOI: 10.1016 / j.ahj.2009.03.020.
DOI: 10.1016 / j.ahj.2009.03.020.
Портер А., Кандалкер Х., Якобишвили З. и др .; Настенный тромб левого желудочка после острого инфаркта миокарда с подъемом переднего сегмента ST в эпоху агрессивной реперфузионной терапии — все еще частое осложнение. Coron Artery Dis. 2005 16 августа (5): 275-9.
Ларсен К.К.; Депрессия после инфаркта миокарда — наблюдаемое осложнение с прогностическим значением. Дэн Мед Дж. 2013, август 60 (8): B4689.
Диагностика инфаркта миокарда 2 типа
Возможность измерения сердечного тропонина, либо сердечного тропонина Т (cTnT), либо сердечного тропонина I (cTnI), знаменовала сдвиг парадигмы в использовании сердечных биомаркеров для диагностики инфаркта миокарда (ИМ).Впервые был доступен полностью кардиоспецифический тест, который выявлял бы повреждение миокарда даже при наличии сопутствующего повреждения скелетных мышц. Сравнение с существующими кардиологическими биомаркерами креатинкиназы и креатинкиназы-миокардиального диапазона (CK-MB) показало диагностическую эквивалентность для выявления классического ИМ. Что еще более важно, у большой части пациентов с диагнозом нестабильная стенокардия был обнаружен повышенный сердечный тропонин, и было обнаружено, что у этих пациентов был худший прогноз по сравнению с теми, у кого не было повышенного сердечного тропонина. 1 Эти данные послужили толчком к переходу к использованию сердечного тропонина в качестве сердечного биомаркера выбора и предложенному переопределению ИМ.
Что еще более важно, у большой части пациентов с диагнозом нестабильная стенокардия был обнаружен повышенный сердечный тропонин, и было обнаружено, что у этих пациентов был худший прогноз по сравнению с теми, у кого не было повышенного сердечного тропонина. 1 Эти данные послужили толчком к переходу к использованию сердечного тропонина в качестве сердечного биомаркера выбора и предложенному переопределению ИМ.
Следует помнить о некоторых предостережениях. На тот момент диагностическим «золотым стандартом» биохимического теста для диагностики ИМ было измерение CK-MB. Во-вторых, обычным порогом был CK-MB, вдвое превышающий верхний референсный предел, что снижало диагностическую чувствительность. Ранее было продемонстрировано, что незначительное повышение CK-MB около верхнего референтного предела, но ниже диагностического предела, было связано с неблагоприятным прогнозом.Поэтому неудивительно, что сердечный тропонин, кардиоспецифический тест, был как более чувствительным, так и более специфичным, поскольку диагностический дискриминант был оптимизирован против CK-MB.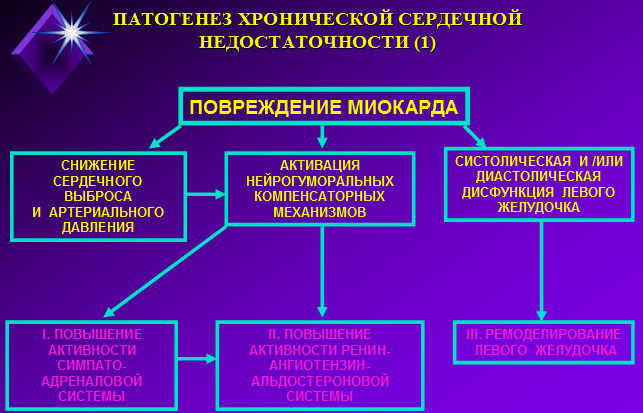
Использование тропонина в качестве биохимического «золотого стандарта» немедленно привело к увеличению числа пациентов, у которых был окончательный диагноз, исключавший ИМ, у которых был отмечен повышенный уровень тропонина. Хроническое повышение как cTnT, так и cTnI было отмечено при почечной недостаточности на раннем этапе внедрения тестирования на тропонин. 1 Рекомендация использовать 99-й процентиль в качестве диагностического дискриминанта и прогрессивное улучшение чувствительности анализа еще больше увеличили диапазон клинических состояний с сопутствующим повышением сердечного тропонина. Это проиллюстрировано в списке, включенном в последнюю версию универсального определения MI. 2 Кроме того, были выявлены новые клинические проявления, имитирующие ИМ, такие как спонтанное расслоение коронарной артерии и кардиомиопатия Такоцубо (стрессовая). 3 Как язвительно заметил Боб Джесси, «когда тропонин был плохим тестом, это был отличный тест, но теперь, когда он становится отличным тестом, он становится плохим тестом». 4 Таким образом, в попытке решить проблему повышения тропонина вне традиционного ИМ, концепция ИМ 2 типа была введена в универсальное определение ИМ. 5
4 Таким образом, в попытке решить проблему повышения тропонина вне традиционного ИМ, концепция ИМ 2 типа была введена в универсальное определение ИМ. 5
ИМ 2 типа определяется как «инфаркт миокарда, вторичный по отношению к ишемии, вызванный либо повышенной потребностью в кислороде, либо снижением поступления кислорода, например.грамм. спазм коронарной артерии, коронарная эмболия, анемия, аритмия, гипертония или гипотония ».
Определение ИМ типа 2 неудовлетворительно, потому что на самом деле он определяется не тем, чем он является, а тем, чем он не является. 6 Тем не менее, клиническая проблема остается: отличить острый ИМ (связанный с разрывом или эрозией бляшки, традиционный ИМ или ИМ 1-го типа) — для которого существует научно обоснованное лечение — от острого вторичного ишемического повреждения сердца, включая ИМ 2-го типа, где такое лечение не основано на доказательствах и может даже быть вредным.
Роль измерения тропонина заключается в дифференциальной диагностике подозреваемого ИМ без подъема сегмента ST (ИМбпST). Пациентам с ИМ с подъемом сегмента ST требуется немедленное вмешательство в соответствии с действующими рекомендациями, и поэтому им не следует ждать результатов исследования тропонина.
Пациентам с ИМ с подъемом сегмента ST требуется немедленное вмешательство в соответствии с действующими рекомендациями, и поэтому им не следует ждать результатов исследования тропонина.
Первый этап заключается в оценке вероятности того, что у пациента имеется основная острая ишемическая болезнь сердца (ИБС) из истории болезни, и что симптомы вызваны ишемией сердца. Оценка вероятности того, что у пациента есть основная ИБС, может быть неформальной классификацией на высокий, средний или низкий риск или более формальной оценкой риска.Ишемию сердца оценивают с помощью электрокардиограммы (ЭКГ) и интерпретации симптомов. Следует провести первоначальное измерение тропонина, а также оценку функции почек и другие соответствующие лабораторные тесты и исследования, руководствуясь клинической картиной пациента.
На этом этапе требуется целостная оценка. Это должно оценивать совокупность результатов в круговой, а не линейной форме. Важно, чтобы результаты лабораторных исследований в целом соответствовали клиническим особенностям и ЭКГ. Если уровень тропонина не повышен, необходимо повторить анализ, прежде чем можно будет с уверенностью исключить острое повреждение миокарда. С другой стороны, один повышенный уровень тропонина сам по себе не является диагностическим признаком ИМ. Однако повышенный уровень тропонина наряду с другими соответствующими клиническими и лабораторными данными повышает вероятность того, что диагноз ИМбпST. Чем выше значение тропонина, тем больше вероятность того, что окончательный диагноз будет ИМ. Следует подчеркнуть, что данные должны быть согласованными.Повышенный тропонин плюс нормальная ЭКГ или неспецифические изменения должны немедленно вызвать подозрение на альтернативный диагноз. Точно так же не должно быть никаких других скрытых, но признанных причин незначительного повышения тропонина, таких как почечная недостаточность или значительный возраст. Другие потенциальные острые причины повышения тропонина, связанные с ИБС, такие как тахикардия или другие состояния, вызывающие повышенную потребность в кислороде или снижение подачи кислорода, указывают на ИМ 2 типа.
Если уровень тропонина не повышен, необходимо повторить анализ, прежде чем можно будет с уверенностью исключить острое повреждение миокарда. С другой стороны, один повышенный уровень тропонина сам по себе не является диагностическим признаком ИМ. Однако повышенный уровень тропонина наряду с другими соответствующими клиническими и лабораторными данными повышает вероятность того, что диагноз ИМбпST. Чем выше значение тропонина, тем больше вероятность того, что окончательный диагноз будет ИМ. Следует подчеркнуть, что данные должны быть согласованными.Повышенный тропонин плюс нормальная ЭКГ или неспецифические изменения должны немедленно вызвать подозрение на альтернативный диагноз. Точно так же не должно быть никаких других скрытых, но признанных причин незначительного повышения тропонина, таких как почечная недостаточность или значительный возраст. Другие потенциальные острые причины повышения тропонина, связанные с ИБС, такие как тахикардия или другие состояния, вызывающие повышенную потребность в кислороде или снижение подачи кислорода, указывают на ИМ 2 типа. Однако даже если клиническая вероятность лежащей в основе ИБС высока, окончательный диагноз ИМ требует демонстрации меняющегося значения тропонина.Современные чувствительные анализы способны обнаруживать значительное изменение тропонина при повторном тестировании, если исходное значение повышается при повторном тесте, проводимом через 2-3 часа, и при тестах с высокой чувствительностью в течение 1 часа.
Однако даже если клиническая вероятность лежащей в основе ИБС высока, окончательный диагноз ИМ требует демонстрации меняющегося значения тропонина.Современные чувствительные анализы способны обнаруживать значительное изменение тропонина при повторном тестировании, если исходное значение повышается при повторном тесте, проводимом через 2-3 часа, и при тестах с высокой чувствительностью в течение 1 часа.
Повторное тестирование позволяет сразу отличить острое повреждение миокарда от основного хронического повреждения миокарда, вызывающего повышение уровня тропонина. Это решает дилемму пациента с почечной недостаточностью (или пожилого возраста). Повышенного уровня тропонина в первом образце следует ожидать у пациента с почечной недостаточностью.Изменение тропонина указывает на острую травму и может быть вызвано острым инфарктом миокарда. Напротив, повышенный уровень тропонина, который существенно не изменяется, связан с хроническим повреждением миокарда и может потребовать дальнейшего исследования, но, возможно, не в стационаре и не обязательно у кардиолога.
На следующем этапе оценки проводится различие между резким повышением тропонина, которое соответствует острому инфаркту миокарда, и тем, которое вызвано другой причиной. Диагноз острого ИМ никогда не следует ставить только на основании повышения уровня тропонина.Опять же, полное обследование пациента требует, чтобы повышение тропонина соответствовало клиническим данным и ЭКГ. Повышенный уровень тропонина при минимальных результатах ЭКГ может возникать при миокардите или тромбоэмболии легочной артерии. Самый важный фактор — это знать, что другие клинические состояния могут вызвать повышение тропонина. Повышение тропонина характерно для повреждения миокарда, но не каждое повышение тропонина является ИМ. Наличие других клинических состояний, таких как пневмония или тромбоэмболия легочной артерии, должно сместить клинический акцент на понимание того, что повышение тропонина является дополнительным прогностическим, а не диагностическим признаком.Если имеется диагностическая неопределенность, для получения дополнительной информации необходима визуализация сердца, инвазивная или неинвазивная, а также другие типы поперечных срезов.
Таким образом, ключевые особенности диагностики ИМ 2 типа (точнее, вторичного ишемического повреждения сердца) можно резюмировать следующим образом:
- Повышенное, но изменяющееся значение тропонина
- Клинические признаки, несовместимые с острым инфарктом миокарда 1 типа
- Известные клинические состояния, повышающие потребность в кислороде или снижающие подачу кислорода, например тахикардия
- Потенциально смешанные клинические состояния или сопутствующие заболевания, которые потенциально связаны или, как известно, связаны с повреждением миокарда
- Отсутствие симптомов и / или признаков, указывающих на другие неишемические причины повышения тропонина, такие как миокардит.
Лечение ИМ 2 типа заключается в лечении основного состояния и, следовательно, в устранении сердечного инсульта. Для адекватной оценки прогноза и определения соответствующего дальнейшего лечения пациентов с ИМ 2 типа важна информация о том, есть ли у пациента (или вероятно, будет) существенная основная ИБС. 7 Кроме того, важно помнить, что повышенный уровень тропонина у пациентов с неострым ИМ не является избыточной информацией, но также указывает на неблагоприятный прогноз (рис. 1). 8
7 Кроме того, важно помнить, что повышенный уровень тропонина у пациентов с неострым ИМ не является избыточной информацией, но также указывает на неблагоприятный прогноз (рис. 1). 8
Рисунок 1
Эта статья содержит учебные материалы, предназначенные для лицензированных специалистов в области здравоохранения, и предназначена для использования исключительно в образовательных и информационных целях. Хотя контент может касаться конкретных медицинских вопросов и вопросов здравоохранения, он не заменяет или заменяет персонализированные медицинские консультации и не предназначен для использования в качестве единственной основы для принятия индивидуальных медицинских или связанных со здоровьем решений.Выраженные взгляды и мнения принадлежат авторам и редакторам и не обязательно отражают точку зрения АКК. Материал не предназначен для представления единственных или обязательно лучших методов или процедур для рассматриваемых медицинских ситуаций, а скорее предназначен для представления подхода, точки зрения, утверждения или мнения.
Список литературы
- Collinson PO, Garrison L, Christenson RH. Кардиологические биомаркеры — Краткая биография. Clin Biochem 2015; 48: 197-200.
- Thygesen K, Alpert JS, Jaffe AS и др. Третье универсальное определение инфаркта миокарда. Eur Heart J 2012; 33: 2551-67.
- Леттьери С., Заваллони Д., Россини Р. и др. Ведение и долгосрочный прогноз спонтанного расслоения коронарной артерии. Am J Cardiol 2015; 116: 66-73.
- Джесси Р.Л. Об относительной ценности теста по сравнению с тестом: наличие тропонина в анамнезе для диагностики инфаркта миокарда. J Am Coll Cardiol 2010; 55: 2125-8.
- Thygesen K, Alpert JS, White HD и др. Универсальное определение инфаркта миокарда. Circulation 2007; 116: 2634-53.
- Коллинсон П., Линдаль Б. Инфаркт миокарда 2 типа: химеры кардиологии? Сердце 2015; 101: 1697-703.
Клинические темы: Острые коронарные синдромы, аритмии и клинические EP, сердечная недостаточность и кардиомиопатии, профилактика, сосудистая медицина, атеросклеротическое заболевание (CAD / PAD), ACS и кардиологические биомаркеры, имплантируемые устройства, SCD / желудочковые аритмии Аритмии, сердечная недостаточность и сердечные биомаркеры, гипертония
Ключевые слова: Анемия, Стенокардия, нестабильная, Аритмии, Сердечные, Биологические маркеры, Коморбидность, Заболевание коронарной артерии, MB, Креатинкиназа Креатинкиназа 9023 902 Диагностика, дифференциальная, Электрокардиография, Фибриноген, Гипертония, Гипотония, Мышцы, скелет, Инфаркт миокарда, Миокардиальная ишемия, 9023 Миокардиальная ишемия Легочная эмболия, Почечная недостаточность, Спазм, Тахикардия, Тропонин I, Тропонин Т, Острый коронарный синдром
<Вернуться к списку
Диагностика острого инфаркта миокарда у пациентов с почечной недостаточностью с использованием высокочувствительного тропонина Т
Хуан, Хуалань, Чжу, Шуай, Ван, Вэйцин, И, Хун, Ду, Сянъян, Не, Синь, Хэ, Юн, Сун, Хаолань, Мяо, Цян, Ван, Ланлан и Ли, Гуйсин.«Диагностика острого инфаркта миокарда у пациентов с почечной недостаточностью с помощью высокочувствительного тропонина Т» Клиническая химия и лабораторная медицина (CCLM) , vol. 53, нет. 5, 2015, стр. 723-730. https://doi.org/10.1515/cclm-2014-0715
Хуанг, Х., Чжу, С., Ван, В., И, Х., Ду, X., Не, Х., Хе, Ю., Сун, Х., Мяо, К., Ван, Л. и Ли, Г. (2015). Диагностика острого инфаркта миокарда у пациентов с почечной недостаточностью с помощью высокочувствительного тропонина Т. Клиническая химия и лабораторная медицина (CCLM) , 53 (5), 723-730. https://doi.org/10.1515/cclm-2014-0715
Хуанг, Х., Чжу, С., Ван, В., И, Х., Ду, X., Не, Х., Хе, Ю., Сун, Х., Мяо, К., Ван, Л. и Ли, Г. (2015) Диагностика острого инфаркта миокарда у пациентов с почечной недостаточностью с использованием высокочувствительного тропонина T. Клиническая химия и лабораторная медицина (CCLM), Vol. 53 (Выпуск 5), стр. 723-730. https://doi.org/10.1515/cclm-2014-0715
Хуан, Хуалань, Чжу, Шуай, Ван, Вэйцин, И, Хун, Ду, Сянъян, Не, Синь, Хэ, Юн, Сун, Хаолань, Мяо, Цян, Ван, Ланлан и Ли, Гуйсин.«Диагностика острого инфаркта миокарда у больных с почечной недостаточностью с помощью высокочувствительного тропонина Т» Клиническая химия и лабораторная медицина (CCLM) 53, №1. 5 (2015): 723-730. https://doi.org/10.1515/cclm-2014-0715
Huang H, Zhu S, Wang W, Yi H, Du X, Nie X, He Y, Song H, Miao Q, Wang L, Li G. Диагностика острого инфаркта миокарда у пациентов с почечной недостаточностью с использованием высокочувствительного тропонина T. Клиническая химия и лабораторная медицина (CCLM) .2015; 53 (5): 723-730. https://doi.org/10.1515/cclm-2014-0715
Сердечная недостаточность
Сердечно-сосудистые заболевания
Сердечная недостаточность
Сердечная недостаточность существует, когда сердце не может производить выброс, необходимый для функционирования организма, то есть необходимое количество крови, обогащенной кислородом из стен.
Обычно страдают от 1 до 3% населения
Приблизительно 120 000 новых случаев в год
Во Франции 5% людей старше 75 лет, по всей видимости, страдают этим заболеванием, и говорят, что это затронет более 1 миллиарда человек…
Что означает сердечная недостаточность?
Сердечная недостаточность может касаться:
- Левое сердце :
Это может касаться недостаточности левого желудочка или правого сердца
- Правое сердце :
Это может касаться правого желудочка недостаточность или правая сердечная
Может быть очень острой : сердечный шок, даже коллапс, но такой же хронический, и это наиболее частый случай..
Она может проявляться в разных формах:
- Систолическая дисфункция , соответствующая снижению сократительной способности правого желудочка
- Диастолическая дисфункция , соответствующая аномалии расслабляющей способности сердечных волокон, которые мешают наполнению желудочков: слишком медленно для того, что необходимо, замедленно или даже не полностью.
Что вызывает сердечную недостаточность?
Некоторые из наиболее частых причин сердечной недостаточности:
- предыдущий сердечный криз
- Ишемическая болезнь сердца
- Артериальная гипертензия
- Вальвулопатия сердца
- Кардиомиопатия или воспаление сердца
- Врожденная аномалия развития сердце
- Пневмония
- Употребление алкоголя или наркотиков
Состояния, которые могут вызвать этот тип сердечной недостаточности, а именно:
- Инфекция
- Заболевание почек или дисфункция почек
- Анемия
- Нарушение сердечного ритма
- Гиперактивность щитовидной железы
Эта сердечная недостаточность часто может улучшиться, если лечить эти причины, вызвавшие ее.
Другие причины, например диабет, могут усугубить сердечную недостаточность.
Каковы его симптомы?
Его основным симптомом является одышка (затрудненное дыхание):
Пациент чувствует затруднение дыхания во время усилий (одышка при усилии), либо лежа в постели, либо испытывает кризис ночью.
Сердечная печень большая и очень болезненная. Боли, исходящие от усилия, прибывают жестоко или, наоборот, как более тупые боли, кажущиеся тяжестью в области правого бедра или в эпигастральной впадине с лучевой терапией, распространяются на позвоночник.Эта боль заставляет пациента остановиться, затем она исчезнет. Он возвращается, как только пациент снова приступает к усилию (прогулка, еда). Это может создать впечатление спутанности сознания с печеночной коликой или даже с неотложной операцией на брюшной полости (аппендицит и т. Д.).
Какие методы лечения существуют?
В основном:
- Соблюдение гигиенической диеты и низкого количества соли
- диуретическая терапия
- очистка грудной клетки и легких от мокроты
- терапия дигиталисом
- антикоагулянтная терапия
.

