| Название | Форма выпуска | Владелец рег. уд. | ||
Айронгард | Раствор для в/в введения рег. №: ЛП-005775 | ФАРМАСИНТЕЗ (Россия) | ||
Айрондекст | Раствор для в/в введения рег. №: ЛП-004509 | ФАРМАЦЕВТИЧЕСКИЕ ПРОЕКТЫ (Россия) Произведено: GLAND PHARMA (Индия) | ||
Аргеферр | Раствор для в/в введения рег. | GENFA MEDICA (Швейцария) | ||
Бинноферум® | Раствор для в/в введения рег. №: ЛП-006021 | БИННОФАРМ (Россия) | ||
Велферрум® | Раствор для в/в введения рег. №: ЛП-002843 | ИНДУКЕРН-РУС (Россия) Произведено: NANJING PHARMACEUTICAL FACTORY Co. (Китай) | ||
Венофер® | Р-р д/в/в введения 20 мг/1 мл: амп. 2 мл 5 шт. рег. №: П N014041/01 | VIFOR (International) (Швейцария) Фасовка и упаковка: ALTANA PHARMA (Германия) | ||
Венофер® | Р-р д/в/в введения 20 мг/1 мл: амп. 5 мл 5 шт. рег. №: П N014041/01 | VIFOR (International) (Швейцария) Фасовка и упаковка: ALTANA PHARMA (Германия) контакты: (Япония) | ||
Виалфер | Раствор для в/в введения рег. | ВИАЛ (Россия) | ||
Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: 2 мл или 5 мл амп. 10 шт. рег. №: ЛП-006159 | АльТро (Россия) Произведено: ЭКОФАРМПЛЮС (Россия) | ||
Железа (III) гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. рег. №: ЛП-006554 | БРЫНЦАЛОВ-А (Россия) | ||
Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. 5 мл 5 шт. рег. №: ЛП-005089 | БИОКАД (Россия) | ||
Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. 5 мл 5 шт. рег. №: ЛП-006141 | ДЖОДАС ЭКСПОИМ (Россия) Произведено: STANEX DRUGS & CHEMICALS PVT. (Индия) | ||
Железа [III] гидроксид сахарозный комплекс | Раствор для в/в введения рег. №: ЛП-004118 | ФАРМСТАНДАРТ-УФИМСКИЙ ВИТАМИННЫЙ ЗАВОД (Россия) | ||
Железа [III] гидроксид сахарозный комплекс APC | Раствор для в/в введения рег. №: ЛП-004176 | АРС (Россия) Произведено: VMG Pharmaceuticals (Индия) Упаковано: VMG Pharmaceuticals (Индия) РОЗЛЕКС ФАРМ (Россия) | ||
Ликферр 100® | Р-р д/в/в введения 20 мг/1 мл: амп. рег. №: ЛСР-008006/10 Дата перерегистрации: 23.05.14 | ФармФирма СОТЕКС (Россия) Произведено: SAMRUDH PHARMACEUTICALS (Индия) Упаковано: ФармФирма СОТЕКС (Россия) контакты: (Россия) | ||
Ликферр 100® | Р-р д/в/в введения 20 мг/1 мл: амп. рег. №: ЛСР-008006/10 Дата перерегистрации: 23.05.14 | ФармФирма СОТЕКС (Россия) Произведено: EMCURE PHARMACEUTICALS (Индия) HELP (Греция) контакты: (Россия) |
В каких случаях педиатр должен назначать препараты железа парентерально? | Захарова
1. UNICEF, United Nations University, WHO. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers [Электронный ресурс] / Geneva: World Health Organization; 2001 (WHO/NHD/01.3). 114 p. Режим доступа: http: //www.who.int/nutrition/publications/micronutrients/anaemia_iron_deficiency/WHO_NHD_01.3/en.
2. WHO. Guideline: intermittent iron supplementation in preschool and school-age children [Электронный ресурс] / Geneva: World Health Organization, 2011.Режим доступа: http: //apps.who.int/iris/bitstream/10665/44648/1/9789241502009_eng.pdf?ua=1.
3. Руководство по гематологии: в 3 т. Под ред. А.И. Воробьева. М.: Ньюдиамед, 2005, 3. 416 с./Textbook on hematology: in 3 volumes. Ed. By A.I. Vorobyev. M.: Newdiamed, 2005, 3. 416 p.
4. Румянцев А.Г., Захарова И.Н., Чернов В.М., Тарасова И.С., Заплатников А.Л., Коровина Н.А., Боровик Т.Э., Звонкова Н.Г., Мачнева Е.Б., Пудриков К.А. Диагностика и лечение железодефицитной анемии у детей и подростков (пособие для врачей). Под ред. А.Г. Румянцева, И.Н. Захаровой. М.: Конти Принт, 2015. 76 с. / Rumyantsev A.G., Zakharova I.N., Chernov V.M., Tarasova I.S., Zaplatnikov A.L., Korovina N.A., Borovik T.E., Zvonkova N.G., Machneva E.B., Pudrikov K.A. Diagnostics and therapy of irondeficient anemia in children and teenagers (textbook for doctors). Ed. by A.G. Rumyantsev, I.N. Zakharova, M.: Konti Print, 2015. 76 p.
5. Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с./Idelson L.I. Hypochromic anemias. M.: Meditsina, 1981. 190 p.
6. Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых. Принят на 42-й Научной сессии ЦНИИГ (2-3 марта 2016 г.). Consilium Medicum. Педиатрия. Приложение к журналу, 2016, 1: 6-19. / All-Russian Consensus on Diagnostics and Therapy of Celiac Disease in Children and Adults. Approved at the 42nd Scientific Session of Central Scientific and Research Institute of Gastroenterology (March 2-3, 2016). Consilium Medicum. Pediatria. Appendix to Journal, 2016, 1: 6-19.
Consilium Medicum. Pediatria. Appendix to Journal, 2016, 1: 6-19.
7. Grasso P. Sarcoma after intramuscular iron injection. Br. Med. J., 1973, 2: 667.
8. Greenberg G. Sarcoma after intramuscular iron injection. Br. Med. J., 1976, 1: 1508-1509.
9. Auerbach M, Ballard H, Glaspy J et al. Clinical update: intravenous iron for anaemia. Lancet, 2007, 369: 1502-1504.
10. Регистр лекарственных средств России. РЛС -2000-2016 (Энциклопедия лекарств и товаров аптечного ассортимента). Режим доступа: http://www.rlsnet.ru/. / Register of Russia’s drugs. Drugs Register – 2000 – 2016 (Encyclopedia of Drugs and Goods of Pharmacy Assortment). Access regime: http://www.rlsnet.ru.
11. Инструкция по применению лекарственного препарата для медицинского применения Феринжект® (Ferinject®)./Patient Information Leaflet on Ferinject®.
12. Lyseng-Williamson KA, Keating GM. Ferric carboxymaltose: a review of its use in iron-deficiency anaemia. Drugs, 2009, 69(6): 739-56.
Особенности определения стерильности различных групп твердых лекарственных препаратов для парентерального применения | Гунар
Р. А. Лавренчук, И. В. Сакаева, Е. И. Саканян, Материалы международной конференции «Тенденции развития современной медицины»: материалы международной заочной научно-практической конференции, Новосибирск (2012), сс. 50 – 55.
Р. А. Лавренчук, Автореферат дис. канд. фарм. наук, Москва (2013).
Государственный реестр лекарственных средств Российской Федерации; [Электронный ресурс]. Режим доступа: http://grls.rosminzdrav.ru/.
Режим доступа: http://grls.rosminzdrav.ru/.
Государственная фармакопея СССР, издание XI, выпуск 2: Общие методы анализа. Лекарственное растительное сырье, Медицина, Москва (1989).
Отраслевой стандарт «91500.05.001.00 — Стандарты качества лекарственных средств. Основные положения»; Москва (2000).
Р. А. Лавренчук, И. В. Сакаева, Е. И. Саканян, Ведомости научного центра экспертизы средств мед. применения, № 2, 40 – 42 (2012).
Guide to inspections of lyophilization of parenterals; [Электронный ресурс] Режим доступа: http://www.fda.gov/ICECI/Inspections/InspectionGuides/ucm074909.htm
Tests for sterility. Brit. Pharm., London (1932), рр. 632 – 633.
D. M. Bryce, J. Pharm. Pharmacol., 8, 561 – 572 (1956).
Государственная фармакопея Российской Федерации, изд. XII, «Научный центр экспертизы средств медицинского применения», Москва (2008).
Ashutosh Kar, Pharmaceutical microbiology, New Age International (P) Ltd., Publishers, New Delhi (2008).
Moldenhauer Jeanne, Scott V. W. Sutton, PDA J. Pharm. Sci. Technol., 56(6), 248 – 286 (2004).
Sterility tests. The United State Pharmacopeia, 23 ed., The United States Pharmacopeial Convention, Rockville, MD (1995), рр. 1686 – 1690.
European Pharmacopoeia. Third Edition, Council of Europe, Strasbourg (1997).
Sterility tests. The United State Pharmacopeia, 24 ed., The United States Pharmacopeial Convention, Rockville, MD (1995), рр. 1818 – 1823.
European Pharmacopoeia, Fourth Edition, Council of Europe, Strasbourg (2001).
R. R. Ernst, K. L. West, J. E. Hoyle, Bul. Parent. Drug Assoc., 23(1), 29 – 39 (1969).
Ю. Д. Пахомов, Л. П. Блинкова, Л. Г. Стоянова, Иммунопатол., аллергол., инфектол. , № 4, 57 (2010).
, № 4, 57 (2010).
Md. Fakruddin, Khaniada Shahnewaj Bin Mannan, Stewart Andrews, ISRN Microbiology, Vol. 2013, Article ID 703813 (2013).
Sonia R. Vartoukian, Richard M. Palmer, William G. Wade, FEMS Microbiol. Let., No 309, 1 – 7 (2010).
N. J. Rowan, Int. J. Microbiol., Vol. 2011, Article ID 462832 (2011).
S. R. Pai, J. K. Actor, E. Sepulveda, et al.,Microbiol. Pathogen., 28(6), 335 – 342 (2000).
R. H. Veeh, M. E. Shirtliff, J. R. Petik, et al., J. Infect. Diseas., No 88, 519 – 530 (2003).
J. P. Diaper, C. Edwards, J. Appl. Bacteriol., No. 77, 221 – 228 (1994).
O. Aulet, C. Silva, S. G. Fraga, et al., J. Brazil. Soc. Tropical Med., 40, 385 – 390 (2007).
Изменения и дополнения к государственной фармакопее XII, часть 1, ОФС «Стерильность»; [Электронный ресурс]/Режим доступа: http://old.rosminzdrav.ru/docs/mzsr/regulation/80.
Н. В. Медуницын, Вакцинология, Триада-Х, Москва (2004).
Н. Б. Эпштейн, В. Г. Скворцов, Л. Д. Артамонова, Научная сессия НИЯУ МИФИ, 1, 1 – 5 (2010).
Ilse Zolle (ed.), Technetium-99m pharmaceuticals. Preparation and quality control in nuclear medicine, Springer, Berlin, Heidelberg (2007).
Marianne Chen, Buck A. Rhodes, Steven M. Larson, Henry N. Wagner Jr., J. Nuclear Med., 15(12), 1142 – 1144 (1974).
Особенности фармацевтической разработки лиофилизата Гк-2 для парентерального применения | Блынская
1. ICH Q8. International Conference on Harmonization (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use. Geneva, 2005. 28 р.
2. International Conference on Harmonization (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use, Topic Q9: Quality Risk Management, ICH. Geneva, Switzerland, 2005. 30 р.
Geneva, Switzerland, 2005. 30 р.
3. Блынская Е.В., Тишков С.В., Алексеев К.В., Марахова А.И. Вспомогательные вещества в технологии лиофилизации пептидов и белков. Фармация 2017;66(1):14–8. [Blynskaya E.V., Tishkov S.V., Alekseev K.V., Marakhova A.I. Auxiliary substances in the technology of lyophilization of peptides and proteins. Farmatsya = Pharmacy 2017;66(1):14–8. (In Russ.)].
4. Блынская Е.В., Тишков С.В., Алексеев К.В. Технологические подходы к совершенствованию процесса лиофилизации белковых и пептидных лекарственных препаратов. Российский биотерапевтический журнал 2017;16(1):6–11. DOI: 10.17650/1726-9784-2017-16-1-6-11. [Blynskaya E.V., Tishkov S.V., Alekseev K.V. Technological approaches to improving the process of lyophilization of protein and peptide drugs. Rossiysky Bioterapevtichesky Zhurnal = Russian Journal of Biotherapy 2017;16(1):6–11. (In Russ.)].
5. Гулякин И.Д., Хашем Али, Николаева Л.Л. и др. Разработка новой технологии получения лекарственной формы для внутривенного введения производного индолокарбазола ЛХС-1208. Российский биотерапевтический журнал 2016;15(2):55–60. DOI: 10.17650/1726-9784-2016-15-2-55-60. [Gulyakin I.D., Hashem Ali, Nikolaeva L.L. et al. Development of a new technology for the preparation of a dosage form for the intravenous administration of an indole carbazole derivative, LHS-1208. Rossiysky Bioterapevtichesky Zhurnal = Russian Journal of Biotherapy 2016;15(2):55–60. (In Russ.)].
6. Ланцова А.В., Котова Е.А., Санарова Е.В. и др. Разработка лиофилизированной липосомальной лекарственной формы цифелина. Российский биотерапевтический журнал 2012;14(2):79–84. DOI: 10.30906/0023-1134-2012-46-5-39-42. [Lantsova A.V., Kotova E. A., Sanarova E.V. et al. Development of a lyophilized liposomal drug form of cipheline. Rossiysky Bioterapevtichesky Zhurnal = Russian Journal of Biotherapy 2015;14(2):79–84. (In Russ.)].
A., Sanarova E.V. et al. Development of a lyophilized liposomal drug form of cipheline. Rossiysky Bioterapevtichesky Zhurnal = Russian Journal of Biotherapy 2015;14(2):79–84. (In Russ.)].
7. The Common Technical Document for the Registration of Pharmaceuticals for Humman Use: Quality – M4Q (R1). Quality Overall Summary of Module 3: Qulity. London, 2003. 23 р.
| Наименование | Кол-во | Цена за ед. | Стоимость, ₽ |
|---|---|---|---|
|
ОКПД
|
| 51,00 | 2 550,00 |
|
ОКПД
|
| 3,22 | 3 542,00 |
|
ОКПД
|
| 5,01 | 50 100,00 |
|
ОКПД
|
| 3,13 | 53 210,00 |
|
ОКПД
|
| 7,18 | 57 440,00 |
|
ОКПД
|
| 3,84 | 34 560,00 |
|
ОКПД
|
| 2,44 | 4 880,00 |
|
ОКПД
|
| 18,83 | 941,50 |
|
ОКПД
|
| 9,54 | 477,00 |
|
ОКПД
|
| 37,70 | 1 885,00 |
кому, когда и как назначать
Авторы:
А. Я. Дзюблик, д.м.н., профессор
Я. Дзюблик, д.м.н., профессор
Хороший профиль безопасности и широкий спектр действия макролидов помог им заслужить популярность у врачей во всем мире. Не так давно на украинском рынке появились макролидные антибиотики для парентерального применения. Украинские специалисты только начинают внедрять эти препараты в свою клиническую практику, и поэтому вопросы, касающиеся основных аспектов их применения, вызывают у врачей большой интерес.
В своем докладе «Место и значение макролидов для парентерального применения в лечении больных с инфекциями нижних дыхательных путей», который был озвучен в ходе Х Украинской школы по антимикробной химиотерапии «Современные принципы лечения пациентов с социально значимыми инфекционными заболеваниями», состоявшейся 7 декабря 2006 г. в Киеве, заведующий отделением технологий лечения неспецифических заболеваний легких Института фтизиатрии и пульмонологии им. Ф.Г. Яновского АМН Украины, доктор медицинских наук, профессор Александр Ярославович Дзюблик обратил внимание врачей на проблему выбора не только класса антибактериальных средств, но и формы их выпуска, а также в очередной раз подчеркнул, что для назначения любого антибиотика существуют строго определенные показания.
– Несмотря на то что в последние десятилетия практически во всех странах мира отмечается тенденция к повышению устойчивости пневмококков и гемофильной палочки к различным классам антибиотиков, эта группа макролидов по-прежнему высокоэффективна в лечении инфекций нижних дыхательных путей. Об этом свидетельствуют многоцентровые рандомизированные контролируемые исследования, отвечающие всем принципам доказательной медицины, на основании результатов которых составляются международные и национальные рекомендации по лечению различных заболеваний.
Макролиды – один из наиболее безопасных классов антибиотиков, они практически не оказывают токсического действия на ткани, органы и организм в целом и значительно реже, чем другие антибиотики, вызывают аллергические реакции.
В Украине зарегистрировано большое количество пероральных макролидов, в том числе 14- (рокситромицин, эритромицин, кларитромицин), 15- (азитромицин) и 16-членные (мидекамицин, спирамицин). В то же время всего четыре макролидных антибиотика зарегистрированы в виде парентеральной формы выпуска: Ровамицин, Клацид, Сумамед и Азитромицин-Нортон. Первые три препарата уже широко применяются в украинских клиниках, и полученные результаты свидетельствуют об их высокой эффективности. Из них наилучшими фармакокинетическими характеристиками обладает азитромицин (Сумамед), который не только позволяет достичь необходимого результата, но и значительно сократить курс антибиотикотерапии, а также улучшить комплайенс в связи с однократным введением препарата в течение суток.
По мнению одного из ведущих специалистов России в области антибактериальной химиотерапии, профессора О.И. Карпова, парентеральные макролиды по ряду характеристик отличаются от других парентеральных антибиотиков. Они обладают выраженным тканевым аффинитетом, очень быстро доставляются макрофагами в ткани. Фармакокинетика парентеральных макролидов практически не отличается от пероральных форм, вследствие чего инъекционные препараты следует применять в качестве монотерапии только в тех случаях, когда использование пероральных антибиотиков по различным причинам невозможно.
Так, фармакокинетические характеристики парентерального и перорального Сумамеда очень схожи: длительный период полувыведения, позволяющий вводить препарат один раз в сутки; поддержание высокой концентрации антибиотика в тканях в течение длительного времени (особенно в органах дыхания и репродуктивной системы). Единственное отличие заключается в том, что при внутривенном введении препарата создается несколько более высокая концентрация действующего вещества в крови, однако она быстро снижается в связи с поглощением антибиотика макрофагами и доставкой в ткани.
Парентеральные макролиды в комбинации с другими антибиотиками должны применяться по определенным показаниям: тяжелое течение внебольничной пневмонии и инфекционных заболеваний малого таза (ограниченный перитонит, эндометрит и др. ). Согласно приказу МЗ Украины № 499 именно IV группе пациентов (с тяжелым течением пневмонии при отсутствии факторов риска инфицирования P. aeruginosa) целесообразно внутривенное введение β-лактамного антибиотика в комбинации с парентеральным макролидом. С учетом фармакокинетических характеристик (однократное введение в течение суток) оптимальным является сочетание цефтриаксона и азитромицина.
). Согласно приказу МЗ Украины № 499 именно IV группе пациентов (с тяжелым течением пневмонии при отсутствии факторов риска инфицирования P. aeruginosa) целесообразно внутривенное введение β-лактамного антибиотика в комбинации с парентеральным макролидом. С учетом фармакокинетических характеристик (однократное введение в течение суток) оптимальным является сочетание цефтриаксона и азитромицина.
По мнению профессора О.И. Карпова, макролид в этой комбинации следует рассматривать не только как «прикрытие» в случае внутриклеточных возбудителей, но и как препарат с потенцирующим действием в отношении других антибиотиков.
Это предположение подтверждается тремя фактами. Во-первых, точка приложения β-лактамного антибиотика – пенициллинсвязывающий белок, а макролида – рибосомный. Такое разнонаправленное действие обусловливает потенцирование эффекта антибиотиков, чему также способствуют фармакокинетические различия этих двух классов. Кроме того, макролиды характеризуются не только антибактериальным, но и противовоспалительным эффектом. Взаимодействие макролидных антибиотиков с макрофагами проявляется в виде снижения активности свободнорадикального окисления, уменьшения выделения провоспалительных и увеличения противовоспалительных цитокинов, активации хемотаксиса и фагоцитоза, улучшения мукоцилиарного клиренса, уменьшения секреции слизи.
Самое масштабное исследование по влиянию макролидов на иммунную систему, опубликованное два года назад (Gottfried и соавт., 2004), установило, что применение макролидов приводит к снижению концентрации иммунных комплексов в сыворотке крови, ускоряет апоптоз нейтрофилов, ослабляет реакцию «антиген-антитело». Японские ученые, изучавшие противовоспалительный эффект макролидов, установили, что данная группа антибиотиков блокирует выделение супероксида, окислительный «взрыв», ингибирует секрецию ИЛ-1, 2, 3 и 4, фактора некроза опухоли, подавляет ИЛ-5, увеличивает продукцию противовоспалительных цитокинов, ингибирует выработку и высвобождение оксида азота альвеолярными макрофагами и усиливает продукцию эндогенного кортизола.
Эти особенности наряду с активностью против C. pneumoniae и M. pneumoniaе послужили основанием для изучения эффективности этих препаратов при бронхиальной астме, панброхиолите, атеросклерозе и муковисцидозе.
Инъекционные формы макролидов должны использоваться в виде ступенчатой терапии с переходом на пероральную форму, что позволяет сократить длительность пребывания пациента в стационаре и оправдано с фармакоэкономической точки зрения.
Механизм действия макролидов заключается в обратимом связывании с различными доменами каталитического пептидилтрансферазного центра 50S субъединицы рибосом, вследствие чего нарушаются процессы транслокации/транспептидации и преждевременно отщепляется растущая тРНК-полипептидная цепочка, обусловливая нарушение синтеза белка в бактериальной клетке, ее рост и размножение. В настоящее время макролиды принято считать бактериостатическими препаратами, однако при определенных условиях (рН>7,5, очень высокая концентрация действующего вещества в очаге поражения, в случае инфицирования пневмококком, пиогенным стрептококком, дифтерийной палочкой, возбудителем коклюша) они могут оказывать и бактерицидное действие.
Спектр действия макролидов достаточно широк и включает большое количество Грам+ и Грам– микроорганизмов (гемофильная палочка, моракселла, пневмококк, гонококк, менингококк, хеликобактер пилори, легионелла и др.) Макролиды очень эффективны при инфекциях, вызванных внутриклеточными возбудителями (хламидии, микоплазмы и др.). Макролиды несколько менее активны по отношению к анаэробам.
Очень важно, что макролиды обладают высокой активностью в отношении основных возбудителей внебольничных инфекций нижних дыхательных путей. In vitro установлено, что максимальный эффект на пневмококк, пиогенный стрептококк и легионеллу оказывает кларитромицин, на гемофильную палочку, микоплазму и моракселлу – азитромицин. Однако этот факт принципиального клинического значения не имеет, поскольку оба препарата высокоэффективны in vivo при внебольничных инфекциях нижних дыхательных путей.
В связи с увеличением резистентности основных патогенов внебольничной пневмонии к макролидным антибиотикам следует остановиться на механизмах этого явления. В настоящее время известно два основных механизма устойчивости бактерий к макролидам: модификация мишени их действия и эффлюкс.
Модификация мишени действия происходит вследствие выработки метилазы, что обусловливает резистентность микроорганизмов ко всем макролидам (14-, 15- и 16-членным), линкозамидам и стрептограминам. Под действием метилазы эти антибиотики теряют способность связываться с рибосомами (MLSВ-фенотип). Этот механизм характерен для S. aureus, M. pneumoniae, S. pneumoniae, S. pyogenes, Enterococcus spp., Enterobacteriaceae и Bacteroides spp.
Еще один механизм – М-фенотип – связан с активным выведением препарата из клетки (эффлюксом), в результате чего формируется устойчивость бактерий к 14- и 15-членным макролидам, причем менее выраженная, чем в предыдущем случае. В то же время при М-фенотипе микроорганизмы сохраняют чувствительность к 16-членным макролидам, кетолидам, линкозамидам, стрептограминам. Эффлюкс характерен для S. pneumoniae, S. pyogenes, Staphylococcus epidermidis, S. aureus, Enterococcus spp.
К сожалению, серьезных исследований, которые бы позволили определить преобладающий в Украине механизм резистентности, не проводилось, поэтому представим российские данные. В России преобладает М-фенотип, поэтому уровень резистентности основных микроорганзмов к 14- и 15-членным макролидам составляет в среднем 9%, а к мидекамицину – 5%. Отрицательной динамики в последние годы в РФ отмечено не было. Исследование ПеГАС II, которое проводилось в 2004-2005 гг., показало, что устойчивость пневмококка к 14- и 15-членным макролидам не изменилась (около 6%).
Согласно результатам международного многоцентрового исследования PROTEKT (2002 г.) распространенность S. pneumoniae, резистентных к эритромицину, составила 31,5%. Резистентность пневмококков к макролидам в Европе в 2000-2001 гг. варьировала от 12,2% (Великобритания) до 36,6 и 58,1% (Испания и Франция соответственно). В Юго-Восточной Азии более 70% штаммов пневмококков резистентны к макролидам.
варьировала от 12,2% (Великобритания) до 36,6 и 58,1% (Испания и Франция соответственно). В Юго-Восточной Азии более 70% штаммов пневмококков резистентны к макролидам.
Около 10% штаммов гемофильной палочки в России устойчивы к кларитромицину, 2,5% – к азитромицину. В большинстве стран мира отмечаются подобные результаты, свидетельствующие о высокой чувствительности гемофильной палочки к азитромицину и удовлетворительной – к кларитромицину.
В заключение хотелось бы отметить, что в лечении инфекций нижних дыхательных путей целесообразно использовать антибиотики трех классов: макролиды, фторхинолоны и β-лактамы. Рациональное использование противомикробных препаратов позволит не только достигать хороших клинических результатов, но и сдерживать рост резистентности микроорганизмов к антибиотикам.
Подготовила Наталья Мищенко
СТАТТІ ЗА ТЕМОЮ
27.03.2021
Гастроентерологія
Роль мікробіоти кишечнику в перебігу COVID-19
Сьогодні людство зіштовхнулося з пандемією COVID-19 та відсутністю специфічного лікування нової хвороби. Саме тому надзвичайно важливим та актуальним став пошук можливих механізмів впливу на захисні сили людського організму. Вагоме значення для підтримки імунного статусу має мікробіота кишечнику (МК), адже 70-80% імунних клітин містяться саме у цьому органі. Неправильне харчування, стрес, вік, прийом антибактеріальних препаратів, а також наявність тих чи інших захворювань можуть спровокувати розвиток дисбіозу (E. Thursby, N. Juge, 2017)….
Thursby, N. Juge, 2017)….
27.03.2021
Гастроентерологія
Особенности ведения больных с НПВП-индуцированной гастропатией
Обсуждаются риски развития неблагоприятных явлений у лиц пожилого возраста с коморбидной патологией, возникающие на фоне длительного применения нестероидных противовоспалительных препаратов (НПВП) с целью купирования болевого и воспалительного суставного синдромов в сочетании с приемом препаратов других лекарственных групп (в частности, ацетилсалициловой кислоты и антитромбоцитарных средств), используемых для лечения сопутствующих заболеваний сердечно-сосудистой системы. …
27.03.2021
Гастроентерологія
Практические подходы к ведению больных со вздутием и растяжением живота
Практически каждый человек в то или иное время испытывает вздутие и растяжение живота вследствие повышенного газообразования. У многих эти ощущения возникают после еды, разрешаются спонтанно и не требуют врачебной консультации. Однако у некоторых людей вздутие и растяжение живота являются хроническими и негативно влияют на качество повседневной жизни. Эти проблемы беспокоят от 16 до 31% всего населения и 66-90% пациентов с синдромом раздраженного кишечника (СРК) в частности [1, 2]….
Эти проблемы беспокоят от 16 до 31% всего населения и 66-90% пациентов с синдромом раздраженного кишечника (СРК) в частности [1, 2]….
27.03.2021
Гастроентерологія
Цироз печінки. Синдроми при декомпенсованому цирозі. Менеджмент асциту
Асцит є найчастішим ускладненням цирозу печінки (ЦП). Його розвиток асоційований із несприятливим прогнозом і зниженням якості життя пацієнта. У рамках «Школи цирозу» на медичній освітній платформі для лікарів «Гіппократ» вичерпними знаннями стосовно ведення пацієнтів із асцитом поділилася з онлайн-слухачами професор кафедри внутрішньої медицини стоматологічного факультету Національного медичного університету ім. О.О. Богомольця (м. Київ), керівник Гастроцентру клініки «Оберіг», доктор медичних наук Галина Анатоліївна Соловйова. У своїй доповіді на прикладі клінічного випадку вона коротко розповіла про патогенез асциту, причини його виникнення, класифікацію, діагностичні можливості та лікування….
Инфузионное дело. Аспекты парентерального введения лекарственных препаратов
Уведомление об использовании файлов cookie и похожих технологий
Наш сайт использует файлы cookie и похожие технологии, чтобы гарантировать максимальное удобство пользователям, предоставляя персонализированную информацию, запоминая предпочтения в области маркетинга и продукции, а также помогая получить правильную информацию. При использовании данного сайта, вы подтверждаете свое согласие на использование файлов cookie в соответствии с настоящим уведомлением в отношении данного типа файлов. Если вы не согласны с тем, чтобы мы использовали данный тип файлов, то вы должны соответствующим образом установить настройки вашего браузера или не использовать сайт
При использовании данного сайта, вы подтверждаете свое согласие на использование файлов cookie в соответствии с настоящим уведомлением в отношении данного типа файлов. Если вы не согласны с тем, чтобы мы использовали данный тип файлов, то вы должны соответствующим образом установить настройки вашего браузера или не использовать сайт
Что такое файл cookie и похожие технологии?
Файл cookie представляет собой небольшой файл, обычно состоящий из букв и цифр. Этот файл сохраняется на вашем компьютере, планшетном ПК, телефоне или другом устройстве, которое Вы используете для посещения сайта. Файлы cookie широко используются владельцами сайтов для обеспечения работы сайтов или повышения эффективности работы, а также для получения аналитической информации.
Мы и наши поставщики услуг можем использовать на наших сайтах различные типы файлов cookie:
- Строго необходимые файлы cookie. Эти файлы cookie необходимы, чтобы сайт работал корректно, они позволят Вам передвигаться по нашему сайту и использовать его возможности. Эти файлы не идентифицируют вас как личность. Если вы не согласны использовать данный тип файлов, это может оказать влияние на производительность веб-сайта, или его компонентов.
- Файлы cookie, относящиеся к производительности, эффективности и аналитике. Эти файлы помогают нам понять, как посетители взаимодействуют с нашим сайтом, предоставляя информацию о тех областях, которые они посетили и количестве времени, которое они провели на сайте, так же они показывают проблемы в работе интернет-ресурса, например, сообщения об ошибках. Это поможет нам улучшить работу сайта. Файлы cookie, относящиеся к аналитике, также помогают нам измерять эффективность рекламных кампаний и оптимизировать содержание сайтов для тех, кого заинтересовала наша реклама. Данный тип файлов cookies не может быть использован для вашей идентификации. Вся информация, которая собирается и анализируется, анонимна.
Функциональные файлы cookie. Эти файлы cookie служат для того, чтобы опознавать пользователей, возвращающихся на наш сайт. Они позволяют нам индивидуально подбирать содержание сайта для Вас, приветствовать Вас по имени и запоминать Ваши предпочтения. Если вы блокируете этот тип файлов, то это может повлиять на производительность и функциональность веб-сайта и может ограничить доступ к контенту на сайте.
Эти файлы cookie служат для того, чтобы опознавать пользователей, возвращающихся на наш сайт. Они позволяют нам индивидуально подбирать содержание сайта для Вас, приветствовать Вас по имени и запоминать Ваши предпочтения. Если вы блокируете этот тип файлов, то это может повлиять на производительность и функциональность веб-сайта и может ограничить доступ к контенту на сайте.
- Рекламные файлы cookie. В эти файлы cookie записываются сведения о Ваших действиях в Интернете, в том числе о посещении наших сайтов и страниц, а также данные о ссылках и рекламе, которые Вы выбирали для просмотра. Одна из целей, которые мы ставим перед собой, — отражать на наших веб-сайтах тот контент, который наиболее полно ориентирован на Вас. Другая цель — обеспечить нам и нашим поставщикам услуг возможность предоставления рекламной или другой информации в более точном соответствии с Вашими явными интересами. (Действуя таким образом, мы и наши поставщики привлекаем таких партнеров, как информационные порталы, платформы управления данными и платформы изучения спроса, которые предоставляют помощь в обработке таких данных.) Например, если Вы просматриваете страницу нашего сайта, посвященную какой-либо определенной продукции, мы можем сделать так, чтобы на всех наших сайтах или на других сайтах Вы видели рекламу, связанную с этой (или аналогичной) продукцией и сопутствующими услугами. Мы, наши поставщики услуг и партнеры можем дополнительно использовать другие данные и информацию, собранную с помощью указанных файлов cookie, в том числе информацию, полученную от третьих лиц, в целях предоставления Вам рекламы.
Каким образом собираетcя и используетcя другая информация?
Мы и наши поставщики услуг можем использовать файлы cookie в различных целях, в том числе, чтобы:
- Облегчить себе и третьим лицам получение информации о Ваших посещениях сайта.
- Обрабатывать Ваши заказы.
- Анализировать информацию о Вашем посещении страниц для совершенствования нашего сайта.

- Предоставлять рекламу, сообщения и контент, созданные нами и третьими лицами, на данном сайте и сайтах других лиц, учитывая Ваши интересы.
- Помогать Вам в получении необходимой информации.
- Определять количество посетителей и то, как они используют наш сайт, —для повышения эффективности сайта и для наилучшего понимания интересов их аудитории
Как долго файлы cookie хранятся на моем устройстве?
Некоторые файлы cookie действуют с момента вашего входа на сайт до конца данной конкретной сессии работы в браузере. При закрытии браузера эти файлы становятся ненужными и автоматически удаляются. Такие файлы cookie называются «сеансовыми».
Некоторые файлы cookie сохраняются на устройстве и в промежутке между сессиями работы в браузере — они не удаляются после закрытия браузера. Такие файлы cookie называются «постоянными». Срок хранения постоянных файлов cookie на устройстве различается для разных файлов cookie. Мы и другие компании используем постоянные файлы cookie в различных целях: например, чтобы точнее определить, как часто Вы посещаете наши сайты или как часто Вы на них возвращаетесь, как с течением времени меняется характер использования наших сайтов, а также для оценки эффективности рекламы.
Кто размещает файлы cookie на моем устройстве?
Файлы cookie могут размещаться на Вашем устройстве администрацией сайта. Эти файлы cookie называются «собственными». Некоторые файлы cookie могут размещаться на Вашем устройстве другими операторами. Такие файлы cookie называются файлами «третьих лиц».
Мы и третьи лица можем использовать файлы cookie, чтобы узнать, когда Вы посещаете наши сайты, как взаимодействуете с электронной почтой, рекламой и другим контентом. На основе файлов cookie может собираться и использоваться обобщенная и другая информация, не связанная с идентификацией отдельных пользователей (например, об операционной системе, версии браузера и URL-адресе, с которого выполнен переход на данную страницу, в том числе из электронного письма или рекламного объявления) — благодаря этому мы можем предоставить Вам более широкие возможности и проанализировать маршруты посещения сайтов. Такая технология позволяет подсчитать количество пользователей, которые посетили конкретный сервис, перейдя по ссылке с определенного баннера за пределами данного сайта, по текстовой ссылке или изображениям, включенным в рассылку. Кроме того, она служит инструментом для сбора обобщенной статистики об использовании сайта в целях аналитического исследования и помогает нам оптимизировать наши сайты, предлагать рекламу в соответствии с Вашими интересами, как подробно описано ниже.
Такая технология позволяет подсчитать количество пользователей, которые посетили конкретный сервис, перейдя по ссылке с определенного баннера за пределами данного сайта, по текстовой ссылке или изображениям, включенным в рассылку. Кроме того, она служит инструментом для сбора обобщенной статистики об использовании сайта в целях аналитического исследования и помогает нам оптимизировать наши сайты, предлагать рекламу в соответствии с Вашими интересами, как подробно описано ниже.
Каким образом используется интернет-реклама и мобильная реклама?
Мы вместе с третьими лицами, включая технологических партнеров и поставщиков услуг, участвуем в ориентированной на интересы пользователей рекламной деятельности, предоставляя рекламу и персонализированный контент, который, по нашему мнению и по мнению других рекламодателей, будет представлять интерес для Вас. Сторонние поставщики используют файлы cookie при реализации сервисов для нас или других компаний; в таких случаях мы не контролируем использование указанной технологии или полученной при этом информации и не несем ответственности за любые действия или политики третьих лиц.
Реклама может предоставляться Вам с учетом характера Вашей деятельности в Интернете или при использовании мобильных устройств, а также с учетом Ваших действий при поиске, Ваших откликов на одно из наших рекламных объявлений или электронных писем, посещенных Вами страниц, Вашего географического региона или другой информации. Такие рекламные объявления могут появляться на нашем сайте или на сайтах третьих лиц. Технологические партнеры, с которыми мы сотрудничаем и которые помогают нам проводить рекламные кампании с учетом Ваших интересов, могут являться участниками саморегулируемых ассоциаций. На данном сайте Вы можете также видеть рекламу третьих лиц в зависимости от того, какие страницы Вы посещаете, какие действия выполняете на нашем сайте и на других сайтах.
Как управлять файлами cookie?
Большинство интернет-браузеров изначально настроены автоматически принимать cookie. Вы можете изменить настройки таким образом, чтобы блокировать cookie или предупреждать пользователя, когда файлы данного типа будут отправлены на устройство. Есть несколько способов управления cookie. Пожалуйста, обратитесь к инструкции браузера для того, чтобы узнать больше о том, как скорректировать или изменить настройки браузера. Если отключить cookie, которые мы используем, то это может повлиять на вашу работу в Интернете, в то время как на www.1day1step.ru вы, возможно, не сможете получать персональную информацию при посещении сайта. Если вы используете различные устройства для просмотра и доступа к нашему сайту(например, компьютер, смартфон, планшет и т.д.), вы должны убедиться, что каждый браузер на каждом устройстве настроен в соответствии с вашей точкой зрения на работу с файлами cookie.
Вы можете изменить настройки таким образом, чтобы блокировать cookie или предупреждать пользователя, когда файлы данного типа будут отправлены на устройство. Есть несколько способов управления cookie. Пожалуйста, обратитесь к инструкции браузера для того, чтобы узнать больше о том, как скорректировать или изменить настройки браузера. Если отключить cookie, которые мы используем, то это может повлиять на вашу работу в Интернете, в то время как на www.1day1step.ru вы, возможно, не сможете получать персональную информацию при посещении сайта. Если вы используете различные устройства для просмотра и доступа к нашему сайту(например, компьютер, смартфон, планшет и т.д.), вы должны убедиться, что каждый браузер на каждом устройстве настроен в соответствии с вашей точкой зрения на работу с файлами cookie.
Парентеральных препаратов, проблемы в составах | Фармацевтический аутсорсинг
Глобальное бизнес-подразделение Фарма и здоровье
Введение
Парентеральные препараты — это растворы, суспензии, эмульсии для инъекций или инфузий, порошки для инъекций или инфузий, гели для инъекций и имплантаты. 1 Это стерильные препараты, предназначенные для непосредственного введения в системный кровоток людям или животным.
Они должны, как и любые фармацевтические лекарственные формы, соответствовать фармацевтическим стандартам качества, описанным в pharma-copeias, и быть безопасными для предполагаемой цели использования. 1,2,3 Парентеральные препараты не только стерильны, но и не содержат пирогенов. Стерильность может быть достигнута с помощью различных процессов стерилизации, которые должны соответствовать рецептурам, 4 , в то время как апирогенный аспект потребует, если во время приготовления стерильных лекарственных препаратов не используется процесс депирогенизации, использование апирогенных препаратов. фармацевтические ингредиенты; лекарственные вещества или API (активный фармацевтический ингредиент) и вспомогательные вещества.
Они обычно поставляются в стеклянных или пластиковых контейнерах для однократного приема (в настоящее время реже рекомендуется использовать ПВХ или полиолефин) или чаще и чаще в предварительно заполненных шприцах или ручках для облегчения использования. 1 В этой статье будут описаны основные проблемы, возникающие при составлении парентеральных препаратов, а также решения Roquette, отвечающие потребностям разработчиков.
Свойства препаратов для парентерального введения
Препараты для парентерального введения предназначены для введения через организм человека или животного либо путем прямых инъекций (например, болюсного внутривенного (IV), внутримышечного (IM) или подкожного (SC)), либо путем инфузии контролируемая скорость инфузии или путем прямой имплантации через IM или SC.Они должны соответствовать следующим минимальным критериям соответствия: 1,2,3
- быть стерильными и апирогенными
- быть прозрачными или практически не содержать видимых частиц и быть свободными от невидимых частиц, если требуется по фармакопеям EP, USP и JP
- Отсутствие признаков разделения фаз для эмульсий или образования агрегатов для водных дисперсий, таких как инъекционные препараты Mab (моноклональные антитела)
- В случае суспензий следует использовать частицы подходящего размера и осадок. легко диспергироваться при встряхивании, давая стабильные составы и обеспечивая правильную дозу для извлечения и инъекции.
Парентеральные препараты могут потребовать использования вспомогательных веществ, которые должны быть биосовместимыми, выбираться для соответствующего использования и быть включены в минимальную эффективную концентрацию. 3 Функциональные возможности этих вспомогательных веществ следующие:
- Для придания препаратам изотоничности по отношению к крови (глюкоза / декстроза, маннит, хлорид натрия…)
- Для доведения pH до физиологического значения (минеральные или органические кислоты или соли)
- Для предотвращения разложения лекарственных веществ (стабилизатор…)
- Для обеспечения или увеличения растворимости лекарственного вещества
- Для обеспечения адекватных антимикробных консервативных свойств (применимо только к многодозовым препаратам)
Следует подчеркнуть, что вспомогательные вещества не должны отрицательно влиять на предполагаемое лечебное действие лекарственных средств или в концентрации, используемой для токсичности или чрезмерного местного раздражения.
Проблемы, связанные с составами
Основная проблема всех различных парентеральных лекарственных форм состоит в достижении хорошей совместимости лекарственных веществ с наполнителями (отсутствие образования новых примесей в результате разложения лекарственного вещества или образования нового химического соединения между ними). лекарственное вещество и вспомогательные вещества), а также совместимость препаратов с первичным контейнером (отсутствие вымывания или адсорбции в контейнере). 3
Что касается растворов и эмульсий, то лекарственные вещества должны быть растворимыми и оставаться растворимыми в течение всего срока хранения лекарственных препаратов.Когда лекарственные вещества нерастворимы, растворение может быть достигнуто за счет использования сорастворителей, поверхностно-активных веществ или растворимого пролекарства, или, в конечном итоге, использования усилителей растворимости, таких как циклодекстрины, благодаря образованию комплекса включения.
pH — один из важнейших аспектов парентеральных препаратов, которые должны иметь pH, близкий к физиологическому. Однако в определенных случаях следует найти компромисс между pH, обеспечивающим стабильность лекарственного вещества (например, для пептидов, требующих щелочного pH или белков при pH, близких к изоэлектрической точке), и физиологического значения.Во всех случаях препараты большого объема (LVP, т.е. более 100 мл, как определено в фармакопее) не должны содержать буфер pH, поскольку кровь уже обладает свойством буферного эффекта, которое может вступить в конкуренцию с введенным лекарственным продуктом.
Стабильность лекарственного вещества — еще один критический момент, с которым может столкнуться разработчик рецептур во время разработки состава. Нестабильные лекарственные вещества приведут к образованию новых примесей, что поставит под угрозу безопасность использования препаратов.Когда использование стабилизатора оправдано (например, использование маннита в качестве акцептора свободных радикалов или цистеина в растворе парацетамола для инъекций), его следует включать в минимальной концентрации, которая продемонстрировала свою эффективность при высвобождении и в течение всего срока хранения. . 3
В случае порошков для инъекций или инфузий, полученных с помощью процесса сублимационной сушки, потребуется использование наполнителя (такого как маннит) и / или криопротектора, когда доза лекарственного вещества (веществ) не может гарантировать исключительно формирование приемлемого «пирога».
Наконец, процесс стерилизации должен быть выбран в соответствии с характеристиками парентеральных препаратов (например, стерилизация паром для водных растворов и сухим теплом для неводных растворов), но в любом случае это может быть оправдано природой. первичных контейнеров. 4 На рисунках 1 и 2 показаны деревья решений для выбора процесса стерилизации водных продуктов или неводных растворов, включая полутвердые и сухие порошковые продукты.
Рисунок 1. Дерево решений для выбора стерилизации для водных продуктов (CPMP / QWP / 054/98) Рисунок 2. Дерево решений для выбора стерилизации для неводных жидких, полутвердых или сухих порошковых продуктов ( CPMP / QWP / 054/98)
Эффективность выбранного процесса стерилизации должна быть продемонстрирована посредством валидационных исследований с использованием соответствующих биологических индикаторов, чтобы гарантировать ASL (уровень гарантии стерильности) 10 -6 . 1
Solutions
Roquette разработала ассортимент апирогенных продуктов, соответствующих высоким фармацевтическим стандартам и биосовместимых для производства парентеральных препаратов. Все эти апирогенные продукты производятся из натурального и возобновляемого сырья.Помимо соответствия фармакопеям и другим требованиям качества ICH (например, ICHQ3D для элементарных примесей), все эти апирогенные продукты, даже при использовании в качестве вспомогательных веществ, производятся в соответствии с GMP, ICHQ7 и сертифицированы компетентными органами (ANSM, французский язык. Компетентный орган и FDA США).
Заключение
Препараты для парентерального введения — это стерильные и апирогенные препараты, предназначенные для непосредственного введения в системный кровоток организма человека или животного.Они должны соответствовать фармацевтическим стандартам качества, описанным в фармакопеях и руководствах ICH, а также обеспечивать клиническую переносимость, а также быть безопасными для предполагаемого использования.
Ссылки
- EP, USP и JP Pharmacopeias
- ICH Q6, Спецификации: процедуры испытаний и критерии приемлемости для новых лекарственных веществ и новых лекарственных препаратов
- ICH Q8, Фармацевтические разработки
- Деревья принятия решений для выбора методов стерилизации ( CPMP / QWP / 054/98)
- www.roquettepharma.com
Эльхам Блуэ, Фармацевт с многолетним опытом работы в промышленных фармацевтических компаниях и органах здравоохранения. Она присоединилась к Roquette в 2007 году, занимая в настоящее время должность менеджера по глобальному рынку (инъекции и диализ) в глобальном бизнес-подразделении, фармацевтика и здоровье.
Парентеральные поливитаминные продукты; Лекарственные препараты для человека; Проведение исследования эффективности лекарств; Поправка
Начать преамбулу
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, HHS.
Уведомление.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) вносит поправки в условия сбыта эффективных поливитаминных лекарственных препаратов для взрослых, которые опубликованы в Федеральном реестре № от 17 сентября 1984 г. (49 FR 36446). Агентство уведомляет производителей об изменениях в составе для взрослых и некоторых частях маркировки продуктов.
Дополнения к утвержденным заявкам на новые лекарственные препараты (NDA) и сокращенным заявкам на новые лекарственные препараты (ANDA) должны быть внесены не позднее 19 июня 2000 г.
Сообщение в ответ на это уведомление должно быть обозначено ссылочным номером DESI 2847 и направлено в соответствующий офис, указанный ниже.
Дополнения к полным NDA (укажите номер NDA): Отдел метаболических и эндокринных лекарственных препаратов (HFD-510), Центр оценки и исследований лекарственных средств, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 5600 Fishers Lane, Rockville, MD 20857.
Оригинальные ANDA: Управление генерических лекарственных средств (HFD-600), Центр оценки и исследований лекарственных средств, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 7500 Standish Pl., Роквилл, Мэриленд 20855.
Запросы заключения о применимости данного уведомления к конкретному продукту: Отдел соблюдения и надзора за рецептурными препаратами (HFD-330), Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 7500 Standish Pl., Rockville, MD 20855.
Начать дополнительную информацию
Мэри Э. Кэтчингс, Центр оценки и исследований лекарственных средств (HFD-7), Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 5600 Fishers Lane, Rockville, MD 20857, 301-594-2041.
Конец Дополнительная информация
Конец преамбулы
Начать дополнительную информацию
В сообщении, опубликованном в Федеральном реестре от 17 сентября 1984 г. (49 FR 36446), FDA объявило об условиях продажи эффективного парентерального поливитаминного препарата.Эффективный 12-витаминный состав, указанный в уведомлении, был основан на клинической оценке руководящего состава, рекомендованного в 1975 году Американской медицинской ассоциацией (AMA). В уведомлении также говорилось, что, поскольку парентеральные поливитаминные продукты используются и оцениваются у пациентов с различными заболеваниями, в будущем может потребоваться корректировка состава.
21 августа 1985 г. Отдел метаболических и эндокринных лекарственных препаратов FDA и Отдел политики личного и общественного здравоохранения AMA организовали открытый семинар на тему «Мультивитаминные препараты для парентерального применения.На семинаре были представлены и обсуждены дополнительные данные клинических испытаний состава AMA 1975 года и ряд других данных в свете имеющейся информации о парентеральной витаминной терапии. После изучения данных комитет семинара AMA-FDA рекомендовал увеличить дозировку витаминов B 1 , B 6 , C и фолиевую кислоту, а также добавить витамин K. На основании анализа рекомендаций комитета директор Центра оценки лекарственных средств и исследований пришел к выводу, что формулировку AMA 1975 года для парентеральных поливитаминов следует изменить, чтобы отразить рекомендации комитета.
Соответственно, это уведомление вносит поправки в часть раздела «Условия утверждения и сбыта» в уведомлении от 17 сентября 1984 г. (в соответствии с текущей практикой маркировки количества, ранее указанные в международных единицах (МЕ), были преобразованы в веса) :
Пункт 1 (а) (i) изложен в следующей редакции:
1. Состав для взрослых (предназначен для детей от 11 лет и старше )
| Ингредиент | Количество на единичную дозу | ||||
|---|---|---|---|---|---|
| Жирорастворимые витамины | |||||
| A | 5 мкг (мкг) | ||||
| E (альфа-токоферол) | 10 мг | ||||
| K (филлохинон) | 150 мкг | Витамины | |||
| C (аскорбиновая кислота) | 200 мг | ||||
| Фолиевая кислота | 600 мкг | ||||
| Ниацин 14 9014 | 409 409 Ниацин ) | 3.6 мг. | Пантотеновая кислота | 15,0 мг | |
| Биотин | 60 мкг |
2. Условия маркировки .
(a) На этикетке должно быть указано «Только Rx.”
(б) Обозначение . Пункт 2 (b) (i) (a) редактируется следующим образом (эта формулировка может быть редакционно адаптирована к маркировке конкретного продукта, в зависимости от обстоятельств):
Взрослый . Этот состав показан как дневная поддерживающая доза поливитаминов для взрослых и детей в возрасте 11 лет и старше, получающих парентеральное питание. Он также показан в других ситуациях, когда требуется внутривенное введение.Такие ситуации включают хирургическое вмешательство, обширные ожоги, переломы и другие травмы, тяжелые инфекционные заболевания и коматозные состояния, которые могут спровоцировать стрессовую ситуацию с глубокими изменениями метаболических потребностей организма и, как следствие, истощением тканей питательными веществами. Этот продукт (вводимый внутривенно при правильном разбавлении) способствует потреблению этих витаминов, которые необходимы для поддержания нормальной сопротивляемости организма и процессов восстановления.
Врач не должен ждать развития клинических признаков авитаминоза до начала витаминотерапии.
Пациентам с множественной недостаточностью витаминов или с заметно повышенными потребностями можно давать кратные суточные дозы в течение 2 или более дней, в зависимости от клинического статуса. Клинические испытания показывают, что некоторые пациенты не поддерживают адекватный уровень определенных витаминов, когда этот состав в рекомендуемых количествах является единственным источником витаминов.
(в) Противопоказания:
Известная гиперчувствительность к любому из витаминов или вспомогательных веществ в этом продукте или ранее существовавший гипервитаминоз.Известно, что после внутривенного введения тиамина и витамина K возникает аллергическая реакция. Препарат противопоказан перед забором крови для выявления мегалобластной анемии, поскольку фолиевая кислота и цианокобаламин в растворе витаминов могут маскировать дефицит сыворотки.
Кроме того, следующие разделы, требуемые 21 CFR 201.57, должны читаться следующим образом:
1. Меры предосторожности: (Следующий абзац должен быть добавлен и выделен жирным шрифтом.)
Следует проявлять осторожность при назначении этой поливитаминной композиции пациентам, получающим антикоагулянтную терапию варфарином натрия. У таких пациентов периодический мониторинг протромбинового времени имеет важное значение для определения подходящей дозировки антикоагулянтной терапии.
2. Реакции на лекарства: Этот раздел изменен и теперь он читается как «Взаимодействие с лекарствами» и в этот список добавлены аминофиллин 125 мг и ампициллин 500 мг.
Дополнения к утвержденным NDA или ANDA, предусматривающие соответствующий пересмотр маркировки лекарственных препаратов, затронутых данным уведомлением, должны быть представлены не позднее 19 июня 2000 г.
Это уведомление выпущено в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (разделы 201 (n), 502, 505, 52 Stat. 1041, 1050-1053 с поправками (21 USC 321 (n), 352, 355). ) и в соответствии с полномочиями, переданными директору Центра оценки и исследований лекарственных средств (21 CFR 5.70).
Начать подпись
Датировано: 28 марта 2000 г.
Джанет Вудкок,
Директор Центра оценки и исследований лекарственных средств.
Конец подписи
Конец дополнительной информации
[FR Док.00-9848 Подача 4-19-00; 8:45]
КОД СЧЕТА 4160-01-F
Парентеральная доставка лекарств | Клинические ворота
Введение
В медицине и фармации энтеральное введение — это термин, используемый для описания введения лекарства через желудочно-кишечный тракт. Большинство лекарств этим путем вводятся перорально в форме таблеток, капсул или жидкостей. Энтеральный путь также включает ректальное введение с использованием лекарственных форм, таких как суппозитории, клизмы или ректальная мазь.В противоположность этому, термин парентеральное введение буквально означает любой способ введения лекарственного средства, при котором не используется желудочно-кишечный тракт, такой как ингаляция или нанесение на кожу. Однако на практике под парентеральным введением обычно понимают введение лекарственного средства путем инъекции.
В этой главе мы исследуем, почему парентеральный путь введения может быть выбран клиницистом или производителем лекарства. Обозначены пути, доступные для парентерального введения, а также ткани, органы и анатомические пространства, к которым можно получить доступ с помощью инъекции.Описываются различные формы или типы обычно производимых парентеральных продуктов и обсуждаются фармакопейные стандарты для инъекционных продуктов. Ингредиенты сформулированных продуктов для инъекций в отношении носителей или растворителей, наполнителей и консервантов описаны вместе с физиологическими соображениями, такими как pH и тоничность продукта перед введением. Наконец, обсуждаются контейнеры, укупорочные средства и первичная упаковка, обычно используемые для парентеральных продуктов.
Причины выбора парентерального введения
Подавляющее большинство пациентов предпочли бы получать свои лекарства в виде пероральных таблеток или жидкости для проглатывания или в виде крема, мази или трансдермального пластыря для нанесения на кожу, а не получать лечение посредством инъекции, которое может быть болезненным или вызывать стресс (действительно некоторые пациенты страдают фобией иглы). С точки зрения производителя часто проще и намного дешевле приготовить лекарства, такие как таблетки или жидкости, особенно с учетом менее строгих требований к производственным помещениям для этих нестерильных продуктов, по сравнению с затратами, связанными с производством стерильных лекарств, таких как инъекции в узкоспециализированных контролируемых средах.Однако существует ряд клинических преимуществ, связанных с парентеральным введением.
Многие лекарства вводятся парентерально просто потому, что сама молекула лекарства будет быстро расщепляться в желудочно-кишечном тракте и, таким образом, будет инактивирована, прежде чем она сможет абсорбироваться в систему кровообращения. Хорошим примером этого являются антибиотики-аминогликозиды, такие как гентамицин. Инъекционный путь может быть выбран для обеспечения высоко локализованного эффекта. Это особенно верно, когда путь инъекции касается конкретной анатомической области или системы органов.Примеры этого включают инъекции лекарств, таких как стероиды, в суставные пространства (внутрисуставные инъекции), внутриглазные инъекции для лечения глазных заболеваний или интратекальные инъекции, когда лекарства вводятся в позвоночник для доставки лекарств в спинномозговую жидкость. которые в противном случае не могли бы накапливаться в этой ткани в достаточном количестве для достижения желаемого эффекта.
Внутривенная инъекция доставляет лекарство непосредственно в систему кровообращения, где оно быстро распределяется по телу.Это важно с клинической точки зрения, так как лекарство быстро даст эффект, тогда как пиковые уровни в крови могут быть достигнуты не в течение одного-двух часов после перорального введения. Такое быстрое начало действия препарата, вводимого внутривенно, может иметь решающее значение в экстренных ситуациях. И наоборот, если выбрать введение лекарственного средства путем внутримышечной инъекции, высвобождение лекарства из места инъекции в кровоток может быть отложено или продлено. В самом деле, как будет видно позже, манипулируя составом для внутримышечных инъекций, можно обеспечить пролонгированное высвобождение лекарственного средства, позволяя требовать дозы только один раз в месяц.Наконец, внутривенный путь инъекции обычно используется для введения лекарства пациенту без сознания, который не может глотать. Этот способ также используется для пациентов в сознании или без сознания, если желудочно-кишечный тракт не работает. В этом сценарии не только лекарства, но и жидкости для гидратации и замещения электролитов, а также все питательные вещества, витамины и микроэлементы, обычно получаемые из здоровой диеты, поставляются парентерально внутривенно.
Пути парентерального введения
Как отмечалось выше, лекарства вводятся разными путями, и выбор пути зависит от цели лечения и объема вводимого лекарства.
Внутривенные инъекции и инфузии
Внутривенные (в / в или в / в) инъекции и инфузии вводятся в легкодоступную выступающую вену у поверхности кожи, обычно на тыльной стороне руки или во внутреннем сгибе локтя. Вводимые объемы могут варьироваться от 1 мл для внутривенной инъекции до нескольких литров для внутривенной инфузии. Лекарства, вводимые путем внутривенной инъекции (или внутривенной болюсной дозы), быстро увеличивают концентрацию лекарства в плазме и дают быстрый эффект.Если лекарство сначала добавляется в большой объем жидкости (от 500 мл до 1 л инфузионного пакета), а затем вводится внутривенной инфузией с медленной и контролируемой скоростью, часто с использованием помпы, лекарство будет поступать в кровоток гораздо медленнее и медленнее. контролируемая скорость. Изменяя скорость инфузии, врач может титровать дозу в зависимости от требуемого эффекта, например регулирование артериального давления путем изменения скорости инфузии, например, инотропного лекарственного средства, такого как добутамин.
Лекарственные растворы с высоким или низким pH или высококонцентрированные гипертонические растворы (см. Ниже) повреждают клетки, выстилающие вену, и вызывают локальную боль и воспаление (тромбофлебит).Чтобы избежать этой проблемы, можно вставить центральную линию . Это длинный постоянный катетер, вводимый в вену на шее или предплечье, причем конец катетера расположен в верхней полой вене рядом с правым предсердием сердца (см. Рис. 36.1). Лекарства, вводимые внутривенно через центральную линию, быстро растворяются в большом объеме крови и не вызывают местного раздражения кровеносных сосудов. Следует отметить, что инъекции, составленные в виде эмульсий или суспензий вода в масле, не должны вводиться внутривенным путем.Это связано с тем, что взвешенные частицы лекарства могут физически блокировать кровеносные капилляры, а масляная фаза инъекции воды в масле может вызвать жировую эмболию, снова блокируя кровеносные сосуды.
Рис. 36.1 Размещение по центральной линии.
Внутриартериальные и внутрисердечные инъекции
Подавляющее большинство лекарств, которые вводятся парентерально, вводятся внутривенно. Как отмечалось выше, это доставляет лекарство непосредственно в кровоток, обеспечивая быстрый и предсказуемый клинический эффект.Однако это не единственный способ введения лекарств в сосудистую систему.
Внутриартериальное введение по существу аналогично внутривенному, за исключением того, что лекарство вводится в артерию, а не в вену. Артерии не так легко доступны, как вены, и этот метод гораздо более инвазивен и сопряжен с большим риском, чем простое внутривенное введение. По этой причине он редко используется. Внутриартериальное введение иногда используется, когда внутривенный доступ не может быть легко установлен, например, у очень недоношенных детей, из-за очень малого размера их вен по сравнению с катетерными трубками, используемыми для поддержания доступа к сосудам.Внутриартериальное введение также использовалось при лечении некоторых видов рака (например, рака печени), когда противораковые лекарства вводились в артерию выше по течению от места опухоли, чтобы гарантировать, что максимальное количество лекарства достигнет опухоли до того, как будет распространено где-либо еще. тело. Однако преимущества этого метода введения, по-видимому, не перевешивают риски в какой-либо значительной степени.
Внутрисердечные инъекции используются для введения лекарственного средства (обычным примером является водный раствор адреналина) непосредственно в сердечную мышцу или в желудочек сердца.Это предпринимается только в опасных для жизни чрезвычайных ситуациях, чтобы вызвать быстрое локальное воздействие на сердце во время сердечного приступа или при недостаточности кровообращения.
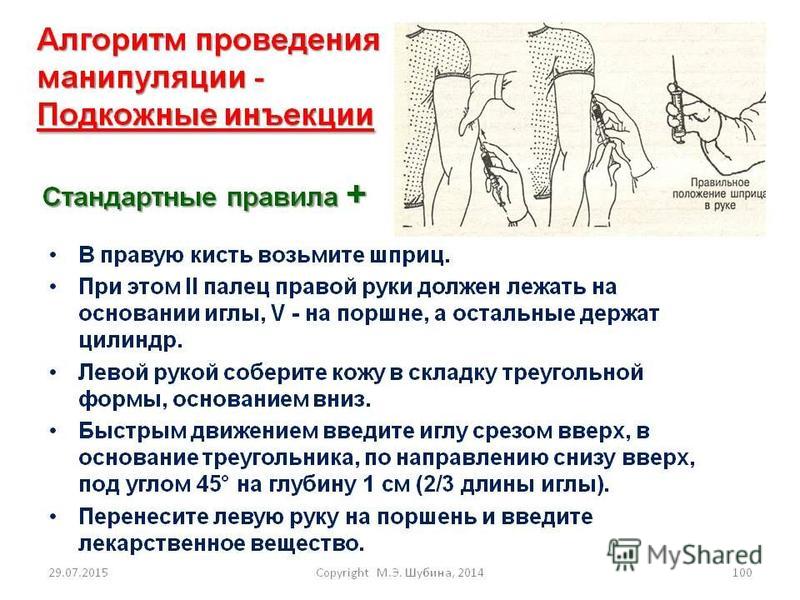
Внутрикожные инъекции
Внутрикожные (ID или i.d.) инъекции вводятся в кожу между эпидермальным и дермальным слоями (рис. 36.2). Этим путем можно вводить объемы до 0,2 мл, а всасывание из места внутрикожной инъекции происходит медленно. Этот способ используется для иммунологических диагностических тестов, таких как тесты на аллергию, или инъекции белка туберкулина для определения иммунитета против туберкулеза.Некоторые вакцины, такие как БЦЖ (туберкулез), вводятся внутрикожно.
Рис. 36.2. Пути внутрикожных, подкожных и внутримышечных инъекций.
Инъекции подкожные
Подкожные (п / к, также называемые подкожными) инъекции вводятся в рыхлые соединительные и жировые ткани непосредственно под слоем кожи (рис. 36.2). Типичные места инъекций — живот, плечи и ноги. Можно удобно вводить объемы до 1 мл, и водные растворы или суспензии лекарств вводятся этим путем.Поскольку эта ткань очень сосудистая, лекарства, вводимые подкожно, довольно быстро и предсказуемо всасываются из этого места. Типичным примером препарата, вводимого подкожно, является инсулин.
Внутримышечные инъекции
Внутримышечные (в / м или в / м) инъекции предпочтительно вводить в ткань расслабленной мышцы (рис. 36.2). Обычно для внутримышечной инъекции используются мышцы ягодиц, бедер или плеч. Водные или масляные растворы или суспензии можно вводить в объемах до 4 мл.У взрослых ягодичные мышцы будут использоваться для инъекций большего объема, тогда как у детей мышцы бедра обычно больше и поэтому предпочтительнее. Лекарства, вводимые внутримышечно, медленнее всасываются из места инъекции в системный кровоток по сравнению с теми, которые вводятся подкожным путем.
Интраспинальные инъекции
Интраспинальные инъекции вводятся между позвонками позвоночника в область позвоночного столба (рис.36,3). Этим путем вводятся только лекарства в водном растворе. Интратекальные (IT или i.t.) инъекции вводятся в спинномозговую жидкость (CSF) в субарахноидальном пространстве между паутинной оболочкой и мягкой мозговой оболочкой, двумя внутренними защитными мембранами, окружающими спинной мозг. Этот способ можно использовать для спинномозговой анестезии, и в этом случае можно изменять удельный вес инъекции, чтобы локализовать место действия и, таким образом, область анестезируемого тела. Также вводятся интратекальные инъекции для введения в спинномозговую жидкость лекарственных веществ, которые в противном случае не диффундировали бы через гематоэнцефалический барьер.Обычно это могут быть антибиотики для лечения менингита или противоопухолевые средства, такие как метотрексат или цитарабин. Объемы до 10 мл можно вводить путем интратекальной инъекции.
Рис. 36.3 Анатомия позвоночника.
Интракистернальные инъекции делаются между атлантом и осью позвонков в большую цистерну. Этот путь также используется для введения антибиотиков в спинномозговую жидкость или для вывода спинномозговой жидкости в диагностических целях.
Эпидуральные инъекции или инфузии вводятся в перидуральное пространство между твердой мозговой оболочкой (внешняя защитная мембрана, покрывающая спинной мозг) и позвонками.Этот способ обычно используется для спинномозговой анестезии, например, во время родов.
Внутрисуставные инъекции
Внутрисуставные (IA или i.a.) инъекции вводятся в синовиальную жидкость суставных полостей, таких как колено. Этим путем можно вводить водные растворы или суспензии. Этот способ инъекции дает местный эффект, и обычно для лечения артрита или спортивных травм вводят противовоспалительные препараты.
Инъекции офтальмологические
Офтальмологические инъекции вводятся вокруг или в глаз; в последнем случае они называются внутриглазными инъекциями (Глава 41).Субконъюнктивальные инъекции обычно в объеме 1 мл или меньше вводятся под конъюнктиву или в кожу вокруг глаза (например, внутри века). Внутриглазные инъекции можно далее классифицировать как внутрикамерные инъекции в переднюю камеру глаза (перед линзой) или интравитреальные инъекции в камеру стекловидного тела (за линзой). Объем внутрикамерных инъекций может составлять от 0,1 мл до 1 мл в зависимости от того, остается ли препарат в глазу или вводится во время операции на открытом глазу.Этот способ использовался для введения антибиотиков или местных анестетиков во время операций на глазах (например, хирургии катаракты). Интравитреальные инъекции используются для введения ряда различных лекарств, используемых для лечения различных глазных заболеваний. Из-за опасности, связанной с повышением внутриглазного давления, которое может повредить сетчатку, интравитреальным путем можно вводить максимальный объем всего 0,1 мл. Доставка офтальмологических лекарств с помощью инъекций обсуждается далее в главе 41.
парентерально в предложении — как использовать слово «парентерально» в предложении
SentencesMobile
- Хинин является приемлемой альтернативой, если парентеральный артесунат недоступен.
- Руководящие принципы рекомендуют лечение парентеральным железом до лечения эритропоэтином.
- Лошади, которые плохо питаются, также могут нуждаться в парентеральном питании.
- Есть случаи, когда парентеральное введение железа предпочтительнее перорального.
- Более того, GLP2 предотвращает гипоплазию кишечника в результате полного парентерального питания.
- Альтернативный парентеральный режим — ампициллин / сульбактам плюс доксициклин.
- Это также важно при производстве парентеральных фармацевтических препаратов.
- Парентеральное введение тиамина связано с очень небольшим риском анафилаксии.
- Этот вариант следует оценить, прежде чем прибегать к парентеральной терапии.
- Однако это может произойти у лиц, получающих парентеральное питание.
- Парентерально в предложении увидеть сложно.
- Лечение выбора — хирургическая обработка раны и парентеральное введение бензилпенициллина.
- Хирургическая обработка раны редко требуется после продолжительного курса парентеральной антимикробной терапии.
- Артесунат предпочтительнее парентерального хинина при тяжелом лечении малярии. и Азия.
- Другой альтернативой является использование парентерального режима с цефтриаксоном или цефокситином плюс доксициклин.
- Также Juhel Nigeria построила в городе завод по производству парентеральных препаратов.
- Полное парентеральное питание датируется концом 1960-х годов.
- Парентеральное железо все чаще используется при анемии при хронических заболеваниях почек и воспалительных заболеваниях кишечника.
- В большинстве стран препарат доступен также в парентеральной форме для внутривенной инфузии.
- «Цефотиам» — парентеральный цефалоспориновый антибиотик второго поколения.
- Доступен для парентерального и перорального введения
- Другие предложения № 1 2 3
Использование для одного пациента — новый термин для парентеральных препаратов
FDA опубликовало новый проект Руководства (с названием, которое может занять половину этого сообщения в блоге), озаглавленный «Выбор подходящих условий для типов упаковки и рекомендаций для маркировки инъекционных медицинских продуктов, упакованных в многодозовой, однократной и однократной дозировке». -Контейнеры для пациентов ».Скажи ЭТО на одном дыхании!
В любом случае, этот проект Руководства добавляет два конкретных термина, которые FDA давно использует для парентеральных продуктов — контейнер для одной дозы и контейнер для нескольких доз — но они даже изменили эти термины и теперь определяют их следующим образом:
Контейнер для однократной дозы: Контейнер для однократной дозы — это контейнер стерильного лекарства для парентерального введения (инъекции или инфузии), которое не требуется для соответствия требованиям тестирования противомикробной эффективности.Контейнер для разовой дозы предназначен для использования с одним пациентом в виде разовой инъекции / инфузии. Если позволяет пространство, контейнер с одной дозой маркируется как таковой, и на этикетке должны быть указаны соответствующие инструкции по утилизации. Примерами контейнеров для разовой дозы являются флаконы, ампулы и предварительно заполненные шприцы.
Контейнер для многократных доз: Контейнер для многократных доз — это контейнер для стерильного лекарства для парентерального введения (инъекции или инфузии), который отвечает требованиям тестирования противомикробной эффективности или исключен из таких требований к тестированию в соответствии с правилами FDA.Контейнер для многократных доз предназначен для содержания более одной дозы лекарственного препарата. Если позволяет место, контейнер для многократных доз помечается как таковой. Обычно предполагается, что контейнеры для многократных доз содержат 30 мл или меньше лекарства. Срок истечения срока годности для открытого или введенного (например, проколотого иглой) контейнера для многократных доз составляет 28 дней, если иное не указано производителем на этикетке. Примером контейнера для многократных доз является флакон.
В связи с длительной историей ненадлежащего использования некоторых парентеральных продуктов, которое привело к значительным неблагоприятным последствиям для здоровья (как описано в Руководящем документе), Агентство вводит новый термин — контейнер для одного пациента, который более точно описывает использование продукт, который имеет несколько доз, но должен использоваться только для одного пациента.
Емкость для одноразового использования: Емкость для одноразового использования — это контейнер стерильного лекарства для парентерального введения (инъекции или инфузии), который предназначен для многократного использования одним пациентом. Если позволяет пространство, контейнер для одноразового использования маркируется как таковой, и на этикетке должны быть указаны соответствующие инструкции по утилизации. Примерами контейнеров для одноразового использования являются картриджи для обезболивания, контролируемые пациентом, и некоторые ручки для инъекций .
Типы представлений для NDA и BLA отличаются от ANDA для изменений в обозначении типа упаковки. За исключением изменения с «разового применения» на «разовую дозу», которое может быть представлено в годовом отчете, другие изменения в соответствии с настоящим Руководством для NDA и BLA должны быть представлены в качестве дополнений к предварительному утверждению. После утверждения кандидаты ANDA могут подать изменение в CBE-0. Чтобы просмотреть проект Руководства полностью, щелкните здесь.
Использование микросфер для парентеральной доставки лекарств
Использование микросфер для парентеральной доставки лекарств
Автор: Dr.Афсане Мотамед-Хорасани
Составление и доставка лекарств — важный процесс в разработке лекарств, где целевое и длительное высвобождение лекарства играет решающую роль в этом аспекте. В последнее время системы микросфер стали использовать для замедленного высвобождения белков и химических лекарств.
Препарат от ревматоидного артрита, инфликсимаб, был приготовлен с сополимером PLGA 50:50 (сополимолочная кислота / гликолевая кислота) с использованием методики разделения фаз и метода двойной эмульсии.Результаты пришли к выводу, что микросферы могут быть безопасным и эффективным методом приготовления инфликсимаба.
Микросферы также подходят для длительного высвобождения пероральных препаратов с меньшим риском сброса дозы. Ученые успешно использовали микросферы для доставки перорального диабетического препарата глипизида. Полисахарид семян тамаринда или ксилоглюкан использовали в качестве носителя для рецептуры глипизида методом распылительной сушки.Размер частиц микросфер составлял от 3 до 6 микрон, и они могли захватывать 97-99 процентов лекарства со временем высвобождения семь часов.
Кроме того, была разработана самоэмульгирующаяся система доставки лекарств для другого плохо растворимого диабетического лекарства, глимепирида. Состав был оптимизирован путем контроля диаметра капель с использованием статистического дизайна Бенкена. Система смогла эффективно высвободить почти 80 процентов лекарства в течение первых пяти минут.
Микросферы успешно используются для доставки лекарств, специфичных для толстой кишки.Была разработана новая система доставки лекарств, специфичная для толстой кишки, с использованием метронидазола (МТЗ) в качестве модельного лекарственного средства. Поверхности сшитых микросфер поливинилового спирта полимеризовали 4-стиролсульфонатом натрия (SSS). Система инициирования окислительно-восстановительного потенциала соль церия-гидроксильная группа была использована для привитой полимеризации, инициированной поверхностью.
Новые привитые микросферы, несущие лекарственное средство МТЗ, были протестированы на их способность высвобождать лекарство в условиях in vitro. Микросферы продемонстрировали сильную адсорбцию лекарственного средства в кислых условиях с адсорбционной емкостью 112 мг / г.
Высвобождение препарата МТЗ из привитых носителей было высоко рН-специфичным. В кислой среде (pH = 1) лекарство не высвобождается из привитых носителей, тогда как в почти нейтральной среде (pH = 7,4) лекарство высвобождается немедленно. Результаты показали, что привитые микросферы лучше всего подходят для доставки лекарств в толстую кишку.
Другой пример — пантопразол натрия, который обычно используется при гастроэзофагеальных рефлюксных заболеваниях. Однако это лекарство неустойчиво к кислотам и ультрафиолетовому излучению.Микрочастицы Eudragit S 100 использовали в качестве гастрорезистентных микрочастиц для доставки пантопразола натрия.
В присутствии солнечного света не наблюдалось значительной деградации микрочастиц, содержащих лекарство, тогда как чистое лекарство разложилось на 25 процентов. Разложение в присутствии УФ-излучения с длиной волны 254 и 366 нм составляло 38,6% и 12,11% для чистого лекарственного средства и 35,11% и 6,13% для микрочастиц, содержащих лекарственное средство, соответственно.Микрокапсулирование лекарственного средства пантопразола натрия с микрочастицами Eudragit S 100 улучшило стабильность лекарственного средства как в кислой среде, так и в УФ-свете.
Таким образом, микросферы являются потенциальными носителями лекарств для различных типов лекарств. Они обеспечивают прямое лечение и способны доставлять лекарство к месту заболевания с более низкой дозировкой лекарства и незначительными системными побочными эффектами. Микросферы особенно подходят для доставки лекарств, специфичных для толстой кишки, поскольку они предотвращают разложение лекарства в проксимальной части и высвобождают лекарство только в области толстой кишки.
Д-р Афсане Мотамед-Хорасани — специалист в области медицины и науки с большим опытом работы в биомедицинских науках, клинических испытаниях / исследованиях и медицинских / нормативных документах / документах. Она является президентом и управляющим директором Neometrix Consulting Inc., которая помогает глобальным фармацевтическим компаниям и компаниям, производящим медицинское оборудование, с их медицинскими и нормативными документами, а также в медицинских вопросах.
Содействие безопасному использованию парентеральных антикоагулянтов
Медсестры могут играть ведущую роль в предотвращении вреда, связанного с введением гепарина.
На вынос
- Парентеральные антикоагулянты требуют соответствующего обучения пациентов для повышения приверженности к назначению лекарств.
- Использование нефракционированного гепарина / низкомолекулярных гепаринов предотвращает побочные эффекты от событий, которые вызывают снижение подвижности пациента.
- Антикоагулянты являются основным средством лечения венозной тромбоэмболии.
Примечание редактора: антикоагулянты остаются основой фармакологического лечения венозной тромбоэмболии. (VTE).В июне 2019 года Американский журнал медсестер опубликовал «Пероральные антикоагулянты: обновленная информация о фармакологическом менеджменте» (myamericannurse.com/oral-anticoagulants-pharmacologic-update), который включает описание гемостаза и каскада свертывания крови. Здесь автор статьи обращает внимание на парентеральные антикоагулянты.
Парентеральные антикоагулянты — нефракционированный и низкомолекулярный гепарин — в основном используются для профилактики и лечения ВТЭ (тромбоза глубоких вен [ТГВ] и тромбоэмболии легочной артерии [ТЭЛА]), связанных с такими заболеваниями, как фибрилляция предсердий, болезни сердца и атеросклероз; они также используются для предотвращения свертывания крови во время диализа и экстракорпорального кровообращения.Объединенная комиссия считает гепарин препаратом повышенной опасности, который может нанести значительный вред, поэтому медсестры должны понимать различия между двумя типами гепарина, знать о возможных осложнениях и обеспечивать надлежащий уход и обучение пациентов.
Нефракционированный гепарин
Нефракционированный гепарин (НФГ) — парентеральный антикоагулянт быстрого действия, подавляющий коагуляцию за счет связывания с белком плазмы антитромбином III с
усиливает его ингибирующую активность против факторов свертывания крови IIa (тромбин), Xa, XIIa и IXa.Без этих факторов образование фибрина снижается, и кровь не может образовывать адекватный сгусток. Комплекс гепарин / антитромбин образуется быстро, и эффекты наблюдаются в течение нескольких минут, когда препарат вводится внутривенно. Гепарин также можно вводить подкожно, но из-за его большого молекулярного размера и полярности его нельзя вводить перорально.
Фармакокинетика
При внутривенном введении UFH имеет период полувыведения от 1 до 2 часов. У пациентов с нарушением функции печени или почек период полувыведения увеличивается и требует корректировки дозировки.Поскольку гепарин не проникает через мембраны, его безопасно использовать во время беременности. НФГ (который метаболизируется в печени и выводится почками) является неспецифическим связующим звеном с белками плазмы, поэтому уровни свободного гепарина в плазме могут варьироваться.
Терапевтическое применение
В больницах НФГ используется для лечения ТЭЛА и ТГВ, вызванных такими состояниями, как фибрилляция предсердий. Он также используется во время крупных операций, таких как тазовые и гинекологические онкологические операции. Кроме того, гепарин можно использовать для лечения диссеминированного внутрисосудистого свертывания (нарушения, при котором фибриновые сгустки образуются по всей сосудистой системе) и в качестве дополнительной терапии после тромболитической терапии для предотвращения повторного образования сгустка.
Дозировка
UFH доступен в нескольких концентрациях, и количество и способ введения (внутривенное вливание или подкожная инъекция) зависят от лечения. Многие больницы установили протоколы гепарина с конкретными дозировками для каждого излечиваемого состояния. Эти протоколы обеспечивают структуру ухода за пациентом и требуют корректировки дозировки на основе результатов активированного частичного тромбопластинового времени пациента (АЧТВ) или уровней анти-фактора Ха.
АЧТВ (обычно от 30 до 40 секунд) — это наиболее часто используемый метод для мониторинга эффектов НФГ.На терапевтических уровнях АЧТВ пациента должно быть в полтора-два раза больше, чем обычно. Если АЧТВ выходит за пределы этого диапазона, следует скорректировать дозировку. АЧТВ измеряется каждые 4-6 часов, пока не будет установлена эффективная дозировка, затем один раз в день.
Тест на анти-фактор Ха напрямую измеряет НФГ и его активность. Уровень активности Ха обратно пропорционален активности гепарина в крови. Уровни от 0,3 до 0,7 международных единиц / мл находятся в терапевтическом диапазоне.
Побочные эффекты
Основными побочными эффектами НФГ являются кровотечение и гепарин-индуцированная тромбоцитопения (ГИТ). (См. HIT: быстрые факты .) Кровотечение может произойти в любом месте тела и может быть смертельным. Обильное кровотечение можно лечить с помощью сульфата протамина, который немедленно нейтрализует гепарин и длится до 3 часов. При необходимости протамин следует вводить через медленное внутривенное введение. толкайте с максимальной скоростью 20 мг / мин или 50 мг за 10 минут; 1 мг протамина может обратить действие 100 единиц гепарина.
Другие побочные эффекты включают раздражение места инъекции, гематому, анемию, остеопороз (при длительном применении), алопецию и приапизм.
HIT: быстрые факты
Гепарин-индуцированная тромбоцитопения (ГИТ) встречается у 1–5% пациентов, получающих гепарин, и чаще встречается у хирургических пациентов, у которых была длительная (от 10 до 14 дней) послеоперационная тромбопрофилактика или операция коронарного шунтирования и / или замены клапана .
- ГИТ типа 1, который обычно возникает в течение первых 2 дней терапии гепарином, представляет собой временное снижение количества тромбоцитов, которое нормализуется по мере продолжения терапии.
- Тип 2 — это иммуноопосредованное заболевание, вызываемое антителами, которые развиваются в ответ на комплексы гепарин-тромбоциты. Антитела вызывают уменьшение тромбоцитов и увеличение образования сгустков. ГИТ типа 2 увеличивает свертываемость крови в сосудистой системе и может быть фатальным.
- Количество тромбоцитов следует проверять два-три раза в неделю в течение первых 3 недель терапии, а затем ежемесячно. Если количество тромбоцитов падает ниже 100 000 / мм3, прием гепарина следует прекратить.
- Поскольку HIT приводит к повышенному свертыванию и парадоксальному образованию тромбов, для уменьшения чрезмерного свертывания крови необходим альтернативный антикоагулянтный препарат.Аргатробан и бивалирудин можно использовать для лечения ГИТ.
Противопоказания
UFH не следует использовать у пациентов с тромбоцитопенией или неконтролируемым кровотечением, а также у пациентов, перенесших операции на спинном мозге, головном мозге или глазах. С особой осторожностью следует применять пациентам с гемофилией, пептическими язвами, расслаивающейся аневризмой, тяжелой гипертензией, повышенной проницаемостью капилляров, угрозой прерывания беременности или тяжелыми заболеваниями печени или почек. В этих случаях врачи должны тщательно оценить риски и преимущества.Если принято решение о введении НФГ, за пациентом следует внимательно наблюдать.
Гепарин низкомолекулярный
Два низкомолекулярных гепарина (НМГ) доступны в США: эноксапарин и далтепарин. Эноксапарин является наиболее широко используемым. Подобно UFH, LMWH блокирует фактор Xa, но менее эффективно инактивирует тромбин; В отличие от НФГ, НМГ не требует регулярного лабораторного контроля.
Фармакокинетика
НМГ метаболизируется в печени и выводится почками, но его более длительный период полувыведения и способность связываться со специфическими белками плазмы делает его действие более предсказуемым, чем НФГ.Хотя молекулы НМГ меньше, чем в НФГ, они очень полярны, поэтому НМГ можно использовать во время беременности.
Терапевтическое применение
НМГ используются для предотвращения ТГВ после операций на брюшной полости, бедре и колене, а также для предотвращения ишемических осложнений от нестабильной стенокардии у пациентов, перенесших инфаркт миокарда или острый коронарный синдром. Эноксапарин можно назначить, когда пациенту необходимо отменить варфарин, но по-прежнему требуется антикоагулянт.
Дозировка
Эноксапарин назначают в миллиграммах или миллиграммах на килограмм в зависимости от веса пациента; Далтепарин назначают в единицах на килограмм.Количество и частота НМГ зависят от лечения; рутинный лабораторный контроль не требуется. Если у пациента наблюдается кровотечение, НМГ можно измерить с помощью трех тестов: АЧТВ, анализа образования тромбина и анализа антифактора Ха (анти-FXa).
Побочные эффекты
Частота кровотечений у НМГ меньше, чем у НФГ. Однако ГИТ может возникнуть, что потребует тех же вмешательств, что и у пациента, получающего НФГ. Обильное кровотечение можно лечить с помощью сульфата протамина. Стандартная доза составляет 1 мг сульфата протамина для нейтрализации 100 мг эноксапарина или далтепарина.
Другие побочные эффекты НМГ включают кровотечение, раздражение места инъекции, гематому, анемию, тромбоцитопению, остеопороз при длительном применении, алопецию и приапизм.
Противопоказания
Противопоказания для НМГ включают пациентов с тромбоцитопенией и неконтролируемым кровотечением. Все НМГ имеют предупреждение в виде черного ящика в отношении использования с пациентами, которые получают спинальную или эпидуральную анестезию или спинномозговую пункцию. Лекарства могут увеличить риск кровотечения, которое может привести к серьезным неврологическим травмам, включая паралич.Пациентам, перенесшим ГИТ, не следует назначать НМГ.
Соображения по уходу
Гепарин — препарат высокого риска, и одна из национальных целей Совместной комиссии по безопасности пациентов на 2020 год — снизить вероятность нанесения вреда пациенту, связанного с антикоагулянтной терапией. (См. Предупреждение ошибок .) Достижение этой цели зависит от медсестер, наблюдающих за пациентами и обеспечения соответствующего обучения. Он также основан на понимании пациентами важности лечения и соблюдении последующих назначений и инструкций по самостоятельной инъекции.
Предотвращение ошибок
Организации должны выполнить следующие шаги, чтобы предотвратить ошибки введения гепарина:
- Создать межпрофессиональную команду, в которую входят фармацевты, для разработки и регулярного пересмотра политик и протоколов назначения, введения и наблюдения за пациентами, получающими гепарин.
- Стандартизация руководств по дозировке и лабораторного мониторинга, а также включение предупреждений в электронную медицинскую карту.
- Не допускайте перерывов при приготовлении лекарств.
- Используйте интеллектуальные насосы для инфузии I.V. гепарин.
- Отслеживайте и проводите анализ первопричин ошибок и возможных сбоев, чтобы определить области, которые необходимо улучшить.
- Обеспечить обучение пациентов перед выпиской (включая демонстрацию возвращения) по самостоятельному управлению и мониторингу.
- Используйте два RN для проверки заказа и дозировки.
Обязанности медсестры
Чтобы снизить риски, связанные с терапией гепарином, медсестры должны:
- Наблюдать за результатами лабораторных исследований и оценивать кровотечение
- предоставить устные и письменные инструкции для пациентов (убедитесь, что инструкции составлены на предпочитаемом пациентом языке и что размер отпечатка достаточно велик для людей с нарушением зрения).
- попросить пациента провести демонстрацию возврата лекарственного препарата, в том числе:
- смена иглы перед подкожным введением после извлечения лекарства из флакона
- , используя соответствующие места инъекции, такие как слой жира в животе или брюшной полости (избегая областей в пределах 2 дюймов от рубцовой ткани или пупка) или на передней и боковой поверхности верхней части бедра
- быстро вытащить иглу и слегка надавить на место инъекции, но не массировать или прикладывать тепло или холод.
Обязанности пациента
В рамках обучения пациентов проинструктируйте пациентов:
- при необходимости посещать контрольные приемы
- понимать важность приема препарата по назначению и что делать в случае пропуска дозы
- Хранить препарат при комнатной температуре
- проверять срок годности препарата перед введением каждой дозы
- чередовать места инъекции, используя прилагаемую диаграмму, показывающую приемлемые места, и вести учет, чтобы они не забыли образец
- мыть руки перед введением препарата
- Иглы и шприцы утилизировать в герметичном контейнере с крышкой; когда контейнер полон, они должны утилизировать его должным образом в соответствии с требованиями штата или округа
- следите за повышением частоты появления синяков, черного или дегтеобразного стула, а также увеличения частоты кровотечений из носа, что может указывать на увеличение времени кровотечения.
- знать об изменениях образа жизни, которые могут помочь снизить риск кровотечения, в том числе:
- Бритье электробритвой
- Используйте зубную щетку с мягкой щетиной и вощеную нить.
- При работе с ножами надевайте устойчивые к порезам перчатки и держите ножи заточенными, чтобы уменьшить скольжение
- Избегайте действий и поведения (занятия контактными видами спорта, повышенное потребление алкоголя), которые могут привести к падению или членовредительству
- удалить или переставить предметы (мебель, коврики) в доме, которые могут представлять опасность травмы или падения
- при езде на велосипеде надевайте шлем.
- носить браслет с медицинским предупреждением.
- обратитесь к поставщику медицинских услуг, прежде чем принимать какие-либо вновь прописанные или отпускаемые без рецепта лекарства, витамины или травяные добавки. (См. Межлекарственные взаимодействия .)
Межлекарственные взаимодействия
Пациентам, получающим терапию гепарином (нефракционированный гепарин [UFH] или низкомолекулярный гепарин [LMWH]), следует избегать любых препаратов, угнетающих функцию тромбоцитов или влияющих на антикоагуляцию, таких как аспирин, напроксен и клопидогрел.Сбор подробного анамнеза поможет выяснить, принимают ли пациенты какие-либо травяные добавки, которые могут увеличить риск кровотечения. Поручите пациентам избегать приема этих добавок во время терапии гепарином.
Пациентам, получающим НФГ, нельзя принимать:
- dong quai • имбирь
- примула вечерняя • гинкго билоба
- пажитник • клевер красный
- чеснок
Пациентам, получающим НМГ, нельзя принимать:
- рыбий жир • гинкго билоба
- чеснок • женьшень
- имбирь
Способствовать положительным результатам
Гепарин может быть лекарством, спасающим жизнь, но он имеет серьезные побочные эффекты, которые могут быть опасными для жизни.Когда медсестры предупреждают о возможных осложнениях и проводят тщательное обучение пациентов, они могут способствовать положительным результатам
Нэнси Хауген — заместитель декана, предварительное лицензирование и программы бакалавриата в Школе медсестер Университета Сэмюэля Мерритта в Окленде, Калифорния.
Артикул:
Американское общество гематологов. Рекомендации ASH VTE: гепарин-индуцированная тромбоцитопения (HIT). 2018. hematology.org/Clinician/Guidelines-Quality/VTE/9180.aspx
.
Бурчум Дж, Розенталь Л.Антикоагулянтные, антиагрегантные и тромболитические препараты. В: Lehne’s Pharmacology for Nursing Care. 10 -е изд. Филадельфия, Пенсильвания: Эльзевьер; 2018: 604-32.
Eke S, May SK. Гепарин-индуцированная тромбоцитопения. Medscape. 24 апреля 2018 г. emedicine.medscape.com/article/1357846-overview#a6
Грей Э, Хогвуд Дж, Маллой Б. Антикоагулянтные и антитромботические механизмы гепарина. Handb Exp Pharmacol . 2012; 207: 43-61.
Совместная комиссия, г. Национальные цели безопасности пациентов с января 2020 г .: Программа аккредитации больниц. Jointcommission.org/assets/1/6/NPSG_Chapter_HAP_Jan2020.pdf
Совместная комиссия, г. Отчет R3, выпуск 19: Национальная цель безопасности пациентов при антикоагулянтной терапии . 7 декабря 2018 г. Jointcommission.org/assets/1/18/R3_19_Anticoagulant_therapy_Rev_FINAL1.PDF
Кеарон С., Акл Э.А., Орнелис Дж. И др. Антитромботическая терапия при ВТЭ: руководство CHEST и отчет экспертной комиссии. Сундук . 2016; 149 (2): 315-52.
RN.com. Понимание опасностей гепарина. Май 2018 г. lms.rn.com/getpdf.php/2247.pdf?Main_Session=15a98fee0cac6fcb06ebc9a809988209
Шурр Дж. У., Стивенс КА, Бэйн А. и др. Описание и оценка внедрения номограммы гепарина с указанием веса медсестрой в медицинском центре высшего образования. Clin Appl Thromb Hemost. 2018; 24 (2): 248-53.
Скидмор-Рот Л. (2020). Справочник лекарств для медсестер Мосби 2020 .33 -е изд. Филадельфия, Пенсильвания: Эльзевьер; 2020.
.

 №: ЛСР-008788/10
№: ЛСР-008788/10 Ltd.
Ltd. №: ЛП-004038
№: ЛП-004038 5 мл 5 или 10 шт.
5 мл 5 или 10 шт. LTD.
LTD. 5 мл 3, 5, 6 или 24 шт.; , фл. 5 мл 1, 3 или 5 шт.
5 мл 3, 5, 6 или 24 шт.; , фл. 5 мл 1, 3 или 5 шт. 5 мл 3, 5, 6 или 24 шт.; фл. 5 мл 1, 3 или 5 шт.
5 мл 3, 5, 6 или 24 шт.; фл. 5 мл 1, 3 или 5 шт. В комплекте с насаженной иглой не менее 0,45х15 мм. Уплотнения поршня в цилиндре и конусного соединения наконечника цилиндра с головкой иглы должны быть воздухо- и водонепроницаемы. Поршень мягко перемещаться по всей градуированной длине шприца, имеет четыре ребра жесткости. Разность между максимальным и минимальным значениями нагрузки при перемещении поршня не более 5 Н. Метод стерилизации газовый. Индивидуальная упаковка газопроницаемая- блистер
В комплекте с насаженной иглой не менее 0,45х15 мм. Уплотнения поршня в цилиндре и конусного соединения наконечника цилиндра с головкой иглы должны быть воздухо- и водонепроницаемы. Поршень мягко перемещаться по всей градуированной длине шприца, имеет четыре ребра жесткости. Разность между максимальным и минимальным значениями нагрузки при перемещении поршня не более 5 Н. Метод стерилизации газовый. Индивидуальная упаковка газопроницаемая- блистер , стерильный, не токсичный, апирогенный, однократного применения. Цилиндр прозрачный, изготовлен из полипропилена одобренного к применению в медицинских целях, 3-х компонентный, с резиновой уплотнительной манжетой на поршне. Манжета изготовлена из нетоксичного эластичного компаунда. Поршень белого цвета. Игла 22G ( не менее 0,7*40мм), из нержавеющей хромникелевой стали с трехгранной заточкой, с силиконовым покрытием, соединение типа Луер. Размерность иглы на упаковке указана как в международном формате, так и в миллиметрах. Блистерная упаковка. Стерилизовано: окись этилена. Срок годности: 5 лет.
, стерильный, не токсичный, апирогенный, однократного применения. Цилиндр прозрачный, изготовлен из полипропилена одобренного к применению в медицинских целях, 3-х компонентный, с резиновой уплотнительной манжетой на поршне. Манжета изготовлена из нетоксичного эластичного компаунда. Поршень белого цвета. Игла 22G ( не менее 0,7*40мм), из нержавеющей хромникелевой стали с трехгранной заточкой, с силиконовым покрытием, соединение типа Луер. Размерность иглы на упаковке указана как в международном формате, так и в миллиметрах. Блистерная упаковка. Стерилизовано: окись этилена. Срок годности: 5 лет. , стерильный, не токсичный, апирогенный, однократного применения. Цилиндр прозрачный, изготовлен из полипропилена одобренного к применению в медицинских целях, 3-х компонентный, с резиновой уплотнительной манжетой на поршне. Манжета изготовлена из нетоксичного эластичного компаунда. Поршень белого цвета. Игла 22G ( не менее0,7*40мм), из нержавеющей хромникелевой стали с трехгранной заточкой, с силиконовым покрытием, соединение типа Луер. Размерность иглы на упаковке указана как в международном формате, так и в миллиметрах. Блистерная упаковка. Стерилизовано: окись этилена. Срок годности: 5 лет.
, стерильный, не токсичный, апирогенный, однократного применения. Цилиндр прозрачный, изготовлен из полипропилена одобренного к применению в медицинских целях, 3-х компонентный, с резиновой уплотнительной манжетой на поршне. Манжета изготовлена из нетоксичного эластичного компаунда. Поршень белого цвета. Игла 22G ( не менее0,7*40мм), из нержавеющей хромникелевой стали с трехгранной заточкой, с силиконовым покрытием, соединение типа Луер. Размерность иглы на упаковке указана как в международном формате, так и в миллиметрах. Блистерная упаковка. Стерилизовано: окись этилена. Срок годности: 5 лет.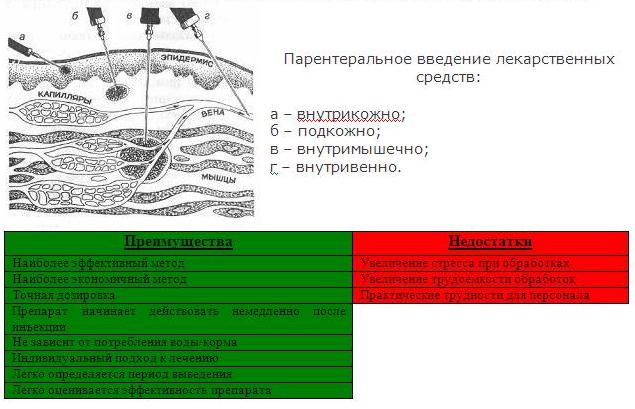
 Дополнительная подушечка для абсорбеции отделяемого и предотвращения травматизации места пункции. Размер не менее 8,5×6 см (+-0,5) см
Дополнительная подушечка для абсорбеции отделяемого и предотвращения травматизации места пункции. Размер не менее 8,5×6 см (+-0,5) см