Серповидно-клеточная анемия — причины, симптомы, диагностика и лечение
Серповидно-клеточная анемия – наследственная гемоглобинопатия, обусловленная синтезом аномального гемоглобина S, изменением формы и свойств эритроцитов крови. Серповидно-клеточная анемия проявляется гемолитическими, апластическими, секвестрационными кризами, тромбозами сосудов, костно-суставными болями и припухлостью конечностей, изменениями скелета, сплено- и гепатомегалией. Диагноз подтверждается по данным исследования периферической крови и пунктата костного мозга. Лечение серповидно-клеточной анемии является симптоматическим, направленным на предупреждение и купирование кризов; может быть показано переливание эритроцитов, прием антикоагулянтов, проведение спленэктомии.
Общие сведения
Серповидно-клеточная анемия (S-гемоглобинопатия) – разновидность наследственной гемолитической анемии, характеризующаяся нарушением структуры гемоглобина и присутствием в крови эритроцитов серповидной формы. Заболеваемость серповидно-клеточной анемией распространена, главным образом, в странах Африки, Ближнего и Среднего Востока, Средиземноморского бассейна, Индии. Здесь частота носительства гемоглобина S среди коренного населения может достигать 40%. Любопытно, что больные серповидно-клеточной анемией имеют повышенную врожденную устойчивость к заражению малярией, поскольку малярийный плазмодий не может проникнуть в эритроциты серповидной формы.
Серповидно-клеточная анемия
Причины
В основе серповидно-клеточной анемии лежит генная мутация, обусловливающая синтез аномального гемоглобина S (HbS). Дефект структуры гемоглобина характеризуется заменой глутаминовой кислоты валином в ß-полипептидной цепи. Образующийся при этом гемоглобин S после потери присоединенного кислорода приобретает консистенцию высокополимерного геля и становится в 100 раз менее растворимым, чем нормальный гемоглобин А. В результате этого эритроциты, несущие деоксигемоглобин S, деформируются и приобретают характерную полулунную (серповидную) форму. Измененные эритроциты становятся ригидными, малопластичными, могут закупоривать капилляры, вызывая ишемию тканей, легко подвергаются аутогемолизу.
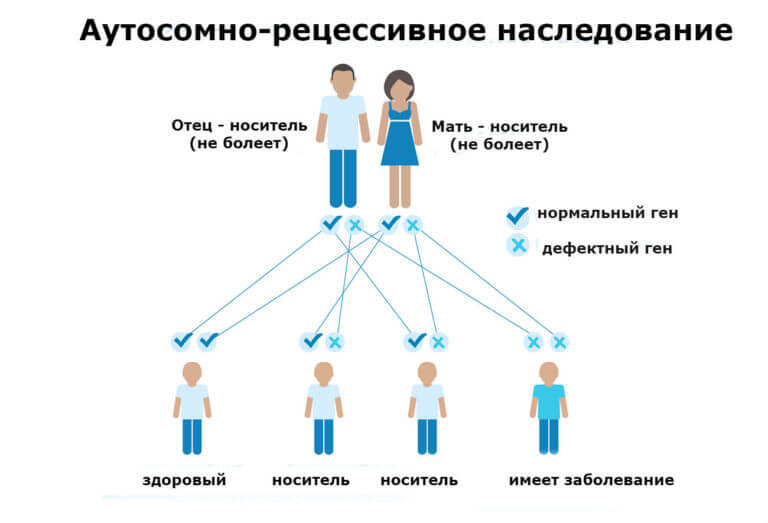
Наследование серповидно-клеточной анемии происходит по аутосомно-рецессивному типу. При этом, гетерозиготы наследуют дефектный ген серповидно-клеточной анемии от одного из родителей, поэтому, наряду с измененными эритроцитами и HbS, имеют в крови и нормальные эритроциты с HbА. У гетерозиготных носителей гена серповидно-клеточной анемии признаки заболевания возникают лишь в определенных условиях. Гомозиготы наследуют по одному дефектному гену от матери и от отца, поэтому в их крови присутствуют только серповидные эритроциты с гемоглобином S; заболевание развивается рано и протекает тяжело.
Таким образом, в зависимости от генотипа, в гематологии различают гетерозиготную (HbAS) и гомозиготную (HbSS, дрепаноцитоз) форму серповидно-клеточной анемии. К редко встречающимся вариантам заболевания относятся промежуточные формы серповидно-клеточной анемии. Обычно они развиваются у двойных гетерозигот, несущих один ген серповидно-клеточной анемии и другой дефектный ген — гемоглобина C (HbSC), серповидной β-плюс (HbS/β +) или β-0 (HbS/β0) талассемии.
Симптомы серповидно-клеточной анемии
Гомозиготная серповидно-клеточная анемия обычно проявляется у детей к 4-5 месяцу жизни, когда увеличивается количество HbS, а процентное содержание серповидных эритроцитов достигает 90%. В таких случаях раннее возникновение гемолитической анемии у ребенка обуславливает задержку физического и умственного развития. Характерны нарушения развития скелета: башенный череп, утолщение лобных швов черепа в виде гребня, кифоз грудного или лордоз поясничного отдела позвоночника.
В развитии серповидно-клеточной анемии выделяют три периода: I — с 6 месяцев до 2-3 лет, II — с 3 до 10 лет, III — старше 10 лет. Ранними сигналами серповидно-клеточной анемии служат артралгии, симметричное опухание суставов конечностей, боли в груди, животе и спине, желтушность кожи, спленомегалия. Дети с серповидно-клеточной анемией относятся к категории часто болеющих. Степень тяжести течения серповидно-клеточной анемии тесно коррелирует с концентрацией HbS в эритроцитах: чем она выше, тем тяжелее выражена симптоматика.
В условиях интеркуррентной инфекции, стрессовых факторов, обезвоживания, гипоксии, беременности и пр. у больных данным видом наследственной анемии могут развиваться серповидно-клеточные кризы: гемолитический, апластический, сосудисто-окклюзионный, секвестрационный и др.
При развитии гемолитического криза состояние больного резко ухудшается: возникает фебрильная лихорадка, в крови повышается непрямой билирубин, усиливается желтушность и бледность кожных покровов, появляется гематурия. Стремительный распад эритроцитов может привести к анемической коме. Апластические кризы при серповидно-клеточной анемии характеризуются угнетением эритроидного ростка костного мозга, ретикулоцитопенией, снижением гемоглобина.
Следствием депонированием крови в селезенке и печени служат секвестрационные кризы. Они сопровождаются гепато- и спленомегалией, сильными болями в животе, резкой артериальной гипотонией. Сосудисто-окклюзионные кризы протекают с развитием тромбоза сосудов почек, ишемии миокарда, инфаркта селезенки и легких, ишемического приапизма, окклюзии вен сетчатки, тромбоза мезентериальных сосудов и др.
Гетерозиготные носители гена серповидно-клеточной анемии в обычных условиях ощущают себя практически здоровыми. Морфологически измененные эритроциты и анемия у них возникают только в ситуациях, связанных с гипоксией (при тяжелой физической нагрузке, авиаперелетах, восхождении в горы и др.). Вместе с тем, остро развившийся гемолитический криз при гетерозиготной форме серповидно-клеточной анемии может иметь летальный исход.
Симметричное опухание суставов при серповидно-клеточной анемии
Осложнения
Хроническое течение серповидно-клеточной анемии с повторными кризами приводит к развитию целого ряда необратимых изменений, нередко становящихся причиной гибели больных. Примерно у трети больных отмечается аутоспленэктомия – сморщивание и уменьшение размеров селезенки, вызванное замещением функциональной ткани рубцовой. Это сопровождается изменением иммунного статуса больных серповидно-клеточной анемией, более частым возникновением инфекций (пневмонии, менингита, сепсиса и др.).
Исходом сосудисто-окклюзионных кризов могут стать ишемические инсульты у детей, субарахноидальные кровоизлияния у взрослых, легочная гипертензия, ретинопатия, импотенция, почечная недостаточность. У женщин с серповидно-клеточной анемией отмечается позднее становление менструального цикла, склонность к самопроизвольному прерыванию беременности и преждевременным родам. Следствием ишемии миокарда и гемосидероза сердца служит возникновение хронической сердечной недостаточности; повреждения почек — хронической почечной недостаточности.
Длительный гемолиз, сопровождаемый избыточным образованием билирубина, приводит к развитию холецистита и желчнокаменной болезни. У больных серповидно-клеточной анемией часто возникают асептические некрозы костей, остеомиелит, язвы голеней.
Диагностика
Диагноз серповидно-клеточной анемии выставляется гематологом на основании характерных клинических симптомов, гематологических изменений, семейно-генетического исследования. Факт наследования ребенком серповидно-клеточной анемии может быть подтвержден еще на этапе беременности с помощью биопсии ворсин хориона или амниоцентеза.
В периферической крови отмечается нормохромная анемия (1-2х1012/л), снижение гемоглобина (50-80 г/л), ретикулоцитоз (до 30%). В мазке крови обнаруживаются серповидно измененные эритроциты, клетки с тельцами Жолли и кольцами Кабо. Электрофорез гемоглобина позволяет определить форму серповидно-клеточной анемии – гомо- или гетерозиготную. Изменение биохимических проб крови включает гипербилирубинемию, увеличение содержания сывороточного железа. При исследовании пунктата костного мозга выявляется расширение эритробластического ростка кроветворения.
Дифференциальная диагностика направлена на исключение других гемолитических анемий, вирусного гепатита А, рахита, ревматоидного артрита, туберкулеза костей и суставов, остеомиелита и др.
Серповидно-клеточная анемия
Лечение серповидно–клеточной анемии
Серповидно-клеточная анемия относится к категории неизлечимых болезней крови. Таким пациентам требуется пожизненное наблюдение гематолога, проведение мероприятий, направленных на предупреждение кризов, а при их развитии – проведение симптоматической терапии.
В период развития серповидно-клеточного криза требуется госпитализация. С целью быстрого купирования острого состояния назначается кислородотерапия, инфузионная дегидратация, введение антибиотиков, обезболивающих средств, антикоагулянтов и дезагрегантов, фолиевой кислоты. При тяжелом течении обострений показано переливание эритроцитарной массы. Проведение спленэктомии не способно повлиять на течение серповидно-клеточной анемии, однако может на время уменьшить проявления заболевания.
Прогноз и профилактика
Прогноз гомозиготной формы серповидно-клеточной анемии неблагоприятный; большая часть пациентов погибает в первое десятилетие жизни от инфекционных или тромбоокклюзионных осложнений. Течение гетерозиготных форм патологии гораздо более обнадеживающее.
Для предупреждения быстро прогрессирующего течения серповидно-клеточной анемии следует избегать провоцирующих условий (обезвоживания, инфекций, перенапряжения и стрессов, экстремальных температур, гипоксии и пр.). Детям, страдающим данной формой гемолитической анемии, в обязательном порядке показана вакцинация против пневмококковой и менингококковой инфекции. При наличии в семье больных серповидно-клеточной анемией необходима медико-генетическая консультация для оценки риска развития заболевания у потомства.
Серповидноклеточная анемия: причины, симптомы и лечение

Что такое серповидноклеточная анемия?

Серповидноклеточная анемия в мазке крови
Серповидноклеточная анемия — наследственное заболевание, когда форма эритроцитов изменяется на серповидную. Это происходит из-за мутировавшего белка гемоглобина, который кристаллизуется в эритроците. Такие клетки крови не в состоянии полноценно доносить кислород тканям всех органов, они закупоривают сосуды, а сами подвержены преждевременному разрушению, что приводит к снижению дыхательной функции крови — анемии.
Подобные мутации гемоглобина диагностируются по всему миру, но самая большая концентрация заболевания сосредоточена среди негроидной расы. В некоторых районах Африки число носителей этого заболевания доходит до 45% от общего населения региона. В Нигерии ежегодно рождается около 150 000 детей с серповидноклеточной анемией. При этом 50% детей не доживает до 1 года, ещё 40% умирает, не достигнув зрелого возраста.
В других странах статистика более благоприятная, пациенты достигают возраста 45 — 55 лет, а смертность в возрасте до 1 года составляет 10%. Болезнь считается неизлечимой, все терапевтические меры направлены на устранение симптомов и осложнений. Однако в 2014 году в Париже была проведена уникальная операция по модификации генов костного мозга. С тех пор у пациента исчезли симптомы болезни, а его костный мозг стал производить эритроциты правильной формы. Это дало надежду миллионам людей, страдающим от этого недуга.
Патогенез

Измененная форма эритроцита при серповидноклеточной анемии
При серповидноклеточной анемии в гемоглобине одна аминокислота заменяется на другую, вследствие чего происходит мутация, и вместо здорового гемоглобина А появляется гемоглобин S. Гемоглобин S не способен растворяться в цитоплазме эритроцита, вместо этого он образует длинные жгуты и так и застывает, кристаллизуясь в эритроците.
Эритроциты становятся хрупкими, продолжительность их жизни сокращается в 10 раз. Костный мозг производит новые эритроциты в ускоренном темпе, но они снова быстро разрушаются. Серповидные клетки, при попытке пройти через узкие капилляры, застревают в них, образуя тромбы. Это приводит к нарушению кровообращения и ломкости капилляров.
Несмотря на мутацию гемоглобина, проявляется болезнь не постоянно, а приступами. В некоторых случаях эритроциты нормально циркулируют по кровяному руслу, не меняя свою форму, пока не появляется причина, которая провоцирует усиленную кристаллизацию. Это может быть нехватка воздуха, недостаток какого-либо элемента в питании, обезвоживание, инфекционная болезнь. Во время приступов пациенты испытывают в течение нескольких дней мучительную боль, которую зачастую не удаётся заглушить самыми сильными обезболивающими.
Причины серповидноклеточной анемии

Тип наследования серповидноклеточной анемии
Заболевание передаётся только по наследству и не является заразным. Ребёнок заболевает в случае, если оба родителя передали ему мутировавшие гены. Если от одного родителя получены здоровые гены, а от другого изменённые, ребёнок станет лишь носителем заболевания. Он передаст мутировавший ген и своему потомству, а если его супруг(а) тоже будет носителем, с большой вероятностью их дети будут страдать от патологии.
Причина изначальной мутации гемоглобина — эволюция эритроцитов в районах с повышенным риском заражения малярией. Плазмодии, вызывающие малярию, живут сначала в печени, а потом отправляются в кровяное русло размножаться, используя местом своего обитания эритроциты. Устроившись в тельце эритроцита, паразит насыщается молекулами гемоглобина, а затем путём деления образует множество своих копий. Паразитические организмы очень быстро приводят к необратимым последствиям и человек умирает.
При серповидноклеточной болезни эритроциты наполняются кристаллами гемоглобина, и паразиты уже не могут питаться и размножаться.
Исследования показали, что чем больше определённый регион подвержен малярии, тем большее число носителей серповидноклеточной анемии там зарегистрировано. Таким образом, изменение формы кровяных клеток направлено на спасение жизни от очень опасного заражения малярией.
Симптомы

Припухлость стоп при анемии
Чаще всего симптомы начинают проявляться в возрасте 6 месяцев. Признаки заболевания включают в себя:
- Припухлость стоп и кистей. Происходит из-за закупоривания серповидными эритроцитами кровеносных сосудов.
- Болевые приступы. Провоцируются блокированием артерий в различных участках тела. Приступы обладают неоднородной цикличностью, могут наступить в любой момент и развиваться с различной интенсивностью.
- Нарушения развития скелета. Могут определяться деформации черепа, искривления позвоночника.
- Септические некрозы плечевой и/или бедренной кости развиваются из-за закупорки сосудов участков кости, питающихся одной артерией.
- Снижение зрения происходит из-за блокирования сосудов, снабжающих глаза.
Также заболевание характеризуются признаками, присущими всем видам анемий:
- Вялость, быстрая утомляемость.
- Бледность кожи и слизистых оболочек.
- Отставание детей в физическом и психомоторном развитии.
- Частые инфекционные заболевания.
Диагностика

Диагностический амниоцентез
Серповидноклеточную анемию можно определить у ребёнка, когда он ещё находится в утробе матери. Для этого проводится диагностическая манипуляция — биопсия хориона либо амниоцентез. Для новорожденных и старше методы выявления заболевания включают в себя следующие параметры.
- Общий анализ крови. Уровень гемоглобина снижен, значения ретикулоцитов повышены, объём эритроцитов приближен к норме.
- Биохимический анализ крови. Увеличение содержания сывороточного железа, повышение билирубина.
- Мазок периферической крови. Определяются эритроциты с заострёнными концами в форме серпа.
- Электрофорез. Выявляется наличие S гемоглобина.
- УЗИ брюшной полости. Увеличение селезёнки (в тяжелой стадии происходит уже уменьшение), печени, наличие камней в желчном пузыре.
Лечение

Лечение заболевания — симптоматическое
Терапия направлена на общее укрепление организма во избежание осложнений и присоединения инфекционных заболеваний.
- Для купирования болевых приступов назначаются анальгетики — морфин и другие опиоидные средства.
- Обильное питьё рекомендуется всем пациентам для улучшения циркуляции крови по сосудам.
- Антибиотики пенициллинового ряда назначаются с 6 месяцев для профилактики присоединения инфекций. Антибиотики широкого спектра назначаются при подозрении на бактериальное заражение.
- Переливание крови осуществляется для профилактики образования тромбов.
- Хороший эффект по ослаблению осложнений даёт терапия на основе оксимочевины. Оксимочевина способствует снижению количества S гемоглобина за счёт увеличения фетального гемоглобина (F гемоглобина). Таким образом, уменьшается количество приступов боли у пациента. Терапия оксимочевиной проводится для пациентов на протяжении всей их жизни.
- Пересадка костного мозга сопряжена с риском летальности при данном диагнозе, но опубликованы данные об успешно проведённых операциях, в результате которых симптомы ослабевают.
Возможные осложнения

Анемия может осложниться почечной недостаточностью
Осложнения имеют разнонаправленный характер и затрагивают системы всех органов. Смертельные случаи в большинстве своём спровоцированы присоединением инфекции. Также могут развиться следующие последствия:
- сплющивание и уменьшение селезёнки с замещением здоровой ткани на рубцовую;
- ишемические инсульты, инфаркты, сердечная недостаточность;
- почечная недостаточность;
- некрозы костей, остеомиелит;
- легочная гипертензия;
- поражение печени;
- слепота;
- кожные язвы.
Прогноз и профилактика

Консультация генетика с профилактической целью
Прогноз неблагоприятный, так как болезнь не поддаётся лечению. По мере развития медицины появляется надежда на полное устранение болезни при помощи генной терапии, но пока это касается только развитых стран. Большинство же пациентов с серповидноклеточной анемией не могут позволить себе даже пройти обследование.
Профилактические меры включают в себя обязательную консультацию с генетиком для пар — носителей заболевания, желающих зачать ребёнка. Такая практика уже позволила избежать рождения множества больных детей, но этот процесс породил массу этических вопросов. Можно ли отказаться от ребёнка, даже зная, что он будет болен?
В любом случае информированность родителей о том, с чем им предстоит столкнуться, как помочь ребёнку с первых проявлений заболевания, какие препараты принимать для облегчения состояния, с какого возраста начинать профилактический приём антибиотиков — помогает справиться с приступами болезни и продлить пациенту жизнь.
Патогенез серповидноклеточной анемии
(схема
2)
Замещение
глутаминовой аминокислоты на валин в
β-цепи
↓
Образование
нестабильной (аномальной) молекулы
гемоглобина S
↓
Аггрегация
и полимеризация гемоглобина под влиянием
гипоксии.
Серповидность
эритроцитов
↓
Застой
серповидных клеток
Нарушение
микроциркуляции
Ускоренное
разрушение эритроцитов
↓
Анемия
Стазы
и микрортромбозы легких и почек
Спленомегалия
Гепатомегалия
↓
Стимуляция
костного мозга гипоксией
и
продуктами гемолиза активация
эритропоэза
↓
Гиперплазия
костного мозга
↓
Болевой
синдром с признаками гиперпластического
кроветворения
Периферическая
кровь и кроветворение.
При
гемолитических кризах отмечается
резкое снижение гемоглобина — до 30-50
г/л., ретикулоцитоз резко выражен
— 70-80%, значительно увеличивается
содержание железа в сыворотке, что
крайне неблагоприятно в плане возникновения
гемохроматоза. Выражена гипохромия
эритроцитов.
Талассемии
(болезнь
Кули) – это
группа заболеваний с наследственным
дефектом темпа синтеза глобиновых
цепей, вследствие чего образование ά-
и β-цепей не сбалансировано. Кули
— американский педиатр, впервые описавший
это заболевание.
Различают
ά-талассемию и β-талассемию.
Для ά-талассемии
(талассемия minor)
характерно снижение синтеза или полное
отсутствие ά-цепей и
в гемоглобине превалируют β-цепи.
При β-талассемии (талассемия major)
не образуются β-цепи и имеется избыток
ά-цепей. Последовательность
аминокислот в цепях не нарушена. Наиболее
распространенной формой является
β-талассемия
(талассемия
major).
Молекулярные
основы и клинические варианты β-талассемии.
Различают
β-талассемию с полным отсутствием
продукции β-цепей и с уменьшением
их продукции (β°- и β+
талассемии).
Патогенез
β-талассемии
схема
3
Мутация в генах
синтеза β-цепей глобина.
Дефицит β-цепей
↓
Избыточная
продукция α-цепей
Агрегация
и полимеризация избытка α-цепей
Распределение
гемоглобина в форме мишени
↓
Нарушение формы
эритроцита, повреждение его мембраны
↓
Повышение
проницаемости мембран для ионов кальция
↓
Активация
трансглютаминазы
↓
Синтез
глютамил-лизиновых мостиков
↓
Усиление ригидности
мембраны эритроцита
↓
Задержка эритроцитов
в селезенке, агрегация в мелких сосудах
с тромботическими явлениями, увеличение
селезенки,
ишемическое
повреждение различных органов
↓
Лизис эритроцитов
↓
Гипоксия
↓
Гиперплазия
костного мозга.усиление эритропоэза
Усиление
апоптоза клеток-предшественниц
эритропоэза
↓
Деформации
скелета, болевой синдром
При
отсутствии достаточного количества
β-цепей α-цепи не находят для
себя комплементарные пары, и эти свободные
α-цепи быстро преципитируются и образуют
нерастворимые включения в костномозговых
нормобластах, которые распределяются
в форме мишени. Включения эти достаточно
ригидны, они способны вызывать механическую
травму и повреждения мембран
эритрокариоцитов и образующихся из них
эритроцитов.
Повреждение
мембран костномозговых эритрокариоцитов
приводит к потере клеткой калия, нарушения
синтеза
ДНК в эритробластах, внутрикостномозговому
гемолизу эритрокариоцитов-предшественников.
Потомство сохранившихся эритрокариоцитов
подвергается гемолизу в сосудистом
русле. Периферические эритроциты имеет
форму мишени, отсюда название анемии –
мишеневидная.
Обильное
преципитирование α-цепей
в костном мозге влечет за собой
неэффективный эритропоэз и крайнюю
степень гиперплазии костного мозга.
Таким
образом в патогенезе β-талассемии,
связанный с избытком α-цепей,
имеет место неэффективный эритропоэз
наслаивается на несостоятельность
образования нормального гемоглобина
со снижением содержания гемоглобина в
клетках (гипохромия) и частичной блокадой
синтеза гема (схема 3).
Энзимопатии
—
гемолитические
анемии, обусловленные дефектами
эритроцитарных ферментов. Среди них
наиболее распространена анемия вследствие
недостатка фермента глюкозо-6-фосфатдегидрогеназы.
Это
наиболее
частый вариант энзимопатии. Заболевание
передается по аутосомно-рецессивному
типу и является краевой патологией, так
как оно наиболее распространено в
странах Средиземноморья, на Среднем
Востоке и среди черного населения
Америки (10%).
Существует
несколько генетических форм этой
энзимопатии, но наиболее
значимыми являются те, что приводят к
гемолизу эритроцитов. Биологическое
значение этой генной аномалии
рассматривается как защита организма
от малярийного
плазмодия.
При
этой патологии основным биохимическим
дефектом эритроцитов является
недостаточный синтез ферментов
пентозофосфатного цикла, обеспечивающих
ликвидацию перекисных соединений,
образующихся на поверхности
эритроцита при воздействии на него
сильных окислителей.
Среди
окислителей преобладают лекарства
(противомалярийные препараты,
сульфаниламиды, левомицетин, фурацилин,
амидопирин) и эндогенные первичные
и вторичные оксиданты.
В
норме перекисные радикалы инактивируются
за счет окисления донатора электронов
— восстановленного глютатиона мембраны
эритроцита. Для восстановления
глютатиона необходимы ионы водорода,
источником которых является
восстановленная НАДФ. При
дефиците глюкозо-6-фосфатдегидрогеназы:
восстановление
НАДФ резко сокращается,истощаются
запасы восстановленного глютатиона в
эритроцитах,резко
усиливаются окислительные процессы,повышается
проницаемость мембраны для ионов Na.набухание
клетки, гемолиз.
Острый
гемолиз может возникнуть и у здоровых
лиц при попадании в их организм очень
сильных окислителей (хлораты, перхлораты).
Нужно отметить, что
мишенью для гемолиза при этой форме
энзимной недостаточности, чаще всего
служат стареющие эритроциты, в какой-то
мере потерявшие запас этого энзима.
Клиника
и гематологические показатели энзимопатий.
Клинически
проявления
обычные для гемолитических анемий.
Бледность кожных покровов и желтушность
после воздействия провоцирующего
фактора. Частый гемолиз может
привести к увеличению и легкой
болезненности селезенки.
Анемия,
как правило, нормохромная, нормоцитарная
и регенераторная. При просмотре мазка
крови можно обнаружить в эритроцитах
включения, носящие
название телец Гейнца. Это внутриэритроцитарные
кристаллы гемоглобина, образующиеся
в результате его окисления и последующей
денатурации.
Диагностика
заболевания проводится с помощью
количественного анализа
глюкозо-6-ФДГ в эритроцитах больного.
Приобретенные
гемолитические анемии — это
группа заболеваний с различным
патогенезом. Их объединяет гемолиз
эритроцитов в периферической крови
(внутрисосудистый
гемолиз).
По механизму разрушения эритроцитов
различают приобретенные гемолитические
анемии
иммунного
и
неиммунного
характера.
Клинические
признаки этих анемий, как правило,
совпадают, несмотря на разные
патогенетические механизмы.
Иммунные
гемолитические анемии. Классификация
иммунных гемолитических анемий основана
на характере
вовлекаемых в иммунный гемолиз антител,
а их основным диагностическим критерием
является выявление антиэритроцитарных
антител в антиглобулиновом
тесте Кумбса. Этот тест базируется на
способности антител, полученных от
животных путем их иммунизации человеческим
глобулином, агглютинировать эритроциты
больного, если на их поверхности имеются
глобулины (про-тивоэритроцитарные
антитела).
Гемолитическая
анемия, вызванная тепловыми (IgG)_антителами.
Это
наиболее
распространенный тип иммунной
гемолитической анемии, однако, в 50%
случаев она является идиопатической —
с нераспознанной этиологией. В остальных
50% случае у больных имеется предрасположенность
к
лекарственному гемолизу. Такие
лекарства, как пенициллин и цефалоспорины
являются гаптенами, но в комбинации с
белками мембраны они способны вызывать
иммунизацию
организма. Эта форма гемолитической
анемии обычно возникает после
внутривенного введения большой дозы
антибиотиков через 1-2 недели после
начала терапии. Гибель эритроцитов при
лекарственно-зависимых иммуногемолитических
анемиях, как правило, происходит внутри
сосудов после фиксации на них комплемента,
хотя возможно и участие в этом процессе
селезенки и гибель эритроцитов по
типу АЗКЦ (антителозависимой клеточной
цитотоксичности), здесь же происходит
и иммунный фагоцитоз эритроцитов.
Наряду
с «гаптеновой» моделью гемолиза
эритроцитов существет и другая —
«модель аутоантител». Некоторые
антигипертензивные вещества, например,
а-метилдофа, вызывают образование
антител, направленных против
внутриклеточных
компонентов, в частности, против
Rh-антигена
эритроцитов
Приблизительно у 10% больных, получающих
этот препарат, обнаруживаются антитела
к этому антигену, однако только в 1%
случаев у них возникает аутоиммунная
гемолитическая анемия.
Иммунная
гемолитическая анемия с холодовыми
агглютининами (JgM-антитела).
Эта
форма иммунной гемолитической анемии
вызывается антителами,
которые приобретают сродство к эритроцитам
при низкой температуре (4°С),
и поскольку они агглютинируют эритроциты
на холоду, называются холодовыми. Эта
форма анемии хорошо компенсируется
самим организмом и редко проявляется
клинически подтвержденным гемолизом.
Такого рода антитела постоянно
обнаруживаются в крови больных
лимопролиферативными заболеваниями,
а также при идиопатической форме. Тот
факт, что по своей природе они являются
моноклональными антителами, предполагает,
что заболевания,
при которых они обнаруживаются,
принадлежат к группе моноклональных
гамма-глобулинопатий.
Симптомы
анемии (побледнение и цианоз областей,
подвергшихся охлаждению)
связаны с агглютинацией эритроцитов в
присутствии комплемента в дистальных
частях тела (конечности), когда их
температура снижается ниже 30°С.
Анемия
с холодовыми (IgG)
гемолизинами.
Эти
антитела характерны для пароксизмальной
холодовой гемоглобинурии, клиническим
проявлением которой
являются острые приступы массивного
гемолиза эритроцитов, часто сопровождающиеся
гемоглобинурией после охлаждения
больного. Лизис имеет четкий
комплементзависимый характер. Случаи
пароксизмальной холодовой гемоглобинурии
связывают с такими инфекциями, как
микоплазменная пневмония,
корь, свинка и инфекцией, вызванной
респираторными вирусами.
Гемолитические
анемии неиммуного генеза.
Причиной
этой разнообразной группы гемолитических
анемий могут стать инфекционные
заболевания (тифы, сепсис, сифилис),
малярия, укусы змей,
гемолиз, вызванный синтетическими
материалами (сосудистые протезы,
искусственные клапаны сердца), ожоговая
болезнь, гиперспленизм.
Картина
крови
при
различных видах неиммунных гемолитических
анемий может иметь свои особенности,
однако наиболее общими признаками этих
анемий служат: нормохромия (реже
гипохромия), нормоцитоз (реже микроци-тоз),
пойкилоцитоз, достаточно высокий
ретикулоцитоз (более 100%с), появление
ядросодержащих клеток (про- и нормобластов),
умеренная лейкопения, тромбоцитопения.
Серповидноклеточная анемия: причины, симптомы, диагностика, лечение
Острые обострения (кризы) происходят периодически, часто без видимой причины. В некоторых случаях повышенная температура тела, вирусная инфекция, местная травма способствуют обострению заболевания. Наиболее частым видом обострения заболевания является болевой криз, обусловленный ишемией и инфарктом костей, но может происходить и в селезенке, легких, почках. Апластический криз происходит в случаях замедления костномозгового эритропоэза в период острой инфекции (особенно вирусной), когда может проявляться острая эритробластопения.
Большинство симптомов проявляется у гомозигот и являются результатом анемии и окклюзии сосудов, приводя к ишемии тканей и инфаркту. Анемия обычно тяжелой степени, но сильно варьируют среди больных. Типичными проявлениями являются умеренная желтушность и бледность.
Больные могут быть плохо развиты и часто имеют относительно короткое туловище с длинными конечностями и череп «башенной» формы. Гепатоспленомега-лия типична для детей, но из-за частых инфарктов и последующих фиброзных изменений (аутоспленэктомия) селезенка у взрослых обычно очень маленькая. Часто отмечаются кардиомегалия и систолические шумы изгнания, а также холелитиаз и хронические язвы голеней.
Болевые кризы вызывают выраженные боли в трубчатых костях (например, большеберцовой), руках, кистях и стопах (синдром «кисть-стопа»), суставах. Типично появление гемартрозов и некрозов головки бедра. Сильные боли в животе могут развиваться с тошнотой или без нее и, если они обусловлены серповидными эритроцитами, обычно сопровождаются болями в спине или в суставах. У детей анемия может обостряться в результате острого разрушения серповидных эритроцитов в селезенке.
Острый «торакальный» синдром, обусловленный микроваскулярной окклюзией, является основной причиной смерти и встречается у 10 % больных. Синдром встречается в любом возрасте, но наиболее типичен для детей. Характеризуется внезапной лихорадкой, болью в груди и появлением легочных инфильтратов. Инфильтраты появляются в нижних долях, в 1/3 случаев с двух сторон, и могут сопровождаться плевральным выпотом. Впоследствии может развиваться бактериальная пневмония, быстро развивающаяся гипоксемия. Повторяющиеся эпизоды предрасполагают к развитию хронической легочной гипертензии.
Приапизм является серьезным осложнением, которое может вызвать эректильную дисфункцию, и встречается чаще у молодых мужчин. Возможно развитие ишемических инсультов и поражение сосудов ЦНС.
При гетерозиготной форме (HbAS) не развиваются гемолиз, болевые кризы или тромботические осложнения, кроме возможных гипоксических состояний(например, при подъеме в горы). Рабдомиолиз и внезапная смерть может развиться в период выраженных физических нагрузок. Нарушение способности концентрировать мочу (гипостенурия) является типичным осложнением. Унилатеральная гематурия (неизвестной природы и обычно из левой почки) может встречаться у половины больных. Иногда диагностируется папиллярный некроз почек, но он более характерен для гомозигот.
Серповидноклеточная анемия (серповидная) у человека
Серповидноклеточная анемия (серповидная) у человека
Этиология и встречаемость серповидноклеточной анемии. Серповидноклеточная анемия (MIM № 603903) — аутосомно-рецессивное заболевание гемоглобина, вызванное миссенс-мутацией гена бета-субъединицы, заменяющей валин на глутаминовую кислоту в 6 положении. Болезнь чаще вызвана гомозиготностью по мутации серповидноклеточности, хотя серповидноклеточную анемию также может вызывать компаундная (составная) гетерозиготность по аллелю серповидноклеточности и аллелям HbC или бета-талассемии.
Распространение серповидноклеточной анемии широко изменяется среди популяций в соответствии с прошлым и настоящим распространением малярии. Мутация серповидноклеточности, как оказалось, несколько повышает сопротивляемость малярии, таким образом, давая преимущество выживания гетерозиготным носителям мутации.
Патогенез серповидноклеточной анемии
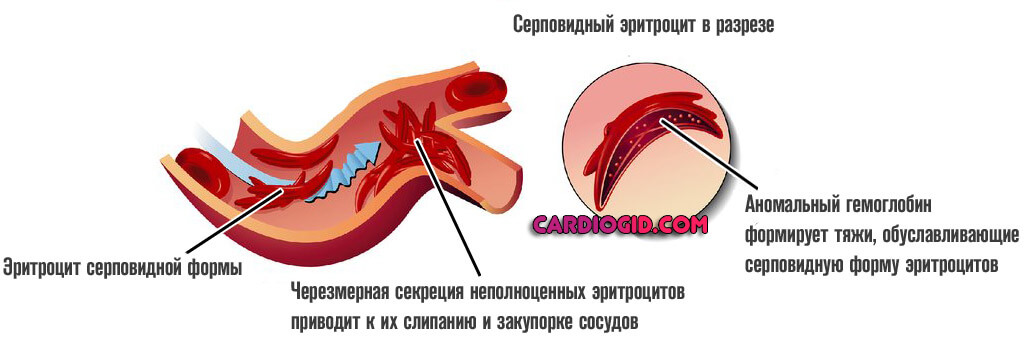
Гемоглобин формируется из четырех субъединиц: двух а-субъединиц, кодируемых геном ЯВА в хромосоме 16, и двух бета-субъединиц, кодируемых геном ЯВВ в хромосоме 11. Мутация Glu6Val в бета-субъединице уменьшает растворимость ненасыщенного кислородом гемоглобина и вызывает формирование сети жестких волокнистых полимеров, искажающих строение эритроцита, придавая ему форму серпа. Серповидные эритроциты закупоривают капилляры и вызывают инфаркты.
Первоначально обогащение кислородом заставляет полимер гемоглобина растворяться, и эритроциты восстанавливают нормальную форму; тем не менее, регулярное нарушение формы приводит к необратимому переходу клеток в серповидную форму, впоследствии такие эритроциты удаляются из кровотока в селезенке. Скорость удаления эритроцитов из кровотока превышает возможность их синтеза в костном мозге, что приводит к гемолитической анемии.
Аллельная гетерогенность часто встречается при большинстве менделирующих заболеваний, особенно когда мутантные аллели вызывают снижение функции. Серповидноклеточная анемия — важное исключение из этого правила, поскольку в данном случае единственная специфическая мутация ответственна за уникальные новые свойства HbS. HbC тоже менее растворим, чем HbA, и тоже стремится кристаллизоваться в эритроцитах, уменьшая их деформируемость в капиллярах и вызывая легкий гемолиз, но HbC не формирует полимерные волокна, как HbS. Неудивительно, что другие мутации с новыми функциями, например, мутации в гене FGFR3, вызывающие ахондроплазию, часто имеют аналогичное снижение аллельной гетерогенности, когда фенотип зависит от специфического, уникального изменения функции белка.
Фенотип и развитие серповидноклеточной анемии
Клиническая картина у больных серповидноклеточной анемией обычно проявляется в течение первых двух лет жизни анемией, задержкой развития, спленомегалией, регулярными инфекциями и дактилитами (болезненными припухлостями кистей или стоп, вызванными закупоркой капилляров в небольших костях, обнаруженных у приведенной в примере пациентки).
Инфаркты вследствие закупорки сосудов происходят во многих тканях, вызывая инсульты мозга, острый кардиальный синдром, почечный папиллярный некроз, инфаркты селезенки, язвы ног, приапизм, асептический некроз костей и снижение зрения. Окклюзия сосудов костей вызывает приступы болей, при отсутствии лечения эти болезненные эпизоды могут продолжаться в течение нескольких дней и даже недель. Функциональная аспления вследствие инфарктов и других недостаточно ясных факторов, предрасполагает к бактериальным инфекциям, например, пневомококковому или сальмонеллезному сепсису и остеомиелиту.
Инфекция — основная причина смерти во всех возрастных группах, хотя прогрессирующая почечная и дыхательная недостаточность также нередкие причины смерти на четвертом и пятом десятилетиях жизни. Пациенты также имеют высокий риск развития угрожающей жизни апластической анемии после парвовирусной инфекции, поскольку парвовирусы вызывают временное прекращение образования эритроцитов.
Гетерозиготные носители мутации («признака» серповидноклеточности) не имеют анемии и обычно клинически здоровы. Однако в условиях серьезной гипоксии, например, при восхождении в горы, эритроциты пациентов с «признаком» серповидноклеточности могут принимать форму серпа, вызывая симптомы, подобные наблюдаемым при серповидноклеточной анемии.
Особенности фенотипических проявлений серповидноклеточной анемии:
• Возраст начала: детство
• Анемия
• Инфаркты
• Аспления
Лечение серповидноклеточной анемии
Конкретному больному серповидноклеточной анемией дать точный прогноз тяжести течения болезни невозможно. Хотя молекулярная основа болезни стала известной раньше других моногенных заболеваний, лечение остается только симптоматическим. Никакой специфический терапии, предохраняющей от процесса образования серповидных эритроцитов, не найдено.
Существенно снижает тяжесть болезни персистенция HbE Исследуется несколько фармакологических препаратов, нацеленных на увеличение концентрации HbF, в этих целях одобрено использование гидрокси-мочевины. Хотя генотерапия имеет шанс улучшить или излечить эту болезнь, эффективная пересадка гена b-глобина не достигнута. Пересадка костного мозга остается единственным доступным в настоящее время лечением, способным помочь при серповидноклеточной анемии.
Из-за 11% смертности, вызванной сепсисом в первые 6 мес жизни, большинство штатов в США проводит неонатальный скрининг на серповидноклеточную анемию с целью проведения профилактики антибиотиками, продолжающейся до 5-летнего возраста.
Риски наследования серповидноклеточной анемии
Поскольку серповидноклеточная анемия — аутосомно-рецессивное заболевание, будущие сибсы больного ребенка имеют 25% риск серповидноклеточной анемии и 50% риск носительства серповидноклеточности. Используя ДНК плода, полученную при БВХ или амниоцентезе, можно провести пренатальную диагностику обнаружением мутации.
Пример серповидноклеточной анемии. Второй раз за полгода семейная пара карибского происхождения обратилась со своей 24-месячной дочерью в отделение неотложной помощи, поскольку девочка не может стоять. В анамнезе отсутствуют повышение температуры, инфекция или травма, и в остальном медицинская история ничем не примечательна; данные предыдущих осмотров соответствовали норме, за исключением низкого уровня гемоглобина и слегка увеличенной селезенки. При текущем осмотре патологии не найдено, за исключением пальпируемого края селезенки и отека стоп.
Стопы болезненны при пальпации, и девочка не хотела вставать на ноги. Оба родителя имели сибсов, умерших в детстве от инфекций, и других сибсов, вероятно, имевших серповидноклеточную анемию. С учетом анамнеза и повторного болезненного увеличения стоп врач проверил ребенка на наличие серповидноклеточной анемии методом электрофореза гемоглобина. Результат этого теста подтвердил наличие HbS.
Серповидно-клеточная анемия
- Что такое Серповидно-клеточная анемия
- Что провоцирует Серповидно-клеточная анемия
- Патогенез (что происходит?) во время Серповидно-клеточной анемии
- Симптомы Серповидно-клеточной анемии
- Диагностика Серповидно-клеточной анемии
- Лечение Серповидно-клеточной анемии
- Профилактика Серповидно-клеточной анемии
- К каким докторам следует обращаться если у Вас Серповидно-клеточная анемия
Что такое Серповидно-клеточная анемия
Серповидно-клеточная анемия весьма распространена в регионах мира, эндемичных по малярии, причем больные серповидно-клеточной анемией обладают повышенной (хотя и не абсолютной) врожденной устойчивостью к заражению различными штаммами малярийного плазмодия. Серповидные эритроциты этих больных также не поддаются заражению малярийным плазмодием в пробирке.
Что провоцирует Серповидно-клеточная анемия
Серповидно-клеточная анемия наследуется по аутосомно-рецессивному типу. У больных, гетерозиготных по гену серповидно-клеточной анемии, наряду с серповидными эритроцитами, несущими гемоглобин S, в крови наличествуют и нормальные, несущие гемоглобин А. При этом болезнь менее выражена клинически, протекает легче, а иногда вообще не вызывает симптомов, и серповидные эритроциты выявляются случайно при лабораторном исследовании крови. У гомозигот по гену серповидно-клеточной анемии в крови имеются только серповидные эритроциты, несущие гемоглобин S, и болезнь протекает тяжело.
Если оба родителя несут ген серповидно-клеточной анемии, то у их детей с 25% вероятностью может быть серповидно-клеточная анемия и существует 50% вероятность унаследовать только предрасположенность к ней. Если ген серповидно-клеточной анемии есть только у одного родителя, нет абсолютно никакого риска, что у ребенка будет серповидно-клеточная анемия, хотя есть 50% шанс, что ребенок унаследует один ген серповидно-клеточной анемии.
Патогенез (что происходит?) во время Серповидно-клеточной анемии
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидно-клеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Симптомы Серповидно-клеточной анемии
Серповидно-клеточная анемия клинически характеризуется симптомами, вызванными, с одной стороны, тромбозом сосудов различных органов серповидными эритроцитами, а с другой — гемолитической анемией. Степень тяжести анемии зависит от концентрации HbS в эритроците: чем она больше, тем ярче и тяжелее симптоматика. Кроме того, в эритроцитах могут присутствовать и другие патологические гемоглобины: HbF, HbD, НЬС и др. Иногда серповидно-клеточная анемия сочетается с талассемией, при этом клинические проявления могут уменьшаться или, напротив, нарастать.
В первоначальном периоде болезни поражается преимущественно костномозговая система: появляется припухлость, а также боль за счет тромбоза сосудов, питающих сустав и кость. Возможен асептический некроз головки бедренной кости с присоединением в дальнейшем инфекции и остеомиелита. Гемолитические кризы развиваются обычно после перенесенных инфекций, имеют регенераторный либо гипорегенераторный характер и являются основной причиной смерти этих больных. В редких случаях наблюдается секвестрационный криз за счет депонирования крови в селезенке и печени, который выражается болевым абдоминальным синдромом за счет быстрого увеличения этих органов и сопровождается коллапсом; при этом гемолиз может отсутствовать, встречается легочный инфаркты в связи с нарушением микроциркуляции на уровне легочных сосудов.
Во втором периоде постоянный симптом — гемолитической анемии. Развивающаяся в трубчатых костях гиперплазия костного мозга (в них совершается активное кроветворение как компенсаторная реакция на гемолиз) сопровождается характерными изменениями скелета: тонкие конечности, искривленный позвоночник, башенный череп с выпуклостями в области лба и теменной кости. Гепато- и спленомегалия развиваются за счет активации в них эритропоэза, а также вторичного гемохроматоза и тромбоза; у части больных формируется желчнокаменная болезнь. Гемосидероз сердечной мышцы приводит к сердечной недостаточности, а гемосидероз печени, поджелудочной железы — к циррозу печени и сахарному диабету.
Тромбоз сосудов почек протекает с гематурией и последующей почечной недостаточностью. Неврологическая симптоматика обусловлена инсультом, параличом черепных нервов и др. Характерны трофические язвы на нижних конечностях. Большинство больных с тяжелой формой серповидно-клеточной анемии погибает в течение 5 лет, а пережившие этот срок вступают в третий период, который характеризуется признаками нерезко выраженной гемолитической анемии. Селезенка у них обычно не прощупывается, так как повторные инфаркты приводят к ее сморщиванию — аутоспленэктомии. Печень остается увеличенной, неравномерно уплотненной, а частые инфекции принимают нередко септическое течение.
Гематологические изменения. Концентрация гемоглобина снижается (
Медицинские новости
Специалисты сходятся во мнении, что необходимо привлечение внимания общественности к проблемам сердечно-сосудистых заболеваний. Некоторые из них являются редкими, прогрессирующими и трудно диагностируемыми. К таким относится, например, транстиретиновая амилоидная кардиомиопатия
12, 13 и 14 октября, в России проходит масштабная социальная акция по бесплатной проверке свертываемости крови – «День МНО». Акция приурочена к Всемирному дню борьбы с тромбозами.
Заболеваемость менингококковой инфекцией в РФ за 2018 г. (в сравнении с 2017 г.) выросла на 10 % (1). Один из распространенных способов профилактики инфекционных заболеваний – вакцинация. Современные конъюгированные вакцины направлены на предупреждение возникновения менингококковой инфекции и менингококкового менингита у детей (даже самого раннего возраста), подростков и взрослых.
Грядут долгие выходные, и, многие россияне поедут отдыхать за город. Не лишним будет знать, как защитить себя от укусов клещей. Температурный режим в мае способствует активизации опасных насекомых.
Заболеваемость коклюшем в РФ за 2018 г. (в сравнении с 2017 г.) выросла почти в 2 раза 1, в том числе у детей в возрасте до 14 лет. Общее число зарегистрированных случаев коклюша за январь-декабрь выросло с 5 415 случаев в 2017 г. до 10 421 случаев за аналогичный период в 2018 г. Заболеваемость коклюшем неуклонно растет с 2008 года.
Медицинские статьи
Почти 5% всех злокачественных опухолей составляют саркомы. Они отличаются высокой агрессивностью, быстрым распространением гематогенным путем и склонностью к рецидивам после лечения. Некоторые саркомы развиваются годами, ничем себя не проявляя.
Вирусы не только витают в воздухе, но и могут попадать на поручни, сидения и другие поверхности, при этом сохраняя свою активность. Поэтому в поездках или общественных местах желательно не только исключить общение с окружающими людьми, но и избегать.
Вернуть хорошее зрение и навсегда распрощаться с очками и контактными линзами – мечта многих людей. Сейчас её можно сделать реальностью быстро и безопасно. Новые возможности лазерной коррекции зрения открывает полностью бесконтактная методика Фемто-ЛАСИК.
Косметические препараты, предназначенные ухаживать за нашей кожей и волосами, на самом деле могут оказаться не столь безопасными, как мы думаем
Патогенез серповидноклеточной анемии и ее лечение
Что такое серповидноклеточная анемия?
Серповидноклеточная анемия — наследственное заболевание, когда форма эритроцитов изменяется на серповидную. Это происходит из-за мутировавшего белка гемоглобина, который кристаллизуется в эритроците. Такие клетки крови не в состоянии полноценно доносить кислород тканям всех органов, они закупоривают сосуды, а сами подвержены преждевременному разрушению, что приводит к снижению дыхательной функции крови — анемии.
Подобные мутации гемоглобина диагностируются по всему миру, но самая большая концентрация заболевания сосредоточена среди негроидной расы. В некоторых районах Африки число носителей этого заболевания доходит до 45% от общего населения региона. В Нигерии ежегодно рождается около 150 000 детей с серповидноклеточной анемией. При этом 50% детей не доживает до 1 года, ещё 40% умирает, не достигнув зрелого возраста.
В других странах статистика более благоприятная, пациенты достигают возраста 45 — 55 лет, а смертность в возрасте до 1 года составляет 10%. Болезнь считается неизлечимой, все терапевтические меры направлены на устранение симптомов и осложнений. Однако в 2014 году в Париже была проведена уникальная операция по модификации генов костного мозга. С тех пор у пациента исчезли симптомы болезни, а его костный мозг стал производить эритроциты правильной формы. Это дало надежду миллионам людей, страдающим от этого недуга.
Патогенез
При серповидноклеточной анемии в гемоглобине одна аминокислота заменяется на другую, вследствие чего происходит мутация, и вместо здорового гемоглобина А появляется гемоглобин S. Гемоглобин S не способен растворяться в цитоплазме эритроцита, вместо этого он образует длинные жгуты и так и застывает, кристаллизуясь в эритроците.
Эритроциты становятся хрупкими, продолжительность их жизни сокращается в 10 раз. Костный мозг производит новые эритроциты в ускоренном темпе, но они снова быстро разрушаются. Серповидные клетки, при попытке пройти через узкие капилляры, застревают в них, образуя тромбы. Это приводит к нарушению кровообращения и ломкости капилляров.
Несмотря на мутацию гемоглобина, проявляется болезнь не постоянно, а приступами. В некоторых случаях эритроциты нормально циркулируют по кровяному руслу, не меняя свою форму, пока не появляется причина, которая провоцирует усиленную кристаллизацию. Это может быть нехватка воздуха, недостаток какого-либо элемента в питании, обезвоживание, инфекционная болезнь. Во время приступов пациенты испытывают в течение нескольких дней мучительную боль, которую зачастую не удаётся заглушить самыми сильными обезболивающими.
Причины серповидноклеточной анемии
Заболевание передаётся только по наследству и не является заразным. Ребёнок заболевает в случае, если оба родителя передали ему мутировавшие гены. Если от одного родителя получены здоровые гены, а от другого изменённые, ребёнок станет лишь носителем заболевания. Он передаст мутировавший ген и своему потомству, а если его супруг(а) тоже будет носителем, с большой вероятностью их дети будут страдать от патологии.
Причина изначальной мутации гемоглобина — эволюция эритроцитов в районах с повышенным риском заражения малярией. Плазмодии, вызывающие малярию, живут сначала в печени, а потом отправляются в кровяное русло размножаться, используя местом своего обитания эритроциты. Устроившись в тельце эритроцита, паразит насыщается молекулами гемоглобина, а затем путём деления образует множество своих копий. Паразитические организмы очень быстро приводят к необратимым последствиям и человек умирает.
При серповидноклеточной болезни эритроциты наполняются кристаллами гемоглобина, и паразиты уже не могут питаться и размножаться.
Симптомы
Чаще всего симптомы начинают проявляться в возрасте 6 месяцев. Признаки заболевания включают в себя:
- Припухлость стоп и кистей. Происходит из-за закупоривания серповидными эритроцитами кровеносных сосудов.
- Болевые приступы. Провоцируются блокированием артерий в различных участках тела. Приступы обладают неоднородной цикличностью, могут наступить в любой момент и развиваться с различной интенсивностью.
- Нарушения развития скелета. Могут определяться деформации черепа, искривления позвоночника.
- Септические некрозы плечевой и/или бедренной кости развиваются из-за закупорки сосудов участков кости, питающихся одной артерией.
- Снижение зрения происходит из-за блокирования сосудов, снабжающих глаза.
Также заболевание характеризуются признаками, присущими всем видам анемий:
- Вялость, быстрая утомляемость.
- Бледность кожи и слизистых оболочек.
- Отставание детей в физическом и психомоторном развитии.
- Частые инфекционные заболевания.
Диагностика
Серповидноклеточную анемию можно определить у ребёнка, когда он ещё находится в утробе матери. Для этого проводится диагностическая манипуляция — биопсия хориона либо амниоцентез. Для новорожденных и старше методы выявления заболевания включают в себя следующие параметры.
- Общий анализ крови. Уровень гемоглобина снижен, значения ретикулоцитов повышены, объём эритроцитов приближен к норме.
- Биохимический анализ крови. Увеличение содержания сывороточного железа, повышение билирубина.
- Мазок периферической крови. Определяются эритроциты с заострёнными концами в форме серпа.
- Электрофорез. Выявляется наличие S гемоглобина.
- УЗИ брюшной полости. Увеличение селезёнки (в тяжелой стадии происходит уже уменьшение), печени, наличие камней в желчном пузыре.
Лечение
Терапия направлена на общее укрепление организма во избежание осложнений и присоединения инфекционных заболеваний.
- Для купирования болевых приступов назначаются анальгетики — морфин и другие опиоидные средства.
- Обильное питьё рекомендуется всем пациентам для улучшения циркуляции крови по сосудам.
- Антибиотики пенициллинового ряда назначаются с 6 месяцев для профилактики присоединения инфекций. Антибиотики широкого спектра назначаются при подозрении на бактериальное заражение.
- Переливание крови осуществляется для профилактики образования тромбов.
- Хороший эффект по ослаблению осложнений даёт терапия на основе оксимочевины. Оксимочевина способствует снижению количества S гемоглобина за счёт увеличения фетального гемоглобина (F гемоглобина). Таким образом, уменьшается количество приступов боли у пациента. Терапия оксимочевиной проводится для пациентов на протяжении всей их жизни.
- Пересадка костного мозга сопряжена с риском летальности при данном диагнозе, но опубликованы данные об успешно проведённых операциях, в результате которых симптомы ослабевают.
Возможные осложнения
Осложнения имеют разнонаправленный характер и затрагивают системы всех органов. Смертельные случаи в большинстве своём спровоцированы присоединением инфекции. Также могут развиться следующие последствия:
- сплющивание и уменьшение селезёнки с замещением здоровой ткани на рубцовую;
- ишемические инсульты, инфаркты, сердечная недостаточность;
- почечная недостаточность;
- некрозы костей, остеомиелит;
- легочная гипертензия;
- поражение печени;
- слепота;
- кожные язвы.
Прогноз и профилактика
Прогноз неблагоприятный, так как болезнь не поддаётся лечению. По мере развития медицины появляется надежда на полное устранение болезни при помощи генной терапии, но пока это касается только развитых стран. Большинство же пациентов с серповидноклеточной анемией не могут позволить себе даже пройти обследование.
Профилактические меры включают в себя обязательную консультацию с генетиком для пар — носителей заболевания, желающих зачать ребёнка. Такая практика уже позволила избежать рождения множества больных детей, но этот процесс породил массу этических вопросов. Можно ли отказаться от ребёнка, даже зная, что он будет болен?
В любом случае информированность родителей о том, с чем им предстоит столкнуться, как помочь ребёнку с первых проявлений заболевания, какие препараты принимать для облегчения состояния, с какого возраста начинать профилактический приём антибиотиков — помогает справиться с приступами болезни и продлить пациенту жизнь.
Серповидноклеточная анемия
Поделиться статьей в социальных сетях:
Наследственная болезнь – серповидноклеточная анемия: что это
Кровь артериального типа оттекает от легких и несет по организму кислород, но на уровне тканей он проникает в клетки всех органов, и это неизбежно приведет к реакции полимеризации белка и появлению эритроцитов с формой полумесяца.
Способность пластической адаптации у серповидных эритроцитов сильно снижена, он уже не может претерпевать обратную деформацию, проходя через капилляры, поэтому закупоривает их. Что приводит к нарушению кровоснабжения разных систем и органов, развивается тканевая гипоксия. Это провоцирует дальнейшее увеличение числа месяцеподобных эритроцитов.
У больных серповидноклеточной анемией эритроцитарная мембрана слишком ломкая и хрупкая, поэтому продолжительность жизни клетки весьма коротка. На фоне этого уменьшается и общее число эритроцитов, появляются локальные сбои в цикле кровообращения на тканевом уровне, закупориваются сосуды, в почках начинает усиленно образовываться эритропоэтин. Это ускоряет процессы эритропоэза в красном веществе костного мозга, за счет чего компенсируется анемичное состояние.
Наследование серповидноклеточной анемии
Как указывалось выше – серповидноклеточная анемия наследуется как генетическое заболевание. Мутация обуславливается изменениями в одном или двух генах, отвечающих за кодирование b-цепей в белке. Такая патология не возникает в организме самостоятельно, а передается от обоих родителей.
Половые клетки содержат в себе по 23 хромосомы. В момент успешного оплодотворения они сливаются, таким образом появляется зигота, то есть, клетка с новыми качествами. Из нее затем и развивается плод. Сливаются между собой и ядра половых клеток обоих полов, и, по сути, благодаря этому восстанавливается полный хромосомный набор (23 пары). Что и присуще клеткам организма человека. Таким образом новорожденный унаследует генетический материал и от матери, и от отца.
Серповидноклеточная анемия: тип наследования – аутосомно-рецессивный. Чтобы родившийся ребенок был болен, он должен получить мутировавшие гены от обоих родителей. Все зависит о того, какой именно комплект генов унаследовал новорожденный:
- Малыш с диагностированной серповидноклеточной анемией. Но этот вариант будет возможен при соблюдении следующего условия: мать и отец имеют эту патологию или являются ее бессимптомным носителем. Еще одно условие – новорожденный получает по одному «бракованному» гену от каждого. Это называется гомозиготной формой заболевания.
- Опять рождается человек, являющийся бессимптомным носителем. Этот вариант развивается, если малыш получает «в наследство» только один дефективный ген, а второй – нормальный. Это называется гетерозиготным типом заболевания. Как результат – эритроцит содержит приблизительно равное число как гемоглобина типа S, так и типа А. Что помогает поддерживать оптимальную форму и эритроцитарные функции, при условии, что нет никаких отягчающих состояние патологий.
Серповидная анемия: диагностирование и лечение
Диагностировать и лечить серповидноклеточную патологию может только врач-гематолог. Диагноз не ставят только на основании внешней симптоматики, нужно собрать подробный семейный анамнез, уточнить время и обстоятельства, при которых признаки патологии проявились в первый раз. Но подтвердить диагноз можно только посредством специфических обследований:
Серповидноклеточная анемия в одной из популяций определяется по:
- Традиционному анализу крови.
- Биохимии крови.
- Результатам УЗИ, рентгенографии.
Эффективных средств лечения, дающих возможность полноценного избавления от этой болезни – не существует. Помочь больному можно только путем предотвращения увеличения количества видоизмененных эритроцитов. Кром того, нужно вовремя купировать внешние признаки болезни.
Принципиальное лечение этой анемии состоит из:
- Здорового образа жизни.
- Лекарств, повышающих показатели белка-гемоглобина и увеличивающих число недеформированных эритроцитов.
- Кислородотерапии.
- Купирования локальных болей.
- Устранения профицита железа.
- Профилактики вирусных инвазий.
что это, симптомы и лечение, мутации
Серповидноклеточная анемия — это хроническое нарушение, генетическая аномалия, при которой происходит два связанных процесса: синтез неполноценного S-гемоглобина, а также изменение нормальной формы эритроцитов на серпообразную, как и следует из названия состояния.
Основной контингент пациентов — лица ближневосточного происхождения, и население Индии и некоторых других стран. Заболеваемость в регионах повышенного риска находится на уровне 20-40%. Среди прочих европеоидов число значительно ниже и составляет всего 0.5-2% от общей массы больных и патологиями крови.
Серповидно-клеточная анемия (сокращенно СКА) отличается группой смертельно опасных симптомов. Без постоянного контроля есть риски гибели от осложнений.
Полностью излечить расстройство невозможно, нужна симптоматическая коррекция по потребности. От ее качества зависят прогнозы.
Механизм развития
В основе патогенеза отклонения лежит наследственный процесс. Приобретенные формы практически не встречаются, это казуистика. Потому и рассматривать заболевание нужно как сложную генетическую аномалию.
Наследование СКА происходит по аутосомно-рецессивному типу. Что это значит? Для того, чтобы стать обладателем патологического процесса нужно унаследовать два гена, ответственных за рассматриваемое заболевание.
Здесь присутствуют варианты. Это могут быть сразу оба родителя с аномальным геномом или же за расстройство в ответе предыдущие поколения. Разбираться с этим вопросом должен профильный специалист. Проводятся специальные исследования.
Наследование не всегда идет по идентичному сценарию.
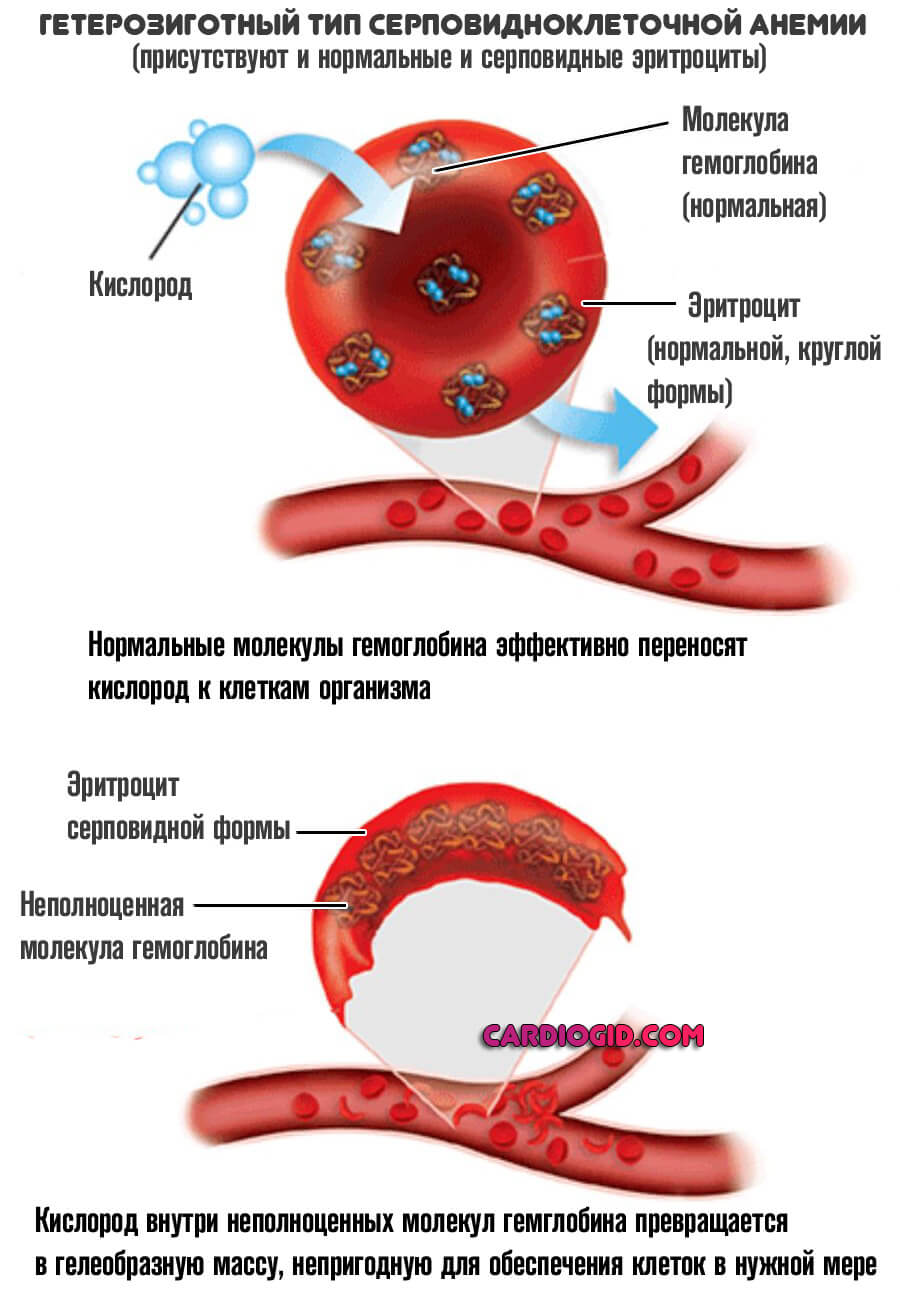
Смешанный (гетерозиготный)
Вполне возможна ситуация, когда в генотипе присутствует и доминантный (нормальный) и рецессивный (аномальный ген).
В таком случае гетерозиготные организмы становятся носителями и измененных, и правильно структурированных эритроцитов. Потому заболевание у них проявляется только в некоторых случаях, каких именно — зависит от конкретного пациента.
Обычно это сильные стрессы, анемия других типов, перенесенные воспалительные заболевания. Все возвращается на круги своя спустя какое-то время.
Как правило, такие пациенты не ощущают изменений в самочувствии и практически не страдают от осложнений. Считаются условно здоровыми большую часть времени.
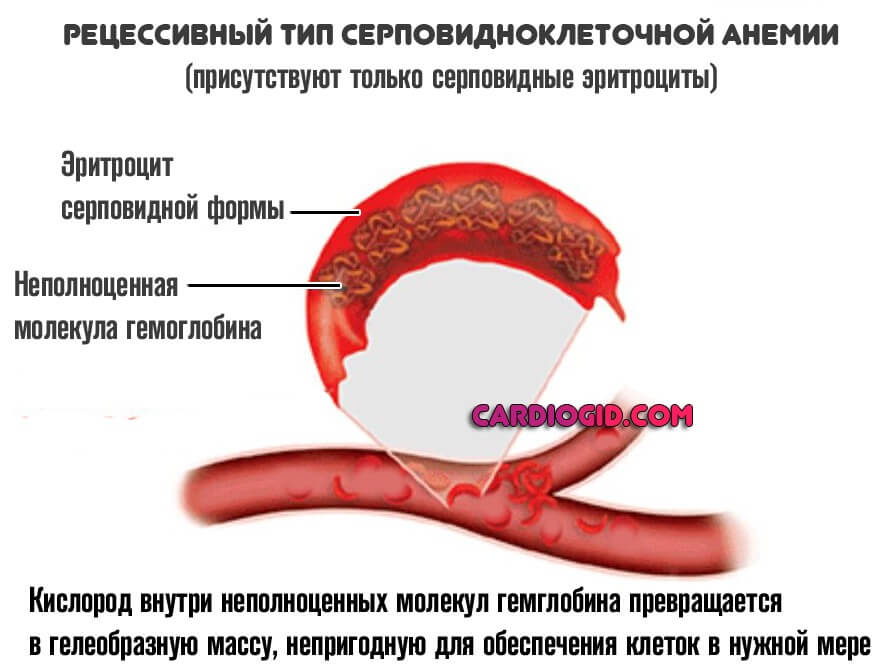
Рецессивный
При полноценном рецессивном варианте, когда нормальные клетки отсутствуют, формируется группа типичных изменений. В первую очередь — это синтез неполноценного S-гемоглобина.
В отличие от своего нормального варианта, он не способен быстро переносить кислород, вызывает его трансформацию в гелеобразную массу, непригодную для обеспечения тканей и органов в нужной мере.
Ситуация усугубляется еще и изменением нормальной формы эритроцитов. Они принимают вид полумесяца и также не способны к адекватной транспортировке кислорода к клеткам.
Отсюда постоянная гипоксия тканей, изменения со стороны физиологических процессов. Особенно заметны отклонения от нормы у детей.
Полного восстановления добиться не удается, потому остается предпринимать симптоматические меры, чтобы снизить агрессивность патологического состояния. От регулярности и качества получаемой помощи и зависит прогноз.
Причины становления
Ключевой фактор один — это аномалии в генотипе родителей. Далеко не обязательно сами отец или мать страдают серповидноклеточной анемией.
Как было сказано выше, для мутации нужны определенные условия, чтобы два измененных гена составили пару. Однако они вполне могут быть носителями проблемных структур, которые и передаются детям.
Сказать заранее, какого типа будет анемия, гомо- или гетерозиготная (когда присутствуют и нормальные и аномальные гены) не всегда сможет даже профильный врач.
Внимание:
Родителям еще на этапе планирования беременности рекомендуется посетить специалиста, оценить характерные отклонения в собственном генотипе и исходить из этих положений.
Доказанных факторов, увеличивающих риски становления проблемы пока нет. Однако, есть предположения, которые оценивают вероятность тяжелого будущего течения процесса у ребенка.
К таковым можно отнести:
- Выраженные стрессовые ситуации. Психологические травмы, влияющие на гомеостаз организма (нахождение в состоянии динамического равновесия).
- Физические перегрузки различного происхождения.
- Перенесенные в недавнем прошлом инфекционные заболевания.
- Несептические аутоиммунные воспалительные процессы.
- Беременность. Сама по себе гестация — большой стресс для тела женщины. В такой момент может актуализироваться расстройство. Особенно у гетерозиготных пациентов, которые имеют в составе крови и нормальные, и аномальные структуры.
- Стремительный рост, пубертатный период.
- Переход в климактерическую стадию, затухание репродуктивных функций.
- Гормональный дисбаланс любого характера.
Все эти причины могут усугубить течение серповидной анемии, но не спровоцировать ее манифестацию.
Больные с классической гомозиготной формой знают о собственном заболевании, встречаются с ним еще в ранние годы и даже месяцы жизни.
Что касается пациентов со смешанным генотипом, присутствием нормальных и патологически измененных структур, они могут и не подозревать о проблеме, пока не встретятся с провоцирующим фактором. Таковым способен стать один из названных в списке.
В любом случае, при наличии оснований предполагать болезнь, стоит навестить гематолога для превентивной диагностики.
Симптомы в зависимости от стадии
Всего можно выделить 4 этапа развития патологического процесса.
Первая
Приходится на самые ранние периоды. С полугода до 3 лет, примерно. Для этого интервала типичны следующие возможные признаки:
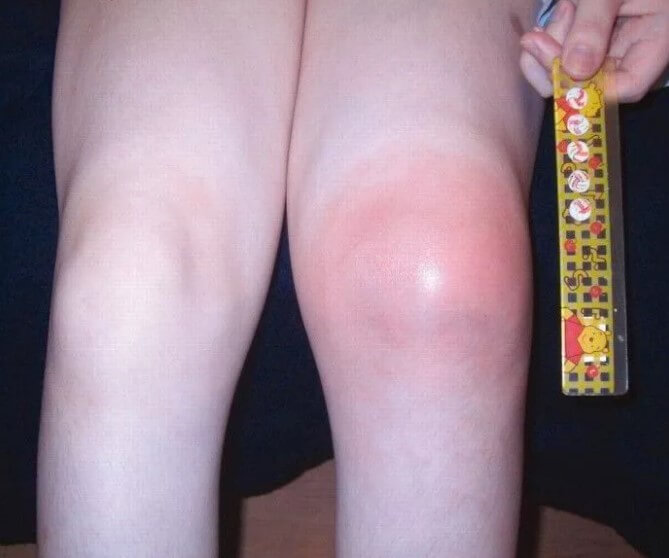
- Боли в суставах. Различной интенсивности. Поскольку пациент пока не может рассказать о своих ощущениях, судят по объективному поведению и дополнительным клиническим проявлениям. Страдают в основном крупные структуры: коленные, локтевые, бедренные. Возможны и даже вероятны отклонения со стороны позвоночника в грудном и поясничном отделах.
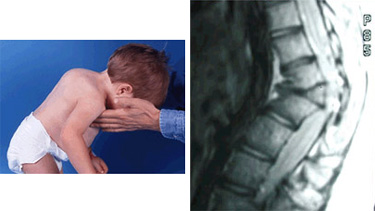
- Отечность, опухлость суставов. Сопровождается выраженными изменениями размеров. Клиника в этом случае напоминает таковую при артрите, с нарушением подвижности, сильной отечностью.
Этот признак хорошо заметен даже невооруженным глазом. Поскольку проблемы опорно-двигательного аппарата и детей столь юного возраста практически исключены, суставные изменения можно рассматривать как подозрительные признак в рамках диагностики серповидноклеточной анемии.
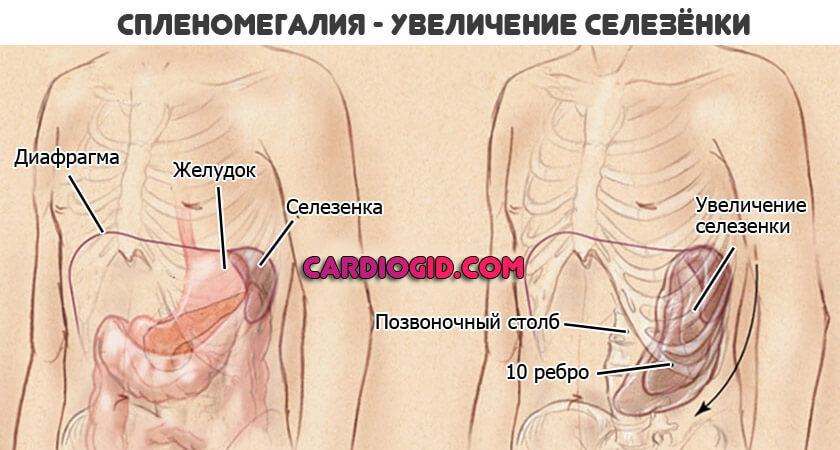
- Увеличение размеров селезенки. Спленомегалия. Возникает временами, не постоянное расстройство. Обнаруживается по результатам ультразвукового обследования и пальпации. Вероятны риски по типу разрыва органа, кровотечения. За пациентом постоянно наблюдают. При критическом изменении размеров показано удаление.
- Аномальное развитие скелета и мускулатуры. Типичны трансформации со стороны грудного и пояснично-крестцового отделов позвоночника. Они выглядят неестественно гипертрофированными, проявляются кифозом (горбатостью), лордозом .
- Частые инфекционно-воспалительные заболевания. В результате падения качества работы защитных сил организма. Встречается практически у всех пациентов. Есть некоторая сезонность. В весеннее и осеннее время процесс более активный. Объективно проявляется частыми острыми респираторными вирусными инфекциями.
Вторая
С 3 до 10 лет, наблюдаются те же симптомы, в более выраженной форме плюс дополнительные признаки:
- Снижение общего иммунитета. О нем уже было сказано. Но в таком случае дефицит постоянный, не зависит от сезона и прочих факторов. Это результат недостаточного обеспечения тканей кислородом, вялой выработки лейко-, лимфоцитов, форменных клеток, ответственных за иммунную реакцию. Восстановление симптоматическое, требуется во всех случаях.
- Увеличение размеров печени. Гепатомегалия. Развивается спонтанно, так же внезапно исчезает. Это тревожный признак. Зачастую он указывает на приближение кризового состояния. Смертельно опасного для пациента. Необходимо динамическое наблюдение. Желательно в условиях гематологического стационара.
- Повышение рисков тромбоза. Агрегация (накопление) форменных клеток остается на прежнем уровне, но если организм пытается компенсировать неполноценность структур за счет их количества, вероятна цепная реакция с развитием кровяных сгустков. Способных закупорить сосуды, вызвать некроз тканей и смертельно опасные последствия.
Третья
У пациентов старше 10 лет вероятно развитие еще группы проявлений:
- Слабость, общая астения. Это сказывается на успеваемости в школе. Продуктивности деятельности и мышления. Нет сил ни на что. Активность минимальна, что нетипично для лиц в столь ранние годы.
Возможна симптоматическая активизирующая терапия. Причина такого состояния — гипоксия тканей центральной нервной системы. Необходимо увеличить интенсивность кровотока и, соответственно, обеспечить ЦНС кислородом.
- Вероятность развития гемолитического криза. Сопровождается стремительным спонтанным распадом эритроцитов. Результатом становится критическая гипоксия.
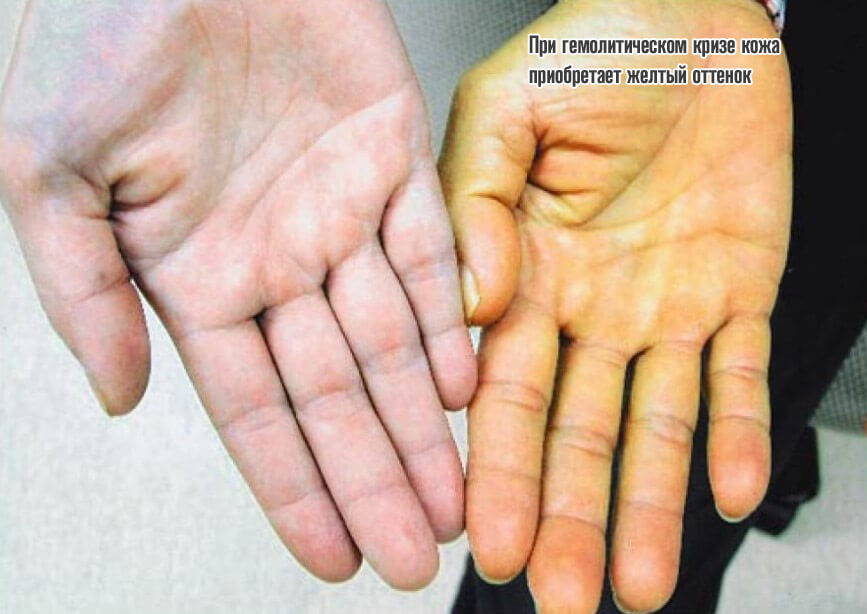
Объективно процесс дает знать о себе несколькими моментами: растет температура тела, появляется слабость, сонливость, кожные покровы приобретают желтый оттенок, обнаруживается кровь в моче. Без срочной помощи велика вероятность гибели.
Четвертая
Приходится на взрослые годы. Для него типично повышение рисков столкнуться с кризами разного рода и степени выраженности:
- Уже названным гемолитическим.
- Апластическим. Не менее опасная форма. Клетки не распадаются, а просто перестают нормально вырабатываться. Результатом оказывается резкое уменьшение уровня гемоглобина, проблемы с клеточным дыханием. Возможен летальный исход. Требуется срочная госпитализация.
- Секвестрационным. Характерные черты — увеличение печени, селезенки, падение артериального давления.
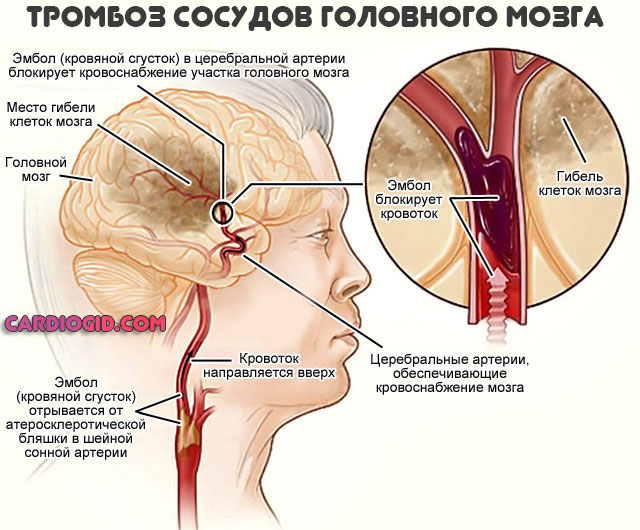
В критические периоды также возможны тромбозы, закупорка сосудов с некрозом тканей (инфаркт, инсульт и прочие процессы).
Симптомы серповидноклеточной анемии ставят крест на нормальном физическом и умственном развитии ребенка, но при достаточной коррекции удается сгладить негативные явления.
У взрослых пациентов риски заключается в вероятности смертельно опасных кризов, помимо невозможности вести нормальную повседневную активность.
У гетерозиготных носителей симптоматики как таковой нет практически никогда. Она может стать актуальной в пиковые периоды: стрессовые ситуации, перегрузки психологического и физического плана, беременность, гормональные перестройки, вот неполный перечень возможных провокаторов.
Диагностика
Проводится гематологом, при необходимости подключают генетика. Последний может определить тип наследования серповидноклеточной анемии, сказать больше о характере процесса, его активности.
Задача — констатировать факт наличия патологии. Более сделать нельзя ничего, потому как причины и так понятны.
Необходимые мероприятия:
- Устный опрос больного или его родителей при невозможности самостоятельной речи.
- Сбор анамнеза. Позволяет определить, в какой момент началась проблема. Присутствует ли она с рождения или манифестировала позже.
- Общий анализ крови. Наиболее информативен. Наблюдается резкое снижение уровня гемоглобина, малое количество нормальных эритроцитов. При микроскопии хорошо заметны измененные форменные клетки. Чем их больше, тем тяжелее общее состояние пациента.
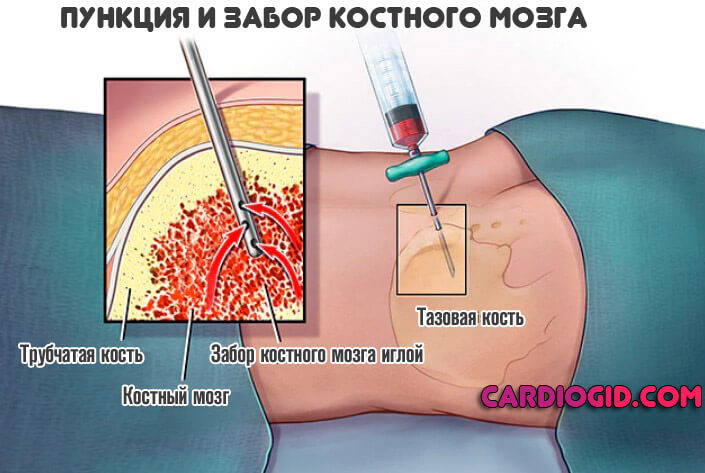
- При необходимости проводится пункция для забора образца костного мозга. Как правило, такая процедура крайне редко требуется.
- Информативной методикой выступает и биохимическое исследование венозной крови. Способ используется для выявления концентрации щелочной фосфатазы, билирубина, которые также повышены. Печеночные пробы (АЛТ, АСТ) дают выраженное отклонение нормальных показателей вверх.
В рамках расширенного обследования имеет смысл определить состояние внутренних органов. Для этих целей применяется ультразвуковая методика. Исследуются структуры брюшной полости.
При увеличении размеров селезенки показано динамическое наблюдение за состоянием больного. То же касается изменения нормальных характеристик печени.
В рамках консультации генетика возможна сдача некоторых анализов. Обычно к исследованию привлекаются и родители. По усмотрению профильного специалиста.
Лечение
Надежного метода терапии пока нет. Единственное, что могут сделать доктора — частично или полностью сгладить симптоматику.
Но не всегда клиническая картина поддается изменению. Возможность помощи зависит от количества аномальных клеток в крови. Чем их больше, тем сложнее что-либо сделать.
- Систематически больного должен осматривать гематолог. Вне острого периода назначаются препараты витаминного ряда, также фолиевая кислота, минеральные комплексы для поддержания организма в тонусе.
- Кризовые состояния требуют обязательной госпитализации в профильный стационар. Это единственный способ помочь человеку.
В рамках срочной помощи проводится вливание питательных растворов внутривенно, применяются антибиотики. Препараты для восстановления текучести крови (чтобы не было тромбов), вроде Аспирина и его современных аналогов, по усмотрению докторов. В тяжелых случаях имеет смысл перелить эритроцитарную массу.
Удаление селезенки назначается по показаниям. Как свидетельствуют исследования, при тяжелом трудно купируемом течении серповидноклеточной анемии этот метод достаточно эффективен для прерывания острого состояния.
Что он дает в долгосрочной перспективе — пока сказать врачи не могут.
Прогноз и профилактика
Гомозиготные пациенты, имеющие значительное количество измененных клеток рискуют погибнуть в первые 10-15 лет жизни. Чем больше аномальных эритроитов присутствует, тем хуже.
Что касается прочих больных — все куда более обнадеживающе. Однако такие пациенты должны регулярно осматриваться гематологом, при необходимости проходить пожизненное лечение по предписанной схеме.
Надежных методов профилактики серповидноклеточной анемии нет. Это задача, скорее, родителей. На стадии планирования беременности нужно исключить присутствие аномального гена и матери и отца. Поможет консультация профильного специалиста.
Необходимо систематически посещать гематолога. Это единственная мера.
Возможные последствия
Осложнения стоит подразделить на группы:
- Инфекционные процессы. От воспаления легких до сепсиса.
- Сосудистые изменения. Инсульт, инфаркт, тромбоз, проблемы с потенцией в результате скудного кровоснабжения, прочие аномальные состояния.
- Сердечная недостаточность.
- Выраженная дисфункция почек.
- Проблемы с репродукцией: невозможность зачать, выкидыши.
Это лишь часть возможных последствий.
Серповидно клеточная анемия — смертельно опасная и неизлечимая форма заболевания. Тем не менее, руки опускать не стоит, несмотря на неблагоприятные прогнозы. Известны случаи длительной жизни даже со столь тяжелым расстройством в течение многих лет.
Важно следовать рекомендациям гематолога и систематически посещать врача для коррекции лечения или назначения такового, если потребуется.
Патогенез серповидноклеточной анемии обусловлен
Гемоглобинопатии (гемоглобинозы).
Гемоглобинопатии занимают одно из первых мест среди наследственных заболеваний крови. Согласно данным ВОЗ в мире насчитывается 100 миллионов носителей аномального гемоглобина. Чаще всего гемоглобинозы возникают у лиц, проживающих в «малярийном поясе» (Африка, Средиземноморье, в России — Закавказье). Примером гемоглобинопатий является серповидно- клеточная анемия.
Серповидноклеточная анемия — аутосомно-рецессивное заболевание, в основе лежат способность гемоглобина менять свою структуру в условиях гипоксии. Наследуемый дефект заключается в том, что в каждой β-цепи в ее 6-ом положении глутаминовая аминокислота заменена на валин (точковая мутация). Такой гемоглобин носит название гемоглобина S.
Патогенез (схема 1).У гемоглобина, отдавшего кислород, обычно снижается растворимость. Но степень снижения растворимости для гемоглобина А и гемоглобина S различна. Гемоглобин А, лишенный кислорода, растворим вдвое меньше, чем гемоглобин А, насыщенный кислородом. Растворимость гемоглобина S, отдавшего кислород, уменьшается в 100 раз. Гемоглобин S переходит в гелеобразное состояние, кристаллизуется, выпадает в осадок в форме серпа — отсюда названии анемии — «серповидноклеточная». Предполагают, что выраженное снижение растворимости отдавшего кислород гемоглобина S связано с тем, что замена глютаминовой кислоты на валин приводит к усилению связи одной молекулы гемоглобина с другой.
Так называемое серпление эритроцитов вначале носит обратимый характер, и гемоглобин после окисления восстанавливается, а эритроциты принимают свою прежнюю форму. Однако повторное серпление приводит и к повреждению эритроцитарной мембраны, и повреждение становится необратимым, несмотря на дезаггрегацию гемоглобина. Нарушается структура и функция мембраны, в частности, в ней повреждаются механизмы фосфорилирования. С повреждением мембраны эритроциты теряют калий и в то же время накапливают кальций. Это приводит к затруднениям в поддержании нормального объема клетки и увеличению ее плотности из-за концентрации гемоглобина. По-видимому, именно нарушения в эритроцитарной мембране и являются причиной окклюзии мелких сосудов и тромбозов при серповидноклеточной анемии.
(схема 2)
Замещение глутаминовой аминокислоты на валин в β-цепи
↓
Образование нестабильной (аномальной) молекулы гемоглобина S
↓
Аггрегация и полимеризация гемоглобина под влиянием гипоксии.
Серповидность эритроцитов
↓
Застой серповидных клеток
Нарушение микроциркуляции
Ускоренное разрушение эритроцитов
↓
Анемия
Стазы и микрортромбозы легких и почек
Спленомегалия
Гепатомегалия
↓
Стимуляция костного мозга гипоксией
и продуктами гемолиза активация эритропоэза
↓
Гиперплазия костного мозга
↓
Болевой синдром с признаками гиперпластического кроветворения
Периферическая кровь и кроветворение. При гемолитических кризах отмечается резкое снижение гемоглобина — до 30-50 г/л., ретикулоцитоз резко выражен — 70-80%, значительно увеличивается содержание железа в сыворотке, что крайне неблагоприятно в плане возникновения гемохроматоза. Выражена гипохромия эритроцитов.
Талассемии (болезнь Кули) –это группа заболеваний с наследственным дефектом темпа синтеза глобиновых цепей, вследствие чего образование ά- и β-цепей не сбалансировано. Кули — американский педиатр, впервые описавший это заболевание.
Различают ά-талассемию и β-талассемию. Для ά-талассемии (талассемия minor) характерно снижение синтеза или полное отсутствие ά-цепей и в гемоглобине превалируют β-цепи. При β-талассемии (талассемия major) не образуются β-цепи и имеется избыток ά-цепей. Последовательность аминокислот в цепях не нарушена. Наиболее распространенной формой является β-талассемия (талассемия major).
Молекулярные основы и клинические варианты β-талассемии.Различают β-талассемию с полным отсутствием продукции β-цепей и с уменьшением их продукции (β°- и β+ талассемии).
Патогенез β-талассемии
схема 3
Мутация в генах синтеза β-цепей глобина.
Дефицит β-цепей
↓
Избыточная продукция α-цепей
Агрегация и полимеризация избытка α-цепей
Распределение гемоглобина в форме мишени
↓
Нарушение формы эритроцита, повреждение его мембраны
↓
Повышение проницаемости мембран для ионов кальция
↓
Активация трансглютаминазы
↓
Синтез глютамил-лизиновых мостиков
↓
Усиление ригидности мембраны эритроцита
↓
Задержка эритроцитов в селезенке, агрегация в мелких сосудах с тромботическими явлениями, увеличение селезенки,
ишемическое повреждение различных органов
↓
Лизис эритроцитов
↓
Гипоксия
↓
Гиперплазия костного мозга.усиление эритропоэза
Усиление апоптоза клеток-предшественниц эритропоэза
↓
Деформации скелета, болевой синдром
При отсутствии достаточного количества β-цепей α-цепи не находят для себя комплементарные пары, и эти свободные α-цепи быстро преципитируются и образуют нерастворимые включения в костномозговых нормобластах, которые распределяются в форме мишени. Включения эти достаточно ригидны, они способны вызывать механическую травму и повреждения мембран эритрокариоцитов и образующихся из них эритроцитов.
Повреждение мембран костномозговых эритрокариоцитов приводит к потере клеткой калия, нарушения синтеза ДНК в эритробластах, внутрикостномозговому гемолизу эритрокариоцитов-предшественников. Потомство сохранившихся эритрокариоцитов подвергается гемолизу в сосудистом русле. Периферические эритроциты имеет форму мишени, отсюда название анемии – мишеневидная.
Обильное преципитирование α-цепей в костном мозге влечет за собой неэффективный эритропоэз и крайнюю степень гиперплазии костного мозга.
Таким образом в патогенезе β-талассемии, связанный с избытком α-цепей, имеет место неэффективный эритропоэз наслаивается на несостоятельность образования нормального гемоглобина со снижением содержания гемоглобина в клетках (гипохромия) и частичной блокадой синтеза гема (схема 3).
Энзимопатии— гемолитические анемии, обусловленные дефектами эритроцитарных ферментов. Среди них наиболее распространена анемия вследствие недостатка фермента глюкозо-6-фосфатдегидрогеназы. Это наиболее частый вариант энзимопатии. Заболевание передается по аутосомно-рецессивному типу и является краевой патологией, так как оно наиболее распространено в странах Средиземноморья, на Среднем Востоке и среди черного населения Америки (10%).
Существует несколько генетических форм этой энзимопатии, но наиболее значимыми являются те, что приводят к гемолизу эритроцитов. Биологическое значение этой генной аномалии рассматривается как защита организма от малярийного плазмодия.
При этой патологии основным биохимическим дефектом эритроцитов является недостаточный синтез ферментов пентозофосфатного цикла, обеспечивающих ликвидацию перекисных соединений, образующихся на поверхности эритроцита при воздействии на него сильных окислителей.
Среди окислителей преобладают лекарства (противомалярийные препараты, сульфаниламиды, левомицетин, фурацилин, амидопирин) и эндогенные первичные и вторичные оксиданты.
В норме перекисные радикалы инактивируются за счет окисления донатора электронов — восстановленного глютатиона мембраны эритроцита. Для восстановления глютатиона необходимы ионы водорода, источником которых является восстановленная НАДФ. При дефиците глюкозо-6-фосфатдегидрогеназы:
• восстановление НАДФ резко сокращается,
• истощаются запасы восстановленного глютатиона в эритроцитах,
• резко усиливаются окислительные процессы,
• повышается проницаемость мембраны для ионов Na.
• набухание клетки, гемолиз.
Острый гемолиз может возникнуть и у здоровых лиц при попадании в их организм очень сильных окислителей (хлораты, перхлораты). Нужно отметить, что мишенью для гемолиза при этой форме энзимной недостаточности, чаще всего служат стареющие эритроциты, в какой-то мере потерявшие запас этого энзима.
Клиника и гематологические показатели энзимопатий.Клинически проявления обычные для гемолитических анемий. Бледность кожных покровов и желтушность после воздействия провоцирующего фактора. Частый гемолиз может привести к увеличению и легкой болезненности селезенки.
Анемия, как правило, нормохромная, нормоцитарная и регенераторная. При просмотре мазка крови можно обнаружить в эритроцитах включения, носящие название телец Гейнца. Это внутриэритроцитарные кристаллы гемоглобина, образующиеся в результате его окисления и последующей денатурации.
Диагностика заболевания проводится с помощью количественного анализа глюкозо-6-ФДГ в эритроцитах больного.
Приобретенные гемолитические анемии — это группа заболеваний с различным патогенезом. Их объединяет гемолиз эритроцитов в периферической крови (внутрисосудистый гемолиз). По механизму разрушения эритроцитов различают приобретенные гемолитические анемии иммунного и неиммунногохарактера.
Клинические признаки этих анемий, как правило, совпадают, несмотря на разные патогенетические механизмы.
Иммунные гемолитические анемии.Классификация иммунных гемолитических анемий основана на характере вовлекаемых в иммунный гемолиз антител, а их основным диагностическим критерием является выявление антиэритроцитарных антител в антиглобулиновом тесте Кумбса. Этот тест базируется на способности антител, полученных от животных путем их иммунизации человеческим глобулином, агглютинировать эритроциты больного, если на их поверхности имеются глобулины (про-тивоэритроцитарные антитела).
Гемолитическая анемия, вызванная тепловыми (IgG)_антителами. Это наиболее распространенный тип иммунной гемолитической анемии, однако, в 50% случаев она является идиопатической — с нераспознанной этиологией. В остальных 50% случае у больных имеется предрасположенностьк лекарственному гемолизу. Такие лекарства, как пенициллин и цефалоспорины являются гаптенами, но в комбинации с белками мембраны они способны вызывать иммунизацию организма. Эта форма гемолитической анемии обычно возникает после внутривенного введения большой дозы антибиотиков через 1-2 недели после начала терапии. Гибель эритроцитов при лекарственно-зависимых иммуногемолитических анемиях, как правило, происходит внутри сосудов после фиксации на них комплемента, хотя возможно и участие в этом процессе селезенки и гибель эритроцитов по типу АЗКЦ (антителозависимой клеточной цитотоксичности), здесь же происходит и иммунный фагоцитоз эритроцитов.
Наряду с «гаптеновой» моделью гемолиза эритроцитов существет и другая — «модель аутоантител». Некоторые антигипертензивные вещества, например, а-метилдофа, вызывают образование антител, направленных против внутриклеточных компонентов, в частности, против Rh-антигена эритроцитов Приблизительно у 10% больных, получающих этот препарат, обнаруживаются антитела к этому антигену, однако только в 1% случаев у них возникает аутоиммунная гемолитическая анемия.
Иммунная гемолитическая анемия с холодовыми агглютининами (JgM-антитела).Эта форма иммунной гемолитической анемии вызывается антителами, которые приобретают сродство к эритроцитам при низкой температуре (4°С), и поскольку они агглютинируют эритроциты на холоду, называются холодовыми. Эта форма анемии хорошо компенсируется самим организмом и редко проявляется клинически подтвержденным гемолизом. Такого рода антитела постоянно обнаруживаются в крови больных лимопролиферативными заболеваниями, а также при идиопатической форме. Тот факт, что по своей природе они являются моноклональными антителами, предполагает, что заболевания, при которых они обнаруживаются, принадлежат к группе моноклональных гамма-глобулинопатий.
Симптомы анемии (побледнение и цианоз областей, подвергшихся охлаждению) связаны с агглютинацией эритроцитов в присутствии комплемента в дистальных частях тела (конечности), когда их температура снижается ниже 30°С.
Анемия с холодовыми (IgG) гемолизинами. Эти антитела характерны для пароксизмальной холодовой гемоглобинурии, клиническим проявлением которой являются острые приступы массивного гемолиза эритроцитов, часто сопровождающиеся гемоглобинурией после охлаждения больного. Лизис имеет четкий комплементзависимый характер. Случаи пароксизмальной холодовой гемоглобинурии связывают с такими инфекциями, как микоплазменная пневмония, корь, свинка и инфекцией, вызванной респираторными вирусами.
Дата добавления: 2015-07-02; Просмотров: 1169; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Серповидноклеточная анемия — Медицинское видео
00:00
Когда же тогда РБК станет серпом?
И что это значит или какой термин следует называть серпом?
Что ж, дело в том, что сейчас у вас повышенный спрос.
00:14
Так, например, подумайте об африканском ребенке, который сейчас бежит.00:19
И вы должны знать, что серповидно-клеточная анемия очень распространена среди африканского населения.
00:26
Итак, здесь вы обнаружите, что происходит замена
и с повышенной активностью ребенка внезапно этот ребенок теперь страдает от боли.00:35
И мы скоро поговорим об этой презентации.
00:38
Теперь во время этого эпизода повышенной активности, когда ребенок чувствует боль,
тогда эритроциты становятся серповидными.00:44
Это называется полимеризованным.
00:48
Итак, когда эритроциты полимеризуются, это означает, что они выглядят как серп.
00:53
И я покажу вам приближающуюся картинку.На что это похоже?
Что ж, я хочу, чтобы вы придумали, скажем конкретно, цифры в руках.
01:01
Допустим, у вас проходит артерия.
01:03
А потом, что он будет делать? Он раздвоится.01:06
Он разделит, разделит, разделит, разделит на многочисленные подразделения.
01:10
Теперь предположим, что эритроциты проходят через большую артерию, и я буду здесь преувеличивать.
01:14
Достаточно места для этого эритроцита, чтобы пройти через эту артерию.Правильно?
Теперь вы знаете, что активность увеличилась, и эритроциты стали серпом.
01:24
Что происходит с этим диаметром кровеносного сосуда при раздвоении?
Становится меньше. Итак, теперь вы серп и куча эритроцитов
серповидные или полимеризованные, попадают в бифуркацию, в разделение.01:39
Боже мой. Я не могу двигаться дальше. Что не может двигаться дальше?
Кровь. Эритроциты не могут выйти за пределы группы серповидных клеток, которые не собираются в месте бифуркации,
блокируя попадание крови в мои пальцы.Итак, как будет себя чувствовать пациент?
Ой. Моя рука болит. Что называется клинически при серповидно-клеточной анемии? Хороший. Дактилит.
02:05
Это действительно вообще с ног до головы
известный как ваш вазоокклюзионный кризис, который вы обнаруживаете при серповидно-клеточной анемии.02:14
Это вызывает боль. Почему?
Снижение оксигенации различных тканей, различных мозговых оболочек, о чем я сказал.
02:23
Полимеризация вызывает серповидность эритроцитов в условиях низкого давления кислорода.02:28
Что это за события? Что это за окружающая среда? Чаще всего встречается инфекция.
02:36
Итак, вы даете мне два различия, в которых инфекция создает среду анемичного типа.02:43
Мы говорили о дефиците G6PD при инфекции и о том, как свободные радикалы
и RBC не могут защитить себя.
02:52
Здесь при инфекции у вашего пациента генетическая мутация
и тогда инфекция приведет к полимеризации ваших эритроцитов.03:00
Обезвоживание — еще один источник или причина стресса, очевидно, гипоксии, стресса.
03:09
Это условия, при которых … ну, тогда эритроциты становятся серповидными, низкое давление кислорода.
3:15
Давайте посмотрим на бифуркацию, которую мы только что обсудили.03:19
И на картинке вверху показаны нормальные эритроциты.
которые затем проходят бифуркацию. Нет проблем.
03:27
На картинке внизу вы заметите, что эритроциты стали серповидными.3:31
Давайте назовем это цифрами.
03:34
Итак, если вы пойдете в крайнее правое положение и продолжите,
давайте назовем это рукой, и вы заметите нижнюю картинку,
есть группа или банда серповидных эритроцитов, которые не хотят двигаться дальше,
вы преграждаете путь.Как тромб, не так ли?
Итак, что мы сделаем позже, мы углубимся в то, что известно как ваш вазоокклюзионный кризис.
03:54
Итак, теперь, когда у вас есть серповидный эритроцит, ну, это …
помните, это часть меню для макрофагов селезенки.04:02
Итак, у вас есть макрофаг селезенки, который говорит:
«Это серп. Очень хорошо смотрится в меню. Я возьму это».
Добро пожаловать на сайт внесосудистого гемолиза.
04:12
На самом деле в селезенке может быть столько экстраваскулярного гемолиза, что …
что тогда происходит с селезенкой? Спленомегалия.04:20
Что вас беспокоит? Аутоспленэктомия. Что это значит?
Селезенка вылезет — нет. Это не выскочит из твоего желудка.
04:26
Но затем эта селезенка будет разрушена, и как только это произойдет,
вы думаете о своем инкапсулированном организме
и вам следует подумать о вакцинации вашего пациента Pneumovax.04:38
Как это называется, когда вы видите такие блокировки? Это называется вазоокклюзионный криз.
04:45
Позвольте имени говорить с вами. Как будет себя чувствовать пациент с вазоокклюзионным кризом?
Боль.Дактилит, острый грудной синдром. Что это значит?
Кровеносные сосуды ткани в легких и тому подобное, это не работает, не работает.
05:02
Итак, острый грудной синдром. Что еще может случиться?
Что ж, у пациента может быть приапизм снова из-за тромбоза.05:09
Кроме того, у вас может быть закупорка сонной артерии, поэтому могут возникнуть проблемы, похожие на инсульт.
05:15
Ты со мной? Хорошо? Это ваша настоящая полная картина вашего патогенеза и клинической картины.05:21
Картина, которую вы видите на мазке периферической крови,
Я не хочу, чтобы вы сосредотачивались на клетках-мишенях. Они у вас есть здесь.
05:28
Но на самом деле вы сосредоточены здесь на серповидно-клеточной клетке.05:33
Взгляните на тот RBC, совершенно уродливый.
05:35
Расскажите о гемолизе. Где это? Селезенке.
05:38
Как узнать, что селезенка повреждена гистологически?
Вы говорите мне гистологический образец, к которому вы привыкли
что вы видели в медицинской школе, в которой —
что ж, это будет указывать на то, что задействована селезенка.05:54
Это называется трупами Хауэлла-Джолли. Правильно? Это тела Хауэлл-Джолли.
05:58
Вы не видите их здесь, но тогда это будет включение, которое вы найдете в своем RBC.
что для вас означает: «О, селезенка определенно вовлечена.»
И поэтому вы должны быть очень осторожны, потому что вы беспокоитесь об аутоспленэктомии.
.
Нормоцитарная анемия: серповидноклеточная анемия (серповидноклеточная анемия)
Патология
ПРОДОЛЖИТЬ ОБУЧЕНИЕ
НАЧАТЬ СЕЙЧАС
ПРОДОЛЖИТЬ ОБУЧЕНИЕ
НАЧАТЬ СЕЙЧАС
КАТЕГОРИИ
- Медицинская онлайн-библиотека Lecturio
- Pre-Med
- Биология
- Химия
- Физика
- Статистика
- Доклиническая учебная программа
- Анатомия
- Бихевиоризм
- Биохимия
- Биомедицинские науки
- Эмбриология
- Эпидемиология и биостатистика
- Гистология
- Иммунология
- Микробиология
- Патология
- Фармакология
- Физиология
- Клиническая программа
- Анестезиология
- Кардиология
- Дерматология
- Скорая помощь
- Эндокринология
- Семейная медицина
- Гастроэнтерология
- Гинекология
- Гематология
- Гепатология
- Инфекционные болезни
- Медицинская генетика
- Неврология
- Офтальмология
- Отоларингология (ЛОР)
- Онкология
- Ортопедия
- Психиатрия
- Педиатрия
- Радиология
- Ревматология
- Болезни репродуктивной системы
- Респираторная медицина
- Хирургия
- Нефрология / урология
Учебная программа
.
Патофизиология урогенитальных заболеваний при серповидно-клеточной анемии
Серповидноклеточная анемия является одним из наиболее изученных наследственных заболеваний, и, несмотря на то, что она вызвана единственной точечной мутацией в гене HBB , множественные плейотропные эффекты аномального диапазона продукции гемоглобина S. от вазоокклюзионного криза, инсульта и легочной гипертензии до остеонекроза и язв на ногах. Урогенитальная функция не щадит, и хотя приапизм вспоминают чаще всего, описаны другие связанные клинические проявления, такие как никтурия, энурез, повышенная частота инфекций нижних мочевых путей, недержание мочи, гипогонадизм и инфаркт яичек.Исследования серповидно-клеточной вазоокклюзии и приапизма с использованием моделей in vitro и in vivo пролили свет на патогенез некоторых из этих событий. Авторы рассматривают то, что известно о пагубном воздействии серповидного налета на мочеполовой тракт и о том, как роль передачи сигналов циклическими нуклеотидами и протеинкиназ может помочь понять патофизиологию, лежащую в основе этих проявлений, и разработать новые методы лечения урогенитальных нарушений при серповидно-клеточной анемии.
1. Введение
Серповидно-клеточная анемия (СКК) была впервые описана более века назад [1] и стала одним из наиболее изученных наследственных заболеваний человека. Несмотря на то, что они вызваны единственной точечной мутацией в гене HBB , множественные плейотропные эффекты аномальной продукции гемоглобина S варьируются от вазоокклюзионного криза, инсульта и легочной гипертензии до остеонекроза и язв ног [2–4].
Функция мочеполовых путей также нарушается при SCA, и, хотя приапизм вспоминается чаще всего, описаны другие связанные клинические проявления, такие как никтурия, энурез, учащение инфекций нижних мочевых путей, недержание мочи, гипогонадизм и инфаркт яичек.Серповидный гемоглобин S (HbS) полимеризуется при дезоксигенировании, что приводит к серии клеточных изменений в морфологии и функции эритроцитов, которые сокращают продолжительность жизни эритроцитов и приводят к окклюзии сосудов. Вазоокклюзия при серповидно-клеточной анемии (SCD) представляет собой сложный многофакторный процесс, характеризующийся окислительным стрессом и повторяющимся ишемическим реперфузионным повреждением в порочном круге, способствующем снижению кровотока и, в конечном итоге, к полной блокаде микроциркуляции и органической дисфункции [3– 6].Точные патогенетические механизмы, которые связывают мочеполовые осложнения с основным событием полимеризации HbS и гемолитической анемией при SCA, только начали выясняться.
Эта статья фокусируется на том, как предыдущие, иногда плохо объясненные, клинические наблюдения урогенитальных нарушений у пациентов с ВСС связаны с более поздними открытиями роли циклических нуклеотидов и протеинкиназ в патофизиологии серповидной вазоокклюзии.
2. Приапизм
Приапизм определяется как длительная и стойкая эрекция полового члена, не связанная с сексуальным интересом или стимуляцией, и является одним из осложнений, связанных с серповидноклеточной анемией (СКА) с начала 1934 года [7].Приапизм достигает 45% у пациентов мужского пола с ВКА, а частота возникающей в результате эректильной дисфункции (ЭД) превышает 30% [8–10]. Хотя это осложнение ранее было подробно рассмотрено в этом журнале [11], основные концепции, лежащие в основе его патофизиологии, будут суммированы здесь для лучшего понимания механизмов, обсуждаемых в статье, но читателям рекомендуется прочитать предыдущий обзор.
Согласно рекомендациям Американской ассоциации урологов по лечению приапизма, приапизм можно разделить на три категории: ишемический, заикание и неишемический.Ишемический приапизм (веноокклюзионный, низкий кровоток) — это стойкая эрекция, характеризующаяся ригидностью кавернозных тел (CC) и небольшим или отсутствующим притоком кавернозных артерий. При ишемическом приапизме наблюдаются зависящие от времени изменения в метаболической среде тела с прогрессирующей гипоксией, гиперкарбией и ацидозом, которые обычно вызывают боль в половом члене. Синусоиды полового члена являются областями, склонными к серповидному развитию красных кровяных телец у мужчин с SCD из-за застоя крови и медленной скорости кровотока, а ишемический приапизм, как полагают, является результатом длительной блокады венозного оттока вазоокклюзионным процессом.Клинически наблюдается застой и болезненность ЦК, сохраняющая головку и губчатое тело, обычно продолжительное время более 3 часов, что часто приводит к фиброзу и эректильной дисфункции. Приапизм заикания (острый, перемежающийся, рецидивирующий ишемический приапизм) характеризуется рецидивом, но увеличение частоты или продолжительности эпизодов заикания может предвещать серьезный ишемический приапизм. Неишемический приапизм (артериальный, высокий кровоток) — это стойкая эрекция, вызванная нерегулируемым притоком кавернозной артерии.Обычно тела опухшие, но не жесткие, половой член не вызывает болезненных ощущений и чаще всего связан с травмой [12–16].
Традиционные методы лечения в основном симптоматические, обычно назначаются после того, как эпизод приапизма уже произошел, поскольку этиология и механизмы, участвующие в развитии приапизма, плохо изучены [17, 18]. Были предложены профилактические вмешательства, но без четкого представления о задействованных молекулярных механизмах они остаются в значительной степени непрактичными для регулярного применения в клинике [17].Из-за сложности исследования этих механизмов у пациентов использование животных моделей приапизма стало чрезвычайно важным для решения этой разрушительной клинической проблемы [19]. Животными моделями приапизма являются собаки [20, 21], кролики [22], крысы [23–27] и мыши [28–41].
Молекулярная биология и генная инженерия широко использовались в моделях животных для изучения функции генов как в физиологии человека, так и в исследовании патологии приапизма человека. Были разработаны четыре основные модели приапизма на животных, которые позволили лучше узнать внутренние механизмы, лежащие в основе приапизма: модель крыс с внутрикорпоративным переносом гена опиорфинов [42–45], эндотелиальная синтаза оксида азота (eNOS) с нейронным NOS (nNOS) или без него. -out) модели мышей [28, 29, 31–33], модель мышей с нокаутом аденозиндезаминазы () [35, 36, 40, 41] и модель мыши с трансгенными серповидными клетками Berkeley [30, 33, 34, 37 –39].Однако мышь Беркли — единственная общепринятая модель на животных, которая демонстрирует клинические проявления, подобные тем, которые наблюдаются у людей с тяжелыми формами ВСС, включая приапизм [30, 34].
Приапизм — это нарушение нормальной эрекции. Эрекция полового члена — это гемодинамическое событие, которое регулируется расслаблением / сокращением гладких мышц кавернозных тел и связанных артериол во время сексуальной стимуляции. Вялость полового члена (состояние детумесценции) в основном поддерживается тоническим высвобождением норэпинефрина посредством симпатической иннервации сосудистых и кавернозных гладкомышечных клеток [46].Во время эрекции полового члена (состояние припухлости) расслабление гладких мышц сосудов снижает сопротивление сосудов, тем самым увеличивая кровоток через кавернозные и спиральные артерии и заполняя синусоиды, которые расширяются из-за расслабления гладкомышечных клеток в CC [47]. Это физиологическое расслабление гладкой мускулатуры полового члена в основном, но не исключительно, опосредуется нейромедиатором оксида азота (NO), который вырабатывается ферментами, называемыми NO-синтазами (NOS). NOS подразделяются на три изоформы: эндотелиальные NOS (eNOS или NOS3), нервные NOS (nNOS или NOS1) и индуцибельные NOS (iNOS или NOS2) [48, 49].В гладких мышцах полового члена NO высвобождается как из нитрергических нервов, так и из синусоидального эндотелия [46, 50–52]. NO стимулирует растворимую гуанилилциклазу (sGC) в гладких мышцах кавернозных тел, вызывая повышенный синтез циклического GMP (cGMP), который обеспечивает основной сигнал для расслабления гладких мышц [53]. Уровни цГМФ в ЦК регулируются скоростью синтеза, определяемой рГЦ, и скоростью гидролиза цГМФ, опосредованного фосфодиэстеразой типа 5 (ФДЭ5) [54, 55]. Сообщалось, что гемоглобин плазмы, высвобождаемый внутрисосудистыми гемолизированными серповидными эритроцитами, потребляет NO, снижая его биодоступность в эректильной ткани, смещая нормальный баланс тонуса гладких мышц в сторону сужения сосудов [17, 56, 57].Чемпион и соавторы [33] показали, что гладкие мышцы полового члена SCD трансгенных мышей обладают дисрегулируемой активностью экспрессии PDE5A. Более того, у этих мышей был спонтанный приапизм, усиленный ответ релаксации CC, опосредованный сигнальным путем NO-cGMP, и повышенное внутрикавернозное давление in vivo [37, 38].
Недавние данные показали, что другой сигнальный путь, который также может вносить вклад в патофизиологию приапизма при SCD, включает регуляцию аденозина.Подобно NO, аденозин является сильнодействующим вазодилататором, продуцируемым деградацией адениновых нуклеотидов. Аденозин преимущественно образуется в результате дефосфорилирования аденозинмонофосфата (АМФ), катализируемого внутриклеточной 5′-нуклеотидазой. Гидролиз s-аденозил-гомоцистеина также способствует образованию внутриклеточного аденозина [58, 59]. Внеклеточный аденозин может образовываться как при деградации адениновых нуклеотидов, так и при дефосфорилировании эктонуклеотидазами [60]. Затем аденозин катаболизируется двумя ферментами: аденозинкиназой (ADK), которая фосфорилирует аденозин до АМФ и является важным регулятором внутриклеточных уровней аденозина; и аденозиндезаминаза (ADA), которая катализирует необратимое превращение аденозина в инозин [58].
На несколько физиологических процессов может влиять внеклеточный аденозин, и это опосредуется четырьмя различными рецепторами, называемыми A 1 , A 2A , A 2B и A 3 . Все четыре подтипа являются членами суперсемейства рецепторов, связанных с G-белком (GPCR). Активация аденозиновых рецепторов A 1 и A 3 ингибирует активность аденилатциклазы, а также приводит к увеличению активности фосфолипазы C, тогда как активация подтипов A 2A и A 2B увеличивает активность аденилилциклазы [58, 61].Аденозин-индуцированная вазодилатация опосредуется увеличением внутриклеточных уровней циклического аденозинмонофосфата (цАМФ) в гладкомышечных клетках сосудов посредством передачи сигналов рецептора A 2 [62, 63]. цАМФ активирует протеинкиназу A (PKA), что приводит к снижению кальций-кальмодулин-зависимого фосфорилирования MLC и усилению релаксации гладких мышц [64]. Его роль в эрекции полового члена изучалась в исследованиях, показывающих, что интракавернозная инъекция аденозина приводит к припухлости и эрекции полового члена [36, 61, 65].Кроме того, аденозин индуцирует синтез NO в эндотелиальных клетках посредством передачи сигналов рецептора A 2 , а аденозин-опосредованная релаксация CC частично зависит от происходящего из эндотелия NO [36, 66–70].
Был идентифицирован приапический фенотип у мышей, что привело к дальнейшим исследованиям влияния аденозина на патофизиологию приапизма [59]. Предыдущие отчеты показали, что высокие уровни аденозина вызывают длительную релаксацию гладких мышц тела in vitro . Однако этот эффект был быстро исправлен внутрибрюшинным введением высокой дозы полиэтиленгликоль-АДА (ПЭГ-АДА), которая эффективно снижает системный уровень аденозина [36, 71].Более того, аденозин индуцировал значительное повышение уровней цАМФ в кавернозе за счет активации рецептора A 2B . Это продемонстрировало, что передача сигналов рецептора A 2B необходима для опосредованной аденозином стимуляции продукции цАМФ в гладкомышечных клетках СС [36, 71]. Mi и его сотрудники [36] изучали уровни аденозина в пенисе серповидно-клеточных мышей и обнаружили значительное увеличение уровней аденозина, предполагая, что избыточная продукция аденозина может вносить вклад в приапическую активность при SCD [71, 72].Серповидно-клеточные мыши, подвергнутые лечению PEG-ADA, испытали значительное снижение силы и продолжительности расслабления по сравнению с необработанными мышами [71]. Кроме того, повышенные уровни аденозина способствовали развитию фиброза полового члена у мышей, а также у трансгенных серповидно-клеточных мышей [72]. Эти данные предполагают общую роль повышенного аденозина в патофизиологии приапизма, связанного с SCD.
Хотя эндотелий сосудов полового члена и гладкомышечные клетки являются источниками факторов вазодилатации, таких как NO и аденозин, существуют пути сужения сосудов, важные для гемодинамики полового члена, такие как путь Rho-киназы (ROCK).Путь передачи сигнала RhoA / ROCK, как было показано, влияет на эректильную функцию in vivo посредством ряда механизмов, включая вазоконстрикцию сосудистой сети полового члена посредством сокращения гладких мышц и регуляцию eNOS [73–76]. Этот путь участвует в регуляции тонуса гладких мышц, модулируя чувствительность сократительных белков к [77]. RhoA регулирует сокращение гладкой мускулатуры за счет циклического переключения между GDP-связанной неактивной формой (связанной с ингибитором диссоциации гуанина, RhoGDI) и GTP-связанной активной формой [78–80].Активация гетеротримерных G-белков выше по течению приводит к обмену GDP на GTP — событию, осуществляемому факторами обмена гуанина (GEF) p115RhoGEF [81], PDZ-RhoGEF [82] и LARG (RhoGEF, ассоциированным с лейкемией) [83] , которые способны передавать сигналы от рецепторов, связанных с G-белком, в RhoA [84–86]. ROCK активируется RhoA и ингибирует миозинфосфатазу посредством фосфорилирования его миозин-связывающей субъединицы, что приводит к увеличению чувствительности. Путь сенсибилизации RhoA / ROCK Ca 2+ участвует в регуляции сокращения и тонуса гладких мышц полового члена как у людей, так и у животных [77, 87].ROCK оказывает сократительное действие на половой член за счет независимого продвижения киназы легкой цепи миозина (MLC) или ослабления активности MLC-фосфатазы и снижения продукции NO эндотелиального происхождения [88]. Активация RhoA, экспрессия белка ROCK2, а также снижение общей активности ROCK в половом члене трансгенных мышей SCD, подчеркивая, что молекулярный механизм приапизма при SCD связан со снижением вазоконстрикторной активности в половом члене [39]. Следовательно, если нарушенная RhoA / ROCK-опосредованная вазоконстрикция способствует развитию SCD-ассоциированного приапизма, этот путь может стать новой терапевтической мишенью в лечении этого осложнения.
В лечении острого тяжелого приапизма, ассоциированного с серповидно-клеточной анемией, не достигнуто определенного прогресса. Аспирация полового члена с интракавернозной инъекцией или без нее и, в конечном итоге, хирургическое шунтирование остается основой лечения, без очевидной пользы от более распространенных подходов, таких как внутривенная гидратация, переливание крови и ощелачивание мочи [89, 90]. Фармакологические вмешательства в таких случаях ограничиваются интракавернозным применением симпатомиметических препаратов, таких как адреналин, норэпинефрин и этилефрин, но есть отдельные сообщения об остром применении ингибитора ФДЭ5 силденафила [91].
Тем не менее, большинство попыток контролировать приапизм ВСС были сосредоточены на его рецидивирующей форме заикания. Сообщалось о небольших сериях гормональных манипуляций с диэтилстильбэстролом [92], аналогами гонадотропин-рилизинг-гормона (ГнРГ) [93] и финастеридом [94] для успешного лечения рецидивирующего приапизма. Повышение тонуса гладкой мускулатуры пероральным приемом α -агониста этилэфрина также дает лишь отдельные свидетельства его пользы [95]. К сожалению, проспективное исследование, сравнивающее этилефрин и эфедрин, не смогло продемонстрировать превосходство или эквивалентность обоих препаратов в предотвращении рецидивирующего приапизма из-за плохой приверженности и низкого набора статистических данных, что снижает статистическую мощность, но были получены некоторые доказательства, подтверждающие безопасность использования таких стратегий и, возможно, указывающие на меньшая тяжесть приступов приапизма у согласных пациентов [96].Это способствует использованию псевдоэфедрина не по назначению перед сном, за что выступают некоторые эксперты [57, 90]. Гидроксимочевина также эффективна в предотвращении рецидивов приапизма при ВСС в небольшом количестве случаев [97, 98]. На основе современных знаний о NO-зависимых путях было изучено использование ингибиторов PDE5. Одно клиническое испытание тадалафила у пациентов с ВСС было прекращено, но данные об исходах еще не опубликованы (ClinicalTrials.gov NCT00538564), а одно продолжающееся испытание направлено на изучение эффекта силденафила в тех же условиях (ClinicalTrials.gov NCT00940901). Несмотря на эти усилия, ученые стали менее оптимистичны в отношении переносимости этого подхода после преждевременного прекращения исследования силденафила по лечению легочной гипертензии у пациентов с внезапной сердечной недостаточностью, у которых у пациентов, принимавших ингибитор ФДЭ5, с большей вероятностью возникли тяжелые болевые кризы, требующие госпитализации [99 ]. Таким образом, новые методы лечения приапизма при ВСС по-прежнему оправданы, если ожидается, что частота импотенции среди этих пациентов будет снижена в долгосрочной перспективе.
3. Бесплодие
Прогресс в терапии ВСС, особенно использование гидроксимочевины, значительно улучшил прогноз пациентов с ВСС [100, 101], средняя продолжительность жизни которых превышает 40 лет [102–104] , что делает бесплодие важной проблемой. Тем не менее, задолго до того, как гидроксимочевина стала стандартом лечения ВСС, параметры семенной жидкости самцов ВСС попадали в субфертильный диапазон из-за снижения концентрации сперматозоидов, общего количества, подвижности и измененной морфологии [105–107], а также более недавнее исследование показало, что более 90% пациентов имели по крайней мере один аномальный параметр спермы [108].
Гидроксимочевина (HU), как сообщается, нарушает сперматогенез, вызывая атрофию яичек, обратимое снижение количества сперматозоидов, а также аномальную морфологию и подвижность сперматозоидов [108–114], и ее текущее или предыдущее использование должно быть одной из первых вероятных причин. для рассмотрения у пациентов с ВСС, жалующихся на бесплодие. Более того, аномалии сперматозоидов до HU были приписаны различным эффектам гипогонадизма, вызванного самим SCD, и отсутствие соответствующей продукции тестостерона, по-видимому, усугубляется использованием HU в модели SCD у мышей [115].
Учитывая, что мужская фертильность не зависит исключительно от качества семенной жидкости, другие причины, которые также могут сделать пациентов мужского пола с ВСС склонными к бесплодию, включают сексуальные проблемы, такие как потеря либидо, преждевременная эякуляция, частый приапизм и импотенция, связанная с приапизмом [105–107, 116–121].
Выявление единственной основной причины мужского бесплодия у конкретного пациента с ВСС крайне маловероятно и, вероятно, будет связано с некоторой степенью эндокринологического нарушения.Более широкое понимание того, как гипогонадизм возникает при ВСС, необходимо для объяснения проблем фертильности и требует знания сложности регуляции выработки половых гормонов.
4. Гипогонадизм
Этиология гипогонадизма у пациентов с ВСС многофакторна, поскольку было предложено несколько механизмов, способствующих его возникновению, например, первичная гонадная недостаточность [117, 122, 123], связанная с повторным инфарктом яичка или вызванная им. [124], дефицит цинка [125, 126] и частичный гипоталамический гипогонадизм [127].
Физическое и половое развитие нарушается как у мужчин, так и у женщин с SCD, с наступлением половой зрелости (менархе) и появлением вторичных половых признаков (лобковые и подмышечные волосы и борода), как правило, с задержкой. Задержка больше при гомозиготной SCA и S-талассемии, чем при SC-заболевании и S- β + -талассемия [128–130]. Более того, исследования у пациентов мужского пола с SCD сообщили об уменьшении объема эякулята, количества сперматозоидов, подвижности и аномальной морфологии сперматозоидов [106, 116].
Биохимические анализы показали низкий уровень тестостерона и дигидротестостерона и различные уровни фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) у пациентов с ВСС [105–107, 118, 119, 121, 131]. Сравнение пациентов и контрольных групп, соответствующих стадии развития вторичных половых признаков, показало более высокие уровни ЛГ при серповидно-клеточной анемии, что свидетельствует в пользу некоторой роли гипергонадотропного гипогонадизма.
Клетки Лейдига семенников и других стероидогенных тканей продуцируют гормоны в результате мультиферментного процесса, при котором свободный холестерин из внутриклеточных хранилищ переносится на внешнюю, а затем на внутреннюю митохондриальную мембрану.Клетки Лейдига продуцируют андрогены под контролем ЛГ или его плацентарного аналога хорионического гонадотропина человека (ХГЧ), а также в ответ на многочисленные интратестикулярные факторы [114, 132]. Рецепторы LH / hCG принадлежат к семейству рецепторов sGC-связанных семи трансмембранных доменов, активация которых приводит к стимуляции аденилатциклазы [133]. Возникающее в результате накопление внутриклеточного уровня циклического аденозинмонофосфата (цАМФ) и сопутствующая активация цАМФ-зависимой протеинкиназы (ПКА) приводят к фосфорилированию многих белков, в том числе стероидогенного белка острой регуляции (StAR) [134, 135].StAR локализуется преимущественно в тканях, продуцирующих стероидные гормоны, и состоит из предшественника 37 кДа, содержащего Nh3-концевую митохондриальную целевую последовательность и несколько изоэлектрических форм зрелого белка 30 кДа [136–138]. Производство стероидов в клетках гонад и надпочечников требует как синтеза de novo , так и PKA-зависимого фосфорилирования белка StAR-37 [139]. Недавно синтезированный StAR является функциональным и играет критическую роль в переносе холестерина с внешней на внутреннюю митохондриальную мембрану, тогда как митохондриальный импорт и процессинг до 30 кДа белка StAR прекращают это действие [140–142].
Полимеризация HbS опосредована предшествующей активацией аденозинового рецептора A 2B R гипоксией, а гемолиз необратимых серповидных эритроцитов увеличивает биодоступность аденозина за счет преобразования АТФ эктонуклеотидазами CD39 и CD73, тем самым предрасполагая пациентов с ВСС к устойчивым высоким уровням цАМФ [143, 144]. С этой точки зрения можно ожидать увеличения стероидогенеза у этих пациентов.
Хотя стероидогенез клеток Лейдига преимущественно регулируется цАМФ / PKA, другие пути также влияют на этот процесс [145], включая путь передачи сигналов NO-cGMP [146].NO способствует двухфазной модуляции продукции андрогенов, стимулируя при низких концентрациях и подавляя при высоких концентрациях [49, 147, 148]. SCA вызывает истощение NO, а при низких уровнях NO стимулирует стероидогенез клеток Лейдига путем активации sGC [48, 49, 149] и способствует образованию низких уровней cGMP, хотя и достаточных для активации cGMP-зависимой протеинкиназы (PKG) и фосфорилирования. СТАР [49, 150]. Эта передача сигналов контролируется фосфодиэстеразами (PDEs) [151] и активными транспортными системами, которые экспортируют циклические нуклеотиды (белки множественной лекарственной устойчивости) из клетки [152].В клетках zona glomerulosa активация PKG II с помощью cGMP регулирует базальные уровни продукции альдостерона и фосфорилирования белка StAR [150], но неизвестно, играет ли роль cGMP в zona reticularis, где происходит андрогенез надпочечников.
Гипогонадизм, наблюдаемый у пациентов с ВСС с более низким уровнем циркулирующего тестостерона и более высоким уровнем ЛГ, предполагает, что, по крайней мере, в этих условиях, несмотря на снижение опосредованных цГМФ и повышенных цАМФ стимулов на продукцию андрогенов, гонадная недостаточность с поражением клеток Лейдига преобладает в отношении половых гормонов. производственная дисфункция (рисунок 1).Это еще раз подчеркивает, что первичный гипогонадизм, возможно, в значительной степени недооценивается, и требует дополнительных исследований патогенеза инфаркта яичка.
5. Инфаркт яичка
Сегментарный инфаркт яичка — нечастая причина острой мошонки, о нем редко сообщается, на момент публикации этой статьи было опубликовано менее 40 случаев. Его этиология не всегда четко определена, и на первых порах клинически он может быть ошибочно принят за опухоль яичка [153, 154].Частыми причинами инфаркта яичка являются перекрут семенного канатика, ущемленная грыжа, инфекция, травма и васкулит [131]. Обычное проявление — болезненное образование яичка, не поддающееся лечению антибиотиками [155]. Это заболевание яичек было связано с эпидидимитом, гиперчувствительным ангиитом, фиброплазией интимы артерий семенного канатика, полицитемией, применением антикоагулянтов, доброкачественными опухолями яичек и, в интересах данного обзора, серповидно-клеточной ангиогенезом и серповидно-клеточной анемией [124, 131, 155 –158].
Об инфаркте яичка, связанном с серповидным поражением, сообщалось очень редко: ретроспективно было выявлено только пять отдельных случаев, три из которых были связаны с серповидноклеточной анемией и два — с серповидно-клеточной анемией [124, 155–157, 159]. Холмс и Кейн сообщили о первом инфаркте яичка у пациента с внезапной сердечной смертью, у которого наблюдалась опухоль яичек, не реагирующая на антибиотики. Физикальное обследование показало, что поражение, подозрительное на злокачественное новообразование, и ультразвуковое исследование продемонстрировало гиперэхогенное образование с анэхоидным ободком и нормальным кровотоком в окружающей паренхиме.Радикальная орхиэктомия выявила геморрагический инфаркт с серповидными эритроцитами. В другом отчете о клиническом случае пациент с SCA поступил с острой мошонкой и историей острого грудного синдрома, инфаркта селезенки, остеомиелита и гемолиза. Физикальное обследование показало эритематозное, болезненное, опухшее яичко, а ультразвуковое исследование снова показало нормальную эхотекстуру и кровоток. Хирургическое обследование и патологическое обследование выявили сегментарный инфаркт яичка с закупоркой сосудов и серповидными эритроцитами [124].В последнем отчете о случае инфаркта яичка у пациента с ВСС с увеличенным объемом яичек, УЗИ мошонки показало как эхогенные, так и гипоэхогенные области, а допплерография выявила сосудистые изменения, совместимые с инфарктом яичка. Радикальная орхиэктомия была выполнена через 10 дней после первичного обследования, и микроскопическая оценка показала некротические семенные канальцы, лишенные ядерных остатков, скопления или острого воспалительного инфильтрата, что соответствует коагулятивному некрозу ишемического происхождения [131].
Кровоток в яичках зависит от внутренней семенной, кремастерной и семяпроводящей артерий. Обструкция венозного оттока может вызвать венозный тромбоз, нагрубание яичек и последующий геморрагический инфаркт. При SCD низкое кислородное напряжение в эритроцитах приводит к серповидным клеткам, которые теряют пластичность в микроциркуляции. Следовательно, капиллярный кровоток становится затрудненным, что усугубляет местную гипоксию тканей, продлевает цикл серповидности и способствует инфаркту яичка [124, 131, 157].
Циклические нуклеотиды и протеинкиназы могут играть важную роль в патофизиологии инфаркта яичек при ВСС. Усиление гемолиза и окислительного стресса способствует снижению биодоступности оксида азота (NO) за счет поглощения NO свободным гемоглобином и генерацией активных форм кислорода (ROS) [160, 161]. Как упоминалось ранее, тестикулярный сигнальный путь NO участвует в регуляции стероидогенеза клеток Лейдига [48, 49, 147–149, 162–164], но также может влиять на кровообращение в яичках.Мы предполагаем, что снижение биодоступности NO и последующее снижение уровней GMPc и активности PKG может уменьшить процесс расширения сосудов в яичках. Более того, снижение уровня NO у пациентов с серповидно-клеточной анемией способствует развитию тромбообразования в сосудистой системе и может еще больше усилить локальную ишемию [165, 166]. Более того, cGMP-зависимый путь передачи сигналов протеинкиназы обычно должен ингибировать RhoA-индуцированную сенсибилизацию Ca 2+ , передачу сигналов RhoA / ROCK и активность протеинкиназы C (PKC), которая обеспечивает сокращение в гладких мышцах сосудов [167–171].Таким образом, сниженные уровни NO могут снижать активность цГМФ-зависимой протеинкиназы и способствовать увеличению индуцированной RhoA сенсибилизации и активности PKC, способствуя сужению сосудов в семенниках. Таким образом, тканевая гипоксия, серповидность эритроцитов, снижение уровня NO, возможное образование тромбов, повышенная RhoA-индуцированная сенсибилизация и активность PKC могут привести к обструкции капилляров и венозного кровотока, способствующей инфаркту яичка (рис.
Хотя об инфаркте яичек при ВСС сообщалось очень редко, было высказано предположение, что тихие инфаркты яичек гораздо более распространены, но обычно упускаются из виду клинически.Биопсия яичек у пациентов выполняется редко, и необходимы дополнительные исследования, чтобы установить истинную частоту инфаркта яичка у пациентов с ВСС или даже с серповидно-клеточными признаками.
6. Дисфункция мочевого пузыря
Мочевой пузырь выполняет две важные функции: накопление и опорожнение мочи. Накопление мочи происходит при низком давлении, что означает, что мочевой пузырь расслабляется во время фазы наполнения. Нарушения функции накопления могут привести к симптомам нижних мочевых путей (СНМП), таким как позывы, учащение позывов и недержание мочи, составляющие синдромов гипоактивного или гиперактивного мочевого пузыря [172, 173].Пассивная фаза наполнения мочевого пузыря позволяет увеличить объем при низком внутрипузырном давлении. Шейка мочевого пузыря и уретра остаются в тоническом состоянии, чтобы предотвратить утечку, таким образом поддерживая удержание мочи. Опорожнение мочевого пузыря сопровождается изменением функции, при которой в теле мочевого пузыря преобладает сокращение гладких мышц детрузора (DSM), что сопровождается одновременным снижением выходного сопротивления шейки мочевого пузыря и уретры [174–176]. Наполнение и опорожнение мочевого пузыря регулируются взаимодействиями норадреналина (симпатический компонент, высвобождаемый при стимуляции гипогастрального нерва), ацетилхолина и АТФ (парасимпатические компоненты, высвобождаемые при стимуляции тазового нерва) с активацией адренергических, мускариновых и пуринергических рецепторов соответственно [175].
Пациенты с ВСС редко спонтанно сообщают о дисфункции мочевого пузыря своим опекунам. По мере увеличения выживаемости этих пациентов врачи могут ожидать, что количество жалоб на мочеиспускание возрастет в связи с классическими урологическими расстройствами, связанными с преклонным возрастом, такими как стрессовое недержание мочи у повторнородящих женщин и доброкачественная гиперплазия простаты у мужчин. Тем не менее, клинические наблюдения медицинских жалоб, связанных с мочевым пузырем, начинаются уже в детстве, с энуреза, и продолжаются в зрелом возрасте с никтурией и инфекциями мочевыводящих путей, и это лишь некоторые из них, хотя им часто пренебрегают.
Ноктурию давно связывают с постоянным увеличением объема мочи при ВСС. Как часть почечных осложнений, связанных с серповидностью, инфаркты мозгового вещества почек приводят к снижению способности концентрировать мочу, что приводит к увеличению суточных объемов мочи [177], компенсаторной полидипсии и, в конечном итоге, к необходимости ночного мочеиспускания.
Для сравнения, влияние полиурии на функцию мочевого пузыря лучше охарактеризовано при диабетической дисфункции мочевого пузыря (DBD). И ВСС, и сахарный диабет вызывают увеличение объема мочи, и, в некоторой степени, эти два заболевания связаны с повреждением клеток медиаторами окислительного стресса; поэтому данные предыдущих исследований DBD могут помочь пролить некоторый свет на предварительные данные о функции мочевого пузыря на моделях SCD на животных, понимая известную модель дисфункции мочевого пузыря.
Было высказано предположение, что DBD включает в себя так называемые раннюю и позднюю фазы заболевания из-за кумулятивных эффектов начальной полиурии, вторичной по отношению к гипергликемии, осложненной влиянием окислительного стресса на уротелий и нервным повреждением в долгосрочной перспективе естественного течения болезни. сахарного диабета. На ранней стадии ДБД мочевой пузырь гиперактивен, что приводит к СНМП, состоящим в основном из ноктурии и позывов к недержанию мочи. Позже по ходу заболевания гладкие мышцы детрузора становятся атоничными, аномально растянутыми, а недержание мочи в основном возникает из-за переполнения, связанного с плохим контролем сфинктеров уретры, и проблемы с мочеиспусканием берут верх [178].
Физиология DSM также включает циклические нуклеотиды и активацию протеинкиназ. Сокращения DSM являются следствием холинергических сокращений и снижения опосредованной β-адренорецепторами релаксации [179]. DSM содержит гетерогенную популяцию подтипов мускариновых рецепторов [180, 181], с преобладанием подтипа M2 и меньшей популяцией рецепторов M3. Однако функциональные исследования показали, что рецепторы M3 ответственны за стимулирование сокращения в DSM нескольких животных моделей [182–185] и у людей [186, 187].Активация мускариновых рецепторов M3 в DSM способствует стимуляции фосфолипазы C, активирует PKC и увеличивает образование трифосфата инозитола (IP 3 ) и диацилглицерина (DAG) для высвобождения кальция из внутриклеточных запасов, что приводит к сокращению DSM [87]. Более того, активация рецепторов M2 также косвенно вызывает сокращение DSM, ингибируя продукцию цАМФ, снижая активность PKA и обращая релаксацию, индуцированную β -адренорецепторами [179]. Следовательно, оба механизма способствуют опорожнению мочевого пузыря.
Имеются данные о том, что -независимый путь RhoA / ROCK участвует в регуляции тонуса гладких мышц, изменяя чувствительность сократительных белков к Ca 2+ [77]. Было показано, что этот путь влияет на эректильную функцию in vivo посредством ряда механизмов, включая фосфорилирование миозин-связывающей субъединицы MLC-фосфатазы, что приводит к усилению фосфорилирования миозина. RhoA, член низкомолекулярной группы GTP-связывающих белков Ras (саркомы крысы), опосредует индуцированную агонистами активацию ROCK.Обмен GDP на GTP на RhoA и транслокация RhoA из цитозоля на мембрану являются маркерами его активации и обеспечивают последующую стимуляцию различных эффекторов, таких как ROCK, протеинкиназа N, фосфатидилинозитол-3-киназа и фосфорилирование тирозина [77] . Путь сенсибилизации RhoA / ROCK участвует в регуляции сокращения и тонуса гладких мышц мочевого пузыря у людей и животных [77, 188–191]. Таким образом, изменения в механизмах сокращения или расслабления DSM во время фаз наполнения и опорожнения могут способствовать дисфункции мочевого пузыря.Пациенты с SCD не обследовались на предмет дисфункции мочевого пузыря систематически, но предварительные данные показали, что мыши Berkeley (гомозиготные SS) демонстрируют гипоконтрактильную DSM ex vivo из-за значительного снижения сократительной реакции на мускариновый агонист карбахол и электрическое поле. стимуляция [192]. Эта дисфункция мочевого пузыря может способствовать повышенному риску инфекций мочевыводящих путей, наблюдаемому у пациентов с ВСС.
В эпидемиологическом исследовании 321 ребенка с ВСС, у 7% была задокументированная инфекция мочевыводящих путей (ИМП), у одной трети были рецидивирующие инфекции, а у двух третей — лихорадочные ИМП [193].Как и у нормальных детей, преобладали самки, и обычно культивировали грамотрицательные микроорганизмы, особенно Escherichia coli . Большинство эпизодов грамотрицательной септицемии при ВСС являются вторичными по отношению к ИМП [194]. Более того, ИМП более часты во время беременности у женщин с ВКА или серповидно-клеточными признаками [195–197]. Распространенность ИМП у женщин с ВКА почти в два раза выше, чем у здоровых чернокожих американок. Эта связь, по-видимому, напрямую связана с уровнями HbS, поскольку пациенты с серповидным признаком имеют повышенную распространенность бактериурии, но в меньшей степени, чем пациенты с SCA.Совсем недавно исследование показало, что у группы детей и подростков со SCD было больше симптомов гиперактивного мочевого пузыря, чем у контрольной группы [198]. Это может быть первым документом о клинически очевидной ранней фазе серповидно-клеточной дисфункции мочевого пузыря, но еще предстоит продемонстрировать наличие поздней гипотонической фазы мочевого пузыря у пожилых серповидно-клеточных взрослых.
Наличие повышенного внутрикавернозного давления, связанного с усиленной реакцией релаксации кавернозного тела (приапизм), опосредованной сигнальным путем NO-cGMP, отсутствие RhoA / ROCK-опосредованной вазоконстрикции у серповидноклеточных трансгенных мышей Беркли и связь приапизма с мочеполовой системой инфекции и задержка мочи также предполагают возможность того, что изменения реактивности DSM могут вносить вклад в урогенитальные осложнения при SCD [36, 38–40, 192].Несмотря на успехи в понимании урогенитальных расстройств при ВСС, дальнейшие исследования должны прояснить патофизиологические механизмы, лежащие в основе мочеполовых проявлений ВСС.
7. Выводы
Урогенитальные расстройства при ВСС являются результатом плеотропных эффектов продукции аномального серповидного гемоглобина S. Хотя приапизм все еще выделяется как наиболее часто встречающийся, современные знания о влиянии продукции циклических нуклеотидов и активации протеинкиназы позволяют заподозрить недостаточную диагностику дисфункции мочевого пузыря и гипогонадизма вследствие недостаточности яичек.Более того, несмотря на наше растущее понимание этих осложнений, адекватные, эффективные и хорошо переносимые методы лечения по-прежнему недоступны, а пациенты мужского пола продолжают страдать от бесплодия и эректильной дисфункции. Дальнейшая работа, как клинические оценки, так и экспериментальные исследования в этой области, являются многообещающими и должны помочь повысить осведомленность врачей о важности более точных диагнозов, разработать улучшенные терапевтические стратегии и, в конечном итоге, улучшить качество жизни пациентов с ВСС.
Аббревиатуры
| АФК: | Активные формы кислорода | |
| NO: | Оксид азота | |
| цАМФ: | Циклический аденозинмонофосфат | c-монофосфат |
| cGMP: | Циклический гуанозинмонофосфат; | |
| PKG: | Циклическая гуанозинмонофосфат протеинкиназа; | |
| PKC: | Протеинкиназа C. |
.
Серповидноклеточная анемия — Медицинская биохимия Страница
Генетика серповидноклеточной анемии
Мутации в генах глобина, которые изменяют состав белка, но не обязательно степень экспрессии, называются качественными мутациями. Из мутаций, приводящих к качественным изменениям гемоглобина, наиболее распространенной является миссенс-мутация в гене β-глобина, вызывающая серповидно-клеточную анемию. Мутация, вызывающая серповидно-клеточную анемию, представляет собой замену одного нуклеотида (от A до T) в кодоне аминокислоты 6.Это изменение превращает кодон глутаминовой кислоты (GAG) в кодон валина (GTG). Форма гемоглобина у людей с серповидно-клеточной анемией обозначается как HbS. Номенклатура нормального белка гемоглобина взрослого человека — HbA 1 . Взрослые эритроциты также несут другую второстепенную форму взрослого гемоглобина (около 2% от общего количества), идентифицированную как HbA 2 . Гетеротетрамер HbA 1 состоит из двух пептидов α-глобина и двух пептидов β-глобина. Гетеротетрамер HbA 2 состоит из двух пептидов α-глобина и двух пептидов δ-глобина.Кластер генов β-глобина человека содержит несколько генов, чья ориентация с 5 ‘на 3’ на хромосоме 11 отражает онтогенез их экспрессии от эмбрионального глобина [ген эпизилона (ε)] до β-глобина плода [гены gammaG (γG) и γA. ], взрослому β-глобину [слабо дельта (δ) ген, за которым следует β ген]. Ген β-глобина (HBB) расположен в 11p15.5 и состоит из 3 экзонов, которые кодируют белок из 147 аминокислот.
Основная проблема серповидно-клеточной анемии заключается в том, что валин для замещения глутаминовой кислоты приводит к образованию тетрамеров гемоглобина, которые собираются в массивы при дезоксигенации в тканях.Эта агрегация приводит к деформации эритроцита в серповидную форму, что делает его относительно негибким и неспособным проходить через капиллярные русла. Это структурное изменение в красных кровяных тельцах можно легко увидеть под световой микроскопией, и оно является источником названия этого заболевания. Повторяющиеся циклы оксигенации и деоксигенации приводят к необратимому серповидному поражению.
Серповидно-клеточная анемия — аутосомно-рецессивное заболевание. Это означает, что для полного проявления симптомов болезни у человека они должны нести две копии (гомозиготный генотип = SS) гена HbS.Однако люди, которые являются гетерозиготными (генотип = AS), имеют так называемый серповидноклеточный признак, фенотипически доминантный признак. Хотя пациенты с АС клинически нормальны, их красные кровяные тельца могут вызывать серп при очень низком давлении кислорода, например на большой высоте в самолетах с пониженным давлением в салоне. Из-за этого феномена индивидуумы с AS демонстрируют фенотипическое преобладание, но при этом генотипически рецессивны.
Патофизиология серповидной анемии
Серповидно-клеточная анемия характеризуется стойкими эпизодами гемолитической анемии и возникновением острых эпизодов, называемых серповидными кризами.Серповидные эритроциты приводят к закупорке тонких капилляров. Кроме того, из-за этих повторяющихся васкулярно-окклюзионных эпизодов возникает ряд осложнений. Поскольку снижение кровотока особенно влияет на кости, возникают частые и сильные боли в костях. Это типичный симптом во время серповидно-клеточного криза. В долгосрочной перспективе периодическое закупоривание капиллярного русла приводит к повреждению внутренних органов, в частности, почек, сердца и легких. Непрерывное разрушение серповидных эритроцитов приводит к хронической анемии и эпизодам гипербилирубинемии.
Серповидно-клеточная анемия обычно проявляется в младенчестве, хотя более легкие случаи проявляются только в более позднем возрасте. Характерными проявлениями являются задержка развития, повторяющиеся инфекции и повторяющиеся приступы болезненного синдрома кистей и стоп, называемого дактилитом. Для этого симптома характерно внезапное появление болезненного отека на спине (тыльной стороне) кистей и стоп. Новорожденные будут бледными, с легкой желтухой (желтухой), видимой в склере глаз, и селезенка будет прощупываться.Клиническое течение серповидно-клеточной анемии варьируется даже у больных из одного родства.
Дети с серповидно-клеточной анемией имеют повышенную восприимчивость к инфекциям, вызванным Streptococcus pneumonia , Salmonella и Hemophilus influenza . Повышенная склонность к инфекции приводит к нарушению функции селезенки, напоминающему инфекции у детей, которым удалили селезенку по другим причинам. Пневмококковая пневмония и сепсис — самые разрушительные последствия серповидно-клеточной анемии.Септицемия и шок — частая причина смерти, особенно у младенцев и в детстве.
.
