Рентгенодиагностика острого и хронического неспецифического воспаления костно-суставного аппарата. Лекция Текст научной статьи по специальности «Клиническая медицина»
Перейти в содержание Вестника РНЦРР МЗ РФ N12.
Текущий раздел: Лекции
Рентгенодиагностика острого и хронического неспецифического воспаления костносуставного аппарата.
Жарков П.Л.
ФГБУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития РФ, г.Москва.
Адрес документа для ссылки: http://vestnik.rncrr.ru/vestnik/v12/papers/zhar_v12.htm Статья опубликована 29 сентября 2012 года.
Контактная информация:
Рабочий адрес: 117997, Москва, ГСП-7, ул. Профсоюзная, д. 86, ФГБУ «РНЦРР»
Жарков Павел Львович — д.мн., профессор.
Контакты:Автор — Жарков П.Л.,
Адрес: 107113, Москва, Сокольнический вал, 40, кв. 39, 8-916-545-60-79.
E-mail: [email protected]
Резюме
Диагностика воспалительных поражений костей, суставов, позвоночника представляет определённые трудности, особенно в настоящее время, когда антибактериальное лечение нередко начинают до установления окончательного диагноза. Серьёзные трудности возникают и при дифференциальной диагностике с дистрофическими и опухолевыми процессами. В статье представлены рентгенологические признаки наиболее часто встречающихся неспецифических воспалительных заболеваний костей, суставов, позвоночника.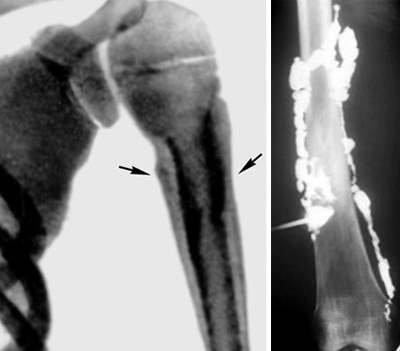
Ключевые слова: рентгенодиагностика, неспецифическое воспаление кости, сустава, позвоночника.
X-ray diagnostics of acute and chronic non-specific inflammation of bones and joints. Zharkov P.L.
Federal State Budget Establishment Russian Scientific Center of Roentgenoradiology (RSCRR) of Ministry of Health and Social Development of Russian Federation, Moscow
Summary
Diagnostics of inflammatory diseases of bones, joints, spine present certain difficulties, especially now when antibacterial treatment often begins before the establishment of the definitive diagnosis. Serious difficulties arise also in differential diagnostics of those diseases with dystrophic processes and tumors. The radiological signs of the commonest skeletal inflammatory diseases are presented.
Оглавление:
Введение
Воспалительные заболевания костей (остеомиелит)
Воспалительные заболевания суставов (артриты)
Воспалительные заболевания позвоночника (спондилит)
Выводы
Список литературы
Введение
Изложенные в настоящей статье данные основаны на полувековом опыте работы автора в диагностике заболеваний опорно-двигательной системы.
Воспаление — местная реакция ткани на любое её повреждение (механическое, электрическое, термическое, химическое, микробное — в конечном счете, тоже химическое). Эта местная реакция находится под коррекцией общей реактивности организма.
Эта местная реакция находится под коррекцией общей реактивности организма.
Проявляется местная реакция клеточным (инфильтрат) и экссудативным компонентами. В данном сообщении речь пойдёт лишь о воспалительных процессах, вызванных кокковой инфекцией, а также о воспалении в костях неясной, но предположительно инфекционной этиологии.
В кости воспалительный процесс любой этиологии развивается в костном мозге. Поэтому любое воспаление в кости является остеомиелитом. В опорно-двигательной системе воспалением, в основном, поражаются кости, суставы и позвоночный столб. Соответственно мы и рассмотрим поражение кости (остеомиелит), сустава (артрит) и позвоночника (спондилит).
Перейти в оглавление статьи >>>
Воспалительные заболевания костей (остеомиелит)
Кокковый остеомиелит. Острый кокковый остеомиелит принято называть неспецифическим, хотя его можно уверенно распознать с помощью рентгенологического исследования, клинического течения и лабораторных данных, то есть на основании присущих именно ему специфических симптомов. Острое начало, высокая температура, тяжелое общее состояние, изменения формулы крови, свидетельствующие об инфекционном заболевании, а затем и местные симптомы — локальные боли и болезненность, повышение
местной температуры и покраснение кожи, припухлость позволяют заподозрить гнойный процесс в скелете. Поражаются обычно метафизы трубчатых костей с тенденцией распространения воспаления в сторону диафиза [8; 1; 13; 5; 9; 2]. Рентгенография, выполненная в течение первой недели заболевания, не обнаруживает каких-либо изменений. Лишь к концу второй — началу третьей недели удается выявить местный (локальный) остео-пороз, нежные периостальные наслоения, а иногда и один или несколько мелких деструктивных очажков в метафизе кости (рис.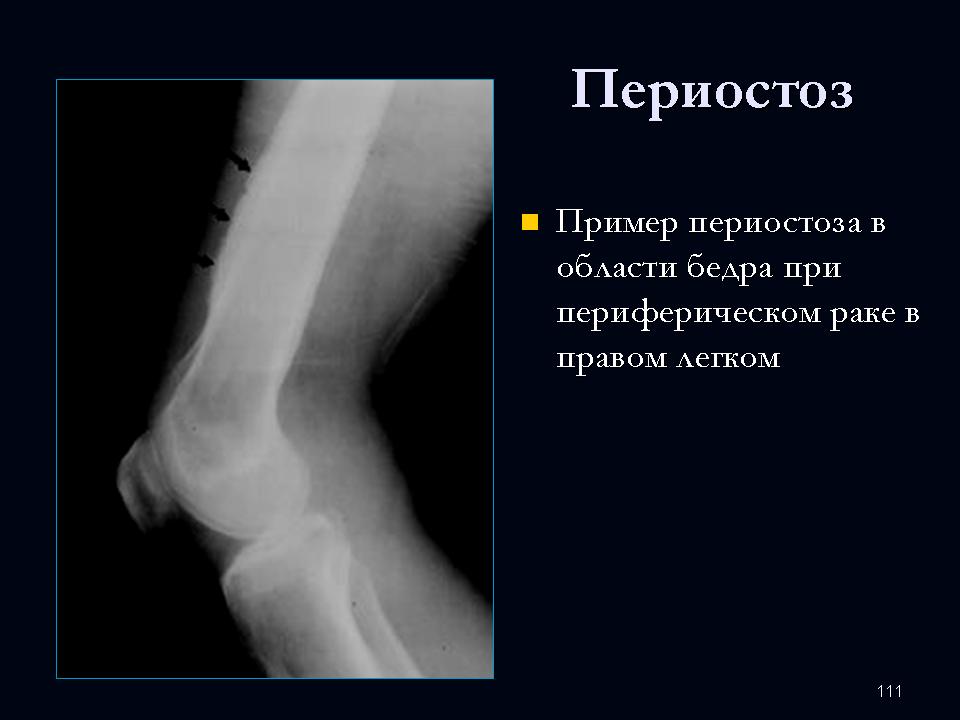 1а).
1а).
Рис.1. а) Начало коккового остеомиелита. Неоднородный местный остеопороз метафиза плечевой кости. б) Тот же больной через 1 месяц. Разгар остеомиелита.
Множество очагов деструкции в метафизе плечевой кости, окружённых диффузным остеосклерозом. Плечевая кость утолщена за счёт массивных периостальных наслоений. Намечаются участки кортикальных секвестров. в) Тот же больной ещё через 2 месяца. Путём массированного антибактериального лечения (инъекции в ягодичные области) процесс приостановлен и переведён в хронический. Кость утолщена, резко склерозирована, на фоне остеосклероза видны множественные остаточные деструктивные очаги.
Периостальные наслоения и очаги деструкции лучше выявляются при их краеобразующем положении. Поэтому для их выявления необходимы рентгенограммы как минимум в двух проекциях. У маленьких детей линейные периостальные наслоения в области мета-диафиза, идущие параллельно наружному контуру кости, можно обнаружить уже в конце первой недели. В дальнейшем корковый слой кости представляется разволокнённым, расслоенным, а затем и полностью разрушенным. На этом уровне появляются новые периостальные напластования, за счёт которых кость постепенно утолщается [3; 5; 12].
В конце второй — начале третьей недели очаги деструкции становятся отчётливо видимыми. Надкостница реагирует на воспаление активизацией костеобразования. При этом сама надкостница не воспаляется. На этой стадии процесс сопровождается регионарным остеопорозом, который более наглядно выявляется на компьютерных томограммах [6].
На четвертой неделе вокруг деструктивных очагов появляется остеосклероз, распространённость и интенсивность которого постепенно нарастает и приобретает характер диффузного. Распространённый диффузный остеосклероз является характерным признаком коккового остеомиелита и свидетельствует о запоздалом или неправильном лечении и угрозе перехода процесса в хроническую форму.
С прогрессированием заболевания на фоне склерозированной кости появляются новые очаги деструкции, а затем и краевые секвестры. Для коккового остеомиелита характерны кортикальные секвестры, которые имеют вид краевых плотных костных фрагментов вытянутой формы, величина которых варьирует в широких пределах от нескольких миллиметров до тотальной секвестрации некротизированного диафиза трубчатой кости (рис.1б). К этому времени вокруг некротизированной кости образуется мощная периостальная коробка, формируемая надкостницей, активно продуцирующей новую кость [4]. Рентгенологическое выявление секвестров имеет большое значение для планирования лечебной тактики, поскольку мёртвые секвестры поддерживают нагноительный процесс и должны быть удалены хирургическим путем. Иногда выявление секвестров на обычных рентгенограммах сопряжено с определенными трудностями, так как на фоне выраженного остеосклероза их можно не увидеть. В подобных случаях помощь может оказать обычная линейная томография, рентгеновская компьютерная томография (РКТ), магниторезонансная томография (МРТ), которые позволяют выявить сравнительно небольшие очаги деструкции и более точно оценить размеры и количество отторгнувшихся некротизированных костных фрагментов. По данным Г.Г. Кармазановского [6] при обычной рентгенографии выявляется не более 80% секвестров, в то время как компьютерная томография обеспечивает выявление секвестров в 100%. При обычной рентгенографии трудно выявляются мелкие секвестры размерами 3-6 мм, окруженные зоной остеосклероза и периостальными наслоениями. Труднее всего выявляются губчатые секвестры, когда плотность окружающих их структур значительно превышает плотность самого секвестра.
Если воспаление в кости полностью не ликвидировано, то продолжает нарастать остеосклероз, на фоне которого возникают новые деструктивные очаги (рис.1в). Но даже при ликвидированном костном воспалении в окружающих мягких тканях он может продолжаться, в них образуются извилистые свищевые ходы, которые прорываются через кожу
наружу.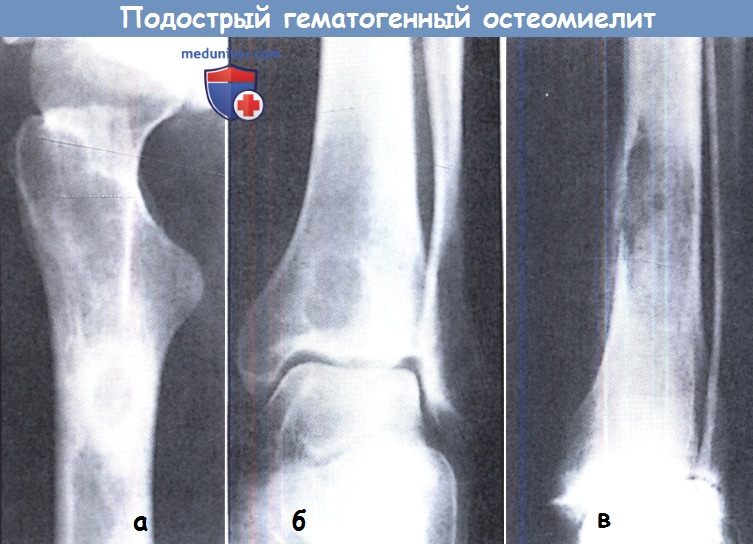 Для правильного хирургического лечения такого процесса необходимо знание количества и топографии свищевых ходов. Для этого необходима высококачественная фистулография, что может быть обеспечено только при условии тугого заполнения всех свищевых ходов (рис. 2), для чего требуется специальный инструментарий [7; 10].
Для правильного хирургического лечения такого процесса необходимо знание количества и топографии свищевых ходов. Для этого необходима высококачественная фистулография, что может быть обеспечено только при условии тугого заполнения всех свищевых ходов (рис. 2), для чего требуется специальный инструментарий [7; 10].
Рис. 2. Фистулография при наличии свищевого отверстия. Извилистый свищевой ход распространяется далеко вверх и вниз в мягких тканях бедра.
Остеомиелиты неясной этиологии
Своеобразием клинических проявлений и рентгенологической картины отличаются первично-хронические формы остеомиелита. К ним . относятся метафизарный абсцесс Броди и склерозирующий диафизарный остеомиелит Гарре. К этой же группе чаще все го относят и так называемую остеоидную остеому, хотя инфекционная природа всех этих поражений пока не установлена.
При своевременно начатом и правильном лечении воспалительный процесс может быть прерван и быстро полностью ликвидирован (рис.3).
Рис.3. Динамика раневого остеомиелита (ранение иглой) у ребёнка 9 лет под влиянием введения антибиотиков в поражённую кость (одна инъекция в день в течение 4 дней). При первом обследовании — припухлость и покраснение кожи в нижней трети предплечья, пальпация резко болезненна, температура тела 37,8 □. а — рентгенограмма через 10 дней после ранения и через 3 дня от начала лечения: лучевая кость на границе средней и нижней трети несколько утолщена, плотность её увеличена за счёт периостальных наслоений; б — через 1 месяц после первой рентгенограммы: клинически — полное затихание процесса, болей нет, температура тела нормальная, анализ крови без патологии, кость стала значительно толще за счёт периостальных наслоений; в — ещё через 1 месяц: клинически — полное выздоровление, пальпация и все нагрузки безболезненны, кость остаётся утолщенной за счёт периостальных наслоений, которые уменьшились в объёме, стали ровными, чёткими; г — ещё через 4 месяца — полная нормализация формы и структуры кости.
Абсцесс Броди чаще встречается у молодых мужчин. Клинически проявляет себя неопределёнными тупыми умеренными болями, иногда небольшой припухлостью на уровне поражения. Обычно локализуется в области метафиза или метаэпифиза длинной трубчатой кости. На первом месте по частоте поражения стоят суставные концы костей, образующих коленный, голеностопный и локтевой суставы. Излюбленной локализацией является большеберцовая кость. Практически никогда не поражаются мелкие и плоские кости. Характерным является ограниченный очаг деструкции правильно округлой или овальной формы, окруженный широкой зоной диффузного остеосклероза (рис.4).
Рис. 4. Первичнохронический остеомиелит Броди. Очаг деструкции в эпиметафизе большеберцовой кости, окружённый широкой зоной диффузного остеосклероза. Клинически — умеренные перемежающиеся боли.
Периостальные наслоения выражены незначительно, но при длительном течении кость может быть утолщена за счет периостальных наслоений. Секвестров не наблюдается.
Диафизарный остеомиелит Гарре чаще встречается у молодых мужчин. Процесс в большинстве случаев локализуется в области диафиза большеберцовой или бедренной кости. Поражённый участок кости веретенообразно утолщается за счет периостальных наслоений, охватывающих кость в виде муфты. Иногда утолщение имеет асимметричный вид. Костномозговой канал сужен или полностью закрыт за счет эндостального остеосклероза. Очагов деструкции и секвестров обычно не бывает (рис. 5).
Рис. 5. Первичнохронический остеомиелит Гарре. Утолщение и уплотнение участка диа-физа большеберцовой кости за счет периостального и эндостального костеобразования.
В мягких тканях определяется твёрдый, неподвижный, соединенный с костью инфильтрат, который нередко принимают за опухоль.
Остеоидная остеома по своим гистологическим проявлениям не укладывается ни в одну группу общепринятых классификаций. По поводу природы этого заболевания нет единой точки зрения. Одни исследователи считают его хроническим очаговонекротическим негнойным остеомиелитом, другие относят к доброкачественным новообразованиям. Морфологически остеоидная остеома представляет собой отграниченное суб-периостальное образование, «гнездо» из беспорядочно переплетающихся слабо обызвествлённых остеоидных балок, пространства между которыми заполнены соединительной тканью клеточно-волокнистого строения с большим количеством мелких тонкостенных сосудов.
Клиническая картина и течение заболевания вполне укладываются в проявления локального воспалительного процесса. Для остеоидной остеомы характерны резкие локальные боли, усиливающиеся по ночам. В области поражения может возникать припухлость мягких тканей и болезненность при пальпации. Однако, в отличие от коккового остеомиелита, при остеоидной остеоме не наблюдается покраснения кожных покровов, не отмечается повышения температуры тела и каких-либо лабораторных сдвигов.
На рентгенограммах выявляется овальной формы краевой очаг деструкции, окруженный зоной диффузного остеосклероза и утолщение кости на уровне очага за счёт периостальных наслоений (рис. 6).
Рис. 6. Остеоидная остеома в диафизе бедренной кости. Выраженное периостальное утолщение задней поверхности кости и диффузный эндостальный остеосклероз, на фоне которого бобовидный очаг деструкции.
После хирургического удаления содержимого очага боли исчезают, а кость в течение нескольких месяцев приобретает нормальную форму и размеры. Рецидивов заболевания и метастазов не описано. Всё это позволило С.А. Рейнбергу [11] отнести эту патологию к остеомиелиту.
Перейти в оглавление статьи >>>
Воспалительные заболевания суставов (артриты)
Артриты — большая группа заболеваний суставов инфекционного, аллергического и смешанного происхождения. В данной статье рассматривается острый кокковый артрит. Острый гнойный кокковый артрит. Попадание инфекции в сустав может происходить тремя путями: 1) заносом микроорганизмов при различных инфекционных заболеваниях, сопровождающихся бактериемией, 2) при непосредственном проникновении в сустав извне при ранениях и 3) переходом воспаления на сустав со стороны гнойного очага вблизи сустава. Последний путь поражения сустава при кокковых остеомиелитах очень редок, тогда как при туберкулёзном остеомиелите он самый частый. При кокковом инфицировании сустава поражается синовиальная оболочка, в которой и протекает воспалительный процесс. Вслед за этим разрушается суставной хрящ, а затем воспаление переходит на кость, что проявляется на рентгенограммах вначале резким сужением суставной щели, а потом контактной деструкцией сочленяющихся костей.
В первой стадии — воспаления синовиальной оболочки — заболевание проявляется высокой температурой, резким ограничением движений в суставе из-за сильной болезненности, изменением крови, характерным для острой гнойной инфекции, припухлостью и покраснением и покраснением кожи в области сустава [9]. Рентгенологическое исследование в первые дни не показывает никаких изменений. Однако, уже на 4-6 день появляется и быстро нарастает остеопороз области сустава, который может достигать такой степени, что при обычных условиях съёмки суставные концы костей могут быть вообще не видны.
Поскольку резчайший остеопороз сохраняется в течение всего периода острого воспаления, то в таких случаях для выявления изображения костей следует резко уменьшить жёсткость излучения (кУ) и увеличить экспозицию (шЛБ). При переходе воспаления на суставные хрящи суставная щель быстро истончается, а затем и вовсе исчезает. Через разрушенные хрящи воспаление распространяется на кости, что на рентгенограммах проявляется разрушением замыкающих пластинок эпифизов сочленяющихся костей, которые становятся неровными, нечётко очерченными, как бы изъеденными. В остром периоде заболевания, когда возможности обычной рентгенографии ограничены из-за резкого остеопо-роза, особенно полезна магниторезонансная томография.
При переходе воспаления на суставные хрящи суставная щель быстро истончается, а затем и вовсе исчезает. Через разрушенные хрящи воспаление распространяется на кости, что на рентгенограммах проявляется разрушением замыкающих пластинок эпифизов сочленяющихся костей, которые становятся неровными, нечётко очерченными, как бы изъеденными. В остром периоде заболевания, когда возможности обычной рентгенографии ограничены из-за резкого остеопо-роза, особенно полезна магниторезонансная томография.
По мере затихания воспаления под воздействием антибактериального или хирургического лечения быстро уменьшается остеопороз и образуется сращение лишённых хряща костей, формируется костный анкилоз (рис. 7).
Рис. 7. Костный анкилоз в коленном суставе после перенесённого гонорейного артрита.
Если антибактериальное лечение гнойного коккового артрита начато рано и проведено правильно, то суставные хрящи могут частично сохраниться. В таких случаях при сохранении движений в дальнейшем развивается артроз с характерным для него сужением суставной щели, субхондральным остеосклерозом, краевыми костными разрастаниями, деформацией суставных отделов сочленяющихся костей.
Компьютерная рентгеновская и магниторезонансная томография значительно расширяют возможности визуализации патологических изменений в суставах. Они позволяют судить о характере суставного выпота, о состоянии суставной капсулы и параартикулярных тканей, о глубине и распространенности костной и хрящевой деструкции [6].
Перейти в оглавление статьи >>>
Воспалительные заболевания позвоночника (спондилит)
Кокковый спондилит возникает в результате заноса инфекции гематогенным путём или при ранениях. Если во втором случае диагностика не представляет никаких трудностей, то при гематогенном инфицировании диагностика далеко не всегда проста. Начинается заболевание как острая общая инфекция с высокой температурой и другими симптомами общей интоксикации. Поэтому не возникает мысли о патологии позвоночника. Если в начальном периоде не проводится антибактериальная терапия, то через несколько дней при шейной локализации возникают боли в шее и болезненное глотание; при грудной локализации — боли в грудном отделе спины; при поясничной локализации — боли в животе. Соответственно резко ограничиваются движения пораженного отдела позвоночника. Боли в животе при поясничной локализации нередко наводят на мысль об «остром животе» и длительным поискам патологии органов брюшной полости. Высокая температура, выраженные симптомы общей интоксикации заставляют, как правило, сразу же применить большие дозы антибиотиков до ликвидации или снижения интенсивности этих симптомов. Однако, ликвидировать полностью местный воспалительный процесс чаще всего не удаётся, и он из острого переводится в хронический. Течение его замедляется, но продолжает неуклонно нарастать, приобретая сходство с туберкулёзным спондилитом [7]. Постепенно на первый план выходят боли при движениях позвоночника и нагрузках на него, что ведёт к необходимости рентгенологического исследования.
Если во втором случае диагностика не представляет никаких трудностей, то при гематогенном инфицировании диагностика далеко не всегда проста. Начинается заболевание как острая общая инфекция с высокой температурой и другими симптомами общей интоксикации. Поэтому не возникает мысли о патологии позвоночника. Если в начальном периоде не проводится антибактериальная терапия, то через несколько дней при шейной локализации возникают боли в шее и болезненное глотание; при грудной локализации — боли в грудном отделе спины; при поясничной локализации — боли в животе. Соответственно резко ограничиваются движения пораженного отдела позвоночника. Боли в животе при поясничной локализации нередко наводят на мысль об «остром животе» и длительным поискам патологии органов брюшной полости. Высокая температура, выраженные симптомы общей интоксикации заставляют, как правило, сразу же применить большие дозы антибиотиков до ликвидации или снижения интенсивности этих симптомов. Однако, ликвидировать полностью местный воспалительный процесс чаще всего не удаётся, и он из острого переводится в хронический. Течение его замедляется, но продолжает неуклонно нарастать, приобретая сходство с туберкулёзным спондилитом [7]. Постепенно на первый план выходят боли при движениях позвоночника и нагрузках на него, что ведёт к необходимости рентгенологического исследования.
На рентгенограммах к этому времени определяется уменьшение высоты или полное отсутствие межпозвонкового диска, разрушение прилежащего к этому диску участка тела одного или чаще двух смежных позвонков. Поражаются практически всегда, как и при туберкулёзе, тела позвонков. При анализе структуры тел поражённых позвонков можно отметить выраженный остеосклероз, что позволяет заподозрить нетуберкулёзную природу заболевания (рис.8).
Рис. 8. Хронический кокковый спондилит. Контактная деструкция в телах 2 и 3 поясничных позвонков, в смежных участках тел поражённых позвонков — диффузный остеосклероз. Высота диска резко уменьшена, но промежуток между телами сохранён благодаря мощным подсвязочным окостенениям по боковым и передней поверхностям сегмента.
Высота диска резко уменьшена, но промежуток между телами сохранён благодаря мощным подсвязочным окостенениям по боковым и передней поверхностям сегмента.
Наряду с разрушением тел позвонков и межпозвонковых дисков выявляются абсцессы, в шейном отделе — превертебральный, в грудном отделе — перифокальный веретёнообраз-ный, в поясничном отделе — псоас-абсцесс. Определяются они в шейном отделе по утолщению превертебральных мягких тканей, которые на рентгенограмме в боковой проекции резко контрастируют с глоткой и гортанью. В грудном отделе веретёнообразная тень абсцесса легко определяется на рентгенограмме в прямой проекции по контрасту с лёгкими (рис. 9).
Рис. 9. Веретёнообразная тень перифокального абсцесса в грудном отделе позвоночника (стрелки).
В поясничном отделе абсцесс распространяется в поясничной мышце, изображение наружного контура которой на рентгенограмме в прямой проекции становится выпуклым и асимметричным при сравнении с симметричной мышцей (рис. 10).
Рис. 10. Спондилит с частичным разрушением межпозвонкового диска Ь3-4 и контактной деструкцией в смежных отделах тел позвонков. Расширены границы поясничных мышц за счёт псоа-абсцессов (стрелки).
Однако получить изображение поясничных мышц далеко не всегда удаётся из-за содержимого кишечника. В таких случаях можно прибегнуть к зонографии или линейной томографии, а где есть возможность — к компьютерной рентгеновской или магниторезонансной. Абсцессы при хроническом кокковом воспалении рентгенологически ничем не отличаются от туберкулёзных [10].
Дифференциальная диагностика вяло текущего, ослабленного антибиотиками хронического коккового спондилита с туберкулёзным процессом на основании только рентгенологических данных практически невозможна. Для этого обязательны данные правильно собранного анамнеза, туберкулиновые пробы, а нередко результаты микробиологического и даже биологического исследований. Причём туберкулиновые пробы имеют значение только при отрицательных показателях.
Для этого обязательны данные правильно собранного анамнеза, туберкулиновые пробы, а нередко результаты микробиологического и даже биологического исследований. Причём туберкулиновые пробы имеют значение только при отрицательных показателях.
Перейти в оглавление статьи >>>
Выводы
Подводя итог, можно сформулировать основные признаки коккового воспаления в опорно-двигательной системе, представив их в виде таблицы (Табл. 1).
Табл. 1. Основные диагностические признаки коккового воспаления
Кости (остит) Сустава (артрит) Позвоночника (спондилит)
1. Острое начало с высокой температурой 1. Острое начало с высокой температурой 1. Острое начало с высокой температурой
2. Выраженное увеличение СОЭ и лейкоцитоз 2. Выраженное увеличение СОЭ и лейкоцитоз 2. Выраженное увеличение СОЭ и лейкоцитоз
3. Боль в области поражённой кости 3. Боль в области поражённого сустава 3. Боль в области поражённого сегмента позвоночника
4. Очаги деструкции в метафизе 4. Резкое ограничение движений в суставе из-за болезненности 4. Резкое ограничение движений позвоночника из-за болезненности
5. Нечёткие контуры очагов деструкции 5. Утолщение мягких тканей области сустава (на рентгенограммах, РКТ, МРТ) 5. Уменьшение высоты межпозвонкового диска (на рентгенограмме)
6. Местный остеопороз вокруг очагов деструкции 6. Сужение суставной щели 6. Очаги деструкции в одном или смежных участках тел позвонков
5. 7. Появление и быстрое нарастание остеосклероза вокруг очагов деструкции 7. Нечёткие контуры суставных поверхностей сочленяющихся костей 7. Нечёткие контуры поражённых поверхностей
7. Появление и быстрое нарастание остеосклероза вокруг очагов деструкции 7. Нечёткие контуры суставных поверхностей сочленяющихся костей 7. Нечёткие контуры поражённых поверхностей
8. Распространение процесса в сторону диафиза 8. Бурное течение с исходом в костный анкилоз 8. Отсутствие всяких движений в поражённом сегменте при функциональном исследовании
9. Появление превертебраль-ного абсцесса в шейном, пе-рифокального в грудном, псо-ас-абсцесса в поясничном отделе
10. Острое течение при кокковом спондилите и у детей , и у взрослых
11. Вялое, хроническое течение при кокковом спондилите в случае рано начатого антибактериального лечения
Перейти в оглавление статьи >>>
Список литературы:
1. Войно-Ясенецкий В. Ф. Очерки гнойной хирургии. — М.: Медгиз. 1956. 626 с.
2. ГорбылевМ.Н., Алборов О.И., Ильин А.И., Белова Т.А. Хронический остеомиелит у детей.- Владимир: 1997. 92 с.
3. ГринёвМ.В. Остеомиелит. — Л.: 1977. 152 с.
4. ЖитницкийР.Е., Виноградов В.Г., Шапурма Д.Г. Хронический травматический остеомиелит длинных костей. — Иркутск: 1989. 108 с.
5. Зедгенидзе Г.А., Жарков П.Л. Клиническая рентгено-радиология. — М.: Медицина,
1984, Т.3, гл. 7.
6. Кармазановский Г.Г. Компьютернотомографическая диагностика при хирургическом лечении хронического остеомиелита нижних конечностей и таза — Автореф.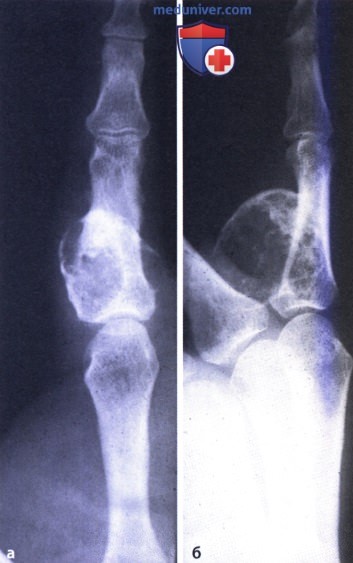 дис. докт. мед. наук: М. 1995.
дис. докт. мед. наук: М. 1995.
7. Корнев П.Г. Хирургия костно-суставно го туберкулёза. — Л.: 1971.
8. Лагунова И.Г. Рентгенологическая картина первичнохронического остеомиелита длинных трубчатых костей. // В кн.: Вопросы рентгенологии, С.161 — 166. — М.: 1952.
9. Мерзликин Н.В. Острый гематогенный остеомиелит. Хронический остеомиелит. Гнойные артриты. // В кн. Избранные лекции по клинической хирургии С. 148-201. -Томск: 2008.
10. Райлло И.В., Бекзадян Г.Р. Абсцессо- и фистулография при нагноительных осложнениях туберкулёзного спондилита // В кн. Хирургия туберкулёзного спондилита. С.13-14. — Л.:1961.
11. Рейнберг С.А. Рентгенодиагностика заболеваний костей и суставов. — М.: 1964.
12. Усик С.Ф., Федосеев М.М., Братийчук А.Н., Анипченко А.Н. Остеомиелит: клиника, диагностика, лечение. Уч. пос. 96 с.- Саратов: 2007.
13. Чаклин В.Д. Острый гематогенный остеомиелит. // Ортоп., травмат. и протезир.. 1966, № 11. С. 3-12.
Перейти в оглавление статьи >>>
КБК 1999-7264 © Вестник РНЦРР Минздрава России © Российский научный центр рентгенорадиологии Минздрава России
N.N. Priorov Journal of Traumatology and OrthopedicsN.N. Priorov Journal of Traumatology and Orthopedics0869-86782658-6738Eco-vector4769910.17816/vto201522346-53Original ArticleCarbonic Nano-Structural Grafts — Innovation Product for Traumatology and Orthopaedics.Part 1: Experimental Study ResultsMironovS. P-ShevtsovV. I-KononovichN. A-StepanovM. A-GorbachE. N-GolubevG. Sh-SergeevK. S-ArkhipenkoV. I-Grin’A. A-SkryabinV. L-ReznikL. B-ShatokhinV. D-BaimuratovA. A-Central Institute of Traumatology and Orthopaedics named after N.N. Priorov, MoscowRussian Ilizarov Scientific Center for Restorative Traumatology and Orthopaedics, KurganRostov State Medical University, Rostov-on-DonPerm State Medical Academy, Perm’Omsk State Medical Academy, Omsk15092015223465320102020Copyright © 2015, Eco-Vector2015Study of the general organism response to carbonic nano-structural grafts, their osteoinductive properties, possibilities of bone defects substitution and acceleration of the distraction regenerate formation was performed. Four series of experiments were performed on 69 animals (Chinchilla rabbits and adult mongrel dogs). Laboratory and roentgenologic data showed that study grafts possessed pronounced osteoconductive properties, were not toxic and did not cause rejection response. Their application ensured the formation of strong osteo-carbonic block at the interface bone-implant. Distraction regenerate achieved required strength in 37 days after carbonic graft implantation into the bed formed in the regenerate. That enabled to discontinue external fixation with the apparatus.carbonic nano-structural graftsexperimentroentgenographytransosseous osteosynthesis by Ilizarovdistractionregenerateуглеродные наноструктурные имплантатыэкспериментрентгенографиячрескостный остеосинтез по Илизаровудистракциярегенерат1.Алабут А.В. Экспериментально-клиническое обоснование применения конструкций из никелида титана в травматологии и ортопедии: Дис. … канд. мед. наук. Ростов-на-Дону. 2003.2.Мюллер М.Е., Алльговер М., Шнайдер Р., Виллинеггер X. Руководство по внутреннему остеосинтезу. М.: Ad Margineum; 1996.3.Вильямс Р. Имплантаты в хирургии. М.: Медицина; 1978.4.Костиков В.И., Варенков А.И. Сверхвысокотемпературные композиционные материалы. М.: Интермет Инжиниринг; 2003.5.5. Schröder J. Use of polymethylmethacrylate (PMMA). Spine (Phila Pa 1976). 2001; 26 (23): 2638.6.Benson J.
S-ArkhipenkoV. I-Grin’A. A-SkryabinV. L-ReznikL. B-ShatokhinV. D-BaimuratovA. A-Central Institute of Traumatology and Orthopaedics named after N.N. Priorov, MoscowRussian Ilizarov Scientific Center for Restorative Traumatology and Orthopaedics, KurganRostov State Medical University, Rostov-on-DonPerm State Medical Academy, Perm’Omsk State Medical Academy, Omsk15092015223465320102020Copyright © 2015, Eco-Vector2015Study of the general organism response to carbonic nano-structural grafts, their osteoinductive properties, possibilities of bone defects substitution and acceleration of the distraction regenerate formation was performed. Four series of experiments were performed on 69 animals (Chinchilla rabbits and adult mongrel dogs). Laboratory and roentgenologic data showed that study grafts possessed pronounced osteoconductive properties, were not toxic and did not cause rejection response. Their application ensured the formation of strong osteo-carbonic block at the interface bone-implant. Distraction regenerate achieved required strength in 37 days after carbonic graft implantation into the bed formed in the regenerate. That enabled to discontinue external fixation with the apparatus.carbonic nano-structural graftsexperimentroentgenographytransosseous osteosynthesis by Ilizarovdistractionregenerateуглеродные наноструктурные имплантатыэкспериментрентгенографиячрескостный остеосинтез по Илизаровудистракциярегенерат1.Алабут А.В. Экспериментально-клиническое обоснование применения конструкций из никелида титана в травматологии и ортопедии: Дис. … канд. мед. наук. Ростов-на-Дону. 2003.2.Мюллер М.Е., Алльговер М., Шнайдер Р., Виллинеггер X. Руководство по внутреннему остеосинтезу. М.: Ad Margineum; 1996.3.Вильямс Р. Имплантаты в хирургии. М.: Медицина; 1978.4.Костиков В.И., Варенков А.И. Сверхвысокотемпературные композиционные материалы. М.: Интермет Инжиниринг; 2003.5.5. Schröder J. Use of polymethylmethacrylate (PMMA). Spine (Phila Pa 1976). 2001; 26 (23): 2638.6.Benson J. Elemental carbon as a biomaterial. J. Biomed. Material Res. 1971; 5: 41-7.7.Bokros D.S. Carbon in Medical Devices. II Ceramics international congress. 1983; 9 (1): 3-7.8.Гордеев С.К. Углеродные нанокомпозиционные материалы из наноалмаза: получение и свойства. Сверхтвердые материалы. 2002; 6: 60-79.9. Медик В.А., Гордеев С.К., Киселев О.И. Использование углерода в медицине. СПб-Нижний Новгород; 2012.10.10. Акт №25032981-14 Сертификационного исследовательского центра оценки результатов технических испытаний медицинских изделий «Имплантатов углеродных наноструктурных». СПб; 2014.11.11. Головин Р.К. Клинико-экспериментальное изучение эффективности применения рентгено-контрастного углеродного материала при реконструктивно-восстановительных операциях в челюстно-лицевой области. Дис. … канд. мед. наук. М.; 2005.12.12. Золкин П.И., Кавалерский Г.М., Середа А.П., Аберяхимов Х.М., Алтуфьев А.В., Бережнова А.А. Углеродный эндопротез тазобедренного сустава. Гений ортопедии. 2015; 2: 32-5.13.13. Набиев Ф.Х. Клинико-экспериментальное обоснование применения углеродсодержащих материалов в челюстно-лицевой хирургии: Дис. … д-ра мед. наук. М.; 1997.14.Штраубе Г.И. Применение имплантатов из углерода в челюстно-лицевой хирургии (клинико-экспериментальное исследование): Автореф. дис. … д-ра мед. наук. Пермь; 2001.15.Юмашев Г.С., Костиков В.И., Мусалатов Х.А., Янушевский А.В. и др. Применение углеродных имплантатов в травматологии и ортопедии. В кн.: Сборник научных трудов «Эндопротезирование в травматологии и ортопедии». Саратов; 1987: 3.16.Ekstrand K., Ruyter J.E., Wellendorf H. Carbon/graphite fiber reinforced poly (methylmethacrylate): properties under dry and wet conditions. J. Biomed. Mater. Res. 1987; 21 (9): 1065-80.
Elemental carbon as a biomaterial. J. Biomed. Material Res. 1971; 5: 41-7.7.Bokros D.S. Carbon in Medical Devices. II Ceramics international congress. 1983; 9 (1): 3-7.8.Гордеев С.К. Углеродные нанокомпозиционные материалы из наноалмаза: получение и свойства. Сверхтвердые материалы. 2002; 6: 60-79.9. Медик В.А., Гордеев С.К., Киселев О.И. Использование углерода в медицине. СПб-Нижний Новгород; 2012.10.10. Акт №25032981-14 Сертификационного исследовательского центра оценки результатов технических испытаний медицинских изделий «Имплантатов углеродных наноструктурных». СПб; 2014.11.11. Головин Р.К. Клинико-экспериментальное изучение эффективности применения рентгено-контрастного углеродного материала при реконструктивно-восстановительных операциях в челюстно-лицевой области. Дис. … канд. мед. наук. М.; 2005.12.12. Золкин П.И., Кавалерский Г.М., Середа А.П., Аберяхимов Х.М., Алтуфьев А.В., Бережнова А.А. Углеродный эндопротез тазобедренного сустава. Гений ортопедии. 2015; 2: 32-5.13.13. Набиев Ф.Х. Клинико-экспериментальное обоснование применения углеродсодержащих материалов в челюстно-лицевой хирургии: Дис. … д-ра мед. наук. М.; 1997.14.Штраубе Г.И. Применение имплантатов из углерода в челюстно-лицевой хирургии (клинико-экспериментальное исследование): Автореф. дис. … д-ра мед. наук. Пермь; 2001.15.Юмашев Г.С., Костиков В.И., Мусалатов Х.А., Янушевский А.В. и др. Применение углеродных имплантатов в травматологии и ортопедии. В кн.: Сборник научных трудов «Эндопротезирование в травматологии и ортопедии». Саратов; 1987: 3.16.Ekstrand K., Ruyter J.E., Wellendorf H. Carbon/graphite fiber reinforced poly (methylmethacrylate): properties under dry and wet conditions. J. Biomed. Mater. Res. 1987; 21 (9): 1065-80.
Периостит — это… Что такое Периостит?
воспаление надкостницы. Обычно начинается во внутреннем или наружном ее слое и распространяется затем на остальные слои. Вследствие тесной связи между надкостницей (периостом) и костью воспалительный процесс легко переходит с одной ткани на другую (остеопериостит).
По клиническому течению П. делят на острый (подострый) и хронический; по патологоанатомической картине, а отчасти и по этиологии — на простой, фиброзный, гнойный, серозный, оссифицирующий, туберкулезный, сифилитический.
Простой периостит — острый асептический воспалительный процесс, при котором наблюдаются гиперемия, незначительное утолщение и инфильтрация надкостницы. Развивается после ушибов, переломов (травматический П.), а также вблизи воспалительных очагов, локализующихся, например, в кости, мышцах. Сопровождается болями и припухлостью на ограниченном участке. Чаще всего поражается надкостница на участке костей, слабо защищенных мягкими тканями (например, передняя поверхность большеберцовой кости). Воспалительный процесс большей частью быстро стихает, но иногда может привести к возникновению фиброзных разрастаний или отложению солей кальция и новообразованию костной ткани (развитию остеофитов), т.е. переходит в оссифицирующий периостит.
Фиброзный периостит развивается постепенно и течет хронически. Он возникает под влиянием длящихся годами раздражений и проявляется мозолистым фиброзным утолщением надкостницы, плотно спаянным с костью. Наблюдается, например, на большеберцовой кости в случаях хронической язвы голени, при некрозе кости, хроническом воспалении суставов и др. Значительное развитие фиброзной ткани может привести к поверхностному разрушению кости. В некоторых случаях при большой продолжительности процесса отмечается новообразование костной ткани. После устранения раздражителя обычно наблюдается обратное развитие процесса.
Гнойный периостит развивается обычно в результате инфицирования при ранении надкостницы, проникновения в нее инфекции из соседних органов (например, П. челюсти при кариесе зубов), а также гематогенным путем (например, метастатический П. при пиемии). При метастатическом П. обычно поражается надкостница какой-либо длинной трубчатой кости (чаще всего бедра, большеберцовой кости, плечевой кости) или одновременно нескольких костей. Гнойный П. — обязательный компонент острого гнойного Остеомиелита. Встречаются случаи гнойного П., при которых не удается обнаружить источник инфекции.
Гнойный П. — обязательный компонент острого гнойного Остеомиелита. Встречаются случаи гнойного П., при которых не удается обнаружить источник инфекции.
Гнойный П. начинается с гиперемии надкостницы, появления в ней серозного или фибринозного экссудата. Затем наступает гнойная инфильтрация надкостницы, и она легко отделяется от кости. Рыхлый внутренний слой периоста пропитывается гноем, который затем скапливается между периостом и костью, образуя субпериостальный абсцесс. При значительном распространении процесса периост отслаивается на значительном протяжении, что может привести к нарушению питания кости и поверхностному ее некрозу. Некрозы, захватывающие целые участки кости или всю кость, образуются лишь тогда, когда гной проникает в костномозговые полости. Воспалительный процесс может остановиться в своем развитии (особенно при своевременном удалении гноя или при самостоятельном прорыве его наружу через кожу) или перейти на окружающие мягкие ткани (см. Флегмона) и на вещество кости (см. Остит).
Начало гнойного П. обычно острое, с повышением температуры до 38—39°, ознобами и увеличением числа лейкоцитов в крови (до 10,0—15,0․109 /л). В области очага поражения отмечаются сильные боли, прощупывается болезненная припухлость. При продолжающемся скоплении гноя обычно вскоре удается отметить флюктуацию; в процесс могут быть вовлечены окружающие мягкие ткани и кожа. Течение процесса в большинстве случаев острое, хотя и отмечаются случаи первично-затяжного, хронического течения, особенно у ослабленных больных. Иногда наблюдается стертая клиническая картина без высокой температуры и выраженных местных явлений.
Выделяют злокачественный, или острейший, П., при котором экссудат быстро становится гнилостным; набухшая, серо-зеленого цвета, грязного вида надкостница легко рвется, распадается. В кратчайший срок кость лишается надкостницы и окутывается слоем гноя. После прорыва периоста гнойный или гнойно-гнилостный воспалительный процесс переходит по типу флегмоны на окружающие мягкие ткани.
Злокачественный П. может сопровождаться септикопиемией (см. Сепсис).
Серозный альбумниозный периостит — воспалительный процесс в надкостнице с образованием экссудата, скапливающегося поднадкостнично и имеющего вид серозно-слизистой (тягучей) жидкости, богатой альбуминами. Экссудат окружен грануляционной тканью коричнево-красного цвета. Снаружи грануляционная ткань вместе с экссудатом покрыта плотной оболочкой и напоминает кисту, которая при локализации на черепе может симулировать мозговую грыжу. Количество экссудата иногда достигает 2 л. Он обычно находится под надкостницей или в виде кистевидного мешка в самой надкостнице, может даже скапливаться на ее наружной поверхности; в последнем случае наблюдается разлитое отечное припухание окружающих мягких тканей. Если экссудат находится под надкостницей, она отслаивается, кость обнажается и может наступить ее некроз — образуются полости, заполненные грануляциями, иногда с мелкими секвестрами.
Процесс локализуется обычно в концах диафизов длинных трубчатых костей, чаще всего бедренной кости, реже костей голени, плечевой кости, ребер; заболевают обычно юноши. Часто П. развивается после травмы. Появляется болезненная припухлость, температура тела вначале повышается, но вскоре становится нормальной. При локализации процесса в области сустава может наблюдаться нарушение его функции. Вначале припухлость имеет плотную консистенцию, но с течением времени она может размягчаться и более или менее явственно флюктуировать. Течение подострое или хроническое.
Оссифицирующий периостит — частая форма хронического воспаления надкостницы, которая развивается при длительных раздражениях периоста и характеризуется образованием новой кости из гиперемированного и интенсивно пролиферирующего внутреннего слоя периоста. Этот процесс может быть самостоятельным или, чаще, сопровождает воспаление в окружающих тканях. Оссифицирующий П. развивается в окружности воспалительных или некротических очагов в кости (например, остеомиелита), под хроническими варикозными язвами голени, в окружности воспалительно-измененных суставов, туберкулезных очагов в кортикальном слое кости. Выраженный оссифицирующий П. наблюдается при сифилисе. Известно развитие реактивного оссифицирующего П. при опухолях костей, рахите. Явления оссифицирующего генерализованного П. характерны для Бамбергера — Мари периостоза, могут присоединяться к кефалгематоме (Кефалгематома).
Выраженный оссифицирующий П. наблюдается при сифилисе. Известно развитие реактивного оссифицирующего П. при опухолях костей, рахите. Явления оссифицирующего генерализованного П. характерны для Бамбергера — Мари периостоза, могут присоединяться к кефалгематоме (Кефалгематома).
По прекращении раздражений, вызывающих явления оссифицирующего П., дальнейшее костеобразование останавливается; в плотных компактных остеофитах может произойти внутренняя перестройка кости (медуллизация), и ткань принимает характер спонгиозной кости. Иногда оссифицирующий П. ведет к образованию синостозов, чаще всего между телами соседних позвонков, между берцовыми костями, реже между костями запястья и предплюсны.
Туберкулезный периостит чаще всего локализуется на ребрах и костях лицевого черепа, где он в значительном числе случаев является первичным. Процесс часто встречается в детском возрасте. Течение туберкулезного П. хроническое, зачастую с образованием свищей, выделением гноевидных масс.
Сифилитический периостит. Большинство поражений костной системы при сифилисе начинается и локализуется в надкостнице. Эти изменения отмечаются как при врожденном, так и при приобретенном сифилисе. По характеру поражения сифилитический П. бывает оссифицирующим и гуммозным. У новорожденных с врожденным сифилисом возможны случаи оссифицирующего П. в области диафизов костей.
Изменения надкостницы при приобретенном сифилисе могут быть обнаружены уже во вторичном периоде. Они развиваются либо непосредственно вслед за явлениями гиперемии, предшествующими периоду высыпаний, либо одновременно с более поздними возвратами сифилидов (чаще пустулезных) вторичного периода, возникают преходящие периостальные набухания, не достигающие значительных размеров, которые сопровождаются резкими летучими болями. Наибольшей интенсивности и распространенности изменения надкостницы достигают в третичном периоде, причем часто наблюдается комбинация гуммозного и оссифицирующего периостита.
Оссифицирующий П. при третичном сифилисе обычно локализуется в длинных трубчатых костях, особенно в большеберцовой, и в костях черепа. В результате П. развиваются ограниченные или диффузные Гиперостозы.
При сифилитическом П. нередки сильные, обостряющиеся по ночам боли. При пальпации обнаруживают ограниченную плотную эластичную припухлость, имеющую веретенообразную или круглую форму; в других случаях припухлость более обширна и имеет плоскую форму. Она бывает покрыта неизмененной кожей и связана с подлежащей костью; при ощупывании ее отмечается значительная болезненность. Наиболее благоприятным исходом является рассасывание инфильтрата, наблюдаемое главным образом в свежих случаях. Чаще всего наблюдается организация и оссификация инфильтрата с новообразованиями костной ткани. Реже при быстром и остром течении развивается гнойное воспаление надкостницы; процесс распространяется обычно на окружающие мягкие ткани, возможно образование наружных свищей.
Периостит при других заболеваниях. При сапе отмечаются очаги ограниченного хронического воспаления надкостницы. У больных лепрой возможно возникновение инфильтратов в надкостнице, а также веретенообразных вздутий на трубчатых костях вследствие хронического периостита. При гонорее в надкостнице развиваются воспалительные инфильтраты, в случае прогрессирования процесса — с гнойным отделяемым. Выраженный П. описан при бластомикозах длинных трубчатых костей, возможны поражения ребер после сыпного тифа в виде ограниченных плотных утолщений периоста с ровными контурами. Локальный П. встречается при варикозном расширении глубоких вен голени, при варикозных язвах. П. наблюдается также при ревматизме (процесс обычно локализуется в пястных и плюсневых, а также в основных фалангах), заболеваниях кроветворных органов, при болезни Гоше (периостальные утолщения преимущественно вокруг дистальной половины бедренной кости). При длительной ходьбе и беге может возникать П. большеберцовой кости, для которого характерны сильные боли, особенно в дистальных частях голени, усиливающиеся при ходьбе и физических упражнениях и стихающие в покое. Местно видна ограниченная припухлость в связи с отечностью надкостницы, очень болезненная при пальпации.
Местно видна ограниченная припухлость в связи с отечностью надкостницы, очень болезненная при пальпации.
Рентгенодиагностика. Рентгенологическое исследование позволяет выявить локализацию, распространенность, форму, размеры, структуру, очертания периостальных наслоений, их взаимоотношения с корковым слоем кости и окружающими тканями. Рентгенологически различают линейные, бахромчатые, гребневидные, кружевные, слоистые, игольчатые и другого вида периостальные наслоения. При хронических, медленно текущих процессах в кости, особенно воспалительных, обычно наблюдаются более массивные напластования, как правило, сливающиеся с основной костью, что ведет к утолщению кортикального слоя и увеличению объема кости (рис. 1—3). Быстро протекающие процессы ведут к отслоению надкостницы гноем, распространяющимся между ней и кортикальным слоем, воспалительным или опухолевым инфильтратом. Это можно наблюдать при остром остеомиелите, опухоли Юинга, ретикулосаркоме. Гладкие, ровные периостальные наслоения сопровождают поперечную патологическую функциональную перестройку. При остром воспалительном процессе, когда под периостом скапливается гной под большим давлением, надкостница может разорваться, и на участках разрывов продолжает продуцироваться кость, давая на рентгенограмме картину неровной, рваной бахромы (рис. 4).
При быстром росте злокачественной опухоли в метафизе длинной трубчатой кости периостальные наслоения успевают образоваться только в краевых участках в виде так называемых козырьков.
При дифференциальной диагностике периостальных наслоений нужно иметь в виду нормальные анатомические образования, например бугристости костей, межкостные гребни, проекции кожных складок (например, по верхнему краю ключицы), не слившиеся с основной костью апофизы (по верхнему краю крыла подвздошной кости) и т.п. Не следует также принимать за П. отложение солей кальция у мест прикрепления сухожилий мышц к костям.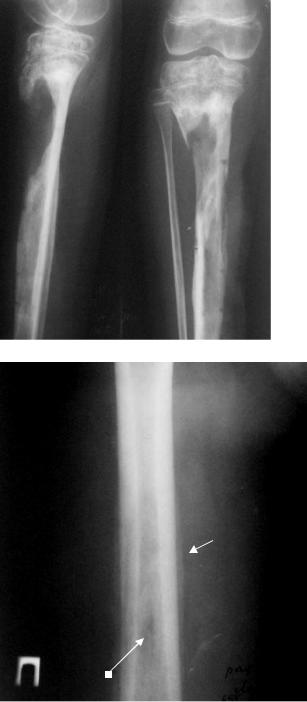 Дифференцировать отдельные формы только) по рентгенологической картине не представляется возможным.
Дифференцировать отдельные формы только) по рентгенологической картине не представляется возможным.
Лечение может быть консервативным или оперативным. Оно определяется характером основного патологического процесса и его течением. Так, например, при сифилитическом П. обычно проводят специфическое лечение (см. Сифилис), а при прорыве гуммы наружу с образованием язвы или некрозе кости может потребоваться оперативное вмешательство. Лечение других форм П. — см. Остеомиелит, Остит, Туберкулез внелегочный (Туберкулёз внелёгочный), туберкулез костей и суставов и др.
Библиогр.: Клиническая рентгенология, под ред. г.А. Зедгенидзе, т. 3, М., 1984; Лагунова И.Г. Рентгеновская семиотика заболеваний скелета, М., 1966.
Рентгенограмма бедренной кости ребенка 10 лет при опухоли Юинга (прямая проекция): линейные слоистые периостальные наслоения (указаны стрелками) диафиза бедренной кости»>
Рис. 3. Рентгенограмма бедренной кости ребенка 10 лет при опухоли Юинга (прямая проекция): линейные слоистые периостальные наслоения (указаны стрелками) диафиза бедренной кости.
Рис. 2. Рентгенограмма плечевой кости ребенка 10 лет при хроническом остеомиелите в стадии обострения (прямая проекция): линейные тени периостальных наслоений (указаны стрелками) в проксимальном отделе плечевой кости.
Рис. 1. Рентгенограмма костей голени ребенка 13 лет при гуммозном периостите (боковая проекция): гладкие, ровные периостальные наслоения вокруг гумм (указаны стрелками).
остеофиты (2) вследствие разрывов и отслоений надкостницы на задней ее поверхности»>
Рис. 4. Рентгенограмма бедра ребенка 11 лет, больного остеомиелитом (боковая проекция): неровные, бахромчатые, периостальные наслоения (1) на передней поверхности бедренной кости, беспорядочные рваные периостальные остеофиты (2) вследствие разрывов и отслоений надкостницы на задней ее поверхности.
воспаление надкостницы.
Периости́т гно́йный (р. purulenta) — П. , характеризующийся скоплением гноя под надкостницей.
, характеризующийся скоплением гноя под надкостницей.
Периости́т злока́чественный (р. maligna; син.: П. острейший, флегмона поднадкостничная) — форма острого гнойного П., отличающаяся особо быстрым распространением процесса, тяжестью и обширностью поражения.
Периости́т одонтоге́нный острый (р. odontogena acuta; син.: парулис, флюс — устар.) — гнойный П. альвеолярного отростка челюсти, возникающий в результате распространения воспалительного процесса из очага, расположенного в тканях зуба или пародонта.
Периости́т оссифици́рующий (р. ossificans) — хронический П., характеризующийся утолщением коркового слоя кости, образованием остеофитов и синостозов; наблюдается, например, при хроническом остеомиелите, сифилисе, синдроме Мари — Бамбергера, болезни Камурати — Энгельманна.
Периости́т остре́йший (р. acutissima) — см. Периостит злокачественный.
Периости́т отсло́енный — П., сочетающийся с отслоением надкостницы от кости на ограниченном участке в результате поднадкостничного кровоизлияния или скопления гноя.
Периости́т просто́й (р. simplex) — П., характеризующийся гиперемией, отеком и лейкоцитарной инфильтрацией надкостницы без образования свободного экссудата; возникает после травмы или в окружности очага воспаления костной ткани.
Периости́т рахити́ческий (р. rachitica) — оссифицирующий П. при рахите.
Периости́т сифилити́ческий (р. syphilitica) — П. при сифилисе, протекающий в форме оссифицирующего П. главным образом длинных трубчатых костей и черепа или с образованием гумм, чаще в надкостнице лобной и теменной кости, грудины, ключицы, большеберцовой кости.
Периости́т туберкулёзный (р. tuberculosa) — П. при туберкулезе, характеризующийся образованием гранулем, очагов творожистого некроза и гнойного расплавления, чаще на ребрах и костях лица.
Периости́т фибро́зный (р. fibrosa) — П., характеризующийся утолщением надкостницы за счет плотной соединительной ткани; наблюдается при хроническом воспалении прилегающих тканей.
Bio Banking Solutions | Саркома Юинга
Многих интересует вопрос: саркома Юинга что это за болезнь? В этой статье мы попытаемся дать ответ.
Саркома Юинга — что это за болезнь?
Саркома Юинга — это своеобразная опухоль, впервые описанная Ewing J. в 1921 г. Он выделил ее как самостоятельную форму из группы «недифференцированных сарком кости». В 1939 г. из той же группы «недифференцированных сарком кости» F. Parker и Н. Jackson выделили «первичную ретикулоклеточную саркому кости», отличную от опухоли, описанной Юингом, как по клиническому течению, так и по гистологическому строению. До сих пор гистогенез опухоли остается спорным и ее общепринято называть индифферентно — «саркома Юинга». В соответствии с Международной гистологической классификацией костных опухолей большинство авторов рассматривают саркому Юинга и ретикулосаркому как отдельные формы злокачественных новообразований в группе костномозговых опухолей.
James Ewing — первооткрыватель опухоли
Распространенность
Саркома Юинга это болезнь, которая встречается у детей и лиц молодого возраста, чаще у мужчин, преимущественно на первом-втором десятке жизни. Возникновение опухоли после сорока лет крайне редкое явление. Наиболее часто опухоли локализуются в длинных трубчатых костях, в которых опухоль располагается обычно в метадиафизарной области или даже диафизарно. Считается, что возможно одновременное возникновение множественных опухолей, однако вопрос о том, не является ли это следствием быстрого метастазирования первично одиночной опухоли, до сих пор остается неясным.
Клиника
Особенно характерны для этой опухоли локальные боли и припухлость мягких тканей в области пораженной кости. Часто отмечается покраснение кожи в области припухлости, а также гипертермия, лейкоцитоз и увеличение РОЭ. Именно из-за этого заболевание вначале часто путают с воспалительным процессом, в частности с остеомиелитом.
Рентгенологическая диагностика
Саркома Юинга локтевой кости (гистологическое подтверждение)
Рентгенологическая картина при саркоме Юинга весьма разнообразна и заметно меняется в течение заболевания. Рентгенологические признаки являются отображением как опухолевой деструкции костной ткани, так и реактивного эндостального и, в особенности, периостального костеобразования.
Рентгенологические признаки являются отображением как опухолевой деструкции костной ткани, так и реактивного эндостального и, в особенности, периостального костеобразования.
Наиболее типичными считаются рентгенологические признаки, выявляемые при опухолях диафизов длинных трубчатых костей.
В начале развития опухолевого процесса отмечаются очажки деструкции или склероза без периостита и других реакций. В дальнейшем возникает быстрое распространение очаговой деструкции вдоль кости, кортикальный слой расслаивается, разволокняется, приобретает трабекулярный, полосчато-пятнистый вид. Наряду с этим отмечаются и очаги реактивного склеротического уплотнения кости, а также периостальные наслоения. Пораженный участок кости при этом может представляться веретенообразно утолщенным. В таких случаях не только клиническая, но и рентгенологическая картина может очень напоминать подостро протекающий остеомиелит. С ростом опухоли более выраженными становятся признаки разрушения кости, очаги деструкции сливаются, между собой, а по краю кости возникает картина радиарного костеобразования благодаря спикулам, которые обычно представляются более тонкими, нежными, чем при остеосаркоме (смотрите фото саркомы Юинга). Опухоль может распространяться за пределы кости, в связи с чем возникают признаки опухолевой инфильтрации прилегающих мягких тканей. В целом наблюдается картина, достаточно характерная для злокачественного новообразования. Однако гистологическая верификация обязательна для установления диагноза саркомы Юинга.
Из выше приведенной информации становится понятно, что это такое саркома Юинга и какие у нее клинические и диагностические критерии. Стоит добавить, для данной опухоли характерна очень выраженная радиочувствительность, определенный эффект отмечается и при химиотерапии. Несмотря на это, прогноз при данном заболевании чрезвычайно плохой — большинство больных погибают от метастазирования прогресса в течение 2 лет.
Оригинальный текст опубликован на сайте http://newvrach. ru/
ru/
Вопросы дифференциальной диагностики костно-суставной патологии. — 24Radiology.ru
Болезни костно-суставной системы и соединительной ткани представляют актуальную медико-социальную проблему не только национального, но и мирового значения.
Занимают одно из ведущих мест в структуре первичной и общей заболеваемости населения.
Являются наиболее частой причиной длительных болей и нетрудоспособности.
Структура костно-суставной патологии.
- дистрофические заболевания
- диспластические заболевания
- метаболические заболевания
- травма
- воспалительные заболевания
- неопластические заболевания
Вопросы, на которые должен ответить рентгенолог при обнаружении образования кости.
1 — неопластическое, инфекционное образование или результат дистрофических (диспластических) изменений или обменных нарушений
2 — доброкачественное или злокачественное
3 — первичное или вторичное образование
Необходимо использовать не скиалогический, а морфологический язык описания.
Цель лучевых исследований.
• Локализация
• Количественная оценка:
количество образований
инвазия.
• Качественная оценка:
злокачественное или доброкачественное предположительный гистологический тип
• Предполагаемый диагноз:
вариант нормы дистрофические/диспластические изменения нарушения обмена веществ (метаболические) травма
воспаление опухоль

Важно.
Направительный диагноз
• Возраст
• Оценка результатов предыдущих исследований, анализов
• Симптомы и результаты физикального обследования
• Моно – или полировальное поражение

Оценка изменений в анализах
• Остеомиелит – повышенное СОЭ, лейкоцитоз
• Доброкачественные опухоли — нет изменений в анализах
• Саркома Юинга – лейкоцитоз
• Остеосаркома — повышение ЩФ
• Метастазы, миеломная болезнь – анемия, повышение кальция в крови
• Миеломная болезнь – белок Бенс-Джонсона в моче
Оценка.
• Локализация образования
• Число образований
• Деструкция/склеротические изменения кости
• Наличие гиперостоза
• Тип периостальной реакции
• Изменения в окружающих тканях
Количественная оценка.
• Первичные опухоли – чаще солитарные
• Метастазы и миелома – множественные
Группы основных изменений
• изменениями формы и величины кости
• изменениями контуров кости
• изменениями костной структуры
• изменения надкостницы, хряща
• изменения окружающих мягких тканей
Группы основных изменений.
• Искривление кости (дугообразное, угловое, S -образное)
• Изменение длины кости (укорочение, удлинение)
• Изменение объема кости (утолщение (гиперостоз, гипертрофия), истончение, вздутие)
• Изменение костной структуры
остеолиз (деструкция, остеопороз, остеонекроз, секвестрация) – хорошо дифференцируемые, слабо дифференцируемые
• остеосклероз
Деструкция костной ткани.
• Доброкачественная — за счет экспансивного роста, повышения давления, надкостница сохраняется (долгое время), доброкачественная персональная реакция
• Злокачественная — инвазивный рост, плохая дифференцировка краев,мягкотканыйкомпонент, злокачественная периостальная реакция, периостальная гиперплазия, рисунок «изъеденный молью»
Кортикальная деструкция.
Определяется при широком спектре патологии, воспалительных измениях доброкачественных и злокачественных опухолях. Полная деструкция может быть при высокодифференцированных злокачественных опухолях, при локальных агрессивных доброкачественных образованиях, таких как эозинофильная гранулема, при остеомиелите. Частичная деструкция может быть у доброкачественных и низкодифференцированных злокачественных опухолях.
Фестончатость по внутренней поверхности (эндостальная) может при фиброзном кортикальном дефекте и низкодифференцированных хондросаркомах.
Вздутие кости так же является вариантом кортикальной деструкции — происходит резорбция эндоста и костеобразование за счет периоста, «неокортекс» может быть гладким, непрерывным и с участками прерывистости.
По данным рентгенографии при злокачественных мелко- круглоклеточных опухолях (саркома Юинга, мелкоклеточная остесакрома, лимфома, мезенхимальная хондросаркома) целостность кортикальной пластинки может быть сохранена, но, распространяясь чрез гаверсовы каналы, они могут формировать массивный мягкотканый компонент.
Типы персональной реакции.
- Солидный – линейный, отслоенный периостит
- «Луковичный» — слоистый периостит
- Спикулообразный – игольчатый периостит
- Козырек Кодмана (Codman) – периостит в виде козырька
- В отечественной практике деление на доброкачественный и агрессивные типы не используется и является противоречивым.
- Типы периостальной реакции
Линейный периостит (слева)
Луковичный периостит (справа)
- Типы периостальной реакции
Спикулообразный периостит (слева)
Козырек Кодмана (справа)
Кальцификация матрикса.
• Кальцинация хондроидного матрикса в хрящевых опухолях. Симптом «попкорна», кальцинация по типу хлопьев, по типу колец и дуг.
• Кальцинация остеоидного матрикса в остеогенных опухолях. Трабекулярная оссификация. Может быть в доброкачественных (остеоид остеома) и злокачественных опухолях (остеогенная саркома)
Остеомиелит.
— бактериальное воспаление костного мозга после металлоостеосинтеза (чаще у взрослых)
— ограниченный гнойный очаг с формированием деструкции (очаговый остеомиелит)
— поверхностная форма – затрагивает кортикальный слой кости и окружающие мягкие ткани
— распространенный тип остеомиелита – обширное поражение кости на фоне предшествующего процесса
— хронический остеомиелит – слоистые периостальные наслоения, происходит чередование процесса периостального костеобразования (периостоз) с образованием новой кости
— отек костного мозга (рентген негативная фаза, до 4 недель, метод выбора — МРТ )
— инфильтрация парасоссальных мягких тканей
— гнойное воспаление костного мозга
— некротизация костного мозга
— очаги деструкции
— образование секвестров
— распространение гноя вдоль мышечных структур, образование свищей

Сравнительное изображение остеомиелита
1) остеогенная саркома
2) остеомиелит
3) эозинофильная гранулема.
Отек костного мозга.
Отек мозга визуализируется при 15 разных патологиях.
- Слева — отек при ревматоидном артрите
- В центре — отек при талассемии
- Справа -энхондрома
Остеоартроз.
1 стадия
— субхондральный склероз
— краевые костные разрастания
2 стадия
субхондральные кисты (геоды)  выход на край — эрозии
сужение суставной щели
3 стадия
-дефигурация суставный поверхностей, нарушение взаимоотношения в суставе
— хондромаляция, субхондральный отек (МРТ)
— выпот в суставе (реактивный синовиит, МРТ)
— вакуум-феномен (кт)
Геоды встречаются при:
— остеоартрозы
- ревматоидный артрит (так же эрозии) 
— болезни с нарушением отложения кальция (пирофосфатная
артропатия, хондрокальциноз, гиперпаратиреоидизм)
— аваскулярный некроз
Геоды. Эрозии.
Гиперпаратиреоз.
• поднадкостничная резорбция в трубчатых костях кистей (лучевая часть), шейке бедренной кости, проксимальный отдел большеберцовой кости, ребрах
• туннелирование кортикального слоя
• опухоль Брауна (бурые опухоли) – литическое поражение с четкими ровными краями, раздувает надкостницу, м.б. кровоизлияние (кости таза, ребра, бедренная кость, кости лица). Чаще у женщин, возраст 30-60 лет. Развиваются У 20 % больных гиперапаратиреозом. Гетерогенный сигнал во последовательности на МРТ
• хондрокальциноз

Опухоль Брауна при гиперпаратиреозе
Возрастное распределение костных образований.
Локализация костных образований
FD- фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф.гранулема
Osteoidosteoma- остеоид- остеома
NOF – не оссифицир. Фиброма
SBC – простая костная киста
CMF – хондромиксоидная фиброма
ABC – анеривзматическая костная киста
Osteosarcoma – остеогенная саркома
Chondroblastoma – хондробластома
Osteohondroma – остеохондрома
Enchondroma-энхондрома
Chondrosarcoma –
хондросаркома
Infection — инфекция
Geode (геоды) –
субхондральная киста
Giant CT (GCT) – гигантоклеточная опухоль
Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм

Расположение.
• Центральное: простая костная киста, аневризматическая костная киста, эозинофильная гранулема, фиброзная дисплазия, энхондрома.
• Эксцентричное: остеосаркома, неоссифицирующая фиброма,хондробластома, хондромиксоидная фиьрома, остеобластома, гиганоклеточные опухоли.
• Кортикальное: остеоид-остеома.
• Юкстакортикальное : остеохондрома, парадоксальная остеосаркома
Принцип оценки рентгенографии.
Отношение возраста и наиболее частой патологии.
FD- фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф.гранулема Osteoidosteoma- остеоид-остеома
NOF – не оссифицир. Фиброма
SBC – простая костная киста
CMF – хондромиксоидная фиброма ABC – анеривзматическая костная киста Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция
Geode (геоды) – субхондральная киста
Giant CT (GCT) – гигантоклеточная опухоль Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм
Leukemia — лейкемия
Bone island –костные островки
Low grade – низкодифференцированная
High grade — высокодиффернцированная Parosteal Osteosar – параостальная остеосаркома

Ключевые моменты дифференциальной диагностики.
• Основная масса костных опухолей — остеолитические.
• У пациентов до 30 лет наличие зон роста является нормой
• Метастазы и миеломная болезнь всегда включаются в дифференциальный ряд множественного литического поражения у поражения у пациентов старше 40 лет
• Остемиелит (инфекция) и эозинофильная гранулемы могут симулировать злокачественную опухоль (агрессивный тип периостальной реакции, деструкция кортикальной пластинки, плохое дифференцирование краев)
• Злокачественные опухоли не могут вызывать доброкачественной периостальной реакции
• Наличие периостальной реакции исключает фиброзную дисплазию, энхондрому, неоссифицирующую фиброму, простую костную кисту.

Локализация опухолей костей.
FD-фиброзная дисплазия
Ewing – саркома Юинга
EG- эфозиноф. гранулема Osteoidosteoma- остеоид-остеома NOF – не оссифицир. Фиброма SBC – простая костная киста
CMF – хондромиксоидная фиброма ABC – анеривзматическая костная
киста
Osteosarcoma – остеогенная саркома Chondroblastoma –хондробластома Osteohondroma – остеохондрома Enchondroma-энхондрома Chondrosarcoma – хондросаркома Infection — инфекция
Geode (геоды) – субхондральная киста Giant CT (GCT) – гигантоклеточная
опухоль
Metastasis – метастаз
Myeloma –миелома
Lymphoma – лимфома
HPT- гиперпаратиреоидизм
Leukemia — лейкемия
Bone island –костные островки
Low grade – низкодифференцированная High grade —
высокодиффернцированная Parosteal Osteosar – параостальная
остеосаркома

Специфическая локализация ряда костных образований.
Образования с множественными литическими изменениями по типу «изъеденных молью»
Изменения, которые могут формировать секвестр
Образования с множественными литическими изменениями по типу «мыльных пузырей»
Наиболее частые спинальные литические поражения.
1- гемангиома 2- метастаз
3- множественная миелома
4 — плазмоцитома

Другие варианты спинальных литических поражений.
Болезнь Педжета.
Болезнь Беджета (БП) является довольно распространенным заболеванием во многих европейских странах, США. Оценка распространенности у людей старше 55 лет колебалась от 2% до 5%. Факт, что значительная доля пациентов остаются бессимптомными на протяжении всей их жизни. БП всегда следует рассматривать в дифференциальной диагностике остеосклеротических, а также остеолитических скелетных поражений.
I стадия (литическя) — острая стадия, определяется деструкция кортикального слоя в виде очагов пламени или в форме клина.
II стадия (переходная) – смешанное поражение (остеолиз + склероз).
III стадия (склеротическая) – преобладание склероза с возможной деформацией кости
В монооссальных случаях, частота которых, согласно публикациям, начинается от 10-20% доходя до почти 50%, дифференциальный диагноз может быть гораздо сложнее. В огромном большинстве случаев БП, наличие неоднородных участков костного склероза или остеолиза с искажением трабекулярной архитектуры в сочетании с кортикальным утолщением и фокальным утолщением кости практически патогномоничен для данного заболевания. Бедренная кость является второй наиболее распространенной монооссальной локализацией после таза. В случаях, когда имеется ее дистальное поражение, рентгенологические признаки, характерные для БП, выявляются с меньшей частотой или менее выражены, так что дифференциация с другими процессами, в частности, опухолевыми, может быть затруднена.
Аневризматические костные кисты.
• Интрамедуллярное эксцентричное метаэпизеальное многокамерное кистозное образование
• В полостях определяются множественные уровни жидкости содержащие кровь
• Ограничены мембраной различной толщины, состоящие из костных трабекул и остеокластов
• В 70% — первичные, без явных причин
• В 30% — вторичные, в результате травмы
• Этиология неизвестна, предполагается неопластическая природа
• Половой предрасположенности нет, в любом возрасте
• Чаще располагаются в длинных трубчатых костях и позвоночнике
Аневризматические костные кисты
• Многокамерные кисты с перегородками
• Множественные уровни жидкости
• Склеротическое кольцо по периферии
• При локализации в позвонках – поражает более одного сегмента
• Редко располагается центрально
«Раздувает» кость, вызывает деструкцию костных балок, компактного вещества
• Может распространяться на соседние костные элементы
Еще один случай АКК
Простая костная киста.
Интрамедуллярные, чаще односторонние полости, с серозным или серозно-геморрагическим содержимым, отделены мембраной различной толщины
• Чаще встречаются у мужчин (2/3:1)
Обнаруживаются на первых двух декадах жизни у 80 %
• В 50 % — проксимальная половина плечевой кости
• В 25 % — проксимальная половина бедренной кости
• Третья локализация по частоте встречаемости – проксимальная половина малоберцовой кости
• У пожилых пациентов чаще встречается в таранной и пяточной костях

• Хорошо отграниченные, симметричные
• Не распространяются выше эпифизиальной пластинки
• Располагается в метаэпифизе, с ростом в диафиз
Деформируют и истончают компактную пластинку
• Периостальная реакция отсутствует
• Возможны переломы, на фоне кист
• Септ практически не содержат
• На T2W, stir, PDFS высокий однородный сигнал, низкий на T1W, без солидного компонента. Признаки высокобелкового компонента (кровь, повышение сигнала на T1W) возможно при переломах
Юкстаартикулярная костная киста.
• Ненеоплатическое субхондральное кистозное образование, развивается в результате мукоидной дегенерации соединительной ткани
• Не связно с дистрофическими процессами
• Содержит муцинозную жидкость и отграничена фиброзной тканью с миксоидными имениями
• Если в суставе определяются дистрофические изменения, это изменение трактуется как дегенеративнная субхондральная псевдокиста (чаще носят множественны характер)
• Преобладают мужчины
• 80% — между 30 и 60 годами
• Чаще располагается в тазобедренном, коленном суставах, голеностопных, лучезапястных и плечевых
Юкстаартикулярная костная киста
• Определяется в виде хорошо отграниченного овального или округлого кистозного образования
• Эксцентрично
• Располагается субхондрально, в эпифизах
• Ограничены соединительнотканной мембраной с фибробластами, коллагеном, синовиальными клетками
• Синонимы – внутрикостный ганглион, внутрикостная мукоидная киста.
• Могут деформировать надкостницу
• Отграничены склеротическим ободком
• Чаще1-2см,редкодо5см
• Дистрофические изменения в суставе не выражены
- Однородный низкий сигнал на T1W, высокий на T2W
- Низкий сигнал во все последовательности в склеротическом ободке
- Может быть отек (высокий сигнал на stir) в прилежащем костном мозге
Метаэпифизиальный фиброзный дефект (фиброзный кортикальный дефект).
• Синоним – неоссифицирующая фиброма (не путать с фиброзной дсиплазией), применяется для образований более 3 см
• Ненеоплатическое образование
• Состоит из фиброзной ткани с многоядерными гигантскими клетками, гемосидерином, воспалительными элементами, гистиоцитами с жировой тканью
• Одно из самых частых опухолеподобных образований костной ткани
• 60% — мужчины, 40% — женщины
• 67% — на второй декаде жизни, 20% — на первой
• Наиболее часто поражает дистальный метаэпифиз бедренной кости и проксимальный метаэпифиз большеберцовой кости. Составляют 80 % случаев
• Длинник располагается вдоль оси кости
• 2-4см, редко до 7 см и более
• Кистозное образование в метаэпифизе, всегда вплотную прилежит к эндостальной поверхности компактной пластинки, часто по периферии склероз, четко отграничена от окружающего костного мозга
• Может вызывать деструкцию кортикальной пластинки, осложняться переломом
• Шире в дистальной части
• Роста через метаэпифизиальную пластинку нет, распространяется по направления к диафизу
• Могут быть геморрагические изменения
• Нет периостальной реакции, изменений со стороны прилежащих мягких тканей
• Сниженный сигнал на T1W, вариабельный на T2W, stir чаще — высокий
Периостальный десмоид.
• Вариант фиброзного кортикального дефекта, локализующийся по дорзальной поверхности дистальной трети бедренной кости
• Семиотика аналогичная фиброзному кортикальному дефекту,толькопроцессограничен кортикальный пластинкой
Фиброзная дисплазия.
• Доброкачественное интрамедуллярное фиброзно-костное диспластическое приобретенное образование
• Может быть моно- и полиоссальное поражение
• Монооссльаная форма – 75%
• Немного преобладают женщины (Ж-54%, М-46%)
• Возрастные характеристики представлены на следующем слайде
• У 3% пациентов с полиоссальной формой развивается синдром McCune-Albright (пятна цвета «кофе с молоком» + эндокринные нарушения, наиболее часто – гонадотропнозависимое преждевременное половое созревание)
Локализация
Длинные трубчатые кости – проксимальная треть бедра, плечевая кость,большеберцовая кость
• Плоские кости — ребра, челюстно-лицевая область — верхняя и нижняя челюсть
• В трубчатых костях локализуется в метаэпифзах и диафизах
При открытых зонах роста – локализация в эпифизах редкость
• Гистологически состоит из фибробластов, плотног о коллагена, богато васкуляризированного матрикса, присутствуют костные трабекулы, незрелые остеоиды, остеобласты
• Возможны патологические переломы, перпендикулярно длинной оси
Патогномоничным признаком является картина «матового стекла» по данным КТ и рентгенографии, реже может наблюдаться картина литических изменений, в зависимости от степени преобладания фиброзного компонента
• Экспансивный рост
• Четкие контуры
• Высокие цифры плотности, в сравнении с губчатым веществом, но меньше, чем у компактного
• Деформирует, «раздувает » кость
• В трубчатых костях формируется деформация по типу «посоха пастуха»
• Периостальная реакция, мягкотканый компонент не выражены, деструкции кортикальной пластинки не определяется
Могут формироваться массы с экспансивным ростом
• Редко хрящевый компонент
• Высокий сигнал на T2W, симптом «матового стекла» определяется как легко минерализованное образование. КТ картина более специфична и показательна
• На МРТ могут определяться кисты, четко отграниченные, гомогенно высокий сигнал на T2W
• Фестончатый край внутренней поверхности кортикальной пластинки

Остеофиброзная дисплазия.
• Доброкачественное фиброзно-костное образование
• Синоним – оссифицирующая фиброма
• Чаще у детей, преобладают мальчики
• Первые две декады жизни
• Наиболее частая локализация -передняя кортикальная пластинка большеберцовой, реже малоберцовой костей
• Представляет собой мультифокальное кистозного образование, основной массой, ограниченное передней кортикальной пластинкой и склерозом по периферии
• Деформирует, раздувает кость кпереди и по бокам • Высокий сигнал на T2W, низкий на T1W
• Периостальной реакции нет
• В отличие от фиброзной дисплазии – экстрамедуллярное, кортикальное образование

Оссифицирующий миозит (гетеротопическая оссификация).
Редкое, доброкачественное образование
• Локальное, четко-отграниченное, фиброзно-костное
• Локализуется в мышцах или других мягких тканях, сухожилиях
• Преобладают мужчины
• Могут встречаться в любом возрасте, преобладает подростковый или молодой возраст
• Чаще вовлекается нижняя конечность (четырехглавая и ягодичная мышцы)
• На ранней стадии определяется уплотнение мягких тканей
• С 4 по 6 недели – клочкообразная кальцинация по типу «вуали»
• Кортикальная пластинка не вовлекается
Инвазии костного мозга нет
• Периостальной реакции нет, при близком расположении может казаться ложная принадлежность к кости
• К 3-4 месяцу минерализуется, менее выраженная минерализация в центре, часто наблюдается периферическая кальцинация, по типу скорлупы, или может сохраняться глыбчатая кальцинация.
• На МРТ в виде негомогенной массы (высокий сигнал на T2W, stir, низкий на T1W) участки низкого сигнала на T1W, T2W, PDFS за счет кальцинации, для точной визуализации лучше выполнять T2* (GRE)
• Хрящевой ткани не содержит, что хорошо видно по T2* и PDFS
• КТ более информативна

Лангергансноклеточный гистиоцитоз.
Формы:
— эозинофильная гранулема
— Hand–Schuller–Christian заболевание (диссеминированная форма)
— Letterer–Siwe disease заболевание (диссеминированная форма)
Этиология неизвестна. Менее 1% от всех образований костей. Чаще монооссальная форма, чем полиоссальная. Может быть в любом возрасте, чаще встречается у детей. Свод черепа, нижняя челюсть, позвонки, долинные кости нижних конечностей – редко.
Ребра — чаще поражаются у взрослых
«отверстие в отверстии» — плоские кости (свод черепа), склероз по периферии
— «vertebra plana»
— при поражении длинных трубчатых костей- литическое интрамедуллярное поражение в метаэпифизе илидиафизе
— может быть кортикальная деструкция, периостальная реакция
— очень редко уровень жидкости
— низкий сигнал на T1W, высокий на T2W, stir, накапливают КВ
Метастазы рак молочной железы
Остеоид остеома
Выводы
1. Дифференциальная диагностика в костно-суставной патологии сложна и объемна.
2. Целесообразно и оправданно применять муль тимодальный подход, с использованием данных рентгенографии, КТ, МРТ, УЗ-диагностики
3. Необходимо учитывать данные лабораторных методов исследования и клиническую картину при выстраивании дифференциального ряда.
4. Неукоснительно соблюдать методику и полностью использовать все возможности методов лучевой диагностики (полипозиционная, сравнительная рентгенография, костный режим при КТ ОБП, DWI последовательности при любом очаговом процессе и т.д)
Материал взят из лекции:
- Вопросы дифференциальной диагностики костно-суставной патологии.
Что должен знать рентгенолог? Екатеринбург 2015 - Мешков А.В. Цориев А.Э.
Онлайн-тесты на oltest.ru: Рентгенология — все вопросы (103/129)
Онлайн-тестыТестыМедицинаРентгенологиявопросы
1531. При наличии метастазов рака в кости первичная локализация рака прижизненно не обнаруживается:
• в меньшинстве случаев
1532. При нейрогенной остеоартропатии стоп у взрослых следует провести дифференциальную диагностику среди перечисленных ниже заболеваний, кроме
• сирингомиелии
1533. При нефрогенной остеодистрофии раньше всего выявляются сосудистые обызвествления:
• в стопах
1534. При отличительном распознавании фиброзной дисплазии костей от других доброкачественных опухолей и опухолеподобных поражений скелета имеют значение все перечисленные признаки, кроме
• монооссального характера поражения
1535. При переходе гематогенного остеомиелита в хроническую стадию периостальные наслоения:
• сливаются с кортикальным слоем
1536. При повреждении менисков коленных суставов информативны
• контрастирование полости коленного сустава
1537. При повреждениях периферических нервов изменения костей характеризуются:
• гипертрофией
1538. При подозрении на перелом вертлужной впадины дополнительно необходимо использовать:
• прямую заднюю проекцию с ротацией бедренной кости наружу
1539. При ретикулогистиоцитозе-X в костях отмечаются:
• деструктивные очаги и фокусы
1540. При ретикулогистиоцитозе-X могут наблюдаться сходные со злокачественными опухолями костей симптомы, исключая
• игольчатая периостальная реакция
1541. При саркоидозе преимущественно поражается:
• дистальный отдел конечности
1542. При сирингомиелии наиболее часто наблюдаются изменения
• в суставах верхних конечностей
1543. Продавливание вертлужной впадины характерно:
• для деформирующей остеодистрофии Педжета
• для коксартоза
1544. Пятнисто-хлопьевидный рисунок костной структуры при деформирующей остеодистрофии Педжета характерен:
• для костей свода черепа
1545. Ранние изменения при болезни Дойчлендера чаще всего выявляются:
• в боковой проекции
• в прямой проекции
Лучевая диагностика остеомиелита у детей
Остеомиелит у детей в возрасте до одного года вызывается Streptococcus группы B, Staphylococcus aureus (70-90% случаев), Haemophilus influenza (5-50%), и Escherichia coli. Старше года возбудителем является S aureus, E coli, H influenza, Serratia marcescens, и Pseudomonas aeruginosa, изредка Salmonella, грамм-положительные кокки и анаэробы. До одного года частота остеомиелита составляет около 1 случая на 1000, старше года – 1 на 5000. Бактерия попадает в метафизы через питающие сосуды, там развивается воспалительный процесс, который дальше распространяется в субпериостальные пространства и, при прорыве абсцесса, на окружающие мягкие ткани. Остеомиелит у детей чаще поражает дистальный и проксимальный метафизы бедренной и большой берцовой кости, дистальный метафиз плечевой кости и дистальный метафиз малой берцовой кости. Выделяют острый, подострый и хронический остеомиелит. При остром остеомиелите имеются клинические проявления в виде локальных болей, отёка и повышения температуры. Ранний воспалительный период длится 2-3 дня, после которого начинает формироваться абсцесс, а через 7 дней образуются секвестры. Особой формой остеомиелита является абсцесс Броди – локальный процесс в подострой стадии без предшествовавших симптомов острого остеомиелита. Дальнейший развитие процесса зависит от эффективности антибиотикотерапии и хирургического лечения. Осложнениями острого остеомиелита являются переход в хроническую форму (5-25%), метастатическая инфекция, септический артрит, нарушение зоны роста с угловой деформацией кости, патологические переломы, сепсис, воспаление мягких тканей и образование свищей.
Выявление остеомиелита в острой фазе осуществляется с помощью радионуклидной диагностики, чувствительность которой превышает 90%. Отёк костного мозга и субпериостальные абсцессы обнаруживаются методом МРТ, чувствительность которой для ранней диагностики остеомиелита составляет около 85%. Несколько меньшей чувствительностью обладает ультразвуковая диагностика. Первые изменения на рентгенограммах появляются не ранее 7-10 дня и только на 10-14 день становятся отчётливыми. В этот период отмечается и наибольшая чувствительность КТ. Развитый воспалительный процесс характеризуется большим спектром симптомов в том или ином сочетании: деструктивный очаг, разнообразной величины и формы, склеротическая реакция окружающей кости, каналы-выпускники гноя, открывающиеся в мягкие ткани, секвестры в очаге или в каналах, периостальная реакция (линейная, бахромчатая, без спикул), гиперостоз различной степени выраженности, сужение костномозгового канала, отек мягких тканей при отсутствии мягкотканого компонента .
При хроническом остеомиелите КТ служит методом выбора: выявляются четкие очаги деструкции кости, часто содержащие секвестры, контуры очагов неровные, нечеткие . В перифокально расположенных участках костной ткани отмечается очаговый остеопороз с явлениями реактивного костеообразования (очаговый остеосклероз). Отчетливо видны секвестры , могут образовываться секвестральные свищи. Вдоль коркового слоя кости образуется плоска отслоенного периоста. В дальнейшем периостальные наслоения ассимилируются, поперечник кости увеличивается, контуры становятся бугристыми.
Хронический остеомиелит грудинного конца ключицы. Определяется очаг деструкции грудинного конца правой ключицы с наличием мелких секвестров внутри и отеком окружающих тканей.
МРТ Т2-взвешенного типа. Остеомиелит большеберцовой кости. Яркий сигнал соответствует костной деструкции и распространению по костному мозгу.
Роль свободных надкостничных трансплантатов в улучшении выживаемости аутогенных накладных костных трансплантатов на лицевые кости у кроликов
Олби, Ф.Х .: Хирургия костного трансплантата при заболеваниях, травмах и деформациях. Нью-Йорк: Appleton 1940
Google ученый
Axhausen, G .: Arbeiten aus dem Gebiet der Knochenpathologie und Knochenchirurgie. Langenbecks Arch. клин. Чир. 94 , 241 (1911)
Google ученый
Duhamel, H.L .: Sur le développement et la crue des os des animaux. Mem. Акад. Sci. 55 , 354 (1742)
Google ученый
Энгдаль, Э .: Восстановление кости при дефектах верхней челюсти. Экспериментальное исследование влияния надкостницы и различных сред (кровь, Surgicel, костный мозг и костные трансплантаты) на формирование кости и рост верхней челюсти. Сканд. J. plast. реконструировать. Surg. Дополнение 8 (1972)
Enneking, W.F .: Гистологическое исследование костных трансплантатов у иммунологически подготовленных животных. J. Bone Jt Surg. А 39 , 597 (1957)
Google ученый
Flourens, P .: Theoric Expérimentale de la Formation des Os. Париж. Бейлиер 1847
Google ученый
Клинкерфус, Г.Х .: Исследование способности роста периостальной мозоли при трансплантации в реберные хрящи.Surg. Gynec. Акушерство. 38 , 625 (1924)
Google ученый
Книз, Д.М .: Влияние надкостницы и кальцитонина на выживаемость костного трансплантата накладки. Рентгенографическое исследование. Пласт. реконструировать. Surg. 53 , 190 (1974)
Google ученый
Leriche, R., Policard, A .: Нормальная и патологическая физиология кости. Лондон: Kimpton 1928
Google ученый
Macewen, W .: Рост костей. Наблюдения за остеогенезом. Экспериментальное исследование развития и воспроизводства диафизарной кости. Глазго: Маклеозе и сыновья 1912
Google ученый
McWilliams, CA: Функция надкостницы при трансплантации кости, на основе 4 трансплантаций человека без надкостницы и некоторых экспериментов на животных. Surg. Gynec. Акушерство. 18 , 159 (1914)
Google ученый
Ollier, L .: Traité Experimental et Clinique de la Régénération des Os et de la Production Artificielle du Tissu Osseux. Париж: Masson et Cie 1867
Google ученый
Пир, Л.А .: Трансплантация тканей, Vol. 1. Балтимор, США: Williams and Wilkins Co. 1955
Google ученый
Фемистер, Д.Б .: Судьба трансплантированной кости и регенеративная сила ее различных компонентов.Surg. Gynec. Акушерство. 19 , 303 (1914)
Google ученый
Рицила, В., Альхопуро, С., Ринтала, А .: Костеобразование со свободной надкостницей. Экспериментальное исследование. Сканд. J. plast. реконструировать. Surg. 6 , 51 (1972)
Google ученый
Рицила В., Альхопуро С., Гиллинг У., Ринтала А. Использование свободной надкостницы для образования кости при врожденных расщелинах верхней челюсти.Предварительный отчет. Сканд. J. plast. реконструировать. Surg. 6 , 57 (1972)
Google ученый
Роде, К. Формируется ли кость из остеобластов или из метаплазии окружающей ткани? Surg. Gynec. Акушерство. 41 , 740 (1925)
Google ученый
Скуг, Т .: Использование надкостницы и Surgicel для восстановления кости при врожденных расщелинах верхней челюсти.Сканд. J. plast. реконструировать. Surg. 1 , 113 (1967)
Google ученый
Скуг, Т .: Восстановление односторонней деформации губы расщелины: верхней челюсти, носа и губы. Сканд. J. plast. реконструировать. Surg. 3 , 109 (1969)
Google ученый
Томпсон, Н., Кассон, Дж. А .: Экспериментальные костные трансплантаты накладок на челюсти. Предварительное исследование на собаках. Пласт. реконструировать.Surg. 46 , 341 (1970)
Google ученый
Тонна, Э.А., Кронкайт, Э.П .: Авторадиографические исследования пролиферации клеток в надкостнице интактных и сломанных бедренных костей мышей с использованием ДНК-мечения 3H-тимидином. Proc. Soc. опыт Биол. (Нью-Йорк) 107 , 719 (1961)
Google ученый
Роль свободных надкостничных трансплантатов в повышении выживаемости аутогенных накладных костных трансплантатов на лицевые кости у кроликов
Олби, Ф.Х .: Хирургия костного трансплантата при заболеваниях, травмах и деформациях. Нью-Йорк: Appleton 1940
Google ученый
Axhausen, G .: Arbeiten aus dem Gebiet der Knochenpathologie und Knochenchirurgie. Langenbecks Arch. клин. Чир. 94 , 241 (1911)
Google ученый
Duhamel, H.L .: Sur le développement et la crue des os des animaux. Mem.Акад. Sci. 55 , 354 (1742)
Google ученый
Энгдаль, Э .: Восстановление кости при дефектах верхней челюсти. Экспериментальное исследование влияния надкостницы и различных сред (кровь, Surgicel, костный мозг и костные трансплантаты) на формирование кости и рост верхней челюсти. Сканд. J. plast. реконструировать. Surg. Дополнение 8 (1972)
Enneking, W.F .: Гистологическое исследование костных трансплантатов у иммунологически подготовленных животных.J. Bone Jt Surg. А 39 , 597 (1957)
Google ученый
Flourens, P .: Theoric Expérimentale de la Formation des Os. Париж. Бейлиер 1847
Google ученый
Клинкерфус, Г.Х .: Исследование способности роста периостальной мозоли при трансплантации в реберные хрящи. Surg. Gynec. Акушерство. 38 , 625 (1924)
Google ученый
Knize, D.M .: Влияние надкостницы и кальцитонина на выживаемость костного трансплантата onlay. Рентгенографическое исследование. Пласт. реконструировать. Surg. 53 , 190 (1974)
Google ученый
Leriche, R., Policard, A .: Нормальная и патологическая физиология кости. Лондон: Kimpton 1928
Google ученый
Macewen, W .: Рост костей. Наблюдения за остеогенезом.Экспериментальное исследование развития и воспроизводства диафизарной кости. Глазго: Маклеозе и сыновья 1912
Google ученый
McWilliams, CA: Функция надкостницы при трансплантации кости, на основе 4 трансплантаций человека без надкостницы и некоторых экспериментов на животных. Surg. Gynec. Акушерство. 18 , 159 (1914)
Google ученый
Ollier, L .: Traité Experimental et Clinique de la Régénération des Os et de la Production Artificielle du Tissu Osseux. Париж: Masson et Cie 1867
Google ученый
Пир, Л.А .: Трансплантация тканей, Vol. 1. Балтимор, США: Williams and Wilkins Co. 1955
Google ученый
Фемистер, Д.Б .: Судьба трансплантированной кости и регенеративная сила ее различных компонентов.Surg. Gynec. Акушерство. 19 , 303 (1914)
Google ученый
Рицила, В., Альхопуро, С., Ринтала, А .: Костеобразование со свободной надкостницей. Экспериментальное исследование. Сканд. J. plast. реконструировать. Surg. 6 , 51 (1972)
Google ученый
Рицила В., Альхопуро С., Гиллинг У., Ринтала А. Использование свободной надкостницы для образования кости при врожденных расщелинах верхней челюсти.Предварительный отчет. Сканд. J. plast. реконструировать. Surg. 6 , 57 (1972)
Google ученый
Роде, К. Формируется ли кость из остеобластов или из метаплазии окружающей ткани? Surg. Gynec. Акушерство. 41 , 740 (1925)
Google ученый
Скуг, Т .: Использование надкостницы и Surgicel для восстановления кости при врожденных расщелинах верхней челюсти.Сканд. J. plast. реконструировать. Surg. 1 , 113 (1967)
Google ученый
Скуг, Т .: Восстановление односторонней деформации губы расщелины: верхней челюсти, носа и губы. Сканд. J. plast. реконструировать. Surg. 3 , 109 (1969)
Google ученый
Томпсон, Н., Кассон, Дж. А .: Экспериментальные костные трансплантаты накладок на челюсти. Предварительное исследование на собаках. Пласт. реконструировать.Surg. 46 , 341 (1970)
Google ученый
Тонна, Э.А., Кронкайт, Э.П .: Авторадиографические исследования пролиферации клеток в надкостнице интактных и сломанных бедренных костей мышей с использованием ДНК-мечения 3H-тимидином. Proc. Soc. опыт Биол. (Нью-Йорк) 107 , 719 (1961)
Google ученый
«Надкостница: обзор изображений» — ScienceDirect
Основные моменты
- •
Надкостница имеет разные характеристики в зависимости от пола и возраста и может измениться в зависимости от приема лекарств.
- •
Обычная простая рентгенография часто может определить агрессивность периостальных реакций.
- •
Знание анатомии надкостницы облегчает понимание ее периостальных реакций.
- •
Системные периостальные реакции обычно недооцениваются из-за разрозненного анализа.
Abstract
Надкостница представляет собой фиброзную оболочку, покрывающую внешнюю кость, за исключением суставных поверхностей, прикреплений сухожилий и поверхности сесамовидной кости¹.С возрастом он меняет свои аспекты и характеристики, становясь все менее эластичным и более твердым. Он состоит из двух разных слоев: внешнего волокнистого (плотный, наполненный коллагеном) и внутреннего пролиферативного (камбий, содержащий клетки остеопрогенитора) ² . За кровоснабжение надкостницы отвечают четыре сосудистые системы: внутренняя периостальная система, расположенная между фиброзным и пролиферативным слоями; периостеокортикальные, основные питательные артерии надкостницы; мышечно-надкостничная, отвечающая за образование костной мозоли после переломов; фасцио-надкостничный, специально для каждой кости.³ Это критически важно для образования и резорбции костей, реагируя на повреждения кортикального слоя кости, такие как опухоли, инфекции, травмы, лекарства и артритные заболевания. Об агрессивности реакции можно судить по ее радиологическому аспекту и внешнему виду 4 . Надкостница у детей более рыхлая по сравнению со взрослыми, что приводит к более ранней и более бурной реакции. Все эти аспекты будут подробно описаны, поэтому будет обсуждена важная информация, которую должны знать все радиологи.
Ключевые слова
Надкостница
Формирование кости
Резорбция кости и реакция надкостницы
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию
© 2020 Опубликовано Elsevier Ltd.
Рекомендуемые статьи
Цитирующие статьи
Роль периостального рукава в реконструкции костных дефектов с использованием неваскуляризированного трансплантата малоберцовой кости в педиатрической популяции
Реферат
Предпосылки
После резекции больших доброкачественных опухолей кости хирурги должны столкнулся с костными дефектами, серьезно влияющими на стабильность конечности. Для восстановления механической целостности кости описаны различные методы лечения с использованием костных трансплантатов.Считается, что у педиатрических пациентов толстая надкостница способствует формированию кости.
Гипотеза
Неповрежденный периостальный рукав имеет решающее значение для ремоделирования кости вокруг неваскуляризированного малоберцового трансплантата, используемого для перекрытия крупных костных дефектов.
Методы
Мы представляем методику лечения, примененную в 6 случаях, включающую резекцию поднадкостничной опухоли на диафизарном или метафизарном уровне длинных костей с последующим перекрытием дефекта неваскуляризированным трансплантатом малоберцовой кости, вставленным в надкостничный рукав зоны резекции.Для стабилизации использовали эластичные интрамедуллярные стержни или пластины.
Результаты
Из-за неповрежденной надкостницы в месте резекции интеграция кости произошла быстро, и полное ремоделирование наблюдалось во всех случаях, кроме одного. Местоположение опухоли в этом случае было на уровне метафиза, что привело к резекции опухоли на пластине роста. Хотя заживление кости в области дистальной резекции наблюдалось через несколько недель, проксимальная консолидация была лишь частичной. Полное восстановление малоберцовой кости в оставшейся надкостничной манжете наблюдалось в 5 случаях, частичное восстановление — в 1 случае.
Обсуждение
У педиатрических пациентов описанная методика является эффективным и надежным методом лечения больших доброкачественных опухолей костей, требующих резекции. Однако большое несоответствие диаметров донорского и реципиентного участков и тонкая надкостница могут быть ограничивающим фактором для его применения.
Уровень доказательности
Клиническое исследование уровня IV.
Ключевые слова
Неваскуляризованный трансплантат малоберцовой кости
Дефекты длинных костей
Аневризматические костные кисты
Фиброзная дисплазия
Костная пластика
Надкостничная втулка
Рекомендуемые статьи Massiting статьи
Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Сравнение перицитов скелета и мягких тканей выявляет CXCR4 + костные муральные клетки в тканях человека
Выделение периостальных, жировых и кожных CD146
+ перицитов
Если не указано иное, материалы приобретен у Sigma-Aldrich (Сент-Луис, Миссури). CD146 + периостальные клетки выделяли из надкостницы человека с помощью сортировки клеток, активируемой флуоресценцией (FACS).Человеческая периостальная ткань была получена от взрослых пациентов-доноров с одобрения IRB в JHU с отказом от информированного согласия и хранилась в течение <48 ч при 4 ° C перед обработкой. Образцы приведены в дополнительной таблице S1. Полные клетки надкостницы надкостницы человека получали расщеплением коллагеназой II. Вкратце, ткань надкостницы удаляли из кости, мелко измельчали и расщепляли с помощью 1 мг · мл коллагеназы -1 типа II в среде Игла, модифицированной Дульбекко (DMEM), в течение 70 минут при перемешивании при 37 ° C.Клетки отделяли и удаляли центрифугированием. Осадок клеток ресуспендировали в буфере для лизиса эритроцитов (155 ммоль · л −1 NH 4 Cl, 10 ммоль · л −1 KHCO 3 и 0,1 ммоль · л −1 EDTA) и инкубировали при 37 ° C в течение 5 мин. После центрифугирования клетки ресуспендировали в PBS и фильтровали по очереди при 100, 70 и 40 мкм. Полученные в результате клетки надкостницы были дополнительно обработаны для сортировки клеток с использованием смеси следующих непосредственно конъюгированных антител: анти-CD31-APC-cy7 (1: 100; BD Pharmingen, Сан-Диего, Калифорния), анти-CD45-APC-cy7 ( 1:30; BD Pharmingen) и изотиоцианат флуоресцеина против CD146 (1: 100; Bio-Rad, Hercules, CA) (сводка антител представлена в дополнительной таблице S2).Все инкубации проводили при 4 ° C в течение 15 мин. Затем раствор пропускали через фильтр с размером пор 70 мкм и затем прогоняли на DakoCytomation MoFlo (Beckman, Indianapolis, IN, USA). Программное обеспечение FlowJo использовалось для анализа данных проточной цитометрии. Таким образом выделяли периостальные перициты (CD146 + CD31 — CD45 — ). В избранных исследованиях для культивирования также выделяли несортированные (неочищенные) периостальные клетки из тех же образцов пациентов.
Выделение кожных и жировых перицитов было выполнено с использованием подхода, аналогичного выделению периостальных клеток, и было ранее опубликовано. 60 Дермальные перициты были получены из микродиссектированной дермы из образцов плановой абдоминопластики от n = 3 взрослых женщин-доноров. Жировые перициты были получены из образцов плановой липосакции от из = 3 взрослых женщин-доноров. Аналогичную процедуру окрашивания и стробирования проводили с добавлением анти-CD34-APC (1: 100, BD Pharmingen) для получения популяции перицитов CD146 + CD31 — CD45 — CD34 — . В некоторых исследованиях перициты или ASC были дополнительно разделены с использованием анти-CXCR4-APC (1: 5, BD Pharmingen).
FACS-очищенные перициты CD146 + либо анализировали проточной цитометрией, мгновенно замораживали для выделения РНК, применяли в модели внутримышечной имплантации мыши, либо культивировали для исследований in vitro. Для размножения in vitro все клетки культивировали при 37 ° C в увлажненной атмосфере, содержащей 95% воздуха и 5% CO 2 . Все клетки культивировали в среде DMEM с 10% фетальной бычьей сывороткой (FBS) (Gibco, Grand Island, NY, США) и 1% пенициллина / стрептомицина (Life technologies corporation, Gaithersburg, MD, USA).Среду меняли каждые 3 дня, если не указано иное.
Проточная цитометрия
Маркеры клеточной поверхности были обнаружены с помощью проточной цитометрии после размножения отсортированных клеток CD146 + (пассаж 3). Если не указано иное, все антитела были от BD Pharmingen (дополнительная таблица S2). Вкратце, клетки окрашивали с плотностью 1 × 10 5 клеток на мл в PBS следующими антителами и разведениями: мышиное mAb против CD31-Apc-cy7 (1:30), анти-CD44-Alexa Fluor. 700 (1:20), анти-CD45-Apc-cy7 (1:30), анти-CD73-PE (1:30), анти-CD90-FITC (1:30) и анти-CD105-PE-CF594 (1:20) добавляли отдельно и инкубировали при 4 ° C в течение 15 мин.Затем клетки пропускали через фильтр 70 мкм и исследовали с помощью DakoCytomation MoFlo (Beckman). Программное обеспечение FlowJo использовалось для анализа данных проточной цитометрии.
Анализы остеогенной дифференцировки
CD146 + периостальные, жировые и дермальные перициты или субпопуляции на основе экспрессии CXCR4 с равным числом пассажей высевали в 24- или 48-луночные планшеты с плотностью 2 × 10 5 клеток на мл. Среда для остеогенной дифференцировки (ODM) состояла из DMEM, 10% FBS, 1% пенициллина / стрептомицина с 10 ммоль · л -1 β-глицерофосфата, 50 мкмоль · л -1 аскорбиновой кислоты и 1 ммоль · л — 1 дексаметазон.Всего через 24 ч после посева клеток базальную среду заменяли ODM, пополняя ее каждые 3 дня. Для окрашивания AR клетки промывали PBS и фиксировали 4% параформальдегидом через 7 дней дифференцировки. После фиксации клетки окрашивали 2% -ным раствором AR при комнатной температуре в течение 10 мин, затем промывали деионизированной водой и позволяли высохнуть. Снимки сделаны с помощью сканера Olympus Epson (Лос-Анджелес, Калифорния, США). Для количественной оценки отложения костных узелков костные узелки растворяли в 0,1 н. Гидроксиде натрия и количественно определяли с помощью микроспектрофотометра Epoch (BioTek, Winooski, VT, USA) по поглощению при 548 нм.Все эксперименты были выполнены с n = 3 человеческими образцами на анатомическое депо и в трех лунках (биологический и технический трижды).
Анализы адипогенной дифференцировки
CD146 + периостальные, жировые и дермальные перициты или субпопуляции на основе экспрессии CXCR4 с равным числом пассажей высевали в 24- или 48-луночные планшеты с плотностью 2 × 10 5 клеток на мл и оставлен на ночь. Всего через 24 часа после посева базальную среду заменили средой для адипогенной дифференцировки, пополняемой каждые 3 дня (среда Mesencult Adipogenic Differentiation, StemCell technologies Inc., Ванкувер, Британская Колумбия). Окрашивание масляным красным О проводили через 10–14 дней дифференциации. Клетки промывали PBS и фиксировали 4% параформальдегидом в течение 15 мин. После фиксации клетки промывали водой и 500 мкл окрашивающего раствора O Oil red O. Исходный раствор масляного красного О готовили растворением 0,5 г масляного красного О в 100 мл изопропанола. Окрашивающий раствор масляный красный О готовили разбавлением исходного раствора дистиллированной водой в соотношении 3: 2 с последующей фильтрацией. Окрашивание масляным красным О проводили в течение 30 мин при 37 ° C.После инкубации клетки промывали водопроводной водой с последующей микроскопией. Все эксперименты были выполнены с n = 3 человеческими образцами на анатомическое депо и в трех лунках (биологический и технический трижды).
Анализы хондрогенной дифференциации
CD146 + периостальные и жировые перициты суспендировали с высокой плотностью 1 × 10 7 клеток на мл и высевали в 10 мкл микромассовой культуры в 6-луночные планшеты на 4 ч инкубации. После инкубации осторожно добавляли среду для хондрогенной дифференцировки (MesenCultTM-ACF Chondrogenic Differentiation Basal Medium, STEMCELL Technologies, Cat # 05456) для хондрогенной дифференцировки в течение 21-дневного периода, добавляя среду каждые 3 дня.После сбора микромассовые культуры делали криосрезы толщиной 12 мкм и окрашивали раствором альцианового синего (1 г порошка альцианового синего 8GX в 100 мл 3% раствора уксусной кислоты, pH 2,0). Все эксперименты были выполнены с n = 3 человеческими образцами и в трех лунках (биологический и технический трижды).
Анализы образования пуповины
CD146 + периостальных перицитов перед использованием метили красным флуоресцентным красителем PKh36. Матригель с восстановленным фактором роста (BD Biosciences) помещали в 96-луночные культуральные планшеты и инкубировали при 37 ° C для полимеризации в течение 30 минут.Для анализа совместного культивирования HUVEC (Lonza, № по каталогу C2517A) (1,5 × 10 4 клеток / лунка) и периостальные перициты CD146 + (500 клеток / лунка) высевали на полимеризованный матригель. Клетки совместно культивировали со средой, состоящей из равных частей EGM2: DMEM (соотношение 1: 1) в течение 2 часов. Образование канальцев наблюдали через 2 часа с помощью микроскопии (10 ×). Все эксперименты были выполнены с n = 3 человеческими образцами и в трех лунках (биологический и технический трижды).
Пролиферация
Анализы пролиферации выполняли в 96-луночных планшетах (2 × 10 3 клеток / лунку) и анализировали через 72 часа с использованием набора CellTiter96® AQueous One Solution Cell Proliferation Assay kit (MTS, G358A; Promega, Madison, WI).Вкратце, в каждую лунку добавляли 20 мкл раствора MTS. После инкубации в течение 1 ч при 37 ° C оптическую плотность измеряли при 490 нм с помощью микроспектрофотометра Epoch (BioTek).
Миграция
Для анализа миграции 61 2,0 × 10 4 CXCR4 — или CXCR4 + ASC ресуспендировали в 100 мкл среды α -MEM без FBS и помещали в верхнюю лунку. 24-вставных пластин Transwell с размером пор 8 мкм (Корнинг, Нью-Йорк, США). Анализ миграции выполняли путем добавления в нижнюю лунку 600 мкл среды α-MEM с добавлением 10% FBS или CXCL12 (50 нг / мл).Через 4 часа клетки на дне вставок фиксировали 100% метанолом в течение 30 минут и окрашивали 0,5% кристаллическим фиолетовым (Sigma-Aldrich). Затем клетки, которые проникли в нижнюю поверхность, были сфотографированы с помощью 100-кратного микроскопа (Leica). Окрашенные камеры элюировали 33% раствором уксусной кислоты и количественно определяли элюент по поглощению при 570 нм.
Количественная (q) ОТ-ПЦР
Специфическую экспрессию гена среди периостальных, жировых и кожных перицитов CD146 + анализировали с помощью qRT-PCR на 0, 3 и 7 дни остеогенной / адипогенной дифференцировки.Последовательности праймеров показаны в дополнительной таблице S3. Вкратце, тотальную РНК экстрагировали с использованием реагента TRIzol (корпорация Life Technologies). Всего 1 мкг общей РНК из каждого образца подвергали синтезу первой цепи комплементарной дезоксирибонуклеиновой кислоты (кДНК) с использованием набора для синтеза кДНК iScript ™ (Bio-Rad) до конечного объема 20 мкл. Реакцию обратной транскрипции проводили при 25 ° C в течение 5 минут, затем при 46 ° C в течение 20 минут и 95 ° C в течение 1 минуты. Для qRT-PCR реакцию проводили с использованием 2 × SYBR green RT-PCR мастер-микса и системного прибора QuantStudio 5 Real-Time PCR (Thermo Scientific, Waltham, MA).qRT-PCR выполняли с использованием 384-луночных оптических планшетов при 95 ° C в течение 10 мин, затем 40 циклов при 95 ° C в течение 15 с и при 60 ° C в течение 60 с. Относительную количественную оценку экспрессии гена проводили с использованием метода сравнительной CT согласно протоколу производителя и нормализовали до уровней экспрессии гена домашнего хозяйства ACTB в каждом образце.
Вестерн-блот
CD146 + периостальные, жировые и кожные перициты лизировали в буфере RIPA (Thermo Scientific) с коктейлем ингибиторов протеаз (Cell Signaling Technology, Danvers, MA, USA).Общие белки (20 мкг) разделяли электрофорезом в SDS-полиакриламидном геле и переносили на нитроцеллюлозную мембрану, затем блокировали 5% бычьим сывороточным альбумином (BSA) и зондировали кроличьими антителами против CXCR4 и GAPDH человека при 4 ° C в течение ночи. Мембраны инкубировали с вторичным антителом, конъюгированным с пероксидазой хрена (HRP), и визуализировали с помощью системы ChemiDoc XRS + (Bio-rad). ImageJ (NIH, Bethesda, MD, USA) использовали для денситометрии.
Анализ микроматрицы
Транскриптом CD146 + периостального, жирового и кожного перицитов исследовали с помощью экспрессионного микрочипа.Вкратце, тотальную РНК экстрагировали из перицитов CD146 + компанией Trizol (корпорация Life Technologies). После очистки и аттестации образцы РНК были отправлены в центр JHMI Transcriptomics and Deep Sequencing Core (JHU, Балтимор, Мэриленд, США) для анализа с использованием микроматрицы Affymetrix Clariom D (Affymetrix, Санта-Клара, Калифорния, США). Анализ данных проводился с использованием пакетов программного обеспечения, включая Partek Genomics Suite, Spotfire DecisionSite с функциональной геномикой и QIAGEN Ingenuity ® Pathway Analysis.
Секвенирование одноклеточной РНК (ScRNA)
Данные выровненных scRNA-seq были загружены из Gene Expression Omnibus (GEO) под номером доступа суперсерии GSE128889. Вкратце, подкожный жир измельчали вручную и расщепляли коллагеназой D и диспазой II. После центрифугирования супернатант, содержащий зрелые адипоциты, аспирировали, и осадок, состоящий из SVC, выделяли и сортировали по потоку с гейтированием для выделения отдельных клеток от дебриса, дублетов и мертвых клеток, а также против CD45 для исключения лейкоцитов.Библиотека была создана с использованием контроллера хрома 10X и секвенирована на Ilumina HiSeq 2500. Полученные считывания были выровнены и демультиплексированы с помощью CellRanger. Сначала клетки были отфильтрованы, чтобы иметь> 500 и <6000 обнаруженных генов, а также <5% митохондриальных транскриптов. Регрессия для nUMI, процента митохондриальных генов и клеточного цикла, наряду с уменьшением размерности, выполненным с помощью t-стохастического метода встраивания соседей (tSNE), была выполнена с использованием Seurat. tSNE, графики скрипки и тепловые карты экспрессии были созданы из пользовательского списка генов с использованием функций Сера.
Внутримышечная имплантация
Животных разместили, и эксперименты проводили в соответствии с институциональными рекомендациями Университета Джона Хопкинса, штат Мэриленд. Все эксперименты на животных проводили в соответствии с утвержденным протоколом Комитета по уходу и использованию животных (ACUC) Университета Джона Хопкинса (номер разрешения MO16M302). DBM Putty (DBX, любезно предоставлено Musculoskeletal Transplant Foundation, Эдисон, штат Нью-Джерси) использовался для анализа формирования эктопической кости у мышей. Вкратце, CD146 + человека периостальные, жировые или кожные перициты получали с плотностью 2.5 × 10 7 клеток на мл в PBS. Для каждого образца имплантации 40 мкл клеточной суспензии механически смешивали с 50 мг DBM Putty (всего 1 миллион клеток в 40 мкл PBS) и имплантировали внутримышечно в мышечный мешок бедра самцам мышей NOD / SCID в возрасте 16 недель (The Jackson Лаборатория, Бар-Харбор, Мэн, США). Вкратце, животных анестезировали ингаляцией изофлурана и предварительно вводили бупренорфин. Делали надрезы на задних конечностях и разрезали карманы в двуглавой мышце бедра тупым рассечением параллельно длинной оси мышечного волокна.Методы диссекции и хирургические манипуляции с тканями у всех животных были по возможности постоянными. См. Дополнительную таблицу S4 для животных на экспериментальную группу. После имплантации композита клетка + каркас фасции, покрывающие мышцу, сшивали простым непрерывным рисунком, а кожу закрывали отдельным слоем с использованием 5-0 Vicryl (Ethicon, San Angelo, TX). В избранных экспериментах AMD3100 (Sigma-Aldrich) или контрольный носитель PBS вводили в соответствии с предыдущими сообщениями 62 (5 мг / кг, ежедневные внутрибрюшинные инъекции).Во время процедуры хирурги не знали об экспериментальных группах лечения. В избранных исследованиях человеческие CXCR4 — или CXCR4 + ASC были имплантированы и проанализированы аналогичным образом (имплантированы с плотностью 7,5 × 10 7 клеток на мл в PBS, с 40 мкл клеточной суспензии, механически смешанной с 50 мг DBM Putty).
Микрокомпьютерная томография и анализ
Ткани собирали и фиксировали в 4% PFA (параформальдегид) в течение 24 часов, переносили в PBS и сканировали с помощью микрокомпьютерной томографии высокого разрешения (microCT) (SkyScan 1275; Bruker MicroCT N.V) при разрешении изображения 15 мкм, со следующими настройками: алюминиевый фильтр 1 мм, напряжение рентгеновского излучения 65 кВП, анодный ток 153 мкА, время экспозиции 160–218 мс, усреднение кадра 6, шаг вращения 0,3 градуса. Затем трехмерные изображения были реконструированы из двумерных рентгеновских проекций путем реализации алгоритма Фельдкампа с использованием коммерческого программного пакета NRecon software (2.0.4.0 SkyScan). Для трехмерного морфометрического анализа изображений использовались программы CTVox и CTAn (1.13 SkyScan).Интересующие нас объемы были сформированы из многоугольников, чтобы покрыть новую кость. Все анализы выполнялись слепым методом.
Гистологический анализ
После рентгенографии образцы были перенесены в 14% EDTA (pH 7,6) для декальцификации на 30 дней. Затем образцы заливали компаундом с оптимальной температурой резания и разрезали в корональной плоскости толщиной 16 мкм. Окрашивание H&E проводили на серийных срезах. Все изображения были исследованы под микроскопом Leica DM6 B (Leica Microsystems Inc, Buffalo Grove, IL, USA).Окрашивание ALP выполняли в соответствии с инструкциями производителя (Sigma-Aldrich).
Полная иммуногистохимия
Ткань надкостницы человека микродиссектировали из одного образца пациента (донор-мужчина, надкостница бедренной кости). Часть надкостницы размером 3 × 3 см фиксировали в 4% PFA в течение ночи, промывали водопроводной водой в течение 5 часов и затем инкубировали с блокирующим буфером (0,1% Triton 100 и 1% BSA в PBS) в течение ночи. Инкубацию с первичным антителом (кроличье поликлональное антитело против CD146, Abcam, Сан-Франциско, Калифорния, США; 1:50) проводили в течение 4 дней при осторожном вращении при 4 ° C.Биотинилированное козье антитело против кроличьего IgG (1: 200, Vector Laboratories, BA-1000, Burlingame, CA, USA) использовали в качестве вторичного антитела, а также использовали набор ABC HRP (Vector Laboratories, PK-6100) и раствор DAB. для визуализации (Vector Laboratories, SK-4100). Образцы исследовали с помощью микроскопа Motic smz-171 (Motic, Карлсбад, Калифорния, США).
Непрямое иммунофлуоресцентное окрашивание
Для дополнительного иммунофлуоресцентного окрашивания использовали либо CD146 + периостальных перицитов в культуре, либо криосрезы (12–16 мкм) надкостницы, жировой ткани и внутримышечных имплантатов человека.Все образцы были заблокированы 5% сывороткой в PBS в течение 1 часа при 25 ° C. Извлечение антигена осуществляли с помощью раствора для извлечения антигена ферментативным трипсином (каталожный номер ab970; Abcam) в течение 5 мин. Образцы инкубировали со следующими первичными антителами: анти-CD146 (Abcam, 1:50), анти-CD31 (Cell Signaling Technology, 1: 320 или Abcam, 1: 100), анти-Gli1 (Abcam, 1: 100), анти-PDGFRα (Abcam, 1: 200), анти-PDGFRβ (Abcam, 1: 100), анти-OCN (Abcam, 1: 200) и анти-CXCR4 (Abcam, 1: 150). Dylight 594 козьих антител против кроличьих IgG (H + L), поликлональных (Вектор, 1: 200), козьих антител против армянских хомячков (H + L), Alexa Fluor 647 (Abcam, 1: 200) или козьих антител против мышиных IgG ( H + L) Alexa Fluor 488 или 647 (Abcam, 1: 200) использовали в качестве вторичных антител.Срезы контрастировали с монтажной средой DAPI (каталожный номер H-1500, лаборатории Vector). Все гистологические срезы исследовали с помощью конфокального микроскопа Zeiss 780 (Zeiss, Торнвуд, Нью-Йорк, США) или микроскопии Leica DM6 B (Leica Microsystems Inc).
Статистический анализ
Средние значения и стандартные отклонения были рассчитаны на основе числовых данных, представленных в тексте, рисунках и подписях к рисункам. На рисунках гистограммы представляют средние значения, а столбики ошибок представляют собой одно стандартное отклонение.Средние значения групп сравнивались с использованием теста Манна-Уитни и , когда сравнивались только два набора данных, и теста Краскела-Уоллиса с апостериорными тестами Бонферрони для сравнения более двух групп. Статистическое программное обеспечение SPSS для Windows версии 18.0 (SPSS) или GraphPad Prism (версия 7.0) использовалось для всех статистических анализов. Статистическая значимость обозначена * P <0,05; ** P <0,01; и *** P <0,001.
Рамановский спектроскопический анализ минерализации периостальных клеток челюсти
Для обеспечения более безопасного лечения пациентов необходимо создать условия культивирования клеток без сыворотки для клеточной терапии.В предыдущих исследованиях мы продемонстрировали, что бессывороточная культура способствует пролиферации остеопрогениторов MSCA-1 + , происходящих из надкостницы челюсти. В этом исследовании in vitro формирование костно-специфического матрикса MSCA-1 + периостальными клетками челюсти (JPC, 3 донора) оценивалось и сравнивалось в условиях бессывороточной и содержащей сыворотку сред с использованием безмаркерной рамановской спектроскопии. . Основываясь на стандартном флуоресцентном анализе, JPC от одного пациента не смогли минерализоваться в условиях культивирования, содержащих сыворотку, тогда как другие клетки показали аналогичные уровни минерализации в обоих условиях.Рамановские спектры минерализующихся MSCA-1 + JPC выявили более высокие уровни образования гидроксиапатита и более высокое соотношение минералов и матрикса в условиях культивирования без сыворотки. Более высокое соотношение карбоната к фосфату и более высокая кристалличность в JPC, культивируемых в условиях, содержащих сыворотку, указывают на незрелое образование кости. Из-за снижения выработки коллагена в бессывороточных условиях мы получили значительные различия в зрелости коллагена и соотношении пролина и гидроксипролина по сравнению с бессывороточными условиями.Мы пришли к выводу, что рамановская спектроскопия является полезным инструментом для оценки и неинвазивного мониторинга минерализации in vitro клеток-остеопрогениторов. Дальнейшие исследования должны расширить эти знания и улучшить минерализацию JPC за счет оптимизации условий культивирования.
1. Введение
Остеопрогениторные клетки (JPC), происходящие из надкостницы челюсти, представляют собой оптимальный источник стволовых клеток для инженерии костной ткани при хирургических вмешательствах в полости рта и челюстно-лицевой области. Чтобы получить лицензию на эти клетки для исследований на пациентах, необходимо разработать подробную характеристику JPC, оптимизированную бессывороточную культуру и условия дифференцировки.Популяции клеток, выделенные из тканей надкостницы челюсти, неоднородны. Ранее мы показали, что субпопуляция JPC, экспрессирующая высокий уровень антигена-1 мезенхимальных стволовых клеток (MSCA-1), демонстрирует повышенный остеогенный потенциал по сравнению с фракцией MSCA-клеток [1]. Чтобы избежать иммунологических реакций в будущих клинических исследованиях, мы установили бессывороточные условия культивирования и наблюдали, что пролиферация фракции клеток MSCA-1 + благоприятствовала в бессывороточной среде [2].В то же время мы обнаружили более ранний, но более слабый потенциал минерализации бессывороточных культивированных JPC, что может значительно противодействовать успеху будущих приложений тканевой инженерии.
Для оценки осадка фосфата кальция, образованного клетками, обычно используются процедуры окрашивания, такие как Alizarin Red S, von Kossa и OsteoImage® [2–4]. Эти подходы позволяют количественно оценить отложение минералов, но не позволяют оценить качество минерализованных видов. Рамановская спектроскопия преодолевает это ограничение, обнаруживая колебательные моды молекул.Было описано, что спектры комбинационного рассеяния по отпечатку пальца представляют собой неразрушающее считывание для идентификации фенотипов клеток [5], классификации и оценки злокачественности [6-8] и анализа компонентов внеклеточного матрикса [9, 10]. Было продемонстрировано, что обнаружение и улавливание циркулирующих опухолевых клеток представляет собой дополнительные способы применения рамановской технологии [11, 12]. В минерализованных тканях спектроскопия комбинационного рассеяния чувствительна к структурам минеральной решетки фосфатов и карбонатов. Кроме того, он может обнаруживать вибрации, исходящие от коллагеновой матрицы.Этот метод может дать исчерпывающее представление о биохимическом составе и структуре кости, а также о влиянии различных матричных белков на свойства костного материала [13]. Рамановские спектры в окне от 400 см -1 до примерно 1800 см -1 включают наиболее характерные фосфатные и карбонатные полосы, которые представляют костные минералы и компоненты костного матрикса [13]. Наиболее заметная фосфатная полоса обнаруживается при ~ 961 см -1 , при этом точное положение чувствительно к моногидрофосфату (HPO 4 ) [13].Было показано, что вновь сформированная кость демонстрирует высокое содержание HPO 4 , что приводит к смещению полосы комбинационного рассеяния в сторону более низких волновых чисел [13, 14]. Сообщаемые положения основных пиков карбонатов и апатитов различаются в зависимости от возраста, состояния здоровья и индивидуальных различий между образцами людей [13]. Костные белки представлены в спектре комбинационного рассеяния в полосе фенилаланина при 1005 см -1 , пролина (856 см -1 ), гидроксипролина (881 см -1 ) и амида III (1242-1280 см ). −1 ), а также полосу амида I между 1660 и 1690 см −1 .На основе этих пиков комбинационного рассеяния, а также сигналов, специфичных для фосфатов и карбонатов, можно получить качественные данные о минерализации путем расчета соотношений минералов и матриц, соотношения карбонатов и фосфатов и кристалличности [13]. Поскольку белковые сигналы чувствительны к биохимическим характеристикам коллагена, спектры могут использоваться для исследования зрелости коллагена [13, 15].
В этом исследовании мы использовали рамановскую микроскопию для оценки остеогенной дифференциации и биохимического состава минерализованных видов, образованных JPC в различных условиях среды.JPC, полученные из надкостницы челюсти трех пациентов мужского пола, перед дифференцировкой подвергали магнитному разделению на предмет экспрессии MSCA-1 + . Мы индуцировали in vitro остеогенез этих клеток в сывороточных и бессывороточных условиях культивирования (DMEM по сравнению со средой MesenCult (MC)) и собрали спектры комбинационного рассеяния от обеих культур через 5 и 20 дней дифференцировки. Используя многомерный подход, мы сравнили содержание минерализации на основе полученных спектров. Кроме того, качественные показатели минерализованной матрицы, сформированной in vitro, были получены из спектров комбинационного рассеяния и сравнивались в условиях обеих сред.
2. Материалы и методы
2.1. Выделение клеток и культивирование
После получения письменного информированного согласия JPC были получены от 4 доноров (3 мужчины: 21 год (донор №1 со сложными переломами средней зоны лица, называемый здоровым), 60, 74 и 81 год (донор №2). , карцинома дна ротовой полости; №3, карцинома щечной стороны; №4, карцинома альвеолярного отростка)) были включены в это исследование в соответствии с местным этическим комитетом (номер одобрения: 194 / 2008BO2). Ткань периоста челюсти доноров № 2, 3 и 4 была извлечена из области на безопасном расстоянии от идентифицированной опухоли.Поэтому периостальные ткани челюсти механически разрушали с последующим ферментативным расщеплением с использованием коллагеназы типа XI (1500 Ед / мл, Sigma-Aldrich, Steinheim, Германия) в течение 90 минут. После этого JPC помещали в культуральные колбы размером 75 см 2 . Для размножения JPC клетки культивировали в среде DMEM / F-12 (Invitrogen-BioSource Europe, Nivelles, Бельгия), содержащей 10% FCS (Sigma-Aldrich, Steinheim, Германия) и 1% фунгицида и пенициллин / стрептомицин (Biochrom, Берлин, Германия). ). Клетки, культивируемые в среде DMEM, пассировали с использованием трипсин-версен-ЭДТА (1x, Lonza, Базель, Швейцария).После ступенчатого снижения содержания FCS в культурах среду заменяли на среду без сыворотки и ксенонов MesenCult-XF (MC-XF, STEMCELL Technologies, Ванкувер, Канада), и клетки пассировали с использованием набора для диссоциации MesenCult-ACF. . Кроме того, для условий культивирования MC-XF чашки или колбы для культивирования покрывали в течение ночи прикрепляющим субстратом MesenCult-XF, предоставленным той же компанией.
Для анализа комбинационного рассеяния все сывороточные и бессывороточные культуры MSCA-1 + JPC (полученные от доноров № 1, № 2 и № 3) оценивались в покрытых (подложка для прикрепления MesenCult-XF) чашках со стеклянным дном. (Чашки для клеточных культур CELLview ™ от Greiner Bio-One GmbH, Германия).Для рамановских измерений используемые JPC не фиксировались, но измерения проводились на живых клетках, покрытых средой для культивирования клеток. Культуры MSCA-1 + JPC, полученные из # 4, использовали вместе с тремя другими донорами для анализа экспрессии генов (количественная ПЦР).
2.2. Магнитное разделение клеточной фракции MSCA-1
+ с помощью MACS
Вся популяция JPC подвергалась магнитному разделению для выделения фракции клеток MSCA-1 + , как описано ранее [16].Вкратце, JPC инкубировали с реагентом, блокирующим FcR (400 мкл мкл) и микрошариками против MSCA-1 (400 мкл мкл, Miltenyi Biotec, Bergisch Gladbach, Германия) в течение 20 мин при 4 ° C. Это моноклональное антитело реагирует с тканевой неспецифической щелочной фосфатазой [17]. После промывки образцы наносили на фильтры предварительного разделения, а затем на колонки МС. Клетки MSCA-1 + оставались внутри столбца в магнитном поле. После удаления колонки из магнитного поля фракция MSCA-1 + могла быть элюирована.
Для перехода от условий среды, содержащей сыворотку, к условиям среды без сыворотки, фракции клеток MSCA-1 +/- подвергались ступенчатому восстановлению сыворотки, а затем клетки культивировались в среде MesenCult-XF (MC-XF, STEMCELL Technologies, Grenoble , Франция), содержащий 1% глутамина и 1% фунгицида и пенициллин / стрептомицин, как уже описано в другом месте [2]. Для рамановского спектроскопического анализа фракции клеток MSCA-1 + культивировали в условиях, содержащих FCS (DMEM), и в условиях культивирования без животных (MC).
2.3. Остеогенная дифференцировка
Фракции клеток MSCA-1 + , культивируемые в DMEM, были засеяны с плотностью 4 10 4 клеток, а фракция культивированных MC клеток была засеяна при плотности 6 10 4 клеток на культуру CELLview блюдо со встроенным стеклянным дном (Greiner Bio-One, Фриккенхаузен, Германия). Для всех рамановских анализов чашки для культивирования CELLview были предварительно покрыты прикрепляющим субстратом MesenCult-XF для лучшей адгезии клеток. Предварительные тесты показали низкую адгезию клеток с частичным отслоением клеток без предварительного покрытия (рис. 1), особенно для клеток, индуцированных остеогеном.Для остеогенной дифференцировки фракции клеток MSCA-1 + обрабатывали остеогенной средой (ob, DMEM / F12, содержащей 10% FCS, 10 мМ β -глицерофосфата, 100 мк M 2-фосфата L-аскорбиновой кислоты и 4 µ м дексаметазон, Sigma-Aldrich) в течение 20 дней.
Ксено-свободный (MC-) культивированный MSCA-1 + / — Фракции клеток были остеогенно индуцированы с использованием остеогенной среды MesenCult (ob), содержащей базальную среду MesenCult MSC, 5% остеогенно-стимулирующую добавку и 3 .5 мМ ß-глицерофосфат, как описано ранее [2], в течение того же периода времени, что и клетки, культивируемые в среде DMEM. Для обоих условий культивирования без сыворотки и содержащих сыворотку одновременно культивировали необработанные и недифференцированные контроли (со).
2.4. Рамановская микроскопия и анализ данных
Специально изготовленный рамановский микроскоп, как описано ранее, использовался для всех измерений [18]. Вкратце, система составлена на коммерческом флуоресцентном микроскопе (IX71 Olympus, Япония).Спектры комбинационного рассеяния света возбуждались путем направления лазерного луча с длиной волны 785 нм (TOPTICA AG, Мюнхен, Германия) через масляно-иммерсионный объектив 100x (NA 1.4, Olympus). Система была откалибрована на основе пика кремния при 522 см -1 перед всеми измерениями. Выходная мощность лазера для сбора спектров была установлена на 85 мВт. Спектры комбинационного рассеяния собирали либо для JPC MSCA-1 + , культивированных с сывороткой, содержащей среду (DMEM), либо для JPC MSCA-1 + , культивированных в бессывороточных условиях (MC) после 5 и 20 дней остеогенной дифференцировки.Все клетки культивировали в чашках для культивирования клеток со стеклянным дном (Greiner Bio-One GmbH, Германия). Общее время сбора данных на спектр составляло 100 секунд. Для каждого набора данных брали фоновый спектр из стеклянной чашки, содержащей среду для культивирования клеток. Из всех полученных рамановских спектров вычитали фон с использованием конкретного фонового спектра, а затем корректировали по базовой линии (метод резиновой ленты, 64 точки данных) с использованием OPUS (Bruker Optics, Биллерика, Массачусетс, США). Алгоритм сглаживания (Савицкий-Голей, второй полиномиальный порядок, 7 точек данных) использовался для всех спектров.Затем были рассчитаны многомерные модели PCA для сравнения данных комбинационного рассеяния через 5 и 20 дней дифференциации для каждого пациента с использованием Unscrambler 10.3 (CAMO Software, Осло, Норвегия), как описано ранее [10]. Все основные компоненты (ПК) были проверены на наличие сигналов апатита при 961 см -1 . В каждом PCA были идентифицированы и отобраны загрузки ПК, показывающие сигналы апатита. Значения баллов для выбранных ПК были построены и изображены в виде трехмерных диаграмм рассеяния с использованием OriginPro 2015.
Спектры комбинационного рассеяния света
были дополнительно использованы для сравнения минерального состава, который образовался в условиях культивирования DMEM и MC.Следующие спектральные отношения были вычислены из спектров комбинационного рассеяния: гидроксиапатит (HA) к фенилаланину (961/1005 см -1 ), HA к амиду III (961/1244 см -1 ) и карбонат к HA (1070 / 961 см −1 ). В качестве меры кристалличности ГК была рассчитана величина, обратная величине полной ширины на полувысоте (FWHM) для спектрального диапазона от 900 до 1000 см -1 с использованием MATLAB (MathWorks, Натик, США). Был выделен диапазон и проведен детрендинг. Затем аппроксимировали пик апатита с использованием стандартной кривой Гаусса.На основе подобранной кривой была рассчитана величина, обратная FWHM (1 / FWHM) для пика HA при 961 см -1 .
2,5. Анализ экспрессии генов в JPC, культивируемых в DMEM и MC-XF, с помощью количественной ПЦР.
Выделение
РНК из MSCA-1 + JPC (= 4 для каждой группы), культивированных в сывороточных и бессывороточных условиях, проводили с использованием Набор NucleoSpin RNA XS (Macherey-Nagel, Düren, Германия) в соответствии с инструкциями производителя. После фотометрического определения концентраций РНК (GeneQuant Pro; GE Healthcare) 15 нг РНК были синтезированы в кДНК с использованием набора QuantiTect Whole Transcriptome Kit (Qiagen, Венло, Нидерланды) в соответствии с инструкциями производителя.
Уровни транскрипции мессенджер-РНК определяли количественно с использованием системы LightCycler в реальном времени (Roche Diagnostics, Mannheim, Germany). Для реакций ПЦР использовали коммерческие наборы праймеров (Search LC, Гейдельберг, Германия) и DNA Master SYBR Green 1 (Roche). Для амплификации целевых мРНК использовали 35 циклов. Отношения количества транскриптов коллагена типа I ( α 1 и α 2 цепей) к соответствующим уровням гена глицеральдегид-3-фосфатдегидрогеназы (GAPDH) домашнего хозяйства были рассчитаны и проиллюстрированы на рисунке 7.
2.6. Статистический анализ
Рамановские спектры от каждого донора усредняли. Спектры от каждого донора использовали для расчета средних значений рамановских спектральных отношений. Двусторонний дисперсионный анализ ANOVA был использован (Prism, GraphPad Software, La Jolla, USA) для выявления статистических различий в костях, образованных в условиях DMEM и бессывороточной MC для всех доноров (= 3, для всех тестов).
Для оценки данных ПЦР выражены средние значения ± стандартное отклонение, а для статистического анализа использовались двусторонние тесты.Значение <0,05 считалось значимым.
3. Результаты
3.1. Идентификация планшетов со стеклянным дном, подходящих для проведения рамановских измерений.
JPC засевали в чашки со стеклянным дном с предварительно нанесенным или непокрытым покрытием в необработанных или остеогенных условиях. Как показано на рисунке 1, особенно остеогенно индуцированные монослои клеток иногда отслаиваются в стеклянных чашках без покрытия. Поэтому мы решили покрыть чашки для всех измерений комбинационного рассеяния и для обоих анализируемых условий культивирования (условия, содержащие сыворотку, и условия без сыворотки).
3.2. Рамановские спектры указывают на остеогенную дифференциацию в MSCA-1
+ JPC
Рамановские спектры из MSCA-1 + JPC после 5 дней дифференциации показали высокую вариабельность у пациентов и низкое отношение сигнал / шум, что затрудняло определение пиков ( Дополнительный рисунок в дополнительных материалах доступен в Интернете по адресу https://doi.org/10.1155/2017/1651376). После 20 дней дифференциации спектры комбинационного рассеяния JPC от пациента № 1 показали типичные режимы колебаний гидроксиапатита при 430 (v 2 ), 961 (v 1 ) и 1045 см -1 (v 3 ). в среде MC.Напротив, когда эти клетки были дифференцированы в среде DMEM, явный вклад гидроксиапатита не наблюдался на основе средних спектров (рис. 2 (а)). В спектрах комбинационного рассеяния от пациента № 2 были обнаружены все колебательные моды гидроксиапатита, включая 590 см -1 (v 4 ), что указывает на более высокую степень отложения минералов по сравнению с культивированными MC JPC от пациента № 1. В культивированных DMEM JPC от пациента № 2 также было обнаружено образование апатита. Интенсивность сигналов гидроксиапатита в JPC, культивируемых в DMEM, от пациента № 2 была ниже по сравнению со спектрами от того же пациента, культивированных в условиях MC (рис. 2 (b)).Из-за наложения с пиком v 3 карбонатная вибрация v 1 при 1070 см -1 была обнаружена как плечо пика в спектрах от пациента № 1 и пациента № 2 в условиях обеих сред. Рамановские спектры пациента № 3 показали более низкую интенсивность сигнала и, следовательно, более низкое отношение сигнал / шум для обоих условий по сравнению со спектрами JPC пациента № 1 и пациента № 2. В культивированных MC JPC от этого пациента было обнаружено v 1 при 961 см -1 , тогда как более заметные амидные колебания и деформации CH от белков были обнаружены в спектрах в условиях DMEM (рис. 2 (c)).
3.3. Флуоресцентное обнаружение минерализации и многомерный анализ спектров комбинационного рассеяния
Остеогенную дифференциацию оценивали по фракциям клеток MSCA-1 + JPCs через 20 дней в среде DMEM или MC с помощью флуоресцентного окрашивания гидроксиапатита (OsteoImage). Гидроксиапатит не был обнаружен в JPC MSCA-1 + пациента № 1, культивированных в среде DMEM (рисунки 3 (а) и 3 (b)), тогда как клетки пациента № 2 и № 3 образовывали отложения гидроксиапатита в условиях культивирования DMEM ( Рисунки 3 (г) и 3 (ж)).В среде MC MSCA-1 + JPC от всех пациентов образовывали кристаллы гидроксиапатита (рисунки 3 (b), 3 (e) и 3 (h)). Для анализа разнородных наборов спектральных данных комбинационного рассеяния и визуализации различий в минерализованных видах для JPC, культивируемых в среде DMEM и MC, для спектров использовался PCA. PCA извлекает значения оценки PC и спектры нагрузки, которые описывают спектральные отклонения в наборе данных и демонстрируют изменчивость отдельных спектров комбинационного рассеяния для каждого условия культивирования клеток. Этот метод позволяет выявить различия в спектрах из-за разных стадий созревания матрикса в JPC MSCA-1 + , культивируемых в DMEM и MC.Из-за высокой вариабельности доноров данные комбинационного рассеяния от DMEM- и MC-культивированных MSCA-1 + JPC каждого донора были проанализированы в отдельной модели PCA. Построив оценки PCA для PC 1, PC 2 и PC 3, было подтверждено, что спектры комбинационного рассеяния от дифференцированных MC- и DMEM-культивированных MSCA-1 + JPC от пациента № 1 можно отделить от недифференцированных культур. В то время как более зрелый костный матрикс формировался в условиях MC, показатели PCA также указывают на раннюю (незрелую) стадию минерализации JPC, культивируемых в DMEM, после 20 дней дифференциации (рис. 3 (c)).Загрузки ПК 1, ПК 2 и ПК 3 показали сильный пик гидроксиапатита (рис. 4 (а)), который подтверждает, что значения баллов PCA отражают разную степень минерализации. В MSCA-1 + JPC пациента № 2 оценки PCA выявили различия между MC- и DMEM-культивированными клетками после 20 дней дифференцировки (рис. 3 (f)). В этом PCA сигналы комбинационного рассеяния от гидроксиапатита отражались преимущественно в нагрузках ПК 1 и ПК 4 (рис. 4 (b)). PCA клеток от пациента № 2 снова указывает на более раннюю (незрелую) стадию дифференцировки в условиях DMEM по сравнению с условиями MC (рис. 3 (f)).В обоих условиях среды спектры комбинационного рассеяния от дифференцированных клеток от пациента № 3 показали снижение интенсивности в положениях гидроксиапатита по сравнению с JPC от других пациентов. Этот результат может коррелировать с тем фактом, что дифференцированные MSCA1 + JPC от пациента № 3 образовывали более мелкие кристаллы гидроксиапатита (Рисунок 3 (g)). Загрузка ПК 1, ПК 2 и ПК 3 показала сильное влияние пика гидроксиапатита для данных от пациента № 3 (Рисунок 4 (c)). JPC, дифференцированные в условиях DMEM и MC в течение 20 дней, показали популяцию, которая немного отделена от недифференцированных клеток; таким образом, PCA указывает на вклад минерализованных частиц в спектры JPC, дифференцированных как в среде DMEM, так и в среде MC.PCA продемонстрировал, что некоторые спектры культивированных MC JPC пациента № 3 демонстрируют сильную минерализацию (рис. 3 (f)).
3.4. Оценка качества костей, образованных in vitro дифференцированными MSCA-1
+ JPC
Отношения пиков комбинационного рассеяния использовали для сравнения качества минерализованной матрицы, образованной MSCA1 + JPC в условиях DMEM и MC. Анализируя соотношение между спектральными интенсивностями комбинационного рассеяния гидроксиапатита и фенилаланина (рис. 5 (a)) и пиков гидроксиапатита к амиду III (рис. 5 (b)), было очевидно, что костный матрикс, образованный JPC, имеет значительно более низкие соотношения минералов к матрице. в условиях DMEM по сравнению с JPC, дифференцированными в условиях MC.Более того, увеличение соотношения минералов и матрикса было обнаружено для JPC, культивируемых MC, при сравнении культур с 5-го и 20-го дня (). JPC, культивируемые в DMEM, не претерпели значительных изменений в соотношении минералов к матрице с течением времени культивирования (рисунки 5 (a) и 5 (b)). Напротив, соотношение карбоната к фосфату было значительно выше в клетках, культивируемых в условиях среды DMEM (рис. 5 (c)). Обратная величина FWHM пика гидроксиапатита 961 см -1 связана с размером кристалла или кристалличностью [13, 19].JPC, культивируемые в DMEM, демонстрируют значительно более высокую степень кристалличности, и поэтому клетки формируют более крупные кристаллы по сравнению с культурами MC, что указывает на более отчетливый пик гидроксиапатита в JPC, культивируемых в DMEM (рис. 5 (d)) с небольшим вкладом незрелых минеральных компонентов, таких как гидрофосфат [20 ].
Коллагеновая сеть, необходимая для инициирования образования кристаллов апатита, была дополнительно оценена путем исследования специфичных для коллагена показателей в спектрах комбинационного рассеяния всех наборов данных.Пик амида I, который, как было описано, отражает различия между вновь образованными и зрелыми коллагеновыми волокнами [19, 21], показывает, что коллагены, образованные JPC MSCA1 + в условиях MC и DMEM, различаются по степени их зрелости (рисунки 6 (а) и 6 (б)). Отношения пролина к гидроксипролину были значительно ниже в культивируемых МК JPC, что подтверждает гипотезу о том, что бессывороточная среда MC поддерживает минерализацию через созревание коллагенов в JPC. На дополнительном рисунке показаны репрезентативные средние рамановские спектры JPC, культивируемых в DMEM и MC, от пациента № 2, отражающие обнаруженные различия в отношении зрелости коллагена.
3.5. Анализ экспрессии генов коллагена I типа
Основываясь на том факте, что коллаген I типа представляет собой основной коллагеновый компонент кости, мы проанализировали уровни экспрессии генов в бессывороточных и содержащих сыворотку условиях культивированных JPC.
После нормализации до уровней домашней мРНК GAPDH в сывороточных культивированных MSCA-1 + JPC были обнаружены значительно более высокие уровни α 1 цепи коллагена типа I по сравнению с клетками, культивированными в бессывороточных условиях (необработанные : 110.4 ± 44,8 против 29,7 ± 26,4; остеогенно индуцированный (10 дней): 219,2 ± 81,7 против 96,5 ± 25,8; ,).
Значительно более высокие уровни мРНК α 2 цепи коллагена типа I были также обнаружены в необработанных культивированных DMEM JPC по сравнению с бессывороточными культивированными JPC MSCA-1 + JPC (49,8 10 3 ± 17 10 3 против 22,1 10 3 ± 14,3 10 3 ;,). Различия в уровнях экспрессии генов Coll 1 ( α 2) не достигли значимых значений в остеогенно индуцированных JPC, но была обнаружена аналогичная тенденция (62.7 10 3 ± 24,5 10 3 против 34,2 10 3 ± 4,3 10 3 ).
4. Обсуждение
JPC представляют собой идеальный источник клеток для подходов тканевой инженерии к лечению и регенерации дефектов костей полости рта и челюстно-лицевой области. Чтобы сертифицировать эти клетки для клинического применения, необходимо создать условия для выращивания без животных. Ранее мы описали, что JPC демонстрируют более высокую скорость пролиферации и более высокую экспрессию маркера остеопрогенитора MSCA-1 после размножения в бессывороточных условиях культивирования [2].Чтобы получить более глубокое представление о биохимических характеристиках остеогенеза в бессывороточных условиях, мы сравнили минеральный состав внутри внеклеточного матрикса, продуцируемого MSCA-1 + JPC, независимо от состояния среды с помощью спектрального анализа комбинационного рассеяния.
Для анализа качества костей и их образования, рамановская микроскопия ex vivo была описана как мощный метод [13]. С помощью рамановской микроскопии было показано, что биохимический состав кости изменяется при патологических состояниях, таких как постменопаузальный остеопороз и несовершенный остеогенез [19, 21–24].Кроме того, была указана корреляция биомеханических свойств со спектральной информацией комбинационного рассеяния [25, 26]. Ранее Эванс и его коллеги использовали рамановскую микроспектроскопию для сравнения биохимического состава костных узелков, образованных эмбриональными стволовыми клетками, мезенхимальными стволовыми клетками и остеобластами [27]. Насколько нам известно, это первое исследование, в котором сравнивается минерализация клеток в стандартных и бессывороточных средах с использованием рамановской микроскопии. В нашем исследовании сигналы апатита и карбоната в спектрах комбинационного рассеяния клеток от разных доноров сильно различались.Эти межиндивидуальные биохимические характеристики минерализованных видов могут отражать степень созревания матрикса. Hung et al. определили, что сигнал комбинационного рассеяния гидроксиапатита увеличивается с прогрессирующей дифференцировкой мезенхимальных клеток по направлению к кости и может идентифицировать комбинационные сигналы гидроксиапатита, октакальция фосфата и β-трикальция фосфата от минерализованных видов на разных стадиях [14]. По нашим данным, различия в интенсивности сигнала гидроксиапатита после 20 дней дифференциации могут отражать специфичную для доноров динамику отложения минералов.Интенсивность пиков фосфата и коллагена сильно зависит от поляризационных эффектов [28, 29]. Поэтому возможно, что разные условия среды приводят к разной ориентации минеральных кристаллов и коллагеновых волокон. Эффекты поляризации здесь не исследовались, поскольку ожидалось, что ориентация кристаллов апатита, сформированных in vitro, будет сопоставимой в обоих условиях.
PCA широко используется для анализа спектров комбинационного рассеяния. Использование PCA упрощает интерпретацию очень сложных биологических спектров комбинационного рассеяния за счет разрешения индивидуальных биохимических компонентов [30].Kunstar et al. показали, что значения PC Score можно использовать для отделения спектров эндохондральной кости от спектров прилегающих хрящевых тканей бедренной кости [31]. В их подходе наиболее заметная полоса фосфата на ~ 961 см -1 была идентифицирована в спектре нагрузки ПК как индикатор костной ткани. Точно так же загрузка нашего ПК показывала очевидные фосфатные сигналы. Значения баллов PCA этих PC использовали для отделения спектров JPC, которые были дифференцированы в условиях DMEM, от спектров, дифференцированных в бессывороточных условиях.За исключением культивированных MC JPC от пациента № 3, спектры сформировали четко определенные популяции в пределах графика оценок, что свидетельствует об относительной низкой вариабельности спектральных сигналов в одной чашке для культивирования клеток. Графики баллов отображают постепенное изменение спектров с 5-го по 20-й день для обоих условий среды и предполагают более незрелую степень минерализации для JPC, культивируемых в условиях, содержащих сыворотку.
Как описано многими другими [19, 32], мы оценили отношения минералов к матрице, отношения карбонатов к фосфатам и кристалличность минералов на основе наших данных комбинационного рассеяния, чтобы сравнить минерализованные культуры через 20 дней в условиях культивирования с сывороткой и без нее. .В соответствии с нашими результатами анализа спектров методом PCA, соотношение минералов и матрикса в сывороточных культивированных MSCA-1 + JPC показало аналогичные значения через 5 и 20 дней дифференциации, что указывает на то, что неминерализованные (коллагены и белки), а не минерализованные компоненты матрикса (фосфаты) откладывались из обработанных сывороткой JPC. Однако наши предыдущие исследования, а также исследования других групп показали, что клетки минерализуются в большей степени в условиях, содержащих сыворотку, чем в условиях культивирования без сыворотки [2, 33].Напротив, в текущем исследовании спектры комбинационного рассеяния, PCA и соотношение минералов и матрикса продемонстрировали более зрелое костеобразование в бессывороточных культурах клеток. Эти результаты можно объяснить нашими данными ПЦР (рис. 7) и ранее опубликованными данными, в которых неразделенные бессывороточные культивированные JPC экспрессировали значительно сниженные уровни коллагена типа I по сравнению со стандартными культурами JPC [2]. Хотя пик карбоната частично перекрывается v 3 при 1045 см -1 в наших данных комбинационного рассеяния, было обнаружено, что отношения карбоната к фосфату были значительно выше в условиях культивирования, содержащих сыворотку, что указывает на то, что больше карбоната было помещено в решетка гидроксиапатита.В недавней работе исследовали состав костной ткани и вязкоупругие свойства стареющей губчатой кости человека [34], демонстрируя, что минерализация уменьшается с возрастом, а карбонатное замещение увеличивается [34]. Принимая во внимание эти знания, более высокое соотношение карбонатов и фосфатов и более низкое соотношение минералов и матрикса, обнаруженное в условиях дифференцировки, содержащей сыворотку, может указывать на плохое качество кости. Напротив, McManus и соавторы использовали рамановскую спектроскопию для сравнения остеогенной дифференцировки клеток остеосаркомы с первичными остеобластами [35].Они обнаружили значительно более высокое соотношение карбонатов и фосфатов и более низкое соотношение минералов и матрикса в клетках остеосаркомы, которые могут образовывать дефектные костные структуры по сравнению с первичными остеобластами. Roschger и соавторы сообщили о линейной корреляции между соотношением минералов и матрикса, измеренным с помощью рамановской спектроскопии, и содержанием кальция в костной ткани здорового человека [36]. Однако мы имеем дело с моделью искусственной культуры клеток in vitro, которая, скорее всего, неточно сопоставима с остеональной костью.
Кристалличность минерала соответствует размеру кристалла, и было предложено коррелировать с отношением карбоната к фосфату [19, 32]. В нашем исследовании минерализация в бессывороточных условиях показала более низкие уровни карбоната до фосфата и более мелкие кристаллы гидроксиапатита. Более крупные кристаллы минералов, указывающие на более высокую минерализационную способность, были обнаружены при сывороточном остеогенном дифференцировании. Бычья сыворотка содержит множество активных компонентов, которые, как было описано, ускоряют кристаллизацию свободных фосфатов и кальция [37].В этом аспекте неудивительно, что отношение карбоната к фосфату ниже в условиях культивирования без сыворотки. Для нашего исследования мы можем сделать вывод, что бессывороточные культивированные JPC MSCA-1 + образуют гетерогенные кристаллы апатита, что приводит к более широкому пику гидроксиапатита, который генерируется незрелыми кристаллическими структурами [32]. Подобный феномен был описан для несовершенного остеогенеза [19], показывая более мелкие, но более многочисленные минеральные кристаллы и предполагая, что эти структурные изменения могут привести к более высокой минеральной плотности ткани с более низким модулем Юнга [19].В будущих исследованиях мы стремимся изучить влияние сыворотки в среде на модуль упругости и твердость кости, сформированной in vitro, и сопоставить эти данные с измерениями комбинационного рассеяния. Биомеханические характеристики костных тканей в основном определяются ориентацией и структурой коллагеновых волокон [38]. Как показано в этом исследовании, экспрессия коллагена отличалась в бессывороточных культивированных JPC от стандартных культур. Возможным объяснением может быть тот факт, что значительно более низкая экспрессия коллагена в бессывороточных культивируемых JPCs коррелирует с высоким соотношением минералов и матрикса и низкой кристалличностью, как было замечено ранее при несовершенном остеогенезе [19].Эти структурные изменения в коллагеновых волокнах могут влиять на кристаллизацию фосфата вдоль коллагеновых фибрилл и могут быть спусковым крючком для контроля и управления минерализацией.
Ранее было показано, что жесткость субстрата может влиять на дифференцировку клеток [39]. В нашем исследовании соблюдение JPC на чашках со стеклянным дном не было оптимальным, и из-за этого наблюдения было выполнено предварительное покрытие пластин (рис. 1). Однако JPC MSCA-1 + от донора №1 не осаждали гидроксиапатит в условиях содержания сыворотки на стеклянных планшетах с покрытием, тогда как те же самые клетки способны минерализоваться в 6-луночных планшетах без предварительного покрытия.Клетки от разных пациентов минерализовались в разной степени. Для обоих условий среды спектры комбинационного рассеяния от клеток пациента № 3 показали гораздо более низкие отношения сигнал / шум. Характеристики матрицы, специфичные для пациента, могут влиять на спектральные качества. Эту гипотезу необходимо подтвердить в будущих исследованиях, в которых необходимо исследовать несколько чашек с культурами от одного пациента. Наше исследование подчеркивает способность рамановской спектроскопии анализировать формирование матрицы и сравнивать минеральный состав для различных условий культивирования.Одноточечные Рамановские измерения, выполненные в этом исследовании, не являются репрезентативными для содержания минерализации во всей чашке для культивирования целых клеток, что происходит скорее локально. Автоматическое сканирование более определенных областей внутри монослоев клеток может обеспечить рамановские изображения, которые могут быть более репрезентативными для количественной оценки содержания минерализации [40].
Оптимальные подложки для рамановских измерений состоят из кварцевого стекла или фторида кальция и генерируют меньше фонового сигнала при рамановских измерениях по сравнению со стандартным стеклом.С другой стороны, из-за своих гигроскопических характеристик фторид кальция не совсем стабилен в воде и поэтому, вероятно, не подходит для экспериментов по дифференцировке, которые занимают не менее 20 дней культивирования / дифференцировки клеток. Рамановские совместимые слайды CaF 2 больше подходят для залитых парафином срезов или для культивирования и / или фиксации коротких клеток. В будущих исследованиях мы проверим пригодность тарелок на основе кварца и насадок для 2D-дифференциации и визуализации JPC.Мы могли бы обойти эти проблемы в будущем, наблюдая за 3D-конструкциями TE, где клетки должны расти внутри 3D-конструкций, а не на стеклянных нижних поверхностях.
Таким образом, мы обнаружили значительные различия в биохимическом составе минерализованных видов, образованных MSCA-1 + JPC в условиях культивирования с сывороткой и без нее. Более зрелый костный матрикс, сформированный при бессывороточном культивировании, вероятно, обладает менее эластичными свойствами из-за пониженной экспрессии коллагена.Спектры содержат мощные данные, которые могут поддержать создание протоколов остеогенной дифференциации и адаптацию культур к условиям бессывороточной среды. Биохимическая характеристика минерализованных тканей может предоставить структурную и функциональную информацию, которая может помочь классифицировать и различать образование костной ткани низкого качества. Более того, рамановская микроскопия подходит для сравнения тканей, созданных in vitro, с настоящими природными тканями с глобальной молекулярной чувствительностью.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов относительно публикации этой статьи.
Дополнительные материалы
Дополнительный рисунок 1: Рамановские спектры от MSCA-1 + JPC после 5 дней дифференциации показали высокую вариабельность пациента и низкое отношение сигнал / шум, что затрудняло определение пиков.
Дополнительный рисунок 2: показывает репрезентативные средние рамановские спектры JPC, культивируемых в DMEM и MC, от пациента № 2, отражающие обнаруженные различия в отношении зрелости коллагена.
- Дополнительные материалы
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.
