При беременности повышен плазминоген – в каких случаях назначается этот анализ?
При вынашивании ребенка в организме женщины происходят множественные физиологические изменения. Они затрагивают и систему гемостаза. Эта система отвечает за жидкое состояние крови, образование тромбов для остановки кровотечения и их растворение после того, как они выполнили свои задачи.
Изменения в гемостазе приводят к повышенной или пониженной свертываемости крови, что нежелательно, а в ряде случаев опасно. Для определения степени свертываемости делают коагулограмму.
Под ней понимается совокупность нескольких тестов, которые позволяют оценить гемостаз.
Одним из тестов, входящих в расширенную коагулограмму, является анализ на плазминоген.
 Фибринолиз
Фибринолиз
Что это такое?
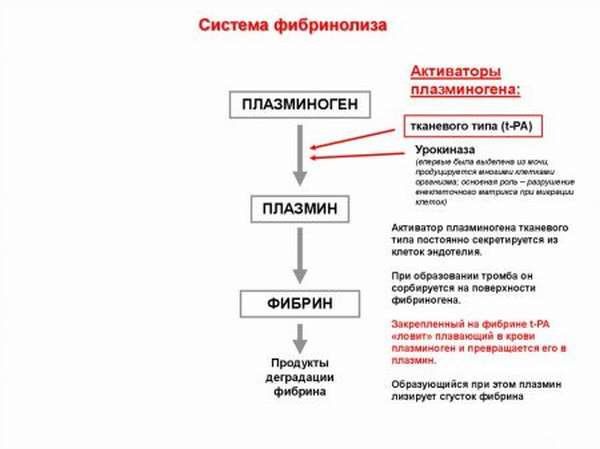
Представляет собой плазминоген циркулирующий в крови профермент, т.е. является неактивным предшественником биологически активного фермента. Плазминоген – продукт синтеза эозинофилов, клеток почек и печени. При воздействии на него плазменных и тканевых активаторов плазминоген трансформируется в фермент плазмин.
Этот фермент – главная действующая сила фибринолиза. Под фибринолизом понимается процесс растворения тромбов.
- Плазмин разрушает фибрин и фибриноген, которые составляют основу тромба, образующегося при свертывании крови.
- Плазмин обеспечивает нормальный ток крови в сосудах, препятствуя чрезмерному тромбообразованию.
- Способствует заживлению кожи и слизистых оболочек, очищая раны от излишнего фибрина.
На современном технологическом уровне медицины измерить содержание плазмина пока невозможно, поскольку он в активном виде пребывает очень короткое время. Поэтому измеряется содержание плазминогена, и по этому показателю определяется активность плазмина, делается вывод о свертываемости крови.
Показания
При беременности тест на плазминоген обязателен, когда она проходит с осложнениями, или были выявлены какие-то отклонения от нормы при проведении стандартной коагулограммы.
 Плацента – норма и отслойка
Плацента – норма и отслойка
К осложнениям относятся:
- угроза выкидыша или преждевременных родов;
- отслойка плаценты.
- Преждевременное прерывание беременности может произойти в течение всего времени вынашивания плода. Когда прерывание случается до 28 недель, диагностируется выкидыш или самопроизвольный аборт. Если беременность прерывается на временном отрезке 28-37 недель – преждевременные роды. Причин этого печального для женщины явления много, начиная от инфекционных поражений и заканчивая травмами. На угрозу прерывания указывают два симптома: кровянистые выделения и боль в центре нижней части живота, которая может быть тянущей или схваткообразной.
- Отделение плаценты может быть частичным или полным. Когда отслойка незначительная и не прогрессирует, беременность и роды проходят в основном нормально. Если частичная отслойка имеет значительный характер, то она начинает представлять серьезную угрозу для здоровья плода и матери. Чтобы ребенок погиб, достаточно отделения более одной трети плаценты. Полная отслойка встречается очень редко.
Об отслойке можно судить по таким признакам: кровотечение из матки, боли в животе, напряженная матка, нарушение сердечной деятельности плода.
 Тромбоз нижней конечности
Тромбоз нижней конечности
Помимо патологий, имеющих прямое отношение к беременности, тест назначается, когда у человека есть заболевания, связанные с наличием тромбов. К ним относятся инсульт, инфаркт, различные аритмии, транзисторная ишемическая атака, тромбоз глубоких венозных сосудов, тромбоэмболия легочной артерии.
Врач может направить пациента на измерение уровня плазминогена, если он жалуется на то, что ноги отекают, болят и тяжелые, постоянно болит голова, образовались сосудистые «звездочки». Все эти признаки могут указывать на высокую вероятность тромбообразования.
Когда тест не нужен
Тест не проводится, если есть острые воспалительные явления, инфекционные заражения, повреждение тканей. Плазминоген в таких случаях повышается, но временно. Поэтому тест малоинформативен для оценки фибринолитической системы.
Следует отметить, что результаты при тестировании на плазминоген не способны точно указать на причину отклонения от нормы. Интерпретировать эти данные нужно в комплексе с результатами других анализов, инструментальных исследований.
Подготовка и сдача анализа
- Специально готовиться, чтобы сдать кровь на плазминоген, не требуется. Перерыв между забором крови и последним приемом пищи должен составлять не менее шести часов. Поэтому лучше прийти на процедуру с утра, натощак.
- Рекомендуется перед процедурой избегать интенсивных физических нагрузок, сильных душевных переживаний.
- Обо всех лекарствах, которые применяются для лечения, нужно предупредить врача.
 Процедура взятия крови
Процедура взятия крови
Кровь берется из вены. Собирается она в пробирку, в которой находится определенное количество антикоагулянта (цитрат натрия). После забора кровь аккуратно перемешивается и отправляется в лабораторию. Материал обрабатывается на центрифуге. Плазму исследуют методом фотометрии с применением автоматического анализатора. Далее в материал вводится стрептокиназа, после нее особый пептидный субстрат. В результате химической реакции появляется окрашенное соединение. По количеству этого соединения выясняется концентрация плазминогена в образце крови.
Исследование, как правило, не занимает более четырех часов.
Норма
У детей, не достигших шестимесячного возраста, норма колеблется в пределах 50-90 процентов. После достижения этого возраста нормальные детские показатели не отличаются от взрослых (80-132 процента).
У женщин фибринолиз несколько увеличивается в менструальный период. Если плазминоген повышен при беременности (второй и третий триместры), это считается нормальным. К родам его концентрация может достигать 165-167 процентов.
Пониженный плазминоген
Нехватка белка может обуславливаться разными факторами.
- В одних ситуациях к ней приводит болезни печени (гепатит, цирроз, поздние стадии рака), в результате которых она не в состоянии должным образом участвовать в синтезе плазминогена.
- В других ситуациях причиной дефицита может стать ДВС-синдром на первой стадии. Другие названия – коагулопатия потребления, диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром.
Развиться патология может по многим причинам, при беременности таковыми являются:
- эмболия околоплодными водами, особенно если они инфицированы;
- прекэклампсия и эклампсия;
- атония и массаж матки;
- внутриутробная смерть ребенка;
- ранняя отслойка и предлежание плаценты.
 «Стрептокиназа»
«Стрептокиназа»
- Еще одна причина нехватки – длительная терапия препаратами урокиназы и стрептокиназы, которые стимулируют образование плазмина и приводят к излишнему расходованию плазминогена.
- Иногда недостаточное количество белка вызывается врожденной патологией.
Повышенный плазминоген
Причинами увеличения концентрации этого белка сверх нормы нередко являются:
- тиреотоксикоз;
- воспаление поджелудочной железы и панкреонекроз;
- инфекции;
- рак печени, предстательной железы, яичников;
- меланома.
Плазминогенный всплеск в крови может быть реакцией организма на хирургические операции.
Высокий уровень характерен для второй и третьей стадий ДВС-синдрома.
Лечение
Терапия высокого или низкого уровня белка сводится к устранению причин, которые вызвали его выход за пределы нормы.
Физиологически обусловленное повышение (менструация, беременность) в лечении не нуждается.
К любым отклонениям в гемостазе нужно отнестись со всей серьезностью, ибо они могут стать источником серьезных рисков для здоровья. Все выявленные отклонения, в том числе по плазминогену, должны быть приведены к нормальным величинам путем устранения факторов, их вызвавших.
Больше узнать о тромбофилии при беременности можно из видеоматериала.
Плазминоген — это фермент, который активизируется в плазме в начале свертываемости крови.
Плазминоген
Исследование крови на плазминоген входит в группу анализов по гемостазу крови, но является показателем антисвертывающей системы крови.
Гликопротеин плазминоген:
- синтезируется в печени, циркулирует в плазме крови;
- является предшественником плазмина, одного из компонентов системы фибринолиза, которая обеспечивает разрушение фибриновых сгустков, тромбов;
- процесс активации в плазмин осуществляется посредством активаторов, кровяных, тканевых, экзогенных;
- используется в качестве показателя состояния фибринолитической (плазминовой) системы из-за невозможности непосредственной оценки плазмина.
Описание анализа
Анализ на уровень активности плазминогена в циркулирующей крови:
- служит для обнаружения нарушений фибринолиза, как врожденных, так и приобретенных;
- предназначен для диагностирования случаев тромбофилии; ДВС-синдрома; для осуществления контроля терапевтического применения препаратов с тромболитическим механизмом действия;
- позволяет диагностировать клинические проявления патологических процессов системы по уровню активности белка в крови;
- выполняется за один рабочий день.
Показатели нормального содержания плазминогена у детей и взрослых, выраженные как % активности, варьируют от 80 до 120%, у новорожденных эти значения составляют от 50 до 90%.
Показания к прохождению анализа
Анализ показан нескольким категориям пациентов с целью проведения оценки функционирования фибринолитической системы:
- лицам, в анамнезе которых имеются случаи инфарктов миокарда, тромбозов, тромбоэмболии;
- лицам с ДВС-синдромом;
- лицам с семейной предрасположенностью к развитию тромбозов;
- женщинам, у которых беременность протекает с осложнениями;
- лицам, принимающим тромболики (стрептокиназа, урокиназа).
Подготовка к анализу
В качестве материала для проведения теста на активность плазминогена используют образцы венозной крови, помещенные в пробирку с цитратом натрия.
Взятие образцов крови производится на голодный желудок, либо через четыре часа после еды.
Не требуется специальной подготовки к анализу, кроме консультации с врачом по поводу принимаемых лекарственных препаратов.
В случае приема лекарств, потенциально влияющих на результаты анализа, использование их временно прекращают по согласованию с лечащим врачом.
Результаты анализа и их интерпретация
Данные проведенного тестирования, выдаваемые на руки пациенту, могут быть в пределах нормы, свидетельствовать об отклонениях от нормальных значений в сторону повышения или понижения уровня активности плазминогена.
Повышенные значения показателя обнаруживаются:
- при острой фазе инфекционных процессов; травматических повреждений, воспалений, злокачественных новообразований, инфарктах;
- в ходе беременности, особенно в третьем триместре;
- после хирургических вмешательств по трансплантации печени, почек;
- при гипотиреозе;
- при приеме анаболических стероидов, гормональных контрацептивов.
Пониженные значения активности плазминогена выявляются:
- в относительно редких случаях наличия врожденной формы дефицита;
- при имеющемся ДВС-синдроме;
- при заболеваниях печени;
- при проведении терапевтического курса тромболитиками;
- при гипертиреозе;
- в послеоперационный период.
плазминоген это — 25 рекомендаций на Babyblog.ru
PAI является белком острой фазы . Его активность возрастает после больших
операций, тяжелых травм, инфаркта миокарда. После введения в организм
кортикостероидов, эндотоксина (бактериальный LPS) активность PAI нарастает.
Статины вызывают снижение экспрессии гена PAI-1 . Уровень тканевого
активатора плазминогена в плазме пострадавших с травматическим шоком
уменьшается в 2—3 раза, а его ингибитора в 1,8—2 раза .
Выявлено повышенное содержание PAI-1 в тучных клетках, что подтверждает
участие этого белка в патогенезе бронхиальной астмы и других IgE-
опосредованных аллергических заболеваниях . Также показано участие PAI-1 в
ремоделировании дыхательных путей.
Активность PAI в течение беременности постепенно нарастает, и в третьем
триместре концентрация PAI-2 повышается до 100 мкг/мл (определяется
иммунологическим методом), особенно при действии отягощающих беременность
факторов, а после родов возвращается к норме.
У больных инфарктом миокарда отмечено повышение активности PAI и снижение
содержания и активности тканевого активатора. Часто активность PAI повышается
у больных венозными тромбозами. Повышение PAI у таких больных в
предоперационном периоде угрожает послеоперационным тромбозом.
PAI-1 участвует в ремоделировании сосудов и репарации тканей . Показано, что
высокий уровень PAI-1 тормозит образование intima media артерий .
Полиморфизм -675 5G>4G.
Полиморфный вариант 4G затрагивает промоторную область и сопровождается
повышенной экспрессией гена и повышением уровня PAI-1 в крови . В результате
снижается активность тромболитической системы.
Различия в фенотипических проявлениях генотипа PAI-1 обусловлены тем, что с
промотором гена 5G может связываться как активатор, так и репрессор, а с
промотором гена 4G — только активатор. Поэтому ген 5G, легко включается и легко
выключается, а ген 4G легко включается, но плохо выключается (Рисунок 2).
При беременности повышен плазминоген – в каких случаях назначается этот анализ?
При вынашивании ребенка в организме женщины происходят множественные физиологические изменения. Они затрагивают и систему гемостаза. Эта система отвечает за жидкое состояние крови, образование тромбов для остановки кровотечения и их растворение после того, как они выполнили свои задачи.
Изменения в гемостазе приводят к повышенной или пониженной свертываемости крови, что нежелательно, а в ряде случаев опасно. Для определения степени свертываемости делают коагулограмму.
Под ней понимается совокупность нескольких тестов, которые позволяют оценить гемостаз.
Одним из тестов, входящих в расширенную коагулограмму, является анализ на плазминоген.
Что это такое?
Представляет собой плазминоген циркулирующий в крови профермент, т.е. является неактивным предшественником биологически активного фермента. Плазминоген – продукт синтеза эозинофилов, клеток почек и печени. При воздействии на него плазменных и тканевых активаторов плазминоген трансформируется в фермент плазмин.
Этот фермент – главная действующая сила фибринолиза. Под фибринолизом понимается процесс растворения тромбов.
- Плазмин разрушает фибрин и фибриноген, которые составляют основу тромба, образующегося при свертывании крови.
- Плазмин обеспечивает нормальный ток крови в сосудах, препятствуя чрезмерному тромбообразованию.
- Способствует заживлению кожи и слизистых оболочек, очищая раны от излишнего фибрина.
На современном технологическом уровне медицины измерить содержание плазмина пока невозможно, поскольку он в активном виде пребывает очень короткое время. Поэтому измеряется содержание плазминогена, и по этому показателю определяется активность плазмина, делается вывод о свертываемости крови.
Показания
При беременности тест на плазминоген обязателен, когда она проходит с осложнениями, или были выявлены какие-то отклонения от нормы при проведении стандартной коагулограммы.
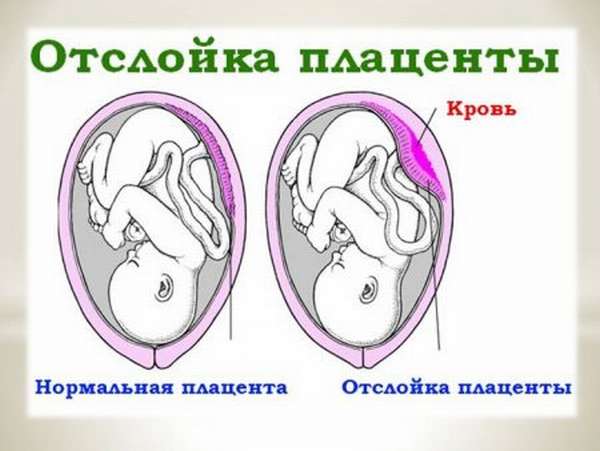
К осложнениям относятся:
- угроза выкидыша или преждевременных родов,
- отслойка плаценты.
- Преждевременное прерывание беременности может произойти в течение всего времени вынашивания плода. Когда прерывание случается до 28 недель, диагностируется выкидыш или самопроизвольный аборт. Если беременность прерывается на временном отрезке 28-37 недель преждевременные роды. Причин этого печального для женщины явления много, начиная от инфекционных поражений и заканчивая травмами. На угрозу прерывания указывают два симптома: кровянистые выделения и боль в центре нижней части живота, которая может быть тянущей или схваткообразной.
- Отделение плаценты может быть частичным или полным. Когда отслойка незначительная и не прогрессирует, беременность и роды проходят в основном нормально. Если частичная отслойка имеет значительный характер, то она начинает представлять серьезную угрозу для здоровья плода и матери. Чтобы ребенок погиб, достаточно отделения более одной трети плаценты. Полная отслойка встречается очень редко.
Об отслойке можно судить по таким признакам: кровотечение из матки, боли в животе, напряженная матка, нарушение сердечной деятельности плода.
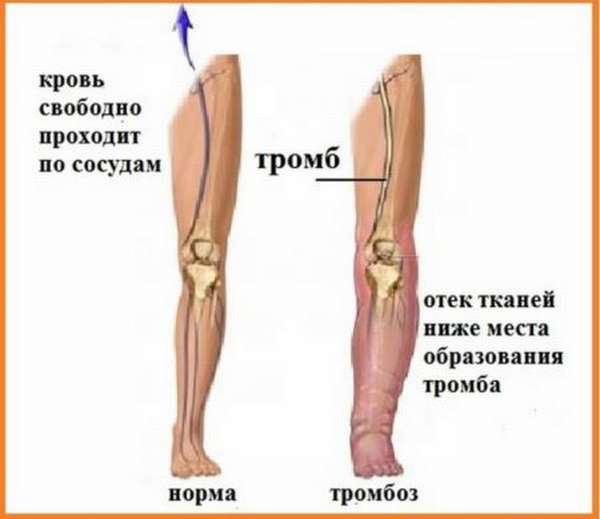
Помимо патологий, имеющих прямое отношение к беременности, тест назначается, когда у человека есть заболевания, связанные с наличием тромбов. К ним относятся инсульт, инфаркт, различные аритмии, транзисторная ишемическая атака, тромбоз глубоких венозных сосудов, тромбоэмболия легочной артерии.
Врач может направить пациента на измерение уровня плазминогена, если он жалуется на то, что ноги отекают, болят и тяжелые, постоянно болит голова, образовались сосудистые «звездочки». Все эти признаки могут указывать на высокую вероятность тромбообразования.
Когда тест не нужен
Тест не проводится, если есть острые воспалительные явления, инфекционные заражения, повреждение тканей. Плазминоген в таких случаях повышается, но временно. Поэтому тест малоинформативен для оценки фибринолитической системы.
Следует отметить, что результаты при тестировании на плазминоген не способны точно указать на причину отклонения от нормы. Интерпретировать эти данные нужно в комплексе с результатами других анализов, инструментальных исследований.
Подготовка и сдача анализа
- Специально готовиться, чтобы сдать кровь на плазминоген, не требуется. Перерыв между забором крови и последним приемом пищи должен составлять не менее шести часов. Поэтому лучше прийти на процедуру с утра, натощак.
- Рекомендуется перед процедурой избегать интенсивных физических нагрузок, сильных душевных переживаний.
- Обо всех лекарствах, которые применяются для лечения, нужно предупредить врача.
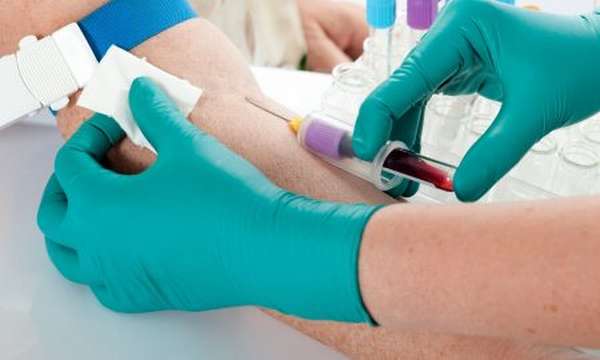
Кровь берется из вены. Собирается она в пробирку, в которой находится определенное количество антикоагулянта (цитрат натрия). После забора кровь аккуратно перемешивается и отправляется в лабораторию. Материал обрабатывается на центрифуге. Плазму исследуют методом фотометрии с применением автоматического анализатора. Далее в материал вводится стрептокиназа, после нее особый пептидный субстрат. В результате химической реакции появляется окрашенное соединение. По количеству этого соединения выясняется концентрация плазминогена в образце крови.
Исследование, как правило, не занимает более четырех часов.
Норма
У детей, не достигших шестимесячного возраста, норма колеблется в пределах 50-90 процентов. После достижения этого возраста нормальные детские показатели не отличаются от взрослых (80-132 процента).
У женщин фибринолиз несколько увеличивается в менструальный период. Если плазминоген повышен при беременности (второй и третий триместры), это считается нормальным. К родам его концентрация может достигать 165-167 процентов.
Пониженный плазминоген
Нехватка белка может обуславливаться разными факторами.
- В одних ситуациях к ней приводит болезни печени (гепатит, цирроз, поздние стадии рака), в результате которых она не в состоянии должным образом участвовать в синтезе плазминогена.
- В других ситуациях причиной дефицита может стать ДВС-синдром на первой стадии. Другие названия – коагулопатия потребления, диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром.
Развиться патология может по многим причинам, при беременности таковыми являются:
- эмболия околоплодными водами, особенно если они инфицированы,
- прекэклампсия и эклампсия,
- атония и массаж матки,
- внутриутробная смерть ребенка,
- ранняя отслойка и предлежание плаценты.

- Еще одна причина нехватки – длительная терапия препаратами урокиназы и стрептокиназы, которые стимулируют образование плазмина и приводят к излишнему расходованию плазминогена.
- Иногда недостаточное количество белка вызывается врожденной патологией.
Повышенный плазминоген
Причинами увеличения концентрации этого белка сверх нормы нередко являются:
- тиреотоксикоз,
- воспаление поджелудочной железы и панкреонекроз,
- инфекции,
- рак печени, предстательной железы, яичников,
- меланома.
Плазминогенный всплеск в крови может быть реакцией организма на хирургические операции.
Высокий уровень характерен для второй и третьей стадий ДВС-синдрома.
Лечение
Терапия высокого или низкого уровня белка сводится к устранению причин, которые вызвали его выход за пределы нормы.
Физиологически обусловленное повышение (менструация, беременность) в лечении не нуждается.
К любым отклонениям в гемостазе нужно отнестись со всей серьезностью, ибо они могут стать источником серьезных рисков для здоровья. Все выявленные отклонения, в том числе по плазминогену, должны быть приведены к нормальным величинам путем устранения факторов, их вызвавших.
Больше узнать о тромбофилии при беременности можно из видеоматериала.
 Загрузка…
Загрузка…
Причины нарушения в плазминовой системе
Под влиянием различных патологических процессов изменяются состояние плазминовой системы и продукция её отдельных компонентов. В результате активации плазминовой системы нарушается гемостаз и довольно часто развивается геморрагический фибринолитический синдром. Клинически он проявляется тяжёлыми кровотечениями вследствие множественных дефектов в системе гемостаза. Этот синдром может протекать латентно: кровоточивость отмечается у больных лишь в послеоперационном и послеродовом периодах при повреждении тканей. Чаще всего такие состояния выявляют у больных с поражениями печени в результате уменьшения синтеза ею антиплазминов, при поражении органов, богатых активаторами плазминогена, и при оперативных вмешательствах на них (при операциях по поводу рака предстательной железы, лёгкого), реже — у пациентов с усиленной выработкой (лекарственной, бактериальной, стрессовой и др.) активаторов плазминогена или повышенной их концентрацией. Такой фибринолиз, обусловленный первичной активацией плазминовой системы как таковой и не отражающий реакцию организма на повышение образования фибрина, является первичным фибринолизом. Для его коррекции назначают антифибринолитические препараты типа антипротеаз (апротинин, ε-аминокапроновая кислота).
В большинстве случаев наблюдают вторичный фибринолиз вследствие активации плазминовой системы на образование фибрина в организме. При вторичном фибринолизе плазминовая активность вначале повышается, а затем постепенно снижается и, наконец, полностью исчезает из-за исчерпания запасов плазминогена. Нередко снижается концентрация и активаторов плазминогена на фоне сниженного или повышенного количества антиплазминов. На способности ряда препаратов превращать неактивный плазминоген в плазмин основано проведение тромболитической терапии у больных с инфарктом миокарда и тромбоэмболиями — путём введения активаторов плазминогена (чаще всего препаратов стрептокиназы). При проведении тромболитической терапии необходим постоянный контроль за уровнем плазминогена в крови.
Изменения в системе гемостаза при первичном и вторичном фибринолизе
Показатели | Фибринолиз | |
первичный | вторичный | |
Фибриноген | Снижен | Снижен |
Плазминоген | Повышен | Снижен |
α2-АП | Снижен | Повышен |
ПДФ | Повышен | Повышен |
Наиболее ярко сдвиги в плазминовой системе прослеживаются при ДВС-синдроме, когда вначале активация фибринолиза является защитной, саногенной реакцией, и поэтому ингибиторы плазмина здесь противопоказаны.
Следует иметь в виду, что плазминоген, так же как и все другие белки острой фазы, повышается при инфекциях, травмах, опухолях и в последние месяцы беременности.
плазминоген. В каких случаях необходимо сдавать анализы на плазминоген, показатели нормы, повышенное или пониженное его значение.
Медицинское исследование — Плазминоген.
Плазминоген является показателем антисвертывающей системы крови. Он оценивает способность крови рассасывать сгусток фибрина. Показания к применению данного анализа является оценка системы фибринолиза при ДВС-индроме, тромбозах, инфарктах, а также в период лечения урокиназой и стрептокиназой.
Перед выполнением диагностической процедуры, никаких ограничений в режиме питания или диете не требуется. Однако лечащий врач должен знать о применении пациентом различных препаратов, которые могут оказать негативное влияние на результат обследования. Если необходимо, то эти препараты отменяют. Исследование проводят путем пункции вены. Из нее набирают кровь в пробирку, в которой находится цитрат натрия. На место пункции плотно прикладывают ватный шарик для остановки кровотечения. После процедуры пациент может возобновлять прием медицинских препаратов, которые до этого пришлось отменить.
Показатели плазминогена.
При норме уровень активности плазминогена составляет 80 — 135%. У детей, сразу после рождения активность плазминогена составляет около 60% от уровня взрослых.
Показатель плазминогена выше нормы.
Повышенные значения уровня активности плазминогена чаще всего наблюдаются при: панкреатите, панкреонекрозе, метастазах, меланомах, раке предстательной железы или яичников, после хирургического лечения поджелудочной, легких, предстательной железы, при состояниях развивающего синдрома диссеменированного внутрисосудистого свертывания (ДВС), при циррозах и поражениях печени с метастазами, гипертоническом кризе.
Также это может быть во время беременности (в 3-м триместре иногда повышение плазминогена составляет до165%).
Показатель плазминогена ниже нормы.
Пониженная активность плазминогена может быть определена врожденным дефицитом, что в свою очередь может спровоцировать опасность тромбоза. При аномальном белке уровень активности антигена остается в пределах нормы. Случаи, когда уровень плазминогена может быть понижен, встречаются очень редко. Это явление наблюдается при гепатоцеллюлярных заболеваниях, ДВС-синдроме, а также в период лечения стрептокиназой или урокиназой.
Факторы, которые влияют на результат исследования.
На результаты исследования могут оказывать влияния такие факторы, как гемолиз из-за травматического прокола вены, недостаточное перемешивание крови с реагентом (цитратом натрия), хранение исследуемого материала без заморозки, поздняя отправка плазмы в лабораторию. При слишком длительном пережиме вены жгутом, возможна наступление гемоконцентрации, в связи, с чем может быть получен заниженный результат.
Референтные величины содержания плазминогена в плазме крови — 80
Референтные величины содержания плазминогена в плазме крови — 80-120%.
Плазминоген (профибринолизин) — неактивный предшественник фермента плазмина (фибринолизина). Определение плазминогена имеет важнейшее значение для оценки состояния фибринолитической системы.
Плазминовая система включает четыре основных компонента: плазми-ноген, плазмин, активаторы проферментов фибринолиза и его ингибиторы. Плазминоген превращается в плазмин под влиянием физиологических активаторов — веществ, активирующих фибринолиз. Они могут быть плазменного, тканевого и экзогенного (бактериального) происхождения. Тканевые активаторы образуются в ткани предстательной железы, лёгких, матки, плаценты, печени, сосудистой стенки. Активаторы плазминогена содержатся в секреторных жидкостях (к ним относится, в частности, уро-киназа, вырабатывающаяся в почках). Экзогенный активатор плазминоге-на бактериального происхождения (стрептокиназа) активирует плазмино-ген, образуя с ним активный комплекс.
Плазминовая система в основном предназначена для лизиса фибрина, хотя плазмин легко может разрушать фибриноген, факторы V, VIII и другие. Мощная антиплазминовая система (а1-антитрипсин, а2-АП, а2-мак-роглобулин, АТШ) защищает эти белки от действия плазмина, сосредотачивая его действие на фибрине.
Нарушения в плазминовой системе. Под влиянием различных патологических процессов изменяются состояние плазминовой системы и продукция её отдельных компонентов. В результате активации плазминовой системы нарушается гемостаз и довольно часто развивается геморрагический фиб-ринолитический синдром. Клинически он проявляется тяжёлыми кровотечениями вследствие множественных дефектов в системе гемостаза. Этот синдром может протекать латентно: кровоточивость отмечается у больных лишь в послеоперационном и послеродовом периодах при повреждении тканей. Чаще всего такие состояния выявляют у больных с поражениями печени в результате уменьшения синтеза ею антиплазминов, при поражении органов, богатых активаторами плазминогена, и при оперативных вмешательствах на них (при операциях по поводу рака предстательной железы,
лёгкого), реже — у пациентов с усиленной выработкой (лекарственной, бактериальной, стрессовой и др.) активаторов плазминогена или повышенной их концентрацией (табл.). Такой фибринолиз, обусловленный первичной активацией плазминовой системы как таковой и не отражающий реакцию организма на повышение образования фибрина, является первичным фибринолизом. Для его коррекции назначают антифибрино-литические препараты типа антипротеаз (апротинин, е-аминокапроновая кислота).
В большинстве случаев наблюдают вторичный фибринолиз вследствие активации плазминовой системы на образование фибрина в организме. При вторичном фибринолизе плазминовая активность вначале повышается, а затем постепенно снижается и, наконец, полностью исчезает из-за исчерпания запасов плазминогена. Нередко снижается концентрация и активаторов плазминогена на фоне сниженного или повышенного количества антиплазминов (табл.). На способности ряда препаратов превращать неактивный плазминоген в плазмин основано проведение тромболити-ческой терапии у больных с ИМ и тромбоэмболиями — путём введения активаторов плазминогена (чаще всего препаратов стрептокиназы). При проведении тромболитической терапии необходим постоянный контроль за уровнем плазминогена в крови.
Таблица Изменения в системе гемостаза при первичном и вторичном фибри-нолизе
Таблица Изменения в системе гемостаза при первичном и вторичном фибри-нолизе
Наиболее ярко сдвиги в плазминовой системе прослеживаются при ДВС-синдроме, когда вначале активация фибринолиза является защитной, сано-генной реакцией, и поэтому ингибиторы плазмина здесь противопоказаны.
Следует иметь в виду, что плазминоген, так же как и все другие белки острой фазы, повышается при инфекциях, травмах, опухолях и в последние месяцы беременности.
Обновлено: 2019-07-09 21:45:32
Врожденный дефицит плазминогена — Genetics Home Reference
Врожденный дефицит плазминогена — это заболевание, которое приводит к воспаленным разрастаниям на слизистых оболочках, которые представляют собой влажные ткани, выстилающие отверстия тела, такие как веки и внутренняя часть рта. Развитие новообразований обычно вызывается инфекциями или травмами, но они также могут возникать спонтанно при отсутствии известных триггеров. После удаления новообразования могут повториться.
Врожденная недостаточность плазминогена чаще всего поражает конъюнктиву, которая представляет собой слизистую оболочку, защищающую белую часть (склеры) и покрывающую веки.Характерным признаком этого заболевания является деревянистый конъюнктивит, при котором накопление белка, называемого фибрином, вызывает воспаление конъюнктивы (конъюнктивит) и приводит к образованию толстых, древесных (деревянистых) воспаленных новообразований желтого, белого или красного цвета. Древесный конъюнктивит чаще всего возникает на внутренней стороне век. Однако примерно в одной трети случаев деревянистый конъюнктивит на склере растет на роговице, которая представляет собой прозрачное покрытие, защищающее окрашенную часть глаза (радужную оболочку) и зрачок.Такие новообразования могут порвать роговицу или вызвать рубцевание. Эти проблемы с роговицей, а также закупорка наростами внутри века могут привести к потере зрения.
У людей с врожденной недостаточностью плазминогена также могут развиваться деревянистые наросты на других слизистых оболочках, включая внутреннюю часть рта и десны; слизистая оболочка носовой полости; а у женщин — влагалище. Рост на слизистых оболочках, выстилающих желудочно-кишечный тракт, может привести к язве. Наросты также могут развиваться в трахее, что может вызвать опасную для жизни обструкцию дыхательных путей, особенно у детей.В небольшом количестве случаев пораженные люди рождаются с нарушенным оттоком жидкости, которая окружает и защищает головной и спинной мозг (или спинномозговая жидкость), что приводит к скоплению этой жидкости в черепе (окклюзионная гидроцефалия). Неясно, как эта особенность связана с другими признаками и симптомами врожденной недостаточности плазминогена.
.
Функциональная стабильность ингибитора активатора плазминогена-1
Ингибитор активатора плазминогена-1 (PAI-1) является основным ингибитором активаторов плазминогена, таких как активатор плазминогена тканевого типа (t-PA) и активатор плазминогена урокиназного типа (u- PA) и главный регулятор фибринолитической системы. PAI-1 играет ключевую роль в острых тромботических событиях, таких как тромбоз глубоких вен (ТГВ) и инфаркт миокарда (ИМ). Биологические эффекты PAI-1 выходят далеко за рамки тромбоза, включая его критическую роль при фиброзных расстройствах, атеросклерозе, почечном и легочном фиброзе, диабете 2 типа и раке.Превращение PAI-1 из активной в латентную конформацию, по-видимому, является уникальным среди серпинов тем, что происходит спонтанно с относительно быстрой скоростью. Считается, что латентный переход представляет собой регуляторный механизм, снижающий риск тромбоза из-за длительного антифибринолитического действия PAI-1. Таким образом, полагаясь исключительно на плазменные концентрации PAI-1 без оценки его функции, можно ввести в заблуждение при интерпретации роли PAI-1 во многих сложных заболеваниях. Условия окружающей среды, взаимодействие с другими белками, мутации и гликозилирование являются основными факторами, которые оказывают значительное влияние на стабильность структуры PAI-1.В этом обзоре представлен обзор современных знаний об PAI-1, особенно важности уровня и стабильности PAI-1, а также подчеркивается потенциальное использование ингибиторов PAI-1 для лечения сердечно-сосудистых заболеваний.
1. Введение
Ингибитор активатора плазминогена-1 (PAI-1) является членом суперсемейства ингибиторов сериновых протеиназ (серпинов). Каждый серпин состоит примерно из 350–400 аминокислотных остатков (в зависимости от степени гликозилирования) с молекулярными массами в диапазоне от 38 до 70 кДа [1].Конформационное изменение «от стресса к расслаблению» является отличительной чертой членов семейства серпиновых белков, которая приводит к значительной термодинамической стабилизации, и механизм ингибирования серпинов основан на этом переходе. Серпины делятся на две группы: ингибирующие серпины и не ингибирующие серпины [2]. PAI-1 относится к группе ингибирующих серпинов, то есть к ингибитору активаторов плазминогена. Сообщается о двух типах PAI-1, активатора плазминогена тканевого типа (t-PA) и активатора плазминогена урокиназного типа (u-PA) [3].Оба типа активаторов плазминогена являются членами сериновых протеаз. Циркулирующий профермент плазминоген расщепляется этими сериновыми протеазами, образуя активную протеазу плазмин.
Лизис фибрина в сгустке крови и перицеллюлярный протеолиз являются результатом активации плазминогена t-PA и u-PA, соответственно. В качестве потенциальных контрольных точек в регуляции фибринолиза активность плазмина может быть напрямую ингибирована α 2-антиплазмин или активируемый тромбином ингибитор фибринолиза (TAFI) или ингибиторы активатора плазминогена могут блокировать превращение плазминогена в плазмин [4].PAI-1 является наиболее важным прямым физиологическим ингибитором t-PA и u-PA и главным регулятором фибринолитической системы (рис. 1) [5]. Сообщалось о тяжести и неблагоприятных исходах при ряде заболеваний из-за повышенных уровней антигена PAI-1 в плазме [6–9] и активности [9–11]; в результате PAI-1 рассматривается как биомаркер и потенциальная молекулярная мишень для терапевтических средств.
2. Биохимия PAI-1
PAI-1 представляет собой одноцепочечный гликопротеин 47 кДа, состоящий из 379 или 381 аминокислоты в зависимости от гетерогенности N-конца, вызванной двумя возможными сайтами расщепления сигнальными пептидазами [12] и в молекуле PAI-1 нет цистеина.PAI-1 — глобулярный белок с 3 бета-листами (A, B и C) и 9 альфа-спиралями (hA – hI) [13]. Открытая пептидная петля петли реактивного центра PAI-1 (RCL) имеет большое значение для механизма ингибирования [14].
Об очистке человеческого PAI-1 до видимой гомогенности и о моноклональных антителах против человеческого PAI-1 сообщалось в 1984 [15] и 1986 [16, 17], соответственно. Выделение полноразмерной кДНК, кодирующей PAI-1 человека, было независимо описано четырьмя группами в 1986 г. (инвентарный номер NCBI M16006) [18–21].
Были клонированы кДНК, кодирующие PAI-1 крысы [22], крупного рогатого скота [23], мыши [24], кролика [25], свиньи [26] и верветки [27], и эти исследования выявили от 81 до 97 % идентичности нуклеиновых кислот и 78–97% идентичности аминокислот с PAI-1 человека [28].
Ген PAI-1 человека расположен на хромосоме 7 (q21.3 – q22) (рис. 2), охватывает примерно 12200 пар оснований и состоит из девяти экзонов и восьми интронов [29]. Несколько групп проанализировали и секвенировали весь ген PAI-1 [29–33].Некоторые агенты, включая дексаметазон, эндотоксин, липополисахарид, фактор роста, тромбин, интерлейкин-1, фактор некроза опухоли, инсулин, липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП) и липопротеины, стимулируют синтез и секрецию ПАИ. -1 [34, 35].
В гене PAI-1 описано несколько генетических вариаций. Полиморфизм PAI-1 включает два динуклеотидных (CA) повтора в промоторе и в интроне 4, полиморфизм длины рестрикционного фрагмента Hind III (RFLP) и полиморфизм вставки (5G) / делеции (4G) в положении -675 PAI- 1, замена T-на-G в положении +11 053, две замены G-на-A в положениях -844 и +9785 в интроне 7, делеция девяти нуклеотидов из трехкратно повторяющейся последовательности между нуклеотидами +11 320 и +11 345, и полиморфизм G +12 078 A в 3′-нетранслируемой области [36].Гомозиготность по 4G в полиморфизме 4G / 5G коррелировала с повышенным уровнем белка PAI-1, повышенным риском тромбоза и нарушением фибринолиза [37].
3. Физиологическая функция PAI-1
PAI-1 может быть синтезирован в различных тканях и типах клеток, таких как печень, селезенка, адипоциты, гепатоциты, тромбоциты, мегакариоциты, макрофаги, гладкомышечные клетки, плацента и эндотелиальные клетки [ 38]. PAI-1 образует ковалентную связь как с t-PA, так и с u-PA (молярное соотношение 1: 1) и блокирует деградацию активного фибрина, предотвращая образование плазмина (протеазы фибринолиза) из неактивного предшественника плазминогена [39, 40] .PAI-1 играет важную роль в острых тромботических событиях, таких как ТГВ и ИМ, диабет 2 типа, рак и фиброзные расстройства, включая атеросклероз, почечный и легочный фиброз [39–41].
Тканевый активатор плазминогена (t-PA) и ингибитор активатора плазминогена-1 (PAI-1) напрямую влияют на образование и деградацию тромбов и, следовательно, на риск артериального тромбоза. PAI-1 — прокоагулянтная, провоспалительная и профибротическая молекула [39, 40]. PAI-1 часто экспрессируется в поврежденных тканях, включая миокард и мозг, и соотношение PAI-1 / тканевый активатор плазминогена (tPA) указывает на фибринолитический баланс пациента, который может указывать на риск тромба и инсульта.Исследования показывают доказательства активации эндотелия при повреждении мелких сосудов головного мозга, связанном с низким уровнем PAI-1. Предыдущие исследования связывают высокий уровень t-PA и различия в активности компонентов фибринолитической системы с развитием поражения белого вещества [42].
Атеросклероз — это воспалительный процесс, который приводит к накоплению липидов на стенке артерии. Адаптивный и врожденный иммунитет играют активную роль в атеросклеротическом процессе. В основном моноциты дают начало макрофагам, и они становятся пенистыми клетками в интиме артерий, что является отличительной чертой артериальной жировой полосы.Тучные клетки, тромбоциты, а также Т- и В-клетки также играют роль в атерогенезе [43]. Основным признаком атеросклероза является ингибирование фибринолиза из-за повышенных уровней ингибитора-1 активатора плазминогена (PAI-1), индикатора неэффективного фибринолиза. Это приводит к увеличению тромбообразования [44] и делает бляшку нестабильной. Также было показано, что высокая концентрация глюкозы в сыворотке связана с повышенным уровнем PAI-1. Повышенные уровни PAI-1 встречаются при многих болезненных состояниях, включая метаболический синдром [45], диабет [44] и ожирение.Недавние исследования показали, что PAI-1 также играет роль в развитии жировой ткани и в контроле передачи сигналов инсулина в адипоцитах [45].
Тромболитики являются основными средствами лечения острых тромботических сосудистых событий. PAI-1 является основным ингибитором активаторов плазминогена как тканевого, так и урокиназного типа, который подавляет фибринолиз и имеет причинную связь с различными сосудистыми осложнениями [40]. Кроме того, PAI-1 также играет ключевую роль в врожденном иммунитете, регулируя миграцию клеток и фагоцитоз.PAI-1 стимулировал миграцию моноцитов и макрофагов, взаимодействуя с LRP или tPA. PAI-1 также способствует миграции лимфоцитов и нейтрофилов в участки воспаления [46]. PAI-1 самопроизвольно превращается в термодинамически стабильную латентную форму и имеет короткий период полураспада () около 2 часов [47]. Активаторы плазминогена (PA) и ингибиторы PA (PAI) сбалансированы в крови и регулируют превращение плазминогена в плазмин [40]. Плазмин проявляет протеолитическую активность в отношении широкого спектра белков, включая матриксные металлопротеиназы (MMP), трансформирующий фактор роста (TGF-b1), ламинин, коллаген IV типа и фибронектин.Концентрация антигена PAI-1 в плазме и уровни активности PAI-1 заметно различаются даже в нормальных популяциях [48].
Через регуляцию активаторов плазминогена урокиназного и тканевого типа, PAI-1 играет роль в таких физиологических процессах, как заживление ран и ремоделирование тканей. Эта ключевая роль придает большое значение PAI-1 во многих патофизиологических состояниях, включая сердечно-сосудистые заболевания, метастазирование и распространение рака [1, 49].
Дефицит PAI-1 в экспериментальных моделях на животных был связан с защитными эффектами против периваскулярного фиброза, индуцированного L-NAME, фиброза почек и фиброза легких, индуцированного блеомицином [50, 51].
4. Клиническое значение PAI-1
PAI-1 является основным ингибитором активации плазминогена и, таким образом, имеет особое значение при сердечно-сосудистых заболеваниях. Исследования показывают сильную корреляцию между уровнями PAI-1 в сыворотке и риском сердечно-сосудистых заболеваний в различных клинических условиях. Например, повышенный уровень PAI-1 в сыворотке крови связан с риском инфаркта миокарда (ИМ), рецидивирующего ИМ, стенокардии и атеросклероза [52–56]. В дополнение к его модулирующей роли в фибринолитической системе, ингибитор активатора плазминогена-1 (PAI-1) i
.
Бактериальные рецепторы плазминогена используют систему плазминогена хозяина для эффективной инвазии и распространения
Чтобы инвазивные патогены мигрировали за пределы очага инфекции, физиологические барьеры хозяина, такие как внеклеточный матрикс, базальная мембрана и инкапсулирующая фибриновая сеть, должны быть разрушены. Чтобы обойти эти препятствия, протеолитические ферменты способствуют распространению микроорганизма. Рекрутирование протеаз хозяина на бактериальную поверхность представляет собой особенно эффективный механизм повышения инвазивности.Плазмин представляет собой сериновую протеазу широкого спектра действия, которая разрушает фибрин, внеклеточные матриксы и соединительную ткань. Большое количество патогенов экспрессируют рецепторы плазминогена, которые иммобилизуют плазмин (оген) на бактериальной поверхности. Затем связанный с поверхностью плазминоген активируется активаторами плазминогена в плазмин посредством ограниченного протеолиза, что запускает развитие протеолитической поверхности на бактериях и в конечном итоге способствует распространению бактерий. Система гемостаза хозяина играет важную роль в системной инфекции.Взаимодействие между гемостатическими процессами, такими как коагуляция и фибринолиз, и воспалительной реакцией составляет важные компоненты защиты хозяина и бактериальной инвазии. Цель данной статьи — выделить механизмы, посредством которых патогенные бактерии, взаимодействуя с поверхностными рецепторами, используют плазминоген и фибринолитическую систему хозяина для успешного распространения внутри хозяина.
1. Введение
Бактериальная инвазия обычно опосредуется бактериальной поверхностью и секретируемыми продуктами, которые часто действуют, чтобы обойти врожденные и приобретенные системы защиты хозяина.Уклонение от иммунного ответа хозяина и производство инвазивных молекул часто являются первыми важными шагами для инициирования системных заболеваний. Система гемостаза хозяина играет важную роль в системной инфекции и бактериальном патогенезе. Гемостатические процессы, такие как коагуляция и отложение фибрина в результате воспаления, являются важной частью системы защиты хозяина. Однако инвазивные бактериальные патогены разработали множество стратегий, чтобы ускользнуть от линии защиты хозяина и проникнуть в окружающую ткань хозяина.Способность разрушать тканевые барьеры, образованные внеклеточными матрицами (ЕСМ) и базальными мембранами (БМ), является одним из наиболее важных факторов патогенеза бактериальной инфекции. Деградация этой сети секретируемыми бактериальными протеазами приводит к повреждению тканей и структур и, таким образом, усиливает инвазию бактерий в организм хозяина. Однако ряд инвазивных бактерий, таких как Streptococcus , Haemophilus , Neisseria и большинство кишечных бактерий, таких как E.coli являются внеклеточными патогенами и продуцируют низкие уровни протеаз. Следовательно, деградация и проникновение через эту сеть мембран требует использования различных механизмов инвазии. Ряд этих механизмов основан на взаимодействии с протеазозависимыми каскадными системами их хозяина, которые включают фибринолиз, коагуляцию, фагоцитоз и активацию комплемента. Фибринолитическая система млекопитающих, которая представляет собой растворение тромба сериновой протеиназой плазмин (Pm), предлагает потенциальную протеолитическую систему, которая может быть использована патогенными бактериями для проникновения в систему хозяина.Связывание плазминогена (Plg) с бактериями можно считать универсальным событием [1–3]. Известно, что плазмин играет значительную роль в нескольких физиологических процессах, помимо разложения фибринового сгустка при фибринолизе и различных компонентов внеклеточного матрикса и соединительной ткани, таких как ламинин и фибронектин. Pm также активирует проколлагеназы до активных коллагеназ и участвует в активации некоторых прогормонов и факторов роста [4–6]. Недавно было также показано, что проникновение гематоэнцефалического барьера усиливается за счет приобретения Pm [7].Посредством активации матриксных металлопротеаз (ММП) Pm может разрушать внеклеточные матриксы и базальные мембраны прямо или косвенно и разрушать комплемент и иммуноглобулины, тем самым повышая вероятность бактериального распространения (см. Обзор [3]) [8, 9]. Следовательно, активность Pm необходимо строго контролировать, чтобы поддерживать гомеостаз ткани и избегать случайного повреждения ткани. Такая регуляция достигается системой плазминогена благодаря доступности рецепторов Plg (PlgR) и активаторов плазминогена (PA).
Бактерии взаимодействуют с системой Plg, секретируя PA и экспрессируя PlgR на своей поверхности, которые направляют активность Pm в места, где требуется протеолитическая активность. Многие из бактериальных PlgR являются критическими факторами вирулентности и входят в число основных целей при разработке вакцин.
Известно, что фибринолитическая система играет важную роль в воспалительной реакции на бактериальные инфекции, а система Plg хозяина играет центральную роль в фибринолизе. Фибринолитическая система разрушает существующий фибринсодержащий сгусток крови и является важным элементом механизмов заживления ран.Сгустки фибрина образуются во время коагуляции и повреждения стенок кровеносных сосудов, что приводит к отложению фибрина и агрегации тромбоцитов. Основным активным ферментом, участвующим в фибринолитическом процессе, является Pm. Фибринолиз инициируется, когда Plg превращается в Pm физиологическими активаторами хозяина, активатором плазминогена урокиназного типа (uPA) или активатором плазминогена тканевого типа (tPA). Во время инфекции в месте локального микробного повреждения воспалительные клетки хозяина в сочетании с секретируемыми бактериями продуктами, такими как эндотоксины, вызывают интенсивный ответ в окружающей сосудистой сети, что приводит к локальному тромбозу сосудов.Это служит для ограждения очага инфекции и, в свою очередь, может задерживать бактерии и действовать как барьер для предотвращения бактериального вторжения и системного распространения. Скорее всего, поэтому на месте инфекции часто видны отложения фибрина. Образование активного Pm на бактериальной поверхности способствует разложению фибринового слоя, отложенного хозяином вокруг места локальной инфекции, способствуя высвобождению бактерий из фибринового сгустка, и впоследствии способствует деградации ECM, тем самым облегчая распространение бактерий в более глубокие ткани.Следовательно, существует тонкая механистическая взаимосвязь между бактериальными белками и белками хозяина, которые способствуют распространению и выживанию бактерий. Благодаря своей способности напрямую связываться с Plg хозяина, PlgR, таким образом, служат для усиления активации поверхностно связанного Plg с Pm, создавая протеолитическое микроокружение, используемое патогенами для катализирования разрушения матричных барьеров, что затем способствует распространению бактерий [23]. , 24] (рис. 1). В последние годы исследования, направленные на понимание механизмов и роли системы Plg в бактериальных инфекциях, значительно расширились, и в этой статье суммируются наши текущие знания об избранной группе бактериальных патогенов, которые используют систему Plg / Pm хозяина для распространения в окружающие ткани. .
2. Ключевые участники системы плазминогена
2.1. Плазминоген и плазмин
Плазминоген человека (hPlg) синтезируется в печени в виде полипептидной цепи 90 кДа из 810 аминокислот. Во время секреции лидерный пептид из 19 аминокислот отщепляется, образуя зрелую форму этого белка, содержащую 791 аминокислоту [25, 26]. Эта нативная форма Plg называется Glu-Plg из-за наличия аминотерминального остатка глутаминовой кислоты. Молекула Plg содержит в общей сложности семь структурных доменов, каждый из которых обладает различными свойствами.N-концевая часть молекулы состоит из активационного пептида (AP), за которым следует серия из 5 повторяющихся гомологичных участков пептида с тройной дисульфидной связью, длиной примерно 80 аминокислот, называемых кринглами (K1 – K5). Разрыв пептидной связи между остатками 77 и 78 необходим для высвобождения активирующего пептида. Укороченная форма зимогенов затем обозначается как Lys-Plg. Расщепление пептидной связи Arg561-Val562 в hPlg приводит к образованию Pm, который содержит тяжелую цепь из 561 аминокислотного остатка, дисульфидно связанную с легкой цепью из 230 аминокислотных остатков.Тяжелая цепь массой 65 кДа включает N-концевую часть молекулы Plg, которая состоит из АР и 5 кринглов (K1 – K5) (рис. 2). Функция пяти кринглов в тяжелой цепи Plg заключается в первую очередь в опосредовании белок-белковых взаимодействий, таких как взаимодействия между связыванием Plg или Pm с фибрином, мишенями ЕСМ и лизинсодержащими рецепторами / аналогами. Кринглы Plg также независимо участвуют в ангиогенезе и ингибировании миграции клеток [27, 28]. Легкая цепь Pm содержит карбоксильный конец hPlg, который включает каталитический домен, напоминающий домен семейства сериновых протеаз.Каталитическая триада аминокислот, определяющих сериновые протеазы, присутствует в Pm человека и состоит из His603, Asp646 и Ser741 [5]. Каталитический домен или домен сериновой протеазы (SP) Pm представляет собой компактный модуль, который может привлекать адапторные молекулы или кофакторы, такие как бактериальные PAs стрептокиназа и стафилокиназа, которые изменяют представление субстрата ферменту и его специфичность [29]. Почти все модули крингла связываются с лизином или лизиноподобными лигандами, за исключением K3. K1 и K4 демонстрируют самое сильное сродство к лигандам [30–33], тогда как K2 обладает самым слабым сродством [34].K2 проявляет сильное сродство к эндополипептиду (VEK-30), происходящему из белка M рецептора Streptococcal Plg (PAM) [35]. Сила связывания крингл-модулей зависит от природы лиганда.
.
