Посев нa флору c определением чувствительности к расширенному спектру антибиотиков
Меню
Вход в личный кабинет
x
Восстановление пароля
x
Подтверждение номера телефона
На ваш телефон отправлено сообщение с кодом. Для подтверждения Вашего телефонного номера введите код из смс
Для подтверждения Вашего телефонного номера введите код из смс
Повторно отправить SMS можно через 50 секунд.
Повторно отправить SMS
Авторизация успешна!
Подтвердите свой номер телефона для доступа к новому личному кабинету
Повторно отправить SMS можно через 50 секунд.
Повторно отправить SMS
Подтвердить
Выберите офис
Горячая линия
Анализы и цены
string(91) «posev-na-floru-c-opredelenijem-chuvstvitelnosti-k-rasshirennomu-spektru-antibiotikov_140007»
| Подготовка к исследованию: |
|
Методы определения видов бактерий и их чувствительности
Анализы на чувствительность к антибиотикам в медицине называют бактериальным посевом. Эти методы позволяют определить возбудителя заболевания и его концентрацию в организме. Цель анализа – выявить в полученном материале вредные микроорганизмы, чтобы в дальнейшем решить задачи насчет специфического лечения.
Выделив микроорганизмы, проводят антибиотикограмму – определение чувствительности обнаруженных микробов к бактериофагам и антибактериальным препаратам.
Методы лабораторного определения чувствительности бактерий к антибиотикам
Метод отличается высокой специфичностью – не наблюдается перекрестных ложных реакций. Есть возможность исследовать любую биологическую жидкость. Проводится он в целях определения чувствительности выявленного микроба к лечебным средствам, что позволяет применять самую эффективную терапию.
Проводится он в целях определения чувствительности выявленного микроба к лечебным средствам, что позволяет применять самую эффективную терапию.
Результат получают не сразу. Требования к забору материала высокие. Персонал лаборатории должен быть высококвалифицированным.
Этим методом широко пользуются в медицинской практике, особенно при инфекционных заболеваниях, в гинекологии, хирургии, урологии, онкологии, отоларингологии и пр.
Абсолютным показанием являются любые воспалительные заболевания органов и систем, подозрение на сепсис.
Исследовать могут следующие материалы: слизь из зева, носоглотки, цервикального канал, уретры; мокроты; кал; урину; кровь; секрет простаты; грудное молоко; желчь; спинномозговую жидкость; содержимое кист; раневое отделяемое.
Слизь из носа и зева может содержать: гемолитические стрептококки, пневмококки, золотистый стафилококк, коринобактерии дифтерии, менингококк, гемофильную палочку, листерии.
В кале могут выделить:
- кишечную группу бактерий – сальмонеллы, шигеллы, иерсинии;
- тифопаратифозную группу;
- условно-патогенных возбудителей кишечных инфекций;
- анаэробных микробов; возбудителей пищевых инфекций;
- обследовать на дисбактериоз кишечника.

В биопунктате, гнойном отделяемом и содержимом ран выделяют:
- псевдомонады;
- синегнойные палочки.
Урогенитальную слизь исследуют так:
- на наличие возбудителей половых инфекций – гонококк, грибы, трихомонады, уреаплазму, листерии, микоплазму;
- на бактериальную флору.
Кровь могут исследовать на стерильность. Грудное молоко, секрет простаты, мочу, мазки, раневое отделяемое, суставная жидкость, желчь – эти материалы могут быть обследованы на обсемененность (бактериальную флору).
Собранный материал помещают в специальные среды. В зависимости от необходимого результата посев делают в разные среды. К примеру, в избирательная или элективная среда, примером которой является свернутая лошадиная сыворотка для обнаружения возбудителя дифтерии или же среда с солями желчных кислот/селенитом для определения возбудителя кишечных инфекций.
Другой вариант – дифференциально-диагностические среды, которые применяют для расшифровки бактериальных культур.
Если есть необходимость, делают пересев с жидкой на твердую питательную среду, чтобы идентифицировать колонии.
После этого питательную среду помещают в термостат, где создают благоприятные условия для жизнедеятельности возбудителей заболеваний. При этом задают конкретное время, влажность и температуру.
После извлечения образца из термостата проводят контрольный осмотр выросших колоний микробов (культура микроорганизмов). Если есть необходимость, проводится микроскопия полученного материала со специальной окраской. Контрольный осмотр – оценка формы, цвета, плотности колоний.
В заключение проводится подсчет возбудителей. В лабораторной практике используется понятие колониеобразующая единица (КОЕ) – одна микробная клетка, которая способна образовать колонию, или же видимая колония микробов. Показатель КОЕ позволяет определить количество микробов в образце или определить их концентрацию. Подсчет КОЕ может проводиться разными методами.
Качество теста зависит от нескольких факторов, включая соблюдение правил при заборе материала для исследований. Посуда и инструменты должны быть стерильными! В противном случае происходит контаминация (происходит обсеменение бактериями, не имеющих клинического значения), что делает тест бессмысленным.
Посуда и инструменты должны быть стерильными! В противном случае происходит контаминация (происходит обсеменение бактериями, не имеющих клинического значения), что делает тест бессмысленным.
Если человек принимает антибиотики, посев не будет точным. Прием таковых нужно прекратить за 10 суток до предполагаемой даты анализа. Также нужно сообщить лечащему врачу о приеме любых медикаментозных средств.
Доставка в лабораторию должна быть очень быстрой, не допускается высыхание материала и изменение его кислотности.
К примеру, кал нужно доставлять в теплом виде.
- Забор мочи проводится после утренних гигиенических процедур. Собирают среднюю порцию урины. Объем мочи – 10-15 мл. посуда должна быть стерильной. В лабораторию ее нужно доставить за 2 часа;
- Если назначен мазок из носа или зева: нельзя чистить зубы, полоскать рот/нос дезинфекторами, есть и пить;
- Забор кала проводят утром стерильной лопаткой в такую же посуду. Объем – 15-30 г. Не допускается попадание в него мочи.
 Максимальное время доставки – 5 часов. Не допускается замораживание. Кал собирают без слабительных и клизм;
Максимальное время доставки – 5 часов. Не допускается замораживание. Кал собирают без слабительных и клизм; - Кровь берут до антибиотикотерапии. Минимальное количество – 5 мл для детей, не меньше 15 мл взрослым;
- Проба мокрот берется утром натощак. Предварительно полощут рот и чистят зубы. Доставляют в лабораторию максимум за 1 час;
- Грудное молоко собирают после водных процедур. Кожу около соска обрабатывают спиртом. Сцеживают 15 мл молока, затем последующие 5 мл выдавливают в стерильный контейнер. Доставляют его за 2 часа;
- Мазок половых органов: забор осуществляют минимум через 14 с момента окончания менструаций, не раньше месяца после курса антибиотиков. Не мочиться на протяжении 2 часов женщинам и 5-6 часов до пробы мужчинам.
Данный анализ проводят с целью определения аллергии у человека на конкретный медикамент. Это позволяет после выявления бактерий и определения их чувствительности к антибиотику подобрать лечение. Но если у человека имеются какие-либо противопоказания к таким лекарствам, проводится внутрикожная проба, чтобы снизить риск развития побочных реакций.
Результат исследования слизи из носоглотки готов спустя 5-7 суток, испражнения – 4-7, урогенитальный соскоб– 7, посев на общую флору – 4-7, кровь на стерильность – 10.
Учитывают качество и количество, то есть сам факт наличия микробов, так и их концентрацию. Расшифровка результатов проводится очень простым методом.
В исследуемом материале выделяют несколько степеней роста микроорганизмов (обсемененность).
- Первая степень – рост отсутствует;
- вторая степень – рост на твердой среде до 10 колоний;
- третья – до 100;
- четвертая – больше 100 колоний.
Результаты очень важны при выявлении условно-патогенной микрофлоры, так как 1 и 2 степени не считаются причинами заболевания, а просто свидетельствуют о загрязненности исследуемого материала, однако 3 и 4 степень указывают на причину воспаления. При выделении патогенной флоры учитывают абсолютно все колонии.
Результаты подсчета КОЕ/мл расшифровывают следующим методом:
- 103/мл – одна колония;
- 104/мл – от одной до пяти;
- 105/мл – от 5;
- 106/мл – больше 15.

Количество колоний важно для определения степени патологии и контроля проводимой терапии.
Важной составляющей диагностики и лечения является определение чувствительности возбудителя к антибактериальным препаратам. Набор антибиотиков, к которому резистентный или чувствителен возбудитель, называют антибиотикограммой. Чувствительность микроорганизма – это когда антибиотик подавляет его размножение. Резистентность – это устойчивость бактерии, то есть лекарство никак на нем не отразится. Антибиотикограмма выдается в конкретных единицах измерения – минимальной ингибитирующей концентрации (МИК).
Как видите, исследованием данного вопроса может заниматься искючительно пофильный специалист. Здоровья вам и хорошего самочувствия!
Материалы, размещённые на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остаётся исключительной прерогативой вашего лечащего врача.
Посев на флору с определением чувствительности к основному спектру антибиотиков | 800 |
Посев мочи на флору с определением чувствительности к основному спектру антибиотиков | 800 |
Посев на флору с определением чувствительности к расширенному спектру антибиотиков | 1000 |
Посев мочи на флору с определением чувствительности к расширенному спектру антибиотиков | 1000 |
Посев на флору с определением чувствительности к основному спектру антибиотиков и бактериофагам | 900 |
Посев мочи на флору с определением чувствительности к основному спектру антибиотиков и бактериофагам | 900 |
Посев на флору с определением чувствительности к расширенному спектру антибиотиков и бактериофагам | 1100 |
Посев мочи на флору с определением чувствительности к расширенному спектру антибиотиков и бактериофагам | 1100 |
Посев на Mycoplasma hominis и Ureaplasma urealyticum с определением чувствительности к антибиотикам | 1300 |
Посев на грибы рода Candida с идентификацией и определением чувствительности к антимикотическим препаратам | 800 |
Посев крови на стерильность с определением чувстивительности к антибиотикам | 1100 |
Посев Corynebacterium diphtheriae | 900 |
Посев Staphylococcus aureus с определением чувствительности к антибиотикам | 800 |
Посев Streptococcus pyogenes с определением чувствительности к антибиотикам | 800 |
Исследование на биоценоз влагалища | 1000 |
Посев на анаэробные бактерии и чувствительность к антибиотикам | 800 |
Посев на Clostridium difficile | 700 |
Дисбактериоз с определением чувствительности к фагам | 1000 |
Дисбактериоз с определением чувствительности к антибиотикам и фагам | 1000 |
Посев на иерсиниоз с определением чувствительности к антибиотикам | 800 |
Посев на возбудителей кишечной инфекции (сальмонеллы, шигеллы) с определением чувствительности к антибиотикам | 800 |
Посев на E. | 800 |
как сдавать и что показывает анализ мочи, расшифровка бакпосева
Посев мочи на флору с определением чувствительности к антибиотикам является комплексным анализом, позволяющим диагностировать разнообразные инфекции мочевыводящих путей и точно выявить возбудителя такого рода патологий.
Каковы основные показания к назначению этого мероприятия? Что показывает бактериологический анализ на посев мочи? Как правильно к нему подготовиться? Есть ли альтернативные методики выявления бактериальных инфекций в организме и определения чувствительности к антибиотикам? Об этом и многом другом вы прочитайте в нашей статье.
Показания к проведению бактериологического исследования
Бактериологическое исследование урины в общем случае является классическим анализом, позволяющим выявить бессимптомные типы бактериурии, а также правильно диагностировать инфекции мочевыводящих путей.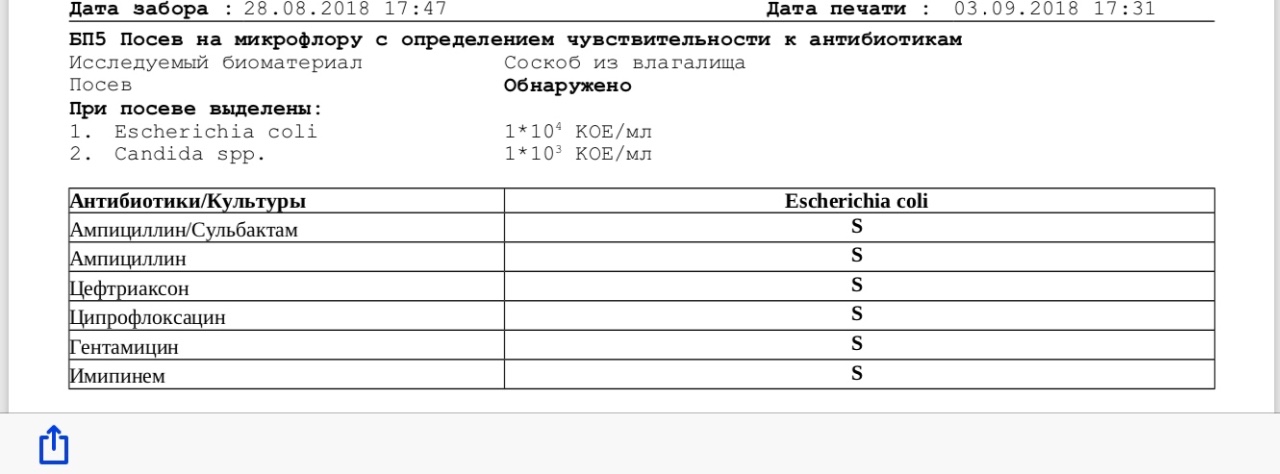
Общеизвестно, что в норме моча человека может содержать в себе различные непатогенные формы микрофлоры в минимальных концентрациях. Они не представляют опасности для человека, однако при существенном снижении местного либо общего иммунитета на фоне наличия разнообразных проблем и провоцирующих факторов создают предпосылки к развитию инфекций и воспалений мочевыделительной системы.
Как показывает современная клиническая практика у женщин и детей бактериурия встречается в 5-10 раз чаще, нежели у мужчин.
В первом случае существенную роль играют особенности строения мочевыделительной системы с более коротким каналом вывода мочи. Во втором же основными факторами выступают плохая развитость иммунитета, системная перестройка организма в процессе взросления, несоблюдение норм личной интимной гигиены и так далее.
Бак посев мочи на микрофлору и чувствительность к антибиотикам обычно назначают следующих ситуациях:
- Подозрение на инфицирование мочеполовой системы различными патогенными микроорганизмами;
- Рецидив заболеваний мочевыделительной и половой сферы, а также острых состояний, ранее плохо поддающихся терапии и перешедших в хроническую фазу;
- Наличие у пациента в качестве осложняющих факторов риска иммунодефицитного состояния либо сахарного диабета;
- Непосредственное уточнение диагноза и контроль проводимого лечения.

Как сдавать бак посев мочи?
Для правильной интерпретации бакпосева урины необходимо придерживаться ряда правил предварительной подготовки. Основные моменты включают в себя:
- Соблюдение диеты. За трое суток до предполагаемого забора биоматериалов на анализ мочи на посев с определением чувствительности к антибиотикам из рациона исключаются всё острое, жареное, солёная и иная вредная пища, которая способна существенно перегрузить работой желудочно-кишечный тракт либо же изменить параметры мочи, в том числе и объем, плотность, консистенцию и прочие параметры. Существенно ограничивается употребление бобовых культур, субпродуктов, грибов, жирных сортов мяса и рыбы, экзотических овощей и фруктов, специй и пряностей, копченостей, сладкого и сдобы. Не рекомендуется пить крепкий кофе, черный чай, также газированные напитки, как сладкие, так и обычные. Еду желательно готовить на пару, запеканием либо жаркой, блюда подавать теплыми, уменьшать калорийность суточного рациона к необходимому физиологическому минимуму, а также применять принцип дробного питания, соответственно есть чаще, но меньшими порциями;
- Контроль привычек и активности.
 В рамках предварительной подготовки за 3 суток до забора биоматериала на анализ необходимо исключить употребление алкоголя в любой форме, уменьшить к необходимому минимуму любые физические и психологические нагрузки, спать достаточное количество времени, а также коренным образом не менять стиль жизни;
В рамках предварительной подготовки за 3 суток до забора биоматериала на анализ необходимо исключить употребление алкоголя в любой форме, уменьшить к необходимому минимуму любые физические и психологические нагрузки, спать достаточное количество времени, а также коренным образом не менять стиль жизни; - Приём препаратов. За трое суток до забора урины на бакпосев следует воздержаться от употребления любых препаратов, в особенности антибиотиков, цитостатиков, мочегонных средств и иных лекарств, способных существенно изменить качественный и количественный состав урины. При невозможности отказа от употребления в случае необходимости их регулярного использования, о проблеме следует сообщить профильному специалисту, выписавшему назначение на проведение бактериального исследования мочи с указанием типа действующего вещества, его дозировки, схемы приема и прочих данных по необходимости.
Сбор биоматериала для анализа
Анализ на чувствительность к антибиотикам и на флору можно сдать в любой современной российской клинике, как частой, так и государственной.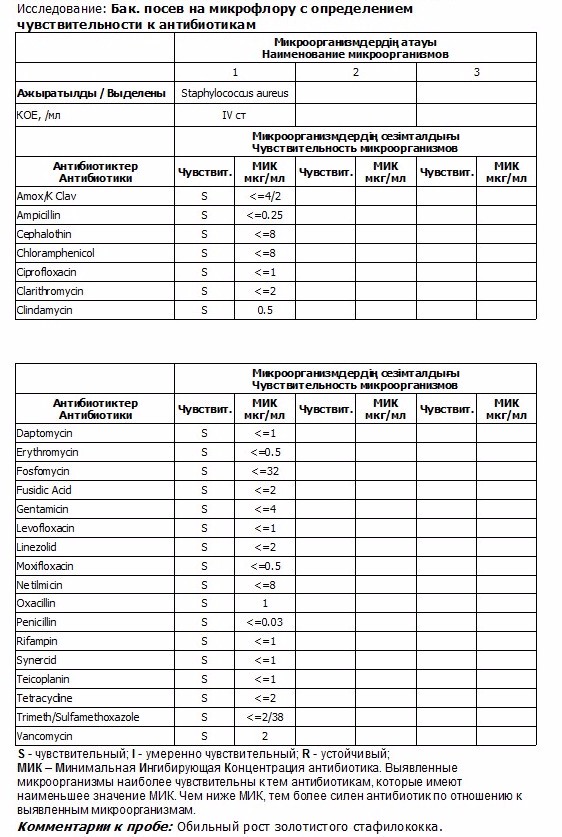 Забор биоматериала на тест осуществляется утром натощак, соответственно за 12 часов до данной процедуры запрещено употреблять пищу, допускается лишь лёгкое питье обычной чистой воды.
Забор биоматериала на тест осуществляется утром натощак, соответственно за 12 часов до данной процедуры запрещено употреблять пищу, допускается лишь лёгкое питье обычной чистой воды.
Перед сбором урины сразу после пробуждения необходимо провести необходимые меры по осуществлению личной интимной гигиены, заключающейся в промывания половых органов чистым потоком воды без использования мыла, шампуней, гелей и прочих средств подобного рода. Оптимальной для анализа считается так называемая «срединная» доза урины. Как ее правильно собрать?
Непосредственно с началом акта мочеиспускания первые несколько секунд моча сливается в унитаз, после чего под струю поставляется стерильный контейнер для забора жидких материалов и ёмкость наполняется в среднем наполовину, от 50-ти до 100-а миллилитров, в зависимости от объема тары. Последняя порция урины также должна быть слита в унитаз.
После осуществления забора стерильный контейнер плотно закрывается крышкой и доставляется в лабораторию на протяжении 2 часов. При невозможности немедленной доставки ёмкость с биоматериалом может быть помещена в холодильник, где хранится до 4-х часов при температуре от -ти до 6-ти градусов тепла.
Расшифровка посева на микрофлору и чувствительность к антибиотикам
Процесс диагностики с данной лабораторной пробы достаточно сложный и представляет собой комплексную процедуру качественной и количественной оценки колоний бактерий. Первая не дает возможность точно подсчитать конкретные концентрации патогенов, однако позволяет ориентировочно определить их тип. Вторая проводится дольше и предполагает непосредственный подсчёт количества развившихся колоний.
В рамках проведения мероприятия происходит засевание отдельных порций мочи на особых питательных средах в виде сахарного бульона, или агара. При этом используется либо классический секторный посев платиновой петлей либо же экспресс-метод.
Классический секторный посев на определение чувствительности является более точным, но осуществляется на протяжении минимум 5-ти суток, второй, же позволяет получить необходимые предварительные данные уже за первые сутки, однако иногда дает ложноположительный результат.
Биоматериал на специально подготовленной поверхности либо в пробирке помещается в термостат, под температуру 37 градусов. После выемки с данного устройства под микроскопом подсчитывается количество колониеобразующих единиц и делается перерасчет и концентрации на 1 миллилитр биологической жидкости.
Какие виды бактерий могут быть выделены в рамках исследования? Преимущественно — это аэробные бактерии и ряд грибов, в сумме около полутора десятков микроорганизмов, от кандид, энтеробактерий и клебсиелл до лактобацилл, протей, стафилококка, псевдомонад и эшерихий.
Оценка степени бактериурии в рамках оценивания количества колониеобразующих единиц (КОЕ):
- До 102 КОЕ. Клинического значения не представляет, поскольку высока вероятность побочного внешнего заражения биоматериалов;
- До 103 КОЕ. Обычно свидетельствует об отсутствии воспалительного процесса, но может указывать на предпосылки к инфицированию;
- До 104 КОЕ. Промежуточный результат, явно не указывающий на наличие инфицирования, в большинстве случаев требуется повтор бакпосева;
- 105 КОЕ и выше. Явно подтверждается наличие воспалительного процесса и инфицирования.
Квалифицированный лаборант в рамках анализа биоматериала после процедуры выращивания на питательной среде может оперативно обнаружить и дифференциально исключить попутное заражение условно-патогенной микрофлорой, например при наличии в анализе грамположительных палочек, лактобациллы и прочих компонентов, преимущественно обитающих на оболочках половых органов.
В большинстве случаев высокая степень бактериурии выявляется в случае явного наличия патогенной монокультуры, соответственно на результат могут влиять такие обстоятельства, как прием антибиотиков, плохой отток мочи, снижение удельного веса биоматериала и его невысокая кислотность.
Комплексная антибиограмма, являющаяся эффективным методом выявления чувствительности антибиотиков к патогенным микроорганизмам проводится сразу после выращивания их на питательных средах.
В рамках первичного исследования применяется набор стандартных препаратов антимикробного действия широкого спектра. Однако в ряде случаев, например при выборе перорального препарата узконаправленного действия, тяжёлого течения патологии, плохой восприимчивости антибиотиков пациентом и так далее, необходима расширенная диагностика.
Качественная и количественная оценка влияния конкретного препарата осуществляется при помощи диско-диффузионного метода. Его суть заключается в накладывании картонных диска с растворами антибактериальных средств на выращенные культуры возбудителя. При этом анализируется комплексная динамика роста ингибиции либо размножения, на основании которой и выбирается наиболее подходящий вариант.
Бак посев мочи при беременности
Достаточно часто беременным назначают бакпосев мочи. Общеизвестно, что различные инфекции мочевыводящих путей занимает значительную часть структуры заболеваний мочевыделительной системы и половой сферы.
Для правильного и своевременного лечения уретрита, цистита и пиелонефрита у женщин важно как можно более точно подобрать необходимое антибактериальное средство.
Примечательно, что подобное исследование назначается всем беременным без исключения, как при первичном взятии на учет в женскую консультацию либо роддом, так и в 36 недель вынашивания плода. В случае наличия явного подозрения на инфицирование выделительной либо половой системы, анализ проводят внеочередно.
Как показывает практика, использование антибиотиков широкого спектра действия нерационально, может вызвать у беременной различные вторичные патологии, плохо влияющие на плод, соответственно бакпосев мочи с определением чувствительности к группе лекарственных средств ускорит и облегчит процесс консервативной терапии, минимизирует негативное влияние лечения.
Другие методы посева
Бактериологическому анализу помимо мочи может подвергаться любой биологический материал человека, в том числе кровь, кожа, сперма, поверхности слизистых и дыхательных путей, прочее. Чаще всего в дополнение к бакпосеву урины назначают аналогичную процедуру для крови и проведение мазка.
Основной целью бакпосева является поиск в биоматериале бактериологических агентов. Естественно, их невозможно выявить простым мониторингом с помощью микроскопа. Поэтому частицы проб помещаются в типичные питательные среды, содержащее в себе все необходимые компоненты для активного роста отдельных видов бактерий, после чего они инкубируются при температуре около 37-ми градусов и наблюдаются на протяжении определенного времени, от 1-го в путь до 7-ми суток.
Как только лаборант обнаруживает видимый рост колоний бактериальных агентов, отдельные проявившиеся культуры окрашиваются и исследуются под микроскопом. Первичный вид такой диагностики дополняется бакпосевом жидкой культуры на плотную среду в чашке Петри. Полностью идентифицировав и выделив конкретный вид патогена, диагност начинает проверять их чувствительность к антибиотикам.
Кровь и мазок на анализ собирается не в домашних условиях, а непосредственно в клинике либо же стационаре, используются необходимые инструменты, сосуды и прочие элементы, требуемые для проведения мероприятия.
Посев на микрофлору отделяемого других органов и тканей с определением чувствительности к расширенному спектру антибиотиков и бактериофагам, в т.ч. кандида — сдать в Москве, цена исследования
Этот метод относится к микробиологическим исследованиям, которые помогают в определении качественного и количественного состава микрофлоры биоматериала, а также дают возможность выявлять различных микроорганизмов, и самое главное — определить чувствительность микроорганизмов к антибиотикам.
При выполнении данным методом определения микроорганизмов, которые будут составлять нормальную микрофлору, либо условно-патогенных организмов в титре меньше диагностического, чувствительность к антибиотикам – не будет определяться. Связано это с тем, что эти количества не являются значимым и не будут требовать назначения лечения.
Для того чтобы проводить исследование могут применять различные биоматериалы: моча, урогенитальный мазок, мокрота, мазок из ротоглотки, грудное молоко, мазок из носоглотки, отделяемое уха, мазок с конъюнктивы, синовиальную жидкость, мазок из цервикального канала, мазок из уретры, отделяемое абсцесса полости рта, ликвор, смыв из бронхов, желчь.
Это исследование будут использовать в следующих целях:
1) Для того чтобы достоверно установить возбудителя, который вызвал инфекционное заболевание.
2) Для необходимости индивидуального подбора антимикробной терапии.
3) Для того чтобы проследить имеет ли положительную динамику назначенная терапия.
Рационально назначать это исследование при воспалительных патологиях ( исключение составляют воспалительные заболевания кишечника).
Референсные значения у различных видов микроорганизмов будут зависеть от точки, из которой производили забор биологического материала.
Важно учитывать, что предшествующая противогрибковая либо антибактериальная терапия, может оказывать весомое значение на результаты исследования.
Определение чувствительности микроорганизмов к антибиотикам и бактериофагам
Определение чувствительности микроорганизмов к антибиотикам и бактериофагам
Культуральное бактериологическое исследование (посев на питательные среды, бак.посев) позволяет получить непосредственно культуру микроорганизма – возбудителя данной инфекции. Выделив культуру, ее можно во-первых точно идентифицировать (определить вид микроба), а во-вторых определить ее чувствительность к лекарственным препаратам – антибиотикам (антибактериальным препаратам) и бактериофагам.
Этот тест (определение антибиотикочувствительности, «подтитровка антибиотиков» ) имеет важнейшее значение для последующего лечения, т.к. позволяет выбрать препарат, максимально подходящий для лечения конкретного возбудителя. Необходимость такого анализа связана с тем, что даже бактерии одного вида, но выделенные от разных животных (разные штаммы) могут отличаться по спектру чувствительности. Сегодня выпускаются десятки наименований антибиотиков (АБ), относящиеся по своему строению к различным группам. Например, для лечения стафилококка могут применяться препараты как минимум девяти фармакологических групп, каждая из которых включает несколько наименований. Выбрать из них оптимальный для лечения конкретного возбудителя – непростая задача, решить которую невозможно без определения антибиотикочувствительности.
Характерная особенность современных возбудителей – частая встречаемость высокоустойчивых (мультирезистентных) штаммов микроорганизмов. Они проявляют устойчивость к действию различных групп антибиотиков – одной или сразу нескольких. Например, грамотрицательные бактерии семейства Enterobacteriaceae (к ним относятся такие распространенные возбудители как Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa) образуют ферменты БЛРС – беталактамазы расширенного спектра. Эти ферменты нейтрализуют действие бета-лактамных антибиотиков (пенициллинов и цефалоспоринов). У штаммов стафилококков также существует механизм резистентности, маркерным признаком которого является устойчивость к метициллину. МРС – метициллинрезистентные стафилококки – проявляют устойчивость ко всем бета-лактамным антибиотикам. Среди энтерококков растет количество полирезистентных штаммов, устойчивых в том числе и к ванкомицину (препарату выбора).
В ходе бактериологического исследования в компетентных лабораториях у микроорганизмов проводят определение указанных маркеров резистентности, и дают результаты в заключении. Это дает информацию лечащему врачу, антибиотики каких групп будут эффективны, какие будут бесполезны. В лабораторной практике нередки случаи, когда возбудитель устойчив почти ко всем протестированным антибиотикам, за исключением 1-2 препаратов.
Определение чувствительности к антибиотикам обычно проводят диско-диффузионным методом, используя стандартизованные питательные среды и стандартизованные диски с антибиотиками. Используют как минимум два набора антибиотиков – один для грамположительных (Гр+), другой для грамотрицательных (Гр-) микроорганизмов (что соблюдается увы не во всех лабораториях). Также наборы антибиотиков несколько отличаются в зависимости от источника происхождения – например, для культур из мочи обычно ставят дополнительно несколько препаратов-«уросептиков».
Если от животного выделено несколько культур микроорганизмов, чувствительность к АБ определяется индивидуально к каждой из них. Результаты лаборатория выдает по общепринятой градации: «Ч» — культура чувствительна к антибиотику; «П» — промежуточный уровень чувствительности; «У» — культура устойчива.
Также целесообразно определение чувствительности к бактериофагам – препаратам вирусной природы, имеющим ряд преимуществ по сравнению с антибиотиками, хорошо себя зарекомендовавшим в гуманной медицине. Существуют моновалентные и поливалентные бактериофаги. В лабораториях обычно определяют чувствительность к трем бактериофагам – одному моновалентному (специфичному для конкретного возбудителя) и двум поливалентным, включающим комплекс фагов против нескольких видов бактерий. Без лабораторного определения чувствительность возбудителя к бактериофагам практически непредсказуема. Фаг может «работать» очень хорошо, а может быть вообще не активным против данной культуры микроба.
Итак, по результатам лабораторного бактериологического исследования врач получает на руки информацию, необходимую для эффективного лечения конкретной инфекции. Традиционный подход (сначала лечим тем, что есть, потом диагностируем) постепенно уходит из практики. Препараты широкого спектра, на которые привыкли надеяться лечащие врачи, все чаще дают сбои, в силу распространения высокоустойчивых штаммов. Кроме того, лечение животного неспецифическим антибиотиком ведет к тому, что нормальная микрофлора организма сильно страдает, а патогенная флора адаптируется к антибиотикам, приобретает устойчивость, и вылечить такое животное в дальнейшем будет крайне сложно.
Очевидно что в экстренных случаях, при критических состояниях у врача нет времени дожидаться результатов анализов. Однако в остальных случаях потраченное на анализ время окупится гораздо быстрее, чем длительное лечение неэффективным препаратом.
Определение чувствительности грибов к противогрибковым препаратам (антимикотикам) также проводится в некоторых диагностических бак.лабораториях и имеет свои особенности, о чем Вы можете прочитать в соответствующем разделе сайта БакПосев-Вет.Ру.
Источник: www.bakposev-vet.ru
Распространенность β-лактамаз расширенного спектра и антимикробная чувствительность клинических изолятов Pseudomonas от пациентов в Хайбер-Пахтунхва, Пакистан
Большинство грамотрицательных патогенных бактерий ответственны за продукцию β -лактамаз (БЛРС) расширенного спектра, которые проявляют устойчивость к антибиотикам нового поколения. Исследование было направлено на оценку распространенности БЛРС и паттерна чувствительности к антибиотикам у изолятов Pseudomonas , собранных в период с 2010 по 2014 год в больницах третичного уровня Пешавара, Пакистан.Из 3450 образцов 334 Pseudomonas spp. изоляты, состоящие из 232 пациентов в помещении и 102 пациентов на открытом воздухе, были получены из разных образцов, и их характер чувствительности был определен по 20 антибиотикам. Тестирование на чувствительность к противомикробным препаратам проводилось с использованием метода диффузии в агаре Кирби-Бауэра, а образование БЛРС определялось с помощью метода диффузии дисков Synergy. Средняя возрастная группа пациентов составила 29,9 + 9,15 года. Меронем показал лучшую активность (91,02%) из класса карбапенемов, β -лактама и β -лактамаз — 69.Активность 16%, а активность доксициклина снижена (10,18%) до Pseudomonas spp. Изоляты на открытом воздухе были более устойчивыми, чем домашние, и в ходе исследования уровень чувствительности к антибиотикам постепенно снижался. Продукция ESBL наблюдалась в 44,32%, в то время как остальная часть не была ESBL. Среди изолятов, продуцирующих ESBL, умеренно активными антибиотиками были амикацин (50,7%), SCF (51,4%), TZP (52,7%) и MXF (54,1%). Отсутствие политики в отношении антибиотиков, нерациональное использование (особенно 3GC) и появление в больницах устойчивых к антибиотикам организмов могут быть причинами высокой устойчивости к антибиотикам.
1. Введение
Род Pseudomonas является важным членом семейства Pseudomonadaceae. Они имеют прямую или иногда слегка изогнутую форму, характерную для аэробной природы, и жгутиковые [1]. По данным Obritsch et al. [2], Pseudomonas находится на третьем месте по причине ИМП, и дерматиты, отиты, конъюнктивиты, ЖКТ, инфекции мягких тканей, костей и суставов также часто вызываются этими видами [3]. Исследования, проведенные на ВИЧ-инфицированных пациентах, сообщили о прогрессирующем росте грамотрицательных бацилл, включая Pseudomonas spp.Фактически, Pseudomonas spp. индуцированная инвазивная инфекция все чаще наблюдается среди хозяев с ослабленным иммунитетом и пациентов с некоторыми предрасполагающими состояниями, такими как злокачественные новообразования, возрастные ограничения, нейтропения, длительная госпитализация, хирургическое вмешательство, травмы и инструменты [4].
Штаммы Pseudomonas были выделены из ран ожоговых больных (от 22 до 73%) [5]. Он является основным возбудителем заболеваемости и смертности у пациентов пожилого возраста с муковисцидозом респираторного тракта [6].Устойчивость к противомикробным препаратам является одним из наиболее серьезных осложнений, связанных с Pseudomonas . Ограниченное количество антибиотиков является эффективным из-за их тенденции к естественной резистентности к ряду патогенов [7], а устойчивость возрастает с повышенной частотой к тем терапевтическим препаратам, которые ранее были чувствительны к Pseudomonas [8]. Устойчивость к противомикробным препаратам в нозокомиальных условиях связана с неблагоприятными клиническими последствиями и более высокими затратами [9].Бета-лактамазы расширенного спектра (БЛРС) — это ферменты, которые гидролизуют и индуцируют устойчивость к цефалоспориновым монобактамам [10]. Различные исследования, проведенные на субконтиненте, показали, насколько распространена продукция ESBL у Pseudomonas spp. составляет от 22 до 36% [11, 12]. Синергетическая активность двух препаратов считается наиболее эффективной при лечении псевдомонадных инфекций при использовании пенициллина в сочетании с аминогликозидами и карбапенемами (ингибиторы β -лактамазы) или одного антипсевдомонального пенициллина [13].
Целью данного исследования является определение частоты возникновения, характера восприимчивости к противомикробным препаратам и распространенности продукции этих бактерий БЛРС в трех основных больницах третичного уровня в районе Пешавара, КПК, Пакистан, поскольку ранее проводилась ограниченная работа эта тема.
2. Методология
2.1. Сбор бактериальных изолятов (образцы)
Это исследование проводилось в отделении микробиологии отделения патологии Хайберской клинической больницы, Пешавар, с 2010 по 2014 год.В течение периода исследования было собрано 3450 проб из трех основных больниц третичного уровня Пешаварского КПК, Пакистан. Собранные образцы состояли из гноя (раны, ожоги, ушные раковины, TS и HVS), мочи и крови пациентов, находящихся в помещении гинекологии, хирургии, медицины, ожоговых отделений и пациентов на открытом воздухе.
Образцы от подозреваемого пациента были внесены в инокуляцию на кровяном агаре, питательном агаре, агаре МакКонки и CLED-агаре, и после ночной аэробной инкубации при 37 ° C их исследовали на рост бактерий.Выросшие колонии выделяли и идентифицировали на основании морфологии колоний, признаков окрашивания, продукции пигмента, подвижности и соответствующих биохимических тестов в соответствии со стандартными лабораторными методами идентификации [14, 15].
2.2. Протокол определения чувствительности к противомикробным препаратам
Для приготовления инокулятов триптический соевый бульон (CM129-OXOID) был приготовлен путем заливки 4-5 мл бульонной среды в пробирки с завинчивающейся крышкой и стерилизован автоклавированием при 121 ° C в течение 15 минут при давлении 15 фунтов на квадратный дюйм. Среды охлаждали и выдерживали в инкубаторе в течение 24 часов при 35 ° C перед посевом.Плотность инокулята стандартизировали до конечной концентрации 1,5 × 10 8 КОЕ / мл согласно CLSI и помещали в инкубатор на 2–6 часов при 35 ° C для проверки стерильности.
Обычно используемые различные группы антибиотиков (закупленные у Oxoid, Англия) подвергали определению антимикробной чувствительности с помощью метода дисковой диффузии [16, 17]. Минимальные ингибирующие концентрации (МПК) были обнаружены методом разведения в агаровой среде для репрезентативных антибиотиков различных групп.Стандартные точки разрыва были стандартизированы с помощью CLSI, описанной Кокериллом [18].
2.3. Обнаружение ESBL
Изоляты подвергали скринингу в соответствии с CLSI, как предписано Hawser et al. [19], чтобы оценить распространенность ESBL у Pseudomonas spp. Изоляты, хранящиеся при -20 ° C, обновляли на среде триптического соевого агара для производства ESBL с использованием метода дисковой диффузии.
2.4. Synergy Disc Diffusion Method
При первоначальном скрининге продукции ESBL использовался дисковый метод диффузии.Диски цефотаксима (CTX = 30 мкм г), цефтазидима (CAZ = 30 мкм г), цефтриаксона (CRO = 30 мкм г) и азтреонама (AZM = 30 мкм г) помещали в расстояние 25–30 мм от амоксициллина + клавулановой кислоты. Амоксициллин + клавулановая кислота (AMC = 20 + 10 мкл г) помещали в центр засеянных чашек, содержащих агар Мюллера-Хинтона в соответствии с рекомендациями CLSI [19]. Зоны ингибирования вокруг дисков цефалоспорина 3G и азтреонама наблюдались после инкубации в течение ночи при 37 ° C.Когда зоны ингибирования вокруг дисков цефалоспоринов третьего поколения и азтреонама были расширены на сторонах, ближайших к AMC, изолят считается продуцентом ESBL.
2,5. Фенотипическое определение ESBL
В фенотипическом подтверждающем тесте тестируемые организмы были засеяны на агар Мюллера-Хинтона (MHA) и диски цефтазидима (30 мкг г) и цефотаксима (30 мкг г) отдельно и диск в комбинации. с клавулановой кислотой (30/10 мкл г) помещали на инокулированный агар для каждого изолята.Оба диска помещали на расстоянии 25 мм друг от друга (от центра к центру) на газонной культуре тестового планшета и инкубировали в течение 24 часов при 37 ° C. Увеличение зоны (≥5 мм) для любого противомикробного агента, испытанного в комбинации с клавулановой кислотой, по сравнению с его зоной при тестировании отдельно, было обозначено как положительное по БЛРС. Klebsiella pneumonia ATCC (700603) и E. coli ATCC (25922) использовали в качестве штаммов положительного и отрицательного контроля соответственно.
2.6. Статистический анализ
Данные были проанализированы с помощью теста SPSS версии 16.0.
3. Результаты
Всего было собрано 3450 проб в трех основных больницах третичного уровня Пешавара, а именно в Хайберской учебной больнице, больнице Леди Ридинг и медицинском комплексе Хаятабад. Pseudomonas spp. полученные из разных источников, перечислены на рисунке 1. Эти образцы были дополнительно проверены на чувствительность к противомикробным препаратам и распространенность БЛРС. Образцы были взяты из разных источников: гной 162 (48,50%), моча 67 (20,05), кровь 16 (4,79%) и HVS, а также мазки из горла и уха 32 (9.58%).
В общей сложности 334 изолята, включающих 232 (69,46%) пациентов в помещении и 102 (30,54%) наружных пациентов, включая мужчин и женщин, как указано на Рисунке 2 (соотношение мужчин и женщин 1: 1,4), были извлечены как Pseudomonas положительных, из которых большинство изолятов было взято из больницы Хайбер 191 (57,18%), за ней следовали больница Леди Ридинг 79 (23,65%) и Медицинский комплекс Хаятабад, Пешавар 64 (19,16%) со средним возрастом лет. Подробности приведены на Рисунке 3.
3.1. Структура чувствительности Pseudomonas spp. к различным противомикробным средствам
В β -лактамных средствах частота восприимчивости к цефалоспоринам 2-го поколения (цефаклор) 21,26%, 3-го поколения (цефтазидим и цефтриаксон) 33,23% и 36,23% соответственно, а 4-го поколения (цефепим) ) составил 48,5%, показал более высокую активность среди группы цефалоспоринов. В то время как из β -лактамных средств наиболее сильным противомикробным средством был имипенем (84.43%) и Меронема (91,02%) из класса карбапенемов против Pseudomonas spp., Наименьшую активность наблюдал амоксициллин 14,97%.
Среди ингибиторов β -лактамов и β -лактамаз максимальную активность наблюдали цефоперазон + сульбактам (69,16%), а затем пиперациллин + тазобактам (60,78%) и амоксициллин + клавулановая кислота (24,5%). Чувствительность к амикацину составила 66,0%, а к гентамицину — 19,6% в аминогликозидах.
В классе фторхинолонов, 61.Было обнаружено, что 7% изолятов чувствительны к моксифлоксацину, 44,6% — к гатифлоксацину, 55,7% — к спарфлоксацину, 50,3% — ципрофлоксацину и 35% — к эноксацину. В группе антибиотиков макролидов кларитромицин имел хорошую активность (42,51%), а к эритромицину — 19,16%. В классе тетрациклинов 10,18% штаммов оказались чувствительными к доксициклину. Тем не менее, ни один из антибиотиков не оказался полностью устойчивым к Pseudomonas spp. Показатель устойчивости был самым высоким к тетрациклину, затем к пенициллину, а изоляты были устойчивыми к макролидам и фторхинолонам (таблица 1).
Frontiers | Устойчивость к антибиотикам, биоцидам, консервантам и металлам у бактерий, выделенных из морепродуктов: совместный отбор штаммов, устойчивых или толерантных к различным классам соединенийВведениеМировой рынок рыбы в 2016 году достиг 175 миллионов тонн (Продовольственная и сельскохозяйственная организация ООН (ФАО), 2016).В секторе рыболовства растет беспокойство по поводу увеличения распространенности штаммов бактерий с множественной лекарственной устойчивостью в пищевой цепи (EFSA, 2010; ECDC, 2012, 2013; EFSA-ECDC, 2013; Watts et al., 2017). Бактерии с множественной лекарственной устойчивостью, несущие гены β-лактамаз расширенного спектра (ESBL), теперь можно найти у здоровых людей, а также у различных видов животных, продуктов питания и даже в образцах окружающей среды, и они стали угрозой в больницах. Вызывающие карбапенемазы Enterobacteriaceae вызывают особую озабоченность, поскольку имеют тенденцию к распространению, что затрудняет лечение инфекции (Iovleva and Doi, 2017).Гены устойчивости к противомикробным препаратам, таким как β-лактамы, хинолоны и фторхинолоны, могут быть связаны с плазмидами. Плазмиды устойчивости к фторхинолонам у Enterobacteriaceae широко распространены и часто связаны с устойчивостью к β-лактамам у штаммов с фенотипами множественной лекарственной устойчивости (Crémet et al., 2011). Некоторые гены, такие как вариант aac (6 ‘) -Ib-cr , одновременно придают устойчивость к аминогликозидам и фторхинолонам (Kim et al., 2011).Другие, такие как оттокный насос oqxAB , описанный в Escherichia coli , придают устойчивость к различным антибиотикам и биоцидам (Hansen et al., 2007; Wong and Chen, 2013). Различные типы селективного давления (например, антибиотики, биоциды или тяжелые металлы) могут играть роль в распространенности устойчивости к противомикробным препаратам в пищевой цепи. Биоциды могут совместно отбирать штаммы, устойчивые к антибиотикам, применяемым в клинической практике, что подтверждено в случае триклозана и других (Chuanchuen et al., 2001; Браудаки и Хилтон, 2004; Ортега-Моренте и др., 2013). Биоциды широко используются в дезинфицирующем оборудовании и объектах, включая рыбоводство и предприятия по переработке рыбы (Директива 98/8 / CE). У грамотрицательных бактерий описано несколько генов устойчивости к биоцидам, принадлежащих к группе четвертичных аммониевых соединений (ЧАС): qacE, qacE Δ 1, qacF, qacG и qacH . Среди них qacE Δ 1 является наиболее распространенным, так как он обнаруживается в различных группах грамотрицательных бактерий (Kücken et al., 2000). Сообщалось об ассоциации qacE Δ 1 (реже также qacH и qacF ) с интегронами класса I вместе с генами устойчивости к антибиотикам (Mulvey et al., 2006; De Toro et al., 2011) . Исследование микробных популяций в среде, загрязненной ЧАС, связывает повышенную частоту устойчивости к ЧАС с более высокой частотой интегронов класса I (Gaze et al., 2005), предполагая, что воздействие ЧАС также может быть выбрано для устойчивости к антибиотикам, связанной с такими интегронами. .Другие противомикробные препараты, такие как комбинации лизоцим-ЭДТА и химические консерванты, такие как лактат натрия и тринатрийфосфат, также заслуживают внимания из-за их широкого использования и потенциального применения в пищевой промышленности для обеззараживания и консервирования пищевых продуктов (Lucera et al., 2012; Bjornsdottir-Butler et al. др., 2015; Wang et al., 2015). Также растет интерес к расширению использования растительных эфирных масел или их антимикробных соединений (таких как карвакрол или тимол) для дезинфекции и консервирования пищевых продуктов (Lucera et al., 2012; Патель, 2015; Wang et al., 2015). Одно исследование показало, что воздействие соснового масла вызывает снижение восприимчивости к ряду антимикробных соединений (включая антибиотики и биоциды; Moken et al., 1997). Тем не менее, мало что известно о развитии устойчивости / толерантности к этим соединениям и сопутствующей устойчивости к антибиотикам. Соли металлов используются для дезактивации в рыбоводстве. Такие металлы, как медь (Cu) и цинк (Zn), являются важными питательными микроэлементами для живых существ, но они могут стать токсичными, если их концентрация превышает определенную.Медь и цинк часто используются в аквакультуре, а также в качестве необрастающих красок на лодках (Yebra et al., 2004; Watermann et al., 2005; Guardiola et al., 2012). Медь может попадать в окружающую среду как в результате деятельности человека, так и естественных процессов. Цинк редко встречается в природе в металлическом состоянии, но многие минералы содержат цинк в качестве основного компонента. Основными антропогенными источниками цинка являются горнодобывающая промышленность, предприятия по производству цинка, производство железа и стали, коррозия оцинкованных конструкций, сжигание угля и топлива, удаление и сжигание отходов, а также использование удобрений и пестицидов, содержащих цинк (ВОЗ, 2001) .Рыба может накапливать и передавать тяжелые металлы по пищевой цепочке. Гены, контролирующие устойчивость к металлам, могут быть связаны с плазмидами, которые обеспечивают бактериям конкурентное преимущество перед другими организмами при наличии определенных металлов (Trevors et al., 1985; Hobman and Crossman, 2014). Появление плазмид с множественной лекарственной устойчивостью, несущих устойчивость к тяжелым металлам, вызывает тревогу и требует дополнительного мониторинга (Gómez-Sanz et al., 2013). Совместное расположение генов устойчивости к металлам и устойчивости к противомикробным препаратам может способствовать их сохранению, совместному отбору и распространению (Gómez-Sanz et al., 2013; Уэльс и Дэвис, 2015). Целью этого исследования было дать представление об устойчивости к клинически значимым антибиотикам у штаммов бактерий, выделенных из морепродуктов, продаваемых в супермаркетах и на рыбном рынке. Поскольку воздействие других типов противомикробных препаратов, таких как биоциды и металлы, может способствовать совместному отбору устойчивости к антибиотикам, мы предположили, что устойчивые к антибиотикам штаммы из морепродуктов также могут быть фенотипически устойчивыми и / или нести генетические детерминанты устойчивости к другим противомикробным препаратам, тем самым увеличивая риск передачи устойчивости к антибиотикам через цепочку производства морепродуктов.Таким образом, была оценена чувствительность бактериальных штаммов, выделенных из различных образцов морепродуктов, к различным биоцидам, антибиотикам и металлам, а также определено наличие генов устойчивости в мультирезистентных штаммах. Особое внимание было уделено генам β-лактамаз расширенного спектра из-за рисков, которые бактерии, продуцирующие БЛРС, могут представлять для здоровья человека. Материалы и методыИзоляция бактерийБыло исследовано в общей сложности 22 образца морепродуктов из 16 различных видов рыбы и морепродуктов, купленных в супермаркетах и на рыбном рынке в провинции Хаэн (Испания) в течение 2013 и 2014 годов (таблица 1).Если не указано иное, образцы состояли из необработанных целых образцов морского рыболовства и продавались без рецепта по льду. Образцы (по 25 г каждый) суспендировали в 225 мл забуференной пептонной воды с добавлением 10 г NaCl / литр и гомогенизировали путем промывания желудка с помощью Stomacher 400 (Sewald, UK). Образцы анализировали в соответствии со стандартными процедурами микробиологического анализа пищевых продуктов путем посева серийных разведений на триптиказо-соевый агар (TSA, Scharlab, Барселона, Испания) с добавлением 10 г NaCl / литр (физиологический раствор TSA, STSA).Через 24–48 ч инкубации при 30 ° C колонии очищали штриховкой на TSA (без добавления NaCl), чистые культуры исследовали окрашиванием по Граму, тестами на каталазу и оксидазу и хранили при -80 ° C в триптиказой сои. Бульон (TSB, Scharlab) с добавлением 20% глицерина. Таблица 1 . Чувствительность к антибиотикам, биоцидам и другим противомикробным препаратам в изолятах бактерий, выделенных из морепродуктов. Определение устойчивости к антибиотикам, биоцидам и другим антимикробным соединениямКоллекция из 87 бактерий, случайно выделенных из различных образцов морепродуктов, была проверена на чувствительность к биоцидам, антибиотикам и другим антимикробным соединениям, как описано ниже.Бензалкония хлорид (BC), цетримид (CT), гексадецилпиридин хлорид (HDP), хлоргексидина диглюконат (CHX), триклозан (TC) и гексахлорофен (CF) были от Sigma-Aldrich (Мадрид, Испания). Коммерческий раствор хлорида бензалкония содержал 50% (мас. / Об.) Активного соединения. Триклозан и гексахлорофен растворяли (10% мас. / Об.) В 96% этаноле. HDP (5% мас. / Об.), CT (10% мас. / Об.) И CHX (20% мас. / Об.) Растворяли в стерильной дистиллированной воде в асептических условиях. Раствор поли- (гексаметиленгуанидиния) гидрохлорида (ПГМГ) (содержащий 7.8% ПГМГ по весу) был любезным подарком компании Oy Soft Protector Ltd (Эспоо, Финляндия). P3 oxonia (OX, содержащий 25–35% перекиси водорода, 0,83–2,5 N уксусной кислоты и 0,26–0,66 N перуксусной кислоты) был поставлен компанией ECOLAB (Барселона, Испания). Растворы биоцидов хранили при 4 ° C в течение ≤7 дней. Карвакрол (CVC), тимол (THY), лактат натрия (SL), тринатрийфосфат (TSP), лизоцим (L) и этилендиаминтетрауксусная кислота (EDTA) были от Sigma-Aldrich. Растворы, содержащие 100 мг / л лизоцима и 5 мМ EDTA, объединяли в различных пропорциях, чтобы получить следующие конечные концентрации: A, 30 мг / л лизоцима плюс 3.5 мМ ЭДТА; B, 50 мг / л лизоцима плюс 2,5 мМ EDTA; С, лизоцим 70 мг / л плюс 1,5 мМ ЭДТА. Минимальные ингибирующие концентрации (МПК) определяли методом микроразведения в бульоне на 96-луночных планшетах для микротитрования с плоским дном (Becton Dickinson Labware, Franklin Lakes, NJ). Вкратце, серийные разведения каждого противомикробного препарата инокулировали (1%, об. / Об.) Ночными культурами бактериальных штаммов, выращенных в триптиказо-соевом бульоне (TSB; Scharlab). Для каждого изолята был включен контроль роста и стерильности.Планшеты для микротитрования инкубировали при 30 ° C. Показания оптической плотности (OD 595 нм) были выполнены с помощью iMark Microplate Reader (BioRad, Madrid) после 24–48 ч инкубации. Все анализы были выполнены в трех экземплярах. Устойчивость к антибиотикам определяли методом дисковой диффузии, как описано в CLSI Института клинических и лабораторных стандартов (2015), на агаре Мюллера-Хинтона с поправкой на катионы (Fluka, Sigma-Aldrich, Мадрид, Испания). Диски, содержащие ампициллин (AMP, 10 мкг), цефтазидин (CAZ, 30 мкг), цефотаксим (CTX, 30 мкг), имипенем (IMP, 10 мкг), стрептомицин (S, 10 мкг), тетрациклин (TE, 30 мкг), ципрофлоксацин (CIP, 5 мкг), налидиксовая кислота (NA, 30 мкг) и триметоприм / сульфаметоксазол (TM / STX, 1.25 / 23,75 мкг) были поставлены Biomérieux (Мадрид, Испания). Хлорамфеникол (CM, 30 мкг) был от BBL (Мадрид, Испания). Идентификация устойчивых к противомикробным препаратам изолятовВ результате предварительного скрининга на устойчивость к противомикробным препаратам было отобрано 30 изолятов для дальнейшего изучения на основе источника пищи, устойчивости к антибиотикам и толерантности к биоцидам. Выбранные изоляты были устойчивы по крайней мере к трем антибиотикам или по крайней мере к одному антибиотику и одному биоциду. 30 изолятов были идентифицированы секвенированием 16S рДНК.ДНК экстрагировали с помощью набора для экстракции бактериальной геномной ДНК (GenElute TM, Sigma-Aldrich) и 16 S рДНК амплифицировали, как описано Abriouel et al. (2005). Продукты ПЦР-амплификации очищали с использованием набора для очистки ДНК GFX PCR и гель-ленты (GE-Healthcare, Испания), а затем секвенировали согласно Weisburg et al. (1991) в системе анализа ДНК CEQ 2000 XL (Beckman Coulter, CA, США). Полученные последовательности ДНК исследовали на предмет гомологии с использованием алгоритма BLAST, доступного в Национальном центре биотехнологической информации (NCBI, США). Определение толерантности к металламОтобранные 30 изолятов были протестированы на устойчивость к меди и цинку следующим образом. В чашки с агаром Мюллера-Хинтона II (Sigma-Aldrich, Мадрид, Испания) добавляли CuSO 4 • 5H 2 O (PanReac, Барселона, Испания) (4, 8, 12, 16, 20, 24, 32, и 36 мМ, доведено до pH 7,2) или ZnCl 2 (PanReac) (2, 4, 8 и 16 мМ, доведено до pH 6,5) согласно Cavaco et al. (2011). Затем в чашки засевали 2 мкл ночных культур бактериальных штаммов, разведенных в 10 раз стерильным физиологическим раствором.Планшеты инкубировали при 37 ° C в аэробных условиях и проверяли на рост бактерий через 24 часа. За МИК принимали самую низкую концентрацию металла, которая подавляла рост инокулированных бактериальных штаммов. Исследование генетических детерминант устойчивостиОтобранные 30 изолятов были исследованы на наличие генетических детерминант устойчивости. Присутствие генов устойчивости к биоцидам qacE и qacE Δ 1 и их возможная связь с интегронами класса I исследовали с помощью ПЦР согласно Chuanchuen et al.(2007). В частности, прямой праймер qacEF использовали в комбинации с обратными праймерами qacER и sulR для амплификации qacE, qacE Δ 1 и 3′-кодирующей последовательности (3 ‘CS). Следующие генетические детерминанты β-лактамаз расширенного спектра были исследованы с помощью ПЦР: bla TEM (Sáenz et al., 2004), bla PSE (Chiu et al., 2006), bla CTX − M и bla CTX − M − 2 (Bertrand et al., 2006), а также карбапенемазы bla IMP , bla NDM −1 , bla OXA − 23 и bla VIM − 2 (et al. 2014). Другими генами устойчивости к противомикробным препаратам, исследованными с помощью ПЦР, были гены устойчивости к аминогликозидам aadA1 (Guerra et al., 2001) и aac (6 ′ ) -Ib (Park et al., 2006), гены устойчивости к фениколу . floR (Chiu et al., 2006) и cmlA (Sáenz et al., 2004), а также гены устойчивости к сульфонамиду и триметоприму sul1 (Guerra et al., 2001), sul2 (Sáenz et al., 2004) и sul3 (Sáenz et al., 2010). Ген мультикоппероксидазы, обнаруженный в плазмидных оперонах pcoABCDRSE (описанных в Pseudomonas syringae ) и copABCDRS ( E. coli ), исследовали с использованием праймеров и условий ПЦР, описанных для / pcoA . copA по Badar et al.(2014). Также были исследованы дополнительные гены copB, copC, copD (Kamika, Momba, 2013; Badar et al., 2014) и pcoR (Brown et al., 1992). Хромосомный оперон cueAR , кодирующий предполагаемую АТФазу P1-типа и регуляторный белок MerR-типа, участвующий в гомеостазе меди у Pseudomonas putida , исследовали согласно Adaikkalam and Swarup (2002). Ген czcD , участвующий в регуляции системы оттока цинка, кобальта и кадмия CZC, был исследован с помощью ПЦР согласно Medardus et al.(2014). Ген устойчивости к хромату chrB исследовали, как описано Chihomvu et al. (2015) и Nies et al. (1990). Статистический анализВзаимосвязь между устойчивостью к различным протестированным противомикробным препаратам изучалась методом главных компонентов с коэффициентом корреляции Пирсона (r) с использованием IBM SPSS Statistics 22 (IBM Corporation, Армонк, Нью-Йорк, США) и статистического и графического пакета Mystat (Systat Software, Хаунслоу, Лондон, Великобритания; ознакомительная версия 2015 г.1). Положительные корреляции были определены как очень слабые (0,00–0,19), слабые (0,20–0,39), умеренные (0,4–0,59), сильные (0,60–0,79) или очень сильные (0,80–0,99) со значимостью P < 0,05. РезультатыМикробная нагрузка и изоляция бактерийМикробная нагрузка (аэробные мезофилы) различных образцов морепродуктов показана в таблице 1. В большинстве образцов количество жизнеспособных клеток составляло от 4 до 7 log КОЕ / г. Наименьшее количество жизнеспособных микроорганизмов было зарегистрировано у синей акулы, а максимальное количество было обнаружено в охлажденных сырых ломтиках лосося, упакованных в лотки. После подсчета жизнеспособных клеток бактериальные колонии, выросшие на физиологическом растворе TSA из самых высоких разведений, повторно очищали штриховкой на TSA без добавления соли. Это было сделано для того, чтобы избежать возможного вмешательства добавленной соли в питательную среду в тесты на устойчивость к противомикробным препаратам. Всего было отобрано 87 случайных бактериальных колоний, представляющих отобранные образцы различных морепродуктов (таблица 1). Восемьдесят два из них были грамотрицательными (включая в основном бациллы), а остальные пять были грамположительными (включая четыре кокка и одну палочку). Устойчивость к противомикробным препаратам87 изолятов были протестированы на чувствительность к антибиотикам, биоцидам и другим противомикробным препаратам (кавакрол, тимол, лактат натрия, тринатрийфосфат, лизоцим и различные комбинации лизоцим-ЭДТА; таблица 1). Частота устойчивости к β-лактамным антибиотикам была самой высокой для AMP (57,47% изолятов), за которым следовали CTX (27,59%), IMP (14,94%) и CAZ (11,49%). Устойчивость к ингибиторам синтеза белка выявлена в основном к CM (33,33%) и S (20.69%), тогда как устойчивость к TE (2,30%) и NET (2,30%) была низкой. Примечательно, что 35,63% изолятов были устойчивы к NA, но только 2,30% были устойчивы к CIP. 27,58% изолятов были устойчивы к TM / STX. 39,08% изолятов были устойчивы к трем или более антибиотикам, а 18,40% — к пяти и более. Два изолята оказались устойчивыми к 10 из 11 протестированных антибиотиков. Бактериальные изоляты были протестированы на толерантность к биоцидам в двух группах (грамположительные и грамотрицательные), поскольку грамотрицательные бактерии в целом более устойчивы к биоцидам из-за барьера проницаемости внешней мембраны.Только низкий процент грамотрицательных изолятов показал высокий уровень толерантности к биоцидам BC (5,75%; MIC ≥ 250 мг / л), CT (5,75%; MIC ≥ 25 мг / л), HDP (6,90%; MIC ≥ 250 мг. / л), ПГМГ (6,90%; МИК ≥ 100 мг / л) и OX (4,60%; МИК> 250 мкл / л) (Таблица 1). Более высокий процент устойчивых к биоцидам изолятов был получен для CHX (19,54%; MIC ≥ 50 мг / л) и TC (16,09%; MIC ≥ 250 мг / л). Среди грамположительных изолятов только один имел высокий MIC 250 мг / л для BC. Всего семь изолятов показали высокую толерантность к трем и более биоцидам (таблица 1). Изоляты показали большие различия в чувствительности к карвакролу и тимолу (таблица 1). Только два изолята имели MIC выше 0,25% для карвакрола, а 16,39% изолятов требовали 0,1% для ингибирования. Напротив, 43,68% изолятов ингибировались очень низкой концентрацией карвакрола (0,01%). Что касается тимола, 26,44% изолятов имели МИК 0,25%, но ни один не требовал концентраций выше этого значения для ингибирования. Также был высокий процент изолятов (55,17%), которые подавлялись низкой концентрацией тимола (0.025%). Большинство изолятов ингибировались лактатом натрия на 3% (55,17%) или 5% (35,63%), в то время как остальные (9,20%) подавлялись на 1% (Таблица 1). Однако изоляты были более гетерогенными по чувствительности к тринатрийфосфату (TSP). Около 80% изолятов ингибировались при концентрациях TSP в диапазоне 0,75–1,5%, и только небольшой процент (8,04%) требовал концентрации TSP 3% для ингибирования. Большинство изолятов (85,06%) были устойчивы к самой высокой концентрации протестированного лизоцима (100 мг / л) и только к низкому проценту (14.94%) ингибировались низкой концентрацией лизоцима (2,5 мг / л; таблица 1). Когда лизоцим тестировался в комбинации с ЭДТА в различных пропорциях, все комбинации были эффективны против большинства изолятов, за исключением одного изолята, который ингибировался только комбинацией лизоцим-ЭДТА С, содержащей более высокую долю лизоцима по отношению к ЭДТА. Корреляция между устойчивостью к противомикробным препаратамИз 87 изолятов 66 (75,86%) были устойчивы к антибиотикам и / или к биоцидам. При сравнении биоцидов и антибиотиков из 29 изолятов, устойчивых хотя бы к одному биоциду (33.33%), 27 (31,03%) также были устойчивы как минимум к одному антибиотику (таблица 1). Шесть изолятов (6,90%) были толерантны как минимум к трем биоцидам и как минимум к трем антибиотикам. Корреляции между различными противомикробными препаратами, протестированными для 87 бактериальных изолятов, показаны на рисунке 1 и в таблице 2. Ниже описаны только статистически значимые ( P <0,05) положительные корреляции, которые были умеренными, сильными или очень сильными. Статистически значимые ( P <0,05) слабые корреляции также перечислены в таблице 2, но не описаны в тексте. Рисунок 1 . Биплот для толерантности к биоцидам и устойчивости к противомикробным препаратам (баллы) для 87 бактериальных изолятов (переменные) из морепродуктов. Противомикробные препараты (A) , красные точки, и изоляты (B) , синие точки указаны. В (B) буквы указывают на бактериальные изоляты с выдающимся числом признаков устойчивости к противомикробным препаратам. BC, бензалкония хлорид; CT, цетримид; HDP, гексадецилпиридиния хлорид; ТС, триклозан; CF, гексахлорофен; ПГМГ, гидрохлорид поли (гексаметиленгуанидиния); OX, P3 oxonia; АМП, ампициллин; CTX, цефотаксим; CAZ, цефтазидим; ИМП, имипенем; CM, хлорамфеникол; S, стрептомицин; ТЕ, тетрациклин; NA, налидиксовая кислота; TM / STX, триметоприм-сульфаметоксазол; CVC, карвакрол; THY, тимол; SL, лактат натрия; TSP, тринатрийфосфат. Таблица 2 . Корреляция между устойчивостью к антибиотикам и толерантностью к биоцидам и другим противомикробным препаратам у 87 бактериальных изолятов, выделенных из морепродуктов. Следующие пары биоцидов показали положительные корреляции, которые были очень сильными (CT-HDP), сильными (BC-CT, BC-HDP и HDP-TC) или умеренными (BC-TC, BC-PHMG, CT-TC, CT -PHMG, HDP-PHMG, TC-PHMG и PHMG-OX). Для антибиотиков следующие положительные корреляции были очень сильными (CIP-NET), сильными (CTX-CM) или умеренными (AMP-CTX, AMP-CM, AMP-TM / STX, CTX-NA, CAZ-CIP, CAZ- SM, CAZ-NET, CIP-TE, NA-CM и TE-NET). Для остальных протестированных противомикробных препаратов (CVC, THY, SL, TSP) единственные достоверные ( P <0,05) обнаруженные корреляции были слабыми (Таблица 2). Интересно, что значимые ( P <0,05) положительные корреляции также были обнаружены между противомикробными препаратами, принадлежащими к различным тестируемым группам. Например, умеренные положительные корреляции были обнаружены для биоцидов CT, HDP и TC с антибиотиком CTX, а также для TC с CM и TM / STX и с фенольным соединением THY (таблица 2).Некоторые антибиотики показали умеренную положительную корреляцию с остальными протестированными противомикробными препаратами, как в случае AMP с SL и IMP с THY и TSP. Из предварительного общего исследования было отобрано 30 изолятов для дальнейшего анализа устойчивости к металлам, идентификации и изучения генетических детерминант устойчивости. Идентификация выбранных изолятов30 изолятов, отобранных для дальнейшего изучения, были идентифицированы секвенированием 16s рДНК (таблица 3).Большинство из них (96,66%) были идентифицированы как грамотрицательные бактерии: Pseudomonas brassicacearum (10,00%), Pseudomonas poae (16,67%), P. putida (3,33%), Pseudomonas synxantha (26,67%). , Pseudomonas spp. (6,67%), Acinetobacter calcoaceticus (10,00%), Acinetobacter oleivorans (3,33%), Aeromonas salmonicida (10,00%), Aeromonas spp. (3,33%), Shewanella baltica (3,33%) и Proteus mirabilis (3.33%). Единственный идентифицированный грамположительный изолят принадлежал к Listeria innocua (3,33%). Таблица 3 . Характеристика выбранных изолятов. Генетические детерминанты толерантности к биоцидам и устойчивости к антибиотикамРезультаты, полученные по генетическим детерминантам устойчивости для выбранных изолятов, показаны в таблице 3. Двадцать семь из 30 изолятов дали положительный результат по крайней мере по одной из изученных генетических детерминант. Единственный обнаруженный детерминант устойчивости QAC был qacE Δ 1 .Он был обнаружен в трех изолятах A. calcoaceticus от лосося и в одном изоляте Proteus mirabilis от голубой акулы. Генетическая детерминанта устойчивости к сульфонамидам sul1 была обнаружена у 13 изолятов, два из которых также дали положительный результат на sul2 . Кроме того, три изолята A. calcoaceticus , положительные по sul1 , также были положительными по qacE Δ 1 . Однако эксперименты ПЦР с использованием праймера qacEF и праймера sulR не привели к какой-либо амплификации, что позволяет предположить, что обе генетические детерминанты не были физически близки, как в интегронах класса I. Среди протестированных генов β-лактамаз наиболее часто встречались bla TEM и bla CTX-M . Из пяти изолятов, положительных по bla TEM , три принадлежали к роду Acinetobacter , выделенному из лосося, один — к Aeromonas и один — к Pseudmonas . Пять изолятов дали положительный результат на bla CTX − M : Pseudomonas (3), Acinetobacter и Proteus .Генетическая детерминанта bla PSE была обнаружена в трех изолятах, включая два изолята Pseudomonas и изолят L. innocua , полученных от кальмаров. Кроме того, bla IMP и bla NDM-1 были обнаружены в одном изоляте Pseudomonas каждый, оба от анчоусов. Остальные исследованные гены β-лактамаз обнаружены не были. Детерминанта устойчивости к фениколу floR была обнаружена у пяти изолятов (все они принадлежат к роду Pseudomonas ) из разных источников: анчоусы, черная макрель и морской окунь.Напротив, cmlA не было обнаружено ни в одном изоляте. Детерминанта устойчивости к аминогликозидам aadA1 была обнаружена у шести изолятов, пять из которых принадлежали к роду Pseudomonas и один — к Proteus , а aac (6 ′ ) -Ib обнаружен у пяти изолятов (в том числе три из род Acinetobacter , выделенный из лосося, один Shewanella и один Pseudomonas ). Устойчивость к меди и цинкуА 26.60% из 30 протестированных изолятов были способны расти в присутствии 24 мМ CuSO 4 , и все же 23,30% были способны расти при 32 мМ соли меди (Таблица 3). Что касается устойчивости к цинку, 46,60% изолятов могли расти в присутствии 8 мМ ZnCl 2 . Однако все протестированные изоляты ингибировались 16 мМ ZnCl 2 . Изучение генетических детерминант устойчивости к металлам (таблица 3) дало положительные результаты для плазмидного гена мульти-медной оксидазы pcoA / copA (36.66% отобранных изолятов) и ген ДНК-связывающего репрессорного белка pcoR (6,66%) и гена устойчивости к хромату цинка chrB (13,33%). Остальные исследованные гены устойчивости к металлам не обнаружены. ОбсуждениеВ настоящем исследовании устойчивость к биоцидам и устойчивость к антибиотикам была выявлена среди бактерий, выделенных из морепродуктов. Биоциды используются для множества различных целей, в том числе для продуктов здравоохранения и в процессах дезинфекции в пищевой промышленности.Например, бензалкония хлорид используется для очистки воды, общей дезинфекции участков, удаления паразитов у рыб и предотвращения инфекционных заболеваний рыб и моллюсков. В результате в воду попадает большое количество биоцидов. Было описано влияние триклозана на водные бактериальные сообщества (Dann and Hontela, 2011; McNamara et al., 2014). Предыдущий контакт с биоцидами, а также естественная фоновая резистентность могут объяснить толерантность к биоцидам, наблюдаемую в настоящем исследовании. Также стоит отметить положительную корреляцию не только по толерантности к биоцидам одной химической группы, но и между биоцидами из разных групп.Однако между полигуанидами были различия, поскольку гидрохлорид поли (гексаметиленгуанидиния) показал положительную корреляцию с несколькими другими биоцидами, а хлоргексидин — нет. Эти результаты можно объяснить различиями в химической формуле, механизмах адаптации (включая внутреннюю резистентность), а также развитием специфических механизмов толерантности при воздействии нескольких биоцидов. Относительно высокий процент изолятов был устойчив по крайней мере к одному биоциду и по крайней мере к одному антибиотику, и был значительным ( P <0.05) положительная корреляция между толерантностью к биоцидам и устойчивостью к антибиотикам. Эти результаты подтверждают общую обеспокоенность по поводу того, что использование биоцидов может совместно использоваться для выявления устойчивости к антибиотикам (SCENIHR, 2009; Ortega-Morente et al., 2013; Wales and Davies, 2015). Перекрестная резистентность между антибиотиками и биоцидами, а также между различными биоцидами была зарегистрирована для разных бактерий, например, Pseudomonas aeruginosa (Lambert et al., 2001; Lavilla Lerma et al., 2015). Более того, предыдущие исследования показали, что адаптация к биоцидам при многократном воздействии приводит к повышению устойчивости к антибиотикам (Gadea et al., 2016, 2017а). Стоит отметить, что были также некоторые положительные корреляции между толерантностью / устойчивостью к биоцидам, антибиотикам и другим противомикробным препаратам. Например, фенольный биоцид триклозан показал положительную корреляцию с более низкой чувствительностью к фенольному соединению тимол (но не к карвакролу), а антибиотик ампициллин также показал положительную корреляцию с тимолом. Предыдущие исследования показали, что воздействие растительных эфирных масел (которые богаты фенольными соединениями), таких как сосновое масло, привело к отбору мутантов с нерегулируемым опероном mar , которые имели пониженную чувствительность к ряду антимикробных соединений (включая антибиотики и биоциды). как следствие пониженной проницаемости клеток и повышенной активности откачивающего насоса (Moken et al., 1997; Ортега-Моренте и др., 2013). Следует отметить, что химические консерванты лактат натрия и тринатрийфосфат показали только умеренную положительную корреляцию с антибиотиками ампициллином и имипенемом, но не с биоцидами. Недавнее исследование показало, что бактерии, адаптированные к четвертичным аммониевым соединениям в лабораторных условиях, показали общую повышенную толерантность к консервантам (таким как 4-гидроксибензойная кислота, тимьян и гвоздичное масло, нитраты натрия и калия, сорбат калия), тогда как наблюдалось обратное. в случае триклозана (Gadea et al., 2017б). Сульфаниламиды, потенцированные триметопримом или орметопримом и флорфениколом, являются одними из антибиотиков, обычно используемых в аквакультуре (Hernández Serrano, 2005). В настоящем исследовании ген устойчивости к сульфонамидам sul1 был генетическим детерминантом, обнаруживаемым наиболее часто. Устойчивость к сульфонамидам чаще всего связана с интегронами класса I. Эти мобильные генетические элементы имеют тенденцию накапливать различные гены устойчивости к антибиотикам, а также гены устойчивости к биоцидам, такие как qacE Δ 1 .Однако qacE Δ 1 был обнаружен в комбинации с sul1 только в изолятах A. calcoaceticus , а ПЦР-амплификация с прямым праймером для qacE Δ 1 и обратным праймером для sul1 не предполагал близкого физического расположения двух генов, если только они не находились в противоположном направлении. Интегроны устойчивости класса 1 расположены на мобильных элементах, таких как транспозоны и плазмиды, и широко распространены среди клинических штаммов, а также в изолятах из окружающей среды и играют важную роль в качестве резервуаров генов устойчивости к противомикробным препаратам (L’Abée-Lund and Sørum, 2001; Stokes and Gillings, 2011; Koczura et al., 2013, 2014). Примечательно, что одно исследование, проведенное на объектах аквакультуры в северной части Балтийского моря (Финляндия), показало, что гены устойчивости к антибиотикам для сульфаниламидов ( sul1 и sul2 ) и триметоприма ( dfrA1 ) и гена интегразы для интегрона класса 1 ( intI1 ) сохранялся в донных отложениях под рыбоводными хозяйствами при очень низких концентрациях антибиотиков в течение 6-летнего периода наблюдений (Muziasari et al., 2014). Предположительно, гены устойчивости к противомикробным препаратам могут распространяться в морских отложениях на другие бактерии, которые колонизируют неаквакультурную рыбу, а от них — на среду переработки морепродуктов.Это могло бы объяснить обнаружение sul1 в бактериях, выделенных в настоящем исследовании из таких рыб, как сардины, анчоусы, атлантическая ставрида, морской окунь, морской лещ и лосось, или из кальмаров. Кроме того, в ряде случаев бактериальные изоляты, несущие sul1 , также дали положительный результат на ген устойчивости к флорфениколу floR , который также может быть связан с интегронами класса 1 (Toleman et al., 2007; Lin et al., 2016) . Аквакультура в значительной степени зависит от использования антибиотиков (Hernández Serrano, 2005), и в нескольких исследованиях сообщалось об устойчивости к противомикробным препаратам бактерий из экосистем аквакультуры (например,г., Shah et al., 2014; Хуанг и др., 2015; Xiong et al., 2015; Watts et al., 2017). Примечательно, что один из двух изолятов из настоящего исследования с самым широким спектром устойчивости к противомикробным препаратам (обозначенный как A. oleivorans ) был выделен из креветок, выращенных в аквакультуре. Штамм A. oleivorans из настоящего исследования был устойчивым к 10 антимикробным препаратам и дал положительный результат на генетические детерминанты bla TEM и bla CTX-M .Поскольку креветки варили и замораживали, а затем продавали в незамороженном виде на льду, существует вероятность того, что этот штамм попал в пищу в результате перекрестного заражения во время обработки. Вареные креветки готовы к употреблению, поэтому бактерии с множественной устойчивостью к антибиотикам вместе с их генами устойчивости к антибиотикам могут передаваться от креветок к человеку. Acinetobacters обитают в почве и воде, а также являются условно-патогенными микроорганизмами для человека, а патогенные для человека штаммы, как известно, проявляют как внутреннюю, так и приобретенную устойчивость к широкому спектру противомикробных препаратов (Doughari et al., 2011). Также стоит отметить, что оставшиеся ацинетобактеры, обнаруженные в настоящем исследовании (все они идентифицированы как A. oleivorans ), были выделены из сырых ломтиков лосося, также выращенных в аквакультуре. Они были устойчивы к меньшему количеству антибиотиков (4 и 6), но все они дали положительный результат на генетические детерминанты qacE Δ 1, sul1 и aac (6 ′ ) -Ib , и еще два. были положительны по гену β-лактамазы расширенного спектра bla TEM . A. oleivorans был описан как бактерия, разлагающая дизельное топливо и н-гексадекан, выделенная с рисовых полей (Kang et al., 2011). Пока что устойчивость к антибиотикам непатогенных видов Acinetobacter изучена слабо, но результаты настоящего исследования позволяют предположить, что они могут быть важным резервуаром признаков устойчивости к противомикробным препаратам. 14,94% из 87 изолятов настоящего исследования были устойчивы к имипенему. Карбапенемы были последними β-лактамами, сохранившими почти универсальную антиграмотрицательную активность, но гены карбапенемаз распространяются, обеспечивая устойчивость (Nordmann et al., 2011). Кроме того, среди металло-β-лактамаз, исследованных в настоящем исследовании, в двух изолятах были обнаружены имипенемаза (IMP) и ген металло-β-лактамазы NDM-1 из Нью-Дели, оба принадлежащие к Pseudomonas . Некоторые металло-β-лактамазы, кодируемые мобильной ДНК, возникли у важных грамотрицательных патогенов (Cornaglia et al., 2011). NDM был зарегистрирован в основном у Klebsiella pneumoniae и E. coli , но он также был обнаружен у ряда других представителей Enterobacteriaceae , включая Acinetobacter spp., у Pseudomonas spp. и Vibrio cholerae (Poirel et al., 2011; Walsh et al., 2011; Mataseje et al., 2016). Сообщается, что в Pseudomonas aeruginosa хромосомный ген bla NDM − 1 находится в общей области 1 инсерционной последовательности, несущей интегрон класса 1 (IS) (IS CR1 ) в Tn 402 — подобная структура (Janvier et al., 2013; Jovcic et al., 2013). Примечательно, что интегрон также содержал детерминанту устойчивости к ЧАС qacE Δ 1 и ген устойчивости к сульфонамидам sul1 .О подобном массиве генов сообщалось для bla областей NDM-1 из трансферируемой плазмиды E. coli pNDM15-1078 (Mataseje et al., 2016). Кроме того, bla NDM-1 часто появляется в связи с геном ble MBL , который придает устойчивость к блеомицину, гликопептидному антибиотику, который естественным образом продуцируется Streptomyces verticillus . Возможно, что блеомициноподобные молекулы способствуют селективному давлению, что приводит к дальнейшему распространению продуцентов NDM в окружающей среде (Mataseje et al., 2016). Все изоляты Aeromonas из настоящего исследования были устойчивы к хлоргексидину, ампициллину и имипенему. Вдобавок два из них дали положительный результат на sul1 и bla TEM , а один также был положительным на bla CTX-M . Aeromonas широко распространены в водной среде (Holmes et al., 1996). В род входят виды, патогенные для рыб (например, A. salmonicida и другие) и человека.В одном исследовании резистентных к ампициллину изолятов из устьевых вод Henriques et al. (2006) обнаружили присутствие гена интегразы (наряду с другими генами, связанными с интегронами класса I) в штаммах Aeromonas . Авторы также обнаружили наличие генов β-лактамаз bla TEM , bla SHV , bla CphA и bla OXA − B у штаммов Aeromonas . Примечательно, что bla OXA − B , обнаруженный в Aeromonas sp.и A. hydrophila был связан с интегронами класса I. Другое исследование Aeromonas , выделенных из девяти пресноводных форелевых хозяйств в Австралии, сообщило о наличии sul1 вместе с другими генами устойчивости к антибиотикам, обычно связанными с интегронами класса I (Ndi and Barton, 2011). Однако исследованные гены β-лактамаз ( bla TEM и bla SHV ) обнаружены не были. Необходимо провести дальнейшие исследования для определения возможной ассоциации генов β-лактамаз, обнаруженных в изолятах Aeromonas из настоящего исследования, с интегронами класса I. В настоящем исследовании один изолят, устойчивый к цефотаксиму, цефтазидиму, стрептомицину и налидиксовой кислоте, был идентифицирован как Listeria innocua . Этот изолят дал положительный результат на ген устойчивости к β-лактамазам bla PSE . В предыдущих исследованиях сообщалось об устойчивости к противомикробным препаратам у Listeria spp. изолированы от сырой рыбы и на открытом рыбном рынке (Jamali et al., 2015). Авторы сообщили о высокой устойчивости L. monocytogenes к тетрациклину и пенициллину G в согласии с другими исследованиями (Rodas-Suárez et al., 2006; Fallah et al., 2013). В другой работе сообщается о высоком уровне устойчивости к ампициллину, цефотаксиму (100%) и пенициллину (57%) в изолятах из морепродуктов L. monocytogenes (Abdollahzadeh et al., 2016). Мы могли бы предположить, что L. innocua , выделенное в настоящем исследовании из кальмаров, произошло из среды обработки и обработки морепродуктов. Хотя это непатогенный вид, результаты позволяют предположить, что различные виды Listeria в условиях переработки морепродуктов могут действовать как резервуары для признаков устойчивости к противомикробным препаратам. Воздействие антибиотиков, дезинфицирующих средств, химических загрязнителей и металлов в низких концентрациях может действовать как селективная сила, приводящая к процессам резистентности среди местных бактериальных популяций (Martinez, 2009). Есть опасения, что воздействие металлов может способствовать развитию устойчивости к антибиотикам. В настоящем исследовании изоляты, способные расти при высоких концентрациях сульфата меди и хлорида цинка, включали представителей Pseudomonas, Aeromonas, Acinetobacter и Proteus .Наблюдаемая устойчивость к металлам может быть связана с прямым воздействием этих металлов в окружающей среде. Кроме того, ген мульти-медной оксидазы pcoA / copA был обнаружен в нескольких штаммах Pseudomonas , которые также были положительны в отношении различных генов устойчивости к антибиотикам ( bla CTX-M , bla TEM , bla , bla NDM − 1 , bla IMP , aadA1, aac (6 ′ ) -Ib, sul1, sul2, floR ).Индуцируемая медью система copABCDRS была впервые описана в плазмиде pPT23D в P. syringae (Cha and Cooksey, 1991) и гомологична системе pco , обнаруженной на конъюгированной плазмиде pRJ1004 из E. coli . В дополнение к плазмидной системе, хромосомные АТФазы P-типа ответственны за придание толерантности к металлам, таким как медь, цинк, кобальт, хром и кадмий (Teitzel and Parsek, 2003). Как указано Berendonk et al. (2015), селективное давление, присутствующее в естественных средах, таких как реки и озера, в результате деятельности человека, приводит к появлению все большего числа изолятов Pseudomonas из окружающей среды с множественной лекарственной устойчивостью (Berendonk et al., 2015). Тем не менее, при исследовании резистома P. aeruginosa E67, эпифитного изолята из загрязненного металлами эстуария, физические связи между генами устойчивости к металлам и антибиотикам не были идентифицированы, что свидетельствует о преобладании перекрестной устойчивости, связанной с множественными оттоком лекарств. (Teixeira et al., 2016). Насосы для оттока нескольких лекарственных препаратов из бактерий могут содержать множество противомикробных препаратов, включая красители, антибиотики и биоциды (Poole, 2007). Тем не менее, возможная ассоциация плазмиды pcoA / copA с генами устойчивости к антибиотикам в Pseudomonas заслуживает дальнейшего изучения. В заключение, результаты настоящего исследования ясно указывают на то, что бактерии из морепродуктов обладают свойствами устойчивости к различным противомикробным препаратам. Возможная роль этих бактерий в распространении устойчивости к противомикробным препаратам по пищевой цепи заслуживает дальнейшего изучения. Также важно найти альтернативные способы борьбы с устойчивостью к противомикробным препаратам. Биологические методы, такие как использование пробиотиков (Tan et al., 2016; Banerjee and Ray, 2017) или применение бактериофагов (Letchumanan et al., 2016; Торрес-Барсело и др., 2016; Parmar et al., 2017) могут быть многообещающими альтернативами классическим противомикробным препаратам. Авторские взносыКомпания JR провела отбор проб морепродуктов, микробиологический анализ и ПЦР-исследование генетических детерминант устойчивости. MG принимала участие в планировании и контроле экспериментальной работы, а также участвовала в идентификации штаммов и подготовке экспериментов ПЦР. RP внесла свой вклад в анализ данных и подготовку графического материала для рукописи.RL и AG провели глобальный анализ результатов и написали рукопись. Заявление о конфликте интересовАвторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. БлагодарностиЭта работа была поддержана исследовательским проектом P08-AGR-4295 (CICE, FEDER) и Университетом Хаэна (Исследовательская структура AGR230). Мы также признательны Campus de Excelencia Internacional Agroalimentario CeiA3. Список литературыАбдоллахзаде, Э., Оджаг, С. М., Хоссейни, Х., Гаеми, Э. А., Ираджян, Г., и Нагизаде, Х. М. (2016). Устойчивость к противомикробным препаратам Listeria monocytogenes , выделенных из морепродуктов и людей в Иране. Microb. Патог. 100, 70–74. DOI: 10.1016 / j.micpath.2016.09.012 PubMed Аннотация | CrossRef Полный текст | Google Scholar Абриуэль, Х., Лукас, Р., Бен Омар, Н., Вальдивия, Э., Македа, М., Мартинес-Канамеро, М., и другие. (2005). Энтероцин AS-48RJ: вариант энтероцина AS-48, хромосомно кодируемый Enterococcus faecium RJ16, выделенный из пищи. Syst. Appl. Microbiol. 28, 383–397. DOI: 10.1016 / j.syapm.2005.01.007 CrossRef Полный текст | Google Scholar Адаиккалам В. и Сваруп С. (2002). Молекулярная характеристика оперона cueAR, кодирующего предполагаемую АТФазу P1-типа и регуляторный белок MerR-типа, участвующих в гомеостазе меди у Pseudomonas putida.Микробиология 148, 2857–2867. DOI: 10.1099 / 00221287-148-9-2857 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бадар У., Ахмед Н., Шуб Э. и Гадд Г. М. (2014). Идентификация оперона pco у видов Enterobacter , выделенных из загрязненной почвы. Инт . J. Adv. Res. 2, 227–233. DOI: 10.21474 / IJAR01 CrossRef Полный текст | Google Scholar Банерджи, Г., и Рэй, А. К.(2017). Развитие исследований пробиотиков и их применение в рыбоводстве. Res. Вет. Sci. 115, 66–77. DOI: 10.1016 / j.rvsc.2017.01.016 PubMed Аннотация | CrossRef Полный текст | Google Scholar Берендонк, Т. У., Манайя, К. М., Мерлин, К., Фатта-Кассинос, Д., Цитрин, Э., Уолш, Ф. и др. (2015). Борьба с устойчивостью к антибиотикам: основы окружающей среды. Nat. Rev. Microbiol. 13, 310–317. DOI: 10.1038 / nrmicro3439 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бертран, С., Weill, F.X., Cloeckaert, A., Vrints, M., Mairiaux, E., Praud, K., et al. (2006). Появление клонов β-лактамазы расширенного спектра (CTX-M-2), продуцирующих изолятов серовара Вирхова Salmonella enterica с пониженной чувствительностью к ципрофлоксацину среди домашней птицы и людей в Бельгии и Франции (2000–2003 гг.). J. Clin. Microbiol. 44, 2897–2903. DOI: 10.1128 / JCM.02549-05 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бьорнсдоттир-Батлер, К., Грин Д. П., Болтон Г. Э., Макклеллан-Грин П. Д. (2015). Контроль гистамин-продуцирующих бактерий и образования гистамина в мышцах рыб с помощью тринатрийфосфата. J. Food Sci. 80, M1253 – M1258. DOI: 10.1111 / 1750-3841.12875 PubMed Аннотация | CrossRef Полный текст | Google Scholar Браудаки, М., и Хилтон, А. С. (2004). Адаптивная устойчивость к биоцидам у Salmonella enterica и Escherichia coli O157 и перекрестная устойчивость к антимикробным агентам. J. Clin. Microbiol. 42, 73–78. DOI: 10.1128 / JCM.42.1.73-78.2004 PubMed Аннотация | CrossRef Полный текст | Google Scholar Браун, Н. Л., Руш, Д. А., и Ли, Б. Т. О. (1992). Системы устойчивости к меди у бактерий. Плазмида 27, 41–51. DOI: 10.1016 / 0147-619X (92) -U CrossRef Полный текст Кавако, Л. М., Хасман, Л., и Ареструп, Ф. М. (2011). Устойчивость Staphylococcus aureus животного происхождения к цинку тесно связана с устойчивостью к метициллину. Вет. Microbiol. 150, 344–348. DOI: 10.1016 / j.vetmic.2011.02.014 PubMed Аннотация | CrossRef Полный текст | Google Scholar Ча, Дж. С., Кукси, Д. А. (1991). Устойчивость к меди в Pseudomonas syringae опосредуется периплазматическими белками и белками внешней мембраны. Микробиология 88, 8915–8919. DOI: 10.1073 / pnas.88.20.8915 CrossRef Полный текст | Google Scholar Чихомву П., Стегманн П. и Пиллэй М. (2015). Характеристика и предсказание структуры последовательностей белков частичной длины генов pcoA, pcoR и chrB из устойчивых к тяжелым металлам бактерий из реки Клип, Южная Африка. Внутр. J. Mol. Sci. 16, 7352–7374. DOI: 10.3390 / ijms16047352 PubMed Аннотация | CrossRef Полный текст | Google Scholar Chiu, C.H., Su, L.H., Chu, C.H., Wang, M.H., Yeh, C.M., Weill, F.X., et al. (2006). Обнаружение мультирезистентных фагов Salmonella enterica serovar typhimurium типов DT102, DT104 и U302 с помощью мультиплексной ПЦР. J. Clin. Microbiol. 44, 2354–2358. DOI: 10.1128 / JCM.00171-06 PubMed Аннотация | CrossRef Полный текст | Google Scholar Chuanchuen, R., Бейнлих, К., Хоанг, Т. Т., Бехер, А., Каркофф-Швейцер, Р. Р., и Швейцер, Х. П. (2001). Перекрестная резистентность между триклозаном и антибиотиками в Pseudomonas aeruginosa опосредуется оттоком нескольких лекарственных препаратов: воздействие на чувствительный мутантный штамм триклозана отбирает мутанты nfxB, сверхэкспрессирующие MexCD-OprJ. Антимикробный. Агенты Chemother. 45, 428–432. DOI: 10.1128 / AAC.45.2.428-432.2001 PubMed Аннотация | CrossRef Полный текст | Google Scholar Chuanchuen, R., Кхемтонг, С., и Падунгтод, П. (2007). Встречаемость генов qacE / qacEΔ1 и их корреляция с интегронами класса 1 в изолятах Salmonella enterica от домашней птицы и свиней. Юго-Восточная Азия. J. Trop. Med. Паб. Здоровье 38, 855–862. Cornaglia, G., Giamarellou, H., and Rossolini, G.M. (2011). Металло-β-лактамазы: последний рубеж для β-лактамов? Ланцетная инфекция. Dis. 11, 381–393. DOI: 10.1016 / S1473-3099 (11) 70056-1 PubMed Аннотация | CrossRef Полный текст | Google Scholar Crémet, L., Карофф, Н., Даувернь, С., Рейно, А., Лепеллетье, Д., и Корвек, С. (2011). Распространенность детерминант устойчивости к хинолонам, опосредованных плазмидами, в клинических изолятах ESBL Enterobacteriaceae в течение 1 года во французской больнице. Pathol. Биол. 59, 151–156. DOI: 10.1016 / j.patbio.2009.04.003 PubMed Аннотация | CrossRef Полный текст | Google Scholar Де Торо, М., Саенс, Ю., Серценадо, Э., Рохо-Безарес, Б., Гарсия-Кампелло, М., Ундабейтия, и др.(2011). Генетическая характеристика механизмов устойчивости к амоксициллину / клавуланату и цефалоспоринам третьего поколения у Salmonella enterica из трех испанских больниц. Инт . Microbiol. 14, 173–181. DOI: 10.2436 / 20.1501.01.146 CrossRef Полный текст CLSI (2015). Тестирование на чувствительность к противомикробным препаратам; Двадцать четвертое информационное приложение , Vol. 35. Уэйн, Пенсильвания: Стандарты деятельности Института клинических и лабораторных стандартов для документа M100 – S25. Дугари, Х. Дж., Ндакидеми, П. А., Хуман, И. С., Бенаде, С. (2011). Экология, биология и патогенез Acinetobacter spp: обзор. Microb. Environ. 26, 101–112. DOI: 10.1264 / jsme2.ME10179 CrossRef Полный текст | Google Scholar Европейский центр профилактики и контроля заболеваний (ECDC) (2013 г.). Эпидемиологические новости: вспышка инфекции Salmonella Stanley с несколькими штатами . Сольна: Европейский центр профилактики и контроля заболеваний (ECDC). Европейское агентство по безопасности пищевых продуктов (EFSA) (2010 г.). Сводный отчет сообщества об устойчивости к противомикробным препаратам зоонозных и индикаторных бактерий животных и пищевых продуктов в Европейском Союзе в 2004–2007 гг. EFSA J. 8: 1309. DOI: 10.2903 / j.efsa.2010.1309 CrossRef Полный текст Европейское агентство по безопасности пищевых продуктов (EFSA) и Европейский центр профилактики и контроля заболеваний (ECDC) (2013 г.). Сводный отчет европейского союза об устойчивости к противомикробным препаратам зоонозных и индикаторных бактерий человека, животных и продуктов питания в 2011 году. EFSA J. 11: 3196. DOI: 10.2903 / j.efsa.2013.3196 CrossRef Полный текст Фаллах, А.А., Саи-Дехкорди, С.С., и Махзуние, М. (2013). Распространенность и профили устойчивости к антибиотикам Listeria monocytogenes , выделенного из морепродуктов, а также рыночных и производственных сред в Иране. Продовольственная Конт. 34, 630–636. DOI: 10.1016 / j.foodcont.2013.06.015 CrossRef Полный текст | Google Scholar Продовольственная и сельскохозяйственная организация (ФАО).(2016). Globefish Highlights — выпуск 3/2016 . Рим: ФАО. Гадеа Р., Фернандес Фуэнтес М. А., Перес Пулидо Р., Гальвес А. и Ортега Э. (2016). Адаптивная толерантность к фенольным биоцидам у бактерий из органических продуктов питания: влияние на чувствительность к противомикробным препаратам и толерантность к физическим нагрузкам. Food Res. Int. 85, 131–143. DOI: 10.1016 / j.foodres.2016.04.033 CrossRef Полный текст | Google Scholar Гадеа, Р., Фернандес Фуэнтес, М.А., Перес Пулидо, Р., Гальвес, А., и Ортега, Э. (2017a). Влияние воздействия биоцидов на основе четвертичного аммония на чувствительность к противомикробным препаратам и устойчивость к физическим нагрузкам у бактерий из органических продуктов питания. Food Microbiol. 63, 58–71. DOI: 10.1016 / j.fm.2016.10.037 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гадеа Р., Глибота Н., Перес Пулидо Р., Гальвес А. и Ортега Э. (2017b). Влияние воздействия биоцидов на чувствительность бактерий из органических продуктов к эфирным маслам и химическим консервантам. Продовольственная Конт. 80, 176–182. DOI: 10.1016 / j.foodcont.2017.05.002 CrossRef Полный текст | Google Scholar Гэйз, В. Х., Абдуслам, Н., Хоуки, П. М., и Веллингтон, Э. М. Х. (2005). Распространенность интегронов класса 1 в среде, загрязненной четвертичными аммониевыми соединениями. Антимикробный. Агенты Chemother. 49, 1802–1807. DOI: 10.1128 / AAC.49.5.1802-1807.2005 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гомес-Санс, Э., Кадлец, К., Фесслер, А. Т., Заразага, М., Торрес, К., и Шварц, С. (2013). Новые erm (T) -содержащие плазмиды множественной резистентности из изолятов метициллин-устойчивого Staphylococcus aureus ST398 свиньи и человека, которые также содержат детерминанты резистентности к кадмию и меди. Антимикробный. Агенты Chemother. 57, 3275–3282. DOI: 10.1128 / AAC.00171-13 PubMed Аннотация | CrossRef Полный текст | Google Scholar Гвардиола, Ф. А., Куэста, А., Месегер, Дж., И Эстебан, М. А. (2012). Риски использования биоцидов против обрастания в аквакультуре. Внутр. J. Mol. Sci. 13, 1541–1560. DOI: 10.3390 / ijms13021541 PubMed Аннотация | CrossRef Полный текст | Google Scholar Герра Б., Сото С. М., Аргуэльес Дж. М. и Мендоса К. (2001). Множественная лекарственная устойчивость опосредуется большими плазмидами, несущими интегрон класса 1 в появляющемся серотипе Salmonella enterica [4,5,12: i: -]. Антимикробный. Агенты Chemother. 45, 1305–1308. DOI: 10.1128 / AAC.45.4.1305-1308.2001 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хансен, Л.С., Йенсен, Л. Б., и Соренсен, Х. И. (2007). Субстратная специфичность насоса множественной лекарственной устойчивости OqxAB в Escherichia coli и некоторых кишечных бактериях. J. Antimicrob. Chemother. 60, 145–147. DOI: 10.1093 / jac / dkm167 PubMed Аннотация | CrossRef Полный текст | Google Scholar Энрикес, И. С., Фонсека, Ф., Алвес, А., Сааведра, М. Дж., И Коррейя, А. (2006). Встречаемость и разнообразие интегронов и генов β-лактамаз среди ампициллин-резистентных изолятов из устьевых вод. Res. Microbiol. 157, 938–947. DOI: 10.1016 / j.resmic.2006.09.003 PubMed Аннотация | CrossRef Полный текст | Google Scholar Эрнандес Серрано, П. (2005). Ответственное использование антибиотиков в аквакультуре . Технический документ ФАО по рыболовству 469, ФАО, Рим. Google Scholar Холмс П., Николлс Л. М. и Сартори Д. П. (1996). «Экология мезофильных аэромонад в водной среде», в The Genus Aeromonas , ред.Остин, М. Альтвегг, П. Дж. Гослинг и С. Джозеф (Нью-Йорк, штат Нью-Йорк: Джон Уайли и сыновья), 127–150. Google Scholar Хуанг Ю., Чжан Л., Тиу Л. и Ван Х. Х. (2015). Характеристика устойчивости к антибиотикам у комменсальных бактерий из экосистемы аквакультуры. Фронт. Microbiol. 6: 914. DOI: 10.3389 / fmicb.2015.00914 CrossRef Полный текст | Google Scholar Джамали, Х., Пайдар, М., Исмаил, С., Луи, К. Ю., Вонг, В. Ф., Радмех, Б. и др.(2015). Распространенность, чувствительность к антимикробным препаратам и вирулотипирование видов Listeria и видов Listeria monocytogenes , выделенных на открытых рыбных рынках. BMC Microbiol. 15: 144. DOI: 10.1186 / s12866-015-0476-7 PubMed Аннотация | CrossRef Полный текст | Google Scholar Жанвье, Ф., Жанно, К., Тессе, С., Робер-Никуд, М., Делакур, Х., Рапп, К. и др. (2013). Молекулярная характеристика blaNDM-1 в последовательности типа 235 изолята Pseudomonas aeruginosa из Франции. Антимикробный. Агенты Chemother. 57, 3408–3411. DOI: 10.1128 / AAC.02334-12 PubMed Аннотация | CrossRef Полный текст | Google Scholar Йовчич, Б., Лепсанович, З., Бегович, Дж., Раконьяц, Б., Перованович, Дж., Топи Сирович, Л. и др. (2013). Клинический изолят Pseudomonas aeruginosa MMA83 содержит две копии Frontiers | Транс-коричный альдегид и эвгенол повышают чувствительность Acinetobacter baumannii к бета-лактамным антибиотикамВведениеAcinetobacter baumannii — это грамотрицательная аэробная палочка с множественной лекарственной устойчивостью (МЛУ), которая стала основной причиной внутрибольничных инфекций с уровнем смертности от 34 до 61% (Karageorgopoulos and Falagas, 2008; Wieczorek et al., 2008; Эстерли и др., 2011). У людей MDR A. baumannii вызывает широкий спектр клинических состояний, включая пневмонию (Leung et al., 2005), инфекции кровотока (Wisplinghoff et al., 2004; Центры по контролю и профилактике заболеваний [CDC]) , 2004), менингит (Metan et al., 2007), инфекции мочевыводящих путей (Sunenshine et al., 2007) и раневые инфекции (Scott et al., 2007). Кроме того, сообщения о других проявлениях, таких как эндокардит, перитонит, и остеомиелит, связанный с A.baumannii (Olut and Erkek, 2005; Menon et al., 2006). A. baumannii считается одной из наиболее распространенных бактерий, связанных с отделениями интенсивной терапии (Garnacho-Montero and Amaya-Villar, 2010; Ulu -Kilic et al., 2013), и его трудно лечить из-за его устойчивости к большинству доступных в настоящее время антибиотиков (Maragakis and Perl, 2008; Doi et al., 2009; Neonakis et al., 2011; Al Mobarak et al. ., 2014; Ellis et al., 2015) Например, карбапенемы, которые когда-то были противомикробными препаратами выбора для лечения A.baumannii , больше не являются полностью эффективными из-за развития устойчивости бактерий (Falagas et al., 2006; Bassetti et al., 2008; Abbott et al., 2013; Fonseca et al., 2013). Аналогичным образом, хотя полимиксины были успешно использованы для лечения инфекций A. baumannii , появились штаммы, устойчивые к этим препаратам (Hernan et al., 2009; Lean et al., 2014; Pogue et al., 2015). В свете этих отчетов Американское общество инфекционных болезней оценило A. baumannii как один из наиболее приоритетных, устойчивых к антибиотикам патогенов, на которые необходимо воздействовать из-за его быстрой склонности к развитию лекарственной устойчивости и ограниченного выбора антибиотиков, доступных для лечения. инфекции, вызванные этой бактерией (Talbot et al., 2006; Shlaes et al., 2013). A. baumannii считается мультирезистентным, если он проявляет устойчивость к более чем трем классам антибиотиков (Falagas et al., 2006). Устойчивость A. baumannii к антибиотикам объясняется множеством механизмов, включая снижение проницаемости его внешней мембраны для антибиотиков, конститутивную экспрессию насосов оттока лекарств и его способность приобретать и включать генетические элементы, такие как плазмиды, транспозоны и интегроны (Giamarellou et al., 2008; Cai et al., 2012). Кроме того, A. baumannii обладает значительной способностью к образованию биопленок на различных поверхностях (Espinal et al., 2012; Longo et al., 2014), что не только увеличивает потенциал A. baumannii для нозокомиального распространения, но также способствует его устойчивости к антибиотикам и вирулентности (Lee et al., 2008; Rao et al., 2008). Таким образом, существует острая необходимость в изучении новых стратегий лечения инфекций A. baumannii . Традиционно растения служили источником новых лекарств для лечения различных заболеваний человека (Cowan, 1999).Были задокументированы различные соединения растительного происхождения, обладающие антимикробными свойствами в отношении широкого спектра микроорганизмов (Kon and Rai, 2012; Upadhyay et al., 2014). Сообщалось об антимикробном эффекте четырех компонентов имбиря против штаммов МЛУ A. baumannii (Wang et al., 2010). Аналогичным образом было обнаружено, что эфирное масло кориандра оказывает синергетическое или аддитивное действие с антибиотиками, такими как тетрациклин, хлорамфеникол, ципрофлоксацин, гентамицин, пиперациллин и цефоперазон против A.baumannii (Duarte et al., 2012). Недавно было обнаружено, что водный экстракт киви ( Actinidia deliciosa ) и гвоздики ( Syzygium aromaticum ) проявляет антибиотикопленочную активность против A. baumannii (Tiwari et al., 2017). Аналогичным образом было показано, что растительный экстракт из Aegle marmelos и имипенем обладают синергическим действием против устойчивого к карбапенему штамма Acinetobacter baumannii (Tiwari et al., 2016). В другом исследовании эфирное масло из Origanum vulgare обладало сильной антимикробной активностью против MDR A.baumannii (Саги и др., 2015). Кроме того, предыдущие исследования в нашей лаборатории показали, что несколько антимикробных препаратов растительного происхождения (КПК), включая транс -коричный альдегид (TC), ингредиент корицы, эвгенол (присутствует в гвоздике), а также карвакрол и тимол, полученные из масла и масла орегано. тимьяна, соответственно, снижает устойчивость к антибиотикам у MDR S . Typhimurium DT 104 (Johny et al., 2010). Эти исследователи отметили, что ТС снижает устойчивость DT 104 к пяти антибиотикам, тогда как тимол и карвакрол снижают устойчивость к трем антибиотикам. Антибиотики β-лактамной группы являются наиболее часто назначаемыми антибиотиками для лечения бактериальных инфекций во всем мире (Pitout et al., 1997; Thakuria and Lahon, 2013). A. baumannii способен продуцировать β-лактамазы, которые могут гидролизовать β-лактамное кольцо пенициллинов, цефалоспоринов и карбапенемов, тем самым обеспечивая устойчивость к этим антибиотикам. Таким образом, в этом исследовании изучалась эффективность TC и эвгенола (EG) в повышении чувствительности A.baumannii к семи β-лактамным антибиотикам. Кроме того, было определено влияние этих КПК на гены устойчивости к β-лактамным антибиотикам у A. baumannii . Материалы и методыA. baumannii Культуры и условия выращиванияВ исследовании использовались два клинических изолята A. baumannii , а именно 251847 (International Health Management Associates, IL) и 17978 (ATCC; изолят фатального менингита). Все бактериологические среды, использованные в исследовании, за исключением агара Leeds MDR Acinetobacter , были приобретены у Difco (Becton Dickinson, Sparks, MD, США).Лидс-MDR-агар был закуплен у Hardy Diagnostics (Санта-Мария, Калифорния, США). Бактериальные изоляты культивировали отдельно в течение ночи в 10 мл триптического соевого бульона (TSB) с последующим нанесением штрихов на чашки с агаром Leeds MDR Acinetobacter и инкубацией при 37 ° C в течение 24 часов. Индивидуальную колонию из агара Leeds MDR Acinetobacter субкультивировали дважды в 10 мл TSB при 37 ° C в течение 24 ч при перемешивании до достижения ∼8 log · 10 КОЕ / мл. Культуры осаждали центрифугированием (3700 × г , 15 мин, 4 ° C), осадок дважды промывали и ресуспендировали в стерильном фосфатно-солевом буфере (PBS; pH 7.2). Затем культуры разводили соответствующим образом в PBS, чтобы получить от ~ 5 до 6 log 10 КОЕ / мл для использования в качестве инокулята. Бактериальную популяцию в посевном материале подтверждали посевом на триптический соевый агар (TSA) с инкубацией при 37 ° C в течение 24 часов. Противомикробные препараты (КПК) и химические вещества растительного происхожденияТранс -коричный альдегид (≥98%; TC, транс -3-фенил-2-пропеналь), эвгенол (≥98%; EG, 4-аллил-2-метоксифенол), 1- N -фенилнафтиламин (NPN), EDTA, бромид этидия (EtBr), карбонилцианид м-хлорфенилгидразон (CCP) и пиронин Y были приобретены у Sigma-Aldrich (St.Луис, Миссури, США). Определение субингибиторной концентрации (SIC) и минимальной ингибирующей концентрации (MIC) КПК против A. baumanniiСубингибиторная концентрация (SIC) и минимальная ингибирующая концентрация (MIC) TC и EG против A. baumannii были определены, как сообщалось ранее (Johny et al., 2010; Amalaradjou and Venkitanarayanan, 2011) TSB (10 мл) пробирки, содержащие 0,75–7,5 мкМ (TC) и 0,61–6,1 мкМ (EG) с шагом 0.375 мкМ (TC) и 0,305 мкМ (EG инокулировали отдельно A. baumannii при ∼ 6 log 10 КОЕ / мл и инкубировали при 37 ° C в течение 24 ч. Пробирки без добавленных КПК служили контролем. После После инкубации образцы серийно разводили (1:10) в PBS, высевали на TSA и инкубировали при 37 ° C в течение 24 ч перед подсчетом колоний.Наибольшая концентрация TC или EG, которая не подавляла рост A. baumannii после 24 ч инкубации была выбрана в качестве SIC, в то время как самая низкая концентрация противомикробного вещества, которая ингибировала видимый рост бактерий после 24 ч инкубации, была принята в качестве MIC для этой обработки.Эксперимент проводили в двух экземплярах и повторяли трижды. Влияние КПК на устойчивость к антибиотикам у A. baumanniiβ-лактамные антибиотики, протестированные в текущем исследовании, включали ампициллин, меропенем, метициллин, пенициллин, азтреонам, амоксициллин и пиперациллин (Sigma-Aldrich). В исследовании использовались ранее опубликованные МИК каждого из вышеупомянутых антибиотиков против A. baumannii (Vashist et al., 2011; Morfin-Otero and Dowzicky, 2012; Malone and Kwon, 2013) (Таблица 1).Чтобы определить влияние комбинации КПК и антибиотиков на A. baumannii , MIC каждого антибиотика и TC / EG добавляли к 10 мл TSB, содержащему A. baumannii (∼ 6 log 10 КОЕ / мл. ) и инкубировали при 37 ° C в течение 24 ч (Johny et al., 2010). Подсчет бактерий определяли после анализа разбавления бульона и посева на поверхность соответствующих разведений на TSA. Обработки включали только A. baumannii (положительный контроль), A. baumannii + антибиотик, A.baumannii + КПК и A. baumannii + антибиотик + КПК. Кроме того, были включены подходящие контроли, включая A. baumannii + разбавитель (этанол) и A. baumannii + этанол + антибиотик. Для каждой обработки были включены повторяющиеся образцы, и эксперимент повторили три раза. ТАБЛИЦА 1. МИК антибиотиков, использованных при тестировании против A. baumannii. Анализ ингибирования откачивающего насосаИзучить влияние TC и EG на ингибирование действия насосов оттока в A.baumannii , анализы оттока EtBr и пиронина Y проводили в соответствии с опубликованным протоколом (Chusri et al., 2009). Ночные культуры A. baumannii дважды промывали и ресуспендировали в PBS, содержащем 0,4% глюкозы, до OD 600 ~ 0,5. В бактериальную суспензию добавляли MIC TC / EG или CCP (положительный контроль, 100 мкМ) и инкубировали при 37 ° C в течение 5 часов. Суспензия A. baumannii в PBS + 0,4% глюкозы служила контролем. После инкубации 200 мкл обработок / контроля отдельно переносили в 96-луночный микротитровальный планшет с последующим добавлением EtBr (Sigma) до конечной концентрации 4 мг / л, и флуоресценцию измеряли при возбуждении 530 нм и эмиссии. 645 нм.Анализ повторяли с пиронином Y (Sigma) до конечной концентрации 5 мг / л при 530 нм и эмиссии 645 нм. Эксперимент был повторен трижды с дубликатами для A. baumannii 17978 и A. baumannii 251847. Анализ проницаемости внешней мембраныДля изучения влияния TC и EG на внешнюю мембрану A. baumannii был проведен анализ поглощения NPN с использованием опубликованного протокола (Chusri et al., 2009). Ночевка A. baumannii 17978 и A.baumannii 251847 культур отдельно промывали и ресуспендировали в 5 мМ буфере HEPES до OD 600 ~ 0,5. Аликвоты по 100 мкл суспензии A. baumannii переносили на планшет для микротитрования вместе с MIC буфера TC / EG или EDTA 1 мМ / HEPES. После этого добавляли 40 мкМ NPN, чтобы довести общий объем до 200 мкл, флуоресценцию измеряли в течение 3 минут при возбуждении 355 нм и испускании 460 нм и непрерывно регистрировали в течение 3 часов каждые 10 минут. Эксперимент повторяли трижды с дубликатами для каждой обработки. Влияние КПК на экспрессию гена устойчивости к антибиотикам у A. baumanniiЭкстракция РНК и синтез кДНК sДля изучения влияния TC и EG на гены, связанные с устойчивостью к β-лактамным антибиотикам у A. baumannii , бактериальные культуры выращивали отдельно с или без SIC TC / EG при 37 ° C в TSB до середины log. фаза. A. baumannii , выращенные либо с одним антибиотиком, либо с одним только PDA, также были включены в качестве контроля.После инкубации культуры подвергали центрифугированию (12000 × g, 15 мин, 4 ° C) и к полученному осадку добавляли 0,5 мл стерильной воды, не содержащей РНКаз, и 1 мл реагента для защиты РНК (Qiagen, Valencia, CA, Соединенные Штаты). Суммарную РНК из каждого образца экстрагировали с помощью мини-набора RNeasy (Qiagen), и следовали инструкциям производителя при оценке общей РНК с помощью Nanodrop (Thermo Fisher Scientific, Waltham, MA, США). Набор обратной транскриптазы Super-script II (Invitrogen, Карлсбад, Калифорния, США) использовали для синтеза кДНК, и полученную кДНК использовали в качестве матрицы для RT-qPCR.Амплифицированный продукт детектировали с использованием реагентов SYBR Green. Количественная ПЦР в реальном времени (RT-qPCR)Гены устойчивости к антибиотикам A. baumannii , проанализированные для анализа экспрессии, включали гены эффлюксной помпы, а именно adeA, adeB, adeC ; ген устойчивости к β-лактамам, blaP ; и ген белка множественной лекарственной устойчивости, mdrp . Программное обеспечение Primer Express ® (Applied Biosystems, Foster city, CA, США) использовали для конструирования праймеров, специфичных для генов и для эндогенного контроля (16S рРНК).Праймеры были сконструированы из генома A. baumannii AB0057 (CP001182.1), опубликованного в базе данных NCBI (Adams et al., 2008), и их последовательности представлены в таблице 2. Синтезированные индивидуально праймеры были получены от Integrated DNA Technologies ( Фостер-Сити, Калифорния, США). RT-qPCR выполняли с помощью системы ПЦР в реальном времени StepOnePlus TM (Applied Biosystems) с использованием анализа SYBR green (Applied Biosystems) в пользовательских условиях термоциклирования с нормализованной РНК в качестве шаблона (Bookout and Mangelsdorf, 2003).Двойные образцы были проанализированы и стандартизированы в отношении экспрессии гена 16S рРНК. Относительные изменения уровней экспрессии мРНК определяли с использованием метода сравнительного порогового цикла (СТ) (2 -ΔΔ C T ) между контролем и обработками. ТАБЛИЦА 2. Список праймеров, используемых для обнаружения генов устойчивости к антибиотикам A. baumannii . Статистический анализИспользовался полностью рандомизированный план с факторной структурой лечения.Факторы включали два штамма A. baumannii , семь антибиотиков и два КПК. Данные анализировали с использованием процедуры PROC GENMOD программного обеспечения для статистического анализа (SAS ver. 9.4; SAS Institute Inc., Кэри, Северная Каролина, США). Средние наименьшие квадраты считались значимыми при P <0,05. Сравнение данных для исследования экспрессии генов проводилось с использованием теста Стьюдента t . Разницу считали значимой при P <0,05. РезультатыSIC TC и EG против A.baumannii оказался равным 1,1 мМ (0,015%) и 1,8 мМ (0,03%), соответственно, тогда как MIC составлял 4 мМ (0,05% TC и 0,065% EG) для обоих КПК. Хотя в исследовании использовались ранее сообщенные МИК каждого антибиотика против A. baumannii , оба изолята A. baumannii выросли примерно на 2,0 log 10 КОЕ / мл через 24 часа (контроль антибиотиков), как показано на рисунках. 1, 2 и дополнительные рисунки 1, 2. В присутствии MIC TC количество бактерий через 24 часа существенно не изменилось по сравнению с инокуляцией уровня 6.0 log 10 КОЕ / мл (рисунок 1), как и ожидалось. Однако, когда A. baumannii выращивали в присутствии каждого антибиотика и TC, его рост через 24 часа был значительно снижен по сравнению с положительным контролем, контролем антибиотика и контролем TC ( P <0,05). В обоих изолятах A. baumannii наибольшая чувствительность наблюдалась к метициллину, а наименьшая — к ампициллину и меропенему (рисунок 1 и дополнительный рисунок 1).Точно так же чувствительность обоих изолятов A. baumannii ко всем семи антибиотикам была значительно увеличена в присутствии EG, на что указывает снижение роста через 24 часа ( P <0,05) (рисунок 2 и дополнительный рисунок 2). У A. baumannii 17978 наибольшая чувствительность наблюдалась против ампициллина (рисунок 2), тогда как у A. baumannii 251847 была максимальная чувствительность к амоксициллину (дополнительный рисунок 2). РИСУНОК 1. Эффект TC в комбинации с β-лактамными антибиотиками в A. baumannii 17978. Столбцы с разными надстрочными индексами отличаются друг от друга в пределах кластера ( P <0,05). A. baumannii 17978 выращивали с каждым β-лактамным антибиотиком отдельно или в комбинации с TC. Бактерии, не подвергавшиеся никакому лечению (ПК), и бактерии, подвергавшиеся только ТС (ТС Ctrl), служили контролем для эксперимента. РИСУНОК 2. Эффект ЭГ в сочетании с β-лактамными антибиотиками в A.baumannii 17978. Столбцы с разными надстрочными индексами отличаются друг от друга внутри кластера ( P <0,05). A. baumannii 17978 выращивали с каждым β-лактамным антибиотиком отдельно или в комбинации с EG. Бактерии, не подвергавшиеся никакому лечению (ПК), и бактерии, подвергавшиеся только воздействию EG (EG Ctrl), служили контролем для эксперимента. Результаты анализа ингибирования откачивающего насоса с использованием EtBr и пиронина Y в A. baumannii ATCC 17978 и A.baumannii 251847 представлены на рисунках 3, 4 и дополнительных рисунках 3, 4. EtBr и пиронин Y являются известными субстратами для отводящих насосов AdeABC и AdeIJK, соответственно (Magnet et al., 2001; Xing et al., 2014). MIC TC и EG приводили к увеличению накопления EtBr внутри бактериальных клеток, на что указывало увеличение флуоресценции по сравнению с контролем PBS ( P <0,05) (Фигуры 5A – G). CCP, ингибитор откачивающей помпы, используемый в качестве положительного контроля (Magnet et al., 2001), также привел к увеличению флуоресценции, указывающему на подавление оттока насоса в A.baumannii . Однако аналогичное увеличение флуоресценции не наблюдалось для пиронина Y по сравнению с контролем PBS (рисунок 4 и дополнительный рисунок 4). Результаты анализа поглощения NPN у A. baumannii ATCC 17978 и A. baumannii 251847 представлены на дополнительных рисунках 5 и 6 соответственно. Ни TC, ни EG не увеличивали поглощение NPN, в то время как контроль EDTA не показывал увеличения флуоресценции. Кроме того, образцы, обработанные TC или EG, демонстрировали уменьшение флуоресценции с течением времени (данные не показаны). РИСУНОК 3. Внутриклеточное накопление бромида этидия (EtBr) в A. baumannii ATCC 17978 после обработки MIC TC и EG, как измерено по интенсивности флуоресценции. A. baumannii ATCC 17978 добавляли MIC TC / EG или CCP (100 мкМ) и инкубировали в течение 5 ч при 37 ° C. Флуоресценцию (возбуждение 530 нм и испускание 645 нм) измеряли после добавления EtBr (4 мг / л). Обработки с * значительно отличаются от PBS (контроль) ( P <0.05). РИСУНОК 4. Внутриклеточное накопление пиронина Y в A. baumannii ATCC 17978 после обработки MIC TC и EG, как измерено по интенсивности флуоресценции. A. baumannii ATCC 17978 добавляли MIC TC / EG и инкубировали в течение 5 часов при 37 ° C. Флуоресценцию (возбуждение 530 нм и испускание 645 нм) измеряли после добавления пиронина Y (5 мг / л). Обработки с * значительно отличаются от PBS (контроль) ( P <0.05). РИСУНОК 5. Влияние TC и EG на гены устойчивости к антибиотикам у A. baumannii 17978. (A) A. baumannii 17978 выращивали с использованием SIC TC / EG отдельно или в комбинации с амоксициллином. , и RT-qPCR была проведена, чтобы проверить влияние лечения на основные гены антибиотиков у A. baumannii. Бактерии, подвергшиеся воздействию только амоксициллина, и бактерии, не подвергавшиеся никакому лечению, служили контролем. Столбики с * существенно отличаются от контроля ( P <0.05). (B) A. baumannii 17978 обрабатывали SIC TC / EG либо отдельно, либо в комбинации с ампициллином, и проводили RT-qPCR, чтобы проверить влияние обработок на основные гены антибиотиков в A. baumannii. Бактерии, подвергшиеся воздействию только ампициллина, и бактерии, не подвергавшиеся никаким обработкам, служили контролем. Столбики с * достоверно отличаются от контроля ( P <0,05). (C) A. baumannii 17978 обрабатывали SIC TC / EG отдельно или в комбинации с пиперациллином, а RT-qPCR выполняли для проверки влияния обработок на основные гены антибиотиков в A.baumannii. Бактерии, подвергшиеся воздействию одного пиперациллина, и бактерии, не подвергавшиеся никакому лечению, служили контролем. Столбики с * достоверно отличаются от контроля ( P <0,05). (D) A. baumannii 17978 обрабатывали SIC TC / EG либо отдельно, либо в комбинации с азтреонамом, и проводили RT-qPCR для проверки воздействия обработок на основные гены антибиотиков в A. baumannii. Бактерии, подвергшиеся воздействию только азтреонама, и бактерии, не подвергавшиеся никаким обработкам, служили контролем.Столбики с * достоверно отличаются от контроля ( P <0,05). (E) A. baumannii 17978 обрабатывали SIC TC / EG либо отдельно, либо в комбинации с меропенемом, и проводили RT-qPCR для проверки влияния обработок на основные гены антибиотиков в A. baumannii. Бактерии, подвергшиеся воздействию одного меропенема, и бактерии, не подвергавшиеся никаким обработкам, служили контролем. Столбики с * существенно отличаются от контроля ( P <0.05). (F) A. baumannii 17978 обрабатывали SIC TC / EG либо отдельно, либо в комбинации с пенициллином, и RT-qPCR выполняли для проверки воздействия обработок на основные гены антибиотиков в A. baumannii. Бактерии, подвергшиеся воздействию одного пенициллина, и бактерии, не подвергавшиеся никакому лечению, служили контролем. Столбики с * достоверно отличаются от контроля ( P <0,05). (G) A. baumannii 17978 обрабатывали SIC TC / EG либо отдельно, либо в комбинации с метициллином, а RT-qPCR проводили для проверки влияния обработок на основные гены антибиотиков в A.baumannii. Бактерии, подвергшиеся воздействию одного метициллина, и бактерии, не подвергавшиеся никакому лечению, служили контролем. Столбики с * достоверно отличаются от контроля ( P <0,05). Влияние семи антибиотиков и двух КПК и их комбинации на экспрессию различных генов устойчивости к антибиотикам у A. baumannii 17978 показано на рисунках 5A – G. Было замечено, что по сравнению с контролем экспрессия всех тестируемых генов была повышена ( P <0.05) после роста A. baumannii в присутствии антибиотиков. Однако TC значительно подавлял экспрессию основных генов, придающих устойчивость к β-лактамным антибиотикам по сравнению с контролем ( P <0,05). Гены, кодирующие эффлюкс-насос adeA и adeB , подавлялись в 6 и 9 раз соответственно. Более того, экспрессия генов, кодирующих β-лактамазу ( blaP ) и белок множественной лекарственной устойчивости ( mdrp ), снизилась примерно в 3 раза ( P <0.05). Подобно результатам, полученным с ТС, все гены устойчивости к антибиотикам подавлялись при воздействии EG по сравнению с контролем ( P <0,05). Экспрессия генов, кодирующих эффлюксные насосы, adeA и adeB была понижена в 3 и 14 раз, соответственно. Аналогично, blaP и mdrp также подавлялись в обоих штаммах ( P <0,05). Комбинация TC или EG с антибиотиками также приводила к подавлению регуляции большинства тестируемых генов ( P <0.05). Среди комбинаций TC или EG с семью антибиотиками комбинация, содержащая азтреонам, привела к значительному подавлению всех тестируемых генов по сравнению с контролем (рис. 5D). Комбинация EG с пиперациллином (рис. 5C) или пенициллином (рис. 5F) также значительно снизила экспрессию всех генов устойчивости к антибиотикам ( P <0,05). ОбсуждениеБыстрое появление устойчивости к антибиотикам у патогенных микроорганизмов, особенно к нескольким антибиотикам, стимулировало исследовательские усилия по открытию новых антибиотиков и разработке эффективных производных имеющихся в настоящее время антибиотиков.Однако никаких многообещающих антибиотиков не ведется, а скорость и сложность развития устойчивости у патогенов еще больше усугубили ситуацию. В свете этого был изучен потенциально жизнеспособный подход к снижению устойчивости бактерий к антибиотикам при развитии ингибиторов механизмов устойчивости у бактерий (Renau et al., 1999; Walsh and Fanning, 2008). Эта стратегия включает совместное введение антибиотика с «ингибитором», который противодействует механизму (ам) устойчивости бактерий, тем самым делая устойчивый патоген чувствительным к лекарству.Преимущество этого подхода заключается в том, что он позволяет продолжать использование существующих антибиотиков, для которых уже доступны подробные фармакологические и токсикологические данные. В этом отношении КПК представляют собой потенциальную естественную группу «ингибиторов» механизмов устойчивости бактерий к антибиотикам. Существует обширная литература по антимикробным свойствам различных растительных соединений в отношении широкого круга микроорганизмов (Burt, 2004; Upadhyay et al., 2014). Однако лишь несколько исследований изучали их влияние на устойчивость бактерий к антибиотикам, особенно у грамотрицательных бактерий (Gallucci et al., 2006; Чусри и др., 2009; Johny et al., 2010; Илич и др., 2014). В текущем исследовании и TC, и EG повысили чувствительность A. baumannii ко всем семи протестированным β-лактамным антибиотикам (рисунки 1, 2 и дополнительные рисунки 1, 2). Это очевидно из значительного сокращения количества бактерий, наблюдаемых в образцах, содержащих КПК и антибиотики, по сравнению с таковыми в обработках, содержащих каждый КПК или только антибиотик. Для определения их комбинаторного действия на бактерию обычно используется метод шахматной доски, проверяющий широкий диапазон концентраций двух противомикробных препаратов (Jayamani et al., 2017; Tharmalingam et al., 2018). Однако, поскольку наши предварительные исследования показали, что концентрации TC и EG ниже МИК не были значительно эффективны в повышении чувствительности A. baumannii к антибиотикам, мы не использовали анализ шахматной доски, а вместо этого протестировали комбинаторный эффект МИК растительных молекул. и антибиотики от возбудителя. Недавнее исследование также показало синергетический эффект Eucalyptus camaldulensis с полимиксином B против MDR Acinetobacter baumannii (Knezevic et al., 2016). В другом исследовании было обнаружено, что энрофлоксацин и корица обладают синергетическим действием против Salmonella enterica (Solarte et al., 2017). Кроме того, экстракты лекарственного растения Holarrhena antidysenterica с конессином повышали восприимчивость широко устойчивых к лекарствам A. baumannii к новобиоцину и рифампицину (Siriyong et al., 2016). Кроме того, ранее не сообщалось о цитотоксическом воздействии на эпителиальные клетки человека в тестируемых концентрациях с TC и EG (Amalaradjou et al., 2010; Каруматил и др., 2016). Более того, наши предыдущие исследования показали, что добавление в корм цыплят-бройлеров TC и EG (Kollanoor-Johny et al., 2012) и TC у мышей (Narayanan et al., 2017) в течение 10 дней не привело к какой-либо токсичности. Сообщалось, что A. baumannii проявляет устойчивость к β-лактамным антибиотикам за счет нескольких механизмов, включая продукцию β-лактамаз, изменения в пенициллин-связывающих белках (PBP), изменение структуры и количества белков порина, уменьшение мембран проницаемость и использование насосов оттока, которые выводят антибиотики из бактериальной клетки (Vila et al., 2007; Manchanda et al., 2010; Боннин и др., 2013; Tang et al., 2014). Более того, присутствие эффлюксных насосов и белков MDR в A. baumannii вносит значительный вклад как в внутреннюю, так и в приобретенную устойчивость к антибиотикам (Lomovskaya and Bostian, 2006). Геном A. baumannii кодирует широкий спектр систем оттока нескольких лекарственных препаратов, включая AdeABC, насос семейного типа с резистентностью-нодуляцией (RND) (Damier-Piolle et al., 2008; Wieczorek et al., 2008; Yoon et al. др., 2013; Сан и др., 2014). Субстраты для этого насоса включают бета-лактамы, аминогликозиды, эритромицин, хлорамфеникол, тетрациклин, фторхинолон, триметоприм и EtBr (Magnet et al., 2001; Higgins et al., 2004; Heritier et al., 2005; Peleg et al. , 2007). Трехкомпонентные структуры AdeABC включают слитый белок внутренней мембраны (AdeA), трансмембранный компонент (AdeB) и белок внешней мембраны (AdeC), при этом инактивация adeB приводит к потере функции насоса и множественной лекарственной устойчивости (Magnet et al. al., 2001). Чтобы определить, оказывают ли TC или EG ингибирующее действие на вышеупомянутые отводящие насосы в A. baumannii , был проведен анализ ингибирования оттока с EtBr и пиронином Y вместе с CCP, зарегистрированным ингибитором оттока (Magnet et al. ., 2001; Чусри и др., 2009). EtBr и пиронин Y являются известными субстратами для оттокных насосов AdeABC и AdeIJK, соответственно (Magnet et al., 2001; Damier-Piolle et al., 2008; Chusri et al., 2009; Xing et al., 2014). Как TC, так и EG приводили к ингибированию откачивающего насоса AdeABC в двух испытанных A.baumannii , о чем свидетельствует увеличение флуоресценции в обработанных образцах по сравнению с контролем PBS (рисунок 3 и дополнительный рисунок 3). Однако КПК не оказывали какого-либо ингибирующего эффекта на действие оттокного насоса AdeIJK в A. baumannii , о чем свидетельствует отсутствие разницы в единицах флуоресценции между контрольными образцами, обработанными КПК и PBS (рисунок 4 и дополнительный рисунок 4). . Точно так же результаты анализа поглощения NPN показали, что TC и EG не увеличивают A.baumannii , как видно из дополнительных рисунков 5, 6, где не наблюдалось увеличения флуоресценции у обработанных КПК A. baumannii по сравнению с образцами, обработанными ЭДТА, известным стабилизатором проницаемости внешней мембраны у грамотрицательных бактерии (Helander, Mattila-Sandholm, 2000; Alakomi et al., 2006). Эти результаты показывают, что TC и EG увеличивают чувствительность A. baumannii к тестируемым антибиотикам, по крайней мере частично, за счет ингибирования оттока, AdeABC. Для того, чтобы определить, оказывают ли TC или EG ингибирующее действие на какой-либо из генов устойчивости к антибиотикам, придающих устойчивость к β-лактамным антибиотикам у A. baumannii , мы провели RT-qPCR на мРНК, выделенной из A. baumannii после роста в наличие и отсутствие КПК. Результаты RT-qPCR показали, что TC и EG в сочетании с каждым антибиотиком или без него значительно подавляли экспрессию большинства генов, которые придают устойчивость к β-лактамным антибиотикам (рисунки 5A – G).Среди различных проверенных генов гены, кодирующие эффлюксные насосы, adeA и adeB , были максимально подавлены обоими КПК. Эти результаты согласуются с результатами анализа ингибирования откачивающей помпы EtBr и предполагают, что ТС и ЭГ повышали эффективность семи β-лактамных антибиотиков против A. baumannii , препятствуя различным механизмам резистентности, особенно тем, которые включают откачивающие насосы. ЗаключениеРезультаты этого исследования предполагают потенциальное использование TC и EG в сочетании с доступными в настоящее время β-лактамными антибиотиками для лечения MDR A.baumannii и может привести к разработке новых вариантов лечения с пониженной дозировкой антибиотиков. Тем не менее, прежде чем рекомендовать их клиническое использование, необходимы исследования эффективности на подходящих животных моделях. Авторские взносыKV является автором-корреспондентом и основным контактным лицом в процессе подачи, рецензирования и публикации рукописей. Работа велась под его руководством как главного исследователя. Он внес значительный вклад в разработку, составление, редактирование и интерпретацию данных.Рукопись отправляется с его окончательным одобрением для публикации. MN — автор заявки. DK и AK-J разработали исследование. DK и JG проводили эксперименты. DK и MN подготовили рукопись для подачи. Заявление о конфликте интересовАвторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Дополнительные материалыДополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fmicb.2018.01011/full#supplementary-material Список литературыЭбботт И., Серкейра Г. М., Бхуян С. и Пелег А. Ю. (2013). Устойчивость к карбапенемам в Acinetobacter baumannii : лабораторные проблемы, механистические идеи и терапевтические стратегии. Expert Rev. Anti. Заразить. Ther. 11, 395–409. DOI: 10.1586 / eri.13.21 PubMed Аннотация | CrossRef Полный текст | Google Scholar Адамс, М.Д., Гоглин, К., Molyneaux, N., Hujer, K.M, Lavender, H., Jamison, J.J., et al. (2008). Сравнительный анализ последовательности генома Acinetobacter baumannii с множественной лекарственной устойчивостью. J. Bacteriol. 190, 8053–8064. DOI: 10.1128 / JB.00834-08 PubMed Аннотация | CrossRef Полный текст | Google Scholar Аль Мобарак, М. Ф., Матбули, Р. М., Меир, Х., Аль Гехани, Н., Эль-Тухи, А. А. М., Аль Куреши, К. Ф. и др. (2014). Структура устойчивости к противомикробным препаратам среди Acinetobacter baumannii , выделенных из больницы им. Короля Абдулазиза, Джидда, Саудовская Аравия, четырехлетнее эпиднадзорное исследование (2010–2013). Египет. J. Med. Microbiol. 23, 53–60. DOI: 10.12816 / 0025920 CrossRef Полный текст | Google Scholar Алакоми, Х. Л., Паананен, А., Суйко, М. Л., Хеландер, И. М., и Саарела, М. (2006). Ослабление действия пермеабилизаторов клеток на грамотрицательные бактерии с помощью биодестерирования. заявл. Environ. Microbiol. 72, 4695–4703. DOI: 10.1128 / AEM.00142-06 PubMed Аннотация | CrossRef Полный текст | Google Scholar Амалараджу, М.А.Р., Нараянан, А., Баскаран, С.А., Венкитанараян, К. (2010). Антибиотикопленочный эффект транс-коричного альдегида на уропатогенные бактерии Escherichia coli . J. Urol. 184, 358–363. DOI: 10.1016 / j.juro.2010.03.006 PubMed Аннотация | CrossRef Полный текст | Google Scholar Амалараджу, М.А.Р., и Венкитанараянан, К. (2011). Влияние транс-коричного альдегида на снижение устойчивости Cronobacter sakazakii к стрессам окружающей среды. Патогенный микроорганизм пищевого происхождения. Dis. 8, 403–409.DOI: 10.1089 / fpd.2010.0691 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бассетти, М., Риги, Э., Эспозито, С., Петросилло, Н., и Николини, Л. (2008). Медикаментозное лечение инфекций Acinetobacter baumannii с множественной лекарственной устойчивостью. Future Microbiol. 3, 649–660. DOI: 10.2217 / 17460913.3.6.649 PubMed Аннотация | CrossRef Полный текст | Google Scholar Боннин Р. А., Нордманн П. и Пуарель Л. (2013). Скрининг и расшифровка устойчивости к антибиотикам у Acinetobacter baumannii : современное состояние. Expert Rev. Anti. Заразить. Ther. 11, 571–583. DOI: 10.1586 / eri.13.38 PubMed Аннотация | CrossRef Полный текст | Google Scholar Bookout, A. L., and Mangelsdorf, D. J. (2003). Протокол количественной ПЦР в реальном времени для анализа сигнальных путей ядерных рецепторов. Nucl. Прием. Сигнал. 1, 1–7. DOI: 10.1621 / nrs.01012 PubMed Аннотация | CrossRef Полный текст | Google Scholar Берт, С. (2004). Эфирные масла: их антибактериальные свойства и потенциальное применение в пищевых продуктах — обзор. Внутр. J. Food Microbiol. 94, 223–253. DOI: 10.1016 / j.ijfoodmicro.2004.03.022 PubMed Аннотация | CrossRef Полный текст | Google Scholar Цай, Ю., Чай, Д., Ван, Р., Лян, Б., и Бай, Н. (2012). Устойчивость к колистину Acinetobacter baumannii : клинические отчеты, механизмы и противомикробные стратегии. J. Antimicrob. Chemother. 67, 1607–1615. DOI: 10.1093 / jac / dks084 PubMed Аннотация | CrossRef Полный текст | Google Scholar Центры по контролю и профилактике заболеваний [CDC] (2004).Инфекции, вызванные Acinetobacter baumannii, среди пациентов военных медицинских учреждений, занимающихся лечением раненых военнослужащих США, 2002–2004 гг. Morb. Mortal Wkly. Реп. 53, k1063–1066. Google Scholar Чусри, С., Вильянуэва, И., Воравутикунчай, С. П., и Дэвис, Дж. (2009). Повышение активности антибиотиков: стратегия борьбы с инфекциями Acinetobacter. J. Antimicrob. Chemother. 64, 1203–1211. DOI: 10.1093 / jac / dkp381 PubMed Аннотация | CrossRef Полный текст | Google Scholar Коуэн, М.М. (1999). Растительные продукты как противомикробные средства. Clin. Microbiol. Ред. 12, 564–582. Google Scholar Damier-Piolle, L., Magnet, S., Bremont, S., Lambert, T., and Courvalin, P. (2008). AdeIJK, насос деления резистентности-клубеньков, выводящий множество антибиотиков в Acinetobacter baumannii. Антимикробный. Агенты Chemother. 52, 557–562. DOI: 10.1128 / AAC.00732-07 PubMed Аннотация | CrossRef Полный текст | Google Scholar Дои, Ю., Хусейн, С., Потоски, Б.А., МакКарри, К.Р., и Патерсон, Д.Л. (2009). Acinetobacter baumannii с широкой лекарственной устойчивостью. Emerg. Заразить. Болезни 15, 980–982. DOI: 10.3201 / eid1506.081006 PubMed Аннотация | CrossRef Полный текст | Google Scholar Дуарте, А., Феррейра, С., Сильва, Ф., и Домингес, Ф. К. (2012). Синергетическая активность кориандрового масла и традиционных антибиотиков против Acinetobacter baumannii. Фитомедицина 19, 236–238. DOI: 10.1016 / j.phymed.2011.11.010 PubMed Аннотация | CrossRef Полный текст | Google Scholar Эллис, Д., Коэн, Б., Лю, Дж., И Ларсон, Э. (2015). Факторы риска госпитальной устойчивой к противомикробным препаратам инфекции, вызываемой Acinetobacter baumannii : antimicrob. Resist. Заразить. Контроль. 4, 1–5. DOI: 10.1186 / s13756-015-0083-2 PubMed Аннотация | CrossRef Полный текст | Google Scholar Espinal, P., Marti, S., and Vila, J. (2012). Влияние образования биопленок на выживаемость Acinetobacter baumannii на сухих поверхностях. J. Hosp. Заразить. 80, 56–60. DOI: 10.1016 / j.jhin.2011.08.013 PubMed Аннотация | CrossRef Полный текст | Google Scholar Эстерли, Дж. С., Гриффит, М., Ци, К., Мальчински, М., Постельник, М. Дж., И Шитц, М. Х. (2011). Влияние устойчивости к карбапенемам и активной антимикробной терапии на клинические исходы инфекций кровотока Acinetobacter baumannii . Антимикробный. Агенты Chemother. 55, 4844–4849. DOI: 10.1128 / AAC.01728-10 PubMed Аннотация | CrossRef Полный текст | Google Scholar Фалагас, М.Е., Колец, П. К., Близиотис, И. А. (2006). Разнообразие определений множественной лекарственной устойчивости (МЛУ) и устойчивости к пандемиям (PDR) Acinetobacter baumannii и Pseudomonas aeruginosa. J. Med. Microbiol. 55, 1619–1629. DOI: 10.1099 / jmm.0.46747-0 PubMed Аннотация | CrossRef Полный текст | Google Scholar Фонсека, Э. Л., Шайдеггер, Э., Фрейтас, Ф. С., Чиприано, Р., Висенте, А. С. (2013). Карбапенем-резистентный Acinetobacter baumannii из Бразилии: роль экспрессии аллелей carO и гена blaOXA-23. BMC Microbiol. 13: 245. DOI: 10.1186 / 1471-2180-13-245 PubMed Аннотация | CrossRef Полный текст | Google Scholar Галуччи, Н., Касеро, К., Олива, М., Зигадло, Дж., И Демо, М. (2006). Взаимодействие терпенов и пенициллина на штаммах бактерий, устойчивых к бета-лактамным антибиотикам. Мол. Med. Chem. 10, 30–32. Google Scholar Гарначо-Монтеро, Дж., И Амайя-Виллар, Р. (2010). Мультирезистентные инфекции Acinetobacter baumannii : эпидемиология и лечение. Curr Opin Infect Dis. 23, 332–339. DOI: 10.1097 / QCO.0b013e32833ae38b PubMed Аннотация | CrossRef Полный текст | Google Scholar Джамареллу, Х., Антониаду, А., и Канеллакопулу, К. (2008). Acinetobacter baumannii : универсальная угроза общественному здоровью? Внутр. J. Antimicrob. Агенты 32, 106–119. DOI: 10.1016 / j.ijantimicag.2008.02.013 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хеландер, И.М., и Маттила-Сандхольм, Т. (2000). Флуорометрическая оценка проницаемости грамотрицательных бактерий. J. Appl. Microbiol. 88, 213–219. DOI: 10.1046 / j.1365-2672.2000.00971.x PubMed Аннотация | CrossRef Полный текст | Google Scholar Heritier, C., Poirel, L., Lambert, T., and Nordmann, P. (2005). Вклад приобретенных карбапенем-гидролизующих оксациллиназ в устойчивость к карбапенемам у Acinetobacter baumannii. Антимикробный. Агенты Chemother. 49, 3198–3202.DOI: 10.1128 / AAC.49.8.3198-3202.2005 PubMed Аннотация | CrossRef Полный текст | Google Scholar Эрнан, Р. К., Карина, Б., Габриэла, Г., Марсела, Н., Карлос, В., и Анджела, Ф. (2009). Селекция колистин-устойчивых изолятов Acinetobacter baumannii при постнейрохирургическом менингите в отделении интенсивной терапии с высокой гетерорезистентностью к колистину. Диагн. Microbiol. Заразить. Dis. 65, 188–191. DOI: 10.1016 / j.diagmicrobio.2009.05.019 PubMed Аннотация | CrossRef Полный текст | Google Scholar Хиггинс П.Г., Висплингхофф, Х., Стефаник, Д., и Зейферт, Х. (2004). Отбор мутаций топоизомеразы и сверхэкспрессия транскриптов мРНК adeB во время вспышки Acinetobacter baumannii. J. Antimicrob. Chemother. 54, 821–823. DOI: 10.1093 / jac / dkh527 PubMed A Использование, резистентность и побочные эффектыАнтибиотики, также известные как антибактериальные средства, — это лекарства, которые уничтожают или замедляют рост бактерий. Они включают в себя ряд сильнодействующих лекарств и используются для лечения заболеваний, вызванных бактериями. Антибиотики не могут лечить вирусные инфекции, такие как простуда, грипп и большинство видов кашля. В этой статье объясняется, что такое антибиотики, как они действуют, возможные побочные эффекты и устойчивость к антибиотикам. Краткие сведения об антибиотиках
Поделиться на PinterestАнтибиотики — это распространенные лекарства, которые врачи назначают для борьбы с бактериями. Антибиотики — это мощные лекарства, которые борются с определенными инфекциями и могут спасти жизни при правильном применении. Они либо останавливают размножение бактерий, либо уничтожают их. Прежде чем бактерии смогут размножиться и вызвать симптомы, иммунная система обычно убивает их. Лейкоциты (лейкоциты) атакуют вредные бактерии, и даже если симптомы действительно возникают, иммунная система обычно может справиться и бороться с инфекцией. Иногда, однако, количество вредных бактерий чрезмерно, и иммунная система не может бороться со всеми ними. В этом случае полезны антибиотики. Первым антибиотиком был пенициллин. Антибиотики на основе пенициллина, такие как ампициллин, амоксициллин и пенициллин G, по-прежнему доступны для лечения различных инфекций и используются уже давно. Доступно несколько типов современных антибиотиков, и в большинстве стран они обычно отпускаются только по рецепту.Антибиотики для местного применения доступны в виде кремов и мазей, отпускаемых без рецепта. Некоторые медицинские работники опасаются чрезмерного употребления антибиотиков. Они также считают, что такое чрезмерное использование способствует увеличению числа бактериальных инфекций, которые становятся устойчивыми к антибактериальным препаратам. По данным Центров по контролю за заболеваниями (CDC), чрезмерное использование антибиотиков в амбулаторных условиях представляет собой особую проблему. В некоторых регионах, например, на Юго-Востоке, использование антибиотиков выше. Использование карбапенемов, основного класса антибиотиков последней линии, значительно увеличилось с 2007 по 2010 год. Александр Флеминг, выступая в своей речи о вручении Нобелевской премии в 1945 году, сказал:
Как и предсказал человек, открывший первый антибиотик почти 70 лет назад, устойчивость к лекарствам становится обычным явлением. Существуют различные типы антибиотиков, которые действуют одним из двух способов:
Врач прописывает антибиотики для лечения бактериальной инфекции. Он не эффективен против вирусов. Знать, является ли инфекция бактериальной или вирусной, помогает эффективно ее лечить. Вирусы вызывают большинство инфекций верхних дыхательных путей (ИВДП), таких как простуда и грипп. Антибиотики не действуют против этих вирусов. Если люди злоупотребляют антибиотиками или используют их неправильно, бактерии могут стать устойчивыми. Это означает, что антибиотик становится менее эффективным против этого типа бактерий, так как бактерия смогла улучшить свою защиту. Врач может назначить антибиотик широкого спектра действия для лечения широкого спектра инфекций.Антибиотик узкого спектра действия эффективен только против некоторых видов бактерий. Некоторые антибиотики атакуют аэробные бактерии, а другие действуют против анаэробных бактерий. Aerobic ba Распространенность и характеристика бета-лактамаз расширенного спектра, продуцирующих Enterobacteriaceae, у здоровых детей и связанные с ними факторы риска1 DOI / s Annals of Clinical Microbiology and Antimicrobials RESEARCH Открытый доступ Распространенность и характеристика бета-лактамаз расширенного спектра, продуцирующих Enterobacteriaceae, у здоровых детей и связанные с ними факторы риска S.М. Хиджази 1 *, М. А. Фаузи 2, Ф. М. Али 3 и К. Х. Абд Эль Галил 1,4 Аннотация: увеличилось количество внебольничных инфекций, вызванных энтеробактериями, продуцирующими бета-лактамазы расширенного спектра (ESBL-PE). Фекальная флора детей в сообществе представляет собой огромный потенциальный резервуар для ESBL, которые расположены на высокотрансмиссивных плазмидах. В этом исследовании изучали распространенность фекального носительства БЛРС-ПЭ, характер чувствительности к противомикробным препаратам, возможные факторы риска и охарактеризовали гены, кодирующие эти ферменты БЛРС в детском сообществе Ливана.Методы. Всего было взято 125 ректальных мазков у здоровых детей в возрасте от 1 до 5 лет. Обнаружение ESBL проводили с использованием метода комбинированного диска и мультиплексной ПЦР. Была проиллюстрирована анкета относительно образа жизни ребенка и факторов риска носительства БЛРС. Результаты. Тридцать один из 125 участников (24,8%) имели БЛРС-ПЭ. Регулярное потребление мяса и курицы было значимо связано с высоким уровнем носительства ESBL-PE, в то время как связь молочных продуктов (молоко, йогурт, сыр) была незначительной.Было обнаружено, что привычки к интимной гигиене также влияют на скорость носительства. Множественные гены bla были наиболее распространенными, 48,4% (15/31) ESBL-PE несли как bla CTX-M, так и bla TEM, и 22,6% (7/31) несли bla CTX-M, bla SHV и bla TEM, 29% (9) имели только bla CTX-M. Что касается типов CTX-M, CTX-M-9 был наиболее преобладающим (24/31) и в основном в сочетании с типом CTX-M-15. Заключение. Наблюдалась высокая скорость колонизации у здоровых детей БЛРС-ПЭ, регулярное употребление пищевых продуктов животного происхождения (мясо или курица) было связано с этой колонизацией в обществе у детей, не госпитализированных.Насколько нам известно, это первое исследование, посвященное регулярному потреблению молочных продуктов как фактору риска носительства ESBL-PE в сообществе, первые данные о частоте носительства ESBL-PE среди детей в сообществе в Ливане и на Ближнем Востоке, а также для широкого круга лиц. распространение CTX-M-9 типа в этой популяции. Ключевые слова: бета-лактамаза расширенного спектра, дети, ТЕА, SHV, CTX-M, CTX-9, молочные продукты, мясо, Ливан. Предпосылки. Энтеробактерии, несущие бета-лактамазы расширенного спектра (БЛРС), оказались значительными патогенами.Такие штаммы устойчивы к нескольким антимикробным препаратам, и их трудно лечить, поскольку они являются терапевтическими вариантами * Переписка: 1 Кафедра фармацевтических наук (фармацевтическая микробиология), фармацевтический факультет Бейрутского арабского университета, Бейрут, Ливан Полный список сведений об авторах приведен доступных в конце статьи немного [1]. Устойчивость к β-лактамам у Enterobacteriaceae в первую очередь связана с опосредованным β-лактамазами гидролизом антибиотиков; в то время как измененная экспрессия насосов оттока и / или поринов играет лишь второстепенную роль (2).В зависимости от специфики субстрата; Семейство β-лактамаз делится на четыре функциональные группы: пенициллиназы, БЛРС, карбапенемазы и цефалоспориназы AmpC-типа [2]. Из них БЛРС, которые могут гидролизовать практически все пенициллины и цефалоспорины, включая цефалоспорины расширенного спектра, такие как цефотаксим или цефтазидим, составляют 2016 Hijazi et al. Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 (которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе, при условии, что вы укажете соответствующую ссылку на оригинального автора (авторов) и источник, предоставите ссылку на Лицензия Creative Commons и укажите, были ли внесены изменения.Отказ Creative Commons Public Domain Dedication (publicdomain / zero / 1.0 /) распространяется на данные, представленные в этой статье, если не указано иное. 2 Страница 2 из 9 самая большая и наиболее распространенная группа ферментов [3]. Многие продуценты БЛРС обладают множественной устойчивостью к не-β-лактамным антибиотикам, включая фторхинолоны и аминогликозиды [4], триметоприм, тетрациклины, сульфаниламиды и хлорамфеникол, а также к аминогликозидам, и это часто кодируется теми же плазмидами, которые определяют БЛРС [4]. 5].Следовательно, эффективная антибиотикотерапия для лечения этих инфекций ограничивается небольшим количеством лекарств [6], таких как карбапенемы, что увеличивает вероятность устойчивости к карбапенемам среди Enterobacteriaceae. Основное беспокойство вызывает сосуществование множества генов БЛРС, карбапенемаз и других детерминант устойчивости к антибиотикам на мобильных элементах, что может привести к появлению организмов с устойчивостью ко всем антибиотикам [2]. Быстрое распространение изолятов Escherichia coli и Klebsiella pneumoniae, продуцирующих БЛРС, широко в сообществе, привело к возникновению как местных, так и связанных с больницей инфекций во всем мире [7].Более 200 типов БЛРС были описаны у различных видов семейства Enterobacteriaceae и других неинтеральных организмов, включая Pseudomonas aeruginosa и Acinetobacter spp. Эти организмы продуцируют варианты β-лактамаз ТЕМ, SHV и CTX-M [8]. Β-лактамазы TEM- и SHV-типа, в основном продуцируемые K. pneumoniae, распространились по больницам, а ферменты CTX-M, в основном продуцируемые E. coli, стали преобладающими в обществе [9]. Ферменты CTX-M были открыты в 1989 году [10], но они не стали преобладающими над другими ферментами БЛРС до первого десятилетия двадцать первого века, в течение которого наблюдалось необычайное распространение этих ферментов [11] как в больнице, так и в обществе. настройки [12].Ген bla CTX-M-15 обнаружен в основном у Enterobacteriaceae и был недавно назван плазмидами устойчивости, ответственными за вспышку, из-за их способности приобретать гены устойчивости и переноситься между бактериями [13]. Таким образом, сообщество может представлять собой резервуар для ESBL, не обнаруженных в клинических изолятах [14]. Большинство данных о распространенности, факторах риска и молекулярных характеристиках организмов, продуцирующих БЛРС, получены из исследований у взрослых пациентов как в больницах, так и в общинах, или из исследований, ограниченных госпитализированными младенцами [15], только немного данных доступно относительно здоровых педиатрических популяций.Крайне важно лучше определить распространенность, фактор риска и молекулярную характеристику организма, продуцирующего БЛРС, переносимого детьми, чтобы принять передовые меры инфекционного контроля и помочь в соответствующем выборе эмпирического охвата антимикробными препаратами для инфекций в этих группах населения. Целью данного исследования является изучение распространенности и предрасполагающих факторов кишечного носительства энтеробактерий, продуцирующих ESBL (ESBL-PE), среди детей ливанского сообщества и определение молекулярной характеристики генов устойчивости (bla TEM, bla CTX, bla SHV, bla CTX-M-2, bla CTX-M-9 и bla CTX-M-15).Методы. Этичное разрешение. Протоколы исследования были одобрены Комитетом институционального наблюдательного совета Бейрутского арабского университета. Письменное информированное согласие было получено от всех родителей пациентов (по крайней мере, от одного родителя каждого ребенка) до включения в исследование. Выборочная популяция и анкета Исследование проводилось с января по май 2013 года в трех разных педиатрических клиниках Ливана. Для этого исследования были выбраны всего 125 здоровых детей в возрасте от 1 до 5 лет, поступающих на вакцинацию или общий осмотр.Однако дети, которые лечились антибиотиками в течение 5 дней до даты включения, были исключены из этого исследования. Для каждого участника заполнялся вопросник, касающийся имени, возраста, пола, истории болезни (предыдущий прием антибиотиков или антацидов, предыдущая госпитализация), диетических привычек (потребление молока, йогурта, сыра, мяса или курицы) и привычек интимной гигиены. Выделение бактерий, обнаружение и подтверждение БЛРС. Ректальные мазки брали стерильными тампонами, смоченными стерильным физиологическим раствором, и немедленно высевали на чашки с агаром МакКонки (Oxoid, Великобритания) с добавлением цефтазидима 2 мг / л (использовали в течение 5 дней после приготовления), инкубировали при 37 C в течение 24 часов.Когда образец показал положительный рост на селективной среде, для последующей характеристики отбирали по крайней мере три колонии плюс каждый отдельный морфотип. Идентификацию бактерий выполняли с помощью окрашивания по Граму, биохимического тестирования (индол, метиловый красный, vogus-prauskaur, цитрат и уреаза) и системы API 20E (biomerieux, marcy l Etoile, Франция). Сначала изоляты были проверены на продукцию БЛРС с использованием цефтазидима, цефепима, цефотаксима, цефподоксима, цефтриаксона и азтреонама (Oxoid Ltd, Бейзингстон, Великобритания), а затем был проведен фенотипический подтверждающий тест с использованием синергии двойного диска и метода комбинированных дисков по Мюллеру Агар Хинтона с использованием цефтазидима, цефтазидим-клавулановой кислоты, цефотаксима и цефотаксим-клавулановой кислоты.Считалось, что микроорганизмы продуцируют БЛРС при увеличении на 5 мм диаметра зоны для любого противомикробного агента, испытанного в комбинации с клавулановой кислотой, по сравнению с диаметром зоны агента при испытании отдельно [16]. Затем был проведен молекулярный анализ всех проверенных положительных изолятов. 3 Страница 3 из 9 Тестирование на чувствительность к противомикробным препаратам Тесты на чувствительность к противомикробным препаратам всех продуцентов БЛРС были исследованы методом диффузии в агар в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) [16].Диск с антибиотиками (Oxoid Ltd, Бейзингстон, Великобритания): цефепим 30 мкг, азтреонам 30 мкг, имипенем 10 мкг, меропенем 10 мкг, гентамицин 10 мкг, амикацин 30 мкг, тетрациклин 30 мкг, ципрофлоксацин 5 мкг, норфлоксацин 5 мкг, левофлокс. , 30 мкг налидиксовой кислоты, 12,5 / 23,75 мкг триметоприм-сульфаметоксазола и 75 мкг тикарциллина были использованы для определения структур устойчивости собранных изолятов. Характеристика генов, кодирующих ESBL. Были выполнены две стандартные мультиплексные ПЦР, первая для обнаружения генов TEM, SHV, CTX-M, а вторая — для обнаружения CTX-M-2, CTX-M-9, CTX-M-15. кодирующие гены.Неочищенную геномную ДНК экстрагировали из изолятов тепловым лизисом. Вкратце, одну чистую колонию суспендировали в 40 мкл стерильной дистиллированной воды, и клетки лизировали путем нагревания при 95 ° C в течение 5 минут. Для первой мультиплексной ПЦР использовали подходящие праймеры (Sigma-Aldrich) [17], нацеленные на каждую выбранную область, bla TEM, bla SHV и bla CTX-M (таблица 1). Реакции амплификации выполняли в объеме 25 мкл, в котором 12,5 мкл реакционного буфера Master Mix 2 (Thermo Scientific) для ПЦР, содержащего 0,05 Taq ДНК-полимеразы, 4 мМ мк / мкл MgCl2, 0,0.4 мм каждой смеси дезоксинуклеозидтрифосфатов dntp (datp, dctp, dgtp и dttp) смешивали с 12,5 мкл ДНК, праймерами и H 2 O следующим образом; 0,5 мкл TEM F, 0,5 мкл TEM R, по 1 мкл каждого оставшегося праймера (SHV, CTX-M) (10 мкм / мкл), 2,5 мкл H 2 O и 5 мкл матричной ДНК. Реакции проводили в термоциклере ДНК (BIOER) в следующих условиях: денатурация при 94 ° C в течение 5 минут, затем 30 циклов при 94 ° C в течение 20 секунд, 61 ° C в течение 30 секунд и 72 ° C в течение 1 минуты с окончательным продлением 72 ° C в течение 5 мин [18].Для второй мультиплексной ПЦР были использованы подходящие праймеры, каждый из которых нацелен на выбранную область bla CTX-M-2, bla CTX-M-9 и bla CTX-M-15 [17] (таблица 2). Реакции проводили в термоциклере ДНК с использованием следующей таблицы 1 Праймеры для генов bla TEM, bla SHV и bla CTX-M, использованные в этом исследовании Праймеры Последовательность праймеров от 5 до 3 Размер (п.н.) TEM F TEM R SHV F SHV R CTX F CTX R AGT GCT GCC ATA ACC ATG AGT G CTG ACT CCC CGT CGT GTA GAT A GAT GAA CGC TTT CCC ATG ATG CGC TGT TAT CGC TCA TGG TAA ATG TGC AGY ACC AGT AAR GT TGG GTR AAR TAR GTS ACC Таблица 2 Праймеры для генов bla CTX-M-2, bla CTX-M-9 и bla CTX-M-15, использованные в этом исследовании Праймеры Последовательность праймеров от 5 до 3 Размер (п.о.) CTX-M-2 F CTX-M-2 R CTX-M-9 F CTX-M-9 R CTX-M-15 F CTX-M-15 R AAA CAG AGC GAG AGC GAT AAG GGG TAA AGT AGG TCA CCA GAA C GGA TTA ACC GTA TTG GGA GTT T GAT ACC GCA GAT AAT ACG CAG G CAC GTC AAT GGG ACG ATG T GAA AGG CAA TAC CAC CGG T условия: денатурация при 94 ° C в течение 5 минут с последующими 30 циклами при 94 ° C в течение 15 секунд, 56 ° C в течение 15 секунд и 72 ° C в течение 45 с с окончательным удлинением 72 ° C в течение 5 мин.После амплификации ПЦР 2,5 мкл каждой реакции разделяли электрофорезом в 1,5% агарозном геле в течение 30 мин при 100 В в буфере 0,5 TBE. ДНК окрашивали бромидом этидия (1 мкг / мл), и полосы детектировали с использованием УФ-трансиллюминатора (Cleaver Scientific Ltd). Статистический анализ. Данные были проанализированы с использованием критерия χ 2 с поправкой Йейтса. Тест хи-квадрат был проведен для установления статистической разницы в пропорциях для категориальных данных. Статистическая значимость была установлена как значения P <0.05 с доверительным интервалом 95%. Для многомерного логистического регрессионного анализа двумя независимыми переменными были молочные продукты и мясо. Для молочных продуктов данные учитывались для потребителей любого из молочных продуктов (молока, йогурта или сыра). Для мяса переменные данные были рассчитаны для потребителя либо для мяса животных, либо для курицы в совокупности как мяса. Носительство ESBL-PE было зависимой переменной. Статистический анализ выполняли с помощью программы Minitab (статистическое программное обеспечение Minitab 14, Пенсильвания, США) и программы Статистический пакет для социальных наук (SPSS, версия 20) (IBM, Армонк, Нью-Йорк).Результаты. Распространенность ESBL PE. В этом исследовании приняли участие сто двадцать пять субъектов, 63 (50,4%) женщины и 62 (49,6%) мужчины в возрасте от 1 до 5 лет. Из этих участников 31 (24,8%), как показано в таблице 3, были носителями ESBL-PE. Самцы имели более высокую частоту колонизации (33,9%), чем самки (15,9%) (P = 0,09). Факторы, связанные с носительством ESBL PE. Субъекты, которые принимали антибиотики или антациды в течение последних 8 недель, имели более высокий уровень носительства ESBL-PE, чем их коллеги (таблица 3), хотя между этими переменными не было значительных различий, в то время как субъекты допускались к 4 Страница 4 из 9 Таблица 3 Факторы, связанные с фекальным носительством ESBL-PE у здоровых детей в ливанской общине Характеристика Всего N (%) ESBL + N (%) ESBL N (%) 125 (100%) 31 (24.8%) 94 (75,2%) Значение P Пол Мужской 62 (49,6%) 21 (67,7%) 41 (43,6%) Женский 63 (50,4%) 10 (32,3%) 53 (56,4%) Принимали антибиотики в течение последних 8 недель Да 56 (44,8%) 18 (58,1%) 38 (40,41%) Нет 69 (55,2%) 13 (41,9%) 56 (59,6%) Госпитализация за последние 12 месяцев Да 23 (18,4%) 10 (32,3%) 13 ( 13,8%) Нет 102 (81,6%) 21 (67,7%) 81 (86,2%) Принимали антацидные препараты в течение последних 8 недель Да 11 (8,8%) 5 (16,1%) 6 (6,4%) Нет 114 (91,2%) 26 ( 83,9%) 88 (93,6%) Пьет молоко регулярно * 75 (60%) 25 (80.или никогда 50 (40%) 6 (19,4%) 44 (46,8%) Пить или есть йогурт Регулярно 77 (61,6%) 23 (74,2%) 54 (57,4%) Редко или никогда 48 (38,4%) 8 (25,8%) 40 (42,6%) Есть сыр Регулярно 74 (59,2%) 23 (74,2%) 51 (54,3%) Редко или никогда 51 (40,8%) 8 (25,8%) 43 (45,7%) Мясо 0,02 Регулярно 56 (44,8%) 19 (61,3%) 37 (39,4%) Редко или никогда 69 (55,2%) 12 (38,7%) 57 (60,6%) Есть курица 0,03 Регулярно 58 (46,6%) 19 (61,3%) 39 (41,5%) Редко или никогда 67 (53,6%) 12 (38,7%) 55 (58,5%) Привычка к интимной гигиене 0.Редко: считалось, что госпитализация проводилась 2 раза или реже в неделю в течение последних 12 месяцев, была достоверно связана с высоким уровнем носительства 43,5% (10/23), чем их аналоги 20,6% (21/102) с P = (Таблица 3). Однофакторный и многомерный логистический регрессионный анализ проводился для проверки регулярного потребления (3 раза в неделю и более) молока, йогурта, сыра, курицы или мяса и носительства ESBL-PE. Как видно из таблицы 3, одномерный анализ для каждого предиктора выявил значительное влияние (P <0.05) для регулярного употребления молока, йогурта, сыра, мяса или курицы. Однако многомерный логистический регрессионный анализ (таблица 4) не смог выявить какие-либо из этих диетических продуктов, потребляемых в качестве предиктора носительства ESBL-PE. Чтобы определить тип пищи как молочные продукты или мясо (мясо или курицу) в качестве прогностического фактора, анализ показал, что мясо и курица являются значимыми (P <0,02) прогностическими факторами для носительства ESBL-PE, в то время как влияние молочных продуктов было незначительным (P> 0.2) (таблица 5). Что касается интимной гигиены, участник, который умывается водой или водой с мылом, а затем сушит салфеткой, имеет более низкий коэффициент выноса ESBL-PE 20.3% (15/74) по сравнению. 5 Стр. 5 из 9 Таблица 4 Оценки параметров для многомерной логистической регрессии различных типов продуктов питания в качестве предикторов для носительства ESBL-PE Тип продукта P значение ИЛИ 95% доверительный интервал для ИЛИ Молочный йогурт с нижней границей Сыр Мясо Курица Верхний предел% восприимчивых изолятов ESBL-PE ИЛИ, отношение шансов постоянного потребителя пищи по сравнению с редким или непотребителем для положительного результата на ESBL-PE по сравнению с отрицательным Таблица 5 Оценки параметров для многомерной логистической регрессии молочных продуктов или мяса и курица в качестве предикторов для значения P носительства ESBL-PE ИЛИ 95% ДИ для ИЛИ Меньшее OR, отношение шансов постоянного потребителя пищи по сравнению с редким или непотребителем для положительного ESBL-PE по сравнению с отрицательным верхним молочным мясом / курицей до 31.4% (16/51) для тех, кто использовал только сухие салфетки или салфетки с P = 0,07, OR 1,8, 95% CI для OR (Таблица 3). Было обнаружено, что участник, который пользовался общим туалетом (пользовался общественным туалетом), имел 18,4% (7/38) процент перевозки по сравнению с 27,6% (24/87) для тех, кто не пользовался общим туалетом, и это было статистически незначимым. Данные о чувствительности к антибиотикам. Все изоляты были устойчивы к азетреонаму, цефепиму, цефподоксиму и тикарциллину. 100% были чувствительны к имипенему и меропенему, тогда как 93,5 и 54.8% были чувствительны к амикацину и гентамицину соответственно. Чувствительность к исследуемым хинолонам (левофлоксацин, ципрофлоксацин) составляла 61,3%. Кроме того, 41,9, 32,3 и 35,5% изолятов были чувствительны к тетрациклину, триметоприм-сульфаметоксазолу и налидиксовой кислоте соответственно (рис. 1). bla-генный состав PE ESBL. Молекулярная характеристика 31 ESBL-PE среди педиатрических изолятов показала, что множественные генные продуценты были наиболее преобладающими 71% (22/31), тогда как CTX-M тип был продуцирован всеми изолятами (31/31).Из 31 изолята, продуцирующего CTX-M, 48,4% (15/31) совместно продуцировали TEM, 22,6% (7/31) совместно продуцировали SHV и TEM, и 29% (9/31) продуцировали только гены CTX-M (Рис. 2). Рис.1 Чувствительность к противомикробным препаратам для 31 ESBL-PE, переносимого здоровыми ливанскими детьми. Большинство изолятов ESBL-PE, выделенных в ходе исследования, были E. coli (n = 25), K. pneumoniae (n = 3), Klebsiella oxytoca (n = 1) и Enterobacter cloacae (n = 2) (рис. 3). Пятьдесят шесть процентов изолированных E. coli содержали гены bla CTX-M и bla TEM, 28% содержали только ген bla CTX-M и 16% содержали гены bla CTX-M, bla TEM и bla SHV.Все изоляты K. pneumonia несли гены bla CTX-M, bla TEM и bla SHV, причем один изолированный E. cloacae содержал ген bla CTX-M, а другой выделенный один содержал гены bla CTX-M и bla TEM. Молекулярная характеристика изолятов 31ESBL-PE, несущих bla CTX-M, с использованием специфических праймеров для CTX-M-2, CTX-M-9 и CTX-M-15, показала, что тип CTX-M-9 был наиболее распространенным 77,4 % (24/31), за которыми следуют типы CTX-M-15 [61,3% (19/31)] и CTX-M-2 [29% (9/31)] (рис. 4). Из этих 24 производителей CTX-M-9 только 33.3% (8/24) изолятов продуцировали только CTX-M-9-тип, а другие изоляты были сопродюсерами других типов; 41,7% (10/24) были сопродюсерами CTX-M-15, 25% (6/24) были сопродюсерами CTX-M-15 и CTX-M-2. Два изолята продуцировали только тип CTX-M-15, а один изолят продуцировал как тип CTX-M-15, так и тип CTX-M-2 (таблица 6). Остальные четыре изолята (4/31) не показали ни одного из этих трех CTX-M-типов. Обсуждение Микроорганизмы, продуцирующие БЛРС, становятся все более распространенными во всем мире, они признаны важными внутрибольничными патогенами у детей и часто связаны со вспышками [19].Скрининг кишечного носительства имеет решающее значение для прогнозирования риска заражения БЛРС, так как толстая кишка служит резервуаром для внекишечных патогенных E. coli [20]. Это исследование было первым исследованием кишечного носительства ESBL-PE в детском сообществе, проведенным в Ливане, и очень редкие исследования были зарегистрированы на основании 6 Страница 6 из 9 Рис. 2 Электрофорез в агарозном геле для продуктов ПЦР, полученных из ESBL-PE. изоляты с праймерами TEM, SHV и CTX-M Общее количество изолятов E.coli K.pneumonia K.oxytoca E. cloacae CTX-M TEM и CTX-M TEM, SHV и CTX-M Рис. 3 Состав гена bla 31 ESBL-PE, выделенного из 125 ректальных мазков, полученных от здоровых ливанских детей Рис. 4 Электрофорез в агарозном геле для продуктов ПЦР, полученных из изолятов ESBL-PE с праймерами CTX-M-2, CTX-M-9 и CTX-M-15, Ближний Восток. Распространенность составила 24,8%, что является высоким показателем по сравнению с 13,4, 2,7 и 2,9% случаев носительства среди здоровых детей в Ливии, Португалии и Швеции соответственно [21 23].Сравнение этого показателя с фекальным носительством среди взрослого населения в Саудовской Аравии 12,7% [24], среди медицинских работников в Египте 21% [25] и среди взрослого населения в 2005 году в Ливане 2,4% [26], вызывает тревогу высокий уровень носительства В этой популяции была обнаружена частота, которая может служить резервуаром для распространения за пределами кишечника ESBL-продуцирующих E. coli и K. pneumoniae и, таким образом, источником инфекции в условиях сообщества. У самцов уровень колонизации выше, чем у самок. Это наблюдение сложно объяснить и требует дальнейшего изучения.Высокий уровень носительства был у тех людей, которые принимали антибиотики или антациды в течение последних 8 недель или были госпитализированы в течение последних 12 месяцев. Факторами риска, упомянутыми в литературе, были длительное пребывание в больнице, проживание в домах престарелых или учреждениях длительного ухода, сопутствующие заболевания, недавняя операция, гемодиализ, а также предшествующее использование антибиотиков, особенно хинолонов и цефалоспоринов третьего поколения, а также сопутствующих препаратов. тримоксазол, аминогликозид и метронидазол [9]. Что касается приема антибиотиков, хотя отобранные дети были здоровы и не принимали антибиотики (за 5 дней до зачисления), было замечено, что 44.8% из них принимали антибиотики в течение последних 8 недель до обследования, этот показатель считается очень высоким и отражает высокую подверженность детей воздействию антибиотиков и может объяснить сравнительно высокий уровень колонизации. Как известно, одним из основных факторов риска развития резистентности бактерий является увеличение потребления некоторых антибиотиков [27]. В Ливане нет мер контроля и руководств по применению антибиотиков в этой возрастной группе. Кроме того, антибиотики принимают без рецепта врача, особенно в районах с более низким социально-экономическим положением [28].Насколько нам известно, это первый случай изучения регулярного потребления молочных продуктов (молока, йогурта и сыра) и перевозки ESBL-PE. В настоящем исследовании однофакторный анализ выявил значительную связь между регулярным потреблением молочных продуктов, курицы или мяса с высокой скоростью разноса ESBL-PE. Однако анализ с использованием многомерной логистической регрессии для проверки мешающих факторов не показал значительного воздействия ни одного из этих протестированных диетических продуктов. Частично это можно объяснить потреблением более чем одного типа большинством 7 Страница 7 из 9 Таблица 6 Молекулярная характеристика 31 изолята ESBL-PE, продуцирующего CTX-M-тип, полученного из ректальных мазков 125 здоровых детей в ливанской общине Тип CTX-M Общее количество изолятов N = 31 E.coli N = 25 (80,6%) K. pneumonia N = 3 (9,7%) K. oxytoca N = 1 (3,2%) E. cloacae N = 2 (6,5%) CTX-M-9 8 (25,8%) 7 ( 28%) 1 (33,3%) 0 (0%) 0 (0%) CTX-M-9 и CTX-M (32,3%) 9 (36%) 0 (0%) 1 (100%) 0 (0% ) CTX-M-9, CTX-M-15 и CTX-M-2 6 (19,3%) 5 (20%) 1 (33,3%) 0 (0%) 0 (0%) CTX-M-15 2 (6,5%) 1 (4%) 1 (33,3%) 0 (0%) 0 (0%) CTX-M-15 и CTX-M-2 1 (3,2%) 1 (4%) 0 (0%) 0 (0%) 0 (0%) CTX-M-2 0 (0%) 0 (0%) 0 (0%) 0 (0%) 0 (0%) Тип CTX-M кроме 2, 9, 15 4 (12,9%) 2 (8%) 0 (0%) 0 (0%) 2 (100%) участников.Кроме того, количество случаев, в которых использовался только один тип, невелико, чтобы продемонстрировать силу теста. Это было очевидно, так как сбор молока, йогурта и сыра как молочных продуктов, а также мяса и курицы вместе, поскольку мясо показало значительную связь между мясом и колонизацией ESBL-PE. Вывод о том, что мясо является предиктором носительства ESBL-PE по сравнению с молочными продуктами, также был очевиден из-за незначительного влияния молочных продуктов на носительство ESBL-PE, хотя у обоих была более высокая частота положительных изолятов ESBL по сравнению с контрольной группой, которая редко или никогда не принимала.Соотношение шансов составило 3 и 2 для мясных и молочных продуктов соответственно. Эти диетические продукты происходят из животного происхождения, и, как известные антибиотики, используются для различных целей в сельском хозяйстве и животноводстве, например, для ускорения роста или в качестве терапевтического лечения и профилактики заболеваний. E. coli и некоторые другие Enterobacteriaceae колонизируют кишечник как животных, так и человека, и в последнее время увеличилось количество исследований, описывающих распространенность ESBL-PE в мясе и сыром молоке [29, 30].Многие исследования показали значительное генетическое сходство между ESBL-положительными изолятами E. coli из куриного мяса и человека в соответствии с мобильными элементами устойчивости, генами вирулентности и геномным фоном [31–33]. Однако другие менее контрастирующие наблюдения показали, что существуют значительные различия в типах БЛРС между домашней птицей и людьми в Европе [34], а потребление мяса не связано с передачей БЛРС, что указывает на источники окружающей среды, такие как вода для питья и приготовления пищи [35]. Нет прямого исследования между потреблением молочных продуктов и носительством ESBL-PE.Недавнее исследование, проведенное в Тунисе, выделило E. coli из молока крупного рогатого скота, несущее ген bla CTX-M-15 на плазмиде F2: A-: B, комбинацию, часто встречающуюся у людей [36]. Хотя распространение генов устойчивости в E. coli может происходить несколькими путями, наше исследование показывает потенциальную угрозу, которую представляют пищевые продукты животного происхождения как источники для БЛРС-положительных изолятов человека [33]. Исследования, касающиеся ESBL-PE в молочных продуктах и мясе на рынке Ливана, должны быть оценены, чтобы определить влияние пищевых продуктов как резервуаров и распространителей таких штаммов через цепочку производства пищевых продуктов на человека.Мытье водой или мылом и водой интимной области после мочеиспускания, опорожнения фекалий или смены подгузника может иметь тенденцию к защитному эффекту против носительства ESBL-PE по сравнению с использованием только сухой ткани или салфеток, хотя P = 0,07, это может быть больше изучил и объяснил. Помимо высокой чувствительности к имипенему и амикацину, большинство изолятов были устойчивы к другим протестированным антимикробным препаратам. Было обнаружено, что изоляты, продуцирующие БЛРС, обладают высокой устойчивостью к налидиксовой кислоте, тетрациклину, гентамицину и триметоприм-сульфаметоксазолу, и этот результат подтверждает носительство БЛРС-ПЭ с множественной лекарственной устойчивостью в выбранной популяции бессимптомных здоровых детей в Ливане.Эта высокая частота носительства ESBL-PE и связанная с этим устойчивость к аминогликозидам и триметоприм-сульфаметоксазолу, а также высокая частота сосуществования устойчивости к фторхинолонам увеличивает риск заражения мультирезистентными бактериями и, следовательно, необходимость использования антибиотиков в крайнем случае. , такие как карбапенемы и колистин, при лечении распространенных инфекций [6]. Большинство ESBL-PE несут несколько генов bla, из которых CTX-M-тип был наиболее преобладающим. БЛРС CTX-M были увеличены во всем мире среди E.coli и Klebsiella spp., это первое исследование в Ливане, которое конкретно определило высокую распространенность БЛРС CTX-M-типа, выделенных от здоровых бессимптомных детей, где фермент бета-лактамазы CTX-M типа продуцировался всеми изолятами, и Было обнаружено, что большинство изолятов являются сопродюсерами гена ТЕА, следовательно, тип ТЕА также считался частым типом диссеминированных бета-лактамаз. Это контрастировало с исследованием медработников Египта, где SHV была преобладающей [25]. Это массовое распространение БЛРС типа CTX-M в нашем результате и его быстрое и глобальное распространение, о котором почти везде сообщалось, можно назвать пандемией CTX-M [25]. 37, 38], так как плазмиды, кодирующие CTX-M, часто передаются посредством конъюгации in vitro; это свойство объясняет легкое распространение плазмид, несущих bla CTX-M [39].Это распространение БЛРС типа CTX-M не ограничивается внутрибольничными условиями, но также затрагивает сообщество. Это явление действует, чтобы изменить эпидемиологию БЛРС, тогда как эти ферменты ранее были в основном ограничены внутрибольничными условиями [40], это может быть коррелировано с каналом обработки пищи, особенно с ферментами животного происхождения. Молекулярная характеристика БЛРС CTX-M-типа показала, что большинство из них было CTX-M-9, за которым следовал тип CTX-M-15. Большее количество изолятов было сопродюсером либо 2, либо 3 генов (bla CTX-M-9, bla CTX-M-15, bla CTX-M-2) вместе.CTX-M-9 впервые был обнаружен из E. coli, взятой из образцов мочи из Испании и Бразилии в 1996 году [41, 42], а недавно был опубликован отчет из Индии [43]. Если тип CTX-M преобладал в E. coli, полученной от ливийских детей с различными группами CTX-M-1, CTX-M-15 и CTX-M-3 [21], основным типом был CTX-M-15. и отсутствие CTX-M-2 и CTX-M-9-типов в изоляте E. coli, полученном из стула тегеранских детей, страдающих диареей [44], и CTX-M-1, CTX-M-15 и CTX-M -14 были преобладающими типами ESBL-PE, полученными из ректальных мазков французских детей [45].Это первое исследование, проведенное в Ливане, которое демонстрирует такую высокую распространенность ферментов CTX-M-9 среди штаммов Enterobacteriaceae, выделенных от детей в общинах. В этих условиях преобладающим геном БЛРС был bla CTX-M-9. Хотя CTX-M-15 являются наиболее частыми ферментами CTX-M, выделяемыми у людей, животных, а также в окружающей среде во всем мире [46], и связаны с глобальной пандемией CTX-M, но в нашем исследовании CTX-M- БЛРС 9 типа оказывается наиболее распространенной. Это показатель того, что в Ливане могут появиться новые механизмы сопротивления.Заключение Носительство ESBL-PE у детей раннего возраста в ливанской общине очень высоко по сравнению с другими странами. Была обнаружена значительная корреляция между уровнем колонизации и регулярным потреблением мяса или курицы. Тревожная множественная лекарственная устойчивость БЛРС-ПЭ вызывает серьезную озабоченность, особенно в этой возрастной группе. Более того, ESBL-PE носительство множественных генов TEM, SHV и CTX-M было преобладающим, тогда как CTX-M-9 и CTX-M-15 были в основном распространяющими типами ESBL. Сведения об авторе 1 Кафедра фармацевтических наук (фармацевтическая микробиология), фармацевтический факультет, Бейрутский арабский университет, Бейрут, Ливан.2 Кафедра фармацевтической микробиологии фармацевтического факультета Александрийского университета, Александрия, Египет. 3 Кафедра микробиологии и иммунологии, инфекционный контроль, медицинский факультет, Университет Айн-Шамс, Каир, Египет. 4 Кафедра фармацевтической микробиологии, фармацевтический факультет, Университет Мансура, Мансура, Египет. Благодарности Мы благодарим педиатров Маха Абу Альфа, Халила Оста и Нуссайба Шейх Аммар, которые согласились участвовать в этом исследовании; Г-ну Хасану Абу Заиду за его плодотворное сотрудничество; Медсестре Оле Саад за ее помощь в сборе проб и анкетировании; Профессору Ахмаду Эль Маллаху за помощь в статистической части.Конкурирующие интересы Авторы заявляют, что у них нет конкурирующих интересов. Рекомендация Необходимы дальнейшие исследования, чтобы оценить корреляцию между потреблением определенных продуктов питания и носительством БЛРС-ПЭ. Молочные продукты и мясо на рынке Ливана должны быть проверены на наличие ESBL-PE. Требуется рациональное использование антибиотиков, особенно у детей. Неожиданная взаимосвязь между привычками к интимной гигиене и частотой носительства БЛРС-ПЭ требует дальнейшего исследования. Получено: 30 июня 2015 г. Принято: 17 января 2016 г. Список литературы 1.Брэдфорд PA. Бета-лактамазы с расширенным спектром действия в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости. Clin Microbiol Rev.2001; 14: Буш К. Тревожная бета-лактамазная резистентность у Enterobacteriaceae с множественной лекарственной устойчивостью. Curr Opin Microbiol. 2010; 13: Ливермор DM. Современная эпидемиология и растущая устойчивость грамотрицательных микроорганизмов. Korean J Intern Med. 2012; 27: Ливермор DM, Canton R, Gniadkowski M, Nordman P, Rossolini GM, Arlet G и др. CTX-M: изменение облика БЛРС в Европе.J Antimicrob Chemother. 2007; 59: Карисик Э., Эллингтон М.Дж., Пайк Р., Уоррен Р.Э., Ливермор Д.М., Вудфорд Н. Молекулярная характеристика плазмид, кодирующих бета-лактамазы CTX-M-15 из штаммов Escherichia coli в Соединенном Королевстве. J Antimicrob Chemother. 2006; 58: Pitout JD. Инфекции с бета-лактамазой расширенного спектра действия, продуцирующей Enterobacteriaceae: изменение эпидемиологии и выбора лекарственного лечения. Наркотики. 2010; 70: Льюис Дж. С., Эррера М., Викес Б., Паттерсон Дж. Э., Йоргенсен Дж. Х. Первое сообщение о появлении бета-лактамаз расширенного спектра CTX-M-типа (БЛРС) как преобладающих БЛРС, выделенных в системе здравоохранения США.Антимикробные агенты Chemother. 2007; 51: Патерсон Д.Л., Бономо РА. Бета-лактамазы расширенного спектра: клинические обновления. Clin Microbiol Rev.2005; 18: Pitout JDD, Laupland KB. Enterobacteriaceae, продуцирующие бета-лактамазы расширенного спектра действия: новая проблема общественного здравоохранения. Lancet Infect Dis. 2008; 8: Bauernfeind A, Casellas JM, Goldberg M, Holley M, Jungwirth R, Mangold P и др. Новая плазмидная цефотаксимаза от пациентов, инфицированных Salmonella typhimurium. Инфекция. 1992; 20: Кантон Р. Эпидемиология и эволюция β-лактамаз.В: Бакеро Ф., Номбела С., Кассель Г. Х., Гутьеррес-Фуэнтес Дж. А., редакторы. Эволюционная биология бактериальных и грибковых патогенов. Вашингтон: АСМ Пресс; p Cantón R, Coque TM. Пандемия β-лактамаз CTX-M. Curr Opin Microbiol. 2006; 9: Coque TM, Novais A, Carattoli A, Poirel L, Pitout J, Peixe L. и др. Распространение клонально родственных штаммов Escherichia coli, экспрессирующих бета-лактамазу расширенного спектра CTX-M-15. Emerg Infect Dis. 2008; 14: Вальверде А, Coque TM, Санчес-Морено МП, Роллан А, Бакеро Ф, Кантон Р.Резкое увеличение распространенности фекального носительства Enterobacteriaceae, продуцирующей бета-лактамазы расширенного спектра действия, в отсутствие вспышек заболеваний в Испании. J Clin Microbiol. 2004; 42: Чандрамохан Л., Ревелл, Пенсильвания. Распространенность и молекулярная характеристика энтеробактерий, продуцирующих β-лактамазы расширенного спектра действия, в популяции педиатрических пациентов. Антимикробные агенты Chemother. 2012; 56: Институт клинических и лабораторных стандартов. Стандарт производительности для тестирования дисковой чувствительности к антимикробным препаратам: утвержденные стандарты.23-е изд. Уэйн, Пенсильвания: CLSI; 2013 г. (документ M100-S20). 9 Страница 9 из Integrated DNA Technologies. Доступ осуществлен 21 сентября: Kim J, Jeon S, Lee B, Park M, Lee H, Lee J и др. Быстрое обнаружение β-лактамазы расширенного спектра (ESBL) для Enterobacteriaceae с использованием метода на основе мультиплексной ПЦР. Заразить Chemother. 2009; 41: Moissenet D, Salauze B, Clermont O, Bingen E, Arlet G, Denamur E, et al. Менингит, вызванный Escherichia coli, продуцирующей бета-лактамазу расширенного спектра TEM-52, в рамках обширной вспышки в неонатальном отделении: эпидемиологическое расследование и характеристика штамма.J Clin Microbiol. 2010; 48: Эмори Т.Г., Гейнес Р.П. Обзор нозокомиальных инфекций, включая роль микробиологической лаборатории. Clin Microbiol Rev.1993; 6: Ахмед С.Ф., Али М.М., Мохамед З.К., Мусса Т.А., Клена Дж.Д. Фекальное носительство β-лактамаз расширенного спектра и Escherichia coli, продуцирующих AmpC, в ливийском сообществе. Ann Clin Microbiol Antimicrob. 2014; 13: Гимарайнш Б., Баррету А., Радуани Х., Фигейредо Н., Гаспар Э., Родригес Дж. И др. Генетическое обнаружение изолятов Escherichia coli, содержащих бета-лактамазу расширенного спектра, и устойчивых к ванкомицину энтерококков в образцах кала здоровых детей.Microb Drug Resist. 2009; 15: Kaarme J, Molin Y, Olsen B, Melhus A. Распространенность энтеробактерий, продуцирующих бета-лактамазы расширенного спектра, у здоровых шведских детей дошкольного возраста. Acta Paediatr. 2013; 102: Кадер А.А., Камат К.А. Фекальное носительство бактерий, продуцирующих бета-лактамазы расширенного спектра действия, в сообществе. East Mediterr Health J. 2009; 15: Bassyouni RH, Gaber SN, Wegdan AA. Фекальное носительство Escherichia coli, продуцирующей β-лактамазу и AmpC расширенного спектра, среди медицинских работников. J Infect Dev Ctries.2015; 9: Мубарек С., Дауд З., Хакиме Н.И., Хамзе М., Мангени Н., Матта Х. и др. Распространение энтеробактерий, продуцирующих бета-лактамазу расширенного спектра (CTX-M-15), в Ливане, по всей стране. J Clin Microbiol. 2005; 43: Gómez J, García Vázquez E, Ruiz Gómez J. Клиническая значимость бактериальной устойчивости: исторический подход (). Преподобный Эсп Кимиотер. 2008; 21: Фарах Р., Лахуд Н., Саламе П., Салех Н. Выдача антибиотиков ливанскими фармацевтами: сравнение более высоких и более низких социально-экономических уровней.J Инфекция общественного здравоохранения. 2015; 8: Гесер Надин, Стефан Роджер, Хехлер Герберт. Встречаемость и характеристики β-лактамазы расширенного спектра действия (БЛРС), продуцирующей Enterobacteriaceae, у животных-производителей пищевых продуктов, мясного фарша и сырого молока. BMC Vet Res. 2012; 8: Казелла Т., Родригес М.М., Такахаши Дж. Т., Гильоне Б., Дропа М., Ассунсао Э. и др. Обнаружение генов типа blactx-m в комплексных интегронах класса 1, переносимых Enterobacteriaceae, выделенными из розничного куриного мяса в Бразилии. Int J Food Microbiol. 2015; 16: Overdevest I, Willemsen I, Rijnsburger M, Eustace A, Xu L, Hawkey P и др.Гены β-лактамаз расширенного спектра Escherichia coli в курином мясе и людях, Нидерланды. Emerg Infect Dis. 2011; 17: Kluytmans JA, Overdevest IT, Willemsen I, Kluytmans-van den Bergh MF, van der Zwaluw K, Heck M и др. Escherichia coli, продуцирующая β-лактамазу расширенного спектра действия из куриного мяса и людей в розничной торговле: сравнение штаммов, плазмид, генов устойчивости и факторов вирулентности. Clin Infect Dis. 2013; 56: Leverstein-van Hall MA, Dierikx CM, Cohen Stuart J, Voets GM, van den Munckhof MP, van Essen-Zandbergen A, et al.Голландские пациенты, розничная торговля куриным мясом и домашней птицей имеют одни и те же гены, плазмиды и штаммы БЛРС. Clin Microbiol Infect. 2011; 17: Wu G, Day MJ, Mafura MT, Nunez-Garcia J, Fenner JJ, Sharma M и др. Сравнительный анализ ESBL-положительных изолятов Escherichia coli от животных и людей из Великобритании, Нидерландов и Германии. PLoS One. 2013; 8: e Königer D, Gastmeier P, Kola A, Schwab F, Meyer E. Вегетарианцы не менее колонизированы бактериями, продуцирующими b-лактамазу расширенного спектра, чем мясоеды.J Antimicrob Chemother doi: / jac / dkt Grami R, Dahmen S, Mansour W., Mehri W., Haenni M, Aouni M, Madec JY. BlaCTX-M-15-несущая F2: A-: B-плазмида в Escherichia coli из молока крупного рогатого скота в Тунисе. Microb Drug Resist. 2014; 20: Пурнарас С., Икономидис А., Кристо И., Цакрис А., Маниатис А.Н. Ферменты CTX-M являются наиболее распространенными β-лактамазами расширенного спектра действия среди Escherichia coli в греческих больницах третичного уровня. J Antimicrob Chemother. 2004; 54: Ян Дж. Дж., Сюэ П. Р., Лу Дж. Дж., Чанг Ф.Й., Шир Дж. М., Ван Дж. Х. и др. Бета-лактамазы с расширенным спектром и плазмид-опосредованные ферменты AmpC среди клинических изолятов Escherichia coli и Klebsiella pneumoniae из семи медицинских центров на Тайване.Антимикробные агенты Chemother. 2006; 50: Baraniak A, Fiett J, Sulikowska A, Hryniewicz W., Gniadkowski M. Распространение в Польше производящих бета-лактамазы CTX-M-3 микроорганизмов расширенного спектра действия из семейства Enterobacteriaceae в Польше. Антимикробные агенты Chemother. 2002; 46: Россолини Г.М., Д. Андреа М.М., Мугнайоли С. Распространение β-лактамаз расширенного спектра CTX-M-типа. Clin Microbiol Infect Rev.2008; 14 (Дополнение 1): Cantón R, Novais A, Valverde A, Machado E, Peixe L, Baquero F и др. Распространенность и распространение Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра действия, в Европе.Clin Microbiol Infect. 2008; 14 (Приложение 1): Боннет Р. Растущая группа бета-лактамаз расширенного спектра действия: ферменты CTX-M. Антимикробные агенты Chemother. 2004; 48: Рой С., Кришнан Р., Мукерджи С., Шнайдерс Т., Нийоги С.К., Басу С. Распространенность штаммов, связанных с вирулентностью ST131, среди продуцирующих CTX-M Escherichia coli в кишечнике госпитализированных новорожденных в Индии. Диагностика Microbiol Infect Dis. 2013; 77: Memariani M, Najar Peerayeh S, Zahraei Salehi T., Shokouhi Mostafavi SK. Встречаемость генов β-лактамаз SHV, TEM и CTX-M среди энтеропатогенных штаммов Escherichia coli, выделенных от детей с диареей.Jundishapur J Microbiol. 2015; 8 (4): e Бирджи Андре, Коэн Роберт, Леви Коринн, Биде Филипп, Курру Селин, Бенани Мохамед и др. Фекальное носительство энтеробактерий, продуцирующих бета-лактамазы расширенного спектра действия, у французских детей. BMC Infect Dis. 2012; 12: Lahlaoui H, Ben Haj Khalifa A, Ben Moussa M. Эпидемиология Enterobacteriaceae, продуцирующая β-лактамазу расширенного спектра CTX-M (ESBL). Méd Mal Infect Rev.2014; 44: Отправьте следующую рукопись в BioMed Central, и мы поможем вам на каждом этапе: Мы принимаем предварительные запросы. Наш инструмент выбора поможет вам найти наиболее подходящий журнал. Мы обеспечиваем круглосуточную поддержку клиентов. онлайн-подача Тщательная экспертная оценка Включение в PubMed и все основные службы индексирования Максимальная видимость вашего исследования Отправьте рукопись по телефону Инфекции при беременности: использование антибиотиковЛекарства, используемые для борьбы с бактериальными инфекциями, называются антибиотиками.Те, которые используются для борьбы с грибковыми инфекциями, называются противогрибковыми препаратами , а те, которые борются с вирусами, — это противовирусные препараты . Все эти препараты можно объединить в группу противоинфекционных средств. Однако в этом обсуждении термин антибиотики будет использоваться в более общем смысле для обозначения всех трех. Пенициллин (PenVK), тетрациклин (Sumycin) и сульфаниламидные препараты (триметоприм-сульфаметоксазол, Septra) являются одними из наиболее известных типов антибиотиков. Некоторые антибиотики (например, пенициллины) имеют узкий спектр действия, то есть атакуют одну или несколько конкретных инфекций.Антибиотики широкого спектра действия (тетрациклины или ампициллины) атакуют ряд бактериальных заболеваний. Знаете ли вы? Некоторые виды бактерий от природы более устойчивы к антибиотикам, чем другие. Это верно, например, в отношении грамотрицательных бацилл, таких как Campylobacter, Salmonella, Shigella и Vibrio. В отличие от других типов бактерий, они имеют двойную мембрану, окружающую каждую клетку, что частично объясняет их повышенную стойкость к антибиотикам. Хотя антибиотики являются полезными лекарствами, их следует принимать только при необходимости, потому что:
Если врачи прописывают антибиотики, когда в них нет необходимости, пациенты могут подвергаться ненужному риску. Это особенно актуально во время беременности, поскольку подвергается воздействию и мать, и ее ребенок.Некоторые препараты могут быть совершенно безвредными для будущего ребенка, но известно, что другие вызывают серьезные пороки развития. Поскольку только несколько контролируемых научных исследований касались вопроса о том, безопасны ли лекарства во время беременности, врачи обычно полагаются на данные исследований на животных и коллективный практический опыт, чтобы решить, назначать ли антибиотики беременной женщине. В 1979 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разработало систему классификации лекарств, в том числе противоинфекционных, с учетом их способности оказывать вредное воздействие на нерожденного ребенка: Категория A Категория B Категория C Категория D Категория X Вот несколько общих практических правил использования антибиотиков во время беременности:
| ||||||||||||||||||||||||||||||||||||||||||||||


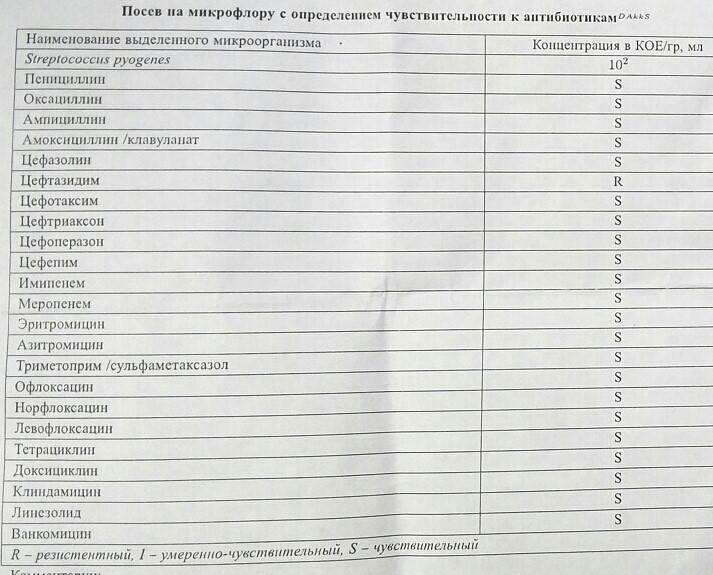
 Максимальное время доставки – 5 часов. Не допускается замораживание. Кал собирают без слабительных и клизм;
Максимальное время доставки – 5 часов. Не допускается замораживание. Кал собирают без слабительных и клизм;
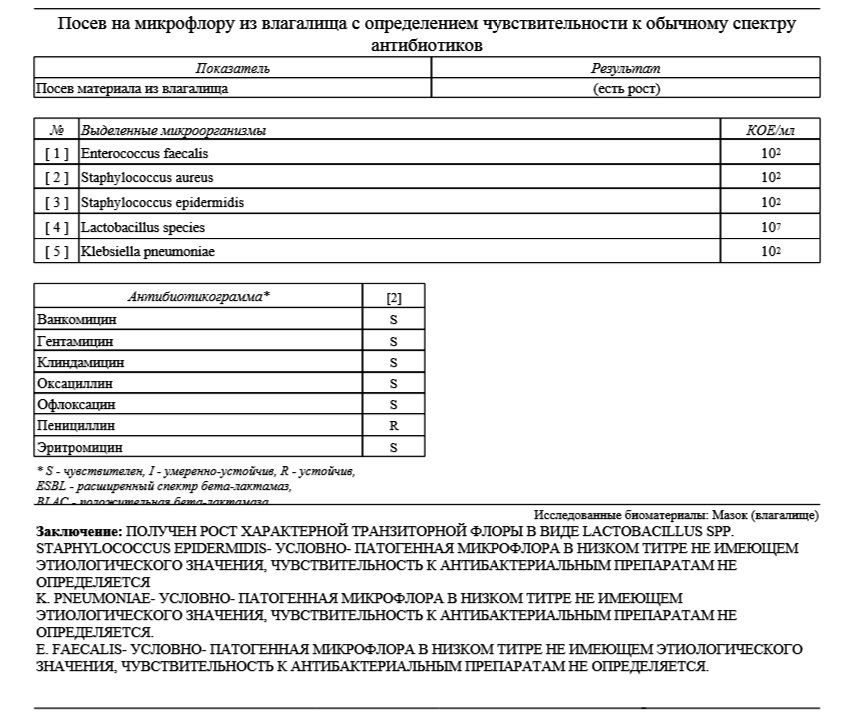 сoli O157:H7 и чувствительность к антибиотикам
сoli O157:H7 и чувствительность к антибиотикам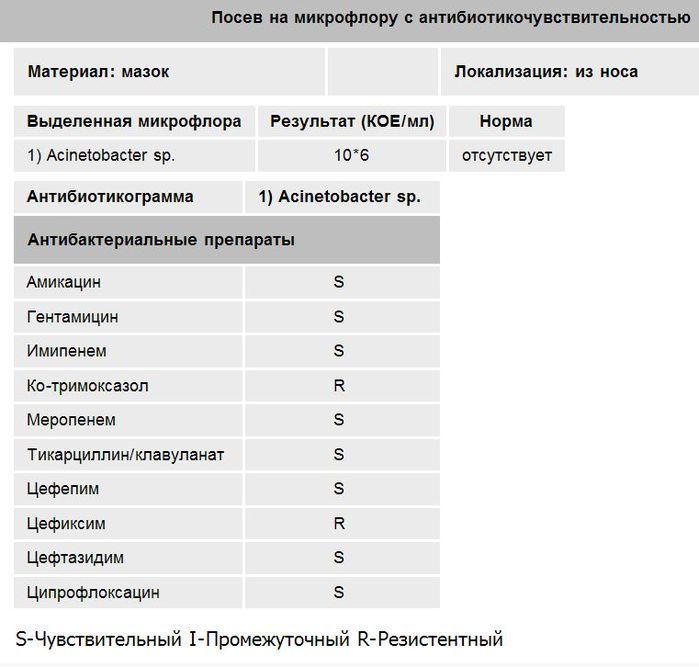
 В рамках предварительной подготовки за 3 суток до забора биоматериала на анализ необходимо исключить употребление алкоголя в любой форме, уменьшить к необходимому минимуму любые физические и психологические нагрузки, спать достаточное количество времени, а также коренным образом не менять стиль жизни;
В рамках предварительной подготовки за 3 суток до забора биоматериала на анализ необходимо исключить употребление алкоголя в любой форме, уменьшить к необходимому минимуму любые физические и психологические нагрузки, спать достаточное количество времени, а также коренным образом не менять стиль жизни;