Проект списка русских названий бактерий санитарно-эпидемиологического контроля: транслитерация ста родовых названий и ассимиляция двухсот двадцати пяти видовых эпитетов
Резюме. Исследование предпринято в соответствии с давнишней традицией бережного отношения украинской науки к русской биологической номенклатуре (первый перевод руководства Берги, составление русско-украинско-латинского зоологического словаря и др.) и в связи с назревшей необходимостью выявления результатов влияния международной номенклатурной реформы в бактериологии на формирование русской номенклатуры бактерий, имеющих санитарно-эпидемиологическое значение. В отличие от положения дел в ботанике и зоологии, бактериологи единодушно выступают не только против традиционных русских названий, но и против переводов видовых эпитетов. Установлено, что почти все родовые названия вошли в лексический состав языка, причем отмечен отказ от усечения или изменения окончаний новых названий. Выявлена тенденция замены транслитерированных видовых эпитетов ассимилированными (то есть вместо «гемолитикус» — «гемолитический»), и в задачу исследования входило ускорить использование латинских слов и корней, вошедших ранее или только сейчас входящих в русский язык, в качестве видовых эпитетов. Работа в этом направлении продолжается.
Работа в этом направлении продолжается.
ВВЕДЕНИЕ
Существуют прямо противоположные точки зрения в отношении необходимости русских названий биологических объектов. Научные сотрудники убеждены, что вполне достаточно латинских названий, которые дают возможность ученым разных стран хорошо понимать друг друга, использование национальных названий ведет не вперед, а назад. С другой стороны, педагоги сталкиваются с проблемой обучения студентов латинской номенклатуре, с задачей объяснения значения латинских слов, без чего невозможно сознательное освоение терминологии (Кузякин А.П., 2005; Лобанов А.Л., 2005). Но если с растениями и животными люди сталкиваются веками и их национальные названия уживаются с научными, в настоящее время происходит бурный процесс описания новых видов бактерий и вследствие огромного их значения едва ли не во всех областях практической деятельности бактериологи решительно отказываются от образования национальных эквивалентов путем перевода латинских названий и нередко транслитерируют видовые эпитеты. И хотя этим путем обеспечивается идентичность научных и национальных названий, при этом засоряется язык, с чем, естественно, примириться невозможно. Между тем бактериологи нашли выход из этого тупика: все чаще в качестве видовых эпитетов используются слова, ассимилированные русским языком.
И хотя этим путем обеспечивается идентичность научных и национальных названий, при этом засоряется язык, с чем, естественно, примириться невозможно. Между тем бактериологи нашли выход из этого тупика: все чаще в качестве видовых эпитетов используются слова, ассимилированные русским языком.
Актуальность проблемы вызвана двумя обстоятельствами. Прошло четверть века после проведения Международной номенклатурной реформы в бактериологии (Skerman V.B.D. et al., 1980), и пора подвести итоги влияния реформы на формирование русской номенклатуры бактерий, имеющих санитарно‑бактериологическое значение. С другой стороны, биологи Украины всегда бережно относились к русской биологической номенклатуре. Так, именно в Киеве был осуществлен первый перевод определителя Берги на русский язык (Ручко И.Е. (ред.), 1936), так как сотрудники Института микробиологии прекрасно понимали, что определитель нужен не только для украинских бактериологов, но и для своих коллег во всех союзных республиках. Был также составлен русско‑украинско‑латинский зоологический словарь, который отвечал потребностям зоологов всех республик (Маркевич А. П., Татарко К.И., 1983).
П., Татарко К.И., 1983).
Кроме того, проявляется обеспокоенность в отношении обеспечения эпидемиологической безопасности Союза независимых государств (Тер‑Казарьян С., 1993), и требуется создание лингвистической базы, которая могла бы послужить основой разработки национальных эквивалентов названий бактерий. Такой базой могут послужить ассимилированные русским языком видовые эпитеты этой группы бактерий.
ЦЕЛЬ СТАТЬИ
Была поставлена задача установить, какова доля традиционных русских, переведенных и ассимилированных названий в ботанике, зоологии и бактериологии, проанализировать состояние дел в бактериологии в этом отношении, выявить тенденцию и попытаться довести происходящий процесс до конца.
МАТЕРИАЛ И МЕТОДЫ
Для анализа состояния дел в ботанике использован словарь Н.Н. Кадена и Н.Н. Терентьевой (1979), в зоологии —А.П. Маркевича и К.И. Татарко (1983). Круг исследуемых видов бактерий определили два документа — Указ Президента Российской Федерации (2001) о бактериях таможенного контроля и перечень микроорганизмов, составленный кафедрой фармакологии Смоленской медицинской академии и предназначенный для антиинфекционной химиотерапии (Страчунский Л.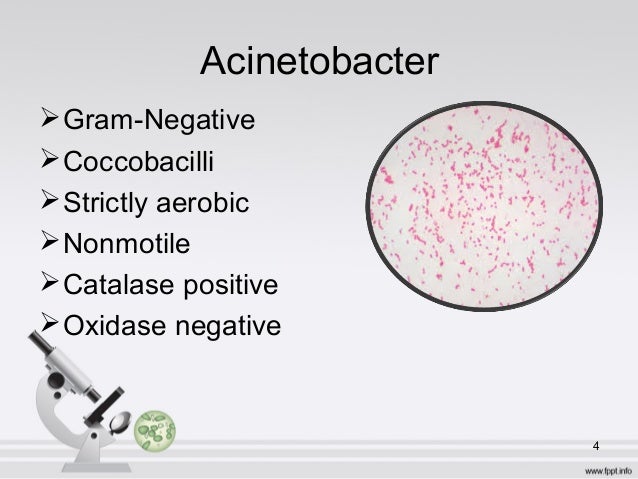 С. и др., 2005). Латинские названия сверялись по потрясающему (по нравственному выбору ученого рода деятельности) сайту Жана Эзеби (Euzeby J.P., 2006). Состояние русской номенклатуры бактерий определялось с помощью Интернета.
С. и др., 2005). Латинские названия сверялись по потрясающему (по нравственному выбору ученого рода деятельности) сайту Жана Эзеби (Euzeby J.P., 2006). Состояние русской номенклатуры бактерий определялось с помощью Интернета.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Выборка из словаря названий растений (230 видов) показала, что ботаники в 70% случаев используют переводные эпитеты, где неискушенный читатель может не отождествить латинское и русское название, а в 30% это отождествление налицо, так как эта часть видов — географические названия и фамилии.
Анализ выборки из зоологического словаря (180 видов) свидетельствовал о том, что 50% являются исконно русскими названиями, 40% — переводами и только 10% являются ассимилированными географическими названиями и фамилиями.
Обращаясь к названиям бактерий, мы видим, что бактериологи не считают нужным передавать видовые эпитеты переводом, а упорно используют транслитерацию, так что остается одна возможность — найти в лексическом фонде или образовать ассимилированные эпитеты. Широко используются эпитеты «бледная», «золотистый», «кишечная», «сенная», «газовой гангрены». Для них существуют, соответственно, «паллидная», «аурумный», несклоняемое «коли», «субтильная» и «перфрингенсная». Значительная часть видовых эпитетов связана с названиями болезней — корью, коклюшем, рожей свиней, сапом, сибирской язвой, столбняком, чумой, риккетсиозным и сальмонеллезным тифами, крысиным тифом. Для них существуют, соответственно, использующиеся в языке слова «морбил(л)озная», «пертуссиновый», «рузиопатии», «маллеиновый», «антраксная, антракса», «тетаническая, тетануса», несклоняемое «пестис», «тифозная». Для крысиного тифа (крысы относятся к семейству мышиных), по-видимому, возможно сочетание «тифомуриновая».
Широко используются эпитеты «бледная», «золотистый», «кишечная», «сенная», «газовой гангрены». Для них существуют, соответственно, «паллидная», «аурумный», несклоняемое «коли», «субтильная» и «перфрингенсная». Значительная часть видовых эпитетов связана с названиями болезней — корью, коклюшем, рожей свиней, сапом, сибирской язвой, столбняком, чумой, риккетсиозным и сальмонеллезным тифами, крысиным тифом. Для них существуют, соответственно, использующиеся в языке слова «морбил(л)озная», «пертуссиновый», «рузиопатии», «маллеиновый», «антраксная, антракса», «тетаническая, тетануса», несклоняемое «пестис», «тифозная». Для крысиного тифа (крысы относятся к семейству мышиных), по-видимому, возможно сочетание «тифомуриновая».
Кроме «коли» и «пестис», есть также несклоняемые эпитеты «акне», «тетайотаомикрон», «цуцугамуши».
В случае принятия этих названий устраняется разрыв между латинскими названиями и их русскими эквивалентами.
Полученные результаты приведены ниже. Для удобства читателя видовые эпитеты и родовые названия помещены в одном алфавитном ряду. Грамматический род эпитетов зависит от грамматического рода русских родовых названий (то есть если «бацилла», то эпитет «сферическая», если «стрептококк», то эпитет — «пиогенный»).
Грамматический род эпитетов зависит от грамматического рода русских родовых названий (то есть если «бацилла», то эпитет «сферическая», если «стрептококк», то эпитет — «пиогенный»).
Проект списка русских названий бактерий санитарно‑эпидемиологического контроля:
транслитерация ста родовых названий и ассимиляция двухсот двадцати пяти видовых эпитетов
abortus абортная
acidominimus ацидоминимальный
Acinetobacter акинетобактер («неподвижная бактерия»)
acne акне не склон. (угревая)
Actinobacillus актинобацилла («лучеобразная бацилла»)
Actinomyces актиномицет («лучеобразный гриб»)
actinomycetemcomitans актиномицет(комитет)ная (состоящая в компании — «комитете» — с актиномицетом)
adecarboxylata адекарбоксилатная (не декарбоксилирующая)
adolescentis адолесцентная (подростковая)
aegyptius египетский
Aerococcus аэрококк («газообразующий кокк»)
aerogenes аэрогенный, ‑ая (образующий, ‑ая газ)
Aeromonas аэромонас («газообразующее тельце»)
aeruginosa аэругинозный (медноржавчинный)
Afipia афипия (AFIP — Armed Forces Institute of Pathology, USA: Институт патологии вооруженных сил, США)
afzelii Афзеля (Афзаль, M. A. Afzal, университет Белфаста, Англия)
A. Afzal, университет Белфаста, Англия)
agalactiae агалактийный (препятствующий молокоотделению)
agglomerans агломерирующий (образующий комки из клеток)
akari акарусная (Acarus акарус, клещ)
alactolyticus алактолитический (не лизирующий молоко)
albilineans альбилинейный (белополосчатый)
Alcaligenes алкалигенес («подщелачивающий»)
alcaligenes алкалигенный (подщелачивающий)
alginolyticus альгинолитический (расщепляющий альгин)
alvei альвейная (ульевая)
amalonaticus амалонатный (не использующий малонат натрия)
anaerobius анаэробный
anginosus ангинозный
anthracis антракса (сибиреязвенная)
anthropi антропный (человека)
aphrophilus афрофильный (пенолюбивый)
Arcanobacterium арканобактерия («скрытная бактерия»)
arthritidis артритная
asaccharolytica асахаролитический (не гидролизующий сахарозу)
asburiae Асбури (Асбури, Mari Asburi, амер. бактериолог)
бактериолог)
ascorbata аскорбатная (на среде с аскорбатом натрия)
asteroides астероидный (звездовидный)
Atopobium атопобиум («живой, не связанный с определенным местом»)
atypica атипичная (не типичная)
aureus аурумный (традиционно, по крайней мере от Котляра, 1892, «золотистый»)
auricularis аурикулярный (ушной)
avidum авидная (жадная)
bacilliformis бациллоформенная
Bacillus бацилла («палочка»)
Bacteroides бактероидес («подобный бактерии»)
Bartonella бартонелла (Бартон, A.L. Barton, 1871–1950, перуанский врач)
baumannii Баумана (Пауль и Линда Бауманы, Paul и Linda Baumann, Калифорнийский университет)
Bifidobacterium бифидобактерия («раздвоенная бактерия»)
bivius бивиальный (двусторонний: сахаролитический и протеолитический пути)
Bordetella бордетелла (Борде, Bordet, Jules, 1870–1961, бельг. бактериолог)
бактериолог)
Borrelia боррелия (Боррель, Amedee Borrel, 1867–1936, франц. ученый)
botulinum ботулизма
bovis бовисный, -ая (бычий, -ья)
boydii Бойда (Бойд, John Boyd, 1889–1968, англ. бактериолог)
brasiliensis бразильская
Brevundimonas бревундимонас («тельце с коротким жгутиком»)
bronchiseptica бронхисептическая (инфицирующая бронхи)
Brucella бруцелла (Брюс, David Bruce, 1855–1931, шотл. военврач)
buccalis буккальная (щечная)
burgdorferi Бургдорфера (Бургдорфер, Willi Burgdorfer, энтомолог Нац. института здравоохранения, Гамильтон, шт. Монтана, США, с 1986 г. — «заслуженный профессор в отставке»)
Burkholderia беркхолдерия (Беркхолдер, Walter H. Burkholder, амер. бактериолог)
burnetii Бернета (Бернет, Burnet, Frank McFarlane, 1899–1985, австрийский вирусолог и эмбриолог)
calcoaceticus кальцийацетатный
Calymmatobacterium калимматобактерия («одетая в оболочку»)
campestris кампестральный (полевой)
Campylobacter кампилобактер («изогнутая бактерия»)
canadensis канадская
canis канисная, -ый (собаки)
Capnocytophaga капноцитофага («клетка, поедающая дым»: рост только при 5% углекислого газа в воздухе)
Cardiobacterium кардиобактерия («бактерия сердца»)
casseliflavus касселифлавиновый (желтый — флавиновый, как вилла лондонского банкира Эрнеста Касселя, которую он построил в 1901 г. в Ридеральпе, Швейцария)
в Ридеральпе, Швейцария)
catarrhalis катаральная
caviae кавиевый (Cavia — морская свинка)
Cedecea цедецеа (CDC — Centers for Disease Control and Prevention, Atlanta, USA: Центры по контролю и профилактике заболеваний, Атланта, США)
cereus цереусная (восковидная)
Chlamydia хламидия («одетая в хламиду, мантию»)
cholerae холерный, холеры
choleraesuis холересуисная (холеры свиней)
Chromobacterium хромобактерия («окрашенная бактерия»)
Chryseobacterium хризеобактерия («желтая бактерия»)
Chryseomonas хризеомонас («желтое тельце»)
Citrobacter цитробактер («цитратная бактерия»)
cloacae клоачный (сточноканальный)
Clostridium клостридия («веретенце»)
cohnii Кона (Кон, Ferdinand Cohn, 1828–1898, нем. ботаник и бактериолог)
ботаник и бактериолог)
coli коли не склон. (кишечная, -ый)
conorii Конора (Конор (A. Conor) и Брух (A. Bruch) в 1910 г. описали «прыщевидную» лихорадку, позднее получившую название марсельской)
constellatus констеллатный (звездчатый)
corrodens корродирующая
Corynebacterium коринебактерия («булавообразная бактерия»)
Coxiella коксиелла (Кокс, Harold Rae Cox, амер. бактериолог)
cryocrescens криокреативная («создающая холод», хотели сказать «холодостойкая»)
damsela дамселов (аквариумных рыбок)
davisae Дэвис (Бетти Дэвис, Betty Davis)
denitrificans денитрифицирующая
denticola дентальная, дентиколонистская
Dialister диалистер (этимология неизвестна)
Dichelobacter дихелобактер («двуклешневая бактерия?»)
diphtheriae дифтерийная
diversus дивергентный
ducreyi Дюкре (Дюкре, Agosto Ducrey, 1866–1940, итальянский дерматолог)
dysenteriae дизентерийная
Edwardsiella эдвардсиелла (Эдвардс, Edwards, Philip Rarick, 1901–1966, амер. ветеринарный бактериолог)
ветеринарный бактериолог)
Eikenella эйкенелла (Эйкен, M. Eiken, скандинавский ученый)
endodontalis эндодонтальный (пульпитный)
enterica энтеральная (тощекишечная)
enteritidis энтеритная (тонкокишечная)
Enterobacter энтеробактер («кишечная бактерия»)
Enterococcus энтерококк («кишечный кокк»)
enterocolitica энтероколитная
epidermidis эпидермальный
Erysipelothrix эризипелотрикс («волосок рожи»)
Escherichia эшерихия (Эшерих, Escherich, Theodor, 1857–1911, нем. врач)
Eubacterium эубактерия («подлинная бактерия»)
faecalis фекальный
faecium фециумный
fastidiosa фастидиозная (привередливая)
felis фелинная (кошачья)
fergusonii Фергусона (Фергусон, Ferguson W. W., амер. бактериолог)
W., амер. бактериолог)
fermentans ферментирующая
fetus фетальный (внутриутробный)
Flavimonas флавимонас («желтое тельце»)
Flavobacterium флавобактерия («желтая бактерия»)
flexneri Флекснера (Флекснер, Simon Flexner, 1863–1946, амер. бактериолог и патолог)
fluorescens флюоресцирующий
fluvialis флювиальный (речной)
forsythus форситский (Форсит, Forsyth, шт. Джорджия, США, Форситский биомедицинский центр, инфекционные болезни ротовой полости)
fortuitum фортунная (случайная)
fragilis фрагильный (ломкий)
Francisella франсиселла (Франсис, Edward Francis, 1872–1957, амер. бактериолог)
freudenreichii Фрейденрейха (Фрейденрейх, Eduard Freidenreich, 1851–1906, нем. бактериолог в молочном деле)
freundii Фройнда (Фройнд, A. Freund, нем. химик, показавший, что бактерия, названная впоследствии его именем, превращает глицерин в триметилгликоль, вовлекая метильные группы в удлинение углеродных цепочек)
Freund, нем. химик, показавший, что бактерия, названная впоследствии его именем, превращает глицерин в триметилгликоль, вовлекая метильные группы в удлинение углеродных цепочек)
furnissii Ферниса (Фернис, A.L. Furniss, Мейдстонская сан.‑гиг. лаборатория, Англия)
Fusobacterium фузобактерия («веретенообразная бактерия»)
Gardnerella гарднерелла (Гарднер, Herman L. Gardner, 1912–1982, амер. гинеколог и бактериолог)
garinii Гарина (Гарин, Charles H. Garin, ?–1971, франц. клиницист)
Gemella гемелла («двойняшка»)
genitalium генитальная
gergoviae герговийский (Герговийская возвышенность возле Клермон‑Феррана, Франция)
gingivalis гингивальный (десенный)
gonorrhoeae гонореи
granulomatis гранулематозная
granulosum гранулярная
haemolysans гемолизирующая
haemolytica, ‑um, ‑us гемолитическая, ‑ий
Haemophilus гемофилус («кроволюбивый»)
Hafnia гафния (Гафния, историч. название Копенгагена)
название Копенгагена)
hansenii Хансена
Helicobacter геликобактер («спиральная бактерия»)
henselae Хенсель (Диана Хенсель, Diana M. Hensel, амер. микробиолог)
hermannii Германа (Герман, G.H. Hermann, бактериолог)
histolyticum гистолитическая (тканерастворяющая)
hoshinae Хошин (женщина)
hydrophila гидрофильный
ictaluri икталуровых (Ictaluridae икталуровые или кошачьи сомы)
indologenes индологенная
influenzae инфлюэнцы
intermedia, ‑us интермедиальная, ‑ый (промежуточная, ‑ый)
interrogans интеррогативная (вопросительная, похожая на этот знак)
israelii Исраэла (James Israel, 1848–1926, нем. хирург)
jejuni еюнальный (тощекишечный)
kansasii канзасская
kingae Кинг (женщина, см. ниже)
ниже)
Kingella кингелла (Элизабет Кинг, Elizabeth O. King, амер. бактериолог)
Klebsiella клебсиелла (Клебс, Klebs, Theodor Albrecht Edwin, 1834–1913, нем.‑амер. бактериолог)
Kluyvera клюйвера (Клюйвер, Albert Jan Kluyver, 1888–1956, нидерл. биохимик и микробиолог)
koseri Козера (Козер, A. Koser, 1894–?, амер. бактериолог)
kristinae Кристины («Мисс Кристина Кинстад — Kristin Kinstad — прекрасный технический ассистент»)
lactamica лактамная (лактамы — циклические амиды карбоновых кислот)
lacunata лакунная (ямчатая)
lari ларидных (Larus чайка, Laridae чайковые, ларидные)
laterosporus латероспоровая (латеральноспоровая)
Leclercia леклерция (Леклерк, H. Leclerc, франц. бактериолог)
Legionella легионелла (уменьш. от «легион», возбудитель болезни легионеров)
leprae лепры
Leptospira лептоспира («тонкая спираль»)
Leptotrichia лептотрихия («тонкий волосок»)
Listeria листерия (Листер, Joseph Lister, 1827–1912, англ. хирург)
хирург)
lusitaniae лузитанская (Лузитания — название древней Португалии)
lwoffii Львова (Львов, Andre Mishel Lvoff, 1902–1994, франц. генетик и вирусолог)
mallei маллеиновая, -ый
maltophilia мальтофильный (солодолюбивый)
melaninogenica, ‑us меланиногенная, ‑ый
melitensis мальтийская (остров и гос‑во Мальта, Средиземное море)
meningitidis менингитная
megaterium мегатерная (мегатериум, Megaterium, «большой зверь», ископаемый ленивец)
meningosepticum менингосептическая
Micrococcus микрококк («маленький кокк»)
mirabilis мирабильный (удивительный)
mizutaii Мицуты (Акира Мицута, Akira Mizuta)
Mobiluncus мобилункус («подвижный»)
monocytogenes моноцитогенная
Moraxella моракселла (Моракс, Victor Morax, 1866–1935, швейц. ‑франц. офтальмолог)
‑франц. офтальмолог)
morbillorum морбил(л)озная (коревая)
Morganella морганелла (Морган, Harry De R. Morgan, 1863–1931, англ. врач)
morganii Моргана (см. выше)
mucosa мукозная (со слизистой оболочки)
multivorum мультиворусная (всеядная)
multocida мультоцидная (убивающая многие виды животных)
Mycobacterium микобактерия («грибообразная бактерия»)
mycoides микоидная (грибовидная)
Mycoplasma микоплазма («грибообразная плазма»)
Myroides мироидес («сходный с миррой — благоухающей смолой»)
naeslundii Неслунда (Неслунд, C. Neslund, в 1925 г. выделил из ротовой полости актиномицет, названный впоследстии его именем)
necrophorum некрофорная (несущая некроз)
Neisseria нейссерия (Нейссер, Albert Neisser, 1855–1926, франц. бактериолог)
бактериолог)
neteri Нетера (Эрвин Нетер, Erwin Neter, амер. врач‑микробиолог)
Nocardia нокардия (Нокард, Edmond Nocard, 1850–1903, франц. ветврач)
nodosus нодозный (узловатый)
novyi Нови (Нови, Frederick G. Novy, 1864–1957, амер. бактериолог)
nucleatum нуклеарная (имеющая ядро, ядерная)
Obesumbacterium обесумбактерия («тучная бактерия»)
ochracea охряная
Ochrobactrum охробактрум («охряно‑желтая палочка»)
odoratus одорантный (ароматный)
Oligella олигелла («маленькая, с узким кругом пищевых потребностей»)
oralis оральный (ротовой)
Orientia ориентиа («восточная»)
osloensis ословская (прилаг. от Осло, столицы Норвегии, ударение на первом слоге)
ovis овечья
ozaenae озены
pallidum паллидная (традиционно, от Омелянского, 1909 — «бледная»)
parahaemolyticus парагемолитический
parainfluenzae параинфлюэнцы
parapertussis парапертуссиновая
paraphrophilus парафрофильный (см. афрофильный)
афрофильный)
paratyphi паратифозная
Pasteurella пастерелла (Луи Пастер, Louis Pasteur, 1822–1895, франц. бактериолог)
paucimobilis пауцимобильный (малоподвижный)
penneri Пеннера (Пеннер, Penner J.L., амер. бактериолог‑биохимик)
Peptococcus пептококк («переваривающий кокк»)
Peptostreptococcus пептострептококк («переваривающий стрептококк»)
perfringens перфрингенсная (прорывающая (кожу при нарыве), традиционно, от Евсеенко, 1896, палочка «газовой гангрены»)
pertussis пертуссиновая
pestis пестис не склон. (возбудитель чумы)
phenylpyruvica фенилпировиноградная
Plesiomonas плезиомонас («соседнее — к Aeromonas — тельце»)
pneumoniae пневмонии
pneumophila пневмофильная (любящая легкие)
Porphyromonas порфиромонас («порфирное тельце»)
Prevotella превотелла (Прево, Andre Roman Prevot, 1894–1982, франц. микробиолог)
микробиолог)
Propionibacterium пропионибактерия («пропионовая бактерия»)
propionicum пропионовая
Proteus протей (Протей, морской бог; бактерия изменчива, как Протей)
Providencia провиденция (Провиденс, Providence, адм. центр штата Род‑Айленд, США)
prowazekii Провачека (Провачек, Станислав, Stanislav Provazek, 1875–1915, чеш.‑нем. микробиолог)
pseudoalcaligenes псевдоалкалигенный
pseudodiphtheriticum псевдодифтерийная
pseudomallei псевдомаллеиновая, -ый
Pseudomonas псевдомонас («ложное тельце»)
Pseudoramibacter псевдорамибактер («ложная рамибактерия»)
pseudotuberculosis псевдотуберкулезная
psittaci пситтакозная
ptyseos птиаловая (слюнная)
pylori пилорический (привратниковый)
pyogenes пиогенный (гноеобразующий)
quintana квинтанская (пятая: возбудитель лихорадки, повторяющейся каждые пять дней)
raffinosus рафинозный
recurrentis рекуррентная (возвращающаяся, возвратная)
regensburgei регенсбургская (Регенсбург, Германия)
renale ренальная (почечная)
rettgeri Реттгера (Реттгер, L. F. Rettger, амер. бактериолог)
F. Rettger, амер. бактериолог)
rhinoscleromatis риносклеромы
rhusiopathiae рузиопатии (рожи свиней)
Rickettsia риккетсия (Риккетс, Howard Teilor Ricketts, 1871–1910, амер. бактериолог)
rickettsii Риккетса (см. выше)
Rochalimaea рошалимея (Роша‑Лима, Henrique Rocha‑Lima, 1879–1956, бразильский патологоанатом)
roseus розовый
Ruminococcuss руминококк («кокк рубца»)
salivarius саливарный (слюнный)
Salmonella сальмонелла (Сальмон, Daniel Salmon, 1850–1914, амер. ветврач‑бактериолог)
sanguinis сангвы (крови)
saprophyticus сапрофитный
Sarcina сарцина («пакет, тюк»)
schleiferi Шлейфера (Шлейфер, Karl Heinz Schleifer, Мюнхенский ун‑т)
Serratia серратия (Серрати, Serafino Serrati, итальянский физик 18‑го века, который изобрел пароход; перитрихиальные палочки, которым дали его имя, напоминали пароход)
Shewanella шеванелла (Шеван, J. M. Shewan, англ. бактериолог)
M. Shewan, англ. бактериолог)
shigelloides шигеллоидный (похожий на шигеллу)
Shigella шигелла (Шига, Kiyoshi Shiga (1870–1957), японский бактериолог)
sibirica сибирская
simulans симулирующий
sonnei Зонне (Зонне, Carl Sonne, 1882–1948, датский бактериолог)
sordellii Сорделли (Сорделли, Alfredo Sordelli, 1891–1967, аргентинский микробиолог)
sphaericus сферическая
Sphingobacterium сфингобактерия («сжатые бактерии»)
Sphingomonas сфингомонас («сжатые тельца»)
sporogenes спорогенная
Staphylococcus стафилококк («гроздевидные кокки»)
Stenotrophomonas стенотрофомонас («тельце с узким кругом пищевых веществ»)
Stomatococcus стоматококк («ротовой кокк»)
Streptobacillus стрептобацилла («цепочка бацилл»)
Streptococcus стрептококк («цепочка кокков»)
stuartii Стюарта (Стюарт, C. A. Stuart, амер. бактериолог)
A. Stuart, амер. бактериолог)
stutzeri Штуцера (Штуцер, A. Stuzer, Цюрихский ун‑т, Швейцария)
subtilis субтильная (тщедушная) (традиционно, от Цопфа, 1884, «сенная палочка»)
suis суисная (свиней)
Suttonella саттанелла (Саттон, R.G.A. Sutton, амер. бактериолог)
Tatumella татумелла (Татум, Harvey Tatum, амер. бактериолог)
thetaiotaomicron тетайотаомикрон не склон. (название трех греческих букв — «тета», «йота» и «омикрон»)
tetani тетануса
thuringiensis тюрингская (Тюрингия, истор. название области Германии)
trachomatis трахомы
Treponema трепонема («вращающаяся нить»)
tsutsugamushi цуцугамуши не склон. (цуцугамуши — японская речная или кустарниковая лихорадка)
tuberculosis туберкулезная
tularensis туляремийная
typhi тифозная (традиционно, от Шульгина, 1885)
typhimurium тифомуриновая (традиционно, от Червякова, 1894 — «мышиного тифа», позднее — «крысиного тифа»)
urealyticum уреалитическая (разлагающая мочевину)
Ureaplasma уреаплазма («мочевинная плазма»)
ureolytica уреолитическая
urethralis уретральная (мочеиспускательного канала)
vaginalis вагинальная (влагалищная)
varium варьирующая
Veillonella вейлонелла (Вейлон, A. Veilon, франц. бактериолог)
Veilon, франц. бактериолог)
ventriculi вентрикулярная (желудочковая)
vesicularis везикулярный (состоящий из пузырьков)
vestibularis вестибулярный
Vibrio вибрион («вибрирующий»)
violaceum фиолетовая
vulgaris вульгарный (обыкновенный)
vulgatus вульгарный
warneri Варнера
Wolinella волинелла (Волин, Wolin, город в Польше)
Xanthomonas ксантомонас («желтое тельце»)xerosis ксерозная (вызывающая сухость конъюнктивы, кожи)
Xylella ксилелла («одеревенелые кусочки», это во что бактерия превращает виноградную лозу)
xylosus ксилозный
xylosoxidans ксилозоксидантный (окисляющий ксилозу)
Yersinia иерсиния (Йерсин, Alexandre Yersin, 1863–1943, швейц. бактериолог)
Yokenella иокенелла (kokuritsu‑YOboueisei‑KENkyusho — Национальный институт профилактики болезней и здоровья, Япония)
ОБСУЖДЕНИЕ
Роды.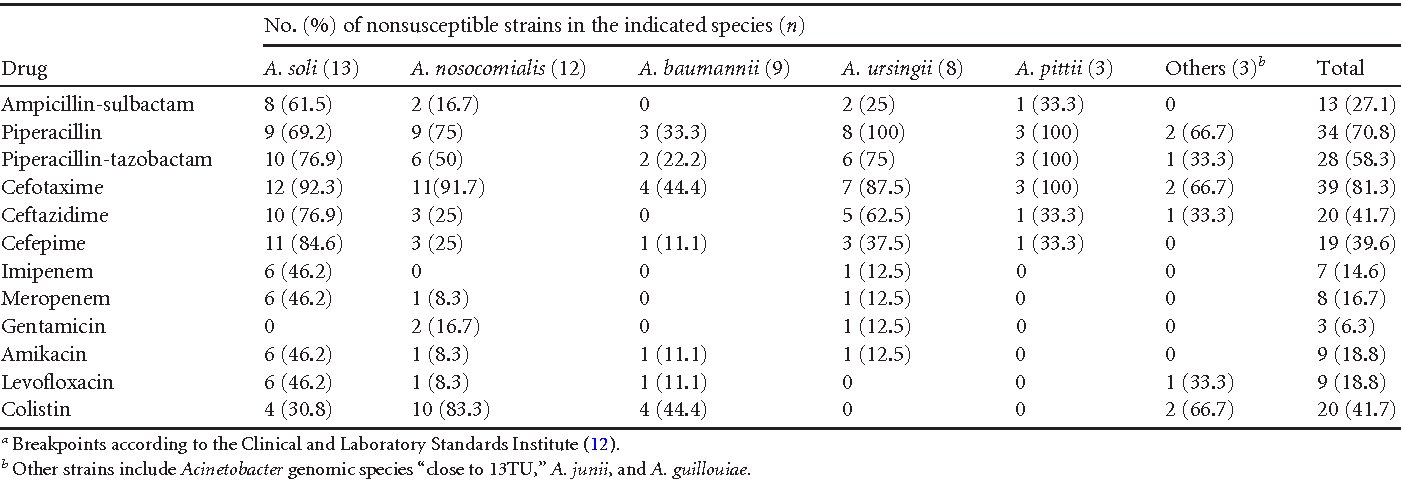 При ассимиляции названий родов «‑coccus» превратился в «кокк», «bacterium» — в бактерию, «‑myces» — в «мицет», «proteus» — в «протей», «clostridium» — в «клостридию». Эти изменения появились в конце 19‑го века: микрококк — Хомяков, 1876; стрептококк — Кудинов, 1895; бактерия — Шульгин, 1895; бацилла — Френкель, 1887; протей — Павловский, 1886. Однако прослеживается тенденция сохранения окончания: клостридиум — Гамалея, 1899; протеус — Соловцова, 1908. «Гемофилусу» повезло — он был принят без усечения, как и недавно описанные «атопобиум» и «мобилункус». Интересно, что в лексикон благополучно вошли без усечения окончаний слова на «‑ум» — форум, на «‑ес» — кариес, анофелес, геркулес, бизнес, адрес, деликатес и особенно много на «‑ус»: вирус, тонус, минус, страус, ребус, глобус, градус, радиус, фикус, лакмус, гумус. Возможно, эти слова ассимилировались позднее, когда стало ясно, что в изменении окончаний нет особой необходимости. По всей видимости, изменения окончаний у новых названий уже не будет.
При ассимиляции названий родов «‑coccus» превратился в «кокк», «bacterium» — в бактерию, «‑myces» — в «мицет», «proteus» — в «протей», «clostridium» — в «клостридию». Эти изменения появились в конце 19‑го века: микрококк — Хомяков, 1876; стрептококк — Кудинов, 1895; бактерия — Шульгин, 1895; бацилла — Френкель, 1887; протей — Павловский, 1886. Однако прослеживается тенденция сохранения окончания: клостридиум — Гамалея, 1899; протеус — Соловцова, 1908. «Гемофилусу» повезло — он был принят без усечения, как и недавно описанные «атопобиум» и «мобилункус». Интересно, что в лексикон благополучно вошли без усечения окончаний слова на «‑ум» — форум, на «‑ес» — кариес, анофелес, геркулес, бизнес, адрес, деликатес и особенно много на «‑ус»: вирус, тонус, минус, страус, ребус, глобус, градус, радиус, фикус, лакмус, гумус. Возможно, эти слова ассимилировались позднее, когда стало ясно, что в изменении окончаний нет особой необходимости. По всей видимости, изменения окончаний у новых названий уже не будет. Прослеживаются также некоторые другие особенности ассимиляции родовых названий. Соединительная гласная двукорневых слов не меняется, если не соответствует принятым у нас правилам (коринебактерия, но не коринобактерия, пропионибактерия, но не пропионобактерия). По действующим нормам правильно «геликобактер», а не «хеликобактер».
Прослеживаются также некоторые другие особенности ассимиляции родовых названий. Соединительная гласная двукорневых слов не меняется, если не соответствует принятым у нас правилам (коринебактерия, но не коринобактерия, пропионибактерия, но не пропионобактерия). По действующим нормам правильно «геликобактер», а не «хеликобактер».
Не удалось обнаружить новые названия «бревундимонас», «диалистер», «обесумбактерия», «охробактрум», «олигелла», «ориентиа», «псевдорамибактер», «рошалимея», «шеванелла», «сфингобактерия», «сфингомонас», зато выделяются роды, цитированные тысячу и более раз (актиномицет, бацилла, бифидобактерия, бруцелла, хламидия, коринебактерия, энтерококк, эшерихия, гарднерелла, ксебсиелла, легионелла, лептоспира, листерия, микобактерия, микоплазма, риккетсия, сальмонелла, шигелла, стафилококк, стрептококк, трепонема, уреаплазма, вибрион, иерсиния). По‑видимому, эти слова могут быть включены в общелитературные словари.
Виды. В общелитературный и специальный языки вошло много заимствований, которые соответствуют видовым эпитетам: агалактийный, агломерирующий, анаэробный, ангинозный, катаральный, клоачный, корродирующий, денитрифицирующий, дентальная, дивергентная, дизентерийная, энтеритная, энтероколитная, эпидермальная, фекальный, ферментирующая, флюоресцирующий, генитальная, гингивальный, грануломатозная, гранулярная, гемолизирующая, гемолитическая, гидрофильный, интермедиальная, лакунная, меланиногенная, микоидная, нуклеарная, охряная, одорантный, фенилпировиноградная, пневмонийная, пилорическая, пиогенный, рафинозный, саливарный, сапрофитный, симулирующий, сферическая, спорогенная, туберкулезная, туляремийная, уреалитическая, вагинальная, варьирующий, везикулярный, вестибулярный, ксерозный, ксилозный (эти слова согласованы с грамматическим родом названий бактерий, к которым они относятся).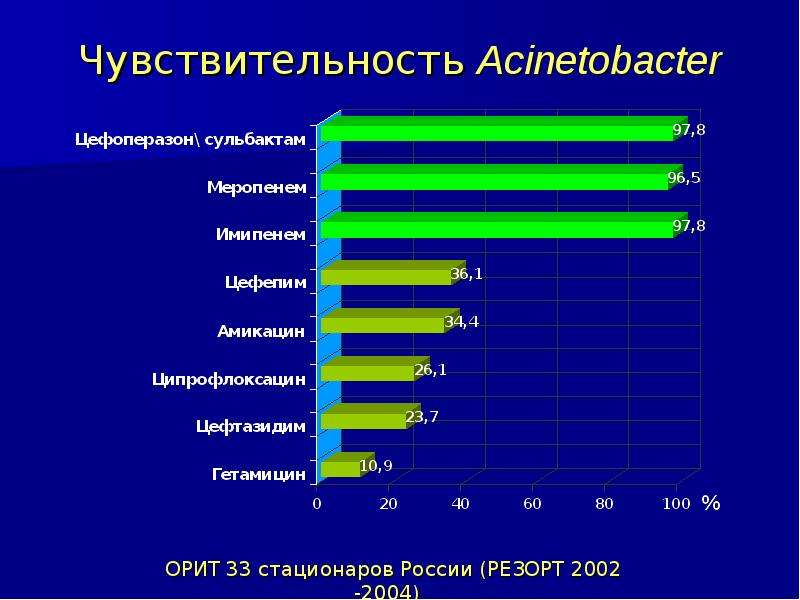 Приведенные слова давно могли быть использованы в качестве видовых эпитетов.
Приведенные слова давно могли быть использованы в качестве видовых эпитетов.
Интернет дает возможность подойти к унификации орфографии иностранных фамилий: Бойд, Бургдорфер, Бернет, Кон, Конор, Фергусон, Флекснер, Фрейденрейх, Фройнд, Фернис, Гарин, Хансен, Герман, Исраэл, Козер, Львов, Морган, Неслунд, Стюарт, Варнер. В родительном падеже прибавляется окончание «‑а». Афзель превращается в «Афзеля», Мицута — в «Мицуты». Фамилии женщин — Асбури, Дэвис, Хенсель, Хошин, как известно, не склоняются, имя «Кристина» превращается в «Кристины». Написание их фамилий (или имени) с большой буквы и в родительном падеже не будет ли свидетельством уважения к нашим выдающимся коллегам?
ВИДОВЫЕ ЭПИТЕТЫ, НЕ ВКЛЮЧЕННЫЕ В СПИСОК
Если в основной список включены видовые эпитеты, для которых оказалось возможным подобрать ассимилированные слова, независимо от того, использовались ли эти эпитеты в транслитерированном виде, или не использовались, то в этот раздел включены видовые эпитеты, для которых нам пока не удалось найти ассимилированные слова. В этом разделе находится около шестидесяти видовых эпитетов:
В этом разделе находится около шестидесяти видовых эпитетов:
alcalifaciens, avium, capitis, cepacia, cuniculi, diminuta, difficile, dispar, durans, equi, equinus, flavescens, gallinarum, hirae, hominis, jeikeium, lentum, liquefaciens, luteola, luteus, magnus, marcescens, marinum, micros, minutissimum, mitis, moniliformis, mucilaginosus, mulieris, mutans, niger, nonliquefaciens, oryzihabitans, oxytoca, parvula (-um), pneumosintes, productus, proteus, pumilus, putida, putrefaciens, recta (-us), rubidaea, septicum, sicca, solitarius, striatum, subflava, tarda, uberis, ulcerans, viridans, virosa, vulneris, vulnificus, zoohelcum.
Такие эпитеты, как «гоминис», «мутанс», «авиум», «диффициле» и «окситока» использовались в таком транслитерированном виде десятки раз. Всего же, с раздельным учетом одинаковых видовых эпитетов у разных видов, в нашей выборке находилось не менее трехсот видов.
ЗАКЛЮЧЕНИЕ
Разработка темы «Русские названия бактерий» прошла три этапа.
1. Вначале предметом исследования явились компоненты бактобиоты всех климатических поясов Земли. В Ленинградском химико‑фармацевтическом институте было объяснено значение полутора тысяч видовых эпитетов, приведенных в 8‑м издании определителя Берги (Минц И.П., Надель Н.Н., 1980).
Вначале предметом исследования явились компоненты бактобиоты всех климатических поясов Земли. В Ленинградском химико‑фармацевтическом институте было объяснено значение полутора тысяч видовых эпитетов, приведенных в 8‑м издании определителя Берги (Минц И.П., Надель Н.Н., 1980).
2. Затем исследованию подверглись компоненты ближневосточной бактобиоты субтропического пояса, которые были выявлены в Международном центре криптогамных растений и грибов при Институте эволюции Хайфского университета под руководством профессора С.П. Вассера (Rosen S., Ter‑Kazarian M., 2001). В состав биоты вошло четыреста видов, относящихся к ста родам. Объяснения значения каждого видового эпитета были представлены в виде однословных прилагательных, согласованных грамматически с родовыми названиями, так, как это было сделано в словаре названий высших растений (Каден Н.Н., Терентьева Н.Н., 1979). При этом была надежда на то, что в случае принятия этих толкований они могут стать русскими эквивалентами научных названий (Тер‑Казарьян С. Ш., 1983). Эти надежды, по всей видимости, не оправдались, но был предложен новый подход к этимологизации видовых эпитетов бактерий, без которой невозможна популяризация латыни.
Ш., 1983). Эти надежды, по всей видимости, не оправдались, но был предложен новый подход к этимологизации видовых эпитетов бактерий, без которой невозможна популяризация латыни.
3. И, наконец, третий этап — эта статья. Объектом исследования послужила группа видов, имеющих санитарно‑эпидемиологическое значение. Изучение хода образования русских эквивалентов научных названий показало, что то, что проходит у ботаников и зоологов, не проходит у бактериологов: в данном случае невозможны не только традиционные русские названия, но и переводные; теперь стало ясно, что национальными эквивалентами могут стать только ассимилированные эпитеты. Исследование возможностей использования в качестве видовых эпитетов ассимилированных слов показало, что из трехсот видов выборки это как будто бы удалось для двухсот двадцати пяти, что составляет 75%, возможность ассимиляции остальных эпитетов изучается. В лексический состав языка продолжают входить слова с латинскими или латинизированными корнями, которые могут быть использованы в создании национальных эквивалентов видовых эпитетов. Пополнение лексического фонда русского языка международными словами, как представляется, может явиться источником создания национальных эквивалентов бактерий этой группы в Восточноевропейских, Закавказских и Среднеазиатских постсоветских странах, в рамках обеспечения эпидемиологической безопасности Союза Независимых Государств.
Пополнение лексического фонда русского языка международными словами, как представляется, может явиться источником создания национальных эквивалентов бактерий этой группы в Восточноевропейских, Закавказских и Среднеазиатских постсоветских странах, в рамках обеспечения эпидемиологической безопасности Союза Независимых Государств.
ЛИТЕРАТУРА
- Каден Н.Н., Терентьева Н.Н. (1979) Этимологический словарь научных названий сосудистых растений, дикорастущих и разводимых в СССР. Вып. 1. Изд‑во Московского университета, М., 268 с.
- Кузякин А.П. (2005) Галерея лепидоптерологов России и сопредельных стран. Александр Петрович Кузякин (1915–1988) (http://jugan2.narod.ru/kuzyakin.html).
- Лобанов А.Л. (2005) Систематика и филогения. Жуки. Упрощенная классификация и русские названия (http://www.zin.ru/Animalia/Coleoptera/rus/syst.htm).
- Маркевич А.П., Татарко К.И. (1983) Русско‑украинско‑латинский зоологический словарь. Терминология и номенклатура.
 Наук. думка, К., 412 с.
Наук. думка, К., 412 с. - Минц И.П., Надель Н.Н. (1980) Методические указания по изучению латинских названий бактерий. Лен. химфарм. ин‑т, Л., 116 с.
- Ручко И.Е. (ред.) (1936) Бердже Д. Определитель микробов. Пер. А.П. Васильева. Изд‑во АН УССР, К., 770 с.
- Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н. (ред.) (2005) Практическое руководство по антиинфекционной химиотерапии (http://www.antibiotic.ru/ab/abbr_org.shtml).
- Тер‑Казарьян С. (1993) Не только водка валит с ног. Литературная газета, № 5 от 17 марта.
- Тер‑Казарьян С.Ш. (1983) О разработке упорядоченной транслитерированной и собственнорусской номенклатуры бактерий. В кн: М.Н. Чернявский (Отв. ред.) Проблемы обучения медицинской терминологии. Ереван, с. 116–118.
- Указ Президента Российской Федерации (2001) Об утверждении списка возбудителей заболеваний (патогенов) человека, животных и растений, генетически измененных микроорганизмов, токсинов, оборудования и технологий, подлежащих экспортному контролю.
 Указ Президента Российской Федерации от 8 августа 2001 г. № 1004 (http://document.kremlin.ru/doc.asp?ID=008466).
Указ Президента Российской Федерации от 8 августа 2001 г. № 1004 (http://document.kremlin.ru/doc.asp?ID=008466). - Euzeby J.P. (2006) List of prokaryotic names with standing in nomenclature (http://www.bacterio.net).
- Rosen S., Ter‑Kazarian M. (2001) Latin‑English‑Russian semasiological dictionary of bacterial names. J. Euzeby, Ed.‑in‑Chief. Ed. Board: E. Nevo, S.P. Wasser. Bactaxon, Moscow‑Eilat. 80 p.
- Skerman V.B.D., McGowan V., Sneath P.H.A. (1980) Approved lists of bacterial names. Int. J. Syst. Bacteriol., 30: 225–420 (См. также в кн.: Одобренные списки названий бактерий. Айастан, Ереван, 1982 г., с. 1–42, 231–420).
Тер-Казар’ян (Розен) Сергій Шмавонович, Романовська Вікторія Олександрівна
Резюме. Дослідження проведено відповідно до давньої традиції дбайливого ставлення української науки до російської біологічної номенклатури (перший переклад посібника Берги, укладання російсько-українсько-латинського зоологічного словника тощо) і в зв’язку з назрілою необхідністю виявлення результатів впливу міжнародної номенклатурної реформи в бактеріології на формування російської номенклатури бактерій, які мають санітарно-епідеміологічне значення. На відміну від ботаніків і зоологів, бактеріологи одностайно виступають не лише проти традиційних російських назв, але й проти перекладів видових епітетів. Показано, що майже всі родові назви ввійшли в лексичний склад мови, причому відзначено відмову від усічення або зміни закінчень нових назв. Виявлено тенденцію заміни транслітерованих видових епітетів асимільованими (тобто замість «гемолітикус» — «гемолітичний»). Одним із завдань дослідження було прискорення використання латинських слів і коренів, що ввійшли в даний час або раніше у російську мову як видові епітети. Робота в цьому напрямку триває.
На відміну від ботаніків і зоологів, бактеріологи одностайно виступають не лише проти традиційних російських назв, але й проти перекладів видових епітетів. Показано, що майже всі родові назви ввійшли в лексичний склад мови, причому відзначено відмову від усічення або зміни закінчень нових назв. Виявлено тенденцію заміни транслітерованих видових епітетів асимільованими (тобто замість «гемолітикус» — «гемолітичний»). Одним із завдань дослідження було прискорення використання латинських слів і коренів, що ввійшли в даний час або раніше у російську мову як видові епітети. Робота в цьому напрямку триває.
Ключові слова:бактерії санітарно-епідеміологічного контролю, родові назви — транслітерація, видові епітети — асиміляція
Ter-Kazarian S Sh, Romanovskaya V A
Summary. The study was conducted following the centuries-old tradition of Ukrainian science to carefully treat the Russian biological nomenclature (first translation of Bergey’s manual, compilation of the Russian-Ukrainian-Latin zoological dictionary, etc. ) and with regard to the ripening necessity of defining the impact of the 1980 international bacteriological nomenclature reform on the generation of Russian nomenclature of bacteria, having sanitary and epidemiological significance. Unlike botany and zoology, the bacteriologists unanimously object not only to the traditional Russian names but to the translation of specific epithets as well. It was found that nearly all generic names formed the organic part of the language thesaurus and so that the endings of these new names were not changed or truncated. The tendency for replacing the transliterated specific epithets by the assimilated ones was traced, and the study was aimed at accelerating the usage of Latin words and roots that have already come or are at present coming into Russian-language use as the specific epithets. The work is still under way.
) and with regard to the ripening necessity of defining the impact of the 1980 international bacteriological nomenclature reform on the generation of Russian nomenclature of bacteria, having sanitary and epidemiological significance. Unlike botany and zoology, the bacteriologists unanimously object not only to the traditional Russian names but to the translation of specific epithets as well. It was found that nearly all generic names formed the organic part of the language thesaurus and so that the endings of these new names were not changed or truncated. The tendency for replacing the transliterated specific epithets by the assimilated ones was traced, and the study was aimed at accelerating the usage of Latin words and roots that have already come or are at present coming into Russian-language use as the specific epithets. The work is still under way.
Адрес для переписки:Тер‑Казарьян Сергей Шмавонович (Сергей Розен)POB 2314, Eilat, 88000, IsraelTel./fax: (9728) 633-00-57E‑mail: Ter‑Kazarian2001@yandex. ruРомановская Виктория Александровна03143, Киев, ул. Академика Заболотного, 154Институт микробиологии и вирусологии им. Д.К. Заболотного НАН УкраиныПОГЛЯД НА ПРОБЛЕМУУКРАЇНСЬКИЙ МЕДИЧНИЙ ЧАСОПИС – № 3(53) – V/VI 2006
ruРомановская Виктория Александровна03143, Киев, ул. Академика Заболотного, 154Институт микробиологии и вирусологии им. Д.К. Заболотного НАН УкраиныПОГЛЯД НА ПРОБЛЕМУУКРАЇНСЬКИЙ МЕДИЧНИЙ ЧАСОПИС – № 3(53) – V/VI 2006
Бесплатные консультации врачей онлайн
Вопрос создается. Пожалуйста, подождите…
Только зарегистрированные пользователи могу задавать вопрос.
Зарегистрируйтесь на портале, задавайте вопросы и получайте ответы от квалифицированных специалистов!
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Зарегистрироваться
Как получить бонусы
К сожалению, у вас недостаточно бонусов для оплаты вопроса.
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Как получить бонусы
Раздел медицины*:
— Не указано —КоронавирусАкушерствоАллергология, иммунологияАнестезиологияВенерологияВертебрологияВетеринарияГастроэнтерологияГематологияГепатологияГериатрияГинекологияГирудотерапияГомеопатияДерматологияДиетологияИглотерапия и РефлексотерапияИнфекционные и паразитарные болезниКардиологияКардиохирургияКосметологияЛабораторная и функциональная диагностикаЛечение травмЛогопедияМаммологияМануальная терапияМРТ, КТ диагностикаНаркологияНеврологияНейрохирургияНетрадиционные методы леченияНефрологияОбщая хирургияОнкологияОстеопатияОториноларингологияОфтальмологияПедиатрияПлазмаферезПластическая хирургияПодологияПроктологияПсихиатрияПсихологияПсихотерапияПульмонология, фтизиатрияРадиология и лучевая терапияРеабилитологияРеаниматология и интенсивная терапияРевматологияРепродукция и генетикаСексологияСомнологияСпортивная медицинаСтоматологияСурдологияТерапияТравматология и ортопедияТрансфузиологияТрихологияУЗИУльтразвуковая диагностикаУрология и андрологияФармакологияФизиотерапияФлебологияЧелюстно-лицевая хирургияЭндокринологияЗатрудняюсь выбрать (будет выбрана терапия)
Кому адресован вопросВопрос адресован:
ВсемКонсультантам
Консультант, которому задается вопрос:
Всем. ..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Педиатр)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Али Мохамед Гамал Эльдин Мансур (Педиатр)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Дибиров Магомед Гусейнович (Стоматолог)Димина Тамара Олеговна (Акушер, Аллерголог, Ангиохирург)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Жердакова Дарья Владимировна (Акушер, Гинеколог)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Педиатр)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Али Мохамед Гамал Эльдин Мансур (Педиатр)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Дибиров Магомед Гусейнович (Стоматолог)Димина Тамара Олеговна (Акушер, Аллерголог, Ангиохирург)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Жердакова Дарья Владимировна (Акушер, Гинеколог)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
Описание проблемы:
Пол:
—укажите пол—ЖенщинаМужчина
Возраст:
Современные подходы к терапии хронического бактериального простатита | #09/04
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
На долю хронического бактериального простатита (ХБП) приходится 5–15% случаев заболевания [6]. Наиболее распространенными, по мнению большинства исследователей, этиологическими агентами ХБП являются такие грамотрицательные бактерии семейства Enterobacteriaceae, как Escherichia coli, которые обнаруживаются в 65–80% случаев инфекций. Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
В настоящее время обсуждается роль грамположительных бактерий — коагулазо-негативных стафилококков и стрептококков в развитии ХБП [5, 6, 7]. По нашим данным (Е. Б. Мазо и соавт., 2003, 2004) [1], основанным на результатах микробиологического исследования, которое проводилось в виде четырехстаканного теста Meares–Stamey у 70 больных с ХБП с 2002 г., именно коагулазо-негативные стафилококки играют ведущую роль (66%), если говорить об этиологии ХБП. Между тем на долю грамотрицательных патогенов приходится 19% случаев ХБП, а 15% составляют больные с Enterococcus faecalis. Аналогичными данными располагают М. Ф. Трапезникова и соавторы (2004), суммировавшие результаты идентификации 662 штаммов микроорганизмов у 264 больных ХБП, за которыми велось наблюдение в течение последних 13 лет. При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате.
При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
К предрасполагающим факторам развития ХБП относятся: уретропростатический рефлюкс; фимоз; анально-генитальные сношения без предохранения; инфекции мочевых путей; острый эпидидимит; постоянные уретральные катетеры и проведение трансуретральных операций у мужчин с инфицированной мочой без предшествующей антимикробной терапии [1]. У пациентов с ХП может быть выявлено нарушение секреторной функции простаты, характеризующееся изменением состава секрета, т. е. снижением уровней фруктозы, лимонной кислоты, кислой фосфатазы, катионов цинка, магния и кальция; цинксодержащего антибактериального фактора простаты. При этом увеличиваются такие показатели, как рН, отношения изоферментов лактатдегидрогеназы-5 к лактатдегидрогеназе-1, белков воспаления — церулоплазмина и компонента комплемента С3. Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции (см. табл. 1).
| Таблица 1 Симптомы хронического простатита | ||
| Локализация боли в тазовой области | Расстройство мочеиспускания | Расстройство эякуляции |
| В промежности В половом члене В яичках В паховой области Над лоном В прямой кишке В крестце | Учащенное мочеиспускание Неполное опорожнение мочевого пузыря Слабая или прерывистая струя мочи Боль или ее усиление во время мочеиспускания | Боли во время или после эякуляции Гемоспермия |
Ведущее место в лабораторной диагностике ХБП принадлежит микробиологическому исследованию — четырехстаканному локализационному тесту, предложенному в 1968 г. Meares и Stamey [8]. Он состоит в получении, после тщательного туалета наружных половых органов (во избежание контаминации поверхностными бактериями), первой (10 мл) и второй (средней) порций мочи для бактериологического исследования, массажа предстательной железы (ПЖ) со взятием секрета для микроскопии и посева, а также третьей порции мочи (после взятия секрета) для посева (рис. 1). Количественные посевы первой и второй порций мочи выявляют бактерии в уретре и мочевом пузыре, в то время как при посевах секрета простаты и порции мочи после взятия секрета (третьей порции мочи) выявляют флору простаты. ХБП характеризуется воспалительной реакцией в секрете (при микроскопии определяется более 10 лейкоцитов в поле зрения при большом увеличении). После инкубации посевов подсчитывают количество колониеобразующих единиц (КОЕ).
| Рисунок 1. Четырехстаканный локализационный тест Meares–Stamey |
Бактериологическое подтверждение ХБП мы проводим на основании, по крайней мере, одного из следующих критериев, предложенных K. G. Naber (2003):
- третья порция мочи или образец секрета простаты содержат бактерии одного штамма в титре 103 КОЕ/мл и более при условии стерильной второй порции мочи;
- третья порция мочи или образец секрета простаты содержат количество бактерий, десятикратно превышающее количество бактерий (КОЕ/мл) второй порции мочи;
- третья порция мочи или образец секрета простаты содержат более 103 КОЕ/мл истинных уропатогенных бактерий, отличных от других бактерий во второй порции мочи.
Характерное для ХБП содержание патогенов в образцах примерно следующее:
первая порция мочи < 103 КОЕ/мл;
вторая порция мочи < 103 КОЕ/мл;
секрет простаты ≥ 104 КОЕ/мл;
третья порция мочи ≥ 103 КОЕ/мл.
Четкое соблюдение правил микробиологической диагностики и вышеуказанных критериев интерпретации результатов локализационного теста Meares — Stamey на большом количестве наблюдений позволят более точно определить частоту встречаемости истинных патогенов ХБП.
Антимикробная терапия. После идентификации этиологического агента и определения антибиотикорезистентности возникает необходимость назначения больному с ХБП антимикробной терапии. К факторам, оказывающим влияние на выбор антимикробного препарата для лечения ХБП, относятся: чувствительность идентифицированного микроорганизма к антибиотику, его способность в достаточной концентрации проникать через гематопростатический барьер и накапливаться в ткани и секрете простаты, сперме, а также способность препарата преодолевать экстрацеллюлярную полисахаридную оболочку, формируемую микроколониями бактерий, и хорошая переносимость при длительном пероральном приеме. Идеальный антибактериальный препарат для лечения ХБП должен быть жирорастворимым, слабощелочным, с коэффициентом диссоциации, способствующим максимальной концентрации препарата в простате [2]. Антимикробные средства из группы фторхинолонов на сегодняшний день отвечают вышеперечисленным требованиям и являются препаратами выбора для лечения ХБП. Особенностью антибактериального действия фторхинолонов является наличие двух мишеней действия в бактериальной клетке, каковыми являются ферменты (топоизомеразы II типа), ответственные за изменения пространственной конфигурации бактериальной ДНК: ДНК-гираза и топоизомераза IV. ДНК-гираза осуществляет суперспирализацию бактериальной ДНК, а топоизомераза IV — разделение дочерних хромосом в процессе репликации. Ключевым моментом в действии фторхинолонов является образование трехкомпонентного комплекса (бактериальная ДНК–фермент–фторхинолон). Указанный комплекс предотвращает репликацию бактериальной ДНК. Благодаря тому, что топоизомеразы обладают расщепляющей активностью, происходит разрушение молекулы ДНК (С. В. Сидоренко, 2002).
| Рисунок 2. Классификация фторхинолонов (по K.G. Naber,1998) |
В настоящее время в практическое здравоохранение внедрены новые антимикробные препараты из группы фторхинолонов III и IV поколений, которые проявляют активность в отношении как грамотрицательных и грамположительных бактерий, так и атипичных внутриклеточных микроорганизмов, а также обладают способностью воздействовать на бактерии в биологических пленках (см. рис. 2). Антимикробная активность in vitro фторхинолонов III поколения — спарфлоксацина и левофлоксацина, а также фторхинолона IV поколения — моксифлоксацина наглядно представлена в таблице 2.
| Таблица 2 Антимикробная активность in vitro спарфлоксацина, левофлоксацина и моксифлоксацина (МПК90, мкг/мл) [4] | |||
| Микроорганизмы | Спарфлоксацин | Левофлоксацин | Моксифлоксацин |
| Acinetobacter spp. | 0,25 | 16 | 0,5 |
| Citrobacter freundii | 0,25 | 0,5 | 0,5 |
| Enterobacter cloacae | 0,5 | 0,5 | 0,5 |
| Escherichia coli | 0,12 | 0,12 | 0,5 |
| Klebsiella pneumoniae | 0,25 | 0,25 | 0,5 |
| Proteus mirabilis | 0,5 | 0,25 | 0,12 |
| Pseudomonas aeruginosa | 8 | 4 | 16 |
| Staphylococcus epidermidis | 1 | 1 | 2 |
| Staphylococcus saprophyticus | 0,25 | — | 0,5 |
| Enterococcus faecalis | 2 | 16 | 4 |
В 2004 г. мы сравнили чувствительность 25 различных штаммов коагулазо-негативных стафилококков — наиболее распространенных, по нашим данным (Е. Б. Мазо и соавт., 2003, 2004), этиологических агентов ХБП — к левофлоксацину, спарфлоксацину и моксифлоксацину. Бактериологическое исследование проводили классическим методом: выполняли посев мочи и секрета простаты на питательные среды с выделением чистой культуры и идентификацией выделенных штаммов при помощи полуавтоматического микробиологического анализатора Sceptor (Becton Dickinson, USA). Чувствительность выделенных микроорганизмов к левофлоксацину, спарфлоксацину и моксифлоксацину определяли дискодиффузионным методом на среде Мюллера–Хинтона. Результаты оценивали по значениям диаметров зон задержки роста. Всего было изучено 25 штаммов коагулазо-негативных стафилококков (21 — Staphylococcus haemolyticus, 3 — Staphylococcus epidermidis, 1 — Staphylococcus warnerii), выделенных в диагностическом титре из секрета простаты и мочи у больных ХБП при четырехстаканном тесте Meares–Stamey. Проведенный нами анализ чувствительности коагулазо-негативных стафилококков к фторхинолонам III и IV поколений показал наиболее высокую чувствительность этих бактерий к моксифлоксацину — у 24 (96%) штаммов. К левофлоксацину оказались чувствительны 21 (84%), а к спарфлоксацину 20 (80%) штаммов коагулазо-негативных стафилококков. Пять резистентных к спарфлоксацину штаммов были выделены нами у больных после длительной антимикробной терапии этим препаратом. Был выделен также штамм гемолитического стафилококка, резистентный ко всем фторхинолонам III и IV поколений у больного, ранее принимавшего в течение 6 нед моксифлоксацин. Проведенное исследование продемонстрировало высокую чувствительность коагулазо-негативных стафилококков, выделенных от больных ХБП, к фторхинолонам III и IV поколений. Чувствительность исследованных бактерий к моксифлоксацину оказалась наиболее высокой, в то время как к левофлоксацину и спарфлоксацину была практически одинаково ниже. Таким образом, длительная антимикробная терапия моксифлоксацином может привести к селекции устойчивых штаммов и развитию перекрестной резистентности к фторхинолонам III и IV поколений.
На сегодняшний день проведено ограниченное количество клинических исследований применения фторхинолонов в лечении ХБП. Результаты таких исследований, с периодом наблюдения не менее 6 мес, представлены в таблице 3.
Как видно из данных, приведенных в таблице 3, несмотря на существенные различия в количестве больных, принимавших участие в исследованиях, бактериальная эрадикация при различной длительности терапии фторхинолонами, наблюдалась более чем у 60% пациентов. Проведение подобных исследований в будущем, с соблюдением стандартов микробиологической диагностики, позволит выработать единый подход к рациональной антимикробной терапии ХБП.
Согласно актуальным на сегодняшний день рекомендациям Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин, принятым в 2001 г., длительность антимикробной терапии ХБП фторхинолонами или триметопримом должна составлять 2 нед (после установления предварительного диагноза). После повторного обследования больного антимикробную терапию рекомендуют продолжать суммарно в течение 4–6 нед только при положительном результате микробиологического исследования секрета простаты, взятого до начала лечения, или в случае, если у больного улучшилось состояние после приема антимикробных препаратов [2].
Антимикробные препараты, используемые для лечения ХБП, а также способы их применения приведены в таблице 4.
| Таблица 4 Способы применения антимикробных препаратов для лечения хронического бактериального простатита | ||
| Группа препаратов | Препараты | Способ применения |
| Фторхинолоны | Ципрофлоксацин (сифлокс, ципролет, цифран) | По 500 мг 2 раза в сутки |
| Офлоксацин (джеофлокс, заноцин, офлоксин 200) | По 400 мг 2 раза в сутки | |
| Ломефлоксацин (ксенаквин, ломфлокс, максаквин) | По 400 мг 1 раз в сутки | |
| Левофлоксацин (таваник) | По 500 мг 1 раз в сутки | |
| Спарфлоксацин (спарфло) | Первый прием 400 мг, затем по 200 мг 1 раз в сутки | |
| Моксифлоксацин (авелокс) | По 400 мг 1 раз в сутки | |
| Триметоприм/ сульфаметоксазол | Ко-тримоксазол (бикотрим, бисептол) | По 960 мг 2 раза в сутки |
Следует отметить, что больные с ХБП должны принимать антибиотик фторхинолонового ряда в течение длительного периода (от 4 до 6 нед) для предотвращения рецидива инфекции нижних мочевых путей. Продолжительная терапия антибиотиками в низких профилактических дозах или супрессивная антимикробная терапия могут применяться в случаях рецидивирующего или невосприимчивого к лечению простатита.
Литература
- Мазо Е. Б. Хронический инфекционный простатит// Материалы пленума правления Российского Общества урологов. — Саратов, 2004. — С. 267–289.
- Мазо Е. Б., Попов С. В., Карабак В. И. Антимикробная терапия хронического бактериального простатита// Русский Медицинский Журнал. — 2004. — Т. 12. — № 12. — С. 737–740.
- Трапезникова М. Ф., Савицкая К. И., Нестерова М. В. Мониторинг возбудителей хронического бактериального простатита// Материалы пленума правления Российского Общества уроло-гов. – Саратов, 2004. — С. 366.
- Zhanel G. G., Ennis K. et al. A critical review of the fluoroquinolones: focus on respiratory tract infections. Drugs. 2002; 62 (1): 13–59.
- Naber K. G. Antimicrobial treatment of bacterial prostatitis. Eur.Urol. Suppl. 2003; 2: 23–25.
- Krieger J. N., Egan K. J. Comprehensive evaluation and treatment of 75 men referred to chronic prostatitis clinic. Urology, 1991; 38: 11–19.
- Bergman B. On the relevance of gram-positive bacteria in prostatitis. Infection 1994; 22(Supp l):22.
- Meares E. M., Stamey T. A. Invest. Urol 1968; 5; 492.
С. В. Попов
А. К. Чепуров, доктор медицинских наук, профессор
В. И. Карабак, кандидат медицинских наук
РГМУ, Москва
Обратите внимание!
- В России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет.
- Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков.
- Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции.
Регламент синего света распространяется в пределах рода Acinetobacter
Abstract
Ранее мы показали, что условно-патогенный внутрибольничный патоген Acinetobacter baumannii способен воспринимать свет и реагировать на него через BlsA, белок фоторецепторного домена BLUF (определение синего света с использованием FAD). Здесь мы расширяем наши предыдущие исследования, показывающие, что регуляция света не ограничивается A. baumannii , а довольно широко распространена в пределах рода Acinetobacter .Во-первых, мы обнаружили, что синий свет модулирует подвижность и образование биопленок у многих видов этого рода, включая представителей Acinetobacter calcoaceticus-A. Бауманний комплекс. У многих из этих видов синий свет выступает в качестве ключевого фактора, определяющего выбор между подвижностью или сидячим положением при 24 ° C, тогда как у A. baumannii свет подавляет как подвижность, так и образование биопленок. Мы также показываем, что световая регуляция подвижности происходила не только при 24 ° C, но и при 37 ° C в не A.baumannii , в отличие от A. baumannii , который показывает фоторегуляцию только при 24 ° C. Во-вторых, мы показываем, что Acinetobacter baylyi (штамм ADP1) BLUF-фоторецепторы могут функционально заменять in vivo белок A. baumannii 17978 BlsA и что пути, ведущие к образованию биопленок, регулируются обратно пропорционально при 24 ° C между этими двумя микроорганизмы. Наконец, мы обнаружили наличие предсказанных генов, кодирующих BLUF-содержащие белки, во всех секвенированных геномах Acinetobacter , даже несмотря на то, что количество копий среди них варьируется.Филогенетический анализ предполагает общее происхождение всех доменов BLUF, присутствующих у членов этого рода, и может различать хорошо дифференцированные кластеры, которые группируют вместе гомологи BLUF из разных видов, ситуация особенно ясна для членов комплекса ACB. Несмотря на то, что эти белки, содержащие домен BLUF, играют роль в фоторегуляции, наблюдаемой у представителей рода , Acinetobacter является вероятным сценарием, учитывая наши данные для A. baumannii и A.baylyi , дальнейшие исследования подтвердят эту возможность.
Образец цитирования: Golic A, Vaneechoutte M, Nemec A, Viale AM, Actis LA, Mussi MA (2013) Взгляд на холодное солнце: регулирование синего света распространено в пределах рода Acinetobacter . PLoS ONE 8 (1):
e55059.
https://doi.org/10.1371/journal.pone.0055059
Редактор: Адам Дрикс,
Медицинский центр Университета Лойолы, Соединенные Штаты Америки
Поступила: 04.08.2012; Одобрена: 23 декабря 2012 г .; Опубликован: 24 января 2013 г.
Авторские права: © 2013 Golic et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: CONICET PIP 326 2011–2013 (www.conicet.gov.ar), PIP 114–200801–00469 (www.conicet.gov.ar), ANPCyT PICT 25972 (www.agencia.gov.ar) , Secretaría de Estado de Ciencia, Tecnología e Innovación de la Provincia de Santa Fe, Grant 2012 (www.santafe.gov.ar/index.php/web/content/view/full/93773). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Представители рода Acinetobacter являются строго аэробными, оксидазонегативными, повсеместно распространенными грамотрицательными кокобациллами, которые часто встречаются в окружающей среде, но также и в больничных условиях, где некоторые определенные группы этого рода были связаны со вспышками внутрибольничных инфекций [1].В настоящее время род включает 27 видов с действительными названиями (www.bacterio.cict.fr/a/acinetobacter.html) и несколько предполагаемых видов с предварительными обозначениями, включая девять геномных видов, очерченных гибридизацией ДНК-ДНК [1], [2]. Комплекс Acinetobacter calcoaceticus — Acinetobacter baumannii (ACB) представляет собой подгруппу в пределах рода, состоящую из близкородственных видов, включая A. baumannii , A. calcoaceticus, Acinetobacter nosocomialis и . 2]. A. calcoaceticus — это в основном экологический микроорганизм, редко участвующий в инфекциях человека, тогда как A. nosocomialis и A. pittii преимущественно выделяются от госпитализированных пациентов [1] — [3]. A. baumannii — клинически наиболее важный вид этого рода. В течение последних десятилетий он превратился в один из наиболее распространенных условно-патогенных микроорганизмов, участвующих в внутрибольничных инфекциях, обычно поражающих пациентов с ослабленным иммунитетом и пациентов с тяжелыми травмами [4].Вспышки штамма A. baumannii , как правило, обладают множественной лекарственной устойчивостью, могут легко колонизировать внутрибольничную среду и выдерживать неблагоприятные условия, такие как высыхание, недостаток питательных веществ и антимикробное лечение. Было предложено, что ключевым фактором, определяющим успех этого патогена в клинических условиях, является его способность прикрепляться и формировать биопленки на абиотических и биотических поверхностях [5] — [8]. Недавно мы сообщили, что этот внутрибольничный патоген воспринимает свет как стимул, управляющий многими процессами его жизненного цикла при низких температурах окружающей среды [5].Фактически, мы обнаружили, что синий свет ингибирует образование биопленок и пленок в клетках A. baumannii ATCC 17978, культивируемых при 24 ° C в жидком бульоне, и усиливает способность бактерий убивать нитевидную форму эукариотического гриба . Candida albicans [5]. Мы также показали, что клеток A. baumannii ATCC 17978 перестали перемещаться на пластинах с полутвердой средой в присутствии синего света при 24 ° C, в то время как они распределялись по всей поверхности пластин в темноте.Анализ геномной последовательности предложил вероятного кандидата на фоторецептор, участвующего в этом процессе: белок, содержащий BLUF-домен, кодируемый открытой рамкой считывания A1S_2225. Его участие в фоторегуляции A. baumannii было позже подтверждено как биофизическими, так и генетическими подходами, и поэтому он был обозначен как BlsA для синего света A [5]. Интересно, что регуляция света была потеряна при 37 ° C, температуре, совместимой с теплокровными хозяевами [5]. Эта температурная зависимость заставила задуматься о роли светочувствительности в образе жизни A.baumannii . Наша текущая гипотеза постулирует, что светочувствительность может играть роль в жизнедеятельности патогенов в окружающей среде, модулируя их поведение вне человеческого тела.
Многие вопросы возникают из нашей предыдущей работы, например, широко ли распространена регуляция синего света в пределах рода Acinetobacter . В таком случае уместными могут быть вопросы о том, проявляют ли виды в окружающей среде светопосредованные реакции и температурную зависимость, аналогичные описанным выше для A.baumannii . С другой стороны, регуляция синего света может быть ограничена только подгруппой, в которой содержится A. baumannii , что позволяет предположить, что приобретение светочувствительных генов произошло в результате недавних событий горизонтального переноса генов.
Таким образом, в этой работе мы оценили, разделяют ли другие виды в пределах рода Acinetobacter светозависимые ответы, описанные в A. baumannii , в частности, путем изучения фоторегуляции подвижности и образования биопленок.Мы также предоставляем понимание эволюции BLUF-доменов, кодируемых в геномах Acinetobacter , которые, как было показано, опосредуют регуляцию света в A. baumannii , путем вывода и анализа их филогенетических отношений. Эти знания могут способствовать нашему нынешнему пониманию роли, важности и эволюции светочувствительности и регуляции у этих видов бактерий.
Материалы и методы
Бактериальные штаммы
A. baumannii и E.coli , а также плазмиды, сконструированные и / или использованные в этой работе, перечислены в таблице 1. Штаммы Acinetobacter , использованные в этом исследовании, которые включают представителей 25 правильно названных видов, и их происхождение (если известно) являются перечислены в Таблице 2. « A. indicus » и « A. oleivorans » являются эффективно, но не валидно опубликованными названиями для отдельных штаммов (CCM 7832 и DR1, соответственно), и поэтому упоминаются между апострофами. О многих из этих штаммов уже сообщалось в литературе, в то время как другие, выбранные из нашей коллекции, были идентифицированы на уровне видов с помощью рестрикционного анализа амплифицированной рибосомальной ДНК (ARDRA) [9].Вся эта информация также указана в Таблице 2.
Эксперименты по подвижности клеток и анализы биопленок
Подвижность клеток тестировали на чашках с «плавающей агарозой» (триптон 1%, NaCl 0,5%, агароза 0,3%; 5) или LB-агарозой (пептон 1%, NaCl 1%, дрожжевой экстракт 0,5%, агароза 0,3%), инкубированных в наличие или отсутствие света. «Плавательная агароза» — это унаследованное название чашек с таким составом, но следует отметить, что представители рода Acinetobacter не совершают опосредованное жгутиками плавание, поскольку они не производят этот тип клеточных придатков [10].Анализы биопленки проводили в стеклянных пробирках, как описано ранее [5]. Все анализы выполняли по крайней мере в трех экземплярах как для светлых, так и для темных условий.
Планшеты или пробирки с биопленкой инкубировали при 24 ° C или 37 ° C в темноте или под светом, излучаемым матрицами светодиодов (светоизлучающих диодов) с интенсивностью от 6 до 10 мкмоль фотонов / м2 / с, определяемой с использованием литиевого Измеритель освещенности 250А (LI-COR). Каждый массив был построен с использованием трех светодиодных модульных полос (содержащих по три светодиода каждая), излучающих синий, зеленый или красный свет с пиками излучения с центрами при 462 нм, 514 нм и 636 нм соответственно, как было определено с помощью LI-COR LI- Спектрорадиометр 1800 [5].Следует отметить, что температура как жидкой, так и агаризованной среды в условиях освещения, использованных в этих экспериментах, существенно не отличалась от температуры, измеренной в темноте или в инкубационной камере.
Для количественной оценки биопленок использовали дубликаты культур для каждого образца при каждом условии. Одну пробирку немедленно обрабатывали ультразвуком в течение 5 с с помощью тонкого зонда и определяли OD 600 культуры для оценки общей биомассы клеток. Супернатант из другой пробирки был аспирирован и тщательно промыт дистиллированной водой.Клетки, прикрепленные к стенкам пробирки, визуализировали и количественно определяли путем окрашивания кристаллическим фиолетовым и солюбилизации этанолом-ацетоном, как описано в ссылке. [11]. Отношение OD 580 / OD 600 использовали для нормализации количества образующейся биопленки к общему содержанию клеток в каждом тестируемом образце, чтобы избежать вариаций из-за различий в росте бактерий в различных экспериментальных условиях. Планки погрешностей показывают стандартную ошибку среднего для 3 различных биологических повторов (n = 3).
Общие процедуры ДНК
Геномную и плазмидную ДНК выделяли, как описано ранее [4], и эксперименты по рестрикции и клонированию ДНК проводили с использованием стандартных протоколов [12]. Последовательности ДНК определяли в Центре секвенирования ДНК Университета штата Мэн, Ороно, штат Мэн, США; или в Macrogen (Корея).
Конструирование плазмид комплементации
фрагментов ДНК 886, 890, 942 и 772 п.н., соответствующих A. baylyi ACIAD1499, ACIAD2110, ACIAD2129 и ACIAD2125, предсказали гены, содержащие домен BLUF, и родственные промоторы были амплифицированы с помощью ПЦР с использованием A.Baylyi , общая ДНК ADP1 и праймеры 1499F (5′- ggatcc ctcatcaactataagta-3 ‘) и 1499R (5’- ggatcc aagtggctgatattaat-3′), 2110F (5′- ggatcat-3acgt и acgatccata 9000agt) 2110R (5′- ggatcc, tatttatgatccatcta-3 ′), 2125F (5′- ggatcc taacgacaagctataat-3 ′) и 2125R (5′- ggatcc acatatgaaagatacat-3 ′), 21ccatgaaagatacat-3 ′ agatatgtactcactca-3 ‘) и 2129R (5’- ggatcc gattatgtactggtaga-3′), все из которых имеют сайты рестрикции BamHI (указаны курсивом в последовательностях праймеров).Соответствующие ампликоны сначала клонировали в pGEM-T Easy (Promega), а затем субклонировали как фрагменты BamHI в родственный сайт pWh2266 [13]. Правильные конструкции комплементарных плазмид проверяли автоматическим секвенированием ДНК. Плазмидную ДНК электропорировали в A . baumannii ATCC 17978 blsA мутант (17978.OR), как описано ранее [5].
Амплификация и секвенирование генов, кодирующих BLUF
Наличие генов, кодирующих домен BLUF в штаммах A.calcoaceticus ACI 412, A. nosocomialis ACI 32 и A. pittii ACI 988 анализировали методом ПЦР колоний с использованием информации о последовательности, полученной из секвенированных геномом штаммов A. calcoaceticus PHEA-2, A. nosocomialis RUH 2624 и A. pittii SH 024 для конструирования специфических праймеров, которые амплифицируют родственные гены BLUF: A. calcoaceticus ADY82057, праймеры 82057F 5′-ggACATATgTATgCAAgTAAAACCA-3 ‘и 82057R 5’- gCTATCCA; А.nosocomialis EEW98085, праймеры 98085F 5′- gCTAgCATgAATgACTTTAgACTAC-3 ‘и 98085R 5′- ggATCCTTACTTTTTTAAAgCTTTACT-3’; A. nosocomialis EEX00046, грунтовки 46F 5′- ggACATATgAgTTTAATAggCTTTATg-3 ‘и 5′-46 R ggATCCTTAAACTTgATATTgATCCg-3’, и А. pittii EFF86081, праймеры 86081F 5′- ggACATATgAgTTTAATAggCTTTATg-3 ‘и 5’-86081R ggATCCCTAACCTTgATATTgATCAA -3 ′). Для амплификации близких гомологов A. baumannii BlsA, присутствующих в этих штаммах (ADY82317, EEX01065 и EFF86339), мы использовали праймеры EblsA.R / 5 (5′-GGATCCCTAGAACGGGTTTAC-3 ‘) и EblsA.F / 6 (5′-CATATGAACGTTCGCCTGTGT-3’), ранее описанные в ссылке. [5]. Амплифицированные фрагменты очищали гель-экстракцией (GFX, Amersham) и секвенировали в Macrogen (Корея).
Дисковый диффузионный тест на чувствительность к антибиотикам
чашки с агаром Müeller Hinton (MH) были засеяны культурой каждого тестируемого штамма, мутность которых была предварительно доведена до 0,5 стандарта МакФарланда с использованием свежей культуральной среды или физиологического раствора в соответствии с рекомендациями Национального комитета по клиническим лабораторным стандартам [14]. .Коммерческие противомикробные диски (BBL, Кокисвилл, Мэриленд, США), содержащие 10 мг ампициллина, 30 мг амикацина, 30 мг цефепима, 30 мг цефотаксима, 30 мг цефокситина, 30 мг цефалотина, 30 мг хлорамфеникола, 5 мг. ципрофлоксацина, 10 мг имипенема, 10 мг гентамицина, 10 мг меропенема, 100 мг пиперациллина или 5 мг рифампицина помещали на поверхность планшетов, которые затем инкубировали в течение ночи при 24 ° C или 37 ° C под синим светом. свет или тьма. Анализы проводили в трех экземплярах.
Анализ последовательности
Последовательности
белков были получены из баз данных NCBI (http://www.ncbi.nlm.nih.gov) и Pfam [15] и выровнены с использованием ClustalW версии 1.7 [16]. Чтобы исключить высокую вариабельность последовательностей, часто обнаруживаемую после доменов BLUF, которая — в некоторых случаях — предполагает разнообразие сопутствующих эффекторных доменов [17], только область, соответствующая домену BLUF (включающая 93–96 аминокислотных остатков, в зависимости от организма) был извлечен из полных последовательностей и использован для выравнивания.Пробелы были удалены из выравниваний с помощью BioEdit версии 7.05.3 [18].
Филогенетические выводы
Филогенетические отношения были выведены из выравнивания аминокислотных последовательностей с использованием программ, предоставленных в пакете PHYLIP, версия 3.69 [19] (http://evolution.genetics.washington.edu/phylip.html). Метод максимального правдоподобия (PROTML) был использован для построения филогенетического дерева BLUF-домена. Во всех случаях уровни достоверности были рассчитаны на основе 1000 повторных выборок начальной загрузки (SEQBOOT) выравниваний, используемых для филогенетических выводов, как методом объединения соседей с использованием матрицы расстояний Дейхоффа PAM (PROTDIST), так и метода экономии (PROTPARS), также включенного в программное обеспечение PHYLIP. пакет [19].
Результаты
Подвижность также регулируется синим светом у A. baumannii, отличных от
, Представители рода Acinetobacter
Учитывая, что свет регулирует подвижность у A. baumannii [5], мы проанализировали, способны ли другие виды этого рода также двигаться и реагировать на свет при 24 ° C. Мы обнаружили, что A. baylyi, A. calcoaceticus, A. nosocomialis, ‘A. oleivorans ’, A. pittii и A. tjernbergiae продемонстрировали светозависимую регуляцию подвижности, по крайней мере, у одного от трех до пяти исследованных штаммов (см. Фигуру 1 и Таблицу 2).Так же, как описано для A. baumannii [5], подвижность этих бактерий подавлялась в синем свете, тогда как в темноте они распространялись по всей поверхности чашки (рис. 1). В случае A. baylyi и A. pittii подавление синего света не было абсолютным, и бактерии все еще могли двигаться, хотя и в гораздо меньшей степени, чем в темноте (рис. 1). Интересно отметить, что внешний вид A. pittii отличается от внешнего вида других видов, таких как A.baumannii или A. calcoaceticus. A. pittii не двигался однородно от точки инокуляции, а скорее образовывал независимые полосы, исходящие из центра. Мы не наблюдали подвижность ни у одного из A. beijerinckii, A. bereziniae, A. bouvettii, A. brissouii, A. gerneri, A. guillouiae , A. gyllenbergii, A. haemolyticus, ‘A. indicus ’, A. johnsonii , A. junii , A. lwoffii , A. parvus , A. radioresistens , A.rudis , A. schindleri, A. tandoii, A. towneri, A. ursingii и A. venetianus проанализированы, хотя целых пять различных штаммов были протестированы для нескольких видов (таблица 2). В нашем предыдущем исследовании мы показали, что световая регуляция подвижности у A. baumannii происходит при 24 ° C, но не при температурах, связанных с теплокровными хозяевами, таких как 37 ° C [5]. Таким образом, затем мы оценили, проявляет ли какой-либо из штаммов, демонстрирующих фоторегуляцию при 24 ° C, также светорегуляцию при 37 ° C, и обнаружили, что в отличие от A.baumannii, все они действительно реагировали на свет при более высокой температуре инкубации (рисунок 1 и таблица 2). Следует отметить, что аналогичные результаты были получены, когда все штаммы были протестированы с использованием 0,3% LB-агарозы вместо «плавающей агарозы» в аналогичных экспериментальных условиях.
Рис. 1. Влияние света и температуры на подвижность бактерий.
Клетки разных видов в пределах рода Acinetobacter инокулировали на поверхность плавательных чашек. Планшеты проверяли и фотографировали после инкубирования в течение ночи в темноте (D) или в присутствии синего света (BL), зеленого света (GL) или красного света (RL) при 24 ° C или 37 ° C.Показаны только некоторые штаммы, демонстрирующие фоторегулируемую подвижность.
https://doi.org/10.1371/journal.pone.0055059.g001
Формирование биопленок также регулируется синим светом у не
A. baumannii Представителей рода Acinetobacter
Мы также оценили, регулируется ли фоторегуляция образования биопленок у разных видов в пределах рода, изучая их способность образовывать биопленки на стекле как в синем свете, так и в темноте при 24 ° C.Мы обнаружили, что по крайней мере один штамм A. baylyi, A. bereziniae, A. calcoaceticus, A. gerneri и A. rudis образовывал большое количество биопленки на пробирках, инкубированных в неподвижном свете под синим светом в течение четырех дней, в то время как уровни биопленок, образовавшихся в темноте, были значительно ниже или незначительны (Рисунок 2, Рисунок S1 и Таблица 2). Некоторые штаммы A. beijerinckii, A. brissouii, A. guillouiae, A. johnsonii, A. lwoffii, A. nosocomialis, A. pittii, A. ursingii и A.venetianus также продемонстрировал фоторегуляцию образования биопленок (Рисунок 2, Рисунок S1 и Таблица 2), но уровни биопленок стенки были ниже, чем у вышеупомянутых штаммов (Рисунок 2A). Интересно отметить, что даже несмотря на то, что у этих видов существует фоторегуляция образования биопленок (аналогично A. baumannii ), количество биопленок стенок, образованных не видами A. baumannii , было намного больше в синем свете, чем у видов A. baumannii . темнота, в отличие от A. baumannii , у которого более высокие уровни наблюдаются в темноте [5].У видов A. baumannii , отличных от , мы наблюдали в основном наличие только биопленок стенки. Присутствие пелликулов (при отсутствии биопленки на стенках одновременно) было очевидно только у нескольких штаммов: A. bereziniae , A. guillouiae , A. nosocomialis , A. pittii и A. radioresistens, и светорегуляции на них не обнаружено. Влияние света на образование биопленок при 37 ° C штаммами Acinetobacter , используемыми в этом исследовании, не могло быть оценено из-за больших различий, наблюдаемых в разных анализах.Такой ответ неудивителен, поскольку подобные ситуации были описаны ранее для клинических изолятов A. baumannii [5]. Сводка свойств биопленок всех исследованных штаммов представлена в таблице 2, а количественная оценка образования биопленок для штаммов, демонстрирующих фоторегуляцию, показана на рисунке 2 для репрезентативных случаев или на рисунке S1.
Рис. 2. Влияние света на формирование биопленки.
A. Биопленки, образованные клетками разных видов в пределах рода Acinetobacter , в стеклянных пробирках в присутствии синего света (L) или в темноте (D) регистрировали после статической инкубации в течение 96 ч при 24 ° C с помощью прямой визуальный осмотр и окрашивание кристаллическим фиолетовым.Показаны только репрезентативные примеры. B. Количественная оценка биопленок родственных образцов, показанных на A. Планки погрешностей показывают стандартную ошибку среднего для 3 различных биологических повторов (n = 3). OD 580 / 600 , оптическая плотность при 580 или 600 нм соответственно. L: свет; Д: Темный.
https://doi.org/10.1371/journal.pone.0055059.g002
Байлый А. : пример из практики
Тот факт, что A. baylyi содержит четыре паралогичных гена, кодирующих предполагаемые фоторецепторы, содержащие BLUF, обозначенные ACIAD1499, ACIAD2110, ACIAD2125 и ACIAD2129 (таблица 2), предполагает, что свет может играть ключевую роль в образе жизни бактерии, что может обосновать обилие этих генов и их возможную функциональную избыточность.Чтобы лучше охарактеризовать реакцию этой бактерии на свет, мы сравнили ее способность двигаться при красном или зеленом свете с ее реакцией на синий свет или темноту при 24 ° C. Мы заметили, что зеленый свет подавляет подвижность, хотя и в меньшей степени, чем синий свет (рис. 2). Напротив, при красном свете бактерии вели себя как в темноте. Таким образом, A. baylyi способен воспринимать зеленый свет и реагировать на него так же, как A. baumannii [5], что указывает на то, что по крайней мере один из четырех предполагаемых фоторецепторов способен реагировать на зеленый свет.
Затем мы проверили, способен ли какой-либо из различных фоторецепторов, присутствующих в A. baylyi , восстановить утраченную фоторегуляцию подвижности и образование биопленок при 24 ° C у мутанта A. baumannii ATCC 17978 blsA (17978.OR). ) [5]. С этой целью мы клонировали каждый из предсказанных A. baylyi генов фоторецепторов под их собственным промоторным контролем в челночной плазмиде pWh2266, чтобы получить pWh2499, pWh3110, pWh3125 и pWh3129 (Таблица 1).Затем мы трансформировали мутантный штамм 17978.OR этими конструкциями, а также пустым вектором, чтобы получить 17978.ORc 1499 , 17978.ORc 2110 , 17978.ORc 2125 , 17978.ORc 2129 и 17978.ИЛИ p соответственно. Наконец, мы проанализировали, проявляют ли эти штаммы фоторегуляцию подвижности или образование биопленок при 24 ° C.
На фиг. 3А показано, что 17978.OR, несущий пустую плазмиду pWh2266 (17978.ORp), не проявляет фоторегуляции подвижности, распространяясь по пластине ни в синем свете, ни в темноте при 24 ° C.Напротив, 17978.ORc 1499 , 17978.ORc 2125 и 17978.ORc 2129 показали резкое подавление подвижности в синем свете при распространении по пластине в темноте. Такой ответ напоминает реакцию дополненного штамма 17978.ORc BlsA , несущего нативный аллель A. baumannii blsA дикого типа (см. Рисунок 3A) [5]. Следовательно, соответствующие предполагаемые фоторецепторы A. baylyi способны полностью дополнять ген blsA .Напротив, фоторецептор A. baylyi , кодируемый ACIAD2110, только частично дополнял мутацию blsA в ATCC 17978, показывая, что он не может полностью восстановить функционирование BlsA в A. baumannii , по крайней мере, в отношении подвижности (рис. 3A).
Рисунок 3. Влияние синего света на биопленку и подвижность, опосредованное фоторецепторами A. baylyi ´ в генетическом фоне A. baumannii .
А. Клетки АТСС 17978.Мутант OR blsA , трансформированный плазмидами pWh2499, pWh3110, pWh3125 и pWh3129 или пустым вектором pWh2266, инокулировали на поверхность плавающих чашек. Планшеты проверяли и фотографировали после инкубации в течение ночи в темноте (D) или в присутствии синего света (L) при 24 ° C. Б. Биопленки, образованные мутантом ATCC 17978.OR blsA , трансформированные плазмидами pWh2499, pWh3110, pWh3125 и pWh3129 или пустым вектором pWh2266 на стеклянных пробирках, записывали после статической инкубации в течение 96 ч при 24 ° C путем прямого визуального осмотра и окрашивания. с кристально-фиолетовым.C. Количественная оценка биопленок родственных образцов, показанных на B. Столбики ошибок показывают стандартную ошибку среднего для 3 различных биологических повторов (n = 3). OD 580 / 600 , оптическая плотность при 580 или 600 нм соответственно. L: свет; Д: Темный.
https://doi.org/10.1371/journal.pone.0055059.g003
Мы также проанализировали влияние экспрессии различных фоторецепторов A. baylyi на способность A. baumannii ATCC 17978.OR клетки для образования биопленок при 24 ° C (рис. 3B и C). В этом случае все четыре фоторецептора, содержащие BLUF-домен A. baylyi , восстанавливали исходный фенотип, ведя себя как штамм 17978.ORc BlsA при тестировании, как описано ранее [5].
Синий свет и устойчивость к антибиотикам
Поскольку многие клинически значимые виды Acinetobacter демонстрируют выдающуюся способность быстро развивать устойчивость к антибиотикам, уменьшая, таким образом, доступные терапевтические возможности [4], мы предположили, влияет ли синий свет также на устойчивость к антибиотикам.С этой целью мы провели диско-диффузионные анализы чувствительности к антибиотикам как при 24 ° C, так и при 37 ° C в синем свете или в темноте, используя штаммы A. nosocomialis ACI 32, A. pitii ACI 988, оба из которых демонстрируют фоторегуляцию подвижности и образования биопленок, и A. haemolyticus ACI 25. Несмотря на различные антибиотики, принадлежащие к разным группам, такие как ампициллин (β-лактам), цефтазидим (β-лактам), цефалотин (β-лактам), хлорамфеникол (хлорамфеникол), ципрофлоксацин (фторхинолон), гентамицин (аминогликозид), имипенем (карбапенем-β-лактам), меропенем (карбапенем-β-лактам), пиперациллин (β-лактам) и рифампицин (рифамицин) не выявили значительных различий между светлые и темные условия при любой температуре для этих штаммов (Таблица S1).
Мы также оценили влияние света на устойчивость к антибиотикам у штаммов A. baumannii , так как этот вид наиболее часто восстанавливается в клинических условиях и тот, который, как широко сообщалось, проявляет устойчивость к нескольким антибиотикам [4]. Мы использовали здесь штамм ATCC 17978 (так как сообщалось, что он реагирует на свет), который чувствителен к большинству антибиотиков; а также штамм Ab244 [4], который демонстрирует устойчивость к нескольким антибиотикам и небольшую фоторегуляцию образования биопленок (Рисунок S1).Здесь снова, хотя многие антибиотики, принадлежащие к разным группам, были протестированы, например, имипенем, меропенем, клорамфеникол, рифампицин, ампициллин, амикацин (аминогликозид), пиперациллин, цефокситин (β-лактам), цефалотин (β-лактам), цефотаксим (β- лактам), цефепим (β-лактам) и цефтазидим (β-лактам), не наблюдалось никаких существенных различий, которые могли бы быть результатом дифференциальной резистентности, опосредованной светом (Таблица S1).
Белки, содержащие домен BLUF, у A. baumannii, отличных от
, Члены рода Acinetobacter
Ранее мы показали, что белок, содержащий домен BLUF, кодируемый в A.baumannii Геном ATCC 17978 является активным фоторецептором, который модулирует различные характеристики, такие как подвижность и образование биопленок [5], а также то, что четыре белка, содержащие домен BLUF, кодируемые штаммом A. baylyi ADP1, являются активными фоторецепторами, способными воспринимать свет и трансдуцируют сигнал в генетическом фоне A. baumannii , модулирующем подвижность и образование биопленок в этом организме. Чтобы еще больше расширить наши знания о белках, содержащих домен BLUF, мы проанализировали наличие и филогенетические отношения этих доменов у других представителей рода Acinetobacter , поскольку они, вероятно, могли бы играть аналогичные роли у других видов.С этой целью мы проверили полные (или почти полные) секвенированные геномы, доступные в базах данных представителей рода Acinetobacter , на наличие генов, кодирующих белки, содержащие BLUF-домен, чтобы определить, распространено ли их присутствие в роду и оценить их филогенетическое родство. Гены, кодирующие BLUF-содержащие белки, присутствовали во всех проверенных геномах, то есть геномах A. baumannii , A. baylyi , A. calcoaceticus , A.johnsonii , A. lwoffii , A. nosocomialis , ‘ A. oleivorans ’, A. pittii , A. radioresistens и Acinetobacter sp. ATCC 27244 (таблица 2). Стоит отметить, что на основе схемы Пастера MLST [20], а также сравнений последовательностей rpoB и фенотипического анализа [21], « A. oleivorans » DR1 тесно связан с одним из двух штаммов, обозначенных «Между 1 и 3 ‘, поэтому он также является членом комплекса ACB [A.Nemec, неопубликованные данные].
Как показано в таблице 2, количество предсказанных BLUF-содержащих белков, кодируемых на геном у вышеуказанных видов, колеблется от одного до шести. Действительно, примечательно, что близкие виды, такие как те, что входят в состав комплекса ACB, демонстрируют вариабельность количества генов, кодирующих белки, содержащие BLUF-домен. Как видно из таблицы 2, A. calcoaceticus PHEA-2, A. pittii SH024 и « A. oleivorans ’ DR1 кодируют два, а A.baumannii и A. nosocomialis RUh3624 кодируют один и три белка, содержащих BLUF-домен, соответственно. Кроме того, A. baylyi ADP1 кодирует четыре предполагаемых BLUF-фоторецептора, а A. radioresistens SK8 и Sh264 кодирует шесть и четыре, соответственно. Все предсказанные BLUF-белки, обнаруженные у представителей рода Acinetobacter , соответствуют наиболее распространенным бактериальным фоторецепторам BLUF, небольшим белкам, содержащим флавин-связывающее фотосенсирующее ядро, в котором отсутствует распознаваемый эффекторный или выходной домен (-ы), например BlsA из . А.baumannii [5].
Для определения филогенетических взаимоотношений между доменами BLUF, присутствующими в пределах рода Acinetobacter , мы извлекли 93 белковые последовательности, соответствующие доменам BLUF предсказанных и известных фоторецепторов синего света различных членов этого рода, а также организмов, принадлежащих к разным таксоны, такие как α, β, γ и δ Proteobacteria; и от эукариот, таких как Euglenozoa и Fungi (рис. 4) [22]. В некоторых случаях, таких как последовательности Euglena и Eutreptiella , которые содержат два BLUF-домена в одной и той же молекуле белка, обе последовательности были включены в анализ.На рисунке 4 показано филогенетическое дерево максимального правдоподобия, построенное на основе сопоставлений вышеуказанных последовательностей, при этом значения начальной загрузки были рассчитаны с помощью методов объединения соседей и экономии. Дерево ясно показывает, что все BLUF-домены, присутствующие в представителях рода Acinetobacter , сгруппированы в хорошо поддерживаемый монофилетический кластер (значения начальной загрузки 100% и 99% по NJ и экономичности, соответственно), что позволяет предположить, что все эти предполагаемые фоторецепторные домены имеют общее происхождение.Кластер Acinetobacter содержит две основные ветви, B1 и B2 (рисунок 4). Каждая ветвь содержит по крайней мере один ген паралога от каждого вида (похожие цвета в B1 и B2), за исключением A. lwoffii (чьи паралоги ограничены B2, голубыми последовательностями) и всех штаммов A. baumannii , каждый показывает один ген, кодирующий очень похожие белки, содержащие BLUF-домен ( blsA ), также сконцентрированные в B2.
Рисунок 4. Филогенетические отношения доменов BLUF, обнаруженных в разных таксонах.
Филогенетическое дерево максимального правдоподобия домена BLUF, построенное с использованием последовательностей из различных ветвей бактерий, Euglenozoa и Fungi. Регистрационные номера различных последовательностей указаны после соответствующих названий видов. Показаны различные кластеры, поддерживаемые значениями начальной загрузки (от C1 до C4) в пределах Acinetobacter . Этим же цветом обозначены паралоги одного вида Acinetobacter . Процентное соотношение 1000 повторных попыток начальной загрузки, поддерживающих различные кластеры, полученное с помощью объединения соседей (над линиями) или экономия (под линиями), указано в бифуркациях (сообщаются только результаты начальной загрузки> 50%).
https://doi.org/10.1371/journal.pone.0055059.g004
Стоит отметить, что, за единственным исключением Psychrobacter , другие роды семейства Moraxellaceae, , т.е. Alkanindiges , Enhydrobacter , Moraxella , Oligella , Paraperlucidibaca и Perlucidibaca, не содержат генов, кодирующих BLUF-содержащие белки. Несмотря на присутствие BLUF-доменов в Psychrobacter , как показано на примере гомолога, присутствующего в P.cryohalolentis , эта последовательность не группируется вместе с последовательностями Acinetobacter (фиг. 4), что указывает на значительное расхождение с доменами BLUF, присутствующими у представителей этого рода. В целом, на дереве не наблюдается горизонтального переноса генов между представителями рода Acinetobacter и другими организмами, не содержащими Acinetobacter BLUF. Скорее всего, все гены, содержащие BLUF-домен, обнаруженные у существующих в настоящее время видов рода Acinetobacter , произошли от местного гена, содержащего BLUF-домен, уже присутствующего у общего предка рода.Дальнейший анализ позволяет дифференцировать четыре кластера, поддерживаемых значениями начальной загрузки (C1, C2, C3 и C4, рисунок 4), которые группируют вместе гомологи домена BLUF из разных видов (особенно ясно для членов комплекса ACB). Например, кластер C4 внутри B2 группирует последовательности домена BLUF членов комплекса ACB, таких как все белков BlsA A. baumannii , с гомологами, присутствующими в A. calcoaceticus , DR1, A. nosocomialis и A. pittii. , которые, в свою очередь, разделяют монофилетический кластер с A.baylyi (ACIAD2110), A. radioresistens и Acinetobacter ATCC 27244. Кластер C2 внутри B1 объединяет другой набор гомологов домена BLUF, также присутствующих в членах комплекса ACB, включая A. calcoaceticus , DR1, A В. nosocomialis и A. pittii , все они составляют монофилетический кластер с BLUF-доменом A. baylyi (ACIAD2125). Наконец, в кластере C1 (B1) сгруппированы третий паралог домена BLUF, присутствующий в A.nosocomialis RUh3624 делит кластер с гомологами, присутствующими в A. baylyi (ACIAD1499 и ACIAD2129) и A. radioresistens . В целом, множественные дупликации и дифференциальные потери генов, происходящие во время эволюции различных линий Acinetobacter , могут объяснить присутствие разного числа паралогов генов, содержащих BLUF-домен, у различных видов, составляющих род. Кроме того, ортологам могут соответствовать гомологи от разных видов, сгруппированные вместе в разные кластеры (C1 – C4); я.е. они были разделены событием видообразования, но также могли возникнуть в результате горизонтального переноса генов, кодирующих BLUF, среди видов Acinetobacter .
Наконец, не было получено надежных значений начальной загрузки для ветвей, группирующих последовательности, отличные от Acinetobacter , вероятно, из-за структурного сходства, а не сходства последовательностей между различными доменами BLUF.
Присутствие генов, кодирующих BLUF, в штаммах, демонстрирующих фоторегуляцию подвижности и образования биопленок
Наконец, мы проанализировали, обладают ли штаммы, которые проявляют фоторегуляцию подвижности и образование биопленок, такие как A.calcoaceticus ACI 412, A. nosocomialis ACI 32 и A. pittii ACI 988 содержал гены, содержащие домен BLUF. Для этой цели мы использовали информацию, полученную из секвенированных геном штаммов A. calcoaceticus PHEA-2, A. nosocomialis RUH 2624 и A. pittii SH 024, чтобы разработать специфические праймеры, которые амплифицируют родственные гены, кодирующие BLUF ( соотв. номера ADY82057 и ADY82317 для A. calcoaceticus ; EEW98085, EEX00046 и EEX01065 для A.nosocomialis ; и EFF86081 и EFF86339 для A. pittii ) и исследовали их присутствие с помощью ПЦР и нуклеотидного секвенирования. Мы обнаружили присутствие гомологов, демонстрирующих 100% идентичность с ADY82057 и ADY82317, в A. calcoaceticus ACI 412, EEX00046 и EEX01065 в A. nosocomialis ACI 32 и EFF86081 и EFF86339 в A. pittii ACI (таблица ACI). 2). Нам не удалось получить продукт амплификации в случае A. nosocomialis EEW98085, несмотря на то, что мы исследовали различные условия амплификации.
Обсуждение
В этой работе мы показываем, что регуляция света не ограничивается A. baumannii , а довольно широко распространена в пределах рода Acinetobacter . Фактически, мы обнаружили, что синий свет эффективно регулирует подвижность и образование биопленок при 24 ° C у многих видов Acinetobacter , включая членов комплекса ACB, таких как A. calcoaceticus, A. nosocomialis и A. pittii ( см. рисунок 1 и таблицу 2). Но в отличие от А.baumannii , у которых образование биопленок подавляется синим светом при стимуляции в темноте, противоположное наблюдали у всех других видов, у которых была обнаружена регуляция синего света: образование биопленок подавлялось в темноте при стимуляции синим светом. У видов A. baumannii , отличных от , у которых регулируется как образование биопленок, так и подвижность, таких как A. baylyi , A. calcoaceticus , A. nosocomialis и A. pittii, низкая биопленка коррелирует с высокой подвижностью под землей. темные условия.Этот ответ имеет смысл, поскольку большой объем данных поддерживает идею о том, что можно ожидать, что подвижность и образование биопленок будут взаимоисключающими и контррегулируемыми, то есть липкость кажется контрпродуктивной для передвижения, тогда как адгезия и оседание могут потребовать снижения активности двигательный аппарат [23] — [25]. Таким образом, у этих бактерий синий свет способствует выбору между подвижностью и сидячим поведением, а также может облегчить акклиматизацию в различных средах. В нашей предыдущей работе мы показали, что регулирование синего света в А.baumannii происходил только при низкой температуре, что позволяет предположить, что он важен во время его жизни в окружающей среде, возможно, позволяя бактериям определять места в окружающей среде за пределами человеческого хозяина [5]. Однако представленные здесь результаты показывают, что многие виды в окружающей среде, такие как A. baylyi , A. calcoaceticus и A. tjernbergiae, , а также клинически значимые виды A. nosocomialis и A. pittii , отображались регулирование моторики синим светом также при 37 ° C.Такое различное поведение при 37 ° C по сравнению с A. baumannii может быть результатом дополнительного содержания предполагаемых фоторецепторов BLUF-домена, закодированных в геномах этих видов A. baumannii , отличных от (Рисунок 4 и Таблица 2). Действительно, в геноме A. baumannii кодируется только один фоторецептор. Белок, присутствующий в штамме ATCC 17978, BlsA, скорее всего, функционирует только при 24 ° C: уровни мРНК blsA при 37 ° C значительно ниже по сравнению с уровнями при 24 ° C [5], а содержание белка BlsA в количество клеток при 37 ° C незначительно или равно нулю [Mussi et al., неопубликованные данные]. В качестве альтернативы, различное поведение при 37 ° C между A. baumannii и другими видами Acinetobacter может быть результатом идиосинкразических различий в паттернах экспрессии фоторецепторов и / или путей и партнеров, модулирующих функции подвижности ниже по ходу этапа светочувствительности у этих организмов. В любом случае, A. baumannii мог стать «слепым» для света при 37 ° C, потому что в относительной темноте теплокровных тканей хозяина нет положительного отбора для ответа на этот стимул.
Способность генов, содержащих BLUF-домен A. baylyi , восстанавливать фоторегуляцию при 24 ° C в мутанте ATCC 17978 blsA не только подтверждает, что они кодируют настоящие фоторецепторы BLUF, но также и то, что они могут преобразовывать свет. сигнал в A. baumannii каскадов регуляции подвижности и биопленки, вероятно, с использованием партнера / партнеров BlsA. В этом контексте A. baylyi образовывали большое количество биопленок в синем свете, и почти ничтожное количество образовывалось в темноте.Поэтому примечательно, что противоположная ситуация наблюдается, когда фоторецепторов A. baylyi экспрессируются в мутанте A. baumannii blsA , восстанавливая во всех случаях фенотип дикого типа, соответствующий этому виду. Следовательно, оба каскада в A. baumannii и A. baylyi , по-видимому, имеют обратное влияние при 24 ° C, независимо от происхождения используемого фоторецептора.
Кроме того, мы обнаружили, что гены, содержащие BLUF-домен, являются активными фоторецепторами в A.baumannii и A. baylyi , присутствуют во всех полностью секвенированных геномах, доступных для представителей этого рода, а также в штаммах, демонстрирующих фоторегуляцию подвижности и образования биопленок, таких как A. calcoaceticus ACI 412, A. nosocomialis ACI 32 и A. pittii ACI 988. Различное количество генов, кодирующих белки, содержащие BLUF-домен (от одного до шести) у разных видов, проанализированных в этом исследовании, предполагает, что восприятие света и реакция на свет могут иметь различное значение среди их, вероятно, отражая их разный образ жизни и разнообразие ниш, в которых они преуспевают.Филогенетический анализ предполагает общее происхождение всех доменов BLUF в пределах Acinetobacter и может различать хорошо дифференцированные кластеры, которые группируют вместе гомологи BLUF из разных видов, что особенно ясно для членов комплекса ACB, которые, скорее всего, соответствуют группам ортологов. Различные кластеры могут отражать более тесные филогенетические отношения между видами с родственными ортологами, или наблюдаемая кластеризация могла быть результатом горизонтального переноса генов, кодирующих BLUF, между видами Acinetobacter .
Наконец, мы не смогли обнаружить фоторегуляцию ни подвижности, ни образования биопленок у многих видов или штаммов рода Acinetobacter , несмотря на присутствие нескольких генов, содержащих BLUF-домен (таких как 4-6 предполагаемых фоторецепторов BLUF-домена присутствует в геномах A. radioresistens , Таблица 2). Это неудивительно, поскольку аналогичная ситуация ранее была описана нами в случае штамма A. baumannii ATCC 19606 T [5].Многие возможности могут привести к вышеуказанным результатам: механизмы подвижности или образования биопленок могут быть нарушены у некоторых из этих штаммов, или их специфические компоненты могут не экспрессироваться в изученных условиях. Тем не менее, свет может регулировать другие клеточные процессы, не проверенные в этой работе. Кроме того, другие возможные объяснения предполагают, что гены фоторецепторов в этих штаммах могут не экспрессироваться в исследуемых условиях, соответствующие белки могут быть не активными или партнеры нижестоящего сигнального каскада или мишени фоторецепторов, участвующих в этих фенотипах, могут отсутствовать.Оставляя в стороне частные случаи, которые не были бы неожиданными, поскольку высокая генетическая гетерогенность была описана для штаммов некоторых представителей Acinetobacter , таких как A. baumannii [4], [5], [26], сохранение множественных Гены, содержащие BLUF-домен, а также тот факт, что они не были подвергнуты генетическому происхождению, предполагает, что они были сохранены, чтобы играть важную роль в бактериальной физиологии. Скорее всего, эти предполагаемые фоторецепторы могут выполнять функции, модулирующие другие клеточные процессы, которые остаются неидентифицированными у этих видов.Тем не менее, функциональная характеристика белков, содержащих домен BLUF, кодируемых у видов рода Acinetobacter , отличных от таковых из A. baumannii или A. baylyi , все еще должна быть проведена, чтобы установить их роль в качестве фоторецепторов, участвующих в восприятии света. эти микроорганизмы. Что касается других клеточных процессов, на которые влияет свет, стоит упомянуть, что мы не смогли обнаружить световую регуляцию устойчивости к антибиотикам у различных клинически значимых видов рода Acinetobacter .Тем не менее, дальнейшие исследования помогут сделать окончательный вывод в этом смысле.
Наше понимание механизмов передачи сигнала и регуляторных каскадов, участвующих в A. baumannii BlsA и его гомологах, присутствующих в других видах рода Acinetobacter , все еще ограничено и в настоящее время изучается в нашей лаборатории. Конечная цель — получить полное представление о регуляции света в отношении ниш и образа жизни хозяина, что, возможно, потребует дальнейшего понимания биологии Acinetobacter .
Дополнительная информация
Рисунок S1.
Количественная оценка биопленок, продуцируемых различными штаммами, показывающая фоторегуляцию образования биопленок в пределах рода Acinetobacter . Планки погрешностей показывают стандартную ошибку среднего для 3 различных биологических повторов (n = 3). OD 580 / 600 , оптическая плотность при 580 или 600 нм соответственно.
https://doi.org/10.1371/journal.pone.0055059.s001
(TIF)
Таблица S1.
Синий свет и устойчивость к антибиотикам. Обсуждение диффузионного анализа чувствительности к антибиотикам в синем свете или в темноте при 24 или 37 ° C некоторых штаммов A. nosocomialis , A. pittii и A. baumannii , который показал фоторегуляцию подвижности и / или биопленки. формирование. Штаммы A. haemolyticus , проанализированные в этой работе, не показали фоторегуляции ни подвижности, ни образования биопленок, но один штамм был включен в это исследование из-за важности этого вида в клинических условиях.Указан диаметр ингибирования из трех независимых экспериментов (мм +/- SEM из трех биологических повторов). AM, ампициллин; АН, амикацин; ФЭП, цефепим; CTX, цефотаксим; FOX, цефокситин; CAZ, цефтазидим; CF, цефалотин; C, левомицетин; CIP, ципрофлоксацин; ИПМ, имипенем; ГМ, гентамицин; МЕМ, меропенем; ПИП, пиперацилин; РА, рифампицин.
https://doi.org/10.1371/journal.pone.0055059.s002
(XLSX)
Благодарности
Мы в долгу перед Р.Дж. Севиур за предоставление штаммов, представляющих некоторые из различных видов рода Acinetobacter . Мы также благодарим доктора Вуджун Пак за предоставление A. sp. DR1 (« A. oleivorans ») и доктору Харальду Зейферту за предоставление секвенированных геномов штаммов Acinetobacter . M.A.M. и A.M.V. карьерные исследователи CONICET.
Вклад авторов
Эксперимент задумал и спроектировал: MAM LAA. Проведены эксперименты: АГ МАМ. Проанализированы данные: МАМ ЛАА МВ АН.Предоставленные реагенты / материалы / инструменты анализа: MAM AMV. Написал статью: МАМ ЛАА АМВ АН МВ.
Ссылки
- 1.
Vaneechoutte M, Kaempfer P, Dijkshoorn L, Nemec A, Wauters G (2011) Acinetobacter , Chryseobacterium , Moraxella и другие неферментативные грамотрицательные палочки. В: Versalovic J, Carroll KA, Funke G, Jorgensen JH, Landry ML, Warnock DW, редакторы. Руководство по клинической микробиологии 10 th Ed. Вашингтон, округ Колумбия: ASM Press.714–738. - 2.
Nemec A, Krizova L, Maixnerova M, van der Reijden TJ, Deschaght P и др. (2011) Генотипическая и фенотипическая характеристика комплекса Acinetobacter calcoaceticus-Acinetobacter baumannii с предложением Acinetobacter pittii sp. ноя (ранее Acinetobacter геномных видов 3) и Acinetobacter nosocomialis sp. ноя (ранее Acinetobacter геномных видов 13TU). Res Microbiol 162: 393–404. - 3.
Дугари Х., Ндакидеми П., Человек I, Бенаде С. (2011) Экология, биология и патогенез Acinetobacter spp .: обзор. Microbes Environ 26: 101–112. - 4.
Мусси М.А., Лиманский А.С., Реллинг В., Раваси П., Аракаки А. и др. (2011) Горизонтальный перенос генов / ассортативная рекомбинация в клинической популяции Acinetobacter baumannii обеспечивает генетическое разнообразие в одном гене carO , кодирующем главный белковый канал внешней мембраны.J Bacteriol 193: 4736–4748. - 5.
Mussi MA, Gaddy JA, Cabruja M, Arivett BA, Viale AM и др. (2010) Условно-патогенный микроорганизм человека Acinetobacter baumannii воспринимает свет и реагирует на него. J Bacteriol 192: 6336–6345. - 6.
Gaddy JA, Actis LA (2009) Регулирование образования биопленок Acinetobacter baumannii . Future Microbiol 4: 273–278. - 7.
Gaddy JA, Tomaras AP, Actis LA (2009) Белок Acinetobacter baumannii 19606 OmpA играет роль в образовании биопленок на абиотических поверхностях и во взаимодействии этого патогена с эукариотическими клетками.Заражение иммунной 77: 3150–3160. - 8.
Томарас А.П., Дорси К.В., Эдельманн Р.Э., Актис Л.А. (2003) Прикрепление и формирование биопленки на абиотических поверхностях с помощью Acinetobacter baumannii : участие новой системы сборки шаперон-помощник пилей. Microbiol 149: 3473–3484. - 9.
Dijkshoorn L, van Harsselaar B, Tjernberg I, Bouvet PJM, Vaneechoutte M (1998) Оценка амплифицированного рестрикционного анализа рибосомальной ДНК для идентификации геномных видов Acinetobacter .Системное приложение Microbiol 21: 33–39. - 10.
Towner KJ, Bergogne-Berezin E, Fewson CA (1991) Acinetobacter : портрет рода. В: К. Дж. Таунер, Э. Бергонь-Березин и К. А. Фьюсон, редакторы. Биология Acinetobacter . Нью-Йорк: Пленум Пресс. 1–24. - 11.
О’Тул Г.А., Пратт Л.А., Уотник П.И., Ньюман Д.К., Уивер В.Б. и др. (1999) Генетические подходы к изучению биопленок. Методы Enzymol 310: 91–109. - 12.
Sambrook J, Russell DW (2001) Молекулярное клонирование: лабораторное руководство, 3-е изд.Колд-Спринг-Харбор: Лаборатория Колд-Спринг-Харбор. - 13.
Hunger M, Schmucker R, Kishan V, Hillen W. (1990) Анализ и нуклеотидная последовательность ориджина репликации ДНК в Acinetobacter calcoaceticus и его использование для челночных плазмид Escherichia coli . Gene 87: 45–51. - 14.
Стандарты производительности для тестов на чувствительность к антимикробным препаратам: Утвержденный стандарт M2-A9. (2006) Пенсильвания: Институт клинических и лабораторных стандартов. - 15.
Punta M, Coggill PC, Eberhardt RY, Mistry J, Tate J и др. (2012) База данных семейств белков Pfam. База данных исследования нуклеиновых кислот, выпуск 40: D290 – D301. - 16.
Томпсон Дж. Д., Хиггинс Д. Г., Гибсон Т. Дж. (1994) CLUSTAL W: повышение чувствительности последовательного прогрессивного множественного выравнивания последовательностей посредством взвешивания последовательностей, штрафов за пропуски для конкретных позиций и выбора матрицы весов. Nucleic Acids Res 22: 4673–4680. - 17.
Гомельский М., Клуг Г. (2002) BLUF: новый FAD-связывающий домен, участвующий в сенсорной трансдукции у микроорганизмов.Тенденции Biochem Sci 27: 497–500. - 18.
Hall TA (1999) BioEdit: удобный редактор выравнивания биологических последовательностей и программа анализа для Windows 95/98 / NT. Нуклеиновые кислоты Symp Ser 41: 95–98. - 19.
Фельзенштейн Дж. (1989) Пакет вывода PHYLIP-филогении (версия 3.2). Кладистика 5: 164–166. - 20.
Diancourt L, Passet V, Nemec A, Dijkshoorn L, Brisse S (2010) Популяционная структура Acinetobacter baumannii : расширение мультирезистентных клонов из наследственного восприимчивого генетического пула.PLoS ONE 5: e10034. - 21.
Nemec A, Vaneechoutte M, Dijkshoorn L (2009) Acinetobacter beijerinckii sp. ноя и Acinetobacter gyllenbergii sp. nov., гемолитические организмы, выделенные от человека. Int J Syst Evol Microbiol 59: 118–124. - 22.
Юнг А., Домрачева Т., Тарутина М., Ву К., Ко В. и др. (2005) Структура бактериального фоторецептора BLUF: понимание передачи сигнала, опосредованного синим светом. Proc Nat Acad Sci USA 102: 12350–12355. - 23.
Зан Дж., Чичирелли Э.М., Мохамед Н.М., Сибхату Х., Кролл С. и др. (2012) Комплексная сенсорная сеть кворума типа LuxR-LuxI в симбионте морской губки розеобактерий активирует подвижность жгутиков и ингибирует образование биопленок.Mol Microbiol In press. - 24.
Песавенто С., Беккер Г., Зоммерфельдт Н., Посслинг А., Чоури Н. и др. (2008) Обратная регуляторная координация подвижности и опосредованной курли адгезии у Escherichia coli . Гены Дев 22: 2434–2446. - 25.
Caiazza NC, Merritt JH, Brothers KM, O’Toole GA (2007) Обратное регулирование образования биопленок и подвижности роения с помощью Pseudomonas aeruginosa PA14. J Bacteriol 189: 3603–3612. - 26.
McQueary CN, Actis LA (2011) Acinetobacter baumannii биопленок: различия между штаммами и корреляции с другими свойствами клеток. J Microbiol 49: 243–250. - 27.
Bouvet PJM, Grimont P (1986) Таксономия рода Acinetobacter с распознаванием Acinetobacter baumannii sp.nov., Acinetobacter hemolyticus sp. nov., Acinetobacter johnsonii sp. nov. и Acinetobacter junii sp. ноя и исправленные описания Acinetobacter calcoaceticus и Acinetobacter lwoffii . Int J Syst Bacteriol 36: 228–240. - 28.
Vaneechoutte M, Young DM, Ornston LN, De Baere T, Nemec A и др. (2006) Естественно трансформируемый Acinetobacter sp. Штамм ADP1 принадлежит к недавно описанному виду Acinetobacter baylyi .Appl Environ Microbiol 72: 932–936. - 29.
Nemec A, Musílek M, Sedo O, De Baere T., Maixnerová M, et al. (2010) Acinetobacter bereziniae sp. ноя и Acinetobacter guillouiae sp. nov., для размещения Acinetobacter геномных видов 10 и 11 соответственно. Int J Syst Evol Microbiol 60: 896–903. - 30.
Carr EL, Kämpfer P, Patel BK, Gürtler V, Seviour RJ (2003) Семь новых видов Acinetobacter , выделенных из активного ила.Int J Syst Evol Microbiol 53: 953–63. - 31.
Anandham R, Weon HY, Kim SJ, Kim YS, Kim BY и др. (2010) Acinetobacter brisouii sp. nov., изолированное от водно-болотных угодий в Корее. J. Microbiol. 48: 36–39. - 32.
Zhan Y, Yan Y, Zhang W, Yu H, Chen M и др. (2011) Последовательность генома Acinetobacter calcoaceticus PHEA-2, выделенная из промышленных сточных вод. J Bacteriol 193: 2672–3. - 33.
Малхотра Дж., Ананд С., Джиндал С., Раман Р., Лал Р. (2012) Acinetobacter indicus sp.nov., выделенный из свалки гексахлорциклогексана (ГХГ). Int J Syst Evol Microbiol In Press. - 34.
Зайферт Х., Дейксхорн Л., Гернер-Смидт П., Пельцер Н., Тьернберг И. и др. (1997) Распространение видов Acinetobacter на коже человека: сравнение методов фенотипической и генотипической идентификации. J Clin Microbiol 35: 2819–2825. - 35.
Jung J, Baek JH, Park W (2010) Полная последовательность генома дизельного разлагающего Acinetobacter sp.штамм DR1. J Bacteriol 192: 4794–4795. - 36.
Nemec A, Dijkshoorn L, Cleenwerck I, De Baere T, Janssens D, et al. (2003) Acinetobacter parvus sp. nov., небольшой колониеобразующий вид, выделенный из клинических образцов человека. Int J Syst Evol Microbiol 53: 1563–1567. - 37.
Nishimura Y, Kairiyama E, Shimadzu M, Iizuka H (1981) Характеристика радиационно-устойчивого Acinetobacter . Z Allg Mikrobiol 21: 125–30. - 38.Ваз-Морейра I, Ново А., Ханцис-Захаров Э., Лопес А.Р., Гомила М. и др. (2011) Acinetobacter rudis sp. nov., изолированное от сырого молока и сырых сточных вод. Int J Syst Evol Microbiol 61: 2837–2843.
- 39.
Nemec A., de Baere T., Tjernberg I., Vaneechoutte M, van der Reijden TJ, et al. (2001) Acinetobacter ursingii sp. ноя и Acinetobacter schindleri sp. nov., выделенный из клинических образцов человека. Int J Syst Evol Microbiol 51: 1891–1899. - 40.
Vaneechoutte M, Nemec A, Musílek M, van der Reijden TJ, van den Barselaar M, et al. (2009) Описание Acinetobacter venetianus ex Di Cello et al. , 1997 sp. nov.Int J Syst Evol Microbiol 59: 1376–1381. - 41.
Сослау Г., Рассел Дж. А., Спотила Дж. Р., Мэтью А. Дж., Багсьяо П. и др. (2011) Acinetobacter sp. HM746599 выделен из крови кожистой черепахи. FEMS Microbiol Lett 322: 166–171.
Характеристика состава бактерий в сообществе и профиля восприимчивости к противомикробным препаратам в отделении интенсивной терапии общественной больницы на Бермудских островах
Характеристика состава сообщества бактерий и профиля восприимчивости к противомикробным препаратам в отделении интенсивной терапии общественной больницы на Бермудских островах
Цель: Это исследование было проведено для определения наличия множественной лекарственной устойчивости
(МЛУ) патогенные бактерии в среде отделения интенсивной терапии
в общественной больнице на Бермудских островах.
Методы: Двадцать шесть мазков из окружающей среды, взятых из определенных областей, таких как
дверные ручки, раковины, шкафы, водостоки, перила кроватей, рабочие места, компьютер
клавиатуры и телефоны были получены для исследования. Стандартный микробиологический
методы с использованием Института клинических лабораторных стандартов (CLSI) были использованы в
изучение. Идентификация и тестирование на чувствительность для всех изолятов проводились с использованием
автоматизированная система Vitek II (BioMerieux, Inc., Дарем, Северная Каролина).
Результаты: В отделении интенсивной терапии не было выделено организмов с множественной лекарственной устойчивостью.
среда.Большинство выделенных организмов были непатогенными грамположительными.
кокки, такие как коагулазо-отрицательные Staphylococcus, Micrococcus spp и Dermacoccus spp. Были обнаружены оппортунистические патогенные грамотрицательные бактерии, такие как Pseudomonas aeruginosa, Acinetobacter hemolyticus и Klebsiella oxytoca .
обнаружены и были относительно чувствительны к антимикробным препаратам. Кроме того,
Грамотрицательные организмы, такие как Brevundimons diminuta и Parococcus yeei , были изолированы из окружающей среды.Однако эти организмы обычно не
патогенный.
Заключение: Хорошее соблюдение мер по профилактике и контролю инфекций
а также противомикробные меры важны для предотвращения госпитализации
инфекции (HAI), в том числе вызванные микроорганизмами с множественной лекарственной устойчивостью, особенно в отделениях интенсивной терапии
параметр.
Автор (ы):
Ротвелл Л., Сваби Л., Такер М., Дагначью Б., Десилва Дж., Фаррелл Дж. И Уилсон К.
Аннотация |
Полнотекстовый |
PDF
Поделиться
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
микроорганизмов | Бесплатный полнотекстовый | Штамм Acinetobacter KUO11TH, уникальный организм, родственный Acinetobacter pittii и выделенный из кожной слизи здорового пестрого сома, и его эффективность против нескольких патогенов рыб
1.Введение
Род Acinetobacter, принадлежащий к семейству Moraxellaceae, был впервые установлен Brisou & Prevot [1] с типовым видом Acinetobacter lwoffii. В настоящее время этот род включает 61 опубликованное действительное название вида, включая четыре пары синонимов (https://apps.szu.cz/anemec/Classification.pdf, 26 августа 2019 г.). Бактерии рода Acinetobacter, как правило, являются грамотрицательными, неподвижными, каталазоположительными, оксидазонегативными коккобациллами аэробами, которые выживают в широком диапазоне условий окружающей среды.Представители рода Acinetobacter имеют уровни G + C в ДНК от 34,9 до 47,0 мол.% [2], а C18: 1ω9c и C16: 0 являются основными жирными кислотами клетки [3]. Несмотря на то, что Acinetobacter spp. Описываются как неподвижные бактерии, обладают различными формами подвижности, такими как подергивание из-за особенностей ворсинок на их клеточной мембране [4]. Род Acinetobacter — большая и разнообразная группа биохимически, физиологически и естественно разносторонних бактерий. Семь видов Acinetobacter с действительными опубликованными названиями, а именно A.beijerinckii, A. gyllenbergii, A. haemolyticus, A. junii, A. parvus, A. tjernbergiae и A. venetianus относятся к гемолитическим кладам. Эти бактерии обладают гемолитическими характеристиками и могут лизировать эритроциты млекопитающих [5,6,7,8]. Кроме того, комплекс Acinetobacter calcoaceticus-Acinetobacter baumannii (Acb) также является важной группой бактерий рода Acinetobacter; эти бактерии были изолированы из широкого круга сред обитания и симптоматически связаны со здоровьем человека.Эти бактерии в настоящее время включают шесть различных допустимых опубликованных видов, а именно A. calcoaceticus, A. baumannii, A. pittii, A. nosocomialis, A. seifertii и A. lactucae (более поздний гетеротипический синоним A. dijkshoorniae) [9,10] . Основные характеристики комплекса Acb генетически и физиологически очень похожи друг на друга, и их трудно различить на уровне видов стандартными методами [11]. Однако эти виды различаются по своей эпидемиологии, устойчивости к антибиотикам и патогенности [12].Некоторые члены комплекса Acb, особенно A. baumannii, обычно упоминаются среди членов комплекса Acb, ассоциированных с условно-патогенными микроорганизмами у людей с возникновением устойчивости к антибиотикам [11,13,14]. Кроме того, повсеместно и широко распространены A. pittii, A. nosocomialis, A. seifertii и A. lactucae, которые иногда связаны с появляющимися важными нозокомиальными патогенами, вовлеченными в внутрибольничные инфекции [9,10,15]. В течение последнего десятилетия некоторые члены комплекса Acb и не входящие в него комплексы были зарегистрированы как возбудители сепсиса, вызывающие массовую смертность водных животных, таких как рыбы, включая мандариновую рыбу (Siniperca chuatsi) [13], канальный сом (Ietalurus punetaus) [14]. ], гибрид прусского карпа (Carassais auratus gibebio) [16] и вьюна (Misgurnus anguillicaudatus) [15].Хотя большинство представителей рода Acinetobacter были выделены из клинических образцов человека и зарегистрированы как важные условно-патогенные микроорганизмы, характеристика новых членов из нечеловеческой среды и их пользы для окружающей среды и животных никогда не проводилась. Недавно многие новые виды рода Acinetobacter были тщательно охарактеризованы после выделения из природных источников, таких как медоносные пчелы, лошади, хлопок, рис, кора язвы Populus x euramericana, овощи, активный ил, почва, речная вода и другие источники окружающей среды. источники по всему миру [10,17,18,19,20,21,22,23,24].Насколько нам известно, разведение сома в Таиланде за последние десятилетия значительно расширилось. Промышленность по производству сома не только ежегодно способствует увеличению национального дохода Таиланда, но также дает доступный источник животных белков для потребителей в стране и во всем мире. Годовой объем производства сома является вторым по величине в тайской рыбной индустрии аквакультуры после нильской тилапии (Oreochromis niloticus): в 2000 году было произведено около 76 миллиардов тонн, а пиковое производство составило 159 314 миллиона тонн в 2004 году.С 2004 года снижение производства тайского сома в среднем составляло 5,76% ежегодно [25]. Местный пестрый сом (Clarias macrocephalus Günther, 1864) — важный вид сома в аквакультуре Таиланда. Из-за своего уникального мясного состава, пестрый сом используется в качестве выводка для получения гибридных сомов (C. macrocephalus × C. gariepinus). К сожалению, этот вид медленно растет, дает ограниченное количество мальков, восприимчив к инфекционным заболеваниям и чувствителен к различным условиям окружающей среды [26].В частности, этот вид подвержен вспышкам заболеваний, вызываемых патогенными бактериями, особенно Aeromonas hydrophila и Flavobacterium columnare, что стало серьезной проблемой, способствующей сокращению производства сома в Таиланде. Традиционно химические вещества и антибиотики широко применялись для лечения болезней разводимых сомов. Однако неблагоприятное воздействие этих веществ было причиной для беспокойства в течение многих лет, поскольку чрезмерное использование антибиотиков и химикатов может привести к образованию устойчивых к лекарствам бактерий, а также к загрязнению пищевых продуктов и окружающей среды [27].В качестве альтернативы полезные и эффективные микроорганизмы, известные как «пробиотики», были введены в ряд видов водных животных в индустрии аквакультуры для борьбы с инфекционными бактериальными заболеваниями и усиления роста и иммунного ответа [28]. Тем не менее, многообещающий вид бактерий, первоначально выращенный из тайского сома, никогда не описывался и не оценивался для использования в промысле сома.
Здесь мы описываем характеристики нового бактериального штамма рода Acinetobacter, штамма KU011TH.Бактериальный штамм KU011TH был выделен из слизи кожи здорового большеголового сома на сомовых фермах в провинции Патум Тани, Таиланд. Полная таксономическая характеристика бактериального штамма подтвердила классификацию бактериального штамма KU011TH как нового члена рода Acinetobacter и комплекса Acb и название Acinetobacter sp. KU011TH предлагается для этого штамма с типом штамма KU011TH. Кроме того, полученные данные об этом новом штамме бактерий необходимы для дальнейшего изучения его функции и антагонистической эффективности в отношении различных патогенов рыб, вызывающих опасные заболевания у пестрого сома (C.macrocephalus) и других видов рыб. Широкий спектр ингибирующих эффектов нового бактериального штамма требует дальнейших исследований для определения эффективных стратегий его использования в профилактике заболеваний. Новые предварительные результаты исследований этого нового бактериального штамма могут быть расширены для разработки потенциального пробиотического подхода, который поможет поддержать индустрию аквакультуры сома.
2. Материалы и методы
2.1. Выделение и культивирование бактерий
Колония бактериального штамма KU011TH была выделена из слизи кожи большеголового сома.Кожную слизь серийно разводили от 10 -1 до 10 -4 в физиологическом растворе (0,85% NaCl), помещали на агар для подсчета планшетов (PCA, содержащий 0,5% триптона, 0,3% дрожжевого экстракта, 1,0% декстрозы / глюкозы и 1,5% агар; HiMedia Laboratories) и культивировали при 32 ° C в течение 24 часов. После инкубации отчетливую круглую колонию кремового цвета, сплошного края и выпуклой формы субкультивировали на стандартном питательном бульоне (NB, содержащем 0,5% триптона, 0,3% дрожжевого экстракта и 1,0% декстрозы / глюкозы) в течение 18–24 часов.Бактериальные осадки отделяли центрифугированием при 3000 × g в течение 5 минут, суспендировали в глицерине (20% об. / Об.) И затем хранили при -80 ° C. Были выполнены микроскопические исследования морфологии колоний и клеток, чтобы подтвердить отсутствие заражения другими группами бактерий. Штамм KU011TH обычно выращивали на PCA и в среде NB при pH 7,3 и 32 ° C в течение 18–24 ч для всех фенотипических тестов.
Это исследование было проведено в соответствии с принципом Базельской декларации и рекомендациями Руководства по уходу и использованию лабораторных животных Этического комитета Университета Касетсарт, Таиланд, с номером одобрения ACKU61-FIS-004, Дата утверждения: 9 сентября 2018 г.
2.2. Анализ морфологии бактериальных клеток
Окрашивание по Граму бактериальных клеток, выращенных на PCA или PCA с 1,5% (мас. / Об.) NaCl, проводили с использованием световой микроскопии (Olympus, Массачусетс, США) при 1000-кратном увеличении, как описано в [29]. Размер и морфологию бактериальных клеток анализировали с помощью сканирующей электронной микроскопии (SEM) (SU8020, Hitachi High-Technologies, Tokyo, Japan). Вкратце, бактериальные колонии выращивали на чашках PCA при 32 ° C в течение 24 часов, после чего одну колонию фиксировали фиксатором SEM в течение ночи.Образцы колоний дегидратировали посредством возрастающей серии концентраций этанола, а затем подвергали сверхкритической сушке в сушилке для критической точки. Образцы были покрыты золотом напылением и исследованы с помощью SEM.
2.3. Экстракция ДНК, ПЦР-амплификация и секвенирование ДНК
Для идентификации штамма на уровне видов геномную ДНК бактериального штамма KU011TH получали с использованием мини-набора QIAamp DNA Mini Kit (QIAamp, CA, USA) в соответствии с инструкциями производителя. ДНК амплифицировали для получения почти полноразмерных нуклеотидных последовательностей гена 16S рРНК с использованием бактериальных универсальных праймеров 27f (5′-AGAGTTTGATCMTGGCTCAG-3 ‘) и 1492r (5′-TACGGYTACCTTGTTACGACTT-3′) [9,30].Кроме того, части генов бета-субъединицы РНК-полимеразы (rpoB) и субъединицы B ДНК-гиразы (gyrB) также были амплифицированы с помощью rpoB-696f (5’-TAYCGYAAAGAYTTGAAAGAAG-3 ‘), rpoB-1598r (5’-CGBGCRTGCATTTGTC ‘), GyrBf (5′-CAGGAAACAGCTATGACCAYGSNGGNGGN AARTTYRA-3′) и gyrBr (5’-TGTAAAACGACGGCCAGTGCNGGRTCYTTYTCYTG RCA-3 ‘) праймеров, которые были ранее описаны [31, 32 генотипа], чтобы проверить сходство другие представители рода. ПЦР проводили с использованием высокоточной ДНК-полимеразы Phusion с корректирующей активностью (Thermo Fisher Scientific, Уолтем, Массачусетс, США) в соответствии с инструкциями производителя.ПЦР начинали с этапа предварительной денатурации при 95 ° C в течение 5 минут, за которым следовали 30 циклов при 95 ° C в течение 30 секунд, 55 ° C в течение 30 секунд и 72 ° C в течение 2 минут, а затем завершали пост-растяжением при 72 ° C в течение 10 мин. Продукты ПЦР очищали и клонировали в вектор CloneJET1.2 / blunt (Thermo Fisher Scientific, Массачусетс, США), и конструкции секвенировали с помощью службы секвенирования Macrogen (Macrogen Inc., Сеул, Корея) с использованием pJET1.2 forward. и праймеры для обратного секвенирования.
2.4. Филогенетический анализ
Последовательности генов 16S рРНК, gyrB и rpoB подвергали BLAST-анализу (https: // blast.ncbi.nlm.nih.gov/Blast.cgi) против последней версии базы данных GenBank. Расчеты сходства полученных последовательностей проводили с помощью программы MATGAT версии 2.0 [33]. Кроме того, последовательности ДНК были выровнены с последовательностями родственных видов Acinetobacter с помощью ClustalW [34]. Филогенетические деревья были построены с использованием программного обеспечения молекулярно-эволюционного генетического анализа (MEGA), версия 7.0 (собственная бесплатная программа, Япония) [35], с алгоритмами объединения соседей (NJ) [36] с начальной загрузкой 1000 повторений.
2,5. Секвенирование, сборка и аннотации генома
Качество экстрагированной ДНК определяли с помощью флуорометрического количественного анализа QubitTM (Thermo Fisher Scientific, США). Приготовление библиотеки секвенирования ДНК осуществляли с использованием наборов Nextera XT (Illumina, Сан-Диего, Калифорния, США), а затем выполняли полногеномное секвенирование с использованием парных прогонов на платформе Illumina HiSeq с длиной считывания 251 п.н. Подготовка библиотеки и полногеномное секвенирование были выполнены поставщиком услуг (Новоген, Сингапур).Затем необработанные данные были обрезаны, чтобы отфильтровать низкое качество (оценка Q 37]. Качество полученных сборок определялось с помощью программы QUAST [38]. Для дальнейшей аннотации генома с помощью MicroScope web использовались только контиги длиной> 1000 п.н. на основе сервиса (http://www.genoscope.cns.fr/agc/microscope) [39].
2.6. Анализ секвенирования генома, ANI, in silico расчеты DDH и филогения
Геномное родство бактерий было исследовано с помощью различных алгоритмов для определения генома -сравнение генома.Средние значения идентичности нуклеотидов (ANI) были рассчитаны на основе BLAST (ANIb) с использованием онлайн-сервера веб-сервиса JSpeciesWS (http://jspecies.ribohost.com/jspeciesws/) [40]. Для анализа in silico гибридизации ДНК-ДНК (DDH) результаты были получены из веб-службы калькулятора расстояния между геномами (GGDC) с использованием формулы 2 (идентичности / длина HSP) (http://ggdc.dsmz.de) [41]. Рекомендуемые пороговые значения по видам были ниже 95–96% для ANIb и 70,0% для значений DDH in silico [42,43]. Дистанционная филогения генома BLAST (GBDP) бактериального штамма KU011TH, близкородственных видов с комплексом Acb и видов, не относящихся к комплексу Acb, из рода Acinetobacter была исследована с использованием сервера генома типового штамма (TYGS) [44].
2.7. Анализ содержания G + C ДНК
Содержание G + C бактериального штамма KU011TH было автоматически получено из расчетов генома с использованием калькулятора ANI и веб-платформы MicroScope [38,39].
2,8. Номера доступа GenBank / EMBL / DDBJ
Нуклеотидные последовательности бактериального штамма KU011TH депонированы в DDBJ / EMBL / GenBank под номерами доступа MG372049 для гена 16S рРНК, MG950236 для гена gyrB и MG950238 для гена rpoB. Аннотированный проект полногеномного ружья депонирован в DDBJ / ENA / GenBank под номером доступа PSSN00000000.В этом документе описывается версия PSSN01000000.1.
2.9. Фенотипический и хемотаксономический анализ
Активность цитохром с оксидазы определяли, как описано ранее [45]. Активность каталазы анализировали с помощью 3% раствора перекиси водорода, и образование пузырьков кислорода показало положительный результат. Гемолитическую активность тестировали на агаре Мюллера-Хинтона (MH), содержащем стерильную 10% (об. / Об.) Цельную овечью кровь. Подвижность клеток, а также окислительную и ферментативную активность анализировали с использованием агара Хью и Лейфсона (базальная среда окислительно-ферментативного (OF); Merck, Германия) с добавлением 10% (мас. / Об.) D-глюкозы.Тесты роста при различных температурах (4, 25, 30, 37, 41 и 45 ° C), значениях pH (4,0–10,0 с интервалом 1,0 единицы pH) и концентрациях NaCl (0–10% мас. / Об.) Проводили в 10,0 мл бульона MH (HiMedia Laboratories). Рост бактерии измеряли, определяя оптическую плотность при 600 нм и используя стандартные методы подсчета на планшете с 24-часовыми интервалами в течение 7 дней. Испытания на использование других источников углерода проводились с использованием наборов для испытаний API 50 CHB / E (bioMérieux, Франция). Тестовые наборы API 20NE (bioMérieux, Франция) и API 20E (bioMérieux, Франция) также использовали для определения ферментативной активности штамма в соответствии с инструкциями производителя.Чтобы подтвердить фенотипические результаты API, гидролиз крахмала, казеина и мочевины исследовали с помощью стандартных микробиологических анализов путем инкубации штамма на крахмальном агаре (HiMedia Laboratories), обезжиренном молоке (HiMedia Laboratories) и основе мочевины (HiMedia Laboratories) с добавлением стерильного 40 % раствора мочевины соответственно. Липазную активность тестировали на трибутириновом агаре (HiMedia Laboratories) [46], и чистая зона вокруг колонии была интерпретирована как положительный результат. Все фенотипические тесты были выполнены в трех экземплярах.
2.10. Анализ клеточных жирных кислот
Бактериальные клетки культивировали на агаре MH при 32 ° C в течение 24 часов. Клеточные жирные кислоты были получены омылением, метилированием и экстракцией в соответствии с версией 6.2 Системы идентификации микроорганизмов Шерлока (MIDI), следуя инструкциям для системы [47]. Профили клеточных жирных кислот анализировали путем разделения метиловых эфиров жирных кислот методом газовой хроматографии. Пики были автоматически интегрированы и рассчитаны с использованием Sherlock MIDI версии 6.2 (MIDI, Inc., Ньюарк, Делавэр, США) [47, 48].
2.11. Идентификация генов устойчивости к антибиотикам
Сборка выходного генома была использована для поиска аналогичных генов устойчивости к антибиотикам в Комплексной базе данных устойчивости к антибиотикам (CARD) (https://card.mcmaster.ca/home) [49] с использованием BLAST + [50]. Результаты были представлены только на основе лучших совпадений генов из базы данных.
2.12. Тест на чувствительность к антибиотикам
Тест на антибактериальную чувствительность бактериального штамма KU011TH проводили с использованием метода дисковой диффузии [51,52].Культивированная бактериальная суспензия 2,0 × 10 8 КОЕ / мл была выращена и приготовлена, как описано выше, а затем нанесена мазками на чашки с агаром MH. Коммерческие бумажные диски с антибиотиками с фиксированными концентрациями помещали на поверхность засеянного агара. В этом исследовании были использованы восемнадцать антибиотиков, полученных от Thermo Scientific TM , а именно ампициллин (AMP10), амоксициллин (AML10), ципрофлоксацин (CIP5), хлорамфеникол (C30), цефалотин (KF30), доксициклин (DO30), эрициклин (DO30) ), энрофлоксацин (FNR5), неомицин (N30), новобиоцин (NV5), окситетрациклин (OT30), полимиксин B (PB300), спектиномицин (Sh35), сульфаметоксазол (SXT25), сульфаметоксазол (RL25), церафоперазон TE30) и триметоприм (W5).Перед определением результатов планшеты инкубировали 18–24 ч при 37 ° C. После инкубации измеряли чистые зоны задержки роста вокруг каждого диска с антибиотиком в миллиметрах. Диаметр прозрачной зоны связан с восприимчивостью изолята, которая была интерпретирована с использованием критериев, опубликованных Институтом клинических и лабораторных стандартов (CLSI) [52]. Результаты были качественно разделены на три категории восприимчивости: восприимчивые, промежуточные и устойчивые.Тест проводился в трех повторностях.
2.13. Антагонизм против патогенных бактерий
Антагонистическую активность бактериального штамма KU011TH против патогенных бактерий оценивали с использованием анализов как точечной агаровой точки, так и количественной ПЦР в реальном времени (qPCR). Для оценки антагонистической активности использовали десять штаммов, патогенных для пресноводных и морских водных животных, полученных из лаборатории управления здоровьем водных животных кафедры аквакультуры факультета рыболовства Университета Касетсарт, Таиланд.Шесть штаммов патогенов пресноводных рыб, а именно: A. hydrophila, F. columnare, Flectobacillus roseus, Streptococcus agalactiae, Staphylococcus warneri и Edwardsiella tarda, а также четыре штамма патогенов морских рыб, а именно Vibrio alginolyticus, Vibrio hardeniha, Vibrio. Vibrio vulnificus.
Используя методы, ранее описанные в [53], был проведен анализ точечных пятен на агаровой основе на PCA и PCA с 1,5% (мас. / Об.) NaCl для патогенов пресноводных и морских рыб, соответственно.Отдельные штаммы изолята KU011TH и патогенные бактерии сначала инокулировали на PCA или PCA с 1,5% (мас. / Об.) Чашками NaCl при 32 ° C в течение 18 часов. После инкубации клетки патогенов собирали и ресуспендировали в фосфатно-солевом буфере (PBS, pH 7,4). Для этого эксперимента использовалась концентрация приблизительно 1,0 × 10 6 КОЕ / мл. Бактериальную суспензию немедленно наносили мазками на подготовленный PCA или PCA с пластинами с 1,5% NaCl. Затем штамм KU011TH на пластинах PCA наносили точечными пятнами на пластины, которые ранее были промыты соответствующими патогенами.После 18 ч инкубации при 32 ° C диаметры прозрачных зон задержки роста измеряли в миллиметрах. Тест проводился трижды на каждой пластине с тремя повторностями.
2.14. Количественный анализ результатов анализа бактериальной кокультуры
Количественную оценку активности бактериального штамма KU011TH против десяти патогенных бактерий проводили путем совместного культивирования бактерий и использования анализов количественной ПЦР. Изменение морфологии клеток совместно культивируемых бактерий визуализировали с помощью световой микроскопии (Olympus, Массачусетс, США) при увеличении в 1000 раз.Одну колонию пресноводных или морских патогенных бактерий инокулировали либо в 30 мл стандартного NB (содержащего 0,5% триптона, 0,3% дрожжевого экстракта и 1% декстрозы / глюкозы), либо в среду NB с 1,5% NaCl при 32 ° C в течение 18 часов. . Штамм KU011TH также инокулировали в NB и NB с 1,5% -ной средой NaCl для совместного культивирования с пресноводными и морскими патогенными бактериями. После инкубации бактериальный инокулят собирали, очищали центрифугированием при 2500 × g в течение 5 мин и ресуспендировали в PBS (pH 7,4) до достижения конечной концентрации 1.0 × 10 5 КОЕ / мл. Все бактериальные штаммы дополнительно контролировали на предмет роста как на чашках с одной культурой, так и на чашках для совместного культивирования через 24 часа. Один миллилитр каждой суспензии патогенных бактерий (1,0 × 10 5 КОЕ / мл) совместно культивировали с 1,0 мл бактериального штамма KU011TH в общем объеме культуры 50 мл NB или NB в среде 1,5% NaCl при 32 ° C в течение 24 ч. Соотношение сокультивированных бактерий составляло 1: 1. Расчетное начальное количество каждого бактериального штамма составляло 2,0 × 10 3 КОЕ / мл (общая начальная концентрация 4.0 × 10 3 КОЕ / мл каждой сокультуры). Для контроля каждого бактериального штамма 1,0 мл каждой бактериальной суспензии выращивали без штамма KU011TH в общем объеме культуры 50 мл NB или NB с 1,5% средой NaCl при 32 ° C в течение 24 часов, и рост измеряли как единая культура.
Через 24 часа культивирования аликвоты по 1,0 мл из всех совместных культур и отдельных культур (контроль) каждого теста были собраны для извлечения геномной ДНК для количественного определения количества копий ДНК и определения доли культивируемых бактерий с использованием анализа qPCR.Бактериальную геномную ДНК получали с использованием набора QIAamp DNA Mini Kit (QIAamp, CA, USA) в соответствии с инструкциями производителя. Праймеры для анализа кПЦР были разработаны для измерения специфичности и эффективности праймеров для отдельных штаммов (таблица 1).
Анализ кПЦР выполняли с использованием Brilliant III Ultra-Fast SYBR ® Green (Agilent, Калифорния, США) в системах Mx3005P QPCR (Agilent, Санта-Клара, Калифорния, США). КПЦР оптимизировали в 20 мкл реакционных объемов, содержащих 10 мкл 2 × SYBR Green QPCR Master Mix с 0.5 мМ праймер. Условия цикла кПЦР включали начальный цикл при 95 ° C в течение 5 минут; 40 циклов 95 ° C в течение 30 с, 55 ° C в течение 30 с и 72 ° C в течение 90 с; с последующим окончательным удлинением при 72 ° C в течение 10 мин. Специфичность набора праймеров была подтверждена по одиннадцати эталонным штаммам. Используя указанные выше оптимизированные условия ПЦР-амплификации в реальном времени, стандартную кривую для количественного определения всех бактериальных штаммов получали с использованием 10-кратного серийного разведения ДНК от 10 2 до 10 10 копий / мл.Пороговый цикл (C T ) измеряли для каждой кПЦР. Затем рассчитанные значения C T образцов наносили на график в зависимости от количества микроорганизмов по сравнению с контролем (единичная культура). Полученные значения (число копий ДНК) рассчитывали по стандартному уравнению для каждого бактериального штамма. Все тесты и количественная ПЦР были выполнены в трех экземплярах.
Результаты по количеству бактерий представлены как среднее ± стандартное отклонение. Для анализа данных использовался t-критерий Стьюдента.Значение p менее 0,05 считалось статистически значимым.
3. Результаты и обсуждение
Штамм бактерий KU011TH был выделен из слизи кожи здорового большеголового сома (C. macrocephalus Günther, 1864) в провинции Патум Тани, Таиланд, 20 августа 2016 г. Клетки бактериального штамма KU011TH были граммом. -отрицательные, неспорообразующие коккобациллы. Ячейки имели различные размеры от 0,8 до 1,5 мкм. На клеточных мембранах бактериального штамма были обнаружены структуры пилуса, как показано на рисунке 1.Сравнение последовательностей генов домашнего хозяйства 16S рРНК, gyrB и rpoB показало, что бактериальный штамм KU011TH сгруппирован с членами комплекса Acb рода Acinetobacter. Последовательности 16S рРНК бактериального штамма обладают высоким сходством, в диапазоне от 98,0 до 99,9%, с последовательностями из бактериальных штаммов в комплексе Acb. Кроме того, сходство генов gyrB и rpoB составляло от 87,6 до 97,6% и от 87,6 до 98,7% соответственно. Основываясь на анализе последовательности трех генов домашнего хозяйства, виды, наиболее близкие к бактериальному штамму KU011TH среди видов в комплексе Acb, были A.pittii, A. lactucae, A. calcoaceticus, A. nosocomialis, A. seifertii и A. baumannii. Сходство последовательностей генов между бактериальным штаммом KU011TH и наиболее близкими штаммами в комплексе Acb и в роде Acinetobacter показано в таблице 2. Филогенетическое дерево последовательности гена 16S рРНК из бактериального штамма KU011TH и других штаммов в комплексе Acb и не-Acb комплекс рода Acinetobacter был сконструирован и показан на рисунке 2. Филограмма гена 16S рРНК показала, что этот штамм является членом комплекса Acb и четко отделен от наиболее близкородственных бактериальных штаммов в комплексе Acb, особенно А.lactucae (99,9% сходства последовательностей 16S рРНК), A. pittii (99,8% сходства последовательностей 16S рРНК) и A. calcoaceticus (99,5% сходства последовательностей 16S рРНК). Кроме того, филограммы продемонстрировали, что бактериальный штамм KU011TH находился в той же кладе, что и комплекс Acb без A. baumannii, как показано на рисунке 2. Кроме того, филограмма 16S рРНК четко показывает, что бактериальный штамм KU011TH и несколько близкородственных штаммов являются генотипически отличается от допустимых опубликованных штаммов комплекса Acb и рода Acinetobacter.Видовой статус бактериального штамма KU011TH в комплексе Acb подтверждался генетическим родством, определенным с помощью полногеномного анализа, значениями средней идентичности нуклеотидов (ANIb) и значениями in silico DDH. Кроме того, значения ANIb и in silico DDH между бактериальным штаммом KU011TH и комплексом Acb составляли 94,0–94,6% и 62,4–63,2%, соответственно, для A. pittii; 92,2–92,7% и 50,1–51,3% соответственно для A. lactucae; 89,4–90,2% и 38,5–40,8% соответственно для A. calcoaceticus; 87.3–87,6% и 34,1–34,5% соответственно для A. seifertii; 87,1–87,3% и 33,7–33,9% соответственно для A. baumannii; и 86,8–87,2% и 33,1–33,4% соответственно для A. nosocomialis (таблица 3). Кроме того, рассчитанные in silico значения DDH были также подтверждены различиями в процентном содержании G + C в геномах между разными видами, которое было довольно близко к нулю и не превышало 1,0 [44].
Значения генетического родства для ANIb и in silico DDH подтвердили видовой статус между бактериальным штаммом KU011TH и его штаммом ближайшего типа в комплексе Acb; значения были значительно ниже, чем рекомендуемые пороговые значения для определения видов (95–96% для ANI и 70% для значений DDH in silico), что подтверждает наш вывод о том, что бактериальный штамм KU011TH представляет собой новый вид бактерий в комплексе Acb и в роду Acinetobacter.
Филогенетический анализ, основанный на коровом геноме бактериального штамма KU011TH, далее показал, что бактериальный штамм KU011TH принадлежал к кластеру комплекса Acb в том же подкластере, что и A. pittii. Однако наши результаты показали, что внутри комплекса Acb бактериальный штамм KU011TH геномно отделен от своих близкородственных видов (A. pittii), а также от других не связанных с Acb сложных видов рода Acinetobacter с действительными опубликованными названиями. Результаты филогенетического анализа, основанного на коровом геноме комплекса Acb и не-Acb комплекса рода Acinetobacter, показаны на рисунке 3.Общие геномные характеристики бактериального штамма KU011TH и близкородственных типовых штаммов в комплексе Acb показаны в таблице 4. В этом исследовании A5-miseq генерировал 27 контигов из бактериального штамма KU011TH. Размер генома нового бактериального штамма составлял приблизительно 3,79 Мбит / с, а значение N50 составляло 325. Приблизительная глубина покрытия ансамблей составляла 172 ×. Согласно схеме аннотации MicroScope, общее количество CDS, рРНК и тРНК в штамме KU011TH составляло 3619, 8 и 63 соответственно.Кроме того, геномные особенности и картина распределения генома нового бактериального штамма KU011TH проиллюстрированы на Фигуре 4 и показаны в Таблице 4, соответственно. Кроме того, содержание G + C в бактериальном штамме KU011TH составляло 38,5 мол.%, Что находится в диапазоне от 34,9 до 47,0 мол.%, Указанном для представителей рода Acinetobacter, и близко к содержанию G + C видов комплекса Acb, в том числе A. pittii (38,80 мол.%), A. lactucae (38,80 мол.%), A. calcoaceticus (38,70 мол.%), A. nosocomialis (38.70 мол.%), A. seifertii (38,60 мол.%) И A. baumannii (38,90 мол.%) (Таблица 4). Для дальнейшей оценки фенотипической взаимосвязи между видами комплекса Acb были выполнены метаболические и физиологические тесты, как описано [ 10,54]. Штамм был отрицательным по оксидазе и положительным по каталазе. Подвижность и гемолитическая активность штамма не наблюдались. Однако штамм был положительным по окислению и отрицательным по ферментации на базальной среде OF. Штамм был отрицательным по гидролизу крахмала, казеина и мочевины и положительным по активности липазы на трибутириновом агаре (HiMedia Laboratories).Штамм рос при температурах от 4 до 41 ° C, при значениях pH от 3,0 до 10,0 и в присутствии 0–10% (мас. / Об.) NaCl. Оптимальный рост штаммов наблюдался при 30–32 ° C, pH 7,0–8,0 и в присутствии 1,0% (мас. / Об.) NaCl. Дифференциальные фенотипические характеристики бактериального штамма KU011TH и наиболее близких штаммов в комплексе Acb рода Acinetobacter показаны в таблице 5. Преобладающими жирными кислотами в бактериальном штамме KU011TH были C18: 1ω9c (35,3%), C16: 0. (31.2%), C16: 1 (8,5%), C20: 2 (5,2%), C18: 2ω6c (3,5%) и C18: 1ω9t (3,5%). Различные профили клеточных жирных кислот бактериального штамма KU011TH и наиболее близкородственных видов в комплексе Acb и не-Acb комплекса рода Acinetobacter перечислены в таблице 6. Гены устойчивости к антибиотикам в штамме KU011TH были проанализированы путем поиска в CARD [ 49]. Полученная антибиотикограмма генома бактериального штамма KU011TH выявила ряд генов, кодирующих устойчивость к нескольким антибиотическим соединениям, включая гены acrA, acrB, alaS, ampC, bepE, macB, mfd, nolG, smvA и tufB, и сведена в таблицу 7.Восемнадцать коммерческих антибиотиков были использованы для оценки чувствительности бактериального штамма KU011TH к антибиотикам. Штамм был устойчив к семи распространенным антибиотикам, а именно к ампициллину (AMP10), хлорамфениколу (C30), цефалотину (KF30), новобиоцину (NV5), сульфаметоксазолу (SXT25), сульфаметоксазолу (RL25) и триметоприму (W5). Штамм также был полностью чувствителен к ципрофлоксацину (CIP5), доксициклину (DO30), энрофлоксацину (FNR5), неомицину (N30), окситетрациклину (OT30), полимиксину B (PB300) и тетрациклину (TE30).Штамм продемонстрировал промежуточную чувствительность только к четырем антибиотикам, использованным в этом эксперименте, а именно к амоксициллину (AML10), эритромицину (E15), спектиномицину (Sh35) и цефоперазону (SCF105). Уровни устойчивости или восприимчивости к восемнадцати антибиотикам штамма широко варьировались (рис. 5). Эти результаты являются первыми, которые предоставляют важную информацию об уровнях устойчивости бактериального штамма KU011TH к антибиотикам. Этот шаг необходим, чтобы указать на потенциальное использование этой бактерии в доклинических или экологических условиях.Поскольку бактериальный штамм KU011TH был первоначально выделен из слизи кожи здорового большеголового сома, его антагонистическая активность против патогенных бактерий у пресноводных и морских водных животных была исследована для продвижения и применения этого штамма в качестве пробиотика для устойчивой аквакультуры в будущем. Штамм проявлял сильную антагонистическую активность против всех патогенов пресноводных рыб, включая A. hydrophila, F. columnare, F. roseus, S. agalactiae, S. warneri и E. tarda, в анализах точечных точек на агаре.Интересно, что штамм также мог расти в условиях солевого раствора и проявлял активность против патогенов морских рыб, включая V. alginolyticus, V. harveyi, V. parahaemolyticus AHPND и V. vulnificus, в анализах точек на агаре. Уровни антагонистической активности против всех патогенных бактерий в анализах агаровых точек показаны в Таблице 8 и на Рисунке 6. Чтобы подтвердить преобладающую антагонистическую активность нового бактериального штамма по отношению к различным патогенам рыб, ингибирование роста за счет взаимодействия между штаммом KU011TH и патогенами в Условия совместного культивирования были дополнительно рассмотрены.Ингибирующее действие бактериального штамма KU011TH на рост патогенов сильно наблюдалось у патогенов пресноводных рыб. В частности, совместное культивирование значительно снизило рост A. hydrophila (pF. Columnare (pF. Roseus (pS. Agalactiae, S. warneri) (pE. Tarda (таблица 8)). Изменения в морфологии клеток совместно культивируемых бактерий наблюдались для F. columnare, A. hydrophila и E. tarda, которые демонстрируют хрупкие клетки и накопление неактивных клеток во время совместного культивирования по сравнению с их отдельными культурами (рис. 6).Напротив, рост не был значительно снижен в совместных культурах нового пробиотического штамма KU011TH и патогенов морских рыб, включая V. alginolyticus, V. harveyi, V. parahaemolyticus AHPND и V. vulnificus, по сравнению с соответствующими отдельными культурами (p> 0,05) (Таблица 8). Кроме того, значительно снизился рост бактериального штамма KU011TH в сокультуре с Vibrio spp. по сравнению с ростом в одиночной культуре не наблюдалось (p> 0,05), тогда как значительно снижался рост бактериального штамма KU011TH в сокультуре с V.parahaemolyticus AHPND (наблюдались pVibrio spp.. Полномасштабные взаимодействия, указывающие на антагонистическую активность бактериального штамма KU011TH против различных патогенов рыб, показаны в Таблице 8 и на Рисунке 6. В системах аквакультуры по всему миру, особенно в Таиланде, вспышки болезней продолжаются. является серьезной проблемой для устойчивого развития отрасли аквакультуры. Эта проблема может отрицательно сказаться на здоровье рыб и экономической выгоде. Ряд видов бактерий в водной среде могут вызывать инфекционные заболевания у различных видов пресноводных и морских водных животных.Эти патогены включают A. hydrophila (септицемия аэромонад), F. roseus, F. columnare (болезнь столбчатой формы), S. agalactiae (стрептококкоз), S. warneri (стафилококкоз), E. tarda (эдвардсиеллез), V. alginolyticus (вибриоз). , V. harveyi (люминесцентный вибриоз креветок), V. parahaemolyticus AHPND (острый гепатопанкреатический некроз) и V. vulnificus (вибриоз). Традиционно при лечении болезней разводимых рыб широко используются различные химические вещества, такие как пестициды, дезинфицирующие средства и антибиотики.Однако неблагоприятное воздействие этих химикатов было причиной для беспокойства в течение многих лет, поскольку чрезмерное использование антибиотиков и химикатов может привести к образованию устойчивых к лекарствам патогенов, а также к загрязнению пищевых продуктов и окружающей среды [27,53]. Количество пробиотиков резко возросло, и их можно найти в самых разных областях, от здравоохранения до аквакультуры. Следовательно, разработка пробиотиков в качестве альтернативной стратегии предотвращения болезней рыб привлекает все большее внимание в отрасли рыбоводства.Пробиотики определяются как «живые микроорганизмы, которые оказывают благотворное влияние на хозяина» за счет увеличения показателей роста, улучшения усвоения питательных веществ, усиления иммунных реакций и улучшения качества водной среды [60]. Обычные пробиотики, используемые в аквакультуре, включают виды Aeromonas, Bacillus, Enterococcus, Enterobacter, Lactobacillus, Lactococcus, Pseudomonas и Vibrio [61]. Однако до настоящего времени не сообщалось о микроорганизмах с пробиотической эффективностью, происходящих из рода Acinetobacter.Хотя механизмы, лежащие в основе антагонизма пробиотиков против водных патогенов, не были хорошо документированы, несколько исследований показали, что большинство пробиотиков могут продуцировать несколько антимикробных соединений, которые играют ключевую роль в антагонистической активности против патогенов. В качестве антагониста против патогенных бактерий бактериальный штамм KU011TH давал чистые зоны, свободные от патогенов, демонстрируя, что секреция антимикробных соединений из бактериального штамма KU011TH может подавлять рост различных патогенов пресноводных рыб в условиях совместного культивирования.С аналогичными результатами супернатант культуральной среды Bacillus spp. показали сильное ингибирующее действие на S. typhimurium, L. monocytogenes, S. aureus, V. vulnificus, V. harveyi, E. coli и S. aureus [62]. Предыдущие исследования также показали, что виды Bacillus могут продуцировать различные противомикробные соединения, такие как бактериоцин, сурфактины, итурин, фенгицин, бацилизин, субтилин и субланцин, некоторые из которых широко используются для борьбы с микроорганизмами в пищевой промышленности [63,64] . Кроме того, липопептид N3 и амикумацин А продуцируются B.amyloliquefaciens и B. pumilus и проявляют сильную активность против вибрионов, разрушая клеточные мембраны и вызывая лизис клеток [65]. Более того, виды молочнокислых бактерий (LAB) могут продуцировать ряд антимикробных соединений, таких как перекись водорода и бактериоциноподобные вещества, которые обладают сильной ингибирующей активностью в отношении патогенов V. metschnikovi, V. harveyi и S. aureus, заражающих апельсин. пятнистый морской окунь [66]. В последнее время появилось несколько анти-A. Соединения salmonicida, выделенные из B. velezensis V4, принадлежащие к группам итурина, макролактина и диффицидина, были идентифицированы [67].Эти соединения сильно подавляли рост A. salmonicida in vitro. Однако противомикробные механизмы бактериального штамма KU011TH на патогенных микроорганизмах пресноводных рыб не могут быть напрямую объяснены, что позволяет предположить, что некоторые антимикробные пептиды, продуцируемые бактериальным штаммом KU011TH, способны либо убивать патогены, либо ингибировать механизмы их действия. Несмотря на неактивность бактериального штамма KU011TH против патогенов морских рыб в условиях совместного культивирования, этот штамм показал способность расти в культуре с Vibrio spp.в тех же условиях, предполагая, что штамм может расти в условиях с высоким содержанием соли, но не может продуцировать антимикробные соединения и / или противомикробные молекулы и, таким образом, неэффективен против патогенов в этих условиях. Дальнейшая работа по очистке и идентификации противомикробных молекул бактериального штамма KU011TH поможет выяснить механизм, лежащий в основе его антимикробной активности против различных патогенов рыб.
Антибиотикограмма Acinetobacter spp. выделен из различных клинических образцов в больнице третичного уровня в Западной Бенгалии, Индия.
— Биомедицинские исследования (2013), том 24, выпуск 1
Антибиотикограмма Acinetobacter spp. изолированные из различных клинических образцов
в больнице третичного уровня в Западной Бенгалии, Индия.
Bhattacharyya S * , Bhattacharyya I, Rit K, Mukhopadhyay PK, Dey JB, Ganguly U, Ray R.
Кафедра микробиологии, Медицинский колледж Банкура Саммилани, Банкура, Западная Бенгалия, Индия.
- * Автор для переписки:
- Бхаттачарья С.
Кафедра микробиологии
Медицинский колледж Банкура Саммилани
Банкура, Западная Бенгалия, Индия.
Дата принятия: 7 ноября 2012 г.
Абстракция
Acinetobacter spp. являются грамотрицательными коккобациллами, вызывающими различные внутрибольничные инфекции. Они обладают различными типами бета-лактамаз, такими как SHV, TEM и другие, которые приводят к неэффективности лечения в случае инфекций, вызванных этим патогеном. Следовательно, важно изучить их видовое распределение при различных инфекциях и паттернах лекарственной устойчивости. Таким образом, наше исследование было направлено на изучение различных инфекций, вызываемых Acinetobacter spp, в больнице третичного уровня в Восточной Индии и их чувствительности к антибиотикам.
Ключевые слова
Acinetobacter , нозокомиальный, резистентный.
Введение
Acinetobacte r spp. грамм-отрицательные, строго аэробные,
неприхотливые, неферментирующие инкапсулированные коккобациллы
вызывая в основном внутрибольничные инфекции. По мнению большинства
последняя научная литература, Acinetobacter spp. вторые
наиболее распространенный неферментирующий грамотрицательный патоген
выделен из клинических образцов после Pseudomonas
aeruginosa [1].Они обладают окислительным действием в метаболизме и
коккоид в стационарной фазе культивирования [2]. Род
включает несколько видов, среди которых важными являются A.
baumannii группа, A. lwoffii, A. johnsonii, A. junii, A.
hemolyticus и не менее 25 геномовидов [3]. Acinetobacter spp. являются важными причинами инфекций, связанных с устройствами
и инфекции мочевыводящих путей, но в последние годы
также были изолированы от кровотока и других участков, и
печально известны своей устойчивостью к бета-лактамным антибиотикам.Распространение штаммов Acinetobacter с множественной лекарственной устойчивостью
среди госпитализированных пациентов стало все больше
повод для беспокойства [4]. Следовательно, важно искать
новые классы антибиотиков, эффективных при лечении
инфекция, вызванная Acinetobacter spp.
Материалы и методы
Исследование проводилось с июня 2010 г. по май 2011 г. в г.
Кафедра микробиологии, Bankura Sammilani
Медицинский колледж, Банкура, Западная Бенгалия, Индия.
Сто (100) изолятов Acinetobacter spp.мы
извлечены из различных клинических образцов, а именно гноя
(23 образца), моча (54 образца), спинномозговая жидкость (12 образцов),
мазок из зева (4 образца), вагинальный мазок (1 образец) и
неуточненные образцы мазков (6 образцов). Только изоляты
выращены из образцов пациентов, у которых развиваются различные симптомы
после госпитализации в разные палаты больницы по
более 48 часов (нозокомиальные изоляты) были отобраны
для учебы. Были определены виды изолятов и их антимикробные свойства.
была изучена картина сопротивления. Полученные образцы
в лаборатории были привиты 5% овец.
Кровяной агар и агар Mac Conkey Agar и инкубировали в течение ночи.
аэробно при температуре 37 ° C (для выделения Acinetobacter spp.кроме A. johnsonii ) и 25 ° C (для изоляции A. johnsonii ,
соответственно). После этого определение видов и
Были проведены тесты на чувствительность к антибиотикам in vitro. В
В случае образцов мочи изоляты подвергали биохимическому анализу.
тесты и чувствительность к антимикробным препаратам, только если
количество колоний было значительным (> 10 5 КОЕ / мл). Acinetobacter spp. были идентифицированы характерными колониями
(Не ферментирующие лактозу, блестящие, маленькие слизистые колонии),
Картина окрашивания по Граму и стандартный биохимический анализ
реакции [1] (каталаза, оксидаза, окисление Хью-Лейфсона-
Тест ферментации, производство индола, утилизация цитрата,
Подвижность, активность уреазы, реакция на тройной сахар
Железная среда), как показано в Таблице 1.
После идентификации фенотипическими методами антибиотик
чувствительность определялась для каждого изолята
Дисковый диффузионный метод Кирби-Бауэра по Мюллеру-Хинтону
Агар (4) с использованием стандарта мутности МакФарланда 0,5 и
сравнение размеров зоны с контрольным штаммом P. aeruginosa ATCC 27853. Использовали следующие диски с антибиотиками: —
Амикацин (30 мкг), пенициллин G (10 мкг), пиперациллин-
Тазобакт (100/10 мкг), цефотаксим (30 мкг), цефтазидим
(30 мкг), гатифлоксацин (10 мкг), левофлоксацин (5 мкг), ципрофлоксацин (
5 мкг), котримоксазол (25 мкг), тетрациклин (30 мкг)
(в случае образцов, отличных от мочи) и нитрофурантоин
(300 мкг) (только для образцов мочи).Результаты восприимчивости
были интерпретированы путем измерения диаметров полученных зон и сопоставления их со стандартами CLSI [5].
Производство ESBL было протестировано с использованием приближения двойного диска.
метод с использованием цефтазидима и цефтазидима-
Диски с клавулиновой кислотой [6].
Результаты
Из 100 изолятов 54% (54 изолята) принадлежали к
В группе A. baumannii 44% (44 изолята) составляли A. lwoffii и 2% (2 изолята) были идентифицированы как A. hemolyticus на основании уже упомянутых биохимических реакций. А.
johnsonii не был выделен ни в одном из образцов. Все
как упоминалось ранее, изоляты были нозокомиального происхождения. Acinetobacter spp. составляли около 17% всех госпитальных
обработаны бактериальные изоляты из всех клинических образцов
в течение периода исследования, как было отмечено из записи
из 100 бактериальных изолятов, выделенных из различных образцов
за тот же период и около 33,3% всех бактериальных
изоляты из I.C.U.
Средний возраст больных 27 лет. Гендерное соотношение было
1.46: 1 (мужчина: женщина). Таким образом, небольшой мужской перевес
наблюдалось в нашем исследовании.
Практически все изоляты показали устойчивость in vitro к одному
или более антибиотиков, упомянутых ранее. Среди
изолятов, 29% (29 изолятов) были МЛУ или множественной лекарственной устойчивостью
(устойчивость к 3 или> 3 различным классам антибиотиков)
, при этом 79,3% от общего числа штаммов МЛУ принадлежат A.
baumannii (23 изолята). Среди изолятов A. baumannii ,
44% из них были МЛУ.
Устойчивость к амикацину была обнаружена у 55 человек.5% изолятов, а
показатели для пенициллина G, пиперациллина-тазобакта, котримоксазола,
Левофлоксацин, Офлоксацин, Гатифлоксацин, Ципрофлоксацин,
Цефотаксим, цефтазидим, имипенем и нитрофурантоин
были 100%, 18,2%, 71,8%, 21,42%, 58,82%,
6,75%, 52,17%, 75,2%, 80%, 15% и 64,28% соответственно.
Таким образом, устойчивость к левофлоксацину in vitro была ниже.
по сравнению с другими хинолонами, а также с
Имипенем и очень незначительная устойчивость к гатифлоксацину.
Бета-лактамы показали пониженную эффективность, в то время как амикацин
и пиперациллин-тазобакт были немного эффективными.Примерно
78,5% всех изолятов были продуцентами БЛРС,
определяется по аппроксимации двойного диска
метод [6].
Обсуждение
Acinetobacter spp., Быстро появляющиеся как возбудители условно-патогенных
нозокомиальная инфекция с развивающейся лекарственной устойчивостью,
стали реальной проблемой при организации больниц, особенно
в отделениях интенсивной терапии. Более того, это часто показывает
вариабельная реакция Грама с плеоморфизмом и может
имитируют многие распространенные грамположительные кокки [7]. В
патогену ранее были присвоены различные названия, такие как Micro
coccus calcoaceticus, Mima polymorpha и Herellea
vaginicola .Род Acinetobacter претерпел значительные
модификация номенклатуры за последние 30
годы. Текущее обозначение рода Acinetobacter (производное
от греческого «акинетос», что означает неподвижный)
был первоначально предложен в 1954 г. [8]. В настоящее время род включает
около 28 видов, среди которых A. baumannii, A.
calcoaceticus, A. johnsonii, A. junii, A. ursingii и A.
hemolyticus среди других. Есть много геномовидов
в дополнение к упомянутым видам. A. calcoaceticus был получен только из проб почвы и воды и
никогда не участвовал в клинических проявлениях болезни. Следовательно, номенклатура группа A. calcoaceticus-baumannii больше не приемлема.
[8]. Acinetobacter spp. в основном причастны к
различные нозокомиальные инфекции, такие как инфекции дыхательных путей,
инфекции кровотока, раневые инфекции, мочевыводящие пути
инфекции трактов, менингит и редко кератит и другие
инфекции [8]. По нашим данным, возбудитель
был выделен в основном с мочой (54%, т.е. 54 изолята) followed
гноем (23%, т.е. 23 изолята), CSF (12%, т.е. 12
изолятов) и других образцов (11%, т.е. 11 изолятов). Acinetobacter spp. были вовлечены примерно в 10% всех
Инфекции ICU в Европе [9]. По нашему опыту,
возбудитель составил 16,9% от всех внутрибольничных бактериальных
изолирует. Заражению способствует способность бактерии
колонизировать больничное оборудование и упорствовать на неодушевленном
поверхности в течение длительных периодов времени
от 3 дней до 5 месяцев, и Acinetobacter spp.может быть
обнаружены на различном оборудовании, включая перила, занавески,
вентиляционное оборудование (например, мешки AMBU, вентиляция
фильтр) [8]. Колонизация пациентов, медицинских работников
и у здоровых людей встречается часто. Несколько
факторы вирулентности, такие как липазы и сидерофоры, были
изучены [10]. Лечение инфекций Acinetobacter — это
огромная проблема из-за широкого спектра противомикробных
резистентность и способность патогена вырабатывать новые
сопротивление быстро. Были выявлены различные модели сопротивления.
обнаружены даже с проверенными клональными изолятами Acinetobacter spp.в нозокомиальном учреждении. Противомикробные средства, которые
обычно активны против патогена, включая карбапенемы (
Имипенем и меропенем), амикацин, сульбактум,
Колистин, рифампицин и тетрациклины. Комбинация
терапию можно рассмотреть, но она неоднозначна из-за отсутствия
доказанное снижение смертности и повышение токсичности
[8]. Acinetobacter baumannii штаммов по своей природе обладают
хромосомно-кодируемые цефалоспориназы AmpC, которые
опосредуют устойчивость к цефалоспоринам. Аминогликозиды, модифицирующие
Ферменты широко распространены в A с множественной лекарственной устойчивостью.baumannii штаммов. Устойчивость к хинолонам
опосредуется модификациями ДНК-гиразы или топоизомеразы
IV, в то время как для тетрациклинов происходит отток
насосы или рибосомальная защита [7]. Сопротивление было
связаны с хромосомной областью 86 т.п.н. или резистентностью
остров, отвечающий за выработку сопротивления
к большому количеству антимикробных средств [7]. Мультилекарственный
резистентность (MDR), то есть устойчивость к цефотаксиму, цефтазидиму, амикацину и ципрофлоксацину [11], является новой
проблема с Acinetobacter spp.Пан лекарственно устойчивый A.
baumannii , т.е. изоляты, устойчивые ко всем антимикробным
агентов in vitro, были зарегистрированы из Азии и
Ближний Восток [8]. В нашем исследовании 29% изолятов были
Множественная лекарственная устойчивость. Около 44,4% изолятов A. baumannii
были множественной лекарственной устойчивостью. Исследования цитируют изоляцию
Acinetobacter spp. с множественной лекарственной устойчивостью из Индии
и азиатские больницы. В обзоре сравнения больниц
из 10 стран Азии, 1,2-87% всех изолятов Acinetobacter
от пациентов с госпитальной пневмонией (
HAP) были МЛУ, причем наиболее распространенными были штаммы МЛУ
в Индии и Таиланде [12].
В исследовании из Пуны от 48% до 68,6% изолятов A. baumannii были МЛУ [13]. В репортаже 48 европейских
больницы с 2002 по 2004 год, 32,4%, 34% и 47,6% изолятов
показали чувствительность к цефтазидиму, ципрофлоксацину
и гентамицин соответственно [9]. В Азии и на Ближнем Востоке,
показатели нечувствительности к цефтазидиму составляют около 40%,
35% для амикацина и 45% для ципрофлоксацина [9]. Мы нашли соответствующие цифры для этих
группы противомикробных препаратов составляют 80%, 55,5% и 52.17%
соответственно. Таким образом, в нашем исследовании несколько более высокие значения
были зарегистрированы для цефалоспоринов третьего поколения и
Ципрофлоксацин соответственно. Acinetobacter spp. составлен
около 33,3% всех бактериальных изолятов и 25% всех микробных
изоляты I.C.U. образцы, согласно нашим
изучение.
Колистин, также называемый полимиксином E, обычно сохраняет
активность против Acinetobacter spp. перед лицом широкого спектра
устойчивость к противомикробным препаратам. Однако это может быть
нефротоксичен и ототоксичен, что ограничивает его рутинное использование,
хотя было обнаружено, что токсичность аналогична другим
противомикробные препараты в отделении интенсивной терапии [8].
Примечательно, что наши результаты показывают, что левофлоксацин эффективен
против Acinetobacter spp. (устойчивость 21,42%), а
6,25% изолятов были устойчивы к гатифлоксацину. Другой
исследование показало устойчивость к левофлоксацину у Acinetobacter
baumanii порядка 26% [14]. Таким образом, Левофлоксацин,
S-энантиомер офлоксацина, более безопасный и лучший
переносится, чем другие фторхиниолоны [15], может быть хуже
токсичный и экономичный терапевтический вариант против изолятов Acinetobacter , особенно в этой части Индии.Карбапенем
Устойчивость является новой проблемой для Acinetobacter spp. Только несколько центров, таких как I.M.S., B.H.U., Варанаси.
и A.I.I.M.S., Нью-Дели, упомянули Меропенем.
устойчивость к Acinetobacter spp. быть около 6,4% и
22,16% соответственно в своих исследованиях [16,17]. Один отчет
из США процитировал устойчивость к имипенему у Acinetobacter
baumannii порядка 23,1% в их
исследование [18]. В аналогичном исследовании из Индии упоминается, что примерно
14,2% от А.baumannii в своем исследовании были
Имипенем устойчивый [19]. Acinetobacter spp., В целом
проявляют большую устойчивость к меропенему in vitro, чем
Имипенем [16,17]. Наши результаты показывают, что около 15% всех
изоляты Acinetobacter spp. были устойчивы к имипенему.
Еще один важный вывод нашего исследования заключается в том, что производство БЛРС
оказалось порядка 78,5%, что в
соответствие с результатами исследования в Мееруте, Север
Индия показала, что этот показатель составляет около 75% [20].Однако исследования из Бангалора, Южная Индия, показали, что
низкая распространенность БЛРС у Acinetobacter spp. (28%) [21]. Есть только несколько отчетов в
литература о распространенности БЛРС у Acinetobacter spp. из Индии, особенно Восточной Индии, и наши
Таким образом, исследование заслуживает упоминания.
Ограничения исследования
Размер выборки (100) был не очень большим и, следовательно,
распределение видов, как упомянуто здесь, должно быть коррелировано
с исследованиями с большим количеством изолятов.Также,
устойчивость in vitro Acinetobacter spp. Колистину
не изучался, особенно в I.C.U., который мог быть
эпидемиологически важно.
Благодарности
Авторы признательны г-ну Сумитре Рою и г-ну
С.П. Дабал за своевременное предоставление питательных сред
и помощь в интерпретации результатов восприимчивости.
Список литературы
- Гаутам В., Сингхал Л., Рэй П. Комплекс Burkholoderia cepacia: помимо Pseudomonas и Acinetobacter.Ind J Med Microbiol 2011; 29: 4-12.
- Аллен Д.М., Хартман Б.Дж. Виды Acinetobacter. В: Манделл Г.Л., Беннетт Дж. Э., Долин Р., редакторы. Принципы и практика инфекционных заболеваний. Черчилль Ливингстон. 6-е изд. .Philadelphia 2005; С. 2632-2636.
- Винн В. (младший), Аллен С., Джанда В., Конеман Э, Прокоп Г., Шрекенбергер П., Вудс Г. Неферментативные грамотрицательные бациллы. В кн .: Цветовой атлас Конемана и учебник по диагностической микробиологии. Липпинкотт Уильямс и Уилкинс. 6-е изд..Philadelphia 2006; С. 353-354.
- Dijkshoorn L, Nemec A, Seifert H. Растущая угроза в больницах: Acinetobacter baumannii с множественной устойчивостью. Nat Rev Microbiol 2007; 5: 939-951.
- Bauer AW, Kirby WMM, Sherris JC, Turck M Тестирование чувствительности к антибиотикам стандартным методом с одним диском. Am J Clin Pathol 1966: 45: 493.
- Брэдфорд PA. Β-лактамазы расширенного спектра в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости.Clin Microbiol Rev 2001; 14: 933-951.
- Мюррей СК, Госпиталь DR. Инфекция Acinetobacter в отделении интенсивной терапии. Critic Care Clin 2008; 24: 237-248.
- Wayne PA: Клиническая лаборатория института стандартов. Стандарты производительности для тестирования чувствительности к противомикробным препаратам; 17-е информационное приложение, 2006 г .; CLSI M2-A9.
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: появление успешного возбудителя. Clin Microbiol Rev 2008: 21: 538-582.
- Govan JRW. Псевдомонады и неферментеры.В: Greenwood D, Slack R, Peutherer J, Barer M, редакторы. Медицинская микробиология. Руководство по микробным инфекциям: патогенез, иммунитет, лабораторная диагностика и контроль. Черчилль Ливингстон Эльзевьер: 17-е изд., Лондон, 2007; С. 298.
- Bergogne-Berezin E, Towner KJ. Acinetobacter spp. как внутрибольничные возбудители: микробиологические, клинико-эпидемиологические особенности. Clin Microbiol Rev 1996; 9: 148-163.
- Lagamayo EN. Устойчивость к противомикробным препаратам основных возбудителей госпитальной пневмонии в странах Азии.Am J Inf Control 2008: 36: S101-S108.
- Джоши С.Г., Литаке Г.М., Сатпуте М.Г., Теланг Н.В., Гол В.С., Нипхадкар КБ. Клинико-демографические особенности инфекции, вызванной видами Acinetobacter. Ind J Med Sc 2006; 60: 351-360.
- Heinemann B, Wisplinghoff H, Edmond M, Seifert H. Сравнительная активность ципрофлоксацина, клинафлоксацина, гатифлоксацина, гемифлоксацина, левофлоксацина, моксифлоксацина и тровафлоксацина против эпидемиологически определенного штамма Acinetobacter baumannii. Противомикробные агенты Chemother 2000; 44: 2211-2213.
- Штальманн Р. Клинические токсикологические аспекты фторхинолонов. Toxicol Lett 2002; 127: 269-277.
- Гаур А, Банда А, Пракаш П., Анупурба С., Мохапатра TM. Наблюдения за устойчивостью к карбапенемам по минимальной ингибирующей концентрации в нозокомиальных изолятах видов Acinetobacter. J Health Popul Nutr 2008; 26: 183-188.
- Гупта Э, Моханти С., Суд С., Дхаван Б., Дас Б.К., Капил А. Возникающая устойчивость к карбапенемам в больнице третичного уровня на севере Индии. Ind J Med Res 2006; 124: 95-98.
- Lautenbach E, Synnestvedt M, Weiner MG, Bilker WB, Vo L, Schein J, Kim M. Эпидемиология и влияние устойчивости к имипенемам у Acinetobacter baumannii. Inf C Hosp Epidemiol 2009; 30: 1186-1192.
- Гладстон П., Раджендран П., Брахмадатан К.Н. Заболеваемость устойчивыми к карбапенему неферментирующими грамотрицательными бациллами у пациентов с респираторными инфекциями в отделениях интенсивной терапии. Ind J Med Microbiol 2005; 23: 189-191.
- Kansal R, Pandey A, Asthana AK. Виды Acinetobacter, продуцирующие β-лактамазу, у госпитализированных пациентов.Ind J Pathol Microbiol 2009; 52: 456-457.
- Sinha M, Srinivasa H, Macaden R. Профиль устойчивости к антибиотикам и продукция бета-лактамаз расширенного спектра (ESBL) у видов Acinetobacter. Ind J Pathol Microbiol 2007; 126: 63-67.
Антибиотикограмма Acinetobacter spp. изолят
Ключевые слова
Acinetobacter , нозокомиальный, резистентный.
Введение
Acinetobacte r spp. грамм-отрицательные, строго аэробные,
неприхотливые, неферментирующие инкапсулированные коккобациллы
вызывая в основном внутрибольничные инфекции.По мнению большинства
последняя научная литература, Acinetobacter spp. вторые
наиболее распространенный неферментирующий грамотрицательный патоген
выделен из клинических образцов после Pseudomonas
aeruginosa [1]. Они обладают окислительным действием в метаболизме и
коккоид в стационарной фазе культивирования [2]. Род
включает несколько видов, среди которых важными являются A.
baumannii группа, A. lwoffii, A. johnsonii, A. junii, A.hemolyticus и не менее 25 геномовидов [3]. Acinetobacter spp. являются важными причинами инфекций, связанных с устройствами
и инфекции мочевыводящих путей, но в последние годы
также были изолированы от кровотока и других участков, и
печально известны своей устойчивостью к бета-лактамным антибиотикам.
Распространение штаммов Acinetobacter с множественной лекарственной устойчивостью
среди госпитализированных пациентов стало все больше
повод для беспокойства [4].Следовательно, важно искать
новые классы антибиотиков, эффективных при лечении
инфекция, вызванная Acinetobacter spp.
Материалы и методы
Исследование проводилось с июня 2010 г. по май 2011 г. в г.
Кафедра микробиологии, Bankura Sammilani
Медицинский колледж, Банкура, Западная Бенгалия, Индия.
Сто (100) изолятов Acinetobacter spp. мы
извлечены из различных клинических образцов, а именно гноя
(23 образца), моча (54 образца), спинномозговая жидкость (12 образцов),
мазок из зева (4 образца), вагинальный мазок (1 образец) и
неуточненные образцы мазков (6 образцов).Только изоляты
выращены из образцов пациентов, у которых развиваются различные симптомы
после госпитализации в разные палаты больницы по
более 48 часов (нозокомиальные изоляты) были отобраны
для учебы. Были определены виды изолятов и их антимикробные свойства.
была изучена картина сопротивления. Полученные образцы
в лаборатории были привиты 5% овец.
Кровяной агар и агар Mac Conkey Agar и инкубировали в течение ночи.
аэробно при температуре 37 ° C (для выделения Acinetobacter spp.кроме A. johnsonii ) и 25 ° C (для изоляции A. johnsonii ,
соответственно). После этого определение видов и
Были проведены тесты на чувствительность к антибиотикам in vitro. В
В случае образцов мочи изоляты подвергали биохимическому анализу.
тесты и чувствительность к антимикробным препаратам, только если
количество колоний было значительным (> 10 5 КОЕ / мл). Acinetobacter spp. были идентифицированы характерными колониями
(Не ферментирующие лактозу, блестящие, маленькие слизистые колонии),
Картина окрашивания по Граму и стандартный биохимический анализ
реакции [1] (каталаза, оксидаза, окисление Хью-Лейфсона-
Тест ферментации, производство индола, утилизация цитрата,
Подвижность, активность уреазы, реакция на тройной сахар
Железная среда), как показано в Таблице 1.
После идентификации фенотипическими методами антибиотик
чувствительность определялась для каждого изолята
Дисковый диффузионный метод Кирби-Бауэра по Мюллеру-Хинтону
Агар (4) с использованием стандарта мутности МакФарланда 0,5 и
сравнение размеров зоны с контрольным штаммом P. aeruginosa ATCC 27853. Использовали следующие диски с антибиотиками: —
Амикацин (30 мкг), пенициллин G (10 мкг), пиперациллин-
Тазобакт (100/10 мкг), цефотаксим (30 мкг), цефтазидим
(30 мкг), гатифлоксацин (10 мкг), левофлоксацин (5 мкг), ципрофлоксацин (
5 мкг), котримоксазол (25 мкг), тетрациклин (30 мкг)
(в случае образцов, отличных от мочи) и нитрофурантоин
(300 мкг) (только для образцов мочи).Результаты восприимчивости
были интерпретированы путем измерения диаметров полученных зон и сопоставления их со стандартами CLSI [5].
Производство ESBL было протестировано с использованием приближения двойного диска.
метод с использованием цефтазидима и цефтазидима-
Диски с клавулиновой кислотой [6].
Результаты
Из 100 изолятов 54% (54 изолята) принадлежали к
в группе A. baumannii 44% (44 изолята) составляли A. lwoffii и 2% (2 изолята) были идентифицированы как A.hemolyticus на основе уже упомянутых биохимических реакций. А.
johnsonii не был выделен ни в одном из образцов. Все
как упоминалось ранее, изоляты были нозокомиального происхождения. Acinetobacter spp. составляли около 17% всех госпитальных
обработаны бактериальные изоляты из всех клинических образцов
в течение периода исследования, как было отмечено из записи
из 100 бактериальных изолятов, выделенных из различных образцов
за тот же период и около 33.3% всех бактериальных
изоляты из I.C.U.
Средний возраст больных 27 лет. Гендерное соотношение было
1,46: 1 (самец: самка). Таким образом, небольшой мужской перевес
наблюдалось в нашем исследовании.
Практически все изоляты показали устойчивость in vitro к одному
или более антибиотиков, упомянутых ранее. Среди
изолятов, 29% (29 изолятов) были МЛУ или множественной лекарственной устойчивостью
(устойчивость к 3 или> 3 различным классам антибиотиков)
, с 79.3% от общего числа штаммов МЛУ, относящихся к A.
baumannii (23 изолята). Среди изолятов A. baumannii ,
44% из них были МЛУ.
Устойчивость к амикацину была обнаружена у 55,5% изолятов, в то время как
показатели для пенициллина G, пиперациллина-тазобакта, котримоксазола,
Левофлоксацин, Офлоксацин, Гатифлоксацин, Ципрофлоксацин,
Цефотаксим, цефтазидим, имипенем и нитрофурантоин
были 100%, 18,2%, 71,8%, 21,42%, 58,82%,
6,75%, 52,17%, 75.2%, 80%, 15% и 64,28% соответственно.
Таким образом, устойчивость к левофлоксацину in vitro была ниже.
по сравнению с другими хинолонами, а также с
Имипенем и очень незначительная устойчивость к гатифлоксацину.
Бета-лактамы показали пониженную эффективность, в то время как амикацин
и пиперациллин-тазобакт были немного эффективными. Примерно
78,5% всех изолятов были продуцентами БЛРС,
определяется по аппроксимации двойного диска
метод [6].
Обсуждение
Acinetobacter spp., быстро появляющиеся как агенты оппортунистических
нозокомиальная инфекция с развивающейся лекарственной устойчивостью,
стали реальной проблемой при организации больниц, особенно
в отделениях интенсивной терапии. Более того, это часто показывает
вариабельная реакция Грама с плеоморфизмом и может
имитируют многие распространенные грамположительные кокки [7]. В
патогену ранее были присвоены различные названия, такие как Micro
coccus calcoaceticus, Mima polymorpha и Herellea
vaginicola .Род Acinetobacter претерпел значительные
модификация номенклатуры за последние 30
годы. Текущее обозначение рода Acinetobacter (производное
от греческого «акинетос», что означает неподвижный)
был первоначально предложен в 1954 г. [8]. В настоящее время род включает
около 28 видов, среди которых A. baumannii, A.
calcoaceticus, A. johnsonii, A. junii, A. ursingii и A.
hemolyticus среди других.Есть много геномовидов
в дополнение к упомянутым видам. A. calcoaceticus был получен только из проб почвы и воды и
никогда не участвовал в клинических проявлениях болезни. Следовательно, номенклатура группа A. calcoaceticus-baumannii больше не приемлема.
[8]. Acinetobacter spp. в основном причастны к
различные нозокомиальные инфекции, такие как инфекции дыхательных путей,
инфекции кровотока, раневые инфекции, мочевыводящие пути
инфекции трактов, менингит и редко кератит и другие
инфекции [8].По нашим данным, возбудитель
был выделен в основном из мочи (54%, т.е. 54 изолята), после чего
гноем (23%, т.е. 23 изолята), CSF (12%, т.е. 12
изолятов) и других образцов (11%, т.е. 11 изолятов). Acinetobacter spp. были вовлечены примерно в 10% всех
Инфекции ICU в Европе [9]. По нашему опыту,
возбудитель составил 16,9% от всех внутрибольничных бактериальных
изолирует. Заражению способствует способность бактерии
колонизировать больничное оборудование и упорствовать на неодушевленном
поверхности в течение длительных периодов времени
от 3 дней до 5 месяцев, и Acinetobacter spp.может быть
обнаружены на различном оборудовании, включая перила, занавески,
вентиляционное оборудование (например, мешки AMBU, вентиляция
фильтр) [8]. Колонизация пациентов, медицинских работников
и у здоровых людей встречается часто. Несколько
факторы вирулентности, такие как липазы и сидерофоры, были
изучены [10]. Лечение инфекций Acinetobacter — это
огромная проблема из-за широкого спектра противомикробных
резистентность и способность патогена вырабатывать новые
сопротивление быстро.Были выявлены различные модели сопротивления.
обнаружены даже с проверенными клональными изолятами Acinetobacter spp. в нозокомиальном учреждении. Противомикробные средства, которые
обычно активны против патогена, включая карбапенемы (
Имипенем и меропенем), амикацин, сульбактум,
Колистин, рифампицин и тетрациклины. Комбинация
терапию можно рассмотреть, но она неоднозначна из-за отсутствия
доказанное снижение смертности и повышение токсичности
[8]. Acinetobacter baumannii штаммов по своей природе обладают
хромосомно-кодируемые цефалоспориназы AmpC, которые
опосредуют устойчивость к цефалоспоринам.Аминогликозиды, модифицирующие
Ферменты широко распространены в штаммах A. baumannii с множественной лекарственной устойчивостью. Устойчивость к хинолонам
опосредуется модификациями ДНК-гиразы или топоизомеразы
IV, в то время как для тетрациклинов происходит отток
насосы или рибосомальная защита [7]. Сопротивление было
связаны с хромосомной областью 86 т.п.н. или резистентностью
остров, отвечающий за выработку сопротивления
к большому количеству антимикробных средств [7].Мультилекарственный
резистентность (MDR), то есть устойчивость к цефотаксиму, цефтазидиму, амикацину и ципрофлоксацину [11], является новой
проблема с Acinetobacter spp. Пан лекарственно устойчивый A.
baumannii , т.е. изоляты, устойчивые ко всем антимикробным
агентов in vitro, были зарегистрированы из Азии и
Ближний Восток [8]. В нашем исследовании 29% изолятов были
Множественная лекарственная устойчивость. Около 44,4% изолятов A. baumannii
были множественной лекарственной устойчивостью.Исследования цитируют изоляцию
Acinetobacter spp. с множественной лекарственной устойчивостью из Индии
и азиатские больницы. В обзоре сравнения больниц
из 10 стран Азии, 1,2-87% всех изолятов Acinetobacter
от пациентов с госпитальной пневмонией (
HAP) были МЛУ, причем наиболее распространенными были штаммы МЛУ
в Индии и Таиланде [12].
В исследовании из Пуны от 48% до 68,6% изолятов A. baumannii были МЛУ [13]. В репортаже 48 европейских
больниц с 2002 по 2004 гг., 32.4%, 34% и 47,6% изолятов
показали чувствительность к цефтазидиму, ципрофлоксацину
и гентамицин соответственно [9]. В Азии и на Ближнем Востоке,
показатели нечувствительности к цефтазидиму составляют около 40%,
35% для амикацина и 45% для ципрофлоксацина [9]. Мы нашли соответствующие цифры для этих
группы противомикробных препаратов — 80%, 55,5% и 52,17%
соответственно. Таким образом, в нашем исследовании несколько более высокие значения
были зарегистрированы для цефалоспоринов третьего поколения и
Ципрофлоксацин соответственно. Acinetobacter spp. составлен
около 33,3% всех бактериальных изолятов и 25% всех микробных
изоляты I.C.U. образцы, согласно нашим
изучение.
Колистин, также называемый полимиксином E, обычно сохраняет
активность против Acinetobacter spp. перед лицом широкого спектра
устойчивость к противомикробным препаратам. Однако это может быть
нефротоксичен и ототоксичен, что ограничивает его рутинное использование,
хотя было обнаружено, что токсичность аналогична другим
противомикробные препараты в отделении интенсивной терапии [8].
Примечательно, что наши результаты показывают, что левофлоксацин эффективен
против Acinetobacter spp. (устойчивость 21,42%), а
6,25% изолятов были устойчивы к гатифлоксацину. Другой
исследование показало устойчивость к левофлоксацину у Acinetobacter
baumanii порядка 26% [14]. Таким образом, Левофлоксацин,
S-энантиомер офлоксацина, более безопасный и лучший
переносится, чем другие фторхиниолоны [15], может быть хуже
токсичный и экономичный терапевтический вариант против изолятов Acinetobacter , особенно в этой части Индии.Карбапенем
Устойчивость является новой проблемой для Acinetobacter spp. Только несколько центров, таких как I.M.S., B.H.U., Варанаси.
и A.I.I.M.S., Нью-Дели, упомянули Меропенем.
устойчивость к Acinetobacter spp. быть около 6,4% и
22,16% соответственно в своих исследованиях [16,17]. Один отчет
из США процитировал устойчивость к имипенему у Acinetobacter
baumannii порядка 23,1% в их
исследование [18]. В аналогичном исследовании из Индии упоминается, что примерно
14.2% из изолятов A. baumannii в их исследовании были
Имипенем устойчивый [19]. Acinetobacter spp., В целом
проявляют большую устойчивость к меропенему in vitro, чем
Имипенем [16,17]. Наши результаты показывают, что около 15% всех
изоляты Acinetobacter spp. были устойчивы к имипенему.
Еще один важный вывод нашего исследования заключается в том, что производство БЛРС
оказалось порядка 78,5%, что в
соответствие с результатами исследования в Мееруте, Север
Индия показала, что этот показатель составляет около 75% [20].Однако исследования из Бангалора, Южная Индия, показали, что
низкая распространенность БЛРС у Acinetobacter spp. (28%) [21]. Есть только несколько отчетов в
литература о распространенности БЛРС у Acinetobacter spp. из Индии, особенно Восточной Индии, и наши
Таким образом, исследование заслуживает упоминания.
Ограничения исследования
Размер выборки (100) был не очень большим и, следовательно,
распределение видов, как упомянуто здесь, должно быть коррелировано
с исследованиями с большим количеством изолятов.Также,
устойчивость in vitro Acinetobacter spp. Колистину
не изучался, особенно в I.C.U., который мог быть
эпидемиологически важно.
Благодарности
Авторы признательны г-ну Сумитре Рою и г-ну
С.П. Дабал за своевременное предоставление питательных сред
и помощь в интерпретации результатов восприимчивости.
Список литературы
- Гаутам В., Сингхал Л., Рэй П. Комплекс Burkholoderia cepacia: помимо Pseudomonas и Acinetobacter.Ind J Med Microbiol 2011; 29: 4-12.
- Аллен Д.М., Хартман Б.Дж. Виды Acinetobacter. В: Манделл Г.Л., Беннетт Дж. Э., Долин Р., редакторы. Принципы и практика инфекционных заболеваний. Черчилль Ливингстон. 6-е изд. .Philadelphia 2005; С. 2632-2636.
- Винн В. (младший), Аллен С., Джанда В., Конеман Э, Прокоп Г., Шрекенбергер П., Вудс Г. Неферментативные грамотрицательные бациллы. В кн .: Цветовой атлас Конемана и учебник по диагностической микробиологии. Липпинкотт Уильямс и Уилкинс.6-е изд .. Филадельфия 2006; С. 353-354.
- Dijkshoorn L, Nemec A, Seifert H. Возрастающая угроза в больницах: Acinetobacter baumannii с множественной устойчивостью. Nat Rev Microbiol 2007; 5: 939-951.
- Bauer AW, Kirby WMM, Sherris JC, Turck M Тестирование чувствительности к антибиотикам стандартным методом с одним диском. Am J Clin Pathol 1966: 45: 493.
- Брэдфорд PA. Β-лактамазы расширенного спектра в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости.Clin Microbiol Rev 2001; 14: 933-951.
- Мюррей СК, Госпиталь DR. Инфекция Acinetobacter в отделении интенсивной терапии. Critic Care Clin 2008; 24: 237-248.
- Wayne PA: Клиническая лаборатория института стандартов. Стандарты производительности для тестирования чувствительности к противомикробным препаратам; 17-е информационное приложение, 2006 г .; CLSI M2-A9.
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: появление успешного возбудителя. Clin Microbiol Rev 2008: 21: 538-582.
- Govan JRW. Псевдомонады и неферментеры. В: Greenwood D, Slack R, Peutherer J, Barer M, редакторы. Медицинская микробиология. Руководство по микробным инфекциям: патогенез, иммунитет, лабораторная диагностика и контроль. Черчилль Ливингстон Эльзевьер: 17-е изд., Лондон, 2007; С. 298.
- Bergogne-Berezin E, Towner KJ. Acinetobacter spp. как внутрибольничные возбудители: микробиологические, клинико-эпидемиологические особенности. Clin Microbiol Rev 1996; 9: 148-163.
- Lagamayo EN.Устойчивость к противомикробным препаратам основных возбудителей госпитальной пневмонии в странах Азии. Am J Inf Control 2008: 36: S101-S108.
- Джоши С.Г., Литаке Г.М., Сатпуте М.Г., Теланг Н.В., Гол В.С., Нипхадкар КБ. Клинико-демографические особенности инфекции, вызванной видами Acinetobacter. Ind J Med Sc 2006; 60: 351-360.
- Heinemann B, Wisplinghoff H, Edmond M, Seifert H. Сравнительная активность ципрофлоксацина, клинафлоксацина, гатифлоксацина, гемифлоксацина, левофлоксацина, моксифлоксацина и тровафлоксацина против эпидемиологически определенного штамма Acinetobacter baumannii.Противомикробные агенты Chemother 2000; 44: 2211-2213.
- Штальманн Р. Клинические токсикологические аспекты фторхинолонов. Toxicol Lett 2002; 127: 269-277.
- Гаур А, Банда А, Пракаш П., Анупурба С., Мохапатра TM. Наблюдения за устойчивостью к карбапенемам по минимальной ингибирующей концентрации в нозокомиальных изолятах видов Acinetobacter. J Health Popul Nutr 2008; 26: 183-188.
- Гупта Е., Моханти С., Суд С., Дхаван Б., Дас Б.К., Капил А. Возникновение устойчивости к карбапенемам в больнице третичного уровня на севере Индии.Ind J Med Res 2006; 124: 95-98.
- Lautenbach E, Synnestvedt M, Weiner MG, Bilker WB, Vo L, Schein J, Kim M. Эпидемиология и влияние устойчивости к имипенемам у Acinetobacter baumannii. Inf C Hosp Epidemiol 2009; 30: 1186-1192.
- Гладстон П., Раджендран П., Брахмадатан К.Н. Заболеваемость устойчивыми к карбапенему неферментирующими грамотрицательными бациллами у пациентов с респираторными инфекциями в отделениях интенсивной терапии. Ind J Med Microbiol 2005; 23: 189-191.
- Kansal R, Pandey A, Asthana AK.Виды Acinetobacter, продуцирующие β-лактамазу, у госпитализированных пациентов. Ind J Pathol Microbiol 2009; 52: 456-457.
- Sinha M, Srinivasa H, Macaden R. Профиль устойчивости к антибиотикам и продукция бета-лактамаз расширенного спектра (ESBL) у видов Acinetobacter. Ind J Pathol Microbiol 2007; 126: 63-67.
Подвергание стрессу минимизирует зону противомикробного действия: фенотипическая демонстрация с шестью штаммами Acinetobacter baumannii
1. Ларсон Э.Факторы сообщества в развитии устойчивости к антибиотикам. Анну Рев Паб Здоровье. 2007; 28: 435-447.
2. Гонсалес Виллория AM, Вальверде Гардуно В. Устойчивый к антибиотикам Acinetobacter baumannii, рост успеха которого остается проблемой как внутрибольничный патоген. J Pathogen. 2016: 7318075.
3. Celenza G, Pellegrini C, Caccamo M, Segatore B, Amicosante G, Perilli M. Распространение бета-лактамазегенов bla (CTX-M-тип) и bla (PER-2) в клинических изолятах из Боливии. больницы. J Antimicrob Chemother.2006; 57: 975-978.
4. Гуссенс Х. Европейский статус устойчивости к внутрибольничным инфекциям. Химиотерапия. 2005; 51: 177-181.
5. Лееб М. Антибиотики: укол в руку. Природа. 2004; 431: 892-893.
6. Рис LB. Федеральное финансирование исследования устойчивости к противомикробным препаратам внутрибольничных патогенов: нет ESKAPE. J Infect Dis. 2008; 197: 1079-1081.
7. Ward NR, Wolfe RL, Justice CA, Olson BH. Идентификация грамотрицательных неферментативных бактерий из воды: проблемы и альтернативные подходы к идентификации.Adv Appl Microbiol. 1986; 31: 293-365.
8. Хренович Дж., Дурн Дж., Гойч-Баришич И., Ковачич А. Возникновение штамма Acinetobacter baumannii в окружающей среде, аналогичного клиническому изоляту, в палеозоле из Хорватии. Appl Environ Microbiol. 2014; 89: 2860-2866.
9. Лопес-Эрнандес С., Аларкон Т., Лопес-Бреа М. Устойчивость к карбапенему, опосредованная бета-лактамазами, в клинических изолятах Acinetobacter baumannii в Испании. Eur J Clin Microbiol Infect Dis. 1998; 17: 282-285.
10. Towner KJ.Acinetobacter: старый друг, но новый враг. J Hosp Infect. 2009; 73: 355-363.
11. Ливермор Д-М. Угроза из розового угла. Ann Med. 2003; 35: 226-234.
12. Гейнес Р., Эдвардс-младший, Национальная система надзора за внутрибольничными инфекциями. Обзор внутрибольничных инфекций, вызванных грамотрицательными палочками. Clin Infect Dis. 2005; 41: 848-854.
13. Гарза-Гонсалес Э., Ллака-Диаз Дж. М., Боскес-Падилья Ф. Дж., Гонсалес Г. М.. Распространенность бактерий с множественной лекарственной устойчивостью в клинической больнице третичного уровня в Мексике: особое внимание Acinetobacter baumannii.Химиотерапия. 2010; 56: 275-279.
14. Морфин-Отеро Р., Алькантар-Куриэль, доктор медицины, Роча М.Дж., Альпуч-Аранда С.М., Сантос-Пресьядо Д.И., Гайосо-Васкес С. и др. Инфекции Acinetobacter baumannii в больнице третичного уровня в Мексике за последние 13 лет. Химиотерапия. 2013; 59: 57-65.
15. Ли Дж., Нейшн Р.Л., Тернидж Д.Д., Милн Р.В., Култхард К., Рейнер С.Р., Патерсон Д.Л. Колистин: вновь появляющийся антибиотик от грамотрицательных бактериальных инфекций с множественной лекарственной устойчивостью. Lancet Infect Dis. 2006; 6: 589-601.
16. Гейлс А.С., Джонс Р.Н., Садер Х.С. Глобальная оценка антимикробной активности полимиксина B против 54731 клинического изолята грамотрицательных бацилл: отчет программы SENTRY Antimicrobial Surveillance Programme (2001-2004 гг.). Clin Microbiol Infect. 2006; 12: 315-321.
17. Эрнан Р.К., Карина Б., Габриэла Г., Марсела Н., Карлос В., Анжела Ф. Отбор колистин-устойчивых изолятов Acinetobacter baumannii при постнейрохирургическом менингите в отделении интенсивной терапии с высоким уровнем гетерорезистентности к колистину.Диагностика Microbiol Infect Dis. 2009; 65: 188-191.
18. Пак Ю.К., Чой Дж.Й., Юнг С.И., Пак К.Х., Ли Х., Юнг Д.С. и др. Два отдельных клона изолятов Acinetobacter baumannii, устойчивых к карбапенемам, из корейских больниц. Диагностика Microbiol Infect Dis. 2009; 64: 389-395.
19. Уилсон С.Дж., Книп С.Дж., Зигер М.Дж., Габехарт К.М., Гудман Дж.Э., Фолк Х.М., Суд Р. Прямые затраты на Acinetobacter baumannii с множественной лекарственной устойчивостью в ожоговом отделении государственной клинической больницы. Am J Infect Control. 2004; 32: 342-344.
20. Bergogne BE, Towner KJ. Acinetobacter spp. как внутрибольничные возбудители: микробиологические, клинико-эпидемиологические особенности. Clin Microbiol Rev.1996; 9: 148-165.
21. Ли Нью-Йорк, Ли ХК, Ко Нью-Йорк, Чанг СМ, Ши Х.И., Ву СиДжей, Ко WC. Клинические и экономические последствия множественной лекарственной устойчивости при внутрибольничной бактериемии Acinetobacter baumannii. Инфекционный контроль Hosp Epidemiol. 2007; 28: 713-719.
22. Хота Б. Загрязнение, дезинфекция и перекрестная колонизация: являются ли больничные поверхности резервуаром для внутрибольничной инфекции? Clin Infect Dis.2004; 39: 1182-1189.
23. Виллегас М.В., Хартштейн А.И. Вспышки Acinetobacter, 1977-2000 гг. Инфекционный контроль Hosp Epidemiol. 2003; 24: 284-295.
24. Getchell-White SI, Donowitz LG, Gröschel DH. Неодушевленная среда в отделении интенсивной терапии как потенциальный источник внутрибольничных бактерий: свидетельство длительного выживания Acinetobacter calcoaceticus. Инфекционный контроль Hosp Epidemiol. 1989; 10: 402-407.
25. Пул К. Реакции на бактериальный стресс как детерминанты устойчивости к противомикробным препаратам.J Anitmicrob Chemother. 2012; 196: 1-21.
26. Eng RH, Padberg FT, Smith SM, Tan EN, Cherubin CE. Бактерицидное действие антибиотиков на медленно растущие и нерастущие бактерии. Противомикробные агенты Chemother. 1991; 35: 1824-1828.
27. Морита Ю., Собел М.Л., Пул К. Индуцируемость антибиотиками системы оттока нескольких лекарственных препаратов MexXY синегнойной палочки: участие индуцируемого антибиотиками генного продукта. J Bacteriol. 2006; 188: 1847-1855.
28. Cirz RT, Romesberg FE.Контроль мутации: вмешательство в эволюцию как терапевтическая стратегия. Crit Rev Biochem Mol Biol. 2007; 42: 341-354.
29. Дорр Т., Льюис К., Вулич М. Ответ SOS вызывает стойкость к фторхинолонам в Escherichia coli. PLoS Genet. 2009; 5: e1000760.
30. Ебинеш А, Кайлаш Т.В. Рассмотрение неэффективности антибиотиков: считается угрозой, на самом деле нет. Int J Appl Res Stud. 2016; 5.
31. Эбинеш А, Кайлаш Т.В. Манипуляции с микробиомом, опосредованные бактериофагами: новое предприятие в укреплении здоровья кишечника младенцев.Int J Med Biotechol Genetics. 2016; 4: 34-39.
32. Ебинеш А, Кайлаш Т.В. Горизонт новой надежды на здоровый детский кишечник: появление бактериофагов в тонком кишечном микробиоме. Arch Clin Microbiol. 2016; 7: 5.
33. МакМахон М.С., Сюй Дж., Мур Дж. Э., Блер И.С., Макдауэлл Д.А. Экологический стресс и устойчивость к антибиотикам у пищевых патогенов. Приложение Environ Microbiol. 2007; 73: 211-217.
34. FaeziGhasemi M, Gazemi S. Влияние сублетальных экологических стрессов на выживаемость клеток и антибактериальную чувствительность Listeria monocytogenes PTCC1297.Zahedan J Res Med Sci. 2015; 17: 1-6.
35. Ан-Набулси А.А., Осайли Т.М., Шейкер Р.Р., Олаймат А.Н., Джарадат З.В., Зайн Элабедин Н.А., Холли Р.А. Влияние осмотического давления, кислотного или холодового стресса на чувствительность Listeria monocytogenes к антибиотикам. Food Microbiol. 2015; 46: 154-160.
36. Ганджан Х., Никокар И., Тиешаяр А., Мостафаей А., Амирмозафари Н., Киани С. Влияние солевого стресса и устойчивости к противомикробным препаратам и белковый профиль Staphylococcus aureus. Jundishapur J Microbiol.2012; 5: 328-331.
37. Doughari JH, Ndakidemi PA, Human IS, Benade S. Влияние окислительного стресса на жизнеспособность и вирулентность изолятов Acinetobacter hemolyticus в окружающей среде. Sci Res Essays. 2012; 7: 504-510.
38. Стандарты эффективности тестов на чувствительность дисков к антимикробным препаратам, M100-S25. CLSI, Vol. 35 № 3, январь 2015 г.
39. Литаке Г. М., Голе В. С., Нипхадкар К. Б., Джоши С. Г.. Фенотипическое обнаружение БЛРС у Acinetobacter baumannii: настоящая проблема. Am J Infect Dis. 2015; 11: 49-53.
40. Кумар Э., Уша К., Чаудхури А., Рамана Б.В., Гопал Д.В. Обнаружение продукции AmpC β-лактамаз у видов Acinetobacter с помощью ингибиторов (диск) и модифицированных трехмерных методов (экстракция ферментов). Индийский J Med Res. 2014; 140: 688-690.
41. Yong D, Lee K, Yum JH, Shin HB, Rossolini GM, Chong Y. Дисковый метод имипенема-EDTA для дифференциации клинических изолятов Pseudomonas spp, продуцирующих металло-β-лактамазу. и Acinetobacter spp. J Clin Microbiol. 2002; 40: 3798-3801.
42. Манчанда В., Санчайта С., Сингх Н.П. Acinetobacter с множественной лекарственной устойчивостью. J Glob Infect Dis. 2010; 2: 291-304.
43. Бономо Р.А., Сабо Д. Механизмы множественной лекарственной устойчивости у видов Acinetobacter и Pseudomonas aeruginosa. Clin Infect Dis. 2006; 43 (приложение 2): S49-56.
44. Куале Дж., Брату С., Ландман Д., Хеддуршетти Р. Молекулярная эпидемиология и механизмы устойчивости к карбапенемам у Acinetobacter baumannii, эндемичного в Нью-Йорке. Clin Infect Dis. 2003; 37: 214-220.
45. Патра П., Клумпп С. Популяционная динамика устойчивости бактерий. PLoS One. 2013; 8: e62814.
46. Бахрам Р.А., Маги Д.Т., Джексон С.К. Влияние температуры на сайты связывания аминогликозидов у Stenotrophomonas maltophilia. J Antimicrob Chemother. 1997; 39: 19-24.
47. Helmann JD. Сигма-факторы экстрацитоплазматической функции (ВКФ). Adv Microb Physiol. 2002; 46: 47-110.
48. Cao M, Helmann JD. Фактор σX экстрацитоплазматической функции Bacillus subtilis регулирует модификацию клеточной оболочки и устойчивость к катионным антимикробным пептидам.J Bacteriol. 2004; 186: 1136-1146.
49. Bandow JE, Brotz H, Hecker M. Толерантность Bacillus subtilis к умеренным концентрациям рифампина включает σB-зависимую общую и множественную стрессовую реакцию. J Bacteriol. 2002; 184: 459-467.
50. Ades SE. Контроль альтернативного сигма-фактора σE у Escherichia coli. Curr Opin Microbiol. 2004; 7: 157-162.
51. Эриксон К.Д., Детвейлер К.С. Система фосфорации Rcs специфична для кишечных патогенов / комменсалов и активирует ген ydeI, важный для стойкой инфекции сальмонеллы у мышей.Mol Microbiol. 2006; 62: 883-894.
52. Höller C, Witthuhn D, Janzen-Blunck B. Влияние низкой температуры на рост, структуру и метаболизм Campylobacter coli SP10. Appl Environ Microbiol. 1998; 64: 581-587.
53. Ан-Набулси А.А., Осейли Т.М., Элабедин Н.А., Джарадат З.В., Шейкер Р.Р., Хейраллах К.А. и др. Влияние высыхания, кислотности, щелочности, тепла или холода экологического стресса на чувствительность Cronobacter sakazakii к антибиотикам. Int J Food Microbiol. 2011; 146: 137-143.
54.Алонсо-Эрнандо А., Кэпита Р., Прието М., Алонсо-Каллея С. Сравнение моделей устойчивости к антибиотикам у штаммов Listeria monocytogenes и Salmonella enterica, предварительно подвергнутых дезинфекции домашней птицы. Контроль пищевых продуктов. 2009; 20: 1108-1111.
55. Гилберт П., Кольер П.Дж., Браун М.Р. Влияние скорости роста на восприимчивость к антимикробным агентам: биопленки, клеточный цикл, покой и строгий ответ. Противомикробные агенты Chemother. 1990; 34: 1865-1868.
56. Бишофф М., Бергер-Бачи Б.Стресс-селективные мутации тейкопланина, повышающие активность σB у Staphylococcus aureus. Противомикробные агенты Chemother. 2001; 45: 1714-1720.
57. Морикава К., Маруяма А., Иноза Y, Хигашиде М., Хаяси Х, Охта Т. Сверхэкспрессия сигма-фактора σB заставляет Staphylococcus aureus утолщать клеточную стенку и противостоять β-лактамам. Biochem Biophys Res Commun. 2001; 288: 385-389.
58. Дорел К., Лежен П., Родриг А. Система Cpx Escherichia coli, стратегический сигнальный путь для противостояния неблагоприятным условиям и для заселения сообществ биопленок? Res Microbiol.2006; 157: 306-314.
59. Раффа Р.Г., Райвио Т.Л. Третий путь передачи сигнала стресса оболочки у Escherichia coli. Mol Microbiol. 2002; 45: 1599-1611.
60. Батчелор Э., Вальтерс Д., Кенни Л.Дж., Гулиан М. Система стрессового ответа оболочки Escherichia coli CpxA-CpxR регулирует экспрессию поринов OmpF и OmpC. J Bacteriol. 2005; 187: 5723-5731.
61. Аль-Махин А., Сугимото С., Хигаши С. Повышение устойчивости к множественному стрессу и выработки молочной кислоты у Lactococcus lactis NZ9000 в условиях теплового стресса за счет гетерологичной экспрессии ДНК Escherichia coli.Appl Environ Microbiol. 2010; 76: 4277-4285.
62. Като А., Гройсман Э.А. Регуляторная сеть PhoQ / PhoP Salmonella enterica. Adv Exp Med Biol. 2008; 631: 7-21.
63. Барроу К., Квон, DH. Изменения в двухкомпонентных регуляторных системах phoPQ и pmrAB связаны с устойчивостью к полимиксину B у клинических изолятов Pseudomonas aeruginosa. Противомикробные агенты Chemother. 2009; 53: 5150-5154.
64. Миллер А.К., Браннон М.К., Стивенс Л., Йохансен Х.К., Селград С.Е., Миллер С.И. и др.Мутации PhoQ способствуют модификации липида А и устойчивости к полимиксину синегнойной палочки, обнаруживаемой у пациентов с муковисцидозом, леченных колистином. Противомикробные агенты Chemother. 2011; 55: 5761-5769.
65. Фернандес Л., Гудерхэм В. Дж., Бейнс М., Макфи Дж. Б., Виганд И., Хэнкок Р. Р.. Адаптивная резистентность к антибиотикам «последней надежды» полимиксину В и колистину у синегнойной палочки опосредуется новой двухкомпонентной регуляторной системой ParR-ParS. Противомикробные агенты Chemother. 2010; 54: 3372-3382.
66. Muller C, Plesiat P, Jeannot K. Двухкомпонентная регуляторная система связывает устойчивость Pseudomonas aeruginosa к полимиксинам, аминогликозидам, фторхинолонам и b-лактамам. Противомикробные агенты Chemother. 2010; 55: 1211-1221.
67. Fraud S, Campigotto AJ, Chen Z, Poole K. Система оттока нескольких лекарственных препаратов Pseudomonas aeruginosa MexCD-OprJ: участие в резистентности к хлоргексидину и индукция агентами, повреждающими мембрану, в зависимости от сигма-фактора стресс-реакции AlgU.Противомикробные агенты Chemother. 2008; 52: 4478-4482.
68. Велков В.В. Как факторы окружающей среды регулируют мутагенез и перенос генов у микроорганизмов. J Biosci. 1999; 24: 529-559.
69. Macia MD, Blanquer D, Togores B, Sauleda J, Perez JL, Oliver A. Гипермутация является ключевым фактором в развитии множественной антимикробной устойчивости у штаммов Pseudomonas aeruginosa, вызывающих хронические легочные инфекции. Противомикробные агенты Chemother. 2005; 49: 3382-3386.
70. Мартинес Дж. Л., Бакеро Ф.Частота мутаций и устойчивость к антибиотикам. Противомикробные агенты Chemother. 2000; 44: 1771-1777.
71. Роуэн, штат Нью-Джерси. Доказательства того, что враждебные барьеры для хранения продуктов питания изменяют устойчивость микробов, морфологию клеток и вирулентность. Trends Food Sci Technol. 1999; 10: 261-270.
72. Эбинеш А. Заговор домашней микросреды, реакция бактериального стресса и направленный мутагенез в сторону устойчивости к противомикробным препаратам: уроки для здравоохранения.

 Наук. думка, К., 412 с.
Наук. думка, К., 412 с. Указ Президента Российской Федерации от 8 августа 2001 г. № 1004 (http://document.kremlin.ru/doc.asp?ID=008466).
Указ Президента Российской Федерации от 8 августа 2001 г. № 1004 (http://document.kremlin.ru/doc.asp?ID=008466).