Постгастрорезекционный синдром | Компетентно о здоровье на iLive
Демпинг-постгастрорезекционный синдром
Демпинг-постгастрорезекционный синдром — наиболее частое функциональное расстройство после операций на желудке. Он часто сочетается с другими расстройствами. Основные звенья: быстрая эвакуация пищевых масс из культи желудка, стремительный пассаж по тонкой кишке, дисфункция поджелудочной, железы, вазомоторные расстройства кровообращения.
Характерны резкая слабость, потливость, головная боль, головокружение, сердцебиение, желание лечь, часто режущие боли в верхней части живота или по всему животу, усиленная перистальтика кишечника с поносом. Выраженность зависит от тяжести расстройств. При легкой степени, приступы развиваются 1-2 раза в неделю, через 10-15 минут после еды, обычно после приема сладкой и молочной пищи, продолжаются 10-20 минут. При средней тяжести приступы возникают почти ежедневно, продолжительность их до часу. При тяжелой форме возникают после каждого приема пищи, продолжаются до двух часов, отмечается выраженное похудание больного, даже легкие физические нагрузки невозможны из-за постоянной слабости, часто имеют место нервно-психические расстройства. Подтверждают диагноз рентгеноскопией желудка (желательно ФГС). При тяжелом течении направляют в хирургический стационар.
Подтверждают диагноз рентгеноскопией желудка (желательно ФГС). При тяжелом течении направляют в хирургический стационар.
[7], [8], [9], [10]
Гипогликемический постгастрорезекционный синдром
В основе его развития лежат резкие колебания уровня сахара крови с развитием гипогликемии, вплоть до гипогликемической комы. Часто сочетается с демпинг-синдромом и в основе лежит дисфункция поджелудочной железы, особенно инсулярного аппарата, либо возникают морфологические изменения в ней по типу панкреатодистрофии (чаще склероз).
Приступ начинается через 2-3 часа после приема пищи, сопровождается головокружением, слабостью, резким чувством голода, эйфорией; больные отмечают сосущие боли в эпигастрии, дрожь, потливость, сердцебиение. Характерно снижение артериального давления и брадикардия. Явления быстро купируются приемом небольшого количества пищи, особенно углеводной. Диагноз ставят на основе клиники и данных лабораторного исследования крови на сахар (до еды и. после еды).
Рефлюкс-синдром (синдром приводящей петли)
Чаще развивается после операции резекции по Бильрот II. В основе лежит нарушение эвакуации содержимого из приводящей петли с забросом содержимого в культю желудка и дискинезия отводящей петли. В результате чего развиваются: анастомозит, рефлюкс-гастрит, еюнит, могут быть рецидив язвы, нарушение функции печени и поджелудочной железы.
Клиника проявляется распирающими болями в эпигастрии и правом подреберье, чувством тяжести, которые усиливаются после еды. Интенсивность болей постепенно нарастает, и они заканчиваются обильной рвотой желчью, иногда с примесью сведенной пищи, приносящей значительное облегчение. Внешние проявления бывают иногда: выпячивание раздутой приводящей петли в правом подреберье, дающей асимметрию живота, которая исчезает после рвоты, желтушность склер, похудание, вплоть до истощения. Рвота может быть до нескольких раз в день, а желчи может за сутки выделяться до-500-700 мл. Подтверждают диагноз рентгеноскопией желудка и ФГС, лабораторно исследуют полную биохимию крови и солевой состав.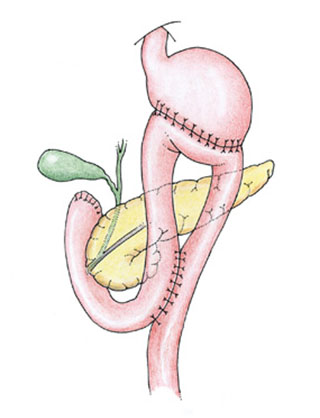 Пациент должен быть направлен в хирургический стационар для корригирующей операции.
Пациент должен быть направлен в хирургический стационар для корригирующей операции.
Хронический постгастрорезекционный синдром
Протекает по типу болевой формы хронического панкреатита. Часто сочетается с, рефлюкс-синдромом и демпинг-синдромом. Лечение консервативное.
[11], [12], [13], [14], [15], [16], [17]
Метаболический постгастрорезекционный синдром
Сочетается со всеми вышеуказанными синдромами и выражается в нарушении белкового обмена, что выражается в похудении больного, развитии хронических водно-электролитных нарушений, развитии железодефицитной и В12-дефицитной анемии и др. Лечение консервативное.
Постгастрорезекционные расстройства | Компетентно о здоровье на iLive
Согласно литературным данным постгастрорезекционных расстройства развиваются у 35-40% больных, перенесших резекцию желудка. Наиболее распространенной классификацией этих расстройств является классификация Alexander-WiUams (1990), согласно которой выделяют следующие три основных группы:
- Нарушение опорожнения желудка в результате резекции пилорического отдела и, следовательно, транспорта желудочного содержимого и пищевого химуса в обход 12-перстной кишки.

- Метаболические нарушения вследствие удаления значительной части желудка.
- Заболевания, к которым имелась предрасположенность до операции.
Нарушение опорожнения желудка
Демпинг-синдром
Демпинг-синдром — это некоординированное поступление пищи в тонкий кишечник в связи с выпадением резервуарной функции желудка.
Различают демпинг-синдром ранний, наступающий сразу или через 10-15 минут после еды, и поздний, который развивается спустя 2-3 ч после еды.
Демпинг-синдром
Пострезекционный рефлюкс-гастрит
В происхождении пострезекционного рефлюкс-гастрита играет роль заброс кишечного содержимого с желчью в желудок. Желчь оказывает повреждающее влияние на слизистую оболочку желудка, чему способствует также прекращение продукции гастрина после удаления дистальной части желудка. Пострезекционный рефлюкс-гастрит развивается чаще после операции резекции желудка по Бильрот-II.
Клинически рефлюкс-гастрит проявляется тупыми болями в эпигастрии, ощущением горечи и сухости во рту, отрыжкой, снижением аппетита. При ФЭГДС выявляется картина атрофии слизистой оболочки культи желудка с признаками воспаления.
Постгастрорезекционный рефлюкс-эзофагит
Рефлюкс-эзофагит возникает вследствие недостаточной запирательной функции кардии. Как правило, при этом имеется и рефлюкс-гастрит. В этом случае кишечное содержимое с примесью желчи забрасывается в пищевод, возникает щелочной рефлюкс-эзофагит. Он проявляется ощущением боли или жжения (саднения) за грудиной, чувством изжоги. Указанные признаки появляются обычно после еды, но могут быть и не связаны с приемом пищи. Часто беспокоят сухость и горечь во рту, ощущение «застревания» пищи в горле, чувство комка. Диагноз рефлюкс-эзофагита подтверждается при эзофагоскопии. В некоторых случаях рфлюкс-эзофагит может осложняться стенозированием пищевода.
Синдром приводящей петли
Синдром приводящей петли характеризуется стазом химуса с примесью желудочного, дуоденального содержимого и желчи в приводящей петле.
Синдром приводящей петли
Синдром отводящей петли
Синдром отводящей петли — это нарушение проходимости отводящей петли, обусловленное спаечным процессом. Основными симптомами являются неоднократно повторяющаяся рвота (практически после каждого приема пищи и часто вне связи с едой), прогрессирующее снижение массы тела, выраженные явления обезвоживания. Таким образом, клиническая картина синдрома отводящей петли соответствует высокой кишечной непроходимости.
Синдром малого желудка
Синдром малого желудка развивается приблизительно у 8% перенесших резекцию желудка и обусловлен уменьшением объема желудка. Клиническая картина характеризуется выраженным ощущением тяжести в эпипории, переполненного желудка даже после небольшого приема пищи. Нередко наблюдаются тупые боли в эпигастрии, тошнота, отрыжка и даже рвота. При ФЭГДС обнаруживается, как правило, гастрит культи желудка.
По мере увеличения срока после операции клинические признаки синдрома малого желудка уменьшаются.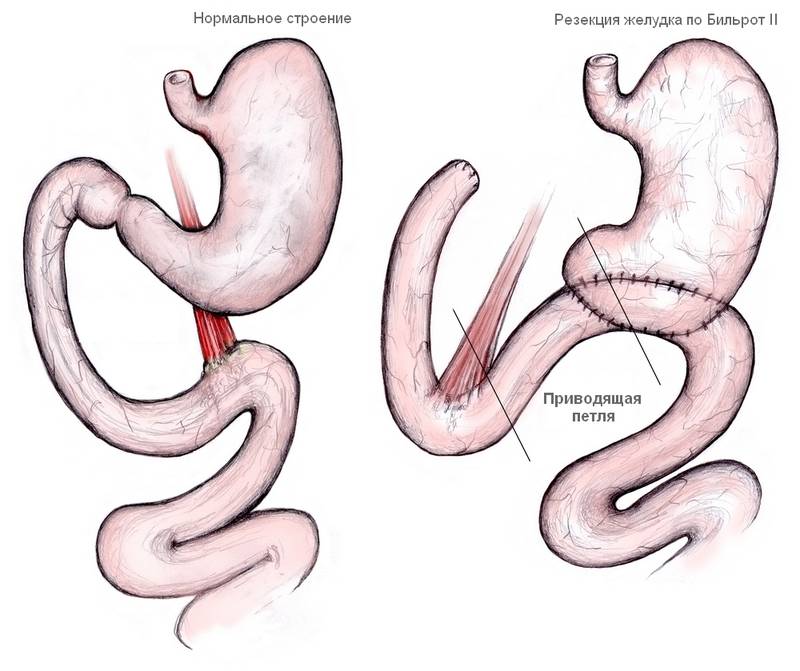
Метаболические нарушения вследствие удаления значительной части желудка
Наиболее ярким проявлением метаболических нарушений после резекции желудка является постгастрорезекционная дистрофия. Ее развитие обусловлено нарушением моторной и секреторной функции резецированного желудка и кишечника, нарушением выделения желчи, панкреатического сока, формированием синдромов мальабсорбции и малвдигестии. Постгастрорезекционная дистрофия характеризуется общей слабостью, снижением работоспособности, сухостью кожи, значительным падением массы тела, анемией, гипопротеинемией, гипохолестеринемией. Очень характерны электролитные нарушения: гипокальциемия, гипонатриемия, гипохлоремия. У некоторых больных развивается гипогликемия. Нарушение всасывания кальция в кишечнике приводит к появлению болей в костях, суставах, развитию остеопороза. При резком дефиците кальция развивается гипокальциемическая тетания. Выраженная пострезекционная дистрофия предрасполагает к развитию туберкулеза легких.
Заболевания, к которым имелась предрасположенность до операции
Пептическая язва анастомоза
Развитие пептической язвы анастомоза обусловлено сохранением гастринпродуцирующих клеток в культе оперированного желудка, что приводит к стимуляции секреторной функции желудка.
Пептическая язва анастомоза
Рак культи желудка
Рак культи желудка развивается чаще после резекции желудка по Бильрот-II, чем по Бильрот-I, что связывают с рефлюксом желчи в желудок. Определенную роль в развитии рака культи желудка играет также анаэробная флора, превращающая нитраты пищи в канцерогенные нитрозамины.
Рак культи желудка
Больной после резекции должен находиться на диспансерном наблюдении и проходить ФЭГДС 1-2 раза в год. В дальнейшем ФЭГДС производится при появлении или усилении «желудочных» жалоб.
[1], [2], [3], [4], [5], [6]
Болезни оперированного желудка — причины, симптомы, диагностика и лечение
Болезни оперированного желудка — это патологические состояния, возникшие после гастрорезекционных вмешательств и патогенетически связанные с ними. Проявляются диспепсическими расстройствами, болью в эпигастрии, вазомоторными и нейровегетативными реакциями, метаболическими и нутриционными нарушениями. Диагностируются с помощью рентгенографии желудка, эзофагогастродуоденоскопии, общего и биохимического анализа крови. Для лечения используют серотониновые, симпато- и холиноблокаторы, заместительную ферментную терапию, седативные средства, спазмолитики, прокинетики, антибактериальные препараты, эубиотики. При необходимости выполняют повторные операции.
Общие сведения
Симптомы постгастрорезекционной болезни развиваются у 20-45% пациентов после удаления 2/3-3/4 органа, проведения ваготомии и антрумэктомии. У 2,5-3% больных тяжесть клинической картины оперированного желудка превышает тяжесть первичного заболевания. В связи с успехами консервативной терапии язвенной болезни, после хирургического лечения которой в прошлом обычно развивались постгастрорезекционные расстройства, в настоящее время превалируют синдромы, связанные с удалением органа по поводу рака.
У 3,4-35% пациентов, прооперированных по методу Бильрот II, развивается демпинг-синдром, у 3-29% — болезнь приводящей петли, у 5-10% — гипогликемическое расстройство. Постгастрорезекционная анемия выявляется у 10-15% оперированных, послеоперационная дистрофия — у 3-10%, пептические язвы — у 1-3%. Постваготомической дисфагией страдает 3-17% пациентов. Рецидив язвы после пересечения блуждающего нерва наблюдается в 10-30% случаев. У 8-15% больных после операции по технике Бильрот 2 в течение 20-25 лет возникает рак желудочной культи.
Болезни оперированного желудка
Причины
Развитие болезней оперированного желудка может быть обусловлено как изменением физиологических условий функционирования органов ЖКТ, так и врачебными ошибками, допущенными в ходе операции и послеоперационном периоде. Зачастую факторы, провоцирующие возникновение БОЖ, сочетаются и усиливают эффект друг друга. По мнению специалистов в сфере гастроэнтерологии, основными причинами постгастрорезекционной болезни являются:
- Перестройка системы пищеварения. У пациентов, перенесших объемную дистальную резекцию, отсутствует антральный отдел, продуцирующий основную часть гастрина и соляной кислоты, что сказывается на эффективности переваривания белков. Потеря резервуарной функции органа способствует попаданию в просвет тонкой кишки недостаточно подготовленной пищи, которая плохо переваривается и всасывается. При выполнении резекции методом Бильрот-2 из процесса пищеварения практически исключается двенадцатиперстная кишка. Осложнением ваготомии зачастую становится нарушение эвакуации химуса из полости желудка.
- Технические ошибки при выполнении вмешательства. Риск развития различных расстройств оперированного желудка возрастает при выборе неподходящей техники операции, избыточной или недостаточной по объему резекции органа, которая существенно влияет на секреторно-эвакуаторную функцию либо способствует дальнейшему прогрессированию заболевания. Нормальному прохождению химуса может препятствовать неправильное наложение швов при формировании анастомозов и ушивании культи. Отсутствие шпоры при создании гастроеюноанастомоза часто провоцирует синдром приводящей петли.
- Патологический преморбидный фон. При наличии сопутствующей патологии снижаются постоперационные компенсаторные возможности пищеварительной системы. У 42% пациентов с синдромом оперированного желудка диагностируются болезни ЖКТ, у 49% — хронические заболевания других органов и систем. Постгастрорезекционные расстройства с большей вероятностью развиваются при недостаточном уровне вазоактивного интестинального полипептида, мотилина, холецистокинина, энкефалинов и других гастроинтестинальных гормонов, секретируемых диффузной нейроэндокринной системой для регуляции процессов пищеварения.
По наблюдениям некоторых исследователей, постгастрорезекционная болезнь чаще встречается у пациентов, имеющих психические травмы и стрессы в анамнезе. У 42% больных с БОЖ установлена связь предшествовавшей язвенной болезни с физическими травмами, заболеваниями ЦНС. В таких случаях послерезекционные нарушения протекали тяжелее, с резко выраженной невротической симптоматикой. В группу повышенного риска входят пациенты холерического и меланхолического склада с неуравновешенным и слабым типами высшей нервной деятельности, больные, которые из экономических соображений отказались от поддерживающего медикаментозного лечения.
Патогенез
Механизм развития постгастрорезекционных расстройств основан на различных сочетаниях нарушений гастроинтестинальной секреции, моторики и всасывания, а также их влиянии на работу других органов. Патогенез конкретного патологического состояния зависит от вызвавших его причин. В большинстве случаев пусковыми моментами являются снижение выработки компонентов желудочного сока и ускоренный пассаж химуса в кишечник, повышающие функциональную нагрузку на тонкую кишку, гепатобилиарную систему, панкреатическую железу оперированного пациента. В ответ на поступление гипертонического химуса усиливается секреция жидкого компонента кишечного сока, увеличивается приток крови к внутренним органам, часто возникает диарея.
Уменьшение объема циркулирующей крови сопровождается развитием гемодинамических расстройств и неврологической симптоматики. При растяжении тонкой кишки большим объемом пищевых масс, которые транзитом поступили из желудка, происходит массивный выброс серотонина, приводящий к нарушению регуляции активности головного мозга. Рефлекторное усиление секреции инсулина поджелудочной железой вызывает падение уровня глюкозы. Конечным итогом недостаточного переваривания и всасывания белков, жиров, углеводов, витаминов, ключевых макро- и микроэлементов, в первую очередь – железа, становятся нарушения обмена веществ и кроветворения, значительное снижение массы тела, полиорганные расстройства.
У части оперированных пациентов ведущую роль играет застой пищевых масс в разных отделах ЖКТ — в двенадцатиперстной кишке (при болезни приводящей петли) либо в желудке (после ваготомии). Кишечный стаз или гастростаз, нарушающий процессы пищеварения, приводит к растяжению стенки соответствующего органа с возникновением болевого синдрома, способствует развитию дисбактериоза, гнилостного брожения. При некоторых состояниях происходит обратный заброс кишечного и желудочного содержимого в расположенные выше отделы ЖКТ с раздражением их слизистой оболочки, возникновением реактивного воспаления, атрофических и неопластических процессов.
Классификация
При систематизации различных форм болезни оперированного желудка учитывают патогенез постгастрорезекционного синдрома, отсутствие или наличие органических изменений, особенности клинических проявлений. С учетом техники вмешательства в абдоминальной хирургии различают пострезекционную и постваготомическую патологию. В группе болезней, возникших после удаления части желудка, в свою очередь, выделяют:
- Функциональные расстройства. Связаны с нарушением нейрогуморальной регуляции пищеварительных процессов и пассажа химуса. Наблюдаются у 70% оперированных пациентов с БОЖ, в части случаев предшествуют органической патологии или сочетаются с ней. К этой категории заболеваний относят ранний и поздний (гипогликемический) синдромы, синдромы малого желудка и приводящей петли функционального происхождения, пищевую аллергию, дуодено- или еюногастральный, гастроэзофагальный рефлюксы, постгастрорезекционную астению, постваготомическую диарею.
- Органические нарушения. Сопровождаются морфологическими изменениями оперированных органов. Группа органических болезней представлена синдромом приводящей петли механического происхождения, рецидивирующей, в том числе пептической язвой, язвенным дефектом в рамках синдрома Золлингера-Эллисона, желудочно-кишечным свищом, рубцовой деформацией и сужением анастомоза, анастомозитом, раком культи, дистальным пептическим эзофагитом, пищеводом Баррета, сопутствующим послеоперационным гепатитом, панкреатитом.
Постваготомическими болезнями считаются рецидивировавшая язва, послеоперационная диарея, дисфункция желудочной кардии с развитием пептического воспаления пищевода и гастроэзофагорефлюксной болезни, ускоренная (демпинг-синдром) или замедленная (гастростаз) эвакуация химуса, рефлюкс-гастрит щелочного генеза. С пересечением блуждающего нерва также могут быть ассоциированы другие заболевания ЖКТ — панкреатит, холелитиаз. В некоторых случаях (при демпинг-болезни, функциональном и механическом синдромах приводящей петли) оправдано выделение нескольких степеней тяжести.
Симптомы
Симптоматика зависит от вида болезни оперированного желудка. В клинической картине могут наблюдаться как гастроинтестинальные симптомы, так и системные вазомоторные, нейровегетативные нарушения. При наиболее распространенном раннем демпинг-синдроме спустя 20-25 минут после приема пищи возникает слабость, сосудистые реакции (краснота или побледнение кожи лица), мелькание мушек перед глазами, головокружение, учащается сердцебиение. Приступ может длиться от 15 минут до нескольких часов. Характерно появление диспепсических симптомов: ухудшения аппетита, отрыжки, тошноты, урчания, дискомфорта в эпигастрии.
У оперированного больного, страдающего гипогликемическим синдромом, через 2-3 часа после употребления легкоуглеводистых продуктов внезапно развивается выраженная слабость, потливость, озноб. Пациент предъявляет жалобы на головокружение, сильное чувство голода. Урежается пульс, падает АД. Приступ обычно длится 5-20 минут. При синдроме приводящей петли отмечается тошнота, тяжесть в правой подреберной области, отрыжка. Типичный признак болезни — обильная рвота желчью и пищей, съеденной накануне, с последующим улучшением состояния. При прогрессировании заболевания присоединяются общие нарушения: потеря веса, слабость, снижение трудоспособности, отеки.
Клинические проявления пептических язв оперированного желудка выявляются через 6-12 месяцев после хирургического вмешательства. У пациентов возникает выраженный болевой синдром, который не связан с приемом пищи. Возможны диспепсические расстройства. Основными симптомами пострезекционной анемии являются слабость, бледность кожных покровов, одышка, головокружение, глоссит (воспаление языка), тахикардия. В тяжелой стадии болезни могут появляться боли в ногах, парестезии, снижение мышечной силы. У четверти оперированных наблюдается снижение веса ниже рекомендованного или невозможность восстановить дооперационный вес.
Осложнения
Из-за ускоренного продвижения пищи по кишечнику у пациентов после гастрорезекции возникают нарушения всех видов обмена, что клинически проявляется авитаминозами, тяжелыми электролитными сдвигами, остеопорозом, частыми переломами, сухостью кожи, выпадением волос, ломкостью ногтей, снижением остроты зрения, в терминальных стадиях — кахексией. При прогрессировании болезни возможны коллаптоидные состояния, требующие неотложной помощи.
Частыми осложнениями пептических язв являются прободение, сопровождающееся профузным кровотечением, пенетрация в соседний орган. При длительном течении анемии формируется гипоксия, которая может приводить к энцефалопатии, дистрофическим изменениям во внутренних органах. Развитие щелочного рефлюкс-гастрита с атрофией эпителиального слоя, ахлоргидрией повышает риск малигнизации желудочной культи. После резекции зачастую наблюдаются вторичные гнойные осложнения вследствие угнетения иммунитета.
Диагностика
Диагностический поиск при болезни оперированного желудка направлен на уточнение степени функциональных и органических нарушений, оценку состоятельности анастомоза, выявление критических состояний, требующих неотложной терапии. Обследование пациента осуществляется комплексно с применением таких лабораторных и инструментальных методов, как:
- Клинический анализ крови. Для пострезекционной В12-дефицитной анемии характерны изменения в виде уменьшения содержания эритроцитов и гемоглобина, увеличения цветного показателя более 1,05, появления макроцитов. Метод дополняют проведением биохимического исследования крови – при заболеваниях оперированного желудка наблюдается гипопротеинемия, повышение уровня печеночных ферментов, снижение концентрации глюкозы.
- Рентгенологическое исследование. При демпинг-синдроме на рентгенограммах желудка выявляют стремительное продвижение контраста в тонкую кишку и расширение отводящей петли. Типичные рентгенологические признаки рецидивировавшей язвы – симптом «ниши» (депо бария), конвергенция складок слизистой оболочки. В случае расстройства приводящей петли при рентгеноскопии натощак определяется жидкость в желудочной культе, что связано с ее рефлюксом из кишечника.
- Эзофагогастродуоденоскопия. Введение эндоскопа через пищевод в желудок и 12-перстную кишку позволяет оценить состояние слизистой оболочки пищеварительного тракта, обнаружить воспалительные изменения и нарушения моторики, установить локализацию язвенного дефекта, его размеры. Язвы чаще всего располагаются в зоне анастомоза или в отводящей петле. Во время ЭГДС может выполняться биопсия для последующего гистологического анализа.
При возможном рецидиве язвы рекомендовано выполнение анализа кала на скрытую кровь. Для верификации диагноза демпинг-синдрома производится провокационная проба – при положительном результате наблюдается ухудшение состояния пациента через 15-20 минут после перорального приема 150 мл гипертонического раствора глюкозы. Больным с постгастрорезекционной болезнью может потребоваться обследование других органов ЖКТ: УЗИ желчного пузыря, поджелудочной железы, МСКТ брюшной полости, МРТ-панкреатохолангиография и др.
Дифференциальная диагностика патологии оперированного желудка проводится со злокачественными новообразованиями ЖКТ, синдромом Золлингера-Эллисона, частичной кишечной непроходимостью, желудочно-кишечным свищем, хроническим энтеритом, болезнью Крона, инсулиномой, нейроэндокринными опухолями, гипопластической анемией. Кроме наблюдения у врача-гастроэнтеролога и абдоминального хирурга пациенту рекомендованы консультации гематолога, онколога, эндокринолога, инфекциониста, невролога.
Лечение болезней оперированного желудка
Выбор врачебной тактики определяется особенностями патологического постгастрорезекционного состояния. С учетом этапа развития болезни и выраженности симптоматики могут применяться как терапевтические, так и хирургические подходы к лечению БОЖ. Независимо от патологии всем пациентам показана диета с исключением ингредиентов, к которым выявлена непереносимость, жареной, копченой, консервированной, острой, горячей пищи, легкоусвояемых углеводов. В рационе рекомендуется увеличить долю богатых клетчаткой овощей, фруктов, зелени, отрубей, ягод, каш, диетического мяса (говядины, курятины, крольчатины). Питание должно быть частым, дробным (до 6-8 приемов пищи в день). Для коррекции отдельных симптомов оперированного желудка применяют следующие группы медикаментозных средств:
- Неселективные β-блокаторы. Замедляют эвакуацию химуса из желудка и перистальтику тонкого кишечника у больных с демпинг-синдромом. При постоянном приеме медикаментов в малых дозах симптоматика болезни уменьшается либо полностью исчезает. С аналогичной целью назначают ганглиоблокаторы, блокаторы М-холинорецепторов, новокаиновые блокады.
- Ферментные препараты. Заместительная терапия способствует процессу переваривания пищи. При функциональной недостаточности оперированного желудка показан прием желудочного сока, соляной кислоты с пепсином. Для улучшения кишечного пищеварения используют полиферментные средства, ферменты с двухэтапным эффектом, холинолитики.
- Седативные средства и транквилизаторы. Рекомендованы пациентам, у которых в структуре болезни ярко выражен нейровегетативный компонент. Обычно лечение начинают с растительных препаратов (настоев пустырника, валерианы, пиона), в более тяжелых случаях применяют малые дозы барбитуратов, производных бензодиазепина.
- Антагонисты серотонина. Назначение лекарственных средств патогенетически обосновано ролью серотонина в развитии демпинг-синдрома. При ускоренном пассаже пищи из оперированного желудка серотониновые блокаторы замедляют перистальтику кишечника и уменьшают выраженность вазомоторных расстройств за счет ингибирующего эффекта на уровне ЦНС.
- Спазмолитики и прокинетики. Выбор медикамента определяется типом нарушений, возникших после операции. Препараты применяются для нормализации процессов желчевыделения, моторно-эвакуаторной функции ЖКТ. Производные пиперидина способны замедлить кишечную пропульсию и повысить тонус сфинктеров, уменьшив выраженность демпинг-болезни.
- Антибактериальная терапия. Может потребоваться пациентам с симптомокомплексом приводящей петли. Курсовое назначение полусинтетических пенициллинов, тетрациклинов, сульфаниламидов позволяет устранить воспаление и санировать слепой участок петли от развившейся микрофлоры. Для уменьшения дисбиотических расстройств терапию дополняют эубиотиками.
Лечение послеоперационной или рецидивировавшей язвы производится по стандартам противоязвенных протоколов. Некоторым больным с заболеваниями оперированного желудка могут быть показаны антациды, противодиарейные и обволакивающие средства, энтеросорбенты. Для коррекции метаболических и нутриционных расстройств рекомендованы курсы витаминно-минеральных препаратов, восполняющих возможный дефицит витаминов группы В, железа. При терапевтической резистентности и прогрессировании постгастрорезекционной болезни требуется повторное оперативное вмешательство. С учетом клинической формы патологии проводится редуоденизация (гастроеюнодуоденопластика), хирургическая коррекция типа гастроэнтероанастомоза (сужение, реконструкция в анастомоз по Ру), дуоденоеюностомия, наложение Брауновского соустья.
Прогноз и профилактика
В 75% случаев своевременное назначение адекватной терапии позволяет существенно улучшить или нормализовать состояние больного. У 25% пациентов наблюдается прогрессирование органических и функциональных осложнений резекции желудка, приводящее к стойкой утрате трудоспособности. Профилактика патологий оперированного желудка заключается в развернутом предоперационном обследовании, подборе вида хирургической методики в зависимости от симптоматики, соблюдении техники операции, правильном наложении анастомозов, выборе объема гастрорезекции с учетом кислотопродуцирующей желудочной функции, тщательном наблюдении за больным в послеоперационном периоде с последующим ежегодным проведением ЭГДС.
синдром — причины, симптомы, диагностика и лечение
Демпинг-синдром – это патологическое состояние, развивающееся после резекции желудка вследствие нарушения нейрогуморальной регуляции деятельности пищеварительной системы. Течение демпинг-синдрома характеризуется вегетативными кризами с приступами головокружения, потливости, сердцебиения, слабости, развитием диспепсических явлений, обморочных состояний. Диагностика основывается на данных анамнеза, объективного обследования, рентгенологического исследования желудка и тонкой кишки. Лечение патологии легкой степени заключается в медикаментозной коррекции проявлений; при тяжело выраженных симптомах показана гастроеюнодуоденопластика.
Общие сведения
Демпинг-синдром в современной гастроэнтерологии относится к так называемым болезням оперированного желудка или пострезекционным синдромам. Характеризуется ускоренной эвакуацией, «сбрасыванием» пищи из культи желудка в кишечник, что сопровождается нарушением углеводного обмена и функционирования пищеварительной системы. Развивается у 10-30% пациентов, перенесших операции на желудке, в ближайшем или отдаленном послеоперационном периоде. В большинстве случаев выражен в легкой или средней степени; тяжелая выраженность синдрома, требующая хирургического вмешательства, встречается в 1—9 % случаев, чаще у женщин.
Демпинг-синдром
Причины
Демпинг-синдром развивается в различные сроки после перенесенного хирургического вмешательства на желудке. Как правило, причиной резекции служит язва 12-перстной кишки или желудка, реже – рак желудка. Частота возникновения пострезекционного синдрома зависит от типа выполненной операции: максимальное число случаев демпинг-синдрома наблюдается после резекции желудка по Бильрот II, меньшее – после резекции по Бильрот-I, минимальное – после селективной проксимальной ваготомии или стволовой ваготомии с пилоропластикой.
Патогенез
Механизм развития патологии обусловлен слишком быстрым поступлением необработанной пищи с высокой осмолярностью из желудка в верхние отделы тонкого кишечника. При стремительном опорожнении оперированного желудка и пассаже содержимого стенки кишки растягиваются, выделяется внеклеточная жидкость и биологически активные вещества (гистамин, серотонин, кинины), что сопровождается уменьшением ОЦК, вазодилатацией и усилением перистальтики кишечника.
Нарушается баланс гормонов желудочно-кишечного тракта: гастроингибирующего пептида, гастрина, нейротензина, энтероглюкагона и др.; изменяется эндокринная регуляция пищеварения, что проявляется вазомоторными и желудочно-кишечными реакциями. Вегетативные кризы при демпинг-синдроме в 2/3 случаев протекают по вагоинсулярному типу, у 1/3 пациентов – по симпатоадреналовому типу.
Классификация
По времени развития вегетативного криза различают ранний и поздний демпинг-синдром: в первом случае симптоматика появляется через 10-15 минут после еды, во втором – спустя 2-3 часа после приема пищи. По степени тяжести проявлений патология может протекать в легкой (I), средней (II) или тяжелой (III) степени. Легкая степень реакции развивается только в связи с приемом сладких или молочных блюд; в этом случае отмечается небольшая слабость, головокружение, потливость, учащение пульса на 10-15 уд. в мин., сердцебиение. Приступ продолжается до 30 мин.; дефицит массы тела больного не превышает 5 кг, трудоспособность не страдает.
Демпинг-синдром средней тяжести развивается в ответ на прием любой пищи; слабость вынуждает пациента лечь, пульс учащается на 20-30 уд. в мин., повышается систолическое давление. Больные отмечают тошноту, боли в животе, бурную кишечную перистальтику, профузный понос, шум в ушах, зябкость конечностей, которая сменяется чувством жара. Продолжительность приступа до 1 часа; дефицит массы составляет до 10 кг; трудоспособность нарушена. Тяжелый демпинг-синдром харатеризуется симптоматикой ярко выраженного вегетативного криза. Типична тахикардия (иногда брадикардия), лабильность АД, обмороки, страх смерти. Криз длится от 1 до 2 часов и заканчивается обильным мочеиспусканием. Больной истощен, нетрудоспособен.
Симптомы
Клиническое течение патологии характеризуется общими, вазомоторными и желудочно-кишечными проявлениями. Клиника раннего демпинг-синдрома развивается через 10-15 мин после еды, характеризуется слабостью, головокружением, вплоть до обморочного состояния, головной болью, сердцебиением, кардиалгией, обильным потоотделением, чувством жара. Одновременно появляются боли в эпигастрии, рвота, метеоризм, кишечные колики, понос. Тяжелый приступ вынуждает пациента принимать горизонтальное положение на 2-3 часа после еды.
Поздний (гипогликемический) вариант синдрома развивается спустя 2-3 ч после приема пищи. Его механизм связан с повышением уровня глюкозы в крови в период ранней демпинг-реакции и следующей за этим избыточной секрецией инсулина, снижающей концентрацию сахара в крови до субнормальных значений. В момент приступа ощущается резкая слабость, чувство голода, дрожь, обильное потоотделение, головокружение, гипотония, брадикардия, острая боль в эпигастрии. Эти симптомы быстро исчезают после приема углеводистой пищи. Демпинговая атака длится от 30 мин. до 1 часа.
Диагностика
Демпинг-синдром диагностируется на основании данных анамнеза (резекция желудка), субъективных и объективных проявлений. При рентгенографии желудка определяется стремительное опорожнение оперированного желудка от контрастной взвеси. В ходе рентгенографии пассажа бария по тонкому кишечнику отмечается ускоренное продвижение бария, дискинезия тонкой кишки. В диагностике применяются провокационные пробы: демпинг-реакция может быть вызвана приемом концентрированного раствора глюкозы или сладкого сиропа. Из лабораторных тестов используется определение уровня глюкозы крови, инсулина, альбуминов.
Дифференциальную диагностику демпинг-синдрома проводят с инсулиномой, нейроэндокринными опухолями, болезнью Крона, частичной кишечной непроходимостью, хроническим энтеритом, секреторной недостаточностью поджелудочной железы. Пациентам, страдающим данным расстройством, необходима консультация невролога для выявления и коррекции вегетативно-сосудистых и нервно-психических нарушений.
Лечение демпинг-синдрома
При легкой степени патологии рекомендуется диета, основанная на высококалорийном дробном питании, ограничении жидкости и углеводов, полноценном витаминном составе пищи. Демпинг-синдром средней тяжести требует приема медикаментозных средств, снижающих перистальтику тонкого кишечника (ганглиоблокаторов, препаратов атропина, местных анестетиков), проведения общеукрепляющей терапии (введения р-ра глюкозы с инсулином, парентеральной витаминотерапии), назначения заместительной терапии (прием желудочного сока, соляной кислоты, ферментов — панкреатина). Применяют новокаиновые блокады поясничной области, многоканальную электрическую стимуляцию. При психоневрологических нарушениях показан прием нейролептиков.
При демпинг-синдроме тяжелой выраженности, неэффективности диетотерапии и комплексной медикаментозной терапии проводится хирургическое лечение — реконструктивная гастроеюнодуоденопластика. Суть оперативного вмешательства заключается в интерпозиции сегмента тонкой кишки (трансплантата из отводящей петли тощей кишки) между двенадцатиперстной кишкой и культей желудка. Благодаря наложению гастроеюнодуоденоанастомоза происходит восстановление пассажа пищи через 12-перстную кишку, нормализация пищевых рефлексов, функции ферменто- и желчевыделения, замедление пассажа пищевых масс в тощей кишке.
Прогноз и профилактика
Чаще всего демпинг-синдром развивается в первые полгода после операции: у 50% пациентов со временем он становится выражен слабее, у 25% не прогрессирует, еще у 25% с годами нарастает. Прогрессирующая или тяжелая патология приводит к стойкой потере трудоспособности.
Профилактика состоит в широком применении органосохраняющих вмешательств в сочетании с ваготомией в хирургии язвенной болезни желудка. При необходимости проведения резекции желудка целесообразно наложение гастродуоденоанастомоза. В постоперационном периоде больному необходимо систематическое наблюдение врача-гастроэнтеролога, диетолога, эндокринолога, невролога; проведение психосоматической реабилитации, курортная терапия.
|
If any surgeon told me he was about to remove a very large part of my stomach for a tiny little duodenal ulcer, I am sure, I would run much faster then he.
|
Лапароскопическая резекция культи желудка с реконструкцией по Ру. Первый опыт применения лапароскопических технологий в коррекции постгастрорезекционного синдрома.
В статье представлен первый опыт реконструктивной операции по поводу постгастрорезекционного синдрома – реконструкции по Ру, выполненной лапароскопическим доступом. The first experience of reconstructive operation for a postgastrectomy syndrome – Roux-en-Y-reconstruction executed by laparoscopic access is presented in article.
Лапароскопическая резекция культи желудка с реконструкцией по Ру. Первый опыт применения лапароскопических технологий в коррекции постгастрорезекционного синдрома.
Евсеев М.А., Владыкин А.Л., Головин Р.А., Дынников А.В.
Laparoscopic resection of gastric stump with Roux-en-Y-reconstruction. First experience of laparoscopic technologies in treatment of postgastrectomy syndrome.
Evseev M., Vladykin A., Golovin R., Dynnikov A.
Актуальность.
На сегодняшний день дистальная резекция желудка является стандартизированной лечебной процедурой с предсказуемыми и, в подавляющем большинстве случаев, благоприятными непосредственными и отдаленными результатами. Тем не менее, как столетие назад, так и сейчас, термины «болезни оперированного желудка» и «постгастрорезекционный синдром» имеют полное право на существование в клинике, поскольку обобщенные этими терминами диспептические расстройства встречаются по разным оценкам у 10 – 25% пациентов, перенесших резекцию желудка или гастрэктомию [1-8]. При этом по-прежнему принято считать, что наиболее часто болезни оперированного желудка возникают у пациентов, подвергнутых различным модификациям дистальной резекции желудка по методу Бильрот-II [1,3,5,7,9-13].
Традиционно постгастрорезекционные синдромы разделяют на функциональные и органические. Вполне очевидно, что если функциональные нарушения по определению могут и должны быть корригированы консервативными мероприятиями, то органические нарушения способны быть нивелированы только с помощью хирургического пособия. Наиболее частые органические нарушения в группе болезней оперированного желудка – синдром приводящей петли и пептические язвы гастро-энтероанастомоза – хорошо известны по-своему этиопатогенезу, клиническим проявлениям, методикам хирургического лечения и по возможным способам профилактики при первичной операции. Последнее обстоятельство особенно интересно, поскольку пациенты с указанными синдромами по-прежнему появляются в хирургических клиниках, нередко по прошествии нескольких месяцев или даже лет упорного лечения у гастроэнтерологов. И по-прежнему при повторных вмешательствах становятся очевидными характерные особенности первичной операции в виде недостаточного объема резекции желудка (антрумрезекция или гемигастрэктомия) и/или проведенного реконструктивного этапа (неправильно выбранные длина и расположение приводящих и отводящих петель тонкой кишки, размер и ориентация анастомоза и т.д.). В этой связи приходится признать правоту авторов, категорично утверждающих, что причиной постгастрорезекционных синдромов органической природы являются исключительно технические дефекты, имевшие место при выполнении первичной резекции желудка [1,3,4,5,7,8,13-15].
Для оперативной коррекции постгастрорезеционного синдрома за несколько десятилетий развития хирургической гастроэнтерологии было предложено и апробировано не менее нескольких десятков различных методик реконструктивных вмешательств. Тем не менее, на сегодняшний день практически все авторы единодушны в том, что практически единственной приемлемой методикой повторного вмешательства по поводу болезней оперированного желудка является реконструкция пищеварительной трубки по Ру (Roux). Формирование билио-панкреатической и алиментарной кишечных петель, соединенных по типу Roux-en-Y, исключает рефлюксы пищеварительных соков и химуса, препятствует быстрому опорожнению культи желудка и ускоренному пассажу химуса, что определяет возможность быстрой компенсации имевшихся постгастрорезекционных расстройств пищеварения после проведения реконструкции по Ру [1,3,4,8,10,12-14,16-18]. Хорошо известно, что антирефлюксные свойства билио-панкреатической петли, в том числе в плане ликвидации дуоденальной гипертензии, проявляются при ее длине не менее 50 см. Аналогично антирефлюксные свойства алиментарной петли и, соответственно, профилактика рефлюкс-гастрита и эзофагита обеспечиваются длиной последней не менее 40 см [1,2,5,8,12,14,17].
Известным негативным моментом резекции по Ру является потенциальная возможность возникновения Ру-стаз-синдрома. В настоящее время принято считать, что ведущую роль в патогенезе данного синдрома играет пересечение волокон интрамуральных нервных сплетений первой петли тонкой кишки, приводящее к нарушению распространения активирующего влияния дуоденального пейсмекера на тонкую кишку и возникновению ее пареза. Несмотря на то, что при первичных резекциях желудка по Ру доказанное возникновение Ру-стаз-синдрома выявлено не более чем у 8% пациентов, данное обстоятельство формально дало повод к утолению хирургического тщеславия внедрением «новой» методики так называемой «uncut Roux-en-Y» — резекции желудка по Ру без пересечения тонкой кишки [6,15]. Не можем не заметить в этой связи, что для сохранения исторических приоритетов все-таки имеет смысл сопоставить эту «новую» технику uncut Roux-en-Y и ставший уже академическим способ реконструкции по Бильрот-II в модификации Braun-Balfour с заглушкой на приводящей петле по А.А. Шалимову [3]. В проведенных сравнительных исследованиях показана более быстрая эвакуация из культи желудка после uncut Roux-en-Y, чем после стандартной резекции по Ру, не влекущая за собой, однако, значимого улучшения отдаленных результатов оперативного лечения.
Уже более четверти века прошло с момента внедрения в хирургическую гастроэнтерологию технологий лапароскопического доступа. В наше время абсолютно стандартными являются ушивание перфоративных язв, фундопликации, парциальные, продольные, дистальные резекции желудка, гастрэктомии, регионарные лимфаденэктомии, выполненные с применением лапароскопических технологий. В отдельных сообщениях описаны реконструктивные лапароскопические операции после ранее выполненных бариатрических вмешательств и лапароскопические операции, проведенные после постгастрорезекционных осложнений ближайшего послеоперационного периода [6,7,21]. Тем не менее, сообщения о повторных реконструктивных операциях по поводу постгастрорезекционного синдрома, проведенных лапароскопически, в доступной литературе (PubMed, e-LIBRARY) отсутствуют. В этой связи мы посчитали возможным поделиться своим первым опытом реконструктивной операции, выполненной по поводу постгастрорезекционного синдрома лапароскопическим доступом.
Клиническое наблюдение.
Пациент Александр П., 67 лет, поступил в Отделение абдоминальной хирургии ФГБУ «Клиническая больница №1 (Волынская)» УДП РФ 17 апреля 2018 года в срочном порядке с клинической картиной рецидивирующего желудочного кровотечения: периодическая (один раз в 2-3 дня) рвота содержимым типа «кофейной гущи», неоднократные эпизоды мелены. Помимо жалоб на общую слабость и головокружение, пациент указывал на возможность принятия только жидкой пищи в малых количествах. Употребление полужидкой пищи в стандартном объеме ограничивалось неизбежным появлением дискомфорта, ощущения тяжести и болей в эпигастрии после еды, сопровождавшихся отрыжкой и периодической рвотой съеденной пищей. Прием спазмолитиков и анальгетиков существенного облегчения страданий не приносил.
Из анамнеза известно, что около двадцати лет назад пациент перенес дистальную резекцию желудка по поводу кровоточащей язвы. Тип выполненного оперативного вмешательства по причине утери медицинской документации неизвестен. После проведенной операции пациент неукоснительно придерживался рекомендованной диеты. Тем не менее, спустя год после вмешательства пациент начал отмечать появление дискомфорта и тяжести в эпигастрии после еды, с течением времени дополнившихся периодическими болями в эпигастрии, отрыжкой и рвотой съеденной пищей. Указанные явления послужили причиной не только изменения режима питания пациента (частое дробное питание только жидкой пищей в малых количествах), но и изменения места жительства: пациент был вынужден проводить большую часть времени в регионе Кавказских минеральных вод, поскольку субъективно использование лечебных и столовых минеральных вод оказывало значительное уменьшение явлений диспепсии. Появление рвоты содержимым типа «кофейной гущи» и эпизодов мелены пациент отметил за две недели до настоящей госпитализации.
При первичном осмотре состояние пациента было расценено как среднетяжелое (АРАСНЕ II 12 баллов). Пациент сниженного питания, ИМТ 16,7 кг/м², астенизирован. Показатели внешнего дыхания и гемодинамики находились в пределах референсных значений. При физикальном исследовании живота определяется рубец после верхне-срединной лапаротомии без формирования грыжи, объемные образования пальпаторно не определяются. При ректальном исследовании — следы мелены. Лабораторно – гемоглобин 82 г/л, лейкоциты 9,1х109, общий белок 51 г/л, альбумин 29 г/л.
При экстренной эзофагогастродуоденоскопии выявлена картина оперированного по Бильрот-II желудка с культей желудка средних размеров, проходимым гастро-энтероанастомозом и наличием приводящего (содержит желчь) расширенного и отводящего спавшегося сегментов тонкой кишки. Слизистая культи желудка с явлениями острого воспаления и множественными мелкими эрозиями. В отводящем сегменте тонкой кишки в 0,5 см от линии анастомоза определяются две острые язвы до 0,5 см в диаметре с фиксированными сгустками крови в их дне (Forrest IIB). Проведен превентивный эндогемостаз аргоно-плазменной коагуляцией. В отводящий сегмент тонкой кишки установлен назо-интестинальный питательный зонд.
При рентгенологическом исследовании желудка с контрастированием бариевой взвесью определяется культя желудка, оперированного по Бильрот-II в модификации Гофмейстера-Финстерера, соответствующая по своим размерам проведенной гемигастрэктомии. Контраст практически без депонирования в желудке поступает в расширенную приводящую петлю тонкой кишки, а из нее – в дилатированную до 5 см двенадцатиперстную кишку. Длина приводящей к гастро-энтероанастомозу тонкокишечной петли составляет 12 см. При полном заполнении приводящей петли и двенадцатиперстной кишки отмечается рефлюкс контраста в желудок и отсроченная эвакуация в отводящую петлю тонкой кишки.
На основании проведенного обследования клинический диагноз был сформулирован следующим образом: К91.1. Синдром оперированного желудка (состояние после дистальной резекции желудка по Бильрот-II в модификации Гофмейстера-Финстерера от 1998 года). Пептические язвы гастро-энтероанастомоза, осложненные рецидивирующим кровотечением. Синдром приводящей петли. Хронический панкреатит. Хроническая постгеморрагическая анемия. Синдром нутритивной недостаточности. Состояние после превентивного эндогемостаза по поводу кровотечения из язв гастро-энтероанастомоза Forrest IIB.
С учетом очевидной бесперспективности консервативной коррекции диспепсии, обусловленной синдромом приводящей петли, и сохраняющейся угрозы рецидива кровотечения из язв гастро-энтероанастомоза были установлены показания к проведению срочного оперативного вмешательства. Предполагаемый объем вмешательства – резекция культи желудка с реконструкцией по Ру (Roux—en—Y). С учетом наличия у пациента ультракороткой приводящей петли для адекватной декомпрессии двенадцатиперстной кишки и предотвращения еюно-дуоденального рефлюкса было решено удлинить билио-панкреатическую петлю пятидесятисантиметровой тонкокишечной вставкой с последующим формированием собственно Y-образного анастомоза между билио-панкреатической и алиментарной петлями тонкой кишки. Накопленный в Отделении абдоминальной хирургии опыт лапароскопических операций на желудке (фундопликация, дистальная резекция желудка, гастрэктомия, продольная резекция желудка) сделал обоснованным решение о выполнении оперативного вмешательства лапароскопическим доступом. Принимая во внимание наличие у пациента синдрома нутритивной недостаточности алиментарного генеза, вмешательство было решено отложить на срок, необходимый для интенсивной коррекции нутритивного статуса.
Нутритивная поддержка включала в себя введение в назо-интестинальный зонд сбалансированных энтеральных смесей Nutricomp®Energy и парентеральное питание системой «три в одном» Nutriflex Lipid® 70/180. Общий суточный калораж проводимого питания составлял 3450 ккал/сут, количество вводимого белка – 90 г/сут. Параллельно проводились однократная трансфузия эритроцитарной массы, компенсация водно-электролитных нарушений, продленная инфузия эзомепразола в дозе 160 мг/сут. В течение пяти суток предоперационной подготовки клинико-лабораторных признаков рецидива кровотечения отмечено не было. Лабораторные показатели в исходе предоперационной подготовки формально характеризовали компенсацию нутритивного статуса пациента: гемоглобин 112 г/л, лейкоциты 6,1х109, общий белок 71 г/л, альбумин 39 г/л.
Пациент оперирован на шестые сутки с момента госпитализации под комбинированным эндотрахеальным наркозом с эпидуральной анестезией. Оперативное вмешательство проведено в запланированном объеме: лапароскопическая резекция культи желудка с реконструкцией по Ру и удлинением билио-панкреатической петли изоперистальтическим тонкокишечным сегментом.
В брюшную полость введены шесть троакаров: в параумбиликальной области, три 5-мм троакара в подреберьях и костальном углу, два 12-мм троакара в боковых областях. При ревизии: в верхнем этаже брюшной полости — массивный рубцово-спаечный процесс с вовлечением париетальной брюшины передней брюшной стенки, большого сальника, поперечно-ободочной кишки и мезоколон, висцеральной и диафрагмальной поверхностей левой доли печени, культи желудка. С помощью диссектора Harmonic® и коагулятора LigaSure® произведен адгезиолизис, поэтапно выделены из спаек и рубцов поперечно-ободочная кишка, мезоколон, висцеральная поверхность левой доли печени, передняя и задняя стенки культи желудка (культя желудка соответствует выполненной ранее гемигастрэктомии). Установлено, что реконструктивный этап первичной операции был выполнен по методике Гофмейстера-Финстерера на ультракороткой (до 12 см) приводящей петле, проведенной позадиободочно. С учетом предоперационного обследования и операционной находки (ультракороткая приводящая петля) решение об объеме оперативного пособия соответствовало предоперационной концепции: резекция культи желудка по Ру с удлинением билио-панкреатической петли сегментом тонкой кишки, расположенным изоперистальтически.
Зона гастроэнтероанастомоза с предлежащими петлями тонкой кишки выделена из ткани мезоколон; культя желудка мобилизована по передней и задней стенкам, малой и большой кривизне до уровня субтотальной резекции (субкардия – ворота селезенки). Желудок пересечен по уровню мобилизации с использованием аппарата EchelonFlex®60. Произведено формирование функционального анастомоза «бок в бок» между приводящей и отводящими петлями тонкой кишки с одномоментным пересечением приводящей петли тонкой кишки в 2 см проксимальнее, а отводящей петли – в 6 см дистальнее гастроэнтероанастомоза аппаратом EchelonFlex®60. Операционный препарат – дистальная часть культи желудка с участком приводящей и участком отводящей тонкой кишки – помещен в контейнер. В 50 см дистальнее сформированного функционального анастомоза тонкая кишка пересечена аппаратом EchelonFlex®60. Таким образом при пересечении тонкой кишки были сформированы билио-панкреатическая и алиментарная петли. Алиментарная петля тонкой кишки проведена к культе желудка позадиободочно через уже имевшееся окно в мезоколон. На алиментарной петле сформирован задний продольный гастро-энтероанастомоз «бок в бок» аппаратом EchelonFlex®60. В 40 см дистальнее гастро-энтероанастомоза алиментарная петля соединена с билио-панкреатической петлей (Y-образная реконструкция по Ру) формированием межкишечного анастомоза «бок в бок» аппаратом EndoGia®45. Технологические отверстия анастомозов ушиты непрерывным швом нитью Biosyn 3/0; анастомозы герметичны. Через левосторонний трансректальный минилапаротомный доступ операционный препарат удален в контейнере; под левую долю печени через троакарную рану в правом подреберье установлен трубчатый дренаж.
Продолжительность оперативного вмешательства составила 3 часа 10 минут; общая кровопотеря – до 100 мл. Пациент экструбирован на операционном столе и переведен в отделение хирургической реанимации на самостоятельном дыхании.
Ранний послеоперационный период у пациента П. проходил по программе ускоренной послеоперационной реабилитации. Физическая активизация пациента и пероральный прием воды малыми порциями начаты через 6 часов после вмешательства.
Проводился послеоперационный мониторинг перистальтической активности на селективном полиграфе ЖКТ с возможностью проведения коррекции моторно-эвакуаторных нарушений методом транскутанной резонансной стимуляции (патент РФ 2648819). На селективном полиграфе ЖКТ кривая перистальтической активности приняла физиологический ритм с приростом амплитуды до нормальных значений (14-18мкВ) с 4 часа после операции. На основании анализа кривых и собственного восстановления перистальтики было принято решение о нецелесообразности стимуляции электрофизиологическими методами.
Перистальтические шумы аускультативно начали определяться через 8 часов, отхождение газов началось через 20 часов, первый стул – через 36 часов после операции. На вторые сутки послеоперационного периода пациент переведен в хирургическое отделение на пролонгированной эпидуральной анальгезии, полностью восстановлена двигательная активность пациента при отсутствии болевых ощущений, удален дренаж из брюшной полости. Начат пероральный прием сбалансированных смесей для сипинга Nutricomp®Drink Plus на фоне продолжения парентерального питания системой «три в одном» Nutriflex Lipid® 70/180.
На третьи сутки послеоперационного периода выполнена контрольная рентгенография желудка с контрастированием бариевой взвесью. Определяется свободное прохождение контраста через пищевод, заполнение культи желудка, соответствующей объему субтотальной резекции, порционное своевременное поступление контраста через гастро-энтероанастомоз в тонкую кишку и дальнейший свободный пассаж контраста по ней. Рефлюкса контраста в билио-панкреатическую петлю не выявлено. С третьих суток послеоперационного периода пациентом начат прием пищи по варианту жидкой части щадящей диеты с дополнительным употреблением смесей для сипинга. Удален катетер для продленной эпидуральной анальгезии.
С учетом гладкого течения ближайшего послеоперационного периода, отсутствия болей и явлений диспепсии при употреблении жидкой и полужидкой пищи, пациент выписан для последующей амбулаторной реабилитации под наблюдение врача-гастроэнтеролога. На протяжении последующих трех месяцев проводился мониторинг состояния пациента еженедельно по телефону и в ходе трех плановых осмотров в клинике. Известно, что уже в первую неделю после выписки из стационара пациент совершил путешествие с авиаперелетом средней продолжительности. В течение последующих трех месяцев пациент отмечал возможность расширения пищевого рациона без явлений диспепсии, стойкую тенденцию к прибавке в весе, отсутствие необходимости в приеме каких бы то ни было лекарственных препаратов.
Заключение.
Приведенное клиническое наблюдение позволяет сделать ряд заключений. Прежде всего, данное наблюдение очередной раз подтверждает правомочность положения о том, что реконструкция пищеварительной трубки по Ру является оптимальным способом лечения пациентов с постгастрорезекционными синдромами, требующими хирургической коррекции – синдромом приводящей петли, пептическими язвами гастро-энтероанастомоза. Именно реконструкция с формированием билио-панкреатической и алиментарной кишечных петель, соединенных по типу Roux-en-Y, исключает рефлюксы пищеварительных соков, препятствует быстрому опорожнению культи желудка и ускоренному пассажу химуса. Данные обстоятельства, в свою очередь, определяют возможность быстрой компенсации имевшихся постгастрорезекционных расстройств пищеварения после проведения резекции культи желудка с реконструкцией по Ру. Действительно, уже в первую неделю послеоперационного периода пациент имел возможность полноценного питания в рамках лечебной диеты без малейших симптомов диспепсии. При этом у пациента не было отмечено ни клинических, ни рентгенологических признаков развития Ру-стаз-синдрома. Тощая кишка во время реконструктивной операции была пересечена всего в 10 см от дуодено-еюнального перехода, что по распространенному в зарубежной литературе мнению должно было привести к изоляции дуоденального пейсмекера кишечной перистальтики и практически облигатному возникновению пареза тонкой кишки с нарушением эвакуации из культи желудка. Тем не менее, клинически значимого и рентгенологически доказанного нарушения эвакуации из желудка после выполненного вмешательства выявлено не было, что указывает на безосновательность категорических утверждений ряда авторов о необходимости облигатного сохранения непрерывности интрамуральных нервных сплетений «новой» техникой uncut Roux-en-Y реконструкции. Дополнительный элемент проведенного оперативного вмешательства – удлинение билио-панкреатической петли изоперистальтической тонкокишечной вставкой – с одной стороны, полностью исключил возможность рецидива синдрома приводящей петли, а с другой, при закономерном снижении интрадуоденального давления создал предпосылки для разрешения явлений хронического панкреатита.
Приведенное наблюдение иллюстрирует техническую возможность выполнения повторных, в том числе и реконструктивных операций на желудке с применением лапароскопических технологий. В свою очередь малая травматичность лапароскопической операции сделала абсолютно реальным ведение пациента в рамках программы ускоренной послеоперационной реабилитации с ранней физической активизацией и с ранним началом перорального приёма пищевых субстанций. Помимо вышеприведенных нюансов хирургической техники и тактики данный клинический пример явился яркой иллюстрацией необходимости целенаправленной предоперационной и послеоперационной коррекции нутритивного статуса пациента. Очевидно, что компенсация исходно имевшихся нутритивных нарушений и последующего послеоперационного катаболизма во многом определили гладкое течение ближайшего послеоперационного периода. Успешный опыт проведения лапароскопической резекции культи желудка с реконструкцией по Ру стал для нашей клиники важной вехой освоения лапароскопических технологий в абдоминальной хирургии и закономерным основанием для продолжения разработок в области реконструктивно-восстановительной хирургии пищеварительного тракта.
|
№
|
Литературы
|
Reference
|
|
1
|
Волков С.В. Патологические синдромы после гастрэктомии. Чебоксары, 1998. 208с.
|
Volkov S.V. Patologicheskiye sindromy posle gastrektomii. Cheboksary, 1998. 208p. (In Russian)
|
|
2
|
Петров В.П., Бадуров Б.Ш., Хабурзания А.К. Резекция желудка по Ру. М., ПИК ВИНИТИ, 1998, 212с.
|
Petrov V.P., Badurov B.SH., Khaburzaniya A.K. Rezektsiya zheludka po Ru. M., PIK VINITI, 1998, 212p (in Russian)
|
|
3
|
Шалимов А.А., Саенко В.Ф. Хирургия желудка и двенадцатиперстной кишки. Киев, 1972, 355 с.
|
Shalimov A.A., Sayenko V.F. Khirurgiya zheludka i dvenadtsatiperstnoy kishki. Kiyev, 1972, 355p. (in Russian)
|
|
4
|
Eagon JC, Miedema BW, Kelly KA. Postgastrectomy syndromes. Surg Clin North Am. 1992 Apr;72(2):445-65.
|
Eagon JC, Miedema BW, Kelly KA. Postgastrectomy syndromes. Surg Clin North Am. 1992 Apr;72(2):445-65.
|
|
5
|
Inokuchi M., Long-term outcomes of Roux-en-Y and Billroth-I reconstruction after laparoscopic distal gastrectomy. Gastric Cancer. 2013;16(1):67-73
|
Inokuchi M., Long-term outcomes of Roux-en-Y and Billroth-I reconstruction after laparoscopic distal gastrectomy. Gastric Cancer. 2013;16(1):67-73
|
|
6
|
Ma JJ. A modified uncut Roux-en-Y anastomosis in totally laparoscopic distal gastrectomy: preliminary results and initial experience. Surg Endosc. 2017;31(11):4749-4755.
|
Ma JJ. A modified uncut Roux-en-Y anastomosis in totally laparoscopic distal gastrectomy: preliminary results and initial experience. Surg Endosc. 2017;31(11):4749-4755.
|
|
7
|
Martin RF. Surgical management of ulcer diseases. Surg. Clin. N. Am. 2005;85:907-929.
|
Martin RF. Surgical management of ulcer diseases. Surg. Clin. N. Am. 2005;85:907-929.
|
|
8
|
Takahashi M., Terashima M., Kawahira H. Quality of life after total vs distal gastrectomy with Roux-en-Y reconstruction: Use of the Postgastrectomy Syndrome Assessment Scale-45. World J Gastroenterol. 2017; 23(11):2068-2076.
|
Takahashi M., Terashima M., Kawahira H. Quality of life after total vs distal gastrectomy with Roux-en-Y reconstruction: Use of the Postgastrectomy Syndrome Assessment Scale-45. World J Gastroenterol. 2017; 23(11):2068-2076.
|
|
9
|
Ablasmaier В., Gellert К., Tanzella U., Muller J.M. Laparoscopic Billroth-II gastrectomy. J Laparoendosc Surg. 1996.;6:319-324.
|
Ablasmaier В., Gellert К., Tanzella U., Muller J.M. Laparoscopic Billroth-II gastrectomy. J Laparoendosc Surg. 1996.;6:319-324.
|
|
10
|
Miwa K. Jejunal pouch interposition and distal gastrectomy. Nippon. Geka. Gakkaai. Zasshi. 1997;98(6):560-564.
|
Miwa K. Jejunal pouch interposition and distal gastrectomy. Nippon. Geka. Gakkaai. Zasshi. 1997;98(6):560-564.
|
|
11
|
Soper N.J., Brunt L.M., Brewer J.D., Meininger T.A. Laparoscopic Billroth II gastrectomy in the canine model. Surg Endosc. 1994;8:1395-1398.
|
Soper N.J., Brunt L.M., Brewer J.D., Meininger T.A. Laparoscopic Billroth II gastrectomy in the canine model. Surg Endosc. 1994;8:1395-1398.
|
|
12
|
Zang L. Reconstruction after laparoscopic assisted distal gastrectomy: technical tips and pitfalls. Transl Gastroenterol patol. 2017;21;2:66.
|
Zang L. Reconstruction after laparoscopic assisted distal gastrectomy: technical tips and pitfalls. Transl Gastroenterol patol. 2017;21;2:66.
|
|
13
|
Zornig C, Emmermann A, Blöchle C, Jäckle S. Laparoscopic 2/3 resection of the stomach with intracorporal Roux-en-Y anastomosis. Chirurg. 1998;69(4):467-700.
|
Zornig C, Emmermann A, Blöchle C, Jäckle S. Laparoscopic 2/3 resection of the stomach with intracorporal Roux-en-Y anastomosis. Chirurg. 1998;69(4):467-700.
|
|
14
|
Kawano F, Tashiro K, Nakao H, Fujii Y, Ikeda T, Takeno S, Nakamura K, Nanashima A. Jejunogastric intussusception after distal gastrectomy with Roux-en-Y reconstruction: A case report. Int J Surg Case Rep. 2018;44:105-109. doi: 10.1016/j.ijscr.2017.12.042
|
Kawano F, Tashiro K, Nakao H, Fujii Y, Ikeda T, Takeno S, Nakamura K, Nanashima A. Jejunogastric intussusception after distal gastrectomy with Roux-en-Y reconstruction: A case report. Int J Surg Case Rep. 2018;44:105-109. doi: 10.1016/j.ijscr.2017.12.042
|
|
15
|
Uyama I, Sakurai Y, Komori Y. Laparoscopy-assisted uncut Roux-en-Y operation after distal gastrectomy for gastric cancer. Gastric Cancer. 2005;8(4): 253-7.
|
Uyama I, Sakurai Y, Komori Y. Laparoscopy-assisted uncut Roux-en-Y operation after distal gastrectomy for gastric cancer. Gastric Cancer. 2005;8(4): 253-7.
|
|
16
|
Евсеев М.А., Фомин В.С., Владыкин А.Л., Клишин И.М., Никитин В.Е. Применение комплексного консервативного лечения пареза желудочно-кишечного тракта после оперативного вмешательства большого объема. Анналы хирургии. 2018;23(3):188-195.
|
Evseev MA, Fomin VS, Vladykin AL, Klishin IM, Nikitin V.Ye. The use of complex conservative treatment of paresis of the gastrointestinal tract after surgical intervention of large volume. Annaly khirurgii. 2018;23(3):188-195. (In Russian)
|
|
17
|
Tanaka T. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology. 1997;44(15):891-896.
|
Tanaka T. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology. 1997;44(15):891-896.
|
|
18
|
Yeon-Ju H, Joo-Ho L. The Advances of Laparoscopic Gastrectomy for Gastric Cancer. Gastroenterology Research and Practice. 2017;3:9278469.
|
Yeon-Ju H, Joo-Ho L. The Advances of Laparoscopic Gastrectomy for Gastric Cancer. Gastroenterology Research and Practice. 2017;3:9278469.
|
|
19
|
Dapri G, Cadière GB, Himpens J. Laparoscopic reconversion of Roux-en-Y gastric bypass to original anatomy: technique and preliminary outcomes. Obes Surg. 2011;21(8):1289-95.
|
Dapri G, Cadière GB, Himpens J. Laparoscopic reconversion of Roux-en-Y gastric bypass to original anatomy: technique and preliminary outcomes. Obes Surg. 2011;21(8):1289-95.
|
|
20
|
Dong Jin Kim, Wook Kim. Role of Laparoscopic Management for Postgastrectomy Complications. J Laparoendosc Adv Surg Tech A. 2018;28(4):402-407. doi: 10.1089/lap.2017.0541.
|
Dong Jin Kim, Wook Kim. Role of Laparoscopic Management for Postgastrectomy Complications. J Laparoendosc Adv Surg Tech A. 2018;28(4):402-407. doi: 10.1089/lap.2017.0541.
|
|
21
|
Zurita Mv LC, Tabari M, Hong D. Laparoscopic conversion of laparoscopic Roux-en-Y gastric bypass to laparoscopic sleeve gastrectomy for intractable dumping syndrome and excessive weight loss. Surg Obes Relat Dis. 2013;9(2): 34-7.
|
Zurita Mv LC, Tabari M, Hong D. Laparoscopic conversion of laparoscopic Roux-en-Y gastric bypass to laparoscopic sleeve gastrectomy for intractable dumping syndrome and excessive weight loss. Surg Obes Relat Dis. 2013;9(2): 34-7.
|
Статья добавлена 19 июля 2018 г.
замкнутый круг, анастомоз, лечение пострезекционного синдрома
Заболевания оперированного желудка, заболевания желудка, развившиеся в связи с ранее проведенным оперативным вмешательством. Чаще всего развивается после гастроэнтеростомии (см.) По поводу язвенной болезни двенадцатиперстной кишки и желудка.
При повышенной кислотности и длительном отведении в петле тонкой кишки развивается анастомоз язвенной болезни или тощей кишки, что дает
тяжелая клиническая картина, плохо консервативное лечение и склонность к проникновению (перфорации) в окружающие органы с образованием внутреннего свища (желудочные колики).Лечение — резекция желудка с наложенным ранее анастомозом, ваготомия (см.).
| Рис. 3. Свищ между желудком и нисходящей частью двенадцатиперстной кишки. Рис. 4. Замкнутый круг (схема). |
Порочный круг как заболевание оперированного желудка состоит в том, что при хорошо проходимом привратнике и гастроеюностомии, накладываемых на длинную петлю, эвакуация желудка происходит в основном через привратника.Содержимое переполняет двенадцатиперстную кишку и вызывает колено тонкой кишки, которое расширяется и частично сжимает выходную кишку, затрудняя эвакуацию через нее. В результате пища попадает из переполненной афферентной петли частично или полностью через анастомоз обратно в желудок (рис. 4). Клиническое течение характеризуется прогрессирующим истощением, диарейными расстройствами, тошнотой, рвотой. В диагностике помогает рентгенологическое исследование, свидетельствующее о прохождении бария через анастомоз в желудке.Лечение — резекция желудка и анастомоза, наложение дополнительных энтеро-энтероанастомозов между ведущей и латеральной петлями тощей кишки.
Анастомоз — возникшее послеоперационное острое воспаление желудочно-кишечного анастомоза, сопровождающееся его сокращением и нарушением опорожнения. Клинические проявления связаны с скоплением в желудке или его культом жидкого содержимого и газов, что приводит к тошноте и рвоте съеденной пищи. Иногда в эпигастральной области при пальпации определяется инфильтрация (см.).Рентгенологически установлена задержка эвакуации контрастного вещества. Лечение — противовоспалительная терапия (антибиотики, внутривенное введение хлорида кальция, лучевая терапия в противовоспалительных дозах), длительное отсасывание застойного содержимого тонким зондом. Повторное хирургическое вмешательство (гастроеюностомия — только при безуспешном применении консервативных мер. Давно существующий анастомоз приводит к деформации и сужению анастомоза, что требует повторной операции — резекции желудка с анастомозом.
Пострезекционный синдром означает группу возникающих заболеваний как позднее осложнение после резекции желудка.Включает ряд нарушений: нарушение проходимости пищи, нарушения крови (австралийская анемия) и др.
Синдром после остановки сердца («Постреанимационный синдром»)
Это ненормальное физиологическое состояние, которое возникает, когда за ишемией всего тела следует реперфузия всего тела.
Таким образом, это системное воспалительное состояние, напоминающее все другие формы вазодилататорного шока; степень органной дисфункции зависит от чувствительности этих органов к ишемии и продолжительности ишемического периода.
«Постреанимационная болезнь»
В 1960-х и 1970-х годах Владимир Неговский («Реаниматор») опубликовал много материалов, касающихся новой сущности болезни, которая возникла в значительной степени в результате развития методов реанимации; он назвал это «постреанимационным синдромом».
Так вот, методы реанимации еще не продвинулись так далеко. Газеты пролили свет на некоторые необычные практики специалистов по реанимации в бывшем СССР. Во-первых, жидкостная реанимация арестованного пациента была проведена в виде внутриартериальной инфузии цельной крови, смешанной с глюкозой, адреналином и перекисью водорода (в качестве донора кислорода).Но наблюдения, проведенные над животными, были правильными.
Последующие десятилетия привели к усовершенствованию методов реанимации и лучшему пониманию патофизиологических процессов, происходящих в организме недавно реперфузированного. На Западе люди также перестали называть эту науку «реаниматологией», возможно, из-за того, что этот термин имеет значение Лавкрафта.
Но, возвращаясь к теме, синдром после остановки сердца — это хорошо описанная совокупность сбоев в работе систем органов, которые возникают вместе после периода глобальной ишемии.Можно предположить, что наиболее голодные по АТФ ткани пострадают больше всего, и это действительно так в большинстве случаев. Кроме того, развивается системная воспалительная реакция, поскольку эндотелий сосудов реагирует на ишемию и реперфузию, становясь дисфункциональным, как и при септическом шоке. Кроме того, основная проблема — что бы ни стало причиной остановки сердца — все еще сохраняется; учитывая, что чаще всего это инфаркт миокарда, можно ожидать развития кардиогенного шока. Наконец, может развиться «настоящий» септический шок, когда реперфузированный кишечник теряет свою целостность и кишечные бактерии попадают в системный кровоток.
Первые секунды после остановки сердца
Теперь, когда поток насыщенной кислородом крови прекратился, у клеток мало резервов. Внутриклеточного кислорода мало. Некоторые из них, например, в мышцах, хранятся в миоглобине (и, следовательно, доступны для ишемизированных мышц), но остальные клетки, особенно важные клетки, такие как нейроны, имеют мало кислорода в цитоплазме — все, что растворено в клеточной воде, с парциальное давление может быть 1-3 мм рт.
Другой запас кислорода содержится в капиллярной крови, единственной крови, доступной для газообмена.Только около 5% циркулирующего объема находится в капиллярах, поэтому можно представить, что для человека весом 70 кг для газообмена доступно только около 250 мл насыщенной кислородом крови, когда циркуляция прекращается.
ATP необходимо оформить. Этот запас кислорода пережевывается довольно быстро. Один автор предлагает период времени в 20 секунд.
Первые минуты после остановки сердца
Когда кислород истощается, ткани переключаются на анаэробный метаболизм в попытке поддерживать некоторые жизненно важные функции, но это неадекватный процесс, и потребность в АТФ слишком велика.Недостаток АТФ приводит к нарушению основных клеточных процессов. Это знакомая картина ишемии, характеризующаяся коллапсом трансмембранных градиентов концентрации и образованием молекул свободных радикалов.
Временные рамки этого периода более эластичны. Конечно, во время СЛР некоторое количество кислорода достигнет некоторых тканей; это можно описать как состояние «низкого расхода». Во время СЛР процесс ишемии может быть в некоторой степени обращен вспять (на самом деле, в этом и суть — если оксигенация миокарда может быть восстановлена, он потенциально может быть дефибриллирован или стимулирован адреналином).
А теперь давайте рассмотрим конец реанимации. Восстанавливается спонтанное кровообращение, и насыщенная кислородом кровь возвращается в ткани, испытывающие недостаток кислорода. Как бы весело это ни было, некоторый ущерб уже был нанесен.
Кроме того, возникает определенная степень реперфузионного повреждения, что приводит к перекисному окислению липидов и апоптозу.
При широком распространении сочетание глобального ишемического повреждения и глобального реперфузионного повреждения приводит к огромному количеству свободных жирных кислот, свободных радикалов, липидных фрагментов и разлитого клеточного содержимого, плавающих в кровотоке.Осознав эту ситуацию, иммунная система приходит в ярость. Комплемент активируется, и эндотелиальные клетки экспрессируют молекулы адгезии и хемокины; лейкоциты наводняют кровоток провоспалительными молекулами.
Эта ситуация приводит к отказу полиорганной системы, и теперь я сделаю попытку обсудить более важные системы органов в отдельных деталях.
Патогенез недостаточности полиорганной системы после остановки сердца
Побывав какое-то время без кислорода, ткани всех органов начинают работать ненормально.
Краткое содержание этой диаграммы занятости состоит в том, что практически ничего не работает. Кроме того, дисфункция порождает дисфункцию, и без внимания весь этот процесс приводит к ухудшению перфузии тканей.
Системная воспалительная реакция у пациента после остановки сердца
Во многом это связано с активацией эндотелия, вызванной гипоксией. Эндотелий — животное, устойчивое к гипоксии; эти клетки могут выжить при очень низком давлении кислорода, регулируя свой метаболизм.Это, изначально, защитный механизм; но если гипоксия длительная и тяжелая, в игру вступают другие механизмы, и эндотелиальный ответ становится провоспалительным. Это очень похоже на шоковый синдром сепсиса, а гипотензия также реагирует на норадреналин.
Оглушение миокарда после остановки сердца
Миокард, который недавно массировали, не является здоровым органом. По крайней мере, в исследованиях на свиньях фракция выброса снижается с 55% до 20%. Примерно через шесть часов после остановки сердца плохой сердечный выброс действительно начинает способствовать гипотензии.
Однако это обратимое явление. Через 48-72 часа функция миокарда приходит в норму. Более того, пока это происходит, он легко реагирует на инотропы.
В дополнение к этому есть первичное оскорбление — помните, что большинство этих арестов связано с серьезным событием окклюзии коронарных артерий (48% согласно статье NEJM, 70% согласно французской статье в Circulation ). Пораженная область обычно значительна.
Дисфункция надпочечников после остановки сердца
Ишемическое повреждение надпочечников никак не влияет на состояние системы гипоталамус-гипофиз-надпочечники.Исследования пациентов после ареста продемонстрировали неспособность реагировать на АКТГ, что было интерпретировано как относительная надпочечниковая недостаточность (хотя циркулирующий уровень кортизола может быть повышен до аномально высокого диапазона, этого все же недостаточно!). Однако эта надпочечниковая недостаточность еще не вызвала каких-либо призывов к стандартному назначению кортикостероидов пациентам после ареста. Это можно рассматривать только в том случае, если шоковое состояние не реагирует на вазопрессоры (фактически, так же, как при сепсисе).
Гипоксическое повреждение головного мозга после остановки сердца
В конце концов, там деньги. Повреждение нейронов после остановки сердца происходит в течение нескольких часов или дней и, таким образом, дает большой промежуток времени, в течение которого реаниматолог может попытаться вмешаться. Некоторые из повреждений связаны с мигрирующей гипоксией, которая возникает во время СЛР, когда кровоток в полушариях головного мозга колеблется между отсутствием и низким. После 15 минут простоя в игру вступают другие факторы; Наиболее интересным из них, вероятно, является микротромбоз (вероятно, больше из-за застоя, чем из-за эндотелиальной дисфункции).Можем ли мы сделать тромболизис? Испытание TROICA решило эту проблему; опубликованных результатов нет, но личное общение исследователей с группой ILCOR дало убедительный ответ на этот вопрос «нет».
После восстановления кровообращения нарушается механизм ауторегуляции церебрального кровотока. Результат — вазодилатация головного мозга и гиперемия. Во время этой фазы (которая может длиться часами) слишком много кислорода потенциально очень плохо, так как это увеличивает образование свободных радикалов и, следовательно, перекисное окисление липидов нейронов.
Однако в целом специалисты ILCOR пришли к выводу, что церебральный кровоток после остановки сердца обычно достаточен для удовлетворения потребностей окислительного метаболизма, и это подтверждается выводом о том, что инфузия нимодипина не улучшает неврологический исход у этих пациентов.
Почечная недостаточность после остановки сердца
Мозговое вещество почек обычно функционирует на пороге максимальной экстракции кислорода, поэтому логично предположить, что при остановке сердца эта голодная ткань значительно пострадает.действительно, похоже, что у значительной части пациентов после ареста развивается острое повреждение почек, особенно если время простоя было продолжительным, если у них разовьется значительный кардиогенный шок или если они забивают свои органы микротромбами ДВС. Однако местные исследователи из Мельбурна продемонстрировали, что среди выживших после остановки сердца после остановки сердца это осложнение встречается на удивление редко. В недавней серии случаев около 7% выживших после остановки сердца вне больницы получали гемодиализ.
В любом случае, что бы вы с этим сделали.Ваш контроль жидкости и поддержка вазопрессоров уже оптимизированы для улучшения перфузии сердца и мозга, поэтому почки получают выгоду как сторонний наблюдатель. Вы действительно не можете избежать определенной степени нефротоксичности, поскольку у вас неизбежно будет ангиограмма с контрастированием, и угроза почечной недостаточности не будет препятствием для этой критически важной процедуры. И, конечно, если это действительно выходит из-под контроля, пациенту всегда можно предложить диализ.
Язвенная болезнь желудка после остановки дыхания
Пациенты после ареста могут страдать не только от разрыва или разрыва желудка во время СЛР, но и язвы на слизистой оболочке желудка.Эта слизистая оболочка — еще один кислородно-голодный орган, которому требуется нормоксия для поддержания своей нормальной защитной функции. По мере развития гипоксии слизистая оболочка не может защитить себя от кислого содержимого желудка, и происходит повреждение слизистой оболочки желудка. Конечно, с их трубкой NG на свободном дренировании мы часто видим, как коричневый материал просачивается из желудка пациента, и все мы заключаем, что это, должно быть, кофейная гуща диффузного повреждения слизистой оболочки. Однако в литературе мало доказательств того, что остановка сердца сама по себе является значительным фактором риска возникновения стрессовых язв.Фактически, в рекомендациях по профилактике стрессовых язв это не указано в качестве одного из основных показаний.
Аспирация при остановке сердца и после остановки сердца из-за недостаточности нижнего сфинктера пищевода
Из всех сфинктеров, которые могут вас подвести, этот, на удивление, самый неприятный. Учтите, что пациенты с остановкой сердца редко бывают настолько вежливыми, чтобы послушно поститься до того, как они окажутся на грани смерти, и поэтому обычно имеют хотя бы частично полный желудок, когда появляется жнец.
Подумайте, что мы с ними делаем. Учтите, что во время СЛР они лежат на спине; и кто-то сжимает их грудь, очень близко к эпигастрию. Подумайте о том, что во время сжатия грудной клетки стажер-анестетик нагнетает воздух в грудную полость мощными и уверенными движениями мешка. Предполагается, что это происходит между компрессиями, но в безумии реанимации это обычно асинхронный процесс. Если сжатие грудной клетки происходит одновременно с вдохом из мешка, весь сжатый воздух не сможет попасть в сжатую грудную клетку и пойдет по пути наименьшего сопротивления в желудок, минуя расслабленный сфинктер.
По мере продолжения этого процесса желудок наполняется воздухом. Содержимое желудка поднимается и опускается по пищеводу и всасывается в легкие. А затем вы интубируете пациента и выдуваете эту кислотную грязь на все его бронхи.
Короче говоря, потеря тонуса нижнего сфинктера пищевода во время реанимации — это действительно плохо.
Дыхательная недостаточность после остановки сердца и ОРДС
Итак, отказавший желудочек вернулся назад, как раковина, и ваши легкие наполняются пеной отека легких.Этот отек смешивается с аспирированным содержимым желудка, которое вентилируется по всей паренхиме легких. К этому добавляется энергичная сердечно-легочная реанимация, вызывающая ушибы легких. И, наконец, ишемия всего тела и реперфузионное повреждение привели к глобальной эндотелиальной дисфункции, которая также включает дисфункцию легочного эндотелия.
Короче говоря, существует множество причин для развития респираторной недостаточности, подобной ОРДС, после остановки сердца.
ILCOR не может рекомендовать какую-либо конкретную стратегию вентиляции.Они просто указывают на то, что лечение такого рода дыхательной недостаточности, вероятно, будет несколько отличаться от лечения простого ОРДС. Вентиляция с низким дыхательным объемом при ОРДС обычно приводит к неохотно переносимому гиперкапноэ. Это не будет полезно после ареста, так как вы будете навязчиво следить за PaCO 2 и стремиться к строгому нормокапноэ, чтобы предотвратить чрезмерную вазодилатацию мозга.
К счастью, терапевтическая гипотермия снижает скорость метаболизма всего тела и, таким образом, снижает количество CO 2 , вырабатываемого тканями, снижая требования к минутному объему и позволяя использовать более низкие дыхательные объемы.
Дисфункция печени после остановки сердца
Как и все остальное, прекращение кровотока во время остановки сердца имеет тенденцию вызывать некоторую степень гипоксического поражения печени. Когда кровообращение восстанавливается и преобладает состояние шока с низким потоком, печень снова испытывает недостаток кислорода, поскольку брыжеечная циркуляция особенно чувствительна к активированной ренин-ангиотензин-альдостероновой системе. Типичными признаками ишемического гепатита являются начальное повышение уровня билирубина и ферментов трансаминаз, за которым следует повышение уровня холестатических ферментов (при набухании ишемической печени уменьшается отток желчных протоков).Учитывая, что это, по-видимому, более тесно связано с правожелудочковой недостаточностью и венозным застоем в печени, а не с самим шоковым состоянием, можно предположить, что тщательное введение инотропов и жидкостей для улучшения сердечного выброса будет наиболее гепатозащитным действием, которое вы могли бы сделать. .
Ишемия желудочно-кишечного тракта и бактериальная транслокация после остановки сердца
Ишемия кишечника возникает в результате остановки сердца. Кишечник, на время лишенный кислорода, страдает вместе с другими органами; однако, в отличие от других внутренностей, этот содержит бесчисленные легионы враждебных организмов.В восторге они проникают сквозь ошеломленные защитные сети слизистой оболочки желудочно-кишечного тракта и вторгаются в кровоток. Некоторые исследования согласны с тем, что грамотрицательные бактерии являются наиболее частой бактериемией у лиц, перенесших остановку сердца; однако пневмония по-прежнему является наиболее частым инфекционным осложнением, а золотистый стафилококк — наиболее частым клинически значимым патогеном.
Иммунная дисфункция и сепсис после остановки сердца
Существует известная тенденция у выживших после остановки сердца к развитию инфекционных осложнений в последующие 24 часа.На самом деле кажется, что у 2/3 из них развивается та или иная инфекция, но это не влияет на их смертность. Фактически, Шведский регистр гипотермии сообщает, что, хотя у 41% пациентов развилась пневмония, только у 4% развился сепсис. Таким образом, в настоящее время AHA не может рекомендовать профилактику антибиотиками.
Некоторая предрасположенность к сепсису на самом деле может быть следствием терапевтического переохлаждения, но, по-видимому, не является серьезной проблемой.
К сожалению, запрошенная страница не найдена
К сожалению, запрошенная страница не найденаДля того, чтобы предоставить вам наилучшее взаимодействие с пользователем, этот сайт использует Javascript.Если вы видите это сообщение, вероятно, в вашем браузере отключен параметр Javascript. Для оптимального просмотра этого сайта убедитесь, что в вашем браузере включен Javascript.
Вы знали, что ваш браузер устарел? Чтобы получить наилучшие впечатления от использования нашего веб-сайта, мы рекомендуем вам перейти на более новую версию. Учить больше.
Пожалуйста, попробуйте использовать нашу поисковую систему
Вас также может заинтересовать
Членство
Мы объединяем специалистов в области сердечно-сосудистых заболеваний всех специальностей, ролей и этапов карьеры по всему миру.Узнайте, как вы можете присоединиться к мировому кардиологическому сообществу.
Узнать больше
Методические рекомендации
Все соответствующие доказательства, чтобы помочь врачам взвесить преимущества / риски диагностических или терапевтических процедур.
Узнать больше
Образование
Интерактивные и научно обоснованные образовательные ресурсы по общей кардиологии и специальностям для поддержки вашего непрерывного медицинского образования.
Узнать больше
Рак желудка: причины, симптомы и лечение
Рак желудка или рак желудка — это скопление аномальных клеток, которые образуют массу в части желудка. Он может развиться в любом отделе желудка.
По данным Всемирной организации здравоохранения (ВОЗ), в 2018 году рак желудка стал причиной 783 000 смертей во всем мире. Это шестой по распространенности вид рака в мире, но третье место среди причин смерти от рака.
В Соединенных Штатах число новых диагнозов рака желудка сокращалось примерно на 1,5% ежегодно в течение последнего десятилетия.
Около 90–95% всех случаев рака желудка составляют аденокарциномы. В этом типе рак развивается из клеток, которые образуются в слизистой оболочке. Это слизистая оболочка желудка.
В этой статье мы рассмотрим, как распознавать, диагностировать и лечить рак желудка, а также факторы риска.
Рак желудка может вызывать несколько симптомов. Однако эти симптомы могут не проявляться в течение многих лет, поскольку рак желудка растет очень медленно.
По этой причине многие люди с раком желудка не получают диагноз до тех пор, пока болезнь уже не продвинулась.
Симптомы рака желудка на ранней стадии включают:
- ощущение сытости во время еды
- трудности с глотанием
- ощущение вздутия живота после еды
- частая отрыжка
- изжога
- расстройство желудка, которое не устраняет
- боль в животе
- боль в грудины
- задержанный ветер
- рвота, которая может содержать кровь
Однако многие из этих симптомов очень похожи на симптомы других, менее серьезных заболеваний.Тем не менее, любой человек с повышенным риском рака желудка, который испытывает трудности с глотанием, должен немедленно обратиться за медицинской помощью.
По мере прогрессирования рака желудка у некоторых людей могут наблюдаться следующие симптомы:
- анемия
- скопление жидкости в желудке, из-за чего желудок может казаться бугристым на ощупь
- черный стул, содержащий кровь
- усталость
- потеря аппетита
- потеря веса
Лечение рака желудка зависит от нескольких факторов, в том числе от тяжести рака, общего состояния здоровья и предпочтений человека.
Лечение может включать хирургическое вмешательство, химиотерапию, лучевую терапию, прием лекарств и участие в клинических испытаниях.
Хирургия
Хирург может попытаться удалить рак желудка, а также часть здоровой ткани. Хирург должен сделать это, чтобы убедиться, что они не оставляют раковых клеток.
Примеры включают:
- Эндоскопическая резекция слизистой оболочки: Хирург будет использовать эндоскопию для удаления крошечных опухолей из слоя слизистой оболочки.Врачи обычно рекомендуют этот метод лечения рака желудка на ранней стадии, который еще не распространился на другие ткани.
- Субтотальная резекция желудка: Это включает удаление части желудка.
- Тотальная резекция желудка: Хирург удаляет весь желудок.
Операции на брюшной полости — это сложная процедура, которая может потребовать длительного периода восстановления. Людям, возможно, придется оставаться в больнице в течение 2 недель после процедуры. За этим последуют несколько недель выздоровления в домашних условиях.
Лучевая терапия
В лучевой терапии специалист использует радиоактивные лучи для нацеливания и уничтожения раковых клеток. Этот вид терапии не используется при лечении рака желудка из-за риска повреждения близлежащих органов.
Однако, если рак запущен или вызывает серьезные симптомы, такие как кровотечение или сильная боль, лучевая терапия является вариантом.
Медицинская бригада может комбинировать лучевую терапию с химиотерапией перед операцией, чтобы уменьшить опухоль.Это упрощает хирургическое удаление. Они также могут использовать радиацию после операции, чтобы убить оставшиеся раковые клетки вокруг желудка.
Люди могут испытывать расстройство желудка, тошноту, рвоту и диарею в результате лучевой терапии.
Химиотерапия
Химиотерапия — это специальное лечение, при котором используются лекарственные препараты, предотвращающие деление и размножение быстрорастущих раковых клеток. Эти препараты известны как цитотоксические лекарства. Это первичное лечение рака желудка, который распространился на отдаленные участки тела.
Лекарство распространяется по всему телу человека и атакует раковые клетки в первичном очаге рака и любых других регионах, на которые он распространился.
При лечении рака желудка команда специалистов по лечению рака может назначить химиотерапию, чтобы уменьшить опухоль перед операцией или убить оставшиеся раковые клетки после операции.
Целевые лекарства
Целевые терапии распознают и атакуют определенные белки, которые производят раковые клетки. В то время как химиотерапия нацелена на быстро делящиеся клетки в целом, нацеленные лекарства действуют на раковые клетки с другими характеристиками.
Это уменьшает количество здоровых клеток, разрушаемых химиотерапией.
Онкологические бригады вводят два целевых лекарства для людей с раком желудка с помощью внутривенной инфузии (IV):
- Трастузумаб (герцептин): Он нацелен на HER2, белок, который способствует росту клеток. Некоторые виды рака желудка производят избыток HER2.
- Рамуцирумаб (Цирамза): Это лекарство направлено на блокирование белка, называемого VEGF, который сообщает организму производить новые кровеносные сосуды, необходимые для роста опухолей.
Иммунотерапия
Это лечение, при котором используются лекарства, которые побуждают иммунные клетки организма атаковать раковые клетки.
Люди с запущенным раком желудка, получившие два или более лечения, являются кандидатами на иммунотерапию.
Людям со стойкими симптомами рака желудка следует как можно скорее обратиться к врачу.
Врач спросит об их симптомах, семейном анамнезе и истории болезни, а также о выборе образа жизни, например, что они едят и пьют и курят ли.Они также проведут медицинский осмотр, чтобы проверить, нет ли болезненности или опухоли желудка.
Они также могут проводить анализы крови, чтобы определить, есть ли избыток определенных веществ, указывающих на рак. Они также могут выполнить полный анализ крови для измерения количества красных и белых кровяных телец, а также тромбоцитов и гемоглобина.
Если врач подозревает рак желудка, он направит пациента на обследование к специалисту по заболеваниям желудка. Этот специалист известен как гастроэнтеролог.
Диагностические меры могут включать следующее.
Верхняя эндоскопия
Специалист использует эндоскоп, чтобы заглянуть внутрь желудка. Они исследуют пищевод, желудок и двенадцатиперстную кишку, которая является первым отделом тонкой кишки.
Если врач подозревает рак, он сделает биопсию для сбора образцов ткани, которые отправят в лабораторию для анализа.
Компьютерная томография
Компьютерная томография позволяет получать подробные изображения областей внутри тела под разными углами.
Перед компьютерной томографией врач может ввести краситель или попросить пациента проглотить его. Этот краситель позволяет сканеру создавать более четкие изображения пораженных участков.
Бариевый глоток
Человек глотает жидкость, содержащую барий, выстилающую пищевод и желудок. Это помогает выявить аномалии желудка во время рентгена.
После этого рентгенолог сделает рентгеновские снимки пищевода и желудка.
Определенные факторы повышают риск рака, в том числе:
Заболевания
Состояния, связанные с раком желудка, включают:
- H.pylori инфекция в желудке
- кишечная метаплазия, при которой клетки, которые обычно выстилают линию кишечника слизистую оболочку желудка
- пептические язвы желудка
- хронический атрофический гастрит или длительное воспаление желудка, при котором слизистая оболочка желудка истончается
- злокачественная анемия , который может развиться из-за дефицита витамина B12
- полипы желудка
Определенные генетические состояния увеличивают риск рака желудка, в том числе:
- синдром Ли-Фраумени
- семейный аденоматозный полипоз (FAP)
- синдром Линча
- тип A кровь
Курение
Регулярные и длительные курильщики имеют повышенный риск рака желудка по сравнению с некурящими.
Подробнее о том, как бросить курить.
Семейный анамнез
Наличие близкого родственника, у которого был или был рак желудка, может увеличить риск.
Диета
Люди, которые регулярно едят соленую, маринованную или копченую пищу, имеют более высокий риск развития рака желудка. Высокое потребление красного мяса и очищенных зерен также увеличивает риск рака желудка.
Некоторые продукты содержат вещества, которые могут вызывать рак. Например, сырые растительные масла, какао-бобы, древесные орехи, арахис, инжир и другие сушеные продукты и специи содержат афлатоксины.Некоторые исследования связывают афлатоксины с раком у некоторых животных.
Возраст
Риск развития рака желудка значительно возрастает после 50 лет. По данным Американского онкологического общества, 60% людей, которым поставили диагноз рака желудка, старше 65 лет.
Пол
Мужчины чаще заболевают раком желудка, чем женщины.
Некоторые хирургические процедуры
Операция на желудке или части тела, которая влияет на желудок, например, лечение язвы, может увеличить риск рака желудка спустя годы.
Людям, которые испытывают симптомы и имеют один или несколько из этих факторов риска, следует обратиться к врачу за консультацией.
Полностью предотвратить рак желудка невозможно.
Однако человек может предпринять шаги, чтобы снизить риск развития болезни. К ним относятся следующие.
Диета
Некоторые диетические меры могут помочь снизить риск рака желудка.
Американское онкологическое общество предполагает, что ежедневное употребление не менее двух с половиной стаканов фруктов и овощей может помочь снизить риск.
Они также рекомендуют сократить количество маринованных, соленых и копченых продуктов в рационе. Замена рафинированного зерна на цельнозерновые хлопья, хлеб и макароны и замена красного или обработанного мяса на фасоль, рыбу и птицу также может снизить вероятность развития рака желудка.
Курение
Курение табака может увеличить риск рака, развивающегося в части желудка рядом с пищеводом.
Тем, кто курит, следует обратиться за советом по отказу от курения.Людям, которые еще не курят, следует избегать воздействия табачного дыма.
Прием нестероидных противовоспалительных препаратов (НПВП)
Использование НПВП, таких как аспирин, напроксен или ибупрофен, может снизить риск рака желудка. Однако они несут дополнительные риски, например опасное для жизни внутреннее кровотечение.
Принимайте НПВП только для лечения других заболеваний, таких как артрит. Не принимайте их исключительно для снижения риска рака желудка.
Тестирование на другие заболевания и рак
Поделиться на PinterestЛюдям, в семейном анамнезе которых был рак желудка, может быть полезно генетическое тестирование.
Лица с наследственным синдромом диффузного рака желудка и синдромом Линча имеют резко повышенный риск рака желудка. Признание этого и принятие мер предосторожности после консультации с врачом могут снизить риск.
Люди, чьи близкие родственники болели раком желудка, а также те, кто болел инвазивным лобулярным раком груди в возрасте до 50 лет, могут получить пользу от генетического тестирования.
Если тест показывает изменения в гене CDh2 , врач может порекомендовать удалить желудок до того, как разовьется рак.
Текущее исследование изучает возможные раковые связи хронической инфекции Helicobacter pylori ( H. pylori ) в слизистой оболочке желудка.
Ранние исследования показывают, что лечение инфекции H. pylori антибиотиками может снизить риск рака желудка, хотя необходимы дальнейшие исследования.
Перспективы после постановки диагноза рака желудка в целом плохие.
Относительная 5-летняя выживаемость — это вероятность того, что человек с раком желудка проживет 5 или более лет по сравнению с человеком, у которого нет рака.Это уменьшается по мере того, как рак становится более агрессивным и распространяется за пределы исходной опухоли.
Если человек получает диагностику и лечение до распространения рака желудка, 5-летняя выживаемость составляет 68%. Если рак метастазирует в более глубокие ткани желудка, это сокращается до 31%.
Когда рак желудка достигает отдаленных органов, выживаемость падает до 5%.
Ранняя диагностика — ключ к улучшению прогнозов рака желудка.
Посттромботический синдром — симптомы, лечение, причины, диагноз
Что такое посттромботический синдром?
Посттромботический синдром — наихудшее состояние при тромбозе глубоких вен.Анатомически крошечные клапаны присутствуют в глубоких венах на ногах и помогают контролировать направление кровотока. Любое образование сгустка в глубокой вене ноги может вызвать отек и затруднить кровообращение.
Результатом этого является повреждение клапанов. Повреждение клапанов вызывает утечку и скопление жидкости вокруг лодыжки. Задержка отверждения или неправильно заживший сгусток также может вызвать нарушение кровообращения в ноге. Боль, воспаление, покраснение в ноге постепенно переходят в образование язвы на пораженной ноге на поздней стадии посттромботического синдрома, которую трудно лечить 1,2,3 .
Симптомы
Симптомы посттромботического синдрома (ПТС) возникают на ногах, и клинические проявления включают хроническую боль в ногах, воспаление, частую утомляемость мышц ног, чувство тяжести, пятна на коже ног из-за гиперпигментации, отеков и подкожных тканей. фиброз пораженной нижней конечности.
Если состояние становится тяжелым, может развиваться венозная хромота и венозные язвы ног. Оба эти условия могут значительно ограничить передвижение пострадавшего и ограничить работоспособность, что в конечном итоге ухудшает качество жизни пациентов.Доказательства также подтверждают, что степень снижения качества жизни при хроническом посттромботическом синдроме может быть сопоставима с другими хроническими заболеваниями, такими как хроническая обструктивная болезнь легких и артрит 4,5 .
Симптомы посттромботического синдрома можно разделить на две стадии: начальную стадию и продвинутую стадию. В начальной стадии симптомы похожи на тромбоз глубоких вен.
Начальные симптомы
- Спазмы в ногах
- Зуд в ногах
- Продолжительное стояние или ходьба приводит к более сильной боли в ногах, боли и воспалению.Отдых и подъем ноги помогают избавиться от этих симптомов.
- Сухость кожи ног
- Неспецифическое беспокойство пораженной нижней конечности
Расширенные симптомы
- Хроническое воспаление пораженной ноги
- Хроническая боль в ноге
- Кожа на пораженной нижней конечности стала блестящей
- Усталость, тяжесть и спазмы ноги
- Диффузная ноющая
- Ощущение покалывания
- Снижение способности голени
- Посттромботическая пигментация приводит к появлению пигментных темных пятен на коже ног
- На пальцах или стопе пораженной ноги появляется синюшное изменение цвета
- Экзема
- Кожа голени затвердевает
- Образование варикозного расширения вен
- Образование язвы на коже голени
Всегда желательно, чтобы при появлении любого симптома лучше обсудить с врачом, который может диагностировать возможность посттромботического Развитие синдрома по симптоматическому анализу 3 .
Факторы риска
Результаты исследования подтвердили, что от 20 до 50% пациентов имеют посттромботический синдром (ПТС) после развития начального эпизода тромбоза глубоких вен нижних конечностей (ТГВ) 7 . Некоторые люди имеют более высокую вероятность развития посттромботического синдрома (ПТС) при следующих условиях:
- Образование сгустка над коленом, клинически это состояние называется проксимальным тромбозом глубоких вен.
- Неоднократное образование нескольких сгустков крови в одной ноге
- Симптомы сгустка крови сохраняются более одного месяца
- Лица с ожирением
- Разжижающие кровь лекарства не могут контролировать уровни разжижителей крови после продолжения приема лекарства в течение 3 месяцев 3 .
Диагностика
Специальных диагностических тестов для PTS нет. Первичный диагностический инструмент для диагностики посттромботического синдрома — это анатомические и / или физиологические данные.
Анатомо-физиологические результаты
Подробный анамнез с симптоматическим анализом и / или физическими данными являются основными инструментами исследования посттромботического синдрома. Все эти данные указывают на то, что дуплексное ультразвуковое исследование требует выполнения для выявления закупорки подвздошной вены и / или дефицита поверхностного клапана в большой подкожной вене (БПВ) и / или малой подкожной вене (SSV).
Симптоматический анализ обычно указывает на следующие симптомы для выявления закупорки подвздошной вены
- Воспаление и боль в бедре и голени пораженной конечности и постепенно распространяется на всю конечность, что является характерной чертой раннего возникновения ТГВ
- Одновременно эти симптомы продолжаются регулярно и указывают на симптомы ПИН. При физикальном обследовании подробно описаны симптомы PTS
- Преобладание венозной хромоты
- Предыдущий случай с зарегистрированным результатом визуализации показал образование тромбоза в общей бедренной вене и / или подвздошной вене
- Ультразвуковое исследование показало признаки неполной сжимаемой общей бедренной вены
- Отсутствие фазичности доплеровской формы волны общей бедренной вены по сравнению с контрлатеральной общей бедренной веной 5
Лабораторный тест
Ультразвуковая оценка
Ультразвуковая оценка бедренной вены и глубокой бедренной вены 5 .
Лечение
Существуют различные подходы к лечению пациентов с посттромботическим синдромом. Ниже приведены некоторые
Фармакологические средства
Традиционно антикоагулянтная терапия назначается при ТГВ и начальной стадии ПТС. Но в настоящее время антикоагулянтная терапия назначается нечасто, поскольку посттравматический синдром часто повторяется.
Пациенты с венозными изъязвлениями ног обычно лечат неселективными ингибиторами фосфодиэстеразы (пентоксифиллин) и ингибиторами агрегации тромбоцитов (рутозидами).В качестве альтернативы можно также назначить сулодексид в комбинации с рутозидами. Для местного ухода за раной сулодексид вводят внутримышечно в начале терапии, а затем перорально.
Компрессионная терапия
Эластичные компрессионные чулки могут контролировать симптомы посттравматического стресса от легкой до умеренной, а также снижать риск прогрессирования посттравматического стресса, но могут оказаться неэффективными при лечении тяжелых симптомов посттравматического стресса.
Прерывистая пневматическая компрессия (IPC) — это новый подход к компрессионной терапии для лечения пациентов с повышенным венозным давлением, страдающих ПИН.IPC может эффективно контролировать тяжелый отек ног и / или венозные язвы ног. Но IPC дороже, чем другие компрессионные методы лечения, такие как ношение чулок, и также вызывает неудобства, поскольку терапия требует, чтобы сцеживание продолжалось более нескольких часов в день.
Еще одним новым подходом к компрессии является загрузочное устройство сжатия с питанием от батареи, то есть VenoWave. Это устройство легкое и портативное. Применение этого устройства дает хороший прогноз.
ЛФК
Пациенты с легким и умеренным поражением, страдающие ПТС, могут получить пользу от лечебной физкультуры.
Уход за ранами
Для лечения венозных язв ног доступны различные медицинские продукты, такие как местные антибиотики, эксфолианты, мази, компрессионные обертывания и факторы роста. В зависимости от состояния пациента и характера симптомов врач прописывает эти препараты 5 .
Ссылки
- Ашрани А.А., Хейт Дж. Заболеваемость и стоимость посттромботического синдрома. J Тромб Тромболизис. 2009; 28: 465–476.
- Кан SR.Как я лечу посттромботический синдром. Кровь. 2009; 114: 4624–4631.
- Сара Р. Васкес, Сьюзан Р. Кан; Посттромботический синдром; DOI https://doi.org/10.1161/CIRCULATIONAHA.109.925651; Тираж. 2010; 121: e217-e219; Первоначально опубликовано 1 марта 2010 г .; Доступно в Интернете по адресу http://circ.ahajournals.org/content/121/8/e217
- Кан С. Р. Посттромботический синдром. Thromb Res. 2011; 127 03: S89 – S92
- Лина Наяк, Суреш Ведантам, Многостороннее лечение посттромботического синдрома; Semin Intervent Radiol.2012 Март; 29 (1): 16–22 .; DOI: 10.1055 / s-0032-1302447; Доступно в Интернете по адресу https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3348767/
- Посттромботический синдром; Национальный альянс по сгустку крови; Доступно в Интернете по адресу https://www.stoptheclot.org/postthrombotic-syndrome.htm
- Кан С. Р., Шриер И., Джулиан Дж. А. и др. Детерминанты и динамика посттромботического синдрома после острого тромбоза глубоких вен. Ann Intern Med. 2008; 149 (10): 698–707
Синдром торакального выхода | Johns Hopkins Medicine
Грудной выход — это кольцо, образованное верхними ребрами, чуть ниже ключицы.Синдром грудного выхода (TOS) возникает, когда нервы или кровеносные сосуды сжимаются ребром, ключицей или мышцами шеи в верхней части выходного отверстия.
Какие типы синдрома грудной апертуры?
Нейрогенный TOS возникает, когда нервы, идущие от шеи к руке (плечевое сплетение), сдавлены. Более 90 процентов случаев являются нейрогенными.
Венозный TOS возникает, когда вена сдавливается, что приводит к тромбозу верхней части тела.Пять процентов случаев венозные.
Артериальный TOS возникает, когда артерия сдавливается. Только около 1 процента случаев являются артериальными.
Иногда венозный и артериальный синдромы вместе известны как сосудистый торакальный синдром выхода.
Каковы симптомы синдрома грудной апертуры?
Симптомы синдрома грудного выхода зависят от типа TOS.
Симптомы нейрогенного синдрома грудного выхода
Боль или слабость в плече и руке
Покалывание или дискомфорт в пальцах
Рука, которая быстро утомляет
Атрофия — сокращение и слабость подушечки большого пальца, мышцы ладони, ведущей к большому пальцу; это довольно редко
Симптомы могут появляться и исчезать, но они часто ухудшаются, когда руки подняты вверх.Чем дольше руки остаются поднятыми, тем хуже могут быть симптомы.
Симптомы синдрома венозного торакального выхода
Отек (припухлость) руки, кисти или пальцев
Синяя кисть и кисть
Болезненное покалывание в руке и руке
Очень выступающие вены на плече, шее и руках
Эти симптомы возникают из-за того, что сдавление вены может вызвать образование тромбов.Это известно как тромбоз усилия , или синдром Педжета-Шреттера. Тромбоз усилия — это разновидность тромбоза глубоких вен. В этом случае сгустки образуются в результате движений (усилий) над головой, сдавливающих вену.
Тромбоз глубоких вен чаще встречается на ногах. Когда это происходит в плечах или руках, причиной является недавняя операция, инородный объект, вставленный в верхнюю часть тела, например, центральную линию, кардиостимулятор или имплантируемый кардиовертер-дефибриллятор, или синдром грудной апертуры.
Симптомы синдрома артериального выхода грудной клетки
Холодная и бледная рука
Боль в руке и руке, особенно при движении руки над головой
Эмболия (закупорка) артерии кисти или руки
Аневризма подключичной артерии
Что вызывает синдром торакального выхода?
Иногда врожденная аномалия (от рождения) может вызвать синдром грудной апертуры, но более вероятно, что это произойдет после травмы или бодибилдинга.В частности:
Шейное ребро: Шейное ребро — это дополнительное ребро, которое растет из шейного отдела позвоночника — шейной части позвоночника. От 1 до 3 процентов населения имеет шейное ребро, которое может расти с одной или обеих сторон и может доходить до первого ребра или может быть не полностью сформировано. Наличие шейного ребра увеличивает вероятность сдавления нерва или кровеносного сосуда между ребром или его мышцами и связками, разделяющими это небольшое пространство.У небольшого процента людей с шейным ребром развивается синдром грудной апертуры. Многие люди с шейным ребром никогда не узнают об этом, потому что кость часто бывает крошечной и не замечается даже на рентгеновских снимках.
Аномальная мышца или образование первого ребра: У некоторых людей может быть лишняя или аномальная лестничная мышца (внутренняя мышца шеи) или аномальное первое ребро или ключица (ключица). Любое из этих аномальных образований может сдавливать кровеносные сосуды или нервы.
Следующие события могут вызвать синдром грудной апертуры, особенно у людей с вышеуказанными аномалиями костей или мышц шеи:
Whiplash : Симптомы рук и кистей, сохраняющиеся долгое время после хлыстовой травмы, могут быть признаком синдрома грудной апертуры.
Бодибилдинг: Накопленные мышцы шеи могут стать слишком большими и сдавливать нервы или подключичные сосуды.
Повторяющиеся движения над головой: У людей, которые занимаются плаванием, бейсболом или рисованием, или которые работают парикмахерами, автомеханиками или занимаются другой работой, требующей поднятия рук, может развиться синдром грудного выхода.
Прибавка в весе: Как и в случае с дополнительной мышечной массой, лишний жир на шее может сдавливать нервы или подключичные сосуды.
Опухоль шеи: В редких случаях причиной компрессии может быть опухоль.
Как диагностируется синдром грудной апертуры?
Синдром грудного выхода иногда считается спорным, поскольку симптомы могут быть нечеткими и похожими на другие состояния.Важно, чтобы его обследовал специалист, который может различать различные типы синдрома грудной апертуры и исключать другие состояния.
Оценка начинается с большинства или всех из следующих критериев:
Полная история болезни и анализ симптомов
Физические маневры (движения), вызывающие симптомы
Оцените анамнез, чтобы исключить связанные с нервом состояния, такие как синдром запястного канала, синдром кубитального канала, заболевание шейного отдела позвоночника или другие типы защемления нерва, которые имеют схожие симптомы и могут быть приняты за синдром грудного выхода.Иногда для их исключения необходимы такие тесты, как исследования нервной проводимости или МРТ шейного отдела позвоночника.
Другие часто назначаемые тесты, помогающие в диагностике:
Дуплексное ультразвуковое исследование для проверки стеноза (сужения) или окклюзии (закупорки) кровеносных сосудов
Рентген грудной клетки для проверки шейного ребра или аномалии первого ребра
При подозрении на нейрогенный синдром выхода из грудной клетки:
Как лечится синдром торакального выхода?
Лечение зависит от того, является ли синдром торакального выхода нейрогенным или сосудистым.
Лечение нейрогенного синдрома грудного выхода
Физическая терапия обычно является первым лечением.
Инъекции ботулотоксина иногда эффективны, когда физиотерапия не полностью снимает симптомы.
Если симптомы не исчезнут после физиотерапии и инъекций, может быть рекомендовано хирургическое вмешательство. Хирургия может включать разрезание мелких мышц шеи (передняя и средняя лестничная клетка) и удаление шейного или первого ребра.
Рецидив: Иногда неврогенный синдром TOS рецидивирует через месяцы или годы после лечения. Это может произойти из-за рубцовой ткани на месте операции или из-за ошибочного диагноза.
Лечение синдрома венозно-грудного выхода
Хирургия обычно рекомендуется для венозного TOS. Это может включать удаление лестничной и подключичной мышц, а также первого ребра.
Лечению подлежит и сама вена.Сгустки крови часто образуются вокруг поврежденной внутренней поверхности сдавленной вены. Лечебные процедуры включают:
Лекарство: Разжижители крови для лечения тромбов
Тромболизис: Процедура по удалению сгустка из вены, обычно проводится перед операцией TOS
Резекция после ребер венограмма : Процедура, проводимая через две или три недели после операции TOS для проверки любых оставшихся повреждений вены; вену обычно можно лечить с помощью баллонной ангиопластики, при которой баллон используется для расширения суженной вены.
Лечение синдрома артериального выхода грудной клетки
Хирургия обычно рекомендуется при TOS на артериях. Это может включать удаление лестничных мышц шеи, шейного ребра, если оно есть, и первого ребра. Другие методы лечения включают:
Двустороннее лечение
Иногда синдром грудной апертуры бывает двусторонний — это означает, что он возникает с обеих сторон. Людям, у которых с одной стороны диагностирован синдром TOS, следует проверить другую сторону, но их не следует лечить, если у них не проявляются определенные признаки или симптомы.
.

