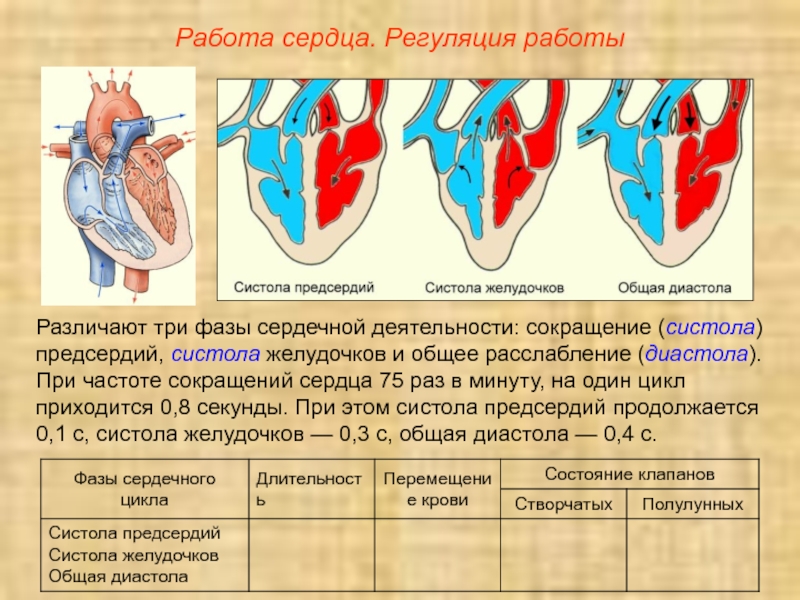
Сердечно-сосудистая хирургия (В.И. Бураковский) — часть 66
лией развития и различной локализацией его верхуш
ки целесообразно объединить в одну группу.
В процессе обследования больных с аномалиями
расположения сердца необходимо решить две задачи:
определить тип аномалии и диагностировать порок.
Каждый тип аномального расположения сердца имеет
свои анатомо-топографические особенности и типич
ные диагностические признаки.
2.5.23.1. Правосформированное
праворасположенное сердце
Для обозначения в литературе часто употребляются
следующие термины: декстроверсия, изолированная
декстрокардия.
Правосформированное праворасположенное сердце
встречается у 54% больных с правосторонним распо
ложением сердца [Подзолков В. П. и др., 1974J.
Анатомия. При правосформированном правораспо-
ложенном сердце продольная его ось ротирована
вправо и образует угол от 30° до 45° с сагиттальной
осью грудной клетки в горизонтальной плоскости.
Ротация оказывает влияние преимущественно на рас
положение желудочков, что R. Grant (1958) сравнивал
с «переворачиванием страницы книги».
Полые вены и правое предсердие располагаются
справа, но медиальнее, чем в норме. Правое предсер
дие через трехстворчатый клапан сообщается с пра
вым желудочком. Последний расположен кпереди от
правого предсердия и поэтому его приточный отдел
направлен вперед, вправо и вниз, тогда как выходной
отдел — назад, влево и вверх. Левое предсердие, нор
мально соединяясь с легочными венами, находится
слегка кпереди, чем правое, и посредством митрально
го клапана сообщается с левым желудочком, который
лежит справа и кпереди от левого предсердия. Правый
желудочек располагается справа, выше и несколько
кзади от левого желудочка. Несмотря на заднюю
локализацию правого желудочка, его выводной отдел
расположен кпереди и вверху, тогда как выход из
левого желудочка находится несколько сзади и ниже.
Магистральные сосуды отходят от соответствующих
желудочков, но вследствие ротации вправо увеличива
ется окно между восходящей и нисходящей частями
аорты. Ствол легочной артерии расположен медиаль
нее, чем обычно, и кпереди от аорты. Последняя
проходит над левым главным бронхом. Дуга аорты
чаще расположена слева, верхушка сердца—справа от
грудины, она направлена вперед и вниз (рис. 2.240).
Расположение других органов грудной клетки и
топография органов брюшной полости в пределах
физиологической нормы. В ряде случаев могут наблю
даться признаки висцеральной симметрии.
У 90—98% больных с правосформированным право-
расположенным сердцем встречаются ВПС
[Schmidt J., Korth С, 1954; Grant R., 1958], которые у
96,7% из них носят множественный характер [Буха
рин В. А., Подзолков В. П., 1979]. Чаще всего встре
чаются корригированная ТМС с ДМЖП и стенозом
легочной артерии, сочетание ДМПП с аномальным
дренажем легочных вен, ДМЖП, синдром гипоплазии
правого желудочка сердца, ЕЖС, атрезия легочной
артерии, тетрада Фалло, ОАП и др.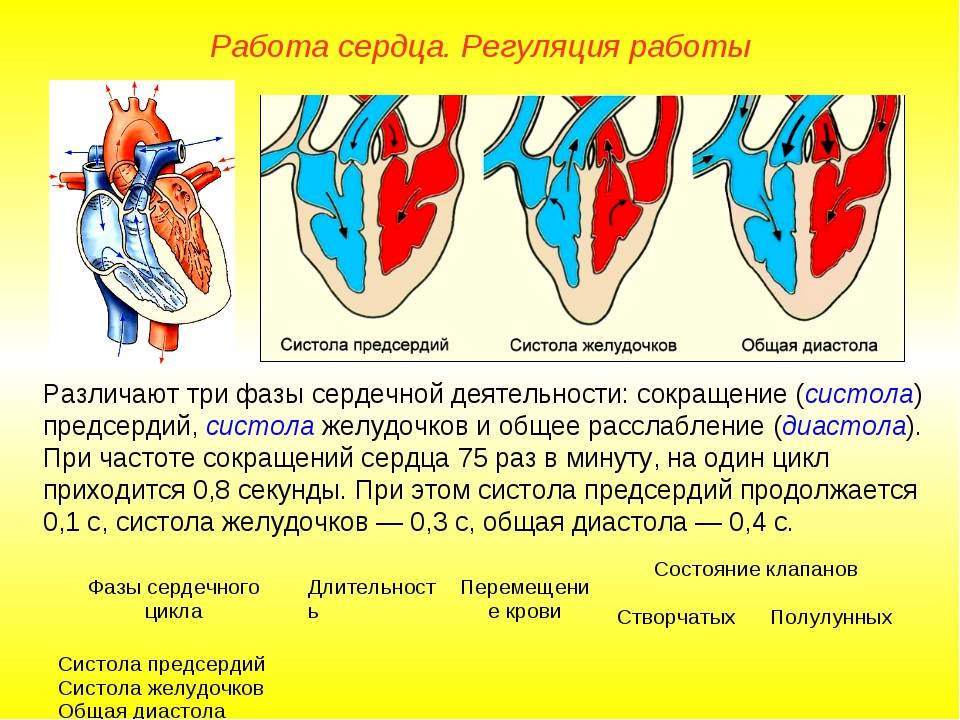
2.240. Схематическое изображение анатомических струк
тур при правосформированном праворасположенном сердце.
1 — верхняя полая вена; 2—нижняя полая вена; 3—легочные
вены; 4 — правое предсердие; 5—левое предсердие; 6 — пра
вый желудочек; 7—левый желудочек; 8—легочный ствол;
9—аорта; 10—печень; II — желудок.
Гемодинамика. Гемодинамические нарушения отме
чаются в тех случаях, когда правосформированному
праворасположенному сердцу сопутствуют ВПС.
Клиника и диагностика. При клиническом обследо
вании больных можно заподозрить наличие правос-
формированного праворасположенного сердца в том
случае, если верхушечный толчок и сердечная тупость
определяются справа от грудины, а органы брюшной
полости расположены нормально, т. е. печеночная
тупость определяется справа, а желудочный тимпа
нит— слева. При существовании ВПС клиническая
При существовании ВПС клиническая
картина определяется характером патологии сердечно
сосудистой системы и степенью гемодинамических
расстройств.
Электрокардиографическая картина характеризует
ся положительным зубцом Р в I стандартном отведе
нии, что объясняется нормальным распространением
предсердной деполяризации благодаря нормальному
расположению предсердий (рис. 2.241). Положитель
ный зубец Р наблюдается также в отведениях aVL и
aVF, левых грудных и большинстве правых грудных
отведений, отрицательный — в отведении aVR.
Вольтаж комплексов QRS прогрессивно увеличива
ется в грудных отведениях от VeR до V i_2 и далее
снижается к V
6
, указывая на правостороннее располо
жение сердца.
Переходная зона смещается вправо, ее потенциалы
регистрируются в отведениях V
3
R — V i.
При рентгеноскопии выявляется тень сердца, рас
положенная преимущественно в правой половине груд
ной клетки, тогда как тень печени и газовый пузырь
267
2. 241. Электрокардиограмма больного с правосформирован-
241. Электрокардиограмма больного с правосформирован-
ным праворасположенным сердцем и тетрадой Фалло.
Электрическая ось сердца отклонена вправо; признаки
гипертрофии правых отделов сердца.
2.242. Рентгенограмма грудной клетки больной с правос-
формированным праворасположенным сердцем (переднезад-
няя проекция).
Тень сердца определяется в правой половине грудной клет
ки, тень печени и газовый пузырь желудка в пределах
нормы.
желудка определяются в обычных местах (рис. 2.242).
Верхушка сердца ориентирована вправо. В противопо
ложность нормальной картине отмечается более
низкое расположение правого купола диафрагмы, чем
левого.
Катетеризация сердца и ангиокардиография позво
ляют уточнить правостороннее расположение полых
вен и правого предсердия (рис. 2.243). Правое предсер
дие, за исключением верхнелатеральной части, почти
полностью прикрывается тенью контрастированного
правого желудочка. При поступлении контрастного
При поступлении контрастного
вещества в левые отделы сердца определяется левое
предсердие, образующее левый латеральный край
сердца и левый желудочек, смещенный вниз и вправо.
Верхушка сердца находится справа от средней линии
тела и часто образована правым желудочком. В
боковой проекции тени контрастированных желудоч
ков часто накладываются друг на друга. Магистраль
ные сосуды отходят от соответствующих желудочков,
дуга аорты—слева.
Хирургическое лечение. Операция предпринимается
по поводу сопутствующих ВПС. Выбор того или
иного радикального или паллиативного метода лече
ния, как и в обычных условиях, определяется анато-
мо-гемодинамическим вариантом порока. Аномалия
расположения сердца обязывает индивидуально ре
шать вопрос об операционном доступе.
2.5.23.2. Правосформированное срединно-
расположенное сердце
Синонимами для обозначения данной аномалии явля
ются «мезокардия», «мезоверсия».
Правосформированное срединно-расположенное
сердце составляет 9% от числа всех аномалий распо
ложения сердца [Бухарин В. А., Подзолков В. П.,
1979].
Анатомия. В отличие от правосформированного
праворасположенного сердца ротация вправо в данных
условиях менее выражена и продольная ось сердца
вместе с межжелудочковой перегородкой располагает
ся по среднесагиттальной оси грудной клетки, в
результате чего сердце занимает срединное положение
(рис. 2.244).
Среди сопутствующих ВПС чаще всего встречаются
тетрада Фалло, ДМЖП, ОАВК, корригированная
ТМС. В связи с тем что развивающийся дивертикул
левого желудочка в процессе эмбриогенеза оказывает
фиксирующее влияние на верхушку сердца, затрудняя
ее движение справа налево, правосформированное
срединно-расположенное сердце может считаться спе
цифическим компонентом данного порока.
Клиника и диагностика. Смещение сердечной тупо
Смещение сердечной тупо
сти вправо обычно расценивается как увеличение
правых отделов сердца, а верхушечный толчок, паль
пируемый в подложечной области, может ошибочно
приниматься за пульсацию гипертрофированного пра
вого желудочка. При перкуссии печеночная тупость и
желудочковый тимпанит определяются в обычных
местах.
Электрокардиографическая картина характеризу
ется положительным зубцом Р в I стандартном
отведении, aVF и отрицательным в отведении aVR
(рис. 2.245).
При рентгенологическом исследовании в передне-
задней проекции выявляется тень сердца, занимающая
срединное положение и имеющая шаровидную форму
в виде дождевой капли (рис. 2.246). При повороте
268
Anomalies1 — Стр 7
диаметре, но в редких случаях расширяется до значительных размеров.
Иногда крупная аневризма вызывает стеноз выходного отдела правого желудочка. Такие аневризмы могут разорваться, и тогда возникает сброс крови слева направо.
Такие аневризмы могут разорваться, и тогда возникает сброс крови слева направо.
Дефект межжелудочковой перегородки – в большинстве случа-
ев является составной частью сложных пороков. Частота наблюдения дефектов межжелудочковой перегородки колеблется от 12,1 до 39,4%. Размеры дефекта составляют от 1 до 30 мм и более. Дефект имеет раз- личную форму (круглый, эллипсовидный), края его мягкие или фиброз- но изменены, на них можно встретить вегетации при осложнении бакте- риальным эндокардитом. Изолированные дефекты межжелудочковой перегородки обычно разделяются, в зависимости от их локализации, в мышечной или мембранозной части перегородки. Кроме того, различа- ют следующие группы дефектов:
Группа А: полное отсутствие перегородки, ее передней и задней частей – так называемый единый желудочек.
Группа В: дефект в задней части межжелудочковой перегородки;
дефект частично прикрыт септальной створкой трехстворчатого клапана и сухожильными нитями.
Группа С: дефект в передней части межжелудочковой перегород- ки. Полное отсутствие передней части часто называют высоким дефектом.
Полное отсутствие передней части часто называют высоким дефектом.
Может сочетаться с дефектом межпредсердной перегородки (20%), с открытым артериальным протоком (20%), коарктацией аорты (12%), врожденной недостаточностью митрального клапана (2%), с врожденным стенозом аорты (5%), стенозом легочного ствола, право- сторонней дугой аорты, аномальным дренажем легочных вен. Среди изолированных дефектов выделяют:
А) Дефект межжелудочковой перегородки высокий – дефект разной величины, локализованный в задне-верхнем отделе мембраноз- ной части перегородки. Чаще всего (до 85% случаев) дефект располага- ется в перепончатой части межжелудочковой перегородки в виде щели, овального или круглого отверстия диаметром 0,5–1,5 см под клапаном аорты, реже – под клапаном легочного ствола.
Б) Дефект межжелудочковой перегородки низкий (син.: Толо-
чинова – Roger синдром, morbus Roger) – небольшой (до 1 см) дефект в мышечной части межжелудочковой перегородки. Клинически – грубый систолический шум в IV межреберье слева от грудины, определяемый во всех точках, а также на спине; приподнятый сильный толчок верхуш- ки сердца, сильно пульсирующие артерии шеи.
Дефект межпредсердной перегородки – один из наиболее часто встречающихся пороков сердца (7–25% всех врожденных пороков серд- ца и до 45% как компонент более сложных пороков), при котором име- ется сообщение правого предсердия с левым через отверстие в меж-
Впервые в ГБ №4 проведена аортография ребенку
Опубликовано .
2-х месячный ребенок был доставлен в больницу №4 из реанимационного отделения детской больницы №9. Мальчик родился со сложнейшей патологией, включающей атрезию легочной артерии с дефектом межжелудочковой перегородки, леворасположенное правосформированное сердце, атриовентрикулярную дискордантность, дефекты межпредсердной перегородки с полным отсутствием межпредсердной перегородки (единое предсердие).
В первые же дни жизни в Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева РАМН ему была проведена операция наложения системно-легочного анастамоза слева и перевязка открытого артериального протока. Все это стало первым этапом в лечении, благодаря которому ребенок смог адаптироваться к жизни и набирать массу тела.
Все это стало первым этапом в лечении, благодаря которому ребенок смог адаптироваться к жизни и набирать массу тела.
В результате резкого ухудшения состояния мальчик был доставлен в реанимационное отделение детской больницы, а затем для проведения аортографии – в больницу №4 с подозрением на тромбоз подключично-легочного шунта.
– Аортография с контрастированием левой подключичной артерии и подключично-легочного шунта была проведена через небольшой прокол в бедренной артерии. Благодаря исследованию, проведенному под рентген-контролем, мы смогли убедиться, что шунт функционирует и жизни ребенка ничего не угрожает, — рассказал сердечно-сосудистый хирург отделения рентгенхирургических методов диагностики и лечения больницы №4 Эдвард Карташян.
Подобное исследование на базе больницы №4 ребенку проводилось впервые, но стоит добавить, что этот диагностический метод для специалистов не был новым.. Доктор Эдвард Карташян, ранее трудившийся в НИИ комплексных проблем сердечно-сосудистых заболеваний (г. Кемерово) имеет 12-летний опыт работы сердечно-сосудистым хирургом. По долгу службы ему приходилось оказывать помощь как взрослым пациентам, так и детям.
Кемерово) имеет 12-летний опыт работы сердечно-сосудистым хирургом. По долгу службы ему приходилось оказывать помощь как взрослым пациентам, так и детям.
— Работать с детьми, безусловно, сложнее, так как у такого маленького пациента, при массе тела в 4,5 килограмма сердце в диаметре едва достигает 6 сантиметров, а толщина сосудов составляет 1 миллиметр, — отметил сердечно-сосудистый хирург Эдвард Карташян.
Стоит добавить, что с открытием в больнице отделения рентгенхирургических методов диагностики и лечения у хирургов появилась возможность выполнять эндоваскулярные диагностические и лечебные манипуляции и операции любой сложности. Выполнение такой в буквальном смысле ювелирной работы стало возможным благодаря не только высокому профессионализму врачей, но и необходимому современному оборудованию, которым оснащена больница.
После стабилизации состояния ребенок был перемещен в реанимацию больницы №9. Впереди у него подготовка к следующему этапу лечения в Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева.
А.Н.Бакулева.
КСТАТИ
По данным НЦССХ им. А.Н. Бакулева, частота атрезии легочной артерии в сочетании с дефектом межжелудочковой перегородки составляет около 0,07 на 1000 новорожденных. Анатомическое нарушение состоит в том, что легочная артерия не отходит от правого желудочка. Выход закрыт, а кровь, попадающая в него, должна идти назад в предсердие, а уже оттуда, через овальное окно — в большой круг, и через открытый артериальный проток — в легкие. В результате сердце переполнено кровью, а легочный кровоток и, соответственно, насыщение крови кислородом, резко уменьшены. Такойпорок совместим с жизнью только в течение нескольких дней.За десять лет (в период с 2003 по 2013 год) с подобным диагнозом в Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева было пролечено 84 ребенка.
двойного отхождения сосудов от правого желудочка
В отдел Телемедицины НЦССХ им. А.Н. Бакулева для уточнения диагноза и определения плана дальнейшего лечения поступила выписка на ребёнка восьми лет из Смоленска с направительным диагнозом:
Врождённый порок сердца (ВПС), комбинированный: двойное отхождение магистральных сосудов от правого желудочка, дефект межжелудочковой перегородки, дефект межпредсердной перегородки (ДОС ПЖ, ДМЖП, ДМПП), декстрокардия, состояние после операции суживания лёгочной артерии (в возрасте одного года), НК 2а-б степени. Гетеротопический синдром: аспления, леворасположенная печень, декстракардия. Внутренняя гидроцефалия, стадия субкомпенсации.
Гетеротопический синдром: аспления, леворасположенная печень, декстракардия. Внутренняя гидроцефалия, стадия субкомпенсации.
Обследование по месту жительства
Мальчик родился от первой беременности, протекавшей с фетоплацентарной недостаточностью, от первых срочных родов на 40 неделе. Масса тела при рождении составила 3310 г, длина — 53 см. На седьмой день жизни ребёнок был переведён в отделение патологи новорожденных в тяжелом состоянии в связи с врождённой сердечной патологией, неврологической симптоматикой и неонатальной желтухой. Выставлен диагноз:
ВПС (декстракардия, ДМЖП, ДМПП, ОАП).
Пациент получал лечение препаратами, затем был выписан под наблюдение кардиохирурга.
В возрасте одного года ребёнку была выполнена операция:
Суживание лёгочной артерии.
После чего ребёнок наблюдался в центре кардиологии и кардиохирургии (Киев).
В дальнейшем была запланирована поэтапная коррекция порока. Но по причинам организационного характера последующие этапы хирургического лечения не состоялись.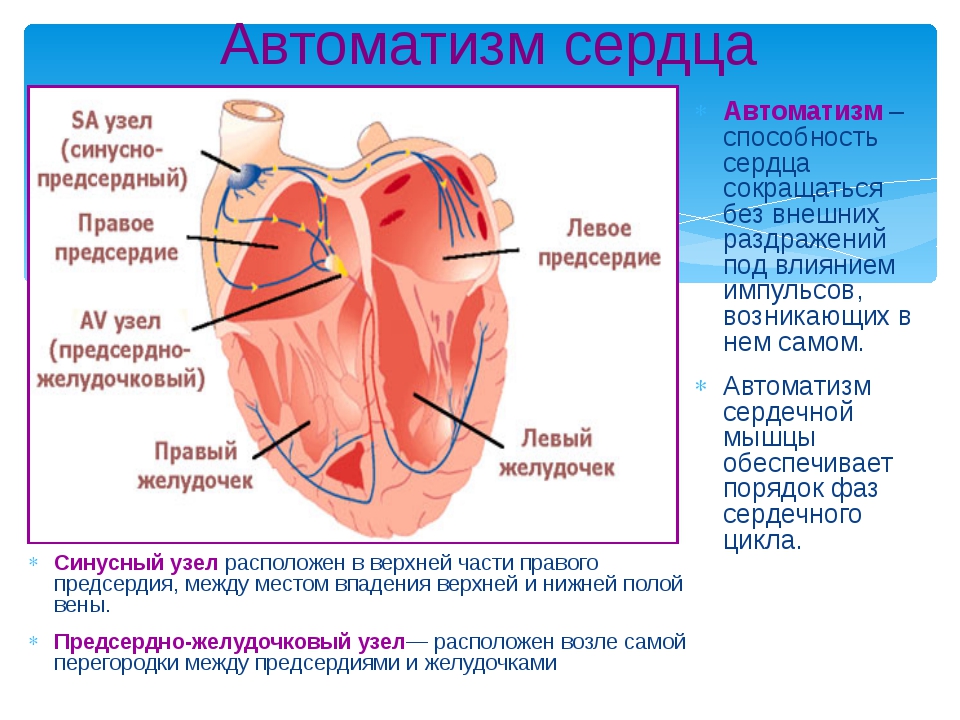 К моменту консультации ребёнок проживал в лагере беженцев (Смоленска).
К моменту консультации ребёнок проживал в лагере беженцев (Смоленска).
Результаты исследований
Из объективного осмотра:
Состояние мальчика тяжёлое, за счёт хронической сердечной недостаточности. Не лихорадит. Частота дыхания (ЧД) 26-28 в минуту, частота сердечных сокращений (ЧСС) 100уд\мин, артериальное давление (АД) 80/50 мм.рт.ст., насыщение крови О2 — 79-81%.
Мальчик низкого роста, пониженного питания. Отмечается деформация грудной клетки (грудина западает, послеоперационный рубец, реберные дуги приподняты вверх), деформация пальцев по типу «барабанных палочек», ногтей — по типу «часовых стекол». Подкожно-жировая клетчатка практически отсутствует. Лимфатические узлы не увеличены. Кожные покровы чистые, бледные, расширена венозная сеть в области груди, живота, верхних и нижних конечностей. Отмечается акроцианоз. Слизистые влажные, цианотичные. В зеве без признаков воспаления. Перкуторно над лёгкими лёгочный звук с коробочным оттенком. Дыхание в лёгких жесткое, хрипов нет. Границы сердца смещены, т.к. оно расположено справа. Тоны сердца звучные ритмичные; систолический шум грубый, «машинного тембра», над всей областью сердца, проводящийся на спину и в подмышечную область. Живот мягкий, безболезненный при пальпации, печень слева, не увеличена. Селезёнка отсутствует. Отёков нет. Стул и мочеиспускание не нарушены.
Дыхание в лёгких жесткое, хрипов нет. Границы сердца смещены, т.к. оно расположено справа. Тоны сердца звучные ритмичные; систолический шум грубый, «машинного тембра», над всей областью сердца, проводящийся на спину и в подмышечную область. Живот мягкий, безболезненный при пальпации, печень слева, не увеличена. Селезёнка отсутствует. Отёков нет. Стул и мочеиспускание не нарушены.
Инструментальные исследования
Электрокардиография (ЭКГ): нижнепредсердный эктопический ритм с ЧСС=80 уд\мин. Отклонение электрической оси сердца (ЭОС) вправо. Предсердные нарушения. ЭКГ признаки гипертрофии ПЖ и ПП.
Рис 1 — Результат электрокардиографии
Рис 2 — Результат электрокардиографии
Холтеровское мониторирование ЭКГ: основной ритм предсердный (83,8%), с ЧСС=98 уд\мин, синусовый ритм (6,1%), в среднем 105 уд\мин, эпизоды миграции водителя ритма. Среднесуточная ЧСС=99 уд\мин. Ригидный циркадный профиль сердечного ритма (1,13). Максимальная частота сердечных сокращений — 150 уд\мин (после игры), минимальная ЧСС — 58 уд\мин (сон). Отмечена тенденция к тахикардии в ночные часы. Нельзя исключить преходящий WPW. Патологических пауз не выявлено. Регистрируются частые, одиночные, политопные экстасистолы, всего 1538. Интервал ОТ соответствует нормативному. ST-T без диагностически значимой динамики. Функция разброса снижена, повышена функция концентрации сердечного ритма. Уровень парасимпатических влияний на ритм сердца снижен.
Ригидный циркадный профиль сердечного ритма (1,13). Максимальная частота сердечных сокращений — 150 уд\мин (после игры), минимальная ЧСС — 58 уд\мин (сон). Отмечена тенденция к тахикардии в ночные часы. Нельзя исключить преходящий WPW. Патологических пауз не выявлено. Регистрируются частые, одиночные, политопные экстасистолы, всего 1538. Интервал ОТ соответствует нормативному. ST-T без диагностически значимой динамики. Функция разброса снижена, повышена функция концентрации сердечного ритма. Уровень парасимпатических влияний на ритм сердца снижен.
Ультразвуковое исследование (УЗИ) органов брюшной полости: аномалия расположения печени — гетеротопия (под левой реберной дугой), лабильный перегиб желчного пузыря. Нижняя полая вена не визуализируется, паренхима печени диффузно изменена, почки без эхоструктурных изменений.
Рентгенограмма органов грудной клетки: ВПС, комбинированный, оперированный, декстракардия. Очаговых и инфильтративных теней не видно. Корни лёгких: левый нечётко структурен, правый не виден из-за тени сердца. Лёгочный рисунок избыточный в нижних отделах с обеих сторон. Сердце расположено в правой половине грудной клетки, расширено, увеличено в поперечнике. Сердечно-лёгочный коэффициент — 67%. Контуры диафрагмы чёткие. Синусы свободные. Г азовый пузырь желудка расположен справа.
Корни лёгких: левый нечётко структурен, правый не виден из-за тени сердца. Лёгочный рисунок избыточный в нижних отделах с обеих сторон. Сердце расположено в правой половине грудной клетки, расширено, увеличено в поперечнике. Сердечно-лёгочный коэффициент — 67%. Контуры диафрагмы чёткие. Синусы свободные. Г азовый пузырь желудка расположен справа.
Рис 3 — Рентгенограмма органов грудной клетки
Эхокардиография (ЭхоКГ): Сердце расположено справа. Расширены камеры сердца, больше правые. Гипертрофия миокарда обоих желудочков, перегрузка объёмом правых камер. Аорта и лёгочная артерия смещены в правый желудочек. Верхушка сердца выполнена правым желудочком. Расширен коронарный синус в левом предсердии. ДМЖП подаортальный 17 мм, вторичный ДМПП 12-14мм. Снижена сократительная способность левого желудочка, ФВ — 53%. Расширение аорты в области синусов, кровоток ускорен. Выражена недостаточность трикуспидального клапана. Высокая лёгочная гипертензия, среднее давление в лёгочной артерии — 102,7 мм. рт. ст.
Высокая лёгочная гипертензия, среднее давление в лёгочной артерии — 102,7 мм. рт. ст.
В анализах крови и мочи патологии нет.
|
|
Рис 4,5 — Результаты ЭхоКГ-исследования
Для подтверждения диагноза и определения тактики лечения данные направлены в НЦССХ им. А.Н. Бакулева.
Телемедицинская консультация в Центре Бакулева
Телемедицинская конференция проведена в 8 лет 26 дней жизни ребенка. После разговора с лечащими врачами, изучения результатов исследований принято решение о необходимости госпитализации в НЦССХ для дополнительного обследования и решения вопроса о возможности оперативного лечения.
Поликлиника НЦССХ
Через 14 дней после телемедицинской консультации в поликлинике НЦССХ проведено обследование, по результатам которого поставлен диагноз:
Situs inversus.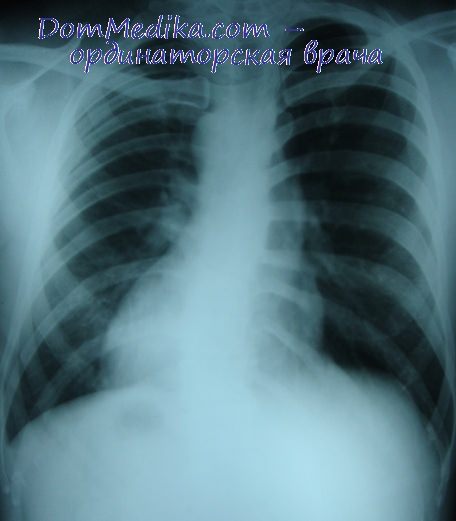 Левосформированное праворасположенное сердце. Двойное отхождение магистральных сосудов от правого желудочка. Дефект межжелудочковой перегородки. Дефект межпредсердной перегородки (вторичный). Состояние после операции суживания лёгочной артерии по Мюллеру. НК 2а-б степени.
Левосформированное праворасположенное сердце. Двойное отхождение магистральных сосудов от правого желудочка. Дефект межжелудочковой перегородки. Дефект межпредсердной перегородки (вторичный). Состояние после операции суживания лёгочной артерии по Мюллеру. НК 2а-б степени.
Ребёнок госпитализирован.
Госпитализация в Центр Бакулева
Ребёнок госпитализирован в возрасте восьми лет в отделение лёгочной гипертензии (ОЛГ).
В стационаре при осмотре:
Общее состояние ребёнка — средней степени тяжести. Рост — 118 см, вес — 17 кг. Площадь поверхности тела: BSA = 0,75, BMI — 15,5.
Развитие подкожной клетчатки резко снижено. Отёков нет. Окраска кожи: цианоз, насыщение по датчику — 68%. Слизистые цианотичные. Лимфатические узлы не увеличены, не спаяны с близлежащими тканями. Симптом «барабанных палочек». Симптом «часовых стёкол». Грудная клетка — диспластическая.
В лёгких ясный лёгочный звук. ЧД — 22 в мин. Дыхание везикулярное, проводится во все отделы, хрипов нет. Сердце расположено справа. ЧСС 94 уд/мин. Систолический шум над всей областью сердца, эпицентр вдоль правого края грудины. Частота пульса 94, удовлетворительного наполнения. Пульсация на верхних и нижних конечностях отчетлива, симметрична. Артериальное давление: на левой руке — 113/58 мм. рт. ст., на правой руке — 110/60 мм. рт. ст. Язык чистый, влажный. Печень расположена слева, не увеличена. Cелезёнка не пальпируется. Стул со слов папы б/о. Мочеполовая система сформирована по мужскому типу. Зрение б/о. Слух б/о. Нервная система без грубой очаговой патологии. Умственное развитие — в соответствии с возрастом.
Сердце расположено справа. ЧСС 94 уд/мин. Систолический шум над всей областью сердца, эпицентр вдоль правого края грудины. Частота пульса 94, удовлетворительного наполнения. Пульсация на верхних и нижних конечностях отчетлива, симметрична. Артериальное давление: на левой руке — 113/58 мм. рт. ст., на правой руке — 110/60 мм. рт. ст. Язык чистый, влажный. Печень расположена слева, не увеличена. Cелезёнка не пальпируется. Стул со слов папы б/о. Мочеполовая система сформирована по мужскому типу. Зрение б/о. Слух б/о. Нервная система без грубой очаговой патологии. Умственное развитие — в соответствии с возрастом.
Инструментальные исследования:
Рентгенография органов грудной клетки:
свежих инфильтративных изменений не выявлено. Избыточный лёгочный рисунок — в нижних отделах с обеих сторон. Сердце расположено в правой половине грудной клетки, расширено, увеличено в поперечнике. Декстрокардия. КТИ — 67%.
ЭКГ: Нижнепредсердный эктопический ритм с ЧСС — 86 уд/мин. Отклонение ЭОС вправо. Признаки перегрузки правых отделов сердца.
Отклонение ЭОС вправо. Признаки перегрузки правых отделов сердца.
ЭхоКГ:
Таблица 1 — Результаты ЭхоКГ исследования при поступлении в отделение
|
ЛП
|
4.2 см
|
КЛА — створки подвижные
|
МК — створки тонкие
| ||
|
ПП
|
увеличен
|
ФК — 15 мм
|
Грманжета 80Hg
|
ФК — 20 мм
|
Регург — 1 +
|
|
КДР ПЖ
|
3,9
|
АК — не изменен
|
ТК — ств тонкие
| ||
|
ФВ
|
60%
|
ФК — 18 мм
|
Регург — 1 +
|
ФК — 28 мм
|
Регург — 2+
|
|
Аорта — диаметр аорты 21 мм, дуга 20 мм, перешеек 12 мм.
| |||||
|
ДМЖП подаортальный 20 мм, ДМПП вторичный 13 мм.
| |||||
ЛП — левое предсердие, КДР — конечный диастолический размер, ФВ — фракция выброса, ПП — правый желудочек, ПЖ — правый желудочек, АК — аортальный клапан, ФК — фиброзное кольцо, КЛА — клапан легочной артерии, МК — митральный клапан, ТК — трикуспидальный клапан, ДМЖП — дефект межжелудочковой перегородки, ДМПП — дефект межпредсердной перегородки.
Ангиокардиография: Неопределенно сформированное право расположенное сердце (левый изомеризм), отхождение аорты и лёгочной артерии от правого желудочка, ДМЖП, умеренная гипоплазия левого желудочка, Л-мальпозиционное расположение аорты и лёгочной артерии, сужение ствола ЛА манжетой, ДМПП, добавочная левосторонняя верхняя полая вена, отсутствует печёночный сегмент нижней полой вены с непарным продолжением, не исключено сужение нижней полой вены в области непарной вены. Небольшая коллатеральная артерия — к правому легкому, нельзя исключить аномальный дренаж левых легочных вен в ПП.
Небольшая коллатеральная артерия — к правому легкому, нельзя исключить аномальный дренаж левых легочных вен в ПП.
На пятый день госпитализации проведена операция:
Наложение правостороннего двунаправленного кава-пульмонального анастомоза (ДКПА), иссечение межпредсердной перегородки в условиях ИК.
Послеоперационный период и выписка
При поступлении в реанимацию состояние мальчика средней степени тяжести. Кардиотоническая поддержка. Искусственная вентиляция лёгких. Послеоперационный период протекал без осложнений. Из реанимации ребёнок переведён на вторые сутки после операции.
Объективный осмотр
Незначительный акроцианоз, отёков нет, лимфатические узлы не увеличены. Дыхание везикулярное, хрипов нет, частота дыхания (ЧД) — 26 в мин. Тоны сердца ритмичные. Выслушивается систолический шум справа от грудины. Частота сердечных сокращений (ЧСС) — 86 уд/мин. Определяется пульсация на верхних и нижних конечностях. АД на левой руке — 100/65 мм. рт. ст. Печень расположена слева, не увеличена. Физиологические отправления в норме. Послеоперационная рана без признаков воспаления.
рт. ст. Печень расположена слева, не увеличена. Физиологические отправления в норме. Послеоперационная рана без признаков воспаления.
Инструментальные исследования
ЭхоКГ: Жидкости в полости перикарда и плевральных полостях нет. ФВ — 58%. Функционирующий двунаправленный кава-пульмональный анастомоз.
ЭКГ: нарушений ритма и проводимости нет.
Рентгенография: лёгкие расправлены. Свободной жидкости в плевральных полостях не выявлено.
На четырнадцатые сутки после операции в удовлетворительном состоянии ребенок выписывается домой.
Рекомендации при выписке
Наблюдение кардиолога по месту жительства, продолжить прием названченных препаратов, отвод от прививок на один год, ограничение физических нагрузок, контроль анализа крови и мочи через семь дней после выписки и контроль в поликлинике НЦССХ через год.
Желательна реабилитация в санатории кардиологического профиля.
Текст описания клинического случая подготовила Макаренко М. В.
В.
Клинический случай сочетания врожденного порока сердца и обратного расположения внутренних органов у подростка
Статья опубликована на с. 113-117
К настоящему времени в литературе накопилось достаточно сведений о различных типах аномального внутригрудного расположения сердца, причем значительный вклад в разработку проблемы внесли работы С.А. Рейнберга, М.Э. Мандельштама, 1927; Б.А. Константинова, Г.И. Астраханцева, 1965; В.П. Подзолкова, 1974; С. Korth, J. Sehmidt, 1953; M. Lev, 1968 [1, 7, 11]. Первые сообщения об аномалии касались правостороннего расположения сердца при обратном расположении всех внутренних органов (Leccius, 1643; Riolan, 1652). Правостороннее расположение сердца как изолированная аномалия, т.е. с нормальным расположением других внутренних органов, было описано значительно позднее (Grunmach E., 1890). Само по себе аномальное расположение сердца не сопровождается расстройствами гемодинамики, и лишь наличие сопутствующего порока сердца приводит пациентов в кардиохирургическую клинику [7, 11].
У 90–98 % больных с правосформированным праворасположенным сердцем встречаются врожденные пороки сердца (ВПС), которые у 96,7 % из них носят множественный характер [2, 6, 11]. Чаще всего сочетается корригированная транспозиция магистральных сосудов (КТМС) с дефектом межжелудочковой перегородки (ДМЖП), клапанным или подклапанным стенозом легочной артерии, дефектом межпредсердной перегородки (ДМПП), аномальным дренажем легочных вен, гипоплазией легочной артерии, открытым артериальным протоком (ОАП) [2, 6]. Корригированная транспозиция магистральных сосудов — это ВПС «бледного» типа, при котором аорта аномально исходит из морфологически правого желудочка, но физиологически артериального, а легочная артерия исходит из морфологически левого желудочка, но физиологически венозного, при этом сохраняется нормальное кровообращение. Возможны несколько вариантов КТМС: КТМС без сопутствующих ВПС и с нормальным расположением сердца; КТМС с сопутствующими ВПС и нормальным расположением сердца; КТМС с сопутствующими ВПС и аномальным расположением сердца [2, 6, 9].
Обследование больных с аномалиями расположения сердца имеет целый ряд особенностей. Основными задачами при этом являются установление типа аномального расположения сердца, раскрытие анатомического содержания сопутствующего порока и характера нарушений гемодинамики, обусловленного пороком. План обследования таких пациентов включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ), рентгенографию органов грудной клетки, эхокардиографию (ЭхоКГ), зондирование полостей сердца и ангиокардиографию. При этом наиболее ценными методами исследования являются ЭхоКГ и ангиокардиография [2, 6].
Обследование больного необходимо проводить последовательно, поскольку, не установив тип аномального положения сердца, трудно дать правильную трактовку проявлений порока. При аномалиях расположения сердца топография сердечных камер изменена, поэтому правильное их распознавание основывается на изучении особенностей анатомического строения их внутренней поверхности. Следует отметить, что каждая камера сердца имеет присущие только ей специфические морфологические признаки, совокупность которых позволяет ее опознать. Однако не всем признакам придается одинаковое диагностическое значение: одни из них играют определяющую роль, другие — лишь вспомогательную [1, 3, 10].
Однако не всем признакам придается одинаковое диагностическое значение: одни из них играют определяющую роль, другие — лишь вспомогательную [1, 3, 10].
Приводимые ниже морфологические особенности предсердий и желудочков даны в порядке степени их важности, причем меткой «х» обозначены признаки, которым придается наибольшее диагностическое значение в распознавании камер.
Правое предсердие (ПП)
1. На перегородочной поверхности определяются лимбус и овальная ямка (х).
2. Впадает нижняя полая вена (НПВ) (х).
3. Впадает коронарный синус (х).
4. Впадает верхняя полая вена (ВПВ).
5. Наблюдается crista terminalis и гребешковые мышцы на латеральной и передней поверхностях.
6. Ушко имеет пирамидальную форму с широким основанием.
Левое предсердие (ЛП)
1. На перегородочной поверхности отмечается дериват первичной перегородки (х).
2. Впадают легочные вены.
3. Отмечается сглаженная внутренняя поверхность.
4. Ушко извилистой формы и узким отверстием открывается в полость ЛП.
Правый желудочек (ПЖ)
1. Характеризуется грубой трабекулярностью внутренней поверхности, особенно в области перегородки (х).
2. Имеется наджелудочковый гребень, разделяющий полость желудочка на приточный и выводной отделы (х).
3. Отделен от предсердия трехстворчатым клапаном.
4. Полулунные клапаны располагаются спереди и высоко.
Левый желудочек (ЛЖ)
1. Характеризуется нежной трабекулярностью, особенно на перегородочной поверхности (х).
2. Отсутствует наджелудочковый гребень (х).
3. Отделен от предсердия двухстворчатым клапаном.
4. Полулунные клапаны располагаются сзади и низко.
По данным ЭКГ, локализация желудочков сердца устанавливается по морфологии комплекса QRS в грудных отведениях; над анатомически ПЖ обычно регистрируются комплексы rS или RS, над анатомически ЛЖ — желудочковые комплексы в виде qRs, qRS или qR [4, 6].
Локализация верхушки сердца устанавливается физикальным (пальпация), рентгенологическим и ангиокардиографическим методами исследования. После сопоставления полученных диагностических признаков становится возможным представить пространственное расположение сердечных камер, магистральных сосудов и определить тип аномального положения сердца. Диагноз сопутствующих пороков сердца ставят уже с учетом типа положения сердца [5, 6].
Независимо от типа аномального положения сердца и вида врожденного порока всем больным показана катетеризация сердца, которую целесообразно производить через большую подкожную вену бедра. Этим уточняется расположение полых вен, ПП, ПЖ, а если удается, то и легочного ствола (ЛС). Катетеризация сердца через вены верхних конечностей является менее ценной для установления типа положения сердца из-за возможности существования добавочной ВПВ, имеющей меньшее значение в опознавании ПП. Однако установление добавочной ВПВ играет важную роль в тактическом отношении при хирургическом вмешательстве. В тех случаях, когда обнаруживают правостороннее положение НПВ и левостороннее — ВПВ, необходима дополнительная катетеризация через вены правой верхней конечности с целью выявления правосторонней ВПВ. При ее определении делают заключение о существовании добавочной левосторонней ВПВ. При ее отсутствии следует помнить, что отток венозной крови от верхней половины тела происходит только по левосторонней ВПВ. При установлении левосторонней НПВ и праволежащей ВПВ необходима катетеризация через вены левой верхней конечности [5, 6].
В тех случаях, когда обнаруживают правостороннее положение НПВ и левостороннее — ВПВ, необходима дополнительная катетеризация через вены правой верхней конечности с целью выявления правосторонней ВПВ. При ее определении делают заключение о существовании добавочной левосторонней ВПВ. При ее отсутствии следует помнить, что отток венозной крови от верхней половины тела происходит только по левосторонней ВПВ. При установлении левосторонней НПВ и праволежащей ВПВ необходима катетеризация через вены левой верхней конечности [5, 6].
С помощью ангиокардиографического исследования диагностика аномалий расположения сердца, одного или двух сопутствующих врожденных пороков часто не представляет особых трудностей. Во избежание путаницы при обозначении камер сердца, которая может возникнуть при аномалиях его расположения, особенно сопровождающихся КТМС, необходимо пользоваться единой терминологией, содержащей основные сведения о том или ином отделе сердца. Характеризуя сердечную камеру, следует учитывать сторону ее расположения, анатомическое строение и тип протекающей крови. Для предсердий при аномалиях расположения сердца важной считается сторона их расположения, т.е. предсердие может быть правосторонним или левосторонним. Функциональная направленность и анатомическое строение предсердий, как правило, совпадают. Венозное предсердие, к которому по полым венам и коронарному синусу притекает венозная кровь, имеет анатомическую характеристику ПП, а артериальное предсердие, принимающее кровь легочных вен, — ЛП. Поэтому во избежание громоздкости терминов целесообразно пользоваться одним из них. Следовательно, характеристика предсердий при их нормальном расположении не меняется, а при зеркальном расположении предсердий, которое встречается в левосформированном сердце, правостороннее, анатомически левое артериальное предсердие можно обозначать как правостороннее артериальное предсердие или правостороннее левое предсердие. Точно так же левостороннее, анатомически правое венозное предсердие целесообразно называть левосторонним венозным предсердием или левосторонним правым предсердием.
Для предсердий при аномалиях расположения сердца важной считается сторона их расположения, т.е. предсердие может быть правосторонним или левосторонним. Функциональная направленность и анатомическое строение предсердий, как правило, совпадают. Венозное предсердие, к которому по полым венам и коронарному синусу притекает венозная кровь, имеет анатомическую характеристику ПП, а артериальное предсердие, принимающее кровь легочных вен, — ЛП. Поэтому во избежание громоздкости терминов целесообразно пользоваться одним из них. Следовательно, характеристика предсердий при их нормальном расположении не меняется, а при зеркальном расположении предсердий, которое встречается в левосформированном сердце, правостороннее, анатомически левое артериальное предсердие можно обозначать как правостороннее артериальное предсердие или правостороннее левое предсердие. Точно так же левостороннее, анатомически правое венозное предсердие целесообразно называть левосторонним венозным предсердием или левосторонним правым предсердием. Для желудочков в функциональном отношении меньшее значение имеет сторона их расположения, так как для каждого типа нормально или аномально расположенного сердца их положение неизменно. Например, при правосформированном сердце желудочек, выбрасывающий венозную кровь, всегда локализуется справа по отношению к артериальному желудочку, расположенному слева. При лево–сформированном сердце их соотношение противоположно, т.е. артериальный желудочек расположен всегда справа, а венозный — слева. Вот почему значительно большее значение следует придавать типу нагнетаемой ими крови, т.е. они могут быть определены как венозный и артериальный [5, 8, 9]. Не меньшую роль играет характер анатомического строения желудочков, независимо от их положения: они могут быть обозначены как анатомически правый и анатомически левый. Для обозначения взаимоотношения магистральных сосудов применяют следующие термины: под нормальным положением магистральных сосудов в правосформированном сердце понимают правостороннее и заднее расположение аорты по отношению к слева и кпереди лежащему ЛС, а в левосформированном сердце — левостороннее и заднее положение аорты по отношению к справа и кпереди лежащему ЛС.
Для желудочков в функциональном отношении меньшее значение имеет сторона их расположения, так как для каждого типа нормально или аномально расположенного сердца их положение неизменно. Например, при правосформированном сердце желудочек, выбрасывающий венозную кровь, всегда локализуется справа по отношению к артериальному желудочку, расположенному слева. При лево–сформированном сердце их соотношение противоположно, т.е. артериальный желудочек расположен всегда справа, а венозный — слева. Вот почему значительно большее значение следует придавать типу нагнетаемой ими крови, т.е. они могут быть определены как венозный и артериальный [5, 8, 9]. Не меньшую роль играет характер анатомического строения желудочков, независимо от их положения: они могут быть обозначены как анатомически правый и анатомически левый. Для обозначения взаимоотношения магистральных сосудов применяют следующие термины: под нормальным положением магистральных сосудов в правосформированном сердце понимают правостороннее и заднее расположение аорты по отношению к слева и кпереди лежащему ЛС, а в левосформированном сердце — левостороннее и заднее положение аорты по отношению к справа и кпереди лежащему ЛС. Термины «полная» или «простая транспозиция магистральных сосудов» употребляют в тех случаях, когда аорта находится справа и кпереди по отношению к кзади и слева расположенному стволу легочной артерии или лежит прямо перед ЛС (декстротранспозиция аорты) в правосформированном сердце и когда аорта лежит слева и спереди от расположенного справа и кзади ЛС или находится прямо перед ним в левосформированном сердце. Под корригированной транспозицией магистральных сосудов понимается левостороннее и переднее расположение аорты по отношению к справа и кзади лежащему ЛС (синистратранспозиция аорты) в правосформированном сердце и правосторонняя и передняя позиция аорты по отношению к левостороннему и заднему положению ЛС в левосформированном сердце. При этом в правосформированном сердце термины «простая транспозиция магистральных сосудов» или «декстротранспозиция аорты» применяют для случаев праворасположенной аорты, а термины «корригированная транспозиция магистральных сосудов» или «синистратранспозиция аорты» — для случаев леворасположенной аорты, когда имеются тяжелые пороки сердца типа единственного желудочка, двухкамерного сердца и др.
Термины «полная» или «простая транспозиция магистральных сосудов» употребляют в тех случаях, когда аорта находится справа и кпереди по отношению к кзади и слева расположенному стволу легочной артерии или лежит прямо перед ЛС (декстротранспозиция аорты) в правосформированном сердце и когда аорта лежит слева и спереди от расположенного справа и кзади ЛС или находится прямо перед ним в левосформированном сердце. Под корригированной транспозицией магистральных сосудов понимается левостороннее и переднее расположение аорты по отношению к справа и кзади лежащему ЛС (синистратранспозиция аорты) в правосформированном сердце и правосторонняя и передняя позиция аорты по отношению к левостороннему и заднему положению ЛС в левосформированном сердце. При этом в правосформированном сердце термины «простая транспозиция магистральных сосудов» или «декстротранспозиция аорты» применяют для случаев праворасположенной аорты, а термины «корригированная транспозиция магистральных сосудов» или «синистратранспозиция аорты» — для случаев леворасположенной аорты, когда имеются тяжелые пороки сердца типа единственного желудочка, двухкамерного сердца и др.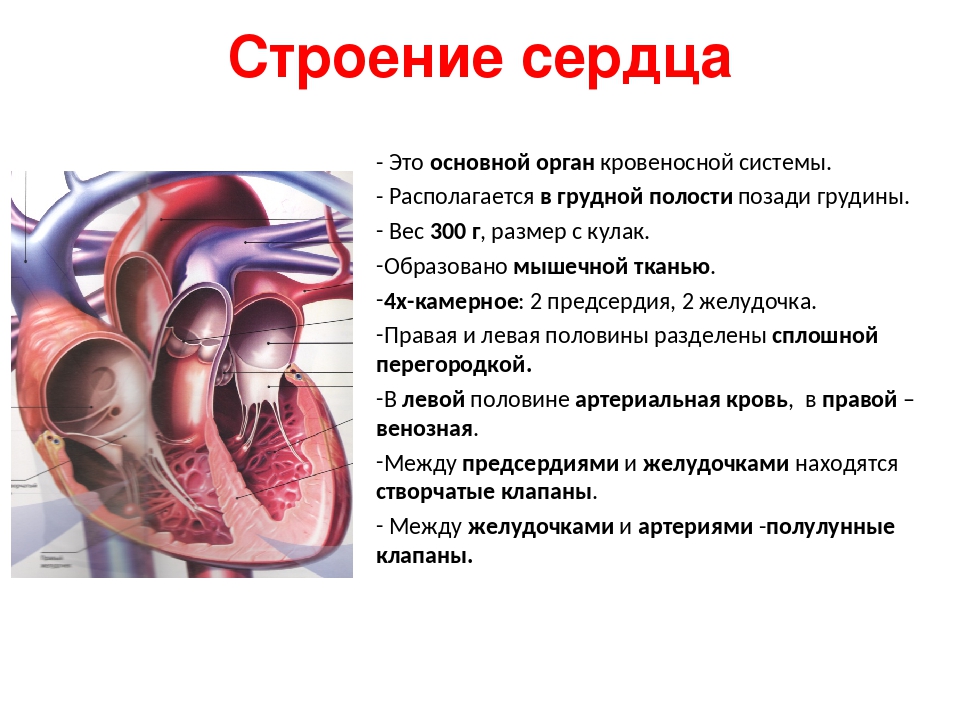 Наоборот, в левосформированном сердце простой транспозицией магистральных сосудов или синистратранспозицией аорты называют случаи леворасположенной аорты, а термины «корригированная транспозиция магистральных сосудов» или «декстротранспозиция аорты» применяют для случаев праворасположенной аорты. Термины «полная транспозиция магистральных сосудов» и «корригированная транспозиция магистральных сосудов» используют в тех случаях, когда отмечается правильное развитие желудочков сердца, а анатомия сопутствующих врожденных пороков позволяет произвести их полную хирургическую коррекцию. Термин «транспозиция» применяют только при аномальном расположении магистральных сосудов в смысле нарушения их переднезадних соотношений, т.е. когда аорта занимает переднее положение по отношению к кзади лежащему ЛС [3–5].
Наоборот, в левосформированном сердце простой транспозицией магистральных сосудов или синистратранспозицией аорты называют случаи леворасположенной аорты, а термины «корригированная транспозиция магистральных сосудов» или «декстротранспозиция аорты» применяют для случаев праворасположенной аорты. Термины «полная транспозиция магистральных сосудов» и «корригированная транспозиция магистральных сосудов» используют в тех случаях, когда отмечается правильное развитие желудочков сердца, а анатомия сопутствующих врожденных пороков позволяет произвести их полную хирургическую коррекцию. Термин «транспозиция» применяют только при аномальном расположении магистральных сосудов в смысле нарушения их переднезадних соотношений, т.е. когда аорта занимает переднее положение по отношению к кзади лежащему ЛС [3–5].
Следует отметить, что под обратным расположением внутренних органов (situs viscerum inversus) или обратным расположением брюшных органов (situs viscerum inversus abdominalis) подразумевают зеркальное их положение по отношению к нормальному состоянию. Термин «абдоминальная гетеротаксия» используют для того, чтобы подчеркнуть тенденцию брюшных органов к аномальной симметрии. В литературе применяют синонимы: situs inversus partialis и situs solitus partialis [1–3].
Термин «абдоминальная гетеротаксия» используют для того, чтобы подчеркнуть тенденцию брюшных органов к аномальной симметрии. В литературе применяют синонимы: situs inversus partialis и situs solitus partialis [1–3].
Приводим собственное клиническое наблюдение подростка С., 16 лет.
Мальчик находился в отделении детской кардиологии, кардиохирургии и реабилитации Института неотложной и восстановительной хирургии им. В.К. Гусака г. Донецка с 26.11.2014 г. по 10.12.2014 г. Поступил с жалобами на утреннюю слабость.
Анамнез заболевания. Болен с рождения. В первые часы жизни был обнаружен шум в области сердца, заподозрен ВПС. Была проведена ЭхоКГ, консультация кардиохирурга, диагностированы декстрокардия и ВПС (транспозиция магистральных сосудов и ДМЖП). Направлен на консультацию в Национальный институт сердечно-сосудистой хирургии г. Киева, где был консультирован в 4-месячном возрасте. Диагноз подтвержден, рекомендовано зондирование полостей сердца и оперативное лечение. Родители от предложенного лечения отказались. В дальнейшем ежегодно наблюдался в ИНВХ им. В.К. Гусака. В 10-летнем возрасте при плановой ЭхоКГ у ребенка диагностирован ВПС, КТМС, стеноз легочной артерии с градиентом давления 28,8 мм рт.ст. Вновь рекомендовано зондирование полостей сердца, которое не было проведено. В 11-летнем возрасте ребенок находился на обследовании и лечении в ГДКБ № 1 г. Донецка с диагнозом: правосформированное праворасположенное сердце, КТМС, стеноз легочной артерии, Н1. Вегетососудистая дисфункция с липотимическими состояниями по гипотензивному типу на фоне перинатального неврологического дефицита. Нарушение ритма сердца (экстрасистолия). Кроме того, у мальчика было обнаружено обратное расположение внутренних органов (situs viscerum inversus). В 14-летнем возрасте вновь госпитализирован в ГДКБ № 1 г. Донецка. Проведена ЭхоКГ: правосформированное праворасположенное сердце, КТМС, клапанный стеноз легочной артерии с увеличением градиента давления на клапане до 68,6–73,5 мм рт.
Родители от предложенного лечения отказались. В дальнейшем ежегодно наблюдался в ИНВХ им. В.К. Гусака. В 10-летнем возрасте при плановой ЭхоКГ у ребенка диагностирован ВПС, КТМС, стеноз легочной артерии с градиентом давления 28,8 мм рт.ст. Вновь рекомендовано зондирование полостей сердца, которое не было проведено. В 11-летнем возрасте ребенок находился на обследовании и лечении в ГДКБ № 1 г. Донецка с диагнозом: правосформированное праворасположенное сердце, КТМС, стеноз легочной артерии, Н1. Вегетососудистая дисфункция с липотимическими состояниями по гипотензивному типу на фоне перинатального неврологического дефицита. Нарушение ритма сердца (экстрасистолия). Кроме того, у мальчика было обнаружено обратное расположение внутренних органов (situs viscerum inversus). В 14-летнем возрасте вновь госпитализирован в ГДКБ № 1 г. Донецка. Проведена ЭхоКГ: правосформированное праворасположенное сердце, КТМС, клапанный стеноз легочной артерии с увеличением градиента давления на клапане до 68,6–73,5 мм рт. ст. Рекомендовано для уточнения анатомии сердца и коррекции ВПС зондирование полостей сердца с выполнением баллонной дилатации стеноза легочной артерии. От исследования родители вновь отказались. В течение времени наблюдения ребенок получал кардиотрофическую терапию: тиотриазолин, аспаркам, рибоксин. Цель настоящей госпитализации — плановое обследование подростка, определение дальнейшей тактики ведения.
ст. Рекомендовано для уточнения анатомии сердца и коррекции ВПС зондирование полостей сердца с выполнением баллонной дилатации стеноза легочной артерии. От исследования родители вновь отказались. В течение времени наблюдения ребенок получал кардиотрофическую терапию: тиотриазолин, аспаркам, рибоксин. Цель настоящей госпитализации — плановое обследование подростка, определение дальнейшей тактики ведения.
Анамнез жизни. Ребенок рожден от IV беременности, I родов (предшествующие беременности закончились 2 медицинскими абортами, 1 выкидышем). Рожден на дому, в течение 30 минут был доставлен в родильное отделение. В первые дни состояние ребенка расценивалось как тяжелое. Тяжесть была обусловлена неврологическими расстройствами на фоне гипоксического поражения центральной нервной системы. В первые 5 лет жизни болел острыми респираторными инфекциями 7–9 раз в год. Привит по возрасту. Аллергологический анамнез не отягощен. Семейный анамнез, со слов родителей, без особенностей.
При поступлении состояние ребенка средней тяжести. Физическое развитие по массе ниже среднего (масса 50 кг, рост 170 см, долженствующая масса 58,85 ± 7,05 кг, долженствующий рост 169,8 ± 7,6 см). Кожные покровы чистые. Периферические лимфатические узлы мелкие во всех группах, щитовидная железа не увеличена. Осанка кифосколиотическая, уплощение свода стоп. Над легкими перкуторно — легочный звук, аускультативно — везикулярное дыхание. Верхушечный толчок пальпируется в V межреберье на 1 см кнутри от правой среднеключичной линии. Границы сердца смещены вправо. Тоны ритмичные, приглушены, систолический шум средней интенсивности над предсердной областью с максимумом во 2-м межреберье справа от грудины. Живот при пальпации мягкий, безболезненный. Печень пальпируется по левой среднеключичной линии на 1 см ниже реберной дуги, по срединной линии — на границе верхней и средней трети расстояния от мечевидного отростка до пупка. Физиологические отправления не нарушены.
Данные дополнительных методов обследования: клинический анализ крови в пределах нормы, общий анализ мочи без патологии.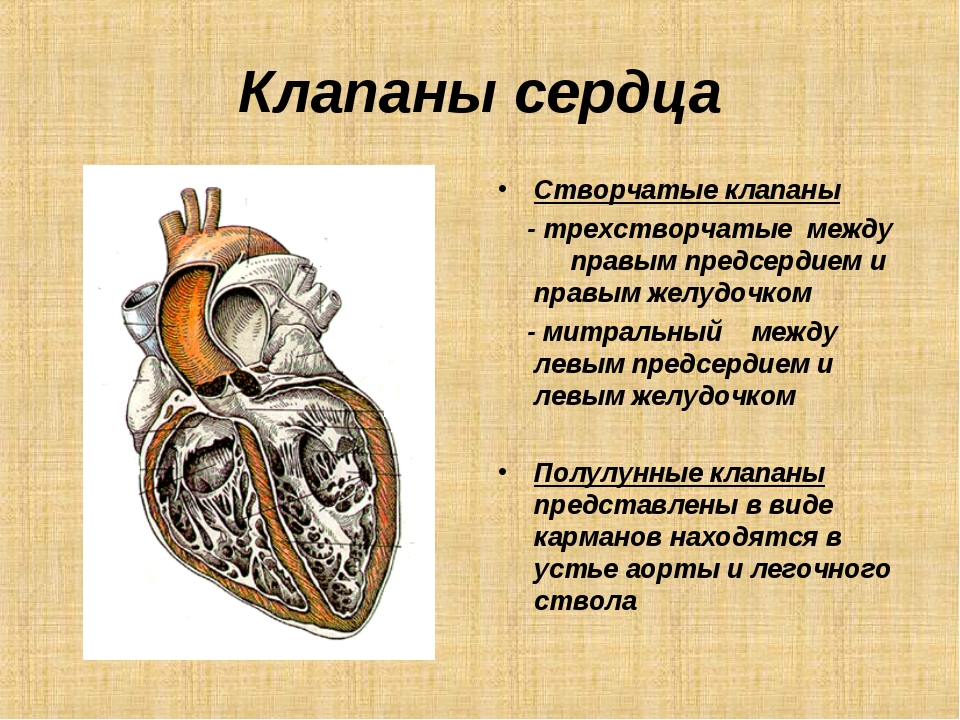 Биохимические показатели крови: общий холестерин, глюкоза в норме, билирубин, трансаминазы, мочевая кислота не повышены, коагулограмма без патологии, острофазовые показатели не повышены.
Биохимические показатели крови: общий холестерин, глюкоза в норме, билирубин, трансаминазы, мочевая кислота не повышены, коагулограмма без патологии, острофазовые показатели не повышены.
На стандартной ЭКГ: электрическая ось сердца отклонена вправо, нарушение процессов реполяризации в миокарде. Суточное мониторирование ЭКГ по Холтеру: тахикардия в течение суток; наджелудочковая эктопическая активность в пределах нормы; желудочковая эктопическая активность не обнаружена; ишемические изменения на ЭКГ не обнаружены; толерантность к физической нагрузке низкая; значимых изменений интервала QT в течение суток не выявлено.
УЗИ органов желудочно-кишечного тракта: situs viscerum inversus, структурных изменений не обнаружено.
ЭхоКГ: правосформированное праворасположенное сердце. Корригированная транспозиция магистральных сосудов. Клапанный стеноз легочной артерии с градиентом давления на клапане 57 мм рт.ст.
УЗИ брахиоцефального отдела: умеренная экстравазальная компрессия позвоночных артерий в сегменте V2, больше значимая справа, непрямолинейность их хода. Гипоперфузия по мозговым сосудам.
Гипоперфузия по мозговым сосудам.
Ребенку установлен диагноз: правосформированное праворасположенное сердце. Врожденный порок сердца — корригированная транспозиция магистральных сосудов, клапанный стеноз легочной артерии, Н1. Situs viscerum inversus. Недифференцированная дисплазия соединительной ткани — кифосколиз грудного отдела позвоночника, плоскостопие.
Мальчик консультирован кардиохирургом: рекомендовано зондирование полостей сердца, баллонная вальвулопластика стеноза легочной артерии.
Следует подчеркнуть, что правосформированное праворасположенное сердце образуется на ранней стадии эмбриогенеза (6-я неделя), причем при нормальной, декстробульбовентрикулярной петле оно является результатом отсутствия поворота верхушки развивающегося сердца справа налево, а при аномальной, синистрабульбовентрикулярной петле нормальное завершение ее развития сопровождается поворотом верхушки сердца слева направо. Наиболее характерный признак данной аномалии — правостороннее расположение верхушки сердца при нормальном расположении предсердий. Продольная ось сердца при правосформированном праворасположенном сердце ротирована вправо и образует угол 30–45° с сагиттальной осью грудной клетки в горизонтальной и угол 0–50° — во фронтальной плоскости. Ротация оказывает влияние преимущественно на расположение желудочков, которые являются наиболее мобильными. Топография других отделов изменяется в меньшей степени [4, 11]. Схема гемодинамики при аномальном расположении сердца, согласно ЭхоКГ, представлена на рис. 1.
Продольная ось сердца при правосформированном праворасположенном сердце ротирована вправо и образует угол 30–45° с сагиттальной осью грудной клетки в горизонтальной и угол 0–50° — во фронтальной плоскости. Ротация оказывает влияние преимущественно на расположение желудочков, которые являются наиболее мобильными. Топография других отделов изменяется в меньшей степени [4, 11]. Схема гемодинамики при аномальном расположении сердца, согласно ЭхоКГ, представлена на рис. 1.
По ВПВ и НПВ кровь поступает в леворасположенное предсердие, через трикуспидальный клапан попадает в гемодинамически ПЖ, а затем в легочную артерию. Обогащенная кислородом кровь по легочным венам поступает в праворасположенное предсердие, через митральный клапан попадает в гемодинамически ЛЖ, а затем в аорту.
Таким образом, приведенное клиническое наблюдение демонстрирует сочетание КТМС с ДМЖП, клапанным стенозом легочной артерии, аномальным положением сердца, обратным расположением внутренних органов у подростка и представляет интерес для педиатров и детских кардиологов.
Библиотека ГАУЗ МКДЦ — Неонатальная кардиология
ОГЛАВЛЕНИЕ
Предисловие.
Кровообращение плода и новорожденного ребенка.
Морфофункциональные особенности сердца плода и новорожденного ребенка.
Кровообращение плода.
Переходное кровообращение.
Кровообращение в периоде новорожденности.
Кровообращение недоношенного ребенка.
Методы диагностики заболеваний сердца у новорожденных.
Электрокардиография.
Прекордиальное картирование сердца, модифицированное для новорожденных.
Суточное мониторирование ЭКГ по Холтеру.
Ультразвуковое исследование сердца.
Биохимические методы диагностики.
Рентгенография в диагностике неонатальных кардиопатий.
Влияние ЦНС на формирование функциональных кардиопатий в периоде новорожденности (цереброкардиальный синдром).
Синдром дезадаптации неонатального кровообращения.
Транзиторная постгипоксическая ишемия миокарда.
Транзиторная неонатальная легочная гипертензия у недоношенных.
Открытый артериальный проток.
Аномалии внутригрудного расположения сердца.
Правосформированное праворасположенное сердце.
Правосформированное срединнорасположенное сердце.
Правосформированное леворасположенное сердце с обратным расположением органов брюшной полости.
Левосформированное праворасположенное сердце.
Левосформированное леворасположенное сердце.
Неопределенно-сформированное сердце.
Сердечная недостаточность.
Врожденные пороки сердца.
Пороки сердца с ранним цианозом.
Полная транспозиция магистральных сосудов.
Тетрада Фалло.
Аномальный дренаж легочных вен.
Пороки сердца с ранней сердечной недостаточностью.
Гипоплазия левого желудочка.
Открытый атриовентрикулярный канал.
Трехкамерное сердце с единственным желудочком.
Общий артериальный ствол.
Предуктальная коарктация аорты.
Пороки сердца, не создающие критической ситуации в неонатальном периоде.
Дефект межжелудочковой перегородки.
Открытый артериальный проток.
Изолированный стеноз легочной артерии.
Триада Фалло.
Аномалии клапанного аппарата сердца.
Недостаточность трикуспидального клапана.
Врожденная недостаточность митрального клапана.
Врожденный стеноз митрального клапана.
Врожденная недостаточность клапанов легочной артерии.
Врожденная недостаточность аортальных клапанов.
Аномалии развития коронарных артерий.
Аномальное отхождение левой коронарной артерии от легочной артерии (синдром Бланда—Уайта—Гарленда).
Аномальное отхождение правой коронарной артерии от легочной артерии.
Аномальное отхождение единой коронарной артерии от легочной артерии.
Аномальное отхождение левой коронарной артерии от правого синуса Вальсальвы.
Стеноз и атрезия устья коронарных артерий.
Аритмии периода новорожденности.
Неонатальные нарушения ритма сердца.
Синусовая тахикардия.
Синусовая брадикардия.
Синусовая аритмия.
Экстрасистолия.
Пароксизмальная тахикардия.
Послеоперационные нарушения ритма сердца.
Неонатальные нарушения проводимости.
Синоатриальная блокада.
Атриовентрикулярная блокада.
Внутрижелудочковые блокады.
Неонатальные кардиомиопатии.
Дилатационная кардиомиопатия.
Фиброэластоз эндомиокарда.
Гипертрофическая кардиомиопатия.
Диабетическая кардиомиопатия.
Болезнь Помпе.
Кардиомиопатии при врожденйом гипо и гипертиреоидизме.
Кокаиновая кардиопатия.
Кардиомиопатии при гипербилирубинемии.
Неонатальные инфаркты миокарда.
Воспалительные заболевания сердца.
Миокардиты.
Эндокардит.
Перикардит.
Опухоли сердца.
Болезни сердца, редко встречающиеся в периоде новорожденности.
Врожденные аневризмы камер сердца.
Аневризма предсердной перегородки.
Аневризма межжелудочковой перегородки.
Идиопатический артериальный кальциноз.
Тромбоз камер сердца.
Синдром врожденного удлиненного интервала Q-T.
Кардиопатии при генетических синдромах.
Синдром Дауна.
Синдром Марфана.
Синдром Муна.
Синдром трисомии.
Синдром Тернера.
Синдром трисомии.
Синдром трисомии.
Синдром делеции 2-й хромосомы.
Синдром Robinow.
Синдром Williams-Beuren.
Синдром 22-й хромосомы.
Кардиопатии при некоторых патологических состояниях в неонатологии.
Кардиопатии при внутричерепных кровоизлияниях.
Кардиопатии при пневмонии.
Кардиопатии при нарушениях электролитного баланса.
Кардиопатии при аспирационном синдроме.
Кардиопатия при синдроме дыхательных расстройств.
Кардиопатия при гипогликемии.
Библиографический список.
Электронная библиотека
По данным ВОЗ, ежегодно 4–5 % новорожденных появляются на свет с врожденной или наследственной патологией. Из них около 2 % имеют тяжелые аномалии, несовместимые с жизнью, и, прежде всего, это врожденные пороки сердца (ВПС). Почти 40 % ранней детской смертности частично или полностью обусловлено наследственными заболеваниями, половину из которых составляет патология сердечно-сосудистой системы [1, 2, 4].
ВПС являются одним из клинических симптомов многочисленных синдромов, связанных с известными хромосомными нарушениями. Ярким примером является синдром Дауна (СД) – частая форма слабоумия, комбинирующаяся с характерными соматическими признаками. Этот синдром описан в 1866 г. J. Down, его частота в популяции составляет – 1:700 новорожденных.
Ярким примером является синдром Дауна (СД) – частая форма слабоумия, комбинирующаяся с характерными соматическими признаками. Этот синдром описан в 1866 г. J. Down, его частота в популяции составляет – 1:700 новорожденных.
Необходимо отметить, что 50 % больных с СД имеют ВПС, при этом более чем у 40 % пациентов диагностируют атриовентрикулярную коммуникацию (АВК). В то же время в общей популяции частота этого порока составляет 4,7–6,5 % [2–4]. Как объяснение такой неслучайной ассоциации исследователи предполагают, что участок 21-й хромосомы может быть задействован в развитии сердца вообще и эндокардиальных подушечек в частности, дефект которых и лежит в основе АВК. Кроме того, у больных с СД выявляют дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток, тетраду Фалло и др.
АВК – сложный многокомпонентный ВПС, при котором существует аномальное сообщение между желудочками и предсердиями через общий атриовентрикулярный канал, возникновение которого обусловлено дефектом развития эндокардиальных валиков (подушечек). В процессе эмбриогенеза эндокардиальные подушечки, срастаясь между собой, формируют два атриовентрикулярных клапана и участвуют в конечной фазе формирования атриовентрикулярной перегородки, поэтому нарушение эмбриогенеза, вызванное различными причинами, приводит к недоразвитию атриовентрикулярной перегородки и нарушению дифференциации единого атриовентрикулярного канала на митральную и трикуспидальную части. Нарушается развитие межпредсердной и межжелудочковой перегородок, створок митрального и трикуспидального клапанов, а предсердия и желудочки соединяются между собой общим атриовентрикулярным каналом, состоящим из единого атриовентрикулярного отверстия и сложного единого аномального створчатого аппарата [2, 5, 6].
В процессе эмбриогенеза эндокардиальные подушечки, срастаясь между собой, формируют два атриовентрикулярных клапана и участвуют в конечной фазе формирования атриовентрикулярной перегородки, поэтому нарушение эмбриогенеза, вызванное различными причинами, приводит к недоразвитию атриовентрикулярной перегородки и нарушению дифференциации единого атриовентрикулярного канала на митральную и трикуспидальную части. Нарушается развитие межпредсердной и межжелудочковой перегородок, створок митрального и трикуспидального клапанов, а предсердия и желудочки соединяются между собой общим атриовентрикулярным каналом, состоящим из единого атриовентрикулярного отверстия и сложного единого аномального створчатого аппарата [2, 5, 6].
В зависимости от степени недоразвития эндокардиальных валиков выделяют две формы порока: неполную и полную.
Полная АВК – это ВПС, включающий сливающиеся между собой низкий (первичный большой) ДМПП, высокий (мембранозный) ДМЖП, аномальное единое центрально расположенное большое атриовентрикулярное отверстие, расщепление створок – чаще митрального (переднемедиальная) или трикуспидального (септальная) клапанов. Общее центральное атриовентрикулярное отверстие при этом прикрывается клапаном, состоящим из передней и задней створок, связанных с остатками перегородок, и двух латеральных створок, прикрепляющихся к боковым стенкам каждого из желудочков.
Общее центральное атриовентрикулярное отверстие при этом прикрывается клапаном, состоящим из передней и задней створок, связанных с остатками перегородок, и двух латеральных створок, прикрепляющихся к боковым стенкам каждого из желудочков.
Порок относится к группе ВПС с гиперволемией малого круга кровообращения, обусловленной артериовенозным сбросом крови через общий атриовентрикулярный септальный дефект в правые отделы сердца и в систему легочной артерии (ЛА). Сброс происходит на уровне предсердий и желудочков. При этом кровь из левого желудочка (ЛЖ) может поступать одновременно через ДМЖП в правый желудочек (ПЖ), через ДМПП в правое предсердие (ПП) и через дефектный атриовентрикулярный клапан в левое предсердие (ЛП), то есть имеет место гемодинамическая ситуация, обусловленная сочетанием трех дефектов: ДМЖП, ДМПП и недостаточности атриовентрикулярного клапана. В результате циркуляции балластного объема крови практически через все отделы сердца возникают объемная перегрузка и дилатация ЛП, ПП и ПЖ, а также гиперволемия и нарастающая спастическая гипертензия малого круга кровообращения. Из-за того что ДМЖП и ДМПП большие, давление между правыми и левыми камерами сердца быстро выравнивается и объем сброса слева направо на уровне предсердий определяется большей растяжимостью ПП, а на уровне желудочков (в основном) – мощностью сокращений ЛЖ и величиной градиента давления между аортой и ЛА. В результате выраженной объемной перегрузки правых камер сердца быстро формируется кардиомегалия и расширяется ЛА. Особенно выражена перегрузка ПП, поскольку в него кровь сбрасывается не только из ЛП, но и из ЛЖ. Легочная гипертензия (ЛГ) развивается быстро, что добавляет к диастолической перегрузке и систолическую перегрузку правых отделов сердца и вызывает их гипертрофию. С нарастанием ЛГ появляются признаки синдрома Эйзенменгера и перекрестного, а затем и стойкого венозно-артериального шунта с хронической артериальной гипоксемией, обусловленной сбросом венозной крови в аорту [4, 6, 7].
Из-за того что ДМЖП и ДМПП большие, давление между правыми и левыми камерами сердца быстро выравнивается и объем сброса слева направо на уровне предсердий определяется большей растяжимостью ПП, а на уровне желудочков (в основном) – мощностью сокращений ЛЖ и величиной градиента давления между аортой и ЛА. В результате выраженной объемной перегрузки правых камер сердца быстро формируется кардиомегалия и расширяется ЛА. Особенно выражена перегрузка ПП, поскольку в него кровь сбрасывается не только из ЛП, но и из ЛЖ. Легочная гипертензия (ЛГ) развивается быстро, что добавляет к диастолической перегрузке и систолическую перегрузку правых отделов сердца и вызывает их гипертрофию. С нарастанием ЛГ появляются признаки синдрома Эйзенменгера и перекрестного, а затем и стойкого венозно-артериального шунта с хронической артериальной гипоксемией, обусловленной сбросом венозной крови в аорту [4, 6, 7].
Представляем два клинических случая сочетания СД и полной АВК у детей, находившихся под наблюдением в городском специализированном доме ребенка г. Донецка.
Донецка.
Первое клиническое наблюдение.
Ребенок Д., 5 лет 8 мес. Девочка поступила в дом ребенка в возрасте 7 мес 28 дней. Родилась от 15-й беременности, протекавшей с анемией, фетоплацентарной недостаточностью, хронической внутриутробной гипоксией плода, маловодием. Роды вторые, срочные. Масса при рождении 3050 г, длина тела 54 см, оценка по шкале Апгар 6–7 баллов. В родах имела место кефалогематома. После рождения отмечали следующий характерный внешний вид ребенка: косой разрез глаз, уплощенный нос, большой язык, маленький рот, уплощенный затылок, кожная складка на короткой и широкой шее, диспластичные ушные раковины, мышечная гипотония, «бедный» рефлекс Моро, короткие пальцы рук, обезьянья (поперечная) складка на коротких и широких ладонях и стопах. Заподозрен СД. Ребенок обследован в Донецком межобластном медико-генетическом центре, в котором диагноз был подтвержден. У ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Шум иррадиировал в правую и левую аксиллярную области, на спину. Диагностирован ВПС (полная АВК). Ребенка консультировал кардиохирург.
Шум иррадиировал в правую и левую аксиллярную области, на спину. Диагностирован ВПС (полная АВК). Ребенка консультировал кардиохирург.
У девочки неоднократно, особенно на первом году жизни, отмечали пневмонии, пиелонефрит. Девочка развивалась с резким отставанием в физическом и нервно-психическом развитии. В возрасте 5 лет 8 мес масса тела составила 15 800 г, рост – 103 см, что по таблице сигмальных отклонений соответствует физическому развитию ниже среднего. Обращают внимание проявления атопического дерматита. У ребенка рано развились признаки хронической сердечной недостаточности (ХСН) IIА стадии, проявившейся тахикардией, одышкой в покое, периоральным цианозом, акроцианозом, увеличением печени, пастозностью стоп. Вследствие хронической гипоксемии у ребенка сформировались признаки хронической гипоксии тканей: пальцы в виде «барабанных палочек», ногти по типу «часовых стекол». Девочка самостоятельно ходит, говорит несколько элементарных слов, ест из ложки, пьет из чашки.
Приводим результаты обследования ребенка в 5 лет 8 мес.
Клинический анализ крови: эритроциты – 5,0·1012/л, гемоглобин – 160 г/л, цветной показатель – 0,95, гематокрит – 46 %, лейкоциты – 8,2·109/л, базофилы – 1 %, эозинофилы – 2 %, нейтрофилы палочкоядерные – 4 %, нейтрофилы сегментоядерные – 48 %, лимфоциты – 39 %, моноциты – 6 %, ретикулоциты – 8 ‰, тромбоциты – 182 Г/л, СОЭ – 6 мм/ч.
Биохимические исследования крови: общий белок – 83 г/л, кальций – 2,3 ммоль/л. IgG к токсоплазме, цитомегаловирусу, вирусу простого герпеса, вирусам гепатита В, С, ВИЧ не обнаружены.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка всех отделов сердца.
Эхокардиография: полная АВК. Тотальная гипертрофия миокарда. Признаки ЛГ (давление в ЛА 86–91 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 78 %. Полости не расширены.
Ребенку установлен диагноз: СД, трисомия 21, мейотическое нерасхождение. ВПС (полная АВК), ЛГ, ХСН ІІА стадии. Задержка физического развития. Умеренная умственная отсталость. Атопический дерматит, период неполной ремиссии.
Получает с 7-месячного возраста дигоксин, каптоприл, верошпирон по показаниям. Периодически получает курсы лечения ноотропами, кардиотрофическими, антигистаминными препаратами, ферментами.
Анализируя возможные пути оказания медицинской помощи ребенку, необходимо отметить следующее. Известно, что основное лечение АВК оперативное. Хирургическая коррекция данного вида ВПС является одной из сложнейших кардиохирургических операций и сопровождается высокой летальностью. Если же не проводить оперативного вмешательства, то порок будет иметь злокачественное прогредиентное течение с развитием тяжелой, рефрактерной к терапии ХСН, присоединением пневмонии, прогрессированием ЛГ и необратимостью поражения сосудов легких. Так, в течение первых 4–6 мес жизни без оперативной коррекции погибает до 50 % детей, в 1–2-ой годы жизни – до 87 % больных, к 5 годам – до 96 % пациентов [2, 4, 8]. ЛГ достигает высокой степени уже к концу первого года жизни, причем это касается, прежде всего, детей с СД, а к концу второго года у этого контингента пациентов часто возникают необратимые морфологические изменения в легочных сосудах. Операцию проводят с применением искусственного кровообращения и регулируемой гипотермии тела до 20–22 °С. Радикальная коррекция порока включает закрытие ДМЖП и ДМПП заплатой с одновременным разделением атриовентрикулярного кольца на правое и левое, устранение недостаточности предсердно-желудочковых клапанов.
Изучение литературы по оперативной коррекции полной АВК у детей с СД [2, 4, 8, 9] свидетельствует, что такие пациенты могут быть успешно прооперированы на первом году жизни, что позволяет устранить проблемы, связанные с прогрессирующей ХСН и ЛГ. Ранняя хирургическая коррекция у пациентов с СД до увеличения легочного сосудистого сопротивления и деформации атриовентрикулярного клапана имеет благоприятную перспективу. Данный подход позволяет снизить раннюю смертность, обеспечивает хорошие показатели выживаемости в отдаленный период и более надежную защиту от последующей дегенерации клапана.
Оперативная коррекция полной АВК у детей с СД в возрасте старше одного года, как правило, связана с более высоким риском операционной смертности и меньшей надеждой на улучшение гемодинамики по сравнению с детьми без СД. Кроме того, дети с СД имеют предрасположенность к развитию тяжелых послеоперационных инфекционных осложнений, прежде всего со стороны респираторного тракта, что требует более продолжительной искусственной вентиляции легких, длительного пребывания в отделении интенсивной терапии, удлиняющих сроки госпитализации [2, 8, 10].
Особенностью представленного случая явилось то, что, несмотря на высокую летальность при данном пороке без операции, девочка жива к 5 годам 8 мес. Состояние больной в настоящее время стабильное, однако ХСН и ЛГ прогрессируют. Высокие показатели ЛГ уже на первом году жизни не позволили провести оперативную коррекцию ребенку.
Второе клиническое наблюдение.
Ребенок У., 27.07.2008 г. рождения. Умерла 11.11. 2008 г. в возрасте 3 мес 15 дней.
Девочка рождена от 3-й беременности (1-я беременность в 1997 г. – искусственные роды в 30 нед по социальным показаниям, 2-я беременность в 2000 г. – медицинский аборт). Настоящая беременность наступила в результате стимуляции яичников матери по поводу вторичного бесплодия. Беременность протекала на фоне миомы матки, хронического сальпингоофорита, эрозии шейки матки, интенсивного табакокурения. В сроке гестации 21–22 нед обследована в Донецком межобластном медико-генетическом центре, где был установлен высокий риск рождения ребенка с СД. Вместе с тем, женщина продолжала донашивать настоящую беременность. Роды первые, преждевременные, в сроке 31– 32 нед. Масса при рождении 1700 г. Состояние девочки после рождения тяжелое, обусловленное недоношенностью, внутриутробной пневмонией. В родильном доме выявлены стигмы даунизма. Диагноз СД подтвержден в Донецком межобластном медико-генетическом центре. Кроме того, у ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Установлен ВПС (полная АВК). Ребенка консультировал кардиохирург. После выписки из родильного дома ребенок находился на лечении в ЦГКБ № 3, реанимационном отделении ГДКБ № 1 г. Донецка.
Приводим результаты обследования девочки в возрасте 3 мес 12 дней.
Клинический анализ крови: эритроциты – 2,9·1012/л, гемоглобин – 79 г/л, цветной показатель – 0,82, гематокрит – 28 %, лейкоциты – 20,0·109/л, плазменные клетки – 1 %, метамиелоциты – 3 %, базофилы – 1 %, эозинофилы – 1 %, нейтрофилы палочкоядерные – 15 %, нейтрофилы сегментоядерные – 57 %, лимфоциты – 17 %, моноциты – 5 %, тромбоциты – 115 Г/л, СОЭ – 5 мм/ч.
Биохимические исследования крови: общий белок – 48 г/л, кальций – 1,98 ммоль/л, сахар – 10,0 ммоль/л, протромбиновый индекс – 83 %, фибриноген – 4,83 г/л.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка левых отделов сердца.
Рентгенограмма органов грудной клетки: двусторонняя пневмония. Смещение левой границы сердца влево.
Эхокардиография: полная АВК. Дилатация левых отделов сердца. Признаки ЛГ (давление в ЛА 40 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 72 %.
У ребенка рано развились признаки ХСН, по поводу которой были назначены дигоксин, каптоприл, фуросемид, калия и магния аспарагинат. В связи с присоединением пневмонии девочка получала комбинированную антибактериальную терапию, инфузионно-трансфузионную терапию. Кроме того, проводились курсы лечения нейрометаболическими препаратами.
Несмотря на проводимое лечение, состояние девочки прогрессивно ухудшалось, нарастали явления сердечно-легочной недостаточности. Отмечали одышечно-цианотические приступы, по поводу которых проводили оксигенотерапию. Однако продолжали нарастать проявления сердечной недостаточности (одышка, цианоз кожных покровов). Ребенку 11.11.2008 г. в 7.00 в реанимационном отделении ГДКБ № 1 начата искусственная вентиляция легких с помощью аппарата «Малятко». Состояние продолжало ухудшаться. 11.11.2008 г. в 8.15 зафиксирована остановка кровообращения. Реанимационные мероприятия в течение 30 мин не имели эффекта и в 8.45 – констатирована смерть.
Основной клинический диагноз: врожденный порок сердца (полная АВК), ЛГ. СД.
Осложнения: двусторонняя пневмония. Гипотрофия. Отек-набухание головного мозга. Отек легких. Острая сердечно-сосудистая недостаточность.
Сопутствующий диагноз: перинатальное поражение ЦНС.
Основной патологоанатомический диагноз: болезнь Дауна (кариотип 47 ХХ+21 от 01.08.2008 г.) со сложным пороком сердца (открытый общий предсердно-желудочковый канал, коарктация перешейка аорты). Состояние после катетеризации правой подключичной вены, искусственной вентиляции легких, реанимации.
Осложнения основного заболевания: ЛГ. Двусторонняя крупноочаговая пневмония. Гипотрофия (масса тела 2175 г). Дистрофические изменения паренхиматозных органов. Отек оболочек и вещества головного мозга.
Непосредственная причина смерти: сердечно-легочная недостаточность, двусторонняя очаговая пневмония, СД со сложным пороком сердца, гипотрофия.
Патологоанатомическое описание сердца: сердце ребенка правосформированное, леворасположенное, размерами 48ґ42ґ36 мм. Правые отделы органа расширены. Расположение магистральных сосудов в области его основания не нарушено. Верхняя и нижняя полые вены соединяются с ПП, а легочные вены – с ЛП. Легочный ствол расширен, артериальный проток в стадии облитерации. В области перешейка аорты имеется сужение с диаметром просвета 3ґ2 мм. Диаметр нисходящей части аорты достигает 8ґ7 мм. При вскрытии камер сердца установлено, что эндокард предсердий и желудочков гладкий, блестящий и прозрачный. Полость ПП расширена, нижний отдел межпредсердной перегородки отсутствует и через дефект имеется сообщение с полостью ЛП. Остаток межпредсердной перегородки нависает над общим предсердно-желудочковым отверстием, через которое сообщаются полости предсердий с желудочковыми камерами. Под расщепленными створками предсердно-желудочковых клапанов имеется ДМЖП, сообщающий между собой полости желудочков. Артериальный конус ПЖ расширен и соединен с устьем легочного ствола. Легочный клапан состоит из трех полулунных заслонок, которые уплотнены, но смыкаются свободно. Выходной отдел ЛЖ соединяется с устьем аорты. Аортальный клапан состоит из трех полулунных заслонок, которые сформированы обычно. Устья венечных артерий располагаются в правом и левом аортальных синусах. Венечная пазуха своим расширенным устьем открывается в полость ПП. Толщина стенок ПЖ достигает 7 мм, а ЛЖ – 7,5 мм. У ребенка имеет место сложный ВПС – открытый общий предсердно-желудочковый канал, коарктация перешейка аорты.
Особенностями данного случая являются сочетание СД со сложным ВПС – полной АВК и коарктацией перешейка аорты, резистентная к медикаментозной терапии ХСН, прогрессирующая кахексия, приведшие к смерти ребенка в раннем возрасте.
Литература
- Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. – М.: Медицина, 1987. – Т. 1. – С. 230-235.
- Задко Т.И., Туманян М.Р., Левченко Е.Г. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10-18.
- Лимаренко М.П. Наследственные заболевания и врожденные пороки сердца у детей // Врачеб. практика. – 2005. – № 5. – С. 4-7.
- Мутафьян О.А. Врожденные пороки сердца у детей. – СПб.: Невский Диалект, 2002. – С. 116-129.
- Ciach K., Grzybowski W., Wydra D. et al. Prenatal diagnosis of an atrioventricular canal in a foetus with deletion of chromosome 8 (pter і p 21) // Ginekol. Pol. – 2008. – Vol. 79. – № 3. – P. 209-211.
- Gorbachevskii S.V., Khamida A.V. Embryologic and pathogenetic aspects of the common atrioventricular canal development // Arkh. Patol. – 1999. – Vol. 61. – № 3. – P. 53-57.
- Hung J.H., Lu J.H., Hung C.Y. Prenatal diagnosis of complete atrioventricular canal associated with tetralogy of Fallot // J. Clin. Ultrasound. – 2008. – Vol. 36, № 3. – P. 180-185.
- Michell M.E., Litwin S.B., Tweddell J.S. Complex atrioventri-cular canal // Semin. Thorac. Cardivasc. Surg. Pediatr. Card. Surg. Annu. – 2007. – P. 32-41.
- Vazquez-Antona C.A., Lomeli C., Buendia A., Vargas-Barron J. Pulmonary hypertension in children with Down’s syndrome and congenital heart disease. Is it really more severe? // Arch. Cardiol. Mex. – 2006. – Vol. 76, № 1. – P. 16-27.
-
Vida V.L., Barnoya J., Larrazabal L. A. et al. Congenital cardiac disease in children with Down’s syndrome in Guatemala // Cardiol. Young. – 2005. – Vol. 15. – № 3. – P. 286-290.
Донецкий национальный медицинский университет им. М. Горького.
дефектов одиночного желудочка | Американская кардиологическая ассоциация
Что это такое?
Редкие заболевания, поражающие одну нижнюю камеру сердца. Камера может быть меньше, недоразвита или не иметь клапана.
Синдром гипоплазии левых отделов сердца (HLHS) — Недоразвитая левая сторона сердца. Аорта и левый желудочек слишком малы, а отверстия в артерии и перегородке не созрели и не закрылись должным образом.
Легочная атрезия / Неповрежденная желудочковая перегородка — Легочного клапана не существует, и единственная кровь, получающая кислород, — это кровь, которая направляется в легкие через отверстия, которые обычно закрываются во время развития.
Атрезия трехстворчатого клапана — В сердце нет трехстворчатого клапана, поэтому кровь не может течь из тела в сердце обычным образом. Кровь не наполняется кислородом должным образом, поэтому она не завершает нормальный цикл тело — сердце — легкие — сердце — тело.
Родители детей с одним из этих пороков единственного желудочка
Гипопластический синдром левых отделов сердца
Что это?
При синдроме гипоплазии левых отделов сердца (HLHS) левая сторона сердца, включая аорту, аортальный клапан, левый желудочек и митральный клапан, недоразвита.
Что вызывает это?
У большинства детей причина неизвестна. У некоторых детей наряду с HLHS могут быть и другие пороки сердца.
Как это влияет на сердце?
При HLHS кровь, возвращающаяся из легких, должна проходить через отверстие в стенке между предсердиями (дефект межпредсердной перегородки). Правый желудочек качает кровь в легочную артерию, и кровь достигает аорты через открытый артериальный проток (см. Схему).
Как дефект влияет на моего ребенка?
Ребенок часто кажется нормальным при рождении, но обращается за медицинской помощью в течение нескольких дней после рождения, когда проток закрывается.Ребенок может бледнеть, дышать учащенно и с трудом, а также с трудом при кормлении. Этот порок сердца, если его не лечить, обычно приводит к летальному исходу в первые дни или месяц жизни.
Что можно сделать с дефектом?
Этот дефект нельзя исправить, но некоторых детей можно вылечить с помощью серии операций или трансплантации сердца. Пока не будет проведена операция, проток остается открытым с помощью внутривенных лекарств. Поскольку эти операции сложны и должны быть адаптированы для каждого ребенка, необходимо обсудить все медицинские и хирургические варианты с врачом вашего ребенка.
Если вы и врач вашего ребенка согласны с тем, что операция должна быть проведена, она будет проходить в несколько этапов. Первый этап, называемый процедурой Норвуда, позволяет правому желудочку перекачивать кровь как в легкие, так и в тело без необходимости держать проток открытым. Кровь направляется в легкие через шунт Блэлока-Тауссига (стрелка на вставке) или через шунт Сано. Процедуру Норвуда необходимо проводить вскоре после рождения. Второй этап (двунаправленный Гленн или Хеми-Фонтан) обычно выполняется между 4 и 12 месяцами, а третий этап (боковой туннельный Фонтан или экстракардиальный Фонтан) обычно выполняется между 18 месяцами и 3 годами.
Эти операции создают связь между венами, возвращающими кровь с низким содержанием кислорода в сердце, и легочной артерией. Цель состоит в том, чтобы позволить правому желудочку перекачивать в организм только насыщенную кислородом кровь, а также предотвратить или уменьшить цианоз (уровень кислорода в крови ниже нормального). Некоторым младенцам для этого требуется несколько промежуточных операций.
Некоторые врачи рекомендуют трансплантацию сердца для лечения HLHS. Хотя он может дать младенцу сердце с нормальной структурой, младенцу потребуются пожизненные лекарства, чтобы предотвратить отторжение.Могут развиться многие другие проблемы, связанные с трансплантацией, и их следует обсудить с врачом вашего ребенка.
Чем может заниматься мой ребенок?
Детям с HLHS можно посоветовать ограничить физические нагрузки своей выносливостью. Как правило, многие соревновательные виды спорта представляют больший риск. Детский кардиолог вашего ребенка поможет определить необходимый уровень активности.
Что понадобится моему ребенку в будущем?
Детям с HLHS требуется пожизненное наблюдение кардиолога для повторных проверок работы их сердца.Практически всем детям с HLHS потребуются сердечные лекарства, катетеризация сердца и дополнительная операция.
А как насчет предотвращения эндокардита?
Дети с HLHS имеют повышенный риск развития эндокардита. Спросите своего детского кардиолога о том, нужно ли вашему ребенку принимать антибиотики перед определенными стоматологическими процедурами, чтобы предотвратить эндокардит. См. Дополнительную информацию в разделе «Эндокардит».
Идентификационный лист врожденного порока сердца (PDF) (ссылка откроется в новом окне) (ссылка откроется в новом окне)
Атрезия легочной артерии
Что это?
При атрезии легочной артерии легочный клапан отсутствует.Кровь не может течь из правого желудочка в легочную артерию и далее в легкие. Правый желудочек и трикуспидальный клапан часто развиты слабо.
Что вызывает это?
У большинства детей причина неизвестна. У некоторых детей наряду с атрезией легкого могут быть другие пороки сердца. (Дети с тетралогией Фалло, у которых также есть легочная атрезия, могут проходить лечение, аналогичное лечению других тетралогий Фалло.)
Как это влияет на сердце?
Отверстие в межпредсердной перегородке позволяет крови выходить из правого предсердия, поэтому кровь с низким содержанием кислорода смешивается с богатой кислородом кровью в левом предсердии.Левый желудочек перекачивает эту бедную кислородом кровь в аорту и выводит ее по телу. Младенец выглядит синим (синюшным), потому что в крови меньше кислорода. Единственный источник кровотока в легких — открытый артериальный проток (ОАП), открытый проход между легочной артерией и аортой.
Как легочная атрезия влияет на моего ребенка?
Если КПК сужается или закрывается, кровоток в легких снижается до критически низкого уровня. Это может вызвать очень сильный цианоз.Симптомы могут появиться вскоре после рождения.
Что можно сделать с дефектом?
Временное лечение включает лекарство, препятствующее закрытию КПК. Хирург может создать шунт между аортой и легочной артерией, что может помочь увеличить приток крови к легким.
Более полное восстановление зависит от размера легочной артерии и правого желудочка. Если легочная артерия и правый желудочек очень маленькие, хирургическое исправление дефекта может оказаться невозможным.У некоторых детей между коронарными артериями и правым желудочком образуются аномальные каналы (синусоиды). Эти синусоиды также могут ограничивать тип хирургии, которую может сделать ребенок. У детей, у которых легочная артерия и правый желудочек более нормальные по размеру, операция на открытом сердце может помочь сердцу лучше работать.
Если правый желудочек остается слишком маленьким, чтобы быть хорошей насосной камерой, хирург может соединить вены тела непосредственно с легочными артериями. Дефект предсердия также можно закрыть, чтобы уменьшить цианоз.Эти операции называются процедурами Гленна и Фонтана.
Чем может заниматься мой ребенок?
Детям с атрезией легкого можно посоветовать ограничить свои физические нагрузки своей выносливостью. Некоторые соревновательные виды спорта могут представлять больший риск. Детский кардиолог вашего ребенка поможет определить необходимый уровень активности.
Что понадобится моему ребенку в будущем?
Детям с атрезией легочной артерии необходимо регулярное наблюдение у детского кардиолога, а по достижении совершеннолетия — регулярное наблюдение в течение всей жизни у кардиолога, прошедшего специальную подготовку в области врожденных пороков сердца.Некоторым детям могут потребоваться лекарства, катетеризация сердца или дополнительная операция.
А как насчет предотвращения эндокардита?
Дети с атрезией легких имеют повышенный риск развития эндокардита. Спросите своего детского кардиолога о том, нужно ли вашему ребенку принимать антибиотики перед определенными стоматологическими процедурами, чтобы предотвратить эндокардит. См. Дополнительную информацию в разделе «Эндокардит».
Паспортный лист врожденного порока сердца (PDF)
Что это?
В этом состоянии нет трикуспидального клапана, поэтому кровь не может течь из правого предсердия в правый желудочек.В результате правый желудочек становится маленьким и не полностью развитым. Выживание ребенка зависит от наличия отверстия в стенке между предсердиями (дефект межпредсердной перегородки) и, как правило, отверстия в стенке между двумя желудочками (дефект межжелудочковой перегородки). В результате кровь с низким содержанием кислорода, которая возвращается из вен тела в правое предсердие, проходит через дефект межпредсердной перегородки в левое предсердие. Там он смешивается с богатой кислородом кровью из легких. Большая часть этой частично насыщенной кислородом крови идет из левого желудочка в аорту и далее по телу.Меньшее, чем обычно, количество проходит через дефект межжелудочковой перегородки в малый правый желудочек, через легочную артерию и обратно в легкие. Из-за этого нарушения кровообращения ребенок выглядит синим (синюшным).
Что можно сделать для его лечения?
Часто необходимо сделать хирургическую процедуру, называемую шунтом, чтобы увеличить приток крови к легким. Это улучшает цианоз. У некоторых детей с атрезией трикуспидального клапана в легкие поступает слишком много крови.Им может потребоваться другой тип хирургии, называемый перевязкой легочной артерии, чтобы уменьшить приток крови к легким. Это важно для защиты кровеносных сосудов легких.
Можно ли отремонтировать?
Большинству детей с атрезией трикуспидального клапана можно сделать операцию, чтобы сердце могло работать как обычно. Между венами тела и легочными (легочными) артериями создаются соединения. Обычно это делается в два этапа. Во-первых, большая вена в верхней половине тела (верхняя полая вена) соединяется с легочными артериями с помощью процедуры, называемой двунаправленной операцией Гленна.
Позже, большая вена нижней половины тела (нижняя полая вена), а также вены печени соединяются с легочными артериями в ходе операции, называемой операцией Фонтана. Иногда во время операции Фонтана намеренно оставляют отверстие между сторонами кровотока с низким и высоким содержанием кислорода. Операция Фонтана может устранить или значительно улучшить цианоз, но без нормально работающего правого желудочка сердце не будет работать как нормальное сердце, у которого есть два насоса.Процедура Фонтана может выполняться с использованием трубки, которая проходит вокруг сердца, как показано на рисунке, или с дорожкой (перегородкой), проходящей внутри сердца. Оба типа операций Фонтана направляют бедную кислородом кровь из нижней части тела и печени в легкие.
Что понадобится моему ребенку в будущем?
Детям с атрезией трикуспидального клапана требуется пожизненное наблюдение кардиолога для повторных проверок работы их сердца.
А как насчет предотвращения эндокардита?
Дети с атрезией трикуспидального клапана подвержены повышенному риску развития эндокардита.Спросите своего детского кардиолога о том, нужно ли вашему ребенку принимать антибиотики перед определенными стоматологическими процедурами, чтобы предотвратить эндокардит. См. Дополнительную информацию в разделе «Эндокардит».
Взрослые с одним из этих дефектов единственного желудочка
Атрезия трехстворчатого клапана
В этом состоянии нет трикуспидального клапана, поэтому кровь не может нормально течь из правого предсердия в правый желудочек.
В результате правый желудочек становится маленьким и не полностью развитым.Выживание зависит от наличия отверстия в стенке между предсердиями (дефект межпредсердной перегородки) и, как правило, отверстия в стенке между двумя желудочками (дефект межжелудочковой перегородки). В результате кровь с низким содержанием кислорода, которая возвращается из вен тела в правое предсердие, проходит через дефект межпредсердной перегородки в левое предсердие. Там он смешивается с богатой кислородом кровью из легких. Большая часть этой частично насыщенной кислородом крови идет из левого желудочка в аорту и далее по телу. Меньшее, чем обычно, количество проходит через дефект межжелудочковой перегородки в малый правый желудочек, через легочную артерию и обратно в легкие.Из-за этого нарушения кровообращения пациент с этим заболеванием выглядит синим (синюшным) до тех пор, пока не будет проведена операция.
Легочная атрезия / интактная желудочковая перегородка
При атрезии легочной артерии легочный клапан отсутствует. Кровь не может течь из правого желудочка в легочную артерию и далее в легкие. Правый желудочек и трикуспидальный клапан часто развиты слабо.
Отверстие в межпредсердной перегородке позволяет крови выходить из правого предсердия, поэтому кровь с низким содержанием кислорода смешивается с богатой кислородом кровью в левом предсердии.Левый желудочек перекачивает эту бедную кислородом кровь в аорту и выводит ее по телу. Младенец выглядит синим (синюшным), потому что в крови меньше кислорода. Единственный источник кровотока в легких — открытый артериальный проток (ОАП), открытый проход между легочной артерией и аортой.
У некоторых пациентов с атрезией легочной артерии / неповрежденной перегородкой может быть выполнено восстановление, которое позволяет правому желудочку расти и функционировать более нормально, чем у других пациентов с одним желудочком.Более полное восстановление зависит от размера легочной артерии и правого желудочка. Если легочная артерия и правый желудочек очень маленькие, пациенту может потребоваться такая же операция, как и другим пациентам с одним желудочком. У некоторых пациентов между коронарными артериями и правым желудочком образуются аномальные каналы (синусоиды). Эти синусоиды могут осложнить это состояние и даже привести к необходимости пересадки сердца.
Гипопластический синдром левых отделов сердца
При синдроме гипоплазии левых отделов сердца (HLHS) левая сторона сердца, включая аорту, аортальный клапан, левый желудочек и митральный клапан, недоразвита.Кровь, возвращающаяся из легких, должна проходить через отверстие в стенке между предсердиями (дефект межпредсердной перегородки). Правый желудочек качает кровь в легочную артерию, и кровь достигает аорты через открытый артериальный проток.
Серия операций аналогична операциям, выполняемым другим пациентам с одним желудочком; однако первая операция (стадия I по Норвуду) более сложна, чем у других пациентов с одним желудочком.
Что вызывает порок сердца с одним желудочком?
В некоторых случаях генетическая проблема может быть связана с одним желудочком сердца.В большинстве случаев причина не устанавливается.
Как это влияет на сердце?
Недоразвитие желудочка в одних случаях может нарушить приток крови к телу, а в других — к легким. Без раннего вмешательства многие пациенты умирают в младенчестве. У небольшого числа пациентов тип единственного желудочка обеспечивает сбалансированное кровообращение между телом и легкими, и выживание в детстве возможно без хирургического вмешательства.
Как это влияет на меня?
Почти все взрослые с одним желудочком перенесли в детстве по крайней мере одну, а во многих случаях две или три операции.Большинство этих операций приводит к тому, что бедная кислородом кровь из вен идет в легкие, не проходя через насосную камеру (желудочек) и желудочек, который перекачивает кровь в организм. Проблемы могут возникать из-за неэффективности кровотока, идущего в легкие и возвращающегося из них, из-за отсутствия насосной камеры в легких.
Если в детстве восстановили единственный желудочек, чего мне ожидать?
В первую неделю жизни часто требуется операция для увеличения или уменьшения кровотока в легких.Процедура, называемая шунтом, проводится для увеличения притока крови к легким в первую неделю жизни. Это улучшает цианоз. У некоторых детей с атрезией трикуспидального клапана в легкие поступает слишком много крови. Им может потребоваться другой тип хирургии, называемый перевязкой легочной артерии, чтобы уменьшить приток крови к легким. Это важно для защиты кровеносных сосудов легких. У небольшого числа детей в легкие поступает ровно необходимое количество крови, и им не требуется первичная операция.
Почти все взрослые с единичным желудочком также подверглись последующим операциям по созданию связей между венами тела (нижняя полая вена и верхняя полая вена) и легкими (легочными) артериями.Обычно это делается в два этапа. Во-первых, большая вена в верхней половине тела (верхняя полая вена) соединяется с легочными артериями с помощью процедуры, называемой двунаправленной операцией Гленна.
Позже, большая вена нижней половины тела (нижняя полая вена), а также вены печени соединяются с легочными артериями в ходе операции, называемой операцией Фонтана.
Иногда во время операции Фонтана между бедной кислородом и богатой кислородом сторонами кровотока намеренно оставляют отверстие, называемое фенестрацией.Операция Фонтана может устранить или значительно улучшить цианоз, но без нормального правого желудочка сердце не будет работать так, как нормальное сердце, у которого есть две помпы.
Проблемы, которые могут возникнуть у вас
Многие пациенты выжили от трех до пяти десятилетий после операции на единственном желудочке в детстве. Многие из этих пациентов очень функциональны и обладают хорошим уровнем активности. Однако у некоторых пациентов с пороком одного желудочка есть проблемы со здоровьем.
У тех немногих пациентов, которым не проводилось хирургическое вмешательство, наблюдается цианоз (более низкий уровень кислорода, вызывающий синюшность), более низкая энергия и более высокий риск инфекций, таких как абсцесс мозга или эндокардит (инфекция сердца).Эти проблемы укорачивают жизнь некоторым людям.
Если вам сделали операцию по поводу дефекта одного желудочка, вы можете жить относительно нормальной жизнью. Однако ваша способность активно заниматься спортом обычно снижается.
Несколько основных типов проблем наиболее часто встречаются в этой группе людей. Эти проблемы могут быть связаны с возрастом человека на момент операции и типом операции. Возможные проблемы включают:
- Проблемы с ритмом, обычно учащенное сердцебиение (тахикардия, наджелудочковая тахикардия, трепетание предсердий) или медленное сердцебиение.
- Задержка жидкости, особенно в брюшной полости и нижних конечностях. У некоторых взрослых после операции может развиться варикозное расширение вен.
- Более высокий риск ослабления и разрушения сердечной мышцы, когда имеется только один желудочек.
- Сгустки крови в сердце, которые могут потребовать антикоагулянтной терапии.
Текущее обслуживание
Что мне понадобится в будущем?
Дефекты одного желудочка — одни из самых сложных врожденных пороков сердца.Если у вас есть этот дефект, вам потребуются регулярные осмотры у кардиологов, специализирующихся на врожденных пороках сердца у взрослых, а также постоянный уход на протяжении всей вашей жизни. Вам также следует проконсультироваться с кардиологом, имеющим опыт лечения врожденных пороков сердца у взрослых, если вы подвергаетесь какой-либо хирургической или инвазивной хирургии.
Медицинский
Многим людям с дефектом одного желудочка требуется ежедневный или многократный прием лекарств. Лучше всего эту помощь оказывает кардиолог, который хорошо знаком с анатомическими сложностями и осложнениями, которые возникают у этих пациентов.Для этого требуется опыт кардиолога, специализирующегося на врожденных пороках сердца.
Вам нужно будет как минимум раз в год проверять свое здоровье. Это может означать, что вам потребуются такие тесты, как электрокардиограмма (ЭКГ), эхокардиограмма (УЗИ сердца, в том числе чреспищеводная эхокардиограмма), катетеризация сердца, холтеровское мониторирование и мониторинг аритмии, а также нагрузочные тесты.
Ограничения деятельности
Возможно, вам придется ограничить свою активность, особенно спортивные соревнования.Если у вас пониженная функция сердца или нарушение ритма, возможно, вам придется больше ограничить свою активность. См. Раздел «Физическая активность» для получения дополнительной информации. Кардиолог поможет вам определить, нужно ли вам ограничивать свою активность.
Профилактика эндокардита
Антибиотики для предотвращения эндокардита необходимы перед некоторыми стоматологическими процедурами. См. Дополнительную информацию в разделе «Эндокардит».
Беременность
Некоторые женщины, перенесшие операцию по типу Фонтана, могут забеременеть и безопасно вынести беременность.Риск увеличивается, если сердечная мышца слабая, если есть обструкция или сгусток в соединении Фонтана или если есть аритмии. Если вы хотите забеременеть, важно до зачатия поговорить со своим кардиологом, чтобы выяснить риски беременности. Также важно иметь акушера из группы высокого риска, имеющего опыт ухода за пациентами с врожденными пороками сердца во время беременности и родов. См. Дополнительную информацию в разделе «Беременность».
Вам понадобится дополнительная операция?
Большинство операций на одном желудочке выполняются в первые два-четыре года жизни и не требуют дополнительных операций.Если у вас есть какие-либо из перечисленных выше осложнений, вам, возможно, придется пересмотреть предыдущие хирургические процедуры. Дополнительные вмешательства могут включать закрытие отверстий, установку кардиостимуляторов или ремонт или замену негерметичных клапанов. В редких случаях можно рассмотреть возможность пересадки сердца. Ваш врач объяснит эти возможности, потому что каждый отдельный желудочек имеет уникальные особенности.
Рентгенологические аномалии грудной клетки — контур сердца и отек легких
Ключевые точки
- Если сердце увеличено — обратите внимание на признаки сердечной недостаточности (выпуклость сосудов верхней зоны, отек легких и плевральный выпот)
- Отек легких проявляется в две формы — интерстициальный отек (перегородки) и альвеолярный отек (затенение / уплотнение воздушного пространства)
- Когда сердце увеличено, иногда можно определить, увеличена ли конкретная камера сердца
- Контур сердца может быть ненормальным из-за сердечного или заболевание перикарда
- Контур сердца может быть не виден из-за соседнего заболевания легких
Кардиомегалия и сердечная недостаточность
Если сердце увеличено — кардио-торакальное соотношение ( CTR )> 50% — тогда поищите другие особенности сердца отказ.Специально проверьте наличие увеличения сосудов в верхней зоне, признаков отека легких и плеврального выпота.
Увеличение емкости верхней зоны
Резервуары верхней зоны обычно меньше, чем емкости нижней зоны. Выступление сосудов верхней зоны, которые имеют такой же размер или больше, чем сосуды нижней зоны, является признаком повышенного легочного венозного давления.
Признаки сердечной недостаточности
Наведите / выключите изображение, чтобы показать / скрыть результаты
Коснитесь / выключите изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять с верхней частью страницы
Признаки сердечной недостаточности
- Кардиомегалия CTR = 18/30 (> 50%)
- Увеличение сосудов верхней зоны ( 1 ) — признак легочной венозной гипертензии
- Перегородочные (Керли В) линии ( 2 ) — признак интерстициального отека — см. Далее изображение
- Затенение воздушного пространства ( 3 ) — из-за альвеолярного отека — остро в перихилярном (крыло летучей мыши) распределении
- Тупые реберно-диафрагмальные углы ( 4 ) — из-за плеврального выпота
Клиническая информация
- Ухудшение толерантности к физической нагрузке
- Хроническая неконтролируемая гипертензия
- Быстрое начало одышки
- Фибрилляция предсердий
Диагноз
- Левожелудочковая недостаточность с p отек легких
Отек легких
Отек легких проявляется в двух формах — интерстициальный отек и альвеолярный отек.
Интерстициальный отек — перегородочные линии (линии Керли B)
Перегородочные линии (также известные как линии Керли B) возникают из-за утолщения межлобулярных перегородок, которые разделяют вторичные дольки на периферии легких. Они могут быть очень незаметными, но если рассматривать их в контексте клинического подозрения на сердечную недостаточность, перегородочные перегородки являются сильным индикатором интерстициального отека.
Линии перегородки (линии Керли B)
Наведите указатель мыши на изображение, чтобы показать / скрыть результаты
Нажмите на изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять его с верхней частью страницы
Линии перегородки (Керли B линий)
- Реберно-диафрагмальный угол (деталь изображения выше)
- Горизонтальные линии, доходящие до края легкого
Диагноз
- Перегородочные линии являются специфическим признаком интерстициального отека в контексте подозрения на сердечную недостаточность
Дифференциальный диагноз
- Если нет клинического подозрения на сердечную недостаточность, то состояния, вызывающие лимфатическую обструкцию, такие как саркоидоз или карциноматозный лимфангит, следует рассматривать как возможную причину перегородок.
Альвеолярный отек
По мере прогрессирования интерстициального отека происходит утечка жидкости из интерстициальная ткань в альвеолы и небольшие дыхательные пути.В условиях острого отека легких эта альвеолярная тень исходит из прикорневых областей, где относительно больше интерстициальной ткани, по образцу «крыла летучей мыши». По мере прогрессирования отека легких это затенение становится более генерализованным.
Жидкость также просачивается в плевральные полости, вызывая плевральный выпот.
Альвеолярный отек — затенение воздушного пространства
Наведите указатель мыши на изображение, чтобы показать / скрыть результаты
Нажмите на изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять его с верхней частью страницы
Альвеолярный отек — затенение воздушного пространства
- Плотное затемнение воздушного пространства из-за альвеолярного отека, вызванного жидкостью, заполняющей альвеолы и небольшие дыхательные пути
- В острых условиях это затенение воздушного пространства излучается из прикорневых областей в виде «крыла летучей мыши», а затем становится более обобщенным
Увеличение камеры сердца
Если сердце увеличено, иногда можно определить, какая камера увеличена.Например, признаки увеличения левого предсердия включают двойную границу правого сердца, выпуклость левой границы сердца и расширение киля более чем на 90 градусов.
Увеличение левого предсердия
Наведите указатель мыши на изображение, чтобы показать / скрыть результаты
Нажмите на изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять его с верхней частью страницы
Увеличение левого предсердия
- Левое и отмечены границы правого сердца ( стрелки )
- Дополнительная граница правого сердца — образована краем увеличенного левого предсердия (выделенная область )
- Небольшая выпуклость на границе левого сердца (звездочка ) из-за увеличения ушка левого предсердия
- Раскачивание киля более чем на 90 градусов — киль лежит непосредственно над левым предсердием
Клиническая информация
- История ревматической болезни сердца и кардиохирургии — обратите внимание на замену металлических аортальных и митральных клапанов сердца ( стрелка )
Диагноз
- Кардиомегалия с увеличением левого предсердия вследствие хронического митрального клапана смешанного типа Болезнь альве
Аномальные контуры сердца
Контуры сердца могут быть ненормальными из-за сердечных аномалий, таких как аневризма левого желудочка, или аномалий перикарда, таких как перикардиальный выпот.
Аневризма левого желудочка
Наведите указатель мыши на изображение, чтобы отобразить / скрыть результаты
Нажмите на изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять его с верхней частью страницы
Аневризма левого желудочка
- Прямая грудная клетка AP Рентгеновский снимок
- Выпуклость левой границы сердца
- Круговой ободок кальцификации ( стрелок )
Клиническая информация
- Инфаркт миокарда в анамнезе
Диагноз
- Инфаркт миокарда левого желудочка — осложнение аневризмы миокарда левого желудочка
Контуры сердца не видны
Контуры сердца могут быть не видны из-за заболевания соседнего легкого.Подобно тому, как консолидация правой средней доли может скрывать правую границу сердца (правый край предсердия), так и консолидация язычка (переднего сегмента левой верхней доли) может скрывать левую границу сердца (край левого желудочка).
Консолидация язычка
Наведите указатель мыши на изображение, чтобы показать / скрыть результаты
Нажмите на изображение, чтобы показать / скрыть результаты
Щелкните изображение, чтобы выровнять его с верхней частью страницы
Консолидация язычка
- Плохо определенная граница левых отделов сердца из-за уплотнения в соседнем язычке
Клиническая информация
- Продуктивный кашель
- Повышенное количество лейкоцитов
Диагноз
Врожденные пороки сердца — факты о гипопластическом синдроме левых отделов сердца
Гипопластический (произносится как hi-puh-PLAS-tik) синдром левых отделов сердца или HLHS — это врожденный дефект, который влияет на нормальный кровоток через сердце.
Что такое синдром гипоплазии левых отделов сердца?
Синдром гипоплазии левых отделов сердца (HLHS) — это врожденный дефект, который влияет на нормальный кровоток через сердце. Поскольку ребенок развивается во время беременности, левая часть сердца формируется неправильно. Синдром гипоплазии левых отделов сердца — это один из видов врожденного порока сердца. Врожденный означает наличие при рождении. Поскольку ребенку с этим дефектом требуется хирургическое вмешательство или другие процедуры вскоре после рождения, HLHS считается критическим врожденным пороком сердца (CCHD).
Синдром гипоплазии левых отделов сердца поражает ряд структур в левой части сердца, которые не развиваются полностью, например:
- Левый желудочек недоразвит и слишком мал.
- Митральный клапан не сформирован или очень мал.
- Аортальный клапан не сформирован или очень мал.
- Восходящая часть аорты недоразвита или слишком мала.
- Часто у детей с синдромом гипоплазии левых отделов сердца также имеется дефект межпредсердной перегородки, который представляет собой отверстие между левой и правой верхними камерами (предсердиями) сердца.
У ребенка без врожденного порока сердца правая сторона сердца перекачивает бедную кислородом кровь из сердца в легкие. Левая часть сердца перекачивает богатую кислородом кровь к остальному телу. Когда ребенок растет в утробе матери во время беременности, между левой и правой сторонами сердца есть два небольших отверстия: открытый артериальный проток и открытый овальный проток . Обычно эти отверстия закрываются через несколько дней после рождения.
У детей с синдромом гипоплазии левых отделов сердца левая сторона сердца не может перекачивать богатую кислородом кровь в организм должным образом. В течение первых нескольких дней жизни ребенка с синдромом гипоплазии левых отделов сердца богатая кислородом кровь обходит плохо функционирующую левую часть сердца через открытый артериальный проток и открытое овальное отверстие. Затем правая сторона сердца перекачивает кровь как к легким, так и к остальному телу. Однако у детей с синдромом гипоплазии левых отделов сердца, когда эти отверстия закрываются, богатой кислородом крови становится трудно добраться до остального тела.
Узнайте больше о том, как работает сердце »
происхождение
По оценкам Центров по контролю и профилактике заболеваний (CDC), каждый год в США рождается около 1025 детей с синдромом гипоплазии левых отделов сердца.1 Другими словами, примерно 1 из каждых 3841 ребенка, рожденных в США каждый год, рождается родился с синдромом гипоплазии левых отделов сердца.
Женщины могут принимать меры до и во время беременности, чтобы снизить риск рождения ребенка с врожденными дефектами.Такие меры включают ежедневный прием поливитаминов с фолиевой кислотой (400 мкг), отказ от курения и отказа от алкоголя во время беременности.
Узнайте больше о том, как предотвратить врожденные дефекты »
Причины и факторы риска
Причины пороков сердца, таких как синдром гипоплазии левых отделов сердца у большинства младенцев, неизвестны. Некоторые дети имеют пороки сердца из-за изменений в их генах или хромосомах . Считается, что эти типы пороков сердца вызваны комбинацией генов и других факторов риска, таких как факторы, с которыми мать контактирует в окружающей среде, или то, что мать ест или пьет, или лекарства, которые она использует.
Подробнее о работе CDC по причинам и факторам риска »
Диагностика
Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности или вскоре после рождения ребенка.
Во время беременности
Во время беременности существуют скрининговые тесты (также называемые пренатальными тестами) для выявления врожденных дефектов и других состояний. Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности с помощью ультразвука (который создает изображения тела). Некоторые результаты ультразвукового исследования могут заставить врача подозревать, что у ребенка синдром гипоплазии левых отделов сердца.В таком случае врач может запросить эхокардиограмму плода , УЗИ сердца ребенка, чтобы подтвердить диагноз. Этот тест может показать проблемы со структурой сердца и то, как сердце работает с этим дефектом.
После рождения ребенка
Младенцы с синдромом гипоплазии левых отделов сердца могут не иметь проблем в течение первых нескольких дней жизни, пока открытый артериальный проток и открытое овальное отверстие (нормальные отверстия в сердце) открыты, но вскоре после закрытия этих отверстий появляются признаки :
- Проблемы с дыханием,
- Бьющееся сердце,
- Слабый пульс, или
- Пепельный или голубоватый цвет кожи.
Во время медицинского осмотра врач может увидеть эти признаки или услышать шум в сердце (ненормальный свистящий звук, вызванный неправильным кровотоком). Если слышен шум или присутствуют другие признаки, поставщик медицинских услуг может запросить один или несколько тестов для постановки диагноза, наиболее частым из которых является эхокардиограмма. Эхокардиография также помогает врачу следить за состоянием здоровья ребенка с течением времени.
HLHS — это дефект, который также может быть обнаружен при скрининге новорожденных с помощью пульсоксиметрии.Пульсоксиметрия — это простой прикроватный тест для определения количества кислорода в крови ребенка. Низкий уровень кислорода в крови может быть признаком ХБС. Скрининг новорожденных с использованием пульсоксиметрии может выявить некоторых младенцев с ХБП, например, HLHS, до того, как у них появятся какие-либо симптомы.
Процедуры
Лечение некоторых проблем со здоровьем, связанных с синдромом гипоплазии левых отделов сердца, может включать:
Лекарства
Некоторым младенцам и детям потребуются лекарства, которые помогут укрепить сердечную мышцу, снизить кровяное давление и помочь организму избавиться от лишней жидкости.
Питание
Некоторые дети с синдромом гипоплазии левых отделов сердца устают во время кормления и не едят достаточно, чтобы набрать вес. Чтобы обеспечить здоровую прибавку в весе младенцев, может быть прописана специальная высококалорийная смесь. Некоторые младенцы сильно устают во время кормления, и им может потребоваться кормление через зонд для кормления .
Хирургия
Вскоре после рождения ребенка с синдромом гипоплазии левых отделов сердца необходимо провести несколько операций в определенном порядке, чтобы увеличить приток крови к телу и обойти плохо функционирующую левую часть сердца.Правый желудочек становится главной насосной камерой тела. Эти операции не излечивают синдром гипоплазии левых отделов сердца, но помогают восстановить работу сердца. Иногда до или после операции назначают лекарства для лечения симптомов дефекта. Хирургия синдрома гипоплазии левых отделов сердца обычно проводится в три отдельных этапа:
- Norwood Процедура
Эта операция обычно проводится в течение первых 2 недель жизни ребенка. Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть голубоватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце. - Процедура двунаправленного шунта Гленна
Обычно выполняется, когда младенцу от 4 до 6 месяцев.Эта процедура создает прямую связь между легочной артерией и сосудом (верхней полой веной), возвращающим бедную кислородом кровь из верхней части тела в сердце. Это сокращает работу правого желудочка, позволяя крови, возвращающейся из тела, течь непосредственно в легкие. - Процедура Фонтана
Эта процедура обычно выполняется в период, когда младенцу от 18 месяцев до 3 лет. Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела к сердцу, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца больше не выглядит синеватой.
Младенцы, перенесшие эти операции, неизлечимы
У младенцев с синдромом гипоплазии левых отделов сердца могут быть пожизненные осложнения. Им потребуются регулярные контрольные посещения кардиолога (кардиолога), чтобы следить за их прогрессом. Если синдром гипоплазии левых отделов сердца очень сложен или сердце становится слабым после операций, может потребоваться пересадка сердца.Младенцам, которым сделают пересадку сердца, необходимо будет принимать лекарства всю оставшуюся жизнь, чтобы их организм не отвергал новое сердце.
Список литературы
- Mai CT, Isenburg JL, Canfield MA, et al. для Национальной сети профилактики врожденных дефектов. Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.
Изображения являются общественным достоянием и, следовательно, свободны от каких-либо ограничений авторских прав.В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Изображения являются общественным достоянием и, следовательно, свободны от каких-либо ограничений авторских прав. В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Выпрямление левой границы сердца при тяжелом митральном стенозе | QJM: Международный медицинский журнал
27-летняя женщина латиноамериканского происхождения во втором триместре беременности поступила в наше отделение неотложной помощи с постепенно ухудшающейся одышкой. Физикальное обследование было значимым для громкого S1, среднедиастолического шума митрального стеноза и базилярных хрипов. Рентген грудной клетки показал двусторонний отек легких и выпрямление левого края сердца (рис. 1).Эхокардиограмма также выявила увеличение левого предсердия и классический вид передней створки митрального клапана, напоминающий «хоккейную клюшку», что соответствует ревматическому митральному стенозу (рис. 2). Пациент был госпитализирован в отделение интенсивной терапии сердца и лечился диуретиками. Однако беременность была признана нежизнеспособной, и ее пришлось прервать. Пациент полностью выздоровел и впоследствии перенес успешную замену митрального клапана.
Рисунок 1.
Рентгенограмма грудной клетки, показывающая выпрямление левой границы сердца
Рисунок 1.
Рентгенограмма грудной клетки, показывающая выпрямление левой границы сердца
Рисунок 2.
Парастернальный вид по длинной оси, показывающий классический вид передней створки митрального клапана как «хоккейную клюшку».
Рисунок 2.
Парастернальный вид длинной оси, показывающий классический вид передней створки как «хоккейной клюшки» митрального клапана
Структуры, образующие левую границу сердца на рентгенограмме грудной клетки, суставы аорты, расширенная легочная артерия, выступающий придаток левого предсердия и левый желудочек выстраиваются по прямой линии при тяжелом митральном стенозе и создают впечатление выпрямления левая граница сердца или «митрализация» сердца.
Конфликт интересов: Не объявлен.
© Автор, 2012 г. Опубликовано издательством Oxford University Press от имени Ассоциации врачей. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Сердце (правое и левое предсердие): анатомия и функция
Заболевания предсердий
Хотя предсердия важны для временного хранения крови и подготовки сердца, большая часть работы, выполняемой сердцем, выполняется желудочками.Следовательно, большинство случаев дисфункции предсердий могут оставаться относительно незамеченными до тех пор, пока человек не попытается напряженных действий . Тем не менее, существует довольно много нарушений, влияющих на предсердия; однако большинство из них вторично к клапанной или желудочковой дисфункции.
Основными врожденными проблемами, связанными с предсердиями, являются дефекты перегородки . Другие врожденные проблемы включают аномальные электрических цепей в предсердиях, которые могут привести к суправентрикулярной тахикардии .Приобретенные нарушения включают предсердий аритмий , которые могут быть следствием дилатации и увеличения предсердий.
Дефекты межпредсердной перегородки
Дефекты межпредсердной перегородки относятся к аномальным коммуникациям между верхними камерами сердца. Напомним, что во время внутриутробной жизни существует физиологический шунт, где насыщенная кислородом кровь (от матери) входит в правое предсердие и проходит через овальное отверстие (или foramen primum и foramen secundum до 8-й недели гестации) в левое предсердие, чтобы быть прошел в левый желудочек и распространился по кровотоку плода.При нормальных обстоятельствах эти коммуникации прекращаются в течение трех месяцев после внематочной жизни. Если есть дефект межпредсердной перегородки, то первоначально кровь будет течь из левого предсердия вправо. Обычно это не связано со значительной заболеваемостью, поскольку смешанная кровь направляется в легкие, где она будет в достаточной степени насыщена кислородом. К сожалению, со временем правое предсердие будет подвергаться относительно более высокому давлению, и его миокард будет гипертрофирован . Если давление в правом предсердии превышает давление в левом предсердии, шунт будет реверсирован (справа налево) .Следовательно, кровь с более низким насыщением кислородом будет закачиваться в большой круг кровообращения, и человек, вероятно, испытает симптомы гипоксемии .
Генетическая основа дефектов межпредсердной перегородки хорошо задокументирована. Синдромные аномалии, такие как DiGeorge (микроделеция 22q11.2), Down (трисомия 21) и Эллис-ван Кревельд (мутация 4p16, также известная как хондроэктодермальная дисплазия), были связаны с синдромами предсердной перегородки. дефекты.Хотя их обычно диагностируют в детстве, нередки случаи, когда у взрослых также возникают дефекты межпредсердной перегородки. Наряду с вальвулопатиями они являются наиболее частыми типами врожденных пороков сердца. Шесть из десяти пациентов с дефектом межпредсердной перегородки — женщины. Наиболее распространенный тип дефектов межпредсердной перегородки — патентное отверстие secundum , за которым следует патентное овальное отверстие . Другие дефекты межпредсердной перегородки включают стойкое устье primum на фоне дефекта эндокардиальной подушки, венозного синуса и общего предсердия.
Патогенез можно свести к одной из следующих проблем:
- Аномальное всасывание первичной перегородки, когда реабсорбируется неправильная часть или слишком большая часть перегородки, может привести к открытому овальному отверстию. Аномально большое овальное отверстие также может сохраняться из-за того, что оно не будет адекватно закупорено оставшейся первичной перегородкой.
- Неспособность вторичной перегородки сформироваться должным образом и закупорить вторичное отверстие может привести к сохранению дефекта во внематочной жизни.
- Если эндокардиальные подушки не срастаются, тогда первичная перегородка останется проходимой, поскольку первичной перегородке не с чем сливаться. Это наиболее вероятная причина дефектов эндокардиальной подушки с ostium primum.
Заболевания синоатриального узла
Вегетативная нервная система работает в тандеме, чтобы регулировать деятельность синоатриального узла . Считается, что сердце находится в синусном ритме , пока есть скоординированные сокращения предсердий, за которыми следуют нормальные сокращения желудочков.Это можно продемонстрировать на электрокардиографе по зубцу P, предшествующему каждому комплексу QRS, с нормальными интервалами.
Нормальный пульс колеблется от 60 до 100 ударов в минуту. У некоторых людей, склонных к спорту, частота сердечных сокращений в состоянии покоя может быть менее 60 ударов в минуту. Это синус брадикардия может быть нормальным вариантом; однако есть патологические причины этих результатов. Патологический пример этого — больной синус синдром (также называемый синоатриальной болезнью), который представляет собой возрастную дегенерацию или ишемическое повреждение синусового узла, приводящее к фиброзу специализированного миокарда.Помимо синусовой брадикардии, пациенты могут также испытывать головокружение, сердцебиение и синкопальные приступы в результате периодической остановки синусового узла и предсердных или желудочковых аритмий.
Предсердная тахиаритмия
Предсердные тахиаритмии — это группа заболеваний, характеризующихся аномально высокой частотой сокращений предсердий (> 100 ударов в минуту ). Эти сокращения часто бывают нескоординированными и неэффективными, что приводит к снижению наполнения желудочков.Эти формы тахикардии обычно связаны с эктопическими очагами , которые распространяются в аномальной электрической цепи. Два наиболее распространенных типа предсердных тахиаритмий включают фибрилляцию предсердий и трепетание предсердий.
Мерцательная аритмия
Предсердия Фибрилляция — обычно заболевание пожилых людей; с коэффициентами распространенности (первоначально около 0,5%), которые увеличиваются с возрастом (примерно 9% лиц старше 80 лет).Патофизиология фибрилляции предсердий такова, что существует аномальных автоматических , обычно происходящих из легочных вен или аномальной ткани предсердий, которая распространяется вокруг возвратных электрических петель внутри предсердий. Наличие реентерабельного пути и постоянного эктопического , запускающего , способствует хронизации аритмии.
Предсердие дилатация и ишемическая ткань способствует развитию возвратных цепей.Расширение приводит к растяжению электрического пути, что замедляет распространение потенциала действия через определенную петлю. В результате некоторые ткани выходят из нормального рефрактерного периода после потенциала действия (т.е. завершают реполяризацию) и, следовательно, могут быть преждевременно деполяризованы эктопическим сокращением. Миокард заживает, образуя фиброзную ткань, которая плохо проводит электричество. Следовательно, потенциал действия должен найти альтернативный (возможно, более длинный) маршрут путешествия; что приводит к аналогичной ситуации, описанной выше.
Неэффективная, нескоординированная и быстрая активность предсердий передается в желудочки через атриовентрикулярный узел. Случайно, из-за плохой координации этих импульсов, нерегулярно активируется атриовентрикулярный узел . Следовательно, у пациентов с фибрилляцией предсердий характерна нерегулярно-нерегулярная ( нерегулярная прерывистая ) пульс частота . Эти пульсации не только нерегулярны, но и происходят с разными интервалами.Электрокардиограф пациента с фибрилляцией предсердий покажет нерегулярную активность желудочков и нерегулярную активность предсердий в виде фибрилляции волн . Следовательно, нет четкой взаимосвязи между предсердной и желудочковой активностью. Для завершения у пациента также может быть регулярно нерегулярная (регулярная прерывистая) частота пульса. Хотя эти пульсации нерегулярны, они происходят с типичными интервалами. Подобные закономерности можно наблюдать при синусовой аритмии или блокаде сердца второй степени.
Фибрилляция предсердий бывает одной из трех форм:
- Пароксизмальная фибрилляция предсердий длится до семи дней, а затем самопроизвольно прекращается,
- Стойкая фибрилляция предсердий , требующая химической или электрической кардиоверсии,
- Постоянная фибрилляция предсердий
Вскоре после появления электрической аномалии сердце, вероятно, подвергнется электрическому ремоделированию.Если он сохраняется в течение нескольких месяцев, произойдет структурное перестройка сердца. По этой причине фибрилляция предсердий считается прогрессирующим заболеванием, так что у пациентов с пароксизмальным заболеванием со временем может развиться постоянная фибрилляция предсердий.
К сожалению, фибрилляция предсердий связана со значительной заболеваемостью (приступы обморока, учащенное сердцебиение, ускорение основного заболевания сердца) и смертностью (обычно вызванной инсультом). Слабое сокращение предсердий приводит к гемостазу внутри предсердий.Гемостаз способствует образованию тромба (вспомните триаду Вирхова ), как правило, в пределах ушка левого предсердия; где эти сгустки могут вызвать тромбоэмболические события .
В свете этих потенциально катастрофических событий, основа лечения этих пациентов включает ритм контроль (химически с бета-блокаторами и / или антиаритмическими агентами класса III или электрически с дефибрилляцией постоянного тока), скорость контроль ( с бета-блокадой, дигоксином или верапамилом) и тромбоэмболия профилактика (с варфарином или новым пероральным антикоагулянтом, таким как дабигатран).Катетерная абляция аномальной электрической цепи также является вариантом лечения для пациентов с фибрилляцией предсердий, которые не поддаются медикаментозной терапии.
Трепетание предсердий
В отличие от фибрилляции предсердий, которая связана с эктопическими очагами, трепетание предсердий возникает в результате больших обратных контуров в области трикуспидального кольца правого предсердия. Кроме того, предсердная тахикардия примерно 300 ударов в минуту связана с вариабельной атриовентрикулярной блокадой.Предсердные сокращения передаются в желудочки и могут привести к гемодинамической нестабильности. Электрокардиограф отображает патогномоничную особенность «зубчатой» предсердной активности ; что может быть связано с атриовентрикулярной блокадой. Эта конкретная аномалия должна быть главным дифференциалом для пациентов с электрокардиографами, которые показывают узкую сложную тахикардию с частотой> 150 ударов в минуту.
Химический (амиодарон) или электрический (дефибрилляция постоянным током) кардиоверсия может помочь восстановить нормальный ритм, в то время как контроль частоты сердечных сокращений достигается с помощью бета-блокаторов, дигоксина или верапамила.Как амиодарон, так и бета-адреноблокаторы предотвращают рецидив трепетания предсердий. Катетерная абляция — окончательный вариант лечения; предлагая полное излечение до 90% пациентов.
Увеличение предсердия
Увеличение предсердий означает увеличение объема предсердий. Это всегда патологический процесс, который может затронуть оба предсердия. Однако увеличение левого предсердия () встречается чаще, чем увеличение правого предсердия.Любое состояние, повышающее давление на предсердия, может привести к увеличению предсердий. Следовательно, спектр этиологических факторов, вызывающих увеличение предсердий, включает (но не ограничивается ими) дефекты перегородки, вальвулопатии и гипертензию (как системную, так и легочную).
Увеличение левого предсердия
Увеличение левого предсердия встречается чаще, чем увеличение правого предсердия, в основном потому, что причины увеличения левого предсердия встречаются чаще.Причины можно разделить на врожденных (таких как дефекты межжелудочковой перегородки или открытый артериальный проток) или приобретенных причин (таких как гипертрофия левого желудочка или митральная недостаточность вследствие хронической гипертензии или митрального стеноза).
Другой способ сгруппировать причины увеличения левого предсердия — рассмотреть причины, которые приводят к перегрузке объемом в предсердии (дефекты перегородки, открытый артериальный проток и митральная регургитация) и те, которые приводят к увеличению давления в левом предсердии на (хроническая гипертензия, митральный стеноз и гипертрофия левого желудочка).Независимо от причины, конечным результатом является растяжение предсердий. Прогрессирующая дилатация отмечена как независимый фактор риска повышенной смертности и заболеваемости, поскольку это явление связано как с фибрилляцией предсердий, так и с тромбоэмболическими явлениями (обсуждалось ранее), а также с легочной гипертензией.
Помимо осложнений фибрилляции предсердий и тромбоэмболии, пациенты могут также испытывать паралич левого рецидивирующего гортанного нерва ( синдром Ортнера ) и затруднение глотания в тяжелых случаях ( дисфагия мегатриенс ) в результате массового эффекта увеличенное левое предсердие.На электрокардиограмме раздвоенных зубцов P, (по крайней мере с одним маленьким прямоугольником — 0,04 секунды между двумя пиками) и общее увеличение продолжительности зубца P (около 0,11 секунды) видны во II отведении. В отведении V1 будет отображаться двухфазный зубец P, причем отрицательная часть (соответствующая деполяризации левого предсердия) будет глубже как минимум на 1 мм. Однако точный диагноз лучше всего поставить с помощью эхокардиографии, где можно измерить фактический объем предсердия.
Увеличение правого предсердия
Как и увеличение левого предсердия, увеличение правого предсердия возникает в результате увеличения объема крови или давления в предсердии.Повышение давления в правом предсердии на может быть результатом накачки стенозированных трикуспидальных или легочных клапанов, гипертрофированного правого желудочка или переданного повышения давления в результате легочной гипертензии (вторично по отношению к хроническому заболеванию легких). Дефект межпредсердной перегородки с шунтом слева направо также может привести к увеличению передаваемого давления в правое предсердие.
Несостоятельный трикуспидальный клапан (либо из-за первичного клапанного заболевания, либо как последствия дилатационной кардиомиопатии) может привести к увеличению на объема крови, прошедшей в правое предсердие, на .Последствия аналогичны тем, которые наблюдаются при недостаточности митрального клапана при дилатации правого предсердия. Хотя эхокардиография будет подходящим тестом для окончательного диагноза, есть ключевые особенности электрокардиографии, которые подтверждают диагноз. Эти изменения включают увеличение амплитуды зубца P в нижних отведениях (> 2,5 мм) и в прекардиальных отведениях V1 и V2 (> 1,5 мм).
Сердце — AMBOSS
Сводка
Сердце — мышечный орган, расположенный в среднем средостении, который перекачивает кровь по кровеносной системе.Сердце окружено перикардом и разделено на четыре камеры: два предсердия и два желудочка. Правое предсердие и желудочек часто называют правым сердцем, а левое предсердие и желудочек часто называют левым сердцем. Предсердия и желудочки разделены атриовентрикулярными клапанами, тогда как желудочки и артериальные пути оттока сердца (а именно легочный ствол и аорта) разделены полулунными клапанами. Стенка сердца состоит из эндокарда (самого внутреннего), миокарда и эпикарда.Проводящая система сердца состоит из специализированных узлов и кардиостимуляторов, которые инициируют и координируют сокращение сердца.
Правое сердце получает дезоксигенированную кровь из большого круга кровообращения и перекачивает ее по малому кругу кровообращения, где она насыщается кислородом. Затем левое сердце получает насыщенную кислородом кровь из малого круга кровообращения и перекачивает ее по кровеносным сосудам большого круга кровообращения. Коронарные артерии, а именно правая коронарная артерия и левая коронарная артерия, возникают в корне аорты и снабжают миокард и эндокард.Сердце развивается эмбриологически из сердечной трубки, которая подвергается петлеобразованию и перегородке, чтобы разделить его на четыре камеры.
Макроанатомия
Обзор
Левое предсердие — это самая задняя часть сердца, расположенная непосредственно перед пищеводом. Это можно визуализировать с помощью TEE. Правый желудочек является самой передней частью сердца и подвергается наибольшему риску травмы в результате травмы грудной клетки.
Сокращение верхушки сердца обычно можно пальпировать слева от грудины, медиальнее среднеключичной линии в межреберье 4 –5 .У пациентов с декстрокардией ориентация сердца обратная, поэтому верхушка располагается справа от средостения, а не слева.
Камеры сердца
Два предсердия
Разделены межпредсердной перегородкой (Овальная ямка видна на перегородке как небольшое углубление овальной формы в межпредсердной перегородке.)
Два желудочка сердца
- Правый желудочек
- Левый желудочек
Границы сердца
Границы сердца образуют силуэт сердца на рентгенограмме грудной клетки!
Клапаны сердца
- Два типа сердечных клапанов, различающиеся расположением и морфологией
- Каркас сердца
- Состоит из четырех фиброзных колец (annuli fibrosi cordis), окружающих атриовентрикулярное и артериальное отверстия.
- Функция
- Разделяет предсердия и желудочки
- Обеспечивает анкерную и структурную поддержку клапанов
- Обеспечивает электрическую изоляцию между предсердиями и желудочками
- Закрытие сердечных клапанов производит тоны сердца (подробнее см. Аускультацию сердца при обследовании сердечно-сосудистой системы.)
Эта мнемоника показывает порядок, в котором кровь течет через сердечные клапаны: Попробуйте ПУЛЛИНГ Мою АОРТУ (трикуспидальную, легочную, митральную, аортальную)!
Атриовентрикулярные клапаны
- Строение: створки на подклапанном аппарате
- Клапаны
- Подклапанный аппарат
Эта мнемоника обеспечивает правило двойки и тройки для атриовентрикулярных клапанов: трехстворчатый клапан имеет три створки и расположен с правой стороны, как и трехлопастное правое легкое.Двустворчатый (митральный) клапан имеет две створки и расположен с левой стороны, как и двудольное левое легкое!
Клапаны полулунные
- Состав: три бугорка серповидной формы без подклапанного аппарата.
- Клапаны
Коронарные артерии
- Левая и правая коронарные артерии отходят от корня аорты и снабжают сердечную мышцу артериальной кровью.
- Доминирование коронарных артерий
- Коронарный кровоток достигает пика во время ранней диастолы в момент, когда перепад давления между аортой и желудочком является наибольшим (см. Диаграмму давление-объем левого желудочка.)
ПМЖВ является наиболее часто окклюзированной коронарной артерией, и ее часто называют «вдовой» из-за высокой смертности, связанной с инфарктом ПМЖВ.
ПКА обычно снабжает проводящую систему сердца (синус и АВ-узел), поэтому стеноз или окклюзия этого сосуда часто приводит к сердечной аритмии!
Венозный дренаж
Лимфатические сосуды сердца оттекают в передние средостенные и трахеобронхиальные узлы.
Иннервация
Структуры проводящей системы сердца
Ссылки: [1] [2] [3] [4] [5]
Микроскопическая анатомия
Слои сердца
- Сама стенка сердца состоит из трех слоев (изнутри наружу):
- Перикард: мембрана, которая непосредственно окружает сердце
Эндокард
Миокард
- Описание: толстый миокардиальный слой, состоящий из следующих элементов:
Поврежденная ткань миокарда заменяется неконтрактильной рубцовой тканью (фиброз), которая плохо проводит электрические импульсы и, таким образом, предрасполагает к сердечным аритмиям.
Перикард
Объем полости перикарда ограничен жестким фиброзным перикардом. Если жидкость ненормально скапливается в перикардиальном пространстве (перикардиальный выпот), внутриперикардиальное давление увеличивается и может нарушить сердечную функцию → тампонада перикарда.
Из-за сенсорной иннервации перикарда диафрагмальным нервом перикардит может вызывать боль в шее, руках или плечах (часто с левой стороны).
Каталожные номера: [6]
Эмбриология
Обзор
- Мезодермальное происхождение
- Этапы развития сердца
- Две отдельные эндокардиальные трубки сливаются, образуя сердечную трубку.
- Прямая сердечная трубка трансформируется в S-образную сердечную петлю.
- Эндокардиальные подушки срастаются друг с другом и сливаются, разделяя предсердия и желудочки.
- Формируются два предсердия и два желудочка, а один общий тракт оттока делится на ствол аорты и легочный ствол.
- Клапаны формируются из эндокардиальной подушки.
- Кровообращение плода рассматривается в соответствующем разделе пренатальной и послеродовой физиологии.
- Постнатальные производные сосудистых структур плода рассматриваются в разделе постнатальной адаптации кровеносной и дыхательной системы статьи по пренатальной и постнатальной физиологии.
Стойкий артериальный ствол — врожденный порок сердца, при котором артериальный ствол не может разделиться на аорту и легочную артерию до рождения.
Сердечный морфогенез
См. Бледные врожденные пороки сердца и цианотические пороки сердца для ассоциированных пороков сердца.
Сердечная петля
4-я неделя беременности: петлевание первичной сердечной трубки устанавливает лево-правую полярность
Сердце начинает спонтанно биться к 4-й неделе беременности и определяется с помощью трансвагинального ультразвукового исследования на 6-й неделе беременности.
Дефект сердечной петли вызван дефектом динеинового плеча микротрубочек и приводит к синдрому Картагенера с обратным положением и декстрокардией. Подробнее см. Первичную дискинезию.
Перегородка камеры
Перегородка предсердия
- Развитие первичной перегородки и первичного затылочного отверстия
- Сужение первичного затылочного отверстия происходит по мере того, как первичная перегородка приближается к эндокардиальной подушке.
- Развитие вторичного затылочного отверстия
- Развитие второй перегородки
- Вторая мышечная перегородка начинает расти двумя сегментами:
- Развитие ovale cordis
- Формирование межпредсердной перегородки (без дальнейшего межпредсердного сообщения)
Если первичная перегородка и вторая перегородка не срастаются после рождения, остается открытое овальное отверстие (PFO). В более позднем возрасте PFO может привести к парадоксальному эмболу, при котором венозный тромб может перемещаться через PFO из венозного в артериальный кровоток и вызывать инфаркт органа-мишени (например,г., ход).
Желудочковая перегородка
- Каудально расположенная мышечная межжелудочковая перегородка образует межжелудочковое отверстие между двумя желудочками.
- Краниально развивающаяся аортопульмональная перегородка вращается и каудально сливается с мышечной межжелудочковой перегородкой → это слияние образует перепончатую межжелудочковую перегородку и закрывает межжелудочковое отверстие (сердце).
- Эндокардиальные подушки растут для дальнейшего разделения желудочков и предсердий.
Аномальное развитие перепончатой межжелудочковой перегородки приводит к дефекту межжелудочковой перегородки, наиболее частой врожденной аномалии сердца.
Развитие оттока
- Развитие аортально-легочной перегородки (AP перегородки)
- Отделение желудочкового оттока
Ассоциированные патологии конотрункала:
— Нарушение спирали: транспозиция магистральных сосудов
— Смещенная передне-передняя перегородка: тетралогия Фалло
— Частичное развитие передне-передней перегородки: стойкий артериальный ствол
Формирование клапана
Неправильное развитие сердечных клапанов может привести к
— Стенотические клапаны
— Регургитирующие клапаны
— Смещенные клапаны (напр.g., аномалия Эбштейна)
— Атретические клапаны (например, атрезия трехстворчатого клапана)
— Незначительные аномалии (например, двустворчатый аортальный клапан)
Ссылки: [1]
Клиническое значение
Врожденные пороки сердца — типы
Врожденная болезнь сердца относится к ряду возможных пороков сердца.
Стеноз аортального клапана
Стеноз аортального клапана — серьезный тип врожденного порока сердца.
При стенозе аортального клапана сужается аортальный клапан, который контролирует поток крови из основной насосной камеры сердца (левый желудочек) в главную артерию тела (аорту). Это влияет на поток богатой кислородом крови от сердца к остальным частям тела и может привести к утолщению мышцы левого желудочка, потому что насос должен работать с большей нагрузкой.
Коарктация аорты
Коарктация аорты (КоА) — это место, где основная артерия (аорта) имеет сужение, что означает, что через нее может проходить меньше крови.
КоА может возникать сам по себе или в сочетании с другими типами пороков сердца, такими как дефект межжелудочковой перегородки или тип дефекта, известный как открытый артериальный проток.
Сужение может быть серьезным и часто требует лечения вскоре после рождения.
Аномалия Эбштейна
Аномалия Эбштейна — редкая форма врожденного порока сердца, при которой клапан на правой стороне сердца (трикуспидальный клапан), разделяющий правое предсердие и правый желудочек, не развивается должным образом.Это означает, что кровь может течь в неправильном направлении в сердце, а правый желудочек может быть меньше и менее эффективным, чем обычно.
Аномалия Эбштейна может возникнуть сама по себе, но часто возникает при дефекте межпредсердной перегородки.
Открытый артериальный проток
Когда ребенок развивается в утробе матери, кровеносный сосуд, называемый артериальным протоком, соединяет легочную артерию непосредственно с аортой. Артериальный проток отводит кровь от легкого (которое до рождения не работает нормально) в аорту.
Открытый артериальный проток — это место, где это соединение не закрывается после рождения, как предполагалось. Это означает, что в легкие закачивается лишняя кровь, заставляя сердце и легкие работать тяжелее.
Стеноз клапана легочной артерии
Стеноз легочного клапана — это дефект, при котором легочный клапан, который контролирует поток крови из правой насосной камеры сердца (правого желудочка) в легкие, уже, чем обычно.Это означает, что правый сердечный насос должен работать сильнее, чтобы протолкнуть кровь через суженный клапан в легкие.
Дефекты перегородки
Дефект перегородки — это аномалия в стенке (перегородке) между главными камерами сердца. Ниже описаны два основных типа дефекта перегородки.
Дефекты межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) — это отверстие между двумя собирающими камерами сердца (левым и правым предсердиями).Когда есть РАС, дополнительная кровь течет через дефект в правую часть сердца, заставляя его растягиваться и увеличиваться.
Дефекты межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) — распространенная форма врожденного порока сердца. Это происходит, когда есть отверстие между двумя насосными камерами сердца (левый и правый желудочки).
Это означает, что лишняя кровь течет через отверстие из левого желудочка в правый из-за разницы давлений между ними.Избыточная кровь поступает в легкие, вызывая высокое давление в легких и растяжение левой насосной камеры.
Маленькие отверстия часто в конечном итоге закрываются сами по себе, но большие отверстия необходимо закрывать хирургическим путем.
Дефекты одиночного желудочка
Дефект одиночного желудочка — это место, где только одна из насосных камер (желудочков) развивается должным образом. Без лечения эти дефекты могут быть фатальными в течение нескольких недель после рождения.Однако в настоящее время можно проводить сложные операции на сердце, которые улучшают долгосрочную выживаемость, но могут оставить у человека симптомы и сократить продолжительность жизни.
Два наиболее распространенных дефекта одиночного желудочка описаны ниже.
Синдром гипоплазии левых отделов сердца
Синдром гипоплазии левых отделов сердца (HLHS) — это редкий тип врожденного порока сердца, при котором левая сторона сердца не развивается должным образом и слишком мала. Это приводит к тому, что в организм не поступает достаточно насыщенной кислородом крови.
Атрезия трехстворчатого клапана
Атрезия трехстворчатого клапана — это место, где трикуспидальный клапан сердца сформирован неправильно. Трехстворчатый клапан разделяет правую сборную камеру (предсердие) и насосную камеру (желудочек). Кровь не может нормально течь между камерами, что приводит к недостаточному развитию правой насосной камеры.
Тетралогия Фалло
Тетралогия Фалло — это редкое сочетание нескольких дефектов.
Дефекты, составляющие тетралогию Фалло:
- Дефект межжелудочковой перегородки — отверстие между левым и правым желудочком
- стеноз клапана легочной артерии — сужение клапана легочной артерии
- гипертрофия правого желудочка — утолщение мышцы правого желудочка
- преобладающая аорта — где аорта находится не в своем обычном положении, выходит из сердца
В результате такого сочетания дефектов насыщенная кислородом и не насыщенная кислородом кровь смешивается, в результате чего общее количество кислорода в крови становится ниже нормы.Это может привести к тому, что ребенок иногда будет казаться синим (это называется цианозом).
Полная (или частичная) аномалия соединения легочных вен (TAPVC)
TAPVC возникает, когда 4 вены, по которым насыщенная кислородом кровь из легких поступает в левую часть сердца, не соединены нормальным образом. Вместо этого они подключаются к правой стороне сердца.
Иногда только некоторые из 4 вен соединяются ненормально, что известно как частичное аномальное соединение легочных вен и может быть связано с дефектом межпредсердной перегородки.Реже сужаются и вены, что может привести к летальному исходу в течение месяца после рождения.
Транспозиция магистральных артерий
Транспозиция магистральных артерий серьезная, но редкая.
Здесь легочные и аортальные клапаны и артерии, с которыми они связаны (легочная артерия (легкая) и артерия аорты (основного тела)) «переставлены местами» и подключены не к той насосной камере. Это приводит к тому, что кровь с низким содержанием кислорода перекачивается по телу.
Артериальный ствол
Артериальный ствол — необычный тип врожденного порока сердца.
Здесь две основные артерии (легочная артерия и аорта) не развиваются должным образом и остаются единым сосудом. Это приводит к тому, что в легкие поступает слишком много крови, что со временем может вызвать затруднение дыхания и повредить кровеносные сосуды в легких.
Артериальный ствол обычно заканчивается летальным исходом, если его не лечить.
Схема сердца
Кредит:
ttsz / Thinkstock
https://www.istockphoto.com/gb/vector/heart-anatomy-gm505694104-83813687
Фондовой библиотеки больше не существует. Изображение было добавлено на веб-страницу в течение срока подписки и может использоваться на той же странице неограниченное время — в соответствии с правилами подписки Thinkstock. Дополнительная информация о лицензировании ThinkStock находится внизу этой страницы:
https: // слияние.service.nhs.uk/display/VP/Photography+stock+sites
Последняя проверка страницы: 12 июня 2018 г.
Срок следующей проверки: 12 июня 2021 г.
.