Работа № 3. Определение количества эритроцитов в крови
3.1. Подсчет количества эритроцитов в камере Горяева
Принцип метода
состоит в подсчете эритроцитов в камере
Горяева. Для уменьшения концентрации
форменных элементов и создания удобной
для подсчета их концентрации кровь
предварительно разводится стандартным
образом.
Ход работы
Пипеткой отмерьте
4 мл разводящего раствора (3,5% раствор
NaCl)
и вылейте в сухую пробирку. Капилляр
Сали обработайте раствором цитрата
натрия.
Из прокола пальца
(работа № 1) выпустите свежую каплю
крови, приставьте к ней кончик капилляра
Сали и наполните его до отметки 0,02. Это
соответствует объему 0, 02 мл или 20 мкл.
Вытрите кончик капилляра и выпустите
кровь в пробирку с разводящим раствором.
Полученное таким образом разведение
крови — 1:200.
После тщательного
перемешивания раствора крови небольшой
каплей заполните подготовленную — с
притертым стеклом камеру Горяева. Камеру
Камеру
перед заполнением промойте водой и
насухо вытрите. На участок камеры, где
нанесены сетки, уложите обезжиренное
покровное стекло, при этом нижняя
поверхность камеры должна находиться
на третьих пальцах обеих рук, двумя
вторыми пальцами придерживайте ее
спереди. Двумя пальцами притрите
покровное стекло, плавно продвигая его
по поверхности прямоугольных пластинок
до появления цветных колец Ньютона в
местах соприкосновения покровного
стекла с поверхностью пластинок камеры.
Каплю исследуемой
жидкости пипеткой поместите перед
щелью, образованной покровным стеклом
и пластинкой камеры Горяева с нанесенной
сеткой. Капля должна заполнить камеру
самотеком (под действием капиллярных
сил). Следите, чтобы в пространстве над
сеткой не было пузырьков воздуха и
избытка жидкости.
До начала подсчета
оставьте счетную камеру на 1 — 2 мин для
осаждения форменных элементов. Камеру
положите на столик микроскопа и настройте
его на малое увеличение (объектив 8 — 9,
окуляр 10 или 15). Подсчет производите при
Подсчет производите при
несколько опущенном конденсоре. Хорошую
контрастность обеспечивает
фазово-контрастное устройство. Эритроциты
считайте в пяти больших квадратах,
состоящих из 16 малых (5
16 = 80 малых), расположенных по диагонали.
Для записи результатов рекомендуется
предварительно расчертить на листе 5
больших квадратов, разлинованных 4х4 и
записывать найденное число эритроцитов
в каждую клеточку. При подсчете необходимо
помнить правило буквы «Г».
Подсчитав число
эритроцитов в 80 маленьких квадратах
(N)
рассчитывают число клеток в 1 мкл (мм3)
крови (X).
Для этого учитывается разведение в 200
раз, объем камеры над одним маленьким
квадратиком 1/4000 мкл и то, что клетки
подсчитывались в 80 таких квадратах.
Таким образом, формула для вычисления
количества эритроцитов следующая:
Х=(Nх4000х200)/80
Полученное
количество эритроцитов можно также
выразить в количестве на 1л крови
(умножением полученного количества на
106),
что является стандартной размерностью
этого показателя.
Рекомендации
по оформлению протокола работы. Выводы
делаются исходя из того, что в норме
количество эритроцитов должно составлять:
3,6-4,5 х 1012
кл/л для
женщин; 4,5 — 5 х 1012
кл/л — для
мужчин. После небольшой нагрузки – 5 —
5,5 х 1012 кл/л.
Сразу
после рождения количество эритроцитов
составляет около 6,0
х 1012 кл/л
(колебания в пределах 5,4 — 7,2 х 1012
кл/л). С
конца первых — начала вторых суток
жизни обычно происходит снижение числа
эритроцитов в крови, наиболее выраженное
на 5 — 7-й день. Минимального значения
этот показатель достигает к 2 — 3 мес, а
затем несколько увеличивается и в
дальнейшем (с 5 — 6-го месяца) поддерживается
на уровне взрослых.
Если количество
эритроцитов выше нормы, то это явление
называется эритроцитоз,
а если меньше, то эритропения
или
анемия.
Увеличение количества эритроцитов в
крови (эритроцитоз)
встречается
при гемоконцентрации (ложный
эритроцитоз),
а также при
усилении эритропоэза на фоне неизменной
интенсивности гемолиза (истинный
эритроцитоз).
Уменьшение
количества эритроцитов в крови может
наблюдаться при гемодилюции (ложная
эритропения).
| Обратная связь | Количество форменных элементов в крови имеет большое значение для нормального состояния организма. Определение их количества производят под микроскопом, используя специальные счетные камеры. Подсчет производят в 1 мм3 (мкл) крови, для чего пробу крови разбавляют в специальных смесителях (меланжерах), чтобы создать нужную концентрацию клеток, удобную для подсчета.
Цель работы. Определить количество форменных элементов (эритроцитов и лейкоцитов) в исследуемой пробе крови.
Материалы и оборудование: Счетная камера Горяева (рис. 3) представляет собой толстое предметное стекло, в средней части которого имеются четыре желобка. Между ними образуются узкие площадки. Средняя площадка ниже боковых на 0,1 мм и разделена пополам поперечным желобком (канавкой).
Рис. 3. Камера Горяева (внешний вид)
Каждый третий квадрат разделен на 16 малых квадратов. Таких больших квадратов, разделенных на маленькие, в сетке 25. Сторона малого квадрата равняется 1/20 мм, площадь – 1/400 мм2, а объем пространства над малым квадратом равен 1/400 мм2 ´ 1/10 мм = 1/4000 мм3 (мкл). Сторона большого квадрата равняется 1/5 мм, площадь – 1/25 мм2, а объем пространства над квадратом равен 1/25 мм2 ´ 1/10 мм = 1/250 мм3 (мкл). Длина стороны всей сетки составляет 3 мм, площадь – 9 мм2, объем 0,9 мм3 (мкл).
Знакомимся с устройством счетной камеры и сеткой, поместив ее под микроскоп и рассмотрев на малом (объектив ´10) и большом (объектив ´40) увеличениях.
Рис. 4. Сетка камеры Горяева
Смеситель представляет собой пипетку с ампулообразным расширением (рис. 5). В ампуле находится стеклянная бусинка для лучшего размешивания крови. На капилляре нанесены две метки: «0,5» и «1,0»; третья метка стоит за ампулообразным расширением: на смесителе для эритроцитов – «101», для лейкоцитов – «11». Если в смеситель для эритроцитов набирают кровь до метки «1,0», а затем наливают разбавляющую жидкость, доводя общий объем до «101», кровь разводится в 100 раз.
Рис.
При разведении в 200 раз кровь следует набирать в смеситель до метки «0,5». Аналогично в смесителе для лейкоцитов получают разбавление крови в 10 и 20 раз.
Для разбавления крови при подсчете эритроцитов применяют гипертонический раствор NaCl (3 %), в котором эритроциты сморщиваются. При подсчете лейкоцитов применяют 5 % раствор уксусной кислоты, подкрашенной метиленовой синью. Кислота разрушает оболочки эритроцитов и лейкоцитов, а метиленовая синь окрашивает ядра последних. При этом эритроциты становятся невидимыми и не мешают подсчету лейкоцитов.
Зарисовываем смесители для эритроцитов и лейкоцитов. Обозначаем их составные части и метки.
Ход работы. При помощи груши, соединенной гибким резиновым шлангом со смесителем для эритроцитов, набираем кровь в его капилляр до метки «0,5» (следим, чтобы не попали пузырьки воздуха). Вытираем конец капилляра фильтровальной бумагой и быстро переносим его в раствор для разведения крови.
Сетку камеры плотно закрываем покровным стеклом, притерев последнее до появления цветных колец (кольца Ньютона), что служит показателем того, что стекла прилегают вплотную. Для этого камеру перед работой тщательно моют водой, вытирают насухо; так же подготавливают шлифованное покровное стекло. Камеру Горяева берут в руку. На участок камеры, где нанесена сетка, укладывают шлифованное покровное стекло. Затем стекло берут и другой рукой. При этом нижняя поверхность камеры находится на двух средних пальцах, два указательных пальца придерживают ее спереди. Свободными двумя большими пальцами притирают шлифованное покровное стекло, плавно продвигая его по поверхности прямоугольных стеклянных пластинок до появления цветных колец Ньютона в местах плотного прилегания (притирания) покровного стекла к поверхности прямоугольных пластинок камеры (это свидетельствует о высоте камеры в 0,1 мм).
Сняв резиновую трубку со смесителя и зажав пальцами оба конца встряхиваем его в течение минуты. Выдуваем три капли из смесителя на вату, нанося четвертую на среднюю пластинку камеры у края покровного стекла. Капля заполняет камеру благодаря капиллярным силам. Обычно одну из сеток заполняют для подсчета эритроцитов, другую – для подсчета лейкоцитов. Излишек раствора при этом стекает в желобки. Если на сетку попал воздух, то камеру следует промыть дистиллированной водой, насухо вытереть и заполнить снова. Заполненную камеру оставляем в горизонтальном положении на 1 мин (для оседания форменных элементов на ее дно), а затем, не меняя ее положения, ставим под микроскоп, и если форменные элементы расположены равномерно, приступаем к подсчету. Считать удобно на малом увеличении.
В последнее время, для разведения исследуемой пробы крови вместо смесителей используют обычные пробирки, наполненные разводящей жидкостью (4 мл при подсчете эритроцитов и 0,4 мл при подсчете лейкоцитов).
Подсчитываем число эритроцитов в 5 больших квадратах, разделенных на 16 малых, расположенных в различных местах сетки, например, по диагонали.
, где
Э – найденная сумма эритроцитов в 5 больших (80 малых) квадратах.
Подсчет лейкоцитов производим в 25 больших квадратах (400 малых). Итоговая формула для подсчета лейкоцитов следующая:
, где
Л – сумма лейкоцитов в 25 больших (400 малых) квадратах.
Для расчета количества лейкоцитов в 1 л крови полученную величину умножают на 106.
Результаты подсчета форменных элементов крови заносим в таблицу и сравниваем полученные значения с нормой.
Результаты.
Примечание. Существует набор причин, способных выраженно повлиять на итоговый результат при подсчете количества форменных элементов крови. Это неточность при взятии крови в пипетку, неудовлетворительная градуировка пипеток, образование сгустка крови, неправильное притирание покровного стекла камеры или недостаточная его толщина (менее 0,3 мм), подсчет сразу после заполнения камеры, когда клетки еще не успели осесть на дно, плохо вымытые и недостаточно высушенные пипетки и пробирки, недоброкачественность реактивов, вызывающая гемолиз.
Вывод (сделайте вывод о количестве эритроцитов и лейкоцитов в крови)
Нормальные величины. У здоровых людей количество эритроцитов составляет 4,0–5,0 ´ 106/мкл (мужчины) и 3,9–4,7 ´ 106/мкл (женщины), лейкоцитов – 4,0–9,0 ´ 103/мкл. | |
Методические указания к лабораторным занятиям по нормальной физиологии для студентов II курса Тирасполь, 2010 — Методические указания
П
р о в е д е н и е р а б о т ы:
Ознакомиться
с устройством смесителя (меланжера)
(рис. 1). В настоящее время кровь для
1). В настоящее время кровь для
подсчета форменных элементов крови
разводят не в смесителях, а в пробирках
(пробирочный
метод разведения по Николаеву).Кровь
для подсчета эритроцитов набрать в
смеситель до метки 0,5 (или 1) и сюда же
добавить раствор хлористого натрия
до отметки 101. Кровь разводится в 200 раз.
(Техника забора крови описана в работе
№1).При
пробирочном разведении крови в чистую
и сухую пробирку точно отмерить 4 мл
хлористого натрия (512 мм/л). С помощью
капилляра Сали набрать 20 мм3
крови и осторожно опустить ее на дно
пробирки. Промыть этим же раствором
(из верхнего слоя) капилляр и слегка
встряхивая пробирку, тщательно перемешать
содержимое.Рассмотреть
под микроскопом сетку счетной камеры
Горяева (см. рис. 1).Осторожно
притереть покровное стекло к узким
боковым пластинам камеры Горяева до
появления колец Ньютона.
Заполнить
камеру. Для этого из смесителя две-три
капли крови следует выпустить на ватку,
а затем заполнить камеру: кончик
смесителя поднести к краю притертого
покровного стекла – в силу закона
капиллярности камера заполнится.
Заполнение из пробирки: пробирку с
разведенной кровью несколько раз
встряхнуть, держа вертикально для
равномерного перемешивания, сразу же
после этого концом стеклянной палочки
или капилляра Сали (не пользуясь грушей)
перенести каплю смеси на сетку счетной
камеры Горяева. Для этого кончик палочки
или капилляра следует поднести к краю
притертого покровного стекла. Необходимо
следить за тем, чтобы под покровным
стеклом не образовались пузырьки
воздуха.
Рис.
1. Подсчет элементов крови: а — скарификатор;
б — меланжеры; в — фрагмент сетки счетной
камеры Горяева; г — схема подсчета
эритроцитов (правило Егорова)
Через
две-три минуты поместить камеру под
микроскоп и сосчитать эритроциты (при
окуляре микроскопа х 15 можно считать
под малым увеличением).
Техника
подсчета. Эритроциты подсчитывают в
пяти больших квадратах расположенных
по диагонали сетки счетной камеры
Горяева, каждый из которых разделен на
16 маленьких квадратиков (всего их 80).
Форменные элементы в квадратиках
подсчитывают по правилу Егорова (см.рис.
1,г):
из
эритроцитов, лежащих на границах,
относить к данному квадратику только
те, которые лежат на верхней и левой
границах;порядок
просмотра маленьких квадратиков в
большом – по зигзагу.
Записать
результаты подсчета в каждом квадратике
и просуммировать число эритроцитов.
9. Рассчитать количество
эритроцитов в 1 мкл крови при ее разбавлении
в 200 раз по следующей формуле:
Сэх200
х 4000,
где Сэ – сумма
подсчитанных эритроцитов
80
10.
В протоколе кратко описать ход работы,
внести полученные данные и сделать
выводы (соответствие физиологической
норме).
РАБОТА
№3
Подсчет
количества лейкоцитов
Цель
работы: познакомится с
принципом и методикой подсчета лейкоцитов.
Подсчитать их количество в крови у
одного из студентов.
Необходимо
для работы: испытуемый,
микроскоп с окуляром 10 или15, счетная
камера Горяева, шлифованное покровное
стекло, штатив с маленькой пробиркой,
бюретка или мерный цилиндр на 3-5 мл с
делениями в долях мм, капилляр Сали с
резиновой трубкой и маленькой грушей,
смеситель для лейкоцитов, стеклянная
палочка, стерильные скарификатор и
пинцет, спирт, йод, вата, 5%-ный р-р уксусной
кислоты, окрашенный метиленовым синим.
П р о
в е д е н и е р а б о т ы:
Кровь
из пальца набрать в смеситель до метки
0,5 и сюда же добавить р-р уксусной кислоты
до метки 11. Зажав двумя пальцами
Зажав двумя пальцами
отверстия, меланжер тщательно встряхнуть.При
пробирочном разведении в чистую и сухую
пробирку точно отмерить 0,4 мл р-ра
уксусной кислоты. Набрать с помощью
капилляра Сали 20 мм3
крови и осторожно выпустить ее на дно
пробирки. Промыть этим же раствором
из верхнего слоя капилляр и, осторожно
встряхнуть пробирку, тщательно перемешать
содержимое. Полученное разведение 1:21
можно принять за 1:20.Далее,
провести опыты как описано в пп.5-8 работы
№2Техника
подсчета. Сосчитать количество лейкоцитов
в 25 больших квадратах под малым
увеличением, пользуясь правилом Егорова.Рассчитать
количество лейкоцитов при разбавлении
крови в 20 раз по формуле:
Л=Слх20
х 4000,
где Сл –
сумма подсчитанных лейкоцитов.
400
В
протоколе кратко описать ход работы,
внести полученные данные и сделать
выводы (соответствие физиологической
норме).
РАБОТА
№4
Определение
количества гемоглобина
Цель
работы: ознакомиться с
колориметрической методикой определения
количества гемоглобина по методу Сали
и определить его количество в крови у
одного из студентов..
Необходимо
для работы: испытуемый,
гемометр Сали, стерильные скарификатор
и пинцет, спирт, йод, вата, 0,1 N
р-р соляной кислоты, дистиллированная
вода.
П р о
в е д е н и е р а б о т ы:
Набрать
в градуированную пробирку гемометра
Сали 0,2 мл (до нижнего кругового кольца)
децинормального раствора соляной
кислоты. Кислоту набирать обычной
пипеткой, имеющейся в приборе (рис.2)Проколоть
палец и набрать капилляром Сали 20 мм3
крови.Кровь
желательно взять у того же студента, у
которого определяли количество
эритроцитов.
Погрузив
кончик капилляра в раствор HCl,
выпустить кровь на дно градуированной
пробирки под кислоту, а из верхнего
слоя раствора промыть два-три раза
капилляр (следить за тем, чтобы не
образовалась пена).Встряхивая
пробирку легкими ударами пальца по ее
дну, быстро перемешать содержимое,
чтобы предотвратить образование сгустка
на дне.Вставить
градуированную пробирку в корпус
гемометра, оставить на пять минут до
полного гемолиза и образования соляного
гематина
(темно-коричневый цвет).Пипеткой
добавлять по каплям дистиллированную
воду до выравнивания цвета полученной
смеси с цветом стандартных растворов.
Каждый раз после добавления воды
содержимое пробирки тщательно
перемешивать стеклянной палочкой.
Сравнивать цвета следует в проходящем
дневном свете, держа гемометр в вытянутой
руке.Определить
количество гемоглобина в исследуемой
крови в г% по показаниям шкалы
градуированной пробирки на уровне
нижнего мениска окрашенного раствора.
Рассчитать
количество гемоглобина в относительных
единицах Сали. Пересчет произвести с
учетом того, что в
стандартном растворе 166,7 г/л (16,67%)
гемоглобина соответствуют отн. ед.
Сали.В
протоколах кратко описать ход работы,
внести полученные результаты и сделать
выводы о соответствии физиологической
норме.
Рис.
2. Схема гемометра Сали: 1 — пробирки со
стандартным раствором хлорида гематина;
2 – пробирка для определения количества
гемоглобина; 3 – пипетка для крови; 4 —
пипетка для воды; 5 – палочка для
размешивания.
РАБОТА
№5
Определение
осмотической резистентности эритроцитов
Цель
работы: ознакомиться со
свойствами осмотической устойчивости
эритроцитов и произвести количественную
оценку их резистентности по отношению
к гипотоническим растворам.
Необходимо
для работы: восемь чистых
и сухих пробирок, штатив, мерный цилиндр
на 5-10 мл, 1%-ный раствор хлористого натрия,
дистиллированная вода, стерильные
скарификаторы и пинцет, спирт, йод, вата,
стеклянные палочки, мерные пипетки.
П р о
в е д е н и е р а б о т ы:
В
каждую из пробирок налить 1%-ный раствор
хлористого натрия в убывающем количестве
от 0,6 до 0,15 мл, затем в каждую пробирку
добавить дистиллированной воды до 1
мл. Пробирки пронумеровать.Во
все пробирки добавить с помощью капилляра
Сали по капле крови. Добавление крови
лучше начинать с пробирки, в которую
помещен раствор с наименьшей концентрацией,
и идти в сторону увеличения. Осторожно
перемешать содержимое, чтобы не
образовались пузырьки воздуха.Оставить
пробирки в штативе на хорошо освещенном
месте на 30-40 мин, после чего рассмотреть
их содержимое (не
взбалтывать!).
Проанализировать результаты.О
границах (уровне) осмотической
резистентности эритроцитов судить по
степени гемолиза крови в различных
гипотонических растворах.Результаты
наблюдений занести в таблицу:
Концентрация растворов (%) | Результаты наблюдений | выводы | |||
Цвет верхнего прозрачного | Вид остальной части | осадок | степень гемолиза | уровень резистентности | |
0,60 | |||||
0,55 | |||||
0,50 | |||||
0,45 | |||||
0,40 | |||||
0,35 | |||||
0,30 | |||||
0,25 | |||||
И | |||||
Отметить
пробирки, в которых:
отсутствует
гемолиз;частичный
гемолиз;полный
гемолиз.
В
выводах дать определение верхней и
нижней границ резистентности эритроцитов
и сделать заключение о соответствии
полученных результатов физиологической
норме.
Тема
№2: «Группы крови, правила переливания
крови. Свертывание крови. Гемостаз его
регуляция».
НЕОБХОДИМО
ЗНАТЬ:
Группы
крови, правила переливания крови.Резус-фактор.
Механизмы формирования резус-конфликтных
ситуаций.Система
гемостаза. Сосудисто-тромбоцитарный
гемостаз.
Внутрисосудистая
коагуляция. Факторы свертывания крови.
Основные стадии образования тромба
фибринового происхождения.Фибринолиз.
Внешний и внутренний механизмы
фибринолиза.Противосвертывающая
система организма, ее физические и
химические компоненты.Регуляция
свертывания крови и фибринолиза.
Взаимодействие свертывающей и
противосвёртывающей систем.Лимфа
и тканевая жидкость, состав и механизм
образования. Циркуляция лимфы в
организме, значение лимфатических
узлов, роль лимфооттока в обмене воды
в организме.
Ключевые
понятия и определения
Свертывающая
система крови
– это
совокупность факторов, участвующих в
процессах крови. Изучение процессов
свертывания крови. Изучение процессов
свертывания крови имеет практическое
значение при переливании крови для
сохранения ее в жидком состоянии, для
предупреждения смертельных кровотечений,
предотвращения образования тромбов в
сосудах и лечения внутрисосудистых
тромбозов.
Противосвертывающая
система крови – это
совокупность содержащихся в крови
веществ, препятствующие образованию
кровянистого сгустка и его ретракции.
Группы
крови
В
эритроцитах, на мембране находятся
антитела
(агглютиногены)
А
и В,
а в плазме
—
антитела
(агглютинины) α
и β.
В зависимости от присутствия различных
антигенов и антител выделяют 4
группы крови.
При сочетании одноименных антител с
антигенами происходит агглютинация
(склеивание) эритроцитов, что в дальнейшем
приводит к развитию гемотрансфузионного
шока.
Существует
еще один антиген
– Д
(резус-фактор), который может присутствовать
в эритроцитах независимо от групповой
принадлежности. Антител к данному
антигену не существует, однако они могут
образовываться при иммунизации организма
кровью, содержащей резус-фактор
(Rh),
и в дальнейшем при переливании
резус-положительной крови иммунизированному
реципиенту может произойти агглютинация
эритроцитов донорской крови.
группа | Антигены | антитела |
I | — | α, |
II | A | B |
III | B | A |
IV | A,B | — |
НЕОБХОДИМО
УМЕТЬ:
1.Ознакомиться
с принципами и методикой определения
СОЭ по Панченкову и определить ее у
студентов.
2.
Рассчитывать цветной показатель крови.
3.
Определять время свертывания крови
4.
Определять продолжительности
кровотечения.
5.
Определять
группу крови резус- принадлежности
крови человека.
РАБОТА
№6
Определение
скорости оседания эритроцитов
Цель
работы: ознакомиться с
принципами и методикой определения СОЭ
по Панченкову и определить СОЭ у
студентов.
Необходимо
для работы: испытуемый,
прибор Панченкова, два часовых стекла
или тигелечка, 5%-ный раствор лимонно-кислого
натрия (цитрат натрия), стерильные
скарификаторы и пинцет, спирт, йод, вата.
П р о в е д
е н и е р а б о т ы:
Рассмотреть
капилляр Панченкова (рис. 3), разобрать
все его цифры и метки (О — на уровне 100
мм; Р- на уровне 50 мм).Налить
немного цитрата на часовое стекло или
тигелек, промыть им капилляр.
Удалить
продуванием образовавшиеся в капилляре
пузырьки, чтобы предотвратить
возникновение воздушных пробок при
последующем наборе в капилляр.Отметить
этим же капилляром 50 мм раствора цитрата
натрия, набрав его до
метки Р,
и выпустить на чистое часовое стекло.Проколоть
палец и, сняв первую каплю, приступить
к взятию крови.Взять
капилляр в правую руку так, чтобы видеть
все деления. Погрузить его кончик в
каплю крови, не прижимая отверстие
плотно к пальцу, свободный конец
капилляра опустить несколько ниже
горизонтального уровня.Быстро
набрать 100 мм крови без пузырьков (до
метки К).
Растекающиеся капли стереть влажной
ваткой, смоченной раствором цитрата.Осторожно,
не допуская пузырей, выдуть всю порцию
крови в отмеренный раствор цитрата и
тщательно перемешать концом капилляра.
Вновь
промыть капилляр раствором цитрата,
еще раз набрать в него кровь до
метки К
и осторожно выдуть на то же стекло.Все
хорошо перемешать и затем набрать часть
получившейся смеси (без пузырьков
воздуха) в капилляр до
метки К.
Разведение 1:4.Кровь
набирать самотеком, для чего капилляр
наклонить несколько ниже горизонтального
уровня по отношению к часовому стеклу
с разведенной кровьюЗажать
указательным пальцем правой руки
верхний конец капилляра, повернуть его
вертикально и вставить в штатив. Палец
можно отпустить только после того, как
вы твердо убедились в том, что нижний
конец капилляра прижат к резинке на
стойке прибора Панченкова.Засечь
время установки капилляра в штатив.
Штатив с места не сдвигать.Судить
о величине СОЭ по высоте столбика плазмы
(мм), освободившейся от эритроцитов за
один час стояния крови (прозрачный
слой).
В
протоколе кратко описать ход работы,
зарисовать капилляр с нанесенными
метками. Записать время СОЭ. Сравнить
полученные результаты с физиологической
нормой.
Рис.3.
Система прибора Панченкова. А – общий
вид прибора; Б – капилляр с метками К
(кровь) и Р (реактив).
РАБОТА
№7
Вычисление
цветного показателя крови
Цель
работы: научиться рассчитывать
цветной показатель крови.
Необходимо
для работы: данные определения
содержания гемоглобина в крови и
количество в ней эритроцитов (взять из
предыдущих работ).
П
р о в е д е н и е р а б о т ы:
Для
вычисления цветного показателя крови
количество гемоглобина, выраженное в
относительных процентах (по отношению
к стандарту, принимаемому за 100%), делят
на три первые цифры числа эритроцитов,
и полученное значение умножают на 5.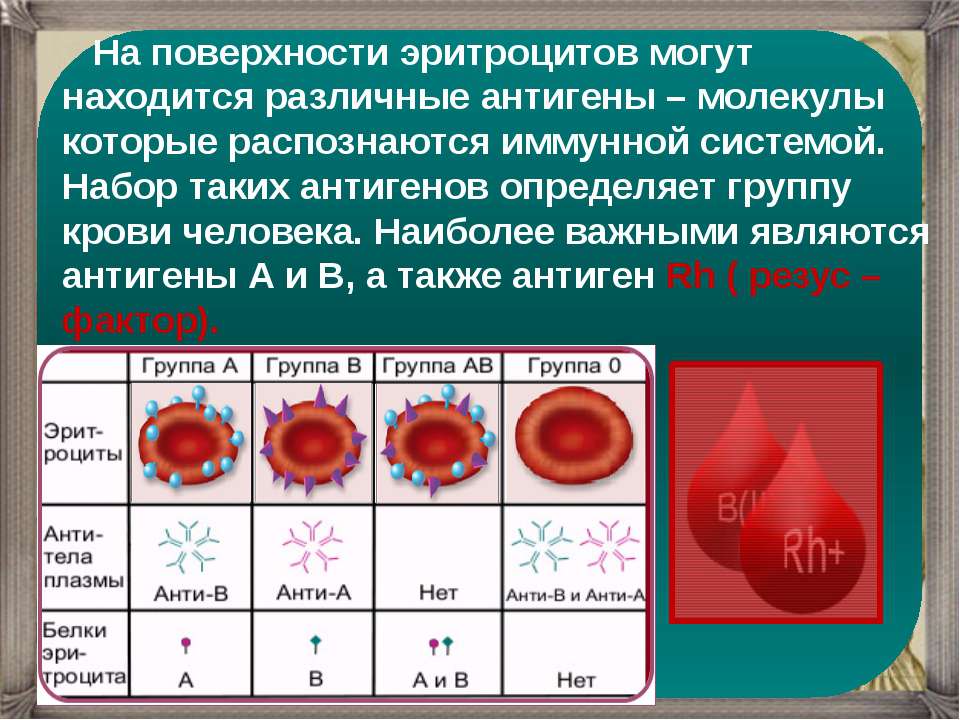
Такой способ вычисления рассчитан на
то, что в идеальных условиях (при
содержании гемоглобина 100% и эритроцитов
5 млн. в 1 мм3
крови) – цветной показатель соответственно
равен (100:500)х5=1.
Если
цветной показатель меньше единицы, то
такое явление называется – гипохромазией,
больше единицы –
гиперхромазией.
Рассчитать
цветной показатель и дать ему оценку,
сравнить с физиологической нормой.
РАБОТА
№8
Определение
скорости свертывания крови
Цель
работы: научиться определять
время свертывания крови по одной из
предлагаемых методик.
Подсчёт количества эритроцитов в камере Горяева. — КиберПедия
ХОД РАБОТЫ: смотри пособие для практических занятий
Напишите формулу для подсчета количества эритроцитов:
Подсчитайте количество эритроцитов в исследуемой крови:
Подсчёт количества лейкоцитов в камере Горяева (смотри пособие для практических занятий).
Напишите формулу для подсчета количества лейкоцитов:
Ответьте на вопросы
Почему количество эритроцитов определяется исходя из 80 малых квадратов, а количество лейкоцитов из 100 больших?___________________________________________
_____________________________________________________________________________
Почему при определении количества эритроцитов кровь разводится в 200 раз, а при определении лейкоцитов в 20?___________________________________________________
_____________________________________________________________________________
Определение содержания гемоглобина методом Сали.
ХОД РАБОТЫ: смотри пособие для практических занятий
Количество гемоглобина в норме: у мужчин:___________г/л; у женщин:____________г/л
Виды гемоглобина:
__________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
Соединения гемоглобина:
__________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
ЦЕЛЬ: освоить определение содержания гемоглобина по методу Сали.
ХОД РАБОТЫ: смотри пособие для практических занятий
| Подпишите приборы на рисунке:
1 – 2 – 3 – |
Определите содержание гемоглобина в образце крови, предлагаемом для исследования; сделайте вывод:
__________________________________________________________________________________________________________________________________________________________
Расчёт цветового показателя.
Что такое цветовой показатель:
__________________________________________________________________________________________________________________________________________________________
что такое
нормохромазия ______________________________________________________________
гипохромазия________________________________________________________________
гиперхромазия_______________________________________________________________
Формула для расчета цветового показателя:
Рассчитайте цветовой показатель, сопоставьте с показателями нормы.
__________________________________________________________________________________________________________________________________________________________
Е практическое занятие по теме физиология крови.
Антигенные системы крови. Группы крови. Гемостаз.
Ответьте на следующие вопросы:
1. Какая антигенная система крови имеет естественные антитела? _____________________
2. Какие антигены по системе АВ0 известны?______________________________________
3. Какой из антигенов группы А имеет наиболее выраженные антигенные свойства?_____
4. Какие антитела по системе АВ0 известны?_______________________________________
5. Какой агглютинин может способствовать склеиванию эритроцитов, содержащих О (Н)-антиген?______________________________________________________________________
6. Какими антигенами представлена система Резус? _________________________________
7. Что характерно для сосудисто-тромбоцитарного гемостаза?________________________
Что характерно для сосудисто-тромбоцитарного гемостаза?________________________
_____________________________________________________________________________
8. Что характерно для плазменного (коагуляционного) гемостаза?_____________________
_____________________________________________________________________________
9. Какие вещества образуются в конце первой, второй и третьей фазы плазменного гемостаза? ____________________________________________________________________
10. Как запускаются внутренний, внешний механизмы образования протромбиназы?
_____________________________________________________________________________
_____________________________________________________________________________
11. Какова роль тромбопластина (III фактор)?______________________________________
_____________________________________________________________________________
12. Какие вещества активируют фактор контакта (XII или Хагемана)?_________________
Какие вещества активируют фактор контакта (XII или Хагемана)?_________________
_____________________________________________________________________________
13. Какие вещества активируют Х фактор при внешнем и внутреннем механизмах?______
_____________________________________________________________________________
14. Какие факторы активируют переход протромбина в тромбин?_____________________
_____________________________________________________________________________
15. Какие факторы обеспечивают жидкое состояние крови?__________________________
_____________________________________________________________________________
16. . Какие вещества относятся к образующимся антикоагулянтам, а какие к постоянным?
_____________________________________________________________________________
17. Какие факторы относятся к фибринолитической системе?_________________________
_____________________________________________________________________________
18. Какие вещества активируют переход плазминогена в фибринолизин?_______________
Какие вещества активируют переход плазминогена в фибринолизин?_______________
_____________________________________________________________________________
Практические работы.
Определение групповой принадлежности крови по системе АВ0 перекрёстным методом — стандартных сывороток и стандартных эритроцитов.
ЦЕЛЬ:ознакомиться с методикой определения групп крови по системе АВ0 методами стандартных сывороток и стандартных эритроцитов.
а) Метод стандартных сывороток.
1. Укажите принцип определения групповой принадлежности крови методом стандартных сывороток:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Метод стандартных эритроцитов.
1. Укажите принцип определения групповой принадлежности крови методом стандартных эритроцитов:
Укажите принцип определения групповой принадлежности крови методом стандартных эритроцитов:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Заполните таблицу по оценке результатов:
| Группы крови
| стандартные сыворотки | Стандартные
эритроциты | |||
| I ab | II b | III a | А(II) | В (III) | |
| 0(I) ab
| |||||
| A(II)b
| |||||
| B(III)a
| |||||
| АВ (IV) —
|
Определение групповой принадлежности крови по системе АВ0 методом цоликлонов.
ЦЕЛЬ: освоить методику определения групп крови по системе АВ0 методом цоликлонов.
ХОД РАБОТЫ: смотри пособие для практических занятий
Что такое цоликлоны:
__________________________________________________________________________________________________________________________________________________________
Цоликлон анти-А – это_________________________________________________________
Цоликлон анти-В – это_________________________________________________________
Оценка результатов:
| цоликлон анти-А | цоликлон анти-В | Вывод: |
| эритроциты исследуемой крови относятся
к группе |
Задания для самостоятельной работы — Студопедия
I. 1. Выполните работу №1 «Подсчет форменных элементов крови» и оформите протокол, в котором:
а) укажите, чем разводится кровь для подсчета эритроцитов и почему;
б) напишите формулу для подсчета эритроцитов и проведите ее анализ — опишите значение всех цифр в формуле;
в) нарисуйте фрагмент сетки Горяева, укажите площадь маленького квадрата и его объем.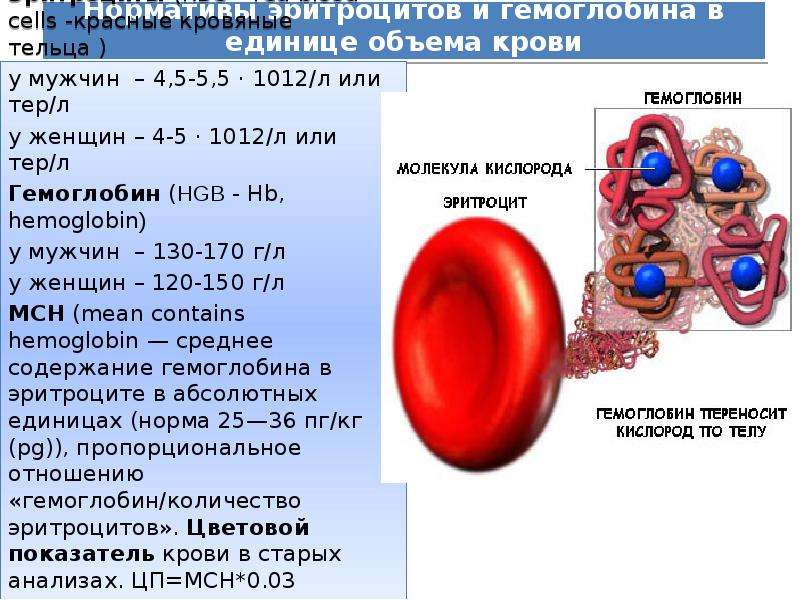
г) выпишите и выучите нормальные значения количества эритроцитов у мужчин и женщин.
В выводах сравните полученный в работе результат с нормальными значениями для мужчин и женщин.
2. Познакомьтесь с методом определения числа лейкоцитов, коротко опишите его:
а) укажите, чем разводится кровь для подсчета лейкоцитов и почему;
б) проведите анализ формулы для подсчета лейкоцитов;
в) выпишите и выучите нормальные значения содержания лейкоцитов у мужчин и женщин.
II. 1. Напишите, в чем заключается роль гемоглобина в организме, почему гемоглобин является идеальным переносчиком кислорода? Перечислите виды гемоглобина, нормальные и патологические соединения гемоглобина в организме взрослого и ребёнка.
2. Выполните работу № 2. «Определение количества гемоглобина». Предварительно внимательно ознакомьтесь с градуировкой пробирки, в которой будет разводиться кровь, поскольку она отличается от описанной в практикуме.
В протоколе отметьте, чем разводится кровь для определения концентрации гемоглобина и почему. В выводах сравните полученные результаты с нормой.
В выводах сравните полученные результаты с нормой.
III. 1. Выполните работу №3. «Вычисление цветового показателя». В протоколе напишите, что называется цветовым показателем, приведите формулу расчета и подсчитайте цветовой показатель исследуемой крови. В выводах сравните полученный результат с нормой.
2. Напишите, какие изменения в составе крови могут явиться причиной гипо- и гиперхромии.
Ситуационные задачи
1.Клинический анализ крови, в частности, определение содержания лейкоцитов рекомендуется проводить рано утром, сразу же после сна. Почему?
2.Известны случаи, когда дымоход жарко натопленной печи закрывали рано, уснувшие в помещении люди погибали. Укажите возможные причины гибели людей.
3. Известно, что у людей, постоянно живущих в горах, в крови содержится большее число эритроцитов. Каков механизм увеличения эритроцитов? Какое это имеет физиологическое значение?
4. Проведен клинический анализ крови у людей, постоянно живущих в горах, содержание эритроцитов колебалось от 5,6´1012/л до 7´1012/л.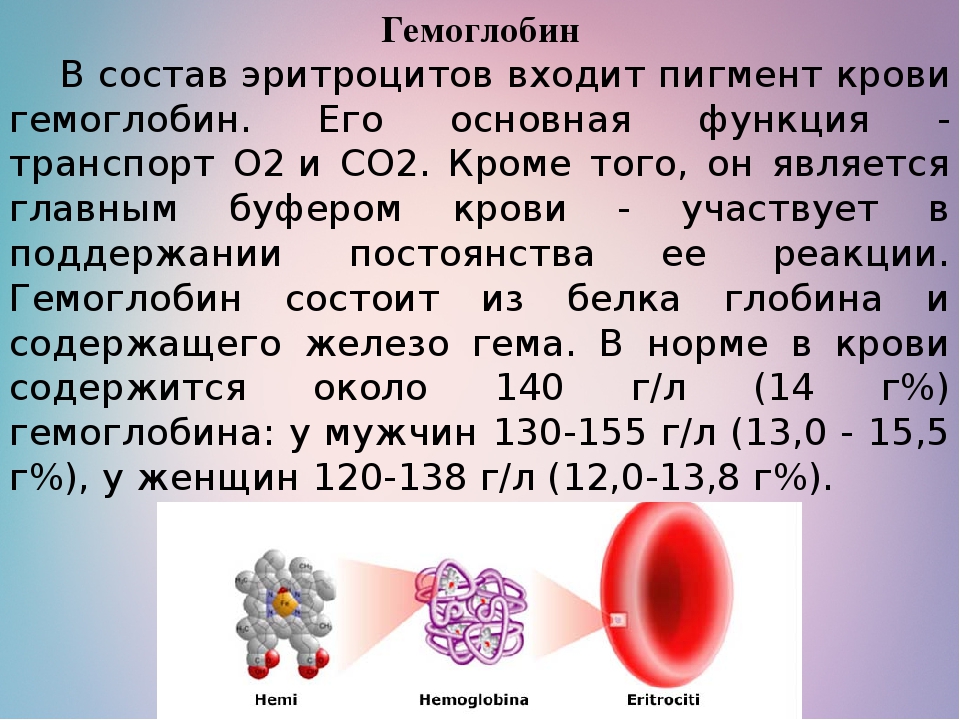 Оцените полученные результаты.
Оцените полученные результаты.
5. В исследуемой крови спортсмена исходное количество лейкоцитов 6´109/л. Оцените, нормально ли такое явление, как оно называется, объясните его механизм.
6. В исследуемой крови взрослого человека содержится 4,2 х 1012/л эритроцитов, 123 г/л гемоглобина. Рассчитайте цветовой показатель крови, оцените полученные результаты.
7. При подсчете эритроцитов в счетной камере Горяева в одном маленьком квадратике оказалось в среднем 5 эритроцитов. Рассчитайте, сколько их находится в 1 литре.
8. Клинический анализ крови производится утром натощак. Объясните почему.
9. Клинический анализ крови показал, что у обследуемого мужчины скорость оседания эритроцитов (СОЭ) составляет 37 мм/час. О чем может свидетельствовать такой показатель?
10. В исследуемой крови взрослого человека содержится 4,0 х 1012 /л эритроцитов, 95 г/л гемоглобина. Оцените полученные результаты.
11. В исследуемой крови взрослого человека содержится 3,3 х 1012 /л эритроцитов, 70 г/л гемоглобина. Оцените полученные результаты.
В исследуемой крови взрослого человека содержится 3,3 х 1012 /л эритроцитов, 70 г/л гемоглобина. Оцените полученные результаты.
12. В печати сообщалось о семье Лыковых. По религиозным соображениям они ушли «из мира» в глухую тайгу и жили там десятки лет, после чего были случайно обнаружены. Медицинское обследование показало, что жизнь в условиях тишины и покоя, чистого лесного воздуха положительно сказалась на состоянии здоровья членов семьи. Лишь одна из систем организма оказалась ослабленной, что и привело к почти одновременной смерти трех из пяти членов семьи. Какая эта система? В чем причина ее ослабления?
13. У студента, принимавшего во время сессии с целью поднятия трудоспособности фенацетин, появились все признаки кислородной недостаточности. Однако клинический анализ показал, что число эритроцитов и Hb находится в пределах нормы, сердце работает нормально, а количество кислорода в воздухе достаточно. О какой причине можно думать и какой анализ крови может помочь в установлении причины появления таких симптомов, если известно, что фенацетин — сильный окислитель?
Для студентов ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТА
1. Проведено исследование крови новорожденного. Гемоглобин — 130 г/л. Оцените полученный результат. Назовите формы гемоглобина ,присущие крови в период новорожденности.
Проведено исследование крови новорожденного. Гемоглобин — 130 г/л. Оцените полученный результат. Назовите формы гемоглобина ,присущие крови в период новорожденности.
2. Известно, что у большинства новорожденных наблюдается физиологическая желтуха. Объясните механизм ее возникновения.
3. В исследуемой крови новорожденного содержится 4,2 х 1012/л эритроцитов, 123 г/л гемоглобина. Рассчитайте цветовой показатель крови, оцените полученные результаты.
4. В исследуемой крови новорожденного содержится 4,0 х 1012 /л эритроцитов, 95 г/л гемоглобина. Оцените полученные результаты.
5. В исследуемой крови новорожденного содержится 3,3 х 1012 /л эритроцитов, 70 г/л гемоглобина. Оцените полученные результаты.
Вопросы для самоконтроля
1. Состав крови.
2. Строение, форма, размеры эритроцитов.
3. Общее количество эритроцитов в одном литре крови у мужчин, женщин.
4. Принцип подсчета эритроцитов, формула подсчета эритроцитов, смысл всех входящих в нее величин.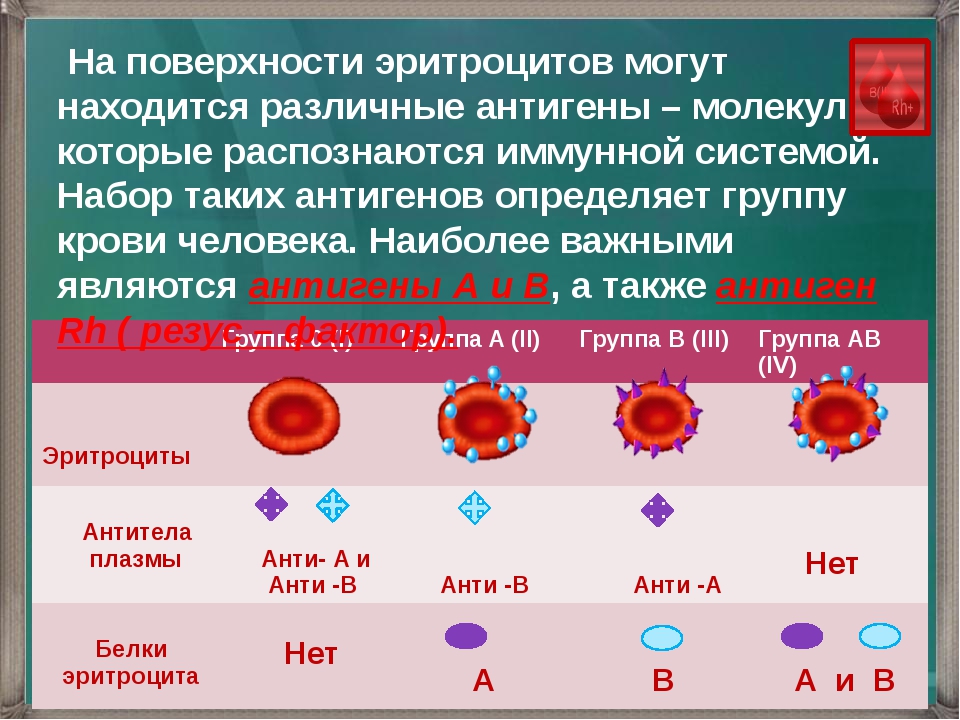
5. Функции эритроцитов.
6. Сколько молекул глобина и молекул гема входит в состав гемоглобина?
7. Какова валентность атомов железа, входящего в состав гема, при присоединении кислорода?
8. Количество гемоглобина (г/л) в крови у мужчин и женщин.
9. Метод количественного определения гемоглобина.
10. Перечислите виды гемоглобина, его физиологические и патологические соединения.
11. Как называются соединения гемоглобина с кислородом, углекислым газом, угарным газом?
12. Почему гемоглобин является идеальным переносчиком кислорода?
13. Что такое цветовой показатель? Чему равна его величина?
14. Формула вычисления цветового показателя.
15. Как называется состояние, при котором содержание гемоглобина в эритроците увеличивается, снижается или остается нормальным?
16. Каково клиническое значение определения количества эритроцитов, гемоглобина, цветового показателя?
17. Лейкоциты, виды, содержание в одном литре крови у человека. Лейкоцитарная формула. Функции эозинофилов, базофилов, нейтрофилов, моноцитов и лимфоцитов.
Лейкоцитарная формула. Функции эозинофилов, базофилов, нейтрофилов, моноцитов и лимфоцитов.
18. Принцип подсчета лейкоцитов, формула подсчета лейкоцитов, смысл всех входящих в нее величин.
19. Что такое физиологический лейкоцитоз?
Заполнение счетной камеры
⇐ ПредыдущаяСтр 4 из 19Следующая ⇒
|
Рис. 2. Счетная камера: А — вид сверху. Б — вид сбоку. В — сетка Горяева. 1 — маленький квадрат, 2 — большой квадрат.
Счетная камера (рис.2) состоит из толстого прямоугольной формы стекла с двумя сетками Горяева, нанесенными на средние площадки камеры. Кнаружи от желобков, образующих букву «Н», находятся две прямоугольные пластинки, к которым прикладывается покровное стекло. Сетка Горяева состоит из 225 больших квадратов, 25 из которых разделены на 16 малых. Сторона малого квадрата составляет 1/20 мм, площадь — 1/400 мм2, глубина камеры — 1/10 мм. Следовательно, объем камеры над малым квадратом равен 1/4000 мм3.
Следовательно, объем камеры над малым квадратом равен 1/4000 мм3.
Незаполненную счетную камеру помещают под микроскоп и сначала под малым, а затем большим увеличением рассматривают сетку, находят большие и малые квадраты.
Затем счетную камеру и покровное стекло промывают водой, протирают марлевым тампоном, смоченным эфиром, спиртом и сухой полотняной салфеткой.
Придавливают покровное стекло к боковым поверхностям камеры (см. описание камеры).
Перед заполнением камеры выпускают на ватный тампон две-три капли содержимого из капилляра смесителя, затем заполняют камеру: наносят каплю разведенной крови на среднюю пластинку у края покровного стекла. В силу капиллярности жидкость равномерно распределится над сеткой.
После заполнения камеру оставляют на одну минуту для равномерного распределения и оседания эритроцитов.
Подсчет эритроцитов
Камеру кладут на предметный столик микроскопа, установленный горизонтально, и приступают к подсчету эритроцитов при малом увеличении микроскопа (объектив 8x, окуляр 10x или 15x).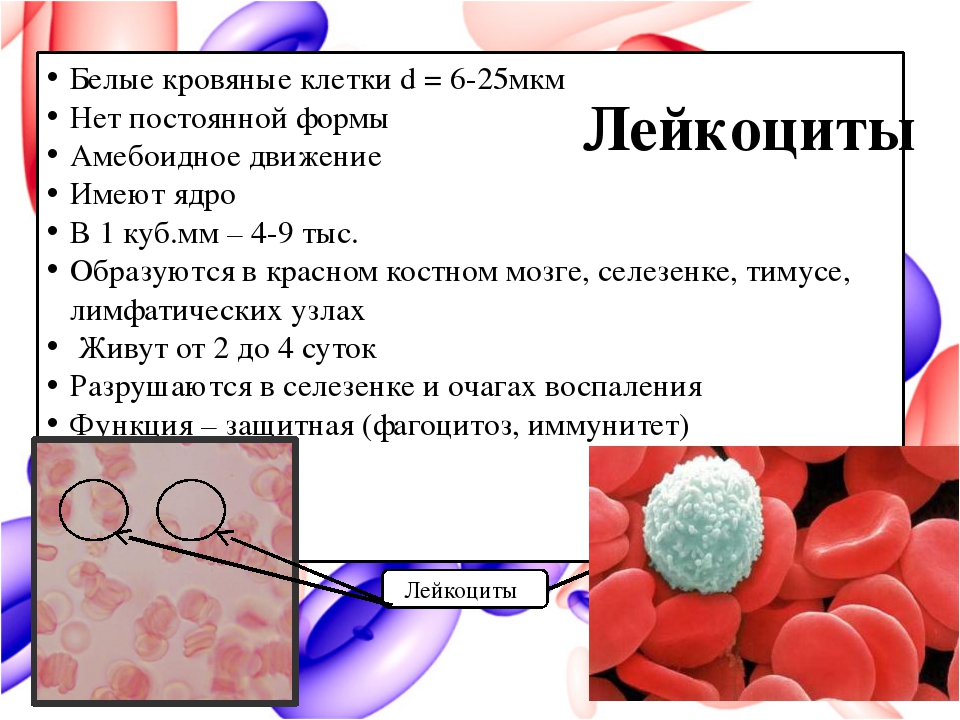 Поле зрения должно быть затемнено диафрагмой и несколько опущенным конденсатором. Подсчитывают эритроциты в 5 больших квадратах, разделенных на 16 малых (всего в 5 x 16 = 80 малых квадратах), расположенных по диагонали. Во избежание двукратного подсчета клеток, лежащих на границах квадратов, руководствуются правилом Егорова. Считают эритроциты, находящиеся внутри квадрата и на его верхней и левой границах.
Поле зрения должно быть затемнено диафрагмой и несколько опущенным конденсатором. Подсчитывают эритроциты в 5 больших квадратах, разделенных на 16 малых (всего в 5 x 16 = 80 малых квадратах), расположенных по диагонали. Во избежание двукратного подсчета клеток, лежащих на границах квадратов, руководствуются правилом Егорова. Считают эритроциты, находящиеся внутри квадрата и на его верхней и левой границах.
Подсчитав, таким образом, сумму эритроцитов в 5 больших квадратах (т.е. в 80 малых), находят среднее арифметическое число эритроцитов в одном малом квадрате — Э/80. Зная, что объем пространства камеры над одним малым квадратом равен 1/4000 мм3, умножают найденное число на 4000. Получают число эритроцитов в 1 мкл разведенной крови. Умножив на кратность разведения (200), рассчитывают количество эритроцитов в 1 мкл цельной крови.
Таким образом, формула для вычисления количества эритроцитов следующая:
Х = (А ´ 4000 ´ 200) / 80,
где Х — искомое число эритроцитов в 1 мкл крови;
А — число эритроцитов в 80 малых квадратах;
1/4000 мм3 — объем разведенной крови над одним малым
квадратом;
80 — число малых квадратов;
200 — степень разведения.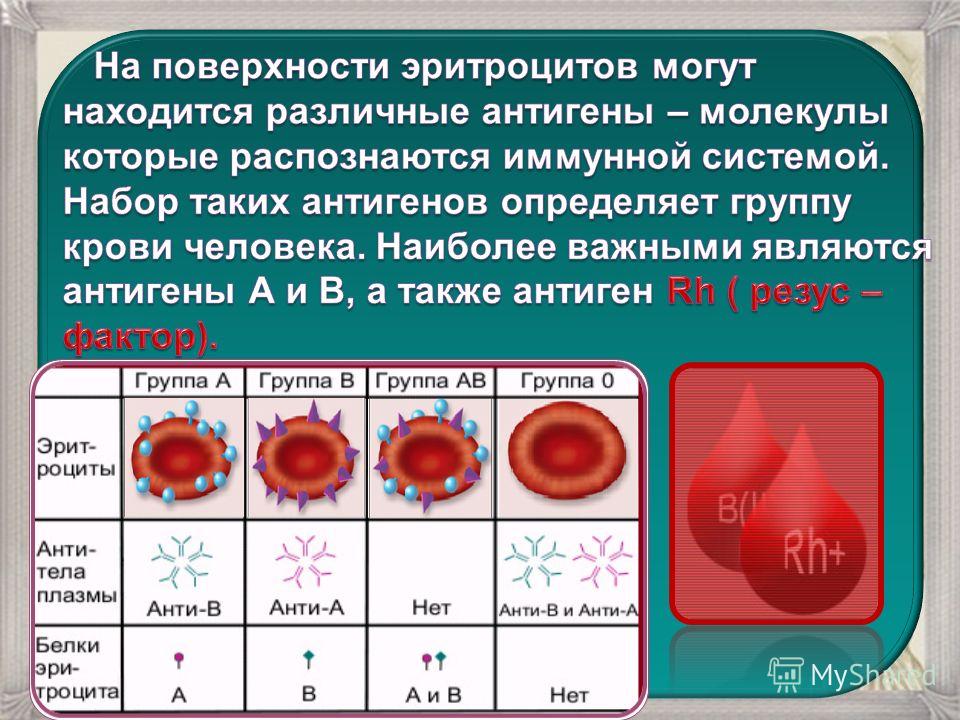
Полученное число эритроцитов умножают на 106 и получают содержание клеток в 1 литре крови.
Ошибка метода составляет ±2-3%.
Возможные источники ошибок при подсчете эритроцитов:
· Образование сгустка во время взятия и разведения крови.
· Несоблюдение условий, обеспечивающих должную высоту камеры (неправильный выбор покровного стекла и плохое его прижатие к камере).
· Проведение подсчета сразу после заполнения камеры, когда клетки еще не распределились равномерно и не осели.
· Попадание воздуха в капилляр с кровью.
Оформление протокола. Указать, чем разводится кровь для подсчета эритроцитов и почему. Написать формулу подсчета эритроцитов, провести ее анализ – описать значение всех цифр в формуле. Нарисовать фрагмент сетки Горяева, указать площадь малого квадрата и объем крови над ним. Начертить пять больших квадратов, указать подсчитанное количество эритроцитов в них. Записать нормальные значения количества эритроцитов у мужчин, женщин и новорожденных.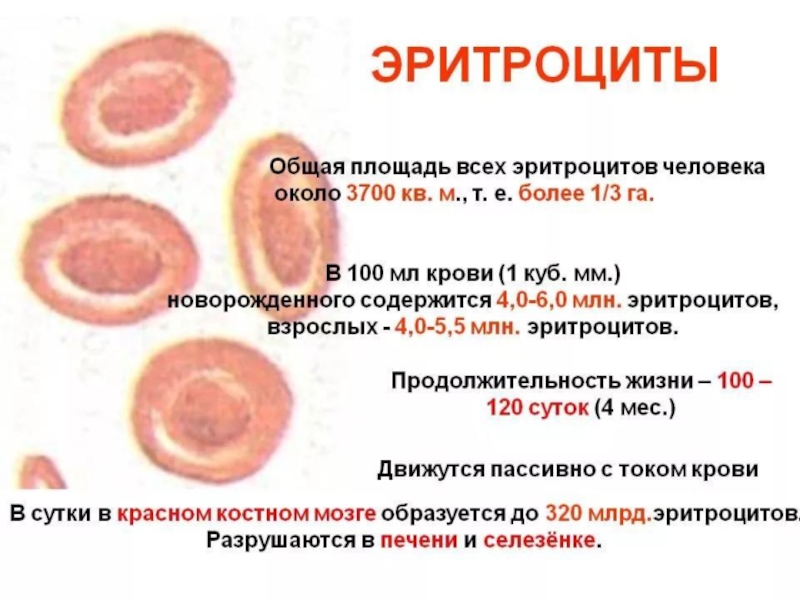
Вывод. Сравнить полученный результат с нормой.
Подсчет эритроцитов с использованием пробирочного
Метода разведения крови
Цель работы: ознакомиться с методом подсчета эритроцитов.
Объект исследования – кровь человека.
Для работы необходимо: Донорская кровь, химические или серологические пробирки с пробками, капиллярная пипетка от гемометра Сали, градуированная пипетка для отмеривания разводящей жидкости, камера с сеткой Горяева, 3% раствор хлористого натрия (желательно подкрасить красителем типа метиленового синего), микроскоп, вата.
Проведение работы. В чистую пробирку точно отмеривают 4 мл разводящей жидкости и закрывают ее резиновой пробкой. Кровь в количестве 20 мкл набирают до метки в капилляр от гемометра Сали. Осторожно выдувают кровь из капилляра в пробирку и тщательно перемешивают и промывают капилляр разводящей жидкостью; полученное разведение можно приравнять к 1:200. Капиллярную пипетку промывают несколько раз дистиллированной водой.
Капиллярную пипетку промывают несколько раз дистиллированной водой.
Заполнение камеры, подсчет эритроцитов, анализ результатов и оформление протокола осуществляют, как указано в работе 3.1.1. в пунктах 2 и 3. Источники ошибок и точность метода такие же, как и в работе 3.1.1.
Рекомендуемые страницы:
ПОДСЧЁТ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ
ПОДСЧЁТ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ
При подсчёте форменных элементов крови определяются количества эритроцитов и лейкоцитов в 1 мм8 крови. Количества настолько постоянны для каждого определённого вида и для определённого физиологического „состояния животных, что дают возможность отличить нормальное физиологическое состояние животного от патологии и делать из этого практические выводы.
Для определения форменных элементов крови в единице объёма пользуются специальными счетными камерами. Очень широко распространёнными являются
Рис.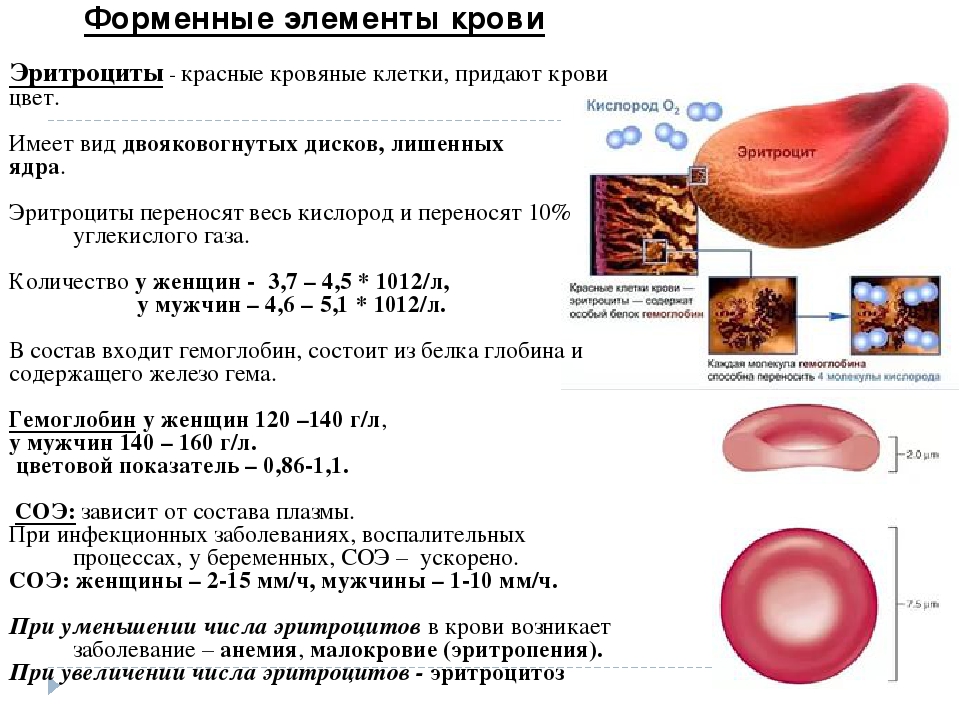 30. Счётная камера Бюркера.
30. Счётная камера Бюркера.
камеры Тома-Цейса, Бюркера, Тюрка, Горяева. Кроме счётных камер, для подсчёта необходимо иметь меланжеры (смесители Потэна) и соответствующую жидкость для разведения крови, которая сохраняла бы неизменными лейкоциты и эритроциты.
Рис. 31. Смесители для форменных элементов крови.
Кровь для подсчёта может быть взята как из артерии, так и из вены. Работа Данилова по сравнению крови из артерий и вен сельскохозяйственных животных показала, что количественной разницы между соответствующими форменными элементами крови артерий и вен не имеется.
Смесителями служат капиллярные трубочки около 10 см длиной, с шаровидным или грушевидным расширением, внутри которого находится стеклянный шарик, способствующий лучшему смешиванию. На капиллярной части смесителя нанесены деления, обозначенные цифрами 0,5 и 1,0, а за расширением на трубочке—101 и 11. Меланжер, имеющий метку 101, предназначается для подсчёта эритроцитов, а с меткой 11—для лейкоцитов. Резервуар эритроцитарных смесителей, как правило, в 10 раз больше, чем у лейкоцитарных. На меланжер надевается резиновая трубочка с костяным или стеклянным мундштуком. Меланжеры Паппенгейма вместо резинки имеют поршень в расширенной части смесителя. Кровь набирается не ртом, а путём выдвигания поршня.
Резервуар эритроцитарных смесителей, как правило, в 10 раз больше, чем у лейкоцитарных. На меланжер надевается резиновая трубочка с костяным или стеклянным мундштуком. Меланжеры Паппенгейма вместо резинки имеют поршень в расширенной части смесителя. Кровь набирается не ртом, а путём выдвигания поршня.
Жидкости для разведения. Для подсчёта эритроцитов кровь разводится в смесителе 0,9% («физиологическим») раствором поваренной соли. Так как, по Фрейфельд, этот раствор через некоторое время гемолизирует эритроциты, можно пользоваться 3% раствором. При исследовании крови у крупного рогатого скота Никольский использует 3% раствор поваренной соли. Кроме того, эритроциты жвачных хорошо сохраняются в жидкости Гайема:
Для лейкоцитов употребляются растворы уксусной кислоты с примесью краски.
При исследовании крови кур можно применить 5% раствор уксусной кислоты.
Для подсчёта эритроцитов кровь набирается в смеситель до метки 0,5 или 1,0. Конец меланжера обтирают от крови, и затем в капилляр до метки 101 набирается раствор поваренной соли. Если кровь взята до метки 0,5, получается разведение в 200 раз, а до метки 1,0—в 100 раз.
Если кровь взята до метки 0,5, получается разведение в 200 раз, а до метки 1,0—в 100 раз.
Для подсчёта лейкоцитов пользуются смесителями с меткой 11. Наполнение производится так же, как и для подсчёта эритроцитов, с той разницей, что для разведения берётся уксусная кислота; кровь набирается до метки 0,5 или 1,0, а кислота до метки 11. Разведенце в первом случае будет равно 20, а во втором—10.
При наполнении смесителей нужно следить за тем чтобы во время насасывания крови или разводящей жидкости в капилляр не попали пузырьки воздуха. Кровь и растворяющая жидкость набираются точно до соответствующей метки. __
Когда смеситель наполнен кровью и растворяющей жидкостью, концы его зажимают между большим и указательным пальцами и несколько раз энергично встряхивают, заставляя перекатываться шарик в резервуаре для смешения крови с жидкостью. Непосредственно перед заряжением камеры содержимое смесителя вновь тщательно перемешивается до получения равномерно мутной жидкости (гомогенной взвеси).
Счётные камеры почти все построены по одному образцу. Камора состоит из толстого предметного стекла, на котором укреплены стеклянные пластинки; на одной из них нанесена сетка. В последнее время имеются камеры, сделанные целиком из одного куска шлифованного стекла, без приклеенных частей.
Пластинки, на которых нанесена сетка, ниже боковых пластинок точно на 0,1 мм. Если на боковые пластинки положить покровное стекло, то между ним и средней пластинкой образуется щель, равная 0,1 мм. В эту щель и вводится кровь для подсчёта.
Чтобы высота камеры не изменялась, необходимо покровное стекло плотно притереть к боковым стеклянным рамкам. Критерием протёртости стекла к рамке служит образование так называемых ньютоновских колец. Ьез образования колец не следует производить подсчет. В новейших моделях камер имеются особые металлические зажимы, плотно прижимающие покровное стекло. » После тщательного перемешивания крови первые 3—4 капли её удаляют из смесителя на платок или бумагу и затем каплю средней величины вводят под покровное стекло камеры. Капля, в силу капиллярности, втягивается в просвет между пластинками. Величина капли должна, быть такой, чтобы она покрывала всю среднюю пластинку, на которую нанесена сетка, но не выступала за боковые пластинки и на покровное стекло.
Капля, в силу капиллярности, втягивается в просвет между пластинками. Величина капли должна, быть такой, чтобы она покрывала всю среднюю пластинку, на которую нанесена сетка, но не выступала за боковые пластинки и на покровное стекло.
В камерах старого образца покровное стекло накладывается после того, как кровь будет помещена на середине маленького круглого поля камеры. В этих случаях покровное стекло накладывается быстро, но осторожно, чтобы не было пузырьков воздуха. Сначала накладывают один край стекла, затем покровное стекло осторожно опускают до соприкосновения его с поверхностью капли. Если капля взята правильно, то пространство между покровным стеклом и круглой серединой камеры заполняется, а некоторый избыток стекает в окружающий желобок. При надавливании на покровное стекло с двух сторон, если смотреть под углом, появляются кольца Ньютона, которые остаются и после осторожного удаления пальцев.
Заряженная камера помещается под микроскопом, без иммерсии. Находят сетку и устанавливают препарат так, чтобы деления сетки и лежащие в пей форменные элементы крови были отчётливо видны. Конденсор Аббе можно опустить или совсем снять. Заряженная камера должна постоять 1 —2 минуты, и тогда можно приступить к подсчёту эритроцитов. Выждать некоторое время нужно для того, чтобы эритроциты осели на дно камеры, перестали двигаться и стали видны так же отчётливо, как и сетка.
Конденсор Аббе можно опустить или совсем снять. Заряженная камера должна постоять 1 —2 минуты, и тогда можно приступить к подсчёту эритроцитов. Выждать некоторое время нужно для того, чтобы эритроциты осели на дно камеры, перестали двигаться и стали видны так же отчётливо, как и сетка.
Сетка камеры Тома нанесена в виде большого квадрата, разделённого тройными линиями на 16 средних квадратов. Каждый из 16 квадратов разделён, в свою очередь, простыми линиями на \ 6 маленьких квадратов. Во всей камере Тома—Цейса, включая квадраты, разделённые тройными линиями, имеется 400 маленьких квадратиков. Вся сетка камеры Тома—Цейса равна 1 мм2. Каждая сторона квадрата сетки разделена на 20 равных частей. Боковая сторона малого квадрата сетки имеет длину 1/20 мм, а поверхность его, следовательно, равна 1/20 X 1/20 = 1/4о0 мм2-Так как высота слоя крови в камере равна 710 мм2, то объём крови в 1 малом квадратике определяется
Необходимо отличать камеру от сетки. На камерах Тома нанесены обычно сетки Тома же, но есть камеры Тома и с другими сетками, например, Предтеченского.
Сетка Бюркера состоит из 144 больших квадратов, по 12 в каждом ряду; между ними размещены малые квадраты, по 13 в каждом ряду. Ёмкость камеры Бюркера равна 9 мм3. Высота камеры=1/10, площадь большого квадрата = 1/аб и малого = 7400 мм2.
Сетка Тюрка получена наложением сетки Тома на сетку Бюркера. Средний и большой квадрат—сетка Тома, а боковые квадраты—Бюркера.
В сетке Предтеченского дно счётной камеры разделено на 100 больших квадратов, из которых 50 разделены на 16 маленьких. Сторона маленького квадрата = 1/20, а площадь = 74оомм2- Высота, как и в других камерах, =0,1 мм.
Рис. 32. Сетка Тома. / Рис. 33. Сетка Бюркера.
В последнее время f нас в Советском Союзе широкое распространение получила камера Горяева.
Рис. 34. Сетка Тюрка. / Рис. 35. Сетка Предтеченского.
Горяев предложил сетку, представляющую видоизменение сетки Предтеченского. Сетка Горяева имеет площадь, равную 9 мм2 (сетка Предтеченского 4 мм2).
Сетка Горяева состоит из 15 вертикальных и 15 горизонтальных полос. Ширина одной полосы равняется */20 мм,
Причём каждая третья, в свою очередь, разделена на 4 узких полоски в 7зо мм> пересечением которых образуются малые квадратики с площадью в е/400 мм2- Они группируются по 16; всего таких групп 25. Общая площадь сетки 9 мм2.
Эритроциты подсчитываются в малых квадратиках, а лейкоциты—в полосах шириной 4/20 мм и длиной 3 мм.
При высоком содержании лейкоцитов Горяев рекомендует считать в группах по три квадрата в J/26 мм2 или даже по отдельным квадратам; в последнем случае выгоднее пользоваться теми же квадратами, что и для счёта эритроцитов.
Положительной стороной сетки Горяева, по мнению её автора, является: 1) отчётливость рисунка, а отсюда лёгкость и удобство ориентировки при подсчёте; 2) группировка малых квадратов по 16, причём эти группы разделены между собою; 3) большая площадь сетки по сравнению с сеткой Предтеченского.
Если взвесь хорошо размешана и камера заряжена правильно, эритроциты распределяются по сетке равномерно; при отступлении от принятой методики эритроциты могут лежать неравномерно—в одних квадратах редко, а в других, напротив, слишком скученно.
При ориентировочном подсчёте ограничиваются большей частью пятью большими квадратами. Для получения более точных цифр, необходимо подсчитать 10 и даже 16 больших квадратов. Чем больше будет подсчитано квадратов, тем ближе к истине будут результаты исследования.
Подсчёт эритроцитов начинают обыкновенно с маленького квадрата, расположенного в левом углу первого большого квадрата, затем переходят ко второму, третьему и четвёртому того жо ряда. Сосчитав клетки первого ряда, переходят на второй и считают в обратном порядке. Меняя с каждым рядом направление, заканчивают подсчёт в левом нижнем квадратике первого большого квадрата и переходят на второй большой квадрат.
Подсчитывать нужно все эритроциты, которые лежат внутри квадрата и на его внутренних линиях (см. рисунок на стр. 336). Что же касается ограничивающих линий, то, чтобы не фиксировать одну и ту же клетку несколько раз, рекомендуется учитывать только те клетки, которые лежат на левой и верхней ограничивающих линиях подсчитываемого квадрата. Клетки, лежащие на правой и нижней ограничивающих линиях, будут подсчитаны в других квадратах. В крайних правых квадратах, как верхних, так и нижних, клетки, лежащие на правой и нижних линиях, подсчитываются с последними квадратиками.
Клетки, лежащие на правой и нижней ограничивающих линиях, будут подсчитаны в других квадратах. В крайних правых квадратах, как верхних, так и нижних, клетки, лежащие на правой и нижних линиях, подсчитываются с последними квадратиками.
При вычислении количества эритроцитов в 1 мм3 исходят из того, что истинный объём крови над одним большим квадратом составляет или 7seoon (при разведении крови в 100 раз), или (при разведении в 200, раз)—1/ъ0 000 часть объёма крови в 1 мм3. Поэтому для получения количества эритроцитов в 1 мм8 нужно: 1) найти среднее количество эритроцитов в одном большом квадрате; 2) полученное число умножить, в зависимости от разведения, или на 25 000 (при разведении в 100 раз) или на 50000 (при разведении в 200 раз).
При подсчёте эритроцитов в пяти больших квадратах (80 маленьких) и разведении крови на 200, подсчитанное количество эритроцитов умножается на 10 000, а при разведении в 100 раз—на 5 000.
Рис. 36. Схема подсчёта эритроцитов.
Расчёт производится следующим образом: каждая сторона малого квадрата равна 7°.омм> высота камеры—7юмм-Таким образом, объём 1 маленького квадратика =>1гоХ X 7»oX7io==I/4o4D мм8- а 80 сосчитанных квадратиков = 7«пи«><е-80=7«о мм>- Если кровь была взята до метки 0,5, т. е. разведение равнялось 200, то объём её над пятью квадратами будет равен 7м> * 7-.о0 = 7к> оо» мм»- Та« как количество эритроцитов исчисляется на 1 кубический миллиметр, то умножением полученного количества эритроцитов в пяти больших квадратах на 10 000 получается искомое количество эритроцитов в 1 мм3. Практически к сумме чисел, полученных при подсчёте в пяти больших квадратах, приписывают четыре нуля. Если же кровь бралась до метки 1, то полученный результат нужно разделить на 2.
При подсчёте в 16 больших квадратах количество эритроцитов в 1 мм3 определяется по формуле:
в которой т—количество подсчитанных эритроцитов, 4000—ёмкость камеры, 200 (пли 100 разведение и 256— количество подсчитанных квадратиков.
В камере с сеткой Бюркера количество эритроцитов определяется в 80 малых квадратах. Для этого подсчитывается 6 рядов по 13 квадратов и 2 квадрата из 7-го ряда. К найденному числу приписывают 4 нуля, так как ёмкость 80 малых квадратов камеры Бюркера соответствует вполне ёмкости 80 квадратов камеры Тома.
В камере с сеткой Тюрка эритроциты подсчитываются в центральном большом квадрате, имеющем сетку Тома; подсчёт и определение количества эритроцитов ведётся так же, как и в камере Тома.
При счёте красных кровяных телец по Горяеву применяется следующая формула:
Если нет микроскопа или счётной камеры, Мухин рекомендует производить определение количества эритроцитов в крови лошади в аппарате Вастергрена или Панченко.
Для определения количества эритроцитов в 1 мм3 крови лошади по этому способу необходимо уровень осадков красных кровяных телец в пипетке аппарата Вастергрена через 24 часа после производства РОЭ помножить на 108 000, а в аппарате Панченко—на 216 000.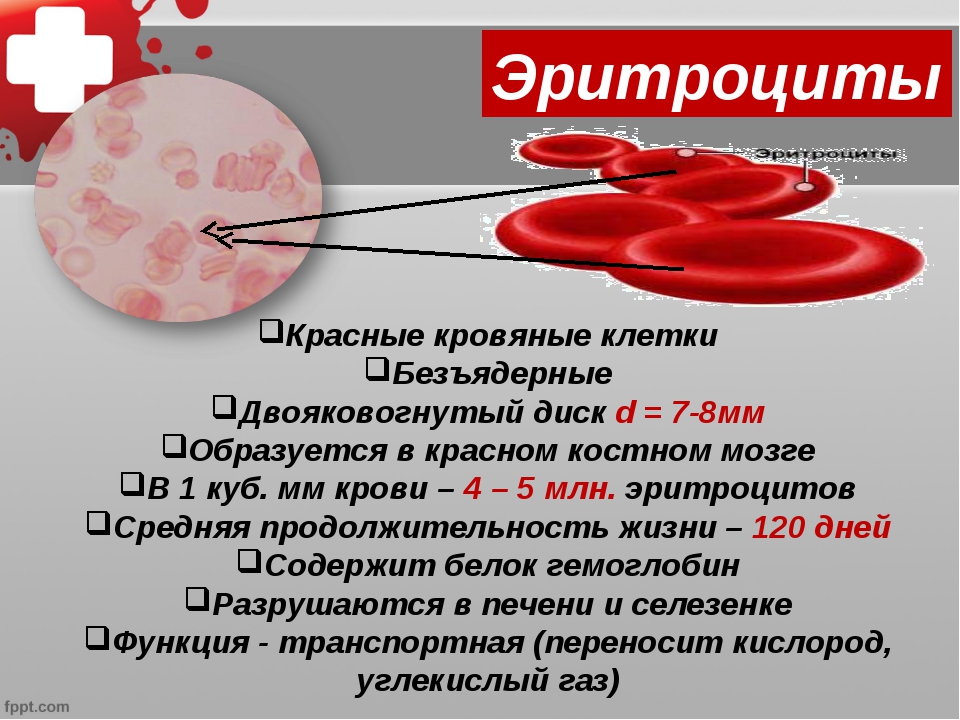
На случай возможных ошибок автор рекомендует заряжать не менее двух пипеток. Кроме того, с целью проверки точности градуировки пипеток необходимо каждый новый прибор опробовать с кровью одного и того же животного не менее трёх раз, и пипетки, дающие через
24 часа отклонения в высоте осадка эритроцитов больше 0,5 деления, выбраковать.
Необходимым условием в работе должна быть чистота пипеток и соблюдение одинаковой температуры.
Подсчёт лейкоцитов. Камера для подсчёта лейкоцитов заряжается так же, как и для подсчёта эритроцитов.
В камере Тома для определения общего числа лейкоцитов необходимо сосчитать все лейкоциты на площади 400 маленьких квадратиков, считая и квадраты, пересечённые третьей линией. Лейкоциты подсчитываются в том же порядке, как и эритроциты, по зигзагообразной линии: слева направо, вниз и справа налево и т. д. Этим устраняется возможность спутать ряды и клетки. При подсчёте в камере Тома—Цейса, с сеткой Тома, в каждом ряду находится по 4 маленьких квадрата и один ряд таких, пересочённых третьей линией. Всего подсчитывается 20 рядов по 20 маленьких квадратиков в каждом. Для получения более точных цифр камера заряжается второй и третий раз, после чего выводят среднее арифметическое. Расчёт производится по формуле:
Всего подсчитывается 20 рядов по 20 маленьких квадратиков в каждом. Для получения более точных цифр камера заряжается второй и третий раз, после чего выводят среднее арифметическое. Расчёт производится по формуле:
В камерах с другими сетками подсчёт лейкоцитов дает более точные результаты, благодаря большей их площади, а отсюда — большему количеству сосчитанных клеток.
Наилучшей сеткой для подсчёта лейкоцитов является сетка Тюрка, равная 9 сеткам Тома.
При счёте лейкоцитов в камере с сеткой Тюрка подсчитываются все лейкоциты, расположенные внутри 4 больших квадратов по углам сетки. Каждый квадрат имеет размер 1 мм2. Чтобы узнать количество лейкоцитов в 1 мм3, необходимо все сосчитанные лейкоциты умножить на 25 при разведении в 10 раз и на 50 при разведении в 20 раз. Если же подсчитываются все 9 квадратов, то расчёт ведётся по формуле:
В камере с сеткой Вюркера подсчитывается 80 больших квадратов. Найденное число умножают на 2, делят на 9 и частное вновь умножают на 10 и на степень разведения (10 или 20).
Счёт в камере с сеткой Предтеченского производится во всех 100 больших квадратах. При расчёте необходимо учесть, что в каждом из 100 больших квадратов имеется 16 маленьких.
Расчёт ведётся по формуле:
Другими словами, чтобы определить число лейкоцитов в 1 мм3, пользуясь сеткой Предтеченского, нужно количество сосчитанных в 100 больших квадратах белых кровяных телец умножить на 25.
По Горяеву, число белых телец в 1 мм3 при разведении 1 : 10 узнаётся по формуле: .
Для получения точных результатов при подсчёте форменных элементов крови требуются некоторый опыт и большая тщательность в выполнении всех деталей. Счётная камера и смесители должны быть безукоризненно чисты и вполне сухи. После каждого исследования смесители тщательно промываются дестиллированной водой и высушиваются спиртом и эфиром.
Продувание смесителей проще всего производить шарами Ричардсона. Стеклянный шарик не должен прилипать к стеклу.
Счётную камеру можно обмывать только дестиллированной водой и вытирать очень мягкой тряпкой.
- Подробности
-
Раздел: ГЕМАТОЛОГИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Подсчет клеток крови • Гемоцитометр
Что мне считать?
Кровь орошает все наше тело и, следовательно, содержит множество типов клеток, которые выполняют различные задачи: красные кровяные тельца, переносящие кислород, лимфоциты, которые борются с инфекцией с помощью адаптивных механизмов (т.е. они находят индивидуальное «лекарство»), лейкоциты, которые составляют врожденную реакция на инфекцию (т.е. они демонстрируют универсальное «лекарство» и способствуют процессу заживления ран и т. д.…). Когда мы сделаем подсчет кровяных телец, все они появятся.Однако из-за своего размера красные кровяные тельца будут отличаться от белых кровяных телец (всех остальных). Так мы будем различать их при подсчете.
Разбавление крови
Вы можете подсчитать клетки крови с помощью всего лишь капли крови. Поскольку плотность клеток очень высока, вам нужно разбавить так много, чтобы вы могли сделать более 200 подсчетов клеток!
Поскольку плотность клеток очень высока, вам нужно разбавить так много, чтобы вы могли сделать более 200 подсчетов клеток!
Обычно выполняется разведение 1: 200 кровь: изотонический раствор. Так, например, мы могли бы взять 1 мкл неразбавленной крови и добавить 199 мкл изотонического раствора (или выполнить серийные разведения).
Загрузка образца в гемоцитометр
Чтобы подготовить гемоцитометр, убедитесь, что вы правильно очистили его тканью и этанолом, и поместите сверху чистое предметное стекло.
После разбавления образца вы можете дополнительно добавить краситель жизнеспособности, такой как эритрозин B или трипановый синий, в пропорции 1: 1. Итак, вы можете взять 10 мкл уже имеющейся разбавленной крови и добавить еще 10 мкл эритрозина B. Это будет ваш счетный раствор.
Введите его с помощью пипетки в зазор между гемоцитометром и предметным стеклом, стараясь не переполнить камеру, при этом покрывая всю приподнятую поверхность камеры.
Подсчет клеток
Белые кровяные тельца: поскольку они больше, вы должны пересчитать их в четырех угловых квадратах.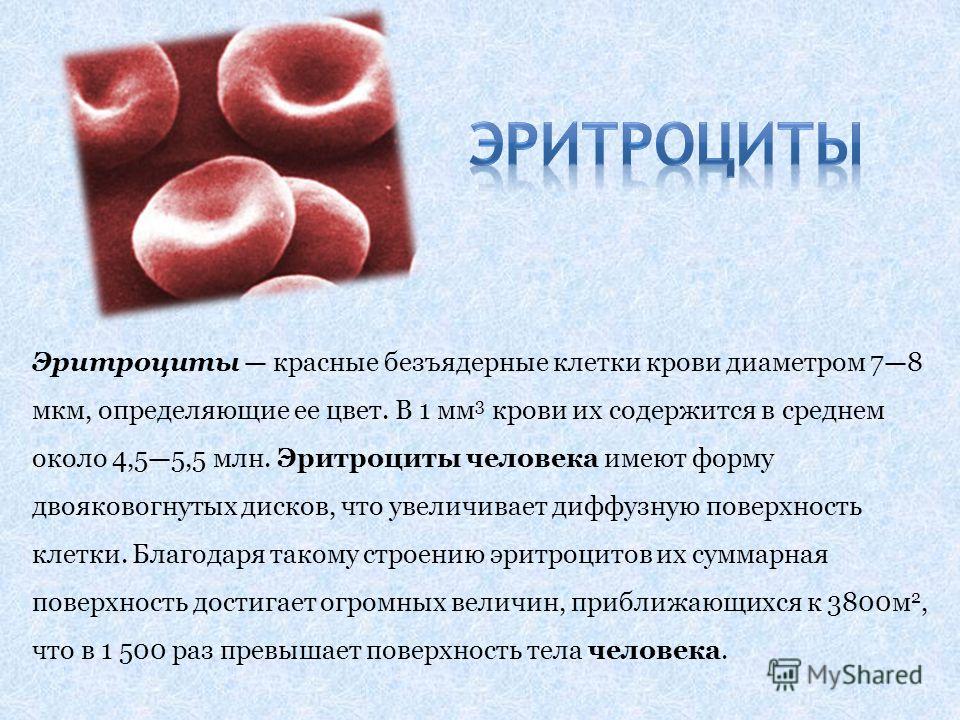 Напоминаем, что вы должны установить правило для ячеек, которые касаются периферийных линий: вы можете подсчитать те, которые касаются верхней и левой линии, и пропустить те, которые находятся внизу и справа, или любые другие комбинации двух последовательных линий, которые вы хотите. . Запишите свои подсчеты (различие между живыми и мертвыми, если вы добавили краситель).
Напоминаем, что вы должны установить правило для ячеек, которые касаются периферийных линий: вы можете подсчитать те, которые касаются верхней и левой линии, и пропустить те, которые находятся внизу и справа, или любые другие комбинации двух последовательных линий, которые вы хотите. . Запишите свои подсчеты (различие между живыми и мертвыми, если вы добавили краситель).
Красные кровяные тельца: увеличьте изображение центрального квадрата, на котором нарисованы квадраты меньшего размера.Подсчитайте клетки в четырех маленьких угловых квадратах и небольшом центральном квадрате, и сделайте то же, что и при подсчете WBC.
Расчет плотности клеток
Вы можете продолжить подсчет так же, как здесь, но на этот раз не забудьте умножить на 200 из-за сделанного вами первоначального разбавления и дополнительно на 2 из-за жизнеспособности красителя. Для более быстрого подсчета воспользуйтесь HemocyTap, приложением для гемоцитометра.
Связанные
Общее количество эритроцитов гемоцитометром
КРАТКОЕ ВВЕДЕНИЕ В КРАСНУЮ КЛЕТКУ
Красные кровяные тельца (эритроциты) представляют собой двояковогнутые диски круглой формы, присутствующие в крови, которые помогают транспортировать газы по всему телу. Двояковогнутая форма помогает эритроцитам делать красные клетки достаточно гибкими, чтобы они могли легко проходить через капилляры. В среднем размер красных кровяных телец (эритроцитов) составляет 7,2 — 7,4 мм (микрон). Зрелые эритроциты — это безъядерные клетки с железосодержащим пигментом, известным как гемоглобин, который помогает транспортировать кислород из легких в ткани и углекислый газ из тканей обратно в легкие для выделения. Средняя продолжительность жизни красных кровяных телец (эритроцитов) составляет 100–120 дней.
Двояковогнутая форма помогает эритроцитам делать красные клетки достаточно гибкими, чтобы они могли легко проходить через капилляры. В среднем размер красных кровяных телец (эритроцитов) составляет 7,2 — 7,4 мм (микрон). Зрелые эритроциты — это безъядерные клетки с железосодержащим пигментом, известным как гемоглобин, который помогает транспортировать кислород из легких в ткани и углекислый газ из тканей обратно в легкие для выделения. Средняя продолжительность жизни красных кровяных телец (эритроцитов) составляет 100–120 дней.
Проверить состав крови
ЦЕЛЬ / ЦЕЛЬ ВЫПОЛНЕНИЯ ОБЩЕГО СЧЕТА эритроцитов
Целью подсчета общего количества эритроцитов является определение того, страдаете ли вы эритроцитозом или полицитемией (т.е. увеличение нет. красных кровяных телец до более чем 6,5 миллионов / мм ( 3 ) или эритроцитопении или эритропении (т.е. Снижение количества красных кровяных телец до менее 3,5 миллионов / мм 3 ).
КРАСНЫЕ КЛЕТКИ КРОВИ
ПРИНЦИП ОБЩЕГО ПОДСЧЕТА эритроцитов С ПОМОЩЬЮ ГЕМОЦИТОМЕТРА
В образце крови присутствует очень большое количество красных кровяных телец. Практически подсчитать такое количество эритроцитов непосредственно под микроскопом крайне невозможно. Итак, количество красных кровяных телец подсчитывается с помощью камеры особого типа, предназначенной для подсчета клеток крови в образце, известной как гемоцитометр или камера Нойбауэра.
Для этого образец крови разбавляется (обычно в соотношении 1: 200) с помощью жидкости для разведения эритроцитов (обычно жидкости Хайема), которая сохраняет и фиксирует эритроциты. Жидкость Хайема изотонична эритроцитам и не причиняет им никакого вреда. Для этого также можно использовать физиологический раствор, но он вызывает небольшое образование красных кровяных телец и допускает образование колец, что может привести к ошибкам в результатах.
После разбавления образца содержимое загружается в камеру гемоцитометра / Нойбауэра, и клетки подсчитываются в областях, специфичных для подсчета эритроцитов.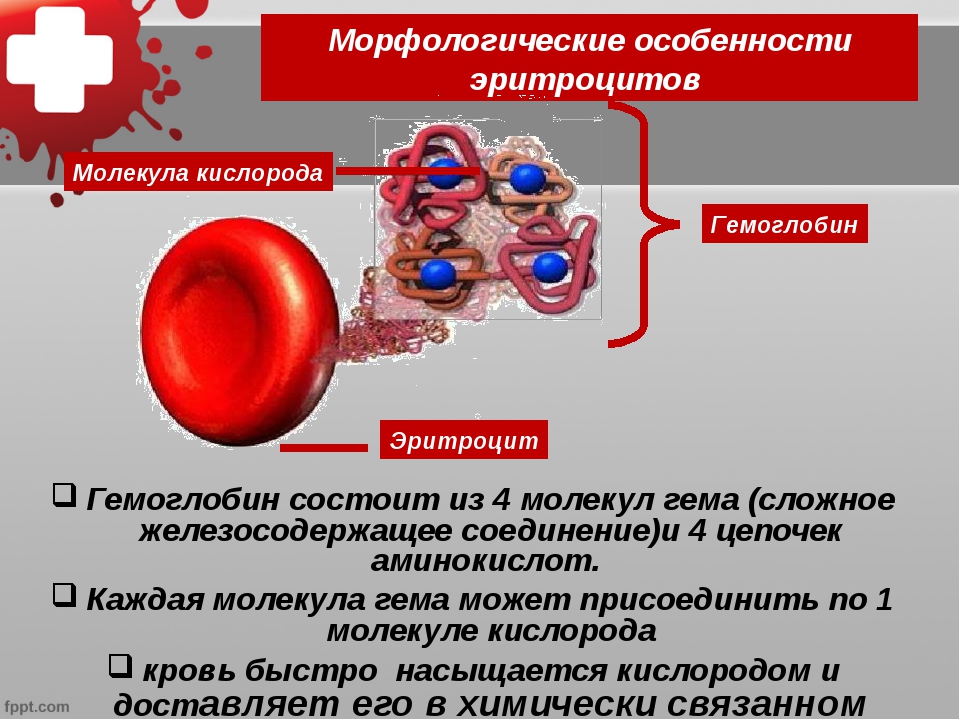
В настоящее время в лабораториях обычно используются два типа жидкости для разбавления эритроцитов —
- Жидкость для разбавления RBC Хайема
- Жидкость для разбавления цитрата формалина
Состав разбавляющей жидкости Хайема
| КОМПОНЕНТЫ | КОЛИЧЕСТВО |
|---|---|
| Хлорид ртути | 0,25 грамма |
| Сульфат натрия | 2.5 грамм |
| Хлорид натрия | 0,5 г |
| Дистиллированная вода | 100 мл |
Конечный pH раствора (при 25 ° C) варьируется от 5,8 до 6,0, что зависит от состава и компаний-производителей.
Приведенный выше состав основан на протоколе разбавляющей жидкости HIMEDIA Hayem, который вы можете проверить здесь.
Состав разбавляющей жидкости цитрата формалина
| КОМПОНЕНТЫ | КОЛИЧЕСТВО |
|---|---|
| Тринатрийцитрат | 3 грамма |
| Формалин | 1 мл |
| Дистиллированная вода | 99 мл |
Эта разбавляющая жидкость обычно используется, потому что она дешевле, чем жидкость Хайема. Однако разбавляющая жидкость Хайема дает лучшие результаты.
Однако разбавляющая жидкость Хайема дает лучшие результаты.
Гемоцитометр / камера Нойбауэра —
Это особый тип стеклянной камеры, которая используется для подсчета клеток, особенно клеток крови. В настоящее время чаще всего используется улучшенная камера Нойбауэра, а в некоторых лабораториях также используются другие типы камер, такие как камера Беркерса, камера Леви, камера Фуша-Розенталя и т. Д.
ГЕМОЦИТОМЕТР А.К.А. КАМЕРА НОЙБАУЭРА
Камера Нойбауэра определила площадь в 9 квадратных мм и глубину 0.1 мм, как если бы покровное стекло помещалось на поверхность счетной камеры, расстояние между дном покровного стекла и основанием области с канавками составляет 0,1 мм в глубину.
Центральный квадрат 1 строго линейчатый, он разделен на 25 квадратов. Каждый квадрат Центральной площади делится на 16 квадратов.
При подсчете РБК ячейки подсчитываются в 5 квадратах Центральной площади как 4 Угловых квадрата Центральной площади (разделенных на 25 квадратов) и 1 центральный квадрат Большой Центральной площади (разделенные на 25 квадратов).
R — ЗОНЫ РБК W — ЗОНЫ WBC
Каждый квадрат Центральной площади (разделенный на 25 квадратов) содержит 16 маленьких квадратов, поэтому общее количество квадратов нет. площади для подсчета РБК —
16 × 5 = 80 маленьких квадратов
Два метода были разработаны для ручной оценки общего количества эритроцитов с использованием гемоцитометра / камеры Нойбауэра —
Метод микроразведения
Метод макроразбавления
Здесь я объясню оба метода, но метод Microdilution не является предпочтительным в настоящее время из-за использования пипеток для рта.Итак, давайте начнем с метода Microdilution, а затем перейдем к методу Macrodilution….
МЕТОД МИКРОРАЗВЕДЕНИЯ ДЛЯ ОЦЕНКИ ОБЩЕГО количества эритроцитов с помощью гемоцитометра
Материалы, необходимые для подсчета общего количества красных кровяных телец (эритроцитов) методом микроразведения —
- Образец крови (капиллярная кровь или образец с антикоагулянтом ЭДТА)
- Жидкость для разбавления эритроцитов (предпочтительно жидкость Хайема)
- Кусок марли или хлопок
- Пипетка для RBC
- Гемоцитометр а.
 k.a. Камера Нойбауэра
k.a. Камера Нойбауэра - Покровное стекло
- Микроскоп
Краткое введение в дозатор RBC
Пипетка
RBC — это градуированная пипетка, обеспечивающая разведение 1: 100 и 1: 200. Он имеет две метки внизу — 0,5 и 1, а верх пипетки — 101. Он имеет грушу круглой формы, в которой находится красный шарик для смешивания пробы крови и разбавляющей жидкости. Сверху к пипетке прикреплена резиновая трубка для отсасывания пробы крови и разбавления жидкости.
RBC PIPETTE
Когда кровь всасывается до 0,5 метки и разбавляющая жидкость до 101 метки, дает разведение крови 1: 200: Разбавляющая жидкость и Когда кровь всасывается до 1 метки и разжижающая жидкость до 101, дает Разведение крови 1: 100: жидкость для разведения, которая обычно используется у пациентов с анемией. После всасывания образца и жидкости для разбавления содержимое осторожно перемешивают, вращая пипетку вокруг ее длинной оси, чтобы обеспечить тщательное смешивание крови и разбавляющей жидкости.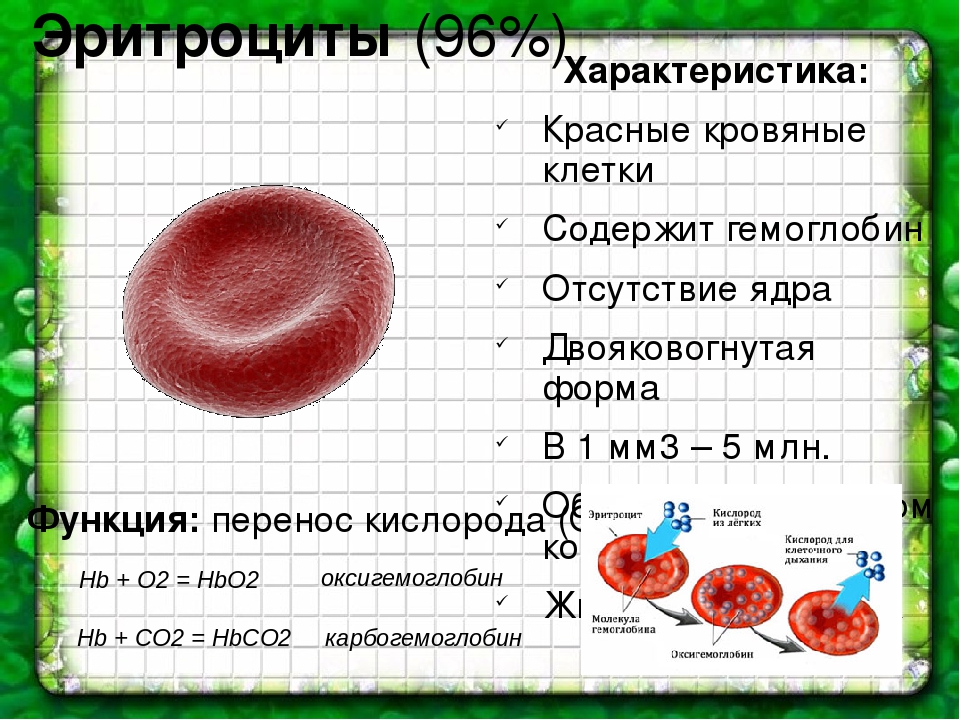
Примечание: В настоящее время пипетирование через рот запрещено в большинстве лабораторий из-за высокого риска заражения сильно инфицированными образцами пациентов.Таким образом, вместо метода микроразведения в лабораториях используются методы макроразведения… ..
Процедура подсчета общего количества красных кровяных телец (эритроцитов) методом микроразведения
⇒ Заполните пипетку для эритроцитов до отметки 0,5 образцом крови и вытрите пипетку снаружи, чтобы избежать ложно завышенных результатов.
⇒ Заполните ту же пипетку жидкостью для разбавления эритроцитов (предпочтительно жидкостью Хайема) до отметки 101.
⇒ Будьте осторожны, чтобы в груши дозатора не было пузырьков воздуха.
⇒ Смешайте кровь и разбавляющую жидкость в пипетке, вращая пипетку (по горизонтали) между ладонями.
⇒ Выньте камеру Нейбауэра / гемоцитометр из футляра и очистите ее тампоном или марлей. Точно так же очистите покровное стекло и поместите его на желобчатую область гемоцитометра.
Точно так же очистите покровное стекло и поместите его на желобчатую область гемоцитометра.
Примечание: Здесь используется специальный тип покровного стекла толщиной 0,4 мм с очень гладкой поверхностью и одинаковой толщиной, так что зазор между желобом камеры и покровным стеклом составляет ровно 0.1 мм.
⇒ Теперь вставьте пипетку для эритроцитов, снова перемешайте имеющийся в ней раствор и затем слейте 1-2 капли из пипетки перед загрузкой камеры.
⇒ Осторожно нажмите на резиновую трубку дозатора RBC, чтобы следующая капля жидкости оказалась в подвешенном состоянии.
⇒ Прикоснитесь кончиком пипетки свисающей каплей к краю покровного стекла, образуя угол примерно 45 °.
⇒ Позвольте небольшому количеству жидкости из пипетки заполнить камеру за счет капиллярного действия.Не перезаряжайте камеру, и в ней не должно быть пузырьков воздуха.
⇒ После зарядки подождите 3-5 минут, чтобы клетки осели в камере, а затем сфокусируйте камеру под микроскопом для расчета красных клеток.
МЕТОД МАКРОРАЗБАВЛЕНИЯ ДЛЯ ОЦЕНКИ ОБЩЕГО количества эритроцитов с помощью гемоцитометра
Материалы, необходимые для подсчета общего количества красных кровяных телец (эритроцитов) методом макроразбавления
- Образец крови (капиллярная кровь или образец с антикоагулянтом ЭДТА)
- Жидкость для разбавления эритроцитов (предпочтительно жидкость Хайема)
- Hb или микропипетка (0.02 мл или 20 µ л )
- Гемоцитометр / камера Нойбауэра
- Кусок марли или ватный тампон
- Градуированная пипетка (5 мл)
- Пробирки
- Накладка
Пипетка
Процедура подсчета общего количества красных кровяных телец (эритроцитов) методом макроразбавления
⇒ Наберите 3,98 мл жидкости для разведения эритроцитов в чистую, сухую и обезжиренную пробирку.
Примечание: Если у вас в лаборатории нет дозатора для измерения 3. 98 мл или 3980 мкл жидкости для разбавления, затем возьмите 4 мл жидкости для разбавления с помощью 5 мл градуированной пипетки в пробирку и слейте 20 мкл жидкости с помощью микропипетки или пипетки для эритроцитов.
98 мл или 3980 мкл жидкости для разбавления, затем возьмите 4 мл жидкости для разбавления с помощью 5 мл градуированной пипетки в пробирку и слейте 20 мкл жидкости с помощью микропипетки или пипетки для эритроцитов.
⇒ Теперь добавьте 0,02 мл или 20 µ л Образца крови в пробирку, содержащую разбавляющую жидкость, с помощью микропипетки или пипетки для эритроцитов.
⇒ Хорошо перемешайте в течение нескольких минут и подготовьте свой гемоцитометр / камеру Нойбауэра.
⇒ Выньте камеру Нейбауэра / гемоцитометр из футляра и очистите ее тампоном или марлей. Точно так же очистите покровное стекло и поместите его на желобчатую область гемоцитометра.
Примечание: Здесь используется специальный тип покровного стекла толщиной 0,4 мм с очень гладкой поверхностью и равномерной толщиной, так что зазор между канавкой камеры и покровным стеклом составляет точно 0,1 мм.
⇒ Теперь выньте пипетку для эритроцитов и заполните ее разбавленным образцом, хорошо перемешайте раствор и затем слейте 1-2 капли из пипетки перед загрузкой камеры.
⇒ Осторожно нажмите на резиновую трубку дозатора RBC, чтобы следующая капля жидкости оказалась в подвешенном состоянии.
⇒ Прикоснитесь кончиком пипетки свисающей каплей к краю покровного стекла, образуя угол примерно 45 °.
⇒ Позвольте небольшому количеству жидкости из пипетки заполнить камеру за счет капиллярного действия. Не перезаряжайте камеру, и в ней не должно быть пузырьков воздуха.
Использование микропипетки вместо дозатора эритроцитов для зарядки гемоцитометра
⇒ Вы также можете использовать микропипетку вместо дозатора эритроцитов для зарядки гемоцитометра. Итак, с помощью микропипетки осторожно наберите около 20 µ l разбавленного образца. Нажмите ручку пипетки, чтобы на кончике микропипетки образовалась свисающая капля.
Нажмите ручку пипетки, чтобы на кончике микропипетки образовалась свисающая капля.
⇒ Теперь осторожно прижмите наконечник пипетки к краю покровного стекла и, если необходимо, медленно выдавите больше жидкости, пока счетная камера не заполнится.Этот процесс происходит за счет капиллярного действия, но следует соблюдать осторожность, чтобы не переполнить камеру. Объем 10 µ л достаточен для заполнения одной счетной камеры.
⇒ После зарядки подождите 3-5 мин, чтобы элементы осели в камере.
ПОДСЧЕТ КРАСНЫХ КЛЕТОК КРОВИ ПОД МИКРОСКОПОМ
⇒ Сфокусируйте линию, используя линзу объектива 10x, а затем подсчитайте эритроциты в 5 небольших квадратах центрального квадрата, как описано выше, используя линзу объектива 40x.
⇒ Подсчитайте ячейки, которые лежат на правой и нижней линиях 5 маленьких квадратов, но не на противоположной линии. В случае маргинальных ячеек, подсчитайте ячейки на линии «L», которая находится либо на правой и нижней линиях, либо на левой и верхней линиях.
РАСЧЕТ ОБЩЕГО ПОДСЧЕТА RBC С ПОМОЩЬЮ ГЕМОЦИТОМЕТРА
⇒ После подсчета клеток под микроскопом мы знаем количество эритроцитов в 5 квадратах центрального квадрата. Будем считать это «N» нет.ячеек.
⇒ Теперь объем жидкости внутри камеры является произведением площади и глубины камеры гемоцитометра / Нойбауэра.
⇒ Центральная площадь — 1 кв. Мм, разделенная на 25 частей, так что площадь равна
.
25 квадратов = 1 кв. Мм
⇒ Из этих 25 квадратов RBC подсчитываются в 5 квадратах. Итак, Площадь 5 маленьких квадратов равна
.
5/25, т.е. 1/5
⇒ Глубина гемоцитометра равна 0.1 мм, как описано выше в кратком описании гемоцитометра.
⇒ Теперь примените следующую формулу, чтобы получить общее количество красных кровяных телец —
.
Общее количество эритроцитов = N × разведение / площадь × глубина
N × 200 (или 100 при разбавлении) / (1/5 × 0,1)
Общее количество эритроцитов = N × 10,000 / мм 3
Используя приведенную выше формулу, мы можем рассчитать общее количество красных кровяных телец, присутствующих в образце крови.
НОРМАЛЬНЫЕ ЗНАЧЕНИЯ КЛЕТОК КРАСНОЙ КРОВИ
У мужчин — 4.8-5,5 млн / мм 3
У женщин — 4,5-5 млн / мм 3
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ВЫПОЛНЕНИИ ОБЩЕГО ПОДСЧЕТА эритроцитов ГЕМОЦИТОМЕТРОМ
⇒ Использование ротовых пипеток (пипеток для эритроцитов) запрещено во многих странах. Однако, если вам нужно его использовать, будьте осторожны, чтобы не принимать разбавляющую жидкость или образец.
⇒ Точно измерьте количество образца и разбавляющей жидкости, чтобы избежать ошибок в результатах.
⇒ В случае, если вы выполняете этот тест методом микроразведения, смешайте образец и разбавленную жидкость соответствующим образом, осторожно вращая между ладонями.
⇒ Тщательно зарядите гемоцитометр или камеру Нойбауэра, чтобы она не была перезаряжена и не содержала пузырьков воздуха.
Привет, я основатель и разработчик Paramedics World, блога, посвященного фельдшерам. Я техник в медицинской лаборатории, веб-разработчик и библиофил.Мое самое большое хобби — учить и мотивировать других людей делать то, что они хотят делать в жизни.
Как проводится подсчет эритроцитов? | Типы | Клетки крови
Получите ответ: Как проводится подсчет эритроцитов?
Это количественный показатель популяции циркулирующих кровяных телец. Подсчет клеток в обращении. Подсчет клеток можно производить в основном с помощью микроскопа после разбавления крови и изготовления влажного образца. Этот метод известен как гемоцитометрия.
В настоящее время используется дневная автоматизированная система подсчета клеток крови электрометрическим и фотометрическим методом. Метод гемоцитометрии имеет некоторые недостатки, поскольку они не могут отличить различные типы лейкоцитов и ретикулоцитов от зрелых эритроцитов.
Количество эритроцитов:
Красные кровяные тельца (эритроциты) :
(эритроциты)
Erythros — Красный
Cyte — ячейка
Клетка красного цвета обычно называется эритроцитом.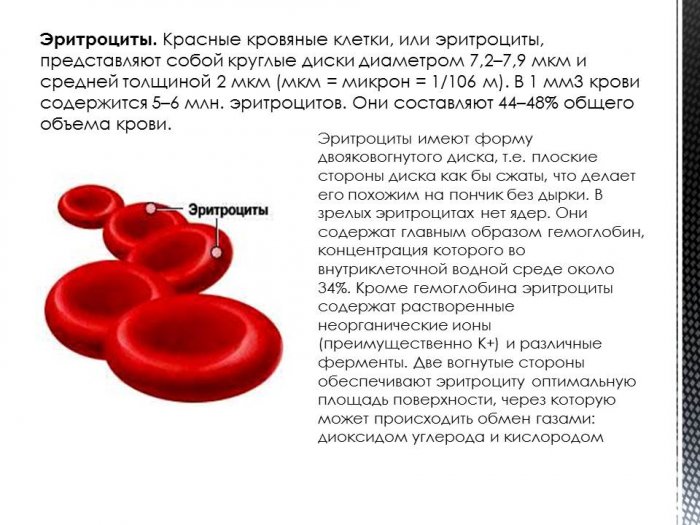 Цвет эритроцитов обусловлен наличием гемоглобина, в котором гем является цветным пигментом, а глобин — белком.
Цвет эритроцитов обусловлен наличием гемоглобина, в котором гем является цветным пигментом, а глобин — белком.
Количество эритроцитов колеблется от 4 до 5,5 миллионов на кубический миллиметр крови.
У взрослых мужчин это 5 млн / куб. Мм крови, а у взрослых женщин — 4,5 млн. Куб. Мм крови.
Морфология красных кровяных телец :
Нормальный размер
Диаметр — 7,2 мкм (µ) (6,9-7,4 м)
Толщина — на периферии толще на 2.2 мкм в центре тоньше на 1 мкм
Нормальная форма :
Обычно форма R.B.C. имеет форму двояковогнутого диска или гантели.
Из-за двояковости R.B.C. имеет следующие механические преимущества:
1. Он способствует равномерной и быстрой диффузии кислорода и других веществ внутрь клетки.
2. Большая поверхность предназначена для абсорбции или удаления различных веществ.
3. Минимальное натяжение мембраны создается при изменении объема ячейки.
4. Проходя через мелкие капилляры, эти клетки могут очень легко протиснуться через капилляры.
Общее количество эритроцитов по данным гемоцитометрии :
Образец:
и. Двойная оксалатная кровь или кровь с ЭДТА или
ii. Капиллярная кровь.
Принцип:
Образец крови разбавляют 1: 200 жидкостью для разведения эритроцитов. Подсчитывают клетки при высоком увеличении (объектив 10X) с помощью счетной камеры.Количество клеток в неразбавленной крови рассчитывается и выражается как количество эритроцитов на 1 м3 (мкл) цельной крови.
Требование:
1. Микроскоп
2. Улучшенная камера неубэра
3. Пипетка для эритроцитов
4. Приготовление разбавляющей жидкости для эритроцитов:
а. Цитрат натрия: 3,09 г
г. Формалин: 1,0 мл
г. Дистиллированная вода: 100 мл.
Этот раствор стабилен при комнатной температуре (25 ° C ± 5 ° C) не менее одного года.
Состав хайемовой жидкости, разбавляющей эритроциты:
(1) Хлорид ртути — 0,5 г
(2) Хлорид натрия — 5 г
(3) Сульфат натрия — 5 г
Для предотвращения роста бактерий или грибков
(4) Д.У. —200 мл
Примечание:
1. Жидкость для разведения эритроцитов изотонична крови, поэтому гемолиз не происходит. Также можно использовать физиологический раствор, но он вызывает небольшое зазубривание красных кровяных телец и способствует образованию пузырьков.
2. Формалин действует как консервант и сдерживает рост бактерий и грибков.
3. Цитрат натрия предотвращает свертывание крови и обеспечивает правильное осмотическое давление.
Процедура :
1. Тщательно перемешайте антикоагулированную кровь, покачивая колбу.
2. При наличии капиллярной крови укол ланцета должен быть достаточно глубоким, чтобы кровь могла свободно течь; он быстро набирается в пипетку для эритроцитов.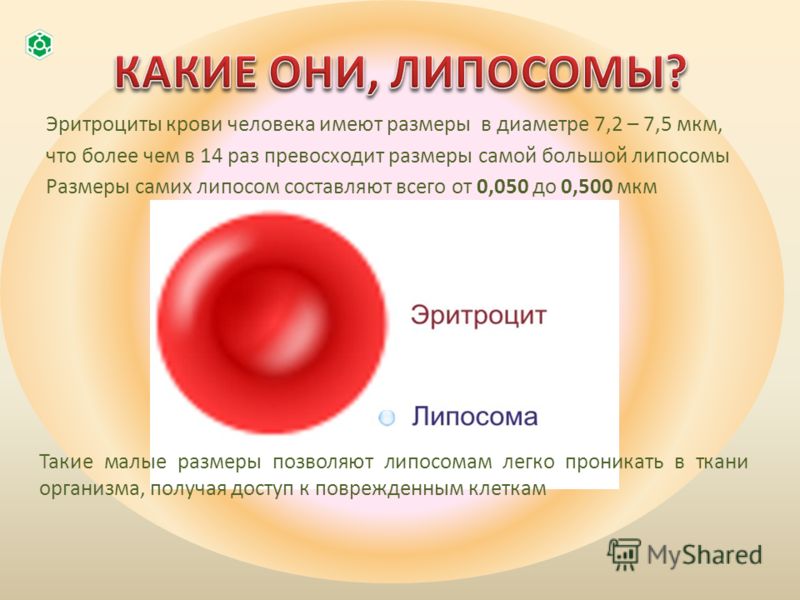
3.Забрать кровь до 0,5 балла.
4. Осторожно вытрите излишки крови снаружи пипетки с помощью ваты или марли.
5. Набрать разбавляющую жидкость до отметки 101.
6. Пипетка быстро вращается, удерживая ее в горизонтальном положении во время перемешивания.
7. Через пять минут, отбросив несколько капель из пипетки и удерживая ее под небольшим наклоном, небольшой объем жидкости вводится под покровное стекло, которое помещается в счетную камеру.
8.Дайте клетке отстояться от 2 до 3 минут.
9. Поместите счетную камеру на предметный столик микроскопа.
10. Переключитесь на меньшее увеличение (10-кратное увеличение). Отрегулируйте свет и поместите большой квадрат в центре с 25 маленькими квадратами.
11. Теперь переключитесь на высокое увеличение (40-кратное увеличение).
12. Подсчитываются эритроциты в четырех угловых квадратах и в центральном квадрате.
13. Используйте следующую формулу для расчета красных кровяных телец.
Общее количество эритроцитов / куб. Мм (мкл). = Количество подсчитанных эритроцитов × фактор разведения / подсчитанная площадь × глубина
Нормальное значение:
Мужской: от 4,5 до 6,0 x 10 6 клеток / куб.мм (мкл)
Гнездо: от 4,0 до 44,5 x 10 6 клеток / куб. Мм (мкл)
Клиническая значимость:
Увеличение общего количества эритроцитов наблюдается в таких условиях, как:
1.При ожогах хлора
2. Болезнь сердца.
3. Полицитемия
Уменьшение количества эритроцитов наблюдается у:
1. Старость
2. Беременность.
3. Анемия
Источник ошибки:
1. Разбавляемая жидкость не должна содержать эритроцитов.
2. Следите за тем, чтобы в счетной камере и покровном стекле не было пыли, ворса и засохшей крови.
3. Используйте мягкое моющее средство (1% бикарбонат натрия), затем промойте водопроводной водой и ополосните деионизированной водой.
4. Одним из основных источников технических ошибок является неправильное измерение объема (кровь и разбавитель). Неправильная зарядка камеры Нойбауэра, использование неисправной пипетки неправильный подсчет, нарушение камеры во время переключения объектива, недопущение касания объективом покровного стекла, невыполнение очистки пипетки для забора крови, невыполнение очистки пробы крови пипетка, неправильный расчет и клиническая ошибка в записи.
Ложно высокое количество:
1.Неадекватное протирание пипетки.
2. Неправильное перемешивание.
3. Неправильное пипетирование крови и жидкости.
4. Ошибка в расчетах.
Ложно низкое количество:
1. Разведение крови тканевой жидкостью
Метод Дайса:
Принцип:
Количество эритроцитов в образце разбавленной крови подсчитывают в гемолитике известного размера. По количеству наблюдаемых клеток рассчитывается общее количество эритроцитов в неразбавленном образце.
Регенты и аппарат:
и. Жидкость для разбавления
ii. Жидкость Дайса
iii. Пипетка для эритроцитов, малая пробирка и пипетка для гемоглобина
iv. Гемоцитометр
Метод:
и. Антикоагулянт или капиллярная кровь наносят пипеткой до отметки 0,5 на пипетке Thoma, и внешняя поверхность очищается от крови.
ii. Затем разбавляющая жидкость доводится до отметки 10%, стараясь не допустить попадания пузырьков воздуха в колбу.
iii. Пипетку встряхивают для перемешивания и удаляют первые несколько капель разведения.
iv. Гемоцитометр подготавливается путем размещения покрывающих стержней Lipton transferees.
v. Указательным пальцем контролируйте конец пипетки. Позвольте капле разбавленной крови заполнить одну из сторон камеры за счет притяжения капилляров. Следует следить за тем, чтобы капля была достаточного размера, чтобы полностью заполнить область. Он не должен перетекать на прилегающую территорию.
vi.Клеткам дают возможность поселиться в размеченной зоне на 2.3 минуты.
vii. С помощью 10-кратного объектива микроскопа подсчитывают клетки, видимые в Fine Square из 25 центральной последовательности гемоцитометра.
Методы разбавления трубки :
3,98 мл разбавляющей жидкости
0,02 мл крови с использованием пипетки Hb
Остальные шаги такие же, как указано выше.
Расчет:
Источник ошибок:
1.Разбавляемая жидкость не должна быть загрязнена кровяными тельцами.
2. Не допускайте попадания пыли, ворса и засохшей крови в камеру Нойбауэра и покровное стекло.
3. Некоторые основные источники технических ошибок включают неправильное измерение объема (образца и разбавителей), неправильную загрузку счетной камеры, использование дефектных пипеток, неправильный подсчет, нарушение камеры во время переключения объектива (не позволяйте объективу касаться покровное стекло), невыполнение очистки пипетки для забора крови, неправильная промывка пипетки, неправильный расчет и канцелярская ошибка в записи.
Подсчет эритроцитов — обзор
Субъективная оценка цвета, мутности, запаха и объема (по оценке легкости или скорости сбора) плевральной жидкости в грудной полости часто может дать предварительный диагноз и, таким образом, позволить начать терапию до получения лабораторных результатов. Однако, когда образцы умеренно загрязнены периферической кровью при отборе, такие диагностические выводы сделать сложнее. Оценка внешнего вида плевральной жидкости не должна заменять подсчет клеток и цитологическое исследование.Однако во многих случаях, особенно при отсутствии значительного кровотечения, такие оценки позволяют в общих чертах классифицировать жидкость как происходящую из транссудативного или экссудативного процесса.
Подсчет клеток, определение общего белка и цитологическая оценка могут выполняться в лаборатории. Такие тесты требуют небольшого количества оборудования и дают много полезной информации. Метод, которым мазки готовятся в лаборатории для цитологической оценки, зависит от клеточности образца и доступного оборудования. Жидкости с общим количеством ядросодержащих клеток менее 5000 / мкл легче всего исследовать, если мазки сделаны после того, как клетки каким-либо образом сконцентрированы. В диагностических лабораториях для этого часто используются специальные цитоцентрифуги. Аликвота 100 мкл дает идеальную морфологию клеток для исследования цитоспина большинства жидких образцов. (См. Рис. 9-1 и 9-2.) Транссудативным выпотам с очень низкой клеточностью может потребоваться до 200 мкл для улучшения клеточности при микроскопическом исследовании. Экссудативный выпот с чрезвычайно высокой клеточностью может потребовать аликвоты уменьшенного объема (от 25 до 50 мкл) или разбавления образца для получения препаратов цитоспина с идеальной морфологией и количеством клеток.
Жидкости с общим количеством ядросодержащих клеток менее 5000 / мкл легче всего исследовать, если мазки сделаны после того, как клетки каким-либо образом сконцентрированы. В диагностических лабораториях для этого часто используются специальные цитоцентрифуги. Аликвота 100 мкл дает идеальную морфологию клеток для исследования цитоспина большинства жидких образцов. (См. Рис. 9-1 и 9-2.) Транссудативным выпотам с очень низкой клеточностью может потребоваться до 200 мкл для улучшения клеточности при микроскопическом исследовании. Экссудативный выпот с чрезвычайно высокой клеточностью может потребовать аликвоты уменьшенного объема (от 25 до 50 мкл) или разбавления образца для получения препаратов цитоспина с идеальной морфологией и количеством клеток.
В практической лаборатории без цитоцентрифуги концентрация образца достигается центрифугированием до 10 мл плевральной жидкости в пробирке в течение примерно 5 минут при 1000-1500 об / мин. Полученный супернатант удаляют и сохраняют для измерения общего белка. Затем осажденные клетки осторожно ресуспендируют примерно в 0,25–0,5 мкл плевральной жидкости и готовят мазки, часто с использованием техники мазка по линии для концентрации клеток на переднем крае мазка (см. Главу 1). Обычно используются красители типа Романовского, такие как Райта, Мая-Грюнвальда, Гимза или Дифф-Квик.Жидкости с общим количеством ядросодержащих клеток от 5000 до 10000 / мкл могут быть приготовлены из центрифугированных или нецентрифугированных образцов, в зависимости от предпочтений исследователя. (Препараты цитоспина или мазки из центрифугированных отложений дают больше клеток и, следовательно, в этих ситуациях легче сканировать мазки.) Когда общее количество ядросодержащих клеток составляет> 10 000 / мкл и, следовательно, мутность жидкости выше нормы, прямые мазки нецентрифугированных образцов являются обычно удовлетворительное.
Затем осажденные клетки осторожно ресуспендируют примерно в 0,25–0,5 мкл плевральной жидкости и готовят мазки, часто с использованием техники мазка по линии для концентрации клеток на переднем крае мазка (см. Главу 1). Обычно используются красители типа Романовского, такие как Райта, Мая-Грюнвальда, Гимза или Дифф-Квик.Жидкости с общим количеством ядросодержащих клеток от 5000 до 10000 / мкл могут быть приготовлены из центрифугированных или нецентрифугированных образцов, в зависимости от предпочтений исследователя. (Препараты цитоспина или мазки из центрифугированных отложений дают больше клеток и, следовательно, в этих ситуациях легче сканировать мазки.) Когда общее количество ядросодержащих клеток составляет> 10 000 / мкл и, следовательно, мутность жидкости выше нормы, прямые мазки нецентрифугированных образцов являются обычно удовлетворительное.
Подсчет клеток и цитологическое исследование
Подсчет общего количества ядросодержащих клеток и эритроцитов в плевральной жидкости выполняется так же, как и в случае пробы крови. В зависимости от лабораторных ресурсов это может варьироваться от ручного разведения с микроскопическим подсчетом до использования автоматических счетчиков клеток. Справочные значения подробно описаны в Таблице 8-2. Образцы небольшого объема (пробирка с ЭДТА заполнена менее чем на четверть) могут быть разбавлены в достаточной степени, чтобы слегка снизить количество клеток. 18
В зависимости от лабораторных ресурсов это может варьироваться от ручного разведения с микроскопическим подсчетом до использования автоматических счетчиков клеток. Справочные значения подробно описаны в Таблице 8-2. Образцы небольшого объема (пробирка с ЭДТА заполнена менее чем на четверть) могут быть разбавлены в достаточной степени, чтобы слегка снизить количество клеток. 18
Хотя эритроциты присутствуют в плевральной жидкости, взятой у клинически здоровых лошадей, они считаются результатом заражения незначительным кровоизлиянием из межреберных мышц.Соответственно, эритрофагоцитоз не является признаком нормальной плевральной жидкости. 11 Жидкий супернатант также прозрачный и негемолизированный в нормальных образцах. Подсчет эритроцитов в плевральной жидкости выполняется нечасто, если не используются автоматизированные методы, которые обычно включают определение количества эритроцитов.
Ядерные клетки обычно подразделяются на нейтрофилы, лимфоциты, большие мононуклеарные клетки (включая моноциты, макрофаги и мезотелиальные клетки), эозинофилы, базофилы или тучные клетки.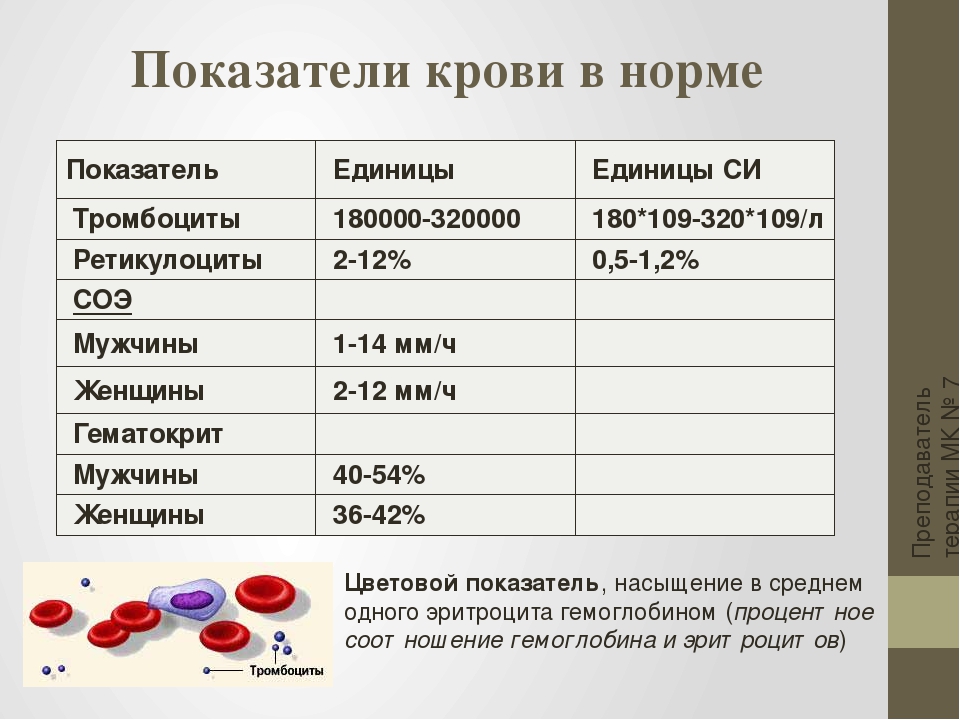 Дифференциальный подсчет обычно выполняется от 100 до 200 клеток. Хотя количество клеток каждого типа обычно выражается в процентах, для точной интерпретации эти цифры должны быть связаны с общим количеством ядерных клеток, общей концентрацией белка и объемом жидкости. Оценка морфологии клеток — очень важная часть цитологического исследования. Общие комментарии, относящиеся к морфологии лейкоцитов перитонеальной жидкости, вероятно, применимы к плевральной жидкости, хотя легкодоступной такой информации мало.
Дифференциальный подсчет обычно выполняется от 100 до 200 клеток. Хотя количество клеток каждого типа обычно выражается в процентах, для точной интерпретации эти цифры должны быть связаны с общим количеством ядерных клеток, общей концентрацией белка и объемом жидкости. Оценка морфологии клеток — очень важная часть цитологического исследования. Общие комментарии, относящиеся к морфологии лейкоцитов перитонеальной жидкости, вероятно, применимы к плевральной жидкости, хотя легкодоступной такой информации мало.
Нейтрофилы: Нейтрофилы, попадающие в грудную полость (как нейтрофилы, попадающие в другие полости или ткани тела), не возвращаются в кровоток. Следовательно, старение и смерть клеток — нормальные явления. Старые нейтрофилы часто от умеренной гиперсегментации до пикнотических, 20–23 , и лейкофагоцитоз стареющих нейтрофилов макрофагами может наблюдаться нечасто (Рис. 8-1). Это открытие может быть трудно отличить от скрытого или легкого воспаления. Нейтрофилы в нормальной плевральной жидкости сами по себе не проявляют фагоцитарной активности.
Нейтрофилы в нормальной плевральной жидкости сами по себе не проявляют фагоцитарной активности.
Присутствие палочкоядерных нейтрофилов или более незрелых гранулоцитарных клеток свидетельствует об остром воспалении и мобилизации хранилищ нейтрофилов и их созревания. Наличие дегенеративных изменений (таких как набухание клеток, потеря ядерной сегментации и нечеткие границы ядер) 24 предполагает жесткую плевральную среду. Это может происходить вторично по отношению к наличию бактериальных цитотоксинов в грудной полости.Токсические изменения (такие как усиление цитоплазматической базофилии, вакуолизация или тельца Дохла) также могут наблюдаться при сепсисе или энтеротоксемии. Такое токсическое изменение считается «предсуществующим», происходящим во время миелопоэза, а не после миграции в плевральную полость. Эти изменения, сопровождаемые визуализацией фагоцитированных бактериальных организмов (рис. 8-2, 9-13 и 9-14), совместимы с септическим плевритом.
Большие мононуклеарные клетки: Категория крупных мононуклеарных клеток включает нереактивные (тканевые) макрофаги моноцитарного происхождения крови, реактивные (тканевые) макрофаги и мезотелиальные клетки (см. Рис.С 9-2 и с 9-4 до 9-69-49-59-6). Как и в перитонеальной жидкости, эти клетки часто трудно различить морфологически. 11 Их удобно сгруппировать вместе и часто вместе называют мононуклеарными фагоцитами, поскольку все они обладают фагоцитарным потенциалом (рис. 8-1 и 8-3). Все эти клетки большие, обычно с умеренным или высоким соотношением ядер к цитоплазме и обильной, отчасти базофильной цитоплазмой (см. Рис. 9-2 и 9-4). Ядро — их самая отличительная особенность, но даже это не особенно характерно, и подклассификация крупных мононуклеарных клеток весьма субъективна.
Рис.С 9-2 и с 9-4 до 9-69-49-59-6). Как и в перитонеальной жидкости, эти клетки часто трудно различить морфологически. 11 Их удобно сгруппировать вместе и часто вместе называют мононуклеарными фагоцитами, поскольку все они обладают фагоцитарным потенциалом (рис. 8-1 и 8-3). Все эти клетки большие, обычно с умеренным или высоким соотношением ядер к цитоплазме и обильной, отчасти базофильной цитоплазмой (см. Рис. 9-2 и 9-4). Ядро — их самая отличительная особенность, но даже это не особенно характерно, и подклассификация крупных мононуклеарных клеток весьма субъективна.
Мезотелиальные клетки обычно имеют овальное ядро с тонко ретикулярной структурой хроматина. При индивидуализации тонкая эозинофильная «корона» или ореол гликокаликса может быть очевидна по краю клетки (рис. 8-5). При транссудативных излияниях они могут образовываться в виде пластин или пластин, иметь однородный внешний вид и иметь форму от многоугольника до ромбовидной формы. В экссудативных излияниях мезотелиальные клетки могут стать реактивными или трансформированными и проявлять особенности, предполагающие повышенную пролиферацию, включая повышенную цитоплазматическую базофилию, многоядерность, выраженные ядрышки и митотическую активность (рис. 8-4 и 8-5). Гиперпластические / диспластические признаки могут начать имитировать неоплазию при тяжелых воспалительных состояниях. Большое количество мезотелиальных клеток должно вызывать подозрение на мезотелиому. 13
8-4 и 8-5). Гиперпластические / диспластические признаки могут начать имитировать неоплазию при тяжелых воспалительных состояниях. Большое количество мезотелиальных клеток должно вызывать подозрение на мезотелиому. 13
Нереактивные макрофаги (или моноцитарные клетки) обычно имеют зазубренное овальное ядро с более однородным рисунком хроматина. Его ядро, однако, может быть довольно плеоморфным, от удлиненного, круглого, извилистого или дольчатого.
Реактивные клетки, как правило, имеют более обильную и более базофильную цитоплазму.Реактивные макрофаги часто имеют взъерошенные цитоплазматические края, выступающие цитоплазматические вакуоли и / или включения (фагосомы). Последние могут быть неидентифицируемыми обломками или дегенерирующими воспалительными клетками или эритроцитами (см. Рис. 8-1 и 8-3). Реактивные крупные мононуклеарные клетки не наблюдались в образцах плевральной жидкости 18 клинически здоровых лошадей. 11 При острых воспалительных выпотах относительный процент моноцитов / макрофагов уменьшается с увеличением количества гранулоцитарных клеток. При более хронических излияниях мононуклеары / макрофаги обычно присутствуют в повышенном количестве и могут проявлять реактивные изменения.
При более хронических излияниях мононуклеары / макрофаги обычно присутствуют в повышенном количестве и могут проявлять реактивные изменения.
Лимфоциты: Лимфоциты в нормальной плевральной жидкости обычно представляют собой клетки малого и среднего размера, похожие на лимфоциты в периферической крови. Они рециркулируют в кровоток через плевральные лимфатические сосуды.
Повышенный процент лимфоцитов может наблюдаться при хронических воспалительных состояниях, хилотораксе (особенно остром) или неоплазии. Лимфобласты в нормальной плевральной жидкости не наблюдаются. Эти клетки имеют плотно окрашенный, грубо сгруппированный образец хроматина, возможно, с явными ядрышками, и сильно базофильную цитоплазму, которая может содержать вакуоли от маленьких до больших.Цитологический диагноз лимфомы обычно основан на наличии большого количества таких клеток. 13 Клетки плазмы не являются нормальным явлением и могут отражать хроническую антигенную стимуляцию.
Другие клетки: Морфология эозинофилов и базофилов в плевральной жидкости такая же, как и в мазке периферической крови, а морфология тучных клеток такая же, как и в других тканях.
Неопластические клетки могут быть идентифицированы при цитологическом исследовании плевральной жидкости, хотя относительная диагностическая ценность этой процедуры для всех типов опухолей может быть низкой. 1, 25 Круглые опухолевые клетки (чаще всего лимфобласты), мезотелиальные клетки (мезотелиомы) и эпителиальные клетки (карциномы и аденокарциномы) чаще всего встречаются. 25 (см. Рис. 8-8-8-17) . Критерии злокачественности включают анизоцитоз, анизокариоз, изменение соотношения ядра и цитоплазмы, увеличение размера клеток, ядерный гигантизм, многоядерность, выраженные / большие / угловые / множественные ядрышки и повышенную / аномальную митотическую активность. Наличие сопутствующего воспаления может в некоторых случаях затуманивать отличия от реактивной гиперплазии / дисплазии, что требует дальнейшего диагностического исследования.Отсутствие идентифицируемых неопластических клеток при цитологическом исследовании плевральной жидкости не исключает неоплазию, поскольку опухолевые клетки не всегда расслаиваются в плевральные выпоты. В одном исследовании с участием 38 лошадей с неоплазией грудной клетки цитологический диагноз плевральной жидкости был поставлен только у 12 (32%), у 10 из которых была лимфома. 25 В другом исследовании, в котором оценивали только лошадей с лимфомой, у 12 из 13 обследованных лошадей был плевральный выпот, а цитология жидкости была диагностической у 10. 26 Это говорит о том, что более высокий диагностический результат для цитологии плевральной жидкости возможен в случаях лимфомы, чем при других видах новообразований грудной клетки.Учитывая тот факт, что лимфома составляет более половины новообразований грудной клетки у лошадей 25, 26 и что сопутствующий плевральный выпот является обычным явлением, 26, 27 торакоцентез и цитология плевральной жидкости остаются ценным диагностическим инструментом.
кровь | Определение, состав и функции
Кровь , жидкость, которая транспортирует кислород и питательные вещества к клеткам и уносит углекислый газ и другие продукты жизнедеятельности. Технически кровь — это транспортная жидкость, перекачиваемая сердцем (или аналогичной структурой) ко всем частям тела, после чего она возвращается в сердце, чтобы повторить процесс.Кровь — это одновременно ткань и жидкость. Это ткань, потому что она представляет собой набор подобных специализированных клеток, которые выполняют определенные функции. Эти клетки взвешены в жидком матриксе (плазме), что делает кровь жидкостью. Если кровоток прекратится, смерть наступит в течение нескольких минут из-за воздействия неблагоприятной окружающей среды на высокочувствительные клетки.
Британская викторина
Кровь: факт или вымысел?
Эта специализированная жидкость оживляет человеческий организм, но что вы действительно знаете о крови? От клеток крови до групп крови — погрузитесь в эту викторину своими зубами вампира.
Постоянство состава крови обеспечивается циркуляцией, при которой кровь проходит через органы, регулирующие концентрацию ее компонентов. В легких кровь поглощает кислород и выделяет углекислый газ, переносимый тканями. Почки выводят лишнюю воду и растворенные продукты жизнедеятельности. Питательные вещества, полученные с пищей, попадают в кровоток после всасывания в желудочно-кишечном тракте. Железы эндокринной системы выделяют свои секреты в кровь, которая транспортирует эти гормоны к тканям, в которых они проявляют свое действие.Многие вещества рециркулируются через кровь; например, железо, высвобождающееся во время разрушения старых эритроцитов, переносится плазмой к участкам производства новых эритроцитов, где оно повторно используется. Каждый из многочисленных компонентов крови удерживается в соответствующих пределах концентрации с помощью эффективного регулирующего механизма. Во многих случаях действуют системы управления с обратной связью; таким образом, снижение уровня сахара в крови (глюкозы) приводит к ускоренному высвобождению глюкозы в кровь, так что потенциально опасное истощение глюкозы не происходит.
Одноклеточные организмы, примитивные многоклеточные животные и ранние зародыши высших форм жизни лишены кровеносной системы. Из-за своего небольшого размера эти организмы могут поглощать кислород и питательные вещества и сбрасывать отходы непосредственно в окружающую среду путем простой диффузии. Губки и кишечнополостные (например, медузы и гидры) также не имеют кровеносной системы; Средства для транспортировки пищевых продуктов и кислорода ко всем клеткам этих более крупных многоклеточных животных обеспечивается водой, морской или пресной, прокачиваемой через пространства внутри организмов.У более крупных и сложных животных транспортировка достаточного количества кислорода и других веществ требует определенного типа кровообращения. У большинства таких животных кровь проходит через дыхательную обменную мембрану, которая находится в жабрах, легких или даже коже. Там кровь поглощает кислород и избавляется от углекислого газа.
Клеточный состав крови варьируется от группы к группе в животном мире. У большинства беспозвоночных есть различные крупные клетки крови, способные к амебовидному движению.Некоторые из них помогают транспортировать вещества; другие способны окружать и переваривать инородные частицы или мусор (фагоцитоз). Однако по сравнению с кровью позвоночных у беспозвоночных имеется относительно мало клеток. Среди позвоночных есть несколько классов амебоидных клеток (лейкоцитов или лейкоцитов) и клеток, которые помогают остановить кровотечение (тромбоциты или тромбоциты).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишись сейчас
Потребность в кислороде играет важную роль в определении как состава крови, так и архитектуры кровеносной системы.У некоторых простых животных, включая мелких червей и моллюсков, переносимый кислород просто растворяется в плазме. Более крупные и сложные животные, которые нуждаются в большем количестве кислорода, имеют пигменты, способные переносить относительно большие количества кислорода. Красный пигмент гемоглобин, содержащий железо, встречается у всех позвоночных и некоторых беспозвоночных. Почти у всех позвоночных, включая человека, гемоглобин содержится исключительно в эритроцитах (эритроцитах). Эритроциты низших позвоночных (например,g., птицы) имеют ядро, тогда как у эритроцитов млекопитающих ядро отсутствует. У млекопитающих размер эритроцитов заметно различается; у козла гораздо меньше, чем у людей, но коза компенсирует это за счет того, что на единицу объема крови приходится гораздо больше эритроцитов. Концентрация гемоглобина внутри эритроцитов мало различается у разных видов. Гемоцианин, медьсодержащий белок, химически непохожий на гемоглобин, содержится у некоторых ракообразных. Гемоцианин имеет синий цвет при насыщении кислородом и бесцветный при удалении кислорода.У одних кольчатых червей есть железосодержащий зеленый пигмент хлорокруорин, у других железосодержащий красный пигмент гемеритрин. У многих беспозвоночных дыхательные пигменты переносятся в растворе в плазме, но у высших животных, включая всех позвоночных, пигменты заключены в клетках; если бы пигменты находились в растворе в свободном состоянии, требуемые концентрации пигментов привели бы к тому, что кровь стала бы настолько вязкой, что препятствовала бы циркуляции.
В этой статье рассматриваются основные компоненты и функции крови человека.Для полноценного лечения группы крови см. статьи группы крови. Для получения информации о системе органов, которая передает кровь ко всем органам тела, см. сердечно-сосудистая система. Для получения дополнительной информации о крови в целом и сравнении крови и лимфы различных организмов, см. Циркуляция .
Компоненты крови
У человека кровь представляет собой непрозрачную жидкость красного цвета, свободно текущую, но более плотную и вязкую, чем вода. Характерный цвет придает гемоглобин — уникальный железосодержащий белок.Гемоглобин становится ярче при насыщении кислородом (оксигемоглобин) и темнеет при удалении кислорода (дезоксигемоглобин). По этой причине частично дезоксигенированная кровь из вены темнее, чем насыщенная кислородом кровь из артерии. Красные кровяные тельца (эритроциты) составляют около 45 процентов объема крови, а остальные клетки (белые кровяные тельца или лейкоциты, тромбоциты или тромбоциты) менее 1 процента. Жидкая часть, плазма, представляет собой прозрачную слегка липкую жидкость желтоватого цвета.После жирной еды плазма временно мутнеет. Внутри тела кровь постоянно текучая, а турбулентный поток гарантирует, что клетки и плазма довольно однородно перемешаны.
Диаграмма крови
Кровь состоит из нескольких компонентов, включая эритроциты, лейкоциты, тромбоциты и плазму.
Encyclopædia Britannica, Inc.
Общее количество крови у людей зависит от возраста, пола, веса, типа телосложения и других факторов, но приблизительное среднее значение для взрослых составляет около 60 миллилитров на килограмм веса тела.У среднего молодого мужчины объем плазмы составляет около 35 миллилитров, а объем эритроцитов — около 30 миллилитров на килограмм веса тела. Объем крови здорового человека в течение длительного периода времени мало меняется, хотя каждый компонент крови находится в непрерывном состоянии потока. В частности, вода быстро входит и выходит из кровотока, достигая баланса с внесосудистыми жидкостями (находящимися вне кровеносных сосудов) в течение нескольких минут. Нормальный объем крови обеспечивает такой адекватный резерв, что заметная кровопотеря хорошо переносится.Забор 500 миллилитров (около пинты) крови у нормальных доноров — безвредная процедура. Объем крови быстро восстанавливается после кровопотери; в течение часов объем плазмы восстанавливается за счет движения внесосудистой жидкости в кровоток. Замена эритроцитов завершается в течение нескольких недель. Обширная площадь капиллярной мембраны, через которую вода проходит свободно, позволила бы мгновенно потерять плазму из кровотока, если бы не белки плазмы, в частности, сывороточный альбумин.Мембраны капилляров непроницаемы для сывороточного альбумина, они имеют наименьший вес и самую высокую концентрацию белков плазмы. Осмотический эффект сывороточного альбумина удерживает жидкость в кровотоке, противодействуя гидростатическим силам, которые имеют тенденцию выталкивать жидкость наружу в ткани.
Источники ошибок подсчета гемоцитометра
Источники ошибок гемоцитометра
- Человеческая ошибка (смешивание, обращение, разбавление, просчет и процедурные ошибки, допущенные людьми)
- В исследовании с участием пяти наблюдателей ошибки оператора и случайные ошибки составили 3.12% и 7,8% соответственно. 3
- Джеймс М. Рэмси провел эксперимент, чтобы измерить, как площадь отбора проб и факторы разведения влияют на изменение количества клеток. Он проверил три размера площади (18, 9 и 4 мм 2 ) и два фактора разбавления (1: 100 и 1:25). CV увеличивались по мере уменьшения площади выборки. Более высокие коэффициенты разбавления также приводили к более низким CV. 4
- Бэйн обнаружил, что если один и тот же оператор должен был подсчитывать повторяющиеся образцы спермы, вариация результатов была связана с 55% ошибкой отбора проб и пипетирования и 45% ошибкой камеры и подсчета. 5 Фройнд и Кэрол опубликовали дополнительное измерение, чтобы показать, что вариации между разными операторами могут достигать 52%, а разница может составлять 20% из-за одного оператора. 5
- Необходимость подсчета нескольких образцов клеток для обеспечения статистической точности
- В 1907 году Джон К. ДаКоста заявил, что необходимо измерять несколько капель образцов крови. 1
- Нильсен, Смит и Гринфилд пришли к выводу, что для получения точности 10%, 15% и 20% при подсчете гемацитометром необходимое количество образцов составляло 7, 3 и 2 в дополнение к 180, 200, и 125 клеток, подсчитанных на образец, соответственно. 6
- В 1881 году Лайон и Тома приблизили стандартную ошибку гемоцитометра к значению, где n — количество подсчитанных клеток.
- В 1907 году Уильям Сили опубликовал свою работу по подсчету пивных дрожжей под названием «Студент», в которой он специально рассчитал статистическую вариацию путем экспериментов и математического моделирования, что привело к тому же уравнению. 7, 8
- Необходимость равномерного распределения ячеек
- В 1912 году Джеймс К.Тодд назвал неравномерное распределение ячеек источником ошибок. 1
- Стьюдент также заявил, что есть два основных источника ошибок: один был связан с получением образцов дрожжей, которые могут не быть репрезентативными для основного раствора, и ошибка случайного отбора образцов, когда клетки не были равномерно распределены в зоне наблюдения. 7, 8
- 1947, была опубликована статья об изменении плотности клеток из-за неравномерного распределения в гемацитометре.Первоначальные результаты показали, что ближайшая и самая дальняя от входа территория была на 3,5% ниже и выше средней плотности соответственно. 9
- Инструменты и материалы (решетки, глубина, покровные стекла, тип буфера и пипетки)
- Результаты показали, что экспериментальные расчеты погрешности камеры и пипетки (CV%) составили приблизительно 4,6% и 4,7% соответственно. 10
- В исследовании с участием пяти наблюдателей ошибки, связанные с пипетками и гемацитометрами, составили 9.46% и 4,26% соответственно. 3
- В 1961 году Сандерс и Скерри пришли к выводу, что положение покровного стекла может составлять 7,6%. 11
- В этом эксперименте измеряли CV для каждой модели гемацитометра с несколькими этапами разведения. По мере увеличения шагов разбавления вариация увеличивалась для следующих моделей: Bürker-Türk (BT) (7,7–12%), Thoma (6,6–14,1%) и Makler (19,8–23,6%). 12
Устранение проблем с гемоцитометром
С развитием компьютеров, программного обеспечения для автоматизации, оптики, флуоресцентных красителей и прецизионных производственных технологий, а также современных технологий, таких как флуоресцентная микроскопия, проточная цитометрия и цитометрия изображений, автоматизация разрешила многие ловушки, связанные с гемацитометром. 13-25
Автоматизация решает:
Человеческая ошибка — Чтобы решить эту проблему, автоматизация и робототехника могут заменить ручную обработку жидкостей и операции подсчета.
Ошибки выборки — Чем больше полей и ячеек подсчитано, тем меньше случайная ошибка, но тем больше требуется времени. Используя автоматизированные проточные цитометры или цитометры для визуализации, можно проанализировать от тысяч до миллионов клеток за более короткий промежуток времени, что повысит эффективность и минимизирует случайную статистическую ошибку в анализе.
Ошибки дозирования и разбавления — Они зависят от технических знаний оператора. Эту ошибку можно свести к минимуму, используя автоматические пипетки или системы для обработки жидкостей. 26
Ошибки материала — Ошибка камеры возникает из-за различий между гемацитометрами разных производителей, а также различий в одной и той же линейке продуктов. Эту проблему также можно решить, используя автоматические цитометры для увеличения объема выборки и сведения к минимуму случайной ошибки.
Неравномерное распределение клеток — Если гемоцитометр не очищен должным образом или покровное стекло установлено неправильно, возникают отклонения. Их можно устранить с помощью цитометров, в которых не используются камеры, такие как проточный цитометр. Образцы клеток, которые по своей природе являются комковатыми, по-прежнему сложно автоматизировать. Однако, используя цитометры изображений, комковатые клетки могут быть декластеризованы с помощью алгоритмов анализа изображений, которые могут повысить точность подсчета клеток.
Сводка
Гемоцитометр был важным инструментом в области биомедицинских исследований на протяжении сотен лет, и потребовалось много итераций, чтобы разработать устройство, которое исследователи используют сегодня, однако он остается подверженным множеству неизбежных источников ошибок.Использование современной автоматизации в значительной степени устранило многие из этих источников ошибок, повысив точность и эффективность подсчета клеток сегодня.
Список литературы
- Дэвис JD. ГЕМОЦИТОМЕТР И ЕГО ВЛИЯНИЕ НА ПРОГРЕССИВНУЮ МЕДИЦИНУ. Урбана: Университет Иллинойса в Урбане-Шампейн; 1995.
- Verso ML. Некоторые пионеры гематологии девятнадцатого века. История болезни 1971; 15 (1): 55-67.
- Biggs R, Macmillan RL. Ошибки некоторых гематологических методов при их использовании в повседневной лаборатории. Журнал клинической патологии 1948; 1 : 269-87.
- Рэмси Дж. М.. Влияние размера области отбора проб и разведения на количество лейкоцитов в гемоцитометре. Научный журнал Огайо 1969; 69 (2): 101-4.
- Фройнд М., Кэрол Б. Факторы, влияющие на подсчет гемоцитометром концентрации сперматозоидов в сперме человека. Журнал репродуктивной фертильности 1964; 8 : 149-55.
- Нильсен Л.К., Смит Г.К., Гринфилд П.Ф.Распределение количества клеток в гемоцитометре: последствия непуассоновского поведения. Прогресс биотехнологии 1991; 7 : 560-3.
- Студент. Об ошибке счета гемоцитометром. Биометрика 1907; 5 (3): 351-60.
- Shapiro HM. «Клеточная астрономия» — обозримое будущее цитометрии. Cytometry Part A 2004; 60A : 115-24.
- Хайнс М. Распределение лейкоцитов в счетной камере. Журнал клинической патологии 1947; 1 : 25-9.
- Berkson J, Magath TB, Hurn M. Ошибка оценки количества клеток крови, сделанных с помощью гемоцитометра. Американский журнал физиологии 1940; 128 : 309-23.
- Сандерс С, Скерри DW. Распределение клеток крови в счетных камерах гемоцитометра со специальной ссылкой на измененную спецификацию британских стандартов 748 (1958). Журнал клинической патологии 1961; 14 : 298-304.
- Кристенсен П., Стрин Х., Хансен С. Расхождения в определении концентрации сперматозоидов с использованием счетных камер Бюркер-Тюрк, Тома и Маклер. Theriogenology 2005; 63 : 992-1003.
- Аль-Рубай М, Вельценбах К., Ллойд Д.Р., Эмери А.Н. Быстрый метод оценки количества и жизнеспособности клеток с помощью проточной цитометрии. Cytotechnology 1997; 24 : 161-8.
- Fazal SS. Тест на обобщенное распределение Пуассона. Биометрический журнал 1977; 19 (4): 245-51.
- Hansen C, Vermeiden T, Vermeiden JPW, Simmet C, Day BC, Feitsma H. Сравнение системы FACSCount AF, улучшенного гемоцитометра Neubauer, фотометра Corning 254, SpermVision, UltiMate и NucleoCounter SP-100 для определения концентрации спермы в семени хряка. Териогенология 2006; 66 (9): 2188-94.
- Despotis GJ, Saleem R, Bigham M, Barnes P. Клиническая оценка нового гемоцитометра для стационарного лечения. Реанимационная медицина 2000; 28 (4): 1185-90.
- Paulenz H, Grevle IS, Tverdal A, Hofmo PO, Berg KA. Точность счетчика Коултера (R) для повседневной оценки концентрации спермы кабана по сравнению с гемоцитометром и спектрофотометром. Размножение домашних животных 1995; 30 (3): 107-11.
- Лутц П, Дзик WH. Камера для гемоцитометра большого объема для точного подсчета белых клеток (Wbcs) в тромбоцитах с пониженным содержанием Wbc — проверка и применение для контроля качества тромбоцитов с пониженным содержанием Wbc, полученных аферезом и фильтрацией. Transfusion 1993; 33 (5): 409-12.
- Brecher ME, Harbaugh CA, Pineda AA. Точный подсчет низкого количества лейкоцитов — использование проточной цитометрии и ручной камеры с низким подсчетом. Американский журнал клинической патологии 1992; 97 (6): 872-5.
- Вачула М., Симпсон С.Дж., Мартинсон Дж.А. и др. Метод проточной цитометрии для подсчета очень низких уровней лейкоцитов в крови и ее компонентах. Transfusion 1993; 33 (3): 262-7.
- Сабо С.Е., Монро С.Л., Фиорино С., Битзан Дж., Лопер К. Оценка автоматизированного прибора для измерения жизнеспособности и концентрации криоконсервированных гемопоэтических клеток. Лаборатория гематологии 2004; 10 : 109-11.
- Чан Л.Л., Уилкинсон А.Р., Парадис Б.Д., Лай Н. Быстрая цитометрия на основе изображений для сравнения методов флуоресцентного окрашивания жизнеспособности. Журнал флуоресценции 2012; 22 : 1301-11.
- Чан Л.Л., Чжун Х, Цю Дж, Ли ПЙ, Линь Б.Cellometer Vision как альтернатива проточной цитометрии для анализа клеточного цикла, митохондриального потенциала и иммунофенотипирования. Cytom Part A 2011; 79A (7): 507-17.
- Chan LL-Y, Lai N, Wang E, Smith T., Yang X, Lin B. Метод быстрого обнаружения апоптоза и некроза с использованием цитометрии с визуализацией изображений Cellometer. Апоптоз 2011; 16 (12): 1295-303.
- Bocker W, Gantenberg HW, Muller WU, Streffer C. Автоматический анализ клеточного цикла с флуоресцентной микроскопией и анализом изображений. Физика в медицине и биологии 1996; 41 (3): 523-37.
- Macfarlane RG, Payne AM-M, Poole JCF, Tomlinson AH, Wolff HS. Автоматический прибор для подсчета эритроцитов. Британский журнал гемоцитологии 1959; 5 : 1-15.
Полный анализ крови
— Обзор
Общий анализ крови — Обзор
CBC Обзор
Общий анализ крови, или
Общий анализ крови — один из наиболее часто заказываемых лабораторных тестов.CBC — ценный
скрининговый тест, дающий важную диагностическую информацию. Тесты измерены
в рамках общего анализа крови определяют количество, тип, процент, концентрацию и
качество различных клеток крови. Эти тесты выполняются
одновременно, обычно менее чем за минуту, с использованием автоматического гематологического анализатора.
В некоторых ситуациях, например, при очень низких или очень высоких результатах, или при ненормальном
определение популяции клеток, ручной подсчет клеток или ручное микроскопическое исследование
сделаны.
Тесты обычно включаются в
CBC включает:
- Общий анализ крови (WBC)
- Количество эритроцитов
(РБК) - Гематокрит (Hct)
- Гемоглобин (Hb или Hgb)
- Показатели эритроцитов: (среднее
корпускулярный объем [MCV], средний корпускулярный гемоглобин (MCH) и средний корпускулярный
концентрация гемоглобина [MCHC] - A дифференциал белый
может потребоваться заказывать подсчет клеток крови или «diff» и подсчет тромбоцитов
особенно, если они не включены в CBC.Параметры для нормальной лаборатории
значения различаются среди возрастных групп, полов и лабораторий. Лаборатория
ссылки, представленные в этом курсе, предназначены для использования в качестве руководства и не предназначены
заменить таковые в вашем учреждении.
Средний взрослый циркулирует
примерно 5 литров крови, разделенных примерно на 3 литра плазмы
и 2 литра форменных элементов или клеток крови. Красные кровяные тельца (эритроциты),
лейкоциты (лейкоциты) и тромбоциты (тромбоциты) производятся в
костный мозг.Эритроцитов намного больше, чем лейкоцитов.
и тромбоциты.
Для действительных результатов CBC он
Важно принять во внимание несколько соображений. Если заказан CBC
через регулярные промежутки времени, например, каждый день или через день, кровь должна
рисоваться примерно в одно и то же время, чтобы избежать физиологических колебаний
это обычно происходит в определенное время дня.
Гидратация пациента
status значительно изменяет значения CBC.Например, большие объемы внутривенного
(IV) жидкости могут чрезмерно расширять жидкий или плазменный компонент периферической крови,
уменьшение процентного содержания образующихся элементов клеток крови. С другой стороны, обезвоживание
может вызвать гемоконцентрацию, уменьшающую плазменный компонент крови. Этот
приводит к подсчету кровяных телец, который вводит в заблуждение, потому что
количество форменных элементов в крови непропорционально завышено.
Когда пациенты сохраняются НКО для хирургического вмешательства или других процедур, существует риск обезвоживания.
и изменений в некоторых аспектах CBC увеличивается.
Мгновенно
Обратная связь:
Все
другие факторы остаются неизменными, как обезвоживание влияет на содержание гемоглобина?
Взять
посмотрите на это изображение красных и белых клеток, а также тромбоцитов, полученное с помощью электронного микроскопа,
из Центра крови Пьюджет-Саунд.

 По обе стороны от этого желобка расположены сетки, нанесенные на стекло. При наложении на боковые площадки покровного стекла над сеткой образуется камера глубиной 0,1 мм. Сетка Горяева (рис 4.) состоит из 225 больших квадратов.
По обе стороны от этого желобка расположены сетки, нанесенные на стекло. При наложении на боковые площадки покровного стекла над сеткой образуется камера глубиной 0,1 мм. Сетка Горяева (рис 4.) состоит из 225 больших квадратов.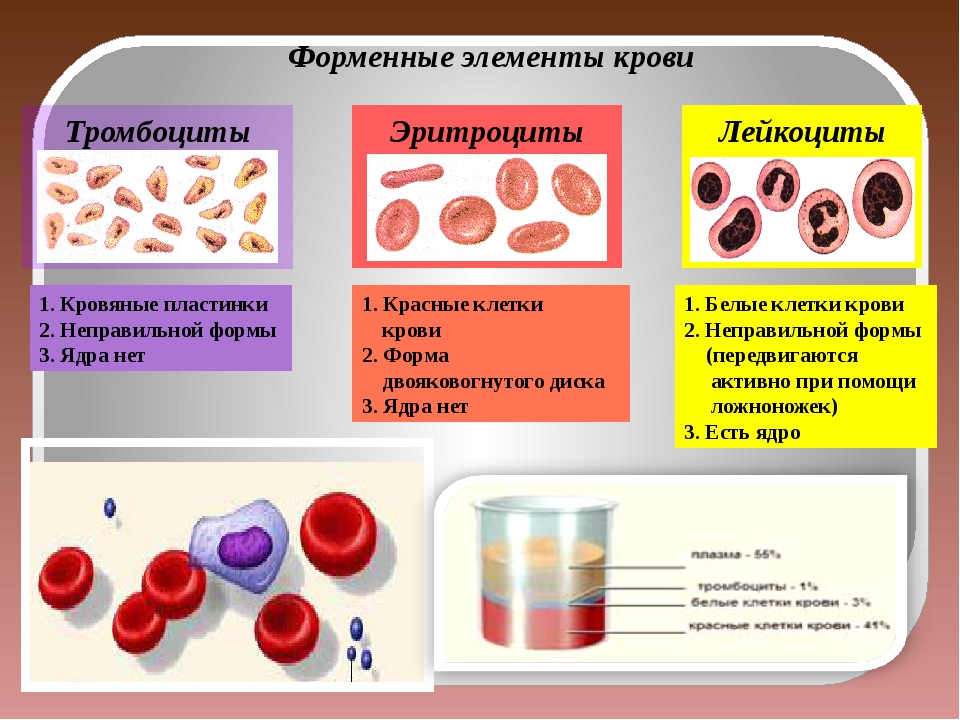
 5. Смесители для эритроцитов (а) и лейкоцитов (б)
5. Смесители для эритроцитов (а) и лейкоцитов (б) Набираем раствор до метки «101». После этого смеситель переводим в горизонтальное положение и кладем на стол. Аналогичным образом заполняем и смеситель для лейкоцитов (кровь до метки «0,5», раствор до метки «11»).
Набираем раствор до метки «101». После этого смеситель переводим в горизонтальное положение и кладем на стол. Аналогичным образом заполняем и смеситель для лейкоцитов (кровь до метки «0,5», раствор до метки «11»).
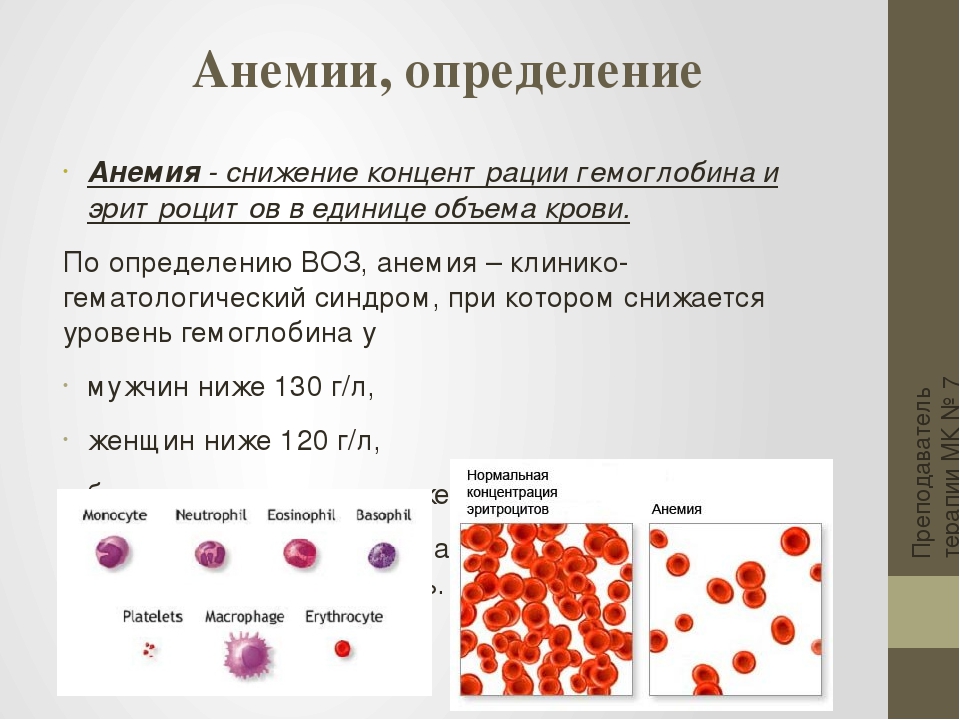 Пробу крови (объемом 0,02 мл) забирают стандартной пипеткой. Затем пробу крови выдувают на дно пробирки с разводящей жидкостью, а пипетку промывают верхним слоем жидкости, повторно набирая и выдувая ее в пробирку. Итоговое разведение, в результате, составит 200 раз при подсчете эритроцитов и 20 раз при подсчете лейкоцитов. Содержимое пробирки перемешивают и оставляют до исследования. При этом форменные элементы рекомендуется считать с помощью камеры Горяева не позднее 3-х часов после взятия пробы. Перед заполнением камеры разведенной кровью, необходимо предварительно несколько раз встряхнуть содержимое пробирки. Затем пастеровской пипеткой или стеклянной палочкой с оплавленным концом отбираем каплю разведенной крови и подносим ее к щели, образующейся между покровным стеклом и счетной камерой. Жидкость под действием капиллярных сил заполняет пространство над сеткой камеры Горяева.
Пробу крови (объемом 0,02 мл) забирают стандартной пипеткой. Затем пробу крови выдувают на дно пробирки с разводящей жидкостью, а пипетку промывают верхним слоем жидкости, повторно набирая и выдувая ее в пробирку. Итоговое разведение, в результате, составит 200 раз при подсчете эритроцитов и 20 раз при подсчете лейкоцитов. Содержимое пробирки перемешивают и оставляют до исследования. При этом форменные элементы рекомендуется считать с помощью камеры Горяева не позднее 3-х часов после взятия пробы. Перед заполнением камеры разведенной кровью, необходимо предварительно несколько раз встряхнуть содержимое пробирки. Затем пастеровской пипеткой или стеклянной палочкой с оплавленным концом отбираем каплю разведенной крови и подносим ее к щели, образующейся между покровным стеклом и счетной камерой. Жидкость под действием капиллярных сил заполняет пространство над сеткой камеры Горяева. Считаем клетки, расположенные внутри квадрата и лежащие на любых двух его линиях (например, левой и верхней), чтобы дважды не подсчитывать одну и ту же клетку. Находим среднее арифметическое число эритроцитов в одном малом квадрате. Для этого полученное число эритроцитов (Э) делим на 80 (т. к. в 1 большом квадрате находится 16 малых: 5´16 = 80). Объем пространства над одним малым квадратом равен 1/4000 мм3 (мкл). Умножая полученное число на 4000, получаем количество эритроцитов в 1 мм3 (мкл) разведенной крови, умножая на 200 – получаем количество эритроцитов в 1 мм3 (мкл) цельной крови. Итоговая формула для подсчета эритроцитов следующая:
Считаем клетки, расположенные внутри квадрата и лежащие на любых двух его линиях (например, левой и верхней), чтобы дважды не подсчитывать одну и ту же клетку. Находим среднее арифметическое число эритроцитов в одном малом квадрате. Для этого полученное число эритроцитов (Э) делим на 80 (т. к. в 1 большом квадрате находится 16 малых: 5´16 = 80). Объем пространства над одним малым квадратом равен 1/4000 мм3 (мкл). Умножая полученное число на 4000, получаем количество эритроцитов в 1 мм3 (мкл) разведенной крови, умножая на 200 – получаем количество эритроцитов в 1 мм3 (мкл) цельной крови. Итоговая формула для подсчета эритроцитов следующая:
 Более того, при подсчете лейкоцитов ошибка неизбежна в 6–8 % случаев. Это связано с тем, что при большом количестве нормоцитов в периферической крови их засчитывают в число лейкоцитов, т. к. и лейкоциты, и нормоциты – ядросодержащие клетки. Для правильного определения числа лейкоцитов из общего числа ядросодержащих клеток крови надо вычесть количество нормоцитов.
Более того, при подсчете лейкоцитов ошибка неизбежна в 6–8 % случаев. Это связано с тем, что при большом количестве нормоцитов в периферической крови их засчитывают в число лейкоцитов, т. к. и лейкоциты, и нормоциты – ядросодержащие клетки. Для правильного определения числа лейкоцитов из общего числа ядросодержащих клеток крови надо вычесть количество нормоцитов. 1). В настоящее время кровь для
1). В настоящее время кровь для
 Зажав двумя пальцами
Зажав двумя пальцами


 д.
д.



 k.a. Камера Нойбауэра
k.a. Камера Нойбауэра