этиология, варианты течения, диагностика, лечение. Синдром Уотерхауса-Фридериксена.
Острая надпочечниковая
недостаточность — тяжелое состояние
организма, клинически проявляющееся
сосудистым коллапсом, резкой адинамией,
постепенным затемнением сознания.
Возникает при внезапном уменьшении или
прекращении секреции гормонов коры
надпочечников.
Этиология.
Надпочечниковые, или аддисонические,
кризы развиваются чаще у больных с
первичным или вторичным поражением
надпочечников. Реже встречаются у
больных без предшествующих заболеваний
надпочечников.
Декомпенсация
обменных процессов у больных с хронической
надпочечниковой недостаточностью,
возникающая в результате неадекватной
заместительной терапии на фоне острых
инфекций, травм, операций, смены климата
и тяжелой физической нагрузки,
сопровождается развитием острой формы
болезни. Развитие аддисонического криза
иногда является первым проявлением
заболевания при латентно протекающей
и недиагностированной болезни Аддисона,
синдроме Шмидта.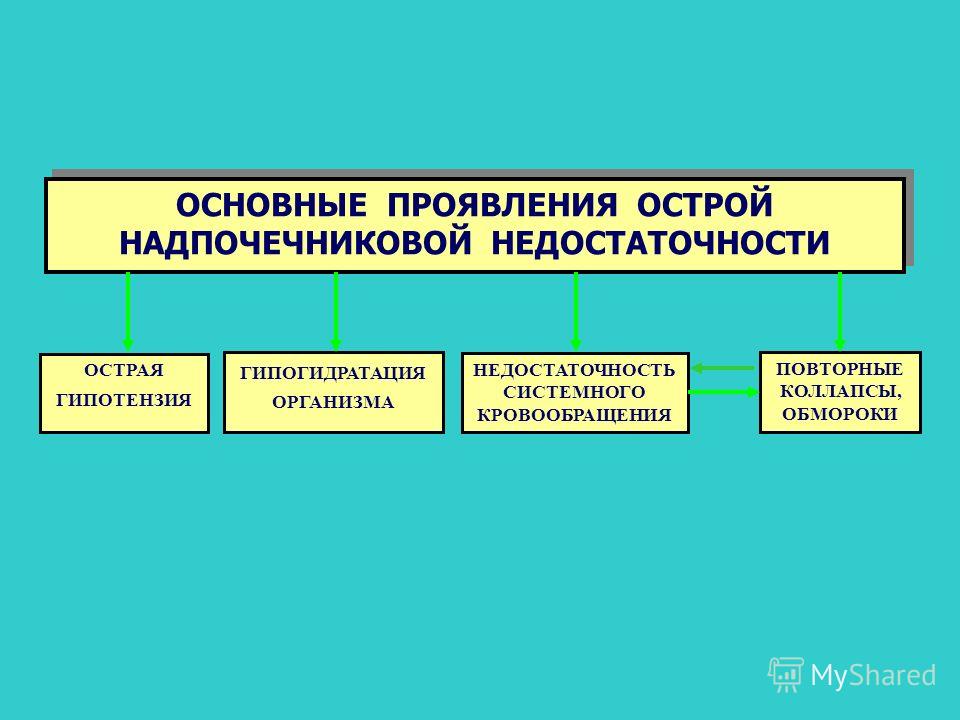 Острая надпочечниковая
Острая надпочечниковая
недостаточность постоянно угрожает
больным с двусторонней адреналэктомией,
произведенной у больных болезнью Иценко—
Кушинга и других состояниях.
Клиническая картина.
Развитие острой надпочечниковой
недостаточности для больных с хроническими
заболеваниями надпочечников представляет
большую угрозу для жизни.
Для аддисонического
криза характерно развитие продромального
предкризового состояния, когда основные
признаки заболевания заметно усиливаются.
Этот период протекает
у больных с хронической надпочечниковой
недостаточностью. В случаях, когда
функция надпочечников нарушается
внезапно в результате кровоизлияния,
некрозов, клинические симптомы острого
гипокортицизма могут развиться без
предвестников. Время течения аддисонического
криза может быть различным: от нескольких
часов до нескольких дней. Это зависит
от степени выраженности надпочечниковой
недостаточности, причины криза, от
общего состояния организма и времени
назначения гормональной терапии.
Развитие предвестников аддисонического
криза может наблюдаться и у больных,
принимающих заместительную терапию,
если дозы по каким-либо причинам
недостаточные. Симптомы предкризового
состояния воз¬никают и у больных с
недиагностированной формой заболевания.
Для латентно протекающей хронической
надпочечниковой недостаточности
характерно частое возникновение кризов
при различных стрессовых состояниях.
В период продромы
аддисонического криза нарастает общая
астенизация больного, ухудшается
аппетит, снижается масса тела, усиливается
пигментация кожных покровов, появляются
боли в суставах и мышцах, нарастает
гипотония.
Существуют различные
формы клинических проявлений острой
надпочечниковой недостаточности.
Типичным для криза является наличие
сердечно-сосудистой недостаточности,
желудочно-кишечных проявлений и
психоневрологической симптоматики
различной степени тяжести.
Целесообразно
выделить:
1) криз, протекающий
с преобладанием сердечно-сосудистой
декомпенсации;
2) острый гипокортицизм,
сопровождающийся желудочно-кишечными
расстройствами;
3) криз, протекающий
с преобладанием нервно-психических
симптомов.
При сердечно-сосудистой
форме превалируют симптомы сосудистой
недостаточности. Прогрессивно снижается
артериальное давление, пульс становится
слабого наполнения, сердечные тоны —
глухие, пигментация усиливается и за
счет цианоза, температура тела снижается,
при дальнейшем развитии этих симптомов
развивается коллапс.
Желудочно-кишечные
проявления вначале характеризуются
полной потерей аппетита до отвращения
к пище и даже запаху от нее. Затем
возникает тошнота, рвота, которая нередко
становится неукротимой, присоединяется
жидкий стул. Многократные рвота и понос
быстро приводят к обезвоживанию
организма. Появляются боли в животе,
чаще носящие разлитой спастический
характер. Иногда возникает картина
острого живота с характерными симптомами
для острого аппендицита, панкреатита,
холецистита, прободной язвы, кишечной
непроходимости.
Ошибка в диагностике
у больных с аддисоническим кризом и
оперативное вмешательство могут быть
для них роковыми.
В период развития
аддисонического криза появляются
церебральные нарушения: эпилептические
судороги, менингеальные симптомы,
бредовые реакции, заторможенность,
затемнение сознания, ступор. Нарушения
Нарушения
центральной нервной системы обусловлены
отеком мозга, изменениями электролитного
баланса, гипогликемией. Купирование
судорожных эпилептических припадков
у больных во время острого гипокортицизма
препаратами ДОКСА дает лучший
терапевтический эффект, чей различные
противосудорожные средства. Повышение
содержания калия в плазме у больных с
острой надпочечниковой недостаточностью
приводит нарушению нервно-мышечной
возбудимости. Клинически это проявляется
в виде парестезии, проводниковых
расстройств поверхностной и глубокой
чувствительности. Мышечные судороги
развиваются в результате уменьшения
внеклеточной жидкости.
Клинические
проявления острой надпочечниковой
недостаточности, которая начинается у
детей и взрослых внезапно без
предшествующего заболевания коры
надпочечников, имеют ряд особенностей.
Развитие клинических симптомов зависит
при синдроме Уотерхауса—Фридриксена
от степени разрушения коры надпочечников.
У детей причиной
острой надпочечниковой недостаточности
чаще бывает именно синдром
Уотерхауса—Фридериксена. Асфиксия,
Асфиксия,
родовая травма, инфекционные процессы
(грипп, скарлатина, дифтерия) могут
приводить к острой деструкции коры
надпочечников. Патогенетической основой
синдрома являются инфекционный шок,
ведущий к острому сосудистому спазму,
кровоизлияниям и некрозам коры и
мозгового слоя надпочечников, а также
посттравматический инфаркт надпочечников.
Клинические проявления острой
надпочечниковой недостаточности в
детском возрасте развиваются быстро.
В течение нескольких часов ребенок
становится вялым, отказывается от пищи,
у него повышается температура, возникают
судорожные подергивания мышц, боли в
животе. В дальнейшем нарастает падение
артериального давления, появляются
менингеальные симптомы, наступает
потеря сознания.
У взрослых синдром
Уотерхауса—Фридериксена чаще возникает
при хирургическом стрессе, применении
коагулянтов, родах. При больших, длительных
операциях применение для наркоза и
обезболивания различных препаратов,
которые являются активаторами
гипоталамо-гипофизарно-надпочечниковой
системы, может привести к инфаркту
надпочечников. Острое массивное
Острое массивное
кровоизлияние в надпочечники сопровождается
внезапными коллаптоидными состояниями.
Прогрессивно снижается артериальное
давление, появляется петехиальная сыпь
на коже, повышается температура тела,
наступают признаки острой сердечной
недостаточности — цианоз, одышка,
учащенный малый пульс. Иногда ведущим
симптомом являются сильные боли в
животе, чаще в правой половине или
околопупочной области. В некоторых
случаях возникают симптомы внутреннего
кровотечения. В клинической картине
острой надпочечниковой недостаточности,
кроме симптомов, свойственных кризу,
всегда можно обнаружить нарушения,
являющиеся причинами его возникновения:
сепсис, инфекции, чаще пневмонии,
бронхиты, операционный стресс.
Лечение криза. При
развитии острой недостаточности коры
надпочечников проводят комплексное
лечение, предусматривающее заместительное
введение глюко- и минералокортикоидов,
борьбу с обезвоживанием, гипогликемией,
коллапсом, а также профилактику возможного
возникновения инфекции.
Внутривенно капельно
вводят до 250 мг (и более) гидрокортизона,
10—20 мл 5%-ного раствора аскорбиновой
кислоты на 500—1 тыс. мл 5%-ного раствора
глюкозы и 500—1 тыс. мл изотонического
раствора натрия хлорида.
Дексавен: доза
определяется клинической ситуацией,
разовая доза — 4—8 мг до 3—4 раз в сутки
(в тяжелых случаях—до 50 мг), вводится
в/м или в/в струйно и капельно.
Урбазон: 250—500 мг
препарата, в/в струйно, медленно, перерыв
между инъекциями от 30 мин до 1 суток в
зависимости от тяжести состояния.
Масляный раствор
ДОКСА: в/м по 20—40 мг в день с интервалом
в 6 ч. При коллапсе в/в капельно вводят
норадреналин, мезатон, кордиамин. Через
2—3 дня гормоны вводят в/м в убывающих
дозах с переходом на поддерживающие
дозы.
В комплексную
терапию аддисоновой болезни входит
санаторно-курортное лечение.
Хроническая и острая надпочечниковая недостаточность в хирургической практике Текст научной статьи по специальности «Клиническая медицина»
© Коллектив авторов, 2006 УДК 616. 45-008.64-07-08
45-008.64-07-08
А.Е.Борисов, Л.М.Краснов, Е.А.Федоров, И.Х.Баталов, А.А.Кричиневский
ХРОНИЧЕСКАЯ И ОСТРАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ В ХИРУРГИЧЕСКОЙ ПРАКТИКЕ
Кафедра хирургии им. Н.Д.Монастырского (зав. — проф. А.Е.Борисов) ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования»
Ключевые слова: надпочечниковая недостаточность, диагностика, лечение.
Прошло уже более 150 лет с тех пор как в 1855 г. английский врач Т. Аддисон впервые описал клиническую картину хронической надпочечниковой недостаточности (гипокортицизма). В настоящее время это заболевание привлекает особое внимание не только эндокринологов, но и хирургов, потому что такие пациенты, поступающие в хирургические стационары для проведения плановых и неотложных вмешательств, составляют группу риска в отношении развития острой надпочечниковой недостаточности [8, 31].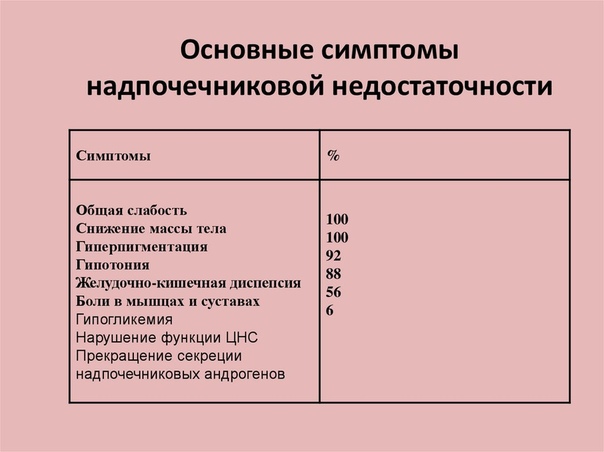 Точные данные о частоте гипокортицизма среди больных с сопутствующей хирургической патологией в литературе отсутствуют. Однако, если принять во внимание, что заболеваемость среди взрослого населения составляет от 40-60 до 100-110 новых случаев на 1 млн человек в год, то становится очевидной актуальность проблемы [7, 8, 34]. Нераспознанная хроническая надпочечниковая недостаточность (ХНН) может обернуться трагедией для больного даже при проведении, казалось бы, небольшого по объему оперативного вмешательства или, на первый взгляд, совершенно безобидной манипуляции. Острая надпочечниковая недостаточность (ОНН) у таких больных развивается вследствие резкого возрастания потребности организма в глюко-кортикоидных гормонах в период стресса и отсутствия резервных возможностей коркового вещества в продукции этих гормонов. Примерно у -*-/4 больных заболевание впервые диагностируется, когда пациент находится в критическом состоянии. При этом летальность составляет 40-50% [6].
Точные данные о частоте гипокортицизма среди больных с сопутствующей хирургической патологией в литературе отсутствуют. Однако, если принять во внимание, что заболеваемость среди взрослого населения составляет от 40-60 до 100-110 новых случаев на 1 млн человек в год, то становится очевидной актуальность проблемы [7, 8, 34]. Нераспознанная хроническая надпочечниковая недостаточность (ХНН) может обернуться трагедией для больного даже при проведении, казалось бы, небольшого по объему оперативного вмешательства или, на первый взгляд, совершенно безобидной манипуляции. Острая надпочечниковая недостаточность (ОНН) у таких больных развивается вследствие резкого возрастания потребности организма в глюко-кортикоидных гормонах в период стресса и отсутствия резервных возможностей коркового вещества в продукции этих гормонов. Примерно у -*-/4 больных заболевание впервые диагностируется, когда пациент находится в критическом состоянии. При этом летальность составляет 40-50% [6].
Различают первичную, вторичную и третичную хроническую надпочечниковую недостаточность. Первичная является результатом повреждения коркового слоя при различных патологических состояниях. Вторичная — обусловлена снижением продукции адре-нокортикотропного гормона (АКТГ) аденогипофизом. Третичная — возникает вследствие повреждения вышестоящих структур головного мозга и, прежде всего, гипоталамуса, что ведет к снижению секреции кортикотропин-рилизинг-гормона (КРГ) и, возмож-
Первичная является результатом повреждения коркового слоя при различных патологических состояниях. Вторичная — обусловлена снижением продукции адре-нокортикотропного гормона (АКТГ) аденогипофизом. Третичная — возникает вследствие повреждения вышестоящих структур головного мозга и, прежде всего, гипоталамуса, что ведет к снижению секреции кортикотропин-рилизинг-гормона (КРГ) и, возмож-
но, других гипоталамических стимуляторов секреции АКТГ [21]. В клинической практике наиболее часто встречается первичный гипокортицизм (около 95% всех случаев) [5, 14, 16, 24].
Причины первичной недостаточности могут быть разными. Т.Аддисон описал клиническую картину деструкции надпочечников, вызванную их туберкулезным поражением [38]. В настоящее время первое место среди прочих причин занимает аутоиммунная деструкция надпочечников, так называемый аутоиммунный адреналит (80-85% случаев). Туберкулез надпочечников выявляется в 5-10% наблюдений. Среди других причин надпочечниковой недостаточности могут быть адренолейкодистрофия, метастатические поражения надпочечников, двусторонний гормонально-неактивный рак коркового слоя, ВИЧ-инфекция [42], амилоидоз, сифилис, системные кандидозы, у больных после двусторонней адреналэктомии, анти-фосфолипидный синдром, врожденная вирилизиру-ющая дисфункция коры надпочечников [25, 38, 41]. Прием разных лекарственных веществ также может привести к гипокортицизму. Подавляют стероидогенез аминоглютетимид (ориметен, мамомит), кетоконазол, рифампицин, фенитоин и др. [19].
Среди других причин надпочечниковой недостаточности могут быть адренолейкодистрофия, метастатические поражения надпочечников, двусторонний гормонально-неактивный рак коркового слоя, ВИЧ-инфекция [42], амилоидоз, сифилис, системные кандидозы, у больных после двусторонней адреналэктомии, анти-фосфолипидный синдром, врожденная вирилизиру-ющая дисфункция коры надпочечников [25, 38, 41]. Прием разных лекарственных веществ также может привести к гипокортицизму. Подавляют стероидогенез аминоглютетимид (ориметен, мамомит), кетоконазол, рифампицин, фенитоин и др. [19].
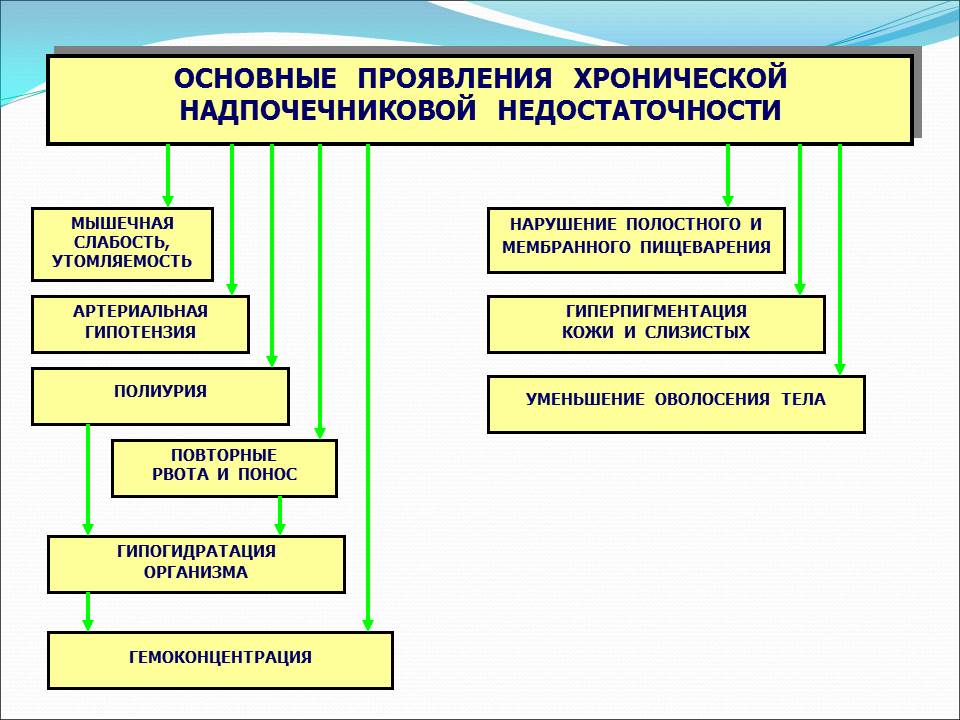
При деструкции коры надпочечников нарушаются все виды обмена веществ. Изменяется обеспечение минерального гомеостаза и адаптативная функция — приспособление организма к физическим и психическим нагрузкам и к стрессовым ситуациям. Альдостерон и, в определенной мере, кортизол играют решающую роль в обеспечении минерального гомеостаза. Воздействуя на рецепторы эпителия канальцев нефрона и в меньшей степени кишечника, альдостерон усиливает реабсорбцию натрия. С каждой молекулой натрия задерживается 3-5 молекул воды. Таким образом, поддерживается необходимый объем внеклеточной жидкости. При этом выводятся калий и магний. При снижении продукции альдостерона увеличивается потеря натрия и воды почками. Отмечается также увеличение экскреции натрия через кишечник. Возникают гиповолемия, гипонатриемия и гиперкалиемия [2, 31].
С каждой молекулой натрия задерживается 3-5 молекул воды. Таким образом, поддерживается необходимый объем внеклеточной жидкости. При этом выводятся калий и магний. При снижении продукции альдостерона увеличивается потеря натрия и воды почками. Отмечается также увеличение экскреции натрия через кишечник. Возникают гиповолемия, гипонатриемия и гиперкалиемия [2, 31].
Глюкокортикоиды обеспечивают гликонеогенез. При их снижении исчезают запасы гликогена в пече-
ни и в мышцах. Снижается уровень глюкозы в крови и тканях [3]. На фоне водно-электролитных сдвигов гипокортизолемия ведет к генерализованной миопа-тии. Развиваются миокардиодистрофия с аритмиями, атония и атрофия поперечнополосатой мускулатуры. Нарушается функция гладких мышц кишечника, развивается мальабсорбция. Чем больше выводится натрия в кишечник, тем больше выражена диспепсия. Нарушения обмена веществ усугубляются и развивающейся сердечно-сосудистой недостаточностью на фоне прогрессирования циркуляторной гипоксии [11,
22, 23, 83].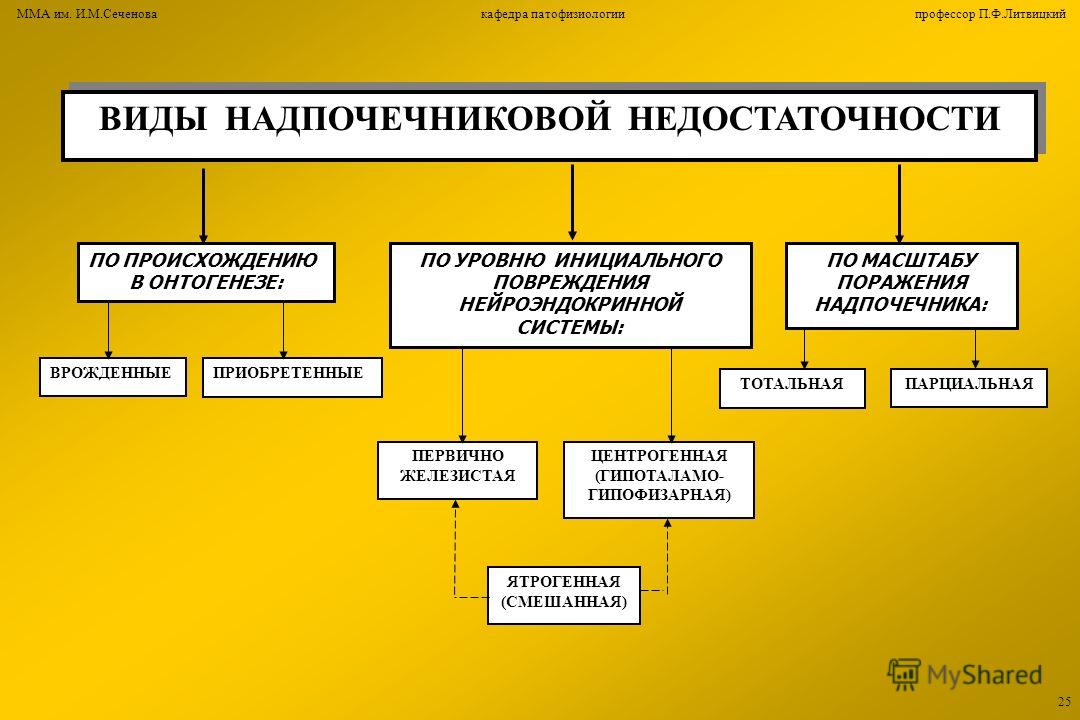
Инфекции, травма (в том числе и операционная), беременность, другие стрессовые ситуации могут быстро привести к декомпенсации надпочечниковой недостаточности. В ответ на такое беспрепятственное воздействие организм отвечает универсальной реакцией — падением артериального давления и коллапсом [42]. Начинается аддисонический криз с прогрессирующей потерей внеклеточного натрия, хлоридов и воды с мочой. Быстро уменьшается объем внеклеточной жидкости. Уменьшается скорость клубочковой фильтрации и почечного плазмотока. Осмотическое давление внутри клеток становится выше, чем в интерстициальном пространстве. Внеклеточная жидкость устремляется внутрь клеток, что еще больше усугубляет внеклеточную дегидратацию. Масса циркулирующей плазмы резко снижается. Потеря натрия, хлора, дегидратация сопровождаются снижением всасывания электролитов в кишечнике, что вызывает рвоту и понос. К перечисленным расстройствам присоединяется ацидоз. Он связан со снижением выделения почками ионов водорода. Все эти изменения происходят на фоне нарастающей гиперкалиемии. Больной впадает в кому при явлениях нарастающей сердечно-сосудистой недостаточности и прогрессирования метаболических нарушений [2, 23, 29, 40].
Все эти изменения происходят на фоне нарастающей гиперкалиемии. Больной впадает в кому при явлениях нарастающей сердечно-сосудистой недостаточности и прогрессирования метаболических нарушений [2, 23, 29, 40].
Наиболее характерным, а часто и самым первым симптомом первичной ХНН является гиперпигментация кожи и слизистых оболочек — меланодер-мия, на которую больные могут не обращать никакого внимания. Примерно в 5-8% случаев она может отсутствовать [44]. При первичной надпочечниковой недостаточности аутоиммунного характера на фоне гиперпигментации наблюдаются также беспигментные пятна — витилиго. Важным и характерным симптомом ХНН является артериальная гипотензия. В типичных случаях наблюдаются сосудистые коллапсы, которые провоцируются различными стрессовыми ситуациями [10, 14, 30]. Другим несомненным признаком гипо-кортицизма являются диспептические расстройства: плохой аппетит, чередование поноса и запора, неопределенные боли в верхней половине брюшной полости. Как правило, отмечается выраженное пристрастие к соленой пище [5].
Как правило, отмечается выраженное пристрастие к соленой пище [5].
Клиническая картина ОНН значительно варьирует. В подавляющем большинстве случаев ОНН возникает
на фоне декомпенсации хронического процесса при резком снижении резервных возможностей коркового слоя. Тяжесть и быстрота развития аддисонического криза во многом зависит от характера стрессовой ситуации, тяжести сочетанных повреждений или объема оперативного вмешательства, предпринятого у больного с недиагностированной ХНН [2]. В литературе имеются данные о возможности развития молниеносной формы аддисоновой болезни [43]. Однако значительно чаще декомпенсация развивается медленно, в течение нескольких дней, реже недель. При этом и об имеющейся у больного ХНН никто не подозревает. Усиливаются пигментация кожного покрова, общая слабость, полностью исчезает аппетит, становятся выраженными тошнота, неопределенные боли в животе.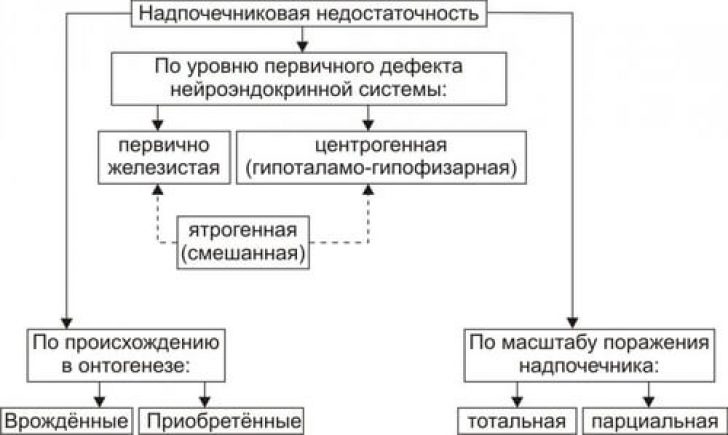 При прогрессировании процесса появляются рвота, которая может быть неукротимой, адинамия, депрессия. На фоне развивающейся сердечной недостаточности больной впадает в кому. В связи с болями в животе может быть заподозрена острая патология органов брюшной полости и больного ошибочно доставляют в хирургический стационар [6]. Известны случаи проведения неоправданных оперативных вмешательств у таких пациентов.
При прогрессировании процесса появляются рвота, которая может быть неукротимой, адинамия, депрессия. На фоне развивающейся сердечной недостаточности больной впадает в кому. В связи с болями в животе может быть заподозрена острая патология органов брюшной полости и больного ошибочно доставляют в хирургический стационар [6]. Известны случаи проведения неоправданных оперативных вмешательств у таких пациентов.
Первично ОНН может развиться после двусторонней адреналэктомии при лечении болезни Иценко-Кушинга, а также после односторонней адреналэкто-мии с удалением автономно фукционирующей корти-костеромы [1, 13, 14]. Несколько чаще она является результатом геморрагического инфаркта — двустороннего кровоизлияния в надпочечники вследствие тромбоза или эмболии надпочечниковых вен (синдром Уотерхауса-Фридериксена). Геморрагический инфаркт надпочечников был описан у детей при менингококко-вом сепсисе, практически же он может быть и у взрослых при любом другом виде сепсиса, коагулопатиях, наблюдается также при ДВС-синдроме, при тяжелых стрессовых ситуациях. В таких случаях клиническая картина развертывается внезапно, без каких-либо предвестников [20, 25, 35, 45].
В таких случаях клиническая картина развертывается внезапно, без каких-либо предвестников [20, 25, 35, 45].
Решающее значение имеет исследование функции коры надпочечников. Большую ценность в этом отношении представляет определение суточной экскреции с мочой свободного кортизола. Его снижение достоверно подтверждает наличие ХНН. Уровень кортизола плазмы является менее информативным показателем [26, 34].
«Золотым стандартом» в диагностике скрытой ХНН является проба с АКТГ. Используется синтетический препарат АКТГ синактен (или синкорпин). После забора крови для определения АКТГ в вену вводится синактен в дозе 250 мкг, через 60 мин производят повторный забор крови. Повышение уровня кортизола менее чем до 550 нмоль/л свидетельствует о недостаточности коры надпочечников [2, 6, 27, 28, 36, 37].
Вследствие токсического влияния гиперкалиемии на миокард определяются характерные изменения на ЭКГ:
высокий заостренный зубец Т, замедление проводимости, удлинение интервала 8-Т, комплекса QRS [17].
Большое значение в оценке состояния больного и в постановке правильного диагноза имеет изучение характера центрального кровообращения и водных секторов организма. У пациентов с ХНН, как правило, выявляется снижение объема внеклеточной и увеличение объема внутриклеточной жидкости. Кроме того, вследствие снижения продукции глюкокортикоидов, уменьшаются минутный объем кровообращения, функциональные резервы миокарда и общее периферическое сосудистое сопротивление. Эти нарушения становятся наиболее выраженными при развитии ОНН. Перечисленные изменения легко выявляются при эхокардиографии и интегральной реографии тела [4, 15, 39].
Все больные с надпочечниковой недостаточностью нуждаются в заместительной гормональной терапии. Существуют множество различных схем введения глю-кокортикоидов [37]. При впервые выявленной ХНН, как правило, начинают с внутримышечного введения гидрокортизона ацетата в течение нескольких дней до нормализации состояния, затем переходят на таблети-рованные препараты. При сопутствующих инфекционных заболеваниях, стрессах, травмах доза глюко- и минералокортикоидов увеличивается в 2-3 раза по сравнению с поддерживающей дозой. При проведении небольших по объему операций (вскрытие абсцессов, экстракция зубов, гастроскопия) перед вмешательством внутримышечно вводится 50 мг гидрокортизона. После операции целесообразнее продолжить внутримышечное введение гидрокортизона по следующей схеме: в день операции по 50 мг 2 раза, на следующий день по 50 мг утром и во второй половине дня. С 3-го дня после операции может быть продолжен прием обычной дозы препаратов в таблетках [25, 26].
При сопутствующих инфекционных заболеваниях, стрессах, травмах доза глюко- и минералокортикоидов увеличивается в 2-3 раза по сравнению с поддерживающей дозой. При проведении небольших по объему операций (вскрытие абсцессов, экстракция зубов, гастроскопия) перед вмешательством внутримышечно вводится 50 мг гидрокортизона. После операции целесообразнее продолжить внутримышечное введение гидрокортизона по следующей схеме: в день операции по 50 мг 2 раза, на следующий день по 50 мг утром и во второй половине дня. С 3-го дня после операции может быть продолжен прием обычной дозы препаратов в таблетках [25, 26].
При проведении больших оперативных вмешательств у больных с ХНН используется следующая схема лечения: накануне операции внутримышечно вводят 100 мг гидрокортизона (солукортефа), во время операции (родов) внутривенно капельно вводят еще 100 мг солукортефа на 5-10% растворе глюкозы (или гидрокортизона гемисукцината). Далее через дозатор продолжается введение солукортефа до 8.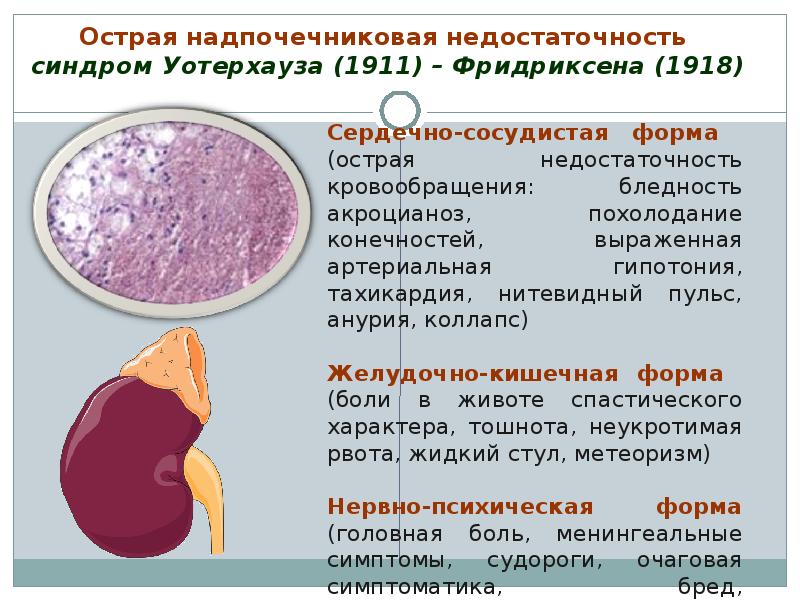 00 следующих суток в дозе 200 мг. В течение 2 сут также внутривенно вводят 300 мг солукортефа. При развитии выраженной слабости, тошноты, рвоты, артериальной гипотензии следует увеличить дозу вводимых глюкокортикоидов на 20-30%. В течение 3 сут при отсутствии нарушений гемодинамики доза вводимого гидрокортизона может составить 200 мг. Если больной уже начал прием пищи, то переходят на пероральный прием кортизона (по 50 мг 4 раза в сутки). Далее суточная доза снижается на 25-50 мг. Начинают снижение с вечерней дозы на 25 мг. Следует отметить, что подбор дозы вводимого препарата должен всегда осуществляться индивидуально при постоянном мониторировании артериального давления, показателей центрального кровообращения,
00 следующих суток в дозе 200 мг. В течение 2 сут также внутривенно вводят 300 мг солукортефа. При развитии выраженной слабости, тошноты, рвоты, артериальной гипотензии следует увеличить дозу вводимых глюкокортикоидов на 20-30%. В течение 3 сут при отсутствии нарушений гемодинамики доза вводимого гидрокортизона может составить 200 мг. Если больной уже начал прием пищи, то переходят на пероральный прием кортизона (по 50 мг 4 раза в сутки). Далее суточная доза снижается на 25-50 мг. Начинают снижение с вечерней дозы на 25 мг. Следует отметить, что подбор дозы вводимого препарата должен всегда осуществляться индивидуально при постоянном мониторировании артериального давления, показателей центрального кровообращения,
ЭКГ, центрального венозного давления, содержания электролитов, кортизола в плазме крови. В условиях хирургического отделения контроль за состоянием центральной гемодинамики легко осуществляется с помощью интегральной реографии тела [9, 12, 18]. Так, при снижении разовой производительности сердца можно предполагать возможность развития у больного сердечной недостаточности до появления клинических симптомов и проводить соответствующее лечение. Снижение системного артериального тонуса при нормальных разовой производительности и минутного объема кровообращения, скорее всего, свидетельствует о развивающейся ОНН [32]. Подходы к лечению острого гипокортицизма различного генеза принципиально одинаковые. Начинают с быстрого (одномоментного) внутривенного введения 100 мг гидрокортизона гемисукцината (солукортефа). Затем под контролем основных показателей периферического и центрального кровообращения в течение 3 ч вводят еще 200 мг гидрокортизона на изотоническом растворе натрия хлорида. Введение гидрокортизона продолжается до стабилизиции гемодинамики. При этом суточная доза препарата может составить 800-1000 мг. В течение суток внутривенно капельно необходимо ввести 2-3 л изотонического раствора натрия хлорида, 1 л 10-20% раствора глюкозы.
Так, при снижении разовой производительности сердца можно предполагать возможность развития у больного сердечной недостаточности до появления клинических симптомов и проводить соответствующее лечение. Снижение системного артериального тонуса при нормальных разовой производительности и минутного объема кровообращения, скорее всего, свидетельствует о развивающейся ОНН [32]. Подходы к лечению острого гипокортицизма различного генеза принципиально одинаковые. Начинают с быстрого (одномоментного) внутривенного введения 100 мг гидрокортизона гемисукцината (солукортефа). Затем под контролем основных показателей периферического и центрального кровообращения в течение 3 ч вводят еще 200 мг гидрокортизона на изотоническом растворе натрия хлорида. Введение гидрокортизона продолжается до стабилизиции гемодинамики. При этом суточная доза препарата может составить 800-1000 мг. В течение суток внутривенно капельно необходимо ввести 2-3 л изотонического раствора натрия хлорида, 1 л 10-20% раствора глюкозы. Препараты калия, мочегонные и сердечные гликозиды при этом противопоказаны. Чем раньше начато интенсивное лечение аддисонического криза, тем лучше результаты [2, 45].
Препараты калия, мочегонные и сердечные гликозиды при этом противопоказаны. Чем раньше начато интенсивное лечение аддисонического криза, тем лучше результаты [2, 45].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Баранов В.Г,. Нечай А.И Синдром Иценко-Кушинга.—Л.: Медицина, 1988.—224 с.
2. Богданович В.Л. Интенсивная и неотложная терапия в эндокринологии: Руководство для врачей.—Н.Новгород: Изд-во НГМА, 2000.—324 с.
3. Венгеровский А. И., Батурина Н.О., Саратиков А.С. Влияние препаратов глюкокортикоидов на метаболизм печени // Эксперим. и клин. фармакол.—1999.—Т. 62.—С. 75-80.
4. Григорьев Е. В., Слепушкин В. Д. Возможности неинвазивного мониторинга регуляторных процессов у больных с шоком // Вестн. интенсивной тер.—1998.—№ 3.—С. 54-56.
5. Дедов И. И., Мельниченко Г. А., Фадеев В. В. Эндокрино-логия.—М.: Медицина, 2000.—630 с.
Дедов И. И., Мельниченко Г. А., Фадеев В. В. Эндокрино-логия.—М.: Медицина, 2000.—630 с.
6. Дедов И. И., Фадеев В. В., Мельниченко Г. А. Недостаточность надпочечников.—М.: Знание-М, 2002.—320 с.
7. Дедов И.И., Балаболкин М.И., Марова Е.И. и др. Болезни органов эндокринной системы: Руководство для врачей.—М.: Медицина, 2000.—568 с.
8. Дильман В.М. Эндокринологическая онкология.—Л.: Медицина, 1983.—405 с.
9. Доленко В. Х., Куливник В. В., Сиденко В. П. и др. Исследование центральной гемодинамики в пред- и послеоперационном периоде // Воен.-мед. журн.—1993.—№ 3.—С. 55.
10. Зелинский Б.А., Вернигородский В.С., Вернигородская М.В. Состояние центральной и периферической гемодинамики при болезни Аддисона // Врач. дело.—1987.—№ 5. —С. 38-41.
—С. 38-41.
11. Зелинский Б.А., Вернигородский В.С., Гамарник Л.В. и др. Функциональное состояние миокарда у больных Аддисоновой болезнью // Врач. дело.—1987.—№ 2.—С. 44-47.
12. Иванов Л.Б., Макаров В.А. Лекции по клинической реогра-фии.—М.: АОЗТ «Антидор», 2000.—320 с.
13. Калинин А. П., Майстренко Н. А. Хирургия надпочечников.— М.:Медицина, 2000.—216 с.
14. Калинин А. П., Камынина Т.С., Тишенина Р.С. Надпочечниковая недостаточность: Пособие для врачей.—М.: МОНИКИ, 1998.— 25 с.
15. Костюченко А.Л., Филин В.И. Неотложная панкреатология.— СПб.: Деан, 2000.—480 с.
16. Лавин Н. (ред.) Эндокринология: Пер. с англ.—М.: Практика, 1999.—1128 с.
17. Лебединский К.М Анестезия и системная гемодинамика. Оценка и коррекция системной гемодинамики во время операции и анестезии.—СПб.: Человек, 2000.—200 с.
18. Лебединский К.М., Гордеев В.И., Волков Н.Ю. и др. Рео-графический мониторинг интраоперационной гемодинамики // Вестн. хир.—2000.—№ 5.—С. 71-74.
19. Лейкок Дж.Ф., Вайс П.Г. Основы эндокринологии: Пер. с англ.—М.: Медицина, 2000.—504 с.
20. Мак Дермотт М.Т. Секреты эндокринологии: Пер.с англ.— М.: Бином, 1998.—416 с.
21. Марова Е.И. Нейроэндокринология. Клинические очерки.— Ярославль: ДИА-пресс, 1999.—506 с.
22. Петренюк Л.М., Шелыгина Н.М., Алешина Р.М. и др. Состояние глюкокортикоидной функции коры надпочечников, симпа-тико-адреналовой и иммунной систем у больных кардио-миопатией // Врач. дело.—1989.—№ 11.—С. 70-72.
23. Потемкин В.В. Эндокринология: Учебник.—М.: Медицина, 1999.—640 с.
24. Старкова Н.Т. (ред) Руководство по клинической эндокрино-логии.—СПб.: Питер, 1996.—544 с.
25. Фадеев В.В. Первичная хроническая надпочечниковая недостаточность: (Этиология, клиника, замест. терапия): Автореф. дис. … канд. мед. наук.—М., 1998.—24 с.
26. Фадеев В.В., Мельниченко Г.А. Заместительная терапия первичной хронической надпочечниковой недостаточности: Обзор // Пробл. эндокринол.—2000.—№ 3.—С. 31-45.
27. Шустов С.Б., Халимов Ю.Ш. Функциональная и топическая диагностика в эндокринологии.—СПб.: ЭЛБИ, 2001.—239 с.
28. Barton R.N., Stoner H.B., Watson S.M. Relationship among plasma cortisol, adrenocorticotropin, and severity of injury in recently injured patients // J. Trauma.—1987.—Vol. 27.—P. 384.
29. Bouachour G., Tirot P., Varache N. et al. Haemodynamic changes in acute adrenal insufficiency // Intensiv. Care Med.—1994.— Vol. 20.—P. 138-141.
30. Clark O. Textbook of Endocrine Surgery.—Philadelphia etc.: Saunders company, 1997.—546 p.
31. Claussen M.S., Landercasper J., Cogbill T.H. Acute adrenal insufficiency presenting as shock after trauma and surgery: Three cases and review of the literature // J. Trauma.—1992.—Vol. 32.—P 94.
32. Emanuel P. Rivers, Heidi C. Blake. et al. Adrenal dysfunction in hemodynamically unstable patients in the emergency department // Academic Emergency Med.—1999.—Vol. 6.—P. 626630.
33. Erica W., Rebecca F. Case report: microcardia secondary to chronic adrenocortical insufficiency // CMAJ.—2001.—Vol. 11.— P 1585-1586.
34. Grinspoon S.K., Biller B.M. Clinical review 62: Laboratory assessment of adrenal insufficiency // J. Clin. Endocrinol. Metab.— 1994.—Vol. 79.—P 923.
35. Hardwicke M.D., Kisly A. Prophylactic subcutaneous heparin therapy as a cause of bilateral adrenal hemorrhage // Arch. Intern. Med.—1992.—Vol. 152.—P 845.
36. Javaid A. Normal short synacten test in patient with secondary adrenal failure // Ann. Saudi Med.—1998.—Vol. 18, № 2.— P. 151-153.
37. Kung A.W., Pun K.K., Lam K. et al. Addisonian crisis as presenting features in malignancies // Cancer.—1990.—Vol. 65.—P 177.
38. Lawton J.W. Acute adrenal insufficiency: Hemodynamic and echo-cardiographic characteristics // Wis. Med. J.—1992.—Vol. 91.— P. 214.
39. Loisa P, Rinne T., Kaukinen S. Adrenocortical function and multiple organ failure in severe sepsis // Acta Anaesthesiol. Scand.— 2002.—Vol. 46.—P 145-151.
40. Marik PE., Kiminyo K., Zaloga G.P Adrenal insufficiency in critically ill patients with human immunodeficiency virus // Crit. Care Med.—2002.—Vol. 30.—P 1267-1273.
41. Paul E. Marik, Gary P Zaloga. Adrenal insufficiency during septic shock // Crit. Care Med.—2003.—Vol. 31.—P 141-145.
42. Philippe C., Marie N., Jean-Pierre C. Definitive adrenal insufficiency due to bilateral adrenal hemorrhage and primary antiphospholipid syndrome // J. Clin. Endocrinol. Metab.—1998.—Vol. 83.— № 5.—P 1437-1439.
43. Runcie C.J., Semple C.G., Slater S.D. Addison’s disease without pigmentation // Scott Med J.—1986.—Vol. 31.—P 111.
44. Shy-Shin C., Shiumn-Jen L., Bullard M.J. et al. Adrenal insufficiency in critically Ill emergency department patients // Academic Emergency Med.—2001.—Vol. 8.—P 761-764.
Поступила в редакцию 15.06.2006 г.
Лабораторная диагностика надпочечниковой недостаточности | Мельниченко
Надпочечниковая недостаточность (НН) — клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечников, являющийся результатом нарушения функционирования одного или нескольких звеньев гипоталамо- гипофизарно-надпочечниковой системы (ГГНС). При широкой трактовке понятия НН к этому синдрому, помимо собственно гипокортизолизма, можно отнести врожденную дисфункцию коры надпочечников (ВДКН; врожденный адреногенитальный синдром), изолированный гипоальдостеронизм и некоторые другие еще более редкие заболевания. Однако, как правило, под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортизолизма. Первичная НН (1-НН) аутоиммунной и туберкулезной этиологии более известна под названием «болезнь Аддисона».
Причины 1-НН
- Аутоиммунная деструкция коры надпочечников (75% от всех случаев 1-НН [27]).
- Туберкулез, амилоидоз, грибковые инфекции, сифилис, метастазы опухолей, ВИЧ-ассо- циированный комплекс, синдром Уотерхауса— Фридериксена.
- Ятрогенные причины (двусторонняя адреналэктомия по поводу болезни Иценко—Кушинга, двустороннее кровоизлияние в надпочечники на фоне терапии антикоагулянтами).
II. Центральные формы НН
- Вторичная НН (2-НН). Обусловлена патологией гипофиза и возникает в результате гипопитуитаризма различной этиологии.
- Третичная НН (3-НН). Ее вызывают опухоли, ишемические и любые другие повреждения гипоталамической области.
1-НН развивается вследствие двустороннего поражения коры надпочечников и является относительно редким заболеванием — 40—60 новых случаев на 1 млн взрослых в год [27]. Центральные формы НН могут явиться следствием дефицита продукции адренокортикотропного гормона (АКТГ) гипофизом (2-НН) и /или кортикотро- пин-рилизинг-гормона (КРГ), а возможно, и других гипоталамических стимуляторов секреции АКТГ (3-НН). Истинная частота центральных форм НН неизвестна, но ее наиболее частой причиной является подавление ГГНС на фоне хронической терапии глюкокортикоидами. НН имеет широкий спектр клинических проявлений, выраженность которых варьирует от грубых гемодинамических нарушений до субклинической дисфункции, которая может манифестировать только на фоне тяжелого стресса. В связи с этим лабораторной диагностике НН придается первостепенное значение (см таблицу).
Наиболее частыми клиническими ситуациями, в которых бывает необходимо исследовать функциональное состояние ГГНС на предмет выявления НН, являются следующие.
- Обследование пациентов, у которых имеются клинические признаки НН или подозрение на нее. Целью обследования является выяснение адекватности продукции кортизола корой надпочечника. После того как диагноз НН установлен, необходимо определить уровень повреждения ГГНС. Каждой из эитих задач служат различные диагностические тесты.
- Обследование пациентов, имеющих высокий риск развития НН. Самым частым фактором риска является длительная терапия препаратами глюкокортикоидных гормонов, затем следуют различные гипоталамо-гипофизарные заболевания, особенно если по их поводу предпринимались нейрохирургические вмешательства или лучевая терапия.
Кроме того, если предполагается симптоматический характер НН, для правильной постановки диагноза необходимо дальнейшее обследование пациента. В частности, при подозрении на ВДКН исследуют уровень экскреции 17-оксипро- гестерона и дегидроэпиандростерона с мочой, при подозрении на адренолейкодистрофию или адре- номиелонейропатию (нарушение матаболизма длинноцепочечных жирных кислот с Х-сцеплен- ным рецессивным типом наследования различной степени экспрессивности, вплоть до «мягких» клинически неявных форм) — плазменный уровень длинноцепочечных жирных кислот.
Лабораторная диагностика НН строится на 3 основных принципах функционирования ГГНС.
- Кортизол по механизму отрицательной обратной связи подавляет секрецию АКТГ гипофизом и КРГ гипоталамусом.
- Основным секреторным и трофическим регулятором деятельности коры надпочечников является АКТГ. Недостаток АКТГ в течение непродолжительного времени приводит к обратимому подавлению секреции кортизола, в дальнейшем эти изменения становятся необратимыми.
ГГНС может быть активизирована различными фармакологическими и/или физиологическими стимулами, что на практике используется Лабораторная диагностика НН ([10] с дополнениями)
Метод
Процедура | Интерпретация | Показания | Механизм |
Спонтанное определение уровня кортизола
По срочным показаниям, одновременно с определением уровня АКТГ
Утренний уровень кортизола плазмы
Короткий тест с синактеном
Между 6 и 8 ч
250 мг АКТГ внутривенно. Уровень F исследуется в пробах крови через 0, 30 и 60 мин
Норма: F1 > 18 мкг%. Вероятная
НН: F 5-13 мкг%. Сомнительный результат: F 13—18 мкг%.
НН: F < 5 мкг% Норма: F > 19 мкг%. Сомнительный результат: F 3—19 мкг%.
НН: F < 3 мкг% Норма: F > 18 мкг% в любой из проб
Исследование состояния ГГНС в острой, неотложной ситуации
Исследование состояния ГГНС у госпитализированных пациентов
Непрямое исследование целостности ГГНС
В условиях острого физиологического стресса ГГНС находится в состоянии активации
Продукция F пульса- торна и пикового уровня достигает в утренние часы Деятельность коры надпочечников зависит от секреторных и трофических стимулов АКТГ
Часто в проведении этого исследования нет необходимости
То же
ИТТ
0,1 —0,15 ЕД инсулина внутривенно. Исследование уровня гликемии и F в пробах через 0, 30 и
60 мин
HopMa:F > 18 мкг% в любой из проб. НН: F < 18 + гипогликемия (< 40 мкг%)
Прямое исследование целостности ГГНС
Гипогликемически стресс является сильным стимулятором ГГНС
Короткий ме- тирапоновый тест
30 мг/кг метирапона per os в 24 ч с определением уровней F и S3 в 8 ч следующего утра
Норма: S > 7,0 мкг%. Сомнительный результат: S 5—7 мкг%;
F > 5мкг%. НН:
S < 7 мкг%,
F < 5 мкг%
Чувствительный тест в диагностике центральной формы НН
Длинный ме- тирапоновый тест
500—750 мг метирапона per os 6 раз через 4 ч. Через 24 ч — исследование суточной мочи на содержание 17-ОКС
Плазменный уровень АКТГ
Между 6 и 8 ч
Норма: уровень 17-ОКС возрастает в 2—3 раза и более по сравнению с предшествовавшим базальным. НН: уровень 17-ОКС возрастает в 2—3 раза и более 1-НН: АКТГ > 100 пг/мл (РИА)
То же
Г ипокортизолемия вследствие подавления 1 ip-гидроксилазы стимулирует секрецию АКТГ и стероидогенез проксимальнее ферментного блока То же
Относительные показатели повышения уровня F (в % от базального) менее ценны. При 2-НН и 3-НН уровень F возрастает адекватно Противопоказан у тяжелобольных и душевнобольных пациентов. При инсулино- резистентности различного генеза необходимы большие дозы инсулина Может спровоцировать острую НН. Производится в стационаре. После взятия крови — введение глюкокортикоидов
То же
Наилучший тест для дифференциальной диагностики 1-НН и 2-НН
При 1-НН в ответ на гипокортизолемию плазменный уровень АКТГ по механизму отрицательной обратной связи значительно возрастает
Тест с длитель- Синактен-депо (1 мг ной стимуля- АКТГ) внутримышеч- цией АКТГ4 но. На •> 3, 5-й день Г1 21 исследуется содержа
ние F и 17-ОКС в суточной моче
Тест с длитель- 3 мг /ч АКТГ внутри- ной стимуля- венно на протяжении цией АКТГ4 2 Дней с определением содержания 17-ОКС в суточной
Норма: экскреция F и Дифференциальная 17-ОКС увеличивает- диагностика 1-НН и ся до 300—700% от 2-НН исходного базального
уровня
Центральная НН: То же
17-ОКС > 10 мг/24 ч.
1-НН: 17-ОКС
< 4 мг/24 ч.
Атрофия надпочечников на фоне длительной стимуляции АКТГ подвергается обратному развитию
То же
Не должен использоваться собственно для диагностики НН. Уровень АКТГ нормализуется уже через несколько часов после введения глюкокортикоидов. Проба крови максимально быстро должна доставляться в лабораторию во льду Фенобарбитал, фенитоин и ряд других препаратов усиливают метаболизм F и выделение 17-ОКС снижается
То же
КРГ-тест
Активность
моче на протяжении последующих 2 дней 1 мг/кг КРГ внутривенно F и АКТГ исследуются в пробах через 0, 15, 30, 60, 90 и 120 мин Спонтанное опреде-
Общепринятые кри- Позволяет отличить терии на сегодняш- 1-НН и 2-НН от ний день отсутствуют 3-НН
ренина плазмы ление уровня
1-НН: АРП > 3,0 нг/дл Применение ограничено
Тест со стимуляцией секреции альдосте-
АКТГ-стимулирую- щий тест с дополнительным исследова-
рона
нием уровня альдостерона плазмы на 60-й минуте
1-НН: базальный уро- Применение ограни- вень альдостеро- чено
на < 5 нг% не реаги
рует на стимуляцию синактеном
При изолированном поражении гипоталамуса экзогенный КРГ стимулирует секрецию АКТГ и кортизола При дефиците минералокортикоидов активность ренина плазмы увеличивается При 1-НН уровень альдостерона в ответ на введение АКТГ не повышается
Побочные реакции в виде приливов, реже тахипноэ
Тест не позволяет достоверно отличить 1-НН от центральных форм
То же
- F — обозначение кортизола (соединение F).
- Для пересчета показателей из мкг% в мкмоль/л используют коэффициент 0,0277 (18 мкг% = 0,5 мкмоль/л).
- S — обозначение 11-дезоксикортизола (соединение S Рейхштейна).
- Различные варианты этого теста обсуждаются в тексте статьи.
для выяснения ее потенциальных функциональных резервов.
Кортизол и его метаболиты
Нормальная продукция кортизола осуществляется благодаря координированному функционированию всей ГГНС. На протяжении суток высвобождение гормона происходит в пульсирующем режиме и наиболее высокого уровня достигает в ранние утренние часы. Продукция кортизола корой надпочечников активизируется при снижении уровня гормона в плазме, а также в ответ на физиологические стрессоры, такие как гипогликемия. В качестве самостоятельного теста уровень кортизола исследуют между 6 и 8 ч. Кроме того, его определяют в рамках различных динамических тестов, исследующих состояние ГГНС. Необходимо иметь в виду, что ряд препаратов глюкокортикоидов, в частности гидрокортизон (кортизол), кортизон и метилпреднизолон (медрол, урбазон), дают перекрестную реакцию с эндогенным кортизолом, что требует их отмены как минимум за 24 ч до исследования. Дексаметазон (дексазон, корта- декс, миникорт) такой перекрестной реакции не дает, однако следует иметь в виду, что он является наиболее мощным ингибитором секреции АКТГ гипофизом. В плазме крови большая часть (80%) кортизола связана со специфическим кор- тикостероидсвязывающим глобулином — транс- кортином, колебание уровня которого также может сказаться на результатах определения уровня кортизола [2]. Эстрогены (в том числе входящие в контрацептивные препараты) стимулируют продукцию транскортина печенью, в результате чего увеличивается и общий уровень кортизола. При циррозе печени, нефротическом синдроме, гипертиреозе и ряде других состояний содержание транскортина в плазме уменьшается, однако на плазменном уровне кортизола это сказывается не всегда.
На протяжении многих десятилетий глюкокортикоидную функцию надпочечников оценивали по уровню суточной экскреции 17-оксикортико- стероидов (17-ОКС) с мочой (реакция Портера- Зильбера). Несмотря на то что 70—80% экскретируемых метаболитов кортизола относится к фракции 17-кетогенных стероидов (кортол, кортолон), в состав 17-ОКС входят наиболее физиологически важные стероиды — кортизол, кортизон, 11-дезоксикортизол и их тетрагидроформы. В норме уровень экскреции 17-ОКС у взрослых составляет примерно 8,2—22 мкмоль (3—8 мг) в сутки. Несмотря на достаточно низкую диагностическую ценность этого исследования, его результаты для сопоставления с данными литературы прошлых лет продолжают описывать и в современных работах. Еще менее информативна оценка суточной экскреции 11-оксикортикостероидов (11-ОКС), к фракции которых, помимо кортизола и кортизона, относится кортикостерон. Экскреция 11-ОКС с мочой в норме составляет 250—830 нмоль в сутки. Кроме того, имеются различные варианты исследования плазменного уровня метаболитов кортикостероидов, в том числе и в рамках динамических тестов (см. ниже). Следует еще раз подчеркнуть, что определение уровней 17-ОКС и 11- ОКС — малоинформативный метод, который на сегодняшний день для диагностики НН использоваться не должен.
Косвенные лабораторные данные
Косвенную оценку надпочечниковой функции, а в клинической практике ориентировочную оценку адекватности заместительной терапии можно производить, исходя из минералокортикоидных эффектов кортикостероидов и их препаратов. Кортизол (не говоря уже об альдостероне, а в той или иной степени и о большинстве синтетических стероидов), действуя на уровне почечных канальцев, повышает задержку в организме натрия и экскрецию калия с мочой. Таким образом, для гипокортицизма характерны гиперкалиемия и гипонатриемия той или иной степени выраженности. Результатом глюкокортикоидной недостаточности является гипогликемия. Кроме того, в крови часто отмечаются нормохромная или гипохромная анемия, умеренная лейкопения, относительный лимфоцитоз и эозинофилия. СОЭ возрастает лишь при сопутствующем воспалительном процессе [1].
Экскреция свободного кортизола с мочой
Радиоиммунологический анализ с использованием высокоспецифических антител, которые связываются исключительно с D-кольцом кортизола, исключает перекрестную реакцию с другими стероидами. Экскреция свободного кортизола составляет менее 1% от объема его суточной секреции надпочечниками, однако вполне адекватно отражает последнюю. На фоне развернутой клинической картины болезни Аддисона низкое содержание свободного кортизола в суточной моче (норма 55—250 нмоль, или 20—90 мкг, в сутки) свидетельствует о НН и диктует необходимость начала заместительной терапии. Однако ценность этого метода в диагностике НН также ограничена, поскольку 20% больных с НН имеют нормальное содержание свободного кортизола в суточной моче [35].
Утренний уровень кортизола
Для оценки функционального состояния коры надпочечников уже длительное время используется определение уровня кортизола плазмы в утренние часы, поскольку именно этот уровень отражает пик активности ГГНС. Однако нормальный уровень кортизола (9—25 мкг%, или 0,24—0,69 мкмоль/л) может определяться и при наличии НН. В одном исследовании у 15% пациентов с документированной НН утренний уровень кортизола колебался в пределах 9—19 мкг% [35]. При сопоставлении утреннего уровня кортизола с результатами других исследований выяснилось, что у 51 из 52 пациентов, у которых он составил И мкг% (0,3 мкмоль/л), инсулинотолерантный тест (ИТТ) патологии не выявил [11]. В другом исследовании ИТТ оказался отрицательным у всех пациентов с уровнем кортизола выше 14 мкг% (0,39 мкмоль/л) [38]. Приводить пограничную цифру, оторванную от конкретной лаборатории, нецелесообразно, однако можно с уверенностью сказать, что утренний уровень кортизола плазмы выше 19 мкг% (0,53 мкмоль/л) исключает НН, и такие пациенты в дальнейшем обследовании на этот счет не нуждаются [10].
Нормальный утренний уровень кортизола считается маркером нормальной надпочечниковой функции после операций на гипофизе и после длительной глюкокортикоидной терапии. Показано, что утренний уровень кортизола, превышающий 9 мкг% (0,25 мкмоль/л), через несколько дней после операции на гипофизе является благоприятным, и еще через 2—3 дня у этих пациентов можно обнаружить нормальную реакцию в ИТТ [40]. Спорной является информативность определения утреннего уровня кортизола у больных, находящихся на хронической терапии глюкокортикоидами. Только половина из них с уровнем кортизола более 5 мкг% (0,14 мкмоль/Л) демонстрировали при дальнейшем обследовании адекватную реакцию на введение КРГ [32]. Следует, однако, заметить, что уровень кортизола 5 мкг% в этом исследовании был выбран достаточно низким. Большинство исследователей утверждают, что уровень кортизола менее 3 мкг% (0,08 мкмоль/л) является абсолютно диагностичным в отношении НН [И, 32, 40].
Таким образом, становится понятной недостаточная информативность исследования утреннего уровня кортизола — у многих пациентов он будет иметь пограничные значения, примерно между 3 и 19 мкг%, что требует дальнейшего обследования. И тем не менее технически простое определение уровня кортизола в плазме крови между 6 и 8 ч в обследовании пациентов с подозрением на наличие у них НН является тестом ’первого уровня». Обнаружение у пациентов нормальных, пограничных или очень низких показателей позволяет быстро сориентироваться в ситуации и определить целесообразность дальнейшего обследования.
Произвольное определение уровня кортизола
Исследование уровня кортизола в произвольно взятый момент времени (не утром) целесообразно только по неотложным показаниям [10], в состоянии тяжелого стресса, когда, с одной стороны, ГГНС максимально активирована, а с другой — нет времени дожидаться утра или проводить динамическое исследование (стимулирующие тесты). Диагноз острой НН, как правило, ставят на основании клинической картины. Помочь в этом плане может обнаружение характерной дисэлектролитемии (гиперкалиемии, гипонатриемии). При подозрении на острую НН заместительная терапия должна быть начата сразу же после взятия крови. Если с этой целью используется дексаметазон, это никак не отразится на результатах синактенового теста, который необходимо будет провести в дальнейшем.
Уровень кортизола ниже 18 мкг% (0,49 мкмоль /л) в ситуации острого физиологического стресса расценивается как неадекватно низкий [25]. Этот вывод авторы сделали на основании последующего короткого синактенового теста. Уровень кортизола у тяжелобольных колеблется в широких пределах. Есть сообщение об уровнях кортизола 22, 40 и 15 мкг% у пациентов соответственно с желудочно-кишечными кровотечениями, дыхательной недостаточностью и сепсисом [10]. У тяжелобольных уровень кортизола плазмы ниже 13 мкг% (0,36 мкмоль/л) является прогностически неблагоприятным: высокая смертность, как правило, неадекватная реакция в ответ на стимуляцию АКТГ [25]. Существуют данные о пациентах, у которых в тяжелом состоянии уровень кортизола составлял 5 мкг%, а проведенный в дальнейшем тест с АКТГ выявлял нормальный секреторный ответ коры надпочечников [17]. Таким образом, уровень кортизола на фоне тяжелого стресса (в произвольно взятый момент времени) ниже 5 мкг% свидетельствует о НН, уровень в пределах 5—13 мкг% позволяет с высокой долей вероятности предполагать НН и диктует необходимость начала терапии глюкокортикоидами в связи с потенциальной опасностью ситуации. Уровень 13—18 мкг% — пограничный, требует динамического обследования и временного назначения глюкокортикоидов [10].
Инсулинотолерантный тест
ИТТ — один из самых старых, однако до сегодняшнего дня не потерявших своего значения в диагностике НН тестов, который позволяет исследовать интегративную целостность сразу всей ГГНС. Гипогликемический стресс является сильным непрямым стимулятором секреции кортизола, которая опосредуется через активацию гипоталамических центров и кортикотропной функции гипофиза.
Инсулин короткого действия вводят внутривенно в дозе 0,1—0,15 ЕД/кг. Если у пациента имеет место инсулинорезистентность того или иного генеза (например, при акромегалии), дозу инсулина можно повысить. Следует иметь в виду, что доза инсулина менее 0,1 ЕД/кг не приведет к достаточной активации ГГНС [19]. Как и в синак- теновом тесте (см. ниже), в ИТТ наиболее важным показателем является не прирост уровня кортизола по сравнению с базальным, а его пиковый уровень, более адекватно отражающий резервные функциональные способности ГГНС [8]. Нормальную надпочечниковую функцию отражает повышение уровня кортизола на протяжении теста выше 18 мкг% (0,5 мкмоль/л) [10, 26]. НН диагностируется, если пиковый уровень кортизола не достигает 18 мкг% и при этом развивается гипогликемия (40 мг%, или 2,2 ммоль/л). В редких случаях при наличии клинических признаков НН ИТТ может оказаться отрицательным. Это было продемонстрировано на группе, состоящей из 6 человек, у которых, несмотря на гипокорти- золемию и регресс симптомов НН на фоне терапии глюкокортикоидами, определялось достаточное повышение уровня кортизола в ответ на гипогликемию [39]. И тем не менее ИТТ считается чувствительным тестом, исследующим функциональное состояние ГГНС, особенно в плане выявления кортикотропных резервов гипофиза у па- циетов, имеющих риск развития 2-НН [10, 30]. Основным недостатком ИТТ является его потенциальная опасность из-за развития при имеющейся НН тяжеДых гипогликемий, которые могут сопровождаться сосудистым коллапсом, т. е. может быть спровоцирован аддисонический криз. Пожилым пациентам, а также лицам с сердечно-сосудистой и другой тяжелой патологией ИТТ противопоказан.
Синактеновый стимуляционный тест
Синактен (кортрозин, р1_«24-кортикотропин) представляет собой соединение, состоящее из первых 24 аминокислот от всех 39 аминокислот природного АКТГ, и обладает всеми его фармакологическими свойствами, т. е. при нормальном функциональном состоянии коры надпочечников он стимулирует биосинтез кортикостероидов. Стимуляционный тест с исследованием уровня кортизола плазмы через 30 и 60 мин после внутривенного введения 250 мг (25 ЕД) синактена на 5мл физиологического раствора — классическое исследование в диагностике НН. Однако этот тест позволяет исследовать только функциональную целостность коры надпочечников и лишь косвенно судить о состоянии всей ГГНС, поскольку в такой дозе и за такой промежуток времени АКТГ не успевает оказать на кору надпочечника трофического влияния, вызывая лишь экстренный секреторный ответ. При достаточно длительном нарушении продукции АКТГ в результате гипотала- мо-гипофизарной патологии надпочечники теряют способность реагировать на кратковременную экзогенную стимуляцию. В отношении короткого синактенового теста обсуждаются в основном 2 вопроса: оцениваемые в тесте показатели (пик кортизола или относительный прирост его уровня) и диагностические критерии.
Ранее придавали значение обоим указанным показателям, однако, как выяснилось, относительный прирост уровня кортизола плазмы (в процентах от базального) — показатель не вполне надежный [10]. В одном из исследований было показано, что у 1/3 нормальной контрольной группы уровень кортизола плазмы в ответ на введение АКТГ повысился менее чем на 7 мг% [36]. В связи с тем что относительный прирост кортизола обратно пропорционален его базальному уровню, утром, когда уровни эндогенного АКТГ и кортизола максимальны, этот прирост будет небольшим [20, 23]. Максимальный уровень, которого кортизол достигает в ответ на введение синактена, является более ценным показателем, позволяющим судить о функциональном состоянии надпочечников [3, 10]. Таким образом, ориентироваться на один только прирост уровня кортизола в тесте с синактеном, как это рекомендует ряд руководств [1, 2], не следует.
Повышение уровня кортизола до 15—25 мкг% (0,42—0,69 мкмоль/л) в тесте с синактеном принято считать критерием нормального надпочечникового ответа на стимуляцию [10]. Значение уровня кортизола 18—20 мкг% (0,5—0,55 мкмоль/л) также подтверждено в литературе [36]. Ценность короткого синактенового теста показана в работах, сопоставлявших его результаты с полученными в других динамических исследованиях. Только у 8 из 200 обследованных на предмет НН лиц результаты синактенового теста и ИТТ расходились. В 6 случаях эти расхождения либо были незначительными, либо относились к неадекватной реакции на гипогликемию. В 2 случаях, где у пациентов имела место острая гипофизарная дисфункция, синактеновый тест патологии не выявил, тогда как ИТТ свидетельствовал о НН [22]. Эти случаи демонстрируют тот феномен, когда на протяжении нескольких недель с момента выпадения собственной секреции АКТГ кора надпочечника еще сохраняет способность нормально реагировать на экзогенное введение АКТГ [13]. Как было показано, при впервые диагностированных (свежих) заболеваниях гипоталамо-гипофизарной системы тест с синактеном может оказаться ложноотрицательным по сравнению с положительными результатами ИТТ [4].
Наиболее частой клинической ситуацией, в которой не показано проведение синактенового теста, является послеоперационный период после нейрохирургического вмешательства на гипофизе, когда эндогенная секреция АКТГ может быть нарушена, а кора надпочечника еще не успела подвергнуться гипо- или атрофии. В этой ситуации целесообразно определение утреннего уровня кортизола, а также проведение метирапоново- го теста или ИТТ. Последний тест является более чувствительным для исследования резервов АКТГ, но имеет много противопоказаний. Поэтому как альтернатива стандартному тесту с 250 мг синактена был предложен тест с 5 мг синактена, который, как выяснилось, в этой ситуации оказался чувствительнее первого. Из 26 пациентов, у которых ИТТ выявил снижение резервов АКТГ, тест с 250 мг синактена обнаружил НН только у 18, тогда как тест с 5 мг — у 22 пациентов, которым накануне было предпринято нейрохирургическое вмешательство на гипофизе [30]. Через 1 мес после вмешательства методом выбора, по-ви- димому, является стандартный синакгеновый тест, хотя были описаны его ложноотрицательные по сравнению с ИТТ результаты и через 3 мес после операции [6].
Наиболее часто причиной относительной НН является подавление ГГНС длительным экзогенным введением глюкокортикоидов [10]. У таких больных необходимо выяснить их способность переносить сильные стрессовые воздействия, в том числе оперативные вмешательства, без дополнительного назначения глюкокортикоидов. Нормальное повышение уровня кортизола в ответ на стимуляцию синактеном хорошо коррелирует с уровнем кортизола, который определяется во время операции [18]. Более того, пациенты с субнормальным ответом на синактен в периоператив- ном периоде продемонстрировали меньший подъем уровня кортизола, чем пациенты с нормальным ответом на синактен, но патологическими результатами ИТТ и метирапонового теста [15].
Таким образом, короткий синактеновый тест является на сегодняшний день «золотым стандартом» в диагностике НН, за исключением случаев de novo заболеваний гипоталамо-гипофизарной системы (в первую очередь речь идет о состояниях после операций на гипофизе). Повышение уровня кортизола до 18 мкг% (0,5 мкмоль/л) и более на протяжении теста является адекватным. При небольшом снижении этого уровня — до 13—17 мкг% (0,36—0,47 мкмоль/л) тест следует повторить. Решение вопроса о необходимости начала заместительной терапии решается индивидуально в зависимости от весомости подозрения на НН [10, 24].
Метирапоновый тест
Метирапоновый (метопироновый) тест исследует наличие функциональных резервов АКТГ гипофиза. Метирапон подавляет надпочечниковый фермент 1 ip-гидроксилазу, который обеспечивает превращение 11-дезоксикортизола (вещество S) в кортизол, что является конечным этапом надпочечникового стероидогенеза. 11-дезоксикортизол, хотя и обладает глюкокортикоидной активностью, не подавляет продукцию АКТГ гипофизом. В норме при приеме метирапона блокада продукции кортизола приведет к стимуляции секреции АКТГ, которая в свою очередь активизирует стероидогенез проксимальнее ферментного блока и приведет к накоплению избытка И- дезоксикортизола. При НН этого не произойдет.
В классической форме (по G. Liddle и соавт.) метирапоновый тест заключается в назначении пациенту 500—750 мг препарата per os 6 раз каждые 4 ч (суммарно 3—4,5 г) с оценкой содержания в моче 17-ОКС (одной из фракций которых является 11-дезоксикортизол) на протяжении последующих 2 дней [21]. О НН будет свидетельствовать увеличение содержания 17-ОКС в суточной моче менее чем в 2 —3 раза от исходного уровня. В дальнейшем была предложена более простая модификация метирапонового теста. Пациент выпивает препарат в дозе 30 мг/кг одномоментно ночью в 24 ч. На следующее утро в 8 ч у пациента берут кровь для определения в ней содержания кортизола и 11-дезоксикортизола [37]. Поскольку метирапон потенциально может спровоцировать острую НН, тест проводят только у госпитализированных пациентов. После взятия крови пациентам с вероятной НН с профилактической целью вводятся преднизолон или гидрокортизон [10]. Нормальную функцию ГГНС отражает уровень 11- дезоксикортизола более 7 мкг% (0,19 мкмоль/л) независимо от параллельно определенного уровня кортизола [37]. НН диагностируют, если уровень 11-дезоксикортизола не достигает 7 мкг% и при этом определяется низкий уровень кортизола (2—5 мкг%, или 0,06—0,14 мкмоль/л). Последний свидетельствует об адекватной блокаде 11р-гидро- ксилазы. Если уровень 11-гидроксикортизола ниже 7 мкг%, а уровень кортизола превышает 5 мкг%, никакого заключения по результатам теста сделать нельзя.
Для диагностики НН метирапоновый тест, по- видимому, является наиболее чувствительным [10]. В одном исследовании сравнивали диагностическую ценность метирапонового, синактенового тестов и ИТТ у пациентов, перенесших хирургическое вмешательство на гипофизе, и пациентов, длительно получавших терапию глюкокортикоидами. В 6 из 25 случаев результаты тестов расходились. Синактеновый тест оказался положительным в 1, ИТТ — в 3 , а метирапоновый тест в 4 из 6 случаев [12]. В другой работе изучали функциональное состояние ГГНС у 31 пациента, перенесшего облучение области гипофиза, при этом определяли уровень кортизола, а также проводили тесты с синактеном, КРГ и метирапоном. У всех пациентов утренний уровень кортизола, а также результаты тестов с АКТГ и КРГ были в пределах нормы, тогда как метирапоновый тест оказался положительным в 35% случаев [5]. Клиническое значение выявленной в данном случае дисфункции ГГНС непонятно. Такм образом, высокая чувствительность метирапонового теста сомнений не вызывает, однако его специфичность требует дальнейшего изучения.
Результаты метирапонового теста могут быть искажены приемом глюкокортикоидов, фенитоина (дифенина) и фенобарбитала. Последние 2 препарата усиливают метаболизм метирапона, снижая, таким образом, его плазменный уровень и делая неадекватной блокаду 11|3-гидроксилазы [24].
Определение уровня поражения ГГНС
После того как с помощью описанных исследований диагноз НН установлен, на следующем этапе необходимо выявить уровень поражения ГГНС. Это во многом определяет тактику лечения. Так, пациентам с 2-НН нет необходимости назначать препараты минералокортикоидных гормонов (кортинеф), поскольку при этой форме клубочковая зона коры надпочечника интактна и продолжает функционировать автономно в системе ренин—ангиотензин—альдостерон. При 1-НН в деструктивный процесс вовлекается вся кора надпочечника, что в большинстве случаев требует дополнительного назначения минералокортикоидов. Информативность инструментальных методов обследования (прежде всего компьютерной томографии и магнитно-резонансной томографии) варьирует в зависимости от предполагаемого уровня повреждения ГГНС и его характера. Указанные визуализирующие методы более ценны при выявлении гипоталамо-гипофизарной патологии, чем в диагностике 1-НН (за исключением случаев поражения надпочечников объемным процессом и возможного обнаружения кальцина- тов при туберкулезе). Таким образом, целесообразность использования визуализирующих методов будет определяться, исходя из данных клинической картины и лабораторных исследований.
Уровень АКТГ
Исследование плазменного уровня АКТГ позволяет дифференцировать 1-НН и 2-НН. Секреция АКТГ происходит пульсаторно и, если гипофиз и гипоталамус интактны, в ответ на гипокор- тизолемию она возрастает. Уровень АКТГ более 100 пг/мл, определенный с помощью радиоимму- нологического анализа [10], при уже подтвержденной НН, однозначно свидетельствует о ее первичном генезе. Короткое время полужизни АКТГ в плазме и его очень большая уязвимость для клеточных ферментов требуют скорейшей доставки крови в лабораторию во льду. Кровь для определения уровня АКТГ необходимо взять до назначения глюкокортикоидов, которые нормализуют его уровень буквально за несколько часов. Такое колебание уровня АКТГ можно наблюдать на фоне болезни Аддисона препаратами глюкокортикоидов короткого действия [34]. К последним относят кортизол (гидрокортизон) и кортизон с периодом полувыведения 90 мин и периодом полураспада 8—12 ч в отличие от препаратов средней продолжительности действия — преднизолона и метипреда (соответственно 200 мин и 18—36 ч), и длительного действия — дексаметазона и триамцинолона (250 мин и 36—48 ч).
Следует еще раз подчеркнуть, что само по себе исследование уровня АКТГ для диагностики НН непригодно, а лишь помогает локализовать уровень поражения ГГНС, наличие которого было доказано с помощью описанных выше методик. Как было показано, уровень АКТГ пациентов с гипоталамо-гипофизарной патологией почти не отличался от такового в контрольной группе — 4—81 и 8—75 пг/мл соответственно [28].-кортикотропина), при этом содержание в суточной моче свободного кортизола и 17-ОКС исследуют на 1, 3, 5-й день. В норме их экскреция увеличивается до 300—700% от исходной. При полной 1-НН уровень свободного кортизола и 17-ОКС в крови и моче будет низким и одинаковым как до, так и после стимуляции. При относительной
- НН исходные показатели могут быть в норме или сниженными, в 1-й день стимуляции могут увеличиваться до нормы, однако на 3-й день снижаются, сохраняясь на подпороговом уровне. При
- НН в первые дни стимуляции АКТГ уровни свободного кортизола и 17-ОКС могут остаться неизменными, но в последующие 3—5 дней достигают нормы [1, 2]. В еще одной модификации теста АКТГ вводят постоянно внутривенно на протяжении 48 ч со скоростью 3 ЕД/ч. Содержание 17-ОКС в суточной моче на следующий день при 2-НН составит как минимум 10 мг/сут, а при
- НН не превысит 4 мг/сут [31].
Следует отметить, что такие препараты, как фенобарбитал, рифампицин и фенитоин (дифенин), стимулируют печеночную метаболизацию кортизола до соединений, не относящихся к фракции 17-ОКС, что требует их предварительной отмены [10]. При необходимости оценки функции надпочечников на фоне лечения ингибиторами стероидогенеза следует помнить, что аминоглютетимид (элиптен) и митотан (хлодитан) оказывают аналогичное влияние на печеночный метаболизм кортизола.
С целью дифференциации 1-НН и 2-НН предлагалось определять уровень альдостерона на фоне стимуляции АКТГ [7], однако ни данное исследование, ни определение активности ренина плазмы не позволяют сделать это достаточно надежно [10, 28]. Таким образом, тест с длительной стимуляцией коры надпочечников АКТГ — точное, но требующее много времени исследование, позволяющее дифференцировать 1-НН и 2-НН.
Уровень КРГ
Определение уровня КРГ и тест с КРГ в будущем, возможно, приобретут диагностическое значение для определения уровня поражения ГГНС. Секреция КРГ значительно возрастает в ответ на гипокортизолемию, что происходит при 1-НН и
- НН, однако не при повреждении собственно гипоталамуса, т. е. при 3-НН. В норме плазменный уровень КРГ увеличивается в ответ на введение инсулина (ИТТ) и метирапона и уменьшается при введении дексаметазона. Однако такая закономерность непостоянна [29]. Причиной этого могут быть колебание уровня КРГ-связывающего белка, различные методики исследования, наличие других стимуляторов секреции АКТГ [10]. Кроме того, весьма сомнительно, что по уровню КРГ, который определяется в пробе крови, взятой из кубитальной вены, можно судить о его колебаниях в портальной системе гипофиза. Таким образом, определение уровня КРГ для диагностики НН использоваться не может.
Сравнительно недавно был предложен КРГ- стимулирующий тест, диагностическая ценность которого продолжает исследоваться как в отношении выявления НН, так и для топической диагностики уровня повреждения ГГНС. Пациенту внутривенно вводят КРГ в дозе 1 мг/кг массы, после чего через 2 ч исследуют уровень кортизола плазмы. Такая доза КРГ безопасна для пациента и только в 20 случаев вызывает такие побочные реакции, как тахипноэ и приливы [32]. В одном из исследований у пациентов (61 человек), получавших длительную терапию глюкокортикоидами, ценность этого теста сопоставляли с ИТТ. Результаты тестов с учетом того, что в качестве диагностического критерия был выбран уровень кортизола 20 мкг% (0,55 мкмоль/л), оказались одинаковыми в 85% случаев [32].
Предполагается, что исследование изменений уровня АКТГ в ответ на стимуляцию КРГ позволит различить 1-НН, 2-НН и 3-НН. При 1-НН изначально высокий базальный уровень АКТГ в ответ на введение КРГ возрастает еще более, а затем медленно возвращается к исходно высокому уровню. При 2-НН исходно низкий уровень АКТГ на стимуляцию КРГ никак не реагирует. При 3-НН исходно низкий уровень АКТГ в ответ на введение КРГ делает значительный скачок и затем еще долго продолжает оставаться высоким [33]. Широкого распространения и, таким образом, исчерпывающей оценки эти исследования пока не получили.
Лабораторные исследования в этиологической диагностике НН
Наиболее часто (примерно в 75% случаев) причиной хронической 1-НН является аутоиммунное поражение коры надпочечника, далее следует туберкулезный процесс [27]. До недавнего времени аутоиммунную природу НН (идиопатическую НН) устанавливали путем исключения других возможных причин (туберкулез, метастатическое поражение). На сегодняшний день многочисленными исследованиями выявлен специфический маркер «аутоиммунного адреналита» — антитела к надпочечниковому ферменту 21 — гидроксилазе (Р450с21), которые до этого описывались как антитела к антигену микросомальной фракции 55 кД. В одном из исследований антитела к 21-гидроксилазе обнаружены у 24 (86%) из 28 пациентов с идиопатической 1-НН и не обнаружены ни у одного из 5 пациентов, имевших туберкулезную природу 1-НН, ни у одного из 3 пациентов с адренолейкодистрофией и ни у одного из 2 пациентов, перенесших адреналэктомию [9]. Эти антитела были обнаружены только у 1 (1,4%) из 70 здоровых лиц.
При аутоиммунном поражении надпочечников необходимо скринирующее исследование состояния других эндокринных желез — уровня кальциемии, фосфатемии, гликемии, трийодтиро- нина, тироксина, тиреотропного, фолликулостимулирующего, лютеинизирующего гормонов, антител к тиреоглобулину, поскольку 1-НН может являться частью аутоиммунного полигландуляр- ного синдрома. По последним сообщениям, найден маркер и этого процесса — антител к L-ами- ноацидде карбоксил азе [14].
Заключение
Существующие методы лабораторной диагностики НН имеют разное диагностическое значение и, таким образом, разные показания. Наиболее оптимален ступенчатый принцип. В зависимости от тяжести состояния пациента обследование начинают со спонтанного определения уровня кортизола плазмы или с короткого синактенового теста. При подозрении на острую гипотала- мо-гипофизарную дисфункцию проводят метирапоновый тест. Исследование базального уровня АКТГ позволяет дифференцировать 1-НН и 2-НН. Как альтернатива в этом плане может рассматриваться тест с длительной стимуляцией АКТГ. Обследование пациентов в связи с имеющимся риском развития НН более проблематично, поскольку нарушения могут иметь минимальную выраженность и носить функциональный характер. В этой ситуации тактика будет варьировать у разных пациентов в зависимости от конкретных факторов риска и предполагаемого уровня дисфункции ГГНС. Для этого рекомендуются синактеновый, метирапоновый тесты и ИТТ. Ценность КРГ-стимулирующего теста в диагностике НН окончательно не выяснена. Специфическим маркером 1-НН аутоиммунного генеза являются антитела к надпочечниковому ферменту 21-гидроксилазе.
Острая почечная недостаточность (ОПН) у собак — симптомы, диагностика, лечение
Острая почечная недостаточность (ОПН) – это тяжелое заболевание, сопровождающееся нарушением выделительной функции почек. Это состояние является тяжелым, но, как правило, обратимым. Породной и возрастной предрасположенности нет.
Причины, вызывающие острую почечную недостаточность у собак, могут быть локализованы непосредственно в самой почке при развитии воспалительных процессов, например, бактериальных инфекциях почек, системных инфекциях (лептоспироз), при поражении почек токсинами (соли тяжелых металлов, этиленгликоль), применении препаратов (препараты для химиотерапии). Частая причина развития процесса в почках — это закупорка почечных канальцев эритроцитами при пироплазмозе. Другая группа причин развития ОПН у собак — это недостаточное кровоснабжение почек при кровотечениях, сердечной недостаточности, отравлении или тепловом ударе. Так же ОПН может развиться вследствие закупорки мочеиспускательного канала, что приводит к нарушению оттока мочи, камнями при мочекаменной болезни, опухолью или увеличенной простатой.
Симптомы
Симптомы острой почечной недостаточности у собак неспецифические: слабость, отказ от пищи, рвота и диарея, снижение объема выделяемой мочи, нарушение пульса. Все признаки, сопровождающие ОПН, считаются тяжелыми, при обнаружении их у своего питомца его необходимо срочно обратиться за ветеринарной помощью.
Диагностика
При диагностике используют общий и биохимический анализ крови, анализ мочи, УЗ-исследование почек и всей брюшной полости. Иногда для постановки окончательно диагноза необходима биопсия почки. Однако эти методы не исключают осмотр животного и сбор анамнеза.
Лечение
Как правило, лечение собак с острой почечной недостаточность проводят в условиях стационара, т.к. адекватное лечение амбулаторно невозможно. Лечение комплексное. Направлено на устранение причины, вызывающей ОПН, если таковую удается найти, например, прекратить курс химиотерапии. Также необходимо стимулировать диурез, нормализовать водный и электролитный баланс организма. При бактериальных инфекциях назначают антибиотики. Несмотря на своевременную и адекватную помощь, нередко выздоровление не наступает из-за необратимых процессов в организме, связанных с нарушениями функций почек.
Статья подготовлена врачами терапевтического отделения «МЕДВЕТ»
© 2015 СВЦ «МЕДВЕТ»
Заболевания надпочечников в Германии, стоимость лечения
Надпочечники – небольшие железы внутренней секреции, играющие важную роль в поддержании правильного количества воды и электролитов в организме, в регулировании артериального давления, уровня и усвоения глюкозы, а также в правильном функционировании половой системы мужчин и женщин.
В надпочечниках выделяют две основные зоны (так называемое, корковое и мозговое вещество), образованных разными типами клеток.
Если секреция одного из гормонов надпочечников не соответствует потребностям организма, развиваются серьезные отклонения здоровья.
Диагностика и лечение заболеваний надпочечников в Германии успешно проводится в отделениях эндокринологии, согласно современным мировым стандартам.
Функции надпочечников определяются действием гормонов, которые они выделяют:
- Корковое вещество надпочечников вырабатывает гормоны минералокортикоиды, глюкокортикоиды и половые гормоны – андрогены.
- В мозговом веществе надпочечников образуются и выделяются адреналин и норадреналин – всем известные гормоны «борьбы и бегства», ответственные за правильную физиологическую реакцию организма на стресс.
Причинами нарушения функции надпочечников могут быть:
- Опухоли коркового или мозгового вещества (доброкачественные или злокачественные)
- Врожденное недоразвитие
- Врожденная гиперфункция коркового вещества надпочечников
- Снижение функции надпочечников в результате поражения инфекцией, кровоизлияния в надпочечник, аутоиммунного поражения и других причин
- Нарушение регулирования функции надпочечников гипофизом.
При поражениях надпочечников развивается ряд заболеваний и синдромов, характеризующихся клинической картиной недостаточности или избытка того или иного гормона.
Наиболее часто встречающиеся заболевания надпочечников:
- Болезнь и синдром Иценко-Кушинга
- Альдостерома
- Феохромоцитома
- Болезнь Адиссона
- Острая надпочечниковая недостаточность
- Адрено-генитальный синдром.
Болезнь и синдром Иценко-Кушинга развивается при избытке гормонов глюкокортикоидов (причиной болезни Иценко-Кушинга является усиление регулирующего влияния гипофиза на выработку глюкокортикоидов надпочечниками, а при синдроме Иценко-Кушинга проблема возникает в самих надпочечниках). Развиваются характерные изменения строения тела, ожирение, избыточное оволосение на теле и дисфункция половой системы у женщин, сахарный диабет, гипертония.
Альдостерома – доброкачественная опухоль коркового вещества надпочечников, продуцирующая избыток минералокортикоидов, что вызывает симптомы гиперальдостеронизма: задержку жидкости и повышение артериального давления, а также нарушение обмена натрия и калия, что приводит к судорогам.
Феохромоцитома – доброкачественная или злокачественная опухоль мозгового вещества надпочечников, продуцирующая соответствующие гормоны, основным проявлением при этом бывает злокачественная, плохо поддающаяся лечению артериальная гипертензия.
Болезнь Адиссона – хроническая недостаточность функции коры надпочечников. Заболевание может развиться при тяжелых инфекционных, аутоиммунных заболеваниях, туберкулезе. Проявления характерны: усиленная пигментация кожи (историческое название – «бронзовая болезнь»), снижение аппетита и веса, низкое артериальное давление и общее истощение.
Острая надпочечниковая недостаточность может развиваться при тяжелых травмах, острых инфекционных заболеваниях, тяжелом стрессе любой природы, а также при резкой отмене заместительной терапии гормонами, которая проводилась длительно. Резкая слабость, низкое артериальное давление, боль в животе, понос и угнетение сознания – симптомы, которые должны указать на необходимость срочного эндокринологического обследования и , возможно, госпитализации.
Адреногенитальный синдром – врожденная или приобретенная гиперфункция коркового вещества надпочечников, с преобладанием признаков вирилизации («мужских» черт у женщин и преждевременного формирования вторичных половых признаков у мужчин), нарушений водно-солевого обмена или артериальной гипертензии.
Гемодиализ — шанс выжить
Отравления какими веществами могут эффективно лечится с помощью гемодиализа?
Токсические вещества, подвергающиеся диализу:
Ацетаминофен, ацетон, спирты, амикацин, аминофиллин, ампициллин, анальгетики, химиотерапевтические средства, атенолол, азатиоприн, бацитрацин, бромиды, эрготамин, этиленгликоль, флуорид, 5-фторурацил, фолиевая кислота, гентамицин, йодиды, изопропранолол, канамицин, калий, пропранолол, салицилаты, камфора, карбенициллин, литий, ингибиторы МАО, свинец, маннитол, паральдегид, паракват, пенициллин, фенобарбитал, фосфаты, цефамандол, метанол, метилдопа, стрептомицин, хлоралгидрат, сульфонамиды, тетрациклин, стрихнин, метилпреднизолон, хлориды, хлороквин, колхицин, циклосерин, неомицин, теофиллин, тобрамицин, ванкомицин.
Барбитураты: амобарбитал, апробарбитал, барбитал, бутабарбитал, циклобарбитал, пентобарбитал, фенобарбитал, хиналбитал, секобарбитал.
Небарбитуратные снотворные, седативные, противосудорожные средства и транквилизаторы: карбамазепин, карбромал, хлоралгидрат, хлордиазепокид, диазепам, дифенилгидантоин, дифенилгидрамин, этиамат, этхлорвинол, этосуксимед, гапамин, глютетимид.
Антимикробные и противораковые средства: амикацин, дибекацин, фосфомицин, гентамицин, канамицин, неомицин, нетилмицин, сизомицин, стрептомицин, тобрамицин, ванкомицин, бацитрацин, копистин, ампициллин, аомксициллин, азлоциллин, карбенициллин, клавулиновая кислота, клоксациллин, флоксациллин, мециллинам, мезлоциллин, хлорамфеникол, ципрофлоксацин, клиндамицин, эритромицин, метронидазол, нитрофурантоин, орнидазол, сульфаниламиды, тетрациклин, тинидазол, ацикловир, амантадин, циклосерил, этамбутол, 5-фторцитозин, изониазид, хинин, азатиоприн, брединин, циклофосфамид, 5-фторурацил, героин, мепробамат, метаквалон, метсуксимид, метиприлон, паральдегид, примидон, вальпроевая кислота.
Спирты: этанол, этиленгликоль, изопропанол, метанол.
Анальгетики и антиревматические средства: ацетаминофен, пенициллин, пиперациллин, темоциллин, тикарциллин, цефаклор, цефадроксил, цефамандол, цефазолин, цефиксим, цефменоксим, цефоперазон, цефоранид, цефотаксим, цефотетан, цефотиам, цефокситин, цефроксадин, цефсулодин, цефтазидим, цефтриаксон, цефуроксим, цефацетрил, цефалексин, цефалотин, метотрексат.
Сердечно-сосудистые средства: ацебутолол, N-ацетилпрокаинамид, атенолол, бретилий, каптоприл, диазоксид, дигоксин, лидокаин, метопролол, метилдофа, уабаин, надолол, практолол, прокаинамид, пропранолол, хинидин, токаинид.
Металлы, неорганические вещества: мышьяк, железо, свинец, литий, ацетофенетидин, ацетилсалициловая кислота, колхицин, метилсалицилат, салициловая кислота, азтреонам, циластин, моксалактам, магний, ртуть, калий, фосфат, натрий, стронций, олово, бромид, хлорид, йодид, фторид.
Другие лекарственные средства: аципимокс, аминофиллин, бораты, анилин, борная кислота, циметидин, фолиевая кислота, маннитол, метилпреднизолон, калия бихромат, натрия цитрат, теофиллин, ранитидин.
Растворители, газы: ацетон, камфора, окись углерода, эвкатиптовое масло, тиолы, толуол, трихлорэтилен.
Растения, животные, гербициды, инсектициды: алкифосфат, аманитин, диметоат, дикват, паракват, натрия хлорат, калия хлорат, змеиный яд.
Заболевание надпочечников: описание болезни, причины, симптомы, стоимость лечения в Москве
Надпочечники – это парный орган, выполняющий важную роль в работе организма человека. Основная роль – синтез гормонов, отвечающих за функционирование всех систем. Сбой в работе надпочечников вызывает развитие тяжелых заболеваний вплоть до летального исхода.
Анатомически надпочечники расположены прямо над почками, что и дало им название. Правый имеет треугольную форму, левый – форму полумесяца.
Строение и функционирование надпочечников
В основе надпочечников – две структуры:
Они регулируются нервной системой.
Мозговое вещество
Мозговое вещество – основной источник катехоламиновых гормонов в организме — адреналина и норадреналина.
Адреналин – главный гормон при борьбе со стрессами. Увеличение его выработки происходит при положительных и негативных эмоциях, например, при травме, стрессовой ситуации.
При воздействии адреналина организм использует запасы накопленного гормона, что проявляется такими реакциями:
-
резкий прилив сил;
-
учащение дыхания;
-
расширение зрачков.
Человек ощущает себя более сильным, чем обычно, значительно снижается болевой порог.
Норадреналин – тоже гормон стресса, но его выработка происходит перед выработкой адреналина. По воздействию намного слабее. Его функция – регуляция кровяного давления, что стимулирует работу миокарда – сердечной мышцы.
Корковое вещество
Корковое вещество надпочечников состоит из нескольких слоев, каждый из которых выполняет определенную функцию.
-
Сетчатая зона.
-
Пучковая зона.
-
Клубочковая зона.
В сетчатой зоне синтезируются андрогены – половые гормоны. Они ответственны за развитие вторичных половых признаков и влияют на:
-
состояние либидо – полового влечения у мужчин и женщин;
-
уровень холестерина и липидов в крови;
-
отложение жира;
-
увеличение силы и массы мышц.
Независимо от пола, в каждом организме вырабатываются и мужские, и женские половые гормоны. Разница – в их количестве. Например, у женщин синтезируются эстроген и прогестерон, ответственные за репродуктивную функцию – зачатие и рождение детей, но также и тестостерон в небольшом объеме, который считается мужским гормоном.
Пучковая зона
Эта зона ответственна за синтез глюкокортикостероидов. Они отвечают за белковый, углеводный и жировой обмены в организме. Тесно взаимосвязаны с выработкой инсулина и катехоламинов.
Глюкокортикостероиды снижают иммунный ответ, угнетают воспалительные процессы, постепенно подавляя их.
Один из гормонов пучковой зоны – кортизол. Он принимает участие в углеводном обмене, сохраняет энергетические ресурсы организма. Уровень кортизола в организме постоянно меняется – в утренние часы его больше, чем в вечерние или ночью.
Клубочковая зона
Клубочковая зона коры надпочечников отвечает за минеральный обмен в организме. Продуцируемые здесь гормоны нормализуют функционирование почечных канальцев, поэтому из организма выходит избыточная жидкость, что, в свою очередь, держит в норме показатели артериального давления.
В клубочковой зоне происходит секреция таких гормонов:
-
Альдостерон. Его функция – в поддержании баланса ионов натрия и калия в крови. Гормон принимает участие в водно-солевом обмене, улучшает циркуляцию крови, увеличивает кровяное давление.
-
Кортикостерон – гормон с малой активностью, участвует в минеральном балансе.
-
Дезоксикортикостерон – тоже регулирует водно-солевой баланс, придает силу скелету и мышечной ткани.
Как проявляются заболевания надпочечников?
При нарушении баланса гормонов в организме происходит сбой в его работе. Симптомы появляются по схеме зависимости, то есть конкретное продуцируемое в надпочечниках вещество отвечает за присущий только ему симптом. Например, при дефиците альдостерона из организма вместе с мочой выводится натрий, что понижает показатели давления, значительно увеличивает содержание калия в крови.
Чтобы избежать тяжелых последствий, необходимо обратиться к врачу при первых признаках заболеваний надпочечников. К ним относятся:
-
слабость в мышцах;
-
постоянную усталость;
-
сильное похудение следствие снижения аппетита;
-
низкую стрессоустойчивость;
-
высокую раздражительность;
-
быструю и постоянную утомляемость;
-
проблемы со сном;
-
головокружение, головные боли.
Далее – наиболее распространенные заболевания надпочечников, которые имеют свои симптомы и причины, требуют определенной тактики лечения.
Болезнь Аддисона
Другие названия болезни Аддисона – первичная надпочечниковая недостаточность и гипокортицизм.
Редкая патология, на которую приходится 50 – 100 случаев на один миллион в год. Диагностируют и у женщин, и у мужчин. Средний возраст – от 20 до 40 лет.
При заболевании происходит поражение всех трех зон надпочечниковой коры. Характеризуется дефицитом выработки кортикостероидов. Нарушение синтеза гормонов вызывает серьезные осложнения в организме.
Причина разрушения коры надпочечников – попавшие в организм болезнетворные микроорганизмы – вирусы, бактерии, грибки, а также иммунные нарушения.
Проявления болезни Аддисона:
-
снижение показателей артериального давления;
-
быстрая утомляемость, слабость, отсутствие физических сил;
-
отсутствие аппетита;
-
нарушение работы пищеварительной системы;
-
пигментация кожных покровов, появление темных пятен на слизистых оболочках;
-
озноб;
-
повышение температуры тела.
Для выявления заболевания необходима сдача анализов на уровень кортизола в крови. Проводят обследование состояния коры надпочечников, функционирования желез.
Лечение – прием препаратов с содержанием кортикостероидов на протяжении всей жизни. Возможно введение гидрокортизона внутримышечно.
Болезнь Иценко-Кушинга
Относится к нейроэндокринным патологиям. Причина – сбой работы гипоталамо-гипофизарной системы в результате травмирования головного мозга или перенесенных человеком инфекций. Характеризуется продуцированием излишнего объема кортикостероидов надпочечниками.
Болезнь Иценко-Кушинга – редкая патология. Диагностируют преимущественно у женщин в возрасте от 30 до 45 лет.
Сбой в работе гипоталамо-гипофизарной системы провоцирует нарушения в организме. Утрачивается связь между надпочечниками, гипоталамусом и гипофизом. Сигналы, идущие в гипоталамус, провоцируют избыточную выработку гормонов, высвобождающих адренокортикотропный гормон (АКТГ) в гипофизе, что стимулирует выброс вещества в кровь. Излишнее количество АКТГ влияет на надпочечники, которые начинают усиленного вырабатывать много кортикостероидов.
При прогрессировании патологии происходит видимое увеличение гипофиза и надпочечников в размерах.
Признаки болезни Иценко-Кушинга:
-
головные боли, мигрени;
-
прогрессирующая гипертония;
-
атрофия мышц;
-
формирование лунообразной формы лица;
-
отсутствие менструации у женщин;
-
развитие остеопороза;
-
рост волос на лице у женщин.
Для выявления заболевании назначают сдачу анализов крови и мочи, в которых определяется избыточное количество АКТГ и кортизола. Дополнительно проводят инструментальное обследование.
Цель терапии – восстановление нарушенного обмена веществ, нормализация работы гипоталамуса, приведение в норму синтеза кортикостероидов.
Синдром Нельсона
Развивается как следствие операции по удалению надпочечников при прогрессирующей болезни Иценко-Кушинга.
Симптомы заболевания:
-
регулярные головные боли;
-
снижение чувствительности рецепторов вкуса;
-
понижение остроты зрения;
-
гиперпигментация кожных покровов.
Феохромоцитома
Феохромоцитома представляет собой опухоль, развивающуюся в мозговом веществе надпочечников. В ее основе – хромаффинные тела, которые способствует синтезу большого количества катехоламинов.
Причина – артериальная гипертензия и катехоламиновые кризы.
Симптомы феохромоцитомы:
-
высокое артериальное давление, гипертонические кризы;
-
головная боль;
-
повышенное потоотделение;
-
одышка;
-
обезвоживание организма;
-
судороги;
-
кардиомиопатия;
-
высокий уровень сахара в крови.
Для диагностики заболевания назначают анализы для определенияметаболитов катехоламинов в моче и крови. Для выявления образования применяются аппаратные методы – МРТ и ультразвуковое сканирование.
Лечение медикаментозное, направлено на снижение степени выраженности пароксизмальных приступов.
Гиперальдостеронизм
Другие название патологии – синдром Кона. Состояние, при котором в коре надпочечников вырабатывается излишнее количество альдостерона и дезоксикортикостерона.
Причины гиперальдостеронизма – злокачественное образование в коре надпочечников или гиперплазия тканей коры.
Синдром Кона имеет первичную и вторичную степени развития. Симптомы первичной степени заболевания:
-
повышение артериального давления;
-
головные боли;
-
нарушение сердечного ритма;
-
кардиалгия – боли в левой части груди;
-
снижение остроты зрения.
Симптомы вторичной степени возникают в результате избытка калия и дефицита натрия:
-
отеки;
-
хроническая почечная недостаточность;
-
деформация глазного дна;
-
артериальная гипертензия.
Диагностические мероприятия включают определение уровня калия и натрия, альдостерона в крови и моче.
Терапия зависит от результатов проведенного обследования. Чаще это медикаментозное лечение с назначением гормональных препаратов. При наличии опухоли возможно проведение операции.
Гиперплазия коры надпочечников
Это увеличение в размере коры надпочечников, что ведет к усиленному синтезу андрогенов. Основная причина – генетическая, то есть заболевание является врожденным.
Выделяют три основные формы гиперплазии:
-
Простая вирилизирующая. Происходит усиление синтеза андрогенов, в результате увеличиваются половые органы, мышечная ткань, ускоренно растут волосы на всем теле независимо от пола больного человека.
-
С синдромом утраты соли. Характеризуется избытком калия и дефицитом других гормонов.
-
Гипертоническая. Происходит избыточное продуцирование андрогенов и кортикостероидов, в результате развивается артериальная гипертензия, ухудшается зрительная функция.
Симптомы гиперплазии коры надпочечников:
-
ранний рост волос на теле и на половых органах;
-
рост меньше нормы;
-
грубый голос;
-
проблемы с памятью;
-
частые психозы;
-
слабость мышечной системы.
Признаки появляются в детском возрасте. Для уточнения диагноза назначают сдачу анализов, лабораторные исследования.
Лечение медикаментозное, включает постоянный прием гормональных препаратов. При тяжелом течении заболевания показано хирургическое вмешательство.
Недостаточность коры надпочечников
Это нарушение функционирования надпочечников аутоиммунной природы. Бывает двух видов – острая и хроническая.
Хроническая недостаточность коры надпочечников возникает в результате деструктивных изменений в железистых тканях органа. Основные причины – перенесенные инфекционные заболевания, опухоль гипофиза или макроаденома, омертвление или угнетение передней доли гипофиза.
Острая форма развивается на фоне хронической. Самостоятельно почти не возникает, исключение – сепсис или внезапное кровоизлияние в надпочечниках.
Симптомы надпочечниковой недостаточности:
-
слабость, постоянный упадок сил;
-
снижение аппетита, в результате этого – резкое снижение массы тела;
-
гиперпигментация кожных покровов;
-
артериальная гипотензия;
-
снижение уровня сахар в крови;
-
частое мочеиспускание;
-
тошнота, переходящая в рвоту;
-
нехарактерный стул.
Воспаление надпочечников
Воспалительные процессы в надпочечниках возникают чаще всего на фоне туберкулезного поражения их коры. Особенность патологии – в медленном развитии.
Характерные симптомы воспаления:
-
ощущение постоянной усталости;
-
низкая стрессоустойчивость;
-
регулярные ноющие головные боли;
-
неприятный запах изо рта;
-
тошнота, переходящая в рвоту.
При запущенной форме высока вероятность развития хронического воспалительного процесса.
Туберкулез надпочечников
Туберкулез надпочечников – редкая патология. Для нее характерно накапливание кальцинатов в тканях надпочечников.
Чаще диагностируют в детском и подростковом возрасте. Причина – проникновение туберкулезной палочки из зараженных легких в надпочечники через общий кровоток.
Симптомы туберкулеза надпочечников:
-
низкое артериальное давление;
-
нарушение работы желудочно-кишечного тракта, выражающееся диарей, тошнотой с рвотными приступами;
-
гипогликемия;
-
постоянная слабость, ощущение усталости;
-
дистрофия миокарда.
Киста
Это доброкачественное образование в тканях надпочечников. Опухоль появляется редко и становится опасной только при перерождении в злокачественную. Опасно состояние, при котором происходит разрыв кисты надпочечника.
Симптомы опухоли:
-
боли в пояснице, спине, по бокам;
-
нарушение функционирования почек;
-
увеличение надпочечников в размере;
-
повышение артериального давления в результате сдавливания почечной артерии.
Диагностика кисты надпочечников затруднена из-за ее небольших размеров. Выявить патологию можно только при прогрессировании и росте опухоли.
Опасные опухоли
Если киста является доброкачественным образованием, то есть ряд опухолей, склонных к озлокачествлению.
Наиболее частые из них:
-
альдостерома;
-
андостерома;
-
глюкокортикостерома;
-
кортикоэстрома.
Точные причины развития образований установить сложно, но высока вероятность их гормональной активности на фоне следующих провоцирующих факторов:
-
гиперплазия клеток и разрастание тканей надпочечников;
-
избыточное количество продуцируемых гормонов;
-
онкологические заболевания щитовидной железы;
-
заболевания, связанные с врожденными патологиями кожи, глазной оболочки, сосудов головного мозга.
Локализация опухолей различна. Они могут формироваться и в мозговом, и в корковом слоях. Характерные симптомы:
-
высокие показатели артериального давления;
-
опоздание процесса полового развития;
-
частая тошнота, переходящая в рвоту;
-
боли в животе, в области груди;
-
изменение цвета кожи на лице – бледнеет, краснеет, приобретает синюшный оттенок;
-
резкое изменение уровня глюкозы в крови;
-
сухость во рту;
-
судороги;
-
тремор конечностей;
-
повышенная раздражительность, возбудимость;
-
повышенная тревожность, постоянное чувство страха.
Диагностика
Возможности современной медицины позволяют выявить заболевания надпочечников в короткие сроки. При обращении к эндокринологу будет назначено обследование.
Основные лабораторные методы включают:
-
общий анализ крови;
-
общий анализ мочи;
-
сдача проб на содержание гормонов (тестостерон, альдостерон, кортизол, ДЭА-с, АКТГ).
Инструментальные методы диагностики, которые применяют для выявления патологий надпочечников:
-
МРТ или компьютерная томография;
-
ультразвуковое исследование;
-
рентгенологическое исследование головного мозга для определения размеров гипофиза;
-
флебография;
-
лучевое обследование, позволяющее получить полную картину состояния органа.
Кризис надпочечников — обзор
Управление надпочечниковым кризисом
Кризис надпочечников — это опасное для жизни состояние, которое требует немедленного лечения. В большом проспективном исследовании сообщалось о 8,3 эпизодах надпочечникового криза на 100 пациенто-лет с ассоциированным уровнем смертности 0,5 на 100 пациенто-лет (Hahner et al. , 2015). Пациенты с ХАГ используют правила больничного дня 171 раз в течение своей жизни и посещают больницу из-за криза надпочечников 11 раз (Hummel et al., 2016). Важное значение имеет просвещение пациентов относительно возможных факторов, вызывающих опасные факторы, необходимость увеличения доз глюкокортикоидов в периоды стресса и быстрое распознавание ранних признаков надпочечникового криза. Всем пациентам рекомендуется носить или носить с собой удостоверения личности, предупреждающие медицинских работников о диагнозе ИИ, чтобы обеспечить быстрое лечение в экстренных случаях.
Наиболее вероятно поражение пациентов с первичной надпочечниковой недостаточностью, но в периоды стресса, особенно во время рвоты или диарейных заболеваний, когда пероральное всасывание глюкокортикоидов ненадежно, а потери жидкости и электролитов могут быть высокими, пациенты с вторичным или третичным AI также могут пострадать затронутый.К другим распространенным провоцирующим факторам относятся гриппоподобные заболевания, а у детей — инфекции дыхательных путей. Введение новых лекарств, изменяющих клиренс глюкокортикоидов (таблица 2), также может спровоцировать надпочечниковый криз.
Биохимические особенности криза надпочечников включают гипонатриемию и гиперкалиемию у пациентов с дефицитом минералокортикоидов с высоким содержанием мочевины. Пациенты с вторичным и третичным AI, вероятно, будут иметь нормальную минералокортикоидную активность, но может присутствовать гипонатриемия из-за секреции вазопрессина.Гипогликемия чаще встречается у детей, чем у взрослых.
Лечение надпочечникового криза основано на мнении экспертов, и до настоящего времени не проводилось никаких клинических испытаний для определения оптимального режима дозирования глюкокортикоидов ни у взрослых, ни у детей. В 2016 году Эндокринологическое общество в сотрудничестве с Европейским обществом эндокринологов и Американским обществом клинической химии опубликовало рекомендации по лечению, подробно описанные в таблице 3. Гидрокортизон всегда используется для неотложного лечения надпочечникового криза, поскольку он оказывает минералокортикоидный эффект в высокой степени. дозы, предписанные в этом сценарии, поскольку 11βHSD типа 2 насыщается при высоких концентрациях кортизола.
Таблица 3. Лечение надпочечникового криза
| Гидрокортизонотерапия | Внутривенное введение жидкости |
|---|---|
| Взрослые Болюс 100 мг внутривенно С последующим Инфузия 200 мг в день — 1 в виде непрерывной инфузии в течение 24 часов Затем 100 мг в день — 1 в виде непрерывной инфузии 50–100 мг м — 2 Внутривенно болюс Далее 50–100 мг м — 2 день — 1 в виде болюсов каждые 6 часов | Взрослые 1000 мл изотонического солевого раствора или 5% декстрозы в изотоническом солевом растворе в течение первого часа Затем Непрерывная инфузия изотонического физиологического раствора, регулируемая в соответствии с пациенту необходимо Быстрый болюс изотонического раствора 20 мл кг — 1 , повторяется до 60 мл кг — 1 в течение первого час для шока Гипогликемия: 0.5–1,0 г декстрозы или 2–4 мл кг — 1 25% декстрозы (максимальная разовая доза 25 г), вводимая со скоростью 2–3 мл / ч или 5–10 мл кг — 1 10% декстроза для пациенты & lt; 12 лет. |
От Bornstein, S. R., Allolio, B., Arlt, W., et al. (2016). Диагностика и лечение первичной надпочечниковой недостаточности: Руководство по клинической практике эндокринного общества. Журнал клинической эндокринологии и метаболизма 101 (2), 364–389.
Концентрация кортизола была измерена у восьми здоровых добровольцев после подавления Дексаметазоном HPA после введения 50 мг гидрокортизона внутривенно. У этих субъектов концентрации кортизола превышали 2000 нмоль л — 1 через 30 минут после введения дозы и колебались от 400 до 900 нмоль л — 1 через 5 часов после введения дозы (Jung et al. , 2014), предполагая, что использование более низких доз гидрокортизона во время острого заболевания может быть безопасным.
Надпочечниковая недостаточность | Nature Reviews Disease Primers
Арлт В. и Аллолио Б. Надпочечниковая недостаточность. Ланцет 361 , 1881–1893 (2003).
CAS
PubMed
PubMed Central
Google Scholar
Росс, И. Л. и Левитт, Н. С. Симптомы болезни Аддисона — перекрестное исследование в городах Южной Африки. PLoS ONE 8 , e53526 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Erichsen, M. M. et al. Клинические, иммунологические и генетические особенности аутоиммунной первичной надпочечниковой недостаточности: наблюдения из норвежского регистра. J. Clin. Эндокринол. Метаб. 94 , 4882–4890 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Африн, Б., Хан, К. А. и Риаз, А. Надпочечниковая недостаточность у пакистанских ВИЧ-инфицированных пациентов. J. Ayub Med. Coll. Абботтабад 29 , 428–431 (2017).
PubMed
PubMed Central
Google Scholar
Мофокенг, Т. Р. П., Бешях, С. А., Магомед, Ф., Ндлову, К. К. З. и Росс, И. Л. Существенные препятствия на пути диагностики и лечения надпочечниковой недостаточности в Африке. Endocr. Соединять. 9 , 445–456 (2020).
PubMed
PubMed Central
Google Scholar
Одений, И.А., Фасанмаде, О. А., Аджала, М. О., Оховориоле, А. Е. Адренокортикальная функция у нигерийцев с инфекцией вируса иммунодефицита человека. Гана. Med. J. 47 , 171–177 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Трипати, С. К., Агравала, Р. К. и Балиарсинха, А. К. Эндокринные изменения у ВИЧ-инфицированных пациентов. Индийский. J. Endocrinol. Метаб. 19 , 143–147 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Броерсен, Л. Х., Перейра, А. М., Йоргенсен, Дж. О. и Деккерс, О. М. Надпочечниковая недостаточность при использовании кортикостероидов: систематический обзор и метаанализ. J. Clin. Эндокринол. Метаб. 100 , 2171–2180 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Bleicken, B., Hahner, S., Ventz, M. & Quinkler, M. Распространена отсроченная диагностика надпочечниковой недостаточности: кросс-секционное исследование у 216 пациентов. Am. J. Med. Sci. 339 , 525–531 (2010).
PubMed
PubMed Central
Google Scholar
Аллолио, Б. Большой опыт в эндокринологии криза надпочечников. Eur. J. Endocrinol. 172 , R115 – R124 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Hahner, S. et al. Высокая частота надпочечникового криза у образованных пациентов с хронической надпочечниковой недостаточностью: проспективное исследование. J. Clin. Эндокринол. Метаб. 100 , 407–416 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Пуар, Т. Х., Стиккельбрук, Н. М., Сманс, Л. К., Зелиссен, П. М. и Хермус, А. Р. Кризис надпочечников: все еще смертельное событие в 21 веке. Am.J. Med. 129 , 339 e331–339 e339 (2016).
Google Scholar
Рашворт, Р. Л., Торпи, Д. Дж., Фалхаммар, Х. Кризис надпочечников: перспективы и направления исследований. Эндокринная 55 , 336–345 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Сманс, Л. К., Ван дер Валк, Э. С., Хермус, А.Р. и Зелиссен, П. М. Частота надпочечникового криза у пациентов с надпочечниковой недостаточностью. Clin. Эндокринол. 84 , 17–22 (2016).
CAS
Google Scholar
Bornstein, S.R. et al. Диагностика и лечение первичной надпочечниковой недостаточности: руководство по клинической практике эндокринного общества. J. Clin. Эндокринол. Метаб. 101 , 364–389 (2016). Практическое руководство по лечению надпочечниковой недостаточности от международной группы экспертов .
CAS
PubMed
PubMed Central
Google Scholar
Данлоп Д. Восемьдесят шесть случаев болезни Аддисона. Br. Med. J. 2 , 887–891 (1963).
CAS
PubMed
PubMed Central
Google Scholar
Лаурети С., Векки Л., Сантеусанио Ф. и Фалорни А. Недооценивается ли распространенность болезни Аддисона? Дж.Clin. Эндокринол. Метаб. 84 , 1762 (1999).
CAS
PubMed
PubMed Central
Google Scholar
Hellesen, A., Bratland, E. & Husebye, E. S. Аутоиммунная болезнь Аддисона — обновленная информация о патогенезе. Ann. Эндокринол. 79 , 157–163 (2018).
Google Scholar
Мейсон, А.С., Мид, Т.В., Ли, Дж.А. и Моррис, Дж. Н. Эпидемиологическая и клиническая картина болезни Аддисона. Ланцет 2 , 744–747 (1968).
CAS
PubMed
PubMed Central
Google Scholar
Олафссон, А.С. и Сигурджонсдоттир, Х.А. Возрастающая распространенность болезни Аддисона: результаты общенационального исследования. Endocr. Практик. 22 , 30–35 (2016).
PubMed
PubMed Central
Google Scholar
Bjornsdottir, S. et al. Структура назначения лекарств у пациентов с болезнью Аддисона: когортное исследование на основе шведского населения. J. Clin. Эндокринол. Метаб. 98 , 2009–2018 (2013).
PubMed
PubMed Central
Google Scholar
Мейер, Г., Нойман, К., Баденхуп, К. и Линдер, Р. Растущая распространенность болезни Аддисона среди немецких женщин: данные медицинского страхования за 2008-2012 гг. Eur.J. Endocrinol. 170 , 367–373 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Stewart, P. M. et al. Изучение госпитализаций и заболеваемости у пациентов с надпочечниковой недостаточностью. J. Clin. Эндокринол. Метаб. 101 , 4843–4850 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Уиллис, А. К. и Винс, Ф. П. Распространенность болезни Аддисона в Ковентри, Великобритания. Аспирантура. Med. J. 73 , 286–288 (1997).
CAS
PubMed
PubMed Central
Google Scholar
Chantzichristos, D. et al. Заболеваемость, распространенность и сезонные колебания начала болезни Аддисона среди лиц с сахарным диабетом 1 типа: общенациональные сопоставленные когортные исследования. Eur. J. Endocrinol. 178 , 113–120 (2018). Общенациональное согласованное наблюдательное когортное исследование, изучающее заболеваемость и распространенность первичной надпочечниковой недостаточности в Швеции .
CAS
PubMed
PubMed Central
Google Scholar
Betterle, C., Dal Pra, C., Mantero, F. и Zanchetta, R. Аутоиммунная надпочечниковая недостаточность и аутоиммунные полиэндокринные синдромы: аутоантитела, аутоантигены и их применимость в диагностике и прогнозировании заболеваний. Endocr. Ред. 23 , 327–364 (2002).
CAS
PubMed
PubMed Central
Google Scholar
Laureti, S. et al. Уровни адренокортикальных аутоантител коррелируют со степенью дисфункции надпочечников у субъектов с доклинической болезнью Аддисона. J. Clin. Эндокринол. Метаб. 83 , 3507–3511 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Херндон, Дж., Надо, А. М., Дэвидж-Питтс, К. Дж., Янг, В. Ф. и Бэнкос, И. Первичная надпочечниковая недостаточность из-за двустороннего инфильтративного заболевания. Эндокринная 62 , 721–728 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Merke, D. P. & Auchus, R. J. Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы. N. Engl. J. Med. 383 , 1248–1261 (2020).
CAS
PubMed
PubMed Central
Google Scholar
White, P.C. и Speiser, P.W. Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы. Endocr. Ред. 21 , 245–291 (2000).
CAS
PubMed
PubMed Central
Google Scholar
Bancos, I., Hahner, S., Tomlinson, J. & Arlt, W. Диагностика и лечение надпочечниковой недостаточности. Ланцет Диабет Эндокринол. 3 , 216–226 (2015).
PubMed
PubMed Central
Google Scholar
Михельс А. В. и Готтлиб П. А. Аутоиммунные полигландулярные синдромы. Нат. Rev. Endocrinol. 6 , 270–277 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Husebye, E. S., Anderson, M.С. и Кампе, О. Аутоиммунные полиэндокринные синдромы. N. Engl. J. Med. 378 , 2543–2544 (2018).
PubMed
PubMed Central
Google Scholar
Dalin, F. et al. Клинические и иммунологические характеристики аутоиммунной болезни Аддисона: общенациональное шведское многоцентровое исследование. J. Clin. Эндокринол. Метаб. 102 , 379–389 (2017).
PubMed
PubMed Central
Google Scholar
Reato, G. et al. Преждевременная недостаточность яичников у пациентов с аутоиммунной болезнью Аддисона: клиническая, генетическая и иммунологическая оценка. J. Clin. Эндокринол. Метаб. 96 , E1255 – E1261 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Charmandari, E., Nicolaides, N.C. & Chrousos, G.P. Надпочечниковая недостаточность. Ланцет 383 , 2152–2167 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Регал, М., Парамо, К., Сьерра, С. М. и Гарсиа-Майор, Р. В. Распространенность и частота гипопитуитаризма среди взрослого европейского населения на северо-западе Испании. Clin. Эндокринол. 55 , 735–740 (2001).
CAS
Google Scholar
Бейтс, А.С., Вант Хофф, В., Джонс, П. Дж. И Клейтон, Р. Н. Влияние гипопитуитаризма на продолжительность жизни. J. Clin. Эндокринол. Метаб. 81 , 1169–1172 (1996).
CAS
PubMed
PubMed Central
Google Scholar
Tomlinson, J. W. et al. Связь между преждевременной смертностью и гипопитуитаризмом. Группа перспективных исследований гипогипофиза в Уэст-Мидлендсе. Ланцет 357 , 425–431 (2001). Проспективное исследование с участием 1014 пациентов с гипопитуитаризмом, изучающее общую смертность и смертность от конкретных причин по сравнению с аналогичным по возрасту и полу британским населением .
CAS
PubMed
PubMed Central
Google Scholar
Carosi, G. et al. Гипоталамо-гипофизарная ось при нефункционирующих аденомах гипофиза: основное внимание уделяется распространенности изолированного центрального гипоадренализма. Нейроэндокринология 102 , 267–273 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Аппельман-Дейкстра, Н.M. et al. Дисфункция гипофиза у взрослых пациентов после краниальной лучевой терапии: систематический обзор и метаанализ. J. Clin. Эндокринол. Метаб. 96 , 2330–2340 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Дженкинс, П. Дж., Бейтс, П., Карсон, М. Н., Стюарт, П. М. и Васс, Дж. А. Обычное облучение гипофиза эффективно для снижения уровня гормона роста в сыворотке и инсулиноподобного фактора роста-I у пациентов с акромегалией. J. Clin. Эндокринол. Метаб. 91 , 1239–1245 (2006).
CAS
PubMed
PubMed Central
Google Scholar
Knappe, U. J. et al. Фракционная лучевая терапия и радиохирургия при акромегалии: анализ 352 пациентов из Немецкого реестра акромегалии. Eur. J. Endocrinol. 182 , 275–284 (2020).
CAS
PubMed
PubMed Central
Google Scholar
Имбер, Б.С., Ли, Х.С., Кунвар, С., Блевинс, Л.С. и Аги, М.К. Гипофизит: серия одноцентровых случаев. Гипофиз 18 , 630–641 (2015).
PubMed
PubMed Central
Google Scholar
Wang, S. et al. Первичный лимфоцитарный гипофизит: клиническая характеристика и лечение 50 случаев в одном центре в Китае за 18 лет. Clin. Эндокринол. 87 , 177–184 (2017).
CAS
Google Scholar
Turcu, A. F. et al. Поражения гипофиза: опыт клиники Мэйо. J. Clin. Эндокринол. Метаб. 98 , 1812–1818 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Лу, Дж., Ли, Л., Лан, Ю., Лян, Ю. и Мэн, Х. Дисфункция гипофиза и надпочечников, связанная с ингибиторами иммунных контрольных точек: систематический обзор и метаанализ. Cancer Med. 8 , 7503–7515 (2019).
PubMed
PubMed Central
Google Scholar
Barroso-Sousa, R. et al. Частота эндокринной дисфункции после использования различных схем ингибиторов иммунных контрольных точек: систематический обзор и метаанализ. JAMA Oncol. 4 , 173–182 (2018).
PubMed
PubMed Central
Google Scholar
Chang, L. S. et al. Эндокринная токсичность иммунотерапии рака, нацеленной на иммунные контрольные точки. Endocr. Ред. 40 , 17–65 (2019).
PubMed
PubMed Central
Google Scholar
Li, T. et al. Распространенность опиоидной недостаточности надпочечников у пациентов, хронически принимающих опиоиды. J. Clin. Эндокринол. Метаб. 105 , e3766 – e3775 (2020).
Google Scholar
de Vries, F. et al. Опиоиды и их эндокринные эффекты: систематический обзор и метаанализ. J. Clin. Эндокринол. Метаб. 105 , 1020–1029 (2020).
Google Scholar
Саид, З. И., Бэнкос, И. и Донеган, Д. Текущие знания и практика медицинских работников по поводу опиоидной недостаточности надпочечников. Endocr. Практик. 25 , 1012–1021 (2019).
PubMed
PubMed Central
Google Scholar
Woods, C.P. et al. Подавление надпочечников широко распространено у пациентов, принимающих ингаляционные глюкокортикоиды, и лечение может осуществляться с помощью утреннего кортизола. Eur. J. Endocrinol. 173 , 633–642 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Schlaghecke, R., Kornely, E., Santen, R. T. & Ridderskamp, P. Влияние длительной глюкокортикоидной терапии на гипофизарно-надпочечниковые реакции на экзогенный кортикотропин-рилизинг-гормон. N. Engl. J. Med. 326 , 226–230 (1992).
CAS
PubMed
PubMed Central
Google Scholar
Mebrahtu, T. F. et al. Дозозависимость избытка ятрогенных глюкокортикоидов, надпочечниковой недостаточности и смертности: когортное исследование в Англии. J. Clin. Эндокринол. Метаб. 104 , 3757–3767 (2019).
Google Scholar
Pofi, R. et al. Короткий тест на синактен (кортикотропин) можно использовать для прогнозирования восстановления функции гипоталамо-гипофизарно-надпочечниковой системы. J. Clin. Эндокринол. Метаб. 103 , 3050–3059 (2018). Ретроспективный анализ 776 пациентов с обратимыми причинами ИИ, у которых было проведено не менее двух коротких тестов Synacthen для прогнозирования восстановления функции оси HPA .
PubMed
PubMed Central
Google Scholar
Джозеф Р. М., Хантер А. Л., Рэй Д. В. и Диксон В. Г. Системная глюкокортикоидная терапия и надпочечниковая недостаточность у взрослых: систематический обзор. Семин. Ревматоидный артрит. 46 , 133–141 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Леонг, С. Х., Шандер, С. и Ратнасингам, Дж. Прогнозирование восстановления оси гипоталамус-гипофиз-надпочечники после длительного использования глюкокортикоидов. Endocr. Практик. 24 , 14–20 (2018).
PubMed
PubMed Central
Google Scholar
Odenwald, B. et al. Дети с классической врожденной гиперплазией надпочечников испытывают потерю соли и гипогликемию: оценка кризов надпочечников в течение первых 6 лет жизни. Eur. J. Endocrinol. 174 , 177–186 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Reisch, N. et al. Частота и причины кризов надпочечников в течение жизни у пациентов с дефицитом 21-гидроксилазы. Eur. J. Endocrinol. 167 , 35–42 (2012).
CAS
PubMed
PubMed Central
Google Scholar
Ritzel, K. et al. Клинический обзор: результат двусторонней адреналэктомии при синдроме Кушинга: систематический обзор. J. Clin. Эндокринол. Метаб. 98 , 3939–3948 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Мейер Г., Баденхуп К. и Линдер Р. Болезнь Аддисона с полигландулярным аутоиммунитетом несет в себе более чем 2,5-кратный риск надпочечникового кризиса: данные медицинского страхования Германии за 2010-2013 гг. Clin. Эндокринол. 85 , 347–353 (2016).
CAS
Google Scholar
Паперска, Л.& Rabijewski, M. Задержка диагностики надпочечниковой недостаточности — частая причина надпочечникового криза. Внутр. J. Endocrinol. 2013 , 482370 (2013).
PubMed
PubMed Central
Google Scholar
Gidlof, S. et al. Сто лет врожденной гиперплазии надпочечников в Швеции: ретроспективное популяционное когортное исследование. Ланцет Диабет Эндокринол. 1 , 35–42 (2013).
PubMed
PubMed Central
Google Scholar
Бергторсдоттир, Р., Леонссон-Закриссон, М., Оден, А. и Йоханссон, Г. Преждевременная смертность у пациентов с болезнью Аддисона: популяционное исследование. J. Clin. Эндокринол. Метаб. 91 , 4849–4853 (2006). Популяционное ретроспективное обсервационное исследование из Швеции, показывающее, что коэффициент риска смерти более чем в два раза выше у пациентов с болезнью Аддисона, чем в фоновой популяции .
CAS
PubMed
PubMed Central
Google Scholar
Bensing, S. et al. Повышенный риск смерти и изменение картины заболеваемости раком у пациентов с изолированной или комбинированной аутоиммунной первичной недостаточностью коры надпочечников. Clin. Эндокринол. 69 , 697–704 (2008).
Google Scholar
Erichsen, M. M. et al. Нормальный общий уровень смертности при болезни Аддисона, но молодые пациенты подвержены риску преждевременной смерти. Eur. J. Endocrinol. 160 , 233–237 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Falhammar, H. et al. Повышенная смертность у пациентов с врожденной гиперплазией надпочечников из-за дефицита 21-гидроксилазы. J. Clin. Эндокринол. Метаб. 99 , E2715 – E2721 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Hahner, S. et al. Эпидемиология надпочечникового криза при хронической надпочечниковой недостаточности: необходимость новых стратегий профилактики. Eur. J. Endocrinol. 162 , 597–602 (2010).
CAS
PubMed
PubMed Central
Google Scholar
El-Maouche, D. et al. Продольная оценка заболеваний, дозирования стресса и последствий болезни у пациентов с врожденной гиперплазией надпочечников. J. Clin. Эндокринол.Метаб. 103 , 2336–2345 (2018).
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л., Крисп, Г. Л., Дин, Б., Фалхаммар, Х. и Торпи, Д. Дж. Госпитализация детей с надпочечниковой недостаточностью и гипопитуитаризмом: существует ли различное бремя между мальчиками и девочками и между возрастными группами? Horm. Res. Педиатр. 88 , 339–346 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л., Фалхаммар, Х., Маннс, К. Ф., Магуайр, А. М. и Торпи, Д. Дж. Модели госпитализации у детей с ХАГ: частота госпитализаций и надпочечниковый кризис снижается с возрастом. Внутр. J. Endocrinol. 2016 , 5748264 (2016).
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л. и Торпи, Д. Дж. Описательное исследование надпочечникового криза у взрослых с надпочечниковой недостаточностью: повышенный риск с возрастом и у лиц с бактериальными инфекциями. BMC Endocr. Disord. 14 , 79 (2014).
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л. и Торпи, Д. Дж. Современные схемы заместительной терапии гидрокортизоном у пациентов с надпочечниковой недостаточностью и риск надпочечникового криза. Horm. Метаб. Res. 47 , 637–642 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л. и Торпи, Д. Дж. Надпочечниковая недостаточность в Австралии: возможно ли, что использование более низких доз глюкокортикоидов короткого действия увеличило риск надпочечникового криза? Horm. Метаб. Res. 47 , 427–432 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Окамото М. Метаболизм кортизола при гипертиреозе и синдроме Кушинга. Эндокринол. Jpn. 10 , 159–168 (1963).
CAS
PubMed
PubMed Central
Google Scholar
Fonseca, V., Brown, R., Hochhauser, D., Ginsburg, J. & Havard, C. W. Острый надпочечниковый криз, спровоцированный тироксином. Br. Med. J. 292 , 1185–1186 (1986).
CAS
Google Scholar
Рашворт, Р. Л., Крисп, Г. Л.И Торпи, Д. Дж. Глюкокортикоид-индуцированная надпочечниковая недостаточность: исследование заболеваемости у больничных пациентов и обзор периоперационного ведения. Endocr. Практик. 24 , 437–445 (2018).
PubMed
PubMed Central
Google Scholar
Рашворт, Р. Л., Слободян, П. и Торпи, Д. Дж. Перебои с поставками высоких доз гидрокортизона в таблетках и частота надпочечниковых кризов. Clin.Эндокринол. 83 , 999–1000 (2015).
Google Scholar
Gjerstad, J. K., Lightman, S. L. & Spiga, F. Роль глюкокортикоидной отрицательной обратной связи в регуляции пульсации оси HPA. Напряжение 21 , 403–416 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Лайтман, С. Л. и Конвей-Кэмпбелл, Б.L. Решающая роль пульсирующей активности оси HPA для непрерывного динамического уравновешивания. Нат. Rev. Neurosci. 11 , 710–718 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Roelfsema, F., Aoun, P. & Veldhuis, J. D. Пульсирующая обратная связь кортизола на секрецию АКТГ опосредуется глюкокортикоидным рецептором и модулируется в зависимости от пола. J. Clin. Эндокринол. Метаб. 101 , 4094–4102 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Уокер, Дж. Дж., Терри, Дж. Р. и Лайтман, С. Л. Происхождение ультрадианной пульсации в оси гипоталамус-гипофиз-надпочечники. Proc. Биол. Sci. 277 , 1627–1633 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Лайтман, С.Л., Бирни, М.Т.И Конвей-Кэмпбелл, Б. Л. Динамика секреции АКТГ и кортизола и последствия для болезни. Endocr. Ред. 41 , 470–490 (2020).
Google Scholar
Oster, H. et al. Функциональное и клиническое значение суточного ритма циркуляции глюкокортикоидов. Endocr. Ред. 38 , 3–45 (2017).
PubMed
PubMed Central
Google Scholar
Caratti, G. et al. Функция рецепторов глюкокортикоидов при здоровье и болезнях. Clin. Эндокринол. 83 , 441–448 (2015).
CAS
Google Scholar
Хрусос, Г. П. в Эндокринология 7-е издание (ред. Джеймсон, Дж. Л. и Де Гроот, Л.) 1727–1740.e5 (Elsevier, 2016).
Ставрева Д.А. и др. Стимуляция ультрадиановым гормоном вызывает импульсы транскрипции генов, опосредованные глюкокортикоидными рецепторами. Нат. Cell Biol. 11 , 1093–1102 (2009). Это исследование показало, что введение глюкокортикоидов с высокой точностью индуцирует циклическую GR-опосредованную регуляцию транскрипции в культивируемых клетках и на животных моделях .
CAS
PubMed
PubMed Central
Google Scholar
Kalafatakis, K. et al. Ультрадианная ритмичность кортизола в плазме необходима для нормальных эмоциональных и когнитивных реакций человека. Proc. Natl Acad. Sci. США 115 , E4091 – E4100 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Чан, В. Л., Каррелл, Р. В., Чжоу, А. и Рид, Р. Дж. Как изменения сродства кортикостероид-связывающего глобулина модулируют концентрацию свободного кортизола. J. Clin. Эндокринол. Метаб. 98 , 3315–3322 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Хенли, Д., Лайтман, С. и Каррелл, Р. Кортизол и CBG — Доставка кортизола в нужное место в нужное время. Pharmacol. Ther. 166 , 128–135 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Стоуассер М., Ахмед А. Х., Пимента Э., Тейлор П. Дж. И Гордон Р. Д. Факторы, влияющие на соотношение альдостерон / ренин. Horm. Метаб. Res. 44 , 170–176 (2012).
CAS
PubMed
PubMed Central
Google Scholar
Атлас, С. А. Ренин-ангиотензин-альдостероновая система: патофизиологическая роль и фармакологическое ингибирование. J. Manag. Care Pharm. 13 , 9–20 (2007).
PubMed
PubMed Central
Google Scholar
Туччи, Дж. Р., Эспинер, Э. А., Джаггер, П. И., Паук, Г. Л. и Лаулер, Д.P. Стимуляция секреции альдостерона АКТГ у здоровых людей и у пациентов с хронической надпочечниковой недостаточностью. J. Clin. Эндокринол. Метаб. 27 , 568–575 (1967).
CAS
PubMed
PubMed Central
Google Scholar
Kem, D. C. et al. Ответ плазменного альдостерона на АКТГ при первичном альдостеронизме и у пациентов с гипертензией с низким содержанием ренина. J. Clin. Эндокринол. Метаб. 46 , 552–560 (1978).
CAS
PubMed
PubMed Central
Google Scholar
Боллаг, В. Б. Регулирование синтеза и секреции альдостерона. Компр. Physiol. 4 , 1017–1055 (2014).
PubMed
PubMed Central
Google Scholar
Митчелл, А. Л. и Пирс, С. Х. Аутоиммунная болезнь Аддисона: патофизиология и генетическая сложность. Нат. Rev. Endocrinol. 8 , 306–316 (2012).
CAS
PubMed
PubMed Central
Google Scholar
Винквист О., Карлссон Ф. А. и Кампе О. 21-гидроксилаза, главный аутоантиген при идиопатической болезни Аддисона. Ланцет 339 , 1559–1562 (1992).
CAS
PubMed
PubMed Central
Google Scholar
Naletto, L. et al. Естественная история аутоиммунной болезни Аддисона от обнаружения аутоантител до развития болезни: длительное последующее исследование с участием 143 пациентов. Eur. J. Endocrinol. 180 , 223–234 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Dawoodji, A. et al. Высокая частота цитолитических 21-гидроксилаз-специфичных CD8 + Т-клеток у пациентов с аутоиммунной болезнью Аддисона. J. Immunol. 193 , 2118–2126 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Братланд, Э., Скиннингсруд, Б., Ундлиен, Д. Э., Мозес, Э. и Хусебай, Э. С. Ответы Т-клеток на стероидный цитохром P450 21-гидроксилазу у пациентов с аутоиммунной первичной надпочечниковой недостаточностью. J. Clin. Эндокринол. Метаб. 94 , 5117–5124 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Eriksson, D. et al. Общие генетические вариации в локусе аутоиммунного регулятора (AIRE) связаны с аутоиммунной болезнью Аддисона в Швеции. Sci. Отчет 8 , 8395 (2018).
PubMed
PubMed Central
Google Scholar
Skov, J. et al. Наследственность болезни Аддисона и распространенность ассоциированного аутоиммунитета в когорте из 112 100 шведских близнецов. Эндокринная 58 , 521–527 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Лоеб Р.Ф. Химические изменения в крови при болезни Аддисона. Наука 76 , 420–421 (1932).
CAS
PubMed
PubMed Central
Google Scholar
Хан, Т. С., Уокер, Б. Р., Арлт, В. и Росс, Р. Дж. Лечение и результаты для здоровья взрослых с врожденной гиперплазией надпочечников. Нат. Rev. Endocrinol. 10 , 115–124 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Кемп, С., Хаффнагель, И. К., Линторст, Г. Э., Вандерс, Р. Дж. И Энгелен, М. Адренолейкодистрофия — нейроэндокринный патогенез и новое определение естественной истории. Нат. Rev. Endocrinol. 12 , 606–615 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Laureti, S. et al. Х-сцепленная адренолейкодистрофия является частой причиной идиопатической болезни Аддисона у молодых взрослых пациентов мужского пола. J. Clin. Эндокринол. Метаб. 81 , 470–474 (1996).
CAS
PubMed
PubMed Central
Google Scholar
Bezman, L. & Moser, H. W. Частота Х-сцепленной адренолейкодистрофии и относительная частота ее фенотипов. Am. J. Med. Genet. 76 , 415–419 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Ханна-Шмуни, Ф. и Стратакис, К. А. Обзор врожденных нарушений метаболизма, проявляющихся первичной надпочечниковой недостаточностью. Rev. Endocr. Метаб. Disord. 19 , 53–67 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Наруми С. Редкие моногенные причины первичной надпочечниковой недостаточности. Curr. Opin. Эндокринол. Диабет Ожирение. 25 , 172–177 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Tanriverdi, F. et al. Дисфункция гипофиза после черепно-мозговой травмы: клинико-патофизиологический подход. Endocr. Ред. 36 , 305–342 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Gubbi, S., Hannah-Shmouni, F., Stratakis, C. A. & Koch, C. A. Первичный гипофизит и другие аутоиммунные заболевания селлярной и супраселлярной областей. Rev. Endocr. Метаб. Disord. 19 , 335–347 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Faje, A. Иммунотерапия и гипофизит: клинические проявления, лечение и биологические идеи. Гипофиз 19 , 82–92 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Caturegli, P. et al. Аутоиммунный гипофизит. Endocr. Ред. 26 , 599–614 (2005).
CAS
PubMed
PubMed Central
Google Scholar
Абдель Разек, М. А., Венна, Н. и Стоун, Дж. Х. Заболевания центральной и периферической нервной системы, связанные с IgG4. Lancet Neurol. 17 , 183–192 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Lamprecht, A., Sorbello, J., Jang, C., Torpy, D. J. & Inder, W. J. Вторичная надпочечниковая недостаточность и дисфункция гипофиза у потребителей пероральных / трансдермальных опиоидов с болью, не связанной с раком. Eur. J. Endocrinol. 179 , 353–362 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Fraser, L.A. et al. Пероральные опиоиды при хронической нераковой боли: гипогонадизм чаще встречается у мужчин, чем у женщин. Exp. Clin. Эндокринол. Диабет 117 , 38–43 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Фунтас А., Ван Уум С. и Каравитаки Н. Эндокринопатии, вызванные опиоидами. Ланцет Диабет Эндокринол. 8 , 68–80 (2020).
CAS
PubMed
PubMed Central
Google Scholar
Пекич С. и Попович В. Диагностика эндокринных заболеваний: расширение причины гипопитуитаризма. Eur. J. Endocrinol. 176 , R269 – R282 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Хайэм, К. Э., Йоханссон, Г. и Шале, С. М. Гипопитуитаризм. Ланцет 388 , 2403–2415 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Wu, W. et al. Мутации в PROP1 вызывают семейный комбинированный дефицит гормона гипофиза. Нат. Genet. 18 , 147–149 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Jullien, N. et al. Клинические уроки конституционного гипопитуитаризма, извлеченные из двух десятилетий опыта большой международной когорты. Clin. Эндокринол. 94 , 277–289 (2021).
Google Scholar
Тутункулер, Ф., Сака, Н., Аркая, С. К., Аббасоглу, С. и Бас, Ф. Оценка адреномедуллярной функции у пациентов с врожденной гиперплазией надпочечников. Horm. Res. 72 , 331–336 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Morita, S. et al. Снижение резерва адреналина в ответ на инсулино-индуцированную гипогликемию у пациентов с аденомой гипофиза. Eur. Дж.Эндокринол. 157 , 265–270 (2007).
CAS
PubMed
PubMed Central
Google Scholar
Merke, D. P. et al. Адреномедуллярная дисплазия и гипофункция у пациентов с классической недостаточностью 21-гидроксилазы. N. Engl. J. Med. 343 , 1362–1368 (2000).
CAS
PubMed
PubMed Central
Google Scholar
Борнштейн, С. Р., Брейдерт, М., Эрхарт-Борнштейн, М., Клоос, Б. и Шербаум, В. А. Катехоламины плазмы у пациентов с болезнью Аддисона. Clin. Эндокринол. 42 , 215–218 (1995).
CAS
Google Scholar
Mpoy, M. & Kolanowski, J. Экскреция катехоламинов с мочой у пациентов с вторичной недостаточностью коры надпочечников. J. Endocrinol. Вкладывать деньги. 9 , 253–255 (1986).
CAS
PubMed
PubMed Central
Google Scholar
Kim, M. S. et al. Снижение адреномедуллярной функции у младенцев с классической врожденной гиперплазией надпочечников. J. Clin. Эндокринол. Метаб. 99 , E1597 – E1601 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Гейгер, А. М., Питтс, К. П., Фельдкамп, Дж., Киршбаум, К. и Вольф, Дж. М. Кортизол-зависимые стрессовые воздействия на распределение клеток у здоровых людей и людей, страдающих хронической надпочечниковой недостаточностью. Brain Behav. Иммун. 50 , 241–248 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Wurtman, R.J. & Axelrod, J. Контроль ферментативного синтеза адреналина в мозговом веществе надпочечников корковыми стероидами надпочечников. J. Biol. Chem. 241 , 2301–2305 (1966).
CAS
PubMed
PubMed Central
Google Scholar
Эрхарт-Борнштейн, М., Хинсон, Дж. П., Борнштейн, С. Р., Шербаум, В. А. и Винсон, Г. П. Интраадренальные взаимодействия в регуляции стероидогенеза надпочечников. Endocr. Ред. 19 , 101–143 (1998).
CAS
PubMed
PubMed Central
Google Scholar
К, Т. Т. et al. Гипофизарно-межпочечное взаимодействие в развитии межпочечных органов у рыбок данио. Мол. Эндокринол. 21 , 472–485 (2007).
CAS
PubMed
PubMed Central
Google Scholar
Weise, M. et al. У пациентов с классической врожденной гиперплазией надпочечников наблюдается снижение резерва адреналина и недостаточное повышение уровня глюкозы в ответ на упражнения высокой интенсивности. J. Clin. Эндокринол.Метаб. 89 , 591–597 (2004).
CAS
PubMed
PubMed Central
Google Scholar
Эльбельт, У., Ханер, С. и Аллолио, Б. Изменение потребности в инсулине у пациентов с диабетом 1 типа и первичной надпочечниковой недостаточностью, получающих стандартную заместительную терапию глюкокортикоидами. Eur. J. Endocrinol. 160 , 919–924 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Орентрейх, Н., Бринд, Дж. Л., Райзер, Р. Л. и Фогельман, Дж. Х. Возрастные изменения и половые различия в концентрациях дегидроэпиандростерона сульфата в сыворотке крови на протяжении взрослого возраста. J. Clin. Эндокринол. Метаб. 59 , 551–555 (1984).
CAS
PubMed
PubMed Central
Google Scholar
Korth-Schutz, S., Levine, L. S. & New, M. I. Андрогены сыворотки у нормальных детей препубертатного и пубертатного возраста и у детей с преждевременным развитием надпочечников. J. Clin. Эндокринол. Метаб. 42 , 117–124 (1976).
CAS
PubMed
PubMed Central
Google Scholar
Lebbe, M. et al. Метаболом стероидов в изолированном фолликуле яичника и его ответ на воздействие андрогенов и антагонизм. Эндокринология 158 , 1474–1485 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Глейхер Н., Вегхофер А. и Барад Д. Х. Роль андрогенов в созревании фолликулов и индукции овуляции: друг или враг лечения бесплодия? Репродукция. Биол. Эндокринол. 9 , 116 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Ланг, К., Бургер-Стритт, С. и Ханер, С. Полезна ли замена ДГЭА при хронической надпочечниковой недостаточности? Best Pract. Res. Clin.Эндокринол. Метаб. 29 , 25–32 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Labrie, F. et al. Структура, регуляция и роль ферментов 3β-гидроксистероиддегидрогеназы, 17β-гидроксистероиддегидрогеназы и ароматазы в образовании половых стероидов в классических и периферических внутрикринных тканях. Baillieres Clin. Эндокринол. Метаб. 8 , 451–474 (1994).
CAS
PubMed
PubMed Central
Google Scholar
Pluchino, N. et al. Нейробиология DHEA и его влияние на сексуальность, настроение и познание. J. Steroid Biochem. Мол. Биол. 145 , 273–280 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Arlt, W. et al. Замена дегидроэпиандростерона у женщин с надпочечниковой недостаточностью. N. Engl. J. Med. 341 , 1013–1020 (1999). Двойное слепое клиническое исследование DHEA у женщин с AI, демонстрирующее улучшение самочувствия и сексуальности .
CAS
PubMed
PubMed Central
Google Scholar
Сапольски, Р. М., Ромеро, Л. М., Мунк, А. У. Как глюкокортикоиды влияют на реакцию на стресс? Интеграция разрешающих, подавляющих, стимулирующих и подготовительных действий. Endocr. Ред. 21 , 55–89 (2000).
CAS
PubMed
PubMed Central
Google Scholar
Бессе, Дж. К. и Басс, А. Д. Усиление гидрокортизоном ответов на катехоламины в гладких мышцах сосудов. J. Pharmacol. Exp. Ther. 154 , 224–238 (1966).
CAS
PubMed
PubMed Central
Google Scholar
Калснер, С. Механизм потенцирования гидрокортизоном ответов на адреналин и норадреналин в аорте кролика. Circ. Res. 24 , 383–395 (1969).
CAS
PubMed
PubMed Central
Google Scholar
Prete, A. et al. Профилактика надпочечникового криза: реакция кортизола на сильный стресс по сравнению с доставкой стрессовой дозы гидрокортизона. J. Clin. Эндокринол. Метаб. 105 , 2262–2274 (2020). Это исследование обеспечивает доказательную базу стероидогенного ответа коры надпочечников в случае серьезного стресса (тяжелая травма, сепсис и боевой стресс) .
Google Scholar
Udelsman, R. et al. Адаптация при хирургическом стрессе. Переоценка роли глюкокортикоидов. J. Clin. Вкладывать деньги. 77 , 1377–1381 (1986).
CAS
PubMed
PubMed Central
Google Scholar
Quinkler, M., Oelkers, W., Remde, H. & Allolio, B. Замещение минералокортикоидов и мониторинг при первичной надпочечниковой недостаточности. Best Pract. Res. Clin. Эндокринол. Метаб. 29 , 17–24 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Мунк, А., Гайр, П. М. и Холбрук, Н. Дж. Физиологические функции глюкокортикоидов при стрессе и их связь с фармакологическими действиями. Endocr. Ред. 5 , 25–44 (1984).
CAS
PubMed
PubMed Central
Google Scholar
Беседовский, Х., дель Рей, А., Соркин, Э. и Динарелло, С. А. Иммунорегуляторная обратная связь между интерлейкином-1 и глюкокортикоидными гормонами. Science 233 , 652–654 (1986).
CAS
PubMed
PubMed Central
Google Scholar
Barber, A. E. et al. Терапия глюкокортикоидами изменяет гормональные и цитокиновые реакции на эндотоксин у человека. J. Immunol. 150 , 1999–2006 (1993).
CAS
PubMed
PubMed Central
Google Scholar
Морроу, Л. Э., Макклеллан, Дж. Л., Конн, К. А. и Клюгер, М. Дж. Глюкокортикоиды изменяют лихорадку и реакцию ИЛ-6 на психологический стресс и липополисахарид. Am. J. Physiol. 264 , R1010 – R1016 (1993).
CAS
PubMed
PubMed Central
Google Scholar
Кониарис, Л. Г., Ванд, Г. и Райт, Т. М. TNF опосредует мышиную модель кризиса Аддисона. Шок 15 , 29–34 (2001).
CAS
PubMed
PubMed Central
Google Scholar
Boonen, E. et al. Снижение метаболизма кортизола во время тяжелой болезни. Н.Англ. J. Med. 368 , 1477–1488 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Husebye, E. S. et al. Заявление о консенсусе по диагностике, лечению и последующему наблюдению за пациентами с первичной надпочечниковой недостаточностью. J. Intern. Med. 275 , 104–115 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Buonocore, F., McGlacken-Byrne, S.M., Del Valle, I. & Achermann, J.C. Современные взгляды на надпочечниковую недостаточность у новорожденных и младенцев. Фронт. Педиатр. 8 , 619041 (2020).
PubMed
PubMed Central
Google Scholar
Саевик А.Б. и др. Подсказки для раннего выявления аутоиммунной болезни Аддисона — мифы и реальность. J. Intern. Med. 283 , 190–199 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Эль-Фархан Н. и др. Ответы сывороточного кортизола на адренокортикотропиновый тест, специфичные для метода: сравнение результатов газовой хроматографии-масс-спектрометрии и пяти автоматических иммуноанализов. Clin. Эндокринол. 78 , 673–680 (2013).
CAS
Google Scholar
Ueland, G.A. et al. Пересмотр короткого теста на косинтропин: новый нормальный референсный диапазон с использованием ЖХ-МС / МС. J. Clin. Эндокринол. Метаб. 103 , 1696–1703 (2018).
PubMed
PubMed Central
Google Scholar
Dickstein, G. et al. Тест на стимуляцию адренокортикотропином: влияние базального уровня кортизола, времени суток и предложенный новый чувствительный тест с низкой дозой. J. Clin. Эндокринол. Метаб. 72 , 773–778 (1991).
CAS
PubMed
PubMed Central
Google Scholar
Мэй, М. Э. и Кэри, Р. М. Экспресс-тест на адренокортикотропный гормон на практике. ретроспективный обзор. Am. J. Med. 79 , 679–684 (1985).
CAS
PubMed
PubMed Central
Google Scholar
Oelkers, W. Роль тестов на высокие и низкие дозы кортикотропина в диагностике вторичной надпочечниковой недостаточности. Eur. J. Endocrinol. 139 , 567–570 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Lutz, A. et al. Функция надпочечников у пациентов с макрометастазами надпочечников. Eur. J. Endocrinol. 143 , 91–97 (2000).
CAS
PubMed
PubMed Central
Google Scholar
Мао, Дж. Дж., Дагес, К. Н., Суреш, М. и Бэнкос, И. Представление, прогрессирование заболевания и исходы метастазов в надпочечники. Clin. Эндокринол. 93 , 546–554 (2020).
CAS
Google Scholar
Петерсенн, С., Онеггер, Дж. И Квинклер, М. Национальный немецкий аудит диагностики, лечения и обучения при вторичной надпочечниковой недостаточности. Horm. Метаб. Res. 49 , 580–588 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Шмидт, Иллинойс, Ланер, Х., Манн, К. и Петерсенн, С. Диагностика надпочечниковой недостаточности: оценка теста высвобождающего гормона кортикотропина и базального уровня кортизола в сыворотке по сравнению с тестом на толерантность к инсулину у пациентов при гипоталамо-гипофизарно-надпочечниковом заболевании. J. Clin. Эндокринол. Метаб. 88 , 4193–4198 (2003).
CAS
PubMed
PubMed Central
Google Scholar
Гроссман, А. Б. Диагностика и лечение центрального гипоадренализма. J. Clin. Эндокринол. Метаб. 95 , 4855–4863 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Эртурк, Э., Яффе, К. А. и Баркан, А. Л. Оценка целостности гипоталамо-гипофизарно-надпочечниковой оси с помощью теста на инсулиновую гипогликемию. J. Clin. Эндокринол. Метаб. 83 , 2350–2354 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Hurel, S.J. et al. Короткие стресс-тесты Synacthen и инсулина в оценке гипоталамо-гипофизарно-надпочечниковой оси. Clin. Эндокринол. 44 , 141–146 (1996).
CAS
Google Scholar
Рейнольдс Р. М., Стюарт П. М., Секл Дж. Р. и Падфилд П.L. Оценка оси HPA у пациентов с заболеванием гипофиза: исследование в Великобритании. Clin. Эндокринол. 64 , 82–85 (2006).
Google Scholar
Mukherjee, J. J. et al. Сравнение теста толерантности к инсулину / глюкагона с коротким тестом стимуляции АКТГ при оценке гипоталамо-гипофизарно-надпочечниковой оси в раннем послеоперационном периоде после гипофизэктомии. Clin. Эндокринол. 47 , 51–60 (1997).
CAS
Google Scholar
Ospina, N. S. et al. Тесты стимуляции АКТГ для диагностики надпочечниковой недостаточности: систематический обзор и метаанализ. J. Clin. Эндокринол. Метаб. 101 , 427–434 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Steiner, H., Bahr, V., Exner, P. & Oelkers, P. W.Функциональные пробы гипофиза: сравнение ответов на АКТГ и 11-дезоксикортизол в метирапоновом тесте и с тестом на инсулиновую гипогликемию. Exp. Clin. Эндокринол. 102 , 33–38 (1994).
CAS
PubMed
PubMed Central
Google Scholar
Berneis, K. et al. Комбинированная стимуляция адренокортикотропина и соединения-S с помощью теста с однократной дозой метирапона в амбулаторных условиях для оценки функции гипоталамуса, гипофиза и надпочечников. J. Clin. Эндокринол. Метаб. 87 , 5470–5475 (2002).
CAS
PubMed
PubMed Central
Google Scholar
Giordano, R. et al. Оценка гипоталамус-гипофизарно-надпочечниковой оси у пациентов с гипоталамо-гипофизарными нарушениями: сравнение различных провокационных тестов. Clin. Эндокринол. 68 , 935–941 (2008).
CAS
Google Scholar
Hamrahian, A.H. et al. Пересмотренные пороговые значения GH и кортизола для теста стимуляции глюкагоном при оценке осей GH и гипоталамо-гипофизарно-надпочечников у взрослых: результаты проспективного рандомизированного многоцентрового исследования. Гипофиз 19 , 332–341 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Deutschbein, T., Unger, N., Mann, K. & Petersenn, S. Диагностика вторичной надпочечниковой недостаточности у пациентов с гипоталамо-гипофизарным заболеванием: сравнение кортизола в сыворотке и слюне во время короткого приема высоких доз синактен тест. Eur. J. Endocrinol. 160 , 9–16 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Debono, M. et al. Кортизон слюны отражает воздействие кортизола в физиологических условиях и после приема гидрокортизона. J. Clin. Эндокринол. Метаб. 101 , 1469–1477 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Thil’en, A. et al. Преимущества неонатального скрининга на врожденную гиперплазию надпочечников (дефицит 21-гидроксилазы) в Швеции. Педиатрия 101 , E11 (1998).
PubMed
PubMed Central
Google Scholar
Кишор Кумар, Р., Дас, Х. и Кини, П. Скрининг новорожденных на врожденную гиперплазию надпочечников в Индии: чего нам нужно остерегаться? J. Obstet. Gynaecol. Индия 66 , 415–419 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Yanase, T. et al. Диагностика и лечение надпочечниковой недостаточности, включая криз надпочечников: руководство по клинической практике Японского эндокринного общества [Мнение]. Endocr. J. 63 , 765–784 (2016).
PubMed
PubMed Central
Google Scholar
Woodcock, T. et al.Рекомендации по лечению глюкокортикоидов в периоперационном периоде для пациентов с надпочечниковой недостаточностью: рекомендации Ассоциации анестезиологов, Королевского колледжа врачей и Общества эндокринологов Великобритании. Анестезия 75 , 654–663 (2020).
CAS
PubMed
PubMed Central
Google Scholar
Grossman, A., Johannsson, G., Quinkler, M. & Zelissen, P.Терапия эндокринных заболеваний: перспективы лечения надпочечниковой недостаточности: клинические наблюдения со всей Европы. Eur. J. Endocrinol. 169 , R165 – R175 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Debono, M. et al. Гидрокортизон с модифицированным высвобождением для обеспечения циркадных профилей кортизола. J. Clin. Эндокринол. Метаб. 94 , 1548–1554 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Hahner, S. et al. Нарушение субъективного статуса здоровья 256 пациентов с надпочечниковой недостаточностью, получающих стандартную терапию, на основании перекрестного анализа. J. Clin. Эндокринол. Метаб. 92 , 3912–3922 (2007). Поперечное исследование, показывающее, что пациенты с ИИ, получающие стандартную замену, страдают от значительного ухудшения субъективного состояния здоровья, связанного со здоровьем, независимо от происхождения заболевания или сопутствующего заболевания .
CAS
PubMed
PubMed Central
Google Scholar
Johannsson, G. et al. Улучшение профиля времени воздействия кортизола и результатов у пациентов с надпочечниковой недостаточностью: проспективное рандомизированное исследование новой лекарственной формы гидрокортизона с двойным высвобождением. J. Clin. Эндокринол. Метаб. 97 , 473–481 (2012). Рандомизированное испытание, сравнивающее три раза в день традиционную замену гидрокортизона с гидрокортизоном двойного высвобождения один раз в день .
CAS
PubMed
PubMed Central
Google Scholar
Европейское агентство по лекарственным средствам. Краткое описание характеристик продукта: Plenadren. https://www.ema.europa.eu/en/medicines/human/EPAR/plenadren (2018).
Giordano, R. et al. Улучшение антропометрических и метаболических параметров и качества жизни после лечения гидрокортизоном двойного высвобождения у пациентов с болезнью Аддисона. Эндокринная 51 , 360–368 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Quinkler, M., Miodini Nilsen, R., Zopf, K., Ventz, M. & Oksnes, M. Гидрокортизон с модифицированным высвобождением снижает ИМТ и HbA1c у пациентов с первичной и вторичной надпочечниковой недостаточностью. Eur. J. Endocrinol. 172 , 619–626 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Isidori, A. M. et al. Влияние гидрокортизона с модифицированным высвобождением один раз в сутки по сравнению со стандартной терапией глюкокортикоидами на метаболизм и врожденный иммунитет у пациентов с надпочечниковой недостаточностью (DREAM): простое слепое рандомизированное контролируемое исследование. Ланцет Диабет Эндокринол. 6 , 173–185 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Whittle, E. & Falhammar, H. Режимы глюкокортикоидов в лечении врожденной гиперплазии надпочечников: систематический обзор и метаанализ. J. Endocr. Soc. 3 , 1227–1245 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Lovas, K. & Husebye, E. S. Непрерывная подкожная инфузия гидрокортизона при болезни Аддисона. Eur. J. Endocrinol. 157 , 109–112 (2007).
PubMed
PubMed Central
Google Scholar
Гальярди, Л.и другие. Непрерывная подкожная инфузионная терапия гидрокортизона при болезни Аддисона: рандомизированное плацебо-контролируемое клиническое исследование. J. Clin. Эндокринол. Метаб. 99 , 4149–4157 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Nella, A. A. et al. Исследование фазы 2 непрерывной подкожной инфузии гидрокортизона у взрослых с врожденной гиперплазией надпочечников. J. Clin.Эндокринол. Метаб. 101 , 4690–4698 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Whitaker, M. et al. Пероральная заместительная терапия гидрокортизоном с модифицированным высвобождением, состоящая из нескольких частиц, обеспечивающая физиологическое воздействие кортизола. Clin. Эндокринол. 80 , 554–561 (2014).
CAS
Google Scholar
Mallappa, A. et al. Исследование фазы 2 Chronocort, препарата гидрокортизона с модифицированным высвобождением, в лечении взрослых с классической врожденной гиперплазией надпочечников. J. Clin. Эндокринол. Метаб. 100 , 1137–1145 (2015). Фаза II исследования, посвященного изучению препарата Хронокорт с модифицированным высвобождением гидрокортизона у 16 взрослых с классической врожденной гиперплазией надпочечников. Хронокорт индуцировал профили кортизола два раза в день, аналогичные физиологической секреции кортизола .
CAS
PubMed
PubMed Central
Google Scholar
Merke, D. P. et al. Фаза 3 исследования гидрокортизона с модифицированным высвобождением в лечении врожденной гиперплазии надпочечников [аннотация OR25-02]. J. Endocr. Soc. 4 (Приложение 1), A107 – A108 (2020).
Google Scholar
Turcu, A. F. et al. Исследование однократной дозы антагониста рецептора-1 рилизинг-фактора кортикотропина у женщин с дефицитом 21-гидроксилазы. J. Clin. Эндокринол. Метаб. 101 , 1174–1180 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Саевик А. Б. и др. Остаточная продукция кортикостероидов при аутоиммунной болезни Аддисона. J. Clin. Эндокринол. Метаб. 105 , 2430–2441 (2020).
Google Scholar
Pofi, R. et al. Измерения ренина в плазме не связаны с заместительной дозой минералокортикоидов у пациентов с первичной надпочечниковой недостаточностью. J. Clin. Эндокринол. Метаб. 105 , 314–326 (2020).
Google Scholar
Элкерс, В., Дидерих, С. и Бар, В. Диагностика и наблюдение за терапией при болезни Аддисона: экспресс-тест на адренокортикотропин (АКТГ) и измерение АКТГ, активности ренина и альдостерона в плазме. J. Clin. Эндокринол. Метаб. 75 , 259–264 (1992).
CAS
PubMed
PubMed Central
Google Scholar
Schultebraucks, K., Wingenfeld, K., Otte, C. & Quinkler, M. Роль флудрокортизона в когнитивных способностях и настроении у пациентов с первичной надпочечниковой недостаточностью (болезнь Аддисона). Нейроэндокринология 103 , 315–320 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Эспозито, Д., Паскуали, Д. и Йоханссон, Г. Первичная надпочечниковая недостаточность: управление заместительной терапией минералокортикоидами. J. Clin. Эндокринол. Метаб. 103 , 376–387 (2018).
PubMed
PubMed Central
Google Scholar
Flad, T. M., Conway, J. D., Cunningham, S. K. & McKenna, T. J. Роль активности ренина плазмы в оценке адекватности замены минералокортикоидов при первичной надпочечниковой недостаточности. Clin. Эндокринол. 45 , 529–534 (1996).
CAS
Google Scholar
Коэн, Н., Гилберт, Р., Вирт, А., Кэсли, Д. и Джерумс, Г. Предсердный натрийуретический пептид и уровни ренина в плазме при оценке замены минералокортикоидов при болезни Аддисона. J. Clin. Эндокринол. Метаб. 81 , 1411–1415 (1996).
CAS
PubMed
PubMed Central
Google Scholar
Oelkers, W. & L’Age, M. Контроль замещения минералокортикоидов при болезни Аддисона путем измерения ренина в плазме. Клин. Wochenschr. 54 , 607–612 (1976).
CAS
PubMed
PubMed Central
Google Scholar
Smith, S.J. et al. Доказательства того, что пациенты с болезнью Аддисона недостаточно получают флудрокортизон. Ланцет 1 , 11–14 (1984).
CAS
PubMed
PubMed Central
Google Scholar
Хортис, В.и другие. Терапия митотаном при раке коры надпочечников индуцирует CYP3A4 и ингибирует 5α-редуктазу, что объясняет необходимость индивидуальной замены глюкокортикоидов и андрогенов. J. Clin. Эндокринол. Метаб. 98 , 161–171 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Johannsson, G. et al. Низкие дозы дегидроэпиандростерона влияют на поведение женщин с гипогипофизарным дефицитом андрогенов: плацебо-контролируемое исследование. J. Clin. Эндокринол. Метаб. 87 , 2046–2052 (2002).
CAS
PubMed
PubMed Central
Google Scholar
Lovas, K. et al. Замена дегидроэпиандростерона при надпочечниковой недостаточности: отсутствие пользы для субъективного состояния здоровья и сексуальности в 9-месячном рандомизированном клиническом исследовании в параллельных группах. J. Clin. Эндокринол. Метаб. 88 , 1112–1118 (2003).
CAS
PubMed
PubMed Central
Google Scholar
van Thiel, S. W. et al. Влияние дегидроэпиандростендиона, наложенного на замену гормона роста, на качество жизни и инсулиноподобный фактор роста I у пациентов с вторичной надпочечниковой недостаточностью: рандомизированное, плацебо-контролируемое перекрестное исследование. J. Clin. Эндокринол. Метаб. 90 , 3295–3303 (2005).
PubMed
PubMed Central
Google Scholar
Gurnell, E.M. et al. Долгосрочная замена DHEA при первичной надпочечниковой недостаточности: рандомизированное контролируемое исследование. J. Clin. Эндокринол. Метаб. 93 , 400–409 (2008).
CAS
PubMed
PubMed Central
Google Scholar
Coles, A.J. et al. Замена дегидроэпиандростерона у пациентов с болезнью Аддисона оказывает бимодальное действие на регуляторные (CD4 + CD25hi и CD4 + FoxP3 +) Т-клетки. Eur. J. Immunol. 35 , 3694–3703 (2005).
CAS
PubMed
PubMed Central
Google Scholar
Дхатария, К., Бигелоу, М. Л. и Наир, К. С. Влияние замены дегидроэпиандростерона на чувствительность к инсулину и липиды у женщин с гипоадреналовой функцией. Диабет 54 , 765–769 (2005).
CAS
PubMed
PubMed Central
Google Scholar
Srinivasan, M. et al. Влияние замены дегидроэпиандростерона на профиль липопротеинов у женщин с гипоадреналовой функцией. J. Clin. Эндокринол. Метаб. 94 , 761–764 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Callies, F. et al. Замена дегидроэпиандростерона у женщин с надпочечниковой недостаточностью: влияние на состав тела, уровень лептина в сыворотке крови, метаболизм костной ткани и работоспособность. J. Clin. Эндокринол. Метаб. 86 , 1968–1972 (2001).
CAS
PubMed
PubMed Central
Google Scholar
Christiansen, J. J. et al. Очень краткосрочное лечение дегидроэпиандростероном при надпочечниковой недостаточности у женщин: влияние на углеводный, липидный и белковый обмен. Eur. J. Endocrinol. 152 , 77–85 (2005).
CAS
PubMed
PubMed Central
Google Scholar
Alkatib, A.A. et al. Систематический обзор и метаанализ рандомизированных плацебо-контролируемых исследований влияния лечения DHEA на качество жизни женщин с надпочечниковой недостаточностью. J. Clin. Эндокринол. Метаб. 94 , 3676–3681 (2009). Метаанализ рандомизированных исследований DHEA при AI, показывающий в целом небольшое влияние DHEA на параметры качества жизни и сексуальность .
CAS
PubMed
PubMed Central
Google Scholar
Аллолио, Б., Арлт, В. и Ханер, С. ДГЭА: почему, когда и сколько — замена ДГЭА при надпочечниковой недостаточности. Ann. Эндокринол. 68 , 268–273 (2007). Всестороннее отражение имеющихся данных о надпочечниковом кризисе и обсуждение будущих направлений .
CAS
Google Scholar
Lovas, K. et al. Заместительная глюкокортикоидная терапия и фармакогенетика при болезни Аддисона: влияние на кости. Eur. J. Endocrinol. 160 , 993–1002 (2009).
PubMed
PubMed Central
Google Scholar
Koetz, K. R., Ventz, M., Diederich, S. & Quinkler, M. Минеральная плотность костной ткани существенно не снижается у взрослых пациентов, получающих заместительную терапию низкими дозами глюкокортикоидов. J. Clin. Эндокринол. Метаб. 97 , 85–92 (2012). Систематическая оценка МПК у 122 пациентов с ИА, демонстрирующих нормальные значения МПК при низких заместительных дозах глюкокортикоидов .
CAS
PubMed
PubMed Central
Google Scholar
Schulz, J. et al. Снижение суточной дозы гидрокортизона улучшает здоровье костей при первичной надпочечниковой недостаточности. Eur. J. Endocrinol. 174 , 531–538 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Bjornsdottir, S. et al. Риск перелома шейки бедра при болезни Аддисона: популяционное когортное исследование. J. Intern. Med. 270 , 187–195 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Ragnarsson, O., Nystrom, H. F. & Johannsson, G. Заместительная терапия глюкокортикоидами независимо связана со снижением минеральной плотности костной ткани у женщин с гипопитуитаризмом. Clin. Эндокринол. 76 , 246–252 (2012).
CAS
Google Scholar
Mo, D. et al. Риск перелома у взрослых пациентов, получавших заместительную терапию гормоном роста при дефиците гормона роста: проспективное наблюдательное когортное исследование. Ланцет Диабет Эндокринол. 3 , 331–338 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Mazziotti, G. et al. Ведение эндокринных заболеваний: риск избыточного лечения у пациентов с надпочечниковой недостаточностью: текущие и новые аспекты. Eur. J. Endocrinol. 177 , R231 – R248 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Фалхаммар, Х., Филипссон Нистром, Х., Уэделл, А., Брисмар, К. и Торен, М. Минеральная плотность костей, маркеры костей и переломы у взрослых мужчин с врожденной гиперплазией надпочечников. Eur. J. Endocrinol. 168 , 331–341 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Guarnotta, V., Ciresi, A., Pillitteri, G. & Giordano, C. Повышение чувствительности и секреции к инсулину у пациентов с преддиабетическим состоянием и надпочечниковой недостаточностью при лечении гидрокортизоном двойного высвобождения: ретроспективный анализ за 36 месяцев. Clin. Эндокринол. 88 , 665–672 (2018).
CAS
Google Scholar
Plat, L. et al. Метаболические эффекты кратковременного повышения уровня кортизола в плазме более выражены вечером, чем утром. J. Clin. Эндокринол. Метаб. 84 , 3082–3092 (1999). Это исследование показало, что повышение вечернего уровня кортизола может способствовать изменению толерантности к глюкозе, чувствительности к инсулину и секреции инсулина .
CAS
PubMed
PubMed Central
Google Scholar
Филипссон, Х., Монсон, Дж. П., Колтовска-Хаггстром, М., Маттссон, А. и Йоханссон, Г. Влияние схем замещения глюкокортикоидов на метаболический исход и сопутствующие заболевания у пациентов с гипопофизом. J. Clin. Эндокринол. Метаб. 91 , 3954–3961 (2006). Крупное шведское контрольное исследование, показывающее повышенный риск ишемической болезни сердца при увеличении заместительной дозы стероидов у женщин с аутоиммунной болезнью Аддисона.Повышения риска цереброваскулярных заболеваний не выявлено .
CAS
PubMed
PubMed Central
Google Scholar
Сков, Дж., Сандстрем, А., Людвигссон, Дж. Ф., Кампе, О. и Бенсинг, С. Специфический для пола риск сердечно-сосудистых заболеваний при аутоиммунной болезни Аддисона — популяционное когортное исследование. J. Clin. Эндокринол. Метаб. 104 , 2031–2040 (2019).
PubMed
PubMed Central
Google Scholar
Falhammar, H. et al. Повышенная сердечно-сосудистая и метаболическая заболеваемость у пациентов с дефицитом 21-гидроксилазы: шведское популяционное национальное когортное исследование. J. Clin. Эндокринол. Метаб. 100 , 3520–3528 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Quinkler, M. et al. Преднизолон ассоциируется с худшим липидным профилем, чем гидрокортизон, у пациентов с надпочечниковой недостаточностью. Endocr. Соединять. 6 , 1–8 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Han, T. S. et al. Качество жизни взрослых с врожденной гиперплазией надпочечников связано с лечением глюкокортикоидами, ожирением и инсулинорезистентностью: Исполнительное руководство по исследованию врожденной гиперплазии надпочечников Соединенного Королевства (CaHASE). Eur. J. Endocrinol. 168 , 887–893 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Han, T. S. et al. Схема лечения глюкокортикоидами и результаты для здоровья взрослых с врожденной гиперплазией надпочечников. Clin. Эндокринол. 78 , 197–203 (2013).
CAS
Google Scholar
Behan, L.A. et al. Заместительная терапия низкими дозами гидрокортизона связана с улучшением индекса артериальной жесткости и динамики артериального давления у пациентов мужского пола с тяжелым дефицитом адренокортикотропина и гипопофиза. Eur. J. Endocrinol. 174 , 791–799 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Werumeus Buning, J. et al. Влияние гидрокортизона на регуляцию артериального давления: результаты рандомизированного контролируемого исследования. J. Clin. Эндокринол. Метаб. 101 , 3691–3699 (2016).
PubMed
PubMed Central
Google Scholar
Ventura, M. et al. Спектр детской надпочечниковой недостаточности: выводы из 34-летнего опыта. J. Pediatr. Эндокринол. Метаб. 32 , 721–726 (2019).
PubMed
PubMed Central
Google Scholar
Стернс, Р. Х. Нарушения натрия в плазме — причины, последствия и коррекция. N. Engl. J. Med. 372 , 55–65 (2015).
PubMed
PubMed Central
Google Scholar
Кампмайер, Д., Ленерт, Х., Мёниг, Х., Хаас, С. и Харбек, Б. Сильная потребность в повышении квалификации врачей по заместительной терапии глюкокортикоидами при надпочечниковой недостаточности: междисциплинарная и многоцентровая оценка. Eur. J. Intern. Med. 33 , e13 – e15 (2016).
PubMed
PubMed Central
Google Scholar
Harbeck, B. et al. Заместительная глюкокортикоидная терапия при надпочечниковой недостаточности — вызов врачам? Endocr.J. 62 , 463–468 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Hahner, S., Burger-Stritt, S. & Allolio, B. Подкожное введение гидрокортизона для экстренного применения при надпочечниковой недостаточности. Eur. J. Endocrinol. 169 , 147–154 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Burger-Stritt, S., Bachmann, L., Kurlbaum, M. & Hahner, S. Неотложное лечение надпочечникового криза суппозиториями с преднизоном: исследование биоэквивалентности у пациенток с болезнью Аддисона. Endocr. Соединять. 8 , 425–434 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Andela, C. D. et al. Качество жизни пациентов с надпочечниковой недостаточностью сильнее коррелирует с дозировкой гидрокортизона, чем с долгосрочным системным уровнем кортизола. Психонейроэндокринология 72 , 80–86 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Ловас, К., Логе, Дж. Х. и Хусебай, Э. С. Субъективный статус здоровья норвежских пациентов с болезнью Аддисона. Clin. Эндокринол. 56 , 581–588 (2002). Это первая систематическая оценка субъективного состояния здоровья большой группы пациентов с первичной надпочечниковой недостаточностью .
Google Scholar
Forss, M., Batcheller, G., Skrtic, S. & Johannsson, G. Текущая практика заместительной глюкокортикоидной терапии и предполагаемые пациентом результаты для здоровья при надпочечниковой недостаточности — всемирный опрос пациентов. BMC Endocr. Disord. 12 , 8 (2012).
CAS
PubMed
PubMed Central
Google Scholar
Клюгер, Н.и другие. Ухудшение качества жизни, связанное со здоровьем, при болезни Аддисона — влияние заместительной терапии, сопутствующие заболевания и социально-экономические факторы. Clin. Эндокринол. 81 , 511–518 (2014).
CAS
Google Scholar
Tiemensma, J. et al. Психологическая заболеваемость и снижение качества жизни у пациентов, получающих стабильное лечение по поводу первичной надпочечниковой недостаточности: кросс-секционное исследование и обзор литературы. Eur. J. Endocrinol. 171 , 171–182 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Ragnarsson, O. et al. Взаимосвязь между заместительной глюкокортикоидной терапией и качеством жизни у 2737 пациентов с гипогипофизом. Eur. J. Endocrinol. 171 , 571–579 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Oksnes, M. et al. Качество жизни европейских пациентов с болезнью Аддисона: валидность анкеты для конкретных болезней AddiQoL. J. Clin. Эндокринол. Метаб. 97 , 568–576 (2012).
PubMed
PubMed Central
Google Scholar
Burger-Stritt, S., Pulzer, A. & Hahner, S. Качество жизни и ожидаемая продолжительность жизни пациентов с надпочечниковой недостаточностью: что правда, а что такое городской миф? Фронт.Horm. Res. 46 , 171–183 (2016).
PubMed
PubMed Central
Google Scholar
Bleicken, B. et al. Нарушение субъективного статуса здоровья при хронической надпочечниковой недостаточности: влияние различных схем заместительной глюкокортикоидной терапии. Eur. J. Endocrinol. 159 , 811–817 (2008).
CAS
PubMed
PubMed Central
Google Scholar
Bleicken, B. et al. Влияние схемы дозирования гидрокортизона на качество жизни пациентов с надпочечниковой недостаточностью. Clin. Эндокринол. 72 , 297–304 (2010).
CAS
Google Scholar
Oksnes, M. et al. Непрерывная подкожная инфузия гидрокортизона в сравнении с пероральной заменой гидрокортизона для лечения болезни Аддисона: рандомизированное клиническое исследование. J. Clin.Эндокринол. Метаб. 99 , 1665–1674 (2014). Рандомизированное клиническое испытание, сравнивающее непрерывную подкожную инфузию гидрокортизона с обычным пероральным гидрокортизоном у 33 пациентов с болезнью Аддисона, показывающее большее улучшение некоторых параметров качества жизни при более физиологических профилях кортизола .
PubMed
PubMed Central
Google Scholar
Nilsson, A. G. et al. Долгосрочная безопасность гидрокортизона двойного высвобождения один раз в день у пациентов с надпочечниковой недостаточностью: открытое расширенное исследование фазы 3b. Eur. J. Endocrinol. 176 , 715–725 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Bancos, I. et al. Первичная надпочечниковая недостаточность связана с нарушением функции естественных клеток-киллеров: потенциальная связь с повышенной смертностью. Eur. J. Endocrinol. 176 , 471–480 (2017). Анализ 42 пациентов с первичным AI, показывающий нормальную функцию нейтрофилов, но значительно сниженную цитотоксичность естественных клеток-киллеров, которая потенциально ставит под угрозу противовирусную иммунную защиту .
CAS
PubMed
PubMed Central
Google Scholar
Smans, L.C., Souverein, P.C., Leufkens, H.G., Hoepelman, A.I. & Zelissen, P.M. Увеличение использования противомикробных препаратов и госпитализация по поводу инфекций у пациентов с первичной надпочечниковой недостаточностью: когортное исследование. Eur. J. Endocrinol. 168 , 609–614 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Tresoldi, A. S. et al. Повышенный риск инфицирования при болезни Аддисона и врожденной гиперплазии надпочечников. J. Clin. Эндокринол. Метаб. 105 , 418–429 (2020).
Google Scholar
Ган, Э. Х. и Пирс, С. Х. Управление эндокринными заболеваниями: регенеративные методы лечения аутоиммунной болезни Аддисона. Eur. J. Endocrinol. 176 , R123 – R135 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Балюра М. и соавт. Трансплантация клеток коры надпочечников крупного рогатого скота, инкапсулированных в альгинат. Proc. Natl Acad. Sci. США 112 , 2527–2532 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Gan, E.H. et al. Остаточная функция надпочечников при аутоиммунной болезни Аддисона: улучшение после лечения тетракозактидом (ACTh2-24). J. Clin. Эндокринол. Метаб. 99 , 111–118 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Pearce, S.H. et al. Стероидогенез надпочечников после терапии истощения В-лимфоцитов при впервые возникшей болезни Аддисона. J. Clin. Эндокринол. Метаб. 97 , E1927 – E1932 (2012).
CAS
PubMed
PubMed Central
Google Scholar
Napier, C. et al. Остаточная функция надпочечников при аутоиммунной болезни Аддисона — эффект двойной терапии ритуксимабом и депо-тетракозактидом. J. Clin. Эндокринол. Метаб. 105 , e1250 – e1259 (2020).
Google Scholar
Hahner, S. et al. Сроки в управлении адреналовым кризисом — цели, пределы и реальность. Clin. Эндокринол. 82 , 497–502 (2015).
Google Scholar
Burger-Stritt, S. et al. Ведение неотложных состояний надпочечников у образованных пациентов с надпочечниковой недостаточностью — проспективное исследование. Clin. Эндокринол. 89 , 22–29 (2018).
Google Scholar
Реппинг-Вутс, Х. Дж., Стиккельбрук, Н. М., Нордзий, А., Керстенс, М. и Хермус, А. Р. Встреча группы по обучению глюкокортикоидам: эффективная стратегия улучшения самоконтроля для предотвращения надпочечникового кризиса. Eur. J. Endocrinol. 169 , 17–22 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Burger-Stritt, S. et al. Стандартизированное обучение пациентов с надпочечниковой недостаточностью — проспективное многоцентровое обследование. Eur. J. Endocrinol. 183 , 119–127 (2020). В этом долгосрочном проспективном многоцентровом исследовании на основе анкетирования участвовало 526 пациентов с ИИ, и было доказано, что групповое обучение пациентов с хроническим ИИ представляет собой полезный инструмент для руководства пациентами, их уверенности в себе и их знаний о предотвращении надпочечников .
CAS
PubMed
PubMed Central
Google Scholar
Quinkler, M., Hahner, S., Johannsson, G. & Stewart, P.M. Спасение жизней пациентов с надпочечниковой недостаточностью: общеевропейская инициатива? Clin. Эндокринол. 80 , 319–321 (2014).
Google Scholar
Bornstein, S. R., Bornstein, T. D. & Andoniadou, C.L. Новые препараты, вызывающие надпочечниковую недостаточность. Нат. Rev. Endocrinol. 15 , 561–562 (2019).
PubMed
PubMed Central
Google Scholar
Nicolaides, N.C., Chrousos, G.P. & Charmandari, E. in Endotext (eds Feingold, K. R. et al) (MDText.com, Inc, 2000).
Mah, P. M. et al. Дозирование в зависимости от веса, время и мониторинг заместительной терапии гидрокортизоном у пациентов с надпочечниковой недостаточностью. Clin. Эндокринол. 61 , 367–375 (2004).
CAS
Google Scholar
Bratland, E. & Husebye, E. S. Клеточный иммунитет и иммунопатология при аутоиммунной болезни Аддисона. Мол. Клеточный эндокринол. 336 , 180–190 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Реге, Дж., Турку, А.F., Else, T., Auchus, R. J. & Rainey, W. E. Стероидные биомаркеры при заболевании надпочечников человека. J. Steroid Biochem. Мол. Биол. 190 , 273–280 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Mannstadt, M. et al. Гипопаратиреоз. Нат. Преподобный Дис. Prim. 3 , 17055 (2017).
PubMed
PubMed Central
Google Scholar
Lebbe, M. & Arlt, W. Какова наилучшая стратегия диагностики и лечения пациентки Аддисон во время беременности? Clin. Эндокринол. 78 , 497–502 (2013).
CAS
Google Scholar
Эриксен М. М., Хусебай Э. С., Михельсен Т. М., Даль А. А. и Ловас К. Сексуальность и фертильность у женщин с болезнью Аддисона. J. Clin. Эндокринол. Метаб. 95 , 4354–4360 (2010).
PubMed
PubMed Central
Google Scholar
Ремде, Х., Цопф, К., Швандер, Дж. И Квинклер, М. Фертильность и беременность при первичной надпочечниковой недостаточности в Германии. Horm. Метаб. Res. 48 , 306–311 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Bjornsdottir, S. et al. Болезнь Аддисона у женщин является фактором риска неблагоприятного исхода беременности. J. Clin. Эндокринол. Метаб. 95 , 5249–5257 (2010).
PubMed
PubMed Central
Google Scholar
Schneiderman, M., Czuzoj-Shulman, N., Spence, A.R. & Abenhaim, H.A. Материнские и неонатальные исходы беременностей у женщин с болезнью Аддисона: популяционное когортное исследование 7,7 миллиона рождений. BJOG 124 , 1772–1779 (2017).
CAS
PubMed
PubMed Central
Google Scholar
Bothou, C. et al. Текущее ведение и исходы беременностей у женщин с надпочечниковой недостаточностью: опыт многоцентрового исследования. J. Clin. Эндокринол. Метаб. 105 , e2853 – e2863 (2020). Большой ретроспективный многоцентровый анализ течения беременности у женщин с надпочечниковой недостаточностью .
Google Scholar
Hirschberg, A. L. et al. Репродуктивные и перинатальные исходы у женщин с врожденной гиперплазией надпочечников: популяционное когортное исследование. J. Clin. Эндокринол. Метаб. 106 , e957 – e965 (2021 г.).
PubMed
PubMed Central
Google Scholar
Quinkler, M. et al. Агонистические и антагонистические свойства метаболитов прогестерона в отношении человеческого минералокортикоидного рецептора. Eur. J. Endocrinol. 146 , 789–799 (2002).
CAS
PubMed
PubMed Central
Google Scholar
Quinkler, M., Meyer, B., Oelkers, W. & Diederich, S. Инактивация почек, образование минералокортикоидов и ингибирование 11β-гидроксистероиддегидрогеназы улучшают антиминералокортикоидный эффект прогестерона in vivo. J. Clin. Эндокринол. Метаб. 88 , 3767–3772 (2003).
CAS
PubMed
PubMed Central
Google Scholar
Козимо, К. и Франко, К. Болезнь Аддисона и беременность: клинический случай. J. Prenat. Med. 3 , 53–54 (2009).
PubMed
PubMed Central
Google Scholar
Oelkers, W. K. Влияние эстрогенов и прогестагенов на ренин-альдостероновую систему и артериальное давление. Стероиды 61 , 166–171 (1996).
CAS
PubMed
PubMed Central
Google Scholar
Стиррат, Л.I. et al. Перенос и метаболизм кортизола изолированной перфузируемой плацентой человека. J. Clin. Эндокринол. Метаб. 103 , 640–648 (2018).
PubMed
PubMed Central
Google Scholar
Курсин Д. Б. и Вуд К. Е. Кортикостероидные добавки при надпочечниковой недостаточности. JAMA 287 , 236–240 (2002).
CAS
PubMed
PubMed Central
Google Scholar
Li, D. et al. Детерминанты результатов самооценки здоровья при надпочечниковой недостаточности: исследование с несколькими сайтами. J. Clin. Эндокринол. Метаб. https://doi.org/10.1210/clinem/dgaa668 (2020).
Артикул
PubMed
PubMed Central
Google Scholar
Флеминг, Л., Кнафл, К., Кнафл, Г. и Ван Рипер, М. Родительский контроль надпочечникового криза у детей с врожденной гиперплазией надпочечников. Дж.Спец. Педиатр. Nurs. 22 , e12190 (2017).
Google Scholar
Kienitz, T., Hahner, S., Burger-Stritt, S. & Quinkler, M. Терапевтическое обучение пациентов с надпочечниковой недостаточностью в условиях пандемии COVID-19. Exp. Clin. Эндокринол. Диабет https://doi.org/10.1055/a-1217-7208 (2020).
Артикул
PubMed
PubMed Central
Google Scholar
Надпочечниковая недостаточность — AMBOSS
Резюме
Надпочечниковая недостаточность — это снижение выработки адренокортикальных гормонов (глюкокортикоидов, минералокортикоидов и андрогенов надпочечников) и классифицируется как первичная, вторичная или третичная.Первичная надпочечниковая недостаточность (болезнь Аддисона) вызвана поражением надпочечников. Наиболее частой причиной первичной надпочечниковой недостаточности в США на сегодняшний день является аутоиммунный адреналит, который может возникать спорадически или как проявление полигландулярных аутоиммунных синдромов. Вторичная надпочечниковая недостаточность является результатом снижения выработки АКТГ (адренокортикотропного гормона), а третичная надпочечниковая недостаточность является результатом снижения выработки CRH (кортикотропин-рилизинг-гормона) гипоталамусом.Снижение уровней АКТГ или CRH наблюдается после внезапного прекращения длительной терапии глюкокортикоидами и при заболеваниях гипофиза / гипоталамуса. У пациентов с хронической надпочечниковой недостаточностью может наблюдаться постуральная гипотензия, тошнота, рвота, потеря веса, анорексия, летаргия, депрессия и / или хроническая гипонатриемия. Также может быть потеря либидо в результате гипоандрогении. У пациентов с первичной надпочечниковой недостаточностью дополнительно развиваются гиперпигментация кожи, легкая гиперкалиемия и метаболический ацидоз.Уровни кортизола в сыворотке, которые остаются низкими даже после введения экзогенного АКТГ (тест стимуляции АКТГ), подтверждают диагноз первичной надпочечниковой недостаточности. Заместительная глюкокортикоидная терапия гидрокортизоном требуется при всех формах надпочечниковой недостаточности. Дозу глюкокортикоидов следует увеличивать в периоды стресса (например, операции, травмы, инфекции), чтобы предотвратить надпочечниковый криз, который представляет собой тяжелый, острый тип надпочечниковой недостаточности, который проявляется шоком, лихорадкой, нарушением сознания и тяжелым абдоминальным боль.Кризис надпочечников опасен для жизни, и его следует немедленно лечить высокими дозами гидрокортизона и внутривенными жидкостями.
Этиология
Надпочечниковая недостаточность — это неспособность надпочечников вырабатывать адекватное количество гормонов коры надпочечников. Он может быть первичным, вторичным или третичным.
Первичная надпочечниковая недостаточность (болезнь Аддисона)
Первичная надпочечниковая недостаточность может быть вызвана резким разрушением надпочечников (острая надпочечниковая недостаточность; e.g., из-за массивного кровоизлияния в надпочечники) или из-за его постепенного прогрессирующего разрушения или атрофии (хроническая надпочечниковая недостаточность; например, из-за аутоиммунных состояний, инфекции).
Вторичная надпочечниковая недостаточность
Вторичная надпочечниковая недостаточность вызвана состояниями, снижающими выработку АКТГ (нарушение гипоталамо-гипофизарно-надпочечниковой оси).
Третичная надпочечниковая недостаточность
Третичная надпочечниковая недостаточность вызвана состояниями, снижающими выработку CRH.
- Наиболее частой причиной является внезапное прекращение хронической терапии глюкокортикоидами.
- Более редкие причины включают гипоталамическую дисфункцию (например, из-за травмы, образования, кровотечения или анорексии): ↓ CRH → ↓ ACTH → ↓ высвобождение кортизола
Вторичная и третичная надпочечниковая недостаточность встречается гораздо чаще, чем первичная надпочечниковая недостаточность!
Патофизиология
Для получения основной информации о надпочечниках и их функциях см. «Гормоны коры надпочечников.”
Повреждение надпочечников приводит к дефициту всех трех гормонов, вырабатываемых корой надпочечников: андрогена, кортизола и альдостерона.
Каталожные номера: [11]
Клинические особенности
Большинство случаев надпочечниковой недостаточности носит субклинический характер и проявляется только в периоды стресса (например, операции, травмы, инфекции), когда потребность в кортизоле выше!
Первичная надпочечниковая недостаточность Пигментирует кожу.Вторичная недостаточность надпочечников щадит кожу. Третичная надпочечниковая недостаточность возникает из-за лечения (кортизол).
Каталожные номера: [12]
Диагностика
Подход
Поддерживайте низкий порог для скрининга надпочечниковой недостаточности (особенно у пациентов с неспецифическими симптомами), поскольку до 50% пациентов имеют надпочечниковый криз, часто из-за пропущенной или поздней диагностики. [17]
Эндокринные исследования
Скрининг на гипоальдостеронизм и гипоандрогенизм
[18]
У пациентов с первичной надпочечниковой недостаточностью следует измерять следующие параметры.
Другие динамические эндокринные исследования
Они могут быть выполнены после консультации с эндокринологом, например, если предыдущие анализы не дали результатов.
Дополнительная оценка
Следующие тесты используются для исследования основных причин.
Первичная надпочечниковая недостаточность
[18]
Наиболее частой причиной первичной надпочечниковой недостаточности в странах с высоким уровнем дохода является аутоиммунный адреналит. [15]
- Аутоиммунный экран
- Визуализация
Вторичная / третичная надпочечниковая недостаточность
[15]
Наиболее частой причиной третичной надпочечниковой недостаточности является введение экзогенных глюкокортикоидов. [11]
Лечение
Подход
Заместительная глюкокортикоидная терапия гидрокортизоном требуется при всех формах надпочечниковой недостаточности.
Глюкокортикоиды
[18]
- Агенты
- Соображения
- Общая суточная заместительная доза должна вводиться в разделенных дозах, при этом самая высокая доза назначается утром для имитации суточных колебаний.
- Информируйте пациентов об увеличении дозы глюкокортикоидов в соответствии с правилами дневного больничного.
- Побочные эффекты могут возникнуть из-за чрезмерного лечения (см. «Синдром Кушинга»).
Минералокортикоиды
[18]
Андрогены
[18]
Рассмотрите возможность лечения пациентов женского пола анатомического типа с низким либидо, депрессивными симптомами и низким уровнем энергии.
- Агенты: DHEA [18]
- Соображения
- DHEA не одобрен FDA, но доступен как безрецептурная добавка.
- Результаты исследований положительных эффектов ДГЭА неоднозначны, а данные о долгосрочных результатах отсутствуют. [18]
- Прекратите через 6 месяцев, если нет положительного эффекта.
Лечение основной причины и сопутствующих состояний
Стероиды, вызывающие стресс
[28] [29]
Дозы стероидов должны быть увеличены, чтобы предотвратить криз надпочечников у пациентов из группы риска, например, при остром болезнь, операция или травма (см. также «Вызывающие факторы» в «Надпочечниковый кризис»).
- Дозы стероидов в стационаре корректируются в зависимости от уровня стресса.
- Пациентов, не нуждающихся в госпитализации, можно обучить планам самолечения, известным как правила больничного дня.
Если не увеличивать дозу глюкокортикоидов в периоды стресса, у пациента может развиться надпочечниковый криз!
Стационарные стрессовые стероиды
[18] [28]
Придерживайтесь любого ранее существовавшего протокола / плана лечения, разработанного эндокринологом пациента.Следующие рекомендации могут применяться ко всем пациентам, принимающим адреносупрессивные дозы глюкокортикоидов.
- Лихорадочное заболевание: удвойте обычную пероральную дозу до выздоровления; рассмотрите вариант внутривенного введения, если у пациента рвота.
- Пациенты в критическом состоянии: гидрокортизон внутривенно [30]
- Пациенты в периоперационном периоде
Правила амбулаторного больничного дня
[18] [17]
Пациентам с первичной надпочечниковой недостаточностью необходимо обучать следующим правилам, чтобы они могли самостоятельно вводить глюкокортикоиды во время болезни / физиологического стресса:
Кризис надпочечников (Аддисонский криз)
Кризис надпочечников — это острый, тяжелый дефицит глюкокортикоидов, требующий немедленной неотложной помощи.
Препятствующие факторы
Чтобы предотвратить развитие вторичной и третичной надпочечниковой недостаточности, длительную стероидную терапию следует постепенно снижать, а не прекращать резко.
Признаки и симптомы
[17]
Диагноз
[11] [17]
- На основании клинического подозрения: поддерживайте низкий порог диагностики у пациентов из группы риска, особенно у тех, у кого шок резистентен к жидкостям и / или вазопрессорам. [32]
- Тестирование в месте оказания медицинской помощи и стандартные лабораторные исследования
- Эндокринное тестирование: подумайте, если диагноз сомнительный (например, первое обращение).
Рассмотреть надпочечниковый криз у пациентов с тяжелой гипотонией, невосприимчивой к жидкостной реанимации и / или вазопрессорам.
Кризис надпочечников может быть опасным для жизни, поэтому лечение высокими дозами гидрокортизона следует начинать немедленно, не дожидаясь диагностического подтверждения гипокортизолизма!
Менеджмент
[17] [18]
Пять S при лечении надпочечникового криза — это соль (0.9% физиологический раствор), сахар (50% декстроза), стероиды (100 мг гидрокортизона внутривенно один раз, затем 200 мг в течение 24 часов), Support (физиологический раствор для коррекции гипотонии и электролитных нарушений) и Search (для основного заболевания).
Контрольный список неотложной помощи при надпочечниковом кризе
- Установите внутривенный доступ с двумя периферическими линиями большого диаметра.
- Введите гидрокортизон внутривенно / внутримышечно.
- Жидкая реанимация 1 л нормального (изотонического) физиологического раствора в первый час
- Лечите гипогликемию с помощью внутривенного введения декстрозы.
- Выявить и лечить первопричину (например, сепсис).
- Обратитесь к эндокринологу на ранней стадии.
- Контролировать жизненно важные показатели, уровень глюкозы в крови и диурез каждые 1-2 часа.
- Продолжайте вливание жидкости для поддержания артериального давления и диуреза.
- Продолжайте замену гидрокортизона болюсно или непрерывно внутривенно.
- Рассмотрите возможность мониторинга более высокого уровня, например, в отделении интенсивной терапии, если есть постоянный гемодинамический компромисс.
Аутоиммунные полигландулярные синдромы
Ссылки: [38] [39]
Необычный случай острой надпочечниковой недостаточности | SFEBES2017 | Общество эндокринологов BES 2017
Надпочечниковая недостаточность — это редкое эндокринное заболевание с частотой 4 случая на миллион.Общие неятрогенные причины включают аутоиммунитет, инфекции и инфильтрации. Мы описываем случай острой надпочечниковой недостаточности, вызванной необычной причиной.
Женщина 77 лет поступила к хирургу с болями в животе и гипертермией. Ультразвуковое исследование брюшной полости показало большие камни в утолщенном желчном пузыре, и был поставлен вероятный диагноз острого холецистита. Все микробиологические тесты были отрицательными, и ей были начаты антибиотики широкого спектра действия. Состояние ее ухудшилось, возникла гипотония, и ее перевели в реанимацию.КТ брюшной полости выявила дополнительные признаки в виде неокклюзионного тромба нижней полой вены, тромбоза печеночной вены и двустороннего увеличения надпочечников, о которых сообщалось как «возможно двусторонние аденомы». После интенсивного лечения ей стало лучше, и ее выписали с длительной антикоагулянтной терапией и записью в клинику для исследования новообразований надпочечников.
Через 4 недели она повторно поступила с головокружением, гипотонией и острым повреждением почек. Синактеновый тест подтвердил надпочечниковую недостаточность, и ей была назначена заместительная терапия гидрокортизоном.Повторная компьютерная томография показала полное разрешение ранее отмеченного двустороннего увеличения надпочечников и был поставлен диагноз кровоизлияния в надпочечники. Повторить синактен через 3 мес. Продемонстрировал стойкий гипокортизолизм. Интересно, что причина одновременного возникновения двустороннего кровоизлияния в надпочечники и окклюзии НПВ остается неясной, и гематологические исследования ожидаются. Она чувствует себя хорошо после заместительной терапии гидрокортизоном и флудрокортизоном.
Наш пациент выделяет несколько важных сообщений.Гипокортизолизм следует рассматривать у пациентов с тяжелым сепсисом со стойкой гипотонией, несмотря на агрессивное лечение. Надпочечниковая недостаточность, вызванная кровоизлиянием в надпочечники, может иметь место у 15% пациентов, умирающих от септического шока. У> 90% пациентов состояние необратимо, что подтверждено в нашем случае отсроченной переоценкой резерва надпочечников. В этом случае также подчеркивается, что случайные образования надпочечников должны быть незамедлительно исследованы при выявлении у нездорового пациента.
Острая надпочечниковая недостаточность как первичное проявление внелегочного туберкулеза: история болезни
Аддисон Т. О конституциональных и местных последствиях заболевания надпочечных капсул. История болезни. 1969; 13 (2): 195-202. http://dx.doi.org/10.1017/S0025727300014290.
Патнаик М.М., Дешпанде АК. Диагноз — болезнь Аддисона вторичная по отношению к туберкулезу надпочечников. Clin Med Res. 2008; 6 (1): 29. http: //dx.doi.org / 10.3121 / cmr.2007.754a.
Brooke AM, Monson JP. Болезнь Эддисона. Медицина. 2009; 37 (8): 416-9. http://dx.doi.org/10.1016/j.mpmed.2009.05.006.
Guttman PH. Болезнь Аддисона: статистический анализ 566 случаев и изучение патологии. Путь к арке. 1930; 10: 742-85.
Киндзё Т., Хигучи Д., Оширо Ю., Накамацу Ю., Фудзита К., Накамото К. и др. Болезнь Аддисона, вызванная туберкулезом, которая требует дифференциации от SIADH.J Infect Chemother. 2009; 15 (4): 239-42. http://dx.doi.org/10.1007/s10156-009-0690-Z.
Lam KY, Lo CY. Критическое обследование туберкулеза надпочечников и 28-летнее вскрытие. Клин Эндокринол (Oxf). 2001; 54 (5): 633-9. http: //10.1046/j.1365-2265.2001.01266.x.
Ма ES, Ян З.Г., Ли И, Го Ю.К., Дэн Ю.П., Чжан XC. Туберкулезная болезнь Аддисона: морфологическая и количественная оценка с помощью многорядной компьютерной томографии. Eur J Radiol. 2007; 62 (3): 352-8. http: // dx.doi.org/10.1016/j.ejrad.2006.12.012.
Йокояма Т., Тода Р., Кимура Ю., Микаги М., Айзава Х. Болезнь Аддисона, вызванная милиарным туберкулезом и введением рифампицина. Inter Med. 2009; 48 (15): 1297-300. http://doi.org/10.2169/internalmedicine.48.1974.
Zhang XC, Yang ZG, Li Y, Min PQ, Guo YK, Deng YP и др. Болезнь Аддисона при туберкулезе надпочечников: особенности МРТ. Визуализация брюшной полости. 2008; 33 (6): 689-94. http://doi.org/10.1007/s00261-007-9352-8.
Номура К., Демура Х., Сарута Т. Болезнь Аддисона в Японии: характеристики и изменения, выявленные в ходе общенационального исследования. Intern Med. 1994; 33 (10): 602-6. http://doi.org/10.2169/internalmedicine.33.602.
Бхатия Э., Джайн С.К., Гупта Р.К., Пандей Р. Туберкулезная болезнь Аддисона: отсутствие нормализации функции надпочечников после противотуберкулезной химиотерапии. Клин Эндокринол (Oxf). 1998; 48 (3): 355-9. http://doi.org/10.1046/j.1365-2265.1998.00409.Икс.
Го Ю.К., Ян З.Г., Ли И, Ма ES, Дэн Ю.П., Мин PQ и др. Болезнь Аддисона, вызванная туберкулезом надпочечников: особенности контрастирования и корреляция клинической продолжительности. Eur J Radiol. 2007; 62 (1): 126-31. http://dx.doi.org/10.1016/j.ejrad.2006.11.025.
Rowińska-Zakrzewska E, Szopiński J, Remiszewski P, Szymański D, Miller P, Pawlicka L, et al. Туберкулез в материалах вскрытия: анализ 1500 вскрытий, проведенных в период с 1972 по 1991 год в Институте туберкулеза и болезней грудной клетки, Варшава, Польша.Tuber Lung Dis. 1995; 76 (4): 349-54. http://dx.doi.org/10.1016/S0962-8479(05)80035-8.
Болезнь Соула С. Аддисона в Африке — опыт преподавания в больнице. Клин Эндокринол (Oxf). 1999; 50 (1): 115-20. http://dx.doi.org/10.1046/j.1365-2265.1999.00625.x.
Jacobi J, Schnellhardt S, Kulschewski A, Amann KU, Kuefner MA, Eckardt KU, et al. Необычный случай гипонатриемии. Пересадка нефрола Dial. 2010; 25 (3): 998-1001. http://dx.doi.org/10.1093/ndt/gfp698.
Дорин Р.И., Куоллс CR, Крапо Л.М. Диагностика надпочечниковой недостаточности. Ann Intern Med. 2003; 139 (3): 194-204. http://dx.doi.org/10.7326/0003-4819-139-3-200308050-00017.
Упадхьяй Дж., Судхиндра П., Абрахам Дж., Триведи Н. Туберкулез надпочечников: отчет о клиническом случае и обзор литературы по инфекциям надпочечников. Int J Endocrinol. 2014; 2014: 876037. http://dx.doi.org/10.1155/2014/876037.
Wise GJ, Marella VK.Мочеполовые проявления туберкулеза. Urol Clin North Am. 2003; 30 (1): 111-21. PMID: 12580563.
Келестимур Ф. Восстановление функции надпочечников после лечения туберкулезной болезни Аддисона. Postgrad Med J. 1993; 69 (816): 832-4. http://dx.doi.org/10.1136/pgmj.69.816.832.
Visweswaran RK, Bhat S. Туберкулез мочевыводящих путей. В кн .: Комплексная клиническая нефрология. J Floege, RJ Johnson, J Feehally, ред. 4-е изд. Сент-Луис: Elsevier Saunders, 2010.
Домбровска А., Тарач Дж., Приступа А., Куровска М. Болезнь Аддисона, вызванная туберкулезом надпочечников. Журнал Pre-Clin Clin Res. 2012; 6 (2): 88-92.
Bancos I, Hahner S, Tomlinson J, Arlt W. Диагностика и лечение надпочечниковой недостаточности. Ланцет Диабет Эндокринол. 2015; 3 (3): 216-26. http://dx.doi.org/10.1016/S2213-8587(14)70142-1.
Острый криз надпочечников у астматиков, получавших высокие дозы флутиказона пропионата
Реферат
Представлено четыре случая астмы (один взрослый, трое детей), у которых развился острый надпочечниковый криз после введения высоких доз ингаляционного флутиказона пропионата.Трем детям в возрасте 7–9 лет был назначен ингаляционный флутиказон в дозе 500–2000 мкг в день –1 и продолжительностью от 5 месяцев до 5 лет. У всех наблюдались судороги из-за гипогликемии (уровень глюкозы в крови 1,3–1,8 мМ). Четвертым пациентом был 33-летний мужчина с трудноизлечимой астмой, принимавший пропионат флутиказона 1000–2000 мкг в день –1 в течение 3 лет. Он обратился с жалобами на утомляемость, вялость, тошноту и постуральную гипотензию.
Острый криз надпочечников в каждом случае подтверждался исследованиями, которые включали измерение уровней кортизола в острой фазе, короткие и длинные тесты стимуляции Synacthen и тесты стимуляции глюкагоном.Другие случаи подавления оси гиптоалам-гипофиз-надпочечники были исключены.
Биохимически определяемое подавление гипоталамо-гипофизарно-надпочечниковой оси (HPA) у пациентов, принимающих ингаляционные кортикостероиды (ICS), является обычным явлением, но острый надпочечниковый криз очень редок, и только два случая были зарегистрированы в течение почти 30 лет клинического применения беклометазона и будесонида. 1. Пропионат флутиказона был представлен в Великобритании в 1993 году как потенциально более безопасный ИУС, чем те, которые уже используются.Он подвергается очень высокому метаболизму при первом прохождении через печень (99,9%), и его эффективность и безопасность были установлены у детей в дозах 200 мкг · день -1 2, но не в более высоких дозах, которые часто используются в более тяжелых случаях .
Отчеты о случаях
Пациент 1
Мужчина 33 лет обратился с жалобой на утомляемость, потливость и снижение толерантности к физической нагрузке. Его трудно поддающаяся контролю астма лечилась в течение предыдущих 3 лет флутиказоном (Diskhaler; Allen & Hanbury, Uxbridge, UK) 1000–2000 мкг в день –1 .В это время пероральные кортикостероиды не назначались. Спортсмен, его пиковая скорость потока составляла 500–720 л · мин –1 , и он не мог тренироваться или работать при более низких потоках. Короткий тест на стимуляцию Synacthen (SSST) (250 мкг тетракозактида внутримышечно) показал, что базальный уровень кортизола с 69 нМ повышается до 256 нМ (нормальное повышение составляет ≥200 нМ, максимум ≥500 нМ). Его лекарство было изменено на будесонид 800 мкг · день -1 (сухой порошок). Три недели спустя он обратился с жалобой на тошноту, рвоту, боли в животе, усталость и головокружение.Его артериальное давление составляло 90/50 мм рт. Он начал терапию гидрокортизоном 20 мг в день -1 . Заметное симптоматическое улучшение появилось в течение нескольких часов, и его кровяное давление поднялось до 120/80 мм рт. Аутоантитела надпочечников были отрицательными, признаков гипопитуитаризма не было. Пятнадцать месяцев спустя не было ответа кортизола на SSST, но во время длительной стимуляции Synacthen (1 мг тетракозактида внутримышечно ежедневно в течение 3 дней) уровни кортизола в сыворотке увеличились с 30 нМ на исходном уровне до 806 нМ на 3 день, что свидетельствует о подавлении функции надпочечников. к введению экзогенных стероидов.
У этого пациента системный эффект будесонида 800 мкг · день −1 был меньше, чем у флутиказона пропионата 1000–2000 мкг · день −1 , в той степени, в которой острый надпочечниковый криз был спровоцирован изменением ингаляционной дозы. стероидный препарат.
Пациент 2
Мальчик в возрасте 7 лет с астмой средней степени тяжести поступил после тяжелого припадка. При поступлении его оценка комы по Глазго составляла 10, и у него была гипогликемия (уровень глюкозы в крови 1.4 мМ) с признаками метаболического ацидоза (pH 7,27) и легкой гипонатриемии (натрий 131 мМ). Его реанимировали с помощью внутривенного введения глюкозы и жидкостей, его состояние быстро улучшилось. Случайное измерение уровня кортизола в сыворотке (169 нМ) было очень низким, учитывая его клиническую картину (ответ кортизола на критическое заболевание должен превышать 700-830 нМ) 3, тогда как нормальные оценки свободного инсулина в плазме, лактата сыворотки, аминокислот в плазме и органических кислот в моче исключены. гиперинсулинизм и врожденные нарушения обмена веществ.Позже SSST подтвердил наличие гипоадренализма. Впоследствии длительный тест стимуляции Synacthen показал повышение уровня кортизола в сыворотке на 3-й день до 380 нМ, что свидетельствует о гипоадренализме из-за вторичного подавления надпочечников.
Его астму было трудно контролировать, и 3 года назад беклометазон 2000 мкг в день -1 (спейсер) был заменен на пропионат флутиказона 1000 мкг в день -1 (спейсер), снизившись до 500 мкг в день −1 иногда.Ему также потребовалось 15 дней перорального приема преднизолона 20 мг в день -1 в предыдущем году. Его скорость роста была нормальной.
Пациент 3
Девятилетняя девочка, страдающая астмой средней степени тяжести, поступила с большим припадком. При поступлении у нее уровень глюкозы в крови был 1,8 мМ, а уровень кортизола в сыворотке 156 нМ, оба неприемлемо низкие 3. Ей лечили внутривенным введением декстрозы 10% и 2 мг дексаметазона, и она полностью выздоровела. Обширный метаболический, инфекционный и неврологический скрининг, включая магнитно-резонансную томографию мозга, дал нормальные результаты.Тестирование функции передней доли гипофиза со стимуляцией глюкагоном (500 мкг внутримышечно) продемонстрировало очень плохую реакцию кортизола на стресс; исходный уровень был <70 нМ без последующего повышения (нормальный ответ> 580 нМ). Исходные уровни адренокортикотропного гормона были низкими (<6 нг · л -1 , нормальный диапазон 10–80 нг · л -1 ), и был нормальный ответ гормона роста с максимальным уровнем 49,3 мЕд · л -1. (норма> 20 мЕд · л -1 ), что свидетельствует о подавлении HPA вторично по отношению к введению экзогенных стероидов.
Она получала флутиказон 1000 мкг в день -1 (спейсер), иногда снижая его до 500 мкг в день -1 , в течение 5 лет, и не получала никаких пероральных стероидов в течение предшествующих 12 месяцев. В течение последних 6 месяцев жаловалась на общее недомогание и вялость. Скорость ее роста была низкой по сравнению с предыдущими 4 годами, а ее рост упал с 25-го на 3-й процентиль.
Пациент 4
7-летняя девочка с астмой средней степени тяжести с эпилептическим статусом.Она была здорова до тех пор, пока несколько дней назад у нее не развилась инфекция дыхательных путей, а затем рвота. Она была госпитализирована непосредственно в отделение интенсивной терапии с непрерывными крупными припадками продолжительностью более 30 минут и остановкой дыхания. Ей потребовались интубация и вентиляция легких. Уровень глюкозы в плазме был 1,3 мМ. SSST, проведенный в течение нескольких часов после госпитализации, показал неадекватно низкий уровень кортизола 3 в состоянии покоя, равный 575 нМ, с повышением только до 600 нМ. Ей не удалось выздороветь после коррекции уровня глюкозы в плазме, и улучшение произошло только через несколько часов после внутривенного введения гидрокортизона.Компьютерная томография головного мозга дала нормальные результаты. Исключались гиперинсулинизм и врожденные нарушения обмена веществ. Тест на стимуляцию глюкагоном исключил гипопитуитаризм.
У нее в анамнезе была астма, которую трудно было контролировать в течение предыдущего года. Пятью месяцами ранее будесонид 1600 мкг / день -1 (сухой порошок) был заменен на флутиказона пропионат 1000 мкг / день -1 (Accuhaler; Allen & Hanbury) с увеличением до 2000 мкг / день -1 , и, вскоре после этого скорость ее роста заметно снизилась.В прошлом году она не получала пероральных стероидов. Она была выписана из больницы, получая будесонид 800 мкг в день -1 , и в течение 4 лет наблюдения оставалась здоровой с нормальным ростом.
Обсуждение
Бессимптомное вторичное угнетение функции надпочечников из-за ИКС является обычным явлением и не имеет клинического значения. Задержка роста и подавление надпочечников описаны у детей и более вероятны при приеме высоких доз, то есть > 400 мкг · день -1 беклометазон или будесонид 4.Другие побочные эффекты ICS, , например: Синдром Кушинга также может возникать 5, 6. Однако примерно через 30 лет лечения астмы беклометазоном и будесонидом острый надпочечниковый криз был зарегистрирован только в двух случаях 1. Флутиказона пропионат был введен в Великобритании в 1993 году как потенциально более безопасный ICS, благодаря очень высокому метаболизму через печень (99,9%). Безопасность флутиказона в более низких дозах хорошо известна 2; однако ранее сообщалось о задержке роста и тяжелом, но бессимптомном угнетении функции надпочечников у детей, получающих высокие дозы флутиказона 7.В настоящих клинических случаях описаны один взрослый и трое детей с острым кризом надпочечников из-за высоких доз флутиказона (таблица 1).
Таблица 1—
Данные пациентов с острым надпочечниковым кризом
У троих детей из этой серии были гипогликемические судороги. Механизм гипогликемии при гипоадренализме сложен. Дефицит надпочечников связан с уменьшением запасов гликогена в печени, а также недостаточностью кортизола нарушается способность глюкагона и адреналина повышать внутрипеченочные уровни циклического аденозинмонофосфата и мобилизовать гликоген.Кроме того, кортизол является одним из контррегулирующих гормонов, которые противостоят гипогликемическим эффектам инсулина, и его концентрация должна повышаться по мере падения уровня глюкозы в крови.
Флутиказон подвергается очень высокому метаболизму в печени (99,9%), а также является очень липофильным (примерно в 300 раз сильнее, чем беклометазон или будесонид), что приводит к гораздо более высоким уровням в тканях, более длительному периоду полужизни в плазме и большему сродству с рецепторами глюкокортикоидов. чем беклометазон или будесонид 8. Недавний метаанализ 22 исследований 9 показал более резкое дозозависимое подавление функции надпочечников при приеме флутиказона по сравнению с беклометазоном (2.1-кратно) 4 или будесонид (2,5-кратно). Взятые вместе, эти данные могут объяснить тяжесть супрессии надпочечников в представленных случаях.
Лечение детей с тяжелой астмой дозами флутиказона> 1000 мкг в день -1 разрешено международными руководящими принципами 10, а также лицензировано для использования в дозах до 2000 мкг в день -1 у взрослых в Великобритании . Флутиказон был предпочтительным для многих пациентов, которым требуются более высокие дозы ИКС, из-за заявленного лучшего соотношения терапевтическая эффективность / безопасность 11, хотя это утверждение было оспорено 12.
Кризис надпочечников редко случается у астматиков, получавших ингаляционные кортикостероиды; однако врачи, лечащие пациентов с тяжелой астмой, должны знать, что почти полный метаболизм флутиказона в печени при первом прохождении не может защитить от серьезных системных побочных эффектов. В настоящее время советуют применять высокие дозы очень липофильных ингаляционных кортикостероидов, таких как флутиказон, только с особой осторожностью у взрослых и детей, страдающих астмой. Кроме того, после отмены высоких доз флутиказона или перехода на другой ингаляционный кортикостероид с более низкой общей эффективностью пациенты должны находиться под тщательным наблюдением на предмет признаков надпочечниковой недостаточности.
- Получено 20 августа 2001 г.
- Принято 28 октября 2001 г.
Список литературы
- ↵
Вонг Дж., Блэк П. Острая надпочечниковая недостаточность, связанная с высокими дозами ингаляционных стероидов. BMJ 1992; 304: 1414.
- ↵
MacKenzie CA, Weinberg EC, Tabachnik E, Taylor M, Harpan J, Crescenzi K. Плацебо-контролируемое испытание флутиказона пропионата у детей с астмой. Eur J Pediatr 1993; 152: 856–860.
- ↵
Золога ГП. Синдром дефицита надпочечников, вызванный сепсисом. Crit Care Med 2001; 29: 688–689.
- ↵
Рассел Г. Терапия ингаляционными кортикостероидами у детей: оценка потенциала побочных эффектов. Thorax 1994; 49: 1185–1188.
- ↵
Прифтис К., Аверард М.Л., Миллнер А.Д. Неожиданные побочные эффекты ингаляционных стероидов: отчет о болезни.Eur J Pediatr 1991; 150: 448–449.
- ↵
Уилсон А.М., Блюмсон А., Юнг Р.Т., Липуорт Б.Дж. Астма и синдром Кушинга. Chest 2000; 117: 593–594.
- ↵
Тодд Г., Данлоп К., МакНабо Дж., Райан М.Ф., Карсон Д., Шилдс, доктор медицины. Подавление роста и надпочечников у детей-астматиков, получавших высокие дозы флутиказона пропионата. Lancet 1996; 348: 27–29.
- ↵
Педерсен С., О’Бирн П.Сравнение эффективности и безопасности ингаляционных кортикостероидов при астме. Аллергия 1997; 52: Дополнение. 39, 1–34.
- ↵
Липуорт Б.Дж., Уилсон А.М. Дозовая реакция на ингаляционные кортикостероиды: польза и риски. Semin Respir Crit Care Med 1998; 19: 625–646.
- ↵
Аноним. Программа лечения астмы, состоящая из шести частей. Глобальная стратегия лечения и профилактики астмы, семинар NHLBI / ВОЗ. Публикация NIH No.95-3659, 92. 1995.
- ↵
Фуллер Р., Джонсон М., Пока А. Флутиказона пропионат — обновленная информация о доклиническом и клиническом опыте. Respir Med 1995; 89: Suppl. А, 3–18.
- ↵
Clark DJ, Grove A, Cargill RI, Lipworth P. Сравнительное подавление надпочечников с помощью ингаляционного будесонида и флутиказона пропионата у взрослых пациентов с астмой. Thorax 1996; 51: 262–266.
Кризис надпочечников | Общество эндокринологов
Д-р Хелен Л. Симпсон , FRCP, PhD (председатель)
Консультант-эндокринолог
Комитет по безопасности пациентов RCP
Отделение диабета и эндокринологии, UCLH NHS Foundation Trust
Д-р Ясир Эльхассан
Консультант эндокринолог
Больница Королевы Елизаветы Бирмингем и Бирмингемский университет
Д-р Анна Л. Митчелл
Консультант-эндокринолог
Больницы Ньюкасл-апон-Тайн Фонд NHS Foundation Trust
Д-р Майкл О’Рейли
Консультант эндокринолога Больница Бомонт Дублин
Доцент клинического отделения Королевского колледжа хирургов в Ирландии (RCSI)
Д-р Роберт Д. Мюррей
Консультант-эндокринолог и почетный доцент
Центр диабета и эндокринологии Лидса, Учебные больницы Лидса NHS Trust
Профессор Джереми Томлинсон
Оксфордский центр биомедицинских исследований NIHR и Оксфордский университет
Профессор Джон Васс
Профессор эндокринологии Оксфордского университета.
GIRFT, ведущий специалист по эндокринологии, Национальная служба здравоохранения Англии
Д-р Антония Брук FRCP, MD, MA
Центр диабета и эндокринной системы Маклауда
Фонд Royal Devon and Exeter Foundation Trust
Алессандро Прете , MD
Научный сотрудник по клиническим исследованиям в области эндокринологии и диабета
Институт метаболизма и системных исследований, Университет Бирмингема
Профессор Алед Рис
Профессор эндокринологии и консультант-эндокринолог
Научно-исследовательский институт неврологии и психического здоровья
Кардиффский университет
Д-р Клэр Хайэм
Консультант-эндокринолог
Госпиталь Кристи Доверительный фонд NHS
Лиза Шеперд
ANP / NMP по эндокринологии, научный сотрудник клинической докторантуры NIHR
Диабет и эндокринология, Бирмингемская больница Heartlands / Центр диабета и эндокринной системы
Луиза Брин
Медсестра-специалист по эндокринологии, практикующая медсестра высокого уровня в эндокринологии
Доверительный фонд NHS Гая и Св. Томаса
Мириам Азия
Старший врач-эндокринная клиническая медсестра
Университетские больницы Бирмингемский фонд NHS Foundation Trust
Профессор Вибке Арльт Доктор медицинских наук FRCP FMedSci
Уильям Визеринг Кафедра медицины
Директор Института метаболизма и системных исследований (IMSR)
Колледж медицинских и стоматологических наук, Университет Бирмингема
Профессор Саймон Пирс
Профессор эндокринологии
Институт трансляционных и клинических исследований, Факультет медицинских наук, Университет Ньюкасла
Профессор Питер Клейтон MD FRCPCH
Почетный педиатр-консультант Королевской детской больницы Манчестера, Фонд NHS Манчестерского университета Доверие (MFT)
Профессор детской эндокринологии, Отдел биологии развития и медицины, FBMH, UoM
Главный научный сотрудник, Инновации в области здравоохранения, Манчестер
Клинический директор Манчестерского академического научного центра здравоохранения
Заместитель вице-президента и заместитель декана факультета биологии, медицины и здравоохранения Манчестерского университета
Колин Перри PhD FRCP (Великобритания)
Консультант-эндокринолог
Заместитель директора медицинского образования
Почетный доцент клинического профессора
Больница Университета Королевы Елизаветы, Глазго
Д-р Мигель Дебоно
Консультант по эндокринологии Почетный старший преподаватель Учебной больницы Шеффилда Фонд NHS Foundation Trust / Университет Шеффилда
.
