34. Септический шок. Этиология, патогенез, клиника, диагностика, лечение, профилактика
СЕПСИС
И СЕПТИЧЕСКИЙ ШОК.
Это
крайне тяжелые состояния, самая большая
летальность именно при этих состояниях.
· В
гинекологии генерализованные септический
процесс возникает чаще всего после
внебольничных абортов (инфицированные).
· Также
сепсис возникает как закономерное
развитие гнойных тубоовариальных
абсцессов ( могут выполнять весь малый
таз).
· как
осложнение после оперативных вмешательств.
· онкологические
заболевания (рак шейки матки — прорастает
в соседние органы и дает распространенную
гнойную инфекцию в виде уросепсиса,
перитонита, свищей и т.п;)
Сепсис
— тяжелый инфекционный процесс, возникающий
на фоне местного очага инфекции, снижения
защитных свойств организма и
сопровождающийся полиорганной
недостаточностью.
Способствующие
факторы: кровопотеря (при аборте,
выкидыше, операции т.д.),
ПАТОГЕНЕЗ.
Генерализация инфекции обусловлена
преобладанием возбудителя над
бактериостатическими возможностями
организма в результате массивной инвазии
(например, прорыв гнойника в кровь из
инфицированного тромба, т.п.) либо
врожденного или приобретенного снижения
иммунитета. Нарушения иммунитета,
предшествующие сепсису, как правило,
остаются неопределимыми, за исключением
случаев депрессии кроветворения. Однако
сепсис возникает не в результате
нарушений иммунитета вообще, а вследствие
срыва в каком-то одном из его звеньев,
ведущего к нарушению выработки антител,
снижению фагоцитарной активности или
активности выработки лимфокинов и т.д.
ДВС-синдром и шок — постоянные осложнения
сепсиса, вызванного грамотрицательными
микробами, менингококкемии, острейшего
пневмококкового и стафилококкового
сепсиса. Накоплению кининов при сепсисе
и ДВС-синдроме способствует истощение
таких ферментов, как кининаза, ингибитор
калликреина, обычно содержащихся в
плазме здоровых лиц. Активирующийся в
Активирующийся в
начале ДВС-синдрома фибринолиз затем
резко снижается вследствие истощения
фактора Хагемана, калликреина, собственно
плазминогена. Угнетение фибринолиза —
характерный признак ДВС-синдрома,
осложняющего сепсис. При инфицированности
микротромбов ДВС-синдром неизбежно
приводит к выраженной полиорганной
патологии, в патогенезе которой важнейшую
рль играет в начале сама инфекция, а по
прошествии 2-3 недель — патология иммунных
комплексов.
Первичного
сепсиса практически не бывает. Под
сепсисом понимают как бы вторую болезнь,
но по тяжести клинических проявлений
— это самостоятельное заболевание.
По
возбудителям выделяют Гр+ и Гр — виды
сепсиса, стафилококковый, колибациллярный
, клостридиальный, неклостридиальный
сепсис.
По
темпу развертывания: молниеносный
(септический шок, развивается в течение
1-2 суток, встречается у 2% больных). Острый
сепсис (40%, продолжается до 7 суток),
подострый сепсис (60%, продолжается 7-14
суток), хрониосепсис.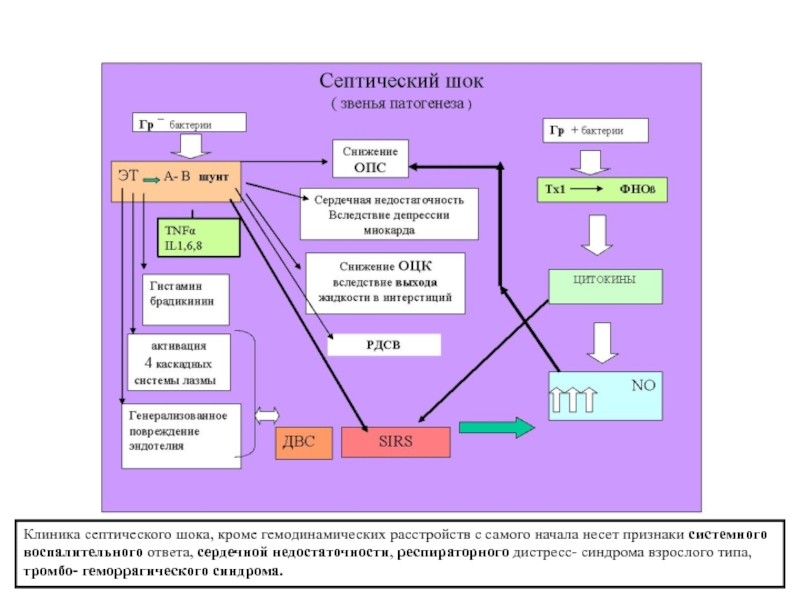
По
фазам течения (клиническим формам)
гинекологический сепсис: септицемия
(сепсис без метастазов, септикопиемия.
Любая форма может дать септический шок.
Различают также септический перитонит,
анаэробный сепсис (изолированно,
чрезвычайно аггресивная форма).
Фазы
течения:
· фаза
напряжения, или фаза реакции на внедрение
возбудителя. При этой фазе всегда имеется
недостаточность местных защитных
механизмов. Нестабильность барьера
приводит к распространению инфекционного
агента по микроциркуляторному руслу.
Постоянно идет уменьшение или
недостаточность энергетических ресурсов.
В клинике доминируют гемодинамические
расстройства и токсические проявления
в виде интоксикационного синдрома —
энцефалопатии, очаговые нарушения со
стороны ЦНС. Несоответствие между
защитой и агрессией нарастает, и
развиваются тяжелые гемодинамические
нарушения — несоответствие внутрисосудистого
объема сосудистой емкости.
· катаболическая
фаза.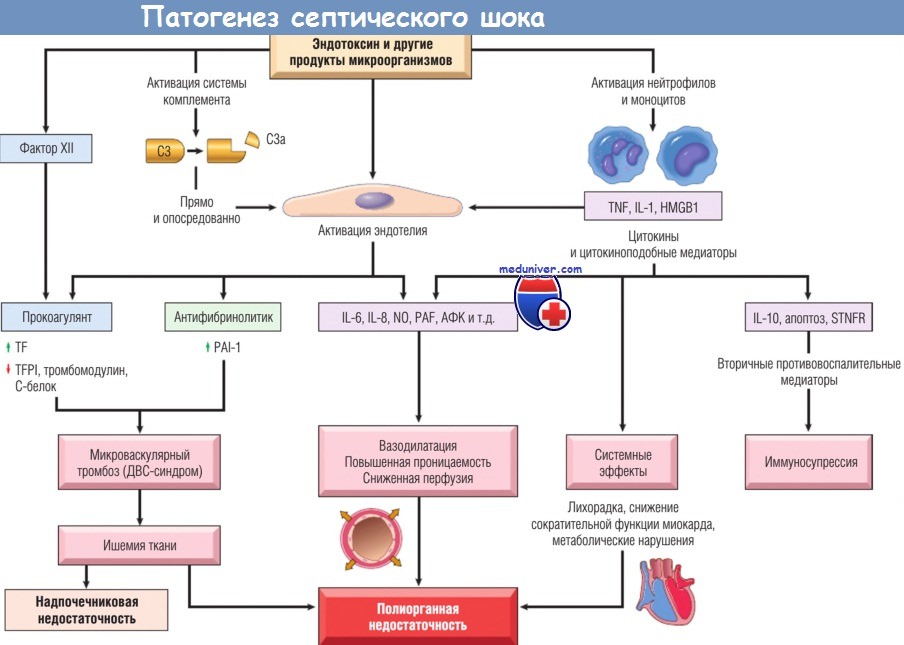 По клиническому течению эта самая
По клиническому течению эта самая
тяжелая фаза — идет прогрессирующий
расход ферментных и структурных факторов.
Нарушаются все виды обмена. В местный
процесс вовлекаются все большее
количество тканей, органов. Если в первой
фазе повреждаются матка и придатки
ограничено, то в этой фазе поражаются
соседние органы — мочевой пузырь, прямая
кишка и .т.д. В этой фазе идет разрушительные
процесс в виде септикопиемии и таким
образом развиваются системные нарушения,
приводящие к полиорганной недостаточности
(ОПН, острая печеночная недостаточность,
надпочечниковая недостаточность, и
т.д.). развивается сердечно-легочная
недостаточность, ДВС-синдром, и большинство
больных погибает в этой фазе.
· анаболическая
фаза. Воостановление утраченных резервов,
переход из катаболической фазы переходит
медленно, слабо. Иногда сепсис приобретает
волнообразное течение. Может быть и
выздоровление, иногда переход в
хрониосепсис.
Осложненный
инфицированный аборт через переходную
форму — гнойную резорбтивную лихорадку
— в сепсис.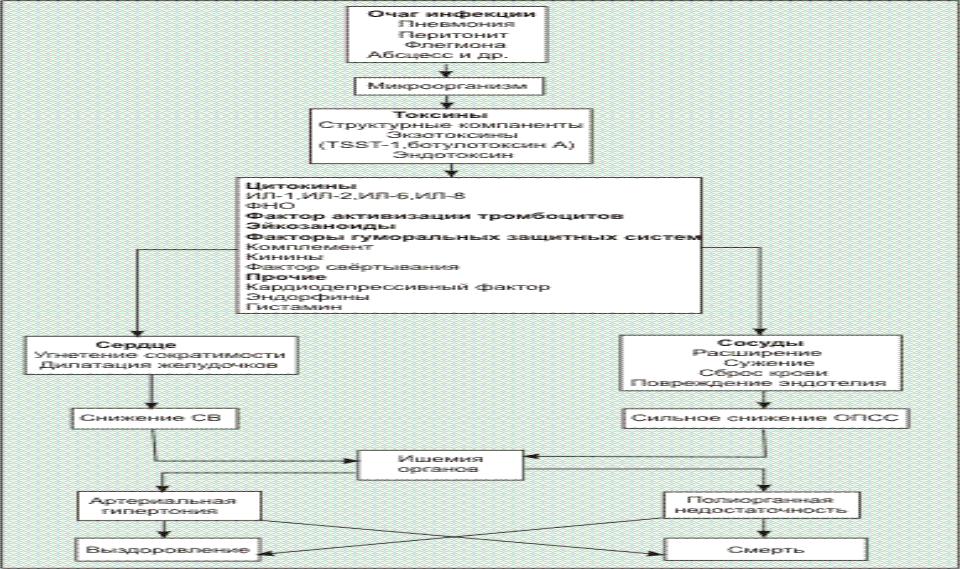 Чаще всего погибают от этого
Чаще всего погибают от этого
предсепсиса ( врача пытается убрать
инфицированные остатки в матке — при
нестабильном барьере происходит
обнажение сосудов, и микробы и токсины
прорываются в кровь и происходит
пирогенная реакция по типу септического
шока (описан Маккеем, названа феномен
Санарелли-Шварцмана). Гнойно-резорбтивная
лихорадка может перейти во все виды
течения сепсиса. Это состояние
заканчивается смертью, редко —
выздоровлением , если местный процесс
уменьшается. Гнойно-резорбтивная
лихорадка дает летальность 40%, септицемия
осложненная септическим шоком —
летальность 80%, септикопиемия с септическим
шокок — 60-80%. Эти процессы могут перейтив
хрониосепсис.
КЛИНИКА.
Клиническая
картина зависти от возбудителя, источника
проникновения и состояния иммунитета.
Начало заболевания может быть бурным
с потрясающим ознобом, гипертермией,
миалгиями, геморрагической или папулязной
сыпью либо постепенным с медленно
нарастающей интоксикацией. К частым,
но неспецифическим признакам сепсиса
относят увеличение селезенки, и печени,
выраженную потливость после озноба,
резкую слабость, гиподинамию, анорексию,
запор.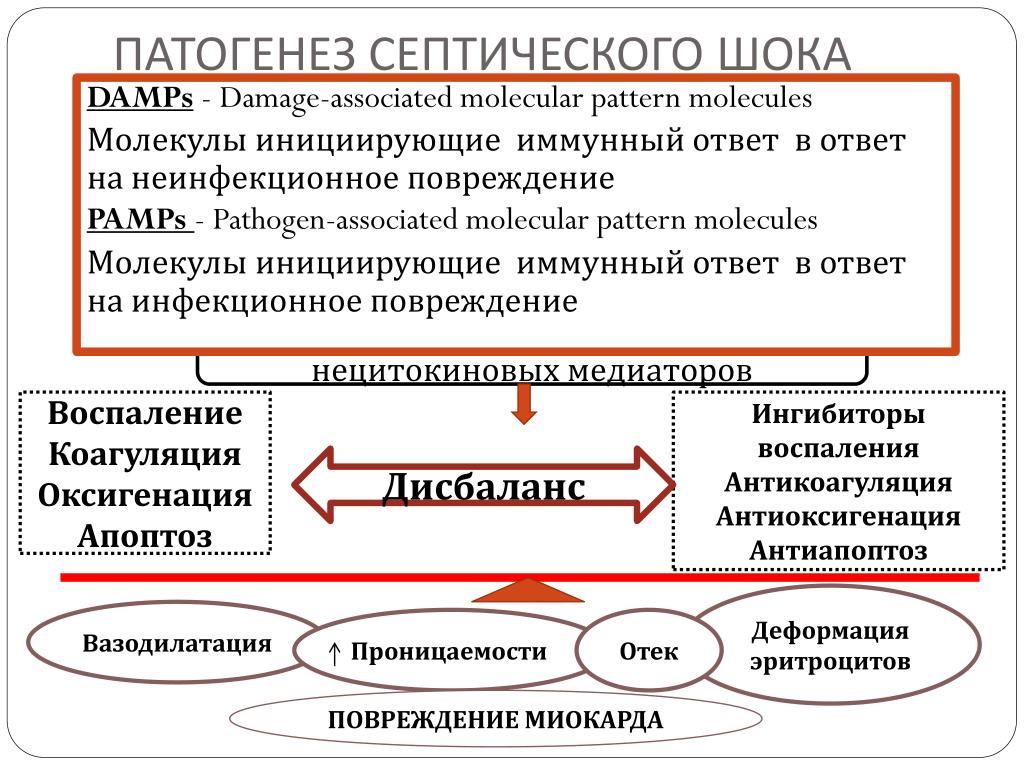 При отсутствии антибактериальной
При отсутствии антибактериальной
терапии сепсис, как правило, заканчивается
смертью от множественных нарушений
всех органов и систем. Характерны
тромбозы (особеннос вен нижних конечностей)
в сочетании с геморрагическим синдромом.
При
адекватной антибактериальной терапии
на фоне снижения температуры, уменьшения
интоксикации через 2-4 недели от начала
болезни появляются артралгии (вплоть
до развития полиартрита), признаки
гломерулонефрита (белок, эритроциты,
цилиндры в моче), симптомы полисерозита
(шум трения плевры, шум трения перикарда)
и миокардита (тахикардия, ритм галопа,
преходящий систолический шум на верхушке
или на легочной артерии, расширение
границ относительной тупости сердца,
снижение или даже негативизация зубца
Т и смещение вниз сегмента ST
преимущественно в передних грудных
отведениях).
При
тяжелом ДВС-синдроме, респираторном
дистресс-синдроме отмечаются множественные
дисковидные ателектазы и нестойкие
полиморфные тени в легких, обусловленные
интерстициальным отеком. Подобные
Подобные
изменения наблюдаются при тяжелом
течении сепсиса независимо от возбудителя
и на единичных рентгенограммах почти
не отличимы от пневмонии. Однако для
теней воспалительной природы характерна
стойкость, а для теней интерстициального
отека — эфемерность. При аускультации
легких об интерстициальном отеке могут
свидетельствовать незвучные мелкопузырчатые
хрипы, крепитация.
Для
септического аборта кровотечение не
характерно, так как при этом состоянии
имеется воспалительная реакция в матке.
Обычно сосуды забиваются микробами,
тромбами и т.п. кровянистые выделения
с примесью гнойных. При септическом
поражении идет токсическое поражение
красного ростка — появление токсической
анемии (анизоцитоз, пойкилоцитоз,
токсические нейтрофилы, и.т.п.). Изменяется
окраска кожи — появляется землистая
окраска кожи, иногда наблюдается
иктеричность , особенно при нарастающей
печеночной недстаточности, иногда могут
появиться петехиальные кровоизлияния.
Петехии могут на слизистой, коже, в
органах. Петехии могут носит сливной
Петехии могут носит сливной
характер, можно видеть массивные
поверхностные некрозы.
Наблюдается
тахипное (частота дыхания может достигать
до 40 дыханий в минуту, что является
следствием нарушения сердечно-сосудистой
системы и самих легких). Септические
пневмонии — это довольно частое осложнение
септического процесса.
Поражение
печени — печень выходит из под края
реберной дуги, болезненна. В крови
нарастают трансаминазы, нарастает
билирубин, снижается протромбиновый
индекс, снижается общий белок и белковые
фракции, и все это может привести к
острой печечной недостаточности с
необратимыми изменениями.
Поражение
почек — в начале когда идет гиповолемия,
идет снижение АД, и возникают функциональные
изменения — снижение почасового диуреза
( 30 мл/ч и ниже ), моча становится низкой
плостности, нарастает белок, различные
цилиндры, появляется лейкоцитурия,
эритроцитурия и таким образом почки
претерпевают разные этапы от функциональных
до органических расстроств ( ОПН).
Кортикальный некроз является абсолютно
необратимым. Эти нарушения сопровождаются
явлениями вторичных процессов — обострение
пиелонефрита, возникновение карбункула
почки и т.п.
возникает
нарушение моторики кишечника — парез
кишечника, тяжелые нарушения пристеночного
пищеварения. Возникает гнилостный
процесс в кишке, развиваются септические
поносы, явления дисбактериоза.
Компенсировать эти потери чрезвычайно
трудно.
Изменения
в самой ране — практически буду такими
же как и при локализованных формах —
матка увеличенных размеров, мягкой
структуры так как вся пропитана
воспалительным инфильтратом, канал
проходим, брюшина раздражена, обильные
гнойно-кровянистые выделения, иногда
с пузырьками газа.
Рано
появляются трофические нарушения —
пролежни, поскольку нарушены процессы
микроциркуляции. Нарасатют изменения
периферической крови — сдвиг до юных
форм, появление токсической зернистости
нейтрофилом, уменьшение количество
сегментоядерных нейтрофилов, уменьшается
количество лимфоцитов и моноцитов.
Высокая СОЭ. Нарастающая анемия.
Увеличивается
селезенка, появляются дегенеративные
изменения (септическая селезенка).
При
сепсисе всегда делают посевы крови,
мочи, из гнойных очагов, мокроты и т.д.
то есть из всех возможных мест,
неоднократно, чтобы выявить весь спектр
микробов вызвавших сепсис.
Септикопиемия
характеризуется как бы дополнением
признаков метастатического поражения
органов (перитонит, абсцесс мозга,
заглоточный абсцесс, абсцесс легкого,
карбункул почки, и т.д.).
ЛЕЧЕНИЕ.
Лечение
сепсиса должно быть прежде всего
патогенетическим. Поскольку решающую
всего патогенетическим. Поскольку
решающую роль в развитии сепсиса ( в
отличие от любой другой инфекции) играют
массивность инфекции, присутствие
микроорганизмов в крови и во всех тканях
в сочетании с выраженным диссеминированным
внутрисосудистым свертыванием крови,
то и терапия направлена против двух
составных частей процесса — инфекции и
ДВС-синдрома. Больных сепсисом надо
Больных сепсисом надо
госпитализировать немедленно при
подозрении на него в отделение интенсивной
терапии или реанимации. Кровоизлияния
в надпочечники, гангрена конечностей,
необратимые изменения внутренних
органов являются следствием запоздалой
патогенетической терапии больного
сепсисом.
Вслед
за установлению из вены берут кровь на
посев, для биохимических исследований
(билирубин, протромбин, трансаминзы,
ЛДГ, креатинин, белковые фракции) и для
анализа системы свертывания
(фибринолитическая активность,
протаминсульфатный и этаноловый тесты,
продукты деградации фибриногена). При
исследовании крови обязателен подсчет
тромбоцитов, а затем и ретикулоцитов.
Сразу после взятия крови на различные
исследования через ту же иглу вводят в
вену антибиотик соотвественно характеру
преполагаемой инфекции, но в максимально
возможных дозах. При наличии выраженных
признаков ДВС-синдрома (в частности,
обильная сыпь, особенно геморрагического
характера), миалгий и болезненности
мышц при пальпации, полиморфных теней
интерстициального отека легких или
более или менее однотипных теней
гематогенной диссеминации инфекции на
рентгенограмме органов грудной полости
должен быть немедленно начат плазмаферез.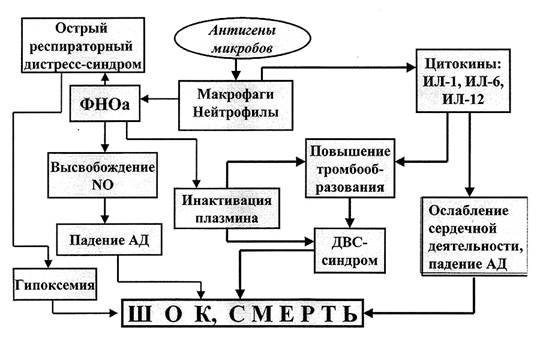
Удалют около 1.5 л плазмы заменяя ее
примерно ан 2/3 соответствющим объемом
свежезамороженной плазмы. При тяжелом
течении сепсиса объем переливаемой
свежезамороженной плазмы может превышать
объем удаляемой плазмы, вводить при
этом надо не менее 2 л плазмы.
Вслед
за плазмоферезом, а при необходимости
и во врея его проведения применяют
гепарин в дозе 20-24 тыс. ЕД/сут. Гепарин
вводят внутривенно капельно либо
непрерывно, либо ежечасно. Увеличивать
промежутки между введениями доз гепарина,
по крайней мере в первые сутки лечения,
не следуе. Наличие геморрагического
синдрома — не противопоказание, а
показание для лечения гепарином. В
первые дни лечения нежелательны подкожные
и внутримышечные инъекции.
При
артериальной гипотензии применяют
симпатомиметики; при стойком снижении
АД внутривенно вводят гидрокортизон
или преднизолон в дозе, достаточной для
стабилизации состояния больного, после
чего стероидный гормоны отменяют в тот
же день, а при длительном их применении
— в течение 2-3 дней.
Антибактериальная
терапия сепсиса определяется видом
предполагаемого или установленного
возбудителя. Если ни клинические, ни
лабораторныепризнаки не позволяют с
какой-либо достоверностью установить
этиологический фактор, то назначают
курс так называемой эмпирической
антибактериальной терапии: гентамцин
(160-240 мг/сут) в сочетании с цефалоридином
(цепорином) ил цефазолином (кефзол) в
дозе 4 г/сутки внутривенно. Оценивать
эффективность лечебных мероприятий
необходимо по улучшению субъективного
состояния больного, стабилизации АД,
снижению температуры тела, исчезновению
озноба, уменьшению температуры тела,
или отсутствии новых высыпаний на коже.
К лабораторным признакам действенности
антибиотиков относится уменьшение
процента палочкоядерных элементов в
формуле крови. Отчетливое утяжеление
состояния по всем перечисленным
показателям в течение 24-48 часов и
ухудшение самочувствия больных на
следующие сутки после начала
антибактериальной терапии свидетельствуют
о неэффективности выбранных антибиотиков
и необходимости их замены.
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Роль глюкокортикоидных гормонов и вазопрессоров в комплексной терапии септического шока — Acta Medica Eurasica
Полный текст статьи
УДК: 616. 94-001.36:615.357
94-001.36:615.357
ББК: 514.85-532
Волков В.Е., Волков С.В.
Роль глюкокортикоидных гормонов и вазопрессоров в комплексной терапии септического шока
Ключевые слова:
сепсис, септический шок, патогенез, внутрисосудистое воспаление, вазопрессоры, глюкокортикоиды, летальность
Приведены результаты лечения 65 больных септическим шоком. Из них мужчин было 46, женщин ‒ 19; возраст этих больных ‒ от 36 до 78 лет. Причинами развития септического шока являлись гнойный перитонит, гнойный плеврит, интраабдоминальные абсцессы различной локализации и забрюшинная флегмона, наблюдаемые у 846 больных после гастрэктомии по поводу рака и других заболеваний желудка. Обращено внимание на важную роль в патогенезе сепсиса и септического шока тяжелых форм внутрисосудистого воспаления. Установлены показания к применению вазопрессоров и глюкокортикоидов при септическом шоке. Септический шок явился причиной летального исхода 38 (58,5%) больных.
Септический шок явился причиной летального исхода 38 (58,5%) больных.
Volkov V., Volkov S.
The role of glucorticoid hormones and vasopressors in septic shock treatment
Keywords: sepsis, septic shock, pathogenesis, intravascular inflammation, vasopressors, glucocorticoids, mortality
The results of treatment of 65 patients with septic shock were analyzed. Among them there were 46 males, 19 female, their age ranged between 36 and 78 years. Causes of septic shock development were purulent peritonitis, purulent pleuritis, intraabdominal abscesses of different localization and retroperitoneal phlegmone observed in 846 patients after gastrectomy due to gastric cancer and other gastric diseases. The key role of severe intravascular inflammation in pathogenesis of sepsis and septic shock was highlighted. Indications to use vasopressors and glucocorticoids in septic shock were established. Septic shock was the cause of fatal outcome in 38 (58,5%) patients.
Septic shock was the cause of fatal outcome in 38 (58,5%) patients.
Литература
- Волков В.Е. Применение кортикостероидов при шоке. Чебоксары: Чувашкнигоиздат, 1974. 96 с.
- Марино П. Интенсивная терапия: пер. с англ. М.: ГЭОТАР-Медиа, 2012. С. 541–636.
- Интенсивная терапия / В.Д. Малышев, С.В. Свиридов, И.В. Веденина, Х.Т. Омаров; под ред. В.Д. Малышева, С.В. Свиридова. 2-е изд. М.: МИА, 2009. С. 373–376.
- Савельев В.С. Сепсис в хирургии: состояние проблемы и перспективы // 80 лекций по хирургии / под ред. В.С. Савельева. М.: Литтерра, 2008. С. 696–704.
- Al-Rhafaji A.H., Pinsky M.R. Multiple organ dysfunction syndrome in sepsis (Updated, 2017, Mar. 7). Available at: https://emedicine.medscape.com/article/169640-overview.
- Annane D., Sebille V., Charpentier C. et al. Effect of treatment with low doses of hydrocortisone and fludrocortisones on mortality in patients with septic shock.
 JAMA, 2002, vol. 288, pp. 862–871.
JAMA, 2002, vol. 288, pp. 862–871. - Beale R.J., Hollenberg S.M., Vincent J.L. Vasopressor and inotropic Support in septic shock: an evidence-based review. Care Med., 2004, vol. 32 (suppl.), pp. S.455–S.465.
- Dellinger R.P., Carlet J.M., Masur H. et al. Campaign guidelines for management of severe sepsis and septic shock. Care Med., 2004, vol. 32, pp. 858–873.
- Hollenberg S.M., Ahrens T.S., Annane D. et al. Practice parameters for hemodynamic support of sepsis in adult patients. Care Med., 2004, vol. 32, pp. 1928–1998.
References
- Volkov V.E. Primenenie kortikosteroidov pri shoke [Use of Corticosteroids in shock]. Cheboksary, Chuvashknigoizdat Publ., 1974, 96 p.
- Marino P.L. The ICU Book 3rd Philadelphia [etc.], Wolters Kluwer, Lippincott Williams & Wilkins, 2007 (Russ. ed: Intensivnaia terapiia.
 Moscow, GEOTAR-Media Publ., 2012.).
Moscow, GEOTAR-Media Publ., 2012.). - Malyshev V.D., Sviridov S.V., Vedenina I.V., Omarov Kh.T. Intensivnaia terapiia. 2-e izd. [Intensive therapy. 2nd]. Moscow, MIA Publ., 2009, pp. 373–376.
- Savelev V.S. Sepsis v khirurgii: sostoianie problemy i perspektivy [Sepsis in surgery: state of the art, problems and perspective]. In: Savelev V.S., ed. 80 lektcii po khirurgii [80 lectures in surgery]. Moscow, Litterra Publ., 2008, pp. 696–704.
- Al-Rhafaji A.H., Pinsky M.R. Multiple organ dysfunction syndrome in sepsis (Updated, 2017, Mar. 7). Available at: https://emedicine.medscape.com/article/169640-overview.
- Annane D., Sebille V., Charpentier C. et al. Effect of treatment with low doses of hydrocortisone and fludrocortisones on mortality in patients with septic shock. JAMA, 2002, vol. 288, pp. 862–871.
- Beale R.J., Hollenberg S.M., Vincent J.L. Vasopressor and inotropic Support in septic shock: an evidence-based review.
 Care Med., 2004, vol. 32 (suppl), pp. S.455–S.465.
Care Med., 2004, vol. 32 (suppl), pp. S.455–S.465. - Dellinger R.P., Carlet J.M., Masur H. et al. Campaign guidelines for management of severe sepsis and septic shock. Care Med., 2004, vol. 32, pp. 858–873.
- Hollenberg S.M., Ahrens T.S., Annane D. et al. Practice parameters for hemodynamic support of sepsis in adult patients. Care Med., 2004, vol. 32, pp. 1928–1998.
Сведения об авторах
- Волков Владимир Егорович
-
доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней, Чувашский государственный университет, Россия, Чебоксары ([email protected])
- Волков Сергей Владимирович
-
доктор медицинских наук, профессор кафедры хирургических болезней, Чувашский государственный университет, Россия, Чебоксары (volkovserguei@mail. ru)
ru)
Ссылка на статью
Волков В.Е., Волков С.В. Роль глюкокортикоидных гормонов и вазопрессоров в комплексной терапии септического шока [Электронный ресурс]
// Acta medica Eurasica. – 2017. – №4.
– С. 1-8. – URL: http://acta-medica-eurasica.ru/single/2017/4/1/.
Септический шок реферат по медицине
кислорода (РТК 800 мл/мин/м2 и более), что характерно для ранней стадии
септического шока.
При прогрессировании процесса данную клиническую фазу
септического шока сменяет фаза «теплой гипотензии», для которой
характерны максимальное повышение температуры тела, ознобы, изменения
психического состояния больного (возбуждение, беспокойство,
неадекватность поведения, иногда психоз). При осмотре больного кожа
теплая, сухая, гиперемированная или розовая. Нарушения дыхания выражены
Нарушения дыхания выражены
по типу гипервентиляции, которая в дальнейшем приводит к дыхательному
алкалозу и утомлению дыхательной мускулатуры. Отмечается тахикардия до
120 ударов и более в минуту, которая сочетается с хорошим наполнением
пульса и гипотензией (Адсист < 100 мм рт.ст.). Гипотензия скорее умеренная
и обычно не привлекает внимание врачей. Уже в этой стадии септического
шока выявляются признаки неспособности системы кровообращения
обеспечить потребность тканей в кислороде и питательных веществах, а
также создать возможность детоксикации и удаления токсичных метаболитов.
Для того чтобы поддержать адекватность перфузии тканей и избежать
анаэробного окисления, больным необходим более высокий уровень DO2 (15
мл/мин/кг вместо 8—10 мл/мин/кг в норме). Однако в этой стадии
септического шока даже повышенный СВ (СИ 4,3—4,6 л/мин/м2) не
обеспечивает должной потребности в кислороде.
Нередко гемодинамические и дыхательные изменения сочетаются с
отчетливыми нарушениями деятельности пищеварительного тракта:
диспепсические расстройства, боли (особенно в верхней части живот), понос,
которые можно объяснить особенностями метаболизма серотонина,
начальными изменениями кровотока в зоне чревных сосудов и активацией
центральных механизмов тошноты и рвоты. В этой фазе септического шока
отмечается снижение диуреза, иногда достигающее уровня олигурии
(мочеотделение менее 25 мл/ч).
Клиническая картина поздней стадии септического шока
характеризуется нарушениями сознания, выраженными расстройствами
ОрГМУ — Информация для студентов
Темы лекций и занятий согласно УМК
- Лекция: Современные принципы СЛМР. Первичный и расширенный реанимационные комплексы. Ранняя дефибрилляция.
- Лекция: ОДН. Клиника, диагностика, интенсивная терапия РДСВ.
- Лекция: Определение шока.
 Патогенетические механизмы циркуляторного шока. Классификация шоковых состояний. Реанимация и интенсивная терапия при шоке (травматическом, геморрагическом, септическом, анафилактическом). Интенсивная терапия кровопотери.
Патогенетические механизмы циркуляторного шока. Классификация шоковых состояний. Реанимация и интенсивная терапия при шоке (травматическом, геморрагическом, септическом, анафилактическом). Интенсивная терапия кровопотери. - Лекция: Основы инфузионно-трансфузионной терапии. Инфузионные среды (коллоиды, кристаллоиды, искусственные носители кислорода). Показания к переливанию крови и ее компонентов. Принципы составления программ инфузионной терапии. Основы парентерального питания и нутритивной поддержки.
- Лекция: Острые экзогенные отравления. Токсикологическая болезнь. Принципы интенсивной терапии острых отравлений. Неотложная помощь при укусах змей и ядовитых насекомых. Экстракорпоральные методы детоксикации: гемодиализ, ультрафильтрация, гемо- и лимфосорбция, плазмаферез.
- Лекция: Особенности интенсивной терапии на догоспитальном этапе. Шок, кома, астматический статус, инфаркт миокарда, ликвидация медицинских последствий несчастных случаев и террористических актов.

ЗАНЯТИЕ 1:
Тема: «Организация анестезиолого-реанимационной службы РФ, отделение реанимации и интенсивной терапии, структура и штатное расписание. (Приказ №841). Методы интенсивной терапии, мониторинг жизненно важных функций больного. Патофизиология терминальных состояний. Сердечно-легочная и мозговая реанимация (А,В,С), критерии эффективности. Постреанимационная болезнь. Смерть мозга. Правовые и этические аспекты деятельности медработников при оказании неотложной помощи».
ЗАНЯТИЕ 2:
Тема: «Реанимация и интенсивная терапия острой дыхательной недостаточности при нарушении проходимости верхних дыхательных путей, массивной пневмонии, астматическом статусе, асфиксии различной этиологии на догоспитальном и госпитальном этапах. Показания к проведению оксигенотерапии, ИВЛ, ВЧИВЛ, критерии прекращению ИВЛ. Экстракорпоральные методы оксигенации».
ЗАНЯТИЕ №3.
Тема: Реанимация и интенсивная терапия острой сердечно-сосудистой недостаточности и остановки кровообращения при осложненном инфаркте миокарда (кардиогенный шок, отек легких, нарушения ритма и проводимости). Показания, методика проведения, техника безопасности, оценка эффективности электрокардиостимуляции сердца. Интенсивная терапия при геморрагическом, анафилактическом, токсико-септическом травматическом шоках, ДВС-синдроме.
Показания, методика проведения, техника безопасности, оценка эффективности электрокардиостимуляции сердца. Интенсивная терапия при геморрагическом, анафилактическом, токсико-септическом травматическом шоках, ДВС-синдроме.
ЗАНЯТИЕ №4.
Тема: Расстройство кислотно-щелочного, водно-электролитного и белкового баланса организма. Современные основы рациональной инфузионно-трансфузионной терапии, интенсивная терапия коматозных состояний, дифференциальная диагностика ком (гипер- и гипогликемическая, гипер — и гипоосмоляльная, печеночная, тиреотоксическая, алкогольная, токсическая комы). Интенсивная терапия отека мозга, острых нарушений мозгового кровообращения и судорожного синдрома.
ЗАНЯТИЕ №5
Тема: Токсикологическая болезнь. Общие принципы интенсивной терапии при экзогенных интоксикациях: отравления снотворными и седативными препаратами, алкоголем и его суррогатами, ФОС, прижигающими жидкостями, хлорированными углеродами, угарным газом, ядовитыми грибами, при укусах змей и насекомых..gif) Эндотоксикоз, диагностика, интенсивная терапия.
Эндотоксикоз, диагностика, интенсивная терапия.
Для реализации поставленных задач обучения студентам 6 курса на кафедре анестезиологии и реаниматологии с курсом ППС предлагаются следующие виды деятельности:
- Приобретение практических навыков.
- Самостоятельная подготовка по тестовым заданиям МЗ РФ.
- Просмотр учебных видеоматериалов.
- Подготовка к практическим занятиям по указанной литературе в соответствии с их темами.
- Выполнение итоговой работы в форме реферата и его доклад для группы, по актуальным проблемам интенсивной терапии и реанимации.
- Решение ситуационных задач.
- Составление алгоритмов лечения неотложных состояний (в виде блок схем).
ТЕМЫ РЕФЕРАТОВ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ СТУДЕНТОВ
- Постреанимационная болезнь (ПРБ). Диагностика, стадии ПРБ. Основные принципы лечения ПРБ.
- Астматический статус. Диагностика, принципы интенсивной терапии астматического статуса.

- Искусственная вентиляция легких. Показания к переводу пациентов на ИВЛ. Выбор основных параметров ИВЛ. Методы проведения ИВЛ. Критерии прекращения ИВЛ и перевода на спонтанное дыхание.
- Отек легких. Патофизиологические варианты отека легких. Диагностика и принципы дифференцированной интенсивной терапии.
- Тромбоэмболия легочной артерии. Клиника, диагностика, принципы интенсивной терапии и профилактики.
- Современные методы обезболивания острого инфаркта миокарда.
- Кардиогенный шок. Патофизиология, классификация, принципы интенсивной терапии.
- Электроимпульсная терапия. Дефибрилляция (кардиоверсия), электрокардиостимуляция. Сущность методов и показания к применению.
- Анафилактический шок. Патофизиология, принципы интенсивной терапии.
- Септический шок. Патофизиология, варианты, принципы интенсивной терапии.
- Дифференциальная диагностика и специфическая терапия диабетических ком.

- Дегидратация, гипергидратация. Виды нарушений гидро-ионного баланса. Принципы дифференцированной инфузионной терапии.
- Инфузионно — трансфузионные среды. Классификация, показания к использованию.
- Отравления алкоголем и его суррогатами. Диагностика, принципы интенсивной терапии.
- Отравления уксусной эссенцией. Диагностика, принципы интенсивной терапии.
- Отравления фосфоорганическими соединениями. Диагностика, принципы интенсивной терапии.
- Отравления транквилизаторами и седативными препаратами. Дифференциальная диагностика, принципы интенсивной терапии.
- Острая почечная недостаточность. Клиника, классификация, принципы интенсивной терапии.
- Основы кислотно-основного состояния. Виды нарушений, принципы коррекции.
- Принципы организации и оказания неотложной помощи при ликвидации последствий автокатастроф и террористических актов.
ЛИТЕРАТУРА
|
Анестезиологическая и реанимационная помощь раненым на войне.
|
|
Прощаев К.И. Анестезиологическое обеспечение оперативных вмешательств у больных с артериальной гипертензией. 2003. С.69
|
|
Анестезиология и реаниматология. Учебник для студентов медвузов. Под ред. О.А.Долиной. 2002. С. 453
|
|
Анестезиология и реаниматология. Учебник для вузов. Под ред. О.А.Долиной. 2006 С. 478
|
|
Беляевский А.Д. Анестезиология и реаниматология: задачи, вопросы и ответы с разъяснениями: советы специалиста. 2006. С.134
|
|
Назаров И.П. Анестезиология и реаниматология. Уч. Пособие для послевузовского образования. 2007. С.389
|
|
Анестезиология и реаниматология. Учебник для вузов. Под ред. О.А.Долиной. 2007. С.495
|
|
Неймарк М.
|
|
Анестезия и реанимация в акушерстве и гинекологии. В.И.Кулаков и др. 2000.
|
|
Анестезия и интенсивная терапия в акушерстве и неонатологии. А.В.Кулаков. 2001. С. 112
|
|
Беляевский А.Д. Анестезиология и реаниматология в задачах, вопросах, ответах и разъяснениях. В 2-х томах. 1992. С.124, С.154
|
|
Анестезиология и реаниматология уч. Пособие для студентов. Под ред. О.А.Долиной. 1998. С.424
|
|
Ленцев. Анестезия и аналгезия при кесаревом сечении. 1991 С. 125
|
|
Лян Н.В. Анестезия и опухолевый процесс. 1992 С.168
|
|
Анестезиология и реаниматология. Журнал с 1997года.
|
|
Вестник интенсивной терапии. Журнал, с 2000.
|
|
Клиническая анестезиология и реаниматология.
|
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА.
- Г.В. Алексеева и соавт. Постреанимационная энцефалопатия. //Омск 2002г.
- А.А. Беляевский Анестезиология и реаниматология в вопросах и ответах. // Ростов 1991.
- Брайан Дж. Поллард. Руководство по клинической анестезиологии.//М.МедПресс-информ,2006.
- А.А. Бунятян и соавт. Атаралгезия. //М.: Медицина 1983.
- В.М. Женило и соавт. Основы современной общей анестезии. //Ростов 1998.
- А.П. Зильбер Этюды критической медицины. Том 1-4. //Петрозаводск. 1995-1998.
- В.Л. Кассиль ИВЛ в интенсивной терапии. //М.: Медицина 1987.
- А.В.Куликов. Острые нарушения гемостаза в акушерстве (кровотечения и тромбозы).//Пр.руководство, Екатеринбург. 2007.
- А.В.Куликов. Регионарная анестезия в обезболивании родов.// Пр.руководство. Екатеринбург. 2007.
- Р.Н. Лебедева Фармакотерапия острой боли.
 М.: Медицина 1998.
М.: Медицина 1998. - Дж. Х. Леви Анафилактические реакции в анестезии и интенсивной терапии. //М.: Медицина 1990.
- Е.А. Лужников и соавт. Детоксикационная терапия. //С.-П. 2000.
- В.Д. Малышев Острая дыхательная недостаточность. //М.: Медицина 1989
- В.Д. Малышев Интенсивная терапия. //М.: Медицина 2002.
- И.В. Молчанов и соавт. «Правовое регулирование труда персонала анестезиолого-реанимационного отделения». //Вестник интенсивной терапии №3, 2000.
- Э.В. Недашковский Освежающий курс лекций. //Архангельск 1994-2007.
- Н.А. Осипова Оценка эффекта наркотических, анальгетических и психотропных средств в клинической анестезиологии. //Л.: Медицина 1988.
- Н.А.Осипова «Подготовка больного к анестезии и операции». Руководство по анестезиологии. //М.: Медицина 1994.
- Т.С. Попова и соавт. Нутритивная поддержка больных в критических состояниях. //М.: Медицина 2002.
- Инфузионно-трансфузионная терапия.
 //Российский журнал анестезиологии и интенсивной терапии. №2 1999.
//Российский журнал анестезиологии и интенсивной терапии. №2 1999. - Г.М. Соловьёв и соавт. Кровопотеря и регуляция кровообращения в хирургии. //М.: Медицина 1973.
- Федеральное руководство для врачей по использованию лекарственных средств (формулярная система). //М.: Медицина 2001.
- Клиническая анестезиология. Книга 1,2. //М.: Медицина 2001.
- Реанимация новорожденных // American Academy of Pediatrics. Руководство для учащихся под ред. J.Kattwinkel, 2000.
- Г.А. Рябов и соавт. Экстренная анестезиология. //М.: Медицина 1983.
- Г.А. Рябов Синдромы критических состояний. //М.: Медицина 1994.
- Е.М.Шифман, А.Д.Тиканадзе, В.Я.Вартанов Инфузионно-трансфузионная терапия в акушерстве. // «ИнтелТек», Петрозаводск,2001.
- Е.М.Шифман Преэклампсия, эклампсия, HELLP-синдром.// «ИнтнлТек», Петрозаводск. 2002.
- Журналы: Анестезиология и реаниматология. Клиническая анестезиология. Вестник интенсивной терапии.
 Эфферентная терапии.
Эфферентная терапии. - Материалы съездов ООО «Федерации анестезиологов-реаниматологов» Российской Федерации.
- Проект протокола ООО «ФАР» «Регионарная аналгезия родов».//Санкт-Петербург. 2008.
- Закон об охране здоровья граждан РФ. //М.: Медицина 1993.
- Приказы МЗ РФ №50 (1970), 1188 (1975), 841 (1986), 73 (2003).
ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ К ИГА
1. Токсикологическая болезнь.
1.1. Определение понятия токсикологической болезни. Этиология. Патогенез. Лечение.
1.2.Стадии и клинико-патогенетические принципы лечения токсикологической болезни.
1.3.Яды и пути их поступления в организм. Интоксикация, детоксикация.
1.4.Принципы диагностики острых экзогенных отравлений.
1.5. Диагностика и интенсивная терапия отравлений алкоголем и его суррогатами.
1.6.Диагностика, клиника и интенсивная терапия отравлений фосфорорганическими соединениями.
1. 7.Диагностика, клиника и интенсивная терапия отравлений кислотами и щелочами (уксусная кислота и др.).
7.Диагностика, клиника и интенсивная терапия отравлений кислотами и щелочами (уксусная кислота и др.).
1.8.Диагностика, кдиника и интенсивная терапия отравлений психотропными препаратами.
1.9.Диагностика и принципы интенсивной терапии отравлений лекарственными препаратами.
1.10. Диагностика и принципы интенсивной терапии отравлений биологическими и растительными ядами (укусы змей, насекомых, отравления грибами).
1.11. Принципы и методы детоксикации организма. Методики проведения.
1.12. Первая помощь при отравлении бытовыми и промышленными ядами. Методы профилактики.
1.13. Методы экстракорпоральной детоксикации организма. Показания к проведению. Осложнения и их профилактика.
1.14. Экзотоксический шок, принципы и методы интенсивной терапии.
1.15. Синдром эндогенной интоксикации организма. Этиология. Патогенез, Принципы терапии.
2. Фундаментальные основы гемотрансфузии. Методы детоксикации. Трансфузионное лечение (инфузионная терапия).
2.1. Основы водно-электролитного и белкового обмена.
2.2 Водные сектора организма. Основные биофизические законы распределения жидкости по водным секторам.
2.3 Определение понятий осмоляльности и коллоидно-осмотического давления (их клиническое значение).
2.4 Определение инфузионно-трансфузионной терапии. Показания к проведению инфузионно-трансфузионной терапии.
2.5 Инфузионные среды. Классификация.
2.6 Обьемзамещающие растворы (коллоидные), классификация, показания к применению.
2.7 Кристаллоидные растворы, классификация, показания к применению.
2.8 Нарушения водно-электролитного баланса и методы его коррекции.
- Принципы парентерального питания.
- Принципы проведения и контроля за инфузионно-трансфузионной терапии.
- Осложнения и профилактика инфузионно-трансфузионной терапии.
3. Терминальные состояния.
3.1 Понятие терминального состояния. Этиология, Патофизиология. Классификация.
Этиология, Патофизиология. Классификация.
3.2 Клинико-морфологическая характеристика терминальных состояний.
3.3 Диагностика клинической смерти.
3.4 Принципы и алгоритм сердечно-легочно-мозговой реанимации (АВСD).
3.5 Техника выполнения комплекса реанимационных мероприятий.
3.6 Критерии эффективности проведения реанимационных мероприятий.
- Правовые аспекты реанимационных пособий (Инструкция об определении момента смерти, отказ от применения или прекращения реанимационных мероприятий).
- Понятие смерти мозга. Принципы диагностики. (Закон о смерти мозга).
- Постреанимационная болезнь. Этиология, патофизиология, клиника.
- Коматозные состояния. Этиология. Патогенез. Классификация степени тяжести (шкала Глазго).
3.11 Принципы интенсивной терапии коматозных состояний.
3.12 Диабетические комы. Дифференциальная диагностика и интенсивная терапия.
3.13 Шок, определение, классификация, клинические критерии. Патогенетические принципы терапии.
Патогенетические принципы терапии.
- Принципы интенсивной терапии гиповолемического шока (геморрагический, ожоговый, травматический).
3.15 Принципы интенсивной терапии кардиогенного шока.
- Принципы интенсивной терапии септического шока
- Принципы интенсивной терапии анафилактического шока.
- Дифференциальная диагностика шока, коллапса, обморока. Неотложная помощь.
4. Теоретические основы учения о боли (ноцицепции).
Принципы и способы анальгезии.
- Ненаркотические анальгетики. Характеристика группы. Показания к применению, дозировки, побочные эффекты.
- Наркотические анальгетики. Характеристика группы. Показания к применению, дозировки, побочные эффекты.
- Местная анестезия. Виды, показания к применению. Местные анестетики.
- Проводниковая анестезия (блокады нервных стволов и сплетений). Препараты для проводниковой анестезии.
 Показания.
Показания. - Методики регионарной анестезии (эпидуральная и спиномозговая анестезии). Показания. Осложнения.
- Методики общей анестезии. Показания. Осложнения. Профилактика побочных эффектов. Представление о нейролептаналгезии и атаралгезии.
- Ингаляционные анестетики. Характеристика основных препаратов.
- Неингаляционные анестетики (внутривенные анестетики). Характеристика основных препаратов.
- Обезболивание острого инфаркта миокарда.
5. Догоспитальный этап лечения больных.
- Определение и научное содержание понятия «догоспитальный этап».
- Определение и содержание понятий «неотложная медицинская помощь» и «скорая медицинская помощь».
- Проблема «медицины катастроф». Медицинское содержание понятия.
- Медико-организационные аспекты ликвидации последствий катастроф и стихийных бедствий.
- Медицинская характеристика чрезвычайных ситуаций.

- Медицинская сортировка при ликвидации последствий катастроф и стихийных бедствий.
- Интенсивная терапия поражений электричеством (природным и бытовым).
- Догоспитальная помощь при утоплении.
- Догоспитальная помощь при механической асфиксии.
Сепсис
Общая информация
Сепсис — это опасная для жизни дисфункция внутренних органов, вызванная нарушением регуляции ответа организма на инфекцию (7). Если сепсис не распознать на ранней стадии не обеспечить своевременное лечение, он может вызвать септический шок, полиорганную недостаточность и смерть. Сепсис может быть вызван любым типом инфекционного патогена. Устойчивость к противомикробным препаратам является ведущим фактором, вызывающим отсутствие клинического ответа на лечение и быстрое развитие сепсиса и септического шока. Среди пациентов с сепсисом, вызванным лекарственно-устойчивыми патогенами, наблюдается повышенный риск больничной летальности.
Кто подвергается риску?
Сепсис может развиться у любого человека с инфекцией, однако повышенному риску подвергаются уязвимые группы населения,такие как пожилые люди, беременные женщины, новорожденные, госпитализированные пациенты и лица с ВИЧ/СПИДом, циррозом печени, раком, заболеваниями почек, аутоиммунными заболеваниями и удаленной селезенкой (8).
Признаки и симптомы
Сепсис является неотложным состоянием. Однако признаки и симптомы сепсиса у пациентов могут быть различными в различные моменты времени, поскольку такое клиническое состояние, как сепсис, может вызываться множеством возбудителей и менять свой характер на различных этапах. К тревожным признакам и симптомам относятся повышение или понижение температуры тела и озноб, изменение психического состояния, затрудненное/учащенное дыхание, учащенное сердцебиение, ослабление пульса/низкое кровяное давление, олигурия, синюшность или мраморность кожи, похолодание конечностей и сильные боли или дискомфорт в теле (9-11). Возникновение подозрения на сепсис является первым шагом к его раннему распознаванию и диагностике.
Профилактика
Существует два основных пути профилактики сепсиса:
1. предотвращение передачи микроорганизмов и инфицирования;
2. недопущение осложнения инфекции до состояния сепсиса.
Профилактика инфекций среди населения предусматривает соблюдение эффективных правил гигиены, таких как мытье рук и безопасное приготовление пищи, улучшение качества и доступности водоснабжения и средств санитарии, обеспечение доступа к вакцинам, особенно лиц, подверженных высокому риску развития сепсиса, а также надлежащее питание, включая грудное вскармливание новорожденных.
Профилактика внутрибольничных инфекций, как правило, обеспечивается наличием функционирующих программ по профилактике инфекций и инфекционному контролю, а также соответствующих групп персонала, применением эффективных методов соблюдения гигиены, в том числе гигиены рук, наряду с чистотой в помещениях и правильной работой оборудования.
Профилактика развития сепсиса как среди населения, так и в медицинских учреждениях предполагает надлежащее лечение инфекций с применением антибиотиков, в том числе регулярную оценку состояния больных для рационального применения антибиотиков, быстрое обращение за медицинской помощью и раннее обнаружение признаков и симптомов сепсиса.
Эффективность профилактики инфекций однозначно подтверждается научными данными. Например, при строгом соблюдении правил гигиены рук в учреждениях здравоохранения уменьшение числа случаев инфицирования может составить до 50% (12), а в общественных местах эти меры могут сократить риск возникновения диареи как минимум на 40% (13). Меры по улучшению водоснабжения, санитарии и гигиены (ВСГ) способны привести к сокращению общего бремени заболеваний во всем мире на 10%14. Каждый год вакцинации помогают предотвратить 2–3 миллиона случаев смерти, связанных с инфекциями (15) .
Меры по улучшению водоснабжения, санитарии и гигиены (ВСГ) способны привести к сокращению общего бремени заболеваний во всем мире на 10%14. Каждый год вакцинации помогают предотвратить 2–3 миллиона случаев смерти, связанных с инфекциями (15) .
Диагностика и клиническое ведение
Чтобы выявить сепсис на ранних этапах и своевременно организовать его надлежащее клиническое ведение, крайне важно распознать и не игнорировать перечисленные выше признаки и симптомы, а также выявить определенные биомаркеры (в частности прокальцитонин). На этапе после раннего выявления важное значение имеют диагностические процедуры, помогающие выявить возбудитель вызвавшей сепсис инфекции, поскольку от этого зависит выбор целенаправленного противомикробного лечения. Устойчивость к противомикробным препаратам (УПП) может препятствовать клиническому ведению сепсиса, поскольку оно нередко требует подбора антибиотика эмпирическим путем. Поэтому необходимо понимать эпидемиологические параметры распространения УПП в данных условиях. После определения источника инфекции важнейшей задачей является его ликвидация, например, путем дренирования абсцесса.
После определения источника инфекции важнейшей задачей является его ликвидация, например, путем дренирования абсцесса.
На раннем этапе ведения сепсиса важное значение также имеет инфузионная терапия для нормализации объема циркулирующей жидкости. Кроме того, для улучшения и поддержания перфузии тканей может потребоваться применение сосудосуживающих препаратов. Дальнейшие мероприятия по правильному ведению сепсиса выбираются исходя из данных повторных обследований и диагностических мероприятий, включая контроль основных показателей жизнедеятельности пациента.
Проблема сепсиса и Цели в области устойчивого развития
Сепсис является крайне актуальной причиной материнской смертности, а также смертности новорожденных и детей в возрасте до пяти лет. По этой причине борьба с сепсисом будет очевидным образом способствовать выполнению задач 3.1 и 3.2 в рамках Целей в области устойчивого развития (ЦУР).
Сепсис является крайне актуальной причиной материнской смертности, а также смертности новорожденных и детей в возрасте до пяти лет. По этой причине борьба с сепсисом будет очевидным образом способствовать выполнению задач 3.1 и 3.2 в рамках Целей в области устойчивого развития (ЦУР).
По этой причине борьба с сепсисом будет очевидным образом способствовать выполнению задач 3.1 и 3.2 в рамках Целей в области устойчивого развития (ЦУР).
Показателями выполнения этих двух задач ЦУР являются коэффициенты смертности матерей, новорожденных и детей младше пяти лет. Сепсис занимает важное место среди причин, вызывающих эти предотвратимые виды смертности. Именно он нередко является клиническим состоянием, вызывающим, в конечном счете, смерть пациентов, страдающих ВИЧ, туберкулезом, малярией и другими инфекционными заболеваниями, упомянутыми в задаче 3.3, но при этом он, как правило, не регистрируется в качестве причины смерти таких пациентов и не включается в статистику по показателям выполнения задачи 3.3 ЦУР.
Проблема сепсиса также имеет важное, хотя и более опосредованное значение для других связанных со здоровьем задач в рамках ЦУР 3. Так, профилактика и/или надлежащая диагностика и ведение сепсиса имеют также отношение к надлежащему охвату вакцинами, всеобщему охвату качественными услугами здравоохранения, возможностям для соблюдения Международных медико-санитарных правил, обеспечению готовности и предоставлению услуг водоснабжения и санитарии. Вместе с тем, обеспечение повсеместной профилактики, диагностики и ведения сепсиса остается сложной задачей.
Вместе с тем, обеспечение повсеместной профилактики, диагностики и ведения сепсиса остается сложной задачей.
Деятельность ВОЗ
В мае 2017 г. Семидесятая сессия Всемирной ассамблеи здравоохранения на основании доклада Секретариата ВОЗ приняла резолюцию о сепсисе.
Резолюция WHA70.7. Совершенствование профилактики, диагностики и клинического ведения сепсиса
Доклад Секретариата ВОЗ A70/13. Совершенствование профилактики, диагностики и клинического ведения сепсиса
В настоящее время в рамках нескольких программ уровня штаб-квартиры ВОЗ, осуществляемых в сотрудничестве и координации с региональными бюро ВОЗ, изучаются вопросы воздействия сепсиса на общественное здравоохранение, а также предоставляются руководящие указания и поддержка на уровне стран по вопросам профилактики, ранней и правильной диагностики, а также своевременного и эффективного клинического ведения сепсиса в интересах комплексного решения этой проблемы. Глобальная группа по вопросам профилактики инфекций и инфекционного контроля, работающая в штаб-квартире ВОЗ при Департаменте предоставления услуг и обеспечения их безопасности, обеспечивает координацию деятельности по проблеме сепсиса и руководит мероприятиями в области его профилактики.
Библиография
(1) Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. Am J Respir Crit Care Med 2016; 193(3): 259-72.
(2) Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, Schlapbach LJ, Reinhart K, Kissoon N. The global burden of paediatric and neonatal sepsis: a systematic review. The Lancet Respiratory medicine 2018; 6(3): 223-30.
(3) Laxminarayan R, Matsoso P, Pant S, et al. Access to effective antimicrobials: a worldwide challenge. Lancet 2016; 387(10014): 168-75.
(4) Say L, Chou D, Gemmill A, et al. Global causes of maternal death: a WHO systematic analysis. The Lancet Global health 2014; 2(6): e323-33.
(5) Reproductive, Maternal, Newborn, and Child Health: Disease Control Priorities, Third Edition (Volume 2). In: Black RE, Laxminarayan R, Temmerman M, Walker N, eds. Reproductive, Maternal, Newborn, and Child Health: Disease Control Priorities, Third Edition (Volume 2). Washington (DC): The International Bank for Reconstruction and Development / The World Bank(c) 2016 International Bank for Reconstruction and Development / The World Bank.; 2016.
Washington (DC): The International Bank for Reconstruction and Development / The World Bank(c) 2016 International Bank for Reconstruction and Development / The World Bank.; 2016.
(6) World Health Organization. WHO Report on the burden of endemic health care-associated infection worldwide. 2017-11-21 15:11:22 2011.
http://apps.who.int/iris/bitstream/handle/10665/80135/9789241501507_eng.pdf?sequence=1 (accessed April 10 2018).
(7) Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315(8): 801-10.
(8) Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management. British Medical Journal 2016.
(9) United States Centers for Disease Control and Prevention. Healthcare Professional (HCP) Resources : Sepsis. 2018-02-01T06:23:15Z.
https://www.cdc.gov/sepsis/get-ahead-of-sepsis/hcp-resources.html (accessed April 10 2018).
(10) Global Sepsis Alliance. Toolkits. https://www.world-sepsis-day.org/toolkits/ (accessed April 10 2018).
Toolkits. https://www.world-sepsis-day.org/toolkits/ (accessed April 10 2018).
(11) UK SepsisTrust. Education. 2018. https://sepsistrust.org/education/ (accessed April 10 2018).
(12) Luangasanatip N, Hongsuwan M, Limmathurotsakul D, et al. Comparative efficacy of interventions to promote hand hygiene in hospital: systematic review and network meta-analysis. British Medical Journal. 2015;351:h4728.
(13) UNICEF. UNICEF Data : Monitoring the Situation of Children and Women — Diarrhoeal Disease. https://data.unicef.org/topic/child-health/diarrhoeal-disease/ (accessed April 10 2018).
(14) Pruss-Ustun A, Bartram J, Clasen T, et al. Burden of disease from inadequate water, sanitation and hygiene in low- and middle-income settings: a retrospective analysis of data from 145 countries. Tropical medicine & international health : TM & IH 2014; 19(8): 894-905.
(15) World Health Organization. Fact sheet: Immunization coverage. 2018-04-10 14:55:37.
2018-04-10 14:55:37.
| ||
Септический шок — обзор
Этиология и патофизиология
Септический шок является наиболее сложным и противоречивым типом шока и заслуживает независимой классификации. Септический шок часто представляет собой комбинацию нескольких проблем, включая инфекцию, относительную или абсолютную гиповолемию, неправильное распределение кровотока, угнетение миокарда и множественные метаболические, эндокринные и гематологические проблемы. Таким образом, шок при сепсисе содержит многие элементы других типов шока, описанных ранее (гиповолемический, кардиогенный и распределительный шок) (см. Главы 91 и 103, глава 91, глава 103).
Септический шок включает в себя каскад метаболических, гемодинамических и клинических изменений, вызванных инвазивной инфекцией и выбросом микробных токсинов в кровоток. Была предпринята попытка корреляции клинических данных с типом вторгающегося микроорганизма. Однако системный воспалительный ответ не зависит от типа вторгающегося организма (бактерия, вирус, грибок, Rickettsia ) и является ответом, зависимым от хозяина.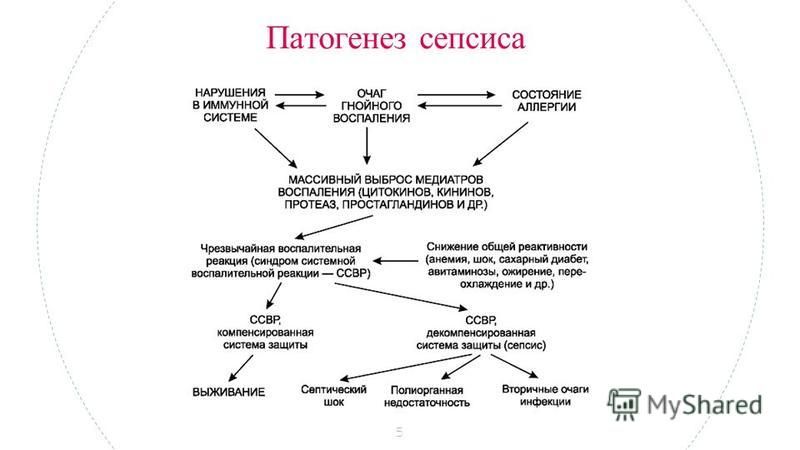 78
78
Патофизиология септического шока изучена не полностью.Комбинация прямого воздействия микробных агентов, микробиологических токсинов, воспалительной реакции пациента на инфекцию и активации эндогенных медиаторов приводит к сердечнососудистой нестабильности и мультисистемной органной недостаточности. 79 Септический шок — это совокупность признаков и симптомов, которые отражают нарушение множественной системы органов на субклеточном уровне. Высвобождение медиатора, по-видимому, является последним общим путем к развитию этого шокового состояния независимо от этиологии. 78 Некоторые медиаторы представляют собой цитокины, фактор некроза опухоли, интерлейкин-1, интерлейкин-6, кинины, эйкозаноиды, фактор активации тромбоцитов и оксид азота.
Клиническая картина и проявления септического шока сильно различаются и зависят от динамического взаимодействия вторгающегося организма, времени до лечения и реакции хозяина на инфекцию и лечение. У всех пациентов наблюдается абсолютная или функциональная гиповолемия. Несколько факторов могут способствовать гиповолемии. Повышенная проницаемость микрососудов, расширение артериол и вен с периферическим объединением внутрисосудистого объема, несоответствующая полиурия и недостаточное пероральное потребление — все это в совокупности приводит к снижению эффективного объема крови.Потеря объема, вызванная лихорадкой, диареей, рвотой или секвестрированием жидкости в третьем пространстве, также способствует гиповолемии.
Несколько факторов могут способствовать гиповолемии. Повышенная проницаемость микрососудов, расширение артериол и вен с периферическим объединением внутрисосудистого объема, несоответствующая полиурия и недостаточное пероральное потребление — все это в совокупности приводит к снижению эффективного объема крови.Потеря объема, вызванная лихорадкой, диареей, рвотой или секвестрированием жидкости в третьем пространстве, также способствует гиповолемии.
Аномальные гемодинамические реакции являются основным признаком септического шока. 80 Наиболее частым проявлением (80%) у детей является низкий сердечный индекс с нарушениями сосудистого тонуса или без них. 25 У этих детей наблюдается тахикардия, изменения психического статуса, снижение периферического пульса, пятнистые холодные конечности и длительное наполнение капилляров (более 2 секунд).Взрослые и некоторые дети (20%) находятся в гипердинамическом состоянии, характеризующемся повышенным (или нормальным) сердечным выбросом и снижением системного сосудистого сопротивления. При физикальном обследовании у пациентов наблюдается полнокровие с теплыми конечностями. У них есть тахикардия, ограничивающие (или схлопывающиеся) импульсы и повышенное пульсовое давление. Может присутствовать высокая температура, спутанность сознания и гипервентиляция. На этом этапе неопытный наблюдатель может не распознать шок. Как это ни парадоксально, гипотензия может возникать при нормальном или повышенном сердечном выбросе.В любом случае гипотония не является обязательной для диагностики шока.
При физикальном обследовании у пациентов наблюдается полнокровие с теплыми конечностями. У них есть тахикардия, ограничивающие (или схлопывающиеся) импульсы и повышенное пульсовое давление. Может присутствовать высокая температура, спутанность сознания и гипервентиляция. На этом этапе неопытный наблюдатель может не распознать шок. Как это ни парадоксально, гипотензия может возникать при нормальном или повышенном сердечном выбросе.В любом случае гипотония не является обязательной для диагностики шока.
Прогрессирование сепсиса характеризуется потерей сердечной компенсации за снижение системного сосудистого сопротивления, возможно, в результате воспалительной утечки капилляров, вазодилатации и / или опосредованной токсинами депрессии сердца. Некоторые пациенты умирают от рефрактерной гипотензии в результате низкого системного сосудистого сопротивления. 82
Переход от высокого сердечного выброса к низкому может происходить быстро.По мере снижения сердечного выброса физические симптомы меняются на симптомы гипоперфузии. У пациента тахипноэ, тахикардия, артериальная гипотензия, слабый нитевидный пульс, пятнистые холодные конечности и задержка наполнения капилляров. По мере ухудшения тканевой перфузии наступает анаэробный метаболизм и накапливается молочная кислота.
У пациента тахипноэ, тахикардия, артериальная гипотензия, слабый нитевидный пульс, пятнистые холодные конечности и задержка наполнения капилляров. По мере ухудшения тканевой перфузии наступает анаэробный метаболизм и накапливается молочная кислота.
Прогрессирующее ухудшение потребления кислорода и экстракции кислорода предвещает плохой прогноз. У педиатрических пациентов с септическим шоком потребление кислорода зависит от доставки кислорода. 83 Это похоже на физиологическую взаимосвязь, наблюдаемую у педиатрических пациентов с кардиогенным шоком, предполагая, что эти две группы могут быть реанимированы с использованием тех же физиологических принципов. Помимо кислорода, при септическом шоке было продемонстрировано нарушение использования других метаболических субстратов. Перед началом клеточной гипоксии происходит нарушение регуляции глюкозы, жира и аминокислот с 1-3 . Изменения гликолиза и глюконеогенеза, возможно, являются самым ранним метаболическим проявлением сепсиса.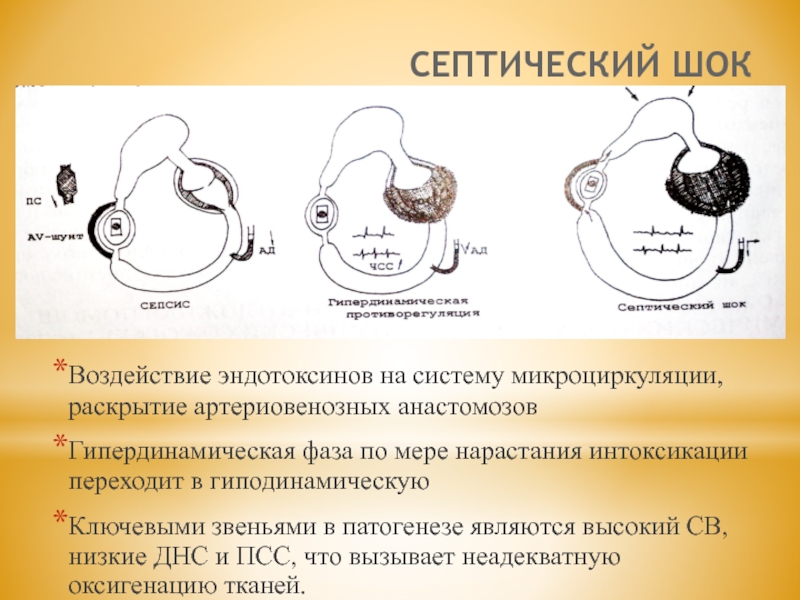 Были задействованы 84 Инсулино-чувствительность, 85 внутриклеточный кальций, 86 распределение глюкозы, 87 и адренергические эффекты 88 .
Были задействованы 84 Инсулино-чувствительность, 85 внутриклеточный кальций, 86 распределение глюкозы, 87 и адренергические эффекты 88 .
Хотя у большинства взрослых наблюдается гипердинамический септический шок, у большинства детей и особенно младенцев с ограниченным сердечным резервом наблюдается низкий сердечный выброс, клинически неотличимый от кардиогенного шока. 81 Даже во время гипердинамического состояния, наблюдаемого у взрослых, сократимость миокарда снижается из-за депрессивного фактора миокарда, диффузного отека миокарда, дисфункции адренергических рецепторов и нарушения сарколеммического потока кальция. 89 Выживаемость детей при септическом шоке зависит от скорости и адекватности реанимационных мероприятий. Когда реанимация откладывается или неадекватна, наступает клеточная гипоксия и полиорганная недостаточность, которые являются последним общим путем к смерти.
Признавая, что септический шок у детей отличается от септического шока у взрослых и что клинические проявления аналогичны шоку другой этиологии, стандартизированные определения ССВО, сепсиса, септического шока (вставка 29-7) и дисфункции органов (вставка 29- 8) были разработаны с целью проведения сравнения в рамках клинических исследований и между ними. 90 Несмотря на то, что эти определения полны и подробны, клиническая полезность этих определений подвергается сомнению. 91
90 Несмотря на то, что эти определения полны и подробны, клиническая полезность этих определений подвергается сомнению. 91
Сепсис — симптомы и причины
Обзор
Сепсис — это потенциально опасное для жизни состояние, которое возникает, когда реакция организма на инфекцию повреждает его собственные ткани. Когда в организме включаются процессы борьбы с инфекциями, они вызывают плохое и ненормальное функционирование органов.
Сепсис может прогрессировать до септического шока.Это резкое падение артериального давления, которое может привести к серьезным заболеваниям органов и смерти.
Раннее лечение антибиотиками и внутривенными жидкостями увеличивает шансы на выживание.
Продукты и услуги
Показать больше товаров от Mayo Clinic
Симптомы
Признаки и симптомы сепсиса
Чтобы получить диагноз сепсиса, у вас должна быть вероятная или подтвержденная инфекция и все следующие признаки:
- Изменение психического статуса
- Систолическое артериальное давление — первая цифра в показании артериального давления — меньше или равно 100 миллиметрам ртутного столба (мм рт.
 Ст.)
Ст.) - Частота дыхания выше или равна 22 вдохам в минуту
Признаки и симптомы септического шока
Септический шок — это серьезное падение артериального давления, которое приводит к крайне ненормальным проблемам с работой клеток и выработкой энергии.Развитие септического шока увеличивает риск смерти. Признаки прогрессирования септического шока включают:
- Необходимость приема лекарств для поддержания систолического артериального давления выше или равного 65 мм рт. Ст.
- Высокий уровень молочной кислоты в крови (лактат сыворотки). Слишком много молочной кислоты в крови означает, что ваши клетки не используют кислород должным образом.
Когда обращаться к врачу
Чаще всего сепсис возникает у людей, госпитализированных или недавно госпитализированных.У людей, находящихся в отделении интенсивной терапии, выше вероятность развития инфекций, которые затем могут привести к сепсису.
Однако любая инфекция может привести к сепсису.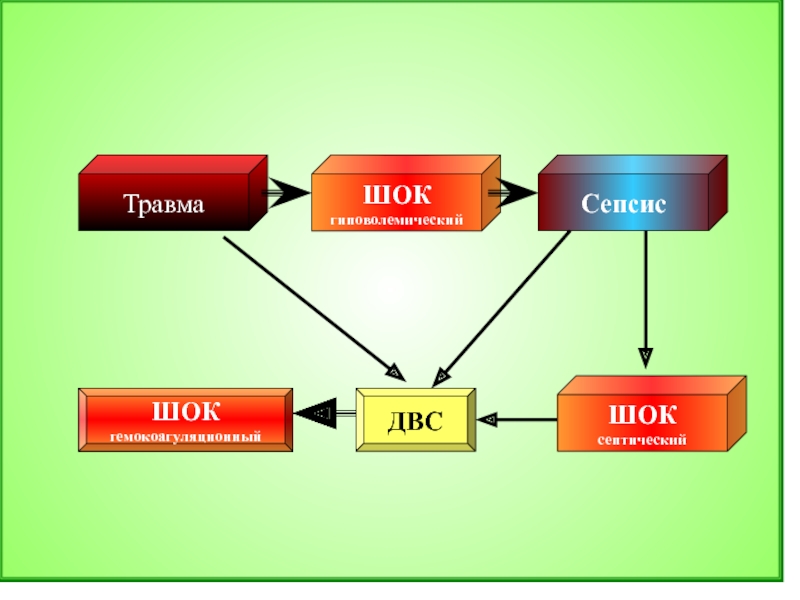 Обратитесь к врачу по поводу инфекции или раны, не поддающейся лечению. Признаки или симптомы, такие как спутанность сознания или учащенное дыхание, требуют неотложной помощи.
Обратитесь к врачу по поводу инфекции или раны, не поддающейся лечению. Признаки или симптомы, такие как спутанность сознания или учащенное дыхание, требуют неотложной помощи.
Причины
В то время как любой тип инфекции — бактериальная, вирусная или грибковая — может привести к сепсису, инфекции, которые чаще всего приводят к сепсису, включают инфекции:
- Легкие, например пневмония
- Почки, мочевой пузырь и другие части мочевыделительной системы
- Пищеварительная система
- Кровоток (бактериемия)
- Участки для катетера
- Раны или ожоги
Факторы риска
Несколько факторов повышают риск сепсиса, в том числе:
- Пожилой возраст
- Младенчество
- Нарушение иммунной системы
- Диабет
- Хроническая болезнь почек или печени
- Поступление в отделение интенсивной терапии или более длительное пребывание в больнице
- Инвазивные устройства, такие как внутривенные катетеры или дыхательные трубки
- Предыдущее применение антибиотиков или кортикостероидов
Осложнения
По мере обострения сепсиса приток крови к жизненно важным органам, таким как мозг, сердце и почки, нарушается. Сепсис может вызвать аномальное свертывание крови, в результате чего образуются небольшие сгустки или разрываются кровеносные сосуды, которые повреждают или разрушают ткани.
Сепсис может вызвать аномальное свертывание крови, в результате чего образуются небольшие сгустки или разрываются кровеносные сосуды, которые повреждают или разрушают ткани.
Большинство людей выздоравливают после легкого сепсиса, но уровень смертности от септического шока составляет около 40%. Кроме того, эпизод тяжелого сепсиса повышает риск заражения в будущем.
19 января 2021 г.
Септический шок Артикул
[1]
Тяжелый сепсис и септический шок: обзор литературы и руководств по ведению отделения неотложной помощи., Nguyen HB, Rivers EP, Abrahamian FM, Moran GJ, Abraham E, Trzeciak S, Huang DT, Osborn T., Stevens D, Talan DA, Annals of Emergency Medicine, июль 2006 г. [PubMed PMID: 16781920]
[2]
Уровень инфицирования и риск острой органной дисфункции как объяснение расовых различий при тяжелом сепсисе. , Mayr FB, Yende S, Linde-Zwirble WT, Peck-Palmer OM, Barnato AE, Weissfeld LA, Angus DC, JAMA, 23 июня 2010 г. [ PubMed PMID: 20571016]
, Mayr FB, Yende S, Linde-Zwirble WT, Peck-Palmer OM, Barnato AE, Weissfeld LA, Angus DC, JAMA, 23 июня 2010 г. [ PubMed PMID: 20571016]
[3]
Международное исследование распространенности и исходов инфекции в отделениях интенсивной терапии., Винсент Дж. Л., Релло Дж., Маршалл Дж., Сильва Е., Анзуэто А., Мартин С. Д., Морено Р., Липман Дж., Гомерсалл К., Сакр И., Рейнхарт К., JAMA, 2 декабря 2009 г. [PubMed PMID: 19952319]
[4]
Эпидемиология бактериального сепсиса., Rangel-Frausto MS, Инфекционные больницы Северной Америки, июнь 1999 г. [PubMed PMID: 10340168]
[5]
Новый метод классификации инфекций у тяжелобольных., Коэн Дж., Кристофаро П., Карлет Дж., Опал С., Медицина интенсивной терапии, июль 2004 г.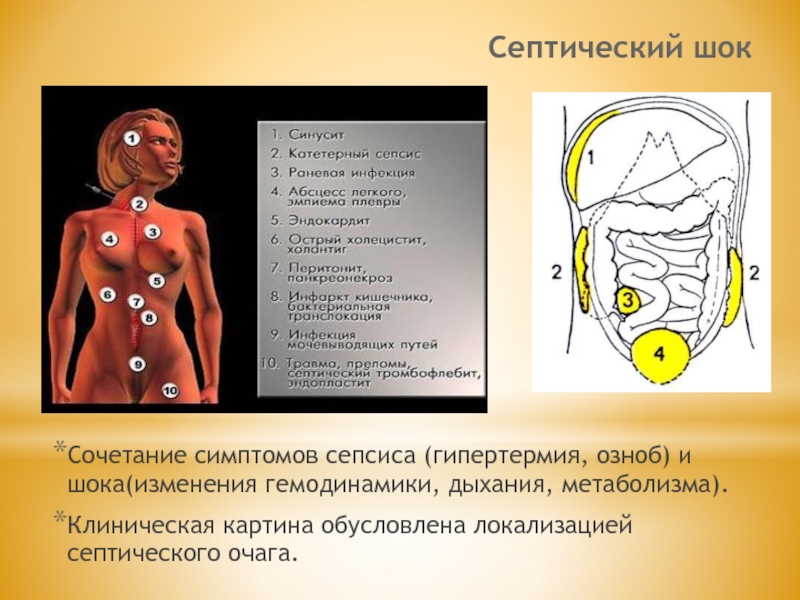 [PubMed PMID: 15241096]
[PubMed PMID: 15241096]
[6]
Текущая эпидемиология септического шока: сеть CUB-Réa., Annane D, Aegerter P, Jars-Guincestre MC, Guidet B, Американский журнал респираторной медицины и реанимации, 15 июля 2003 г. [PubMed PMID: 12851245]
[7]
Эпидемиология сепсиса в США с 1979 по 2000 год., Мартин Г.С., Маннино Д.М., Итон С., Мосс М., Медицинский журнал Новой Англии, 17 апреля 2003 г. [PubMed PMID: 12700374]
[8]
Септицемия в больницах США, 2009: Статистический бюллетень № 122, Elixhauser A, Friedman B, Stranges E ,,, 2006 февраль [PubMed PMID: 22049570]
[9]
Национальные расходы на стационарное лечение: самые дорогие условия с точки зрения плательщика, 2011 г . : Статистический отчет № 160, Torio CM, Andrews RM ,,, февраль 2006 г. [PubMed PMID: 24199255]
: Статистический отчет № 160, Torio CM, Andrews RM ,,, февраль 2006 г. [PubMed PMID: 24199255]
[10]
Эпидемиологические характеристики, временные тенденции, предикторы смерти и распределение выписок у пациентов с диагнозом сепсис: перекрестное ретроспективное когортное исследование., Elfeky S, Golabi P, Otgonsuren M, Djurkovic S, Schmidt ME, Younossi ZM, Журнал интенсивной терапии, июнь 2017 г. [PubMed PMID: 28199891]
[11]
Эпидемиология тяжелого сепсиса в Соединенных Штатах: анализ заболеваемости, исходов и связанных с ними затрат на лечение., Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR, Critical care Medicine, июль 2001 г. [PubMed PMID: 11445675]
[12]
случаев госпитальной смерти пациентов с сепсисом из 2 независимых когорт. , Лю В., Эскобар Дж. Дж., Грин Дж., Соул Дж., Виппи А., Ангус, округ Колумбия, Ивашина Т. Дж., Джама, 2 июля 2014 г. [PubMed PMID: 24838355]
, Лю В., Эскобар Дж. Дж., Грин Дж., Соул Дж., Виппи А., Ангус, округ Колумбия, Ивашина Т. Дж., Джама, 2 июля 2014 г. [PubMed PMID: 24838355]
[14]
Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ, Определения сепсиса и органной недостаточности и рекомендации по использованию инновационных методов лечения сепсиса. Комитет конференции по консенсусу ACCP / SCCM. Американский колледж грудных врачей / Общество интенсивной терапии.Грудь. 1992 июнь [PubMed PMID: 1303622]
[15]
Гочкис Р.С., Карл И.Е., Патофизиология и лечение сепсиса. Медицинский журнал Новой Англии. 2003, 9 января [PubMed PMID: 12519925]
[16]
Леви М.М., Финк М. П., Маршалл Дж. К., Абрахам Э., Ангус Д., Кук Д., Коэн Дж., Опал С. М., Винсент Дж. Л., Рамзи Г., 2001 SCCM / ESICM / ACCP / ATS / SIS Международная конференция по определениям сепсиса.Реанимационная медицина. 2003 г., апр. [PubMed PMID: 12682500]
П., Маршалл Дж. К., Абрахам Э., Ангус Д., Кук Д., Коэн Дж., Опал С. М., Винсент Дж. Л., Рамзи Г., 2001 SCCM / ESICM / ACCP / ATS / SIS Международная конференция по определениям сепсиса.Реанимационная медицина. 2003 г., апр. [PubMed PMID: 12682500]
[17]
Джонс А.Е., Пушкарич М.А., Руководство кампании выживших при сепсисе 2012: обновление для врачей неотложной помощи. Летопись неотложной медицины. 2014, янв [PubMed PMID: 24067755]
[18]
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, Rochwerg B, Rubenfeld GD, Angus DC, Annane D, Beale RJ, Bellinghan GJ, Bernard GR, Chiche JD, Coopersmith C, De Backer DP, French CJ, Fujishima S, Gerlach H, Hidalgo JL, Hollenberg SM, Jones AE, Karnad DR, Kleinpell RM, Koh Y, Lisboa TC, Machado FR, Marini JJ, Marshall JC , Мазуски Дж. Э., Макинтайр Л. А., Маклин А. С., Мехта С., Морено Р. П., Майбург Дж., Навалеси П., Нишида О., Осборн Т. М., Пернер А., Планкетт К. М., Раньери М., Шорр К. А., Секель М. А., Сеймур К. В., Ши Л., Шукри KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T., Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP, Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016.Реанимационная медицина. Март 2017 г. [PubMed PMID: 28098591]
Э., Макинтайр Л. А., Маклин А. С., Мехта С., Морено Р. П., Майбург Дж., Навалеси П., Нишида О., Осборн Т. М., Пернер А., Планкетт К. М., Раньери М., Шорр К. А., Секель М. А., Сеймур К. В., Ши Л., Шукри KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T., Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP, Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016.Реанимационная медицина. Март 2017 г. [PubMed PMID: 28098591]
[19]
Риверс Э., Нгуен Б., Хавстад С., Ресслер Дж., Маззин А., Кноблих Б., Петерсон Э., Томланович М. Ранняя целенаправленная терапия в лечении тяжелого сепсиса и септического шока. Медицинский журнал Новой Англии. 2001, 8 ноября [PubMed PMID: 11794169]
[20]
Ventura AM, Shieh HH, Bousso A, Góes PF, de Cássia FO Fernandes I, de Souza DC, Paulo RL, Chagas F, Gilio AE, Двойное слепое проспективное рандомизированное контролируемое исследование допамина по сравнению с эпинефрином в качестве вазоактивных препаратов первой линии в Детский септический шок. Реанимационная медицина. 2015 ноя [PubMed PMID: 26323041]
Реанимационная медицина. 2015 ноя [PubMed PMID: 26323041]
[22]
Annane D, Renault A, Bellissant E, Глюкокортикоиды с флудрокортизоном или без него при септическом шоке. Медицинский журнал Новой Англии. 30 августа 2018 г. [PubMed PMID: 30179381]
[23]
Карденас-Гарсия Дж., Шауб К.Ф., Бельчиков Ю.Г., Нарасимхан М., Кениг С.Дж., Майо П.Х., Безопасность периферического внутривенного введения вазоактивных препаратов.Журнал госпитальной медицины. 2015 сен [PubMed PMID: 26014852]
[24]
Angus DC, Barnato AE, Bell D, Bellomo R, Chong CR, Coats TJ, Davies A, Delaney A, Harrison DA, Holdgate A, Howe B, Huang DT, Iwashyna T, Kellum JA, Peake SL, Pike F, Reade MC, Rowan KM, Singer M, Webb SA, Weissfeld LA, Yealy DM, Young JD, Систематический обзор и метаанализ ранней целенаправленной терапии септического шока: исследователи ARISE, ProCESS и ProMISe. Медицина интенсивной терапии. 2015 сен [PubMed PMID: 25952825]
Медицина интенсивной терапии. 2015 сен [PubMed PMID: 25952825]
[25]
Osborn TM, Исследования тяжелого сепсиса и септического шока (ProCESS, ARISE, ProMISe): что такое оптимальная реанимация? Клиники интенсивной терапии. 2017 г., апр. [PubMed PMID: 28284298]
Сепсис
Предпосылки
Сепсис — это опасная для жизни дисфункция органа, вызванная нерегулируемой реакцией хозяина на инфекцию (3).Если не распознать на ранней стадии и своевременно не лечить, это может привести к септическому шоку, полиорганной недостаточности и смерти. Чаще всего это серьезное осложнение инфекции, особенно в странах с низким и средним уровнем дохода, где оно является основной причиной материнской и неонатальной заболеваемости и смертности.
В условиях сообщества сепсис часто проявляется как клиническое ухудшение общих и предотвратимых инфекций. Сепсис также часто возникает в результате инфекций, приобретенных в медицинских учреждениях, которые являются одним из наиболее частых побочных эффектов во время оказания помощи и ежегодно затрагивают сотни миллионов пациентов во всем мире (2).
Инфекции, связанные со здравоохранением, часто устойчивы к антибиотикам и могут быстро привести к ухудшению клинического состояния. Устойчивость к противомикробным препаратам является основным фактором, определяющим клиническую невосприимчивость к лечению и быстрое развитие сепсиса и септического шока. Установлено, что пациенты с сепсисом с устойчивыми патогенами имеют более высокий риск госпитальной смертности.
Осуществление профилактических мер против инфекций, таких как соблюдение правил гигиены, обеспечение доступа к программам вакцинации, улучшение санитарии и качества и доступности воды, а также другие передовые методы профилактики и контроля инфекций как в сообществе, так и в медицинских учреждениях, являются ключевыми шагами в сокращении возникновение сепсиса.Ранняя диагностика и своевременное и надлежащее клиническое ведение сепсиса, такое как оптимальное использование противомикробных препаратов и жидкостная реанимация, имеют решающее значение для повышения вероятности выживания. Даже несмотря на то, что начало сепсиса может быть острым и сопряжено с краткосрочным бременем смертности, оно также может быть причиной значительной долгосрочной заболеваемости, требующей лечения и поддержки. Таким образом, сепсис требует мультидисциплинарного подхода.
Кто подвергается риску?
Любой человек, пострадавший от инфекции, тяжелой травмы или серьезного неинфекционного заболевания, может прогрессировать до сепсиса, но уязвимые группы населения подвергаются более высокому риску (4), включая:
- пожилых людей,
- беременных или недавно беременных женщин,
- новорожденных,
- госпитализированных пациентов,
- пациентов в отделениях интенсивной терапии,
- человек с ВИЧ / СПИДом,
- человек с циррозом печени,
- человек с онкологическими заболеваниями,
- человек с заболеванием почек,
- человек с аутоиммунными заболеваниями,
- и люди без селезенки.
Признаки и симптомы
Сепсис — это неотложная медицинская помощь, которая может проявляться различными признаками и симптомами в разное время. Предупреждающие знаки и симптомы включают:
- лихорадка или низкая температура и озноб,
- измененное психическое состояние,
- затрудненное дыхание / учащенное дыхание,
- учащенное сердцебиение,
- слабый пульс / низкое кровяное давление,
- низкий диурез ,
- синюшная или пятнистая кожа,
- холодные конечности,
- и сильная боль или дискомфорт в теле (5-7).
Подозрение на сепсис — первый важный шаг на пути к раннему распознаванию и диагностике.
Распространенные причины
В 2017 году наибольший вклад в случаи сепсиса и смертность от сепсиса во всех возрастах внесли диарейные заболевания (от 9,2 до 15 миллионов случаев в год) и инфекции нижних дыхательных путей (1,8-2,8 миллиона в год) (1) . Однако количество неинфекционных заболеваний растет; одна треть случаев сепсиса и почти половина всех смертей, связанных с сепсисом, в 2017 году были вызваны основной травмой или хроническим заболеванием (1).Заболевания матери были наиболее частым неинфекционным заболеванием, осложненным сепсисом. Среди детей наиболее частыми причинами смерти от сепсиса были неонатальные расстройства, инфекции нижних дыхательных путей и диарейные заболевания (1). Стрептококк группы B является ведущей причиной сепсиса как у новорожденных, так и у матерей, хотя Escherichia coli представляет собой новую угрозу (8,9). Оба этих патогена продемонстрировали значительную устойчивость к лечению и считаются приоритетными патогенами для исследований и разработок (НИОКР) новых антибиотиков.
Профилактика сепсиса
Есть два основных шага для предотвращения сепсиса:
- Профилактика микробной передачи и инфекции
- Профилактика инфекции, переходящей в сепсис
Профилактика инфекции в сообществе включает в себя эффективную гигиену такие методы, как мытье рук и безопасное приготовление пищи, улучшение санитарии и качества и доступности воды, обеспечение доступа к вакцинам, особенно для тех, кто находится в группе высокого риска, а также надлежащее питание, включая грудное вскармливание для новорожденных.
Профилактика инфекций в медицинских учреждениях в основном зависит от наличия действующих программ и групп по профилактике и контролю инфекций (ПИИК), эффективных методов гигиены и мер предосторожности, включая гигиену рук, а также наличия чистой, хорошо функционирующей среды и оборудования.
Профилактика развития сепсиса как в сообществе, так и в медицинских учреждениях требует соответствующего лечения инфекции антибиотиками, включая переоценку для оптимизации, быстрое обращение за медицинской помощью и раннее обнаружение признаков и симптомов сепсиса.
Диагностика и клиническое ведение
Выявление и отсутствие недооценки признаков и симптомов, перечисленных выше, наряду с обнаружением некоторых биомаркеров (таких как C-реактивный белок и прокальцитонин), являются ключевыми элементами для ранней диагностики сепсиса и своевременного установления надлежащего клинического ведения. После раннего распознавания важна диагностика, помогающая идентифицировать возбудителя инфекции, приводящей к сепсису, для выбора целевого противомикробного лечения.После определения источника инфекции решающее значение приобретает контроль источника инфекции, например дренирование абсцесса. Устойчивость к противомикробным препаратам (УПП) может поставить под угрозу клиническое ведение сепсиса, поскольку часто требуется эмпирическое лечение антибиотиками. Ранняя инфузионная терапия для улучшения объемного статуса также важна на начальной стадии лечения сепсиса. Кроме того, могут потребоваться вазопрессоры для улучшения и поддержания перфузии тканей. Повторные осмотры и оценки, в том числе мониторинг показателей жизнедеятельности, позволяют со временем правильно вести себя при сепсисе.
Сепсис является важной причиной материнской, неонатальной и детской смертности. Следовательно, борьба с сепсисом будет способствовать достижению целей в области устойчивого развития (ЦУР) 3.8 по качеству медицинской помощи и 3.1 и 3.2 за счет повышения показателей смертности в этих уязвимых группах населения. Сепсис также может в конечном итоге привести к смерти пациентов, инфицированных ВИЧ, туберкулезом, малярией и другими инфекционными заболеваниями, включенными в задачу 3.3. Профилактика и / или надлежащая диагностика и лечение сепсиса также связаны с адекватным охватом вакцинами, всеобщим качественным медицинским страхованием, способностью соблюдать Международные медико-санитарные правила, подготовкой, а также услугами водоснабжения и санитарии.Однако проблема остается в том, как достичь универсальной профилактики, диагностики и лечения сепсиса.
Ответные меры ВОЗ на сепсис
В ответ на эту серьезную глобальную угрозу здоровью ВОЗ представила доклад Секретариата ВОЗ, и в мае 2017 года Семидесятая сессия Всемирной ассамблеи здравоохранения приняла резолюцию WHA70.7 от Улучшение профилактики, диагностики и клинического ведения сепсиса . Основными направлениями Резолюции WHA 70.7 являются:
- Разработка руководства ВОЗ по профилактике и лечению сепсиса
- Привлечение внимания к последствиям сепсиса для общественного здравоохранения и оценка глобального бремени сепсиса
- Поддержка государств-членов в определении и внедрении стандартов и установлении руководящие принципы, инфраструктура, лабораторный потенциал, стратегии и инструменты для выявления, снижения заболеваемости, заболеваемости и смертности от сепсиса
- Сотрудничать с организациями ООН, партнерами, международными организациями и заинтересованными сторонами для улучшения лечения сепсиса и профилактики инфекций и борьбы с ними, включая вакцинацию
В сотрудничестве и координации с региональными бюро ВОЗ, государствами-членами и другими заинтересованными сторонами несколько программ штаб-квартиры ВОЗ в настоящее время работают над воздействием сепсиса на общественное здоровье и предоставляют рекомендации и поддержку странам по профилактике сепсиса, ранней и надлежащей диагностике, a найти своевременное и соответствующее клиническое ведение.
Ссылки
(1) Радд К.Э., Джонсон С.К., Агеса К.М., Шакелфорд К.А., Цой Д., Киевлан Д.Р. и др. Глобальная, региональная и национальная заболеваемость и смертность от сепсиса, 1990-2017 гг .: анализ для исследования глобального бремени болезней. Ланцет (Лондон, Англия). 2020; 395 (10219): 200-11.
(2) Всемирная организация здравоохранения. Отчет ВОЗ о бремени эндемических инфекций, связанных с оказанием медицинской помощи, во всем мире. 2017-11-21 15:11:22 2011.
(3) Singer M, Deutschman CS, Seymour CW и др.Третий международный консенсус в определениях сепсиса и септического шока (Сепсис-3). JAMA 2016; 315 (8): 801-10.
(4) Gotts JE, Matthay MA. Сепсис: патофизиология и клиническое ведение. British Medical Journal, 2016.
(5) Центры США по контролю и профилактике заболеваний. Ресурсы для медицинских работников (HCP): Сепсис. Обновлено 27 августа 2019 г. T06: 23: 15Z. https://www.cdc.gov/sepsis/get-ahead-of-sepsis/hcp-resources.html (по состоянию на 25 февраля 2020 г.).
(6) Глобальный альянс по сепсису.Наборы инструментов. https://www.world-sepsis-day.org/toolkits/ (по состоянию на 25 февраля 2020 г.).
(7) UK Sepsis Trust. Образование. 2018. https://sepsistrust.org/education/ (по состоянию на 25 февраля 2020 г.).
(8) Lawn JE, Bianchi-Jassir F, Russell NJ, Kohli-Lynch M, Tann CJ, Hall J, et al. Стрептококковая инфекция группы B среди беременных, мертворожденных и детей во всем мире: зачем, что и как проводить оценки? Clin Infect Dis. 2017; 65 (допл_2): S89-S99.
(9) Столл Б.Дж., Хансен Н.И., Санчес П.Дж., Фаикс Р.Г., Пойндекстер Б.Б., Ван Мерс К.П. и др.Ранний неонатальный сепсис: бремя стрептококков группы B и кишечной палочки продолжается. Педиатрия. 2011; 127 (5): 817-26.
СЕПТИЧЕСКИЙ ШОК: Обзорная статья
Аннотация
Септический шок по-прежнему остается одной из основных причин смерти пациентов больниц. Лучшая осведомленность, понимание состояния и знание наиболее эффективных доступных лечебных мер могут снизить уровень смертности. Ранняя и точная диагностика септического шока — ключ к увеличению выживаемости.Чрезмерное воспаление, чрезмерная коагуляция и подавление фибринолиза — признаки сепсиса. Инфекционный контроль, стабилизация гемодинамики и модуляция септического ответа являются краеугольными камнями лечения. На лечение больше влияет соответствующее лечение антибиотиками и жидкостями, чем специальная интенсивная терапия. Септический ответ можно модулировать с помощью стероидов и активированного протеина С, а также с помощью жесткого контроля уровня глюкозы. Другие полезные стратегии при сепсисе — вентиляция с низким дыхательным объемом и гемофильтерация с большим объемом.Поскольку септический шок усиливается и не поддается лечению, нужно быть готовым ограничить и отменить лечение.
Септический шок по-прежнему остается одной из основных причин смерти пациентов больниц. Едва более 50% пациентов с тяжелым сепсисом выживают после госпитализации. Этот неприемлемо высокий уровень смертности можно снизить только при большей осведомленности и понимании этого состояния, а также при знании наиболее эффективных доступных лечебных мер.Незапланированная госпитализация в отделение интенсивной терапии (ОИТ) и потенциально предотвратимые смертельные случаи в палатах связаны с неспособностью создать ранние профилактические условия. Более 40% госпитализаций в отделения интенсивной терапии потенциально можно предотвратить с помощью улучшенного ухода.
Выживаемость пациентов с септическим шоком, по-видимому, лучше, если шок развивается, когда пациент находится в отделении интенсивной терапии, а не в палате общего профиля, несмотря на большую тяжесть заболевания в группе интенсивной терапии [1].Это говорит о том, что более тщательное наблюдение и более раннее лечение могут повлиять на исход сепсиса.
АВАРИЯ:
Септический шок становится все более распространенной проблемой. Заболеваемость сепсисом увеличивается с каждым годом. Причины этого увеличения заключаются в том, что люди живут дольше и это пожилое население наиболее уязвимо для сепсиса. Мы используем передовые технологии для поддержания жизни, и число пациентов с ослабленным иммунитетом выросло из-за агрессивной терапии рака и увеличения распространенности ВИЧ.Широкое применение антибиотиков широкого спектра действия привело к увеличению как устойчивости к антибиотикам, так и внутрибольничных инфекций.
Проспективное многоцентровое обсервационное исследование, недавно проведенное для оценки эпидемиологии сепсиса и других характеристик пациентов из отделений интенсивной терапии в европейских странах (так называемое исследование SOAP), было одобрено Европейским обществом интенсивной медицины [2]. Это обсервационное исследование показало заметную разницу в частоте сепсиса между странами, и более высокая частота сепсиса отражалась более высоким уровнем смертности.(Рис.1)
Рис. 1. Заболеваемость сепсисом в европейских странах
Была прямая связь между количеством отказов органов и смертностью в отделении интенсивной терапии. У пациентов без органной недостаточности при поступлении уровень смертности составлял 6%, тогда как у пациентов с четырьмя или более недостаточностью органов смертность составляла 65%. [2] (Рис. 2)
Рис. 2: Исследование SOAP
По сравнению с другими патологиями в Европе частота тяжелого сепсиса выше (32%) [2] (рис. 3)
Рис. 3. Распространенность различных патологий в Европе
У больных сепсисом, пожилой возраст, положительный водный баланс, сопутствующие заболевания при поступлении; рак и цирроз печени являются наиболее важными факторами смертности.
ОПРЕДЕЛЕНИЯ
Сепсис определяется как инфекция, которая вызывает определенный синдром системного воспалительного ответа (SIRS). Он характеризуется температурой тела за пределами 36oC — 38oC, ЧСС> 90 уд / мин, частотой дыхания> 20 / мин, количеством лейкоцитов> 12000 / мм3 или <4000 / мм3. (Рис. 4)
Рис. 4: Определения
В иерархии воспалительной реакции выделяют три стадии, при которых постепенно увеличивается риск органной недостаточности и смерти.Пациенты с инфекциями и двумя или более элементами ССВО соответствуют критериям сепсиса. Считается, что у тех, у кого есть органная недостаточность, тяжелый сепсис; а те, у кого имеется рефрактерная гипотензия наряду с вышеуказанными критериями, считаются находящимися в септическом шоке (рис. 5)
Рис. 5: Определения
ПАТОФИЗИОЛОГИЯ:
Сепсис — это сложное заболевание, начинающееся с инфекционного стимула и приводящее к усиленному иммунному ответу.Воспалительная реакция, инициированная для борьбы с инфекцией, в конечном итоге приводит к повреждению различных органов всего тела.
В начале сепсиса воспалительная система становится гиперактивной, включая как клеточные, так и гуморальные защитные механизмы. Эндотелиальные и эпителиальные клетки, а также нейтрофилы, макрофаги и лимфоциты производят мощные провоспалительные медиаторы, особенно фактор некроза опухоли (TNF-). , интерлейкин (ИЛ) -6, ИЛ-1 и ИЛ-8. Одновременно происходит устойчивое производство белков острой фазы, таких как C-реактивный белок, и активируются гуморальные защитные механизмы, такие как система комплемента, что приводит к выработке провоспалительных медиаторов, включая C5a, продукт расщепления комплемента.C5a в конечном итоге увеличивает выработку цитокинов и хемокинов. Кроме того, система свертывания крови активируется посредством различных механизмов, что часто приводит к диссеминированной внутрисосудистой коагулопатии.
Признаками сепсиса являются чрезмерное воспаление, чрезмерная коагуляция и подавление фибринолиза. Кроме того, уменьшается количество эндогенного активированного протеина С, который модулирует свертывание, контролирует воспаление и поддерживает фибринолиз. Существует значительная вариабельность реакции, которая почти наверняка в значительной степени определяется генетически.Те, у кого есть тенденция к чрезмерной выработке цитокинов и TNF, будут иметь более выраженный воспалительный ответ. Одновременно начальное повреждение сосудов приводит к активации нейтрофилов, адгезии нейтрофилов к эндотелиальным клеткам и дальнейшей выработке воспалительных цитокинов. В тканях, уже склонных к дисфункциональному поглощению и метаболизму кислорода, это сосудистое повреждение способствует дальнейшей гипоксии тканей из-за региональной гипоперфузии. Этот неконтролируемый каскад воспаления и коагуляции способствует прогрессированию сепсиса, что приводит к гипоксии тканей и ишемии, что приводит к дисфункции органов и смерти.
ДИАГНОСТИКА:
Диагностика сепсиса — дело непростое. Ранняя и точная диагностика септического шока — ключ к увеличению выживаемости. Признаки и симптомы тяжелого сепсиса могут быть незаметными. Хотя компоненты ССВО неспецифичны, сочетание подозреваемой инфекции и наличия ССВО может помочь врачу предупредить о возможном диагнозе сепсиса. Хотя артериальная гипотензия является еще одним клиническим признаком, который может сигнализировать о начале септического шока, у пациента может развиться тяжелый сепсис и клинически значимая глобальная гипоксия тканей в ее отсутствие.Метаболические маркеры, такие как лактат сыворотки, дефицит артериального основания, могут помочь в выявлении тяжелых случаев. Единичное измерение лактата 4 ммоль / л или более при первичном обращении связано с повышенным уровнем смертности [3]. Вполне могут быть признаки измененного мышления и нарушения функционального теста почек и печени, а также нарушения коагуляции. По крайней мере, две посевы крови и культуры из других участков, как указано до начала антибактериальной терапии. Диагностические исследования, такие как Ультразвук и компьютерная томография, следует проводить незамедлительно.
Диммеры
D сильно подняты при сепсисе. Снижается уровень протеина С, что имеет терапевтическое значение. Потенциальная роль биомаркеров для диагностики инфекции у пациентов с тяжелым сепсисом остается неопределенной. Возможно, наиболее распространенными диагностическими биомаркерами сепсиса являются С-реактивный белок и прокальцитонин. Несмотря на первоначальный энтузиазм по поводу их потенциальных диагностических преимуществ [4], в последнее время они были связаны с растущей грудой биомаркеров, которые не смогли точно дифференцировать сепсис от подобных критических заболеваний.
Наиболее захватывающим достижением за последние 2 года является признание «растворимого пускового рецептора, экспрессируемого на миелоидных клетках-1» (sTREM-1) в качестве потенциального биомаркера сепсиса. [5] Для этого маркера уровень выше 60 нг / мл был более точным, чем любые другие клинические и лабораторные данные, указывающие на инфекцию
.
ЛЕЧЕНИЕ:
Разработка новых методов лечения привела к появлению целого ряда алгоритмов лечения, часто распространяемых медицинскими обществами и организациями по улучшению здравоохранения.По мере распространения этих методов появляется все больше доказательств, подтверждающих или опровергающих их полезность при лечении пациентов с сепсисом. Одним из самых масштабных начинаний на сегодняшний день является Кампания по борьбе с сепсисом (SSC) [6], которая была первоначально запущена в 2002 году с заявленной целью снизить смертность на 25%. Основным методом достижения этой цели была разработка научно обоснованных руководств по лечению сепсиса, которые были опубликованы в 2004 году [6] и недавно пересмотрены в 2008 году.
Институт улучшения здравоохранения (IHI) выделил сепсис в качестве приоритетной области и выявил несколько недостатков, которые могут привести к неоптимальному уходу за пациентами с тяжелым сепсисом.Эти недостатки включают непоследовательность в ранней диагностике тяжелого сепсиса и септического шока, частую реанимацию недостаточного объема без определенных конечных точек, позднее или неадекватное применение антибиотиков, частую неспособность поддерживать сердечный выброс при депрессии, частую неспособность адекватно контролировать гипергликемии, частую неэффективность лечения. использовать низкие дыхательные объемы и давление при остром повреждении легких и частую неэффективность лечения недостаточности надпочечников при рефрактерном шоке.
На ведение пациентов с сепсисом больше влияет соответствующее лечение антибиотиками и жидкостями, чем специальная интенсивная терапия.Поэтому раннее вмешательство никогда не следует откладывать до поступления в отделение интенсивной терапии. Раннее и агрессивное лечение септического шока было хорошо задокументировано в кампании по выживанию при сепсисе, основанной на лучших современных практиках.
Краеугольными камнями лечения являются инфекционный контроль, стабилизация гемодинамики и модуляция септического ответа.
1. Инфекционный контроль:
Инфекционный контроль жизненно важен, если у пациента есть шанс на выживание.Соответствующие антибиотики широкого спектра действия необходимо назначить в течение первого часа после распознавания сепсиса после получения различных культур. Фактические данные ясно показывают, что отсрочка или неадекватное лечение антибиотиками приводит к ухудшению результатов. Смертность за каждый час увеличивается на 9%. [7]
Первоначальная эмпирическая противоинфекционная терапия должна включать один или несколько препаратов, которые обладают активностью против всех вероятных патогенов (бактериальных и / или грибковых) и которые проникают в адекватных концентрациях в предполагаемый источник сепсиса [8]. Антимикробный режим должен оцениваться ежедневно для оптимизации активности , чтобы предотвратить развитие резистентности, снизить токсичность и сократить расходы
Необходимо найти очаг инфекции и в случае его обнаружения немедленно принять меры.Пациент должен быть обследован на предмет очаговой инфекции, поддающейся лечению с помощью мер контроля источника, включая дренаж абсцесса или санацию тканей. Необходимо взвесить преимущества и риски конкретной выбранной процедуры. Если внутрисосудистые устройства являются потенциальным источником, они должны быть немедленно удалены после установления другого сосудистого доступа. Когда требуется контроль источника, следует использовать эффективное вмешательство, связанное с наименьшим физиологическим повреждением (например, чрескожное, а не хирургическое дренирование абсцесса)
2.Гемодинамическая стабилизация:
При септическом шоке обширное сердечно-сосудистое заболевание. Гипотония вызывается угнетением миокарда, патологической вазодилатацией и экстравазией циркулирующего объема из-за обширной утечки капилляров. Первоначальное реанимационное усилие — попытка исправить абсолютную и относительную гиповолемию путем заполнения сосудистого дерева. Нет никаких доказательств того, что один тип жидких кристаллоидов или коллоидов превосходит другой. Имеются убедительные доказательства того, что ранняя агрессивная объемная реанимация с применением золота улучшает исход сепсиса [9]. В течение первых 6 часов реанимации целями начальной реанимации являются центральное венозное давление 8-12 мм рт. мм рт. ст., диурез ≥ 0.5 мл • кг-1 • час и центральная венозная (верхняя полая вена) или смешанная венозная сатурация кислородом ≥ 70% или ≥ 65%, соответственно. Исследование Риверса ясно показывает снижение госпитальной смертности, смертности на 28 и 60 дней. смертность, связанная с терапией, направленной на раннее достижение цели (EGDT) [10]. В рандомизированном контролируемом одноцентровом исследовании было показано, что ранняя целенаправленная реанимация улучшает выживаемость пациентов отделения неотложной помощи с септическим шоком. [11] Реанимация, направленная на достижение ранее упомянутых целей в течение начального 6-часового периода реанимации, смогла снизить уровень госпитальной, 28-дневной, а также 60-дневной смертности (рис.6).
Рис. 6: Результаты терапии, направленной на раннее достижение цели (EGDT)
Если Scvo2 или SVo2 70% или 65%, соответственно, не достигается с помощью жидкостной реанимации до целевого значения центрального венозного давления, тогда переливание эритроцитов в эритроцитах для достижения гематокрита ≥ 30% и / или введение инфузии добутамина (до максимум 20 мкг • кг-1 • мин-1) можно использовать для достижения этой цели.
Важно помнить, что вазопрессоры следует использовать не только тогда, когда жидкости не могут вылечить гипотензию, но также во время реанимации для поддержания минимально адекватного артериального давления.Традиционно применение норадреналина у пациентов с шоком ограничивалось опасением чрезмерного сужения сосудов, которое может привести к гипоперфузии органов-мишеней. В прошлом его обычно давали только тогда, когда другие препараты вазопрессина не помогали, и, таким образом, у таких пациентов прогнозировался неблагоприятный исход. Недавние исследования показывают, что опасения пагубного воздействия были необоснованными и что норадреналин может играть роль вазопрессорного средства первой линии у пациентов с септическим шоком.
Вазопрессин следует рассматривать при рефрактерном шоке, несмотря на высокие дозы обычных вазопрессоров.Вазопрессин — это эндогенно продуцируемый гормон, дефицит которого наблюдается у многих пациентов с септическим шоком. Экзогенно вводимый вазопрессин в физиологических замещающих дозах может действовать синергетически с другими вазопрессорами и связан с ранней отменой катехоламина. В большинстве исследований оценивали краткосрочные инфузии вазопрессина со скоростью 0,08 Ед / мин или меньше в качестве дополнительной терапии у пациентов, нуждающихся в адренергических средствах. Результаты показывают, что начало приема вазопрессина у пациентов с септическим шоком увеличивает системное сосудистое сопротивление и артериальное давление, что снижает требования к дозировке адренергических агентов [12].Эти эффекты быстрые и устойчивые. Существенное увеличение выработки мочи, вероятно, из-за увеличения скорости клубочковой фильтрации, было показано в нескольких исследованиях. Несколько исследований продемонстрировали клинически значимое снижение сердечного выброса или сердечного индекса после назначения вазопрессина, что требует осторожного применения у пациентов с сердечной дисфункцией.
3. Модуляция септического ответа:
Есть несколько способов модулировать септический ответ. Сюда входит использование стероидов, жесткий контроль уровня глюкозы и использование активированного протеина С.Септический шок вызывает угнетение функции надпочечников, и это можно подтвердить, измерив уровень кортизола или используя синактановый тест. По сравнению с плацебо, назначение низких доз гидрокортизона (200–300 мг / сут в разделенных дозах) пациентам с септическим шоком снижает потребность в вазопрессорах [13] и снижает их смертность [14]. Низкие дозы гидрокортизона следует назначать только пациентам, не ответившим на синактановый тест, но на практике все пациенты получают это лечение до получения результата теста.После исследования кортикостероидной терапии септического шока (CORTICUS) в настоящее время наблюдается растущая тенденция к ограничению использования низких доз гидрокортизона только пациентами с рефрактерной гипотензией, которые уже принимают высокие дозы вазопрессоров [15]. Испытание действительно показало более быстрое разрешение септического шока у пациентов, получавших стероиды, но не продемонстрировало улучшения смертности при терапии стероидами. Было показано, что тщательный контроль уровня глюкозы в крови увеличивает выживаемость у пациентов с сепсисом в критическом состоянии.Когда консервативный (10-11,1 моль / л) гликемический контроль сравнивали с жестким контролем (4,4-6,1 ммоль / л) в многоцентровом рандомизированном контролируемом исследовании, жесткий контроль привел к значительному снижению смертности (8% против 4-6%). %), p <0-04 и снижение заболеваемости через 12 месяцев [16].
Активированный белок C
Человеческий активированный протеин C (APC) является эндогенным регулятором коагуляции. Для активации протеина C в плазме он должен соединяться с тромбином и тромбомодулином вместе с рецептором эндотелиального протеина C.При повреждении эндотелия эта активация не происходит, что приводит к его дефициту. Поэтому добавление APC является рациональным вариантом лечения. APC играет важную роль в лечении тяжелого сепсиса. Он защищает от разрушения мембраны эндотелиальных клеток, улучшает перфузию микроциркуляции, обладает противовоспалительным, прокоагулянтным, фибринолитическим и антиапоптотическим действием. В идеале АРС следует начинать в первые 24 часа после начала септического шока. В исследовании «Всемирная оценка рекомбинантного активированного протеина С человека при тяжелом сепсисе» (PROWESS) было обнаружено, что активированный протеин С снижает риск смерти среди всех пациентов с тяжелым сепсисом на 20% [17]. Это исследование также признало риск осложнений, особенно кровотечений.
Последующие исследования показали аналогичные результаты. «Применение дротрекогина альфа (активированного) при ранней стадии тяжелого сепсиса» (исследование ADDRESS) также предоставляет доказательства использования rhAPC у взрослых [18]. Дополнительная информация о безопасности получена из открытого наблюдательного исследования «Расширенная оценка рекомбинантного активированного протеина C» (след ENHANCE). [19] Исследование ENHANCE также показало, что раннее введение rhAPC было связано с лучшими результатами.
Другие полезные стратегии при сепсисе
Вентиляция с низким дыхательным объемом: использование вентиляции с нормальным или высоким дыхательным объемом (10-12 мл / кг) приведет к чрезмерному расширению нормальных сегментов легких.Это, в свою очередь, приведет к высвобождению медиаторов воспаления в ткани легких. Последствиями этого являются развитие острой травмы легких (ALI) или острого респираторного дистресс-синдрома (ARDS). Поэтому крайне важно использовать вентиляцию с низким дыхательным объемом (6 мл / кг), чтобы поддерживать давление в дыхательных путях на плато ниже 30 см вод. Ст. [20, 21]
Гемофильтерация большого объема: за последние пять лет было проведено множество исследований для оценки и демонстрации преимуществ увеличения объема ультрафильтрации и восполнения жидкости во время непрерывной заместительной почечной терапии [22, 23], особенно при сложных и очень тяжелых синдромах, таких как Тяжелый сепсис и септический шок, связанные с острой почечной недостаточностью или без нее.
В целом подход большого объема обеспечивает более высокий клиренс для растворенных веществ со средней / высокой молекулярной массой, чем простой диффузионный транспорт, непрерывный венозный гемодиализ (CVVHD) или конвекционный транспорт при меньших объемах, непрерывная венозная гемофильтрация (CVVH). Эти растворенные вещества, по-видимому, в первую очередь участвуют в синдроме системной воспалительной реакции, который характеризует синдром сепсиса, и поэтому их эффективное удаление может быть полезным. [24]
Альтернативные подходы основаны на более эффективном удалении медиаторов воспаления с помощью гемофильтров с высоким отсечением, которые характеризуются увеличенным эффективным размером пор.Большинство имеющихся в продаже гемофильтров не допускают существенного удаления цитокинов из-за низкой точки отсечения их мембран. Использование гемофильтров с высоким порогом отсечки — новый и эффективный подход к удалению цитокинов, но он имеет потенциально вредные побочные эффекты, такие как потеря основных белков, таких как альбумин [25].
Поскольку обратимость этого заболевания и связанная с ним смертность могут быть самыми высокими на самых ранних стадиях проявления, надлежащее лечение сепсиса не должно ограничиваться стенами отделения интенсивной терапии.Особый упор на соответствующую сортировку для обеспечения своевременной диагностики пациента из группы высокого риска имеет жизненно важное значение для начала скоординированных и совместных усилий лечащего врача и реаниматолога
Этические дилеммы при септическом шоке
Пациенты с септическим шоком имеют высокую смертность, и до сих пор не существует системы оценки, которая бы давала точные прогнозы исхода для отдельного пациента. Выживаемость после эпизода и септического шока зависит от возраста пациента, количества поврежденных органов, предыдущего состояния здоровья и времени задержки до начала медицинского вмешательства, а также от целесообразности и качества медицинской помощи.Доступные нам ресурсы не безграничны, поэтому приходится принимать трудные решения, выбирая между потенциальными преимуществами для одного тяжелобольного пациента и потребностью для нескольких менее тяжелых пациентов. Как интенсив, человек должен устанавливать реалистичные ожидания, которые должны быть четко доведены до сведения соответствующих семей. Поскольку септический шок усиливается и не поддается лечению, нужно быть готовым ограничить и отменить лечение.
КОНКУРЕНТНЫЕ ИНТЕРЕСЫ
Не задекларировано
ДАННЫЕ ОБ АВТОРЕ
KHADIJA E QURESHI, BSC, MBBS, DA, FCPS, ST2- Anesthetics, Hemel Hempstead General Hospital, Великобритания
ABID RAJAH, MB ChB, FRCA, FFARCSI, ведущий врач и консультант в области интенсивной терапии, больница общего профиля Хемел Хемпстед, Великобритания
ПЕРЕПИСКА: Д-р Абид Раджа, ведущий врач и консультант отделения интенсивной терапии, больница общего профиля Хемел-Хемпстед, Hillfield Road, Hemel Hempstead, HP2 4AD
Электронная почта: ARajah @ aol.com
ССЫЛКИ
- Лундберг Дж., Perl TM. Септический шок: анализ результатов для пациентов с дебютом в больничных палатах по сравнению с отделениями интенсивной терапии. Crit Care Med 1998; 26: 1020-24
- Vincent JL, Sakr Y, и Sprung CL, et al. Сепсис в европейских отделениях интенсивной терапии: результаты исследования SOAP. Crit Care Med. 2006; 34: 344-353.
- Шапиро Н.И., Гомельский доктор медицинских наук, Талмор Д., Натансон Л.А., Лиссабон А., Вулф Р.Э. и др. Лактаты сыворотки как предиктор смертности у пациентов отделения неотложной помощи с инфекцией.Ann Emerg Med. 2005; 45: 524-8.
- Харбарт С., Гарбино Дж., Пугин Дж. И др. Несоответствующая начальная антимикробная терапия и ее влияние на выживаемость в клинических испытаниях иммуномодулирующей терапии тяжелого сепсиса. Am J Med. 2003; 115: 529-535.
- Гибот С., Колопп-Сарда М.Н., Бене М.С. и др. Уровень триггерного рецептора, экспрессируемого на миелоидных клетках-1 в плазме: его диагностическая точность у пациентов с подозрением на сепсис. Ann Intern Med. 2004; 141: 9-15.
- Кампания выживших при сепсисе.Доступно по адресу: http://www.surviving sepsis.org/, дата обращения 6 марта 2007 г.
- Деллинджер Р.П., Карлет Дж. М., Мазур Н и др. Руководство Surviving Sepsis C по ведению тяжелого сепсиса и септического шока. Crit Care med. 2004; 32: 858-873
- Battleman DS, Каллахан М, Талер HT. Быстрая доставка антибиотиков и соответствующий выбор антибиотиков сокращают продолжительность пребывания в больнице пациентов с внебольничной пневмонией: связь между качеством помощи и использованием ресурсов. Arch Intern Medicine 2002; 162 (6): 682-8.
- Леви М.М., Финк М.П., Маршалл Дж. К. и др. 2001 SCCM / ESICM / ACCP / ATS / SIS Международная конференция по определениям сепсиса. Crit Care Med. 2003; 31: 1250-1256.
- Rivers E, Nguyen B, Havstad S и др. Ранняя целенаправленная терапия в лечении тяжелого сепсиса и септического шока. N Engl J Med. 2001; 345: 1368-1377
- Эмануэль Риверс. Исход пациентов, поступающих в отделение неотложной помощи с тяжелым сепсисом или септическим шоком. Crit Care. 2006; 10 (4): 154
- Obritsch MD; Bestul DJ; Юнг Р; Рыба DN; Макларен Р.Роль вазопрессина при вазодилататорном септическом шоке. Фармакотерапия. 2004; 24 (8): 1050-63 (ISSN: 0277-0008)
- Briegel J, Frost H, Haller M, Shelling G, Kilger E, Kuprat G et. Стрессовые дозы гидрокортизона обратного гипердинамического септического шока: проспективное рандомизированное двойное слепое одноцентровое исследование. Crit Care Med 1999; 27: 723-32.
- Annane D, Sebille V, Charpentier C и др. Влияние лечения низкими дозами гидрокортизона и флудрокортизона на смертность пациентов с септическим шоком.JAMA. 2002; 288: 862-871.
- Подрессоренная CL. Обновленная информация о клинических испытаниях при тяжелом сепсисе. CORTICUS испытание. Программа и рефераты Общества реанимации больным инфекцией. Ann Emerg Med 2005: 45 (524-8).
- Van den Berghe G, Wilmer A, Hermans G, et al. Интенсивная инсулинотерапия в медицинском отделении интенсивной терапии. N Engl J Med. 2006; 354: 449-461
- Бернард Г.Р., Винсент Дж.Л., Латерир П.Ф. и др. Группа исследования «Всемирная оценка рекомбинантного человеческого протеина С при тяжелом сепсисе» (PROWESS).Эффективность и безопасность рекомбинантного активированного протеина С человека при тяжелом сепсисе. N Engl J Med. 2001; 344: 699-709.
- Abraham E, Laterre PF, Garg R, et al: Drotrecogin alfa (активированный) для взрослых с тяжелым сепсисом и низким риском смерти. N Engl J Med 2005; 353: 1332-1341.
- Винсент Дж. Л., Бернард Г. Р., Бил Р. и др.: Лечение дротрекогином альфа (активированным) при тяжелом сепсисе из глобального открытого исследования ENHANCE: дополнительные доказательства выживаемости и безопасности и значение для раннего лечения.Crit Care Med 2005; 33: 2266-2277.
- Исследователи сети ARDS. Вентиляция с меньшими дыхательными объемами по сравнению с традиционными дыхательными объемами при остром повреждении легких и остром респираторном дистресс-синдроме. N Engl J Med. 2000; 342: 1301-1308.
- Национальный институт сердца, легких и крови, сеть клинических испытаний острого респираторного дистресс-синдрома (ARDS), Wiedemann HP, Wheeler AP, et al. Сравнение двух стратегий управления жидкостями при остром повреждении легких. N Engl J Med. 2006; 354: 2564-2575.
- Piccinni P, Dan M, Barbacini S, Carraro R, Lieta E, Marafon S, Zamperetti N, Brendolan A, D’Intini V, Tetta C и др .: Ранняя изоволемическая гемофильтрация у олигурических пациентов с септическим шоком. Intensive Care Med 2006, 32: 80-86.
- Reiter K, D’Intini V, Bordoni V, Baldwin I, Bellomo R, Tetta C, Brendolan A, Ronco C: Гемофильтрация большого объема при сепсисе. Нефрон 2002, 92: 251-258.
- Ronco C, Tetta C, Mariano F, Wratten ML, Bonello M, Bordoni V, Cardona X, Inguaggiato P, Pilotto L, d’Intini V, Bellomo R: Интерпретация механизмов непрерывной заместительной почечной терапии при сепсисе: максимальная концентрация гипотеза.Artif Organs 2003, 27: 792-801.
- Мариано Ф., Фонсато В., Ланфранко Дж., Полмайер Р., Ронко С., Триоло Дж., Камусси Дж., Тетта С., Пасслик-Дитджен Дж .: Адаптация высокопрочных мембран и возможное применение при острой почечной недостаточности, связанной с сепсисом: исследования in vitro. Трансплантат Nephrol Dial 2005, 20: 1116-1126.
.
Отчет о клиническом случае и обзор литературы
ВВЕДЕНИЕ
Сепсис — серьезное бремя для здравоохранения во всем мире [ 1 ] .В США ежегодно регистрируется 970000 случаев сепсиса [ 2 ] . При общем сепсисе в США связанная с ним смертность составляет 12,5%. Тяжесть сепсиса влияет на исходы, при этом смертность от септического шока составляет 35% [ 2 ] . Своевременная диагностика и раннее лечение — ключ к лечению. Любая задержка с назначением антибиотиков связана с обострением сепсиса [ 3 ] .
Мартин и др. [ 4 ] проанализировано 2.6 миллионов случаев сепсиса из основной базы данных США за шесть лет. У пятнадцати процентов пациентов на момент госпитализации не было проявлений сепсиса. В этой группе пациентов показатели смертности были наихудшими. В группе больных сепсисом на момент обращения смертность ниже. Этот улучшенный результат может быть связан со своевременной диагностикой и быстрым введением антибиотиков.
Доказано, что эмпирическое введение антибиотиков в течение одного часа после поступления снижает смертность от сепсиса [ 5 ] .Антимикробные агенты широкого спектра действия выбираются на основе наиболее распространенных грамположительных и грамотрицательных бактериальных инфекций [ 6 ] . Инфекция дыхательных путей является наиболее частой этиологией сепсиса и септического шока [ 7 ] . Туберкулез (ТБ) — это необычная, но хорошо известная этиология сепсиса, которая редко обсуждается среди населения западных стран.
Mycobacterium tuberculosis — кислотоустойчивые бактерии с преобладающим легочным представлением [ 8 ] , хотя и не частая причина пневмонии в западном населении.Только двадцать процентов случаев имеют единственное внелегочное проявление [ 8 ] . Заболеваемость туберкулезным септическим шоком (TBSS), хотя и не сообщается, носит спорадический характер. Центр по контролю и профилактике заболеваний сообщил о снижении заболеваемости туберкулезом [ 9 ] . Редкость TBSS делает эту серию дел новой. Мы описываем три случая TBSS, представленных в нашем учреждении. Несмотря на диагноз сепсиса при поступлении, уровень летальности очень высок, в отличие от общих ожиданий в эпидемиологии сепсиса [ 2 ] .Каждый случай уникален своей презентацией, и эта серия случаев дает прекрасную возможность проанализировать демографические особенности, клинические характеристики, рентгенологические и лабораторные данные, а также подводные камни в ведении пациентов с TBSS.
ПРЕДСТАВЛЕНИЕ ДЕЛА
Дело 1
Основная жалоба: Женщина 67 лет, поступившая в отделение неотложной помощи с прогрессирующим ухудшением одышки и лихорадки.
Анамнез настоящего заболевания: Пациент жаловался на потерю веса на 20 фунтов за три месяца.У нее была одышка, лихорадка и продуктивный кашель в течение четырех недель.
История перенесенных заболеваний: У нее были заболевания гипертонией, хронической обструктивной болезнью легких, гастроэзофагеальной рефлюксной болезнью, подагрой и 40-летним стажем курения. Она жила дома и в 9 лет болела туберкулезом, а также имела положительный туберкулиновый кожный тест. Она никогда не выезжала за пределы страны.
Физикальное обследование: Показатели жизненно важных функций были значимы для субфебрильной температуры 37.9 ° C, пульс 110 ударов в минуту, артериальное давление 165/100 мм рт. Ст. И насыщение кислородом 96% на воздухе помещения. У нее были двусторонние хрипы при аускультации легких, остальная часть физического осмотра была без особенностей
Лабораторные исследования: Анализ крови был значимым для гипонатриемии (натрий 118 мэкв / л) и анемии (гемоглобин 7,3 г / дл).
Визуализирующие исследования: Рентгенография грудной клетки и компьютерная томография (КТ) при поступлении показали двусторонние очаговые инфильтраты преимущественно в верхних долях (рис. 1A и B).
Рис. 1 Рентген грудной клетки и компьютерная томография (случай 1).
A: Рентген грудной клетки, демонстрирующий двусторонние пятнистые инфильтраты во время госпитализации; B: компьютерная томография грудной клетки с корональным срезом, демонстрирующая двусторонние очаговые инфильтраты во время госпитализации; C: рентгеновский снимок грудной клетки, демонстрирующий ухудшение двусторонних инфильтратов после интубации и назначения противотуберкулезных препаратов.
Лечение: Цефтриаксон и азитромицин были начаты по поводу внебольничной пневмонии (ВП), и она была госпитализирована в отделение интенсивной терапии (ОИТ) по поводу сепсиса и гипонатриемии. Ее также поместили в респираторную изоляцию из-за высокого подозрения на туберкулез. На 2-й день госпитализации было зарегистрировано положительное окрашивание на кислотоустойчивые бациллы мокроты (КУБ), и пациенту начали принимать изониазид, рифампин, этамбутол и пиразинамид (RIPE) в отношении Mycobacterium tuberculosis .Тест на вирус иммунодефицита человека (ВИЧ) был отрицательным. Mycobacterium tuberculosis был подтвержден полимеразной цепной реакцией (ПЦР) перед окончательным отчетом о культуре. Впоследствии она становилась все более гипоксической и гипотензивной, требующей искусственной вентиляции легких и вазопрессорной поддержки. Рентген грудной клетки после интубации показал ухудшение двусторонних инфильтратов в легких (рис. 1С). У нее развилась полиорганная недостаточность вследствие шока, включая нарушения функции печени и почек, требующие гемодиализа.Пациенту также были назначены высокие дозы стероидов, расширился охват антибиотиками без значительного улучшения гемодинамического статуса.
Окончательный диагноз: Септический шок, вызванный Mycobacterium tuberculosis .
Результат и дальнейшие действия: Из-за плохого прогноза и отсутствия улучшения состояния пациента семья пожелала перевода в хоспис, и пациент умер на 22 день госпитализации. Окончательные отчеты о культуре и восприимчивости подтвердили чувствительность к RIPE.
Дело 2
Жалобы начальника: Мужчина 33 лет был вызван в отделение неотложной помощи с отклонениями в результатах лабораторных исследований.
История настоящего заболевания: В отделении неотложной помощи он сообщил о субъективном повышении температуры тела, плохом аппетите и потере веса в течение одного месяца. Он также сообщил о диарее в течение последних нескольких дней, но без боли в животе, тошноты, рвоты, кашля или одышки.
История перенесенного заболевания: Пациент имел в анамнезе ВИЧ / синдром приобретенного иммунодефицита (СПИД), не принимавший антиретровирусные препараты с очень высокой вирусной нагрузкой и числом CD4 менее 20, употребление наркотиков в прошлом и активная табачная зависимость.В анамнезе он болел анемией и тромбозом глубоких вен и несколько месяцев до обращения жил в доме престарелых. Он родился в Пуэрто-Рико и приехал в Соединенные Штаты год назад.
Физикальное обследование при поступлении: Показатели жизненно важных функций были значимыми для гипотонии с артериальным давлением 91/60 мм рт.ст., тахикардии с ЧСС 130 ударов в минуту и лихорадки с температурой 39,4 ° C. При медицинском осмотре он был вялым и сбитым с толку. Гипотония первоначально уменьшилась при внутривенном введении жидкостей
Лабораторные исследования: Первоначальные лабораторные данные были значимыми для лейкоцитоза 31151 / мкл и гипонатриемии (натрий 121 мэкв / л).
Визуализирующие исследования: Рентгенография грудной клетки при поступлении не показала инфильтратов (рис. 2А). Ультразвуковое исследование брюшной полости выявило гепатоспленомегалию, асцит и увеличенные перипанкреатические лимфатические узлы
Рисунок 2 Рентген грудной клетки (случай 2).
А: Рентген грудной клетки без инфильтратов на момент поступления; B: Рентген грудной клетки с новыми инфильтратами и гипоксией, требующими интубации и искусственной вентиляции легких.
Лечение: Пациент был госпитализирован в отделение интенсивной терапии с предположительным диагнозом сепсис и начат прием антибиотиков широкого спектра действия (ванкомицин и пиперациллин-тазобактам). Ему начали прием метронидазола при подозрении на колит Clostridium difficile . Впоследствии у него развилась острая гипоксическая дыхательная недостаточность и септический шок, потребовавшие интубации и вазопрессорной поддержки. Рентген грудной клетки после интубации показал новые двусторонние инфильтраты (рис. 2В).Культуры крови были отрицательными. Ему была сделана люмбальная пункция, которая показала давление открытия 35 см H 2 O, количество красных кровяных телец (RBC) 1825 клеток / дл, количество лейкоцитов 1 клетка / дл, глюкоза 65 мг / дл и белок 36 мг / дл. Ввиду значительного количества эритроцитов в спинномозговой жидкости (ЦСЖ) и высокого давления открытия ему также был назначен ацикловир в качестве эмпирического лечения энцефалита простого герпеса. Бронхоальвеолярный лаваж (БАЛ) был отрицательным для бактериальных, вирусных, грибковых культур и Pneumocystis jirovecii культур.Первоначальные мазки на AFB были отрицательными. Бактериальные культуры спинномозговой жидкости и ПЦР вируса простого герпеса были отрицательными. Он был назначен на антиретровирусную терапию на 8-й день госпитализации после отрицательного результата предварительных посевов. В связи с постоянными скачками температуры и лимфаденопатией была проведена консультация гематолога, пациенту была сделана биопсия костного мозга и биопсия правого подмышечного лимфатического узла. Каспофунгин был добавлен к его схеме приема антибиотиков при рефрактерном септическом шоке и стойкой лихорадке. Биопсия костного мозга была положительной на кислотоустойчивые организмы.Патология биопсии правого подмышечного лимфатического узла сообщается как некротические гранулемы с микобактериями. Было начато эмпирическое лечение Mycobacterium tuberculosis и комплекса Mycobacterium avium с изониазидом, этамбутолом, рифабутином, пиразинамидом и кларитромицином, ожидая окончательного подтверждения
Окончательный диагноз: Септический шок, вызванный Mycobacterium tuberculosis.
Результат и наблюдение: Пациент умер в результате обострения шока и полиорганной недостаточности через 22 дня после госпитализации.Культуры мокроты, БАЛ и перитонеальной жидкости оказались положительными для комплекса Mycobacterium tuberculosis после вскрытия, а отчеты о чувствительности не подтвердили устойчивости.
Случай 3
Основные жалобы: Женщина 49 лет, поступившая в больницу с продуктивным кашлем на три-четыре недели.
Анамнез настоящего заболевания: Пациент обратился с жалобой на усиливающийся кашель, одышку и хрипы. Она отрицала жар, озноб, потерю веса, недавние путешествия или контакты с больными.
История перенесенных болезней: Ее медицинские состояния включали гипертонию, латентный туберкулез (лечился в течение 6 месяцев в 2007 году в зависимости от пациента), астму и курение.
Физикальное обследование при поступлении: Показатели жизненно важных функций были значимыми для умеренной тахикардии с частотой сердечных сокращений 114 ударов в минуту. У нее не было лихорадки, нормальное кровяное давление и 98% сатурация кислорода в помещении. При аускультации были двусторонние хрипы, остальная часть исследования без особенностей.
Лабораторные исследования: Первичный анализ крови выявил лейкоцитоз с количеством лейкоцитов 11300 клеток / мкл. Ее электролиты и функциональные пробы печени были нормальными, за исключением высокого уровня щелочной фосфатазы 111 единиц / дл.
Визуальные исследования: Рентген грудной клетки при поступлении показал стабильную полость с толстыми стенками левой верхней доли и новые инфильтраты левой нижней доли по сравнению с рентгеновским снимком грудной клетки, сделанным несколько недель назад (рис. 3A). Была сделана компьютерная томография грудной клетки, которая выявила дополнительные полости левого легкого с толстыми стенками и множественные узелки с обеих сторон (Рисунок 3B).
Рис. 3 Рентген грудной клетки и компьютерная аксиальная томография (случай 3).
A: Рентген грудной клетки выявляет левую полость верхней доли и инфильтраты левой нижней доли во время поступления; B: компьютерная томография грудной клетки при поступлении, выявляющая толстостенные полости левого легкого и множественные узелки с обеих сторон; C: рентгеновский снимок грудной клетки, показывающий ухудшение двустороннего инфильтрата после интубации и приема противотуберкулезных препаратов.
Лечение: Учитывая высокий уровень подозрения на туберкулез, она была помещена на респираторную изоляцию и начата антибиотики широкого спектра действия с внутривенным введением пиперациллин-тазобактама и ванкомицина. Три образца мокроты изначально были отрицательными на КУБ. Дифференциальный диагноз включал туберкулез легких, атипичные микобактерии и грибковые инфекции. Ей сделали бронхоскопию, БАЛ и трансбронхиальную биопсию. Окрашивание БАЛ было положительным на КУБ, и микобактерии ТБ были идентифицированы с помощью ДНК-зонда и последующих культур.Культуры из БАЛ также росли pseudomonas aeruginosa с низким количеством колоний 1000-9000 КОЕ / мл. Pseudomonas был пан-чувствительным. Антибиотики титровали с началом RIPE и отменой ванкомицина.
Окончательный диагноз: Септический шок, вызванный Mycobacterium tuberculosis .
Результат и наблюдение: На 6-й день госпитализации ее респираторный статус отказался от необходимости интубации по поводу гипоксической дыхательной недостаточности и перевода в отделение интенсивной терапии. У нее развились двусторонние инфильтраты (рис. 3C), гипонатриемия (125 мэкв / л натрия) и септический шок.Она осталась в шоке и скончалась на 12-й день госпитализации.
ОБСУЖДЕНИЕ
Существует достаточно литературы, подтверждающей летальность TBSS [ 10 ] . Очевидно, что быстрое выявление и раннее введение антибиотиков снижает смертность. Факторы риска смерти тяжелобольных больных туберкулезом определены [ 11 ] . Однако, учитывая ограниченность TBSS, не существует стандартного протокола для улучшения результатов этого редкого заболевания.Мы рассмотрели наши дела и проанализировали их, чтобы определить препятствия в ведении TBSS. Чтобы лучше понять управление TBSS, мы разделили его на несколько категорий. Сюда входит понимание патофизиологии TBSS, клинических проявлений высокого риска, методов оперативной диагностики и полезности эмпирического лечения ТБ на основе клинических подозрений.
TBSS встречается крайне редко. Kethireddy и др. [ 10 ] в ограниченном институциональном обзоре по всему миру могут определить TBSS как этиологию септического шока в 1% случаев из 5419 пациентов.Большинство из них были идентифицированы за пределами США. Заболеваемость в Соединенных Штатах практически не обнаруживалась. Учитывая клиническую редкость туберкулеза в зоне низкой распространенности [ 10 ] , подозрение на диагноз невелико. Следовательно, следует определить районы с высокой распространенностью ТБ. Калифорния лидирует по уровню заболеваемости ТБ в Соединенных Штатах, за ней следуют Техас, Нью-Йорк и Флорида [ 12 ] . За один год в Нью-Йорке число случаев ТБ увеличилось на 10% с 2016 по 2017 год [ 13 ] .Каждое учреждение должно определить свой уровень риска туберкулеза на основе географии и временных тенденций заболеваемости туберкулезом.
Клинические признаки, такие как длительная лихорадка, типичные результаты рентгенограммы грудной клетки, латентный ТБ, диагностированный по положительному туберкулиновому тесту кожи [ 14 ] очень подозрительны на активную инфекцию ТБ. По аналогии с этими клиническими параметрами была предложена прогностическая модель для диагностики туберкулеза у госпитализированных пациентов [ 15 ] .Следовательно, сочетание высокой географической распространенности, временных тенденций и симптоматических подозрений на активный туберкулез следует использовать в целях клинической проницательности для раннего выявления случаев высокого риска.
Чтобы поставить окончательный диагноз, необходимо незамедлительно сочетать эффективный протокол тестирования с высоким клиническим подозрением на ТБ. Легочные проявления — самые частые проявления. Типичные рентгенологические данные грудной клетки играют важную роль в высоком клиническом подозрении. Однако ему не хватает специфичности [ 16 ] .Рентгенограмма грудной клетки и клинические признаки могут быть ошибочно интерпретированы как CAP [ 17 ] . До постановки диагноза ТБ [ 18 ] пациенты часто проходят лечение с помощью целевых противомикробных агентов CAP. Микроскопия мокроты с кислотостойким окрашиванием, первый шаг в диагностике, является быстрой и простой, хотя и за счет надежности из-за низкой чувствительности [ 19 ] . Для определения туберкулеза легких в соответствии с рекомендациями ВОЗ необходимо наличие бактерий в мокроте [ 20 ] .Посев мокроты — надежный, предпочтительный и золотой стандарт диагностики туберкулеза легких. Тем не менее, культивирование требует затрат времени, и отчет о них занимает от двух до шести недель [ 19 ] . Тест амплификации нуклеиновых кислот (NAAT) в мокроте представляет собой идеальное сочетание быстроты и надежности [ 21 ] для получения микробиологического заключения и начала применения противомикробных агентов ТБ. Чувствительность различается у больных туберкулезом с положительной и отрицательной мокротой [ 21 ] .Использование NAAT со временем увеличивается [ 22 ] . Нет единого мнения о проведении NAA для всех госпитализированных пациентов с подозрением на активный ТБ. Центры по контролю за заболеваниями рекомендуют NAAT мокроты по крайней мере на одном образце мокроты у пациента с клиническими признаками, указывающими на туберкулез, если предполагаемый тест изменяет тактику, устанавливая диагноз [ 23 , 24 ] .
Клинические проявления ТБ у пациентов с иммуносупрессией, вызванной ВИЧ, не похожи на иммунокомпетентного хозяина.ВИЧ-инфицированные люди с большей вероятностью заболеют внелегочным туберкулезом по сравнению с ВИЧ-отрицательными людьми [ 25 ] . Те, у кого более низкое количество CD4, с большей вероятностью будут иметь внелегочный ТБ [ 26 ] . Широкий спектр различий для системного заболевания у пациентов с запущенным СПИДом, как в нашем сценарии, затрудняет диагностику диссеминированного ТБ. ВИЧ-инфицированные люди с туберкулезом могут иметь атипичные рентгенологические данные грудной клетки [ 27 ] , у небольшой части из них рентгенограммы грудной клетки нормальные [ 24 ] .Эти неблагоприятные факторы в виде атипичных проявлений в сочетании с нехарактерными радиологическими данными у пациентов с ВИЧ препятствуют раннему назначению противотуберкулезных препаратов и, следовательно, могут иметь худшие результаты при TBSS.
Культура эмпирического лечения туберкулеза в разных странах разная. Мы предполагаем, что эту тенденцию определяют заболеваемость и распространенность болезни. Термин «эмпирический» обозначает две фундаментальные концепции. Первый — это предполагаемое лечение подозрительного заболевания в ожидании диагноза.Во-вторых, это предполагаемый режим при ожидании культуры и чувствительности. Оба параметра влияют на исход сепсиса. Тесты на молекулярную лекарственную устойчивость позволяют быстро определить лекарственную устойчивость к изониазиду и рифампицину [ 28 ] и могут использоваться для титрования противотуберкулезных препаратов. Однако, учитывая наш ограниченный опыт и редкость TBSS, трудно высказать мнение о рутинном использовании молекулярных тестов на лекарственную устойчивость для лечения TBSS.Мы провели стандартное тестирование лекарственной чувствительности при ведении наших пациентов, и никакой лекарственной устойчивости выявлено не было.
Время играет важную роль в лечении сепсиса. Сроки приема антибиотиков подразделяются на: (1) сроки от отделения неотложной помощи; и (2) Время от начала сепсиса или септического шока [ 29 ] . Мы тщательно проанализировали результаты Kethireddy et al [ 10 ] , чтобы проанализировать «время» приема антибиотиков и исход TBSS.Прием противотуберкулезных препаратов в течение 24 часов после септического шока улучшил показатели смертности. В наших случаях мы использовали нашу клиническую проницательность, чтобы быстро поставить диагноз ТБ с помощью соответствующих тестов на чувствительность и своевременного приема противотуберкулезных препаратов. Несмотря на оптимальное управление, результаты были наихудшими. Эти парадоксальные открытия разожгли наше любопытство, чтобы глубже изучить патогенез TBSS.
Синдром системного воспалительного ответа (SIRS) определяется иммунным ответом хозяина в форме четырех переменных: частота сердечных сокращений, частота дыхания, температура и лейкоцитоз [ 30 ] .Учитывая вариабельность иммунного ответа, это определение сепсиса [ 31 ] имело некоторые недостатки. Воспалительная реакция может быть достаточно серьезной, чтобы вызвать нарушение кровообращения и обмена веществ, идентифицированное как септический шок [ 32 ] . Своевременное введение антибиотиков, нацеленных на провоцирующую этиологию ССВО, должно привести к предотвращению септического шока. Однако в наших случаях мы наблюдали парадоксальное клиническое ухудшение после введения противотуберкулезных препаратов, которое может быть объяснено воспалительным синдромом восстановления иммунитета после приема антибиотиков (IRIS).
У наших иммунокомпетентных пациентов клиническое течение ухудшилось после начала приема противотуберкулезных препаратов. В случаях Кетиредди и др. [ 10 ] и других сериях [ 33 ] тяжелобольных пациентов с ТБ мы не смогли получить какие-либо аналогичные наблюдения обострения вызванного ТБ сепсиса. после приема антибиотиков. В случае коинфекции ВИЧ хорошо известен субъект IRIS [ 34 ] .Однако парадоксальное ухудшение во время противотуберкулезной терапии может быть связано с туберкулезом IRIS у ВИЧ-отрицательной популяции [ 35 ] . При туберкулезе, не инфицированном ВИЧ, ВСВИ имеет внелегочную форму и хроническое течение [ 36 ] . Патогенез туберкулеза IRIS у людей, не инфицированных ВИЧ, был предложен [ 37 ] , но не получил широкого распространения в клинической практике. Бактериальная нагрузка ТБ была определена как один из факторов риска ТБ IRIS [ 38 ] .Преднизон использовался для профилактики IRIS [ 39 ] . Однако нет четкого консенсуса относительно использования стероидов у ВИЧ-отрицательных пациентов, но их можно рассматривать как [ 37 ] . Тщательный анализ клинического течения в нескольких отчетах о случаях и сериях показывает аналогичное клиническое течение [ 40 — 42 ] . Следовательно, следует оценить возможность ВСВИ в клинических сценариях TBSS после введения противомикробных препаратов.
Гипонатриемия — еще одна поразительная особенность наших пациентов. Гипонатриемия часто встречается у пациентов с легочным туберкулезом, и ее тяжесть коррелирует с обширным поражением легочной паренхимы и положительным результатом мокроты [ 43 ] . Эта корреляция показывает возможность высокой бактериальной нагрузки ТБ у пациентов с гипонатриемией. Патогенез гипонатриемии, хотя и плохо изучен, был связан с несоответствующей секрецией антидиуретического гормона [ 44 ] .Гипонатриемия, хотя и не является статистически значимой, связана с высокими показателями смертности у пациента с легочным туберкулезом [ 45 ] . Но быстрая гибель иммунокомпетентных пациентов после приема противомикробных препаратов от ТБ заставляет задуматься о том, есть ли какая-либо корреляция между гипонатриемией и высокой бактериальной нагрузкой ТБ и ВСВИ. Насколько нам известно, не существует протокола исследования, посвященного этому конкретному обоснованию. Учитывая скудность данных, мы хотим сделать вывод о том, что этот факт гипонатриемии и туберкулезного ВСВИ является «наблюдением», а не «сильной ассоциацией».
Патогенез и клиническое течение туберкулеза у пациентов с ослабленным иммунитетом различаются с частыми атипичными проявлениями и внелегочной диссеминацией [ 46 ] . ТБ может приводить к обострению ВИЧ-виремии и ускорению иммуносупрессии [ 47 ] , следовательно, к увеличению смертности от ВИЧ [ 48 ] . У нашего пациента с коинфекцией ВИЧ начало септического шока было до постановки диагноза ТБ и назначения лекарств.Клинические данные свидетельствуют о распространенном туберкулезе. Пациент принимал внутривенные стероиды до введения противотуберкулезных микробов. Это показывает другую патофизиологию, чем у наших иммунокомпетентных хозяев. Нарушение регуляции иммунитета более вероятно из-за бактериальной инфекции, чем из-за восстановления иммунной системы. Однако распространенный ВИЧ мог способствовать смертности, несмотря на введение противотуберкулезных микробов.
От патофизиологии к индивидуальному уходу за пациентами
Сепсис превратился в серьезную экономическую проблему здравоохранения: в больницах умирает больше пациентов из-за связанных с сепсисом осложнений, чем от рака груди и колоректального рака вместе взятых.Несмотря на обширные исследования, направленные на улучшение исходов при сепсисе за последние несколько десятилетий, результаты крупных многоцентровых исследований в целом были очень разочаровывающими. Это фиаско можно объяснить несколькими факторами, но одной из наиболее важных причин является неопределенное определение сепсиса, приводящее к очень разнородным популяциям пациентов, и отсутствие понимания патофизиологии, которое в основном основано на дисбалансе иммунного ответа хозяина. . Однако эта героическая исследовательская работа не прошла даром.Рассматривая результаты положительных и отрицательных исследований в контексте, мы можем теперь подойти к сепсису с другой точки зрения, что может привести нас к новым перспективам в диагностике и лечении. В то время как принятие решений на основе традиционных определений сепсиса может неизбежно привести к ложному суждению из-за неоднородности пациентов, новые концепции, основанные на текущих знаниях в иммунологии, могут помочь адаптировать оценку и лечение этих пациентов к их реальным потребностям. Целью этого обзора является обобщение того, где мы находимся в настоящее время и что нас ждет в будущем.
1. Введение
Одной из наиболее сложных задач в медицине интенсивной терапии является лечение серьезной полиорганной дисфункции, связанной с инфекцией, которую обычно называют сепсисом, тяжелым сепсисом и септическим шоком. Однако сепсис означает очень разнородную популяцию пациентов, которая различается по этиологии и степени тяжести; поэтому трудно определить универсальные диагностические критерии и алгоритмы лечения. Эта неоднородность оказалась одним из самых сложных препятствий, с которым не могли согласиться большинство проспективных рандомизированных исследований; следовательно, они не смогли продемонстрировать ни четкого улучшения выживаемости, ни положительных результатов одноцентровых исследований, которые позже были опровергнуты крупными многоцентровыми исследованиями [1].Тем не менее, сепсис стал очень важной проблемой здравоохранения во всем мире.
Кроме того, лечение сепсиса — это многопрофильная задача. Раннее распознавание и начало первых шагов реанимации неизбежны, чтобы дать наилучшие возможные шансы на выживание, которые следует начинать на уровне первичной медико-санитарной помощи: вне больницы, в отделении неотложной помощи или в палатах. В отсутствие надлежащего начального лечения оказание даже интенсивной терапии наивысшего уровня было бы напрасным.
Хотя результаты проспективных рандомизированных клинических испытаний могут быть неутешительными с точки зрения выживаемости, несомненно, что мы многое узнали о патофизиологии сепсиса в ходе проведения этих исследований за последние несколько десятилетий. Понимание иммунологического фона клинической картины имеет первостепенное значение, что позволяет клиницисту интерпретировать результаты диагностических тестов и оптимизировать методы лечения наиболее подходящим образом. Цель этого обзора состоит в том, чтобы выделить некоторые из текущих новшеств в патофизиологии сепсиса и потенциальные новые перспективы.
2. Сепсис не является «окончательным» заболеванием
В медицинской школе нас воспитывали в мире «окончательных диагнозов». Это означает, что пациенты приходят с определенной жалобой, врач после сбора истории болезни, проведения физикального обследования и диагностических тестов определяет диагноз и соответственно лечит пациента. В случае четко определенного заболевания во всем мире проводятся более или менее одинаковые или похожие диагностические тесты и терапевтические вмешательства (например, инсульт и инфаркт миокарда).Это верно для большинства болезней в классической медицине и хирургии. Однако определить сепсис не так просто. Термин, который мы называем «синдромом сепсиса», был придуман в гостиничном номере в Лас-Вегасе в 1980 году во время написания протокола одного из первых проспективных рандомизированных исследований сепсиса, проведенного группой ученых во главе с покойным Роджером Боуном [2, 3]. Основываясь на критериях включения в это исследование, те же авторы позже опубликовали отчетный документ под названием «Синдром сепсиса: достоверное клиническое проявление» [3].Однако эти классические признаки «синдрома сепсиса», такие как лихорадка / гипотермия, лейкоцитоз / лейкопения, тахикардия и гипотензия, означали очень большую и неспецифическую / неинфекционную группу пациентов. По этой причине несколько лет спустя была собрана консенсусная конференция, на которой были определены так называемые «критерии консенсуса» сепсиса [4], которые также недавно подвергались сомнению и критике со стороны Винсента и др. [5]. В самом последнем «Руководстве по кампании по выживанию при сепсисе» было дано более надежное и подробное определение, чтобы «спасти» предыдущую концепцию критериев кости [6].
Эти усилия ясно показывают, что поиск подходящего определения сепсиса был постоянной проблемой на протяжении более 30 лет. Сложность определения сепсиса проистекает из его патофизиологии, которая будет обсуждаться в разделе 4. Это было признано международными сообществами, и в настоящее время международная рабочая группа работает над новым, основанным на патофизиологии определением сепсиса. Тем не менее, в большинстве специальностей само заболевание легко диагностируется с помощью лабораторных или рентгенологических исследований.Однако в случае сепсиса все иначе, что затрудняет не только диагностику, но и интерпретацию результатов клинических испытаний, а также эпидемиологических данных.
3. Эпидемиология
Согласно недавним исследованиям, в настоящее время мы лечим в несколько раз больше тяжелобольных пациентов в отделениях интенсивной терапии (ОИТ) по всему миру по сравнению с данными, полученными более 10 лет назад [7]. Похоже, что наблюдается рост заболеваемости сепсисом, уровень смертности составляет 20–50%, и, согласно последним данным из США, сепсис является единственной самой дорогой причиной госпитализации в настоящее время [8, 9].Однако важно отметить, что зарегистрированные показатели смертности значительно различаются по всему миру. Недавний ретроспективный анализ, проведенный в Австралии и Новой Зеландии, показал увеличение числа тяжелых больных и пациентов с сепсисом за последние 12 лет при снижении смертности с более чем 30% до менее чем 20% [7]. В исследовании PROCESS, проведенном в США, смертность составила около 20% [10]. Согласно этим данным, результат за последние годы значительно улучшился. Однако результаты из Европы, как ретроспективные, так и проспективные, указывают на более высокую смертность на 45–55%, что также сопровождалось увеличением времени пребывания в ОИТ и больнице в 2–3 раза [11, 12] по сравнению с данными, полученными в исследовании. два ранее упомянутых исследования.Возникает вопрос: лучше ли медицинское обслуживание в тех странах, где уровень смертности ниже, или это различие вызвано отбором пациентов? Хотя трудно дать окончательный ответ, ссылаясь на нашу предыдущую главу, из-за трудностей с определением сепсиса, тяжелого сепсиса и септического шока, нельзя исключать, что эта разница может быть результатом неопределенности при выборе пациентов, и в странах, сообщающих о более высоких показателях смертности, более тяжелые пациенты были включены в когорту «септического шока».
Действительно, пациенты с одним и тем же диагнозом «септический шок» могли иметь совершенно разную степень тяжести и прогноз. То же самое относится к любому потенциальному «оскорблению» в отделениях интенсивной терапии, например, травме, стерильному воспалению (острый панкреатит), ишемии-реперфузии, серьезному хирургическому вмешательству, ожогам и инфекциям. Эти состояния имеют одну и ту же особенность в своей патофизиологии, а именно, что не инсульт как таковой , а ответ хозяина, особенно иммунный ответ, определяет серьезность и исход (рис. 1).
4. Патофизиология
4.1. От локализованного оскорбления к «цитокиновой буре»
Иммунная система — это «командная работа», в которой задействовано множество разных игроков, взаимодействующих друг с другом как оркестр. Иммунный ответ на патогены зависит как от врожденных, так и от адаптивных компонентов. Первая линия защиты от захватчиков состоит из физических барьеров, таких как кожа [13, 14], слизистые оболочки желудочно-кишечного тракта [15], дыхательных [16] и мочеполовых [17] трактов.Вторая линия — это быстрая защита со стороны системы врожденного иммунитета (включая белки комплемента, сторожевые фагоциты и естественные клетки-киллеры), которая играет роль активатора и регулятора адаптивной иммунной системы [18]. Врожденная система действует путем широкого распознавания антигенов, главным образом путем распознавания ассоциированных с патогенами молекулярных паттернов (PAMP) углеводов и жирных кислот, расположенных на поверхности обычных патогенов. В целом, когда местный ответ распространяется системно, активация нескольких классов рецепторов распознавания образов вызовет «цитокин-хемокиновый шторм» [19].Однако очень похожие молекулы высвобождаются из-за повреждения клеток после травм, ожогов, ишемии-реперфузии, панкреатита, серьезной операции и т. Д., Происходящие из некротических клеток, в основном из митохондрий. Их называют «молекулярными структурами, связанными с повреждениями» (DAMP). Это было очень важным осознанием того, что после клеточного повреждения подобные белки будут высвобождаться во время бактериальной инфекции, потому что генетический фон бактерий и митохондрий очень похож [20]. Это подчеркивает тот факт, что концепция Кости неизбежно смешивала пациентов, перенесших инсульт из-за PAMP, DAMP или их смеси.
Активация нейтрофилов, макрофагов и моноцитов костимулирующими молекулами в месте инфекции включает местную адаптивную иммунную систему и дает «разрешение» адаптивной системе реагировать на инфекционное поражение. Целью врожденного ответа является искоренение DAMP и PAMP, за которым следует адаптивный ответ с разрешением иммунологического процесса. Адаптивный иммунный ответ основан на созревании и пролиферации, на которые влияет «цитокиновая сигнатура» врожденного ответа.Другими словами, у каждого хозяина есть своя «цитокиновая подпись» для определенного повреждения. В нормальных условиях эти процессы хорошо регулируются, поддерживая равномерный баланс между противодействующими силами, тем самым сохраняя локализацию воспалительной реакции.
Однако в случае несбалансированной (провоспалительной и противовоспалительной), нерегулируемой (созревание и пролиферация) реакции локализованный процесс выходит из-под контроля и становится системным, другими словами, заболеванием всего организма; следовательно, он уступает место нарушению функции отдаленных жизненно важных органов.Это делает клинические проявления критического заболевания такими похожими независимо от травмы. Например, такая же степень тяжести острого респираторного дистресс-синдрома (ОРДС), шока или ухудшения психической функции может возникнуть при панкреатите так же, как и после серьезной операции, или из-за любого типа инфекции (Рисунок 2). Адаптивная иммунная система как третий уровень защиты основана на ее воспоминаниях. Он может адаптироваться и защитить нас практически от любого захватчика.
Вкратце, «цитокиновая сигнатура» нейтрофилов и макрофагов будет давать сигналы Т- и В-лимфоцитам через дендритные клетки, которые после пролиферации путем созревания будут экспрессировать различные рецепторы клеточной поверхности в растворимой или мембраносвязанной формах.Адаптивный иммунный ответ представляет собой растворимую матрицу, которая состоит из каскадной активации цитокинов, факторов свертывания крови, высвобождения белков острой фазы, гормонов стресса и различных хемокинов и гормонов, образующих сложную сеть. Ключевым фактором иммунного разрешения является баланс между провоспалительными и противовоспалительными силами, который в основном определяется балансом между отношениями Th2, Th3, Th27 и ΔT друг к другу, а именно, созреванием, величиной и продолжительностью. их деятельности [19].
4.2. Синдром системного воспалительного ответа (SIRS) и иммунопаралич
Основываясь на критериях костей, синдром системного воспалительного ответа, изобретенный на Консенсусной конференции в 1991 г. [4], первоначально означал классические критерии «синдрома сепсиса» без доказанной инфекции. Критерии SIRS также подвергались критике по тем же причинам, что и определение «синдрома сепсиса», но, тем не менее, эта «концепция SIRS» предполагала, что системная воспалительная реакция может возникать на инсульт без инфекции.
В прошлом считалось, что ССВО связано с дисбалансом между провоспалительными ответами и противовоспалительными ответами. Однако все сложнее. В контексте врожденного и адаптивного иммунных ответов как провоспалительные, так и противовоспалительные процессы протекают параллельно. Когда вступают в действие провоспалительные и противовоспалительные силы, провоспалительные силы вначале подавляют противовоспалительный процесс.В целом можно сказать, что противовоспалительный ответ имеет небольшую задержку по сравнению с провоспалительным. Это провоспалительное «доминирование» длится от 2 до 4 дней, но чрезмерный ответ, который означает, что локализованное поражение становится системным, приведет к разной степени повреждения тканей, шоку и, в конечном итоге, к отказу органа. Во время болезни адаптивный ответ инициируется реакцией Th2. На следующем этапе провоспалительный процесс медленно «выключается», а адаптивный ответ переключается на ответ Th3.Другими словами, эта более поздняя фаза помогает пережить провоспалительный процесс после искоренения инсульта с помощью « restitutio ad integrum » [21]. Однако дисрегулируемая системная форма адаптивного ответа может позже вызвать иммунопаралич, ставя под угрозу защиту организма и, следовательно, делая его склонным к дальнейшим, даже оппортунистическим инфекциям. В этом процессе остается много вопросов, на которые нет ответа, но их подробное обсуждение выходит далеко за рамки данной статьи [22].
4.3. Измененный иммунный ответ и перепрограммирование лейкоцитов
На более поздней стадии, у пациентов с сепсисом и у пациентов с тяжелым неинфекционным ССВО (например, ожоги, травмы, серьезная операция, кровотечение или ишемия-реперфузия после остановки сердца) противовоспалительный процесс может подавить провоспалительные силы. Это часто называют «анергией», «непереносимостью эндотоксина», «иммунопараличом» или «иммунодепрессией», но это очень общие и упрощенные описания того, что на самом деле происходит.Термин клеточное перепрограммирование может быть более точным, указывая на клеточные изменения во время этого процесса. Вкратце, перепрограммирование клеток означает два противоположных параллельных клеточных процесса: клетки, происходящие из гематопоэтических отделов, таких как костный мозг, селезенка, лимфатические узлы и кровь, становятся гипореактивными. Напротив, клетки, полученные из других тканей и твердых органов (например, печени, почек, легких, головного мозга или желудочно-кишечного тракта), часто могут быть гиперреактивными, вызывая гипервоспаление в определенных органах, особенно в инфицированном органе.Подавление одних сигнальных путей параллельно с другими, которые поддерживаются или усиливаются, приводит к большому разнообразию иммунных ответов. Сама по себе иммуносупрессия не причиняет вреда, но оставляет пациента подверженным инфекции. К сожалению, тесты, позволяющие измерить степень иммуносупрессии, не доступны круглосуточно; следовательно, врачу не на что полагаться, кроме как на этиологию, клиническую картину и биомаркеры, чтобы как можно скорее обнаружить начало потенциально разрушительной новой инфекции [21, 22].
5. Проблемы диагностики
Одно из наиболее распространенных заблуждений при диагностике сепсиса состоит в том, что мы искали специфический «маркер (маркеры) сепсиса». Однако нет и никогда не будет единого маркера, который мог бы диагностировать сепсис, в основном из-за очень ярких проявлений сепсиса и из-за неоднородности пациентов.
Распознавание пациента с сепсисом состоит из двух основных элементов. С одной стороны, мы должны оценить функцию жизненно важных органов и степень дисфункции органов с помощью объективных признаков, таких как гипотония, гипоперфузия, изменение психического статуса, кислотно-щелочной дисбаланс, гипоксемия, уровни лактата, дисфункция почек и печени и тромбоцитопения.Основываясь на этих результатах, мы должны начать поддерживающую терапию без каких-либо дальнейших задержек, и если есть какие-либо подозрения на возможность инфекции, эмпирическую антибактериальную терапию также следует начать немедленно (рис. 1) [16].
А пока мы должны диагностировать этиологию критического заболевания. Другими словами, мы должны решить, является ли критическое заболевание из-за инфекции или нет . Потому что, если это связано с инфекцией, антибиотики следует начинать как можно скорее, но если это не связано с бактериальной инфекцией, антибиотики — это не просто пустая трата времени и денег, но они также могут нанести вред в краткосрочной и долгосрочной перспективе.К сожалению, диагностировать инфекцию у тяжелобольных пациентов непросто.
5.1. Обычные маркеры инфекции
Клинические признаки являются наиболее важными для распознавания критического заболевания, но они не могут доказать наличие инфекции сами по себе. Обычные (лихорадка / гипотермия, лейкоцитоз / лейкопения, тахипное, тахикардия и гипотензия) показатели, также перечисленные в классических критериях «сепсис-синдрома», очень неспецифичны, фактически являются плохими показателями инфекции. Для микробиологического доказательства инфекции, хотя это очень важно, результаты, к сожалению, становятся доступны не ранее чем через 24–48 часов после отправки образца в лабораторию.Согласно нашей нынешней концепции, крайне важно начать адекватную антибактериальную терапию как можно скорее, но, по крайней мере, в течение часа после начала инфекции, вызвавшей гипотензию; в противном случае шансы на выживание сокращаются с каждым часом [23].
Теперь доступны новые методы молекулярной биологии для определения присутствия ДНК бактерий или грибов в кровотоке пациентов [24, 25]. Сложные тесты на основе молекулярной биологии, такие как полимеразная цепная реакция (ПЦР), матричная лазерная десорбция / ионизация (Мальди / Тоф) и обнаружение патогенов на основе пептидной флуоресценции нуклеиновых кислот in situ (PNAFISH), теоретически могут сократить время распознавания основного патогена. примерно до 8 часов [26].Однако они не могут отличить колонизацию от клинически значимой инфекции. Поэтому нам нужны лабораторные тесты, которые являются достаточно чувствительными и специфичными, чтобы как можно скорее показать начало и масштабы бактериальной инвазии, вызвавшей воспалительный ответ, а также могут отслеживать прогресс заболевания в течение нескольких часов. Эти биологически активные вещества называются биомаркерами .
5.2. Роль биомаркеров у постели больного
К настоящему времени разработано несколько биомаркеров [1], но ни один из них не подходит для всех целей.У каждого маркера есть свои достоинства и ограничения. Они неизбежно могут поддержать принятие решений, но они никогда не смогут отличить «сепсис» от «SIRS» со 100% чувствительностью и специфичностью, в основном из-за проблем, которые мы подробно обсуждали ранее относительно проблем определения сепсиса, а также из-за сложный, перекрывающийся патомеханизм PAMP и DAMP. Тем не менее, поиск лучших, новых маркеров воспалительной реакции и инфекции все еще продолжается, с многообещающими предварительными результатами [40].
Существует почти 200 так называемых маркеров сепсиса; поэтому обсуждение их характеристик не может быть включено в текущий обзор. В основном мы сосредоточимся на двух наиболее часто используемых маркерах: прокальцитонине (ПКТ) и С-реактивном белке (СРБ). Однако краткое упоминание основных характеристик некоторых других новых маркеров, уже применяемых в повседневной практике, таких как растворимый подтип CD14 (пресепсин) и растворимый рецептор активатора плазминогена урокиназного типа (suPAR), может иметь смысл. Более высокие концентрации пресепсина у пациентов с сепсисом были связаны со смертностью в ОИТ в недавнем крупном многоцентровом исследовании [41].Было также высказано предположение, что изменения концентраций в плазме могут отражать целесообразность антибактериальной терапии, но это должно быть подтверждено будущими исследованиями [41]. Что касается молекулы suPAR, то было показано, что она является очень хорошим индикатором тяжести острого заболевания и показывает хорошую корреляцию со степенью органной дисфункции у тяжелобольных, но не может рассматриваться как «маркер сепсиса» из-за своей низкой специфичности [ 42].
Любое состояние, индуцирующее DAMP [43] или PAMP, может разрушить слой эндотелиального гликокаликса.В нескольких экспериментальных исследованиях на различных септических моделях было подтверждено, что повреждение эндотелиального слоя гликокаликса отражается в повышенных уровнях сывороточного синдекана-1 и синдекана-4 [44–47], которые могут быть потенциально очень интересным маркером в будущем, но опять же, он может быть неспецифическим только для бактериальной инфекции.
Наконец, соотношение нейтрофилов и лимфоцитов является дешевым, быстрым и легкодоступным инструментом для диагностики бактериемии. В недавнем исследовании, проведенном в отделении неотложной помощи [48] , было обнаружено, что он улучшает диагностику инфекций кровотока. Этот простой тест может иметь потенциал в будущем.
Тем не менее, двумя наиболее часто используемыми маркерами в диагностике инфекций / сепсиса и для определения терапевтических вмешательств являются ПКТ и СРБ [49]. Несмотря на их популярность, все еще есть много плюсов и минусов без четких ответов относительно их полезности и интерпретации при ведении пациентов.
Прокальцитонин обнаруживается в сыворотке крови в течение нескольких (4–6) часов после начала бактериальной инфекции.Во время «нормального» течения инфекции она достигает своего пика в течение 24 часов, а затем начинает свое снижение в случае адекватного лечения, когда уровни снижаются примерно на 50% ежедневно в соответствии с периодом полувыведения [27]. Напротив, CRP движется «медленно» и при аналогичных обстоятельствах достигает своего максимального значения обычно в течение 48 часов. Однако у большинства пациентов интенсивной терапии уровни обычно повышены, что очень затрудняет интерпретацию СРБ [50]. Другая серьезная проблема с CRP в отделении интенсивной терапии заключается в том, что он сильно отстает от фактических событий воспалительного процесса.Наиболее важные различия между двумя маркерами суммированы в таблице 1.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Прокальцитонин позволяет дифференцировать бактериальные инфекции другой воспалительной природы с более высокой чувствительностью и специфичностью по сравнению с CRP [39].Имеются убедительные доказательства того, что принятие решений при принятии решений во время лечения антибиотиками при помощи ПКТ имеет несколько положительных эффектов. Это значительно сократило использование антибиотиков при инфекциях нижних дыхательных путей без ущерба для выживаемости [51], а также может сократить продолжительность лечения антибиотиками в отделении интенсивной терапии [52].
Хотя в следующих параграфах мы будем в основном ссылаться на исследования, изучающие ПКТ, концепция интерпретации этих данных потенциально применима для любого воспалительного маркера и должна приниматься во внимание при оценке уровней биомаркеров у постели больного.
6. Устный перевод РСТ
6.1. Сепсис отличается у хирургических и медицинских пациентов
Хотя сепсис часто называют «окончательным заболеванием» (см. Выше), в клиническом исследовании, опубликованном более 10 лет назад, было обнаружено, что уровни ПКТ в хирургических случаях в несколько раз выше по сравнению с медицинскими пациентами с септическим шоком, несмотря на сходные клинические проявления и тяжесть клинической картины [53]. Это указывает на разную степень воспалительной реакции в зависимости от этиологии.Действительно, появляется все больше доказательств того, что в случае массивного повреждения клеток, например, при тяжелой травме [54], после обширного хирургического вмешательства [55], и любого повреждения типа ишемии-реперфузии, включая кардиогенный шок [37], из-за механизма DAMP [56] неспецифическое повышение уровня ПКТ обычно наблюдается даже в отсутствие бактериальной инфекции [57, 58]. Теоретически у хирургических пациентов с сепсисом DAMP и PAMP имеют место одновременно, что приводит к подавляющему воспалительному ответу, тогда как у медицинских пациентов это в первую очередь активация PAMP, что приводит к менее обширному воспалительному ответу, следовательно, к более низким уровням биомаркеров [53 ].В исследовании Clec’h et al. Среднее значение ПКТ в SIRS у медицинских пациентов по сравнению с хирургическими пациентами составляло 0,3 (0,1–1,0), против 5,7 (2,7–8,3), а при септическом шоке: 8,4 (3,6–8,3). 76,0) против 34,0 (7,1–76,0) нг / мл соответственно.
Еще одним очень важным дополнением к этим результатам было исследование Charles et al., В котором они обнаружили различную степень воспалительного ответа у пациентов с первым септическим инсультом по сравнению с пациентами со вторым септическим инсультом [59].Они исследовали пациентов с первичными и вторичными инфекциями кровотока и обнаружили, что одинаковая тяжесть инфекции сопровождалась в несколько раз меньшим максимальным уровнем ПКТ у пациентов во время второго события инфекции по сравнению с пациентами с первичным событием. Кривая рабочих характеристик приемника сывороточного ПКТ для диагностики инфекции кровотока у тяжелобольных пациентов с первичным сепсисом с пороговым значением 55,6 нг / мл составила 0,934, 95% ДИ: 0,881–0,970, а у пациентов со вторичным сепсисом с Отсечка PCT 6.4 нг / мл это было 0,805, 95% ДИ: 0,699–0,879. Это наблюдение согласуется с тем, что мы уже обсуждали об иммунопараличе и клеточном репрограммировании в предыдущих параграфах в контексте ПКТ на Рисунке 3. Это показывает, что к более низким уровням ПКТ следует относиться серьезно в случае предупреждения (второго или третьего). ) начало инфекции, и эта концепция получила дальнейшее подтверждение в нескольких недавних сообщениях [60, 61].
Эти исследования ясно показывают, что данное значение ПКТ следует интерпретировать по-разному, в зависимости от этиологии и динамики критического состояния.Очевидно, что «один размер [биомаркера] не подходит всем»; следовательно, нельзя пренебрегать тщательной оценкой данного клинического сценария при интерпретации данного лабораторного результата. Прежде чем мы обсудим важность кинетики биомаркеров, давайте сначала рассмотрим результаты недавно опубликованных клинических испытаний в этом контексте.
В недавних крупных клинических испытаниях была проверена эффективность антибиотических стратегий на основе ПКТ с применением принципа «один размер подходит всем»; другими словами, заранее определенные абсолютные значения (например,g.,> 1 нг / мл) в качестве концепции, и результаты были либо незначительными, либо пациентам требовалась более длительная искусственная вентиляция легких и длительное применение антибиотиков в группе PCT [62, 63]. Однако процент хирургических пациентов в обоих исследованиях составлял около 40%, а значение ПКТ, указывающее на необходимость вмешательства, было выбрано равным ≥1 нг / мл. Основываясь на результатах предыдущих исследований, посвященных изучению уровней ПКТ у хирургических и медицинских пациентов, как мы обсуждали ранее, это пороговое значение 1 нг / мл для вмешательства является очень низким значением ПКТ в конкретной хирургической популяции, в основном из группы высокого риска.Действительно, в исследовании Layios et al., Пациентам с ПКТ ≥1 нг / мл антибиотики не назначались только в 11%. Хотя данные по этой подгруппе хирургических пациентов предоставлены не были, можно предположить, что эти пациенты получали антибиотики в больших количествах без необходимости. То же самое может относиться к исследованию PASS, в котором ненужное использование антибиотиков и их эскалация были неизбежны в группе ПКТ из-за в целом низких уровней «тревожного ПКТ» (≥1 нг / мл) в протоколе исследования [63] . Однако, если период полувыведения биомаркера достаточно короткий, учет кинетики вместо или в дополнение к их абсолютным значениям может дать несколько теоретических преимуществ.
6.2. Кинетика по абсолютным значениям
Хотя абсолютные значения ПКТ демонстрируют существенные различия в зависимости от этиологии и течения заболевания, кинетика может быть схожей и более полезной. Tsangaris et al. изучили 50 пациентов, которые находились в отделении интенсивной терапии более 10 дней, не имели инфекции и у которых впервые появилась лихорадка. Прокальцитонин показал как минимум 2-кратное повышение у 27 пациентов со дня до начала лихорадки, и у этих пациентов инфекция была в конечном итоге доказана.Напротив, инфекция не была доказана у 23 пациентов, у которых уровень ПКТ оставался стабильно низким и неизменным по сравнению с предыдущими днями. Они пришли к выводу, что двукратное повышение ПКТ между началом лихорадки и накануне было связано с доказанной инфекцией. Кроме того, нормальное значение ПКТ на третий день после начала лихорадки было связано с лучшей выживаемостью. Важно отметить, что наблюдаемые максимальные значения ПКТ у пациентов с доказанной инфекцией оставались относительно низкими (<1.5 нг / мл), но это было не абсолютное значение, а увеличение в несколько раз, свидетельствовавшее об остром начале инфекции [64].
Это подводит нас к важности кинетики ПКТ. В большинстве исследований кинетика ПКТ в основном тестировалась для прогнозирования тяжести и исхода, а не для выбора терапии [32, 65]. В недавнем пилотном исследовании у пациентов, получавших лечение в отделении интенсивной терапии, мы обнаружили значительные различия в изменении ПКТ за день до этого (день -1 ) до дня, когда в соответствии с клинической картиной подозревалась новая инфекция (день 0 ). ).В день -1 уровни ПКТ были аналогичны у пациентов, у которых инфекция была в конечном итоге доказана, по сравнению с пациентами, у которых мы не могли доказать наличие инфекции. Хотя в день -0 абсолютные значения уровней ПКТ были повышены в обеих группах, уровни были значительно выше у пациентов, у которых позднее была подтверждена инфекция. Что наиболее важно, хотя в неинфекционной группе не было значительного изменения уровней ПКТ с -1 до 0 дней, скорость повышения была значительной в группе с инфекцией [34].Также было показано, что кинетика ПКТ (падение> 80% от максимального значения) может быть очень полезной для преждевременного прекращения антибактериальной терапии, что значительно снижает потребление антибиотиков и продолжительность лечения, что также рекомендуется в недавнем Руководстве по выживанию при сепсисе [6 , 52]. Эти результаты предполагают, что терапия, основанная на кинетике ПКТ, может быть лучше по сравнению с предопределенными абсолютными значениями, и эта гипотеза будет проверена в будущем.
6.3. Грибковые и вирусные инфекции
Недавние исследования показывают, что грибковые инфекции имеют тенденцию к увеличению у пациентов в критическом состоянии [66, 67].Candida spp. являются третьим или четвертым из наиболее часто выделяемых микроорганизмов в кровотоке пациентов ОИТ, и, как сообщается, связанная с ним смертность достигает 40–60% [67, 68]. Кандидемию или инвазивный кандидоз определяют по положительному посеву крови и наличию клинических признаков системной инфекции. Грибковые инфекции трудно диагностировать с помощью посевов крови, потому что для выращивания этих организмов требуется значительное время, а результаты часто остаются отрицательными [69, 70]. К сожалению, клинические признаки очень неспецифичны для отделения бактериального сепсиса от кандидозного сепсиса.В ряде клинических испытаний было предложено потенциальное диагностическое значение ПКТ в этом контексте. Martini et al. исследовали уровни ПКТ для диагностики кандидемии или бактериемии у пациентов с сепсисом. Они обнаружили, что низкий уровень ПКТ (0,71 [0,5–1,1] нг / мл) у тяжелобольного пациента с сепсисом с большей вероятностью связан с кандидемией, чем с бактериемией [71]. Другое испытание Cortegiani et al. сообщили, что ПКТ может быть полезным диагностическим инструментом для отделения Candida spp. инфекция кровотока (0.99 нг / мл, 0,86–1,34) от инфекции кровотока, вызванной бактериями (16,7 нг / мл, 7,65–50,2) или при смешанных инфекциях (4,76 нг / мл, 2,98–6,08). Не было различий в уровнях ПКТ, чтобы исключить обнаружение Candida spp. При посеве крови (живые Candida) и ПЦР в реальном времени (убитые Candida) у пациентов с сепсисом. В этом исследовании значительно более низкие значения ПКТ наблюдались в [72].
Marková et al. определена роль тестирования ПКТ у пациентов с высоким риском инвазивной грибковой инфекции. В их число вошли гематологические пациенты с ослабленным иммунитетом, перенесшие химиотерапию или трансплантацию аллогенных гемопоэтических стволовых клеток, у которых были бактериальные или грибковые инфекционные осложнения.С-реактивный белок и ПКТ проспективно оценивались со следующего дня после начала лихорадки в течение четырех дней подряд. Они обнаружили повышенный уровень СРБ в сочетании с умеренным или не повышенным уровнем ПКТ у пациентов с ослабленным иммунитетом, вероятно, из-за грибковой инфекции. Следовательно, дополнительное использование этих биомаркеров может помочь в диагностическом методе [35].
В недавнем системном обзоре и метаанализе обобщены текущие данные о роли ПКТ в дифференциации грибковых инфекций от других инфекционных заболеваний.Они определили 8 подходящих исследований и обобщили 474 эпизода подозреваемых грибковых инфекций. Наиболее часто выделяемыми возбудителями были Candida albicans , Candida parapsilosis , Candida glabrata , Candida tropicalis , Aspergillus spp., и Penicillium zygomycota . Они обнаружили, что ПКТ обладает хорошей диагностической силой для отделения инвазивных грибковых и бактериальных инфекций от неинфекционных заболеваний [73].
В другом клиническом исследовании изучались различия между грамотрицательными (G-), грамположительными (G +) и грибковыми инфекциями кровотока. Они наблюдали значительно более высокие уровни ПКТ у пациентов с G− по сравнению с G + -инфекциями и даже более низкие уровни при фунгемии [74].
Что касается вирусных инфекций, большинство опубликованных результатов согласны с тем, что ПКТ может различать вирусные и бактериальные инфекции, поскольку в последнем случае уровни будут оставаться низкими [75–77]. Однако важно признать, что любое состояние, включая тяжелую вирусную инфекцию, небактериальное системное воспалительное состояние, такое как стерильный острый панкреатит или любое ишемически-реперфузионное повреждение, которое сопровождается значительной гипотензией / гипоперфузией тканей, может вызывать DAMP-индуцированный Повышение ПКТ, что может затруднить дифференциальную диагностику [56, 78, 79].
7. Лечение: что нас ждет в будущем?
7.1. Экстракорпоральное удаление медиаторов и токсинов
Экстракорпоральное удаление плазмы посредством гемофильтрации и плазменного фереза в последние десятилетия вызвало большой интерес в исследованиях сепсиса. Поскольку результаты были противоречивыми, в настоящее время внимание сосредоточено на новых альтернативах, таких как целенаправленное удаление токсинов и медиаторов посредством специфической адсорбции.
7.1.1. Полимиксин-B
Полимиксин-B (PMX-B) представляет собой циклический катионный полипептидный антибиотик, происходящий из Bacillus polymyxa .Этот антибиотик обладает способностью связывать и нейтрализовать эндотоксины [80]. Исследования показали, что PMX-B подавляет реакцию TNF- α на эндотоксин [81], что связано с высокой аффинностью связывания PMX-B с молекулами LPS. К сожалению, инфузия PMX-B вызывает нефротоксичность и нейротоксичность у людей [82]. Однако, когда полимиксин B ковалентно связан с волокном, полученным из полистирола, в картридже для гемоперфузии, его можно использовать для удаления циркулирующих эндотоксинов без систематического проявления его нежелательных эффектов.Площадь поверхности колонки чрезвычайно велика, поэтому она может удалить большое количество циркулирующих эндотоксинов за относительно короткий период времени [83]. Другой потенциально полезный эффект гемоперфузии PMX-B — удаление некоторых воспалительных клеток [84]. Это устройство использовалось и проверялось на многих пациентах с очень низкой частотой нежелательных явлений (<1%), таких как тромбоцитопения, аллергические реакции и преходящая гипотензия [82]. Поскольку гемофильтрация PMX-B доступна уже несколько лет, ее нельзя рассматривать как «новую» альтернативу лечения как таковую ; тем не менее, он далек от рутинного использования в повседневной практике; следовательно, необходимы дальнейшие исследования.
7.1.2. CytoSorb
CytoSorb — это устройство для гемадсорбции. Он удаляет как провоспалительные, так и противовоспалительные цитокины. Картридж содержит биосовместимые, сильно пористые полимерные шарики, способные поглощать молекулы в диапазоне ~ 10–50 кДа [85–87].
Избыточное производство цитокинов является обычным явлением при многих опасных для жизни состояниях, помимо сепсиса, таких как травмы, серьезные хирургические вмешательства у пациентов с высоким риском, вирусные инфекции, острый респираторный дистресс-синдром (ОРДС), серьезные ожоговые травмы и острый панкреатит, печень неспособность назвать лишь несколько.За последние пару лет было опубликовано несколько клинических случаев использования CytoSorb. К ним относятся β -гемолитический стрептококк-индуцированный некротический фасциит [88], септический шок с полиорганной дисфункцией [89] и рабдомиолиз [90]. Сообщалось о повышенных уровнях цитокинов во время подготовки донора к трансплантации органов, что было связано с дисфункцией донорских органов до и после трансплантации [91, 92]. В недавнем клиническом исследовании было обнаружено, что в дополнение к традиционному лечению, ослаблению воспалительной реакции путем абсорбции цитокинов, можно продлить выживаемость трансплантата [91].
7.2. Иммунотерапия анти-PD-1 при сепсисе и опухолевых заболеваниях
Поздняя фаза сепсиса и поздняя фаза рака в целом имеют сходный механизм подавления иммунитета. Одно из сходств основано на наличии отрицательных костимулирующих молекул, таких как PD-1 (запрограммированная гибель клеток-1). Его экспрессия индуцируется в первую очередь на поверхностных белках CD4 и CD8 Т-клеток, передача сигналов, посредством которых PD-1 ингибирует пролиферацию Т-клеток, выработку цитокинов и цитотоксическую способность.Постоянное воздействие антигена (DAMP-PAMP) вызывает повышенный уровень PD-1, следовательно, истощение Т-клеток [93, 94]. Теоретически блокирование рецептора PD-1 или его лиганда антителами могло бы обратить вспять дисфункцию Т-клеток и ингибировать патоген или опухолевые клетки, инициирующие иммуносупрессию [94]. Ингибирование пути PD-1 на животных моделях привело к клинически значимому увеличению выживаемости при бактериальном и грибковом сепсисе [95, 96]. В недавнем клиническом исследовании пациенты с раком легкого, меланомой и мелкоклеточным раком почек ответили на лечение антителами против PD-1 в 20-25% [97].Основываясь на схожем иммунопатологическом механизме рака и сепсиса, тестирование эффекта анти-PD-1 или анти-PD-L1 в будущем, безусловно, имеет смысл. Более того, поскольку пациенты с сепсисом не нуждаются в длительной терапии анти-PD-1 или анти-PD-L1, потенциальные побочные эффекты определенных аутоиммунных реакций или других серьезных осложнений должны быть очень редкими. Следовательно, необходимы будущие исследования для подтверждения вопросов безопасности и эффективности лечения анти-PD-1 и анти-PD-1L у пациентов с иммунопарализованным сепсисом [98]; кроме того, оценка экспрессии PD-1 или PD-L1 в иммунных клетках может быть полезным биомаркером для иммуномодулирующей терапии.
7.3. Стволовые клетки и генетическое лечение
Мультипотентные мезенхимальные стволовые клетки (МСК), полученные из костного мозга, уже используются в клинической практике при множественных клинических заболеваниях, включая инфаркт миокарда [99], диабет [100], гематологические злокачественные новообразования [101], печеночные [102] , и почечная недостаточность [103]. Недавние эксперименты на животных показали, что МСК костного мозга также могут играть потенциальную роль в лечении острой почечной недостаточности, ОРДС и сепсиса [104–106].
В нескольких недавних моделях животных на мышах, исследующих острое повреждение почек, вызванное лекарствами и ишемией-реперфузией, было обнаружено, что терапия MCS улучшает восстановление и продлевает выживаемость [104, 107, 108].В других моделях животных циркулирующие МСК были способны помочь в регенерации новых клеток почечных канальцев при остром повреждении почек [109, 110].
МСК
также потенциально могут быть использованы при ОРДС путем ослабления провоспалительного ответа за счет регулирования как врожденной, так и адаптивной иммунной систем и модуляции макрофагов [111]. Они могут влиять на активированные CD4 и CD8 Т-клетки посредством ингибирования продукции воспалительных цитокинов и стимулировать регуляторные Т-клетки. МСК могут напрямую влиять на сепсис, одну из наиболее частых причин ОРДС, путем усиления фагоцитоза макрофагов и увеличения секреции антимикробных пептидов, тем самым увеличивая бактериальный клиренс [106, 111].Другой эксперимент на животных показал, что МСК также могут помочь восстановить поврежденное легкое после повреждения легкого, вызванного вентиляцией [112]. Появляется все больше данных о потенциальных механизмах, посредством которых МСК действуют в поврежденном легком [113]. В настоящее время проводится одно многоцентровое клиническое исследование эффектов терапии аллогенными МСК у пациентов с умеренным и тяжелым ОРДС, набор пациентов для которого уже начался [ClinicalTrials.gov, NCT01775774].
Поскольку пациенты по-разному реагируют на, казалось бы, одни и те же инфекционные инсульты, генетические варианты, вероятно, объясняют различную восприимчивость к риску тяжелого сепсиса.Очевидно, что генетика хозяина может влиять на исход сепсиса, но конкретные локусы еще не подтверждены. В этом году первое полногеномное исследование показало значительную корреляцию между определенными однонуклеотидными полиморфизмами и 28-дневной смертностью у пациентов интенсивной терапии с сепсисом, тяжелым сепсисом или септическим шоком [114]. После точного выяснения некоторых ответственных локусов и их роли в основе, механизме и течении сепсиса генетические манипуляции могут стать еще одним потенциальным терапевтическим подходом к терапии сепсиса в будущем.
8. Заключение
Понимание патологии, лежащей в основе сепсиса и критического заболевания в целом, неизбежно для оценки клинических признаков и биомаркеров в правильном контексте у постели больного. Углубленный анализ недавних исследований пролил свет на несколько важных вопросов, включая иммунологический фон ответа хозяина на различные повреждения, обобщенные в концепции DAMP и PAMP, которая также объясняет, почему уровни биомаркеров следует интерпретировать по-разному в зависимости от этиологии и почему их кинетика может иметь более подходящая информация, чем абсолютные значения.Более того, это понимание может привести нас к совершенно другой стратегии лечения, где основную роль будут играть методы адсорбции и перепрограммирование клеток.
Однако это знание также показало, что в сложном состоянии сепсиса ничто никогда не заменит хорошо обученного, опытного, думающего врача, который принимает во внимание всю доступную информацию у постели больного, а затем принимает решение.

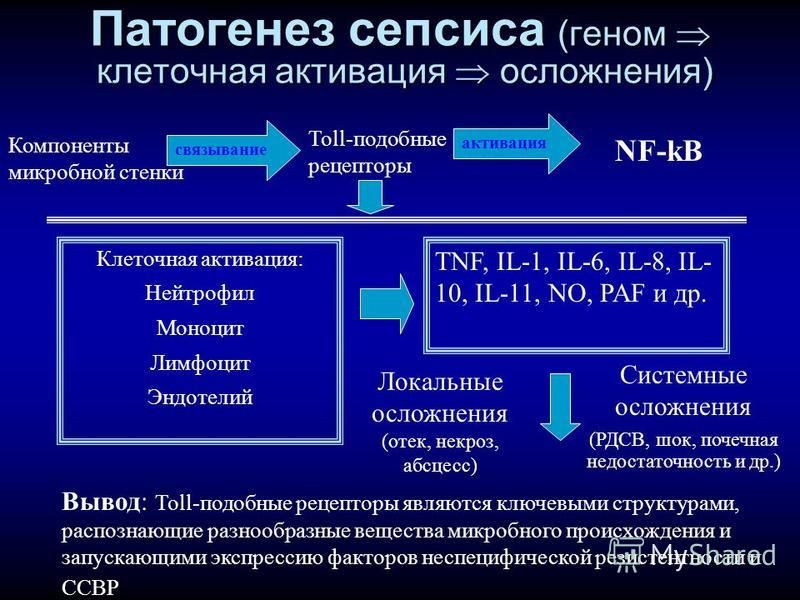 JAMA, 2002, vol. 288, pp. 862–871.
JAMA, 2002, vol. 288, pp. 862–871. Moscow, GEOTAR-Media Publ., 2012.).
Moscow, GEOTAR-Media Publ., 2012.). Care Med., 2004, vol. 32 (suppl), pp. S.455–S.465.
Care Med., 2004, vol. 32 (suppl), pp. S.455–S.465. ru)
ru) Патогенетические механизмы циркуляторного шока. Классификация шоковых состояний. Реанимация и интенсивная терапия при шоке (травматическом, геморрагическом, септическом, анафилактическом). Интенсивная терапия кровопотери.
Патогенетические механизмы циркуляторного шока. Классификация шоковых состояний. Реанимация и интенсивная терапия при шоке (травматическом, геморрагическом, септическом, анафилактическом). Интенсивная терапия кровопотери.


 Уч. пособие для системы послевуз. профобразования врачей. Б.Н.Богомолов и др. под редакцией Ю.С.Полушина.. 2003. С.321
Уч. пособие для системы послевуз. профобразования врачей. Б.Н.Богомолов и др. под редакцией Ю.С.Полушина.. 2003. С.321 И. Анестезия и интенсивная терапия в хирургии аорты и ее ветвей. 2005
И. Анестезия и интенсивная терапия в хирургии аорты и ее ветвей. 2005 Журнал с 2008.
Журнал с 2008.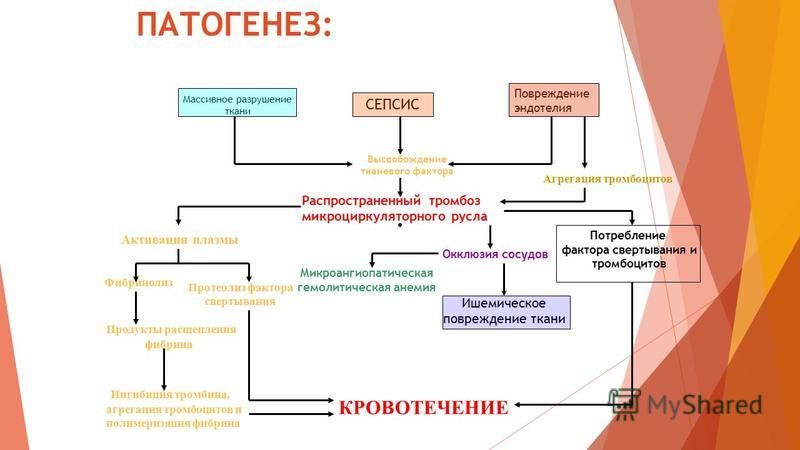 М.: Медицина 1998.
М.: Медицина 1998. //Российский журнал анестезиологии и интенсивной терапии. №2 1999.
//Российский журнал анестезиологии и интенсивной терапии. №2 1999.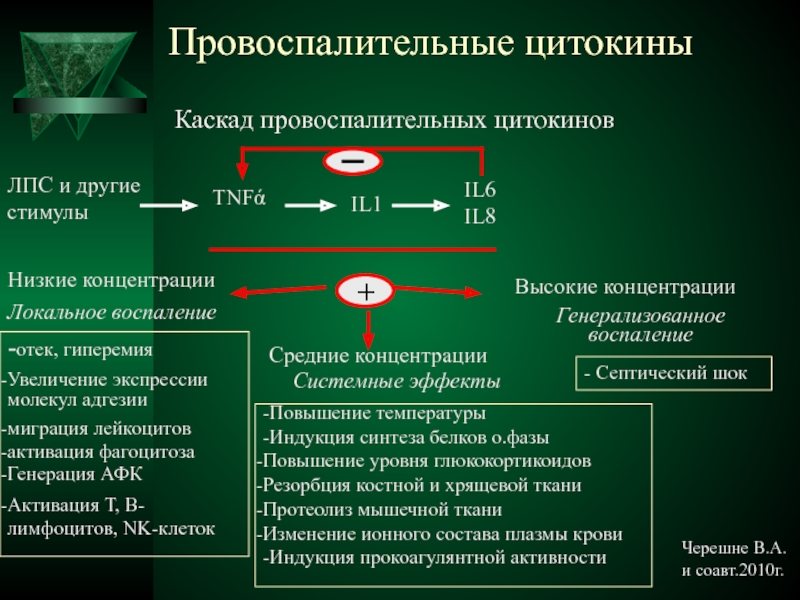 Эфферентная терапии.
Эфферентная терапии. Показания.
Показания.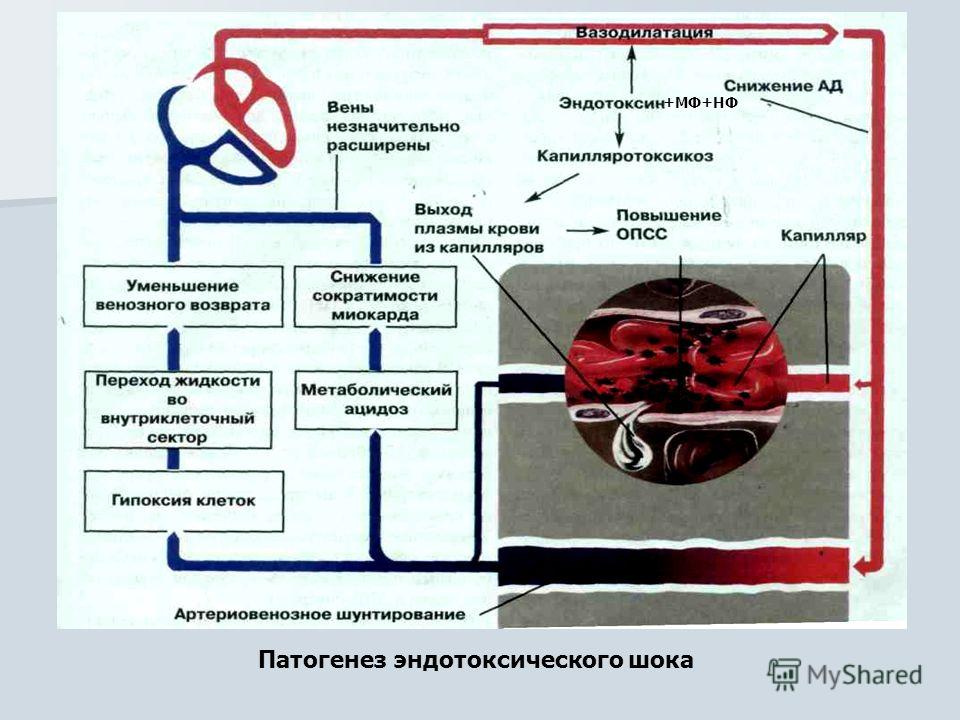
 Системная воспалительная реакция может быть обусловлена не только тяжелыми инфекциями, но и некоторыми неинфекционными заболеваниями (рис. 50-4). Более того, системная воспалительная реакция не обязательно сопровождается бактериемией. Термин синдром системной воспалительной реакции (CCBP) был предложен на Согласительной
Системная воспалительная реакция может быть обусловлена не только тяжелыми инфекциями, но и некоторыми неинфекционными заболеваниями (рис. 50-4). Более того, системная воспалительная реакция не обязательно сопровождается бактериемией. Термин синдром системной воспалительной реакции (CCBP) был предложен на Согласительной Тяжелым осложнением сепсиса является септический шок. Септический шок — сложный патофизиологический процесс, возникающий в результате действия экстремального
Тяжелым осложнением сепсиса является септический шок. Септический шок — сложный патофизиологический процесс, возникающий в результате действия экстремального Дейл, Роберт Г. Петерсдорф (David С. Dale, Robert G. Petersdorf) Определение. Септический шок характеризуется недостаточной перфузией тканей вследствие бактериемии, чаще всего обусловленной грамотрицательными кишечными бактериями. У большинства больных отмечают гипотензию, олигурию, тахикардию, тахипноэ и лихорадочное состояние. Циркуляторная недостаточность обусловливается
Дейл, Роберт Г. Петерсдорф (David С. Dale, Robert G. Petersdorf) Определение. Септический шок характеризуется недостаточной перфузией тканей вследствие бактериемии, чаще всего обусловленной грамотрицательными кишечными бактериями. У большинства больных отмечают гипотензию, олигурию, тахикардию, тахипноэ и лихорадочное состояние. Циркуляторная недостаточность обусловливается • Бактерии являются источником эндотоксинов, вызывающих воспалительный
• Бактерии являются источником эндотоксинов, вызывающих воспалительный
 Ст.)
Ст.)