Синдром фетального кровообращения
При этой патологии у ребенка после рождения частично сохраняется плодный тип кровообращения. Сосуды малого круга кровообращения остаются суженными, и поступающая в правые отделы сердца кровь попадает, минуя легкие, в сосуды большого круга через овальное окно и артериальный проток. Этиологию стойкого сужения легочных сосудов установить порой трудно, однако во многих случаях клинические признаки свидетельствуют в пользу перинатальной гипоксемии.
Патофизиология. В 11-5 представлены основные последствия перинатальной гипоксемии у новорожденных, в результате чего появляются признаки синдрома фетального кровообращения. Гипоксемия и ацндемня приводят к спазму легочных артериол и легочной гипертензии, что, возможно, сопровождается гипертрофией гладкомышечного слоя сосудов. Однако в результате гипоксемии может снизиться функция правого или левого желудочка и развиться преходящая сердечная недостаточность. Эти проявления могут сочетаться по-разному, что обуславливает разнообразие клинической картины. У некоторых больных с СФК на эхокардиограмме определяется снижение насосной функции левого желудочка, что сопровождается расширением полостей сердца п застоем в сосудах малого круга кровообращения, у других при отсутствии застоя в сосудах малого круга — увеличение размеров правого желудочка и клинические признаки недостаточности трехстворчатого клапана. При выраженной гипоксии наряду с многочисленными признаками из перечисленных появляются симптомы асфпктпческого повреждения ЦНС, почек и желудочно-кишечного тракта. Любой из них может сочетаться с пороком сердца пли паренхиматозным поражением легких.
У некоторых больных с СФК на эхокардиограмме определяется снижение насосной функции левого желудочка, что сопровождается расширением полостей сердца п застоем в сосудах малого круга кровообращения, у других при отсутствии застоя в сосудах малого круга — увеличение размеров правого желудочка и клинические признаки недостаточности трехстворчатого клапана. При выраженной гипоксии наряду с многочисленными признаками из перечисленных появляются симптомы асфпктпческого повреждения ЦНС, почек и желудочно-кишечного тракта. Любой из них может сочетаться с пороком сердца пли паренхиматозным поражением легких.
Клинические проявления. К типичным проявлениям относится цианоз у доношенного новорожденного, сопровождаемый респираторным дистресссиндромом разной степени. Примерно у 80% больных анамнестические данные свидетельствуют о перинатальной гипоксемии. Оценка ребенка по шкале обычно низкая, п порой состояние новорожденного требует проведения неотложных реанимационных мероприятий. При физикальном обследовании нередко выявляют шум по левому краю грудины II регурги тацию трехстворчатого клапана. Необычно большое гематокритное число свидетельствует о повышенной вязкости крови, что приводит к повышению легочного сопротивления. Как и при врожденных пороках сердца у больных с СФК на ЭКГ определяются признаки гипертрофии правого желудочка, что представляет собой физиологическую норму для детей этого возраста.
Необычно большое гематокритное число свидетельствует о повышенной вязкости крови, что приводит к повышению легочного сопротивления. Как и при врожденных пороках сердца у больных с СФК на ЭКГ определяются признаки гипертрофии правого желудочка, что представляет собой физиологическую норму для детей этого возраста.
Размер сердца и характер легочной васкуляризации, определяемые на рентгенограмме, не относятся к диагностическим признакам. Соотношение периодов предызгнания и изгнания их правого желудочка на эхокардиограмме свидетельствует о гипертензии в системе легочной артерии, однако, это не специфично для СФК. Вдыхание кислорода в большинстве случаев не способствует существенному повышению кислородного насыщения артериальной крови. Неэффективность кислородотерапии свидетельствует в данном случае об истинном шунте справа налево, что не исключает порока сердца синего типа.
Клиническая картина при СФК отличается большим разнообразием. Уровень смертности достаточно высок и составляет 10-30%.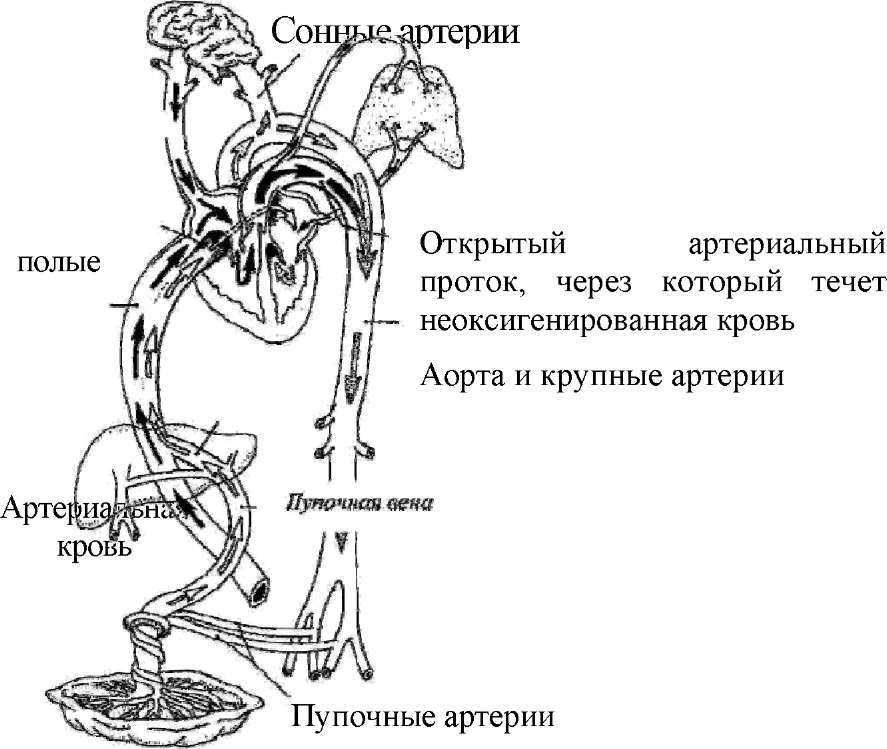 Состояние большинства выживших детей прогрессивно улучшается в течение нескольких дней и к концу 1й недели жизни нормализуется.
Состояние большинства выживших детей прогрессивно улучшается в течение нескольких дней и к концу 1й недели жизни нормализуется.
Дифференциальный диагноз. Поскольку синдром приводит к возникновению истинного шунта справа налево, гемодинамика при нем сходна с таковой при пороках сердца синего типа. Синдром дифференцируют от:
1) выраженной сердечной недостаточности;
2) препятствия току крови на уровне митрального клапана, левого предсердия или легочных вен;
3) выраженного сужения легочных сосудов, вторичного по отношению к основному патологическому процессу. Из всей группы врожденных пороков сердца дифференциальную диагностику следует проводить в основном транспозицией магистральных сосудов. Последняя, как н СФК, чаще всего встречается у доношенных детей с выраженным цианозом, без четко определяемых шумов в сердце и с малоинформативными рентгено и ЭКГ-признаками. В диагностике важную роль играют данные эхокардиографии.
Нарушения оксигенации у больных с легочной патологией или заболеванием ЦНС обусловлены гиповентиляцией или вентиля цнонноперфузионным несоответствием. Подобные состояния дифференцируют от первичной СФК по характерной клинической картине и реакции газового состава артериальной крови на вдыхание кислорода. Следует, однако, отметить, что при целом ряде заболеваний цианотический компонент может быть обусловлен СФК.
Подобные состояния дифференцируют от первичной СФК по характерной клинической картине и реакции газового состава артериальной крови на вдыхание кислорода. Следует, однако, отметить, что при целом ряде заболеваний цианотический компонент может быть обусловлен СФК.
Лечение. Основная задача состоит в обеспечении адекватной оксигенации ребенка до тех пор, пока процесс естественного развития его не приведет к спонтанному улучшению состояния. Потребность в кислородотеранни и искусственной вентиляции легких определяется по показателям газового состава крови. В ряде медицинских центров рекомендуется проведение гипервентиляцпи. У больного необходимо контролировать уровень гемоглобина в крови. При выраженной полпцитемии прибегают к обменному переливанию адекватных количеств крови или плазмы. Метаболический ацидоз корригируют введением гпдробикарбоната натрия. У многих грудных детей может развиться тяжелая гипогликемия или гипокальцпемия, что также требует проведения корригирующих мероприятий.
Лечение толазолином сопровождалось благоприятными, однако, недостаточно убедительными результатами; он оказывает минимальное действие на сосуды легких у тяжелобольных детей. При введении его резко увеличивается легочный кровоток и повышается уровень артериального Ро2 Нередко на первых этапах после введения давление в легочной артерии не изменяется, однако по мере усиления оксигенации оно нормализуется. Толазолин, введенный даже непосредственно в легочную артерию, оказывает выраженное системное действие. Снижение сопротивления сосудов большого круга кровообращения может привести к снижению АД и развитию шока. Препарат следует вводить осторожно вначале струйно в течение примерно 1 мин, а затем капельно из расчета 2-5 мг. Необходимо осуществлять мониторное наблюдение за уровнем АД и внимательно следить за ребенком с целью не пропустить желудочно-кишечного кровотечения, наблюдаемого при лечении толазолином.
Синдром персистирующего фетального кровообращения педиатрия
I. Определение. Персистирующее фетальное кровообращение (ПФК) характеризуется легочной гипертензией, обусловленной вазоконстрикцией в малом круге кровообращения. В свою очередь легочная гипертензия является причиной праволевого шунтирования крови через артериальный проток и овальное окно. Это состояние обычно сохраняется в течение 3—5 дней. Если жизнь ребенка удается спасти в этом остром периоде заболевания, в дальнейшем синдром персистирующего фетального кровообращения, как правило, купируется самостоятельно.
Определение. Персистирующее фетальное кровообращение (ПФК) характеризуется легочной гипертензией, обусловленной вазоконстрикцией в малом круге кровообращения. В свою очередь легочная гипертензия является причиной праволевого шунтирования крови через артериальный проток и овальное окно. Это состояние обычно сохраняется в течение 3—5 дней. Если жизнь ребенка удается спасти в этом остром периоде заболевания, в дальнейшем синдром персистирующего фетального кровообращения, как правило, купируется самостоятельно.
II. Патофизиология. Сразу после рождения происходит последовательный ряд событий, обеспечивающих переход от кровообращения плода к кровообращению взрослого человека. В норме расправляются легкие, снижается легочное сосудистое сопротивление, растет PО2, вызывая констрикцию артериального протока. Системное сосудистое сопротивление увеличивается, происходит функциональное закрытие овального окна. Однако, если во время этого нормального процесса развивается легочная гипертензия, овальное окно и артериальный проток остаются открытыми, так как легочное сосудистое сопротивление превышает системное, обусловливая сброс крови справа налево. В результате развиваются гипоксия и ацидоз, вызывающие прогрессирование вазоконстрикции в легких и легочной гипертензии. Легочная гипертензия, ведущая к развитию у новорожденного синдрома персистирующего фетального кровообращения, может быть вызвана следующими причинами:
В результате развиваются гипоксия и ацидоз, вызывающие прогрессирование вазоконстрикции в легких и легочной гипертензии. Легочная гипертензия, ведущая к развитию у новорожденного синдрома персистирующего фетального кровообращения, может быть вызвана следующими причинами:
A. Легочная вазоконстрикция. Вазоконстрикция и легких может быть результатом гипоксии, ацидоза, преждевременного закрытия артериального протока вследствие приема матерью ингибиторов простагландинсинтетазы, например, аспирина.
Б. Гипоплазия легочного сосудистого русла. Она может быть следствием хронического олигогидрамниона. Чаще всего наблюдается при синдроме Поттера и врожденной диафрагмальной грыже.
B. Обструкция легочного сосудистого русла является следствием полицитемии.
Г. Заболевание сердца. Причиной легочной гипертензии могут быть врожденные пороки сердца или транзиторная дисфункция левого желудочка.
Д. Патологические изменения гладких мышц сосудистой стенки легочных артерий. Патологическая маскуляризация и гипертрофия мышечного слоя сосудистой стенки артерий могут быть результатом внутриутробной гипоксии или дистресса плода, а также отклонений в его развитии.
Е. Гуморальные факторы. Тромбоксан A2, являющийся мощным легочным вазоконстриктором и продуктом липоксигеназного пути метаболизма арахидоновой кислоты, может способствовать развитию легочной гипертензии.
III. Факторы риска. Высокий риск развития персистирующего фетального кровообращения наблюдается при следующих состояниях:
A. Заболевание легких или аспирация мекония. Заболевания легких являются причиной гипоксемии.
Б. Диафрагмальная грыжа. Диафрагмальная грыжа обусловливает гипоплазию сосудистого русла легких, увеличение легочного сосудистого сопротивления и легочную гипертензию.
B. Гестационный возраст. Мышечный слой в легочных артериолах формируется в последние недели беременности. Это приводит к уменьшению общей площади поперечного сечения легочного сосудистого русла с последующим увеличением сопротивления кровотоку, обусловливающему персистирующую легочную гипертензию.
Г. Гипоксия и ацидоз. Гипоксия и ацидоз могут быть следствием асфиксии в родах (о чем свидетельствует низкая оценка по шкале Апгар) и вызывают развитие легочной гипертензии.
Д. Дистресс плода. Внутриутробный дистресс плода, проявляющийся урежением сердцебиений перед его рождением, ведет к развитию гипоксии и ацидоза.
Е. Новорожденный от матери с сахарным диабетом. У новорожденных от матерей с сахарным диабетом часто наблюдается полицитемия. Она может вызывать обструкцию легочного сосудистого русла, ведя к синдрому персистирующего фетального кровообращения. Заболевания легких также чаще встречаются в этой группе детей.
Ж. Сепсис. У новорожденных с сепсисом нередко развивается тяжелый метаболический ацидоз, вызывающий спазм сосудов легких.
З. Повторное плановое кесарево сечение. Самопроизвольные роды являются фактором, стимулирующим снижение легочного сосудистого сопротивления, всасывание жидкости из легких, их созревание и высвобождение из пневмоцитов сурфактанта. Если самопроизвольные роды заменяются кесаревым сечением, этот механизм нарушается, приводя к легочной гипертензии.
И. Гипокальциемия или гипогликемия. Эти нарушения обусловливают снижение сердечного выброса, следствием чего являются гипоксия и ацидоз.
IV. Клинические данные
А. Симптомы и признаки. Для оценки тяжести заболевания и принятия решения о выборе тактики лечения удобно пользоваться классификацией заболевания по стадиям, принятой в медицинском центре университета Кентукки.
1. Стадия 1 (новорожденные, угрожаемые по развитию синдрома персистирующего фетального кровообращения)
а. Растет альвеолярно-артериальный градиент по кислороду и повышается риск развития у ребенка ПФК. В этом случае проводят тщательное наблюдение.
б. Необходим динамический контроль газов крови.
в. Альвеолярно-артериальный градиент (в норме обычно не превышает 20 мм рт. ст.) рассчитывают следующим образом:
(7 х FiO2) — (РCO2 + PO2).
2. Стадия 2
а. Альвеолярно-артериальный градиент по кислороду превышает 250 мм рт. ст.
б. Отмечается выраженная лабильность показателей газов крови (во время пеленания, забора крови, возбуждения, крика и нарастания двигательной активности ребенка, а также в ответ на действие громкого шума, появляется цианоз и падают показатели транскутанного монитора или пульсоксиметра). Прекратить проведение оксигенотерапии невозможно из-за нестабильного клинического состояния ребенка,
Прекратить проведение оксигенотерапии невозможно из-за нестабильного клинического состояния ребенка,
в. Вследствие высокого альвеолярно-артериального градиента показано проведение механической вентиляции легких.
3. Стадия 3
а. Альвеолярно-артериальный градиент по кислороду превышает 500 мм рт. ст.
б. Выраженная лабильность оксигенации крови ведет к персистирующему цианозу.
в. Обычно возникают трудности в поддержании адекватного объема циркулирующей крови.
г. Трудно поддерживать уровень PO2 более 60 мм рт. ст.
д. Периодически возникающий цианоз в конечном итоге сменяется персистирующим цианозом.
е. Даже при постоянной инфузии коллоидных растворов с трудом удается поддерживать нормальное центральное венозное давление и системное артериальное давление. Диурез снижен.
4. Стадия 4
а. Альвеолярно-артериальный градиент превышает 600 мм рт. ст.
б. Очень трудно поддерживать PO2 выше 40 мм рт. ст.
в. Центральное венозное давление и системное артериальное давление низкие.
5. Стадия 5. Это терминальная стадия персистирующего фетального кровообращения. Предложено много схем лечения, но эффективность их невысока.
а. Альвеолярно-артериальный градиент превышает 625 мм рт. ст.
б. Выражена стойкая гипоксия (PO2 менее 40 мм рт. ст.).
в. Отмечается стойкая ацидемия (pH менее 7,25).
Б. Лабораторные исследования. У больного с подозрением на синдром персистирующего фетального кровообращения необходимо тщательно контролировать следующие показатели:
1. Уровень общего и ионизированного кальция. Гипокальциемия (если она имеется) может вызвать снижение сердечного выброса и нарастание гипоксии.
2. Уровень глюкозы в сыворотке крови. Гипогликемия также усугубляет гипоксию за счет снижения сердечного выброса.
3. Газы артериальной крови. Тщательный мониторинг газов артериальной крови необходим для расчета альвеолярно-артериального градиента по кислороду, выявления метаболического ацидоза, гиперкапнии или гипоксии.
В. Рентгенография.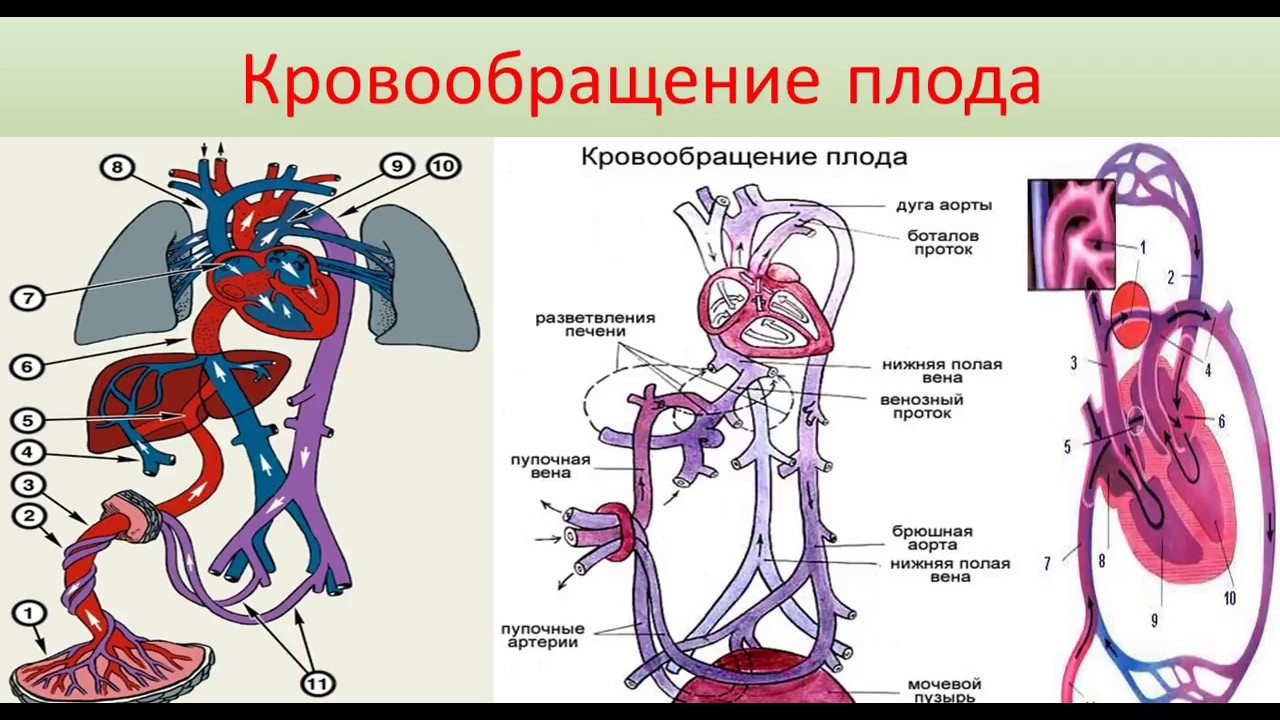 Рентгенография позволяет выявить поражение легких. Часто говорят о том, что при ПФК потребность в кислороде не соответствует тяжести поражения легких поданным рентгенографии грудной клетки. Изменения на рентгенограмме включают признаки пневмонии, синдрома утечки воздуха из легких (пневмоторакса, интерстициальной эмфиземы, пневмомедиастинума, пневмоперикарда) или отек легких. Ho изменения легких на рентгенограмме могут быть и не видны.
Рентгенография позволяет выявить поражение легких. Часто говорят о том, что при ПФК потребность в кислороде не соответствует тяжести поражения легких поданным рентгенографии грудной клетки. Изменения на рентгенограмме включают признаки пневмонии, синдрома утечки воздуха из легких (пневмоторакса, интерстициальной эмфиземы, пневмомедиастинума, пневмоперикарда) или отек легких. Ho изменения легких на рентгенограмме могут быть и не видны.
Г. Эхокардиография. Эхокардиография необходима для исключения врожденного порока сердца синего типа. После того как диагноз врожденного порока сердца исключен, эхокардиография теряет свою диагностическую ценность для выявления персистирующего фетального кровообращения, так как изменения на эхокардиограмме может не быть. К признакам ПФК, которые могут выявляться на эхокардиограмме, относятся правожелудочковая недостаточность со снижением сократимости миокарда и дилатацией правого желудочка.
Д. Дифференциальная оксиметрия. Оксиметрия помогает выявить праволевый шунт крови, свидетельствующий о наличии у ребенка персистирующего фетального кровообращения.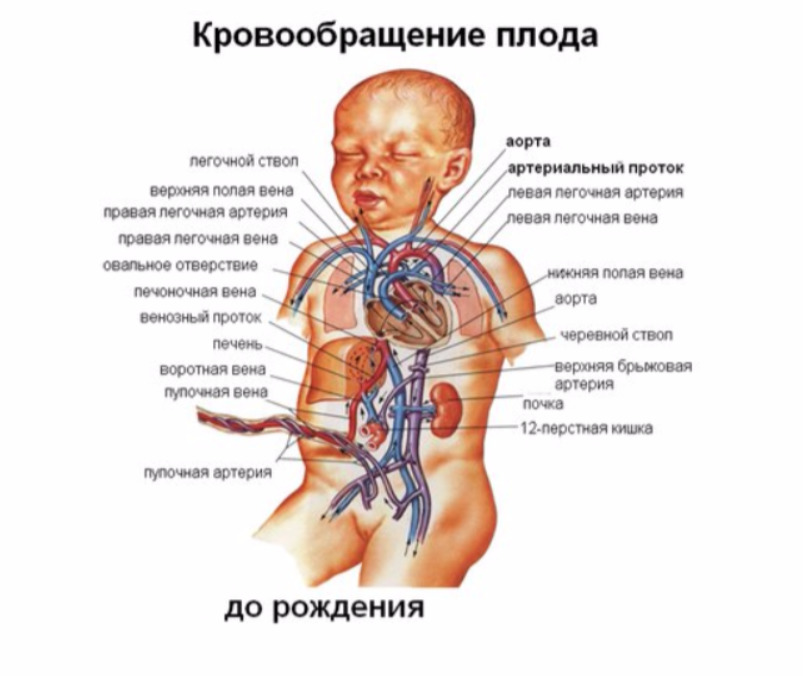 Используют два транскутанных оксиметра. Один датчик фиксируют в верхней правой части грудной клетки (предпротоковый датчик), второй — в нижней левой части живота (послепротоковый датчик). Если разница показаний оксиметров превышает 10 мм рт. ст., следует предположить наличие праволевого шунта крови через артериальный проток.
Используют два транскутанных оксиметра. Один датчик фиксируют в верхней правой части грудной клетки (предпротоковый датчик), второй — в нижней левой части живота (послепротоковый датчик). Если разница показаний оксиметров превышает 10 мм рт. ст., следует предположить наличие праволевого шунта крови через артериальный проток.
V. Лечение
А. Медикаментозная терапия.
1. Жидкости и электролиты. Для поддержания адекватного сердечного выброса необходимо обеспечивать нормальный уровень глюкозы и кальция в сыворотке крови. Требуется частое введение щелочей с целью коррекции pH, так как ацидоз является главной причиной вазоконстрикции в легких. Решение об использовании гидрокарбоната натрия или трометамина (Tham) зависит от уровня электролитов в сыворотке крови, функции легких и диуреза.
2. Седативные препараты. Седативная терапия часто используется у новорожденных с выраженным возбуждением ЦНС и «борющихся» с респиратором. Хороший седативный эффект и уменьшение частоты развития синдрома утечки воздуха из легких дает введение фенобарбитала.
3. Миорелаксанты. Миорелаксанты применяют у новорожденных, не реагирующих на седативную терапию, остающихся возбужденными и не синхронизирующихся с респиратором. Наиболее широко применяют панкуроний (павулон), так как он не оказывает гипотензивного действия, свойственного тубокурарину.
4. Растворы для восполнения объема циркулирующей крови. Артериальное давление необходимо поддерживать частым введением коллоидов: свежезамороженной плазмы, белковой фракции плазмы (плаз-манат) или цельной крови в зависимости от уровня гематокрита. При низком гематокрите применяйте цельную кровь, при высоком — коллоидные препараты, названные выше. Поддержание нормального артериального давления обеспечивает увеличение системного сосудистого сопротивления, что может способствовать уменьшению праволевого шунта.
5. Прессорные агенты. Когда не удается поддерживать нормальное артериальное давление и есть подозрение на снижение почечного кровотока, применяют допамин (интропин). Соблюдайте осторожность при использовании допамина, так как в экспериментах на животных было показано, что он может повышать сосудистое сопротивление в легких, а это может способствовать увеличению праволевого шунта.
6. Легочные вазодилататоры. Толазолин (присколин), блокатор альфа-адренергических рецепторов, применяют только в тех случаях, когда трудно поддерживать адекватный уровень оксигенации. Считают, что он вызывает дилатацию сосудов легких. Сначала, как правило, вводят пробную дозу. Если отмечается улучшение оксигенации (обычно более чем на 10—25 мм рт. ст.), начинают непрерывное введение препарата.
Б. Механическая вентиляция легких
1. Показаниями к механической вентиляции легких являются альвеолярно-артериальный градиент по кислороду более 250 мм рт. ст. и неспособность ребенка самостоятельно поддерживать адекватную вентиляцию. Главная цель — обеспечить эффективную вентиляцию легких, используя возможно минимальное среднее давление в дыхательных путях. Уровни газов крови во время механической вентиляции легких будут идеальными, если поддерживаются следующие параметры: pH 7,4—7,5; РСО2 25—30 мм рт. ст.; PО2 более 50 мм рт. ст.
2. Высокочастотную вентиляцию легких можно использовать для обеспечения гипервентиляции и поддержания критического уровня РСО2 (следствием чего является расширение легочных артерий и повышение P(S2). У разных больных критический уровень РСО2 бывает различным, составляя приблизительно 15—25 мм рт. ст.
3. Синдром утечки воздуха из легких является частым осложнением механической вентиляции с применением высокого среднего давления в дыхательных путях. Необходимо внимательно следить за появлением признаков пневмоторакса и других разновидностей баротравмы легких.
4. Вентиляция с помощью мешка-маски с различными значениями частоты и давления на вдохе может оказаться полезной для определения оптимальных параметров механической вентиляции легких. Новорожденные с персистирующим фетальным кровообращением обычно хорошо реагируют на этот тест.
В. Экстракорпоральная мембранная оксигенация (ЭКМО) ЭКМО в настоящее время применяют только в нескольких клиниках. Ее рекомендуют проводить новорожденным не старше 7 дней жизни с гестационным возрастом более 34 нед и массой тела свыше 2 кг. Для выполнения операции требуется канюляция внутренней яремной вены и общей сонной артерии, а также использование аппарата искусственного кровообращения. Пока еще ограниченный опыт применения ЭКМО представляется обнадеживающим.
Дифференциальная диагностика. — МегаЛекции
Транзиторное тахипное новорождённых (синдром влажных легких, респираторный дистресс — синдром II типа). Диагноз ставится на основании данных анамнеза (кесарево сечение, астма у матери, избыточное назначение жидкости) и характерной рентгенологической картины (Рис.8). Заболевание чаще всего протекает доброкачественно и не требует инвазивной респираторной поддержки.
Синдром острого легочного повреждения (респираторный дистресс — синдром взрослого типа (Рис.9)). Всегда осложнение другого заболевания (пневмония, мекониальная аспирация, сепсис, шок, длительное экстракорпоральное кровообращение).
Идиопатическая легочная гипертензия новорождённых (синдром персистирующего фетального кровообращения) (Рис.10). Диагноз ставится на основании рентгенологической картины (обеднение сосудистого рисунка, «синдром чёрных легких») и данных эхокардиографии (право — левый шунт или бидиректоральный ток крови по фетальным коммуникациям).
Дифференциальный диагноз проводят с дыхательными расстройствами как легочного (пневмонии, пороки развития легких и др.), так и нелегочного генеза (вторичные дыхательные расстройства — внутричерепная родовая травма головного или спинного мозга, врожденные пороки сердца, диафрагмальная грыжа, полицитемия, метаболические нарушения и др.). Дифференциальная диагностика с пневмониями изложена ниже.
Агенезия хоан обусловливает невозможность дышать носом и появление цианоза, расстройств дыхания после нормального первого вдоха. Типичны обильные слизистые выделения, заполняющие нос. Порок развития становится очевидным, когда не удается провести катетер или зонд через нос в носоглотку. Лечение хирургическое, но сразу же вводят воздуховод в рот.
Трахеопищеводные свищи клинически проявляются поперхиванием, приступами цианоза, кашлем, появлением хрипов в легких в момент кормления или сразу после него. Контрастное исследование пищевода (с водорастворимым контрастным веществом) и бронхоскопия подтвердят диагноз.
Диафрагмальная грыжа выявляется при рождении или вскоре после него нарастающим тяжелым расстройством дыхания.
Рисунок 8.Синдром задержки жидкости в легких. Рентгенограмма в прямой проекции, в горизонтальном положении. Сосудисто-интерстициальный рисунок легких размыт на фоне симметричного слабоинтенсивного снижения прозрачности легочных полей. Контуры средостения нечёткие. (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
Рисунок 9.РДС взрослого типа. Рентгенограмма в прямой проекции, в горизонтальном положении. Визуализируется слабоинтенсивное затемнение верхней и средней доли правого лёгкого и нижней доли слева. На фоне затемнения дифференцируются более плотные участки, сосудисто-интерстициальный рисунок нечёткий (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
Рисунок 10.Персистирующая легочная гипертензия новорождённого. Рентгенограмма грудной клетки в прямой проекции. Тень средостения расширена в верхнем этаже, имеет чёткие, не ровные контуры. (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
Типичен малый ладьевидный живот, втянутая передняя брюшная стенка при рождении. При осмотре обращают на себя внимание асинхронные движения правой и левой половины грудной клетки и смещение верхушечного толчка сердца, чаще вправо (ибо левосторонняя диафрагмальная грыжа встречается в 5 — 1 0 раз чаще, чем правосторонняя), резкое укорочение перкуторного тона в нижнем отделе легкого и отсутствие здесь же дыхательных шумов, внезапный цианоз при положении ребенка на здоровом боку. Решающее диагностическое значение имеет рентгенография грудной клетки, которая показывает наличие в грудной клетке структур, ей несвойственных (кишечник, печень и др.). Лечение хирургическое.
У детей с родовой травмой головного и спинного мозга, наряду с расстройствами дыхания, отмечаются и признаки поражения ЦНС. Помогают своевременной диагностике патологии мозга и вспомогательные исследования: нейросонография, рентгенография позвоночника, люмбальная пункция и др.
Врожденные пороки сердца синего типа и синдром персистирующей фетальной циркуляции иногда трудно отличить от РДС. Однако в первые часы жизни у детей с РДС зачастую обычный цвет кожных покровов. При использовании 100% кислорода для дыхания в течение 10-15 мин, особенно при постоянном положительном давлении в воздухоносных путях, у детей с РДС РаО2 повышается, иногда даже выше 100, тогда как при пороках сердца синего типа этого не происходит. Безусловно, имеют значение и данные клинического осмотра, аускультации, оценка по шкале Сильвермана, а также дополнительных исследований (рентгенография грудной клетки, ЭКГ, результаты эхокардиографии).
Пневмонии, вызванные стрептококками В, другими стрептококками (пептострептококки, энтерококки), дают клиническую картину, практически не отличимую от БГМ, ибо вызывают ингибирование сурфактанта и отсюда его дефицит. Диагностическое значение в этом случае имеет выявление других инфекционных очагов (менингит и др.), результаты клинических анализов крови, посевов крови, содержимого трахеи.
Прогнозирование.
Наиболее часто РДС отмечается у глубоко недоношенных детей при гестационном возрасте менее 34 недель. Однако существует группа угрожаемых по развитию РДС новорожденных, родившихся в более поздние сроки беременности. К ним относятся дети, родившиеся у матерей с сахарным диабетом и другими эндокринопатиями при многоплодной беременности, изосерологической несовместимости крови матери и плода, при кровотечениях в связи с отслойкой и предлежанием плаценты. Большую группу составляют новорожденные с морфофункциональной незрелостью, возникшей под влиянием неблагоприятных факторов внешней среды или в результате плацентарной недостаточности, врожденной и наследственной патологии плода, а также дети, родившиеся в асфиксии. Прогностическим критерием является определение в крови беременных женщин уровня альфа-фетопротеина (Таблица №3). Повышение его концентрации выше 75-го перцентиля указывает, помимо нарушения процесса формирования и развития плода во II и в начале III триместра, на отставание зрелости плода по отношению к гестационному возрасту.
Таблица № 3
Перцентили альфа-фетопротеина
| Срок беременности, недель | Перцентили | ||||||
| 13-14 | 1.76 | 3.89 | 7.38 | 12.9 | 20.1 | 27.8 | 36.4 |
| 14-15 | 2.29 | 4.93 | 9.17 | 15,8 | 24.3 | 33.2 | 43.1 |
| 15-16 | 2.95 | 6.22 | 11.4 | 19.3 | 29.3 | 39.7 | 51.2 |
| 16-17 | 3.79 | 7.83 | 14.1 | 23.6 | 35.4 | 47.6 | 60.9 |
| 17-18 | 4,85 | 9.83 | 17.4 | 28.8 | 42.8 | 57.1 | 72.7 |
| 18-19 | 6.17 | 12.3 | 21.5 | 35.2 | 51.8 | 68.7 | 86.8 |
| 19-20 | 7.84 | 15.4 | 26.6 | 62.7 | 82.6 | ||
| 20-21 | 9.93 | 19.2 | 32.8 | 52.5 | 75.9 | 99.5 | |
| 21-22 | 12.5 | 40.5 | 64.1 | ||||
| 22-23 | 15.8 | 29.8 | 49.9 | 78.3 | |||
| 23-24 | 19.2 | 35.8 | 59.2 | 92.2 | |||
| 24-25 | 21.9 | 40.4 | 66.4 | ||||
| 25-26 | 24.8 | 45.2 | 73.6 | ||||
| 26-27 | 27.7 | 80.7 | |||||
| 27-28 | 30.4 | 54.4 | 87.2 | ||||
| 28-29 | 32.9 | 58.3 | 92.8 | ||||
| 29-30 | 61.5 | 97.2 | |||||
| 30-31 | 36.6 | 63.8 | |||||
| 31-32 | 37.6 | 65.1 | |||||
| 32-33 | 65.3 | ||||||
| 33-34 | 37.7 | 64.4 | 99.3 | ||||
| 34-35 | 36.8 | 62.5 | 95.8 | ||||
| 35-36 | 35.4 | 59.7 | 91.1 | ||||
| 36-37 | 33.5 | 56.1 | 85.2 | ||||
| 37-38 | 31.3 | 78.6 | |||||
| 38-39 | 28.8 | 47.6 | 71.7 | ||||
| 39-40 | 26.3 | 43.2 | 64.2 | 92.2 |
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Фето фетальный синдром — причины, симптомы, риски
Рождение в семье близнецов — это важное событие, но нередко оно омрачается различными осложнениями и патологиями. При вынашивании одновременно нескольких эмбрионов увеличивается риск возникновения неприятных последствий, как для матери, так и ребенка. Фето фетальный синдром считается опасным состоянием, которое диагностируется у монохориальной двойни.
Что это за патология
Многоплодная беременность считается границей между нормой и патологией. Специалисты разделяют ее на несколько видов по типу плацентарной оболочки и количеству амниотических полостей.
В том случае, если женщина вынашивает дихориальную диамниотическую двойню, то у каждого ребенка имеется своя плацента и амниотическая полость. На свет появляются дети разного пола, или новорожденные, не похожие друг на друга.
При монохориальной диамниотической двойне младенцы растут в отдельных амниотических полостях, но при этом у них одна плацентарная оболочка на двоих. В результате на свет появляются дети одного пола, похожие друг на друга.
Такое патологическое состояние считается клинической картиной развивающейся болезни плаценты. Он диагностируется во время беременности у однояйцевых близнецов и характеризуется неравномерным перетеканием крови по соединительным сосудам от одного младенца к другому.
В результате один из них получает избыточное количество крови, что вызывает повышенную нагрузку на сердце и сосуды. Следствием этого становится смерть ребенка по причине сердечной недостаточности.
В это же время другой плод, наоборот, получает недостаточное количество крови. Это может закончиться его гибелью.
Причины
Фетоплацентарная трансфузия диагностируется лишь у некоторых младенцев, которые имеют одну плацентарную оболочку. Предположительно, она возникает при делении оплодотворенной яйцеклетки и определении ее структуры с разветвлениями кровеносных сосудов. Считается, что более позднее деление оплодотворенной женской клетки сопровождается серьезными проблемами и возникновением ФФТС.
Обсуждается возможность воздействия слишком позднего разделения близнецов, проблем с кровоснабжением матки и тератогенных факторов. Выяснение точных причин ФФТС осложняется его поздней диагностикой и непредсказуемостью его возникновения.
Симптомы
Фето фетальный трансфузионный синдром не имеет субъективных проявлений и его удается диагностировать лишь при проведении скрининговых ультразвуковых исследований. У женщин с таким нарушением часто отмечается гипертонус детородного органа и иные состояния, которые угрожают выкидышем.
Проведенные исследования допускают, что определенная часть самопроизвольных абортов при вынашивании женщиной сразу нескольких плодов обусловлена фетофетарной трансфузией до ее выявления.
При осложнении женщина может жаловаться на болевые ощущения в области груди и живота. Кроме этого, возможно профузное маточное кровотечение или кровянистые выделения из влагалища. На более позднем сроке свидетельствовать о гибели близнецов может прекращение их движения.
Чем опасна
Фето фетальный синдром при вынашивании двойни считается одним из самых опасных нарушений. При его возникновении в плаценте между близнецами образуются артериовенозные анастомозы, что вызывает неравномерное распределение кровотока.
Кроме этого, наблюдается сброс крови от одного плода к другому. Иначе говоря, один младенец забирает питательные вещества у другого. При отсутствии эффективной терапии возможен самопроизвольный выкидыш или гибель обоих близнецов в период внутриутробного развития.
У ребенка-реципиента при синдроме плацентарной трансфузии отмечается многоводие и избыточное количество урины. Следствием этого становится развитие различных осложнений и повышенное давление на зев матки, что нередко заканчивается прерыванием беременности либо преждевременным началом родовой деятельности.
У донора практически нарушается процесс мочеобразования, поэтому диагностируется маловодие в плодном пузыре. В случае выживания младенцев высока вероятность различных физических и неврологических нарушений.
При фетофетальном нарушении развитие младенца не нарушается. Основная проблема кроется в плаценте, которая и вызывает появление различных аномалий и проблем. При возникновении синдрома до 26 недели в большинстве случаях младенцы гибнут либо появляются на свет с серьезными патологиями.
При постановке врачом диагноза после 26 недели большинство детей выживают и шансы избежать инвалидности у них высоки.
Достаточно редким осложнением считается внутриутробная гибель младенца с инфицированием либо мумификацией трупа.
Когда и к какому врачу обратиться
Диагностировать фетофетарную трансфузию удается при проведении будущей матери УЗИ. При вынашивании монохориальной многоплодной беременности ее ставят в группу риска, и она находится под наблюдением врача.
Диагностировать признаки осложнения с помощью УЗИ удается после 16 недели, но в редких ситуациях возможно после 11-12.
Диагностика
Для подтверждения патологического состояния и мониторинга состояния младенцев женщине назначается проведение дополнительных исследований. Они помогают сделать прогноз фетоплацентарной трансфузии и собрать информацию для дальнейшего лечения.
Оценить состояние двойни можно с помощью следующих методов.
- УЗ-скрининг. Применение такого метода особенно информативно во втором и третьем триместре. С учетом стадии нарушения у одного малыша может диагностироваться многоводие, увеличение размеров мочевого пузыря и различные пороки развития. У близнеца-донора на УЗИ наблюдается маленький размер мочевого пузыря и маловодие.
- Ультразвуковая фетометрия. При ФФТС отмечается отставание в росте ребенка-донора. Кроме этого, фетометрические показатели не соответствуют определенному сроку. При ФФТС разница в основных показателях составляет около 20%.
С помощью допплерометрии плода определить патологические изменения кровотока удается с 3 стадии ФФТС при беременности. Эхокардиография дает возможность диагностировать поздние проявления синдрома у близнеца-реципиента.
При отсутствии лечения и регулярного наблюдения у врача прогноз неблагоприятный. В большинстве случаев это приводит к преждевременному началу родовой деятельности либо внутриутробной гибели плода.
К сожалению, профилактика такой патологии не разработана, как и не выяснена точная причина ее развития.
Материал подготовлен
специально для сайта kakrodit.ru
под редакцией врача-диагноста Васильевой О.С.
классификация, до какого срока ставится
Беременность двойней – это особое состояние для матери и плодов, сопряженное с разного рода трудностями, двойная нагрузка на женский организм в сравнении с одноплодной беременностью. Но помимо всех традиционных проблем, при вынашивании однояйцовой двойни могут возникать еще и специфические осложнения, связанные с особенностями развития плодов – если у них общая плацента, внутри которой сосуды особым образом переплетены, формируя своеобразное «обкрадывание» кровотока у одного ребенка в пользу другого. Если говорить простым языком, один из малышей развивается быстрее и активнее за счет того, что отбирает часть питательных веществ и кислорода, поступающих в кровь второго плода. Это приводит к резким различиям в размерах и состоянии здоровья обоих плодов, а также изменению количества околоплодных вод, что грозит обоим как пороками развития, так и гибелью в утробе матери.
Оглавление: Опасность синдрома и встречаемость Причины фето-фетального синдрома при двойне Особенности влияний при синдроме Механизмы развития и последствия фето-фетального синдрома Классификация фето-фетального синдрома у двойни Проявления фето-фетального синдрома при беременности Каковы последствия синдрома для плодов: донора и реципиента До какого срока ставится диагноз фето-фетальный синдром? Методы лечения фето-фетального синдрома Каковы прогнозы при развитии синдрома при гестации?
Опасность синдрома и встречаемость
Встречается подобный синдром только у однояйцовых близнецов или троен, у которых плацента единая, но пуповины и плодные оболочки у каждого свои. Частота возникновения колеблется от 5-6 до 17% и выше. По мнению некоторых специалистов, встречаемость синдрома может быть и выше, но нередко она приводит к выкидышу на ранних сроках беременности, что не дает учета данных в статистике.
Важно
Опасен данный синдром тем, что приводит к высокой смертности плодов и новорожденных детей при подобной беременности, если вовремя не была произведена коррекция, и зачастую приводит в 15% и выше к внутриутробной гибели одного или сразу обоих плодов в разные сроки гестации.
Впервые его описали еще в позапрошлом веке, первые научные упоминания синдрома датируются 1882 годом, но если в то время лечение было невозможно, и формировалась только констатация фактора рождения разных по весу и степени развития малышей, то сегодня медицина позволяет корректировать подобные пороки еще в утробе, что позволяет родить вполне здоровыми обоих младенцев.
Причины фето-фетального синдрома при двойне
Изначально при развитии обоих плодов в области формирующейся плаценты образуется множество сосудистых анастомозов (особые сплетения из венок и артерий). Соответственно подобные сосудистые сплетения и могут быть основой для формирования фето-фетального синдрома. У однояйцовой двойни во время беременности сосудистые анастомозы определяют в плаценте практически у 90% всех женщин. Они делятся на поверхностные и глубокие сплетения, а также сплетения между венами (венозно-венозные) и между артериями (артерио-артериальные). За счет них кровь переносится во всех возможных направлениях, исходя из градиента давления (у кого из близнецов оно выше) и за счет них выравнивается давление крови между плодами, а значит – равномерно поступает и питание.
В глубоких сплетениях строение особое, артериальная кровь от одного ребенка, которая попадает в плаценту, перетекает в область венозной системы другого плода. По мнению ученых из-за преобладания глубоких сплетений в плаценте над поверхностными и развивается фето-фетальный синдром.
На сегодняшний день не ясно, какие факторы влияют к формированию больших объемов глубоких сосудистых сплетений. Ученые предполагают, что они могут возникать в силу проблем с формированием плаценты у того ребенка, который больше страдает (донор). У него изменяется давление в сосудах плаценты, из-за чего открываются особые «шунты», сбрасывающие избыток крови в сосуды второго плода (реципиент).
Также ученые ведут речь о позднем процессе разделения плодов, негативном влиянии внешних тератогеных факторов и дефицита кровотока в области матки беременной. Но окончательно данный синдром не изучен, зачастую он выявляется уже в поздней стадии и течение его непредсказуемо.
Особенности влияний при синдроме
В период беременности образуется уникальный орган – плацента, обеспечивающая плод кислородом, питательными веществами и отводящая продукты обмена. При развитии однояйцовых близнецов формируется единая для обоих плацента, от которой отходят две пуповины к каждому плоду. При идеальных условиях половина плаценты должна питать один плод, а вторая – другой. Но в некоторых случаях внутри половинок плаценты образуются патологические сообщения между сосудами – их назвали анастомозами. Через них кровь течет неравномерно, одному из близняшек больше, чем второму. Таким образом, основу синдрома составляет аномальное строение сосудов плаценты и отходящих от них пуповин. Чем раньше выявляются проблемы кровообращения у плодов при синдроме, тем хуже для них будут прогнозы. Если он проявится до 26-ой недели беременности, почти всегда происходит гибель одного плода или обоих, в поздние сроки или при оперативной коррекции синдрома шансы на благоприятный исход гораздо выше.
Механизмы развития и последствия фето-фетального синдрома
По мнению врачей, формирование фето-фетальной трансфузии происходит в разные сроки гестации, и чем позднее образуются патологические анастомозы, тем это лучше для детей. Но часть специалистов считает, что зачатки синдрома возникают еще в период, когда близнецы разделяются – это с 4-х по 12-е сутки от зачатия, и степень выраженности дальнейших проблем зависит от того, сколько патологических анастомозов образовалось и насколько страдает кровоток у близнецов. В начальном этапе образуется простое перетекание крови от близнеца-донора к тому, который является реципиентом, но это пока не отражается на темпах их развития и внешних характеристиках детей.
У близнеца, постоянно отдающего кровь, постепенно формируется снижение объема крови, циркулирующей в тельце, что приводит к задержке развития и внутриутробной гипоксии. У него страдает работа почек и выделение мочи, что уменьшает и объем мочевого пузыря, выделение мочи в околоплодные воды, что формирует маловодие. Это, в свою очередь, нарушает развитие легочной ткани, замедляет развитие органов дыхания, а если подобное состояние не лечить, может формироваться гибель плода внутриутробно из-за гипоксии и недоразвития всех тканей и органов.
Но не меньше страдает и тот близнец, которому притекает крови больше, чем нужно. У него повышается объем кровотока по сосудам, что сильно нагружает сердце, сосуды и почки. Из-за этого отделы сердца расширяются и утолщаются, сердце разрастается и может грозить пороками. Почки работают усиленно, увеличивается мочевой пузырь и образуется многоводие из-за большого объема мочи плода. Если же плодный пузырь у близнецов общий, изменений объема околоплодных вод можно не заметить, и тогда гибель плода реципиента может наступать из-за перегрузки и пороков сердца и почек, а донора – от гипоксии и гипотрофии.
Классификация фето-фетального синдрома у двойни
Врачами принято выделять несколько степеней тяжести синдрома фето-фетальной трансфузии, исходя из степени тяжести состояния плодов, объема амниотической жидкости и копчико-теменного размера по УЗИ. При прогрессировании синдрома изменения при беременности нарастают таким образом, что к предыдущим изменениям присоединяются еще и новые. По данным медиков сегодня выделяют пять степеней тяжести (они же стадии) фетального синдрома:
- на первой стадии по данным УЗИ может фиксироваться разница в количестве амниотической жидкости у плодов. У донора будет выявлено маловодие, а у реципиента вод слишком много. Это приводит еще в ранние сроки гестации к формированию складочек в перегородке между пузырями плодов (этот признак врачи видят на УЗИ уже в 11-16 недель).
Обратите внимание
Если у двойни общий плодный пузырь, подобный признак не выявляется.
- на второй стадии видна разница в объеме околоплодной жидкости, а у плода-донора нет наполненности мочевого пузыря, он значительно меньше по размерам и массе тела, разница составляет 20% и более. У плода-реципиента врач видит переполненный и большого размера мочевой пузырь.
- на третьей стадии по данным УЗИ можно вывить изменения в строении сердца и сосудов у обоих плодов, что видно как при исследовании традиционным аппаратом, так и при использовании доплера. У ребенка-реципиента сердце резко увеличено, имеется недостаточность в области клапанов и расширен легочный ствол.
- в четвертую стадию плод-реципиент страдает от водянки, у него сильно отекает все тело, печень и селезенка резко увеличены, жидкость копится в полостях тела.
- на последней, пятой стадии врач регистрируют внутриутробную гибель одного плода или сразу обоих.
Важно понимать, что стадии течения синдрома не привязаны к срокам беременности, при неблагоприятном стечении обстоятельств синдром может выявляться уже в конце первого триместра. Для врачей важной границей для развития данного синдрома будет срок 25-26 недель, если он появился ранее этого периода, это приводит к неблагоприятным исходам и прерыванию беременности даже при полноценном лечении.
Важно
В некоторых случаях принимается решение о спасении только одного плода в ущерб более страдающему и больному близнецу.
Проявления фето-фетального синдрома при беременности
Как таковых внешних и субъективных ощущений развитие данного синдрома для матери не формирует. Его вываляют только по данным УЗИ-скрининга, хотя по данным врачей нередко на фоне него могут формироваться:
- Гипертонус матки
- Угроза прерывания беременности
- Кровянистые выделения из влагалища
- Часть врачей говорит о том, что самопроизвольное прерывание беременности при многоплодии нередко связано именно с ранним формированием данного синдрома, еще до возможностей его обнаружения по данным УЗИ.
При внутриутробной гибели плода или обоих на фоне синдрома могут возникать боль в груди и животе, маточные кровотечения или кровянистые выделения из влагалища. В поздние сроки мать перестает ощущать движения плодов.
Каковы последствия синдрома для плодов: донора и реципиента
Итак, мы разобрались, что из-за особенностей строения сосудов в плаценте, один из близнецов, именуемый реципиентом, «обворовывает» своего второго близнеца-донора. И в этой ситуации страдают оба ребенка, а не только тот, у кого оттекает кровь с кислородом и питательными веществами.
Ребенок-донор испытывает следующие проблемы:
- Выражено отстает в ростовых и весовых показателях, это формируется из-за обделенности питательными компонентами, что приводит к ЗВУР.
- Снижается образование мочи или она полностью перестает отделяться. Это происходит в силу того, что резко сниженный кровоток в теле доставляет мало крови к почкам, которые очень слабо работают и не образуют мочу, из-за чего она не оттекает в мочевой пузырь, тот не наполняется и не виден врачу на УЗИ.
- обнаруживается выраженное маловодие из-за малого образования мочи ребенком и выделения ее в околоплодные воды. Из-за снижения работы почек объем околоплодной жидкости резко снижается, при критическом снижении объема жидкости на плод давят стенки матки, что затрудняет его двигательную активность с отставанием моторного развития.
- развивается снижение гемоглобина с эритроцитами, что формирует анемию. Это усиливает кислородный дефицит в тканях плода, нарушая еще больше работу почек и мозговой ткани.
Ребенок-реципиент страдает от следующих изменений:
- формируется сгущение крови с состоянием полицитемии, что происходит за счет активного и чрезмерного сброса крови в сосуды плода. Это формирует избыточные объемы клеток крови на фоне несколько сниженного объема плазмы.
- повышение давления крови в сосудах и увеличение сердца в размерах, чтобы прокачать весь этот повышенный объем крови. Она более густая и вязкая, ее много, чтобы справиться с нагрузками, необходимо увеличить объем мышц в сердечной стенке.
- повышенное давление и объем крови приводят к усилению работы почек плода, что приводит к большим объемам мочи и растяжению мочевого пузыря. Излишки жидкости поступают в околоплодные воды, формируя многоводие.
- развиваются сердечная и почечная недостаточности.
- избыток околоплодных вод давит на плаценту, приводя к гипоксии второго плода еще более выраженной.
Избыточное давление одного из плодов на общие плодные оболочки грозит их ранним разрывом и запуском преждевременных родов. Самым тяжелым из осложнений станет гибель обоих малышей. При отсутствии лечения такой сценарий достигает 80-100%, особенно, если патология развилась ранее 25 недель беременности.
Важно
Методы лечения синдрома могут приводить к выживанию хотя бы одного из плодов, а если остаются живы оба, у них повышен риск ДЦП, перинатальных поражений нервной системы и пороков сердца и почек.
До какого срока ставится диагноз фето-фетальный синдром?
Для того чтобы разработать тактику ведения беременности с подобным синдромом, важно вовремя и предельно точно установить диагноз, определив степень тяжести патологии и выраженность страданий обоих плодов. Обычно синдром фето-фетальной трансфузии можно выявить в периоды скрининговых УЗИ и уже по факту определения двойни и ее типа (однояйцовые близнецы с общей плацентой). Уже с этим женщину вносят в группу риска и тщательно за нею наблюдают, проводя УЗИ несколько раз до срока в 16-20 недель. Если выявлены подозрения на синдром, проводят дополнительные исследования, что помогает в прогнозировании осложнении и разработке тактики дальнейшего ведения и лечения.
Прежде всего, необходимо полноценное УЗИ плодов, которое наиболее показательно со второго триместра. Исходя из стадии патологии, при помощи УЗИ определяется многоводие у плода-реципиента, которое не соответствует сроку беременности, а также резкое превышение размеров мочевого пузыря, а если это тяжелые процессы – общий отек тела и пороки в развитии внутренних органов. У плода-донора выявляют маловодие и уменьшение размеров как самого тела и массы, так и мочевого пузыря.
Обратите внимание
По данным фетометрии обнаруживается резкий дисбаланс между размерами и массой плодов, у них нет соответствия окружностей головки, животика и груди, различная длина трубчатых костей и нет соответствия их срокам гестации. Разница по данным УЗИ при синдроме достигает 20% и более.
Определяют по данным доплерометрии проблемы с кровотоком у плода, как донора, так и реципиента, а по данным исследования сердца определяют изменения у донора с пороком сердца, его увеличением.
Методы лечения фето-фетального синдрома
Как мы уже говорили ранее, без полноценного и активного лечения подобный синдром почти в 100% случаев приводит к гибели обоих плодов или рождению крайне тяжелых детей, которые практически не выживают. Консервативная терапия сосудистыми препаратами и средствами для нормализации микроциркуляции в сосудах плаценты и пуповины показала себя неэффективной, и используется только как дополнительная и вспомогательная при планировании или проведении хирургической коррекции. Такие же прогнозы имеет и применение гормональной терапии за счет препаратов прогестерона или иных медикаментов, которые применимы для пролонгации беременности в акушерстве. Сегодня помочь в решении проблемы фето-фетального синдрома трансфузии могут только современные и радикальные методики:
- На заре попыток лечения проводились попытки амниоредукции (дренаж амниотических вод). Это периодические проколы матки и плодного пузыря с удалением избытка вод и реципиента, помогавший частично при состоянии острого многоводия. Но частые инвазивные вмешательства резко повышали шансы на преждевременные роды, отслойки плаценты и кровотечения. Выживает при такой процедуре до 60% плодов реципиентов, доноры обычно гибнут, риск ДЦП как осложнения оставляет до 15%.
- были попытки применения септостомии, создания просвета между плодными пузырями плодов. Многими из специалистов ставится под сомнение необходимость и эффективность процедуры, при которой создается искусственное отверстие, что затрудняет оценку динамики изменения вод у каждого из плодов. Также есть риск при проведении повреждении одной и пуповин у плодов с гибелью малыша. Но и здравое зерно в подобной процедуре есть – избыток вод у одного плода помогает в компенсации их нехватки у второго.
- методика фетоскопической окклюзии пуповины у одного из плодов. При ней происходит гибель одного из плодов для спасения жизни второго, и проводится она только в крайних случаях, когда высок риск потери обоих детей. При проведении методики перекрывается кровоток в одной из пуповин (выбирают более пострадавший плод), что улучшает состояние и развитие второго. Применяют в ранние сроки беременности, и вероятность сохранить второй плод достигает 80%, с риском осложнений в его здоровье около 5% после рождения.
- на сегодня самым прогрессивным и эффективным для спасения обоих плодов является лазерное коагулирование области патологических анастомозов в области плаценты. При подобной процедуре в маточную полость вводятся очень тонкая трубка-инструмент, под контролем зрения хирурга прижигаются участки патологических плацентарных сосудов. При первой процедуре процент выживаемости одного плода достигает 90%, а обоих детей до 70%. Если же провести несколько вмешательств, можно спасти жизни обоим детям.
Важно
Современные инструменты и оборудование с компьютерной точностью позволяет свести к минимуму риски осложнений и достичь процента выживаемости одного плода до 100%, а сразу двух – до 90%. Операции обычно проводят за границей, стоят они дорого и у нас бесплатно их выполнить пока нельзя.
Каковы прогнозы при развитии синдрома при гестации?
Развитие синдрома фето-фетальной аномалии кровотока без полноценного лечения и радикальных хирургических вмешательств приведет к неблагоприятным прогнозам. Если женщина с подобной беременностью не наблюдается у врача – это гибель обоих плодов практически с 100%-ной вероятностью еще в ранние сроки гестации. Заканчивается такая беременность самопроизвольным ее прерыванием.
Если же поставлен диагноз и проведено оперативное вмешательство в период вынашивания плодов, его результаты могут зависеть от множества факторов:
- какая стадия в развитии имеется на момент терапии
- каков срок беременности у женщины
- имеются ли у матери определенные патологии в здоровье
- есть ли отклонения в течении гестации кроме проблем плода.
Нередко встает тяжелый и печальный выбор перед родителями, сохранить жизнь хотя бы одному из плодов или потерять обоих, но и в этом случае прогнозы для здоровья второго малыша не будут 100%-но положительными. Важно применять лечебные меры с самого раннего срока беременности. А мер профилактики для подобного состояния на сегодня не разработано в силу того, что неизвестны точные причины его возникновения. Предугадать, разовьется ли подобная проблема при беременности или нет – невозможно.
Парецкая Алена, педиатр, медицинский обозреватель
9,618 просмотров всего, 10 просмотров сегодня
Загрузка…
Фетальный вальпроевый синдром
Фетальный вальпроевый синдром является редким врожденным расстройством. Оно развивается из-за воздействия на плод вальпроевой кислоты в течение первых трех месяцев беременности. Вальпроевая кислота представляет собой противосудорожное лекарственное средство. Оно применяется в управлении определенными типами судорог и в лечении эпилепсии. Небольшой процент беременных женщин, которые принимают этот препарат, могут иметь ребенка с этим синдромом. Точная распространенность этого синдрома неизвестна. Симптомы и проявления нарушения могут включать: расщелины позвоночника, отличительные черты лица и другие нарушения (в частности опорно-двигательного аппарата).
Фетальный вальпроевый синдром. Эпидемиология
Фетальный вальпроевый синдром развивается у лиц обоих полов. Расщелина позвоночника встречается приблизительно у 1-5% пациентов, а аномалии лица встречаются почти у половины детей, подвергшихся воздействию вальпроевой кислоты в период внутриутробного развития.
Фетальный вальпроевый синдром. Причины
Фетальный вальпроевый синдром является редким расстройством. Это нарушение может развиться у плода, чья мама принимала вальпроевую кислоту в течение первых трех месяцев беременности. Считается, что вальпроевая кислота проникает через плаценту и препятствует нормальному развитию плода, вызывая аномалии развития (тератогенез). Некоторые исследователи считают, что тяжесть дефектов может быть связанна с дозами и длительностью приема этого препарата.
Фетальный вальпроевый синдром. Фото
Двусторонние аномалии рук, дряблая кожа, двусторонняя паховая грыжа у ребенка с фетальным вальпроевым синдромом.
Обратите внимание на низкорасположенные уши, широкую переносицу, вздернутый нос, тонкую верхнюю губу, толстую нижнюю губу, маленький рот и на аномалии бровей у ребенка с фетальным вальпроевым синдромом.
Фетальный вальпроевый синдром. Симптомы и проявления
Младенцы с фетальным вальпроевым синдромом могут родиться с расщелиной позвоночника. Часть содержимого позвоночного канала может выступать через эту расщелину. В зависимости от тяжести порока, у ребенка могут отмечаться различные неврологические и физические проявления.
Младенцы могут иметь вертикальные складки кожи по обе стороны носа, которые образуют канавку под глазом, небольшой вздернутый нос с плоским мостом, маленький рот, длинную и тонкую верхнюю губу и / или незначительные аномалии ушей.
Другие аномалии, которые могут быть обнаружены у небольшого количества детей, включают: слаборазвитые ногти пальцев рук и ног, вывих бедра, длинные, тонкие пальцы рук и ног (арахнодактилия), перекрывающиеся пальцы рук и ног, диастаз прямых мышц живота, отсутствие первого ребра, гипоспадии, аномалии сердца, трахеомаляция и / или косолапость.
Дефицит роста и необыкновенно маленькая голова (микроцефалия), могут также наблюдаться у некоторых детей, но только в том случае, если мама во время беременности принимала вальпроевую кислоту в сочетании с другими противосудорожными препаратами.
Фетальный вальпроевый синдром. Лечение
Легкие расщелины позвоночника редко требуют лечения. В умеренных случаях, как правило, будет требоваться операция. Хирургической операцией можно предотвратить ухудшение этого состояния (в некоторых случаях), но восстановить потерянные функции мышц уже не получится. В крайних случаях, когда менингоцеле находится на грани разрыва, хирургам придется провести немедленную операцию. Лица с тяжелыми расщелинами позвоночника могут развить контрактуры суставов и аномальную осанку. Это происходит из-за паралича мышц в ногах. Ребенок с повреждением позвонков должен пройти необходимую ортопедическую и физическую терапии, начиная с раннего возраста, чтобы можно было предотвратить развитие контрактур.
Хирургическое вмешательство может быть необходимо для устранения дефектов сердца, а также других крупных пороков развития. Другое лечение только симптоматическое и поддерживающее.
Синдром постоянного фетального кровообращения — RightDiagnosis.com
Введение: Синдром устойчивого кровообращения плода
Описание синдрома устойчивого кровообращения плода
Синдром стойкого кровообращения у плода : Синдром стойкой ЛЕГКОЙ ГИПЕРТЕНЗИИ у новорожденного (НОВОРОЖДЕННОГО, НОВОРОЖДЕННОГО) без явных ЗАБОЛЕВАНИЙ СЕРДЦА. Это состояние новорожденного может быть вызвано тяжелой вазоконстрикцией легких (реактивный тип), гипертрофией мышц легочной артерии (гипертрофический тип) или аномально развитыми легочными артериолами (гипопластический тип).Новорожденный пациент демонстрирует ЦИАНОЗ и АКИДОЗ из-за сохранения паттерна кровообращения плода — шунтирования крови справа налево через открытый артериальный проток (DUCTUS ARTERIOSUS, ПАТЕНТ) и иногда через открытое овальное отверстие (FORAMEN OVALE, ПАТЕНТ).
Источник: MeSH 2007
Синдром постоянного фетального кровообращения: Связанные темы
Эти темы о медицинских состояниях или симптомах могут иметь отношение к
Медицинская информация при синдроме постоянного кровообращения у плода:
Термины, связанные с синдромом постоянного кровообращения плода:
Термины, похожие на синдром постоянного кровообращения плода:
Источник — MeSH 2007
Расширенные термины для синдрома постоянного кровообращения плода
Источник — MeSH 2007
Иерархическая классификация синдрома постоянного фетального кровообращения
В следующем списке предпринимается попытка классифицировать синдром постоянного кровообращения плода по категориям, где каждая строка является подмножеством следующей.
MeSH 2007 Иерархия:
MeSH 2007 Иерархия
Интересные медицинские статьи:
Медицинские словари:
Другие темы в медицинском словаре
Узнать больше
Чтобы узнать больше о синдроме постоянного кровообращения у плода, выполните поиск:
»Следующая страница: Постоянный фронтальный шов
Медицинские инструменты и изделия:
Инструменты и услуги:
Медицинские изделия:
Форумы и доски сообщений
- Задайте или ответьте на вопрос в советах директоров:
Синдром стойкого кровообращения плода: болезнь Биоинформатика: Novus Biologicals
Разместите свое изображение, связанное с болезнями, чтобы его разместили!
Социальные сети
Разместите свою учетную запись в Твиттере, связанную с синдромом постоянного кровообращения плода, чтобы быть избранным!
Блоги
Разместите свой блог о синдроме стойкого кровообращения у плода, чтобы быть избранным! |
События
| Разместите свое мероприятие по синдрому стойкого кровообращения у плода, чтобы быть популярным! |
Видео
Отправьте свое видео о синдроме стойкого кровообращения плода, чтобы его отметили!
Благотворительность
Отправьте свою благотворительную организацию по теме «Синдром стойкого кровообращения у плода», чтобы ее представили!
Исследования синдрома постоянного кровообращения у плода связывают с гипертонической болезнью, легочной гипертензией, гипоксией, диафрагмальной грыжей, грыжей.Об исследовании синдрома постоянного кровообращения у плода упоминалось в исследовательских публикациях, которые можно найти с помощью нашего инструмента биоинформатики ниже. Исследованные пути, связанные с синдромом стойкого кровообращения плода, включают транспорт, секрецию, вазоконстрикцию, патогенез, расширение сосудов. Эти пути дополняют наш каталог исследовательских реагентов для изучения синдрома персистирующей фетальной циркуляции, включая антитела и наборы для ELISA против POMC, NOS3, EDN1, TNF, INS.
Инструмент для биоинформатики синдрома постоянной циркуляции плода
Laverne — это удобный инструмент биоинформатики, помогающий облегчить научное исследование родственных генов, болезней и путей на основе совместного цитирования.Узнайте больше о синдроме постоянного кровообращения у плода ниже!
Для получения дополнительной информации о том, как использовать Laverne, прочтите Руководство.
Лучшие исследовательские реагенты
У нас есть 2838 продуктов для исследования синдрома персистирующего кровообращения плода, которые могут быть применены для вестерн-блоттинга, проточной цитометрии, иммуноцитохимии / иммунофлюоресценции, иммуногистохимии из нашего каталога антител и наборов для ELISA.
NB100-1533
Коза Поликлональная
Виды Человек, мышь, крыса
Приложения WB, Flow, ICC / IF
| 10 Публикаций | добавить в корзину |
NB300-500
Кролик Поликлональный
Виды Человек, мышь, крыса
Приложения WB, IHC, IHC-Fr
| 3 Обзоры 16 Публикации | добавить в корзину |
DET100
| 6 Обзоры 40 Публикации | добавить в корзину |
210-ТА
| 30 Обзоры 643 Публикации | добавить в корзину |
NBP2-34260
Мышь Monoclonal
Виды Человек, мышь, свинья
Приложения WB, Flow, ICC / IF
| 5 Обзоров 1 Публикация | добавить в корзину |
H00001392-M02
Мышь Моноклональная
Виды Человек
Приложения WB, ELISA, IHC
| 3 Публикации | добавить в корзину |
291-G1
| 5 Обзоры 138 Публикации | добавить в корзину |
NBP2-26116
Коза Поликлональная
Виды Человек
Приложения WB, IHC, IHC-P
| 1 Публикация | добавить в корзину |
NBP2-32001
Кролик Поликлональный
Виды Человек, Мышь
Приложения WB, IHC, IHC-P
| 1 Публикация | добавить в корзину |
NB600-41532
Коза Поликлональная
Виды Человек, Мышь
Приложения WB, ELISA, ICC / IF
| 37 Публикации | добавить в корзину |
NBP1-48002
Мышь Monoclonal
Виды Человек, собака, примат
Приложения WB, ICC / IF, IHC
DVE00
| 25 Обзоры 512 Публикации | добавить в корзину |
NB100-62346
Мышь Моноклональная
Виды Человек, мышь, крыса
Приложения WB, ELISA, IHC
| 12 Публикаций | добавить в корзину |
NB600-101
Кролик Поликлональный
Виды Человек, Мышь, Крыса
Приложения WB, Simple Western, DB
| 24 Публикации | добавить в корзину |
NBP2-69822
| 1 Публикация | добавить в корзину |
Кровообращение плода | Американская кардиологическая ассоциация
Кровь, которая течет через плод, на самом деле сложнее, чем после рождения ребенка (нормальное сердце).Это потому, что мать (плацента) выполняет ту работу, которую легкие ребенка будут делать после рождения.
Плацента принимает кровь без кислорода от плода по кровеносным сосудам, которые выходят из плода через пуповину (пупочные артерии, их две). Когда кровь проходит через плаценту, она забирает кислород. Затем богатая кислородом кровь возвращается к плоду через третий сосуд в пуповине (пупочная вена). Богатая кислородом кровь, которая попадает в плод, проходит через печень плода и попадает в правую часть сердца.
Богатая кислородом кровь проходит через одно из двух дополнительных соединений в сердце плода, которые закрываются после рождения ребенка.
Отверстие между двумя верхними камерами сердца (правым и левым предсердием) называется открытым овальным отверстием (PFO). Это отверстие позволяет богатой кислородом крови проходить из правого предсердия в левое, а затем в левый желудочек и выходить из аорты. В результате в мозг попадает кровь с наибольшим количеством кислорода.
Кровь, возвращающаяся из тела плода, также поступает в правое предсердие, но плод может посылать эту бедную кислородом кровь из правого предсердия в правый желудочек (камера, которая обычно перекачивает кровь в легкие).Большая часть крови, которая покидает правый желудочек у плода, проходит через легкие через второе из двух дополнительных фетальных соединений, известных как артериальный проток.
Артериальный проток отправляет бедную кислородом кровь к органам в нижней половине тела плода. Это также позволяет бедной кислородом крови выходить из плода через пупочные артерии и возвращаться к плаценте, чтобы забрать кислород.
Поскольку открытое овальное отверстие и артериальный проток являются нормальным явлением у плода, невозможно предсказать, закроются ли эти соединения нормально после рождения в нормальном сердце плода.Эти два обходных пути в кровообращении плода позволяют большинству плодов пережить беременность даже при наличии сложных проблем с сердцем, и не затрагиваются до тех пор, пока после рождения эти пути не начнут закрываться.
К сожалению, запрошенная страница не найдена
К сожалению, запрошенная страница не найденаДля того, чтобы предоставить вам наилучшее взаимодействие с пользователем, этот сайт использует Javascript. Если вы видите это сообщение, вероятно, в вашем браузере отключен параметр Javascript.Для оптимального просмотра этого сайта убедитесь, что в вашем браузере включен Javascript.
Знаете ли вы, что ваш браузер устарел? Чтобы получить наилучшие впечатления от использования нашего веб-сайта, мы рекомендуем вам перейти на более новую версию. Учить больше.
Пожалуйста, попробуйте использовать нашу поисковую систему
Вас также может заинтересовать
Членство
Мы объединяем профессионалов в области сердечно-сосудистой системы, занимающихся проблемами сердечно-сосудистой системы, всех специальностей, ролей и этапов карьеры по всему миру.Узнайте, как вы можете присоединиться к мировому кардиологическому сообществу.
Узнать больше
Методические рекомендации
Все соответствующие доказательства, чтобы помочь врачам взвесить преимущества / риски диагностических или терапевтических процедур.
Узнать больше
Образование
Интерактивные и научно обоснованные образовательные ресурсы по общей кардиологии и специальностям для поддержки вашего непрерывного медицинского образования.
Узнать больше
определение persistent_fetal_circulation и синонимы persistent_fetal_circulation (английский)
содержание сенсагента
- определения
- синонимы
- антонимы
- энциклопедия
Решение для веб-мастеров
Александрия
Всплывающее окно с информацией (полное содержание Sensagent), вызываемое двойным щелчком по любому слову на вашей веб-странице.Предоставьте контекстные объяснения и перевод с вашего сайта !
Попробуйте здесь или получите код
SensagentBox
С помощью SensagentBox посетители вашего сайта могут получить доступ к надежной информации на более чем 5 миллионах страниц, предоставленных Sensagent.com. Выберите дизайн, который подходит вашему сайту.
Бизнес-решение
Улучшите содержание вашего сайта
Добавьте новый контент на свой сайт из Sensagent by XML.
Сканировать продукты или добавлять
Получите доступ к XML, чтобы найти лучшие продукты.
Индексирование изображений и определение метаданных
Получите доступ к XML, чтобы исправить значение ваших метаданных.
Напишите нам, чтобы описать вашу идею.
Lettris
Lettris — любопытная игра-клон-тетрис, в которой все кубики имеют одинаковую квадратную форму, но разное содержание. На каждом квадрате есть буква. Чтобы квадраты исчезли и сэкономили место для других квадратов, вам нужно собрать английские слова (left, right, up, down) из падающих квадратов.
болт
Boggle дает вам 3 минуты, чтобы найти как можно больше слов (3 буквы и более) в сетке из 16 букв. Вы также можете попробовать сетку из 16 букв. Буквы должны располагаться рядом, и более длинные слова оцениваются лучше. Посмотрите, сможете ли вы попасть в Зал славы сетки!
Английский словарь
Основные ссылки
WordNet предоставляет большинство определений на английском языке.
Английский тезаурус в основном является производным от The Integral Dictionary (TID).
Английская энциклопедия лицензирована Википедией (GNU).
Перевод
Измените целевой язык, чтобы найти перевод.
Советы: просмотрите семантические поля (см. От идей к словам) на двух языках, чтобы узнать больше.
9154 онлайн посетителей
вычислено за 0,063 с
определение синдрома устойчивого кровообращения плода и синонимов синдрома постоянного кровообращения плода (английский)
синдром стойкого кровообращения плода: определение синдрома постоянного кровообращения плода и синонимы синдрома постоянного кровообращения плода (английский)
арабский
болгарский
китайский язык
хорватский
Чешский
Датский
Голландский
английский
эстонский
Финский
французкий язык
Немецкий
Греческий
иврит
хинди
Венгерский
исландский
индонезийский
Итальянский
Японский
корейский язык
Латышский
Литовский язык
Малагасийский
норвежский язык
Персидский
Польский
португальский
румынский
русский
сербский
словацкий
словенский
испанский
Шведский
Тайский
турецкий
вьетнамский
арабский
болгарский
китайский язык
хорватский
Чешский
Датский
Голландский
английский
эстонский
Финский
французкий язык
Немецкий
Греческий
иврит
хинди
Венгерский
исландский
индонезийский
Итальянский
Японский
корейский язык
Латышский
Литовский язык
Малагасийский
норвежский язык
Персидский
Польский
португальский
румынский
русский
сербский
словацкий
словенский
испанский
Шведский
Тайский
турецкий
вьетнамский
сообщить о проблеме
Синдром устойчивого кровообращения у плода (n.)
1. (MeSH) Синдром стойкой ЛЕГКОЙ ГИПЕРТЕНЗИИ у новорожденного (НОВОРОЖДЕННОГО, НОВОРОЖДЕННОГО) без явных ЗАБОЛЕВАНИЙ СЕРДЦА. Это состояние новорожденного может быть вызвано тяжелой вазоконстрикцией легких (реактивный тип), гипертрофией мышц легочной артерии (гипертрофический тип) или аномально развитыми легочными артериолами (гипопластический тип). Новорожденный пациент демонстрирует ЦИАНОЗ и АКИДОЗ из-за сохранения паттерна кровообращения плода — шунтирования крови справа налево через открытый артериальный проток (DUCTUS ARTERIOSUS, ПАТЕНТ) и иногда через открытое овальное отверстие (FORAMEN OVALE, ПАТЕНТ).
сообщить о проблеме
аналоговый словарь
Врожденные, наследственные и неонатальные заболевания и аномалии, Врожденные пороки, расстройства, врожденные, неонатальные заболевания и аномалии — болезни, легочные, болезни, легочные, болезни легких, врожденные болезни, легочные пороки сердца, пороки сердца, аномалии Врожденные пороки сердца, пороки, врожденные пороки сердца, пороки сердца, пороки сердца, врожденные пороки сердца, пороки сердца, врожденные [Hyper.]
Синдром постоянного кровообращения плода (n.)
[MeSH] ↕
Все переводы синдрома устойчивого кровообращения плода
содержание сенсагента
- определения
- синонимы
- антонимы
- энциклопедия
Решение для веб-мастеров
Александрия
Всплывающее окно с информацией (полное содержание Sensagent), вызываемое двойным щелчком по любому слову на вашей веб-странице.Предоставьте контекстные объяснения и перевод с вашего сайта !
Попробуйте здесь или получите код
SensagentBox
С помощью SensagentBox посетители вашего сайта могут получить доступ к надежной информации на более чем 5 миллионах страниц, предоставленных Sensagent.com. Выберите дизайн, который подходит вашему сайту.
Бизнес-решение
Улучшите содержание вашего сайта
Добавьте новый контент на свой сайт из Sensagent by XML.
Сканировать продукты или добавлять
Получите доступ к XML, чтобы найти лучшие продукты.
Индексирование изображений и определение метаданных
Получите доступ к XML, чтобы исправить значение ваших метаданных.
Напишите нам, чтобы описать вашу идею.
Lettris
Lettris — любопытная игра-клон-тетрис, в которой все кубики имеют одинаковую квадратную форму, но разное содержание. На каждом квадрате есть буква. Чтобы квадраты исчезли и сэкономили место для других квадратов, вам нужно собрать английские слова (left, right, up, down) из падающих квадратов.
болт
Boggle дает вам 3 минуты, чтобы найти как можно больше слов (3 буквы и более) в сетке из 16 букв. Вы также можете попробовать сетку из 16 букв. Буквы должны располагаться рядом, и более длинные слова оцениваются лучше. Посмотрите, сможете ли вы попасть в Зал славы сетки!
Английский словарь
Основные ссылки
WordNet предоставляет большинство определений на английском языке.
