Случай нефрогенного синдрома неадекватного антидиуреза, обусловленный мутацией рецептора вазопрессина 2-го типа
Геномную ДНК выделяли из периферических лейкоцитов с использованием стандартных методов. С помощью полимеразной цепной реакции (ПЦР) амплифицировали фрагменты геномной ДНК, охватывающие кодирующую последовательность гена AVPR2 с примыкающими участками интронов. После электрофореза в 1% агарозном геле продукты ПЦР очищали с использованием набора Cleanup Standard («Евроген», Россия), а затем секвенировали на автоматическом секвенаторе ABI Genetic Analyzer 3130 («Applied Biosystems», США).
При проведении ПЦР и последующем секвенировании соответствующих экзонов и примыкающих участков интронов использовали следующие олигонуклеотиды: 1 °F, 5’-GACCCTGGGCCATTGAACTTG-3’; 2 °F, 5’-CTCTCCATAGTCTTTGTG-3’; 3R, 5’-CACA GGCTCTGGCCAATTCTC-3’. В качестве референсной последовательности гена AVPR2 использовалась ссылка Genbank (http://www.ncbi.nlm.nih.gov/sites/entrez) под номером Z11687. 1. Обозначение мутаций проводили в соответствии с рекомендациями den Dunnen и Antonarakis [0].
1. Обозначение мутаций проводили в соответствии с рекомендациями den Dunnen и Antonarakis [0].
При секвенировании гена AVPR2 выявлена гемизиготная транзиция c. 935T>С в экзоне 3, что приводило к замене кодона лейцина (TTG) на серин (TCG) в положении 312 (p.L312S). Кодон L312 располагается в VII трансмембранном домене рецептора. У матери ребенка данная мутация была выявлена в гетерозиготном состоянии. Данная мутация описывается впервые, ее патогенность была доказана при проведении функционального исследования [3].
Обсуждение
НСНАД — нарушение водного баланса, обусловленное активирующей мутацией гена AVPR2. Заболевание редкое; на сегодняшний день активирующая мутация AVPR2 описана у 28 человек, из них большая часть — семейные варианты [4—7].
Известны 4 активирующие мутации AVPR2, ведущие к развитию НСНАД: R137L, R137С, F229V и I130N [1, 6—8]. Также был описан клинический случай НСНАД с мутантным рецептором V266A, функциональное исследование которого доказало его интактность; причиной заболевания, по-видимому, являлся дефект на уровне аквапорина-2 [10].
Заболевание носит Х-сцепленный характер, чаще встречается у мужчин: всего описано 8 женщин с активирующей мутацией AVPR2, из них клинико-лабораторная картина НСНАД наблюдалась у 5 [4, 11, 12]. Уровень натрия плазмы у матери нашего пациента, измеренный впервые в связи с заболеванием мальчика, был в пределах нормы.
Неадекватный антидиурез, развивающийся при избытке АДГ или при конституциональной (лиганд-независимой) активации рецептора AVPR2, — это нерегулируемая реабсорбция жидкости, обусловливающая, с одной стороны, увеличение осмоляльности мочи со снижением ее объема, а с другой — рост объема жидкости в организме с развитием гипонатриемии разведения и гипоосмоляльности. Кроме того, увеличение объема экстрацеллюлярной жидкости приводит к активации предсердного натрийуретического пептида, что увеличивает экскрецию ионов натрия с мочой [11].
Критерии неадекватного антидиуреза [14]:
— эуволемическая гипоосмоляльная гипонатриемия;
— увеличение экскреции Na+ более 20 ммоль/л при нормальном уровне потребления жидкости и соли;
— увеличение осмоляльности мочи более 100 мОсм/кг;
— исключение гипокортицизма, гипотиреоидизма;
— ненарушенная функция почек, отсутствие приема диуретиков.
АРП у таких пациентов снижена, альдостерон — в пределах нормы [1, 15]. Снижение активности ренин-ангиотензиновой системы должно быть обусловлено повышенным ОЦК, однако гипоосмоляльная гипонатриемия стимулирует секрецию альдостерона [16].
Дифференциальная диагностика синдрома неадекватной секреции антидиуретического гормона (СНСАДГ) и НСНАД основывается на уровне АДГ. При отсутствии возможности измерения данного показателя (как в нашем случае) целесообразно проведение анализа гена AVPR2.
Клинические проявления НСНАД обусловлены гипонатриемической энцефалопатией: тошнота, рвота, нарушение сознания, судороги. Выраженность клинической картины и время манифестации НСНАД отличаются большой вариабельностью — от гипонатриемических судорог с детства до бессимптомной гипонатриемии с олигодипсией [4, 5]. Гипонатриемия может возникать лишь при значительной водной нагрузке, причем как при гемизиготных мутациях (у мужчин), так и при гетерозиготных (у женщин) [15].
В нашем случае имела место бессимптомная хроническая гипонатриемия, причиной обострения которой, скорее всего, явилась водная нагрузка в условиях жаркого климата.
Исходя из патогенеза заболевания, обязательным лечебным мероприятием является ограничение жидкости (50—70 мл/кг/сут), обычно легко переносящееся пациентами. Мочевина, вызывающая осмотический диурез, доказала свою эффективность в применении как у взрослых, так и у детей, в дозе от 0,1 до 2 г/кг/сут [4, 15].
Ваптаны, антагонисты АДГ, неэффективны при мутации R137L/С, что было доказано при клиническом применении [9] и in vitro [17]. Однако функциональное исследование мутации F229V in vitro показало снижение уровня цАМФ в ответ на введение антагонистов АДГ [6]. Таким образом, активирующие мутации AVPR2 могут приводить к различным изменениям структуры рецептора, что имеет значение при оценке возможности терапевтического использования антагонистов АДГ.
Учитывая мягкое течение гипонатриемии у нашего пациента лечебные мероприятия ограничились снижением количества потребляемой жидкости с контролем уровня натрия крови в динамике. Таким образом, впервые в отечественной практике описан случай НСНАД, ассоциированного с мутацией в гене рецептора вазопрессина 2-го типа.
Таким образом, впервые в отечественной практике описан случай НСНАД, ассоциированного с мутацией в гене рецептора вазопрессина 2-го типа.
Заключение
Нефрогенный синдром неадекватного антидиуреза следует включить в алгоритм дифференциальной диагностики синдрома гипонатриемии у детей. Молекулярно-генетическое исследование позволяет установить правильный диагноз и обосновать необходимость долгосрочного ограничения жидкости.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Согласие пациента. Законные представители пациента дали письменное информированное согласие на публикацию медицинских данных в рамках настоящей статьи.
Участие авторов: концепция и дизайн исследования, анализ полученных данных, написание текста — Н.В. Маказан, А.Н. Тюльпаков; сбор материала, анализ полученных данных: Н.А. Зубкова; проведение молекулярно-генетического исследования: А.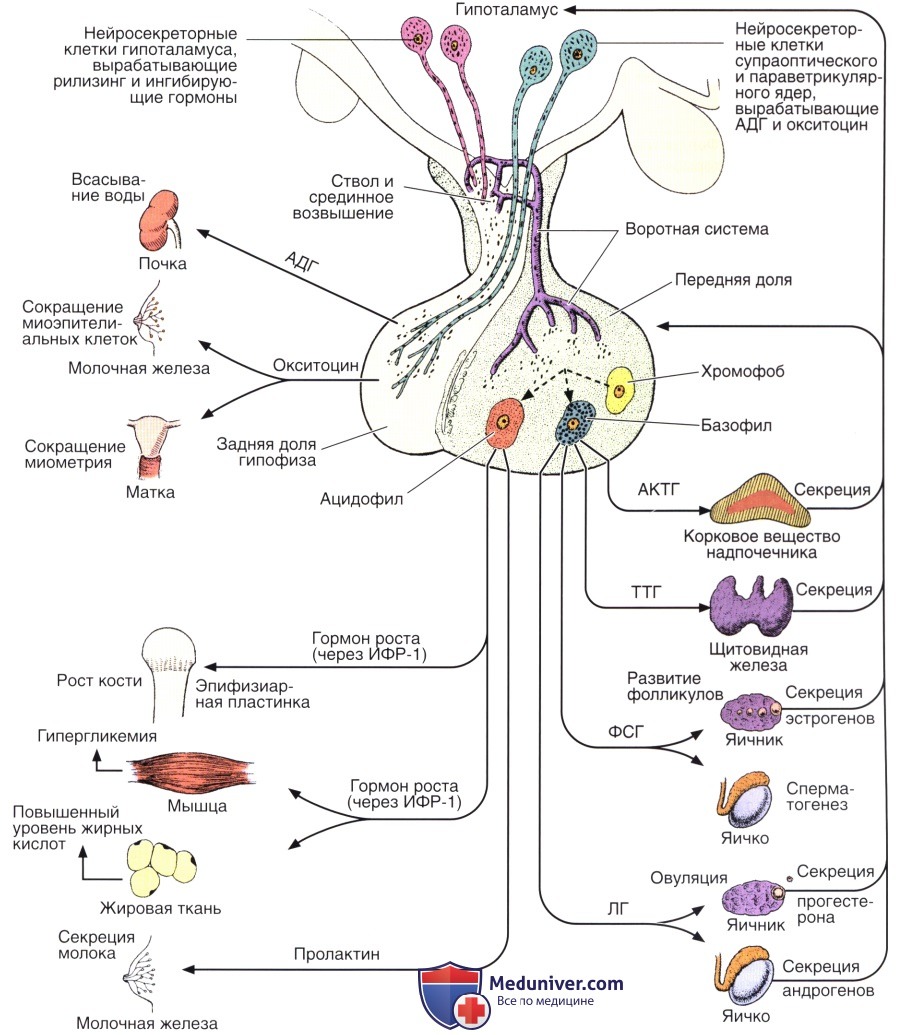 Н. Тюльпаков.
Н. Тюльпаков.
проблемы диагностики и терапии – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
© И.Г. Каюков. В.Г.Лукнчсв, Ю.О.Котовой, 2003 УДК [616.631.15:612.018J-07-08
И. Г. Каюков, Б. Г. Лукичев, Ю.О. Котовой
СИНДРОМ НЕАДЕКВАТНОЙ СЕКРЕЦИИ АНТИДИУРЕТИЧЕСКОГО ГОРМОНА: ПРОБЛЕМЫ ДИАГНОСТИКИ И ТЕРАПИИ
I.G. Kayukov, B.G. Lukichev, Yu.O. Kotovoy
SYNDROME OF INAPPROPRIATE SECRETION OF ANTIDIURETIC HORMONE: PROBLEMS OF DIAGNOSIS AND THERAPY
Кафедра пропедевтики внутренних болезней, Научно-исследовательский институт нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Россия
Ключевые слова: гипонатриемия, брохогенный рак, синдром неадекватной секреции антидиуретического гормона. Key words: hyponatremia, bronchogenic cancer, syndrome of inappropriate secretion of antidiuretic hormone.
Key words: hyponatremia, bronchogenic cancer, syndrome of inappropriate secretion of antidiuretic hormone.
Гипонатриемия по мнению ряда специалистов является наиболее распространенным нарушением водно-солевого гомеостаза. Например, показано, что среди госпитализированных пациентов у 15 — 20% уровень натрия в сыворотке крови составляет менее 135 ммоль/л (норма 135 — 145 ммоль/л), у 3 — 6% — выраженность гипо-натриемии достигает 130 ммоль/л или менее, наконец, примерно у 1 — 3% больных концентрация сывороточного натрия может доходить до 125 ммоль/л или опускаться ниже этой границы [1] В то же время многие врачи, сталкиваясь с пациентом с гипонатриемией, испытывают затруднения в диагностике, особенно дифференциальной, и выборе правильной тактики лечения. Сложности, возникающие при ведении больного с гипонатриемией, в полной (если не в большей) мере относятся к гипонатриемиям, развивающимся на почве синдрома неадекватной секреции антидиуретического гормона (СНСАДГ) [2]. На особенностях патогенеза, клиники и лечения этого состояния мы предполагаем кратко остановиться в данном сообщении.
На особенностях патогенеза, клиники и лечения этого состояния мы предполагаем кратко остановиться в данном сообщении.
Опасность гипонатриемии определяется физиологической ролью натрия и особенностями гомеостаза данного катиона. Натрий распределен в организме крайне неравномерно. Большая его часть находится во внеклеточной жидкости, где концентрация этого элемента достигает уже упомянутых 135 — 145 ммоль/л. В клетках натрия сравнительно немного. Концентрация данного катиона во внутриклеточной среде составляет порядка 10 ммоль/л [3, 4].
Натрий довольно плохо проникает через клеточные мембраны и является основным компонентом эффективной осмолятьпости (тоничности) внеклеточной жидкости.
Оставаясь в том или ином водном пространстве организма натрий удерживает воду и таким образом не позволяет водным потокам хаотично перераспределятся между вне- и внутриклеточной средами. Значительная концентрация натрия во внеклеточной жидкости должна была бы способствовать выходу воды из клетки. Однако этого не происходит из-за высокого содержания во внутриклеточной среде калия (концентрация во внутриклеточной жидкости около 150 — 160 ммоль/л). Такое распределение этих важнейших катионов позволяет выравнивать уровни осмотического давления во вне- и внутриклеточной средах. Все это в конечном итоге дает возможность клеткам поддерживать относительное постоянство их объема, или тонус [3, 4].
Значительная концентрация натрия во внеклеточной жидкости должна была бы способствовать выходу воды из клетки. Однако этого не происходит из-за высокого содержания во внутриклеточной среде калия (концентрация во внутриклеточной жидкости около 150 — 160 ммоль/л). Такое распределение этих важнейших катионов позволяет выравнивать уровни осмотического давления во вне- и внутриклеточной средах. Все это в конечном итоге дает возможность клеткам поддерживать относительное постоянство их объема, или тонус [3, 4].
Очевидно при снижении концентрации натрия во внеклеточной среде вода, которая через системы специальных мембранных каналов — аквапоринов [5,6] легко пересекает клеточные оболочки и начинает поступать внутрь клеток. При этом клетка увеличивается в объеме, а при очень значительном поступлении жидкости может даже разорваться. Поэтому одним из основных нежелательных последствий гипонатриемии, особенно развивающейся в течение 1 — 2 суток (острая гипонатриемия), является внутриклеточный отек. Внутриклеточный отек особенно опасен для клеток головного мозга. Поэтому при гипонатриемии преобладают проявления,
Внутриклеточный отек особенно опасен для клеток головного мозга. Поэтому при гипонатриемии преобладают проявления,
так или иначе связанные с вовлечением ЦНС. Они могут складываться в подчас весьма полиморфную клиническую картину [3,4,7,8,9].
Клинические проявления тяжелой гипонатрие-мии:
• головная боль
• тошнота
• рвота
нарушения терморегуляции
слабость
брадикардия
мышечные подергивания
• непроизвольное мочеиспускание и (или) дефекация
дезориентация во времени и пространстве неадекватное поведение экстрапирамидные расстройства стойкое расширение зрачков опистотонус
• возбуждение
• галлюцинации
• сонливость сопор
• судороги
эпилептиформные припадки (по типу больших эпилептических)
• гиповентиляция и остановка дыхания
• декортикация кома
Ведущее место неврологических проявлений при тяжелой гипонатриемии определяется развитием отека в жестком замкнутом пространстве (черепной коробке), которая создает дополнительные, непреодолимые препятствия к расширению отечной мозговой ткани и способствует сдавливанию мозга. Все это может закончиться синдромом вклинения. Кроме того, в данной ситуации из-за сдавливания сосудов и, возможно, отека клеток эндотелия резко нарушается церебральный кровоток, что, естественно, крайне негативно сказывается на деятельности центральной нервной системы [2].
Все это может закончиться синдромом вклинения. Кроме того, в данной ситуации из-за сдавливания сосудов и, возможно, отека клеток эндотелия резко нарушается церебральный кровоток, что, естественно, крайне негативно сказывается на деятельности центральной нервной системы [2].
Очевидно, что при развитии внутриклеточного отека клетка должна стремиться вернуть свой тонус если не к нормальным, то к приемлемым величинам. Основным механизмом адаптации клеток к увеличению собственного объема, вызванного снижением уровня тоничности внеклеточной жидкости, служит выброс во внешнюю (по отношению к клетке) среду внутриклеточных осмотически активных веществ. Этот процесс протекает в два этапа: быстрый и медленный. На первом, длящемся минуты и часы, из клетки начинают интенсивно выбрасываться неорганические ионы: калий, хлор и натрий. На втором, продолжитель-
ность которого составляет около двух суток, из внутриклеточной среды во внеклеточную поступают органические осмолиты. Они представляют собой низкомолекулярные, осмотически активные органические вещества, образующиеся в процессах клеточного метаболизма: глютамат, креатин, таурин, миоинозитол, глютамин, глицеро-фосфорилхолин [2, 10]. В результате потери неорганических и органических осмолитов уровни осмотического давления во внутриклеточной и внеклеточной средах выравниваются. Это позволяет, если не вернуть к норме, то по крайней мере существенно уменьшить объем клетки.
Они представляют собой низкомолекулярные, осмотически активные органические вещества, образующиеся в процессах клеточного метаболизма: глютамат, креатин, таурин, миоинозитол, глютамин, глицеро-фосфорилхолин [2, 10]. В результате потери неорганических и органических осмолитов уровни осмотического давления во внутриклеточной и внеклеточной средах выравниваются. Это позволяет, если не вернуть к норме, то по крайней мере существенно уменьшить объем клетки.
После описанных выше событий, несмотря на относительную нормализацию тонуса клеток, они существуют в гипотоническом окружении. При этом тоничность и внутриклеточного содержимого сохраняется на уровне ниже нормы. В данной связи быстрое и значительное увеличение эффективной осмоляльности внеклеточной жидкости, например, за счет введения гипертонических растворов NaCl, должно привести к энергичному оттоку воды из внутриклеточного пространства во внеклеточное. Проблема усугубляется тем, что реадаптация клеток (особенно нейронов ЦНС) к ги-пертоничности внеклеточной жидкости в принципе требует большего времени, чем их приспособление к уменьшению эффективной осмоляльности внешней для клетки среды [2]. В такой ситуации клетки сморщиваются, что, естественно, приводит к тяжелым нарушениям их структуры и функции. Наиболее неприятным последствием этих сдвигов является повреждение клеточных мембран. Больше всего от сморщивания страдают нейроны центральной нервной системы, имеющие массивные миелиновые оболочки, которые в данных условиях разрушаются, подчас необратимо. Такая ситуация получила название «синдрома осмотической демиелинизации», или, поскольку наиболее выраженными миелиновыми оболочками окружены нейроны варолиевого моста, «центрального понтинно-го миелинолиза» (ЦПМ; central pontine myelinolysis — СРМ), который может стать причиной летального исхода [7, 8, 10-12].
В такой ситуации клетки сморщиваются, что, естественно, приводит к тяжелым нарушениям их структуры и функции. Наиболее неприятным последствием этих сдвигов является повреждение клеточных мембран. Больше всего от сморщивания страдают нейроны центральной нервной системы, имеющие массивные миелиновые оболочки, которые в данных условиях разрушаются, подчас необратимо. Такая ситуация получила название «синдрома осмотической демиелинизации», или, поскольку наиболее выраженными миелиновыми оболочками окружены нейроны варолиевого моста, «центрального понтинно-го миелинолиза» (ЦПМ; central pontine myelinolysis — СРМ), который может стать причиной летального исхода [7, 8, 10-12].
Клинические проявления синдрома осмотической демиелинизаци («центрального понтинного миелинолиза») [9].
• двигательные нарушения
• вялый тетрапарез
• остановка дыхания псевдобульбарный паралич различные нарушения психики и поведения потеря сознания
В настоящее время хорошо известны и факто-
ры риска развития повреждений ЦНС (как отека мозга, так и ЦПМ) при гипонатриемии (табл. 1).
1).
Таблица 1
Группы пациентов с повышенным риском развития неврологических осложнений при гипонатриемии, по [3,8,9]
Острый отек мозга Осмотическая
демиелинизация
Послеоперационные боль- Алкоголики
ные, особенно женщины во Пациенты с:
время менструации пониженным питанием
Пожилые женщины, получа- гипокалиемией
ющие тиазиды ожогами
Пациенты с полидипсией циррозом печени предшествующими эпизодами гипоксии Пожилые женщины, получающие тиазиды
Однако гипонатриемия при незначительном снижении уровня натрия в сыворотке крови нередко протекает бессимптомно и обычно не представляет опасности для жизни. В то же время тяжелая, особенно острая, гипонатриемия (концентрация натрия в сыворотке крови 115 — 110 ммоль/л) вызывает выраженные клинические проявления. Тяжелая гипонатриемия создает непосредственную угрозу жизни больного и нередко является причиной смерти. Как следует из предыдущего изложения, помимо самой гипонатриемии, не меньшую (если не большую) опасность может представлять неправильная (слишком быстрая и энергичная) ее коррекция. Очевидно, что риск массивных инфу-зий гипертонических расстворов №С1 наиболее высок при хронической гипонатриемии. С другой стороны, по мнению некоторых авторов, подтвержденному достаточным числом наблюдений, вероятность развития тяжелых осложнений даже при выраженной гипонатриемии преувеличена [13]. Тем не менее потенциальную опасность и острой и хронической гипонатриемии никто не берется отрицать.
В то же время тяжелая, особенно острая, гипонатриемия (концентрация натрия в сыворотке крови 115 — 110 ммоль/л) вызывает выраженные клинические проявления. Тяжелая гипонатриемия создает непосредственную угрозу жизни больного и нередко является причиной смерти. Как следует из предыдущего изложения, помимо самой гипонатриемии, не меньшую (если не большую) опасность может представлять неправильная (слишком быстрая и энергичная) ее коррекция. Очевидно, что риск массивных инфу-зий гипертонических расстворов №С1 наиболее высок при хронической гипонатриемии. С другой стороны, по мнению некоторых авторов, подтвержденному достаточным числом наблюдений, вероятность развития тяжелых осложнений даже при выраженной гипонатриемии преувеличена [13]. Тем не менее потенциальную опасность и острой и хронической гипонатриемии никто не берется отрицать.
Антидиуретический гормон (аргинин-вазопрес-син — АДГ, АВП) — основной, если не единственный регулятор уровня тоничности внеклеточной жидкости. АДГ представляет собой циклический октапептид, имеющий конечную часть, состоящую из трех аминокислот, среднее положение в которой занимает аргинин. Особенности строения именно этого «хвоста» определяют антидиуретические свойства гормона [14].
АДГ представляет собой циклический октапептид, имеющий конечную часть, состоящую из трех аминокислот, среднее положение в которой занимает аргинин. Особенности строения именно этого «хвоста» определяют антидиуретические свойства гормона [14].
АВП синтезируется магноцеллюлярными нейронами паравентрального и супраоптического ядер
гипоталамуса, откуда в комплексе с полипептидом-переносчиком иейрофизином II переносится в заднюю долю гипофиза, где накапливается в виде ней-росекреторных гранул и по мере необходимости секретируется в кровоток [14].
Как следует из названий данного гормона, он обладает по крайней мере двумя основными эффектами-антидиуретическим и вазопрессорным. Они реализуются за счет наличия двух типов рецепторов к АВП — V, и V,. Через V,-рецепторы осуществляется вазоконстрикторное и некоторые другие действия гормона. Напротив, стимуляция У2-рецепторов приводит к реализации гидроосмотического (антидиуретического) эффекта АВП в почках. Существенно, что У2-рецепторы экспрес-сируются практически только в почках и локализованы почти исключительно на базолатеральных мембранах клеток восходящих отделов петли Ген-ле и медуллярных отделов собирательных трубок. В клетках собирательных трубок активация V, рецепторов под воздействием АВП в конечном итоге приводит к встраиванию в апикальные мембраны специфических водных каналов (в данном случае аквапорина-2), что позволяет воде интенсивно реабсорбироваться в этом отделе нефрона. В нефротелии толстого восходящего колена петли Генле стимуляция У,-рецепторов вазопрессином усиливает активность апикального 1Ма,К.,2С1 -кот-ранспортера (МКСС2), что далее интенсифицирует реабсорбцию 1МаС1 в данном отделе нефрона и приводит к целому ряду последствий [5,6,15,16]. Наиболее важными из них в рассматриваемом аспекте являются генерация осмотически свободной воды и повышение осмоляльности (тоничности) интерстиция мозгового слоя почек.
Напротив, стимуляция У2-рецепторов приводит к реализации гидроосмотического (антидиуретического) эффекта АВП в почках. Существенно, что У2-рецепторы экспрес-сируются практически только в почках и локализованы почти исключительно на базолатеральных мембранах клеток восходящих отделов петли Ген-ле и медуллярных отделов собирательных трубок. В клетках собирательных трубок активация V, рецепторов под воздействием АВП в конечном итоге приводит к встраиванию в апикальные мембраны специфических водных каналов (в данном случае аквапорина-2), что позволяет воде интенсивно реабсорбироваться в этом отделе нефрона. В нефротелии толстого восходящего колена петли Генле стимуляция У,-рецепторов вазопрессином усиливает активность апикального 1Ма,К.,2С1 -кот-ранспортера (МКСС2), что далее интенсифицирует реабсорбцию 1МаС1 в данном отделе нефрона и приводит к целому ряду последствий [5,6,15,16]. Наиболее важными из них в рассматриваемом аспекте являются генерация осмотически свободной воды и повышение осмоляльности (тоничности) интерстиция мозгового слоя почек.
В петле Генле в целом реабсорбируется от 25 до 40% от фильтрационной нагрузки (количества профильтровавшегося) натрия. При этом имеет место диссоциация между реабсорбцией воды и соли. Нисходящие отделы петли высокопроницаемы для воды, но мало проницаемы для натрия. Напротив, в восходящих — натрий и хлор всасываются без эквивалентных количеств жидкости. В тонком восходящем участке петли реабсорбция натрия преимущественно пассивна и осуществляется по концентрационному градиенту. В толстом восходящем отделе всасывание натрия и хлора имеет характер вторично активного транспорта и решающим образом определяется активностью 1МКСС2. Во многом за счет деятельности этого транспортера к началу дистального извитого канальца притекает гипотоническая тубулярная жидкость с осмоляль-ностыо около 100 мосм/кг Н30 или ниже. Иными словами внутри канальца появляется какой-то объем
жидкости, не содержащий осмотически активных веществ (прежде всего электролитов), — осмотически свободная вода. В отсутствии АДГ гипотонич-ная канальцевая жидкость, образовавшаяся в основном в восходящих отделах петли Генле и, возможно, в какой-то мере за счет относительно большей ре-абсорбции солей по сравнению со всасыванием воды в дистальных извитых и связующих канальцах, а также в кортикальных отделах собирательных трубок, будет выделяться в виде окончательной мочи. Таким образом достигается осмотическое разведение последней. Очевидно, что в физиологических условиях именно этот процесс происходит при избыточном потреблении жидкости. В конечном итоге осмотическое разведение мочи позволяет организму выводить излишки воды без эквивалентного количества осмотически активных веществ. Это, естественно, позволяет поддерживать физиологический уровень эффективной осмоляль-ности внеклеточной жидкости [14,16].
В отсутствии АДГ гипотонич-ная канальцевая жидкость, образовавшаяся в основном в восходящих отделах петли Генле и, возможно, в какой-то мере за счет относительно большей ре-абсорбции солей по сравнению со всасыванием воды в дистальных извитых и связующих канальцах, а также в кортикальных отделах собирательных трубок, будет выделяться в виде окончательной мочи. Таким образом достигается осмотическое разведение последней. Очевидно, что в физиологических условиях именно этот процесс происходит при избыточном потреблении жидкости. В конечном итоге осмотическое разведение мочи позволяет организму выводить излишки воды без эквивалентного количества осмотически активных веществ. Это, естественно, позволяет поддерживать физиологический уровень эффективной осмоляль-ности внеклеточной жидкости [14,16].
Способность петли реабсорбировать соли и воду относительно независимо друг от друга имеет решающее значение в обеспечении способности почек не только разводить, но и концентрировать мочу.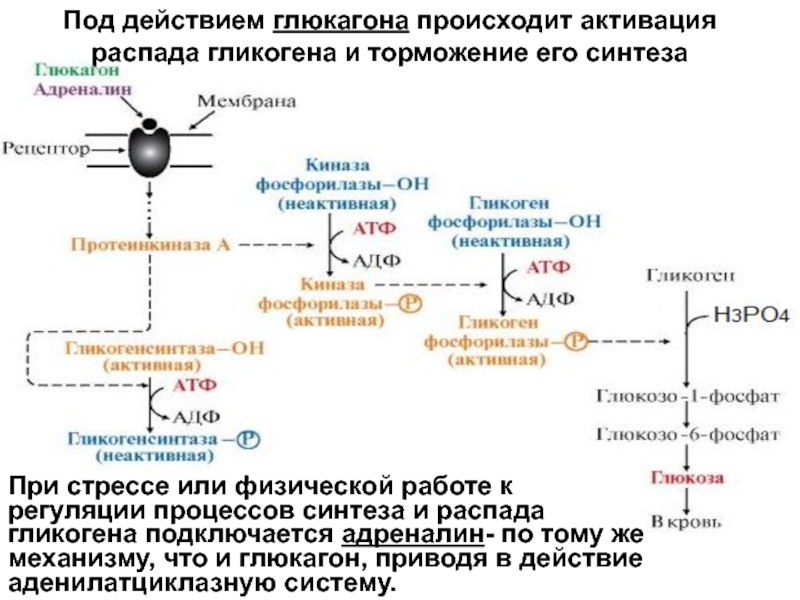 При этом активная абсорбция 1ЧаС1 в водонепроницаемом толстом восходящем колене петли нефрона, опосредуемая ЫКСС2, служит важнейшим детерминантом в обеспечении энергией «единичного эффекта» противоточного умножения. Последнее позволяет поддерживать постоянно высокую осмоляльность (тоничность) мозгового слоя почек, создает осмотический градиент для пассивной реабсорбции воды в медуллярных отделах собирательных трубок при наличии АДГ и в конечном итоге способствует концентрированию мочи. При этом в присутствии вазопрессина и достаточной чувствительности к гормону в собирательных трубках внутреннего мозгового вещества осмотически свободная вода всасывается даже в избыточном количестве. Это в конечном итоге приводит к образованию концентрированной мочи, осмоляльность которой может в три-четыре раза превышать осмоляльность сыворотки крови, составляющей в норме 285 — 295 мосм/кг Н,0. [16].
При этом активная абсорбция 1ЧаС1 в водонепроницаемом толстом восходящем колене петли нефрона, опосредуемая ЫКСС2, служит важнейшим детерминантом в обеспечении энергией «единичного эффекта» противоточного умножения. Последнее позволяет поддерживать постоянно высокую осмоляльность (тоничность) мозгового слоя почек, создает осмотический градиент для пассивной реабсорбции воды в медуллярных отделах собирательных трубок при наличии АДГ и в конечном итоге способствует концентрированию мочи. При этом в присутствии вазопрессина и достаточной чувствительности к гормону в собирательных трубках внутреннего мозгового вещества осмотически свободная вода всасывается даже в избыточном количестве. Это в конечном итоге приводит к образованию концентрированной мочи, осмоляльность которой может в три-четыре раза превышать осмоляльность сыворотки крови, составляющей в норме 285 — 295 мосм/кг Н,0. [16].
Интересно, что, несмотря на интенсификацию реабсорбции натрия (и хлора) в толстом восходящем отделе петли Генле, суммарная экскреция натрия при воздействии АДГ меняется мало или не меняется вообще. Это давно известное положение нашло подтверждение в исследованиях с применением специфических антагонистов У2-ре-цепторов [17]. Такое влияние аргинин-вазопресси-на на реабсорбцию натрия в толстом восходящем отделе петли Генле способствует уменьшение его
Это давно известное положение нашло подтверждение в исследованиях с применением специфических антагонистов У2-ре-цепторов [17]. Такое влияние аргинин-вазопресси-на на реабсорбцию натрия в толстом восходящем отделе петли Генле способствует уменьшение его
всасывания в нижележащих отделах почечных канальцев.
Исходя из цели настоящего сообщения, наиболее важным является то, что при активации секреции (повышении уровня АДГ) наблюдается задержка воды без консервации эквивалентных количеств осмотически активных веществ, прежде всего натрия.
Физиологическими стимулами усиления секреции АДГ служат либо повышение эффективной осмоляльности (тоничности) плазмы крови, либо уменьшение эффективного объема внеклеточной жидкости (гиповолемия).
Увеличение осмоляльности внеклеточной жидкости на 2% приводит как к увеличению чувства жажды, так и к снижению мочевыделения. Объемный (или гемодинамический) стимул менее значим в повышении секреции АДГ. Принято считать, что уменьшение объема циркулирующей крови должно составить около 10%, чтобы возрос уровень АВП [14].
Объемный (или гемодинамический) стимул менее значим в повышении секреции АДГ. Принято считать, что уменьшение объема циркулирующей крови должно составить около 10%, чтобы возрос уровень АВП [14].
Помимо физиологических стимулов увеличения секреции АДГ гипофизом (осмотического и объемного) существуют и другие факторы, приводящие к повышению концентрации данного гормона в плазме крови. К ним, в частности, относятся: тошнота, боль, эмоциональный стресс, нарастание уровня ангиотензина II, прием лекарственных средств (см. ниже) [3,4,8,9].
В большинстве современных классификаций гипонатриемии разделяют на три основные группы: изотонические, гипертонические и гипотонические гипонатриемии (ЫВ! термины «гипертонические» и «гипотонические» в данном случае не имеют отношения к уровню артериального давления, а отражают величины эффективной осмоляльности или тоничности внеклеточной жидкости). Изотонические и гипертонические гипонатриемии
Изотонические и гипертонические гипонатриемии
— довольно редки. Изотонические гипонатриемии
— это почти всегда так называемые «псевдогип-натриемии». Последние встречаются при выраженных гипертриглцеридемиях или парапротеинозах. Они связаны с тем, что в данных ситуациях часть объема плазмы оказывается занятой триглицери-дами или парапротеинами, увеличивающими «безжидкостную» («твердую») фазу сыворотки, в которой не присутствуют и ионы натрия. В жидкой фазе сыворотки концентрация данного катиона, естественно, оказывается нормальной [3,4,8,9]
Гипертонические гипонатриемии являются следствием нарастания во внеклеточной жидкости концентрации осмотически эффективных веществ, например, глюкозы при декомпенсации сахарного диабета или маннитола (при инфузиях его гипертонических растворов) [4,9].
В контексте настоящего сообщения следует более подробно остановиться на гипотонических гипонатриемиях (или, по другой терминологии [7], — гипонатриемиях со сниженной осмоляльностью плазмы крови).
Гипотонические гипонатриемии развиваются при наличии хотя бы одного из трех основных механизмов. Во-первых, гипонатриемия может возникать вследствие значительного уменьшения скорости клубочковой фильтрации и (или) резкого нарастания изотоничной проксимальной реабсор-бции. Во-вторых, причиной гипотоничной гипонатриемии может стать нарушение реабсорбции №С1 в разводящем сегменте нефрона (восходящие отделы петли Генле, дистальный извитой каналец, кортикальные отделы собирательных трубок). Наконец, третьим важнейшим патогенетическим механизмом служит неспособность к подавлению секреции антидиуретичекого гормона в ответ на снижение тоничности внеклеточной жидкости. На практике, однако, эти причины нередко комбинируются в разных сочетаниях [4].
Не оспаривая справедливость описанных выше положений, отметим, что они затрагивают в основном почечные механизмы развития гипонатриемий и неадекватную секрецию АДГ. В то же время по крайней мере пусковым звеном в нарушениях го-меостаза натрия и воды могут стать и экстраре-нальные факторы. Поэтому на проблемы развития гипонатриемий можно взглянуть и с несколько других позиций. Во-первых, гипонатриемии могут возникать в том случае, когда в организме задерживается относительно больше воды, чем натрия. При этом, суммарное содержание натрия в организме может быть и нормальным и повышенным. Нормальный уровень общего количества натрия характерен, например, для гипонатриемий, связанных с синдромом неадекватной секреции антидиуретического гормона (см. ниже) или первичной психогенной полидипсии; повышенный — для гипонатриемий при хронической почечной недостаточности, нефротическом синдроме, застойной недостаточности кровообращения и некоторых других состояниях [8,9].
В то же время по крайней мере пусковым звеном в нарушениях го-меостаза натрия и воды могут стать и экстраре-нальные факторы. Поэтому на проблемы развития гипонатриемий можно взглянуть и с несколько других позиций. Во-первых, гипонатриемии могут возникать в том случае, когда в организме задерживается относительно больше воды, чем натрия. При этом, суммарное содержание натрия в организме может быть и нормальным и повышенным. Нормальный уровень общего количества натрия характерен, например, для гипонатриемий, связанных с синдромом неадекватной секреции антидиуретического гормона (см. ниже) или первичной психогенной полидипсии; повышенный — для гипонатриемий при хронической почечной недостаточности, нефротическом синдроме, застойной недостаточности кровообращения и некоторых других состояниях [8,9].
Вторым путем развития гипонатриемии может стать потеря гипертонической жидкости (организм теряет относительно больше натрия, чем воды). В этом случае уменьшение концентрации натрия во внеклеточной жидкости будет, очевидно, сочетаться с общим его дефицитом. В данной ситуации не существенно, почечным (диуретики, синдром Бар-ттера, интерстициальные повреждения почек) или внепочечным (рвота, диаррея, значительное потоотделение) путем будет выводиться гипертоничес-
В данной ситуации не существенно, почечным (диуретики, синдром Бар-ттера, интерстициальные повреждения почек) или внепочечным (рвота, диаррея, значительное потоотделение) путем будет выводиться гипертоничес-
кая жидкость. Нельзя, однако, не согласиться с мнением С. Palm и P. Gross о том, что хотя в сознании большинства врачей гипонатриемия нередко ассоциируется с первичным дефицитом натрия, такие случаи достаточно редки. Подавляюще большая часть клинически значимых гипонатриемий связана с избытком воды в организме [17]. Причем этот избыток может возникать и вторично вследствие активации секреции АДГ в ответ на потерю натрия и последующее сокращение эффективного объема внеклеточной жидкости (гиповолемию-см. ниже).
В конечном итоге любую гипотоническую ги-понатриемию можно охарактеризовать как абсолютный или относительный избыток в организме осмотически свободной воды.
Как бы то ни было, персистирующая секреция антидиуретического гормона является одной из основных иричин нарушения экскреции воды, что, в конечном итоге, ведет к гипонатриемии. Данная ситуация может быть создана, как минимум, двумя путями. На первом задействуются гемодинамические стимулы усиления секреции АВП: гиповолемия, снижение сердечного выброса или вазодилатация. Обычно в таких си туациях неосмотическая секреция АДГ проявляется на фоне уменьшения почечной экскреции натрия (если только ренальные потери натрия не были причиной гиповолемии) [4]. Такой механизм развития гипонатриемии («преренапьныйтип гипонатриемии») наиболее характерен для застойной сердечной недостаточности или цирроза печени [17] и, возможно, некоторых вариантов нефротического синдрома. Хотя в последнем случае, как свидетельствуют результаты и последних и довольно давних исследований, гиповолемия скорее исключение, чем правило [18,19].
Данная ситуация может быть создана, как минимум, двумя путями. На первом задействуются гемодинамические стимулы усиления секреции АВП: гиповолемия, снижение сердечного выброса или вазодилатация. Обычно в таких си туациях неосмотическая секреция АДГ проявляется на фоне уменьшения почечной экскреции натрия (если только ренальные потери натрия не были причиной гиповолемии) [4]. Такой механизм развития гипонатриемии («преренапьныйтип гипонатриемии») наиболее характерен для застойной сердечной недостаточности или цирроза печени [17] и, возможно, некоторых вариантов нефротического синдрома. Хотя в последнем случае, как свидетельствуют результаты и последних и довольно давних исследований, гиповолемия скорее исключение, чем правило [18,19].
На втором пути гемодинамическая и осмотическая стимуляции секреции АДГ не участвуют. В этом случае уровень аргинин-вазопрессина оказывается увеличенным по отношению к величине тоничности внеклеточной жидкости: возникает синдром неадекватной секреции АДГ (СНСАДГ).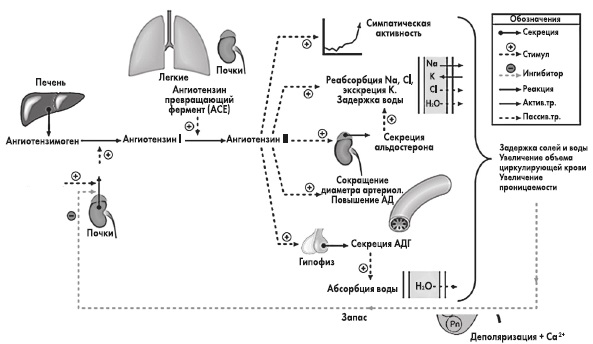 В данной ситуации формируется «СНСАДГ-тип гипонатриемии» [17].
В данной ситуации формируется «СНСАДГ-тип гипонатриемии» [17].
Причины неадекватной секреции АДГ многообразны (табл. 2).
Следует, однако, отметить, что в вопросе отнесения тех или иных патологий к СНСАДГ не наблюдается единства. Так, многие авторы не включают в рамки СНСАДГ гипнатриемии, развивающиеся на почве надпочечниковой недостаточности, гипотиреоза [8,9] и даже приема лекарственных средств [3].
Тем не менее, сколь не был бы обширен список причин, приводящих к СНСАДГ, основное зна-
Таблица 2
Причины синдрома неадекватной секреции антидиуретического гормона
(по R.H. Sterns и соавт. [4])
Виды СНСАДГ Непосредственные причины
Связанный с опухолями Бронхогенный рак; злокачественные опухоли: поджелудочной железы, 12-пер-стной кишки, мочеточников, предстательной железы, мочевого пузыря; саркома Юинга, лимфома
Связанный с патологией ЦНС Травмы; инфекции: бактериальные, вирусные, грибковые, туберкулез; опухоли, оперативные вмешательства на гипофизе, кровоизлияния, тромбозы, дегенеративные процессы: рассеянный склероз, атрофия; разные причины: гидроцефалия, синдром БИу-Огадег
Связанный с патологией легких Воспалительные процессы: вирусные, грибковые, бактериальные, туберкулезные; астма, дыхание при положительном давлении в конце выдоха, пневмоторакс, кистозный фиброз
Связанный с патологией эндокринной системы Гипотиреоз, глюкокортикоидная недостаточность: первичная надпочечниковая, дефицит АКТГ
Лекарственный Активация секреции АДГ: винкристин, циклофосфамид, карбамазепин, окскар-базепин, клофибрат, никотин, хлорпропамид*, наркотические анальгетики. Воздействие на почки — аналоги АДГ: десмопрессин (дДАВП), окситоцин; хлорпропамид*, нестероидные противовоспалительные средства, тиазиды
Воздействие на почки — аналоги АДГ: десмопрессин (дДАВП), окситоцин; хлорпропамид*, нестероидные противовоспалительные средства, тиазиды
Примечание. *Хлорпропамид усиливает как секрецию АДГ нейрогипофизом, так и влияние этого гормона на почки, по-видимому, за счет подавления синтеза простагландинов, которые являются физиологическими антагонистами вазопрес-сина и противодействуют реализации (или способствуют прекращению) его гидроосмотического эффекта [8].
ченне в его развитии все же имеют опухоли или патология гипоталамуса. Причем среди опухолей важное место занимает бронхогенный рак и особенно такие его формы, как мелкоклеточный и ов-сяноклеточный [3,4,8,9].
Опухолевые клетки продуцируют АВП или пептиды, обладающие АДГ-подобным эффектом. Очевидно, что клетки опухолей не способны реагировать на гипоосмотический стимул (снижение тоничности внеклеточной жидкости), в обычных условиях подавляющий секрецию гормона [3,4,8,9].
Персистирующая, не подавляемая гипоосмоти-ческим стимулом секреция АДГ приводит к задержке в организме осмотически свободной воды. Этот избыток воды легко распределяется во вне- и внутриклеточном пространствах, поэтому увеличение эффективного объема плазмы (выраженность гиперволемии) оказывается незначительной. В данной связи необходимо иметь в виду, что примерно две трети избыточной жидкости попадает во внутриклеточный сектор, и лишь одна треть распределяется во внеклеточном компартменте. При этом начальная гиперволемия, возникшая вследствие задержки воды, провоцирует транзиторный натрийурез, который ведет к минимизации экспансии внеклеточного объема [14]. Более того, при сравнительно длительном существовании СНСАДГ развивается феномен «ускользания» по-
чек от действия вазопрессина [2]. Чувствительность клеток медуллярных отделов собирательных трубок к гормону снижается.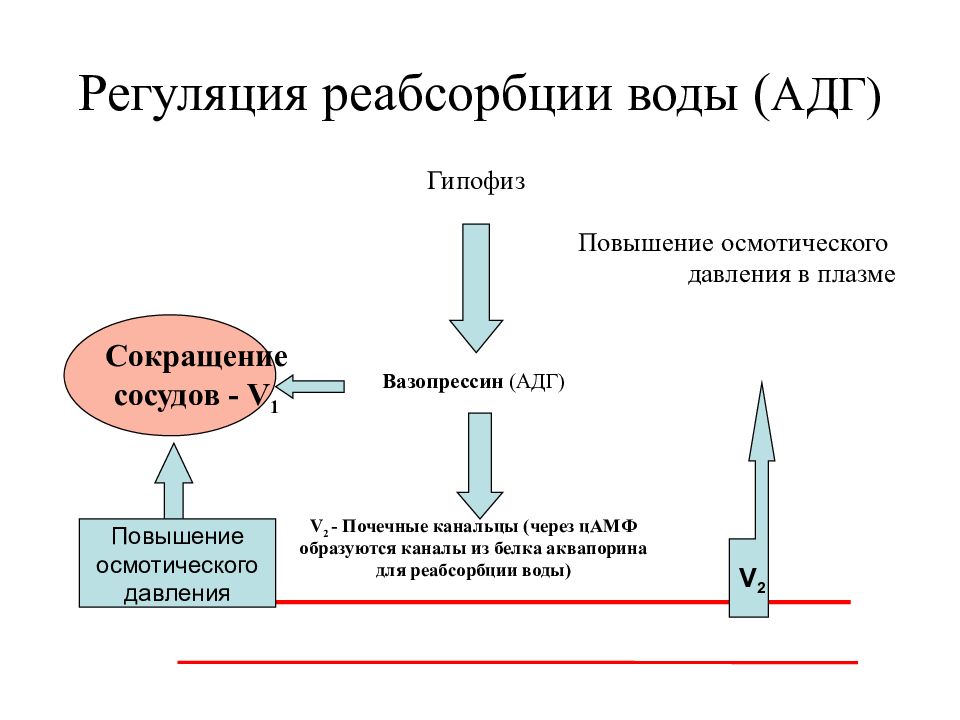 На этом фоне у многих больных практически восстанавливается способность почек к экскреции осмотически свободной воды параллельно ее потреблению и максимальному осмотическому разведению мочи. Хотя встречаются и пациенты с нарушениями осмотического разведения, выделяющие в условиях водной нагрузки умеренно гипертоническую мочу [2, 7] (у здоровых лиц в условиях водной нагрузки в 2% от массы тела или 20 — 22 мл/кг массы тела осмоляльность мочи снижается до 50- 100 мосм/кг Н,0).
На этом фоне у многих больных практически восстанавливается способность почек к экскреции осмотически свободной воды параллельно ее потреблению и максимальному осмотическому разведению мочи. Хотя встречаются и пациенты с нарушениями осмотического разведения, выделяющие в условиях водной нагрузки умеренно гипертоническую мочу [2, 7] (у здоровых лиц в условиях водной нагрузки в 2% от массы тела или 20 — 22 мл/кг массы тела осмоляльность мочи снижается до 50- 100 мосм/кг Н,0).
Логично предположить, что наряду с быстрым перераспределением воды в жидкостных пространствах организма феномен ускользания вносит дополнительный вклад в стабилизацию объемного статуса. Все это, в частности, приводит объем циркулирующей плазмы если не к физиологическим, то очень близким к ним величинам. Поэтому гипонат-риемии при СНСАДГ относят к «изоволемическо-му варианту» гипотонических гипонатриемий [2,4].
В конечном итоге пациенты с СНСАДГ обычно характеризуются [2,-4,8,9] нормальными уровнями:
• артериального давления скорости клубочковой фильтрации
• почечной экскреции натрия.
Чаще всего близки к нижним границам нормы сывороточные концентрации:
• креатинина, мочевины
• мочевой кислоты калия
Как правило, нормальны или снижены плазматические уровни таких биологически вазоактив-ных веществ, как: ренин
• ангиотензин II альдостерон
• эндотелии норадреналин
В то же время концентрация атриального на-трийуретического пептида обычно увеличена. Отеки при СНСАДГ, как правило, отсутствуют. У ряда больных отмечается полидипсия той или иной степени выраженности.
Следует также иметь в виду, что нормальная функция почек или отсутствие артериальной ги-пертензии не обязательны для СНСАДГ. И гипер-тензия и снижение СКФ могут встречаться у больных с данным синдромом, хотя они обычно обусловлены сопутствующей патологией.
И гипер-тензия и снижение СКФ могут встречаться у больных с данным синдромом, хотя они обычно обусловлены сопутствующей патологией.
Уровень АДГ у пациентов с СНСАДГ, естественно, повышен. Однако нельзя забывать о том, что абсолютные значения концентрации вазапрес-сина имеет смысл рассматривать только в связи с уровнем тоничности внеклеточной жидкости. Другими словами, нормальные значения концентрации АДГ при уровне натрия сыворотки 140 ммоль/л -это действительно нормальные значения. Однако та же самая концентрация гормона при уровне сывороточного натрия 120 ммоль/л уже повышена (она неадекватна величинам тоничности — отсюда и название синдрома). По-видимому, у некоторых пациентов с СНСАДГ даже формально сниженные величины уровня АДГ могут оказаться завышенными по отношению к степени гипонатриемии [2].
Исходя из особенностей секреции АВП, предпринимаются попытки выделения нескольких типов СНСАДГ (табл 3) [4].
Первый характеризуется хаотичной, абсолютно не зависящей от уровня тоничности внеклеточной жидкости секрецией вазопрессина. Наиболее часто он встречается при бронхогенном раке и активном легочном туберкулезе.
При втором уровень АДГ тесно коррелирует с изменениями тоничности внеклеточной жидкости, однако «заданное регулируемое значение» (set-point) последнего параметра уменьшается. Иначе говоря, у здорового человека организм стремиться удерживать концентрацию сывороточного на-
трия примерно на уровне 140 ммоль/л. Нарастание данного значения очень быстро активирует секрецию АДГ, что, естественно, ведет к почечной ретенции осмотически свободной воды и в конечном итоге уменьшению выраженности гипер-натриемии. В обратной ситуации, при снижении концентрации натрия сыворотки менее 140 ммоль/ л, секреция вазопрессина подавляется. Почки выводят осмотически чистую воду, выделяя гипотоническую мочу. роЫ’а в настоящее время не очень ясны и требуют отдельного обсуждения. Наиболее частые причины второго типа СНСАДГ — брон-хогенный рак и туберкулезный менингит.
роЫ’а в настоящее время не очень ясны и требуют отдельного обсуждения. Наиболее частые причины второго типа СНСАДГ — брон-хогенный рак и туберкулезный менингит.
Третий тип синдрома несоответствующей секреции АВП встречается как при патологии ЦНС, так и при заболеваниях, упомянутых выше. При данном варианте СНСАДГ уровень вазопрессина коррелирует с величиной тоничности внеклеточной жидкости. Однако в данном случае даже при очень выраженной гипоосмоляльности секреция АДГ не подавляется полностью. Имеет место персисти-рующая «базальная утечка» гормона.
У пациентов с четвертым типом СНСАДГ, по-видимому, отмечается повышение чувствительности почек к гормону. В этом случае даже чрезвычайно низкие, практически неизмеримые уровни АДГ способны приводить к стойкой ретенции воды.
Диагностика СНСАДГ нередко представляет собой большие трудности. К сожалению, даже при условиях, довольно ясно указывающих на большую вероятность данного синдрома, диагноз нередко устанавливается поздно или не устанавливается вообще, поскольку врачи забывают о существовании СНСАДГ.
К сожалению, даже при условиях, довольно ясно указывающих на большую вероятность данного синдрома, диагноз нередко устанавливается поздно или не устанавливается вообще, поскольку врачи забывают о существовании СНСАДГ.
Диагноз этой патологии должен базироваться, прежде всего, на клинике, учете анамнестических
Таблица 3
Типы СНСАДГ в зависимости от особенностей секреции гормона (R. Н. StemsncoaBT.[4])
Тип синдрома Доля среди всех типов СНСАДГ Особенности секреции АДГ Наиболее частые причины
I 37% Полностью независима от уровня тоничности внеклеточной жидкости Бронхогенный рак, туберкулез легких
II 33% Не нарушена при уменьшении «заданного значения регулируемого уровня тоничности» (веЬро^’а) Бронхогенный рак, туберкулезный менингит
III 16% Отсутствует полное подавление секреции при низких уровнях тоничности Бронхогенный рак, туберкулез легких, поражения ЦНС, в том числе туберкулезный менингит
IV 14% Не нарушена при увеличении чувствительности клеток собирательных трубок к гормону ?
данных и указаний на наличие состояний, потенциально способных привести к СНСАДГ (см. табл. 2), а также результатов некоторых, порой весьма простых и общедоступных, лабораторных тестов.
табл. 2), а также результатов некоторых, порой весьма простых и общедоступных, лабораторных тестов.
Одним из основных клинических критериев, дающим серьезные основания для подозрений на наличие СНСАДГ, является наличие гипонатри-емии при отсутствии отеков.
Если отсутствию отеков сопутствуют нормальная функция почек и нормотензия, диагноз СНСАДГ становиться еще более вероятным, хотя, как уже указывалось выше, эти критерии являются далеко не абсолютными.
Среди лабораторных исследований немаловажное значение имеет уровень экскреции натрия с мочой. Поскольку при СНСАДГ истинных потерь (или ретенции) натрия не происходит, уровень выделения данного элемента почками обычно соответствует его поступлению (per os или парентерально). Хотя данные литературы в этом плане несколько расходятся, больше оснований полагать, что при концентрации натрия (и/или хлора) в моче 15-20 ммоль/л и более при наличии других признаков синдрома диагноз СНСАДГ становится более вероятным [3, 4, 7].
Дополнительным аргументом в пользу наличия синдрома несоответствующей продукции вазоп-рессина может быть значительное нарастание экскреции натрия и хлора при попытках коррекции ги-понатриемии за счет инфузий гипертонических растворов NaCl. Тем не менее следует иметь в виду, что выведение этих электролитов с мочой сильно зависит от ряда привходящих обстоятельств: диеты, способности почек консервировать
ионы (интерстициальные нефропатии с потерей солей), приема лекарственных препаратов (диуретики, способствующие нарастанию экскреции Ыа и С1).
Столь же доступными лабораторными исследованиями являются сывороточные концентрации мочевины и мочевой кислоты. Низкие (или близкие к нижним границам нормы) значения данных параметров повышают вероятность диагноза СНСАДГ.
Некоторое значение в диагностике синдрома неадекватной продукции АВП может иметь и несоответствие уровней осмоляльности (или концентрации натрия) сыворотки крови величинам осмоляльности мочи. У здоровых людей уменьшение уровня сывороточного натрия на 3% или более приводит к практически полному подавлению секреции АДГ. Последнее, в свою очередь, снижает осмоляльность мочи до значений менее 100 моем/ кг Н,0. Осмоляльность мочи около 200 мосм/кг Н20 при концентрации сывороточного натрия порядка 128 ммоль/л или осмоляльности плазмы 240 мосм/кг Н,0 может рассматриваться как указание на неадекватную секрецию АДГ [3,9]. Однако дифференциально-диагностическая значимость данного положения в настоящее время справедливо оспаривается, поскольку практически при всех видах гипотонических гипонатриемий (кроме первичной полидипсии) имеют место аналогичные взаимоотношения между величинами осмоляльности мочи и плазмы.
У здоровых людей уменьшение уровня сывороточного натрия на 3% или более приводит к практически полному подавлению секреции АДГ. Последнее, в свою очередь, снижает осмоляльность мочи до значений менее 100 моем/ кг Н,0. Осмоляльность мочи около 200 мосм/кг Н20 при концентрации сывороточного натрия порядка 128 ммоль/л или осмоляльности плазмы 240 мосм/кг Н,0 может рассматриваться как указание на неадекватную секрецию АДГ [3,9]. Однако дифференциально-диагностическая значимость данного положения в настоящее время справедливо оспаривается, поскольку практически при всех видах гипотонических гипонатриемий (кроме первичной полидипсии) имеют место аналогичные взаимоотношения между величинами осмоляльности мочи и плазмы.
Еще раз обратим внимание на то, что определение уровня вазопрессина в плазме крови для диагностики СНСАДГ может иметь значение толь-
ко при сопоставлении его величин со значениями осмоляльности внеклеточной жидкости (см.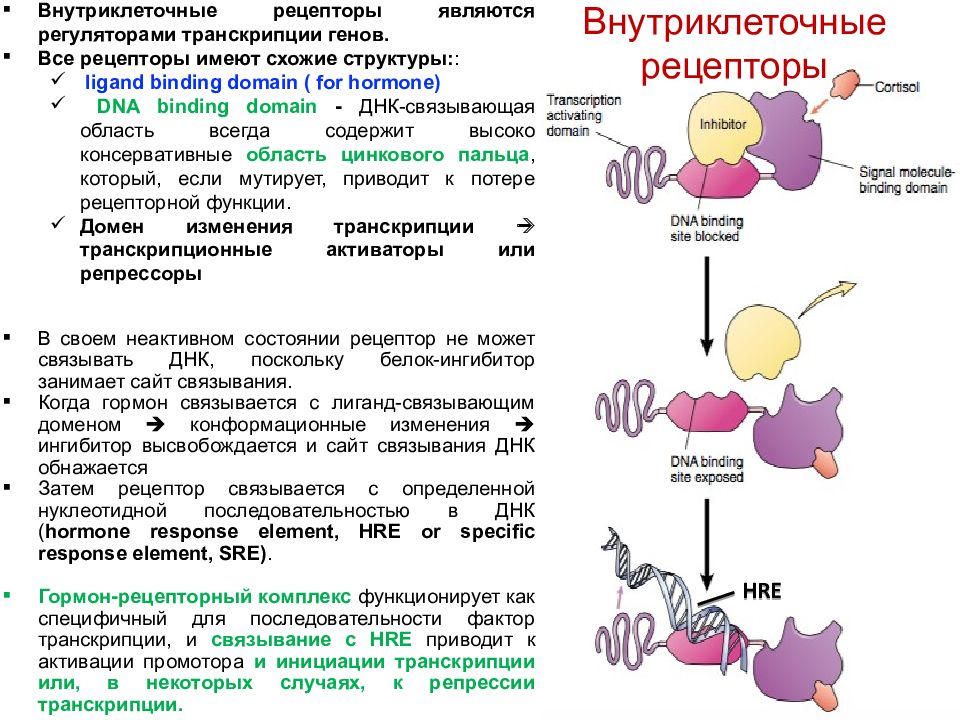 выше). Кроме того, некоторые виды опухолей, как уже указывалось ранее, по-видимому, продуцируют не аргинин-вазопрессин, а пептиды с АДГ-подобным действием, которые невозможно зарегистрировать известными методами определения антидиуретического гормона.
выше). Кроме того, некоторые виды опухолей, как уже указывалось ранее, по-видимому, продуцируют не аргинин-вазопрессин, а пептиды с АДГ-подобным действием, которые невозможно зарегистрировать известными методами определения антидиуретического гормона.
При выборе подхода к терапии пациента с СНСАДГ необходимо принимать во внимание ряд условий. Очевидно, что устранение причины неадекватной секреции антидиуретичсского гормона рано или поздно приведет к излечению СНСАДГ. К сожалению, не всегда возможно радикальное удаление опухоли, успешное излечение патологии ЦНС или легких. В то же время адекватная заместительная терапия глюкокортикоида-ми, гормонами щитовидной железы, а также отмена лекарственных средств, усиливающих секрецию АДГ или способствующих реализации его гидроосмотического эффекта, нередко может привести к нормализации секреции вазопрессина. Тем не мене, как уже указывалось выше, остается открытым вопрос, можно ли отнести надпочечниковую недостаточность, гипопаратиреоз или назначение препаратов, способствующих секреции АДГ или реализации его гидроосмотического эффекта, собственно к СНСАДГ.
При выработке тактики лечения пациента с СНСАДГ в контексте общих подходов к терапии дис-натриемий прежде всего необходимо учитывать, что гипонатриемии при СНСАДГ — это, как правило, гипонатриемии хронические. В связи с этим следует придерживаться весьма осторожной стратегии повышения концентрации натрия в сыворотке крови. Наконец, специфическими моментами ведения пациентов с СНСАДГ может считаться использование ряда лекарственных препаратов, способствующих нормализации уровня сывороточного натрия.
При выборе алгоритма лечения гипонатриемии у пациентов с СНСАДГ нужно различать неотложные и долговременные мероприятия, хотя граница между ними порой оказывается достаточно размытой.
Показаниями для проведения неотложной терапии могут считаться снижение концентрации натрия в сыворотке крови менее 120 ммоль/л и (или) наличие неврологических знаков, прежде всего судорог и комы.
В ургентном (как и долговременном) лечении гипонатриемии при СНСАДГ основное место занимает ограничение жидкости. В острых ситуациях уровень водопотребления должен быть сразу же сокращен до покрытия только неизбежных для организма (почечных и экстраренальных) потерь
воды. В этой ситуации формируется негативный водный баланс (почки вынуждены выводить относительно больше воды), чем осмотически активных веществ, что в конечном итоге ведет к коррекции гипонатриемии. По общему правилу пациенты с СНСАДГ не должны получать более 800- 1000 мп воды из всех источников, включая парэнетераль-ное введение [4,7-9].
Инфузионная терапия гипертоническими растворами ЫаС1 может быть использована у больных с СНСАДГ только в качестве меры неотложной помощи. Не входя в детали дискуссии об эффективности и безопасности режимов «быстрой» и «медленной» коррекции гипонатриемии или наличии или отсутствии необходимости почасового учета роста концентрации сывороточного натрия, отметим самое, на наш взгляд, важное. Нарастание уровня N8 в сыворотке крови за определенный интервал времени не должно превышать конкретной границы. Мнения об ее величине, правда, расходятся. Одни считают допустимым прирост концентрации сывороточного натрия за сутки до 12 ммоль [12], другие ограничивают данный порог 8 ммоль/сут [7]. По-видимому, в любом случае нельзя наращивать уровень № в сыворотке крови более, чем на 20 ммоль/л в течение первых 48 ч коррекции, а желаемые концентрации этого катиона к концу данного периода не должны превышать значений, соответствующих умеренной гипонатриемии (128 — 130 ммоль/л). Несоблюдение данных условий резко повышает риск развития ЦПМ [2].
При инфузионной терапии хлоридом натрия обычно используются гипертонические растворы с концентрацией №С1 от 2% до 5%. Применение более концентрированных растворов в принципе возможно, но нежелательно. В любом случае концентрация натрия в инфузионной среде должна превышать суммарную концентрацию натрия № и К в моче. В противной ситуации будет нарастать не экскреция, а задержка осмотически свободной воды, что может способствовать усугублению гипонатриемии. В силу этих же соображений инфу-зии изотонического (0,9%) раствора №С1 при попытках коррекции гипонатриемии у пациентов с СНСАДГ, как правило, не только бессмысленны, но и опасны.
Для расчета количества вводимого хлорида натрия, необходимого для достижения той или иной желаемой сывороточной концентрации этого катиона, предложен ряд способов [20, 21, 22]. Однако самый простой ориентировочный вариант следующий [22]:
Количество вводимого Ыа (ммоль) = (Ыаж -Ыаи) х 0,6 х МТ, где:
Ыаж — желаемая концентрация Ыа в сыворотке крови, ммоль/л
1Чаи — имеющаяся (истинная) концентрация № в сыворотке крови, ммоль/л
0,6-эмпирический коэффициент, отражающий содержание воды в организме по отношению к массе тела («общая вода организма»)
МТ — масса тела, кг.
В клинической практике обычно пользуются процентными концентрациями солей в инфузионных средах. В связи с этим стоит иметь в виду, что в 1 мл 10% гипертонического раствора хлорида натрия содержится примерно 1,7 ммоль Ыа. Тогда, пользуясь простыми пропорциями, нетрудно рассчитать содержание натрия в 1 мл любого другого гипертонического раствора №С1. В свою очередь, концентрацию натрия в в гипертонических инфузионных средах, содержащих ЫаС1, легко понизить, разбавляя его в соответствующее число раз водой для инъекций или, на практике зачастую более доступным, изотоническим (5%) раствором глюкозы.
В лечении пациентов с СНСАДГ и относительно высокой осмоляльностью мочи (во всяком случае, превышающей 300 мосм/кг Н20) или тяжелой гипонатриемией (Ыа сыворотки <115 ммоль/л) могут использоваться петлевые диуретики (фуро-семид), которые способствуют экскреции осмотически свободной воды. При этом, естественно, фуросемид вызывает потерю не только воды, но и солей, прежде всего натрия и калия. Эти потери должны возмещаться в ходе диуретической терапии больных с СНСАДГ [2,7].
Одним из вариантов такой терапии может быть схема, предложенная Я. БсИпег с сотрудниками [23]. Она обычно используется для лечения пациентов с тяжелой гипонатриемией (1Ча сыворотки < 115 ммоль/л). Согласно этим предписаниям можно назначать в/в фуросемид (лазикс) из расчета 10 мг/ч, а потери № и К возмещать их инфузиями в количестве, эквивалентном их потерям в ходе терапии. При этом для возмещения потерь натрия используется 5% раствор ЫаС1. Очевидно, что такой подход требует контроля за уровнями натрия и калия в сыворотке крови и моче. Причем определение концентраций электролитов в крови в процессе этого лечения должно проводиться каждые три часа на протяжении первых 12 часов. Нарастание уровня сывороточного натрия не должно превышать 0,5 ммоль/л в час, общее его нарастание не может быть более 20 ммоль/л за 48 ч. Наконец, как уже отмечалось ранее, не следует стремиться к достижению нормонатриемии и, тем более, необходимо избегать гипернатриемичес-ких значений концентраций Ага.
В плане долговременной терапии гипонатрие-мий при СНСАДГ основное значение остается за ограничением потребления воды (см.выше).
Многократные повторные вливания гипертонических растворов NaCl и даже значительное увеличение потребления Na с пищей мало перспективны. У пациентов с СНСАДГ баланс натрия быстро восстанавливается и его выведение уравновешивает количество потребляемого катиона. Поэтому все попытки, направленные на повышение поступления натрия в организм почти не сказываются на уровнях его сывороточной концентрации.
Среди дополнительных вариантов условно долговременной терапии гипонатриемий при СНСАДГ обсуждается возможность использования карбоната лития, димеклоциклина и перорального приема мочевины. Однако соли лития и димеклоциклин высокотоксичны (в том числе нефротоксичны). Поэтому в настоящее время от их применения рекомендуется воздерживаться [7].
Использование мочевины при лечении гипонат-риемии у больных с СНСАДГ основано на способности этого вещества вызывать осмотический диурез. Последний приводит к экскреции избытка осмотически свободной воды и таким образом уменьшает выраженность гипонатриемии. Мочевину нказначают per os, обычно в дозе 10 — 30 г/ сут [7]. Однако значение такого подхода в целом остается неопределенным [2].
Примером трудностей, возникающих в диагностике и выборе тактики ведения пациента с СНАДГ, может служить следующее наблюдение.
Больная 61 года, по специальности врач-фтизиатр, поступила 23.02.2002 г. по экстренным показаниям с диагнозом направления: «гипертоническая болезнь III ст., преходящее нарушение мозгового кровообращения».
При поступлении жаловалась на общую слабость, тошноту, головокружение, однократно отмечалась рвота. В приемном отделении осмотрена невропатологом, офтальмологом (выявлена гипертоническая ангиопатия сетчатки) и терапевтом. В результате диагноз острого нарушения мозгового кровообращения был отвергнут и пациентка госпитализирована на терапевтическое отделение с предварительным диагнозом: «гипертоническая болезнь II ст., гипертонический криз».
Из анамнеза известно, что около 15 лет страдает артериальной гипертензией, с максимальными величинами артериального давления (АД) 170/110 мм рт. ст. Гипер-тензия характеризовалась «кризовым» течением, повышения АД сопровождались головокружениями, тошнотой, рвотой, сильными головными болями. Последнее ухудшение 7.02.2002 г., когда в стрессовой ситуации зафиксирован подъем АД до 170/110 мм рт. ст. на фоне которого возникли головокружение, тошнота, рвота. Гос-питализрована в одну из больниц Санкт-Петербурга, откуда была выписана 22.02.2002 г. без значительного улуч-
шения с диагнозом «гпертоническая болезнь, гипертонический криз». Во время госпитализации сохранялись все указанные выше симптомы, неоднократно рецидивировала рвота. На следующие сутки после выписки нарастание общемозговой симптоматики послужило причиной вызова бригады скорой помощи и повторной госпитализации.
Из перенесенных и имеющихся заболеваний имели место варикозная болезнь вен нижних конечностей (фле-бэктомия в 1985 г), язвенная болезнь с локализацией язвы в луковице 12-перстной кишки, грыжа пищеводного отверстия диафрагмы, узловой нетоксический зоб (резекция правой доли щитовидной железы в 1999 г.). В 1980 г выполнена резекция нижней доли правого легкого по поводу аденомы бронха.
Пациентка курила в течение 40 лет. Алкоголем и наркотиками не злоупотребляла.
В анамнезе I роды, менопауза с 48 лет.
При поступлении состояние больной расценено как удовлетворительное. Сознание ясное.
В правой половине грудной клетки, на правой голени и в области шеи послеоперационные рубцы.
Кожные покровы обычной окраски, подкожно-жировая клетчатка распределена равномерно, отеков нет. Пальпировались паховые лимфатические узлы, плотно-эластичной консистенции, безболезненные.
Пульс 76 уд./мин, ритмичный. Расширение границ относительной сердечной тупости на 1,0 см. влево от средне-ключичной линии в пятом межреберье. Тоны сердца приглушены, акцент второго тона на аорте.
В легких жесткое дыхание со значительным ослаблением в проекции нижней доли правого легкого.
Живот мягкий, безболезненный, печень у реберной дуги, край ее мягкий, безболезненный. Симптомы раздражения брюшины отсутствовали.
Симптом поколачивания по пояснице отрицательный. Почки не пальпировались.
При осмотре невропатологом симптомов очагового поражения головного и менингеальных знаков не обнаружено. Выявлена гиперпатия кистей и стоп по типу «носок и перчаток». Офтальмологом диагностирована гипертоническая ангиопатия сетчатки.
В клиническом анализе крови: гемоглобин — 153 г/л, эритроциты — 4,8 х ! 0|2/л, цветовой показатель 0,96, лейкоциты — 6,1 х Ю»/л. Лейкоцитарная формула: палочкоя-дерные- 5%; сегментоядерпые- 70%; лимфоциты — 20%; моноциты — 5 %. Скорость оседания эритроцитов (СОЭ) — 18 мм/ч.
Общий анализ мочи: относительная плотность — 1012; белок — 0,066 г/л; лейкоциты — 0 — I в п/зр.; эритроциты 0 -2 в п/зр.
Биохимическое исследование сыворотки крови: билирубин общий — 16,4 мкмоль/л, аспартаттрансамипо-фераза (АСТ) — 0,81 ммоль/л х ч, аланинтрансаминофе-раза (АЛТ) — 1,27 ммоль/л х ч, натрий — 128 ммоль/л, калий — 3,5 ммоль/л.
ЭКГ: синусовый ритм, ЧСС 71/мин, нарушения внут-рижелудочковой проводимости по правой ножке п. Гиса, нарушения внутрипредсердной проводимости, косвенные признаки гипертрофии левого желудочка, изменения рсполяризации в передне-перегородочной области (дисметаболического характера?).
При рентгенографии грудной клетки высказано по-
дозрение на наличие жидкости в правой плевральной полости уровень, которой достигал переднего отрезка VI ребра.
Сонографическое исследование органов брюшной полости обнаружило в левой доле печени округлое гипе-рэхогснное образование размерами 1,3 — 1,4 см, расцененное как гемангиома.
Функциональное состояние почек (26.02.2002). Концентрации в сыворотке крови: креатинина 0,08 ммоль/л, мочевины 2,5 ммоль/л, натрия I 19 ммоль/л, калия 4,5 ммоль/л, кальция общего — 2,1 ммоль/л, ионизированного — 0,96 ммоль/л., хлора 96 ммоль/л, неорганического фосфора — 0.5 ммоль/л. Диурез 1 л/сут, клиренс креатинина 51 мл/мин. Концентрация натрия в моче 43,5 ммоль/ л, хлора — 54 ммоль/л. Суточная экскреция с мочой мочевины 280 ммоль, натрия 43,5 ммол, калия 27 ммоль, кальция 3,0 ммоль, хлора 54 ммоль, неорганического фосфора 12,8 ммоль.
Функциональное состояние почек (7.03.2002). Концентрации в сыворотке крови: креатинина 0,08 ммоль/л, мочевины 5,3 ммоль/л, калия 3,9 ммоль/л, натрия 133 ммоль/л, кальция общего — 2,33 ммоль/л, ионизированного — 0,95 ммоль/л., хлора 100 ммоль/л, неорганического фосфора — 1,0 ммоль/л. Диурез 1,25 л/су г, клиренс креатинина 40 мл/мин. Концентрация натрия в моче 150 ммоль/л, хлора — 134 мммоль/л. Суточная экскреция с мочой мочевины 225 ммоль, натрия 187,5 ммоль, калия 44 ммоль, кальция 4,0 ммоль, хлора 167,5 ммоль, неорганического фосфора 8, 8 ммоль.
При наблюдении в клинике сохранялись жалобы на тошноту, слабость, рвоты не было. Артериальное давление варьировало от 120/80 до 150/90 мм рт. ст. При пара станин АД до значений, указанных последними, у пациентки появлялась головная боль, усиливалось чувство тошноты. Тем не менее рвоты за все время наблюдения не отмечалось.
16.03. резко усилились головные боли, появились «боли во всем теле» (мышечные боли), зафиксирован подъем АД до 160/90 мм рт. ст. Невропатологом ухудшение состояния расценено, как нарастание проявлений дисциркуляторной энцефалопатии атеросклеротическо-го и гипертонического генеза и наличие миалгии мышц грудной клетки.
Зафиксировано нарастание СОЭ до 40 мм/ч. Возросли активности АЛТ (2,9 ммоль/л х ч,) и ACT (1,0 ммоль/л х ч). В связи с этим консультирована инфекционистом, который не обнаружил убедительных данных за наличие активного вирусного гепатита.
В дальнейшем пациентку беспокоила нарастающая слабость, усиление мышечных болей, появилась выраженная одышка. Нарастала анемизация, прогрессивно увеличивалось СОЭ, достигнув 60 — 70 мм/ч. Периодически выявлялся субфебрилитет.
У пациентки в первую очередь велись поиски наличия неопластического процесса. В связи с этим выполнялась ирригоскопия кишечника (получены данные за дивертикулез нисходящей части толстой кишки). При фиброгастродуодсноскопии обнаружена язва кардиаль-ного отдела желудка, рубцово-язвенная деформация луковицы 12-перстной кишки, получены данные за гипертрофический гастрит.
При магнитно-резонансной томографии головного мозга обнаружена MP-картина наружной и внутренней
гидроцефалии. Арахноидальные ликворокистозные изменения. МР-признаки атрофических изменений лобных долей, преимущественно левой. «Пустое» турецкое седло. Очаговые изменения мозга дистрофического характера. МР-признаки воспалительных изменений в области сосцевидных отростков.
19.03 проведена обычная рентгеновская томография средостения. На томограммах прослеживался просвет трахеи, главных бронхов, правого верхнедолевого, долевые бронхи левого легкого до их деления на сегментарные. Просветы бронхов равномерной ширины, не сужены. При ретроспективном анализе было высказано заключение, что ранее высказанное предположение о наличии жидкости в правой плевральной полости, скорее всего, не соответствует действительности. Более вероятна возможность наслоений по костальной плевре справа.
24.03 у пациентки возникли сильные боли в области живота, в связи с чем она была переведена на хирургическое отделение, где при повторном сонографическом исследовании были обнаружены очаговые изменения в паренхиме печени, позволяющие заподозрить наличие метастазов опухоли неясной локализации.
Была выполнена диагностическая фибробронхоско-пия. Выявлена бугристая гиперваскуляризированная инфильтрация в области бифуркации трахеи и главных бронхов, преимущественно правого. Проведена биопсия подозрительных участков. При морфологическом исследовании полученного материала установлен диагноз мелкоклеточного рака бронха.
Пациентка передана под наблюдение онкологов со следующим основным диагнозом:
опухоль (мелкоклеточный рак) правого главного бронха с распространением на трахею IV ст. Метастазы в печень. Синдром неадекватной секреции АДГ, гипонат-риемия. Синдром полимиалгии. Опухолевая интоксикация. Нормохромная анемия.
На наличие гипонатриемии обратили внимание практически сразу же при поступлении больной (табл. 4). Причины ее долгое время оставались неясными. Первоначально генез гипонатриемии связывали с рвотой, которая имела место на догоспитальном этапе.
Однако за все время пребывания в клинике рвота не рецидивировала, хотя уровень натрия в сыворотке оставался низким (см. табл. 4). Поэтому роль рвоты в происхождении гипонатриемии у данной пациентки пришлось отвергнуть.
Далее была выдвинута версия о патологии надпочечников, как возможной причине гипонатриемии (что, вообще говоря, может быть одной из причин СНСАДГ — см. табл. 4, хотя мысль о наличии данного синдрома, как такового, еще не фигурировала). Тем не менее и от этого предположения пришлось отказаться, как не соответствующего ни клинике заболевания, ни результатам определения уровней кортизола в крови и моче.
Наконец, выявление очаговых изменений в паренхиме печени при повторной сонографии и пос-
ледующие результаты фибробронхоскопии и морфологического исследования биоптата позволили остановиться на диагнозе СНСАДГ, ассоциированном с опухолью бронха.
Для коррекции гипонатриемии больной назначались инфузии гипертонического раствора NaCl (от 50 до 100 мл/сут — максимальное количество вводимого Na не превышало 150 ммоль/л). Концентрации натрия в сыворотке крови по большей части поддерживались на значениях выше критических (см. табл. 4).
Данный случай представляет, на наш взгляд, довольно типичную картину СНСАДГ: сочетание гипотонической гипонатриемии с малонару-шенной скоростью клубочковой фильтрации, низкие значения концентрации мочевины в сыворотке крови при поступлении, отсутствие отеков. Дополнительным обоснованием диагноза СНСАДГ может быть отмеченное выше быстрое нарастание экскреции натрия с мочой на фоне инфузий гипертонического раствора NaCl (ср. данные функционального обследования от 26.02 и 7.03). В то же время у пациентки не наблюдалось клинических симптомов, которые однозначно можно было бы связать с гипо-натриемией, хотя и исключить подобную связь тоже нельзя. Необходимо учесть, что уровни натрия в сыворотке за время наблюдения, как правило, оставались на значениях выше критических (см. табл. 4). Кроме того, все имевшиеся у больной клинические проявления, в том числе и неврологические, могут иметь и другие объяснения (опухлевая интоксикация, артериальная ги-пертензия, атеросклероз). В силу этих же причин не поддаются однозначной трактовке и результаты MP-томографии головного мозга.
При попытках коррекции гипонатриемии, несомненно, учитывался ее хронический характер, поэтому выбиралась более чем осторожная тактика введения гипертонических pacTBopoB’NaCl. Однако, на наш взгляд, в-данной ситуации можно было попытаться ограничиться только уменьшением по-требления’жидкости.
Особенностью случая является и то, что СНСАДГ, несомненно, протекал на фоне бурно прогрессирующего неопластического процесса.
Наконец, одним из важнейших выводов из представленного наблюдения должно быть следующее: выявление гипонатриемии, не имеющей каких-либо явных объяснений у любого пациента (особенно пожилого), требует тщательных поисков злокачественной опухоли, в первую очередь брон-хогенного рака. Нельзя забывать, что гипонатрие-мия, обусловленная синдромом неадекватной сек-
Таблица 4
Концентрации натрия, калия и уровень осмоляльности сыворотки крови, в зависимости от
количества вводимого натрия
Показатели Дата
24.02 24.02 24.02 25.02 26.02 1.03 2.03 2.03 2.03 3.03 3.03 3.03 4.03 4.03 5.03
Введение NaCI 0,9% — 400 (плюс NaHC03 — 5 % — 200) 0,9% -200 10%-50 10%-50 10% -50 10%-50 10%-50 10%-50 10%-50 10%-50
Na’ 128 121 125 127 119 121 123 123 121 123 135 135 125 127 130
К* 3,5 3,2 3,4 3,7 4,5 3,7 3,6 3,6 3,9 3,2 3,8 3,8 4,0 3,7 3,5
Осм 253 278
Таблица 4 (продолжение)
Показатели Дата
5.03 6.03 6.03 7.03 8.03 9.03 10.03 11.03-15.03 16.03 18.03 30.03 2.04 8.04
Введение NaCI 10% -50 10%-50 10% -50 10% -5С 0,9% 300 10%-50
Na* 131 129 134 133 130 135 135 127-129 129 141 132 132 130
К* 4,7 3,6 3,4 3,9 3,9 3,2 3,5 3,7-4,1 4,1 4,2 4,0 3,9 4,3
Осм 272 280 271 281
реции антидиуретического гормона, иногда может служить первой манифестацией скрытно развивающегося неопластического процесса.
Таким образом, СНСАДГ является если не слишком частой, но и не столь уж редкой патологией. В своей практике с ним могут встретиться врачи самых разных специальностей. Поэтому мы надеемся, что данная публикация поможет нашим коллегам пополнить свои знания об этом своеобразном состоянии.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Anderson RJ, Chung HM, Kluge R et al. Hyponatremia: A prospective analysis of its epidemiology and the pathogenic role of vasopressin. Ann Intern Med 1985; 102: 164-168
2. Gross P, Reimann D, Neidel J et al. The treatment of severe hyponatremia. Kidney Int 1998; 53 [Suppl 64]: S6 -S11.
3. Humes HD. Disorders of water metabolism. In: Kokko JP, Tannen RL, eds. Fluids and electrolytes. W.B. Saunders,
Philadelphia et al.: 1986; 118-136
4. Sterns RH, Heilig CW, Narins RG. Hyponatremia and hypernatremia. In: Massry SG, Glassock RJ, eds. Textbook of nephrology. Volume 1. Williams & Wilkins, Baltimore et al.: 1995;276-292
5. van Os CH, Deen PMT. Role of aquaporins in renal water handling: physiology and pathophysiology. Nephrol Dial Transplant 1998; 13: 1645-1651
6. Yamamoto T, Sasaki S. Aquaporins in the kidney: Emerging new aspects. Kidney Int 1998; 54: 1041-1051
7. Гальперин МЛ, Ox MC. Гипонатриемия: особенности терапии. Нефрология 1998; 2(2): 107-113
8. Brennan S, Carlos Ayus J. Treatment of hypoosmolar and hyperosmolar states. In: Suki WN, Massry SG, eds. Therapy of renal diseases and related disorders. Kluver, Boston: 1991; 1-16
9. Halterman RK, Berl T. Therapy of dysnatremic disorders. In: Brady HR, Wilcox CS, eds. Therapy in nephrology and hypertension. W.B. Saunders, Philadelphia et al.: 1999; 257-269
10. Verbalis JG, Gullians SR. Rapid correction of hyponatremia produces differential effects on brain osmolyte and electrolyte reaccumulation In rats. Brain Res 1993; 606: 19-27
11. Norenberg MD, Leslie КО, Robertson AS. Association
between rise in serum sodium and central pontine myelinolysis. Ann Neurol 1982; 11: 128-135
12. Sterns RH, Riggs JE, Schochet SS Jr. Osmotic demyelination syndrome following correction of hyponatremia. N Engl J Med ‘1986; 314: 1535-1542
13. Sterns RH. Severe symptomatic hyponatremia: Treatment and outcome. A study of 64 cases. Ann Intern Med 1987;107:656-664
14. Senkfor SI, Anger MS, Berl T. Control of water excretion. In: Massry SG, Glassock RJ, eds. Textbook of nephrology. Volume 1. Williams & Wilkins, Baltimore et al.: 1995; 258-265
15. Martin P-Y, Schrier RW. Role of aquaporin-2 water channels in urinary concentration and dilution defects. Kidney Int 1998; 53 [Suppl 65): S57-S62
16. Sands JM, Kokko JP. Current concepts of the countercurrent multiplication system. Kidney Int 1996; 50 [Suppl 57]: S93 -S99.
17. Palm S, Gross R V2-vasopressin receptor antagonists — mechanism of effect and clinical implications in hyponatremia. Nephrol Dial Transplant 1999; 14: 2559 -2562
18. Каюков ИГ. Современные представления о патогенезе нефротического отека. В: Рябов СИ, Наточин ЮВ. Функциональная нефрология. Лань, СПб.: 1997; 108-121
19. Deschenes G, Feraille Е, Doucet A. Mechanisms of oedema in nephrotic syndrome: old theories and new ideas. Nephrol Dial Transplant 2003; 18: 454 -456
20. Barsuom NR, Levine BS. Current prescription for the correction of hyponatremia and hypernatremia: are they too simple? Nephrol Dial Transplant 2002; 17: 1176 — 1180
21. Adrogue HJ, Madias NE. Aiding the fluid prescription for the dysnatremias. Intensive Care Med 1997; 23: 309-316
22. Oster JR, Singer I. Hyponatremia, hypoosmolality and hypotonicity: tables and and fables. Arch Inern Med 1999; 159: 33-336
23. Hantman D, Rossier B, Zolhmann R, Schrier RW. Rapid correction of hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Ann Intern Med 1973; 78: 870-875
Поступила в редакцию 4.04.2003 г.
Какая терапия эффективнее при синдроме неадекватной секреции антидиуретического гормона?
Актуальность
Терапией первой линии синдрома неадекватной секреции антидиуретического гормона является ограничение потребления жидкости. В случае неэффективности этого метода назначают фуросемид и увеличивают потребление хлорида натрия. Несмотря на высокую распространённость синдрома неадекватной секреции антидиуретического гормона эффективность терапевтических мероприятий не была изучена в рандомизированных контролируемых исследованиях.
В открытом рандомизированном исследовании сравнили комбинацию ограничения жидкости, фуросемида с или без дополнительного использования NaCl с ограничением жидкости в коррекции гипонатриемии при синдроме неадекватной секреции антидиуретического гормона.
Дизайн исследования
В открытое рандомизированное контролируемое исследование были включены пациенты с сывороточной концентрацией натрия ≤ 130 ммоль/л, связанной с синдромом неадекватной секреции антидиуретического гормона.
Пациентов рандомизировали в одну из 3 групп: ограничение жидкости, ограничение жидкости + фуросемид, ограничение жидкости + фуросемид + NaCl.
Ограничение жидкости <1 000 мл или <500 мл/день определялось по отношению электролитов мочи и сыворотки.
Доза фуросемида составила от 20 до 40 мг/день. Добавка NaCl 3 г/день. Терапия проводилась на протяжении 28 дней.
В качестве первичной конечной точки рассматривали изменение концентрации натрия на 4,7, 14 и 28 день терапии.
Результаты
- В исследование включили 92 пациентов, которые были рандомизированы в отношении 1:1:1.
- Исходный показатель натрия составил 125 ± 4 ммоль/л, уровень сывороточного натрия достоверно не различался между группами.
- Показано, что средний показатель натрия на 4 день значительно повысился на 5 ммоль/л во всех группах терапии (P < 0,001). При этом статистически значимых различий между группами получено не было (P = 0,7).
- Не отмечено достоверных различий в проценте пациентов или времени достижения концентрации натрия ≥ 130 или ≥135 ммоль/л между 3 группами.
- Острая почечная недостаточность и гипокалиемия (≤ 3,0 ммоль/л) чаще диагностировались у пациентов, получавших фуросемид.
Заключение
Согласно результатам исследования у пациентов с синдромом неадекватной секреции антидиуретического гормона фуросемид и комбинации с добавкой NaCl и ограничением потребления жидкости не превосходит меру по ограничению употребления жидкости в коррекции гипонатриемии. Терапия фуросемидом ассоциирована с повышением частоты гипокалиемии и острого повреждения почек.
Источник: Krisanapan P et al. Efficacy of furosemide, oral sodium chloride, and fluid restriction for treatment of syndrome of inappropriate antidiuresis (SIAD): An open-label randomized controlled study (the EFFUSE-FLUID trial). Am J Kidney Dis 2020 Aug; 76:203-212.
Клинический случай развития церебрального синдрома потери соли у собаки после удаления новообразования гипофиза
Автор: Грачёва Галина, ветеринарный врач ОРИТ Ветеринарной клиники доктора Сотникова, г. Санкт-Петербург.
В ветеринарии критических состояний мало сведений о механизмах развития водно-электролитных нарушений, связанных с патологиями головного мозга. Чаще всего описания перекликаются с таковыми в гуманной медицине.
Гипофизарные патологии не исключение. Выделяют возможность развития гипо- и гипернатриемии, но из нозологических единиц можно выделить разве что синдром неадекватной секреции антидиуретического гормона (SIADH) и несахарный диабет. Мозговой сольтеряющий синдром (церебральный синдром потери соли, CWS) не описан у животных как отдельная нозологическая единица1. Тем не менее необходимо знать, что при развитии гипонатриемии есть принципиальная разница между SIADH и CWS2 и важно уметь отличать одно от другого, так как эти состояния имеют различный патогенез, а значит, разное лечение.
В передней и средней долях гипофиза (аденогипофиз) образуются тропные гормоны. Задняя доля гипофиза (нейрогипофиз) секретирует вазопрессин и окситоцин, образующиеся в ядрах гипоталамуса3.
После удаления опухолей гипофиза одной из целей интенсивной терапии является терапия заместительная. Есть рекомендуемые дозировки вазопрессина, левотироксина и кортикотропных гормонов, но их применение всегда приходится аргументировать тем или иным проявлением питуитарной недостаточности. Для этого в первые 24 часа осуществляется строгий почасовой контроль за темпом диуреза, количеством электролитов в сыворотке крови, показателями артериального давления.
За 6 лет сбора проспективных статистических данных в условиях нашего отделения (ОРИТ Ветеринарной клиники неврологии, травматологии и интенсивной терапии доктора Сотникова) в среднем 80 % случаев приходится на развитие центрального несахарного диабета (чаще всего транзиторного), 5 % – на развитие синдрома SIADH, 1 % – синдрома потери соли и чуть менее 5 % –пангипопитуитаризма (выборка – 30 пациентов с диагнозом «новообразование гипофиза»; в статистику включены как кошки, так и собаки разных возрастов и половой принадлежности; оценка частоты и вида проявлений водно-электролитных нарушений проводилась на протяжении всего времени нахождения пациентов в отделении).
Клинический случай
Пациент: собака породы йоркширский терьер, дата рождения – 15 декабря 2014 года, вес при поступлении – 3 кг. Вакцинирован, чипирован, кастрирован. Содержание домашнее, кормление промышленными кормами. Поступил в клинику 28 февраля 2018 года с диагнозом «новообразование гипофиза».
Анамнез. Со слов владельцев животного, с декабря 2017 года стала проявляться агрессия со стороны питомца по отношению к владельцам. За 3 недели до обращения в клинику у собаки появились манежные движения по большому радиусу в левую сторону, сенситивная атаксия. На фоне однократного приема преднизолона улучшений не наступило. Последние 3 дня (конечный прием – накануне в 19:00) получал дексаметазон в дозе 0,1 мл 1 раз в день и катадолон – по 30 мг 3 раза в день. 23 февраля 2018 года пациенту была сделана магнитно-резонансная томография (исследование проведено на Украине), по результатам которой было выявлено объемное новообразование гипофиза (фото 1).
Лечение
Было принято решение о проведении хирургического вмешательства по удалению гипофиза. Операция была сделана 1 марта 2018 года.
Предоперационная подготовка:
- преднизолон – 0,66 мг внутримышечно;
- минирин – 4 мкг внутримышечно;
- трамадол – 12 мг внутримышечно;
- цефтазидим – 150 мг внутримышечно.
Проведена гипофизэктомия модифицированным ростротенториальным доступом. В полость, образовавшуюся после удаления гипофиза, были помещены гемостатическая губка (извлечена 2 марта 2018 года) и датчик внутричерепного давления. В ходе операции давление составило 5–7 мм рт. ст., после закрытия доступа – 8 мм рт. ст. Материал был отправлен на гистологическое исследование. Установлена гастростома (фото 2).
Ранний послеоперационный период протекал с осложнениями в виде развития полиурии и гипонатриемии. В условиях развития гиповолемии у пациента не мог быть установлен синдром SIADH, поскольку последний характеризуется стойкой гиперволемией из-за задержки жидкости. Коррекция состояния проводилась по протоколам коррекции CWS.
Окончательный диагноз был установлен, полагаясь на клиническую картину (полиурия, гипотермия, артериальная гипотензии), а также на основе показателей фракционной экскреции электролитов с мочой, электролитов крови и плотности мочи.
Пациент получал минирин (субконъюнктивально), преднизолон и левотироксин (фото 3).
Эндокринологом была назначена заместительная терапия, которая преследовала цель коррекции эндокринных нарушений (эндокринные нарушения в этом случае объединяют клинические картины надпочечниковой недостаточности и гипотиреоза, развивающиеся при повреждении гипоталамо-гипофизарных структур, что по определению приводит к нарушению синтеза тропных гормонов).
Коррекция гипонатриемии осуществлялась в первые 24 часа после операции посредством проведения инфузии 3%-го раствора натрия хлорида, затем – инфузии 0,9%-го раствора натрия хлорида, а после этого – энтерального введения 0,9%-го раствора натрия хлорида. Гипонатриемия имела стойкий характер, поэтому ее коррекция была затруднена.
15 марта 2018 года пациенту повторно проведено МРТ-исследование (фото 4), которое выявило восстановление паренхимы головного мозга, отсутствие признаков накопления контраста в зоне хирургического вмешательства (что свидетельствовало о вероятном полном удалении новообразования) (фото 5).
В ночь с 29 на 30 марта у животного наступило ухудшение неврологического статуса. Повторное МРТ-исследование, показавшее выраженный цитотоксический отек головного мозга, было проведено 30 марта 2018 года. Пациент погиб 31 марта. По результатам патологоанатомического вскрытия, причиной смерти стал центральный понтинный миелинолиз, развившийся, вероятно, вследствие резкого повышения уровня натрия в крови.
Заключение
Мозговой сольтеряющий синдром (церебральный синдром потери соли, CWS) развивается в результате патологических процессов в головном мозге и сопровождается потерей натрия с мочой из-за развития гипонатриемии, гиповолемии (Harrigan MR, 1996). Механизмы потери натрия почками недостаточно изучены. Считается, что наиболее вероятными механизмами являются повышение уровня натрийуретических пептидов или нарушения нервной регуляции почек.
Принципиально важной является дифференциальная диагностика CWS и SIADH. CWS приводит к гиповолемии, а SIADH сопровождается умеренной гипергидратацией, что и определяет различия в методах коррекции4.
Коррекция гипонатриемии должна проводиться поэтапно, а контроль за электролитами необходимо осуществлять на протяжении всего времени регистрации полиурии (до 6 раз в сутки). Но даже эти меры не гарантируют пациентам с CWS благоприятного прогноза. В описанном случае не было учтено времени, которое пациент провел в состоянии гипонатриемии, а также его замедленного метаболизма ввиду гипотиреоза, при этом натрий в крови был выведен на уровень 140 ммоль слишком быстро, что и привело к миелинолизу моста.
Литература:
- Stephen J. Ettinger, E. Feldman. Textbook of veterinary internal medicine, 2017.
- Curtis W. Dewey, Ronaldo C. da Costa. Practical Guide to Canine and Feline neurology, 2016.
- Timbonnier M., Barrow and Selman eds. Antidiuretic hormone: regulation, disorders and clinical evaluation, Vol. 5, 1990.
- Савин И. А. Нарушения нейроэндокринных процессов, 2016.
СИНДРОМ НЕАДЕКВАТНОЙ СЕКРЕЦИИ АНТИДИУРЕТИЧЕСКОГО ГОРМОНА: ПРОБЛЕМЫ ДИАГНОСТИКИ И ТЕРАПИИ | Каюков
1. Anderson RJ, Chung HM, Kluge R et al. Hyponatremia: A prospective analysis of its epidemiology and the pathogenic role of vasopressin. Ann Intern Med 1985; 102: 164-168
2. Gross P, Reimann D, Neidel J et al. The treatment of severe hyponatremia. Kidney Int 1998; 53 [Suppl 64]: S6 -S11.
3. Humes HD. Disorders of water metabolism. In: Kokko JP, Tannen RL, eds. Fluids and electrolytes. W.B. Saunders, Philadelphia et al.: 1986; 118-136
4. Sterns RH, Heilig CW, Narins RG. Hyponatremia and hypernatremia. In: Massry SG, Glassock RJ1 eds. Textbook of nephrology. Volume 1. Williams & Wilkins, Baltimore et al.: 1995; 276-292
5. van Os Ch2 Deen PMT. Role of aquaporins in renal water handling: physiology and pathophysiology. Nephrol Dial Transplant 1998; 13: 1645-1651
6. Yamamoto T, Sasaki S. Aquaporins in the kidney: Emerging new aspects. Kidney Int 1998; 54: 1041-1051
7. Гальперин МЛ, Ox MC. Гипонатриемия: особенности терапии. Нефрология 1998; 2(2): 107-113
8. Brennan S, Carlos Ayus J. Treatment of hypoosmolar and hyperosmolar states. In: Suki WN, Massry SG, eds. Therapy of renal diseases and related disorders. Kluver, Boston: 1991; 1-16
9. Halterman RK, Berl T. Therapy of dysnatremic disorders. In: Brady HR, Wilcox CS, eds. Therapy in nephrology and hypertension. W.B. Saunders, Philadelphia etal.: 1999; 257-269
10. Verbalis JG, Gullians SR. Rapid correction of hyponatremia produces differential effects on brain osmolyte and electrolyte reaccumulation in rats. Brain Res 1993; 606: 19-27
11. Norenberg MD, Leslie KO, Robertson AS. Association between rise in serum sodium and central pontine myelinolysis. Ann Neurol 1982; 11: 128-135
12. Sterns RH, Riggs JE, Schochet SS Jr. Osmotic demyelination syndrome following correction of hyponatremia. N Engl JMed ‘1986; 314: 1535-1542
13. Sterns RH. Severe symptomatic hyponatremia: Treatment and outcome. A study of 64 cases. Ann Intern Med 1987; 107:656-664
14. Senkfor SI, Anger MS, Berl T. Control of water excretion. In: Massry SG, Glassock RJ, eds. Textbook of nephrology. Volume I. Williams & Wilkins, Baltimore et al.: 1995; 258-265
15. Martin P-Y, Schrier RW. Role of aquaporin-2 water channels in urinary concentration and dilution defects. Kidney Int 1998; 53 [Suppl 65]: S57-S62
16. Sands JM, Kokko JP. Current concepts of the countercurrent multiplication system. Kidney lnt 1996; 50 [Suppl 57]: S93 -S99.
17. Palm S, Gross P. V2-vasopressin receptor antagonists -mechanism of effect and clinical implications in hyponatremia. Nephrol Dial Transplant 1999; 14: 2559 -2562
18. Каюков ИГ. Современные представления о патогенезе нефротического отека. В: Рябов СИ, Наточин ЮВ. Функциональная нефрология. Лань, СПб.: 1997; 108-121
19. Deschenes G, Feraille Е, Doucet A. Mechanisms of oedema in nephrotic syndrome: old theories and new ideas. Nephrol Dial Transplant 2003; 18: 454 -456
20. Barsuom NR, Levine BS. Current prescription for the correction of hyponatremia and hypernatremia: are they too simple? Nephrol Dial Transplant 2002; 17: 1176 -1180
21. Adrogue HJ, Madias NE. Aiding the fluid prescription for the dysnatremias. Intensive Care Med 1997; 23: 309-316
22. Oster JR, Singer I. Hyponatremia, hypoosmolality and hypotonicity: tables and and fables. Arch Inem Med 1999; 159: 33-336
23. Hantman D, Rossier B, Zolhmann R, Schrier RW. Rapid correction of hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Ann Intern Med 1973; 78: 870-875
Hyponatremia: A clinical approach | Shchekochikhin
Hyponatremia is the most common electrolyte metabolic abnormality in clinical practice. The unfavorable course of many diseases is associated with hyponatremia. Acute severe hyponatremia is life-threatening because cerebral edema may develop. Less obvious chronic hyponatremia increases the risk of balance problems, falls and fractures, especially in elderly patients. In any occasion, hyponatremia should not be now regarded only as a laboratory phenomenon in critically ill patients, but it necessitates a thorough clinical analysis of each individual case and appropriate therapy. The paper presents approaches to diagnosing and treating hyponatremia in various clinical situations.
АВП — аргинин-вазопрессин ЛП — лекарственные препараты МПКТ — минеральная плотность костной ткани СНСАДГ — синдром неадекватной секреции антидиуретического гормона СТН — соль-теряющая нефропатия ХСН — хроническая сердечная недостаточность ЦНС — центральная нервная система ЦП — цирроз печени Аннотация Гипонатриемия, определяемая как снижение содержания натрия в сыворотке крови до 135 ммоль/л и менее, — наиболее распространенное электролитное расстройство. Развитие гипонатриемии указывает на относительное увеличение содержания осмотически не связанной воды по сравнению с содержанием натрия в организме. Подобный дисбаланс является следствием превышения потребления осмотически свободной воды над способностью почечных канальцев разводить мочу. В большинстве случаев избыток свободной воды в организме вызван повышенной секрецией антидиуретического гормона, аргинина-вазопрессина (АВП) под влиянием осмотических и неосмотических стимулов [1]. АВП синтезируется в нейросекреторных клетках супраоптического и паравентрикулярных ядер гипоталамуса, аккумулируется в задней доле гипофиза и высвобождается в ответ на повышение осмолярности плазмы крови. Даже небольшое повышение осмолярности плазмы (на 1%) вызывает секрецию гормона. Секрецию АВП регу-лируют также неосмотические стимулы. Концентрация АВП в крови повышается при снижении среднего артериального давления на 5—7% или уменьшении эффективного объема артериального кровообращения («недозаполненности артериального русла») на 8—10% [1, 2]. Эффекты АВП опосредованы рецепторами вазопрессина V1a, V1b и V2. Активация рецепторов V1a сосудистой стенки приводит к системной вазоконстрикции. Рецепторы V1b преимущественно располагаются в передней доле гипофиза. Рецепторы V2 локализованы большей частью в собирательных трубочках почек. При их активации происходит перемещение белка—канала свободной воды аквапорина 2-го типа к апикальной поверхности последних, что увеличивает реабсорбцию осмотически свободной воды [3, 4]. Распространенность гипонатриемии в общетерапевтической амбулаторной практике точно неизвестна и, по разным данным, колеблется от 21 до 34% [5—6]. В пожилом возрасте и у больных в критическом состоянии распространенность гипонатриемии выше из-за нарушения функции разведения мочи и способности экскретировать осмотически свободную воду. Остро возникшая гипонатриемия и, соответственно, резкое снижение внеклеточной осмолярности приводят к повышению внутричерепного давления и развитию отека мозга [7]. В клинике внутренних болезней так называемая острая гипонатриемическая энцефалопатия является неотложной ситуацией, сопровождающейся высокой смертностью (до 42%). Сопутствующая гипоксия еще более ухудшает прогноз [8]. С неблагоприятным прогнозом у госпитализированных пациентов, в том числе с повышением смертности и увеличением сроков пребывания в стационаре, связана и хроническая бессимптомная гипонатриемия. При этом прогноз одинаково неблагоприятен независимо от того, поступает ли пациент с гипонатриемией или последняя развивается во время пребывания в стационаре [9, 10]. Распространенность гипонатриемии при различных состояниях представлена в таблице. Распространенность гипонатриемии [13] Примечание. ХСН — хроническая сердечная недостаточность. Гипонатриемия при синдроме неадекватной секреции антидиуретического гормона (СНСАДГ). Это клинический симптомокомплекс, при котором избыточная нерегулируемая секреция АВП приводит к развитию гипонатриемической гипергидратации. СНСАДГ служит основной причиной эуволемической гипонатриемии — гипонатриемии при нормальном объеме циркулирующей крови, плазмы и внеклеточной жидкости. Диагноз СНСАДГ требует исключения гиперволемической гипонатриемии при заболеваниях, сопровождающихся развитием отеков (см. ниже), и гиповолемической гипонатриемии, возникающей при значительных потерях воды и натрия через желудочно-кишечный тракт (диарея, рвота, потеря в «третье пространство») или почки (передозировка диуретиков, особенно действующих дистально, первичная надпочечниковая недостаточность, сольтеряющая нефропатия — СТН, глюкозурия при сахарном диабете, бикарбонатурия с развитием метаболического алкалоза, сольтеряющий синдром при поражении центральной нервной системы — ЦНС). Другими причинами эуволемической гипонатриемии являются выраженный гипотиреоз и дефицит глюкокортикоидов при гипопитуитаризме. В этих ситуациях гипонатриемия корректируется заместительной гормональной терапией [11, 12]. Необходимо отметить возможность развития гипонатриемии при подавленном синтезе АВП в случае употребления очень большого количества жидкости при ограниченном употребления солей (истинная водная интоксикация). При суточной осмотической нагрузке 600 мОсм и более и подавленном синтезе АВП (нормальное состояние) электролитный баланс может поддерживаться в стандартных значениях при употреблении до 12 л жидкости. Таким образом, у пациентов с первичной психогенной полидипсией гипонатриемия развивается при употреблении более 12 л жидкости в сутки. Ограничение осмотической нагрузки до 300 мОсм в отсутствие секреции АПВ приводит к развитию гипонатриемии при употреблении 6 л. Так развивается «пивная потомания», когда при очень большом объеме выпитого пива (гипоосмолярная жидкость) и недостаточном поступлении солей гипонатриемия возникает, несмотря на практически полную супрессию синтеза АВП и максимальную способность почек к разведению. У пациентов с СНСАДГ гипонатриемия развивается при гипоосмолярности плазмы и достаточной осмоляльности мочи (более 100 мОсм на 1 кг воды). У 10% пациентов с гипонатриемией и СНСАДГ, диагностированным согласно общепринятым критериям, уровень АВП в крови определить невозможно. Вероятно, в этих случаях гормон высвобождается в концентрациях ниже порога существующих методов идентификации. Другим объяснением может быть развитие у этих пациентов нефрогенного СНСАДГ, связанного с мутацией гена рецепторов V2 [13, 14]. Этиология СНСАДГ многообразна и включает ряд опухолей, заболевания ЦНС, легких, влияние лекарственных препаратов (ЛП) и др. Второй по частоте причиной развития СНСАДГ после опухолей являются заболевания ЦНС. Любое диффузное поражение головного мозга, включая травмы, может приводить к СНСАДГ [15]. Последний может развиваться также при обострении практически любого психического заболевания. В то же время природу СНСАДГ не удается уточнить у 40% пациентов, особенно пожилых [13]. Гипонатриемия, вызванная ЛП. Частой причиной гипонатриемии служат Л.П. Гиповолемическая гипонатриемия вследствие применения диуретиков с выраженным обезвоживанием развивается довольно редко. Однако дистально действующие диуретические препараты и спиронолактон могут приводить к развитию эуволемической гипонатриемии, связанной с нарушением концентрационной функции канальцев. Распространенной причиной гипонатриемии служат тиазидные диуретики в связи с их широким применением. Другие Л.П., вызывающие гипонатриемию, представлены ниже [16]. ЛП, ассоциированные с гипонатриемией (кроме тиазидных диуретиков): Аналоги АВП: десмопрессин, окситоцин. Препараты, усиливающие почечный эффект АВП: хлорпропрамид, циклофосфамид, нестероидные противовоспалительные препараты, ацетаминофен (парацетамол). Препараты, усиливающие высвобождение АВП в гипофизе: хлорпропамид, клофибрат, карбамазепин, винкристин, никотин, опиаты, ифосфамид; Механизм развития гипонатриемии неизвестен: галоперидол, флуфеназин, амитриптилин, тиоридазин, флуоксетин, метамфетамин (экстази), сертралин. Среди них наиболее частыми причинами гипонатриемии являются психофармакологические ЛП: карбамазепин, окскарбамазепин и антидепрессанты из группы селективных ингибиторов обратного захвата серотонина. Тяжелая гипонатриемия может развиться при применении наркотиков, действующих на серотониновую систему (экстази, 3,4-метилендиоксиметамфетамин) [17]. Гипонатриемия у онкологических больных. Около 14% в структуре причин гипонатриемии у госпитализированных пациентов составляют злокачественные новообразования [18]. В большинстве случаев гипонатриемия развивается у больных с установленным диагнозом опухоли, однако в ряде случаев она предшествует выявлению новообразования. У онкологических пациентов гипонатриемия может осложнить хирургическое или химиотерапевтическое лечение, являясь у этой категории больных неблагоприятным прогностическим фактором [19]. Основным механизмом развития гипонатриемии при злокачественных новообразованиях служит эктопическая продукция АВП опухолью, что приводит к развитию СНСАДГ. Наиболее часто гипонатриемия развивается при раке легкого, особенно мелкоклеточном (у 10—15% пациентов), а также опухолях головы и шеи. Последние сопровождаются развитием СНСАДГ примерно в 3% случаев. При этом наиболее часто гипонатриемия развивается у пациентов со злокачественными новообразованиями полости рта реже — глотки, гортани, синусов и слюнных желез [20]. Возможно, однако, развитие СНСАДГ и при опухолях других локализаций. Развитие гипонатриемии у онкологических больных может осложнять лечение химиотерапевтическими препаратами, в том числе винкристином, винбластином и циклофосфамидом [21]. Применение цисплатина и препаратов на его основе может приводить к развитию СТН, гиповолемии и гиповолемической гипонатриемии [22]. Использование больших объемов растворов для орошения раны при трансуретральной резекции простаты или аблации эндометрия также может вызвать транзиторную гипонатриемию [23]. Гипонатриемия в пожилом возрасте. Распространенность гипонатриемии нарастает с возрастом, о чем свидетельствует распространенность ее у пациентов в домах престарелых, составляющая 18—22,5% [24, 25]. Большинство этих пациентов имели не менее одной причины гипонатриемии, однако в 7% случаев явную причину установить не удалось. Следует отметить, что в группе пациентов старше 75 лет гипонатриемия выявлена в 43% случаев, причем все они соответствовали критериям СНСАДГ [24]. Истинная причина гипонатриемии у пожилых людей неясна, однако существует несколько гипотез, объясняющих это состояние. Вероятно, с возрастом развивается нарушение обмена натрия, близкое к СНСАДГ [24]. У пожилых пациентов имеется исходная умеренная гипонатриемия, но сопутствующие заболевания или ЛП могут ее усугубить, приводя к появлению неврологических симптомов. Определенный вклад в развитие гипонатриемии у больных этой категории вносит и снижающееся чувство жажды, что приводит к гиповолемической гипонатриемии [26]. Гипонатриемия и переломы: нарушение равновесия и прогрессирование остеопороза. Хроническая гипонатриемия приводит к развитию когнитивных нарушений, нарушению равновесия и связанных с ними падениями. При наличии бессимптомной гипонатриемии частота падений увеличивается до 21,3% против 5,4% у пациентов такого же возраста, но без нарушения обмена натрия [25]. Связь гипонатриемии и снижения минеральной плотности костной ткани (МПКТ) изучалась в ряде исследований. Известно, что в костях содержится около 1/3 всех запасов натрия, причем 40% этого натрия способно выходить в кровь. В экспериментах на животных продемонстрировано снижение МПКТ на 30% и более при продолжительной гипонатриемии. Вероятно, при хронической гипонатриемии происходит активация поступления натрия из костной ткани в кровь, что способствует резорбции костного матрикса и деминерализации кости [27]. При гипонатриемии также повышается активность остеокластов, хотя непосредственный механизм этого феномена изучен недостаточно [28]. Гипонатриемия при значительных физических нагрузках. Гипонатриемия может остро развиться при изнурительной физической нагрузке, в том числе у участников марафонов, ультрамарафонов и участников состязаний по триатлону [29]. Распространенность гипонатриемии среди марафонцев-любителей составляет 3—13% [30—32]. Показана корреляция частоты развития гипонатриемии и увеличения массы тела во время забега, вероятно, за счет неограниченного употребления питьевой воды, представляющей собой гипоосмолярный раствор. Имеются также данные о неосмотической секреции АВП при интенсивных длительных нагрузках [33]. Факторами риска развития гипонатриемии у участников марафона являются женский пол, индекс массы тела менее 20 кг/м2 и относительно невысокая скорость бега у менее подготовленных спортсменов [30]. Остро возникшая выраженная гипонатриемия может приводить к выраженным неврологическим симптомам, включая отек мозга и судороги, нейрогенному отеку легких и даже смерти. Гипонатриемия при ХСН. Гиперволемический вариант гипонатриемии в основном встречается при ХСН и циррозе печени (ЦП). Частота развития гипонатриемии при декомпенсации ХСН, по некоторым данным, достигает 38% [9, 34]. Продемонстрирована связь гипонатриемии с увеличением общей и сердечно-сосудистой смертности, а также с повторными госпитализациями и низким качеством жизни у этих больных. У больных с ХСН, кроме того, наличие гипонатриемии увеличивает сроки пребывания в стационаре и риск развития острого кардиоренального синдрома, причем неблагоприятный прогностический эффект гипонатриемии сохраняется даже при длительном наблюдении (4—5 лет) [35, 36]. При ХСН гипонатриемия развивается, несмотря на гипоосмолярность плазмы, при которой в норме синтез АВП максимально подавлен. Причиной гипонатриемии при ХСН является неосмотическая секреция АВП. При ХСН со снижением сердечного выброса уменьшается растяжение барорецепторов стенки дуги аорты и каротидного синуса, что приводит к нарушению нормального тонического ингибиторного эффекта ЦНС, опосредованного блуждающим и языкоглоточным нервами [37]. Результатом является усиление эфферентной симпатической активности, которая вызывает стимуляцию ренин-ангиотензин-альдостерновой системы и неосмотическое высвобождение АВП [38]. Развитие гипонатриемии отражает, таким образом, крайне опасное сочетание низкого сердечного выброса и максимальной активации нейрогуморальных систем, что связано с плохим прогнозом у многих кардиологических больных, в том числе с первичной легочной гипертензией, тромбоэмболией легочной артерии, а также после кардиохирургических вмешательств [39—41]. Гипонатриемия при ЦП. Основной механизм развития гипонатриемии при ЦП—неосмотическая секреция АВП, обусловленная «недозаполненностью» артериального русла вследствие системной (прежде всего внутрибрюшной) вазодилатации на фоне портальной гипертензии [42, 43]. По-видимому, основным механизмом вазодилатации при ЦП служит воздействие оксида азота [44]. Гипонатриемия у больных ЦП является предиктором формирования гепаторенального синдрома и увеличивает риск развития печеночной энцефалопатии [45]. По данным исследования с включением более 500 пациентов с ЦП, гипонатриемия оказалась мощным предиктором снижения качества жизни и фактором, ухудшающим прогноз после трансплантации печени [46—49]. Клинический подход при гипонатриемии. Диагностический алгоритм при наличии гипотонической гипонатриемии представлен на рисунке [50]. Использование этого алгоритма требует исключения изотонической гипонатриемии, возникающей при парапротеинемиях, массивной инфузии гаммаглобулинов, применении рентгеноконтрастных препаратов и тяжелой гиперлипидемии (особенно гипертриглицеридемии). Необходимо также исключить гиперосмолярные состояния (гипергликемия, инфузия маннитола, значительная положительная анионная разница). Таким образом, при всех случаях гипонатриемии желательно предварительно определить осмолярность плазмы. Осмоляльность мочи у больных с гипонатриемией обычно превышает 100 мОсм/кг. Однако у больных с первичной полидипсией и ограничением потребления поваренной соли (например, при пивной потомании) осмолярность мочи может быть низкой. Необходимо отметить, что выраженный натрийурез при приеме диуретиков может затруднить интерпретацию показателей экскреции натрия с мочой. Клинический подход к диагностике и лечению гипонатриемии. ОПН — острая почечная недостаточность; ХПН — хроническая почечная недостаточность. На следующем этапе необходимо определить общее содержание жидкости в организме. Диагностика гиперволемической гипонатриемии обычно не представляет большой сложности в связи с наличием признаков выраженной гиперволемии (отеки, асцит) при тяжелом течении ХСН или ЦП. В клинической практике дифференцировать гиповолемическую и эуволемическую гипонатриемию помогает инфузия физиологического раствора (0,5—1 л в течение 12 ч) [51]. При СНСАДГ в большинстве случаев (особенно при осмоляльности мочи более 500 мОсм/кг) введенный натрий быстро выводится, не изменяя содержание натрия в крови. В то же время при гиповолемической гипонатриемии возмещение объема нормализует гомеостаз натрия в крови. Необходимо подчеркнуть, что при эуволемической гипонатриемии в отличие от гиповолемической за счет абсолютного избытка осмотически свободной воды отмечаются более низкие уровни мочевой кислоты, мочевины и креатинина в крови. Более того, повышение экскреции мочевой кислоты и снижение ее концентрации в крови при СНСАДГ не нарушается даже в случае приема диуретиков [52, 53]. Наиболее достоверным способом диагностики СНСАДГ могло бы стать определение АВП в крови. Однако сложность и дороговизна методики делают ее малопригодной в повседневной клинической практике. В последние годы стало возможным определение содержания в крови копептина — стабильного гликопептида, образующегося из предшественника АВП при синтезе гормона в эквимолярном соотношении. Таким образом, уровень копептина косвенным образом может указывать на содержание АВП и дифференцировать первичную полидипсию от СНСАДГ [54]. При выявлении эуволемической гипонатриемии, т. е. СНСАДГ, необходимо определить его причину. В первую очередь следует отвергнуть влияние ряда ЛП, гипотиреоз и надпочечниковую недостаточность. На следующем этапе необходимо исключение наиболее частых опухолей, приводящих к СНСАДГ, с помощью компьютерной томографии органов грудной клетки и магнитно-резонансной томографии головного мозга. В части случаев, особенно у пожилых пациентов, генез СНСАДГ установить не удается. Терапия гипонатриемии. Подходы к лечению гипонатриемии зависят от ее вида (гиповолемическая, гиперволемическая или эуволемическая), длительности и выраженности симптомов. Независимо от причины гипонатриемии выраженная неврологическая симптоматика (судороги, кома, остановка дыхания) требует немедленного введения 3% гипертонического раствора хлорида натрия для уменьшения выраженности отека мозга. Рекомендуется введение 100 мл раствора болюсно, при необходимости введение можно повторить через 30 мин [55]. Таким образом, содержание натрия в крови повышается на 2—4 ммоль/л. В редких случаях 200 мл гипертонического раствора оказывается недостаточным для достижения клинического эффекта. Эффект гипертонического раствора может усилить одновременное введение фуросемида. Описано успешное применение 30—60 мл 23,4% гипертонического раствора хлорида натрия при вклинении ствола головного мозга, вызванного гипонатриемией. Такой раствор позволяет повысить уровень натрия в крови более чем на 5 ммоль/л [56]. Гипертонический раствор хлорида натрия должен приготовляться в аптеке, и редко бывает доступен. В качестве средства для экстренного повышения уровня натрия в крови можно использовать 8,4% раствор гидрокарбоната натрия. Осмолярность 8,4% раствора гидрокарбоната натрия составляет 2000 мОсм/л, что соответствует осмолярности 5,8% раствора хлорида натрия. Таким образом 50 мл 8,4% раствора гидрокарбоната натрия эквивалентен 100 мл 3% раствора хлорида натрия с точки зрения увеличения уровня натрия крови. При быстром (в течение 24—48 ч) значительном снижении уровня натрия в крови развивается тяжелая неврологическая симптоматика. При более медленном развитии гипонатриемии отмечается «малая» общемозговая симптоматика: заторможенность, дезориентация, тошнота и нарушение когнитивных функций. В этих случаях возможно быстрое прогрессирование до угрожающих жизни состояний, в связи с чем также необходимо применение гипертонического раствора. В то же время не менее опасна слишком быстрая коррекция гипонатриемии. Острое развитие тяжелой гипонатриемии может приводить к отеку мозга, однако при более длительной экспозиции электролитного расстройства (более 48—72 ч) происходит адаптация тканей за счет диффузии калия и органических высокоосмолярных соединений (миринозитол, фосфокреатин) и аминокислот (глутамин, таурин) из клеток. В последнем случае быстрое повышения уровня натрия в крови (более 10—12 ммоль/л/сут) может привести к развитию смертельного осложнения гиперкоррекции гипонатриемии — осмотической демиелинизации головного мозга, которая развивается при исходном уровне натрия менее 115—120 ммоль/л [57, 58]. Факторами риска ее развития являются сопутствующие тяжелые заболевания печени, гипоксия, гипокалиемия, кахексия, а также повышение уровня натрия в крови более 25 ммоль/л за 48 ч. Таким образом, скорость коррекции тяжелой симптоматической гипонатриемии не должна превышать 10—12 ммоль/л/сут, а у пациентов с факторами риска развития демиелинизации, хроническом алкоголизме и при исходном уровне натрия крови менее 105 ммоль/л — не более 8 ммоль/л/сут [59]. Минимальная неврологическая симптоматика при гипонатриемии: головная боль, снижение концентрации внимания, раздражительность, снижение настроения и депрессия обычно развиваются у пациентов с хроническим нарушением электролитного обмена. В этой ситуации, кроме терапии основного заболевания, достаточно ограничения употребления жидкости (при эу- и гиперволемическом варианте). Степень ограничения зависит от диуреза. Так, при суточном диурезе 1200 мл суточное потребление жидкости не должно превышать 750 мл. При таком ограничении жидкости отмечается повышение уровня натрия в крови на 1—2 ммоль/л в сутки. Эффективность ограничения жидкости снижается при более высоком отношении осмолярности мочи к осмолярности плазмы [59]. При гиперволемических вариантах гипонатриемии (при ХСН и ЦП) основой терапии является применение больших доз петлевых диуретиков с коррекцией гипокалиемии и гипомагниемии. Развитие гипонатриемии при этих заболеваниях отражает снижение «эффективного артериального кровотока», выраженные нарушения центральной гемодинамики и активацию нейрогуморальных систем. При декомпенсации ХСН развитие гипонатриемии может быть еще одним поводом для перевода пациента в отделение интенсивной терапии и назначения внутривенных инотропных препаратов или вазодилататоров. При Ц.П. в связи с повышенным риском развития гепаторенального синдрома развитие гипонатриемии делает необходимым инфузию альбумина и коллоидов, назначение вазопрессоров в соответствующих случаях, а также коррекцию дозы лактулозы, так как осмотический эффект препарата может снизить количество осмотически свободной жидкости в организме и увеличить уровень натрия в крови. С целью коррекции гипонатриемии, кроме ограничения потребления жидкости и использования гипертонических растворов, в случаях развития поражения ЦНС возможно использование демеклоциклина, флудрокортизона, мочевины, а также селективных ингибиторов рецепторов АВП, ваптанов. Демеклоциклин вызывает транзиторный нефрогенный несахарный диабет, устойчивый к вазопрессину, однако высокая токсичность препарата ограничивает его применение в широкой клинической практике [60]. Флудрокортизон — минералокортикоидный гормон, усиливающий абсорбцию натрия в почечных канальцах. Применение этого препарата в дозе 0,1—0,4 мг/сут является основой терапии гипонатриемии при надпочечниковой недостаточности, а также при сольтеряющем синдроме с развитием гиповолемической гипонатриемии, осложняющем повреждения головного мозга. Описано успешное применение препарата при СНСАДГ на фоне мелкоклеточного рака легкого [61]. Осмотический диурез с повышением экскреции осмотически не связанной воды и соответственно коррекцию гипонатриемии можно вызвать при применении мочевины (15—30 г/сут в несколько приемов). В условиях отделения реанимации и интенсивной терапии описано успешное применение мочевины через назогастральный зонд (0,5—1 г/кг/сут) [62]. Показана сходная эффективность применения мочевины и антагонистов рецепторов вазопрессина (ваптанов) при длительном применении у больных с гипонатриемией различного генеза [63]. Другой подход к терапии гипонатриемии заключается в назначении петлевых диуретиков при повышенном употреблении поваренной соли. Так как большинство случаев гипонатриемии связано с эффектом АВП, блокада его рецепторов специфическими антагонистами (ваптанами) приводит к коррекции электролитного нарушения. Первым препаратом из этой группы, нашедшим клиническое применение, является кониваптан — парентеральный блокатор рецепторов V1 и V2 [64]. Первым пероральным блокатором рецепторов V2 является толваптан. Показаны эффективность и безопасность применения толваптана при длительном применении (до 3 лет), однако первые дозы необходимо назначать в условиях стационара для предотвращения слишком быстрого повышения уровня натрия в крови [65]. Заключение Гипонатриемия является частым нарушением электролитного обмена в клинической практике терапевтов, нефрологов, онкологов, кардиологов, гепатологов, неврологов и реаниматологов. Гипонатриемия может сопровождать многие заболевания и ассоциирована с их неблагоприятным прогнозом. В то же время выраженная гипонатриемия независимо от причины может представлять угрозу для жизни пациента. О значении хронической небольшой гипонатриемии известно значительно меньше. Подходы к лечению гипонатриемии зависят от выраженности неврологических симптомов, ее длительности и вида (гипо-, эу- или гиперволемическая гипонатриемия). В большинстве случаев (за исключением гиповолемического варианта) гипонатриемия отражает избыток свободной воды, а не недостаток натрия в организме пациента в результате нарушения системы осмотического контроля и осмотически независимой секреции АДГ. Введение гипертонического раствора натрия позволяет быстро устранить тяжелые неврологические проявления этого электролитного расстройства. Однако при длительно существующей гипонатриеми лечебные мероприятия направлены на подавление осмотически независимой секреции АДГ либо на блокирование эффекта АДГ. Авторы заявляют об отсутствии конфликта интересов.
- Schrier RW. Body Water Homeostasis: Clinical Disorders of Urinary Dilution and Concentration. Journal of American Society of Nephrology. 2006;17:1820-1832. https://doi.org/10.1681/ASN.2006030240
- Наточин Ю.В. Вазопрессин: механизмы действия и клиническая физиология. Проблемыэндокринологии. 2003;2:43-50.
- Наточин Ю.В., Шахматова Е.И., Канашкина Т.А. Роль V1- и V2-рецепторов в механизме физиологического парадокса — увеличение реабсорбции осмотически свободной воды на фоне повышения диуреза. Российскийфизиологическийжурнал. 2006;10:1228-1238.
- Nielsen S, Frokiaer J, Marples D, Kwon TH, Knepper AP. Aquaporins in the kidney: from molecules to medicine. Physiological Reviews. 2002;82(1):205-244. https://doi.org/10.1152/physrev.00024.2001
- Hawkins RC. Age and gender as risk factors for hyponatremia and hypernatremia. Clinica Chimica Acta. 2003;337:169-172. https://doi.org/10.1016/j.cccn.2003.08.001
- Hoorn E, Lindemans J, Zietse R. Development of severe hyponatraemia in hospitalized patients: treatment-related risk factors and inadequate management. Nephrology Dialysis Transplantation. 2006;21(1):70-76. https://doi.org/10.1093/ndt/gfi082
- Ayus JC, Achinger SG, Arieff A. Brain cell volume regulation in hyponatremia: role of sex, age, vasopressin, and hypoxia. American Journal of Physiology — Renal Physiology. 2008;295(3):F619-F624. https://doi.org/10.1152/ajprenal.00502.2007
- Pasantes-Morales H, Franco R, Ordaz B, Ochoa LD. Mechanisms counteracting swelling in brain cells during hyponatremia. Archives of Medical Research. 2002;33(3):237-244. https://doi.org/10.1016/S0188-4409(02)00353-3
- Wald R, Jaber BL, Price LL, Upadhyay A, Madias, NE. Impact of Hospital-Associated Hyponatremia on Selected Outcomes. Archives of Internal Medicine. 2010;170(3):294-302. https://doi.org/10.1001/archinternmed.2009.513
- Chawla A, Sterns RH, Nigwekar SU, Cappuccio JD. Mortality and serum sodium: do patients die from or with hyponatremia? Clinical Journal of the American Society of Nephrology. 2011;6(5):960-965. https://doi.org/10.2215/CJN.10101110
- Chen YC, Cadnapaphornchai MA, Yang J, Summer SN, Falk S, Li C, Wang W, Schrier RW. Nonosmotic release of vasopressin and renal aquaporins in impaired urinary dilution in hypothyroidism. AJP: Renal Physiology. 2005;289(4):F672-F678. https://doi.org/10.1152/ajprenal.00384.2004
- Warner MH, Holding S, Kilpatrick ES. The effect of newly diagnosed hypothyroidism on serum sodium concentrations: a retrospective study. Clinical Endocrinology. 2006;64(5):598-599. https://doi.org/10.1111/j.1365-2265.2006.02489.x
- Schrier RW, Sharma S, Shchekochikhin D. Hyponatraemia: more than just a marker of disease severity? Nature Reviews Nephrology. 2013,9(1):37-50. https://doi.org/10.1038/nrneph.2012.246
- Rosenthal SM, Vargas GA, Fenwick RG, Huang EA, Matsuda-Abedini M, Lustig RH, Mathias RS, Portale AA, Miller WL, Gitelman SE. Nephrogenic syndrome of inappropriate antidiuresis. New England Journal of Medicine. 2005;352(18):1884-1890. https://doi.org/10.1056/NEJM200508043530520
- Diringer MN, Zazulia AR. Hyponatremia in neurologic patients: consequences and approaches to treatment. The Neurologist. 2006;12(3):117-126. https://doi.org/10.1097/01.nrl.0000215741.01699.77
- Berl T, Schrier R: Disorders of water metabolism. In: Schrier R, ed. Renal and Electrolyte Disorders. 7th ed. Philadelphia: Lippincott Williams & Wilkins; 2010:1-45.
- Burgess C, O’Donohoe A, Gill M. Agony and ecstasy: a review of MDMA effects and toxicity. European Psychiatry. 2000;15(5):287-294. https://doi.org/10.1016/s0924-9338(00)00396-5
- Gill G, Huda B, Boyd A, Skagen K, Wile D, Watson I, van Heyningen C. Characteristics and mortality of severe hyponatraemia—a hospital-based study. Clinical Endocrinology. 2006;65:246-249. https://doi.org/10.1111/j.1365-2265.2006.02583.x
- Doshi SM, Shah P, Lei X, Lahoti A, Salahudeen A. Hyponatremia in hospitalized cancer patients and its impact on clinical outcomes. American Journal of Kidney Diseases. 2012;59(2):222-228. https://doi.org/10.1053/j.ajkd.2011.08.029
- Onitilo AA, Kio E, Doi SAR. Tumor-Related Hyponatremia. Clinical Medicine & Research. 2007;5(4):228-237. https://doi.org/10.3121/cmr.2007.762
- Sorensen JB, Andersen MK, Hansen HH. Syndrome of inappropriate secretion of antidiuretic hormone (SIADH) in malignant disease. Journal of Internal Medicine. 2005;238:97-110. https://doi.org/10.1111/j.1365-2796.1995.tb00907.x
- Hamdi T, Latta S, Jallad B, Kheir F, Alhosaini MN, Patel A. Cisplatin-induced renal salt wasting syndrome. Southern Medical Journal. 2010;103(8):793-799. https://doi.org/10.1097/smj.0b013e3181e63682
- Issa MM, Young MR, Bullock AR, Bouet R, Petros JA. Dilutional hyponatremia of TURP syndrome: a historical event in the 21st century. Urology. 2004;64:298-301. https://doi.org/10.1016/j.urology.2004.03.023
- Miller M, Hecker MS, Friedlander DA. Apparent idiopathic hyponatremia in an ambulatory geriatric population. Journal of the American Geriatrics Society. 1996;44(4):404-408. https://doi.org/10.1111/j.1532-5415.1996.tb06410.x
- Renneborg B, Musch W, Vandemergel X, Manto M, Decaux G. Mild chronic hyponatremia is associated with falls, unsteadiness, and attention deficits. The American Journal of Medicine. 2006;71e1-71.e8. https://doi.org/10.1016/j.amjmed.2005.09.026
- Hoorn EJ, Rivadeneira F, van Meurs JB, et al. Mild hyponatremia as a risk factor for fractures: the Rotterdam Study. Journal of Bone and Mineral Research. 2011;26(8):1822-1828. https://doi.org/10.1002/jbmr.380
- Verbalis JG, Barsony J, Sugimura Y, et al. Hyponatremia-induced osteoporosis. Journal of Bone and Mineral Research. 2009;25(3): 554-563. https://doi.org/10.1359/jbmr.090827
- Barsony J, Sugimura Y, Verbalis JF. Osteoclast response to low extracellular sodium and the mechanism of hyponatremia-induced bone loss. Journal of Biological Chemistry. 2011;286(12): 10864-75. https://doi.org/10.1074/jbc.m110.155002
- Speedy DB, Noakes TD, Rogers IR, et al. Hyponatremia in ultradistance triathletes. Medicine & Science in Sports & Exercise. 1999; 31(6):809-815. https://doi.org/10.1097/00005768-199906000-00008
- Almond CS, Shin AY, Fortescue EB, et al. Hyponatremia among runners in the Boston Marathon. New England Journal of Medicine. 2005;352(15):1550-1556. https://doi.org/10.1056/nejmoa043901
- Knechtle B, Knechtle P, Rosemann T. Low prevalence of exercise-associated hyponatremia in male 100 km ultra-marathon runners in Switzerland. European Journal of Applied Physiology. 2011;111(6):1007-1016. https://doi.org/10.1007/s00421-010-1729-7
- Kipps C, Sharma S, Pedoe DT. The incidence of exercise-associated hyponatraemia in the London marathon. British Journal of Sports Medicine. 2011;45(1):14-19. https://doi.org/10.1136/bjsm.2009.059535
- Siegel AJ, Verbalis JG, Clement S, et al. Hyponatremia in marathon runners due to inappropriate arginine vasopressin secretion. The American Journal of Medicine. 2007;120(5):461.e11-e17. https://doi.org/10.1016/j.amjmed.2006.10.027
- Shchekochikhin DY, Schrier RW, Lindenfeld J, Price LL, Jaber BL, Madias NE. Outcome differences in community- versus hospital-acquired hyponatremia in patients with a diagnosis of heart failure. Circulation: Heart Failure. 2013;6(3):379-386. https://doi.org/10.1161/circheartfailure.112.000106
- Bettari L, Fiuzat M, Shaw LK et al. Hyponatremia and long-term outcomes in chronic heart failure-an observational study from the Duke Databank for Cardiovascular Diseases. Journal of Cardiac Failure. 2012;18(1):74-81. https://doi.org/10.1016/j.cardfail.2011.09.005
- Allen LA, Gheorghiade M, Reid KJ, et al. Identifying patients hospitalized with heart failure at risk for unfavorable future quality of life. Circulation: Cardiovascular Quality and Outcomes. 2011;4(4):389-398. https://doi.org/10.1161/circoutcomes.110.958009
- Abraham WT. Hormones and hemodynamics in heart failure. New England Journal of Medicine. 1999;19;341(8):577-585. https://doi.org/10.1056/nejm199908193410806
- Schrier RW. Body fluid regulation in health and disease: A unifying hypothesis. Annals of Internal Medicine. 1990;113:155-159. https://doi.org/10.7326/0003-4819-113-2-155
- Forfia PR, Mathai SC, Fisher MR, et al. Hyponatremia predicts right heart failure and poor survival in pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 2008;177(12):1364-1369. https://doi.org/10.1164/rccm.200712-1876oc
- Scherz N, Labarère J, Méan M, Ibrahim SA, Fine MJ, Aujesky D. Prognostic importance of hyponatremia in patients with acute pulmonary embolism. American Journal of Respiratory and Critical Care Medicine. 2010;182(9):1178-1183. https://doi.org/10.1164/rccm.201003-0481oc
- Crestanello JA, Phillips G, Firstenberg MS, et al. Preoperative hyponatremia predicts outcomes after cardiac surgery. Journal of Surgical Research. 2013;181(1):60-66. https://doi.org/10.1016/j.jss.2012.06.004
- Gines P, Schrier RW. Renal failure in cirrhosis. New England Journal of Medicine. 2009;24;361(13):1279-1290. https://doi.org/0.1056/nejmra0809139
- Gines P, Berl T, Bernardi M, et al. Hyponatremia in cirrhosis: from pathogenesis to treatment. Hepatology. 1998;28(3):851-864. https://doi.org/10.1002/hep.510280337
- Martin PY, Gines P, Schrier RW. Nitric oxide as a mediator of hemodynamic abnormalities and sodium and water retention in cirrhosis. New England Journal of Medicine. 1998;339:533-541. https://doi.org/10.1056/nejm199808203390807
- Guevara M, Baccaro ME, Rнos J et al. Risk factors for hepatic encephalopathy in patients with cirrhosis and refractory ascites: relevance of serum sodium concentration. Liver International. 2010;30(8):1137-1142. https://doi.org/10.1111/j.1478-3231.2010.02293.x
- Sola E, Watson H, Guevara M, et al. Factors related to quality of life in patients with cirrhosis and ascites. Relevance of serum sodium concentration and leg edema. Journal of Hepatology. 2012;57(6):1199-1206. https://doi.org/10.1016/j.jhep.2012.07.020
- Hackworth WA, Heuman DM, Sanyal AJ, et al. Effect of hyponatraemia on outcomes following orthotopic liver transplantation. Liver International. 2009;29(7):1071-1077. https://doi.org/10.1111/j.1478-3231.2009.01982.x
- Dawwas MF, Lewsey JD, Neuberger JM, et al . The impact of serum sodium concentration on mortality after liver transplantation: a cohort multicenter study. Liver Transplantation. 2007;13:1115-1124. https://doi.org/10.1002/lt.21154
- Yun BC, Kim WR, Benson JT, et al. Impact of pretransplant hyponatremia on outcome following liver transplantation. Hepatology. 2009;49:1610-1615. https://doi.org/10.1002/hep.22846
- Fenske W, Maier SK, Blechschmidt A, Allolio B, Störk S. Utility and limitations of the traditional diagnostic approach to hyponatremia: a diagnostic study. The American Journal of Medicine. 2010;123(7):652-657. https://doi.org/10.1016/j.amjmed.2010.01.013
- Ellison DH, Berl T. Clinical practice. The syndrome of inappropriate antidiuresis. New England Journal of Medicine. 2007;356(20):2064-2072. https://doi.org/10.1056/nejmcp066837
- Decaux G, Musch W. Clinical laboratory evaluation of the syndrome of inappropriate secretion of antidiuretic hormone. Clinical Journal of the American Society of Nephrology. 2008;3(4): 1175-1184. https://doi.org/10.2215/cjn.04431007
- Fenske W, Störk S, Koschker AC, et al. Value of fractional uric acid excretion in differential diagnosis of hyponatremic patients on diuretics. The Journal of Clinical Endocrinology & Metabolism. 2008;93(8):2991-2997. https://doi.org/10.1210/jc.2008-0330
- Fenske W, Störk S, Blechschmidt A, Maier SG, Morgenthaler NG, Allolio B. Copeptin in the differential diagnosis of hyponatremia. The Journal of Clinical Endocrinology & Metabolism. 2009; 94(1):123-129. https://doi.org/10.1210/jc.2008-1426
- Moritz ML, Ayus JC. 100 cc 3% sodium chloride bolus: a novel treatment for hyponatremic encephalopathy. Metabolic Brain Disease. 2010;25(1):91-96. https://doi.org/10.1007/s11011-010-9173-2
- Koenig MA, Bryan M, Lewin JL 3rd, Mirski MA, Geocadin RG, Stevens RD. Reversal of transtentorial herniation with hypertonic saline. Neurology. 2008;70(13):1023-1029. https://doi.org/10.1212/01.wnl.0000304042.05557.60
- Sterns RH, Cappuccio JD, Silver SM, Cohen EP. Neurologic sequelae after treatment of severe hyponatremia: a multicenter perspective. Journal of the American Society of Nephrology. 1994;4(8):1522-1530.
- Cluitmans FH, Meinders AE. Management of severe hyponatremia: rapid or slow correction? The American Journal of Medicine. 1990;88(2):161-166. https://doi.org/10.1016/0002-9343(90)90467-r
- Verbalis JG, Goldsmith SR, Greenberg A, Schrier RW, Sterns RH. Hyponatremia treatment guidelines 2007: expert panel recommendations. The American Journal of Medicine. 2007; 120(11):S1-21. https://doi.org/10.1016/j.amjmed.2007.09.001
- Miller PD, Linas SL, Schrier RW. Plasma demeclocycline levels and nephrotoxicity. Correlation in hyponatremic cirrhotic patients. JAMA. 1980;243:2513-2515. https://doi.org/10.1001/jama.243.24.2513
- Jaal J, Jõgi T, Altraja A. Small Cell Lung Cancer Patient with Profound Hyponatremia and Acute Neurological Symptoms: An Effective Treatment with Fludrocortisone. Case Reports in Oncological Medicine. 2015:1-4. https://doi.org/10.1155/2015/286029
- Decaux G, Andres C, Gankam Kengne F, Soupart A. Treatment of euvolemic hyponatremia in the intensive care unit by urea. Critical Care. 2010;14(5):R184. https://doi.org/10.1186/cc9292
- Soupart A, Coffernils M, Couturier B, Gankam-Kengne F, Decaux G. Efficacy and Tolerance of Urea Compared with Vaptans for Long-Term Treatment of Patients with SIADH. Clinical Journal of the American Society of Nephrology. 2012;7(5):742-747. https://doi.org/10.2215/cjn.06990711
- Verbalis JG, Zeltser D, Smith N, Barve A, Andoh M. Assessment of the efficacy and safety of intravenous conivaptan in patients with euvolaemic hyponatraemia: subgroup analysis of a randomized, controlled study. Clinical Endocrinology. 2008;69(1):159-168. https://doi.org/10.1111/j.1365-2265.2007.03149.x
- Berl T, Quittnat-Pelletier F, Verbalis JG, et al. SALTWATER Investigators. Oral tolvaptan is safe and effective in chronic hyponatremia. Journal of the American Society of Nephrology. 2010;21(4): 705-712. https://doi.org/10.1681/asn.2009080857
Views
Abstract — 944
PDF (Russian) — 149
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.
МКБ-10 код E22.2 | Синдром неадекватной секреции антидиуретического гормона
ICD-10
ICD-10 is the 10th revision of the International Statistical Classification of Diseases and Related Health Problems (ICD), a medical classification list by the World Health Organization (WHO).
It contains codes for diseases, signs and symptoms, abnormal findings, complaints, social circumstances, and external causes of injury or diseases.
ATC
The Anatomical Therapeutic Chemical (ATC) Classification System is used for the classification of active ingredients of drugs according to the organ or system on which they act and their therapeutic, pharmacological and chemical properties.
It is controlled by the World Health Organization Collaborating Centre for Drug Statistics Methodology (WHOCC).
DDD
The defined daily dose (DDD) is a statistical measure of drug consumption, defined by the World Health Organization (WHO).
It is used to standardize the comparison of drug usage between different drugs or between different health care environments.
Синдром несоответствующей секреции антидиуретического гормона (SIADH): основы практики, общие сведения, патофизиология
Автор
Christie P Thomas, MBBS, FRCP, FASN, FAHA Профессор, кафедра внутренней медицины, отделение нефрологии, отделения педиатрии, акушерства и гинекологии, медицинский директор, программа трансплантации почек и почек / поджелудочной железы, Больницы и клиники Университета Айовы
Christie P Thomas, MBBS, FRCP, FASN, FAHA является членом следующих медицинских обществ: Американского колледжа врачей, Американской кардиологической ассоциации, Американского общества нефрологии, Королевского колледжа врачей
Раскрытие информации: не подлежит разглашению.
Специальная редакционная коллегия
Элеонора Ледерер, доктор медицинских наук, FASN Профессор медицины, руководитель нефрологического отделения, директор программы обучения нефрологии, директор клиники метаболических камней, Программа лечения заболеваний почек, Медицинская школа Университета Луисвилля; Консультант, Госпиталь по делам ветеранов Луисвилля
Элеонора Ледерер, доктор медицины, FASN является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской федерации медицинских исследований, Американского общества биохимии и молекулярной биологии, Американского общества костей. и исследования минералов, Американское общество нефрологии, Американское общество трансплантологии, Международное общество нефрологов, Медицинская ассоциация Кентукки, Национальный фонд почек, Phi Beta Kappa
. консультант или попечитель: Американского общества нефрологов
Полученный доход в размере 250 долларов США от: Healthcare Quality Strategies, Inc
Получил грант / средства на исследования от Департамента по делам ветеранов для исследований; Получал зарплату от Американского общества нефрологов за должность в совете; Получал зарплату от Университета Луисвилля за работу; Получал зарплату от врачей Университета Луисвилля за работу; Получена оплата по контракту от Американского института врачей для продвинутых профессиональных исследований, LLC для независимого подрядчика; Получена оплата по контракту от Healthcare Quality Strategies, Inc для независимого продолжения.
Главный редактор
Ветихи Батуман, доктор медицины, FASN Хубервальд, профессор медицины, отделение нефрологии и гипертонии, временный заведующий кафедрой медицины Деминга, медицинский факультет Тулейнского университета
Вечихи Батуман, доктор медицины, FASN является членом следующих медицинских обществ: Американский колледж врачей, Американское общество гипертонии, Американское общество нефрологов, Международное нефрологическое общество, Южное общество клинических исследований
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Мони Фраер, MD, MHCDS, FACP, FASN Доцент, Отделение нефрологии, Медицинский факультет, Больницы и клиники Университета Айовы; Штатный врач, Медицинский центр по делам ветеранов Айова-Сити
Раскрытие: Ничего не говорится.
Благодарности
Говард А. Бессен, доктор медицины Профессор медицины, отделение неотложной медицины, Медицинская школа Калифорнийского университета в Лос-Анджелесе; Программный директор, Медицинский центр Harbour-UCLA
Говард Бессен, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей скорой помощи
Раскрытие: Ничего не нужно раскрывать.
Кинан Бора, доктор медицинских наук, научный сотрудник, медицинская токсикология, Детройтский медицинский центр; Лечащий врач, Служба неотложной помощи Медицинского центра, Детройт
Кинан Бора, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии клинической токсикологии, Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американского колледжа медицинской токсикологии и Американской медицинской ассоциации
.
Раскрытие: Ничего не нужно раскрывать.
Meher Chaudhry, MD Главный ординатор, Отделение неотложной медицины, Детройтская приемная больница, Университетский поликлиник
Раскрытие: Ничего не нужно раскрывать.
Сонали Дешмук, консультант MBBS , нефрология Омахи, Небраска
Сонали Дешмук, MBBS, является членом следующих медицинских обществ: Американское общество нефрологов
Раскрытие: Ничего не нужно раскрывать.
R obert J Ferry Jr, MD Заведующий отделением детской эндокринологии и метаболизма детской больницы Le Bonheur; Профессор кафедры педиатрии Научного центра здоровья Университета Теннесси в Мемфисе; Санкт-ПетербургДетская исследовательская больница Джуда, Мемфис, Теннесси; Бригадный хирург, 36-я бригада жизнеобеспечения армии США; Адъюнкт-профессор кафедры детской хирургии, Университет короля Сауда, Эр-Рияд, Саудовская Аравия
Роберт Дж. Ферри-младший, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американской диабетической ассоциации, Американской медицинской ассоциации, Общества эндокринологов, Общества педиатрических эндокринологов Лоусона-Уилкинса, Общества педиатрических исследований и Техасского педиатрического общества
.
Раскрытие информации: Выступление и обучение бюро спикеров Nutropin Honoraria; Genotropin Speakers Bureau Honoraria Выступление и обучение; Эли Лилли и Ко.Грант / исследовательские фонды Исследователь; MacroGenics, Inc. Грант / исследовательские фонды Исследователь; Ipsen, S.A. (ранее Tercica, Inc.) Грант / исследовательские фонды Исследователь; НовоНордиск С.А. Грант / исследовательские фонды Исследователь; Диамид Исследователь
Стивен Кемп, доктор медицины, доктор философии Профессор кафедры педиатрии, отделение детской эндокринологии, Медицинский колледж Университета Арканзаса и Детская больница Арканзаса
Стивен Кемп, доктор медицины, доктор философии является членом следующих медицинских обществ: Американская академия педиатрии, Американская ассоциация клинических эндокринологов, Американское педиатрическое общество, Эндокринное общество, Phi Beta Kappa, Южная медицинская ассоциация и Южное общество педиатрических исследований
.
Раскрытие: Ничего не нужно раскрывать.
Элеонора Ледерер, доктор медицины Профессор медицины, начальник нефрологического отделения, директор программы обучения нефрологии, директор клиники метаболических камней, Программа лечения заболеваний почек, Медицинская школа Университета Луисвилля; Консультант, Госпиталь по делам ветеранов Луисвилля
Элеонора Ледерер, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской федерации медицинских исследований, Американского общества биохимии и молекулярной биологии, Американского общества исследований костей и минералов, Американского общества нефрологов, Американского общества. Общество трансплантологии, Международное общество нефрологов, Медицинская ассоциация Кентукки, Национальный фонд почек и Phi Beta Kappa
Раскрытие информации: Грант Департамента по делам ветеранов / исследовательские фонды Исследования
Линн Липтон Левицки, доктор медицины , начальник педиатрического эндокринного отделения, Массачусетская больница общего профиля; Доцент педиатрии Гарвардской медицинской школы
Линн Липтон Левицки, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская педиатрическая академия, Американская диабетическая ассоциация, Американское педиатрическое общество, Эндокринное общество, Детское эндокринное общество Лоусона-Уилкинса и Общество педиатрических исследований
.
Раскрытие информации: грант Pfizer / исследовательские фонды P.Я.; Tercica Грант / исследовательские фонды Другое; Эли Лили Грант / ИП исследовательских фондов; Грант НовоНордиск / исследовательские фонды PI
Чике Магнус Нзеруэ, MD Заместитель декана по клиническим вопросам, заместитель председателя кафедры внутренней медицины Медицинского колледжа Мехарри
Чике Магнус Нзеруэ, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американского колледжа врачей, Американского колледжа врачей-Американского общества внутренней медицины, Американского общества нефрологов и Национального фонда почек
Раскрытие: Ничего не нужно раскрывать.
Jose F Pascual-y-Baralt, MD Начальник отделения детской нефрологии, Военный педиатрический центр Сан-Антонио; Профессор-клиницист, кафедра педиатрии, кампус медицинских наук
Техасского университета
Хосе Ф. Паскуаль-и-Баральт, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества нефрологов, Американского общества детской нефрологии, Ассоциации военных хирургов США и Международного общества нефрологов
.
Раскрытие: Ничего не нужно раскрывать.
Александр Рафаилов, MD Штатный врач, Отделение неотложной медицины, Государственный университет Нью-Йорка Нижний штат / Больница округа Кингс
Раскрытие: Ничего не нужно раскрывать.
Арлан Л. Розенблум, доктор медицины Адъюнкт-почетный профессор педиатрии Университета Флориды; Член Американской академии педиатрии; Сотрудник Американского колледжа эпидемиологии
Арлан Л. Розенблум, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американского эпидемиологического колледжа, Американского педиатрического общества, Эндокринного общества, Флоридского педиатрического общества, Детского эндокринного общества Лоусона-Уилкинса и Общества педиатрических исследований
Раскрытие: Ничего не нужно раскрывать.
Erik D Schraga, MD Консультант, Отделение неотложной медицины, Mills-Peninsula Emergency Medical Associates; Консультант, Permanente Medical Group, Kaiser Permanente, Медицинский центр Санта-Клара
Раскрытие: Ничего не нужно раскрывать.
Ричард Х. Синерт, DO доцент кафедры неотложной медицины, клинический доцент медицины, директор по исследованиям Медицинского колледжа Нью-Йоркского государственного университета; Консультанты, отделение неотложной медицины, госпиталь округа Кингс
Ричард Х. Синерт, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Редактор аптек, Medscape
Раскрытие: Ничего не нужно раскрывать.
Синдром несоответствующей секреции антидиуретического гормона (SIADH)
Синдром несоответствующей секреции антидиуретического гормона возникает, когда вырабатывается чрезмерный уровень антидиуретических гормонов (гормонов, которые помогают почкам и организму сохранять правильное количество воды).Синдром заставляет организм удерживать воду и снижать определенный уровень электролитов в крови (например, натрия). SIADH редко встречается у детей.
SIADH обычно возникает у людей с сердечной недостаточностью или людей с заболеванием гипоталамуса (часть мозга, которая работает непосредственно с гипофизом для выработки гормонов). В других случаях определенный рак (в другом месте тела) может продуцировать антидиуретический гормон, особенно некоторые виды рака легких. Другие причины могут включать следующие:
Менингит (воспаление мозговых оболочек, оболочек, покрывающих головной и спинной мозг)
Энцефалит (воспаление головного мозга)
Опухоли головного мозга
Психоз
Заболевания легких
Травма головы
Синдром Гийена-Барре (обратимое заболевание, поражающее нервы в организме.СГБ может вызвать мышечную слабость, боль и даже временный паралич мышц лица, груди и ног. Паралич грудных мышц может привести к проблемам с дыханием.)
Определенные лекарства
Повреждение гипоталамуса или гипофиза во время операции
Дефицит гормонов щитовидной железы или паращитовидных желез
72
72 ВИЧ-инфекция
72 причины
Каждый человек может испытывать симптомы по-разному.Симптомы в более тяжелых случаях SIADH могут включать:
Тошнота или рвота
Судороги или тремор
Подавленное настроение, нарушение памяти
Раздражительность, например, раздражительность
Судороги
Ступор или кома
Изменения личности, такие как раздражительность
, спутанность сознания и галлюцинации
Симптомы SIADH могут напоминать другие проблемы или заболевания.Всегда консультируйтесь с врачом вашего ребенка для постановки диагноза.
В дополнение к полной истории болезни и физическому обследованию для подтверждения диагноза SIADH необходимо будет выполнить анализы крови и мочи для измерения натрия, калия и осмоляльности (концентрации раствора в крови и моче).
Конкретное лечение SIADH будет определено вашим врачом на основании:
вашего возраста, общего состояния здоровья и истории болезни
Степень заболевания
Ваша переносимость определенных лекарств, процедур или методов лечения
Ожидания в отношении течения болезни
Ваше мнение или предпочтение
Наиболее часто назначаемым лечением SIADH является ограничение жидкости и воды.Если состояние хроническое, ограничение жидкости может быть постоянным. Лечение также может включать:
Определенные лекарства, подавляющие действие АДГ (также называемого вазопрессином)
Хирургическое удаление опухоли, которая производит АДГ
Другие лекарства, помогающие регулировать объем жидкости в организме
Синдром несоответствующей секреции антидиуретического гормона (SIADH): Opti
Введение
Синдром неадекватной секреции антидиуретического гормона (SIADH) — это состояние, характеризующееся гипотонической и эуволемической гипонатриемией наряду с гиперосмолярностью мочи, возникающей в результате высвобождения антидиуретического гормона (ADH) в отсутствие адекватных стимулов.
Этот термин был впервые использован в 1957 году, когда Шварц и др. Описали гипонатриемию, вызванную неспособностью почек сберегать натрий, у двух пациентов, страдающих опухолью легкого. 1
Интерес и знания об этом клиническом состоянии значительно возросли в последние годы, настолько, что это оправдывает изменение его названия с SIADH на SIAD (синдром несоответствующего антидиуреза), в связи с тем, что не у всех пораженных пациентов наблюдается увеличение уровень циркулирующего АДГ в результате повышенного выброса гипофизом или эктопической продукции.Аномальная активность АДГ в почечных рецепторах или конститутивная активация рецептора вазопрессина V2 (V2R) были идентифицированы как причины несоответствующего антидиуреза с нормальным или неизмеримым уровнем гормона. 2
Гидросолевой баланс поддерживается в физиологических условиях с помощью тонкого регулирующего механизма, который объединяет гипоталамус, нейрогипофиз, почки и гормоны; среди них ADH является наиболее важным. Этот гормон, также известный как аргинин-вазопрессин (AVP), синтезируется в супраоптических и паравентрикулярных ядрах гипоталамуса, а затем сохраняется в гипофизе посредством аксонального транспорта.Отсюда он может высвобождаться как следствие осмотических и неосмотических раздражителей. 3
Среди первых наиболее важным является эффективное осмотическое давление плазмы: когда оно достигает порогового значения 284 мОсм / кг или выше, уровень АДГ начинает расти. В последней группе описаны гиповолемия, а также тошнота, рвота, стресс, лекарства, гипогликемия, послеоперационная боль и другие ноцицептивные раздражители. На сегодняшний день известно три рецептора AVP: V1a, V1b (V3) и V2. Рецепторы V1 ответственны за сосудистые эффекты ADH, в частности, их связывание может привести к гипертоническим эффектам, вызывающим сокращение гладкомышечных клеток; Рецепторы V3 размещаются в гипофизе, и при активации уровень адренокортикотропного гормона начинает повышаться.Наконец, V2R обнаруживаются в эндотелиальных клетках и на основных клетках мембраны собирательных каналов почек. Именно из-за эффектов V2Rs ADH получил свое название. 4 Конечными эффектами этого связывания являются усиленный синтез и демонстрация водных каналов аквапорина-2 (AQP-2) на мембране собирающего канала; следовательно, вода пассивно проходит в гипертонический почечный интерстиций, что в конечном итоге приводит к концентрации мочи, реабсорбции воды и снижению осмоляльности плазмы.
Следовательно, патофизиологическая основа SIADH (или SIAD) состоит в увеличении концентрации воды в организме из-за повышенного потребления воды, что преодолевает способность почечного разжижения мочи, а также нарушение регуляции ADH. Однако в некоторых случаях подавленная способность связывания V2R вместе со снижением экспрессии AQP-2 в почках реализует так называемый феномен «ухода от антидиуреза» как попытку нормализовать и, в конечном итоге, увеличить натриемию, объем мочи и почечную воду. потеря. 5,6
Перечислено множество причин SIADH (Таблица 1).
Таблица 1 Причины SIADH |
SIADH является наиболее важной причиной гипонатриемии у онкологических и госпитализированных пациентов. 7,8
Он обычно обнаруживается у пациентов с раком легких, в частности мелкоклеточным раком легкого (SCLC): распространенность в этой группе оценивается в 7–16%, и кажется, что 70% всех SIADH, вызванных злокачественными новообразованиями, связано с SCLC. 9 Заболеваемость другими видами рака легких ниже (0,4–2%). 10
У онкологических больных SIADH представляет собой паранеопластический синдром: по этой причине клинические признаки, связанные с гипонатриемией, не обязательно связаны с бременем опухоли или местами метастазирования. Причину следует искать в эктопической секреции AVP раковыми клетками: регресс опухоли из-за успешного лечения может нормализовать концентрации AVP в плазме.
При опухолях головы и шеи частота SIADH составляет 3% 11 ; К другим злокачественным новообразованиям, связанным с SIADH, относятся саркомы, кожный, гинекологический, рак груди, урологический, гастроэнтерологический и гематологический рак. 12
Некоторые химиотерапевтические препараты также связаны с SIADH: пациенты, получавшие алкалоиды барвинка, могут испытывать гипонатриемию из-за несоответствующего осморецепторного контроля секреции вазопрессина, вызванного винкристином и, что менее важно, винбластином: 13 Периферическая нейропатия, часто описываемая у этих пациентов, может быть косвенный признак их неврологической токсичности.
Кроме того, циклофосфамид может приводить к SIADH по двойному механизму: действуя на высвобождение AVP нервной центральной системы и усиливая его действие на рецепторы мембран собирательных протоков почек.Эти эффекты усиливаются за счет обильного приема воды пациентами, принимающими циклофосфамид; Обычно это рекомендуется для минимизации риска геморрагического цистита, но может привести к опасной для жизни водной интоксикации.
Среди соединений платины цисплатин больше связан с гипонатриемией, чем карбоплатин. Этот препарат также действует посредством двойного механизма: стимуляция секреции вазопрессина и, следовательно, приводящая к SIADH, и вмешательство в реабсорбцию натрия, повреждающую почечные канальцы (нефропатия с потерей соли). 14
Описаны даже таргетные методы лечения, особенно антиангиогенные препараты, для определения гипонатриемии: в частности, пациенты с солидными опухолями, получавшие препараты против VEGFR, — это те, у которых частота низкой концентрации натрия наиболее высока. 15 Точный механизм, лежащий в основе повышенной частоты гипонатриемии у этих пациентов, до сих пор неизвестен: Khaja et al сообщили, что возможное объяснение может быть усиленным высвобождением вазопрессина из-за низкой концентрации растворенных веществ в папиллярных сосочках при высокой осмоляльности мочи. 16
Ингибиторы иммунных контрольных точек произвели революцию в мире лечения рака. Наиболее существенными побочными эффектами этих препаратов являются заболевания, связанные с иммунитетом, а гипонатриемия, по-видимому, связана с гипофизитом. 17
Даже паллиативные препараты (нестероидные противовоспалительные препараты, селективные ингибиторы обратного захвата серотонина, опиоидные анальгетики), противосудорожные, антипсихотические, противодиабетические и запрещенные препараты (например, МДМА) могут быть связаны с SIADH, либо увеличивая высвобождение AVP, либо усиливая его действие в сборный воздуховод.
Классически несоответствующая секреция AVP может также сопровождать легочные заболевания (такие как бактериальная или вирусная пневмония, легочный абсцесс, туберкулез, аспергиллез, астма и муковисцидоз) и расстройства нервной системы (такие как инфекции, субдуральная гематома или субарахноидальное кровоизлияние). Точно так же боль, тошнота, общая анестезия и стресс являются нетрадиционными стимулами для секреции вазопрессина гипофизом.
Другие причины бывают идиопатическими и преходящими (гипонатриемия, связанная с физической нагрузкой).
Наследственные заболевания заслуживают особого упоминания: они могут быть обнаружены у младенцев и взрослых с гипонатриемией и недостаточным разжижением мочи, в отличие от SIADH. У этих пациентов уровни AVP в плазме неопределяемы или очень низкие, так как они связаны с мутациями, вызывающими увеличение функции гена V2R. Затем конститутивно активированный рецептор вызывает реабсорбцию воды в собирающем канале посредством активации рецепторов AQP-2. 2
Клинические проявления
Клиническая картина SIADH связана как с тяжестью гипонатриемии, так и с быстротой начала, определяя острую и хроническую форму гипонатриемии.Симптомы отражают попытку мозга предотвратить снижение концентрации натрия в сыворотке крови путем миграции избыточного количества воды из внеклеточного во внутриклеточное пространство, следуя осмотическому градиенту и вызывая отек мозга. Когда увеличение количества воды в головном мозге превышает способность черепа сдерживать расширение мозга, это вызывает тенториальную грыжу и, как следствие, смерть от остановки дыхания и / или сосудистого церебрального повреждения.
Это обычно происходит, когда гипонатриемия развивается быстро, и у мозга слишком мало времени, чтобы приспособиться к этой гипотонической среде.Если пациент выживает, центральная нервная система выполняет процесс адаптации, который заключается в перемещении растворенных веществ, в основном калия и небольших молекул, из клеток мозга во внеклеточное пространство, пытаясь восстановить объем мозга. Этот процесс осуществляется за 12–48 часов, поэтому порог в 48 часов используется для различения острой (<48 часов) и хронической (> 48 часов) гипонатриемии. 19
Неврологические симптомы могут быть обнаружены у пациентов с хронической гипонатриемией: при уровне натрия от 135 до 125 мг-экв / л (легкая гипонатриемия) пациенты могут протекать бессимптомно или могут жаловаться на тошноту, рвоту, головокружение.Кроме того, нестабильность внимания и походки особенно высока у пожилых людей. 20 Наконец, у них может быть более частый остеопороз и переломы костей по сравнению с пациентами с нормонатриемией. 21–23
Следовательно, когда концентрация натрия ниже, пациенты могут обвинять в потере аппетита, головной боли, раздражительности, дефиците внимания, спутанности сознания и дезориентации. 24
Наконец, гипонатриемия даже коррелирует с повышенным риском смерти. 25,26
Диагностика и дифференциальная диагностика
Гипонатриемия чаще всего выявляется при обычных лабораторных исследованиях; однако его можно заподозрить у пациентов, жалующихся на неврологические симптомы, вызывающие воспоминания.Поэтому необходимо быстро провести дифференциальную диагностику, чтобы обеспечить правильное лечение для каждого пациента.
Определение осмоляльности плазмы — первый шаг в диагностике гипонатриемии. К сожалению, быстрое измерение осмоляльности не всегда доступно. Его можно рассчитать по следующей формуле: 2 × Na (ммоль / л) + глюкоза (мг / дл) / 18 + мочевина (мг / дл) / 2,8. 27
При нормальной или высокой осмоляльности (> 280 мОсм / кг) необходимо выявить чрезмерную концентрацию осмотически активных растворенных веществ в плазме. 7 Они могут быть экзогенными или эндогенными растворенными веществами, которые не могут проходить через клеточную мембрану, оставаясь ограниченными компартментом внеклеточной жидкости и приводя к осмотическому перемещению воды из внутриклеточной во внеклеточную среду.
Прежде всего, необходимо проверить гипергликемию и исключить высокую концентрацию маннита: глюкоза и маннитол являются наиболее важными эффективными осмолями. С другой стороны, мочевина и спирт могут легко пересекать клеточную поверхность, влияя на измеряемую осмоляльность, но не на тоничность.По этой причине их называют «неэффективными осмолями»: они могут повышать осмоляльность сыворотки, но не вызывают гипонатриемии. Также следует исключить псевдогипонатриемию, зависящее от метода снижение уровня натрия в сыворотке: она может возникать при высоких концентрациях липидов или белков, например, при тяжелой гипертриглицеридемии и множественной миеломе. Это может помешать точному измерению натрия. 28
У пациентов с гипотонической гипонатриемией внеклеточный объем (ECV) следует оценивать с помощью истории болезни, физического осмотра и лабораторных тестов.Частыми симптомами и признаками являются рвота или диарея, ортостатическая гипотензия, тахикардия, плохой тургор кожи и сухость слизистых оболочек. По этим признакам можно определить гиповолемию. Повышение креатинина, азота мочевины в крови, гематокрита и уровня мочевой кислоты — типичные признаки у этих пациентов, но они также неспецифичны. На них может влиять, например, диетическое питание. Более полезно измерение почечной потери натрия: если концентрация мочи [Na + ]> 30 мэкв / л, это наводит на мысль о нефропатиях или о применении диуретиков 29 ; вместо этого, точечная моча [Na +] <10 мэкв / л указывает на внепочечную потерю натрия. 30
И наоборот, асцит, подкожный отек и отек легких — все это признаки увеличения ECV, которые обычно встречаются при гиперволемической гипонатриемии. Сердечная недостаточность, цирроз и хроническая болезнь почек, а также острое повреждение почек и нефротический синдром — все это тяжелые состояния, сопровождающиеся либо чрезмерной секрецией AVP, либо измененными внутрипочечными факторами, не позволяющими адекватно вывести свободную воду. 29
При отсутствии истории болезни пациентов, у которых нет симптомов или признаков, указывающих на уменьшение или увеличение объема, следует считать эуволемией.Эуволемическая гипонатриемия возникает в контексте относительного или абсолютного избытка воды в организме и может быть отнесена к нескольким заболеваниям.
Клиницистам необходимо знать осмоляльность мочи на выборочном образце мочи: если она <100 мОсм / кг H 2 O, это означает максимальное разбавление мочи, в основном вызванное чрезмерным потреблением воды (или пива) в сочетании с низким потреблением растворенных веществ, как в потомстве. 31
Если осмоляльность мочи ≥100 мОсм / кг H 2 O, необходимо учитывать другие состояния: гипотиреоз, дефицит глюкокортикоидов и, наиболее часто, SIADH.
Диагноз
SIADH по-прежнему является диагнозом исключения, и критерии те же самые, первоначально описанные Барттером и Шварцем в 1957 году. Все они перечислены в таблице 2. 32
Таблица 2 Критерии диагностики SIADH |
Церебральное солевое истощение (CSW), состояние, вызывающее гипонатриемию у пациентов с заболеваниями центральной нервной системы, заслуживает особого упоминания. Это в основном описывается после аневризматического субарахноидального кровоизлияния, но может наблюдаться после травмы головного мозга, инфекционных заболеваний, рака (глиома, метастатическая карцинома) и даже после операции по поводу опухоли гипофиза или акустической невриномы.Патофизиология не ясна: некоторые авторы указывают пальцем на натрийуретический пептид мозга, выделяющийся после повреждения мозга и подавляющий реабсорбцию натрия почками. Другие подчеркивают, что поврежденный гипоталамус не может улучшить реабсорбцию натрия и высвобождение ренина. 33
Отличить CSW от SIADH важно и сложно из-за противоположных вариантов лечения. Оба заболевания имеют схожие лабораторные данные (пониженная осмоляльность сыворотки, осмоляльность мочи> 100 мОсм / кг, концентрация натрия в моче> 30 ммоль / л), но ECV отличается: пациент с SIADH является эуволемическим или гиперволемическим из-за наличия свободной воды, и наоборот. у одного с CSW появляется гиповолемия.
Этот факт выражается в различном ведении: пациенты CSW должны лечиться в основном с помощью восполнения запасов растворенных веществ и часто флудрокортизона, в то время как пациенты с SIADH должны лечиться с ограничением жидкости. 34
SIADH Лечение и менеджмент
Несколько десятилетий назад внимание было сосредоточено на основном заболевании или лекарстве. Это считалось лучшим доступным вариантом лечения SIADH. Если устранить основную причину было невозможно, дополнительные варианты лечения включали: ограничение жидкости, введение натрия с помощью пероральных препаратов или, в более тяжелых случаях, непрерывную инфузию или болюс гипертонического (3%) физиологического раствора.
Другие подходы к лечению SIADH предполагали тетрациклин, демеклоциклин и литий. Первые применялись с 1970 г. с ограниченными результатами и плохой доступностью, вторым препятствовали потенциально значительные побочные эффекты и сомнительная эффективность. 35–37
Мочевина представляет собой потенциальную стратегию лечения второй линии вместе с комбинацией низких доз пероральных препаратов диуретика натрия хлорида. 32 Однако этому препарату препятствует низкая комплаентность из-за побочных эффектов со стороны желудочно-кишечного тракта, таких как тошнота и спорная эффективность, несмотря на доступную стоимость.
Для обеспечения оптимального лечения SIADH такие факторы, как этиология, время начала, тяжесть, симптомы и статус внеклеточного объема, должны определять способ коррекции.
У бессимптомных пациентов с легкой гипонатриемией ограничение жидкости (около 500–800 кубических сантиметров в день) следует рассматривать как первый вариант постепенной нормализации уровня натрия. Однако этот подход не работает из-за плохого соблюдения пациентом режима лечения и требует времени, чтобы быть эффективным в дополнение к мониторингу функции почек; кроме того, с ним следует осторожно обращаться у онкологических больных с повышенным риском гиповолемических ситуаций и нуждающихся в химиотерапевтических инфузиях. 38–40
По этой теме Furst et al. Предложили формулу, основанную на соотношении электролитов мочи / плазмы, для ограничения жидкости свинцом и облегчения идентификации тех пациентов, которые будут лучше реагировать на это. 40 Время начала — еще один аспект, которым следует руководствоваться при ведении SIADH. В связи с этим врачи должны рассматривать острую, хроническую и рецидивирующую гипонатриемию как отдельные состояния, требующие различного лечения.
Во многих случаях хронической гипонатриемии, особенно у бессимптомных пациентов, выявление и устранение основной причины этого электролитного дисбаланса может быть даже более эффективным, чем повышение концентрации натрия в сыворотке с помощью лечения.
Настой гипертонического раствора (3%) настоятельно рекомендуется в острых ситуациях с неврологическими симптомами. В рекомендациях рекомендуется болюсное введение 100–150 мл за 10 минут, которое можно повторить 2–3 раза, пока уровень натрия в сыворотке не повысится на 5 ммоль, избегая чрезмерной коррекции. 18 Не более 10 ммоль в первые 24 часа или 8 ммоль, если есть факторы риска, должны быть достигнуты, чтобы предотвратить серьезное повреждение центральной нервной системы, такое как миелинолиз центрального моста и, в конечном итоге, кома и смерть.Рекомендуется продолжать коррекцию до исчезновения симптомов, внимательно наблюдая за состоянием пациента и концентрацией натрия в сыворотке, чтобы избежать чрезмерной коррекции гипонатриемии.
Если у пациента имеются симптомы, но гипонатриемия возникает хронически, коррекцию следует проводить более постепенно (от 1,5 до 2 ммоль / л / ч). 41–43
Время для нового терапевтического подхода к SIADH-индуцированной гипонатриемии пришло с введением AVP-антагонистических агентов, специфичных для V2R, названных ваптанами.Толваптан применяется перорально и был одобрен в США и Европе для лечения эуволемической гипонатриемии, вызванной SIADH.
В исследованиях SALT-1 и SALT-2 пациенты с SIADH были рандомизированы для приема перорального толваптана в дозе 15 мг в день или плацебо. Скорость коррекции сывороточного уровня натрия в обоих исследованиях была значительно увеличена с ваптаном по сравнению с плацебо, токсичность препарата была управляемой и включала жажду, сухость во рту, токсичность для печени и полиурию. 44 Более того, толваптан может взаимодействовать с цитохромным метаболизмом нескольких молекул, не говоря уже о его значительной стоимости. 45 Тем не менее, двойное слепое рандомизированное плацебо-контролируемое клиническое исследование, проведенное Salahudeen et al. На онкологических больных с SIADH, доказало превосходство толваптана также при злокачественных новообразованиях. 44
Несмотря на эти результаты, на протяжении многих лет лечение первой линии толваптаном при SIADH не поощрялось европейскими рекомендациями. Фактически, толваптан, хотя и эффективен, не влияет на общую смертность, может привести к чрезмерной коррекции, и его сравнивали только с плацебо. 46
Примечательно, что в исследовании Salahudeen et al. Не сообщалось о чрезмерной коррекции сывороточного натрия в группе толваптана. 44
Petereit et al. Продемонстрировали, что лечение толваптаном может позволить пациентам с гипонатриемическим SCLC пройти химиотерапию и привести к улучшению состояния здоровья. 46
Более того, недавнее многоцентровое исследование в Италии подтвердило роль толваптана в арсенале средств против связанного с раком SIADH с двойным положительным эффектом: улучшение общей выживаемости (OS) и сокращение продолжительности госпитализации.С другой стороны, исследователи также наблюдали значительное увеличение продолжительности пребывания в больнице у тех пациентов, которые не получали толваптан. 47
Отсутствие сравнительных исследований между толваптаном и другими доступными методами лечения SIADH может быть эффективно решено с помощью до сих пор неопубликованных результатов исследования ASSERT, недавно представленного на Конгрессе ESMO 2019. В этом проспективном наблюдательном, многоцентровом и неинтервенционном исследовании умеренная или — пациенты с тяжелым гипонатриемическим раком с SIADH, получавшие толваптан, показали значительно более высокую общую и среднюю выживаемость (mOS) по сравнению с теми, кто получал лечение, отличное от толваптана, в соответствии со стандартами и руководящими принципами больницы. 48
SIADH и прогноз: влияние и последствия
За прошедшие годы несколько исследований пролили свет на отрицательное прогностическое влияние гипонатриемии всех степеней как независимого предиктора заболеваемости и смертности у госпитализированных пациентов независимо от этиологии. 49–51
SIADH вырисовывается в этом сценарии как основная причина гипонатриемии как при злокачественных, так и незлокачественных условиях. 8
Большое количество доказательств связывает снижение уровня натрия в сыворотке с более низким качеством жизни и ухудшением выживаемости при некоторых критических состояниях здоровья, таких как застойная сердечная недостаточность, цирроз печени и почечная недостаточность, особенно у пожилых пациентов, получающих сопутствующие лекарства. 50
Поскольку распространенность этого метаболического нарушения у госпитализированных гериатрических пациентов высока, следует сообщить, что даже легкая бессимптомная гипонатриемия значительно увеличивает риск переломов костей по сравнению с пожилыми людьми с нормонатриемией, в основном это связано с ее неврологическими эффектами ( например, когнитивная дисфункция; неустойчивая походка) и вероятность падения. 21,52,53
Verbalis et al., Используя животную модель SIADH человека, продемонстрировали, что стойкая гипонатриемия ответственна за уменьшение костной массы, в основном за счет резорбции костной ткани остеокластами.Примечательно, что в этом исследовании гипонатриемия, вызванная SIADH, встречалась в два раза чаще, чем описано ранее в других моделях множественного остеопороза у крыс. 54
Как указано Ayus et al., У таких ослабленных пациентов эти наблюдения вызывают серьезные последствия для здоровья и затрат, поэтому предлагают отслеживать и оперативно вмешиваться в это нарушение при оценке у гериатрических пациентов, особенно с медицинскими записями об ортопедических травмах. 55
Однако, насколько нам известно, проспективные исследования, демонстрирующие, что коррекция субнормальных уровней натрия влияет на клинические результаты в этих условиях, все еще отсутствуют.
Как упоминалось выше, этот электролитный дисбаланс часто обнаруживается у онкологических больных, когда основным заболеванием является SIADH. Следует отметить, что в значительном количестве случаев он даже предшествует диагностике опухоли. 7,56
Независимо от происхождения, либо из-за химиотерапевтических агентов, либо из-за наличия опухоли, SIADH-связанная гипонатриемия связана с более низкой выживаемостью при всех типах рака, особенно с SCLC. 5,57
При SCLC, согласно большому ретроспективному анализу прогностической ценности SIADH-связанной гипонатриемии, проведенному Hansen et al., Это электролитическое нарушение, как было показано, присутствует при диагностике почти у половины пациентов (44%) и имеет отрицательную корреляцию. с бременем болезни (более низкий уровень натрия в сыворотке на поздней стадии, чем при ограниченной болезни).В том же исследовании было доказано, что гипонатриемия в значительной степени связана с более низким ОВ, чем пациенты с нормонатриемией (7,7 против 11,2 месяцев, p = 0,0001). С другой стороны, данные показали отсутствие различий в показателях mOS и OS у пациентов с гипонатриемией и нормонатримической контрольной группой, когда было реализовано успешное терапевтическое вмешательство. 58
В метаанализе Corona et al исследовали влияние гипонатриемии, не поддающейся коррекции, при различных типах опухолей, а также другие клинические состояния, которые указали на то, что соответствующее и своевременное лечение может улучшить выживаемость пациента, особенно когда натрий> 130 мэкв / л. 59
Статус работоспособности (PS) — это хорошо известная оценка, которая коррелирует с выживаемостью и ответом на лечение у онкологических больных. 60,61
В этом отношении Tai et al показали, что пациенты с SCLC с SIADH имеют более низкий PS по сравнению с пациентами без SIADH на момент постановки диагноза. 62
Sengupta et al. Также отметили, что начальная гипонатриемия может влиять на оценку ECOG PS при поступлении и может быть связана с более высокой клинической стадией рака, действуя как решающий элемент с пагубным влиянием на прогноз с момента начала заболевания. 63
В систематическом обзоре исследований, собранных за длительный период времени, Castillo et al. Отметили, что неблагоприятная прогностическая роль этого электролитического расстройства при SCLC была признана независимым фактором риска в 6 из 13 исследований, включенных в их анализ. 30
Более недавнее исследование подтвердило, что гипонатриемия является показателем более короткой выживаемости даже после поправки на возраст, пол, уровень лактатдегидрогеназы (ЛДГ) и PS у пациентов с ограниченным и обширным SCLC. 64
Результаты недавнего исследования Castillo et al. Предполагают более высокую частоту этого метаболического нарушения, чем сообщалось ранее, при немелкоклеточном раке легкого (НМРЛ), который традиционно считается менее интересным для SIADH. 65
Несмотря на то, что по подкатегории НМРЛ было проведено мало исследований, несколько исследований подтверждают негативное влияние гипонатриемии на опухоль и статус воспаления при удаленном НМРЛ, а также на исход при запущенном заболевании, леченном эрлотинибом. 66
Наконец, как ранее было продемонстрировано для SCLC, мы выяснили, как нормализация натрия служила независимым прогностическим фактором при терапии NSCLC первой линии как для OS, так и для выживаемости без прогрессирования (PFS), подчеркнув важность оптимальной и быстрой коррекции гипонатриемии для опухоли. ответ на лечение. 67
Тем не менее, рак легких — это лишь самая распространенная злокачественная опухоль, на исход которой влияет SIADH. Фактически, выживаемость других опухолей была отрицательно связана с гипонатриемией: желудочно-кишечный и колоректальный рак, 68,69 мезотелиома плевры 70 и почечно-клеточная карцинома (ПКР). 71
В последнем случае опухоли предоперационные низкие уровни натрия в сыворотке крови независимо и достоверно коррелировали со снижением общей выживаемости и выживаемости без заболевания у кандидатов на операцию почечно-клеточного рака. 72
В научном сообществе растет интерес к предсказательной роли ответа на лечение гипонатриемии. В этой перспективе, чтобы лучше выбрать тех, кому может помочь химиотерапия, избегая бесцельной токсичности при хорошо известном заболевании с плохим прогнозом, Tiseo et al исследовали значительное количество случаев рецидивирующего или рецидивирующего МРЛ при лечении топотеканом второй линии, что доказало гипонатриемию. быть полезным инструментом стратификации в процессе принятия решений. 73
В подтверждение предыдущих результатов, которые связывали гипонатриемию с отсутствием ответа на цитокины при метастатическом ПКР, 71 другое исследование на поздних стадиях ПКР оценивало влияние пониженного содержания натрия на более короткое время до неэффективности лечения и скорость контроля заболевания, поэтому предлагалось, а также предложенный при раке легких, прогностическое значение для гипонатриемии в этих условиях. 74
Если, с одной стороны, отрицательная прогностическая роль гипонатриемии и метастазов в кости (BM), она хорошо закреплена в контексте НМРЛ, с другой стороны, связь между этими двумя факторами риска не исследовалась до тех пор, пока Ринальди и др. Недавний ретроспективный анализ показал, что у пациентов с гипонатриемией НМРЛ IV стадии BM значительно раньше (3.73 против 5,76 месяцев, p = 0,0187), их mOS было короче, чем у эунатремических пациентов без BM, как и ожидалось, но также хуже, чем у эунатремических пациентов с BM. Это наблюдение указывает на взаимный вес двух переменных. 75
Даже в паллиативной помощи, когда химиотерапевтическое вмешательство больше не является вариантом, своевременное и надлежащее вмешательство при гипонатриемии может быть полезным для сохранения стабильного клинического состояния и предотвращения госпитализации в ситуациях конца жизни. 76
Несмотря на то, что лишь несколько исследований были посвящены взаимосвязи между гипонатриемией, продолжительностью госпитализации и соответствующей стоимостью пребывания, в последнее время повышенное внимание уделяется экономическому и медицинскому влиянию этого состояния на систему здравоохранения. 77,78
В связи с этим недавно были опубликованы результаты многоцентрового обсервационного итальянского исследования. Исследование, разработанное с целью оценки клинических и финансовых последствий SIADH для онкологических пациентов, показало значительно более длительное время пребывания у тех пациентов, которые не достигли нормализации натрия во время госпитализации, а также тяжелую и рефрактерную к коррекции гипонатриемию у пациентов, помещенных в лечебные учреждения, отрицательно и значительно коррелировал с рейтингом ОС. 79
Заключение
Как свидетельствует обширная литература на протяжении многих лет, прогностическая роль и негативное влияние на качество жизни пациента гипонатриемии, вызванной SIADH, можно преодолеть с помощью раннего и соответствующего терапевтического вмешательства, косвенно приводящего к улучшению результатов и сопутствующему снижению затрат на здоровье. .
Чтобы обеспечить надлежащую и быструю коррекцию субнормального уровня натрия с положительным влиянием на состояние и выживаемость пациента, лечение SIADH должно быть адаптировано к клиническим характеристикам, биохимическим параметрам и различным настройкам начала.
Результаты недавнего исследования укрепили фармакологический подход, основанный на толваптане, для оптимального лечения гипонатриемии, вторичной по отношению к SIADH, и его прогностическое значение при онкологических заболеваниях.
Раскрытие информации
Проф. Д-р Россана Берарди сообщает о личных гонорарах от Otsuka, помимо представленных работ. Авторы не сообщают о других возможных конфликтах интересов в этой работе.
Список литературы
1. Шварц В.Б., Беннетт В., Курелоп С., Барттер ФК. Синдром почечной потери натрия и гипонатриемии, вероятно, вызванный несоответствующей секрецией антидиуретического гормона. Ам Дж. Мед. . 1957. 23 (4): 529–542. DOI: 10.1016 / 0002-9343 (57)
-3
2. Фельдман Б.Дж., Розенталь С.М., Варгас Г.А. и др. Нефрогенный синдром несоответствующего антидиуреза. N Engl J Med . 2005. 352 (18): 1884–1890. DOI: 10.1056 / NEJMoa042743
3. Эспозито П., Пиотти Г., Бианзина С., Малул Ю., Даль Кантон А. Синдром несоответствующего антидиуреза: патофизиология, клиническое ведение и новые терапевтические возможности. Нефрон Клиническая Практика . 2011; 119 (1): 62–73.DOI: 10.1159 / 000324653
4. Мяч SG. Вазопрессин и нарушения водного баланса: физиология и патофизиология вазопрессина. Энн Клин Биохим . 2007. 44 (5): 417–431. DOI: 10.1258 / 000456307781646030
5. Тиан Й., Сандберг К., Мурас Т., Бейкер Э.А., Спет Р.С., Вербалис Дж. Г.. Связывание рецептора вазопрессина V2 подавляется во время почечного выхода из антидиуреза, вызванного вазопрессином. Эндокринология . 2000. 141 (1): 307–314. DOI: 10.1210 / endo.141.1.7256
6.Verbalis JG. Регулировка объема всего тела и избавление от антидиуреза. Ам Дж. Мед. . 2006. 119 (7): 21–29. DOI: 10.1016 / j.amjmed.2006.05.004
7. Берарди Р., Ринальди С., Караманти М. и др. Гипонатриемия у онкологических больных: время для нового подхода. Crit Rev Oncol Hematol . 2016; 102: 15–25. DOI: 10.1016 / j.critrevonc.2016.03.010
8. Хэннон MJ, Томпсон CJ. Синдром несоответствующего антидиуретического гормона: распространенность, причины и последствия. Eur J Endocrinol .2010. 162 (1): 5–12. DOI: 10.1530 / EJE-09-1063
9. Канаджи Н., Ватанабе Н., Кита Н. и др. Паранеопластические синдромы, связанные с раком легких. Мир J Clin Oncol . 2014. 5 (3): 197–223. DOI: 10.5306 / wjco.v5.i3.197
10. Куэста М., Гаррахи А., Томпсон С.Дж. SIAD: практические рекомендации по диагностике и лечению. Дж Эндокринол Инвест . 2016; 39 (9): 991–1001. DOI: 10.1007 / s40618-016-0463-3
11. Грей С.Т., Холбрук Э.Х., Наджм М.Х., Садоу П.М., Карри В.Т., Лин Д.Т.Синдром несоответствующей секреции антидиуретического гормона у пациентов с обонятельной нейробластомой. Otolaryngol Head Neck Surg . 2012. 147 (1): 147–151. DOI: 10.1177 / 0194599812438842
12. Соренсен Дж. Б., Андерсен М. К., Хансен Х. Х. Синдром неадекватной секреции антидиуретического гормона (SIADH) при злокачественном заболевании. J Intern Med . 1995. 238 (2): 97–110. DOI: 10.1111 / j.1365-2796.1995.tb00907.x
13. Робертсон ГЛ. Нейротоксичность винкристина и нарушение секреции антидиуретического гормона. Arch Gen Intern Med . 1973; 132 (5): 717–720. DOI: 10.1001 / archinte.1973.03650110061013
14. Лиамис Г., Милионис Х., Элизаф М. Обзор лекарственной гипонатриемии. Am J Kidney Dis . 2008. 52 (1): 144–153. DOI: 10.1053 / j.ajkd.2008.03.004
15. Берарди Р., Сантони М., Ринальди С. и др. Риск гипонатриемии у онкологических больных, получавших таргетную терапию: систематический обзор и метаанализ клинических испытаний. PLoS One Epub . 2016; 11 (5).
16.Khaja M, Torchon F, Millerman K. Редкий случай тяжелой гипонатриемии, вызванной сорафенибом [отчет о болезни]. SAGE Open Med Case Rep . 2019; 7: 2050313X19846048.
17. Джавери К.Д., Ванчу Р., Сахия В., Росс Д.В., Фишбейн С. Неблагоприятные почечные эффекты новых молекулярных онкологических таргетных терапий: обзорный обзор. Репутация почек . 2016; 2 (1): 108–123. DOI: 10.1016 / j.ekir.2016.09.055
18. Спасовски Г., Ванхолдер Р., Аллолио Б. и др. Руководство по клинической практике по диагностике и лечению гипонатриемии. Циферблат нефрола . 2014; 29 (2): 1–39.
19. Verbalis JG. Лечение гипонатриемии у пациентов с синдромом несоответствующей секреции антидиуретического гормона. Дж Хосп Мед . 2010. 5 (3): 18–26. DOI: 10.1002 / jhm.783
20. Реннебуг Б., Саттар Л., Деко Г. У пожилых людей с легкой или умеренной хронической гипонатриемией гораздо больше нарушается внимание и постуральное равновесие. Eur J Intern Med . 2017; 41: 25–26. DOI: 10.1016 / j.ejim.2017.02.008
21. Renneboog B, Musch W., Vandemergel X, Manto MU, Decaux G. Легкая хроническая гипонатриемия связана с падениями, неустойчивостью и дефицитом внимания. Ам Дж. Мед. . 2006. 119 (1): 71–78. DOI: 10.1016 / j.amjmed.2005.09.026
22. Ганкам К.Ф., Андрес С., Саттар Л. и др. Легкая гипонатриемия и риск перелома у амбулаторных пожилых людей. Q J Med . 2008. 101 (7): 583–588. DOI: 10.1093 / qjmed / hcn061
23. Barsony J, Sugimura Y, Verbalis JG. Ответ остеокластов на низкий уровень внеклеточного натрия и механизм потери костной массы, вызванной гипонатриемией. Дж. Биол. Хим. . 2011. 286 (12): 10864–10875. DOI: 10.1074 / jbc.M110.155002
24. Берарди Р., Моржезе Ф., Ринальди С., Торниай М. Электролитные нарушения у онкологических больных: клиническое значение и лечение. В: Блэр М.Т., редактор. Новые разработки в онкологических исследованиях . Издательство Nova Science; 2019.
25. Лиамис Г., Роденбург Э.М., Хофман А., Цитце Р., Стрикер Б. Х., Хорн Э. Дж. Электролитные нарушения у субъектов сообщества: распространенность и факторы риска. Ам Дж. Мед. .2013. 126 (3): 256–263. DOI: 10.1016 / j.amjmed.2012.06.037
26. Уолд Р., Джабер Б.Л., Прайс Л.Л., Упадхьяй А., Мадиас, NE. Влияние госпитальной гипонатриемии на отдельные исходы. Arch Intern Med . 2010. 170 (3): 294–302. DOI: 10.1001 / archinternmed.2009.513
27. Берарди Р., Антонуццо А., Блази Л. и др. Практические вопросы лечения гипонатриемии в онкологии. Эндокринная . 2018; 61 (1): 158–164. DOI: 10.1007 / s12020-018-1547-y
28. Остер-младший, певица И.Гипонатриемия, гипосмоляльность и гипотоничность: таблицы и басни. Arch Intern Med . 1999. 159 (4): 333–336. DOI: 10.1001 / archinte.159.4.333
29. Verbalis JG, Goldsmith SR, Greenberg A, et al. Диагностика, оценка и лечение гипонатриемии: рекомендации экспертной комиссии. Ам Дж. Мед. . 2013; 126 (10): 1–42. DOI: 10.1016 / j.amjmed.2013.07.006
30. Кастильо Дж. Дж., Винсент М., Джастис Э. Диагностика и лечение гипонатриемии у онкологических больных. Онколог .2012. 17 (6): 756–765. DOI: 10.1634 / теонколог.2011-0400
31. Талер С.М., Тейтельбаум И., Берл Т. «Пивная потомания» у лиц, не пьющих пиво: эффект низкого потребления растворенных веществ с пищей. Am J Kidney Dis . 1998. 31 (6): 1028–1031. DOI: 10.1053 / ajkd.1998.v31.pm9631849
32. Grohè C, Berardi R, Burst V. Гипонатриемия-SIADH в алгоритмах диагностики и лечения рака легких. Crit Rev Oncol Hematol . 2015; 96 (1): 1–8. DOI: 10.1016 / j.critrevonc.2015.04.005
33. Тенни С., Торелл В. Синдром истощения церебральной соли . Остров сокровищ (Флорида): StatPearls Publishing; 2019.
34. Тюдор Р.М., Томпсон С.Дж. Дисфункция задней доли гипофиза после черепно-мозговой травмы: обзор. Гипофиз . 2019; 22 (3): 296–304. DOI: 10.1007 / s11102-018-0917-z
35. De Troyer A, Demanet JC. Коррекция антидиуреза демеклоциклином. N Engl J Med . 1975. 293 (18): 915–918. DOI: 10.1056 / NEJM197510302931809
36. Черрилл Д.А., Стоте Р.М., Бирге мл., Певица И.Лечение демеклоциклином при синдроме несоответствующей секреции антидиуретического гормона. Энн Интерн Мед. . 1975. 83 (5): 654–656. DOI: 10.7326 / 0003-4819-83-5-654
37. Перкс WH, Mohr P, Liversedge LA. Демеклоциклин в несоответствующем A.D.H. синдром. Ланцет . 1976; 2 (8000): 1414. DOI: 10.1016 / S0140-6736 (76) 91958-9
38. Онитило А.А., Кио Э., Дои С.А. Гипонатриемия, связанная с опухолями. Clin Med Res . 2007. 5 (4): 228–237. DOI: 10,3121 / cmr.2007.762
39.Смит Д., Мур К., Торми В., Бейлис PH, Томпсон С.Дж. Снижение осмотического порога жажды у пациентов с SIADH. Am J Physiol Endocrinol Metab . 2004; 287 (5): E1019 – E1023. DOI: 10.1152 / ajpendo.00033.2004
40. Furst H, Hallows KR, Post J, et al. Соотношение электролитов мочи / плазмы: руководство по прогнозированию ограничения воды. Am J Med Sci . 2000. 319 (4): 240–244. DOI: 10.1097 / 00000441-200004000-00007
41. Ранкл I, Виллабона С., Наварро А. и др.Лечение гипонатриемии, вызванной синдромом несоответствующей секреции антидиуретического гормона: междисциплинарный испанский алгоритм. Нефрология . 2014. 34 (4): 439–450. DOI: 10.3265 / Nefrologia.pre2014.Apr.12220
42. Сантини Д., Берарди Р., Караманти М., Пери А., Арменто Г., Барни С. от имени Итальянской ассоциации медицинской онкологии (AIOM). Нарушение электролитов: рекомендации по диагностике и лечению онкологических больных. Документ с изложением позиции.
43. Verbalis JG, Adler S, Schrier RW, Berl T., Zhao Q, Czerwiec FS.СОЛТ следователи. Эффективность и безопасность пероральной терапии толваптаном у пациентов с синдромом несоответствующей секреции антидиуретического гормона. Eur J Endocrinol . 2011. 164 (5): 725–732. DOI: 10.1530 / EJE-10-1078
44. Салахудин А.К., Али Н., Джордж М., Лахоти А., Палла С. Толваптан у госпитализированных онкологических больных с гипонатриемией: двойное слепое рандомизированное плацебо-контролируемое клиническое исследование эффективности и безопасности. Рак . 2014; 120 (5): 744–751. DOI: 10.1002 / cncr.28468
45.Shoaf SE, Bricmont P, Mallikaarjun S. Влияние ингибирования и индукции CYP3A4 на фармакокинетику и фармакодинамику толваптана, непептидного антагониста AVP у здоровых субъектов. Br J Clin Pharmacol . 2012. 73 (4): 579–587. DOI: 10.1111 / j.1365-2125.2011.04114.x
46. Petereit C, Zaba O, Teber I, Lüders H, Grohé C. Быстрый и эффективный способ лечения гипонатриемии у пациентов с SIADH и мелкоклеточным раком легкого: лечение толваптаном. BMC Pulm Med .2013; 13 (1): 55. DOI: 10.1186 / 1471-2466-13-55
47. Берарди Р., Мастроянни С., Ло Руссо Г. и др. Синдром несоответствующей секреции антидиуретического гормона у онкологических больных: результаты первого многоцентрового итальянского исследования. Тер Адв Мед Онкол . 2019; 11: 1758835919877725.
48. Берарди Р., Ло Руссо Дж., Тисео М. и др. ASSERT: проспективное обсервационное исследование по измерению улучшения содержания натрия и результатов у пациентов, леченных от умеренной до тяжелой гипонатриемии, вторичной по отношению к SIADH.Плакат представлен на: Конгрессе Европейского общества медицинской онкологии (ESMO). Барселона: Испания; 2019 27 сентября.
49. Сельмер С., Мадсен Дж., Торп-Педерсен С., Гисласон Г. Х., Фабер Дж. Гипонатриемия, смертность от всех причин и риск диагнозов рака в учреждениях первичной медико-санитарной помощи: крупное популяционное исследование. Eur J Intern Med . 2016; 36: 36–43. DOI: 10.1016 / j.ejim.2016.07.028
50. Мохан С., Гу С., Парик А., Радхакришнан Дж. Распространенность гипонатриемии и связь со смертностью: результаты исследования NHANES. Ам Дж. Мед. . 2013. 126 (12): 1127–1137. DOI: 10.1016 / j.amjmed.2013.07.021
51. Кан С.Х., Ким Х.В., Ли С.И. и др. Связан ли уровень натрия как таковой со смертностью госпитализированных пациентов с тяжелой гипонатриемией? Клин Нефрол . 2012. 77 (3): 182–187. DOI: 10.5414 / CN107177
52. Кинселла С., Моран С., Салливан М.О., Моллой М.Г., Юстас Дж.А. Гипонатриемия, не зависящая от остеопороза, связана с возникновением переломов. Clin J Am Soc Nephrol . 2010. 5 (2): 275–280.DOI: 10.2215 / CJN.06120809
53. Хорн Э. Дж., Риваденейра Ф., Ван Мерс Дж. Б. и др. Легкая гипонатриемия как фактор риска переломов: Роттердамское исследование. J Bone Miner Res . 2011; 26 (8): 1822–1828. DOI: 10.1002 / jbmr.380
54. Verbalis JG, Barsony J, Sugimura Y, et al. Остеопороз, вызванный гипонатриемией. J Bone Miner Res . 2010. 25 (3): 554–563. DOI: 10.1359 / jbmr.0
55. Ayus JC, Negri AL, Kalantar-Zadeh K, Moritz ML. Является ли хроническая гипонатриемия новым фактором риска перелома шейки бедра у пожилых людей? Циферблат нефрола .2012. 27 (10): 3725–3731. DOI: 10.1093 / ndt / gfs412
56. Бергманс Т, Паесманс М, Тело Дж. Дж. Проспективное исследование гипонатриемии у онкологических больных: эпидемиология, этиология и дифференциальный диагноз. Поддержка рака . 2000. 8 (3): 192–197. DOI: 10.1007 / s005200050284
57. Petereit C, Zaba O, Teber I, Grohé C. Является ли гипонатриемия прогностическим маркером выживаемости при раке легких? Пневмология . 2011. 65 (9): 565–571. DOI: 10.1055 / с-0030-1256668
58.Хансен О., Соренсен П., Хансен К. Возникновение гипонатриемии при SCLC и влияние на прогноз: ретроспективное исследование 453 пациентов, пролеченных в одном учреждении за 10-летний период. Рак легких . 2010. 68 (1): 111–114. DOI: 10.1016 / j.lungcan.2009.05.015
59. Corona G, Giuliani C, Parenti G и др. Умеренная гипонатриемия связана с повышенным риском смертности: данные метаанализа. PLoS One . 2013; 8 (12): e80451. DOI: 10.1371 / journal.pone.0080451
60. Альбайн К.С., Кроули Дж. Дж., Леблан М., Ливингстон РБ. Детерминанты выживаемости при немелкоклеточном раке легкого обширной стадии: опыт юго-западной онкологической группы. Дж. Клин Онкол . 1991. 9 (9): 1618–1626. DOI: 10.1200 / JCO.1991.9.9.1618
61. Сенгелов Л., Камби С., Герцен П., Андерсен Л. Дж., Фон дер Маасе Х. Прогностические факторы ответа на химиотерапию на основе цисплатина и связь ответа с выживаемостью у пациентов с метастатическим уротелиальным раком. Cancer Chemother Pharmacol .2000. 46 (5): 357–364. DOI: 10.1007 / s002800000176
62. Tai P, Yu E, Jones K, Sadikov E, Mahmood S, Tonita J. Синдром несоответствующей секреции антидиуретического гормона (SIADH) у пациентов с мелкоклеточным раком легкого ограниченной стадии. Рак легких . 2006. 53 (2): 211–215. DOI: 10.1016 / j.lungcan.2006.05.009
63. Сенгупта А., Банерджи С.Н., Бисвас Н.М. и др. Частота гипонатриемии и ее влияние на статус показателей ECOG среди пациентов с раком легких. J Clin Диагностика .2013. 7 (8): 1678–1682. DOI: 10.7860 / JCDR / 2013 / 5900.3225
64. Гермес А., Вашки Б., Рек М. Гипонатриемия как прогностический фактор при мелкоклеточном раке легкого, ретроспективный анализ одного учреждения. Респир Мед . 2012. 106 (6): 900–904. DOI: 10.1016 / j.rmed.2012.02.010
65. Castillo JJ, Glezerman IG, Boklage SH, et al. Возникновение гипонатриемии и ее значение как прогностический фактор в разрезе онкологических больных. BMC Рак . 2016; 16 (1): 564.DOI: 10.1186 / s12885-016-2610-9
66. Сватон М., Фиала О., Песек М. и др. Прогностическое и прогностическое значение уровня натрия у пациентов с НМРЛ, получавших эрлотиниб. Противораковое лечение . 2014; 34 (12): 7461–7465.
67. Берарди Р., Сантони М., Ньюсом-Дэвис Т. и др. Нормализация гипонатриемии как независимый прогностический фактор у пациентов с распространенным немелкоклеточным раком легкого, получавших терапию первой линии. Онкотоваргет . 2017; 8 (14): 23871–23879. DOI: 10.18632 / oncotarget.13372
68. Kim HS, Yi SY, Jun HJ, et al. Клинические исходы больных раком желудка с метастазами в костный мозг. Онкология . 2007. 73 (3–4): 192–197. DOI: 10.1159 / 000127386
69. Чой Дж. С., Бэ Э. Х., Ма С. К., Квеон С. С., Ким СВ. Прогностическое влияние гипонатриемии у пациентов с колоректальным раком. Колоректальный Дис . 2015. 17 (5): 409–416. DOI: 10.1111 / codi.12878
70. Берарди Р., Караманти М., Фьордолива И. и др. Гипонатриемия является предиктором клинического исхода злокачественной мезотелиомы плевры. Поддержка рака . 2015; 23 (3): 621–626. DOI: 10.1007 / s00520-014-2398-6
71. Джеппесен А.Н., Йенсен Х.К., Донсков Ф., Маркуссен Н., фон дер Маасе Х. Гипонатриемия как прогностический и прогностический фактор при метастатической почечно-клеточной карциноме. Рак Дж. . 2010. 102 (5): 867–872. DOI: 10.1038 / sj.bjc.6605563
72. Васудев Н.С., Браун Дж. Э., Браун С. Р. и др. Факторы прогноза при почечно-клеточной карциноме: связь предоперационной концентрации натрия с выживаемостью. Clin Cancer Res .2008. 14 (6): 1775–1781. DOI: 10.1158 / 1078-0432.CCR-07-1721
73. Тисео М., Бути С., Бони, Маттиони Р., Ардиццони А. Прогностическая роль гипонатриемии у 564 пациентов с мелкоклеточным раком легкого, получавших топотекан. Рак легких . 2014. 86 (1): 91–95. DOI: 10.1016 / j.lungcan.2014.07.022
74. Schutz FA, Xie W., Donskov F, et al. Влияние низкого уровня натрия в сыворотке на результаты лечения таргетной терапии метастатической почечно-клеточной карциномы: результаты международного консорциума баз данных по метастатическому почечно-клеточному раку. Евро Урол . 2014. 65 (4): 723–730. DOI: 10.1016 / j.eururo.2013.10.013
75. Ринальди С., Сантони М., Леони Дж. И др. Прогностическая и прогностическая роль гипонатриемии у пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) с метастазами в кости. Поддержка рака . 2019; 27 (4): 1255–1261. DOI: 10.1007 / s00520-018-4489-2
76. Пери А., Джулиани С. Лечение эуволемической гипонатриемии, приписываемой SIADH, в условиях больницы. Минерва Эндокринол .2014; 39 (1): 33–41.
77. Берарди Р., Караманти М., Кастаньани М. и др. Гипонатриемия является предиктором продолжительности госпитализации, стоимости пребывания и исхода у онкологических больных. Поддержка рака . 2015. 23 (10): 3095–3101. DOI: 10.1007 / s00520-015-2683-z
78. Нельсон М., Палмер Дж. Л., Фу Дж., Уильямс Дж. Л., Ядав Р., Го Ю. Гипонатриемия у онкологических больных в стационаре реабилитационного отделения. Eur J Cancer Care . 2014. 23 (3): 363–369. DOI: 10.1111 / ecc.12140
79. Берарди Р., Мастроянни С., Ло Руссо Г. и др.Синдром несоответствующей секреции антидиуретического гормона у онкологических больных: результаты первого многоцентрового итальянского исследования. Тер Адв Мед Онкол . 2019; 11: 1758835919877725. DOI: 10.1177 / 1758835919877725
Синдром несоответствующей секреции антидиуретического гормона
Краткий обзор
Синдром неадекватной секреции антидиуретического гормона (SIADH) характеризуется гипонатереемией и гипоосмоляльностью при анализе неправильно сконцентрированного образца мочи.Состояние (как следует из названия) вызвано чрезмерным действием вазопрессина, что снижает способность почек выводить свободную воду. Это приводит к чрезмерному разбавлению компонента плазмы; отсюда гипоосмоляльность. Состояние не связано с отеками и признаками гипергидратации. Клинически пациент обычно эуволемичен, и функция почек с точки зрения экскреции креатинина в норме. Натрийурез (чрезмерное выведение натрия почками) является обычным явлением и, вероятно, является следствием действия натрийуретических пептидов.
Причины SIADH включают:
Злокачественные новообразования, включая солидные опухоли и лимфомы
Заболевания легких (например, пневмония, туберкулез (ТБ), васкулит и вентиляция с положительным давлением)
Лекарственные средства (например, селективные ингибиторы обратного захвата серотонина, трициклические препараты, фенотиазины, карбамазепин, циклофосфамид)
Десмопрессин: синтетический вазопрессин используется в терапии болезни фон Виллебранда и легкой гемофилии.
Внутричерепные заболевания (e.г., менингит, энцефалит, абсцесс, васкулит, кровоизлияние (субдуральное или субарахноидальное))
Острая порфирия
Рассеянный склероз
Синдром Гийена-Барре
Какие тесты мне следует запросить, чтобы подтвердить мой клинический Dx? Кроме того, какие дополнительные тесты могут быть полезны?
Критерии SIADH включают:
Гипонатриемия (Na <134 ммоль / л) и / или гипоосмоляльность плазмы (<280 мосмоль / кг H 2 O)
Несоответствующая концентрация мочи с осмоляльностью мочи, превышающей 100 мосмоль / кг H 2 O
Натрийурез (содержание натрия в моче> 40 ммоль / л при нормальном питании)
Клинический эуволемический (не отечный)
Нет свидетельств гипотиреоза или нарушения функции надпочечников
(таблица 1)
Таблица 1.
| ПЛАЗМА или СЫВОРОТКА | МОЧА | Испытание на водную нагрузку |
|---|---|---|
| Натрий ≤ 135 ммоль / | ||
| Осмоляльность ≤ 280 мосмоль / кг | Осмоляльность> 100 мосмоль / кг | Это дополнительный тест. |
| Дополнительный: | [Na + ]> 40 ммоль / | Обычно> 80% водной нагрузки * выводится за 4-часовой период. В SIADH это <80%. |
| Мочевая кислота <4 мг / дл | * 20 мл на кг массы тела | |
| АМК <10 мг / дл |
Существуют ли какие-либо факторы, которые могут повлиять на результаты лабораторных исследований? В частности, принимает ли ваш пациент какие-либо лекарства — безрецептурные или травяные — которые могут повлиять на результаты лабораторных исследований?
Лекарства, включая нейролептики, антидепрессанты и некоторые противоэпилептические препараты, могут вызывать SIADH или обострять состояние.
Какие лабораторные результаты являются полностью подтверждающими?
Не существует единого теста, который бы полностью подтвердил. Следует учитывать все критерии (и, возможно, дополнительные тесты). Например, однократное измерение вазопрессина может быть трудным для интерпретации, а гипонатриемия и гипоосмоляльность могут быть вызваны первичной полидипсией.
Какие тесты мне следует запросить, чтобы подтвердить свой клинический Dx? Кроме того, какие дополнительные тесты могут быть полезны?
Дополнительные тесты для SIADH включают:
Мочевая кислота в плазме менее 4 мг / дл, АМК менее 10 мг / дл (отражает гемодилюцию с нормальной СКФ), фракционная экскреция Na более 1% и фракционная экскреция мочевины более 55%
Тест на ненормальную водную нагрузку: выполняется (пероральным) введением воды из расчета 20 мл воды на кг веса в течение 30 минут.Затем образцы мочи собираются с 30-минутными интервалами в течение 4 часов. Объем мочи выражается в процентах от количества потребляемой воды. Обычно более 80% водной нагрузки выводится за 4 часа, а осмоляльность мочи падает до менее 100 мосмоль / кг H 2 O.
Анализ плазменного аргинина вазопрессина сложен в этой группе пациентов. Было распознано четыре образца:
Тип A — наиболее распространенная форма SIADH. Вазопрессин в плазме неадекватно повышен для осмоляльности сыворотки и, по-видимому, не зависит от какой-либо осмотической регуляции.Нет линейной зависимости между вазопрессином и осмоляльностью плазмы. Тип А часто встречается при раке легких.
Тип B. Здесь существует линейная зависимость между вазопрессином и осмоляльностью плазмы, а повышение осмоляльности плазмы стимулирует секрецию вазопрессина. Что ненормально, так это то, что осмотический порог сбрасывается, так что вазопрессин высвобождается при гораздо более низких осмоляльностях плазмы, чем обычно.
Тип C встречается редко. Концентрации аргинина вазопрессина (AVP) в плазме неоправданно высоки только при низких осмоляльностях плазмы.Концентрации вазопрессина и реакция на осмоляльность плазмы полностью нормальны в пределах нормального диапазона осмоляльности плазмы. Однако, когда плазма гипоосмолярна, обычно менее 278 мОсм / кг ч3O, вазопрессин чрезмерно секретируется по фиксированному образцу, что приводит к неадекватно повышенной концентрации.
Тип D также встречается редко. Вазопрессин достаточно низкий в условиях гипоосмоляльности. Регуляция секреции вазопрессина за счет осмоляльности плазмы кажется нормальной.Если осмоляльность плазмы повышается до физиологического диапазона инфузией гипертонического солевого раствора, вазопрессин плазмы реагирует нормально и повышается. Тип D может быть следствием нефрогенной формы SIADH, при которой транспорт воды в дистальных отделах нефрона / собирательных канальцах постоянно активируется.
В типах A, B и C уровень вазопрессина в плазме неадекватно повышен для низкой осмоляльности плазмы. Однако при типе D вазопрессин в плазме соответственно подавляется.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
RACGP — Подозреваемый — SIADH
Футболка Kristen
Джерри Данг
Предпосылки
Гипонатриемия — одно из наиболее часто встречающихся электролитных нарушений в общей практике.Синдром несоответствующей секреции антидиуретического гормона (SIADH) является важной, но недостаточно изученной причиной.
Цель / с
В этой статье исследуется представление, исследование, диагностика и лечение SIADH.
Обсуждение
SIADH может возникать вторично по отношению к лекарствам, злокачественному новообразованию, легочной болезни или любому заболеванию, затрагивающему центральную нервную систему. Диагноз ставится на основании клинического эуволемического состояния с низким уровнем натрия и осмоляльности в сыворотке, повышенным уровнем натрия и осмоляльности в моче, а также исключением псевдогипонатриемии и применения диуретиков.Ограничение жидкости 800–1200 мл / 24 часа — основа лечения. Пациенты с тяжелой гипонатриемией и симптомами измененного психического состояния или судорог должны быть госпитализированы для контроля за ограничением жидкости и рассмотрения возможности применения гипертонического раствора. Быстрое повышение уровня натрия может вызвать осмотическую демиелинизацию, поэтому повышение уровня натрия в сыворотке не должно превышать 10 ммоль / л за 24 часа или 18 ммоль / л за 48 часов.
Гипонатриемия, частое нарушение электролитного баланса, наблюдаемое в общей практике, может иметь множество основных причин. 1 Наиболее частые причины включают эффекты лекарств, задержку жидкости и синдром несоответствующей секреции антидиуретического гормона (SIADH). 1 Низкие уровни натрия в сыворотке крови связаны с повышенной смертностью в некоторых группах пациентов, включая госпитализированных пациентов, пожилых людей и людей с сердечной недостаточностью, печеночной недостаточностью или пневмонией. 2 Гипонатриемия увеличивает риск падений и остеопороза и, в тяжелых случаях, может быть связана с изменениями психического состояния, включая риск комы и судорог. 2,3 SIADH составляет около одной трети всех проявлений гипонатриемии, 2 все же остается, как правило, недостаточно диагностированной и, следовательно, недостаточно контролируемой. 4 Эта статья будет посвящена диагностике, исследованию и лечению гипонатриемии, вторичной по отношению к SIADH.
Пример использования
Госпожа С.П., 86 лет, проживает в доме престарелых, попала в больницу после падения без предупреждения. В течение прошлой недели она чувствовала себя неустойчиво на ногах, но ее психическое состояние и жизненные показатели были в норме, и при осмотре не было выявлено неврологических нарушений.В ее прошлой истории болезни были остеопороз, гипертония, гастроэзофагеальное рефлюксное расстройство (ГЭРБ) и депрессия. Г-жа С.П. принимала несколько лекарств, в том числе эсциталопрам от депрессии, телмисартан от гипертонии, оксикодон / налоксон с контролируемым высвобождением при хронической боли в спине, оксибутинин при недержании мочи, симвастатин, прегабалин при ишиасе, эзомепразол при ГЭРБ и инъекции деносумабора каждые шесть месяцев при недержании мочи. . Обследование в больнице показало тяжелую гипонатриемию с низкой осмоляльностью сыворотки и повышенными осмоляльностью мочи и уровнем натрия.Все остальные тесты были нормальными (таблица 1).
Был поставлен диагноз вторичной гипонатриемии по отношению к SIADH, и уровень натрия в сыворотке улучшился до 120 ммоль после ограничения жидкости 1000 мл / 24 часа. Считалось, что наиболее вероятными преципитентами ее SIADH были эсциталопрам и телмисартан. Госпожа С.П. была выписана обратно в дом престарелых с прекращением приема этих двух лекарств.
Повторные анализы крови через неделю после госпитализации показали улучшение с натрием в сыворотке (127 ммоль), креатинином: 40 мкмоль / л и расчетной скоростью клубочковой фильтрации (90 мл / мин / л.73 м 2 ). Артериальное давление оставалось стабильным на отметке 130/80 мм рт. Ограничение жидкости миссис С.П. было ослаблено до 1400 мл / 24 часа, а уровень натрия в сыворотке оставался стабильным на уровне 130–135 ммоль в течение следующих двух месяцев.
Расследования | Результаты | Эталонный диапазон |
|---|---|---|
Натрий сыворотки | 108 ммоль (‘) | 135–145 ммоль |
Калий | 4.5 ммоль | 3,5–5,0 ммоль |
Креатинин | 40 мкмоль / л | 40–90 мкмоль / л |
Расчетная скорость клубочковой фильтрации | 90 мл / мин / 1,73 м 2 | > 90 мл / мин / л.73 кв.м. 2 |
Осмоляльность сыворотки | 254 мОсм / кг (‘) | > 275 мОсм / кг |
Осмоляльность мочи | 140 мОсм / кг (”) | <100 мОсм / кг |
Натрий в моче | 39 ммоль / л (дюйм) | <20 ммоль / л |
Функциональные тесты щитовидной железы | Обычный |
|
Рентген грудной клетки | Обычный |
|
Компьютерная томография головы | Обычный |
|
Определения и патофизиология
Гипонатриемия возникает, когда уровень натрия в сыворотке крови пациента падает ниже 135 ммоль / л; тяжелая гипонатриемия определяется как уровень натрия в сыворотке ниже 120 ммоль / л. 1,2 Причины гипонатриемии можно разделить в зависимости от жидкостного статуса: гиповолемические, эуволемические и гиперволемические. 1
- Гиповолемическая гипонатриемия включает уменьшение объема внеклеточной жидкости с одновременным снижением уровня натрия в сыворотке, что наблюдается в условиях желудочно-кишечных потерь. 1
- Эуволемическая гипонатриемия составляет большинство случаев гипонатриемии и определяется, когда объем внеклеточной жидкости в норме. SIADH, лекарства (вставка 1), гипотиреоз и первичная полидипсия — все это потенциальные причины эуволемической гипонатриемии. 1,2
- Гиперволемическая гипонатриемия, вторичная по отношению к сердечной и почечной недостаточности или циррозу печени, возникает, когда задержка жидкости превышает задержку натрия, и связана с увеличением внеклеточного объема. 1
Также важно учитывать гипергликемию, которая может вызывать гипертоническую гипонатриемию, и причины псевдогипонатриемии, такие как тяжелая гиперлипидемия или гиперпротеинемия. В случае гипергликемии скорректированный натрий можно рассчитать с учетом уровня глюкозы. 3,5,6
При SIADH гипонатриемия возникает из-за несоответствующей секреции антидиуретического гормона (ADH). В нормальном физиологическом состоянии АДГ высвобождается в ответ на повышенную осмоляльность сыворотки, тогда как при SIADH секреция АДГ не регулируется. Повышенная продукция, эктопическая продукция или повышенная чувствительность к АДГ приводит к повышенной проницаемости для воды дистальных почечных канальцев и собирательного канала за счет введения аквапорина. Последующая гипонатриемия разведения активирует чувствительные к объему натрийуретические механизмы, вызывая выведение солей и поддерживая эуволемическую гипонатриемию. 3,7
«МАШИНА ПОСУДА» C гемотерапия A Нтидепрессанты, нейролептики, противосудорожные средства, противовоспалительные препараты (ингибиторы циклооксигеназы-2) R наркотики для отдыха (например, экстази) D мочегонные I ингибиторы — ингибиторы ангиотензинпревращающего фермента, селективные ингибиторы обратного захвата серотонина S ульфонилмочевина H ормоны (например, десмопрессин, окситоцин), снотворные (например, темазепам) |
Диагностика SIADH
Барртер и Шварц описывают следующие критерии диагностики SIADH: 1,3,7
- снижение осмоляльности сыворотки (<275 мОсм / кг)
- Повышенная осмоляльность мочи (> 100 мОсм / кг)
- эвволемия
- повышение натрия в моче (> 20 ммоль / л)
- отсутствие другой причины гипонатриемии (отсутствие диуретиков и отсутствие подозрений на гипотиреоз, дефицит кортизола, выраженную гиперпротеинемию, гиперлипидемию или гипергликемию).
Расследование основных причин
Растет количество исследований причин SIADH, включая секрецию ADH гипоталамусом или гипофизом (например, субарахноидальное кровотечение, менингит, антидепрессанты, туберкулез, синдром Гийена-Барре) и эктопическую продукцию, связанную со злокачественными новообразованиями (вставка 2). 1,3 Следующие исследования следует рассмотреть у пациента с эуволемической гипонатриемией: 1,3
- биохимия с учетом уровня натрия в сыворотке
- Осмоляльность сыворотки
- Осмоляльность мочи (случайный образец, собранный одновременно с образцом сыворотки)
- функциональные пробы щитовидной железы
- Уровень кортизола по утрам, если гипонатриемия потенциально связана с болезнью Аддисона
- компьютерная томография (КТ) головы при подозрении на нейрохирургическое заболевание (например, субарахноидальное кровоизлияние, субдуральная гематома) 8
- Рентген грудной клетки при подозрении на легочные причины SIADH.
Физикальное обследование, включая измерение пульса и артериального давления и оценку гидратации, также должно быть выполнено, чтобы определить, является ли пациент клинически гиповолемическим, гиперволемическим или эуволемическим.
Предлагаемый подход заключался бы в оценке степени тяжести гипонатриемии пациента и, соответственно, в проведении дальнейших исследований. В легких бессимптомных случаях перед повторным измерением уровня натрия в сыворотке можно провести обзор лекарств и исправить любые предполагаемые первопричины.В случаях, когда причина гипонатриемии не ясна и есть подозрение на SIADH, следует оценить уровень натрия в моче и осмоляльность. При тяжелой гипонатриемии, когда у пациента наблюдаются симптомы, следует направить в больницу для дальнейшего обследования и лечения. 1,3
Нейрохирургия или неврология — повышенное высвобождение АДГ:
|
Infective — повышенный выпуск ADH:
|
Респираторный — повышенное высвобождение АДГ:
|
Лекарства — повышенное высвобождение АДГ:
|
Злокачественность — эктопическая выработка АДГ:
|
Высвобождение антидиуретического пептида, не являющегося АДГ:
|
АДГ, антидиуретический гормон; SIADH, синдром неадекватной секреции антидиуретического гормона |
Менеджмент
Первыми соображениями при ведении SIADH являются лечение основных причин и оценка того, является ли пациент симптоматическим или бессимптомным.Ограничение жидкости является терапией первой линии во всех случаях SIADH. 3,7,9 Если гипонатриемия сохраняется более 48 часов и протекает бессимптомно, начальное ограничение жидкости может начинаться с 800–1200 мл в 24 часа, а затем титроваться до 500 мл ниже суточного объема диуреза. 3
Острая и тяжелая гипонатриемия с началом менее 48 часов, уровень натрия в сыворотке <120 ммоль / л и симптомы, включая изменение психического состояния и судороги, требуют госпитализации.Церебральная демиелинизация может произойти, если уровень натрия в сыворотке повышен слишком быстро. Следовательно, повышение уровня натрия в сыворотке не должно превышать 10 ммоль / л за 24 часа или 18 ммоль / л за 48 часов. 1,3 Целью лечения является улучшение симптомов (рис. 1) и получение безопасного уровня натрия> 120–125 ммоль / л. 1,3,9 В то время как ограничение жидкости остается основой терапии в этих случаях, можно также рассмотреть возможность применения гипертонического раствора, что потребует госпитализации в отделение интенсивной терапии. 1,3,9
Рис. 1. Блок-схема серьезности симптомов SIADH и управления им 2
Заключение
Гипонатриемия — одно из наиболее часто встречающихся электролитных нарушений в общей практике, при этом SIADH является важной, но часто недооцененной причиной. Он способствует повышению заболеваемости и смертности при различных состояниях, а также связан с повышенным риском падений и остеопорозом, а также с изменением психического состояния.Эуволемическая гипонатриемия с низким уровнем натрия и осмоляльности в сыворотке и повышенная осмоляльность мочи при отсутствии диуретиков или псевдогипонатриемии являются диагностическими признаками SIADH.
Следует пересмотреть использование лекарств с учетом дальнейших исследований, если есть подозрения на злокачественные новообразования или нейрохирургические заболевания. Следует лечить основные причины, и пациенты должны начать ограничение жидкости до 800–1200 мл / 24 часа. Тяжелая гипонатриемия с измененным психическим состоянием требует госпитализации для мониторинга жидкости и возможной инфузии гипертонического раствора.Во избежание церебральной демиелинизации следует проявлять осторожность и повышать уровень натрия в сыворотке с соответствующей скоростью.
Врачи общей практики играют решающую роль в предотвращении развития тяжелой симптоматической гипонатриемии, и это начинается с простого подозрения на SIADH как на первопричину.
Авторы
Кристен Ти, MBBS, DCH, CWH, регистратор общей практики с ProHealth Care, Кидман Парк, SA. [email protected]
Джерри Данг MBBS, стажер-терапевт, больница Лайелла МакЭвина, Элизабет Вейл, SA
Конкурирующие интересы: Нет.
Происхождение и экспертная оценка: Не введен в эксплуатацию, независимая экспертная оценка.
Список литературы
- Шеннон, Г. Тяжелая гипонатриемия — Распознавание и лечение. Aust Presc 2011; 34: 42–45.
- Laville M, Burst V, Peri A, Verbalis JG. Гипонатриемия, вторичная по отношению к синдрому неадекватной секреции антидиуретического гормона (SIADH): принятие терапевтических решений в реальных случаях. Clin Kidney J 2013; 6 (Дополнение 1): i1 – i20.
- Peri A, Pirozzi N, Parenti G, Festuccia F, Menè P.Гипонатриемия и синдром неадекватной секреции антидиуретического гормона (SIADH). J Endocrinol Invest 2010; 33 (9): 671–82.
- Huda MS, Boyd A, Skagen K, et al. Исследование и лечение тяжелой гипонатриемии в условиях стационара. Postgrad Med J 2006; 82 (965): 216–19.
- Лиамис Дж., Либеропулос Э., Баркас Ф., Элизаф М. Ложные электролитные нарушения: диагностическая проблема для клиницистов. Am J Nephrol 2013; 38 (1): 50–57.
- BMJ Best Practice. Синдром несоответствующего антидиуретического хромона.Лондон: Издательская группа BMJ, 2017. Доступно по адресу http://bestpractice.bmj.com/best-practice/monograph/196/diagnosis/differential.html [по состоянию на 6 августа 2017 г.].
- Пиллай Б.П., Умникришнан АГ, Павитран П.В. Синдром несоответствующей секреции антидиуретического гормона: возвращение к классическому эндокринному заболеванию. Индийский журнал J Endocrinol Metab 2011; 15 (Приложение 3): S208–15.
- Хэннон MJ, Томпсон CJ. Синдром несоответствующего антидиуретического гормона: распространенность, причины и последствия.Eur J Endocrinol 2010; 162 (Приложение 1): S5–12.
- Sterns RH, Nigwekar SU, Hix JK. Лечение гипонатриемии. Семин Нефрол 2009; 29 (3): 282–99.
Переписка [email protected]
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать или загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как …». Следуйте подсказкам, чтобы выбрать место.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader. Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word. Они будут иметь «DOC» в скобках вместе с размером файла для загрузки. Для просмотра этих документов вам понадобится программа, которая может читать формат Microsoft Word. Если у вас ничего нет, вы можете бесплатно скачать MS Word Viewer.
MP3 Большинство веб-браузеров воспроизводят аудио в формате MP3 в браузере
Синдром несоответствующего антидиуретического гормона | патология
Синдром несоответствующего антидиуретического гормона (SIADH) , расстройство, характеризующееся чрезмерным выделением натрия с мочой, что вызывает гипонатриемию (снижение концентрации натрия в плазме крови).
Британская викторина
44 вопроса из самых популярных викторин «Британника» о здоровье и медицине
Что вы знаете об анатомии человека? Как насчет медицинских условий? Мозг? Вам нужно будет много знать, чтобы ответить на 44 самых сложных вопроса из самых популярных викторин Britannica о здоровье и медицине.
SIADH вызывается чрезмерной нерегулируемой секрецией вазопрессина (антидиуретического гормона), гормона, который высвобождается из задней доли гипофиза в результате активации гипоталамуса в ответ на физиологические сигналы. При этом синдроме секреция вазопрессина неуместна, поскольку она не стимулируется высокими концентрациями растворенных веществ в сыворотке (высокая осмоляльность) или низким объемом плазмы — факторами, которые обычно активируют гипоталамус и тем самым запускают высвобождение гормона гипофизом.Избыток вазопрессина стимулирует реабсорбцию воды почками, что приводит к увеличению объема внеклеточной жидкости и снижению сывороточных концентраций натрия, хлорида и других веществ. Эти процессы приводят к образованию концентрированной мочи и являются отражением активности вазопрессина.
Нет опухолей задней доли гипофиза, выделяющих избыточное количество вазопрессина; однако другие опухоли, особенно опухоли легких, могут секретировать большое количество вазопрессина, вызывая SIADH.Другие причины избыточной секреции вазопрессина включают опухоли головного мозга, другие нарушения центральной нервной системы, дефицит адренокортикотропного гормона и некоторых лекарств (таких как опиаты, карбамазепин и некоторые противоопухолевые препараты). Каждое из этих состояний может привести к активации гипоталамо-задней гипофизарной системы и стимуляции высвобождения вазопрессина независимо от обычных регуляторных факторов.
Начало симптомов может быть острым или хроническим, с внезапной или постепенной потерей аппетита, тошнотой и рвотой, сонливостью, спутанностью сознания и дезориентацией и, в конечном итоге, судорогами, комой и смертью.Когда начало очень медленное, симптомов может быть немного или они вообще не проявляются.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Первоначальное лечение SIADH обычно включает ограничение потребления воды и устранение первопричины, если она известна. Пациентов с очень низкой концентрацией натрия в сыворотке можно лечить путем внутривенного введения концентрированных солевых растворов вместе с диуретиком. Это позволяет концентрации растворенных веществ в сыворотке крови увеличиваться, а объем плазмы — уменьшаться.
Синдром несоответствующей секреции антидиуретического гормона
Последнее обновление: 21 апреля 2021 г.
Резюме
Синдром несоответствующей секреции антидиуретического гормона (SIADH) — это эндокринное заболевание, вызванное повышенной секрецией ADH в гипофизе (например, из-за инфекции). , лекарства), эктопическое производство АДГ (например, мелкоклеточный рак легкого) или усиленная стимуляция АДГ в почках в результате мутации гена. Гипонатриемия развивается в результате повышенной задержки воды почками (не из-за дефицита натрия) и системной перегрузки жидкостью.SIADH обычно протекает бессимптомно, а гипонатриемия часто является случайной находкой в лабораторных результатах. В легких случаях симптомы включают потерю аппетита и тошноту; в тяжелых случаях могут возникнуть судороги и нарушение сознания. Лечение зависит от тяжести заболевания и варьируется от ограничения жидкости (бессимптомные пациенты) до введения гипертонического раствора (тяжелые случаи).
Этиология
Повышенная секреция АДГ гипофизом
[1]
Состояние ЦНС
Хроническое заболевание
Лекарственные препараты
Нефрогенный SIADH
[4]
Патофизиология
Другие клинические признаки
Клинические особенности
Пациенты с SIADH обычно эуволемичны, нормотензивны и не имеют отеков.У пациента с гипонатриемией и отеком следует подозревать другие состояния (например, застойную сердечную недостаточность).
Диагностика
Кровь
Моча
[5]
Дифференциальный диагноз
См. «Гипонатриемия».
Перечисленные здесь дифференциальные диагнозы не являются исчерпывающими.
Лечение
Подход
- В целом: лечение основного состояния
- Конкретные меры зависят от того, есть у пациента симптомы или нет.
Бессимптомные пациенты
- Ограничение жидкости
- Повышенное потребление соли
Симптоматические пациенты
Уровни натрия в сыворотке должны повыситься максимум на 10 ммоль / л в течение 24 часов или на 0,5 ммоль / л в час.
Быстрое повышение уровня натрия в сыворотке может привести к синдрому осмотической демиелинизации!
Антагонисты вазопрессина (АДГ) (ваптаны)
- Агенты
- Механизм действия: антагонизм к рецепторам вазопрессина в собирательных протоках почек → ↑ акварель (т.е., свободное водообразование)
- Показания
- Побочные эффекты
- Тошнота, рвота, боли в желудке
- Повышение жажды, голода, мочеиспускания
- Похудание
- Противопоказания
Демеклоциклин
- Механизм действия [7]
- Показания
- Бактериальные инфекции (в первую очередь антибиотики)
- SIADH, используя один из его побочных эффектов
- Побочные эффекты
- Взаимодействия
- Противопоказания
Список литературы
Сахай М., Сахай Р.Гипонатриемия: практический подход. Индийский журнал эндокринологии и метаболизма . 2014; 18
(6): с.760.
DOI: 10.4103 / 2230-8210.141320. | Открыть в режиме чтения QxMDСоларес И., Техедор М., Жерико Д. и др. Лечение гипонатриемии, связанной с острой порфирией — предложение по применению толваптана. Анналы трансляционной медицины . 2020; 8
(17): с.1098-1098.
DOI: 10.21037 / атм-20-1529. | Открыть в режиме чтения QxMDФарах Р., Фарах Р.Экстази (3,4-метилендиоксиметамфетамин) — индуцированная несоответствующая секреция антидиуретического гормона. Скорая педиатрическая помощь . 2008; 24
(9): с.615-617.
DOI: 10.1097 / pec.0b013e3181850c91. | Открыть в режиме чтения QxMDФельдман Б.Дж., Розенталь С.М., Варгас Г.А. и др. Нефрогенный синдром несоответствующего антидиуреза. N Engl J Med . 2005; 352
(18): с.
