Трипаносомоз (Сонная болезнь) что это? Симптом и лечение| H-Clinic
14.12.2020
Трипаносомоз — еще одно заболевание, вызываемое простейшими, а в частности простейшими рода Trypanosome.
Патогенными для человека являются T.brucei и T.cruzi, которые занимают различные территории и передаются разными насекомыми.
Трипаносомоз, вызываемый T.brucei, также называется африканским или сонной болезнью, из названия понятно, какой район для него эндемичен.
Всемирная организация здравоохранения поставила цель ликвидировать африканский трипаносомоз, и в результате усилий по борьбе с этой инфекцией число зарегистрированных случаев заболевания во всем мире в течение последних 20 лет резко сократилось (>95%).
Различают две формы африканского трипанососмоза — гамбийскую (вызываемую T.b.gambiense, распространенную в Западной и Центральной Африке) и родезийскую (вызываемую T. b.rhodesiense, эндемичной для Восточной Африки).
b.rhodesiense, эндемичной для Восточной Африки).
Данные формы имеют свои особенности:
При гамбийском трипаносомозе основным хозяином является человек, а второстепенным свинья. Переносчиком возбудителя является муха цеце (обитает в зарослях растительности по берегам рек и ручьев, проявляет наибольшую активность в светлое время суток).
При родезийской форме основными хозяевами и источником инфекции являются животные (антилопы, крупный рогатый скот, овцы) и реже человек. Возбудителя родезийского трипаносомоза также переносят мухи цеце, но обитающие в саваннах и саванных лесах, более светолюбивые и менее требовательны к влаге.
Человек заражается при укусе мухи цеце, у которой в слюнных железах содержатся инвазионные формы трипаносом (это значит, что трипаносомоз — это трансмиссивное заболевание, но также существует вертикальная передача инфекции — от матери к плоду).
После укуса мухи трипаносомы размножаются в подкожно-жировой клетчатке (на месте входных ворот инфекции формируются шанкр), далее через несколько дней распространяются по лимфатическим и кровеносным сосудам и в дальнейшем продолжают паразитировать в органах и тканях, основные это лимфатическая система, центральная нервная система и сердце.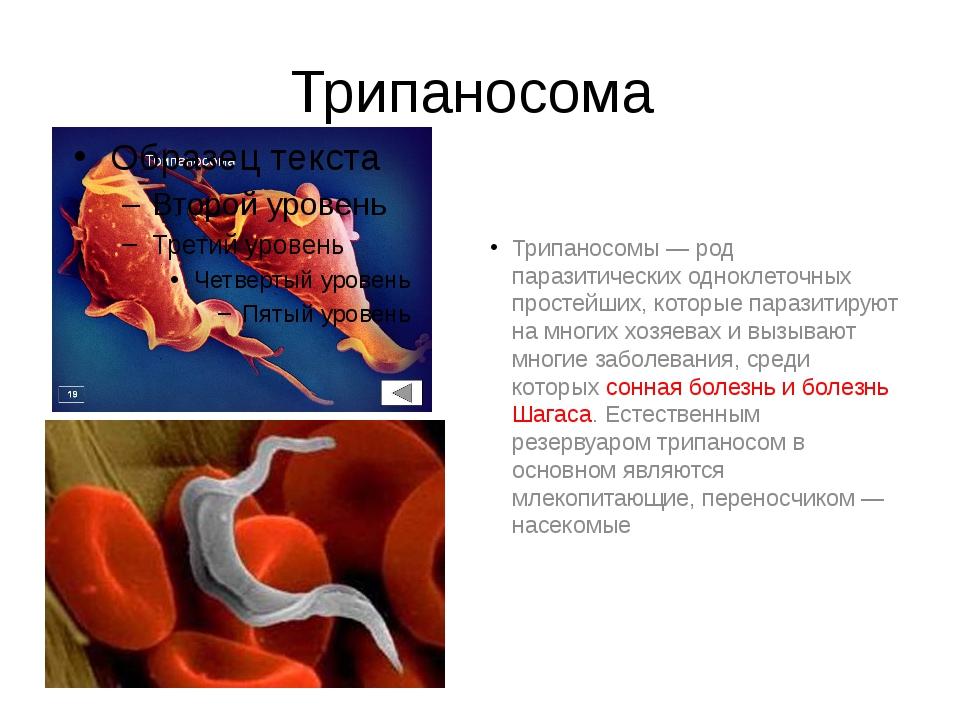 Антитела, выработанные в ответ на внедрение паразита, подавляют его размножение, но в результате изменения комбинации гликопротеинов на своей поверхности трипаносомы могут ускользнуть от иммунного ответа хозяина и запустить новый цикл размножения, с чем связано чередование обострений и ремиссий заболевания.
Антитела, выработанные в ответ на внедрение паразита, подавляют его размножение, но в результате изменения комбинации гликопротеинов на своей поверхности трипаносомы могут ускользнуть от иммунного ответа хозяина и запустить новый цикл размножения, с чем связано чередование обострений и ремиссий заболевания.
Больной заразен, начиная с 10 дня после укуса и в течение всего времени клинических проявлений.
Клинические проявления имеют три стадии: кожная, гемолимфатическая и стадия поражения ЦНС. Клиническая картина родезийского трипаносомоза отличается более острым и тяжелым течением и ранним поражением центральной нервной системы, прогноз более тяжелый.
При кожной стадии папула может развиться на месте укуса мухи цеце в течение нескольких дней до 2 недель. Она развивается в темновато-красный, болезненный, плотный узелок, который может изъязвляться (трипаносомный шанкр). Шанкр чаще встречается при инфицировании T. b. rhodesiense, и у туристов, нежели коренного населения.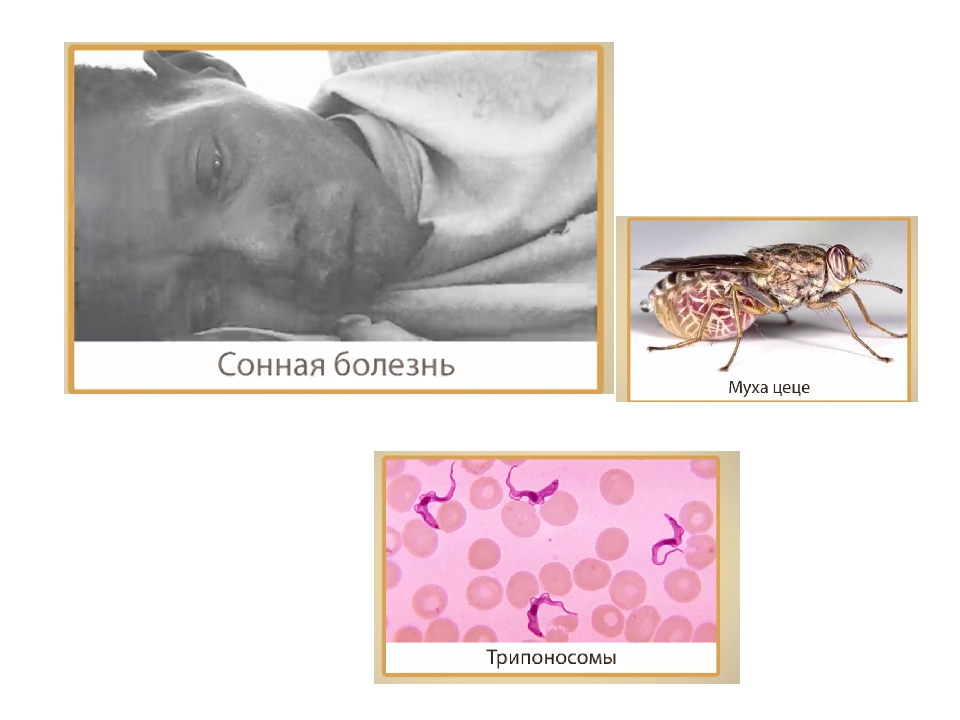
Гемолимфатическая стадия развивается в течение нескольких месяцев при инфицировании T. b. gambiense и нескольких недель — при заражении T. b. rhodesiense. Характерны перемежающаяся лихорадка, головные боли, озноб, мышечные и суставные боли, гиперестезия, лимфаденопатия и отек лица. У светлокожих пациентов может наблюдаться эритематозная сыпь в виде кольцевых эритем до 7-10 см в диаметре. Для гамбийской формы характерен симптом Уинтерботтома (увеличение лимфоузлов в заднем шейном треугольнике).
Стадия поражения ЦНС при гамбийской форме длится от нескольких месяцев до нескольких лет после начала острой болезни. При родезийской форме болезнь более быстрая, и поражение нервной системы часто происходит в течение нескольких недель. Поражение ЦНС вызывает постоянную головную боль, неспособность сконцентрироваться, поведенческие изменения (например, прогрессирующая усталость и безразличие), дневную сонливость, тремор, атаксию и в итоге кому. Без лечения смерть наступает в течение нескольких месяцев от начала заболевания в случае T. b. rhodesiense и в течение 2-3 лет в случае T. b. gambiense. Пациенты без лечения умирают в коме от истощения или вторичных инфекций.
b. rhodesiense и в течение 2-3 лет в случае T. b. gambiense. Пациенты без лечения умирают в коме от истощения или вторичных инфекций.
Для диагностики трипаносомоза используется световая микроскопия крови (тонкий или толстый мазок) или пунктата лимфоузла. Концентрация трипаносом в крови часто низкая, поэтому различные концентрационные методики увеличивают чувствительность диагностических методов. Серологической обследование часто неинформативно.
Всем пациентам с африканским трипаносомозом должна быть выполнена люмбальная пункция и исследование спинномозговой жидкости для определения стадии заболевания. При вовлечении СМЖ в патологический процесс наблюдается повышение уровней лимфоцитов (≥ 6 клеток/мкл), общего белка и неспецифического IgM.
Лечение африканского трипаносомоза зависит от вида возбудителя и стадии заболевания.
Для предотвращения африканского трипаносомоза необходимо избегать эндемичных районов и предохраняться от укусов мух цеце. Следует носить закрытую одежду, использовать репелленты.
Следует носить закрытую одежду, использовать репелленты.
Американский трипаносомоз (или болезнь Шагаса) вызывается T.cruzi. Болезнь характеризуется хроническим течением с преимущественным поражением сердца, желудочно-кишечного тракта и нервной системы.
Трипаносома крузи передается клопами подсемейства Triatominae (поцелуйные клопы) и эндемична в Южной и Центральной Америке, Мексике, редко в США. К носителям, помимо людей, относятся домашние собаки, опоссумы, броненосцы, крысы, еноты и многие другие животные. Значительно реже происходит передача при употреблении в пищу зараженных инфицированными клопами или их испражнениями тростникового сока или пищи, трансплацентарно от инфицированной матери плоду либо при переливании крови или трансплантации органов от инфицированного донора.
Патогенез заболевания сходен с таковым для африканского трипаносомоза.
Клинически болезнь Шагаса протекает в трех стадиях: острая, латентная и хроническая.
Острая болезнь Чагаса в эндемичных районах обычно развивается у детей и может быть бессимптомной. Симптомы могут появляться через 1–2 недели после заражения. на месте внедрения паразита появляется эритематозное поражение кожи. Если место инвазии – конъюнктива, развивается односторонний периокулярный отек с конъюнктивитом и увеличением расположенных перед ушной раковиной лимфатических узлов (симптом Романьи).
Острая болезнь Чагаса смертельна у небольшого процента пациентов. К смерти приводят острый миокардит с сердечной недостаточностью или менингоэнцефалит. У остальных симптомы утихают без лечения.
Первичная острая болезнь Чагаса у пациентов ВИЧ-инфекцией в продвинутой стадии может протекать в тяжелой и нетипичной форме – не только с поражениями кожи, но и с развитием абсцесса головного мозга.
Латентная стадия не имеет никаких клинических проявлений и может быть выявлена только при скрининговом серологическом обследовании.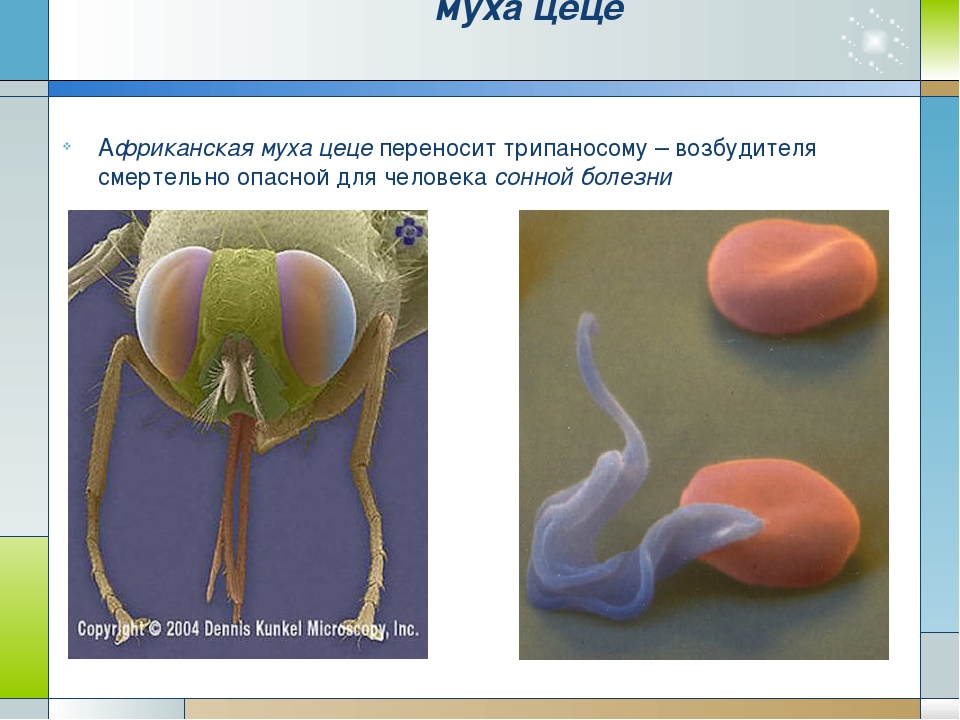
Хроническая болезнь Шагаса развивается у 20–30% пациентов после латентной фазы, которая может тянуться годы или десятилетия. Вероятнее всего этому способствует аутоиммунная реакция организма с преимущественным поражением сердца и желудочно-кишечного тракта.
Сердечные нарушения обычно манифестируют нарушениями проводимости, в том числе блокадой правой ножки пучка Гиса или блокадой передней ветви левой ножки пучка Гиса. Хроническая кардиомиопатия часто приводит к слабому расширению всех полостей сердца, апикальным аневризмам и прогрессированию поражения проводящей системы сердца. У пациентов наблюдается сердечная недостаточность, обмороки, внезапная смерть из-за блокады сердца, желудочковой аритмии или тромбоэмболии.
Поражение желудочно-кишечного тракта проявляется как мегаэзофагус — дисфагия, которая может привести к легочным инфекциям или к серьезной гипотрофии. Или мегаколон, который приводит к кишечной непроходимости.
Для диагностики во время острой фазы болезни информативен анализ тонкого и толстого мазков крови, микроскопия окрашенных препаратов пунктата лимфоузлов.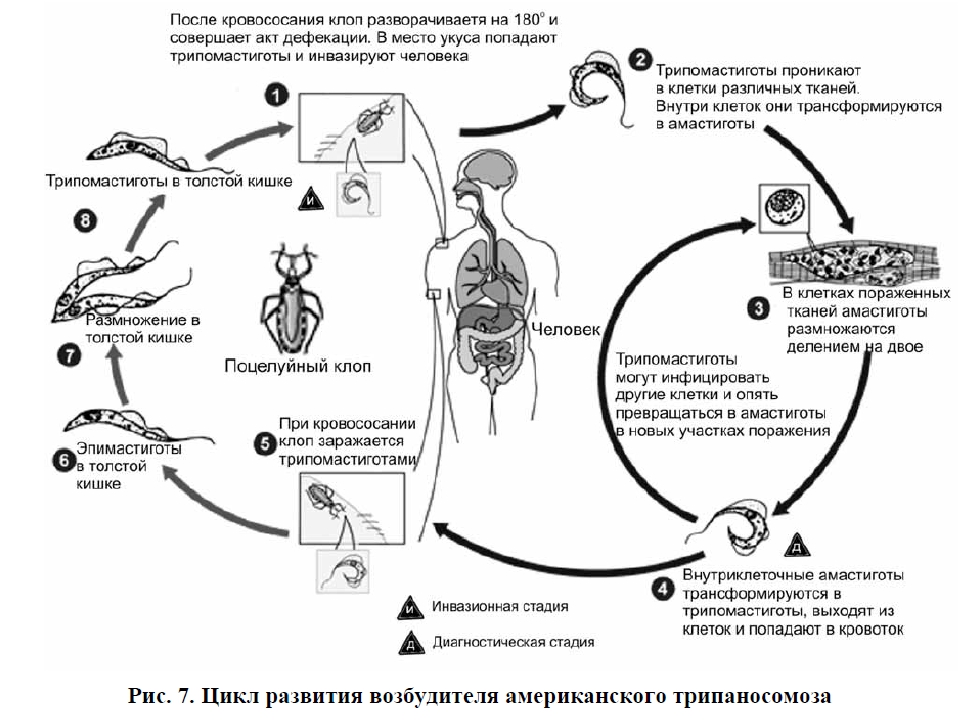 Напротив, для латентной инфекции или хронической болезни характерно небольшое количество паразитов в крови, в связи с чем могут быть использованы методы концентрации. Серологические исследования могут использоваться как скрининговые, положительный результат требует дообследования.
Напротив, для латентной инфекции или хронической болезни характерно небольшое количество паразитов в крови, в связи с чем могут быть использованы методы концентрации. Серологические исследования могут использоваться как скрининговые, положительный результат требует дообследования.
Антипаразитарное лечение показано для всех случаев болезни в острой стадии, пациентам с врождённой формой болезни либо с реактивированной инфекцией, а также детям до 18 лет в латентной стадии заболевания. Чем моложе пациент и чем раньше начато лечение, тем с большей вероятностью оно приведёт к паразитологическому выздоровлению.
Эффективность лечения снижается по мере увеличения продолжительности инфекции, а побочные эффекты более вероятны у взрослых. Лечение рекомендуется проводить лицам в возрасте до 50 лет, если нет признаков прогрессирующего повреждения сердца или желудочно-кишечного тракта. В случае пациентов старше 50 лет лечение подбирают индивидуально, с учетом возможных рисков и пользы.
При появлении выраженных симптомов хронической болезни Шагаса со стороны сердечно-сосудистой или пищеварительной системы противопаразитарные препараты не рекомендуются.
Патогенетическая терапия включает лечение сердечной недостаточности, применение кардиостимуляторов при блокаде сердца, антиаритмических препаратов, трансплантацию сердца, расширение пищевода, инъекции ботулотоксина в нижний сфинктер пищевода и оперативные вмешательства при мегаколон.
Профилактика болезни Шагаса включает мероприятия, направленные на снижение численности клопов а также меры индивидуальной защиты, например сетки на кровать при необходимости ночевать в глиняном жилье.
Будьте здоровы, путешествуйте, но не забывайте о мерах индивидуальной защиты. И если все же не удалось избежать укусов мухи цеце или поцелуйного клопа — будьте внимательны к себе, ведь даже в течение нескольких месяцев и лет могут появиться признаки паразитарного заболевания. И Вы уже знаете, куда обратиться за помощью!
И Вы уже знаете, куда обратиться за помощью!
Услуги, упомянутые в статье*:
Микроскопическое исследование венозной крови методом концентрации на возбудителей филяриатозов и трипаносомозов (А26.05.010.s01)
Микроскопическое исследование крови методом толстой капли на возбудителей филяриатозов, трипаносомозов (А26.05.010.s02)
*Назначение и интерпретация результатов анализов должны проводиться только лечащим врачом
Возврат к списку
Публикации в СМИ
Трипаносомозы — протозойные инфекции, вызываемые жгутиковыми простейшими рода Trypanosoma; протекают в форме африканского (гамбийского и родезийского) трипаносомоза, или сонной болезни и американского трипаносомоза (болезнь Чагаса).
Этиология. Возбудитель гамбийского трипаносомоза — Trypanosoma brucei var. gambiense; родезийского трипаносомоза — Trypanosoma brucei var.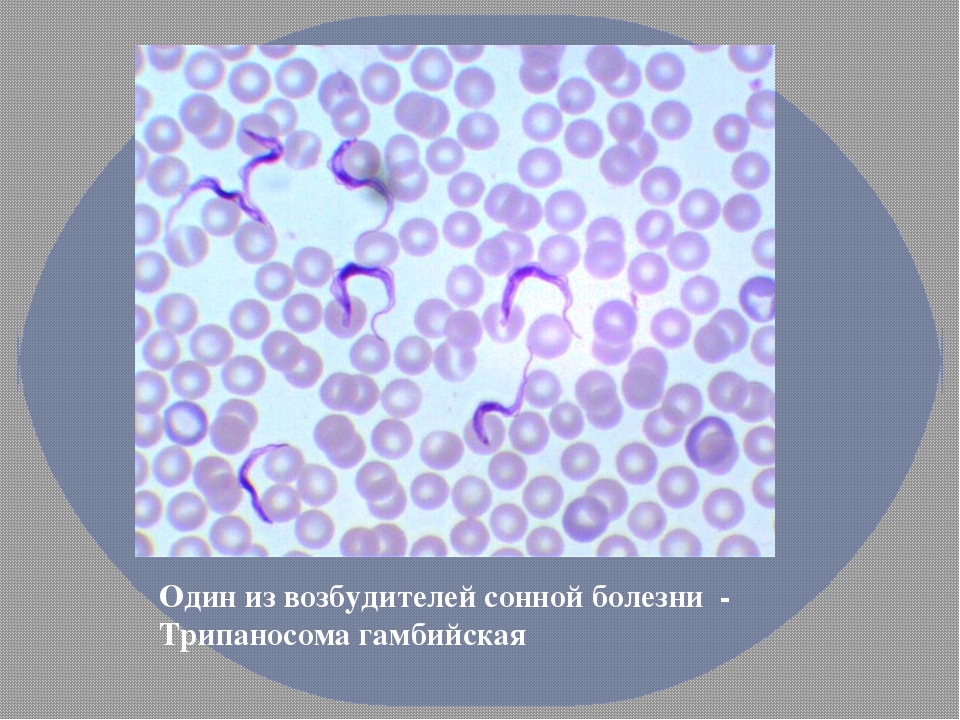 rhodesiense. Возбудитель болезни Чагаса — Trypanosoma cruzi.
rhodesiense. Возбудитель болезни Чагаса — Trypanosoma cruzi.
Эпидемиология • Переносчик гамбийского трипаносомоза — муха цеце Glossina palpalis, обитающая в зарослях рек и озёр. Природный резервуар возбудителя — больной человек. Заболевание чаще регистрируют в Центральной Африке, особенно в местах, расположенных по берегам водоёмов • Переносчик родезийского трипаносомоза — муха цеце Glossina morsitans, обитающая в саваннах Восточной Африки. Природный резервуар — различные мелкие антилопы. Заражение чаще происходит при выпасе скота или на охоте. Пути передачи — от человека человеку и от человека домашним животным. Заболевание распространено в Замбии и Танзании • Переносчики болезни Чагаса — клопы рода Triatoma и близкие им формы семейства Reduviidae. Болезнь развивается при загрязнении ран заражёнными испражнениями переносчиков или при переливании заражённой крови. Заболевание регистрируют в Южной Америке, особенно в Бразилии, Аргентине, Чили.
Заболевание регистрируют в Южной Америке, особенно в Бразилии, Аргентине, Чили.
Клиническая картина
• Африканский трипаносомоз •• Продолжительность инкубационного периода — 2–3 нед. У некоторых пациентов через 2–3 дня на месте укуса переносчика образуется изъязвляющаяся папула (шанкр). В начальной стадии клинические проявления отсутствуют, но возбудитель бурно размножается в месте проникновения и диссеминирует по лимфатической системе в кровоток. У некоторых больных наблюдают регионарную лимфаденопатию (особенно затылочных лимфатических узлов). В стадии паразитемии циркуляция возбудителя в кровотоке достигает своего пика через 2–3 нед и вызывает развитие характерного симптомокомплекса: эритематозные пятна и локальные отёки, боли различной локализации, судороги, тремор и парестезии, увеличение лимфатических узлов, селезёнки и печени, истощение и вечерние подъёмы температуры тела; на поздних стадиях возникают нарушения сознания.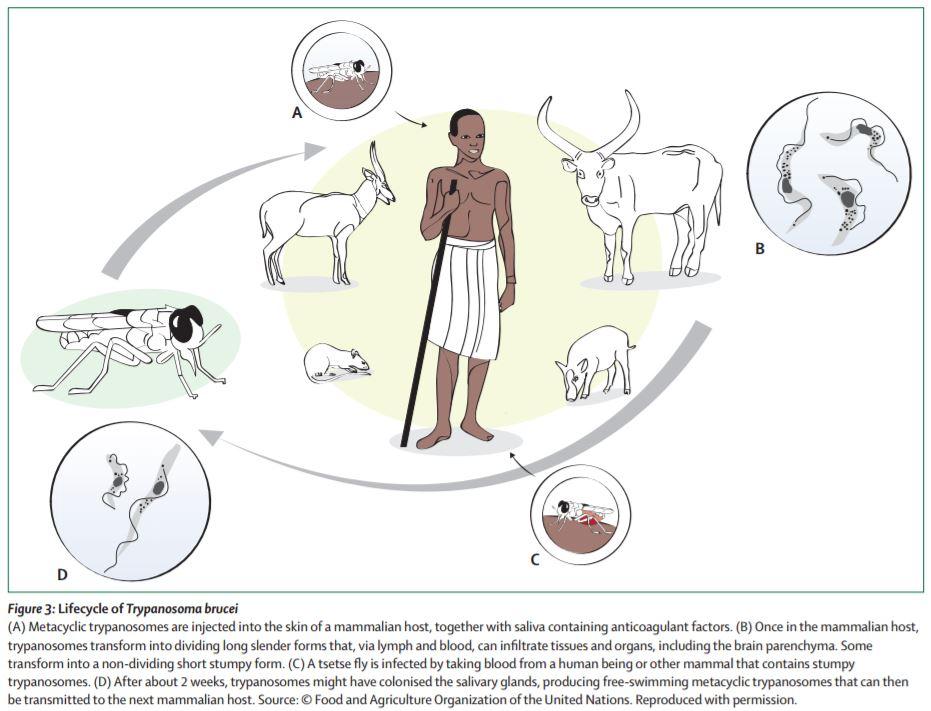 Возможны психические расстройства. Поражения ЦНС развиваются в течение нескольких лет после начала заболевания: сонливость, тремор конечностей, транзиторные параличи, нарушения речи, потеря контроля за сфинктерами •• Родезийский трипаносомоз протекает тяжелее, с поражением головного мозга и миокарда, развивающимся уже через 3–6 нед после начала заболевания. Характерны кома, судороги, острая сердечная недостаточность, сильное истощение, приводящие к смерти больного в течение 6–9 мес.
Возможны психические расстройства. Поражения ЦНС развиваются в течение нескольких лет после начала заболевания: сонливость, тремор конечностей, транзиторные параличи, нарушения речи, потеря контроля за сфинктерами •• Родезийский трипаносомоз протекает тяжелее, с поражением головного мозга и миокарда, развивающимся уже через 3–6 нед после начала заболевания. Характерны кома, судороги, острая сердечная недостаточность, сильное истощение, приводящие к смерти больного в течение 6–9 мес.
• Болезнь Чагаса (южноамериканский трипаносомоз) •• Острая форма (наблюдают преимущественно у маленьких детей). На ранних стадиях характерны лихорадка, лимфаденопатия, увеличение печени, отёк лица. Иногда регистрируют менингоэнцефалиты с судорожным синдромом, приводящие к умственным и физическим дефектам или смерти. Часто развивается острый миокардит с возможным летальным исходом •• Хроническая форма протекает легко, иногда бессимптомно, но может сопровождаться миокардиопатией, мегаэзофагусом и мегаколоном с летальным исходом. В Бразилии и Аргентине чаще наблюдают тяжёлые формы, в Чили — лёгкие.
В Бразилии и Аргентине чаще наблюдают тяжёлые формы, в Чили — лёгкие.
Методы исследования • Выделение возбудителя. Материалы для исследования: ликвор, кровь, биопсийный материал лимфатических узлов. Центрифугирование облегчает обнаружение возбудителя в крови и ликворе. При поражении ЦНС кровь и лимфатические узлы возбудителя не содержат. В начальной стадии заболевания возбудителя обнаруживают в месте укуса и в шейных лимфатических узлах • При отрицательных результатах микроскопии исследуемый материал вводят белым мышам или крысам (п/к или в/м). На 2–3-е сутки в крови обнаруживают возбудителя • Серологические исследования выявляют АТ класса IgM в диагностических титрах у всех больных • При изучении гистологических препаратов секционного материала обнаруживают сходство поражений ЦНС при африканских трипаносомозах и сифилисе.
ЛЕЧЕНИЕ • Эфлорнитин 400 мг/кг/сут в/в в 4 приёма в течение 14 дней — на ранних и поздних стадиях гамбийского трипаносомоза • Сурамин сначала в пробной дозе 100 мг в/в, на следующий день и далее на 3, 7, 14, 21 дни — по 1 г в/в (всего 5 г) (детям после пробной дозы 100 мг — по 20 мг/кг) — при родезийском трипаносомозе • Меларсопрол — 3 курса по 3 сут, в течение которых вводят 3,6 мг/кг/сут в/в. Второй курс назначают через 1 нед после первого, третий — не позднее, чем через 3 нед после второго (для детей начальная доза — 0,36 мг/сут с постепенным повышением до 3,6 мг/сут в/в 1 раз в 1–5 сут, курс лечения — 9–10 доз) — на всех стадиях гамбийского и родезийского трипаносомозов, особенно показан при родезийской форме с поражением ЦНС • Пентамидин • Пентадион.
Второй курс назначают через 1 нед после первого, третий — не позднее, чем через 3 нед после второго (для детей начальная доза — 0,36 мг/сут с постепенным повышением до 3,6 мг/сут в/в 1 раз в 1–5 сут, курс лечения — 9–10 доз) — на всех стадиях гамбийского и родезийского трипаносомозов, особенно показан при родезийской форме с поражением ЦНС • Пентамидин • Пентадион.
Течение и прогноз. Течение обычно хроническое прогрессирующее. Может персистировать в течение нескольких месяцев или лет с последующим поражением ЦНС.
Профилактика • Профилактика африканского трипаносомоза •• В эндемичных районах рекомендуют носить одежду, закрывающую руки и ноги •• Пентамидин 4 мг/кг в/м обеспечивает защиту от гамбийского трипаносомоза (может маскировать заражение и приводить к почечной недостаточности) • Профилактика болезни Чагаса •• Избегать посещения ветхих домов и надворных построек •• Использование защитных сеток и инсектицидов •• Опрыскивание 5% р-ром g-бензолгексахлорида.
МКБ-10 • B56 Африканский трипаносомоз
Сонная болезнь — признаки, причины, симптомы, лечение и профилактика
Диагностика
Африканский трипаносомоз диагностируется терапевтом (инфекционистом) после взятия мазка крови и биопсии лимфатического узла. Необходимой может быть и проба спинномозговой жидкости (берется при помощи люмбальной пункции).
Окончательный вердикт поставят после выявления трипаносом в крови, костном мозге, пунктате. Обычно исследуют как тонкие, так и толстые мазки крови и лейкоконцентрат, выделяющийся из цельной плазмы, которую берут для обследования каждый день на протяжении десяти суток. Если паразит не выявлен, подтвердить окончательный диагноз позволит изучение нативного компонента из препарата, полученного в ходе взятия пункции лимфоузла.
Для определения этапа болезни проводят анализ спинномозговой жидкости. Если поражена центральная нервная система, анализ покажет повышенный уровень белка. На поздних этапах обнаруживается повышенный уровень IgM.
На поздних этапах обнаруживается повышенный уровень IgM.
Лечение
Заболевание поддается медикаментозному лечению. Используются токсические препараты, являющиеся довольно эффективными средствами для борьбы с возбудителем (соединение мышьяка и пентамидина, сурамин). В зависимости от периода воспалительного процесса и характера течения недуга больному может потребоваться индивидуальный курс лечения. Иногда может возникнуть необходимость записаться на прием к врачу-невропатологу.
Профилактика
Не допустить заражения трипаносомозом можно, исключив пребывание в местах активности мухи цеце. Нужно носить светлую одежду с рукавами и иметь при себе средства, отпугивающие насекомых. Защититься можно также благодаря специфическим мерам профилактики. К ним относится применение пентамидина, который вводится внутримышечно. Делается это один раз в полгода, причем второе введение стоит совершать под наблюдением врача и только при строгой необходимости. Помните о том, что посещение Африканского континента возможно только после проведения всех жизненно важных прививок, которые помогут сохранить здоровье и защитить организм от вредоносных насекомых в чуждой для вас местности.
Литература и источники
Видео по теме:
Трипаносомы (Tripanosoma). Виды. Жизненый цикл. Диагностика. Профилактика
Трипаносомы (Tripanosoma). Виды. Жизненый цикл. Диагностика. Профилактика
Возбудителями трипаносомозов являются трипано-сомы (класс жгутиковые). Африканские трипаносомозы вызывают Tripanosoma bruceigambiensi и T. b. rhodesien-se. Американский трипаносомоз (болезнь Чагаса) вызывает Tripanosoma cruzi.
Паразит имеет изогнутое тело, сплющенное в одной плоскости, заостренное с обеих сторон. Размеры – 15–40 мкм. Стадии, обитающие в организме человека, имеют 1 жгутик, ундулирующую мембрану и кине-топласт, расположенный у основания жгутика.
Обитает в плазме крови, лимфе, лимфатических узлах, спинномозговой жидкости, веществе головного и спинного мозга, серозных жидкостях.
Заболевание повсеместно распространено по территории всей Африки.
Трансмиссивное заболевание с природной очаговостью. Возбудитель трипаносомоза развивается со сменой хозяев. Первая часть жизненного цикла проходит в организме переносчика. Tripanosoma brucei gambiensi переносится мухами цеце Glossina palpalis (обитает вблизи человеческого жилища), T. b. rhodes-iense, Glossina morsitans (в открытых саваннах). Вторая часть жизненного цикла протекает в организме окончательного хозяина, в качестве которого могут выступать крупный и мелкий рогатый скот, человек, свиньи, собаки, носороги, антилопы.
При укусе мухой цеце человека трипаносомы попадают в ее желудок, где размножаются и проходят несколько стадий. Полный цикл развития занимает 20 дней. Мухи, в слюне которых содержатся трипаносомы в инвазионной (метациклической) форме, при укусе могут заразить человека.
Сонная болезнь без лечения может протекать долго (до нескольких лет). У больных наблюдаются прогрессирующая мышечная слабость, истощение, сонливость, депрессия, умственная заторможенность. Возможно самоизлечение, но чаще всего без лечения болезнь заканчивается летально. Трипаносомоз, вызываемый T. b. Rhodesiense, протекает более злокачественно и заканчивается летальным исходом через 6–7 месяцев после заражения.
Диагностика. Исследуют мазки крови, спинномозговой жидкости, проводят биопсию лимфатических узлов, в которых видны возбудители.
Tripanosoma cruzi– возбудитель американского трипаносомоза (болезни Чагаса). Для возбудителя характерна способность к внутри-клеточному обитанию. Размножаются только в клетках миокарда, нейроглии и мышц (в виде безжгутиковых форм), но не в крови.
Переносчики – триатомовые клопы. В их теле три-паносомы размножаются. После укуса клопы испражняются, возбудитель в стадии инвазионности попадают с фекалиями в ранку. При этой болезни характерны миокардиты, кровоизлияния в мозговые оболочки, их воспаление.
Диагностика. Обнаружение возбудителя в крови (в остром периоде). При хроническом течении – заражение лабораторных животных.
Профилактика. Борьба с переносчиками, профилактическое лечение здоровых людей в очагах трипа-носомозов, делающее организм невосприимчивым к возбудителю.
108. Трипаносомы. Систематика, морфология, циклы развития, обоснование лабораторной диагностики, профилактика.
Trypanosoma
brucei gambiense
и
T.b.
rhodesiense
(кл.
Жгутиковые)
— возбудители африканского
трипаносомоза,
или сонной
болезни.
Паразит имеет извилистую заостренную
с обеих сторон форму. Длина его 17—28 мкм.
Стадии, паразитирующие у человека, имеют
один жгутик, ундулирующую мембрану
сбоку и хорошо заметный кинетопласт у
основания жгутика.
Трипаносомы
поселяются у человека в крови, лимфе,
спинномозговой жидкости, в тканях
головного и спинного мозга и в серозных
полостях. T.b.
gambiense
встречается в Западной Африке, а T.b.
rhodesiense
— в Восточной
и Юго-Восточной Африке.
Жизненный
цикл этих
паразитов протекает в организме человека,
домашних и диких млекопитающих, в первую
очередь копытных. T.b.
gambiense
чаще поражает человека, свиней и собак,
T.b.
rhodesiense
— диких
животных — антилоп и носорогов.
Переносчиком первого подвида является
муха це-це ,Glossina
palpalis,
живущая поблизости от жилища человека,
второго— G.
morsitans,
обитающая в открытых саваннах и саванновых
лесах. В связи с этим сонная болезнь,
возбудителем которой является T.b.
gambiense,
встречается в антропогенных очагах
культурных ландшафтов. Ежегодно
регистрируется около 10 000 новых случаев
заражения. Восточноафриканский
трипаносомоз распространен значительно
реже в естественной природе. В основном
заболевают охотники, туристы, сезонные
рабочие, каждый год — около 1500 человек.
Сонная
болезнь без лечения протекает около 5
лет и выражается в нарастающей мышечной
слабости, депрессии, истощении и
сонливости. Возможны случаи самоизлечения,
но обычно заболевание заканчивается
смертью больного.
Восточноафриканский
трипаносомоз протекает более
злокачественно, длится не более 6 мес.
и также заканчивается смертью.
Для
паразитирования трипаносом у млекопитающих
и человека характерны циклические
подъемы интенсивности инвазии за счет
их размножения, сопровождающиеся
изменениями строения и антигенных
свойств паразитов. Во время увеличения
количества паразитов в крови преобладают
трипаносомы удлиненной формы. Антигены,
которые они образуют, вызывают формирование
антител в организме хозяина. Под действием
антител многие паразиты гибнут и
интенсивность инвазии снижается.
Выжившие трипаносомы укорачиваются и
начинают вырабатывать другие антигены.
Укороченные формы паразита, инвазионные
для мухи це-це, в ее организме вновь
приобретают удлиненную форму, инвазионную
для человека. Изменение формы тела и
смена антигенных свойств оболочки
повторяются многократно. Таким образом,
популяция паразита в хозяине выживает
и избегает его иммунной реакции.
Лабораторная
диагностика —
исследование мазков крови и спинномозговой
жидкости больного для выявления в них
возбудителя. Используются также
иммунологические реакции и заражение
лабораторных животных.
Профилактика
— кроме
борьбы с переносчиками применяют
профилактическое лечение здоровых
людей, живущих в очагах трипаносомоза,
делающее организм невосприимчивым к
инвазии. Практиковавшийся ранее отстрел
диких животных, являющихся природным
резервуаром паразита, вряд ли рационален
в связи с возможным нарушением
экологического баланса, который
складывался в биогеоценозах на протяжении
тысячелетий.
жизненный цикл: общие симптомы заражения, лечение, диагностика и профилактика заболеваний
Трипаносома – одноклеточный микроорганизм, который составляет семейство трипаносоматид. Он является паразитом – самостоятельно существовать не может, ему необходимо соседство с живым организмом.
Трипаносома распространяется через насекомых: мух-жигалок, триатомовых клопов, мух цеце и самок слепней Табанус. Различные роды этого паразита могут спровоцировать развитие сонной болезни, болезни Шагаса, су-ауру, случайную болезнь непарнокопытных, трипаносомоз парнокопытных. В процессе своей жизнедеятельности трипаносома вызывает необратимые изменения в организме человека.
Что такое трипаносома
Речь идет об одноклеточных паразитах, средой обитания которых являются млекопитающие, а переносчиками – насекомые. Коварство микроорганизма заключается в наличии у него механизма защиты от иммунитета человека и животного. Поражая организм хозяина, он умеет своевременно активизировать гены, которые скрывают его от иммунной системы, тем самым выигрывая время для размножения. Смертельно опасен для человека и других позвоночных.
Если в жизни человека паразит играет негативную роль, вызывая тяжелые заболевания и смерть, то в природе он является важным фактором естественного отбора, регулирующим численность других видов животных. Кроме того, одноклеточные жгутиковые участвуют в жизненном цикле термитов, располагаясь на время в их кишечнике и помогая хозяину переваривать клетчатку.
Строение
Взрослая особь, находясь в теле насекомого или человека, представляет собой одну продольно вытянутую клетку-митохондрию размером 12-70 мкр. Внутри состоит из цитоплазмы, ядра, дисковидного ДНК-содержащего кинетопласта, кинетосомы – небольшого образования, из которого берет начало жгутик. Волнообразная ундулирующая мембрана вместе со жгутиком выполняют двигательную функцию: последний тянется вдоль всего тела клетки и приподнимает мембрану, она изгибается и продвигает клетку в нужном направлении. Сверху клетка покрыта плотной гликопротеиновой оболочкой.
Отряд Многожгутиковые (Hypermastigida)
Гипермастигиды, или многожгутиковые – обитатели кишечника насекомых, питающихся древесиной. Представители этого отряда имеют множество жгутиков, образующих пучки (рис. 8). Кроме жгутиков могут образовывать псевдоподии для захвата кусочков древесины. Внутри клетки – один или несколько аксостилей.
Многожгутиковые – полезные симбионты термитов. Эти жгутиконосцы выделяют фермент целлюлазу, переваривающий клетчатку. Термиты этот фермент не синтезируют, и без жгутиконосцев переварить древесину не способны.
Жизненный цикл трипаносомы
Активность трипаносомы проявляется в организмах насекомых и млекопитающих, в других средах он существовать не может. Паразит попадает в пищеварительный тракт переносчика после того, как последний укусил зараженное животное, остается там примерно 20 дней, постепенно развиваясь и перемещаясь к слюнным железам насекомого. Носитель кусает жертву, зрелые особи переходят к новому хозяину – человеку или животному. 10 дней паразит находится под кожей хозяина, затем с кровью добирается до внутренних органов. Размножаясь, повреждает ткани и отравляет организм в целом.
Отряд Дипломонады (Diplomonadida)
Лямблия (Lamblia intestinalis) паразитирует в организме человека, вызывая заболевание лямблиоз. Локализация – двенадцатиперстная кишка, вторично – протоки печени. Тело лямблии грушевидной формы счетырьмя парами жгутиков. Лямблия имеет два крупных ядра, присасывательный диск, которым прикрепляется к клеткам (рис. 6). Питается веществами, накапливающимися в зоне пристеночного пищеварения. Попадая в нижние отделы кишечника инцистируется. Циста является инвазионной стадией, попадаетв организм человека вместе с продуктами или водой. Лямблиоз у взрослых, как правило, протекает бессимптомно, у детей проявляется в форме нарушения пристеночного пищеварения, всасывания пищевых веществ. Лабораторная диагностика основана на обнаружении цист в фекалиях.
рис. 7. Трихомонада (Trichomonas vaginalis): 1 — ядро, 2 — аксостиль, 2 — жгутики, 4 — ундулирующая мембрана.
Виды
Класс жгутиковых насчитывает несколько десятков видов паразитов. Они отличаются друг от друга продолжительностью жизненных циклов, природными резервуарами размножения, переносчиками и степенью патогенности для млекопитающих, но имеют схожие строение, способы размножения и циклы жизнедеятельности. Некоторые виды паразита способны вызвать у человека опасные патологии:
- Trypanosoma brucei gambience – имеет размер 17-28 мкм, распространена на территории Западной Африки. Переносится мухой цеце, живущей поблизости от жилища людей, конских стойбищ. Поражает человека, собак, свиней, селится в тканях головного и спинного мозга;
- Trypanosoma brucei rhodesience – возбудитель тяжелых быстротечных форм заболеваний. Переносчик – муха цеце, регион обитания – Восточная Африка. Поражает крупный рогатый скот и человека;
- Trypanosoma Cruzi – распространена в Южной и Центральной Америке, переносится триатомовыми клопами. Паразит проникает в ранку от укуса клопа или место расчеса кожи, если они загрязнены фекалиями клопа. Поражает печень, селезенку, сердце, мускулатуру и нейроны человека;
- Trypanosoma eouipedum (конская) – поражает лошадей и других домашних животных. Результатом поражения является так называемая случная болезнь лошадей, поскольку в процессе спаривания происходит дальнейшее распространение паразита.
Где обитают
Трипаносомы обитают преимущественно в Латинской Америке и Африке. Каждый год на Африканском континенте регистрируется около 10 тыс. случаев заболевания. Эндемичными являются более 30 стран, в которых обитает муха цеце. Высокий уровень заболеваемости отмечается у людей, проживающих в сельской местности с развитым животноводством. Высокая распространенность трипаносом обусловлена возможностью передачи инфекции различными путями (половым, трансмиссивным, пищевым, гемотрансфузионным).
Эндемичными являются более 30 стран, в которых обитает муха цеце.
Заболевания, вызываемые трипаносомой
Несколько разновидностей паразита вызывают у человека опасные патологии. Некоторые из них имеют хроническую форму, другие протекают быстро, оба случая дают высокую вероятность смертельного исхода. Заражение может произойти в зонах культурных ландшафтов, естественной природы. Чаще возбудитель сонной болезни настигает охотников, туристов, сезонных рабочих. Распространены следующие виды заболеваний:
- Сонная болезнь гамбийского типа – результат поражения паразитом типа гамбиенс. Выражается нарастающей мышечной слабостью, депрессией, истощением и сонливостью. Без лечения протекает около 5 лет, заканчивается летальным исходом;
- Сонная болезнь родезийского типа протекает более злокачественно, заканчивается смертью. На месте укуса возникает фурункул, начинается лихорадка, сопровождающаяся сильной головной болью. При отсутствии лечения смерть наступает через 9-12 месяцев.
- Болезнь Шагаса является результатом вторжения в организм микроорганизма типа крузи. Начало заболевания может протекать бессимптомно. Сопровождается воспалением сердечной мышцы, оболочек головного мозга, ЖКТ. На поздней стадии больные умирают от инфарктов, инсультов, сердечной недостаточности, в детском возрасте – от менингоэнцефалита. Смерть может быть внезапной.
- Как можно быстро похудеть за месяц на 5 кг
- Какая сталь для ножей самая лучшая
- Имена для девочек: красивые варианты и значения
Отряд Трихомонадовые (Trichomonadida)
Урогенитальная трихомонада (Trichomonas vaginalis) паразитирует в протоках половой и выделительной систем человека, вызывая заболевание трихомоноз. Тело трихомонады овальной формы. От переднего конца отходят четыре свободных жгутика и один, связанный с ундулирующей мембраной. Трихомонада имеет одно ядро, цитостом (клеточный рот), аксостиль – опорный стержень, выступающий на заднем конце тела в виде шипа (рис. 7). Урогенитальная трихомонада не способна образовывать цисты. Заражение человека происходит при половом контакте, при использовании общих предметов (белье, полотенца, губки). У мужчин заболевание протекает бессимптомно. У женщин – в форме воспалительных процессов, имеющих затяжной характер. Лабораторная диагностика основана на обнаружении трихомонад в отделяемом мочеполовых путей.
рис. 8. Гипермастигиды из кишечника термитов
Общие симптомы заражения
Чтобы получить своевременную медицинскую помощь, важно вовремя распознать признаки заражения. На первой стадии сделать это непросто, поскольку симптомы либо отсутствуют, либо проявляются в легкой форме. Болезнь Шагаса имеет характерный признак, на который нельзя не обратить внимания – отек век одного глаза. Другие ощущения человека при заражении разными видами паразитов схожи.
| 1 стадия, период сразу после заражения, когда паразиты еще циркулируют в крови и лимфе | 2 стадия, когда паразиты достигли жизненно важных органов | |
| Гамбийский трипаносомоз | Головная боль, лихорадка, суставные боли, мышечная дрожь, повышенное потоотделение, зуд, бессонница | Общая слабость, лихорадка, апатия, чрезмерная сонливость, двигательные расстройства, кома |
| Родезийский трипаносомоз | ||
| Трипаносомоз американский (крузи) | головная боль, увеличение лимфатических узлов, бледность, затруднение дыхания, отеки области живота и груди, багровый отек век одного глаза | нарушение сердечной деятельности, изменения органов пищеварения, нервной системы, других органов |
Диагностика носительства трипаносомы
Если с момента заражения прошло немного времени, паразита родезийского типа можно обнаружить в периферической крови, а тип гамбиенс – по анализу пунктаты шейных лимфатических узлов. Позже, на этапе поражения центральной нервной системы, возбудители африканских форм в крови и лимфоузлах не определяются. Определение болезни Шагаса на ранней стадии проводится микроскопическим исследованием периферической крови, поздняя диагностика – путем серологических реакций. Методы диагностирования заражения следующие:
- исследование под микроскопом капли периферической крови;
- пункция лимфатического узла;
- исследование спинномозговой жидкости;
- серологическая диагностика (обнаружение антител к паразиту в крови).
Что делать при заражении трипаносомой
Единственно правильное решение при обнаружении симптомов заражения – как можно быстрее обратиться в медицинское учреждение. Терапия может быть только медикаментозной. причем если на первой стадии заболевания используются относительно легко переносимые препараты, то эффективное лечение второй стадии возможно только высокотоксичными лекарственными средствами. Далее в течение 24 месяцев проводится мониторинг состояния больного, поскольку микроорганизм может быть жизнеспособен и вызвать рецидив на протяжении нескольких месяцев после окончания курса лечения.
Медикаментозное лечение
Терапия всех форм заболевания проходит легче, когда диагноз поставлен на ранней стадии, до появления неврологических симптомов. Для лечения сонной болезни используются антипротозойные средства, на первой стадии – Пентамидин или Сурамин, на второй стадии – Меларсопрол или Элофритин. При терапии болезни Шагаса эффективен Нифуртимокс.
- Сурамин – внутривенные инъекции для лечения на стадии, когда жизненно важные органы еще не поражены. Назначают по 20 мг/кг в день, всего 5 уколов, через каждые 3-5 дней. Побочные эффекты: рвота, диарея, головная боль, снижение сознания, поражение почек;
- Меларсопрол – эффективное средство для лечения на 2 стадии заболевания. Токсичен, нерастворим водой, раствор для инъекций готовят на пропиленгликоле. Назначается дозой 2-4 мг/кг в сутки. Процедура повторяется каждые 7 дней, всего требуются не менее 3 серий;
- Нифуртимокс – единственный препарат для лечения болезни Шагаса острой стадии. Назначают 8-10 мг/кг внутрь в 4 приема ежедневно, курс длится 90-120 суток. Побочные явления: рвота, похудение, беспокойство, бессонница, эпилептические припадки.
Профилактика
В 36 странах Африки, где ежегодные показатели заболеваемости сонной болезнью высоки, Всемирная организация здравоохранения реализует программу борьбы с распространением паразита. Профилактические меры сводятся в основном к истреблению переносчиков инфекции, вплоть до полного уничтожения растительности в местах их обитания. Для своевременного выявления заболевания проводится регулярная промежуточная диагностика здоровья населения. Принимаются меры по предупреждению и исключению контакта людей с переносчиками:
- жилье людей оборудуется москитными сетками, экранами и ловушками для мух и клопов;
- общественные помещения обрабатываются системными химическими препаратами для уничтожения вредных насекомых;
- работающим в очагах обитания паразитов выделяется спецодежда и репелленты – вещества для отпугивания насекомых, питающихся кровью;
- практикуется внутримышечное введение Пентамидина;
Терапия трипаносомоза
Чтобы остановить развитие болезни, а также снизить риск возникновения каких-либо осложнений, необходимо незамедлительно начинать терапию данного заболевания. Только в таком случае вас удастся минимизировать необходимость в сложных медицинских процедурах.
Если вы стали ощущать длительное беспричинное недомогание, постарайтесь сразу же обратиться к врачу за подробной диагностикой. Это поможет не только повысить вероятность положительного исхода терапии, но и снизит риск последующего заражения здоровых людей.
Из-за малой развитости стран Африканского континента трипаносома начинает стремительно распространяться среди здорового населения. Именно это и приводит к высокому проценту летального исхода, а также большой распространенности заболевания.
Нужно учитывать, что на различных этапах патология требует совершенно разного метода лечения. Не стоит заниматься самолечением или же надеяться, что недомогание пройдет само, — так вы только спровоцируете развитие негативных последствий.
Лечение трипаносомы будет эффективным лишь в том случае, если вам назначат подходящие лекарственные препараты. Они должны преодолевать гематоэнцефалический барьер, чтобы оказывать подавляющее влияние на паразитов.
Учитывайте, что назначать такие лекарства могут только врачи – они крайне токсичны, назначить необходимую дозу достаточно сложно. Всемирная Организация Здравоохранения представила определенный список препаратов, которые способны вылечить сонную болезнь. К ним относятся:
- Пентамидин – применяют для лечения первой стадии трипаносомы. Пациентами он переносится хорошо, однако вызывает побочные эффекты.
- Сурамин – также применяется для терапии первой стадии инфекции, может вызвать отклонения в работе мочевого пузыря или же аллергические реакции.
- Меларсопрол – предназначен для лечения двух форм сонной болезни, однако может спровоцировать реактивную энцефалопатию, которая в 10% случаев приводит к летальному исходу.
- Эфлорнитин – наиболее современный препарат, который обладает меньшим токсическим воздействием. Он также принимается только под контролем врача.
Наибольшую эффективность показывает комбинированный подход, когда одновременно применяются Нифуртимокс и Эфлорнитин. Подобная практика была введена в 2009 году. Лекарства при правильном применении абсолютно безопасны, они рекомендованы ВОЗ.
Также эта организация занимается бесплатным распространением препаратов на территории эндемичных районов. Это позволяет остановить смертность и снизить скорость распространения инфекции.
Эпидобстановка в Танзании
Эпидемиологическая обстановка в мире, к сожалению, никогда не бывает спокойной. То на одном континенте, то на другом, то в одной стране, то в другой возникают эпидемии различных инфекций, как уже давно известных миру, так и малоизвестных.
Роспотребнадзор
на своем официальном сайте постоянно сообщает об эпидемиологической обстановке в мире:
раздел «эпидемиологический надзор», где можно узнать, какие страны имеют сегодня риск по той или иной инфекции, и рекомендации по поездке в эти страны
Африка
Из-за своего расположения, климатических условий и невысокого экономического развития африканский континент является наиболее благоприятным для появления и распространения множества заболеваний различного происхождения – от простых пищевых инфекций до очень сложных инфекций. Самые серьезные из них, представляющие угрозу для здоровья человека, это — малярия, африканская сонная болезнь, желтая лихорадка.
Малярия
Заражение и симптомы
Малярия вызывается паразитами, передающимися с укусами москитов. Попадая в кровь человека, они блокируют красные кровяные тельца, и клетки крови погибают. Симптомы инфекции: высокая температура, озноб, ломота в мышцах и суставах. Заражение происходит только от укусов москитов. От инфицированных больных заразиться невозможно.
Распространение
Наиболее часто малярия встречается там, где обитают москиты. Очаг малярии находится в Центральной Африке. Ежегодно отмечаются вспышки малярии в Анголе, Камеруне, Центральной Африканской Республике, Чаде, Демократической Республике Конго, Экваториальной Гвинее, Габоне, Судане и Замбии. В Танзании – на популярном северном маршруте сафари, восхождении на Килиманджаро и на Занзибаре – малярия встречается намного реже, чем в соседних странах.
Лечение и профилактика
При постановке диагноза проводится симптоматическое и специальное лечение.
В целях профилактики малярии следует:
— избегать укусов комаров
— стараться не находиться на улице в ночное время суток — самое активное время для паразитов
— носить рубашки с длинными рукавами, длинные штаны и головные уборы
— использовать репелленты на поверхности кожи и одежды
— спать под противомоскитными сетками
Антималярийные препараты такие, как прогуанил, лариам, мефлокин, примакин могут защитить организм, если принимать их до, во время и после пребывания в Африке. Прием этих таблеток носит рекомендательный характер и имеет серьезные побочные эффекты, поэтому каждый посетитель Африки сам принимает решение об их применении, предварительно посоветовавшись с врачом.
Более подробно о малярии можно узнать здесь.
Африканская сонная болезнь
Заражение и симптомы
Муха цеце является переносчиком одной из самых опасных африканских болезней – трипаносомоза или африканской сонной болезни. Недуг вызывается паразитом, который ослабляет иммунную систему. Муха цеце питается как животной, так и человеческой кровью. Напившись крови больного животного, муха-переносчик заражает человека через укус открытых кожных покровов.
Симптомы появляются спустя три недели после инфицирования: высокая температура, слабость, головная боль, боль в суставах, усталость, сонливость, нарушение сна.
Всего существует 12 видов мухи цеце и только один вид переносит сонную болезнь. Встретить больную муху туристам, которые находятся в Африке не более 2-3-х недель, довольно сложно. Именно поэтому сонная болезнь очень редко встречается среди туристов.
В Танзании, где популярный северный маршрут сафари находится на плато, на уровне 1200 м над уровнем моря и большей частью представляет собой степь и саванну, а Занзибар вообще лишен этой болезни, риск заразиться сонной болезнью минимальный.
Распространение
Чаще всего сонная болезнь встречается в тропической Африке, где высокая температура, большая влажность, много зарослей, кустарников, лесов и множество диких животных.
Лечение и профилактика
Вовремя поставленный диагноз и специальное лечение приводят к полному выздоровлению.
Вакцины от этой болезни нет. Единственный способ защитить себя – избегать укусов мухи.
Муха цеце не любит открытые места такие, как степь, саванна, где ее легко сдувает ветер. Ее привлекают движущиеся предметы и контрастные цвета, особенно черный и синий. Муха не боится отпугивающих средств и может укусить даже через легкую ткань. Поэтому лучше всего носить плотную одежду нейтральных тонов, прикрывающую всю поверхность кожи.
Более подробно о сонной болезни можно узнать здесь.
Желтая лихорадка
Заражение и симптомы
Переносчиками вируса желтой лихорадки являются москиты. После укуса москита-переносчика вирус попадает в кровь. Инкубационный период длится от трех до шести дней. Есть две стадии развития этой болезни. Первая приводит к повышению температуры тела, головным болям, болям в мышцах, судорогам, потере аппетита, тошноте и рвоте. Но через три-четыре дня эти симптомы обычно исчезают. Некоторые люди (их около 15%), инфицированные этим вирусом, могут перейти во вторую, так называемую токсическую стадию, которая вызывает желтуху и кровотечения.
Заразиться можно только от укуса переносчика этой болезни – москита, от больного человека нельзя.
Распространение
Встречается желтая лихорадка повсеместно в Центральной Африке. В основном она «обитает» в сельской местности, но вспышки могут наблюдаться и в городах.
Лечение и профилактика
К полному выздоровлению приводят вовремя поставленный диагноз и правильное лечение, в противном случае возможен летальный исход.
Для профилактики желтой лихорадки следуйте всем советам, относящимся к мерам профилактики малярии. Сделайте прививку, которая будет активна, как известно, до десяти лет. Но последние исследования показали, что прививка от желтой лихорадки, сделанная единожды, сохраняет иммунитет против этой болезни на всю жизнь.
В 2011 году решением Всемирной организации здравоохранения Танзания выведена из списка стран с риском по желтой лихорадке. При посещении Танзании туристам НЕ НАДО делать прививку от желтой лихорадки.
Более подробно о желтой лихорадке, о списке стран с риском по ней и центрах вакцинации можно узнать здесь.
Другие болезни и вакцинация
Африка – это родной дом многих болезней, которые передаются при контакте с инфицированным человеком. Это холера, гепатит А, бильгарциоз, тиф, но, к счастью, есть вакцины, которые смогут защитить ваше здоровье. Перед тем, как посетить Африку, можно сделать прививки против гепатита А и Б, менингита, тифа и бешенства. Не помешают вакцины против столбняка, кори, дифтерии и полиомиелита. Все прививки носят рекомендательный характер. Поэтому решение о какой-либо вакцинации турист принимает самостоятельно, посоветовавшись с врачом.
Чтобы ничем этаким не заразиться, не подхватить даже элементарную пищевую инфекцию и тем самым не испортить себе замечательный африканский отпуск, достаточно соблюдать обычные гигиенические правила:
— чаще мойте руки до и после всего, протирайте антибактериальным гелем или салфетками
— пейте воду только из бутылок
— воздержитесь от употребления кубиков льда
— не ешьте полусырое мясо, не употребляйте никакие подливки
— овощи и фрукты тщательно мойте и очищайте сами
— не обнимайтесь, не целуйтесь и не вступайте в тесный контакт с незнакомыми людьми.
Африка – удивительный континент. Она предлагает множество неизведанных и незабываемых ощущений. Для кого-то они могут быть опасными. Но, если принять все меры по сохранению здоровья заранее, во время путешествия и с умом, то вы вернетесь домой довольным и здоровым!
Африканский трипаносомоз (африканская сонная болезнь)
Что такое африканская сонная болезнь?
Африканская сонная болезнь (африканский трипаносомоз) — заболевание, вызываемое паразитами. Он передается через укус инфицированной мухи цеце.
Что вызывает африканскую сонную болезнь?
Есть 2 типа болезни. Они названы в честь тех районов Африки, где они обитают. Западноафриканская сонная болезнь вызывается паразитом Trypanosoma brucei gambiense.Эта длительная (хроническая) инфекция может длиться годами. Восточноафриканская сонная болезнь вызывается Trypanosoma brucei rhodesiense. Это кратковременное (острое) заболевание, которое может длиться от нескольких недель до месяцев.
Люди из США, которые едут в Африку, редко заражаются. В среднем каждый год заражается 1 гражданин США. Человек обычно заражается в игровых парках Восточной Африки.
Кто подвержен риску африканской сонной болезни?
Единственные люди, которым грозит африканская сонная болезнь, — это те, кто едет в Африку.Вот где водится муха цеце. Паразиты, вызывающие заболевание, передаются только мухой цеце.
Мухи цеце обитают только в сельской местности. Они обитают в лесных зарослях саванны и густой растительности вдоль ручьев. Посетители городов и других городских районов обычно не подвергаются риску. Заболевание встречается в основном в тропической Африке. Наибольший риск попасть в:
- Ангола
- Центральноафриканская Республика
- Чад
- Конго
- Демократическая Республика Конго
- Малави
- Танзания
- Судан
- Уганда
- Замбия
Каковы симптомы африканской сонной болезни?
Укусы мухи цеце могут быть довольно болезненными.Путешественники часто вспоминают, как их укусили. В течение недели или около того на месте укуса часто появляется болезненная язвочка, которую называют шанкром.
У каждого человека могут быть разные симптомы. Но симптомы обычно проявляются в течение 1–4 недель после заражения. Сначала они могут включать лихорадку, кожные поражения, сыпь, отек или увеличение лимфатических узлов на задней части шеи. Через много недель инфекция может перерасти в менингоэнцефалит. Это инфекция головного мозга и жидкости, окружающей головной и спинной мозг.По мере обострения болезни симптомы могут включать:
- Сильная головная боль
- Изменение личности
- Похудание
- Раздражительность
- Потеря концентрации
- Прогрессирующая путаница
- Невнятная речь
- Изъятия
- Затруднения при ходьбе и разговоре
- Продолжительный сон
- Бессонница ночью
Если не лечить, смерть наступит в течение нескольких недель или месяцев.Симптомы африканской сонной болезни могут быть похожи на другие проблемы со здоровьем. Всегда обращайтесь к своему врачу за диагнозом.
Как диагностируется африканская сонная болезнь?
Если вы считаете, что инфицированы, как можно скорее обратитесь к врачу. Тесты могут найти паразита. Эти тесты могут включать образцы крови и спинномозговую пункцию (люмбальную пункцию). Ваш врач также может взять образец жидкости или ткани шанкра или жидкости из опухших лимфатических узлов.
Как лечится африканская сонная болезнь?
Ваш лечащий врач подберет для вас лучшее лечение на основе:
- Сколько вам лет
- Ваше общее и прошлое здоровье
- Как вы больны
- Насколько хорошо вы справляетесь с конкретными лекарствами, процедурами или терапией
- Ожидаемый срок действия состояния
- Ваше мнение или предпочтение
Есть лекарства для лечения болезни.Вам нужно будет остаться в больнице. После того, как вы вернетесь домой, вам потребуются контрольные осмотры в течение примерно 2 лет. Они будут включать спинномозговую пункцию. Поскольку эта инфекция встречается очень редко, ваш лечащий врач может поговорить со специалистом по инфекционным заболеваниям или тропической медициной.
Каковы осложнения африканской сонной болезни?
Если болезнь не лечить, симптомы могут ухудшиться до тяжелой формы. Смерть наступит.
Можно ли предотвратить африканскую сонную болезнь?
Никакая вакцина или лекарство не могут предотвратить африканскую сонную болезнь.Но вы можете избежать укусов мухи цеце. Специалисты рекомендуют:
- Носите защитную одежду, например рубашки с длинными рукавами и брюки. Мухи цеце могут прокусывать материал, поэтому одежда должна быть из плотной ткани.
- Носите одежду цвета хаки, оливкового или другого нейтрального цвета. Мух цеце привлекают яркие и темные контрастные цвета.
- Во время сна используйте надкроватную сетку.
- Прежде чем сесть в машину, загляните в машину на наличие мух цеце.
- Не садитесь в джипы, пикапы или другие открытые транспортные средства. Мух цеце привлекает пыль, создаваемая движущимися транспортными средствами и животными.
- Держитесь подальше от кустов. В самое жаркое время дня муха цеце будет отдыхать в кустах. Но они кусаются, если их потревожить.
Жизнь с африканской сонной болезнью
Обязательно следуйте указаниям врача. Вам нужно будет периодически выписываться по крайней мере в течение пары лет.
Когда мне следует позвонить своему врачу?
Если у вас поднялась температура, появилась сыпь или шанкр (изъязвление кожи) после возвращения из районов Африки, где вас, возможно, укусила муха цеце, обратитесь к своему врачу.
Ключевые моменты
- Африканская сонная болезнь — заболевание, вызываемое паразитами. Он передается через укус инфицированной мухи цеце.
- Единственный фактор риска — это поездки в районы Африки, где водится муха цеце.
- Единственный способ предотвратить болезнь — избегать укусов насекомых.
- Лекарство доступно для его лечения.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит поставщик.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые дает вам ваш провайдер.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться со своим поставщиком услуг, если у вас возникнут вопросы.
сонная болезнь | Описание, симптомы и меры профилактики
Сонная болезнь , также называемая Африканский трипаносомоз , заболевание, вызванное инфекцией жгутиковых простейших Trypanosoma brucei gambiense или близкородственным подвидом T.brucei rhodesiense , передается мухой цеце (род Glossina ). Сонная болезнь характеризуется двумя стадиями болезни. На первой стадии инфицированные люди обычно испытывают лихорадку, головную боль, боль в мышцах и суставах, а также воспаление лимфатических узлов. Вторая стадия, которая развивается в течение нескольких недель ( T. brucei rhodesiense ) или одного-двух лет ( T. brucei gambiense ), характеризуется поражением головного и спинного мозга, сопровождающимся изменениями личности, нарушениями сна. и глубокая летаргия, часто заканчивающаяся смертью при отсутствии лечения.
трипаносома
Trypanosoma brucei в мазке крови (световая микрофотография, окрашенная по Гимзе).
Blaine Mathison / Центры по контролю и профилактике заболеваний (CDC) (ID изображения: 11820)
Британская викторина
44 вопроса из самых популярных викторин «Британника» о здоровье и медицине
Что вы знаете об анатомии человека? Как насчет медицинских условий? Мозг? Вам нужно будет много знать, чтобы ответить на 44 самых сложных вопроса из самых популярных викторин Britannica о здоровье и медицине.
Заражение T. brucei gambiense происходит в районе, простирающемся от западного побережья Африки на восток до восточноафриканских озер и на юг до бассейна реки Конго. Случаи, вызванные T. brucei rhodesiense , ограничиваются высокогорьями центрально-восточной и южной частей Африки. В 20 веке произошло несколько крупных эпидемий сонной болезни, но с тех пор количество новых случаев, регистрируемых ежегодно, значительно снизилось.В 2012 году Всемирная организация здравоохранения опубликовала план, направленный на ликвидацию сонной болезни как проблемы общественного здравоохранения к 2020 году.
Нагана, форма сонной болезни, которая в первую очередь поражает крупный рогатый скот и лошадей, продолжает оставаться основным фактором, препятствующим развитию крупного рогатого скота. земледелие в тех частях тропической Африки, где мухи цеце являются эндемиками.
Инфекция и течение болезни
Подавляющее большинство случаев заболевания людей возникает в результате переноса трипаносом T. brucei мухами цеце, которые сосут человеческую кровь.Мухи заражаются, питаясь кровью инфицированных людей или других инфицированных млекопитающих. Обычно проходит от 12 до 15 дней, прежде чем мухи, подцепившие паразитов, становятся заразными для человека. В это время трипаносомы размножаются путем бинарного деления в средней кишке мухи, затем мигрируют в слюнные железы и выходят из хоботка мухи в виде капель слюны во время кровососания мухи.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишись сейчас
После инкубационного периода у людей продолжительностью от одной до двух недель трипаносомы обнаруживаются в значительном количестве в циркулирующей крови. Затем поражаются лимфатические узлы и селезенка, они становятся опухшими, мягкими и болезненными. Заметное увеличение лимфатических узлов в задней части шеи (известное как признак Уинтерботтома) является распространенным признаком болезни. Нерегулярная лихорадка и отсроченное ощущение боли также являются характерными симптомами на этой стадии. При более тяжелой восточноафриканской (или родезийской) форме сонной болезни T.brucei rhodesiense , токсикоз становится настолько серьезным, что пациент умирает в течение нескольких месяцев. У западноафриканского (или гамбийского) типа, инфекции T. brucei gambiense , существует задержка на один или несколько лет до того, как трипаносомы продолжат вторгаться в головной и спинной мозг. Возникающие в результате неврологические симптомы включают сильную головную боль, умственную вялость и апатию, утомленную шаркающую походку, тремор, спастический или вялый паралич, хорею и глубокую сонливость, которая развивается во время еды или когда пациент стоит или идет.Эти симптомы сопровождаются нарастающим истощением, комой и смертью. Западноафриканская форма сонной болезни обычно приводит к смерти через два-три года; в некоторых случаях у пациента развивается толерантность к инфекции, и он может долгие годы жить как носитель паразитов.
Диагностика и лечение
Чем раньше будет диагностирована и вылечена сонная болезнь, тем больше шансов на выздоровление. Диагноз ставится при микроскопическом исследовании крови и лимфы на наличие трипаносом и спинномозговой жидкости на предмет повышенного уровня лейкоцитов.Информация, полученная в результате этих тестов, затем используется для определения стадии заболевания и курса лечения.
Сурамин эффективен на ранних стадиях восточноафриканской сонной болезни. Эфлорнитин используется на ранних стадиях западноафриканского типа, в качестве альтернативы — пентамидин. На более поздних стадиях поражения центральной нервной системы западноафриканская форма лечится эфлорнитином. Высокотоксичный органо-мышьяк меларсопрол может использоваться как средство второго ряда против восточноафриканской формы.Все виды лечения инфекции T. brucei rhodesiense бесполезны после того, как разовьется стадия молниеносной токсемии. Исследователи изучали комбинированные методы лечения западноафриканской сонной болезни на основе эфлорнитина. Наиболее эффективной комбинацией является эфлорнитин, используемый в сочетании с нифуртимоксом, средством, используемым для лечения болезни Шагаса.
Профилактика
В начале 21 века большинство случаев сонной болезни произошло в Демократической Республике Конго (ДРК), где ежегодно регистрировалось около 1000 новых случаев.К 2015 году, за исключением ДРК, большинство других африканских стран регистрировали менее 100 случаев ежегодно, а многие другие не регистрировали случаев заболевания более десяти лет. Резкое сокращение случаев сонной болезни было связано с интенсивными усилиями по борьбе, которые включали изоляцию и надлежащее лечение всех инфицированных людей (включая большое количество бессимптомных хронических носителей) и защиту людей от укусов мухи цеце с помощью инсектицидов и поддержания обширные поляны вокруг деревень и жилых комплексов.Регулярное обследование сообществ в районах, где муха цеце является эндемическим заболеванием, и уничтожение резервуаров диких животных, а также индивидуальные подходы, такие как использование репеллентов от насекомых и ношение рубашек и брюк с длинными рукавами, также помогли снизить количество случаев заболевания. сонной болезни.
Исторически сложилось так, что эпидемии сонной болезни в Западной Африке частично контролировались путем введения профилактических доз пентамидина деревенскому населению. Уничтожение диких животных, которые служили резервуарами хозяев для паразитов, также проводилось, особенно в Восточной Африке; этот подход помог сократить популяции мухи цеце, хотя ни мухи, ни болезнь не были успешно истреблены.
Последняя редакция и обновление этой статьи выполняла Кара Роджерс, старший редактор.
Узнайте больше в этих связанных статьях Britannica:
Первичная профилактика африканского трипаносомоза — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; Заместитель главного редактора: Pilar Almonacid, Aditya Ganti M.B.B.S. [2]
Обзор
Профилактика и борьба направлены на искоренение паразитического хозяина — мухи цеце.Методы первичной профилактики африканского трипаносомоза включают использование инсектицидов для борьбы с переносчиком, использование новых строительных смесей в стенах и крышах зданий и тестирование органов / крови перед сдачей крови. Регулярный активный эпиднадзор, включающий выявление случаев заболевания и лечение, в дополнение к борьбе с мухой цеце, является основой стратегии борьбы с сонной болезнью.
Первичная профилактика
Профилактика и борьба направлены на искоренение паразитического хозяина — мухи цеце.Регулярный активный эпиднадзор, включающий выявление случаев заболевания и лечение, в дополнение к борьбе с мухой цеце, является основой стратегии борьбы с сонной болезнью. Для уменьшения африканских трипаносомозов использовались две альтернативные стратегии.
- Одна из тактик, в первую очередь, является медицинской или ветеринарной и направлена на заболевание напрямую, используя мониторинг, профилактику, лечение и наблюдение, чтобы уменьшить количество организмов, являющихся переносчиками болезни.
- Вторая стратегия, как правило, является энтомологической и направлена на нарушение цикла передачи путем уменьшения количества мух. Подробную информацию о профилактике болезни с помощью борьбы с мухой цеце см. В разделе «Борьба с мухой цеце».
Профилактика укусов мухи цеце и других насекомых
- Носите защитную одежду, включая рубашки с длинными рукавами и брюки. Муха цеце может прокусывать тонкие ткани, поэтому одежда должна быть из плотной ткани.
- Носите одежду цвета хаки или оливкового цвета. Муху цеце привлекают яркие цвета и очень темные цвета.
- Используйте репеллент от насекомых.Хотя репелленты от насекомых не доказали свою эффективность в предотвращении укусов мухи цеце, они эффективны в предотвращении укусов и болезней других насекомых.
- Во время сна используйте сетку для кровати.
- Перед въездом проверьте транспортные средства на наличие мухи цеце.
- Не садитесь в джипы, пикапы или другие открытые транспортные средства. Муху цеце привлекает пыль, которую создают движущиеся машины и дикие животные.
- Избегайте кустов. Муха цеце менее активна в самый жаркий период дня.Он сидит в кустах, но кусает, если его потревожить. [1]
- Избегайте ходьбы босиком. Использование обуви сводит к минимуму риск заражения.
Вакцина
Нет ни вакцины, ни рекомендованного лекарства для предотвращения трипаносомоза в Восточной Африке или трипаносомоза в Западной Африке.
Список литературы
Рассмотрение подходов, фармакологическая терапия, профилактика
Автор
Hazem Alsalman Hnaide, MD Врач-консультант, Arizona ID Consultants
Hazem Alsalman Hnaide, MD является членом следующих медицинских обществ: Американский колледж врачей, Общество инфекционных болезней Америки
Раскрытие информации: не раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Главный редактор
Пранатхарти Харан Чандрасекар, MBBS, доктор медицины Профессор, заведующий отделением инфекционных заболеваний, факультет внутренней медицины, Медицинский факультет Государственного университета Уэйна
Пранатхарти Харан Чандрасекар, магистр медицины и медицины, является членом следующих медицинских обществ: Американский колледж врачей , Американское общество микробиологии, Международное принимающее общество с ослабленным иммунитетом, Общество инфекционных болезней Америки
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Дэниел Р. Люси, доктор медицины, магистр, доктор медицины, магистр здравоохранения
Дэниел Р. Люси, доктор медицины, магистр, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей
раскрыть.
Керри О Кливленд, доктор медицины Профессор медицины, Медицинский колледж Университета Теннесси; Персонал-консультант, Департамент внутренней медицины, Отдел инфекционных заболеваний, Методистская служба здравоохранения Мемфиса
Керри О Кливленд, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Общества эпидемиологии здравоохранения Америки, Общества инфекционных болезней Америки
Раскрытие информации: раскрывать нечего.
Китонга П. Киминьо, доктор медицины Консультант, ID Consultants, Inc
Китонга П. Киминьо, доктор медицинских наук, является членом следующих медицинских обществ: Американское общество инфекционных болезней
Раскрытие информации: не подлежит разглашению.
Randy O Odero, MB, ChB Специалист по инфекционным заболеваниям
Randy Odero, MB, ChB является членом следующих медицинских обществ: Американского колледжа врачей, Общества инфекционных болезней Америки, Общества эпидемиологии здравоохранения Америки
Раскрытие информации: нечего раскрывать.
Благодарности
Гэри Л. Горби, доктор медицины Адъюнкт-профессор кафедры внутренней медицины и медицинской микробиологии и иммунологии, отделение инфекционных болезней, медицинский факультет Университета Крейтон; Адъюнкт-профессор медицины, Медицинский центр Университета Небраски; Заместитель председателя, Медицинский центр по делам ветеранов Омахи
Гэри Л. Горби, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской медицинской ассоциации, Американского общества микробиологов, Общества инфекционных болезней Америки и Нью-Йоркской академии наук
.
Раскрытие: Ничего не раскрывать.
Джозеф Ф. Джон-младший, доктор медицины, FACP, FIDSA, FSHEA Клинический профессор медицины, молекулярной генетики и микробиологии, Медицинский колледж Медицинского университета Южной Каролины; Заместитель начальника отдела образования, Медицинский центр по делам ветеранов Ральфа Джонсона
Раскрытие: Ничего не раскрывать.
Дэниел Р. Люси, доктор медицины, магистр здравоохранения Руководитель, директор программы стипендий, Департамент внутренней медицины, Отделение инфекционных болезней, Вашингтонский госпитальный центр; Профессор кафедры внутренней медицины Университета медицинских наук
Дэниел Р. Люси, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Alpha Omega Alpha и Американского колледжа врачей
Раскрытие: Ничего не раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Значение для уровней профилактики
В данной статье рассматриваются доказательства, подтверждающие использование этиологического лечения болезни Шагаса, которое изменило стандарты оказания помощи пациентам с инфекцией Trypanosoma cruzi за последние десятилетия.Также обсуждаются последствия этих данных для различных уровней профилактики, а также пробелы в имеющихся знаниях. В этом отношении этиологическое лечение оказалось полезным в качестве вмешательства для вторичной профилактики с целью успешного лечения инфекции или задержки, уменьшения или предотвращения прогрессирования заболевания, а также в качестве первичной профилактики заболевания путем разрыва цепи передачи. Своевременная диагностика на начальных этапах позволит назначить соответствующие методы лечения, главным образом, в системе первичной медико-санитарной помощи, что повысит шансы на улучшение качества жизни.Основываясь на имеющихся данных, этиологическое лечение следует рассматривать как важную стратегию общественного здравоохранения, полезную для снижения бремени болезни и полного устранения болезни Шагаса.
1. Введение
Спустя сто лет после того, как Карлос Шагас идентифицировал и описал инфекцию Trypanosoma cruzi ( T. cruzi) , все еще существуют миллионы инфицированных людей и тысячи новых диагностированных случаев каждый год с болезнью Шагаса (CD ). Научное сообщество периодически увеличивало знания и понимание того, как вести пациентов с острой и хронической БК [1].Тем не менее, необходимы дальнейшие исследования, чтобы улучшить лечение и ответить на многие неизвестные вопросы, касающиеся этого изнурительного и широко распространенного заболевания, от которого, по оценкам, страдают около 8 миллионов хронически инфицированных людей только в Северной и Южной Америке [2].
Целью этиологического лечения болезни Шагаса является устранение паразита ( T. cruzi ) из инфицированного человека, чтобы снизить вероятность развития клинических проявлений болезни (например,g., сердечно-сосудистые или пищеварительные заболевания), а также для разрыва цепи передачи заболеваний [3].
В настоящее время существует новый сценарий рекомендуемого этиологического лечения инфекции T. cruzi . Он основан на нескольких убедительных доказательствах, подтвержденных фундаментальными исследованиями, клиническими испытаниями, наблюдательными исследованиями и мнениями экспертов. В этой статье мы рассматриваем текущие данные, подтверждающие этиологическую терапию болезни Шагаса, организованную в соответствии с различными уровнями профилактики.Кроме того, мы обсуждаем доступные инструменты для демонстрации излечения этих пациентов и необходимость дальнейших исследований, необходимых для улучшения ухода за инфицированными T. cruzi людьми.
2. Материалы и методы
Мы рассмотрели доказательства, подтверждающие использование фармакотерапии против T. cruzi (этиологическое лечение) для снижения или предотвращения заболеваемости и смертности от болезни Шагаса на разных уровнях профилактики. В связи с этим с января по июль 2011 г. был проведен поиск в MEDLINE с использованием термина «болезнь Шагаса» с подзаголовками «диагноз», «прогноз», «лечение», названия лекарств (нифуртимокс, бензнидазол и другие препараты), « клинические испытания »и« обсервационные исследования.”Никаких ограничений относительно года, языка или страны публикации не применялось. Недавние руководящие принципы, а также текущие и неопубликованные исследования были также определены исследователями и экспертами в этой области. Доказательства были сгруппированы в соответствии с уровнями профилактики, указанными в извлеченных руководствах или эпидемиологических исследованиях. Наконец, мы рассмотрели силу доказательств для каждого показания на каждом уровне профилактики.
2.1. Определения
2.1.1. Уровни профилактики
Ливелл и Кларк определили три различных уровня профилактики здоровья человека (первичный, вторичный и третичный) в классическом учебнике, опубликованном в 1953 г. [4].Каждый из них включает различные способы вмешательства в зависимости от естественного течения болезни.
Первичная профилактика
Эти стратегии направлены на предотвращение развития болезни, включая приобретение новой инфекции. Большинство мероприятий по укреплению здоровья среди населения являются первичными профилактическими мерами.
Вторичная профилактика
Эти стратегии пытаются диагностировать и лечить существующее заболевание на ранних стадиях до того, как оно приведет к значительной заболеваемости.
Третичная профилактика
Эти методы лечения направлены на уменьшение негативного воздействия установленного заболевания за счет восстановления функции и уменьшения связанных с заболеванием осложнений.
В последние десятилетия Джамулль предложил четвертую концепцию (четвертичная профилактика), которая была включена Международным классификационным комитетом WONCA [5]. В этом отношении четвертичная профилактика описывает комплекс медицинских мероприятий, направленных на смягчение или предотвращение последствий ненужных или чрезмерных вмешательств в систему здравоохранения.
Сила рекомендаций, а также уровень качества доказательств, подтверждающих эти рекомендации, были рассмотрены в соответствии с Подкомитетом по стандартам качества или Комитетом по клиническим вопросам Американского общества инфекционных болезней (IDSA) [6].
2.2. Сила рекомендации
(A) Как убедительные доказательства эффективности, так и рекомендация в поддержку существенной клинической пользы для использования. Его всегда следует предлагать. (B) Умеренные доказательства эффективности — или убедительные доказательства эффективности, но только ограниченная клиническая польза — поддерживают рекомендацию по применению.Обычно его следует предлагать. (C) Доказательств эффективности недостаточно, чтобы поддержать рекомендацию за или против использования. Или доказательства эффективности могут не перевешивать неблагоприятные последствия (например, токсичность лекарств, лекарственные взаимодействия) или стоимость рассматриваемого лечения: необязательно. (D) Умеренные доказательства отсутствия эффективности или неблагоприятного исхода поддерживают рекомендацию против использования. Обычно его не следует предлагать. (E) Хорошие доказательства отсутствия эффективности или неблагоприятного исхода подтверждают рекомендацию против использования.Его никогда нельзя предлагать.
2.3. Качество доказательств, подтверждающих рекомендацию
Тип I: доказательства по крайней мере из одного правильно спланированного рандомизированного контролируемого исследования Тип II: доказательства по крайней мере из одного хорошо спланированного клинического исследования без рандомизации, из когортных или аналитических исследований с контролем случая чем один центр), или из нескольких исследований временных рядов, или впечатляющих результатов из неконтролируемых экспериментов. Тип III: доказательства из мнений уважаемых авторитетов, основанных на клиническом опыте, описательных исследованиях или отчетах комитетов экспертов.
3. Результаты
3.1. Рекомендации по терапии и сила доказательств
За последние годы было опубликовано несколько статей и руководств [7–40], в которых с разной степенью достоверности подтверждается, что этиологическое лечение является эффективным вмешательством как для индивидуального, так и для общественного здоровья. Эти исследования достигли уровня доказательности от I до III, что обеспечило силу рекомендаций (A), (B) и (C) (см. Таблицу 1). Мы обсудим эти критерии, применяемые в различных сценариях, следующим образом.
3.1.1. Эффективность лечения во время острой фазы инфекцииНесколько исследований показали пользу лечения во время острой фазы как бензнидазолом, так и нифуртимоксом с уровнем доказательности I или II типа [10–15]. Оценка неэффективности и / или эффективности лечения пациентов, получавших лечение во время острой фазы, очевидна за короткое время, поскольку паразитемия, прямая или нет (паразитологический тест или молекулярный тест), становится отрицательной через несколько дней после окончания лечения.Кроме того, антитела полностью исчезают (серонегативность) как минимум в 65% случаев, при этом некоторые исследования демонстрируют серонегативность в 100% случаев в течение 18 месяцев наблюдения после лечения. Этот эффект не зависит от возраста пациентов, включая новорожденных (врожденная передача), детей и взрослых. Отсутствие паразитемии, продемонстрированное прямым методом, таким как Strout или микрометод, всегда предшествует снижению уровня антител [10–15]. В целом, лечение хорошо переносится в острой фазе, и риск потенциальных нежелательных явлений уравновешивается уменьшением клинических проявлений острой фазы инфекции Шагаса и даже связанным с этим риском смерти.Существует широкий консенсус в отношении того, что все пациенты, переживающие острую фазу инфекции или реактивацию хронической инфекции, должны получать лечение (сила рекомендации (A)). 3.1.2. Эффективность лечения во время хронической фазы инфекцииНесколько исследований (тип доказательств I) подтвердили использование этиологического лечения (бензнидазол) на ранних стадиях хронической инфекции у детей [16–22]. Два исследования показали эффективность в этой популяции посредством двойных слепых плацебо-контролируемых испытаний бензнидазола у детей в возрасте от 6 до 12 лет с бессимптомным T.cruzi продемонстрировал примерно 60% эффективность, что оценивалось по преобразованию положительных серологических результатов в отрицательные через 3–4 года после лечения [16, 17]. Показатели серонегативизации до 70% были установлены при этиологическом лечении после длительного наблюдения (15 лет) в Южной Америке и до 50% после краткосрочного наблюдения (3 года) в Центральной Америке. Кроме того, дополнительные исследования (тип доказательств II) показали, что серонегативизация с помощью этиологического лечения также возможна на более поздних стадиях хронических инфекций у взрослых [7, 18, 23–31].Однако скорость серонегативности антител (серологический тест), по-видимому, напрямую связана с возрастом пациентов. Хотя полная серонегативизация может быть получена более чем в 70% случаев у детей, уровень серонегативизации у взрослых пациентов достиг примерно 30% после длительного периода наблюдения, около 20 лет [7, 16–31]. Падение титров антител после лечения у детей происходит быстрее, чем у взрослых, даже если оно не превышает пороговое значение и становится нереактивным. Снижение титров антител значительно в первые месяцы после лечения.Статистически значимое снижение наблюдается через 3 месяца с ИФА и ИФА и через 6 месяцев с ИГА [16, 17]. Это явление наблюдалось и у взрослых пациентов [26]. Маленькие дети с более длительным наблюдением имеют более высокие показатели серонегативизации после лечения по сравнению с детьми-пациентами с краткосрочным наблюдением, и такие же явления наблюдаются среди взрослых пациентов с долгосрочным наблюдением по сравнению со взрослыми пациентами с коротким периодом наблюдения [9]. Оценка этиологического эффекта лечения — еще одна важная проблема в исследованиях болезни Шагаса.Демонстрация противопаразитарных эффектов после лечения может быть проведена путем обнаружения антител, паразитов и / или ДНК паразитов. Успех лечения определяется исчезновением антител с помощью серологических тестов, в то время как терапевтическая неудача может быть продемонстрирована только путем демонстрации устойчивости паразита с помощью паразитологических методов. Оценка неэффективности лечения пациентов, получавших лечение в хронической фазе, может быть продемонстрирована за короткое время, поскольку паразитемия (если она присутствует с помощью паразитологического или молекулярного теста) исчезает в конце лечения, если лечение оказывается успешным.В случае неудачи признаки паразитемии остаются положительными после лечения (не более 5% у детей или 10% у взрослых) [9, 10, 17, 18, 20, 41, 42]. Однако Галлерано и Соса [43] показали более высокий уровень ксено-положительных результатов, включая лечение нифуртимоксом, бензнидазолом и аллопуринолом. Однако последний препарат (аллопуринол) не показал устойчивых результатов при клинических испытаниях [44, 45]. Были протестированы другие методики оценки эффективности противопаразитарных препаратов , , но не было достигнуто согласия по изменению текущей стратегии тестирования [9].Методы обнаружения геномных фрагментов паразита в тканях и жидкостях организма с помощью полимеразной цепной реакции (ПЦР) оказались многообещающими инструментами для оценки терапии [13, 36, 45–49], и недавно они были стандартизированы для диагностики [50] . В стадии реализации находятся проекты по стандартизации ПЦР для оценки терапии, направленной на выявление паразитов в крови. Есть согласие, что, даже с ограничениями, это будет полезным инструментом для улучшения оценки неэффективности лечения. Что касается оценки эффективности лечения, несколько исследователей ищут решения.Молекулярные методы показывают признаки для своевременной постановки диагноза при рождении [11, 13, 51]. Поскольку переносимость этиологического лечения у детей лучше, чем у взрослых (см. Раздел 3.3), существует общее мнение, что дети и подростки, проходящие хроническую фазу Шагаса, должны лечиться (сила рекомендации (A)). С другой стороны, скорость серонегативизации у взрослых пациентов (около 30%), основанная на данных наблюдательных исследований, связывающих серонегативизацию с профилактикой клинических заболеваний, в настоящее время исследуется [7, 18, 23–31].Более того, у взрослых пациентов наблюдается более высокая частота нежелательных явлений (17% случаев отказа) по сравнению с детьми, что делает эту рекомендацию более слабой для взрослых (сила рекомендации (B)). В случае взрослых пациентов, находящихся в хронической фазе инфекции, им может быть предложено лечение после тщательного рассмотрения возможных преимуществ и побочных эффектов. В случае принятия, терапия должна быть назначена в связи с убедительностью имеющихся на сегодняшний день доказательств. 3.1.3. Эффективность лечения в особых случаяхДоказательства типа III подтверждают, что медицинские работники, исследователи и т. Д., Пострадавшие от несчастных случаев с инфицированной кровью, должны лечиться в соответствии с определенными протоколами [33]. Что касается пациентов с ослабленным иммунитетом, имеющиеся исследования (тип доказательств II) показали, что после этиологического лечения пациенты выздоравливают от тяжелых проявлений реактивации, таких как менингоэнцефалит, миокардит и панникулит [36, 52]. Однако в этих случаях основной целью является восстановление после опасных для жизни острых событий, а не серонегативизация из-за ограниченной способности интерпретировать результаты серологических тестов в состояниях иммуносупрессии.Поскольку тяжесть реактивации и риск смерти взаимосвязаны, существует общее мнение, что таких пациентов необходимо лечить (сила рекомендации (A)). С другой стороны, в настоящее время нет доказательств, подтверждающих использование этиологического лечения в качестве профилактики у пациентов с ослабленным иммунитетом и хронической чагазовой инфекцией без доказательств реактивации. Хотя в некоторых исследованиях сообщалось об этиологическом лечении беременных женщин без побочных эффектов у новорожденных [32, 33], лечение бензнидазолом или нифуртимоксом в настоящее время не рекомендуется беременным женщинам (абсолютное противопоказание) [7, 9].Дополнительные противопоказания к применению этиологического лечения включают пациентов, перенесших тяжелое острое или хроническое заболевание печени или почек, не связанное с инфекцией T. cruzi (относительное противопоказание), и период лактации (относительное противопоказание) [7, 9]. В таблице 1 приведены сводные данные о различных сценариях этиологического лечения инфекции T. cruzi и результаты различных способов оценки терапевтического ответа. 3.2. Толерантность и приверженностьВо время лечения пациенты должны находиться под постоянным медицинским наблюдением.Исходя из предыдущего опыта, переносимость лечения хорошая, и пациенты не отмечали серьезных побочных эффектов [8, 19, 27, 41, 53, 54]. Хотя сообщалось о случаях серьезных побочных эффектов, они, как правило, были связаны с трудностями в своевременном обращении за медицинской помощью или получении адекватной помощи. Побочные эффекты чаще наблюдаются у подростков и взрослых, чем у детей и младенцев. У новорожденных и детей до 4 лет переносимость отличная. Во всех случаях побочные эффекты исчезали при снижении дозы или прекращении лечения.Типы наблюдаемых побочных эффектов и их распределение во время лечения показаны на рисунке 1.
Другие типы побочных эффектов включают обратимый кластогенез и мутагенез с бензнидазолом и нифуртимоксом без каких-либо связанных проявлений [55, 56], токсичность в отношении других тканей [57]. ] или повышенный риск лимфом у экспериментальных животных [58] были описаны, но никогда не демонстрировались среди общей популяции инфицированных пациентов, проходящих лечение [59], и никогда не играли роли в моделях на животных [60].Адекватное управление побочными эффектами необходимо для проведения лечения, а также для уменьшения необоснованных опасений при использовании трипаноцидных препаратов [53, 61]. 3.3. Роль этиологического лечения инфекции T. cruzi на нескольких уровнях профилактики в общественном здравоохраненииРекомендации по этиологическому лечению позволяют действовать на нескольких уровнях профилактики общественного здравоохранения. Полученные исследования предоставляют доказательства применения стратегий здравоохранения для контроля программ в нескольких странах, в результате чего большая часть населения может получить диагноз, лечение и излечение, создавая новый сценарий снижения бремени болезней в будущем. 3.3.1. Уровень первичной профилактикиЕсли цель состоит в том, чтобы избежать заражения новой инфекцией, этиологическое лечение может иметь косвенный эффект при лечении детей и молодых людей. Лечение детей и женщин репродуктивного возраста позволит избежать в будущем случаев врожденной передачи T. cruzi у новорожденных [62] (рекомендация (B) и тип доказательств III). Кроме того, доступность потенциальных доноров крови и органов будет увеличена за счет лечения инфицированных.К сожалению, эффективность этиологического лечения по этим показаниям первичной профилактики остается неизвестной, хотя можно предположить, что она по крайней мере равна показателям серонегативизации, наблюдаемым в доступных исследованиях. Другой стратегией была бы разработка лечения, которое можно было бы назначать беременным женщинам, например, лечения ВИЧ-инфекции, чтобы избежать врожденной передачи во время беременности. Однако для этой стратегии потребуется информация о безопасности этих препаратов, а она в настоящее время недоступна. Этиологическое лечение в случае несчастных случаев с материалом, зараженным паразитами, или образцами крови пациентов, инфицированных T. cruzi , также может рассматриваться как показание для первичной профилактики. На самом деле, лечение не является строго профилактикой, потому что невозможно избежать инфекций, но инфекцию можно прекратить сразу после несчастного случая при своевременном лечении для получения соответствующей концентрации конкретных лекарств (рекомендация (B) и доказательства III). [33]. 3.3.2. Уровень вторичной профилактикиЕсли профилактические мероприятия не могут предотвратить заражение детей, вылечить инфицированных детей можно путем назначения этиологического лечения [10–22]. В связи с этим, этиологическое лечение показано, когда у этих детей не сильно выражены поражения сердца или желудочно-кишечного тракта. Это лучшая возможность пройти серонегатизацию и избежать болезней, тем самым сохранив социальное, психическое и физическое здоровье до зрелого возраста [63, 64]. В нескольких странах Латинской Америки постепенно внедряется национальная программа контроля. Он состоял из скрининга детского населения в качестве регулярной стратегии, предлагающей возможности для диагностики и лечения (рекомендация (A) и тип доказательств I) [65], а также своевременной диагностики и лечения детей, рожденных с врожденной инфекцией (рекомендация (A), и тип доказательства II). Положительный эффект лечения детей, выявленный серологическим скринингом, необходимо оценивать, принимая во внимание закономерности передачи болезни, ее эволюцию и расчет бремени болезни, связанного с болезнью Шагаса, с тем чтобы проанализировать полезность серологического исследования как индикатора действие против вектора. Другое показание к этиологическому лечению при вторичной профилактике — избежать реактивации хронической инфекции. Иммуносупрессия из-за иммуносупрессивной терапии [36] или ВИЧ / СПИДа [52] увеличивает риск реактивации у пациентов с хронической инфекцией. Хотя эффективность этиологического лечения для клинического контроля эпизодов реактивации была доказана, необходимо собрать доказательства того, эффективно ли профилактическое лечение у пациентов без признаков клинической реактивации и с аномальными иммунологическими параметрами [66].В связи с этим некоторые протоколы рекомендуют лечение доноров органов, инфицированных T. cruzi , с целью снижения риска передачи через трансплантат [67]. В этом случае лечение следует рассматривать как акт первичной профилактики (рекомендация (A) и тип доказательств II). 3.3.3. Уровень третичной профилактикиИспользование этиологического лечения инфекции T. cruzi с целью уменьшения негативного воздействия установленного заболевания проходит оценку в рамках двух рандомизированных клинических испытаний, которые оценивают эффективность у пациентов с сердечными заболеваниями [68–70] .Эти испытания оценивают эффективность бензнидазола для предотвращения прогрессирования сердечного заболевания. Было опубликовано несколько обсервационных исследований, показывающих влияние этиологического лечения у пациентов, инфицированных T. cruzi , на предотвращение прогрессирования хронической кардиомиопатии Шагаса [18, 27, 41, 43, 71]. Эти исследования достигли качества доказательств типа II, что обеспечило силу рекомендаций (B) и (C). Прогноз для пациентов с сердечной недостаточностью или поздними стадиями кардиомиопатии Шагаса плохой [72], но аналогичен прогнозу других пациентов, у которых сердечная недостаточность развивается по другим причинам.Поскольку заболевание носит хронический характер, а поражение сердца развивается в течение десятилетий, очень важно распознать факторы, определяющие прогрессирование заболевания на ранних стадиях [73]. Этиологическое лечение следует рассматривать как защитный фактор в модели физиопатологии кардиомиопатии Шагаса. Как упоминалось выше, эффективность этиологического лечения для контроля эпизодов реактивации была доказана, показывая восстановление тяжелых проявлений реактивации, таких как менингоэнцефалит, миокардит и панникулит [36, 52]. 4. ОбсуждениеРекомендации по надлежащему уходу за пациентами увеличиваются, с упором на уход за пациентами в системе первичной медико-санитарной помощи, использование других уровней помощи, когда это необходимо [74–76], и включение психологической помощи. аспекты ухода [63, 64]. В этом контексте важно учитывать имеющиеся данные об этиологическом лечении и поддерживать перспективу этиологического лечения как инструмента общественного здравоохранения на различных уровнях профилактики, наряду с другими вмешательствами, доступными для контроля и лечения болезни Шагаса. При болезни Шагаса лучшими примерами первичной профилактики являются борьба с переносчиками болезней (на основе эпиднадзора) и контроль доноров крови и органов. Однако этиологическое лечение играет важную роль в первичной профилактике и должно считаться ключевым элементом среди других стратегий программ борьбы с болезнью Шагаса. Лучшим примером вторичной профилактики болезни Шагаса является контроль врожденной передачи и диагностика инфекции у детей (определяемых как недавняя хроническая инфекция) или молодых взрослых пациентов в хронической фазе без клинических проявлений (признак и / или симптом) [77]. Использование этиологического лечения для третичной профилактики болезни Шагаса в настоящее время поддерживается уровнями рекомендаций (B) и (C), когда они назначаются пациентам с сердечными заболеваниями в дополнение к дополнительной терапии для уменьшения клинического прогрессирования болезни. Например, трансплантация сердца — это процедура, которая применялась и продемонстрировала клиническую пользу у некоторых пациентов с терминальной сердечной недостаточностью [78]. Трансплантация стволовых клеток — это новая терапия, применяемая для регенерации сердца посредством выделения или увеличения сердечных миоцитов или неоваскулярной пролиферации у пациентов на последней стадии застойной сердечной недостаточности [79–81], но результаты все еще недостаточны при болезни Шагаса, и есть нет единого мнения о его эффективности [80]. Что касается четвертичной профилактики, национальную политику этиологического лечения инфицированных людей следует рассматривать как деятельность. Этот подход использовался несколькими странами Латинской Америки в последние десятилетия. Оценка эффекта лечения против инфекции T. cruzi требует четкого понимания комбинации переменных для соответствующей интерпретации результатов для оценки. Среди прочего, основными переменными являются инструменты, используемые в качестве индикаторов (паразитологические, молекулярные и серологические тесты), фаза инфекции (острая или хроническая), которой подвергается пациент во время лечения, и время, прошедшее между лечением и лечением. применение теста для оценки эффективности / неудачи. Идеальная оценка реакции на конкретное лечение — это обнаружение свободных паразитов в крови [82] или тканях [83] пациента, что позволяет четко отслеживать неэффективность лечения. Доступны лишь ограниченные методы оценки эффективности лечения. Также необходимо валидировать новые инструменты для своевременного подтверждения излечения или неудачи после того, как в хронической фазе был проведен полный курс лечения, и продолжаются исследования для валидации ПЦР и стандартизации и валидации количественной ПЦР. Если выявляется стойкость паразита, после проверки правильности приема препарата необходимо учитывать возможность развития у паразита устойчивости [84, 85]. Возможные региональные различия (хозяин, штамм T. cruzi и др.) Также описаны [10, 22], но для подтверждения этой гипотезы необходимы дополнительные наблюдения. После этиологического лечения, даже у вылеченных пациентов, антитела могут оставаться обнаруживаемыми в сыворотках в течение длительного времени (в течение многих лет), пока они не станут отрицательными.Из-за этого явления было бы необходимо углубиться в историю болезни пациентов с реактивной серологией, задав вопрос «проходил ли он / она лечение в прошлом?» При положительном ответе серологический тест имеет ограниченную ценность. потому что мы должны учитывать, отражает ли эта реактивность активную инфекцию или пациент был вылечен, и он / она становится отрицательным. Текущие рекомендации возложили большую часть ответственности за диагностику и лечение на систему первичной медико-санитарной помощи.Тем не менее, ведение инфицированных пациентов имеет некоторые основные ограничения, но некоторые исследования ищут решения. (a) Современные препараты способны излечивать инфекцию (или предотвращать заболевание) у взрослых пациентов во время хронической фазы, когда происходит первый контакт с большинством инфицированных пациентов, и клинические испытания завершаются или продолжаются, чтобы продемонстрировать эффекты обычных лечение этой популяции [69, 70]. (b) В настоящее время проводится оценка нового педиатрического препарата бензнидазола для устранения инфекции у новорожденных и детей с недавно перенесенной хронической инфекцией [86].Фактически, большинство новых случаев — это новорожденные с врожденной инфекцией. В целом, приоритеты в исследованиях болезни Шагаса должны заключаться в создании новых лекарств, обеспечивающих более короткий курс лечения с меньшим количеством побочных эффектов, а также в разработке детских смесей. Используются некоторые стратегии, такие как тестирование старых лекарств для продления срока действия текущих рецептов, скрининг новых соединений, тестирование лекарств, разработанных для других рецептов, таких как позанонзол, или разработка новых соединений (Клинические испытания для лечения хронической болезни Шагаса с помощью позаконазола и бензнидазола; NCT01162967 ) [69, 86].Ассоциации соединений с различными механизмами действия были упомянуты как еще один способ поиска новых альтернатив лечения [87]. Основываясь на текущем понимании болезни во время хронической фазы инфекции, существует консенсус, что каждый пациент, инфицированный T. cruzi , должен быть (дети) или должен пройти лечение (взрослые). Лечение может вылечить инфекцию и уменьшить или предотвратить прогрессирование болезни сердца / кардиомиопатии, связанной с Шагасом. Текущие данные о преимуществах и ограничениях этиологического лечения, основанные на клинических и практических исследованиях, служат для определения приоритетности стратегий в первичной медико-санитарной помощи с упором на завершение схемы лечения, а не на демонстрацию серологического отрицания. Включение этиологического лечения в стратегию общественного здравоохранения, полезную при первичной, вторичной и третичной профилактике, необходимо для снижения бремени болезни и устранения болезни Шагаса как проблемы общественного здравоохранения. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов. БлагодарностиАвторы хотели бы поблагодарить Марию Луз Сарафян и Эмили Уилкинсон за их помощь в редактировании этой статьи. Борьба с африканским трипаносомозом человека: достижения и проблемыAbstractСонная болезнь, также известная как африканский трипаносомоз человека (HAT), представляет собой забытое заболевание, от которого страдают 70 миллионов человек, живущих на 1,55 миллиона км. 2 в Африке к югу от Сахары. С начала 20-го века в Африке к югу от Сахары было несколько эпидемий HAT, причем самая последняя эпидемия в 1990-х годах привела к примерно полумиллиону случаев HAT, зарегистрированных в период с 1990 по 2015 год.Здесь мы рассматриваем статус болезни HAT в настоящее время и инструментарий, доступный для борьбы с ней. Мы также подчеркиваем разрабатываемые будущие возможности для новых или улучшенных вмешательств. Образец цитирования: Аксой С., Бушер П., Лехан М., Солано П., Ван ден Аббил Дж. (2017) Борьба с африканским трипаносомозом человека: достижения и проблемы. PLoS Negl Trop Dis 11 (4): https://doi.org/10.1371/journal.pntd.0005454 Редактор: Питер Дж.Хотез, Медицинский колледж Бейлора, Техасская детская больница, СОЕДИНЕННЫЕ ШТАТЫ Опубликовано: 20 апреля 2017 г. Авторские права: © 2017 Aksoy et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Финансирование: Авторы не получали специального финансирования на эту работу. Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует. Африканский трипаносомоз человека (HAT) — это забытая болезнь, от которой страдают 70 миллионов человек, живущих на 1,55 миллиона км. 2 в Африке к югу от Сахары [1]. С начала 20-го века произошло три крупных эпидемии HAT, самая последняя из которых произошла в 1990-х годах, в результате чего с 1990 года по настоящее время было зарегистрировано около 500 000 случаев HAT [2,3]. Заболевание вызывается двумя разными подвидами африканских трипаносом, переносимых мухами цеце ( Glossina spp.: Diptera). В восточной и южной частях Африки Trypanosoma brucei rhodesiense вызывает острую родезийскую форму болезни, тогда как в центральной и западной Африке. Т . б . gambiense вызывает хроническую форму болезни Gambiense (около 95% всех зарегистрированных случаев HAT). Заболевание обычно поражает отдаленные сельские общины, где люди подвергаются укусам мухи цеце во время повседневных занятий на открытом воздухе. Если не лечить, болезнь HAT обычно приводит к летальному исходу.Помимо HAT, родственные паразиты, такие как T . б . Брюсей , Т . конголенсе , Т . vivax , Т . evansi , и Т . equiperdum , вызывают у домашнего скота болезни, вызывающие истощение, называемые африканским трипаносомозом животных (ААТ), которые приводят к крупным экономическим потерям в соответствующих странах [4]. Амбициозная кампания, проводимая ВОЗ, многими неправительственными организациями (НПО) и государственно-частным партнерством с Sanofi-Aventis и Bayer, в рамках которой были предоставлены необходимые лекарства для распространения в пострадавших странах, снизила глобальную заболеваемость Gambiense HAT до <3000 случаев в 2015 г. .Основываясь на успехе контрольной кампании, в настоящее время есть планы устранить Gambiense HAT как проблему общественного здравоохранения к 2020 году [5]. Gambiense HAT обычно считается антропонозом, и, следовательно, контроль в значительной степени зависит от активных и / или пассивных программ выявления случаев и лечения [6]. Контроль над Rhodesiense HAT был более сложным, поскольку болезнь передается через домашних животных, которые служат резервуарами для передачи паразитов переносчиком мухи цеце. Следовательно, для Rhodesiense HAT ключевую роль играет борьба с паразитом в домашних резервуарах и / или сокращение популяций переносчиков мухи цеце, а медицинские вмешательства используются только в гуманитарных целях. Несмотря на обширные исследования биологии трипаносомы, набор инструментов для диагностики и лечения сонной болезни оставался чрезвычайно маленьким и изобиловал трудностями [7]. Однако недавняя эпидемия мобилизовала финансовые ресурсы, доступные для фундаментальных и прикладных исследований, что привело к новым знаниям о физиологии, генетике и геномике как паразитов, так и переносчиков мухи цеце и расширило перспективы трансляционной науки для устойчивого контроля над HAT. Ниже мы рассмотрим некоторые успехи, достигнутые за последнее десятилетие в расширении набора инструментов для устранения HAT. Контроль болезни у млекопитающего-хозяинаДостижение контроля болезни у млекопитающего-хозяина было трудным из-за отсутствия вакцин для млекопитающих из-за процесса антигенной изменчивости, которую паразит проявляет в своем млекопитающем-хозяине. Следовательно, важна точная диагностика паразита и стадия заболевания, особенно из-за токсичности существующих лекарств. Хотя в исследовательских учреждениях были разработаны мощные методы молекулярной диагностики, немногие из них еще достигли пациентов или национальных программ контроля [8].Для Gambiense HAT доступен чувствительный и специфический тест для активного серологического скрининга мобильными группами [9]. Однако, когда распространенность становится низкой, целевые опросы «от двери до двери» могут стать привлекательной альтернативой массовому скринингу [10]. Также станет важным интегрировать пассивное выявление случаев в стационарных медицинских центрах [5]. Разработка индивидуальных экспресс-серодиагностических тестов (ДЭТ), безусловно, облегчит привлечение стационарных медицинских центров к пассивному выявлению случаев заболевания, однако их диагностическая точность остается неопределенной [11].Грохот для Т . б . Инфекция rhodesiense по-прежнему зависит от клинических признаков в отсутствие серологических тестов, доступных для использования в полевых условиях. Хотя недавно были внесены улучшения в паразитологические подтверждающие тесты, их чувствительность остается недостаточной для Gambiense HAT [12]. Что касается лечения, введение комбинированной терапии эфлорнитин-нифуртимокс (NECT) сделало лечение Gambiense HAT более безопасным и эффективным [13]. Сокращение популяций переносчиковХотя борьба с переносчиками жизненно важна для Rhodesiense HAT, она не сыграла большой роли в Gambiense HAT, поскольку считалась слишком дорогой и сложной для развертывания в условиях ограниченных ресурсов очагов HAT.Однако моделирование, исторические исследования и практические мероприятия демонстрируют важную роль, которую борьба с переносчиками инфекции может играть в борьбе с Gambiense HAT [14, 6, 15], особенно с учетом возможности длительного носительства трипаносом как в резервуарах человека, так и в организме животных. [16,17]. Последние модели предполагают, что борьба с переносчиками инфекции будет иметь важное значение, если мы хотим достичь поставленной цели по ликвидации этой болезни как проблемы общественного здравоохранения к 2020 году [18]. Борьба с переносчиками инфекции может быть особенно эффективной в периоды низкой эндемичности, когда активные кампании по эпиднадзору могут быть слишком дорогостоящими в эксплуатации, и на данный момент это единственная существующая профилактическая мера для защиты людей от инфекционного укуса переносчика мухи цеце.Кроме того, было предложено использование коммерчески доступных наборов изотермической амплификации с петлевой связью (LAMP) в качестве высокочувствительного инструмента для ксеномониторинга для выявления потенциальных мест передачи сонной болезни, особенно в периоды низкой эндемичности [19]. Для усилий по сокращению переносчиков инфекций использование метода стерильных насекомых на всем континенте было предложено Африканским союзом после успеха программы ликвидации на Занзибаре [20]. Однако возможность применения этого метода в масштабах всего континента была поставлена под сомнение, учитывая разнообразие видов, которые могут передавать паразита, его высокую стоимость и зависимость от основной инфраструктуры, такой как крупные насекомые, радиационные установки и самолеты [21]. .Было возможно изменить существующие обработанные инсектицидами мишени для создания более экономичного и устойчивого метода борьбы с переносчиками болезней для использования в очагах HAT. Крошечные мишени, состоящие из небольшого квадрата синей ткани, окруженного куском черной сетки аналогичного размера, оказались эффективными и более рентабельными, чем ловушки или большие мишени, обычно используемые в кампаниях по борьбе с видами переносчиков Gambiense [14, 22]. ]. Для мониторинга эффективности и устойчивого воздействия вмешательств по борьбе с мухой цеце разрабатываются чувствительные серологические инструменты с использованием биомаркеров на основе слюны мухи цеце [11, 23].Важным достижением, которое стимулировало исследования фундаментальных аспектов биологии передачи мухи цеце и трипаносомы, стало завершение последовательности генома G . morsitans morsitans [24] и пять дополнительных видов переносчиков [41]. Эта информация была собрана для понимания обонятельной [25, 26], симбиотической [27] и репродуктивной [28] физиологии мухи цеце с целью определения целей, подходящих для усилий по сокращению популяции. Знания об обонятельной физиологии могут быть использованы для повышения эффективности ловушек и мишеней путем выявления новых аттрактантов, в то время как облигатная зависимость мухи цеце от их эндосимбионтов является слабым звеном в способности этого вектора к воспроизводству, обеспечивая идеальные цели для новых методов борьбы с переносчиками. Кроме того, растет объем знаний о популяционной генетике переносчиков мухи цеце в эндемичных по болезни районах Африки. Эта новая информация может помочь выявить естественные препятствия на пути распространения и маршрутов мух и, следовательно, может предоставить важную информацию для программ полевого контроля, направленных на снижение плотности переносчиков с помощью традиционных инструментов, таких как ловушки / мишени, метод стерильных насекомых или аэрозольные распылители [29, 30 ]. Одной из основных причин высокой эффективности методов борьбы с переносчиками мухи цеце является и без того низкая репродуктивная способность этого насекомого из-за его репродуктивной физиологии живородящего.Молекулярные и биохимические аспекты живорождения мухи цеце и ее зависимости от продуктов, обеспечиваемых облигатным симбионтом Wigglesworthia , находятся в стадии изучения. Эти фундаментальные знания предоставляют множество новых мишеней для воздействия на плодовитость мухи цеце с целью сокращения популяций мухи цеце [28]. Борьба с паразитом в векторе мухи цецеРасширение знаний о геномике мухи цеце и трипаносом также расширило знания о молекулярных аспектах взаимодействий паразит-хозяин с несколькими практическими последствиями.Было показано, что важное узкое место для передачи паразитов возникает на ранних этапах инфекционного процесса в средней кишке мухи цеце, для которого характерно перетягивание каната между иммуномодулирующей активностью трипаносомы и противопаразитарными иммунными реакциями мухи цеце [31, 32]. Молекулярные детали сложных взаимодействий паразит-хозяин, которые в конечном итоге позволяют трипаносомам колонизировать мух [33, 34], с последующей модуляцией паразитами иммуномодулирующих компонентов слюны мухи, и влияние этой модификации на динамику передачи трипаносом в организме хозяина. места укусов, способствующие передаче паразита, все еще не раскрыты и создают новые точки помех для передачи паразита [35, 23].Один из подходов, с помощью которого паразитарная инфекция может быть устранена из популяций мухи цеце, заключается в способности придать ей рефрактерность [36, 37]. С этой целью был идентифицирован один комменсальный симбионт мухи цеце, присутствующий в средней кишке, Sodalis , и была разработана система генетической модификации [38]. Кандидаты в антитрипаносомные молекулы также были идентифицированы и экспрессированы в Sodalis для уменьшения трипаносомных инфекций в качестве нового подхода [39, 40]. Многие из этих ранних фундаментальных открытий были сделаны в результате применения омиковых технологий в области борьбы с мухой цеце и трипаносом и открыли возможности для новых целей для новых инновационных подходов. Особенности
Ссылки
Что такое африканская сонная болезнь? | ФактыАфриканский трипаносомоз — это паразитарное заболевание, передающееся мухой цеце. Он получил свое прозвище «сонная болезнь», потому что симптомы могут включать нарушение режима сна. Что такое трипаносомоз?
Сканирующая электронная микрофотография (СЭМ) паразита Trypanosoma brucei. Изображение предоставлено: Gull Lab любезно предоставлено Сью Воан, Wellcome Images Что такое африканский трипаносомоз человека (сонная болезнь)?
Как передается африканский трипаносомоз?
Муха цеце. Жизненный цикл трипаносомы
Иллюстрация жизненного цикла трипаносомного паразита, вызывающего африканскую сонную болезнь. Каковы симптомы африканского трипаносомоза?
Скрининг и диагностика африканского трипаносомоза
Мазок крови, взятый у человека с трипаносомозом (розовые круги — красные кровяные тельца; фиолетовые завитки — трипаносомные паразиты).
Как лечится трипаносомоз?
Как можно предотвратить трипаносомоз?
Инсектицидное опрыскивание против мухи цеце в Нигерии. Эта страница последний раз обновлялась 25.01.2016 . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
